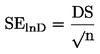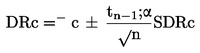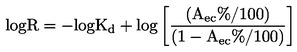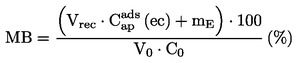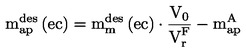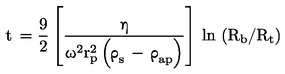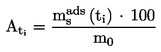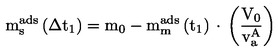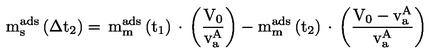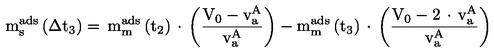EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02008R0440-20101212
Commission Regulation (EC) No 440/2008 of 30 May 2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance)
Consolidated text: Regulamentul (CE) nr . 440/2008 al Comisiei din 30 mai 2008 de stabilire a metodelor de testare în temeiul Regulamentului (CE) nr. 1907/2006 al Parlamentului European și al Consiliului privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH) (Text cu relevanță pentru SEE)
Regulamentul (CE) nr . 440/2008 al Comisiei din 30 mai 2008 de stabilire a metodelor de testare în temeiul Regulamentului (CE) nr. 1907/2006 al Parlamentului European și al Consiliului privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH) (Text cu relevanță pentru SEE)
2008R0440 — RO — 12.12.2010 — 002.001
Acest document reprezintă un instrument de documentare, iar instituţiile nu îşi asumă responsabilitatea pentru conţinutul său.
|
REGULAMENTUL (CE) NR. 440/2008 AL COMISIEI din 30 mai 2008 de stabilire a metodelor de testare în temeiul Regulamentului (CE) nr. 1907/2006 al Parlamentului European și al Consiliului privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH) (Text cu relevanță pentru SEE) (JO L 142, 31.5.2008, p.1) |
Astfel cum a fost modificat prin:
|
|
|
Jurnalul Oficial |
||
|
No |
page |
date |
||
|
REGULAMENTUL (CE) NR. 761/2009 AL COMISIEI din 23 iulie 2009 |
L 220 |
1 |
24.8.2009 |
|
|
REGULAMENTUL (UE) NR. 1152/2010 AL COMISIEI din 8 decembrie 2010 |
L 324 |
13 |
9.12.2010 |
|
REGULAMENTUL (CE) NR. 440/2008 AL COMISIEI
din 30 mai 2008
de stabilire a metodelor de testare în temeiul Regulamentului (CE) nr. 1907/2006 al Parlamentului European și al Consiliului privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH)
(Text cu relevanță pentru SEE)
COMISIA COMUNITĂȚILOR EUROPENE,
având în vedere Tratatul de instituire a Comunității Europene,
având în vedere Regulamentul (CE) nr. 1907/2006 al Parlamentului European și al Consiliului din 18 decembrie 2006 privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH), de înființare a Agenției Europene pentru Produse Chimice, de modificare a Directivei 1999/45/CE și de abrogare a Regulamentului (CEE) nr. 793/93 al Consiliului și a Regulamentului (CE) nr. 1488/94 al Comisiei, precum și a Directivei 76/769/CEE a Consiliului și a Directivelor 91/155/CEE, 93/67/CEE, 93/105/CE și 2000/21/CE ale Comisiei ( 1 ), în special articolul 13 alineatul (3),
întrucât:|
(1) |
În conformitate cu Regulamentul (CE) nr. 1907/2006, se adoptă metode de testare la nivel comunitar în vederea testării substanțelor, atunci când astfel de teste sunt necesare pentru a obține informații privind proprietățile intrinsece ale substanțelor. |
|
(2) |
Directiva 67/548/CEE a Consiliului din 27 iunie 1967 privind apropierea actelor cu putere de lege și a actelor administrative referitoare la clasificarea, ambalarea și etichetarea substanțelor periculoase ( 2 ) a stabilit, în anexa V, metodele de determinare a proprietăților fizico-chimice, a toxicității și a ecotoxicității substanțelor și preparatelor. Anexa V la Directiva 67/548/CEE a fost eliminată prin Directiva 2006/121/CE a Parlamentului European și a Consiliului cu începere de la 1 iunie 2008. |
|
(3) |
Metodele de testare prezentate în anexa V la Directiva 67/548/CEE trebuie incluse în prezentul regulament. |
|
(4) |
Prezentul regulament nu exclude utilizarea altor metode de testare, cu condiția ca aceasta să fie conformă cu articolul 13 alineatul (3) din Regulamentul 1907/2006. |
|
(5) |
La elaborarea metodelor de testare trebuie luate în considerare pe deplin principiile de înlocuire, de reducere și de perfecționare a utilizării animalelor în cadrul procedurilor, în special atunci când sunt disponibile metode corespunzătoare și validate de înlocuire, reducere sau perfecționare a testării pe animale. |
|
(6) |
Dispozițiile prezentului regulament sunt conforme cu avizul comitetului instituit în temeiul articolului 133 din Regulamentul (CE) nr. 1907/2006, |
ADOPTĂ PREZENTUL REGULAMENT:
Articolul 1
Metodele de testare care urmează să fie aplicate în sensul Regulamentului (CE) nr. 1907/2006 sunt prezentate în anexa la prezentul regulament.
Articolul 2
Comisia revizuiește, atunci când este cazul, metodele de testare incluse în prezentul regulament în vederea înlocuirii, reducerii sau perfecționării testelor efectuate pe animale vertebrate.
Articolul 3
Toate trimiterile la anexa V la Directiva 67/548/CEE se interpretează ca trimiteri la prezentul regulament.
Articolul 4
Prezentul regulament intră în vigoare în ziua următoare publicării în Jurnalul Oficial al Uniunii Europene.
Se aplică de la 1 iunie 2008.
Prezentul regulament este obligatoriu în toate elementele sale și se aplică direct în toate statele membre.
ANEXĂ
PARTEA A: METODE PENTRU DETERMINAREA PROPRIETĂȚILOR FIZICO-CHIMICE
|
CUPRINS |
|
|
A.1. |
PUNCTUL DE TOPIRE/CONGELARE |
|
A.2. |
PUNCTUL DE FIERBERE |
|
A.3. |
DENSITATEA RELATIVĂ |
|
A.4. |
PRESIUNEA DE VAPORI |
|
A.5. |
TENSIUNEA SUPERFICIALĂ |
|
A.6. |
SOLUBILITATEA ÎN APĂ |
|
A.8. |
COEFICIENTUL DE PARTIȚIE |
|
A.9. |
PUNCTUL DE INFLAMABILITATE |
|
A.10. |
INFALMABILITATE (SOLIDE) |
|
A.11. |
INFLAMABILITATE (GAZE) |
|
A.12. |
INFLAMABILITATE (CONTACTUL CU APA) |
|
A.13. |
PROPRIETĂȚI PIROFORICE ALE SOLIDELOR ȘI ALE LICHIDELOR |
|
A.14. |
PROPRIETĂȚI EXPLOZIVE |
|
A.15. |
PUNCTUL DE AUTOAPRINDERE (LICHIDE ȘI GAZE) |
|
A.16. |
TEMPERATURA RELATIVĂ DE AUTOAPRINDERE PENTRU SUBSTANȚELE SOLIDE |
|
A.17. |
PROPRIETĂȚI OXIDANTE (SOLIDE) |
|
A.18. |
DETERMINAREA MASEI MOLECULARE NUMERICE MEDII ȘI A DISTRIBUȚIEI MASELOR MOLECULARE A POLIMERILOR |
|
A.19. |
DETERMINAREA CONȚINUTULUI ÎN POLIMERI CU MASĂ MOLECULARĂ MICĂ |
|
A.20. |
COMPORTAMENTUL DE DIZOLVARE/EXTRACȚIE AL POLIMERILOR ÎN APĂ |
|
A.21. |
PROPRIETĂȚI OXIDANTE (LICHIDE) |
|
A.22. |
DIAMETRU MEDIU GEOMETRIC PONDERAT PE LUNGIME AL FIBRELOR |
A.1. PUNCTUL DE TOPIRE/CONGELARE
1. METODĂ
Majoritatea metodelor descrise se bazează pe orientările OCDE privind testele (1). Principiile fundamentale sunt descrise în referințele bibliografice 2 și 3.
1.1. INTRODUCERE
Metodele și dispozitivele descrise se aplică pentru determinarea punctului de topire a substanțelor, oricare ar fi gradul de puritate a acestora.
Alegerea metodei depinde de natura substanței de testat. În consecință, factorul limitativ depinde direct de calitatea substanței de a fi ușor pulverizabilă, greu pulverizabilă sau nepulverizabilă.
Pentru anumite substanțe este preferabil să se determine punctul de congelare sau de solidificare. Acesta este motivul pentru care normele acestor determinări figurează și în prezenta metodă.
Atunci când, datorită proprietăților specifice ale substanței, niciun parametru nu poate fi măsurat într-un mod satisfăcător, se poate determina punctul de curgere.
1.2. DEFINIȚII ȘI UNITĂȚI
Punctul de topire se definește ca temperatura la care are loc tranziția de fază din stare solidă în stare lichidă, la presiunea atmosferică, temperatură care în mod ideal corespunde temperaturii de congelare.
Deoarece în cazul multor substanțe tranziția de fază are loc într-un anumit interval de temperatură, aceasta este deseori descrisă ca interval de topire.
Transformarea unităților de măsură (K în oC)
t = T – 273,15
|
t = |
temperatura Celsius, exprimată în grade Celsius ( oC) |
|
T = |
temperatura termodinamică, exprimată în grade Kelvin (K) |
1.3. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință de fiecare dată când se studiază o substanță nouă. Acestea trebuie să servească în special la verificarea periodică a acurateței metodei și să permită comparația cu rezultatele obținute prin alte metode.
Câteva substanțe-mamă sunt enumerate în referințele bibliografice (4).
1.4. PRINCIPIUL METODEI DE TESTARE
Se determină temperatura (intervalul de temperatură) la care are loc tranziția de fază din starea solidă în starea lichidă. În practică, se determină temperaturile fazei inițiale de topire/congelare și finale de topire/congelare în timpul încălzirii/răcirii unei mostre de substanță la presiunea atmosferică Sunt descrise cinci tipuri de metode, și anume: metoda capilară, metoda blocului fierbinte, determinarea punctului de congelare, metoda analizei termice și determinarea punctului de curgere (pentru uleiurile din petrol).
În anumite cazuri, poate fi mai ușor să se măsoare punctul de congelare în locul punctului de topire.
1.4.1. Metoda tubului capilar
1.4.1.1. Dispozitiv cu baie de lichid
Se introduce o cantitate mică de substanță pulverizată fin într-un tub capilar și se tasează cu atenție. Se încălzește tubul în același timp cu un termometru și pe parcursul operației se reglează creșterea temperaturii cu puțin sub 1 K pe minut. Se înregistrează temperaturile la început și la sfârșit de topire.
1.4.1.2. Dispozitiv prevăzut cu bloc metalic fierbinte
Metoda este aceeași cu cea descrisă la punctul 1.4.1.1, cu diferența că tubul capilar și termometrul sunt plasate într-un bloc de metal încălzit și observate prin orificii practicate în acest bloc.
1.4.1.3. Detecție fotoelectrică
Eșantionul conținut în tubul capilar se încălzește automat într-un cilindru metalic. Printr-un orificiu practicat în acest cilindru se trimite un fascicul de lumină prin substanța de testat către o celulă fotoelectrică etalonată cu precizie. În momentul topirii, proprietățile optice ale majorității substanțelor se modifică, în sensul că din opace devin transparente. Astfel, intensitatea luminii care atinge celula fotoelectrică crește și trimite un semnal de oprire indicatorului digital care înregistrează temperatura termometrului cu rezistență de platină plasat în incinta de încălzire. Această metodă nu se poate aplica anumitor substanțe puternic colorate.
1.4.2. Metode cu suprafață încălzită
1.4.2.1. Metoda bancului de încălzire Kofler
Bancul de încălzire Kofler este compus din două piese cu conductivitate termică diferită care se încălzesc electric. Bancul este construit astfel încât gradientul de temperatură să fie aproape linear pe toată lungimea. Temperatura acestui banc de încălzire poate fi determinată de la 283 la 573 K datorită unui dispozitiv de citire a temperaturii format dintr-un cursor cu ac indicator și o riglă gradată concepute special pentru bancul în cauză. Pentru a determina un punct de topire, este suficientă depunerea unui strat fin de substanță direct pe suprafața bancului. În câtva secunde se formează o linie fină de diviziune între faza fluidă și faza solidă. Temperatura la linia de diviziune se citește plasând acul indicator în dreptul acesteia.
1.4.2.2. Microscop pentru determinarea punctului de topire
Pentru determinarea punctelor de topire cu cantități foarte mici de substanță se folosesc câteva tipuri de microscoape optice cu încălzire. Temperatura se măsoară în general cu ajutorul unui termocuplu sensibil, dar și cu ajutorul unui termometru cu mercur. Dispozitivul tip pentru determinarea punctului de topire prin microscopie optică la cald este format dintr-o incintă cu încălzire, care conține o placă de metal deasupra căreia se pune eșantionul, deja așezat pe o lamă transparentă. În centrul plăcii metalice există un orificiu care permite trecerea luminii provenite din oglinda de iluminare a microscopului. În timpul utilizării, incinta se închide cu ajutorul unei plăci de sticlă pentru a împiedica circulația aerului în câmpul de lucru.
Încălzirea eșantionului se reglează cu ajutorul unui reostat. Pentru măsurători foarte precise la substanțele anizotrope optic se poate folosi lumina polarizată.
1.4.2.3. Metoda meniscului
Această metodă se aplică în special poliamidelor.
Se determină temperatura la care se observă cu ochiul liber deplasarea unui menisc de ulei de silicon, prins între o suprafață caldă și o lamelă plasată peste eșantionul de poliamidă de testat.
1.4.3. Metoda de determinare a punctului de congelare
Se introduce eșantionul într-o eprubetă specială și se așează într-un aparat care permite determinarea punctului de congelare. Se agită ușor eprubeta pe parcursul răcirii, iar temperatura este măsurată la intervale adecvate. Din momentul în care temperatura rămâne constantă la câteva citiri, valoarea acesteia este considerată punct de congelare (după corecția termometrică).
Trebuie evitată răcirea forțată prin menținerea echilibrului între faza solidă și cea lichidă.
1.4.4. Analiza termică
1.4.4.1. Analiza termică diferențială (DTA)
Această tehnică înregistrează diferența de temperatură dintre eșantion și un material de referință, în funcție de temperatură, atunci când substanța și materialul de referință sunt supuse aceluiași regim termic controlat. Atunci când eșantionul suferă o transformare ce presupune o modificare de entalpie, acea modificare este indicată prin îndepărtarea endotermă (topire) sau exotermă (congelare) de linia de referință a temperaturii.
1.4.4.2. Calorimetrie diferențială (DSC)
Această tehnică înregistrează diferența dintre cantitățile de energie absorbite de eșantion și un material de referință în funcție de timp, atunci când eșantionul și materialul de referință sunt supuse aceluiași regim de temperatură controlată. Această energie reprezintă energia necesară pentru ca diferența de temperatură dintre substanță și materialul de referință să devină nulă. Atunci când eșantionul suferă o transformare care implică o modificare de entalpie, acea modificare este indicată prin îndepărtarea endotermă (topire) sau exotermă (congelare) de la linia de referință a fluxului termic.
1.4.5. Punctul de curgere
Această metodă a fost elaborată pentru a fi folosită în cazul uleiurilor din petrol și se utilizează în cazul substanțelor uleioase cu temperaturi de topire scăzute.
După o încălzire preliminară, eșantionul se răcește cu o viteză specifică și se examinează din punctul de vedere al caracteristicilor de curgere la intervale de 3 K. Cea mai scăzută temperatură la care se mai observă o deplasare a substanței se înregistrează ca punct de curgere.
1.5. CRITERII DE CALITATE
Aplicabilitatea și acuratețea diferitelor metode folosite pentru determinarea punctului de topire/intervalului de topire sunt prezentate în următorul tabel:
TABEL: APLICABILITATEA METODELOR
A. Metode capilare
|
Metodă de măsurare |
Substanțe ușor pulverizabile |
Substanțe greu pulverizabile |
Interval de temperatură |
Acuratețea estimării (1) |
Standarde existente |
|
Dispozitiv prevăzut cu baie de lichid |
Da |
Numai câteva |
273 la 573 K |
± 0,3 K |
JIS K 0064 |
|
Dispozitiv prevăzut cu bloc metalic |
Da |
Numai câteva |
293 la > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Detecție fotoelectrică |
Da |
Mai multe cu dispozitive de aplicare |
253 la 573 K |
± 0,5 K |
|
|
(1) În funcție de tipul de instrument și gradul de puritate a substanței. |
|||||
B. Metoda cu suprafață încălzită și metoda punctului de congelare
|
Metodă de măsurare |
Substanțe ușor pulverizabile |
Substanțe greu pulverizabile |
Interval de temperatură |
Acuratețea estimării (1) |
Standarde existente |
|
Banc de încălzire Kofler |
Da |
N u |
283 la > 573 K |
± 1 K |
ANSI/ASTM D 3451-76 |
|
Microscop pentru determinarea punctului de topire |
Da |
Numai la câteva |
273 la > 573 K |
± 0,5 K |
DIN 53736 |
|
Metoda meniscului |
Nu |
Special pentru poliamide |
293 la > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Metode de determinare a punctului de congelare |
Da |
Da |
223 la 573 K |
± 0,5 K |
ex. BS 4695 |
|
(1) În funcție de tipul de instrument și gradul de puritate al substanței. |
|||||
C. Metode de analiză termică
|
Metodă de măsurare |
Substanțe ușor pulverizabile |
Substanțe greu pulverizabile |
Interval de temperatură |
Acuratețea estimării (1) |
Standarde existente |
|
Analiza termică diferențială |
Da |
Da |
173 la 1 273 K |
până la 600 K ± 0,5 K până la 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
Calorimetrie diferențială |
Da |
Da |
173 la 1 273 K |
până la 600 K ± 0,5 K până la 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
(1) În funcție de tipul de instrument și gradul de puritate al substanței. |
|||||
D. Punct de curgere
|
Metodă de măsurare |
Substanțe ușor pulverizabile |
Substanțe greu pulverizabile |
Interval de temperatură |
Acuratețea estimării (1) |
Standarde existente |
|
Punct de curgere |
Pentru uleiuri petroliere și substanțe uleioase |
Pentru uleiuri petroliere și substanțe uleioase |
223 la 323 K |
± 0,3 K |
ASTM D 97-66 |
|
(1) În funcție de tipul de instrument și gradul de puritate al substanței. |
|||||
1.6. DESCRIEREA METODELOR
Modurile de operare corespunzătoare aproape tuturor metodelor de testare au fost descrise în standardele internaționale și naționale (a se vedea apendicele).
1.6.1. Metode cu tub capilar
Atunci când sunt supuse unei creșteri de temperatură, substanțele fin pulverizate prezintă de regulă stadiile de topire prezentate în figura 1.

În timpul determinării punctului de topire se înregistrează temperaturile corespunzătoare primului și ultimului stadiu al procesului.
1.6.1.1. Instalație pentru determinarea punctului de topire cu baie de lichid
Figura 2 descrie un tip de aparat standardizat, confecționat din sticlă (JIS K 0064). Toate specificațiile sunt exprimate în milimetri.
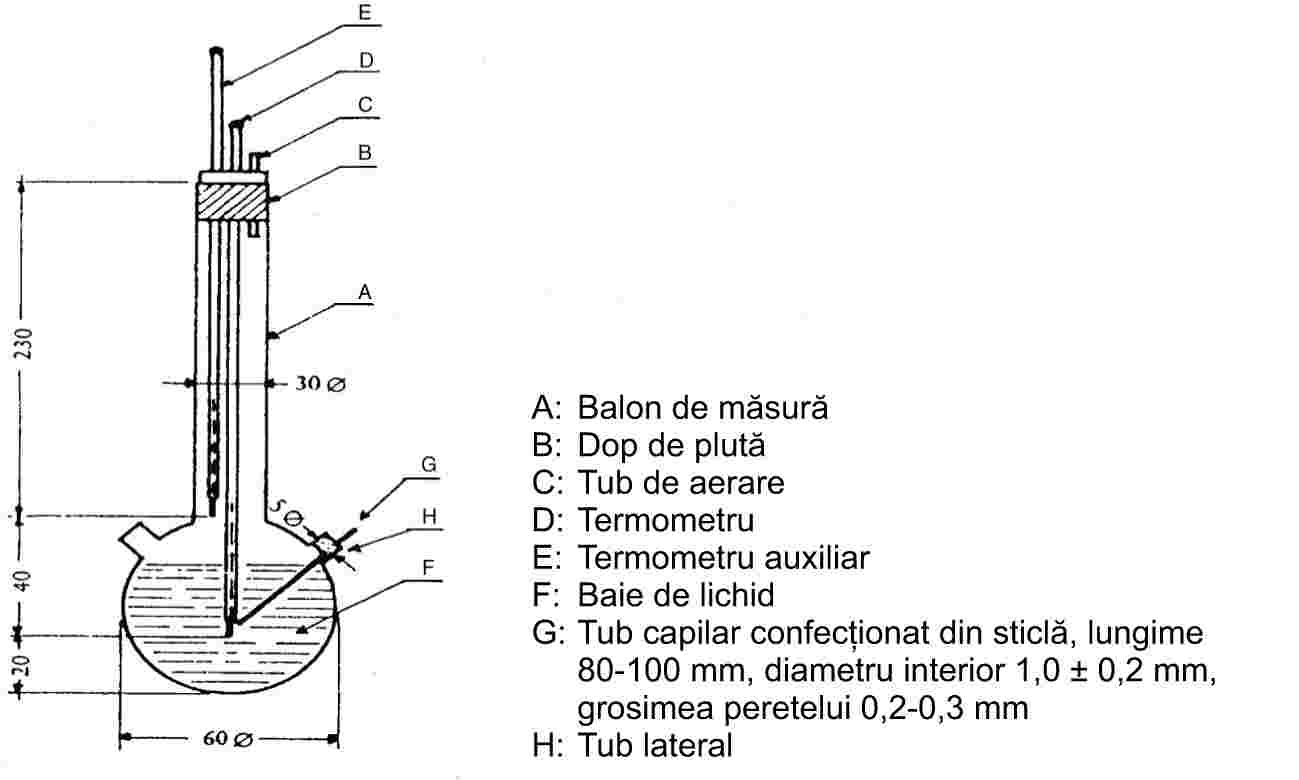
Lichidul care se folosește se alege în funcție de punctul de topire care urmează să fie determinat, de exemplu parafină lichidă pentru punctele de topire care nu depășesc 473 K, ulei de silicon pentru punctele de topire care nu depășesc 573 K.
Se poate folosi un amestec din trei părți de acid sulfuric și două părți de sulfat de potasiu (în proporție masică) pentru punctele de topire care depășesc 523 K. În cazul utilizării unui astfel de amestec, se vor lua măsurile de precauție corespunzătoare.
Pot fi folosite numai acele termometre care îndeplinesc cerințele următoarelor standarde sau ale standardelor echivalente:
ASTM E 1-71, DIN 12770, JIS K 8001.
Substanța uscată se pulverizează fin într-un mojar și se introduce într-un tub capilar, închis la un capăt, astfel încât înălțimea de umplere să fie de aproximativ 3 mm după ce substanța a fost compactată. Pentru a obține un eșantion uniform compactat, tubul capilar trebuie să fie lăsat să cadă de la o înălțime de aproximativ 700 mm, printr-un tub de sticlă vertical pe o sticlă de ceas.
Tubul capilar plin este plasat în baie astfel încât partea centrală a rezervorului de mercur al termometrului să fie în contact cu partea tubului capilar care este amplasat eșantionul. De obicei, tubul capilar se introduce în baie la aproximativ 10 K sub punctul de topire.
Lichidul băii se încălzește astfel încât creșterea temperaturii să fie de 3 K/min. Lichidul trebuie agitat. La aproximativ 10 K sub temperatura presupusă de topire, viteza de creștere a temperaturii se stabilește la maximum 1 K pe minut.
Calculul punctului de topire este redat mai jos:
T = TD + 0,00016 (TD – TE) × n
unde:
|
T |
= |
temperatura de topire corectată, exprimată în K |
|
TD |
= |
temperatura citită la termometrul D, exprimată în K |
|
TE |
= |
temperatura citită la termometrul E, exprimată în K |
|
n |
= |
numărul de gradații ale coloanei de mercur citite pe tija termometrului D, aflate deasupra lichidului. |
1.6.1.2. Dispozitive cu bloc metalic pentru măsurarea punctului de topire
Aparatul cuprinde:
— un bloc metalic cilindric, a cărui parte superioară este scobită și formează o incintă de încălzire (a se vedea figura 3);
— un dop metalic prevăzut cu două sau mai multe orificii care permit introducerea tuburilor în bloc;
— un sistem de încălzire a blocului metalic care poate fi format dintr-o rezistență electrică în bloc;
— un reostat pentru reglarea puterii, în cazul unei încălziri electrice;
— patru ferestre din sticlă termorezistentă, pe pereții laterali ai incintei, dispuse simetric în unghi drept. În fața uneia din ferestre se montează un ocular pentru observarea tubului capilar. Celelalte trei ferestre permit iluminarea interiorului incintei cu ajutorul unor lămpi;
— un tub capilar din sticlă termorezistentă închis la un capăt (a se vedea punctul 1.6.1.1).
A se vedea standardele menționate la punctul 1.6.1.1. Se pot folosi, de asemenea, elemente termoelectrice de precizie echivalentă.

1.6.1.3. Detecție fotoelectrică
Aparatură și mod de operare:
Aparatul este format dintr-o incintă metalică prevăzută cu un sistem de încălzire automatizat. Se umplu trei tuburi capilare după cum s-a indicat la punctul 1.6.1.1 și se pun în cuptor.
Pentru calibrarea aparatului se folosesc mai multe creșteri liniare de temperatură, iar creșterea de temperatură convenabilă este reglată electric la o viteză constantă și liniară, preselectată. Înregistratoarele indică temperatura reală a cuptorului și temperatura substanței în tuburile capilare.
1.6.2. Metodele suprafeței încălzite
1.6.2.1. Bancul de încălzire Kofler
A se vedea apendicele.
1.6.2.2. Microscopul pentru determinarea punctului de topire
A se vedea apendicele.
1.6.2.3. Metoda meniscului (poliamide)
A se vedea apendicele.
În jurul punctului de topire, creșterea temperaturii trebuie să fie mai mică de 1 K pe minut.
1.6.3. Metode pentru determinarea punctului de congelare
A se vedea apendicele.
1.6.4. Analiza termică
1.6.4.1. Analiza termică diferențială
A se vedea apendicele.
1.6.4.2. Calorimetria diferențială
A se vedea apendicele.
1.6.5. Determinarea punctului de curgere
A se vedea apendicele.
2. DATE
În unele cazuri se impune corecția termometrică.
3. RAPORT
Raportul de testare trebuie să conțină, dacă este posibil, informațiile următoare:
— metoda folosită;
— specificațiile precise ale substanței (identitate și impurități) și etapa de purificare preliminară, dacă există;
— estimare acurateței metodei.
Punctul de topire indicat în raport este media a cel puțin două măsurători care se găsesc în intervalul de precizie estimat (a se vedea tabelele).
Dacă diferența dintre temperatura din stadiul inițial și cea din stadiul final al topirii se află în limitele de precizie a metodei, temperatura de topire în stadiul final este considerată ca punct de topire; în caz contrar, se indică în raport cele două temperaturi.
Dacă substanța se descompune sau sublimează înainte de a atinge punctul de topire, se indică în raport temperatura la care s-a observat efectul.
Trebuie prezentate toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cele cu privire la impuritățile și starea fizică a substanței.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline. 102, Decision of the Council C(81) 30 final.
2. IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London, 1975, vol. II, p. 803-834.
3. R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed, Interscience Publ, New York, 1959, vol. I, Part I, Chapter VII.
4. IUPAC, Physicochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, vol. 48, p. 505-515.
Apendice
Pentru mai multe detalii tehnice, pot fi consultate următoarele standarde.
1. Metodele tubului capilar
1.1. Dispozitive pentru măsurarea punctului de topire cu baie de lichid
|
ASTM E 324-69 |
Standard test method for relative initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapillarverfarehn |
|
JIS K 00-64 |
Testing methods for melting point of chemical products |
1.2. Dispozitive pentru determinarea punctului de topire cu bloc metalic fierbinte
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point” |
2. Metodele suprafeței calde
2.1. Banc de încălzire Kofler
|
ANSI/ASTM D 3451-76 |
Standard recommended practices for testing polymeric powder coatings |
2.2. Microscop pentru determinarea punctului de topire
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3. Metoda meniscului (poliamide)
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point” |
|
ANSI/ASTM D 2133-66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51-050 |
Résines de polyamides. Détermination du „point de fusion” méthode du menisque |
3. Metode pentru determinarea punctului de congelare
|
BS 4633 |
Method for the determination of crystallising point |
|
BS 4695 |
Method for Determination of Melting Point of petroleum wax (Cooling Curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de pétrole: détermination de la température de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsäuren |
|
NF T 60-114 |
Point de fusion des paraffines |
|
NF T 20-051 |
Méthode de détermination du point de cristallisation (point de congelation) |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Analiza termică
4.1. Analiza termică diferențială
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2. Calorimetrie diferențială
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Determinarea punctului de curgere
|
NBN 52014 |
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d'écoulement limite – Monsterneming en ontleding van aardolieproducten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils – Determination of pour point |
A.2. PUNCTUL DE FIERBERE
1. METODĂ
Majoritatea metodelor descrise se bazează pe orientările OCDE privind testele (1). Principiile fundamentale sunt prezentate în referințele bibliografice 2 și 3.
1.1. INTRODUCERE
Metodele și aparatele descrise în continuare pot fi aplicate substanțelor lichide și celor cu punct de topire scăzut, care nu intră în reacție chimică sub punctul de fierbere (de exemplu, auto-oxidare, izomerizări, degradare etc.). Metodele se aplică substanțelor lichide pure și impure.
Se acordă atenție descrierii metodelor care folosesc detecția fotoelectrică și analiza termică deoarece acestea permit determinarea nu numai a punctului de fierbere, ci și a punctului de topire. În plus, măsurările se pot efectua în mod automat.
„Metoda dinamică” are avantajul că poate fi folosită și pentru determinarea presiunii vaporilor, iar aducerea temperaturii de fierbere la condiții normale de presiune (101,325 kPa) nu este necesară, deoarece se poate menține presiunea normală pe parcursul măsurării, folosind un manometru de contact.
Observații:
Influența impurităților asupra determinării punctului de fierbere depinde în mare măsură de natura impurităților. Atunci când există în eșantion impurități volatile care ar putea afecta rezultatele, substanța se purifică.
1.2. DEFINIȚII ȘI UNITĂȚI
Punctul de fierbere normal se definește ca temperatura la care presiunea de vapori a lichidului este 101,325 kPa.
Dacă punctul de fierbere nu se măsoară la presiune atmosferică normală, relația între temperatură și presiunea de vapori este dată de ecuația Clausius-Clapeyron:
![]()
unde:
|
P |
= |
presiunea de vapori a substanței, exprimată în pascali |
|
ΔHv |
= |
căldura sa de vaporizare, exprimată în J mol–1 |
|
R |
= |
constanta universală a gazelor = 8,314 J mol–1 K–1 |
|
T |
= |
temperatura termodinamică, exprimată în K |
Indicarea punctului de fierbere este însoțită de precizarea presiunii ambiante în timpul măsurătorii.
Formule de conversie
Presiunea (unități: kPa)
|
100 kPa |
= |
1 bar = 0,1 MPa (folosirea „barului” este încă permisă, dar nu este recomandată) |
|
133 Pa |
= |
1 mm Hg = 1 Torr (unitățile „mm Hg” și „Torr” nu sunt permise). |
|
1 atm |
= |
atmosferă standard = 101 325 Pa (unitatea „atm” nu este permisă). |
Temperatura (unități: K)
t = T – 273,15
|
t |
: |
temperatura Celsius, exprimată în grade Celsius ( oC) |
|
T |
: |
temperatura termodinamică, exprimată în grade Kelvin (K) |
1.3. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință în toate cazurile în care se studiază o nouă substanță. Acestea trebuie în special să servească la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode.
Anumite substanțe de etalonare sunt menționate în metodele enumerate în apendice.
1.4. PRINCIPIUL METODEI DE TESTARE
Cinci metode pentru determinarea punctului de fierbere (a intervalului de fierbere) se bazează pe măsurătoarea temperaturii de fierbere, alte două se bazează pe analiza termică.
1.4.1. Determinarea prin folosirea ebuliometrului
Ebuliometrele au fost create inițial pentru determinarea masei moleculare prin creșterea punctului de fierbere, dar sunt adecvate și pentru măsurarea exactă a punctului de fierbere. Un aparat foarte simplu este descris în standardul ASTM D 1120-72 (a se vedea apendicele). Lichidul se încălzește în acest aparat în condiții de echilibru la presiune atmosferică, până la fierbere.
1.4.2. Metoda dinamică
Această metodă prevede măsurarea temperaturii de recondensare a vaporilor cu ajutorul unui termocuplu montat în reflux în timpul fierberii. În această metodă se poate modifica presiunea.
1.4.3. Metoda distilării pentru punctul de fierbere
Această metodă prevede distilarea lichidului, măsurarea temperaturii de recondensare a vaporilor și determinarea cantității de distilat.
1.4.4. Metoda Siwoloboff
Se încălzește un eșantion într-o eprubetă care este imersată într-o baie cu lichid încălzit. Se scufundă în eprubetă un capilar închis, care conține o bulă de aer în partea inferioară.
1.4.5. Detecția fotoelectrică
Conform principiului Siwoloboff, măsurarea fotoelectrică automată se face folosind ascensiunea bulelor.
1.4.6. Analiza termică diferențială
Această tehnică înregistrează diferența de temperatură dintre substanță și un material de referință în funcție de temperatură în timp ce substanța și materialul de referință sunt supuse aceluiași regim termic controlat. Atunci când eșantionul trece printr-o stare de tranziție ce presupune o variație de entalpie, această modificare este indicată prin endotermică (fierbere) de la linia de referință a temperaturii.
1.4.7. Calorimetria diferențială
Această tehnică înregistrează diferența dintre cantitățile de energie absorbite de o substanță și un material de referință în funcție de timp, atunci când eșantionul și materialul de referință sunt supuse aceluiași regim de temperatură controlată. Această energie reprezintă energia necesară pentru ca diferența de temperatură dintre substanță și materialul de referință să devină nulă. Atunci când eșantionul suferă o transformare care implică o modificare de entalpie, acea modificare este indicată prin îndepărtarea endotermă (fierbere) de la linia de referință a fluxului termic.
1.5. CRITERII DE CALITATE
Aplicabilitatea și precizia diferitelor metode folosite la determinarea temperaturii/intervalului de fierbere sunt prezentate în tabelul 1.
Tabelul 1
Compararea metodelor
|
Metodă de măsurare |
Precizie estimată |
Standard existent |
|
Ebuliometru |
ASTM D 1120-72 (1) |
|
|
Metoda dinamică |
± 0,5 K (până la 600 K) (2) |
|
|
Metoda distilării (domeniu de fierbere) |
± 0,5 K (până la 600 K) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Conform cu Siwoloboff |
± 2 K (până la 600 K) (2) |
|
|
Detecție fotoelectrică |
± 0,3 K (până la 373 K) (2) |
|
|
Calorimetrie termică diferențială |
± 0,5 K (până la 600 K) ± 2,0 K (până la 1 273 K) |
ASTM E 537-76 |
|
Calorimetrie diferențială |
± 0,5 K (până la 600 K) ± 2,0 K (până la 1 273 K) |
ASTM E 537-76 |
|
(1) Această precizie este valabilă numai pentru dispozitive simple cum ar fi cel descris în ASTM D 1120-72; aceasta poate fi îmbunătățită cu ebuliometre mult mai sofisticate. (2) Valabil numai pentru substanțe pure. Folosirea în alte circumstanțe trebuie să fie justificată. |
||
1.6. DESCRIEREA METODELOR
Modurile de operare în unele metode de testare sunt descrise în standardele naționale și internaționale (a se vedea apendicele).
1.6.1. Ebuliometru
A se vedea apendicele.
1.6.2. Metoda dinamică
A se vedea metoda de analiză A.4 pentru determinarea presiunii de vapori.
Se înregistrează temperatura de fierbere observată la o presiune aplicată de 101,325 kPa.
1.6.3. Metoda distilării (intervalul de fierbere)
A se vedea apendicele.
1.6.4. Metoda Siwoloboff
Se introduce eșantionul într-o eprubetă cu un diametru de cca. 5 milimetri și se încălzește într-un aparat care servește la determinarea punctului de topire (figura 1).
Figura 1 prezintă schema unui aparat standardizat de măsurare a punctului de topire și fierbere (JIS K 0064) (confecționat din sticlă, toate specificațiile sunt în milimetri).

Se scufundă un tub capilar (capilar de fierbere), închis la cca. 1 centimetru deasupra extremității inferioare, în eprubeta cu substanța de testat. Nivelul până la care se adaugă substanță de testat este astfel încât partea etanșată a capilarului să fie sub nivelul suprafeței lichidului. Eprubeta se atașează la termometru cu o bandă de cauciuc sau se fixează cu un suport de partea laterală (a se vedea figura 2).
|
Figura 2 Metoda Siwoloboff |
Figura 3 Metoda modificată |
|
|
|
Lichidul din baie se alege în funcție de punctul de fierbere. La temperaturi de până la 573 K se folosește uleiul de silicon. Parafina lichidă se poate folosi numai până la 473 K. Încălzirea băii de lichid se reglează pentru început la o creștere de temperatură de 3 K/min. Lichidul din baie trebuie agitat. La aproximativ 10 K sub punctul de fierbere presupus, încălzirea se reduce astfel încât viteza de creștere a temperaturii să fie mai mică de 1 K/min. Atunci când se apropie de punctul de fierbere, bulele încep să se ridice rapid din capilar.
Punctul de fierbere este acea temperatură la care, în cazul unei răciri momentane, șiragul de bule se întrerupe, iar fluidul începe brusc să se ridice în capilar. Temperatura citită în acel moment pe termometru indică punctul de fierbere a substanței.
În metoda modificată (a se vedea figura 3), punctul de fierbere se determină într-un tub capilar de măsurat la punctul de topire. Extremitatea inferioară a acestuia se prelungește cu un vârf cu o lungime de aproximativ 2 cm (a) în interiorul căruia se aspiră o cantitate mică de substanță de testat. Se etanșează vârful prin încălzire, captându-se o bulă mică de aer în interior. În timpul încălzirii, în aparatul de măsurat punctul de topire (b), bula de aer se dilată. Punctul de fierbere corespunde temperaturii la care eșantionul de substanță atinge nivelul suprafeței lichidului din baie (c).
1.6.5. Detecția fotoelectrică
Se încălzește un eșantion din substanța de testat într-un tub capilar așezat în interiorul unui bloc metalic de încălzire.
Prin orificiile practicate în bloc, un fascicol de lumină este trimis prin substanță către o celulă fotoelectrică calibrată cu precizie.
În timp ce crește temperatura eșantionului, bule de aer individuale încep să se ridice din tubul capilar. Când punctul de fierbere este atins, numărul de bule crește substanțial. Modificarea intensității luminoase care urmează este înregistrată de către celulă, care trimite un semnal de oprire indicatorului de temperatură, respectiv un termometru cu rezistență de platină plasat în interiorul blocului.
Această metodă este deosebit de utilă deoarece permite efectuarea unor determinări sub nivelul temperaturii ambiante până la 253,15 K (– 20 oC), fără nicio modificare a aparatului. Este necesar doar ca aparatul să fie așezat într-o baie de răcire.
1.6.6. Analize termice
1.6.6.1. Analiza termică diferențială
A se vedea apendicele.
1.6.6.2. Calorimetria diferențială
A se vedea apendicele.
2. DATE
Pentru diferențe mici față de presiunea normală (maximum ± 5 kPa) punctul de fierbere se poate corecta (Tn) cu ajutorul ecuației Sidney-Young:
Tn = T + (fT × Δp)
unde:
|
Δp |
= |
(101,325 – p) (atenție la semn) |
|
p |
= |
presiunea măsurată, în kPa |
|
fT |
= |
viteza de variație a punctului de fierbere cu presiunea, în K/kPa |
|
T |
= |
temperatura de fierbere măsurată, în K |
|
Tn |
= |
temperatura de fierbere corectată la presiunea normală, în K |
Pentru numeroase substanțe, factorii de corecție a temperaturii fT și ecuațiile pentru aproximarea acestora figurează în standardele naționale și internaționale mai sus menționate.
De exemplu, metoda DIN 53171 menționează următoarele corecții aproximative pentru solvenți conținuți în vopsele.
Tabelul 2
Temperatura – factori de corecție fT
|
Temperatura T (K) |
Factori de corecție fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,44 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. RAPORT
Raportul de testare trebuie să conțină, dacă este posibil, informațiile următoare:
— metoda folosită;
— specificațiile precise ale substanței (identitate și impurități) și etapa de purificare preliminară, dacă există;
— estimarea acurateței metodei.
Punctul de fierbere indicat în raport este media a cel puțin două măsurători care se găsesc în intervalul de precizie estimat (a se vedea tabelul 1).
Se prezintă punctele de fierbere măsurate și media lor, iar presiunea (presiunile) la care s-au făcut măsurătorile se exprimă în kPa. Este preferabil ca presiunea să fie apropiată de presiunea atmosferică normală.
Trebuie prezentate toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cele cu privire la impurități și la starea fizică a substanței.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 103, Decision of the Council C(81) 30 final.
2. IUPAC, B. Le Neindre, B. Vodar, editions. Experimental thermodynamics, Butterworths, London, 1975, vol. II.
3. R. Weissberger edition: Technique of organic chemistry, Physical methods of organic chemistry, Third Edition, Interscience Publications, New York, 1959, vol. I, Part I, Chapter VIII.
Apendice
Pentru mai multe date tehnice, pot fi consultate standardele următoare, de exemplu.
1. Ebuliometru
1.1. Dispozitive cu baie de lichid
|
ASTM D 1120-72 |
Standard test method for boiling point of engine anti-freezes |
2. Metoda distilării (a intervalului de fierbere)
|
ISO/R 918 |
Test Method for Distillation (Distillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Losungsmittel für Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation: détermination du rendement et de l'intervalle de distillation |
3. Analiza termică diferențială și calorimetria diferențială
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
A.3. DENSITATEA RELATIVĂ
1. METODĂ
Majoritatea metodelor descrise se bazează pe orientările OCDE privind testele (1). Principiile fundamentale sunt menționate în referința bibliografică 2.
1.1. INTRODUCERE
Metodele descrise pentru determinarea densității relative sunt aplicabile substanțelor solide și lichide, fără nicio restricție cu privire la gradul de puritate. Diferitele metode care pot fi folosite sunt prezentate în tabelul 1.
1.2. DEFINIȚII ȘI UNITĂȚI
Densitatea relativă D20 4 a solidelor sau lichidelor reprezintă raportul dintre masa unui volum de substanță, determinată la 20 oC, și masa aceluiași volum de apă, determinată la 4 oC. Densitatea relativă este un număr adimensional.
Densitatea ρ a unei substanțe este raportul dintre masa acesteia m și volumul său v.
Densitatea ρ este exprimată în unități SI în kg/m3.
1.3. SUBSTANȚE DE REFERINȚĂ (1) (3)
Nu este necesar să se folosească substanțe de referință de fiecare dată când se studiază o substanță nouă. Acestea trebuie să servească în special la verificarea periodică a acurateței metodei și să permită comparația cu rezultatele obținute prin alte metode.
1.4. PRINCIPIUL METODELOR
Se folosesc 4 clase de metode.
1.4.1. Metode prin flotabilitate
1.4.1.1. Hidrometrul (pentru substanțe lichide)
Se pot obține determinări ale densității suficient de precise și de rapide cu ajutorul unor hidrometre plutitoare care permit deducerea densității unui lichid din adâncimea de imersiune indicată pe o scară gradată.
1.4.1.2. Balanța hidrostatică (pentru substanțe lichide și solide)
Diferența dintre masa unui eșantion măsurate în aer și într-un lichid corespunzător (de exemplu apa) poate fi folosită pentru a determina densitatea acestuia.
În cazul solidelor, densitatea măsurată nu este reprezentativă decât în cazul acelui eșantion. Pentru a determina densitatea unui lichid se cântărește un corp cu volum V cunoscut, întâi în aer, apoi în lichid.
1.4.1.3. Metoda corpului scufundat (pentru substanțe lichide) (4)
În această metodă, densitatea unui lichid este determinată ca diferența dintre rezultatele cântăririlor lichidului înainte și după imersia unui corp de volum cunoscut în acest lichid.
1.4.2. Metode picnometrice
În cazul solidelor sau al lichidelor se pot folosi picnometre cu forme diferite, ale căror volume sunt cunoscute. Densitatea se determină pornind de la diferența de greutate între picnometrul plin și picnometrul gol, pe de o parte, și volumul cunoscut al acestuia, pe de altă parte.
1.4.3. Picnometru de comparație cu aer (pentru solide)
Densitatea unui solid cu orice formă poate fi măsurată, la temperatura camerei cu ajutorul unui picnometru de comparație cu gaz. Volumul unei substanțe în aer sau în gaz inert se măsoară într-un cilindru gradat, cu volum variabil calibrat. Pentru determinarea densității, după măsurarea volumului se măsoară și masa solidului.
1.4.4. Densimetru oscilant (5) (6) (7)
Densitatea unui lichid se poate măsura cu densimetrul oscilant. Un oscilator mecanic în formă de U vibrează cu o frecvență de rezonanță care depinde de masa sa. Introducerea unui eșantion de substanță modifică frecvența de rezonanță a oscilatorului. Acesta trebuie etalonat cu ajutorul a două substanțe ale căror densități se cunosc. Substanțele se aleg astfel încât densitățile acestora să acopere intervalul de măsură.
1.5. CRITERII DE CALITATE
Aplicabilitatea diferitelor metode folosite pentru determinarea densității relative este prezentată în tabel.
1.6. DESCRIEREA METODELOR
Standardele menționate ca exemple, care se pot consulta pentru mai multe detalii tehnice, sunt enumerate în apendice.
Testele se efectuează la o temperatură de 20 oC și trebuie să cuprindă cel puțin două măsurători.
2. DATE
A se vedea standardele.
3. RAPORT
Raportul de testare trebuie să conțină, dacă este posibil, informațiile următoare:
— metoda folosită;
— specificațiile precise ale substanței (identitate și impurități) și etapa de purificare preliminară, dacă există.
Densitatea relativă
![]()
se indică în conformitate cu definiția de la punctul 1.2, împreună cu starea fizică a substanței.
Trebuie prezentate toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cele cu privire la impuritățile și starea fizică a substanței.
Tabel
Aplicabilitatea metodelor
|
Metoda de măsurare |
Densitate |
Vâscozitatea dinamică maximă posibilă |
Standarde existente |
|
|
Solid |
Lichid |
|||
|
1.4.1.1. Hidrometru |
Da |
5 Pa s |
ISO 387 ISO 649-2 NF T 20-050 |
|
|
1.4.1.2. Balanța hidrostatică |
||||
|
(a) solide |
Da |
ISO 1183(A) |
||
|
(b) lichide |
Da |
5 Pa s |
ISO 901 și 758 |
|
|
1.4.1.3. Metoda plutitorului |
Da |
20 Pa s |
DIN 53217 |
|
|
1.4.2. Picnometru |
ISO 3507 |
|||
|
(a) solide |
Da |
ISO 1183(B) NFT 20-053 |
||
|
(b) lichide |
Da |
500 Pa s |
ISO 758 |
|
|
1.4.3. Picnometru de comparație cu aer |
Da |
DIN 55990 Teil 3 DIN 53243 |
||
|
1.4.4. Densimetru oscilant |
Da |
5 Pa s |
||
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 109, Decision of the Council C(81) 30 final.
2. R. Weissberger ed., Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ., New York, 1959, vol. I, Part 1.
3. IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, p. 508.
4. Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm, 1979, vol. II, p. 427-430.
5. Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19, p. 297-302.
6. Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen – Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, p. 717-726.
7. Riemann, J., Der Einsatz der digital en Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, p. 253-255.
Apendice
Pentru mai multe detalii tehnice pot fi consultate următoarele standarde suplimentare.
1. Metode prin flotabilitate
1.1. Hidrometrul
|
DIN 12790, ISO 387 |
Hydrometer; general instructions |
|
DIN 12791 |
Part I: Density hydrometers; construction, adjustment and use Part II: Density hydrometers; standardised sizes, designation Part III: Use and test |
|
ISO 649-2 |
Laboratory glassware: Density hydrometers for general purpose |
|
NF T 20-050 |
Chemical products for industrial use – Determination of density of liquids – Areometric method |
|
DIN 12793 |
Laboratory glassware: range find hydrometers |
1.2. Balanța hidrostatică
|
ISO 1183 |
Method A: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-049 |
Chemical products for industrial use – Determination of the density of solids other than powders and cellular products – Hydrostatic balance method |
|
ASTM-D-792 |
Specific gravity and density of plastics by displacement |
|
DIN 53479 |
Testing of plastics and elastomers; determination of density |
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Testing of mineral oils and related materials; determination of density |
|
ASTM D 941-55, ASTM D 1296-67 și ASTM D 1481-62 |
|
|
ASTM D 1298 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
|
BS 4714 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
1.3. Metoda corpului scufundat
|
DIN 53217 |
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method |
2. Metode picnometrice
2.1. Pentru substanțe lichide
|
ISO 3507 |
Pycnometers |
|
ISO 758 |
Liquid chemical products; determination of density at 20 oC |
|
DIN 12797 |
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) |
|
DIN 12798 |
Lipkin pycnometer (for liquids with a kinematic viscosity of less than 100.10–6 m2 s–1 at 15 oC) |
|
DIN 12800 |
Sprengel pycnometer (for liquids as DIN 12798) |
|
DIN 12801 |
Reischauer pycnometer (for liquids with a kinematic viscosity of less than 100.10–6 m2 s–1 at 20 oC, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 oC) |
|
DIN 12806 |
Hubbard pycnometer (for viscous liquids of all types which do not have a too high vapour pressure, in particular also for paints, varnishes and bitumen) |
|
DIN 12807 |
Bingham pycnometer (for liquids, as in DIN 12801) |
|
DIN 12808 |
Jaulmes pycnometer (in particular for ethanol – water mixture) |
|
DIN 12809 |
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous) |
|
DIN 53217 |
Testing of paints, varnishes and similar products; determination of density by pycnometer |
|
DIN 51757 |
Point 7: Testing of mineral oils and related materials; determination of density |
|
ASTM D 297 |
Section 15: Rubber products – chemical analysis |
|
ASTM D 2111 |
Method C: Halogenated organic compounds |
|
BS 4699 |
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) |
|
BS 5903 |
Method for determination of relative density and density of petroleum products by the capillary-stoppered pycnometer method |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
2.2. Pentru substanțe solide
|
ISO 1183 |
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
|
DIN 19683 |
Determination of the density of soils |
3. Picnometru de comparație cu aer
|
DIN 55990 |
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichtungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; chlorhaltige Polymere; Prüfung |
A.4. PRESIUNEA DE VAPORI
1. METODĂ
Prezenta metodă este echivalentă cu orientările OECD privind testele nr. 104 (2004).
1.1. INTRODUCERE
Versiunea revizuită a metodei A.4(1) include o metodă suplimentară, metoda prin efuziune: termogravimetrie izotermă, proiectată pentru substanțe cu presiuni de evaporare foarte scăzute (până la 10–10 Pa). Având în vedere necesitatea stabilirii de proceduri, în special în cazul obținerii presiunii de vapori pentru substanțele cu presiune de vapori scăzută, sunt reevaluate alte proceduri ale acestei metode în ceea ce privește intervalele diferite de aplicabilitate.
La echilibru termodinamic, presiunea de vapori a unei substanțe în stare pură este exclusiv o funcție de temperatură. Principiile fundamentale sunt descrise în literatura de specialitate (2)(3).
Nu există o singură metodă de măsurare aplicabilă întregului interval de presiuni de vapori de la < 10–10 la 105 Pa. În această metodă sunt incluse opt metode de măsurare a presiunii de vapori, care pot fi aplicate în intervale diferite de presiuni de vapori. Diferitele metode sunt comparate din punctul de vedere al aplicației și intervalului de măsurare în tabelul 1. Metodele pot fi aplicate doar în cazul compușilor care nu se descompun în condițiile testului. În cazurile în care metodele experimentale nu pot fi aplicate din motive de ordin tehnic, presiunea de vapori poate fi estimată, o metodă de estimare recomandată fiind indicată în apendice.
1.2. DEFINIȚII ȘI UNITĂȚI
Presiunea de vapori a unei substanțe este definită ca presiunea de saturație la suprafața de contact cu aerul a unei substanțe solide sau lichide.
Unitatea din Sistemul Internațional (SI) pentru presiune care trebuie folosită este pascalul (Pa). Alte unități alternative folosite de-a lungul timpului, împreună cu factorii lor de conversie, sunt:
|
1 Torr |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atmosferă |
= |
1,013 × 105 Pa |
||
|
1 bar |
= |
105 Pa |
Unitatea de măsură din SI pentru temperatură este kelvinul (K). Transformarea gradelor Celsius în kelvini are loc după formula:
T = t + 273,15
unde T reprezintă temperatura exprimată în kelvin sau temperatura termodinamică, iar t reprezintă temperatura exprimată în grade Celsius.
Tabelul 1
|
Metodă de măsurare |
Substanța |
Repetabilitate estimată |
Reproductibilitate estimată |
Interval recomandat |
|
|
solid |
lichid |
||||
|
Metoda dinamică |
Topire joasă |
Da |
Până la 25 % 1-5 % |
Până la 25 % 1-5 % |
103 Pa- 2 × 103 Pa 2 × 103 Pa- 105 Pa |
|
Metoda statică |
Da |
Da |
5-10 % |
5-10 % |
10 Pa- 105 Pa 10–2 Pa- 105 Pa (1) |
|
Metoda izoteniscopului |
Da |
Da |
5-10 % |
5-10 % |
102 Pa- 105 Pa |
|
Metoda prin efuziune: balanța pentru presiunea de vapori |
Da |
Da |
5-20 % |
Până la 50 % |
10–3-1 Pa |
|
Metoda prin efuziune: celulă Knudsen |
Da |
Da |
10-30 % |
— |
10–10-1 Pa |
|
Metoda prin efuziune: termogravimetrie izotermă |
Da |
Da |
5-30 % |
Până la 50 % |
10–10-1 Pa |
|
Metoda gazului saturat |
Da |
Da |
10-30 % |
Până la 50 % |
10–10-103 Pa |
|
Metoda rotorului |
Da |
Da |
10-20 % |
— |
10–4- 0,5 Pa |
|
(1) Când se utilizează un manometru cu capacitanță. |
|||||
1.3. PRINCIPIUL DE TESTARE
În general, presiunea de vapori este determinată la diferite temperaturi. Într-un interval limitat de temperaturi, logaritmul presiunii de vapori a unei substanțe pure este o funcție lineară a inversului temperaturii termodinamice, conform ecuației Clapeyron-Clausius simplificate:
![]()
unde:
|
p |
= |
presiunea de vapori a substanței, exprimată în pascali |
|
ΔHv |
= |
căldura de vaporizare, exprimată în J mol–1 |
|
R |
= |
constanta universală a gazelor, 8,314 J mol–1 K–1 |
|
T |
= |
temperatura în K |
1.4. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință. Acestea servesc în special la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode.
1.5. DESCRIEREA METODEI
1.5.1. Metoda dinamică (Metoda lui Cottrell)
1.5.1.1. Principiu
Presiunea de vapori este determinată prin măsurarea temperaturii de fierbere a substanței la diferite presiuni între aproximativ 103 și 105 Pa. Această metodă este recomandată, de asemenea, pentru determinarea temperaturii de fierbere. Este utilă în acest sens pentru temperaturi până la 600 K. Temperaturile de fierbere ale lichidelor sunt cu aproximativ 0,1 °C mai mari la o adâncime de 3-4 cm decât la suprafață, datorită presiunii hidrostatice a coloanei de lichid. În metoda lui Cottrell (4), termometrul este plasat în vaporii de la suprafața lichidului, iar lichidul în stare de fierbere este pompat constant pe rezervorul termometrului. Rezervorul este acoperit de un strat subțire de lichid aflat în echilibru cu vaporii la presiune atmosferică. Astfel, termometrul indică punctul de fierbere real, fără erori apărute ca urmare a supraîncălzirii sau a presiunii hidrostatice. Pompa utilizată inițial de Cottrell este ilustrată în figura 1. Tubul A conține lichidul de fierbere. Un fir de platină B fixat la baza tubului facilitează fierberea uniformă. Tubul lateral C face legătura cu un condensator, iar mantaua D previne atingerea termometrului E de către condensatul rece. Când lichidul A este la punctul de fierbere, bulele și lichidul prinse în pâlnie se scurg pe rezervorul termometrului prin cele două brațe ale pompei F.
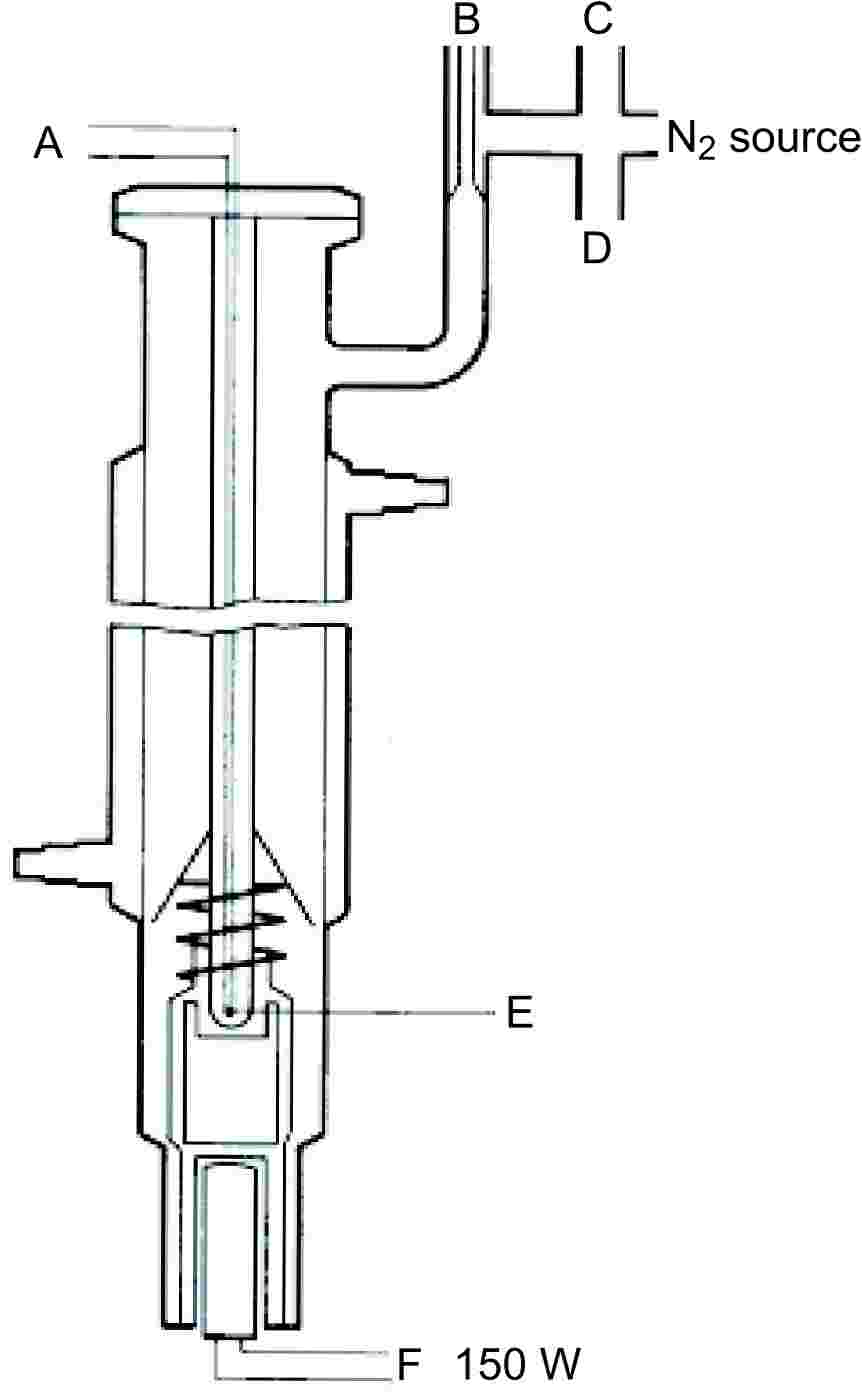
|
Figura 1 |
Figura 2 |
Pompă Cottrell (4)
A: Termocuplu
B: Volum tampon
C: Manometru
D: Vid
E: Punct de măsurare
F: Element de încălzire (circa 150 W)
1.5.1.2. Aparatură
Un aparat foarte precis, care funcționează conform principiului lui Cottrell, este ilustrat în figura 2. Este format dintr-un tub cu o zonă de fierbere în partea inferioară, un vas de răcire în zona mediană și o ieșire și o flanșă în partea superioară. Pompa Cottrell este plasată în zona de fierbere, încălzită cu ajutorul unui cartuș caloric. Temperatura se măsoară cu ajutorul unui termocuplu izolat sau a unui termometru cu rezistență introduse prin flanșa din vârf. Ieșirea se conectează la sistemul de reglare a presiunii. Acesta din urmă este format dintr-o pompă de vid, un volum tampon, un manostat pentru introducerea de azot necesar reglării presiunii și un manometru.
1.5.1.3. Procedură
Substanța se pune în zona de fierbere. Pot să apară probleme în cazul solidelor care nu sunt sub formă de pulbere, dar în unele cazuri acestea se pot rezolva încălzind agentul de răcire din mantaua de răcire. Aparatul se închide la flanșă și substanța se degazează. Această metodă nu poate fi folosită în cazul substanțelor care spumează.
Se stabilește cea mai joasă dintre presiunile dorite și se începe încălzirea. În același timp, senzorul de temperatură se conectează la contor.
Echilibrul este atins atunci când se înregistrează o temperatură de fierbere constantă la presiune constantă. Trebuie evitat fenomenul de vaporizare locală cu fierbere violentă. În plus, în vasul de răcire condensarea trebuie să fie completă. Când se determină presiunea de vapori a solidelor cu punct de topire scăzut, trebuie evitată blocarea condensatorului.
După înregistrarea acestui punct de echilibru se stabilește o presiune mai ridicată. Procesul se continuă în același fel până când se atinge o presiune de 105 Pa (aproximativ 5-10 măsurători în total). Pentru verificare, aceleași puncte de echilibru trebuie să se regăsească la descreșterea presiunii.
1.5.2. Metoda statică
1.5.2.1. Principiu
În metoda statică (5), presiunea vaporilor la echilibru termodinamic se determină la o temperatură specificată. Metoda este adecvată substanțelor și solidelor și lichidelor care conțin mai multe componente în intervalul 10–1-105 Pa, și în intervalul 1-10 Pa, cu condiția să fie aplicată atent.
1.5.2.2. Aparatură
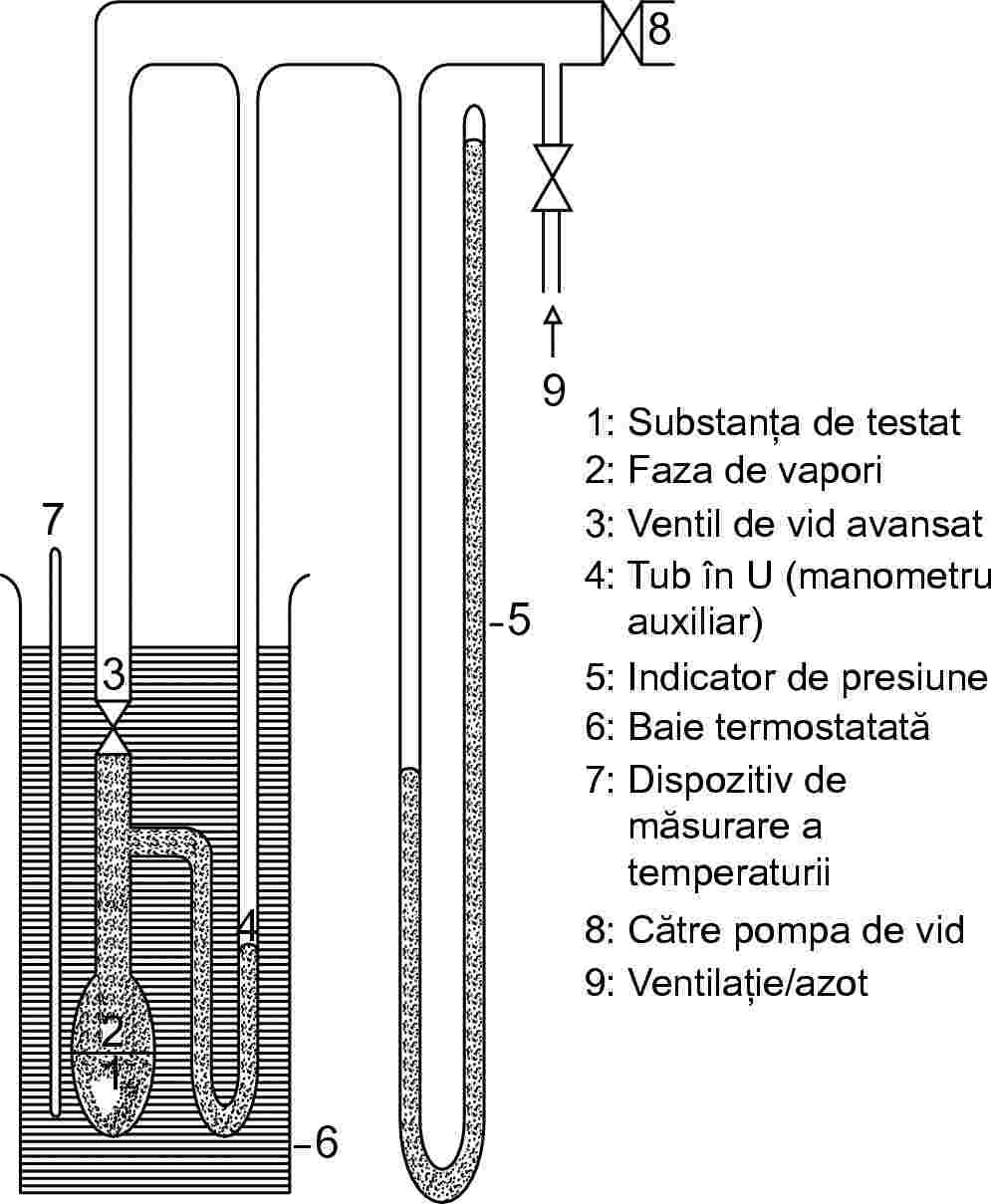
Echipamentul este format dintr-o baie termostatată (precizie de ± 0,2 K), un recipient pentru eșantion conectat la o linie de vid, un manometru și un sistem de reglare a presiunii. Vasul eșantion (figura 3a) este conectat la linia de vid prin intermediul unui ventil și al unui manometru diferențial (un tub în formă de U cu un fluid manometric adecvat) utilizat ca indicator de zero. În manometrul diferențial se pot folosi mercur, uleiuri de silicon și ftalați, în funcție de intervalul de presiune și comportamentul chimic al substanței de testat. Totuși, din rațiuni de protecție a mediului, utilizarea mercurului trebuie să fie evitată dacă este posibil. Substanța de testat nu trebuie să se dizolve perceptibil sau să reacționeze cu fluidul din tubul în formă de U. În locul tubului în formă de U se poate folosi un manometru (figura 3b). Pentru manometru, mercurul poate fi utilizat în intervalul de presiune de la normală scăzând până la 102 Pa, în timp ce uleiurile de silicon și ftalații se folosesc în intervalul de la mai puțin de 102 Pa până la 10 Pa. Există și alte tipuri de aparate de măsurare a presiunii utilizabile sub 102 Pa, precum și manometre cu membrană rezistente la temperatură care pot fi folosite chiar sub 10–1 Pa. Măsurarea temperaturii se face pe peretele exterior al vasului care conține eșantionul sau chiar în vas.
1.5.2.3. Procedură
Utilizând aparatul conform descrierii din figura 3a, se umple vasul în formă de U cu lichidul ales, care trebuie să fie degazat la o temperatură ridicată înainte de a se face citirile. Substanța de testat se introduce în aparat și se degazează la temperatură redusă. În cazul unui eșantion cu mai mulți componenți, temperatura trebuie să fie suficient de scăzută pentru a preveni alterarea compoziției materialului. Echilibrul poate fi stabilit mult mai rapid prin agitare. Eșantionul poate fi răcit cu azot lichid sau gheață carbonică, dar sunt necesare precauții pentru evitarea condensării aerului sau lichidului din pompă. Cu ventilul de deasupra vasului deschis, se evacuează aerul prin aspirație, timp de câteva minute. Dacă este necesar, operația de degazare se repetă de câteva ori.
|
Figura 3a |
Figura 3b |
Când eșantionul se încălzește cu ventilul închis, presiunea de vapori crește și modifică echilibrul fluidului din manometrul auxiliar. Pentru compensare se introduce azot sau aer în aparat până când indicatorul de presiune diferențială revine la zero. Presiunea cerută pentru echilibrare trebuie să fie citită la un manometru sau la un instrument de mai mare precizie. Această presiune corespunde presiunii de vapori a substanței la temperatura dată a eșantionului. Dacă se folosește aparatul descris în figura 3b, presiunea de vapori este citită direct.
Valorile presiunii de vapori se determină la intervale de timp mici (aproximativ 5-10 măsurători în total) până la temperatura maximă cerută.
Citirile la temperaturi scăzute trebuie să fie repetate pentru verificare. Dacă valorile obținute la citirile repetate nu coincid cu curba obținută pentru creșterea temperaturii, aceasta se poate datora următoarelor cauze:
(i) proba conține încă aer (de exemplu, în cazul materialelor cu vâscozitate mare) sau impurități cu temperaturi de fierbere scăzute, care se evaporă în timpul încălzirii;
(ii) substanța suferă o reacție chimică în intervalul de temperatură analizat (de exemplu descompunere, polimerizare).
1.5.3. Metoda izoteniscopului
1.5.3.1. Principiu
Metoda izoteniscopului (6) se bazează pe principiul metodei statice. Metoda presupune introducerea unui eșantion într-un rezervor menținut la temperatură constantă și conectat la un manometru și o pompă de vid. Impuritățile mai volatile decât substanța sunt îndepărtate prin degazare la presiune scăzută. Presiunea de vapori a eșantionului la temperaturi prestabilite este echilibrată cu ajutorul unei presiuni cunoscute a unui gaz inert. Izoteniscopul a fost creat pentru a măsura presiunea de vapori a anumitor hidrocarburi lichide, dar poate fi folosit și pentru studierea materialelor solide. De obicei, această metodă nu este adecvată sistemelor multicomponent. Pentru eșantioane care conțin impurități nevolatile, rezultatele sunt supuse unor marje de eroare destul de scăzute. Intervalul recomandat este 102-105 Pa.
1.5.3.2. Aparatură
Un exemplu de dispozitiv de măsurare este ilustrat în figura 4. O descriere completă poate fi consultată în ASTM D 2879-86 (6).
1.5.3.3. Procedură
În cazul lichidelor, substanța însăși servește ca fluid în manometrul auxiliar. O cantitate de lichid, suficientă pentru a umple rezervorul și brațul scurt al manometrului, se introduce în izoteniscop. Izoteniscopul este atașat la sistemul de vid și golit, după care se umple cu azot. Evacuarea și purjarea sistemului se repetă de două ori pentru îndepărtarea oxigenului rezidual. Izoteniscopul plin este plasat în poziție orizontală, astfel încât proba să se împrăștie într-un strat subțire în rezervorul bulbiform și în manometru. Presiunea sistemului se reduce la 133 Pa și proba se încălzește ușor numai până la fierbere (îndepărtarea gazelor dizolvate). Apoi izoteniscopul este plasat astfel încât proba să se întoarcă în rezervor și în manometru, astfel încât ambele să fie pline cu lichid. Presiunea se menține la 133 Pa. Vârful rezervorului bulbiform se încălzește la flacără mică până când vaporii degajați împing o parte din lichidul de la partea superioară și din brațul manometrului în secțiunea manometrică a izoteniscopului, creând un spațiu umplut cu vapori și fără azot. Izoteniscopul este introdus într-o baie termostatată, iar presiunea azotului este corectată până la presiunea eșantionului. La echilibru, presiunea de vapori a azotului este egală cu presiunea de vapori a substanței.

În cazul substanțelor solide, în funcție de intervalul de presiune și temperatură, se utilizează lichide manometrice, precum uleiuri de silicon sau ftalați. Lichidul manometric degazat este turnat în curbura brațului lung al izoteniscopului. Apoi, substanțele solide ce urmează să fie analizate sunt puse în rezervorul bulbiform și sunt degazate la temperatură ridicată. În continuare, izoteniscopul este înclinat astfel încât lichidul manometric să curgă în tubul în formă de U.
1.5.4. Metoda prin efuziune: balanța pentru presiunea de vapori (7)
1.5.4.1. Principiu
Un eșantion din substanța de testat se încălzește într-un cuptor mic și se introduce într-un clopot de sticlă vidat. Cuptorul este acoperit cu un capac având găuri de mici dimensiuni de diametru cunoscut. Vaporii substanței evacuați prin una dintre găuri sunt direcționați către un taler al unei balanțe foarte sensibile aflate, de asemenea, în clopotul de sticlă vidat. În unele soluții, talerul balanței este înconjurat de o cutie de răcire, care asigură disiparea căldurii către exterior prin conducție termică, și este răcită prin iradiere, astfel încât vaporii evacuați se condensează pe acesta. Forța jetului de vapori acționează asupra balanței. Presiunea de vapori poate fi calculată în două moduri: direct din forța exercitată asupra talerului balanței, precum și din rata de evaporare, utilizând ecuația Hertz-Knudsen (2):
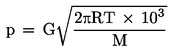
unde:
|
G |
= |
viteza de evaporare (kg s–1 m–2) |
|
M |
= |
masa moleculară (g mol–1) |
|
T |
= |
temperatura (K) |
|
R |
= |
constanta universală a gazelor (J mol–1 K–1) |
|
P |
= |
presiunea de vapori (Pa) |
Intervalul recomandat este 10–3-1 Pa.
1.5.4.2. Aparatură
Principiul general al aparatului este ilustrat în figura 5.

|
A: |
Placă de bază |
F: |
Cutie de refrigerare și bară de răcire |
|
B: |
Instrument cu serpentină mobilă |
G: |
Cuptor evaporator |
|
C: |
Clopot de sticlă |
H: |
Vas Dewar cu azot lichid |
|
D: |
Balanță cu talere |
I: |
Punct de măsurare a temperaturii eșantionului |
|
E: |
Dispozitiv de măsurare a vidului |
J: |
Substanță de testare |
1.5.5. Metoda prin efuziune: celula Knudsen
1.5.5.1. Principiu
Metoda se bazează pe estimarea cantității de substanță analizată care se elimină în unitatea de timp dintr-o celulă Knudsen (8) sub formă de vapori, printr-un orificiu foarte mic, în condiții de vid avansat. Cantitatea de vapori degajați se poate calcula fie prin determinarea pierderii de masă a celulei, fie prin condensarea vaporilor la temperatură joasă și determinarea cantității de substanță volatilizată prin analiză cromatografică. Presiunea de vapori se calculează prin aplicarea relației Hertz-Knudsen (a se vedea punctul 1.5.4.1) cu factori de corecție care depind de parametrii aparatului (9). Intervalul recomandat este 10–10-1 Pa (10)(11)(12)(13)(14).
1.5.5.2. Aparatură
Principiul general al aparatului este ilustrat în figura 6.

|
1: |
Conectare la vid |
7: |
Capac filetat |
|
2: |
Tuburi pentru termometru cu rezistență de platină sau pentru controlul și măsurarea temperaturii |
8: |
Piuliță tip fluture |
|
3: |
Capac pentru cuva de vid |
9: |
Bolțuri |
|
4: |
Garnitură de etanșare |
10: |
Celule de efuziune din oțel inoxidabil |
|
5: |
Cuvă de aluminiu pentru vid |
11: |
Cartuș caloric |
|
6: |
Dispozitiv pentru introducerea și scoaterea celulelor de efuziune |
1.5.6. Metoda prin efuziune: termogravimetrie izotermă
1.5.6.1. Principiu
Metoda se bazează pe determinarea vitezelor de evaporare accelerată pentru substanța de test la temperaturi ridicate și presiune ambiantă prin folosirea termogravimetriei (10)(15)(16)(17)(18)(19)(20). Vitezele de evaporare vT rezultă din expunerea compusului selectat la o atmosferă de gaz inert cu curgere lentă și monitorizarea pierderilor de masă la temperaturi definite T izoterme în kelvin la intervale de timp corespunzătoare. Presiunile de vapori pT sunt calculate din valorile vT prin folosirea relației liniare între logaritmul presiunii de vapori și logaritmul ratei de evaporare. Dacă este necesar, se poate face o extrapolare la temperaturi de 20 și 25 °C prin analiza regresivă a log pT vs. 1/T. Această metodă este adecvată pentru substanțe cu presiune de vapori de până la 10–10 Pa (10–12 mbar) și cu o puritate cât mai apropiată de 100 % pentru a evita interpretarea eronată a pierderilor de masă măsurate.
1.5.6.2. Aparatură
Principiul general al configurației experimentale este ilustrat în figura 7.

Placa de susținere a eșantionului, suspendată de o microbalanță aflată într-un spațiu cu temperatură constantă, se află în calea unui curent de azot uscat care evacuează moleculele vaporizate ale substanței testate. După părăsirea spațiului, curentul de gaze este purificat de către o unitate de sorbție.
1.5.6.3. Procedură
Substanța testată se aplică pe suprafața unei plăci de sticlă rugoasă într-un strat omogen. În cazul substanțelor solide, placa se udă uniform cu o soluție a substanței într-un solvent adecvat și se usucă într-o atmosferă inertă. Pentru măsurare, placa astfel acoperită se suspendă într-un analizor termogravimetric și, ulterior, pierderea sa de masă se măsoară continuu în funcție de timp.
Viteza de evaporare vT la o temperatură dată se calculează din pierderea de masă Δm a plăcii de eșantion prin
![]()
unde F este suprafața acoperită cu substanțele de test, în mod normal suprafața plăcii de eșantion, iar t este timpul pentru pierderea de masă Δm.
Presiunea de vapori pT se calculează pe baza funcției vitezei de evaporare vT:
Log pT = C + D · log vT
unde C și D sunt constante specifice pentru sistemul experimental, în funcție de diametrul spațiului de măsurare și de viteza de scurgere a gazelor. Aceste constante trebuie să fie determinate o singură dată prin măsurarea unui set de compuși cu presiuni de vapori cunoscute și log pT vs. log vT regresiv (11)(21)(22).
Relația între presiunea de vapori pT și temperatura T în kelvini se calculează cu ajutorul formulei
Log pT = A + B · 1/T
unde A și B sunt constante obținute prin regresiunea log pT vs. 1/T. Prin această ecuație, presiunea de vapori poate fi calculată prin extrapolare pentru orice altă temperatură.
1.5.7. Metoda gazului saturat (23)
1.5.7.1. Principiu
Gazul inert este trecut, la temperatura camerei și la o viteză de curgere cunoscută, prin sau peste un eșantion al substanței testate, suficient de lent pentru a fi asigurată saturarea. Atingerea saturării în faza gazoasă este deosebit de importantă. Substanța transportată se colectează, de obicei, cu ajutorul unui absorbant, cantitatea sa fiind apoi calculată. Ca alternativă la colectarea vaporilor și analizarea lor ulterioară, pentru determinarea cantității de material transportat pot fi utilizate tehnici analitice în flux, precum cromatografia în stare gazoasă. Presiunea de vapori se calculează pornind de la ipoteza că legea gazului ideal este respectată, presiunea totală a unui amestec de gaze fiind egală cu suma presiunilor gazelor componente. Presiunea parțială a substanței de test, reprezentând presiunea de vapori, se calculează din volumul total de gaz cunoscut și greutatea materialului transportat.
Metoda gazului saturat se aplică substanțelor chimice solide sau lichide. Poate fi folosită pentru presiuni de vapori de până la 10–10 Pa (10)(11)(12)(13)(14). Metoda are eficiență maximă pentru presiuni de vapori mai mici de 103 Pa. Peste 103 Pa, presiunile de vapori sunt în general supraestimate, probabil ca urmare a formării de aerosoli. Deoarece măsurarea presiunii de vapori se face la temperatura camerei, nu este necesară extrapolarea datelor de la temperaturi mari, erorile grave provocate ca urmare a acestei extrapolări fiind astfel evitate.
1.5.7.2. Aparatură
Procedura necesită folosirea unui recipient izolat termic. Schița din figura 8 ilustrează un recipient conținând câte trei vase de testare pentru eșantioane de substanțe solide și substanțe lichide, ceea ce permite o analiză triplă atât a eșantionului solid, cât și a celui lichid. Temperatura este menținută constantă cu o precizie de ± 0,5 °C sau mai mare.

În general, azotul este folosit ca gaz purtător inert, dar, ocazional, poate fi necesar un alt gaz (24). Gazul purtător trebuie să fie uscat. Curentul de gaz este divizat în 6 curente, controlate prin ventile tip ac (cu orificiu de aproximativ 0,79 mm), și curge în recipient printr-un tub de cupru cu un diametru de 3,8 mm. După echilibrarea temperaturii, gazul curge prin eșantion și separatorul absorbant și iese din recipient.
Eșantioanele solide se încarcă în tuburi de sticlă cu diametru de 5 mm, fiind amplasate între dopuri din vată de sticlă (a se vedea figura 9). Figura 10 ilustrează un suport pentru eșantion lichid și un sistem absorbant. Cea mai ușor de reprodus metodă de măsurare a presiunii de vapori a lichidelor constă în acoperirea cu lichid a unor mărgele de sticlă sau a unui absorbant inert, cum ar fi silice, iar suportul se umple cu aceste mărgele. Ca alternativă, în gazul purtător se pot introduce frită de dimensiuni mari și bule care să treacă printr-o coloană a substanței lichide de testare.
|
Figura 9 |
Figura 10 |
Sistemul absorbant este format dintr-o secțiune frontală și o secțiune de rezervă absorbante. La presiuni de vapori foarte scăzute, absorbantul reține doar cantități mici, iar adsorbția la vata de sticlă și la tubul de sticlă dintre eșantion și absorbant poate fi serios afectată.
Separatoarele răcite cu CO2 solid constituie o altă metodă eficientă de colectare a materialului vaporizat. Acestea nu determină o contrapresiune pe coloana de saturare, iar îndepărtarea cantitativă a materialului separat este facilă.
1.5.7.3. Procedură
Viteza de curgere a gazului purtător efluent se măsoară la temperatura camerei. Viteza de curgere se verifică frecvent pe parcursul experimentului pentru a fi cunoscută valoarea exactă a volumului total de gaz purtător. Se preferă monitorizarea continuă cu un debitmetru de masă. Saturația fazei gazoase poate necesita o perioadă de contact considerabil de lungă care determină, prin urmare, viteze de curgere a gazului destul de scăzute (25).
La sfârșitul experimentului, ambele secțiuni absorbante frontală și de rezervă se analizează separat. Compusul din fiecare secțiune este desorbit prin adăugarea unui solvent. Soluțiile rezultate se analizează în mod cantitativ pentru a se determina masa desorbită din fiecare secțiune. Opțiunea asupra metodei analitice (precum și opțiunea asupra absorbantului și a solventului de desorbire) este dictată de natura materialului de testat. Eficiența desorbției se determină prin injectarea unei cantități cunoscute de eșantion în absorbant, provocând desorbirea acestuia, după care se analizează cantitatea recuperată. Este important să se verifice eficiența desorbției la sau în jurul concentrației eșantionului în condițiile de testare.
În scopul asigurării saturației gazului purtător cu substanța de testat, se folosesc trei viteze de curgere diferite. Dacă presiunea de vapori calculată nu arată că este dependentă de viteza de curgere, se presupune că gazul este saturat.
Presiunea de vapori se calculează prin ecuația:
![]()
unde:
|
p |
= |
presiunea de vapori (Pa) |
|
W |
= |
masa de substanță de testat evaporată (g) |
|
V |
= |
volumul de gaz saturat (m3) |
|
R |
= |
constanta universală a gazelor 8,314 (J mol–1 K–1) |
|
T |
= |
temperatura (K) |
|
M |
= |
masa molară a substanței de testat (g mol–1) |
Volumele măsurate trebuie să fie corectate cu privire la diferențele de presiune și temperatură între debitmetru și coloana de saturație.
1.5.8. Metoda rotorului
1.5.8.1. Principiu
Această metodă folosește un indicator de viscozitate cu rotor, în care elementul de măsurare este o bilă mică de oțel, suspendată într-un câmp magnetic, care se rotește ca urmare a rotirii câmpurilor magnetice (26)(27)(28). Bobinele de control permit măsurarea vitezei de rotire. Când bila a atins o viteză de rotație dată, de regulă aproximativ 400 de rotații pe secundă, se oprește alimentarea bobinelor și are loc o decelerare datorată frecării cu moleculele de gaz. Scăderea vitezei de rotație este măsurată în funcție de timp. Presiunea gazului este calculată din încetinirea mișcării bilei de oțel, care este dependentă de presiune. Intervalul recomandat este 10–4 - 0,5 Pa.
1.5.8.2. Aparatură
O schiță a configurației experimentale este ilustrată în figura 11. Capul de măsurare este introdus într-o incintă cu temperatură constantă, reglată cu o abatere de 0,1 °C. Recipientul conținând eșantionul este plasat într-o incintă separată, de asemenea reglată cu o abatere de 0,1 °C. Toate celelalte părți ale configurației sunt menținute la o temperatură mai înaltă, pentru a preveni condensarea. Întregul aparat este conectat la un sistem de vid avansat.

2. DATE ȘI RAPORTARE
2.1. DATE
În oricare metodă, presiunea de vapori se determină la cel puțin două temperaturi diferite. Este de preferat să se folosească trei sau mai multe temperaturi, în intervalul 0-50 °C, pentru a verifica linearitatea curbei presiunii de vapori. În cazul metodei prin efuziune (celula Knudsen și termogravimetria izotermală) și a metodei gazului saturat, pentru intervalul de temperatură se recomandă 120-150 °C, în loc de 0-50 °C.
2.2. RAPORT DE TESTARE
Raportul de testare include următoarele date:
— metoda folosită;
— specificațiile precise ale substanțelor (identitate și impurități) și etapa de purificare preliminară, după caz;
— cel puțin două valori ale presiunii de vapori la temperaturi diferite – de preferință trei sau mai multe – pentru intervalul 0-50 °C (sau 120-150 °C);
— cel puțin una dintre temperaturi trebuie să fie egală cu mai mică de 25 °C, dacă este posibil din punct de vedere tehnic, în funcție de metoda aleasă;
— toate datele originale;
— o curbă log p în funcție de 1/T;
— o estimare a presiunii de vapori la 20 sau 25 °C.
Dacă se observă o transformare (schimbarea de stare, descompunere), se consemnează următoarele date:
— natura modificării;
— temperatura la care are loc transformarea corectată la presiune atmosferică;
— presiunea de vapori la 10 și 20 °C sub temperatura de tranziție și la 10 și 20 °C peste această temperatură (în afara cazului în care tranziția este de la solid la gaz).
Se consemnează toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cele privitoare la impurități și starea fizică a substanței.
3. REFERINȚE BIBLIOGRAFICE
1. Jurnalul Oficial al Comunităților Europene L 383 A, 26-47 (1992).
2. Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., și Vodar, B., Eds., Butterworths, Londra.
3. Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York.
4. Glasstone, S. (1946). Textbook of Physical Chemistry, ediția a doua, Van Nostrand Company, New York.
5. NF T 20-048 AFNOR (septembrie 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method.
6. ASTM D 2879-86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope.
7. NF T 20-047 AFNOR (septembrie 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method.
8. Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593.
9. Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173.
10. Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521-532.
11. Tomlin, C.D.S. (ed.), The Pesticide Manual, ediția a douăsprezecea (2000).
12. Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22-28.
13. Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269-278.
14. Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 nr. 1 (1987), 117-122.
15. Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137-147.
16. Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393-400.
17. Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161-168.
18. Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Partea IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27-31.
19. Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Partea V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300-310.
20. Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512-20.
21. Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, a optzeci și una ediție (2000), Vapour Pressure in the Range – 25 °C to 150 °C.
22. Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002).
23. 40 CFR, 796. (1993). pp 148-153, Office of the Federal Register, Washington DC.
24. Rordorf B.F. (1985). Thermochimica Acta 85, 435.
25. Westcott et al. (1981). Environ. Sci. Technol. 15, 1375.
26. Messer G., Röhl, P., Grosse G., Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440.
27. Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642.
28. Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715.
Apendice
Metoda estimării
INTRODUCERE
Valorile estimate ale presiunii de vapori pot fi folosite:
— pentru a stabili care metodă experimentală este cea optimă;
— pentru a furniza o estimare sau o valoare limită în cazul în care metoda experimentală nu poate să fie aplicată din cauza unor probleme tehnice.
METODA ESTIMĂRII
Presiunea de vapori a solidelor și lichidelor poate fi estimată folosind corelația Watson modificată (a). Singura dată experimentală necesară este punctul de fierbere în condiții normale. Metoda este aplicabilă pentru intervalul de presiune de la 105 Pa la 10–5 Pa.
Informații detailate asupra metodei se găsesc în „Handbook of Chemical Property Estimation Methods” (Manual de metode de estimare a proprietăților substanțelor) (b). A se vedea și OECD Environmental Monograph nr. 67 (c).
METODA DE CALCUL
Presiunea de vapori este calculată după relația:

unde:
|
T |
= |
temperatura care interesează |
|
Tb |
= |
punct de fierbere în condiții normale |
|
PVP |
= |
presiunea de vapori la temperatura T |
|
ΔHVb |
= |
căldura de vaporizare |
|
ΔZb |
= |
factor de compresibilitate (este estimat la 0,97) |
|
m |
= |
factor empiric depinzând de starea fizică la temperatura T |
în continuare,
![]()
unde KF este un factor empiric dependent de polaritatea substanței. Pentru unele tipuri de compuși, factorii KF sunt enumerați în referința bibliografică (b).
Adesea, există date disponibile pentru punctul de fierbere la presiune redusă. În asemenea situații, presiunea de vapori se calculează conform relației:
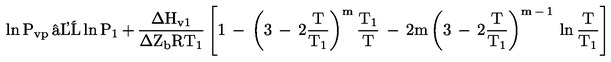
unde T1 este punctul de fierbere la presiunea redusă P1.
RAPORT
În cazul în care se folosește metoda estimării, raportul de testare cuprinde o documentație cuprinzătoare a calculului utilizat.
REFERINȚE BIBLIOGRAFICE
(a) Watson, K.M. (1943). Ind. Eng. Chem, 35, 398.
(b) Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill.
(c) OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993).
A.5. TENSIUNEA SUPERFICIALĂ
1. METODĂ
Majoritatea metodelor descrise se bazează pe orientările OCDE privind testele (1). Principiile fundamentale sunt menționate în referința bibliografică 2.
1.1. INTRODUCERE
Metodele descrise se aplică măsurării tensiunii superficiale a soluțiilor apoase.
Este util să se colecteze informații preliminare asupra solubilității în apă, structurii, proprietăților la hidroliză și concentrației critice pentru formarea de micelii ale substanței înainte de realizarea acestor teste.
Următoarele metode sunt aplicabile celor mai multe substanțe chimice, fără nicio restricție cu privire la gradul de puritate.
Măsurarea tensiunii superficiale prin metoda tensiometrului cu inel se limitează la soluțiile apoase cu o vâscozitate dinamică mai mică decât aproximativ 200 mPa s.
1.2. DEFINIȚII ȘI UNITĂȚI
Entalpia unui lichid la suprafața de contact cu aerul raportată la unitatea de suprafață se numește tensiune superficială.
Unitățile de măsură sunt:
N/m (SI) sau
mN/m (subunitate SI)
1 N/m = 103 dyn/cm
1 mN/m = 1 dyn/cm în sistemul CGS vechi
1.3. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință în toate cazurile în care se studiază o nouă substanță. Acestea trebuie în special să servească la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode.
Substanțele de referință care acoperă un interval larg de tensiuni superficiale sunt date în referințele 1 și 3.
1.4. PRINCIPIUL METODELOR
Metodele se bazează pe măsurarea forței maxime care este necesar să se exercite vertical pe o bridă circulară ori pe un inel aflat în contact cu suprafața lichidului dintr-un vas etalonat, pentru a-l separa de această suprafață, sau pe o placă având o margine în contact cu suprafața lichidului, pentru a ridica pelicula care s-a format.
Substanțele care sunt solubile în apă cel puțin într-o concentrație de 1 mg/l sunt analizate în soluții apoase la o singură concentrație.
1.5. CRITERII DE CALITATE
Aceste metode oferă o precizie mai mare decât este probabil necesară în analizele de mediu.
1.6. DESCRIEREA METODELOR
Se prepară o soluție a substanței de testat în apă distilată. Concentrația acestei soluții reprezintă 90 % din solubilitatea de saturație a substanței în apă; când această concentrație depășește 1 g/l, pentru determinare se utilizează o concentrație de 1 g/l. Testarea substanțelor cu solubilitate în apă mai scăzută de 1 mg/l nu este necesară.
1.6.1. Metoda cu placă
A se vedea ISO 304 și NFT 73-060 (Agenți activi de suprafață – determinarea tensiunii superficiale prin ridicarea unei pelicule de lichid).
1.6.2. Metoda cu bridă
A se vedea ISO 304 și NFT 73-060 (agenți activi de suprafață – determinarea tensiunii superficiale prin ridicarea unei pelicule de lichid)
1.6.3. Metoda cu inel
A se vedea ISO 304 și NFT 73-060 (Agenți activi de suprafață – determinarea tensiunii superficiale prin ridicarea unei pelicule de lichid).
1.6.4. Metodă cu inel corelată cu principiile OCDE
1.6.4.1. Aparatură
Pentru această măsurătoare sunt folosite tensiometre comerciale. Ele constau în următoarele elemente:
— porteșantion mobil;
— dinamometru;
— corp de măsurare (inel);
— vas de măsurare.
1.6.4.1.1.
Porteșantionul mobil se folosește ca suport al recipientului de măsurare termostatat care conține lichidul de testare. Se montează pe același soclu ca și dinamometrul.
1.6.4.1.2.
Dinamometrul (a se vedea figura) se așează deasupra porteșantionului. Eroarea în măsurarea forței nu trebuie să depășească ± 10–6 N, echivalentul unei limite de eroare de ± 0,1 miligrame în măsurarea masei. În majoritatea cazurilor, scara de măsură a tensiometrelor comercializate este etalonată în mN/m, astfel încât se poate citi direct tensiunea superficială în mN/m, cu o precizie de 0,1 mN/m.
1.6.4.1.3.
Inelul este de obicei format dintr-un film de platină sau de platină-iridiu cu o grosime de 0,4 milimetri și o circumferință de 60 milimetri. Acest inel este suspendat orizontal pe etrierul de montaj care este legat printr-o tijă metalică la dinamometru (a se vedea figura).
(Toate dimensiunile sunt exprimate în milimetri)

1.6.4.1.4.
Vasul de măsurare conținând proba ce urmează să fie măsurată trebuie să fie un vas de sticlă cu termostat. Acesta trebuie să fie astfel realizat încât în timpul măsurătorilor temperatura soluției de lichid și a fazei gazoase de deasupra acesteia să rămână constantă, astfel încât proba să nu se poată evapora. Sunt acceptabile vase cilindrice de sticlă cu diametrul interior mai mare de 45 mm.
1.6.4.2. Pregătirea aparaturii
1.6.4.2.1.
Vasele de sticlă se spală cu atenție. Dacă este necesar, sunt spălate cu amestec oxidant (bicromat/acid sulfuric) cald apoi cu acid fosforic concentrat (83-98 % procent de greutate H3PO4), clătite cu apă și în final spălate cu apă dublu distilată până la reacție neutră, apoi uscate sau clătite cu o parte din lichidul de analizat.
Inelul este mai întâi clătit bine cu apă pentru a îndepărta orice substanță solubilă, scufundat rapid în amestec oxidant, spălat cu apă dublu distilată până la reacție neutră și în final încălzit scurt deasupra unei flăcări de metanol.
Notă:
Substanțele contaminante care nu se dizolvă și nu sunt distruse de amestecul oxidant sau de acidul fosforic, precum siliconii, vor fi îndepărtate cu ajutorul unui solvent organic potrivit.
1.6.4.2.2.
Validarea aparatului constă din verificarea punctului zero și corectarea acestuia astfel încât indicația instrumentului să permită realizarea unor determinări corecte în unități mN/m.
Aparatul va fi așezat plan, de exemplu cu ajutorul unei nivele cu bulă de aer așezată la baza termometrului, prin ajustarea picioarelor mobile.
După montarea inelului pe aparat și înaintea imersării în lichid, indicația tensiometrului va fi corectată la zero, iar inelul se va verifica pentru a fi perfect paralel cu suprafața lichidului. În acest scop, suprafața lichidului poate fi folosită ca oglindă.
Testul de calibrare poate fi realizat prin una din următoarele metode:
(a) folosind o greutate: metoda folosește călăreți de masă cunoscută între 0,1 și 1,0 g amplasați pe inel. Factorul de calibrare Φa cu care se înmulțesc toate citirile de pe instrument se stabilește în conformitate cu ecuația (1):
|
|
unde:
![]()
|
m |
= |
masa călărețului (g) |
|
g |
= |
accelerația gravitațională (981 cm s–2 la nivelul mării) |
|
b |
= |
circumferința medie a inelului (cm) |
|
σa |
= |
citirea tensiometrului după plasarea călărețului pe inel (mN/M); |
(b) folosind apa: procedeul utilizează apa pură a cărei tensiune superficială la, de exemplu 23 oC, este egală cu 72,3 mN/m. Acest procedeu se realizează mai rapid decât calibrarea cu greutăți, dar există întotdeauna pericolul ca tensiunea superficială a apei să fie falsificată prin contaminare cu agenți tensioactivi.
Factorul de calibrare (Φb) cu care se înmulțesc toate citirile de pe instrument se stabilește în conformitate cu ecuația (2):
|
|
unde:
|
σo |
= |
valoarea citată în literatură pentru tensiunea superficială a apei (în mN/m) |
|
σg |
= |
valoarea măsurată a tensiunii superficiale a apei (mN/m) ambele la aceeași temperatură. |
1.6.4.3. Prepararea eșantioanelor
Soluțiile apoase se prepară din substanța de testat folosind concentrația necesară în apă și nu conțin nicio substanță nedizolvată.
Soluția trebuie păstrată la o temperatură constantă (± 0,5 oC). Deoarece tensiunea superficială a unei soluții într-un vas variază în timp, se realizează măsurători la anumite intervale de timp și se trasează graficul tensiunii superficiale ca funcție de timp. Atunci când nu se mai produce nicio modificare se consideră că s-a atins starea de echilibru.
Contaminarea cu praf sau gaze din mediul înconjurător poate modifica rezultatele, așadar se va lucra sub clopot de protecție.
1.6.5. Condiții experimentale
Măsurătorile se efectuează la temperatura de aproximativ 20 oC controlată la ± 0,5 oC.
1.6.6. Desfășurarea testului
Soluțiile ce urmează să fie măsurate se transferă cu atenție într-un vas de măsurare curat, evitându-se spumarea, după care vasul de măsurare se așează pe porteșantion. Acesta se ridică până când inelul este imersat sub suprafața soluției de măsurat. Se coboară apoi treptat și uniform (la o viteză de aproximativ 0,5 cm/min) pentru desprinderea inelului de pe suprafață până la atingerea forței maxime necesare. Stratul de lichid atașat de inel trebuie să nu fie separat de inel. După terminarea măsurării, inelul se imersează din nou în lichid, iar măsurătorile se repetă până când se ajunge la o valoare constantă a tensiunii superficiale. Timpul scurs de la transferul soluției în vasul de măsurare se înregistrează pentru fiecare determinare. Citirile se efectuează la forța maximă necesară pentru desprinderea inelului de suprafața lichidului.
2. DATE
Pentru a calcula tensiunea superficială, valoarea citită în mN/m pe aparat este în primul rând multiplicată cu un factor de calibrare Φa sau Φb (în funcție de procedura de calibrare utilizată). Acest rezultat este aproximativ și ca urmare trebuie să fie corectat ulterior.
Harkins și Jordan (4) au determinat un factor de corecție empiric pentru valorile de tensiune superficială măsurate prin metoda cu inel, care depinde de dimensiunile inelului, densitatea lichidului și tensiunea superficială.
Deoarece determinarea factorului de corecție pentru fiecare măsurătoare individuală din tabelele lui Harkins și Jordan este laborioasă, pentru a determina tensiunea superficială la soluții apoase poate fi folosită metoda simplificată de a citi valorile corectate de tensiune superficială direct din tabel. (În cazul citirilor situate între valorile tabelate se va folosi metoda interpolării.)
Tabel
Corecția tensiunii superficiale măsurate
numai pentru soluții apoase, ρ = 1 g/cm3
|
r |
= 9,55 mm (raza medie a inelului) |
|
r |
= 0,185 mm (raza sârmei inelului) |
|
Valoare experimentală mN/m |
Valoare corectată (mN/m) |
|
|
Calibrarea greutății [a se vedea 1.6.4.2.2 (a)] |
Calibrarea apei [a se vedea 1.6.4.2.2 (b)] |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Acest tabel a fost realizat pe baza corecției Harkins-Jordan. Tabelul este similar cu cel din standardul DIN (DIN 53914) pentru apă și soluții apoase (ρ = 1 g/cm3) și se referă la un inel disponibil în comerț cu diametru de R = 9,55 mm (însemnând raza medie a inelului) și r = 0,185 mm (raza sârmei inelului). Tabelul conține valori corectate pentru măsurătorile de tensiune superficială făcute după calibrarea cu greutăți sau cu apă.
Alternativ, în absența procedurii de calibrare, tensiunea superficială poate să fie calculată conform formulei:
![]()
unde:
|
F |
= |
forța măsurată la dinamometru la întreruperea filmului |
|
R |
= |
raza inelului |
|
f |
= |
factor de corecție (1) |
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare cuprinde, dacă este posibil, următoarele date:
— metoda folosită;
— tipul de apă sau soluție folosită;
— specificațiile precise ale substanțelor (identitate, impurități);
— rezultatele măsurătorii: tensiune superficială (citire) menționând citiri individuale și media lor aritmetică, precum și media corectată (luând în considerare factorul de echipament și tabelul cu factorii de corecție);
— concentrația soluției;
— temperatura de testare;
— vechimea soluției folosite; în particular timpul scurs între prepararea și măsurarea soluției;
— descrierea tensiunii superficiale ca funcție de timp după transferul soluției la vasul de măsurare;
— toate informațiile și observațiile relevante pentru interpretarea rezultatelor ce urmează a fi raportate, în special cu privire la impurități și starea fizică a substanței.
3.2. INTERPRETAREA REZULTATELOR
Având în vedere că apa distilată are tensiunea superficială de 72,75 mN/m la 20 oC, substanțele prezentând o tensiune superficială mai scăzută de 60 mN/m în condițiile acestei metode sunt considerate ca fiind agenți activi de suprafață.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 115, Decision of the Council C(81) 30 final.
2. R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, Part I, Chapter XIV.
3. Pure Appl. Chem., 1976, vol. 48, p. 511.
4. Harkins, W.D., Jordan, H.F., J. Amer. Chem. Soc., 1930, vol. 52, p. 1751.
A.6. SOLUBILITATEA ÎN APĂ
1. METODĂ
Majoritatea metodelor descrise se bazează pe orientările OCDE privind testele (1).
1.1. INTRODUCERE
Pentru realizarea acestui test, sunt necesare anumite informații preliminare referitoare la formula structurală, presiunea de vapori, constanta de disociere și de hidroliză a substanței (în funcție de pH).
Pentru a acoperi întregul interval de solubilități în apă, sunt disponibile mai multe metode.
Cele două metode de analiză descrise mai jos acoperă întregul interval de solubilități dar nu sunt aplicabile substanțelor volatile:
— o metodă care se aplică substanțelor relativ pure, cu solubilitate scăzută (< 10–2 grame pe litru) și care sunt stabile în apă, denumită „metoda eluției pe coloană”;
— o altă metodă care se aplică substanțelor relativ pure, cu solubilitate mai mare (> 10–2 grame pe litru) și care sunt stabile în apă denumită „metoda prin solubilitate în flacon”.
Solubilitatea în apă a probei poate fi considerabil afectată de prezența impurităților.
1.2. DEFINIȚII ȘI UNITĂȚI
Solubilitatea în apă a unei substanței este definită prin concentrația masică de saturație a substanței în apă la o temperatură dată. Solubilitatea în apă se măsoară în unități de masă pe volum de soluție. Unitatea SI este kg/m3 (ca unitate de măsură se poate folosi de asemenea gramul pe litru).
1.3. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință în toate cazurile în care se studiază o nouă substanță. Acestea trebuie în special să servească la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode.
1.4. PRINCIPIUL METODEI DE TESTARE
Cantitatea aproximativă dintr-o probă și timpul necesar pentru a realiza concentrația de saturație vor fi determinate într-un test preliminar simplu.
1.4.1. Metoda eluției pe coloană
Această metodă se bazează pe eluția substanței de testat cu apă dintr-o microcoloană încărcată cu un suport inert, cum ar fi mărgele de sticlă sau nisip, acoperite cu proba în exces. Solubilitatea în apă se determină atunci când concentrația masică de eluat este constantă. Valoarea este reprezentată de zona aplatizată a curbei de concentrație ca funcție de timp.
1.4.2. Metoda prin solubilitate în flacon
În această metodă, substanța (solidele trebuie să fie pulverizate) se dizolvă în apă la o temperatură puțin mai mare decât temperatura de testare. Când se atinge saturația, amestecul se răcește și se păstrează la temperatura de testare, sub agitare, atâta timp cât este necesar pentru a ajunge la echilibru. Ca alternativă, determinarea poate fi efectuată direct la temperatura de testare, dacă se garantează, printr-o probă adecvată, că s-a atins starea de echilibru de saturație. Apoi se determină printr-o metodă analitică potrivită concentrația substanței în soluție apoasă, care nu trebuie să conțină niciun fel de particule nedizolvate.
1.5. CRITERII DE CALITATE
1.5.1. Repetabilitatea
Pentru metoda eluției pe coloană, este acceptabilă < 30 %; pentru metoda prin solubilitate în flacon, este necesar ca aceasta să fie < 15 %.
1.5.2. Sensibilitatea metodei
Aceasta depinde de metoda de analiză, dar pot fi realizate determinări ale concentrației până la 10–6 grame pe litru.
1.6. DESCRIEREA METODEI
1.6.1. Condiții experimentale
Este preferabil ca testul să aibă loc la 20 ± 0,5 oC. Dacă se presupune că solubilitatea este dependentă de temperatură (> 3 % pe oC), vor fi folosite două alte temperaturi cu cel puțin 10 oC peste sau sub temperatura aleasă inițial. În acest caz controlul temperaturii va fi de ± 0,1 oC. Temperatura aleasă se menține constantă în toate părțile relevante ale echipamentului.
1.6.2. Testul preliminar
La aproximativ 0,1 grame din proba (substanțele solide trebuie să fie pulverizate) aflată într-un cilindru gradat de 10 ml cu dop de sticlă se adaugă volume crescânde de apă distilată la temperatura camerei în concordanță cu pașii arătați în tabelul de mai jos:
|
0,1 grame solubile în „x” ml apă |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Solubilitate aproximativă (grame pe litru) |
> 1 000 |
1 000-200 |
200-100 |
100-50 |
50-10 |
10-1 |
< 1 |
După fiecare adăugare a cantității de apă indicate, amestecul este agitat puternic timp de 10 minute și examinat vizual pentru a observa particule din probă nedizolvate. Dacă după adăugarea a 10 ml de apă, proba sau părți din ea rămân nedizolvate, experimentul trebuie repetat într-un cilindru gradat de 100 de ml, cu volume mai mari de apă. La solubilități mai mici timpul necesar pentru dizolvarea substanței poate fi considerabil mai mare (cel puțin 24 de ore). Solubilitatea aproximativă se înregistrează într-un tabel, odată cu volumul de apă adăugată la care apare o dizolvare completă a probei. Dacă substanța este încă aparent insolubilă se lasă mai mult de 24 de ore (maximum 96 de ore) sau se diluează în continuare pentru a stabili dacă se folosește metoda eluției pe coloană sau metoda flaconului.
1.6.3. Metoda eluției pe coloană
1.6.3.1. Suport, solvent și eluent
Materialul suport pentru metoda eluției pe coloană trebuie să fie inert. Materiale care pot fi folosite sunt mărgelele de sticlă și nisipul. Pentru a aplica proba pe suport se folosește un solvent volatil potrivit de calitate pro analisis. Ca eluent se folosește apa dublu distilată, în aparatură de sticlă sau cuarț.
Notă:
Nu trebuie folosită apă proaspăt trecută printr-un schimbător de ioni organic.
1.6.3.2. Încărcarea suportului
Aproximativ 600 mg din suport sunt cântărite și transferate într-un balon cu fund rotund de 50 ml.
O cantitate convenabilă de substanță de testat, cântărită, se dizolvă în solventul ales. O cantitate adecvată din această soluție se adaugă la suport. Solventul trebuie să fie complet evaporat, de exemplu într-un evaporator rotativ; în caz contrar, saturarea cu apă a suportului nu se realizează datorită efectelor de partiție pe suprafața suportului.
Încărcarea suportului poate conduce la rezultate eronate dacă proba este depusă ca fază uleioasă sau cristale. Problema se examinează experimental și detaliile se consemnează.
Suportul încărcat se lasă să se îmbibe timp de aproximativ două ore în aproximativ 5 ml de apă, apoi suspensia se adaugă în microcoloană. Ca alternativă, suportul uscat poate fi turnat în microcoloană, care a fost deja umplută cu apă, și apoi lăsat timp de aproximativ 2 ore până la atingerea echilibrului.
Eluția substanței din suport poate fi efectuată într-unul din următoare două moduri:
— cu pompă de recirculare (a se vedea figura 1),
— cu rezervor de apă (a se vedea figura 4).
1.6.3.3. Metoda eluției pe coloană cu pompă de recirculare
Schema unui sistem tipic este prezentată în figura 1. O microcoloană corespunzătoare este prezentată în figura 2, deși sunt acceptabile orice dimensiuni, cu condiția respectării criteriilor de reproductibilitate și sensibilitate. Coloana este prevăzută cu un volum tampon la vârf egal cu cel puțin 5 volume de apă și poate să cuprindă minimum 5 probe. Ca alternativă, dimensiunea poate fi redusă dacă este folosit un solvent pentru a înlocui 5 volume inițiale pentru a îndepărta impuritățile.
Coloana se conectează la o pompă de recirculare cu un debit de aproximativ 25 ml/h. Pompa se conectează cu racorduri din politetrafloretilenă (P.T.F.E) și/sau sticlă. Coloana și pompa, odată asamblate, trebuie să permită eșantionarea efluentului și echilibrarea volumului liber din vârful coloanei la presiunea atmosferică. Materialul din coloană este sprijinit pe un mic dop (5 mm) din vată de sticlă, care servește de asemenea pentru a filtra particulele. Pompa de recirculare poate fi, de exemplu, o pompă peristaltică sau o pompă cu membrană (atenție să nu se producă nicio contaminare și/sau absorbții cu materialul tubului).
Se pornește circuitul prin coloană. Se recomandă utilizarea unui debit de aproximativ 25 ml/h (aceasta corespunde la 10 volume/h pentru coloana descrisă). Primele cinci volume (minim) sunt folosite pentru a îndepărta impuritățile solubile din apă. Apoi, pompa de recirculare se lasă să funcționeze până la stabilirea echilibrului, care este definit prin 5 probe succesive a căror concentrație nu diferă cu mai mult de ± 30 %, în mod aleatoriu. Aceste probe sunt separate de intervale de timp corespunzătoare trecerii a cel puțin 10 volume de eluent.
1.6.3.4. Metoda eluției pe coloană cu vas de nivel
Vasul de nivel: Conectarea la vasul de nivel este făcută prin folosirea unei olive de sticlă conectată prin tuburi din PTFE. Este recomandată folosirea unui debit de aproximativ 25 ml/h. Eluații succesivi se colectează și se analizează prin metoda aleasă.
Pentru a determina solubilitatea în apă sunt folosite acele fracțiuni din intervalul de eluție unde concentrațiile sunt constante (± 30 %) pentru cel puțin 5 fracțiuni consecutive.
În ambele cazuri (folosind o pompă de recirculare sau un vas de nivel), o a doua serie de probe se efectuează la jumătate din debitul primei. Dacă rezultatele celei de a doua serii sunt în concordanță, testul este satisfăcător; dacă există o solubilitate aparentă mai mare la un debit mai mic, atunci înjumătățirea debitului va trebui să continue până când două serii succesive vor da aceeași solubilitate.
În ambele cazuri (folosind o pompă de recirculare sau un vas de nivel) fracțiunile se verifică pentru a decela prezența materiilor coloidale, prin examinarea efectului Tyndall (împrăștierea luminii). Prezența unor astfel de particule invalidează rezultatele și testul se repetă cu îmbunătățirea acțiunii de filtrare a coloanei.
Se înregistrează pH-ul fiecărei probe. Cea de-a doua serie va fi efectuată la aceeași temperatură.
1.6.4. Metoda prin solubilitate în flacon
1.6.4.1. Aparatură
Pentru metoda prin solubilitate în flacon sunt necesare următoarele materiale:
— sticlărie și instrumente obișnuite de laborator;
— un dispozitiv potrivit pentru agitarea soluțiilor la temperatură constantă controlată;
— o centrifugă (preferabil termostatată), în cazul emulsiilor; și
— echipament pentru determinări analitice.
1.6.4.2. Procedeul de măsurare
Cantitatea de substanță necesară pentru a satura volumul de apă dorit este estimată printr-un test preliminar. Volumul de apă necesar depinde de metoda analitică și de intervalul de solubilitate. Aproximativ de cinci ori cantitatea de material determinată mai sus este cântărită în fiecare dintre cele trei vase de sticlă prevăzute cu dopuri de sticlă (de exemplu eprubete pentru centrifugă, flacoane). Volumul de apă este adăugat în fiecare vas și vasele sunt închise ermetic. Vasele închise sunt apoi agitate la 30 oC. (Se folosește un dispozitiv de agitare sau de amestecare care poate funcționa la temperatură constantă, de exemplu un agitator magnetic într-o baie de apă termostatată.) După o zi, unul dintre vase este scos și reechilibrat timp de 24 de ore la temperatura de testare, agitând din când în când. Conținutul vasului este apoi centrifugat la temperatura de testare și concentrația de probă în faza apoasă clară este determinată printr-o metodă analitică adecvată. Celelalte două flacoane sunt tratate similar după atingerea echilibrului inițial la 30 oC timp de 2, respectiv 3 zile. Când concentrația rezultată cel puțin din ultimele două vase este în concordanță cu reproductibilitatea cerută, testul este satisfăcător. Întregul test se repetă, folosind timpi de echilibru mai lungi, dacă rezultatele de la vasele 1, 2 și 3 arată o tendință de creștere a valorilor.
Procedeul de măsurare poate fi aplicat și fără preincubare la 30 oC. Pentru a estima durata necesară stabilirii echilibrului de saturație se iau probe până în momentul în care timpul de agitare nu mai influențează concentrația soluției de probă.
Se înregistrează pH-ul fiecărei probe.
1.6.5. Analiză
Pentru aceste determinări se preferă o metodă analitică specifică substanței, deoarece cantități mici de impurități solubile pot antrena erori mari la măsurarea solubilității. Exemple de astfel de metode sunt: cromatografia de gaz sau lichid, metodele titrimetrice, metodele fotometrice, metodele voltametrice.
2. DATE
2.1. METODA ELUȚIEI PE COLOANĂ
Valoarea medie obținută de la cel puțin cinci probe consecutive în zona platoului de saturație al curbei de solubilitate în funcție de timp se ia în considerare pentru calculul saturației, precum și pentru calcularea deviației standard. Rezultatele se exprimă în unități de masă pe volum de soluție.
Mediile calculate pe două teste folosind debite diferite se compară și trebuie să aibă o repetabilitate mai mică de 30 %.
2.2. METODA PRIN SOLUBILITATE ÎN FLACON
Se prezintă rezultatele individuale pentru fiecare dintre cele trei flacoane, iar pentru acele rezultate considerate a fi constante (repetabilitate mai mică de 15 %) se calculează media, care se exprimă în unități de masă pe volum de soluție. Poate fi necesară convertirea unităților de masă în unități de volum, folosind densitatea, dacă solubilitatea este foarte mare (> 100 grame pe litru).
3. RAPORT
3.1. METODA ELUȚIEI PE COLOANĂ
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— rezultatele testului preliminar;
— specificațiile exacte ale substanței (identitate și impurități);
— concentrațiile individuale, debitele și pH-ul pentru fiecare eșantion;
— deviația medie și deviația standard de la cel puțin 5 probe din zona platoului de saturație a fiecărei testări;
— media a două testări succesive, acceptabile;
— temperatura apei în timpul procesului de saturație;
— metoda de analiză folosită;
— natura suportului folosit;
— cantitatea de substanță depusă pe suport;
— solventul folosit;
— dovezi despre orice instabilitate chimică a substanței în timpul testului și metoda folosită;
— toate informațiile relevante pentru interpretarea rezultatelor, în special referitoare la impurități și la starea fizică a substanței.
3.2. METODA FLACONULUI
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— rezultatele testului preliminar;
— specificațiile exacte ale substanței (identitate și impurități);
— determinările analitice individuale și media lor, acolo unde a fost determinată mai mult decât o valoare pentru fiecare flacon;
— pH-ul fiecărui eșantion;
— media valorilor pentru flacoanele diferite aflate în concordanță;
— temperatura de testare;
— metoda analitică folosită;
— dovezi despre orice instabilitate chimică a substanței în timpul testului și metoda folosită;
— toate informațiile relevante pentru interpretarea rezultatelor, în special referitoare la impurități și starea fizică a substanțelor.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 105, Decision of the Council C(81) 30 final.
2. NF T 20-045 (AFNOR) (September 85). Chemical products for industrial use – Determination of water solubility of solids and liquids with low solubility – Column elution method.
3. NF T 20-046 (AFNOR) (September 85). Chemical products for industrial use – Determination of water solubility of solids and liquids with high solubility – Flask method.
Apendice
Figura 1
Metoda eluției pe coloană cu pompă de recirculare

Figura 2
Microcoloană tip
(Toate dimensiunile în milimetri)

Figura 3
Microcoloană tip
(Toate dimensiunile în milimetri)

Figura 4
Metoda coloanei de eluție cu vas de nivel

A.8. COEFICIENTUL DE PARTIȚIE
1. METODĂ
Metoda „agitării flaconului” descrisă se bazează pe orientările OCDE privind testele (1).
1.1. INTRODUCERE
Pentru efectuarea acestui test este util să se colecteze informații preliminare despre formula structurală, constanta de disociere, solubilitatea în apă, hidroliză, solubilitatea în n-octanol și tensiunea superficială a substanței.
Măsurătorile se fac pe substanțe ionizabile, numai în forma lor neionizată (acizi liberi și baze libere) produse prin folosirea unei soluții tampon adecvate, cu un pH de cel puțin o unitate de mai mic (acizi liberi) sau mai mare (baze libere) decât pK.
Această metodă de analiză include două metode separate: metoda „agitării flaconului” și cromatografia lichidă de mare performanță (HPLC). Prima este aplicabilă când valoarea log Pow (pentru definiții a se vedea mai jos) este în intervalul de la – 2 la 4, iar cea de-a doua în intervalul de la 0 la 6. Înainte de a aplica oricare dintre metodele experimentale se obține o estimare a coeficientului de partiție.
Metoda agitării flaconului se aplică numai substanțelor pure solubile în apă și în n-octanol. Nu este aplicabilă agenților tensioactivi (pentru care se furnizează o valoare calculată sau estimată a solubilității individuale în apă și n-octanol).
Metoda HPLC nu este aplicabilă acizilor și bazelor puternice, complecșilor metalici, agenților tensioactivi sau substanțelor care reacționează cu eluentul. Pentru aceste materiale se furnizează valori calculate sau estimate ale solubilității individuale în apă și n-octanol.
Metoda HPLC este mai puțin sensibilă la prezența impurităților din probă decât metoda agitării flaconului. Cu toate acestea, în unele cazuri impuritățile pot face interpretarea rezultatelor dificilă pentru că identificarea picurilor devine incertă. Pentru amestecuri care dau o bandă imprecisă se menționează limitele superioară și inferioară ale log P.
1.2. DEFINIȚII ȘI UNITĂȚI
Coeficientul de partiție (P) este definit ca raportul dintre concentrațiile de echilibru (ci) ale substanței dizolvate în sistemul bifazic constând din doi solvenți aproape nemiscibili. În cazul n-octanol și apă:
![]()
Coeficientul de partiție (P) este prin urmare raportul dintre două concentrații și de regulă este exprimat ca logaritm în baza 10 (log P).
1.3. SUBSTANȚE DE REFERINȚĂ
Metoda agitării flaconului
Nu este necesar să se folosească substanțe de referință în toate cazurile în care se studiază o nouă substanță. Acestea trebuie în special să servească la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode.
Metoda HPLC
Pentru a corela datele despre un compus determinate prin HPLC cu valoarea sa P, trebuie stabilit un grafic de calibrare log P vs. date cromatografice, folosind cel puțin 6 puncte de referință. Utilizatorul trebuie să selecteze substanțele de referință adecvate. Dacă este posibil, cel puțin un compus de referință trebuie să aibă Pow mai ridicat decât substanța de testat și un altul – un Pow mai scăzut decât eșantionul. Pentru valorile log P mai mici de 4, calibrarea se poate baza pe datele obținute prin metoda agitării flaconului. Pentru valori log P mai mari de 4, calibrarea se poate baza pe valori recunoscute din literatură, dacă acestea sunt în concordanță cu valorile calculate. Pentru o mai mare acuratețe, este preferabil să se aleagă compuși de referință care sunt înrudiți structural cu substanța de testat.
Este disponibilă o listă exhaustivă de valori pentru log Pow pentru mai multe grupe de substanțe chimice (2) (3). Dacă nu sunt disponibile date despre coeficienții de partiție ai compușilor înrudiți structural, atunci poate fi folosită o calibrare mai generală, stabilită cu alți compuși de referință.
În apendicele 2 figurează o listă a substanțelor de referință recomandate care cuprinde și valori pentru Pow.
1.4. PRINCIPIUL METODEI
1.4.1. Metoda agitării flaconului
Pentru a determina coeficientul de partiție trebuie realizat echilibrul între toți componenții sistemului care interacționează și trebuie determinate concentrațiile substanțelor dizolvate în cele două faze. Un studiu asupra literaturii de specialitate dedicată acestui subiect indică mai multe tehnici diferite ce pot fi folosite pentru rezolvarea acestei probleme, de exemplu prin amestecarea completă a două faze urmată de separarea lor pentru a determina concentrația de echilibru a substanței.
1.4.2. Metoda HPLC
HPLC este efectuat într-o coloană analitică umplută cu o fază solidă disponibilă în comerț care conține lanțuri lungi de hidrocarburi (de exemplu C8, C18) legate chimic pe silice. Substanțele injectate într-o astfel de coloană se mișcă de-a lungul ei cu diferite viteze din cauza gradelor diferite de partiție între faza mobilă și faza staționară cu hidrocarburi. Eluția amestecurilor de substanțe se face în funcție de caracterul hidrofob, substanțele solubile în apă fiind eluate mai întâi și cele solubile în solvenți organici eluate ultimele, proporțional cu coeficientul lor de partiție hidrocarbură/apă. Aceasta face posibilă să fie stabilită relația dintre timpul de retenție pe o astfel de coloană (faza inversă) și coeficientul de partiție n-octanol/apă ce trebuie determinat. Coeficientul de partiție este dedus din factorul de capacitate k, dat de:
![]()
în care tr = timpul de retenție al substanței de testat și to = timpul mediu necesar unei molecule de solvent pentru a trece prin coloană (timp mort).
Nu sunt necesare metode analitice cantitative, ci doar determinarea timpilor de eluție.
1.5. CRITERII DE CALITATE
1.5.1. Repetabilitatea
Pentru a asigura acuratețea măsurătorii coeficientului de partiție trebuie realizate determinări duble în trei condiții de testare diferite, prin care cantitatea de substanță utilizată, precum și raportul volumelor de solvent poate fi variat. Valorile determinate ale coeficientului de partiție exprimate logaritmic vor fi în intervalul ± 0,3 unități logaritmice.
Pentru a crește coeficientul de încredere al măsurătorilor, trebuie să fie făcute determinări duble. Valorile pentru log P derivate din măsurătorile individuale vor fi în intervalul ± 0,1 unități logaritmice.
1.5.2. Sensibilitate
Intervalul de aplicabilitate al metodei este determinat de limita de detectare a metodei analitice. Aceasta trebuie să permită evaluarea valorilor log Pow în intervalul de la – 2 la 4 (ocazional, când condițiile impun acest lucru, acest interval poate fi extins pentru log Pow până la 5) când concentrația solutului în oricare fază nu este mai mare de 0,01 mol pe litru.
Metoda HPLC face posibilă estimarea coeficienților de partiție în intervalul 0 până la 6 pentru log Pow.
În mod normal, coeficientul de partiție al unui compus poate fi estimat cu o eroare de ±1 unitate logaritmică față de valoarea determinată prin metoda agitării flaconului. Corelații tipice pot se găsesc în literatura de specialitate (4) (5) (6) (7) (8). O mai mare acuratețe poate fi obținută în mod normal când graficele de corelare se bazează pe compuși de referință înrudiți structural (9).
1.5.3. Specificitate
Legea partiției a lui Nernst se aplică numai la temperatură, presiune și pH constante pentru soluții diluate. Ea se aplică strict unei substanțe pure dispersată între doi solvenți puri. Dacă sunt prezenți diferiți soluți în una sau în ambele faze în același timp, aceasta poate afecta rezultatele.
Disocierea sau asocierea moleculelor dizolvate duce la deviații de la legea partiției a lui Nernst. Astfel de deviații sunt indicate de funcția care descrie dependența coeficientului de partiție de concentrația soluției.
Întrucât presupune echilibre multiple, această metodă nu se folosește în cazul compușilor ionizabili fără a aplica o corecție. Pentru astfel de compuși se ia în considerare folosirea soluțiilor tampon în locul apei; pH-ul soluției tampon trebuie să difere cu cel puțin 1 unitate de pKa-ul substanței ținând seama și de semnificația acestui pH pentru mediu.
1.6. DESCRIEREA METODEI
1.6.1. Estimarea preliminară a coeficientului de partiție
Coeficientul de partiție este estimat de preferință prin calcul (a se vedea apendicele 1) sau, acolo unde este posibil, prin raportul solubilităților substanței testate în solvenți puri (10).
1.6.2. Metoda agitării flaconului
1.6.2.1. Pregătire
n-Octanol: Determinarea coeficientului de partiție va fi efectuată cu reactivi de puritate analitică ridicată.
Apă: se folosește apă distilată sau dublu distilată în aparate din sticlă sau cuarț. Dacă este cazul, pentru compușii ionizabili vor fi folosite în locul apei soluții tampon.
Notă:
Nu se folosește apa luată direct dintr-un aparat cu schimbători de ioni.
1.6.2.1.1.
Înaintea determinării coeficientului de partiție, fazele sistemului de solvent sunt saturate reciproc prin agitare la temperatura de testare. În acest scop, de obicei se agită două sticle mari cu n-octanol de puritate analitică sau apă, fiecare cu o cantitate suficientă din celălalt solvent, timp de 24 de ore, cu un agitator mecanic, apoi se lasă suficient de mult timp pentru a permite fazelor să se separe și pentru a realiza o stare de saturație.
1.6.2.1.2.
Întregul volum al sistemului bifazic trebuie să umple aproape total vasul de testare. Aceasta va ajuta la prevenirea pierderilor de material datorită volatilizării. Raportul volumelor și cantitățile de substanță ce vor fi folosite sunt fixate prin următoarele condiții:
— evaluarea preliminară a coeficientului de partiție (a se vedea mai sus);
— cantitatea minimă din substanța de testat necesară la determinările analitice; și
— limita concentrației maxime în fiecare fază este de 0,01 mol pe litru.
Sunt efectuate 3 măsurători. În prima este folosit raportul de volume n-octanol/apă calculat; în a doua măsurătoare acest raport se împarte la 2; în a treia acest raport înmulțește cu 2 (de exemplu 1:1, 1:2, 2:1).
1.6.2.1.3.
O soluție mamă este preparată în n-octanol presaturat cu apă. Concentrația acestei soluții mamă va fi determinată cu precizie înaintea folosirii ei pentru stabili coeficientului de partiție. Această soluție va fi depozitată în condiții care să-i asigure stabilitatea.
1.6.2.2. Condiții experimentale
Temperatura de testare se menține constantă (± 1 oC) și se află în intervalul 20-25 oC.
1.6.2.3. Procedeul de măsurare
1.6.2.3.1.
Pentru fiecare dintre condițiile de testare se pregătesc două vase de testare conținând cantitățile necesare, precis măsurate din cei doi solvenți, împreună cu cantitatea necesară din soluția mamă.
Fazele cu n-octanol vor fi măsurate volumetric. Vasele de testare sunt amplasate într-un agitator adecvat sau sunt agitate în mână. Când se folosește un tub de centrifugă, o metodă recomandată este aceea să se rotească acest tub repede într-o direcție aflată la 180o față de axa sa transversală, astfel încât aerul captat să se ridice prin cele două faze. Experiența a arătat că 50 de astfel de rotații sunt de regulă suficiente pentru stabilirea partiției de echilibru. Pentru siguranță se recomandă 100 de rotații în 5 minute.
1.6.2.3.2.
Dacă este necesar, se efectuează centrifugarea amestecului pentru a separa fazele. Acest lucru se desfășoară într-o centrifugă de laborator menținută la temperatura camerei sau, dacă este folosită o centrifugă netermostatată, tuburile centrifugei se păstrează pentru echilibrare la temperatura de testare cel puțin o oră înainte de analiză.
1.6.2.4. Analiza
Pentru determinarea coeficientului de partiție este necesară determinarea concentrațiilor de substanță analizată în ambele faze. Aceasta poate fi făcută prin prelevarea unei probe alicote din fiecare din cele două faze din fiecare tub pentru fiecare condiție de testare și analizarea lor prin metoda aleasă. Cantitatea totală de substanță prezentă în ambele faze se calculează și se compară cu cantitatea de substanță introdusă la început.
Faza apoasă este eșantionată printr-o operațiune care reduce la minim riscul includerii unor urme de n-octanol: o seringă de sticlă cu ac detașabil poate fi folosită pentru a lua probe din faza apoasă. Inițial, seringa se umple parțial cu aer. Aerul se elimină cu atenție în timp ce se introduce acul prin stratul de n-octanol. Un volum corespunzător din faza apoasă este tras în seringă. Seringa se scoate repede din soluție și acul se detașează. Conținutul seringii poate fi apoi folosit ca probă apoasă. Concentrația în cele două faze separate este determinată de preferință printr-o metodă specifică substanței. Exemple de metode analitice adecvate sunt:
— metode fotometrice;
— cromatografia cu gaz;
— cromatografia lichidă de înaltă performanță.
1.6.3. Metoda HPLC
1.6.3.1. Pregătire
Este necesar un cromatograf de lichide la care s-a atașat o pompă fără pulsații și un instrument de detecție adecvat. Este recomandată folosirea unei valve de injecție cu bucle de injecție. Prezența grupelor polare în faza staționară poate diminua serios performanțele coloanei HPLC. Prin urmare, faza staționară va avea un procent minim de grupe polare (11). Pot fi folosite umpluturi de microparticule pentru inversarea fazelor sau coloane gata umplute. O coloană de gardă poate fi poziționată între sistemul de injecție și coloana analitică.
Pentru a prepara solventul de eluție se folosește metanol grad HPLC și apă de puritate HPLC; solventul este degazat înainte de folosire. Se folosește eluția izocratică. Se utilizează un raport metanol/apă cu un conținut minim de apă de 25 %. În general, un amestec metanol-apă 3:1 este satisfăcător pentru eluția compușilor cu log P 6 într-o oră, la un debit de 1 ml/minut. Pentru compușii cu log P mare poate fi necesar să se scurteze timpul de eluție (și cel al compușilor de referință) prin descreșterea polarității fazei mobile sau a lungimii coloanei.
Substanțele cu solubilitate foarte scăzută în n-octanol tind să dea valori neobișnuit de mici pentru log Pow prin metoda HPLC; picurile unor astfel de compuși însoțesc uneori frontul de solvent. Aceasta se datorează probabil faptului că procesul de partiție este prea lent pentru a atinge echilibrul în timpul necesar în mod normal pentru o separare. Scăderea debitului și/sau micșorarea raportului metanol/apă poate fi o măsură eficientă pentru a ajunge la o valoare fiabilă.
Compușii de testare și compușii de referință trebuie să fie solubili în faza mobilă într-o concentrație suficientă pentru a permite detectarea lor. Numai în cazuri excepționale pot fi folosiți aditivi împreună cu amestecul metanol-apă, deoarece aditivii vor schimba proprietățile coloanei. Pentru cromatograme cu aditivi este obligatoriu să se folosească o coloană separată de același tip. Dacă amestecul metanol-apă nu este corespunzător, pot fi folosite alte amestecuri solvent organic-apă, de exemplu etanol-apă sau acetonitril-apă.
PH-ul eluentului este un factor critic pentru compușii ionizabili. Trebuie să fie în intervalul de pH al coloanei, care este de obicei cuprins între 2 și 8. Este recomandabilă tamponarea. Se evită atent precipitarea sărurilor și deteriorarea coloanei în cazul unor amestecuri fază organică-soluție tampon. Măsurătorile HPLC cu fază staționară de silicagel nu sunt recomandabile în cazul unui pH mai mare de 8 deoarece folosirea unei faze mobile alcaline poate cauza scăderea rapidă a performanțelor coloanei.
Compușii de referință sunt cei mai puri disponibili. Dacă este posibil, compușii care sunt folosiți în scopuri de testare sau calibrare se dizolvă în faza mobilă.
În timpul măsurătorilor, temperatura nu variază cu mai mult de ± 2 K.
1.6.3.2. Măsurători
Timpul mort t0 poate fi determinat prin folosirea unei serii omoloage (de exemplu n-alchil metil cetone) sau compuși organici care nu se absorb pe coloană (de exemplu tioureea sau formamida). Pentru calcularea timpului mort t0 prin folosirea unei serii omoloage, un set de cel puțin 7 membri ai seriei omoloage este injectat și sunt determinați timpii respectivi de retenție. Timpii retenției brute tr(nc+1) sunt reprezentați ca funcție de tr(nc) și sunt determinate constanta a și panta b a ecuației de regresie:
tr (nc + 1) = a + b tr (nc)
(nc = numărul de atomi de carbon).Timpul mort t0 este dat de:
t0 = a/(l – b)
Următorul pas este trasarea graficului de corelație între valorile lui log k și log P pentru compușii de referință. În practică, un set de 5 până la 10 compuși de referință standard al căror log P se găsește în limitele intervalului preconizat se injectează simultan și se determină timpii de retenție, preferabil cu un înregistrator conectat la sistemul de detecție. Se calculează logaritmii corespunzători ai factorilor de capacitate, log k, și se trasează graficul funcției log P determinat prin metoda agitării flaconului. Calibrarea se execută la intervale egale, cel puțin o dată pe zi, așa încât să se poată ține seama de posibilele schimbări în performanțele coloanei.
Proba este injectată într-o cantitate cât mai mică posibil de fază mobilă. Se determină timpul de retenție (în duplicat), permițând calcularea factorului de capacitate k. Din graficul de corelare al compușilor de referință poate fi interpolat coeficientul de partiție al substanței de testat. Pentru coeficienții de partiție foarte mici și pentru cei foarte mari, este necesară extrapolarea. În aceste cazuri particulare trebuie să se acorde atenție limitelor de încredere ale liniei de regresie.
2. DATE
Metoda agitării flaconului
Fiabilitatea valorilor determinate pentru P poate fi testată prin compararea valorilor medii rezultate la determinările duble cu media generală.
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile exacte ale substanței (identitate și impurități);
— când metodele nu sunt aplicabile (de exemplu, pentru agenții tensioactivi) se prezintă o valoare calculată sau una estimată bazată pe solubilitățile individuale în n-octanol și apă;
— toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cele referitoare la impurități și la starea fizică a substanței.
Pentru metoda agitării flaconului:
— rezultatul estimării preliminare, dacă există;
— temperatura la care s-au făcut determinările;
— date despre metodele analitice folosite pentru determinarea concentrațiilor;
— timpul și viteza de centrifugare, dacă a fost folosită;
— concentrațiile măsurate în ambele faze pentru fiecare determinare (aceasta înseamnă că se prezintă un total de 12 concentrații);
— masa substanței de testat, volumul fiecărei faze folosite în fiecare vas de testare și cantitatea totală calculată de substanță, prezentă în fiecare fază după atingerea echilibrului;
— valorile calculate ale coeficientului de partiție (P) și media lor se consemnează pentru fiecare set de condiții experimentale, ca și media pentru toate determinările. Dacă există vreun indiciu privind coeficientul de partiție în funcție de concentrație, aceasta este notată în raport;
— se consemnează deviația standard a valorilor individuale ale lui P de la media lor;
— media P a tuturor determinărilor se exprimă și ca logaritm (în baza 10);
— valoarea calculată teoretic pentru Pow când această valoare a fost determinată sau când valoarea măsurată este > 104;
— pH-ul apei folosite în timpul experimentului și al fazei apoase;
— dacă sunt folosite soluții tampon, justificarea pentru folosirea soluțiilor tampon în locul apei, compoziția, concentrația și pH-ul soluțiilor tampon, pH-ul fazei apoase, înainte și după experiment.
Pentru metoda HPLC:
— rezultatul estimării preliminare, dacă există;
— substanțele de referință și de testat și puritatea lor;
— intervalul de temperatură al determinărilor;
— pH-ul la care au fost făcute determinările;
— detalii despre coloana analitică și de gardă, faza mobilă și mijlocul de detecție;
— datele privind retenția și valorile log P din literatură pentru compușii de referință folosiți la calibrare;
— detalii despre dreapta de regresie calculată (log k în funcție de log P);
— datele de retenție medii și valoarea interpolată log P pentru compusul de testat;
— descrierea echipamentului și a condițiilor de operare;
— profilurile de eluție;
— cantitățile de substanță de testat și de referință introduse în coloană;
— timpul mort și cum a fost măsurat.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 107, Decision of the Council C(81) 30 final.
2. C. Hansch and A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York 1979.
3. Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A.J. Leo, dir.) – Available from Pomona College Medical Chemistry Project 1982, Pomona College, Claremont, California 91711.
4. L. Renberg, G. Sundström and K. Sundh-Nygärd, Chemosphere, 1980, vol. 80, p. 683.
5. H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sci., 1981, vol. 12, p. 219 (1981).
6. B. McDuffie, Chemosphere, 1981, vol. 10, p. 73.
7. W.E. Hammers et al., J. Chromatogr., 1982, vol. 247, p. 1.
8. J.E. Haky and A.M. Young, J. Liq. Chromat., 1984, vol. 7, p. 675.
9. S. Fujisawa and E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, p. 787.
10. O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E.Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/1, p. 223-339.
11. R.F. Rekker and H.M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, p. 479.
12. A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, vol. 71, p. 525.
13. R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977.
14. NF T 20-043 AFNOR (1985). Chemical prqducts for industrial use – Determination of partition coefficient – Flask shaking method.
15. C.V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, p. 1459.
16. A. Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, vol. 71, p. 525.
17. C. Hansch, A. Leo, S.H. Unger, K.H. Kim, D. Nikaitani and E.J. Lien, J. Med. Chem., 1973, vol. 16, p. 1207.
18. W.B. Neely, D.R. Branson and G.E. Blau, Environ. Sci. Technol., 1974, vol. 8, p. 1113.
19. D.S. Brown and E.W. Flagg, J. Environ. Qual., 1981, vol. 10, p. 382.
20. J.K. Seydel and K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979.
21. R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984.
22. Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Base1,1978.
23. N.S. Nirrlees, S.J. Noulton, C.T. Murphy, P.J. Taylor; J. Med. Chem., 1976, vol. 19, p. 615.
Apendicele 1
Metode de calcul/estimare
INTRODUCERE
O introducere generală în metodele de calcul, cu date și exemple este furnizată de Handbook of Chemical Property Estimation Methods (a).
Valorile calculate pentru Pow pot fi folosite:
— pentru a decide care dintre metodele experimentale este adecvată (intervalul pentru metoda agitării flaconului: log Pow: – 2 până la 4, intervalul HPLC: log Pow: 0 până la 6);
— pentru selectarea condițiilor de testare adecvate (de exemplu, substanțe de referință pentru procedurile HPLC, raportul de volume n-octanol/apă pentru metoda agitării flaconului);
— ca verificare internă de laborator a posibilelor erori experimentale;
— pentru a furniza un Pow estimat în cazul când metodele experimentale nu pot fi aplicate din motive tehnice.
METODA ESTIMATIVĂ
Estimarea preliminară a coeficientului de partiție
Valoarea coeficientului de partiție poate fi estimată prin folosirea solubilităților substanței de testat în solvenți puri. Astfel,
![]()
METODE DE CALCUL
Principiul metodelor de calcul
Toate metodele de calcul se bazează pe fragmentarea formală a moleculei în structuri adecvate pentru care se cunosc creșteri fiabile ale valorilor log Pow. Log Pow al întregii molecule este apoi calculat ca sumă a valorilor corespunzătoare fragmentelor plus suma termenilor de corecție pentru interacțiunile intramoleculare.
Listele constantelor fragmentelor și ale termenilor de corecție sunt disponibile în (b), (c), (d) și (e). Unele sunt actualizate cu regularitate (b).
Criterii de calitate
În general, fiabilitatea metodei de calcul scade odată cu creșterea complexității compusului studiat. În cazul moleculelor simple, cu masa moleculară scăzută și una sau două grupe funcționale, se preconizează abateri de la 0,1 până la 0,3 unități log Pow între rezultatele diferitelor metode de fragmentare și valoarea măsurată. În cazul moleculelor mai complexe, marja de eroare poate fi mai mare. Aceasta va depinde de fiabilitatea și disponibilitatea constantelor de fragmente, precum și de abilitatea analistului de a recunoaște interacțiuni intramoleculare (de exemplu legături de hidrogen) și de corecta folosire a factorilor de corecție (o problemă care apare mai puțin dacă se folosește programul CLOGP-3) (b). În cazul compușilor ionizabili este importantă atribuirea corectă a sarcinii sau a gradului de ionizare.
Metode de calcul
Constanta substituentului hidrofob original, π, introdusă de Fujita et al. (f) se definește ca:
πx = log Pow (PhX) – log Pow (PhH)
unde Pow (PhX) este coeficientul de partiție al unui derivat aromatic și Pow (PhH) este coeficientul de partiție al compusului inițial.
[de exemplu πCl = log Pow (C6H5Cl) – log Pow (C6H6) = 2,84 – 2,13 = 0,71].
În concordanță cu definiția, metoda π este aplicabilă în special pentru substituenții aromatici, valorile π pentru un mare număr de substituenți fiind tabelate (b) (c) (d). Acestea sunt folosite pentru calcularea log Pow pentru molecule sau substructuri aromatice.
Conform lui Rekker (g), valoarea pentru log Pow se calculează după cum urmează:

unde fi reprezintă constantele diferitelor fragmente moleculare și ai frecvența apariției lor în molecula investigată. Termenii de corecție pot fi exprimați ca un multiplu întreg al unei singure constante Cm (așa numita „constantă magică”). Constantele de fragment fi și Cm au fost determinate dintr-o listă de 1 054 valori experimentale pentru Pow (825 de compuși), folosind analiza regresivă multiplă (c) (h). Determinarea termenilor de interacțiune este efectuată în concordanță cu regulile stabilite descrise în literatură (e) (h) (i).
Potrivit lui Leo și Hansch (c), valoarea log Pow se calculează din:

unde fi reprezintă constantele diferitelor fragmente moleculare, Fj termenii de corecție, iar ai, bj frecvența fragmentului corespunzător. Din valorile experimentale Pow, a fost determinată prin încercare și eroare o listă a valorilor pentru fragmentele atomice și de grup și o listă a termenilor de corecție Fj (așa numiții „factori”).Termenii de corecție au fost ordonați în diferite clase (a) (c). A lua în considerare toate regulile și termenii de corecție este relativ complicat și consumă timp. Pentru această metodă există câteva pachete de programe computerizate (b).
Calculul log Pow al moleculelor complexe poate fi considerabil îmbunătățit, dacă molecula este împărțită în substructuri mari, pentru care există valori log Pow fiabile fie din tabele (b) (c), fie din măsurătorile proprii. Astfel de fragmente (de exemplu heterocicluri, antrachinona, azobenzen) pot fi apoi combinate cu valorile π Hansch sau cu constantele fragmentelor Rekker sau Leo.
Observații
(i) Metodele de calcul pot fi aplicate compușilor parțial sau total ionizați numai atunci când este posibil să se ia în considerare factorii de corecție necesari.
(ii) Dacă se presupune că există legături de hidrogen intramoleculare, trebuie adăugați termenii de corecție corespunzători (aproximativ + 0,6 până la + 1,0 unități log Pow) (a). Indicații privind prezența unor astfel de legături pot fi obținute din modelele stereochimice sau din datele spectroscopice ale moleculei.
(iii) Dacă sunt posibile diferite forme tautomere, structura cea mai probabilă va fi folosită ca bază de calcul.
(iv) Edițiile revizuite ale listelor cu constantele fragmentelor se vor urmări atent.
Raport de testare
Când se folosesc metodele de calcul/estimare, raportul de testare cuprinde următoarele informații, dacă este posibil:
— descrierea substanței (amestec, impurități etc.);
— indicarea oricăror posibile legături de hidrogen intramoleculare, a disocierii, a sarcinii și a oricăror altor efecte neobișnuite (de exemplu tautomerie);
— descrierea metodei de calcul;
— identificarea sau anexarea bazei de date folosită;
— particularități în alegerea fragmentelor;
— documentația cuprinzătoare a calculului.
REFERINȚE BIBLIOGRAFICE
(a) W.J. Lyman, W.F. Reehl and D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983.
(b) Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3).
(c) C. Hansch, A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
(d) A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971, vol. 71, p. 525.
(e) R.F. Rekker, H.M. de Kort, Eur. J. Med. Chem.-Chill. Ther. 1979, vol. 14, p. 479.
(f) T. Fujita, J. Iwasa and C. Hansch, J. Amer. Chem. Soc., 1964, vol. 86, p. 5175.
(g) R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, New York, 1977, vol. 1.
(h) C.V. Eadsforth, P. Moser, Chemosphere, 1983, vol. 12, p. 1459.
(i) R.A. Scherrer, ACS, American Chemical Society, Washington D.C., 1984, Symposium Series 255, p. 225.
Apendicele 2
Substanțele de referință recomandate pentru metoda HPLC
|
Nr. crt. |
Substanță de referință |
log Pow |
pKa |
|
1 |
2-butanonă |
0,3 |
|
|
2 |
4-acetilpiridină |
0,5 |
|
|
3 |
anilină |
0,9 |
|
|
4 |
acetanilidă |
1,0 |
|
|
5 |
alcool benzilic |
1,1 |
|
|
6 |
p-metoxifenol |
1,3 |
pKa = 10,26 |
|
7 |
acid fenoxi acetic |
1,4 |
pKa = 3,12 |
|
8 |
fenol |
1,5 |
pKa = 9,92 |
|
9 |
2,4-dinitrofenol |
1,5 |
pKa = 3,96 |
|
10 |
benzonitril |
1,6 |
|
|
11 |
fenilacetonitril |
1,6 |
|
|
12 |
alcool 4-metilbenzilic |
1,6 |
|
|
13 |
acetofenonă |
1,7 |
|
|
14 |
2-nitrofenol |
1,8 |
pKa = 7,17 |
|
15 |
acid 3-nitrobenzoic |
1,8 |
pKa = 3,47 |
|
16 |
4-cloranilină |
1,8 |
pKa = 4,15 |
|
17 |
nitrobenzen |
1,9 |
|
|
18 |
alcool cinamic |
1,9 |
|
|
19 |
acid benzoic |
1,9 |
pKa = 4,19 |
|
20 |
p-crezol |
1,9 |
pKa = 10,17 |
|
21 |
acid cinamic |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22 |
anisol |
2,1 |
|
|
23 |
benzoat de metil |
2,1 |
|
|
24 |
benzen |
2,1 |
|
|
25 |
acid 3- metilbezoic |
2,4 |
pKa = 4,27 |
|
26 |
4-clorofenol |
2,4 |
pKa = 9,1 |
|
27 |
tricloretilenă |
2,4 |
|
|
28 |
atrazină |
2,6 |
|
|
29 |
benzoat de etil |
2,6 |
|
|
30 |
2,6-diclorbenzonitril |
2,6 |
|
|
31 |
acid 3-clorbenzoic |
2,7 |
pKa = 3,82 |
|
32 |
toluen |
2,7 |
|
|
33 |
1- naftol |
2,7 |
pKa = 9,34 |
|
34 |
2,3-dicloranilină |
2,8 |
|
|
35 |
clorbenzen |
2,8 |
|
|
36 |
alil-fenileter |
2,9 |
|
|
37 |
brombenzen |
3,0 |
|
|
38 |
etilbenzen |
3,2 |
|
|
39 |
benzofenonă |
3,2 |
|
|
40 |
4-fenilfenol |
3,2 |
pKa = 9,54 |
|
41 |
timol |
3,3 |
|
|
42 |
1,4-diclorbenzen |
3,4 |
|
|
43 |
difenilamină |
3,4 |
pKa = 0,79 |
|
44 |
naftalină |
3,6 |
|
|
45 |
fenilbenzoat |
3,6 |
|
|
46 |
izopropilbenzen |
3,7 |
|
|
47 |
2,4,6-triclorfenol |
3,7 |
pKa = 6 |
|
48 |
bifenil |
4,0 |
|
|
49 |
benzilbenzoat |
4,0 |
|
|
50 |
2,4-dinitro-6 sec-butilfenol |
4,1 |
|
|
51 |
1,2,4-triclorbenzen |
4,2 |
|
|
52 |
acid dodecanoic |
4,2 |
|
|
53 |
difenileter |
4,2 |
|
|
54 |
n- butilbenzen |
4,5 |
|
|
55 |
fenantren |
4,5 |
|
|
56 |
fluoranten |
4,7 |
|
|
57 |
dibenzil |
4,8 |
|
|
58 |
2,6-difenil-piridină |
4,9 |
|
|
59 |
trifenilamină |
5,7 |
|
|
60 |
DDT |
6,2 |
|
|
Alte substanțe de referință cu log Pow mic |
|||
|
1 |
acid nicotinic |
- 0,07 |
|
A.9. PUNCTUL DE INFLAMABILITATE
1. METODĂ
1.1. INTRODUCERE
Pentru efectuarea acestui test, este util să se colecteze informații preliminare despre inflamabilitatea substanței. Modul de operare este aplicabil substanțelor lichide ai căror vapori se pot aprinde în prezența unei surse de aprindere. Metodele de testare prezentate în acest text sunt fiabile numai pentru intervalele de puncte de inflamabilitate specificate pentru fiecare metodă în parte.
La alegerea metodei ce urmează să fie folosită se va lua în considerare posibilitatea apariției unor reacții chimice între substanță și suportul probei.
1.2. DEFINIȚII ȘI UNITĂȚI
Punctul de inflamabilitate este cea mai joasă temperatură, corectată la presiunea de 101,325 kPa, la care lichidul degajă vapori, în condițiile specifice ale metodei de analiză, într-o asemenea cantitate încât în vasul de testare se produce un amestec inflamabil vapori/aer.
Unități: oC
t = T – 273,15
(t în oC și T în K)
1.3. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință în toate cazurile în care se studiază o nouă substanță. Acestea trebuie în special să servească la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode
1.4. PRINCIPIUL METODEI
Substanța se introduce în vasul de testare și este încălzită sau răcită până la temperatura de testare conform procedurii specifice metodei de testare. Încercările de aprindere sunt efectuate pentru a dovedi dacă eșantionul se aprinde sau nu la temperatura de testare.
1.5. CRITERII DE CALITATE
1.5.1. Repetabilitate
Repetabilitatea variază în funcție de intervalul punctului de inflamabilitate și de metoda folosită; maximum 2 oC.
1.5.2. Sensibilitate
Sensibilitatea depinde de metoda de testare folosită.
1.5.3. Specificitate
Specificitatea unora dintre metode este limitată la anumite intervale de puncte de inflamabilitate și depinde de caracteristicile substanței (de exemplu, viscozitate mare).
1.6. DESCRIEREA METODEI
1.6.1. Pregătiri
O probă de substanță se introduce într-un aparat de testare în conformitate cu punctul 1.6.3.1 și/sau 1.6.3.2.
Pentru siguranță se recomandă ca pentru substanțele reactive sau toxice să fie folosită o metodă care utilizează o cantitate mică de probă, circa 2 cm3.
1.6.2. Condiții experimentale
Aparatul se așează într-o poziție fără curenți de aer, în conformitate cu normele de siguranță.
1.6.3. Desfășurarea testului
1.6.3.1. Metoda echilibrului
A se vedea ISO 1516, ISO 3680, ISO 1523, ISO 3679.
1.6.3.2. Metoda non-echilibrului
A se vedea BS 2000 partea 170, NF M07-011, NF T66-009.
A se vedea EN 57, DIN 51755 partea 1 (pentru temperaturi de la 5o la 65 oC), DIN 51755 partea 2 (pentru temperaturi sub 5 oC), NF M07-036.
A se vedea ASTM D 56.
A se vedea ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M07-019.
Când punctul de inflamabilitate, determinat printr-o metodă de non-echilibru în conformitate cu punctul 1.6.3.2, are valori de 0 ± 2 oC, 21 ± 2 oC sau 55 ± 2 oC, acest lucru se confirmă printr-o metodă de echilibru, folosindu-se același aparat.
Numai metodele prin care se poate determina temperatura de inflamabilitate pot fi folosite pentru notificări.
Pentru a determina punctul de inflamabilitate al lichidelor vâscoase (vopsele, rășini și altele similare) care conțin solvenți, pot fi folosite numai aparate și metode potrivite pentru determinarea punctului de inflamabilitate al lichidelor vâscoase.
A se vedea ISO 3679, ISO 3680, ISO 1523, DIN 53213 partea 1.
2. DATE
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile exacte ale substanței (identificare și impurități);
— o descriere a metodei folosite, precum și orice posibile abateri;
— rezultatele și orice observație suplimentară relevantă pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
Niciuna.
A.10. INFLAMABILITATE (SOLIDE)
1. METODĂ
1.1. INTRODUCERE
Înainte de efectuarea testului este util să se colecteze informații preliminare asupra posibilelor proprietăți explozive ale substanței.
Acest test se aplică numai substanțelor sub formă de pulbere, granule sau pastă.
Pentru a nu include toate substanțele care se pot aprinde, ci numai acelea care ard rapid sau acelea al căror comportament la ardere este periculos în orice mod, se consideră că sunt foarte inflamabile numai substanțele a căror viteză de ardere depășește o anumită valoare-limită.
Poate fi deosebit de periculos dacă incandescența se propagă printr-o pulbere metalică din cauza dificultăților în stingerea focului. Pulberile metalice vor fi considerate foarte inflamabile dacă întrețin propagarea incandescenței în toată masa într-un interval de timp definit.
1.2. DEFINIȚII ȘI UNITĂȚI
Timpul de ardere este exprimat în secunde.
1.3. SUBSTANȚE DE REFERINȚĂ
Nu sunt menționate.
1.4. PRINCIPIUL METODEI
Substanța este dispusă sub forma unei benzi continue sau a unui amestec de pulbere explozivă de aproximativ 250 mm lungime și este efectuat un test preliminar pentru a stabili dacă are loc, prin aprindere cu o flacără de gaz, propagarea prin ardere cu flacără sau mocnit. Dacă propagarea de-a lungul a 200 mm de amestec are loc într-un interval de timp specificat, atunci se efectuează un program complet de testare pentru a determina viteza de ardere.
1.5. CRITERII DE CALITATE
Nu sunt menționate.
1.6. DESCRIEREA METODEI
1.6.1. Testul preliminar
Substanța este dispusă sub forma unui cartuș compact sau a unui amestec de pulbere explozivă de aproximativ 250 mm lungime, 20 mm lățime, 10 mm înălțime, pe o placă de bază necombustibilă, neporoasă și care nu conduce bine căldura. O flacără de la un arzător cu gaz (minimum 5 mm diametru) este aplicată la unul din capetele amestecului de pulbere explozivă până când pulberea se aprinde sau timp de maximum 2 minute (5 minute pentru pulberi metalice sau de aliaje metalice). Se observă dacă de-a lungul celor 200 mm de amestec combustia se propagă în perioada de testare de 4 minute (sau 40 de minute pentru pulberile de metal). Dacă substanța nu se aprinde și combustia nu se propagă, nici prin ardere cu flacără, nici prin ardere mocnită, de-a lungul celor 200 mm de amestec de pulbere explozivă în perioada de testare de 4 minute (sau 40 minute), atunci substanța nu este considerată foarte inflamabilă și nu este necesară o altă testare. Dacă substanța propagă arderea de-a lungul a 200 mm lungime de amestec de pulbere explozivă în mai puțin de 4 minute, sau mai puțin de 40 de minute pentru pulberile metalice, atunci se urmează metoda descrisă mai jos (punctul 1.6.2 și următoarele).
1.6.2. Testarea vitezei de ardere
1.6.2.1. Pregătire
Substanțele granulare sau pulberile sunt introduse lejer într-o matriță de 250 mm lungime cu secțiune transversală triunghiulară cu înălțime interioară de 10 mm și lățime de 20 mm. Pe ambele fețe ale matriței, pe direcție longitudinală, se montează două plăci metalice ca opritoare laterale care depășesc cu 2 mm extremitatea superioară a secțiunii transversale triunghiulare (figura). Apoi se lasă matrița să cadă de trei ori de la o înălțime de 2 cm pe o suprafață solidă. Dacă este necesar, forma este apoi umplută din nou. Substanța în exces care rămâne se curăță cu o racletă oblică. Plăcile opritoare se scot și substanța rămasă este îndepărtată cu o racletă. Se pune deasupra matriței o placă de bază necombustibilă, neporoasă și slab conducătoare de căldură, ansamblul este răsturnat și se scoate forma.
Substanțele sub formă de pastă sunt întinse pe o placă necombustibilă, neporoasă și slab conducătoare de căldură sub forma unei fâșii de 250 mm lungime cu o secțiune transversală de aproximativ 1 cm.
1.6.2.2. Condiții experimentale
În cazul substanțelor sensibile la umezeală, testul va fi efectuat cât mai repede posibil după scoaterea din recipient.
1.6.2.3. Desfășurarea testului
Se pune eșantionul perpendicular pe curentul de aer din nișa de tiraj.
Viteza aerului trebuie să fie suficientă pentru a preveni degajarea vaporilor în laborator și să nu varieze în timpul testului. Curentul de aer trebuie să formeze un ecran în jurul aparatului.
O flacără fierbinte de la un arzător cu gaz (minimum 5 mm diametru) este folosită pentru a aprinde substanța în formă de cartuș, la o margine. Când cartușul a ars pe o distanță de 80 mm se măsoară viteza de ardere de-a lungul următorilor 100 de mm.
Testul se efectuează de 6 ori, folosind de fiecare dată o placă rece, curată, afară de cazul când este observat mai devreme un rezultat pozitiv.
2. DATE
Timpul de ardere din testul preliminar (1.6.1) și cel mai scurt timp de ardere din cele 6 teste (1.6.2.3) sunt relevante pentru evaluare.
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile exacte ale substanței (identificare și impurități);
— o descriere a substanței de testat, starea sa fizică, inclusiv conținutul de umezeală;
— rezultatele testului preliminar de triere și ale testului vitezei de ardere, dacă au fost efectuate;
— toate observațiile suplimentare relevante pentru interpretarea rezultatelor.
3.2. INTERPRETAREA REZULTATELOR
Substanțele sub formă de pulbere, pastă sau granulare se consideră foarte inflamabile dacă timpul de ardere dintr-unul din testele efectuate conform metodei de testare descrise la 1.6.2. este mai mic de 45 de secunde. Pulberile metalice sau de aliaje metalice sunt considerate foarte inflamabile dacă pot fi aprinse și flacăra sau zona de reacție se întinde asupra întregului eșantion în 10 minute sau mai puțin.
4. REFERINȚE BIBLIOGRAFICE
NF T 20-042 (September 85). Chemical products for industrial use. Determination of the flammability of solids.
Apendice
Figură
Matrița și accesoriile pentru eșantionul în formă de cartuș
(Toate dimensiunile în milimetri)

A.11. INFLAMABILITATE (GAZE)
1. METODĂ
1.1. INTRODUCERE
Prin această metodă se determină dacă amestecurile de gaze cu aer, la temperatura camerei (circa 20 oC) și presiune atmosferică, sunt inflamabile și, în acest caz, în ce interval de concentrații. Amestecurile cu aer ale gazului testat, în concentrații crescânde, sunt expuse unei scântei electrice și se observă dacă are loc aprinderea.
1.2. DEFINIȚII ȘI UNITĂȚI
Intervalul de inflamabilitate este intervalul de concentrație dintre limita de explozie inferioară și cea superioară. Limitele de explozie inferioară și superioară sunt acele limite de concentrație ale gazului inflamabil în aer la care propagarea flăcării nu are loc.
1.3. SUBSTANȚE DE REFERINȚĂ
Nu sunt menționate.
1.4. PRINCIPIUL METODEI
Concentrația gazului în aer se crește treptat și în fiecare etapă amestecul se expune la scânteie electrică.
1.5. CRITERII DE CALITATE
Nu sunt menționate.
1.6. DESCRIEREA METODEI
1.6.1. Aparatură
Vasul de testare este un cilindru de sticlă vertical cu un diametru interior de minimum 50 mm și o înălțime de minimum 300 de mm. Electrozii de aprindere sunt separați de o distanță de 3 până la 5 mm și sunt plasați la 60 mm deasupra fundului cilindrului. Cilindrul este prevăzut cu o supapă de descărcare a presiunii. Aparatul trebuie să fie protejat pentru a limita posibilele efecte ale exploziei.
Ca sursă de aprindere este folosită o scânteie cu o durată de 0,5 secunde, generată de un transformator de înaltă tensiune cu o tensiune de ieșire de 10-15 kV (maximum de putere consumată 300 W). Un exemplu de aparat adecvat este descris în referința bibliografică 2.
1.6.2. Condiții experimentale
Testul trebuie efectuat la temperatura camerei (circa 20 oC).
1.6.3. Desfășurarea testului
Folosind o pompă dozatoare, un amestec cu concentrație cunoscută de gaz în aer este introdus în cilindrul de sticlă. Prin amestec se trece o scânteie și se observă dacă flacăra se detașează de sursa de aprindere și se propagă independent. Concentrația gazului este mărită în pași de 1 % din volum până când are loc aprinderea conform descrierii de mai sus.
Dacă structura chimică a gazului indică faptul că acesta nu este inflamabil și poate fi calculată compoziția amestecului stoechiometric cu aerul, atunci este necesar să se testeze numai amestecuri din intervalul de la 10 % sub concentrația stoechiometrică până la 10 % peste această concentrație, în pași de 1 %.
2. DATE
Propagarea flăcării este singura informație relevantă pentru determinarea acestei proprietăți.
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile exacte ale substanței (identificare și impurități);
— o descriere, cu dimensiuni, a aparatului utilizat;
— temperatura la care a fost efectuat testul;
— concentrațiile testate și rezultatele obținute;
— rezultatul testului: gaz neinflamabil sau gaz foarte inflamabil;
— dacă se ajunge la concluzia că gazul nu este inflamabil, se va specifica intervalul de concentrație în care a fost testat în pași de 1 %;
— toate informațiile și observațiile relevante pentru interpretarea rezultatelor trebuie raportate.
4. REFERINȚE BIBLIOGRAFICE
1. NF T 20-041 (September 85). Chemical products for industrial use. Determination of the flammability of gases.
2. W. Berthold, D. Conrad, T. Grewer, H. Grosse-einer Standard-Apparatur zur Messung von Explosionsgrenzen'. Chem.-Ing.- Tech. 1984, vol, 156, 2, p. 126-127. Wortmann, T. Redeker und H. Schacke. 'Entwicklung
A.12. INFLAMABILITATE (CONTACTUL CU APA)
1. METODĂ
1.1. INTRODUCERE
Metoda poate fi folosită pentru a stabili dacă reacția substanței cu apa sau cu umezeala din aer conduce la degajarea unor cantități periculoase de gaz sau gaze foarte inflamabile.
Metoda poate fi aplicată atât substanțelor solide, cât și celor lichide. Această metodă nu este aplicabilă substanțelor care se aprind în mod spontan în contact cu aerul.
1.2. DEFINIȚII ȘI UNITĂȚI
Foarte inflamabil: o substanță care în contact cu apa sau aerul umed degajă gaze foarte inflamabile în cantități periculoase la un debit minim de 1 litru/kg pe oră.
1.3. PRINCIPUL METODEI
Substanța este testată în concordanță cu succesiunea de pași descrisă mai jos; dacă are loc aprinderea la unul din pași, nu mai este necesară testarea în continuare. Dacă se știe că substanța nu reacționează violent cu apa atunci se va trece direct la pasul 4 (punctul 1.3.4).
1.3.1. Pasul 1
Proba se introduce într-un jgheab care conține apă distilată la 20 oC și se notează dacă gazul dezvoltat se aprinde.
1.3.2. Pasul 2
Substanța este plastă pe o hârtie de filtru care plutește la suprafața apei distilate dintr-o capsulă de laborator, la 20 oC, și se observă dacă gazul dezvoltat se aprinde. Hârtia de filtru are rolul numai de a ține substanța într-un loc, pentru a crește șansa de aprindere.
1.3.3. Pasul 3
Eșantionul este prelucrat sub forma unui cartuș de aproximativ 2 cm înălțime și 3 cm diametru. Se adaugă câteva picături de apă și se notează dacă gazul dezvoltat se aprinde.
1.3.4. Pasul 4
Eșantionul este amestecat cu apă distilată la 20 oC și este măsurată viteza de degajare a gazului în timpul unei perioade de 7 ore, la intervale de 1 oră. Dacă viteza de degajare este inegală, sau este crescătoare, după 7 ore, timpul de măsurare poate fi extins la un timp maxim de 5 zile. Testul poate fi oprit dacă viteza la un moment dat depășește 1 l/kg/h.
1.4. SUBSTANȚE DE REFERINȚĂ
Nu sunt menționate.
1.5. CRITERII DE CALITATE
Nu sunt menționate.
1.6. DESCRIEREA METODELOR
1.6.1. Pasul 1
1.6.1.1. Condiții experimentale
Testul este efectuat la temperatura camerei (circa 20 oC).
1.6.1.2. Desfășurarea testului
O cantitate mică (aproximativ 2 mm diametru) din eșantion se introduce într-un jgheab cu apă distilată. Se notează dacă (i) se dezvoltă vreun gaz și (ii) dacă are loc aprinderea gazului. Dacă are loc aprinderea gazului, nu mai este necesară testarea în continuare a substanței deoarece substanța este considerată periculoasă.
1.6.2. Pasul 2
1.6.2.1. Aparatură
O hârtie de filtru este făcută să plutească pe suprafața plană de apă distilată într-un vas potrivit, de exemplu o sticlă de ceas cu 100 mm diametru.
1.6.2.2. Condiții experimentale
Testul se efectuează la temperatura camerei (circa 20 oC).
1.6.2.3. Desfășurarea testului
O cantitate mică (aproximativ 2 mm diametru) din eșantion se introduce în centrul unei hârtii de filtru. Se va nota dacă (i) apar gaze și (ii) dacă are loc aprinderea gazului. Dacă are loc aprinderea gazului, nu mai este necesară testarea în continuare a substanței deoarece substanța este considerată periculoasă.
1.6.3. Pasul 3
1.6.3.1. Condițiile experimentale
Testul se efectuează la temperatura camerei (circa 20 oC).
1.6.3.2. Desfășurarea testului
Eșantionul este prelucrat sub forma unui cartuș de aproximativ 2 cm înălțime și 3 cm diametru și cu o scobitură la vârf. Câteva picături de apă sunt adăugate în scobitură și se notează dacă (i) apar gaze și (ii) dacă are loc aprinderea gazului. Dacă are loc aprinderea gazului, nu mai este necesară testarea în continuare a substanței deoarece substanța este considerată periculoasă.
1.6.4. Pasul 4
1.6.4.1. Aparatură
Instalația este descrisă în figură.
1.6.4.2. Condițiile experimentale
Se examinează containerul cu eșantion pentru a observa dacă există pulberi < 500 μm (dimensiunea particulei). Dacă pulberea reprezintă mai mult de 1 % g/g din total sau dacă eșantionul este friabil, atunci toată substanța va fi mojarată până la pulbere înainte de testare pentru a permite reducerea dimensiunilor particulelor în timpul depozitării și manipulării; în caz contrar, substanța va fi testată așa cum a fost primită. Testul va fi efectuat la temperatura camerei (circa 20 oC) și la presiune atmosferică.
1.6.4.3. Desfășurarea testului
10-20 ml de apă se pun în pâlnia de picurare a aparatului și 10 grame din substanță se introduc în paharul conic. Volumul de gaz degajat poate fi măsurat prin orice mijloc corespunzător. Se deschide robinetul pâlniei de picurare pentru a lăsa apa să treacă în paharul conic și se pornește cronometrul. Degajarea gazului este măsurată la intervale de o oră de-a lungul unei perioade de 7 ore. Dacă în timpul acestei perioade degajarea gazului este inegală sau dacă la sfârșitul acestei perioade viteza de degajare a gazului este în creștere, atunci măsurătorile vor fi continuate timp de cel mult 5 zile. Dacă la un moment dat în timpul măsurărilor viteza de degajare a gazului depășește 1 l/kg/oră, testul poate fi întrerupt. Testul se efectuează de 3 ori.
Dacă identitatea chimică a gazului este necunoscută, gazul se analizează. Atunci când gazul conține componenți foarte inflamabili și nu se cunoaște dacă amestecul este foarte inflamabil, trebuie preparat un amestec cu aceeași compoziție și testat conform metodei A.11.
2. DATE
Substanța este considerată periculoasă dacă:
— are loc o aprindere spontană în oricare din etapele metodei de testare;
— sau
— există o degajare de gaz inflamabil cu o viteză mai mare de 1 l/kg de substanță pe oră.
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile exacte ale substanței (identificare și impurități);
— detalii despre prepararea inițială a substanței;
— rezultatele testelor (pașii 1, 2, 3 și 4);
— identitatea chimică a gazului degajat;
— viteza de degajare a gazului, dacă s-a efectuat pasul 4 (punctul 1.6.4);
— orice observație suplimentară relevantă pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. Recommendations on the transport of dangerous goods, test and criteria, 1990, United Nations, New York.
2. NF T 20-040 (September 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products.
Apendice
Figura
Aparat

A.13. PROPRIETĂȚI PIROFORICE ALE SOLIDELOR ȘI ALE LICHIDELOR
1. METODĂ
1.1. INTRODUCERE
Procedura este aplicabilă substanțelor solide sau lichide care, în cantități mici, se aprind spontan la scurt timp după ce intră în contact cu aerul la temperatura camerei (circa 20 oC).
Această metodă de testare nu reglementează substanțele care necesită expunere la aer ore sau zile la temperatura camerei sau cele la care se produce aprinderea la temperaturi ridicate.
1.2. DEFINIȚII ȘI UNITĂȚI
Substanțele sunt considerate ca având proprietăți piroforice dacă se aprind sau se carbonizează în condițiile descrise la punctul 1.6.
Autoaprinderea lichidelor poate fi, de asemenea, testată folosind metoda A.15 Temperatura de autoaprindere (lichide și gaze).
1.3. SUBSTANȚE DE REFERINȚĂ
Nu sunt menționate.
1.4. PRINCIPIUL METODEI
Substanța, solidă sau lichidă, este depusă pe un suport inert și adusă în contact cu aerul la temperatura ambiantă timp de 5 minute. Dacă substanțele lichide nu se aprind, sunt absorbite pe o hârtie de filtru și expuse la aer la temperatura ambiantă (circa 20 oC) pentru 5 minute. Dacă o substanță lichidă ori solidă se aprinde sau dacă o substanță lichidă aprinde sau carbonizează hârtia de filtru, atunci acea substanță este considerată a fi piroforică.
1.5. CRITERII DE CALITATE
Repetabilitatea: din motive de siguranță, un singur rezultat pozitiv este suficient pentru ca substanța să fie considerată piroforică.
1.6. DESCRIEREA METODEI
1.6.1. Aparatură
O capsulă de porțelan de cca. 10 cm diametru se umple cu pământ de diatomee până la o înălțime de aproximativ 5 mm, la temperatura camerei (circa 20 oC).
Notă:
Pământul de diatomee sau o altă substanță inertă comparabilă care este disponibilă în mod uzual este considerat ca reprezentativ pentru solul pe care proba poate fi răsturnată în caz de accident.
Pentru testarea lichidelor care nu se aprind în contact cu aerul este necesară o hârtie de filtru uscată atunci când intră în contact cu un agent purtător inert.
1.6.2. Desfășurarea testului
(a) Solide sub formă de pulbere
Se toarnă 1-2 cm3 de pulbere de substanță de la circa 1 m înălțime pe o suprafață necombustibilă și se observă dacă substanța se aprinde în timpul turnării sau în 5 minute de la depunere.
Testul este efectuat de 6 ori dacă nu are loc aprinderea.
(b) Lichide
Se toarnă aproximativ circa 5 cm3 de lichid într-o capsulă de porțelan și se observă dacă substanța se aprinde în interval de 5 minute.
Dacă nu are loc nicio aprindere în 6 testări, se vor efectua următoarele teste:
Un eșantion de 0,5 ml este împins dintr-o seringă pe o hârtie de filtru pliată și se observă dacă are loc aprinderea sau carbonizarea hârtiei de filtru în 5 minute de la adăugarea lichidului. Testul este efectuat de 3 ori dacă nu are loc aprinderea sau carbonizarea.
2. DATE
2.1. INTERPRETAREA REZULTATELOR
Testarea poate fi întreruptă atunci când apare un rezultat pozitiv într-unul din teste.
2.2. EVALUARE
Dacă substanța se aprinde în 5 minute de la adăugarea ei la un purtător inert și expunerea la aer sau o substanță lichidă carbonizează sau aprinde o hârtie de filtru în 5 minute de când a fost adăugată și expusă la aer, este considerată a fi piroforică.
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile exacte ale substanței (identificare și impurități);
— rezultatele testelor;
— orice observație suplimentară relevantă pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. NF T 20-039 (September 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids.
2. Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, New York.
A.14. PROPRIETĂȚI EXPLOZIVE
1. METODĂ
1.1. INTRODUCERE
Prezenta metodă permite determinarea probabilității ca o substanță solidă sau sub formă de pastă să prezinte pericol de explozie atunci când este supusă la efectul unei flăcări (sensibilitate termică), la șoc mecanic sau la frecare (sensibilitate la stimuli mecanici) sau ca o substanță lichidă să prezinte pericol de explozie atunci când este supusă la efectul unei flăcări sau la șoc.
Metoda cuprinde trei părți:
(a) un test de sensibilitate termică (1);
(b) un test de sensibilitate mecanică la șoc (1);
(c) un test de sensibilitate mecanică la frecare (1).
Metoda oferă date care permit evaluarea probabilității de a amorsa o explozie cu ajutorul unor stimuli obișnuiți. Scopul ei nu este să determine dacă o substanță sau un preparat este sau nu este susceptibil de a exploda în orice condiții.
Metoda este în măsură să determine dacă o substanță sau un preparat va prezenta pericol de explozie (sensibilitate termică sau mecanică) în condițiile speciale definite în directivă. Metoda se bazează pe mai multe tipuri de aparate, folosite pe scară largă pe plan internațional (1) și care au, în general, rezultate edificatoare. Se admite totuși că metoda nu este definitivă. Se pot folosi aparate alternative, cu condiția ca acestea să fie recunoscute pe plan internațional și ca rezultatele să poată fi corelate în mod adecvat cu cele obținute pe aparatul specificat.
Testele nu se justifică dacă datele termodinamice disponibile (căldura de formare, căldura de descompunere) și absența anumitor grupe reactive (2) în formula structurală permit să se stabilească în mod cert că substanța sau preparatul nu este susceptibil de a se descompune rapid cu degajare de gaze sau de căldură (altfel spus, materialul nu prezintă riscuri de explozie). Pentru lichide nu este necesar testul de sensibilitate mecanică la frecare.
1.2. DEFINIȚII ȘI UNITĂȚI
Exploziv:
Substanțe care sunt susceptibile de a exploda sub efectul flăcării sau sunt sensibile la șoc ori frecare în aparatul specificat (sau sunt mai sensibile din punct de vedere mecanic decât 1,3-dinitrobenzenul într-un aparat alternativ).
1.3. SUBSTANȚE DE REFERINȚĂ
1,3-dinitrobenzen, în stare cristalină, de puritate tehnică, cernut să treacă prin sita cu ochiuri de 0,5 mm, pentru metodele de testare prin frecare și prin șoc.
Perhidro-1,3,5-trinitro-1,3,5-triazina (RDX, hexogen, ciclonit – CAS 121-82-4), recristalizată din soluție apoasă de ciclohexanonă, cernută în stare umedă prin sită cu ochiuri de 250 μm și reținută pe sită cu ochiuri de 150 μm și apoi uscată la 103 ± 2 oC (timp de 4 ore) pentru o a doua serie de teste de sensibilitate mecanică (la șoc și frecare).
1.4. PRINCIPIUL METODEI
Sunt necesare teste preliminare pentru a determina condițiile de siguranță în care se desfășoară cele trei teste de sensibilitate.
1.4.1. Teste pentru determinarea siguranței în manipulare (3)
Din motive de siguranță, înainte de realizarea testelor principale, se supun eșantioane foarte mici (cca. 10 mg.) de substanță la încălzire în aer liber cu flacără de arzător cu gaz, la șoc, în orice formă adecvată de aparat, și la frecare, folosind un ciocan de lemn și o nicovală, sau orice alt dispozitiv de frecare. Obiectivul constă în a determina dacă substanța este suficient de sensibilă și explozibilă încât realizarea testelor de sensibilitate prescrise, în special cel de sensibilitate termică, să necesite precauții speciale pentru a evita vătămarea operatorului.
1.4.2. Sensibilitatea termică
Metoda constă în încălzirea substanței într-un tub din oțel, închis cu plăci cu orificii de diametre diferite, pentru a determina dacă substanța este susceptibilă de a exploda în condiții de încălzire intensă și spațiu limitat într-un mod definit.
1.4.3. Sensibilitatea mecanică (la șoc)
Metoda constă în supunerea substanței la șocul produs de un corp cu masă specificată care cade de la o înălțime specificată.
1.4.4. Sensibilitatea mecanică (la frecare)
Metoda constă în supunerea unei substanțe, aflată în stare solidă sau sub formă de pastă, la frecare între suprafețe standardizate, în condiții specificate de forță și deplasare relativă.
1.5. CRITERII DE CALITATE
Nu sunt menționate.
1.6. DESCRIEREA METODEI
1.6.1. Sensibilitatea termică (efectul flăcării)
1.6.1.1. Aparatură
Aparatura este constituită dintr-un tub din oțel, de unică folosință, cu dispozitive de închidere refolosibile (figura 1), instalat într-un dispozitiv de încălzire și protecție. Fiecare tub este obținut prin ambutisarea adâncă a tablei de oțel (a se vedea apendicele) și are un diametru interior de 24 mm, o lungime de 75 mm și o grosime a pereților de 0,5 mm. Tuburile sunt prevăzute cu flanșă la extremitatea deschisă, pentru a permite închiderea fiecăruia cu setul plăcii cu orificii. Acesta este constituit dintr-o placă cu rezistență la presiune, cu un orificiu central, montată strâns pe tub printr-o îmbinare cu șurub din două părți (piuliță și o șaibă filetată). Piulița și șaiba filetată sunt realizate din oțel crom-mangan (a se vedea apendicele) care nu produce scântei până la 800 oC. Plăcile perforate au o grosime de 6 mm, sunt realizate din oțel termorezistent (a se vedea apendicele) și sunt disponibile într-o gamă de diametre și orificii.
1.6.1.2. Condiții experimentale
În general, substanța este supusă testului în forma în care este primită, deși în anumite cazuri, de exemplu dacă este presată, turnată sau condensată într-un mod anume, s-ar putea să fie necesară mărunțirea acesteia înaintea testului.
Pentru substanțele solide, masa materialului ce urmează să fie supus testelor se determină printr-o metodă, în două etape, a probei în gol. Un tub căruia i s-a determinat tara este umplut cu 9 cm3 de substanță și aceasta este tasată cu o forță de 80 N aplicată pe toată secțiunea transversală a tubului. Din motive de siguranță sau în cazurile în care este posibilă modificarea formei fizice a eșantionului prin compresie, se pot folosi alte procedee de umplere; de exemplu, dacă substanța este foarte sensibilă la frecare, nu se recomandă tasarea. Dacă substanța se poate comprima, atunci se mai adaugă și se tasează până la umplerea tubului pe o lungime de 55 mm de la capăt. Se determină masa totală a substanței folosite la umplerea tubului până la 55 mm și se mai adaugă substanță în două reprize, tasându-se de fiecare dată cu o forță de 80 N. Apoi se mai adaugă și se tasează sau se scoate material, astfel încât tubul să fie umplut pe o lungime de 15 mm de la partea superioară. Se execută a doua operație preliminară a probei în gol, plecând de la o cantitate tasată egală cu o treime din masa totală rezultată în prima etapă a probei gol. Se mai adaugă substanță în două reprize și se tasează cu o forță de 80 N reglându-se nivelul substanței din tub până la 15 mm de la partea superioară prin adăugare sau scoatere de substanță, după caz. Cantitatea de substanță solidă determinată în a doua operație preliminară se utilizează pentru fiecare test; umplerea fiind realizată în trei reprize, cu cantități egale, fiecare comprimată până la 9 cm3 cu forța necesară, oricare ar fi valoarea acesteia. (Această operație poate fi facilitată prin folosirea unor inele de distanțare.)
Lichidele și gelurile se încarcă în tub până la o înălțime de 60 mm, având grijă în mod deosebit să se evite formarea bulelor în gel. Șaiba filetată este glisată pe tub dinspre bază, se inserează placa perforată corespunzătoare și se strânge piulița după aplicare unui lubrifiant pe bază de disulfură de molibden. Este esențial să se verifice dacă nu a rămas substanță prinsă între flanșă și placă sau în filet.
Încălzirea se realizează cu propan dintr-o butelie industrială, prevăzută cu un regulator de presiune (60-70 mbar), care trece printr-un contor de gaze și este distribuit uniform (în funcție de flacăra arzătoarelor) dintr-un rezervor către patru arzătoare. Arzătoarele sunt distribuite în jurul incintei de testare, așa cum se arată în figura 1. Cele patru arzătoare au un consum combinat de aproximativ 3,2 litri de propan pe minut. Se pot utiliza și alte gaze, respectiv arzătoare, dar viteza de încălzire trebui să fie cea menționată în figura 3. Pentru toate aparatele, viteza de încălzire trebuie să se verifice periodic cu ajutorul tuburilor umplute cu dibutilftalat, după cum se indică în figura 3.
1.6.1.3. Desfășurarea testelor
Fiecare test se realizează până la fragmentarea tubului sau după încălzirea tubului timp de cinci minute. Dacă la test se produce fragmentarea tubului în trei sau mai multe bucăți, care uneori pot să fie legate între ele prin fâșii înguste de metal ca în figura 2, se estimează că s-a produs o explozie. Dacă la test rezultă mai puține fragmente sau nu are loc fragmentarea, se consideră că nu s-a produs explozie.
Se realizează mai întâi o serie de trei teste cu o placă perforată, cu orificiul cu diametrul de 6,0 mm și, dacă nu rezultă nicio explozie, se realizează o a doua serie de trei teste cu o placă cu orificiul de 2,0 mm. Dacă în oricare din seria de teste se produce explozia, nu mai este necesară continuarea testelor.
1.6.1.4. Evaluare
Rezultatul testului se consideră ca fiind pozitiv, dacă se produce explozie în oricare din seria de teste menționate anterior.
1.6.2. Sensibilitatea mecanică (la șoc)
1.6.2.1. Aparatura (figura 4)
Piesele esențiale ale unei sonete clasice cu berbec sunt un bloc de oțel turnat cu soclu, nicovală, coloană, ghidaje, greutăți de șoc, dispozitiv de decuplare și suport pentru probă. Nicovala din oțel cu diametru de 100 mm și înălțimea de 70 mm este prinsă în șuruburi la partea superioară a unui bloc din oțel de 230 mm (lungime) × 250 mm (lățime) × 200 mm (înălțime) cu un soclu turnat de 450 mm (lungime) × 450 (lățime) × 60 mm (înălțime). O coloană, realizată dintr-un tub de oțel trefilat fără sudură, este prinsă într-un suport fixat cu șuruburi pe spatele blocului din oțel. Aparatul este fixat cu patru șuruburi pe un bloc din beton de 60 × 60 × 60 cm, astfel încât șinele de ghidare să fie perfect verticale și greutatea de șoc să cadă liber. Sunt disponibile greutăți de 5-10 kg, realizate din oțel calmat. Berbecul este din oțel călit, HRC 60-63, cu un diametru de minimum 25 mm.
Proba supusă testului este închisă într-un dispozitiv de șoc constituit din doi cilindri coaxiali din oțel calmat, unul deasupra celuilalt, situați într-un cilindru gol de oțel, care se folosește ca inel de ghidare. Cilindrii din oțel calmat au diametrul de 10 (- 0,003, - 0,005) mm și înălțimea de 10 mm, cu fețele lustruite, muchiile rotunjite (raza de curbură de 0,5 mm) și o duritate HRC de 58-65. Cilindrul gol trebuie să aibă un diametru exterior de 16 mm, un alezaj șlefuit de 10 (+ 0,005, + 0,010) mm și o înălțime de 13 mm. Dispozitivul de șoc este asamblat pe o nicovală intermediară (diametrul 26 mm și înălțimea de 26 mm) realizată din oțel și centrată cu ajutorul unui inel de centrare cu perforații pentru a permite evacuarea vaporilor.
1.6.2.2. Condiții experimentale
Volumul eșantionului este de 40 mm3 sau un volum corespunzător aparatului utilizat. Substanțele solide se supun testului în stare uscată și se pregătesc după cum urmează:
(a) substanțele sub formă de pulberi se cern (ochiul sitei de 0,5 mm); tot materialul care a trecut prin sită se supune testului;
(b) substanțele presate, turnate sau condensate se fărâmițează și se cern; la teste se folosește fracția dintre sita cu ochiuri de 0,5 mm și sita cu ochiuri de 1 mm, care ar trebui să fie reprezentativă.
Substanțele care se livrează în general sub formă de pastă ar trebui să fie supuse testului în stare uscată, dacă este posibil, sau, în orice caz, după eliminarea cantității maxime posibile de diluant. Pentru testarea substanțelor lichide, aparatul de testare se reglează, astfel încât între cilindrii de oțel superior și inferior să existe un spațiu de 1 mm.
1.6.2.3. Desfășurarea testelor
Se realizează o serie de șase teste cu o greutate de șoc de 10 kg în cădere de la 0,40 m (40 J). Dacă se obține o explozie în primele șase teste la 40 J, trebuie să se mai realizeze un set de șase teste, cu greutatea de 5 kg în cădere de la 0,15 m (7,5 J). În alt aparat, proba se compară cu substanța de referință aleasă printr-o metodă stabilită (de exemplu metoda „up-and-down” etc.).
1.6.2.4. Evaluare
Rezultatul se consideră pozitiv dacă se produce o explozie (izbucnirea unei flăcări și/sau un zgomot caracteristic unei explozii) cel puțin o dată în oricare din testele cu aparatul specificat sau dacă proba este mai sensibilă decât 1,3-dinitrobenzenul sau RDX într-un test alternativ de sensibilitate la șoc.
1.6.3. Sensibilitatea mecanică (la frecare)
1.6.3.1. Aparatură (figura 5)
Aparatul pentru testul de sensibilitate la frecare este constituit dintr-o placă de bază din fontă pe care se montează aparatul de testare la frecare. Acesta conține un bulon din porțelan și un disc mobil din porțelan. Discul din porțelan este fixat într-un culisou care se deplasează pe două ghidaje. Culisoul este cuplat la un motor electric prin intermediul unei biele, a unui excentric și unui angrenaj de transmisie corespunzător, astfel încât să se asigure o deplasare a discului de porțelan, doar o singură dată, înainte și înapoi, pe o distanță de 10 mm, sub bulonul din porțelan. Bulonul poate să fie supus unei sarcini, de exemplu, de 120 sau 360 newtoni.
Discurile din porțelan sunt realizate din porțelan tehnic (rugozitatea de 9-32 μm) și au dimensiuni de 25 mm (lungime) × 25 mm (lățimea) × 5 mm (înălțimea). Bulonul cilindric din porțelan se realizează, de asemenea, din porțelan tehnic și are o lungime de 15 mm, diametru de 10 mm și extremitățile rotunjite, cu suprafața rugoasă și cu o rază de curbură de 10 mm.
1.6.3.2. Condiții experimentale
Volumul probei este de 10 mm3 sau un volum corespunzător aparatului utilizat.
Substanțele solide se supun testului în stare uscată și se pregătesc după cum urmează:
(a) substanțele sub formă de pulberi se cern (sită cu ochiuri de 0,5 mm); tot materialul care a trecut prin sită se supune testului;
(b) substanțele presate, formate în matriță sau condensate se fărâmițează și se cern; la teste se utilizează fracțiunea care a trecut prin site cu ochiuri < 0,5 mm.
Substanțele care se livrează în general sub formă de paste se supun testului în stare uscată, dacă este posibil. Dacă substanța nu se poate prepara în stare uscată, pasta (după eliminarea cantității maxime posibile de diluant) se supune testului sub forma unei pelicule cu următoarele dimensiuni: 0,5 mm grosime, 2 mm lățime și 10 mm lungime, realizată cu un șablon.
1.6.3.3. Desfășurarea testelor
Bulonul din porțelan se așează deasupra eșantionului de testat și se aplică sarcina. În timpul testului, urmele lăsate de burete pe placa de porțelan trebuie să fie dispuse transversal față de direcția de deplasare. Bulonul trebuie să rămână pe eșantion, cantitatea de substanță de testat trebuie să fie suficientă, iar discul să se deplaseze corect sub bulon. Substanțele în formă de pastă se depun, cu un șablon, sub forma unei pelicule cu grosimea de 0,5 mm și 2 × 10 mm. Discul de porțelan trebuie să se deplaseze înainte și înapoi pe o distanță de 10 mm sub bulonul de porțelan timp de 0,44 secunde; cele două extremități ale fiecărui bulon se folosesc fiecare la două încercări și cele două suprafețe ale discului se utilizează fiecare la trei încercări.
Se realizează o serie de șase teste la o sarcină de 360 N. Dacă în aceste șase aceste teste se obține un rezultat pozitiv, trebuie să se mai realizeze o serie de șase teste cu o sarcină de 120 N. În alt aparat, proba se compară cu substanța de referință aleasă printr-o metodă stabilită (de exemplu metoda „up-and-down” etc.).
1.6.3.4. Evaluarea
Rezultatul se consideră pozitiv dacă se produce o explozie (pocnitură și/sau zgomot sau izbucnirea unei flăcări sunt echivalente cu o explozie) cel puțin o dată în oricare din teste cu aparatul de testare la frecare specificat sau sunt satisfăcute criteriile echivalente pentru o altă test de sensibilitate mecanică (la frecare).
2. DATE
În principiu, se consideră că o substanță prezintă pericol de explozie în sensul prezentei directive, în cazul în care se obține un rezultat pozitiv la testele de sensibilitate termică sau de sensibilitate mecanică (la șoc sau la frecare).
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, informațiile următoare:
— identitatea, compoziția, puritatea, conținutul de umiditate etc. al substanței de testat;
— starea fizică a probei și, dacă a fost sau nu mărunțită și/sau cernută;
— observațiile din timpul testelor de sensibilitate termică (de exemplu masa probei, numărul de fragmente etc.);
— observațiile din timpul testelor de sensibilitate mecanică (de exemplu formarea unor cantități importante de fum sau descompunerea totală fără zgomot, flăcări, scântei, pocnitură etc.);
— rezultatele fiecărui tip de test;
— dacă se utilizează alte aparate, trebuie să se prezinte fundamentarea științifică, precum și dovada corelației dintre rezultatele obținute cu aparatul specificat și cele obținute cu unul echivalent;
— orice observație utilă, cum ar fi trimiterea la teste cu produse similare care ar putea să fie relevante pentru o interpretare corectă a rezultatelor;
— orice alte constatări relevante pentru interpretarea rezultatelor.
3.2. INTERPRETAREA ȘI EVALUAREA REZULTATELOR
Raportul de testare menționează toate rezultatele considerate false, anormale sau nereprezentative. Dacă unele rezultate se resping, se prezintă o explicație și rezultatele unor teste suplimentare sau alternative. Cu excepția cazului în care un rezultat anormal se pot explica, acesta trebuie să fie acceptat ca atare și să fie folosit la clasificarea substanței în consecință.
4. REFERINȚE BIBLIOGRAFICE
1. Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York.
2. Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750-60103-5, 1990.
3. Koenen, H., Ide, K.H. and Swart, K.H., Explosivstoffe, 1961, vol. 3, 6-13 and 30-42.
4. NF T 20-038 (September 85). Chemical products for industrial use – Determination of explosion risk.
Apendice
Exemple de specificații ale materialelor pentru testul de sensibilitate termică (a se vedea DIN 1623)
1. Tubul: Specificațiile materialelor nr. 1.0336.505 g
2. Placa cu orificiu: Specificațiile materialelor nr. 1.4873
3. Flanșa filetată și piulița: Specificațiile materialelor nr. 1.3817
Figura 1
Aparatul de testare a sensibilității termice
(toate dimensiunile sunt date în milimetri)

Figura 2
Testul de sensibilitate termică
(Exemple de fragmentare)

Figura 3
Etalonarea vitezei de încălzire pentru testarea sensibilității termice

Curba temperatură/timp obținută la încălzirea dibutilftalatului (27 cm3) într-un tub închis (placă cu orificiu de 1,5 mm) cu un debit de propan de 3,2 litri/minut. Temperatura se măsoară cu un termocuplu cromel/alumel placat cu oțel inoxidabil, cu diametrul de 1 mm, amplasat central la distanța de 43 mm sub bordura tubului. Viteza de încălzire în intervalul cuprins între 135 oC și 285 oC este între 185 și 215 K/minut.
Figura 4
Aparatul de testare a sensibilității mecanice (la șoc)
(toate dimensiunile în milimetri)

Figura 4
Continuare

Figura 5
Aparatul de testare a sensibilității mecanice (la frecare)

A.15. PUNCTUL DE AUTOAPRINDERE (LICHIDE ȘI GAZE)
1. METODĂ
1.1. INTRODUCERE
Substanțele explozive și substanțele care se aprind spontan în contact cu aerul la temperatura ambiantă nu se supun prezentului test. Modul de operare este aplicabil la gaze, lichide și vapori care, în prezența aerului, se aprind la contactul cu o suprafață încălzită.
Punctul de autoaprindere scade considerabil prin influența impurităților catalitice existente, materialul suprafeței în contact sau prin creșterea volumului recipientului de testare.
1.2. DEFINIȚII ȘI UNITĂȚI
Gradul de autoinflamabilitate se exprimă ca punct de autoaprindere. Punctul de autoaprindere este cea mai mică temperatură la care substanța se aprinde în contact cu aerul în condițiile definite în metoda de testare.
1.3. SUBSTANȚE DE REFERINȚĂ
Substanțele de referință sunt specificate în standarde (a se vedea 1.6.3). Acestea trebuie să servească în special la verificarea periodică a acurateței metodei și să permită compararea cu rezultatele obținute prin alte metode.
1.4. PRINCIPIUL METODEI
Metoda determină temperatura minimă a suprafeței interioare a unei incinte, la care are loc aprinderea unui gaz, a vaporilor sau a unui lichid injectat în incinta respectivă.
1.5. CRITERII DE CALITATE
Repetabilitatea variază în funcție de intervalul de temperaturi de autoaprindere și de metoda de testare folosită.
Sensibilitatea și specificitatea depind de metoda de testare folosită.
1.6. DESCRIEREA METODEI
1.6.1. Aparatură
Aparatura este descrisă în metoda menționată la punctul 1.6.3.
1.6.2. Condiții experimentale
Un eșantion din substanța de testat este supus testului conform metodei menționate la punctul 1.6.3.
1.6.3. Desfășurarea testului
A se vedea IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. DATE
Se înregistrează temperatura, presiunea atmosferică, cantitatea de probă utilizată și timpul scurs până la producerea aprinderii.
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specificațiile precise ale substanței (identificarea și proprietățile);
— cantitatea de probă utilizată, presiunea atmosferică;
— aparatura utilizată;
— rezultatele măsurătorilor (temperaturile de testare, rezultatele referitoare la aprindere, timpul scurs);
— toate observațiile suplimentare relevante pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
Niciuna.
A.16. TEMPERATURA RELATIVĂ DE AUTOAPRINDERE PENTRU SUBSTANȚELE SOLIDE
1. METODĂ
1.1. INTRODUCERE
Substanțele explozive și substanțele care se aprind spontan în contact cu aerul la temperatura ambiantă nu se supun prezentului test.
Scopul prezentului test este de a furniza informații preliminare privind autoaprinderea substanțelor solide la temperaturi ridicate.
Dacă temperatura degajată, fie prin reacția substanței cu oxigenul, fie prin descompunerea exotermă, nu se împrăștie destul de repede în mediul înconjurător, se produce autoîncălzirea care conduce la autoaprindere. Autoaprinderea se produce, prin urmare, atunci când viteza de producere a căldurii este mai mare decât viteza de pierdere a căldurii.
Metoda de testare este utilă ca test preliminar de triere a substanțelor solide. Având în vedere natura complexă a fenomenelor de aprindere și de combustie a solidelor, temperatura de autoaprindere determinată conform prezentei metode de testare se folosește numai pentru comparare.
1.2. DEFINIȚII ȘI UNITĂȚI
Temperatura de autoaprindere determinată prin prezenta metodă este temperatura minimă a mediului ambiant, exprimată în oC, la care un volum determinat dintr-o substanță se aprinde în condiții definite.
1.3. SUBSTANȚĂ DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI
Un anumit volum din substanță se introduce într-o etuvă la temperatura camerei; în timp ce temperatura etuvei este crescută cu o viteză de 0,5 oC/min până la 400 oC sau până la punctul de topire, dacă este mai mic, se înregistrează curba temperatură/timp pentru condițiile din centrul eșantionului. În sensul prezentului test, temperatura etuvei la care temperatura eșantionului ajunge la 400 oC prin autoîncălzire se numește temperatură de autoaprindere.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI
1.6.1. Aparatură
1.6.1.1. Etuva
Etuvă de laborator termoreglabilă (volum de aproximativ 2 litri) prevăzură cu circulație naturală de aer și o supapă pentru atenuarea exploziei. Pentru evitarea unui posibil risc de explozie, trebuie evitat contactul tuturor gazelor de descompunere cu elementele de încălzire electrică.
1.6.1.2. Cubul din plasă metalică
Se taie o bucată dintr-o plasă fin oțel inoxidabil cu ochiuri de 0,045 mm conform modelului din figura 1. Plasa se pliază și se fixează cu sârmă într-un cub deschis la partea superioară.
1.6.1.3. Termocuplurile
Termocupluri corespunzătoare.
1.6.1.4. Înregistratorul
Orice înregistrator cu două canale etalonat de la 0 la 600 oC sau la o tensiune corespunzătoare.
1.6.2. Condiții experimentale
Substanțele se supun testului în forma în care se primesc.
1.6.3. Desfășurarea testului
Cubul se umple cu substanță, se tasează ușor, adăugând substanță până la umplerea cubului. Cubul se suspendă apoi în centrul unei etuve la temperatura camerei. Un termocuplu se instalează în centrul cubului și celălalt între cub și peretele etuvei pentru înregistrarea temperaturii din etuvă.
Temperatura etuvei și cea a probei se înregistrează permanent în timpul creșterii temperaturii etuvei până la 400 oC sau până la punctul de topire, dacă este mai mic, cu o viteză de 0,5 oC/min.
Când substanța se aprinde, termocuplul probei va indica o creștere foarte bruscă a temperaturii, peste temperatura etuvei.
2. DATE
Temperatura etuvei la care temperatura probei ajunge la 400 oC prin autoîncălzire este importantă pentru evaluare (a se vedea figura 2).
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— descrierea substanței;
— rezultatele măsurătorilor, inclusiv curba temperatură/timp;
— toate observațiile suplimentare relevante pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
NF T 20-036 (September 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
Figura 1
Modelul cubului de testare de 20 mm

Figura 2
Curbă de tipul temperatură/timp

A.17. PROPRIETĂȚI OXIDANTE (SOLIDE)
1. METODĂ
1.1. INTRODUCERE
Înainte de a realiza acest test, este util să se colecteze informații preliminare privind orice posibile proprietăți explozive ale substanței de testat.
Prezentul test nu se aplică lichidelor, gazelor, substanțelor explozive sau inflamabile sau peroxizilor organici.
Prezentul test nu este necesar dacă examinarea formulei structurale stabilește dincolo de orice îndoială că substanța nu are capacitate de reacție exotermă cu un material combustibil.
Pentru a stabili dacă sunt necesare precauții speciale în timpul testului, se realizează un test preliminar.
1.2. DEFINIȚII ȘI UNITĂȚI
Timpul de ardere: timpul de reacție, exprimat în secunde, necesar pentru ca zona de reacție să traverseze un cartuș, în conformitate cu procedura descrisă la punctul 1.6.
Viteza de ardere: exprimată în milimetri pe secundă.
Viteza maximă de ardere: cea mai mare valoare a vitezelor de ardere obținută cu amestecuri ce conțin oxidant în proporție de 10-90 % greutate.
1.3. SUBSTANȚA DE REFERINȚĂ
Azotatul de bariu (de puritate analitică) se folosește ca substanță de referință în test și în testul preliminar.
Amestecul de referință este amestecul constituit din azotat de bariu și pudră de celuloză, preparat conform descrierii de la punctul 1.6, care are viteza maximă de ardere (amestecul conține, de regulă, 60 % greutate azotat de bariu).
1.4. PRINCIPIUL METODEI
Pentru siguranță se realizează un test preliminar. În cazul în care testul preliminar indică în mod clar că substanța supusă testului are proprietăți oxidante, nu mai este necesar alt test. Dacă nu se întâmplă astfel, substanța se supune testului complet.
Pentru testul complet, se prepară amestecuri cu proporții diferite de substanță de testat și substanță combustibilă. Se prepară apoi câte un cartuș din fiecare amestec, care se aprinde la o extremitate.
1.5. CRITERII DE CALITATE
Dacă este necesar, orice metodă de mărunțire și amestecare este valabilă, cu condiția ca diferența dintre viteza maximă de ardere și valoarea mediei aritmetice, în șase teste separate, să fie de maximum 10 %.
1.6. DESCRIEREA METODEI
1.6.1. Pregătire
1.6.1.1. Substanța de testat
Proba de analizat se aduce la dimensiuni ale particulelor < 0,125 mm prin următoarea metodă: se cerne substanța, se mărunțește fracția rămasă, se repetă acțiunea până când întreaga cantitate de probă trece prin sită.
Se poate utiliza orice metodă de mărunțire sau cernere care satisface criteriile de calitate.
Înaintea preparării amestecului, substanța se usucă la 105 oC, până la o greutate constantă. Dacă temperatura de descompunere a substanței de testat este mai mică de 105 oC, substanța trebuie să se usuce la o temperatură mai mică.
1.6.1.2. Substanța combustibilă
Pulberea de celuloză se utilizează ca substanță combustibilă. Celuloza ar trebui să fie de tipul utilizat în cromatografia în strat subțire sau în cromatografia în coloană. S-a dovedit că tipul care conține mai mult de 85 % fibre cu lungimea de 0,020-0,075 mm este corespunzătoare. Pulberea de celuloză se trece printr-o sită cu ochiuri de 0,125 mm. Se folosește același lot de celuloză pentru tot testul.
Înainte de prepararea amestecului, pulberea de celuloză este uscată la 105 oC până se obține o greutate constantă.
Dacă în testul preliminar se utilizează rumeguș de lemn, se prepară un rumeguș prin colectarea porțiunii care trece prin sita cu ochiuri de 1,6 mm, se amestecă cu grijă, apoi se usucă la 105 oC timp de patru ore într-un strat cu o grosime de maximum 25 mm. Se răcește și se păstrează până când este necesar, de preferință într-un interval de 24 de ore de la uscare, într-un recipient etanș cât mai bine umplut.
1.6.1.3. Sursa de ardere
Ar trebui să se folosească flacăra unui bec de gaz (diametrul minim de 5 mm) ca sursă de aprindere. Dacă de utilizează altă sursă de aprindere (de exemplu la testul în atmosferă inertă), trebuie să se prezinte în raportul de testare descrierea și justificarea acesteia.
1.6.2. Desfășurarea testului
Notă:
Amestecurile din oxidanți și celuloză sau rumeguș trebuie să fie tratate ca posibil explozive și manipulate cu atenția cuvenită.
1.6.2.1. Testul preliminar
Substanța uscată se amestecă cu grijă cu celuloza uscată sau rumegușul uscat în proporții din greutate de substanță/celuloză sau rumeguș de 2:1 și din amestecul obținut se formează un cartuș conic cu dimensiunile 3,5 cm (diametrul la bază) × 2,5 cm (înălțimea) prin umplerea, fără îndesare, a unei forme conice (de exemplu o pâlnie din sticlă de laborator cu robinetul închis).
Cartușul este așezat pe o placă rece, necombustibilă, neporoasă și cu conductibilitate termică redusă. Testul ar trebui să se realizeze sub nișă de tiraj, conform descrierii de la punctul 1.6.2.2.
Sursa de aprindere se aduce în contact cu conul. Se urmăresc amploarea și durata reacției rezultate și se înregistrează.
Dacă reacția este viguroasă, substanța se consideră ca fiind oxidantă.
Dacă rezultatele nu sunt certe, este necesar să se realizeze testul complet descris în continuare.
1.6.2.2. Test complet
Se prepară amestecuri oxidant/celuloză ce conțin 10-90 % greutate oxidant, cu o rație de creștere de 10 % a cantității de oxidant. Pentru cazurile-limită, ar trebui să se utilizeze amestecuri intermediare oxidant/celuloză pentru a obține viteza maximă de ardere cu mai multă precizie.
Cartușul se obține cu o matriță. Matrița este din metal, are o lungime de 250 mm și o secțiune transversală triunghiulară cu o înălțime interioară de 10 mm și o lățime interioară de 20 mm. Pe ambele fețe ale matriței, pe direcție longitudinală, se montează două plăci metalice ca opritoare laterale care depășesc cu 2 mm extremitatea superioară a secțiunii transversale triunghiulare (figura). Dispozitivul obținut se umple fără tasare cu amestec, puțin în exces. După ce se lasă matrița să cadă de la o înălțime de 2 cm pe o suprafață solidă, substanța în exces se curăță cu o racletă oblică. Plăcile opritoare se scot și pulberea rămasă se netezește cu un rulou. Se așează apoi o placă cu conductibilitate termică mică, neporoasă și necombustibilă peste formă, ansamblul se răstoarnă și se scoate forma.
Se introduce cartușul în nișă, perpendicular pe direcția curentului de aer.
Viteza aerului trebuie să fie suficientă pentru a preveni răspândirea vaporilor în laborator și ar trebui să fie constantă în timpul testului. Curentul de aer trebuie să formeze un ecran în jurul aparatului.
Datorită caracterului higroscopic al celulozei și al unor substanțe de testat, testul se execută cât se poate de repede.
Se aprinde un capăt al cartușului prin contactul cu flacăra.
Se măsoară timpul de reacție pe o distanță de 200 mm după ce zona de reacție s-a propagat pe o distanță inițială de 30 mm.
Testul se realizează cu substanța de referință și cel puțin o dată cu fiecare amestec din gama celor constituite din substanța de testat și celuloză în diferite proporții.
Dacă se constată o viteză maximă de ardere cu mult mai mare decât cea a amestecului de referință, testul se poate opri; în caz contrar, testul se repetă de cinci ori pentru fiecare din cele trei amestecuri care au cea mai mare viteză de ardere.
Dacă se suspectează un rezultat fals pozitiv, atunci ar trebui să se repete testul cu o substanță inertă cu particule de dimensiuni similare, de exemplu kiselgur, în loc de celuloză. O altă posibilitate constă în repetarea testului cu amestecul cu viteza de ardere cea mai mare, în atmosferă inertă (cu un conținut de oxigen < 2 % v/v).
2. DATE
Din motive de siguranță, se consideră că viteza maximă de ardere – nu valoarea medie – reprezintă proprietatea oxidantă maximă a substanței supuse testului.
Valoarea cea mai mare a vitezei de ardere într-o serie de șase teste pe un amestec dat este relevantă pentru evaluare.
Se reprezintă grafic valoarea cea mai mare a vitezei de ardere pentru fiecare amestec în funcție de concentrația oxidantului. Din grafic se citește viteza maximă de ardere.
Cele șase valori ale vitezei de ardere măsurate într-un set realizat cu amestecul cu viteza maximă de ardere trebuie să difere cu maximum 10 % față de valoarea mediei aritmetice; în caz contrar, sunt necesare metode îmbunătățite de mărunțire și amestecare.
Se compară viteza maximă de ardere cu viteza maximă de ardere a amestecului de referință (a se vedea punctul 1.3).
Dacă încercările se realizează în atmosferă inertă, se compară viteza maximă de reacție cu cea obținută cu amestecul de referință în atmosferă inertă.
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— identitatea, compoziția, puritatea, conținutul de umiditate etc. ale substanței de testat;
— orice tratament aplicat eșantionului (de exemplu măcinare, uscare,...);
— sursa de aprindere folosită;
— rezultatele măsurătorilor;
— tipul reacției (de exemplu ardere superficială cu flacără, ardere în întreaga masă, orice informații privind produsele de ardere, ...);
— orice observație suplimentară relevantă pentru interpretarea rezultatelor, inclusiv descrierea vigorii (flacără, scântei, degajare de vapori, ardere înăbușită înceată etc.) și durata aproximativă obținută în testul preliminar de siguranță/triere atât pentru substanța de testat, cât și pentru substanța de referință;
— rezultatele testelor cu substanță inertă, după caz;
— rezultatele testelor în atmosferă inertă, după caz.
3.2. INTERPRETAREA REZULTATELOR
Se consideră că o substanță este substanță oxidantă, în cazul în care:
(a) la testul preliminar există o reacție viguroasă;
(b) la testul complet viteza maximă de ardere a amestecurilor testate este mai mare decât sau egală cu viteza maximă de ardere a amestecului de referință constituit din celuloză și azotat de bariu.
Pentru a se evita rezultatele fals pozitive, la interpretarea rezultatelor se iau în considerare și rezultatele obținute la testarea substanței cu un material inert și/sau la testul în atmosferă inertă.
4. REFERINȚE BIBLIOGRAFICE
NF T 20-035 (September 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
Apendice
Figură
Matrița și accesoriile pentru prepararea cartușului
(Toate dimensiunile sunt în milimetri)

A.18. DETERMINAREA MASEI MOLECULARE NUMERICE MEDII ȘI A DISTRIBUȚIEI MASELOR MOLECULARE A POLIMERILOR
1. METODĂ
Această metodă cromatografică pe gel permeabil urmează Orientarea 118 (1996) a OCDE. Principiile fundamentale și toate celelalte informații tehnice sunt prezentate în bibliografie.
1.1. INTRODUCERE
Proprietățile polimerilor sunt atât de diversificate, încât este imposibil de descris o metodă unică, care să indice cu precizie condițiile de separare și evaluare, care să acopere toate eventualitățile și particularitățile întâlnite la separarea polimerilor. Sistemele complexe de polimeri, în special, se pretează mai rar la cromatografia pe gel permeabil. În cazul în care cromatografia pe gel permeabil nu este aplicabilă, se poate determina conținutul de polimeri cu masă moleculară medie, utilizând alte metode (a se vedea apendicele). Într-o astfel de situație, este necesară furnizarea tuturor detaliilor legate de metoda folosită, cu justificarea alegerii.
Metoda descrisă în continuare se bazează pe norma DIN 55672 (1). Aceasta furnizează indicații detaliate asupra modului de realizare a experiențelor și de evaluare a rezultatelor. Dacă este necesară modificarea condițiilor experimentale, schimbările trebuie justificate. Pot fi utilizate alte normative, cu condiția menționării tuturor referințelor. Metoda descrisă utilizează pentru etalonare eșantioane de polistiren a căror polidispersie este cunoscută și ar putea fi, probabil, adaptată pentru cazul altor polimeri, de exemplu, polimerii solubili în apă și polimerii ramificați cu catenă lungă.
1.2. DEFINIȚII ȘI UNITĂȚI
Masa moleculară numerică medie Mn și masa moleculară medie ponderală Mw, se determină prin ecuațiile următoare:
|
|
|
unde:
Hi este amplitudinea semnalului detectat, corespunzător volumului de retenție Vi, față de nivelul de referință;
Mi este masa moleculară a fracțiunii de polimer, corespunzătoare volumului de retenție Vi și
n este numărul de puncte experimentale.
Lărgimea distribuției maselor moleculare, care reprezintă o măsură a polidispersiei sistemului, este exprimată de raportul Mw/Mn.
1.3. SUBSTANȚE DE REFERINȚĂ
Metoda cromatografiei pe gel permeabil este o metodă relativă, fiind necesar să se procedeze la o etalonare. În general, aceasta se realizează cu ajutorul polistirenilor etalon cu lanț liniar și distribuție îngustă, pentru care se cunosc atât masele moleculare medii Mn și Mw, cât și distribuția maselor moleculare. Curba de etalonare nu poate fi utilizată pentru determinarea masei moleculare a unui eșantion necunoscut, decât dacă condițiile de separare a eșantioanelor și etaloanelor au fost selecționate într-un mod identic.
O relație determinată între masa moleculară și volumul de eluare nu este valabilă decât în condițiile particulare ale unei experiențe date. Printre aceste condiții figurează, înainte de toate: temperatura, solventul (sau amestecul de solvenți), condițiile cromatografice, precum și coloana de separare sau sistemul de coloane.
Masele moleculare ale eșantioanelor determinate prin această metodă constituie valori relative; le vom numi „mase moleculare în echivalent-polistiren”. Aceasta semnifică faptul că, în funcție de diferențele chimice și structurale dintre eșantioanele testate și etaloane, masele moleculare pot devia față de valorile absolute, într-o manieră mai mult sau mai puțin importantă. Dacă sunt utilizate alte etaloane, de exemplu, polietilenglicol, poli(etilenoxid), poli(metacrilat de metil) sau acid poliacrilic, este important să se justifice motivul.
1.4. PRINCIPIUL METODEI DE TESTARE
Cromatografia pe gel permeabil permite determinarea distribuției maselor moleculare, precum și a maselor moleculare medii (Mn, Mw). Cromatografia pe gel permeabil reprezintă o metodă particulară de cromatografie lichidă, în cadrul căreia eșantionul pentru testat este separat în funcție de volumul hidrodinamic al fiecărui constituent (2).
Separarea se efectuează pe măsură ce eșantionul înaintează printr-o coloană umplută cu un material poros, în general un gel organic. Moleculele mici pot penetra în pori, în vreme ce moleculele mari sunt excluse. Din acest motiv, traseul moleculelor mari este mai scurt; acestea sunt separate primele. Moleculele de dimensiuni medii penetrează parțial în pori, fiind separate mai târziu. Moleculele cele mai mici, a căror rază hidrodinamică medie este mai mică decât cea a porilor de gel, pot penetra în toți porii. Acestea vor fi eluate ultimele.
În situația ideală, dimensiunea speciilor moleculare este cea care decide integral separarea, dar în practică, este greu de evitat interferența unor fenomene de absorbție. O umplere neregulată a coloanei, ca și existența unui volum mort important, pot agrava situația (2).
Detecția se efectuează, de exemplu, prin măsurarea indicelui de refracție sau al absorbției în UV, pentru realizarea unei curbe de distribuție simple. Totuși, pentru a putea asocia acestei curbe valorile maselor moleculare reale, este necesară etalonarea coloanei prin trecerea unui polimer cu masa moleculară cunoscută și, în cazul ideal, cu o structură cât mai apropiată, de exemplu diferiți polistireni standard. În general, se va obține o curbă Gauss; uneori, aceasta poate prezenta o asimetrie, pe partea maselor moleculare mici; axa verticală indică cantitatea (greutatea) speciilor de diferite mase moleculare eluate, iar pe axa orizontală, figurează logaritmul masei moleculare.
1.5. CRITERII DE CALITATE
Reproductivitatea (deviația-standard relativă) a volumului de eluare trebuie să fie cel mult egală cu 0,3 %. Există modalități de ameliorare a reproductivității de analiză, grație unei corecții ce utilizează un standard intern, dacă un cromatograf este evaluat în funcție de timp și nu satisface criteriile menționate mai sus [a se vedea informațiile complementare la referința (1)]. Polidispersările depind de masele moleculare ale etaloanelor. În cazul polistirenilor etalon, valorile tipice sunt:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp este masa moleculară a etalonului, corespunzătoare semnalului maxim)
1.6. DESCRIEREA METODEI
1.6.1. Prepararea soluțiilor etalon de polistiren
Se vor dizolva polistirenii etalon, amestecând cu grijă până la diluția aleasă. Soluțiile se vor prepara ținând cont de recomandările fabricantului.
Concentrațiile etaloanelor alese depind de diferiți factori, cum ar fi: volumul de injecție, viscozitatea soluției și sensibilitatea detectorului. Volumul de injecție maxim trebuie să fie adaptat lungimii coloanei, având grijă să nu o supraîncarce. Volumele de injecție curente pentru separările analitice prin metoda cromatografică pe gel permeabil, pentru o coloană de 30 cm × 7,8 mm, variază de obicei între 40 și 100 μl. Se va determina raportul optim între volumul de injecție și concentrație, înainte de etalonarea coloanei.
1.6.2. Prepararea soluției de eșantion
În principiu, prepararea soluțiilor de eșantion se realizează în condiții identice. Eșantionul se dizolvă într-un solvent adecvat, de exemplu THF, agitând cu grijă. În niciun caz, nu se va dizolva într-o baie cu ultrasunete. Dacă este necesar, soluția de probă se purifică cu ajutorul unui filtru cu membrană, cu dimensiunea porilor cuprinsă între 0,2-2 μm.
Prezența particulelor nedizolvate trebuie menționată în raportul final, în măsura în care acestea pot rezulta din specii cu mase moleculare mari. Trebuie să se recurgă la o metodă potrivită pentru determinarea procentajului în greutate a particulelor nedizolvate. Analiza soluțiilor se va face în termen de 24 ore.
1.6.3. Aparatură
— un rezervor pentru solvent;
— un sistem pentru degazare (dacă este necesar);
— o pompă;
— un amortizor de impulsuri (dacă este necesar);
— un sistem de injecție;
— coloane cromatografice;
— un detector;
— un debitmetru (dacă este necesar);
— un sistem de înregistrare și tratare a datelor;
— un recipient pentru recuperarea soluțiilor utilizate.
Sistemul cromatografic pe gel permeabil trebuie să fie inert față de solventul utilizat (de exemplu, utilizarea capilarelor din oțel, atunci când solvent este THF).
1.6.4. Injecția și sistemul de pompare a solventului
Un volum definit din soluția de probă este injectat în coloană, într-o zonă bine definită, cu ajutorul unui aparat pentru eșantionare automată sau manuală. Dacă se operează manual, retragerea ori împingerea prea bruscă a pistonului seringii poate determina modificări în distribuția maselor moleculare observate. Este indicat ca sistemul de pompare a solventului să fie lipsit de pulsații; este de preferat ca acesta să includă un amortizor de impulsuri. Debitul este de ordinul a 1 ml/min.
1.6.5. Coloana
În funcție de natura eșantionului testat, polimerul se caracterizează făcând recurs la o singură coloană sau la mai multe coloane, conectate în serie. În comerț sunt disponibile mai multe materiale poroase pentru coloane, cu proprietăți definite (de exemplu, dimensiunea porilor, limita de excludere). Alegerea unui gel de separare sau a lungimii de coloană depinde, pe de o parte, de proprietățile eșantionului testat (volume hidrodinamice, distribuția maselor moleculare) și, pe de altă parte, de condițiile particulare ale separării, cum ar fi: natura solventului, temperatura și debitul (1) (2) (3).
1.6.6. Talere teoretice
Coloana (sau combinația de coloane) utilizată pentru separare trebuie caracterizată prin numărul de talere teoretice. Pentru aceasta, în cazul în care solventul de eluare este THF, se trece o soluție de etilbenzen sau o altă substanță dizolvată nepolară potrivită, printr-o coloană de lungime cunoscută. Numărul de talere teoretice este dat de ecuația următoare:
|
|
sau |
|
unde:
|
N |
= |
numărul de talere teoretice |
|
Ve |
= |
volumul de eluare, corespunzător semnalului maxim |
|
W |
= |
lărgimea semnalului maxim, la nivelul liniei de bază |
|
W1/2 |
= |
este lărgimea semnalului maxim, la jumătatea înălțimii coloanei |
1.6.7. Eficacitatea separării
În afară de numărul de talere teoretice, parametru determinant al lărgimii de bandă, eficacitatea de separare este o altă importantă caracteristică, determinată de panta curbei de calibrare. Eficacitatea de separare a unei coloane se calculează cu ajutorul relației următoare:

unde:
|
Ve, Mx |
= |
volumul de eluare al polistirenului cu masa moleculară Mx |
|
Ve,(10.Mx) |
= |
volumul de eluare al polistirenului cu masa moleculară de 10 ori mai mare |
Rezoluția sistemului este în general definită după cum urmează:

unde:
|
Ve1, Ve2 |
= |
volumele de eluare ale celor doi polistireni standard la semnalul maxim |
|
W1, W2 |
= |
lărgimile vârfului la nivelul liniei bazei |
|
M1, M2 |
= |
masele moleculare corespunzătoare semnalului maxim (aceste mase ar trebui să fie diferite printr-un factor 10) |
Valoarea lui R pentru sistemul de coloane trebuie să fie superioară valorii de 1,7 (4).
1.6.8. Solvenți
Toți solvenții trebuie să aibă o mare puritate (se va folosi THF de puritate 99,5 %). Rezervorul pentru solvent (la nevoie, pus în atmosferă de gaz inert), trebuie să fie suficient de mare pentru a permite etalonarea coloanei și mai multe analize de eșantioane. Solventul va fi degazat înainte de a fi pompat în coloană.
1.6.9. Reglarea temperaturii
Temperatura componentelor interne critice (bucla de injecție, coloana sau coloanele, detectorul și tuburile) trebuie să fie constantă și compatibilă cu solventul ales.
1.6.10. Detectorul
Detectorul înregistrează în mod cantitativ concentrația eșantionului eluat din coloană. Pentru evitarea unei lărgimi nedorite a picului, volumul cuvei detectorului va fi ales cât mai mic posibil. Acesta nu trebuie să depășească 10 μl, cu excepția detectoarelor ce funcționează prin difuzia luminii și a viscozimetrelor. În general, detecția se realizează prin refractometrie diferențială. Totuși, dacă proprietățile specifice ale eșantionului sau ale solventului pentru eluare o cer, se pot folosi alte tipuri de detectoare, cum ar fi cele UV/VIS sau IR, viscozimetrele etc.
2. DATE ȘI RAPORT
2.1. DATE
Se va face referință la normele DIN (1) în ceea ce privește criteriile de evaluare detaliate, la fel pentru specificațiile relative la colectarea și interpretarea datelor.
Pentru fiecare eșantion analizat, se vor realiza două experiențe independente. Rezultatele acestora se vor analiza separat.
Parametrii Mn, Mw, Mw/Mn, Mp se determină pentru fiecare măsurătoare. Trebuie indicat în mod explicit că valorile măsurate sunt valori relative corespunzând unor echivalenți de masă moleculară ale standardului folosit.
După determinarea volumelor și a timpilor de retenție (eventual corectate cu ajutorul unui standard intern) se vor reprezenta grafic valorile log MP (MP fiind semnalul maxim al polimerilor standard), în funcție de una dintre acele cantități. Sunt necesare cel puțin 2 puncte de etalonare pentru fiecare factor 10 de masă moleculară. Pentru trasarea întregii curbe sunt necesare cel puțin 5 puncte de măsură; această curbă va acoperi masa moleculară estimată a eșantionului. Punctul extrem al curbei de etalonare, spre partea maselor moleculare mici, se poate defini folosind n-hexilbenzenul sau altă substanță dizolvată nepolară adecvată. Masele moleculare medii, ca număr și ca greutate, sunt în general determinate prin prelucrarea informatică a datelor, bazată pe formule menționate la punctul 1.2. Dacă s-a optat pentru o prelucrare manuală, este indicat să se consulte ASTM D 3536-91 (3).
Curba de distribuție va fi prezentată sub forma unui tabel sau a unui grafic (frecvența diferențială sau procentajele cumulative în funcție de log M). În cazul reprezentării grafice, o putere de 10 pentru masa moleculară corespunde în mod normal, unei lărgimi de aproximativ 4 cm, în vreme ce pentru maximul de semnal, este adecvată o înălțime de aproximativ 8 cm. În cazul curbelor de distribuție cumulative, diferența între 0 și 100 % pe axa ordonatei trebuie să fie în jur de 10 cm.
2.2. RAPORT DE TESTARE
Raportul de testare va cuprinde informațiile următoare:
2.2.1. Substanța testată:
— informații disponibile legate de substanța testată (natură, aditivi, impurități);
— descrierea tratamentului aplicat eșantionului, observații, probleme.
2.2.2. Dispozitivul experimental:
— un rezervor pentru solvent, gaz inert, sistem pentru degazarea solventului, compoziția solventului, impurități;
— pompă, amortizor de impulsuri, sistem de injecție;
— coloane de separare (fabricant, toate precizările legate de caracteristicile coloanei, cum ar fi dimensiunea porilor, natura materialului de separare etc., numărul, lungimea și ordinul coloanelor utilizate);
— numărul de talere teoretice ale coloanei (sau al combinației de coloane), eficacitatea separării (resorbția sistemului);
— informații legate de simetria semnalelor maxime;
— temperatura coloanei, modul de reglare a temperaturii;
— detector (principiul de măsurare, tip, volumul cuvei);
— debitmetru dacă există (fabricant, principiul de măsurare);
— sistemul utilizat pentru culegere și prelucrarea datelor (echipament și programe informatice).
2.2.3. Etalonarea sistemului:
— descrierea detaliată a metodei utilizate pentru determinarea curbei de etalonare;
— precizări asupra criteriilor de calitate proprii acestei metode (de exemplu, coeficientul de corelare, eroarea pătratică medie etc.);
— informații asupra tuturor extrapolărilor, ipotezelor și aproximărilor efectuate în cursul proceselor experimentale, precum și asupra evaluării și prelucrării datelor;
— toate măsurătorile efectuate pentru stabilirea curbei de etalonare trebuie prezentate sub forma unui tabel, care cuprinde, pentru fiecare punct de etalonare, următoarele informații:
—— denumirea eșantionului;
— fabricantul eșantionului;
— valorile caracteristice Mp, Mn, Mw, Mw/Mn ale etaloanelor furnizate de fabricant, deduse din măsurătorile ulterioare, completate de indicațiile legate de metoda de determinare;
— volumul de injecție și concentrația soluției injectate;
— valoarea de Mp utilizată pentru etalonare;
— volumul de eluare sau timpul de retenție corectat, măsurat la semnalul maxim;
— Mp calculat la semnalul maxim;
— procentajul de eroare la Mp calculat și la valoarea de etalonare.
2.2.4. Evaluare:
— evaluare în funcție de timp: toate metodele care vizează ameliorarea reproductivității cerute (metode de corecție, standard intern etc.);
— se precizează dacă evaluarea s-a efectuat plecând de la volumul de eluare sau de la timpul de retenție;
— se indică limitele de evaluare, dacă un pic nu a fost complet analizat;
— se descriu metodele de netezire, dacă s-au folosit;
— se indică procedeelor de preparare și pretratare a eșantionului;
— dacă există, se indică prezența particulelor nedizolvate;
— se indică volumul de injecție (μl) și concentrația de injecție (mg/ml);
— se menționează observațiile privind efectele generatoare de deviații, în raport cu profilul ideal de cromatografie pe gel permeabil;
— se descriu în detaliu toate modificările aduse procedurilor de analiză;
— se precizează intervalele de eroare;
— se consemnează orice alte informații și observații utile pentru interpretarea rezultatelor.
3. REFERINȚE BIBLIOGRAFICE
1. DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
2. Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979), Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
3. ASTM D 3536-91, (1991) Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
4. ASTM D 5296-92, (1992) Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
Apendice
Exemple de alte metode de determinare a masei moleculare numerice medii (Mn) a polimerilor
Cromatografia pe gel permeabil reprezintă metoda preferată pentru determinarea Mn, mai ales atunci când dispunem de un ansamblu de substanțe standard cu o structură comparabilă cu cea a polimerului. Totuși, atunci când folosirea metodei cromatografiei pe gel permeabil prezintă dificultăți practice sau când ne putem aștepta ca substanța să nu satisfacă un criteriu reglementar pentru Mn (ceea ce cere o confirmare), există metode alternative, ca de exemplu:
1. Utilizarea proprietăților coligative
1.1. Ebulioscopia și crioscopia
înseamnă măsurarea creșterii punctului de fierbere (ebulioscopia) sau coborârea punctului de congelare (crioscopia) ale unui solvent atunci când este adăugat un polimer. Metoda se bazează pe faptul că dizolvarea unui polimer într-un lichid are un efect asupra punctelor de fierbere sau de congelare ale acestuia care depinde de masa moleculară a polimerului (1) (2).
Domeniul de aplicare corespunde unei Mn < 20 000.
1.2. Coborârea presiunii vaporilor
constă în măsurarea presiunii vaporilor unui lichid de referință înainte și după adăugarea unor cantități stabilite de polimeri (1) (2).
Domeniul de aplicare corespunde unei Mn < 20 000 (în teorie; în practică, nu reprezintă decât o valoare limitată).
1.3. Osmometria cu membrană
se bazează pe principiul osmozei, adică tendința naturală a moleculelor de solvent de a traversa o membrană semipermeabilă plecând de la o soluție diluată către o soluție concentrată așa încât să se realizeze echilibrul. În experiment, concentrația soluției diluate este nulă, în timp ce soluția concentrată conține polimerul. Trecerea solventului de-a lungul membranei induce o diferență de presiune care depinde de concentrație și de masa moleculară a polimerului (1) (3) (4).
Domeniul de aplicare corespunde valorilor lui Mn între 20 000 și 200 000.
1.4. Osmometria – faza de vapori
constă în comparația vitezei de evaporare a unui aerosol de solvent pur cu viteza a cel puțin trei aerosoli care conțin polimerul la diferite concentrații (1) (5) (6).
Domeniul de aplicare corespunde unei Mn < 20 000.
2. Analiza grupurilor terminale
Pentru a se utiliza această metodă, trebuie cunoscute atât structura globală a polimerului, cât și natura grupurilor terminale situate în capetele catenei (acestea trebuie să poată fi diferențiate de catena principală, de exemplu, prin spectrul lor RMN sau prin titrarea și formarea derivaților). Determinarea concentrației moleculare a grupurilor terminale prezente pe polimer poate, apoi, să furnizeze o valoare a masei moleculare (7) (8) (9).
Domeniul de aplicare corespunde valorilor lui Mn ce pot atinge valoarea de 50 000 (cu o fiabilitate descrescătoare)
3. Referințe bibliografice
1. Billmeyer, F.W. Jr., (1984), Textbook of Polymer Science, 3rd Edn., John Wiley, New York.
2. Glover, C.A., (1975), Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I P.E. Slade, Jr. ed., Marcel Dekker, New York.
3. ASTM D 3750-79, (1979), Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania.
4. Coll, H. (1989), Membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, pp. 25-52.
5. ASTM 3592-77, (1977), Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania.
6. Morris, C.E.M., (1989), Vapour Pressure osmometry. In: Determinationn of Molecular Weight, A.R. Cooper ed., John Wiley and Sons.
7. Schröder, E., Müller, G., and Arndt, K-F., (1989), Polymer Characterisation, Carl Hanser Verlag, Munich.
8. Garmon, R.G., (1975), End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed. Marcel Dekker, New York.
9. Amiya, S., et al. (1990), Pure and Applied Chemistry, 62, 2139-2146.
A.19. DETERMINAREA CONȚINUTULUI ÎN POLIMERI CU MASĂ MOLECULARĂ MICĂ
1. METODĂ
Această metodă cromatografică pe gel permeabil urmează Orientarea 118 (1996) a OCDE. Principiile fundamentale și toate celelalte informații tehnice sunt prezentate în bibliografie.
1.1. INTRODUCERE
Proprietățile polimerilor sunt atât de diversificate, încât este imposibil de descris o metodă unică, care să indice cu precizie condițiile de separare și evaluare, care să acopere toate eventualitățile și particularitățile întâlnite la separarea polimerilor. Sistemele complexe de polimeri, în special, se pretează mai rar la cromatografia pe gel permeabil. În cazul în care cromatografia pe gel permeabil nu este aplicabilă, se poate determina conținutul de polimeri cu masă moleculară medie, utilizând alte metode (a se vedea apendicele). Într-o astfel de situație, este necesară furnizarea tuturor detaliilor legate de metoda folosită, cu justificarea alegerii.
Metoda descrisă în continuare se bazează pe norma DIN 55672 (1). Aceasta furnizează indicații detaliate asupra modului de realizare a experiențelor și de evaluare a rezultatelor. Dacă este necesară modificarea condițiilor experimentale, schimbările trebuie justificate. Pot fi utilizate alte normative, cu condiția menționării tuturor referințelor. Metoda descrisă utilizează pentru etalonare eșantioane de polistiren a căror polidispersie este cunoscută și ar putea fi, probabil, adaptată pentru cazul altor polimeri, de exemplu, polimerii solubili în apă și polimerii ramificați cu catenă lungă.
1.2. DEFINIȚII ȘI UNITĂȚI
Masa moleculară mică se definește în mod arbitrar ca fiind o masă moleculară inferioară celei de 1 000 daltoni.
Masa moleculară medie (numerică) Mn și masa moleculară medie (greutate) Mw, sunt determinate cu ajutorul ecuațiilor următoare:
|
|
|
unde:
|
Hi |
= |
amplitudinea semnalului detectat, corespunzător volumului de retenție Vi, în funcție de nivelul de referință, |
|
Mi |
= |
este masa moleculară a fracțiunii de polimer, corespunzătoare volumului de retenție Vi și n este numărul de puncte experimentale |
Lărgimea de distribuție a maselor moleculare, care reprezintă o măsură a polidispersiei sistemului, este exprimată de raportul Mw/Mn.
1.3. SUBSTANȚE DE REFERINȚĂ
Metoda cromatografiei pe gel permeabil este o metodă relativă, fiind necesar să se procedeze la o etalonare. În general, aceasta se realizează cu ajutorul polistirenilor etalon cu lanț liniar și distribuție îngustă, pentru care se cunosc atât masele moleculare medii Mn și Mw, cât și distribuția maselor moleculare. Curba de etalonare nu poate fi utilizată pentru determinarea masei moleculare a unui eșantion necunoscut, decât dacă condițiile de separare a eșantioanelor și etaloanelor au fost selecționate într-un mod identic.
O relație determinată între masa moleculară și volumul de eluare nu este valabilă decât în condițiile particulare ale unei experiențe date. Printre aceste condiții figurează, înainte de toate: temperatura, solventul (sau amestecul de solvenți), condițiile cromatografice, precum și coloana de separare sau sistemul de coloane.
Masele moleculare ale eșantioanelor determinate prin această metodă constituie valori relative; le vom numi „mase moleculare în echivalent-polistiren”. Aceasta semnifică faptul că, în funcție de diferențele chimice și structurale dintre eșantioanele testate și etaloane, masele moleculare pot devia față de valorile absolute, într-o manieră mai mult sau mai puțin importantă. Dacă sunt utilizate alte etaloane, de exemplu, polietilenglicol, poli(etilenoxid), poli(metacrilat de metil) sau acid poliacrilic, este important să se justifice motivul.
1.4. PRINCIPIUL METODEI DE TESTARE
Cromatografia pe gel permeabil permite determinarea distribuției maselor moleculare, precum și a maselor moleculare medii (Mn, Mw). Cromatografia pe gel permeabil reprezintă o metodă particulară de cromatografie lichidă, în cadrul căreia eșantionul pentru testat este separat în funcție de volumul hidrodinamic al fiecărui constituent (2).
Separarea se efectuează pe măsură ce eșantionul înaintează printr-o coloană umplută cu un material poros, în general un gel organic. Moleculele mici pot penetra în pori, în vreme ce moleculele mari sunt excluse. Din acest motiv, traseul moleculelor mari este mai scurt; acestea sunt separate primele. Moleculele de dimensiuni medii penetrează parțial în pori, fiind separate mai târziu. Moleculele cele mai mici, a căror rază hidrodinamică medie este mai mică decât cea a porilor de gel, pot penetra în toți porii. Acestea vor fi eluate ultimele.
În situația ideală, dimensiunea speciilor moleculare este cea care decide integral separarea, dar în practică, este greu de evitat interferența unor fenomene de absorbție. O umplere neregulată a coloanei, ca și existența unui volum mort important, pot agrava situația (2).
Detecția se efectuează, de exemplu, prin măsurarea indicelui de refracție sau al absorbției în UV, pentru realizarea unei curbe de distribuție simple. Totuși, pentru a putea asocia acestei curbe valorile maselor moleculare reale, este necesară etalonarea coloanei prin trecerea unui polimer cu masa moleculară cunoscută și, în cazul ideal, cu o structură cât mai apropiată, de exemplu diferiți polistireni standard. În general, se va obține o curbă Gauss; uneori, aceasta poate prezenta o asimetrie, pe partea maselor moleculare mici; axa verticală indică cantitatea (greutatea) speciilor de diferite mase moleculare eluate, iar pe axa orizontală, figurează logaritmul masei moleculare.
Conținutul în polimeri cu masă moleculară mică se deduce cu ajutorul acestei curbe. Calculul nu poate fi exact decât dacă speciile cu masă moleculară mică se comportă în același fel cu ansamblul polimerului, pe unitatea de masă.
1.5. CRITERII DE CALITATE
Reproductivitatea (deviația-standard relativă) a volumului de eluare trebuie să fie cel mult egală cu 0,3 %. Există modalități de ameliorare a reproductivității de analiză, grație unei corecții ce utilizează un standard intern, dacă un cromatograf este evaluat în funcție de timp și nu satisface criteriile menționate mai sus (a se vedea informațiile complementare la referința 1). Polidispersările depind de masele moleculare ale etaloanelor. În cazul polistirenilor etalon, valorile tipice sunt:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp este masa moleculară a etalonului, corespunzătoare semnalului maxim)
1.6. DESCRIEREA METODEI
1.6.1. Prepararea soluțiilor etalon de polistiren
Se vor dizolva polistirenii etalon, amestecând cu grijă până la diluția aleasă. Soluțiile se vor prepara ținând cont de recomandările fabricantului.
Concentrațiile etaloanelor alese depind de diferiți factori, cum ar fi: volumul de injecție, viscozitatea soluției și sensibilitatea detectorului. Volumul de injecție maxim trebuie să fie adaptat lungimii coloanei, având grijă să nu o supraîncarce. Volumele de injecție curente pentru separările analitice prin metoda cromatografică pe gel permeabil, pentru o coloană de 30 cm × 7,8 mm, variază de obicei între 40 și 100 μl. Se va determina raportul optim între volumul de injecție și concentrație, înainte de etalonarea coloanei.
1.6.2. Prepararea soluțiilor de eșantion
În principiu, prepararea soluțiilor de eșantion se realizează în condiții identice. Eșantionul se dizolvă într-un solvent adecvat, de exemplu THF, agitând cu grijă. În niciun caz nu se va dizolva într-o baie cu ultrasunete. Dacă este necesar, soluția de probă se purifică cu ajutorul unui filtru cu membrană, cu dimensiunea porilor cuprinsă între 0,2-2 μm.
Prezența particulelor nedizolvate trebuie menționată în raportul final, în măsura în care acestea pot rezulta din specii cu mase moleculare mari. Trebuie să se recurgă la o metodă potrivită pentru determinarea procentajului în greutate a particulelor nedizolvate. Analiza soluțiilor se va face în termen de 24 ore.
1.6.3. Corecție legată de prezența impurităților și a aditivilor
Fiind vorba despre conținutul în specii cu M < 1 000, pentru care este necesar, în general, să se aplice o corecție care să țină cont de prezența compușilor particulari nepolimerici (cum ar fi impuritățile sau aditivii), cu excepția cazului în care conținutul măsurat nu depășește valoarea de 1 %. Această corecție se poate realiza prin analiza directă a soluției de polimer sau a eluatului pentru cromatografia pe gel permeabil.
În cazul în care eluatul este prea diluat pentru a permite analizarea, după traversarea coloanei, este necesar să fie concentrat. Va fi, eventual, necesară evaporarea soluției până la sec, urmată de redizolvare. Concentrarea soluției se va efectua astfel încât să nu intervină nicio modificare a compoziției. Tratamentul soluției, după faza cromatografiei pe gel permeabil, este funcție de metoda de analiză utilizată pentru determinarea cantitativă.
1.6.4. Aparatură
Un aparat pentru cromatografie pe gel permeabil este compus din următoarele elemente:
— un rezervor pentru solvent;
— un sistem pentru degazare (dacă este necesar);
— o pompă;
— un amortizor de impulsuri (dacă este necesar);
— un sistem de injecție;
— coloane cromatografice;
— un detector;
— un debitmetru (dacă este necesar);
— un sistem de înregistrare și tratare a datelor;
— un recipient pentru recuperarea soluțiilor utilizate.
Sistemul cromatografic pe gel permeabil trebuie să fie inert față de solventul utilizat (de exemplu, utilizarea capilarelor din oțel, atunci când solvent este THF).
1.6.5. Injecția și sistemul de pompare a solventului
Un volum definit din soluția de probă este injectat în coloană, într-o zonă bine definită, cu ajutorul unui aparat pentru eșantionare automată sau manuală. Dacă se operează manual, retragerea ori împingerea prea bruscă a pistonului seringii poate determina modificări în distribuția maselor moleculare observate. Este indicat ca sistemul de pompare a solventului să fie lipsit de pulsații; este de preferat ca acesta să includă un amortizor de impulsuri. Debitul este de ordinul a 1 ml/min.
1.6.6. Coloana
În funcție de natura eșantionului testat, polimerul se caracterizează făcând recurs la o singură coloană sau la mai multe coloane, conectate în serie. În comerț, sunt disponibile mai multe materiale poroase pentru coloane, cu proprietăți definite (de exemplu, dimensiunea porilor, limita de excludere). Alegerea unui gel de separare sau a lungimii de coloană depinde, pe de o parte, de proprietățile eșantionului testat (volume hidrodinamice, distribuția maselor moleculare) și, pe de altă parte, de condițiile particulare ale separării, cum ar fi: natura solventului, temperatura și debitul (1) (2) (3).
1.6.7. Talere teoretice
Coloana (sau combinația de coloane) utilizată pentru separare trebuie caracterizată prin numărul de talere teoretice. Pentru aceasta, în cazul în care solventul de eluare este THF, se trece o soluție de etilbenzen sau o altă substanță dizolvată nepolară potrivită, printr-o coloană de lungime cunoscută. Numărul de talere teoretice este dat de ecuația următoare:
|
|
sau |
|
unde:
|
N |
= |
numărul de talere teoretice |
|
Ve |
= |
volumul de eluare, corespunzător semnalului maxim |
|
W |
= |
lărgimea semnalului maxim, la nivelul liniei de bază |
|
W1/2 |
= |
lărgimea semnalului maxim, la jumătatea înălțimii coloanei |
1.6.8. Eficacitatea separării
În afară de numărul de talere teoretice, parametru determinant al lărgimii de bandă, eficacitatea de separare este o altă caracteristică importantă, determinată de panta curbei de calibrare. Eficacitatea de separare a unei coloane se calculează cu ajutorul relației următoare:

unde:
|
Ve, Mx |
= |
volumul de eluare al polistirenului cu masa moleculară Mx; |
|
Ve,(10.Mx) |
= |
volumul de eluare al polistirenului cu masa moleculară de 10 ori mai mare |
Rezoluția sistemului este în general definită după cum urmează:

unde:
|
Ve1, Ve2 |
= |
volumele de eluare ale celor doi polistireni standard la semnalul maxim |
|
W1, W2 |
= |
lărgimile vârfului la nivelul liniei bazei |
|
M1, M2 |
= |
masele moleculare corespunzătoare semnalului maxim (aceste mase ar trebui să fie diferite printr-un factor 10) |
Valoarea lui R pentru sistemul de coloane trebuie să fie superioară valorii de 1,7 (4).
1.6.9. Solvenți
Toți solvenții trebuie să aibă o mare puritate (se va folosi THF de puritate 99,5 %). Rezervorul pentru solvent (la nevoie, pus în atmosferă de gaz inert), trebuie să fie suficient de mare pentru a permite etalonarea coloanei și mai multe analize de eșantioane. Solventul va fi degazat înainte de a fi pompat în coloană.
1.6.10. Reglarea temperaturii
Temperatura componentelor interne critice (bucla de injecție, coloana sau coloanele, detectorul și tuburile) trebuie să fie constantă și compatibilă cu solventul ales.
1.6.11. Detectorul
Detectorul înregistrează în mod cantitativ concentrația eșantionului eluat din coloană. Pentru evitarea unei lărgimi nedorite a picului, volumul cuvei detectorului va fi ales cât mai mic posibil. Acesta nu trebuie să depășească 10 μl, cu excepția detectoarelor ce funcționează prin difuzia luminii și a viscozimetrelor. În general, detecția se realizează prin refractometrie diferențială. Totuși, dacă proprietățile specifice ale eșantionului sau ale solventului pentru eluare o cer, se pot folosi alte tipuri de detectoare, cum ar fi cele UV/VIS sau IR, viscozimetrele etc.
2. DATE ȘI RAPORT
2.1. DATE
Se va face referință la normele DIN (1) pentru ceea ce privește criteriile de evaluare detaliate, la fel pentru specificațiile relative la colectarea și interpretarea datelor.
Pentru fiecare eșantion analizat, se vor realiza două experiențe independente. Rezultatele acestora se vor analiza separat.
Trebuie indicat în mod explicit că valorile măsurate sunt valori relative corespunzând unor echivalenți de masă moleculară ale standardului folosit.
În toate cazurile, este esențial să se determine și datele relative la blancuri, acestea fiind tratate în același mod ca eșantioanele.
După determinarea volumelor și a timpilor de retenție (eventual corectate cu ajutorul unui standard intern) se vor reprezenta grafic valorile log Mp (Mp fiind semnalul maxim al polimerilor standard), în funcție de una dintre acele cantități. Sunt necesare cel puțin 2 puncte de etalonare pentru fiecare factor 10 de masă moleculară. Pentru trasarea întregii curbe sunt necesare cel puțin 5 puncte de măsură; această curbă va acoperi masa moleculară estimată a eșantionului. Punctul extrem al curbei de etalonare, spre partea maselor moleculare mici, se poate defini folosind n-hexilbenzenul sau altă substanță dizolvată nepolară adecvată. Se determină porțiunea de curbă corespunzătoare maselor moleculare mai mici de 1 000 și se va corecta, dacă va fi necesar, luând în considerare prezența impurităților și a aditivilor. În general, curbele de eluare sunt evaluate prin intermediul unui sistem de prelucrare informatică a datelor. Dacă s-a optat pentru o prelucrare manuală, este indicat să se consulte ASTM D 3536-91 (3).
Dacă un polimer insolubil este reținut în coloană, masa sa moleculară este, foarte probabil, superioară celei corespunzătoare fracțiunii solubile și trebuie ținut cont de aceasta, pentru a evita subestimarea conținutului în polimeri de masă moleculară mică. În apendice se află indicațiile ce permit corecția conținutului în polimeri de masă moleculară mică, luând în considerare polimerii insolubili.
Curba de distribuție va fi prezentată sub forma unui tabel sau a unui grafic (frecvența diferențială sau procentajele cumulative în funcție de log M). În cazul reprezentării grafice, o putere de 10 pentru masa moleculară corespunde în mod normal unei lărgimi de aproximativ 4 cm, în vreme ce pentru maximul de semnal, este adecvată o înălțime de aproximativ 8 cm. În cazul curbelor de distribuție cumulative, diferența între 0 și 100 % pe axa ordonatei trebuie să fie în jur de 10 cm.
2.2. RAPORT DE TESTARE
Raportul de testare va cuprinde informațiile următoare:
2.2.1. Substanța testată:
— informații disponibile legate de substanța testată (natură, aditivi, impurități);
— descrierea tratamentului aplicat eșantionului, observații, probleme.
2.2.2. Dispozitivul experimental:
— un rezervor pentru solvent, gaz inert, sistem pentru degazarea solventului, compoziția solventului, impurități;
— pompă, amortizor de impulsuri, sistem de injecție;
— coloane de separare (fabricant, toate precizările legate de caracteristicile coloanei, cum ar fi dimensiunea porilor, natura materialului de separare etc., numărul, lungimea și ordinul coloanelor utilizate);
— numărul de talere teoretice ale coloanei (sau al combinației de coloane), eficacitatea separării (resorbția sistemului);
— informații legate de simetria semnalelor maxime;
— temperatura coloanei, modul de reglare a temperaturii;
— detector (principiul de măsurare, tip, volumul cuvei);
— debitmetru, dacă există (fabricant, principiul de măsurare);
— sistemul utilizat pentru culegere și prelucrarea datelor (echipament și programe informatice).
2.2.3. Etalonarea sistemului:
— descrierea detaliată a metodei utilizate pentru determinarea curbei de etalonare;
— precizări asupra criteriilor de calitate proprii acestei metode (de exemplu, coeficientul de corelare, eroarea pătratică medie etc.);
— informații asupra tuturor extrapolărilor, ipotezelor și aproximărilor efectuate în cursul proceselor experimentale, precum și asupra evaluării și prelucrării datelor;
— toate măsurătorile efectuate pentru stabilirea curbei de etalonare trebuie prezentate sub forma unui tabel, care cuprinde, pentru fiecare punct de etalonare, următoarele informații:
—— denumirea eșantionului;
— fabricantul eșantionului;
— valorile caracteristice Mp, Mn, Mw, Mw/Mn ale etaloanelor furnizate de fabricant, deduse din măsurătorile ulterioare, completate de indicațiile legate de metoda de determinare;
— volumul de injecție și concentrația substanței injectate;
— valoarea de Mp utilizată pentru etalonare;
— volumul de eluare sau timpul de retenție corectat, măsurat la semnalul maxim;
— Mp calculat la semnalul maxim;
— procentajul de eroare la Mp calculat și la valoarea de etalonare.
2.2.4. Informații asupra conținutului în polimeri cu masă moleculară mică:
— descrierea metodelor de analiză utilizate și a modului în care au fost conduse experimentele;
— informații privind procentajul conținutului în specii de masă moleculară mică (greutate/greutate) în raport cu ansamblul eșantionului;
— informații legate de impurități, aditivi și alte substanțe nepolimerice, în procentaj ponderal, funcție de ansamblul eșantionului;
2.2.5. Evaluare:
— evaluare în funcție de timp: toate metodele care vizează ameliorarea reproductivității cerute (metode de corecție, standard intern etc.);
— se precizează dacă evaluarea s-a efectuat plecând de la volumul de eluare sau de la timpul de retenție;
— se indică limitele de evaluare, dacă un pic nu a fost complet analizat;
— se descriu metodelor de netezire, dacă s-au folosit;
— se indică procedeele de preparare și pretratare a eșantionului;
— dacă există, se indică prezența particulelor nedizolvate;
— se indică volumul de injecție (μl) și concentrația de injecție (mg/ml);
— se menționează observațiile privind efectele generatoare de deviații, în raport cu profilul ideal de cromatografie pe gel permeabil;
— se descriu în detaliu toate modificările aduse procedurilor de analiză;
— se precizează intervalele de eroare;
— se consemnează orice alte informații și observații utile pentru interpretarea rezultatelor.
3. REFERINȚE BIBLIOGRAFICE
1. DIN 55672 (1995), Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
2. Yau, W.W., Kirkland, J.J., and Bly, D.D. eds. (1979), Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
3. ASTM D 3536-91, (1991), Standard Test method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
4. ASTM D 5296-92, (1992), Standard Test method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
Apendice
Indicații care permit corecția conținutului de polimeri cu masă moleculară mică, luând în considerare polimerii insolubili
Prezența unui polimer insolubil într-un eșantion antrenează o pierdere de masă în cursul analizei cromatografice pe gel permeabil. Polimerul insolubil este ireversibil reținut în coloană sau în filtrul eșantionului, atunci când partea solubilă a eșantionului traversează coloana. Dacă indicele de refracție diferențial (dn/dc) al polimerului poate fi estimat sau măsurat, este posibilă estimarea masei pe care eșantionul a pierdut-o în coloană. În acest caz, se efectuează o corecție cu ajutorul unui etalonare extern al refractometrului, cu etaloane având concentrația și raportul dn/dc, cunoscute. În exemplul următor, s-a utilizat un etalon de poli(metacrilat de metil).
Etalonarea externă, practicată în timpul analizei polimerilor acrilici, constă în analizarea cu ajutorul metodei cromatografice pe gel permeabil, a unei soluții etalon de poli(metacrilat de metil) în tetrahidrofuran, cu concentrația cunoscută; rezultatele servesc la calcularea constantei refractometrului, conform ecuației următoare:
K = R/(C × V × dn/dc)
unde:
|
K |
= |
constanta refractometrului (μV sec/ml) |
|
R |
= |
răspunsul etalonului de polimetacrilat de metil (μV/sec) |
|
C |
= |
concentrația etalonului de polimetacrilat de metil (mg/ml) |
|
V |
= |
volumul de injecție (ml) și |
|
dn/dc |
= |
indicele de refracție diferențial al unei soluții de polimetacrilat de metil în tetrahidrofuran (ml/mg) |
Următoarele date caracterizează în general un etalon de polimetacrilat de metil:
|
R |
= |
2 937 891 |
|
C |
= |
1,07 mg/ml |
|
V |
= |
0,1 ml |
|
dn/dc |
= |
9 × 10–5 ml/mg |
Valoarea K rezultată, 3,05 × 1011, este apoi utilizată pentru a calcula răspunsul teoretic al detectorului, adică ceea ce s-ar obține dacă 100 % din polimerul injectat s-ar alege la traversarea detectorului.
A.20. COMPORTAMENTUL DE DIZOLVARE/EXTRACȚIE AL POLIMERILOR ÎN APĂ
1. METODĂ
Metoda descrisă urmează Orientarea 120 (1997) a OCDE. Mai multe informații tehnice se găsesc în referințele bibliografice (1).
1.1. INTRODUCERE
În cazul anumitor polimeri, cum ar fi polimerii în emulsie, poate fi necesar un tratament inițial, înainte de utilizarea metodei expuse. Metoda nu este aplicabilă polimerilor lichizi, nici polimerilor care reacționează cu apa în condițiile experimentale.
Dacă este dificil sau imposibil să se pună în practică metoda, comportamentul de dizolvare/extracție al polimerilor poate fi studiat cu ajutorul altor metode. În acest caz, metoda utilizată va fi în întregime detaliată și justificată.
1.2. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.3. PRINCIPIUL METODEI
Comportamentul de dizolvare/extracție al polimerilor în mediu apos se determină prin metoda flaconului (a se vedea A.6 Solubilitatea în apă, metoda flaconului), căreia i se vor aduce modificările descrise mai jos.
1.4. CRITERII DE CALITATE
Niciunul.
1.5. DESCRIEREA METODEI
1.5.1. Aparatură
Aparatura necesară pentru aplicarea metodei este următoarea:
— un dispozitiv care permite măcinarea eșantionului până la obținerea unei pulberi, cum ar fi un concasor ce produce particule de dimensiuni determinate (1);
— un sistem de agitare, cu posibilitatea de reglare a temperaturii;
— un sistem de filtrare cu membrane;
— un dispozitiv de analiză;
— site standardizate.
1.5.2. Prepararea soluției de eșantion
Inițial trebuie măcinat un eșantion reprezentativ, până la dimensiuni ale particulelor cuprinse între 0,125 și 0,25 mm, utilizând sitele potrivite. Poate fi necesară o răcire pentru a garanta stabilitatea eșantionului sau pentru a se proceda la concasare. Materialele de tipul cauciucului pot fi pulverizate la temperatura azotului lichid (1).
Dacă nu este posibilă obținerea de particule la dimensiunile cerute, se vor reduce dimensiunile acestora cât mai mult posibil și se va consemna rezultatul. În cuprinsul raportului, este necesar să se indice modul în care eșantionul pulverizat a fost conservat înainte de analiză.
1.5.3. Mod de operare
Se cântăresc trei eșantioane din substanța testată, fiecare de 10 g, în trei recipiente prevăzute cu dop de sticlă și se adaugă câte 1 000 ml apă în fiecare recipient. Dacă manipularea a 10 g de polimer se dovedește imposibilă, este indicat să se folosească cea mai mare cantitate care poate fi manipulată; volumul de apă va fi mărit în mod proporțional.
Recipientele se vor închide bine, apoi se vor agita la temperatura de 20 oC. Se va folosi un dispozitiv de agitare care funcționează la temperatură constantă. După 24 ore, conținutul fiecărui recipient este centrifugat sau filtrat, iar concentrația polimerului în faza apoasă limpede va fi determinată cu ajutorul unei metode potrivite de analiză. Dacă nu există o metodă adecvată, care să permită o analiză în faza apoasă, se poate obține o estimare a solubilității/extractibilității totale, prin cântărirea, după uscare, a reziduului filtrat sau a precipitatului centrifugat.
De asemenea, este necesară diferențierea cantitativă a impurităților și aditivilor, pe de o parte, și a speciilor de masă moleculară mică, pe de altă parte. În cazul unei determinări gravimetrice, este important să se realizeze o analiză inițială, fără substanță de testare, în scopul de a lua în considerare reziduurile generate prin metoda experimentală.
În mod similar, se poate determina comportamentul de dizolvare/extracție al polimerilor în apă, la 37 oC, pentru pH 2 și pH 9, așa cum a fost descrisă experiența realizată la 20 oC. Valorile pH-ului pot fi obținute prin adăugare de soluții tampon adecvate sau adăugare de acizi ori baze, potriviți; dintre aceștia, se pot enumera: acid clorhidric, acid acetic, hidroxizi de sodiu și de potasiu de calitate analitică sau amoniac.
Trebuie realizate una sau două experiențe, conform metodei. În cazul în care sunt disponibile metode suficient de specifice, pentru analizarea directă a polimerului în faza apoasă, un experiment ca acela descris mai sus este destul. Însă, atunci când aceste metode nu există, iar determinarea comportamentului de dizolvare-extracție al polimerului, nu se poate face decât indirect – respectiv prin determinarea conținutului în carbon organic total (COT) al extractului apos – este necesară o experiență suplimentară. De asemenea, și aceasta se va face în triplicat, cu eșantioane de polimer de 10 ori mai mici și cu aceleași cantități de apă, ca și la primul experiment.
1.5.4. Analiza
1.5.4.1. Experimente realizate cu eșantioane de dimensiuni unice
Este posibil să dispunem de metode care permit o analiză directă a polimerilor, în fază apoasă. În caz contrar, poate fi luată în considerare analiza indirectă a polimerilor dizolvați sau extrași. Pentru aceasta, se va determina conținutul total în părți solubile, care se va corecta ținând cont de substanțele nepolimerice.
Pentru a determina conținutul total în specii polimerice, analiza extrasului apos se poate realiza:
fie printr-o metodă suficient de sensibilă, de exemplu:
— determinarea COT cu persulfat sau dicromat, pentru a se obține CO2, urmată de o estimare prin IR sau de o analiză chimică;
— spectrometria de absorbție atomică (SAA) sau echivalentul acesteia, emisie în plasmă cuplată prin inducție (PCI);, în cazul polimerilor ce conțin siliciu sau un metal;
— absorbția UV sau spectrofluorimetria pentru polimerii arilici;
— cromatografia în fază lichidă cuplată cu spectrometria de masă, pentru eșantioane cu mase moleculare mici,
fie prin evaporare completă, în vid, a extrasului apos, urmată de o analiză a reziduului prin spectroscopie (IR, UV etc.) sau prin SAA-PCI.
Dacă o astfel de analiză a fazei apoase este imposibilă, extrasul apos se va obține cu ajutorul unui solvent organic nemiscibil în apă (o hidrocarbură clorurată, de exemplu). Apoi, solventul este evaporat și reziduul se analizează (prin IR, UV sau SAA-PCI), pentru determinarea conținutului său în polimer specificat. Toți constituenții acestui reziduu care se dovedesc a fi impurități sau aditivi trebuie separați, în scopul determinării gradului de dizolvare/extracție al polimerului.
Atunci când astfel de substanțe sunt prezente în cantități relativ importante, poate fi necesară supunerea reziduului unei analize cromatografice în fază lichidă, de înaltă performanță, sau în fază gazoasă, de exemplu, în scopul diferențierii acelor impurități prezente, de monomeri și derivați monomerici, astfel încât conținutul real în aceste ultime specii, să poată fi determinat.
În anumite cazuri, o simplă evaporare completă a solventului organic, urmată de cântărirea reziduului uscat, poate fi suficientă.
1.5.4.2. Experimente realizate cu două eșantioane de mărimi diferite
Conținutul în carbon organic total trebuie determinat pentru toate extrasele apoase.
Se realizează o determinare prin gravimetrie, asupra părții nedizolvate sau neextrase a eșantionului. Dacă, după centrifugarea sau filtrarea conținutului fiecărui recipient, reziduul de polimer aderă încă la peretele recipientului, trebuie clătit respectivul recipient cu filtratul, până când nu se mai observă urme de reziduu. După aceea, filtratul este refiltrat sau centrifugat. Reziduurile depuse pe filtru sau în tubul centrifugei sunt uscate la 40 oC, în vid, apoi se cântăresc. Se va continua uscarea, până la obținerea unei mase constante.
2. DATE
2.1. EXPERIMENTE REALIZATE CU EȘANTIOANE DE DIMENSIUNI UNICE
Rezultatele obținute pentru fiecare dintre cele trei flacoane, precum și valorile medii, trebuie consemnate și exprimate în unități de masă per volum de soluție (în general, în mg/l) sau în unități de masă per masă de eșantion de polimer (de obicei, în mg/g). În plus, pierderea de masă de eșantion (calculată prin raportarea masei soluției la masa inițială de eșantion), va fi de asemenea menționată. Trebuie calculate deviațiile standard relative. Diversele valori vor fi menționate o dată, pentru produsul total (polimer + principalii aditivi etc.) și repetate, pentru polimerul singur (pentru a cunoaște, după separare, mărimea relativă a respectivilor aditivi).
2.2. EXPERIMENTE REALIZATE CU EȘANTIOANE DE DIMENSIUNI DIFERITE
Diferitele concentrații ale carbonului organic total în extrasele apoase, provenite din cele două serii a câte trei experiențe, precum și valorile medii pentru fiecare serie, trebuie consemnate și exprimate în unități de masă per volum de soluție (în general, în mgC/l), precum și în unități de masă per masă de eșantion inițial (de obicei, în mgC/g).
Dacă nu există diferențe între rezultatele corespunzătoare rapoartelor dimensiune de eșantion/volum de apă mare sau mic, aceasta poate semnifica faptul că toți constituenții susceptibili a fi extrași, au fost efectiv extrași. În acest caz, o analiză directă nu este, de regulă, necesară.
Diferitele mase de reziduu trebuie consemnate și exprimate în procente de masă inițială de eșantion. Se vor calcula valori medii pentru fiecare experiență. Diferența dintre 100 și procentajul obținut, reprezintă procentul de materii solubile și extractibile din eșantioanele inițiale.
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare trebuie să cuprindă următoarele informații:
3.1.1. Substanța testată:
— informații disponibile, legate de substanța testată (natură, aditivi, impurități, proporția speciilor cu masă moleculară mică).
3.1.2. Condiții experimentale:
— descrierea metodelor utilizate și a condițiilor experimentale;
— descrierea metodelor de analiză și detecție.
3.1.3. Rezultate:
— rezultate de solubilitate/extractibilitate în mg/l: toate valorile și valorile medii obținute pentru experiențele de extracție în diferite soluții, repartizate în polimeri și impurități, aditivi etc.;
— rezultate de solubilitate/extractibilitate în mg/g de polimer;
— concentrațiile carbonului organic total în extractele apoase, masa soluției și procentajele calculate, dacă s-a făcut măsurarea;
— pH-ul fiecărui eșantion;
— informații privind valorile obținute în experiențele martor (fără solvent);
— descrierea metodelor de analiză și detecție;
— dacă este necesar, se va menționa instabilitatea chimică a substanței testate, în cursul procedurii experimentale și în cursul analizei;
— toate informațiile importante pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
DIN 53733 (1976) Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke.
A.21. PROPRIETĂȚI OXIDANTE (LICHIDE)
1. METODĂ
1.1. INTRODUCERE
Această metodă de testare este concepută pentru a măsura potențialul unei substanțe lichide de a crește rata sau intensitatea arderii unei substanțe combustibile sau de a forma cu o substanță combustibilă un amestec care se aprinde spontan când cele două se amestecă omogen. Se bazează pe testul ONU pentru lichide oxidante (1) și este echivalent cu acesta. Cu toate acestea, întrucât această metodă A.21 este concepută în special pentru a îndeplini cerințele Regulamentului (CE) nr. 1907/2006, este necesară comparația cu o singură substanță de referință. Testarea și comparația cu alte substanțe de referință pot fi necesare în cazul în care se estimează utilizarea rezultatelor în alte scopuri ( 3 ).
Nu este necesar să se efectueze acest test în cazul în care examinarea formulei structurale stabilește indubitabil că substanța este incapabilă să reacționeze exotermic cu un material combustibil.
Înainte de efectuarea testului este util să se cunoască informații privind orice potențiale proprietăți explozive ale substanței.
Acest test nu se aplică substanțelor solide, gazoase, explozive sau foarte inflamabile sau peroxizilor organici.
Nu este necesar să se efectueze acest test în cazul în care sunt disponibile rezultatele pentru substanța de testat în cadrul testului ONU pentru lichide oxidante (1).
1.2. DEFINIȚII ȘI UNITĂȚI
Timpul mediu de creștere a presiunii reprezintă media timpilor măsurați în care un amestec testat produce o creștere de presiune de la 690 kPa la 2 070 kPa peste presiunea atmosferică.
1.3. SUBSTANȚA DE REFERINȚĂ
Ca substanță de referință se utilizează o soluție apoasă de acid azotic (calitate analitică) la 65 % (g/g) ( 4 ).
Opțional, dacă experimentatorul prevede că rezultatele acestui test ar putea fi utilizate în alte scopuri, ar putea fi oportună testarea altor substanțe de referință ( 5 ).
1.4. PRINCIPIUL METODEI DE TESTARE
Lichidul care urmează a fi testat se amestecă, în proporție masică de 1 la 1 cu celuloză fibroasă și se introduce într-un vas de presiune. Dacă în timpul amestecării sau umplerii are loc combustia spontană, nu mai sunt necesare alte teste.
Dacă nu intervine combustia spontană, se efectuează testul complet. Amestecul se încălzește într-un vas de presiune și se măsoară timpul mediu de creștere a presiunii de la 690 kPa la 2 070 kPa peste presiunea atmosferică. Acesta este comparat cu timpul mediu de creștere a presiunii pentru amestecul de substanță sau substanțe de referință și celuloză în proporție de 1:1.
1.5. CRITERII DE CALITATE
Dintr-o serie de cinci teste asupra unei singure substanțe, rezultatele nu trebuie să prezinte diferențe de peste 30 % față de media aritmetică. Rezultatele care se abat cu peste 30 % de la medie se ignoră, se îmbunătățește procedura de amestecare și umplere și se repetă testele.
1.6. DESCRIEREA METODEI
1.6.1. Pregătire
1.6.1.1. Substanța combustibilă
Ca material combustibil se utilizează celuloză fibroasă uscată, cu fibre de o lungime între 50 și 250 μm și un diametru mediu de 25 μm ( 6 ). Celuloza se usucă până la obținerea unei greutăți constante în straturi de maximum 25 mm grosime, la 105 oC timp de patru ore, după care se păstrează într-un exsicator, în prezența unui deshidratant, până la răcire și utilizare. Conținutul de apă al celulozei uscate trebuie să fie sub 0,5 % din masa uscată ( 7 ). Dacă este necesar, timpul de uscare se prelungește pentru îndeplinirea acestei condiții ( 8 ). Pe întreg parcursul testului se utilizează același lot de celuloză.
1.6.1.2. Aparatură
1.6.1.2.1.
Este necesar un vas de presiune. Vasul este format dintr-un vas de presiune cilindric, din oțel, cu o lungime de 89 mm și un diametru exterior de 60 mm (a se vedea figura 1). În două puncte diametral opuse se formează două suprafețe plane (care reduc secțiunea transversală a vasului la 50 mm) care permit fixarea sa în momentul instalării dopului de aprindere și a dopului de aerisire. Vasul, care are un alezaj cu un diametru de 20 mm, este fălțuit intern la ambele capete pe o adâncime de 19 mm și filetat pentru fileturi de 1" conform British Standard Pipe (BSP) sau echivalent metric. O priză de presiune, sub forma unui braț lateral, este înfiletată pe fața curbată a vasului de presiune la 35 de mm de unul dintre capete și la 90o față de suprafețele plane. Orificiul pentru priză este alezat la o adâncime de 12 mm și filetat pentru fileturi de 1/2" BSP (sau echivalent metric) la extremitatea brațului lateral. Dacă este necesar, pentru a asigura etanșeitatea la gaz, se folosește o garnitură inertă. Brațul lateral se extinde 55 mm de la corpul vasului de presiune și are un alezaj de 6 mm. Extremitatea brațului lateral este fălțuită și filetată pentru un traductor de presiune de tip diafragmă. Se poate utiliza orice dispozitiv de măsurare a presiunii care nu este afectat de gazele calde sau de produsele de descompunere și care poate reacționa la o creștere de presiune de la 690 la 2 070 kPa în cel mult 5 ms.
Extremitatea vasului de presiune cea mai îndepărtată de brațul lateral este închisă cu un dop de aprindere prevăzut cu doi electrozi, unul izolat de corpul dopului, iar celălalt pus la masă. Cealaltă extremitate a vasului de presiune este închisă cu un disc de rupere (presiunea de rupere aproximativ 2 200 kPa), fixat cu un dop de fixare având un orificiu de 20 mm. Dacă este necesar, dopul de aprindere se montează cu o garnitură inertă pentru a asigura etanșeitatea la gaz. În timpul utilizării, ansamblul este menținut în poziția corectă de un stand de sprijin (figura 2). Acesta cuprinde, de obicei, o placă de bază din oțel moale de 235 mm × 184 mm × 6 mm și un tub cu secțiune pătrată de 70 mm × 70 mm × 4 mm de 185 mm lungime.
La una dintre extremitățile tubului cu secțiune pătrată, se taie câte o secțiune de fiecare parte, astfel încât să se obțină o structură cu secțiune pătrată de 86 mm lungime cu două picioare plate. Capetele acestor picioare pătrate se taie într-un unghi de 60o față de orizontală și sudate pe placa de bază. Pe o parte a capătului superior al secțiunii de bază se decupează o fantă de 22 mm lățime și 46 mm adâncime, astfel încât, atunci când ansamblul vasului de presiune este pus pe suport, cu dopul de aprindere în jos, brațul lateral să intre în fantă. O piesă de oțel de 30 mm lățime și 6 mm grosime se sudează pe fața interioară a părții inferioare a tubului cu secțiune pătrată, pentru a acționa ca distanțier. Două șuruburi cu cap fluture de 7 mm, fixate pe partea opusă, mențin vasul de presiune într-o poziție fixă. Două benzi de 12 mm lățime din tablă de oțel de 6 mm grosime, sudate pe părțile laterale de la baza tubului cu secțiune pătrată, sprijină vasul de presiune de dedesubt.
1.6.1.2.2.
Sistemul de aprindere este format dintr-o sârmă de Ni/Cr cu o lungime de 25 cm, un diametru de 0,6 mm și o rezistență de 3,85 ohm/m. Sârma se înfășoară, pe o tijă cu un diametru de 5 mm, sub forma unei bobine, și se leagă la electrozii dopului de aprindere. Bobina trebuie să aibă una dintre configurațiile prezentate în figura 3. Distanța dintre fundul vasului și partea inferioară a bobinei de aprindere trebuie să fie de 20 mm. Dacă electrozii nu pot fi reglați, secțiunile sârmei de aprindere dintre bobină și fundul vasului se izolează cu o manta ceramică. Sârma este încălzită de o sursă de alimentare constantă care poate asigura cel puțin 10 A.
1.6.2. Desfășurarea testului ( 9 )
Aparatul, echipat complet cu traductor de presiune și sistem de încălzire, dar fără discul de rupere, se sprijină vertical, cu dopul de aprindere în jos. Se amestecă 2,5 g din lichidul de testat cu 2,5 g de celuloză uscată într-un pahar de laborator cu un agitator de sticlă ( 10 ). Pentru siguranță, în timpul amestecării între operator și amestec se amplasează un ecran de protecție. Dacă amestecul se aprinde în timpul amestecării sau umplerii, nu mai sunt necesare teste suplimentare. Amestecul se adaugă, în cantități mici, lovindu-l încet de container, în vasul de presiune, asigurându-se că nu există spații goale în jurul bobinei de aprindere și că amestecul este în contact perfect cu aceasta. Este important ca bobina să nu fie deformată în procesul de umplere, întrucât acest lucru ar putea conduce la rezultate eronate ( 11 ). Discul de rupere se pune pe poziție și dopul de fixare se înșurubează strâns. Vasul umplut se pune, cu discul de rupere în sus, pe suportul de sprijin pentru încălzire care se amplasează într-o hotă sau o cameră de tiraj adecvată. Se conectează sursa de alimentare la bornele externe ale dopului de aprindere și se aplică un curent de 10 A. De la începerea amestecării și până la punerea sub tensiune nu trebuie să treacă mai mult de 10 minute.
Semnalul produs de traductorul de presiune se înregistrează într-un sistem adecvat care permite atât evaluarea, cât și generarea unei înregistrări permanente a graficului presiune/timp obținut (de exemplu un înregistrator de semnale tranzitorii legat la un înregistrator cu bandă). Amestecul se încălzește până când se rupe discul de rupere sau cel puțin 60 s. Dacă discul de rupere nu se rupe, amestecul se lasă să se răcească, după care se dezmembrează cu atenție aparatul, luând măsurile necesare pentru a ține seama de eventuala presurizare. Se fac cinci teste cu substanța de testat și substanța sau substanțele de referință. Se notează timpul necesar pentru creșterea presiunii de la 690 kPa la 2 070 kPa peste presiunea atmosferică. Se calculează timpul mediu de creștere a presiunii.
În unele cazuri, substanțele pot genera o creștere de presiune (prea mare sau prea mică), cauzată de reacții chimice care nu caracterizează proprietățile oxidante ale substanței. În aceste cazuri, este posibil să fie necesară repetarea testului cu o substanță inertă, de exemplu diatomit (kieselgur), în loc de celuloză, pentru a se clarifica natura reacției.
2. DATE
Timpii de creștere a presiunii atât pentru substanța de testat, cât și pentru substanța (substanțele) de referință. Timpii de creștere a presiunii pentru testele cu o substanță inertă, dacă se efectuează astfel de teste.
2.1. PRELUCRAREA REZULTATELOR
Se calculează timpii medii de creștere a presiunii atât pentru substanța de testat, cât și pentru substanța sau substanțele de referință.
Se calculează timpul mediu de creștere a presiunii pentru testele cu o substanță inertă (dacă se efectuează).
Tabelul 1 prezintă câteva exemple de rezultate.
Tabelul 1
Exemple de rezultate ()
|
Substanța () |
Timpul mediu de creștere a presiunii pentru un amestec 1:1 cu celuloză (ms) |
|
Dicromat de amoniu, soluție apoasă saturată |
20 800 |
|
Nitrat de calciu, soluție apoasă saturată |
6 700 |
|
Nitrat feric, soluție apoasă saturată |
4 133 |
|
Perclorat de litiu, soluție apoasă saturată |
1 686 |
|
Perclorat de magneziu, soluție apoasă saturată |
777 |
|
Nitrat de nichel, soluție apoasă saturată |
6 250 |
|
Acid azotic, 65 % |
4 767 () |
|
Acid percloric, 50 % |
121 () |
|
Acid percloric, 55 % |
59 |
|
Nitrat de potasiu, soluție apoasă 30 % |
26 690 |
|
Nitrat de argint, soluție apoasă saturată |
|
|
Clorat de sodiu, soluție apoasă 40 % |
2 555 () |
|
Nitrat de sodiu, soluție apoasă 45 % |
4 133 |
|
Substanță inertă |
|
|
Apă:celuloză |
|
|
(1) A se vedea referința 1 pentru clasificarea conform regimului de transport ONU. (2) Soluțiile saturate se prepară la 20 oC. (3) Valoarea medie obținută la teste comparative interlaboratoare. (4) Presiunea maximă de 2 070 kPa nu a fost atinsă. |
|
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să cuprindă următoarele informații:
— identitatea, puritatea, compoziția, puritatea etc. substanței de testat;
— concentrația substanței de testat;
— procedura de uscare a celulozei utilizate;
— conținutul de apă al celulozei utilizate;
— rezultatele măsurătorilor;
— rezultatele testelor cu o substanță inertă, dacă este cazul;
— timpii medii de creștere a presiunii calculați;
— orice abatere de la această metodă și motivele acesteia;
— orice informații și observații suplimentare relevante pentru interpretarea rezultatelor.
3.2. INTERPRETAREA REZULTATELOR ( 12 )
Rezultatele testelor se evaluează în funcție de:
(a) eventuala combustie spontană a amestecului de substanță de testat și celuloză; și
(b) compararea timpului mediu necesar pentru creșterea presiunii de la 690 kPa la 2 070 kPa cu cel al substanței (substanțelor) de referință.
O substanță lichidă este considerată oxidant dacă:
(a) un amestec de substanță de testat și celuloză în proporție masică de 1:1 se aprinde spontan; sau
(b) un amestec de substanță de testat și celuloză în proporție masică de 1:1 are un timp mediu de creștere a presiunii mai mic sau egal cu cel al unui amestec de acid azotic în soluție apoasă de 65 % (g/g) și celuloză în proporție masică de 1:1.
Dacă este necesar pentru a evita un rezultat pozitiv fals, la interpretarea rezultatelor se iau în considerare și rezultatele obținute la testarea substanței cu un material inert.
4. REFERINȚE BIBLIOGRAFICE
Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, p. 342. Test O.2: Test for oxidising liquids.
Figura 1
Vas de presiune

Figura 2
Stand de sprijin

Figura 3
Sistemul de aprindere

Notă: se poate folosi oricare dintre aceste configurații.
A.22. DIAMETRU MEDIU GEOMETRIC PONDERAT PE LUNGIME AL FIBRELOR
1. METODĂ
1.1. INTRODUCERE
Această metodă descrie procedura de măsurare a diametrului mediu geometric ponderat pe lungime (LWGMD) al Fibrelor Minerale Artificiale (FMA) în vrac. În măsura în care LWGMD al populației are o probabilitate de 95 % de a fi cuprins între limitele de încredere la 95 % (LWGMD ± două erori standard) din eșantion, valoarea raportată (rezultatul testării) va fi limita de încredere inferioară procentului de 95 % din eșantion (adică LWGMD – 2 erori standard). Această metodă se bazează pe actualizarea (iunie 1994) unui proiect de procedură industrială a HSE asupra căruia s-a convenit cu ocazia unei reuniuni între ECFIA și HSE, care a avut loc la Chester la 26 septembrie 1993, și care a fost elaborat pentru și pe baza unui al doilea test interlaboratoare (1, 2). Această metodă de măsurare poate fi utilizată pentru a caracteriza diametrul fibrelor care intră în alcătuirea substanțelor sau a produselor în vrac ce conțin FMA-uri, inclusiv fibre ceramice refractare (FCR), fibre vitroase artificiale (FVA), fibre cristaline și policristaline.
Ponderarea pe lungime reprezintă o metodă de compensare a efectelor asupra distribuției diametrului cauzate de spargerea fibrelor lungi în timpul eșantionării sau manipulării materialului. Statistica geometrică (media geometrică) este utilizată pentru a măsura distribuția diametrelor FMA-urilor, având în vedere că distribuțiile acestor diametre sunt în general apropiate de distribuția log-normală.
Măsurarea lungimii și a diametrului este o operațiune fastidioasă și de durată, însă, dacă se măsoară doar acele fibre care intră în contact cu o linie infinit de subțire a câmpului vizual al unui MEB (microscop electronic cu baleiaj), atunci probabilitatea de a selecționa o fibră dată este proporțională cu lungimea sa. Având în vedere că această metodă ia în considerare lungimea la efectuarea calculelor de ponderare pe lungime, singura măsurătoare necesară este diametrul și LWGMD-2SE poate fi calculat conform descrierii.
1.2. DEFINIȚII
Particulă: Un obiect al cărui raport lungime/lățime este mai mic de 3:1.
Fibră: Un obiect al cărui raport lungime/lățime (raport de aspect) este de cel puțin 3:1.
1.3. DOMENIUL ȘI LIMITELE DE APLICARE
Metoda este concepută pentru a analiza distribuția diametrelor având un diametru mediu cuprins între 0,5 μm și 6 μm. Diametrele mai mari pot fi măsurate cu ajutorul unor grosismente inferioare ale MEB, însă această metodă va fi din ce în ce mai limitată, pe măsură ce distribuțiile fibrelor devin mai fine. În această situație, se recomandă efectuarea de măsurători cu ajutorul unui microscop electronic cu transmisie (MET), dacă diametrul mediu este mai mic de 0,5 μm.
1.4. PRINCIPIUL METODEI DE TESTARE
Un număr de eșantioane reprezentative sunt prelevate din fibre de țesătură sau din fibre destrămate în vrac. Lungimea fibrelor în vrac este redusă printr-o procedură de zdrobire, apoi se dispersează în apă un subeșantion reprezentativ. Un număr de alicote sunt extrase și filtrate cu ajutorul unui filtru din policarbonat cu un diametru al porilor de 0,2 μm, înainte de a fi pregătite spre examinare cu ajutorul tehnicilor de microscopie electronică cu baleiaj (MEB). Diametrele fibrelor sunt măsurate utilizându-se un grosisment al ecranului de cel puțin × 10 000 ( 13 ) cu ajutorul unei eșantionări liniare, astfel încât să se obțină o estimare imparțială a diametrului mediu. Intervalul de încredere mai mic de 95 % (bazat pe un test unilateral) se calculează pentru a obține o estimare a valorii minime a diametrului mediu geometric al fibrelor materialului.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Siguranță/precauții
Este necesar să se reducă la minimum expunerea personalului la fibre în suspensie în atmosferă, precum și să se utilizeze o hotă sau o cutie cu mănuși în timpul manipulării fibrelor. Trebuie efectuate controale periodice privind expunerea personalului, pentru a determina eficacitatea metodelor de control. În timpul manipulării FMA-urilor, personalul trebuie să poarte mănuși de unică folosință pentru a reduce iritația pielii și pentru a preveni contaminarea încrucișată.
1.5.2. Aparatură/echipamente
— Prese și matrițe (capabile să producă 10 MPa).
— Filtre din policarbonat cu pori capilari de 0,2 μm (diametru de 25 mm).
— Filtru din membrană de ester de celuloză cu pori de 5 μm destinat utilizării ca filtru secundar.
— Aparat de filtrare din sticlă (sau sisteme de filtrare de unică folosință) concepute pentru filtre cu diametrul de 25 mm (de exemplu trusă de microanaliză din sticlă Millipore, tip nr. XX10 025 00).
— Apă proaspăt distilată și filtrată cu ajutorul unui filtru cu pori de 0,2 μm pentru îndepărtarea microorganismelor.
— Pulverizator catodic cu anticatod din aur sau din aur/paladiu.
— Microscop electronic cu baleiaj cu o rezoluție capabilă să coboare până la 10 nm și să funcționeze la un grosisment de x 10 000.
— Diverse: spatule, lamă de scalpel de tip 24, pensete, tuburi MEB, adeziv sau bandă adezivă cu carbon, argint coloidal.
— Sondă cu ultrasunete sau baie de ultrasunete de laborator.
— Prelevator sau sondă, pentru prelevarea de eșantioane din țesătura de FMA.
1.5.3. Procedura de testare
1.5.3.1. Eșantionare
Pentru țesături și plăci, se utilizează un prelevator sau o sondă de 25 mm pentru prelevarea de eșantioane din secțiunea transversală. Prelevările trebuie să fie efectuate la intervale identice pe toată lățimea unei mici lungimi din țesătură sau să fie colectate din zone aleatorii, dacă sunt disponibile lungimi mari ale țesăturii. Același echipament poate fi utilizat pentru a preleva eșantioane aleatorii din fibre destrămate. Dacă este posibil, trebuie prelevate șase eșantioane, pentru a reflecta variațiile spațiale din materialul în vrac.
Cele șase eșantioane trebuie zdrobite într-o matriță cu un diametru de 50 mm la 10 MPa. Materialul trebuie amestecat cu spatula și presat din nou la 10 MPa. Materialul este apoi îndepărtat din matriță și depozitat într-o sticlă închisă ermetic.
1.5.3.2. Pregătirea eșantionului
Dacă este necesar, lianții organici pot fi eliminați prin introducerea fibrei într-un cuptor la 450 °C timp de aproximativ o oră.
Se recomandă utilizarea conurilor pentru delimitare și împărțirea în sferturi pentru a subdivide eșantionul (această operațiune trebuie efectuată în interiorul unei incinte cu pulberi).
Cu ajutorul unei spatule, adăugați o cantitate mică (< 0,5 g) din eșantion în 100 ml de apă proaspăt distilată care a fost filtrată printr-un filtru cu membrană de 0,2 μm (pot fi utilizate și alte surse de apă ultra pură, cu condiția ca acestea să fie de o calitate satisfăcătoare). Dispersați atent cu ajutorul unei sonde cu ultrasunete care funcționează la 100 W și care este reglată pentru a produce cavitație. (Dacă nu dispuneți de o sondă, utilizați următoarea metodă: agitați și răsturnați de mai multe ori, timp de 30 de secunde; lansați ultrasunete într-o baie cu ultrasunete de laborator timp de cinci minute; apoi agitați și răsturnați de mai multe ori, timp de alte 30 de secunde.)
Imediat după dispersia fibrei, îndepărtați un anumit număr de alicote (de exemplu trei alicote de 3, 6 și 10 ml) utilizând o pipetă cu gură largă (cu o capacitate de 2-5 ml).
Filtrați sub vid fiecare alicotă cu ajutorul unui filtru din policarbonat de 0,2 μm susținut de un filtru secundar MEC cu pori de 5 μm, utilizând o pâlnie de filtrare din sticlă de 25 mm cu un rezervor clindric. O cantitate de aproximativ 5 ml de apă distilată filtrată trebuie introdusă în pâlnie, urmând ca alicota să fie pipetată încet în apă, menținând totodată vârful pipetei sub menisc. Pipeta și rezervorul trebuie clătite bine după pipetare, deoarece fibrele fine au tendința de a se localiza mai ales la suprafață.
Îndepărtați atent filtrul și separați-l de filtrul secundar înainte de a-l depune într-un recipient pentru a se usca.
Decupați un sfert sau o jumătate din secțiunea de depozit filtrat cu o lamă de scalpel de tip 24 printr-o mișcare oscilatorie. Fixați atent secțiunea decupată pe placa unui MEB cu ajutorul unui bande adezive sau al unui adeziv cu carbon. Argintul coloidal trebuie aplicat în cel puțin trei poziții diferite pentru a îmbunătăți contactul electric la marginile filtrului și ale plăcii. După uscarea lipiciului/argintului coloidal, pulverizați catodic aproximativ 50 nm de aur sau de aur/paladiu pe suprafața depozitului.
1.5.3.3. Calibrarea și funcționarea MEB
1.5.3.3.1. Calibrarea
Calibrarea MEB trebuie verificată cel puțin o dată pe săptămână (la modul ideal o dată pe zi) cu ajutorul unei grile de calibrare omologată. Valorile de calibrare trebuie comparate cu o normă omologată și, în cazul în care valoarea măsurată (MEB) se situează în afara plajei de 2 % din valoarea omologată, calibrarea MEB trebuie ajustată și verificată din nou.
MEB trebuie să ofere cel puțin o rezoluție cu un diametru minim vizibil de 0,2 μm, utilizând o matrice de prelevare reală și un grosisment de × 2 000.
1.5.3.3.2. Funcționarea
MEB trebuie utilizat la un grosisment de 10 000 ( 14 ) în condiții care oferă o bună rezoluție și o imagine acceptabilă la viteze de baleiaj reduse de, spre exemplu, 5 secunde per cadru. Deși cerințele de funcționare ale diferitelor MEB-uri pot fi diferite, este necesar ca, în general, pentru a obține cea mai bună vizibilitate și rezoluție posibile cu materiale prezentând o masă atomică relativ scăzută, să se utilizeze tensiuni de accelerare între 5-10 keV cu o dimensiune redusă a spotului și o distanță mică de lucru. Având în vedere că se realizează o traversare liniară, este necesar să se utilizeze o inclinare de 0o pentru a reduce la minimum refocalizarea sau, dacă MEB-ul prezintă o fază eucentrică, trebuie să se utilizeze distanța de lucru eucentrică. Un grosisment inferior poate fi utilizat dacă materialul nu conține fibre mici și dacă diametrele fibrelor sunt mari (> 5 μm).
1.5.3.4. Dimensionare
1.5.3.4.1. Examinare la un grosisment redus pentru a analiza eșantionul
Inițial, eșantionul trebuie examinat la un grosisment redus pentru a identifica existența unei aglutinări de fibre mari și pentru a determina densitatea fibrei. În cazul formării unei aglutinări excesive, se recomandă pregătirea unui nou eșantion.
Pentru a garanta acuratețea datelor statistice, este necesar să se măsoare un număr minim de fibre. O densitate mare a fibrelor poate părea de dorit, deoarece examinarea câmpurilor goale necesită timp și nu aduce nicio contribuție în ceea ce privește analiza. Cu toate acestea, dacă filtrul este supraîncărcat, măsurarea tuturor fibrelor măsurabile devine dificilă și, având în vedere că fibrele mici pot fi ascunse de altele mai mari, ele sunt susceptibile de a nu fi observate.
O densitate superioară a fibrelor, de 150 de fibre per milimetru de traversare liniară, poate antrena o supraestimare a LWGMD. Pe de altă parte, concentrațiile reduse de fibre vor duce la creșterea timpului necesar efectuării analizei. Este adesea mai eficient din punctul de vedere al costurilor să se pregătească un eșantion cu o densitate a fibrei apropiată de valoarea optimală, decât să se insiste în ceea ce privește numărarea filtrelor cu concentrații reduse. Densitatea optimă de fibre trebuie să ofere o medie de aproximativ una sau două fibre numărabile per câmpuri vizuale la un grosisment de 5 000. Cu toate acestea, densitatea optimă va depinde de dimensiunea (diametrul) fibrelor, fiind așadar necesar ca operatorul să se bazeze pe experiența acumulată atunci când decide dacă densitatea fibrei este sau nu aproape de valoarea optimă.
1.5.3.4.2. Ponderarea pe lungime a diametrelor fibrelor
Numai fibrele care ating (sau intersectează) o linie (infinit) subțire trasată pe ecranul MEB sunt numărate. Din acest motiv, trebuie să se traseze o linie orizontală (sau verticală) de-a lungul centrului ecranului.
De asemenea, este posibil să se fixeze un punct unic în centrul ecranului și să se procedeze la un baleiaj continuu într-o singură direcție de-a lungul filtrului. Diametrul fiecărei fibre, al cărei raport de aspect depășește 3:1 și care atinge sau intersectează acest punct, trebuie măsurat și înregistrat.
1.5.3.4.3. Dimensionarea fibrei
Se recomandă măsurarea a minimum 300 de fibre. Fiecare fibră este măsurată o singură dată la punctul de intersectare cu linia sau punctul trasat pe imagine (sau în apropierea punctului de intersectare, dacă marginile fibrei sunt ascunse). Dacă este vorba de fibre care prezintă secțiuni transversale neuniforme, trebuie să se recurgă la o măsurătoare reprezentând diametrul mediu al fibrei. Trebuie să se acorde o atenție deosebită definirii marginii și măsurării distanței celei mai scurte dintre marginile fibrei. Dimensionarea se poate realiza on-line sau off-line, utilizându-se imagini sau fotografii stocate. Se recomandă utilizarea sistemelor semiautomate de măsurare a imaginii, care descarcă datele direct pe o foaie de calcul, deoarece acestea permit să se câștige timp, duc la eliminarea erorilor de transcriere și la automatizarea calculelor.
Extremitățile fibrelor lungi trebuie verificate la un grosisment redus, pentru a garanta că acestea nu revin în câmpul vizual în care se efectuează măsurătoarea și că sunt măsurate o singură dată.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
În general, diametrele fibrelor nu au o distribuție normală. Cu toate acestea, prin efectuarea unei transformări log, este posibilă obținerea unei distribuții apropiate de cea normală.
Calculați media aritmetică (lnD mediu) și deviația standard (DSlnD) a logaritmului în raport cu valorile de bază (lnD) ale diametrelor celor n fibre (D).
|
|
(1) |
|
|
(2) |
Deviația standard se împarte la rădăcina pătrată a numărului de măsurători (n) pentru a obține eroarea standard (ESlnD).
|
|
(3) |
Scădeți de două ori eroarea standard din medie și calculați exponențiala acestei valori (media minus două erori standard) pentru a obține media geometrică minus două erori standard geometrice.
|
|
(4) |
3. RAPORTAREA
RAPORT DE TESTARE
Raportul de testare trebuie să includă cel puțin următoarele informații:
— Valoarea LWGMD-2ES.
— Toate deviațiile și, în special, cele care riscă să afecteze precizia sau acuratețea rezultatelor, precum și justificările pertinente.
4. REFERINȚE BIBLIOGRAFICE
1. B. Tylee SOP MF 240. Health and Safety Executive, February 1999.
2. G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive, Research and Laboratory Services Division, 1994.
PARTEA B: METODE DE DETERMINARE A TOXICITĂȚII ȘI A ALTOR EFECTE ASUPRA SĂNĂTĂȚII
|
CUPRINS |
|
|
INTRODUCERE GENERALĂ |
|
|
B.1 bis. |
TOXICITATE ORALĂ ACUTĂ – PROCEDURA CU DOZĂ FIXĂ |
|
B.1 tris. |
TOXICITATE ORALĂ ACUTĂ – METODA CLASEI DE TOXICITATE ACUTĂ |
|
B.2. |
TOXICITATEA ACUTĂ (ADMINISTRARE PRIN INHALARE) |
|
B.3. |
TOXICITATEA ACUTĂ (ADMINISTRARE CUTANATĂ) |
|
B.4. |
TOXICITATE ACUTĂ: IRITAȚIE/COROZIUNE DERMICĂ |
|
B.5. |
TOXICITATE ACUTĂ: IRITAȚIE/COROZIUNE OCULARĂ |
|
B.6. |
SENSIBILIZARE CUTANATĂ |
|
B.7. |
TOXICITATE (ORALĂ) PRIN ADMINISTRARE ÎN MOD REPETAT (28 DE ZILE) |
|
B.8. |
TOXICITATE LA DOZĂ REPETATĂ (28 DE ZILE) (ADMINISTRARE PRIN INHALARE) |
|
B.9. |
TOXICITATE LA DOZĂ REPETATĂ (28 DE ZILE) (ADMINISTRARE CUTANATĂ) |
|
B.10. |
MUTAGENITATEA –TESTUL IN VITRO DE ABERAȚIE CROMOZOMIALĂ PE CELULE DE MAMIFERE |
|
B.11. |
MUTAGENITATEA – TESTUL IN VIVO DE ABERAȚIE CROMOZOMIALĂ PE MĂDUVĂ OSOASĂ DE MAMIFERE |
|
B.12. |
MUTAGENITATEA – TESTUL IN VIVO DE MICRONUCLEU PE ERITROCITE DE MAMIFERE |
|
B.13/14. |
MUTAGENITATEA – TESTUL DE MUTAȚIE INVERSĂ PE BACTERII |
|
B.15 |
TESTE DE MUTAGENEZĂ ȘI DE DEPISTARE A CANCEROGENEZEI. MUTAȚIA GENICĂ – SACCHAROMYCES CEREVISIAE |
|
B.16 |
RECOMBINAREA MITOTICĂ – SACCHAROMYCES CEREVISIAE |
|
B.17. |
MUTAGENITATEA – TEST IN VITRO DE MUTAȚIE GENICĂ PE CELULE DE MAMIFERE |
|
B.18. |
ALTERAREA ȘI REPARAREA ADN-ului – SINTEZA NEPROGRAMATĂ A ADN (UDS – UNSCHEDULED DNA SYNTHESIS) – TEST IN VITRO PE CELULE DE MAMIFERE |
|
B.19. |
TEST IN VITRO DE SCHIMBARE A CROMATIDELOR SURORI (SCE) |
|
B.20. |
TEST DE LETALITATE RECESIVĂ ÎN RAPORT CU SEXUL LA DROSOPHILA MELANOGASTER (SLRL) |
|
B.21. |
TEST IN VITRO DE TRANSFORMARE A CELULELOR DE MAMIFERE |
|
B.22. |
TESTUL DE LETALITATE DOMINANTĂ LA ROZĂTOARE |
|
B.23. |
TEST DE ABERAȚIE CROMOZOMIALĂ PE SPERMATOGONII DE MAMIFERE |
|
B.24. |
TESTUL PETEI (SPOT TEST) LA ȘOARECI |
|
B.25. |
TRANSLOCAȚII EREDITARE LA ȘOARECI |
|
B.26. |
TESTUL DE TOXICITATE ORALĂ SUBCRONICĂ. STUDIU DE 90 DE ZILE DE TOXICITATE ORALĂ CU DOZĂ REPETATĂ LA ROZĂTOARE |
|
B.27. |
TESTUL DE TOXICITATE ORALĂ SUBCRONICĂ. STUDIU DE 90 DE ZILE DE TOXICITATE ORALĂ CU DOZĂ REPETATĂ LA NEROZĂTOARE |
|
B. 28 |
STUDIU DE TOXICITATE SUBCRONICĂ – ADMINISTRARE CUTANATĂ. EXPERIMENT EFECTUAT TIMP DE 90 DE ZILE ASUPRA UNOR ROZĂTOARE |
|
B.29 |
STUDIU DE TOXICITATE SUBCRONICĂ – ADMINISTRARE PRIN INHALARE. EXPERIMENT EFECTUAT TIMP DE 90 DE ZILE ASUPRA UNOR ROZĂTOARE |
|
B.30 |
STUDIU DE TOXICITATE CRONICĂ |
|
B.31. |
STUDIU DE TOXICITATE ASUPRA DEZVOLTĂRII INTRAUTERINE |
|
B.32 |
STUDIU DE CANCEROGENEZĂ |
|
B.33 |
STUDIU COMBINAT DE TOXICITATE CRONICĂ ȘI DE CANCEROGENEZĂ |
|
B.34. |
STUDIU DE TOXICITATE PRIVIND REPRODUCEREA LA O GENERAȚIE |
|
B.35. |
STUDIU DE TOXICITATE ASUPRA REPRODUCERII PE DURATA A DOUĂ GENERAȚII |
|
B.36. |
TOXICOCINETICA |
|
B.37. |
NEUROTOXICITATE ÎNTÂRZIATĂ A SUBSTANȚELOR ORGANOFOSFORICE DUPĂ EXPUNERE ACUTĂ |
|
B.38. |
NEUROTOXICITATE ÎNTÂRZIATĂ A SUBSTANȚELOR ORGANOFOSFORICE – STUDIU CU ADMINISTRARE ÎN MOD REPETAT PE O DURATĂ DE 28 DE ZILE |
|
B.39. |
TEST IN VIVO DE SINTEZĂ NEPROGRAMATĂ A ADN (UDS) PE CELULE HEPATICE DE MAMIFERE |
|
B.40. |
COROZIUNEA CUTANATĂ IN VITRO: TESTUL REZISTENȚEI ELECTRICE TRANSCUTANATE (RET) |
|
B.40 BIS. |
COROZIUNEA CUTANATĂ IN VITRO: TESTARE PE UN MODEL DE PIELE UMANĂ |
|
B.41. |
TESTUL DE FOTOTOXICITATE 3T3 NRU IN VITRO |
|
B.42. |
SENSIBILIZAREA DERMICĂ: TESTUL LOCAL PE GANGLIONII LIMFATICI |
|
B.43. |
STUDII DE NEUROTOXICITATE PE ROZĂTOARE |
|
B.44. |
ABSORBȚIA CUTANATĂ: METODA IN VIVO |
|
B.45. |
ABSORBȚIA CUTANATĂ: METODA DE TESTARE IN VITRO |
|
B.46. |
IRITAȚIA CUTANATĂ IN VITRO: TEST PE MODEL DE EPIDERMĂ UMANĂ RECONSTRUITĂ |
|
B.47. |
METODA DE TESTARE A OPACITĂȚII ȘI PERMEABILITĂȚII CORNEENE LA BOVINE PENTRU IDENTIFICAREA SUBSTANȚELOR AVÂND UN CARACTER COROZIV SAU UN POTENȚIAL IRITANT SEVER LA NIVEL OCULAR |
|
B.48. |
DE TESTARE A OCHIULUI IZOLAT DE PUI PENTRU IDENTIFICAREA SUBSTANȚELOR AVÂND UN CARACTER COROZIV ȘI UN POTENȚIAL IRITANT SEVER LA NIVEL OCULAR |
INTRODUCERE GENERALĂ
A. CARACTERIZAREA SUBSTANȚEI ANALIZATE
Înainte de începerea oricărui studiu de toxicitate, trebuie să fie cunoscute compoziția substanței, inclusiv principalele sale impurități, proprietățile sale fizice și chimice, între care și stabilitatea sa.
Proprietățile fizice și chimice ale substanței furnizează informații importante cu privire la alegerea căii de administrare, cu privire la conceperea unor studii, precum și cu privire la manipularea și stocarea substanței.
Dezvoltarea unei metode de analiză care să permită o evaluare calitativă și cantitativă a substanței testate (inclusiv a principalelor sale impurități, dacă este posibil), în vehiculul de administrare și în materialul biologic, trebuie să preceadă efectuarea studiului.
Toate informațiile privind identificarea, proprietățile fizice și chimice, puritatea și comportamentul substanței testate trebuie înregistrate în raportul de testare.
B. ÎNGRIJIREA ANIMALELOR
În cadrul testelor de toxicitate se va proceda în mod obligatoriu la controlarea condițiilor de mediu și se vor utiliza tehnici adecvate de îngrijire a animalelor.
(i) Condiții de adăpostire
Condițiile de mediu în spațiile sau incintele rezervate animalelor experimentale trebuie să fie adaptate speciei utilizate. La șobolani, la șoareci și la cobai temperatura ambiantă trebuie să fie de 22 ± 3 oC, iar umiditatea relativă trebuie să fie de 30-70 %; la iepuri, temperatura ambiantă trebuie să fie de 20 ± 3 oC, iar umiditatea relativă trebuie să fie de 30-70 %.
Unele tehnici de testare sunt deosebit de sensibile la efectele termice; în asemenea cazuri indicații exacte sunt menționate în descrierea metodei de testare, cu privire la condițiile adecvate. În toate testele de toxicitate, temperatura și umiditatea trebuie controlate și înregistrate și trebuie să figureze în raportul final al studiului.
Alternarea de 12 de ore de lumină și de 12 de ore de întuneric va fi asigurată de iluminarea artificială. Detaliile cu privire la iluminare trebuie să fie înregistrate în raportul final al studiului.
Dacă metoda adoptată nu prevede alte condiții, animalele trebuie să fie adăpostite individual sau în grupuri mici de același sex în cuști. În cazul cuștilor colective nu se poate depăși numărul de cinci animale.
Este important ca rapoartele testelor efectuate pe animale să precizeze tipul de cuști utilizate și numărul de animale pe cuști, în momentul expunerii la substanța chimică și pe toată perioada de observație care urmează după test.
(ii) Condiții de hrănire
Regimul alimentar trebuie să aibă în vedere toate necesitățile nutriționale ale speciei supuse testului. În cazul în care substanțele sunt administrate prin hrană, este posibil ca valoarea nutrițională a hranei să fie diminuată printr-o interacțiune dintre substanță și un ingredient al hranei. Această eventualitate trebuie luată în considerare în momentul interpretării rezultatelor testului. Regimurile alimentare clasice folosite în laboratoare sunt acceptabile, apa de băut trebuie furnizată în mod nelimitat. Alegerea regimului alimentar poate fi ghidată de necesitatea de a garanta o proporție adecvată de substanță în cazul alegerii acestei căi de administrare.
Substanțele contaminante din alimentație care au un efect asupra toxicității nu trebuie să fie prezente în concentrații susceptibile de a influența rezultatele.
C. METODE ALTERNATIVE
Unul dintre obiectivele Uniunii Europene este promovarea dezvoltării și validării unor metode alternative care să furnizeze aceeași cantitate de informații ca testele actuale efectuate pe animale, dar pentru care să se necesite un număr mai redus de animale, care să minimizeze suferințele animalelor și să permită evitarea sacrificării acestora.
Din momentul în care asemenea metode sunt disponibile, ele trebuie avute în vedere ori de câte ori este posibil, în vederea caracterizării riscurilor, în vederea clasificării și etichetării substanțelor în funcție de riscurile intrinseci.
D. EVALUAREA ȘI INTERPRETAREA
Extrapolarea directă la om a rezultatelor testelor efectuate asupra animalelor și a testelor in vitro nu este posibilă decât în anumite limite; acest lucru trebuie avut în vedere cu ocazia evaluării și interpretării rezultatelor testelor; pe de altă parte, atunci când au fost observate efecte nedorite la om, aceste informații pot fi folosite în vederea confirmării rezultatelor testelor.
E. REFERINȚE BIBLIOGRAFICE
Majoritatea metodelor prezentate mai sus sunt elaborate în cadrul programului OCDE cu privire la principiile de testare, și trebuie puse în aplicare în conformitate cu principiile de bună practică de laborator, astfel încât să se garanteze recunoașterea reciprocă a datelor.
Informații suplimentare pot fi obținute din referințele citate în cadrul principiilor de bază ale OCDE, precum și din bibliografia de specialitate.
B.1 bis. TOXICITATE ORALĂ ACUTĂ – PROCEDURA CU DOZĂ FIXĂ
1. METODĂ
Acest test este echivalent cu Orientarea 420 (2001) a OCDE.
1.1. INTRODUCERE
Metodele tradiționale de evaluare a toxicității acute utilizează ca punct final decesul animalelor. În 1984, British Toxicology Society a sugerat o nouă abordare pentru testarea toxicității acute, pe baza administrării unei serii de doze fixe (1). Această abordare evita uciderea animalelor ca punct final, bazându-se pe observarea unor semne clare de toxicitate la una dintre seriile de doze fixe. În urma unor studii de validare in vivo, britanice (2) și internaționale (3), procedura a fost adoptată ca metodă de testare în 1992. Ulterior, proprietățile statistice ale procedurii cu doză fixă au fost evaluate utilizând modele matematice într-o serie de studii (4) (5) (6). Împreună, studiile in vivo și cele de modelare au demonstrat că procedura este reproductibilă, utilizează mai puține animale și cauzează mai puțină suferință decât metodele tradiționale și poate fi utilizată pentru clasificarea substanțelor într-un mod similar cu celelalte metode de testare a toxicității acute.
Indicații pentru selectarea celei mai adecvate metode de testare pentru un anumit scop sunt prezentate în Liniile directoare privind testarea toxicității acute orale (7). Liniile directoare în cauză conțin, de asemenea, informații suplimentare privind aplicarea și interpretarea metodei de testare B.1 bis.
Ca un principiu al metodei, în studiul principal se utilizează exclusiv doze cu un nivel mediu de toxicitate și se evită administrarea dozelor care se estimează că sunt letale. De asemenea, nu este necesar să se administreze dozele despre care se știe că provoacă dureri și suferințe grave din cauza acțiunilor corozive și puternic iritante. Animalele muribunde sau cele care manifestă dureri evidente sau prezintă semne de suferință gravă și prelungită sunt eutanasiate și sunt luate în considerare la interpretarea rezultatelor la fel ca animalele care au murit în timpul testului. Criteriile pentru luarea deciziei de eutanasiere a animalelor muribunde sau suferinde și indicații pentru recunoașterea decesului previzibil sau iminent fac obiectul unor linii directoare separate (8).
Metoda furnizează informații privind proprietățile periculoase și permite clasificarea substanței în conformitate cu Sistemul global armonizat (SGA) de clasificare a substanțelor chimice care cauzează toxicitate acută (9).
Laboratorul care efectuează testul ia în considerare toate informațiile disponibile privind substanța de testat înainte de efectuarea studiului. Printre aceste informații se numără identitatea și structura chimică a substanței; proprietățile sale fizico-chimice; rezultatele oricăror alte teste de toxicitate in vitro sau in vivo asupra substanței; date toxicologice privind substanțele înrudite structural și utilizarea sau utilizările anticipate ale substanței. Aceste informații sunt necesare pentru a dovedi tuturor celor interesați că testul este relevant pentru protecția sănătății oamenilor și vor contribui la selectarea unei doze inițiale adecvate.
1.2. DEFINIȚII
Toxicitate orală acută: efectele adverse care intervin după administrarea orală a unei singure doze dintr-o substanță sau a mai multor doze în cursul a 24 de ore.
Deces întârziat: un animal nu moare și nu pare muribund în termen de 48 ore, dar moare în perioada de observație de 14 zile.
Doză: cantitatea administrată din substanța de testat. Doza se exprimă ca greutatea de substanță de testat per unitate de greutate a animalului de experiență (de exemplu mg/kg).
Toxicitate evidentă: termen general care descrie semne clare de toxicitate apărute după administrarea substanței de testat (a se vedea referința 3 pentru exemple), pe baza cărora se poate estima că următoarea doză fixă mai mare ar putea provoca dureri mari și semne persistente de suferință profundă, o stare muribundă [criteriile sunt prezentate în Humane Endpoints Guidance Document (8)] sau, probabil, decesul celor mai multe dintre animale.
SGA: Sistem global armonizat de clasificare a substanțelor și amestecurilor chimice. O activitate comună a OCDE (sănătatea oamenilor și mediul) a Comitetului de experți ONU pentru transportul bunurilor periculoase (proprietăți fizico-chimice) și a OIM (comunicarea pericolelor) și coordonată de Programul interorganizațional pentru buna gestionare a substanțelor chimice (IOMC).
Deces iminent: se așteaptă o stare muribundă sau decesul înainte de următorul moment de observare planificat. Printre semnele care indică această stare la rozătoare s-ar putea număra convulsii, poziție laterală, poziția culcată și tremurat [a se vedea Humane Endpoint Guidance Document (8) pentru mai multe detalii].
LD 50 (doza letală mediană): o singură doză de substanță, derivată statistic, care se poate estima că va cauza decesul a 50 % dintre animale dacă este administrată pe cale orală. Valoarea LD50 se exprimă în greutatea de substanță de testat pe unitate de greutate a animalului de experiență (mg/kg).
Doză-limită: o doză la limita superioară a testării (2 000 sau 5 000 mg/kg).
Stare muribundă: starea precedentă decesului sau incapacitatea de a supraviețui, chiar în cazul administrării unui tratament [a se vedea Humane Endpoint Guidance Document (8) pentru mai multe detalii].
Deces previzibil: prezența semnelor clinice care indică decesul într-un moment cunoscut din viitor, înainte de sfârșitul planificat al experimentului, ca de exemplu: incapacitatea de a ajunge la apă și mâncare [a se vedea Humane Endpoint Guidance Document (8) pentru mai multe detalii].
1.3. PRINCIPIUL METODEI DE TESTARE
Unor grupuri de animale de același sex li se administrează doze fixe de 5, 50, 300 și 2 000 mg/kg într-o procedură secvențială (în mod excepțional, poate fi luată în considerare o doză fixă suplimentară de 5 000 mg/kg, a se vedea punctul 1.6.2). Doza inițială se selectează pe baza unui studiu de observare pentru identificarea dozei care se presupune că produce unele semne de toxicitate fără a cauza efecte toxice grave sau decesul. Manifestările clinice și efectele asociate durerii, suferinței și decesului iminent sunt descrise detaliat într-un document de orientare OCDE (8). Altor grupuri de animale li se pot administra doze fixe mai mari sau mai mici, în funcție de prezența sau absența semnelor de toxicitate sau mortalitate. Această procedură continuă până la doza care provoacă toxicitate evidentă sau decesul unui singur animal, dacă nu se observă efecte la cea mai mare doză sau dacă decesul survine la cea mai mică doză.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Selectarea speciei de animale
Specia preferată de rozătoare este șobolanul, dar pot fi utilizate și alte specii de rozătoare. În mod normal, se utilizează femele (7). Acest lucru este motivat de faptul că studiile din literatură asupra testelor convenționale LD50 arată că, de obicei, diferențele de sensibilitate între sexe sunt mici, dar în cazurile în care se observă diferențe, femelele sunt, în general, puțin mai sensibile (10). Cu toate acestea, în cazul în care informațiile privind proprietățile toxicologice sau toxicocinetice ale unor substanțe chimice înrudite structural arată că este probabil ca masculii să fie mai sensibili, se utilizează acest sex. Dacă testul se efectuează pe masculi, se oferă justificări adecvate.
Se utilizează animale adulte, tinere, sănătoase provenind din liniile utilizate în mod obișnuit în laboratoare. Femelele trebuie să fie nulipare și să nu fie gestante. La începerea testului, fiecare animal trebuie să aibă între 8 și 12 săptămâni, iar greutatea sa trebuie să se situeze într-un interval de ± 20 % față de greutatea medie a animalelor testate anterior.
1.4.2. Condiții de adăpostire și hrănire
În spațiul pentru adăpostirea animalelor de experiență se asigură o temperatură de 22 oC (± 3 oC). Se asigură o umiditate relativă de 50-60 %, cu o valoare minimă de 30 % și o valoare maximă de 70 %, cu excepția momentelor în care se curăță spațiul. Spațiul se iluminează artificial, cu o alternanță de 12 ore lumină, 12 ore întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă. Animalele pot fi grupate în cuști în funcție de doză, dar numărul animalelor dintr-o cușcă nu trebuie să împiedice observarea corectă a fiecărui animal.
1.4.3. Pregătirea animalelor
Animalele sunt selectate la întâmplare, marcate pentru a permite identificarea individuală și ținute în cuștile lor cu cel puțin 5 zile înainte de începerea administrării dozelor, pentru a permite aclimatizarea lor la condițiile de laborator.
1.4.4. Pregătirea dozelor
În general, substanțele de testat se administrează într-un volum constant indiferent de dozele testate, variindu-se concentrația preparatului. În cazul testării unui produs sau amestec final lichid, utilizarea substanței de testat nediluate, și anume la o concentrație constantă, poate fi mai relevantă pentru evaluarea ulterioară a riscurilor substanței și este impusă de unele autorități de reglementare. În orice caz, nu trebuie depășit volumul dozei maxime de administrat. Volumul maxim de lichid care poate fi administrat o singură dată depinde de dimensiunea animalului de experiență. La rozătoare, volumul nu trebuie să depășească, în mod normal, 1 ml/100 g greutate corporală; cu toate acestea, în cazul soluțiilor apoase, pot fi administrați 2 ml/100 g greutate corporală. În ceea ce privește forma de preparare a dozei, se recomandă utilizarea, ori de câte ori este posibil, a unei soluții/suspensii/emulsii apoase, urmată, în ordinea preferinței, de o soluție/suspensie/emulsie în ulei (de exemplu, în ulei de porumb) și, eventual, soluții în alte vehicule. Pentru vehicule altele decât apa, este necesar să se cunoască caracteristicile toxicologice ale vehiculului. Dozele se prepară cu puțin timp înaintea administrării, cu excepția cazului în care stabilitatea preparatului în perioada în care urmează a fi utilizat este cunoscută și s-a demonstrat că este acceptabilă.
1.5. MOD DE LUCRU
1.5.1. Administrarea dozelor
Substanța de testat se administrează într-o singură doză, prin gavaj, utilizând o sondă gastrică sau o canulă de intubare adecvată. În cazurile deosebite în care nu este posibilă administrarea unei singure doze, doza poate fi administrată în fracțiuni mai mici pe parcursul unei perioade de maximum 24 de ore.
Animalele nu se hrănesc înainte de administrarea dozei (de exemplu, șobolanii nu trebuie să fie hrăniți peste noapte, dar pot primi apă; șoarecii nu trebuie să fie hrăniți, dar pot primi apă, cu 3-4 ore înainte). După perioada de flămânzire, animalele se cântăresc și se administrează substanța de testat. După administrarea substanței, animalele pot fi private din nou de hrană, 3-4 ore la șobolani și 1-2 ore la șoareci. Dacă doza se administrează fracționat într-o perioadă de timp, este posibil să fie necesar să li se ofere animalelor hrană și apă, în funcție de durata perioadei de administrare.
1.5.2. Studiu de observare
Scopul studiului de observare este de a permite selectarea dozei inițiale adecvate pentru studiul principal. Substanța de testat se administrează, într-o procedură secvențială, câte unui animal, conform diagramelor din apendicele 1. Studiul de observare este finalizat când se poate lua o decizie privind doza inițială pentru studiul principal (sau dacă survine decesul unui animal la cea mai mică doză fixă).
Doza inițială pentru studiul de observare se selectează dintre dozele fixe de 5, 50, 300 și 2 000 mg/kg ca doza care se așteaptă că provoace toxicitate evidentă, dacă este posibil, pe baza datelor obținute in vivo și in vitro pentru aceeași substanță chimică sau alte substanțe înrudite structural. În absența acestor informații, doza inițială va fi de 300 mg/kg.
Dozele se administrează la un interval de minimum 24 de ore pentru fiecare animal. Toate animalele trebuie observate cel puțin 14 zile.
În mod excepțional și doar dacă acest lucru este necesar pentru îndeplinirea unor cerințe specifice, poate fi administrată o doză suplimentară mai mare, de 5 000 mg/kg (a se vedea apendicele 3). Din motive justificate de bunăstarea animală, testarea pe animale a substanțelor din categoria 5 SGA (2 000-5 000 mg/kg) este descurajată și se ia în considerare doar în cazul în care este foarte probabil ca rezultatele acestor teste să fie direct relevante pentru protecția sănătății oamenilor, a sănătății animale sau a mediului.
În cazurile în care un animal căruia i s-a administrat doza fixă cea mai redusă (5 mg/kg) în cadrul studiului de observare moare, procedura normală este de a încheia studiul și de a încadra substanța în categoria 1 SGA (conform anexei 1). Cu toate acestea, dacă este necesară o confirmare suplimentară a clasificării, se poate aplica o procedură suplimentară opțională, descrisă în continuare. Se administrează o doză de 5 mg/kg unui alt animal. Dacă și al doilea animal moare, se confirmă categoria 1 SGA, iar studiul se încheie imediat. Dacă al doilea animal supraviețuiește, se administrează o doză de 5 mg/kg unui nou grup, de maximum 3 animale. Deoarece riscul de mortalitate este foarte ridicat, dozele vor fi administrate secvențial, pentru protecția bunăstării animale. Intervalul de timp între administrarea dozelor la fiecare animal trebuie să fie suficient pentru a stabili probabilitatea ca animalul anterior să supraviețuiască. Dacă survine decesul unui alt animal, secvența de administrare se încheie imediat, fără testarea pe alte animale. Deoarece decesul celui de-al doilea animal (indiferent de numărul de animale testate în momentul încheierii studiului) se încadrează în rezultatul A (2 sau mai multe decese), se aplică regula de clasificare din apendicele 2 la o doză fixă de 5 mg/kg (categoria 1, dacă survin două sau mai multe decese, sau categoria 2 dacă survine un singur deces). În plus, apendicele 4 ofertă indicații pentru clasificarea în sistemul UE, până la punerea în aplicare a noului SGA.
1.5.3. Studiul principal
1.5.3.1. Numărul de animale și nivelul dozelor
Acțiunile care se întreprind după administrarea dozei inițiale sunt indicate în diagramele din apendicele 2. Se adoptă unul dintre cele trei cursuri de acțiune: fie se oprește testarea și se atribuie clasa adecvată de clasificare a periculozității, fie se continuă testarea cu o doză fixă mai mare sau cu o doză fixă mai mică. Cu toate acestea, pentru a proteja animalele, o doză care a cauzat decesul animalelor în studiul de observare nu va fi reutilizată în studiul principal (a se vedea apendicele 2). Experiența a demonstrat că, cel mai probabil, după administrarea dozei inițiale, substanța va putea fi clasificată și nu vor fi necesare teste suplimentare.
În mod normal, se utilizează un număr total de cinci animale de același sex pentru fiecare nivel investigat al dozei. Grupul de cinci animale va fi format dintr-un animal căruia i s-a administrat doza selectată în studiul de orientare și alte patru animale (cu excepția cazului excepțional în care nivelul dozei utilizat în studiul principal nu a fost inclus în studiul de orientare).
Intervalul de timp dintre administrarea dozelor de la fiecare nivel la fiecare animal se determină în funcție de momentul declanșării, durata și severitatea semnelor de toxicitate. Administrarea următoarei doze se amână până când există certitudinea că animalele testate anterior vor supraviețui. Se recomandă un interval de 3 sau 4 zile între administrarea fiecărui nivel, pentru a permite observarea toxicității întârziate. Intervalul de timp poate fi adaptat după caz, de exemplu în cazul unor rezultate neconcludente.
Dacă se ia în considerare utilizarea dozei fixe maxime de 5 000 mg/kg, se aplică procedura prevăzută în apendicele 3 (a se vedea, de asemenea, punctul 1.6.2).
1.5.3.2. Testul-limită
Testul-limită se utilizează în special în situațiile în care experimentatorul are informații care arată că este posibil ca materialul testat să nu fie toxic, având o toxicitate puțin peste dozele-limită reglementate. Informațiile privind toxicitatea materialului de testat pot fi deduse din cunoștințele despre compuși, amestecuri și produse similare testate, ținând seama de identitatea și procentajul componentelor cunoscute ca fiind semnificative din punct de vedere toxicologic. În situațiile în care nu există sau există puține informații privind toxicitatea materialului sau în care se estimează că materialul de testat este toxic, se efectuează testul principal.
Urmând procedura normală, un studiu de observare cu o doză inițială de 2 000 mg/kg (sau, în cazuri excepționale, 5 000 mg/kg), urmat de administrarea aceleași doze altor patru animale, constituie testul-limită conform acestei linii directoare.
1.6. OBSERVAȚII
Animalele sunt observate individual după administrarea dozelor, cel puțin o dată în primele 30 de minute, periodic în primele 24 de ore, acordându-li-se o atenție specială în primele 4 ore, și, ulterior, zilnic, timp de 14 zile, cu excepția cazului în care trebuie excluse din studiu și eutanasiate din motive de bunăstare animală sau sunt găsite moarte. Cu toate acestea, perioada de observație nu se stabilește rigid. Ea se determină în funcție de reacțiile toxice și momentul declanșării acestora și de durata perioadei de recuperare și, prin urmare, poate fi prelungită, dacă este necesar. Momentele în care semnele de toxicitate apar și dispar sunt importante, în special în cazurile în care semnele de toxicitate au tendința de a apărea cu întârziere (11). Toate observațiile se înregistrează sistematic, întocmindu-se fișe individuale pentru fiecare animal.
Vor fi necesare observații suplimentare în cazul în care animalele manifestă în continuare semne de toxicitate. Observațiile vizează modificările pielii și blănii, ochilor și membranelor mucoaselor, modificările activității sistemului respirator, sistemului circulator, sistemului nervos central și vegetativ și ale activității somato-motorii și modificările de comportament. Se va acorda o atenție specială observării tremuratului, convulsiilor, salivării, diareii, letargiei, somnului și comei. Se iau în considerare principiile și criteriile rezumate în Humane Endpoints Guidance Document (8). Animalele găsite în stare muribundă și animalele care manifestă dureri mari și semne prelungite de suferință profundă sunt eutanasiate. În cazul în care animalele sunt eutanasiate sau sunt găsite moarte, momentul morții se înregistrează cât mai exact posibil.
1.6.1. Greutatea corporală
Animalele se cântăresc puțin înainte de administrarea substanței de testat și, ulterior, cel puțin o dată pe săptămână. Se calculează și se înregistrează variațiile de greutate. La sfârșitul testului, animalele care au supraviețuit sunt cântărite și apoi eutanasiate.
1.6.2. Patologie
Toate animalele participante la test (inclusiv cele care mor în cursul testului sau sunt eliminate din studiu din motive de bunăstare animală) sunt supuse unei autopsii macroscopice. Se înregistrează toate modificările patologice majore intervenite la fiecare animal. Se poate efectua, de asemenea, o examinare microscopică a organelor care prezintă semne de modificări patologice majore la animalele care au supraviețuit cel puțin 24 de ore de la administrarea dozei inițiale, întrucât ar putea furniza informații utile.
2. DATE
Se furnizează date individuale despre animale. În plus, se face un rezumat tabelar al tuturor datelor, prezentând pentru fiecare grup testat, numărul de animale utilizate, numărul de animale care au prezentat semne de toxicitate, numărul de animale găsite moarte în cursul testului sau eutanasiate, ora decesului pentru fiecare animal, o descriere, evoluția în timp și reversibilitatea efectelor toxice și constatările autopsiei.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare include următoarele informații, după caz:
Substanța de testat:
— natura fizică, puritate și, dacă este cazul, proprietăți fizico-chimice (inclusiv izomerizare);
— date de identificare, inclusiv numărul CAS.
Vehicul (dacă este cazul):
— justificarea alegerii vehiculului, dacă este altul decât apa.
Animalele de experiență:
— specie/sușă utilizată;
— starea microbiologică a animalelor, dacă se cunoaște;
— numărul, vârsta și sexul animalelor (inclusiv, dacă este cazul, o justificare pentru utilizarea de masculi în locul femelelor);
— sursă, condiții de adăpostire, hrănire etc.;
Condiții de testare:
— detalii privind prepararea substanței de testat, inclusiv detalii privind forma fizică a materialului administrat;
— detalii privind administrarea substanței de testat, inclusiv volumul dozelor și durata administrării;
— detalii privind calitatea hranei și a apei (inclusiv tipul/sursa hranei, sursa apei);
— o justificare pentru selectarea dozei inițiale.
Rezultate:
— un tabel cu datele privind reacția și nivelul dozei la fiecare animal (animale care prezintă semne de toxicitate, inclusiv mortalitatea, natura, gravitatea și durata efectelor);
— un tabel cu greutatea corporală și variațiile acesteia;
— greutatea fiecărui animal în ziua administrării dozei, la intervale săptămânale ulterior și în momentul morții sau al eutanasierii;
— data și ora morții, dacă a survenit înainte de momentul planificat pentru sacrificare;
— graficul declanșării semnelor de toxicitate și reversibilitatea acestora pentru fiecare animal;
— concluziile autopsiei și concluziile examenului histopatologic pentru fiecare animal, dacă sunt disponibile.
Discutarea și interpretarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, p. 85-92.
2. Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 6, p. 279-291.
3. Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, p. 469-482.
4. Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, p. 313-324.
5. Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol.
6. Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, p. 183-196.
7. OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
8. OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment N. 19.
9. OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
10. Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, p. 223-231.
11. Chan P.K and A.W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology. 3 rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA.
APENDICELE 1
DIAGRAMA PENTRU STUDIUL DE OBSERVARE


APENDICELE 2
DIAGRAMA PENTRU STUDIUL PRINCIPAL


APENDICELE 3
CRITERIILE PENTRU CLASIFICAREA SUBSTANȚELOR DE TESTAT CU VALORI ESTIMATE ALE LD50 DE PESTE 2 000 MG/KG FĂRĂ A FI NECESARĂ TESTAREA
Criteriile pentru categoria de periculozitate 5 au ca scop să permită identificarea substanțelor de testat care prezintă un pericol relativ scăzut de toxicitate acută, dar care, în anumite circumstanțe, pot prezenta pericole pentru populațiile vulnerabile. Se anticipează că aceste substanțe au o LD50 orală și dermică între 2 000 și 5 000 mg/kg sau doze echivalente pentru alte căi de administrare. Substanța de testat se clasifică în categoria de periculozitate definită prin: 2 000 mg/kg < LD50 < 5 000 mg/kg (categoria 5 din SGA) în următoarele cazuri:
(a) dacă este încadrată în această categorie de oricare dintre diagramele de testare din apendicele 2, pe baza incidenței deceselor;
(b) dacă sunt deja disponibile date fiabile care arată că LD50 se situează în limitele categoriei 5 sau alte studii pe animale sau privind efectele toxice asupra oamenilor indică o problemă acută pentru sănătatea oamenilor;
(c) prin extrapolare, estimare sau măsurarea de date, dacă nu se justifică clasificarea într-o clasă de periculozitate mai mare; și
— sunt disponibile informații fiabile privind efecte toxice semnificative asupra oamenilor; sau
— se observă decese la testarea până la valorile din categoria 4 pe cale orală; sau
— dacă concluziile unor experți confirmă semne clinice semnificative de toxicitate, la testarea până la valorile din categoria 4, cu excepția diareii, piloerecției sau a aspectului neîngrijit; sau
— dacă concluziile experților confirmă informații fiabile care indică potențiale efecte acute semnificative conform altor studii asupra animalelor.
TESTAREA CU DOZE PESTE 2 000 MG/KG
În mod excepțional și exclusiv în cazurile în care este justificată pentru îndeplinirea unor cerințe specifice, poate fi luată în considerare utilizarea unei doze fixe mai mari, de 5 000 mg/kg. Recunoscând necesitatea de a proteja bunăstarea animală, testarea cu 5 000 mg/kg este descurajată și se ia în considerare doar în cazul în care este foarte probabil ca rezultatele acestor teste să fie direct relevante pentru protecția sănătății animale sau a sănătății oamenilor (9).
Studiul de observare
Regulile de luare a deciziilor pentru procedura secvențială prezentată în apendicele 1 sunt extinse pentru a include doza de 5 000 mg/kg. Astfel, dacă într-un studiu de observare se utilizează o doză inițială de 5 000 mg/kg, rezultatul A (deces) impune testarea unui alt animal la 2 000 mg/kg; rezultatele B și C (toxicitate evidentă sau fără semne de toxicitate) permit selectarea dozei de 5 000 mg/kg ca doză inițială pentru studiul principal. În mod similar, dacă se folosește o altă doză decât 5 000 mg/kg, testarea va avansa la 5 000 mg/kg în cazul în care se obțin rezultatele B sau C la 2 000 mg/kg: un rezultat ulterior A, la o doză de 5 000 mg/kg, va impune o doză inițială pentru studiul principal de 2 000 mg/kg, iar rezultatele B și C vor impune o doză inițială pentru studiul principal de 5 000 mg/kg.
Studiul principal
Regulile de luare a deciziilor pentru procedura secvențială prezentată în apendicele 2 sunt extinse pentru a include doza de 5 000 mg/kg. Astfel, dacă doza inițială pentru studiul principal este de 5 000 mg/kg, rezultatul A (≥ 2 decese) va impune testarea unui al doilea grup la 2 000 mg/kg; rezultatul B (toxicitate evidentă și/sau ≤ 1 deces) sau C (fără semne de toxicitate) va conduce la neclasificarea conform SGA. În mod similar, dacă se utilizează o doză inițială alta decât cea de 5 000 mg/kg, testarea continuă cu 5 000 mg/kg în cazul obținerii rezultatului C la 2 000 mg/kg; un rezultat ulterior A, la doza de 5 000 mg/kg, va conduce la clasificarea substanței în categoria 5 SGA, iar rezultatele B sau C vor conduce la neclasificarea substanței.
APENDICELE 4
METODA DE TESTARE B.1 bis
Linii directoare pentru clasificarea conform schemei UE pentru perioada de tranziție până la punerea completă în aplicare a Sistemului global armonizat de clasificare (SGA) (preluate din referința 8)
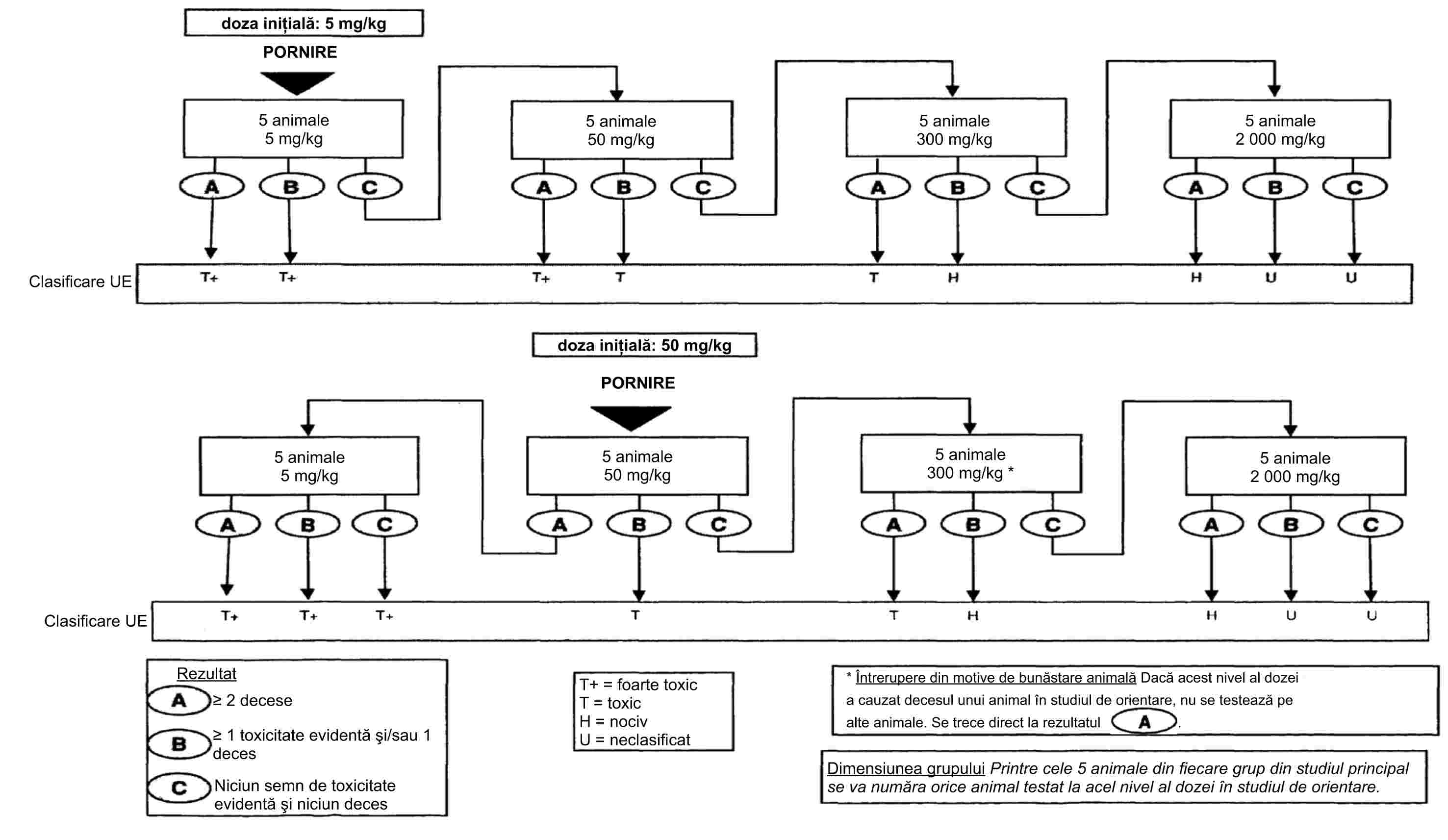

B.1 tris. TOXICITATE ORALĂ ACUTĂ – METODA CLASEI DE TOXICITATE ACUTĂ
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 423 (2001) a OCDE.
1.1. INTRODUCERE
Metoda clasei de toxicitate acută (1) prezentată în acest test este o procedură secvențială care utilizează 3 animale de același sex într-o etapă. În funcție de mortalitatea și/sau starea muribundă a animalelor, pot fi necesare, în medie, 2-4 etape pentru a permite determinarea toxicității acute a substanței de testat. Această procedură este reproductibilă, utilizează foarte puține animale și permite clasificarea substanțelor într-un mod similar cu celelalte metode de testare a toxicității acute. Metoda clasei de toxicitate acută se bazează pe evaluări biometrice (2) (3) (4) (5) cu doze fixe, separate adecvat pentru a permite clasificarea unei substanțe pentru includerea în diverse categorii și evaluarea riscurilor. Metoda, adoptată în 1996, a fost validată intens in vivo comparativ cu datele LD50 obținute din literatură, atât la nivel național (6), cât și la nivel internațional (7).
Pentru indicații privind selectarea celei mai adecvate metode de testare pentru un anumit scop, consultați Guidance Document on Acute Oral Toxicity Testing (8). Acest document conține, de asemenea, informații suplimentare pentru aplicarea și interpretarea metodei de testare B.1 tris.
Nu este necesar să se administreze substanțele de testat la doze despre care se știe că provoacă dureri mari și suferințe profunde din cauza acțiunilor corozive și pronunțat iritante. Animalele muribunde sau cele care manifestă dureri evidente sau prezintă semne de suferință gravă și prelungită sunt eutanasiate și sunt luate în considerare la interpretarea rezultatelor la fel ca animalele care au murit în timpul testului. Criteriile pentru luarea deciziei de eutanasiere a animalelor muribunde sau suferinde și indicații pentru recunoașterea decesului previzibil sau iminent fac obiectul unor linii directoare separate (9).
Metoda utilizează doze predefinite, iar rezultatele permit clasarea și clasificarea unei substanței în conformitate cu Sistemul global armonizat de clasificare a substanțelor chimice care provoacă toxicitate acută (10).
În principiu, această metodă nu are ca scop să permită calcularea unei valori exacte a LD50, dar permite determinarea nivelurilor definite de expunere letale, deoarece decesul unei proporții dintre animale rămâne principalul punct final al acestui test. Metoda permite determinarea unei valori a LD50 doar dacă cel puțin două doze determină o mortalitate peste 0 %, dar mai mică decât 100 %. Utilizarea unor doze predefinite, indiferent de substanța de testat, și faptul că clasificarea se face explicit în funcție de numărul de animale observate în diverse stări favorizează consecvența și repetabilitatea datelor prezentate de diverse laboratoare.
Laboratorul care efectuează testul ia în considerare toate informațiile disponibile privind substanța de testat înainte de efectuarea studiului. Printre aceste informații se numără identitatea și structura chimică a substanței; proprietățile sale fizico-chimice; rezultatele oricăror alte teste de toxicitate in vitro sau in vivo asupra substanței; date toxicologice privind substanțele înrudite structural și utilizarea (utilizările) anticipată (anticipate) a(le) substanței. Aceste informații sunt necesare pentru a dovedi tuturor celor interesați că testul este relevant pentru protecția sănătății oamenilor și va contribui la selectarea unei doze inițiale adecvate.
1.2. DEFINIȚII
Toxicitate orală acută: se referă la efectele adverse care intervin după administrarea orală a unei singure doze dintr-o substanță sau a mai multor doze în cursul a 24 de ore.
Deces întârziat: înseamnă că un animal nu moare și nu pare muribund în termen de 48 ore, dar moare în perioada de observație de 14 zile.
Doză: este cantitatea administrată din substanța de testat. Doza se exprimă ca greutatea de substanță de testat per unitate de greutate a animalului de experiență (de exemplu: mg/kg).
SGA: Sistemul global armonizat de clasificare a substanțelor și amestecurilor chimice. O activitate comună a OCDE (sănătatea oamenilor și mediul), a Comitetului de experți ONU pentru transportul bunurilor periculoase (proprietăți fizico-chimice) și a OIM (comunicarea pericolelor) și coordonată de Programul interorganizațional pentru buna gestionare a substanțelor chimice (IOMC).
Deces iminent: când se așteaptă o stare muribundă sau decesul înainte de următorul moment de observare planificat. Printre semnele care indică această stare la rozătoare s-ar putea număra convulsii, poziție laterală, poziția culcată și tremurat [a se vedea Humane Endpoint Guidance Document (9) pentru mai multe detalii].
LD 50 (doza letală mediană): este o singură doză de substanță, derivată statistic, care se poate estima că va cauza decesul a 50 % dintre animale dacă este administrată pe cale orală. Valoarea LD50 se exprimă în greutatea de substanță de testat per unitate de greutate a animalului de experiență (mg/kg).
Doză-limită: se referă la o doză la limita superioară a testării (2 000 sau 5 000 mg/kg).
Stare muribundă: starea precedentă decesului sau incapacitatea de a supraviețui, chiar în cazul administrării unui tratament [a se vedea Humane Endpoint Guidance Document (9) pentru mai multe detalii].
Deces previzibil: prezența semnelor clinice care indică decesul într-un moment cunoscut din viitor, înainte de sfârșitul planificat al experimentului, ca de exemplu: incapacitatea de a ajunge la apă și mâncare [a se vedea Humane Endpoint Guidance Document (9) pentru mai multe detalii].
1.3. PRINCIPIUL TESTULUI
Principiul acestui test este că, prin aplicarea unei proceduri secvențiale, cu utilizarea unui număr minim de animale în fiecare etapă, se obțin informații suficiente privind toxicitatea acută a substanței de testat pentru a permite clasificarea acesteia. Substanța se administrează oral unui grup de animale de experiență, la una dintre dozele definite. Substanța se testează conform unei proceduri secvențiale, în fiecare etapă utilizându-se trei animale de același sex (de obicei, femele). Absența sau prezența mortalității cauzate de substanța de testat la animalele testate într-o etapă determină etapa următoare, astfel;
— nu sunt necesare alte teste;
— administrarea aceleiași doze altor trei animale;
— administrarea următoarei doze mai mari sau mai mici altor trei animale.
Detaliile procedurii de testare sunt prezentate în apendicele 1. Metoda permite adoptarea unei concluzii privind clasificarea substanței de testat într-una dintre clasele de toxicitate delimitate de valori prestabilite ale LD50.
1.4. DESCRIEREA METODEI
1.4.1. Selectarea speciei de animale
Specia preferată de rozătoare este șobolanul, dar pot fi utilizate și alte specii de rozătoare. În mod normal, se utilizează femele (9). Acest lucru este motivat de faptul că studiile din literatură asupra testelor convenționale LD50 arată că, deși diferențele de sensibilitate între sexe sunt mici, în cazurile în care se observă diferențe, femelele sunt, în general, puțin mai sensibile (11). Cu toate acestea, în cazul în care informațiile privind proprietățile toxicologice sau toxicocinetice ale unor substanțe chimice înrudite structural arată că este probabil ca masculii să fie mai sensibili, se utilizează acest sex. Dacă testul se efectuează pe masculi, se oferă justificări adecvate.
Se utilizează animale adulte, tinere, sănătoase provenind din liniile utilizate în mod obișnuit în laboratoare. Femelele trebuie să fie nulipare și să nu fie gestante. La începerea testului, fiecare animal trebuie să aibă între 8 și 12 săptămâni, iar greutatea sa trebuie să se situeze într-un interval de ± 20 % față de greutatea medie a animalelor testate anterior.
1.4.2. Condiții de adăpostire și hrănire
În spațiul pentru adăpostirea animalelor de experiență se asigură o temperatură de 22 oC (± 3 oC). Se asigură o umiditate relativă de 50-60 %, cu o valoare minimă de 30 % și o valoare maximă de 70 %, cu excepția momentelor în care se curăță spațiul. Spațiul se iluminează artificial, cu o alternanță de 12 ore lumină, 12 ore întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă. Animalele pot fi grupate în cuști în funcție de doză, dar numărul animalelor dintr-o cușcă nu trebuie să împiedice observarea corectă a fiecărui animal.
1.4.3. Pregătirea animalelor
Animalele sunt selectate la întâmplare, marcate pentru a permite identificarea individuală și ținute în cuștile lor cu cel puțin 5 zile înainte de începerea administrării dozelor, pentru a permite aclimatizarea lor la condițiile de laborator.
1.4.4. Pregătirea dozelor
În general, substanțele de testat se administrează într-un volum constant indiferent de dozele testate, variind concentrația preparatului. În cazul testării unui produs sau amestec final lichid, utilizarea substanței de testat nediluate, și anume la o concentrație constantă, poate fi mai relevantă pentru evaluarea ulterioară a riscurilor substanței și este impusă de unele autorități de reglementare. În orice caz, nu trebuie depășit volumul dozei maxime de administrat. Volumul maxim de lichid care poate fi administrat o singură dată depinde de dimensiunea animalului de experiență. La rozătoare, volumul nu trebuie să depășească, în mod normal, 1 ml/100 g greutate corporală; cu toate acestea, în cazul soluțiilor apoase, pot fi administrați 2 ml/100 g greutate corporală. În ceea ce privește forma de preparare a dozei, se recomandă utilizarea, ori de câte ori este posibil, a unei soluții/suspensii/emulsii apoase, urmată, în ordinea preferinței, de o soluție/suspensie/emulsie în ulei (de exemplu, în ulei de porumb) și, eventual, soluții în alte vehicule. Pentru vehicule altele decât apa, este necesar să se cunoască caracteristicile toxicologice ale vehiculului. Dozele se prepară cu puțin timp înaintea administrării, cu excepția cazului în care stabilitatea preparatului în perioada în care urmează a fi utilizat este cunoscută și s-a demonstrat că este acceptabilă.
1.5. MOD DE LUCRU
1.5.1. Administrarea dozelor
Substanța de testat se administrează într-o singură doză, prin gavaj, utilizând o sondă gastrică sau o canulă de intubare adecvată. În cazurile deosebite în care nu este posibilă administrarea unei singure doze, doza poate fi administrată în fracțiuni mai mici pe parcursul unei perioade de maximum 24 de ore.
Animalele nu se hrănesc înainte de administrarea dozei (de exemplu, șobolanii nu trebuie să fie hrăniți peste noapte, dar pot primi apă; șoarecii nu trebuie să fie hrăniți, dar pot primi apă, cu 3-4 ore înainte). După perioada de flămânzire, animalele se cântăresc și li se administrează substanța de testat. După administrarea substanței, animalele pot fi private din nou de hrană, 3-4 ore la șobolani și 1-2 ore la șoareci. Dacă doza se administrează fracționat într-o perioadă de timp, este posibil să fie necesar să li se ofere animalelor hrană și apă, în funcție de durata perioadei de administrare.
1.5.2. Numărul de animale și nivelul dozelor
În fiecare etapă se utilizează trei animale. Nivelul dozei utilizate ca doză inițială se selectează din cele patru doze fixe: 5, 50, 300 și 2 000 mg/kg greutate corporală. Se alege nivelul dozei inițiale cu cea mai mare probabilitate de a produce decesul unora dintre animalele cărora li se administrează. Diagramele din apendicele 1 descriu procedura de urmat pentru fiecare doză inițială. În plus, apendicele 4 prezintă indicații pentru clasificarea în sistemul UE până la punerea în aplicare a noului SGA.
Dacă informațiile disponibile sugerează că este puțin probabil ca cel mai ridicat nivel al dozei inițiale (2 000 mg/kg greutate corporală) să provoace decese, se efectuează testul-limită. Dacă nu există informații privind substanța de testat, din motive de bunăstare animală, se recomandă utilizarea dozei inițiale de 300 mg/kg greutate corporală.
Intervalul de timp dintre administrarea dozelor diverselor grupuri se determină în funcție de momentul declanșării, durata și severitatea semnelor de toxicitate. Administrarea următoarei doze se amână până când există certitudinea că animalele testate anterior vor supraviețui.
În mod excepțional și doar dacă acest lucru este necesar pentru îndeplinirea unor cerințe specifice, poate fi luată în considerare o doză suplimentară mai mare, de 5 000 mg/kg greutate corporală (a se vedea apendicele 2). Din motive de bunăstare animală, testarea pe animale a substanțelor din categoria 5 SGA (2 000-5 000 mg/kg) este descurajată și se ia în considerare doar în cazul în care este foarte probabil că rezultatele acestor teste vor fi direct relevante pentru protecția sănătății oamenilor, a sănătății animale sau a mediului.
1.5.3. Testul-limită
Testul-limită se utilizează în special în situațiile în care experimentatorul are informații care arată că este posibil ca materialul de testat să nu fie toxic, având o toxicitate puțin peste dozele-limită reglementate. Informațiile privind toxicitatea materialului de testat pot fi deduse din cunoștințele despre compuși, amestecuri și produse similare testate, ținând seama de identitatea și procentajul componentelor cunoscute ca fiind semnificative din punct de vedere toxicologic. În situațiile în care nu există sau există puține informații privind toxicitatea materialului sau în care se estimează că materialul de testat este toxic, se efectuează testul principal.
Se poate efectua un test-limită cu o doză de 2 000 mg/kg greutate corporală pe șase animale (trei animale în fiecare etapă). În mod excepțional, se poate efectua un test-limită cu o doză de 5 000 mg/kg cu trei animale (a se vedea apendicele 2). Dacă intervin decese cauzate de substanța de testat, se poate dovedi necesară efectuarea de teste la următorul nivel inferior.
1.6. OBSERVAȚII
Animalele sunt observate individual după administrarea dozelor, cel puțin o dată în primele 30 de minute, periodic în primele 24 de ore, acordându-li-se o atenție specială în primele 4 ore, și, ulterior, zilnic, timp de 14 zile, cu excepția cazului în care trebuie excluse din studiu și eutanasiate din motive de bunăstare animală sau sunt găsite moarte. Cu toate acestea, perioada de observație nu se stabilește rigid. Ea se determină în funcție de reacțiile toxice și momentul declanșării acestora și de durata perioadei de recuperare și, prin urmare, poate fi prelungită, dacă este necesar. Momentele în care semnele de toxicitate apar și dispar sunt importante, în special în cazurile în care semnele de toxicitate au tendința de a apărea cu întârziere (12). Toate observațiile se înregistrează sistematic, întocmindu-se fișe individuale pentru fiecare animal.
Vor fi necesare observații suplimentare în cazul în care animalele manifestă în continuare semne de toxicitate. Observațiile vizează modificările pielii și blănii, ochilor și membranelor mucoaselor, modificările activității sistemului respirator, sistemului circulator, sistemului nervos central și vegetativ și ale activității somato-motorii și modificările de comportament. Se va acorda o atenție specială observării tremuratului, convulsiilor, salivării, diareii, letargiei, somnului și comei. Se iau în considerare principiile și criteriile rezumate în Humane Endpoints Guidance Document (9). Animalele găsite în stare muribundă și animalele care manifestă dureri mari și semne prelungite de suferință profundă sunt eutanasiate. În cazul în care animalele sunt eutanasiate sau sunt găsite moarte, momentul morții se înregistrează cât mai exact posibil.
1.6.1. Greutatea corporală
Animalele se cântăresc individual puțin înainte de administrarea substanței de testat și, ulterior, cel puțin o dată pe săptămână. Se calculează și se înregistrează variațiile de greutate. La sfârșitul testului, animalele care au supraviețuit sunt cântărite și apoi eutanasiate.
1.6.2. Patologie
Toate animalele participante la test (inclusiv cele care mor în cursul testului sau sunt eliminate din studiu din motive de bunăstare animală) sunt supuse unei autopsii macroscopice. Se înregistrează toate modificările patologice majore intervenite la fiecare animal. Se poate efectua, de asemenea, o examinare microscopică a organelor care prezintă semne de modificări patologice majore la animalele care au supraviețuit cel puțin 24 de ore, întrucât ar putea furniza informații utile.
2. DATE
Se furnizează date individuale despre animale. În plus, se face un rezumat tabelar al tuturor datelor, prezentând pentru fiecare grup testat numărul de animale utilizate, numărul de animale care au prezentat semne de toxicitate, numărul de animale găsite moarte în cursul testului sau eutanasiate, ora decesului pentru fiecare animal, o descriere, evoluția în timp și reversibilitatea efectelor toxice și constatările autopsiei.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare include următoarele informații, după caz:
Substanța de testat:
— natura fizică, puritate și, dacă este cazul, proprietăți fizico-chimice (inclusiv izomerizare);
— date de identificare, inclusiv numărul CAS.
Vehicul (dacă este cazul):
— justificarea alegerii vehiculului, dacă este altul decât apa.
Animalele de experiență:
— specie/sușă utilizată;
— starea microbiologică a animalelor, dacă se cunoaște;
— numărul, vârsta și sexul animalelor (inclusiv, dacă este cazul, o justificare pentru utilizarea de masculi în locul femelelor);
— sursă, condiții de adăpostire, hrănire etc.;
Condiții de testare:
— detalii privind prepararea substanței de testat, inclusiv detalii privind forma fizică a materialului administrat;
— detalii privind administrarea substanței de testat, inclusiv volumul dozelor și durata administrării;
— detalii privind calitatea hranei și a apei (inclusiv tipul/sursa hranei, sursa apei);
— o justificare pentru selectarea dozei inițiale.
Rezultate:
— un tabel cu datele privind reacția și nivelul dozei la fiecare animal (animale care prezintă semne de toxicitate, inclusiv mortalitate, natura, gravitatea și durata efectelor);
— un tabel cu greutatea corporală și variațiile acesteia;
— greutatea fiecărui animal în ziua administrării dozei, la intervale săptămânale ulterior și în momentul morții sau al sacrificării;
— data și ora morții, dacă a survenit înainte de momentul planificat pentru sacrificare;
— graficul declanșării semnelor de toxicitate și reversibilitatea acestora pentru fiecare animal;
— concluziile autopsiei și concluziile examenului histopatologic pentru fiecare animal, dacă sunt disponibile.
Discutarea și interpretarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86
2. Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336-341.
3. Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559-610
4. Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734.
5. Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129-134
6. Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic- Class Method – An Alternative to the LD50 Test. Arch. Toxicol. 66, 455-470.
7. Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659-670.
8. OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
9. OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
10. OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
11. Lipnick R L, Cotruvo, J. A., Hill R. N., Bruce R. D., Stitzel K. A., Walker A. P., Chu I; Goddard M., Segal L., Springer J. A. and Myers R. C. (1995), Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223-231.
12. Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA.
ANEXA 1
PROCEDURA DE URMAT PENTRU FIECARE DOZĂ INIȚIALĂ
OBSERVAȚII GENERALE
Pentru fiecare doză inițială, trebuie urmate diferitele scheme de testare, în conformitate cu cele prezentate în prezentul apendice.
— Apendicele 1a: doza inițială este de 5 mg/kg de greutate corporală
— Apendicele 1b: doza inițială este de 50 mg/kg de greutate corporală
— Apendicele 1c: doza inițială este de 300 mg/kg de greutate corporală
— Apendicele 1d: doza inițială este de 2 000 mg/kg de greutate corporală
În funcție de numărul de animale moarte sau eutanasiate, procedura de testare de urmat este indicată prin săgeți.
APENDICELE 1A
PROCEDURA DE TESTARE CU O DOZĂ INIȚIALĂ DE 5 MG/KG GREUTATE CORPORALĂ

APENDICELE 1B
PROCEDURA DE TESTARE CU O DOZĂ INIȚIALĂ DE 50 MG/KG GREUTATE CORPORALĂ
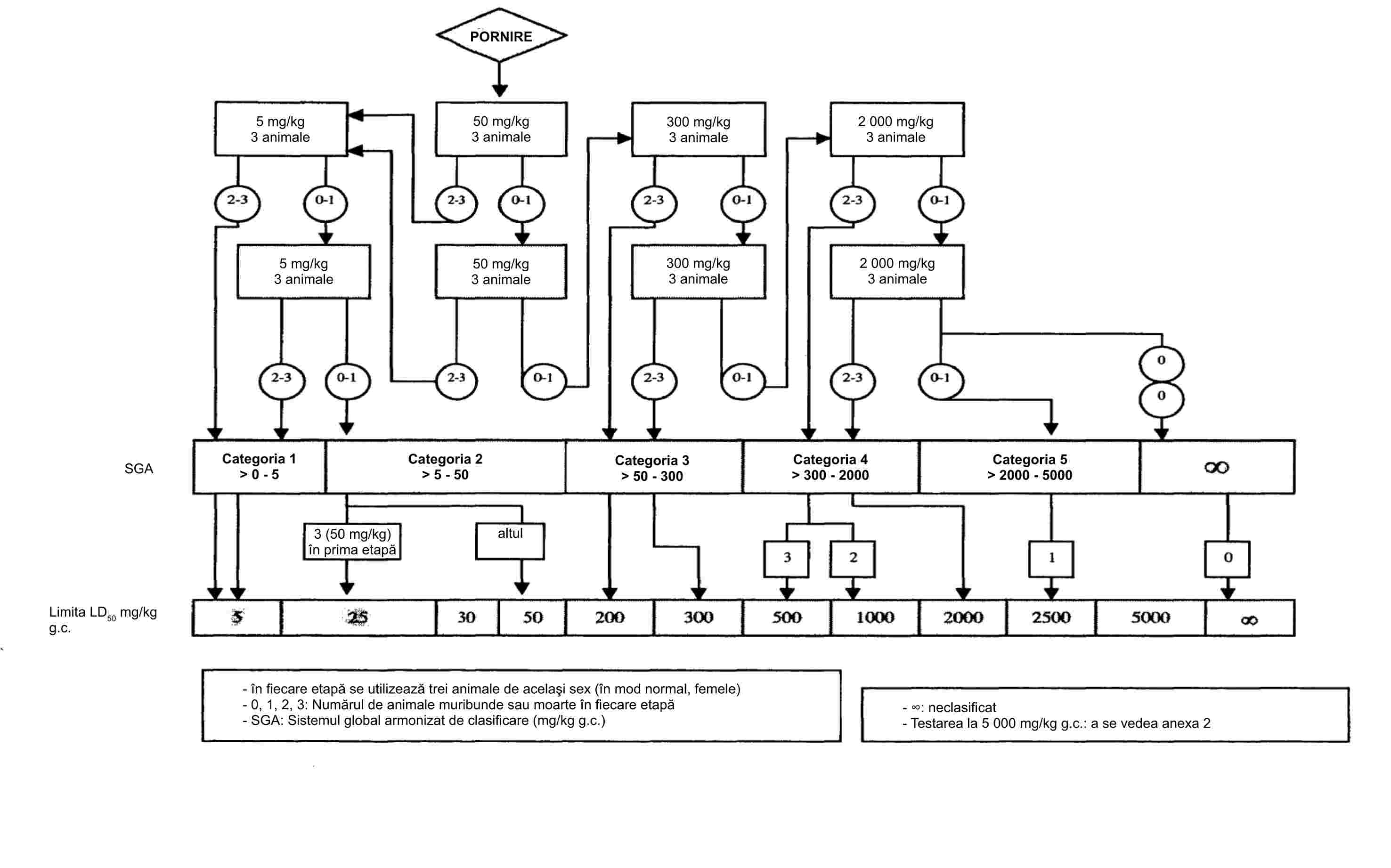
APENDICELE 1C
PROCEDURA DE TESTARE CU O DOZĂ INIȚIALĂ DE 300 MG/KG GREUTATE CORPORALĂ

APENDICELE 1D
PROCEDURA DE TESTARE CU O DOZĂ INIȚIALĂ DE 2 000 MG/KG GREUTATE CORPORALĂ

APENDICELE 2
CRITERIILE PENTRU CLASIFICAREA SUBSTANȚELOR DE TESTAT CU VALORI ESTIMATE ALE LD50 DE PESTE 2 000 MG/KG FĂRĂ A FI NECESARĂ TESTAREA
Criteriile pentru categoria de periculozitate 5 au ca scop să permită identificarea substanțelor de testat care prezintă un pericol relativ scăzut de toxicitate acută dar care, în anumite circumstanțe, pot prezenta pericole pentru populațiile vulnerabile. Se anticipează că aceste substanțe au o LD50 orală sau dermică între 2 000 și 5 000 mg/kg sau doze echivalente pentru alte căi. Substanța de testat se clasifică în categoria de periculozitate definită prin: 2 000 mg/kg < LD50 < 5 000 mg/kg (categoria 5 din SGA) în următoarele cazuri:
(a) dacă este încadrată în această categorie de oricare dintre diagramele de testare din anexele 1a-1d, pe baza incidenței deceselor;
(b) dacă sunt deja disponibile date fiabile care arată că LD50 se situează în limitele categoriei 5 sau alte studii pe animale sau privind efectele toxice asupra oamenilor indică o problemă acută pentru sănătatea oamenilor;
(c) prin extrapolare, estimare sau măsurarea de date, dacă nu se justifică clasificarea într-o clasă de periculozitate mai mare și
— sunt disponibile informații fiabile privind efectele toxice semnificative asupra oamenilor; sau
— se observă decese la testarea până la valorile din categoria 4 pe cale orală; sau
— dacă concluziile unor experți confirmă semne clinice semnificative de toxicitate, la testarea până la valorile din categoria 4, cu excepția diareii, piloerecției sau a aspectului neîngrijit; sau
— dacă concluziile experților confirmă informații fiabile care indică potențiale efecte acute semnificative conform altor studii asupra animalelor.
TESTAREA CU DOZE PESTE 2 000 MG/KG
Recunoscând necesitatea de a proteja bunăstarea animală, testarea pe animale în limitele categoriei 5 (5 000 mg/kg) este descurajată și se ia în considerare doar în cazul în care este foarte probabil că rezultatele acestor teste vor fi direct relevante pentru protecția sănătății oamenilor și a sănătății animale (10). Nu se efectuează alte teste cu doze mai mari.
Când se impune testarea cu o doză de 5 000 mg/kg, este necesară o singură etapă (trei animale). Dacă primul animal tratat moare, testul continuă cu administrarea dozei de 2 000 mg/kg, în conformitate cu diagramele din apendicele 1. Dacă primul animal supraviețuiește, se administrează aceeași doză altor două animale. Dacă doar unul dintre cele trei animale moare, valoarea LD50 este estimată la peste 5 000 mg/kg. Dacă mor două animale, se continuă procedura de administrare cu 2 000 mg/kg.
APENDICELE 3
METODA DE TESTARE B.1 tris Indicații pentru clasificarea conform sistemului UE pentru perioada de tranziție până la punerea completă în aplicare a Sistemului global armonizat de clasificare (SGA) (preluate din referința 8)


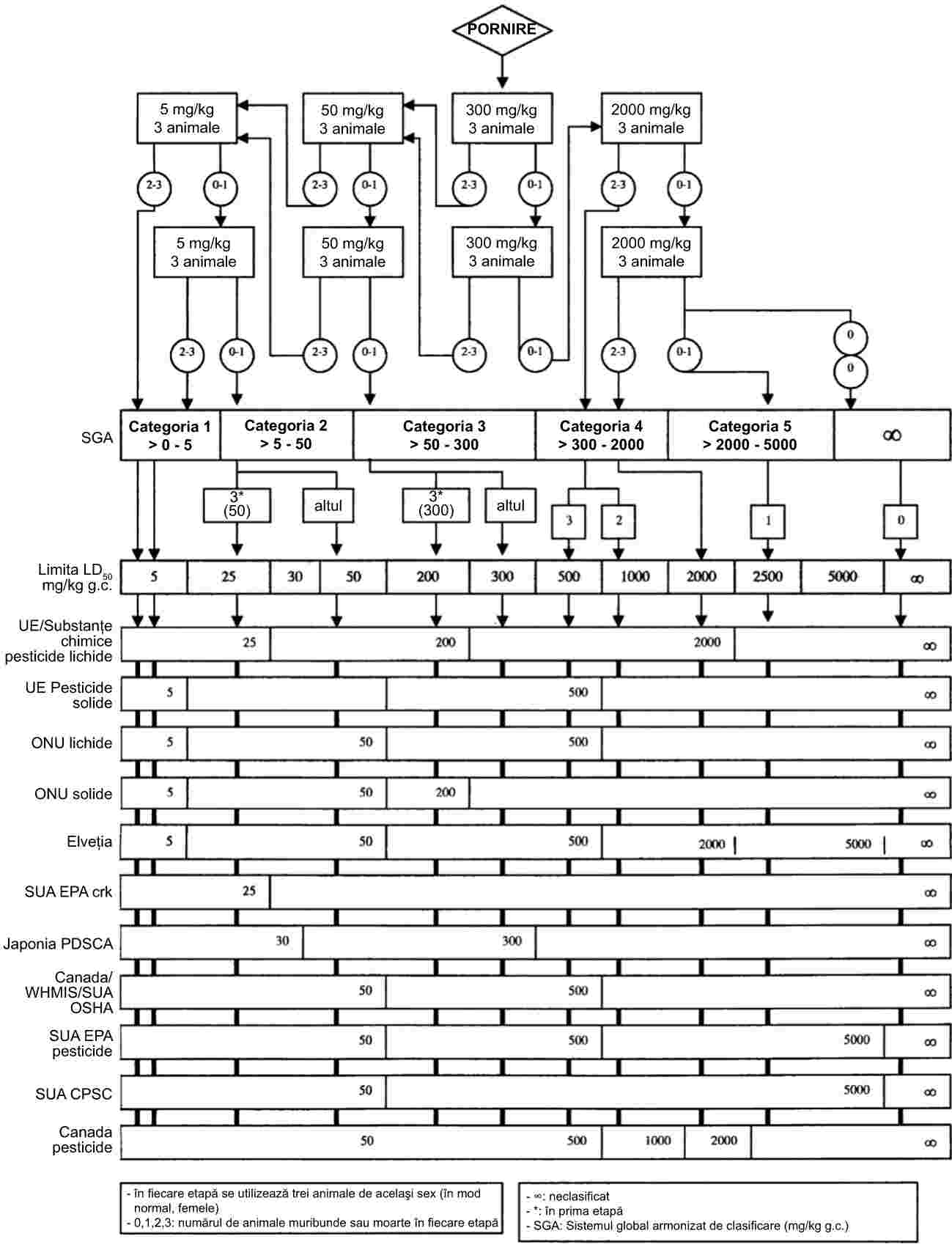
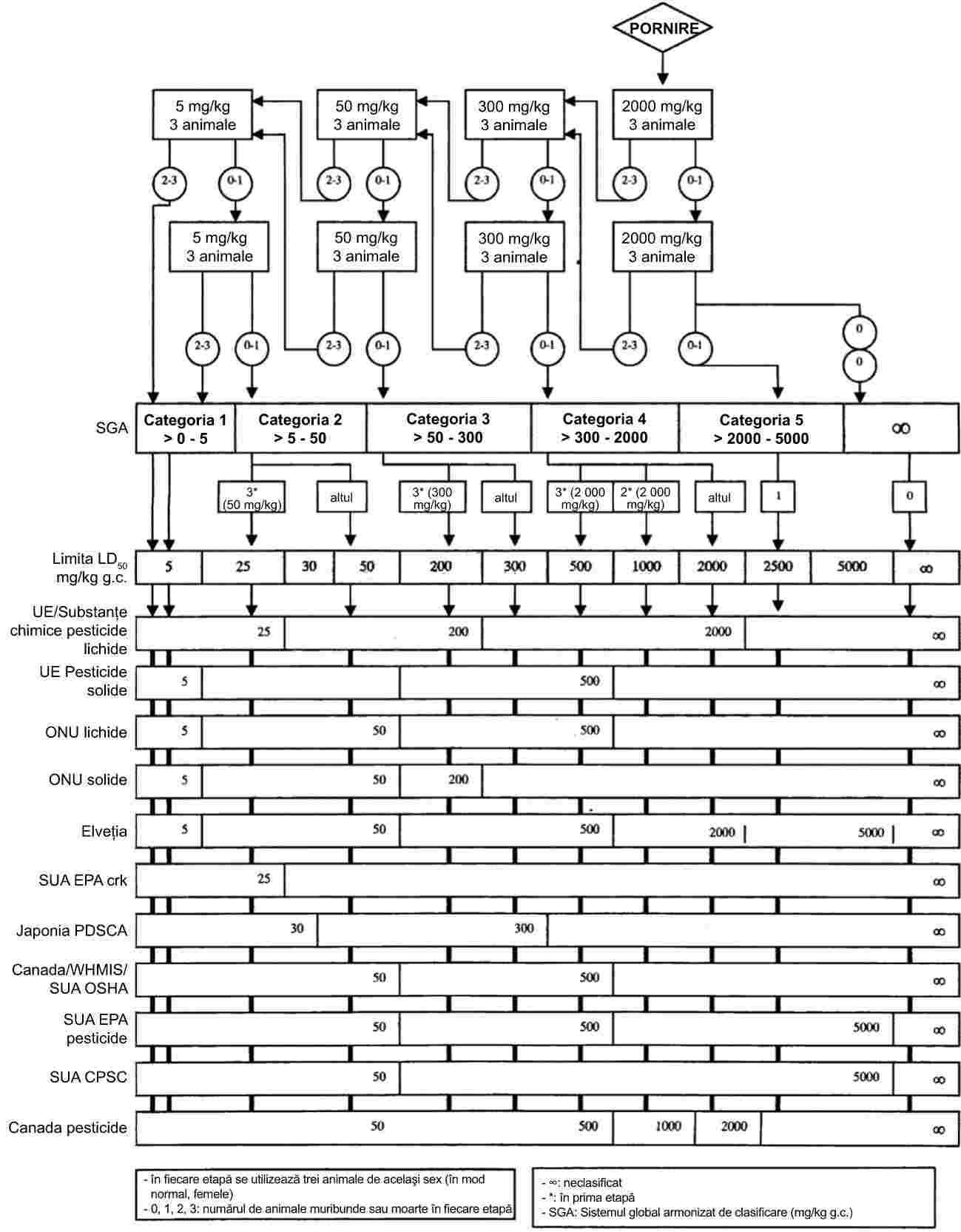
B.2. TOXICITATEA ACUTĂ (ADMINISTRARE PRIN INHALARE)
1. METODĂ
1.1. INTRODUCERE
Este util să se folosească informații preliminare asupra substanței cu privire la mărimea și distribuția particulelor, presiunea vaporilor, punctul de topire, punctul de fierbere, punctul de aprindere și proprietățile explozive (după caz).
A se vedea și introducerea generală partea B (litera A).
1.2. DEFINIȚIE
A se vedea introducerea generală: partea B (litera B).
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Mai multe loturi de animale de experiență se tratează cu substanța de testat pentru o perioadă de timp definită, în concentrații crescătoare, folosindu-se o singură concentrație pe lot. Ulterior, se observă efectele toxice și mortalitatea. Animalele care mor pe parcursul testului și cele care supraviețuiesc până la încheierea experimentului se supun autopsiei.
Animalele care prezintă semne de suferință intensă și de durată trebuie eutanasiate. Se evită administrarea substanțelor cu proprietăți corosive sau iritante în moduri care pot produce suferință intensă.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătiri
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează la întâmplare într-un număr necesar de loturi. Animalele nu sunt supuse unei expuneri simulate decât dacă acest lucru este indicat de tipul de aparat de expunere folosit.
Substanțele solide testate trebuie să fie reduse la dimensiuni micronice, în scopul obținerii unor particule de dimensiuni corespunzătoare.
Atunci când este necesar, la substanța de testat se poate adăuga un vehicul care să ajute la generarea unei concentrații adecvate de substanță de testat în atmosferă și, în acest caz, se folosește un lot martor pentru vehicul. Dacă pentru facilitarea administrării se folosește un vehicul sau alt aditiv, trebuie să fie cunoscute eventualele efecte toxice ale acestuia.
1.6.2. Condiții de testare
1.6.2.1. Animale de experiență
Dacă nu sunt contraindicații, specia preferată este șobolanul. Se folosesc animale aparținând liniilor obișnuite în laborator. Pentru fiecare sex, la începutul experimentului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie.
1.6.2.2. Număr și sex
Pentru fiecare nivel de dozare se folosesc minimum 10 rozătoare (5 masculi și 5 femele). Femelele trebuie să fie nulipare și negestante.
Notă: În testele de toxicitate acută cu animale aparținând unui ordin mai înalt decât cel al rozătoarelor, se are în vedere introducerea în experiment a unui număr mai mic de animale. Dozele se aleg cu atenție și se depun toate eforturile pentru a nu se depăși dozele moderat toxice. În asemenea teste se evită administrarea dozelor letale.
1.6.2.3. Concentrații de expunere
Acestea trebuie să fie în număr suficient, cel puțin 3, distanțate adecvat pentru a produce o gamă de efecte toxice și mortalitate la loturile testate. Rezultatele trebuie să fie suficient de numeroase pentru a permite înregistrarea unei curbe concentrație-mortalitate și determinarea acceptabilă a CL50 acolo unde este posibil.
1.6.2.4. Testul-limită
Dacă expunerea a cinci animale experimentale masculi și cinci animale experimentale femele la 20 mg per litru dintr-o substanță gazoasă sau 5 mg per litru dintr-o substanță sub formă de aerosoli sau dispersii timp de patru ore (sau, dacă acest lucru nu este posibil datorită proprietăților fizice sau chimice, inclusiv cele explozive, ale substanței de testare, concentrația maximă accesibilă) nu produce moartea niciunui animal în termen de 14 zile, se apreciază că nu mai este necesară continuarea testului (a 18-a APT, Directiva 93/21/CEE, L 110/93).
1.6.2.5. Timpul de expunere
Timpul de expunere este de 4 ore.
1.6.2.6. Echipamente
Animalele se expun la substanța de testat cu ajutorul unui dispozitiv de inhalare conceput pentru a asigura un flux continuu sau cel puțin 12 aerisiri pe oră, garantând un conținut de oxigen adecvat și o distribuție uniformă a produsului de testat în aer. Dacă se folosește o incintă, aceasta trebuie concepută astfel încât să reducă la minim aglomerarea animalelor de experiment și să le asigure o expunere maximă, prin inhalare, a substanței de testat. De regulă, pentru a asigura stabilitatea atmosferei din incintă, volumul total al animalelor nu trebuie să depășească 5 % din volumul incintei. Se mai pot folosi expuneri oro-nazale, numai ale capului sau ale întregului corp, în incinte individuale; primele două tipuri de expunere limitează absorbția pe alte căi a substanței de testat.
1.6.2.7. Perioada de observație
Perioada de observație este de minimum 14 zile. Cu toate acestea, durata observațiilor nu este fixată în mod rigid. Ea se stabilește în funcție de efectele toxice, de intensitatea lor la debut și de perioada de recuperare; perioada de observație poate fi extinsă, dacă se consideră necesar. Momentul în care apar și dispar semnele de toxicitate și momentul morții sunt factori importanți, mai ales dacă mortalitatea tinde să fie una tardivă.
1.6.3. Mod de operare
Animalele sunt cântărite cu puțin timp înaintea tratamentului, apoi se tratează cu concentrația testată, în aparatul respectiv, timp de patru ore, după echilibrarea concentrației în incintă. Timpul de echilibrare trebuie să fie scurt. Temperatura la care se realizează testul este de 22 ± 3 oC. În mod ideal, umiditatea relativă este menținută între 30 % și 70 %, dar în anumite cazuri, cum ar fi testarea anumitor aerosoli, acest lucru nu este practicabil. Menținerea unei ușoare presiuni negative în incintă (de exemplu 5 mm H2O) previne pierderea substanței de testat în spațiul înconjurător. Hrana și apa sunt restricționate în timpul expunerii. Se folosesc sisteme corespunzătoare de generare și monitorizare a atmosferei testate. Sistemul este proiectat și funcționează astfel încât să mențină o distribuție omogenă a atmosferei testate în interiorul incintei.
Se măsoară și se controlează:
(a) debitul de aer (în permanență);
(b) concentrația reală a substanței de testat măsurate în zona de respirație, cel puțin de trei ori în timpul expunerii (unele atmosfere, de exemplu cea cu aerosoli la concentrații mari, necesită măsurări mai frecvente); pe parcursul perioadei de expunere, concentrația nu trebuie să varieze cu mai mult de ± 15 % față de valoarea medie; cu toate acestea, în cazul prafului și al aerosolilor, acest grad de control poate să nu fie atins, iar în acest caz se poate accepta o diferență mai mare; în cazul aerosolilor, analiza granulometrică se efectuează ori de câte ori este necesar (cel puțin o dată pe lot);
(c) temperatura și umiditatea, continuu, dacă este posibil.
În timpul expunerii și după aceasta au loc observații care sunt înregistrate sistematic; pentru fiecare animal se consemnează date individuale. Se fac observații frecvente în prima zi. Cel puțin o dată pe zi lucrătoare, se procedează la o examinare clinică atentă; se fac și alte observații zilnice și se iau măsurile necesare pentru a reduce la minim pierderea animalelor din studiu, precum autopsia sau congelarea exemplarelor găsite moarte și izolarea sau sacrificarea celor slăbite sau muribunde.
Observațiile vizează modificări ale părului și ale blănii, ale ochilor și ale mucoaselor, ale aparatului respirator, ale sistemului circulator, ale sistemului nervos autonom și ale sistemului nervos central, precum și ale activității somato-motrice și ale comportamentului. Trebuie acordată o atenție deosebită următoarelor aspecte: tremor, convulsii, salivație, diaree, letargie, somn și comă. Momentul morții este înregistrat cât mai precis posibil. Fiecare animal este cântărit săptămânal, după tratament și la deces.
Animalele care mor pe parcursul testului și cele care supraviețuiesc sunt supuse autopsiei la încheierea testului, acordându-se o atenție specială modificărilor tractului respirator. Trebuie înregistrate toate modificările anatomopatologice macroscopice. Unde este cazul, țesuturile se prelevează pentru examen histopatologic.
2. DATE
Datele se sistematizează în tabele. Pentru fiecare lot testat se consemnează: numărul animalelor introduse în experiment; momentul morții fiecărui animal; numărul de animale care prezintă alte semne de toxicitate; descrierea efectelor toxice; rezultatele autopsiei. Modificările în greutate se calculează și se înregistrează, dacă supraviețuirea depășește o zi. Animalele eutanasiate datorită suferinței intense provocate de compusul folosit se înregistrează ca decese datorate efectelor substanței de testat. LC50 se determină printr-o metodă standardizată. Rezultatele evaluării cuprind, dacă este posibil, o apreciere a relației între expunerea animalului la substanța de testat și incidența și severitatea tuturor modificărilor apărute, care includ: modificări comportamentale și clinice, leziuni anatomopatologice macroscopice, variații ale greutății corporale, mortalitate, alte efecte toxice.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare conține, dacă este posibil, următoarele informații:
— specia, linia, sursa, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare: descrierea aparatului de expunere, inclusiv concepția, tipul, dimensiunile, sursa de aer, sistemul generator de particule și de aerosoli, metoda de condiționare a aerului și, după caz, modul de adăpostire a animalelor în incinta de testare. Se descrie echipamentul folosit pentru măsurarea temperaturii și, dacă este necesar, stabilitatea concentrațiilor de aerosoli și granulometria particulelor.
Datele privind expunerea
Se prezintă sub forma unui tabel care indică valorile medii, precum și măsura variabilității (de exemplu, deviația standard); ele trebuie să includă:
(a) debitul de aer în dispozitivul de inhalare;
(b) temperatura și umiditatea aerului;
(c) concentrațiile nominale (cantitatea totală de substanță de testat introdusă în dispozitivul de inhalare raportată la volumul de aer);
(d) după caz, natura vehiculului;
(e) concentrațiile reale din zona de respirație;
(f) mediana dimensiunilor particulelor (după caz);
(g) perioada de echilibrare;
(h) perioada de expunere:
— înregistrarea rezultatelor pe sexe și nivel de expunere (numărul de animale moarte pe parcursul testului, numărul de animale care prezintă semne de toxicitate, numărul de animale expuse);
— momentul morții pe parcursul testului, criteriile de eutanasiere;
— toate observațiile;
— valoarea CL50 calculată pe fiecare sex, determinată la sfârșitul perioadei de observație, cu specificarea metodei de calcul;
— intervalul de încredere 95 % pentru CL50 (în cazul în care poate fi furnizat);
— curba doză/mortalitate și panta (dacă este permisă de metoda de determinare);
— rezultatele autopsiei;
— rezultatele examenului histopatologic;
— discutarea rezultatelor (o atenție specială se acordă efectelor pe care numărul animalelor sacrificate pe parcursul testului le-ar putea avea asupra valorii calculate a CL50);
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B (litera D).
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B (litera E).
B.3. TOXICITATEA ACUTĂ (ADMINISTRARE CUTANATĂ)
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B (litera A).
1.2. DEFINIȚIE
A se vedea introducerea generală partea B (litera B).
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se aplică pe piele, în doze crescătoare, la mai multe loturi, câte o doză pentru fiecare lot. Ulterior se fac observații cu privire la efectele toxice și mortalitate. Animalele care mor pe perioada testării sunt autopsiate, iar la sfârșitul testului animalele supraviețuitoare se supun și ele autopsiei.
Animalele care prezintă semne grave de suferință sunt eutanasiate. Se evită administrarea substanțelor cu proprietăți corosive sau iritante în moduri care pot produce suferințe grave.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătiri
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de testare, animalele tinere sănătoase se repartizează la întâmplare în loturile tratate. Cu aproximativ 24 ore înaintea testului, blana din zona dorsală a trunchiului animalelor se tunde sau se rade cu atenție pentru a nu produce escoriații care ar putea altera permeabilitatea pielii. Pentru aplicarea substanței de testat este pregătită cel puțin 10 % din suprafața corpului. Dacă se testează substanțe solide, acestea se umezesc suficient cu apă sau, dacă este necesar, cu un vehicul corespunzător care să asigure un contact bun cu pielea. Dacă se folosește un vehicul, trebuie luată în considerare influența acestuia asupra penetrabilității cutanate. Substanțele lichide testate se folosesc, în general, nediluate.
1.6.2. Condiții de testare
1.6.2.1. Animale de experiență
Se folosesc șobolani sau iepuri adulți. Se pot folosi și alte specii, dar folosirea acestora trebuie justificată. Se folosesc animale din liniile obișnuite de laborator. Pentru fiecare sex, la începutul experimentului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie.
1.6.2.2. Număr și sex
Pentru fiecare doză se folosesc cel puțin 5 animale, de același sex. Dacă se folosesc femele, acestea trebuie să fie nulipare și negestante. Dacă există informații demonstrate că unul din sexe prezintă o sensibilitate mai mare, vor fi supuse testului animale de sexul respectiv.
Notă: În testele de toxicitate acută efectuate pe animale aparținând unui ordin mai înalt decât rozătoarele se folosesc mai puține animale. Dozele se aleg astfel încât să nu se depășească dozele moderat toxice. În astfel de teste se evită administrarea dozelor letale de substanță de testat.
1.6.2.3. Doze
Dozele trebuie alese în număr suficient (cel puțin trei) și astfel încât să producă o gamă de efecte toxice și mortalitate. La alegerea dozelor trebuie luate în considerare eventualele efecte iritante sau corosive. Informațiile trebuie să permită înregistrarea unei curbe doză/răspuns și, unde este posibil, determinarea DL50.
1.6.2.4. Testul-limită
Pe un lot de 5 masculi și 5 femele se poate efectua un test-limită cu doză unică de cel puțin 2 000 mg/kg masă corporală, folosind tehnica descrisă mai sus. Dacă apare mortalitate corelată cu doza, se efectuează un studiu complet.
1.6.2.5. Perioada de observație
Perioada de observație este de minimum 14 zile. Cu toate acestea, durata observațiilor nu este fixată în mod rigid, ci se stabilește în funcție de efectele toxice, intensitatea lor la debut și perioada de recuperare. Perioada de observație poate fi extinsă, dacă se consideră necesar. Momentul în care apar și dispar semnele de toxicitate și momentul morții sunt factori importanți, mai ales dacă mortalitatea tinde să fie una tardivă.
1.6.3. Mod de operare
Fiecare animal este ținut într-o cușcă individuală. Substanța de testat se aplică uniform pe o porțiune de aproximativ 10 % din suprafața corporală totală. Zona de aplicare poate fi mai redusă în cazul substanțelor foarte toxice, dar se acoperă o suprafață cât mai mare, cu un strat cât se poate de subțire și de uniform.
Pe parcursul expunerii, substanța de testat se menține în contact cu pielea cu ajutorul unui bandaj de tifon și al unui plasture neiritant. Suprafața tratată se acoperă astfel încât să mențină bandajul de tifon și substanța de testat și să se evite ingerarea acesteia de către animale. Se poate folosi contenționarea pentru a împiedica animalele să ingereze substanța de testat, dar nu se recomandă imobilizarea completă.
La sfârșitul perioadei de expunere, se elimină, dacă este posibil, orice reziduu de substanță, cu apă sau cu ajutorul unui alt procedeu de curățare a pielii.
În timpul expunerii și după aceasta au loc observații care sunt înregistrate sistematic; pentru fiecare animal se consemnează date individuale. Se fac observații frecvente în prima zi. Cel puțin o dată pe zi lucrătoare, se procedează la o examinare clinică atentă; se fac și alte observații zilnice și se iau măsurile necesare pentru a reduce la minim pierderea animalelor din studiu, cum ar fi autopsia sau congelarea exemplarelor găsite moarte și izolarea sau sacrificarea celor slăbite sau muribunde.
Observațiile vizează modificări ale blănii, pielii tratate, ochilor, mucoaselor, sistemului respirator, circulator, sistemului nervos central și sistemului nervos autonom, ale activității somato-motrice și comportamentului. Trebuie acordată o atenție deosebită următoarelor aspecte: tremor, convulsii, salivație, diaree, letargie, somn și comă. Momentul morții se înregistrează cât mai exact posibil. Animalele care mor pe parcursul testului și cele care supraviețuiesc la terminarea lui se supun autopsiei. Toate modificările anatomopatologice macroscopice sunt înregistrate. Dacă este astfel indicat, se recoltează țesuturi pentru examenul histopatologic.
După terminarea studiului pentru unul din sexe, substanța de testat se administrează la cel puțin un lot de 5 animale de sex opus, pentru a stabili dacă animalele care aparțin acestui sex prezintă o sensibilitate mai pronunțată la substanța de testat. În circumstanțe individuale poate fi justificată folosirea unui număr mic de animale. Dacă sunt disponibile informații care demonstrează că animalele aparținând sexului tratat prezintă o sensibilitate mai mare, nu mai este necesară testarea pe animale de sex opus.
2. DATE
Datele se sistematizează în tabele. Pentru fiecare lot testat se consemnează: numărul animalelor la începutul testului; momentul morții pentru fiecare animal; numărul de animale care manifestă alte semne de toxicitate; descrierea efectelor toxice; rezultatele autopsiei. Greutatea animalelor este determinată și înregistrată cu puțin timp înaintea aplicării substanței de testat, apoi săptămânal până în momentul decesului; modificările în greutate se calculează și se înregistrează, dacă supraviețuirea depășește o zi. Animalele sacrificate datorită suferinței intense provocate de compusul folosit se înregistrează ca decese datorate efectelor substanței de testat. DL50 se determină printr-o metodă recunoscută.
Rezultatele evaluării cuprind, dacă este posibil, o apreciere a relației între expunerea animalului la substanța de testat și incidența și severitatea tuturor modificărilor apărute, inclusiv: modificări comportamentale și clinice, leziuni macroscopice, variații ale greutății corporale, mortalitate, alte efecte toxice.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specia, linia, sursa, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare (inclusiv metoda de curățare a pielii și tipul de bandaj: ocluziv sau neocluziv);
— dozele (cu indicarea vehiculului, dacă se folosește, și concentrațiile);
— sexul animalelor tratate;
— tabele cu rezultatele răspunsului, structurate după sex și doză (numărul animalelor care au murit sau au fost sacrificate pe parcursul testului, numărul animalelor care prezintă semne de toxicitate, numărul animalelor expuse);
— momentul morții după tratament, argumente și criterii folosite pentru eutanasierea animalelor;
— toate observațiile;
— valoarea DL50 (cu specificarea metodei de determinare) pentru sexul care a reprezentat obiectul unui studiu complet pe o perioadă de 14 zile;
— intervalul de încredere 95 % pentru DL50 (când poate fi prezentat);
— curba doză/mortalitate și panta dreptei de regresie, acolo unde permite metoda de determinare;
— rezultatele autopsiei;
— rezultatele histopatologice;
— rezultatele testelor pe sexul opus;
— discutarea rezultatelor (o atenție particulară se acordă efectului pe care numărul animalelor sacrificate pe parcursul testului l-ar putea avea asupra valorii calculate a DL50);
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B (litera D).
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B (litera E).
B.4. TOXICITATE ACUTĂ: IRITAȚIE/COROZIUNE DERMICĂ
1. METODĂ
Această metodă este echivalentă cu Orientarea 404 (2002) a OCDE.
1.1. INTRODUCERE
La elaborarea acestei metode actualizate, s-a acordat o atenție deosebită posibilelor îmbunătățiri în ceea ce privește problemele de bunăstare animală și evaluării tuturor informațiilor existente privind substanța de testat pentru a se evita testarea inutilă pe animale de laborator. Această metodă include recomandarea ca, anterior efectuării a testului in vivo de iritație/coroziune descris asupra substanței, să se facă o analiză a valorii probante a datelor existente relevante. Dacă datele disponibile sunt insuficiente, ele pot fi dezvoltate prin aplicarea unor teste secvențiale (1). Strategia de testare include efectuarea unor teste in vitro validate și acceptate și este prezentată în apendicele la această metodă. În plus, dacă este cazul, se recomandă optarea pentru aplicarea succesivă, și nu simultană, a celor trei plasturi la animalul de experiență în cadrul testului inițial in vivo.
În interesul acurateței științifice și al bunăstării animale, testele in vivo se efectuează doar după o analiză a valorii probante a tuturor datelor relevante disponibile privind caracterul coroziv/iritant al substanței la nivel dermic. Printre aceste date se numără dovezi din studiile deja efectuate asupra oamenilor și/sau animalelor de laborator, dovezi privind caracterul coroziv/iritant al uneia sau mai multor substanțe chimice înrudite structural sau al unor amestecuri de astfel de substanțe, date demonstrând o puternică aciditate sau alcalinitate a substanței (2) (3) și rezultatele unor teste in vitro sau ex vivo validate și acceptate (4) (5) (5a). Această analiză ar trebui să reducă necesitatea efectuării unor teste in vivo de coroziune/iritație dermică asupra substanțelor pentru care există deja dovezi suficiente din alte teste privind aceste două puncte finale.
Apendicele la prezenta metodă prezintă o strategie preferată de testare de tip secvențial, care include efectuarea unor teste in vitro și ex vivo de coroziune/iritație. Strategia prezentată a fost dezvoltată și recomandată unanim de participanții la un atelier de lucru OCDE (6) și a fost adoptată ca strategie de testare recomandată în Sistemul global armonizat de clasificare a substanțelor chimice (SGA) (7). Se recomandă aplicarea acestei strategii de testare înainte de efectuarea testelor in vivo. Pentru substanțele noi, se recomandă o abordare a testelor pe etape pentru obținerea unor date științifice exacte privind caracterul coroziv/iritant al substanței. În cazul substanțelor existente pentru care datele privind coroziunea/iritația dermică sunt insuficiente, se aplică strategia pentru completarea datelor lipsă. Utilizarea unei strategii sau proceduri diferite de testare sau decizia de a nu utiliza o abordare a testării pe etape trebuie justificată.
În cazul în care analiza valorii probante a datelor, în conformitate cu strategia de testare secvențială, nu permite determinarea caracterului coroziv sau iritant, se ia în considerare un test in vivo (a se vedea apendicele).
1.2. DEFINIȚII
Iritație dermică: constă în producerea unor leziuni cutanate reversibile ca urmare a aplicării unei substanțe de testat timp de maximum patru ore.
Coroziune dermică: constă în producerea unor leziuni cutanate ireversibile; mai exact, necroză vizibilă prin epidermă și în dermă, ca urmare a aplicării unei substanțe de testat timp de maximum patru ore. Reacțiile cutanate se manifestă, în general, prin ulcere, sângerare, cruste sângerânde, și, spre sfârșitul perioadei de observație de 14 zile, o decolorare datorată albirii pielii, zone de alopecie completă și cicatrice. Leziunile suspecte se supun unui examen histopatologic.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se aplică într-o singură doză pe pielea unui animal de experiență; zonele netratate ale pielii animalului de experiență se utilizează ca martor. La intervale specificate se examinează și se punctează gradul de iritare/coroziune, care este descris în detaliu pentru a permite o evaluare completă a efectelor. Durata studiului trebuie să fie suficientă pentru evaluarea reversibilității sau ireversibilității efectelor observate.
Animalele care manifestă semne persistente de suferință profundă și/sau durere în orice etapă a testului sunt eutanasiate, iar substanța este evaluată în consecință. Criteriile pentru luarea deciziei de eutanasiere a animalelor muribunde sau suferinde pot fi consultate în referința (8).
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătirea testului in vivo
1.4.1.1. Selectarea speciei de animale
Se utilizează, de preferat, exemplare adulte tinere, sănătoase, de iepure albinos. Utilizarea altor specii trebuie justificată.
1.4.1.2. Pregătirea animalelor
Cu aproximativ 24 de ore înainte de test, se rade blana din regiunea dorsală de pe corpul animalelor. Se evită cu atenție jupuirea pielii și se utilizează exclusiv animalele cu pielea sănătoasă, intactă.
La unele sușe de iepuri, blana este mai deasă în unele zone, în anumite perioade ale anului. Zonele în cauză nu se utilizează ca zone de testare.
1.4.1.3. Condiții de adăpostire și de hrănire
Animalele se adăpostesc individual. În spațiul pentru adăpostirea animalelor de experiență, se asigură o temperatură de 20 oC (± 3 oC) pentru iepuri. Se asigură o umiditate relativă de 50-60 %, cu o valoare minimă de 30 % și o valoare maximă 70 %, cu excepția momentelor în care se curăță spațiul. Spațiul se iluminează artificial, cu o alternanță de 12 ore lumină, 12 ore întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă.
1.4.2. Procedura de testare
1.4.2.1. Aplicarea substanței de testat
Substanța de testat se alică pe o suprafață redusă (aproximativ 6 cm2 a pielii și se acoperă cu o compresă de tifon, care se fixează cu plasture care nu irită. În cazurile în care nu este posibilă aplicarea directă (de exemplu, în cazul lichidelor și al unor paste), substanța de testat se aplică mai întâi pe compresa de tifon, care se aplică apoi pe piele. Se asigură un contact ușor între compresă și piele cu ajutorul unui pansament semi-ocluziv pentru întreaga durată a perioadei de expunere. Dacă substanța de testat se aplică pe compresă, aceasta se fixează pe piele astfel încât să se asigure un contact adecvat și o distribuție uniformă a substanței pe piele. Este necesar să se prevină accesul animalului la compresă și ingerarea sau inhalarea substanței de testat.
Substanțele de testat lichide se utilizează, în general, nediluate. La testarea solidelor (care pot fi pulverizate, dacă este necesar), substanța solidă se înmoaie cu cea mai mică cantitate de apă (sau, dacă este necesar, cu un alt vehicul adecvat) suficientă pentru a asigura un contact adecvat cu pielea. Dacă se utilizează alte vehicule decât apa, potențiala influență a vehiculului asupra iritației provocate de substanță la nivel dermic trebuie să fie minimă sau nulă.
La sfârșitul perioadei de expunere, care este, în mod normal, de 4 ore, reziduurile de substanță de testat se îndepărtează, dacă este posibil, cu apă sau un solvent adecvat fără a se modifica reacția existentă sau integritatea epidermei.
1.4.2.2. Nivelul dozei
Pe zona de testare se aplică o doză de 0,5 ml de lichid sau de 0,5 g de substanță solidă sau pastă.
1.4.2.3. Testul inițial (test in vivo de iritație/coroziune dermică utilizând un animal)
Se recomandă ca testul in vivo să se efectueze inițial pe un singur animal, în special dacă substanța de testat riscă să fie corozivă. Această abordare este consecventă cu strategia de testare secvențială (a se vedea apendicele 1).
Dacă se stabilește, pe baza analizei valorii probante a datelor, că o substanță este corozivă, nu este necesară testarea pe animale. Pentru cele mai multe substanțe care sunt considerate corozive, nu sunt, în mod normal, necesare teste suplimentare in vivo. Cu toate acestea, în cazurile în care se justifică obținerea de date suplimentare având în vedere dovezile insuficiente, se pot efectua teste restrânse, utilizând următoarea abordare: Se aplică animalului, secvențial, maximum trei plasturi. Primul plasture se îndepărtează după trei minute. Dacă nu se observă o reacție cutanată serioasă, se aplică al doilea plasture, care se îndepărtează după o oră. Dacă în această etapă, observațiile arată că poate fi permisă prelungirea expunerii la patru ore, fără a cauza suferințe, se aplică un al treilea plasture, care se îndepărtează după patru ore și se punctează reacția.
Dacă se observă un efect coroziv după oricare dintre cele trei expuneri secvențiale, testul se încheie. Dacă nu se observă un efect coroziv după îndepărtarea ultimului plasture, animalul se observă timp de 14 zile, cu excepția cazului în care coroziunea se manifestă mai devreme.
În cazurile în care se estimează că substanța de testat nu este corozivă, dar ar putea fi iritantă, se aplică un singur plasture unui animal, timp de patru ore.
1.4.2.4. Teste de confirmare (test de iritare in vivo pe animale suplimentare)
Dacă la testul inițial nu se observă efecte corozive, reacția de iritație sau negativă se confirmă prin testarea a maximum alte două animale, fiecare cu câte un plasture, cu o perioadă de expunere de patru ore. Dacă se observă un efect iritant la testul inițial, testul de confirmare poate fi efectuat secvențial sau prin expunerea simultană a celor două animale suplimentare. În cazul excepțional în care nu se efectuează testul inițial, două sau trei animale pot fi tratate cu câte un singur plasture, care se îndepărtează după patru ore. Dacă se utilizează două animale și ambele manifestă aceeași reacție, nu mai sunt necesare teste suplimentare. În caz contrar, se testează și al treilea animal. Este posibil să fie necesară evaluarea reacțiilor echivoce utilizând alte animale.
1.4.2.5. Perioada de observare
Durata perioadei de observare trebuie să fie suficientă pentru evaluarea completă a reversibilității efectelor observate. Cu toate acestea, experimentul se încheie dacă animalul prezintă semne persistente de durere sau suferință profundă. Pentru a determina reversibilitatea efectelor, animalele se observă timp de până la 14 zile de la îndepărtarea plasturilor. Dacă reversibilitatea intervine înainte de 14 zile, experimentul se încheie în acel moment.
1.4.2.6. Observații clinice și punctarea reacțiilor cutanate
Se examinează semnele de eritem și edem la toate animalele și se punctează reacțiile la 60 de minute, iar apoi la 24, 48 și 72 de ore de la îndepărtarea plasturilor. Pentru testul inițial pe un singur animal, zona de testare se examinează, de asemenea, imediat după îndepărtarea plasturelui. Reacțiile dermice se punctează și se înregistrează conform punctajelor din tabelul de mai jos. Dacă la 72 de ore se observă leziuni cutanate care nu pot fi identificate ca iritații sau coroziuni, este posibil să fie necesară observarea timp de 14 zile, pentru a determina reversibilitatea efectelor. În plus față de examinarea iritației, se descriu și se înregistrează toate efectele toxice locale, precum uscarea pielii, și orice efecte sistemice adverse (de exemplu, efecte manifestate prin semne clinice de toxicitate sau efecte asupra greutății corporale). Pentru clarificarea reacțiilor echivoce se efectuează un examen histopatologic.
Punctarea reacțiilor cutanate este evident subiectivă. Pentru a promova armonizarea punctării reacțiilor cutanate și pentru a veni în sprijinul laboratoarelor de testare și a persoanelor implicate în efectuarea și interpretarea observațiilor, personalul care efectuează observațiile trebuie să fie instruit corespunzător cu privire la sistemul de punctaj utilizat (a se vedea tabelul de mai jos). Ar putea fi util un ghid ilustrat pentru punctarea iritațiilor dermice și a altor leziuni (9).
2. DATE
2.1. PREZENTAREA REZULTATELOR
Rezultatele studiului se rezumă în formă tabelară în raportul final al testului și includ toate punctele prevăzute la punctul 3.1.
2.2. EVALUAREA REZULTATELOR
Punctajele de iritație dermică se evaluează în legătură cu natura și severitatea leziunilor, precum și cu reversibilitatea sau ireversibilitatea lor. Punctajele individuale nu reprezintă un standard absolut pentru proprietățile iritante ale materialului, întrucât se evaluează și alte efecte ale materialului de testat. În schimb, punctajele individuale trebuie privite ca valori de referință, care se evaluează în legătură cu toate celelalte observații ale studiului.
Reversibilitatea leziunilor cutanate se ia în considerare la evaluarea reacțiilor iritante. Dacă reacțiile precum alopecia (zonă limitată), hiperkeratoza, hiperplazia și exfolierea persistă la sfârșitul perioadei de observare de 14 zile, substanța de testat se consideră a fi iritantă.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare include următoarele informații:
Motivația pentru testarea in vivo: analiza valorii probante a datelor prealabile testului, inclusiv a rezultatelor strategiei de testare secvențiale:
— descrierea datelor relevante disponibile înaintea testului;
— date obținute în fiecare etapă a strategiei de testare;
— descrierea testelor in vitro efectuate, inclusiv detaliile procedurilor, rezultatele obținute cu substanțele de testat/de referință;
— analiza valorii probante pentru efectuarea studiului in vivo.
Substanța de testat:
— date de identificare (de exemplu, numărul CAS; sursă; puritate; impurități cunoscute; numărul lotului);
— natura fizică și proprietățile fizico-chimice (de exemplu, pH, volatilitate, solubilitate, stabilitate);
— pentru amestecuri, compoziția și procentele relative ale componentelor.
Vehicul:
— identificare, concentrație (dacă este cazul), volumul utilizat;
— justificarea alegerii vehiculului.
Animale de experiență:
— specie/sușă utilizată, motivație pentru utilizarea altor animale decât iepurele albinos;
— numărul de animale din fiecare sex;
— greutatea fiecărui animal la începutul și la finalul testului;
— vârsta la începutul studiului;
— sursa animalelor, condiții de adăpostire, hrănire etc.
Condiții de testare:
— tehnica pregătirii zonei de aplicare a plasturelui;
— detalii privind materialele utilizate pentru plasturi și metodele de aplicare;
— detalii privind prepararea, aplicarea și îndepărtarea substanței de testat.
Rezultate:
— tabel cu punctajul acordat reacției de iritație/coroziune pentru fiecare animal în fiecare moment de observare prestabilit;
— descrierea tuturor leziunilor observate;
— descrierea narativă a naturii și gradului de iritație/coroziune observat și concluziile examenului histopatologic;
— descrierea altor efecte locale adverse (de exemplu, uscarea pielii) și a altor efecte sistemice apărute în plus față de iritația sau coroziunea dermică.
— Discutarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. Barratt, M. D., Castell, J. V., Chamberlain, M., Combes, R. D., Dearden, J. C., Fentem, J. H., Gerner, I., Giuliani, A., Gray, T. J. B., Livingston, D. J., Provan, W. M., Rutten, F. A. J. J. L., Verhaar, H. J. M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410-429.
2. Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26.
3. Worth, A. P., Fentem, J. H., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709-720.
4. ECETOC (1990) Monograph No. 15, „Skin Irritation”, European Chemical Industry, Ecology and Toxicology Centre, Brussels.
5. Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsail, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp.483-524.
5a. Metoda de testare B.40 Coroziunea cutanată.
6. OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd1.org/ehs/test/background.htm).
7. OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm).
8. OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd1.org/ehs/test/monos.htm).
9. EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990. [Disponibil la cerere la Secretariatul OCDE].
[Disponibile, la cerere, la secretariatul OCDE.]
Tabelul 1
PUNCTAREA REACȚIILOR CUTANATE
Formarea de eriteme și escare
|
Fără eritem |
0 |
|
Eritem foarte ușor (abia perceptibil) |
1 |
|
Eritem bine definit |
2 |
|
Eritem moderat spre grav |
3 |
|
Eritem grav (roșu violaceu) cu formare de escare care împiedică punctarea eritemului |
4 |
Maximum posibil: 4
Formarea de edeme
|
Fără edem |
0 |
|
Edem foarte ușor (abia perceptibil) |
1 |
|
Edem ușor (marginile zonei bine definite printr-o umflătură vizibilă) |
2 |
|
Edem moderat (umflătură de aproximativ 1 mm) |
3 |
|
Edem grav (umflătură de peste 1 mm extins în afara zonei de expunere) |
4 |
Maximum posibil: 4
Pentru clarificarea reacțiilor echivoce se procedează la un examen histopatologic.
APENDICE
O strategie de testare secvențială pentru iritație și coroziune dermică
CONSIDERENTE GENERALE
În interesul acurateței științifice și al bunăstării animale, este important să se evite utilizarea inutilă a animalelor de experiență și să se reducă la minimum testările care pot produce reacții grave la animale. Este necesar să se evalueze toate informațiile privind o substanță care sunt relevante pentru potențialul său caracter coroziv/iritant la nivel dermic înainte de luarea în considerare a testării in vivo. Este posibil să existe deja date suficiente pentru clasificarea unei substanțe de testat din punctul de vedere al potențialului său coroziv/iritant la nivel dermic, fără a mai fi necesar să se efectueze teste pe animale de laborator. Prin urmare, prin utilizarea unei analize a valorii probante a datelor și a unei strategii de testare secvențiale, se reduce la minimum necesitatea de a efectua teste in vivo, în special dacă substanța are potențialul de a produce reacții grave.
Se recomandă utilizarea unei analize a valorii probante a datelor pentru a evalua informațiile existente privind potențialul iritant și coroziv al substanțelor la nivel dermic și a stabili dacă este necesară efectuarea unor teste suplimentare, altele decât studii dermice in vivo, pentru caracterizarea acestui potențial. Dacă sunt necesare studii suplimentare, se recomandă aplicarea strategiei de testare secvențiale pentru obținerea datelor experimentale relevante. Pentru substanțele care nu au fost testate anterior, se recomandă aplicarea strategiei de testare secvențiale pentru obținerea setului de date necesare pentru evaluarea potențialului său coroziv/iritant la nivel dermic. Strategia de testare descrisă în prezentul apendice a fost dezvoltată în cadrul unui atelier de lucru OCDE (1) și a fost ulterior susținută și extinsă în cadrul Sistemului armonizat integrat de clasificare a riscurilor substanțelor chimice pentru sănătatea oamenilor și mediu (Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances), adoptată la a 28-a reuniune comună a Comitetului pentru substanțe chimice și a Grupului de lucru pentru substanțe chimice, în noiembrie 1998 (2).
Deși această strategie de testare secvențială nu face parte integrantă din metoda de testare B.4, ea reprezintă abordarea recomandată pentru determinarea caracteristicilor iritante/corozive la nivel dermic. Această abordare reprezintă atât cea mai bună practică, cât și un reper etic pentru testarea in vivo pentru iritație/coroziune dermică. Metoda de testare oferă indicații pentru efectuarea testului in vivo și rezumă factorii care trebuie evaluați înainte de un astfel de test. Strategia oferă o abordare pentru evaluarea datelor existente privind proprietățile iritante/corozive la nivel dermic ale substanțelor de testat și o abordare graduală pentru generarea datelor relevante pentru substanțele pentru care sunt necesare studii suplimentare sau care nu au făcut încă obiectul unor studii. Strategia recomandă, de asemenea, efectuarea unor teste in vitro sau ex vivo validate și acceptate pentru coroziune/iritație dermică în condiții specifice.
DESCRIEREA STRATEGIEI DE EVALUARE ȘI TESTARE
Înainte de efectuarea testelor incluse în strategia de testare secvențială (figură), se evaluează toate informațiile disponibile pentru a stabili dacă este necesară testarea cutanată in vivo. Deși se pot obține informații semnificative din evaluarea unor parametri specifici (de exemplu, o valoare extremă a pH-ului), se iau în considerare toate informațiile existente. Se evaluează toate datele relevante privind efectele substanței în cauză și a analogilor săi pentru adoptarea unei decizii prin analiza valorii probante a datelor și se prezintă motivele care stau la baza deciziei. Se acordă o atenție specială datelor privind efectele substanței asupra oamenilor și animalelor, apoi rezultatelor testelor in vitro sau ex vivo. Se evită, ori de câte ori este posibil, efectuarea unor studii in vivo pentru substanțele corozive. Factorii luați în considerare în strategia de testare includ:
Evaluarea datelor privind efectele asupra oamenilor și animalelor (Etapa I). Se iau în primul rând în considerare datele existente privind efectele asupra oamenilor, de exemplu studii clinice și ocupaționale sau studii de caz, și/sau date obținute în cadrul unor teste asupra animalelor, de exemplu studii privind toxicitatea dermică la o singură expunere sau expuneri repetate, deoarece acestea furnizează informații direct legate de efectele cutanate. Nu este necesar să se efectueze studii in vivo asupra substanțelor cu caracter iritant sau coroziv cunoscut și a celor pentru care există date clare că nu sunt corozive sau iritante.
Analiza relațiilor structură-activitate (RSA) (Etapa 2). Se iau în considerare rezultatele testelor asupra substanțelor înrudite din punct de vedere structural, dacă sunt disponibile. Dacă sunt disponibile suficiente date privind efectele asupra oamenilor și/sau animalelor ale unor substanțe înrudite structural sau ale unor amestecuri de astfel de substanțe care indică un potențial coroziv/iritant la nivel dermic, se poate presupune că substanța în curs de evaluare va produce aceleași reacții. În astfel de cazuri, este posibil să nu fie necesare teste asupra substanței în cauză. Datele negative obținute de studiile asupra substanțelor înrudite structural sau asupra amestecurilor de astfel de substanțe nu constituie dovezi suficiente pentru caracterul necoroziv/neiritant al substanței supuse strategiei de testare secvențiale. Se utilizează abordări RSA validate și acceptate pentru a identifica atât potențialul de coroziune dermică, cât și cel de iritație dermică.
Proprietățile fizico-chimice și reactivitatea chimică (Etapa 3). Substanțele care prezintă valori extreme ale pH-ului, precum ≤ 2,0 și ≥ 11,5 pot produce efecte locale puternice. Dacă valorile extreme ale pH-ului constituie baza pentru identificarea unei substanțe ca fiind corozivă la nivel dermic, atunci se poate lua în considerare și rezerva sa acidă/alcalină (sau capacitatea de tamponare) (3) (4). În cazul în care capacitatea de tamponare sugerează că este posibil ca substanța să nu fie corozivă la nivel dermic, se efectuează teste suplimentare pentru confirmare, de preferat prin utilizarea unui test in vitro sau ex vivo validat și acceptat (a se vedea etapele 5 și 6).
Toxicitatea dermică (Etapa 4). Dacă o substanță chimică s-a dovedit foarte toxică pe cale dermică, există riscul ca efectuarea un studiu in vivo de iritație/coroziune dermică să nu fie posibilă, întrucât cantitatea de substanță de testat aplicată în mod normal ar putea depăși doza foarte toxică și, prin urmare, ar putea provoca moartea sau suferință profundă animalelor. În plus, dacă au fost deja efectuate teste de toxicitate dermică pe iepuri albinoși, până la un nivel-limită al dozei de 2 000 mg/kg greutate corporală sau mai mare, fără să se observe iritații sau coroziune dermice, nu sunt necesare teste suplimentare pentru iritație/coroziune dermică. La evaluarea toxicității dermice acute determinate în studiile anterioare se iau în considerare o serie de factori. De exemplu, informațiile raportate privind leziunile dermice pot fi incomplete. Este posibil ca testarea și observațiile să se fi făcut pe alte specii decât pe iepurele albinos, iar speciile pot prezenta diferențe semnificative din punctul de vedere al sensibilității reacțiilor lor. De asemenea, este posibil ca forma substanței de testat aplicate pe animale să nu fi fost adecvată pentru evaluarea iritației/coroziunii dermice [de exemplu, diluarea substanțelor pentru testarea toxicității dermice (5)]. Cu toate acestea, în cazurile în care au fost efectuate teste concepute și desfășurate corespunzător pe iepuri, concluziile negative pot fi considerate dovezi suficiente că substanța nu este corozivă sau iritantă.
Rezultatele testelor in vitro sau ex vivo (Etapele 5 și 6). Substanțele care au prezentat proprietăți corozive sau puternic iritante într-un test in vitro sau ex vivo validat și acceptat (6) (7) conceput pentru evaluarea acestor efecte specifice, nu trebuie să fie testate pe animale. Se poate presupune că substanțele în cauză vor produce efecte la fel de puternice in vivo.
Testul in vivo pe iepuri (Etapele 7 și 8). În cazul în care, în urma analizei valorii probante a datelor, se ia decizia efectuării unui test in vivo, se începe printr-un test inițial pe un singur animal. Dacă rezultatele acestui test arată că substanța este corozivă la nivel dermic, nu se efectuează teste suplimentare. Dacă în cadrul testului inițial nu se observă efecte corozive, efectul iritant sau negativ se confirmă utilizând maximum alte două animale, cu o perioadă de expunere de patru ore. Dacă în cadrul testului inițial se observă un efect iritant, testul de confirmare poate fi efectuat secvențial sau prin expunerea altor două animale simultan.
4. REFERINȚE BIBLIOGRAFICE
1. OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
2. OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
3. Worth, A. P., Fentem J. H., Balls M., Botham P. A., Curren R. D., Earl L. K., Esdaile D. J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, 709-720.
4. Young, J. R., How, M. J., Walker, A. P., Worth, W. M. H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic In vitro, 2 (1) pp. 19-26.
5. Patil, S. M., Patrick, E., Maibach, H. I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, pp. 411-436.
6. Metoda de testare B.40.
7. Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
Figură
STRATEGIE DE TESTARE ȘI EVALUARE A IRITAȚIEI/COROZIUNII DERMICE

B.5. TOXICITATE ACUTĂ: IRITAȚIE/COROZIUNE OCULARĂ
1. METODĂ
Această metodă este echivalentă cu Orientarea 405 (2002) a OCDE.
1.1. INTRODUCERE
La elaborarea acestei metode actualizate s-a acordat o atenție deosebită posibilelor îmbunătățiri prin evaluarea tuturor informațiilor existente privind substanța de testat, astfel încât să se evite testarea inutilă pe animale de laborator și, prin urmare, pentru soluționarea problemelor de bunăstare animală. Această metodă include recomandarea ca, înainte de a se efectua testul in vivo descris pentru coroziune/iritație oculară acută, să se facă o analiză a valorii probante a datelor relevante (1). Dacă datele disponibile sunt insuficiente, se recomandă dezvoltarea acestora prin aplicarea unor teste secvențiale (2) (3). Strategia de testare include efectuarea unor teste in vitro validate și acceptate și este prezentată ca apendice la această metodă de testare. În plus, se recomandă utilizarea unui test in vivo de iritație/coroziune dermică pentru a face o estimare a coroziunii oculare, înainte de a se lua în considerare efectuarea unui test ocular in vivo.
În interesul acurateței științifice și al bunăstării animale, testele in vivo se efectuează doar după o analiză a valorii probante a tuturor datelor disponibile relevante pentru potențialul de coroziune/iritație oculară al substanței. Printre aceste date se numără dovezi din studiile deja efectuate asupra oamenilor și/sau animalelor de laborator, dovezi privind caracterul coroziv/iritant al uneia sau mai multor substanțe chimice înrudite structural sau al unor amestecuri de astfel de substanțe, date demonstrând o puternică aciditate sau alcalinitate a substanței (4) (5) și rezultatele unor teste in vitro sau ex vitro de coroziune și iritație dermică validate și acceptate (6) (6a). Este posibil ca aceste studii să fi fost efectuate înainte de sau ca urmare a analizei valorii probante a datelor.
Pentru anumite substanțe, o astfel de analiză poate indica necesitatea efectuării unor studii in vivo privind potențialul de coroziune/iritație oculară al substanței. În toate aceste cazuri, înainte de a lua în considerare efectuarea testului ocular in vivo, este de preferat să se efectueze un studiu asupra efectelor cutanate in vivo ale substanței și o evaluare în conformitate cu metoda de testare B.4 (7). Efectuarea unei analize a valorii probante a datelor și aplicarea strategiei de testare secvențiale ar trebui să reducă necesitatea efectuării unor teste in vivo de coroziune/iritație oculară asupra substanțelor pentru care există deja date suficiente obținute în cadrul altor studii. Dacă potențialul de coroziune și iritație oculară nu se poate determina prin aplicarea strategiei de testare secvențiale, chiar după efectuarea unui studiu in vivo de coroziune și iritație dermică, se poate trece la efectuarea unui test in vivo de coroziune/iritație oculară.
Apendicele la prezenta metodă prezintă o strategie de testare secvențială preferată, care include efectuarea unor teste in vitro sau ex vivo de coroziune/iritație. Strategia a fost dezvoltată și unanim recomandată de participanții la un atelier de lucru OCDE (8), iar ulterior a fost adoptată ca strategia de testare recomandată în Sistemul global armonizat de clasificare a substanțelor chimice (SGA) (9). Se recomandă aplicarea acestei strategii de testare înainte de efectuarea testelor in vivo. Pentru substanțe noi, este abordarea recomandată pentru testarea secvențială în vederea dezvoltării unor date științifice fiabile privind caracterul coroziv/iritant al substanței. În cazul substanțelor existente pentru care există date insuficiente privind coroziunea/iritația dermică și oculară, strategia se utilizează pentru obținerea unor date complete. Utilizarea unei strategii sau proceduri diferite de testare sau decizia de a nu aplica o abordare de testare secvențială trebuie motivată.
1.2. DEFINIȚII
Iritație oculară: reprezintă producerea unor modificări oculare ca urmare a aplicării unei substanțe de testat pe suprafața anterioară ochiului, care sunt complet reversibile în termen de 21 de zile de la aplicare.
Coroziune oculară: reprezintă producerea unor leziuni tisulare la nivelul ochiului sau a unei deteriorări grave a vederii, ca urmare a aplicării unei substanțe de testat pe suprafața anterioară a ochiului, care nu sunt complet reversibile în termen de 21 de zile de la aplicare.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se aplică, într-o singură doză, pe un ochi al animalului de experiență, celălalt ochi fiind utilizat ca martor. Nivelul de iritație/coroziune oculară se evaluează prin acordarea unui punctaj leziunilor care afectează conjunctiva, corneea și irisul, la intervale prestabilite. Se descriu, de asemenea, celelalte efecte asupra ochiului sau efecte sistemice adverse, pentru a asigura o evaluare completă a efectelor. Durata studiului trebuie să fie suficientă pentru a evalua reversibilitatea sau ireversibilitatea efectelor.
Animalele care manifestă semne persistente de suferință și/sau dureri profunde în orice etapă a testului sunt eutanasiate, iar substanța se evaluează în consecință. Criteriile pentru luarea deciziei de eutanasiere a animalelor muribunde sau suferinde sunt prezentate în referința 10.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătirea pentru testul in vivo
1.4.1.1. Selectarea speciei
Se utilizează, de preferat, exemplare adulte tinere, sănătoase, de iepure albinos. Utilizarea altor sușe sau specii trebuie justificată.
1.4.1.2. Pregătirea animalelor
Cu 24 de ore înainte de începerea testului se examinează ambii ochi ai animalului de experiență selectat provizoriu. Nu se utilizează animalele care prezintă iritații sau defecte oculare sau leziuni corneene preexistente.
1.4.1.3. Condiții de adăpostire și de hrănire
Animalele se adăpostesc individual. În spațiul pentru adăpostirea animalelor de experiență se asigură o temperatură de 20 oC (± 3 oC) pentru iepuri. Se asigură o umiditate relativă de 50-60 %, cu o valoare minimă de 30 % și o valoare maximă 70 %, cu excepția momentelor în care se curăță spațiul. Spațiul se iluminează artificial, cu o alternanță de 12 ore lumină, 12 ore întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă.
1.4.2. Procedura de testare
1.4.2.1. Aplicarea substanței de testat
Substanța de testat se aplică în sacul conjunctival al unui ochi al fiecărui animal, după îndepărtarea delicată a pleoapei inferioare de pe globul ocular. Pleoapele se țin apoi lipite pentru circa o secundă, pentru a preveni pierderea materialului. Celălalt ochi, care nu se tratează, se utilizează ca martor.
1.4.2.2. Irigația
Ochii animalelor testate nu se spală timp de cel puțin 24 de ore de la instilația substanței de testat, cu excepția cazului în care substanța este solidă (a se vedea punctul 1.4.2.3.2) și a cazului în care apar efecte corozive sau iritante imediate. După 24 de ore, se procedează la o spălare, dacă se consideră necesar.
Nu se recomandă utilizarea unui grup satelit de animale pentru a analiza influența spălării, cu excepția cazului în care este justificată științific. Dacă este necesar un grup satelit, se folosesc doi iepuri. Se descriu detaliat condițiile de spălare, precizând momentul spălării; compoziția și temperatura soluției utilizate; durata, volumul și viteza de aplicare.
1.4.2.3. Nivelul dozei
1.4.2.3.1. Testarea lichidelor
Pentru testarea lichidelor se utilizează o doză de 0,1 ml. Nu se utilizează pulverizatoare cu pompă pentru instilarea substanței direct în ochi. Se recomandă extragerea lichidului și colectarea sa într-un container înainte de instilarea a 0,1 ml în ochi.
1.4.2.3.2. Testarea solidelor
La testarea solidelor, a pastelor și a substanțelor sub formă de particule, cantitatea utilizată are un volum de 0,1 ml sau o greutate de cel mult 100 mg. Materialul de testat se macină într-un praf fin. Volumul materialului solid se măsoară după o compactare delicată, de exemplu bătând ușor cu palma recipientul de măsură. Dacă substanța solidă de testat nu a fost îndepărtată din ochiul animalului de experiență prin mecanisme fiziologice în primul moment prestabilit de observare, și anume la o oră după tratament, ochiul poate fi spălat cu o soluție salină sau cu apă distilată.
1.4.2.3.3. Testarea aerosolilor
Se recomandă colectarea conținutului tuturor pulverizatoarelor cu pompă și aerosolilor înainte de instilarea în ochi. Singura excepție o constituie substanțele în containere sub presiune pentru aerosoli, care nu pot fi colectate din cauza vaporizării. În acest caz, ochiul se ține deschis, iar substanța de testat se administrează în ochi cu un singur jet de circa o secundă, de la o distanță de 10 cm perpendicular pe ochi. Distanța poate varia în funcție de presiunea pulverizatorului și a conținutului său. Se evită lezarea ochiului din cauza presiunii pulverizatorului. În unele cazuri, se poate dovedi necesar să se evalueze posibilitatea provocării unor leziuni „mecanice” ochiului prin forța pulverizatorului.
Se poate face o estimare a dozei dintr-un aerosol simulând testul astfel: substanța se pulverizează pe o bucată de hârtie de cântărit, printr-o deschidere de dimensiunea ochiului unui iepure amplasată direct în fața hârtiei. Cantitatea pulverizată în ochi se estimează pe baza creșterii greutății hârtiei. Pentru substanțele volatile, doza poate fi estimată prin cântărirea unui recipient în care este pulverizată substanța, înainte și după îndepărtarea materialului de testat.
1.4.2.4. Testul inițial (Test in vivo de iritație/coroziune oculară pe un animal)
Așa cum se precizează în strategia de testare secvențială (a se vedea apendicele), se recomandă ca testul in vivo să se efectueze pentru început pe un singur animal.
Dacă rezultatul acestui test, obținut conform procedurii descrise, arată că substanța este corozivă sau foarte iritantă la nivel ocular, nu se efectuează teste suplimentare de iritație oculară.
1.4.2.5. Anestezice locale
Se pot utiliza anestezice locale de la caz la caz. Dacă analiza valorii probante a datelor arată că este posibil ca substanța să provoace durere sau dacă testul inițial arată că va avea loc o reacție dureroasă, se poate aplica un anestezic local înainte de instilarea substanței de testat. Se alege cu atenție tipul, concentrația și doza de anestezic local pentru a se asigura că utilizarea anestezicului nu determină reacții diferite la substanța de testat. Se anesteziază în mod similar și ochiul martor.
1.4.2.6. Testul de confirmare (Test in vivo de iritație oculară pe alte animale)
Dacă la testul inițial nu se observă un efect coroziv, reacția iritantă sau negativă se confirmă utilizând maximum alte două animale. Dacă la testul inițial se observă un efect puternic iritant care indică posibilitatea provocării unui efect puternic (ireversibil) în cadrul testului de confirmare, se recomandă ca testul de confirmare să se efectueze secvențial, pe câte un animal, și nu prin expunerea simultană a ambelor animale. Dacă la al doilea animal apar efecte corozive sau puternic iritante, testul se întrerupe. Este posibil să fie necesară testarea altor animale pentru confirmarea unor reacții iritante slabe sau moderate.
1.4.2.7. Perioada de observație
Durata perioadei de observație trebuie să fie suficientă pentru evaluarea completă a amplorii și a reversibilității efectelor observate. Cu toate acestea, experimentul se încheie în momentul în care animalul manifestă semne persistente de suferință sau dureri profunde (9). Pentru a determina reversibilitatea efectelor, animalele sunt puse observație timp de 21 de zile după administrarea substanței de testat. Dacă reversibilitatea intervine înainte de expirarea celor 21 de zile, experimentul se încheie în acel moment.
1.4.2.7.1. Observații clinice și punctarea reacțiilor oculare
Ochii se examinează la 1, 24, 48 și 72 de ore de la aplicarea substanței de testat. Animalele nu sunt menținute în experiment mai mult decât este necesar pentru obținerea unor informații concludente. Animalele care prezintă semne persistente de durere sau suferință profunde sunt eutanasiate imediat, iar substanța se evaluează în consecință. Animalele care după instilare prezintă următoarele leziuni oculare sunt eutanasiate: perforare corneană sau ulcerare corneană semnificativă, inclusiv stafilom; sânge în camera anterioară a ochiului; opacitate corneană de gradul 4 care persistă timp de 48 de ore; absența reflexului fotomotor (reacție a irisului de gradul 2) care persistă timp de 72 de ore; ulcerare a membranei conjunctivale; necroză a conjunctivelor și a membranei nictitante; sau desprinderea țesutului necrozat. Eutanasierea se justifică întrucât astfel de leziuni sunt, în general, ireversibile.
Animalele care nu prezintă leziuni oculare pot fi eutanasiate după cel puțin 3 zile de la instilare. Animalele care prezintă leziuni ușoare și moderate sunt supuse observației până la dispariția leziunilor sau timp de 21 de zile, moment în care studiul se încheie. Animalele sunt examinate la 7, 14 și 21 de zile, pentru a determina starea, reversibilitatea sau ireversibilitatea leziunilor.
Nivelul reacției oculare (conjunctive, cornee și iris) se înregistrează la fiecare examinare (tabelul I). Se înregistrează, de asemenea, orice altă leziune oculară (de exemplu, panus, colorare) și orice efecte sistemice adverse.
Pentru a facilita examinarea reacțiilor, se pot utiliza o lupă binoculară, o lampă portabilă cu fantă, un biomicroscop sau un alt dispozitiv adecvat. După înregistrarea observațiilor la 24 de ore, examinarea ochilor se poate face cu ajutorul fluoresceinei.
Punctarea reacțiilor oculare este evident subiectivă. Pentru a promova armonizarea punctării reacțiilor oculare și pentru a veni în sprijinul laboratoarelor de testare și a persoanelor implicate în efectuarea și interpretarea observațiilor, personalul care efectuează observațiile trebuie să fie instruit corespunzător cu privire la sistemul de punctaj utilizat.
2. DATE
2.2. EVALUAREA REZULTATELOR
Punctajele iritației oculare se evaluează în legătură cu natura și gravitatea leziunilor, precum și cu reversibilitatea sau ireversibilitatea acestora. Punctajele individuale nu reprezintă un standard absolut pentru proprietățile iritante ale unui material de testat, întrucât se evaluează și alte efecte ale materialului. În schimb, punctajele individuale trebuie privite ca valori de referință și nu sunt semnificative decât dacă sunt însoțite de o descriere și o evaluare completă a tuturor observațiilor.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare include următoarele informații:
Motivația pentru testarea in vivo: analiza valorii probante a datelor existente din teste anterioare, inclusiv a rezultatelor strategiei de testare secvențiale
— descrierea datelor relevante disponibile din testele anterioare;
— date derivate din fiecare etapă a strategiei de testare;
— descrierea testelor in vitro efectuate, inclusiv detalii privind procedurile, rezultatele obținute cu substanțele de testat/de referință;
— descrierea studiului in vivo de iritație/coroziune dermică efectuat, inclusiv rezultatele obținute;
— analiza valorii probante a datelor pentru efectuarea studiului in vivo.
Substanța de testat:
— date de identificare (de exemplu, numărul CAS, sursă, puritate, impurități cunoscute, numărul lotului);
— natura fizică și proprietățile fizico-chimice (de exemplu, pH, volatilitate, solubilitate, stabilitate, reactivitatea cu apă);
— în cazul unui amestec, compoziția și procentajele relative ale componentelor;
— dacă se utilizează anestezic local, identificare, puritate, doză și potențial de interacțiune cu substanța de testat.
Vehicul:
— identificare, concentrație (dacă este cazul), volumul utilizat;
— justificarea alegerii vehiculului.
Animale de experiență:
— specie/sușă utilizată, motivație pentru utilizarea altor animale decât iepurele albinos;
— vârsta fiecărui animal la începutul studiului;
— numărul de animale de fiecare sex participante la test și în grupurile de control (dacă este cazul);
— greutatea fiecărui animal la începutul și la sfârșitul testului;
— sursă, condiții de adăpostire, hrănire etc.
Rezultate:
— descrierea metodei utilizate pentru punctarea iritației în fiecare moment de observație (de exemplu, lampă portabilă cu fantă, biomicroscop, fluoresceină);
— un tabel cu datele privind reacțiile iritante/corozive la fiecare animal în fiecare moment de observare, până la excluderea din test a fiecărui animal;
— o descriere narativă a gravității și a naturii iritației sau a coroziunii observate;
— o descriere a oricăror alte leziuni observate la nivel ocular (de exemplu, vascularizare, formarea unui panus, aderențe, colorare);
— descrierea efectelor adverse locale non-oculare și sistemice și a concluziilor examenului histopatologic, dacă sunt disponibile.
Discutarea rezultatelor.
3.2. INTERPRETAREA REZULTATELOR
Extrapolarea rezultatelor studiilor de iritație oculară asupra animalelor la oameni este valabilă doar într-o măsură restrânsă. În multe cazuri, iepurele albinos este mai sensibil decât oamenii la substanțe cu proprietăți iritante sau corozive la nivel ocular.
La interpretarea datelor se acordă o atenție specială excluderii iritației generate de infecții secundare.
4. REFERINȚE BIBLIOGRAFICE
1. Barratt, M. D., Castell, J. V., Chamberlain, M., Combes, R. D., Dearden, J. C., Fentem, J. H., Gerner, I., Giuliani, A., Gray, T. J. B., Livingston, D. J., Provan, W. M., Rutten, F. A. J. J. L., Verhaar, H. J. M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410-429.
2. de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K. G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K. C., Hill, R. N. (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, 159-164.
3. Worth A. P. and Fentem J. H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, 161-177
4. Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26.
5. Neun, D. J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231.
6. Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
6a. Metoda de testare B.40. Coroziunea cutanată.
7. Metoda de testare B.4. Toxicitate acută: iritație/coroziune dermică.
8. OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
9. OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
10. OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd.org/ehs/test/monos.htm).
Tabelul 1
Punctarea leziunilor oculare
Cornee
Opacitate: nivel de densitate (examinarea se face în zona cea mai densă) ( 15 )
|
Fără ulcerare sau opacitate … |
0 |
|
Zone dispersate sau difuze de opacitate (altele decât o ușoară atenuare a strălucirii normale); detaliile irisului clar vizibile … |
1 |
|
Zonă translucidă ușor perceptibilă; detaliile irisului ușor mascate … |
2 |
|
Zonă sidefată: detaliile irisului invizibile; dimensiunea pupilei greu perceptibilă … |
3 |
|
Cornee opacă; iris invizibil din cauza opacității … |
4 |
Maximum posibil: 4
Iris
|
Normal … |
0 |
|
Pliuri vizibil mai adânci, congestie, tumefiere, hiperhemie pericorneană moderată sau conjunctivă injectată; iris reactiv la lumină (o reacție lentă este considerată a fi un efect) … |
1 |
|
Hemoragie, distrugere marcată sau absența reacției la lumină … |
2 |
Maximum posibil: 2
Conjunctive
|
Roșeață (se aplică conjunctivelor palpebrală și oculară, exclusiv corneei și irisului) Normal … |
0 |
|
Hiperhemie evidentă a anumitor vase sanguine (ochi injectați) … |
1 |
|
Colorație purpurie difuză; vasele individuale greu perceptibile … |
2 |
|
Colorație roșie susținută difuză … |
3 |
Maximum posibil: 3
Chemosis
Tumefiere (se referă la pleoape și/sau la membranele nictitante)
|
Normal … |
0 |
|
Tumefiere superioară stării normale … |
1 |
|
Tumefiere evidentă, cu eversiunea parțială a pleoapelor … |
2 |
|
Tumefiere cu pleoapele aproape pe jumătate închise … |
3 |
|
Tumefiere cu pleoape mai mult decât jumătate închise … |
4 |
Maximum posibil: 4
APENDICE
O strategie de testare secvențială pentru iritația și coroziunea oculară
CONSIDERENTE GENERALE
În interesul acurateței științifice și al bunăstării animale, este important să se evite utilizarea inutilă a animalelor de experiență și să se reducă la minimum testările care pot produce reacții grave la animale. Este necesar să se evalueze toate informațiile privind o substanță care sunt relevante pentru potențialul său caracter coroziv/iritant la nivel ocular înainte de luarea în considerare a testării in vivo. Este posibil să existe deja date suficiente pentru clasificarea unei substanțe de testat din punctul de vedere al potențialului său coroziv/iritant la nivel ocular, fără a mai fi necesar să se efectueze teste pe animale de laborator. Prin urmare, prin utilizarea unei analize a valorii probante a datelor și a unei strategii de testare secvențiale, se reduce la minimum necesitatea de a efectua teste in vivo, în special dacă substanța are potențialul de a produce reacții grave.
Se recomandă utilizarea unei analize a valorii probante a datelor pentru a evalua informațiile existente privind potențialul iritant și coroziv al substanțelor la nivel ocular și a stabili dacă este necesară efectuarea unor studii suplimentare, altele decât studii oculare in vivo, pentru caracterizarea acestui potențial. Dacă sunt necesare studii suplimentare, se recomandă aplicarea strategiei de testare secvențiale pentru obținerea datelor experimentale relevante. Pentru substanțele care nu au fost testate anterior, se recomandă aplicarea strategiei de testare secvențiale pentru obținerea datelor necesare pentru evaluarea potențialului său coroziv/iritant la nivel ocular. Strategia de testare descrisă în prezentul apendice a fost dezvoltată în cadrul unui atelier de lucru OCDE (1). Ulterior, ea a fost susținută și extinsă în cadrul Sistemului armonizat integrat de clasificare a riscurilor substanțelor chimice pentru sănătatea oamenilor și mediu (Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances), adoptat la a 28-a reuniune comună a Comitetului pentru substanțe chimice și a Grupului de lucru pentru substanțe chimice, în noiembrie 1998 (2).
Deși această strategie de testare nu face parte integrantă din metoda de testare B.5, ea reprezintă abordarea recomandată pentru determinarea caracteristicilor iritante/corozive la nivel ocular. Această abordare reprezintă atât cea mai bună practică, cât și un reper etic pentru testarea in vivo pentru iritație/coroziune oculară. Metoda de testare oferă indicații pentru efectuarea testului in vivo și rezumă factorii care trebuie evaluați înainte de un astfel de test. Strategia de testare secvențială oferă o abordare bazată pe analiza valorii probante a datelor pentru evaluarea datelor existente privind proprietățile iritante/corozive la nivel ocular ale substanțelor și o abordare graduală pentru generarea datelor relevante pentru substanțele pentru care sunt necesare studii suplimentare sau care nu au făcut încă obiectul unor studii. Strategia include, într-o primă etapă, efectuarea unor teste in vitro sau ex vivo validate și acceptate, iar apoi aplicarea metodei de testare B.4 pentru coroziune/iritație dermică în condiții specifice (3) (4).
DESCRIEREA STRATEGIEI DE TESTARE SECVENȚIALE
Înainte de efectuarea testelor incluse în strategia de testare secvențială (figură), se evaluează toate informațiile disponibile pentru a stabili dacă este necesară testarea oculară in vivo. Deși se pot obține informații semnificative din evaluarea unor parametri specifici (de exemplu, o valoare extremă a pH-ului), se iau în considerare toate informațiile existente. Se evaluează toate datele relevante privind efectele substanței în cauză și a analogilor săi pentru adoptarea unei decizii prin analiza valorii probante a datelor și se prezintă motivele care stau la baza deciziei. Se acordă o atenție specială datelor privind efectele substanței asupra oamenilor și animalelor, apoi rezultatelor testelor in vitro sau ex vivo. Se evită, ori de câte ori este posibil, efectuarea unor studii in vivo pentru substanțele corozive. Factorii luați în considerare în strategia de testare includ:
Evaluarea datelor privind efectele asupra oamenilor și animalelor (Etapa I). Se iau în primul rând în considerare datele existente privind efectele asupra oamenilor, de exemplu studii clinice și ocupaționale sau studii de caz, și/sau date obținute în cadrul unor studii oculare asupra animalelor, deoarece acestea furnizează informații direct legate de efectele asupra ochilor. Apoi, se evaluează datele disponibile din studii de coroziune/iritație dermică asupra oamenilor și/sau animalelor. Nu se instilează în ochii animalelor substanțele având un caracter coroziv sau un potențial iritant sever cunoscut la nivel ocular sau substanțele care prezintă efecte corozive sau iritante la nivel dermic; acestea din urmă sunt considerate a fi corozive și/sau iritante și la nivel ocular. Nu este necesar să se efectueze studii in vivo nici asupra substanțelor pentru care există date suficiente, obținute din studii oculare anterioare, că nu sunt corozive sau iritante.
Analiza relațiilor structură-activitate (RSA) (Etapa 2). Se iau în considerare rezultatele testelor asupra substanțelor înrudite din punct de vedere structural, dacă sunt disponibile. Dacă sunt disponibile suficiente date privind efectele asupra oamenilor și/sau animalelor ale unor substanțe înrudite structural sau ale unor amestecuri de astfel de substanțe care indică un potențial coroziv/iritant la nivel ocular, se poate presupune că substanța în curs de evaluare va produce aceleași reacții. În astfel de cazuri, este posibil să nu fie necesare teste asupra substanței în cauză. Datele negative obținute de studiile asupra substanțelor înrudite structural sau asupra amestecurilor de astfel de substanțe nu constituie dovezi suficiente pentru caracterul necoroziv/neiritant al substanței supuse strategiei de testare secvențiale. Se utilizează abordări RSA validate și acceptate pentru a identifica potențialul coroziv și iritant atât la nivel dermic, cât și ocular.
Proprietățile fizico-chimice și reactivitatea chimică (Etapa 3). Substanțele care prezintă valori extreme ale pH-ului, ≤ 2,0 sau ≥ 11,5 pot produce efecte locale puternice. Dacă valorile extreme ale pH-ului constituie baza pentru identificarea unei substanțe ca fiind corozivă sau iritantă la nivel ocular, atunci se poate lua în considerare și rezerva sa acidă/alcalină (sau capacitatea de tamponare) (5) (6). În cazul în care capacitatea de tamponare sugerează că este posibil ca substanța să nu fie corozivă la nivel ocular, se efectuează teste suplimentare pentru confirmare, de preferat prin utilizarea unui test in vitro sau ex vivo validat și acceptat (a se vedea etapele 5 și 6 din această secțiune).
Analiza altor informații existente (Etapa 4). În această etapă se evaluează toate informațiile disponibile privind toxicitatea sistemică prin absorbție cutanată. Se ia, de asemenea, în considerare toxicitatea dermică acută a substanței. Dacă substanța de testat s-a dovedit foarte toxică prin absorbție cutanată, este posibil să nu fie necesare teste oculare. Deși nu există obligatoriu o relație între toxicitate dermică acută și iritația/coroziunea oculară, se poate presupune că un agent foarte toxic prin absorbție cutanată va prezenta o toxicitate ridicată la instilarea în ochi. Astfel de date pot fi analizate, de asemenea, între etapele 2 și 3.
Rezultatele testelor in vitro sau ex vivo (Etapele 5 și 6). Substanțele care au prezentat proprietăți corozive sau puternic iritante într-un test in vitro sau ex vivo (7) (8) validat și acceptat pentru evaluarea specifică a coroziunii/iritației la nivel dermic sau ocular, nu trebuie să fie testate pe animale. Se poate presupune că substanțele în cauză vor produce efecte similare grave in vivo. Dacă nu sunt disponibile teste in vitro/ex vivo validate și acceptate, se trece peste etapele 5 și 6 și se continuă direct cu etapa 7.
Evaluarea caracterului iritant sau coroziv la nivel dermic al substanței in vivo (Etapa 7). În cazul în care nu există informații suficiente pentru analiza valorii probante a datelor privind potențialul iritant/coroziv la nivel ocular al unei substanțe pe baza studiilor enumerate anterior, se evaluează mai întâi potențialul iritant/coroziv la nivel dermic, utilizând metoda de testare B.4 (4) și apendicele său (9). Dacă se observă că substanța produce coroziune sau iritație puternică la nivel dermic, ea este considerată a fi, de asemenea, corozivă sau iritantă la nivel ocular, cu excepția cazului în care informațiile disponibile conduc la o concluzie diferită. Astfel, nu este necesar să se efectueze un test ocular in vivo. Dacă substanța nu este corozivă sau puternic iritantă la nivel dermic, se efectuează un test ocular in vivo.
Testul in vivo pe iepuri (Etapele 8 și 9). Testul ocular in vivo începe cu un test inițial efectuat pe un singur animal. Dacă rezultatele acestui test indică că substanța este puternic iritantă sau corozivă la nivel ocular, nu se efectuează teste suplimentare. Dacă testul nu relevă efecte corozive sau puternic iritante, se efectuează un test de confirmare pe alte două animale.
REFERINȚE BIBLIOGRAFICE
1. OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
2. OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
3. Worth, A. P. and Fentem J. H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161-177.
4. Metoda de testare B.4. Toxicitate acută: iritație/coroziune dermică.
5. Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26.
6. Neun, D. J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231.
7. Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsail, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483-524.
8. Metoda de testare B.40 Coroziunea cutanată.
9. Apendicele la metoda de testare B.4: O strategie de testare secvențială pentru iritație și coroziune dermică.
Figură
Strategie de testare și evaluare a iritației/coroziunii oculare


B.6. SENSIBILIZARE CUTANATĂ
1. METODĂ
1.1. INTRODUCERE
Observații
Sensibilitatea și capacitatea testelor de a detecta substanțele capabile să provoace o sensibilizare cutanată la om reprezintă criterii importante în sistemul de clasificare a toxicității din motive de sănătate publică.
Nu există o metodă de testare unică care să permită identificarea adecvată a tuturor substanțelor cu un potențial de sensibilizare cutanată la om și care să fie aplicabilă tuturor substanțelor.
Diverși factori, cum ar fi proprietățile fizice ale unei substanțe, inclusiv capacitatea sa de a penetra pielea, trebuie luați în considerare atunci când se alege metoda de testare.
Au fost dezvoltate două tipuri de teste la care se folosesc cobai: pe de o parte, testele cu adjuvant la care starea alergică este potențializată prin dizolvarea sau suspendarea substanței testate în adjuvantul complet Freund (ADF) și fără adjuvant, pe de altă parte.
Testele cu folosirea adjuvantului au o capacitate mai bună de evidențiere a potențialul de sensibilizare cutanată a substanței testate și o mai mare precizie decât testele care nu utilizează adjuvantul complet Freund.
Testul de maximizare la cobai (GPMT: Guinea Pig Maximisation Test) este un test cu adjuvant foarte răspândit. Cu toate că există mai multe metode pentru detectarea potențialului de sensibilizare cutanată, testul GPMT este testul cu adjuvant folosit cu predilecție.
Testele fără adjuvant (testul Buehler este de preferat) sunt considerate a fi mai puțin sensibile în ceea ce privește numeroase clase de produse chimice.
În unele cazuri există motive întemeiate în vederea alegerii testului Buehler, care constă într-o aplicare topică, pe când testul de maximizare necesită o injecție intradermică. Utilizarea testului Buehler trebuie justificată din punct de vedere științific.
Testul de maximizare la cobai GMPT și testul Buehler sunt descrise în cadrul acestei metode. Se pot folosi și alte metode, cu condiția ca ele să fi fost validate în mod corespunzător, iar utilizarea lor să fie argumentată din punct de vedere științific.
Dacă se obține un rezultat pozitiv în cadrul unui test de depistare recunoscut, substanța poate fi considerată ca potențial sensibilizantă și se poate să nu mai fie necesară efectuarea unui test suplimentar pe cobai. Cu toate acestea, dacă s-a obținut un test negativ într-un asemenea test, trebuie efectuat un test pe cobai, utilizându-se procedura descrisă la prezenta metodă de testare.
A se vedea și introducerea generală, partea B.
1.2. DEFINIȚII
Sensibilizarea cutanată (dermatita alergică de contact) reprezintă o reacție imunologică cutanată la o substanță. La om, reacția se poate caracteriza prin apariția pruritului, a unui eritem, al unui edem, a unor vezicule sau papule sau prin asocierea acestor manifestări. La alte specii, reacția poate fi diferită și se poate manifesta doar sub forma unor eriteme sau edeme.
Expunere de inducție: expunere experimentală a unui subiect la o substanță cu scopul de a provoca o hipersensibilitate.
Perioadă de inducție: o perioadă de cel puțin o săptămână după expunerea de inducție, în cursul căreia poate apărea o stare de hipersensibilitate.
Expunere de declanșare: expunere experimentală, după o perioadă de inducție, a unui subiect expus în prealabil substanței respective, cu scopul de a verifica dacă subiectul va avea o reacție hipersenzitivă.
1.3. SUBSTANȚE DE REFERINȚĂ
Sensibilitatea și fiabilitatea tehnicii de testare utilizate trebuie să fie verificate din șase în șase luni, cu ajutorul unor substanțe care au proprietăți cunoscute de sensibilizare cutanată de la slab la moderat.
La testele efectuate în mod corect, substanțele cu proprietăți sensibilizante slabe sau moderate provoacă în mod normal o reacție la cel puțin 30 % dintre animale, la metodele cu adjuvant și la 15 % dintre ele, la metodele fără adjuvant.
Se vor utiliza, de preferință, următoarele substanțe.
|
Număr CAS |
Număr EINECS |
Denumire EINECS |
Denumire uzuală |
|
101-86-0 |
202-983-3 |
α-hexilcinamaldehidă |
α-hexilcinamaldehidă |
|
149-30-4 |
205-736-8 |
benzotiazol-2-tiol (mercaptobenzotiazol) |
kaptax |
|
94-09-7 |
202-303-5 |
benzocaină |
nordcaină |
În unele cazuri justificate în mod suficient, se pot folosi și alte substanțe martor, care să răspundă criteriilor de mai sus.
1.4. PRINCIPIUL METODEI DE TESTARE
Inițial animalele de experiență sunt expuse substanței testate printr-o injecție intradermică și/sau prin aplicare epidermică (expunere de inducție). După o perioadă de odihnă de la 10 la 14 zile (perioada de inducție) în cursul căreia se poate produce o reacție imunitară, animalele sunt supuse unei doze de declanșare. Suprafața și intensitatea reacției cutanate a animalelor se compară cu cele ale animalelor martor cărora li s-a administrat placebo cu ocazia inducerii și care au fost supuse expunerii de declanșare.
1.5. DESCRIEREA METODELOR DE TESTARE
Dacă se dovedește necesară eliminarea substanței testate, acest lucru se va face utilizându-se apă sau un solvent adecvat, astfel încât să nu se modifice reacția existentă sau integritatea epidermei.
1.5.1. Testul de maximizare la cobai (GMPT)
1.5.1.1.
Exemplare tinere de cobai albinoși, în stare bună de sănătate, se aclimatizează în condițiile de laborator, cel puțin cu cinci zile înaintea începerii testului. Înainte de începerea testului, animalele sunt distribuite aleator în grupuri care urmează a fi tratate și loturi martor. Blana va fi tunsă, rasă sau epilată chimic, în funcție de metoda utilizată. Pielea animalelor nu trebuie să fie jupuită. Animalele sunt cântărite, atât înaintea începerii testului, precum și după încheierea acestuia.
1.5.1.2.
1.5.1.2.1. Animalele de experiență
Linii pure de cobai albinos folosite în mod curent în laboratoare.
1.5.1.2.2. Număr și sex
Se vor folosi animale de același sex, indiferent care este acesta. Dacă se vor folosi femele, acestea trebuie să fie nulipare și nu trebuie să fie însărcinate.
Se vor folosi minimum 10 animale în grupul tratat și cel puțin 5 în lotul martor. Dacă grupul tratat constă din mai puțin de 20 de animale, iar lotul martor din mai puțin de 10 și dacă în urma testului nu s-a putut conclude că substanța testată este o substanță sensibilizantă, se recomandă utilizarea și a altor animale pentru a se ajunge la un număr total de cel puțin 20 de animale de experiență și 10 martor.
1.5.1.2.3. Doze
Concentrația de substanță administrată la expunerea de inducție trebuie să fie bine tolerată de organismul animalelor și trebuie să corespundă concentrației maxime care provoacă o iritație cutanată ușoară și moderată. Concentrația folosită pentru expunerea de declanșare trebuie să corespundă concentrației maxime care nu provoacă nicio iritație. Dacă este necesar, concentrațiile adecvate pot fi determinate pe baza unui test-pilot pe două sau pe trei animale. În acest scop, se vor utiliza animale tratate cu adjuvantul complet Freund.
1.5.1.3.
1.5.1.3.1. Inducerea
Ziua 0 – grupul tratat
Trei serii de injecții intradermice de un volum de câte 0,1 ml fiecare se vor administra în regiunea scapulară de unde a fost îndepărtată blana, în prealabil, de o parte și de cealaltă a liniei mediane.
Injecția 1: amestec 1:1 (v/v) adjuvant complet Freund/apă sau ser fiziologic
Injecția 2: substanța testată într-un vehicul adecvat la concentrația aleasă
Injecția 3: substanța de testat la concentrația dorită, amestec 1:1 (v/v) cu adjuvantul complet Freund sau cu ser fiziologic
La injecția 3, substanțele solubile în apă sunt dizolvate în faza apoasă înainte de a fi amestecate cu adjuvantul complet Freund sau cu serul fiziologic. Substanțele liposolubile sau insolubile sunt mai întâi suspendate în adjuvantul complet Freund și mai apoi în faza apoasă. Concentrația finală a substanței testate trebuie să fie egală cu cea utilizată la injecția 2.
Injecțiile 1 și 2 sunt administrate aproape una de cealaltă și cât mai aproape de cap, iar injecția 3 va fi administrată spre partea caudală a zonei de testare.
Ziua 0 – lotul martor
Trei serii de câte două injecții intradermice cu un volum de câte 0,1 ml fiecare se vor administra în aceeași regiune ca la animalele tratate.
Injecția 1: amestec 1:1 (v/v) adjuvant complet Freund/apă sau ser fiziologic
Injecția 2: vehiculul nediluat
Injecția 3: formulă de 50 % a vehiculului într-un amestec 1:1 (v/v) adjuvantul complet Freund/apă sau cu ser fiziologic
Ziua 5-7 – grupul tratat, lotul martor
Aproximativ cu 24 de ore înainte de aplicarea topică de inducție și în cazul în care substanța nu a provocat iritații cutanate, zona de testare rasă și/sau tunsă va fi tratată cu 0,5 ml de sulfat de lauril de sodiu în concentrație de 10 % în vaselină, astfel încât să se provoace o iritație locală.
Ziua 6-8 – grupul tratat
De pe zona de testare se îndepărtează din nou blana. O bucată de hârtie de filtru (2 × 4 cm) îmbibată cu substanța testată și cu vehiculul adecvat se aplică pe zona de testare și se menține în contact cu pielea cu ajutorul unui pansament oclusiv, timp de 48 de ore. Alegerea vehiculului trebuie justificată. Substanțele solide sunt pulverizate și incorporate într-un vehicul adecvat; eventual, substanțele lichide pot fi aplicate direct.
Ziua 6-8 – lotul martor
De pe zona de testare se îndepărtează din nou blana. Se aplică doar vehiculul pe zona de testare, după indicațiile de mai sus și se menține în contact cu pielea cu ajutorul unui pansament oclusiv, timp de 48 de ore.
1.5.1.3.2. Declanșare
Ziua 20-22 – grupul tratat și lotul martor
Se îndepărtează blana de pe șoldurile animalelor tratate și de pe șoldurile animalelor martor. Un plasture sau o capsulă îmbibate cu substanța testată se aplică pe unul dintre șoldurile animalelor și dacă este necesar, un plasture sau o capsulă îmbibate doar cu vehicul se aplică pe celălalt șold. Plasturele se vor menține în contact cu pielea timp de 24 de ore cu ajutorul unui pansament oclusiv.
— la aproximativ 21 de ore după înlăturarea plasturelui, zona de testare se curăță și se rade și/sau se tunde și se epilează dacă este necesar;
— aproximativ 3 ore mai târziu (aproximativ la 48 de ore după începutul aplicării dozei de declanșare), reacția cutanată este examinată și cotată pe baza scalei indicate în apendice;
— aproximativ 24 de ore după această examinare, urmează o nouă perioadă de examinare (la 72 ore) și o nouă cotare.
Se recomandă o citire oarbă a animalelor din ambele grupuri.
Dacă este necesară precizarea rezultatelor obținute cu ocazia primei expuneri de declanșare, o a doua expunere în vederea declanșării unei reacții (și anume o redeclanșare), eventual cu un alt lot martor, poate fi avută în vedere, aproximativ cu o săptămână după prima expunere. Noua expunere în vederea declanșării unei reacții se poate efectua, de asemenea, pe lotul martor inițial.
Toate observațiile și toate reacțiile cutanate, inclusiv cele sistemice, ca urmare a unei expuneri de inducție sau de declanșare trebuie examinate și cotate pe baza scalei Magnusson/Kligman (a se vedea apendicele). Alte tehnici, cum ar fi examinarea histopatologică sau măsurarea pliului cutanat, pot fi folosite la descrierea unor reacții îndoielnice.
1.5.2. Testul Buehler
1.5.2.1.
Exemplare tinere de cobai albinoși, în stare bună de sănătate, sunt lăsați să se aclimatizeze la condițiile de laborator cel puțin cu cinci zile înaintea începerii testului. Înainte de începerea testului, animalele sunt distribuite aleator în grupuri care urmează a fi tratate și grupuri martor. Blana va fi tunsă, rasă sau epilată chimic, în funcție de metoda utilizată. Pielea animalelor nu trebuie să fie jupuită. Animalele sunt cântărite atât înainte de începerea testului, precum și după încheierea acestuia.
1.5.2.2.
1.5.2.2.1. Animalele de experiență
Linii pure de cobai albinos folosite în mod curent în laboratoare.
1.5.2.2.2. Număr și sex
Se vor folosi animale de același sex, indiferent care este acesta. Dacă se vor folosi femele, acestea trebuie să fie nulipare și nu trebuie să fie însărcinate.
Se vor folosi minimum 20 animale în grupul tratat și cel puțin 10 în lotul martor.
1.5.2.2.3. Doze
Concentrația de substanță administrată la expunerea de inducție trebuie să corespundă concentrației maxime care provoacă o iritație cutanată moderată, dar nu exagerată. Concentrația folosită pentru expunerea de declanșare trebuie să corespundă concentrației maxime care nu provoacă nicio iritație. Dacă este necesar, concentrațiile potrivite pot fi determinate pe baza unui test-pilot pe două sau pe trei animale.
La substanțele hidrosolubile se va folosi apa ca vehicul sau o soluție diluată neiritantă de surfactant. La celelalte substanțe, se va utiliza de preferință un amestec de etanol de 80 % în apă, la inducere și de acetonă la declanșare.
1.5.2.3.
1.5.2.3.1. Inducerea
Ziua 0 – grupul tratat
Se îndepărtează blana de pe unul din șoldurile animalelor. Compresa care va servi la efectuarea testului se îmbibă cu substanța testată, incorporată într-un vehicul adecvat (alegerea vehiculului trebuie justificată; dacă este necesar, substanțele lichide pot fi aplicate în mod direct).
Compresa se aplică pe zona de testare și se menține în contact cu pielea timp de 6 ore cu ajutorul unui plasture oclusiv sau al unei capsule și al unui pansament potrivit.
Sistemul trebuie să fie oclusiv. Un tampon de vată circular sau pătrat de 4-6 cm2 este potrivit. Se va utiliza de preferință un dispozitiv de asigurare a etanșeității plasturelui pentru a asigura caracterul oclusiv. Dacă au fost folosite pansamente, o expunere suplimentară poate fi necesară.
Ziua 0 – lotul martor
Se îndepărtează blana de pe unul din șoldurile animalelor. Se aplică doar vehiculul pe zona de testare, după indicațiile de mai sus, la animalele tratate. Compresa care servește la realizarea testului se menține în contact cu pielea cu ajutorul unui plasture oclusiv sau al unei capsule și al unui pansament potrivit. Dacă se poate demonstra faptul că simularea tratamentului pe lotul martor nu este necesară, această etapă poate fi omisă, utilizându-se un lot martor căruia nu i se administrează nimic.
Zilele 6-8 și 13-15 – grupul tratat și lotul martor
Același tratament ca cel descris pentru ziua 0 se aplică pe aceeași zonă de testare (de unde se îndepărtează blana, dacă acest lucru este necesar), pe același șold, în ziua 6-8 și din nou în ziua 13-15.
1.5.2.3.2. Declanșare
Ziua 27-29 – grupul tratat și lotul martor
Se îndepărtează blana de pe șoldurile netratate ale animalelor tratate și ale animalelor martor. Un plasture oclusiv sau o capsulă care conține cantitatea adecvată din substanța testată, la concentrația maximă care nu provoacă nicio iritație, se aplică pe partea posterioară a șoldului netratat al animalelor din grupul tratat și din cel martor.
Dacă este necesar, se aplică și un plasture oclusiv sau o capsulă care nu conține decât vehiculul, pe partea anterioară a șoldului netratat al animalelor din ambele grupuri. Plasturele sau capsulele se vor menține în contact cu pielea timp de 6 de ore, cu ajutorul unui pansament potrivit.
1.5.2.3.3. Examinare și cotare
— la aproximativ 21 de ore după înlăturarea plasturelui, de pe zona de testare se îndepărtează blana;
— cu aproximativ 3 ore mai târziu (aproximativ 30 de ore după începutul aplicării dozei de declanșare), reacția cutanată este examinată și cotată pe baza scalei indicate în apendice;
— la aproximativ 24 de ore după această examinare (aproximativ 54 de ore după aplicarea dozei de declanșare), reacția cutanată este din nou examinată și cotată.
Se recomandă o citire oarbă a reacțiilor, atât în grupul tratat, precum și în lotul martor.
Dacă este necesară precizarea rezultatelor obținute cu ocazia primei expuneri de declanșare, o a doua expunere în vederea declanșării unei reacții, eventual cu un alt lot martor, poate fi avută în vedere, aproximativ cu o săptămână după prima expunere. Noua expunere în vederea declanșării unei reacții se poate efectua, de asemenea, pe primul lot martor.
Toate reacțiile cutanate și toate reacțiile neobișnuite, inclusiv reacțiile sistemice, ca urmare a unei expuneri de inducție sau de declanșare (de redeclanșare) trebuie înregistrate și cotate pe baza scalei Magnusson/Kligman (a se vedea apendicele). Alte tehnici, cum ar fi examinarea histopatologică sau măsurarea pliului cutanat, pot fi folosite la descrierea unor reacții îndoielnice.
2. DATE (GMPT și testul Buehler)
Rezultatele sunt sintetizate și incluse într-un tabel care va indica reacțiile cutanate la fiecare animal, pentru fiecare examinare.
3. RAPORT (GMPT și testul Buehler)
Dacă înainte de testul efectuat pe cobai s-a efectuat și un test de depistare [de exemplu, testul de umflare a urechilor la șoareci (MEST)], trebuie furnizate descrierile sau referințele acestora, precum și detaliile modului de operare și rezultatele obținute cu substanța testată și cu substanța de referință.
Raportul de testare (GMPT sau testul Buehler)
Raportul de testare va conține, în măsura posibilităților, următoarele informații:
Animale de experiență:
— specia/linia pură;
— numărul animalelor, vârsta, sexul;
— originea, condiții de adăpostire, regim alimentar etc.;
— greutatea corporală a fiecărui animal la începutul testului.
Condiții de testare:
— tehnici de preparare a zonei de testare;
— detalii asupra materialelor folosite pentru aplicarea substanței și tehnica aplicării plasturelui;
— rezultatele testului-pilot și concluziile privind concentrațiile de inducție și de declanșare care trebuie utilizate în cadrul testului;
— detalii privind prepararea, aplicarea și eliminarea substanței testate;
— justificarea alegerii vehiculului;
— concentrații ale vehiculului și ale substanței testate utilizate pentru expunerile de inducție și de declanșare, cantitatea totală a substanței aplicate în vederea inducerii și a declanșării.
Rezultate:
— sintetizarea rezultatelor ultimului control de sensibilitate și de fiabilitate (a se vedea 1.3), inclusiv informații cu privire la substanță, la concentrația acesteia și la vehiculul utilizat;
— toate examinările efectuate pe fiecare animal, inclusiv cotările;
— descrierea naturii și a gravității efectelor observate;
— toate examinările histopatologice.
Evaluarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
Această metodă corespunde Orientării 406 a OCDE.
Apendice
TABEL
Scala de cotare Magnusson/Kligman pentru evaluarea reacțiilor declanșate pe locul aplicării plasturilor
0 = niciun semn vizibil
1 = eritem discret sau neomogen
2 = eritem moderat și confluent
3 = eritem cu inflamație masivă
B.7. TOXICITATE (ORALĂ) PRIN ADMINISTRARE ÎN MOD REPETAT (28 DE ZILE)
1. METODĂ
1.1. INTRODUCERE
A se vedea și introducerea generală, partea B.
1.2. DEFINIȚII
A se vedea și introducerea generală, partea B.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța testată va fi administrată zilnic, pe cale orală, cu doze crescânde, la mai multe grupuri de animale de experiență, cu un singur nivel de doză pe grup de animale timp de 28 de zile. Pe perioada administrării, animalele sunt examinate cu atenție zilnic, în vederea detectării eventualelor manifestări toxice. Animalele care au murit sau care au fost sacrificate în cursul testului, precum și cele care supraviețuiesc până la sfârșitul testului, se supun unei autopsii.
Această metodă insistă mai ales pe efectele neurologice; examinările clinice trebuie efectuate în mod riguros, pentru a se obține un maximum de informații posibil. Metoda are în vedere identificarea produselor chimice cu un potențial neurotoxic, care ar trebui supus unor studii mai aprofundate. Pe lângă aceasta, metoda prezentată mai poate furniza indicații asupra efectelor imune și asupra toxicității substanței cu privire la organele reproducătoare.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătirea testului
Exemplare tinere de animale adulte, cu stare bună de sănătate, sunt distribuite aleator în grupuri care urmează a fi tratate și în loturi martor. Cuștile sunt distribuite astfel încât să se minimizeze eventualele efecte datorate amplasării cuștilor. Animalele sunt identificate individual și ținute în cuști timp de cel puțin cinci zile înainte de începerea testului, pentru a se putea adapta la condițiile de laborator.
Substanța se va administra prin gavaj sau prin hrană/apa de băut. Metoda administrării orale depinde de scopul studiului și de proprietățile fizice și chimice ale substanței.
Dacă este necesar, substanța de test se va dizolva sau suspenda într-un vehicul adecvat. Dacă este posibil se va folosi de preferință o soluție/suspensie apoasă, dacă nu este posibil, se va recurge la o soluție/emulsie în ulei (de exemplu, ulei de porumb) sau eventual la alte vehicule. Dacă vehiculul utilizat nu este mediul apos, caracteristicile sale toxice trebuie să fie cunoscute sau să fie determinate înainte de începerea testului. Trebuie determinată și stabilitatea substanței testate în vehiculul respectiv.
1.4.2. Condiții de testare
1.4.2.1. Animalele de experiență
Testele se efectuează de preferință pe șobolani, dar pot fi utilizate și alte specii de rozătoare. Pentru testare sunt selecționate animale adulte, tinere și sănătoase din linii pure folosite în mod curent în laboratoare. Femelele trebuie să fie nulipare și nu trebuie să fie însărcinate. Administrarea substanței trebuie să înceapă cât se poate de repede după înțărcare și în toate cazurile înainte ca animalele să fi împlinit vârsta de 9 săptămâni.
La începutul studiului, diferențele de greutate corporală între animale trebuie să fie minime și să nu depășească ± 20 % a greutății medii la fiecare sex.
Atunci când se efectuează un studiu prin administrare orală repetată înaintea unui studiu mai lung, se recomandă folosirea animalelor de aceeași linie pură și origine la ambele studii.
1.4.2.2. Număr și sex
Se vor folosi minimum 10 animale (5 femele și 5 masculi) pentru fiecare doză. Dacă protocolul testului prevede sacrificii în cursul studiului, numărul de animale trebuit mărit cu numărul de animale care sunt sacrificate.
Pe lângă aceasta, un grup satelit de 10 animale (cinci din fiecare sex) poate fi tratat cu doza cea mai ridicată timp de 28 de zile și ținut sub observație timp de 14 zile după încheierea tratamentului pentru a se studia reversibilitatea, persistența sau apariția întârziată a efectelor toxice. Se va utiliza și un grup satelit martor, de 10 animale.
1.4.2.3. Doze
În general, se vor utiliza cel puțin trei grupuri tratate și un lot martor. Cu excepția substanței de testat, animalele din lotul martor au parte de același tratament ca animalele din grupurile tratate. Dacă s-a folosit un vehicul la administrarea substanței de testat, volumul maxim din acest vehicul va fi administrat grupului martor.
Dacă în urma evaluării unor date se poate estima că administrarea unei doze de 1 000 mg/kg greutate corporală/zi nu va avea niciun efect, se poate efectua un test-limită. Dacă nu există informații relevante, se poate proceda la un studiu de explorare în vederea determinării dozelor de administrat.
Dozele trebuie selecționate ținându-se cont de toate informațiile disponibile și de aspectele toxico-cinetice ale substanței testate sau ale substanțelor cu o structură analoagă. Doza cea mai ridicată va produce efecte toxice care să nu ducă însă la moarte sau la suferințe intense. Se va alege mai apoi o serie de doze descrescânde, pentru a se evidenția relația dintre reacție și doza administrată și pentru a obiectiviza absența efectelor dăunătoare la doza cea mai redusă (doza fără efecte dăunătoare). Diferența optimă dintre două doze este un factor 2 sau 4; este preferabil să se prevadă și o a patra doză, pentru ca distanța dintre două doze să nu fie prea mare (mai mult decât un factor 10, de exemplu).
La substanțele care sunt administrate prin hrană sau prin apă, este important să se verifice dacă cantitățile de substanță nu interferează cu nutriția normală și cu echilibrul hidric. Dacă substanța este administrată prin intermediul hranei, se poate utiliza o concentrație alimentară constantă (ppm) sau o doză constantă în raport cu greutatea animalului; soluția aleasă trebuie precizată. Dacă substanța va fi administrată prin gavaj, doza trebuie administrată zilnic la ore fixe și dacă este nevoie, se va și ajusta doza, astfel încât aceasta să rămână constantă în raport cu greutatea animalului.
Atunci când se efectuează un studiu prin administrare orală repetată înainte de un studiu pe lungă durată, regimul alimentar trebuie să fie indicat în ambele cazuri.
1.4.2.4. Testul-limită
Atunci când un test efectuat pe baza metodelor descrise în prezentul studiu, la o doză de cel puțin 1 000 mg/kilocorp/zi sau în cazul administrării prin hrană sau prin apa de băut, la o concentrație echivalentă (în funcție de greutatea corporală), nu produce efecte toxice detectabile și dacă informațiile despre substanțe cu structuri asemănătoare nu indică toxicitatea acesteia, efectuarea testului cu trei doze se poate dovedi a fi inutilă. În acest caz, un test-limită este justificat, cu excepția cazului în care condițiile de expunere umană impun utilizarea unei doze mai ridicate.
1.4.2.5. Perioada de observație
Perioada de observație durează 28 de zile. Animalele din grupurile satelit, prevăzute pentru examinări suplimentare sunt ținute sub observație, fără tratament timp de alte 14 zile cel puțin, astfel încât să se poată detecta eventualele apariții întârziate ale efectelor toxice, persistența, precum și reversibilitatea acestora.
1.4.3. Procedură
Substanța testată va fi administrată animalelor de experiență, timp de 7 zile din 7, pe o perioadă de 28 de zile. Dacă substanța nu este administrată decât câte cinci zile pe săptămână, această alegere trebuie justificată. În cazul administrării prin gavaj, doza trebuie administrată într-o singură doză cu ajutorul unei sonde esofagiene sau al unei canule de intubare adecvate. Volumul maxim de lichid care se poate administrat într-o singură doză depinde de mărimea animalului. Acest volum nu trebuie să depășească 1 ml/100 g greutate corporală, dar poate atinge 2 ml/100 g greutate corporală în cazul soluțiilor apoase. Cu excepția substanțelor iritante sau cu efecte corozive, la care mărirea concentrației ar duce la rezultate exacerbate, variabilitatea volumelor experimentale trebuie minimizată printr-o ajustare a concentrațiilor, astfel încât volumul să rămână constant, indiferent de doză.
1.4.3.1. Observații generale
Observația clinică generală trebuie efectuată cel puțin o dată zilnic, de preferință în același moment (sau aceleași momente) ale zilei, în funcție de perioada de după încheierea administrării în care efectele sunt mai pronunțate. Starea de sănătate a animalelor trebuie consemnată. Animalele sunt examinate cel puțin de două ori pe zi, toate animalele sunt examinate pentru a se determina morbiditatea sau mortalitatea. Animalele muribunde sau cele care prezintă semne de suferință intensă sau dureri sunt eliminate imediat, sacrificate cu suferință minimă și autopsiate.
Toate animalele sunt supuse unei observații clinice detaliate înaintea primei expuneri (astfel încât mai târziu să se poată facă comparații între diferitele stări de sănătate la același individ) și cel puțin o dată pe săptămână în perioada următoare. Aceste examinări trebuie efectuate în afara cuștii animalelor într-o incintă standard și trebuie efectuate de preferință de fiecare dată în același moment al zilei. Observațiile sunt înregistrate în mod riguros, de preferință cu ajutorul unor sisteme de notare formulate în mod explicit de către laboratorul în care se efectuează testul. Variabilitatea condițiilor de laborator trebuie redusă la minim, iar examinările trebuie să se facă de preferință de către persoane care nu sunt informate asupra tratamentului. Examinările vor avea în vedere între altele modificări ale pielii, ale ochilor, ale mucoaselor, ale secrețiilor și ale excrețiilor, precum și activitatea autonomă (de exemplu, lăcrimare, piloerecție, respirație neobișnuită). Se vor nota, de asemenea, toate modificările de comportament, modificări ale posturii sau ale reacțiilor la manipulare, precum și apariția unor mișcări clonice sau tonice, a unor comportamente stereotipe (de exemplu, curățare excesivă, mișcări circulare repetate), precum și orice alt comportament bizar (automutilare, mers înapoi).
În cursul celei de-a patra săptămâni de expunere, se evaluează reacția la diferiți stimuli senzoriali (auditivi, vizuali și proprioceptivi), precum și prehensiunea și activitatea locomotorie. Metodele de adoptat în acest scop sunt detaliate în publicațiile de specialitate (a se vedea introducerea generală, partea B).
Observațiile funcționale din a patra săptămână de expunere pot fi omise dacă studiul este efectuat înaintea unui studiu subcronic (de 90 de zile). În acest caz observațiile funcționale trebuie să facă parte din studiul complementar. În schimb, dacă există informații pe baza unor observații funcționale efectuate în cadrul unor studii anterioare prin administrarea în mod repetat, acest lucru poate facilita alegerea dozelor la studiul subcronic suplimentar.
În mod excepțional, observațiile funcționale pot fi, de asemenea, omise la grupurile de animale care prezintă manifestări toxice care ar putea compromite rezultatul observațiilor funcționale.
1.4.3.2. Greutatea corporală și consumul de hrană și apă
Toate animalele sunt cântărite cel puțin o dată pe săptămână. Consumul de alimente și de apă trebuie măsurat cel puțin o dată pe săptămână. Dacă substanța este administrată prin apa de băut, consumul de apă trebuie măsurat cel puțin o dată pe săptămână.
1.4.3.3. Hematologie
Următoarele examinări histopatologice trebuie efectuate la sfârșitul perioadei de testare: hematocritul, concentrația de hemoglobină, numărul de hematii și de leucocite și formula leucocitară, numărul de trombocite și timpul/potențialul de coagulare.
Probele de sânge trebuie prelevate într-un punct determinat, chiar înainte sau în timpul sacrificării animalului și trebuie conservate în condiții adecvate.
1.4.3.4. Biochimie clinică
Trebuie efectuate măsurări biochimice clinice în vederea stabilirii principalelor efecte toxice asupra țesuturilor, în special asupra ficatului și asupra rinichilor, pe baza unor probe de sânge prelevate de la toate animalele chiar înainte sau în timpul sacrificării lor (cu excepția animalelor muribunde sau sacrificate în cursul testului). Se recomandă flămânzirea animalelor peste noapte ( 16 ). Aceste determinări efectuate în ser se fac cu privire la sodiu, la potasiu, la glucoză, la colesterolul total, la uree, la creatinină, la proteine totale și la albumină sau cel puțin cu privire la două enzime revelatoare ale efectelor hepatocelulare (cum ar fi alanin aminotransferaza, aspartat aminotransferaza, fosfataza alcalină, gamma glutamil transpeptidaza și sorbitol dezhidrogenaza). În unele cazuri, atât determinarea celorlalte enzime (de origine hepatică sau alta), precum și acizii biliari pot furniza informații utile.
Eventual, se pot efectua analize de urină în cursul ultimei săptămâni a studiului, cu colectarea într-un interval de timp a unui volum de urină, analiză care să includă examinarea aspectului, volumului, a osmolarității sau densității, a pH-ului, a proteinelor, a glucozei, a sângelui sau a celulelor sangvine.
De asemenea, trebuie avute în vedere studii asupra markerilor serici la leziunile tisulare. Celelalte măsurări necesare eventual, în cazurile în care proprietățile substanței testate sunt susceptibile de a modifica profilul metabolic, se vor axa asupra calciului, fosfatului, asupra trigliceridelor măsurate după post, asupra hormonilor specifici, asupra metahemoglobinei și asupra colinesterazei. Aceste analize trebuie efectuate în mod sistematic în cazul substanțelor care aparțin anumitor clase și, după caz, la celelalte substanțe.
În ansamblu, demersul care va fi adoptat va fi suplu și adaptabil în funcție de specia utilizată și de efectele observate și/sau previzibile ale substanței testate.
Dacă informațiile de bază colectate anterior nu sunt suficiente, parametri hematologici și biochimici ar trebui să fie determinați înaintea începerii testului.
1.4.3.5. Autopsia
Toate animalele care participă la studiu trebuie supuse unei autopsii detaliate, care să includă o examinare aprofundată a suprafeței externe a corpului, a tuturor orificiilor, a cavității craniene, toracice și abdominale și a conținutului acestora. De pe ficatul, rinichii, glandele suprarenale, testiculele, epidimidele, timusul, splina, creierul și inima tuturor animalelor se vor înlătura toate țesuturile superficiale, după care aceste organe sunt cântărite cât se poate de repede în vederea evitării deshidratării lor.
După aceasta, țesuturile sunt conservate în mediul de fixare cel mai adecvat în funcție de tipul țesutului și de examinările histopatologice prevăzute: toate țesuturile care prezintă leziuni macroscopice, encefalul (regiuni reprezentative: creierul mare, cerebelul și protuberanța anulară), măduva spinării, stomacul, intestinul gros, intestinul subțire (inclusiv plăcile Pleyer), ficatul, rinichii, glandele suprarenale, splina, inima, timusul, tiroida, traheea și plămânii (conservați prin fixare și imersie), gonadele, organele genitale anexe (de exemplu, uterul și prostata), vezica, ganglionii limfatici (de preferință un ganglion de pe traseul căii de administrare a substanței și un altul mai îndepărtat, pentru a se evidenția efectele sistemice), nervii periferici (sciați sau tibiali), de preferință foarte aproape de mușchi, și o secțiune de măduvă osoasă (sau aspirat de măduvă osoasă proaspăt fixat pe lamă). În funcție de observațiile clinice și de celelalte rezultate, se poate dovedi necesară examinarea celorlalte țesuturi. Toate organele considerate a fi organe-țintă potențiale pe baza proprietăților substanței trebuie conservate și ele.
1.4.3.6. Examinarea histopatologică
Se efectuează o examinare histopatologică completă a organelor și țesuturilor conservate, la toate animalele, atât cele din grupul testat, cărora li s-a administrat doza cea mai ridicată, precum și la cele din lotul martor. Acest examen va fi efectuat la toate grupurile expuse la doze inferioare, dacă sunt observate modificări provocate de substanța testată la animalele din grupul tratat la doza cea mai înaltă.
Toate leziunile macroscopice trebuie să fie examinate.
Atunci când se folosește un grup satelit, se efectuează o examinare histopatologică și la animalele din acest grup, pe organele și țesuturile pe care au fost observate efecte toxice la grupul tratat.
2. DATE
Datele sunt indicate pentru fiecare animal individual. Pe lângă aceasta, datele sunt incluse într-un tabel care va indica la fiecare grup experimental numărul de animale utilizate, numărul de animale care au murit în cursul testului sau care au fost sacrificate din motive umanitare, momentul morții fiecărui animal, numărul de animale care prezintă manifestări toxice, descrierea acestor manifestări, momentul apariției, durata și gravitatea lor, numărul de animale care prezintă leziuni, tipurile de leziuni și procentajul de animale care prezintă un anumit tip de leziuni.
Dacă este posibil, datele cifrice sunt evaluate cu ajutorul unei metode statistice adecvate și recunoscute. Metoda statistică va fi aleasă cu ocazia elaborării studiului.
3. RAPORT
Raportul de testare
Raportul de testare va conține, în măsura posibilităților, următoarele informații:
Animale de experiență:
— specia/linia pură utilizată;
— numărul animalelor, vârsta, sexul;
— originea, condiții de adăpostire, regim alimentar etc.;
— greutatea corporală a fiecărui animal la începutul testului, la intervale de o săptămână în timpul testului și la sfârșitul acestuia
Condiții de testare:
— justificarea alegerii vehiculului, altul decât apa;
— justificarea alegerii nivelului dozei administrate;
— detalii cu privire la formula/prepararea substanței, la concentrația obținută, la stabilitatea și la omogenitatea preparatului;
— detalii cu privire la administrarea substanței;
— după caz, conversia concentrației substanței administrate prin rația alimentară/apa de băut (ppm) în doză efectivă (mg/kg greutate corporală/zi);
— detalii asupra calității hranei și a apei.
Rezultate:
— greutate corporală/modificări ale acesteia;
— consumul de alimente și, după caz, consumul de apă;
— reacție toxică pe sexe și pe doză, inclusiv manifestări toxice;
— natura, gravitatea și durata efectelor clinice observate (eventual, reversibilitatea acestora);
— evaluarea activității senzoriale, a prehensiunii și a activității locomotorii;
— examene hematologice și valori de referință aplicabile;
— examene de biochimie clinică și valori de referință aplicabile;
— greutate corporală în momentul sacrificării animalului și greutatea organelor;
— rezultatele autopsiei;
— descriere detaliată a tuturor rezultatelor histopatologice;
— informații referitoare la absorbție, dacă există;
— prelucrare statistică a rezultatelor, după caz.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
Această metodă corespunde Orientării 407 a OCDE.
B.8. TOXICITATE LA DOZĂ REPETATĂ (28 DE ZILE) (ADMINISTRARE PRIN INHALARE)
1. METODĂ
1.1. INTRODUCERE
Este util să se colecteze informații preliminare asupra substanței cu privire la mărimea și distribuția particulelor, presiunea vaporilor, punctul de topire, punctul de fierbere, punctul de aprindere și proprietățile explozive (după caz).
A se vedea introducerea generală partea B (litera A).
1.2. DEFINIȚIE
A se vedea introducerea generală partea B (litera B).
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Se expun zilnic mai multe grupe de animale, pe parcursul unei perioade determinate, la o substanță de testat în concentrații crescătoare, fiind administrată o doză pe lot timp de 28 de zile. În cazul în care se folosește un vehicul în vederea obținerii unei concentrații adecvate a substanței de testat în atmosferă, se prevede un lot martor pentru vehicul. Pe parcursul perioadei de administrare, se observă zilnic animalele pentru a pune în evidență simptomele de toxicitate. Animalele care mor în timpul testului, precum și cele care supraviețuiesc la sfârșitul testului sunt supuse autopsiei.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătiri
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează la întâmplare în numărul de loturi necesare. La nevoie, se poate adăuga la substanța de testat un vehicul adecvat în vederea obținerii unei concentrații corespunzătoare în atmosferă. Dacă, pentru a ușura administrarea, se folosește un vehicul sau alt tip de aditiv, acesta trebuie să nu producă efecte toxice. Pot fi folosite date istorice, dacă este necesar.
1.6.2. Condiții de testare
1.6.2.1. Animale de experiență
Cu excepția contraindicațiilor, se preferă șobolanul. Se folosesc animale tinere, sănătoase, aparținând unei linii de laborator obișnuite.
La începutul testului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie respectivă.
1.6.2.2. Număr și sex
Se folosesc cel puțin 10 animale (5 femele și 5 masculi) pentru fiecare lot tratat. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul testului, acest număr se adaugă la total. În plus, se poate trata un lot satelit de 10 animale (5 din fiecare sex) la doza maximă timp de 28 de zile, care poate fi supus observației vizând reversibilitatea, persistența sau apariția tardivă a efectelor toxice pe parcursul celor 14 zile care urmează tratamentului. Se folosește, de asemenea, un lot satelit cu 10 animale martor (5 de fiecare sex).
1.6.2.3. Concentrații de expunere
Cel puțin trei concentrații sunt necesare, precum și un lot martor sau, dacă este cazul, un lot martor pentru vehicul (corespunzând concentrației vehiculului la nivelul de expunere cel mai ridicat). Cu excepția inhalării substanței de testat, se tratează animalele din lotul martor la fel cu cele din grupul de experiment. Concentrația maximă produce efecte toxice, dar nu provoacă sau provoacă rar moartea. Concentrația minimă nu trebuie să provoace niciun efect toxic. Dacă există informații privind expunerea umană, concentrația cea mai mică trebuie să fie superioară acestei valori. În condiții ideale, concentrația medie trebuie să producă minime efecte toxice observabile. Dacă se folosesc mai multe concentrații intermediare, acestea se administrează eșalonat, astfel încât să provoace o gradare a efectelor toxice. În loturile care corespund concentrațiilor slabe și intermediare, precum și în lotul martor incidența mortalității trebuie să fie mică, pentru a permite o evaluare semnificativă a rezultatelor.
1.6.2.4. Durata expunerii
Durata expunerii zilnice este de 6 ore, dar în cazul unor cerințe specifice pot fi necesare alte durate de expunere.
1.6.2.5. Aparatură
Animalele se expun la substanța de testat cu ajutorul unui dispozitiv de inhalare conceput pentru a asigura un flux continuu sau cel puțin 12 aerisiri pe oră, garantând un conținut de oxigen adecvat și o distribuție uniformă a produsului de testat în aer. Dacă se folosește o incintă, aceasta trebuie concepută astfel încât să reducă la minim aglomerarea animalelor de experiment și să le asigure o expunere maximă, prin inhalare, a substanței de testat. De regulă, pentru a se asigura stabilitatea atmosferei din incintă, volumul total al animalelor nu trebuie să depășească 5 % din volumul incintei. Se mai pot folosi expuneri oro-nazale, numai ale capului sau ale întregului corp, în incinte individuale; primele două tipuri de expunere limitează absorbția pe alte căi a substanței de testat.
1.6.2.6. Perioada de observație
Se observă toate animalele zilnic în vederea notării simptomelor de toxicitate, pe tot parcursul perioadei de tratare și de recuperare. Se consemnează momentul morții și momentul când apar și dispar simptomele de toxicitate.
1.6.3. Mod de operare
Se expun zilnic animalele la substanța de testat timp de 5-7 zile pe săptămână, pe o perioadă de 28 de zile. Animale aparținând loturilor satelit prevăzute pentru observații ulterioare se țin sub observație încă 14 zile, fără tratament, pentru a se studia vindecarea sau persistența efectelor toxice. Temperatura la care are loc testul se menține la 22 ± 3 oC.
În condiții optime, umiditatea relativă se menține între 30 și 70 % dar, în anumite cazuri, acest lucru poate fi imposibil (de exemplu, în cazul testelor asupra aerosolilor). Menținerea unei presiuni ușor negative în incintă (≤ 5 mm coloană de apă) împiedică împrăștierea substanței în zona învecinată. Pe parcursul perioadei de expunere, nu se administrează animalelor nici hrană, nici apă.
Se recomandă folosirea unui sistem de inhalare dinamic, prevăzut cu un dispozitiv adecvat de control analitic al concentrației. Pentru determinarea concentrațiilor de expunere adecvate, se recomandă să se procedeze la un test preliminar. Se reglează debitul pentru a asigura concentrații omogene în toată incinta. Sistemul trebuie să permită obținerea unor condiții de expunere stabile cât de rapid posibil.
Se măsoară și se controlează:
(a) debitul de aer (în permanență);
(b) concentrația reală a substanței măsurate în zona de respirație; pe parcursul perioadei de expunere zilnică, concentrația nu trebuie să varieze cu mai mult de ± 15 % față de valoarea medie; cu toate acestea, în cazul prafului și al aerosolilor, acest grad de control poate să nu fie atins, iar în acest caz se poate accepta o diferență mai mare; pe durata experimentului concentrațiile administrate zilnic trebuie menținute la valori cât de constante posibil; pentru aerosoli, se efectuează săptămânal cel puțin o analiză granulometrică pe lot tratat;
(c) temperatura și umiditatea, continuu, dacă este posibil.
În timpul expunerii și după aceasta au loc observații care sunt înregistrate sistematic; pentru fiecare animal se consemnează date individuale. Se observă zilnic toate animalele și se înregistrează simptomele de toxicitate, precum și momentul apariției, intensitatea și durata acestora. Observațiile includ modificări ale părului și ale blănii, ale ochilor și ale mucoaselor, ale aparatului respirator, ale sistemului circulator, ale sistemului nervos autonom și ale sistemului nervos central, precum și ale activității somato-motrice și ale comportamentului. Se determină săptămânal greutatea animalelor. Se recomandă, de asemenea, măsurarea săptămânală a consumului alimentar. Animalele sunt observate cu regularitate, pentru a evita pe cât posibil pierderea lor din motive exterioare experimentului, precum: canibalism, autoliză a țesuturilor sau greșeală de plasare a exemplarelor. La sfârșitul perioadei de expunere, se supun autopsiei toate animalele supraviețuitoare din loturile nesatelit. Animalele muribunde și animalele cu suferințe sau dureri grave se scot, se eutanasiază și se supun autopsiei.
Examinările următoare se efectuează la sfârșitul perioadei de testare asupra tuturor animalelor, inclusiv asupra martorilor:
(i) examen hematologic, inclusiv: hematocritul, concentrația hemoglobinei, numărul de eritrocite, formula leucocitară și măsurători ale potențialului de coagulare;
(ii) determinările biochimice clinice ale sângelui cuprinzând cel puțin un parametru al funcției hepatice și unul al celei renale: alanin aminotransferaza (cunoscută anterior ca transaminaza serică glutamo-piruvică), aspartat aminotransferaza (cunoscută anterior ca transaminaza serică glutamo-oxaloacetică), azotul ureic, albumina, creatinina sanguină, bilirubina totală și proteinele totale.
Alte determinări care se pot dovedi necesare pentru o evaluare toxicologică adecvată cuprind: calciu, fosfor, clor, sodiu, potasiu, glucoza à jeun, analiza lipidelor și a hormonilor, echilibrul acidobazic, methemoglobina și activitatea colinesterazică.
Se pot efectua, dacă este necesar, și alte determinări biochimice clinice pentru a extinde investigațiile asupra efectelor toxice observate.
1.6.3.1. Autopsia
Toate animalele supuse testului fac obiectul unei autopsii generale. Se cântăresc în stare umedă cel puțin ficatul, rinichii, glandele suprarenale, plămânii și testiculele cât mai rapid posibil după disecție pentru a se evita deshidratarea. Se conservă într-un mediu adecvat organele și țesuturile (tractul respirator, ficatul, rinichii, splina, testiculele, glandele suprarenale, inima, precum și orice organ care prezintă leziuni macroscopice sau modificări volumetrice) în vederea unor examene histopatologice ulterioare. Plămânii se prelevează intacți, se cântăresc și se tratează cu un fixator adecvat care asigură conservarea structurii pulmonare.
1.6.3.2. Examen histopatologic
Pentru lotul expus la concentrații maxime și pentru lotul martor se întreprinde un examen histopatologic al organelor și al țesuturilor conservate. Organele și țesuturile care prezintă leziuni induse de substanța de testat la doza maximă se examinează în toate loturile care au fost expuse unor doze mai mici. Animalele oricărui lot satelit fac obiectul unui examen histopatologic axat în special pe organele și țesuturile pentru care s-au constatat leziuni în celelalte loturi tratate.
2. DATE
Datele se sistematizează sub formă de tabele, prezentând pentru fiecare lot experimental numărul animalelor la începutul experimentului și numărul animalelor prezentând fiecare tip de leziune.
Toate rezultatele observate se evaluează printr-o metodă statistică adecvată. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— specia, linia, sursa, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare:
— Descrierea aparatului de expunere inclusiv concepția, tipul, dimensiunile, sursa de aer, sistemul generator de particule și de aerosoli, metoda de condiționare a aerului, tratarea aerului expirat și, după caz, modul de adăpostire a animalelor în incinta de testare, atunci când se utilizează. Se descrie echipamentul folosit pentru măsurarea temperaturii și, dacă este necesar, stabilitatea concentrațiilor de aerosoli și granulometria particulelor.
— Datele privind expunerea:
— Acestea se prezintă sub forma unui tabel care indică valorile medii, precum și măsura variabilității (de exemplu, deviația standard) și trebuie, dacă este posibil, să includă:
—(a) debitul de aer în dispozitivul de inhalare;
(b) temperatura și umiditatea aerului;
(c) concentrațiile nominale (cantitatea totală de substanță de testat introdusă în dispozitivul de inhalare raportată la volumul de aer);
(d) după caz, natura vehiculului;
(e) concentrațiile reale din zona de respirație;
(f) diametrul aerodinamic median masic al particulelor (DAMM) și deviația geometrică standard (DSG);
— răspunsul toxic pe sexe și doză;
— momentul morții în timpul experimentului sau dacă animalele au supraviețuit experimentului;
— descrierea efectelor toxice sau de altă natură, nivelul care nu are niciun efect;
— momentul observării oricărui simptom anormal și evoluția acestuia;
— cantitățile de hrană și greutatea corporală;
— examenele hematologice întreprinse și rezultatele complete;
— testele biochimice clinice practicate și rezultatele complete;
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor, când este cazul;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B (litera D)
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B (litera E).
B.9. TOXICITATE LA DOZĂ REPETATĂ (28 DE ZILE) (ADMINISTRARE CUTANATĂ)
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B (litera A).
1.2. DEFINIȚII
A se vedea introducerea generală partea B (litera B).
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Se aplică zilnic substanța de testat pe cale cutanată, în doze crescătoare, mai multor loturi de testare, fiind administrată o doză pe lot timp de 28 de zile. Pe parcursul perioadei de aplicare, se observă zilnic animalele pentru a pune în evidență simptomele de toxicitate Animalele care mor în timpul testului, precum și cele care supraviețuiesc la sfârșitul testului, sunt supuse autopsiei.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătiri
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de testare, animalele tinere sănătoase se repartizează la întâmplare în loturi tratate și loturi martor. Cu puțin timp înainte de testare, se tunde blana din regiunea dorsală a animalelor. Se poate recurge la radere, dar în acest caz operația se efectuează cu cca. 24 de ore înainte de test. Repetarea este, de obicei, necesară la intervale aproximativ săptămânale. În timpul tunderii sau al raderii, trebuie evitată orice lezare a pielii. Suprafața care se degajează în vederea aplicării substanței de testat nu trebuie să fie mai mică de 10 % din suprafața corporală. Pentru a decide zona care trebuie degajată și dimensiunile suprafeței care trebuie tratată, se ia în calcul greutatea animalului. Dacă testul vizează substanțele solide care, dacă este cazul, se pot pulveriza, substanța de testat trebuie umezită cu ajutorul apei sau, la nevoie, al unui vehicul adecvat, astfel încât să se poată obține un bun contact cu pielea. Substanțele lichide se folosesc, în general, în stare nediluată. Se efectuează o aplicare zilnică timp de 5 până la 7 zile pe săptămână.
1.6.2. Condiții de testare
1.6.2.1. Animale de experiență
Animalele de laborator utilizate sunt șobolanul, iepurele sau cobaiul adult. Pot fi folosite și alte specii, dar folosirea lor trebuie justificată.
La începutul experimentului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie.
1.6.2.2. Număr și sex
Se folosesc, pentru fiecare doză, cel puțin 10 animale (5 femele și 5 masculi) a căror piele este sănătoasă. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul experimentului, acest număr se adaugă la total. În plus, se poate trata un lot satelit de 10 de animale (5 din fiecare sex) la doza maximă timp de 28 de zile, care poate fi supus observației vizând reversibilitatea, persistența sau apariția tardivă a efectelor toxice pe parcursul celor 14 zile care urmează tratamentului. Se folosește, de asemenea, un lot satelit cu 10 animale martor (5 de fiecare sex).
1.6.2.3. Doze
Se folosesc cel puțin trei doze, precum și un lot martor sau, dacă este cazul, un lot martor pentru vehicul. Perioada de expunere este de cel puțin șase ore pe zi. Se aplică substanța de testat în fiecare zi în același moment, iar dozele trebuie să facă obiectul unei adaptări (săptămânale sau bisăptămânale) pentru a se menține constant nivelul dozei în raport cu greutatea corporală a animalului. Cu excepția substanței de testat, se tratează animalele din lotul martor la fel cu cele din grupul de experiment. În cazul în care se folosește un vehicul pentru a facilita administrarea dozei, acesta este administrat lotului martor în aceleași condiții ca și pentru loturile tratate, iar doza administrată corespunde cu cea primită de grupul tratat cu doza maximă. Doza maximă produce efecte toxice, dar nu provoacă sau provoacă rar moartea. Doza minimă nu provoacă niciun efect toxic. Atunci când există informații privind expunerea umană, doza cea mai mică trebuie să fie superioară acestei valori. În condiții ideale, doza intermediară trebuie să producă minime efecte toxice observabile. În cazul în care se folosesc mai multe doze intermediare, acestea se administrează eșalonat, astfel încât să provoace o gradare a efectelor toxice. În loturile care corespund dozelor slabe și intermediare, precum și în loturile martor incidența mortalității trebuie să fie mică, pentru a permite o evaluare semnificativă a rezultatelor.
În cazul în care aplicarea substanței de testat provoacă o iritație cutanată gravă, se reduc concentrațiile; aceasta poate avea ca efect diminuarea, chiar dispariția, celorlalte efecte toxice la doza maximă. De asemenea, dacă leziunile cutanate sunt foarte grave, poate fi necesară oprirea experimentului și inițierea unui studiu nou, la concentrații mai scăzute.
1.6.2.4. Testul-limită
În cazul în care în urma unei experiențe preliminare realizate cu o doză de 1 000 mg/kg sau o doză mai ridicată în funcție de expunerea umană posibilă, când se cunoaște această valoare, nu apare niciun efect toxic, continuarea experienței poate fi inutilă.
1.6.2.5. Perioada de observație
Se observă toate animalele zilnic în vederea notării simptomelor de toxicitate. Se consemnează momentul morții și momentul când apar și dispar simptomele de toxicitate.
1.6.3. Mod de operare
Se pun animalele în cuști individuale. În condiții ideale, substanța de testat se administrează animalelor 7 zile pe săptămână timp de 28 de zile. Animalele din orice grup satelit destinate observației ulterioare sunt menținute în viață timp de încă 14 zile, fără tratament, în vederea constatării vindecării sau a persistenței efectelor toxice. Durata de expunere este de minimum șase ore pe zi.
Substanța de testat se aplică pe o suprafață aproximativ egală cu 10 % din suprafața totală a corpului. În cazul substanțelor puternic toxice, suprafața tratată poate fi mai mică, dar stratul trebuie să fie cât mai subțire și mai uniform posibil.
Pe parcursul expunerii, substanța de testat se menține în contact cu pielea cu ajutorul unui pansament de tifon și al unui plasture neiritant. Suprafața tratată se acoperă astfel încât să mențină pansamentul de tifon și substanța de testat și să se evite ingerarea acesteia de către animale. Se poate folosi contenționarea pentru a împiedica animalele să ingereze substanța de testat, dar nu se recomandă imobilizarea completă. Ca alternativă poate fi folosit un „dispozitiv de protecție cu guler înalt”.
La sfârșitul perioadei de expunere, se elimină, dacă este posibil, orice reziduu de substanță, cu apă sau cu ajutorul unui alt procedeu de curățare a pielii.
Se observă zilnic toate animalele și se înregistrează simptomele de toxicitate, precum și momentul apariției, intensitatea și durata acestora. Observațiile includ, între altele, modificări ale părului și ale blănii, ale ochilor și ale mucoaselor, ale sistemului respirator, ale sistemului circulator, ale sistemului nervos autonom și ale sistemului nervos central, precum și ale activității somato-motrice și ale comportamentului. Se determină săptămânal greutatea animalelor. Se recomandă, de asemenea, determinarea săptămânală a consumului alimentar. Animalele sunt observate cu regularitate pentru a evita pe cât posibil pierderea lor din motive exterioare experimentului, precum: canibalism, autoliză a țesuturilor sau greșeală de plasare a exemplarelor. La sfârșitul experimentului, se supun autopsiei toate animalele supraviețuitoare care aparțin loturilor tratate nesatelite. Animalele muribunde și animalele cu suferințe sau dureri grave se scot, se eutanasiază și se supun autopsiei.
Examinările următoare se efectuează la sfârșitul perioadei de testare asupra tuturor animalelor, inclusiv asupra martorilor:
1. examen hematologic, inclusiv: hematocritul, concentrația hemoglobinei, numărul de eritrocite, formula leucocitară și măsurători ale potențialului de coagulare;
2. determinările biochimice clinice ale sângelui cuprinzând cel puțin un parametru al funcției hepatice și unul al celei renale: alanin aminotransferaza (cunoscută anterior ca transaminaza serică glutamo-piruvică), aspartat aminotransferaza (cunoscută anterior ca transaminaza serică glutamo-oxaloacetică), azotul ureic, albumina, creatinina sanguină, bilirubina totală și proteinele totale.
Alte determinări care se pot dovedi necesare pentru o evaluare toxicologică adecvată cuprind: calciu, fosfor, clor, sodiu, potasiu, glucoza à jeun, analiza lipidelor și a hormonilor, echilibrul acidobazic, methemoglobina și activitatea colinesterazică.
Se pot efectua, dacă este necesar, și alte determinări biochimice clinice pentru a extinde investigațiile asupra efectelor observate.
1.6.4. Autopsie
Toate animalele supuse testului fac obiectul unei autopsii generale. Se cântăresc în stare umedă ficatul, rinichii, glandele suprarenale și testiculele cât mai rapid posibil după disecție pentru a evita deshidratarea. Se conservă într-un mediu adecvat ficatul, rinichii, splina, testiculele, glandele suprarenale și inima, precum și orice organ care prezintă leziuni macroscopice sau modificări volumetrice în vederea unor posibile examene histopatologice ulterioare.
1.6.5. Examen histopatologic
Pentru lotul expus la doza maximă și pentru lotul martor se întreprinde un examen histopatologic al organelor și al țesuturilor conservate. Organele și țesuturile care prezintă leziuni induse pe suprafața de testare la nivelul dozei maxime se examinează în toate loturile care au fost expuse unor doze mai mici. Animalele din lotul satelit fac obiectul unui examen histopatologic axat în special pe organele și țesuturile pentru care s-au constatat leziuni în celelalte loturi tratate.
2. DATE
Datele se sistematizează într-un tabel care indică, pentru fiecare lot de experiență, numărul de animale la începutul testului și numărul de animale care prezintă fiecare tip de leziune.
Toate rezultatele observate se evaluează cu ajutorul unei metode statistice adecvate. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— date privind animalele (specia, linia, originea, condițiile ambiante, regimul alimentar etc.);
— condițiile de testare (inclusiv tipul de pansament: ocluziv sau neocluziv);
— dozele (inclusiv vehiculul, dacă este cazul) și concentrațiile;
— dacă este posibil, nivelul care nu are niciun efect;
— răspunsul toxic pe sexe și doză;
— momentul morții în timpul experimentului sau indicarea faptului că animalele au supraviețuit experimentului;
— efectele toxice sau de altă natură;
— momentul observării oricărui simptom anormal și evoluția acestuia;
— cantitățile de hrană și greutatea corporală;
— examenele hematologice întreprinse și rezultatele;
— testele biochimice clinice practicate și rezultatele;
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor, când este cazul;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B (litera D).
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B (litera E).
B.10. MUTAGENITATEA –TESTUL IN VITRO DE ABERAȚIE CROMOZOMIALĂ PE CELULE DE MAMIFERE
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 473 a OCDE, Testul in vitro de aberație cromozomială pe celule de mamifere (1997).
1.1. INTRODUCERE
Scopul testului in vitro de aberație cromozomială este destinat depistării agenților care provoacă aberații cromozomiale ale structurii în celulele de mamifere, în cultură (1) (2) (3). Aberațiile structurale pot fi de două tipuri, cromozomiale sau cromatidice. La majoritatea mutagenilor chimici, aberațiile induse sunt de tip cromatidic, dar se produc și aberații de tip cromozomial. O poliploidie crescută poate să indice că un produs chimic are capacitatea de a provoca aberații ale numărului de cromozomi. Cu toate acestea, prezenta metodă nu este destinată determinării aberațiilor numerice și, în general, nu se utilizează în acest scop. Mutațiile cromozomiale și fenomenele conexe sunt cauza multor maladii genetice umane și există dovezi suficiente ale implicării mutațiilor cromozomiale și a fenomenelor conexe, care provoacă modificări ale oncogenelor și ale genelor supresoare de tumori din celulele somatice, în inducerea cancerului la oameni și la animalele de laborator.
Testul in vitro de aberație cromozomială poate să utilizeze culturi de linii celulare stabilite, sușe celulare sau culturi celulare primare. Celulele utilizate se selectează în funcție de potențialul de dezvoltare în cultură, stabilitatea cariotipului, numărul de cromozomi, diversitatea cromozomilor și frecvența aberațiilor cromozomiale spontane.
Pentru realizarea in vitro a testului este necesar să se utilizeze o sursă exogenă pentru activarea metabolică. Sistemul de activare metabolică de acest tip nu poate să reproducă integral condițiile celulelor de mamifere in vivo. Ar trebui să se acorde atenție evitării condițiilor care ar putea să conducă la obținerea unor rezultate pozitive care nu reflectă o mutagenitate intrinsecă, condiții care s-ar putea datora modificărilor de pH, de osmolalitate sau unor valori mari ale citotoxicității (4) (5).
Prezentul test se utilizează pentru depistarea substanțelor cu posibile efecte mutagene și cancerigene pentru mamifere. Mulți compuși care dau rezultate pozitive la acest test sunt cancerigeni pentru mamifere; cu toate acestea, nu există o corelație perfectă între prezentul test și cancerigenitate. Corelația depinde de clasa de produse chimice și sunt tot mai multe dovezi că există agenți cancerigeni care nu se depistează prin prezentul test deoarece este posibil ca aceștia să acționeze printr-un alt mecanism decât cel care provoacă leziuni directe ale ADN.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Aberație de tip cromatidic: o leziune structurală a cromozomului, care se traduce prin divizarea cromatidelor singure sau prin divizarea și reuniunea între cromatide.
Aberație de tip cromozomial: o leziune structurală a cromozomului, care se traduce prin divizarea sau divizarea și reuniunea ambelor cromatide în același situs.
Endoreduplicare: proces în care, după o perioadă S de replicare a ADN, nucleul nu intră în mitoză, ci începe o altă fază S. Rezultă cromozomi cu 4, 8, 16, … cromatide.
Lacună: leziune acromatică mai mică decât lățimea unei cromatide și cu o eroare minimă de aliniere a cromatidelor.
Index mitotic: numărul celulelor în metafază împărțit la numărul total de celule observate într-o populație de celule; indică gradul de proliferare a populației respective.
Aberație numerică: modificare a numărului de cromozomi față de numărul normal caracteristic pentru celulele utilizate.
Poliploidie: multiplicare a numărului (n) de cromozomi haploizi, alta decât diploidia (și anume 3n, 4n etc.).
Aberație structurală: modificare a structurii cromozomilor, detectabilă la examinarea microscopică a celulelor în stadiul de metafază al diviziunii acestora, care se prezintă sub formă de deleții și fragmente, modificări intracromozomiale și intercromozomiale.
1.3. PRINCIPIUL METODEI DE TESTARE
Culturile de celule sunt expuse la substanța de testat, atât cu, cât și fără activare metabolică. După expunerea celulelor la substanța de testat, acestea se tratează la intervale de timp prestabilite cu o substanță de inhibare a metafazei (de exemplu Colcemid® sau colchicină), se recoltează, se colorează și celulele în metafază sunt analizate la microscop pentru detectarea aberațiilor cromozomiale.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Preparatele
1.4.1.1. Celulele
Se pot utiliza diferite linii celulare, sușe de celule sau culturi de celule primare, inclusiv celule umane (de exemplu celule de hamster chinezesc, limfocite din sângele periferic uman sau al altor mamifere).
1.4.1.2. Mediile și condițiile de cultură
Se recomandă utilizarea mediilor de cultură și a condițiilor de incubare (vasele de cultură, concentrația CO2, temperatura și umiditatea) corespunzătoare pentru dezvoltarea culturilor. Se impune controlul regulat al liniilor și sușelor celulare, pentru verificarea stabilității numărului modal de cromozomi și a absenței contaminării cu micoplasmă și, dacă se constată contaminarea, celulele nu se mai folosesc. Ar trebui să se cunoască perioada ciclului celular normal pentru celulele și condițiile de cultură utilizate.
1.4.1.3. Prepararea culturilor
Liniile și sușele celulare stabilite: celulele se prepară plecând de la culturile de rezervă, se însămânțează în mediul de cultură într-o anumită densitate, astfel încât culturile să nu ajungă la confluență înainte de momentul recoltării, apoi se incubează la 37 oC.
Limfocitele: sângele complet, tratat cu un anticoagulant (de exemplu heparina) sau limfocitele separate obținute de la subiecți sănătoși se adaugă la mediul de cultură ce conține un mitogen (de exemplu fitohemaglutinină) și se incubează la 37 oC.
1.4.1.4. Activarea metabolică
Se recomandă ca expunerea celulelor la substanța de testat să se realizeze atât în prezența, cât și în absența sistemului de activare metabolică corespunzător. Sistemul cel mai frecvent utilizat este o fracție postmitocondrială la care s-au adăugat cofactori (S9), preparată din ficat de rozătoare tratat cu agenți de inducție enzimatică, de exemplu Aroclor 1254 (6) (7) (8) (9) sau un amestec de fenobarbitonă și β-naftoflavonă (10) (11) (12).
Fracția postmitocondrială se utilizează, de obicei, la concentrații cuprinse între limitele 1-10 % v/v în mediul experimental final. Compoziția unui sistem de activare metabolic poate să depindă de clasa din care face parte substanța chimică de testat. În unele cazuri, s-ar putea să fie convenabilă utilizarea mai multor concentrații ale fracției postmitocondriale.
O serie de realizări, inclusiv crearea prin inginerie genetică a unor linii celulare care exprimă enzime activatoare specifice, poate furniza potențialul pentru o activare endogenă. Alegerea liniilor celulare ar trebui să fie justificată din punct de vedere științific (de exemplu prin importanța izoenzimei citocromului P450 pentru metabolismul substanței de testat).
1.4.1.5. Substanța de testat/prepararea
Substanțele de testat în stare solidă ar trebui să se preparare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare, care, dacă este cazul, se diluează înaintea tratamentului celulelor. Substanțele de testat lichide se pot adăuga direct în sistemele experimentale și se diluează înainte de utilizare în tratamentul celulelor. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora în caz de păstrare.
1.4.2. Condițiile de testare
1.4.2.1. Solventul/vehiculul
Solventul/vehiculul ar trebui să fie ales, astfel încât să nu existe suspiciunea reacției chimice a acestuia cu substanța de testat și să nu afecteze negativ supraviețuirea celulelor și activitatea S9. Utilizarea altor solvenți/vehicule decât cele recunoscute ar trebui să fie justificată cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere un solvent/vehicul în soluție/dispersie apoasă. La testarea substanțelor instabile în apă, solventul organic utilizat nu ar trebui să conțină apă. Apa se poate elimina prin adăugarea unei site moleculare.
1.4.2.2. Concentrațiile de expunere
Printre criteriile ce trebuie să fie avute în vedere la determinarea dozei maxime sunt citotoxicitatea, solubilitatea în sistemul experimental și modificările de pH sau osmolalitate.
Citotoxicitatea ar trebui să se determine cu și fără activare metabolică în experimentarea principală, utilizând un indicator corespunzător al integrității și dezvoltării celulare, ca gradul de confluență, numărul de celule viabile sau indexul mitotic. Ar putea fi utilă determinarea citotoxicității și solubilității într-un test preliminar.
Ar trebui să se utilizeze cel puțin trei concentrații analizabile. Dacă o substanță este citototoxică, concentrațiile respective ar trebui să acopere un domeniu de toxicități de la maximă la mică sau lipsa toxicității; aceasta semnifică, de obicei, concentrații care ar trebui să fie separate printr-un factor cuprins între 2 și √10 maximum. În momentul recoltării, concentrația maximă ar trebui să determine o reducere importantă a gradului de confluență, a numărului de celule sau a indexului mitotic (pentru toate mai mare de 50 %). Indexul mitotic variază în timp după tratament și reprezintă doar o măsură indirectă a efectelor citotoxice/citostatice. Cu toate acestea, indexul mitotic este acceptabil pentru culturile în suspensie în care alte determinări de toxicitate pot să fie dificile și nepractice. Datele de cinetică a ciclului celular, cum ar fi timpul de generare medie (TGM), ar putea să reprezinte informații suplimentare. TGM este totuși o medie generală, care nu demonstrează întotdeauna existența unei subpopulații întârziate; chiar și creșterile ușoare ale timpului de generare medie pot să genereze o întârziere foarte substanțială a momentului în care numărul de aberații este optim.
Pentru substanțele relativ necitotoxice, concentrația experimentală maximă trebuie să fie cea mai mică dintre următoarele: 5 μl/ml, 5 mg/ml sau 0,01 M.
Pentru substanțele relativ insolubile care nu sunt toxice la concentrații mai mici decât concentrația la care sunt insolubile, doza maximă utilizată ar trebui să fie o concentrație superioară limitei de solubilitate în mediul final de cultură la terminarea perioadei de tratament. În unele cazuri (de exemplu atunci când toxicitatea se manifestă doar la o concentrație mai mare decât concentrația minimă de insolubilitate), se recomandă să se încerce mai multe concentrații până la apariția precipitării. Ar putea fi utilă evaluarea solubilității la începutul și la sfârșitul tratamentului, deoarece solubilitatea poate să varieze în timpul expunerii în sistemul experimental datorită prezenței celulelor, S9, serului etc. Insolubilitatea se poate constata cu ochiul liber. Ar trebui ca precipitarea să nu interfereze cu determinarea rezultatelor.
1.4.2.3. Martorii negativi și pozitivi
La fiecare experiment, ar trebui să se includă simultan martorii pozitivi și negativi (solvent și vehicul), atât cu, cât și fără activare metabolică. În prezența unui sistem de activare metabolică, substanța utilizată ca martor pozitiv ar trebui să fie aceea care necesită activare pentru a da un răspuns mutagen.
Ca martori pozitivi ar trebui să se utilizeze un elastogen cunoscut, la niveluri de expunere care se estimează că determină o creștere reproductibilă și detectabilă în raport cu zgomotul de fond, ceea ce demonstrează sensibilitatea sistemului de testare.
Concentrațiile martorilor pozitivi ar trebui să fie selectate astfel încât să se obțină efecte clare, dar care să nu permită identificare imediată a lamelelor codificate. În tabelul următor se prezintă exemple de substanțe care se pot utiliza ca martori pozitivi:
|
Starea activării metabolice |
Substanța |
Nr. CAS |
Nr. EINECS |
|
Absența activării metabolice exogene |
metansulfonat de metil |
66-27-3 |
200-625-0 |
|
metansulfonat de etil |
62-50-0 |
200-536-7 |
|
|
etil nitrozouree |
759-73-9 |
212-072-2 |
|
|
mitomicină C |
50-07-7 |
200-008-6 |
|
|
4-nitrochinolină-N-oxid |
56-57-5 |
200-281-1 |
|
|
Prezența activării metabolice exogene |
benzo[a] piren |
50-32-8 |
200-028-5 |
|
ciclofosfamidă ciclofosfamidă monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
Se pot utiliza și alte substanțe corespunzătoare ca martori pozitivi. Ar trebui să se aibă în vedere utilizarea ca martori pozitivi a unor substanțe din aceeași clasă de produse chimice, dacă sunt disponibile.
Pentru fiecare moment de recoltare, ar trebui să se utilizeze ca martori negativi solvenți sau vehicule singure în mediul de tratare, care se tratează în același condiții ca și culturile tratate. În plus, ar trebui să se utilizeze și martori netratați, cu excepția cazului în care există date din testele anterioare care să ateste că solventul selectat nu prezintă efecte vătămătoare sau mutagene.
1.4.3. Modul de lucru
1.4.3.1. Tratamentul cu substanța de testat
Celulele în stadiu de proliferare se tratează cu substanța de testat în prezența sau absența unui sistem de activare metabolică. Tratamentul limfocitelor ar trebui să înceapă la aproximativ 48 de ore de la stimularea mitogenică.
1.4.3.2. Pentru fiecare concentrație ar trebui să se realizeze în mod normal teste pe culturi de celule în dublu exemplar, procedură recomandată cu fermitate pentru culturile cu martor negativ/solvent. Dacă datele testelor anterioare pot să dovedească existența unor diferențe minime între culturile duble (13) (14), se poate preconiza utilizarea unor culturi unice pentru fiecare concentrație testată.
Substanțele în stare gazoasă sau cele volatile ar trebui să fie testate prin metode corespunzătoare, de exemplu în vase de cultură închise ermetic (15) (16).
1.4.3.3. Momentul recoltării culturilor
În primul experiment, expunerea celulelor la substanța de încercat ar trebui să se realizeze atât în prezența, cât și în absența activării metabolice, timp de 3-6 ore, și să se procedeze la prelevarea probelor după un interval de timp egal cu de 1,5 ori durata ciclului celular normal de la inițierea tratamentului (12). Dacă rezultatele testului sunt negative, atât în prezența, cât și în absența activării, ar trebui să se repete testul fără activare, cu tratament continuu până în momentul prelevării probelor care să fie egal cu aproximativ de 1,5 ori durata ciclului celular normal. S-ar putea ca unele produse chimice să fie detectate mai ușor, prin prelungirea timpului de tratament/prelevare a probelor la mai mult de 1,5 ori durata ciclului celular. Rezultatele negative obținute în prezența activării metabolice necesită o confirmare pentru fiecare caz. Pentru cazurile în care se consideră că nu este necesară confirmarea rezultatelor negative, trebuie să se prezinte o justificare.
1.4.3.4. Prepararea cromozomilor
Culturile celulare se tratează cu Colcemid® sau colchicină, de obicei timp de 1-3 ore înainte de recoltare. Fiecare cultură celulară se recoltează și se prelucrează separat pentru prepararea cromozomilor. Prepararea cromozomilor include tratamentul hipotonic al celulelor, precum și fixarea și colorarea acestora.
1.4.3.5. Analiza
Toate lamelele, inclusiv cele cu martorii pozitivi și negativi, ar trebui să fie codificate independent înaintea analizei microscopice. Deoarece procedurile de fixare generează adesea scindarea unei proporții de celulele în metafază cu pierdere de cromozomi, toate celulele înregistrate ar trebui, prin urmare, să conțină un număr de centromeri egal cu numărul modal ± 2 pentru toate tipurile de celule. Pentru fiecare concentrație și fiecare martor ar trebui să se înregistreze cel puțin 200 de celule în metafază bine etalate, repartizate în mod egal între culturile în dublu exemplar, dacă este cazul. Atunci când se constată un număr mare de aberații, numărul menționat se poate reduce.
Deși scopul testului este detectarea aberațiilor cromozomial-structurale ale cromozomilor, este important să se semnaleze cazurile de poliploidie și endoreduplicare, dacă se constată apariția acestora.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Unitatea experimentală este celula și, prin urmare, ar trebui să se evalueze procentul de celule care prezintă o aberație cromozomială sau mai multe aberații cromozomiale. Se întocmește o listă cu diferitele tipuri de aberații cromozomiale și se specifică numărul și frecvența acestora pentru culturile experimentale și cele martor. Lacunele se înregistrează și se prezintă separat, dar în general nu se includ în frecvența totală a aberațiilor.
De asemenea, se înregistrează rezultatele determinărilor concomitente de citotoxicitate realizate pentru toate culturile tratate și pentru cele martor negativ în principalele teste de aberații.
Ar trebui să se prezintă date pentru fiecare cultură. În plus, toate datele ar trebui să fie prezentate centralizat sub formă de tabel.
Nu este necesară verificarea unui răspuns pozitiv net. Rezultatele nesigure ar trebui să fie clarificate prin realizarea de teste suplimentare în care este preferabil să se modifice condițiile de testare. Necesitatea confirmării rezultatelor negative s-a discutat la punctul 1.4.3.3. În cazul experimentelor suplimentare, ar trebui să se aibă în vedere modificările parametrilor cercetați pentru a extinde gama condițiilor evaluate. Parametrii studiați, susceptibili de modificare, includ intervalele dintre concentrații și condițiile de activare metabolică.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Există câteva criterii pentru determinarea unui rezultat pozitiv, ca o creștere în funcție de concentrație sau o creștere reproductibilă a numărului de celule cu aberații cromozomiale. În primul rând, ar trebui să se aibă în vedere relevanța biologică a rezultatelor. Pentru evaluarea rezultatelor testelor se pot utiliza metode statistice (3) (13). Semnificația statistică nu ar trebui să fie singurul factor determinant pentru a decide cu privire la un răspuns pozitiv.
O creștere a numărului de celule poliploide poate să indice faptul că substanța de testat este capabilă să inhibe procesele mitotice și să producă aberații ale numărului de cromozomi. O creștere a numărului de celule cu cromozomi endoreduplicați poate să indice faptul că substanța de testat poate inhiba avansarea ciclului celular (17) (18).
Dacă rezultatele obținute pentru o substanță de testat nu îndeplinesc criteriile menționate anterior, se consideră că substanța respectivă nu este mutagenă în sistemul respectiv.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în rare cazuri datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile independent de numărul de repetări ale testului.
Rezultatele pozitive ale unui test in vitro de aberație cromozomială indică faptul că substanța de testat provoacă aberații cromozomiale ale structurii în celulele somatice de mamifere, în cultură. Rezultatele negative indică faptul că, în condițiile de testare, substanța de testat nu provoacă aberații cromozomiale în celulele somatice de mamifere, în cultură.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Solventul/Vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Celulele:
— tipul și sursa celulelor;
— caracteristicile cariotipului și motivul alegerii celulelor utilizate;
— absența micoplasmei, dacă este cazul;
— date privind durata ciclului celular;
— sexul donatorilor de sânge, sângele complet sau limfocite izolate, mitogenul utilizat;
— numărul de reînsămânțări, dacă este cazul;
— metodele de întreținere a culturilor celulare, dacă este cazul;
— numărul modal de cromozomi.
Condițiile de testare:
— identitatea substanței de inhibare a metafazei, concentrațiile acesteia și timpul de expunere a celulelor;
— justificarea alegerii concentrațiilor și numărului de culturi, inclusiv datele de citotoxicitate și limitele de solubilitate, dacă sunt disponibile;
— compoziția mediului, concentrația de CO2, dacă este cazul;
— concentrația substanței de testat;
— volumul vehiculului și al substanței de testat adăugate;
— temperatura de incubare;
— timpul de incubare;
— durata tratamentului;
— densitatea celulară la însămânțare, dacă este cazul;
— tipul și compoziția sistemului de activare metabolică, inclusiv criteriile de acceptabilitate;
— martorii pozitivi și negativi;
— metodele de preparare a lamelelor;
— criteriile pentru numărătoarea aberațiilor;
— numărul de metafaze analizate;
— metodele de măsurare a toxicității;
— criteriile utilizate la caracterizarea studiilor ca fiind pozitive, negative sau nesigure.
Rezultatele:
— semnele de toxicitate, de exemplu gradul de confluență, datele privind ciclul celular, numărătoarea celulelor, indexul mitotic;
— semnele de precipitare;
— datele privind valoarea pH-ului și osmolalitatea mediului de tratare, dacă s-au determinat;
— definirea aberațiilor, inclusiv a lacunelor;
— numărul de celule cu aberații cromozomiale și tipul aberațiilor cromozomiale, prezentate separat pentru fiecare cultură tratată și cultură martor;
— variațiile ploidiei, dacă există;
— relația doză-răspuns, dacă este posibil;
— analizele statistice, dacă există;
— datele privind martorii negativi (solvent/vehicul) și pozitivi;
— datele anterioare privind martorii negativi (solvent/vehicul) și pozitivi, cu domeniile, valorile medii și deviațiile standard.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Evans, H. J. (1976). Cytological Methods for Detecting Chemical Mutagens. In: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York and London, pp. 1-29.
2. Ishidate, M. Jr. and Sofuni, T. (1985). The in Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture. In: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (Eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, pp. 427-432.
3. Galloway, S. M., Armstrong, M. J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A. D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G.H., Resnick, M.A, Anderson, G. and Zeiger, E. (1978). Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals. Environs. Molec. Mutagen 10 (suppl.10), pp. 1-175.
4. Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B. C. (1991). Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res, 257, pp. 147-204.
5. Morita, T., Nagaki, T., Fukuda, I. and Okumura, K., (1992). Clastogenicity of low pH to Various Cultured Mammalian Cells. Mutation Res., 268, pp. 297-305.
6. Ames, B. N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31, pp. 347-364.
7. Maron, D. M. and Ames, B. N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, pp. 173-215.
8. Natarajan, A. T., Tates, A. D., van Buul, P. P. W., Meijers, M. and de Vogel, N. (1976). Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System in Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37, pp. 83-90.
9. Matsuoka, A., Hayashi, M. and Ishidate, M. Jr. (1979). Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro. Mutation Res., 66, pp. 277-290.
10. Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, pp. 175-177.
11. Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: de Serres, F. J., Fouts, J. R., Bend, J. R. and Philpot, R. M. (eds) In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, pp. 85-88.
12. Galloway, S. M., Aardema, M. J., Ishidate, M. Jr., Ivett, J. L., Kirkland, D. J., Morita, T., Mosesso, P., Sofuni, T. (1994). Report from Working Group on in In Vitro Tests for Chromosomal Aberrations. Mutation Res., 312, pp. 241-261.
13. Richardson, C., Williams, D. A., Allen, J. A., Amphlett, G., Chanter, D. O. and Phillips, B. (1989). Analysis of Data from In Vitro Cytogenetic Assays. In: Statistical Evaluation of Mutagenicity Test Data. Kirkland, D. J., (ed) Cambridge University Press, Cambridge, pp. 141-154.
14. Soper, K. A. and Galloway, S. M. (1994). replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells. Mutation Res., 312, pp. 139-149.
15. Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R. R., Costa, D. L., Schaich, K. M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, pp. 91-103.
16. Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, pp. 795-801.
17. Locke-Huhle, C. (1983). Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res., 119, pp. 403-413.
18. Huang, Y., Change, C. and Trosko, J. E. (1983). Aphidicolin – induced endoreduplication in Chinese hamster cells. Cancer Res., 43, pp. 1362-1364.
B.11. MUTAGENITATEA – TESTUL IN VIVO DE ABERAȚIE CROMOZOMIALĂ PE MĂDUVĂ OSOASĂ DE MAMIFERE
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 475 a OCDE, Testul in vivo de aberație cromozomială pe măduvă osoasă de mamifere (1997).
1.1. INTRODUCERE
Testul in vivo de aberație cromozomială pe măduva osoasă de mamifere se utilizează la detectarea aberațiilor cromozomiale provocate de substanța de testat în structura celulelor din măduva osoasă a mamiferelor, de obicei, rozătoare (1) (2) (3) (4). Aberațiile structurale pot să fie de două tipuri, cromozomiale sau cromatidice. O poliploidie crescută poate să indice că un produs chimic poate să provoace aberații ale numărului de cromozomi. La majoritatea mutagenilor chimici, aberațiile induse sunt de tip cromatidic, dar se produc și aberații de tip cromozomial. Mutațiile cromozomiale și fenomenele conexe sunt cauza multor maladii genetice umane și există dovezi suficiente ale implicării mutațiilor cromozomiale și a fenomenelor conexe, care provoacă modificări ale oncogenelor și ale genelor supresoare de tumori din celulele somatice, în inducerea cancerului la oameni și în sistemele experimentale.
În prezentul test se utilizează, de obicei, rozătoare. Țesutul-țintă în prezentul test este măduva osoasă, deoarece este un țesut puternic vascularizat și conține o populație de celule cu ciclu rapid care se pot izola și prelucra ușor. Alte specii și țesuturi-țintă nu fac obiectul prezentei metode.
Prezentul test de aberație cromozomială este relevant în special la evaluarea riscului mutagen, deoarece permite să se țină seama de factorii de metabolism in vivo, de farmacocinetică și de procesele de reparare a ADN-ului, deși aceștia pot să varieze între specii și între țesuturi. Un test in vivo este, de asemenea, util pentru studierea suplimentară a unui efect mutagen detectat printr-un test in vitro.
Dacă există dovezi că substanța de testat sau un metabolit reactiv nu ating țesutul-țintă, utilizarea prezentului test nu potrivită.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Aberație de tip cromatidic: o leziune structurală a cromozomului, care se traduce prin divizarea cromatidelor singure sau prin divizarea și reuniunea între cromatide.
Aberație de tip cromozomial: o leziune structurală a cromozomului, care se traduce prin divizarea sau divizarea și reuniunea ambelor cromatide în același loc.
Endoreduplicare: proces în care, după o perioadă S de replicare a ADN, nucleul nu intră în mitoză, ci începe o altă perioadă S. Rezultă cromozomi cu 4, 8, 16, … cromatide.
Lacună: leziune acromatică mai mică decât lățimea unei cromatide și cu o eroare minimă de aliniere a cromatidei(lor).
Aberație numerică: modificare a numărului de cromozomi față de numărul normal caracteristic pentru celulele utilizate.
Poliploidie: multiplicare a numărului (n) de cromozomi haploizi, alta decât diploidia (și anume 3n, 4n etc.).
Aberație structurală: modificare a structurii cromozomilor, detectabilă la examinarea microscopică a celulelor în stadiul de metafază al diviziunii acestora, care se prezintă sub formă de deleții și fragmente, modificări intracromozomiale și intercromozomiale.
1.3. PRINCIPIUL METODEI DE TESTARE
Animalele se expun la substanța de testat printr-o cale de expunere corespunzătoare și se sacrifică în momente corespunzătoare după tratament. Înainte de sacrificare, animalele se supun tratamentului cu un agent de inhibare a metafazei (de exemplu colchicină sau Colcemid®). Apoi, din celulele de măduvă osoasă se realizează preparate cromozomiale care se colorează și celulele în metafază se examinează pentru a se pune în evidență aberațiile cromozomiale.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Preparatele
1.4.1.1. Selectarea speciilor de animale
Se utilizează, de obicei, șobolani, șoareci și hamsteri chinezești, deși se poate utiliza orice specie de mamifere potrivită. Se recomandă utilizarea unor animale adulte tinere sănătoase din sușe folosite în mod curent în laborator. La începutul studiului, greutatea animalelor ar trebui să prezinte variații minime, care să nu depășească ± 20 % din greutatea medie a fiecărui sex.
1.4.1.2. Condițiile de adăpostire și de hrănire
Se aplică condițiile generale menționate în introducerea generală partea B, dar umiditatea atinsă ar trebui să fie de 50-60 %.
1.4.1.3. Pregătirea animalelor
Animalele adulte tinere sănătoase se distribuie în mod aleatoriu în grupe martor și grupe de tratament. Cuștile ar trebui să se aranjeze astfel încât posibilele efecte datorate amplasării acestora să fie reduse la minim. Animalele sunt identificate individual. Se procedează la aclimatizarea animalelor la condițiile de laborator timp de minimum cinci zile.
1.4.1.4. Prepararea dozelor
Substanțele de testat în stare solidă ar trebui să se preparare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare și să se dilueze, dacă este cazul, înainte de a fi administrate animalelor. Substanțele de testat lichide se pot administra direct sau dilua înainte de administrare. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora în caz de păstrare.
1.4.2. Condiții de testare
1.4.2.1. Solventul/vehiculul
Solventul/vehiculul nu ar trebui să producă efecte toxice la dozele utilizate și nu ar trebui să existe suspiciunea reacției chimice a acestuia cu substanța de testat. Utilizarea altor solvenți/vehicule decât cele recunoscute ar trebui să fie justificată cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere utilizarea unui solvent/vehicul apos.
1.4.2.2. Martorii
Pentru fiecare sex și pentru fiecare test ar trebui să se prevadă martori pozitivi și negativi (solvenți/vehicule), utilizați în paralel. Cu excepția tratamentului cu substanța de testat, manipularea animalelor din grupele martor ar trebui să fie identică cu cea a animalelor din grupele tratate.
Martorii pozitivi ar trebui să producă aberații cromozomiale de structură in vivo la nivelurile de expunere preconizate a genera o creștere detectabilă în raport cu fondul. Dozele de martor pozitiv ar trebui să fie alese astfel încât să se obțină efecte clare, dar fără a revela imediat examinatorului identitatea lamelelor codificate. Pentru martorul pozitiv, se poate accepta administrarea pe o cale diferită față de cea utilizată în cazul substanței de testat și doar o singură prelevare a probelor. Se poate avea în vedere utilizarea unor martori pozitivi din aceeași clasă de substanțe chimice, dacă sunt disponibili. În tabelul următor se prezintă exemple de substanțe care se pot utiliza ca martori pozitivi:
|
Substanța |
Nr. CAS |
Nr. EINECS |
|
metansulfonat de etil |
62-50-0 |
200-536-7 |
|
etil nitrozouree |
759-73-9 |
212-072-2 |
|
mitomicină C |
50-07-7 |
200-008-6 |
|
ciclofosfamidă ciclofosfamidă monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
trietilenmelamină |
51-18-3 |
200-083-5 |
Martorii negativi, tratați doar cu solvent sau cu vehicule și manipulați în același fel ca și grupele tratate, ar trebui să fie incluși la fiecare prelevare de probe, cu excepția cazului în care se dispune de date acceptabile privind variabilitatea inter-animale și frecvențele celulelor cu aberații cromozomiale, provenite de la martori anteriori. Dacă, pentru martorii negativi, se face o singură prelevare de probe, momentul cel mai potrivit pentru prelevarea probelor este momentul primei prelevări. În plus, ar trebui să se utilizeze și martori netratați, cu excepția cazului în care există date de la martori anteriori sau date publicate, care să ateste că solventul/vehiculul selectat nu induce efecte vătămătoare sau mutagene.
1.5. MOD DE LUCRU
1.5.1. Numărul și sexul animalelor
Fiecare grup tratat și grup martor include minimum cinci animale analizabile din fiecare sex. Dacă în momentul studiului există date disponibile din studii pe aceleași specii, în care s-a folosit aceeași cale de expunere, care să demonstreze lipsa unor diferențe substanțiale de toxicitate între sexe, atunci va fi suficientă testarea pe animale de un singur sex. Dacă expunerea umană la produse chimice este specifică sexului, ca în cazul unor produse farmaceutice, testul ar trebui să se realizeze pe animale de sexul corespunzător.
1.5.2. Modalitatea de tratare
Substanțele de testat se administrează de preferință o singură dată. Substanțele de testat se mai pot administra în doze fracționate, și anume două tratamente în aceeași zi la distanță de doar câteva ore, pentru a facilita administrarea unui volum mare de material. Alte modalități de tratare ar trebui să fie justificate în mod științific.
Prelevarea probelor după tratament ar trebui să se realizeze în două momente diferite din aceeași zi. Pentru rozătoare, primul interval de timp este egal cu de 1,5 ori durata ciclului celular normal (acesta din urmă fiind în mod normal de 12-18 ore) după tratament. Deoarece timpul necesar pentru absorbția și metabolismul substanței de testat, precum și acțiunea acesteia asupra cineticii ciclului celular pot să aibă efecte asupra timpului optim pentru detectarea aberației cromozomiale, se recomandă să se procedeze la o altă prelevare de probe la 24 de ore după prima prelevare. Dacă administrarea dozelor durează mai mult de o zi, ar trebui să se procedeze la o prelevare de probe la un interval de timp egal cu de 1,5 ori durata ciclului celular normal după tratamentul final.
Înainte de sacrificare, se procedează la injectarea intraperitoneală a animalelor cu o doză corespunzătoare de agent de inhibare a metafazei (de exemplu Colcemid® sau colchicină). Probele de la animale se prelevează apoi la un interval corespunzător. Pentru șoareci intervalul respectiv este de aproximativ 3-5 ore; pentru hamsterii chinezești intervalul este de 4-5 ore. Celule se recoltează din măduva osoasă și se examinează pentru detectarea aberațiilor cromozomiale.
1.5.3. Doze
Dacă, în lipsa datelor corespunzătoare, se realizează un studiu pentru stabilirea dozelor, acesta ar trebui să se realizeze în același laborator și să utilizeze aceeași specie, aceeași sușă de animale de același sex, iar regimul de tratare să fie același ca cel ce urmează să fie utilizat în studiul principal (5). În caz de toxicitate, se utilizează trei doze diferite pentru prima prelevare. Aceste trei doze ar trebui să acopere un domeniu de toxicități, de la toxicitatea maximă până la toxicitatea minimă sau lipsă. Pentru prelevările ulterioare se utilizează doar doza maximă. Doza maximă se definește ca doza ce produce astfel de semne de toxicitate, încât dozele mai mari, administrate în același mod, se estimează că sunt letale. Substanțele cu activitate biologică specifică la doze mici netoxice (cum ar fi hormonii și mitogenii) pot face excepție de la criteriile de stabilire a dozelor și să fie stabilite pentru fiecare caz în parte. Doza maximă se mai poate defini ca doza care produce anumite semne de toxicitate în măduva osoasă (de exemplu o reducere cu mai mult de 50 % a indexului mitotic).
1.5.4. Test-limită
Dacă un test realizat cu o doză de minimum 2 000 mg/kg greutate corporală, administrată într-o singură repriză sau în două reprize în aceeași zi, nu produce efecte toxice detectabile și dacă o genotoxicitate este improbabilă pe baza datelor referitoare la substanțe cu o structură apropiată, se poate considera că un studiu complet cu utilizarea a trei doze de mărimi diferite nu este necesar. Pentru studiile pe termen lung, doza-limită este de 2 000 mg/kg greutate corporală/zi pentru un tratament de până la 14 zile și de 1 000 mg/kg greutate corporală/zi pentru un tratament mai lung de 14 zile. În funcție de expunerea umană preconizată, ar putea fi necesară o doză mai mare în testul-limită.
1.5.5. Administrarea dozelor
Substanța de testat se administrează, de obicei, prin cavitatea nazală cu ajutorul unui tub stomacal sau al unei canule de intubație adaptate sau printr-o injecție intraperitoneală. Se pot accepta și alte căi de administrare, dacă se pot justifica. Volumul maxim de lichid care se poate administra prin sondă gastrică introdusă prin cavitatea nazală sau prin injecție într-o singură repriză depinde de dimensiunea animalului de laborator. Volumul ar trebui să fie mai mic sau egal cu 2 ml/100 g greutate corporală. Utilizarea unor volume mai mari decât cel menționat ar trebui să se justifice. Cu excepția substanțelor iritante și corozive, care vor prezenta în mod normal efecte exacerbate la concentrații mai mari, variația volumului administrat ar trebui să fie redusă la minim prin ajustarea concentrației, astfel încât să se asigure un volum constant pentru toate dozele.
1.5.6. Prepararea cromozomilor
Măduva osoasă se extrage imediat după sacrificare, se expune la o soluție hipotonică și se fixează. Apoi, celulele se întind pe lamele și se colorează.
1.5.7. Analiza
Se procedează la determinarea indexului mitotic, care este o măsură a citotoxicității, pe cel puțin 1 000 de celule pentru fiecare animal tratat (inclusiv martorii pozitivi) și pentru fiecare animal martor negativ netratat.
Pentru fiecare animal se analizează minimum 100 de celule. Dacă se observă un număr mai mare de aberații, numărul specificat se poate reduce. Toate lamelele, inclusiv cele cu celule de la martorii pozitivi și negativi, ar trebui să fie codificate independent, înainte de examinarea la microscop. Deoarece metodele de preparare a lamelelor conduc adesea la scindarea unei fracții de celule în metafază cu pierdere de cromozomi, toate celulele examinate ar trebui, prin urmare, să conțină un număr de centromeri egal cu 2n ± 2.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Se recomandă prezentarea sub formă de tabel a datelor pentru fiecare animal. Unitatea experimentală este animalul. Pentru fiecare animal, ar trebui să se evalueze numărul de aberații per celulă și procentul de celule cu aberație sau aberații cromozomiale de structură. Diferitele tipuri de aberații cromozomiale de structură ar trebui să fie consemnate împreună cu numărul și frecvența acestora pentru grupele tratate și cele martor. Lacunele se consemnează și se raportează separat, dar în general acestea nu se includ în frecvența totală a aberațiilor. Dacă nu există dovezi privind diferența de răspunsuri între sexe, datele de la ambele sexe se pot combina pentru analiza statistică.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Există câteva criterii pentru determinarea unui rezultat pozitiv, ca o creștere în funcție de doză a numărului relativ de celule cu aberații cromozomiale sau o creștere clară a numărului de celule cu aberații dintr-o grupă cu o doză unică la un singur moment de prelevare. În primul rând, ar trebui să se aibă în vedere relevanța biologică a rezultatelor. Pentru evaluarea rezultatelor testelor se poate recurge și la ajutorul unor metode statistice (6). Semnificația statistică nu ar trebui să fie singurul factor determinant pentru a decide cu privire la un răspuns pozitiv. Rezultatele nesigure ar trebui să fie clarificate prin teste suplimentare, realizate de preferință printr-o modificare a condițiilor de testare.
O creștere a numărului de celule poliploide poate să indice faptul că substanța de testat poate produce aberații ale numărului de cromozomi. O creștere a numărului de celule cu cromozomi enderoduplicați poate să indice faptul că substanța de testat poate să inhibe avansarea ciclului celular (7) (8).
Dacă rezultatele pentru o substanță de testat nu îndeplinesc criteriile menționate anterior, substanța respectivă se consideră a fi nemutagenă în prezentul test.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în unele cazuri rare, datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile independent de numărul de experimente efectuate.
Rezultatele pozitive ale unui test de aberație cromozomială in vivo indică faptul că o substanță provoacă aberații cromozomiale în măduva osoasă a speciei testate. Rezultatele negative indică faptul că, în condițiile de testare, substanța de testat nu provoacă aberații cromozomiale în măduva osoasă a speciei testate.
Ar trebui discutată probabilitatea ca substanța de testat sau metaboliții acesteia să ajungă în circulația generală sau în mod specific în țesutul-țintă (de exemplu toxicitatea sistemică).
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Solventul/vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Animalele de laborator:
— specia/sușa utilizată;
— numărul, vârsta și sexul animalelor;
— sursa, condițiile de adăpost și hrănire etc.;
— greutatea fiecărui animal la începutul testului, inclusiv intervalul de greutate, greutatea medie și deviația standard pentru fiecare grupă.
Condițiile de testare:
— martorii pozitivi și negativi (solvent/vehicul);
— datele din studiul pentru stabilirea dozelor, dacă s-a realizat;
— justificarea alegerii dozelor utilizate;
— detalii privind prepararea substanței de testat;
— detalii privind administrarea substanței de testat;
— justificarea căii de administrare selectate;
— metodele de verificare pentru a constata dacă substanța de testat a ajuns în circulația generală sau în țesutul-țintă, dacă este cazul;
— conversia concentrației substanței de testat (ppm) în hrană/apa de băut în doza reală (mg/kg greutate corporală/zi), dacă este cazul;
— detalii privind calitatea hranei și a apei;
— descrierea amănunțită a modalităților de tratare și de prelevare a probelor;
— metodele de măsurare a toxicității;
— identitatea substanței de inhibare a metafazei, concentrația acesteia și durata tratamentului;
— metodele de preparare a lamelelor;
— criteriile pentru numărătoarea aberațiilor;
— numărul de celule analizate per animal;
— criteriile utilizate la caracterizarea studiilor ca fiind pozitive, negative sau nesigure.
Rezultatele:
— semnele de toxicitate;
— indexul mitotic;
— tipul și numărul aberațiilor, consemnate separat pentru fiecare animal;
— numărul total de aberații pentru fiecare grupă împreună cu numărul mediu și deviațiile standard;
— numărul de celule cu aberații pentru fiecare grupă împreună cu numărul mediu al acestora și deviațiile standard;
— variațiile ploidiei, dacă există;
— relația doză-răspuns, dacă este posibil;
— analizele statistice, dacă există;
— datele privind martorii negativi studiați în paralel;
— datele anterioare privind martorii negativi, cu domeniile, valorile medii și deviațiile standard;
— datele privind martorii pozitivi studiați în paralel.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Adler, I. D. (1984), Cytogenetic Tests in Mammals, in: Mutagenicity Testing: a Practical Approach, S. Venitt and J. M. Parry (eds.). IRL Press, Oxford, Washington D. C., pp. 275-306.
2. Preston, R. J., Dean, B. J., Galloway, S., Holden, H., McFee, A. F. and Shelby, M. (1987), Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells, Mutation Res., 189, 157-165.
3. Richold, M., Chandly, A., Ashby, J., Gatehouse D. G., Bootman, J. and Henderson, L. (1990), In Vivo Cytogenetic Assays, in: D. J. Kirkland, (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing Report. Part I revised, Cambridge University Press, Cambridge, New Cork, Port Chester, Melbourne, Sydney, pp. 115-141.
4. Tice, R. R. Hayashi, M., MacGregor, J. T., Anderson, D., Blakey, D. H., Holden, H. E., Kirch-Volders, M., Oleson Jr., F. B., Paccierotti, F., Preston R. J., Romagna F., Shimada, H., Sutou, S. and Vannier, B. (1994), Report from the Working Group on the In Vivo Mammalian Bone Marrow Chromosomal Aberration Test, Mutation Res., 312, pp. 305-312.
5. Fielder, R. J., Alleen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. and Richold, M. (1992), Report of British Toxicology Society/UK, Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313-319.
6. Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data, D. J. Kirkland, (ed.) Cambridge University Press, Cambridge, pp. 184-232.
7. Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation-induced G2 arrest, Mutation Res. 119, pp. 403-413.
8. Huang, Y., Change, C. and Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, pp. 1363-1364.
B.12. MUTAGENITATEA – TESTUL IN VIVO DE MICRONUCLEU PE ERITROCITE DE MAMIFERE
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 474 a OCDE, Testul in vivo de micronucleu pe eritrocite de mamifere (1997).
1.1. INTRODUCERE
Testul in vivo de micronucleu pe celule de mamifere se utilizează pentru detectarea leziunilor cromozomilor sau ale aparatului mitotic al eritroblaștilor produse de substanța de testat; detectarea se realizează prin analiza eritrocitelor prelevate din măduva osoasă și din celulele sângelui periferic ale animalelor, de obicei, rozătoare.
Scopul testului de micronucleu este identificarea substanțelor care produc leziuni citogenetice ce determină formarea de micronuclee conținând fragmente de cromozomi sau cromozomi întregi întârziați.
Când un eritroblast din măduva osoasă evoluează într-un eritrocit policromatic, nucleul principal este expulzat; orice micronucleu care se formează poate să rămână în citoplasma anucleată. Micronucleele se vizualizează mai ușor în aceste celule cărora le lipsește nucleul principal. O creștere a frecvenței eritrocitelor policromatice micronucleate la animalele tratate indică producerea unei leziuni cromozomiale.
În prezentul test se utilizează în mod curent măduva osoasă a rozătoarelor deoarece eritrocitele policromatice se produc în acest țesut. Numărătoarea eritrocitelor (policromatice) imature micronucleate în sângele periferic este la fel de acceptabilă la toate speciile la care s-a demonstrat incapacitatea splinei de a elimina eritrocitele micronucleate sau care prezintă o sensibilitate specifică pentru detectarea agenților care produc aberații cromozomiale de natură structurală sau numerică. Există numeroase criterii care permit identificarea micronucleelor. Unul dintre acestea este identificarea prezenței sau absenței unui kinetocor sau a ADN centromeric în micronucleu. Frecvența eritrocitelor (policromatice) imature micronucleate este principalul criteriu. De asemenea, numărul de eritrocite (normocromatice) mature în sângele periferic care conține micronuclee printre un număr dat de eritrocite mature se poate utiliza ca un criteriu în cazul tratării animalelor timp de patru săptămâni sau mai mult.
Prezentul test in vivo de micronucleu pe eritrocite de mamifere este relevant în special la evaluarea riscului mutagen, deoarece permite să se țină seama de factorii de metabolism in vivo, de farmacocinetică și de procesele de regenerare a ADN-ului, deși aceștia pot să varieze între specii, între țesuturi și între efectele genetice. Un test in vivo este, de asemenea, util pentru studierea suplimentară a unui efect mutagen detectat într-un sistem in vitro.
Dacă există dovezi că substanța de testat sau un metabolit reactiv nu atinge țesutul-țintă utilizarea prezentului test nu este potrivită.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Centromer (kinetocor): porțiune sau porțiuni dintr-un cromozom care în timpul diviziunii celulare este legată cu fibrele fusului mitotic, ceea ce permite deplasarea ordonată a cromozomilor fiice către polii celulelor fiice.
Micronuclee: nuclee mici, separate de nucleele principale ale celulelor și prezente în plus față de acestea, produse în timpul telofazei mitozei (meioză) de către fragmentele de cromozomi sau de cromozomii întregi întârziați.
Eritrocit normocromatic: eritrocit matur lipsit de ribozomi și care se poate distinge de eritrocitele policromatice imature cu ajutorul unor substanțe care colorează selectiv ribozomii.
Eritrocit policromatic: eritrocit imatur, aflat într-un stadiu intermediar de dezvoltare, care mai conține ribozomi și, prin urmare, se poate distinge de eritrocitele normocromatice mature cu ajutorul substanțelor care colorează selectiv ribozomii.
1.3. PRINCIPIUL METODEI DE TESTARE
Animalele sunt expuse la substanța de testat printr-o cale de expunere corespunzătoare. Dacă se utilizează măduva osoasă, animalele se sacrifică la momente potrivite după tratament, se extrage măduva osoasă, se prepară și se colorează lamelele (1) (2) (3) (4) (5) (6) (7). Dacă se utilizează sângele periferic, acesta se colectează la momente potrivite după tratament, se depune pe lamele și se colorează (4) (8) (9) (10). Pentru studiile cu sânge periferic, celulele ar trebui să se recolteze cât se poate de repede după ultima expunere. Lamelele preparate se examinează pentru a depista prezența micronucleelor.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătire
1.4.1.1. Selectarea speciilor de animale
Dacă se utilizează măduvă osoasă, se recomandă șoareci și șobolani, deși se poate utiliza orice specie adecvată de mamifere. Când se utilizează sânge periferic, se recomandă șoareci. Cu toate acestea, se poate utiliza orice specie adecvată de mamifere, cu condiția să fie o specie la care s-a demonstrat incapacitatea splinei de a elimina eritrocitele micronucleate sau care prezintă o sensibilitate specifică pentru detectarea agenților care produc aberații cromozomiale de natură structurală sau numerică. Se recomandă utilizarea unor animale adulte tinere din sușe utilizate în mod curent în laborator. La începutul studiului, greutatea animalelor ar trebui să prezinte o variație minimă, ce nu trebuie să depășească ± 20 % din greutatea medie a fiecărui sex.
1.4.1.2. Condițiile de adăpostire și de hrănire
Se aplică condițiile generale menționate în introducerea generală partea B, dar umiditatea atinsă ar trebui să fie de 50-60 %.
1.4.1.3. Pregătirea animalelor
Animalele adulte tinere sănătoase se distribuie în mod aleatoriu în grupe martor și grupe de tratament. Animalele sunt identificate individual. Se procedează la aclimatizarea animalelor la condițiile de laborator timp de minimum cinci zile. Cuștile ar trebui să se aranjeze astfel încât posibilele efecte datorate amplasării acestora să fie reduse la minim.
1.4.1.4. Pregătirea dozelor
Substanțele de testat în stare solidă ar trebui să se preparare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare și să se dilueze, dacă este cazul, înainte de a fi administrate animalelor. Substanțele de testat lichide se pot administra direct sau dilua înainte de administrare. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora în caz de păstrare.
1.4.2. Condiții de testare
1.4.2.1. Solventul/vehiculul
Solventul/vehiculul nu ar trebui să producă efecte toxice la dozele utilizate și nu ar trebui să existe suspiciunea reacției chimice a acestuia cu substanța de testat. Utilizarea altor solvenți/vehicule decât cele recunoscute ar trebui să fie justificată cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere utilizarea unui solvent/vehicul apos.
1.4.2.2. Martorii
Pentru fiecare sex și pentru fiecare test ar trebui să se prevadă martori pozitivi și negativi (solvent/vehicul), utilizați în paralel. Cu excepția tratamentului cu substanța de testat, manipularea animalelor din grupele martor ar trebui să fie identică cu cea a animalelor din grupele tratate.
Martorii pozitivi ar trebui să producă micronuclee in vivo la nivelurile de expunere preconizate a genera o creștere detectabilă în raport cu fondul. Dozele de martor pozitiv ar trebui să fie alese astfel încât să se obțină efecte clare, dar fără să releve imediat examinatorului identitatea lamelelor codificate. Pentru martorul pozitiv, se poate accepta administrarea pe o cale diferită de cea prin care se administrează substanța de testat cu o singură prelevare a probelor. În plus, se poate avea în vedere utilizarea unor martori pozitivi din aceeași clasă de produse chimice, dacă sunt disponibili. În tabelul următor se prezintă exemple de substanțe care se pot utiliza ca martori pozitivi:
|
Substanța |
Nr. CAS |
Nr. EINECS |
|
metansulfonat de etil |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozouree |
759-73-9 |
212-072-2 |
|
mitomicină C |
50-07-7 |
200-008-6 |
|
ciclofosfamidă ciclofosfamidă monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
trietilenmelamină |
51-18-3 |
200-083-5 |
Martorii negativi, tratați doar cu solvent sau cu vehicul și manipulați în același fel ca grupele tratate, ar trebui să fie incluși la fiecare prelevare de probe, cu excepția cazului în care se dispune de date acceptabile privind variabilitatea inter-animale și frecvența incidenței celulelor cu micronuclee, provenite de la martori anteriori. Dacă, pentru martorii negativi, se face o singură prelevare de probe, momentul cel mai potrivit pentru prelevarea probelor este momentul primei prelevări. În plus, ar trebui să se utilizeze și martori netratați, cu excepția cazului în care există date de la martori anteriori sau publicate să ateste că solventul/vehiculul selectat nu prezintă efecte vătămătoare sau mutagene.
Dacă se utilizează sânge periferic, se poate accepta o probă prelevată înainte de tratament în calitate de martor negativ, dar doar în studiile de scurtă durată pe sânge periferic (de exemplu 1-3 tratamente), când datele rezultate se situează între limitele estimate pe baza datelor anterioare privind martorul.
1.5. MOD DE LUCRU
1.5.1. Numărul și sexul animalelor
Fiecare grupă tratată și martor include minimum cinci animale analizabile din fiecare sex (11). Dacă în momentul studiului există date disponibile din studii pe aceleași specii, în care s-a folosit aceeași cale de expunere, care să demonstreze lipsa unor diferențe substanțiale de toxicitate între sexe, atunci va fi suficientă testarea pe animale de un singur sex. Dacă expunerea umană la produse chimice este specifică sexului, ca în cazul unor produse farmaceutice, testul ar trebui să se realizeze pe animale de sexul corespunzător.
1.5.2. Modalitatea de tratare
Nu se poate recomanda un program de tratament standard (și anume unul, două sau mai multe tratamente la intervale de 24 de ore). Probele provenite de la un studiu cu administrare prelungită a dozelor sunt acceptabile, atâta timp cât pentru studiul respectiv s-a demonstrat un efect pozitiv sau, pentru un studiu negativ, atâta timp cât s-a demonstrat toxicitatea sau s-a utilizat doza-limită și administrarea dozei a continuat până în momentul prelevării probelor. Pentru a facilita administrarea unui volum mare de material, substanțele de testat se pot administra și în doză fracționată, și anume două tratamente în aceeași zi, la un interval de câteva ore.
Testul se poate realiza în două moduri:
(a) Substanța de testat se administrează animalelor într-o singură repriză. Probele de măduvă osoasă se prelevează de cel puțin două ori, prelevarea începând cel mai devreme la 24 de ore după tratament, fără să se prelungească mai mult de 48 de ore după tratament, cu intervale corespunzătoare între probe. Dacă prelevarea probelor se realizează mai devreme de 24 de ore după tratament, ar trebui să se justifice acest lucru. Probele de sânge periferic se prelevează cel puțin de două ori, dar nu mai devreme de 36 de ore după tratament, cu intervale corespunzătoare după prima probă și nu trebuie să depășească 72 de ore. Dacă la un moment de prelevare se înregistrează un rezultat pozitiv, prelevarea probelor încetează.
(b) Dacă se practică două sau mai multe tratamente zilnice (de exemplu două sau mai multe tratamente la intervale de 24 de ore), ar trebui ca prelevarea probelor să se realizeze o dată la un interval de timp cuprins între 18 și 24 de ore după tratamentul final pentru măduva osoasă și o dată într-un interval de timp cuprins între 36 și 48 de ore după tratamentul final pentru sângele periferic (12).
Dacă este relevant, se pot utiliza și alte momente de prelevare a probelor.
1.5.3. Doze
Dacă, în lipsa datelor corespunzătoare, se realizează un studiu pentru stabilirea dozelor, acesta ar trebui să se realizeze în același laborator și să utilizeze aceeași specie, aceeași sușă de animale de același sex și regimul de tratare să fie același ca cel ce urmează să fie utilizat în studiul principal (13). În caz de toxicitate, se utilizează trei doze diferite pentru prima prelevare. Aceste trei doze ar trebui să acopere un domeniu de toxicități de la toxicitate maximă până la toxicitate minimă sau netoxicitate. Pentru prelevările ulterioare se utilizează doar doza maximă. Doza maximă se definește ca doza ce produce astfel de semne de toxicitate, încât dozele mai mari, administrate în același mod, se estimează că sunt letale. Substanțele cu activitate biologică specifică la doze mici netoxice (cum ar fi hormonii și mitogenii) pot face excepție de la criteriile de stabilire a dozelor și să fie stabilite pentru fiecare caz în parte. Doza maximă se mai poate defini ca doza care produce anumite semne de toxicitate în măduva osoasă (de exemplu o reducere a proporției de eritrocite imature în raport cu numărul total de eritrocite din măduva osoasă sau din sângele periferic).
1.5.4. Test-limită
Dacă un test realizat cu o doză de minimum 2 000 mg/kg greutate corporală, administrată într-o singură repriză sau în două reprize în aceeași zi, nu produce efecte toxice detectabile și dacă o genotoxicitate este improbabilă pe baza datelor referitoare la substanțe cu o structură apropiată, se poate considera că un studiu complet cu utilizarea a trei doze de mărimi diferite nu este necesar. Pentru studiile pe termen lung, doza-limită este de 2 000 mg/kg greutate corporală/zi pentru un tratament de până la 14 zile și de 1 000 mg/kg greutate corporală/zi pentru un tratament mai lung de 14 zile. În funcție de expunerea umană preconizată, s-ar putea să fie necesară o doză mai mare în testul-limită.
1.5.5. Administrarea dozelor
Substanța de testat se administrează, de obicei, prin cavitatea nazală cu ajutorul unui tub stomacal sau a unei canule de intubație adaptate sau printr-o injecție intraperitoneală. Se pot accepta și alte căi de administrare, dacă se pot justifica. Volumul maxim de lichid care se poate administra prin sondă gastrică introdusă prin cavitatea nazală sau prin injecție într-o singură repriză depinde de dimensiunea animalului de laborator. Volumul ar trebui să fie mai mic sau egal cu 2 ml/100 g greutate corporală. Utilizarea unor volume mai mari decât cel menționat ar trebui să se justifice. Cu excepția substanțelor iritante și corozive care vor prezenta în mod normal efecte exacerbate la concentrații mai mari, variația volumului testat ar trebui să fie redusă la minim prin ajustarea concentrației, astfel încât să se asigure un volum constant pentru toate dozele.
1.5.6. Prepararea măduvei osoase/a sângelui
Celule de măduvă osoasă se extrag în mod curent din femur sau tibie imediat după sacrificare. De obicei, celulele se extrag din femur sau tibie, se depun pe lamele și se colorează prin metodele stabilite. Sângele periferic se obține din vena caudală sau alte vase de sânge corespunzătoare. Celulele sanguine se colorează imediat supravital (8) (9) (10) sau se întinde mai întâi pe lamele și apoi se colorează. Utilizarea unui colorant specific pentru ADN [de exemplu oranj de acridină (14), Hoechst 33258 plus pironină –Y (15)] poate să elimine unele din artefacte datorită utilizării unui colorant nespecific pentru ADN. Avantajul menționat nu exclude utilizarea coloranților convenționali (de exemplu Giemsa). Se pot utiliza și alte sisteme [de exemplu coloane de celuloză pentru eliminarea celulelor nucleate (16)], cu condiția ca sistemele respective să se fi dovedit eficiente pentru prepararea micronucleelor în laborator.
1.5.7. Analiza
Pentru fiecare animal se determină proporția de eritrocite imature în raport cu numărul total de eritrocite (imature + mature) prin examinarea a cel puțin 200 de eritrocite pentru măduva osoasă și 1 000 de eritrocite pentru sângele periferic (17). Fiecare dintre lamele, inclusiv cele cu martori pozitivi și negativi, ar trebui codificată independent, înainte de analiza microscopică. Se identifică minimum 2 000 de eritrocite imature per animal pentru a determina incidența eritrocitelor imature micronucleate. Prin identificarea eritrocitelor mature pentru depistarea micronucleelor se pot obține informații suplimentare. La examinarea lamelelor, proporția de eritrocite imature în raport cu numărul total de eritrocite ar trebui să fie mai mare de 20 % față de valoarea martorilor. Dacă animalele sunt tratate în mod continuu timp de patru săptămâni sau mai mult, se pot identifica, de asemenea, cel puțin 2 000 de eritrocite mature per animal pentru a constata incidența micronucleelor. Sistemele de analiză automată (analiza imaginii și citometria de flux a suspensiilor de celule) se pot utiliza în locul evaluării manuale, dacă sunt validate și justificate corespunzător.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Se recomandă prezentarea sub formă de tabel a datelor pentru fiecare animal. Unitatea experimentală este animalul. Pentru fiecare animal analizat se consemnează în tabel numărul de eritrocite imature examinate, numărul de eritrocite imature micronucleate și numărul de eritrocite imature, în raport cu numărul total de eritrocite. Dacă animalele se tratează continuu timp de patru săptămâni sau mai mult, ar trebui să se prezinte și datele privind eritrocitele mature, dacă s-a făcut colectarea acestora. Pentru fiecare animal se prezintă proporția de eritrocite imature în raport cu numărul total de eritrocite și, dacă se consideră că este cazul, procentul de eritrocite micronucleate. Dacă nu există dovezi privind diferența de răspunsuri între sexe, datele de la ambele sexe se pot combina pentru analiza statistică.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Există câteva criterii pentru determinarea unui rezultat pozitiv, cum ar fi o creștere în funcție de doză a numărului de celule micronucleate sau o creștere clară a numărului de celule micronucleate dintr-o grupă cu o doză unică la un singur moment de prelevare. În primul rând, ar trebui să se aibă în vedere relevanța biologică a rezultatelor. Pentru evaluarea rezultatelor testelor se poate recurge și la ajutorul unor metode statistice (18) (19). Semnificația statistică nu ar trebui să fie singurul factor determinant pentru a decide cu privire la un răspuns pozitiv. Rezultatele nesigure ar trebui să fie clarificate prin teste suplimentare, realizate de preferință printr-o modificare a condițiilor de testare.
Dacă rezultatele pentru o substanță de testat nu îndeplinesc criteriile menționate anterior, substanța respectivă se consideră a fi nemutagenă în prezentul test.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în cazuri rare datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile, independent de numărul de experimente.
Rezultatele pozitive ale testului de micronucleu indică faptul că substanța induce formarea de micronuclee ca urmare a leziunilor cromozomiale sau a leziunilor aparatului mitotic din eritroblaștii speciei testate. Rezultatele negative indică faptul că, în condițiile de testare, substanța de testat nu produce micronuclee în eritrocitele imature ale speciei testate.
Ar trebui să fie discutată probabilitatea ca substanța de testat sau metaboliții acesteia să ajungă în circulația generală sau în mod specific în țesutul-țintă (de exemplu toxicitatea sistemică).
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare ar trebui să conțină următoarele informații:
Solventul/vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Animalele de laborator:
— specia/sușa utilizată;
— numărul, vârsta și sexul animalelor;
— sursa, condițiile de adăpost și hrănire etc.;
— greutatea fiecărui animal la începutul testului, inclusiv intervalul de greutate, greutatea medie și deviația standard pentru fiecare grupă.
Condițiile de testare:
— martorii pozitivi și negativi (solvent/vehicul);
— datele din studiul pentru stabilirea dozelor, dacă s-a realizat;
— justificarea alegerii dozelor utilizate;
— detalii privind prepararea substanței de testat;
— detalii privind administrarea substanței de testat;
— justificarea căii de administrare selectate;
— metodele de verificare pentru a constata dacă substanța de testat a ajuns în circulația generală sau în țesutul-țintă, dacă este cazul;
— conversia concentrației substanței de testat (ppm) în hrană/apa de băut în doza reală (mg/kg greutate corporală/zi), dacă este cazul;
— detalii privind calitatea hranei și a apei;
— descrierea amănunțită a modalităților de tratare și de prelevare a probelor;
— metodele de preparare a lamelelor;
— metodele de măsurare a toxicității;
— criteriile pentru numărătoarea eritrocitelor imature micronucleate;
— numărul de celule analizate per animal;
— criteriile utilizate la caracterizarea studiilor ca fiind pozitive, negative sau nesigure.
Rezultatele:
— semnele de toxicitate;
— proporția de eritrocite imature în raport cu numărul total de eritrocite;
— numărul de eritrocite imature micronucleate, prezentat separat pentru fiecare animal;
— media ± deviația standard pentru eritrocitele imature micronucleate pentru fiecare grupă;
— relația doză-răspuns, dacă este posibil;
— analizele statistice și metodele aplicate;
— datele privind martorii negativi studiați în paralel și anterior testului;
— datele privind martorii pozitivi studiați în paralel.
— Discutarea rezultatelor.
— Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Heddle, J. A. (1973), A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, pp. 187-190.
2. Schmid, W. (1975), The Micronucleus Test, Mutation Res., 31, pp. 9-15.
3. Heddle, J. A., Salamone, M. F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J. G. and Newell, G. W. (1983), The Induction of Micronuclei as a Measure of Genotoxicity, Mutation Res. 123, pp. 61-118.
4. Mavournin, K. H., Blakey, D. H., Cimino, M. C., Salamone, M. F. and Heddle, J. A. (1990), The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, pp. 29-80.
5. MacGregor, J. T., Schlegel, R., Choy, W. N., and Wehr, C. M. (1983), Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice, in: Developments in Science and Practice of Toxicology, ed. A. W. Hayes, R. C. Schnell and T. S. Miya, Elsevier, Amsterdam, pp., 555-558.
6. MacGregor, J. T., Heddle, J. A., Hite, M., Margolin, G. H., Ramel, C., Salamone, M. F., Tice, R. R. and Wild, D. (1987), Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erythrocytes, Mutation Res., 189, pp. 103-112.
7. MacGregor, J. T., Wehr, C. M., Henika, P. R., and Shelby, M. E. (1990), The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies, Fund. Appl. Toxicol. 14, pp. 513-522.
8. Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. and Ishidate, M. Jr. (1990), The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides, Mutation Res., 245, pp. 245-249.
9. The Collaborative Study Group for the Micronucleus Test (1992). Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridine Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS, MMS, Mutation Res., 278, pp. 83-98.
10. The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS, MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995). Protocol recommended for the short-term mouse peripheral blood micronucleus test, Mutagenesis, 10, pp. 153-159.
11. Hayashi, M., Tice, R. R., MacGregor, J. T., Anderson, D., Blackey, D. H., Kirsch-Volders, M., Oleson, Jr. F. B., Pacchierotti, F., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994), In Vivo, Rodent Erythrocyte Micronucleus Assay, Mutation Res., 312, pp. 293-304.
12. Higashikuni, N. and Sutou, S. (1995), An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral blood micronucleus test, Mutagenesis, 10, pp. 313-319.
13. Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. and Rochold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313-319.
14. Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, pp. 241-247.
15. MacGregor, J. T., Wehr, C. M. and Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y, Mutation Res., 120, pp. 269-275.
16. Romagna, F. and Staniforth, C. D. (1989), The automated bone marrow micronucleus test, Mutation Res., 213, pp. 91-104.
17. Gollapudi, B. and McFadden, L. G. (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Res., 347, pp. 97-99.
18. Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D. G. and Henderson, L. (1990), In Vivo Cytogenetics Assay, in: D. J. Kirkland (ed.), Basic Mutagenicity tests. UKEMS Recommended Procedures, UKEMS Sub-Committee on Guidelines for Mutagenicity Testing Report, Part I, revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141.
19. Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232.
B.13/14. MUTAGENITATEA – TESTUL DE MUTAȚIE INVERSĂ PE BACTERII
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 471 a OCDE, Testul de mutație inversă pe bacterii (1997).
1.1. INTRODUCERE
Testul bacterian de mutație inversă se bazează pe sușe de Salmonella typhimurium și Escherichia coli, care necesită aminoacizi, și urmărește detectarea mutațiilor punctiforme, care includ substituția, adăugarea sau deleția uneia sau a câtorva perechi de bază din ADN (1) (2) (3). Principiul prezentului test bacterian de mutație inversă constă în detectarea mutațiilor care reîntorc mutațiile, prezente în sușele experimentale, în starea inițială și refac funcționalitatea bacteriilor de a sintetiza un aminoacid esențial. Bacteriile de inversare se detectează datorită capacității lor de a se dezvolta în absența aminoacidului necesar pentru sușa parentală experimentală.
Mutațiile punctiforme sunt cauza multor maladii genetice umane și există dovezi substanțiale că mutațiile din oncogene și genele supresoare de tumori din celulele somatice sunt implicate în formarea tumorilor la oameni și animalele de laborator. Testul bacterian de mutație inversă este rapid, ieftin și relativ ușor de realizat. Multe dintre sușele experimentale au câteva particularități care le fac mai sensibile pentru detectarea de mutații, inclusiv secvențe de ADN sensibile la mutații în locurile de inversare, permeabilitate celulară crescută pentru moleculele mari și eliminarea sistemelor de regenerare a ADN sau intensificarea proceselor care au tendința să inducă erori în timpul regenerării ADN. Specificitatea sușelor experimentale poate să furnizeze informații utile privind tipurile de mutații care sunt induse de către agenții genotoxici. O bază de date cu un număr mare de rezultate, pentru structuri foarte variate, este disponibilă pentru testele bacteriene de mutații inverse și au fost elaborate metodologii bine stabilite pentru testarea produselor chimice cu diferite proprietăți fizico-chimice, inclusiv a compușilor volatili.
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
Un test de mutație inversă, fie la Salmonella typhimurium, fie la Escherichia coli, detectează mutația într-o sușă care necesită un aminoacid (histidină sau respectiv triptofan) pentru a produce o sușă independentă de aportul exterior de aminoacid.
Mutageni care provoacă substituția perechilor de bază sunt agenți care provoacă substituirea unei baze din ADN. Într-un test de reversie, acest tip de modificare poate să se producă la locul mutației inițiale sau într-un al doilea loc în genomul bacterian.
Mutageni de decalare a cadrului de citire sunt agenți care produc adăugarea sau deleția uneia sau a mai multor perechi de bază din ADN, modificând astfel cadrul de citire în ARN.
1.3. CONSIDERAȚII PRELIMINARE
Testul bacterian de mutație inversă utilizează celule procariote, care diferă de celulele mamiferelor în privința absorbției, a metabolismului, a structurii cromozomilor și a proceselor de regenerare a ADN. Pentru testele realizate in vitro este necesară în general o sursă exogenă de activare metabolică. Sistemele de activare metabolică in vitro nu pot să reproducă în totalitate condițiile metabolismului celulelor de mamifere in vivo. Testul nu furnizează, prin urmare, informații directe privind capacitatea mutagenă și cancerigenă a unei substanțe la mamifere.
Testul bacterian de mutație inversă se utilizează, de obicei, pentru o primă triere a activității genotoxice, în special pentru detectarea mutației punctiforme. O bogată bază de date demonstrează că multe produse chimice care dau rezultate pozitive în prezentul test prezintă activitate mutagenă și în alte teste. Există exemple de agenți mutageni care nu se detectează prin acest test; aceste deficiențe se pot explica prin natura specifică a efectului detectat, activării metabolice diferite sau biodisponibilității diferite. Pe de altă parte, factorii care cresc sensibilitatea testului bacterian de mutație inversă pot să conducă la o supraestimare a activității mutagene.
S-ar putea ca testul bacterian de mutație inversă să nu fie potrivit pentru evaluarea anumitor clase de substanțe chimice, de exemplu compușii cu acțiune bactericidă puternică (de exemplu anumite antibiotice) sau cei despre care se consideră (sau se știe) că interferează în mod specific cu sistemele de replicare a celulelor de mamifere (de exemplu unii inhibitori de topoizomerază și unii analogi de nucleozide). În aceste cazuri, s-ar putea ca testele de mutație pe celule de mamifere să fie mai potrivite.
Deși mulți compuși care dau rezultate pozitive în prezentul test sunt cancerigene pentru mamifere, corelația nu este absolută. Aceasta depinde de clasa de substanțe chimice și există agenți cancerigeni care nu se detectează cu prezentul test, deoarece acționează prin alte mecanisme negenotoxice sau mecanisme care nu sunt prezente în celulele bacteriene.
1.4. PRINCIPIUL METODEI DE TESTARE
Suspensiile de celule bacteriene sunt expuse la substanța de testat în prezența și în absența unui sistem exogen de activare metabolică. În procedeul de încorporare prin depunere pe o placă, suspensiile menționate se amestecă cu o geloză de acoperire (agar) și se depun imediat pe un mediu minimal. În procedeul cu preincubare, amestecul de tratare se incubează și apoi se amestecă cu geloza de acoperire înaintea depunerii pe un mediu minim. Pentru ambele metode, după două sau trei zile de incubare, coloniile care produc inversarea se numără și numărul obținut se compară cu cel al coloniilor spontane de inversare aflate pe plăci cu martor tratate cu solvent.
Sunt descrise câteva proceduri pentru realizarea testului bacterian de mutație inversă. Printre cele utilizate în mod curent sunt metoda de încorporare prin depunere (1) (2) (3) (4), metoda cu preincubare (2) (3) (5) (6) (7) (8), metoda fluctuației (9) (10) și metoda cu suspensie (11). Sunt descrise modificări pentru testarea substanțelor în stare gazoasă sau de vapori (12).
În prezenta metodă se descrie modul de lucru pentru procedeul de încorporare prin depunere și pentru cel cu preincubare. Oricare dintre acestea se poate accepta pentru realizarea experimentelor, atât cu activare metabolică, cât și fără aceasta. Pentru unele substanțe, este mai eficientă detectarea prin procedeul cu preincubare. Substanțele respective aparțin unor clase chimice care includ nitrozamine alifatice cu lanț scurt, metale bivalente, aldehide, coloranți azoici și diazoderivații, alcaloizi ai pirolizidinei, compuși alchilici și nitroderivați (3). De asemenea, se admite că unele clase de mutageni nu se detectează întotdeauna prin procedee standard, ca încorporarea prin depunere sau procedeul cu incubare. Ar trebui să se considere că acestea sunt „cazuri izolate” și se recomandă cu tărie utilizarea unor procedee alternative pentru detectarea lor. Din categoria „cazuri izolate” este posibilă identificarea (împreună cu exemple de procedeele care se pot utiliza pentru detectarea acestora) a următoarelor cazuri: coloranți azoici și compuși diazoici (3) (5) (6) (13), cei în stare gazoasă și volatili (12) (14) (15) (16) și glicozidele (17) (18). Orice deviație de la procedura standard necesită o justificare științifică.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Pregătire
1.5.1.1. Bacteriile
Culturile proaspete de bacterii ar trebui lăsate să se dezvolte până la finalul fazei exponențiale sau debutul fazei staționare de creștere (aproximativ 109 celule pe ml). Culturile aflate în faza staționară finală nu ar trebui să se utilizeze. Este esențial ca în experiment să se utilizeze culturi cu titru mare de bacterii viabile. Titrul se poate determina, fie plecând de la datele anterioare privind curbele de creștere ale culturilor martor, fie pentru fiecare test, prin determinarea numărului de celule viabile prin etalare.
Temperatura de incubare recomandată este de 37 oC.
Se recomandă utilizarea a minimum cinci sușe de bacterii. Acestea ar trebui să includă patru sușe de S. typhimurium (TA 1535; TA 1537 sau TA97a sau TA97; TA98 și TA100) pentru care comparațiile între laboratoare au indicat că sunt fiabile și dau răspunsuri reproductibile. Cele patru sușe de S. typhimurium menționate posedă perechi de bază GC în primul situs de reversie și se cunoaște că acestea nu pot să detecteze anumiți agenți mutageni oxidanți, agenți de reticulare și unele hidrazine. Detectarea acestor substanțe este posibilă cu ajutorul sușelor de E. coli WP2 sau de S. typhimurium TA102 (19) care posedă o pereche de bază AT în situsul primar de reversie. Combinația de sușe recomandată este, prin urmare, următoarea:
— S. typhimurium TA1535; și
— S. typhimurium TA1537 sau TA97 sau TA97a; și
— S. typhimurium TA98; și
— S. typhimurium TA100; și
— E. coli WP2 uvrA sau E. coli WP2 uvrA (pKM101) sau S. typhimurium TA102.
Pentru detectarea agenților mutageni de reticulare s-ar putea prefera includerea sușei TA102 sau adăugarea unei sușe de E. coli capabile de regenerarea ADN [de exemplu E. coli WP2 sau E. coli WP2 (pKM101)].
Ar trebui să se utilizeze procedurile stabilite pentru prepararea culturilor de rezervă, verificarea markerilor și pentru păstrare. Pentru fiecare preparat de cultură de rezervă congelată, ar trebui să se demonstreze necesitatea prezenței unui aminoacid pentru dezvoltarea culturii (histidină pentru sușele S. typhimurium și triptofan pentru sușele E. coli). Ar trebui să se verifice și alte caracteristici ale fenotipului, de exemplu: prezența sau absența plasmidelor factorului R (rezistență), dacă este cazul [și anume rezistența la ampicilină a sușelor TA98, TA100, TA97a sau TA97, WP2 uvrA și WP2 uvrA (pKM101) și rezistența la ampicilină + tetraciclină a sușei TA102]; prezența mutațiilor caracteristice (și anume mutația rfa în S. typhimurium prin sensibilizare la cristal violet și mutația uvrA în E. coli sau mutația uvrB în S. typhimurium prin sensibilizare la lumina ultravioletă) (2) (3). De asemenea, sușele ar trebui să producă un număr de colonii spontane de reversie pe fiecare placă, între limitele de frecvență estimate pe baza datelor de laborator anterioare și, de preferință, între limitele semnalate în literatura de specialitate.
1.5.1.2. Mediul
Se utilizează o geloză minimală corespunzătoare (de exemplu una care conține mediu minimal E Vogel-Bonner și glucoză) și o geloză de acoperire care conține histidină și biotin sau triptofan pentru a permite divizarea doar a unui număr mic de celule (1) (2) (9).
1.5.1.3. Activarea metabolică
Expunerea bacteriilor la substanța de testat ar trebui să se realizeze atât în prezența, cât și în absența unui sistem corespunzător de activare metabolică. Sistemul utilizat cel mai frecvent conține o fracție post mitocondrială îmbogățită cu un cofactor (S9), preparată din ficat de rozătoare tratat cu agenți de inducție enzimatică, de exemplu Aroclor 1254 (1) (2) sau un amestec de fenobarbitonă și β-naftoflavonă (18) (20) (21). Fracția postmitocondrială se utilizează, de obicei, la concentrații cuprinse între 5 și 30 % v/v în amestecul S9. Alegerea și compoziția unui sistem de activare metabolică pot să depindă de clasa chimică a substanței de testat. În unele cazuri, s-ar putea să fie convenabilă utilizarea mai multor concentrații ale fracției postmitocondriale. Pentru coloranții azoici și diazoderivați, s-ar putea să fie mai potrivită utilizarea unui sistem de activare metabolică reducător (6) (13).
1.5.1.4. Substanța de testat/Preparare
Substanțele de testat în stare solidă ar trebui să se prepare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare, care, dacă este cazul, se diluează înaintea tratamentului bacteriilor. Substanțele de testat lichide se pot adăuga direct în sistemele de testare și se diluează înainte de utilizare în tratamentul bacteriilor. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora în caz de păstrare.
Solventul/vehiculul nu ar trebui să reacționeze chimic cu substanța de testat și nu ar trebui să afecteze supraviețuirea bacteriilor și activitatea S9 (22). Utilizarea altor solvenți/vehicule decât cele recunoscute ar trebui să fie justificată cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere utilizarea unui solvent/vehicul apos. Când se testează substanțe instabile în apă, solventul organic utilizat ar trebui să nu conțină apă.
1.5.2. Condiții de testare
1.5.2.1. Sușele experimentale (a se vedea 1.5.1.1)
1.5.2.2. Concentrația de expunere
Printre criteriile care trebuie luate în considerație la determinarea cantității maxime de substanță de testat ce urmează se utilizeze sunt citotoxicitatea și solubilitatea în amestecul final de tratare.
Ar putea fi util un test preliminar pentru determinarea toxicității și caracteristicilor de solubilitate. Detectarea citotoxicității poate fi posibilă printr-o reducere a numărului de colonii care provoacă reversia, o clarificare și diminuare a fondului de bacterii sau a gradului de supraviețuire a culturilor tratate. Prezența sistemelor de activare metabolică poate să influențeze citotoxicitatea unei substanțe. Insolubilitatea ar trebui să fie evaluată prin formarea în amestecul final, în condiții de testare reale, a unui precipitat vizibil cu ochiul liber.
Concentrația de testare maximă recomandată pentru substanțele necitotoxice solubile este de 5 mg/placă sau 5 μl/placă. Pentru substanțele necitotoxice insolubile la 5 mg/placă sau 5 μl/placă, una sau mai multe din concentrațiile de testare ar trebui să fie insolubile în amestecul final de tratament. Pentru substanțele de testat care sunt deja citotoxice la concentrații mai mici de 5 mg/placă sau 5 μl/placă, testarea ar trebui să se realizeze până la o concentrație citotoxică. Ar trebui ca precipitatul să nu interfereze cu evaluarea rezultatelor.
Într-un test inițial, se recomandă utilizarea unui număr minim de cinci concentrații analizabile diferite, cu intervale între punctele de testare de aproximativ o semiunitate logaritmică (și anume √10). Pentru stabilirea unei relații concentrație – răspuns, intervale menționate mai reduse ar putea fi mai adecvate. Când se evaluează substanțe cu un conținut substanțial de posibile impurități mutagene, s-ar putea avea în vedere testarea la concentrații mai mari de 5 mg/placă sau 5 μl/placă.
1.5.2.3. Martorii negativi și pozitivi
Martorii pozitivi specifici sușei și martorii negativi (solvent sau vehicul) utilizați în paralel, ar trebui să se includă în fiecare test, atât în prezența, cât și în absența activării metabolice. Pentru martorii pozitivi, ar trebui să fie selectate acele concentrații care permit să se demonstreze eficiența testului realizat.
Pentru testele care utilizează un sistem de activare metabolică, selectarea substanței sau a substanțelor de referință pentru martorii pozitivi ar trebui să se realizeze în funcție de tipul sușelor bacteriene utilizate.
În tabelul următor sunt prezentate exemple de substanțe care se pot utiliza ca martori pozitivi pentru testele cu activare metabolică:
|
Nr. CAS |
Nr. EINECS |
Substanța |
|
781-43-1 |
212-308-4 |
9,10-dimetilantracen |
|
57-97-6 |
200-359-5 |
7,12-dimetilbenz[a]antracen |
|
50-32-8 |
200-028-5 |
benzo[a]piren |
|
613-13-8 |
210-330-9 |
2-aminoantracen |
|
50-18-0 |
ciclofosfamidă |
|
|
6055-19-2 |
200-015-4 |
ciclofosfamidă monohidrat |
Următoarea substanță este un martor pozitiv adecvat pentru metoda de activare metabolică reductivă:
|
573-58-0 |
209-358-4 |
Roșu de Congo |
2-aminoantracenul nu ar trebui să se utilizeze ca indicator unic al eficienței amestecului S9. Dacă se utilizează 2-aminoantracenul, fiecare lot de S9 ar trebui să fie, de asemenea, caracterizat cu un mutagen care necesită o activare metabolică de către enzimele microzomiale, de exemplu benzo[a]pirenul, dimetilbenzantracenul.
În tabelul următor sunt prezentate exemple de substanțe care se pot utiliza ca martori pozitivi specifici sușei pentru testele realizate fără un sistem de activare metabolică exogenă:
|
Nr. CAS |
Nr. EINECS |
Substanța |
Sușa |
|
26628-22-8 |
247-852-1 |
azidă de sodiu |
TA 1535 și TA 100 |
|
607-57-8 |
210-138-5 |
2-nitrofluoren |
TA 98 |
|
90-45-9 |
201-995-6 |
9-aminoacridină |
TA 1537, TA 97 și TA 97a |
|
17070-45-0 |
241-129-4 |
ICR 191 |
TA 1537, TA 97 și TA 97a |
|
80-15-9 |
201-254-7 |
hidroperoxid de cumenă |
TA 102 |
|
50-07-7 |
200-008-6 |
mitomicin C |
WP2 uvrA și TA 102 |
|
70-25-7 |
200-730-1 |
N-etil-N-nitro-N-nitrozoguanidină |
WP2, WP2 uvrA și WP2uvrA(pKM101) |
|
56-57-5 |
200-281-1 |
4-nitrochinolină-1-oxid |
WP2, WP2 uvrA și WP2uvrA(pKM101) |
|
3688-53-7 |
furilfuramidă (AF2) |
sușe cu conținut de plasmid |
Se pot utiliza și alte substanțe de referință ca martori pozitivi corespunzători. Ar trebui să se aibă în vedere utilizarea unor martori pozitivi din aceeași clasă chimică, dacă sunt disponibili.
Ar trebui să se utilizeze martori negativi, constituiți din solvent sau vehicul fără substanța de testat, dar tratați în același mod ca grupele cu tratament. În plus, ar trebui să se utilizeze și martori netratați, cu excepția cazului în care există date din testele anterioare care să ateste că solventul ales nu are efecte dăunătoare sau mutagene.
1.5.3. Mod de lucru
Pentru metoda de încorporare prin depunere pe o placă (1) (2) (3) (4), fără activare metabolică, se prepară, de obicei, un amestec din 0,05 ml sau 0,1 ml de soluție de testat, 0,1 ml de cultură bacteriană proaspătă (ce conține aproximativ 108 celule viabile) și 0,5 ml de tampon steril cu 2,0 ml geloză de acoperire (agar). Pentru testul cu activare metabolică, se prepară, de obicei, un amestec din 0,5 ml preparat de activare metabolică, ce conține o cantitate specifică de fracție postmitocondrială (în proporție de 5 până la 30 % v/v în preparatul de activare metabolică), 2,0 ml de geloză de acoperire, bacterii și substanța de testat/soluția de testat. Conținutul din fiecare eprubetă se agită și se toarnă pe suprafața unui mediu minimal de geloză depus pe placă. Geloza de acoperire se lasă să se solidifice înainte de incubare.
Pentru metoda de preincubare (2) (3) (5) (6), substanța de testat/soluția de testat se supune la preincubare împreună cu sușa experimentală (ce conține aproximativ 108 celule viabile) și cu tamponul steril sau sistemul de activare metabolică (0,5 ml) de obicei timp de 20 de minute sau mai mult, la 30-37 oC, înainte de a fi amestecată cu geloza de acoperire și turnată pe suprafața unui mediu minimal de geloză depus pe placă. De obicei, se prepară un amestec din 0,05 ml sau 0,1 ml de substanță de testat/soluție de testat, 0,1 ml bacterii și 0,5 ml amestec S9 sau tampon steril cu 2,0 ml geloză de acoperire. Eprubetele ar trebui să fie aerate cu ajutorul unui agitator în timpul preincubării.
Pentru o bună estimare a variației, ar trebui să se utilizeze câte trei plăci cu depuneri pentru fiecare doză. Se acceptă utilizarea a doar două plăci cu depuneri, dacă se justifică științific acest lucru. Pierderea ocazională a unei plăci nu invalidează în mod necesar testul.
Substanțele în stare gazoasă sau cele volatile ar trebui să fie testate în condiții corespunzătoare, de exemplu în vase închise ermetic (12) (14) (15) (16).
1.5.4. Incubarea
Toată plăcile dintr-un test dat ar trebui să fie incubate la 37 oC timp de 48-72 de ore. După incubare, se procedează la numărătoarea coloniilor care provoacă reversia de pe fiecare placă.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Datele ar trebui să se prezinte sub forma numărului de colonii care provoacă reversia de pe fiecare placă. De asemenea, ar trebui să se prezinte numărul de colonii care provoacă reversie, atât pe plăcile cu martor negativ (martor solvent și martor netratat, dacă s-a utilizat), cât și pentru plăcile cu martor pozitiv. Ar trebui să se prezinte numărătoarea pentru fiecare placă, numărul mediu de colonii care provoacă reversia pentru fiecare placă și deviația standard pentru substanța de testat și pentru martorii pozitivi și negativi (netratați și solvent).
Nu este necesară verificarea unui răspuns clar pozitiv. Rezultatele nesigure ar trebui să fie clarificate prin teste suplimentare, realizate de preferință prin modificarea uneia dintre condițiile de testare. Rezultatele negative necesită confirmare pentru fiecare caz. În cazurile în care se consideră că nu este necesară confirmarea rezultatelor negative, ar trebui să se ofere o justificare. Pentru testele de confirmare ar trebui să se aibă în vedere modificarea condițiilor de testare pentru lărgirea gamei de condiții evaluate. Condițiile de testare care ar putea fi modificate includ diferența dintre concentrații, metoda de tratament (încorporarea prin depunere pe placă sau preincubarea în mediu lichid) și condițiile de activare metabolică.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Există câteva criterii pentru determinarea unui rezultat pozitiv, precum creșterea în funcție de concentrație peste intervalul testat și o creștere reproductibilă a uneia sau mai multor concentrații ale numărului de colonii care provoacă reversia per placă, la cel puțin o sușă cu sau fără sistem de activare metabolică (23). În primul rând ar trebui să se aibă în vedere relevanța biologică a rezultatelor. Pentru evaluarea rezultatelor testelor se poate recurge și la ajutorul unor metode statistice (24). Semnificația statistică nu ar trebui să fie totuși singurul factor determinant pentru a decide cu privire la un răspuns pozitiv.
Dacă rezultatele pentru o substanță de testat nu îndeplinesc criteriile menționate anterior, substanța respectivă se consideră a fi nemutagenă în prezentul test.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în unele cazuri rare datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile, independent de numărul de experimente.
Rezultatele pozitive ale unui test de mutație bacteriană inversă indică faptul că substanța de testat induce mutații punctiforme prin substituirea bazelor sau decalarea cadrului de citire în genomul de Salmonella typhimurium și/sau Escherichia coli. Rezultatele negative indică faptul că, în condiții de testare, substanța de testat nu este mutagenă pentru speciile testate.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Solventul/vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Sușele:
— sușele utilizate;
— numărul de celule per cultură;
— caracteristicile sușei.
Condițiile de testare:
— cantitatea de substanță de testat per placă (mg/placă sau μl/placă) cu justificarea alegerii dozei și numărului de plăci per concentrație;
— mediile utilizate;
— tipul și compoziția sistemului de activare metabolică, inclusiv criteriile de acceptabilitate;
— procedurile de tratament.
Rezultatele:
— semnele de toxicitate;
— semnele de precipitare;
— numărătoarea pentru fiecare placă;
— numărul mediu de colonii care provoacă reversia pentru fiecare placă și deviația standard;
— relația doză-răspuns, dacă este posibil;
— analizele statistice, dacă există;
— datele privind martorii negativi (solvent/vehicul) și pozitivi studiați în paralel, cu domenii, valori medii și deviații standard;
— datele privind martorii negativi (solvent/vehicul) și pozitivi studiați anterior, cu domenii, valori medii și deviații standard.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Ames, B. N., McCann, J. and Yamasaki E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, pp. 347-364.
2. Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, pp. 173-215.
3. Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C., Nohmi, T., Venitt, S. and Zeiger, E. (1994), Recommendations for the Performance of Bacterial Mutation Assays, Mutation Res., 312, pp. 217-233.
4. Kier, L. D., Brusick, D. J., Auletta, A. E., Von Halle, E. S., Brown, M. M., Simmon, V. F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T. K. and Ray V. (1986), The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 168, pp. 69-240.
5. Yahagi, T., Degawa, M., Seino, Y.Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975), Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, 1, pp. 91-96.
6. Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M. (1980), Factors Modulating Mutagenicity Microbial Tests, in: Short-term Test Systems for Detecting Carcinogens, ed. Norpoth K. H. and Garner, R. C., Springer, Berlin-Heidelberg-New York, pp. 273-285.
7. Gatehouse, D. G., Rowland, I. R., Wilcox, P., Callender, R. D. and Foster R. (1980), Bacterial Mutation Assays, in: Basic Mutagenicity Tests: UKEMS Part 1 Revised, ed. D. J. Kirkland, Cambridge University Press, pp. 13-61.
8. Aeschacher, H. U., Wolleb, U. and Porchet, L. (1987), Liquid Preincubation Mutagenicity Test for Foods, J. Food Safety, 8, pp. 167-177.
9. Green, M. H. L., Muriel, W. J. and Bridges, B. A. (1976), Use of a simplified fluctuation test to detect low levels of mutagens, Mutations Res., 38, pp. 33-42.
10. Hubbard, S. A., Green, M. H. L., Gatehouse, D. and J. W. Bridges (1984), The Fluctuation Test in Bacteria, in: Handbook of Mutagenicity Test Procedures, 2nd Edition, ed. Kilbey, B. J., Legator, M., Nichols, W. and Ramel, C., Elsevier, Amsterdam-New York-Oxford, pp. 141-161.
11. Thompson, E. D. and Melampy, P. J. (1981), An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium, Environmental Mutagenesis, 3, pp. 453-465.
12. Araki, A., Noguchi, T., Kato, F. and T. Matsushima (1994), Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag, Mutation Res., 307, pp. 335-344.
13. Prival, M. J., Bell, S. J., Mitchell, V. D., Reipert, M. D. and Vaughan, V. L. (1984), Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay, Mutation Res., 136, pp. 33-47.
14. Zeiger, E., Anderson B. E., Haworth, S., Lawlor, T. and Mortelmans, K. (1992), Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals, Environ. Mol. Mutagen., 19, pp. 2-141.
15. Simmon, V., Kauhanen K. and Tardiff, R. G. (1977), Mutagenic Activity of Chemicals Identified in Drinking Water, in Progress in Genetic Toxicology, D. Scott, B. Bridges and F. Sobels (eds.) Elsevier, Amsterdam, pp. 249-258.
16. Hughes, T. J., Simmons, D. M., Monteith, I. G. and Claxton, L. D. (1987), Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay, Environmental Mutagenesis, 9, pp. 421-441.
17. Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M. and Sugimura T. (1979), Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salomonella typhimurium, Cancer Res., 39, pp. 3780-3782.
18. Tamura, G., Gold, C., Ferro-Luzzi, A. and Ames, B. N. (1980), Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora, Proc. Natl. Acad. Sci. USA, 77, pp. 4961-4965.
19. Wilcox, P., Naidoo, A., Wedd, D. J. and Gatehouse, D. G. (1990), Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains, Mutagenesis, 5, pp. 285-291.
20. Matsushima, T., Sawamura, M., Hara, K. and Sugimura T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, in: In Vitro Metabolic Activation in Mutagenesis Testing, eds. F. J. de Serres et al. Elsevier, North Holland, pp. 85-88.
21. Elliot, B. M., Combes, R. D., Elcombe, C. R., Tatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177.
22. Maron, D., Katzenellenbogen, J. and Ames, B. N. (1981), Compatibility of Organic Solvents with the Salmonella/Microsome Test, Mutation Res., 88, pp. 343-350.
23. Claxton, L. D., Allen J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987), Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity, Mutation Res., 189, pp. 83-91.
24. Mahon, G. A. T., Green, M. H. L., Middleton, B., Mitchell, I., Robinson, W. D. and Tweats, D. J. (1989), Analysis of Data from Microbial Colony Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Part II. Statistical Evaluation of Mutagenicity Test Data, ed. Kirkland, D. J., Cambridge University Press, pp. 28-65.
B.15. TESTE DE MUTAGENEZĂ ȘI DE DEPISTARE A CANCEROGENEZEI MUTAȚIA GENICĂ – SACCHAROMYCES CEREVISIAE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Pentru a măsura producerea mutațiilor genice induse de agenți chimici, cu sau fără activare metabolică, pot fi folosite diverse sușe haploide și diploide ale drojdiei Saccharomyces cerevisiae.
Au fost utilizate metode de producere a mutațiilor directe în sușe haploide, cum ar fi măsurarea transformării din mutanți roșii, care au nevoie de adenină (ade-1, ade-2), în mutanți albi cu nevoi duble de adenină, și metode selective cum ar fi inducerea rezistenței la canavnaină și cicloheximidă.
Cel mai folosit sistem de mutație inversă validat presupune folosirea sușei haploide XV 185-14C, care conține mutații nonsens de codon ade 2-1, arg 4-17, lys 1-1 și trp 5-48, reversibile prin acțiunea agenților mutageni responsabili de substituția de bază, care induc mutații într-un situs specific sau mutații supresive de codon. Sușa XV 185-14C conține, de asemenea, markerul his 1-7 cu o mutație cu sens greșit inversată, în special prin mutații în al doilea situs, și markerul hom 3-10 care este inversat de agenți mutageni care conduc la decalarea cadrului de citire a codului genetic (frameshift mutagens).
Dintre sușele diploide de Saccharomyces cerevisiae, singura sușă folosită pe scară largă este D7, care este homozigotă pentru ilv 1-92.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătire
Soluțiile substanțelor de testare, precum și soluțiile martor trebuie să fie preparate imediat înaintea testării, utilizându-se un vehicul corespunzător. În cazul compușilor organici insolubili în apă, trebuie să se utilizeze soluții de cel mult 2 % v/v solvenți organici cum ar fi etanolul, acetona sau dimetilsulfoxidul (DMSO). Concentrația finală a vehiculului nu trebuie să afecteze semnificativ viabilitatea celulară și caracteristicile de creștere.
Celulele trebuie expuse la substanțele de testat atât în prezența, cât și în absența unui sistem exogen de activare metabolică.
Cel mai utilizat sistem este o fracțiune postmitocondrială suplimentată cu un cofactor preparat din ficatul de rozătoare tratate cu inductori enzimatici. Pentru activarea metabolică, pot fi folosite și alte specii, țesuturi, fracțiuni postmitocondriale sau alte metode.
Condiții de testare
Sușele cel mai des utilizate în studiile de mutageneză sunt sușa haploidă XV 185-14C și sușa diploidă D7. Se pot utiliza și alte sușe.
Pentru stabilirea numărului de colonii supraviețuitoare și mutante sunt utilizate medii de cultură corespunzătoare.
Martorii pozitivi, cei netratați și cei tratați cu solvent trebuie preparați simultan. Pentru fiecare mecanism mutagen specific se folosesc substanțe martor pozitiv adecvate.
Trebuie folosite cel puțin cinci concentrații ale substanței de testat, cu intervale corespunzătoare între acestea. În cazul substanțelor toxice, cea mai mare concentrație testată nu trebuie să reducă supraviețuirea la mai puțin de 5-10 %. Substanțele relativ insolubile în apă se testează până la limita de solubilitate, folosindu-se metode adecvate. Pentru substanțele netoxice cu un grad ridicat de solubilitate în apă, limita superioară a concentrației se determină de la caz la caz.
Cutiile se incubează timp de 4-7 zile, la o temperatură de 28-30 oC, la întuneric.
Se folosesc subculturi celulare cu o frecvență a mutațiilor spontane în limitele normale admise.
Pentru analiza prototrofilor produși prin mutageneză și a viabilității celulare se utilizează cel puțin trei replici pentru fiecare concentrație. În cazul experimentelor în care se utilizează markeri cum ar fi hom 3-10 cu o rată scăzută a mutațiilor, numărul replicilor trebuie să crească, astfel încât să se poată obțină rezultate relevante din punct de vedere statistic.
Mod de operare
Tratamentul sușelor de Saccharomyces cerevisiae se realizează de obicei printr-o metodă de testare în lichid, care presupune utilizarea fie de celule staționare, fie de celule în creștere. Experimentele inițiale trebuie realizate pe celule în creștere: 1-5 × 107 celule/ml sunt expuse la substanța chimică de testat pe o perioadă de 18 ore, la o temperatură de 28-37 oC, cu agitare; dacă este necesar; pe parcursul expunerii, se adaugă o cantitate corespunzătoare de sistem de activare metabolică. La sfârșitul tratamentului, celulele sunt centrifugate, spălate și însămânțate pe un mediu de cultură potrivit. După incubare, plăcile sunt inventariate în vederea stabilirii ratei de supraviețuire și a mutațiilor genice produse. Dacă primul experiment este negativ, trebuie realizat un al doilea experiment, folosind celule în fază staționară. Dacă primul experiment este pozitiv, acesta trebuie confirmat printr-un experiment independent adecvat.
2. DATE
Datele se prezintă într-un tabel, indicându-se numărul coloniilor, numărul mutanților, nivelul de supraviețuire și frecvența mutanților. Toate rezultatele trebuie confirmate printr-un experiment independent. Toate rezultatele observate se evaluează cu ajutorul unei metode statistice adecvate.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— sușele folosite;
— condițiile de testare: celule în faza staționară sau celule în creștere, compoziția mediilor de cultură, temperatura de incubare și durata acesteia, sistemul de activare metabolică;
— condițiile de tratament: niveluri de expunere, metoda și durata tratamentului, temperatura la care se realizează tratamentul, martori pozitivi și negativi;
— numărul coloniilor, numărul mutanților, nivelul de supraviețuire și frecvența mutanților, relația doză/răspuns (după caz), evaluarea statistică a datelor;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.16. RECOMBINAREA MITOTICĂ – SACCHAROMYCES CEREVISIAE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
La Saccharomyces cerevisiae se poate decela recombinarea mitotică intergenică (sau, mai general, între o genă și centromerul său) și intragenică. Prima situație este denumită crossing-over mitotic și dă naștere unor schimburi reciproce de material genetic, în timp ce a doua situație, în care schimburile sunt, cel mai adesea, nereciproce, este denumită conversie genică. Crossing-over-ul se determină, în general, prin producerea de colonii homozigote recesive sau sectoare produse într-o sușă heterozigotă, în timp ce conversia genică se determină prin producerea de revertanți prototrofici într-o sușă auxotrofică heteroalelică, purtătoare a două alele defective diferite ale aceleiași gene. Sușele cele mai folosite la decelarea conversiei genice mitotice sunt D4 (heteroalelică la ade 2 și trp 5), D7 (heteroalelică la trp 5), BZ34 (heteroalelică la arg 4) și JD1 (heteroalelică la his 4 și trp 5). Crossing-over-ul mitotic care produce sectoare homozigote roșu și roz poate fi analizat în D5 sau în D7 (care măsoară, de asemenea, conversia genică mitotică și mutația inversă la ilv 1-92), ambele sușe fiind heteroalelice pentru alelele complementare ale ade 2.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătire
Soluțiile substanțelor chimice de testat și ale compușilor martor sau de referință trebuie preparate chiar înaintea testării, folosind un vehicul corespunzător. În cazul compușilor organici insolubili în apă, trebuie utilizate soluții de cel mult 2 % v/v de solvenți organici cum ar fi etanolul, acetona sau dimetilsulfoxidul (DMSO). Concentrația finală a vehiculului nu trebuie să afecteze semnificativ viabilitatea celulară și caracteristicile de creștere.
Celulele trebuie să fie expuse la substanțele chimice de testat atât în prezența, cât și în absența unui sistem exogen adecvat de activare metabolică. Sistemul folosit cel mai des este o fracțiune postmitocondrială suplimentată cu un cofactor preparat din ficatul de rozătoare tratate cu inductori enzimatici. Pentru activarea metabolică pot fi utilizate și alte specii, țesuturi, fracțiuni postmitocondriale sau alte metode.
Condițiile de testare
Sușele cel mai frecvent utilizate sunt cele diploide D4, D5, D7 și JD1. Pot fi utilizate și alte sușe.
Pentru a determina nivelul de supraviețuire și frecvența recombinărilor mitotice se utilizează medii de cultură adecvate.
Martorii pozitivi, cei netratați și cei tratați cu solvent, trebuie preparați simultan. Pentru fiecare tip specific de recombinare se folosesc substanțe martor pozitiv adecvate.
Trebuie realizate cel puțin cinci concentrații ale substanței de testat, cu intervale corespunzătoare între acestea. Printre factorii care trebuie luați în considerare se numără citotoxicitatea și solubilitatea. Concentrația minimă nu trebuie să afecteze viabilitatea celulară. În cazul substanțelor toxice, cea mai mare concentrație testată nu trebuie să reducă supraviețuirea la mai puțin de 5-10 %. Substanțele relativ insolubile în apă trebuie să fie testate până la limita solubilității, folosindu-se metode adecvate. În cazul substanțelor netoxice cu un grad ridicat de solubilitate în apă, limita superioară a concentrației se determină de la caz la caz.
Celulele pot fi expuse la substanțele chimice de testat fie în faza staționară, fie în faza creșterii, pentru perioade de până la 18 ore. În cazul perioadelor lungi de tratament, culturile trebuie studiate microscopic în vederea decelării formării sporilor, prezența acestora invalidând testul.
Plăcile se incubează între 4 și 7 zile la o temperatură de 28-30 oC, la întuneric. Plăcile utilizate pentru determinarea sectoarelor homozigote roșu și roz produse prin crossing-over mitotic se păstrează în frigider la aproximativ 4 oC timp de una-două zile înaintea numărării, pentru a permite dezvoltarea de colonii pigmentate corespunzătoare.
Se utilizează subculturi cu o frecvență a mutațiilor spontane care se situează în limitele normale admise.
Se utilizează cel puțin trei plăci pe concentrație pentru analiza prototrofilor produși prin conversia genică mitotică și pentru analiza viabilității. În cazul analizei homozigotismului recesiv produs prin crossing-over mitotic, numărul plăcilor trebuie să crească, astfel încât să furnizeze un număr corespunzător de colonii.
Mod de operare
Tratamentul sușelor de Saccharomyces cerevisiae se realizează de obicei printr-o metodă de testare în lichid, care presupune utilizarea fie de celule staționare, fie de celule în creștere. Experimentele inițiale trebuie realizate pe celule în creștere. 1-5 × 107 celule/ml sunt expuse la substanța chimică de testat pe o perioadă de 18 ore, la o temperatură de 28-37 oC, cu agitare; după caz, pe parcursul tratamentului, se adaugă o cantitate corespunzătoare de sistem de activare metabolică.
La sfârșitul tratamentului celulele sunt centrifugate, spălate și însămânțate pe un mediu de cultură potrivit. După incubare, plăcile sunt examinate în vederea stabilirii nivelului de supraviețuire și inducerea recombinării mitotice.
Dacă primul experiment este negativ, trebuie realizat un al doilea experiment în care se utilizează celule în fază staționară. Dacă primul experiment este pozitiv, acesta trebuie confirmat printr-un experiment independent corespunzător.
2. DATE
Datele se prezintă sub formă de tabele în care se indică numărul coloniilor numărate, numărul recombinanților, nivelul de supraviețuire și frecvența recombinanților.
Toate rezultatele trebuie confirmate printr-un experiment independent.
Datele se evaluează prin metode statistice corespunzătoare.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— sușele folosite;
— condițiile de testare: celule în faza staționară sau în faza de creștere, compoziția mediilor de cultură, temperatura de incubare și durata acesteia, sistemul de activare metabolică;
— condițiile de tratament: concentrațiile de expunere, procedura și durata tratamentului, temperatura la care se realizează tratamentul, martorii pozitivi și negativi;
— numărul coloniilor, numărul recombinanților, nivelul de supraviețuire și frecvența recombinării, relația doză/răspuns (după caz), evaluarea statistică a datelor;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.17. MUTAGENITATEA – TEST IN VITRO DE MUTAȚIE GENICĂ PE CELULE DE MAMIFERE
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 476 a OCDE, Testul in vitro de mutație genică pe celule de mamifere (1997).
1.1. INTRODUCERE
Testul in vitro de mutație genică pe celule de mamifere se poate utiliza pentru detectarea mutațiilor genice produse de substanțele chimice. Liniile celulare corespunzătoare conțin celule de limfom de șoarece L5178Y, liniile CHO, CHO-AS52 și V79 de celule de hamster chinezesc și celule limfoblastoide umane TK6 (1). În liniile celulare menționate, efectele genetice cel mai frecvent măsurate sunt o mutație în pozițiile timidin kinază (TK) și hipoxantin-guanină fosforibozil transferază (HPRT), precum și o transgenă de xantin-guanină fosforibozil transferază (XPRT). Testele de mutație TK, HPRT și XPRT permit detectarea diferitelor spectre ale diferitelor fenomene genetice. Amplasarea autozomică a TK și XPRT poate să permită detectarea fenomenelor genetice (de exemplu deleții importante) care nu sunt detectate în locusul HPRT la cromozomii X (2) (3) (4) (5) (6).
În testul in vitro de mutație genică pe celule de mamifere, se pot utiliza culturi de linii celulare stabilite sau sușe celulare. Celule utilizate se selectează în funcție de capacitatea de creștere în cultură și de stabilitatea frecvenței de mutație spontană.
Testele realizate in vitro necesită, în general, utilizarea unei surse exogene de activare metabolică. Sistemul de activare metabolică de acest tip nu poate să reproducă integral condițiile celulelor de mamifere in vivo. Ar trebui să se acorde atenție evitării condițiilor care ar putea să conducă la obținerea unor rezultate care nu reflectă o mutagenitate intrinsecă. Rezultatele pozitive care reflectă o mutagenitate intrinsecă ar putea să provină în urma modificărilor de pH, de osmolalitate sau din valori mari ale citotoxicității (7).
Prezentul test se utilizează la depistarea substanțelor cu posibile efecte mutagene și cancerigene pentru mamifere. Mulți compuși care dau rezultate pozitive la acest test sunt cancerigeni pentru mamifere; cu toate acestea, nu există o corelație perfectă între prezentul test și cancerigenicitate. Corelația depinde de clasa chimică și sunt tot mai multe dovezi cu privire la existența unor agenți cancerigeni care nu se depistează prin prezentul test, deoarece este posibil ca aceștia să acționeze prin alte mecanisme, negenotoxice sau mecanisme absente în celulele bacteriene (6).
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Mutație directă: o mutație a genelor de la forma originală la forma mutantă care generează o reducere a activității enzimatice din funcția proteinei codificate.
Mutageni care provoacă substituția perechilor de bază: substanțe care produc substituția uneia sau mai multor perechi de bază din ADN.
Mutageni de decalare a cadrului de citire: substanțe care produc adăugarea sau deleția uneia sau a mai multor perechi de bază din molecula de ADN.
Timpul de manifestare a fenotipului: timpul în care produsele nemodificate ale genelor sunt epuizate din celulele care au suferit o nouă mutație.
Frecvența mutantului: numărul de celule mutante observate împărțit la numărul de celule viabile.
Creștere totală relativă: creșterea numărului de celule în timp, în raport cu populația de celule martor; se calculează ca produsul dintre creșterea în suspensie în raport cu martorul negativ și eficacitatea clonării în raport cu martorul negativ.
Creștere relativă în suspensie: creșterea numărului de celule în timpul de manifestare în raport cu martorul negativ.
Viabilitate: eficacitatea clonării celulelor tratate în momentul depunerii pe placă în condiții selective după perioada de manifestare.
Supraviețuire: eficacitatea clonării celulelor tratate atunci când sunt depuse pe placă la încheierea perioadei de tratament; supraviețuirea se exprimă în raport cu supraviețuirea populației de celule martor.
1.3. PRINCIPIUL METODEI DE TESTARE
Celulele cu deficit de timidin chinază (TK) datorită mutației TK+/- → TK-/- sunt rezistente la efectele citotoxice ale trifluorotimidinei (TFT), un analog al pirimidinei. Celulele care posedă timidin chinază sunt sensibile la TFT, care produce inhibarea metabolismului celular și întrerupe diviziunea celulară. Prin urmare, celulele mutante pot să prolifereze în prezența TFT, în timp ce celulele normale, care conțin timidin chinază, nu pot. În mod similar, celulele cu deficit de HPRT sau XPRT sunt selectate în funcție de rezistența la 6-tioguanină (TG) sau 8-azaguanină (AG). Dacă analogul unei baze sau un compus înrudit cu agentul selectiv este supus la unul din testele de mutație genică pe celule de mamifere, proprietățile substanței de testat trebuie studiate cu grijă. De exemplu, ar trebui să se examineze substanța de testat suspectată de toxicitate selectivă pentru celule mutante și nemutante. În consecință, performanța sistemului/agentului de selecție trebuie să fie confirmată atunci când se testează substanțe chimice cu o structură apropiată de cea a agentului selectiv (8).
Celulele în suspensie sau în cultură monostrat se expun o perioadă de timp corespunzătoare la substanța de testat atât în prezența, cât și în absența activării metabolice și se reînsămânțează pentru determinarea citotoxicității și pentru a permite manifestarea fenotipului înaintea selecției mutantului (9) (10) (11) (12) (13). Citotoxicitatea se determină, de obicei, prin măsurarea eficacității clonării relative (supraviețuirii) sau a creșterii totale relative a culturilor după perioada de tratament. Culturile tratate sunt menținute în mediul de cultură un timp suficient, caracteristic pentru fiecare locus și tip de celulă selectate, pentru a permite o manifestare fenotipică aproape optimă a mutațiilor induse. Frecvența mutanților se determină prin însămânțarea unui număr cunoscut de celule într-un mediu ce conține agentul selectiv pentru a detecta celulele mutante și într-un mediu fără agent selectiv pentru a determina eficacitatea clonării (viabilitatea). După un timp corespunzător de incubare, se numără coloniile. Frecvența mutantului se determină prin compararea numărului de colonii de mutanți în mediul selectiv cu numărul de colonii în mediul neselectiv.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătire
1.4.1.1. Celulele
Există diferite tipuri de celule care se pot utiliza în prezentul test, inclusiv subclonele de celule L5178Y, CHO, CHO-AS52, V79 sau TK6. Tipurile de celule utilizate în prezentul test ar trebui să aibă o sensibilitate dovedită la mutageni chimici, o eficacitate mare de clonare și o frecvență de mutație spontană stabilă. Ar trebui să se verifice contaminarea cu micoplasmă a celulelor și, dacă se constată că sunt contaminate, nu ar trebui să se utilizeze.
Testul ar trebui conceput astfel încât să aibă o sensibilitate și putere predeterminate. Numărul de celule, culturi și concentrațiile substanței de testat utilizate ar trebui să reflecte parametrii definiți anterior (14). Numărul minim de celule viabile care supraviețuiesc tratamentului și se utilizează în fiecare stadiu al testului ar trebui să fie în funcție de frecvența mutației spontane. O regulă generală constă în utilizarea unui număr de celule cel puțin egal cu de 10 ori inversul frecvenței de mutație spontană. Cu toate acestea, se recomandă utilizarea a minimum 106 celule. Pentru a asigura o performanță constantă a testului, ar trebui să se dispună de date anterioare specifice privind sistemul celular utilizat.
1.4.1.2. Mediile și condițiile de cultură
Se recomandă utilizarea mediilor de cultură și a condițiilor de incubare (vasele de cultură, temperatura, concentrația CO2 și umiditatea) corespunzătoare. Alegerea mediilor ar trebui să se facă în funcție de sistemele selective și de tipul celulelor utilizate în test. O importanță deosebită o prezintă alegerea condițiilor de cultură, astfel încât să asigure creșterea optimă a celulelor în perioada de manifestare și capacitatea celulelor, atât mutante, cât și nemutante, de a forma colonii.
1.4.1.3. Prepararea culturilor
Celulele se obțin plecând de la culturile de rezervă, se însămânțează în mediul de cultură și se incubează la 37 oC. Înainte de a fi utilizate în prezentul test, este necesară curățarea culturilor de celulele mutante preexistente.
1.4.1.4. Activarea metabolică
Se recomandă ca expunerea celulelor la substanța de testat să se realizeze atât în prezența, cât și în absența unui sistem de activare metabolică corespunzător. Sistemul cel mai frecvent utilizat este o fracție postmitocondrială la care s-au adăugat cofactori (S9), preparată din ficat de rozătoare tratat cu agenți de inducție enzimatică, de exemplu Aroclor 1254 (15) (16) (17) (18) sau un amestec de fenobarbitonă și β-naftoflavonă (19) (20).
Fracția post-mitocondrială se utilizează, de obicei, la concentrații cuprinse între limitele 1-10 % v/v în mediul de testare final. Selectarea și tipul unui sistem de activare metabolică poate să depindă de clasa chimică a substanței de testat. În unele cazuri, ar putea fi convenabilă utilizarea mai multor concentrații ale fracției postmitocondriale.
O serie de realizări, inclusiv crearea prin inginerie genetică a unor linii celulare care exprimă enzime activatoare specifice, pot să furnizeze potențialul pentru o activare endogenă. Alegerea liniilor celulare ar trebui să fie justificată din punct de vedere științific (de exemplu prin importanța izoenzimei citocromului P450 pentru metabolismul substanței de testat).
1.4.1.5. Substanța de testat/Preparare
Substanțele de testat în stare solidă ar trebui să se preparare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare, care, dacă este cazul, se diluează înaintea tratamentului celulelor. Substanțele de testat lichide se pot adăuga direct în sistemele de testare și se diluează înainte de utilizare în tratamentul celulelor. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora la păstrare.
1.4.2. Condiții de testare
1.4.2.1. Solventul/vehiculul
Solventul/vehiculul ar trebui să fie ales astfel încât să nu existe suspiciunea reacției chimice a acestuia cu substanța de testat și să nu afecteze negativ supraviețuirea celulelor și activitatea S9. Utilizarea altor solvenți/vehicule decât cele recunoscute ar trebui să se justifice cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere un solvent/vehicul apos. La testarea substanțelor instabile în apă, solventul organic utilizat nu ar trebui să conțină urme de apă. Apa se poate elimina prin adăugarea unei site moleculare.
1.4.2.2. Concentrațiile de expunere
Printre criteriile ce trebuie să fie avute în vedere la determinarea dozei maxime sunt citotoxicitatea, solubilitatea în sistemul de testare și modificările de pH sau osmolalitate.
Citotoxicitatea ar trebui să se determine cu și fără activare metabolică în experimentul principal, utilizând un indicator corespunzător al integrității și dezvoltării celulare, ca eficacitatea clonării relative (supraviețuirea) sau creșterea totală relativă. Ar putea fi utilă determinarea citotoxicității și solubilității într-un experiment preliminar.
Ar trebui să se utilizeze cel puțin patru concentrații analizabile. Dacă o substanță este citototoxică, concentrațiile respective ar trebui să acopere un domeniu de toxicități de la maximă la mică sau lipsa toxicității; aceasta semnifică, de obicei, concentrații care ar trebui să fie separate printr-un factor cuprins între 2 și √10 maximum. Dacă, datorită citotoxicității, concentrația este maximă, ar trebui să determine un procent de supraviețuire relativă (eficacitatea relativă a clonării) sau o creștere totală relativă de aproximativ 10-20 % (dar nu mai puțin de 10 %). Pentru substanțele relativ necitotoxice, concentrația de testare maximă ar trebui să fie cea mai mică dintre următoarele trei concentrații: 5 mg/ml, 5 μl/ml sau 1,01 M.
Substanțele relativ insolubile ar trebui să fie testate la concentrații egale sau superioare limitei de solubilitate în condițiile de cultură. Insolubilitatea ar trebui să fie pusă în evidență în mediul final de tratament în care se expun celulele. Ar putea fi utilă evaluarea solubilității la începutul și la sfârșitul tratamentului, deoarece solubilitatea poate să varieze în timpul expunerii în sistemul de testare datorită prezenței celulelor, S9, serului etc. Insolubilitatea se poate constata cu ochiul liber. Ar trebui ca precipitarea să nu interfereze cu determinarea rezultatelor.
1.4.2.3. Martorii
În fiecare experiment, ar trebui să se includă simultan martorii pozitivi și negativi (solvent și vehicul), atât cu, cât și fără activare metabolică. În prezența activării metabolice, substanța utilizată ca martor pozitiv ar trebui să fie aceea care necesită activare pentru a da un răspuns mutagen.
În tabelul următor sunt prezentate exemple de substanțe utilizate ca martori pozitivi:
|
Tipul activării |
Poziția |
Substanța |
Nr. CAS |
Nr. EINECS |
|
Absența activării metabolice exogene |
HPRT |
Metansulfonat de etil |
62-50-0 |
200-536-7 |
|
Etil nitrozouree |
759-73-9 |
212-072-2 |
||
|
TK (colonii mici și mari) |
Metansulfonat de metil |
66-27-3 |
200-625-0 |
|
|
XPRT |
Metansulfonat de etil |
62-50-0 |
200-536-7 |
|
|
Etil nitrozouree |
759-73-9 |
212-072-2 |
||
|
Prezența activării metabolice exogene |
HPRT |
3-metilcolantren |
56-49-5 |
200-276-4 |
|
N-nitrozodimetilamină |
62-75-9 |
200-549-8 |
||
|
7,12-dimetilbenzantracen |
57-97-6 |
200-359-5 |
||
|
TK (colonii mici și mari) |
Ciclofosfamidă |
50-18-0 |
200-015-4 |
|
|
Ciclofosfamidmonohidrat |
6055-19-2 |
|||
|
Benzo[a]piren |
50-32-8 |
200-028-5 |
||
|
3-metilcolantren |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-nitrozodimetilamină (pentru valori mari ale S9) |
62-75-9 |
200-549-8 |
|
|
Benzo[a]piren |
50-32-8 |
200-028-5 |
Se pot utiliza și alte substanțe corespunzătoare ca martori pozitivi, de exemplu se poate utiliza 5-bromo 2'-dezoxiuridina (nr. CAS 59-14-3, nr. EINECS 200-415-9), dacă laboratorul dispune de o bază de date anterioare privind această substanță. Ar trebui să se aibă în vedere utilizarea ca martori pozitivi a unor substanțe din aceeași clasă chimică, dacă sunt disponibile.
Ca martori negativi ar trebui să se utilizeze solvenți sau vehicule singure în mediul de tratare, care se tratează în același condiții ca și culturile. În plus, ar trebui să se utilizeze și martori netratați, cu excepția cazului în care există date din testele anterioare care să ateste că solventul selectat nu prezintă efecte vătămătoare sau mutagene.
1.4.3. Mod de lucru
1.4.3.1. Tratamentul cu substanța de testat
Celulele în stadiu de proliferare se tratează cu substanța de testat atât în prezența, cât și în absența unui sistem de activare metabolică. Timpul de expunere ar trebui să fie corespunzător (de obicei, un timp 3-6 ore este eficient). Timpul de expunere se poate prelungi cu unul sau mai multe cicluri celulare.
Fiecare concentrație se poate testa pe una sau pe două culturi tratate. Dacă se utilizează culturi unice, numărul concentrațiilor ar trebui să fie mai mare pentru a asigura un număr suficient de culturi pentru analiză (de exemplu minimum opt concentrații analizabile). Se recomandă utilizarea culturilor duble pentru martorul negativ (solvent).
Testarea substanțelor în stare gazoasă și a celor volatile ar trebui să se realizeze prin metode specifice, de exemplu în vase de cultură închise ermetic (21) (22).
1.4.3.2. Determinări de supraviețuire, viabilitate și frecvența mutantului
La sfârșitul perioadei de expunere, celulele se spală și se cultivă în mediul de cultură pentru determinarea supraviețuirii și pentru a permite manifestarea fenotipului mutant. Determinarea citotoxicității începe, de obicei, după perioada de tratament și constă în măsurarea eficacității de clonare relativă (supraviețuirii) sau a creșterii totale relative a culturilor.
Fiecărui locus îi corespunde un timp minim definit, necesar pentru a permite manifestarea aproape optimă a fenotipului mutanților nou induși (HPRT și XPRT necesită minimum 6-8 zile și TK minimum două zile). Pentru determinarea numărului de mutanți și a eficacității clonării, celulele sunt crescute în mediu cu și, respectiv, fără agent sau agenți selectivi. Măsurarea viabilității (utilizată la calcularea frecvenței mutantului) începe la terminarea perioadei de manifestare prin depunerea celulelor într-un mediu neselectiv.
Dacă substanța de testat dă un rezultat pozitiv la testul pe TK+/- L5178Y, dimensiunile coloniilor ar trebui să se determine pe minimum una dintre culturile experimentale (la concentrația pozitivă maximă) și pe martorii negativi și pozitivi. Dacă substanța de testat dă un rezultat negativ la testul pe TK+/- L5178Y, dimensiunile coloniilor ar trebui să se determine pe martorii negativi și pozitivi. Dimensiunile coloniilor se pot determina și în studiile în care se utilizează TK6TK+/-.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Datele ar trebui să conțină determinarea citotoxicității și viabilității, numărul de colonii și frecvențele mutanților pentru culturile tratate și cele martor. Dacă se obține un răspuns pozitiv în testul pe TK+/- L5178Y, la numărătoarea coloniilor se face distincția între coloniile mici și mari pentru minimum o concentrație a substanței de testat (concentrația pozitivă maximă) și pentru martorul negativ și pozitiv. Ar trebui să se facă o examinare detaliată a naturii moleculare și citogenice a coloniilor mari și mici de mutanți (23) (24). În testul pe TK+/-, numărătoarea coloniilor se realizează conform criteriului de creștere normală (mare) și creștere lentă (mică) a coloniilor (25). Celulele mutante care au suferit cele mai însemnate alterări genetice au timpi de duplicare prelungiți și formează, așadar, colonii mici. Această alterare variază, de obicei, de la pierderea întregii gene până la aberații cromozomiale care se manifestă în cariotip. Inducerea coloniilor mici de mutanți este pusă pe seama substanțelor chimice care induc aberații cromozomiale însemnate (26). Celulele mutante mai puțin afectate se dezvoltă cu viteze similare cu cele ale celulelor originale și formează colonii mari.
Ar trebui să se prezinte datele privind supraviețuirea (eficacitatea clonării relative) sau creșterea totală relativă. Frecvența mutanților ar trebui să se exprime prin numărul de celule mutante împărțit la numărul de celule supraviețuitoare.
Ar trebui să se prezinte datele pentru fiecare cultură. În plus, toate datele ar trebui să se prezinte sub formă de tabel.
Nu este necesară verificarea unui răspuns pozitiv net. Rezultatele nesigure ar trebui să fie clarificate prin teste suplimentare, realizate de preferință prin modificarea condițiilor de testare. Rezultatele negative necesită confirmare pentru fiecare caz. În cazurile în care se consideră că nu este necesară confirmarea rezultatelor negative, ar trebui să se ofere o justificare. Pentru testele de confirmare, atât a rezultatelor nesigure, cât și acelor negative, ar trebui să se aibă în vedere modificarea condițiilor de testare pentru lărgirea gamei de condiții evaluate. Parametrii care ar putea fi modificați includ diferența dintre concentrații și condițiile de activare metabolică.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Există câteva criterii pentru determinarea unui rezultat pozitiv, ca o creștere în funcție de concentrație sau o creștere reproductibilă a frecvenței mutanților. În primul rând, ar trebui să se aibă în vedere relevanța biologică a rezultatelor. Pentru evaluarea rezultatelor testelor se poate recurge și la ajutorul unor metode statistice. Semnificația statistică nu ar trebui să fie singurul factor determinant pentru a decide cu privire la un răspuns pozitiv.
Dacă rezultatele obținute pentru o substanță de testat nu îndeplinesc criteriile menționate anterior, se consideră că substanța respectivă nu este mutagenă în prezentul sistem.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în unele cazuri rare, datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile independent de numărul de repetări ale experimentului.
Rezultatele pozitive ale unui test in vitro de mutație genică pe celule de mamifere indică faptul că substanța de testat produce mutații genice în celulele de mamifere, în cultură. Un rezultat concentrație-răspuns pozitiv reproductibil este foarte semnificativ. Rezultatele negative indică faptul că, în condiții de testare, substanța de testat nu produce mutații genice în celulele de mamifere utilizate, în cultură.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Solventul/vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Celulele:
— tipul și sursa celulelor;
— numărul de culturi celulare;
— numărul de reînsămânțări, dacă este cazul;
— metodele de întreținere a culturilor celulare, dacă este cazul;
— absența micoplasmei.
Condițiile de testare:
— justificarea alegerii concentrațiilor și a numărului de culturi, inclusiv, de exemplu, datele de citotoxicitate și limitele de solubilitate, dacă sunt disponibile;
— compoziția mediului, concentrația CO2;
— concentrația substanței de testat;
— volumul vehiculului și al substanței de testat adăugate;
— temperatura de incubare;
— timpul de incubare;
— durata tratamentului;
— densitatea celulară în timpul tratamentului;
— tipul și compoziția sistemului de activare metabolică, inclusiv criteriile de acceptabilitate;
— martorii pozitivi și negativi;
— timpul de manifestare (inclusiv numărul de celule însămânțate și reînsămânțate, programele de alimentare, dacă este cazul);
— agenții selectivi;
— criteriile utilizate la caracterizarea studiilor ca fiind pozitive, negative sau nesigure;
— metodele utilizate pentru numărătoarea celulelor viabile și mutante;
— definirea coloniilor pentru care se ține seama de dimensiuni și de tip (inclusiv criteriile pentru coloniile „mici” și „mari”, dacă este cazul).
Rezultatele:
— semnele de toxicitate;
— semnele de precipitare;
— datele privind valoarea pH-ului și osmolalitatea în timpul expunerii la substanța de testat, dacă s-au determinat;
— dimensiunile coloniilor, dacă s-au determinat, cel puțin pentru martorii negativi și pozitivi;
— capacitatea laboratorului de a detecta mutanții în colonii mici cu sistemul TK+/– L5178Y, dacă este cazul;
— relația doză-răspuns, dacă este posibil;
— analizele statistice, dacă există;
— datele privind martorii negativi (solvent/vehicul) și pozitivi utilizați în paralel;
— datele anterioare privind martorii negativi (solvent/vehicul) și pozitivi, cu domeniile, valorile medii și deviațiile standard;
— frecvența mutanților.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Moore, M. M., DeMarini, D. M., DeSerres, F. J. and Tindall, K. R. (eds.) (1987), Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York.
2. Chu, E. H. Y. and Malling, H. V. (1968), Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl. Acad. Sci. USA, 61, pp. 1306-1312.
3. Liber, H. L. and Thilly, W. G. (1982), Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res., 94, pp. 467-485.
4. Moore, M. M., Harington-Brock, K., Doerr, C. L. and Dearfield, K. L. (1989), Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci, Mutagenesis, 4, pp. 394-403.
5. Aaron, C. S. and Stankowski, Jr. L. F. (1989), Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates, Mutation Res., 223, pp. 121-128.
6. Aaron, C. S., Bolcsfoldi, G., Glatt, H. R., Moore, M., Nishi, Y., Stankowski, Jr. L. F., Theiss, J. and Thompson, E. (1994), Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, pp. 235-239.
7. Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B. C. (1991), Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, pp. 147-204.
8. Clive, D., McCuen, R., Spector, J. F. S., Piper, C. and Mavournin, K. H. (1983), Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U. S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 115, pp. 225-251.
9. Li, A. P., Gupta, R. S., Heflich, R. H. and Wasson, J. S. (1988), A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U. S. Environment Protection Agency Gene-Tox Program, Mutation Res., 196, pp. 17-36.
10. Li, A. P., Carver, J. H., Choy, W. N., Hsie, A. W., Gupta, R. S., Loveday, K. S., O'Neill, J. P., Riddle, J. C., Stankowski, L. F. Jr. and Yang, L. L. (1987), A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Cuanine Phosphoribosyl Transferase Gene Mutation Assay, Mutation Res., 189, pp. 135-141.
11. Liber, H. L., Yandell, D. W. and Little, J. B. (1989), A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus, Mutation Res., 216, pp. 9-17.
12. Stankowski, L. F. Jr., Tindall, K. R. and Hsie, A. W. (1986), Quantitative and Molecular Analyses of Ethyl Methanosulphonate – and ICR 191-Induced Molecular Analyses of Ethyl Methanosulphonate – and ICR 191-Induced Mutation in AS52 Cells, Mutation Res., 160, pp. 133-147.
13. Turner, N. T., Batson, A. G. and Clive, D. (1984), Procedures for the L5178Y/TK+/- – TK+/- Mouse Lymphoma Cell Mutagenicity Assay, in: Kilbey, B. J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, pp. 239-268.
14. Arlett, C. F., Smith, D. M., Clarke, G. M., Green, M. H. L., Cole, J., McGregor, D. B. and Asquith, J. C. (1989), Mammalian Cell Gene Mutation Assays Based upon Colony Formation, in: Statistical Evaluation of Mutagenicity Test Data, Kirkland D. J., ed., Cambridge University Press, pp. 66-101.
15. Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977), Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine, Mutation Res., 46, pp. 365-373.
16. Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, pp. 347-364.
17. Clive, D., Johnson, K. O., Spector, J. F. S., Batson, A. G. and Brown M. M. M. (1979), Validation and Characterisation of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System, Mutat Res., 59, pp. 61-108.
18. Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, pp. 173-215.
19. Elliott, B. M., Combes, R. D., Elcome, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177.
20. Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, in In Vitro Metabolic Activation in Mutagenesis Testing, de Serres, F. J., Fouts, J. R., Bend, J. R. and Philpot. R. M. (eds.) Elsevier, North-Holland, pp. 85-88.
21. Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, In: Tice, R. R., Costa, D. L., Schaich, K. M. (eds.), Genotoxic Effects of Airborne Agents, New York, Plenum, pp. 91-103.
22. Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, pp. 795-801.
23. Applegate, M. L., Moore, M. M., Broder, C. B., Burrell, A. and Hozier, J. C. (1990), Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells, Proc. Natl. Acad. Sci. USA, 87, pp. 51-55.
24. Moore, M. M., Clive, D., Hozier, J. C. Howard, B. E., Batson, A. G., Turner, N. T. and Sawyer, J. (1985), Analysis of Trifluorothymidine-Resistant (TFTr) and Mutants of L5178Y/TK+/- Mouse Lymphoma Cells, Mutation Res, 151, pp. 161-174.
25. Yandell, D. W., Dryja, T. P. and Little, J. B. (1990), Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells, Mutation Res., 229, pp. 89-102.
26. Moore, M. M. and Doerr, C. L. (1990), Comparison of Chromosome Aberration Frequency and Small-Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- – 3.7.2C Mouse Lymphoma Cells, Mutagenesis 5, pp. 609-614.
B.18. ALTERAREA ȘI REPARAREA ADN-ULUI – SINTEZA NEPROGRAMATĂ A ADN (UDS – UNSCHEDULED DNA SYNTHESIS) – TEST IN VITRO PE CELULE DE MAMIFERE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Testul de sinteză neprogramată a ADN (UDS) măsoară sinteza de reparare a ADN-ului după excizia și eliminarea unui fragment de ADN care conține regiunea alterată de agenți chimici și fizici. Testul se bazează pe încorporarea timidinei marcate cu tritiu (timidină tritiată) 3H-TdR) în ADN-ul celulelor de mamifere care nu sunt în faza S a ciclului celular. Încorporarea 3H-TdR se poate determina prin autoradiografiere sau prin LSC (liquid scintillation counting) a ADN-ului din celulele tratate. Cu excepția cazului când se folosesc hepatocite primare de șobolan, culturile de celule de mamifere se tratează cu substanța de testat cu și fără un sistem exogen de activare metabolică. USD poate fi măsurată prin metode in vivo.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătire
Substanțele chimice de testat și substanțele martor sau substanțele de referință trebuie preparate în mediul de creștere ori dizolvate sau suspensionate într-un vehicul adecvat și ulterior diluate în mediul de cultură folosit în acest test. Concentrația finală a vehiculului nu trebuie să afecteze viabilitatea celulară.
În acest test pot fi folosite culturi celulare primare de hepatocite de șobolan, limfocite umane sau linii celulare bine caracterizate (de exemplu, fibroblaști diploizi umani).
Celulele trebuie tratate cu substanțele chimice de testat atât în prezența, cât și în absența unui sistem adecvat de activare metabolică.
Condițiile de testare
Pentru fiecare metodă de testare sunt necesare cel puțin două culturi celulare pentru autoradiografiere și șase culturi (sau mai puține, dacă există argumente științifice) pentru determinările prin LSC a UDS.
În fiecare experiment trebuie incluși simultan martori pozitivi și negativi (netratați și/sau vehicul) suplimentari, cu și fără activare metabolică.
În testele care folosesc hepatocite de șobolan, exemple de martori pozitivi sunt 7,12-dimetilbenzantracenul (7,12-DMBA) sau 2-acetilaminofluorenul (2-AAF). În cazul liniilor celulare bine caracterizate, 4-nitroquinolin-N oxid (4-NQO) este un exemplu de martor pozitiv care poate fi utilizat atât pentru autoradiografie, cât și pentru testele LSC efectuate fără activare metabolică; N-dimetilnitrozamina este un exemplu de compus care poate fi folosit ca martor pozitiv când se utilizează sisteme de activare metabolică.
Trebuie folosite mai multe concentrații ale substanței de testat, alese într-un interval adecvat pentru definirea răspunsului. Concentrația maximă trebuie să producă unele efecte citotoxice. Compușii relativ insolubili în apă trebuie testați până la limita superioară a solubilității. Pentru substanțele netoxice, ușor solubile în apă, limita superioară a concentrației se stabilește de la caz la caz.
Mediile de creștere, concentrația de CO2, temperatura și umiditatea adecvate sunt necesare pentru menținerea culturilor. Liniile celulare bine caracterizate trebuie verificate periodic în vederea decelării contaminării cu Mycoplasma.
Pentru culturile primare de hepatocite nu se utilizează un sistem de activare metabolică. Liniile celulare bine caracterizate și limfocitele se tratează cu substanța de testat cu și fără un sistem adecvat de activare metabolică.
Mod de operare
Liniile celulare bine caracterizate se obțin din culturi de sușe (prin tripsinizare sau descuamare) cultivate cu o densitate corespunzătoare în vase de cultură și incubate la 37 oC.
Culturile pe termen scurt de hepatocite de șobolan se obțin permițând hepatocitelor proaspăt disociate într-un mediu adecvat să se fixeze pe suprafața de creștere.
Culturile de limfocite umane sunt produse prin tehnici adecvate.
Hepatocitele de șobolan proaspăt izolate se tratează cu substanța de testat într-un mediu ce conține 3H-TdR o perioadă de timp corespunzătoare. La sfârșitul perioadei de tratare, celulele trebuie filtrate, spălate, fixate și uscate. Lamele trebuie introduse în emulsia autoradiografică (alternativ, poate fi folosit un film fotografic), expuse, developate, colorate și numărate.
Tehnica de autoradiografiere: Culturile celulare se tratează cu substanța de testat o perioadă de timp corespunzătoare, apoi se tratează cu 3H-TdR. Perioadele se stabilesc în funcție de natura substanței, de activitatea sistemelor metabolizante și de tipul celulelor. Pentru determinarea maximului de USD, 3H-TdR trebuie adăugată fie simultan cu substanța de testat, fie la câteva minute după expunerea la substanța de testat. Alegerea uneia dintre aceste metode se va face în funcție de interacțiunile posibile între substanța de testat și 3H-TdR. Pentru a putea face distincția între USD și replicarea semiconservativă a ADN, aceasta din urmă poate fi inhibată, de exemplu, prin utilizarea unui mediu sărac în arginină, cu conținut scăzut în ser sau prin adăugare de hidroxiuree în mediul de cultură.
Măsurarea USD prin LSC: Înainte de începerea tratamentului cu substanța de testat, se blochează intrarea celulelor în faza S în modul descris mai sus. Ulterior, celulele se tratează cu substanța de testat în conformitate cu descrierea pentru autoradiografie. La sfârșitul perioadei de incubare, ADN este extras din celule și se determină conținutul total de ADN și proporția de 3H-TdR încorporată.
Trebuie menționat faptul că dacă în tehnicile descrise mai sus se utilizează limfocite umane, nu este necesară suprimarea replicării semiconservative a ADN pe culturile nestimulate.
Analiză
Pentru determinarea USD în celulele din cultură, nucleele de fază S nu se numără. Trebuie numărate minimum 50 celule per concentrație. Lamele trebuie etichetate înainte de numărare. De pe fiecare lamă se numără mai multe câmpuri distribuite aleatoriu, alese la distanță unul de celălalt. Cantitatea de 3H-TdR încorporată în citoplasmă se determină prin numărarea a trei arii de mărimea nucleului, din citoplasma fiecărei celule numărate.
Pentru determinarea prin LSC a USD se utilizează un număr adecvat de culturi pentru fiecare concentrație a substanței de testat și pentru martori.
Toate rezultatele trebuie confirmate într-un experiment independent.
2. DATE
Datele sunt prezentate sub formă de tabele.
2.1. DETERMINĂRILE AUTORADIOGRAFICE
Cantitatea de 3H-TdR încorporată în citoplasmă și numărul de granulații găsite în nucleii celulari trebuie să fie înregistrate separat.
Pentru descrierea distribuției cantității de 3H-TdR încorporată în citoplasmă și numărul de granulații per nucleu se vor folosi media, mediana și modul șirului.
2.2. TEHNICA LSC
În tehnica LSC, 3H-TdR încorporată trebuie raportată folosind ca unitate de măsură dpm/μg ADN. Pentru descrierea distribuției încorporării se poate folosi media dpm/μg ADN cu deviația standard.
Datele se evaluează prin metode statistice adecvate.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— celulele folosite, densitatea și numărul de pasaje celulare în momentul tratamentului, numărul de culturi celulare;
— metodele folosite pentru menținerea culturilor, inclusiv compoziția mediului, temperatura și concentrația de CO2;
— substanța de testat, vehiculul folosit, concentrațiile și argumentarea alegerii concentrațiilor folosite în experiment;
— informații despre sistemul de activare metabolică;
— schema de tratament;
— martorii pozitivi și negativi;
— tehnica de autoradiografie folosită;
— metodele folosite pentru a bloca intrarea celulelor în faza S;
— metodele folosite pentru extragerea ADN și determinarea conținutului total în ADN prin tehnica LSC;
— dacă este posibil, relația doză-efect;
— evaluarea statistică;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.19. TEST IN VITRO DE SCHIMBARE A CROMATIDELOR SURORI (SCE)
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
SCE este un test de scurtă durată de detectare a schimburilor reciproce de ADN între 2 cromatide surori ale unui cromozom în timpul duplicării. SCE reprezintă schimburile reciproce dintre produsele de replicare a ADN la loci aparent omologi. Se presupune că procesul de schimb implică ruperea și refacerea ADN-ului, însă datele existente despre bazele moleculare ale procesului sunt limitate. Detectarea SCE necesită câteva mijloace de marcare diferențiată a cromatidelor surori, rezultat ce poate fi obținut prin încorporarea bromodeoxiuridinei (BrdU) în ADN-ul cromozomial pentru două cicluri celulare.
Celulele de mamifere sunt tratate in vitro cu substanța de testat cu și fără un sistem exogen de activare metabolică la mamifere, după caz, apoi sunt cultivate pe o perioadă de două cicluri de replicare într-un mediu ce conține BrdU. După tratarea cu un inhibitor de fus mitotic (de exemplu colchicină) pentru oprirea celulelor în stadiul de metafază al mitozei (c-metafaza), celulele sunt prelevate și se efectuează preparatele cromozomiale.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătire
— Pentru acest test se pot folosi culturi celulare primare (limfocite umane) sau linii celulare bine caracterizate (de exemplu, celule ovariene de hamster chinezesc). Liniile celulare trebuie verificate pentru a decela contaminarea cu Mycoplasma.
— Trebuie folosite medii de cultură și condiții de incubare (de exemplu temperatură, vase de cultură, concentrația de CO2 și umiditate) corespunzătoare.
— Substanțele de testat pot fi preparate în mediul de cultură sau dizolvate sau suspensionate într-un vehicul adecvat înainte de începerea tratamentului celulelor. Concentrația finală de vehicul în mediul de cultură nu trebuie să afecteze în mod semnificativ viabilitatea celulară sau rata de creștere, iar efectele asupra frecvenței SCE trebuie monitorizate printr-un solvent martor.
— Celulele se tratează cu substanța de testat atât în prezența, cât și în absența unui sistem exogen adecvat de activare metabolică la mamifere. Alternativ, dacă se folosesc celule cu activitate metabolică intrinsecă, trebuie să se cunoască intensitatea și natura acestei activități, astfel încât să fie corespunzătoare clasei de substanțe chimice testate.
1.6.2. Condiții de testare
Pentru fiecare punct experimental se folosesc cel puțin două culturi.
În toate testele se includ martori pozitivi, utilizându-se atât un compus cu acțiune directă, cât și un compus ce necesită activare metabolică; de asemenea, se utilizează și un martor negativ pentru vehicul.
Exemple de substanțe ce pot fi folosite ca martori pozitivi:
— compuși cu acțiune directă:
—— etilmetansulfonatul;
— compuși cu acțiune indirectă:
—— ciclofosfamida.
După caz, se poate introduce un martor pozitiv suplimentar din aceeași clasă chimică cu substanța de testat.
Se folosesc cel puțin trei concentrații ale substanței de testat, spațiate în mod adecvat. Concentrația maximă trebuie să producă un efect toxic semnificativ, permițând totuși producerea unei replicări celulare corespunzătoare. Substanțele relativ insolubile în apă trebuie testate până la limita superioară a solubilității prin metode adecvate. Pentru substanțele netoxice ușor solubile în apă, limita superioară a concentrației substanței de testat se stabilește de la caz la caz.
1.6.2. Mod de operare
Liniile celulare bine caracterizate se obțin din culturile de tulpini (de exemplu, prin tripsinizare sau prin descuamare), cultivate în vase de cultură cu o densitate corespunzătoare și incubate la 37 oC. Pentru culturile unistratificate, numărul de celule pe cultură trebuie ajustat astfel încât în momentul prelevării culturile să nu fie confluente în proporție mai mare de 50 %. Ca alternativă, se pot folosi suspensiile de culturi celulare. Culturile de limfocite umane se pot obține din sânge heparinizat, prin tehnici adecvate și sunt incubate la 37 oC.
Celulele aflate în stadiul de creștere exponențială se tratează cu substanța de testat pe o perioadă de timp corespunzătoare, în majoritatea cazurilor fiind suficiente una sau două ore. Durata tratamentului poate fi extinsă în anumite cazuri până la două cicluri celulare complete. Celulele fără o activitate metabolică intrinsecă corespunzătoare se tratează cu substanța de testat atât în prezența, cât și în absența unui sistem de activare metabolică. La sfârșitul perioadei de expunere, celulele se spală abundent pentru îndepărtarea substanței de testat și se cultivă timp de două cicluri de replicare în prezența BrdU. Ca metodă alternativă, celulele pot fi tratate simultan cu substanța de testat și BrdU pentru întreaga perioadă de cultură de două cicluri celulare.
Culturile de limfocite umane trebuie tratate când sunt într-o stare semisincronă.
Celulele trebuie analizate în perioada celei de-a doua diviziuni după tratament, asigurând astfel expunerea la substanța chimică în cele mai sensibile stadii ale ciclului celular. Cu toate culturile la care s-a adăugat BrdU se va lucra la întuneric sau iluminare slabă de la o sursă incandescentă până în momentul prelevării celulelor, pentru reducerea la minim a fotolizei ADN-ului care conține BrdU.
Culturile se tratează cu un inhibitor de fus mitotic (de exemplu colchicină) cu 1-4 ore înainte de recoltarea celulelor. Fiecare cultură este recoltată și prelucrată separat în vederea obținerii preparatelor cromozomiale.
Preparatele cromozomiale se obțin prin tehnici citogenetice standard. Colorarea lamelelor pentru evidențierea SCE se poate face prin mai multe tehnici (de exemplu, prin fluorescență plus metoda Giemsa).
Numărul de celule analizate depinde de frecvența spontană a SCE la martori. De obicei, cel puțin 25 de metafaze bine exprimate pe cultură sunt analizate în termeni de SCE. Lamele trebuie etichetate înainte de analiză. La limfocitele umane se analizează numai celulele care conțin 46 de centromeri. Pe liniile celulare bine caracterizate se analizează numai metafazele care conțin ± 2 centromeri din numărul modal. Trebuie precizat dacă marcarea joncțiunii centromerice este sau nu inventariată ca SCE. Rezultatele trebuie confirmate într-un experiment independent.
2. DATE
Datele se sistematizează în tabele. Pentru fiecare cultură tratată sau martor se menționează separat numărul de SCE pentru fiecare metafază și numărul de SCE pe cromozom pentru fiecare metafază.
Datele se evaluează prin metode statistice adecvate.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— celulele folosite, metodele de menținere a culturilor celulare;
— condițiile de desfășurare a testului: compoziția mediului, concentrația de CO2, concentrația substanței de testat, vehiculul folosit, temperatura de incubare, durata tratamentului, inhibitorul fusului de diviziune celulară folosit, concentrația acestuia și timpul de tratament cu acesta, tipul de sistem folosit pentru activarea metabolică la mamifere, martorii pozitivi și negativi;
— numărul de culturi la fiecare punct experimental;
— detalii despre tehnica folosită pentru prepararea lamelelor;
— numărul de metafaze analizate (datele vor fi redate separat pentru fiecare cultură în parte);
— numărul mediu de SCE per celulă și per cromozom (datele trebuie indicate separat pentru fiecare cultură în parte);
— criteriile pentru numărarea SCE;
— argumentarea alegerii dozelor;
— relația doză-răspuns, dacă este posibil;
— evaluarea statistică;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.20. TEST DE LETALITATE RECESIVĂ ÎN RAPORT CU SEXUL LA DROSOPHILA MELANOGASTER (SLRL)
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Testul SLRL pe Drosophila melanogaster este un test care depistează incidența mutațiilor, atât a mutațiilor punctiforme, cât și a delețiilor mici, în liniile germinale ale insectelor. Acest test este un test de mutație directă prin care pot decela mutațiile în aproximativ 800 loci de pe cromozomul X, ceea ce reprezintă aproximativ 80 % din totalul de loci ai acestuia. Cromozomul X reprezintă aproximativ o cincime din întregul genom haploid.
Mutațiile cromozomului X la Drosophila melanogaster se exprimă fenotipic la masculi purtători ai genei mutante. Dacă mutația este letală în condiții de hemizigotism, prezența sa se deduce din absența unei generații de descendenți de sex masculin, din cele două care sunt normal produse de o femelă heterozigotă. Aceste determinări se fac prin intermediul unor cromozomi special marcați și dispuși.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătire
Pot fi folosiți masculi dintr-o tulpină de tip sălbatic bine caracterizată și femele care conțin cromozomul Muller-5. De asemenea, se pot folosi femele din alte tulpini marcate corespunzător cu cromozomi X cu inversiuni multiple.
Substanțele trebuie dizolvate în apă. Substanțele insolubile în apă pot fi dizolvate sau suspensionate într-un vehicul adecvat (de exemplu, un amestec de etanol și Tween-60 sau 80), apoi diluate cu apă sau soluție salină înainte de administrare. Se recomandă evitarea folosirii ca vehicul a dimetilsulfoxidului (DMSO).
Sensibilitatea și puterea testului sunt predeterminate. Frecvența mutanților spontani observați la martorul corespunzător influențează puternic numărul de cromozomi tratați care trebuie analizați.
Expunerea se poate face pe cale orală, prin injectare sau expunere la gaze sau vapori. Administrarea substanței de testat prin hrană se poate face în soluții zaharoase. Dacă este necesar, substanța poate fi dizolvată într-o soluție de NaCl 0,7 % și injectată în torace sau abdomen.
În fiecare experiment trebuie folosiți martori negativi (pentru vehicul) și pozitivi. Cu toate acestea, dacă sunt disponibile date istorice pertinente despre martori, nu este necesară folosirea simultană a acestora.
Se folosesc trei niveluri de expunere. Pentru o evaluare preliminară se poate folosi un singur nivel de expunere, acesta fiind fie concentrația maximă tolerată, fie nivelul de concentrație care produce câteva semne de toxicitate. Pentru substanțele netoxice se face expunerea la concentrația maximă care poate fi obținută practic.
Masculii din tulpinile sălbatice (în vârstă de trei-cinci zile) se tratează cu substanța de testat, apoi sunt împerecheați individual cu un număr în exces de femele virgine din tulpina Muller-S sau dintr-o altă tulpină marcată corespunzător (cu multiple inversiuni ale cromozomilor X). La fiecare două-trei zile femelele trebuie înlocuite cu alte femele virgine pentru a acoperi întregul ciclu al celulelor germinale. Descendenții acestor femele trebuie inventariați pentru depistarea efectelor letale corespunzătoare efectelor asupra spermatozoizilor maturi, spermatidelor în stadiu intermediar și tardiv, spermatidelor în stadiu timpuriu, spermatocitelor și spermatogoniilor din timpul tratamentului.
Femelele F1 heterozigote din împerecherea de mai sus vor fi împerecheate individual (de exemplu, o femelă per fiolă) cu frații lor. În generația F2 fiecare cultură este inventariată pentru a depista absența masculilor din tulpinile sălbatice. Dacă o cultură provine dintr-o femelă F1 purtătoare de genă letală în cromozomul X parental (de exemplu, nu se observă masculi cu cromozomul tratat), fiicele acestei femele cu același genotip trebuie testate pentru a se constata dacă gena letală se repetă în generația următoare.
2. DATE
Datele se sistematizează în tabele în care se specifică numărul de cromozomi X testați, numărul de masculi nefertili și numărul de cromozomi letali la fiecare concentrație de expunere și pentru fiecare perioadă de împerechere, pentru fiecare mascul tratat. Trebuie raportat numărul de clustere de diferite dimensiuni per mascul. Aceste rezultate trebuie confirmate într-un experiment separat.
Pentru evaluarea SLRL se vor folosi metode statistice adecvate. Trebuie luată în considerare aglomerarea de gene letale recesive provenite de la un singur mascul, care trebuie evaluată cu metode statistice corespunzătoare.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— tulpina: tulpinile sau liniile de Drosophila folosite, vârsta insectelor, numărul de masculi tratați, numărul de masculi sterili, numărul de culturi F2 obținute, numărul de culturi F2 fără descendenți, numărul de cromozomi purtători de genă dominantă letală detectați în fiecare stadiu al celulei germinale;
— criteriile de stabilire a dimensiunilor lotului tratat;
— condițiile de testare: descrierea detaliată a tratamentului și schema prelevării probelor, nivelul de expunere, date de toxicitate, martori negativi (solvent) și pozitivi, după caz;
— criteriile pentru numărarea mutațiilor letale;
— dacă este posibil, relația expunere/efect;
— evaluarea statistică;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.21. TEST IN VITRO DE TRANSFORMARE A CELULELOR DE MAMIFERE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Pentru determinarea modificărilor fenotipice in vitro induse de substanțele chimice asociate cu transformări maligne in vivo, se folosesc sisteme de cultură de celule de mamifere. Cele mai des utilizate celule sunt C3H10T1/2, 3T3, SHE și celule de la șobolani Fisher. Testele urmăresc modificările în morfologia celulară, formarea de focare sau modificări în dependența de ancorare pe agar-agar semisolid. Există sisteme folosite mai rar care depistează alte modificări celulare morfologice sau fiziologice în urma expunerii la substanțe chimice cancerigene. Niciunul din mecanismele testate in vitro nu are o legătură mecanică determinată cu cancerul. Anumite sisteme de testare pot detecta promotori tumorali. Citotoxicitatea poate fi determinată prin măsurarea efectelor materialului testat asupra capacităților de formare de colonii (eficiența de clonare) sau asupra ratei de creștere a culturilor. Măsurarea citotoxicității are rolul de a stabili dacă expunerea la substanța chimică testată are relevanță toxicologică, dar nu poate fi folosită pentru a calcula frecvența transformărilor în toate testele, deoarece unele dintre acestea pot necesita incubare prelungită și/sau reînsămânțare.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătire
În funcție de testul de transformare folosit, sunt disponibile diferite linii celulare sau celule primare. Cercetătorul trebuie să se asigure că celulele folosite în cadrul testului manifestă modificări fenotipice corespunzătoare după expunerea la un agent cancerigen cunoscut și că testul efectuat are o validitate și o fiabilitate demonstrate și documentate.
Se utilizează medii și condiții de testare corespunzătoare testului de transformare efectuat.
Substanțele testate pot fi preparate în mediile de cultură sau dizolvate ori suspensionate într-un vehicul adecvat, înainte de tratarea celulelor. Concentrația finală a vehiculului în sistem nu trebuie să afecteze viabilitatea celulară, rata de creștere sau incidența transformărilor.
Celulele sunt expuse la substanța de testat atât în prezența, cât și în absența unui sistem adecvat de activare metabolică. Dacă se utilizează un tip de celule cu activitate metabolică intrinsecă, natura acestei activități va fi recunoscută ca fiind adecvată clasei de substanțe chimice testate.
Condiții de testare
În fiecare experiment se includ martori pozitivi, utilizându-se atât un compus cu acțiune directă, cât și un compus ce necesită activare metabolică; de asemenea, se utilizează și un martor negativ (pentru vehicul).
Printre exemplele de substanțe ce pot fi folosite ca martor pozitiv se numără:
— compuși cu acțiune directă:
—— etilmetansulfonatul,
— β-propiolactona;
— compuși care necesită activare metabolică:
—— 2-acetilaminofluoren,
— 4-dimetilaminoazobenzen,
— 7,12-dimetilbenzantracen.
Dacă este necesar, poate fi inclus un martor pozitiv suplimentar care să aparțină aceleiași clase de substanțe ca și substanța de testat.
Se folosesc mai multe concentrații ale substanței de testat. Acestea trebuie să prezinte efect toxic în funcție de concentrație, concentrația maximă determinând un nivel scăzut de supraviețuire, iar supraviețuirea la concentrația minimă fiind aproximativ aceeași cu cea de la martorul negativ. Pentru substanțele relativ insolubile în apă trebuie testată limita superioară a solubilității, folosind procedee corespunzătoare. Pentru substanțele netoxice, foarte ușor solubile în apă, limita superioară a concentrației se stabilește de la caz la caz.
Mod de operare
Celulele se tratează o perioadă corespunzătoare, în funcție de sistemul de testare utilizat, acest lucru putând presupune reevaluarea dozei prin schimbarea mediului (și, după caz, un amestec de activare metabolică proaspăt) dacă expunerea este prelungită. Celulele fără o activitate metabolică intrinsecă suficientă sunt expuse la substanța de testat atât în prezența, cât și în absența unui sistem adecvat de activare metabolică. La sfârșitul perioadei de expunere, celulele trebuie spălate, îndepărtând substanța de testat, și cultivate în condiții adecvate pentru apariția modificărilor fenotipice urmărite și pentru stabilirea incidenței de transformare. Toate rezultatele trebuie confirmate în cadrul unui experiment independent.
2. DATE
Datele se sistematizează în tabele și pot avea diferite forme în funcție de metoda folosită, ca, de exemplu, numărarea plăcilor, plăci pozitive sau număr de celule transformate. După caz, supraviețuirea se exprimă ca procent din nivelul de supraviețuire la probele martor, iar frecvența de transformare ca raport între numărul de celule transformate și numărul de celule supraviețuitoare. Datele se evaluează prin metode statistice corespunzătoare.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— tipul de celule folosite, numărul de culturi celulare, metoda de menținere a culturilor;
— condițiile de testare: concentrația substanței de testat, vehiculul folosit, timpul de incubare, durata și frecvența tratamentului, densitatea celulară pe parcursul tratamentului, tipul de sistem exogen folosit pentru activarea metabolismului, martorii pozitivi și negativi, caracteristicile fenotipului monitorizat, tipul de sistem selectiv folosit (după caz), argumentarea alegerii dozelor;
— metoda folosită pentru exprimarea numărului de celule viabile și transformate;
— evaluarea statistică;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.22. TESTUL DE LETALITATE DOMINANTĂ LA ROZĂTOARE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Efectele letalității dominante determină moartea embrionului sau a fetusului. Inducerea genelor letalității dominante prin expunere la o substanță chimică indică faptul că acea substanță a acționat la nivelul țesutului germinal al speciei testate. Este cunoscut faptul că letalitatea dominantă se datorează unei anomalii cromozomiale (numerice și structurale). Moartea embrionului, în cazul în care femelele sunt tratate, se poate datora și efectelor toxice.
În general, masculii se tratează cu substanța de testat și se împerechează cu femele virgine netratate. Pot fi studiate separat diferitele stadii ale celulelor germinale, la intervale de împerechere succesive. Creșterea numărului de ovule fecundate moarte per femelă în lotul tratat comparativ cu femelele din lotul martor reflectă posibilitatea pierderii sarcinii după implantare. Pierderile înaintea ovoimplantației pot fi estimate luând în considerare numărul de corpora lutea sau comparând numărul total de implanturi per femelă în lotul tratat și în lotul martor. Efectul total de letalitate dominantă reprezintă suma pierderilor înainte și după implantare. Calcularea efectului total al letalității dominante se bazează pe comparația dintre implanturile viabile la femelele din lotul tratat și la cele din lotul martor. Reducerea numărului de implanturi la anumite intervale de timp poate fi rezultatul distrugerii celulelor (a spermatocitului și/sau a spermatogoniei).
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătire
Dacă este posibil, substanțele folosite se dizolvă sau se suspensionează într-o soluție izotonică salină. Substanțele chimice insolubile în apă pot fi dizolvate sau suspensionate în vehicule corespunzătoare. Vehiculul folosit nu trebuie să interfereze cu substanța chimică de testat și nici nu trebuie să producă efecte toxice. Pentru testarea chimică, se folosesc substanțe chimice de testat proaspete.
Condiții de testare
De regulă, compusul de testat trebuie administrat o singură dată. În funcție de informațiile toxicologice, se poate utiliza o schemă de tratament repetat. Căile normale de administrare sunt: intubarea orală sau injectarea intraperitoneală. Se pot folosi și alte căi de administrare corespunzătoare.
Se recomandă utilizarea șobolanilor sau a șoarecilor. Animalele sănătoase și mature din punct de vedere sexual se repartizează aleatoriu în loturile tratate și în loturile martor.
Se utilizează un număr corespunzător de masculi tratați, luând în considerare variația spontană a caracterelor biologice evaluate. Numărul se stabilește în funcție de sensibilitatea detectării și de gradul de încredere care au fost predeterminate. De exemplu, în cadrul unui test tipic, numărul masculilor din fiecare lot tratat trebuie să fie suficient pentru a asigura între 30 și 50 de femele gestante în fiecare perioadă de împerechere.
În general, în fiecare experiment se utilizează simultan martori pozitivi și negativi. Când experimente efectuate recent în același laborator oferă rezultate acceptabile cu privire la martorii pozitivi, aceste rezultate pot fi folosite ca martori pozitivi în experimentul curent. Substanțele martor pozitiv trebuie folosite la o doză scăzută corespunzătoare (de ex: MMS, intraperitoneal într-o doză de 10 mg/kg) pentru a demonstra sensibilitatea testului.
În mod normal, se utilizează trei doze de tratament. Doza mare trebuie să producă efecte toxice sau să reducă fertilitatea animalelor tratate. În anumite cazuri, este suficientă folosirea unei singure doze mari.
Substanțele care nu sunt toxice se testează la doza de 5 g/kg în cazul unei singure administrări sau 1 g/kg/zi în cazul administrărilor repetate.
Mod de operare
Sunt disponibile mai multe scheme de tratament. Cea mai frecventă este aceea a administrării unice a substanței de testat. Pot fi folosite și alte scheme de tratament.
Fiecare mascul se împerechează pe rând cu una sau două femele virgine netratate, la intervale corespunzătoare după tratament. Femelele sunt lăsate împreună cu masculii pe durata ciclului estral sau până la confirmarea împerecherii (prezența spermei în vagin sau a dopului vaginal).
Numărul împerecherilor după tratament se stabilește în funcție de schema de tratament și trebuie să asigure prelevarea de celule germinale în toate stadiile de dezvoltare a acestora.
Femelele sunt sacrificate în cea de-a doua jumătate a gestației, iar conținutul uterului se examinează în vederea decelării numărului de implanturi viabile și a numărului de implanturi neviabile. Ovarele se examinează pentru stabilirea numărului de corpora lutea.
2. DATE
Datele se sistematizează în tabele și prezintă numărul masculilor, al femelelor gestante și cel al femelelor negestante. Rezultatele fiecărei împerecheri, inclusiv identitatea fiecărui mascul și a fiecărei femele se înregistrează individual. În cazul fiecărei femele se menționează săptămâna de împerechere, doza administrată masculilor și numărul implanturilor vii și moarte.
Calcularea efectului total de letalitate dominantă se bazează pe comparația dintre implanturile vii, pentru fiecare femelă din cadrul lotului tratat și a implanturilor vii pentru fiecare femelă din cadrul lotului martor. Raportul dintre numărul implanturilor vii și moarte în lotul tratat se compară cu raportul din lotul martor și este analizat pentru a evidenția moartea produsului de concepție în faza post-implantare.
Dacă datele sunt înregistrate ca mortalitate precoce și mortalitate tardivă, din tabele trebuie să rezulte clar acest lucru. De asemenea, trebuie înregistrate pierderile în faza de preimplantare. Pierderile în faza de preimplantare se pot calcula în funcție de diferența dintre numărul de corpora lutea și numărul implanturilor sau urmărind reducerea numărului mediu de implanturi per uter la lotul tratat în comparație cu împerecherile martor.
Datele se evaluează prin metode statistice adecvate.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia, linia, vârsta și greutatea animalelor, numărul animalelor pe sexe folosite atât în lotul tratat, cât și în lotul martor;
— substanța de testat, vehiculul, dozele testate și argumentarea selectării dozelor, substanțe folosite ca martor negativ și pozitiv, datele cu privire la toxicitate;
— calea de administrare și schema de tratament;
— schema de împerechere;
— metoda folosită pentru confirmarea împerecherii;
— momentul sacrificării;
— criteriul de inventariere a efectelor de letalitate dominantă;
— relația doză/răspuns;
— evaluarea statistică a rezultatelor;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.23. TEST DE ABERAȚIE CROMOZOMIALĂ PE SPERMATOGONII DE MAMIFERE
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 483 a OCDE, Testul de aberație cromozomială pe spermatogonii de mamifere (1997).
1.1. INTRODUCERE
Scopul testului in vivo de aberație cromozomială pe spermatogonii de mamifere constă în identificarea acelor substanțe care produc aberații cromozomiale ale structurii în celulele spermatogoniale ale mamiferelor (1) (2) (3) (4) (5). Aberațiile de structură pot fi de două tipuri, cromozomiale sau cromatidice. La majoritatea mutagenilor chimici, aberațiile induse sunt de tip cromatidic, dar se produc și aberații de tip cromozomial. Prezenta metodă nu este destinată determinării aberațiilor numerice și, în general, nu se utilizează în acest scop. Mutațiile cromozomiale și fenomenele conexe sunt cauza multor maladii genetice umane.
Prezentul test determină fenomenele cromozomiale din celulele germinale spermatogoniale și, prin urmare, ar trebui să permită estimarea mutațiilor transmisibile produse în celulele germinale.
Pentru test se utilizează, în general, rozătoare. Prezentul test citogenetic in vivo permite detectarea aberațiilor cromozomiale din mitozele spermatogoniale. Alte celule țintă nu fac obiectul prezentului test.
Pentru detectarea aberațiilor de tip cromatidic din celulele spermatogoniale, ar trebui să se examineze prima diviziune celulară mitotică după tratament, înainte ca leziunile respective să se piardă în diviziunile celulare ulterioare. Prin analiza cromozomilor meiotici pentru detectarea aberațiilor de tip cromozomial în diakineză-metafaza I când celulele tratate se transformă în spermatocite, se pot obține informații suplimentare referitoare la celulele germinale spermatogoniale tratate.
Prezentul test in vivo este destinat să verifice dacă mutagenii sunt la fel de activi în celulele germinale ca și în celulele somatice. În plus, testul pe spermatogonii este relevant în evaluarea riscului de mutagenitate, deoarece permite să se țină seama de factorii de metabolism in vivo, de farmacocinetică și de procesele de regenerare a ADN.
Testiculele conțin un număr de generații de spermatogonii care prezintă sensibilități diferite la tratamentul chimic. Astfel, aberațiile detectate reprezintă un răspuns global al populațiilor de celule spermatogoniale tratate, în care predomină celulele spermatogoniale diferențiate, mai numeroase. În funcție de poziția în testicul, diferitele generații de spermatogonii pot să fie sau să nu fie expuse la substanțele prezente în circulația generală, datorită barierei fizice și fiziologice de celule Sertoli și a barierei sânge-testicul.
Dacă există dovezi că substanța de testat sau un metabolit reactiv nu vor ajunge la țesutul țintă, nu este indicată utilizarea prezentului test.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Aberație de tip cromatidic: o leziune structurală a cromozomului, care se traduce prin divizarea cromatidelor singure sau prin divizarea și reuniunea între cromatide.
Aberație de tip cromozomial: o leziune structurală a cromozomului, care se traduce prin divizarea sau divizarea și reuniunea ambelor cromatide în același loc.
Lacună: leziune acromatică mai mică decât lățimea unei cromatide și cu o eroare minimă de aliniere a cromatidelor.
Aberație numerică: modificare a numărului de cromozomi față de numărul normal caracteristic pentru animalele utilizate.
Poliploidie: multiplicare a numărului (n) de cromozomi haploizi, alta decât diploidia (și anume 3n, 4n etc.).
Aberație structurală: modificare a structurii cromozomilor, detectabilă la examinarea microscopică a celulelor în stadiul de metafază al diviziunii acestora, care se prezintă sub formă de deleții, modificări intracromozomiale și intercromozomiale.
1.3. PRINCIPIUL METODEI DE TESTARE
Animalele se expun la substanța de testat printr-o cale de expunere corespunzătoare și sunt sacrificate în momente corespunzătoare după tratament. Înainte de sacrificare, animalele se tratează cu o substanță de inhibare a metafazei (de exemplu colchicină sau Colcemid®). Apoi, din celulele germinale, se realizează preparate cromozomiale care se colorează, iar celulele în metafază sunt analizate la microscop pentru detectarea aberațiilor cromozomiale.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătire
1.4.1.1. Selectarea speciilor de animale
Se utilizează, de obicei, hamsteri chinezești și șoareci de sex masculin. Cu toate acestea, se pot utiliza masculi din orice altă specie de mamifere adecvată. Se recomandă utilizarea unor animale adulte tinere sănătoase, din sușe utilizate în mod curent în laborator. La începutul studiului, greutatea animalelor ar trebui să prezinte o variație minimă, ce nu trebuie să depășească ± 20 % din greutatea medie.
1.4.1.2. Condițiile de adăpostire și de hrănire
Se aplică condițiile generale menționate în introducerea generală partea B, dar umiditatea atinsă ar trebui să fie de 50-60 %.
1.4.1.3. Pregătirea animalelor
Animalele de sex masculin, adulte, tinere, sănătoase se distribuie în mod aleatoriu în grupe martor și grupe de tratament. Cuștile ar trebui să se aranjeze astfel încât posibilele efecte datorate amplasării acestora să fie reduse la minim. Animalele sunt identificate individual. Se procedează la aclimatizarea animalelor la condițiile de laborator timp de minimum cinci zile înainte de începerea studiului.
1.4.1.4. Prepararea dozelor
Substanțele de testat în stare solidă ar trebui să se preparare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare și să se dilueze, dacă este cazul, înainte de a fi administrate animalelor. Substanțele de testat lichide se pot administra direct sau dilua înainte de administrare. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora în caz de păstrare.
1.4.2. Condiții de testare
1.4.2.1. Solventul/vehiculul
Solventul/vehiculul nu ar trebui să producă efecte toxice la dozele utilizate și nu ar trebui să existe suspiciunea reacției chimice a acestuia cu substanța de testat. Utilizarea altor solvenți/vehiculi decât cei recunoscuți ar trebui să fie justificată cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere utilizarea unui solvent/vehicul apos.
1.4.2.2. Martorii
Pentru fiecare test ar trebui să se prevadă martori pozitivi și negativi (solvent/vehicul), utilizați în paralel. Cu excepția tratamentului cu substanța de testat, manipularea animalelor din grupele martor ar trebui să fie identică cu cea a animalelor din grupele tratate.
Martorii pozitivi ar trebui să producă aberații structurale ale cromozomului in vivo la celule spermatogoniale, la nivelurile de expunere preconizate a genera o creștere detectabilă în raport cu fondul.
Dozele de martor pozitiv ar trebui să fie alese, astfel încât să se obțină efecte clare, dar fără să releve imediat examinatorului identitatea lamelelor codificate. Pentru martorul pozitiv, se poate accepta administrarea pe o cale diferită de cea prin care se administrează substanța de testat și doar o singură prelevare a probelor. În plus, se poate avea în vedere utilizarea unor martori pozitivi din aceeași clasă de produse chimice, dacă sunt disponibili. În tabelul următor se prezintă exemple de substanțe care se pot utiliza ca martori pozitivi:
|
Substanța |
Nr. CAS |
Nr. EINECS |
|
ciclofosfamidă ciclofosfamidă monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
ciclohexilamină |
108-91-8 |
203-629-0 |
|
mitomicină C |
50-07-7 |
200-008-6 |
|
acrilamidă monomerică |
79-06-1 |
201-173-7 |
|
trietilenmelamină |
51-18-3 |
200-083-5 |
Martorii negativi, tratați doar cu solvent sau cu vehicule și manipulați în același fel ca și grupele tratate, ar trebui să fie incluși la fiecare prelevare de probe, cu excepția cazului în care se dispune de date acceptabile privind variabilitatea inter-animale și frecvența celulelor cu aberații cromozomiale, provenite de la martori anteriori. În plus, ar trebui să se utilizeze și martori netratați, cu excepția cazului în care există date de la martori anteriori sau publicate care să ateste că solventul/vehiculul selectat nu prezintă efecte vătămătoare sau mutagene.
1.5. MOD DE LUCRU
1.5.1. Numărul de animale
Fiecare grupă tratată și martor trebuie să includă minimum cinci animale de sex masculin, analizabile.
1.5.2. Modalitatea de tratare
Substanțele de testat se administrează de preferință o dată sau de două ori (și anume un singur tratament sau două tratamente). Substanțele de testat se mai pot administra în doze fracționate, și anume două tratamente în aceeași zi la distanță de doar câteva ore, pentru a facilita administrarea unui volum mare de material. Alte modalități de administrare ar trebui să fie justificate în mod științific.
La grupa cu doza maximă prelevarea probelor după tratament se realizează în două momente. Deoarece substanța de testat poate să influențeze kinetica ciclului celular, prima și ultima prelevare de probe se realizează la intervale de 24 de ore și respectiv de 48 de ore după tratament. Pentru alte doze decât doza maximă, prelevarea probelor ar trebui să se realizeze la un interval de 24 de ore sau la un interval de timp egal cu de 1,5 ori durata ciclului celular după tratament, cu excepția cazului în care se cunoaște un alt moment corespunzător de prelevare pentru detectarea efectelor (6).
În plus, se pot utiliza și alte momente de prelevare. De exemplu, pentru produsele chimice care pot produce cromozomi întârziați sau pot să aibă efecte independente de faza S, o prelevare timpurie a probelor ar putea fi adecvată (1).
Adecvarea unui tratament repetat ar trebui să se determine de la caz la caz. După un program de tratamente repetate, animalele ar trebui să fie sacrificate după 24 de ore (1,5 ori durata ciclului celular) de la ultimul tratament. Se pot utiliza momente suplimentare de prelevare a probelor, dacă este necesar.
Înainte de sacrificare, se procedează la injectarea intraperitoneală a animalelor cu o doză corespunzătoare de substanță de inhibare a metafazei (de exemplu Colcemid® sau colchicină). Probele de la animale se prelevează apoi la un interval corespunzător. Pentru șoareci intervalul respectiv este de aproximativ 3-5 ore; pentru hamsterii chinezești intervalul este de 4-5 ore.
1.5.3. Dozele
Dacă, în lipsa datelor corespunzătoare, se realizează un studiu pentru stabilirea dozelor, acesta ar trebui să se realizeze în același laborator și să utilizeze aceeași specie, aceeași sușă de animale și același regim de tratare ca în studiul principal ce urmează (7). În caz de toxicitate, se utilizează trei doze diferite pentru prima prelevare. Aceste trei doze ar trebui să acopere un domeniu de toxicități de la toxicitatea maximă până la toxicitatea minimă sau lipsă. Pentru prelevările ulterioare se utilizează doar doza maximă. Doza maximă se definește ca doza ce produce astfel de semne de toxicitate, încât dozele mai mari, administrate în același mod, se estimează că sunt letale.
Substanțele cu activitate biologică specifică la doze mici netoxice (ca hormonii și mitogenii) pot face excepție de la criteriile de stabilire a dozelor și să fie stabilite pentru fiecare caz în parte. Doza maximă se mai poate defini ca doza care produce anumite semne de toxicitate în celulele spermatogoniale (de exemplu o diminuare a proporției de mitoze spermatogoniale în raport cu prima și a doua metafază meiotică; reducerea respectivă nu ar trebui să fie mai mare de 50 %).
1.5.4. Test-limită
Dacă un test realizat cu o doză de minimum 2 000 mg/kg greutate corporală/zi, administrată într-o singură repriză sau în două reprize în aceeași zi, nu produce efecte toxice detectabile și dacă o genotoxicitate este improbabilă pe baza datelor referitoare la substanțe cu o structură apropiată, se poate considera că un studiu complet cu utilizarea a trei doze de mărimi diferite nu este necesar. În funcție de expunerea umană preconizată, ar putea fi necesară o doză mai mare în testul-limită.
1.5.5. Administrarea dozelor
Substanța de testat se administrează, de obicei, prin cavitatea nazală cu ajutorul unui tub stomacal sau a unei canule de intubație adaptate sau printr-o injecție intraperitoneală. Se pot accepta și alte căi de administrare, dacă se pot justifica. Volumul maxim de lichid care se poate administra prin sondă gastrică introdusă prin cavitatea nazală sau prin injecție într-o singură repriză depinde de dimensiunea animalului de laborator. Volumul ar trebui să fie mai mic sau egal cu 2 ml/100 g greutate corporală. Utilizarea unor volume mai mari decât cel menționat ar trebui să se justifice. Cu excepția substanțelor iritante și corozive care vor prezenta în mod normal efecte exacerbate la concentrații mai mari, variația volumului testat ar trebui să fie redusă la minim prin ajustarea concentrației, astfel încât să se asigure un volum constant pentru toate dozele.
1.5.6. Prepararea cromozomilor
Imediat după sacrificare, suspensiile celulare obținute de la unul sau două testicule se expun la o soluție hipotonică și se fixează. Celulele se întind apoi pe lamele și se colorează.
1.5.7. Analiza
Pentru fiecare animal ar trebui să se analizeze minimum 100 de celule în metafază, bine etalate (de exemplu minimum 500 de celule în metafază pentru fiecare grupă). Dacă se observă un număr mai mare de aberații, numărul specificat se poate reduce. Toate lamelele, inclusiv cele cu celule de la martorii pozitivi și negativi, ar trebui să fie codificate independent înainte de examinarea la microscop. Deoarece metodele de preparare a lamelelor conduc adesea la scindarea unei fracții de celule în metafază cu pierdere de cromozomi, toate celulele examinate ar trebui, prin urmare, să conțină un număr de centromeri egal cu 2n ± 2.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Se recomandă prezentarea sub formă de tabel a datelor pentru fiecare animal. Unitatea experimentală este animalul. Pentru fiecare animal, ar trebui să se evalueze numărul de celule cu aberații cromozomiale de structură și numărul de aberații cromozomiale per celulă. Diferitele tipuri de aberații cromozomiale de structură ar trebui să fie consemnate împreună cu numărul și frecvența acestora pentru grupele tratate și pentru grupele martor. Lacunele se consemnează și se raportează separat, dar în general acestea nu se includ în frecvența totală a aberațiilor.
Dacă se observă concomitent mitoză și meioză, ar trebui să se determine raportul dintre mitozele spermatogoniale, în prima, respectiv în a doua metafază meiotică; această determinare ar trebui să se realizeze pentru toate animalele tratate și cele martori negativi, pe un eșantion total de 100 celule în diviziune pentru fiecare animal pentru a stabili un posibil efect citotoxic. Dacă se constată doar mitoză, ar trebui să se determine indexul mitotic în mimimum 1 000 de celule pentru fiecare animal.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Există câteva criterii pentru determinarea unui rezultat pozitiv, ca o creștere în funcție de doză a numărului relativ de celule cu aberații cromozomiale sau o creștere netă a numărului de celule cu aberații la o singură doză și la o singură prelevare a probelor. În primul rând ar trebui să se aibă în vedere relevanța biologică a rezultatelor. Pentru evaluarea rezultatelor testelor se poate recurge și la ajutorul unor metode statistice (8). Semnificația statistică nu ar trebui să fie singurul factor determinant pentru a decide cu privire la un răspuns pozitiv. Rezultatele nesigure ar trebui să fie clarificate prin teste suplimentare, realizate de preferință printr-o modificare a condițiilor de testare.
Dacă rezultatele obținute pentru o substanță de testat nu îndeplinesc criteriile menționate anterior, se consideră că substanța respectivă nu este mutagenă în prezentul test.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în unele cazuri rare, datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile independent de numărul de repetări ale experimentului.
Rezultatele pozitive ale unui test in vivo de aberație cromozomială pe celule spermatogoniale indică faptul că substanța de testat produce aberații cromozomiale de structură în celulele sexuale ale speciei testate. Rezultatele negative indică faptul că, în condițiile de testare, substanța de testat nu produce aberații cromozomiale în celulele germinale ale speciei testate.
Ar trebui să se discute probabilitatea ca substanța de testat sau metaboliții acesteia să ajungă la țesutul țintă.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Solventul/vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Animalele de laborator:
— specia/sușa utilizată;
— numărul și vârsta animalelor;
— sursa, condițiile de adăpost și hrănire etc.;
— greutatea fiecărui animal la începutul testului, inclusiv intervalul de greutate, greutatea medie și deviația standard pentru fiecare grupă.
Condițiile de testare:
— datele din studiul pentru stabilirea dozelor, dacă s-a realizat;
— justificarea alegerii dozelor utilizate;
— justificarea căii de administrare selectate;
— detalii privind prepararea substanței de testat;
— detalii privind administrarea substanței de testat;
— justificarea momentelor de sacrificare;
— conversia concentrației substanței de testat (ppm) în hrană/apa de băut în doza reală (mg/kg greutate corporală/zi), dacă este cazul;
— detalii privind calitatea hranei și a apei;
— descrierea amănunțită a modalităților de tratare și de prelevare a probelor;
— metodele de măsurare a toxicității;
— identitatea substanței de inhibare a metafazei, concentrația acesteia și durata tratamentului;
— metodele de preparare a lamelelor;
— criteriile pentru numărătoarea aberațiilor;
— numărul de celule analizate per animal;
— criteriile utilizate la caracterizarea studiilor ca fiind pozitive, negative sau nesigure.
Rezultatele:
— semnele de toxicitate;
— indexul mitotic;
— procentul de celule spermatogoniale în mitoză în raport cu cele din prima și a doua metafază meiotică;
— tipul și numărul aberațiilor, consemnate separat pentru fiecare animal;
— numărul total de aberații pentru fiecare grupă;
— numărul de celule cu aberații pentru fiecare grupă;
— relația doză-răspuns, dacă este posibil;
— analizele statistice, dacă există;
— datele privind martorii negativi studiați în paralel;
— datele anterioare privind martorii negativi, cu domeniile, valorile medii și deviațiile standard;
— modificările ploidiei, dacă există.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Adler, I. D. (1986), Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications, in: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C., Lambert B., and Magnusson, J. (eds.) Liss, New York, pp. 477-484.
2. Adler, I. D. (1984), Cytogenic tests in Mammals, in: Mutagenicity Testing: a Practical Approach, ed. S. Venitt and J. M. Parry, IRL Press, Oxford, Washington DC, pp. 275-306.
3. Evans, E. P., Breckon, G. and Ford, C. E. (1964), An Air-Drying Method for Meiotic Preparations from Mammalian Testes, Cytogenetics and Cell Genetics, 3, pp. 289-294.
4. Richold, M., Ashby, J., Chandley, A., Gatehouse, D. G. and Henderson L. (1990), In Vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141.
5. Yamamoto, K. and Kikuchi, Y. (1978), A New Method for Preparation of Mammalian Spermatogonial Chromosomes, Mutation Res., 52, pp. 207-209.
6. Adler, I. D., Shelby, M. D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka, N. (1994), International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests, Mutation Res., 312, pp. 313-318.
7. Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland D. J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313-319.
8. Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232.
B.24. TESTUL PETEI (SPOT TEST) LA ȘOARECI
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Acesta este un test in vivo pe șoareci, în care embrionii aflați în dezvoltare sunt expuși la substanțele chimice de testat. Celulele țintă sunt melanoblastele, iar genele de interes sunt cele care controlează pigmentarea blănii. Embrionii aflați în dezvoltare sunt heterozigoți pentru un număr dintre aceste gene care determină culoarea blănii. În cursul unor evenimente genetice, o mutație sau o pierdere a alelelor dominante ale acestor gene dintr-o melanoblastă determină exprimarea fenotipului recesiv la celulele descendenților, acest fapt manifestându-se prin apariția unei pete de culoare pe suprafața blănii la puii de șoareci. Se evaluează numărul descendenților cu aceste pete (mutații), iar frecvența acestora se compară cu aceea observată la descendenții proveniți din embrionii tratați doar cu solvent. Testul petei decelează apariția presupuselor mutații somatice ce survin în celulele fetale.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI
Pregătire
Dacă este posibil, substanțele de testat se dizolvă sau se suspensionează în soluție izotonică salină. Substanțele chimice insolubile în apă sunt dizolvate sau suspensionate în vehicule corespunzătoare. Vehiculul nu trebuie să interfereze cu substanța de testat și nu trebuie să producă efecte toxice. Se utilizează soluții proaspăt preparate.
Se împerechează șoareci din linia T (nonagouti, a/a; chinchilla, pink eye, cchp/cchp; brown, b/b; dilute, short ear, d se/d se; piebald spotting; s/s) fie cu linia HT (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe), fie cu linia C57BL (nonagouti, a/a). Se mai pot folosi alte împerecheri corespunzătoare, cum ar fi între NMRI (nonagouti, a/a; albino, c/c) și DBA (nonagouti, a/a; brown, b/b; dilute, d/d) pentru a produce descendenți nonagouti.
Se tratează un număr suficient de femele gestante pentru a produce un număr corespunzător de descendenți pentru fiecare doză de tratament. Mărimea corespunzătoare a eșantionului este dată de numărul petelor observate la șoarecii tratați în comparație cu datele obținute la lotul martor. Rezultatele negative se acceptă numai după ce s-au inventariat cel puțin 300 de descendenți de la femelele tratate cu doza maximă.
Este necesar să fie disponibile date martor simultane obținute de la șoarecii tratați numai cu vehicul (martor negativ). Pentru a mări sensibilitatea testului, pot fi puse laolaltă și date martor istorice de la același laborator, cu condiția să fie omogene. În cazul în care nu se detectează niciun efect mutagen al substanței de testat, pot fi folosite ca martor pozitiv rezultatele recente obținute în același laborator pe loturi tratate cu o substanță cunoscută ca fiind mutagenă.
Calea obișnuită de administrare a substanței la femelele gestante este intubarea orală sau injectarea intraperitoneală. Pot fi utilizate, după caz, și alte căi de administrare.
Se folosesc cel puțin două doze, inclusiv o doză care să determine apariția semnelor de toxicitate sau reducerea numărului de pui la o fătare. Pentru substanțele netoxice trebuie folosită doza maximă care poate fi administrată.
Mod de operare
În mod normal, se administrează un tratament unic, în ziua a opta, a noua sau a zecea de gestație, considerând ziua 1 ziua în care se observă pentru prima dată dopul vaginal. Aceste zile corespund zilelor 7,25, 8,25 și 9,25 de la concepție. Tratamente succesive se pot efectua în zilele menționate.
În intervalul cuprins între trei și patru săptămâni de la fătare, descendenții se codează și se examinează pentru observarea eventualelor pete apărute. Se disting trei categorii de pete:
(a) pete albe de până la 5 mm pe linia medio-ventrală, despre care se presupune că apar prin moarte celulară (WMVS);
(b) pete galbene, de tip agouti, dispuse în regiunile mamare, genitale, axilare și inghinale, pe gât, precum și în mijlocul frunții, despre care se presupune că apar ca urmare a procesului de nediferențiere (MDS);
(c) pete pigmentare și pete albe distribuite aleatoriu pe piele, despre care se presupune că provin din mutațiile somatice (RS).
Toate cele trei clase sunt descrise și înregistrate, dar numai ultima, RS, prezintă relevanță din punct de vedere genetic. Problemele pe care le ridică distincția între MDS și RS pot fi rezolvate prin examinarea probelor de blană prin microscopie cu fluorescență.
Se înregistrează anomaliile morfologice genetice macroscopice apărute la descendenți.
2. DATE
Datele sunt prezentate ca număr total al descendenților inventariați și numărul celor care au una sau mai multe pete produse prin mutații somatice. Datele din loturile tratate și loturile martor negativ se compară printr-o metodă corespunzătoare. De asemenea, datele sunt prezentate în raport cu seria de pui de la o fătare.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— liniile folosite la încrucișare;
— numărul femelelor gestante din loturile tratate și loturile martor;
— mărimea medie a seriei de pui din loturile tratate și loturile martor, la naștere și la înțărcare;
— dozele de substanță de testat;
— solventul utilizat;
— ziua gestației în care s-a efectuat tratamentul;
— calea de administrare;
— numărul total de descendenți examinați și numărul celor care prezintă WMVS, MDS și RS din loturile tratate și loturile martor;
— anomalii morfologice macroscopice;
— relația doză-răspuns la RS dacă este posibil;
— evaluarea statistică;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.25. TRANSLOCAȚII EREDITARE LA ȘOARECI
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚIE
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Testul translocației ereditare la șoareci decelează modificările cromozomiale structurale și numerice ale celulelor germinale de mamifere, apărute la descendenții din prima generație. Tipurile de modificări cromozomiale detectate sunt translocații reciproce și, dacă în experiment sunt incluși și descendenții femele din generația F1, pierderea cromozomului X. Purtătorii de translocații și femelele XO prezintă fertilitate redusă care este folosită la selecția descendenților F1 pentru efectuarea analizelor citogenetice. Sterilitatea completă este determinată de anumite tipuri de translocații (X-autozom și tipul c-t). Translocațiile se observă citogenetic în timpul celulele meiotice în diachineză-metafaza I la masculi, fie că sunt masculi F1, fie descendenți masculi ai femelelor F1. Femelele XO sunt identificate citogenetic prin prezența a doar 39 de cromozomi în mitozele măduvei osoase.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA TESTULUI
Pregătire
Substanțele chimice de testat se dizolvă în soluție izotonică salină. Dacă sunt insolubile în apă, se dizolvă sau se suspensionează într-un vehicul corespunzător. Se utilizează soluții proaspăt preparate ale compusului de testat. Vehiculul nu trebuie să interfereze cu compusul de testat și nu trebuie să producă efecte toxice.
Calea de administrare obișnuită este intubarea orală sau injectarea intraperitoneală. Se pot folosi și alte căi de administrare.
Pentru a facilita reproducerea și verificarea citologică, aceste experimente se fac pe șoareci. Nu este necesară utilizarea anumitor linii de șoareci. Cu toate acestea, mărimea medie a seriei de pui din linia respectivă trebuie să fie în medie mai mare de opt și să fie relativ constant.
Se folosesc animale mature din punct de vedere sexual.
Numărul de animale necesare depinde de frecvența apariției translocațiilor spontane și de rata minimă de inducție necesară pentru un rezultat pozitiv.
De obicei, testul se efectuează pe descendenții masculi F1. Trebuie testați cel puțin 500 de descendenți masculi F1 pe lot. Dacă experimentul include și descendenți femele F1, sunt necesari 300 de masculi și 300 de femele.
Este necesar să fie disponibile date martor adecvate obținute din martori simultani și din martori istorici. Atunci când sunt disponibile rezultate acceptabile de la martorul pozitiv din alte experimente desfășurate recent în același laborator, acestea pot fi folosite în locul unui martor pozitiv simultan.
Se testează o singură doză, de obicei doza maximă asociată cu producerea de efecte toxice minime, dar care nu produce efecte asupra comportamentului de reproducere sau asupra supraviețuirii. Pentru stabilirea unei relații doză/răspuns sunt necesare încă două doze mai mici. În cazul expunerii la substanțe chimice netoxice, este necesar să se administreze doza maximă posibilă.
Mod de operare
Există două scheme de tratament. Administrarea în doză unică este cel mai des utilizată; se poate recurge și la administrarea substanței de testat șapte zile pe săptămână timp de 35 de zile. Numărul de împerecheri după efectuarea tratamentului depinde de schema de tratament și trebuie să asigure prelevarea de celule germinale tratate în toate stadiile. La sfârșitul perioadei de împerechere, femelele sunt plasate în cuști individuale. Când gestantele fată, se înregistrează data, mărimea seriei de pui și sexul descendenților. Toți puii masculi sunt înțărcați, iar femelele pui sunt eliminate, cu excepția cazului în care sunt incluse și ele în experiment.
Se utilizează una din cele două metode posibile:
— testarea, prin analize citogenetice, a fertilității descendenței F1 și verificarea ulterioară a eventualilor purtători de translocații prin analiză citogenetică;
— analiza citogenetică a tuturor descendenților masculi F1 fără o selecție prealabilă prin testarea fertilității.
(a) Testarea fertilității
Fertilitatea redusă a unui descendent F1 poate fi stabilită prin observații asupra mărimii seriei de pui și/sau prin analizarea conținutului uterin la femelele gestante.
Este necesar să se stabilească criteriile de determinare a fertilității normale sau reduse la linia de șoareci folosită.
Observații asupra mărimii seriei de pui: Masculii F1 care urmează să fie testați sunt plasați în cuști individuale cu femele din același experiment sau din colonie. Cuștile se verifică zilnic începând cu a optsprezecea zi de la împerechere. La fătare se înregistrează mărimea seriei de pui și sexul descendenței F2, după care puii sunt eliminați. Dacă se testează descendența feminină F1, descendenții F2 proveniți din serii mici de pui sunt păstrați pentru testări suplimentare. Toate femelele purtătoare de translocații sunt verificate prin analiza citogenetică a unei translocații la oricare din descendenții lor masculi. Femelele XO se recunosc prin schimbarea raportului între sexe masculi/femele la descendenții lor, de la 1:1 la 1:2. Într-o metodă secvențială, animalele F1 normale nu fac obiectul unei alte verificări dacă prima serie de pui F2 atinge sau depășește o valoare normală predeterminată, în caz contrar observându-se o a doua sau o a treia serie de pui F2.
Animalele F1 care nu pot fi clasificate ca normale după observațiile efectuate pe cel mult trei serii de pui F2, sunt testate prin analiza conținutului uterin al femelelor gestante sau sunt supuse direct analizei citogenetice.
Analiza conținutului uterin: Reducerea mărimii seriei de pui în cazul purtătorilor de translocații se datorează morții embrionilor, astfel încât un număr mare de implanturi moarte reprezintă un indiciu al prezenței unei translocații la animalul testat. Fiecare mascul F1 care urmează să fie testat este împerecheat cu două-trei femele. Momentul concepției se stabilește prin examinarea zilnică, dimineața, în vederea decelării prezenței dopului vaginal. Femelele se sacrifică în a 14-16-a zi de gestație, înregistrându-se apoi implanturile vii sau moarte din uterul fiecăreia.
(b) Analiză citogenetică
Preparatele testiculare se obțin prin tehnica uscării la aer. Purtătorii de translocații se identifică prin prezența configurațiilor multivalente la diachineză-metafaza I la nivelul spermatociților primari. Prezența a cel puțin două celule cu asociații multivalente constituie dovada necesară că animalul testat este purtătorul unei translocații.
Dacă nu s-a produs nicio selecție prin analiza reproducerii, toți masculii F1 se examinează citogenetic. Se analizează microscopic cel puțin 25 de celule în faza de diachineză-metafaza I pentru fiecare mascul. Examinarea metafazei mitotice în spermatogonii sau în măduva osoasă este necesară la masculii F1 cu testicule mici și rupere meiotică înainte de diachineză sau la femele F1 suspecte de a fi XO. Prezența unui cromozom neobișnuit de lung și/sau scurt în fiecare a zecea celulă indică o translocație specială care induce sterilitatea masculului (tip c-t). Anumite translocații X-autozome care determină sterilitatea masculină pot fi identificate numai printr-o serie de analize ale benzilor de cromozomi mitotici. Prezența a 39 de cromozomi în toate cele 10 mitoze indică starea XO la o femelă.
2. DATE
Datele sunt prezentate sub formă de tabele.
Mărimea medie a seriei de pui și raportul numeric între sexe se înregistrează de la naștere până la înțărcare pentru fiecare perioadă de împerechere.
Pentru evaluarea fertilității animalelor F1, se prezintă mărimea medie a seriei de pui pentru toate împerecherile normale și mărimea fiecărei serii de pui proveniți din animale F1 purtătoare de translocații. Pentru examinarea conținutului uterin se specifică numărul mediu al implanturilor vii și moarte în împerecherile normale și numărul implanturilor vii și moarte pentru fiecare împerechere a purtătorilor de translocații F1.
Pentru analiza citogenetică a diachineză-metafazei I, se înregistrează numărul tipurilor de configurații multivalente și numărul total de celule pentru fiecare purtător de translocații.
Pentru fiecare exemplar F1 steril se raportează numărul total de împerecheri și durata perioadei de împerechere. Se fac analize citogenetice detaliate și se cântăresc testiculele.
Pentru femelele XO se specifică mărimea medie a seriei de pui, raportul numeric dintre sexe la descendența F2 și rezultatele analizei citogenetice.
În cazul în care posibilii purtători de translocații F1 sunt preselecționați în teste de fertilitate, tabelele trebuie să cuprindă informații despre numărul celor care sunt confirmați cu heterozigoți de translocație.
Se raportează, de asemenea, date referitoare la experimentele pe martorii pozitivi și negativi.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— linia de șoareci, vârsta animalelor, greutatea animalelor tratate;
— numărul animalelor parentale de fiecare sex din lotul tratat și din lotul martor;
— condițiile de testare, descrierea amănunțită a tratamentului, dozele, solvenții, schema de împerechere;
— numărul și sexul descendenților pentru fiecare femelă, numărul și sexul descendenților aleși pentru analiza de translocație;
— momentul și criteriile analizei de translocație;
— numărul și descrierea amănunțită a purtătorilor de translocații, inclusiv date privind reproducerea și conținutul uterin, după caz;
— metode citogenetice și detalii asupra analizei microscopice, preferabil cu imagini;
— evaluarea statistică;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.26. TESTUL DE TOXICITATE ORALĂ SUBCRONICĂ STUDIU DE 90 DE ZILE DE TOXICITATE ORALĂ CU DOZĂ REPETATĂ LA ROZĂTOARE
1. METODĂ
Această metodă de testare a toxicității orale subcronice reproduce Orientarea 408 (1998) a OCDE.
1.1. INTRODUCERE
La aprecierea și evaluarea caracteristicilor toxice ale unui produs chimic, determinarea toxicității orale subcronice folosind doze repetate se poate realiza după ce au fost obținute informațiile inițiale asupra toxicității din teste de toxicitate acută sau teste de toxicitate de 28 de zile cu doză repetată. Studiul de 90 de zile furnizează informații despre posibilele pericole pentru sănătate ce pot fi antrenate de expunerea repetată pe o perioadă îndelungată, care se extinde de la înțărcare până la vârsta adultă. Studiul furnizează informații asupra efectelor toxice majore, indicând organele-țintă și posibilitatea de acumulare, și poate furniza și o estimare a nivelului de expunere la risc la care nu se observă efecte adverse, care poate fi folosită în alegerea dozelor pentru studiile de toxicitate cronică și la stabilirea criteriilor de securitate în cazul expunerii la risc a oamenilor.
Această metodă de testare pune un accent suplimentar pe efectele neurologice și furnizează indicii despre efectele imunologice și de reproducere. Se subliniază, de asemenea, necesitatea observării clinice atente a animalelor, astfel încât să se obțină numărul maxim posibil de informații. Studiul ar trebui să aibă în vedere identificarea substanțelor care au potențialul de a produce efecte neurotoxice sau imunologice ori efecte asupra organelor de reproducere, ceea ce ar justifica efectuarea în continuare a unor studii mai aprofundate.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Doza: este cantitatea de substanță testată administrată. Doza este exprimată ca greutate (g, mg) sau ca greutatea substanței testate raportată la unitatea de greutate a animalului de laborator (de exemplu mg/kg) ori ca o concentrație constantă în alimentație (ppm).
Dozajul: este un termen general care cuprinde doza, frecvența acesteia și durata administrării.
DFEAO: este abrevierea pentru „doza fără efecte adverse observabile” (NOAEL: No Observable Adverse Effect Level) și reprezintă doza maximă la care nu s-au constatat stări adverse legate de tratament.
1.3. PRINCIPIUL METODEI DE TESTARE
Diferite doze din substanța testată se administrează zilnic, pe cale orală, câtorva grupuri de animale de laborator, nivelul dozei fiind același pentru un grup, timp de 90 de zile. În perioada administrării, animalele se țin sub observație atentă în scopul de a constata semnele de toxicitate. Animalele care mor sau care sunt sacrificate în timpul testului sunt autopsiate și la sfârșitul testului animalele supraviețuitoare sunt, de asemenea, sacrificate și autopsiate.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătirea animalelor
Trebuie folosite animale sănătoase, care au fost acomodate la condițiile de laborator timp de minimum 5 zile și nu au mai fost folosite în alte experiențe. Trebuie precizate specia, sușa, proveniența, sexul, greutatea și vârsta. Animalele se repartizează aleator în grupurile tratate și grupurile martor. Cuștile se amplasează astfel încât să se reducă la minimum posibilele efecte datorate modului lor de dispunere. Fiecărui animal i se atribuie un număr de identificare unic.
1.4.2. Pregătirea dozelor
Substanța testată se administrează prin introducerea în stomac cu ajutorul unei sonde sau prin alimente ori apa de băut. Metoda de administrare pe cale orală depinde de scopul studiului și de proprietățile fizico-chimice ale substanței testate.
Acolo unde este necesar, substanța testată se dizolvă sau se trece în suspensie într-un purtător adecvat. Se recomandă ca, acolo unde este posibil, să se ia mai întâi în considerare folosirea unei soluții/suspensii apoase, urmată de o soluție/emulsie în ulei (de exemplu ulei de porumb) și în cele din urmă de o soluție în alți purtători. Trebuie cunoscute caracteristicile de toxicitate ale purtătorilor alții decât apa. Se determină stabilitatea substanței testate în condițiile de administrare.
1.4.3. Condițiile de testare
1.4.3.1. Animalele de laborator
Specia preferată este șobolanul, deși pot fi folosite și alte specii de rozătoare, de exemplu șoarecele. Este recomandabil să se folosească animale adulte tinere, sănătoase, provenind din sușe de laborator obișnuite. Femelele trebuie să fie nulipare și să nu fie însărcinate. Administrarea începe cât mai curând posibil după înțărcare și în niciun caz mai târziu de vârsta de nouă săptămâni. La începutul studiului, diferențele de greutate între animalele folosite trebuie să fie minime și să nu depășească ± 20 % din greutatea medie a fiecărui sex. Atunci când studiul este efectuat în preliminariile unui studiu pe termen lung de toxicitate cronică, în ambele studii trebuie folosite animale din aceeași sușă și din aceeași sursă.
1.4.3.2. Numărul și sexul animalelor
La fiecare nivel al dozei se folosesc cel puțin 20 de animale (10 femele și 10 masculi). Dacă sunt planificate sacrificări pe parcurs, numărul trebuie suplimentat cu numărul de animale planificate pentru sacrificare înainte de sfârșitul studiului. Pe baza cunoștințelor existente despre produsul chimic sau un produs foarte asemănător, ar trebui să se ia în considerare includerea unui grup satelit suplimentar de 10 animale (5 de fiecare sex) în grupul martor și în grupul tratat cu doza cea mai puternică, pentru a observa, după tratament, reversibilitatea sau persistența oricărui efect toxic. Durata perioadei post-tratament se fixează în funcție de efectele observate.
1.4.3.3. Doze
Dozele folosite sunt la minimum trei niveluri și există un grup martor, în afara cazului în care se face un test la valori-limită (a se vedea punctul 1.4.3.4). Nivelul dozelor este stabilit în funcție de rezultatele studiilor cu doză repetată sau ale studiilor preliminare și iau în considerare orice date toxicologice și toxico-cinetice disponibile pentru substanța testată sau substanțe înrudite. Dacă nu există limitări datorate proprietăților fizico-chimice sau efectelor biologice ale substanței, este recomandabil să se aleagă doza maximă care induce efectul toxic, dar nu și moartea sau suferința severă. Se alege o serie descrescătoare de doze, în scopul de a demonstra legătura între răspuns și nivelul dozei, precum și nivelul dozei fără efecte adverse observabile (DFEAO), în cazul celei mai mici doze. În mod frecvent, se dovedește că la formarea seriei descrescătoare a dozelor este optimă progresia geometrică cu rația 2-4 și deseori adăugarea unui al patrulea grup de probă este preferabil folosirii unor rații foarte mari (de exemplu, mai mari de 6-10) între doze.
Grupul martor este un grup netratat sau tratat cu purtător, dacă se folosește un purtător la administrarea substanței testate. Cu excepția substanței testate, animalele din grupul martor trebuie tratate în mod identic cu acelea din grupurile de probă. Dacă se folosește un purtător, grupul martor primește purtătorul în cantitatea maximă folosită. Dacă substanța testată se administrează în alimente și provoacă reducerea apetitului, un grup martor hrănit în paralel se poate dovedi folositor pentru a determina dacă reducerea se datorează modificării caracteristicilor organoleptice ale alimentelor sau alterărilor toxicologice din organismul animalelor de laborator.
Trebuie luate în considerare următoarele caracteristici ale purtătorului și ale altor aditivi, după caz: efectele asupra absorbției, circulației, metabolizării sau retenției substanței testate; efectele asupra proprietăților chimice ale substanței testate care pot să altereze caracteristicile sale toxice și efectele asupra consumului de hrană sau apă ori asupra stării de nutriție a animalelor.
1.4.3.4. Testul-limită
Dacă testul efectuat la o doză unică, echivalentă cu cel puțin 1 000 mg/kg greutate corporală/zi, folosind metodologia descrisă pentru acest studiu, nu produce efecte adverse observabile și toxicitatea nu este de așteptat în baza datelor existente pentru substanțele înrudite structural, se consideră că nu este necesar un studiu integral cu trei doze de niveluri diferite. Testul la valori-limită este aplicabil cu excepția cazului în care expunerea oamenilor arată că este necesară folosirea unei doze mai mari.
1.5. MOD DE LUCRU
1.5.1. Administrarea dozelor
Animalelor li se administrează substanța testată zilnic, șapte zile în fiecare săptămână, pentru o perioadă de 90 de zile. Orice alt regim de dozare, de exemplu cinci zile pe săptămână, trebuie justificat. Când substanța testată se administrează cu ajutorul sondei introduse în stomac, se administrează toată doza o dată fiecărui animal, folosind o sondă gastrică sau o canulă de intubare adecvată. Volumul maxim de lichid care poate fi administrat o dată depinde de mărimea animalului de laborator. Volumul nu trebuie să depășească 1 ml/100 g greutate corporală, cu excepția soluțiilor apoase, când se pot folosi 2 ml/100 g greutate corporală. Cu excepția substanțelor iritante sau corozive, care provoacă în mod obișnuit efecte exacerbate la concentrații mai mari, este recomandabil ca variațiile în volumul probei să fie reduse la minimum, ajustându-se concentrația astfel încât să se asigure un volum constant, indiferent de nivelul dozei.
Pentru substanțele administrate în alimente sau în apa de băut, este important să se ia măsuri astfel încât cantitățile de substanță testată implicate să nu interfereze cu nutriția normală sau cu echilibrul hidric. Când substanța testată este administrată în alimente, se folosește fie o concentrație constantă în alimente (ppm), fie o doză de nivel constant în raport cu greutatea animalului; alternativa folosită trebuie specificată. În cazul folosirii sondei, doza trebuie administrată aproximativ în același moment al zilei și ajustată după necesități, pentru a rămâne constantă în raport cu greutatea corporală a animalului. Atunci când un studiu de 90 de zile este folosit în preliminariile unui studiu pe termen lung de toxicitate cronică, se recomandă folosirea unei alimentații asemănătoare în ambele studii.
1.5.2. Observațiile
Perioada de observație se recomandă să fie de minimum 90 de zile. Animalele din grupul satelit programat pentru observație ulterioară trebuie să nu primească tratament o perioadă adecvată, pentru a detecta persistența sau reversibilitatea efectelor toxice.
Se recomandă ca observațiile clinice generale să fie făcute cel puțin o dată pe zi, de preferat la aceeași oră (aceleași ore) în fiecare zi, luând în considerare perioada de vârf a efectelor anticipate după administrare. Se recomandă înregistrarea stării clinice a animalelor. Cel puțin de două ori pe zi, de regulă la începutul și la sfârșitul fiecărei zile, toate animalele sunt examinate pentru constatarea simptomelor de morbiditate și mortalitate.
Se recomandă efectuarea de observații clinice detaliate asupra tuturor animalelor cel puțin o dată înainte de prima expunere (pentru a putea face comparații în cazul aceluiași individ) și apoi o dată pe săptămână. Aceste examene se recomandă să fie făcute în afara cuștii, de preferință într-o incintă standardizată și la aceeași oră de fiecare dată. Ele se consemnează cu atenție, de preferat folosind un sistem de notare definit explicit de laboratorul de testare. Trebuie acționat astfel încât variația condițiilor de observare să fie minimă. Simptomele urmărite cuprind, fără a se limita la ele, schimbări ale pielii, blănii, ochilor, mucoaselor, frecvența secrețiilor și a excrețiilor, ca și activitatea reflexă (de exemplu: lăcrimarea, erecția piloasă, modificarea pupilelor, respirația anormală). Este recomandabil să fie observate, de asemenea, schimbările în mers, ținută și reacție la manipulare, precum și prezența mișcărilor clonice și tonice, a stereotipiilor (de exemplu îngrijirea corporală excesivă, mersul circular repetat) sau a comportamentelor bizare (de exemplu automutilarea, mersul înapoi) (1).
Examinarea oftalmologică, cu un oftalmoscop sau un aparat echivalent adecvat, de preferat a tuturor animalelor dar cel puțin a animalelor din grupul cu doza cea mai mare și din grupul martor, trebuie efectuată înainte de administrarea substanței testate și la încheierea studiului. Dacă se constată modificări ale ochilor, toate animalele trebuie examinate.
Spre sfârșitul perioadei de expunere și în orice caz nu înainte de săptămâna 11, se evaluează reactivitatea senzorială la diferite tipuri de stimuli (1) (de exemplu stimuli auditivi, vizuali, proprioceptivi) (2) (3) (4), se evaluează forța de apucare (5) și activitatea motorie (6). Detalii suplimentare referitoare la metodele utilizabile figurează în referințele bibliografice respective. Se pot folosi și metode diferite de cele menționate.
Observațiile funcționale pot fi omise spre sfârșitul studiului atunci când sunt disponibile date despre observațiile funcționale din alte studii și observațiile clinice zilnice nu au evidențiat deficite funcționale.
În mod excepțional, observațiile funcționale pot fi, de asemenea, omise pentru grupurile care, pe de altă parte, prezintă simptome de toxicitate în asemenea măsură încât ar interfera semnificativ cu desfășurarea testului funcțional.
1.5.2.1. Greutatea corporală și consumul de hrană/apă
Toate animalele trebuie cântărite cel puțin o dată pe săptămână. Măsurarea consumului de hrană se face cel puțin săptămânal. Dacă substanța testată se administrează în apa de băut, se măsoară și apa de băut cel puțin săptămânal. Este recomandabil să se măsoare consumul de apă și în studiile cu substanță testată administrată în alimente sau prin sondă, atunci când băutul apei poate suferi modificări.
1.5.2.2. Hematologia și biochimia clinică
Se prelevează probe de sânge din puncte determinate și se conservă, dacă este cazul, în condiții adecvate. La sfârșitul perioadei de testare, probele se colectează imediat înainte de sacrificarea animalelor sau ca parte a acestei proceduri.
La sfârșitul perioadei de testare și atunci când se colectează probe de sânge pe parcurs, se procedează la următoarele examene hematologice: hematocrit, concentrație de hemoglobină, numărătoarea eritrocitelor și a leucocitelor, formula leucocitară, numărătoarea plachetelor sangvine, măsurarea timpului de coagulare.
Determinările de biochimie clinică în scopul determinării efectelor toxice majore în țesuturi și, în special, efectele asupra rinichiului și a ficatului sunt practicate pe probe de sânge obținute de la fiecare animal imediat înainte de sacrificare sau ca parte a acestei proceduri (dar nu de la cele găsite muribunde sau care au fost sacrificate pe parcurs). Ca și la investigațiile hematologice, se pot recolta pe parcurs probe pentru analize de biochimie chimică. Se recomandă ca animalele să nu primească hrană în timpul nopții dinainte de recoltare ( 17 ). Analizele de plasmă sau ser cuprind sodiu, potasiu, glucoză, colesterol total, uree, acid uric în sânge, creatinină, proteine și albumine totale și mai mult de două enzime indicând efectele hepatocelulare (ca alaninaminotransferaza, aspartat aminotransferaza, fosfataza alcalină, gamaglutamiltranspeptidaza și sorbitol dehidrogenaza). Pot fi incluse și măsurători ale altor enzime (hepatice sau de altă origine) și ale acizilor biliari, care pot furniza informații utile în anumite situații.
Opțional, pot fi efectuate următoarele analize de urină în ultima săptămână a studiului, folosind probe de urină prelevate după un anumit orar: aspect, volum, osmolaritate sau densitate, pH, proteinurie, glucozurie, hematurie.
În plus, trebuie avute în vedere investigații asupra constantelor plasmatice ale leziunilor generale ale țesuturilor. Dacă proprietățile cunoscute ale substanței testate pot sau se apreciază că pot să afecteze curbele metabolice conexe, trebuie efectuate și alte analize, cum sunt: calciu, fosfor, trigliceride à jeun, hormoni specifici, methemoglobină și colinesterază. Acestea trebuie identificate pentru substanțele chimice din anumite clase sau de la caz la caz.
În general, este nevoie de o abordare flexibilă, în funcție de specii și de efectele constatate și scontate ale substanței în cauză.
Dacă datele istorice de referință sunt insuficiente, este cazul să se ia în considerare necesitatea de a determina variabilele hematologice și de biochimie clinică înainte de începerea administrării; în general, nu se recomandă ca aceste date să se obțină înaintea tratamentului (7).
1.5.2.3. Autopsia
Toate animalele cuprinse în studiu sunt supuse unei autopsii complete și detaliate, care cuprinde examinarea atentă a suprafeței externe a corpului, a tuturor orificiilor, a cavităților craniană, toracică și abdominală, precum și a conținutului acestora. Ficatul, rinichii, glandele suprarenale, testiculele, epididimul, uterul, ovarele, timusul, splina, creierul și inima fiecărui animal (cu excepția celor găsite muribunde și a celor sacrificate pe parcurs) sunt curățate de țesuturile aderente, după caz, și cântărite proaspete cât mai repede după disecție, pentru a evita deshidratarea.
Țesuturile următoare se conservă în mediul de fixare cel mai adecvat atât pentru tipul de țesut, cât și pentru examenul histopatologic prevăzut: toate organele prezentând leziuni macroscopice, creierul (regiunile reprezentative, cuprinzând encefalul, cerebelul și trunchiul cerebral), măduva spinării (din trei segmente: cervical, medio-toracic și lombar), hipofiza, glanda tiroidă, glandele paratiroide, timusul, esofagul, glandele salivare, stomacul, intestinul subțire și intestinul gros (inclusiv plăcile lui Peyer), ficatul, pancreasul, rinichii, glandele suprarenale, splina, inima, traheea și plămânii (conservați prin exces de fixativ și apoi imersie) aorta, gonadele, uterul, organele genitale anexe, glanda mamară feminină, prostata, vezica urinară, vezica biliară (șoarece), ganglionii limfatici (de preferință un ganglion limfatic din zona afectată de calea de administrare și un alt ganglion limfatic din altă zonă, aflată la distanță, pentru a detecta eventualele efecte sistemice), nervii periferici (sciatic sau tibial), de preferat din apropierea mușchiului, o probă de măduvă osoasă (și o puncție aspirativă de măduvă osoasă examinată pe loc), piele și ochi (dacă s-au constat modificări la examenele oftalmologice). Observațiile clinice și cele macroscopice pot să conducă la necesitatea de a examina țesuturi suplimentare. Se conservă și alte organe considerate probabile organe-țintă pentru substanța testată, având în vedere proprietățile sale cunoscute.
1.5.2.4. Histopatologia
Se efectuează un examen histopatologic complet al țesuturilor și organelor tuturor animalelor aparținând grupului martor și grupului tratat cu doza cea mai mare. Aceste examene trebuie extinse la animalele tratate cu alte doze, dacă se constată modificări care au legătură cu tratamentul la grupul tratat cu doza cea mai mare.
1.5.2.5. Se examinează toate leziunile macroscopice
Atunci când se folosește un grup satelit, se efectuează un examen histopatologic al țesuturilor și organelor la care au fost identificate efecte în grupurile tratate.
2. DATE ȘI RAPORT
2.1. DATE
Datele se prezintă individual. În plus, toate datele trebuie rezumate în formă tabelară, arătându-se pentru fiecare grup de experiență, numărul de animale la începutul testului, numărul de animale găsite moarte în timpul testului sau sacrificate din motive umanitare și momentul morții sau al sacrificării, numărul de animale prezentând simptome de toxicitate, o descriere a simptomelor de toxicitate, inclusiv momentul apariției acestora, durata și severitatea tuturor efectelor toxice, numărul animalelor prezentând leziuni, tipul leziunilor și procentul animalelor prezentând fiecare tip de leziune.
Dacă este cazul, datele numerice se evaluează printr-o metodă statistică adecvată și general acceptată. Metodele statistice și datele care urmează să fie analizate trebuie să fie selecționate în etapa de redactare a protocolului de testare.
2.2. RAPORTUL DE TESTARE
Raportul de testare cuprinde următoarele informații:
2.2.1. Substanța testată:
— natura fizică, puritatea și proprietățile fizico-chimice;
— datele de identificare chimică;
— purtătorul (dacă este cazul); justificarea alegerii purtătorului dacă este altul decât apa.
2.2.2. Animalele de laborator:
— specia și sușa folosite;
— numărul, vârsta și sexul animalelor;
— sursa, condițiile de adăpost, regimul alimentar etc.;
— greutatea individuală a animalelor la începutul testului.
2.2.3. Condițiile de testare:
— motivația alegerii dozelor;
— detalii privind preparatul hrană/rețeta substanței testate, concentrația realizată, stabilitatea și omogenitatea preparatului;
— detalii privind administrarea substanței testate;
— dozele reale (mg/kg greutate corporală/zi) și factorul de conversie a substanței testate din concentrația în hrană sau apa de băut (ppm) în doza reală, dacă este cazul;
— detalii privind calitatea hranei și a apei.
2.2.4. Rezultatele:
— greutatea corporală și modificările în greutatea corporală;
— consumul de hrană și apă, dacă este cazul;
— rezultate privind răspunsul toxic, pe sexe și nivelul dozelor, inclusiv simptomele de toxicitate;
— natura, severitatea și durata efectelor observate clinic (reversibile sau nu);
— rezultatele examenului oftalmologic;
— activitatea senzorială, forța de apucare, aprecierea activității motorii (dacă sunt disponibile);
— valorile hematologice și valorile de referință corespunzătoare;
— valorile de biochimie clinică și valorile de referință corespunzătoare;
— greutatea corporală la moartea animalului, greutățile organelor interne, raporturile dintre greutatea organului intern și greutatea corporală;
— constatările de la autopsie;
— o descriere detaliată a tuturor observațiilor histopatologice;
— date privind absorbția, dacă sunt disponibile;
— prelucrarea statistică a rezultatelor, dacă este cazul.
Discutarea rezultatelor.
Concluzii.
3. REFERINȚE BIBLIOGRAFICE
1. IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60.
2. Tupper, D. E., Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, pp. 999-1003.
3. Gad, S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, pp. 691-704.
4. Moser, V. C., Mc Daniel, K. M., Phillips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, pp. 267-283.
5. Meyer O. A., Tilson H. A., Byrd W. C., Riley M. T. (1979). A Method for the Routine Assesment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, pp. 233-236.
6. Crofton K. M., Howard J. L., Moser V. C., Gill M. W., Reiter L. W., Tilson H. A., MacPhail R. C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, pp. 599-609.
7. Weingand K., Brown G., Hall R. et al. (1996). „Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies”, Fundam. & Appl. Toxicol., 29, pp. 198-201.
B.27. TESTUL DE TOXICITATE ORALĂ SUBCRONICĂ STUDIU DE 90 DE ZILE DE TOXICITATE ORALĂ CU DOZĂ REPETATĂ LA NEROZĂTOARE
1. METODĂ
Această metodă de testare a toxicității orale subcronice reproduce Orientarea 409 (1998) a OCDE.
1.1. INTRODUCERE
La aprecierea și evaluarea caracteristicilor toxice ale unui produs chimic, determinarea toxicității orale subcronice folosind doze repetate se poate realiza după ce au fost obținute informațiile inițiale asupra toxicității din teste de toxicitate acută sau teste de toxicitate de 28 de zile cu doză repetată. Studiul de 90 de zile furnizează informații despre posibilele pericole pentru sănătate care pot fi antrenate de expunerea repetată la risc pe o perioadă îndelungată, care se extinde de la înțărcare până la vârsta adultă. Studiul furnizează informații asupra efectelor toxice majore, indicând organele-țintă și posibilitatea de acumulare și poate furniza și o estimare a nivelului de expunere la care nu se observă efecte adverse, care poate fi folosită în alegerea dozelor pentru studiile de toxicitate cronică și la stabilirea criteriilor de securitate în cazul expunerii la risc a oamenilor.
Metoda are în vedere identificarea la speciile nerozătoare a efectelor adverse ale expunerii chimice și se folosește doar:
— în cazul în care efectele observate în alte studii indică necesitatea unei clarificări/caracterizări cu ajutorul unei a doua specii, nerozătoare; sau
— în cazul în care studiile toxico-cinetice indică faptul că folosirea unei anumite specii nerozătoare reprezintă cea mai relevantă alegere a animalului de laborator; sau
— în cazul în care alte anumite motive justifică folosirea unei specii nerozătoare.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Doză: este cantitatea de substanță testată administrată. Doza este exprimată ca greutate (g, mg) sau ca greutatea substanței testate pe unitatea de greutate a animalului de laborator (de exemplu mg/kg) sau în concentrații constante în alimentație (ppm).
Dozaj: este un termen general care cuprinde doza, frecvența acesteia și durata administrării.
DFEAO: este abrevierea pentru „doza fără efecte adverse observabile” (NOAEL: No Observable Adverse Effect Level) și reprezintă doza maximă la care nu s-au constatat stări adverse legate de tratament.
1.3. PRINCIPIUL METODEI DE TESTARE
Diferite doze din substanța testată se administrează zilnic, pe cale orală, câtorva grupuri de animale de laborator, nivelul dozei fiind același pentru un grup, timp de 90 de zile. În perioada administrării, animalele se țin sub observație atentă în scopul de a constata semnele de toxicitate. Animalele care mor sau care sunt sacrificate în timpul testului sunt autopsiate și la sfârșitul testului animalele supraviețuitoare sunt, de asemenea, sacrificate și autopsiate.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Alegerea speciei de animale
Specia nerozătoare folosită în mod obișnuit este câinele, care trebuie să fie de rasă definită; frecvent este folosit basetul. Pot fi folosite și alte specii, de exemplu porcul sau porcul pitic. Nu se recomandă primatele, iar folosirea lor trebuie justificată. Trebuie folosite animale tinere și sănătoase, iar în cazul câinelui administrarea trebuie să înceapă de preferință la vârsta de 4-6 luni și nu mai târziu de vârsta de nouă luni. Atunci când studiul este efectuat în preliminariile unui studiu pe termen lung de toxicitate cronică, în ambele studii trebuie folosite animale din aceeași specie/rasă.
1.4.2. Pregătirea animalelor
Trebuie folosite animale tinere și sănătoase, care au fost acomodate la condițiile de laborator și care nu au mai fost folosite în alte experiențe. Durata aclimatizării depinde de specia aleasă și de proveniența sa. Se recomandă cel puțin cinci zile pentru câini sau pentru porci hrăniți anume în acest scop în colonia laboratorului și cel puțin două săptămâni pentru aceleași animale din surse externe. Trebuie precizate specia, sușa, proveniența, sexul, greutatea și vârsta. Animalele se repartizează aleator în grupurile tratate și grupurile martor. Cuștile se amplasează astfel încât să se reducă la minimum posibilele efecte datorate modului lor de dispunere. Fiecărui animal i se atribuie un număr de identificare unic.
1.4.3. Pregătirea dozelor
Substanța testată se administrează în alimente sau în apa de băut ori prin introducerea în stomac cu ajutorul unei sonde sau în capsule. Metoda de administrare pe cale orală depinde de scopul studiului și de proprietățile fizico-chimice ale substanței testate.
Acolo unde este necesar, substanța testată se dizolvă sau se trece în suspensie într-un purtător adecvat. Se recomandă ca, acolo unde este posibil, să se ia mai întâi în considerare folosirea unei soluții/suspensii apoase, urmată de o soluție/emulsie în ulei (de exemplu ulei de porumb) și în cele din urmă de o soluție în alți purtători. Trebuie cunoscute caracteristicile de toxicitate ale purtătorilor, alții decât apa. Trebuie determinată stabilitatea substanței testate în condițiile de administrare.
1.5. MOD DE LUCRU
1.5.1. Numărul și sexul animalelor
La fiecare nivel al dozei se folosesc cel puțin opt animale (patru femele și patru masculi). Dacă sunt planificate sacrificări pe parcurs, numărul trebuie suplimentat cu numărul de animale planificate să fie sacrificate înainte de sfârșitul testului. Numărul animalelor la încheierea studiului trebuie să fie adecvat pentru ca evaluarea efectelor toxice să aibă semnificație. Pe baza cunoștințelor existente despre produsul chimic sau un produs foarte asemănător, ar trebui să se ia în considerare includerea unui grup satelit suplimentar de opt animale (patru de fiecare sex) în grupul martor și în grupul tratat cu doza cea mai puternică, pentru a observa, după tratament, reversibilitatea sau persistența oricărui efect toxic. Durata perioadei post-tratament se fixează în funcție de efectele observate.
1.5.2. Dozajul
Dozele folosite sunt la minimum trei niveluri și există un grup martor, în afara cazului în care se face un test la valori-limită (a se vedea 1.5.3). Nivelul dozelor se stabilește în funcție de rezultatele studiilor cu doză repetată sau ale studiilor preliminare și ia în considerare orice date toxicologice și toxico-cinetice disponibile pentru substanța testată sau substanțe înrudite. Dacă nu există limitări datorate proprietăților fizico-chimice sau efectelor biologice ale substanței, este recomandabil să se aleagă doza maximă care induce efectul toxic, dar nu și moartea sau suferința severă. Se alege o serie descrescătoare de doze, în scopul de a demonstra legătura între răspuns și nivelul dozei precum și nivelul dozei fără efecte adverse observabile (DFEAO), în cazul celei mai mici doze. În mod frecvent, se dovedește că, la formarea seriei descrescătoare a dozelor, este optimă progresia geometrică cu rația 2-4 și deseori adăugarea unui al patrulea grup de testare este preferabil folosirii unor rații foarte mari (de exemplu, mai mari de 6-10) între doze.
Grupul martor este un grup netratat sau tratat cu purtătorul, dacă se folosește un purtător la administrarea substanței testate. Cu excepția substanței testate, animalele din grupul martor trebuie tratate în mod identic cu acelea din grupurile testate. Dacă se folosește un purtător, grupul martor primește purtătorul în cantitatea maximă folosită. Dacă substanța testată se administrează în alimente și provoacă reducerea apetitului, un grup martor hrănit în paralel se poate dovedi folositor pentru a determina dacă reducerea de datorează modificării caracteristicilor organoleptice ale alimentelor sau alterărilor toxicologice din organismul animalelor de laborator.
Trebuie luate în considerare următoarele caracteristici ale purtătorului și ale altor aditivi, după caz: efectele asupra absorbției, circulației, metabolizării sau retenției substanței testate; efectele asupra proprietăților chimice ale substanței testate care pot să altereze caracteristicile sale toxice; și efectele asupra consumului de hrană sau apă sau asupra stării de nutriție a animalelor.
1.5.3. Testul la valori-limită
Dacă testul efectuat la o doză unică, echivalentă cu cel puțin 1 000 mg/kg greutate corporală/zi, folosind metodele de testare descrise pentru acest studiu, nu produce efecte adverse observabile și dacă toxicitatea nu este de așteptat în baza datelor existente pentru substanțele înrudite structural, se consideră că nu este necesar un studiu integral cu trei doze de niveluri diferite. Testul la valori-limită este aplicabil cu excepția cazului în care expunerea oamenilor arată că este necesară folosirea unei doze mai mari.
1.5.4. Administrarea dozelor
Animalelor li se administrează substanța testată zilnic, șapte zile în fiecare săptămână, pentru o perioadă de 90 de zile. Orice alt regim de dozare, de exemplu cinci zile pe săptămână, trebuie justificat. Când substanța testată se administrează cu ajutorul sondei introduse în stomac, se administrează toată doza o dată fiecărui animal, folosind o sondă gastrică sau o canulă de intubare adecvată. Volumul maxim de lichid care poate fi administrat o dată depinde de mărimea animalului de laborator. În mod normal, volumul trebuie menținut cât mai scăzut posibil. Cu excepția substanțelor iritante sau corozive, care provoacă în mod obișnuit efecte exacerbate la concentrații mai mari, este recomandabil ca variațiile în volumul probei să fie reduse la minimum, ajustându-se concentrația astfel încât să asigure un volum constant, indiferent de nivelul dozei.
Pentru substanțele administrate în alimente sau în apa de băut, este important să se ia măsuri astfel încât cantitățile de substanță testată implicate să nu interfereze cu nutriția normală sau cu echilibrul hidric. Când substanța testată este administrată în alimente se poate folosi fie o concentrație constantă în alimente (ppm), fie o doză de nivel constant în raport cu greutatea animalului; alternativa folosită trebuie specificată. În cazul administrării prin sondă sau în capsulă, doza trebuie administrată aproximativ în același moment al zilei și ajustată după necesități, pentru a rămâne constantă în raport cu greutatea corporală a animalului. Atunci când un studiu de 90 de zile este folosit în preliminariile unui studiu pe termen lung de toxicitate cronică, se recomandă folosirea unei alimentații asemănătoare în ambele studii.
1.5.5. Observațiile
Perioada de observație se recomandă să fie de minimum 90 de zile. Animalele din grupul satelit programat pentru observații ulterioare trebuie să nu primească tratament o perioadă adecvată, pentru a detecta persistența sau reversibilitatea efectelor toxice.
Se recomandă ca observațiile clinice generale să fie făcute cel puțin o dată pe zi, de preferat la aceeași oră (aceleași ore) în fiecare zi, luând în considerare perioada de vârf a efectelor anticipate după administrare. Se recomandă înregistrarea stării clinice a animalelor. Cel puțin de două ori pe zi, de regulă la începutul și la sfârșitul fiecărei zile, toate animalele sunt examinate pentru constatarea simptomelor de morbiditate și mortalitate.
Se recomandă efectuarea de observații clinice detaliate asupra tuturor animalelor cel puțin o dată înainte de prima expunere (pentru a putea face comparații în cazul aceluiași individ) și apoi o dată pe săptămână. Aceste examene se recomandă să fie făcute, dacă e posibil, în afara cuștii, de preferință într-o incintă standardizată și la aceeași oră de fiecare dată. Trebuie acționat astfel încât variația condițiilor de observare să fie minimă. Simptomele de toxicitate trebuie să fie consemnate cu atenție, incluzând ora apariției, gradul și durata acestora. Observațiile cuprind, fără a se limita la ele, schimbări ale pielii, blănii, ochilor, mucoaselor, frecvența secrețiilor și a excrețiilor, ca și activitatea reflexă (de exemplu: lăcrimarea, erecția piloasă, modificarea pupilelor, respirația anormală). Este recomandabil să fie observate, de asemenea, schimbările în mers, ținută și reacția la manipulare, precum și prezența mișcărilor clonice și tonice, a stereotipiilor (de exemplu, îngrijirea corporală excesivă, mersul circular repetat) sau a comportamentelor bizare.
Examinarea oftalmologică, cu un oftalmoscop sau un aparat echivalent adecvat, de preferat a tuturor animalelor și cel puțin a animalelor din grupul cu doza cea mai mare și din grupul martor, trebuie efectuată înainte de administrarea substanței testate și la încheierea studiului. Dacă se constată modificări ale ochilor legate de tratament, toate animalele trebuie examinate.
1.5.5.1. Greutatea corporală și consumul de hrană/apă
Toate animalele trebuie cântărite cel puțin o dată pe săptămână. Măsurarea consumului de hrană se face cel puțin săptămânal. Dacă substanța testată se administrează în apa de băut, se măsoară și apa de băut cel puțin săptămânal. Este recomandabil să se măsoare consumul de apă și în studiile cu substanța testată administrată în alimente sau prin sondă, atunci când băutul apei poate suferi modificări.
1.5.5.2. Hematologia și biochimia clinică
Se prelevează probe de sânge din puncte determinate și se conservă, dacă este cazul, în condiții adecvate. La încheierea testului, probele se colectează imediat înainte de sacrificarea animalelor sau ca parte a acestei proceduri.
Se procedează la următoarele examene hematologice: hematocrit, concentrație de hemoglobină, numărătoarea eritrocitelor și a leucocitelor, formula leucocitară, numărătoarea plachetelor sangvine și o măsurare a potențialului de coagulare, cum sunt timpul de coagulare, timpul de protrombină sau de tromboplastină, la începutul studiului și apoi la intervale lunare sau la jumătatea perioadei de testare și, în cele din urmă, la încheierea testului.
Determinările de biochimie clinică în scopul determinării efectelor toxice majore în țesuturi și, în special, efectele asupra rinichiului și a ficatului sunt practicate pe probe de sânge obținute de la toate animalele la începutul studiului, la intervale lunare sau la jumătatea perioadei de testare și la încheierea testului. Domeniile de analiză care trebuie luate în considerare sunt balanța electrolitică, metabolismul carbohidraților și funcțiile hepatică și renală. Alegerea analizelor specifice este influențată de observațiile asupra modului de acțiune a substanței testate. Se recomandă ca animalele să nu primească hrană pentru o perioadă adecvată speciei înainte de prelevarea probei de sânge. Analizele recomandabile cuprind măsurarea următoarelor: calciu, fosfor, clor, sodiu, potasiu, glucoză à jeun, alaninaminotransferază, aspartat aminotransferază, ornitin decarboxilază, gamaglutamiltranspeptidază, acid uric, albumină, creatinină sangvină, bilirubină totală și proteine serice totale.
Analizele de urină trebuie efectuate cel puțin la început, apoi la jumătatea perioadei și la încheierea testului, folosind probe de urină prelevate după un anumit orar. Analizele cuprind: aspect, volum, osmolaritate sau densitate, pH, proteinurie, glucozurie, hematurie. Se pot folosi și alți parametri dacă este necesar să se extindă investigarea efectului (efectelor) observat(e).
În plus, trebuie avute în vedere investigații asupra constantelor plasmatice ale leziunilor generale ale țesuturilor. Alte analize care se pot dovedi necesare pentru o evaluare toxicologică adecvată includ: analiza lipidelor, a hormonilor, echilibrul acido-bazic, methemoglobina și inhibarea colinesterazei. Pot fi folosite analize de biochimie clinică suplimentare, dacă este necesar să se extindă investigarea efectelor observate. Acestea trebuie identificate pentru substanțele din anumite clase sau de la caz la caz.
În general, este nevoie de o abordare flexibilă, în funcție de specii și de efectele constatate și scontate ale substanței în cauză.
1.5.5.3. Autopsia
Toate animalele cuprinse în studiu sunt supuse unei autopsii complete și detaliate, care cuprinde examinarea atentă a suprafeței externe a corpului, a tuturor orificiilor, a cavităților craniană, toracică și abdominală, precum și a conținutului acestora. Ficatul, rinichii, glandele suprarenale, testiculele, epididimul, ovarele, uterul, glanda tiroidă (cu glandele paratiroide) timusul, splina, creierul și inima fiecărui animal (cu excepția celor găsite muribunde și a celor sacrificate pe parcurs) sunt curățate de țesuturile aderente, după caz, și cântărite proaspete cât mai repede după disecție, pentru a evita deshidratarea.
Țesuturile următoare trebuie conservate în mediul de fixare cel mai adecvat atât pentru tipul de țesut, cât și pentru examenul histopatologic prevăzut: toate organele prezentând leziuni macroscopice, creierul (regiunile reprezentative, cuprinzând encefalul, cerebelul și trunchiul cerebral), măduva spinării (din trei segmente: cervical, medio-toracic și lombar), hipofiza, ochii, glanda tiroidă, glandele paratiroide, timusul, esofagul, glandele salivare, stomacul, intestinul subțire și intestinul gros (inclusiv plăcile lui Peyer), ficatul, vezica biliară, pancreasul, rinichii, glandele suprarenale, splina, inima, traheea și plămânii, aorta, gonadele, uterul, organele genitale anexe, glanda mamară feminină, prostata, vezica urinară, ganglionii limfatici (de preferință un ganglion limfatic din zona afectată de calea de administrare și un alt ganglion limfatic din altă zonă, aflată la distanță, pentru a detecta eventualele efecte sistemice), nervii periferici (sciatic sau tibial), de preferat din apropierea mușchiului, o probă de măduvă osoasă (și o puncție aspirativă de măduvă osoasă examinată pe loc), piele. Observațiile clinice și cele macroscopice pot să conducă la necesitatea de a examina țesuturi suplimentare. Se conservă și alte organe considerate probabile organe-țintă pentru substanța testată, având în vedere proprietățile sale cunoscute.
1.5.5.4. Histopatologia
Se efectuează un examen histopatologic complet al țesuturilor și organelor conservate ale tuturor animalelor aparținând grupului martor și grupului tratat cu doza cea mai mare. Aceste examene trebuie extinse la animalele tratate cu alte doze, dacă se constată modificări care au legătură cu tratamentul la grupul tratat cu doza cea mai mare.
Se examinează toate leziunile macroscopice.
Atunci când se folosește un grup satelit, se efectuează un examen histopatologic al țesuturilor și organelor la care au fost identificate efecte în grupurile tratate.
2. DATE ȘI RAPORT
2.1. DATE
Datele se prezintă individual. În plus, toate datele trebuie rezumate în formă tabelară, arătându-se pentru fiecare grup de experiență, numărul de animale la începutul testului, numărul de animale găsite moarte în timpul testului sau sacrificate din motive umanitare și momentul morții sau al sacrificării, numărul de animale prezentând simptome de toxicitate, o descriere a simptomelor de toxicitate, în special momentul apariției acestora, durata și severitatea tuturor efectelor toxice, numărul animalelor prezentând leziuni, tipul leziunilor și procentul animalelor prezentând fiecare tip de leziune.
Dacă este cazul, datele numerice se evaluează printr-o metodă statistică adecvată și general acceptată. Metodele statistice și datele care urmează să fie analizate trebuie să fie selecționate în etapa de redactare a protocolului de testare.
2.2. RAPORTUL DE TESTARE
Raportul de testare cuprinde următoarele informații:
2.2.1. Substanța testată:
— natura fizică, puritatea și proprietățile fizico-chimice;
— datele de identificare chimică;
— purtătorul (dacă este cazul); justificarea alegerii purtătorului dacă este altul decât apa.
2.2.2. Animalele de laborator:
— specia și sușa folosite;
— numărul, vârsta și sexul animalelor;
— sursa, condițiile de adăpost, regimul alimentar etc.;
— greutatea individuală a animalelor la începutul testului.
2.2.3. Condițiile de testare:
— motivația alegerii dozelor;
— detalii privind preparatul hrană/rețeta substanței testate, concentrația realizată, stabilitatea și omogenitatea preparatului;
— detalii privind administrarea substanței testate;
— dozele reale (mg/kg greutate corporală/zi) și factorul de conversie a substanței testate din concentrație în hrană sau apa de băut (ppm) în doza reală, dacă este cazul;
— detalii privind calitatea hranei și a apei.
2.2.4. Rezultatele:
— greutatea corporală și modificările în greutatea corporală;
— consumul de hrană și apă, dacă este cazul;
— rezultate privind reacția toxică, pe sexe și nivelul dozelor, inclusiv simptomele de toxicitate;
— natura, severitatea și durata efectelor observate clinic (reversibile sau nu);
— rezultatele examenului oftalmologic;
— valorile hematologice și valorile de referință corespunzătoare;
— valorile de biochimie clinică și valorile de referință corespunzătoare;
— greutatea corporală la moartea animalului, greutățile organelor interne, raporturile greutatea organului intern/greutate corporală;
— constatările de la autopsie;
— o descriere detaliată a tuturor observațiilor histopatologice;
— date referitoare la absorbție, dacă e cazul;
— prelucrarea statistică a rezultatelor, unde este cazul.
Discutarea rezultatelor.
Concluzii.
B.28. STUDIU DE TOXICITATE SUBCRONICĂ – ADMINISTRARE CUTANATĂ EXPERIMENT EFECTUAT TIMP DE 90 DE ZILE ASUPRA UNOR ROZĂTOARE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Nu sunt specificate.
1.4. PRINCIPIUL METODEI DE TESTARE
Se aplică zilnic substanța de testat pe cale cutanată, în concentrații crescătoare, mai multor loturi de testare, fiind administrată o doză pe lot timp de 90 de zile. Pe parcursul perioadei de aplicare, se observă zilnic animalele pentru a pune în evidență simptomele de toxicitate. Animalele care mor în timpul testului, precum și cele care supraviețuiesc la sfârșitul testului sunt supuse autopsiei.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătiri
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului în cel puțin cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează aleatoriu în loturi tratate și loturi martor. Cu puțin timp înainte de test, se tunde blana din regiunea dorsală a animalelor. Se poate recurge la radere, dar în acest caz operația se efectuează cu aproximativ 24 de ore înainte de test. În timpul tunderii sau al raderii, trebuie evitată orice lezare a pielii. Suprafața care se degajează în vederea aplicării substanței nu trebuie să fie mai mică de 10 % din suprafața corporală. Pentru a decide zona care trebuie degajată și dimensiunile suprafeței care trebuie tratată, se ia în calcul greutatea animalului. Dacă testul vizează substanțele solide care, după caz, se pot pulveriza, substanța de testat trebuie umezită cu ajutorul apei sau, la nevoie, al unui vehicul adecvat, astfel încât să se poată obține un bun contact cu pielea. Substanțele de testat lichide se folosesc în general în stare nediluată. Se efectuează o aplicare zilnică timp de cinci până la șapte zile pe săptămână.
1.6.2. Condiții de testare
1.6.2.1.
Animalele de laborator utilizate sunt șobolanul, iepurele sau cobaiul adult. Pot fi folosite și alte specii, dar folosirea lor trebuie justificată. La începutul experimentului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie. Când studiul de toxicitate subcronică prin administrare cutanată este efectuat ca fază preliminară a unui studiu pe termen lung, trebuie să se folosească aceeași specie și linie pentru ambele studii.
1.6.2.2.
Se folosesc, pentru fiecare doză, cel puțin 20 de animale (10 femele și 10 masculi) a căror piele este sănătoasă. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul experimentului, acest număr se adaugă la total. În plus, se poate trata un lot satelit de 20 de animale (10 din fiecare sex) la doza cea mai mare timp de 90 de zile, care poate fi supus observației cu privire la reversibilitatea, persistența sau apariția tardivă a efectelor toxice pe parcursul celor 28 zile care urmează tratamentului.
1.6.2.3.
Se folosesc cel puțin trei doze, precum și un lot martor sau, după caz, un lot martor pentru vehicul. Perioada de expunere este de cel puțin 6 ore pe zi. Se aplică substanța de testat în fiecare zi în același moment, iar dozele trebuie să facă obiectul unei adaptări (săptămânale sau bisăptămânale) pentru a menține constant nivelul dozei în raport cu greutatea corporală a animalului. Cu excepția tratamentului cu substanța de testat, animalele din lotul martor se tratează în același mod ca și subiecții din loturile tratate. Dacă se folosește un vehicul pentru a facilita administrarea dozei, acesta este administrat lotului martor în aceleași condiții ca și pentru loturile tratate, iar doza administrată corespunde cu cea primită de lotul tratat cu doza maximă. Doza maximă trebuie să producă efecte toxice, dar nu trebuie să provoace sau trebuie să provoace rar moartea. Doza minimă nu trebuie să provoace niciun efect toxic. Dacă există informații privind expunerea umană, doza minimă trebuie să fie superioară acestei valori. În condiții ideale, doza intermediară trebuie să producă efecte toxice minime observabile. Dacă se folosesc mai multe doze intermediare, acestea se administrează eșalonat, astfel încât să provoace o gradare a efectelor toxice. În loturile care corespund dozelor mici și intermediare, precum și în loturile martor, incidența mortalității trebuie să fie mică, pentru a permite o evaluare semnificativă a rezultatelor.
Dacă aplicarea substanței de testat provoacă o iritație cutanată gravă, se reduc concentrațiile; aceasta poate avea ca efect diminuarea, chiar dispariția, celorlalte efecte toxice la doza mare. În plus, dacă leziunile cutanate sunt foarte grave, poate fi necesară oprirea experimentului și inițierea unui studiu nou, la concentrații mai mici.
1.6.3.
Dacă în urma unei experiențe preliminare realizate cu o doză de 1 000 miligrame pe kilogram sau o doză mai mare în funcție de expunerea umană posibilă, când se cunoaște această valoare, nu apare niciun efect toxic, continuarea experienței poate fi inutilă.
1.6.4.
Se observă toate animalele zilnic în vederea notării simptomelor de toxicitate. Se consemnează momentul morții și momentul când apar și dispar simptomele de toxicitate.
1.6.5.
Se pun animalele în cuști individuale. În condiții ideale, substanța de testat se administrează animalelor șapte zile pe săptămână timp de 90 de zile.
Animalele din toate loturile satelit destinate observației ulterioare sunt menținute în viață timp de încă 28 zile, fără tratament, în vederea constatării vindecării sau a persistenței efectelor toxice. Durata de expunere este de minimum șase ore pe zi.
Substanța de testat se aplică pe o suprafață aproximativ egală cu 10 % din suprafața totală a corpului. În cazul substanțelor foarte toxice, suprafața tratată poate fi mai mică, dar stratul trebuie să fie cât mai subțire și mai uniform posibil.
Pe parcursul expunerii, substanța de testat se menține în contact cu pielea cu ajutorul unui pansament de tifon și al unui plasture neiritant. Suprafața tratată se acoperă astfel încât să mențină pansamentul de tifon și substanța de testat și să se evite ingerarea acesteia de către animale. Se poate folosi contenționarea pentru a împiedica animalele să ingereze substanța de testat, dar nu se recomandă imobilizarea completă.
La sfârșitul perioadei de expunere, se elimină, dacă este posibil, orice reziduu de substanță, cu apă sau cu ajutorul unui alt procedeu de curățare a pielii.
Se observă zilnic toate animalele și se înregistrează simptomele de toxicitate, precum și momentul apariției, intensitatea și durata acestora. Observația zilnică vizează, între altele, modificări ale părului și ale blănii, ale ochilor și ale mucoaselor, ale aparatului respirator, ale sistemului circulator, ale sistemului nervos autonom și central, precum și ale activității somato-motrice și ale comportamentului. Se determină săptămânal greutatea animalelor. Se recomandă, de asemenea, măsurarea săptămânală a consumului de hrană. Animalele sunt observate cu regularitate pentru a evita, pe cât posibil, pierderea lor din motive exterioare experimentului, cum ar fi: canibalism, autoliză a țesuturilor sau greșeală de plasare a exemplarelor. La sfârșitul experimentului, se supun autopsiei toate animalele supraviețuitoare care aparțin loturilor nesatelit tratate. Animalele muribunde se scot imediat și se supun autopsiei.
Examinările următoare se efectuează de regulă asupra tuturor animalelor, inclusiv asupra martorilor:
(a) examenul oftalmologic, folosind un oftalmoscop sau un instrument echivalent corespunzător, trebuie făcut înainte de administrarea substanței de testat și la terminarea studiului, de preferință tuturor animalelor, dar cel puțin celor din lotul tratat cu doza mare și celor din lotul martor; dacă se constată modificări oculare, se vor examina toate animalele;
(b) examen hematologic, inclusiv hematocritul, concentrația hemoglobinei, numărul de hematii, numărul de leucocite și măsurători ale potențialului de coagulare, cum ar fi timpul de coagulare, timpul de protrombină, timpul de tromboplastină sau numărul de trombocite se măsoară la sfârșitul perioadei de testare;
(c) determinările biochimice clinice ale sângelui se realizează la sfârșitul perioadei de testare; testele considerate caracteristice pentru toate studiile sunt: balanța electrolitică, metabolismul carbohidraților, funcția hepatică și renală; alegerea unor determinări specifice depinde de observațiile asupra modului de acțiune a substanței de testat. Se pot sugera următoarele determinări: calciu, fosfor, clor, sodiu, potasiu, glucoza à jeun (cu privare de hrană pentru o perioadă caracteristică speciei), transaminaza serică glutamo-piruvică ( 18 ), transaminaza serică glutamo-oxaloacetică ( 19 ), ornitin decarboxilază, gama-glutamil transpetidaza, ureea, albumina, creatinina sanguină, bilirubina totală și proteinele totale. Pentru o evaluare toxicologică adecvată pot fi necesare și alte determinări, care includ analizarea lipidelor, hormonilor, echilibrul acidobazic, methemoglobina și activitatea colinesterazică. Se pot efectua, dacă este necesar, și alte determinări biochimice clinice pentru a extinde investigațiile asupra efectelor observate;
(d) nu este necesară efectuarea cu regularitate a analizei de urină, ci numai atunci când există o indicație bazată pe o toxicitate presupusă sau observată.
Dacă datele istorice de bază sunt insuficiente, înainte de începerea tratamentului trebuie să se determine parametrii hematologici și biochimici clinici.
Toate animalele supuse testului fac obiectul autopsiei generale, aceasta incluzând aspectul exterior al corpului, toate orificiile, cavitatea craniană, toracică și cea abdominală și conținutul acestora. Ficatul, rinichii, glandele suprarenale și testiculele trebuie cântărite în stare umedă, cât mai repede posibil după disecție, pentru a se evita deshidratarea. În vederea unor posibile examene histopatologice ulterioare, următoarele organe și țesuturi vor fi păstrate într-un mediu corespunzător: toate leziunile macroscopice, creier, inclusiv secțiuni prin bulb/punte, cortex cerebelos și cortex cerebral, glanda pituitară, tiroida/paratiroidele, țesut timic, traheea și plămânii, inimă, aortă, (glandele salivare), ficat, splină, rinichi, glande suprarenale, pancreas, gonade, uter (glande genitale anexe), (piele), esofag, stomac, duoden, jejun, ileon, cec, colon, rect, vezică urinară, ganglioni limfatici reprezentativi, (glanda mamară la femele), (musculatura coapsei), nervi periferici, stern cu măduvă osoasă, (ochi), (femur – incluzând articulația), (măduva spinării la trei niveluri – cervical, torace mediu și lombar) și (glande lacrimale extraorbitale). Țesuturile menționate între paranteze trebuie examinate doar atunci când acest lucru este indicat prin apariția semnelor de toxicitate sau implicarea organelor țintă.
(a) Se efectuează examen histopatologic complet pentru toate organele și țesuturile recoltate de la animalele din lotul martor și loturile expuse la doza maximă.
(b) Se examinează toate leziunile macroscopice.
(c) Se examinează organele-țintă ale animalelor din loturile expuse la celelalte doze.
(d) Se examinează histopatologic plămânii animalelor din lotul expus la doza minimă și la cea intermediară pentru a detecta infecțiile, deoarece acestea oferă o evaluare acceptabilă a stării de sănătate a animalelor. Trebuie să fie luată în considerare, de asemenea, examinarea histopatologică a ficatului și rinichiului în cazul acestor loturi. La animalele din aceste loturi nu se fac în mod curent examene histopatologice suplimentare, dar acestea trebuie făcute întotdeauna în cazul acelor organe pentru care s-au constatat leziuni la lotul expus la doza maximă.
(e) Atunci când este folosit un lot satelit, trebuie să se efectueze examene histopatologice pe țesuturile și organele pentru care s-au constatat leziuni la celelalte loturi tratate.
2. DATE
Datele se sistematizează într-un tabel care indică, pentru fiecare lot de experiență, numărul de animale la începutul testului și numărul de animale care prezintă fiecare tip de leziune. Toate rezultatele observate se evaluează cu ajutorul unei metode statistice adecvate. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia, linia, originea, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare;
— dozele (inclusiv vehiculul, dacă este cazul) și concentrațiile;
— răspunsul toxic pe sexe și doză;
— dacă este posibil, nivelul care nu are niciun efect;
— momentul morții în timpul experimentului sau indicarea faptului că animalele au supraviețuit experimentului;
— efectele toxice sau de alt tip;
— momentul observării oricărui simptom anormal și evoluția acestuia;
— consumul de hrană și greutatea corporală;
— observațiile oftalmologice;
— examenele hematologice întreprinse și rezultatele complete;
— testele biochimice clinice practicate și rezultatele complete (inclusiv cele urinare);
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor, după caz;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.29. STUDIU DE TOXICITATE SUBCRONICĂ – ADMINISTRARE PRIN INHALARE EXPERIMENT EFECTUAT TIMP DE 90 DE ZILE ASUPRA UNOR ROZĂTOARE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Se expun zilnic mai multe loturi de animale, pe parcursul unei perioade determinate, la o substanță de testat în concentrații crescătoare, fiind administrată o doză pe lot timp de 90 de zile. Când se folosește un vehicul în vederea obținerii unei concentrații adecvate a substanței de testat în atmosferă, se prevede un lot martor pentru vehicul. Pe parcursul perioadei de administrare, se observă zilnic animalele pentru a pune în evidență simptomele de toxicitate. Animalele care mor în timpul testului, precum și cele care supraviețuiesc la sfârșitul testului, sunt supuse autopsiei.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătiri
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează aleatoriu în loturi tratate și loturi martor. La nevoie, se poate adăuga la substanța de testat un vehicul adecvat în vederea obținerii unei concentrații corespunzătoare în atmosferă. Dacă, pentru a ușura administrarea, se folosește un vehicul sau alt tip de aditiv, acesta trebuie să fie netoxic. Pot fi folosite date istorice, dacă este necesar.
1.6.2. Condiții de testare
Cu excepția contraindicațiilor, specia preferată este șobolanul. Se folosesc animale tinere, sănătoase, aparținând unei linii de laborator obișnuite. La începutul experimentului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie. Când studiul de toxicitate subcronică prin inhalare este efectuat ca fază preliminară a unui studiu pe termen lung, trebuie să se folosească aceeași specie și linie pentru ambele studii.
Se folosesc cel puțin 20 de animale (10 femele și 10 masculi) pentru fiecare concentrație de expunere. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul experimentului, acest număr se adaugă la total. De asemenea, se poate trata un lot satelit de 20 de animale (10 din fiecare sex) la doza maximă timp de 90 de zile, care poate fi supus observației cu privire la reversibilitatea, persistența sau apariția tardivă a efectelor toxice pe parcursul celor 28 de zile care urmează tratamentului.
Cel puțin trei concentrații sunt necesare, precum și un lot martor sau, după caz, un lot martor pentru vehicul (corespunzând concentrației vehiculului la nivelul de expunere cel mai ridicat). Cu excepția tratamentului cu substanța de testat, animalele din lotul martor se tratează în același mod ca și subiecții din loturile tratate. Concentrația maximă provoacă efecte toxice, dar nu trebuie să provoace sau provoacă rar moartea. Dacă există informații privind expunerea umană, concentrația minimă trebuie să fie superioară acestei valori. În condiții ideale, concentrația intermediară trebuie să producă efecte toxice minime observabile. Dacă se folosesc mai multe concentrații intermediare, acestea se administrează eșalonat, astfel încât să provoace o gradare a efectelor toxice. În loturile care corespund concentrațiilor mici și intermediare, precum și în lotul martor, incidența mortalității trebuie să fie mică, pentru a permite o evaluare semnificativă a rezultatelor.
Expunerea zilnică trebuie să fie de 6 ore după echilibrarea concentrației în incinta de testare. Se pot utiliza alte perioade de expunere pentru a răspunde unor cerințe specifice.
Animalele se expun la substanța de testat cu ajutorul unui dispozitiv de inhalare conceput pentru a asigura un flux continuu sau cel puțin 12 aerisiri pe oră, garantând un conținut de oxigen adecvat și o distribuție uniformă a substanței de testat în aer. Dacă se folosește o incintă, aceasta trebuie concepută astfel încât să reducă la minim aglomerarea animalelor de experiență și să le asigure o expunere maximă, prin inhalare, a substanței de testat. De regulă, pentru a asigura stabilitatea atmosferei din incintă, volumul total al animalelor nu trebuie să depășească 5 % din volumul incintei. Se mai pot folosi expuneri oro-nazale, numai ale capului sau ale întregului corp, în incinte individuale; primele două tipuri de expunere limitează absorbția pe alte căi a substanței de testat.
Se observă toate animalele zilnic în vederea notării simptomelor de toxicitate, pe tot parcursul perioadei de tratare și de refacere. Se consemnează momentul morții și momentul când apar și dispar simptomele de toxicitate.
1.6.3. Mod de operare
Se expun zilnic animalele la substanța de testat timp de cinci până la șapte zile pe săptămână, pe o perioadă de 90 de zile. Animale aparținând loturilor satelit prevăzute pentru observații ulterioare se țin sub observație încă 28 de zile, fără tratament, pentru a studia vindecarea sau persistența efectelor toxice. Temperatura la care are loc testul se menține la 22 ± 3 oC. În condiții optime, umiditatea relativă se menține între 30 și 70 % dar, în anumite cazuri, acest lucru poate fi imposibil (de exemplu, în cazul testelor cu aerosoli). Pe parcursul perioadei de expunere, nu se administrează animalelor nici hrană, nici apă.
Se folosește un sistem de inhalare dinamic, prevăzut cu un dispozitiv adecvat de control analitic al concentrației. Pentru determinarea concentrațiilor de expunere adecvate, se recomandă să se procedeze la un test preliminar. Se ajustează debitul pentru a asigura concentrații omogene în toată incinta. Sistemul trebuie să permită obținerea unor condiții de expunere stabile cât de rapid posibil.
Se măsoară și se controlează:
(a) debitul de aer (în permanență);
(b) concentrația reală a substanței măsurate în zona de respirație; pe parcursul perioadei de expunere zilnică, concentrația nu trebuie să varieze cu mai mult de ± 15 % față de valoarea medie; cu toate acestea, în cazul prafului și al aerosolilor, acest grad de control poate să nu fie atins, iar în acest caz se poate accepta o diferență mai mare; pe durata experimentului concentrațiile administrate zilnic trebuie menținute la valori cât de constante posibil; pe durata generării aerosolilor trebuie efectuată analiza granulometrică pentru a determina stabilitatea concentrației acestora; în timpul expunerii, analiza trebuie efectuată suficient de des pentru a determina măsura în care distribuția particulelor este constantă;
(c) temperatura și umiditatea;
(d) în timpul expunerii și după aceasta au loc observații care sunt înregistrate sistematic; pentru fiecare animal se consemnează date individuale; se observă zilnic toate animalele și se înregistrează simptomele de toxicitate, precum și momentul apariției, intensitatea și durata acestora. Observația zilnică în cușcă vizează, între altele, modificări ale pielii și ale blănii, ale ochilor și ale mucoaselor, ale aparatului respirator, ale sistemului circulator, ale sistemului nervos autonom și central, precum și ale activității somato-motrice și ale comportamentului; se determină săptămânal consumul de hrană și greutatea animalelor. animalele sunt observate cu regularitate, pentru a evita pe cât posibil pierderea lor din motive exterioare experimentului, cum ar fi: canibalism, autoliză a țesuturilor sau greșeală de plasare a exemplarelor; la sfârșitul perioadei de expunere, se supun autopsiei toate animalele supraviețuitoare. Animalele muribunde sunt retrase imediat și supuse autopsiei.
Examinările următoare se efectuează de regulă asupra tuturor animalelor, inclusiv asupra martorilor:
(a) examenul oftalmologic, folosind un oftalmoscop sau un instrument echivalent corespunzător, trebuie făcut înainte de administrarea substanței de testat și la terminarea studiului, de preferință tuturor animalelor, dar cel puțin celor din lotul tratat cu doza cea mai mare și din lotul martor; dacă se constată modificări oculare, se vor examina toate animalele;
(b) examen hematologic, inclusiv hematocritul, concentrația hemoglobinei, numărul de hematii, numărul de leucocite și măsurători ale potențialului de coagulare, cum ar fi timpul de coagulare, timpul de protrombină, timpul de tromboplastină sau numărul de trombocite se măsoară la sfârșitul perioadei de testare;
(c) determinările biochimice clinice ale sângelui se realizează la sfârșitul perioadei de testare; testele considerate caracteristice pentru toate studiile sunt: balanța electrolitică, metabolismul carbohidraților, funcția hepatică și renală; alegerea unor determinări specifice depinde de observațiile asupra modului de acțiune a substanței de testat; se pot sugera următoarele determinări: calciu, fosfor, clor, sodiu, potasiu, glucoza à jeun (cu privare de hrană pentru o perioadă caracteristică speciei), transaminaza serică glutamo-piruvică (19) , transaminaza serică glutamo-oxaloacetică (19) , ornitin decarboxilază, gama-glutamil transpetidaza, ureea, albumina, creatinina sanguină, bilirubina totală și proteinele totale; pentru o evaluare toxicologică adecvată pot fi necesare și alte determinări, care includ analizarea lipidelor, a hormonilor, echilibrul acidobazic, methemoglobina și activitatea colinesterazică; se pot efectua, dacă este necesar, și alte determinări biochimice clinice pentru a extinde investigațiile asupra efectelor observate;
(d) nu este necesară efectuarea cu regularitate a analizei de urină, ci numai atunci când există o indicație bazată pe o toxicitate presupusă sau observată.
Dacă datele istorice de bază sunt insuficiente, înainte de începerea tratamentului trebuie să se determine parametrii hematologici și biochimici clinici.
Toate animalele supuse testului fac obiectul autopsiei generale, aceasta incluzând aspectul exterior al corpului, toate orificiile, cavitatea craniană, toracică și cea abdominală și conținutul acestora. Ficatul, rinichii, glandele suprarenale și testiculele trebuie cântărite în stare umedă, cât mai repede posibil după disecție, pentru a se evita deshidratarea. În vederea unor posibile examene histopatologice ulterioare, următoarele organe și țesuturi vor fi păstrate într-un mediu corespunzător: toate leziunile macroscopice, plămânii – care trebuie scoși intacți, cântăriți și tratați cu un fixator potrivit care permite conservarea structurii pulmonare (se consideră că perfuzia cu acest fixator este o metodă eficientă), țesuturile nazo-faringiene, creierul – inclusiv secțiuni prin bulb/punte, cortex cerebelos și cortex cerebral, glanda pituitară, tiroida/paratiroidele, țesutul timic, traheea și plămânii, inima, aorta, (glandele salivare), ficatul, splina, rinichii, glandele suprarenale, pancreasul, gonadele, uterul (glandele genitale anexe), (pielea), esofagul, stomacul, duodenul, jejunul, ileonul, cecul, colonul, rectul, vezica urinară, ganglionii limfatici reprezentativi, (glanda mamară la femele), (musculatura coapsei), nervii periferici, (ochii), sternul cu măduvă osoasă, (femurul, inclusiv articulația), (măduva spinării la trei niveluri – cervical, torace mediu și lombar) și (glande lacrimale extraorbitale). Țesuturile menționate între paranteze trebuie examinate doar atunci când acest lucru este indicat prin apariția semnelor de toxicitate sau implicarea organelor țintă.
(a) Se efectuează examen histopatologic complet pentru tractul respirator și alte organe și țesuturi recoltate de la animalele din lotul martor și loturile expuse la doza cea mai mare.
(b) Se examinează toate leziunile macroscopice.
(c) Se examinează organele-țintă ale animalelor din loturile expuse la celelalte doze.
(d) Se examinează histopatologic plămânii animalelor din lotul expus la doza mică și la cea intermediară, urmărind detectarea infecțiilor, deoarece acestea oferă o evaluare acceptabilă a stării de sănătate a animalelor. La animalele din aceste loturi nu se fac în mod curent examene histopatologice suplimentare, dar acestea trebuie făcute întotdeauna în cazul acelor organe pentru care s-au constat leziuni la lotul expus la doza cea mai mare.
(e) Atunci când este folosit un lot satelit, trebuie să se efectueze examene histopatologice pe țesuturile și organele pentru care s-au constatat leziuni la celelalte loturi tratate.
2. DATE
Datele se sistematizează într-un tabel care indică, pentru fiecare lot de experiență, numărul de animale la începutul testului și numărul de animale care prezintă fiecare tip de leziune. Toate rezultatele observate se evaluează cu ajutorul unei metode statistice adecvate. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia, linia, originea, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare:
— Descrierea aparatului de expunere: inclusiv concepția, tipul, dimensiunile, sursa de aer, sistemul generator de particule și de aerosoli, metoda de condiționare a aerului, tratarea aerului expirat și, după caz, modul de adăpostire a animalelor în incinta de testare. Se descrie echipamentul folosit pentru măsurarea temperaturii și, dacă este necesar, stabilitatea concentrațiilor de aerosoli și granulometria particulelor.
— Datele privind expunerea: se prezintă sub forma unui tabel care indică valorile medii, precum și măsura variabilității
— (de exemplu, deviația standard); ele trebuie să includă:
—(a) debitul de aer în dispozitivul de inhalare;
(b) temperatura și umiditatea aerului;
(c) concentrațiile nominale (cantitatea totală de substanță de testat introdusă în dispozitivul de inhalare raportată la volumul de aer);
(d) după caz, natura vehiculului;
(e) concentrațiile reale din zona de respirație;
(f) dimensiunile mediane ale particulelor (după caz),
— răspunsul toxic pe sexe și concentrație;
— dacă este posibil, nivelul care nu are niciun efect;
— momentul morții în timpul experimentului sau indicarea faptului că animalele au supraviețuit experimentului;
— efectele toxice sau de alt tip;
— momentul observării oricărui simptom anormal și evoluția acestuia;
— consumul de hrană și greutatea corporală;
— observații oftalmologice;
— examenele hematologice întreprinse și rezultatele complete;
— testele biochimice clinice practicate și rezultatele complete (inclusiv cele urinare);
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor, după caz;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.30. STUDIU DE TOXICITATE CRONICĂ
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se administrează în mod normal pe mai multe loturi de animale de experiență, câte o doză pe lot, pe o cale de administrare convenabilă, șapte zile pe săptămână, pe o perioadă îndelungată din viața lor. Pe parcursul expunerii și după expunere la substanța de testat, animalele de experiență sunt ținute sub observație zilnic pentru a depista semnele de toxicitate.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI
1.6.1. Pregătirea testului
Animalele se țin în condițiile de adăpostire și de hrănire specifice experimentului în cel puțin cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează aleatoriu în loturile tratate și loturile martor.
1.6.2. Condiții de testare
Specia preferată este șobolanul.
În funcție de rezultatele obținute din studiile anterioare, pot fi folosite și alte specii (rozătoare sau nerozătoare). Se folosesc animale tinere și sănătoase aparținând unei linii de laborator obișnuite, iar tratamentul trebuie să înceapă cât mai repede după înțărcare.
La începutul studiului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie. Când se efectuează un studiu de toxicitate subcronică prin administrare orală în faza pregătitoare a unui studiu pe termen lung, trebuie să se folosească aceeași specie și linie pentru ambele studii.
În cazul rozătoarelor, se utilizează cel puțin 40 de animale (20 femele și 20 masculi) pentru fiecare doză și pentru fiecare lot martor. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul experimentului, acest număr se adaugă la total.
În cazul nerozătoarelor, se acceptă un număr mai mic de animale, însă nu mai puțin de patru din fiecare sex pentru fiecare lot.
Pe lângă lotul martor pregătit în simultan, se folosesc cel puțin trei doze. Doza maximă trebuie să producă efecte evidente de toxicitate fără a produce mortalitate excesivă.
Doza minimă nu trebuie să producă o toxicitate evidentă.
Doza sau dozele intermediare trebuie să aibă o valoare apropiată de media dozelor maximă și minimă.
Alegerea dozelor trebuie să ia în considerare datele obținute în studiile de toxicitate precedente.
În mod normal, expunerea este zilnică. Dacă substanța se administrează în apa de băut sau în hrană, animalele trebuie să aibă acces permanent la acestea.
Se recomandă folosirea unui lot martor identic din toate punctele de vedere cu loturile tratate, cu excepția expunerii la substanța de testat.
În circumstanțe speciale, cum ar fi studiile de toxicitate prin inhalare care presupun folosirea aerosolilor sau folosirea unui emulsifiant cu activitate biologică necunoscută în studii orale, se impune folosirea unui lot martor negativ. Lotul martor negativ este tratat în aceleași condiții ca loturile testate, exceptând faptul că animalele nu sunt expuse la substanța de testat sau la vreun vehicul.
Cele două căi principale de administrare sunt cea orală și prin inhalare. Alegerea căii de administrare depinde de caracteristicile fizice și chimice ale substanței de testat și de calea probabilă de expunere a oamenilor.
Folosirea căii cutanate de administrare ridică probleme practice considerabile. Toxicitatea cronică sistemică rezultată în urma absorbției percutanate se poate deduce, în mod normal, din rezultatele unui alt test cu administrare orală; informații asupra cantității de substanță absorbită pe cale percutanată pot fi obținute pe baza testelor precedente de toxicitate cu administrare percutanată.
Dacă substanța de testat se absoarbe prin tractul gastro-intestinal și dacă ingestia este una din posibilele căi de expunere la om, atunci este preferată calea de administrare orală, exceptând cazurile în care aceasta este contraindicată. Animalele pot primi substanța în hrană, dizolvată în apa de băut sau sub formă de capsule. În mod ideal, doza trebuie administrată zilnic, șapte zile pe săptămână, deoarece dozarea de cinci zile pe săptămână face posibilă remiterea sau diminuarea toxicității în perioada de pauză, astfel încât ar putea fi afectate rezultatele și evaluările ulterioare. Cu toate acestea, din considerente practice, poate fi acceptată dozarea de cinci zile pe săptămână.
Deoarece studiile de toxicitate prin inhalare ridică probleme tehnice de o mai mare complexitate în comparație cu celelalte căi de administrare, în cele ce urmează se prezintă îndrumări detaliate privind acest mod de administrare. Trebuie remarcat că în anumite situații o alternativă viabilă o constituie instilațiile intratraheale.
Expunerile pe termen lung se modelează de obicei după posibila expunere a omului: substanța se administrează fie zilnic, timp de 6 ore, după echilibrarea concentrației în incintă, câte cinci zile pe săptămână (expunere intermitentă), fie, dacă se urmăresc efectele unei posibile expuneri în mediul înconjurător, timp de 22-24 ore/zi, câte șapte zile pe săptămână (expunere continuă), în acest ultim caz cu pauză de o oră/zi pentru hrănirea animalelor, în același moment al zilei și menținând condițiile specifice din incintă.
În ambele cazuri, animalele sunt expuse de obicei la concentrații constante de substanță. Diferența esențială dintre expunerea intermitentă și cea continuă este aceea că în primul caz există o perioadă de 17-18 ore în care animalele se pot reface după efectele fiecărei expuneri zilnice, refacere chiar mai îndelungată la sfârșit de săptămână.
Alegerea modalității de expunere – intermitentă sau continuă – depinde de obiectivele studiului și de tipul de expunere umană simulat. Cu toate acestea, trebuie avute în vedere anumite dificultăți tehnice. De exemplu, avantajul expunerii continue prin simularea condițiilor de mediu este contrabalansat de cerința hrănirii și adăpării animalelor în timpul expunerii și de necesitatea de a dispune de tehnici mai complicate (și mai fiabile) atât de generare a aerosolilor și a vaporilor, cât și de monitorizare.
Animalele se expun la substanța de testat în incinte de inhalare concepute pentru a asigura un flux continuu sau cel puțin 12 aerisiri pe oră, garantând un conținut de oxigen adecvat și o distribuție uniformă a produsului de testat în aer. Incinta martor și cea de testare trebuie să fie identice ca proiectare și construcție, astfel încât să asigure condiții comparabile sub toate aspectele, cu excepția expunerii la substanțele testate. În incintă se menține o presiune ușor negativă pentru a împiedica pierderea substanței de testat în zona înconjurătoare. În incinte trebuie redusă la minim aglomerarea animalelor testate De regulă, pentru a asigura stabilitatea atmosferei din incintă, volumul total al animalelor nu trebuie să depășească 5 % din volumul incintei.
Se măsoară și se controlează:
(i) fluxul de aer: debitul de aer în incintă este, de preferință, monitorizat continuu;
(ii) concentrația: pe parcursul expunerii zilnice, concentrația substanței de testat nu trebuie să varieze cu mai mult de ± 15 % din valoarea medie;
(iii) temperatura și umiditatea: în cazul rozătoarelor, temperatura trebuie menținută la 22 ± 2 oC, iar umiditatea din incintă la 30-70 %, exceptând cazurile în care se folosește apă ca mediu de suspensie pentru substanța de testat în atmosfera incintei (aerosoli); de preferință, ambii parametri trebuie să fie monitorizați continuu;
(iv) analiza granulometrică a particulelor: în atmosfera incintei unde există aerosoli lichizi sau solizi, trebuie să fie determinată distribuția granulometrică a particulelor; particulele din componența aerosolilor trebuie să aibă o dimensiune respirabilă pentru animalele testate; probele din atmosfera incintei se prelevează de la nivelul zonei de respirație; probele de aer trebuie să fie reprezentative din punct de vedere al distribuției particulelor la care sunt expuse animalele și trebuie să reflecte, în termeni gravimetrici, toate suspensiile de tip aerosol, chiar dacă o mare parte din acestea nu sunt respirabile; pe durata generării aerosolilor trebuie efectuată analiza granulometrică pentru a determina stabilitatea concentrației acestora și, ulterior, ori de câte ori este necesar în timpul expunerii a determina măsura în care este constantă distribuția particulelor la care au fost expuse animalele.
Durata administrării trebuie să fie de cel puțin 12 luni.
1.6.3. Mod de operare
Se efectuează zilnic o examinare clinică amănunțită. După caz, se fac zilnic observații suplimentare și se iau măsuri în consecință pentru a reduce la minim pierderea animalelor din motive exterioare testului, cum ar fi autopsierea sau congelarea animalelor găsite moarte sau izolarea sau sacrificarea celor bolnave sau muribunde. Este necesară observarea detaliată a animalelor pentru a detecta declanșarea și evoluția tuturor efectelor toxice, precum și pentru a reduce la minim pierderile datorate bolilor, autolizei sau canibalismului.
Pentru toate animalele se înregistrează semnele clinice, inclusiv modificările neurologice și oculare, și mortalitatea. Se înregistrează momentul apariției efectelor toxice și evoluția acestora, inclusiv tumorile suspecte.
Greutatea fiecărui animal se înregistrează săptămânal în primele 13 săptămâni de studiu și, ulterior, cel puțin o dată la fiecare 4 săptămâni. Consumul de hrană se determină săptămânal în primele 13 săptămâni de studiu, apoi la intervale de aproximativ trei luni, exceptând cazurile în care starea de sănătate și greutatea corporală a animalelor impun alte intervale.
Examenele hematologice (de exemplu hemoglobina, hematocritul, numărul hematiilor, numărul leucocitelor, trombocitele sau alte măsurători ale potențialului de coagulare) trebuie efectuate la trei luni, șase luni, apoi la intervale de șase luni, iar la sfârșitul studiului se recoltează probe de sânge de la toate nerozătoarele și de la câte 10 șobolani/sex din toate loturile. Dacă este posibil, probele se prelevează de fiecare dată de la aceiași șobolani. În plus, la nerozătoare se recoltează probe de sânge și înainte de începerea experimentului.
Dacă observațiile clinice sugerează o deteriorare a stării de sănătate a animalelor pe parcursul studiului, se stabilește formula leucocitară a fiecărui animal afectat.
Se determină formula leucocitară pe probe prelevate de la animalele aparținând lotului expus la doza maximă și lotului martor. Această formulă nu se determină pentru loturile expuse la doze imediat mai mici decât dacă se constată o discrepanță între loturile expuse la doza maximă și loturile martor sau dacă examenul patologic indică acest lucru.
Trebuie colectate probe de urină de la toate nerozătoarele și de la câte 10 șobolani/sex din toate loturile, dacă este posibil de la aceiași șobolani și la aceleași intervale de timp ca probele de sânge necesare efectuării examenelor hematologice. Pentru fiecare animal sau pe o probă colectată de la mai multe animale rozătoare, de același sex, din același lot, se fac următoarele determinări:
— aspect: volum și densitate pentru fiecare animal;
— proteine, glucoză, corpi cetonici, hemoragii oculte (semicantitativ);
— microscopia sedimentului (semicantitativ).
La intervale de aproximativ 6 luni, precum și la sfârșitul experimentului, se recoltează probe de sânge pentru determinări biochimice de la toate animalele nerozătoare și de la câte 10 șobolani/sex din toate loturile, dacă este posibil de fiecare dată de la aceiași șobolani. În plus, de la nerozătoare trebuie să se recolteze probe înaintea testului. Pe plasma obținută din aceste probe se vor efectua următoarele determinări:
— concentrația proteinelor totale;
— concentrația albuminelor;
— teste ale funcției hepatice: activitatea fosfatazei alcaline, transaminază glutampiruvică (19) , transaminază oxalacetică (19) , gamma glutamil transpeptidază, ornitin decarboxilază;
— metabolismul carbohidraților, cum ar fi glucoza à jeun;
— explorarea funcției renale, cum ar fi azotul ureic din sânge.
Se efectuează autopsia generală a tuturor animalelor, inclusiv a celor care mor pe parcursul experimentului sau care au fost sacrificate, fiind muribunde. Înainte de sacrificare, se prelevează probe de sânge de la toate animalele, pentru formula leucocitară. Se conservă toate leziunile macroscopice, tumorile sau leziunile suspecte de a deveni tumori. Se procedează la corelarea observațiilor macroscopice cu rezultatele microscopice.
Toate organele și țesuturile trebuie conservate într-un mediu corespunzător în vederea examenului histopatologic. De obicei, sunt vizate următoarele organe și țesuturi: creier ( 20 ) (bulb rahidian, punte, cortex cerebelos și cortex cerebral), glanda pituitară, tiroida (inclusiv paratiroida), timus, plămâni (inclusiv trahee), inimă, aortă, glandele salivare, ficat (20) , splină, rinichi (20) , glandele suprarenale (20) , esofag, stomac, duoden, jejun, ileon, cec, colon, rect, uter, vezica urinară, ganglionii limfatici, pancreas, gonade (20) , organe genitale anexe, glandele mamare feminine, piele, mușchi, nervi periferici, măduva spinării (cervicală, toracică, lombară) stern cu măduvă și femur (inclusiv articulația) și ochi. Umplerea plămânilor și a vezicii urinare cu fixator prezintă modalitatea optimă de conservarea a acestora; în studiile de toxicitate prin inhalare, umplerea plămânilor este o cerință esențială pentru examinarea histopatologică adecvată. În cazul acestor studii, întregul tract respirator trebuie conservat, inclusiv cavitatea nazală, faringele și laringele.
Dacă se realizează și alte examinări clinice, informațiile obținute din aceste studii trebuie să fie disponibile înainte de examinarea microscopică, deoarece pot să dea indicii medicului patolog.
Se examinează microscopic toate modificările vizibile, în special tumorile și alte tipuri de leziuni ce apar la nivelul oricărui organ. De asemenea, se recomandă efectuarea următoarelor examinări:
(a) examinarea microscopică a tuturor organelor și țesuturilor conservate, cu descrierea completă a leziunilor evidențiate la:
1. toate animalele care au murit sau au fost sacrificate pe parcursul studiului;
2. toate animalele din loturile martor și din loturile tratate cu doza maximă;
(b) de asemenea, sunt examinate organele și țesuturile care prezintă modificări induse sau posibil induse de substanța de testat la loturile tratate cu doze mai mici;
(c) dacă rezultatul testului indică reducerea substanțială a vieții animalelor sau inducerea unor efecte ce pot afecta răspunsul toxic, atunci se examinează microscopic și lotul tratat cu doza imediat mai mică;
(d) informațiile privind incidența leziunilor care apar în mod normal la linia de animal folosită, în aceleași condiții de laborator, și anume date istorice pentru martori, sunt indispensabile pentru evaluarea corectă a importanței modificărilor observate la animalele tratate.
2. DATE
Datele se sistematizează în tabele care să indice pentru fiecare lot numărul inițial de animale, numărul de animale care prezintă leziuni și procentul de animale pentru fiecare tip de leziune. Rezultatele se evaluează cu ajutorul unei metode statistice adecvate. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia, linia, originea, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare.
— 3.1.1. Descrierea aparatului de expunere:
— Inclusiv concepția, tipul, dimensiunile, sursa de aer, sistemul generator de particule și de aerosoli, metoda de condiționare a aerului, tratarea aerului expirat și, după caz, modul de adăpostire a animalelor în incinta de testare. Se descrie echipamentul folosit pentru măsurarea temperaturii și, dacă este necesar, stabilitatea concentrațiilor de aerosoli și granulometria particulelor.
— 3.1.2. Datele privind expunerea:
— Se prezintă sub forma unui tabel care indică valorile medii, precum și măsura variabilității (de exemplu, deviația standard); ele trebuie să includă:
—(a) debitul de aer în dispozitivul de inhalare;
(b) temperatura și umiditatea aerului;
(c) concentrațiile nominale (cantitatea totală de substanță de testat introdusă în dispozitivul de inhalare raportată la volumul de aer);
(d) după caz, natura vehiculului;
(e) concentrațiile reale din zona de respirație;
(f) dimensiunile mediane ale particulelor (după caz);
— dozele (inclusiv vehiculul, dacă este cazul) și concentrațiile;
— răspunsul toxic pe sexe și doză;
— doza la care nu apar efecte;
— momentul morții în timpul experimentului sau indicarea faptului că animalele au supraviețuit experimentului;
— efectele toxice sau de alt tip;
— momentul observării fiecărui simptom anormal și evoluția acestuia;
— consumul de hrană și greutatea corporală;
— observațiile oftalmologice;
— examenele hematologice întreprinse și rezultatele complete;
— testele biochimice clinice practicate și rezultatele complete (inclusiv cele urinare);
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor, după caz;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.31. STUDIU DE TOXICITATE ASUPRA DEZVOLTĂRII INTRAUTERINE
1. METODĂ
Această metodă corespunde Orientării 414 (2001) a OCDE.
1.1. INTRODUCERE
Această metodă de testare a toxicității asupra dezvoltării intrauterine este concepută pentru a furniza informații generale privind efectele expunerii prenatale asupra animalelor de experiență gestante și asupra dezvoltării intrauterine a organismului; printre acestea se pot număra evaluarea efectelor asupra mamei, precum și moartea, anomalii structurale sau modificările de creștere la fetus. Deficiențele funcționale, deși constituie o parte importantă a dezvoltării, nu sunt incluse în această metodă de testare. Ele pot face obiectul unui studiu separat sau al unei completări a acestui studiu, utilizând metoda privind neurotoxicitatea asupra dezvoltării. Pentru informații privind testarea deficiențelor funcționale și alte efecte postnatale se consultă Metoda de testare a toxicității asupra funcției de reproducere la două generații și studiul privind neurotoxicitatea asupra dezvoltării, după caz.
Este posibil să fie necesară o adaptare a acestei metode de testare la cazurile individuale, pe baza cunoștințelor specifice privind, de exemplu, proprietățile fizico-chimice sau toxicologice ale substanței de testat. Astfel de adaptări sunt acceptabile, în cazurile în care date științifice concludente sugerează că adaptarea va conduce la obținerea mai multor informații din test. În acest caz, datele științifice se documentează în detaliu în raportul studiului.
1.2. DEFINIȚII
Toxicologia dezvoltării: studiul efectelor adverse asupra organismului în curs de dezvoltare care ar putea fi provocate de expunerea înainte de concepție, în cursul dezvoltării intrauterine sau postnatal, până în momentul maturizării sexuale. Principalele manifestări ale toxicității dezvoltării sunt (1) moartea organismului, (2) o anomalie structurală, (3) o modificare a creșterii și (4) o deficiență funcțională. Până acum, toxicitatea dezvoltării a fost denumită deseori teratologie.
Efect advers: orice deviere de la situația de referință care are legătură cu tratamentul și care scade abilitatea unui organism de a supraviețui, de a se reproduce sau de a se adapta la mediu. În ceea ce privește toxicologia dezvoltării, în sensul său cel mai larg, aceasta include orice efect care interferează cu dezvoltarea normală a produsului de concepție atât înainte, cât și după naștere.
Modificare a creșterii: o modificare care afectează un organ, greutatea sau dimensiunea corporale ale descendentului.
Modificări (anomalii): modificări structurale în dezvoltare, care includ malformații și variații (28).
Malformație/Anomalie majoră: modificare structurală considerată dăunătoare animalului (poate fi chiar letală) și, de obicei, rară.
Variație/Anomalie minoră: modificare structurală considerată puțin sau deloc dăunătoare animalului; poate fi temporară și poate interveni relativ frecvent la populația martor.
Produs de concepție: ansamblul produselor unui ovul fecundat în orice stadiu de dezvoltare, de la fertilizare până la naștere, inclusiv membranele extra-embrionare, precum și embrionul sau fetusul.
Implantare (nidație): atașarea blastocistului în membrana epitelială a uterului, inclusiv penetrarea sa prin epiteliul uterin, și fixarea sa în endometru.
Embrion: stadiul precoce sau de dezvoltare al oricărui organism, în special produsul în curs de dezvoltare al fertilizării unui ovul după apariția axei longitudinale și până la apariția tuturor structurilor majore.
Embriotoxicitate: nocivitate pentru structura, dezvoltarea, creșterea și/sau viabilitatea normale ale unui embrion.
Fetus: descendentul nenăscut în perioada post-embrionară.
Fetotoxicitate: nocivitate pentru structura, dezvoltarea, creșterea și/sau viabilitatea normale ale unui fetus.
Avort: expulzarea prematură din uter a unui produs de concepție: a embrionului sau a unui fetus neviabil.
Resorbție: fenomenul prin care un produs de concepție care a decedat după implantarea în uter este sau a fost resorbit.
Resorbție precoce: dovada implantării fără un embrion/fetus detectat.
Resorbție tardivă: embrion sau fetus decedat cu modificări externe degenerative.
NOAEL: abreviere pentru nivelul dozei fără efect advers (no-observed-adverse-effect level); cel mai ridicat nivel al dozei sau al expunerii la care nu se observă efecte adverse provocate de tratament.
1.3. SUBSTANȚA DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
În mod normal, substanța de testat se administrează animalelor gestante cel puțin de la implantare până în ziua anterioară celei planificate pentru sacrificare, care se stabilește cât mai aproape posibil de ziua normală a fătării fără să existe riscul de pierdere a datelor din cauza unei fătări premature. Metoda de testare nu are ca scop doar studierea perioadei de organogeneză (de exemplu, zilele 5-15 la rozătoare și zilele 6-18 la iepure), ci și examinarea efectelor din perioada de preimplantare, dacă este cazul, pe întreaga durată a perioadei de gestație, până în ziua anterioară cezarienei. Cu scurt timp înainte de cezariană, se sacrifică femelele, se examinează conținutul uterin și se examinează fetușii pentru detectarea anomaliilor externe vizibile și a modificărilor țesuturilor moi și ale scheletului.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Selectarea speciei de animale
Se recomandă ca testele să se efectueze pe specia cea mai relevantă și să se utilizeze specii și sușe de laborator care sunt cel mai des utilizate în teste privind toxicitatea asupra dezvoltării intrauterine. Specia preferată de rozătoare este șobolanul, iar specia preferată de nerozătoare este iepurele. Dacă se utilizează altă specie, decizia se motivează.
1.5.2. Condiții de adăpostire și de hrănire
În spațiul pentru adăpostirea animalelor de experiență, se asigură o temperatură de 22 oC (± 3 oC) pentru rozătoare și de 18 oC (± 3 oC) pentru iepuri. Se asigură o umiditate relativă de 50-60 %, cu o valoare minimă de 30 % și o valoare maximă de 70 %, cu excepția momentelor în care se curăță spațiul. Spațiul se iluminează artificial, cu o alternanță de 12 ore lumină, 12 ore întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă.
Procedurile de împerechere se desfășoară în cuști adecvate acestui scop. Deși este de preferat adăpostirea individuală a animalelor împerecheate, adăpostirea în grupuri puțin numeroase este, de asemenea, acceptabilă.
1.5.3. Pregătirea animalelor
Se utilizează animale sănătoase, care au fost aclimatizate la condițiile de laborator timp de cel puțin 5 zile înainte și nu au fost supuse anterior altor proceduri de testare. Pentru animalele de experiență se precizează specia, sușa, sursa, sexul, greutatea și/sau vârsta. Se recomandă ca animalele din toate grupurile testate să aibă, în cea mai mare măsură posibilă, greutăți și vârste apropiate. La fiecare nivel al dozei se utilizează femele adulte tinere, nulipare. Femelele se împerechează cu masculi din aceeași specie și sușă, evitându-se împerecherile între animale cosangvine. La rozătoare, ziua 0 de gestație este ziua în care se observă un dop vaginal și/sau spermă; la iepuri, ziua 0 de gestație este, de obicei, ziua copulației sau a însămânțării artificiale, dacă se utilizează această tehnică. Femelele împerecheate se distribuie la întâmplare în grupurile martor și de tratament. Cuștile se aranjează astfel încât posibilele efecte cauzate de amplasarea lor să fie reduse la minimum. Fiecărui animal i se atribuie un număr unic de identificare. Femelele împerecheate se distribuie la întâmplare în grupurile martor și de tratament, iar dacă împerecherea se face în loturi, animalele din același lot se distribuie uniform în toate grupurile. În mod similar, femelele inseminate de același mascul se distribuie uniform în toate grupurile.
1.6. MOD DE LUCRU
1.6.1. Numărul și sexul animalelor
Fiecare grup tratat și grup martor trebuie să conțină un număr suficient de femele pentru a obține aproximativ 20 de femele cu puncte de implantare la autopsie. Grupurile cu sub 16 animale cu puncte de implantare riscă să fie inadecvate. Mortalitatea maternă nu invalidează obligatoriu studiul, cu condiția să nu depășească aproximativ 10 %.
1.6.2. Pregătirea dozelor
Dacă se folosește un vehicul sau un alt aditiv pentru facilitarea dozării, se iau în considerare următoarele caracteristici: efectele asupra absorbției, distribuției, metabolismului și retenției sau excreției substanței de testat; efectele asupra proprietăților chimice ale substanței de testat care i-ar putea modifica caracteristicile toxice; și efectele asupra consumului de hrană sau apă sau asupra stării nutriționale a animalelor. Vehiculul trebuie să nu fie toxic asupra dezvoltării și să nu aibă efecte asupra reproducerii.
1.6.3. Dozare
În mod normal, substanța de testat se administrează zilnic de la implantare (de exemplu, ziua 5 după împerechere) până în ziua anterioară celei planificate pentru cezariană. În cazul în care studiile preliminare, dacă sunt disponibile, nu indică un risc ridicat de pierdere preimplantare, tratamentul poate fi extins astfel încât să includă întreaga perioadă de gestație, de la împerechere până în ziua anterioară sacrificării planificate. Este binecunoscut faptul că manipularea inadecvată și stresul în perioada gestației pot genera pierderi prenatale. Ca măsură de prevenire a pierderilor prenatale cauzate de factori fără legătură cu tratamentul, se evită manipularea inutilă a animalelor gestante, precum și stresul cauzat de factori externi, precum zgomotul.
Se utilizează cel puțin trei doze diferite și un grup martor paralel. În grupurile martor și de tratament se distribuie uniform animale sănătoase. Dozele se administrează eșalonat astfel încât efectele toxice să fie graduale. Cu excepția cazului în care există limite impuse de natura fizică/chimică sau proprietățile biologice ale substanței, doza cea mai mare se alege astfel încât să inducă toxicitate asupra dezvoltării și/sau toxicitate asupra mamei (semne clinice sau o scădere a greutății corporale), dar nu decesul sau o suferință profundă. Cel puțin una dintre dozele intermediare trebuie să producă efecte toxice minime, observabile. Doza cea mai mică nu trebuie să producă niciun efect toxic asupra mamei sau asupra dezvoltării. Se selectează o serie descrescătoare a nivelurilor dozelor pentru a demonstra o eventuală relație doză-efect și nivelul dozei fără efect advers vizibil (NOAEL). Intervalul optim pentru determinarea nivelurilor descrescătoare ale dozelor este frecvent un factor de doi sau patru și este deseori de preferat să se adauge un al patrulea grup de tratament în loc să se utilizeze intervale foarte mari (de exemplu, un factor mai mare decât 10) între doze. Deși obiectivul este stabilirea unui NOAEL matern, sunt, de asemenea, acceptabile studiile care nu stabilesc un astfel de nivel (1).
Pentru selectarea nivelurilor dozelor se ține seama de datele existente privind toxicitatea, precum și de informațiile suplimentare privind metabolismul și toxicocinetica substanței de testat sau a materialelor înrudite. Informațiile în cauză se utilizează, de asemenea, pentru a demonstra că regimul de dozare este adecvat.
Se utilizează un grup martor paralel. Acest grup este supus unui tratament simulat sau unui tratament exclusiv cu vehicul, în cazul în care pentru administrarea substanței se utilizează un vehicul. Tuturor grupurilor li se administrează același volum de substanță de testat sau vehicul. Animalele din grupul martor se manipulează în același fel ca animalele din grupul de tratament. Animalelor din grupurile martor tratate doar cu vehiculul li se administrează cea mai mare cantitate de vehicul utilizată (la fel ca în grupul de tratament căruia i se administrează doza cea mai mică).
1.6.4. Testul-limită
Dacă un test cu o singură doză de cel puțin 1 000 mg/kg greutate corporală/zi administrată oral, utilizând procedurile descrise pentru prezentul studiu, nu produce efecte toxice observabile la animalele gestante sau descendenții acestora și dacă, pe baza datelor existente (de exemplu, date privind compuși înrudiți structural și/sau metabolic) nu se prevede niciun efect, este posibil să nu fie necesar un studiu complet cu trei niveluri ale dozei. Expunerea umană prevăzută poate indica necesitatea utilizării unui nivel mai ridicat al dozei administrate oral în testul-limită. Pentru alte căi de administrare, precum inhalarea sau aplicarea cutanată, proprietățile fizico-chimice ale substanței de testat pot indica și limita, deseori, nivelul maxim de expunere care poate fi atins (de exemplu, aplicarea cutanată nu trebuie să cauzeze o toxicitate locală ridicată).
1.6.5. Administrarea dozelor
Substanța de testat sau vehiculul se administrează, de obicei, oral, prin intubare. În cazul în care se utilizează o altă cale de administrare, examinatorul trebuie să își justifice și să își motiveze alegerea și pot fi necesare modificări adecvate (2) (3) (4). Substanța de testat se administrează aproximativ la aceeași oră în fiecare zi.
Doza pentru animalele individuale se calculează, în mod normal, în funcție de greutatea corporală a animalului la cea mai recentă cântărire. Cu toate acestea, în ultimul trimestru al gestației, doza se calculează cu prudență. Se utilizează datele existente privind selectarea dozei, pentru a preveni o toxicitate excesivă asupra mamei. Cu toate acestea, dacă se observă o toxicitate excesivă la femelele gestante, animalele în cauză sunt eutanasiate. Dacă mai multe animale gestante prezintă semne de toxicitate excesivă, se ia în considerare sacrificarea grupului tratat cu doza respectivă. Dacă se recurge la gavaj, substanța se administrează, de preferință, într-o singură doză animalelor, printr-o sondă gastrică sau o canulă de intubare adecvată. Volumul maxim de lichid care poate fi administrat o singură dată depinde de greutatea animalului. Volumul nu trebuie să depășească 1 ml/100 g greutate corporală, exceptând cazul soluțiilor apoase, din care se pot administra 2 ml/100 g greutate corporală. Dacă vehiculul utilizat este uleiul de porumb, volumul nu trebuie să depășească 0,4 ml/100 g greutate corporală. Se recomandă ca variațiile volumului administrat să fie reduse la minimum prin modificarea concentrațiilor, astfel încât să se asigure un volum constant la toate nivelurile dozelor.
1.6.6. Observarea femelelor gestante
Observațiile clinice se efectuează și se înregistrează cel puțin o dată pe zi, de preferință în același moment (aceleași momente) ale zilei, ținând seama de perioada de vârf a efectelor anticipate după administrarea dozei. Se înregistrează starea animalelor, inclusiv decesul, agonia, modificările comportamentale relevante și toate semnele de toxicitate evidentă.
1.6.7. Greutatea corporală și consumul de hrană
Animalele se cântăresc în ziua 0 de gestație sau nu mai târziu de ziua 3 de gestație, dacă animalele împerecheate anterior sunt furnizate de către un crescător exterior, în prima zi a tratamentului, cel puțin o dată la trei zile în perioada tratamentului și în ziua planificată pentru sacrificare.
Consumul de hrană se înregistrează o dată la trei zile, în zilele în care se cântăresc animalele.
1.6.8. Examinarea post-mortem
Femelele se sacrifică cu o zi înainte de ziua prevăzută pentru fătare. Femelele care manifestă semne de avort sau fătare prematură înainte de ziua planificată pentru sacrificare sunt sacrificate și supuse unui examen macroscopic complet.
În momentul sacrificării sau al decesului în cursul studiului, femela este examinată macroscopic pentru determinarea oricăror anomalii structurale sau modificări patologice. Evaluarea femelelor în cursul cezarienei și analizele ulterioare asupra fetusului se efectuează, de preferință, fără să se cunoască grupul de tratament, pentru a se asigura un nivel maxim de imparțialitate.
1.6.9. Examinarea conținutului uterin
Imediat după sacrificare sau imediat ce este posibil după deces, se îndepărtează uterul și se confirmă statutul de gestație al animalelor. Uterele care nu par gestante sunt supuse unui examen suplimentar (de exemplu, prin colorare cu sulfură de amoniu la rozătoare și prin colorare Salewski sau o metodă alternativă adecvată la iepuri) pentru confirmarea absenței gestației (5).
Uterele gestante, inclusiv cervixul, se cântăresc. Nu se cântăresc uterele gestante ale animalelor care au fost găsite moarte în cursul studiului.
La animalele gestante se determină numărul de corpuri galbene.
Conținutul uterin se examinează pentru a determina numărul de embrioni sau fetuși decedați și numărul de fetuși viabili. Se descrie gradul de resorbție pentru a estima momentul relativ al decesului produsului de concepție (a se vedea punctul 1.2).
1.6.10. Examinarea fetușilor
Se determină sexul și greutatea fiecărui fetus.
Se examinează fiecare fetus pentru determinarea modificărilor externe (6).
Se examinează fetușii pentru determinarea modificărilor scheletului și ale țesuturilor moi (de exemplu, variații și malformații sau anomalii) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24). Este de preferat, dar nu obligatoriu, ca modificările fetale să fie înregistrate pe categorii. Dacă se stabilesc categorii, se precizează clar criteriile pentru definirea fiecărei categorii. Se examinează cu o atenție specială tractul genital pentru a se stabili dacă prezintă modificări în dezvoltare.
La rozătoare, circa jumătate din fiecare cuib se pregătește și se examinează pentru modificări ale scheletului. Restul se pregătește și se examinează pentru modificări ale țesuturilor moi, utilizând metode de secționare serială acceptate sau adecvate sau procedând cu atenție la disecția macroscopică.
La nerozătoare, de exemplu la iepuri, se examinează toți fetușii atât pentru modificări ale țesuturilor moi, cât și pentru modificări ale scheletului. Corpul fetușilor se evaluează prin disecție atentă pentru modificări ale țesuturilor moi, putând fi utilizate inclusiv proceduri pentru evaluarea structurii cardiace interne (25). Capetele a jumătate din fetușii examinați astfel sunt prelevate și prelucrate pentru evaluarea modificărilor țesuturilor moi (inclusiv ochi, creier, pasaje nazale și limbă), utilizând metode de secționare serială (26) sau o altă metodă la fel de sensibilă. Corpurile acestor fetuși și ceilalți fetuși intacți se prelucrează și se examinează pentru modificări ale scheletului, utilizând metodele descrise pentru rozătoare.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Datele se prezintă individual atât pentru femelele gestante, precum și pentru descendenții acestora și sub forma unui rezumat tabelar care include, pentru fiecare grup de tratament și fiecare generație, numărul de animale la începutul testului, numărul de animale găsite moarte sau eutanasiate, momentul decesului sau al eutanasierii, numărul de animale care au prezentat semne de toxicitate, o descriere a semnelor de toxicitate observate, inclusiv momentul declanșării, durata și severitatea efectelor toxice, tipurile de observații asupra embrionilor/fetușilor și toate datele relevante privind cuiburile.
Rezultatele numerice se evaluează printr-o metodă statistică adecvată, utilizând cuibul ca unitate pentru analiza datelor. Se utilizează o metodă statistică general acceptată; metodele statistice se selectează în etapa de concepere a studiului și se justifică. Se includ și datele privind animalele care nu supraviețuiesc până în ziua planificată pentru sacrificare. Datele în cauză pot fi incluse în mediile grupurilor, dacă sunt relevante. Relevanța datelor obținute de la aceste animale și, prin urmare, includerea sau excluderea lor din media (mediile) grupurilor se justifică și se analizează de la caz la caz.
2.2. EVALUAREA REZULTATELOR
Rezultatele studiului de toxicitate asupra dezvoltării intrauterine se evaluează din punctul de vedere al efectelor observate. Evaluarea include următoarele observații:
— rezultatele testelor asupra mamelor și embrionilor/fetușilor, inclusiv evaluarea relației sau a absenței unei relații între expunerea animalelor la substanța de testat și incidența și gravitatea tuturor efectelor observate;
— criteriile utilizate pentru stabilirea unor categorii de modificări externe, ale țesuturilor moi și ale scheletului la fetuși, dacă s-au stabilit astfel de categorii;
— dacă este cazul, date istorice de control, pentru o mai bună interpretare a rezultatelor studiului;
— numerele utilizate pentru calcularea tuturor procentajelor și indicilor;
— o analiză statistică adecvată a rezultatelor studiului, dacă este cazul, inclusiv informații suficiente privind metoda de analiză pentru ca un revizor/statistician independent să poate reevalua și reface analiza.
În cazul unui studiu care demonstrează absența oricăror efecte toxice, se are în vedere efectuarea unor investigații suplimentare pentru a stabili absorbția și biodisponibilitatea substanței de testat.
2.3. INTERPRETAREA REZULTATELOR
Un studiu de toxicitate asupra dezvoltării intrauterine furnizează informații privind efectele expunerii repetate la o substanță în timpul gestației asupra femelelor gestante și asupra dezvoltării intrauterine a descendenților lor. Rezultatele studiului se interpretează în strânsă legătură cu rezultatele altor studii de toxicitate subcronică, de toxicitate asupra reproducerii, toxicocinetice și altele. Întrucât accentul se pune pe toxicitatea generală, prin toxicitatea asupra mamei, și pe toxicitatea asupra dezvoltării intrauterine, rezultatele studiului permit, într-o anumită măsură, să se facă diferența între efectele asupra dezvoltării în absența toxicității generale și cele care sunt induse doar la nivelul care este, de asemenea, toxic pentru animalul gestant (27).
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare include următoarele informații specifice.
Substanța de testat:
— natura fizică și, dacă sunt relevante, proprietățile fizico-chimice;
— identificare, inclusiv numărul CAS, dacă este cunoscut/stabilit;
— puritate.
Vehicul (dacă este cazul):
— justificare pentru alegerea vehiculului, dacă acesta este diferit de apă.
Animalele de experiență:
— specie și sușă utilizate;
— numărul și vârsta animalelor;
— sursă, condiții de adăpostire, hrănire etc.;
— greutatea fiecărui animal la începutul testului.
Condiții de testare:
— motivația pentru nivelurile dozelor alese;
— detalii privind formula/includerea în hrană a substanței de testat, concentrația obținută, stabilitatea și omogenitatea preparatului;
— detalii privind administrarea substanței de testat;
— transformarea concentrației de substanță de testat în hrană/apa potabilă (ppm) în doza reală (mg/kg greutate corporală/zi), dacă este cazul;
— condiții ambientale;
— detalii privind calitatea hranei și a apei.
Rezultate:
Date privind reacție toxică a femelelor gestante, în funcție de doză, inclusiv, fără a se limita la:
— numărul de animale la începutul testului, numărul de animale supraviețuitoare, numărul de animale gestante și care au avortat, numărul de animale care au fătat prematur;
— ziua decesului în cursul studiului sau dacă animalele au supraviețuit până la sacrificare;
— datele privind animalele care nu supraviețuiesc până în ziua planificată pentru sacrificare se precizează, dar nu se includ în comparațiile statistice între grupuri;
— ziua observării oricărui semn clinic anormal și evoluția sa ulterioară;
— greutatea corporală, variațiile acesteia și greutatea uterului gestant, inclusiv, opțional, variațiile de greutate corporală corectate în funcție de greutatea uterului gestant;
— consumul de hrană și, dacă se măsoară, consumul de apă;
— concluziile autopsiei, inclusiv greutatea uterului;
— se raportează valorile NOAEL pentru efecte asupra femelei gestante și asupra dezvoltării.
Puncte finale pentru dezvoltare în funcție de doză pentru cuiburi cu implantări, inclusiv:
— numărul de corpuri galbene;
— numărul de implantări, numărul și procentajul de fetuși vii și decedați și de resorbții;
— numărul și procentajul de pierderi înainte și după implantare.
Puncte finale pentru dezvoltare în funcție de doză, pentru cuiburile cu fetuși vii, inclusiv:
— numărul și procentajul de descendenți vii;
— raportul între cele două sexe;
— greutatea corporală a fetușilor, de preferință defalcat pe sexe și pentru ambele sexe;
— malformații externe, ale țesuturilor moi și ale scheletului și alte modificări relevante;
— criterii pentru includerea în diverse categorii, dacă este cazul;
— numărul total și procentajul de fetuși și cuiburi cu modificări externe, ale țesuturilor moi și ale scheletului, precum și tipurile și incidențele diverselor anomalii, precum și alte modificări relevante.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Kavlock R. J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399-410.
2. Kimmel, C. A. and Francis, E. Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386-398.
3. Wong, B. A., et al. (1997) Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CUT Activities 17; 1-8.
4. US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350; Inhalation Developmental Toxicity Study.
5. Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367.
6. Edwards, J. A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY.
7. Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171-173.
8. Igarashi, E. et al. (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Technique for Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32; 381-391.
9. Kimmel, C. A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47; 229-242.
10. Marr, M. C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476.
11. Barrow, M. V. and Taylor, W. J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127; 291-306.
12. Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313-320.
13. Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9;:398-408.
14. Kimmel, C. A. and Wilson, J. G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; 309-316.
15. Marr, M. C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; 169-181.
16. Monie, I. W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163-173.
17. Spark, C. and Dawson, A. B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411-445.
18. Staples, R. E. and Schnell, V. L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39; 61-63.
19. Strong, R. M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313-355.
20. Stuckhardt, J. L. and Poppe, S. M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teralogenesis, Carcinogenesis, and Mulagenesis 4; 181-188.
21. Walker, D. G. and Wirtschafter, Z. T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL.
22. Wilson, J. G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J. G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp. 251-277.
23. Wilson, J. G. and Fraser, F. C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY.
24. Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; 233-239.
25. Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37-38.
26. Van Julsingha, E. B. and C. G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126-144.
27. US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798-63826.
28. Wise, D. L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249-292.
B.32. STUDIU DE CANCEROGENEZĂ
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se administrează în mod normal șapte zile pe săptămână, pe o cale adecvată, o doză pe lot, la mai multe loturi de animale de experiență, pe o perioadă semnificativă din viața acestora. Pe parcursul expunerii și după expunere la substanța de testat, animalele de experiență sunt ținute sub observație zilnic pentru a detecta semnele de toxicitate, în special formarea tumorilor.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Animalele se țin în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează aleatoriu în loturi tratate și loturi martor.
În funcție de rezultatele studiilor anterioare, pot fi folosite alte specii (rozătoare sau nerozătoare). Se folosesc animale tinere, sănătoase, aparținând unei linii de laborator obișnuite și administrarea dozei începe cât mai curând după înțărcare.
La începutul studiului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie. Atunci când studiul de toxicitate subcronică prin administrare orală este efectuat ca fază preliminară a unui studiu pe termen lung, trebuie să se folosească aceeași specie și linie pentru ambele studii.
În cazul rozătoarelor se folosesc cel puțin 100 de animale (50 femele și 50 masculi) pentru fiecare doză și pentru lotul martor. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul studiului, efectivul trebuie mărit cu numărul de animale preconizate a fi sacrificate până la sfârșitul studiului.
În afara loturilor martor corespunzătoare, se mai folosesc cel puțin trei doze și un lot martor. Doza maximă ar trebui să fie suficient de mare încât să provoace semne de toxicitate minimă, de exemplu o ușoară diminuare a ritmului de creștere în greutate (mai puțin de 10 %), fără a schimba semnificativ speranța de viață normală datorită altor efecte decât tumorile.
Doza minimă nu trebuie să interfereze cu creșterea normală, dezvoltarea și longevitatea animalului sau să prezinte vreun indiciu de toxicitate. În general, această doză nu trebuie să fie mai mică de 10 % din doza maximă.
Doza sau dozele intermediare se stabilesc în intervalul mediu dintre doza maximă și cea minimă.
Alegerea nivelurilor dozei ia în considerare datele din testele și studiile de toxicitate precedente.
Frecvența expunerii este, în mod normal, zilnică.
Dacă substanța se administrează în apa de băut sau se amestecă în hrană, acestea trebuie să fie permanent disponibile.
Se folosește un lot martor care este în toate privințele identic cu loturile tratate, cu excepția expunerii la substanța de testat.
În situații speciale, cum ar fi studiile de toxicitate prin inhalare de aerosoli sau studiile de toxicitate prin administrare orală care folosesc un emulsifiant cu activitate biologică neanalizată, se poate folosi un lot martor suplimentar, care nu este expus nici la vehicul.
Cele trei căi de administrare principale sunt orală, cutanată și prin inhalare. Alegerea căii de administrare depinde de caracteristicile fizice și chimice ale substanței de testat și de calea de expunere probabilă în cazul omului.
1.6.5.1. Studii de toxicitate prin administrare orală
Atunci când substanța de testat este absorbită din tractul gastro-intestinal, iar ingestia poate fi una din căile la care poate fi expus și omul, se preferă calea orală de administrare, dacă nu există contraindicații. Animalele pot primi substanța de testat în hrană, dizolvată în apa de băut sau sub formă de capsule.
În mod ideal, se folosesc doze zilnice timp de șapte zile pe săptămână, pentru că dozarea pentru cinci zile poate permite remiterea sau diminuarea toxicității în perioadele fără tratament, afectând astfel rezultatele și evaluarea lor. Cu toate acestea, în primul rând din considerente practice, administrarea timp de cinci zile pe săptămână este acceptată.
1.6.5.2. Studii de toxicitate prin administrare cutanată
Expunerea cutanată prin badijonarea pielii poate fi folosită pentru a simula o cale principală de expunere umană și ca modalitate de inducere a leziunilor cutanate.
1.6.5.3. Studii de toxicitate prin inhalare
Deoarece studiile de toxicitate prin inhalare ridică probleme tehnice de o mai mare complexitate în comparație cu celelalte căi de administrare, în cele ce urmează se prezintă îndrumări detaliate privind acest mod de administrare. Trebuie remarcat că în anumite situații o alternativă viabilă o constituie instilațiile intratraheale.
Expunerile pe termen lung se modelează de obicei după posibila expunere a omului: substanța se administrează fie zilnic, timp de 6 ore, după echilibrarea concentrației în incintă, câte cinci zile pe săptămână (expunere intermitentă), fie, dacă se urmăresc efectele unei posibile expuneri în mediul înconjurător, timp de 22-24 ore/zi, câte șapte zile pe săptămână (expunere continuă), în acest ultim caz cu pauză de o oră/zi pentru hrănirea animalelor, în același moment al zilei și menținând condițiile specifice din incintă. În ambele cazuri, animalele sunt expuse de obicei la concentrații constante de substanță de testat. Diferența esențială dintre expunerea intermitentă și cea continuă este aceea că în primul caz există o perioadă de 17-18 ore în care animalele se pot reface după efectele fiecărei expuneri zilnice, refacere chiar mai îndelungată la sfârșit de săptămână.
Alegerea modalității de expunere – intermitentă sau continuă – depinde de obiectivele studiului și de tipul de expunere umană simulat. Cu toate acestea, trebuie avute în vedere anumite dificultăți tehnice. De exemplu, avantajul expunerii continue prin simularea condițiilor de mediu este contrabalansat de cerința hrănirii și adăpării animalelor în timpul expunerii și de necesitatea de a dispune de tehnici mai complicate (și mai fiabile) atât de generare a aerosolilor și a vaporilor, cât și de monitorizare.
Animalele se expun la substanța de testat în incinte de inhalare concepute pentru a asigura un flux continuu sau cel puțin 12 aerisiri pe oră, garantând un conținut de oxigen adecvat și o distribuție uniformă a produsului de testat în aer. Incinta martor și cea de testare trebuie să fie identice ca proiectare și construcție, astfel încât să asigure condiții comparabile sub toate aspectele, cu excepția expunerii la substanțele de testat. În incintă se menține o presiune ușor negativă pentru a împiedica pierderea substanței de testat în zona înconjurătoare. În incinte trebuie redusă la minim aglomerarea animalelor testate. De regulă, pentru a asigura stabilitatea atmosferei din incintă, volumul total al animalelor nu trebuie să depășească 5 % din volumul incintei.
Se măsoară și se controlează:
(i) fluxul de aer: debitul de aer în incintă este recomandabil să fie monitorizat continuu;
(ii) concentrația: pe parcursul expunerii zilnice, concentrația substanței de testat nu trebuie să varieze cu mai mult de ± 15 % din valoarea medie; pe întreaga durată a studiului, concentrațiile zilnice trebuie să fie menținute, pe cât posibil, la niveluri constant;
(iii) temperatura și umiditatea: în cazul rozătoarelor, temperatura trebuie menținută la 22 ± 2 oC, iar umiditatea din incintă la 30-70 %, exceptând cazurile în care se folosește apă ca mediu de suspensie pentru substanță de testat în atmosfera incintei (aerosoli). De preferință, ambii parametri trebuie să fie monitorizați continuu;
(iv) analiza granulometrică a particulelor: în atmosfera incintei unde există aerosoli lichizi sau solizi, trebuie să fie determinată distribuția granulometrică a particulelor; particulele din componența aerosolilor trebuie să aibă o dimensiune compatibilă cu respirarea lor de către animalele testate; probele din atmosfera incintei se prelevează de la nivelul zonei de respirație; probele de aer trebuie să fie reprezentative din punct de vedere al distribuției particulelor la care sunt expuse animalele și trebuie să reflecte, în termeni gravimetrici, toate suspensiile de tip aerosol, chiar dacă o mare parte din acestea nu sunt respirabile; în perioada întregului studiu este necesară menținerea concentrațiilor administrate zilnic la valori constante, pe cât este posibil; pe durata generării aerosolilor trebuie efectuată analiza granulometrică pentru a determina stabilitatea concentrației acestora și după aceea, cât de des este necesar în timpul expunerii pentru a determina în mod corespunzător măsura în care este constantă distribuția particulelor la care au fost expuse animalele.
Durata studiului de cancerogeneză acoperă o perioadă mare de timp în raport cu viața animalelor de experiență. În cazul șoarecilor și hamsterilor, testul se încheie la 18 luni de la momentul inițial, iar în cazul șobolanilor, la 24 de luni; cu toate acestea, în cazul unor linii cu longevitate mai mare și/sau cu o rată mai scăzută de apariție a tumorilor, testul se va încheia după 24 de luni în cazul șoarecilor și hamsterilor, respectiv după 30 de luni în cazul șobolanilor. Alternativ, încheierea unui asemenea test prelungit este acceptabilă atunci când numărul supraviețuitorilor în lotul martor tratat cu doza minimă atinge 25 %. Dacă după încheierea testului se înregistrează răspunsuri diferite în funcție de sex, animalele de același sex trebuie tratate separat. În cazul în care numai animalele din lotul tratat cu doza maximă mor prematur din motive evident legate de toxicitate, acest lucru nu impune încheierea testului decât dacă manifestările toxice cauzează apariția problemelor la alte loturi. Pentru ca rezultatul negativ al unui test să fie acceptabil, se impune ca maximum 10 % din animalele din fiecare lot să fie eliminate în timpul experimentului prin autoliză, canibalism sau probleme organizatorice, iar rata supraviețuitorilor din toate loturile să fie mai mare de 50 % la 18 luni de la începerea studiului pentru șoareci și hamsteri și la 24 de luni în cazul șobolanilor.
1.6.8. Mod de operare
Trebuie efectuate observații zilnice care să cuprindă eventuale modificări ale pielii, blănii, ochilor și mucoaselor, precum și ale sistemelor respirator și circulator, sistemului nervos central și autonom, ale activității somato-motrice și ale comportamentului.
Animalele sunt observate cu regularitate, pentru a evita pe cât posibil pierderea lor din motive exterioare experimentului, cum ar fi: canibalism, autoliză a țesuturilor sau greșeală de plasare a exemplarelor. Animalele muribunde sunt retrase imediat și supuse autopsiei.
Pentru toate animalele se înregistrează semnele clinice și mortalitatea. O atenție specială trebuie acordată dezvoltării tumorilor: se înregistrează momentul apariției, localizarea, dimensiunile, aspectul și dezvoltarea atât a tumorilor vizibile macroscopic, cât și a celor palpabile.
Consumul de hrană și de apă (în cazul în care substanța de testat se administrează în apa de băut) se măsoară săptămânal în primele 13 săptămâni de studiu, apoi la intervale de aproximativ trei luni, exceptând cazurile în care starea de sănătate și greutatea corporală a animalelor impun alte intervale.
Greutatea corporală trebuie înregistrată o dată pe săptămână pentru fiecare animal în timpul primelor 13 săptămâni de testare, apoi cel puțin o dată la patru săptămâni.
1.6.8.2. Examene clinice
Dacă observațiile zilnice sugerează o deteriorare a stării de sănătate a animalelor pe parcursul studiului, se stabilește formula leucocitară a fiecărui animal afectat.
La 12 luni, la 18 luni și înainte de sacrificare se recoltează probe de sânge. Se determină formula leucocitară pe probe prelevate de la animalele aparținând lotului expus la doza maximă și lotului martor. Dacă datele, în special cele obținute înainte de sacrificare, sau rezultatele examinării patologice sugerează că este necesar, se determină formula leucocitară și pentru lotul sau loturile cu doza imediat inferioară.
Se efectuează autopsia generală a tuturor animalelor, inclusiv a celor care mor pe parcursul experimentului sau care au fost sacrificate, fiind muribunde. Se conservă toate leziunile macroscopice, tumorile sau leziunile suspecte de a deveni tumori.
Toate organele și țesuturile trebuie conservate într-un mediu corespunzător în vederea unui viitor examen histopatologic: creierul (inclusiv porțiuni din bulbul rahidian, punte, cortexul cerebelos și cortexul cerebral), glanda pituitară, tiroida/paratiroida, timusul, plămânii și traheea, inima, aorta, glandele salivare, ficatul, splina, rinichii, glandele suprarenale, esofagul, stomacul, duodenul, jejunul, ileonul, cecul, colonul, rectul, uterul, vezica urinară, ganglionii limfatici, pancreasul, gonadele, organele genitale anexe, glandele mamare feminine, pielea, mușchii, nervii periferici, sternul cu măduvă, femurul (inclusiv articulația), măduva spinării la trei niveluri (cervical, toracic și lombar) și ochii.
Umplerea plămânilor și a vezicii urinare cu fixator prezintă modalitatea optimă de conservarea a acestora; în studiile de toxicitate prin inhalare, umplerea plămânilor este o cerință esențială pentru examinarea histopatologică adecvată. În cazul acestor studii, întregul tract respirator trebuie conservat, inclusiv cavitatea nazală, faringele și laringele.
(a) Se efectuează examenul histopatologic complet al organelor și țesuturilor pentru toate animalele care mor sau sunt sacrificate în perioada testului, precum și pentru toate animalele din loturile martor și loturile tratate expuse la doza maximă.
(b) Se examinează microscopic toate tumorile vizibile sau leziunile suspecte a deveni tumori, pentru fiecare lot, indiferent de organul afectat.
(c) Dacă există o diferență semnificativă între incidența apariției leziunilor neoplazice între loturile martor și lotul expus la doza maximă, atunci se impune examinarea histopatologică a organului sau a țesutului respectiv în cazul celorlalte loturi.
(d) Dacă supraviețuirea în lotul expus la doza maximă este substanțial mai mică decât în lotul martor, atunci se impune examinarea completă a loturilor expuse la doza imediat inferioară.
(e) Dacă în lotul expus la doza maximă este dovedită prezența unor efecte toxice sau de alt tip care ar putea afecta răspunsul neoplazic, atunci se impune examinarea completă la loturile expuse la doza imediat inferioară.
2. DATE
Datele se sistematizează într-un tabel care indică, pentru fiecare lot de experiență, numărul de animale la începutul testului, numărul de animale care prezintă tumori sau efecte toxice detectate în perioada testului, momentul apariției acestora, precum și numărul animalelor la care s-au constatat tumori după sacrificare. Toate rezultatele observate se evaluează cu ajutorul unei metode statistice adecvate. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia, linia, originea, condițiile ambiante, regimul alimentar;
— condițiile de testare:
— 3.1.1. Descrierea aparatului de expunere:
— inclusiv concepția, tipul, dimensiunile, sursa de aer, sistemul generator de particule și de aerosoli, metoda de condiționare a aerului, tratarea aerului expirat și, după caz, modul de adăpostire a animalelor în incinta de testare, atunci când se folosește o astfel de incintă. Se descrie echipamentul folosit pentru măsurarea temperaturii și, dacă este necesar, stabilitatea concentrației de aerosoli sau granulometria particulelor.
— 3.1.2. Datele privind expunerea:
— se prezintă sub forma unui tabel care indică valorile medii, precum și măsura variabilității (de exemplu, deviația standard) și trebuie să includă:
—(a) debitul de aer în dispozitivul de inhalare;
(b) temperatura și umiditatea aerului;
(c) concentrațiile nominale (cantitatea totală de substanță de testat introdusă în dispozitivul de inhalare raportată la volumul de aer);
(d) după caz, natura vehiculului;
(e) concentrațiile reale din zona de respirație;
(f) dimensiunile mediane ale particulelor (după caz);
— dozele (inclusiv vehiculul, dacă este cazul) și concentrațiile;
— incidența tumorilor pe sexe, doză și tip de tumoare;
— momentul morții în timpul experimentului sau indicarea faptului că animalele au supraviețuit experimentului;
— răspunsul toxic pe sexe și doză;
— efectele toxice sau de alt tip;
— momentul observării oricărui simptom anormal și evoluția acestuia;
— consumul de hrană și greutatea corporală;
— examenele hematologice întreprinse și rezultatele complete;
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor cu o descriere a metodelor utilizate, după caz;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.33. STUDIU COMBINAT DE TOXICITATE CRONICĂ ȘI DE CANCEROGENEZĂ
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Obiectivul studiului combinat de toxicitate cronică/cancerogeneză este acela de a determina efectele cronice și cancerigene ale unei substanțe după administrare prelungită la o specie de mamifere.
În acest scop, studiul de cancerogeneză se suplimentează cu cel puțin un lot satelit tratat și un lot satelit martor. Doza folosită pentru lotul satelit expus la doza maximă poate fi mai mare decât cea utilizată pe loturile expuse la doza maximă în studiile de cancerogeneză. Animalele folosite la acest test sunt examinate atât cu privire la toxicitatea generală, cât și la răspunsul cancerigen. Animalele din lotul satelit tratat sunt examinate din punct de vedere al toxicității generale.
Substanța de testat se administrează în mod normal șapte zile pe săptămână, pe o cale de administrare convenabilă, la mai multe loturi de animale, o doză pentru fiecare lot, pe o perioadă îndelungată în raport cu viața lor. În timpul și după expunerea la substanța de testat, animalele sunt observate zilnic în vederea detectării semnelor de toxicitate și a dezvoltării tumorilor.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Înainte de începerea testului, animalele tinere sănătoase se repartizează aleatoriu în loturi tratate și loturi martor.
Specia preferată este șobolanul. Pe baza rezultatelor din teste anterioare pot fi folosite și alte specii de animale (rozătoare sau nerozătoare). Se folosesc animale tinere, sănătoase, aparținând unei linii de laborator obișnuite și administrarea dozei începe cât mai curând după înțărcare.
La începutul experimentului, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie. Atunci când studiul de toxicitate subcronică prin administrare orală este efectuat ca fază preliminară a unui studiu pe termen lung, trebuie să se folosească aceeași specie și linie pentru ambele studii.
În cazul rozătoarelor se folosesc cel puțin 100 de animale (50 femele și 50 masculi) pentru fiecare doză și pentru lotul martor. Femelele trebuie să fie nulipare și negestante. Dacă se prevede sacrificarea unui număr de animale pe parcursul studiului, acest număr se adaugă la total.
Lotul sau loturile satelit tratate în scopul evaluării altor efecte patologice decât tumorile trebuie să cuprindă câte 20 de animale de fiecare sex, în timp ce lotul satelit martor trebuie să cuprindă 10 animale/sex.
Pentru studiile de cancerogeneză, se folosesc cel puțin trei doze și un lot martor. Doza maximă ar trebui să provoace semne de toxicitate minimă, de exemplu o ușoară diminuare a ritmului de creștere în greutate (mai puțin de 10 %), fără să schimbe semnificativ speranța de viață normală datorită altor efecte decât tumorile.
Doza minimă nu trebuie să interfereze cu creșterea normală, dezvoltarea și longevitatea animalului sau să prezinte vreun indiciu de toxicitate. În general, această doză nu trebuie să fie mai mică de 10 % din doza maximă.
Doza sau dozele intermediare se fixează pe segmentul mediu al intervalului dintre doza maximă și cea minimă.
Alegerea nivelurilor dozei ia în considerare datele din precedentele teste și studii de toxicitate.
Pentru studierea toxicității cronice, se includ în studiu alte loturi tratate, precum și un lot satelit martor corespunzător. Pentru animalele din lotul satelit tratat doza puternică este aleasă astfel încât să producă un efect toxic sigur.
Frecvența expunerii este, în mod normal, zilnică.
Dacă substanța chimică se administrează în apa de băut sau se amestecă în hrană, acestea trebuie să fie permanent disponibile.
Se folosește simultan un lot martor care este în toate privințele identic cu loturile tratate, cu excepția expunerii la substanța tratată.
În situații speciale, cum ar fi studiile de toxicitate prin inhalare de aerosoli sau studiile de toxicitate prin administrare orală care folosesc un emulsifiant cu activitate biologică neanalizată, se poate folosi un lot martor suplimentar care nu este expus nici la vehicul.
Cele trei căi de administrare principale sunt orală, cutanată și prin inhalare. Alegerea căii de administrare depinde de caracteristicile fizice și chimice ale substanței de testat și de calea de expunere probabilă în cazul omului.
1.6.5.1. Studii de toxicitate prin administrare orală
Atunci când substanța de testat este absorbită din tractul gastro-intestinal, iar ingestia poate fi una din căile la care poate fi expus și omul, se preferă calea orală de administrare, dacă nu există contraindicații. Animalele pot primi substanța de testat în hrană, dizolvată în apa de băut sau sub formă de capsule.
În mod ideal, se folosesc doze zilnice timp de șapte zile pe săptămână, pentru că dozarea pentru cinci zile poate permite refacerea animalului sau diminuarea toxicității în perioadele fără tratament, afectând astfel rezultatele și evaluarea lor. Cu toate acestea, în primul rând din considerente practice, administrarea timp de cinci zile pe săptămână este acceptată.
1.6.5.2. Studii de toxicitate prin administrare cutanată
Expunerea cutanată prin badijonarea pielii poate fi folosită pentru a simula o cale principală de expunere umană și ca modalitate de inducere a leziunilor cutanate.
1.6.5.3. Studii de toxicitate prin inhalare
Deoarece studiile de toxicitate prin inhalare ridică probleme tehnice de o mai mare complexitate în comparație cu celelalte căi de administrare, în cele ce urmează se prezintă recomandări detaliate privind acest mod de administrare. Trebuie remarcat că în anumite situații o alternativă viabilă o constituie instilațiile intratraheale.
Expunerile pe termen lung se modelează, de obicei, după posibila expunere a omului: substanța se administrează fie zilnic, timp de 6 ore, după echilibrarea concentrației în incintă, câte cinci zile pe săptămână (expunere intermitentă), fie, dacă se urmăresc efectele unei posibile expuneri în mediul înconjurător, timp de 22-24 ore/zi, câte șapte zile pe săptămână (expunere continuă), în acest ultim caz cu pauză de o oră/zi pentru hrănirea animalelor în același moment al zilei și menținând condițiile specifice din incintă. În ambele cazuri, animalele sunt expuse de obicei la concentrații constante de substanță. Diferența esențială dintre expunerea intermitentă și cea continuă este aceea că în primul caz există o perioadă de 17-18 ore în care animalele se pot reface după efectele fiecărei expuneri zilnice, refacere chiar mai îndelungată la sfârșit de săptămână.
Alegerea modalității de expunere – intermitentă sau continuă – depinde de obiectivele studiului și de tipul de expunere umană simulat. Cu toate acestea, trebuie avute în vedere anumite dificultăți tehnice. De exemplu, avantajele expunerii continue prin simularea condițiilor de mediu sunt contrabalansate de necesitatea hrănirii și adăpării animalelor în timpul expunerii și de necesitatea de a dispune de tehnici mai complicate (și mai fiabile) atât de generare a aerosolilor și a vaporilor, cât și de monitorizare.
Animalele se expun la substanța de testat în incinte de inhalare concepute pentru a asigura un flux continuu de cel puțin 12 aerisiri pe oră, garantând un conținut de oxigen adecvat și o distribuție uniformă a substanței de testat în aer. Incinta martor și cea de testare trebuie să fie identice ca proiectare și construcție, astfel încât să asigure condiții comparabile sub toate aspectele, cu excepția expunerii la substanțele de testat. În incintă se menține o presiune ușor negativă pentru a împiedica pierderea substanței de testat în zona înconjurătoare. În incinte trebuie redusă la minim aglomerarea animalelor testate. De regulă, pentru a asigura stabilitatea atmosferei din incintă, volumul total al animalelor nu trebuie să depășească 5 % din volumul incintei.
Se măsoară și se controlează:
(i) fluxul de aer: debitul de aer în incintă este recomandabil să fie monitorizat continuu;
(ii) concentrația: pe parcursul expunerii zilnice, concentrația substanței de testat nu trebuie să varieze cu mai mult de ± 15 % din valoarea medie; pe întreaga durată a studiului, concentrațiile zilnice trebuie să fie menținute, pe cât posibil, la niveluri constante;
(iii) temperatura și umiditatea: în cazul rozătoarelor, temperatura trebuie menținută la 22 ± 2 oC iar umiditatea din incintă la 30-70 %, exceptând cazurile în care se folosește apă ca mediu de suspensie pentru substanță de testat în atmosfera incintei. De preferință, ambii parametri trebuie să fie monitorizați continuu;
(iv) analiza granulometrică a particulelor: în atmosfera incintei unde există aerosoli lichizi sau solizi: trebuie să fie determinată distribuția granulometrică a particulelor în atmosfere ale incintei în care se folosesc aerosoli lichizi sau solizi; particulele din componența aerosolilor trebuie să aibă o dimensiune compatibilă cu respirarea lor de către animalele testate; probele din atmosfera incintei se prelevează de la nivelul zonei de respirație; probele de aer trebuie să fie reprezentative din punct de vedere al distribuției particulelor la care sunt expuse animalele și trebuie să reflecte, în termeni gravimetrici, toate suspensiile de tip aerosol, chiar dacă o mare parte din acestea nu sunt respirabile; pe durata întregului studiu este necesară menținerea concentrațiilor administrate zilnic la valori constante, pe cât este posibil; pe durata generării aerosolilor trebuie efectuată frecvent analiza granulometrică pentru a determina stabilitatea concentrației acestora și ulterior cât de des este necesar în timpul expunerii, pentru a determina în mod corespunzător măsura în care este constantă distribuția particulelor la care au fost expuse animalele.
Durata segmentului de test cu privire la cancerogeneză acoperă o perioadă mare de timp în raport cu viața animalelor de experiență. În cazul șoarecilor și hamsterilor, testul se încheie la 18 luni de la momentul inițial, iar în cazul șobolanilor – la 24 de luni; cu toate acestea, în cazul unor linii cu longevitate mai mare și/sau cu o rată mai scăzută de apariție a tumorilor, testul se va încheia după 24 de luni în cazul șoarecilor și hamsterilor, respectiv după 30 de luni în cazul șobolanilor. Alternativ, încheierea unui asemenea test prelungit este acceptabilă atunci când numărul supraviețuitorilor în lotul martor tratat cu doza minimă atinge 25 %. Dacă după încheierea testului se înregistrează răspunsuri diferite în funcție de sex, animalele de același sex trebuie tratate separat. În cazul în care numai animalele din lotul tratat cu doza maximă mor prematur din motive evident legate de toxicitate, acest lucru nu impune încheierea testului decât dacă manifestările toxice cauzează apariția problemelor la alte loturi. Pentru ca rezultatul negativ al unui test să fie acceptabil, se impune ca procentul animalelor din fiecare lot care se elimină în timpul experimentului prin autoliză, canibalism sau probleme organizatorice să nu depășească 10 %, iar rata supraviețuitorilor din toate loturile să nu fie sub 50 % la 18 luni de la începerea studiului pe șoareci și hamsteri și la 24 de luni în cazul șobolanilor.
Loturile satelit alcătuite din 20 animale/sex și loturile martor satelit corespunzătoare, alcătuite din 10 animale/sex și folosite la testarea toxicității cronice, trebuie menținute în experiment timp de cel puțin 12 luni. Aceste animale urmează să fie sacrificate pentru a examina patologia indusă de substanța de testat, dar necomplicată cu modificări gerontologice.
1.6.8. Mod de operare
Trebuie efectuate observații în cușcă zilnice care să cuprindă eventuale modificări ale pielii, blănii, ochilor și mucoaselor, precum și ale sistemului respirator, ale sistemului circulator, ale sistemului nervos central și autonom, ale activității somato-motrice și ale comportamentului.
La intervale adecvate se procedează la examinarea clinică a animalelor din lotul sau loturile satelit tratate.
Animalele sunt observate cu regularitate, pentru a evita pe cât posibil pierderea lor din motive cum ar fi canibalismul, autoliza țesuturilor sau plasarea greșită a exemplarelor. Animalele muribunde sunt retrase imediat și sunt supuse autopsiei.
Pentru toate animalele se înregistrează semnele clinice, în special modificările neurologice și oculare, și mortalitatea. O atenție specială trebuie acordată dezvoltării tumorilor: se înregistrează momentul apariției, localizarea, dimensiunile, aspectul și dezvoltarea atât a tumorilor vizibile macroscopic, cât și a celor palpabile; se înregistrează momentul apariției și evoluția stărilor toxice.
Consumul de hrană și de apă (în cazul în care substanța de testat se administrează în apa de băut) se măsoară săptămânal în primele 13 săptămâni de studiu, apoi la intervale de aproximativ trei luni, exceptând cazurile în care starea de sănătate și greutatea corporală a animalelor impun alte intervale.
Greutatea corporală trebuie înregistrată o dată pe săptămână pentru fiecare animal în timpul primelor 13 săptămâni de testare, apoi cel puțin o dată la patru săptămâni.
1.6.8.2. Examene clinice
Examenul hematologic (de exemplu: hemoglobina, hematocritul, concentrația hemoglobinei, număr de hematii, număr de leucocite sau alte măsurători ale potențialului de coagulare) trebuie realizat la trei și la șase luni și apoi la un interval de șase luni; la sfârșitul studiului se recoltează probe de sânge de la 10 șobolani/sex din toate loturile. Dacă este posibil, probele se prelevează de fiecare dată de la aceiași șobolani.
Dacă observațiile zilnice efectuate în perioada în care sunt ținute în cușcă sugerează o deteriorare a stării de sănătate a animalelor pe parcursul studiului, se stabilește formula leucocitară a fiecărui animal afectat. Se examinează formula leucocitară pe probe prelevate de la animalele din lotul expus la doza maximă și din loturile martor. La lotul sau loturile de animale expuse la dozele imediat inferioare, aceste determinări se vor efectua numai dacă se constată diferențe majore între lotul martor și lotul expus la doza maximă sau dacă există alte indicii patologice.
Trebuie colectate probe de urină de la 10 șobolani/sex din toate loturile, dacă este posibil de la aceiași șobolani, la același interval de timp, ca și în cazul examenului hematologic. Pentru fiecare animal sau pe o probă comună/sex/lot de rozătoare, se fac următoarele determinări:
— aspect: volum și densitate pentru fiecare animal;
— proteine, glucoză, corpi cetonici, hemoragii oculte (semicantitativ);
— microscopia sedimentului urinar (semicantitativ).
La intervale de aproximativ 6 luni, precum și la sfârșitul experimentului se recoltează probe de sânge pentru determinări biochimice de la toate animalele nerozătoare și de la câte 10 șobolani/sex din toate loturile, dacă este posibil de fiecare dată de la aceiași șobolani. În plus, de la nerozătoare trebuie să se recolteze probe înaintea testului. Pe plasma obținută din aceste probe se vor efectua următoarele determinări:
— concentrația proteinelor totale;
— concentrația albuminelor;
— teste ale funcției hepatice: activitatea fosfatazei alcaline, transaminază glutampiruvică (20) și transaminază oxalacetică (20) , gamma glutamil transpeptidază, ornitin decarboxilază;
— metabolismul carbohidraților, cum ar fi glucoza à jeun;
— teste ale funcției renale, cum ar fi azotul ureic din sânge.
Se efectuează autopsia generală a tuturor animalelor, inclusiv a celor care mor pe parcursul experimentului sau care au fost sacrificate, fiind muribunde. Înainte de sacrificare, se prelevează probe de sânge de la toate animalele, pentru stabilirea formulei leucocitare. Se conservă toate leziunile macroscopice, tumorile sau leziunile suspecte de a deveni tumori. Se procedează la corelarea observațiilor macroscopice cu rezultatele microscopice.
Toate organele și țesuturile trebuie conservate într-un mediu corespunzător în vederea examenului histopatologic: creier ( 21 ) (bulb rahidian, punte, cortex cerebelos și cortex cerebral), glanda pituitară, tiroida (inclusiv paratiroida), timus, plămâni (inclusiv trahee), inimă, aortă, glandele salivare, ficat (21) , splină, rinichi (21) , glande suprarenale (21) , esofag, stomac, duoden, jejun, ileon, cec, colon, rect, uter, vezica urinară, ganglioni limfatici, pancreas, gonade (21) , organele genitale anexe, glandele mamare feminine, piele, musculatură, nervi periferici, măduva spinării (cervicală, toracică, lombară) stern cu măduvă și femur (inclusiv articulația) și ochi.
Deși umplerea plămânilor și a vezicii urinare cu fixator reprezintă modalitatea optimă de conservarea a acestora, în studiile de toxicitate prin inhalare, umplerea plămânilor este o cerință esențială pentru examinarea histopatologică adecvată. În cazul acestor studii, întregul tract respirator trebuie conservat, inclusiv cavitatea nazală, faringele și laringele.
Dacă se realizează și alte examinări clinice, informațiile obținute din aceste studii trebuie să fie disponibile înainte de examinarea microscopică, deoarece pot să dea indicii medicului patolog.
Pentru segmentul studiului care urmărește toxicitatea cronică:
Se examinează în detaliu toate organele conservate ce provin de la toate animalele din lotul satelit tratat cu doza maximă și din lotul sau loturile martor. Dacă la lotul satelit tratat cu doza maximă se stabilește o patologie în legătură cu substanța de testat, organele țintă ale tuturor animalelor din orice alt lot satelit tratat vor fi examinate complet și detaliat din punct de vedere histologic, precum și animalele din loturile tratate din segmentul studiului privind cancerogeneza, la sfârșitul acestuia.
Pentru segmentul studiului care urmărește cancerogeneza:
(a) se efectuează examenul histopatologic complet al organelor și țesuturilor pentru toate animalele care mor sau sunt sacrificate în perioada testului, precum și pentru toate animalele din lotul martor și loturile expuse la doza maximă;
(b) se examinează microscopic toate tumorile vizibile sau leziunile suspecte a deveni tumori, pentru fiecare lot, indiferent de organul afectat;
(c) dacă există o diferență semnificativă între incidența apariției leziunilor neoplazice între loturile martor și lotul expus la doza maximă, atunci se impune examinarea histopatologică a organului sau a țesutului respectiv în cazul celorlalte loturi;
(d) dacă supraviețuirea în lotul expus la doza maximă este substanțial mai mică decât în lotul martor, atunci se impune examinarea completă a loturilor expuse la doza imediat inferioară;
(e) dacă în lotul expus la doza maximă este dovedită prezența unor efecte toxice sau de alt tip care ar putea afecta răspunsul neoplazic, atunci se impune examinarea completă la loturile expuse la doza imediat inferioară.
2. DATE
Datele se sistematizează într-un tabel care indică, pentru fiecare lot de experiență, numărul de animale la începutul testului, numărul de animale care prezintă tumori sau efecte toxice detectate în perioada testului, momentul apariției acestora, precum și numărul animalelor care au prezentat tumori la autopsie. Toate rezultatele observate se evaluează cu ajutorul unei metode statistice adecvate. Se poate folosi orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia, linia, originea, condițiile ambiante, regimul alimentar etc.;
— condițiile de testare:
— 3.1.1. Descrierea aparatului de expunere:
— inclusiv concepția, tipul, dimensiunile, sursa de aer, sistemul generator de particule și de aerosoli, metoda de condiționare a aerului, tratarea aerului expirat și, după caz, modul de adăpostire a animalelor în incinta de testare. Se descrie echipamentul folosit pentru măsurarea temperaturii, a umidității și, dacă este necesar, stabilitatea concentrației de aerosoli și granulometria particulelor.
— 3.1.2. Datele privind expunerea:
— se prezintă sub forma unui tabel care indică valorile medii, precum și măsura variabilității (de exemplu, deviația standard); ele trebuie să includă:
—(a) debitul de aer în dispozitivul de inhalare;
(b) temperatura și umiditatea aerului;
(c) concentrațiile nominale (cantitatea totală de substanță de testat introdusă în dispozitivul de inhalare divizată la volumul de aer);
(d) după caz, natura vehiculului;
(e) concentrațiile reale din zona de respirație;
(f) dimensiunile mediane ale particulelor (după caz);
— dozele (inclusiv vehiculul, dacă este cazul) și concentrațiile;
— incidența tumorilor pe sexe, doză și tip de tumoare;
— momentul morții în timpul studiului sau indicarea faptului că animalele au supraviețuit studiului;
— răspunsul toxic pe sexe și doză;
— descrierea efectelor toxice sau de alt tip;
— momentul observării fiecărui simptom anormal și evoluția acestuia;
— observații oftalmologice;
— consumul de hrană și greutatea corporală;
— examenele hematologice întreprinse și rezultatele complete;
— testul biochimic clinic practicat și rezultatele complete (inclusiv cele urinare);
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor histopatologice;
— tratarea statistică a rezultatelor, cu o descriere a metodelor utilizate;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.34. STUDIU DE TOXICITATE PRIVIND REPRODUCEREA LA O GENERAȚIE
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se administrează în doze crescătoare mai multor loturi de masculi și femele. Masculii trebuie tratați în timpul perioadei de creștere și pe durata a cel puțin unui ciclu spermatogen complet (aproximativ 56 de zile la șoarece și 70 de zile la șobolan), astfel încât substanța de testat să își producă efectele adverse asupra spermatogenezei.
Femelele din generația parentală (P) trebuie să fie tratate pe perioada a cel puțin două cicluri estrale complete astfel încât substanța de testat să producă efectele adverse asupra ciclului estral. Apoi animalele sunt împerecheate. Substanța de testat se administrează ambelor sexe în perioada împerecherii, iar apoi numai femelelor în perioada gestației și a alăptării. În cazul administrării prin inhalare, metoda va fi adaptată.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătire
Înainte de testare, animalele tinere sănătoase se repartizează aleatoriu în loturi tratate și loturi martor. Se țin animalele în condițiile de adăpostire și de hrănire specifice experimentului cel puțin în cele 5 zile care îl preced. Se recomandă ca substanța de testat să se administreze în hrană sau în apa de băut. Și alte căi de administrare sunt acceptabile. Aceeași metodă de administrare va fi utilizată pentru toate animalele pe tot parcursul experimentului. Dacă se folosește un vehicul sau alți aditivi pentru a facilita administrarea, aceștia trebuie să nu aibă producă toxice. Tratamentul se face zilnic, șapte zile pe săptămână.
Specia preferată este șoarecele sau șobolanul. Se folosesc animale sănătoase, care nu au mai fost supuse anterior altor experimente. Nu se recomandă folosirea liniilor cu fertilitate scăzută. Animalele de experiență trebuie caracterizate în termeni de specie, linie de descendență, sex, greutate și/sau vârstă.
Pentru o evaluare corespunzătoare a fertilității se studiază atât femelele, cât și masculii. Toate animalele tratate și cele martor trebuie înțărcate înainte de a începe tratamentul.
Fiecare lot martor și fiecare lot tratat trebuie să conțină suficiente animale pentru a se asigura un număr de 20 de femele gestante în momentul sau aproape de momentul fătării.
Obiectivul este acela de a avea un număr suficient de femele gestante și descendenți pentru a asigura o evaluare reprezentativă a potențialului substanței de testat de a afecta fertilitatea, gestația și comportamentul matern la animalele din generația P, precum și suptul, creșterea și dezvoltarea la descendenții F1, de la concepție până la înțărcare.
Hrana și apa trebuie furnizate ad libitum. În apropierea parturiției, femelele gestante se izolează în cuști speciale de fătare sau maternitate și pot primi materiale pentru construirea culcușului.
Se utilizează cel puțin trei doze și un lot martor. Dacă pentru administrarea substanței de testat se folosește un vehicul, acesta i se administrează lotului martor în volumul maxim folosit în experiment. Dacă substanța de testat conduce la scăderea consumului zilnic de hrană, ar putea fi necesar un lot martor hrănit identic. În mod ideal, dacă nu există limite impuse de natura fizică/chimică ori de efectele biologice ale substanței de testat, doza maximă trebuie să inducă efecte toxice, dar nu și mortalitate la animalele parentale (P). Doza sau dozele intermediare trebuie să inducă efecte toxice minime atribuibile substanței de testat, iar doza minimă nu trebuie să determine efecte adverse observabile la părinți sau descendenți. Dacă substanța de testat se administrează prin gavaj sau sub formă de capsule, doza trebuie stabilită în funcție de greutatea corporală a fiecărui animal în parte și ajustată săptămânal, în funcție de modificările în greutatea corporală. În cazul femelelor gestante, administrarea dozelor se poate face, dacă se dorește, în funcție de greutatea corporală în ziua 0 sau 6 de graviditate.
În cazul substanțelor cu toxicitate scăzută, dacă o doză de cel puțin 1 000 mg/kg nu prezintă nicio interferență asupra capacității de reproducere, continuarea experienței poate fi inutilă. Dacă un studiu preliminar cu doza maximă relevă o toxicitate maternă evidentă, dar nu prezintă efecte adverse asupra fertilității, atunci nu mai sunt necesare studii cu alte doze.
1.6.3.3. Desfășurarea testului
Administrarea tratamentului zilnic la masculii parentali (P) poate începe când aceștia au între cinci și nouă săptămâni, după ce au fost înțărcați și aclimatizați timp de cel puțin cinci zile. La șobolani, administrarea substanței continuă timp de 10 săptămâni înainte de perioada de împerechere (la șoareci, timp de opt săptămâni). Masculii trebuie sacrificați și examinați fie la sfârșitul perioadei de împerechere, fie, alternativ, pot fi păstrați primind regimul alimentar prevăzut în test, în vederea unei împerecheri ulterioare, fiind sacrificați și examinați înainte de terminarea studiului. În cazul femelelor parentale (P), administrarea zilnică trebuie să înceapă după cel puțin cinci zile de aclimatizare și să continue timp de cel puțin două săptămâni înainte de împerechere. Administrarea zilnică a dozei de tratament femelelor P continuă în perioada de trei săptămâni de împerechere, pe parcursul gestației și până la înțărcarea descendenților F1. Se poate avea în vedere modificarea schemei de tratament pe baza altor informații disponibile cu privire la substanța de testat cum ar fi inducerea metabolismului sau bioacumularea.
Pentru studiile de toxicitate privind reproducerea, schemele de împerechere folosite pot fi: un mascul la o femelă (1:1) sau un mascul la două femele (1:2).
În varianta împerecherii 1:1, o femelă este plasată împreună cu același mascul până când se produce fecundarea sau trec trei săptămâni. În fiecare dimineață femelele trebuie examinate pentru a identifica prezența spermei sau a dopului vaginal. Ziua „0” a sarcinii este definită ca fiind ziua în care se identifică prezența dopului vaginal sau a spermei în vagin.
Animalele care nu s-au împerecheat trebuie evaluate pentru a stabili cauza aparentei infertilități.
Evaluarea poate presupune posibilități suplimentare de împerechere cu alte exemplare dovedite ca fiind apte, examinarea microscopică a organelor de reproducere, precum și examinarea ciclului estral și a spermatogenezei.
Animalele tratate în timpul studiului de fertilitate fată normal și își cresc puii până la înțărcare, fără a se face o standardizare numerică a seriei de pui.
Dacă are loc standardizarea numerică, se recomandă următoarea metodă. Între zilele 1 și 4 după fătare se ajustează numărul feților, eliminând surplusul de pui prin selecție astfel încât să se obțină un număr de patru pui masculi și patru pui femele pentru fiecare serie de pui.
Dacă numărul de masculi sau femele fătate nu permite obținerea unui număr de patru pui de fiecare sex, se acceptă ajustarea parțială (de exemplu, cinci masculi și trei femele). Ajustările nu se aplică în cazul seriilor cu mai puțin de opt pui.
Pe toată durata testului, fiecare animal trebuie observat cel puțin o dată pe zi. Se înregistrează modificările comportamentale semnificative, semnele unor fătări dificile sau prelungite și toate semnele de toxicitate, inclusiv mortalitatea. În timpul perioadelor de pre-împerechere și de împerechere se măsoară zilnic consumul de hrană. După fătare și în perioada lactației, consumul de hrană (și de apă, în cazul în care substanța de testat se administrează în apa de băut) se măsoară în ziua în care se cântăresc puii. Masculii și femelele din generația P se cântăresc în prima zi a tratamentului, apoi săptămânal. Aceste observații se înregistrează pentru fiecare animal adult în parte.
Perioada gestației trebuie calculată din ziua 0 de graviditate. Fiecare serie de pui proveniți de la o gestantă trebuie examinat imediat după naștere, pentru a se stabili numărul și sexul puilor, numărul de pui vii și morți, precum și prezența anomaliilor macroscopice.
Puii morți și puii sacrificați în ziua a patra trebuie conservați și studiați în vederea identificării posibilelor anomalii. Puii vii se numără și se cântăresc în dimineața de după naștere, în ziua a patra și a șaptea, ulterior săptămânal până la încheierea studiului, când animalele se cântăresc individual.
Anomaliile fizice sau comportamentale observate la femele sau la descendenți trebuie înregistrate.
1.6.5. Patologie
În momentul sacrificării sau al decesului în timpul studiului, toate animalele din generația P sunt supuse unui examen macroscopic în vederea evidențierii anomaliilor structurale sau a modificărilor patologice, o atenție deosebită acordându-se organelor sistemului de reproducere. Puii muribunzi sau morți se examinează în vederea decelării eventualelor anomalii.
În vederea examinării microscopice, de la toate animalele P se conservă următoarele organe: ovare, uter, cervix, vagin, testicule, epididim, vezicule seminale, prostată, glanda coagulantă, glanda pituitară și organul sau organele țintă. În cazul în care aceste organe nu au fost examinate în cadrul altor studii cu doză multiplă, se efectuează un examen microscopic al tuturor animalelor din lotul martor și din lotul tratat cu doza maximă și, dacă este posibil, al animalelor care mor pe perioada studiului.
Dacă la aceste animale se evidențiază anomalii, organele respective se examinează la toate celelalte animale P. În aceste cazuri, se examinează microscopic toate țesuturile care prezintă modificări patologice macroscopice. După cum s-a arătat în paragraful referitor la procedura de împerechere, organele de reproducere ale animalelor suspectate de infertilitate trebuie examinate microscopic.
2. DATE
Datele se sistematizează într-un tabel care indică, pentru fiecare lot de experiență, numărul de animale la începutul testului, numărul de masculi fertili, numărul de femele gestante, tipurile de modificări și procentul de animale care prezintă fiecare tip de modificare.
Dacă este posibil, rezultatele se evaluează printr-o metodă statistică adecvată. Poate fi folosită orice metodă statistică recunoscută.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— specia/linia folosită;
— răspunsul toxic pe sexe și doză, inclusiv fertilitatea, gestația și viabilitatea;
— momentul morții în timpul studiului sau indicarea faptului că animalele au supraviețuit studiului;
— tabel cu greutatea corporală pentru fiecare serie de pui, greutatea corporală medie a puilor și greutățile corporale individuale la încheierea studiului;
— efectele toxice sau de alt tip asupra reproducerii, descendenților și evoluției postnatale;
— ziua observării oricărui simptom anormal și evoluția acestuia;
— greutatea corporală a animalelor P;
— rezultatele autopsiei;
— descrierea detaliată a tuturor observațiilor microscopice;
— tratarea statistică a rezultatelor, după caz;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.35. STUDIU DE TOXICITATE ASUPRA REPRODUCERII PE DURATA A DOUĂ GENERAȚII
1. METODĂ
Această metodă corespunde Orientării 416 (2001) a OCDE.
1.1. INTRODUCERE
Această metodă de testare a reproducerii pe durata a două generații este concepută pentru a furniza informații generale privind efectele unei substanțe de testat asupra integrității și funcționării sistemelor de reproducere masculin și feminin, inclusiv asupra funcției gonadice, ciclului estral, comportamentului de împerechere, concepției, gestației, fătării, alăptării și înțărcării și asupra creșterii și dezvoltării descendenților. Studiul poate furniza, de asemenea, informații privind efectele substanței de testat asupra morbidității și mortalității neonatale și date preliminare privind toxicitatea asupra dezvoltării prenatale și postnatale și poate constitui un ghid pentru testele ulterioare. Această metodă de testare nu studiază doar creșterea și dezvoltarea generației F1, ci evaluează, de asemenea, integritatea și funcționarea sistemelor de reproducere masculin și feminin, precum și creșterea și dezvoltarea generației F2. Pentru informații suplimentare privind toxicitatea asupra dezvoltării și deficiențele funcționale, fie pot fi incluse în acest protocol secvențe suplimentare de studiu, consultând metodele pentru toxicitatea asupra dezvoltării și/sau neurotoxicitatea asupra dezvoltării, după caz, fie aceste puncte finale pot fi studiate în cadrul unor studii separate, utilizând metodele de testare adecvate.
1.2. PRINCIPIILE METODEI DE TESTARE
Substanța de testat se administrează în doze graduale mai multor grupuri de masculi și femele. Substanța se administrează masculilor din generația P în timpul creșterii și cel puțin pe durata unui ciclu spermatogenetic complet (aproximativ 56 de zile la șoarece și 70 de zile la șobolan) pentru a pune în evidență efectele adverse asupra spermatogenezei. Efectele asupra spermei se determină în funcție de mai mulți parametri ai spermei (de exemplu, morfologia și motilitatea spermatozoizilor) și prin preparate de țesut și examene histopatologice detaliate. Dacă sunt disponibile date privind spermatogeneza dintr-un studiu anterior cu doze repetate cu o durată suficientă, de exemplu un studiu de 90 de zile, masculii din generația P nu este necesar să fie incluși în evaluare. Se recomandă totuși ca eșantioanele și înregistrările digitale ale spermei din generația P să fie păstrate, pentru a permite o evaluare ulterioară. Substanța se administrează femelelor din generația P în timpul creșterii și pe durata mai multor cicluri estrale complete pentru a detecta orice efecte adverse produse asupra normalității ciclului estral de către substanța de testat. Substanța de testat se administrează animalelor din generația parentală (P) în perioada împerecherii, pe durata gestațiilor ulterioare și până la înțărcarea descendenților lor din generația F1. După înțărcare, substanța se administrează în continuare descendenților F1 în perioada de creștere și la vârsta adultă și în perioada de împerechere și producere a generației F2, până la înțărcarea generației F2.
Observațiile clinice și examenele patologice se efectuează asupra tuturor animalelor pentru detectarea semnelor de toxicitate, acordându-se o atenție specială efectelor asupra integrității și funcționării sistemelor de reproducere masculin și feminin și asupra creșterii și dezvoltării descendenților.
1.3. DESCRIEREA METODEI DE TESTARE
1.3.1. Selectarea speciei de animale
Specia preferată pentru testare este șobolanul. Dacă se utilizează o altă specie, această opțiune se justifică și este necesar să se facă modificările adecvate. Nu se utilizează liniile cu o fecunditate scăzută sau o incidență ridicată bine-cunoscută a defectelor de dezvoltare. La începutul studiului, variațiile în greutate între animalele utilizate trebuie să fie minime și să nu depășească 20 % din greutatea medie pentru fiecare sex.
1.3.2. Condiții de adăpostire și de hrănire
În spațiul pentru adăpostirea animalelor de experiență, se asigură o temperatură de 22 oC (± 3 oC). Se asigură o umiditate relativă de 50-60 %, cu o valoare minimă de 30 % și o valoare maximă de 70 %, cu excepția momentelor în care se curăță spațiul. Spațiul se iluminează artificial, cu o alternanță de 12 ore lumină, 12 ore întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă. Animalele pot fi grupate în cuști în funcție de doză, dar numărul animalelor dintr-o cușcă nu trebuie să împiedice observarea corectă a fiecărui animal. Alegerea hranei poate fi influențată de necesitatea de a încorpora în hrană substanța de testat, dacă se administrează prin această metodă.
Animalele se adăpostesc individual sau în grupuri mici de același sex. Procedurile de împerechere se desfășoară în cuști adecvate acestui scop. După constatarea copulației, femelele împerecheate se adăpostesc individual în cuști amenajate pentru fătare și maternitate. Șobolanii împerecheați pot fi adăpostiți în grupuri mici, dar se separă cu una sau două zile înainte de fătare. Când se apropie momentul fătării, animalelor împerecheate li se asigură materialele adecvate și determinate pentru construirea cuibului.
1.3.3. Pregătirea animalelor
Se utilizează animale sănătoase, care au fost aclimatizate la condițiile de laborator timp de cel puțin 5 zile înainte și nu au fost supuse anterior altor proceduri de testare. Pentru animalele de experiență se precizează specia, sușa, sursa, sexul, greutatea și/sau vârsta. Este necesar să se cunoască legăturile colaterale dintre animale, pentru a se evita împerecherea între cosangvini. Animalele se distribuie aleatoriu în grupurile martor și de testare (se recomandă gruparea în funcție de greutate). Cuștile se aranjează astfel încât posibilele efecte cauzate de amplasarea lor să fie reduse la minimum. Fiecărui animal i se atribuie un număr unic de identificare. La animalele din generația P, identificarea se face înainte de începerea tratamentului. La animalele din generația F1, identificarea se face la înțărcare, pentru animalele selectate pentru împerechere. Pentru toate animalele selectate din generația F1 se înregistrează cuibul de origine. În plus, dacă se au în vedere cântărirea individuală a puilor sau orice alte teste funcționale, se recomandă ca identificarea individuală a puilor să se efectueze cât mai curând posibil după fătare.
Animalele din generația P trebuie să aibă circa 5 până la 9 săptămâni la începutul tratamentului. Se recomandă ca animalele din toate grupurile de tratament să aibă, în cea mai mare măsură posibilă, greutăți și vârste apropiate.
1.4. MOD DE LUCRU
1.4.1. Numărul și sexul animalelor
Fiecare grup de tratament și grup martor trebuie să conțină un număr suficient de animale pentru a obține, de preferat, cel puțin 20 de femele gestante în momentul sau în apropierea momentului fătării. În cazul substanțelor care cauzează efecte nedorite corelate tratamentului (de exemplu, sterilitate, toxicitate excesivă, la cea mai mare doză), există riscul ca acest lucru să nu fie posibil. Obiectivul este obținerea unui număr suficient de femele gestante pentru a asigura o evaluare relevantă a potențialului substanței de a afecta fertilitatea, gestația și comportamentul mamei și alăptarea, creșterea și dezvoltarea descendenților F1 de la concepție până la maturitate, precum și dezvoltarea descendenților acestora (F2), până la înțărcare. Prin urmare, faptul că nu se obține numărul dorit de animale gestante (20) nu invalidează obligatoriu studiul și se evaluează de la caz la caz.
1.4.2. Pregătirea dozelor
Se recomandă ca substanța de testat să se administreze oral (în hrană, în apa potabilă sau prin gavaj), cu excepția cazului în care o altă cale de administrare (de exemplu, prin absorbție dermică sau inhalare) este considerată a fi mai adecvată.
Dacă este necesar, substanța de testat se dizolvă într-un vehicul adecvat. Se recomandă, ori de câte ori este posibil, să se ia în considerare în primul rând utilizarea unei soluții/suspensii apoase, apoi o soluție/emulsie în ulei (de exemplu, ulei de porumb) și ulterior o altă soluție posibilă într-un alt vehicul. Pentru alte vehicule decât apa, este necesar să se cunoască proprietățile toxice ale vehiculului. Se determină stabilitatea substanței de testat în vehicul.
1.4.3. Dozare
Se utilizează cel puțin trei niveluri ale dozei și un martor paralel. Cu excepția cazului în care există limite impuse de natura fizico-chimică sau de efectele biologice ale substanței de testat, doza cea mai mare se alege astfel încât să inducă toxicitate, dar nu decesul sau o suferință profundă. În cazul unei mortalități neașteptate, studiile cu o rată a mortalității mai mică decât circa 10 procente la animalele din generația parentală (P) este totuși acceptabil, în mod normal. Se alege o serie de administrare în ordine descrescătoare a dozelor, pentru a pune în evidență o eventuală relație doză-efect și nivelul dozei fără efect advers vizibil (NOAEL). Intervalul optim pentru determinarea nivelurilor descrescătoare ale dozelor este frecvent un factor de doi sau patru și este deseori de preferat să se adauge un al patrulea grup de tratament în loc să se utilizeze intervale foarte mari (de exemplu, un factor mai mare decât 10) între doze. Pentru studiile cu administrare în hrană, intervalul între doze nu trebuie să depășească un factor de trei. Nivelurile dozelor se selectează ținând seama de datele existente privind toxicitatea, în special de rezultatele studiilor cu doze repetate. Se iau, de asemenea, în considerare orice informații disponibile cu privire la metabolismul și cinetica compusului de testat sau ale materialelor înrudite. În plus, informațiile în cauză se utilizează, de asemenea, pentru a demonstra că regimul de dozare este adecvat.
Grupul martor nu este supus tratamentului sau i se administrează exclusiv vehiculul, în cazul în care pentru administrarea substanței de testat se utilizează un vehicul. Cu excepția tratamentului cu substanța de testat, animalele din grupul martor sunt manipulate în același fel ca animalele din grupul de tratament. Dacă se utilizează un vehicul, grupului martor i se administrează cel mai mare volum utilizat de vehicul. Dacă substanța de testat se administrează în amestec cu hrana și provoacă o reducere a aportului și consumului de hrană, poate fi considerată necesară utilizarea unui grup martor hrănit în paralel. Alternativ, se pot utiliza date obținute din studii controlate, concepute pentru evaluarea efectelor unui consum redus de hrană asupra parametrilor reproducerii în locul unui grup martor simultan, hrănit în paralel.
Se iau în considerare următoarele caracteristici ale vehiculului și ale altor aditivi: efectele asupra absorbției, distribuției, metabolismului sau retenției de substanță de testat; efectele asupra proprietăților chimice ale substanței de testat care ar putea modifica caracteristicile sale toxice; și efectele asupra consumului de hrană sau apă sau asupra stării nutriționale a animalelor.
1.4.4. Testul-limită
Dacă un studiu oral cu o singură doză de cel puțin 1 000 mg/kg greutate corporală/zi sau, în cazul administrării în amestec cu hrana sau apa potabilă, un procentaj echivalent în hrana sau apa potabilă, efectuat conform procedurilor descrise pentru prezentul studiu, nu produce efecte toxice evidente nici la animalele din generația parentală, nici la descendenții acestora și, dacă, pe baza datelor privind compușii înrudiți structural și/sau metabolic, nu se prevede niciun efect toxic, este posibil să nu fie necesar un studiu complet cu mai multe niveluri ale dozei. Se efectuează testul-limită, cu excepția cazului în care expunerea umană indică necesitatea de a utiliza un nivel al dozei administrate oral mai ridicat. În cazul altor căi de administrare, precum inhalarea sau aplicarea cutanată, proprietățile fizico-chimice ale substanței de testat, precum solubilitatea, pot indica și limita, deseori, nivelul maxim de expunere posibil de realizat.
1.4.5. Administrarea dozelor
Animalelor li se administrează substanța de testat zilnic, 7 zile din 7. Se preferă administrarea pe cale orală (în amestec cu hrana, apa potabilă sau prin gavaj). Alegerea unei alte căi de administrare trebuie justificată și poate impune modificări adecvate. Substanța de testat se administrează prin aceeași metodă tuturor animalelor, pe durata adecvată a experimentului. Dacă substanța de testat se administrează prin gavaj, se utilizează o sondă gastrică. Volumul de lichid administrat o singură dată nu trebuie să depășească 1 ml/100 g greutate corporală (0,4 ml/100 g greutate corporală este volumul maxim pentru uleiul de porumb), cu excepția cazului soluțiilor apoase, din care se pot administra 2 ml/100 g greutate corporală. Cu excepția cazului substanțelor iritante sau corozive, care provoacă, în mod normal, efecte exacerbate la concentrații mai ridicate, se recomandă ca variațiile volumului administrat să fie reduse la minimum prin ajustarea concentrației, pentru a asigura un volum constant la toate nivelurile dozelor. În studiile efectuate prin gavaj, în mod normal puilor li se administrează substanța de testat doar în amestec cu lapte, până la începerea dozării indirecte după înțărcarea lor. În studiile în care se utilizează amestecul în hrană sau apa potabilă, puilor li se administrează substanța de testat direct din momentul în care încep să se hrănească singuri, în ultima săptămână a perioadei de alăptare.
Pentru substanțele administrate în amestec cu hrana sau apa potabilă, este important ca echilibrul nutrițional și hidric normal să nu fie afectat de cantitatea de substanță de testat administrată. Dacă substanța de testat se administrează în amestec cu hrana se poate utiliza fie o concentrație constantă în hrană (ppm), fie o doză constantă raportată la greutatea corporală a animalului; se specifică opțiunea utilizată. În cazul unei substanțe administrate prin gavaj, doza se administrează aproximativ la aceeași oră în fiecare zi și se ajustează cel puțin săptămânal pentru a menține un nivel constant în funcție de greutatea corporală a animalului. La ajustarea în funcție de greutate a dozei administrate prin gavaj, se ține seama de informațiile privind distribuția placentară.
1.4.6. Programe experimentale
Administrarea zilnică a substanței de testat la femelele și masculii din generația parentală (P) începe la vârsta de 5-9 săptămâni. Administrarea zilnică a substanței de testat la femelele și masculii din generația F1 începe la înțărcare; se ține seama de faptul că, în cazul substanțelor de testat administrate în amestec cu hrana sau apa potabilă, expunerea directă a puilor din generația F1 la substanța de testat poate începe încă din perioada de alăptare. La ambele sexe (P și F1), tratamentul continuă timp de cel puțin 10 săptămâni înainte de perioada de împerechere. Tratamentul continuă la ambele sexe în cele 2 săptămâni ale perioadei de împerechere. Masculii sunt eutanasiați și examinați în momentul în care nu mai sunt necesari pentru evaluarea efectelor asupra reproducerii. La femelele din generația parentală (P), tratamentul continuă pe întreaga perioadă a gestației și până la înțărcarea descendenților F1. Se ia în considerare modificarea programului de administrare în funcție de informațiile disponibile privind substanța de testat, inclusiv date existente privind toxicitatea, inducția metabolică și bioacumulare. Doza administrată fiecărui animal se calculează, în mod normal, pe greutatea corporală individuală la ultima cântărire. Cu toate acestea, ajustarea dozelor se face cu atenție în ultimul trimestru de gestație.
Tratamentul masculilor și femelelor din generațiile P și F1 continuă până la sacrificare. Toate animalele adulte din generațiile P și F1, masculi și femele, sunt eutanasiate când nu mai sunt necesare pentru evaluarea efectelor asupra reproducerii. Descendenții F1 care nu sunt selectați pentru împerechere și toți descendenții F2 sunt eutanasiați după înțărcare.
1.4.7. Procedura de împerechere
1.4.7.1. Împerecherea generației parentale (P)
Pentru fiecare împerechere, se adăpostește fiecare femelă cu un singur mascul de la același nivel al dozei (împerechere 1:1), până când are loc copulația sau expiră un termen de 2 săptămâni. În fiecare zi, femele sunt examinate pentru a detecta prezența spermei sau a dopului vaginal. Ziua 0 de gestație se definește ca ziua în care se observă spermă sau un dop vaginal. În cazurile în care împerecherea eșuează, se poate lua în calcul reîmperecherea femelelor în cauză cu masculi care și-au dovedit capacitatea reproductivă. Cuplurile împerecheate se identifică clar în cadrul datelor. Se evită împerecherea cosangvinilor.
1.4.7.2. Împerecherea generației F1
Pentru împerecherea descendenților F1 se selectează cel puțin un mascul și o femelă din fiecare cuib, la înțărcare, pentru împerecherea cu alți pui de la același nivel al dozei, dar din cuiburi diferite, pentru producerea generației F2. Selecția puilor din fiecare cuib se face aleatoriu dacă nu există diferențe majore între puii din același cuib din punctul de vedere al greutății corporale și a aspectului fizic. Dacă se observă astfel de diferențe, se selectează cei mai buni reprezentanți din fiecare cuib. Pragmatic, selecția se face cel mai ușor în funcție de greutatea corporală, dar este posibil ca selecția în funcție de aspect să fie mai relevantă. Descendenții F1 nu se împerechează înainte de a fi atins maturitatea sexuală deplină.
Cuplurile fără descendenți sunt evaluate pentru determinarea cauzei aparente a infertilității. Evaluarea include proceduri precum oportunități suplimentare de împerechere cu alți masculi sau femele care și-au dovedit capacitatea reproductivă, examinarea microscopică a organelor de reproducere și analiza ciclurilor estrale și a spermatogenezei.
1.4.7.3. A doua împerechere
În anumite situații, precum modificări ale dimensiunii cuibului corelate cu tratamentul sau observarea unor efecte echivoce la prima împerechere, se recomandă a doua împerechere a adulților P sau F1, pentru a produce un al doilea cuib. Se recomandă reîmperecherea femelelor sau masculilor care nu au produs un cuib cu animale de sex opus care și-au dovedit capacitățile reproductive. Dacă se consideră necesară producerea celui de-al doilea cuib la oricare dintre generații, animalele se împerechează din nou la aproximativ o săptămână după înțărcarea cuibului anterior.
1.4.7.4. Dimensiunea cuibului
Animalele se lasă să fete normal și să își crească descendenții până la înțărcare. Standardizarea dimensiunii cuibului este opțională. Dacă se recurge la standardizare, se descrie detaliat metoda utilizată.
1.5. OBSERVAȚIILE
1.5.1. Observațiile clinice
Se efectuează zilnic un examen clinic general, iar în cazul administrării prin gavaj, planificarea examenului clinic ține seama de perioada de vârf a efectelor după administrare. Se înregistrează modificările de comportament, semnele de fătare dificilă sau prelungită și orice semne de toxicitate. Cel puțin o dată pe săptămână fiecare animal este supus unui examen mai detaliat, care se poate efectua, pentru conveniență, simultan cu cântărirea animalului. De două ori pe zi sau o singură dată pe zi la sfârșitul săptămânii, dacă este cazul, fiecare animal este supus unui examen pentru stabilirea morbidității sau decesului.
1.5.2. Greutatea corporală și consumul de hrană/apă ale animalelor părinți
Animalele părinți (P și F1) sunt cântărite în prima zi de tratament și, ulterior, cel puțin o dată pe săptămână. Femelele părinți (P și F1) sunt cântărite cel puțin în zilele de gestație 0, 7, 14 și 20 sau 21, iar în perioada de alăptare în zilele în care sunt cântăriți puii și în ziua în care sunt sacrificate. Aceste observații se înregistrează individual pentru fiecare animal adult. În perioada de dinainte de împerechere și în perioada de gestație, consumul de hrană se măsoară cel puțin o dată pe săptămână. Consumul de apă se măsoară cel puțin o dată pe săptămână, dacă substanța de testat se administrează în apă.
1.5.3. Ciclul estral
Lungimea și normalitatea ciclului estral se evaluează la femelele P și F1 prin frotiuri vaginale înainte de împerechere și în perioada de împerechere, opțional, până la obținerea de probe ale împerecherii. La prelevarea de celule vaginale/cervicale se evită cu atenție deteriorarea mucoaselor și, prin urmare, inducerea pseudogestației (1).
1.5.4. Parametrii de evaluare a spermei
La sacrificarea tuturor masculilor din generațiile P și F1, se înregistrează greutatea testiculelor și a epididimului, păstrându-se câte un exemplar din fiecare organ pentru examenul histopatologic (a se vedea secțiunile 1.5.7, 1.5.8.1). Restul testiculelor și epididimelor de la un subgrup de cel puțin zece masculi din fiecare grup de masculi din generațiile P și F1 se utilizează pentru numărarea spermatidelor rezistente la omogenizare și, respectiv, a rezervelor de spermatozoizi din coada epididimului. De la același subgrup de masculi se colectează spermă din coada epididimului sau din canalul deferent pentru evaluarea motilității și a morfologiei spermatozoizilor. Dacă se observă efecte corelate cu tratamentul sau dacă există dovezi din alte studii privind posibilele efecte asupra spermatogenezei, se efectuează o evaluare a spermei tuturor masculilor din grupurile tratate cu diverse niveluri ale dozei; în caz contrar, evaluarea spermei se poate restrânge la masculii din generațiile P și F1 din grupul martor și grupul tratat cu cea mai mare doză.
Se determină numărul total de spermatide testiculare rezistente la omogenizare și numărul de spermatozoizi din coada epididimului (2) (3). Rezervele de spermatozoizi din coada epididimului se pot calcula din concentrația și volumul spermei din suspensia utilizată pentru realizarea evaluărilor calitative și numărul de spermatozoizi recuperați din mărunțirea și/sau omogenizarea ulterioară a țesutului caudal rămas. Evaluarea numerică se efectuează pe subgrupul de masculi selectați din grupurile tratate la toate nivelurile dozei imediat după sacrificarea animalelor, cu excepția cazului în care se fac înregistrări video sau digitale sau a cazului în care eșantioanele sunt înghețate și analizate ulterior. În aceste cazuri, se poate proceda mai întâi la analizarea grupurilor martor și a grupului tratat cu doza cea mai mare. Dacă nu se observă efecte corelate cu tratamentul (de exemplu, efecte asupra numărului de spermatozoizi, motilității și morfologiei spermatozoizilor), nu este necesar să se analizeze grupurile tratate cu alte doze. Dacă la grupul tratat cu doza cea mai mare se observă efecte corelate cu tratamentul, se evaluează și grupurile tratate cu doze mai mici.
Motilitatea spermei din epididim (sau canalele deferente) se evaluează sau se înregistrează pe suport video imediat după sacrificare. Sperma se colectează astfel încât să se evite deteriorarea organelor și se diluează pentru analiza motilității utilizând metode acceptabile (4). Procentajul de spermatozoizi cu motilitate progresivă se determină subiectiv sau obiectiv. Dacă se face o analiză a mobilității asistată de computer (5) (6) (7) (8) (9) (10), calculul motilității progresive se bazează pe limite definite de utilizator pentru viteza medie pe traiectorie, rectiliniaritate și indicele liniar. Dacă eșantioanele sunt înregistrate pe suport video (11) sau se înregistrează imagini în alt mod în momentul autopsiei, analiza ulterioară poate fi restrânsă doar la masculii P și F1 din grupul martor și grupul tratat la cea mai mare doză, cu excepția cazului în care se observă efecte corelate cu tratamentul; în acest caz, se evaluează și grupurile tratate cu doze mai mici. În absența unei imagini video sau digitale, toate eșantioanele prelevate de la toate grupurile de tratament se analizează în momentul autopsiei.
Se efectuează o evaluare morfologică a unui eșantion de spermă colectat din epididim (sau canalul deferent). Spermatozoizii (cel puțin 200 per eșantion) se examinează ca preparate fixe, lichide (12) și clasificați ca normali sau anormali. Printre anomaliile morfologice ale spermatozoizilor se numără fuziunea, capete izolate și capete și/sau cozi malformate. Evaluarea vizează subgrupul selectat de masculi din toate grupurile tratate cu diverse doze și se efectuează fie imediat după sacrificare, fie ulterior, pe baza înregistrărilor video sau digitale. Odată fixate, frotiurile pot fi citite ulterior. În aceste cazuri, se poate proceda mai întâi la analizarea grupurilor martor și a grupului tratat cu doza cea mai mare. Dacă nu se observă efecte corelate cu tratamentul (de exemplu, efecte asupra morfologiei spermatozoizilor), nu este necesar să se analizeze grupurile tratate cu alte doze. Dacă la grupul tratat cu doza cea mai mare se observă efecte corelate cu tratamentul, se evaluează și grupurile tratate cu doze mai mici.
Dacă oricare dintre parametrii de evaluare a spermei menționați anterior a fost analizat în cadrul unui studiu de toxicitate sistemică de cel puțin 90 de zile, nu este obligatoriu ca acesta să fie reevaluat în cadrul studiului pe două generații. Cu toate acestea, se recomandă păstrarea de eșantioane sau înregistrări digitale ale spermei din generația P, pentru a permite efectuarea unor evaluări ulterioare, dacă este cazul.
1.5.5. Descendenți
Se examinează fiecare cuib, cât mai curând posibil după fătare (ziua de alăptare 0) pentru stabilirea numărului de pui și a sexului acestora, a numărului de pui fătați morți, a numărului de pui vii și a prezenței unor anomalii macroscopice. Este de preferat ca puii găsiți morți în ziua 0, dacă nu sunt macerați, să fie examinați pentru detectarea posibilelor anomalii și determinarea cauzei morții și conservați. Puii vii se numără și se cântăresc individual, la naștere (ziua de alăptare 0) sau în ziua 1 și, ulterior, în zilele normale de cântărire, de exemplu, în zilele 4, 7, 14 și 21 de alăptare. Se înregistrează orice anormalități fizice sau comportamentale observate la femele sau descendenți.
Se urmărește dezvoltarea fizică a descendenților, în special prin creșterea greutății corporale. Alți parametri fizici (de exemplu, deschiderea urechilor și a ochilor, erupția dinților, creșterea blănii) pot oferi informații suplimentare, dar aceste date se evaluează, de preferință, în contextul datelor privind maturitatea sexuală (de exemplu, vârsta și greutatea corporală la deschiderea vaginului sau separarea balano-prepuțială) (13). Se recomandă efectuarea unor investigații funcționale (de exemplu, activitatea motorie, funcțiile senzoriale, ontogeneza reflexelor) asupra descendenților F1 înainte și/sau după înțărcare, în special a celor legate de maturizarea sexuală, dacă astfel de investigații nu sunt incluse în studii separate. La puii înțărcați din generația F1 selectați pentru împerechere se determină vârsta la care survine deschiderea vaginului sau separarea prepuțială. În ziua 0 după fătare se măsoară distanța ano-genitală la puii din generația F2, dacă se constantă modificări ale proporției de masculi și femele sau ale momentului maturizării sexuale la generația F1.
Se pot omite observațiile funcționale la grupurile care prezintă semne clare ale unor efecte adverse (de exemplu, o scădere semnificativă a greutății corporale etc.). Dacă se efectuează investigații funcționale, acestea nu se efectuează asupra puilor selectați pentru împerechere.
1.5.6. Autopsia
În momentul sacrificării sau al decesului în cursul studiului, toate animalele din generațiile parentale (P și F1), toți puii care prezintă anormalități externe sau semne clinice, precum și câte un pui/sex/cuib selectat aleatoriu din generațiile F1 și F2 sunt supuși unei autopsii pentru determinarea anomaliilor structurale sau a modificărilor patologice. Se acordă o atenție specială organelor sistemului de reproducere. Puii care sunt eutanasiați în stare muribundă sau puii decedați, dacă nu sunt macerați, sunt examinați pentru determinarea posibilelor defecte și/sau a cauzei decesului și conservați.
Se examinează uterele tuturor femelelor primipare, astfel încât să nu se compromită examenul histopatologic, pentru determinarea prezenței și a numărului de locuri de implantare.
1.5.7. Greutatea organelor
În momentul sacrificării, se stabilește greutatea corporală și greutatea următoarelor organe ale tuturor animalelor din generațiile parentale P și F1 (organele pereche se cântăresc individual):
— uter, ovare;
— testicule, epididime (greutate totală și greutatea cozii);
— prostată;
— vezicule seminale cu glande coagulante și fluidele lor și prostată (împreună);
— creier, ficat, rinichi, splină, glandele pituitare, tiroidă și suprarenale, precum și organele țintă cunoscute.
Se stabilește greutatea corporală la sacrificare a puilor din generațiile F1 și F2 selectați pentru autopsie. Se cântăresc următoarele organe ale puiului/sexului/cuibului selectat aleatoriu (a se vedea punctul 1.5.6): creier, splină și timus.
Dacă este posibil, rezultatele autopsiei macroscopice și greutatea organelor se analizează în corelație cu observațiile altor studii cu doze repetate.
1.5.8. Histopatologie
1.5.8.1. Animale din generațiile parentale
Se fixează și se conversă într-un mediu adecvat pentru examenul histopatologic următoarele organe și țesuturi ale animalelor din generațiile parentale (P și F1) sau eșantioane reprezentative ale acestora.
— vagin, uter cu cervix și ovare (conservate într-un fixativ adecvat);
— un testicul (conservat în fixator Bouin sau fixator analog), un epididim, vezicule seminale, prostată și glanda coagulantă;
— organul sau organele țintă identificate anterior de la toate animalele P și F1 selectate pentru împerechere.
Se efectuează un examen histopatologic complet asupra organelor și țesuturilor conservate enumerate anterior de la toate animalele P și F1 selectate pentru împerechere din grupul martor și grupul tratat cu cea mai mare doză. Examinarea ovarelor animalelor P este opțională. Se examinează, de asemenea, organele care prezintă modificări corelate cu tratamentul de la grupurile tratate cu doza cea mai mică și cu o doză intermediară, pentru a facilita determinarea NOAEL. În plus, se efectuează un examen histopatologic asupra organelor de reproducere ale animalelor tratate cu doza cea mai mică și o doză intermediară care sunt suspectate de fertilitate scăzută, de exemplu, cele care nu s-au împerecheat, nu au conceput, nu au generat sau nu au fătat descendenți sănătoși sau la care au fost afectate ciclul estral sau numărul, motilitatea sau morfologia spermatozoizilor. Se examinează toate leziunile macroscopice, precum atrofia sau tumorile.
Se efectuează un examen histopatologic detaliat al testiculelor (utilizând, de exemplu, fixator Bouin, încapsulare în parafină și secțiuni transversale de 4-5 μm grosime), pentru a identifica efectele corelate cu tratamentul, precum retenția de spermatide, straturi sau tipuri de celule germinale absente, celule multinucleate gigant sau inserția celulelor spermatogene în lumen (14). Examinarea epididimului intact vizează capul, corpul și coada și se poate realiza prin examinarea unei secțiuni longitudinale. Se examinează epididimul pentru detectarea infiltrației de leucocite, modificarea tipurilor de celule preponderente, tipuri de celule aberante și fagocitoza spermatozoizilor. Pentru examinarea organelor masculine de reproducere se poate utiliza colorarea cu periodic acid Schiff (PAS) și hematoxilină.
În perioada de după alăptare, ovarul trebuie să conțină foliculi primordiali și foliculi în creștere, precum și marile corpuri galbene ale lactației. Examenul histopatologic relevă o scădere calitativă a populației de foliculi primordiali. Se efectuează o analiză cantitativă a foliculilor primordiali la femelele F1; numărul de animale, selectarea secțiunii ovariene și dimensiunea eșantionului de secțiuni trebuie să corespundă din punct de vedere statistic procedurii de evaluare utilizate. Examenul include numărarea foliculilor primordiali, care pot fi amestecați cu foliculi mici în creștere, pentru compararea uterelor tratate cu uterele martor (15) (16) (17) (18) (19).
1.5.8.2. Pui înțărcați
Se fixează și se conservă într-un mediu adecvat pentru examenul histopatologic țesuturile care prezintă anormalități macroscopice și organele țintă de la toți puii care prezintă anomalii externe sau semne clinice, precum și de la puiul/sexul/cuibul selectat aleatoriu din generațiile F1 și F2 care nu au fost selectați pentru împerechere. Se face o descriere histopatologică a țesuturilor conservate, acordându-se o atenție specială organelor sistemului de reproducere.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Datele se prezintă individual și sub forma unui rezumat tabelar, prezentându-se, pentru fiecare grup de tratament și fiecare generație, numărul de animale la începutul testului, numărul de animale găsite moarte în cursul testului sau eutanasiate, data decesului sau a eutanasierii, numărul de animale fertile, numărul de femele gestante, numărul de animale care prezintă semne de toxicitate, o descriere a semnelor de toxicitate observate, inclusiv momentul declanșării, durata și gravitatea efectelor toxice, tipul de observații asupra animalelor parentale și descendenților, tipul de modificări histopatologice și toate datele relevante privind cuiburile.
Datele numerice se evaluează printr-o metodă statistică adecvată, general acceptată; metodele statistice se selectează în etapa de concepere a studiului și se justifică. Modelele statistice doză-reacții pot fi utile pentru analiza datelor. Raportul trebuie să includă informații suficiente privind metoda de analiză și programul computerizat utilizate pentru ca un revizor/statistician independent să poată reevalua și reface analiza.
2.2. EVALUAREA REZULTATELOR
Rezultatele acestui studiu de toxicitate asupra reproducerii pe două generații se evaluează în funcție de efectele observate, inclusiv rezultatele autopsiei și ale examenului microscopic. Evaluarea include relația sau absența unei relații între doza de substanță de testat și prezența sau absența, incidența și gravitatea unor anomalii, inclusiv leziuni macroscopice, organe țintă identificate, efecte asupra fertilității, anomalii clinice, efecte asupra producerii și asupra performanțelor descendenților, modificări ale greutății corporale, efecte asupra mortalității și orice alte efecte toxice. La evaluarea rezultatelor se iau în considerare proprietățile fizico-chimice ale substanței de testat și, dacă sunt disponibile, date privind toxicocinetica.
Un test de toxicitate efectuat corespunzător generează o estimare satisfăcătoare a nivelului la care nu se observă efecte și permite înțelegerea efectelor adverse asupra reproducerii, fătării, alăptării și dezvoltării postnatale, inclusiv asupra creșterii și dezvoltării sexuale.
2.3. INTERPRETAREA REZULTATELOR
Un studiu de toxicitate asupra reproducerii pe două generații furnizează informații privind efectele expunerii repetate la o substanță în toate etapele ciclului de reproducere. Studiul furnizează în special informații privind parametrii reproducerii și asupra dezvoltării, creșterii, maturizării și supraviețuirii descendenților. Rezultatele studiului se interpretează în strânsă legătură cu rezultatele studiilor de toxicitate subcronică, de toxicitate asupra dezvoltării intrauterine, de toxicocinetică și ale altor studii disponibile. Rezultatele acestui studiu pot fi utilizate pentru a se determina necesitatea efectuării altor teste asupra unei substanțe. Extrapolarea rezultatelor studiului la om este valabilă într-o măsură restrânsă. Rezultatele studiului sunt mai utile pentru a furniza informații privind nivelurile fără efecte adverse și nivelul admisibil de expunere umană (20) (21) (22) (23).
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare include următoarele informații:
Substanța de testat:
— natura fizică și, dacă sunt relevante, proprietățile fizico-chimice;
— date de identificare;
— puritate.
Vehicul (dacă este cazul):
— justificarea vehiculului ales, în cazul unui vehicul altul decât apa.
Animalele de experiență:
— specie/sușă utilizată;
— numărul, vârsta și sexul animalelor;
— sursă, condiții de adăpostire, hrană, materiale pentru construirea cuibului etc.;
— greutatea fiecărui animal la începutului testului.
Condiții de testare:
— motivație pentru nivelul selectat al dozei;
— detalii privind formula/includerea în hrană a substanței de testat, concentrația obținută;
— stabilitatea și omogenitatea preparatului;
— detalii privind administrarea substanței de testat;
— transformarea concentrației de substanță de testat în hrană/apa potabilă (ppm) în doza reală (mg/kg greutate corporală/zi), dacă este cazul;
— detalii privind calitatea hranei și a apei.
Rezultate:
— consumul de hrană și consumul de apă, dacă este disponibil, eficiența hranei (creștere a greutății corporale per gram de hrană consumată) și consumul de material testat la animalele P și F1, exceptând perioada de coabitare și cel puțin ultima treime a perioadei de alăptare;
— date privind absorbția (dacă sunt disponibile);
— date privind greutatea corporală a animalelor P și F1 selectate pentru împerechere;
— date privind greutatea cuibului și a puilor;
— greutatea corporală la sacrificare și date privind greutatea absolută și relativă a organelor la animalele parentale;
— natura, gravitatea și durata semnelor clinice (dacă sunt reversibile sau nu);
— data decesului în cursul studiului sau date privind animalele care au supraviețuit până la sacrificare;
— date privind reacția toxică în funcție de sex și doză, inclusiv indici de împerechere, fertilitate, gestație, fătare, viabilitate și alăptare; raportul prezintă cifrele utilizate pentru calcularea indicilor;
— efecte toxice sau de altă natură asupra reproducerii, descendenților, creșterii postnatale etc.;
— concluziile autopsiei;
— o descriere detaliată a tuturor observațiilor histopatologice;
— numărul de femele P și F1 cu ciclul normal și durata ciclului;
— numărul total de spermatozoizi în coada epididimului, procentul de spermatozoizi cu motilitate progresivă, procentajul de spermatozoizi normali din punct de vedere morfologic și procentajul de spermatozoizi pentru fiecare anomalie identificată;
— perioada până la împerechere, inclusiv numărul de zile până la împerechere;
— durata gestației;
— numărul de implantări, corpuri galbene, dimensiunea cuiburilor;
— numărul de pui născuți vii și pierderi după implantare;
— numărul de pui cu anomalii macroscopice, numărul de pui mai mici decât normal, dacă se determină;
— date privind reperele fizice la pui și alte date privind dezvoltarea postnatală; reperele fizice evaluate se justifică;
— date privind investigațiile funcționale la pui și adulți, după caz;
— prelucrarea statistică a rezultatelor, dacă este cazul.
Discutarea rezultatelor.
Concluzii, inclusiv valorile NOAEL pentru efectele asupra femelelor gestante și descendenți.
4. REFERINȚE BIBLIOGRAFICE
1. Sadleir, R. M. F. S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York.
2. Gray, L. E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12; 92-108.
3. Robb, G. W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54; 103-107.
4. Klinefelter, G. R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5; 39-44
5. Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3); 237- 244.
6. Chapin, R. E. et al., (1992). Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6; 267-273
7. Klinefelter, G. R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13:409-421.
8. Slott, V. L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449-458.
9. Slott, V. L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida, pp. 319-333.
10. Toth, G. P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10:401-415.
11. Working, P. K. and M. Hurtt, (1987). Computerised Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330-337.
12. Linder, R. E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491-505.
13. Korenbrot, C. C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17; 298-303.
14. Russell, L. D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida.
15. Heindel, J. J. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida.
16. Heindel, J. J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421-426.
17. Manson, J. M. and Y. J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York.
18. Smith, B. J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5; 379-383.
19. Heindel, J. J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C. A. Kimmel, (eds.), ILSI Press, Washington, DC.
20. Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and C. D. Klaassen (eds.), Pergamon, New York.
21. Zenick, H. and E. D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A. W. Hayes (ed.), Raven Press, New York.
22. Palmer, A. K. (1981). In: Developmental Toxicology, Kimmel, C. A. and J. Buelke-Sam (eds.), Raven Press, New York.
23. Palmer, A. K. (1978). In Handbook of Teratology, Vol. 4, J. G. Wilson and F.C. Fraser (eds.), Plenum Press, New York.
B.36. TOXICOCINETICA
1. METODĂ
1.1. INTRODUCERE
A se vedea introducerea generală partea B.
1.2. DEFINIȚII
A se vedea introducerea generală partea B.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se administrează pe calea corespunzătoare. În funcție de scopul studiului, substanța poate fi administrată în doză unică sau în doze repetate, pe anumite perioade de timp determinate, pe unul sau mai multe loturi de animale. Ulterior, în funcție de tipul studiului, se vor determina substanța și/sau metaboliții acesteia în fluidele corpului, în țesuturi și/sau în produsele de excreție.
Studiile pot fi făcute cu forme ale substanței de testat „nemarcate” sau „marcate”. În cazul în care se utilizează un marcaj, acesta trebuie poziționat în substanță în așa fel încât să furnizeze maximul de informații cu privire la evoluția compusului.
1.5. CRITERII DE CALITATE
Niciunul.
1.6. DESCRIEREA METODEI DE TESTARE
Pregătirea testului
Animalele tinere adulte, sănătoase, sunt aclimatizate la condițiile de laborator cu cel puțin cinci zile înainte de începerea experimentului. Înainte de testare, animalele sunt repartizate aleatoriu în loturile de tratament. În situații speciale, se pot utiliza animale foarte tinere, femele gestante sau animale pretratate.
Condiții de testare
Studiile de toxicocinetică se efectuează pe una sau mai multe specii adecvate și trebuie să ia în considerare speciile folosite sau care urmează să fie folosite în alte studii toxicologice pentru aceeași substanță. Dacă pentru un test se folosesc rozătoare, diferența de greutate între animale nu trebuie să depășească cu mai mult de ± 20 % valoarea medie.
Pentru studiile de absorbție sau excreție, fiecare lot tratat trebuie să cuprindă inițial patru animale. Alegerea în funcție de sexe nu este obligatorie, dar în anumite circumstanțe ar putea fi necesară studierea animalelor de ambele sexe. Dacă răspunsul la substanța de testat diferă în funcție de sex, trebuie testate câte patru animale din fiecare sex. În cazul studiilor pe nerozătoare, se pot utiliza mai puține animale. În studiile privind distribuția tisulară, pentru stabilirea mărimii inițiale a lotului se va ține seama de numărul de animale care trebuie sacrificate la fiecare dată fixată pentru examinare, precum și de numărul preconizat de examinări.
Dacă se studiază metabolismul, mărimea lotului depinde de cerințele studiului. În cazul studiilor cu doze multiple și cu examene intermediare multiple, mărimea lotului se stabilește în funcție de numărul de examinări și sacrificări planificate, însă nu trebuie să fie mai mică de două animale. Mărimea lotului trebuie să fie suficientă pentru a permite o evaluare acceptabilă a absorbției, a platoului și a depleției (după caz) substanței de testat și/sau ale metaboliților.
În cazul administrării unei doze unice, se utilizează cel puțin două niveluri. Se utilizează o doză mică, la care să nu se observe efecte toxice și o doză mare, la care pot să apară modificări ale parametrilor toxicocinetici sau la care apar efecte toxice.
În cazul administrării dozelor repetate, doza mică este, de obicei, suficientă, însă în anumite circumstanțe poate fi necesară și o doză mare.
În studiile de toxicocinetică se folosește aceeași cale și, după caz, același vehicul ca în celelalte studii de toxicitate. Substanța de testat se administrează loturilor de animale de experiență oral, prin gavaj sau în hrană, prin inhalații sau aplicații cutanate, pe perioade prestabilite. Administrarea intravenoasă a substanței de testat poate fi utilă în determinarea absorbției pe alte căi, pentru comparație. În plus, se pot afla informații importante asupra modului de distribuție imediat după administrarea intravenoasă a substanței.
Se ia în considerare posibilitatea interferenței dintre substanța de testat și vehicul. O atenție deosebită trebuie acordată diferențelor de absorbție dintre administrarea prin gavaj și cea prin hrană, precum și necesității de a stabili doza cu acuratețe, în special atunci când substanța de testat se administrează în hrană.
Toate animalele trebuie observate zilnic, înregistrându-se semnele de toxicitate și alte particularități clinice, momentul apariției, amploarea și durata acestora.
După cântărirea animalelor de experiență, substanța se administrează pe o cale adecvată. Dacă se consideră relevant, animalele pot fi private de hrană înainte de administrarea substanței.
Nivelul și gradul de absorbție a substanței administrate pot fi evaluate folosind metode variate, cu sau fără lot de referință ( 22 ), de exemplu, prin:
— stabilirea cantității de substanță de testat și/sau a metaboliților în produse de excreție cum ar fi: urina, bilă, fecale, aerul expirat și rezidual;
— compararea răspunsului biologic (de exemplu studii de toxicitate acută) între loturile tratate, martor și/sau de referință;
— compararea cantității de substanță excretată pe cale renală și/sau a metaboliților la loturile tratate și de referință;
— determinarea ariei de sub curba formată concentrația plasmă/timp a substanței și/sau a metaboliților, comparativ cu datele obținute de la lotul de referință.
În prezent, sunt disponibile două metodologii pentru analizarea modelelor de distribuție:
— obținerea de informații calitative utile folosind tehnici autoradiografice ale întregului corp;
— obținerea de informații cantitative prin sacrificarea animalelor la momente diferite după expunere și determinarea concentrației și cantității totale de substanță și/sau metaboliți în țesuturi și organe.
În studiile de excreție se colectează: urină, fecale, aer expirat și, în anumite circumstanțe, bilă. Cantitatea de substanță de testat și/sau metaboliții în aceste produse de excreție se măsoară de mai multe ori după administrare, până când aproximativ 95 % din doza administrată a fost excretată sau timp de șapte zile, dacă procentul menționat nu a fost atins înainte de acest termen.
În cazuri speciale, se poate determina excreția substanței în secreția lactată a animalelor de experiență care alăptează.
Pentru a se stabili calea metabolică și intensitatea metabolismului, probele biologice se analizează prin utilizarea unor tehnici corespunzătoare. Atunci când se caută răspuns la unele întrebări ridicate în studii toxicologice anterioare, trebuie elucidate structurile metaboliților și sugerate căile metabolice adecvate. Ar putea fi utilă efectuarea de studii in vitro în vederea obținerii de informații cu privire la căile metabolice.
Informații suplimentare despre relația dintre metabolism și toxicitate pot fi obținute prin studii biochimice, cum ar fi cele referitoare la determinarea efectelor asupra sistemelor enzimatice metabolizante, depleția din compușii endogeni a grupărilor sulfhidril non-proteice și stabilirea legăturii chimice dintre substanță și macromolecule.
2. DATE
În funcție de tipul studiului realizat, rezultatele sunt sistematizate sub formă de tabele însoțite, după caz, de grafice. Pentru fiecare lot tratat se vor specifica media și variația statistică a măsurătorilor în raport cu timpul, doza, țesuturile și organele, după caz. Gradul de absorbție și cantitatea și ritmul excreției se stabilesc prin metode corespunzătoare. Dacă se realizează studii de metabolism, se indică structura metaboliților identificați și căile metabolice posibile.
3. RAPORT
3.1. RAPORTUL DE TESTARE
În funcție de tipul de studiu realizat, raportul de testare trebuie să cuprindă următoarele informații:
— specia, linia, sursa, condițiile ambiante, regimul alimentar;
— caracterizarea materialelor folosite pentru marcare, după caz;
— dozele și intervalele de administrare folosite;
— calea sau căile de administrare și vehiculul folosit;
— efectele toxice sau de alt tip;
— metodele pentru determinarea substanței de testat și/sau metaboliți din probele biologice, inclusiv din aerul expirat;
— prezentarea sub formă de tabele a măsurătorilor în funcție de sex, doză, regim, moment, țesuturi și organe;
— prezentarea gradului de absorbție și excreție în funcție de timp;
— metodele pentru caracterizarea și identificarea metaboliților din probele biologice;
— metodele biochimice referitoare la metabolism;
— căile de metabolizare propuse;
— discutarea rezultatelor;
— interpretarea rezultatelor.
3.2. EVALUARE ȘI INTERPRETARE
A se vedea introducerea generală partea B.
4. REFERINȚE BIBLIOGRAFICE
A se vedea introducerea generală partea B.
B.37. NEUROTOXICITATE ÎNTÂRZIATĂ A SUBSTANȚELOR ORGANOFOSFORICE DUPĂ EXPUNERE ACUTĂ
1. METODĂ
1.1. INTRODUCERE
Atunci când se face evaluarea efectelor toxice ale unor substanțe, este important să se studieze capacitatea pe care o prezintă unele substanțe de a provoca anumite tipuri de neurotoxicitate pe care alte tipuri de studii nu ar putea să le evidențieze. Unii compuși organofosforici prezintă o neurotoxicitate întârziată și trebuie să fie analizate în cadrul unor asemenea studii.
Teste de depistare in vitro pot fi utilizate în vederea identificării substanțelor care pot provoca o polineuropatie întârziată; cu toate acestea, rezultatele negative în urma unor teste in vitro nu sunt suficiente pentru a demonstra că substanța testată nu este neurotoxică.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Substanțele organofosforice includ esteri, tioesteri organofosforici neîncărcați sau anhidride ale acizilor organofosforici, organofosfonici sau organofosforamidici sau ale acizilor fosforotioci, fosfonotioci sau fosforotioamidici din aceeași clasă sau ale unor substanțe care pot provoca neurotoxicitatea întârziată detectabilă câteodată la substanțele din această clasă.
Neurotoxicitatea întârziată este un sindrom asociat cu instalarea prelungită a unei ataxii întârziate, asociate cu axonopatii distale la nivelul măduvei spinării și a nervilor periferici și cu o inhibare și o îmbătrânire a esterazei caracteristică neuropatiilor (neuropathy target esterase – NTE) în țesuturile nervoase.
1.3. SUBSTANȚE DE REFERINȚĂ
O substanță de referință poate fi testată pe un lot martor pozitiv, astfel încât să se demonstreze că, în condițiile de testare, reacția preconizată a speciei nu s-a schimbat în mod semnificativ.
Un exemplu de substanță neurotoxică cu spectru larg de utilizare este fosfat tri-o-tolil-ul (nr. CAS 78-30-8, nr. EINECS 201-103-5, nomenclatura CAS: acid fosforic, tris(2-metilfenil)ester, cunoscut și sub numele de tris-o-cresilfosfat).
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța testată va fi administrată pe cale orală, într-o singură doză, unor găini de casă protejate, după caz, contra efectelor colinergice acute. Animalele sunt ținute sub observație timp de 21 de zile în vederea detectării anomaliilor de comportament, unei ataxii sau a unei paralizii. Sunt efectuate măsurători biochimice, în special pentru evidențierea inhibării esterazei NTE, pe găinile selecționate aleator din fiecare grup, în general la 24 și la 48 de ore după administrare. La 21 de zile după expunere, găinile care au mai rămas sunt sacrificate și se va efectua o examinare histopatologică a țesuturilor nervoase selecționate.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Pregătirea testului
Găini adulte tinere, fără afecțiuni virale sub tratamente care pot intra în interferență cu substanța testată și care nu prezintă tulburări ale aparatului locomotor, sunt distribuite aleator în grupuri experimentale și în loturi martor și lăsate să se aclimatizeze la condițiile de laborator cel puțin cu cinci zile înaintea începerii testului.
Cuștile sau incintele sunt destul de voluminoase pentru a permite o mișcare liberă găinilor, astfel încât mersul lor să poată fi observat ușor.
Substanța testată va fi administrată în general pe cale orală, prin gavaj sau în capsule de gelatină sau printr-o metodă asemănătoare. Substanțele lichide pot fi administrate în mod direct sau dizolvate într-un vehicul adecvat, cum ar fi uleiul de porumb; substanțele solide trebuie dizolvate, dacă este posibil, altfel se poate întâmpla ca importante cantități de substanțe solide administrate în capsule de gelatină să nu fie absorbite în mod corespunzător. Dacă vehiculul este altul decât apa, caracteristicile sale toxice trebuie să fie cunoscute sau, în caz contrar, determinate înaintea începerii testului.
1.5.2. Condiții de testare
1.5.2.1. Animalele de experiență
Specia recomandată este găina domestică ouătoare adultă și tânără, de o vârstă cuprinsă între 8-12 luni (Gallus gallus domesticus). Se vor folosi rase și linii pure de mărime standard; în mod normal, găinile folosite au fost crescute în condiții care le-au permis mișcarea liberă.
1.5.2.2. Număr și sex
În afară de grupul experimental, va fi selecționat și un lot martor căruia i se administrează doar vectorul, precum și un lot martor pozitiv. Grupul căreia i se administrează doar vectorul va fi tratat la fel ca și grupul experimental, singura excepție constând în administrarea substanței testate.
Trebuie selecționat un număr suficient de ridicat de animale în fiecare grup, astfel încât să se poată sacrifica cel puțin șase în vederea efectuării măsurărilor biochimice (trei la ambele prelevări) și astfel încât să supraviețuiască cel puțin șase după perioada de observație de 21 de zile.
Lotul martor pozitiv poate fi studiat în paralel sau se pot folosi datele unui studiu realizat recent. Trebuie să fie constituit din cel puțin șase găini adulte tratate cu un produs neurotoxic cunoscut, cu efect întârziat; trei găini sunt rezervate măsurărilor biochimice și trei evidențierii semnelor patologice. Se recomandă actualizarea periodică a datelor istorice colectate anterior. Sunt selecționate alte grupuri martor pozitiv, în cazul în care una dintre condițiile esențiale ale testului (cum ar fi linia pură, alimentația, adăpostirea) va fi modificată de către laboratorul care efectuează testul.
1.5.2.3. Doze
Se recomandă efectuarea unui studiu preliminar pe un număr adecvat de găini, distribuite aleator în grupuri experimentale tratate cu doze diferite, în vederea determinării dozei care va fi utilizată în cadrul studiului principal. O anumită rată a mortalității este inevitabilă în acest studiu preliminar. Cu toate acestea, pentru a se evita moartea din cauza efectelor colinergice acute, se poate folosi atropina sau un alt agent protector care să nu perturbe reacția neurologică întârziată. Se pot folosi metode de testare diverse pentru a se evalua doza maximă care nu este letală la o substanță dată (a se vedea metoda B.1 bis). Datele colectate anterior pe găini sau alte informații de ordin toxicologic sunt luate, de asemenea, în considerare la determinarea dozei.
Doza utilizată în studiul principal trebuie să fie cât se poate de ridicată, avându-se în vedere rezultatele studiului anterior și limita superioară de 2 000 mg/kg greutate corporală. Oricare ar fi rata mortalității, trebuie să supraviețuiască un număr suficient de animale pentru a se putea efectua măsurările biochimice (șase) și examenele histologice (șase), în cea de-a 21-a zi. Se va utiliza atropina sau un alt agent care nu perturbă reacțiile neurotoxice întârziate, astfel încât să se evite mortalitatea datorită efectelor colinergice acute.
1.5.2.4. Testul-limită
Atunci când un test efectuat pe baza metodelor descrise în prezentul studiu, la o doză de cel puțin 2 000 mg/kg greutate corporală/zi nu produce efecte toxice detectabile și dacă informațiile cu privire la substanțe cu structuri asemănătoare nu indică toxicitatea acestora, nu este necesar să se efectueze un studiu cu o doză mai ridicată. Testul-limită este justificat, cu excepția cazului în care condițiile de expunere umană impun utilizarea unei doze mai ridicate.
1.5.3. Perioada de observație
Perioada de observație este de 21 de zile.
1.5.4. Procedură
După administrarea unui agent protector în vederea evitării provocării morții din cauza efectelor colinergice acute, se administrează substanța testată într-o singură doză.
Observațiile încep imediat după expunere. Toate găinile sunt observate cu grijă de mai multe ori în cursul primelor două zile, după care cel puțin o dată pe zi, timp de 21 de zile sau până în data sacrificării. Se înregistrează toate manifestările de toxicitate, data apariției anomaliilor de comportament, tipul, gravitatea și durata lor. Ataxia se măsoară cu ajutorul unei scale de evaluare obișnuite cu cel puțin patru niveluri; paralizia trebuie consemnată. Cel puțin de două ori pe săptămână găinile destinate evidențierii semnelor patologice, sunt scoase din cuști și supuse unei activități locomotorii forțate, cum ar fi de exemplu urcarea pe scară, astfel încât să se faciliteze examinarea manifestării efectelor toxice ușoare. Animalele muribunde sau cele care prezintă semne de suferință sau dureri intense trebuie excluse imediat din studiu, eutanasiate și autopsiate.
Toate găinile sunt cântărite cu puțin înaintea administrării substanței, după care cel puțin o dată pe săptămână.
Șase găini selecționate aleator din fiecare grup experimental și din grupurile martor negative, precum și trei găini din lotul martor pozitiv (dacă testul este realizat în paralel și pe acesta) sunt sacrificate câteva zile după administrare, creierul și măduva spinării din zona lombară sunt preparate și analizate în vederea detectării inhibării esterazei caracteristică neuropatiilor. Pe lângă aceasta, poate să fie necesară și analiza inhibării acestei esteraze pe nervul sciatic. În general, sunt sacrificate trei găini din lotul martor și din fiecare grup experimental, după 24 de ore și alte trei, după 48 de ore, iar cele trei găini din lotul martor pozitiv sunt sacrificate după 24 de ore. Dacă observarea semnelor clinice de intoxicare (estimate deseori pe baza momentului apariției efectelor colinergice) indică faptul că substanța toxică se elimină în mod foarte lent, se poate să fie preferabilă prelevarea țesuturilor de la trei găini la alte intervale de timp, între 24 sau cel mult 72 de ore după administrare.
Dacă este necesar, se pot efectua, de asemenea, determinări de acetilcolinesterază (AChE) pe eșantioane. Cu toate acestea, poate avea loc in vivo o reactivare spontană a acetilcolinesterazei, fapt care ar duce la subestimarea activității de inhibitor de AChE a substanței.
Autopsia tuturor animalelor (sacrificii prevăzute sau impuse de starea animalului) trebuie să includă o examinare a aspectului creierului și a măduvei spinării.
Țesuturile nervoase ale tuturor animalelor care au supraviețuit după perioada de observație și care nu au fost utilizate pentru măsurări biochimice, trebuie să fie supuse unui examen microscopic. Țesuturile trebuie fixate in situ prin tehnica perfuziei. Secțiunile sunt practicate la nivelul cerebelului (pe plan longitudinal mediu), al bulbului rahidian, al măduvei spinării și al nervilor periferici. Secțiunile din măduva spinării sunt practicate pe segmentul cervical superior, în regiunea toracică medie și în regiunea lombo-sacrală. Se vor efectua secționări și în partea distală al nervului tibial, la nivelul ramurilor acestuia spre mușchii gastrocnemieni, precum și la nivelul nervului sciatic. Secțiunile sunt colorate cu ajutorul unor coloranți adecvați, specifici mielinei și axonilor.
2. DATE
De regulă, rezultatele obținute pentru diferitele criterii de evaluare reținute (biochimice, histopatologice și cele referitoare la examinarea comportamentului) sunt negative, în mod normal, nu mai este nevoie să se recurgă la teste de neurotoxicitate întârziată. Rezultatele ambigue sau neconcludente pot impune continuarea studiului.
Datele sunt indicate pentru fiecare animal separat. Pe lângă aceasta, datele sunt incluse într-un tabel care va indica la fiecare grup experimental, numărul de animale prezente la începutul testului, numărul de animale care prezintă leziuni, anomalii de comportament sau modificări biochimice, tipul și gravitatea leziunilor sau tulburărilor, precum și procentajul de animale care prezintă fiecare tip de leziuni sau tulburări, la diferite niveluri de gravitate.
Rezultatele acestui studiu trebuie evaluate din punct de vedere al incidenței lor asupra efectelor comportamentale, biochimice și histopatologice sau asupra oricărui alt efect observat la grupurile experimentale și cele martor sau din punct de vedere al gravității acestora și al corelării dintre ele.
Rezultatele cifrice sunt evaluate cu ajutorul unei metode statistice adecvate și recunoscute. Metoda statistică trebuie să fie aleasă cu ocazia elaborării studiului.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare va conține, pe cât posibil, următoarele informații:
3.1. Animale de experiență:
— linia pură utilizată;
— numărul animalelor, vârsta, sexul;
— originea, condiții de adăpostire etc.;
— greutatea corporală a fiecărui animal la începutul testului.
3.2. Condiții de testare:
— detalii cu privire la prepararea substanței testate și la stabilitatea și omogenitatea preparatului, dacă este posibil;
— justificarea alegerii vehiculului;
— detalii cu privire la administrarea substanței testate;
— detalii asupra calității hranei și a apei;
— justificarea alegerii dozei;
— specificarea dozelor administrate, cu indicații detaliate cu privire la vehicul, la volumul și starea de agregare a substanței administrate;
— eventual, identitatea agentului protector utilizat și detalii cu privire la administrarea acestuia.
3.3. Rezultate:
— informații cu privire la greutatea corporală;
— informații cu privire la reacția toxică pe grupuri, inclusiv mortalitatea;
— natura, gravitatea și durata efectelor clinice observate (eventual, reversibilitatea acestora);
— descrierea detaliată a metodelor și rezultatelor biochimice;
— rezultatele autopsiei;
— descrierea detaliată a tuturor rezultatelor histopatologice;
— prelucrare statistică a rezultatelor, după caz.
Evaluarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
Această metodă corespunde Orientării 418 a OCDE.
B.38. NEUROTOXICITATE ÎNTÂRZIATĂ A SUBSTANȚELOR ORGANOFOSFORICE – STUDIU CU ADMINISTRARE ÎN MOD REPETAT PE O DURATĂ DE 28 DE ZILE
1. METODĂ
1.1. INTRODUCERE
Atunci când se face evaluarea efectelor toxice ale unor substanțe, este important să se studieze capacitatea pe care o prezintă unele substanțe de a provoca anumite tipuri de neurotoxicitate pe care alte tipuri de studii nu ar putea să le evidențieze. Unii compuși organofosforici prezintă o neurotoxicitate întârziată și trebuie să fie supuși unor asemenea studii.
Teste de depistare in vitro pot fi utilizate în vederea identificării substanțelor care ar putea provoca o polineuropatie întârziată; cu toate acestea, rezultatele negative în urma unor teste in vitro nu sunt suficiente pentru a demonstra că substanța testată nu este neurotoxică.
Acest test de neurotoxicitate întârziată pe o durată de 28 de zile furnizează informații despre eventualele riscuri pentru sănătate, ca urmare a unor expuneri repetate în cursul unei perioade determinate. Acest test furnizează informații asupra relației doză-efect, precum și o estimare a nivelului dozei care nu are efecte nefaste detectabile și care poate fi utilă la stabilirea criteriilor de securitate în cazul unei expuneri.
A se vedea, de asemenea, introducerea generală partea B.
1.2. DEFINIȚII
Substanțele organofosforice includ esteri, tioesteri organofosforici neîncărcați sau anihidrați ale acizilor organofosforici, organofosfonici sau organofosforamidici sau ale acizilor fosforotioci, fosfonotioci sau fosforotioamidici din aceeași clasă sau ale altor substanțe care pot provoca neurotoxicitatea întârziată detectabilă câteodată la substanțele din această clasă.
Neurotoxicitatea întârziată este un sindrom asociat cu instalarea prelungită a unei ataxii întârziate, asociate cu axonopatii distale la nivelul măduvei spinării și a nervilor periferici și cu o inhibare și o îmbătrânire a esterazei caracteristică neuropatiilor (neuropathy target esterase – NTE) în țesuturile nervoase.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța testată se administrează pe cale orală, timp de 28 de zile, unor găini de casă. Animalele sunt observate cel puțin o dată zilnic, până în a 14-a zi după administrarea ultimei doze, în vederea detectării tulburărilor de comportament, a unei ataxii sau a unei paralizii. Sunt efectuate măsurări biochimice, în special pentru evidențierea inhibării esterazei NTE, pe găinile selecționate aleator din fiecare lot, în general la 24 și la 48 de ore după ultima administrare. La două săptămâni după ultima administrare, găinile care au mai rămas sunt sacrificate și se efectuează examinarea histopatologică a țesuturilor nervoase selecționate.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătirea testului
Găini adulte tinere, fără afecțiuni virale supuse unor tratamente care pot intra în interferență cu substanța testată și care nu prezintă tulburări ale aparatului locomotor, sunt distribuite aleator în grupuri experimentale și în loturi martor și sunt lăsate să se aclimatizeze la condițiile de laborator, cel puțin cu cinci zile înaintea începerii testului.
Cuștile sau incintele sunt destul de voluminoase pentru a permite o mișcare liberă găinilor, astfel încât mersul lor să poată fi observat ușor.
Substanța testată va fi administrată zilnic, șapte zile din șapte, pe cale orală, prin gavaj sau prin capsule de gelatină. Substanțele lichide pot fi administrate în mod direct sau dizolvate într-un vehicul adecvat, cum ar fi uleiul de porumb; substanțele solide trebuie dizolvate, dacă este posibil, altfel se poate întâmpla ca importante cantități de substanțe solide administrate în capsule de gelatină să nu fie absorbite în mod corespunzător. Dacă vehiculul este altul decât apa, caracteristicile sale toxice trebuie să fie cunoscute sau, în caz contrar, trebuie determinate înaintea începerii testului.
1.4.2. Condiții de testare
Specia recomandată este găina domestică ouătoare adultă și tânără, de o vârstă cuprinsă între 8-12 luni (Gallus gallus domesticus). Se folosesc rase și linii pure de mărime standard; în mod normal, găinile folosite au fost crescute în condiții care le-au permis mișcarea liberă.
Ca regulă generală, se lucrează cu cel puțin trei grupuri experimentale și un lot martor căreia i se administrează doar vectorul. Grupul căreia i se administrează doar vectorul, va fi tratat la fel ca și grupul experimental, singura excepție constând în administrarea substanței testate.
Trebuie selecționat un număr suficient de ridicat de animale în fiecare grup, astfel încât să se poată sacrifica cel puțin șase găini în vederea efectuării măsurărilor biochimice (trei la ambele prelevări) și astfel încât să supraviețuiască cel puțin șase după perioada de observație de după tratament de 14 zile.
Dozele trebuie selecționate ținându-se de cont de rezultatele unui test de neurotoxicitate întârziată după expunere acută și de orice alte informații disponibile cu privire la toxicitatea sau la cinetica substanței testate. Se selecționează doza cea mai ridicată, astfel încât aceasta să producă efecte toxice și de preferință o neurotoxicitate întârziată, fără să ducă însă la moarte sau la suferințe intense. După aceasta se definesc o serie de doze descrescătoare, astfel încât să se evidențieze o eventuală relație doză-efect, precum și o doză minimă fără niciun efect detectabil.
Atunci când un test efectuat pe baza metodelor descrise în prezentul studiu, la o doză de cel puțin 1 000 mg/kg greutate corporală/zi, nu produce efecte toxice detectabile și dacă informațiile relevante despre substanțe cu structuri asemănătoare nu indică toxicitatea acestora, nu este necesară efectuarea unui studiu la o doză mai ridicată. Testul-limită este justificat, cu excepția cazului în care condițiile de expunere umană impun utilizarea unei doze mai ridicate.
Toate animalele sunt observate cel puțin o dată zilnic, în timpul expunerii și în următoarele 14 zile, dacă nu este programată sacrificarea lor în vederea efectuării autopsiei.
1.4.3. Mod de lucru
Substanța testată se administrează zilnic, șapte zile din șapte, timp de 28 de zile.
Observațiile încep imediat după expunere. Toate găinile sunt observate cu atenție cel puțin o dată pe zi, în timpul celor 28 de zile de tratament și în cursul celor 14 zile după ultima administrare sau până în data sacrificării. Sunt notate toate manifestările de toxicitate, data apariției, tipul, gravitatea și durata lor. Observația are în vedere tulburările de comportament, dar nu trebuie să se limiteze la acestea. Ataxia va fi măsurată cu ajutorul unei scale de evaluare obișnuite cu cel puțin patru niveluri; paralizia trebuie consemnată. Cel puțin de două ori pe săptămână găinile sunt scoase din cuști și supuse unei activități locomotorii forțate, cum ar fi de exemplu urcarea pe scară, astfel încât să se faciliteze examinarea manifestării efectelor toxice ușoare. Animalele muribunde sau cele care prezintă semne de suferință sau dureri intense trebuie excluse imediat din studiu, eutanasiate și supuse autopsiei.
Toate găinile sunt cântărite cu puțin înaintea primei administrări a substanței, după care cel puțin o dată pe săptămână.
Șase găini selecționate aleator din fiecare grup experimental și din grupurile martor cărora li se administrează doar vectorul, sunt sacrificate câteva zile după ultima administrare; creierul și măduva spinării din zona lombară se prepară și se analizează în vederea detectării inhibării esterazei caracteristice neuropatiilor (NTE). Pe lângă aceasta, poate să fie necesară și analiza inhibării acestei esteraze pe nervul sciatic. În general, sunt sacrificate trei găini din lotul martor și din fiecare grup experimental, 24 de ore după ultima administrare și alte trei, după alte 24 de ore, și anume 48 de ore după ultima administrare; dacă pe baza rezultatelor studiului prin expunere acută sau ale altor studii (studiul toxicocinetic, de exemplu) se consideră că ar fi indicată alegerea unor altor intervale de timp pentru sacrificii, acestea pot fi modificate în consecință cu condiția furnizării documentelor justificative.
Dacă este necesar, se pot efectua, de asemenea, măsurări de acetilcolinesterază (AChE) pe eșantioane. Cu toate acestea, poate avea loc in vivo o reactivare spontană a acetilcolinesterazei, fapt care ar duce la subestimarea activității de inhibitor de AChE a substanței.
Autopsia tuturor animalelor (sacrificii prevăzute sau impuse de starea animalului) trebuie să includă o examinare a aspectului creierului și a măduvei spinării.
Țesuturile nervoase ale tuturor animalelor care au supraviețuit după perioada de observație și care nu au fost utilizate pentru măsurări biochimice, trebuie să fie supuse unui examen microscopic. Țesuturile trebuie fixate in situ prin tehnica perfuziei. Secțiunile sunt practicate la nivelul cerebelului (pe plan longitudinal mediu), al bulbului rahidian, al măduvei spinării și al nervilor periferici. Secțiunile la măduva spinării sunt practicate în segmentul cervical superior, în regiunea toracică medie și în regiunea lombo-sacrală. Se vor efectua secționări și în partea distală a nervului tibial și la nivelul ramurilor acestuia spre mușchii gemeni ai tricepsului, precum și la nivelul nervului sciatic. Secțiunile sunt colorate cu ajutorul unor coloranți adecvați, specifici mielinei și axonilor. Mai întâi, examinarea histopatologică va fi efectuată asupra țesuturilor conservate prelevate de la toate animalele din grupul experimental cărora li s-a administrat doza cea mai ridicată și din lotul martor. Dacă există efecte detectabile la grupul căruia i s-a administrat doza cea mai ridicată, se va efectua un examen microscopic și asupra țesuturilor animalelor cărora li s-a administrat doza intermediară, respectiv doza cea mai scăzută.
2. DATE
De regulă, dacă rezultatele obținute pentru diferitele criterii de evaluare reținute la această metodă (biochimice, histopatologice și cele referitoare la comportament) sunt negative, nu mai este nevoie să se recurgă la teste de neurotoxicitate întârziată. Rezultatele ambigue sau neconcludente pot impune continuarea studiului.
Datele sunt indicate pentru fiecare animal individual. Pe lângă aceasta, datele sunt incluse într-un tabel care va indica la fiecare grup experimental, numărul de animale prezente la începutul testului, numărul de animale care prezintă leziuni, anomalii de comportament sau modificări biochimice, tipul și gravitatea acestor leziuni sau simptome, precum și procentajul de animale care prezintă fiecare tip de leziuni sau simptome la diferite niveluri de gravitate.
Rezultatele acestui studiu trebuie evaluate din punct de vedere al incidenței lor asupra efectelor comportamentale, biochimice și histopatologice sau asupra oricărui alt efect observat la grupurile experimentale și cele martor sau din punct de vedere al gravității acestora și al corelării dintre ele.
Rezultatele cifrice sunt evaluate cu ajutorul unei metode statistice adecvate și recunoscute. Metoda statistică va fi aleasă cu ocazia elaborării studiului.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare va conține, dacă este posibil, următoarele informații:
3.1. Animale de experiență:
— linia pură utilizată;
— numărul animalelor, vârsta;
— originea, condiții de adăpostire etc.;
— greutatea corporală a fiecărui animal la începutul testului.
3.2. Condiții de testare:
— detalii cu privire la prepararea substanței testate și la stabilitatea și omogenitatea preparatului, dacă este posibil;
— justificarea alegerii vehiculului;
— detalii cu privire la administrarea substanței testate;
— detalii asupra calității hranei și a apei;
— justificarea alegerii dozei;
— specificarea dozelor administrate, cu indicații detaliate cu privire la vehicul, la volumul și la starea de agregare a substanței administrate;
— dacă măsurările biochimice nu sunt efectuate la 24 și 48 de ore după ultima administrare, justificarea alegerii intervalelor de timp practicate.
3.3. Rezultate:
— informații cu privire la greutatea corporală;
— informații cu privire la reacția toxică pe grupuri, inclusiv mortalitatea;
— nivelul dozei fără efect nefast detectat;
— natura, gravitatea și durata efectelor clinice detectate (eventual, reversibilitatea acestora);
— descrierea detaliată a metodelor și rezultatelor biochimice;
— rezultatele autopsiei;
— descrierea detaliată a tuturor rezultatelor histopatologice;
— prelucrare statistică a rezultatelor, după caz.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
Această metodă corespunde Orientării 419 a OCDE.
B.39. TEST IN VIVO DE SINTEZĂ NEPROGRAMATĂ A ADN (UDS) PE CELULE HEPATICE DE MAMIFERE
1. METODĂ
Prezenta metodă este reprodusă după Orientarea 486 a OCDE, Testul in vivo de sinteză neprogramată a ADN (UDS) pe celule hepatice de mamifere (1997).
1.1. INTRODUCERE
Scopul testului in vivo de sinteză neprogramată a ADN (UDS) pe celule hepatice de mamifere este identificarea substanțelor de testat care induc regenerarea ADN în celulele hepatice ale animalelor (1) (2) (3) (4).
Prezentul test in vivo oferă o metodă pentru studiul efectelor genotoxice ale produselor chimice în ficat. Efectul măsurat este o indicație a deteriorării ADN și a regenerării ulterioare a acestuia în celulele hepatice. Ficatul este, de obicei, principalul loc de metabolism al compușilor absorbiți. De aceea, este un loc corespunzător pentru determinarea in vivo a degradării ADN.
Dacă există dovezi că substanța de testat nu ajunge la țesutul țintă, nu este indicată utilizarea prezentului test.
Sinteza neprogramată a ADN (UDS) se determină prin încorporarea nucleozidelor marcate în celulele care nu suferă o sinteză programată (faza S) a ADN. Metoda utilizată cel mai frecvent constă în determinarea prin autoradiografie a timidinei marcate cu tritiu 3H-TdR) care a fost încorporată. Pentru testele in vivo, USD se preferă utilizarea ficatului de șobolan. Se pot utiliza și alte țesuturi, dar acestea nu constituie obiectul prezentei metode.
Detectarea unui răspuns UDS depinde de numărul de baze din ADN excizate și înlocuite la locul modificării. Prin urmare testul UDS este valoros în special pentru detectarea regenerării secvențelor lungi (20-30 de baze) induse de substanță. Spre deosebire de acestea, pentru detectarea regenerării secvențelor scurte (1-3 baze) este necesară o sensibilitate mult mai mică. În plus, datorită nereparării, unei reparări eronate sau a unei replicări eronate a leziunilor din ADN, pot apărea fenomene mutagene. Amploarea răspunsului UDS nu oferă nicio indicație despre fidelitatea procesului de regenerare. În plus, este posibilă reacția unui mutagen cu ADN, fără ca modificarea ADN rezultată să poată fi remediată printr-un proces de reparare prin excizie. În testul UDS, lipsa informațiilor specifice privind activitatea mutagenă este compensată de sensibilitatea potențială a acestui efect, care se poate măsura în totalitatea genomului.
A se vedea și introducerea generală partea B.
1.2. DEFINIȚII
Celule în curs de reparare: număr net de grăunți nucleari (NNG) mai mare decât o valoare prestabilită, ce trebuie justificată de laboratorul care realizează testul.
Număr net de grăunți nucleari (NNG): măsură cantitativă a activității UDS a celulelor în testele autoradiografice UDS, calculată prin scăderea numărului mediu de grăunți citoplasmici din zonele citoplasmice echivalente nucleului (CG) din numărul de grăunți nucleari (NG): NNG = NG – CG. NNG se calculează pentru celulele individuale, iar apoi se extrapolează pentru celulele dintr-o cultură, din culturi paralele etc.
Sinteza neprogramată a ADN (UDS): sinteza reparării ADN după excizia și eliminarea unui fragment din ADN, ce conține o regiune deteriorată indusă de acțiunea unor substanțe chimice sau a unor agenți fizici.
1.3. PRINCIPIUL METODEI DE TESTARE
Testul in vivo UDS pe celule hepatice de mamifere indică o sinteză de reparare a ADN după excizia și eliminarea unui fragment din ADN, ce conține o regiune deteriorată indusă de acțiunea unor substanțe chimice sau a unor agenți fizici. Testul se întemeiază, de obicei, pe încorporarea 3H-TdR în ADN-ul celulelor hepatice care prezintă o frecvență redusă de celule în faza S a ciclului celular. Încorporarea 3H-TdR se determină, de obicei, prin autoradiografie, deoarece această tehnică nu este sensibilă la interferența cu celulele în fază S, așa cum este, de exemplu, numărătoarea în scintilație lichidă.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Pregătirea testului
1.4.1.1. Selectarea speciei de animale
Se utilizează, de obicei, șobolani, deși se poate utiliza orice specie de mamifere. Se recomandă utilizarea unor animale adulte tinere sănătoase din sușe folosite în mod curent în laborator. La începutul studiului, greutatea animalelor ar trebui să prezinte variații minime, ce nu trebuie să depășească ± 20 % din greutatea medie a fiecărui sex.
1.4.1.2. Condițiile de adăpostire și de hrănire
Se aplică condițiile generale menționate în introducerea generală partea B, dar umiditatea atinsă ar trebui să fie de 50-60 %.
1.4.1.3. Pregătirea animalelor
Animalele adulte tinere sănătoase se distribuie în mod aleatoriu în grupe martor și grupe de tratament. Cuștile ar trebui să se aranjeze astfel încât posibilele efecte datorate amplasării acestora să fie reduse la minim. Animalele sunt identificate individual și se țin în cuștile lor timp de minimum cinci zile înainte de începerea studiului, pentru a permite aclimatizarea acestora la condițiile de laborator.
1.4.1.4. Substanța de testat/Preparare
Substanțele de testat în stare solidă ar trebui să se preparare sub formă de soluții sau suspensii în solvenții sau vehiculele corespunzătoare și să se dilueze, dacă este cazul, înainte de a fi administrate animalelor. Substanțele de testat lichide se pot administra direct sau dilua înainte de administrare. Se recomandă utilizarea preparatelor proaspete de substanță de testat, cu excepția cazului în care există date care să demonstreze stabilitatea acestora în caz de păstrare.
1.4.2. Condițiile de testare
1.4.2.1. Solventul/vehiculul
Solventul/vehiculul nu ar trebui să producă efecte toxice la dozele utilizate și nu ar trebui să existe suspiciunea reacției chimice a acestuia cu substanța de testat. Utilizarea altor solvenți/vehicule decât cele recunoscute ar trebui să fie justificată cu date care să demonstreze compatibilitatea acestora. Se recomandă ca, ori de câte ori este posibil, să se prefere utilizarea unui solvent/vehicul apos.
1.4.2.2. Martorii
Martorii pozitivi și negativi (solvent/vehicul) utilizați în paralel ar trebui să se includă în fiecare parte a experimentului, realizată independent. Cu excepția tratamentului cu substanța de testat, manipularea animalelor din grupele martor ar trebui să fie identică cu cea a animalelor din grupele tratate.
Martorii pozitivi ar trebui să fie substanțe despre care se știe că produc UDS atunci când se administrează în doze de expunere estimate a genera o creștere detectabilă în raport cu fondul. Martorii pozitivi care necesită o activare metabolică ar trebui să se utilizeze în doze care provoacă un răspuns moderat (4). Dozele se pot alege astfel încât să se obțină efecte clare, dar fără să releve imediat examinatorului identitatea lamelelor codificate. În tabelul următor se prezintă exemple de substanțe care se pot utiliza ca martori pozitivi:
|
Momentele de prelevare a probelor |
Substanța |
Nr. CAS |
Nr. EINECS |
|
Primele prelevări (2-4 ore) |
N-nitrozodimetilamină |
62-75-9 |
200-249-8 |
|
Ultimele prelevări (12-16 ore) |
N-2-fluorenilacetamidă (2-AAF) |
53-96-3 |
200-188-6 |
Se pot utiliza și alte substanțe corespunzătoare ca martori pozitivi. Martorul pozitiv ar trebui să se administreze pe o cale diferită de cea pentru substanța de testat.
1.5. MOD DE LUCRU
1.5.1. Numărul și sexul animalelor
Ar trebui să se utilizeze un număr suficient de animale pentru a ține seama de variația răspunsului testului în funcție de natura biologică. Ar trebui să se utilizeze un număr de minimum trei animale analizabile din fiecare grupă. Dacă în momentul studiului există date acumulate din experimentele anterioare, sunt necesare doar unul sau două animale pentru grupele de martorii pozitivi și negativi analizate în paralel.
Dacă în momentul studiului există date disponibile din studii pe aceleași specii, în care s-a folosit aceeași cale de expunere, care să demonstreze lipsa unor diferențe substanțiale de toxicitate între sexe, atunci va fi suficientă testarea pe animale de un singur sex, de preferință de sex masculin. Dacă expunerea umană la produse chimice este specifică sexului, ca în cazul unor produse farmaceutice, testul ar trebui să se realizeze pe animale de sexul corespunzător.
1.5.2. Modalitatea de tratare
Substanțele se administrează în general într-o singură repriză.
1.5.3. Dozele
În mod normal, se utilizează minimum două doze diferite. Doza maximă se definește ca doza ce produce astfel de semne de toxicitate, încât dozele mai mari, administrate în același mod, se estimează că sunt letale. În general, doza mai mică trebuie să fie egală cu 50 % până la 25 % din doza mare.
Substanțele cu activitate biologică specifică la doze mici netoxice (ca hormonii și mitogenii) pot să facă excepție de la criteriile de stabilire a dozelor și ar trebui evaluate pentru fiecare caz în parte. Dacă, în lipsa datelor corespunzătoare, se realizează un studiu pentru stabilirea dozelor, acesta ar trebui să se realizeze în același laborator și să utilizeze aceeași specie, aceeași sușă de animale de același sex și regimul de tratare să fie același ca cel ce urmează să fie utilizat în studiul principal.
Doza maximă se mai poate defini ca doza care produce anumite semne de toxicitate în ficat (de exemplu nuclee picnotice).
1.5.4. Testul-limită
Dacă un test realizat cu o doză de minimum 2 000 mg/kg greutate corporală, administrată într-o singură repriză sau în două reprize în aceeași zi, nu produce efecte toxice detectabile și dacă o genotoxicitate este improbabilă pe baza datelor referitoare la substanțe cu o structură apropiată, se poate considera că un studiu complet nu este necesar. În funcție de expunerea umană preconizată, ar putea fi necesară o doză mai mare în testul limită.
1.5.5. Administrarea dozelor
Substanța de testat se administrează, de obicei, prin cavitatea nazală cu ajutorul unui tub stomacal sau a unei canule de intubație adaptate. Se pot accepta și alte căi de administrare, dacă se pot justifica. Cu toate acestea, calea intraperitoneală nu se recomandă, deoarece probabilitatea de expunere a ficatului este mai mare decât la administrarea prin intermediul sistemului circulator. Volumul maxim de lichid care se poate administra prin sondă gastrică introdusă prin cavitatea nazală sau prin injecție într-o singură repriză depinde de dimensiunea animalului de laborator. Volumul ar trebui să fie mai mic sau egal cu 2 ml/100 g greutate corporală. Utilizarea unor volume mai mari decât cel menționat ar trebui să se justifice. Cu excepția substanțelor iritante și corozive, care vor prezenta în mod normal efecte exacerbate la concentrații mai mari, variația volumului testat ar trebui să fie redusă la minim prin ajustarea concentrației, astfel încât să se asigure un volum constant pentru toate dozele.
1.5.6. Prepararea celulelor hepatice
Prelevarea celulelor hepatice de la animalele tratate se realizează, de obicei, după 12-16 ore de la administrarea dozei. În general, mai este necesară o prelevare (de obicei, după 2-4 ore de la tratament), cu excepția cazului în care există un răspuns pozitiv net după 12-16 ore. Cu toate acestea, se pot utiliza și alte momente de prelevare, dacă datele toxicokinetice justifică acest lucru.
Culturile pe termen scurt de celule hepatice de mamifere se realizează, de obicei, perfuzând ficatul in situ cu colagenază și lăsând celulele hepatice proaspăt disociate să se fixeze pe o suprafață corespunzătoare. Celulele hepatice de la animale martori negativi ar trebui să aibă o viabilitate (5) de minimum 50 %.
1.5.7. Determinarea UDS
Celulele hepatice proaspăt izolate se supun în general incubării într-un mediu, ce conține 3H-TdR, pentru o perioadă de timp corespunzătoare, de exemplu 3-8 ore. La încheierea perioadei de incubare, ar trebui ca mediul să fie îndepărtat de pe celule, care pot să fie incubate apoi într-un mediu ce conține timidină nemarcată în exces, pentru diminuarea radioactivității neîncorporate („cold chase”). Celulele sunt apoi spălate, fixate și uscate. Pentru perioade de incubare mai lungi, s-ar putea ca procedeul „cold chase” să nu fie necesar. Lamelele sunt imersate în soluție autoradiografică, păstrate la întuneric (de exemplu refrigerate timp de 7-14 zile), developate, colorate și apoi se procedează la numărarea grăunților de argint expuși. Pentru fiecare animal se pregătesc două până la trei lamele.
1.5.8. Analiza
Preparatele depuse pe lamele ar trebui să conțină un număr suficient de celule cu o morfologie normală, pentru a permite o evaluare semnificativă a UDS. Preparatele se examinează la microscop pentru identificarea semnelor de citotoxicitate evidentă (de exemplu picnoză, diminuarea nivelului de marcaj radioactiv).
Se recomandă codificarea lamelelor înainte de numărătoarea grăunților. În general, pentru fiecare animal se identifică 100 de celule pe minimum două lamele; numărătoarea unui număr de celule mai mic de 100 pentru fiecare animal ar trebui justificată. Numărul de grăunți nu se determină pentru nucleele în fază S, dar se poate înregistra proporția de celule în faza S.
Cantitatea de 3H-TdR încorporată în nuclee și citoplasma celulelor normale din punct de vedere morfologic, puse în evidență prin depunerea de grăunți de argint, ar trebui să se determine prin metode corespunzătoare.
Numărul grăunților se determină pe baza nucleelor (grăunți nucleari, NG), iar zonele echivalente nucleului se determină pe baza citoplasmei (grăunți citoplasmici, CG). Numărul CG se obține măsurând fie zona cea mai marcată a citoplasmei, fie media a două sau trei numărători de grăunți citoplasmici adiacenți nucleului. Se pot folosi și alte metode de numărare (de exemplu numărarea celulelor complete), în măsura în care acestea pot fi justificate (6).
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Ar trebui să se prezinte date pentru fiecare lamelă și pentru fiecare animal. În plus, toate datele ar trebui să se prezinte sub formă de tabel. Numărul net de grăunți nucleari (NNG) ar trebui să se calculeze pentru fiecare celulă, pentru fiecare animal și pentru fiecare doză și moment de prelevare prin scăderea numărului CG din numărul NG. Dacă se face numărătoarea „celulelor în curs de reparare”, ar trebui să se justifice criteriile folosite la definirea „celulelor în curs de reparare”, care ar trebui să se întemeieze pe datele obținute din experimentele anterioare sau pe datele obținute pe martori negativi testați în paralel. Pentru evaluarea rezultatelor numerice se pot utiliza metode statistice. În acest caz, ar trebui, înaintea realizării studiului, să se selecteze și să se justifice testele statistice.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Exemplele de criterii de răspunsuri pozitive/negative includ:
|
pozitiv |
(i) |
valori ale NNG mai mari de o valoare-prag stabilită, care se justifică prin datele obținute în laborator în experimente anterioare; sau |
|
(ii) |
valori ale NNG cu mult mai mari decât cele pentru martorul analizat în paralel; |
|
|
negativ |
(i) |
valori ale NNG egale cu/mai mici decât valoarea-prag pentru martor, rezultată din experimente anterioare; sau |
|
(ii) |
valori ale NNG care nu sunt cu mult mai mari decât cele pentru martorul analizat în paralel. |
Ar trebui să se aibă în vedere relevanța biologică a rezultatelor, și anume ar trebui să se țină seama de parametri ca variația între animale, relația doză-răspuns și citotoxicitatea. Pentru evaluarea rezultatelor testelor se poate recurge și la ajutorul unor metode statistice. Semnificația statistică nu ar trebui să fie totuși singurul factor determinant pentru a decide cu privire la un răspuns pozitiv.
Deși majoritatea experimentelor vor da în mod clar rezultate pozitive sau negative, în anumite cazuri rare, datele stabilite vor exclude posibilitatea unei concluzii definitive cu privire la activitatea substanței de testat. Rezultatele pot să rămână nesigure sau discutabile independent de numărul de repetări ale experimentului.
Un rezultat pozitiv al unui test UDS in vivo pe celule hepatice de mamifere indică faptul că substanța de testat produce leziuni in vivo ale ADN din celulele hepatice ale mamiferelor, care se pot remedia prin sinteza neprogramată a ADN in vitro. Un rezultat negativ indică faptul că, în condițiile de testare, substanța de testat nu produce o deteriorare a ADN care să se poată detecta prin prezentul test.
Ar trebui să se discute probabilitatea ca substanța de testat să ajungă în circulația generală sau la țesutul țintă (de exemplu toxicitatea sistemică).
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Solventul/vehiculul:
— justificarea alegerii vehiculului;
— solubilitatea și stabilitatea substanței de testat în solvent/vehicul, dacă se cunoaște.
Animalele de laborator:
— specia/sușa utilizată;
— numărul, vârsta și sexul animalelor;
— sursa, condițiile de adăpost, regimul alimentar etc.;
— greutatea fiecărui animal la începutul testului, inclusiv intervalul de greutate, greutatea medie și deviația standard pentru fiecare grupă.
Condițiile de testare:
— martorii pozitivi și negativi vehicul/solvent;
— datele din studiul pentru stabilirea dozelor, dacă s-a realizat;
— justificarea alegerii dozelor utilizate;
— detalii privind prepararea substanței de testat;
— detalii privind modalitatea de administrare selectată;
— justificarea căii de administrare alese;
— metode de verificare pentru a constata dacă substanța de testat a ajuns în circulația generală sau în țesutul țintă, dacă este cazul;
— conversia concentrației substanței de testat (ppm) în hrană/apa de băut în doza reală (mg/kg greutate corporală/zi), dacă este cazul;
— detalii privind calitatea hranei și a apei;
— descrierea amănunțită a modalităților de tratare și de prelevare a probelor;
— metodele de măsurare a toxicității;
— metoda de preparare și de cultură a celulelor hepatice;
— metoda autoradiografică utilizată;
— numărul de lamele preparate și numărul de celule numărate;
— criteriile de evaluare;
— criteriile utilizate la caracterizarea studiilor ca fiind pozitive, negative sau nesigure.
Rezultatele:
— valorile medii ale numărului de grăunți nucleari, grăunți citoplasmatici și ale numărului net de grăunți nucleari pentru fiecare lamelă, fiecare animal și fiecare grupă;
— relația doză-răspuns, dacă este posibil;
— evaluarea statistică, dacă există;
— semnele de toxicitate;
— datele privind martorii negativi (solvent/vehicul) și pozitivi studiați în paralel;
— datele anterioare privind martorii negativi (solvent/vehicul) și pozitivi, cu domeniile, valorile medii și deviațiile standard;
— numărul de celule „în curs de reparare”, dacă s-a determinat;
— numărul de celule în faza S, dacă s-a determinat;
— viabilitatea celulelor.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Ashby, J., Lefevre, P. A., Burlinson, B. and Penman, M. G. (1985), An Assessment of the In Vivo Rat Hepatocyte DNA Repair Assay, Mutation Res., 156, pp. 1-18.
2. Butterworth, B. E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst G. and Williams, G. (1987), A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay, Mutation Res., 189, pp. 123-133.
3. Kennelly, J. C., Waters, R., Ashby, J., Lefevre, P. A., Burlinson B., Benford, D. J., Dean, S. W. and Mitchell I. de G. (1993), In Vivo Rat Liver UDS Assay, in: Kirkland D. J. and Fox M., (eds.), Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing Report. Part II revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 52-77.
4. Madle, S., Dean, S. W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D. J., Furihata, C., Hertner, T., McQueen, C. A. and Mori, H. (1993), Recommendations for the Performance of UDS Tests In Vitro and In Vivo, Mutations Res., 312, pp. 263-285.
5. Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993), Assessment of the Relation Between the Initital Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS), Mutation Res., 291, pp. 21-27.
6. Mirsalis, J. C., Tyson, C. K. and Butterworth, B. E. (1982), Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay, Environ Mutagen, 4, pp. 553-562.
B.40. COROZIUNEA CUTANATĂ IN VITRO: TESTUL REZISTENȚEI ELECTRICE TRANSCUTANATE (RET)
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 430 (2004) a OCDE.
1.1. INTRODUCERE
Coroziunea cutanată se referă la producerea unei vătămări ireversibile a țesuturilor pielii ca urmare a aplicării unei substanțe de testare [definită de Sistemul global armonizat de clasificare și etichetare a substanțelor și amestecurilor chimice (GHS)] (1). Această metodă prevede o procedură de evaluare a corozivității care nu se efectuează pe animale vii.
Evaluarea corozivității cutanate a implicat în mod obișnuit utilizarea animalelor de laborator (2). Preocuparea pentru durerea și suferința pe care această metodă le implică s-a concretizat în revizuirea metodei de testare B.4 care permite determinarea nivelului de coroziune cutanată utilizând metode alternative, in vitro, prin care se evită provocarea durerii și suferinței animalelor.
O primă etapă către definirea unor teste alternative care ar putea fi folosite pentru testarea corozivității cutanate în vederea reglementării acestora a constat în efectuarea de studii de pre-validare (3). Ca urmare, s-a realizat (6) (7) (8) un studiu precis de validare a metodelor in vitro pentru determinarea coroziunii cutanate (4) (5). Rezultatele acestor studii și al literaturii de specialitate publicate au arătat că următoarele teste ar putea fi folosite pentru evaluarea in vivo a corozivității cutanate (9) (10) (11): testarea pe un model de piele umană (a se vedea metoda de testare B.40 bis) și testul rezistenței electrice transcutanate (prezenta metodă).
Într-un studiu de validare și în alte studii publicate s-a menționat că testul rezistenței electrice transcutanate (RET) efectuat pe o piele de șobolan (12) (13) poate face distincția, într-o manieră fiabilă, între substanțele corozive și necorozive pentru piele cunoscute (5) (9).
Testul descris în această metodă permite identificarea amestecurilor și a substanțelor chimice corozive. În egală măsură, acesta permite identificarea amestecurilor și a substanțelor necorozive pe baza altor elemente de determinare, folosind alte informații existente (de exemplu pH-ul, relații structură-activitate, date despre om sau/și animal) (1) (2) (11) (14). Nu furnizează informații cu privire la iritarea cutanată și nici nu face sub-clasificarea substanțelor corozive, așa cum se procedează în Sistemul global armonizat de clasificare și etichetare a substanțelor și amestecurilor chimice (GHS) (1).
Pentru o evaluare completă a efectelor cutanate locale după o singură expunere, se recomandă să se urmeze strategia de testare secvențială anexată la metoda de testare B.4 (2) și prevăzută în Sistemul global armonizat (1). Această strategie de testare include efectuarea de teste in vitro pentru coroziunea cutanată (așa cum sunt descrise în prezenta metodă) și pentru iritarea cutanată înainte de a se lua în considerare testarea pe animale vii.
1.2. DEFINIȚII
Coroziune cutanată in vivo : producerea unei vătămări ireversibile a pielii, și anume necroza vizibilă prin epidermă și în dermă ca urmare a aplicării unei substanțe de testare pentru o durată de până la patru ore. Reacțiile corozive sunt caracterizate de ulcerații, sângerări, cruste însângerate și, la sfârșitul perioadei de observare de 14 zile, decolorare datorată albirii pielii, zone caracterizate de alopecie și cicatrice. Pentru a evalua leziunile incerte ar trebui să se aibă în vedere efectuarea unui examen histopatologic.
Rezistența electrică transcutanată (RET): măsură a impedanței electrice a pielii, exprimată ca valoare a rezistenței în kiloohmi. Este o metodă simplă și fiabilă de evaluare a funcției de barieră a pielii prin înregistrarea trecerii ionilor prin piele folosind o punte Wheatstone.
1.3. SUBSTANȚE DE REFERINȚĂ
Tabel 1
Substanțe chimice de referință
|
Denumire |
Nr. EINECS |
Nr. CAS |
|
|
1,2-Diaminopropan |
201-155-9 |
78-90-0 |
Puternic coroziv |
|
Acid acrilic |
201-177-9 |
79-10-7 |
Puternic coroziv |
|
2-terț-butilfenol |
201-807-2 |
88-18-6 |
Coroziv |
|
Hidroxid de potasiu (10 %) |
215-181-3 |
1310-58-3 |
Coroziv |
|
Acid sulfuric (10 %) |
231-639-5 |
7664-93-9 |
Coroziv |
|
Acid octanoic (acid caprilic) |
204-677-5 |
124-07-02 |
Coroziv |
|
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Necoroziv |
|
Eugenol |
202-589-1 |
97-53-0 |
Necoroziv |
|
Fenetil bromură |
203-130-8 |
103-63-9 |
Necoroziv |
|
Tetracloretilenă |
204-825-9 |
27-18-4 |
Necoroziv |
|
Acid isostearic |
250-178-0 |
30399-84-9 |
Necoroziv |
|
4-(metiltio)-benzaldehidă |
222-365-7 |
3446-89-7 |
Necoroziv |
Majoritatea substanțelor chimice menționate sunt preluate din lista substanțelor chimice selectate pentru studiul internațional de validare ECVAM (4). Selectarea lor are la bază următoarele criterii:
(i) număr egal de substanțe corozive și necorozive;
(ii) substanțe disponibile pe piață, acoperind majoritatea claselor de substanțe chimice relevante;
(iii) includerea substanțelor puternic corozive, precum și a celor mai puțin corozive pentru a permite diferențierea bazată pe puterea de corodare;
(iv) selectarea substanțelor chimice care pot fi manipulate în laborator fără expunere la alte pericole grave în afară de coroziune.
1.4. PRINCIPIUL METODEI DE TESTARE
Substanța testului este aplicată o perioadă de până la 24 de ore pe suprafețele epidermice ale discurilor de piele într-un sistem de testare cu două compartimente, în care discurile de piele funcționează ca separație între compartimente. Discurile de piele sunt prelevate de la șobolani cu vârsta de 28-30 de zile, eutanasiați fără durere. Materialele corozive sunt identificate după capacitatea lor de a produce o pierdere a integrității normale a stratului cornos și a funcției de barieră, care este măsurată ca o micșorare a RET sub nivelul de prag (12). Pentru testarea RET a pielii de șobolan a fost aleasă o valoare-limită de 5 kΏ, pe baza numeroaselor date referitoare la o gamă largă de substanțe chimice, în care marea majoritate a valorilor au fost în mod clar cu mult peste (deseori > 10 kΩ) sau cu mult sub (deseori < 3 kΩ) această valoare (12). În general, materialele care sunt necorozive pentru animale, dar sunt iritante sau neiritante, nu reduc RET sub această valoare-limită. Mai mult decât atât, utilizarea altor preparate de piele sau a altor echipamente poate modifica valoarea-limită, necesitând o validare ulterioară.
În procedura de testare este introdusă o etapă de fixare a unui colorant pentru testarea de confirmare a rezultatelor pozitive ale RET care prezintă valori apropiate de 5 kΩ. Această etapă de fixare a unui colorant determină dacă creșterea permeabilității ionice are loc datorită distrugerii fizice a stratului cornos. Metoda RET, în care s-a utilizat piele de șobolan, s-a demonstrat a fi anticipativă pentru coroziunea in vivo la iepure, evaluată prin metoda de testare B.4 (2). Trebuie subliniat că testarea in vivo pe iepuri este mult mai conservatoare în ceea ce privește corozivitatea și iritația cutanată în comparație cu testarea pe un eșantion de piele umană (15).
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Animale
Șobolanii sunt speciile alese deoarece sensibilitatea pielii lor la substanțele chimice utilizate pentru acest test a fost demonstrată anterior (10). Vârsta (la care pielea este prelevată) și specia șobolanului sunt extrem de importante pentru a se asigura că foliculii piloși sunt în stare latentă, înainte să înceapă creșterea părului adult.
Părul dorsal și de pe coaste al șobolanilor tineri de aproximativ 22 de zile, femele sau masculi (specia Wistar – comparabilă sau derivată), este îndepărtat cu grijă cu un clește mic. Apoi animalele sunt spălate prin ștergere atentă, în timp ce zona fără păr este cufundată într-o soluție cu antibiotic (care conține de exemplu streptomicină, penicilină, cloramfenicol și amfotericin cu concentrații eficiente pentru inhibarea creșterii bacteriilor). Animalele sunt spălate încă o dată cu antibiotic în a treia sau a patra zi după prima spălare și sunt folosite în termen de trei zile după a doua spălare, atunci când stratul cornos s-a refăcut după îndepărtarea părului.
1.5.2. Pregătirea discurilor de piele
Animalele sunt eutanasiate fără durere la vârsta de 28-30 de zile, această vârstă fiind deosebit de importantă. Se îndepărtează pielea dorso-laterală a fiecărui animal și se desprinde grăsimea subcutanată în exces prin jupuirea cu grijă a acesteia de pe piele. Se prelevează discuri de piele cu un diametru de aproximativ 20 mm fiecare. Pielea poate fi păstrată înainte ca discurile să fie folosite, în cazurile în care se demonstrează că datele de control negative și pozitive sunt echivalente cu cele obținute cu pielea proaspătă.
Fiecare disc de piele este așezat peste un capăt al unui tub PTFE (politetrafluoretilenă), asigurându-se că suprafața epidermei se află în contact cu tubul. Peste capătul tubului se așează prin apăsare un inel de cauciuc „O” pentru a fixa pielea, iar excesul de țesut este tăiat. Dimensiunile tubului și ale inelului „O” sunt prezentate în figura 2. Apoi inelul de cauciuc „O” este etanșat cu grijă la capătul tubului PTFE cu vaselină. Tubul este susținut de o clemă elastică în interiorul unei camere recipient care conține soluție de MgSO4 (154 mM) (figura 1). Discul de piele trebuie scufundat în întregime în soluția de MgSO4. Dintr-o singură piele de șobolan se pot obține 10-15 discuri de piele.
Înainte de începerea testării se măsoară rezistența electrică a două discuri de piele din fiecare piele de animal ca o procedură de control al calității. Ambele discuri ar trebui să aibă valorile rezistenței mai mari de 10 kΩ pentru ca restul discurilor să poată fi folosite pentru test. Dacă valoarea rezistenței este mai mică de 10 kΩ, discurile rămase din pielea respectivă trebuie eliminate.
1.5.3. Aplicarea substanțelor de testare și de control
Pentru fiecare studiu ar trebui efectuate controale pozitive și negative simultane pentru a se asigura realizarea corespunzătoare a modelului experimental. Ar trebui folosite discuri de piele de la un singur animal. Substanțele de control pozitiv și negativ propuse sunt acid clorhidric 10 M și, respectiv, apă distilată.
Substanțele lichide de testare (150 μl) sunt aplicate uniform pe suprafața epidermei din interiorul tubului. Atunci când se testează substanțe solide, pe disc se aplică o cantitate suficientă din substanța solidă, astfel încât întreaga suprafață a epidermei să fie acoperită. Peste substanța solidă se adaugă apă deionizată (150 μl), iar tubul este agitat ușor. Pentru a se obține un contact maxim cu pielea, substanțele solide ar trebui încălzite la 30 oC pentru ca substanțele de testare să se topească sau să se înmoaie sau ar trebui să fie măcinate pentru a se obține granule sau pulbere.
Pentru fiecare test și fiecare substanță de testare se utilizează trei discuri de piele. Substanțele de testare sunt aplicate timp de 24 de ore la o temperatură 20-23 oC, apoi se îndepărtează complet prin spălare cu jet de apă de la robinet, la maximum 30 oC.
1.5.4. Măsurători ale RET
Impedanța pielii, respectiv RET, se măsoară utilizând o punte Wheatstone (13) în curent alternativ de tensiune joasă care prezintă următoarele caracteristici: tensiunea de lucru 1-3 V, curent alternativ sinusoidal sau dreptunghiular de 50-1 000 Hz și un interval de măsurare de cel puțin 0,1-30 kΩ. Puntea folosită în studiul de validare măsoară inductanța, capacitatea electrică și rezistența până la valori de 2 000 H, 2 000 μF și 2 MΩ la frecvențe de 100 Hz sau 1 KHz, utilizând valori în serie sau în paralel. Măsurările testului de corozivitate RET constau în înregistrarea rezistenței la o frecvență de 100 Hz utilizând valori în serie. Înainte de măsurarea rezistenței electrice, se micșorează tensiunea suprafeței pielii prin adăugarea unui volum suficient de etanol 70 % pentru a acoperi epiderma. După câteva secunde etanolul este îndepărtat din tub și apoi țesutul este hidratat prin adăugarea de 3 ml soluție MgSO4 (154 mM). Electrozii punții sunt așezați pe ambele părți ale discului de piele pentru a măsura rezistența în kΩ/disc de piele (figura 1). Dimensiunile electrozilor și lungimea electrodului expus sub clemele-crocodil sunt prezentate în figura 2. În timpul măsurării rezistenței, clema atașată electrodului interior este așezată pe partea superioară a tubului PTFE pentru a se asigura că lungimea electrodului scufundat în soluția de MgSO4 rămâne constantă. Electrodul exterior este introdus în interiorul compartimentului receptor astfel încât să se sprijine pe fundul compartimentului. Distanța dintre clema elastică și fundul tubului PTFE este menținută constantă (figura 2) deoarece această distanță influențează valoarea rezistenței obținute. Prin urmare, distanța dintre electrodul interior și discul de piele trebuie să fie constantă și minimă (1-2 mm).
Dacă valoarea rezistenței măsurate este mai mare de 20 kΩ, acest lucru se poate datora resturilor de substanță de testare care acoperă suprafața epidermică a discului de piele. Se poate încerca o îndepărtare suplimentară a acesteia, de exemplu prin etanșarea tubului PTFE cu degetul mare protejat și agitarea acestuia timp de aproximativ 10 secunde; soluția de MgSO4 este înlăturată și se repetă măsurarea rezistenței cu MgSO4 proaspăt.
Proprietățile și dimensiunile aparatului de testare și ale procedurii de testare utilizate pot influența valorile RET obținute. Pe baza datelor obținute utilizând aparatul specific și procedura descrisă în această metodă, s-a stabilit un prag de corozivitate de 5 kΩ. Dacă se modifică condițiile de testare sau dacă se folosește un alt aparat, valorile de control și de prag pot fi diferite. Prin urmare, este necesar să se etaloneze metodologia și valorile de prag ale rezistenței prin testarea unei serii de substanțe de referință alese dintre substanțele chimice utilizate pentru studiul de validare (4) (5) sau dintre clase de substanțe chimice similare cu substanțele chimice studiate. Tabelul 1 prezintă un set de substanțe chimice de referință adecvate.
1.5.5. Metode de fixare a unui colorant
Expunerea anumitor materiale necorozive poate duce la micșorarea rezistenței sub limita de 5 kΩ, permițându-se trecerea ionilor prin stratul cornos, ceea ce reduce rezistența electrică (5). De exemplu, substanțele chimice și substanțele organice neutre care au proprietăți de tensioactive (inclusiv detergenți, emulgatori și alți agenți tensioactivi) pot îndepărta lipidele pielii, făcând bariera cutanată mai permeabilă pentru ioni. Astfel, dacă în absența unei leziuni vizibile, valorile RET ale substanțelor de testare sunt de aproximativ 5 kΩ sau mai mici, ar trebui efectuată o evaluare a penetrării colorantului pentru țesuturile tratate și de control pentru a se determina dacă valorile RET obținute rezultă dintr-o permeabilitate cutanată mărită sau dintr-o coroziune cutanată (3) (5). Dacă este vorba de o coroziune, acolo unde stratul cornos este rupt, colorantul sulforhodamină B aplicat pe suprafața pielii penetrează rapid și colorează țesutul de dedesubt Acest colorant special rămâne stabil la contactul cu o gamă largă de substanțe chimice și nu este influențat de procedura de extracție descrisă mai jos.
1.5.5.1. Aplicarea și îndepărtarea colorantului sulforhodamină B
După efectuarea măsurătorilor RET, sulfatul de magneziu este îndepărtat din tub, iar pielea este examinată cu atenție pentru a se depista deteriorări evidente. Dacă nu există nicio deteriorare majoră clară, 150 μl de substanță diluată de 10 % (greutate/volum) în apă distilată de sulforhodamină B (Acid roșu 52; C.I. 45100; număr EINECS 222-529-8; număr CAS 3520-42-1), este aplicată pe suprafața epidermică a fiecărui disc de piele timp de 2 ore. Ulterior, aceste discuri de piele sunt spălate cu apă de la robinet la temperatura camerei, timp de aproximativ 10 secunde, pentru a îndepărta colorantul în exces/nefixat. Fiecare disc de piele este scos cu atenție din tubul PTFE și așezat într-o fiolă (de exemplu o fiolă de sticlă cu scintilație de 20 ml) care conține apă deionizată (8 ml). Fiolele sunt agitate ușor timp de 5 minute pentru a se îndepărta orice cantitate de colorant nefixat. Se repetă procedura de spălare, după care discurile de piele sunt scoase și așezate în fiole care conțin 5 ml de dodecilsulfat de sodiu (SDS) 30 % (greutate/volum) în apă distilată și incubate la 60 oC în timpul nopții.
După incubare, fiecare disc de piele este scos și eliminat, iar soluția rămasă este centrifugată timp de 8 minute la 21 oC (forța centrifugală relativă ~ 175 × g). Un eșantion de supernatant de 1 ml este diluat într-o proporție de 1 la 5 (volum/volum) [și anume 1 ml + 4 ml] cu SDS 30 % (greutate/volum) în apă distilată. Densitatea optică (DO) a soluției este măsurată la 565 nm.
1.5.5.2. Calcularea conținutului de colorant
Conținutul de colorant sulforhodamină B al fiecărui disc este calculat plecând de la valorile DO (5) (coeficient molar de extincție al colorantului sulforhodamină B la 565 nm = 8,7 × l04; greutate moleculară = 580). Conținutul de colorant este determinat pentru fiecare disc de piele folosind o curbă caracteristică de etalonare, iar ulterior se calculează conținutul mediu de colorant pentru testele repetate.
2. DATE
Acolo unde este necesar, valorile rezistenței (kΩ) și valorile conținutului mediu de colorant (μg/disc), pentru materialul de testare, precum și pentru controalele pozitive și negative, ar trebui prezentate sub formă de tabel (date individuale de testare și mediile ± DT), inclusiv date pentru mostre/teste repetate, valori medii și individuale.
2.1. INTERPRETAREA REZULTATELOR
Valorile medii ale RET sunt acceptate cu condiția ca valorile controalelor pozitive și negative efectuate în paralel să se încadreze în intervalele acceptabile pentru metoda în laboratorul de testare. Pentru metodologia și aparatele descrise mai sus, intervalele acceptabile ale rezistenței sunt prezentate în următorul tabel:
|
Control |
Substanță |
Interval de rezistență (kΩ) |
|
Pozitiv |
Acid clorhidric 10 moli |
0,5-1,0 |
|
Negativ |
Apă distilată |
10-25 |
Valorile medii de fixare ale colorantului sunt acceptate cu condiția ca valorile controalelor efectuate în paralel să se încadreze în intervalele acceptabile pentru metodă. Pentru metodologia și aparatele descrise mai sus, intervalele propuse pentru conținutul acceptabil de colorant pentru substanțele de control sunt prezentate mai jos:
|
Control |
Substanță |
Interval pentru conținutul de colorant (μg/disc) |
|
Pozitiv |
Acid clorhidric 10 moli |
40-100 |
|
Negativ |
Apă distilată |
15-35 |
Se consideră că substanța de testare nu este corozivă pentru piele:
(i) dacă valoarea medie a RET obținută pentru substanța de testare este mai mare de 5 kΩ; sau
(ii) dacă valoarea medie a RET este mai mică sau egală cu 5 kΩ; și
— discul de piele nu prezintă vreo leziune evidentă; și
— conținutul mediu de colorant al discului este mult inferior conținutului mediu de colorant al discului de control pozitiv (HCl 10 moli) obținut în paralel.
Se consideră că substanța de testare este corozivă pentru piele:
(i) dacă valoarea medie a RET este mai mică sau egală cu 5 kΩ și discul de piele este evident deteriorat; sau
(ii) dacă valoarea medie a RET este mai mică sau egală cu 5 kΩ; și
— discul de piele nu prezintă vreo leziune evidentă; dar
— conținutul mediu de colorant al discului este mai mare sau egal cu conținutul mediu de colorant al discului de control pozitiv (HCl 10 moli) obținut în paralel.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele informații:
Substanțe de testare și control:
— numele substanțelor chimice, precum numele IUPAC sau CAS și număr CAS, dacă este cunoscut;
— puritatea și compoziția substanței sau a preparatului [în procent(e) pe greutate] și starea fizică;
— proprietăți fizico-chimice relevante pentru efectuarea studiului, precum starea fizică, pH-ul, stabilitatea, solubilitatea în apă;
— tratamentul aplicat substanțelor de testare/control înainte de testare, după caz (de exemplu încălzire, măcinare);
— stabilitate, dacă este cunoscută.
Animale testate:
— specia și sexul animalului utilizat;
— vârsta animalelor în momentul prelevării pielii;
— sursa, condițiile de viață, dieta etc.;
— detalii privind pregătirea pielii.
Condiții de testare:
— curbe de etalonare pentru aparatele de testare;
— curbe de etalonare pentru desfășurarea testului cu fixarea colorantului;
— detalii ale procedurii de testare utilizate pentru măsurările RET;
— detalii ale procedurii de testare utilizate pentru evaluarea fixării colorantului, după caz;
— descrierea oricărei modificări a procedurilor de testare;
— descrierea criteriilor de evaluare utilizate.
Rezultate:
— prezentarea sub formă de tabel a datelor obținute în urma testării RET și testului de fixare a colorantului (după caz) pentru fiecare animal și fiecare mostră de piele;
— descrierea tuturor efectelor observate.
Discutarea rezultatelor.
Concluzii.
REFERINȚE BIBLIOGRAFICE
1. OCDE (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OCDE Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.OCDE.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
2. Metoda de testare B.4. Toxicitate acută: iritație/coroziune dermică.
3. Botham, P. A., Chamberlain, M., Barratt, M. D., Curren, R. D., Esdaile, D. J., Gardner, J. R., Gordon, V. C., Hildebrand, B., Lewis, R. W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J. F., Steiling, W., Walker, A. P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219-255.
4. Barratt, M. D., Brantom, P. G., Fentem, J. H., Gerner, I., Walker, A. P., and Worth, A. P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. in Vitro 12, 471-482.
5. Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhütter, H.-G., and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. in Vitro 12, 483-524.
6. OCDE (1996). Final Report of the OCDE Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp.
7. Balls, M., Blaauboer, B. J., Fentem. J. H., Bruner. L., Combes, R. D., Ekwall, B., Fielder. R. J., Guillouzo, A., Lewis, R. W., Lovell, D. P., Reinhardt, C. A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129-147.
8. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf
9. ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280.
10. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
11. OCDE (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st–2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OCDE ENV/EHS, available upon request from the Secretariat
12. Oliver, G. J. A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test -modification sand validation. Fd. Chem. Toxicol. 24, 507-512.
13. Botham, P. A., Hall, T. J., Dennett, R., McCall, J. C., Basketter, D. A., Whittle, E., Cheeseman, M., Esdaile, D. J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. in Vitro 6, 191-194.
14. Worth A. P., Fentem J. H., Balls M., Botham P. A., Curren R. D., Earl L. K., Esdaile D. J., Liebsch M. (1998). An Evaluation of the Proposed OCDE Testing Strategy for Skin Corrosion. ATLA 26: 709-720.
15. Basketter, D. A., Chamberlain, M., Griffiths, H. A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845-852.
16. Oliver G. J. A., Pemberton M. A. and Rhodes C. (1988). An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxic. in Vitro. 2, 7-17.
Figura 1
Aparatura pentru testarea RET pe pielea de șobolan

Figura 2
Dimensiunile tubului de politetrafluoretilenă (PFTE) și a tuburilor receptoare și a electrozilor utilizați

Factori importanți ai aparatului prezentat mai sus:
— diametrul interior al tubului PFTE;
— lungimea electrozilor în raport cu tubul PFTE și tubul receptor, astfel încât discul de piele să nu fie atins de electrozi, iar lungimea standard a electrodului să fie în contact cu soluția de MgSO4;
— cantitatea de soluție de MgSO4 din tubul receptor trebuie să fie suficientă pentru ca adâncimea lichidului, în raport cu nivelul din tubul PFTE, să fie astfel cum se indică în figura 1;
— discul de piele ar trebui fixat de tubul PFTE suficient de bine, astfel încât rezistența electrică să fie o măsură reală a proprietăților pielii.
B.40 BIS. COROZIUNEA CUTANATĂ IN VITRO: TESTARE PE UN MODEL DE PIELE UMANĂ
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 431 (2004) a OCDE.
1.1. INTRODUCERE
Coroziunea cutanată se referă la producerea unei vătămări ireversibile a țesuturilor pielii în urma aplicării unei substanțe de testare [definită de Sistemul global armonizat de clasificare și etichetare a substanțelor și amestecurilor chimice (GHS)] (1). Această metodă de testare prevede o procedură de evaluare a corozivității cutanate care nu se efectuează pe animale vii sau piele animală.
Evaluarea corozivității cutanate implică în mod obișnuit utilizarea animalelor de laborator (2). Preocuparea pentru durerea și suferința pe care această metodă le implică s-a concretizat în revizuirea metodei de testare B.4 care permite determinarea nivelului de coroziune cutanată utilizând metode alternative, in vitro, prin care se evită provocarea durerii și suferinței animalelor.
O primă etapă către definirea unor teste alternative, care ar putea fi utilizate pentru testarea corozivității cutanate în vederea reglementării acestora, a constat în efectuarea de studii de prevalidare (3). În urma acestora, s-a efectuat un studiu formal de validare (6) (7) (8) a metodelor in vitro pentru evaluarea coroziunii pielii (4) (5). Rezultatele acestor studii și al literaturii de specialitate publicate (9) au arătat că testele următoare ar putea fi utilizate pentru evaluarea in vivo a corozivității cutanate (10) (11) (12) (13): testarea pe un model de piele umană (prezenta metodă) și testul rezistenței electrice transcutanate (metoda de testare B.40).
Studiile de validare au arătat că testele care implică folosirea modelelor de piele umană (3) (4) (5) (9) pot face distincția, într-o manieră fiabilă, între substanțele corozive și necorozive pentru piele cunoscute. Protocolul de testare poate furniza, de asemenea, un indicator pentru distincția între substanțele puternic corozive și substanțele mai puțin corozive.
Testul descris în prezenta metodă permite identificarea substanțelor și amestecurilor chimice corozive. În egală măsură, acesta permite identificarea substanțelor și amestecurilor necorozive pe baza unor alte elemente de determinare, folosind alte informații existente (de exemplu pH-ul, relații structură-activitate, date despre om și/sau animal) (1) (2) (13) (14). În mod normal nu furnizează informații cu privire la iritațiile cutanate și nici nu permite subclasificarea substanțelor corozive conform Sistemului global armonizat de clasificare (GHS) (1).
Pentru o evaluare completă a efectelor cutanate locale după o singură expunere, se recomandă strategia de testare secvențială anexată la metoda de testare B.4 (2) și prevăzută în Sistemul global armonizat de clasificare (GHS) (1). Această strategie de testare include efectuarea de teste in vitro pentru coroziunea cutanată (așa cum sunt descrise în prezenta metodă) și pentru iritarea cutanată, înainte de a se lua în considerare testarea pe animale vii.
1.2. DEFINIȚII
Coroziune cutanată in vivo : producerea unei vătămări ireversibile a pielii, și anume necroza vizibilă prin epidermă și în dermă, ca urmare a aplicării unei substanțe de testare pentru o durată de până la patru ore. Reacțiile corozive sunt caracterizate de ulcerații, sângerări, cruste însângerate și, la sfârșitul perioadei de observare de 14 zile, decolorare datorată albirii pielii, zone caracterizate de alopecie și cicatrice. Pentru evaluarea leziunilor incerte ar trebui să se aibă în vedere efectuarea unui examen histopatologic.
Viabilitate celulară: parametru care măsoară activitatea unei populații celulare (de exemplu capacitatea dehidrogenazei mitocondrale celulare de a reduce colorantul vital MTT), care, în funcție de efectul măsurat și de tipul testului utilizat, se corelează cu numărul total și/sau vitalitatea celulelor.
1.3. SUBSTANȚE DE REFERINȚĂ
Tabel 1
Substanțe chimice de referință
|
Denumire |
Nr. EINECS |
Nr. CAS |
|
|
1,2-Diaminopropan |
201-155-9 |
78-90-0 |
Puternic coroziv |
|
Acid acrilic |
201-177-9 |
79-10-7 |
Puternic coroziv |
|
2-terț-butilfenol |
201-807-2 |
88-18-6 |
Coroziv |
|
Hidroxid de potasiu (10 %) |
215-181-3 |
1310-58-3 |
Coroziv |
|
Acid sulfuric (10 %) |
231-639-5 |
7664-93-9 |
Coroziv |
|
Acid octanoic (acid caprilic) |
204-677-5 |
124-07-02 |
Coroziv |
|
4-Amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Necoroziv |
|
Eugenol |
202-589-1 |
97-53-0 |
Necoroziv |
|
Fenetil bromură |
203-130-8 |
103-63-9 |
Necoroziv |
|
Tetracloretilenă |
204-825-9 |
27-18-4 |
Necoroziv |
|
Acid isostearic |
250-178-0 |
30399-84-9 |
Necoroziv |
|
4-(metiltio)-benzaldehidă |
222-365-7 |
3446-89-7 |
Necoroziv |
Majoritatea substanțelor chimice menționate sunt preluate din lista substanțelor chimice selectate pentru studiul internațional de validare ECVAM (4). Selectarea lor se bazează pe următoarele criterii:
(i) număr egal de substanțe corozive și necorozive;
(ii) substanțe disponibile pe piață, acoperind majoritatea claselor de substanțe chimice relevante;
(iii) includerea substanțelor puternic corozive, precum și a celor mai puțin corozive pentru a permite diferențierea bazată pe potențialul coroziv;
(iv) selectarea substanțelor care pot fi manipulate în laborator fără expunere la alte pericole grave în afară de coroziune.
1.4. PRINCIPIUL METODEI DE TESTARE
Materialul de testare se aplică local pe un model tridimensional de piele umană, conținând cel puțin epidermă reconstruită cu un strat cornos funcțional. Materialele corozive sunt identificate în funcție de capacitatea de a produce scăderea viabilității celulare [determinată, de exemplu, prin metoda de reducere MTT (15)] sub nivelele definite pentru perioadele de expunere specificate. Principiul testului pe piele umană se bazează pe ipoteza că substanțele chimice corozive sunt capabile să penetreze stratul cornos prin difuziune sau eroziune și sunt citotoxice până la nivelul epidermei inferioare.
1.4.1. Procedura
1.4.1.1. Modele de piele umană
Modelele din piele umană pot fi construite sau obținute pe cale comercială (de exemplu modelele EpiDermTM și EPISKINTM) (16) (17) (18) (19) sau pot fi dezvoltate sau construite în laboratorul de testare (20) (21). Se admite că utilizarea pielii umane este subiectul considerațiilor și condițiilor etice la nivel național și internațional. Orice nou model ar trebui validat (cel puțin în înțelesul descris la punctul 1.4.1.1.2). Modelele de piele umană utilizate pentru acest test trebuie să îndeplinească următoarele condiții:
1.4.1.1.1.
Pentru construcția epiteliului trebuie utilizate cheratinocite umane. Sub stratul cornos funcțional trebuie incluse mai multe straturi de celule epiteliale viabile. Modelul de piele poate avea, de asemenea, un strat component stromal. Startul cornos ar trebui să fie multistratificat, cu profilul lipidic necesar pentru a produce o barieră funcțională suficient de robustă care să reziste penetrării rapide a marcatorilor citotoxici. Proprietățile de conținut ale modelului trebuie să prevină trecerea substanței de stratul cornos către țesutul viabil. Trecerea substanțelor chimice de stratul cornos va determina o slabă prezentare a expunerii pielii. Modelul de piele nu trebuie să fie contaminat cu bacterii (inclusiv micoplasmă) sau ciuperci.
1.4.1.1.2.
Amplitudinea viabilității este cuantificată, de obicei, utilizând MTT sau alți coloranți vitali convertiți metabolic. În aceste cazuri, densitatea optică (DO) a colorantului (solubilizat) extras din țesutul negativ de control trebuie să fie de cel puțin 20 de ori mai mare decât densitatea optică a solventului extras [pentru rezumat, a se vedea (22)]. Țesutul negativ de control trebuie să fie stabil în cultură (să furnizeze măsurători ale viabilității similare) pentru durata perioadei de expunere la testare. Startul cornos trebuie să fie suficient de robust pentru a rezista la penetrarea rapidă a anumitor marcatori citotoxici chimici (ex. 1 % Triton X-100). Această proprietate poate fi estimată prin timpul de expunere necesar pentru a reduce viabilitatea celulei cu 50 % (ET50) (de exemplu pentru modelele EpiDermTM și EPISKINTM acesta este > 2 ore) Țesutul trebuie să poată fi reprodus în timp și de preferat între laboratoare diferite. Mai mult decât atât, acesta ar trebui să fie capabil să estimeze potențialul coroziv al substanțelor chimice de referință (a se vedea tabelul 1) atunci când se utilizează în cadrul protocolului de testare selectat.
1.4.1.2. Aplicarea testului și a substanțelor de control
Se folosesc două mostre de țesut pentru fiecare tratament (perioada de expunere), incluzând controalele. În cazul substanțelor lichide, trebuie aplicată o cantitate suficientă de substanță de testare pentru a acoperi toată suprafața de piele în mod uniform: trebuie utilizat un minimum de 25 μL/cm2. În cazul substanțelor solide, trebuie aplicată o cantitate suficientă de substanță de testare, în mod egal pe toată suprafața și trebuie hidratată cu apă distilată sau deionizată pentru a asigura un contact bun cu pielea. Atunci când este necesar, substanțele solide trebuie transformate în pudră înainte de aplicare. Metoda de aplicare trebuie selectată în funcție de substanța chimică de testare (a se vedea, de exemplu, substanța de referință 5). La sfârșitul perioadei de expunere, substanța de testare trebuie spălată cu atenție de pe suprafața de piele, utilizând o soluție-tampon adecvată sau 0,9 % NaCl.
Pentru fiecare studiu trebuie utilizate controale pozitive sau negative concomitente pentru a asigura calitatea rezultatelor modelului experimental. Substanțele recomandate pentru controlul pozitiv sunt acidul acetic glacial sau 8N KOH. Substanțele recomandate pentru controlul negativ sunt 0,9 % NaCl sau apă.
1.4.1.3. Măsurători ale viabilității celulare
Pentru măsurarea viabilității celulare trebuie folosite numai metode cantitative validate. În plus, măsurarea viabilității trebuie să fie compatibilă cu utilizarea pe un țesut tridimensional. Fixarea nespecifică a colorantului nu trebuie să interfereze cu măsurarea viabilității. De asemenea, nu sunt adecvați coloranții care se fixează prin utilizarea unei proteine și aceia care nu sunt supuși unei conversii metabolice (de exemplu roșul neutru). Produsul cel mai frecvent utilizat este MTT [bromură de 3-(4,5-dimetiltiazol-2il)-2,5-difeniltetrazoliu, tiazolil albastru: nr. EINECS 206-069-5, nr. CAS 298-93-1)], care a demonstrat rezultate clare și reproductibile (5), dar se pot utiliza și alte produse. Mostra de piele este introdusă într-o soluție MTT de concentrație potrivită (de exemplu 0,3-1 mg/ml) la o temperatură de incubație adecvată, timp de 3 ore. Precipitatul de formazan albastru este apoi extras utilizând un solvent (izopropanol) și concentrația acestuia se măsoară determinând densitatea optică la o lungime de undă cuprinsă între 540 și 595 nm.
Acțiunea chimică a substanței de testare asupra colorantului vital poate imita acțiunea metabolismului celular, determinând o falsă estimare a viabilității. S-a demonstrat că acest fenomen apare atunci când substanța de testare nu este complet eliminată prin spălare de pe suprafața pielii (9). Dacă substanța de testare acționează direct asupra colorantului, trebuie efectuate controale suplimentare pentru a detecta și corecta interferențele substanței de testare cu măsurarea viabilității (9) (23).
2. DATE
Pentru fiecare țesut, trebuie raportate sub formă de tabel valorile densității optice și procentele calculate ale viabilității celulare pentru substanța de testare, precum și controalele negative și pozitive, inclusiv datele obținute din testele repetate, valorile medii și individuale.
2.1. INTERPRETAREA REZULTATELOR
Valorile densității optice obținute pentru fiecare mostră pot fi utilizate pentru a calcula un procent de viabilitate relativ la controlul negativ, care este stabilit, în mod arbitrar, la 100 %. Este necesar să se definească în mod clar și documentat, precum și să se demonstreze, caracterul compatibil al valorii prag a procentului de viabilitate celulară care diferențiază substanțele corozive de cele necorozive (sau diferențiază diferitele clase de substanțe corozive) sau al procedurii (procedurilor) statistice utilizate pentru evaluarea rezultatelor și identificarea materialelor corozive. În general, aceste valori sunt stabilite în timpul etapei de optimizare a testării, controlate în faza de prevalidare și confirmate într-un studiu de validare. De exemplu, evaluarea coroziunii asociate cu modelul EpiDermTM este (9):
Substanța testată este considerată corozivă în contact cu pielea:
(i) dacă viabilitatea este mai mică de 50 % după 3 minute de expunere; sau
(ii) dacă viabilitatea este mai mare sau egală cu 50 % după 3 minute de expunere, respectiv mai mică de 15 % după 1 oră de expunere.
Substanța testată este considerată necorozivă în contact cu pielea:
(i) dacă viabilitatea este mai mare sau egală cu 50 % după 3 minute de expunere, respectiv mai mare sau egală de 15 % după 1 oră de expunere.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele informații:
Substanțe testate și de control:
— denumire chimică, precum denumirea IUPAC sau CAS și numărul CAS, dacă se cunosc;
— puritatea și compoziția substanței sau a preparatului [în procent(e) per greutate];
— proprietăți fizico-chimice, precum starea fizică, pH-ul, stabilitatea, hidrosolubilitatea, utile pentru efectuarea studiului;
— tratamentul substanțelor testate/de control înainte de efectuarea testului, după caz (de exemplu încălzire, măcinare);
— stabilitate, dacă este cunoscută.
Justificarea modelului de piele și a protocolului utilizat.
Condiții de testare
— sistem celular utilizat;
— informații de calibrare pentru instrumentul de măsurare a viabilității celulare (de exemplu spectrofotometru);
— informații complete privind modelul de piele utilizat, inclusiv validitatea acestuia;
— detalii cu privire la procedura de testare utilizată;
— dozaje utilizate în testare;
— descrierea oricărei modificări a procedurii de testare;
— referințe la istoricul modelului;
— descrierea criteriilor de evaluare folosite.
Rezultate:
— prezentarea sub formă de tabel a rezultatelor obținute cu fiecare mostră de testare;
— descrierea altor efecte observate.
Discutarea rezultatelor.
Concluzie.
4. REFERINȚE BIBLIOGRAFICE
1. OCDE (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OCDE Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.OCDE.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
2. Metoda de testare B.4. Toxicitate acută: iritație/coroziune dermică.
3. Botham, P. A., Chamberlain, M., Barratt, M. D., Curren, R. D., Esdaile, D. J., Gardner, J. R., Gordon, V. C., Hildebrand, B., Lewis, R. W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J. F., Steiling, W., Walker, A. P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219-255.
4. Barratt, M. D., Brantom, P. G., Fentem, J. H., Gerner, I., Walker, A. P., and Worth, A. P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In Vitro 12, 471-482.
5. Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, 483-524.
6. OCDE (1996). Final Report of the OCDE Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp.
7. Balls, M., Blaauboer, B. J., Fentem, J. H., Bruner, L., Combes, R. D., Ekwall, B., Fielder, R. J., Guillouzo, A., Lewis, R. W., Lovell, D. P., Reinhardt, C. A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129-147.
8. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
9. Liebsch, M., Traue, D., Barrabas, C., Spielmann, H., Uphill, P., Wilkins, S., McPherson, J. P., Wiemann, C., Kaufmann, T., Remmele, M. and Holzhutter, H. G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp.371-401.
10. ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280.
11. ECVAM (2000). ECVAM News & Views. ATLA 28, 365-67.
12. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
13. OCDE (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st–2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OCDE ENV/EHS, available upon request from the Secretariat
14. Worth A. P., Fentem J. H., Balls M., Botham P. A., Curren R. D., Earl L. K., Esdaile D.J., Liebsch M. (1998). An Evaluation of the Proposed OCDE Testing Strategy for Skin Corrosion. ATLA 26: 709-720.
15. Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J. Immunol. Meth. 65, 55-63.
16. Cannon, C. L., Neal, P. J., Southee, J. A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In Vitro 8, 889-891.
17. Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211-225.
18. Tinois E., Gaetani Q., Gayraud B., Dupont D., Rougier A., Pouradier D.X. (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133-140
19. Tinois E., Tiollier J., Gaucherand M., Dumas H., Tardy M., Thivolet J. (1991). In vitro and post–transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310-319
20. Parentau, N. L., Bilbo, P., Molte, C. J., Mason, V. S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163-171.
21. Wilkins, L. M., Watson, S. R., Prosky, S. J., Meunier, S. F., Parentau, N. L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747-756.
22. Marshall, N. J., Goodwin, C. J., Holt, S. J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69-84.
23. Fentem, J. H., Briggs, D., Chesne’, C., Elliot, G. R., Harbell, J. W., Heylings, J. R., Portes, P., Rouget, R., and van de Sandt, J. J. M., and Botham, P. A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. InVitro 15, 57-93.
B.41. TESTUL DE FOTOTOXICITATE 3T3 NRU IN VITRO
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 432 (2004) a OCDE.
1.1. INTRODUCERE
Fototoxicitatea se definește ca o reacție toxică datorată aplicării unei substanțe pe corp, declanșată sau accentuată (și vizibilă în cazul unor doze mici) după o expunere ulterioară la lumină sau indusă prin iradierea pielii după administrarea sistemică a unei substanțe.
Testul de fototoxicitate 3T3 NRU in vitro se folosește pentru identificarea potențialului fototoxic al unei substanțe testate, indus de substanța chimică după expunerea la lumină. Testul evaluează fotocitotoxicitatea prin reducerea relativă a viabilității celulelor expuse la substanța respectivă în prezența sau în absența luminii. Substanțele identificate prin acest test pot fi fototoxice in vivo după aplicare sistemică și distribuție în piele sau după aplicare locală.
S-au semnalat efecte fototoxice pentru multe tipuri de substanțe chimice (1) (2) (3) (4). Trăsătura comună a acestor substanțe este capacitatea de a absorbi energia luminoasă din gama luminii solare. Conform primei legi din fotochimie (legea lui Grotthaus-Draper), reacția fotochimică necesită absorbția unui număr suficient de cuante de lumină. Astfel, înainte de a se avea în vedere realizarea unui test biologic, se recomandă determinarea unui spectru de absorbție UV/vizibil a produsului chimic analizat, conform liniei directoare 101 a OCDE pentru teste. În cazul în care un coeficient de extincție/absorbție molară este mai mic de 10 litri × mol–1 × cm–1, acel produs chimic nu deține potențial fotoreactiv. Nu este necesar ca un astfel de produs chimic să fie supus testului de fototoxicitate 3T3 NRU in vitro sau oricărui alt test biologic destinat detectării efectelor fotochimice adverse (1) (5). A se vedea, de asemenea, apendicele 1.
Importanța și fiabilitatea testului de fototoxicitate 3T3 NRU in vitro au fost evaluate recent (6) (7) (8) (9). S-a dovedit că testul de fototoxicitate 3T3 NRU oferă posibilitatea de a anticipa efectele fototoxicității acute in vivo la oameni și animale. Testul nu este destinat să anticipeze alte efecte adverse care ar putea apărea în urma acțiunii combinate a unui produs chimic și a luminii, precum fotogenotoxicitatea, fotoalergia și fotocancerigenitatea și nici nu evaluează puterea fototoxică. În plus, testul nu este conceput pentru a determina mecanismele indirecte ale fototoxicității, efectele metaboliților substanței de testare sau efectele amestecurilor.
În timp ce utilizarea sistemelor de metabolizare este o cerință generală pentru toate testele in vitro utilizate pentru estimarea potențialului genotoxic și cancerigen, până în prezent, în cazul fototoxicologiei, se cunosc puține exemple în care este necesară o transformare metabolică, astfel încât substanța chimică să acționeze ca o fototoxină in vivo sau in vitro. Astfel, efectuarea prezentului test cu un sistem de activare metabolică nu se consideră nici necesară și nici nu se justifică din punct de vedere științific.
1.2. DEFINIȚII
Iradianță: intensitatea luminii ultraviolete (UV) sau vizibile, incidente pe o suprafață, măsurată în W/m2 sau mW/cm2.
Doză de lumină: cantitatea (= intensitate × timp) de lumină ultravioletă (UV) sau vizibilă, incidentă pe o suprafață, exprimată în jouli (= W × s) pe unitate de suprafață, de exemplu J/m2 sau J/cm2.
Benzi de lungimi de undă a luminii UV: specificațiile recomandate de CIE (Commission Internationale de l'Eclairage) sunt: UVA (315-400 nm), UVB (280-315 nm) și UVC (100-280 nm). Se utilizează, de asemenea, și alte specificații: limita dintre UVB și UVA este plasată adesea la 320 nm, iar UVA se poate diviza în UV-A1 și UV-A2, cu o limită situată la aproximativ 340 nm.
Viabilitate celulară: parametru care măsoară întreaga activitate a unei populații celulare (de exemplu absorbția colorantului vital roșu neutru în lizozomii celulari), care, în funcție de efectul măsurat și de tipul testului utilizat, se corelează cu numărul total și/sau vitalitatea celulelor.
Viabilitate celulară relativă: viabilitatea celulară exprimată în funcție de probele solvente (negative) prelevate pe toată durata realizării testului (fie + Irr, fie – Irr), dar care nu au fost tratate cu un produs chimic.
PIF (Photo-Irritation Factor) (factor de fotoiritare): factor obținut prin compararea a două concentrații citotoxice la fel de eficiente (IC50) ale produsului chimic testat obținute în absența (– Irr) și în prezența (+ Irr) unei iradieri necitotoxice cu lumină UV/vizibilă.
IC 50 : concentrația produsului chimic testat prin care viabilitatea celulară se reduce cu 50 %.
MPE (Mean-Photo-Effect) (fotoefect mediu): măsură rezultată din analiza matematică a două curbe concentrație-răspuns obținute în absența (– Irr) și în prezența (+ Irr) unei iradieri necitotoxice cu lumină UVA/vizibilă.
Fototoxicitate: reacție toxică acută care apare după o primă expunere a pielii la anumite produse chimice și expunere ulterioară la lumină sau care este indusă în mod similar prin iradierea pielii după administrarea sistemică a unui produs chimic.
1.3. PRINCIPIUL METODEI DE TESTARE
Testul de fototoxicitate 3T3 NRU in vitro se bazează pe o comparație a citotoxicității unui produs chimic atunci când este testat cu expunere sau fără expunere la o doză necitotoxică de lumină solară simulată. În prezentul test, citotoxicitatea se exprimă printr-o diminuare, în funcție de concentrație, a colorantului vital roșu neutru (NR) fixat (9) după 24 de ore de la tratarea cu produsul chimic testat și iradierea acestuia (10). Colorantul roșu neutru este un cation slab care penetrează imediat membranele celulare prin nedifuziune acumulându-se intracelular în lizozomi. Modificarea suprafeței sensibile a membranei lizozomilor duce la o fragilitate a acestora și la alte modificări care, gradual, devin ireversibile. Aceste schimbări produse de acțiunea xenobioticelor duc la o diminuare a fixării colorantului roșu neutru. Astfel, se poate face distincția între celulele viabile, deteriorate sau moarte, fapt ce reprezintă însăși fundamentul acestui test.
Celulele Balb/c 3T3 sunt păstrate în cultură timp de 24 ore pentru formarea monostraturilor. Pentru fiecare produs chimic testat, sunt preincubate două plăci cu 96 de godeuri, cu opt concentrații diferite ale substanței de testare, timp de 1 oră. Ulterior, una dintre cele două plăci este expusă la cea mai înaltă doză de iradiere necitotoxică, iar cealaltă placă se păstrează la întuneric. În ambele plăci, mediul de tratare este înlocuit, ulterior, cu mediul de cultură și după alte 24 de ore de incubare, se determină viabilitatea celulară prin fixarea colorantului roșu neutru. Viabilitatea celulară este exprimată în procent de probe martor solvente netratate și se calculează pentru fiecare concentrație de testare. Pentru estimarea potențialului fotoxic, se compară răspunsurile la concentrații, obținute în prezența și absența iradierii, de obicei la nivelul IC50, respectiv la concentrația care reduce viabilitatea celulară cu 50 % față de probele martor netratate.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Etape pregătitoare
1.4.1.1. Celule
În studiul de validare s-a utilizat o linie permanentă de celule fibroblaste de șoarece – Balb/c 3T3, clona 31 – provenind fie de la ATCC (American Type Culture Collection) Manassas, VA, SUA, fie de la ECACC (European Collection of Cell Cultures) Salisbury, Wiltshire, UK și, prin urmare se recomandă ca celulele să provină de la un depozit de celule calificat corespunzător. Dacă se adaptează condițiile de cultură la nevoile specifice ale celulelor, se pot utiliza cu succes alte celule sau linii celulare pentru aceeași procedură de testare, cu condiția demonstrării echivalenței.
Celulele trebuie controlate cu regularitate pentru a verifica absența contaminării acestora cu micoplasmă și trebuie utilizate numai dacă rezultatele acestui control sunt satisfăcătoare (11).
Este important ca sensibilitatea celulelor la UVA să fie controlată în mod regulat, conform procedurii pentru controlul calității descrisă în prezenta metodă. Datorită faptului că sensibilitatea celulelor la UVA poate să crească o dată cu numărul de reînsămânțări, ar trebui să se utilizeze celulele Balb/c 3T3 cu cel mai mic număr de reînsămânțări posibile, de preferință mai mic de 100 (a se vedea punctul 1.4.2.2.2 și apendicele 2).
1.4.1.2. Medii și condiții de cultură
Se recomandă utilizarea unor medii de cultură și a unor condiții de incubare corespunzătoare pentru reînsămânțarea sistematică a celulelor și în timpul procedurii de testare. De exemplu, pentru celulele Balb/c 3T3, mediul de cultură este DMEM (Dulbecco's Modified Eagle's Medium) la care s-a adăugat 10 % ser de vițel nou-născut, 4 mM de glutamină, penicilină (100 IU), și streptomicină (100 μg/ml), incubarea în atmosferă umidificată la 37 oC, 5-7,5 % CO2,, în funcție de tampon (a se vedea punctul 1.4.1.4, al doilea paragraf). Este foarte important ca aceste condiții de cultură celulară să asigure o durată a ciclului celular într-un interval normal pentru celulele sau linia celulară utilizată.
1.4.1.3. Pregătirea culturilor
Celulele din stocul de culturi congelate se însămânțează într-un mediu de cultură la o densitate corespunzătoare și se reînsămânțează cel puțin o dată înainte de a fi folosite pentru testul de fototoxicitate 3T3 NRU in vitro.
Celulele folosite pentru testul de fototoxicitate sunt însămânțate în mediul de cultură la densitatea corespunzătoare, astfel încât culturile să nu ajungă la confluență înainte de terminarea testului, respectiv atunci când se determină viabilitatea celulară după 48 de ore de la însămânțarea celulelor. Pentru celulele Balb/c 3T3 cultivate pe plăci cu 96 de godeuri, densitatea celulară recomandată este de 1 × 104 celule pe godeu.
Pentru fiecare substanță chimică testată, celule sunt însămânțate în mod identic pe două plăci separate, cu câte 96 de godeuri, utilizate ulterior, în mod concomitent pe toată durata procedurii de testare, în condiții de cultură identice, cu excepția intervalului de timp în care o placă este iradiată (+ Irr) și cealaltă este păstrată la întuneric (– Irr).
1.4.1.4. Pregătirea substanțelor de testare
Substanțele de testare trebuie să fie proaspăt preparate, chiar înaintea utilizării, cu excepția cazului în care există date care dovedesc stabilitatea acestora în timpul depozitării. Se recomandă ca manipularea tuturor substanțelor chimice, precum și tratarea inițială a celulelor să se efectueze în condiții de luminozitate care să evite fotoactivarea sau degradarea substanței de testare înaintea iradierii.
Substanțele chimice testate trebuie dizolvate în soluții saline tamponate, de exemplu soluție salină echilibrată Earl (Earle's Balanced Salt Solution – EBSS) sau alte soluții tampon echilibrate fiziologic, care nu trebuie să conțină componente proteice și care absorb lumina (de exemplu indicatori de pH colorați și vitamine), în vederea evitării interferenței în timpul iradierii. Din moment ce, în timpul iradierii, celulele sunt ținute timp de aproximativ 50 de minute în afara incubatorului CO2, trebuie luate măsuri pentru a evita alcalinizarea. Aceasta se poate realiza prin incubarea celulelor la 7,5 % CO2, în cazul în care se folosesc tampoane slabe ca EBSS. Dacă celulele sunt incubate la doar 5 % CO2, se va selecta un tampon mai puternic.
Substanțele chimice de testare cu solubilitate limitată în apă trebuie dizolvate într-un solvent corespunzător. În cazul în care se utilizează un anumit solvent, acesta trebuie să fie prezent în volum constant în toate culturile, respectiv în probele negative (solvent), precum și în toate concentrațiile substanței chimice testate și să fie necitotoxic în concentrația utilizată. Concentrațiile soluțiilor de testat ar trebui selectate astfel încât să se evite precipitarea sau soluțiile în suspensie.
Solvenții recomandați sunt dimetilsulfoxidul (DMSO) și etanolul (EtOH). Pot fi adecvați și alți solvenți cu citotoxicitate redusă (de exemplu acetona). Se recomandă ca, înainte de utilizare, să se efectueze o evaluare atentă a proprietăților specifice ale tuturor solvenților, de exemplu reacția cu substanța chimică testată, atenuarea efectului fototoxic, proprietățile de fixare a radicalilor și/sau stabilitatea chimică în solvent.
Pentru facilitarea solubilizării, se pot utiliza agitatorul Vortex, dezintegrarea cu ultrasunete și/sau încălzirea la temperaturi adecvate, cu condiția ca stabilitatea substanței testate să nu fie afectată.
1.4.1.5. Condiții de iradiere
1.4.1.5.1.
Alegerea unei surse de lumină și a unei filtrări corespunzătoare reprezintă factorul principal pentru testarea fototoxicității. Gama UVA și de lumină vizibilă sunt asociate, de obicei, reacțiilor fototoxice in vivo (3) (12), în timp ce, în general, gama UVB este mai puțin importantă, dar este foarte citotoxică; citotoxicitatea crește de o mie de ori pe măsură ce lungimea de undă trece de la 313 nm la 280 nm (13). Criteriile pentru alegerea unei surse corespunzătoare de lumină trebuie să includă cerința ca sursa de lumină să emită lungimi de undă absorbite de substanța chimică testată (spectru de absorbție) și ca doza de lumină (care se poate obține într-un timp de expunere rezonabil) să fie suficientă pentru detectarea substanțelor fotocitotoxice cunoscute. În plus, lungimile de undă și dozele utilizate nu ar trebui să dăuneze în mod nejustificat sistemului, de exemplu emisia de căldură (regiunea infraroșu).
Simularea luminii solare cu simulatori solari este considerată sursa optimă de lumină artificială. Distribuția puterii de iradiere a simulatorului solar cu filtru trebuie să fie apropiată de cea a luminii exterioare naturale menționate la punctul (14). Se utilizează ca simulatoarele solare atât arcurile cu xenon, cât și arcurile (dopate) cu halogenuri din mercur/metalice. Acestea din urmă prezintă avantajul că emit mai puțină căldură și sunt mai ieftine, dar reproducerea luminii solare este inferioară în comparație cu arcurile cu xenon. Deoarece toate simulatoarele solare emit cantități importante de UVB, ar trebui să fie dotate cu filtre corespunzătoare pentru atenuarea lungimilor de undă UVB puternic citotoxice. Deoarece materialele plastice pentru culturile de celule conțin stabilizatori UV, spectrul al trebui măsurat cu ajutorul aceluiași tip de placă cu 96 de godeuri, utilizat la testare. Indiferent de măsurile luate pentru atenuarea unor părți din spectru prin filtrare sau prin efecte inevitabile de filtrare a echipamentului, spectrul înregistrat sub aceste filtre nu trebuie să devieze de la lumina naturală, exterioară, standardizată (14). Un exemplu de distribuție a iradianței spectrale a simulatorului solar cu filtru, utilizat în studiul de validare a testului de fototoxicitate 3T3 NRU in vitro, a fost publicat în (8) (16). A se vedea, de asemenea, apendicele 2 figura 1.
1.4.1.5.2.
Intensitatea luminii (iradianța) ar trebui controlată în mod regulat înaintea fiecărui test de fototoxicitate, folosind un radiometru UV corespunzător, cu bandă largă. Intensitatea trebuie măsurată cu ajutorul aceluiași tip de placă cu 96 de godeuri, care va fi utilizat la testare. Radiometrul UV trebuie să fie calibrat în funcție de sursă. Performanța radiometrului UV ar trebui verificată, recomandându-se utilizarea unui al doilea radiometru de referință pentru măsurarea UV, de același tip, calibrat în mod identic. În mod ideal, la intervale mai mari, ar trebui utilizat un spectroradiometru pentru măsurarea iradianței spectrale a sursei de lumină filtrate și controlul calibrării radiometrului UV cu bandă largă.
S-a stabilit că o doză de 5 J/cm2 (măsurată în gama UVA) nu este citotoxică pentru celulele Balb/c 3T3, fiind suficient de puternică pentru a excita chiar și substanțele chimice pentru a obține reacții fototoxice (6) (17). De exemplu, pentru a obține 5 J/cm2 în 50 de minute, iradianța a fost reglată la 1,7 mW/cm2. A se vedea apendicele 2, figura 2. Dacă se utilizează o altă linie de celule sau o sursă diferită de lumină, calibrarea dozei de iradianță poate fi necesară astfel încât doza respectivă să nu fie nocivă pentru celule, dar să fie suficientă pentru a excita fototoxinele standard. Timpul de expunere la lumină se calculează astfel:
|
|
(1 J = 1 Ws) |
1.4.2. Condiții de testare
1.4.2.1. Concentrații ale substanțelor de testare:
Gama concentrațiilor unei substanțe chimice testate în prezența (+ Irr) și în absența (–Irr) luminii ar trebui determinate corespunzător prin experimente pentru aflarea dozelor. S-ar putea dovedi folositoare evaluarea solubilității, la început și după 60 de minute (sau după intervalul de timp utilizat pentru tratare), deoarece solubilitatea se poate modifica în timp sau pe durata expunerii. Pentru a evita toxicitatea provocată de condițiile necorespunzătoare de cultură sau de substanțele chimice puternic acide ori alcaline, pH-ul culturilor de celule la care s-a adăugat substanța chimică testată ar trebui să se încadreze în limitele 6,5-7,8.
Cea mai mare concentrație a substanței testate trebuie să se încadreze în condițiile fiziologice de testare, de exemplu trebuie evitat pH-ul osmotic și de stres. În funcție de substanța chimică testată, ar putea fi necesar să se aibă în vedere și alte proprietăți fizico-chimice ca factori importanți în limitarea celei mai mari valori a concentrației de test. În ceea ce privește substanțele relativ insolubile netoxice la concentrații care merg până la punctul de saturație, ar trebui testată cea mai mare concentrație care poate fi atinsă. În general, trebuie evitată precipitarea substanței chimice de testare la oricare dintre concentrațiile de testare. Concentrația maximă a unei substanțe de test nu trebuie să depășească 1 000 μg/ml; osmolaritatea nu ar trebui să depășească 10 mmolar. Ar trebui utilizată o serie de diluții geometrice incluzând 8 concentrații ale substanței testate cu un factor constant de diluție (a se vedea punctul 2.1 al doilea paragraf).
Dacă s-a obținut informația (pe baza unui experiment de identificare a limitelor) că substanța testată nu este citotoxică până la limita de concentrație a experimentului la întuneric (– Irr), dar că este puternic citotoxică la lumină (+ Irr), limitele concentrației care trebuie selectate pentru experimentul la lumină (+ Irr) pot fi diferite de limitele selectate pentru experimentul la întuneric (– Irr), în vederea îndeplinirii cerințelor privind calitatea corespunzătoare a datelor.
1.4.2.2. Controale
1.4.2.2.1.
Celulele ar trebui verificate în mod regulat (aproximativ la fiecare a cincea reînsămânțare), în ceea ce privește sensibilitatea la sursa de lumină, evaluând viabilitatea acestora în urma expunerii la doze din ce în ce mai mari de iradiere. Pentru această evaluare, trebuie folosite mai multe doze de iradiere, inclusiv niveluri semnificativ mai ridicate decât cele utilizate pentru testul de fototoxicitate 3T3 NRU. Metoda cea mai simplă de cuantificare a acestor doze constă în măsurarea spectrului UV din sursa de lumină. Celulele sunt însămânțate la densitatea utilizată pentru testul de fototoxicitate 3T3 NRU in vitro și iradiate în ziua următoare. Ulterior, viabilitatea celulară se determină o zi mai târziu, utilizând fixarea colorantului roșu neutru. Trebuie să se demonstreze că cea mai mare doză necitotoxică rezultată (de exemplu în studiul de validare: 5 J/cm2 [UVA]) este suficientă pentru a clasifica, în mod corect, substanțele chimice de referință (tabelul 1).
1.4.2.2.2.
Testul îndeplinește criteriile de calitate dacă probele negative/solvente iradiate indică o viabilitate mai mare de 80 % în comparație cu probele negative/solvente neiradiate.
1.4.2.2.3.
Densitatea optică absolută (DO540 NRU) din colorantul roșu neutru extras din probele de solvent indică dacă cele 1 × 104 celule însămânțate per godeu s-au dezvoltat cu un timp de dublare normal în cele două zile de testare. Testul îndeplinește criteriile de acceptare dacă media DO540 NRU pentru probele netratate este ≥ 0,4 (aproximativ de douăzeci de ori absorbanța de bază a solventului).
1.4.2.2.4.
O substanță chimică fototoxică cunoscută este testată în același timp cu fiecare test de fototoxicitate 3T3 NRU in vitro. Se recomandă clorpromazinul (CPZ). Pentru CPZ testat conform procedurii standard în testul de fototoxicitate 3T3 NRU in vitro, s-au stabilit următoarele criterii de acceptare a testului: CPZ iradiată (+ Irr): IC50 = 0,1-2,0 μg/ml, CPZ neiradiată (– Irr): IC50 = 7,0-90,0 μg/ml. Factorul de fotoiritare (PIF) ar trebui să fie > 6. Datele controlului pozitiv trebuie monitorizate.
În locul clorpromazinului se pot utiliza ca probe pozitive simultane și alte substanțe chimice fototoxice, care corespund clasei de substanțe chimice sau caracteristicilor de solubilitate ale substanței chimie evaluate.
1.4.3. Procedura de testare (6) (7) (8) (16) (17):
1.4.3.1. Prima zi
Se varsă 100 μl mediu de cultură în godeurile periferice ale unei plăci de microtitru de cultură tisulară cu 96 de godeuri (= goale). În celelalte godeuri se varsă 100 μl dintr-o suspensie celulară de 1 × 105 celule/ml în mediul de cultură (= 1 × 104 celule/godeu). Se pregătesc două plăci pentru fiecare serie de concentrații ale substanței de testare, precum și pentru probele pozitive și de solvent.
Se incubează celulele timp de 24 de ore (a se vedea punctul 1.4.1.2) până când formează un monostrat semiconfluent. Această perioadă de incubare permite recuperarea, aderența și creșterea exponențială a celulei.
1.4.3.2. A doua zi
După incubație, se decantează mediul de cultură din celule și se spală cu atenție cu 150 μl din soluția tampon folosită pentru incubație. Se adaugă 100 μl de soluție tampon cu o concentrație adecvată a substanței chimice de testare sau a solventului (solvent de control). Se aplică 8 concentrații diferite din substanța chimică de testare. Se incubează celulele cu substanța de testare la întuneric timp de 60 de minute (a se vedea punctul 1.4.1.2 și punctul 1.4.1.4 paragraful al doilea).
Dintre cele două plăci pregătite pentru fiecare serie de concentrații ale substanței de testare și ale probelor de control, se selectează una, în general în mod aleatoriu, pentru a se determina citotoxicitatea (– Irr) (de exemplu, placa de control), iar cealaltă (placa de tratare) pentru determinarea fotocitotoxicității (+ Irr).
Pentru realizarea expunerii la + Irr, se iradiază celulele la temperatura camerei timp de 50 de minute, prin capacul plăcii, cu cea mai mare doză de radiație necitotoxică (a se vedea, de asemenea, apendicele 2). Plăcile neiradiate (– Irr) se păstrează la temperatura camerei, într-o cutie închisă, timp de 50 de minute (= timpul de expunere la lumină).
Se decantează soluția de testare și se spală cu atenție, de două ori, cu 150 μl din soluția tampon folosită pentru incubație, dar care nu conține substanța de testare. Se înlocuiește soluția tampon cu mediul de cultură și se incubează (a se vedea punctul 1.4.1.2) peste noapte (18-22 ore).
1.4.3.3. A treia zi
1.4.3.3.1.
Pentru examinarea celulelor din punct de vedere al dezvoltării, morfologiei și integrității monostratului trebuie utilizat un microscop cu contrast de fază. Se înregistrează modificările apărute în morfologia celulei și efectele asupra dezvoltării celulei.
1.4.3.3.2.
Se spală celulele cu 150 μl de soluție tampon încălzită în prealabil. Soluția de spălare se îndepărtează prin tamponare ușoară. Se adaugă 100 μl de soluție de roșu neutru 50 μg/ml (RN) (clorhidrat de 3-amino-7-dimetilamino-2-metilfenazin, număr EINECS 209-035-8; număr CAS 553-24-2; C.I. 50040) în mediu fără ser (16) și se incubează conform descrierii de la punctul 1.4.1.2, timp de 3 ore. După incubație, se îndepărtează mediul de RN și se spală celulele cu 150 μl de soluție tampon. Se decantează, iar surplusul de soluție tampon se îndepărtează cu un material absorbant sau prin centrifugare.
Se adaugă exact 150 μl de soluție RN de desorbție (preparată proaspăt din 49 părți apă + 50 părți etanol + 1 parte acid acetic).
Se agită ușor placa de microtitru pe un aparat de agitare pentru plăcile de microtitru timp de 10 minute, până când roșul neutru este extras din celule și formează o soluție omogenă.
Se măsoară densitatea optică a extrasului de roșu neutru la 540 nm într-un spectrofotometru, utilizându-se godeurile goale ca puncte de referință. Pentru analize ulterioare, datele se salvează într-un fișier electronic corespunzător.
2. DATE
2.1. CALITATEA ȘI CANTITATEA DATELOR
Datele testului trebuie să permită o analiză semnificativă relațiilor concentrație-răspuns obținute în prezența și în absența iradierii și, dacă este posibil, o identificare a concentrației substanței chimice de testare la care viabilitatea celulară este redusă la 50 % (IC50). Dacă se constată o citotoxicitate, atât gama de concentrații cât și intervalul între fiecare concentrație trebuie stabilite astfel încât să permită adaptarea unei curbe la datele experimentale.
Atât pentru rezultatele clar pozitive, cât și pentru cele clar negative (a se vedea punctul 2.3, primul paragraf), experimentul principal poate fi suficient, însoțit de unul sau mai multe experimente preliminare de identificare a gamei de doze.
Rezultatele echivoce, la limită sau neclare trebuie clarificate prin testări suplimentare (a se vedea, de asemenea, punctul 2.4 al doilea paragraf). În astfel de cazuri, trebuie luată în considerare modificarea condițiilor de testare. Condițiile de testare care ar putea fi modificate includ: gama de concentrații sau distanța dintre ele, timpul de preincubare, precum și timpul de expunere la iradiere. Pentru substanțele chimice instabile în apă, poate fi mai adecvat un timp de expunere mai scurt.
2.2. EVALUAREA REZULTATELOR
Pentru a facilita evaluarea datelor, se poate calcula factorul de fotoiritare (PIF) sau fotoefectul mediu (MPE).
Pentru calcularea măsurilor de fotocitotoxicitate (a se vedea mai jos), setul valorilor concentrație-răspuns distincte trebuie aproximat printr-o curbă concentrație-răspuns continuă corespunzătoare (model). Adaptarea curbei la date se realizează în mod obișnuit printr-o metodă de regresie nelineară (18). Pentru a estima influența variabilității datelor asupra curbei adaptate, se recomandă o procedură de „bootstrap”.
Factorul de fotoiritare (PIF) se calculează folosind următoarea formulă:

Dacă IC50 în prezența sau în absența luminii nu se poate calcula, nici PIF pentru substanța de testare nu poate fi determinat. Fotoefectul mediu (MPE) se bazează pe comparația curbelor concentrație-răspuns complete (19). Acesta este definit ca media ponderală a unui set reprezentativ de valori ale fotoefectului.

Fotoefectul PEc, la o concentrație oarecare C este definit ca produsul dintre efectul de răspuns REc și efectul de doză DEc, respectiv PEc = REc × DEc. Efectul de răspuns REc reprezintă diferența dintre răspunsurile obținute în absența și în prezența luminii, respectiv REc = Rc (– Irr) – Rc (+ Irr). Efectul de doză este dat de formula:

unde C* reprezintă concentrația de echivalență, respectiv concentrația la care răspunsul + Irr este egal cu răspunsul la – Irr la concentrația C. Dacă C* nu poate fi determinat din cauză că valorile de răspuns ale curbei + Irr sunt, în mod constant, mai mari sau mai mici decât de RC(– Irr), efectul de doză este stabilit la valoarea 1. Factorii de ponderare wi rezultă din valoarea de răspuns cea mai mare, respectiv, wi = MAX {Ri (+ Irr), Ri (– Irr)}. Grila de concentrații Ci este selectată astfel încât același număr de puncte să figureze în fiecare dintre intervalele de concentrații definite de valorile de concentrații utilizate în experiment. Calculul MPE se limitează la valoarea maximă a concentrației pentru care cel puțin una dintre cele două curbe indică o valoare de răspuns de minim 10 %. Dacă această concentrație maximă este mai mare decât cea mai mare concentrație utilizată în experimentul + Irr, partea rămasă din curba + Irr se fixează la valoarea de răspuns „0”. Substanța chimică este clasificată drept fototoxică în funcție de valoarea MPE, mai mare sau nu decât o valoare limită selectată corespunzător (MPEc = 0,15).
Pentru calcularea PIF și MPE, referința (20) pune la dispoziție un pachet de programe.
2.3. INTERPRETAREA REZULTATELOR
Pe baza studiului de validare (8), substanța de testare cu un PIF < 2 sau un MPE < 0,1 indică: „absența fototoxicității”. Un PIF > 2 și < 5 sau un MPE > 0,1 și < 0,15 indică: „fototoxicitate probabilă”, iar un PIF > 5 sau un MPE > 0,15 indică: „fototoxicitate”.
În cazul laboratoarelor care efectuează acest test pentru prima dată, substanțele de referință menționate în tabelul 1 trebuie testate înainte de evaluarea fototoxicității substanțelor de testare. Valorile PIF sau MPE trebuie să fie apropiate de valorile menționate în tabelul 1.
Tabelul 1
|
Denumirea chimică |
Nr. EINECS |
Nr. CAS |
PIF |
MPE |
Punctul maxim de absorbție |
Solvent (1) |
|
Amiodaronă HCL |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,27-0,54 |
242 nm 300 nm (prag) |
etanol |
|
Clorpromazin HCL |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33-0,63 |
309 nm |
etanol |
|
Norfloxacin |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34-0,90 |
316 nm |
acetonitril |
|
Antracen |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19-0,81 |
356 nm |
acetonitril |
|
Protoporfirină IX de disodiu |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54-0,74 |
402 nm |
etanol |
|
L-Histidină |
[7006-35-1] |
fără PIF |
0,05-0,10 |
211 nm |
apă |
|
|
Hexaclorofen |
200-733-8 |
[70-30-4] |
1,1-1,7 |
0,00-0,05 |
299 nm 317 nm (prag) |
etanol |
|
Lauril sulfat de sodiu |
205-788-1 |
[151-21-3] |
1,0-1,9 |
0,00-0,05 |
fără absorbție |
apă |
|
(1) Solventul utilizat pentru măsurarea absorbției. |
||||||
2.4. INTERPRETAREA DATELOR
Dacă efectele fototoxice sunt observate doar la cea mai mare concentrație de testare, (în special pentru substanțele chimice solubile în apă), poate fi necesar să se ia în considerare alte elemente pentru evaluarea riscurilor, precum date privind absorbția cutanată, acumularea substanțelor chimice în piele și/sau date obținute de la alte teste, cum ar fi testarea substanței chimice in vitro, pe piele umană sau animală sau pe alte modele de piele.
Dacă nu se demonstrează existența toxicității (+ Irr și – Irr) și dacă solubilitatea scăzută a limitat concentrațiile care puteau fi testate, atunci se poate pune sub semnul întrebării compatibilitatea substanței de testate cu testul, fiind util să se ia în considerare efectuarea unui test de confirmare utilizând, de exemplu, un alt model.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să includă cel puțin următoarele informații:
Substanța testată:
— datele de identificare, denumirile generice comune și numerele IUPAC și CAS, dacă se cunosc;
— starea fizică și puritatea;
— proprietățile fizico-chimice relevante pentru efectuarea studiului;
— spectrul de absorbție UV/vizibilă;
— stabilitatea și fotostabilitatea, dacă se cunosc.
Solventul:
— justificarea alegerii solventului;
— solubilitatea substanței chimice testate în solvent;
— procentul de solvent prezent în mediul de tratare.
Celulele:
— tipul și sursa celulelor;
— absența micoplasmei;
— numărul de reînsămânțare al celulelor, dacă se cunoaște;
— sensibilitatea celulelor la radiații, stabilită cu aparatul de iradiere utilizat în cadrul testului de fototoxicitate 3T3 NRU in vitro.
Condițiile de testare (1); incubația înainte și după tratare:
— tipul și compoziția mediului de cultură;
— condițiile de incubare (concentrația de CO2; temperatura; umiditatea);
— durata incubației (înainte și după tratare).
Condițiile de testare (2); tratare cu substanța chimică:
— motivele selectării concentrațiilor substanței chimice de testare utilizate în prezența și în absența iradierii;
— în cazul unei solubilități limitate a substanței de testare și a absenței cititoxicității: motivul testării celei mai ridicate concentrații;
— tipul și compoziția mediului de tratare (soluție salină tampon);
— durata tratării chimice.
Condiții de testare (3); iradierea:
— motivul pentru alegerea sursei de lumină utilizate;
— producătorul și tipul sursei de lumină și a radiometrului;
— caracteristicile de iradiere spectrală ale sursei de lumină;
— caracteristicile de transmisie și absorbție ale filtrului (filtrelor) utilizat(e);
— caracteristicile radiometrului și detaliile privind calibrarea acestuia;
— distanța dintre sursa de lumină și sistemul de testare;
— iradierea UVA la această distanță, exprimată în mW/cm2;
— durata expunerii la lumină UV/vizibilă;
— doza de UVA (iradiere × timp), exprimată în J/cm2;
— temperatura culturilor de celule în timpul iradierii și a culturilor de celule ținute concomitent la întuneric.
Condiții de testare (4); testul de viabilitate cu roșu neutru:
— compoziția mediului de tratare cu roșu neutru;
— durata de incubație a roșului neutru;
— condițiile de incubație (concentrația de CO2, temperatura, umiditatea);
— condițiile de extragere a roșului neutru (soluția de extragere, durata);
— lungimea de undă utilizată pentru citirea spectrofotometrică a densității optice a roșului neutru;
— a doua lungime de undă (referință), dacă este utilizată;
— conținutul spațiului liber al spectrofotometrului, dacă este utilizat.
Rezultate:
— viabilitatea celulară obținută la fiecare concentrație a substanței chimice de testare, exprimată în viabilitatea procentuală medie a probelor de solvent simultane;
— curbele concentrație-răspuns (concentrația substanței chimice de testare comparată cu viabilitatea celulară relativă) obținute în experimente simultane + Irr și – Irr;
— analiza curbelor concentrație-răspuns: dacă este posibil, estimarea/calcularea IC50 (+ Irr) și IC50 (– Irr);
— compararea celor două curbe concentrație-răspuns obținute în prezența și în absența iradierii, fie prin calcularea factorului de fotoiritare (PIF), fie prin calcularea fotoefectului mediu (MPE);
— criteriile de acceptare a testului, solvent de control simultan:
— viabilitatea absolută (densitatea optică a extrasului de roșu neutru) a celulelor iradiate și neiradiate;
— datele istorice privind controalele negativ și de solvent simultane, deviații medii și standard.
— criteriile de acceptare ale testului, control pozitiv simultan:
— IC50(+ Irr) și IC50(– Irr) și PIF/MPE ale substanței chimice de control pozitiv;
— datele chimice istorice ale controlului pozitiv: IC50(+ Irr) și IC50(– Irr) și PIF/MPE, deviații medii și standard.
Discutarea rezultatelor
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Lovell W. W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In Vitro 7: 95-102.
2. Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In „Research Progress in Organic, Biological and Medicinal Chemistry” Vol. 3 part 1. North Holland Publishing Co. Amsterdam. p XI-XXXV.
3. Spielmann, H., Lovell, W. W., Hölzle, E., Johnson, B. E., Maurer, T., Miranda, M. A., Pape, W. J. W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, 314-348.
4. Spikes, J. D. (1989). Photosensitization. In „The science of Photobiology” Edited by K. C. Smith. Plenum Press, New York. 2nd edition, pp. 79-110.
5. OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No. 7 „Guidance Document On Direct Phototransformation Of Chemicals In Water” Environment Directorate, OECD, Paris.
6. Spielmann, H., Balls, M., Döring, B., Holzhütter, H. G., Kalweit, S., Klecak, G., L’Eplattenier, H., Liebsch, M., Lovell, W. W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793-796.
7. Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7-8.
8. Spielmann, H., Balls, M., Dupuis, J., Pape, W. J. W., Pechovitch, G. De Silva, O., Holzhütter, H. G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W. W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305-327.
9. OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31th October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
10. Borenfreund, E., and Puerner, J. A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119-124.
11. Hay, R. J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225-237.
12. Lambert L. A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In „Dermatotoxicology”, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, pp. 515-530.
13. Tyrrell R. M., Pidoux M. (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825-1829.
14. ISO 10977. (1993). Photography – Processed photographic colour films and paper prints – Methods for measuring image stability.
15. Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No. 90, Vienna, 1993, ISBN 3 900 734 275
16. ZEBET/ECVAM/COLIPA – Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs.
17. Spielmann, H., Balls, M., Dupuis, J., Pape, W. J. W., De Silva, O., Holzhütter, H. G., Gerberick, F., Liebsch, M., Lovell, W. W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679-708.
18. Holzhütter, H. G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127-138.
19. Holzhütter, H. G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445-462.
20. http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1,00.html
APENDICELE 1
Rolul testului de fototoxicitate 3T3 NRU într-o abordare secvențială a testării fototoxicității substanțelor chimice

APENDICELE 2
Figura 1
Distribuția spectrală a iradierii unui simulator solar cu filtru
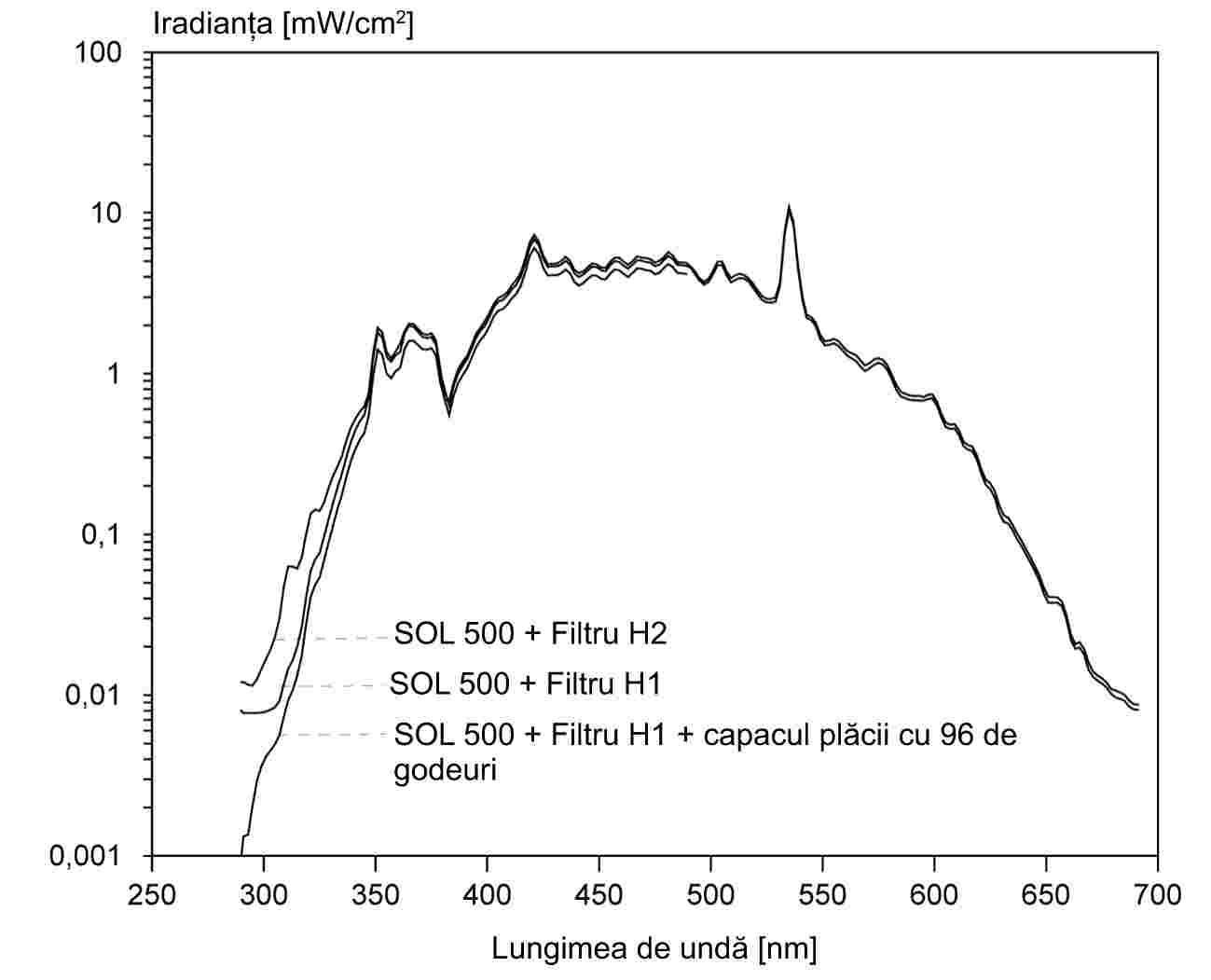
(a se vedea punctul 1.4.1.5 al doilea paragraf)
Figura 1 oferă un exemplu al unei distribuții acceptabile de iradiere spectrală pentru un simulator solar cu filtru. Aceasta corespunde sursei de halgenură metalică dopată utilizată în studiul de validare a testului 3T3 NRU (6) (8) (17). Se prezintă efectul a două filtre diferite și efectul de filtrare suplimentară a capacului plăcii de cultură cu 96 de godeuri. Filtrul H2 a fost utilizat doar cu sistemele de testare care pot tolera o cantitate mai mare de UVB (testul pe modelul de piele și testul de fotohemoliză a globulelor roșii). În cadrul testului 3T3 NRU s-a utilizat filtrul H1. Figura arată că efectul de filtrare suplimentară a capacului plăcii se observă în principal în gama UVB, lăsând suficiente raze UVB în spectrul de iradiere pentru a stimula substanțele chimice care absorb în mod obișnuit gama UVB, precum amiodarona (a se vedea tabelul 1).
Figura 2
Sensibilitatea celulelor Balb/c 3T3 la iradiere (conform măsurătorilor în gama UVA)
Viabilitatea celulară ( % de fixare a roșului neutru a probelor de control la întuneric)
(a se vedea punctele 1.4.1.5.2 al doilea paragraf; 1.4.2.2.1, 1.4.2.2.2)
Sensibilitatea celulelor Balb/c 3T3 la iradierea cu simulatorul solar utilizat în studiul de validare a testului de fototoxicitate 3T3 NRU, conform măsurătorilor efectuate în gama UVA. Figura prezintă rezultatele obținute în 7 laboratoare diferite în cadrul studiului de prevalidare (1). Cele două curbe cu simboluri deschise la culoare au fost obținute cu celule îmbătrânite (număr mai mare de reînsămânțări) care au trebuit înlocuite cu serii de celule noi, iar curbele cu simboluri îngroșate indică celule cu o toleranță acceptabilă la iradiere.
Pe baza acestor date a fost derivată doza cea mai mare de iradiere necitotoxică de 5 J/cm2 (linia verticală punctată). Linia orizontală punctată arată, în plus, efectul de iradiere maxim acceptabil menționat la punctul 1.4.2.2.
B.42. SENSIBILIZAREA DERMICĂ: TESTUL LOCAL PE GANGLIONII LIMFATICI
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 429 (2002) a OCDE.
1.1. INTRODUCERE
Validarea și acceptarea testului local pe ganglionii limfatici (LLNA) sunt suficiente pentru a justifica adoptarea acestuia ca nouă metodă (1) (2) (3). Acesta reprezintă a doua metodă de evaluare a potențialului de sensibilizare dermică al substanțelor chimice la animale. Cealaltă metodă (B.6) implică teste pe cobai, în special testul de maximizare la cobai și testul Buehler (4).
LLNA reprezintă o metodă alternativă de identificare a substanțelor chimice care produc o sensibilizare dermică și de confirmare a faptului că substanțele chimice nu au un potențial semnificativ de sensibilizare dermică. Acest lucru nu înseamnă în mod necesar că LLNA trebuie utilizat întotdeauna în locul testului pe cobai, ci că acest test este de aceeași calitate și că poate fi utilizat ca o alternativă pentru care rezultatele pozitive sau negative nu necesită în general confirmări suplimentare.
LLNA oferă anumite avantaje atât legate de progresul științific, cât și în ceea ce privește bunăstarea animală. În cadrul testului se studiază etapa de inducere a sensibilizării dermice și sunt furnizate date cantitative adecvate pentru evaluarea relației doză-efect. Detaliile privind validarea LLNA și o prezentare a lucrărilor asociate sunt publicate (5) (6) (7) (8). În plus, trebuie avut în vedere faptul că agenții de sensibilizare slabi/moderați, recomandați ca substanțe martor pozitiv adecvate pentru metodele de testare pe cobai, sunt adecvați și pentru utilizarea în cadrul LLNA (6) (8) (9).
LLNA este o metodă in vivo și, în consecință, nu elimină utilizarea animalelor pentru evaluarea activității de sensibilizare prin contact. Cu toate acestea, metoda oferă posibilitatea de a reduce numărul de animale necesare în acest scop. În plus, LLNA permite îmbunătățirea considerabilă a modului în care sunt utilizate animalele pentru testele de sensibilizare prin contact. LLNA se bazează pe evaluarea evenimentelor imunologice stimulate de substanțele chimice pe parcursul etapei de inducere a sensibilizării. Spre deosebire de testele pe cobai, LLNA nu impune inducerea unor reacții de hipersensibilitate dermică provocate de o probă declanșatoare. În plus, spre deosebire de testul de maximizare la cobai, pentru LLNA nu este necesară utilizarea unui adjuvant. Astfel, LLNA reduce suferința animalelor. În ciuda avantajelor oferite de LLNA în comparație cu testele tradiționale pe cobai, trebuie avute în vedere și anumite limitări care pot face necesară utilizarea testelor tradiționale pe cobai (de exemplu rezultatele fals negative la LLNA pentru anumite metale, rezultatele fals pozitive pentru anumiți agenți iritanți dermici) (10).
A se vedea și introducerea generală partea B.
1.2. PRINCIPIUL METODEI DE TESTARE
LLNA se bazează pe principiul conform căruia agenții de sensibilizare induc o proliferare primară a limfocitelor din ganglionul limfatic care drenează zona în care a fost aplicată substanța chimică. Această proliferare este proporțională cu doza aplicată (și cu puterea alergenului) și constituie o metodă simplă pe baza căreia se pot efectua măsurători cantitative obiective ale sensibilizării. Prin LLNA această proliferare este evaluată ca relație doză-efect, comparându-se proliferarea la grupul tratat cu cea de la grupul martor tratat cu vehicul. Se determină raportul dintre proliferarea produsă la grupul tratat și cea produsă la grupul martor tratat cu vehicul, numit indice de stimulare, care trebuie să aibă cel puțin valoarea trei pentru ca o substanță de testat să poată fi evaluată în continuare ca potențial agent de sensibilizare dermică. Metodele descrise în prezentul document se bazează pe utilizarea marcării radioactive pentru măsurarea proliferării celulare. Cu toate acestea, pentru evaluarea proliferării se pot utiliza și alte criterii, cu condiția să existe justificări și dovezi științifice adecvate, inclusiv citări și descrieri complete ale metodologiei.
1.3. DESCRIEREA METODEI DE TESTARE
1.3.1. Pregătire
1.3.1.1. Condiții de adăpostire și de hrănire
Animalele se adăpostesc în incinte individuale. Temperatura sălii în care se află animalele de experiență trebuie să fie de 22 oC (± 3 oC). Deși umiditatea relativă trebuie să fie de cel puțin 30 % și preferabil să nu depășească 70 % decât în timpul operațiunilor de curățare a sălii, obiectivul pentru umiditate este ca aceasta să fie de 50-60 %. Iluminatul trebuie să fie artificial și se alternează 12 ore de lumină cu 12 ore de întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă.
1.3.1.2. Pregătirea animalelor
Animalele se selectează aleatoriu, se marchează pentru a putea fi identificate individual (dar nu se folosește niciun tip de crotalie) și se țin în cuștile lor timp de cel puțin 5 zile înainte de a se începe administrarea dozei astfel încât să se aclimatizeze la condițiile de laborator. Toate animalele sunt examinate înainte de începerea tratamentului, pentru a se stabili că nu prezintă leziuni observabile la nivel dermic.
1.3.2. Condiții de testare
1.3.2.1. Animalele de experiență
Specia preferată pentru acest test este șoarecele. Se folosesc femele adulte din rasa CBA/Ca sau CBA/J, nulipare și care nu sunt însărcinate. La începutul studiului, animalele trebuie să aibă între 8-12 săptămâni, iar diferențele de greutate dintre ele trebuie să fie minime și să nu depășească 20 % din greutatea medie. Se pot utiliza și alte soiuri și masculi dacă se generează suficiente date pentru a demonstra că nu există diferențe semnificative în răspunsul la LLNA specifice rasei și/sau sexului.
1.3.2.2. Verificarea fiabilității
Grupul martor pozitiv se folosește pentru a demonstra că testul a fost realizat corect și că laboratorul îl poate realiza cu succes. Grupul martor pozitiv trebuie să prezinte un răspuns pozitiv la LLNA la un nivel de expunere care se consideră că determină o creștere a indicelui de stimulare (IS) > 3 față de grupul martor negativ. Doza administrată grupului martor pozitiv trebuie aleasă astfel încât inducerea răspunsului să fie evidentă, dar nu excesivă. Substanțele preferate sunt aldehida hexil-cinamică (nr. CAS 101-86-0, nr. EINECS 202-983-3) și mercaptobenzotiazolul (nr. CAS 149-30-4, nr. EINECS 205-736-8). În unele situații și pe bază de justificări adecvate se pot utiliza alte substanțe martor care îndeplinesc criteriile menționate anterior. Deși de obicei pentru fiecare test este necesar un grup martor pozitiv, este posibil ca în anumite situații laboratoarele de testare să aibă la dispoziție date istorice privind grupurile martor pozitiv care să ateste obținerea constantă a unui răspuns satisfăcător pe parcursul unei perioade de șase luni sau mai mare. În astfel de situații se pot efectua teste cu o frecvență mai redusă pe grupul martor pozitiv, dar la intervale de cel mult 6 luni. Deși substanța martor pozitiv trebuie testată împreună cu un vehicul despre care se știe că va provoca un răspuns constant (de exemplu acetonă: ulei de măsline), este posibil să existe și situații prevăzute de lege în care este necesară și testarea cu un vehicul non-standard (preparat cu relevanță clinică/chimică). În astfel de situații trebuie testată posibila interacțiune dintre substanța martor pozitiv și acest vehicul neconvențional.
1.3.2.3. Numărul de animale, doze și selectarea vehiculului
Fiecare grup tratat trebuie să fie format din minimum patru animale și se folosesc cel puțin trei concentrații ale substanței de testat plus un grup martor negativ tratat numai cu vehiculul utilizat împreună cu substanța de testat și, dacă este cazul, un martor pozitiv. Dacă se colectează date individuale privind animalele se folosesc cel puțin cinci animale în fiecare grup tratat. Animalele din grupul martor trebuie manipulate și tratate în mod identic cu animalele din grupurile tratate, cu excepția faptului că nu li se administrează tratamentul cu substanța de testat.
Doza și vehiculul se aleg pe baza recomandărilor din cadrul referințelor (1). Dozele se aleg din gama de concentrații de 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 0,5 % etc. Dacă există, datele privind toxicitatea acută și iritația dermică trebuie avute în vedere la alegerea celor trei concentrații consecutive astfel încât cea mai mare să maximizeze expunerea evitând în același timp toxicitatea sistemică și iritația dermică locală excesivă (2) (11).
Vehiculul trebuie selectat astfel încât să maximizeze concentrațiile de testare și solubilitatea, producând în același timp și o soluție/suspensie adecvată pentru aplicarea substanței de testat. În ordinea preferințelor, vehiculele recomandate sunt: acetonă/ulei de măsline (4:1 v/v), dimetilformamidă, metil etil cetonă, propilen glicol și dimetil sulfoxid (2) (10), dar se pot utiliza și altele dacă sunt furnizate justificări științifice suficiente. În anumite situații este posibil să fie necesară utilizarea unui solvent cu relevanță clinică sau a unui preparat comercial sub forma căruia este comercializată substanța de testat ca martor suplimentar. Trebuie acordată o atenție specială pentru ca materialele hidrofile să fie încorporate într-un sistem vehicul care să umezească pielea și să nu curgă imediat. Astfel, vehiculele formate numai din apă trebuie evitate.
1.3.3. Procedura de testare
1.3.3.1. Schema de tratament
Pentru acest test, schema de tratament este următoarea:
Ziua 1:
Se determină și se identifică greutatea fiecărui animal în parte. Se aplică 25 μl de substanță de test diluată în mod adecvat, numai sistemul vehicul sau martorul pozitiv (după caz) în regiunea dorsală a fiecărei urechi.
Zilele 2 și 3:
Se repetă procedura de aplicare efectuată în ziua 1.
Zilele 4 și 5:
Nu se aplică tratament.
Ziua 6:
Se înregistrează greutatea fiecărui animal. Li se injectează 25 μl de ser fiziologic tamponat cu fosfat (PBS) conținând 20 μCi (7,4e + 8 Bq) de 3H-metil timidină tuturor șoarecilor de experiență și celor din grupul martor prin vena codală. Alternativ, tuturor șoarecilor li se injectează 250 μl PBS conținând 2 μCi (7,4e + 8 Bq) de 125I–iododeoxiuridină și 10–5 M fluorodeoxiuridină prin vena codală.
După cinci ore, animalele sunt sacrificate. Se excizează ganglionii limfatici auriculari de drenare de la fiecare ureche de la toate animalele dintr-un grup experimental și se păstrează împreună în PBS (metodă colectivă la nivel de grup tratat); alternativ, se pot exciza perechi de ganglioni limfatici de la fiecare animal care se păstrează separat în PBS (metodă individuală la nivel de animal). Anexa I din referința 10 conține detalii și diagrame privind identificarea și disecția ganglionilor.
1.3.3.2. Prepararea suspensiilor celulare
Se prepară o singură suspensie celulară conținând celule din ganglionii limfatici fie de la un întreg grup tratat, fie de la un singur animal, printr-o separare mecanică ușoară realizată cu ajutorul unei site din oțel inoxidabil cu ochiuri de 200 μm. Celulele din ganglionii limfatici se spală de două ori cu PBS în exces și se precipită cu o soluție de acid tricloracetic (TCA) 5 % la 4 oC timp de 18 h (2). Granulele se suspendă din nou în 1 ml de soluție de acid tricloracetic și se transferă în flacoane de scintilație conținând 10 ml de fluid de scintilație pentru determinarea tritiului 3H sau se transferă direct în tuburile cu raze gama pentru determinarea iodului 125I.
1.3.3.3. Determinarea proliferării celulare (radioactivitate încorporată)
Încorporarea de 3H-metil timidină se măsoară prin determinarea β-scintilației, în dezintegrări pe minut (DPM). Încorporarea de 125I-iododeoxiuridină se măsoară prin determinarea 125I-iododeoxiuridinei și se exprimă, de asemenea, în DPM. În funcție de metoda utilizată, încorporarea se exprimă ca DPM/grup tratat (metoda colectivă la nivel de grup) sau în DPM/animal (metoda individuală la nivel de animal).
1.3.3.4. Observațiile
1.3.3.4.1.
Animalele se examinează atent o dată pe zi pentru identificarea oricăror semne clinice, fie iritații la locul aplicării, fie toxicitate sistemică. Toate observațiile se consemnează sistematic în înregistrările individuale pentru fiecare animal.
1.3.3.4.2.
După cum se arată în punctul 1.3.3.1, greutatea corporală a fiecărui animal se măsoară la începutul testului și în momentul prevăzut pentru sacrificare.
1.3.4. Calcularea rezultatelor
Rezultatele se exprimă ca indice de stimulare (IS). Dacă se folosește metoda colectivă, IS se obține prin împărțirea încorporării radioactive colective înregistrate de fiecare grup tratat la încorporarea înregistrată de grupul martor tratat cu vehicul; astfel se calculează un IS mediu. Dacă se folosește metoda individuală, IS se determină prin împărțirea valorii medii a DPM/animal din fiecare grup tratat cu substanța de testat și a valorii medii pentru grupul martor pozitiv la valoarea medie a DPM/animal din grupul martor tratat cu vehicul. Indicele de stimulare mediu pentru grupul martor tratat cu vehicul are valoarea 1.
Utilizarea metodei individuale de calculare a IS permite efectuarea unei analize statistice a datelor. Pentru alegerea metodei adecvate de analiză statistică, experimentatorul trebuie să aibă în vedere posibilele inegalități la nivelul varianțelor și alte probleme conexe care ar putea impune transformarea datelor sau o analiză statistică non-parametrică. O bună modalitate de interpretare a datelor constă din evaluarea tuturor datelor individuale obținute pentru grupurile tratate și pentru grupurile martor tratate cu vehicul urmată de determinarea celei mai adecvate curbe care descrie relația doză-efect, având în vedere pragurile de încredere (8) (12) (13). Cu toate acestea, experimentatorul trebuie să acorde atenție posibilelor reacții „excepționale” prezentate de unele animale dintr-un grup, care ar putea impune utilizarea unui mod alternativ de măsurare a reacțiilor (de exemplu mediana în locul mediei) sau eliminarea reacției excepționale.
O reacție este considerată pozitivă dacă indicele de stimulare este ≥ 3, luându-se în considerare relația doză-efect și, dacă este cazul, semnificația statistică (3) (6) (8) (12) (14).
Dacă rezultatele obținute nu sunt suficient de concludente, trebuie examinate diversele proprietăți ale substanței de testat, inclusiv dacă prezintă similitudini structurale cu agenți cunoscuți de sensibilizare dermică și dacă provoacă iritații cutanate excesive, precum și relația doză-efect observată. Aceste considerații, precum și altele, sunt discutate în detaliu în alt document (7).
2. DATE
Datele trebuie recapitulate sub formă de tabel, precizându-se valorile DPM medii și individuale și indicii de stimulare pentru fiecare grup tratat (inclusiv grupul martor tratat cu vehicul).
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Substanța de testat:
— date de identificare (de exemplu numărul CAS, dacă se cunoaște; sursa; puritatea; impuritățile cunoscute; numărul grupului);
— starea fizică și proprietățile fizice și chimice (de exemplu volatilitatea, stabilitatea, solubilitatea);
— în cazul amestecurilor, compoziția și procentul fiecărui constituent.
Vehiculul:
— date de identificare [puritate; concentrație (dacă este cazul); volum utilizat];
— justificarea alegerii vehiculului.
Animale de experiență:
— linia de șoareci utilizată;
— statutul microbiologic al animalelor, dacă se cunoaște;
— numărul, vârsta și sexul animalelor;
— sursa animalelor, condițiile de adăpostire, regimul alimentar etc.
Condiții de testare:
— detalii privind prepararea și aplicarea substanței de testat;
— justificarea dozei alese, inclusiv rezultatele studiului prin care a fost stabilit intervalul de dozare, dacă este cazul; concentrațiile vehiculului și ale substanței de testat utilizate și cantitatea totală de substanță aplicată;
— detalii privind calitatea hranei și a apei (inclusiv tipul/sursa regimului alimentar, sursele de apă).
Verificarea fiabilității
— un rezumat al rezultatelor obținute la ultima verificare a fiabilității, inclusiv informații privind substanța, concentrația și vehiculul utilizat;
— date concomitente și/sau istorice privind martorii pozitivi și negativi utilizate de laboratorul de testare.
Rezultate:
— greutatea fiecărui animal la începutul testului și în momentul prevăzut pentru sacrificare;
— tabloul valorilor DPM medii (pentru metoda colectivă) și individuale (metoda individuală) precum și intervalul de valori pentru ambele metode și indicii de stimulare pentru fiecare grup tratat (inclusiv grupul martor tratat cu vehicul);
— analiza statistică, dacă este cazul;
— momentul declanșării și semnele de toxicitate, inclusiv iritația dermică la locul administrării, dacă este cazul, pentru fiecare animal.
Discutarea rezultatelor:
— un scurt comentariu privind rezultatele, analiza relației doză-efect și analize statistice, dacă este cazul, și o concluzie care să indice dacă substanța de testat trebuie considerată agent de sensibilizare dermică.
4. REFERINȚE BIBLIOGRAFICE
1. Kimber, I. and Basketter, D. A. (1992). The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, 165-169.
2. Kimber, I, Derman, R. J., Scholes E. W, and Basketter, D. A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13-31.
3. Kimber, I., Hilton, J., Dearman, R. J., Gerberick, G. F., Ryan, C. A., Basketter, D. A., Lea, L., House, R. V., Ladies, G. S., Loveless, S. E., Hastings, K. L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An inter laboratory exercise. Journal of Toxicology and Environmental Health, 53, 563-79.
4. Metoda de testare B.6.
5. Chamberlain, M. and Basketter, D. A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology 34, 999-1002.
6. Basketter, D. A., Gerberick, G. F., Kimber, T. and Loveless, S. E. (1996). The local lymph node assay- A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985-997.
7. Basketter, D. A., Gerberick, G. F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327-33.
8. Van Och, F. M. M, Slob, W., De Jong, W. H., Vandebriel, R. J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, 49-59.
9. Dearman, R. J., Hilton, J., Evans, P., Harvey, P., Basketter, D. A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, 281-4.
10. National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov).
11. Metoda de testare B.4.
12. Basketter, D. A., Selbie, E., Scholes, E. W. Lees, D. Kimber, I. and Botham, P.A. (1993) Results with OCDE recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63-67.
13. Basketter D. A., Lea L. J., Dickens A., Briggs D., Pate I., Dearman R. J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, 261-266.
14. Basketter D. A., Blaikie L., Derman R. J., Kimber T., Ryan C. A., Gerberick G. F., Harvey P., Evans P., White T. R. and Rycroft R. T. G. (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, 344-48.
B.43. STUDII DE NEUROTOXICITATE PE ROZĂTOARE
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 424 (1997) a OCDE.
Această metodă de testare a fost elaborată în vederea obținerii informațiilor necesare pentru a confirma sau pentru a caracteriza mai eficient potențiala neurotoxicitate a unei substanțe la animale adulte. Poate fi utilizată împreună cu alte metode de testare în cadrul studiilor de toxicitate cu doză repetată sau în cadrul unui studiu separat. Se recomandă consultarea Liniilor directoare OCDE privind strategiile și metodele de testare a neurotoxicității (1) pentru elaborarea studiilor bazate pe această metodă de testare. Acest lucru este deosebit de important dacă se anticipează modificarea observațiilor și a procedurilor de testare recomandate în mod obișnuit pentru această metodă. Liniile directoare au fost elaborate pentru facilita alegerea altor proceduri de testare care urmează să fie utilizate în împrejurări speciale.
Această metodă nu este destinată evaluării neurotoxicității asupra dezvoltării.
1.1. INTRODUCERE
Pentru evaluarea caracteristicilor toxice ale produselor chimice trebuie avute în vedere posibilele efecte neurotoxice. Metoda de testare a toxicității sistemice cu doză repetată permite o primă triere a substanțelor care ar putea fi neurotoxice. Această metodă de testare poate fi utilizată pentru elaborarea unui studiu destinat obținerii de informații suplimentare privind efectele neurotoxice observate în cadrul studiilor de toxicitate sistemică cu doză repetată sau confirmării acestora. Cu toate acestea, în unele cazuri, potențiala neurotoxicitate a anumitor categorii de substanțe chimice poate fi evaluată în mod mai adecvat direct prin aplicarea acestei metode, fără colectarea în prealabil a indicațiilor care pot fi oferite de studiile de toxicitate sistemică cu doză repetată. Aici sunt incluse, de exemplu, cazurile în care:
— sunt observate semne de neurotoxicitate sau leziuni neuropatologice în cadrul studiilor de toxicitate, altele decât studiile de toxicitate sistemică cu doză repetată; sau
— substanțele prezintă asemănări de structură sau există alte informații privind existența unor caracteristici comune cu substanțe neurotoxice cunoscute.
În plus, utilizarea acestei metode poate fi adecvată și în alte cazuri; pentru mai multe informații a se vedea referința 1.
Această metodă a fost elaborată astfel încât să poată fi adaptată în funcție de diverse nevoi specifice privind confirmarea neurotoxicității histopatologice și comportamentale a unei substanțe chimice, precum și pentru a oferi o caracterizare și o cuantificare a reacției neurotoxice.
În trecut, neurotoxicitatea era asimilată unei neuropatii implicând leziuni neuropatologice sau disfuncții neurologice, cum ar fi convulsiile, paralizia sau tremorul. Deși neuropatia reprezintă o manifestare importantă a neurotoxicității, în prezent este evident că mai există multe alte semne de toxicitate la nivelul sistemului nervos (de exemplu pierderea coordonării motorii, deficiențe senzoriale, diminuarea capacității de învățare și a memoriei) care nu sunt întotdeauna evidențiate de studiile asupra neuropatiei sau de alte tipuri de studii.
Această metodă de testare a neurotoxicității a fost elaborată în vederea detectării efectelor neurocomportamentale și neuropatologice importante la rozătoare adulte. Deși efectele la nivelul comportamentului pot indica un impact negativ asupra organismului chiar și în absența unor modificări morfologice, nu toate modificările la nivelul comportamentului sunt specifice sistemului nervos. În consecință, toate modificările observate trebuie evaluate având în vedere și datele histopatologice, hematologice sau biochimice corespondente, precum și datele privind alte tipuri de toxicitate sistemică. Testele care trebuie realizate în cadrul acestei metode pentru caracterizarea și cuantificarea reacțiilor neurotoxice cuprind proceduri histopatologice și comportamentale specifice care pot fi completate prin investigații electrofiziologice și/sau biochimice (1) (2) (3) (4).
Substanțele neurotoxice pot acționa asupra mai multor ținte din cadrul sistemului nervos prin mai multe mecanisme. Deoarece nu se poate elabora o singură serie de teste care să permită o evaluare aprofundată a potențialului neurotoxic al tuturor substanțelor, poate fi necesară și efectuarea altor teste in vivo sau in vitro specifice tipurilor de neurotoxicitate studiate sau preconizate.
Această metodă de testare poate fi utilizată, de asemenea, împreună cu indicațiile prevăzute în Liniile directoare OCDE privind strategiile și metodele de testare a neurotoxicității (1) în vederea elaborării de studii destinate unei mai bune caracterizări și cuantificări a relației doză-efect pentru o mai bună estimare a nivelului concentrației la care nu se observă niciun efect advers sau pentru a pune în evidență pericolele cunoscute sau potențiale prezentate de substanța respectivă. De exemplu, pot fi elaborate studii destinate identificării și evaluării mecanismului sau mecanismelor neurotoxice sau completării datelor deja obținute prin protocoalele de observație neurocomportamentale și neuropatologice de bază. Prin aceste studii nu trebuie să se încerce obținerea acelorași date care ar fi obținute oricum prin utilizarea protocoalelor standard recomandate pentru această metodă dacă datele respective sunt deja disponibile și nu sunt considerate necesare pentru interpretarea rezultatelor studiului.
Informațiile oferite de acest test de neurotoxicitate, efectuat independent sau în combinație cu alte teste, permit:
— determinarea caracterului permanent sau reversibil al efectelor substanței chimice asupra sistemului nervos;
— o mai bună caracterizare a alterărilor de la nivelul sistemului nervos asociate expunerii la substanța chimică și o mai bună înțelegere a mecanismelor care stau la baza acestora;
— determinarea relației doză-efect și timp-efect în vederea estimării nivelului concentrației la care nu se observă niciun efect advers (care se poate utiliza pentru stabilirea criteriilor de siguranță pentru substanța chimică respectivă).
În cadrul acestei metode de testare, substanța de testat se administrează pe cale orală. Dacă sunt mai adecvate alte căi de administrare (de exemplu dermică sau prin inhalare), este posibil să se impună și modificarea procedurilor recomandate. Alegerea căii de administrare depinde de tipul expunerii la om și de informațiile toxicologice și cinetice disponibile.
1.2. DEFINIȚII
Efect advers: orice alterare față de nivelul de referință provocată de tratament și care reduce capacitatea de supraviețuire, de reproducere sau de adaptare la mediu a organismului.
Doză: cantitatea de substanță de testat administrată. Doza se exprimă ca greutate (g, mg) a substanței de testat sau ca greutate a substanței de testat pe unitatea de greutate corporală a animalului de experiență (de exemplu mg/kg) sau sub formă de concentrație alimentară constantă (ppm).
Dozare: termen general care desemnează doza administrată, frecvența și durata administrării.
Neurotoxicitate: modificare adversă a structurii sau a funcției sistemului nervos provocată de expunerea la un agent chimic, biologic sau fizic.
Substanță neurotoxică: orice agent chimic, biologic sau fizic care poate provoca neurotoxicitate.
NOAEL: abrevierea pentru nivelul dozei fără efect advers vizibil; reprezintă nivelul cel mai mare al dozei la care nu se observă niciun efect advers provocat de tratament.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța de testat se administrează pe cale orală sub forma mai multor doze mai multor grupuri de rozătoare de experiență. În general, se administrează doze repetate, în cadrul unui regim de dozare de 28 de zile, subcronic (90 de zile) sau cronic (1 an sau mai mult). Procedura descrisă în cadrul acestei metode poate fi utilizată și pentru studiile de neurotoxicitate acută. Animalele sunt testate în vederea detectării sau a caracterizării anomaliilor comportamentale și/sau neurologice. Pe parcursul fiecărei perioade de observație se evaluează diferite aspecte ale comportamentului care pot fi afectate de substanțe neurotoxice. La sfârșitul testului se perfuzează in situ animale de fiecare sex din fiecare grup și li se recoltează în vederea preparării și a examinării secțiuni din creier, din măduva spinării și din nervii periferici.
Dacă studiul se realizează independent în vederea depistării neurotoxicității sau a caracterizării efectelor neurotoxice, animalele din fiecare grup care nu sunt utilizate pentru perfuzare și pentru examenul histopatologic ulterior (a se vedea tabelul 1) pot fi utilizate pentru diferite proceduri neurocomportamentale, neurochimice sau electrofiziologice pe baza cărora se pot completa datele colectate în cadrul examinărilor standard impuse de această metodă (1). Aceste examinări suplimentare pot fi deosebit de utile în cazurile în care observațiile empirice sau efectele anticipate sugerează un tip specific de neurotoxicitate sau o țintă a neurotoxicității substanței. Restul animalelor pot fi, de asemenea, utilizate pentru evaluări de tipul celor din cadrul metodelor de testare din studiile de toxicitate cu doză repetată pe rozătoare.
Dacă procedurile din cadrul acestei metode sunt combinate cu cele din cadrul altor metode, trebuie să se prevadă un număr de animale suficient pentru realizarea observațiilor impuse de ambele studii.
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Alegerea speciei de animale
Specia preferată de rozătoare este șobolanul, deși se pot utiliza și alte specii, dacă se justifică alegerea. Se folosesc rase de experiență, alegându-se animale adulte tinere și sănătoase. Femelele trebuie să fie nulipare și să nu fie însărcinate. Administrarea dozelor trebuie să înceapă cât mai curând posibil după înțărcare, preferabil înainte ca animalele să împlinească vârsta de șase săptămâni și în orice caz înainte de atingerea vârstei de nouă săptămâni. Cu toate acestea, dacă acest studiu se realizează în combinație cu altele, este posibil să fie necesară ajustarea acestei limite de vârstă. La începutul studiului diferențele de greutate dintre animalele utilizate nu trebuie să depășească ± 20 % din greutatea medie a fiecărui sex. Dacă se realizează un studiu de scurtă durată cu doză repetată ca test preliminar pentru un studiu pe termen lung, în ambele studii se folosesc animale din aceeași sușă și din aceeași sursă.
1.4.2. Condiții de adăpostire și de hrănire
Temperatura sălii în care se află animalele de experiență trebuie să fie de 22 oC (± 3 oC). Deși umiditatea relativă trebuie să fie de cel puțin 30 % și preferabil să nu depășească 70 % decât în timpul operațiunilor de curățare a sălii, obiectivul pentru umiditate este ca aceasta să fie de 50-60 %. Iluminatul trebuie să fie artificial, și se alternează 12 ore de lumină și 12 ore de întuneric. Sunetele puternice intermitente trebuie reduse la minimum. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă.. Alegerea regimului alimentar poate fi influențată de faptul că în acesta trebuie adăugată și substanța de testat, dacă se administrează prin această metodă. Animalele pot fi găzduite în cuști fie individual, fie în grupuri mici de același sex.
1.4.3. Pregătirea animalelor
Se aleg aleatoriu animal tinere și sănătoase care se împart în grupul tratat și în grupul martor. Cuștile trebuie aranjate astfel încât să se reducă la minimum posibilele efecte provocate de această aranjare. Animalele se marchează individual astfel încât să poată fi identificate și se păstrează în cuști timp de cel puțin 5 (cinci) zile înainte de începerea studiului pentru a permite aclimatizarea la condițiile de laborator.
1.4.4. Calea de administrare și pregătirea dozelor
În cadrul acestei metode substanța de testat se administrează pe cale orală. Substanța de testat se poate administra prin gavaj, prin alimentație, prin apa potabilă sau prin capsule. Se pot utiliza și alte căi de administrare (de exemplu dermică sau prin inhalare), dar este posibil să fie necesară modificarea procedurilor recomandate. Alegerea căii de administrare depinde de tipul expunerii la om și de informații toxicologice și cinetice disponibile. Alegerea căii de administrare precum și eventualele modificări aduse procedurilor din cadrul acestei metode de testare trebuie justificate.
Dacă este necesar, substanța de testat se poate dizolva sau suspenda într-un vehicul adecvat. Se recomandă utilizarea de soluții sau suspensii apoase, și numai dacă acest lucru nu este posibil, utilizarea de soluții/suspensii în ulei (de exemplu, ulei de porumb) sau, ca soluție de ultimă instanță, utilizarea de soluții/suspensii în care se folosesc alte vehicule. Proprietățile toxice ale vehiculului trebuie să fie cunoscute. În plus, trebuie avute în vedere și următoarele caracteristici ale vehiculului: efectele acestuia asupra absorbției, distribuției, metabolismului sau retenției substanței de testat care i-ar putea afecta caracteristicile toxice și efectele asupra consumului de hrană sau de apă sau asupra stării de nutriție a animalului.
1.5. PROCEDURA DE TESTARE
1.5.1. Numărul și sexul animalelor
Dacă studiul se realizează independent, se folosesc cel puțin 20 de animale (10 femele și 10 masculi) pentru fiecare grup tratat sau grup martor pe care se vor realiza observații clinice și funcționale. La sfârșitul studiului, dintre cei zece masculi și cele zece femele se selectează cel puțin cinci masculi și cinci femele care sunt perfuzați in situ și supuși unui examen neuro-histopatologic detaliat. Dacă se observă doar un număr limitat de animale dintr-un grup tratat în vederea detectării efectelor neurotoxice, animalele în cauză trebuie să fie printre cele perfuzate. Dacă studiul se realizează împreună cu un studiu de toxicitate cu doză repetată, se folosește un număr adecvat de animale care permite îndeplinirea obiectivelor ambelor studii. În tabelul 1 este indicat numărul minim de animale din fiecare grup necesar pentru diferite combinații de studii. Dacă este prevăzută sacrificarea unor animale înainte de finalizarea studiului sau constituirea unor grupuri pe care să se observe reversibilitatea efectelor, persistența sau survenirea efectelor toxice cu întârziere după tratare, sau dacă se preconizează realizarea unor observații suplimentare, numărul de animale trebuie majorat astfel încât să fie suficient pentru efectuarea observațiilor și a examenelor histopatologice.
1.5.2. Grupul tratat și grupul martor
Ca regulă generală, trebuie să existe cel puțin trei grupuri tratate, dar dacă din evaluarea altor date disponibile rezultă că administrarea repetată a unei doze de 1 000 mg/kg greutate corporală/zi nu are niciun efect, se poate realiza un test-limită. Dacă nu sunt disponibile date adecvate, se poate realiza un studiu preliminar destinat stabilirii nivelurilor dozelor care trebuie utilizate. Exceptând tratamentul cu substanța de testat, animalele din grupul martor se tratează în mod identic cu animalele din grupul tratat. Dacă substanța de testat se administrează cu ajutorul unui vehicul, grupul martor trebuie să primească, de asemenea, un volum de vehicul egal cu cel mai mare volum utilizat pentru grupul tratat.
1.5.3. Verificarea fiabilității
Laboratorul care realizează studiul trebuie să prezinte date care demonstrează capacitatea sa de a realiza studiul și sensibilitatea metodelor utilizate. Aceste date trebuie să dovedească posibilitatea de detectare și cuantificare, după caz, a diferitelor criterii recomandate, de exemplu reacții neurovegetative, reactivitate senzorială, forță de prehensiune și activitate motorie. Referințele 2-9 conțin informații privind substanțele care provoacă diferite tipuri de reacții neurotoxice și care pot fi utilizate ca substanțe martor pozitiv. Se pot utiliza și date istorice, cu condiția ca elementele principale ale procedurilor de testare să rămână aceleași. Se recomandă actualizarea periodică a datelor istorice. De fiecare dată când laboratorul modifică un element esențial al testelor sau al metodelor trebuie să se obțină date noi care să demonstreze că sensibilitatea procedurii se menține.
1.5.4. Alegerea dozei
Nivelurile dozelor trebuie alese având în vedere toate datele disponibile privind toxicitatea și cinetica substanței de testat sau ale substanțele înrudite. Se alege cea mai mare doză pentru a provoca efecte neurotoxice sau efecte de toxicitate sistemică evidente. În continuare se alege o serie de doze descrescătoare pentru a se pune în evidență o eventuală relație doză-efect și absența nivelului dozei fără efect advers vizibil (NOAEL) la cel mai mic nivel al dozei. În principiu nivelurile dozelor trebuie alese astfel încât efectele neurotoxice primare de la nivelul sistemului nervos să poată fi deosebite de efectele legate de toxicitatea sistemică. Cea mai bună soluție constă de multe ori din alegerea a două sau trei intervale, iar adăugarea unui al patrulea interval este adesea preferabilă utilizării unor intervale foarte mari (de exemplu care depășesc factorul 10) între dozaje. Dacă există estimări realiste privind expunerea umană, acestea trebuie, de asemenea, luate în considerare.
1.5.5. Testul-limită
Dacă un studiu cu o doză de cel puțin 1 000 mg/kg greutate corporală/zi realizat în conformitate cu metoda descrisă anterior nu provoacă niciun efect neurotoxic observabil și dacă datele privind compușii cu structură asemănătoare sugerează că este puțin probabil ca substanța să fie toxică, se poate considera că nu este necesară realizarea unui studiu cu trei niveluri de dozare. În funcție de expunerea umană anticipată, este posibil să fie necesară mărirea dozei orale administrate în cadrul testului-limită. Pentru celelalte căi de administrare, cum sunt inhalarea și aplicarea dermică, nivelul maxim posibil de expunere este adesea determinat de proprietățile fizice și chimice ale substanței de testat. Pentru studiile orale acute, doza din cadrul testului-limită trebuie să fie de cel puțin 2 000 mg/kg.
1.5.6. Administrarea dozelor
Animalelor li se administrează substanța de testat în fiecare zi, șapte zile pe săptămână, timp de cel puțin 28 de zile; administrarea timp de cinci zile pe săptămână sau alegerea unei perioade mai scurte de expunere trebuie justificate. Dacă substanța de testat se administrează prin gavaj, animalele trebuie să primească o doză unică, introdusă cu ajutorul unei sonde gastrice sau al unei canule de intubație adecvate. Volumul maxim de lichid care poate fi administrat o dată depinde de dimensiunea animalelor de experiență. Acest volum nu trebuie să depășească 1 ml/100 g greutate corporală. Cu toate acestea, în cazul soluțiilor apoase se pot utiliza până la 2 ml/100 g greutate corporală. Cu excepția cazului substanțelor iritante sau corozive care produc efecte exacerbate în concentrații mai mari, variațiile volumului administrat trebuie reduse la minimum prin ajustarea concentrației astfel încât să se mențină un volum constant la toate nivelurile dozei.
În cazul substanțelor administrate prin intermediul hranei sau al apei potabile este important ca bilanțul nutrițional sau hidric normal să nu fie afectat de cantitatea de substanță utilizată. Dacă substanța de testat se administrează prin hrană, există două posibilități: fie sub forma unei concentrații constante în alimentație (ppm), fie sub forma unei doze constante în raport cu greutatea corporală a animalului; trebuie să se precizeze alternativa utilizată. Dacă substanța se administrează prin gavaj, doza se administrează în fiecare zi aproximativ la aceeași oră, și se ajustează după cum este necesar pentru a menține un nivel constant al dozei în raport cu greutatea corporală a animalului. Dacă se realizează un studiu cu doză repetată ca studiu preliminar în vederea realizării unui studiu pe termen lung, în cadrul ambelor studii trebuie să se folosească regimuri alimentare similare. În cadrul studiilor de toxicitate acută, dacă nu se poate administra o doză unică, aceasta poate fi administrată în părți mai mici pe parcursul unei perioade de cel mult 24 de ore.
1.6. OBSERVAȚII
1.6.1. Frecvența observațiilor și a testelor
În cadrul studiilor cu doză repetată, perioada de observație trebuie să acopere întreaga perioadă de tratament. În cadrul studiilor de toxicitate acută, observațiile se realizează pe parcursul unei perioade de 14 zile post-tratament. Și animalele din grupurile satelit care nu sunt expuse pe parcursul unei perioade post-tratament trebuie observate pe parcursul aceleiași perioade.
Observațiile trebuie să fie suficient de frecvente pentru a maximiza probabilitatea de detectare a oricăror anomalii comportamentale și/sau neurologice. Observațiile se realizează de preferință în fiecare zi la aceeași oră, având în vedere și perioada pe parcursul căreia se estimează că efectele anticipate ale tratamentului sunt mai pronunțate. Tabelul 2 conține informații privind frecvența observațiilor clinice și a testelor funcționale. Dacă există date cinetice sau de altă natură obținute în cadrul unor studii anterioare care sugerează că sunt mai adecvate alte momente ale zilei pentru observații, teste sau pentru observațiile post-tratament, se adoptă un alt program care să permită colectarea cât mai multor informații posibil. Modificările programului trebuie justificate.
1.6.1.1. Supravegherea stării generale de sănătate și a mortalității/morbidității
Se examinează minuțios toate animalele cel puțin o dată pe zi, verificându-se starea lor de sănătate, iar mortalitatea și morbiditatea se verifică de două ori pe zi.
1.6.1.2. Observații clinice detaliate
Toate animalele selectate pentru a fi supuse unor examinări clinice detaliate (a se vedea tabelul 1) sunt supuse acestei examinări o dată înainte de prima expunere (pentru a permite realizarea de comparații pe același individ) și în continuare la diferite intervale, în funcție de durata studiului (a se vedea tabelul 2). Grupurile satelit pe care se studiază reversibilitatea efectelor sunt supuse unei examinări detaliate la sfârșitul perioadei de recuperare. Aceste examinări se efectuează într-o zonă standard, situată în afara cuștii în care se află animalele de obicei. Rezultatele se consemnează cu atenție, prin utilizarea unor sisteme de cotare incluzând criterii sau scale de cotare pentru fiecare dintre măsurătorile efectuate. Criteriile și scalele utilizate trebuie definite în mod explicit de către laboratorul care efectuează testul. Sunt necesare eforturi pentru a reduce la minimum variațiile condițiilor de testare (cu excepția celor legate de tratament) și pentru ca examinările să fie realizate de observatori experimentați care nu au fost informați cu privire la tratamentul administrat.
Se recomandă o abordare structurată, în cadrul căreia fiecărui animal studiat să i se aplice sistematic criterii clar definite (inclusiv definiția „intervalului” normal) la fiecare examinare. „Intervalul normal” se documentează în mod adecvat. Se înregistrează toate semnele observate. Dacă este posibil, se înregistrează și magnitudinea semnelor observate. Observațiile clinice vizează, dar nu în mod limitativ, modificările la nivelul pielii, blănii, ochilor, mucoaselor, apariția unor secreții și excreții și reacțiile neurovegetative (de exemplu secreții lacrimale, piloerecție, dimensiunea pupilei, respirație neobișnuită și/sau respirație pe gură, urinare și/sau defecație neobișnuită, de exemplu decolorarea urinei).
Se consemnează și toate reacțiile neobișnuite legate de poziția corpului, de nivelul de activitate (de exemplu explorarea mai intensă sau mai redusă a zonei standard) și de coordonarea mișcărilor. Se consemnează, de asemenea, modificările mersului (de exemplu, mers legănat, ataxie), modificările posturii (de exemplu, cocoașe) și reacțiile la manipulare, la locul în care se află și la alți stimuli din mediu, precum și prezența unor mișcări clonice sau tonice, a convulsiilor sau a tremorului, comportamentul stereotip (de exemplu, curățarea excesivă, mișcări neobișnuite ale capului, mișcări circulare repetate) precum și comportamentele bizare (de exemplu, mușcături, lins excesiv, automutilare, mers înapoi, emiterea de sunete) sau agresivitatea.
1.6.1.3. Teste funcționale
Ca și observațiile clinice detaliate, testele funcționale se realizează pe toate animalele selecționate în acest scop (a se vedea tabelul 1) o dată înainte de expunere, iar apoi periodic. Frecvența testelor funcționale depinde și de durata studiului (a se vedea tabelul 2). Pe lângă perioadele de observare prevăzute în tabelul 2, se realizează și observații funcționale pe grupurile satelit, cât mai aproape de momentul sacrificării. Testele funcționale studiază reactivitatea senzorială la diferiți stimuli [de exemplu auditivi, vizuali și proprioceptivi (5) (6) (7)], forța de prehensiune (8) și activitatea motorie (9). Activitatea motorie se măsoară cu ajutorul unui dispozitiv automat care poate detecta atât intensificarea, cât și reducerea activității. Dacă se folosește un alt sistem anume, acesta trebuie să fie cantitativ, și să aibă o sensibilitate și o fiabilitate demonstrate. Fiecare dispozitiv se testează pentru a asigura fiabilitatea sa în timp și coerența rezultatelor obținute cu ajutorul diferitelor dispozitive. Referințele relevante conțin informații suplimentare privind procedurile care pot fi utilizate. Dacă nu există date (de exemplu, informații privind legătura dintre structură și activitate, date epidemiologice, alte studii toxicologice) privind potențialele efecte neurotoxice, trebuie avute în vedere teste mai specializate pentru explorarea funcțiilor senzorială și motorie sau a memoriei și a capacității de învățare. Referința (1) conține informații suplimentare privind teste mai specializate și utilizarea acestora.
În mod excepțional, animalele care prezintă semne marcate de toxicitate care ar putea afecta considerabil testul funcțional pot fi eliminate din cadrul acestui test. Eliminarea animalelor din cadrul unui test funcțional trebuie justificată.
1.6.2. Greutatea corporală și consumul de hrană/apă
În cadrul studiilor cu o durată de până la 90 de zile, toate animalele se cântăresc cel puțin o dată pe săptămână și se măsoară, de asemenea, și consumul de hrană (sau consumul de apă, dacă substanța de testat se administrează pe această cale) cel puțin săptămânal. În cadrul studiilor pe termen lung, toate animalele sunt cântărite cel puțin o dată pe săptămână pe parcursul primelor 13 săptămâni, iar apoi cel puțin o dată la 4 săptămâni. Se măsoară și consumul de hrană (sau consumul de apă, dacă substanța de testat se administrează pe această cale) cel puțin săptămânal pe parcursul primelor 13 săptămâni, iar apoi la intervale de aproximativ trei luni, cu excepția cazurilor în care trebuie procedat altfel din cauza stării de sănătate sau a greutății corporale.
1.6.3. Examenul oftalmologic
În cadrul studiilor cu o durată de peste 28 de zile, înainte de administrarea substanței de testat și la sfârșitul studiului, se realizează un examen oftalmologic cu ajutorul unui oftalmoscop sau al unui instrument echivalent adecvat, de preferință la toate animalele sau cel puțin la animalele din grupul căruia i-a fost administrată doza cea mai mare și la animalele din grupurile martor. Dacă se detectează modificări la nivelul ochilor sau dacă semnele clinice sugerează că este necesar, se examinează toate animalele. În cadrul studiilor pe termen lung se realizează și un examen oftalmologic la 13 săptămâni. Examenele oftalmologice nu sunt necesare dacă există deja date disponibile obținute în cadrul altor studii cu durată și doze similare.
1.6.4. Hematologie și biochimie clinică
În cazul studiilor de neurotoxicitate realizate în combinație cu un studiu de toxicitate sistemică cu doză repetată, examinările hematologice și determinările biochimice clinice se realizează în conformitate cu metoda utilizată în cadrul studiului de toxicitate sistemică. Probele se prelevează astfel încât să se reducă la minimum orice potențiale efecte asupra comportamentului neurologic.
1.6.5. Histopatologie
Examenul neuropatologic trebuie elaborat astfel încât să vină în completarea observațiilor realizate în etapa in vivo a studiului și să le aprofundeze. Se fixează in situ țesuturi de la cel puțin 5 animale/sex/grup (a se vedea tabelul 1 și paragraful următor) utilizându-se tehnicile obișnuite de perfuzare și de fixare (a se vedea referința 3, capitolul 5 și referința 4, capitolul 50). Se înregistrează toate modificările observabile importante. Dacă studiul se realizează independent în vederea depistării neurotoxicității sau pentru caracterizarea efectelor neurotoxice, restul animalelor pot fi utilizate fie pentru examinarea comportamentului neurologic (10) (11), pentru examinări neuropatologice (10) (11) (12) (13), neurochimice (10) (11) (14) (15) sau electrofiziologice (10) (11) (16) (17) în completarea procedurilor și a examinărilor descrise sau pot fi incluse între animalele supuse examenului histopatologic, mărind numărul acestora. Aceste proceduri suplimentare sunt deosebit de utile în cazurile în care observațiile empirice sau efectele anticipate sugerează un tip specific de neurotoxicitate sau o țintă a neurotoxicității (2) (3). Restul animalelor pot fi, de asemenea, utilizate pentru evaluările patologice de rutină din cadrul metodei utilizate în studiile cu doză repetată.
Toate probele de țesut acoperite cu parafină sunt supuse unei proceduri obișnuite de colorație, de exemplu colorație hematoxilin-eozină, și examinate la microscop. Dacă se observă semne de neuropatii periferice sau dacă există suspiciuni în acest sens, se examinează probe de țesut nervos periferic acoperite cu plastic. Semnele clinice pot recomanda, de asemenea, examinarea altor zone sau utilizarea unor proceduri speciale de colorație. Referințele 3 și 4 conțin informații privind alte zone care pot fi examinate suplimentar. Coloranții speciali pot fi utili și pentru evidențierea unor tipuri specifice de modificări patologice (18).
Se realizează și un examen histologic pe secțiuni reprezentative din sistemul nervos central și periferic (a se vedea referința 3, capitolul 5 și referința 4, capitolul 50). În mod normal zonele examinate includ: creierul anterior, centrul emisferelor cerebrale, inclusiv o secțiune din hipocamp, creierul central, cerebelul, puntea lui Varolio, bulbul rahidian, ochiul împreună cu nervul optic și retina, măduva spinării și protuberanțele cervicale și lombare, ganglionii din rădăcina posterioară, fibrele din rădăcinile posterioară și anterioară, nervul sciatic proximal, nervul tibial proximal (la nivelul genunchiului) și ramificațiile nervului tibial în mușchii gambei. Secțiunile din măduva spinării și din nervii periferici trebuie să fie atât transversale cât și longitudinale. Se acordă o atenție specială vascularizării sistemului nervos. Trebuie examinată și o probă de mușchi scheletici, în special de la nivelul gambei. Se acordă o atenție specială regiunilor din sistemul nervos central și din sistemul nervos periferic care au o structură celulară și fibroasă despre care se știe că sunt afectate în mod special de substanțele neurotoxice.
Referințele (3) și (4) conțin informații privind alterările neuropatologice tipice provocate de expunerea la substanțe neurotoxice. Se recomandă o examinare în etape a probelor de țesut, în cadrul căreia probele prelevate de la grupul căruia i s-a administrat doza cea mai mare sunt comparate cu probele prelevate de la grupul martor. Dacă nu este identificată nicio alterare neuropatologică pe baza probelor de la aceste grupuri, nu mai sunt necesare alte analize. Dacă se observă alterări neurologice la grupul căruia i s-a administrat doza cea mai mare, trebuie codate și examinate succesiv probe din toate țesuturile care pot fi afectate, prelevate de la grupurile cărora li s-au administrat doza intermediară și doza cea mai redusă.
Dacă prin examinarea calitativă se evidențiază alterări neuropatologice, se realizează o a doua examinare a tuturor regiunilor sistemului nervos care prezintă astfel de alterări. Se realizează secțiuni din toate regiunile care pot fi afectate de la toate grupurile tratate, și se examinează aleatoriu fără a se cunoaște codul. Se înregistrează frecvența și gravitatea tuturor leziunilor. După evaluarea tuturor regiunilor pentru toate grupurile tratate, se poate realiza decodarea și se efectuează o analiză statistică în vederea determinării relației doză-răspuns. Trebuie descrise diversele niveluri de gravitate pentru fiecare leziune.
Rezultatele examenului neuropatologic se evaluează având în vedere observațiile și măsurătorile privind comportamentul, precum și alte date obținute prin studii de toxicitate sistemică anterioare sau concomitente asupra substanței de testat.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Rezultatele sunt indicate pentru fiecare animal în parte. Pe lângă aceasta, toate rezultatele sunt recapitulate într-un tabel care indică, pentru fiecare test sau grup martor, numărul de animale de la începutul testului, numărul de animale care au murit în timpul testului sau care au fost sacrificate în conformitate cu principiul minimei suferințe, momentul morții sau al sacrificării cu minimă suferință, numărul animalelor care prezentau semne de toxicitate, descrierea semnelor de toxicitate observate, inclusiv momentul apariției, durata, tipul și gravitatea efectelor toxice, numărul de animale care au prezentat leziuni, inclusiv tipul și gravitatea acestora.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Rezultatele studiului se evaluează în vederea stabilirii frecvenței, a gravității și pentru corelarea efectelor neuropatologice și de comportament (și a efectelor neurochimice și electrofiziologice dacă se realizează examinări suplimentare) și a altor efecte adverse observate. Dacă este posibil, rezultatele numerice se evaluează cu ajutorul unei metode statistice adecvate și general acceptate. Metodele statistice se aleg în etapa în care este conceput studiul.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Substanța de testat:
— natura fizică (inclusiv izomerizare, puritate, proprietăți fizice și chimice);
— date de identificare.
Vehiculul (dacă este cazul):
— justificarea alegerii vehiculului.
Animale de experiență:
— specia/rasa utilizată;
— numărul, vârsta și sexul animalelor;
— sursa animalelor, condițiile de adăpostire, aclimatizare, regimul alimentar etc.;
— greutatea fiecărui animal la începutul testului.
Condiții de testare:
— detalii privind prepararea substanței de testat/prepararea hranei, concentrația obținută, stabilitatea și omogenitatea preparatului;
— precizări privind dozele administrate, inclusiv privind vehiculul, volumul și forma fizică a materialului administrat;
— detalii privind administrarea substanței de testat;
— justificarea dozei alese;
— justificarea căii și a duratei de expunere alese;
— transformarea concentrației substanței de testat administrate prin hrană/apa potabilă (ppm) în doză efectivă (mg/kilogram greutate corporală/zi), dacă este cazul;
— detalii privind calitatea hranei și a apei.
Proceduri de observație și de testare:
— detalii privind repartizarea de animale din fiecare grup în sub-grupul perfuzat;
— detalii privind sistemele de evaluare, inclusiv criterii și scale de evaluare utilizate pentru fiecare măsurătoare din cadrul observațiilor clinice detaliate;
— detalii privind testele funcționale de explorare a reactivității senzoriale la diverși stimuli (de exemplu auditivi, vizuali și proprioceptivi); detalii privind evaluarea forței de prehensiune; detalii privind evaluarea activității motorii (inclusiv privind dispozitivele automate pentru detectarea activității) și detalii privind celelalte proceduri utilizate;
— date privind examenul oftalmologic și, dacă este cazul, examenele hematologice și testele de biochimie clinică, cu indicarea nivelurilor de referință relevante;
— detalii privind procedurile specifice de cercetare a modificărilor neurocomportamentale, neuropatologice, neurochimice sau electrofiziologice.
Rezultate:
— greutatea corporală/modificările acesteia, inclusiv greutatea la sacrificare;
— consumul de alimente și, după caz, de apă;
— reacția toxică pe sexe și pe doză, inclusiv semnele de toxicitate sau mortalitatea;
— natura, gravitatea și durata (momentul apariției și durata ulterioară) efectelor clinice observate (indiferent dacă sunt sau nu reversibile);
— descrierea detaliată a rezultatelor tuturor testelor funcționale;
— rezultatele autopsiei;
— descrierea detaliată a tuturor modificărilor neurocomportamentale, neuropatologice, neurochimice sau electrofiziologice, dacă există;
— date privind absorbția și metabolismul, dacă există;
— tratamentul statistic aplicat rezultatelor, dacă este cazul.
Discutarea rezultatelor:
— informații privind relația doză-răspuns;
— legătura dintre orice alte efecte toxice și concluzia privind potențialul neurotoxic al substanței de testat;
— nivelul concentrației la care nu se observă niciun efect advers.
Concluzii:
— se încurajează furnizarea unei aprecieri privind neurotoxicitatea globală a substanței de testat.
4. REFERINȚE BIBLIOGRAFICE
1. OECD Guidance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris. In preparation.
2. Test Guideline for a Developmental Neurotoxicity Study. OECD Guidelines for the Testing of Chemicals. In preparation.
3. World Health Organization (WHO) (1986). Environmental Health Criteria Document 60: Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals.
4. Spencer. P. S. and Schauraburg, H. H. (1980). Spencer, P. S. and Schaumburg, H.H. eds., Williams and Wilkins Co., Baltimore/London, 726-742.
5. Tupper D. E. and Wallace, R. B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, 999-1003.
6. Gad, S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691-704.
7. Moser V. C., McDaniel, K. M. and Phillips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl, Pharmacol., 108, 267-283.
8. Meyer O. A., Tilson, H. A., Byrd, W. C. and Riley, M. T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233-236.
9. Crofton, K. M., Haward, J. L., Moser, V. C., Gill, M. W., Reirer, L. W., Tilson, H. A. and MacPhail, R. C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. teratol., 13, 599-609.
10. Tilson, H. A,, and Mitchell, C. L. eds. (1992), Neumtoxicology Target Organ Toxicology Series. Raven Press, New York.
11. Chang, L. W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker. New York.
12. Broxup, B. (1991). Neuropathology as a screen for Neurotoxicity Assessement. J. Amer. Coll. Toxicol., 10, 689-695.
13. Moser, V. C., Anthony, D. C., Sette, W. F. and MacPhail, R. C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343-352.
14. O’Callaghan J. P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, 445-452.
15. O’Callaghan J. P. and Miller, D. B. (1988). Acute Exposure of the Neonatal Rut to Triethyltin Rcsults in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368-378.
16. Fox. D. A., Lowndes, H. E. and Birkamper, G. G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, pp. 299-335.
17. Johnson, B. L. (1980). Electrophysiological Methods in Neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/London, pp. 726-742.
18. Bancroft, J. D. and Steven A. (1990). Theory and Practice of Histological Techniques, Chapter 17, Neuropathological Techniques, Lowe, James and Cox, Gordon eds. Churchill Livingstone.
Tabelul 1
Numărul minim de animale necesare pe grup pentru studiile de neurotoxicitate realizate separat sau în combinație cu alte studii
|
STUDIU DE NEUROTOXICITATE REALIZAT: |
||||
|
Separat |
În combinație cu un studiu de 28 de zile |
În combinație cu un studiu de 90 de zile |
În combinație cu un studiu de toxicitate cronică |
|
|
Număr total de animale pe grup |
10 masculi și 10 femele |
10 masculi și 10 femele |
15 masculi și 15 femele |
25 masculi și 25 femele |
|
Număr de animale selectate pentru testele funcționale, inclusiv pentru observații clinice detaliate |
10 masculi și 10 femele |
10 masculi și 10 femele |
10 masculi și 10 femele |
10 masculi și 10 femele |
|
Număr de animale selectate pentru perfuzarea in situ și examinare neurohistopatologică |
5 masculi și 5 femele |
5 masculi și 5 femele |
5 masculi și 5 femele |
5 masculi și 5 femele |
|
Număr de animale selectate pentru studii cu doză repetată/subcronice/de toxicitate cronică, examinări hematologice, de biochimie clinică, histopatologie etc. conform dispozițiilor din Linia directoare relevantă |
5 masculi și 5 femele |
|||
|
Observații suplimentare, după caz |
5 masculi și 5 femele |
|||
|
† Aici sunt incluse cinci animale selectate pentru teste funcționale și observații clinice detaliate din cadrul studiului de neurotoxicitate. |
||||
Tabelul 2
Frecvența observațiilor clinice și a testelor funcționale
|
Tipul observațiilor |
Durata studiului |
||||
|
Acut |
28 de zile |
90 de zile |
Cronic |
||
|
La toate animalele |
Stare generală de sănătate |
zilnic |
zilnic |
zilnic |
zilnic |
|
Mortalitate/morbiditate |
de două ori pe zi |
de două ori pe zi |
de două ori pe zi |
de două ori pe zi |
|
|
La animalele selectate pentru observații funcționale |
Observații clinice detaliate |
— înainte de prima expunere — în termen de 8 ore de la administrarea dozei, în momentul estimat al efectului maxim — în zilele 7 și 14 după administrarea dozei |
— înainte de prima expunere — săptămânal în continuare |
— înainte de prima expunere — o dată în prima sau a doua săptămână de după expunere — lunar în continuare |
— înainte de prima expunere — o dată la sfârșitul primei luni de expunere — la fiecare trei luni în continuare |
|
Teste funcționale |
— înainte de prima expunere — în termen de 8 ore de la administrarea dozei, în momentul estimat al efectului maxim — în zilele 7 și 14 după administrarea dozei |
— înainte de prima expunere — în a patra săptămână de tratament, cât mai aproape posibil de sfârșitul perioadei de expunere |
— înainte de prima expunere — o dată în prima sau a doua săptămână de după expunere — lunar în continuare |
— înainte de prima expunere — o dată la sfârșitul primei luni de expunere — la fiecare trei luni în continuare |
|
B.44. ABSORBȚIA CUTANATĂ: METODA IN VIVO
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 427 (2004) a OCDE.
1.1. INTRODUCERE
Expunerea la multe produse chimice are loc în principal prin piele în timp ce majoritatea studiilor toxicologice efectuate pe animale în laboratoare folosesc administrarea pe cale orală. Studiul asupra absorbției percutanate in vivo descris în metoda de față asigură conexiunea necesară pentru a extrapola rezultatele studiilor realizate prin administrare orală atunci când se realizează evaluări în materie de siguranță după expunerea cutanată.
O substanță trebuie să traverseze un număr mare de straturi celulare ale pielii înainte să pătrundă în sânge. Pentru cele mai multe substanțe, stratul care determină proporția de absorbție este stratul cornos compus din celule moarte. Permeabilitatea cutanată depinde atât de lipofilicitatea unor produși chimici și de grosimea stratului extern al epidermei, cât și de factori precum greutatea moleculară și concentrația substanței. În general, pielea șobolanilor și a iepurilor are o permeabilitate mai mare decât cea a oamenilor, în timp ce porcușorii de guineea și maimuțele au pielea asemănătoare cu cea a oamenilor.
Metodele pentru măsurarea absorbției percutanate pot fi împărțite în două categorii: in vivo și in vitro. Metoda in vivo este capabilă să furnizeze informații corespunzătoare asupra absorbției cutanate la diferite animale de laborator. Mult mai recent dezvoltate, metodele in vitro utilizează transportul parțial sau total prin stratul de piele umană sau animală până la un rezervor de fluid. Metoda in vitro este descrisă separat, în cadrul unei alte metode de testare (1). Pentru a alege metoda cea mai adecvată într-o situație dată, se recomandă să se consulte documentul de orientare al OCDE pentru realizarea de studii privind absorbția cutanată (2) care furnizează mai multe detalii privind pertinența metodelor in vivo și in vitro.
Metoda in vivo, descrisă în prezenta metodă, permite determinarea adâncimii de pătrundere prin piele a substanței de testare, în compartimentul sistemic. Tehnica a fost folosită la scară largă timp de mulți ani (3) (4) (5) (6) (7). Deși studiile cu privire la absorbția percutanată in vitro pot fi adecvate în multe cazuri, există situații în care doar un studiu in vivo poate să asigure informațiile necesare.
Avantajele metodei in vivo sunt următoarele: utilizarea unui sistem intact din punct de vedere fiziologic și metabolic, utilizarea unei specii comune multor studii de toxicitate și posibilitatea de modificare în vederea utilizării cu alte specii. Dezavantajele sunt: utilizarea animalelor vii, utilizarea materialului marcat radioactiv pentru a facilita fiabilitatea rezultatelor, dificultăți în determinarea fazei de absorbție precoce și diferențele de permeabilitate între pielea umană și cea a speciilor preferate (șobolani). Pielea animalelor este în general mai permeabilă, ceea ce poate duce la o supraestimare a absorbției percutanate la om (6) (8) (9). Substanțele caustice/corosive nu trebuie testate pe animale vii.
1.2. DEFINIȚII
Doza neabsorbită reprezintă cantitatea de substanță eliminată prin curățare de pe suprafața pielii după expunere și oricare altă cantitate prezentă pe pansamentul nonocluziv, inclusiv orice cantitate volatilizată de pe suprafața pielii în timpul expunerii.
Doza absorbită (in vivo ) reprezintă cantitatea de substanță prezentă în urină, în reziduurile colectate la curățarea cuștii, în fecale, în aerul expirat (dacă este măsurat), în sânge, țesuturi (dacă sunt colectate) și pe carcasa rămasă, după îndepărtarea pielii corespunzătoare zonei de aplicare.
Doza absorbabilă reprezintă cantitatea de substanță prezentă pe piele sau în piele după curățare.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța testată, de preferință marcată radioactiv, este aplicată pe pielea rasă a animalelor în regim de dozaj normal sau adecvat, sub forma unui preparat caracteristic folosit în mod curent. Preparatul de testare rămâne în contact cu pielea o perioadă de timp stabilită sub pansament corespunzător (nonocluziv, semiocluziv sau ocluziv) pentru a preveni ingerarea acestuia. La finalul perioadei de expunere, pansamentul este îndepărtat și pielea este curățată cu agent de curățare adecvat, pansamentul și materialul folosit pentru aplicarea agentului de curățare sunt păstrate pentru analiză și se aplică un pansament nou. Înainte, în timpul și după perioada de expunere, animalele sunt adăpostite în cuști individuale metabolice, iar excrețiile și aerul expirat, pe parcursul acestor perioade, sunt colectate pentru analiză. Colectarea aerului expirat poate fi omisă dacă există suficiente informații care să confirme absența sau formarea în cantități limitate a unui metabolit volatil radioactiv. Fiecare studiu necesită în mod normal mai multe grupuri de animale care vor fi expuse la preparatul de testare. La finalul perioadei de expunere, animalele dintr-un lot sunt eutanasiate. Ulterior și alte loturi de animale sunt eutanasiate la intervale de timp planificate (2). La finalul perioadei de prelevare, animalele rămase sunt eutanasiate, sângele este colectat pentru analiză, zona folosită pentru aplicare este prelevată pentru analiză și carcasa este analizată pentru a găsi substanțele neexcretate. Se examinează probele prin mijloace adecvate și se estimează gradul de absorbție percutanată (6) (8) (9).
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Selectarea speciei de animale
Specia cea mai des utilizată este șobolanul, dar pot fi folosite, de asemenea, speciile fără păr sau cele care au rata de absorbție cutanată mai apropiată de rata de absorbție la om (3) (6) (7) (8) (9). Se utilizează animale adulte tinere, sănătoase, de același sex (de regulă masculi), dintre speciile folosite de obicei în laborator. La începutul studiului, variația greutății animalelor utilizate nu trebuie să depășească ± 20 % din greutatea medie. De exemplu, se utilizează șobolani masculi cu greutatea cuprinsă între 200 și 250 g, în special șobolanii cu greutatea situată spre limita superioară a acestui interval.
1.4.2. Numărul și sexul animalelor
Pentru fiecare preparat de testare și fiecare programată se utilizează un lot de cel puțin patru animale de același sex. Fiecare lot de animale este eutanasiat la intervale de timp diferite, de exemplu la sfârșitul perioadei de expunere (de obicei 6 sau 24 de ore) și la sfârșitul altor perioadelor (de exemplu, 48 și 72 de ore). Dacă există date disponibile care să ateste diferențe semnificative între masculi și femele în ceea ce privește nivelul de toxicitate dermică, se alege sexul cel mai sensibil. Dacă nu există asemenea date, atunci se pot folosi animale de orice sex.
1.4.3. Condiții de adăpostire și de hrănire
Temperatura din camera experimentală trebuie să fie de 22 oC (± 3 oC). Deși se recomandă ca umiditatea relativă să fie de cel puțin 30 % și să nu depășească, de preferință, 70 %, cu excepția momentului în care se curăță camera, se tinde spre un nivel de 50-60 %. Iluminatul trebuie să fie artificial, succesiunea fiind de 12 ore de lumină, 12 ore de întuneric. Pentru alimentație, se poate utiliza hrană convențională de laborator, cu furnizarea unei cantități nelimitate de apă potabilă. În timpul studiului și de preferință în perioada de aclimatizare, animalele sunt adăpostite în cuști metabolice separate. Din moment ce hrana și apa vărsate ar compromite rezultatele, riscurile unor astfel de evenimente trebuie reduse.
1.4.4. Pregătirea animalelor
Animalele sunt marcate pentru a permite identificarea individuală și sunt ținute în cuști timp de cel puțin cinci zile înainte de începerea studiului pentru a permite aclimatizarea la condițiile de laborator.
După perioada de aclimatizare și cu aproximativ 24 de ore înainte de dozare, pielea fiecărui animal va fi rasă pe o porțiune din zona omoplaților și spatelui. Proprietățile de permeabilitate ale pielii vătămate sunt diferite de proprietățile de permeabilitate ale pielii intacte; prin urmare, este necesară o atenție sporită pentru a nu zgâria pielea. După operațiunea de radere și cu aproximativ 24 de ore înainte ca substanța de testare să fie aplicată pe piele (a se vedea punctul 1.4.7) suprafața pielii trebuie ștearsă cu acetonă pentru a îndepărta sebumul. Nu se recomandă spălarea suplimentară cu apă și săpun deoarece orice depunere de săpun poate facilita absorbția substanței de testare. Suprafața trebuie să fie suficient de mare, de preferință de cel puțin 10 cm2, pentru a permite calcularea cantității de substanță chimică absorbită pe cm2 de piele. Această suprafață este practicabilă în cazul șobolanilor cu greutatea de 200-250 g. După pregătire, animalele sunt repuse în cuștile metabolice.
1.4.5. Substanța de testare
Substanța de testare reprezintă produsul ale cărui caracteristici de penetrare urmează să fie studiate. În mod ideal, substanța de testare trebuie să fie marcată radioactiv.
1.4.6. Preparatul de testare
Preparatul de testare (de exemplu material pur, diluat sau amestec care conține substanța chimică de testare aplicată pe piele) trebuie să fie același (sau un înlocuitor realist) cu preparatul la care pot fi expuși oamenii sau alte posibile specii țintă. Orice variație de la preparatul utilizat trebuie justificată. Atunci când este necesar, substanța de testare este dizolvată sau pusă într-o suspensie într-un mediu corespunzător Caracteristicile de absorbție și interacțiunea potențială cu substanța de testare trebuie cunoscute, pentru medii altele decât apa.
1.4.7. Aplicarea pe piele
Pe suprafața pielii se delimitează o zonă de aplicare de dimensiuni specifice. Ulterior, o cantitate cunoscută din preparatul de testare este uniform aplicată pe zona respectivă. În mod normal, această cantitate trebuie să simuleze expunerea umană potențială, de obicei 1-5 mg/cm2 pentru solide și până la 10 μl/cm2 pentru lichide. Orice alte cantități trebuie justificate prin condițiile de utilizare preconizate, obiectivele experimentului sau caracteristicile fizice ale preparatului de testare. După aplicare, zona tratată trebuie protejată astfel încât animalul să nu poată să se curețe. Figura 1 prezintă un exemplu de dispozitiv utilizat în acest scop. În mod normal, zona de aplicare este protejată printr-un pansament nonocluziv (de exemplu un pansament permeabil de tifon din nailon). Totuși, pentru aplicații nelimitate, zona de aplicare trebuie protejată cu un pansament ocluziv. În cazul în care de evaporarea substanțelor de testare semivolatile reduce gradul de recuperare al substanței de testare până la un nivel inacceptabil (a se vedea punctul 1.4.10, primul paragraf), este necesar să se capteze substanță evaporată într-un filtru de cărbune care acoperă dispozitivul de aplicare (a se vedea figura 1). Este important ca niciun dispozitiv să nu producă vătămări ale pielii, să nu absoarbă sau să nu reacționeze cu preparatul de testare. Animalele sunt aduse înapoi în cuștile individuale metabolice pentru colectarea excrementelor.
1.4.8. Durata expunerii și recoltarea probelor
Durata expunerii reprezintă intervalul de timp cuprins între aplicarea și îndepărtarea preparatului de testare prin spălarea pielii. Se utilizează o perioadă de expunere relevantă (de obicei de 6 sau 24 de ore), în funcție de durata de expunere umană presupusă. După perioada de expunere, animalele sunt ținute în cuștile metabolice până la termenul prevăzut. În timpul perioadei de studiu, animalele trebuie ținute sub observație la intervale regulate, pentru depistarea simptomelor de toxicitate/reacții anormale. La sfârșitul perioadei de expunere, pielea tratată trebuie cercetată pentru depistarea semnelor vizibile de iritație.
Cuștile metabolice trebuie să faciliteze colectarea separată a urinei și fecalelor pe tot parcursul studiului. Ele trebuie să permită, de asemenea, colectarea de dioxid de carbon 14C și compuși de carbon 14C volatili, care trebuie analizați atunci când sunt produși într-o cantitate (> 5 %). Urina, fecalele și fluidele recuperate (de exemplu dioxid de carbon 14C și compuși de carbon 14C volatili) trebuie colectate individual de la fiecare lot la fiecare interval de recoltare a probelor. Dacă există suficiente informații că nu se formează niciun metabolit volatil radioactiv sau că este prezent în cantități mici, se pot utiliza cuști deschise.
Excrementele sunt colectate pe parcursul perioadei de expunere, până la 24 de ore de la contactul inițial cu pielea și ulterior în fiecare zi până la finalul experimentului. În mod normal, trei intervale de colectare a excrementelor sunt suficiente, dar, în funcție de scopul preconizat pentru preparatul de testare sau de datele cinetice existente, poate fi necesar să se prevadă intervale de timp suplimentare sau adaptate pentru studiu.
La sfârșitul perioadei de expunere, dispozitivul de protecție este îndepărtat de la fiecare animal și păstrat separat pentru analiză. Pielea tratată a tuturor animalelor trebuie spălată de cel puțin trei ori cu agent de curățare folosind tampoane adecvate. Trebuie evitată contaminarea celorlalte părți ale corpului. Agentul de curățare trebuie să fie reprezentativ pentru practicile de igienă normale (de exemplu, soluție apoasă de săpun). La final, pielea trebuie uscată. Toate tampoanele și materialele de curățare trebuie păstrate pentru analiză. Animalelor din loturile stabilite pentru observații ulterioare li se aplică, înainte de repunerea în cuștile individuale, un pansament nou pentru a proteja zona tratată.
1.4.9. Proceduri finale
Pentru fiecare lot, fiecare animal trebuie eutanasiat la momentul de timp prevăzut, iar sângele trebuie colectat pentru analiză. Dispozitivul protector sau pansamentul trebuie îndepărtate pentru analiză. Pielea din zona de aplicare și o suprafață similară de piele rasă pe care nu s-a aplicat nicio substanță trebuie prelevate de la fiecare animal pentru o analiză separată. Zona de aplicare poate fi fracționată pentru separarea stratului cornos de epiderma de bază pentru a furniza mai multe informații asupra dispunerii substanței chimice. Determinarea acestei dispuneri pe parcursul unui interval de timp, după perioada de expunere, trebuie să furnizeze indicii asupra comportamentului oricărei substanțe chimice în stratul cornos. Pentru a facilita fracționarea pielii (după spălarea finală a pielii și eutanasierea animalului), se îndepărtează orice pansamentul protector. Pielea din zona de aplicare, împreună cu o suprafață de piele circulară din jurul zonei de aplicare este prelevată și fixată în ace pe o planșetă. Pe suprafața de piele se aplică o fâșie de bandă adezivă exercitând o presiune moderată și se îndepărtează banda o dată cu stratul cornos. Se aplică fâșii succesive de bandă până când banda respectivă nu mai aderă la suprafața de piele, atunci când toată porțiunea de strat cornos a fost îndepărtată. Toate fâșiile de bandă adezivă, care provin de la același animal, pot fi amestecate într-un singur recipient în care se adaugă un digestiv de țesut pentru a solubiliza stratul cornos. Se pot îndepărta orice țesuturi-țintă potențiale pentru măsurători separate înainte ca carcasa rămasă să fie analizată pentru determinarea dozei absorbite. Carcasele animalelor sunt reținute pentru analiză. O analiză a conținutului total este de obicei suficientă. Organele țintă pot fi îndepărtate pentru analiză separată (dacă acest lucru este indicat de către alte studii). Urina prezentă în vezică în momentul planificat pentru eutanasiere se adaugă la urina colectată anterior. După colectarea excrementelor din cuștile metabolice în momentul planificat pentru eutanasiere, cuștile și trapele lor trebuie spălate cu un solvent corespunzător. Se analizează, în egală măsură, orice alt echipament potențial contaminat.
1.4.10. Analiza
În toate studiile trebuie să se obțină un nivel adecvat de recuperare (respectiv o medie de 100 ± 10 % de radioactivitate). Recuperările în afara acestui interval trebuie justificate. Cantitatea dozei administrate în fiecare mostră trebuie analizată prin proceduri validate în mod corespunzător.
Considerațiile de natură statistică trebuie să includă o măsurare a variației testelor repetate pentru fiecare aplicație.
2. DATE
Pentru fiecare animal, la fiecare interval de prelevare trebuie efectuate următoarele măsurători pentru depistarea substanței chimice de testare și/sau a metaboliților. În afară de datele individuale, datele grupate în funcție de intervalele de prelevare se raportează sub formă de medii:
— cantitatea asociată cu dispozitivele de protecție;
— cantitatea care poate fi îndepărtată de pe piele;
— cantitatea din/de pe piele care nu poate fi spălată;
— cantitatea prezentă în probele de sânge;
— cantitatea din excremente și aerul expirat (dacă este cazul);
— cantitatea care rămâne în carcasă și orice organe îndepărtate pentru analiză separată.
Cantitatea de substanță de testare și/sau metaboliții din excremente, din aerul expirat, din sânge și din carcasă permit determinarea cantității totale absorbite la fiecare interval de timp. De asemenea, se poate calcula cantitatea de substanță chimică de testare absorbită pe cm2 de piele expusă la substanța de testare pe parcursul perioadei de expunere.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă cerințele stipulate în protocolul de testare, inclusiv o justificare pentru sistemul de testare utilizat și trebuie să cuprindă următoarele:
Substanța de testare:
— date de identificare [număr CAS, dacă este disponibil, sursă, puritate (puritatea radiochimică), impurități cunoscute, număr lot];
— stare fizică, proprietăți fizico-chimice (de exemplu pH, volatilitate, solubilitate, stabilitate, greutate moleculară și coeficientul de partiție octanol/apă – log Pow)
Pregătirea testului:
— formularea și justificarea utilizării;
— detalii referitoare la pregătirea testului, cantitatea aplicată, concentrațiile obținute, mijloacele, stabilitatea și omogenitatea.
Animalele testate:
— speciile/rasele utilizate;
— numărul, vârsta și sexul animalelor;
— proveniența animalelor, condiții de adăpostire, diete, etc;
— greutatea fiecărui animal la începutul testului.
Condițiile de testare:
— detalii cu privire la administrarea preparatului de testare (zonă de aplicare, metode de tastare, ocluzie/non-ocluzie, volum, extracție, detectare);
— detalii cu privire la calitatea hranei și apei.
Rezultate:
— orice semne de toxicitate;
— date privind absorbția, prezentate sub formă de tabel (exprimate ca rată, cantitate sau procent);
— recuperări totale ale experimentului;
— interpretarea rezultatelor, comparație cu alte date disponibile privind absorbția percutanată a substanței de testare.
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOFRAFICE
1. Testing Method B.45. Skin Absorption: In vitro Method.
2. OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
3. ECETOC (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20.
4. Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829-835.
5. Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA.
6. EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment.
7. EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances.
8. Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369-373.
9. Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399-404.
Figura 1
Exemplu de dispozitiv clasic utilizat pentru delimitarea și protejarea zonei de aplicare în timpul studiilor de absorbție percutanată in vivo

B.45. ABSORBȚIA CUTANATĂ: METODA DE TESTARE IN VITRO
1. METODĂ
Prezenta metodă de testare este echivalentă cu Orientarea 428 (2004) a OCDE.
1.1. INTRODUCERE
Prezenta metodă a fost concepută pentru a furniza informații cu privire la absorbția unei substanțe de testare aplicată pe un eșantion de piele excizată. Metoda poate fi folosită fie în combinație cu metoda de absorbție cutanată: metoda in vivo (1), fie separat. În vederea elaborării studiilor bazate pe prezenta metodă se recomandă consultarea documentului de orientare al OCDE pentru realizarea de studii privind absorbția cutanată (2). Documentul de orientare a fost elaborat pentru a facilita alegerea procedurilor in vitro adecvate utilizării în situații specifice, care să asigure fiabilitatea rezultatelor obținute cu ajutorul acestei metode.
Metodele de măsurare a absorbției cutanate și a expunerii dermice pot fi împărțite în două categorii: in vivo și in vitro. Metodele in vivo de măsurare a absorbției cutanate sunt bine cunoscute și furnizează date farmacokinetice în cazul mai multor specii de animale. Metoda in vivo este descrisă separat în cadrul unei alte metode de testare (1). Metodele in vitro au fost utilizate timp de mai mulți ani pentru măsurarea absorbției cutanate. Cu toate că nu s-au efectuat studii de validare a metodelor in vitro incluse în prezenta metodă de testare, experții OCDE au stabilit în 1999 că există suficiente date evaluate pentru susținerea metodei in vitro (3). Documentul de orientare (2) furnizează detalii suplimentare care fundamentează această decizie, printre care și un număr important de comparații directe între metodele in vitro și in vivo. Există o serie de monografii care tratează acest subiect și prezintă un context amănunțit al utilizării metodei in vitro (4) (5) (6) (7) (8) (9) (10) (11) (12). Metodele in vitro măsoară difuzia substanțelor chimice în piele și prin piele până la un rezervor de fluid; acestea utilizează eșantioane de piele neviabilă, pentru a măsura doar difuzia sau eșantioane de piele proaspătă, activă din punct de vedere metabolic, pentru a măsura simultan difuzia și metabolismul cutanat. Astfel de metode sunt folosite pentru a compara absorbția, în piele și prin piele, a diferite formule de substanțe chimice, furnizând în același timp modele utile pentru evaluarea absorbției percutanate la om.
Metoda in vitro nu se poate aplica în toate cazurile sau clasele de substanțe chimice, dar poate fi folosită pentru o evaluare preliminară calitativă a penetrației cutanate. În anumite cazuri poate fi nevoie și de completarea acesteia cu datele in vivo. Se recomandă consultarea documentului de orientare (2) pentru a stabili situațiile în care utilizarea metodei in vitro este adecvată. Referința (3) furnizează informații detaliate suplimentare pentru a facilita luarea unei decizii.
Prezenta metodă prezintă principiile generale pentru măsurarea absorbției cutanate și a difuziei unei substanțe de testare folosind un eșantion de piele excizată. Se poate folosi piele de la multe specii mamifere, inclusiv de la om. Proprietățile de permeabilitate ale pielii se păstrează după excizie pentru că obstacolul principal în calea difuziei este stratul cornos neviabil; nu s-a identificat nicio formă de transport activ al substanțelor chimice prin piele. S-a observat că pielea posedă capacitatea de metabolizare a unor substanțe chimice în timpul absorbției percutanate (6), însă acest proces nu limitează proporția dozei reale absorbite, deși poate afecta natura substanței care intră în fluxul sanguin.
1.2. DEFINIȚII
Doză neabsorbită: reprezintă cantitatea de substanță eliminată prin curățare de la suprafața pielii după expunere, precum și oricare altă cantitate prezentă pe pansamentul neocluziv, inclusiv orice cantitate volatilizată de pe suprafața pielii în timpul expunerii.
Doză absorbită (in vitro ): masă de substanță de testare care ajunge la fluidul receptor sau în circulația sistemică într-o perioadă de timp stabilită.
Doză absorbabilă (in vitro ): reprezintă cantitatea de substanță prezentă pe piele sau în piele după curățare.
1.3. PRINCIPIUL METODEI DE TESTARE
Substanța de testare, marcată radioactiv după caz, este aplicată pe suprafața unui eșantion de piele care separă cele două camere ale unei celule de difuzie. Înainte de a fi îndepărtată printr-o procedură corespunzătoare de curățare, substanța chimică rămâne pe piele în condiții specifice și pentru o perioadă determinată de timp. Fluidul receptor este prelevat la intervale stabilite în cursul perioadei de testare și analizat pentru a căuta substanța de testare și/sau metaboliți.
Atunci când sunt utilizate sisteme metabolic active, metaboliții substanței chimice de testare pot fi analizați utilizând metode corespunzătoare. La sfârșitul experimentului se cuantifică distribuția substanței chimice de testare și a metaboliților.
Absorbția substanței de testare pe o perioadă de timp determinată este măsurată cu ajutorul analizei fluidului receptor și a pielii tratate, în condițiile corespunzătoare descrise în cadrul prezentei metode și în documentul de orientare (2). Dacă nu se poate demonstra că absorbția poate fi determinată numai cu ajutorul valorilor fluidului receptor, substanța de testare rămasă în piele trebuie considerată ca și absorbită. Analiza altor componente (materialul curățat de pe piele și cel rămas în straturile pielii) permite continuarea evaluării datelor, inclusiv evacuarea totală a substanței de testare și procentajul de recuperare.
Pentru a demonstra funcționarea și fiabilitatea sistemului de testare în laboratorul în care se efectuează studiul, trebuie să fie disponibile rezultatele obținute pentru substanțele chimice de referință, în concordanță cu literatura de specialitate referitoare la metoda folosită. Această cerință poate fi îndeplinită prin testarea unei substanțe de referință corespunzătoare (care prezintă, de preferință, o lipofilicitate apropiată de substanța de testare) în paralel cu substanța de testare sau prin furnizarea unui istoric adecvat al datelor referitoare la un anumit număr de substanțe de referință cu lipofilicitate diferită (de exemplu cofeină, acid benzoic și testosteron).
1.4. DESCRIEREA METODEI DE TESTARE
1.4.1. Celula de difuzie
Celula de difuzie este formată dintr-o cameră donatoare și o cameră receptoare, grefa de piele fiind așezată între acestea (un exemplu de model tipic este prezentat în figura 1). Celula trebuie să asigure o etanșare perfectă în jurul pielii, să permită o prelevare ușoară și amestecare bună a soluției receptoare în contact cu partea inferioară a pielii, precum și o bună supraveghere a temperaturii din celulă și a conținutului acesteia. Sunt acceptate celule de difuzie atât statice, cât și dinamice. În mod normal, camerele donatoare sunt lăsate deschise în timpul expunerii la o doză limitată dintr-un preparat de testare. Totuși, camerele donatoare pot fi închise pentru aplicații nelimitate și în anumite cazuri cu doze limitate.
1.4.2. Fluidul receptor
Se preferă folosirea unui fluid receptor care favorizează fenomenele fiziologice, deși se pot folosi și alte fluide, cu condiția ca acestea să fie justificate. Se furnizează compoziția exactă a fluidului receptor. Se demonstrează solubilitatea corespunzătoare a substanței chimice de testare în fluidul receptor, astfel încât aceasta să nu acționeze ca o barieră pentru absorbție. În plus, fluidul receptor nu trebuie să afecteze integritatea de preparare a pielii. Într-un sistem dinamic, viteza de scurgere nu trebuie să împiedice difuzia substanței de testare în fluidul receptor. Într-un sistem celular static, fluidul trebuie amestecat continuu și recoltat în mod regulat. Dacă se studiază metabolismul, fluidul receptor trebuie să întrețină viabilitatea pielii pe parcursul experimentului.
1.4.3. Preparatul de piele
Se poate folosi piele de origine umană sau animală. Se cunoaște faptul că folosirea pielii umane este supusă considerentelor și condițiilor etice naționale și internaționale. Deși se preferă pielea viabilă, se poate folosi și piele neviabilă, cu condiția ca integritatea pielii să poată fi demonstrată. Se acceptă atât membrane epidermice (separate enzimatic, termic sau chimic), cât și eșantioane de piele cu grosime limitată (în mod tipic, cu grosimea cuprinsă între 200-400 μm) prelucrată cu un dermatom. Se poate folosi piele cu grosime integrală, însă trebuie evitată folosirea grosimii excesive (aproximativ > 1 mm), cu excepția cazului în care este necesar pentru determinarea substanței chimice din straturile de piele. Trebuie explicată selecția speciilor, zona anatomică și tehnica de preparare. Trebuie furnizate date acceptabile de la minimum patru mostre pentru fiecare preparat de testare.
1.4.4. Integritatea preparatului de piele
Este esențial ca pielea să fie preparată în mod adecvat. Manevrarea incorectă poate duce la deteriorarea stratului cornos, așadar trebuie verificată integritatea pielii preparate. Atunci când se studiază metabolismul pielii, pielea excizată proaspăt trebuie folosită cât mai repede posibil și în condiții despre care se știe că favorizează activitatea metabolică. În general, pielea proaspăt excizată trebuie folosită în termen de 24 de ore, însă perioada acceptabilă de stocare poate varia în funcție de sistemul enzimatic implicat în metabolism și de temperaturile de stocare (13). Atunci când preparatele de piele au fost stocate înainte de utilizare, trebuie dovedit că și-au păstrat funcția de barieră.
1.4.5. Substanța de testare
Substanța de testare reprezintă produsul ale cărui caracteristici de penetrare urmează să fie studiate. În mod ideal, substanța de testare este marcată radioactiv.
1.4.6. Preparatul de testare
Preparatul de testare (de exemplu materialul pur, diluat sau amestec care conține substanța de testare aplicată pe piele) trebuie să fie același (sau un înlocuitor realist) cu preparatul la care pot fi expuși oamenii sau alte specii țintă posibile. Orice variație de la preparatul utilizat trebuie justificată.
1.4.7. Concentrațiile și formulele substanțelor de testare
În mod normal se folosesc mai multe concentrații ale substanței de testare, astfel încât să se acopere valorile superioare din gama de expuneri potențiale în cazul oamenilor. În egală măsură, se poate lua în considerare testarea unei serii de formule tipice.
1.4.8. Aplicarea pe piele
În condiții normale, omul este supus expunerilor la substanțe chimice în doze limitate. Prin urmare, se folosește o aplicare care simulează expunerea umană, în mod normal de 1-5 mg/cm2 de piele pentru solide și până la 10 μl/cm2 pentru lichide. Cantitatea este explicată de condițiile presupuse de folosire, de obiectivele studiului sau de caracteristicile fizice ale preparatului de testare. De exemplu, aplicările pe suprafața pielii pot fi nelimitate atunci când se aplică volume mari pe unitate de suprafață.
1.4.9. Temperatura
Difuzia pasivă a substanțelor chimice (prin urmare și absorbția acestora în piele) este afectată de temperatură. Camera de difuzie și pielea trebuie menținute la o temperatură constantă apropiată de temperatura normală a pielii de 32 ± 1 oC. În funcție de modele de celule, temperatura băii sau blocului încălzit poate varia, pentru a asigura respectarea normei fiziologice a receptorului/pielii. Se preferă ca umiditatea să fie între 30 și 70 %.
1.4.10. Durata expunerii și prelevarea
Expunerea pielii la preparatul de testare poate avea loc pe durata întregului experiment sau pe o perioadă mai scurtă (pentru a imita un anumit tip de expunere a omului). Pielea se curăță de surplusul de preparat de testare cu ajutorul unui agent de curățare corespunzător, iar materialul rezultat în urma curățării este colectat pentru analiză. Procedura de eliminare a preparatului de testare depinde de condițiile de utilizare prevăzute și trebuie să fie justificată. O caracterizare adecvată a profilului de absorbție necesită, în mod normal, o perioadă de 24 de ore de prelevare a probelor. Perioadele de prelevare nu trebuie să depășească în mod normal 24 de ore, deoarece integritatea pielii poate începe să se deterioreze. În cazul substanțelor de testare care penetrează pielea rapid nu este nevoie de această perioadă de 24 de ore, însă în cazul substanțelor care penetrează încet, poate fi nevoie de perioade mai lungi de timp. Frecvența de prelevare a fluidului receptor ar trebui să permită prezentarea grafică a profilului de absorbție a substanței de testare.
1.4.11. Proceduri finale
Trebuie analizate toate componentele sistemului de testare (camera donatoare, materialul rezultat în urma curățării suprafeței de piele, preparatul de piele și camera receptoare/fluidul receptor), iar rata de recuperare trebuie determinată. În unele cazuri, pielea poate fi fracționată în zona de piele expusă și zona de piele sub marginea celulei și în fracțiuni de strat cornos, epidermă și dermă destinate unei analize separate.
1.4.12. Analiza
În toate studiile trebuie să se obțină un nivel adecvat de recuperare (respectiv o medie de 100 ± 10 % de radioactivitate) Recuperările în afara acestui interval trebuie justificate. Cantitatea de substanță de testare din fluidul receptor, din preparatul de piele, din materialul rezultat în urma curățării suprafeței pielii și din resturile din dispozitiv sunt analizate printr-o procedură corespunzătoare.
2. DATE
Se prezintă analiza fluidului receptor, distribuția substanței chimice testate în sistemul de testare și profilul absorbției în timp. Atunci când are loc expunerea la doze limitate, se calculează cantitatea curățată prin spălare de pe piele, cantitatea prezentă în piele (inclusiv în diferite straturi de piele, în cazul în care există o analiză) și cantitatea prezentă în fluidul receptor (rata și cantitatea sau procentul din doza aplicată). Absorbția cutanată poate fi uneori exprimată doar cu ajutorul datelor fluidului receptor. Totuși, atunci când substanța de testare rămâne în piele la sfârșitul studiului, poate fi necesară includerea acesteia în cantitatea totală absorbită (a se vedea alineatul 66 din referința 3). Atunci când are loc expunerea la doze nelimitate, datele pot permite calcularea unei constante de permeabilitate (Kp). În aceste condiții, procentul absorbit este irelevant.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă cerințele stipulate în protocol, inclusiv justificarea sistemului de testare utilizat, și trebuie să cuprindă următoarele:
Substanța de testare:
— stare fizică, proprietăți fizico-chimice (cel puțin greutatea moleculară și coeficientul de partiție octanol/apă – log Pow), puritate (puritatea radiochimică);
— date de identificare (de exemplu numărul de lot);
— solubilitatea în fluidul receptor.
Preparatul de testare:
— formula și justificarea utilizării;
— omogenitatea.
Condiții de testare:
— sursele și locul pielii, metoda de preparare, condițiile de stocare înainte de folosire, orice tratări preliminare (curățare, tratare cu antibiotice etc.), măsurători de integritate a pielii, statutul metabolic, justificarea utilizării;
— modelul celulei, compoziția fluidului receptor, viteza de scurgere a fluidului receptor sau intervalele și procedeele de prelevare;
— detalii privind aplicarea preparatului de testare și cuantificare a a dozei aplicate;
— durata de expunere;
— detalii privind înlăturarea preparatului de testare de pe piele, de exemplu curățarea prin spălare a pielii;
— detalii privind analiza pielii și tehnicile de fracționare utilizate pentru a demonstra distribuția în piele;
— procedurile de spălare a celulei și a aparaturii;
— metodele de analiză, tehnicile de extracție, limitele de detectare și validarea metodei analitice.
Rezultate:
— recuperările totale ale experimentului (doza aplicată ≡ spălări ale pielii + piele + fluid receptor + spălări ale celulei);
— întocmirea unui tabel cu recuperările fiecărei celule în fiecare compartiment;
— profilul absorbției;
— întocmirea unui tabel cu datele absorbției (exprimate ca rată, cantitate sau procent).
Discutarea rezultatelor.
Concluzii.
4. REFERINȚE BIBLIOGRAFICE
1. Testing Method B.44. Skin Absorption: In vivo Method.
2. OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
3. OECD (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Anexa 1 la ENV/JM/TG(2 000)5. OECD, Paris.
4. Kemppainen B. W. and Reifenrath W. G. (1990). Methods for skin absorption. CRC Press, Boca Raton.
5. Bronaugh R.L. and Collier, SW. (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pag. 237-241.
6. Bronaugh R. L. and Maibach H. I. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton.
7. European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monografia No. 20, Percutaneous Absorption, ECETOC, Brussels.
8. Diembeck W., Beck H., Benech-Kieffer F. Courtellemont P., Dupuis J., Lovell W., Paye M., Spengler J., Steiling W. (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191-205.
9. Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, Nr. 65.
10. Howes D., Guy R, Hadgraft J., Heylings JR et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10.
11. Schaefer H. and Redelmeier T. E. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel.
12. Roberts M. S. and Walters K. A. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York.
13. Jewell, C., Heylings, J. R., Clowes, H. M. And Williams, F. M. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356-365.
Figura 1
Exemplu de model tipic al celulei de difuzie statică pentru studiile in vitro a absorbției percutanate

B.46. IRITAȚIA CUTANATĂ IN VITRO: TEST PE MODEL DE EPIDERMĂ UMANĂ RECONSTRUITĂ
1. METODĂ
1.1. INTRODUCERE
Iritația cutanată se referă la producerea unor leziuni reversibile ale pielii în urma aplicării unei substanțe testate timp de până la 4 ore [conform definiției din Sistemul global armonizat de clasificare și etichetare a substanțelor chimice (GHS) al Națiunilor Unite](1). Această metodă de testare asigură o procedură in vitro care, în funcție de necesarul de informații, poate permite determinarea riscului substanțelor de a produce iritații cutanate ca test substitutiv de sine stătător în cadrul unei strategii de testare, printr-o abordare având la bază forța probantă a datelor (2).
Evaluarea iritației cutanate implică în mod obișnuit utilizarea animalelor de laborator (a se vedea metoda B.4)(3). În ceea ce privește preocupările legate de bunăstarea animalelor, metoda B.4 permite determinarea coroziunii/iritației cutanate prin aplicarea unei strategii de testare secvențială, folosind metode in vitro și ex vivo validate, evitându-se astfel durerea și suferința animalelor. Pentru partea privind corozivitatea din cadrul strategiei de testare secvențială B.4, sunt utile trei metode de testare sau indicații orientative de testare in vitro validate, B.40, B.40bis și TG 435 (4,5,6).
Această metodă de testare se bazează pe modele de epidermă umană reconstruită, al căror design global (utilizarea de keratinocite de proveniență umană ca celule-sursă, țesut reprezentativ și citoarhitectură) copiază îndeaproape proprietățile biochimice și fiziologice ale părții superficiale a pielii umane, și anume epiderma. Procedura descrisă în cadrul prezentei metode de testare permite identificarea riscurilor pe care le prezintă substanțele iritante în conformitate cu categoria 2 din GHS al Națiunilor Unite. Prezenta metodă de testare include, de asemenea, un set de standarde de performanță pentru evaluarea metodelor similare și modificate de testare bazate pe epidermă umană reconstruită (7).
Au fost efectuate studii de prevalidare, optimizare și validare pentru două metode de testare in vitro (8, 9, 10, 11, 12, 13, 14, 15, 16, 17), disponibile sub denumirea comercială de EpiSkin™ și EpiDerm™, care folosesc modele de epidermă umană reconstruită. Aceste referințe au la bază R 38. Anumite aspecte legate de recalculare în scopul GHS sunt abordate în cadrul referinței bibliografice 25. Metodele cu performanțe echivalente cu EpiSkin™ (metoda de referință validată 1) se recomandă ca metodă de testare de sine stătătoare de substituire a testului in vivo pe iepuri pentru clasificarea substanțelor iritante din categoria 2 a GHS. Metodele cu performanțe echivalente cu EpiDermTM (metoda de referință validată 2) se recomandă numai ca metodă screening de testare sau ca parte a unei strategii de testare secvențială cu o abordare având la bază forța probantă a datelor, pentru clasificarea substanțelor iritante din categoria 2 GHS. Înainte ca un test in vitro propus pentru iritația cutanată pe baza unui model de epidermă umană reconstruită să poată fi utilizat în scopul reglementării, trebuie stabilite fiabilitatea, relevanța (precizia) și limitele sale de utilizare în scopul propus, în vederea asigurării comparabilității acestuia cu metoda de referință validată 1, în conformitate cu standardele de performanță stabilite în cadrul prezentei metode de testare (apendice).
În conformitate cu cerințele prezentei metode de testare, au fost validate alte două metode de testare in vitro cu epidermă umană reconstruită, iar acestea duc la obținerea unor rezultate similare cu cele ale metodei de referință validate 1 (18). Acestea sunt metoda de testare EpiDermTM modificată (metoda de referință 2 modificată) și metoda de testare SkinEthic RHETM (metoda similară sau „me-too” 1).
1.2. DEFINIȚII
În cadrul prezentei metode de testare se aplică următoarele definiții:
Precizie: Gradul de apropiere dintre rezultatele metodei de testare și valorile de referință acceptate. Aceasta constituie una dintre caracteristicile de performanță ale metodei de testare și unul dintre aspectele relevanței acesteia. Termenul este adesea utilizat în paralel cu termenul sinonim „concordanță”, pentru a desemna proporția de rezultate corecte ale unei metode de testare.
Substanță de control al lotului: Substanță etalon care produce un răspuns de viabilitate celulară medie al țesutului.
Viabilitate celulară: Parametru care măsoară activitatea totală a unei populații celulare, de exemplu capacitatea dehidrogenazelor mitocondriale celulare de a reduce colorantul vital MTT [bromură de 3-(4,5-Dimetiltiazol-2-il)-2,5-difeniltetrazoliu, albastru de tiazolil], care, în funcție de efectul măsurat și de tipul testului utilizat, se corelează cu numărul total și/sau vitalitatea celulelor vii.
ET50 : Perioada de expunere necesară pentru a reduce viabilitatea celulară cu 50 % la aplicarea substanței marker cu o concentrație specifică fixă; a se vedea, de asemenea, IC50.
Rată de rezultate fals negative: Proporția tuturor substanțelor pozitive identificate în mod fals de o metodă de testare ca fiind negative. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Rată de rezultate fals pozitive: Proporția tuturor substanțelor negative (inactive) care sunt identificate în mod fals ca fiind pozitive. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Doză infinită: Cantitate de substanță testată aplicată pe piele care depășește cantitatea necesară pentru acoperirea completă și uniformă a suprafeței pielii.
GHS (Sistemul global armonizat de clasificare și etichetare a substanțelor chimice): Un sistem care propune clasificarea substanțelor și amestecurilor în funcție de tipuri și niveluri standardizate de riscuri fizice, riscuri pentru sănătate și riscuri pentru mediu, care elaborează elemente de comunicare corespunzătoare, de exemplu pictograme, cuvinte de avertizare, fraze de pericol, fraze de securitate și fișe tehnice de siguranță, pentru a transmite informații privind efectele adverse ale acestora, în scopul protejării populației (inclusiv a angajatorilor, a lucrătorilor, a transportatorilor, a consumatorilor și a serviciilor de urgență) și a mediului (1) și care a fost implementat în cadrul UE în Regulamentul (CE) nr. 1272/2008.
IC50 : Concentrația la care o substanță marker reduce viabilitatea țesutului cu 50 % (IC50) după o perioadă fixă de expunere; a se vedea, de asemenea, ET50.
Standarde de performanță: Standarde bazate pe o metodă de referință validată, care permit evaluarea comparabilității unei metode de testare propuse similare din punct de vedere al mecanismului și din punct de vedere funcțional. Sunt incluse: I. componentele esențiale ale metodei de testare; II. o listă minimală de substanțe de referință selectate dintre substanțele utilizate pentru a demonstra performanțele acceptabile ale metodei de referință validate; și III. nivelurile comparabile de precizie și fiabilitate, pe baza rezultatelor obținute în cazul metodei de referință validate, care trebuie obținute de metoda de testare propusă în momentul evaluării sale pe baza listei minimale de substanțe de referință.
Fiabilitate: Măsura în care o metodă de testare poate fi reprodusă în timp, în același laborator sau în laboratoare diferite, folosind același protocol. Aceasta se evaluează prin calcularea reproductibilității în același laborator sau între laboratoare.
Sensibilitate: Proporția tuturor substanțelor pozitive/active clasificate corect în urma testului. Acesta permite măsurarea preciziei unei metode de testare care conduce la rezultate clasificabile în categorii și constituie un aspect important în evaluarea fiabilității unei metode de testare.
Specificitate: Proporția tuturor substanțelor negative/inactive clasificate corect în urma testului. Acesta permite măsurarea preciziei unei metode de testare care conduce la rezultate clasificabile în categorii și constituie un aspect important în evaluarea fiabilității unei metode de testare.
Iritație cutanată: Producerea de leziuni reversibile ale pielii în urma aplicării unei substanțe testate timp de până la 4 ore. Iritația cutanată este o reacție locală, neimunogenă, care apare la scurt timp după stimulare (24). Principala sa caracteristică este procesul reversibil care implică reacții inflamatorii și majoritatea semnelor clinice caracteristice iritației (eritem, edem, prurit și durere) asociate unui proces inflamator.
1.3. DOMENIUL ȘI LIMITELE DE APLICARE
Una dintre limitele testelor pe model de epidermă umană reconstruită cuprinse în această metodă de testare este aceea că ele permit clasificarea substanțelor chimice ca substanțe iritante pentru piele numai conform categoriei 2 din GHS al Națiunilor Unite. Deoarece acestea nu permit clasificarea substanțelor în categoria 3 opțională, după cum este definită în GHS al Națiunilor Unite, toate celelalte substanțe nu vor fi clasificate (nicio categorie). În funcție de nevoile de reglementare și de posibilitatea includerii ulterioare a unor noi criterii de evaluare, a ameliorării sau dezvoltării unor noi metode similare (me-too), poate fi necesară revizuirea prezentei metode de testare.
Prezenta metodă de testare permite identificarea riscurilor reprezentate de substanțele iritante monocomponente (19), dar nu furnizează informații adecvate privind coroziunea cutanată. Gazele și aerosolii nu se pot testa, iar amestecurile nu au fost încă evaluate în cadrul unui studiu de validare.
1.4. PRINCIPIUL METODEI
Substanța testată se aplică local pe un model tridimensional de epidermă umană reconstruită, compus din keratinocite normale derivate din epidermă umană și cultivate pentru a forma un model multistratificat extrem de diferențiat de epidermă umană. Modelul constă într-un strat bazal, într-un strat spinos și într-un strat granular organizate, precum și într-un strat cornos (stratum corneum) multistratificat care conține straturi lipidice lamelare intercelulare a căror dispunere este similară celei observate in vivo.
Principiul testului pe model de epidermă umană reconstruită se bazează pe ipoteza că substanțele iritante sunt capabile să penetreze stratul cornos prin difuziune și sunt citotoxice pentru celulele din straturile inferioare. Viabilitatea celulară se măsoară prin conversia de către dehidrogenaze a colorantului vital MTT [bromură de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazoliu, albastru de tiazolil; număr EINECS 206-069-5, număr CAS 298-93-1)] într-o sare de formazan de culoare albastră care poate fi măsurată cantitativ după ce a fost extrasă din țesut (20). Substanțele iritante sunt identificate pe baza capacității acestora de a reduce viabilitatea celulară sub pragurile stabilite (și anume ≤ 50 % pentru substanțele iritante din categoria 2 din GHS al Națiunilor Unite). Substanțele pentru care viabilitatea celulară rezultată este superioară pragului stabilit nu vor fi clasificate (și anume > 50 %, nicio categorie).
Sistemele de modele de epidermă umană reconstruită pot fi utilizate pentru testarea substanțelor solide, lichide, semisolide și a cerurilor. Lichidele pot fi apoase sau neapoase; solidele pot fi solubile sau insolubile în apă. În măsura în care este posibil, solidele trebuie testate sub formă de pulbere fină. Deoarece validarea sistemelor de teste pe model de epidermă umană reconstruită a inclus 58 de substanțe atent selecționate, reprezentând o gamă largă de clase de substanțe chimice, se estimează că metodele sunt general aplicabile pentru toate clasele de substanțe chimice (16). Validarea include 13 substanțe iritante din categoria 2 a GHS. Trebuie menționat faptul că acizii necorosivi, bazele, sărurile și alte substanțe anorganice nu au fost incluse în studiul de validare, iar unele categorii cunoscute de substanțe organice iritante, precum hidroperoxizii, fenolii și surfactanții, nu au fost incluse sau au fost incluse numai în măsură limitată.
1.5. DEMONSTRAREA PERFORMANȚELOR
Înainte de utilizarea sistematică a unei metode validate conforme cu prezenta metodă de testare, este posibil ca laboratoarele să dorească să demonstreze performanțele sale tehnice, utilizând cele zece substanțe recomandate în tabelul 1. În cadrul prezentei metode de testare, categoria 3 opțională din GHS al Națiunilor Unite nu corespunde niciunei categorii. În cazul noilor metode de testare similare (me-too) elaborate conform prezentei metode de testare, care sunt similare din punct de vedere structural și funcțional cu metodele de referință validate, sau în cazul modificărilor aduse metodelor validate, trebuie utilizate standardele de performanță descrise în apendicele la prezenta metodă de testare pentru a demonstra că noua metodă are o fiabilitate și o precizie comparabile cu cele ale metodei validate, înainte de a fi utilizată pentru testare în scopul reglementării.
Tabelul 1
Substanțe de verificare care constituie un subansamblu al substanțelor de referință enumerate în apendice
|
Substanța |
Numărul CAS |
Scorul in vivo |
Starea fizică |
Categoria GHS |
|
Acid naftilacetic |
86-87-3 |
0 |
S |
Nicio cat. |
|
Izopropanol |
67-63-0 |
0,3 |
L |
Nicio cat. |
|
Stearat de metil |
112-61-8 |
1 |
S |
Nicio cat. |
|
Butirat de heptil |
5870-93-9 |
1,7 |
L |
Cat. 3 opțională |
|
Salicilat de hexil |
6259-76-3 |
2 |
L |
Cat. 3 opțională |
|
Ciclamenaldehidă |
103-95-7 |
2,3 |
L |
Cat. 2 |
|
1-bromhexan |
111-25-1 |
2,7 |
L |
Cat. 2 |
|
Metacrilat de butil |
97-88-1 |
3 |
L |
Cat. 2 |
|
1-metil-3-fenil-1-piperazină |
5271-27-2 |
3,3 |
S |
Cat. 2 |
|
Heptanal |
111-71-7 |
4 |
L |
Cat. 2 |
1.6. DESCRIEREA METODEI
Descriem în continuare componentele și procedurile testului pe model de epidermă umană reconstruită pentru evaluarea iritației cutanate. Modelul de epidermă umană reconstruită poate fi construit, preparat sau obținut pe cale comercială (de exemplu EpiSkin™, EpiDerm™ și SkinEthic RHE™). Protocoalele standard ale metodei de testare pentru EpiSkin™, EpiDerm™ și SkinEthic RHE™ pot fi obținute de la [http://ecvam.jrc.ec.europa.eu] (21, 22, 23). Testarea trebuie efectuată în conformitate cu următoarele aspecte:
1.6.1. Componentele modelului de epidermă umană reconstruită
1.6.1.1. Condiții generale ale modelului
Pentru construcția epiteliului trebuie utilizate keratinocite umane normale. Sub stratul cornos funcțional trebuie să existe straturi multiple de celule epiteliale viabile (stratul bazal, stratul spinos, stratul granulos). Stratul cornos trebuie să fie multistratificat și să prezinte profilul lipidic esențial pentru a forma o barieră funcțională robustă care să reziste la penetrarea rapidă a substanțelor marker citotoxice, de exemplu dodecilsulfat de sodiu (SDS) sau Triton X-100. Bariera funcțională trebuie evaluată fie prin stabilirea concentrației la care substanța marker reduce viabilitatea celulară cu 50 % (IC50) după o perioadă fixă de expunere, fie prin stabilirea perioadei de expunere necesare pentru a reduce viabilitatea celulară cu 50 % (ET50) la aplicarea substanței marker cu o concentrație specifică fixă. Etanșeitatea modelului trebuie să prevină trecerea substanței dincolo de stratul cornos către țesutul viabil, ceea ce ar duce la o slabă modelizare a expunerii pielii. Modelul de epidermă nu trebuie să fie contaminat cu bacterii, virusuri, micoplasmă sau ciuperci.
1.6.1.2. Condiții funcționale ale modelului
1.6.1.2.1. Viabilitatea
Testul recomandat pentru stabilirea viabilității este MTT (20). Densitatea optică (DO) a colorantului (solubilizat) extras din țesutul tratat cu substanță negativă de control (NC) trebuie să fie de cel puțin 20 de ori mai mare decât DO a solventului de extracție. Trebuie documentat faptul că țesutul tratat cu substanță negativă de control este stabil în cultură (prezintă măsurători similare ale viabilității) pe durata perioadei de expunere la testare.
1.6.1.2.2. Funcția de barieră
Stratul cornos și compoziția lipidică a acestuia trebuie să fie suficiente pentru a rezista la penetrarea rapidă a substanțelor marker citotoxice, de exemplu SDS sau Triton X-100, estimată prin IC50 sau ET50.
1.6.1.2.3. Morfologia
Examinarea histologică a pielii/epidermei reconstruite trebuie să fie efectuată de personal calificat adecvat care va demonstra că modelul prezintă o structură similară celei a pielii/epidermei umane (inclusiv stratul cornos multistratificat).
1.6.1.2.4. Reproductibilitatea
Trebuie demonstrată reproductibilitatea în timp a rezultatelor metodei de testare cu un model specific, de preferat cu ajutorul unei substanțe (etalon) adecvate de control al lotului (a se vedea apendicele).
1.6.1.2.5. Controalele de calitate (CC) ale modelului
Fiecare lot de modele de epidermă utilizat trebuie să îndeplinească anumite criterii bine definite de producție, printre care cele mai importante sunt criteriile privind viabilitatea (punctul 1.6.1.2.1) și funcția de barieră (punctul 1.6.1.2.2). Furnizorul de modele de epidermă (sau investigatorul, atunci când se utilizează un model produs intern) trebuie să stabilească o plajă de valori acceptabile (limita superioară și cea inferioară) pentru IC50 sau ET50. Proprietățile de barieră ale țesuturilor trebuie verificate de laborator după primirea acestora. Numai rezultatele obținute pe baza unor țesuturi corespunzătoare pot fi acceptate în vederea estimării fiabile a efectelor iritante. În continuare sunt prezentate cu titlu de exemplu plajele de valori acceptabile pentru metodele de referință validate.
Tabelul 2
Exemple de criterii pentru controlul calității lotului
|
Limita inferioară de acceptabilitate |
Media plajei de valori acceptabile |
Limita superioară de acceptabilitate |
|
|
Metoda de referință validată 1 (18 ore de tratament cu SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Metoda de referință validată 2 (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
1.6.1.3. Aplicarea substanțelor testate și a substanțelor de control
Trebuie utilizat un număr suficient de țesuturi-replică pentru fiecare tratament și pentru controale (cel puțin trei replici pe serie). Atât în cazul substanțelor lichide, cât și în cazul celor solide, trebuie aplicată o cantitate suficientă de substanță testată pentru a acoperi uniform suprafața pielii, evitându-se totuși o doză infinită (a se vedea 1.2 Definiții), și anume trebuie utilizat minimum 25 μL/cm2 sau 25 mg/cm2. În cazul substanțelor solide, suprafața epidermei trebuie umezită cu apă deionizată sau distilată înainte de aplicare, pentru a asigura un bun contact cu pielea. În măsura în care este posibil, solidele trebuie testate sub formă de pulbere fină. La sfârșitul perioadei de expunere, substanța testată trebuie spălată cu atenție de pe suprafața pielii, utilizând o soluție-tampon apoasă sau NaCl de 0,9 %. În funcție de modelul de epidermă umană reconstruită utilizat, perioada de expunere poate varia între 15 și 60 de minute, iar temperatura de incubare poate varia între 20 și 37 °C. Pentru detalii, a se consulta Procedurile standard de operare pentru cele trei metode (21, 22, 23).
Pentru fiecare test trebuie utilizate simultan substanțe de control negative (NC) și pozitive (PC) pentru a demonstra că viabilitatea (NC), funcția de barieră și sensibilitatea rezultată (PC) a țesuturilor se încadrează în plaja istorică definită de valori acceptabile. Substanța PC recomandată este soluția apoasă de SDS de 5 %. Substanțele NC recomandate sunt apa sau soluție salină tamponată cu fosfat (PBS).
1.6.1.4. Măsurători ale viabilității celulare
Cel mai important element al procedurii de testare este constituit de faptul că măsurătorile de viabilitate celulară nu se efectuează imediat după expunerea la substanțele testate, ci după o perioadă de incubare posttratament suficient de lungă a țesuturilor spălate în mediu proaspăt. Această perioadă permite atât recuperarea în urma unor efecte slab iritante, cât și manifestarea efectelor citotoxice clare. În timpul fazei de optimizare a testului (9, 10, 11, 12, 13), o perioadă de incubare posttratament de 42 de ore s-a dovedit optimă și, prin urmare, a fost utilizată pentru validarea metodelor de testare de referință.
Testul de conversie a MTT este o metodă cantitativă validată care trebuie utilizată pentru măsurarea viabilității celulare. Acesta este compatibil cu o arhitectură tridimensională a țesutului. Mostra de piele este introdusă într-o soluție de MTT de concentrație adecvată (de exemplu 0,3-1 mg/ml) timp de 3 ore. Precipitatul de formazan albastru este apoi extras din țesut utilizând un solvent (de exemplu izopropanol sau izopropanol acid) și concentrația de formazan se măsoară determinând densitatea optică la 570 nm folosind o bandă de trecere de maximum ± 30 nm.
Proprietățile optice ale substanței testate sau acțiunea sa chimică asupra MTT pot interfera cu testul, conducând la o falsă estimare a viabilității (deoarece substanța testată poate împiedica, poate inversa sau poate chiar produce generarea culorii). Acest lucru se poate întâmpla atunci când o anumită substanță testată nu este complet eliminată de pe piele prin spălare sau atunci când penetrează epiderma. Dacă substanța testată acționează direct asupra MTT, dacă este colorată în mod natural sau dacă se colorează în timpul tratamentului țesutului, trebuie utilizate controale suplimentare pentru a detecta și corecta interferența substanței testate cu tehnica de măsurare a viabilității. Pentru descrierea detaliată a modului în care poate fi testată direct reducerea MTT, vă rugăm consultați protocolul metodei de testare pentru metodele de referință validate (21, 22, 23). Culoarea nespecifică (NSC) datorată acestor interferențe nu trebuie să depășească 30 % din NC (pentru corecturi). Dacă NSC > 30 %, se consideră că substanța testată este incompatibilă cu testul.
1.6.1.5. Criterii de acceptabilitate ale testului
Pentru fiecare test care utilizează loturi valabile (a se vedea punctul 1.6.1.2.5), țesuturile tratate cu NC trebuie să prezinte o densitate optică care să reflecte calitatea țesuturilor supuse tuturor etapelor de transport și de recepționare, precum și întregului protocol privind iritația. Valorile densității optice a substanțelor de control nu trebuie să fie inferioare limitelor minime istorice stabilite. În mod analog, țesuturile tratate cu PC, și anume soluție apoasă de SDS de 5 %, trebuie să reflecte sensibilitatea intrinsecă a țesuturilor și capacitatea acestora de răspuns la substanța iritantă, în condițiile fiecărui test individual (de exemplu viabilitate ≤ 40 % pentru metoda de referință validată 1 și ≤ 20 % pentru metoda de referință validată 2). Trebuie definite valorile asociate și adecvate ale variabilității între replicile de țesut (de exemplu, dacă deviațiile standard sunt utilizate, acestea trebuie să fie ≤ 18 %).
2. REZULTATE
2.1. REZULTATE
Pentru fiecare tratament trebuie raportate sub forma unui tabel rezultatele obținute pentru fiecare mostră de țesut (de exemplu valorile densității optice și datele procentuale privind viabilitatea celulară calculate pentru fiecare substanță testată, inclusiv clasificarea corespunzătoare), inclusiv rezultatele obținute în urma repetării experimentelor, dacă este cazul. În plus, trebuie raportate pentru fiecare test valorile medii ± deviația standard. Interacțiunile observate cu reactivul MTT și cu substanțele testate colorate trebuie raportate pentru fiecare substanță testată.
2.2. INTERPRETAREA REZULTATELOR
Valorile densității optice obținute pentru fiecare mostră a testului pot fi utilizate pentru a calcula procentul de viabilitate relativ la substanța negativă de control, care este stabilit la 100 %. Valoarea limită a procentului de viabilitate celulară pe baza căreia se face distincția între substanțele testate iritante și cele neclasificate, precum și procedura (procedurile) statistică (statistice) utilizate pentru evaluarea rezultatelor și identificarea substanțelor iritante trebuie clar definite și documentate; de asemenea, trebuie demonstrat faptul că acestea sunt adecvate. În continuare sunt prezentate valorile limită pentru estimarea efectelor iritante asociate metodelor de referință validate:
Substanța testată este considerată iritantă pentru piele în conformitate cu categoria 2 din GHS al Națiunilor Unite:
(i) dacă viabilitatea țesutului după expunere și perioada de incubare posttratament este mai mică sau egală (≤) cu 50 %.
Substanța testată este considerată neclasificată:
(ii) dacă viabilitatea țesutului după expunere și perioada de incubare posttratament este mai mare (>) de 50 %.
3. RAPORTAREA
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele date:
Substanțe testate și de control:
— denumire (denumiri) chimică (chimice), precum denumirea IUPAC sau CAS și numărul CAS, dacă se cunosc;
— puritatea și compoziția substanței [în procent(e) de greutate];
— proprietățile fizico-chimice relevante pentru desfășurarea studiului (de exemplu starea fizică, stabilitatea și volatilitatea, pH-ul, solubilitatea în apă, dacă se cunosc);
— tratamentul substanțelor testate/de control înainte de efectuarea testului, după caz (de exemplu încălzire, măcinare);
— condiții de depozitare.
Justificare privind modelul de epidermă și protocolul utilizat.
Condiții de testare:
— sistemul celular utilizat;
— informații de calibrare pentru instrumentul de măsurare și banda de trecere utilizată pentru măsurarea viabilității celulare (de exemplu spectrofotometru);
— informații complete privind modelul de epidermă utilizat, inclusiv performanța acestuia. Aceasta trebuie să includă, fără a se limita la:
—(i) viabilitate
(ii) funcția de barieră
(iii) morfologie
(iv) reproductibilitate și predictibilitate
(v) controale de calitate (CC) ale modelului;
— detalii cu privire la procedura de testare utilizată;
— dozele de testare utilizate, durata expunerii și perioada de incubare posttratament;
— descrierea oricăror modificări ale procedurii de testare;
— trimiteri la datele istorice ale modelului. Aceasta trebuie să includă, fără a se limita la:
—(i) acceptabilitatea datelor CC cu trimitere la datele istorice privind lotul;
(ii) acceptabilitatea valorilor substanțelor de control pozitive și negative în comparație cu valorile medii și plajele de valori ale substanțelor de control pozitive și negative;
— descrierea criteriilor de evaluare folosite, inclusiv justificarea privind alegerea punctului (punctelor) limită pentru modelul de estimare.
Rezultate:
— prezentarea sub formă de tabel a rezultatelor obținute cu fiecare mostră de testare;
— descrierea altor efecte observate.
Discutarea rezultatelor.
Concluzii
4. REFERINȚE BIBLIOGRAFICE
1. United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Disponibilă la adresa: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html
2. REACH: Guidance on Information Requirements and Chemical Safety Assessment. Disponibilă la adresa: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649
3. Metoda de testare B.4. TOXICITATE ACUTĂ; IRITAȚIE/COROZIUNE CUTANATĂ.
4. Metoda de testare B.40. COROZIUNE CUTANATĂ IN VITRO: TEST DE REZISTENȚĂ ELECTRICĂ TRANSCUTANATĂ TER.
5. Metoda de testare B.40 BIS. COROZIUNE CUTANATĂ IN VITRO: TEST PE MODEL DE EPIDERMĂ UMANĂ.
6. OECD (2006). Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Adoptată la 19 iulie 2006. Disponibilă la adresa: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html
7. ECVAM (2009) Performance Standards for applying human skin models to in vitro skin irritation. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu
8. Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in Vitro 15, 57-93.
9. Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765-770.
10. Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107-114.
11. Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test. ATLA 33, 351-367.
12. Cotovio, J., Grandidier, M.-H., Portes, P., Roguet, R. & G. Rubinsteen (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329-249.
13. Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30, 109-129.
14. Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559-601.
15. Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 p. + annexes. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu
16. Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603-619.
17. J. Cotovio, M.-H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy – Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351-358.
18. ESAC statement on updated EpiDerm and similar SkinEthic assays. 5 November 2008.
19. CE (2006). Regulamentul (CE) nr. 1907/2006 al Parlamentului European și al Consiliului din 18 decembrie 2006 privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH), de înființare a Agenției Europene pentru Produse Chimice, de modificare a Directivei 1999/45/CE și de abrogare a Regulamentului (CEE) nr. 793/93 al Consiliului și a Regulamentului (CE) nr. 1488/94 al Comisiei, precum și a Directivei 76/769/CEE a Consiliului și a Directivelor 91/155/CEE, 93/67/CEE, 93/105/CE și 2000/21/CE ale Comisiei. Jurnalul Oficial al Uniunii Europene L 396/1 din 30.12.2006. OPOCE, Luxemburg.
20. Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63.
21. EpiSkin™ SOP, Version 1.6 (January 2005). Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu
22. EpiDerm™ SOP, Version 5.0 (October 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu
23. SkinEthic RHE™ SOP. Va fi disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu
24. Harvell, J.D., Lammintausta, K., Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, p. 7-18
25. Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008.
Apendice
Evaluarea caracteristicilor de performanță ale modelelor de epidermă umană reconstruită propuse pentru determinarea apariției iritației cutanate in vitro
INTRODUCERE
Procedurile propuse pentru utilizare în cadrul prezentei metode de testare trebuie evaluate folosind substanțe reprezentând întreaga gamă de scoruri Draize de evaluare a efectelor iritante, pentru a determina fiabilitatea și precizia acestora. Când este evaluată folosind cele 20 de substanțe de referință (tabelul 2), procedura propusă trebuie să prezinte valori ale fiabilității și preciziei comparabile cu cele ale metodei de referință validate 1 (tabelul 3) (1). Standardele de fiabilitate și precizie care trebuie atinse sunt prezentate în continuare, la punctele II și III. Sunt incluse substanțele neclasificate și cele clasificate (categoria 2 din GHS al Națiunilor Unite), reprezentând clasele de substanțe chimice relevante, astfel încât fiabilitatea și performanța (sensibilitatea, specificitatea, ratele de rezultate fals negative, ratele de rezultate fals pozitive și precizia) metodei de testare propuse să poată fi comparate cu cele ale metodei de referință validate 1. Fiabilitatea metodei de testare, precum și capacitatea acesteia de a identifica în mod corect substanțele iritante din categoria 2 din GHS al Națiunilor Unite trebuie determinate înainte ca aceasta să fie utilizată pentru testarea unor substanțe noi.
STANDARDE DE PERFORMANȚĂ
Standardele de performanță cuprind următoarele trei elemente: I. Componentele esențiale ale metodei de testare, II. Substanțele de referință și III. Valorile definite de precizie și fiabilitate (2). Aceste standarde de performanță se bazează pe standardele de performanță definite după încheierea studiului de validare privind iritația cutanată efectuat de ECVAM (3).
I. Componentele esențiale ale metodei de testare
Pentru construcția epiteliului trebuie utilizate keratinocite umane normale. Sub stratul cornos funcțional trebuie să existe straturi multiple de celule epiteliale viabile (stratul bazal, stratul spinos, stratul granulos). Stratul cornos trebuie să fie multistratificat și să prezinte profilul lipidic esențial pentru a forma o barieră funcțională robustă care să reziste la penetrarea rapidă a substanțelor marker citotoxice, de exemplu SDS sau Triton X-100. Bariera funcțională trebuie evaluată fie prin stabilirea concentrației la care substanța marker reduce viabilitatea celulară cu 50 % (IC50) după o perioadă fixă de expunere, fie prin stabilirea perioadei de expunere necesare pentru a reduce viabilitatea celulară cu 50 % (ET50) la aplicarea substanței marker cu o concentrație specifică fixă. Etanșeitatea modelului trebuie să prevină trecerea substanței dincolo de stratul cornos către țesutul viabil, ceea ce ar duce la o slabă modelizare a expunerii pielii. Modelul de epidermă nu trebuie să fie contaminat cu bacterii, virusuri, micoplasmă sau ciuperci.
Testul recomandat pentru stabilirea viabilității este MTT (4). Densitatea optică a colorantului (solubilizat) extras din țesutul tratat cu substanță negativă de control trebuie să fie de cel puțin 20 de ori mai mare decât densitatea optică a solventului de extracție. Trebuie documentat faptul că țesutul tratat cu substanță negativă de control este stabil în cultură (prezintă măsurători similare ale viabilității) pe durata perioadei de expunere la testare.
Stratul cornos și compoziția lipidică a acestuia trebuie să fie suficiente pentru a rezista la penetrarea rapidă a substanțelor marker citotoxice, de exemplu SDS sau Triton X-100, estimată prin IC50 sau ET50.
Examinarea histologică a pielii/epidermei reconstruite trebuie să fie efectuată de personal calificat adecvat care va demonstra că modelul prezintă o structură similară celei a pielii/epidermei umane (inclusiv stratul cornos multistratificat).
Trebuie demonstrată reproductibilitatea în timp a rezultatelor metodei de testare cu un model specific, de preferat cu ajutorul unei substanțe (etalon) adecvate de control al lotului (a se vedea definițiile din punctul 1.2).
Fiecare lot de modele de epidermă utilizat trebuie să îndeplinească anumite criterii bine definite de producție, printre care cele mai importante sunt criteriile privind viabilitatea și funcția de barieră. Furnizorul de modele de epidermă (sau investigatorul, atunci când se utilizează un model produs intern) trebuie să stabilească o plajă de valori acceptabile (limita superioară și cea inferioară) pentru IC50 sau ET50. Proprietățile de barieră ale țesuturilor trebuie verificate de laborator după primirea acestora. Numai rezultatele obținute pe baza unor țesuturi corespunzătoare pot fi acceptate în vederea estimării fiabile a efectelor iritante. În continuare sunt prezentate cu titlu de exemplu plajele de valori acceptabile pentru metodele de referință validate.
Tabelul 1
Exemple de criterii pentru controlul calității lotului
|
Limita inferioară de acceptabilitate |
Media plajei de valori acceptabile |
Limita superioară de acceptabilitate |
|
|
Metoda de referință validată 1 (18 ore de tratament cu SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Metoda de referință validată 2 (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
II. Substanțe de referință
Substanțele de referință sunt folosite pentru a stabili dacă fiabilitatea și precizia unei noi metode propuse de testare in vitro pe model de epidermă umană reconstruită, care s-a demonstrat că prezintă suficiente similitudini de natură structurală și funcțională cu metodele de referință validate sau care reprezintă o modificare minoră a metodei de referință validate, sunt comparabile cu cele ale metodei de referință validate 1 (1). Cele 20 de substanțe de referință enumerate în tabelul 2 includ substanțe reprezentând diferite clase de substanțe chimice de interes, precum și substanțele din categoria 2 din GHS al Națiunilor Unite. Substanțele incluse în această listă cuprind 10 substanțe din categoria 2 din GHS al Națiunilor Unite, 3 substanțe din categoria 3 opțională a GHS al Națiunilor Unite și 7 substanțe neclasificate. În cadrul prezentei metode de testare, categoria 3 opțională nu corespunde niciunei categorii. Aceste substanțe de referință reprezintă numărul minim de substanțe care trebuie utilizat pentru a evalua precizia și fiabilitatea metodei propuse de testare pe model de epidermă umană reconstruită pentru determinarea apariției iritației cutanate. În situațiile în care una dintre substanțele enumerate nu este disponibilă, pot fi utilizate alte substanțe pentru care sunt disponibile informații de referință in vivo adecvate. Dacă este necesar, pe lista minimă de substanțe de referință pot fi adăugate substanțe suplimentare reprezentând alte clase de substanțe, pentru care sunt disponibile informații de referință in vivo adecvate, în vederea evaluării suplimentare a preciziei metodei de testare propuse.
Tabelul 2
Substanțe de referință pentru stabilirea valorilor de precizie și fiabilitate ale modelelor de epidermă umană reconstruită pentru evaluarea iritației cutanate
|
Substanța (1) |
Nr. CAS |
Nr. EINECS |
Starea fizică |
Scorul in vivo |
Cat. GHS in vitro |
Cat. GHS in vivo |
|
1-bromo-4-clorobutan |
6940-78-9 |
230-089-3 |
L |
0 |
Cat. 2 |
Nicio cat. |
|
Ftalat de dietil |
84-66-2 |
201-550-6 |
L |
0 |
Nicio cat. |
Nicio cat. |
|
Acid naftilacetic |
86-87-3 |
201-705-8 |
S |
0 |
Nicio cat. |
Nicio cat. |
|
Fenoxiacetat de alil |
7493-74-5 |
231-335-2 |
L |
0,3 |
Nicio cat. |
Nicio cat. |
|
Izopropanol |
67-63-0 |
200-661-7 |
L |
0,3 |
Nicio cat. |
Nicio cat. |
|
4-(metiltio)-benzaldehidă |
3446-89-7 |
222-365-7 |
L |
1 |
Cat. 2 |
Nicio cat. |
|
Stearat de metil |
112-61-8 |
203-990-4 |
S |
1 |
Nicio cat. |
Nicio cat. |
|
Butirat de heptil |
5870-93-9 |
227-526-5 |
L |
1,7 |
Nicio cat. |
Cat. 3 opțională |
|
Salicilat de hexil |
6259-76-3 |
228-408-6 |
L |
2 |
Nicio cat. |
Cat. 3 opțională |
|
Fosfat de triizobutil |
126-71-6 |
204-798-3 |
L |
2 |
Cat. 2 |
Cat. 3 opțională |
|
1-decanol |
112-30-1 |
203-956-9 |
L |
2,3 |
Cat. 2 |
Cat. 2 |
|
Ciclamenaldehidă |
103-95-7 |
203-161-7 |
L |
2,3 |
Cat. 2 |
Cat. 2 |
|
1-bromhexan |
111-25-1 |
203-850-2 |
L |
2,7 |
Cat. 2 |
Cat. 2 |
|
Hidroclorură de 2-clorometil-3,5-dimetil-4-metoxipiridină |
86604-75-3 |
434-680-9 |
S |
2,7 |
Cat. 2 |
Cat. 2 |
|
Alfa-terpineol |
98-55-5 |
202-680-6 |
L |
2,7 |
Cat. 2 |
Cat. 2 |
|
Disulfură de di-n-propil |
629-19-6 |
211-079-8 |
L |
3 |
Nicio cat. |
Cat. 2 |
|
Metacrilat de butil |
97-88-1 |
202-615-1 |
L |
3 |
Cat. 2 |
Cat. 2 |
|
Benzentiol, 5-(1,1-dimetiletil)-2-metil |
7340-90-1 |
438-520-9 |
L |
3,3 |
Cat. 2 |
Cat. 2 |
|
1-metil-3-fenil-1-piperazină |
5271-27-2 |
431-180-2 |
S |
3,3 |
Cat. 2 |
Cat. 2 |
|
Heptanal |
111-71-7 |
203-898-4 |
L |
4 |
Cat. 2 |
Cat. 2 |
|
(1) Cele 20 de substanțe de referință constituie o selecție reprezentativă din cele 58 de substanțe utilizate inițial pentru validarea metodei de referință 1 (EpiSkin™). Lista completă a substanțelor testate și a criteriilor de selecție a acestora este disponibilă (5). |
||||||
Substanțele enumerate în tabelul 2 asigură o distribuție reprezentativă a celor 58 de substanțe utilizate în studiul internațional de validare pentru evaluarea iritației cutanate al ECVAM (1). Selectarea lor se bazează pe următoarele criterii:
— substanțele sunt disponibile pe piață;
— acestea sunt reprezentative pentru întreaga gamă de scoruri Draize de evaluare a efectelor iritante (de la substanțe neiritante până la substanțe puternic iritante);
— au o structură chimică bine definită;
— sunt reprezentative pentru reproductibilitatea și pentru capacitatea de estimare ale metodei validate, determinate în cadrul studiului de validare al ECVAM;
— sunt reprezentative pentru funcționalitatea chimică utilizată în procesul de validare;
— nu sunt asociate unui profil extrem de toxic (de exemplu cancerigen sau toxic pentru sistemul de reproducere) și unor costuri de eliminare prohibitive.
III. Valorile definite de precizie și fiabilitate
Performanțele (sensibilitatea, specificitatea, ratele de rezultate fals negative, ratele de rezultate fals pozitive și precizia) metodei de testare propuse trebuie să fie comparabile cu cele ale metodei de referință validate 1 (tabelul 3), și anume sensibilitatea trebuie sau fie mai mare sau egală cu (≥) 80 %, specificitatea trebuie să fie mai mare sau egală cu (≥) 70 %, iar precizia trebuie să fie mai mare sau egală cu (≥) 75 %. Performanțele trebuie calculate folosind toate clasificările obținute pentru cele 20 de substanțe în diferite laboratoare participante. Clasificarea fiecărei substanțe în fiecare laborator trebuie obținută folosind valoarea medie de viabilitate corespunzătoare diferitelor serii de teste efectuate (minimum trei serii valabile).
Tabelul 3
Performanțele metodei de referință validate 1 (1)
|
Metoda de testare |
Nr. de substanțe |
Sensibilitatea |
Specificitatea |
Rata de rezultate fals negative |
Rata de rezultate fals pozitive |
Precizia |
|
Metoda de referință validată 1 (2) |
58 |
87,2 % (3) |
71,1 % (4) |
12,8 % |
29,9 % |
74,7 % |
|
Metoda de referință validată (2) |
20 |
90 % |
73,3 % |
10 % |
26,7 % |
81,7 % |
|
(1) Tabelul 3 conține performanțele metodei de referință validate 1, în ceea ce privește capacitatea acesteia de a identifica corect substanțele iritante (categoria 2 din GHS al Națiunilor Unite) și substanțele neclasificate (nicio categorie, inclusiv categoria 3 opțională) pentru cele 58 și, respectiv, cele 20 de substanțe de referință (tabelul 2). (2) EpiSkin™ (3) Pe baza a 13 substanțe iritante din categoria 2 a GHS. (4) Pe baza a 45 de substanțe iritante din categoria 3 a GHS sau din nicio categorie a GHS. |
||||||
Fiabilitatea metodei de testare propuse trebuie să fie comparabilă cu cea a metodelor de referință validate.
Evaluarea variabilității intralaborator trebuie să indice o concordanță mai mare sau egală cu (≥) 90 % a clasificărilor (categoria 2/nicio categorie) obținută în serii de teste diferite și independente cu cele 20 de substanțe de referință în cadrul aceluiași laborator.
Evaluarea reproductibilității între laboratoare nu este esențială dacă metoda de testare propusă se utilizează numai într-un singur laborator. Pentru ca metodele să poată fi transferate între laboratoare, concordanța clasificărilor (categoria 2/nicio categorie) obținute în serii de teste diferite și independente cu cele 20 de substanțe de referință, preferabil în cadrul a minimum trei laboratoare, trebuie să fie mai mare sau egală cu (≥) 80 %.
REFERINȚE BIBLIOGRAFICE
1. Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559-601.
2. OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris.
3. ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Disponibil la rubrica „Download Study Documents”, la adresa http://ecvam.jrc.ec.europa.eu. Accesat la 27.10.2008.
4. Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63.
5. Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603-619.
B. 47 METODA DE TESTARE A OPACITĂȚII ȘI PERMEABILITĂȚII CORNEENE LA BOVINE PENTRU IDENTIFICAREA SUBSTANȚELOR AVÂND UN CARACTER COROZIV SAU UN POTENȚIAL IRITANT SEVER LA NIVEL OCULAR
INTRODUCERE
1. Metoda de testare a opacității și permeabilității corneene la bovine (Bovine Corneal Opacity and Permeability - BCOP) este o metodă de testare in vitro care poate fi utilizată, în anumite circumstanțe și cu anumite limite de aplicare, în scopul încadrării substanțelor și amestecurilor în categoria „substanțelor având un caracter coroziv și un potențial iritant sever la nivel ocular”(1) (2) (3). În sensul prezentei metode de testare, substanțele cu potențial iritant sever sunt definite drept substanțele care induc la iepure leziuni oculare persistente cel puțin 21 de zile după administrare. Deși metoda BCOP nu este considerată adecvată pentru a substitui în totalitate testul in vivo pe ochi de iepure, se recomandă utilizarea acestei metode ca parte a strategiei de testare progresivă pentru clasificarea și etichetarea în scopul reglementării în cadrul unui anumit domeniu de aplicabilitate (4) (5). Substanțele și amestecurile de testare (6) pot fi clasificate drept substanțe având un caracter coroziv sau un potențial iritant fără a se efectua teste suplimentare pe iepuri. O substanță al cărui rezultat este negativ va trebui să fie testată pe iepuri prin intermediul unei strategii de testare secvențiale, astfel cum este descris în orientarea OCDE privind testarea nr. 405 (7) (capitolul B.5 din prezenta anexă).
2. Scopul metodei de testare este de a descrie procedurile utilizate pentru a evalua potențialul coroziv sau iritant sever la nivel ocular al unei substanțe de test, astfel cum rezultă din capacitatea acesteia de a induce opacitatea și permeabilitatea crescută a unei cornee izolate de bovină. Efectele toxice la nivelul corneei sunt măsurate prin: (i) scăderea transmisiei luminii (opacitate) și (ii) creșterea pătrunderii colorantului fluoresceină sodică (permeabilitate). Evaluarea opacității și a permeabilității corneei după expunerea la o substanță de test se combină pentru a deduce un scor de evaluare a efectelor iritante in vitro (In Vitro Irritancy Score - IVIS), care se utilizează pentru clasificarea nivelului de iritabilitate a substanței de test.
3. Metoda de testare BCOP a mai fost utilizată pentru testarea unor substanțe cu potențial iritant la nivel ocular, care provoacă leziuni care se vindecă în mai puțin de 21 de zile, și a unor substanțe neiritante. Totuși, precizia și fiabilitatea metodei de încercare BCOP privind substanțele din aceste categorii nu au fost deocamdată evaluate în mod oficial.
4. Definițiile sunt prevăzute în apendicele 1.
CONSIDERAȚII INIȚIALE ȘI LIMITE DE APLICARE
5. Metoda de testare are la bază protocolul metodei de testare BCOP al Comitetului de Coordonare Interagenții cu privire la Validarea Metodelor Alternative (Interagency Coordinating Committee on the Validation of Alternative Methods - ICCVAM) (8), care a fost dezvoltat în urma unui studiu internațional de validare (4)(5)(9), cu participări din partea Centrului European pentru Validarea Metodelor Alternative (European Centre for the Validation of Alternative Methods - ECVAM) și a Centrului Japonez pentru Validarea Metodelor Alternative (Japanese Centre for the Validation of Alternative Methods - JaCVAM). Protocolul are la bază informațiile obținute de la Institutul pentru științe in vitro (Institute for in vitro sciences - IIVS) și Protocolul 124 al INVITTOX (10), care reprezintă protocolul utilizat pentru studiul de prevalidare al analizei BCOP sponsorizat de Comunitatea Europeană și derulat în perioada 1997-1998. Cele două protocoale se bazează pe metodologia tehnicii BCOP raportată pentru prima dată de Gautheron et al. (11).
6. Limitele de aplicare identificate pentru metoda de testare se datorează ratei ridicate de rezultate fals pozitive pentru alcooli și cetone și ratei ridicate de rezultate fals negative pentru substanțele solide, observate la nivelul bazei de date de validare [a se vedea alineatul (44)] (5). Atunci când substanțele din aceste clase chimice și fizice sunt eliminate din baza de date, precizia BCOP în funcție de sistemele de clasificare ale UE, EPA și SGA este substanțial ameliorată (5). Având în vedere scopul acestei evaluări (identificarea doar a corozivilor/iritanților severi la nivel ocular), ratele de rezultate fals negative nu sunt critice, deoarece substanțele de acest tip vor fi testate ulterior pe iepuri sau utilizate în cadrul altor teste in vitro validate corespunzător, în funcție de cerințele de reglementare, cu ajutorul unei strategii de testare secvențială, printr-o abordare având la bază forța probantă a datelor. În plus, baza de date actuală privind validările nu a permis o evaluare adecvată a unor clase chimice sau de produse (de exemplu, amestecurile). Totuși, inspectorii ar putea avea în vedere utilizarea metodei pentru testarea tuturor tipurilor de materiale (inclusiv amestecuri), în urma căreia un rezultat pozitiv ar putea fi acceptat ca indicator al unei reacții oculare corozive sau sever iritante. Cu toate acestea, rezultatele pozitive obținute cu ajutorul alcoolilor trebuie interpretate cu prudență, având în vedere riscul de supraestimare.
7. Toate procedurile care utilizează ochi și cornee de bovine trebuie să respecte reglementările și procedurile aplicabile ale instalației de testare cu privire la manipularea materialelor de origine animală, care includ țesuturile și fluidele tisulare fără a se limita la acestea. Sunt recomandate măsurile de precauție universale aplicabile în laboratoare (12).
8. O limitare a metodei de testare este aceea că, în pofida faptului că ia în considerare unele dintre efectele oculare evaluate prin metoda de testare a iritării ochiului de iepure și, într-o anumită măsură, severitatea acestora, nu acordă atenție leziunilor conjunctivale și iridiane. De asemenea, deși reversibilitatea leziunilor corneene nu poate fi evaluată în mod separat prin metoda de testare BCOP, s-a propus, pe baza studiilor pe ochi de iepure, evaluarea adâncimii inițiale a leziunii corneei pentru a se face o distincție între efectele ireversibile și cele reversibile (13). În sfârșit, metoda de testare BCOP nu permite evaluarea toxicității sistemice potențiale asociate expunerii oculare.
9. În prezent se depun eforturi pentru a caracteriza utilitatea și limitele de aplicare ale analizei BCOP pentru identificarea substanțelor iritante de intensitate medie și a celor neiritante [a se vedea de asemenea alineatul (45)]. De asemenea, utilizatorii sunt încurajați să furnizeze organizațiilor de validare mostre și/sau date pentru evaluarea oficială a aplicațiilor potențiale ulterioare ale metodei de testare BCOP, inclusiv pentru identificarea substanțelor cu potențial iritant sever și a substanțelor neiritante.
10. Toate laboratoarele care utilizează pentru prima dată prezenta metodă trebuie să utilizeze substanțele de verificare menționate în apendicele 2. Un laborator poate utiliza substanțele chimice respective pentru a-și demonstra performanțele tehnice în ceea ce privește aplicarea metodei de testare BCOP, înainte de trimiterea datelor analizei BCOP în scopul clasificării reglementare a riscurilor.
PRINCIPIUL TESTULUI
11. Metoda de testare BCOP este un model organotipic care permite menținerea pe termen scurt a funcțiilor fiziologice și biochimice normale ale corneei bovine in vitro. În această metodă de testare, leziunea provocată de substanța de test este apreciată prin măsurătorile cantitative ale modificărilor opacității și permeabilității corneene cu ajutorul unui opacimetru și, respectiv, al unui spectrofotometru în lumină vizibilă. Ambele măsurători sunt utilizate pentru a calcula IVIS, care este folosit pentru a desemna o categorie de clasificare a riscului de a provoca efecte iritante in vitro pentru anticiparea potențialului iritant la nivel ocular in vivo al unei substanțe de test (a se vedea criteriile de decizie).
12. Metoda de testare BCOP utilizează cornee izolate de la ochii bovinelor proaspăt sacrificate. Opacitatea corneană este determinată cantitativ prin măsurarea transmisiei luminii prin cornee. Permeabilitatea este determinată cantitativ prin măsurarea cantității de colorant fluoresceină sodică care străbate întreaga grosime a corneei, detectat în centrul camerei posterioare. Substanțele de test sunt aplicate la nivelul suprafeței epiteliale a corneei prin adăugare în camera anterioară a suportului cornean. Apendicele 3 prezintă o descriere și o diagramă a unui suport cornean utilizat în analiza BCOP. Suporturile corneene pot fi obținute din surse comerciale diverse sau pot fi confecționate.
Sursa și vârsta ochilor bovini și selectarea speciilor de animale
13. Bovinele trimise la abator sunt sacrificate de obicei pentru consumul uman sau în alte scopuri comerciale. Numai animalele sănătoase, considerate corespunzătoare pentru alimentația umană sunt utilizate ca sursă de cornee pentru BCOP. Deoarece bovinele au o greutate care variază în limite largi în funcție de rasă, vârstă și sex, nu există o greutate recomandată pentru animale în momentul sacrificării.
14. Utilizarea de ochi de la animale de vârste diferite poate conduce la variații ale dimensiunilor corneene. Corneele cu un diametru orizontal > 30,5 mm și valori ale grosimii corneene centrale (central corneal thickness-CCT) ≥ 1 100 μm sunt obținute în general de la animale cu vârsta de peste opt ani, iar corneele cu diametrul orizontal < 28,5 mm și CCT < 900 μm, de la bovine cu vârsta sub cinci ani (14). Din această cauză, nu se utilizează de obicei ochii de la animale cu vârsta de peste 60 de luni. În mod obișnuit, nu s-au utilizat ochi de la bovine cu vârsta sub 12 luni deoarece, în acest caz, globii oculari sunt în creștere, iar grosimea și diametrul corneei sunt considerabil mai mici decât cele raportate pentru ochii provenind de la animalele mature. Cu toate acestea, utilizarea corneelor de la animale tinere (adică cele cu vârsta cuprinsă între 6 și 12 luni) este permisă deoarece prezintă o serie de avantaje, cum ar fi disponibilitatea sporită, un interval de vârstă mai limitat și riscuri diminuate în ceea ce privește expunerea potențială a lucrătorilor la encefalopatia bovină spongiformă (15). Deoarece evaluarea suplimentară a efectului dimensiunii sau grosimii corneei asupra sensibilității la substanțe corozive sau iritante este valoroasă, utilizatorii sunt încurajați să raporteze vârsta estimativă și/sau greutatea animalelor de la care provin corneele folosite în studiu.
Colectarea și transportul ochilor la laborator
15. Ochii sunt colectați de angajații abatorului. Pentru a reduce la minim lezarea mecanică sau de altă natură a ochilor, aceștia trebuie enucleați cât mai curând posibil după sacrificare. Pentru a preveni expunerea ochilor la substanțe cu potențial iritant, angajații abatorului nu trebuie să utilizeze detergenți la spălarea capului animalului.
16. Ochii trebuie imersați complet în soluție salină echilibrată Hanks (Hanks’ Balanced Salt Solution - HBSS), într-un recipient cu dimensiuni adecvate, și transportați la laborator într-un mod care să diminueze deteriorarea și/sau contaminarea bacteriană. Deoarece ochii sunt colectați în timpul procesului sacrificării, lucrătorii ar putea fi expuși la sânge sau la alte substanțe biologice, inclusiv bacterii și alte microorganisme. Din acest motiv este important să se asigure reducerea la minim a riscului de contaminare [de exemplu, prin păstrarea în gheață a recipientului care conține ochii, prin adăugarea de antibiotice la HBSS utilizat pentru a păstra ochii în timpul transportului (de exemplu, penicilină în concentrație de 100 UI/ml și streptomicină, 100 μg/ml)].
17. Perioada de timp dintre colectarea ochilor și utilizarea corneelor în analiza BCOP trebuie să fie redusă (în mod normal colectate și utilizate în aceeași zi) și trebuie să se demonstreze că nu compromite rezultatele testării. Aceste rezultate au la bază criteriile de selecție a ochilor, precum și răspunsurile de control pozitive și negative. Toți ochii utilizați pentru testare trebuie să aparțină aceluiași grup de ochi și să fie colectați în aceeași zi.
Criterii de selecție pentru ochii utilizați în metoda BCOP
18. În momentul în care ajung la laborator, ochii sunt examinați cu atenție pentru depistarea defectelor, inclusiv a opacității, zgârieturilor și neovascularizării. Numai corneele care provin de la ochi lipsiți de asemenea defecte urmează să fie utilizați.
19. De asemenea, calitatea fiecărei cornee este evaluată în ultimele etape ale analizei. Corneele care au o opacitate mai mare de șapte unități de opacitate (NOTĂ: opacimetrul trebuie calibrat cu standarde care sunt utilizate pentru stabilirea unităților de opacitate, a se vedea apendicele 3) după o perioadă de echilibrare inițială de o oră, urmează să fie îndepărtate.
20. Fiecare grup de tratament (substanță de test, martori pozitivi și negativi testați în paralel) este reprezentat de minim trei ochi. În analiza BCOP trebuie utilizate trei cornee în calitate de cornee martor negativ. Deoarece toate corneele sunt excizate din globul integral și montate în camerele corneene, există posibilitatea producerii de artefacte din cauza manipulării în ceea ce privește valorile opacității corneene individuale și ale permeabilității (inclusiv martorul negativ). În plus, valorile opacității și permeabilității pentru corneele martor negative sunt utilizate pentru a corecta în calculele IVIS valorile permeabilității și opacității corneene ale articolului de test și cele ale martorului pozitiv tratat.
PROCEDURĂ
Pregătirea ochilor
21. Corneele fără defecte sunt disecate cu menținerea unei margini de 2 până la 3 mm de sclerotică pentru a ajuta la manipularea ulterioară, luându-se precauții pentru a preveni lezarea epiteliului și a endoteliului corneei. Corneele izolate sunt montate în suporturi corneene special proiectate care constau din compartimente anterioare și posterioare, care sunt strâns legate de partea epitelială și, respectiv, de partea endotelială a corneei. Ambele camere sunt umplute cu un exces de mediu Eagle esențial minimal (Eagle's Minimum Essential Medium - EMEM) preîncălzit (mai întâi camera posterioară), asigurându-se că nu se formează bule. Dispozitivul este apoi echilibrat la 32 ± 1°C timp de cel puțin o oră, pentru a permite corneelor să se echilibreze cu mediul și, în măsura în care este posibil, să desfășoare o activitate metabolică normală (temperatura aproximativă a suprafeței corneene in vivo este de 32 °C).
22. După perioada de echilibrare, în ambele camere se adaugă EMEM proaspăt preîncălzit și sunt efectuate citirile nivelului de bază pentru opacitatea fiecărei cornee. Toate corneele care prezintă leziuni tisulare macroscopice (de exemplu, zgârieturi, pigmentare, neovascularizare) sau o opacitate > 7 unități de opacitate sunt îndepărtate. Se calculează opacitatea medie a tuturor corneelor echilibrate. Cel puțin trei cornee cu valori ale opacității apropiate de valoarea medie a tuturor corneelor sunt selectate drept cornee martor negativ (sau solvent). Corneele rămase sunt distribuite apoi în grupuri de tratament și grupuri martor pozitiv.
23. Deoarece căldura specifică a apei este mai mare decât cea a aerului, cea dintâi asigură condiții de temperatură pentru incubare mai stabile. Prin urmare, se recomandă utilizarea unei băi de apă pentru menținerea suportului cornean și a conținutului acestuia la temperatura de 32 ± 1°C. Totuși, se pot utiliza de asemenea incubatoarele cu aer, dacă se iau precauții pentru menținerea stabilității temperaturii (de exemplu, prin preîncălzirea suporturilor și a mediilor).
Aplicarea substanței de test
24. Se utilizează două protocoale de tratament diferite, unul pentru substanțe lichide și agenți tensioactivi (solide sau lichide) și altul pentru substanțe solide lipsite de activitate de suprafață.
25. Substanțele lichide sunt testate în stare nediluată, iar agenții tensioactivi sunt testați la o concentrație de 10 % procente masice pe unitate de volum într-o soluție de clorură de sodiu, în apă distilată sau într-un alt solvent cu privire la care există dovezi că este lipsit de efecte adverse asupra sistemului testat. În mod normal, substanțele semisolide, cremele și cerurile sunt testate în același mod ca și substanțele lichide. Trebuie oferită o justificare adecvată pentru concentrații de diluare alternative. Corneele sunt expuse la substanțe lichide și agenți tensioactivi timp de 10 minute. Utilizarea altor durate de expunere trebuie însoțită de o justificare științifică adecvată.
26. În mod normal, substanțele solide lipsite de activitate de suprafață sunt testate sub formă de soluții sau suspensii cu o concentrație de 20 % într-o soluție de 0,9 % clorură de sodiu, în apă distilată sau într-un alt solvent pentru care există dovezi că este lipsit de efecte adverse asupra sistemului testat. În anumite circumstanțe și cu o justificare științifică adecvată, și substanțele solide pot fi testate în stare pură prin aplicarea directă pe suprafața corneană prin utilizarea metodei camerei deschise (a se vedea paragraful 29). Corneele sunt expuse substanțelor solide timp de patru ore, dar, la fel ca în cazul lichidelor sau al agenților tensioactivi, pot fi utilizate durate de expunere alternative cu o argumentare științifică corespunzătoare.
27. În funcție de natura fizică și caracteristicile chimice (de exemplu, substanțe solide, lichide, vâscoase, comparativ cu lichide nevâscoase) ale substanței de test, se pot utiliza diferite metode de tratament. Factorul critic asigură faptul că substanța de test acoperă în mod adecvat suprafața epitelială și că este îndepărtată în mod corespunzător în timpul etapelor de spălare. În mod normal, pentru substanțele de test lichide nevâscoase sau ușor vâscoase, se utilizează o metodă cu camera închisă, iar pentru substanțele lichide semivâscoase și vâscoase, precum și pentru substanțele solide pure, se utilizează o metodă cu camera deschisă.
28. În cazul metodei cu camera închisă, prin orificiile de dozare de pe suprafața superioară a camerei se introduce în camera anterioară suficientă substanță de test (750 μl) pentru a acoperi porțiunea epitelială a corneei, iar orificiile sunt ulterior sigilate cu ajutorul dopurilor camerei în timpul expunerii. Este important să se asigure expunerea fiecărei cornee la o substanță de test pentru perioada de timp adecvată.
29. În cazul metodei cu camera deschisă, inelul de fixare a ferestrei și fereastra de sticlă din camera anterioară sunt îndepărtate înainte de tratament. Substanța martor sau substanța de test (750 μl, sau substanță de test în cantitate suficientă pentru a acoperi complet corneea) sunt aplicate direct pe suprafața epitelială a corneei cu ajutorul unei micropipete. Dacă o substanță de test este dificil de pipetat, substanța de test poate fi încărcată sub presiune într-o pipetă care funcționează pe principiul dezlocuirii pozitive pentru a ajuta dozarea. Vârful unei astfel de pipete este introdus în vârful de distribuire al seringii astfel încât materialul să poată fi încărcat sub presiune în vârful de dezlocuire. Pistonul seringii este apăsat în timp ce pistonul pipetei este tras în sus. Dacă la nivelul vârfului pipetei apar bule de aer, articolul de test este îndepărtat (expulzat) și procedeul se repetă până când vârful se umple fără a exista bule de aer. Dacă este necesar, se poate utiliza o seringă normală (fără ac) deoarece permite măsurarea unui volum precis de substanță de test și o aplicare mai ușoară la nivelul suprafeței epiteliale a corneei. După dozare, fereastra de sticlă este înlocuită la nivelul camerei anterioare pentru a recrea un sistem închis.
Incubarea post-expunere
30. După perioada de expunere, se îndepărtează din camera anterioară substanța de test, martorul negativ sau martorul pozitiv, iar epiteliul este spălat de cel puțin trei ori (sau până când nu se mai constată vizual prezența substanței de test) cu EMEM (care conține roșu fenol). Pentru spălare se utilizează un mediu care conține roșu fenol deoarece schimbarea de culoare a acestui indicator poate fi monitorizată pentru determinarea eficienței spălării materialelor acide sau alcaline. Corneele sunt spălate de mai mult de trei ori dacă roșul fenol este în continuare decolorat (galben sau purpuriu) sau dacă substanța de test este în continuare vizibilă. După ce mediul nu mai conține substanță de test, corneele sunt spălate pentru ultima dată cu EMEM (fără roșu fenol). EMEM (fără roșu fenol) se utilizează pentru spălarea finală pentru a se asigura îndepărtarea substanței roșu fenol din camera anterioară înainte de măsurarea opacității. Camera anterioară se reumple apoi cu EMEM fără roșu fenol.
31. În cazul lichidelor sau al agenților tensioactivi, după spălare, corneele sunt incubate pentru o perioadă suplimentară de două ore la 32 ± 1 °C. Un interval post-expunere mai lung poate fi util în anumite circumstanțe și necesitatea acestuia va fi examinată de la caz la caz. Corneele tratate cu substanțe solide sunt spălate amănunțit după o perioadă de expunere de patru ore, fără a fi necesară o incubare suplimentară.
32. Opacitatea și permeabilitatea fiecărei cornee se înregistrează la sfârșitul perioadei de incubare post-expunere, în cazul substanțelor lichide și al agenților tensioactivi, și la sfârșitul unei perioade de expunere de patru ore în cazul substanțelor solide lipsite de activitate de suprafață. În plus, fiecare cornee se examinează vizual, înregistrându-se observațiile pertinente (de exemplu, exfolierea țesuturilor, reziduuri de substanță de test, tipare de opacifiere neuniformă). Observațiile respective pot fi importante deoarece se pot reflecta în variații ale citirilor opacimetrului.
Substanțe de control
33. În fiecare experiment sunt incluși martori negativi sau grupuri martor solvenți/eluenți și martori pozitivi testați în paralel.
34. Atunci când se testează o substanță lichidă cu puritate de 100 %, în metoda de testare BCOP se include un martor negativ testat în paralel (de exemplu, soluție de clorură de sodiu 0,9 % sau apă distilată), pentru a putea detecta modificările nespecifice din sistemul testat și pentru a furniza un nivel de bază pentru punctele finale ale analizei. În plus, această metodă garantează faptul că nu va apărea o reacție de iritare din cauza condițiilor de analiză neadecvate.
35. Atunci când se testează o substanță lichidă diluată, un agent tensioactiv, sau o substanță solidă, în metoda de testare BCOP se include un grup martor solvent/eluent pentru a putea detecta modificările nespecifice din sistemul testat și pentru a furniza un nivel de bază pentru punctele finale ale analizei. Se poate utiliza numai un solvent/eluent în legătură cu care există dovezi că nu are efecte adverse asupra sistemului testat.
36. În fiecare experiment se introduce un martor pozitiv constând într-un iritant ocular, pentru a se verifica dacă se produce un răspuns sever. Deoarece analiza BCOP este utilizată în această metodă de testare pentru a identifica substanțele care au un caracter coroziv sau un potențial iritant sever, în mod ideal martorul pozitiv ar trebui să fie o substanță de referință care induce o reacție severă. Totuși, pentru a garanta faptul că există posibilitatea evaluării variabilității în timp a reacției la martorul pozitiv, amploarea reacției iritante nu trebuie să fie excesiv de mare.
37. Dimetilformamida sau soluția 1 % de hidroxid de sodiu sunt exemple de martori pozitivi pentru substanțele de test lichide. Soluția de imidazol 20 % (procente masice pe unitate de volum) într-o soluție de clorură de sodiu 0,9 % reprezintă un exemplu de martor pozitiv pentru substanțele de test solide.
38. Substanțele etalon sunt utile pentru evaluarea potențialului iritant la nivel ocular al substanțelor chimice necunoscute din cadrul unei clase de substanțe sau de produse, sau pentru evaluarea potențialului iritant relativ al unei substanțe iritante la nivel ocular într-un interval specific de reacții iritante.
Caracteristici măsurate
39. Opacitatea se determină prin măsurarea luminii transmise prin cornee. Opacitatea corneană este măsurată cantitativ cu ajutorul unui opacimetru, conducând la valori ale opacității măsurate pe o scară continuă.
40. Permeabilitatea este determinată prin măsurarea cantitativă a fluoresceinei sodice care străbate toate straturile celulare corneene (de exemplu, epiteliul de pe suprafața exterioară a corneei prin endoteliul de pe suprafața interioară a corneei). Un ml de soluție de fluoresceină sodică (4 sau 5 mg/ml atunci când se testează substanțe lichide și agenți tensioactivi sau, respectiv, substanțe solide lipsite de activitate de suprafață) se adaugă în camera anterioară a suportului cornean, care se leagă strâns cu porțiunea epitelială a corneei, iar camera posterioară, care se leagă strâns cu porțiunea endotelială a corneei, este umplută cu EMEM proaspăt. Suportul este apoi incubat în poziție orizontală timp de 90 ± 5 min la 32 ± 1 °C. Cantitatea de fluoresceină sodică care pătrunde în camera posterioară este măsurată cantitativ cu ajutorul unui spectrofotometru UV/VIS. Măsurătorile spectrofotometrice efectuate la 490 nm sunt înregistrate sub formă de valori ale densității optice (DO490) sau ale absorbanței, care sunt măsurate pe o scară continuă. Valorile permeabilității fluoresceinei sunt determinate prin utilizarea valorilor DO490 înregistrate de un spectrofotometru în lumină vizibilă care folosește valoarea standard de 1 cm a lungimii traiectoriei.
41. Ca o variantă alternativă, se poate utiliza un cititor de plăci cu 96 de godeuri cu microtitrare cu condiția: (i) să se poată stabili domeniul linear al cititorului de plăci pentru determinarea valorilor DO490 a fluoresceinei; și (ii) să se utilizeze volumul corect de mostre de fluoresceină în placa cu 96 de godeuri pentru a se obține valori ale DO490 echivalente cu valoarea standard de 1 cm a lungimii traiectoriei [acest aspect ar putea necesita un godeu umplut complet (în mod obișnuit 360 μl)].
DATE ȘI RAPORTARE
Evaluarea datelor
42. După corectarea valorilor opacității și ale permeabilității medii (DO490) pentru valorile opacității de fundal și a permeabilității martorului negativ DO490, valorile medii ale opacității și ale permeabilității DO490 pentru fiecare grup de tratament trebuie combinate într-o formulă dedusă în mod empiric pentru a calcula un scor de evaluare a efectelor iritante in vitro (in vitro irritancy score - IVIS) pentru fiecare grup de tratament după cum urmează:
IVIS = valoarea opacității medii + (15 × valoarea permeabilității medii DO490)
Sina et al. (16) au raportat că această formulă a fost dedusă în urma unor studii interne și a studiilor realizate prin colaborarea mai multor laboratoare. Datele generate pentru o serie de 36 de compuși într-un studiu inter-laboratoare au fost supuse unei analize multivariante pentru a determina ecuația cea mai potrivită pentru datele in vivo și cele in vitro. Analiza a fost efectuată de cercetători de la două companii diferite, care au obținut ecuații aproape identice.
43. Valorile opacității și permeabilității trebuie de asemenea evaluate independent pentru a determina, prin utilizarea doar a uneia dintre cele două caracteristici (a se vedea criteriile de decizie), dacă o substanță de test a provocat coroziunea sau iritarea severă.
Criterii de decizie
44. O substanță care provoacă o valoare a IVIS ≥ 55,1 este definită ca fiind corozivă sau având un potențial iritant sever. Astfel cum s-a arătat la punctul 1, dacă substanța de test nu este identificată drept substanță cu caracter coroziv sau cu potențial iritant sever la nivel ocular, trebuie efectuate testări suplimentare în scopul clasificării și etichetării. Prin comparație cu datele metodei de testare in vivo pe ochi de iepure, clasate în conformitate cu sistemele de clasificare EPA (1), UE (2) sau GHS (3), metoda de testare BCOP are o precizie totală cuprinsă între 79 % (113/143) și 81 % (119/147), o rată de rezultate fals pozitive cuprinsă între 19 % (20/103) și 21 % (22/103), și o rată de rezultate fals negative cuprinsă între 16 % (7/43) și 25 % (10/40). Atunci când din baza de date sunt excluse substanțe din anumite clase chimice (de exemplu, alcooli, cetone) sau fizice (de exemplu, substanțe solide), precizia metodei BCOP raportată la sistemele de clasificare UE, EPA și GHS este cuprinsă între 87 % (72/83) și 92 % (78/85), rata de rezultate fals pozitive este cuprinsă între 12 % (7/58) și 16 % (9/56), iar rata de rezultate fals negative între 0 % (0/27) și 12 % (3/26).
45. Chiar dacă pentru o substanță de test nu se obține încadrarea în clasa substanțelor având caracter coroziv sau potențial iritant sever, datele BCOP pot fi utile coroborate cu datele de testare obținute prin testul in vivo pe ochi de iepure sau printr-o testare in vitro validată în mod corespunzător, pentru a evalua în continuare utilitatea și limitele de aplicare ale metodei de testare BCOP în ceea ce privește identificarea substanțelor având un potențial iritant redus și a celor neiritante (sunt în curs de elaborare linii directoare privind utilizarea metodelor de testare in vitro a toxicității oculare).
Criterii de acceptare a studiului
46. Un test este considerat acceptabil dacă pentru martorul pozitiv se obține o valoare a IVIS cuprinsă în intervalul reprezentat de două deviații standard ale mediei istorice actuale, care trebuie actualizată la fiecare trei luni, sau de fiecare dată când un test care poate fi acceptat este efectuat în laboratoare în care testele sunt realizate rar (adică mai puțin de o dată pe lună). Reacțiile negative sau cele ale grupului martor solvent/eluent trebuie să conducă la valori ale opacității și permeabilității care sunt mai mici decât limitele superioare stabilite ale valorilor opacității și permeabilității fundalului pentru corneele de bovine tratate cu martorii negativi sau cu grupurile martor solvent/eluent respective.
Raport de testare
47. Raportul de testare trebuie să conțină următoarele informații, dacă acestea prezintă relevanță pentru desfășurarea studiului:
Substanțe testate și de control
Denumire (denumiri) chimică (chimice), precum denumirea structurală utilizată de Chemical Abstracts Service (CAS), urmată de alte denumiri, dacă se cunosc;
Numărul de înregistrare (Registry Number -RN) CAS, dacă se cunoaște;
Puritatea și compoziția substanței sau a amestecului [în procent(e) de greutate], în măsura în care informația respectivă este disponibilă;
Proprietăți fizico-chimice, precum starea fizică, pH-ul, stabilitatea, hidrosolubilitatea, utile pentru efectuarea studiului;
Tratamentul substanțelor testate/de control înainte de efectuarea testului, după caz (de exemplu, încălzire, măcinare);
Stabilitatea, dacă se cunoaște.
Informații referitoare la sponsor și la instalația de testare
Numele și adresa sponsorului, a instalației de testare și a directorului de studiu;
Identificarea sursei ochilor (și anume întreprinderea unde au fost colectați);
Condițiile de depozitare și transport ale ochilor (de exemplu, data și ora colectării ochilor, perioada de timp până la începerea testării, mediile de transport și condițiile de temperatură, toate antibioticele utilizate);
Dacă sunt disponibile, caracteristicile specifice ale animalelor de la care au fost colectați ochii (de exemplu, vârsta, sexul, greutatea animalului donator).
Justificarea metodei de testare și a protocolului utilizat
Integritatea metodei de testare
Procedura utilizată pentru a asigura integritatea în timp (și anume, precizia și fiabilitatea) a metodei de testare (de exemplu, testarea periodică a substanțelor de verificare, utilizarea datelor istorice de control negative și pozitive).
Criteriile pentru un test acceptabil
Domenii acceptabile pentru martorii pozitivi și negativi testați în paralel pe baza datelor istorice;
După caz, domenii pentru martorii etalon acceptabili testați în paralel pe baza datelor istorice.
Condiții de testare
Descrierea sistemului de testare utilizat;
Tipul de suport cornean utilizat;
Informații privind calibrarea pentru dispozitivele utilizate pentru măsurarea opacității și a permeabilității (de exemplu, opacimetru și spectrofotometru);
Informații privind corneele bovine utilizate, inclusiv specificații privind calitatea acestora;
Detalii privind procedura de testare utilizată,
Concentrația (concentrațiile) substanței de test utilizate;
Descrierea tuturor modificărilor procedurii de testare;
Trimiteri la datele istorice ale modelului (de exemplu, martori negativi și pozitivi, substanțe de verificare, substanțe etalon);
Descrierea criteriilor de evaluare folosite.
Rezultate
Prezentarea sub formă de tabel a rezultatelor obținute cu fiecare mostră de testare [de exemplu, valorile opacității și ale DO490 precum și IVIS calculat pentru substanța de test și martorii pozitivi negativi și etalon (dacă se includ), raportate sub formă de tabel, inclusiv datele de la reproducere repetă experimentele după caz, și mediile ± deviația standard pentru fiecare experiment];
Descrierea altor efecte observate.
Discutarea rezultatelor
Concluzie
REFERINȚE BIBLIOGRAFICE
(1) U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington DC: U.S. Environmental Protection Agency.
(2) Regulamentul (CE) nr. 1272/2008 al Parlamentului European și al Consiliului din 16 decembrie 2008 privind clasificarea, etichetarea și ambalarea substanțelor și a amestecurilor, de modificare și de abrogare a Directivelor 67/548/CEE și 1999/45/CE, precum și de modificare a Regulamentului (CE) nr. 1907/2006. JO L 353, 31.12.2008 p. 1.
(3) UN (2007). Globally Harmonized System of Classification and Labelling of Chemicals - GHS (Sistemul global armonizat de clasificare și etichetare a substanțelor chimice): Second revised edition, New York & Geneva: United Nations Publications, 2007. Disponibil la:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Document disponibil la adresa:
[http://ecvam.jrc.it/index.htm]
(5) ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(6) Regulamentul (CE) nr. 1907/2006 al Parlamentului European și al Consiliului din 18 decembrie 2006 privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH), de înființare a Agenției Europene pentru Produse Chimice, de modificare a Directivei 1999/45/CE și de abrogare a Regulamentului (CEE) nr. 793/93 al Consiliului și a Regulamentului (CE) nr. 1488/94 al Comisiei, precum și a Directivei 76/769/CEE a Consiliului și a Directivelor 91/155/CEE, 93/67/CEE, 93/105/CE și 2000/21/CE ale Comisiei. JO L 396, 30.12.2006, p. 1.
(7) OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Document disponibil la adresa:
[http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(9) ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH Publication No.: 06-4512. Research Triangle Park: National Toxicology Program. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm]
(10) INVITTOX (1999). Protocol 124: Bovine Corneal Opacity and Permeability Assay – SOP of Microbiological Associates Ltd. Ispra, Italy, European Centre for the Validation of Alternative Methods (ECVAM).
(11) Gautheron, P., Dukic, M., Alix, D. and Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449.
(12) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Document disponibil la adresa:
[http://www.cdc.gov/ncidod/dhqp/pdf].
(13) Maurer, J.K., Parker, R.D. and Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(14) Doughty, M.J., Petrou, S. and Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165.
(15) Collee, J. and Bradley, R. (1997). BSE: A decade on - Part I. The Lancet 349: 636-641.
(16) Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D., and Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam Appl Toxicol 26:20-31.
(17) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
(18) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye (ICE) Test Method. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
Apendicele 1
DEFINIȚII
Precizie : Gradul de apropiere dintre rezultatele metodei de testare și valorile de referință acceptate. Aceasta constituie una dintre caracteristicile de performanță ale metodei de testare și unul dintre aspectele relevanței acesteia. Termenul este adesea utilizat în paralel cu termenul sinonim „concordanță”, pentru a desemna proporția de rezultate corecte ale unei metode de testare.
Substanță etalon : O substanță utilizată în calitate de standard pentru comparația cu o substanță de test. O substanță etalon ar trebui să aibă următoarele proprietăți: (i) sursă (surse) compatibilă (compatibile) și sigure; (ii) asemănări structurale și funcționale cu clasa de substanțe care este testată; (iii) caracteristici fizico-chimice cunoscute; (iv) date de susținere privind efecte cunoscute și (v) influență cunoscută în intervalul de răspuns dorit.
Cornee : Regiunea transparentă a părții anterioare a globului ocular care acoperă irisul și pupila și care permite luminii să pătrundă în interior.
Opacitate corneană : Măsurarea gradului de opacitate a corneei după expunerea la o substanță de test. Opacitatea corneană crescută este un indicator al unei leziuni a corneei. Opacitatea poate fi evaluată în mod subiectiv, astfel cum se procedează în cazul testului Draize pe ochi de iepure, sau în mod obiectiv, cu ajutorul unui instrument cum este „opacimetrul”.
Permeabilitatea corneană : Măsurarea cantitativă a lezării epiteliului cornean printr-o determinare a cantității de colorant fluoresceină sodică care străbate toate straturile celulare ale corneei.
Categoria EPA 1 : Caracter coroziv (distrugerea ireversibilă a țesutului ocular) sau afectare a corneei sau iritație care persistă mai mult de 21 de zile (1).
Categoria UE R41 : Producerea de leziuni tisulare la ochi sau deteriorarea fizică gravă a vederii, în urma aplicării unei substanțe de test pe suprafața anterioară a ochiului, care nu sunt complet reversibile într-un interval de 21 de zile de la aplicare (2).
Rată de rezultate fals negative : Proporția tuturor substanțelor pozitive identificate în mod fals de o metodă de testare ca fiind negative. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Rată de rezultate fals pozitive : Proporția tuturor substanțelor negative identificate în mod fals de o metodă de testare ca fiind pozitive. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
GHS (Globally Harmonized System of Classification and Labelling of Chemicals - Sistemul global armonizat de clasificare și etichetare a substanțelor chimice) : Un sistem care propune clasificarea substanțelor chimice (substanțe și amestecuri) în funcție de tipuri și niveluri standardizate de riscuri fizice, riscuri pentru sănătate și riscuri pentru mediu, și care elaborează elemente de comunicare corespunzătoare, de exemplu pictograme, cuvinte de avertizare, fraze de pericol, fraze de securitate și fișe tehnice de siguranță, pentru a transmite informații privind efectele adverse ale acestora, în scopul protejării populației (inclusiv a angajatorilor, a lucrătorilor, a transportatorilor, a consumatorilor și a serviciilor de urgență) și a mediului (3).
Categoria HS 1 : Producerea de leziuni tisulare la ochi sau deteriorarea fizică gravă a vederii, în urma aplicării unei substanțe de test pe suprafața anterioară a ochiului, care nu sunt complet reversibile într-un interval de 21 de zile de la aplicare (3).
Risc : Proprietate intrinsecă a unui agent sau a unei situații care are potențialul de a produce efecte adverse atunci când un organism, sistem sau (sub)populație este expusă la agentul respectiv.
Scor de evaluare a efectelor iritante in vitro (IVIS) : O formulă dedusă în mod empiric utilizată în analiza BCOP în care valorile opacității medii și cele ale permeabilității medii pentru fiecare grup de tratament sunt combinate într-un scor in vitro unic pentru fiecare grup de tratament. IVIS = valoarea opacității medii + (15 x valoarea permeabilității medii).
Martor negativ : O probă replică netratată care conține toate componentele sistemului testat. Această probă este analizată împreună cu probele tratate cu substanță de test și cu alte probe martor pentru a determina dacă solventul interacționează cu sistemul testat.
Substanță neiritantă : Substanțe care nu sunt încadrate în categoriile EPA I, II, sau III, în categoriile UE R41 sau R36; sau categoria GHS 1, 2A, sau 2B de iritanți oculari.
Substanță având un caracter coroziv la nivel ocular : (a) Substanță care provoacă leziuni tisulare ireversibile la nivelul ochiului; (b) Substanțe care sunt încadrate în categoria GHS 1, categoria EPA I sau categoria UE R41 de iritanți oculari (1) (2) (3).
Iritant ocular : (a) Substanță care produce o modificare reversibilă la nivelul ochiului după aplicarea pe suprafața anterioară a ochiului; (b) Substanțe care sunt încadrate în categoria EPA II sau III, categoria UE R36, sau categoria GHS 2A sau 2B de iritanți oculari (1) (2) (3).
Substanță cu potențial iritant sever : (a) O substanță care provoacă lezarea tisulară la nivelul ochiului după aplicarea pe suprafața anterioară a ochiului, care nu se vindecă în 21 de zile de la aplicare sau care provoacă o slăbire fizică severă a vederii; (b) Substanțe care sunt încadrate în categoria GHS 1, categoria EPA I sau categoria UE R41 de iritanți oculari (1) (2) (3).
Opacimetru : Instrument utilizat pentru a măsura „opacitatea corneană” prin evaluarea cantitativă a transmisiei luminii prin cornee. Instrumentul tipic are două compartimente, fiecare dintre acestea fiind dotat cu propria sursă de lumină și propria celulă fotoelectrică. Unul dintre compartimente este utilizat pentru corneea tratată, iar cel de-al doilea servește pentru a calibra și a regla punctul de zero al instrumentului. Lumina care provine de la o lampă cu halogen este trimisă printr-un compartiment de control (o cameră goală fără ferestre sau lichid) la o celulă fotoelectrică și comparată cu lumina trimisă prin compartimentul experimental, care adăpostește camera care conține corneea, către o celulă fotoelectrică. Diferențele între lumina transmisă către celulele fotoelectrice se compară și se afișează valoarea numerică a opacității pe un ecran digital.
Controlul pozitiv : O probă replică conținând toate componentele sistemului testat și care a fost tratată cu o substanță cunoscută pentru faptul că provoacă o reacție pozitivă. Pentru a asigura posibilitatea evaluării variabilității în timp a reacției martorului pozitiv, amplitudinea reacției severe nu trebuie să fie excesiv de mare.
Fiabilitate : Măsura în care o metodă de testare poate fi reprodusă în timp, în același laborator sau în laboratoare diferite, folosind același protocol. Aceasta se evaluează prin calcularea reproductibilității în același laborator sau inter-laboratoare.
Martor solvent/eluent : O probă netratată care conține toate componentele sistemului testat, inclusiv solventul sau eluentul, care este analizată împreună cu probele tratate cu substanță de test și cu alte probe martor pentru a stabili nivelul de bază al reacției pentru probele tratate cu substanța de test dizolvată în același solvent sau eluent. În plus, atunci când este testată în paralel cu un martor negativ, această probă indică dacă solventul sau eluentul interacționează cu sistemul testat.
Testare secvențială : O strategie de testare în trepte în cadrul căreia sunt revizuite toate informațiile existente privind o substanță de test, într-o anumită ordine, utilizând un proces de evaluare a forței probante în fiecare etapă pentru a determina dacă sunt disponibile suficiente informații pentru o decizie privind clasificarea riscului, înainte de a trece la etapa următoare. Dacă potențialul iritant al unei substanțe de test poate fi apreciat pe baza informațiilor existente, nu este necesară o testare suplimentară. Dacă potențialul iritant al unei substanțe de test nu poate fi apreciat pe baza informațiilor existente, se execută o procedură de testare secvențială pe animale până în momentul în care se poate face o clasificare lipsită de echivoc.
Metodă de testare validată : Metodă de testare în legătură cu care studiile de validare au fost încheiate în scopul determinării relevanței (inclusiv precizia) și a fiabilității pentru un anumit scop. Este important de semnalat că este posibil ca performanțele unei metode de testare validate să nu fie suficiente din punct de vedere al preciziei și fiabilității încât aceasta să fie considerată acceptabilă pentru scopul propus.
Forța probantă : Procesul prin care se iau în considerare punctele tari și punctele slabe ale unor informații diverse pentru a ajunge la o concluzie în ceea ce privește riscul potențial al unei substanțe și a susține concluzia respectivă.
Apendicele 2
Substanțe de verificare pentru metoda de testare BCOP
Înainte de utilizarea sistematică a unei metode de testare conforme cu prezenta metodă de testare, este posibil ca laboratoarele să dorească să demonstreze performanțele tehnice proprii, prin identificarea corectă a clasificării caracterului coroziv pentru cele 10 substanțe recomandate în tabelul 1. Substanțele au fost selectate pentru a reprezenta domeniul de reacții pentru iritația/coroziunea locală la nivelul ochilor, care se bazează pe rezultatele testului in vivo pe ochi de iepure (TG 405), și anume, categoriile 1, 2A, 2B, sau neclasificat și etichetat în conformitate cu GHS al Națiunilor Unite) (3) (7). Totuși, ținând cont de utilitatea validată a acestor analize (și anume, în scopul de a identifica numai substanțele care au caracter coroziv/potențial iritant sever la nivel ocular), există numai două rezultate ale testelor destinate clasificării (coroziv/iritant sever sau necoroziv/fără potențial iritant sever) pentru a demonstra performanțele. Alte criterii de selecție au fost ca substanțele să fie disponibile comercial, să fie disponibile informații de referință in vivo de calitate superioară și să existe date de calitate furnizate de două metode in vitro pentru indicațiile orientative de testare care se elaborează. Din acest motiv, substanțele iritante au fost selectate din lista recomandată ICCVAM care cuprinde 122 substanțe de referință pentru validarea metodelor de testare in vitro a toxicității oculare (a se vedea Apendicele H: Substanțe de referință recomandate ICCVAM) (5). Informațiile de referință sunt disponibile în documentele ICCVAM de trecere în revistă a cadrului general pentru metodele de testare a BCOP și a ochiului izolat de pui (Isolated Chicken Eye - ICE) (17) (18).
Tabelul 1
Substanțe recomandate pentru a demonstra performanțele tehnice prin metoda BCOP
|
Substanță |
CAS RN |
Clasă chimică (1) |
Formă fizică: |
Clasificare in vivo (2) |
Clasificare in vitro (3) |
|
Clorură de benzalconiu (5 %) |
8001-54-5 |
Compus de tip onium |
Lichid |
Categoria 1 |
Coroziv/Iritant sever |
|
Clorhexidină |
55-56-1 |
Amină, amidină |
Solid |
Categoria 1 |
Coroziv/Iritant sever |
|
Acid dibenzoil-L-tartric |
2743-38-6 |
Acid carboxilic, ester |
Solid |
Categoria 1 |
Coroziv/Iritant sever |
|
Imidazol |
288-32-4 |
Heterociclu |
Solid |
Categoria 1 |
Coroziv/Iritant sever |
|
Acid tricloracetic (30 %) |
76-03-9 |
Acid carboxilic |
Lichid |
Categoria 1 |
Coroziv/Iritant sever |
|
Clorură de 2,6-diclorbenzoil |
4659-45-4 |
Halogenură de acil |
Lichid |
Categoria 2A |
Necoroziv/Fără potențial iritant sever |
|
Etil-2-metil-acetoacetat |
609-14-3 |
Cetonă, ester |
Lichid |
Categoria 2B |
Necoroziv/Fără potențial iritant sever |
|
Azotat de amoniu |
6484-52-2 |
Sare anorganică |
Solid |
Categoria 2A |
Necoroziv/Fără potențial iritant sever |
|
Glicerol |
56-81-5 |
Alcool |
Lichid |
Neetichetat |
Necoroziv/Fără potențial iritant sever |
|
n-Hexan |
110-54-3 |
Hidrocarbură (aciclică) |
Lichid |
Neetichetat |
Necoroziv/Fără potențial iritant sever |
|
(1) Clasele chimice sunt desemnate pentru fiecare substanță de test prin utilizarea unei scheme de clasificare standard, pe baza sistemului de clasificare al National Library of Medicine Medical Subject Headings (MeSH) (disponibil la http//www.nlm.nih.gov/mesh). (2) Pe baza rezultatelor furnizate de testul in vivo pe ochi de iepure (OCDE TG 405) și prin utilizarea GHS a Națiunilor Unite (3)(7). (3) Pe baza rezultatelor obținute prin analizele BCOP și ICE. Prescurtări: Nr. CASRN = Număr de înregistrare al Chemical Abstracts Service. |
|||||
Apendicele 3
SUPORT CORNEAN BCOP
1. Suporturile corneene BCOP sunt confecționate dintr-un material inert (de exemplu, polipropilenă). Suporturile sunt formate din două jumătăți (o cameră anterioară și una posterioară) și au două camere cilindrice interne similare. Fiecare cameră are un volum de 5 ml și conține la capăt un geam din sticlă, prin care se observă și se înregistrează opacitatea. Camerele interne au un diametru de 1,7 cm și o adâncime de 2,2 cm ( 23 ). Eventualele scurgeri sunt prevenite cu ajutorul unei garnituri amplasate în camera posterioară. Corneele se plasează cu partea endotelială pe garnitura camerei posterioare, iar camerele interioare se plasează pe partea epitelială a corneelor. Camerele sunt fixate cu trei șuruburi din oțel inoxidabil aflate pe muchiile exterioare ale camerei. La capătul fiecărei camere se află un geam de sticlă amovibil, care permite accesul facil la cornee. De asemenea, se plasează o garnitură între geamul de sticlă și cameră pentru prevenirea scurgerilor. Două orificii situate în partea superioară a fiecăreia din cele două camere permit introducerea și îndepărtarea mediului și compușilor de testare. Aceste orificii sunt închise cu capace de cauciuc pe perioadele de tratament și de incubație.

Glosar
Glass disc : Disc de sticlă
PTFE-O-ring : Garnitură PTFE
Refill : Orificiu de umplere
Hanger : Cârlig
Cap : Capac
Nut : Șaibă
O-ring : Garnitură
Posterior compartment : Compartimentul posterior
Anterior compartment : Compartimentul anterior
Fixing screws : Șuruburi de fixare
OPACIMETRUL
2. Opacimetrul este un dispozitiv de măsurare a transmisiei luminii. Lumina care provine de la o lampă cu halogen este trimisă printr-un compartiment de control (o cameră goală fără ferestre sau lichid) la o celulă fotoelectrică și comparată cu lumina trimisă prin compartimentul experimental, care adăpostește camera care conține corneea, către o celulă fotoelectrică. Diferențele între lumina transmisă către celulele fotoelectrice se compară și se afișează valoarea numerică a opacității pe un ecran digital. Se stabilesc unitățile de opacitate.
3. Opacimetrul trebuie să asigure un răspuns linear, aflat într-un interval de valori ale opacității corespunzătoare limitelor utilizate pentru diferitele clasificări prevăzute în modelul de predicție (de exemplu, până la limitele care provoacă coroziune/iritație severă). Pentru obținerea unor valori lineare și precise de până la 75-80 unități de opacitate, este necesară calibrarea opacimetrului cu ajutorul unor dispozitive etalon. Se introduc dispozitive etalon (foi opace de poliester) în camera de calibrare (o cameră corneană proiectată să conțină dispozitivele de calibrare) și se citesc valorile indicate de opacimetru. Camera de calibrare este proiectată astfel încât dispozitivele etalon sunt plasate la aproximativ aceeași distanță între sursa de lumină și celula fotoelectrică la care vor fi plasate corneele pe durata măsurării opacității. Mai întâi, opacimetrul este calibrat la 0 unități de opacitate, când în camera de calibrare nu este introdus niciun dispozitiv etalon. După aceasta, se plasează pe rând trei dispozitive etalon diferite în camera de calibrare și se măsoară opacitatea în fiecare caz. Dispozitivele etalon nr. 1, 2 și 3 trebuie să conducă la valori ale opacității egale cu valorile predeterminate de 75, 150 și, respectiv, 225 unități de opacitate, cu o variație de ± 5 %.
METODA B 48 DE TESTARE A OCHIULUI IZOLAT DE PUI PENTRU IDENTIFICAREA SUBSTANȚELOR AVÂND UN CARACTER COROZIV ȘI UN POTENȚIAL IRITANT SEVER LA NIVEL OCULAR
INTRODUCERE
1. Metoda de testare a ochiului izolat de pui (ICE) este o metodă de testare in vitro care poate fi utilizată, în anumite cazuri și cu anumite limite, în vederea clasificării unor substanțe și amestecuri ca fiind substanțe care au un caracter coroziv și un potențial iritant sever la nivel ocular (1) (2) (3). În scopul prezentei metode de testare, substanțele cu potențial iritant sever sunt iritanții a căror acțiune provoacă leziuni oculare care persistă la iepure timp de cel puțin 21 de zile după administrare. Chiar dacă nu este considerată adecvată pentru a substitui în întregime testul in vivo pe ochi de iepure, metoda ICE este recomandată pentru a fi inclusă într-o strategie de testare secvențială privind clasificarea și etichetarea reglementară într-un domeniu de aplicabilitate specific (4) (5). Substanțele și amestecurile de testare (6) care se dovedesc pozitive după această evaluare pot fi clasificate ca fiind substanțe care au un caracter coroziv și un potențial iritant sever la nivel ocular, fără a mai fi necesară testarea pe iepuri. O substanță al cărui rezultat este negativ va trebui să fie testată pe iepuri prin intermediul unei strategii de testare secvențiale, astfel cum este descris în orientarea OCDE privind testarea nr. 405 (7) (capitolul B.5 din prezenta anexă).
2. Scopul prezentei metode de testare este de a descrie procedurile utilizate pentru a evalua caracterul coroziv sau sever iritant al unei substanțe de încercare, măsurat prin capacitatea acesteia de a induce toxicitate într-un ochi enucleat de pui. Efectele toxice asupra corneei sunt măsurate prin (i) o evaluare calitativă a opacității, (ii) o evaluare calitativă a leziunilor epiteliului prin aplicarea de fluoresceină în ochi (retenția fluoresceinei), (iii) o măsurare cantitativă a creșterii grosimii (inflamare), și (iv) o evaluare calitativă a leziunilor morfologice macroscopice a suprafeței. Opacitatea, inflamarea și evaluarea leziunilor corneei după expunerea la o substanță de test se stabilesc în mod individual, apoi rezultatele se combină pentru a se obține un coeficient de iritare oculară.
3. Metoda de testare ICE a mai fost utilizată pentru testarea unor substanțe cu potențial iritant la nivel ocular, care provoacă leziuni care se vindecă în mai puțin de 21 de zile, și a unor substanțe neiritante. Totuși, precizia și fiabilitatea metodei de încercare ICE privind substanțele din aceste categorii nu au fost deocamdată evaluate în mod oficial.
4. Definițiile sunt prevăzute în apendicele 1.
CONSIDERAȚII INIȚIALE ȘI LIMITE DE APLICARE
5. Această metodă de testare are la bază protocolul de testare ICE al Comitetului de coordonare la nivel de agenții privind validarea metodelor alternative (ICCVAM) (8), elaborat în urma unui studiu internațional de validare (4) (5) (9) la care au contribuit Centrul european pentru validarea metodelor alternative, Centrul japonez pentru validarea metodelor alternative și Departamentul TNO pentru calitatea vieții, toxicologie și farmacologie aplicată (Țările de Jos). Protocolul a fost întocmit pe baza informațiilor conținute în protocoalele publicate și în protocolul utilizat în prezent de către TNO (10) (11) (12) (13) (14).
6. Limitele de aplicare cunoscute ale acestei metode se referă la rata de rezultate fals pozitive privind alcoolii și ratele de rezultate fals negative privind substanțele solide și agenții tensioactivi (a se vedea punctul 47) (4). Atunci când substanțele din aceste clase chimice și fizice sunt eliminate din baza de date, precizia ICE în funcție de sistemele de clasificare ale UE, EPA și SGA este substanțial ameliorată (4). Având în vedere scopul acestei evaluări (identificarea doar a corozivilor/iritanților severi la nivel ocular), ratele de rezultate fals negative nu sunt foarte mari, deoarece substanțele de acest tip vor fi testate ulterior pe iepuri sau utilizate în cadrul altor teste in vitro validate corespunzător, în funcție de cerințele de reglementare, cu ajutorul unei strategii de testare secvențială, printr-o abordare având la bază forța probantă a datelor. În plus, baza de date actuală privind validările nu a permis o evaluare adecvată a unor clase chimice sau de produse (de exemplu, amestecurile). Totuși, inspectorii ar putea avea în vedere utilizarea acestei metode pentru testarea tuturor tipurilor de materiale (inclusiv amestecuri), în urma căreia un rezultat pozitiv ar putea fi acceptat ca indicator al unei reacții oculare corozive sau sever iritante. Cu toate acestea, rezultatele pozitive obținute cu ajutorul alcoolilor trebuie interpretate cu prudență, având în vedere riscul de producere a unor prognostice imprecise.
7. Toate procedurile efectuate pe ochi de pui trebuie să respecte regulamentele și normele de manipulare a materialelor de origine umană sau animală, precum țesuturi și lichide tisulare, fără a se limita la acestea. Sunt recomandate măsurile de precauție universale aplicabile în laboratoare (15).
8. O limitare a metodei de testare este aceea că, în ciuda faptului că ia în considerare unele dintre efectele oculare evaluate prin metoda de testare a iritării ochiului de iepure și, într-o anumită măsură, severitatea acestora, nu acordă atenție leziunilor conjunctivale și iridiane. De asemenea, deși reversibilitatea leziunilor corneene nu poate fi evaluată în mod separat prin metoda de testare ICE, s-a propus, pe baza studiilor pe ochi de iepure, evaluarea adâncimii inițiale a leziunii corneei pentru a se face o distincție între efectele ireversibile și cele reversibile (16). În sfârșit, metoda de testare ICE nu permite evaluarea toxicității sistemice potențiale asociate expunerii oculare.
9. Se depun eforturi permanente de continuare a caracterizării utilității și limitelor metodei de testare ICE de identificare a substanțelor iritante de intensitate medie și a celor neiritante (a se vedea și punctul 48). De asemenea, utilizatorii sunt încurajați să furnizeze specimene și/sau informații către organizațiile de validare, în vederea unei evaluări formale a posibilelor utilizări viitoare ale metodei de testare ICE, care pot consta inclusiv în identificarea substanțelor iritante de intensitate medie și a celor neiritante.
10. Toate laboratoarele care utilizează pentru prima dată prezenta metodă trebuie să utilizeze substanțele de verificare menționate în apendicele 2. Un laborator poate utiliza substanțele chimice respective pentru a-și demonstra competența tehnică în ceea ce privește aplicarea metodei de testare ICE înainte de a transmite datele analizei ICE în scopul clasificării reglementare a riscurilor.
PRINCIPIUL TESTULUI
11. Metoda de testare ICE este un model organotipic care permite menținerea pe termen scurt a funcțiilor fiziologice și biochimice normale a corneei de pui in vitro. În prezenta metodă de testare, leziunile provocate de substanța de testare sunt evaluate în funcție de inflamarea corneană, opacitate și retenția fluoresceinei. În timp ce ultimii doi parametri presupun o evaluare calitativă, analiza inflamării corneene asigură o evaluare cantitativă. Fiecare măsurare este transformată într-un scor cantitativ utilizat pentru a se calcula un indice general de iritare sau primește un indice calitativ utilizat pentru a desemna un grad al corozivității oculare și al iritării severe. Oricare dintre aceste două rezultate poate fi utilizat ulterior pentru a prognostica corozivitatea oculară in vivo și potențialul sever de iritare al unei substanțe de testare (a se vedea criteriile de decizie).
Sursa și vârsta ochilor de pui
12. Până în prezent, pentru această evaluare au fost utilizați ochi colectați de la pui sacrificați în abatoare pentru consumul uman, nefiind necesare animale de laborator. Sunt utilizați exclusiv ochi proveniți de la animale considerate adecvate pentru consumul uman.
13. Chiar dacă nu a fost efectuat un studiu controlat de evaluare a vârstei optime a puilor, vârsta și greutatea puilor utilizați până în prezent pentru acest test sunt cele ale puilor de primăvară prelucrați de obicei de un abator (aproximativ 7 săptămâni, 1,5 – 2,5 kg).
Colectarea și transportul ochilor la laborator
14. Capetele se îndepărtează imediat după sedarea puilor (de obicei, prin șoc electric) și incizia la nivelul gâtului pentru scurgerea sângelui. Se recomandă identificarea unei ferme de pui aflate în apropierea laboratorului, astfel încât capetele să fie transferate de la abator către laborator într-un timp suficient de scurt pentru a reduce riscul de deteriorare și/sau contaminare bacteriană. Perioada de timp dintre colectarea capetelor și utilizarea ochilor în metoda de testare ICE trebuie să fie redusă (în mod normal, se încadrează în 2 ore) și trebuie să se demonstreze că nu compromite rezultatele testării. Aceste rezultate au la bază criteriile de selecție a ochilor, precum și răspunsurile de control pozitive și negative. Toți ochii utilizați pentru testare trebuie să aparțină aceluiași grup de ochi și să fie colectați în aceeași zi.
15. Deoarece ochii sunt disecați în laborator, capetele se transportă intacte de la abator, la temperatură ambiantă, în cutii de plastic, și se mențin umede cu prosoape înmuiate în soluție salină izotonică.
Criterii de selecție pentru ochii utilizați în metoda ICE
16. Sunt respinși ochii care, după enucleare, prezintă un nivel de bază ridicat al colorării cu fluoresceină (de exemplu, peste 0,5) sau opacitate corneană (de exemplu, peste 0,5).
17. Fiecare grup de testare și martor pozitiv este format din cel puțin trei ochi. Grupul martor negativ sau proba solvent (dacă se folosește un solvent diferit de soluția salină) constă din cel puțin un ochi.
PROCEDURĂ
Pregătirea ochilor
18. Pleoapele sunt excizate cu atenție, astfel încât să nu se lezeze corneea. Integritatea corneană este evaluată rapid cu ajutorul unei picături de soluție de fluoresceină de sodiu 2 % (procente masice pe unitate de volum) aplicată pe suprafața corneană timp de câteva secunde, care apoi se clătește cu soluție salină izotonică. Ochii tratați cu fluoresceină sunt apoi examinați cu un microscop oftalmologic, urmărindu-se eventualele leziuni ale corneei (cum ar fi valori ale retenției fluoresceinei și opacității corneene de maximum 0,5).
19. Dacă nu prezintă leziuni, ochiul este îndepărtat din orbită cu atenție, astfel încât corneea să nu fie lezată. Globul ocular este scos din orbită prin fixarea membranei nictitante cu ajutorul unui forceps chirurgical, apoi mușchii oculari se taie cu un foarfece îndoit, cu vârf bont. Este important să se evite lezarea corneei (leziuni de compresie) ca urmare a unei presări excesive.
20. Atunci când ochiul este îndepărtat din orbită, se păstrează atașată o porțiune vizibilă a nervului optic. După îndepărtarea din orbită, ochiul este plasat pe o suprafața absorbantă, iar membrana nictitantă și alte țesuturi conjunctive sunt eliminate.
21. Ochiul enucleat este prins cu o clemă din oțel inoxidabil, cu corneea poziționată vertical. Clema este introdusă apoi într-o cameră a aparatului de suprafuziune (16). Clemele sunt apoi introduse în aparatul de suprafuziune astfel încât corneea să fie irigată cu soluție izotonică. Temperatura camerelor aparatului de superfuziune trebuie menținută la 32 ± 1,5 °C. În apendicele 3 se prezintă o diagramă a aparatului tipic de suprafuziune și a clemelor pentru ochi, care pot achiziționate din comerț sau confecționate. Aparatul poate fi modificat pentru a respecta cerințele din anumite laboratoare (de exemplu, pentru un număr de ochi diferit).
22. După ce au fost introduși în aparatul de suprafuziune, ochii sunt examinați din nou cu un microscop oftalmologic pentru eventuale leziuni apărute în timpul procedurii de disecție. În acest moment, se măsoară grosimea corneei în vârful său, cu ajutorul dispozitivului de măsurare a adâncimii atașat microscopului oftalmologic. Ochii care prezintă: (i) un coeficient al retenției de fluoresceină de peste 0,5; (ii) opacitate corneană de peste 0,5; sau (iii) orice semne suplimentare de leziuni, se înlocuiesc. În cazul ochilor care nu sunt respinși pe baza acestor criterii, se exclud ochii cu o grosime a corneei care deviază cu peste 10 % de la valoarea medie a tuturor ochilor. Utilizatorii trebuie să cunoască faptul că microscoapele oftalmologice pot produce rezultate diferite ale grosimii corneei dacă lărgimea fantei microscopului este diferită. Această lățime se stabilește la 0,095 mm.
23. După examinarea și acceptarea ochilor, aceștia sunt incubați timp de aproximativ 45-60 minute pentru a fi echilibrați cu sistemul de testare anterior dozării. După perioada de echilibrare, se înregistrează o valoare de referință 0 a grosimii și opacității corneei, care va fi utilizată ca valoare de bază (de exemplu, momentul de timp egal cu 0). Cantitatea de fluoresceină determinată în momentul disecției este utilizată ca valoare de referință măsurată pentru acea caracteristică.
Aplicarea substanței de test
24. Imediat după măsurarea valorii de referință 0, ochiul (aflat în suportul său) este extras din aparatul de suprafuziune și plasat într-o poziție orizontală, iar pe cornee se aplică substanța de test.
25. De obicei, substanțele de test lichide se testează nediluate, dar pot fi diluate dacă se consideră necesar (de exemplu, în cadrul elaborării testelor). Solventul preferat pentru substanțele diluate este serul fiziologic. Totuși, în condiții controlate pot fi utilizați solvenți alternativi, dar oportunitatea solvenților diferiți de serul fiziologic nu a fost demonstrată.
26. Substanțele de test lichide se aplică pe cornee astfel încât întreaga suprafață a acesteia să fie acoperită uniform cu substanța de test; volumul standard este de 0,03 ml.
27. Dacă este posibil, substanțele solide se macină cât mai fin posibil cu ajutorul unui mojar cu pistil sau al unui instrument de măcinat comparabil. Pulberea se aplică pe cornee astfel încât suprafața să fie acoperită uniform cu substanța de test; cantitatea standard este de 0,03 g.
28. Substanța de test (lichidă sau solidă) se aplică timp de 10 secunde, după care ochiul se clătește cu soluție salină izotonică (aproximativ 20 ml) la temperatura camerei. După aceasta, ochiul (în suportul său) este reintrodus în aparatul de suprafuziune, în poziția verticală inițială.
Substanțe de control
29. În fiecare experiment se introduc martori negativi sau martori eluenți și martori pozitivi.
30. Atunci când se testează substanțe lichide 100 % sau substanțe solide prin metoda de testare ICE, se utilizează ser fiziologic ca martor negativ pentru a se detecta modificări nespecifice ale sistemului de testare și a se preveni un efect iritant în urma condițiilor de testare.
31. Atunci când sunt testate substanțe lichide diluate, metoda de testare prevede un grup de martori solvenți/eluenți prin care se detectează modificările nespecifice ale sistemului de testare și a se preveni un efect iritant în urma condițiilor de testare. Conform punctului 25, se poate utiliza doar un solvent/eluent care nu afectează în mod negativ sistemul de încercare.
32. În fiecare experiment se introduce un martor pozitiv constând într-un iritant ocular, pentru a se verifica dacă se produce un răspuns sever. Deoarece în această metodă de testare se utilizează testarea de tip ICE pentru a se identifica corozivii sau iritanții severi, martorul control trebuie să fie o substanță de referință care provoacă un răspuns sever în cadrul acestei metode de testare. Totuși, pentru a fi posibilă evaluarea variabilității răspunsului martorului pozitiv în funcție de timp, dimensiunea răspunsului sever nu trebuie să fie excesiv de mare. Este necesar să fie generate suficiente date in vitro pentru martorul pozitiv, astfel încât să poată fi calculat un interval statistic acceptabil pentru acesta. Dacă nu sunt disponibile date adecvate precedente privind metoda de testare ICE pentru un anumit martor pozitiv, pot fi necesare studii pentru obținerea acestora.
33. Acidul acetic 10 % sau clorura de benzalconiu 5 % sunt exemple de martori pozitivi pentru substanțele de test lichide, iar hidroxidul de sodiu sau imidazolul sunt exemple de martori pozitivi pentru substanțe de testare solide.
34. Substanțele etalon sunt utile pentru evaluarea potențialului iritant la nivel ocular al substanțelor chimice necunoscute din cadrul unei clase de substanțe sau de produse, sau pentru evaluarea potențialului iritant relativ al unei substanțe iritante la nivel ocular într-un interval specific de reacții iritante.
Caracteristici măsurate
35. Corneele tratate sunt evaluate înainte tratamentului și la 30, 75, 120, 180, și 240 minute (± 5 minute) după spălarea post-tratament. Aceste momente de observare permit un număr adecvat de măsurători pe parcursul celor patru ore de tratament, lăsând un interval suficient între măsurători pentru efectuarea observațiilor necesare la nivelul tuturor ochilor.
36. Caracteristicile evaluate sunt opacitatea corneană, inflamarea, retenția de fluoresceină și efectele morfologice (de exemplu, corodarea sau detașarea epiteliului). Cu excepția retenției de fluoresceină (determinată numai înainte de tratament și la 30 de minute după expunerea la substanța de test), toate caracteristicile se determină în fiecare din momentele de observare menționate mai sus.
37. Se recomandă realizarea de fotografii pentru documentarea privind opacitatea corneană, retenția de fluoresceină, efectele morfologice și, dacă s-au efectuat, studiile histopatologice.
38. După examinarea finală la un interval de patru ore, utilizatorii sunt încurajați să păstreze ochii într-un fixator adecvat (de exemplu, formol neutru tamponat), pentru o potențială investigare histopatologică.
39. Inflamarea corneană se determină prin măsurarea grosimii corneene efectuată cu ajutorul unui pahimetru optic, atașat unui microscop oftalmologic. Aceasta se exprimă sub formă procentuală și se calculează pe baza măsurătorilor grosimii corneene conform formulei următoare:

40. Valoarea procentuală medie a inflamării corneene pentru toți ochii testați se calculează pentru toate momentele de observare. Pe baza punctajului maxim mediu al inflamării corneene, obținut în oricare din momentele de observare, se furnizează apoi un punctaj general al categoriei pentru fiecare substanță de test.
41. Opacitatea corneană se calculează prin utilizarea pentru înregistrare a suprafeței corneei care este cea mai opacifiată. Valoarea medie a opacității corneene pentru toți ochii testați se calculează pentru toate momentele de observare. Pe baza punctajului mediu maxim al opacității corneene obținut în oricare din momentele de observare, se furnizează apoi un punctaj general al categoriei pentru fiecare substanță de test (Tabelul 1).
Tabelul 1
Punctajele opacității corneene
|
Punctaj |
Observații |
|
0 |
Absența opacității |
|
0,5 |
Opacitate redusă |
|
1 |
Zone dispersate sau difuze; detaliile irisului sunt vizibile în mod clar |
|
2 |
Zone translucide ușor sesizabile; detaliile irisului sunt ușor neclare |
|
3 |
Opacitate corneană severă; nu sunt vizibile anumite detalii ale irisului; dimensiunea pupilei este foarte puțin sesizabilă |
|
4 |
Opacitate corneană completă; iris invizibil |
42. Valoarea medie a retenției de fluoresceină pentru toți ochii testați se calculează numai pentru momentul de observare după 30 de minute, care este utilizat pentru punctajul general al categoriei furnizat pentru fiecare substanță de test (Tabelul 2).
Tabelul 2
Punctajele de retenție a fluoresceinei
|
Punctaj |
Observații |
|
0 |
Absența retenției de fluoresceină |
|
0,5 |
Colorare redusă a unor celule izolate |
|
1 |
Colorare a unor celule izolate dispersate pe zona tratată a corneei |
|
2 |
Colorare intensă focalizată sau confluentă a unor celule izolate |
|
3 |
Zone confluente întinse ale corneei care rețin fluoresceina |
43. Efectele morfologice includ „corodarea” celulelor epiteliale corneene, „detașarea” epiteliului, „formarea de asperități” la nivelul suprafeței corneene și „aderarea” de cornee a substanței de test. Aceste rezultate pot varia în gravitate și pot exista simultan. Clasificarea rezultatelor este subiectivă în funcție de interpretarea formulată de cercetător.
DATE ȘI RAPORTARE
Evaluarea datelor
44. Rezultatele pentru opacitatea corneană, inflamarea corneei și reținerea fluoresceinei trebuie evaluate separat pentru a genera o clasă ICE pentru fiecare caracteristică. Clasele ICE pentru fiecare caracteristică sunt combinate ulterior pentru a genera o clasificare a potențialului iritant pentru fiecare substanță de test.
Criterii de decizie
45. După evaluarea fiecărei caracteristici, se pot desemna clasele ICE în funcție de un interval predeterminat. Interpretarea grosimii corneene (Tabelul 3), a opacității (Tabelul 4), și a retenției de fluoresceină (Tabelul 4) care utilizează patru clase ICE este realizată în conformitate cu următoarele scale:
Tabelul 3
Criteriile de clasificare a ICE pentru grosimea corneană
|
Inflamarea corneană medie (%) (1) |
Clasa ICE |
|
0 până la 5 |
I |
|
> 5 până la 12 |
II |
|
> 12 până la 18 (> 75 min după tratament) |
II |
|
> 12 până la 18 (≤ 75 min după tratament) |
III |
|
> 18 până la 26 |
III |
|
> 26 până la 32 (> 75 min după tratament) |
III |
|
> 26 până la 32 (≤ 75 min după tratament) |
IV |
|
> 32 |
IV |
|
(1) Punctajele pentru inflamarea corneană sunt aplicabile numai dacă grosimea se măsoară cu un microscop oftalmologic Haag-Streit BP900 cu dispozitivul de măsurare a adâncimii nr. I și cu lărgimea fantei setată la 9½, respectiv egală cu 0,095 mm. Utilizatorii trebuie să cunoască faptul că microscoapele oftalmologice pot produce rezultate diferite ale grosimii corneei dacă lărgimea fantei microscopului este diferită. |
|
Tabelul 4
Criteriile de clasificare a ICE pentru opacitate
|
Punctajul maxim mediu pentru opacitate (1) |
Clasa ICE |
|
0,0-0,5 |
I |
|
0,6-1,5 |
II |
|
1,6-2,5 |
III |
|
2,6-4,0 |
IV |
|
(1) Vezi tabelul 1. |
|
46. Clasificarea generală a potențialului iritant in vitro pentru o substanță de test este stabilită prin interpretarea clasificării potențialului iritant care corespunde combinării categoriilor obținute pentru inflamarea corneană, opacitatea corneană și retenția de fluoresceină, precum și prin aplicarea schemei prezentate în tabelul 6.
Tabelul 6
Clasificări generale ale potențialului iritant in vitro
|
Clasificare |
Combinații ale celor 3 caracteristici |
|
Coroziv/Iritant sever |
3 × IV 2 × IV, 1 × III 2 × IV, 1 × II (1) 2 × IV, 1 × I (1) Opacitatea corneană ≥ 3 la 30 min (pentru cel puțin 2 ochi) Opacitatea corneană = 4 în orice moment (pentru cel puțin 2 ochi) Detașarea severă a epiteliului (pentru cel puțin 1 ochi) |
|
(1) Combinații a căror probabilitate de apariție este mai mică. |
|
47. Astfel cum s-a arătat la punctul 1, dacă substanța de test nu este identificată drept substanță cu caracter coroziv sau cu potențial iritant sever la nivel ocular, trebuie efectuate testări suplimentare în scopul clasificării și etichetării. Metoda de testare ICE are o precizie totală cuprinsă între 83 % (120/144) și 87 % (134/154), o rată de rezultate fals pozitive între 6 % (7/122) și 8 % (9/116) și o rată de rezultate fals negative de 41 % (13/32) până la 50 % (15/30) pentru identificarea substanțelor cu caracter coroziv sau cu potențial iritant sever la nivel ocular, prin comparație cu datele metodei de testare in vivo pe ochi de iepure clasificate conform sistemelor de clasificare EPA (1), EU (2), sau GHS (3). Atunci când din baza de date sunt excluse substanțe din anumite clase chimice (și anume, alcooli și agenți tensioactivi) și fizice (și anume, substanțe solide), precizia metodei ICE raportată la sistemele de clasificare UE, EPA și GHS este cuprinsă între 91 % (75/82) și 92 % (69/75), rata de rezultate fals pozitive este cuprinsă între 5 % (4/73) și 6 % (4/70), iar rata de rezultate fals negative este cuprinsă între 29 % (2/7) și 33 % (3/9) (4).
48. Chiar dacă pentru o substanță de test nu se obține încadrarea în clasa substanțelor având caracter coroziv sau potențial iritant sever, datele ICE pot fi utile în combinație cu datele de testare obținute prin testul in vivo pe ochi de iepure sau printr-o testare in vitro validată în mod corespunzător, pentru a evalua în continuare utilitatea și limitele de aplicare ale metodei de testare ICE în ceea ce privește identificarea substanțelor având un potențial iritant redus și a celor neiritante (sunt în curs de elaborare linii directoare privind utilizarea metodelor de testare in vitro a toxicității oculare).
Criterii de acceptare a studiului
49. Un test este considerat acceptabil dacă martorul negativ sau grupul martor solvent/eluent și martorii pozitivi testați în paralel conduc la o clasificare a caracterului iritant care încadrează în clasa substanțelor neiritante și, respectiv, în clasa substanțelor având potențial iritant sever/coroziv.
Raport de testare
50. Raportul de testare trebuie să conțină următoarele informații, dacă acestea prezintă relevanță pentru desfășurarea studiului:
Substanțe testate și de control
Denumire (denumiri) chimică (chimice), precum denumirea structurală utilizată de Chemical Abstracts Service (CAS), urmată de alte denumiri, dacă se cunosc;
Numărul de înregistrare (Registry Number -RN) CAS, dacă se cunoaște;
Puritatea și compoziția substanței sau a amestecului [în procent(e) de greutate], în măsura în care informația respectivă este disponibilă;
Proprietăți fizico-chimice, precum starea fizică, pH-ul, stabilitatea, hidrosolubilitatea, utile pentru efectuarea studiului;
Tratamentul substanțelor testate/de control înainte de efectuarea testului, după caz (de exemplu, încălzire, măcinare);
Stabilitate, dacă este cunoscută.
Informații referitoare la sponsor și la instalația de testare
Numele și adresa sponsorului, a instalației de testare și a directorului de studiu;
Identificarea sursei ochilor (de exemplu, întreprinderea unde au fost colectați);
Condițiile de depozitare și transport ale ochilor (de exemplu, data și ora colectării ochilor, perioada de timp până la începerea testării);
Dacă sunt disponibile, caracteristicile specifice ale animalelor de la care au fost colectați ochii (de exemplu, vârsta, sexul, greutatea animalului donator).
Justificarea metodei de testare și a protocolului utilizat
Integritatea metodei de testare
Procedura utilizată pentru a asigura integritatea în timp (și anume, precizia și fiabilitatea) a metodei de testare (de exemplu, testarea periodică a substanțelor de verificare, utilizarea datelor istorice de control negative și pozitive).
Criteriile pentru un test acceptabil
După caz, intervale pentru martorii etalon acceptabili testați în paralel pe baza datelor istorice.
Condiții de testare
Descrierea sistemului de testare utilizat;
Microscopul oftalmologic utilizat (de exemplu, modelul);
Reglajele instrumentelor pentru microscopul oftalmologic utilizat;
Informații privind ochii de pui utilizați, inclusiv specificații privind calitatea acestora;
Detalii privind procedura de testare utilizată,
Concentrația (concentrațiile) substanței de test utilizate;
Descrierea tuturor modificărilor procedurii de testare;
Trimiteri la datele istorice ale modelului (de exemplu, martori negativi și pozitivi, substanțe de verificare, substanțe etalon);
Descrierea criteriilor de evaluare folosite;
Rezultate
Descrierea altor efecte observate;
După caz, fotografii ale ochiului;
Discutarea rezultatelor
Concluzie
REFERINȚE BIBLIOGRAFICE
(1) U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington DC: U.S. Environmental Protection Agency.
(2) Regulamentul (CE) nr. 1272/2008 al Parlamentului European și al Consiliului din 16 decembrie 2008 privind clasificarea, etichetarea și ambalarea substanțelor și a amestecurilor, de modificare și de abrogare a Directivelor 67/548/CEE și 1999/45/CE, precum și de modificare a Regulamentului (CE) nr. 1907/2006. JO L 353, 31.12.2008, p. 1.
(3) United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Disponibil la:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(5) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Document disponibil la adresa:
[http://ecvam.jrc.it/index.htm].
(6) Regulamentul (CE) nr. 1907/2006 al Parlamentului European și al Consiliului din 18 decembrie 2006 privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH), de înființare a Agenției Europene pentru Produse Chimice, de modificare a Directivei 1999/45/CE și de abrogare a Regulamentului (CEE) nr. 793/93 al Consiliului și a Regulamentului (CE) nr. 1488/94 al Comisiei, precum și a Directivei 76/769/CEE a Consiliului și a Directivelor 91/155/CEE, 93/67/CEE, 93/105/CE și 2000/21/CE ale Comisiei. JO L 396, 30.12.2006, p. 1.
(7) OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Document disponibil la adresa:
[http://www.oecd.org/document/40/0, 2340, en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended ICE Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(9) ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH Publication No.: 06-4513. Research Triangle Park: National Toxicology Program. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm]
(10) Prinsen, M.K. and Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76.
(11) INVITTOX (1994). Protocol 80: Chicken enucleated eye test (CEET). Document disponibil la adresa:
[http://ecvam.jrc.it/index.htm].
(12) Balls, M., Botham, P.A., Bruner, L.H. and Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In Vitro 9:871-929.
(13) Prinsen, M.K. (1996). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/corrosion potential of test materials. Food Chem. Toxicol. 34:291-296.
(14) Chamberlain, M., Gad, S.C., Gautheron, P. and Prinsen, M.K. (1997). IRAG Working Group I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37.
(15) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Document disponibil la adresa:
[http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf].
(16) Maurer, J.K., Parker, R.D. and Jester J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(17) Burton, A.B.G., M. York and R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480.
(18) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
(19) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe IrritantsIsolated Chicken Eye (ICE) Test Method. Document disponibil la adresa:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
Apendicele 1
DEFINIȚII
Precizie : Gradul de apropiere dintre rezultatele metodei de testare și valorile de referință acceptate. Aceasta constituie una dintre caracteristicile de performanță ale metodei de testare și unul dintre aspectele relevanței acesteia. Termenul este adesea utilizat în paralel cu termenul sinonim „concordanță”, pentru a desemna proporția de rezultate corecte ale unei metode de testare.
Substanță etalon : O substanță utilizată în calitate de standard pentru comparația cu o substanță de test. O substanță etalon ar trebui să aibă următoarele proprietăți: (i) sursă (surse) compatibilă (compatibile) și sigure; (ii) asemănări structurale și funcționale cu clasa de substanțe care este testată; (iii) caracteristici fizico-chimice cunoscute; (iv) date de susținere privind efectele cunoscute; și (v) influență cunoscută în intervalul de răspuns dorit.
Cornee : Regiunea transparentă a părții anterioare a globului ocular care acoperă irisul și pupila și care permite luminii să pătrundă în interior.
Opacitate corneană : Măsurarea gradului de opacitate a corneei după expunerea la o substanță de test. Opacitatea corneană crescută este un indicator al unei leziuni a corneei.
Inflamare corneană : O măsurare obiectivă în testul ICE a gradului de dilatare a corneei după expunerea la o substanță de test. Se exprimă sub formă procentuală și se calculează pe baza măsurătorilor nivelului de bază al grosimii corneene (pre-doză) și ale grosimii înregistrate la intervale regulate după expunere la materialul testat prin testul ICE. Gradul de inflamare corneană este un indicator al unei leziuni a corneei.
Categoria EPA 1 : Caracter coroziv (distrugerea ireversibilă a țesutului ocular) sau afectare a corneei sau iritație care persistă mai mult de 21 de zile (1).
Categoria UE R41 : Producerea de leziuni tisulare la ochi sau deteriorarea fizică gravă a vederii, în urma aplicării unei substanțe de test pe suprafața anterioară a ochiului, care nu sunt complet reversibile într-un interval de 21 de zile de la aplicare (2).
Rată de rezultate fals negative : Proporția tuturor substanțelor pozitive identificate în mod fals de o metodă de testare ca fiind negative. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Rată de rezultate fals pozitive : Proporția tuturor substanțelor negative identificate în mod fals de o metodă de testare ca fiind pozitive. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Retenție de fluoresceină : O măsurare subiectivă în cadrul testului ICE a gradului în care fluoresceina de sodiu este reținută de celulele epiteliale din cornee după expunerea la o substanță de test. Gradul de retenție a fluoresceinei este un indicator al unei leziuni la nivelul epiteliului cornean.
GHS (Globally Harmonized System of Classification and Labelling of Chemicals - Sistemul global armonizat de clasificare și etichetare a substanțelor chimice) : Un sistem care propune clasificarea substanțelor chimice (substanțe și amestecuri) în funcție de tipuri și niveluri standardizate de riscuri fizice, riscuri pentru sănătate și riscuri pentru mediu, și care elaborează elemente de comunicare corespunzătoare, de exemplu pictograme, cuvinte de avertizare, fraze de pericol, fraze de securitate și fișe tehnice de siguranță, pentru a transmite informații privind efectele adverse ale acestora, în scopul protejării populației (inclusiv a angajatorilor, a lucrătorilor, a transportatorilor, a consumatorilor și a serviciilor de urgență) și a mediului (3).
Categoria HS 1 : Producerea de leziuni tisulare la ochi sau deteriorarea fizică gravă a vederii, în urma aplicării unei substanțe de test pe suprafața anterioară a ochiului, care nu sunt complet reversibile într-un interval de 21 de zile de la aplicare (3).
Risc : Proprietate intrinsecă a unui agent sau a unei situații care are potențialul de a produce efecte adverse atunci când un organism, sistem sau (sub)populație este expusă la agentul respectiv.
Martor negativ : O probă replică netratată care conține toate componentele sistemului testat. Această probă este analizată împreună cu probele tratate cu substanță de test și cu alte probe martor pentru a determina dacă solventul interacționează cu sistemul testat.
Substanță neiritantă : Substanțe care nu sunt încadrate în categoriile EPA I, II, sau III, în categoriile UE R41 sau R36; sau în categoria GHS 1, 2A, sau 2B de iritanți oculari (1)(2)(3).
Substanță având un caracter coroziv la nivel ocular : (a) Substanță care provoacă leziuni tisulare ireversibile la nivelul ochiului; (b) Substanțe care sunt încadrate în categoria GHS 1, categoria EPA I sau categoria UE R41 de iritanți oculari (1) (2) (3).
Iritant ocular : (a) Substanță care produce o modificare reversibilă la nivelul ochiului după aplicarea pe suprafața anterioară a ochiului; (b) Substanțe care sunt încadrate în categoria EPA II sau III, categoria UE R36 sau categoria GHS 1, 2A, sau 2B de iritanți oculari (1)(2)(3).
Substanță cu potențial iritant sever : (a) O substanță care provoacă lezarea tisulară la nivelul ochiului după aplicarea pe suprafața anterioară a ochiului, care nu este reversibilă după 21 de zile de la aplicare sau care provoacă o slăbire fizică severă a vederii; (b) Substanțe care sunt încadrate în categoria GHS 1, categoria EPA I sau categoria UE R41 de iritanți oculari (1) (2) (3).
Controlul pozitiv : O probă replică conținând toate componentele sistemului testat și care a fost tratată cu o substanță cunoscută pentru faptul că provoacă o reacție pozitivă. Pentru a asigura posibilitatea evaluării variabilității în timp a reacției martorului pozitiv, amplitudinea reacției severe nu trebuie să fie excesiv de mare.
Fiabilitate : Măsura în care o metodă de testare poate fi reprodusă în timp, în același laborator sau în laboratoare diferite, folosind același protocol. Aceasta se evaluează prin calcularea reproductibilității în același laborator sau inter-laboratoare.
Microscop oftalmologic : Instrument utilizat pentru a examina direct ochiul, sub puterea de mărire a unui microscop binocular, prin crearea unei imagini stereoscopice, drepte. În cazul metodei de testare ICE, acest instrument este utilizat pentru a vizualiza structurile anterioare ale ochiului de pui și pentru a măsura în mod obiectiv grosimea corneană cu ajutorul unui dispozitiv atașat de măsurare a grosimii.
Martor solvent/eluent : O probă netratată care conține toate componentele sistemului testat, inclusiv solventul sau eluentul, care este analizată împreună cu probele tratate cu substanță de test și cu alte probe martor pentru a stabili nivelul de bază al reacției pentru probele tratate cu substanța de test dizolvată în același solvent sau eluent. În plus, atunci când este testată în paralel cu un martor negativ, această probă indică dacă solventul sau eluentul interacționează cu sistemul testat.
Testare secvențială : O strategie de testare în trepte în cadrul căreia sunt revizuite toate informațiile existente privind o substanță de test, într-o anumită ordine, utilizând un proces de evaluare a forței probante în fiecare etapă pentru a determina dacă sunt disponibile suficiente informații pentru o decizie privind clasificarea riscului, înainte de a trece la etapa următoare. Dacă potențialul iritant al unei substanțe de test poate fi apreciat pe baza informațiilor existente, nu este necesară o testare suplimentară. Dacă potențialul iritant al unei substanțe de test nu poate fi apreciat pe baza informațiilor existente, se execută o procedură de testare secvențială pe animale până în momentul în care se poate face o clasificare lipsită de echivoc.
Metodă de testare validată : Metodă de testare în legătură cu care studiile de validare au fost încheiate în scopul determinării relevanței (inclusiv precizia) și a fiabilității pentru un anumit scop. Este important de semnalat că este posibil ca performanțele unei metode de testare validate să nu fie suficiente din punct de vedere al preciziei și fiabilității încât aceasta să fie considerată acceptabilă pentru scopul propus.
Forța probantă : Procesul prin care se iau în considerare punctele tari și punctele slabe ale unor informații diverse pentru a ajunge la o concluzie în ceea ce privește riscul potențial al unei substanțe și a susține concluzia respectivă.
Apendicele 2
SUBSTANȚELE CHIMICE DE VERIFICARE PENTRU METODA DE TESTARE ICE
Înainte de utilizarea sistematică a unei metode de testare conforme cu prezenta metodă de testare, este posibil ca laboratoarele să dorească să își demonstreze performanțele tehnice prin identificarea corectă a clasificării caracterului coroziv pentru cele 10 substanțe recomandate în tabelul 1. Aceste substanțe au fost selectate pentru a reprezenta intervalul de reacții pentru iritația/coroziunea locală la nivelul ochilor, care se bazează pe rezultatele testului in vivo pe ochi de iepure (TG 405) (și anume, categoriile 1, 2A, 2B, sau neclasificat și etichetat în conformitate cu GHS al Națiunilor Unite) (3) (7). Totuși, ținând cont de utilitatea validată a acestor analize (și anume, în scopul de a identifica numai substanțele care au caracter coroziv/potențial iritant sever la nivel ocular), există numai două rezultate ale testelor destinate clasificării (coroziv/iritant sever sau necoroziv/fără potențial iritant sever) pentru a demonstra performanțele. Alte criterii de selecție au fost ca substanțele să fie disponibile comercial, să fie disponibile informații de referință in vivo de calitate superioară și să existe date de calitate furnizate de două metode in vitro pentru indicațiile orientative de testare care se elaborează. Din acest motiv, substanțele iritante au fost selectate din lista recomandată a ICCVAM care cuprinde 122 substanțe de referință pentru validarea metodelor de testare in vitro a toxicității oculare (a se vedea Apendicele H: Lista substanțelor de referință recomandate ICCVAM) (4). Informațiile de referință sunt disponibile în documentele ICCVAM de trecere în revistă a cadrului general pentru metodele de testare BCOP și ICE (18) (19).
Tabelul 1
Substanțe recomandate pentru a demonstra performanțele tehnice prin metoda ICE
|
Substanță |
CAS RN |
Clasă chimică (1) |
Formă fizică |
Clasificare in vivo (2) |
Clasificare in vitro (3) |
|
Clorură de benzalconiu (5 %) |
8001-54-5 |
Compus de tip onium |
Lichid |
Categoria 1 |
Coroziv/Iritant sever |
|
Clorhexidină |
55-56-1 |
Amină, amidină |
Solid |
Categoria 1 |
Coroziv/Iritant sever |
|
Acid dibenzoil-L-tartric |
2743-38-6 |
Acid carboxilic, ester |
Solid |
Categoria 1 |
Coroziv/Iritant sever |
|
Imidazol |
288-32-4 |
Heterociclu |
Solid |
Categoria 1 |
Coroziv/Iritant sever |
|
Acid tricloracetic (30 %) |
76-03-9 |
Acid carboxilic |
Lichid |
Categoria 1 |
Coroziv/Iritant sever |
|
Clorură de 2,6-diclorbenzoil |
4659-45-4 |
Halogenură de acil |
Lichid |
Categoria 2A |
Necoroziv/Fără potențial iritant sever |
|
Etil-2-metil-acetoacetat |
609-14-3 |
Cetonă, ester |
Lichid |
Categoria 2B |
Necoroziv/Fără potențial iritant sever |
|
Azotat de amoniu |
6484-52-2 |
Sare anorganică |
Solid |
Categoria 2A |
Necoroziv/Fără potențial iritant sever |
|
Glicerol |
56-81-5 |
Alcool |
Lichid |
Neetichetat |
Necoroziv/Fără potențial iritant sever |
|
n-Hexan |
110-54-3 |
Hidrocarbură (aciclică) |
Lichid |
Neetichetat |
Necoroziv/Fără potențial iritant sever |
|
(1) Clasele chimice sunt desemnate pentru fiecare substanță de test prin utilizarea unei scheme de clasificare standard, pe baza sistemului de clasificare al National Library of Medicine Medical Subject Headings (MeSH) (disponibil la http//www.nlm.nih.gov/mesh). (2) Pe baza rezultatelor furnizate de testul in vivo pe ochi de iepure (OCDE TG 405) și prin utilizarea GHS a Națiunilor Unite (3) (7). (3) Pe baza rezultatelor obținute prin analizele BCOP și ICE. Prescurtări: Nr. CASRN = Număr de înregistrare al Chemical Abstracts Service. |
|||||
Apendicele 3
Scheme ale aparatului de suprafuziune ICE și ale clemelor pentru ochi
[A se vedea Burton et al. (17) pentru descrieri generice suplimentare ale aparatului de suprafuziune și ale clemelor pentru ochi]

PARTEA C: METODE PENTRU DETERMINAREA ECOTOXICITĂȚII
|
CUPRINS |
|
|
C.1. |
TOXICITATEA ACUTĂ LA PEȘTI |
|
C.2. |
DAPHNIA SP. TESTUL IMOBILIZĂRII ACUTE |
|
C.3. |
ALGE DE APĂ DULCE ȘI CIANOBACTERII, TEST DE INHIBARE A CREȘTERII |
|
C.4. |
DETERMINAREA BIODEGRADABILITĂȚII „RAPIDE” |
|
PARTEA I. |
CONSIDERAȚII GENERALE |
|
PARTEA II. |
TESTUL DE EPUIZARE COD (Metoda C.4-A) |
|
PARTEA III. |
TESTUL DE SCREENING MODIFICAT OCDE (Metoda C.4-B) |
|
PARTEA IV. |
TESTUL DE DEGAJARE A CO2 (Metoda C.4-C) |
|
PARTEA V. |
TESTUL DE RESPIROMETRIE MANOMETRICĂ (Metoda C.4-D) |
|
PARTEA VI. |
TESTUL CU VAS ÎNCHIS (Metoda C.4-E) |
|
PARTEA VII. |
TESTUL MITI (METODA C.4-F) |
|
C.5. |
DEGRADAREA – CONSUMUL BIOCHIMIC DE OXIGEN |
|
C.6. |
DEGRADAREA – CONSUMUL CHIMIC DE OXIGEN |
|
C.7. |
DEGRADAREA – DEGRADAREA ABIOTICĂ: HIDROLIZA CA O FUNCȚIE A PH-ULUI |
|
C.8. |
TOXICITATEA LA RÂME |
|
C.9. |
BIODEGRADARE – METODA ZAHN-WELLENS |
|
C.10. |
BIODEGRADARE – TESTE DE SIMULARE CU NĂMOL ACTIV |
|
C.11. |
BIODEGRADARE – NĂMOLUL ACTIV: TEST DE INHIBIȚIE A RESPIRAȚIEI |
|
C.12. |
BIODEGRADARE – TESTUL SCAS MODIFICAT |
|
C.13. |
BIOCONCENTRAREA: EXPERIENȚA CU REÎNNOIRE CONTINUĂ ASUPRA PEȘTILOR |
|
C.14. |
TESTUL DE CREȘTERE A PUIETULUI DE PEȘTE |
|
C.15. |
PEȘTII, TESTUL DE TOXICITATE PE TERMEN SCURT ÎN STADIILE DE EMBRION ȘI DE ALEVIN |
|
C.16. |
ALBINELE – TESTUL DE TOXICITATE ORALĂ ACUTĂ |
|
C.17. |
ALBINELE – TESTUL DE TOXICITATE ACUTĂ PRIN CONTACT |
|
C.18. |
ADSORBȚIA/DESORBȚIA PRINTR-O METODĂ DE STABILIRE A ECHILIBRULUI PROBELOR |
|
C.19. |
ESTIMAREA COEFICIENTULUI DE ADSORBȚIE (KCO) PE SOL ȘI NĂMOL DE EPURARE CU AJUTORUL CROMATOGRAFIEI LICHIDE DE ÎNALTĂ PERFORMANȚĂ (HPLC) |
|
C.20. |
TEST DE REPRODUCERE PENTRU DAPHNIA MAGNA |
|
C.21. |
MICROORGANISMELE DIN SOL: TESTUL DE TRANSFORMARE A AZOTULUI |
|
C.22. |
MICROORGANISMELE DIN SOL: TESTUL DE TRANSFORMARE A CARBONULUI |
|
C.23. |
TRANSFORMĂRI AEROBE ȘI ANAEROBE ÎN SOL |
|
C.24. |
TRANSFORMĂRI AEROBE ȘI ANAEROBE ÎN SISTEMELE DE SEDIMENTE ACVATICE |
|
C.25. |
MINERALIZAREA AEROBĂ ÎN APA DE SUPRAFAȚĂ – TEST DE SIMULARE A BIODEGRADĂRII |
|
C.26. |
TEST DE INHIBARE A CREȘTERII SPECIEI LEMNA |
C.1. TOXICITATEA ACUTĂ LA PEȘTI
1. METODĂ
1.1. INTRODUCERE
Scopul testului de față este de a determina toxicitatea letală acută a unei substanțe la peștii de apă dulce. Este de dorit să se colecteze informații legate de solubilitatea în apă, presiunea vaporilor, stabilitatea chimică, constantele de disociere și biodegradabilitatea substanței, pentru a alege metoda optimă de testare (statică, semistatică sau dinamică) și pentru a asigura concentrații constante satisfăcătoare ale substanței pe durata testării.
Atât la planificarea testului, cât și la interpretarea rezultatelor se iau în considerare informațiile suplimentare (de exemplu formula structurală, gradul de puritate, natura și procentul de impurități semnificative, prezența și cantitatea de aditivi și coeficientul de partiție n-octanol/apă).
1.2. DEFINIȚII ȘI UNITĂȚI
Toxicitatea acută reprezintă efectul advers vizibil indus într-un organism într-o perioadă scurtă (zile) de expunere la o substanță. În testul de față, toxicitatea acută se exprimă drept concentrația letală mediană (CL50), care este acea concentrație a substanței de testat în apă care provoacă moartea a 50 % din lotul de pești de experiență într-o perioadă de expunere continuă și definită.
Toate concentrațiile substanței de testat se exprimă ca greutate pe volum (miligrame pe litru). Ele pot fi, de asemenea, exprimate ca greutate din greutate (mg/kg–1).
1.3. SUBSTANȚE DE REFERINȚĂ
Se poate testa o substanță de referință pentru a demonstra că în condițiile de testare din laborator răspunsul speciilor testate nu s-a schimbat semnificativ.
Pentru acest test nu sunt specificate substanțe de referință.
1.4. PRINCIPIUL METODEI DE TESTARE
Se efectuează un test-limită la 100 mg/l pentru a demonstra că CL50 este mai mare decât această concentrație.
Peștii se tratează cu substanța de testat solubilizată în apă, într-o serie de concentrații, pe o perioadă de 96 de ore. Se înregistrează mortalitatea la intervale de cel puțin 24 de ore și se calculează concentrațiile care provoacă moartea a 50 % dintre pești (CL50) în fiecare perioadă de observare, dacă este posibil.
1.5. CRITERII DE CALITATE
Criteriile de calitate se aplică testului-limită, precum și testului complet.
Mortalitatea la martori nu trebuie să depășească 10 % (sau un pește dacă se folosesc mai puțin de zece pești) până la sfârșitul testului.
Concentrația de oxigen dizolvat trebuie să fie mai mare de 60 % din valoarea de saturație în aer, până la sfârșitul testului.
Concentrațiile substanței de testat se mențin în limita a 80 % din concentrațiile inițiale pe toată durata testului.
Pentru substanțele care se dizolvă ușor în mediul de testare, rezultând soluții stabile, respectiv soluții care nu se volatilizează, degradează, hidrolizează sau adsorb într-o măsură considerabilă, concentrația inițială poate fi considerată echivalentă cu concentrația nominală. Trebuie demonstrat că pe toată durata testului au fost menținute aceleași concentrații, iar criteriile de calitate au fost satisfăcute.
Pentru substanțele care sunt:
(i) puțin solubile în mediul de testare; sau
(ii) capabile să formeze emulsii stabile ori dispersii; sau
(iii) instabile în soluții apoase,
concentrația inițială este considerată drept concentrația determinată analitic în soluție (sau, în cazul în care nu este posibil tehnic, măsurată în coloana de apă) la începutul testului. Concentrația se determină după o perioadă de echilibrare, dar înainte de introducerea peștilor de experiență.
În oricare din aceste cazuri, se efectuează determinări suplimentare pe parcursul testului pentru a confirma concentrațiile reale de expunere sau respectarea criteriilor de calitate.
Valoarea pH-ului trebuie să nu varieze cu mai mult de o unitate.
1.6. DESCRIEREA METODEI DE TESTARE
Se pot folosi trei tipuri de metode:
Test în regim static:
Test de toxicitate în care soluția testată nu se înlocuiește (soluțiile rămân nemodificate pe toată durata testului).
Test în regim semistatic:
Test fără înlocuirea continuă a soluției testate, dar cu înlocuirea cu regularitate a întregii soluții (de exemplu la 24 de ore).
Test în regim dinamic:
Test de toxicitate în care soluția testată este reînnoită constant în vasele de testare, substanța de testat fiind transportată cu apa folosită pentru a reînnoi soluția.
1.6.1. Reactivi
1.6.1.1. Soluțiile substanțelor de testat
Soluțiile mamă în concentrația necesară se prepară prin dizolvarea substanței în apă deionizată sau în apă conform punctului 1.6.1.2.
Concentrațiile de testare alese sunt preparate prin diluarea soluției mamă. Dacă se testează concentrații ridicate, cantitățile corespunzătoare din substanța de testat pot fi solubilizate direct în apa de diluție.
Substanțele se testează în mod normal numai până la limita solubilității. Pentru unele substanțe (de exemplu: substanțele puțin solubile în apă sau cele cu Pow ridicat sau care formează dispersii stabile în loc de soluții apoase propriu-zise), se acceptă folosirea unei concentrații deasupra limitei de solubilitate a substanței, pentru a garanta concentrația maximă solubilă/stabilă. Cu toate acestea, este important ca această concentrație să nu perturbe sistemul de testare (de exemplu, o peliculă de substanță pe suprafața apei care să împiedice oxigenarea apei etc.).
Pentru a prepara soluțiile mamă ale substanțelor cu solubilitate scăzută în apă sau pentru a facilita dispersia acestor substanțe în mediul de testare se pot folosi dispersia cu ultrasunete, solvenți organici, agenți de emulsionare sau agenți de dispersie. În cazul în care se folosesc astfel de substanțe auxiliare, toate concentrațiile trebuie să conțină aceeași cantitate de substanță auxiliară, iar peștii martor sunt tratați cu aceeași concentrație a substanței auxiliare ca și cea folosită în loturile tratate. Concentrația unor astfel de substanțe auxiliare trebuie redusă la minimum și în niciun caz nu trebuie să depășească 100 mg/l.
Testul se efectuează fără reglarea pH-ului. Dacă există dovada unei schimbări pronunțate a pH-ului, se recomandă ca testul să se repete după reglarea pH-ului, iar rezultatele să se consemneze. În acest caz, valoarea pH-ului soluției mamă se reglează la valoarea pH-ului apei de diluție, dacă nu există contraargumente specifice. Pentru reglarea pH-ului sunt preferate HCl și NaOH. Această reglare a pH-ului se face astfel încât concentrația substanței de testat din soluția mamă să nu se modifice în mod semnificativ. Dacă în urma acestei corecții de pH are loc o reacție chimică sau precipitarea fizică a substanței de testat, acest lucru trebuie consemnat.
1.6.1.2. Apa de întreținere și de diluție
Se poate folosi apa potabilă (necontaminată de concentrații potențial dăunătoare de clor, metale grele sau alte substanțe), apa naturală de calitate bună sau apa reconstituită (a se vedea apendicele 1). Se preferă apa cu o duritate totală între 10 și 250 mg/l (CaCO3) și cu un pH cuprins în intervalul 6,0-8,5.
1.6.2. Aparatură
Toată aparatura este confecționată din material inert din punct de vedere chimic.
— sistem automat de diluare (pentru testare în condiții dinamice);
— oxigenometru;
— echipament pentru determinarea durității apei;
— aparatură adecvată pentru controlul temperaturii;
— pH-metru.
1.6.3. Pești de experiență
Peștii trebuie să fie sănătoși și fără malformații vizibile.
Speciile folosite sunt selectate pe baza unor criterii practice cum sunt: disponibilitatea lor tot timpul anului, întreținere ușoară, testare convenabilă, sensibilitatea relativă la substanțe chimice și orice factor economic și biologic sau ecologic important. La selectarea speciilor de pești se va ține seama de necesitatea comparabilității datelor obținute și de armonizarea internațională existentă (referința bibliografică 1).
Lista speciilor de pești recomandate pentru efectuarea acestui test este prezentată în apendicele 2; peștele zebră și păstrăvul curcubeu sunt speciile preferate.
1.6.3.1. Întreținere
Peștii supuși testului trebuie, de preferință, să provină dintr-un singur lot ai cărui indivizi au lungimea și vârsta asemănătoare. Sunt ținuți timp de cel puțin 12 zile în condițiile următoare:
încărcătură:
adecvată sistemului folosit (recirculare sau în regim dinamic) și de specia de pești;
apă:
a se vedea punctul 1.6.1.2;
lumină:
iluminare 12-16 ore pe zi;
concentrația de oxigen dizolvat:
cel puțin 80 % din valoarea de saturație în aer;
alimentație:
zilnic sau de 3 ori pe săptămână, cu o pauză de 24 de ore înaintea începerii testului.
1.6.3.2. Mortalitate
După o perioadă de 48 de ore de adaptare, se înregistrează mortalitatea și se aplică următoarele criterii:
— mai mare de 10 % din populație în 7 zile:
— respingerea întregului lot;
— între 5 și 10 % din populație:
— perioada de întreținere continuă încă 7 zile.
— Dacă nu mai apare mortalitate, lotul este acceptat, în caz contrar este respins;
— sub 5 % din populație:
— acceptarea lotului.
1.6.4. Adaptare
Toți peștii trebuie să fie ținuți în apă de calitatea și temperatura care urmează să fie folosite la test, timp de cel puțin 7 zile înainte de a fi folosiți.
1.6.5. Procedura de testare
Testul principal poate fi precedat de un test de stabilire a intervalului, pentru a obține informații legate de intervalul de concentrații ce urmează să fie folosite.
Pe lângă testarea propriu-zisă, se efectuează un test martor fără substanță de testat și, dacă are semnificație, încă un test martor pentru substanța auxiliară.
În funcție de proprietățile fizice și chimice ale substanței de testat, se alege metoda adecvată statică, semistatică sau dinamică, pentru a îndeplini criteriile de calitate.
Peștii sunt expuși substanței conform celor descrise mai jos:
— durata: 96 ore;
— numărul de organisme testate: cel puțin 7 pe concentrație;
— vase: de capacitate adecvată în funcție de greutatea recomandată a lotului;
— greutatea lotului testat: se recomandă greutatea maximă de 1 g/l pentru testele în regim static și semistatic; pentru testele în regim dinamic se acceptă o greutate mai mare;
— concentrația testată: cel puțin 5 concentrații spațiate printr-un factor constant care nu depășește 2,2 și, dacă este posibil, într-un interval de 0-100 % mortalitate;
— apă: a se vedea punctul 1.6.1.2;
— lumină: 12-16 ore lumină zilnic;
— temperatură: conform speciei (apendicele 2) dar în limita ± 1 oC în cadrul fiecărei testări;
— concentrația de oxigen dizolvat: nu mai puțin de 60 % din valoarea de saturație în aer la temperatura selectată;
— hrănire: nu se administrează hrană.
Peștii sunt observați după primele 2-4 ore și la intervale de cel puțin 24 de ore. Peștii se consideră morți dacă atingerea pedunculului caudal nu produce nicio reacție și nu sunt vizibile mișcări de respirație. Peștii morți se îndepărtează în momentul în care sunt observați și se înregistrează mortalitatea. Se ține evidența comportamentului anormal vizibil (de exemplu, pierderea echilibrului, perturbări de înot, funcția respiratorie, pigmentare etc.).
Trebuie să se efectueze zilnic măsurători ale pH-ului, oxigenului dizolvat și temperaturii.
Folosind modul de operare descris în prezenta metodă de testare, se poate efectua un test-limită la 100 mg/l pentru a demonstra că CL50 este mai mare decât această concentrație.
Dacă natura substanței nu permite atingerea concentrației de 100 mg/l în soluția de testare, testul-limită se efectuează la o concentrație egală cu solubilitatea substanței (sau concentrația maximă pentru formarea unei dispersii stabile) în mediul folosit (a se vedea și punctul 1.6.1.1).
Testul-limită se efectuează folosind între 7 și 10 pești, cu același număr de teste martor. (Conform teoriei binomului, dacă se folosesc 10 pești și mortalitatea este 0, există 99,99 % încredere că CL50 este mai mare decât concentrația folosită în testul-limită. Cu 7, 8 sau 9 pești, absența mortalității asigură cel puțin 99 % încredere că CL50 este mai mare decât concentrația folosită).
Dacă apare mortalitate, trebuie să se efectueze un studiu complet. Dacă se observă efecte subletale, acestea se înregistrează.
2. DATE ȘI EVALUARE
Pentru fiecare perioadă în care s-au înregistrat observații (24, 48, 72 și 96 de ore) se reprezintă grafic mortalitatea exprimată în procente, în funcție de concentrație, pe o hârtie probit logaritmică.
Dacă este posibil, pentru fiecare perioadă de observare se estimează CL50 și limitele de încredere (p = 0,05) prin metode standard; aceste valori se rotunjesc la una sau cel mult două cifre semnificative (exemple de rotunjire la două cifre: 170 pentru 173,5; 0,13 pentru 0,127; 1,2 pentru 1,21).
În cazul în care panta curbei de răspuns concentrație/procentaj este prea abruptă pentru a permite calcularea valorii CL50, este suficientă estimarea grafică a acestei valori.
În cazul în care două concentrații consecutive aflate în raport de 2,2 dau numai 0 și 100 % mortalitate, aceste două valori sunt suficiente pentru a indica intervalul în care se situează CL50.
Dacă se observă că stabilitatea sau omogenitatea substanței de testat nu poate fi menținută, acest lucru se consemnează, iar rezultatele trebuie interpretate cu atenție.
3. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele informații:
— informații despre peștii de experiență (denumirea științifică, linia, furnizorul, orice tratament preliminar, dimensiunea și numărul folosit pentru fiecare concentrație testată);
— sursa apei de diluție și caracteristicile chimice principale (pH, duritate, temperatură);
— în cazul unei substanțe puțin solubile în apă, metoda de preparare a soluției mamă și a soluțiilor de testare;
— concentrația eventualelor substanțe auxiliare;
— lista concentrațiilor folosite și orice informații disponibile legate de stabilitatea substanțelor chimice la concentrațiile din soluția de testare;
— dacă se efectuează analize chimice, metodele folosite și rezultatele obținute;
— rezultatele testului-limită, după caz;
— motivele alegerii metodei de testare folosite și detalii cu privire la aceasta (de exemplu: statică, semistatică, raportul dozelor, viteza curgerii, condițiile de aerare, greutatea lotului de pești testat etc.);
— descrierea echipamentului de testare;
— regimul de iluminare;
— concentrațiile de oxigen dizolvat, valorile pH-ului și temperaturile soluțiilor testate la fiecare 24 de ore;
— dovada îndeplinirii criteriilor de calitate;
— tabelul care prezintă mortalitatea cumulată pentru fiecare concentrație testată și înregistrările aferente controlului (inclusiv pentru testul martor cu substanță auxiliară, după caz) la fiecare perioadă de observație recomandată;
— graficul curbei de răspuns concentrație/procentaj la sfârșitul testării;
— dacă e posibil, valorile CL50 la fiecare perioadă de observație recomandată (cu limite de încredere de 95 %);
— metodele statistice folosite pentru determinarea valorilor CL50;
— dacă s-a folosit o substanță de referință, rezultatele obținute;
— concentrația testată maximă care nu provoacă mortalitate pe durata testării;
— concentrația testată minimă care provoacă mortalitate 100 % pe durata testării.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
2. AFNOR – Determination of the acute toxicity of a substance to Brachydanio rerio – Static and Flow Through methods – NFT 90-303 June 1985.
3. AFNOR- Determination of the acute toxicity of a substance to Salmo gairdneri – Static and Flow – Through methods – NFT 90-305 June 1985.
4. ISO 7346/1,/2 and/3 – Water Quality – Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan – Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
5. Eidgenössisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden – Part II 1974.
6. DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15).
7. JIS K 0102, Acute toxicity test for fish.
8. NEN 6506 – Water – Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980.
9. Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
10. Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978.
11. Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
12. Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWWA-WPCF, 1975.
13. Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicity of a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
14. Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Okotoxikologie, Grundlagen für die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986.
15. Litchfield, J. T and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, Exp. Therap., 1949, vol. 96, p. 99.
16. Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978.
17. Sprague, J.B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3, p. 793-821.
18. Sprague, J. B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, p. 3-32.
19. Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F. I. Mayer and J. L. Hamelink). American Society for Testing and Materials, ASTM STP 634, 1977, p. 65-84.
20. Stephan, C. E., Busch, K. A., Smith, R., Burke, J. and Andrews, R. W. A computer program for calculating an LC50. US EPA.
Apendicele 1
Apă reconstituită
Exemplu de apă de diluție adecvată
Toate substanțele chimice sunt de puritate analitică.
Apa este apă distilată și de calitate bună sau apă deionizată cu o conductibilitate mai mică de 5 μScm–1.
Aparatura pentru distilarea apei trebuie să nu conțină nicio piesă din cupru.
Soluțiile mamă
|
CaCl2. 2H2O (clorură de calciu dihidrat): Dizolvată și completată până la 1 litru cu apă. |
11,76 g |
|
MgSO4. 7H2O (sulfat de magneziu heptahidrat): Dizolvat și completat până la 1 litru cu apă. |
4,93 g |
|
NaHCO3 (carbonat acid de sodiu): Dizolvat și completat până la 1 litru cu apă. |
2,59 g |
|
KCl (clorură de potasiu): Dizolvată și completată până la 1 litru cu apă. |
0,23 g |
Apă de diluție reconstituită
Se adaugă câte 25 ml din cele patru soluții mamă și se completează până la 1 litru cu apă.
Se aerează până când concentrația oxigenului dizolvat este egală cu valoarea de saturație în aer.
PH-ul este 7,8 ± 0,2.
Dacă este necesar, pH-ul se reglează cu NaOH (hidroxid de sodiu) sau HCl (acid clorhidric).
Apa de diluție astfel preparată este lăsată în repaos aproximativ 12 ore și nu mai este aerată.
Suma ionilor de Ca și Mg în această soluție este 2,5 mmol/l. Raportul ionilor Ca:Mg este 4:1, iar cel al ionilor Na:K este 10:1. Alcalinitatea totală a acestei soluții este 0,8 mmol/l.
Orice abatere în prepararea apei de diluție nu trebuie să schimbe compoziția sau proprietățile apei.
Apendicele 2
Speciile de pești recomandate pentru testare
|
Speciile recomandate |
Intervalul de temperatură recomandat pentru testare ( oC) |
Lungimea totală recomandată a animalului de experiență (cm) |
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton-Buchanan) Peștele zebră |
20-24 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Boiștean |
20-24 |
5,0 ± 2,5 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758) Crap comun |
20-24 |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck and Schlege 1850) |
20-24 |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) Guppy |
20-24 |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) |
20-24 |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) Păstrăv curcubeu |
12-17 |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758) Văduviță |
20-24 |
6,0 ± 2,0 |
Aprovizionare
Peștii din lista de mai sus sunt ușor de crescut și/sau se găsesc din abundență în tot timpul anului. Pot fi crescuți și înmulțiți în crescătoriile de pești sau în laborator, în condiții controlate de boală și paraziți astfel încât animalele testate să fie sănătoase și cu ascendență cunoscută. Acești pești sunt disponibili în multe locuri ale lumii.
Apendicele 3
Exemplu de înregistrare grafică: concentrație/procentul de mortalitate
Exemplu de determinare a CL50 cu hârtie probit logaritmică

C.2. DAPHNIA SP. TESTUL IMOBILIZĂRII ACUTE
1. METODĂ
Această metodă de testare a imobilizării acute este echivalentă cu Orientarea 202 (2004) a OCDE.
1.1. INTRODUCERE
Această metodă descrie un test de toxicitate acută care are rolul de a evalua efectele substanțelor chimice asupra dafniilor. Utilizarea măsurilor de testare existente s-a făcut în limita posibilului (1) (2) (3).
1.2. DEFINIȚII
În contextul utilizării acestei metode s-au folosit următoarele definiții:
CE 50 : concentrația estimată capabilă să imobilizeze 50 % din dafnii în cadrul unei perioade de expunere determinate. În cazul în care se utilizează o altă definiție, aceasta trebuie raportată împreună cu referința.
Imobilizare: animalele incapabile să înoate în intervalul de 15 secunde după agitarea ușoară a recipientului de testare sunt considerate ca fiind imobilizate (chiar dacă își pot mișca încă antenele).
1.3. PRINCIPIUL METODEI DE TESTARE
Dafniile tinere, cu vârsta mai mică de 24 ore în momentul începerii testului, sunt expuse timp de 48 de ore la diferite concentrații ale substanței de testare. Imobilizarea este înregistrată la 24 și la 48 de ore și comparată cu valorile de control. Se analizează rezultatele în scopul calculării CE50 la 48 de ore (a se vedea punctul 1.2 pentru definiții). Determinarea CE50 la 24 de ore este opțională.
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Se recomandă cunoașterea solubilității în apă și a presiunii vaporilor substanței de testare și existența unei metode analitice fiabile pentru dozarea substanței în soluțiile de testare, ale cărei eficiență de recuperare și limită de determinare sunt cunoscute. Informațiile utile includ formula structurală, gradul de puritate al substanței, stabilitatea în apă sau la lumină, coeficientul de partiție octanol/apă – log Pow și rezultatele unui test privind biodegrabilitatea imediată (a se vedea metoda C.4).
Notă: Referința 4 furnizează recomandări în ceea ce privește substanțele de testare cu proprietățile fizice și chimice care fac dificilă testarea acestora.
1.5. SUBSTANȚE DE REFERINȚĂ
O substanță de referință poate fi testată pentru determinarea CE50 ca o metodă de siguranță în sensul fiabilității condițiilor de testare. Se recomandă în acest scop substanțe toxice utilizate în testele circulare internaționale (1) (5) ( 24 ). Se recomandă ca testele cu o substanță de referință să se realizeze de preferință în fiecare lună și cel puțin de două ori pe an.
1.6. CRITERII DE CALITATE
Pentru ca testul să fie valid, se aplică următoarele criterii de performanță:
— în cadrul grupurilor de control, inclusiv grupul de control care conține agent de solubilizare, se recomandă a fi imobilizate cel mult 10 % dintre dafnii;
— concentrația de oxigen dizolvată la sfârșitul testului ar trebui să fie ≥ 3 mg/l în recipientele de control și testare.
Notă: Pentru primul criteriu, cel mult 10 % dintre dafniile din grupul de control trebuie să fie imobilizate sau să prezinte alte semne de maladie sau de stress, precum decolorare sau comportament neobișnuit (de exemplu, rămân prinse la suprafața apei).
1.7. DESCRIEREA METODEI DE TESTARE
1.7.1. Aparatură
Se recomandă ca recipientele de testare și alte aparate care vor intra în contact cu soluțiile de testare să fie complet din sticlă sau dintr-un alt material inert din punct de vedere chimic. În mod normal recipientele de testare sunt eprubete sau pahare de laborator. Se recomandă curățarea acestora înainte de fiecare utilizare prin metodele standard de laborator. Se recomandă ca recipientele de testare să fie acoperite pentru a reduce pierderea de apă prin evaporare, precum și pentru a se evita pătrunderea de praf în soluții. Se recomandă ca substanțele volatile să fie testate în recipiente umplute complet și închise, suficient de mari astfel încât concentrația de oxigen să nu fie prea slabă sau limitată (a se vedea punctul 1.6 și primul alineat al punctului 1.8.3).
În plus, se vor folosi unul sau toate echipamentele următoare: un aparat pentru măsurarea concentrației de oxigen (cu microelectrod sau un alt dispozitiv corespunzător pentru măsurarea oxigenului dizolvat în mostre de volum mic); un aparat pentru măsurarea pH-ului; aparatură adecvată pentru controlul temperaturii; echipament pentru determinarea concentrației totale de carbon organic (COT); echipament pentru determinarea necesarului de oxigen chimic (NOC); echipament pentru determinarea durității etc.
1.7.2. Organism de testare
Specia preferată pentru testare este Daphnia magna Straus, deși se pot folosi pentru acest test și alte specii de Daphnia adecvate (de exemplu, Daphnia pulex). La începutul testului, animalele trebuie să aibă vârsta mai mică de 24 de ore, iar pentru reducerea variabilității, se recomandă ca acestea să nu provină din prima generație de descendenți. Se recomandă să provină dintr-un lot sănătos (să nu prezinte semne de stres cum ar fi mortalitatea ridicată, prezența masculilor și ephippia, întârzieri în producerea primei progenituri, animale decolorate etc.). Se recomandă ca toate organismele utilizate pentru un anumit test să provină din culturi înființate din același lot de dafnii. Lotul respectiv trebuie să fie menținut în condiții de cultură (lumină, temperatură, mediu) similare cu cele utilizate în timpul testului. Dacă mediul de cultură al dafniilor care vor fi utilizate în timpul testului diferă de cel utilizat în mod normal pentru o cultură de dafnii, este bine să se includă o perioadă de aclimatizare înainte de test. De aceea, se recomandă ca dafniile provenite din aceeași cultură să fie menținute în apă de diluare la temperatura de testare timp de aproximativ 48 ore înainte de începerea testului.
1.7.3. Apa de păstrare și diluare
Sunt acceptate ca lichid de păstrare și de diluare apele naturale (de suprafață și subterane), lichid reconstituit sau apă de la robinet declorurată dacă dafniile vor supraviețui în acesta pe durata culturii, aclimatizării și testării fără a prezenta semne de stres. Orice tip de apă care corespunde caracteristicilor chimice ale unei ape de diluare de nivel acceptabil așa cum este prezentat în apendicele 1 este potrivit ca apă pentru testare. Este bine ca aceasta să aibă o calitate constantă de-a lungul perioadei de testare. Apa reconstituită poate fi obținută prin adăugarea, la apa deionizată sau distilată, a unei cantități specifice de reactivi având o gradare analitică recunoscută. Referințele 1, 6 și apendicele 2 oferă exemple de apă reconstituită. A se observa că mediile care conțin agenți de chelare cunoscuți, cum ar fi mediile M4 și M7 din apendicele 2, trebuie evitate la testarea substanțelor care conțin metale. Se recomandă un pH într-o gamă de la 6 la 9. Pentru Daphnia Magna se recomandă o duritate cuprinsă între 140 și 250 mg/l (cum ar fi CaCO3), în timp ce un grad mai scăzut de duritate poate fi adecvat pentru alte specii de Daphnia. Apa pentru diluare poate fi aerată înainte de a fi utilizată pentru test astfel încât concentrația de oxigen dizolvat să fi atins gradul de saturație.
Dacă se utilizează apă naturală, se recomandă ca parametrii de calitate să fie măsurați cel puțin de două ori pe an sau ori de câte ori se presupune că aceste caracteristici este posibil să se fi schimbat semnificativ (a se vedea alineatul anterior și apendicele 1). De asemenea, se recomandă realizarea măsurătorilor concentrației de metale grele (de exemplu, Cu, Pb, Zn, Hg, Cd, Ni). Dacă se utilizează apă de robinet declorurată, este de dorit să se realizeze o analiză zilnică a conținutului de cloruri. Dacă apa de diluare provine de la o apă de suprafață sau subterană, se recomandă măsurarea necesarului de conductivitate și carbon organic total (COT) sau de oxigen chimic.
1.7.4. Soluții de testare
Soluțiile de testare cu concentrațiile alese se prepară de obicei prin diluarea unei soluții din stoc. Este preferabil ca soluțiile din stoc să se prepare prin dizolvarea substanței de testare în apa de diluare. Pe cât posibil, se recomandă evitarea solvenților, a emulsifianților sau a dispersanților. Totuși, astfel de componente pot fi necesare în anumite situații pentru a se produce o soluție de stoc cu o concentrație corespunzătoare. Recomandări privind solvenții, emulsifianții și dispersanții adecvați se regăsesc la referința 4. În orice caz, se recomandă ca substanțele de testare din soluțiile de testare să nu depășească limita solubilității în apa de diluare.
Se recomandă ca testul să se desfășoare fără a se regla pH-ul. Dacă pH-ul nu rămâne în interiorul gamei 6-9, atunci se poate realiza un al doilea test, reglând pH-ul soluției de stoc la acela al apei de diluare înainte de adăugarea substanței de testare. Se recomandă ca reglarea pH-ului să se facă astfel încât concentrația soluției de stoc să nu fie schimbată semnificativ și astfel încât să nu se producă nicio reacție chimică sau precipitare a substanței de testare. Se preferă HCl și NaOH.
1.8. PROCEDURĂ
1.8.1. Condiții de expunere
1.8.1.1. Grupuri de testare și control
Vasele pentru testare se umplu cu volume corespunzătoare de apă diluată și soluții de substanțe de testare. Se recomandă ca proporția aer/volum de apă din vas să fie identică pentru grupurile de testare și control. Se plasează apoi dafniile în vasele de testare. Se recomandă a se utiliza cel puțin 20 de animale, împărțite în patru grupuri de câte cinci animale fiecare, la fiecare concentrație a testului și pentru controale. Se vor furniza cel puțin 20 ml de soluție pentru fiecare animal (respectiv o cantitate de 10 ml pentru cinci dafnii pe fiecare vas de testare). Atunci când concentrația substanței de testare nu este stabilă, testul se poate desfășura utilizând un sistem de reînnoire semi-statică sau continuă.
În plus față de seria pentru tratament, trebuie desfășurate o serie de control a apei de diluare și, de asemenea, dacă este relevant, o serie de control conținând agent de solubilizare.
1.8.1.2. Concentrațiile pentru testare
Se poate desfășura un test pentru definirea gamei de concentrații de utilizat la testarea definitivă cu condiția să existe informații privind toxicitatea substanței de test. În acest scop, dafniile sunt expuse unei serii de concentrații a substanței de testare întinsă pe un interval larg. Se vor expune un număr de cinci dafnii la fiecare concentrație de testare timp de 48 ore sau mai puțin, și nu este necesară repetarea. Perioada de expunere poate fi scurtată (de exemplu, 24 ore sau mai puțin) dacă datele necesare desfășurării testului de definire a gamei pot fi obținute în mai puțin timp.
Se recomandă a se utiliza cel puțin cinci concentrații de testare. Se recomandă aranjarea acestora într-o serie geometrică având un factor de separare care este preferabil să nu depășească 2.2. În cazul în care se utilizează mai puțin de cinci concentrații, se vor aduce argumente pentru aceasta. Este de preferat ca cea mai înaltă concentrație testată să conducă la o imobilizare de 100 %, iar cea mai joasă concentrație testată este preferabil să nu producă efecte observabile.
1.8.1.3. Condiții de incubare
Este recomandat ca temperatura să se situeze în intervalul 18-22 oC, iar în cazul unei singure testări, este bine ca aceasta să rămână constantă în limita ± 1 oC. Se recomandă un ciclu de 16 ore de lumină și 8 ore de întuneric. Se acceptă și întuneric deplin, în special pentru substanțele de testare care prezintă instabilitate la lumină.
Este interzis ca vasele să fie aerate pe perioada testării. Testul se desfășoară fără reglarea pH-ului. Se recomandă ca dafniile să nu fie hrănite pe perioada testului.
1.8.1.4. Durată
Durata testului este de 48 ore.
1.8.2. Observații
La fiecare 24 ore și 48 ore după începerea testării, fiecare vas de testare va fi verificat pentru depistarea dafniilor imobilizate (a se vedea punctul 1.2 pentru definiții). În plus față de imobilitate, se va raporta orice reacție sau imagine anormală.
1.8.3. Măsurători analitice
Se măsoară oxigenul dizolvat și pH-ul la începutul și la sfârșitul testării și concentrația cea mai înaltă a substanței de testare și de control. Se recomandă o concentrație a oxigenului dizolvat care să fie în concordanță cu criteriile de validitate (a se vedea punctul 1.6). În mod normal concentrația pH-ului nu trebuie să varieze cu mai mult de 1,5 unități în cadrul oricărui test. De obicei se măsoară temperatura în vasele de control sau în aerul ambiental și se recomandă ca aceasta să fie înregistrată, de preferință, în mod continuu pe perioada testului sau, ca cerință minimă, la începutul și la sfârșitul testării.
Se recomandă măsurarea concentrației substanței de testare cel puțin la valoarea maximă și la valoarea minimă, la începutul și la sfârșitul testării (4). Se recomandă ca rezultatele să fie bazate pe concentrații măsurate. Totuși, dacă există probe care să demonstreze că s-a menținut concentrația substanței de testare în mod corespunzător în intervalul ± 20 % față de concentrația nominală sau măsurată inițial, pe tot parcursul perioadei de testare, atunci rezultatele pot fi calculate pe baza valorilor nominale sau măsurate inițial.
1.9. TEST-LIMITĂ
Utilizând procedurile descrise în prezenta metodă, se poate efectua un test-limită la 100 mg/l de substanță de testare sau până la limita sa de solubilitate în mediul de testare (oricare dintre acestea este mai scăzută) pentru a demonstra că CE50 este mai mare decât această concentrație. Se recomandă efectuarea testului-limită prin utilizarea a 20 de dafnii (împărțite preferabil în patru grupuri de câte cinci), cu același număr de animale grupurile de control. Dacă imobilizarea se manifestă, se va realiza un studiu complet. Se va înregistra orice reacție anormală detectată.
2. DATE
Datele sunt sintetizate sub formă de tabel, indicând, pentru fiecare grup de tratament și control, numărul de dafnii utilizat, imobilizarea la fiecare observare. Procentele imobilizate la 24 și 48 de ore se vor pondera față de concentrațiile de testare. Datele se analizează cu mijloace statistice adecvate (de exemplu analiză de probitate etc.) pentru a se calcula pantele curbelor și CE50 în limite de fiabilitate de 95 % (p = 0,05) (7) (8).
În situațiile în care metodele standard de calculare a CE50 nu sunt aplicabile pentru datele obținute, se recomandă utilizarea celei mai mari concentrații care nu produce imobilitate și a celei mai scăzute concentrații care produce imobilitate 100 % ca metodă de aproximare a CE50 (aceasta devenind media geometrică a acestor două concentrații).
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare va include următoarele:
Substanța de testare:
— stare fizică și proprietățile fizico-chimice relevante;
— date de identificare de natură chimică, inclusiv puritatea.
Specia folosită pentru testare:
— sursa și speciile de Daphnia, originea sursei (dacă este cunoscută) și condițiile de cultură utilizate (inclusiv origine, tip și cantitate de hrană, frecvența hrănirii).
Condiții de testare:
— descrierea vaselor de testare: tipul de vase, volumul soluției, numărul de dafnii pe vas de testare, numărul de vase de testare (replicate) pe concentrație;
— metode de preparare a stocului și a soluțiilor de testare, inclusiv utilizarea oricărui solvent sau dispersant, concentrațiile utilizate;
— detalii privind apa utilizată pentru diluare: caracteristicile sursei și calității apei (pH, duritate; proporția Ca/Mg; proporția Na/K; alcalinitate, conductivitate etc.); compoziția apei reconstituite dacă aceasta a fost utilizată;
— condiții de incubare: temperatură, intensitatea și frecvența luminii; cantitatea de oxigen dizolvat, pH etc.
Rezultate:
— numărul și procentajul de dafnii care au fost imobilizate sau care au prezentat efecte negative (inclusiv reacții anormale) în grupurile de control și în fiecare grup de tratare, la fiecare interval de observare și o descriere a naturii efectelor observate;
— rezultatele și datele testului efectuat cu substanțe de referință, dacă sunt disponibile;
— valorile nominale ale concentrațiilor de testare și rezultatul tuturor analizelor pentru a determina concentrația substanței de testare în vasele de testare; de asemenea, se vor raporta eficiența de recuperare a metodei și limita de determinare;
— toate măsurătorile fizico-chimice ale temperaturii, pH-ului și oxigenului dizolvat de-a lungul perioadei de testare;
— CE50 la 48 de ore referitor la imobilizare cu limite de fiabilitate și grafice ale modelului adecvat utilizat pentru calcul, pantele curbelor de răspuns la dozaj și eroarea standard; procedurile statistice utilizate pentru determinarea CE50; (aceste informații referitoare la imobilizare la 24 de ore se vor raporta la momentul la care au fost măsurate);
— explicații privind orice abatere de la metoda de testare și dacă abaterea a afectat rezultatele testului.
4. REFERINȚE BIBLIOGRAFICE
1. ISO 6341. (1996). Water quality – Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) – Acute toxicity test. Third edition, 1996.
2. EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines – Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
3. Environment Canada. (1996) Biological test method. Acute Lethality Test Using Daphnia sp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada.
4. Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000.
5. Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia.
6. OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998.
7. Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 – American Society for Testing and Materials, p. 65-84.
8. Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK.
APENDICELE 1
ANUMITE CARACTERISTICI CHIMICE ALE UNEI APE DE DILUARE DE NIVEL ACCEPTABIL
|
Substanță |
Concentrație |
|
Particule |
< 20 mg/l |
|
Carbon organic total |
< 2 mg/l |
|
Amoniac neionizat |
< 1 μg/l |
|
Clorură reziduală |
< 10 μg/l |
|
Cantitate totală de pesticide organofosforoase |
< 50 ng/l |
|
Cantitate totală de pesticide organoclorurate plus bifenili policlorurați |
< 50 ng/l |
|
Cantitate totală de clorură organică |
< 25 ng/l |
APENDICELE 2
EXEMPLE DE APĂ DE TESTARE RECONSTITUITĂ ACCEPTABILĂ
ISO Apă de testare (1)
|
Soluție de stoc (o singură substanță) |
Pentru prepararea apei reconstituite, se adaugă următoarele volume de soluții din stoc la 1 l de apă (1) |
|
|
Substanță |
Cantitate adăugată la 1 l de apă (1) |
|
|
Clorură de calciu CaCl2, 2H2O |
11,76 g |
25 ml |
|
Sulfat de magneziu MgSO4, 7H2O |
4,93 g |
25 ml |
|
Bicarbonat de sodiu NaHCO3 |
2,59 g |
25 ml |
|
Clorură de potasiu KCl |
0,23 g |
25 ml |
|
(1) Apă cu un grad de puritate adecvat, de exemplu deionizată, distilată sau obținută prin osmoză inversă, cu o conductivitate de preferință inferioară valorii de 10 μS.cm–1. |
||
Medii Elendt M4 și M7
Aclimatizare la mediile Elendt M4 și M7
Anumite laboratoare au întâmpinat dificultăți în a transfera direct Daphnia în mediile M4 și M7. Totuși, au fost obținute anumite succese printr-o aclimatizate graduală, respectiv prin mutarea din propriul mediu la 30 % Elendt, apoi la 60 % Elendt și apoi la 100 % Elendt. Este posibil ca perioada de aclimatizare să ajungă până la o lună.
Pregătire
Soluțiile de stoc separate (I), conținând elemente individuale de urmărire se prepară mai întâi în apă cu o puritate adecvată, de exemplu, deionizată, distilată sau obținută prin osmoză inversă. Din aceste soluții de stoc diferite (I) se prepară o singură soluție de stoc (II), care conține toate elementele de urmărire (soluție combinată), de exemplu:
|
Soluție (soluții) de stoc I (o singură substanță) |
Cantitate adăugată la apă (mg/l) |
Concentrație (în raport cu mediul M4) |
Pentru prepararea soluției combinate de stoc II, se adaugă următoarele volume de soluții de stoc I la cantitatea de apă (ml/l) |
|
|
M4 |
M7 |
|||
|
H3 BO3 |
57 190 |
20 000 de ori |
1,0 |
0,25 |
|
MnCl2.4H2O |
7 210 |
20 000 de ori |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 de ori |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 de ori |
1,0 |
0,25 |
|
SrCl2.6H2O |
3 040 |
20 000 de ori |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 de ori |
1,0 |
0,25 |
|
Na2 MoO4.2H2O |
1 230 |
20 000 de ori |
1,0 |
0,25 |
|
CuCl2.2H2O |
335 |
20 000 de ori |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 de ori |
1,0 |
1,0 |
|
CoCl2.6H2O |
200 |
20 000 de ori |
1,0 |
1,0 |
|
KI |
65 |
20 000 de ori |
1,0 |
1,0 |
|
Na2 SeO3 |
43,8 |
20 000 de ori |
1,0 |
1,0 |
|
NH4 VO3 |
11,5 |
20 000 de ori |
1,0 |
1,0 |
|
Na2 EDTA.2H2O |
5 000 |
2 000 de ori |
— |
— |
|
FeSO4.7H2O |
1 991 |
2 000 de ori |
— |
— |
|
Ambele soluții, Na 2 EDTA și FeSO4, se prepară independent, se toarnă împreună și se autoclavează imediat. |
||||
|
Aceasta conduce la: |
||||
|
Soluție 2 l Fe-EDTA |
1 000 de ori |
20,0 |
5,0 |
|
Mediile M4 și M7 se prepară utilizând soluția de stoc II, macro-nutrienți și vitamine după cum urmează:
|
Cantitate adăugată la apă (mg/l) |
Concentrație (în raport cu mediul M4) |
Cantitate de soluție de stoc II adăugată pentru a prepara mediul (ml/l) |
||
|
M4 |
M7 |
|||
|
Soluție de stoc II (elemente de urmărire combinate) |
20 de ori |
50 |
50 |
|
|
Soluții complexe pe bază de macro nutrienți (substanță singulară) |
||||
|
CaCl2 · 2H2O |
293 800 |
1 000 de ori |
1,0 |
1,0 |
|
MgSO4 · 7H2O |
246 600 |
2 000 de ori |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 de ori |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 de ori |
1,0 |
1,0 |
|
Na2 SiO3 · 9H2O |
50 000 |
5 000 de ori |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 de ori |
0,1 |
0,1 |
|
KH2 PO4 |
1 430 |
10 000 de ori |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 de ori |
0,1 |
0,1 |
|
Soluție de stoc de vitamine combinate |
— |
10 000 de ori |
0,1 |
0,1 |
|
Soluția de stoc pe bază de vitamine combinate se prepară prin adăugarea a 3 vitamine la 1 l de apă, după cum se indică mai jos: |
||||
|
Clorhidrat de tiamină |
750 |
10 000 de ori |
||
|
Cianocobalamin (B12) |
10 |
10 000 de ori |
||
|
Biotină |
7,5 |
10 000 de ori |
||
Soluția pe bază de vitamine combinate se păstrează congelată în alicoturi. Vitaminele se adaugă în medii imediat înainte de utilizare.
|
NB |
: |
Pentru a evita precipitarea sărurilor atunci când se pregătesc mediile finale, se adaugă conținutul din alicoturi de substanță de stoc la o cantitate de aproximativ 500-800 ml de apă deionizată și apoi se umple până la 1 l. |
|
NB |
: |
Prima publicație referitoare la mediul M4 se găsește în Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, p. 25-33. |
C.3. ALGE DE APĂ DULCE ȘI CIANOBACTERII, TEST DE INHIBARE A CREȘTERII
1. METODĂ
Această metodă este echivalentă cu orientările OECD privind testele nr. 201 (2006)(1).
1.1. INTRODUCERE
Metodele de testare se revizuiesc și se actualizează conform progreselor științifice. Revizuirea metodei de testare C.3 era necesară pentru a include specii noi și pentru a îndeplini cerințele de evaluare a riscurilor și clasificare a substanțelor chimice. Revizuirea a fost efectuată pe baza unei experiențe practice largi, a progresului științific în domeniul studierii toxicității algelor și a utilizării largi în domeniul reglementării care s-au înregistrat după prima adoptare.
1.2. DEFINIȚII
Următoarele definiții și prescurtări se folosesc în sensul prezentei metode de testare:
Biomasă: greutatea uscată a materiei vii prezente într-o populație, exprimată în termenii unui volum dat; de exemplu mg alge/litru soluție de testat. De obicei, „biomasa” se definește ca masă, dar, în prezentul test, acest cuvânt desemnează masa per volum. Tot în prezentul test, se măsoară de obicei înlocuitorii pentru biomasă, cum ar fi numărul de celule, fluorescența etc., iar folosirea termenului „biomasă” se referă așadar și la măsurarea acestor înlocuitori.
Coeficient de variație: este o măsură adimensională a variabilității unui parametru, definită ca raportul dintre deviația standard și medie. Aceasta se poate exprima, de asemenea, ca valoare în procente. Coeficientul mediu de variație al vitezei medii specifice de creștere în culturi de control duplicate se calculează după cum urmează:
1. Se calculează % CV ale vitezei medii specifice de creștere din vitezele de creștere zilnice/pe secțiuni la culturile de control duplicate pentru duplicatul respectiv.
2. Se calculează valoarea medie a tuturor valorilor calculate la subpunctul 1 pentru a se obține coeficientul mediu de variație a vitezei specifice de creștere pe zi/pe secțiuni la culturile de control duplicate.
ECx : este concentrația substanței de testat dizolvate în mediul de testare din care rezultă o reducere de x % (de exemplu 50 %) a creșterii organismului de testat într-o anumită perioadă de expunere (care se menționează explicit în cazul în care durata completă sau normală a testului se modifică). Pentru a se reprezenta în mod clar valoarea EC derivată din viteza de creștere sau randament, se folosesc simbolurile „ErC”, respectiv „EyC”.
Mediu de cultură: este mediul de cultură complet sintetic în care algele de test cresc când sunt expuse substanței de testat. În mod normal, substanța de testat se dizolvă în mediul de test.
Viteza de creștere (viteza medie specifică de creștere): este creșterea logaritmică a biomasei în timpul perioadei de expunere.
Concentrația minimă cu efect observabil (CMEO): este cea mai scăzută concentrație testată la care se observă că substanța are un efect semnificativ din punct de vedere statistic asupra creșterii (la p < 0,05) prin comparație cu lotul martor, la un timp de expunere dat. Toate concentrațiile testate mai mari decât CMEO trebuie să aibă efect nociv egal sau mai mare decât cel observat la CMEO. Dacă aceste două condiții nu pot fi satisfăcute, se va furniza o explicație completă privind modul în care a fost selectat CMEO (și, prin urmare, CFEO).
Concentrația fără efecte observabile (CFEO): este concentrația testată imediat sub valoarea CMEO.
Variabilă de răspuns: este o variabilă pentru estimarea toxicității derivate din orice parametri măsurați care descriu biomasa prin diferite metode de calcul. În cazul acestei metode, vitezele de creștere și randamentul sunt variabile de răspuns derivate din măsurarea directă a biomasei sau a oricăruia dintre înlocuitorii menționați.
Viteza specifică de creștere: este o variabilă de răspuns definită ca raportul dintre diferența dintre logaritmii naturali ai unui parametru de observație (biomasa, în prezenta metodă de test) și perioada respectivă de timp.
Randament: este valoarea unei variabile de măsurare la sfârșitul perioadei de expunere minus valoarea variabilei de măsurare la începutul perioadei de expunere, pentru exprimarea creșterii biomasei în timpul testului.
1.3. APLICABILITATEA TESTULUI
Prezenta metodă de testare se aplică cel mai ușor în cazul substanțelor solubile în apă care, în condițiile testului, sunt susceptibile să rămână în apă. În cazul testării de substanțe volatile, puternic adsorbante, colorate, cu o solubilitate scăzută în apă, sau substanțe care pot afecta disponibilitatea nutrienților sau a mineralelor în mediul de test, pot fi necesare anumite modificări ale procedurii de testare descrise (de exemplu sistem închis, condiționarea vaselor de testare). Îndrumări privind unele modificări corespunzătoare se află la notele (2), (3) și (4).
1.4. PRINCIPIUL TESTULUI
Scopul acestui test constă în determinarea efectelor unei substanțe asupra creșterii microalgelor de apă dulce și/sau cianobacteriilor. Organismele de test cu o creștere exponențială se expun substanței de testat sub formă de loturi de cultură în general pentru o perioadă de 72 de ore. În pofida duratei relativ scurte a testului, se pot evalua efectele asupra câtorva generații.
Sistemul răspunde prin reducerea creșterii la o serie de culturi de alge (unități de test) expuse la diferite concentrații ale substanței de testat. Răspunsul se evaluează ca o funcție a concentrației de expunere în comparație cu creșterea medie a culturilor de control duplicate și neexpuse. Pentru exprimarea completă a răspunsului sistemului la efecte toxice (sensibilitate optimă), culturilor le este permisă o creștere exponențială nerestricționată în condiții de hrănire suficientă și lumină continuă, pentru o perioadă de timp suficientă pentru măsurarea reducerii vitezei specifice de creștere.
Creșterea și inhibarea creșterii sunt cuantificate prin măsurarea biomasei de alge în funcție de timp. Biomasa de alge se definește ca greutatea uscată per volum de soluție de testat, de exemplu mg alge/litru. Greutatea uscată este dificil de măsurat și, prin urmare, se folosesc parametri înlocuitori. Dintre acești parametri, numărul celulelor este cel mai des folosit. Alți parametri înlocuitori sunt volumul celulelor, fluorescența, densitatea optică etc. Este necesară cunoașterea unui factor de conversie între parametrul înlocuitorului măsurat și biomasă.
Punctul final al testului este inhibarea creșterii, exprimată ca creștere logaritmică a biomasei (viteza medie specifică de creștere) în timpul perioadei de expunere. Concentrația care provoacă o inhibare a vitezei de creștere specificată de x % (de exemplu 50 %) și exprimată ca ErCx (de exemplu ErC50) se determină din vitezele specifice medii de creștere înregistrate la o serie de soluții de testat.
Pentru aplicarea acestei metode în cadrul de reglementare al UE, calculul rezultatelor trebuie să se bazeze pe viteza specifică medie de creștere, din rațiunile expuse în continuare la punctul 2.2. O variabilă de răspuns suplimentară folosită în prezenta metodă de testare este randamentul, care poate fi necesar pentru îndeplinirea unor cerințe de reglementare specifice din unele țări. Acesta se definește ca biomasa la sfârșitul perioadei de expunere minus biomasa la începutul perioadei de expunere. Pe baza randamentului înregistrat pentru o serie de soluții de testat, concentrația care provoacă o inhibare a randamentului specificat de x % (de exemplu 50 %) se calculează și se exprimă ca EyCx (de exemplu EyC50).
În plus, concentrația minimă cu efect observabil (CMEO) și concentrația fără efecte observabile (CFEO) se pot determina statistic.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Informațiile referitoare la substanța de testare, care pot fi utile pentru stabilirea condițiilor de testare, includ formula structurală, puritatea, stabilitatea la lumină, stabilitatea în condițiile de testare, proprietățile de absorbție a luminii, pKa și rezultatele studiilor de transformare, inclusiv biodegrabilitatea în apă.
Este necesar să se cunoască solubilitatea în apă, coeficientul de partiție octanol/apă (Pow) și presiunea de vapori a substanței testate și să existe o metodă validată de determinare cantitativă a substanței în soluțiile de testat, cu eficiența recuperării și limita de detecție specificate.
1.6. SUBSTANȚĂ DE REFERINȚĂ
Substanța (substanțele) de referință, cum ar fi 3,5-diclorofenol, folosite în testul internațional interlaboratoare (4), pot fi testate ca mijloc de validare a procedurii de testare. Dicromatul de potasiu poate fi folosit, de asemenea, ca substanță de referință pentru algele verzi. Este de preferat ca o substanță de referință să fie testată de cel puțin două ori pe an.
1.7. VALIDITATEA TESTULUI
Pentru ca un test să fie valabil, trebuie să îndeplinească următoarele criterii de performanță:
— Biomasa din culturile de control trebuie să fi crescut exponențial cu un factor de cel puțin 16 pe durata de 72 ore a perioadei de testare. Acest lucru corespunde unei viteze specifice de creștere de 0,92 zi–1. În cazul speciilor utilizate cel mai frecvent, viteza de creștere este de obicei considerabil mai mare (a se vedea apendicele 1). Este posibil ca acest criteriu să nu fie respectat atunci când sunt folosite specii care cresc mai lent decât cele prezentate în apendicele 1. În acest caz, perioada de testare se extinde pentru a fi obținută o creștere de cel puțin 16 ori în culturile de control, creșterea trebuind să fie exponențială pe durata perioadei de testare. Atât timp cât factorul minim de multiplicare 16 este atins, perioada de testare poate fi redusă la cel puțin 48 de ore în scopul menținerii creșterii exponențiale nelimitate în timpul testului.
— Coeficientul mediu de variație pentru vitezele specifice de creștere pe secțiuni (zilele 0-1, 1-2 și 2-3 pentru testele de 72 ore) în culturile de control (a se vedea „coeficient de variație”, punctul 1.2) nu trebuie să depășească 35 %. A se vedea punctul 2.2.1 al doilea paragraf, pentru calcularea vitezei specifice de creștere pe secțiuni. Acest criteriu se aplică valorii medii a coeficienților de variație calculați pentru culturile de control duplicate.
— Coeficientul de variație al vitezelor medii specifice de creștere a culturilor de control duplicate nu trebuie să depășească 7 % la testele cu Pseudokirchneriella subcapitata și Desmodesmus subspicatus în timpul întregii perioade de testare. În cazul altor specii mai puțin testate, valoarea nu trebuie să depășească 10 %.
1.8. DESCRIEREA METODEI
1.8.1. Aparatură
Vasele de testare și alte aparate care intră în contact cu soluțiile de testat trebuie să fie confecționate în întregime din sticlă sau alt material chimic inert. Vasele trebuie să fie spălate cu atenție pentru prevenirea efectelor contaminanților organici sau anorganici asupra creșterii algelor sau compoziției soluțiilor de testat.
Vasele de testare vor fi recipiente normale din sticlă de dimensiuni cuprinzând un volum suficient de cultură pentru măsurătorile din cursul testului și permițând un transfer suficient de masă de CO2 din atmosferă (a se vedea punctul 1.8.9 al doilea paragraf). Trebuie reținut că volumul de lichid trebuie să fie suficient pentru efectuarea determinărilor analitice (a se vedea punctul 1.8.11 al cincilea paragraf).
În afară de acestea, mai sunt necesare următoarele aparate:
— Aparat pentru cultură: se recomandă un laborator sau o cameră în care se poate menține o temperatură controlată de incubație de ± 2 °C.
— Instrumente de măsurare a luminii: este important de remarcat că metoda de măsurare a intensității luminii și, în special, tipul de receptor (colector) vor influența valoarea măsurată. Măsurătorile se fac preferabil prin folosirea unui receptor sferic (4 π), care răspunde la lumina directă și reflectată provenită din toate unghiurile de deasupra și dedesubtul planului de măsurare, sau a unui receptor (2 π), care răspunde la lumina provenită din toate unghiurile de deasupra planului de măsurare.
— Aparat pentru determinarea biomasei de alge. Numărul celulelor, care este cel mai frecvent utilizat parametru înlocuitor pentru biomasa de alge, poate fi obținut prin folosirea unui contor electronic de particule, a unui microscop cu cameră de numărare sau a unui citometru de flux. Alți înlocuitori de biomasă se pot măsura folosind un citometru de flux, fluorimetru, spectrofotometru sau colorimetru. Este utilă calcularea unui factor de conversie care să stabilească relația dintre numărul de celule și greutatea uscată. Pentru a se obține rezultate utile ale măsurătorilor la concentrații scăzute de biomasă poate fi necesară folosirea de cuve cu un traseu al razelor luminoase de cel puțin 4 cm.
1.8.2. Organismele testate
Se pot folosi câteva specii de microalge și cianobacterii neatașate. S-a demonstrat că sușele descrise în apendicele 1 sunt adecvate prin folosirea procedurii de testare specificate în prezenta metodă de testare.
Dacă se folosesc alte specii, sușa și/sau originea se raportează. Trebuie să se confirme că creșterea exponențială a algelor de testat selectate poate fi menținută pe întreaga durată a perioadei de testare, în condițiile predominante.
1.8.3. Mediu de cultură
Se recomandă două medii alternative de cultură, OECD și AAP. Compozițiile acestor medii sunt prezentate în apendicele 2. Trebuie reținut că valoarea inițială a pH-ului și capacitatea de tamponare (care reglează creșterea pH-ului) pentru cele două medii sunt diferite. Prin urmare, rezultatele testelor pot fi diferite, în funcție de mediul folosit, în special în cazul testării de substanțe ionizante.
Modificarea mediilor de cultură poate fi necesară pentru anumite scopuri, cum ar fi situațiile în care se testează metale și agenți de chelare sau la valori diferite ale pH-ului. Folosirea unui mediu modificat se descrie și se justifică în detaliu (3)(4).
1.8.4. Concentrația inițială a biomasei
Biomasa inițială din culturile testate trebuie să fie egală în toate aceste culturi și suficient de scăzută pentru a permite creșterea exponențială pe parcursul întregii perioade de incubare fără riscul de epuizare a nutrienților. Biomasa inițială nu trebuie să depășească 0,5 mg/l ca greutate uscată. Se recomandă următoarele concentrații celulare inițiale:
|
Pseudokirchneriella subcapitata |
5 × 103-104 |
celule/ml |
|
Desmodesmus subspicatus |
2-5 × 103 |
celule/ml |
|
Navicula pelliculosa |
104 |
celule/ml |
|
Anabaena flos-aquae |
104 |
celule/ml |
|
Synechococcus leopoliensis |
5 × 104-105 |
celule/ml |
1.8.5. Concentrațiile substanței de testat
Intervalul concentrațiilor în care pot apărea efectele se determină pe baza rezultatelor testelor de stabilire a intervalului. Pentru testul final se aleg cel puțin cinci concentrații în serie geometrică cu o rație care nu depășește 3,2. O rație mai mare este justificată în cazul substanțelor de testat care au o curbă de răspuns a concentrației cu pantă lină. Se preferă ca seriile de concentrație să acopere intervalul care provoacă 5-75 % inhibare a vitezei de creștere a algelor.
1.8.6. Duplicate și probe martor
Concepția experimentală a testului trebuie să includă trei duplicate la fiecare concentrație de testare. Dacă determinarea CFEO nu este necesară, testul poate fi modificat în sensul creșterii numărului de concentrații și reducerea numărului de duplicate per concentrație. Numărul de duplicate de control trebuie să fie de cel puțin trei, recomandându-se să depășească de două ori numărul duplicatelor folosite pentru fiecare concentrație de testare.
Pentru determinările analitice ale concentrațiilor substanței de testare se poate pregăti un set separat de soluții de testat (a se vedea punctul 1.8.11 al patrulea și al șaselea paragraf).
Dacă se utilizează un solvent pentru solubilizarea substanței testate, în test se vor include probe martor suplimentare conținând solventul în aceeași concentrație cu cea folosită în cazul culturilor testate.
1.8.7. Pregătirea culturii de inocul
În scopul adaptării algei de testat la condițiile de testare și al asigurării că algele se află în fază de creștere exponențială când sunt folosite pentru inocularea soluțiilor de testat, se pregătește o cultură de inocul în mediul de testare cu 2-4 zile înainte de începerea testului. Biomasa de alge se ajustează pentru a favoriza o creștere exponențială în cultura de inocul până la începerea testului. Cultura de inocul se incubează în aceleași condiții ca și culturile testate. Se măsoară creșterea biomasei în cultura de inocul pentru a se verifica dacă creșterea se încadrează în intervalul normal pentru sușa experimentală în condițiile de cultură. Un exemplu al procedurii pentru cultura algelor este descris în apendicele 3. Pentru a se evita diviziunile sincronizate ale celulelor în timpul testului, poate fi necesară o a doua etapă de propagare a culturii de inocul.
1.8.8. Pregătirea soluțiilor de testat
Toate soluțiile de testat trebuie să conțină aceleași concentrații de mediu de cultură și de biomasă inițială a algelor testate. Soluțiile de testat ale concentrațiilor alese se pregătesc de obicei prin amestecarea unei soluții mamă a substanței de testat cu mediu de cultură și cultură de inocul. De obicei, soluțiile mamă se pregătesc prin dizolvarea substanței în mediul de testare.
Solvenții, cum ar fi acetona, t-butil alcool și dimetil-formamida, pot fi folosiți ca purtători pentru adăugarea în mediul de testare de substanțe cu solubilitate scăzută în apă (2)(3). Concentrația solventului nu trebuie să depășească 100 μl/l, aceeași concentrație de solvent adăugându-se în toate culturile (inclusiv în probele martori) din seria de testare.
1.8.9. Incubarea
Se acoperă vasele de testare cu capace care permit trecerea aerului. Vasele se agită, după care se introduc în aparatul de cultură. Este necesar ca, în timpul testului, algele să fie menținute în suspensie și să se faciliteze transferul de CO2. În acest scop, se vor folosi mișcări de agitare și amestecare constante. Culturile se mențin la temperaturi între 21-24 °C, cu o marjă de ± 2 °C. În cazul altor specii decât cele prezentate în apendicele 1, cum ar fi specii tropicale, pot fi utile temperaturi mai înalte, cu condiția îndeplinirii criteriilor de validitate. Se recomandă ca recipientele să fie așezate aleatoriu și repoziționate în fiecare zi în incubator.
pH-ul mediului de control nu trebuie să crească cu mai mult de 1,5 unități în timpul testului. În cazul metalelor și compușilor care se ionizează parțial la un pH aproximativ egal cu pH-ul de test, poate fi necesară limitarea devierii pH-ului în scopul obținerii de rezultate reproductibile și bine definite. O deviere de < 0,5 unități pH este posibilă din punct de vedere tehnic și poate fi obținută prin asigurarea unei viteze adecvate de transfer de masă CO2 din aerul înconjurător către soluția de testat, de exemplu prin creșterea vitezei de agitare. O altă metodă constă în reducerea necesarului de CO2 prin reducerea biomasei inițiale sau a duratei testului.
Suprafața unde sunt incubate culturile trebuie să primească iluminare fluorescentă continuă și uniformă, de tipul celei „alb-rece” sau „lumina zilei”. Sușele de alge și cianobacterii sunt diferite din punctul de vedere al necesarului de lumină. Intensitatea luminii se selectează la un nivel adecvat pentru organismul folosit. În cazul speciilor recomandate de alge verzi, intensitatea luminii la nivelul soluțiilor de testat se selectează în domeniul 60-120 μE·m–2·s–1 când se măsoară în domeniul de lungimi de undă eficient din punct de vedere fotosintetic de 400-700 nm, folosindu-se un receptor corespunzător. Unele specii, în special Anabaena flos-aquae, cresc bine la intensități scăzute ale luminii și pot fi afectate la intensități ridicate. În cazul unor astfel de specii se selectează o intensitate luminoasă medie în intervalul 40-60 μE·m–2·s–1. (În cazul instrumentelor de măsurare a luminii calibrate în lux, un interval echivalent de 4 440-8 880 lucși pentru lumină albă rece corespunde aproximativ intensității luminoase recomandate 60-120 μE·m–2·s–1). Intensitatea luminii nu trebuie să varieze cu mai mult de ± 15 % din intensitatea medie a luminii din zona de incubare.
1.8.10. Durata testului
Durata normală a testului este de 72 de ore. Cu toate acestea, pot fi folosite durate de test mai lungi sau mai scurte, cu condiția respectării tuturor criteriilor de validitate de la punctul 1.7.
1.8.11. Măsurători și determinări analitice
Biomasa de alge din fiecare recipient se determină cel puțin o dată pe zi în timpul perioadei de testare. Dacă măsurătorile se fac pe volume mici, extrase din soluția de testat cu o pipetă, acestea nu se înlocuiesc.
Măsurarea biomasei are loc prin numărarea manuală a celulelor cu ajutorul unui microscop sau al unui contor electronic de particule (prin estimarea numărului celulelor și/sau a biovolumului). Tehnici alternative, cum ar fi citometria de flux, fluorescența clorofilei in vitro sau in vivo (6)(7) sau densitatea optică, pot fi folosite dacă se demonstrează o corelație satisfăcătoare cu biomasa pentru intervalul de cantități de biomasă utilizate în test.
pH-ul soluțiilor se măsoară la începutul și la sfârșitul testului.
Dacă este disponibilă o procedură analitică de determinare a substanței de testat în intervalul de concentrații utilizat, soluțiile de testat se analizează pentru a fi verificate concentrațiile inițiale și menținerea concentrațiilor de expunere în timpul testului.
Analizarea concentrației substanței de testat la începutul și la sfârșitul testului unei concentrații de testare scăzute și înalte, precum și o concentrație în jurul valorii anticipate EC50, pot fi suficiente în cazurile în care este probabil ca variația concentrațiilor expunerilor să fie de mai puțin de 20 % din valorile nominale din timpul testului. Analizarea tuturor concentrațiilor de testare la începutul și sfârșitul testului este recomandată în cazul concentrațiilor care nu rămân în intervalul de 80-120 % din valoarea nominală. În cazul substanțelor de testat volatile, instabile sau puternic absorbante, se recomandă recoltarea suplimentară la intervale de 24 de ore în timpul perioadei de expunere în scopul definirii cu mai mare precizie a pierderii de substanță de testat. Pentru aceste substanțe sunt necesare duplicate suplimentare. În toate cazurile, concentrațiile substanței testate se determină doar la un vas dintre cele identice pentru fiecare concentrație de testat (sau la conținutul vaselor grupate în funcție de duplicat).
Mediile de testare pregătite pentru analizarea concentrațiilor de expunere în timpul testului se tratează identic cu cele folosite pentru testare, adică se inoculează cu alge și sunt incubate în condiții identice. Dacă este necesară analizarea concentrației substanței de test dizolvate, se poate impune separarea algelor de mediu. Este de preferat ca separarea să aibă loc prin centrifugare la o forță gravitațională scăzută, suficientă pentru depunerea algelor.
Dacă se poate dovedi menținerea satisfăcătoare, pe toată durata testului, a concentrației substanței testate în limitele de ± 20 % din cea nominală sau măsurată inițial, atunci analizarea rezultatelor poate avea loc pe baza valorilor nominale sau măsurate inițial. Dacă abaterea de la concentrația nominală sau cea măsurată inițial este mai mare de ± 20 %, este necesar ca rezultatele să se exprime în funcție de media geometrică a concentrației în timpul expunerii sau de modelele care descriu scăderea concentrației substanței testate (3)(8).
Testul de inhibare a creșterii algelor este un sistem de testare mai dinamic decât majoritatea testelor de toxicitate acvatică pe termen scurt. Prin urmare, concentrațiile de expunere reale se pot dovedi dificil de definit, în special în cazul substanțelor adsorbante testate la concentrații scăzute. În astfel de cazuri, dispariția substanței din soluție prin adsorbție în biomasa de alge în creștere nu înseamnă că aceasta s-a pierdut din sistemul de testare. În cursul analizării rezultatului testului se va verifica dacă o descreștere a concentrației substanței testate în cursul testului este însoțită de o reducere a inhibării creșterii. Dacă acesta este cazul, poate fi luată în considerare aplicarea unui model adecvat de descriere a scăderii concentrației substanței testate (8). Dacă nu este cazul, analizarea rezultatelor se poate întemeia pe valorile concentrațiilor inițiale (nominale sau măsurate).
1.8.12. Alte observații
Observația microscopică se efectuează în scopul verificării stării normale și sănătoase a culturii de inocul și pentru observarea oricărei stări anormale a algelor (care poate fi provocată de expunerea la substanța de testat) la sfârșitul testului.
1.8.13. Testul la valori limită
În unele condiții, de exemplu atunci când un test preliminar arată că substanța de testat nu are efecte toxice la concentrații de până la 100 mg·l–1 sau până la limita solubilității în mediul de testare (oricare dintre ele este mai scăzută), poate avea loc un test la valori limită, care presupune compararea răspunsurilor unui grup de control și ale unei grupe supuse tratamentului (100 mg·l–1 sau o concentrație egală cu limita solubilității). Se recomandă ca acest test să fie confirmat prin analizarea concentrației de expunere. Unui test la valori limită i se aplică toate condițiile de testare și criteriile de validitate descrise anterior, cu excepția celei privind numărul de duplicate supuse tratării, care trebuie să fie de cel puțin șase. Variabilele de răspuns din grupul de control și din cel supus tratării pot fi analizate folosind un test statistic de comparare a mediilor, cum ar fi un test t (Student). Dacă varianțele acestor două grupuri sunt inegale, se va efectua un test t ajustat pentru varianțe inegale.
1.8.14. Modificări în cazul substanțelor puternic colorate
Iradierea (intensitatea luminii) trebuie să se afle la marginea superioară a intervalului descris în această metodă de testare: 120 μE m–2s–1 sau mai ridicat.
Traseul luminii trebuie scurtat prin reducerea volumului soluției de testat (în intervalul de 5-25 ml).
Trebuie asigurată agitarea suficientă pentru a se obține o frecvență a expunerii algelor la iradiere înaltă la suprafața culturii.
2. DATE
2.1. TRASAREA CURBELOR DE CREȘTERE
Biomasa în vasele de testare poate fi exprimată în unități ale parametrului înlocuitor folosit pentru măsurare (de exemplu numărul de celule, fluorescență).
Concentrația estimată a biomasei în culturile de testare și probele martor se prezintă sub forma unui tabel, împreună cu concentrațiile materialului de testare și perioadele de măsurare, înregistrate cu o rezoluție de cel puțin ore întregi, pentru a rezulta grafice ale curbelor de creștere. Ambele scale, logaritmică și lineară, pot fi utile în prima etapă, dar scalele logaritmice sunt obligatorii și, în general, prezintă mai bine variațiile modelului de creștere în timpul perioadei de testare. Trebuie reținut că creșterea exponențială este reprezentată ca o linie dreaptă când se face trasarea pe o scală logaritmică, iar înclinația liniei (panta) indică viteza specifică de creștere.
Folosind graficele, se examinează dacă, pe parcursul testului, culturile de control cresc exponențial la viteza prevăzută. Se examinează critic toate punctele experimentale și aspectul graficelor și se verifică datele brute și procedurile de detectare pentru identificarea posibilelor erori. Se verifică, în special, orice punct experimental care pare să devieze printr-o eroare sistematică. Dacă este evident că pot fi identificate erori de procedură și/sau acestea sunt considerate foarte probabile, punctul experimental se marchează ca valoare excepțională și nu se include în analiza statistică ulterioară. (O concentrație a algelor egală cu zero în unul din două sau trei vase duplicate poate arăta că vasul nu a fost inoculat corect sau nu a fost curățat corespunzător.) Motivele respingerii unui punct experimental ca fiind excepțional se indică în mod clar în raportul de testare. Motivele acceptate sunt numai erorile (rare) de procedură, nu simpla imprecizie. Procedurile statistice de identificare a valorilor excepționale au aplicabilitate limitată pentru acest tip de problemă și nu pot înlocui opinia specialiștilor. Se preferă ca valorile excepționale (marcate ca atare) să fie reținute între punctele experimentale ilustrate în orice prezentare grafică sau tabelară ulterioară a datelor.
2.2. VARIABILELE DE RĂSPUNS
Scopul testului este de a determina efectele substanței de testat asupra creșterii algelor. Prezenta metodă de testare descrie două variabile de răspuns, deoarece statele membre au diferite preferințe și necesități de reglementare. Pentru ca rezultatele de testare să fie acceptabile în toate statele membre, efectele se evaluează folosind ambele variabile de răspuns (a) și (b) descrise mai jos.
(a) Viteza medie specifică de creștere: această variabilă de răspuns se calculează pe baza creșterii logaritmice a biomasei în timpul perioadei de testare, exprimată pe zi.
(b) Randament: această variabilă de răspuns reprezintă biomasa de la sfârșitul testului minus biomasa de la începutul testului.
Pentru aplicarea acestei metode în cadrul de reglementare al UE, calculul rezultatelor trebuie să se bazeze pe viteza medie specifică de creștere din rațiunile descrise în continuare. Trebuie remarcat că valorile toxicității calculate prin folosirea acestor două variabile de răspuns nu sunt comparabile, iar această diferență trebuie să fie menționată atunci când se folosesc rezultatele testului. Valorile ECx bazate pe viteza medie specifică de creștere (ErCx) vor fi în general mai înalte decât rezultatele bazate pe randament (EyCx) dacă se respectă condițiile de testare din prezenta metodă de testare, ca urmare a bazei matematice a abordărilor respective. Aceasta nu se va interpreta ca o diferență de sensibilitate între cele două variabile de răspuns, valorile fiind diferite din punct de vedere matematic. Conceptul vitezei medii specifice de creștere se bazează pe modelul general al creșterii exponențiale a algelor în culturi nelimitate, în care toxicitatea se estimează pe baza efectelor asupra vitezei de creștere, fără a fi dependentă de valoarea absolută a vitezei specifice de creștere a probei martor, de panta curbei concentrație-răspuns sau de durata testului. Prin contrast, rezultatele bazate pe variabila de răspuns-randament depind de toate aceste variabile. EyCx depinde de viteza specifică de creștere a speciilor de alge folosite pentru fiecare test și de viteza maximă specifică de creștere, care poate varia între specii și chiar între sușe diferite de alge. Această variabilă de răspuns nu se folosește pentru compararea sensibilității la substanțe toxice între specii de alge sau chiar sușe diferite. În timp ce folosirea vitezei medii specifice de creștere în scopul estimării toxicității este preferată din punct de vedere științific, estimările de toxicitate bazate pe randament sunt incluse în prezenta metodă de testare pentru a satisface cerințele de reglementare din unele țări.
2.2.1. Viteza medie de creștere
Viteza medie specifică de creștere pentru o anumită perioadă se calculează ca fiind creșterea logaritmică a biomasei, pe baza ecuației pentru fiecare vas de probe martor și de probe supuse tratamentului:
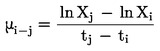
unde:
|
μ i-j : |
este viteza medie specifică de creștere de la momentul i la momentul j |
|
X i : |
este biomasa la momentul i |
|
X j : |
este biomasa la momentul j. |
Pentru fiecare grup etalon și grup supus tratării, se calculează o valoare medie a vitezei de creștere în paralel cu estimările varianței.
Se calculează viteza medie specifică de creștere pentru întreaga durată a testului (în mod normal, zilele 0-3), folosind biomasa inoculată nominal ca valoare inițială în locul unei valori inițiale măsurate, în acest mod fiind obținută o precizie sporită. Dacă dispozitivul folosit pentru măsurarea biomasei permite o determinare suficient de precisă a biomasei scăzute de inocul (de exemplu citometru de flux), se poate folosi concentrația biomasei măsurate inițial. De asemenea, se evaluează viteza de creștere pe secțiuni, calculată ca viteze specifice de creștere pentru fiecare zi din perioada testului (zilele 0-1, 1-2 și 2-3) și se examinează dacă viteza de creștere a probei martor rămâne constantă (a se vedea criteriile de validitate, punctul 1.7). O viteză de creștere specifică semnificativ mai scăzută poate indica o fază de latență. În timp ce o fază de latență poate fi minimizată și, practic, eliminată din culturile de control prin propagarea adecvată a preculturii, o fază de latență la culturile expuse poate indica recuperarea după un stres toxic inițial sau o expunere redusă ca urmare a pierderii de substanță de testat (inclusiv sorbție în biomasa de alge) după expunerea inițială. Prin urmare, viteza de creștere pe secțiuni poate fi estimată în scopul evaluării efectelor substanței de testat care se manifestă în timpul perioadei de expunere. Existența unor diferențe substanțiale între viteza de creștere pe secțiuni și viteza medie de creștere indică o deviere de la creșterea exponențială constantă și justifică examinarea atentă a curbelor de creștere.
Inhibarea procentuală a vitezei de creștere pentru fiecare duplicat supus tratării se calculează pe baza ecuației:
![]()
unde:
|
% Ir: |
inhibarea vitezei medii specifice de creștere, în procente |
|
μC: |
valoarea medie a vitezei medii specifice de creștere (μ) în grupul martor |
|
μT: |
viteza medie specifică de creștere pentru duplicatul supus tratării. |
Când se folosesc solvenți pentru pregătirea soluțiilor de testat, pentru calcularea inhibării se folosesc probele martor ale solvenților în locul probelor martor fără solvenți.
2.2.2. Randament
Randamentul se calculează ca biomasa la sfârșitul testului minus biomasa de la începutul testului în cazul fiecărui vas de probe martor și probe supuse tratamentului. Pentru fiecare concentrație de testare și probă martor, se calculează o valoare medie a randamentului împreună cu estimările varianței. Procentul de inhibare a randamentului (% Iy) se poate calcula pentru fiecare duplicat supus tratării, după cum urmează:
![]()
unde:
|
% Iy: |
inhibarea randamentului, în procente |
|
YC: |
valoarea medie a randamentului la grupul martor |
|
YT: |
valoarea randamentului pentru duplicatul supus tratării. |
2.3. TRASAREA CURBELOR DE RĂSPUNS A CONCENTRAȚIEI
Se reprezintă procentul de inhibare în funcție de logaritmul concentrației substanței de testat și se examinează graficul cu atenție, ignorându-se toate punctele experimentale care au fost indicate ca valori excepționale în prima fază. Punctele experimentale se unesc printr-o linie netedă, cu ochiul liber sau prin interpolare computerizată, pentru a se obține o primă impresie asupra relației concentrație-răspuns, apoi se continuă cu o metodă mai detaliată, preferabil o metodă de statistică informatizată. În funcție de viitoarea utilizare a datelor, calitatea (precizia) și cantitatea de date, precum și de disponibilitatea instrumentelor de analiză a datelor, se poate decide (uneori, bine justificat) oprirea analizării datelor în această etapă și se citesc doar cifrele cheie EC50 și EC10 (și/sau EC20) de pe curba trasată cu ochiul liber (a se vedea și punctul de mai jos despre efectele stimulatorii). Motivele valide de a nu folosi o metodă statistică pot include:
— Datele nu sunt adecvate pentru ca metodele computerizate să producă rezultate mai precise decât pot fi obținute prin concluziile experților – în astfel de situații, unele programe de computer pot chiar să nu producă o soluție precisă (iterațiile pot să nu conveargă etc.).
— Răspunsurile de creștere stimulatorie nu pot fi prelucrate adecvat prin folosirea programelor de computer disponibile (a se vedea mai jos).
2.4. PROCEDURI STATISTICE
Obiectivul este de a se obține o relație cantitativă concentrație-răspuns prin metoda analizei regresiei. Este posibilă folosirea unei regresii lineare ponderate după ce s-a efectuat o transformare de linearizare a datelor de răspuns – de exemplu în funcția probit, logit sau unități Weibull (9), dar procedurile de regresie nelineară sunt tehnici preferate, care tratează mai bine inexactitățile inevitabile ale datelor și abaterile de la distribuțiile netede. Când se apropie de zero sau inhibiție totală, aceste inexactități se pot amplifica prin transformare, interferând cu analiza (9). Trebuie remarcat că metodele standard de analiză folosind transformatele probit, logit sau Weibull se folosesc în cazul datelor cantitative (de exemplu date despre mortalitate sau supraviețuire) și trebuie să fie modificate pentru a reflecta datele despre creștere sau biomasă. Proceduri specifice de determinare a valorilor ECx pe baza datelor continue pot fi consultate la notele (10), (11) și (12). Folosirea analizei regresiei nelineare este detaliată în apendicele 4.
Pentru fiecare variabilă de răspuns de analizat, se utilizează relația concentrație-răspuns pentru calcularea estimărilor punctului valorilor ECx. Dacă este posibil, se vor determina limitele de încredere de 95 % pentru fiecare estimare. Calitatea de ajustare a datelor de răspuns la modelul de regresie se evaluează în mod grafic sau statistic. Analiza regresiei se efectuează folosind răspunsuri individuale ale duplicatului, nu medii ale grupului supus tratării. Dacă totuși interpolarea nelineară este dificilă sau eșuează ca urmare a datelor prea împrăștiate, problema poate fi ocolită prin efectuarea regresiei pe medii de grup, aceasta fiind o metodă practică de reducere a influenței valorilor excepționale suspectate. Folosirea acestei opțiuni se consemnează în raportul de testare ca abatere de la procedura normală, deoarece intersectarea curbei cu duplicatele individuale nu a produs un rezultat corect.
Estimările și limitele de încredere ale EC50 pot fi obținute folosind interpolarea lineară cu „bootstrap” (13), dacă modelele/metodele disponibile de regresie sunt inadecvate pentru date.
Pentru estimarea CMEO și, prin urmare, a CFEO și a efectelor substanței de testat asupra vitezei de creștere, este necesară compararea mediilor de tratare folosind tehnici de analizare a varianței (ANOVA). Media pentru fiecare concentrație se compară apoi cu media probei martor folosind o metodă de comparare multiplă adecvată sau de testare a tendinței. Testul lui Dunnett sau cel al lui Williams pot fi utile în acest sens (14)(15)(16)(17)(18). Este necesar să se evalueze dacă ipoteza ANOVA de omogenitate a varianței se verifică. Această evaluare se poate efectua grafic sau printr-un test formal (18). Teste adecvate în acest sens sunt cele ale lui Levene sau Bartlett. Neîndeplinirea ipotezei de omogenitate a varianțelor poate fi corectată uneori prin transformarea logaritmică a datelor. Dacă heterogenitatea varianței este extremă și nu poate fi corectată prin transformare, se va lua în considerare analizarea prin metode precum testele Jonkheere regresive de stabilire a tendinței. Îndrumări suplimentare privind determinarea CFEO sunt prezentate la nota (12).
Progresele științifice recente au condus la recomandarea de abandonare a conceptului de CFEO și înlocuirea sa cu estimările punctului ECx bazate pe regresie. Nu a fost stabilită o valoare adecvată a x pentru acest test cu alge. Un interval cuprins între 10-20 % pare a fi adecvat (în funcție de variabilele de răspuns alese) și se recomandă raportarea atât a EC10, cât și a EC20.
2.5. STIMULAREA CREȘTERII
Se observă uneori o stimulare a creșterii (inhibare negativă) la concentrații scăzute. Aceasta poate rezulta fie din hormesis („stimulare toxică”), fie în urma adăugării de factori de stimulare a creșterii odată cu materialul de testat la mediul minimal folosit. Rețineți că adăugarea de nutrienți anorganici nu ar trebui să aibă niciun efect direct, deoarece mediul de testare ar trebui să își mențină un surplus de nutrienți pe întreaga durată a testului. Stimularea cu doze scăzute poate fi ignorată de obicei în calculele EC50, cu excepția cazurilor când este extremă. Dacă este extremă sau se calculează o valoare ECx pentru x scăzut, pot fi necesare proceduri speciale. Ștergerea răspunsurilor stimulatorii din rezultatele analizării datelor trebuie să fie evitată dacă este posibil, iar dacă programele software de interpolare disponibile nu pot accepta stimulare minoră, se poate utiliza interpolarea lineară cu „boostrap”. Dacă stimularea este extremă, poate fi luată în considerare folosirea unui model hormetic (19).
2.6. INHIBARE NETOXICĂ A CREȘTERII
Materialele de testare fotoabsorbante pot determina o reducere a vitezei de creștere, deoarece umbra reduce cantitatea de lumină disponibilă. Astfel de tipuri de efecte fizice trebuie să fie separate de efectele toxice prin modificarea condițiilor de testare, iar primele se raportează separat. Îndrumări în acest sens sunt prezentate la notele (2) și (3).
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele informații:
Substanța de testat:
— starea fizică și proprietățile fizico-chimice relevante, inclusiv limita solubilității în apă;
— date de identificare de natură chimică, inclusiv puritatea.
Speciile folosite pentru testare:
— sușa, furnizorul sau sursa și condițiile de cultură folosite.
Condițiile de testare:
— data de începere a testului și durata acestuia;
— descrierea protocolului testului: vasele de testare, volumele de cultură, densitatea biomasei la începutul testului;
— compoziția mediului;
— concentrații de testare și duplicate (de exemplu numărul duplicatelor, numărul concentrațiilor de testare și progresia geometrică utilizată);
— descrierea modului de preparare a soluțiilor testate, inclusiv folosirea de solvenți etc.;
— aparatul pentru cultură;
— intensitatea și calitatea luminii (sursa, omogenitatea);
— temperatura;
— concentrațiile testate: concentrațiile nominale de testare și rezultatele tuturor analizelor pentru determinarea concentrației substanței testate în vasele de testare. De asemenea, se prezintă eficiența de recuperare a metodei și limita de cuantificare în matricea de testare;
— orice deviere de la prezenta metodă de testare;
— metoda de determinare a biomasei și dovada corelației dintre parametrul măsurat și greutatea uscată.
Rezultate:
— valorile pH-ului la începutul și sfârșitul testului, pentru toate tipurile de tratare;
— biomasa pentru fiecare recipient la fiecare punct de măsurare și pentru fiecare metodă de măsurare a biomasei;
— curbele de creștere (graficul biomasei în funcție de timp);
— variabilele de răspuns calculate pentru fiecare duplicat supus tratării, cu valori medii și coeficient de variație pentru duplicate;
— prezentare grafică a relației concentrație/efect;
— estimări ale toxicității pentru variabile de răspuns, cum ar fi EC50, EC10, EC20 și limitele de încredere aferente. Dacă au fost calculate, CMEO și CFEO, precum și metodele statistice folosite pentru determinarea acestora;
— dacă s-a folosit ANOVA, dimensiunea efectului care poate fi detectat (de exemplu diferența cea mai puțin importantă);
— orice stimulare a creșterii constatată în cazul oricărei tratări;
— orice alte efecte observate, cum ar fi modificările morfologice ale algelor;
— discutarea rezultatelor, inclusiv orice influență asupra rezultatului testului manifestată în urma abaterilor de la prezenta metodă de testare.
4. REFERINȚE BIBLIOGRAFICE
1. OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test.
2. ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442.
3. OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23.
4. ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667-16.
5. ISO 1993: Water quality – Algal growth inhibition test. ISO 8692.
6. Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525-2531.
7. Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), p. 919-925.
8. Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073-2079.
9. Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
10. Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
11. Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485-1494.
12. OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
13. Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN.
14. Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096-1121.
15. Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482-491.
16. Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117.
17. Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510-531.
18. Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
19. Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
Apendicele 1
Sușe demonstrate ca fiind adecvate pentru testare
Alge verzi
— Pseudokirchneriella subcapitata (cunoscută anterior ca Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
— Desmodesmus subspicatus (cunoscută anterior ca Scenedesmus subspicatus) 86.81 SAG
Diatomee
— Navicula pelliculosa, UTEX 664
Cianobacterii
— Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
— Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
Surse ale sușelor
Sușele recomandate sunt disponibile în culturi cu un singur tip de alge din următoarele colecții (în ordine alfabetică):
ATCC: Colecție de culturi tip american
10801 University Boulevard
Manassas, Virginia 20110-2209
Statele Unite ale Americii
CCAP: Colecție de culturi de alge și protozoare
Institute of Freshwater Ecology
Windermere Laboratory
Far Sawrey, Amblerside
Cumbria
LA22 0LP
Regatul Unit
SAG: Colecție de culturi de alge
Institutul de Fiziologie a Plantelor
Universitatea din Göttingen
Nicholausberger Weg 18
D-3400 Göttingen
Germania
UTEX: Colecție de cultură de alge
Secțiunea Biologie Moleculară, Celulară și Evolutivă
School of Biological Sciences
the University of Texas at Austin
Austin, Texas 78712
Statele Unite ale Americii
Aspectul și caracteristicile speciilor recomandate
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
A. flos-aquae |
S. leopoliensis |
|
|
Aspect |
Curbat, celule unice răsucite |
Oval, predominant celule unice |
Bastonașe |
Lanț de celule ovale |
Bastonașe |
|
Dimensiune (L × l) μm |
8-14 × 2-3 |
7-15 × 3-12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Volumul celulei (μm3/celulă) |
40-60 (1) |
60-80 (1) |
40-50 (1) |
30-40 (1) |
2,5 (2) |
|
Greutatea uscată a celulei (mg/celulă) |
2-3 × 10–8 |
3-4 × 10–8 |
3-4 × 10–8 |
1-2 × 10–8 |
2-3 × 10–9 |
|
Viteză de creștere (3) (zi–1) |
1,5-1,7 |
1,2-1,5 |
1,4 |
1,1-1,4 |
2,0-2,4 |
|
(1) Măsurată cu contor electronic de particule. (2) Calculat pe baza dimensiunii. (3) Viteza de creștere observată cel mai frecvent în mediu OECD, la o intensitate a luminii de aprox. 70 μE·m–2·s–1 și o temperatură de 21 °C. |
|||||
Recomandări specifice privind cultura și manipularea speciilor de testare recomandate
Pseudokirchneriella subcapitata și Desmodesmus subspicatus
Aceste alge verzi sunt, în general, ușor de întreținut în diferite medii de cultură. Informații privind mediile adecvate sunt disponibile în colecțiile de culturi. În mod normal, celulele sunt solitare, iar măsurătorile densității celulelor pot fi efectuate cu ușurință folosind un contor electronic de particule sau un microscop.
Anabaena flos-aquae
Pentru păstrarea unei culturi mamă pot fi folosite diferite medii de cultură. Cultura cultivată în serie nu trebuie să depășească faza de dezvoltare logaritmică în etapa de reînnoire, recuperarea fiind dificilă în acest punct.
Anabaena flos-aquae dezvoltă agregate de lanțuri de celule în serie. Dimensiunea acestor agregate poate varia în funcție de condițiile de cultură. Separarea acestor agregate poate fi necesară în timpul numărării la microscop sau când se folosește un contor electronic de particule pentru determinarea biomasei.
Desfacerea lanțurilor, în scopul reducerii variabilității numărului, se poate obține prin dezintegrarea cu ultrasunete a subeșantioanelor. O dezintegrare cu ultrasunete pentru o perioadă mai lungă decât cea necesară pentru desfacerea lanțurilor în lungimi mai mici poate avea ca efect distrugerea celulelor. Intensitatea și durata dezintegrării cu ultrasunete trebuie să fie identice în cazul fiecărei tratări.
Se vor număra suficiente câmpuri pe hemocitometru (cel puțin 400 de celule) pentru a se compensa variabilitatea. Aceasta va ameliora precizia determinărilor microscopice ale densității.
După desfacerea lanțului de celule prin dezintegrare prudentă cu ultrasunete, volumul total de celule de Anabaena se va putea determina folosind un contor electronic de particule. Energia dezintegrării se va ajusta pentru a se preveni distrugerea celulelor.
Folosiți un agitator Vortex sau o metodă adecvată similară pentru a vă asigura că suspensia de alge utilizată pentru inocularea vaselor de testare este bine amestecată și omogenă.
Vasele de testare se așază pe o masă de agitare orbitală sau oscilantă la aproximativ 150 de rotații pe minut. În mod alternativ, tendința Anabaena de a se agrega poate fi prevenită prin agitare intermitentă. Dacă se produce agregarea, eșantioanele reprezentative pentru măsurătorile de biomasă vor fi selectate cu atenție. Agitarea cu putere înainte de recoltare poate dezintegra agregatele de alge.
Synechococcus leopoliensis
Pentru păstrarea unei culturi mamă pot fi folosite diferite medii de cultură. Informații privind mediile adecvate sunt disponibile în colecțiile de culturi.
Synechococcus leopoliensis crește sub formă de celule solitare în formă de bastonașe. Celulele sunt foarte mici, ceea ce îngreunează numărarea acestora la microscop în scopul măsurării biomasei. Sunt utile contoarele electronice de particule calibrate pentru numărarea particulelor cu o dimensiune de până la 1 μm. Se pot folosi, de asemenea, măsurători fluorometrice in vitro.
Navicula pelliculosa
Pentru păstrarea unei culturi mamă pot fi folosite diferite medii de cultură. Informații privind mediile adecvate sunt disponibile la colecțiile de culturi. Rețineți că în mediu este necesară prezența silicatului.
Navicula pelliculosa poate forma agregate în anumite condiții de creștere. Ca urmare a producției de lipide, celulele algice tind uneori să se acumuleze în pelicula de suprafață. În această situație, se vor adopta măsuri speciale pentru obținerea de eșantioane reprezentative când se recoltează subeșantioane pentru determinarea biomasei. Poate fi necesară agitarea cu putere, cu ajutorul, de exemplu, al unui agitator Vortex.
Apendicele 2
Medii de cultură
Se poate folosi unul dintre următoarele două medii de cultură:
Mediul OECD: Mediu original, conform cu orientările OECD privind testele nr. 201 și ISO 8692
Statele Unite, mediu EPA AAP, conform și cu ASTM.
Pentru pregătirea acestor medii se folosesc reactivi sau substanțe chimice de puritate analitică și apă deionizată.
Compoziția mediului AAP (Statele Unite, EPA) și a mediului conform cu orientările OECD privind testele nr. 201
|
Componentă |
EPA |
OECD |
||
|
mg/l |
mM |
mg/l |
mM |
|
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
||
|
NH4Cl |
15,0 |
0,280 |
||
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
||
|
KH2PO4 |
1,60 |
0,00919 |
||
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
|
(1) Raportul molar al EDTA-fier depășește ușor unitatea. Aceasta previne precipitarea fierului și, în același timp, este minimizată chelatizarea ionilor de metale grele. |
||||
În testul cu diatomeea Navicula pelliculosa, ambele medii trebuie să fie suplimentate cu Na2SiO3·9H2O pentru a se obține o concentrație de 1,4 mg Si/l.
pH-ul mediului se obține la echilibrul între sistemul carbonat al mediului și presiunea parțială a CO2 în aerul atmosferic. O relație aproximativă între pH la 25 °C și concentrația molară a bicarbonatului este:
PHeq = 11,30 + log [HCO3]
cu 15 mg NaHCO3, pHeq = 7,5 (mediu conform EPA, Statele Unite) și cu 50 mg NaHCO3/l, pHeq = 8,1 (mediu OECD).
Compoziția elementală a mediului de testare
|
Element |
EPA |
OECD |
|
mg/l |
mg/l |
|
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
Pregătirea mediului OECD
|
Nutrient |
Concentrație în soluție mamă |
|
Soluție mamă nr. 1: macronutrienți |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
Soluție mamă nr. 2: fier |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
Soluție mamă nr. 3: elemente de urmărire |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
Soluție mamă nr. 4: bicarbonat |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H2O |
|
Soluțiile mamă se sterilizează prin filtrare prin membrană (diametrul mediu al porilor 0,2 μm) sau termic (120 °C, 15 min). Soluțiile se depozitează la întuneric la 4 °C.
Soluțiile mamă nr. 2 și 4 nu se sterilizează termic, ci doar prin filtrare prin membrană.
Se pregătește un mediu de creștere prin adăugarea unui volum adecvat al soluțiilor mamă 1-4 în apă:
Se adaugă 500 ml de apă sterilizată:
— 10 ml de soluție mamă nr. 1
— 1 ml de soluție mamă nr. 2
— 1 ml de soluție mamă nr. 3
— 1 ml de soluție mamă nr. 4
Se completează până la 1 000 ml cu apă sterilizată.
Se lasă suficient timp pentru echilibrarea mediului cu CO2 atmosferic, prin barbotare timp de câteva ore cu aer steril filtrat, dacă este necesar.
Pregătirea mediului AAP
A1.1. Se adaugă 1 ml din fiecare soluție mamă în A1.2.1-A1.2.7 la aproximativ 900 ml de apă deionizată sau distilată, apoi se diluează la 1 l.
A1.2. Soluțiile mamă de macronutrienți se alcătuiesc prin dizolvarea următoarelor substanțe în 500 ml de apă deionizată sau distilată. Reactivii A1.2.1, A1.2.2, A1.2.3 și A1.2.4 pot fi combinați într-o singură soluție mamă.
A1.2.1. NaNO3 —12,750 g.
A1.2.2. MgCl2 ·6H2O—6,082 g.
A1.2.3. CaCl2 ·2H2O—2,205 g.
A1.2.4. Soluție mamă de micronutrienți—(a se vedea A1.3).
A1.2.5. MgSO4·7H2O—7,350 g.
A1.2.6. K2HPO4 —0,522 g.
A1.2.7. NaHCO3 —7,500 g.
A1.2.8. Na2SiO3·9H2O—A se vedea nota A1.1.
Nota A1.1 – Se folosește exclusiv pentru specii de diatomee-test. Se poate adăuga direct (202,4 mg) sau prin soluția mamă, pentru a rezulta 20 mg/l Si concentrație finală în mediu.
A1.3. Soluția mamă de micronutrienți se obține prin dizolvarea următoarelor substanțe în 500 ml de apă deionizată sau distilată:
A1.3.1. H3BO3 —92,760 mg.
A1.3.2. MnCl2·4H2O—207,690 mg.
A1.3.3. ZnCl2 —1,635 mg.
A1.3.4. FeCl3·6H2O—79,880 mg.
A1.3.5. CoCl2·6H2O—0,714 mg.
A1.3.6. Na2MoO4·2H2O—3,630 mg.
A1.3.7. CuCl2·2H2O—0,006 mg.
A1.3.8. Na2EDTA·2H2O—150,000 mg.
[(Etilendiamino)tetraacetat disodic].
A1.3.9. Na2SeO4·5H2O—0,005 mg. A se vedea nota A1.2.
Nota A1.2 – Se folosește exclusiv în mediul pentru culturile mamă ale speciilor de diatomee.
A1.4. Se ajustează pH la 7,5 ± 0,1 cu soluție 0,1 N sau 1,0 N de NaOH sau HCl.
A1.5. Se filtrează mediul într-un recipient steril printr-un filtru cu membrană de 0,22 μm, dacă se folosește un contor de particule, sau printr-un filtru de 0,45 μm, dacă nu se folosește un contor de particule.
A1.6. Mediul se depozitează la întuneric la 4 °C până la utilizare.
Apendicele 3
Exemplu de procedură pentru cultura de alge
Observații generale
Scopul cultivării pe baza metodei de mai jos este acela de a obține culturi de alge pentru testele de toxicitate.
Se folosesc metode adecvate pentru a garanta lipsa infectării cu bacterii a culturilor de alge. Se recomandă culturile necontaminate, dar se stabilesc și se folosesc culturile cu un singur tip de alge.
Toate operațiile se efectuează în condiții sterile pentru a evita contaminarea cu bacterii sau alte alge.
Echipament și materiale
A se vedea secțiunea Aparatură din Metoda de testare.
Proceduri pentru obținerea culturilor de alge
Prepararea soluțiilor de elemente nutritive (medii):
Toate sărurile nutritive ale mediului se prepară ca soluții mamă concentrate și se păstrează la rece și întuneric. Aceste soluții se sterilizează prin filtrare sau autoclavare.
Mediul se prepară prin adăugarea cantității corecte de soluție mamă la apa distilată sterilă, acordându-se atenție prevenirii infecțiilor. Pentru mediul solid se adaugă 0,8 % agar-agar.
Cultura mamă:
Culturile mamă sunt culturi mici de alge care se transferă cu regularitate într-un mediu proaspăt pentru a acționa ca material inițial de testare. Dacă nu sunt folosite cu regularitate, se scurg pe tuburile înclinate acoperite cu agar-agar. Culturile se transferă într-un mediu proaspăt cel puțin o dată la două luni.
Culturile mamă se cresc în vase conice care conțin mediul corespunzător (volum cca 100 ml). Când algele sunt incubate la 20 °C cu iluminare continuă, este necesar un transfer săptămânal.
În timpul transferului, o cantitate din cultura „veche” se transferă cu pipete sterile într-un vas cu mediu proaspăt, astfel încât, în cazul speciilor cu creștere rapidă, concentrația inițială să fie de cca 100 de ori mai mică decât în cultura veche.
Viteza de creștere a speciei se poate determina din curba de creștere. Dacă aceasta se cunoaște, este posibil să se estimeze densitatea la care cultura trebuie transferată într-un mediu nou. Acest lucru trebuie să se facă înainte ca algele din cultură să atingă faza morții.
Precultura:
Precultura are ca scop obținerea unei cantități de alge adecvată pentru inocularea culturilor de testare. Precultura se incubează în condițiile testării și se folosește în timpul creșterii exponențiale, în mod normal după o perioadă de incubare între 2-4 zile. Când culturile de alge conțin celule deformate sau anormale, acestea sunt înlăturate.
Apendicele 4
Analiza datelor prin metoda regresiei nelineare
Considerații generale
Răspunsul la testele pe alge și alte teste de creștere microbiană – în mod natural, creșterea biomasei este o variabilă continuă sau metrică – o viteză de proces, dacă se folosește viteza de creștere, și integrala sa în funcție de timp, dacă se selectează biomasa. Ambele fac trimitere la răspunsul mediu corespunzător al probelor martor duplicate neexpuse care manifestă un răspuns maxim pentru condițiile impuse – lumina și temperatura fiind principalii factori determinanți în testul pe alge. Sistemul este distribuit sau omogen, iar biomasa poate fi considerată ca fiind un continuum fără a se ține cont de celulele individuale. Distribuția varianței tipului de răspuns pentru un astfel de sistem are legătură exclusiv cu factorii experimentali (descriși în mod obișnuit de distribuțiile log-normale sau normale ale erorilor). Aceasta este în contrast cu răspunsurile tipice din cadrul biotestului cu date cantitative, pentru care toleranța (distribuită de obicei binomial) a organismelor individuale este adesea presupusă a fi componenta dominantă a varianței. Răspunsurile de control sunt, în acest caz, zero sau nivel de fond.
În situația necomplicată, răspunsul normalizat sau relativ r descrește uniform de la 1 (inhibare zero) la 0 (100 % inhibare). Rețineți că toate răspunsurile au o marjă de eroare aferentă și că inhibările aparent negative pot fi calculate doar ca rezultat al unei erori aleatorii.
Analiza regresiei
Modele
Obiectivul unei analize a regresiei este de a descrie cantitativ curba concentrație-răspuns sub forma unei funcții matematice de regresie Y = f (C) sau, mai frecvent, F (Z), unde Z = log C. Folosită invers, C = f–1 (Y) permite calcularea valorilor ECx, inclusiv EC50, EC10 și EC20 și limitele lor de încredere de 95 %. Câteva formule funcționale matematice simple au demonstrat că pot descrie cu succes relațiile concentrație-răspuns obținute în testele de inhibare a creșterii algelor. Funcțiile includ, de exemplu, ecuația logistică, ecuația Weibull nesimetrică și funcția de distribuție log-normală, toate acestea fiind curbe sigmoide care se apropie asimptotic de 1 pentru C → 0 și de 0 pentru C → infinit.
Folosirea modelelor funcției limită continue (de exemplu modelul Koyman „de inhibare a creșterii populațiilor”, Kooijman et al. 1996) este o alternativă propusă recent la modelele asimptotice. Acest model nu presupune efecte la concentrații sub o anumită limită EC0+, care se estimează prin extrapolarea relației concentrație-răspuns pentru a intersecta axa concentrației prin folosirea unei funcții continue simple care nu este diferențiabilă în punctul de pornire.
Trebuie reținut că analiza poate consta într-o simplă minimizare a sumelor pătratelor reziduale (presupunând că varianța este constantă) sau a pătratelor ponderate, dacă heterogenitatea varianței este compensată.
Procedură
Procedura poate fi descrisă după cum urmează: se selectează o ecuație funcțională adecvată Y = f (C) și se ajustează la date prin regresie nelineară. Se preferă folosirea măsurătorilor pentru fiecare recipient individual, și nu valorile medii ale duplicatelor, pentru a se obține din date cât mai multe informații posibil. Dacă, pe de altă parte, varianța este mare, experiența practică arată că valorile medii ale duplicatelor pot asigura o estimare matematică mai precisă, mai puțin influențată de erorile sistematice ale datelor decât în cazul fiecărui punct experimental reținut.
Se reprezintă curba adaptată și datele măsurate și se examinează dacă ajustarea curbei este adecvată. Analiza valorilor reziduale poate fi un instrument deosebit de util în acest scop. Dacă relația funcțională aleasă pentru ajustarea răspunsului concentrației nu descrie în mod corect întreaga curbă sau o parte esențială a acesteia, cum ar fi răspunsul la concentrații scăzute, se alege altă opțiune de ajustare a curbei – de exemplu o curbă asimetrică, cum ar fi funcția Weibull, în locul uneia simetrice. Inhibările negative pot fi o problemă pentru funcția de distribuție log-normală, de exemplu, fiind necesară și în acest caz o funcție de regresie alternativă. Nu se recomandă atribuirea valorii zero sau a unei valori pozitive mici unor astfel de valori negative, deoarece aceasta distorsionează distribuția erorilor. În scopul estimării valorilor ECscăzut x, se poate dovedi utilă trasarea de ajustări separate ale curbei pe părți ale acesteia, cum ar fi partea de inhibare scăzută. Se calculează pe baza ecuației ajustate [prin „estimare inversă”, C = f–1 (Y)] estimările punctului caracteristic al ECx și se raportează EC50 ca minim și una sau două estimări ECscăzut x. Experiența dobândită în urma testării practice a arătat că precizia testului pe alge permite, în mod normal, o estimare suficient de precisă la un nivel de inhibare de 10 %, dacă punctele experimentale sunt suficiente – cu excepția situațiilor când stimularea are loc la concentrații scăzute, ca factor de confuzie. Precizia unei estimări a EC20 este adesea considerabil mai bună decât cea a unui EC10, deoarece EC20 este poziționat de obicei pe partea aproximativ lineară a curbei concentrație-răspuns centrale. Uneori, EC10 poate fi dificil de interpretat ca urmare a stimulării creșterii. Astfel, chiar dacă EC10 poate fi obținut, în mod normal, cu o suficientă precizie, se recomandă ca și EC20 să fie întotdeauna raportat.
Factori de ponderare
Varianța experimentală nu este în general constantă și include de obicei o componentă proporțională, aplicarea unei regresii ponderate permanente fiind, prin urmare, avantajoasă. Factorii de ponderare pentru o astfel de analiză sunt dați de obicei invers proporțional cu varianța:
Wi = 1/Var(ri)
Mai multe programe de regresie includ opțiunea de analiză de regresie ponderată, factorii de ponderare fiind enumerați într-un tabel. Pentru simplificare, factorii de ponderare se normalizează prin multiplicarea lor cu n/Σ wi (n este numărul punctelor experimentale), astfel încât suma lor să fie egală cu 1.
Răspunsuri de normalizare
Normalizarea prin răspunsul mediu de control ridică unele probleme de principiu și determină apariția unei structuri a varianței destul de complicate. Împărțirea răspunsurilor la răspunsul mediu de control, în scopul obținerii procentajului de inhibare 1, introduce o eroare suplimentară, cauzată de eroarea pe media de control. Cu excepția cazului în care această eroare este neglijabilă, factorii de ponderare din regresie și limitele de încredere se corectează pentru covarianța cu proba martor (17). Rețineți că precizia înaltă pe răspunsul mediu de control estimat este importantă pentru minimizarea varianței generale pentru răspunsul relativ. Această varianță este descrisă mai jos:
indicele i se referă la nivelul concentrației i, iar indicele 0 se referă la probele martor.
Yi = Răspuns relativ = ri/r0 = 1 – I = f (Ci)
cu o varianță:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
și deoarece
(∂ Yi/ ∂ ri) = 1/r0 și (∂ Yi / ∂ r0) = ri/r0 2
cu date distribuite normal și duplicate mi și m0:
Var(ri) = σ2/mi
varianța totală a răspunsului relativ Yi devine astfel:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Eroarea pe media de control este invers proporțională cu rădăcina pătrată a numărului de duplicate de probe martor exprimat ca medie, uneori fiind justificată introducerea de date anterioare în scopul reducerii considerabile în acest fel a erorii. O procedură alternativă este de a nu normaliza datele și adăuga răspunsurile absolute, inclusiv datele despre răspunsul de control, ci de a introduce valoarea răspunsului de control ca parametru adițional de adăugat prin regresie nelineară. Cu o ecuație obișnuită de regresie cu doi parametri, această metodă impune ajustarea a trei parametri, necesitând prin urmare mai multe puncte experimentale decât regresia nelineară pe date care sunt normalizate prin folosirea unui răspuns de control presetat.
Intervale de încredere inverse
Calcularea intervalelor de încredere ale regresiei nelineare prin estimare inversă este destul de complexă, nefiind inclusă ca dotare standard în programele uzuale de statistică informatizată. Limitele de încredere aproximative pot fi obținute cu ajutorul programelor standard de regresie nelineară cu opțiunea de reparametrizare (Bruce and Versteeg, 1992), care presupune rescrierea ecuației matematice cu estimările punctului dorit, de exemplu EC10 și EC50 ca parametri de estimat. [Fie funcția I = f (α, β, concentrație) și se folosesc relațiile de definiție f (α, β, EC10) = 0,1 și f (α, β, EC50) = 0,5 pentru a substitui f (α, β, concentrație) cu o funcție echivalentă g (EC10, EC50, concentrație)].
Un calcul mai direct (Andersen et al., 1998) se efectuează prin reținerea ecuației originale și folosirea unei expansiuni Taylor în jurul mediilor ri și r0.
În ultimul timp au devenit populare „metodele bootstrap”. Aceste metode folosesc datele măsurate și reeșantionarea frecventă cu ajutorul unui generator de numere aleatorii pentru a estima o distribuție empirică a varianței.
Referințe bibliografice
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625-1632.
Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485-1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405-420.
C.4. DETERMINAREA BIODEGRADABILITĂȚII „RAPIDE”
PARTEA I. CONSIDERAȚII GENERALE
I.1. INTRODUCERE
Sunt descrise șase metode de testare care permit trierea substanțelor chimice pentru biodegradabilitate rapidă în mediul apos aerob:
(a) Epuizarea Carbonului Organic Dizolvat (COD) (Metoda C.4-A)
(b) Test de screening OCDE – Epuizarea COD (Metoda C.4-B)
(c) Degajarea bioxidului de carbon (CO2) (Testul modificat Sturm) (Metoda C.4-C)
(d) Respirometrie manometrică (Metoda C.4-D)
(e) Vas închis (Metoda C.4-E)
(f) MITI (Ministerul Comerțului și Industriei Internaționale – Japonia) (Metoda C.4-F)
Considerațiile generale și comune privind cele șase teste sunt prezentate în partea I a metodei. Aspectele specifice metodelor individuale sunt prezentate în părțile II-VII. Apendicele conțin definiții, formule și material orientativ.
Un test interlaboratoare OCDE, efectuat în 1988 ca exercițiu de comparabilitate, a arătat că metodele dau rezultate compatibile. Cu toate acestea, în funcție de caracteristicile fizice ale substanței ce urmează a fi testată, poate fi preferată o metodă sau alta.
I.2. ALEGEREA METODEI ADECVATE
Pentru a alege cea mai adecvată metodă, sunt necesare informații legate de solubilitatea substanței chimice, presiunea de vapori și caracteristicile de adsorbție. Structura sau formula chimică trebuie cunoscute pentru a calcula valorile teoretice și/sau a verifica valorile determinate ale parametrilor, de exemplu, CTO, CO2T, COD, COT, CCO (a se vedea apendicele 1 și 2).
Substanțele de testat care sunt solubile în apă până la cel puțin 100 mg/l pot fi evaluate prin toate metodele, cu condiția ca ele să fie nevolatile și neadsorbante. Pentru substanțele chimice care sunt greu solubile în apă, volatile sau adsorbante, metodele adecvate sunt indicate în tabelul 1 și descrise în apendicele 3. Substanțele chimice cu volatilitate moderată pot fi testate prin metoda epuizării COD, dacă există destul spațiu pentru gaz în vasele de testare (care trebuie să aibă dopuri adecvate). În acest caz, se pregătește și un martor abiotic care să permită urmărirea pierderilor de masă.
Tabelul 1
Aplicabilitatea metodelor de testare
|
Test |
Metoda analitică |
Adecvare la substanțele care sunt: |
||
|
greu solubile |
volatile |
adsorbante |
||
|
Epuizare COD |
Carbon organic dizolvat |
— |
— |
+/– |
|
Epuizare OCDE modificată |
Carbon organic dizolvat |
— |
— |
+/– |
|
Degajarea CO2 |
Respirometrie: degajarea CO2 |
+ |
— |
+ |
|
Respirometrie manometrică |
Respirometrie manometrică: consum de oxigen |
+ |
+/– |
+ |
|
Vas închis |
Respirometrie: oxigen dizolvat |
+/– |
+ |
+ |
|
MITI |
Respirometrie: consum de oxigen |
+ |
+/– |
+ |
Sunt necesare informații legate de puritatea sau proporțiile relative ale componentelor majore ale compusului de testat pentru a interpreta rezultatele obținute, în special când rezultatele au valori mici sau marginale.
Informațiile legate de toxicitatea substanței față de bacterii (apendicele 4) sunt foarte folositoare pentru alegerea concentrațiilor și se pot dovedi esențiale pentru interpretarea corectă a valorilor scăzute de biodegradare.
I.3. SUBSTANȚE DE REFERINȚĂ
Pentru a verifica metoda, se testează substanțe de referință care îndeplinesc criteriile de biodegradabilitate rapidă într-un flacon adecvat în paralel cu testele propriu-zise.
Substanțele chimice adecvate sunt anilina (proaspăt distilată), acetatul de sodiu și benzoatul de sodiu. Toate aceste substanțe chimice de referință se degradează în condițiile de lucru din prezentele metode, chiar și când nu se adaugă deliberat inocul.
S-a sugerat faptul că trebuie găsită o substanță chimică de referință ușor degradabilă, dar care să necesite adăugarea unui inocul. S-a propus ftalatul acid de potasiu, însă este nevoie de obținerea mai multor dovezi în cazul acestei substanțe înainte ca ea să fie acceptată ca substanță de referință.
La testele de respirometrie, compușii care conțin azot pot afecta consumul de oxigen din cauza nitrificării (a se vedea apendicele 2 și 5).
I.4. PRINCIPIUL METODELOR DE TESTARE
O soluție sau suspensie a substanței de testat în mediu mineral este inoculată și incubată în condiții aerobe la întuneric sau lumină difuză. Cantitatea de COD datorată inoculului în soluție trebuie să fie menținută la valori cât mai mici posibile în comparație cu cantitatea de COD datorată substanței de testat. Activitatea endogenă a inoculului este cuantificată făcând teste martor paralele, cu inocul și fără substanță de testat, deși activitatea endogenă a celulelor în prezența substanței nu se suprapune exact peste activitatea endogenă a martorului. În paralel se testează o substanță de referință pentru a controla funcționarea modului de operare.
În general, degradarea este urmată de determinarea parametrilor, cum ar fi COD, generarea de CO2 și consumul de oxigen, iar măsurătorile se fac la intervale destul de scurte, pentru a permite identificarea momentului de începere și terminare a biodegradării. Cu respirometre automate măsurarea se efectuează continuu. COD se măsoară uneori alături de un alt parametru, dar acest lucru se face în mod obișnuit numai la începutul și sfârșitul testării. De asemenea, se poate folosi o analiză chimică specifică pentru a estima degradarea primară a substanței de testat și pentru a se determina concentrația substanțelor intermediare formate (obligatoriu în testul MITI).
În mod normal, testul durează 28 zile. Cu toate acestea, testele se pot încheia înainte de 28 zile, adică de îndată ce curba biodegradării se aplatizează pentru cel puțin 3 determinări. Testele se pot, de asemenea, prelungi peste 28 zile, când curba arată că biodegradarea a început, dar că nu s-a ajuns la aplatizare în a 28-a zi.
I.5. CRITERII DE CALITATE
I.5.1. Reproductibilitate
Dată fiind natura biodegradării și a culturilor bacteriene mixte folosite ca inoculi, determinările se fac cel puțin în duplicat.
S-a observat experimental că la o concentrație mai mare de microorganisme adăugate inițial în mediul de testare variațiile între replici sunt mai mici. Testele interlaboratoare au arătat, de asemenea, că pot exista mari variații între rezultatele obținute de diferite laboratoare, dar că se poate ajunge la o armonizare acceptabilă în cazul compușilor ușor biodegradabili.
I.5.2. Validitatea testului
Testul se consideră validat dacă diferența dintre valorile extreme reprezentând gradul de îndepărtare al substanței la momentul aplatizării curbelor de biodegradare ale replicilor este mai mică de 20 % fie la sfârșitul testului, fie la începutul ferestrei de 10 zile, după caz, și dacă procentul de degradare a substanței de referință a atins nivelul de biodegradabilitate rapidă în 14 zile. Dacă nu este întrunită niciuna din aceste condiții, testul se repetă. Dată fiind rigoarea metodelor, valorile scăzute nu înseamnă în mod necesar că substanța de testat nu este biodegradabilă în condiții de mediu, ci că sunt necesare alte studii pentru a determina biodegradabilitatea.
Dacă într-un test de toxicitate care conține atât substanța de testat, cât și o substanță chimică de referință are loc mai puțin de 35 % degradare (bazat pe COD) sau mai puțin de 25 % (bazat pe CTO sau CO2T) în 14 zile, se poate presupune că substanța de testat este inhibitoare (a se vedea și apendicele 4). Seria de teste se repetă, dacă este posibil folosind o concentrație mai scăzută a substanței de testat și/sau o concentrație mai ridicată a inoculului, dar nu mai mult de 30 mg solide/litru.
I.6. MOD DE OPERARE GENERAL ȘI PREGĂTIRI
Condițiile generale aplicabile testelor sunt rezumate în tabelul 2. Aparatura și alte condiții de testare legate în mod specific de un anume test sunt descrise în subcapitolul destinat testului respectiv.
Tabelul 2
Condiții de testare
|
Test |
Epuizare COD |
Eliminare CO2 |
Respirometrie manometrică |
Test de screening OCDE |
Vas închis |
MITI (I) |
|
Concentrația substanței de testat |
||||||
|
în mg/l |
100 |
2-10 |
100 |
|||
|
mg COD/l |
10-40 |
10-20 |
10-40 |
|||
|
mg CTO/l |
50-100 |
5-10 |
||||
|
Concentrația inoculului (în celule/l, aprox.) |
≤ 30 mg/l SS sau ≤ 100 ml efluent/l (107-108) |
0,5ml efluent secundar/l (105) |
≤ 5 ml efluent/l (104-106) |
30 mg/l SS (107-108) |
||
|
Concentrația elementelor în mediu mineral (în mg/l) |
||||||
|
P |
116 |
11,6 |
29 |
|||
|
N |
1,3 |
0,13 |
1,3 |
|||
|
Na |
86 |
8,6 |
17,2 |
|||
|
K |
122 |
12,2 |
36,5 |
|||
|
Mg |
2,2 |
2,2 |
6,6 |
|||
|
Ca |
9,9 |
9,9 |
29,7 |
|||
|
Fe |
0,05 - 0,1 |
0,05 - 0,1 |
0,15 |
|||
|
pH |
7,4 ± 0,2 |
De preferință 7,0 |
||||
|
temperatură |
22 ± 2 oC |
25 ± 1 oC |
||||
|
COD = carbon organic dizolvat |
CTO = cerere teoretică de oxigen |
SS = materii solide în suspensie |
||||
I.6.1. Apa de diluție
Se folosește apa deionizată sau distilată fără concentrații inhibitoare de substanțe toxice (de exemplu, ioni de Cu++). Compusul de testat trebuie să nu contribuie cu mai mult de 10 % la conținutul de carbon organic al apei. Pentru a elimina valorile ridicate ale probei martor este necesar ca apa de testare să aibă o puritate ridicată. Contaminarea poate rezulta din impuritățile inerente și din rășinile schimbătoare de ioni și material provenit din liza de bacterii și alge. Pentru fiecare serie tratată se folosește numai o șarjă de apă, verificată înainte prin analiza COD. O astfel de verificare nu este necesară pentru testul în vas flacon închis, dar consumul de oxigen al apei trebuie să fie scăzut.
I.6.2. Soluțiile mamă ale componentelor minerale
Pentru a prepara soluțiile de testare se prepară soluțiile mamă ale componentelor minerale, cu concentrațiile adecvate. Se pot folosi următoarele soluții mamă (cu factori de diluție diferiți) pentru metodele: epuizare COD, test de screening modificat OCDE, eliminare CO2, respirometrie manometrică, testul în vas închis.
Factorii de diluție și, pentru testul MITI, pregătirea specifică a mediului mineral, sunt prezentate în capitolele referitoare la testele respective.
Se prepară următoarele soluții mamă folosind reactivi de puritate analitică:
|
(a) |
ortofosfat diacid de potasiu, KH2PO4 |
8,50 g |
|
ortofosfat acid de potasiu, K2HPO4 |
21,75 g |
|
|
ortofosfat acid de sodiu dihidrat, Na2HPO4·2 H2O |
33,40 g |
|
|
clorură de amoniu, NH4Cl |
0,50 g |
|
|
Se dizolvă în apă și se completează până la 1 litru. pH-ul soluției este 7,4. |
||
|
(b) |
clorură de calciu, anhidră, CaCl2 |
27,50 g |
|
sau clorură de calciu dihidrat, CaCl2·2 H2O |
36,40 g |
|
|
Se dizolvă în apă și se completează până la 1 litru |
||
|
(c) |
sulfat de magneziu heptahidrat, MgSO4·7H2O |
22,50 g |
|
Se dizolvă în apă și se completează până la 1 litru. |
||
|
(d) |
clorură ferică (III) hexahidrat, FeCl3·6H2O |
0,25 g |
|
Se dizolvă în apă și se completează până la 1 litru. |
Notă: Pentru a evita prepararea acestei soluții imediat înainte de folosire, se adaugă o picătură de HCl concentrat sau 0,4 g sare disodică a acidului etilendiamin-tetraacetic (EDTA) pe litru.
I.6.3. Soluții mamă ale substanțelor chimice
De exemplu, 1-10 g de substanță de testat sau de referință se dizolvă în apă deionizată și se completează până la 1 litru, când solubilitatea depășește 1 g/l. În caz contrar, soluțiile mamă se prepară în mediu mineral sau se adaugă substanța de testat direct în mediul mineral. Pentru manevrarea substanțelor chimice mai puțin solubile, a se vedea apendicele 3, dar în testul MITI (Metoda C.4-F), nu se folosesc nici solvenți și nici agenți de emulsionare.
I.6.4. Inocul
Inoculul poate proveni dintr-o varietate de surse: nămol activ, efluenți uzați (neclorinați), ape de suprafață și soluri sau dintr-un amestec al acestora. Pentru testele de epuizare COD, eliminarea CO2 și respirometrie manometrică, dacă se folosește nămol activ, acesta se ia dintr-o instalație de tratare sau o instalație de laborator care primește predominant ape reziduale menajere. S-a constatat că inoculi din alte surse dau rezultate foarte difuze. Pentru testul de screening modificat OCDE și testul în vas închis, este nevoie de un inocul mai diluat, fără agregate floculate de nămol, iar sursa preferată este un efluent secundar dintr-o instalație industrială sau de laborator pentru tratarea apei reziduale menajere. În testele MITI inoculul provine dintr-un amestec de surse și este descris în capitolul testului respectiv.
I.6.4.1. Inocul din nămoluri active
Se prelevează o probă de nămol activ proaspăt din bazinul de aerare al unei instalații de tratare ape reziduale sau dintr-o instalație de laborator care tratează în special apele reziduale menajere. Se îndepărtează particulele grosiere dacă este necesar, prin filtrate printr-o sită fină, apoi nămolul se menține în condiții aerobe.
Ca alternativă, se lasă la decantat sau se centrifughează proba (de exemplu, la 1 100 rot./min timp de 10 minute) după îndepărtarea tuturor particulelor grosiere. Se îndepărtează stratul de supernatant. Nămolul se spală în mediu mineral. Se prepară o suspensie de nămol concentrat în mediu mineral pentru a obține o concentrație de 3-5 g solide în suspensie/l și se aerează până în momentul folosirii.
Nămolul este prelevat dintr-o instalație clasică, care funcționează corect. Dacă nămolul provine dintr-o instalație de tratare cu debit mare sau se presupune că ar conține inhibitori, trebuie spălat. După o amestecare puternică, se lasă la decantat sau se centrifughează nămolul din noua suspensie, apoi se îndepărtează supernatantul; nămolul spălat se trece din nou în suspensie într-un alt volum de mediu mineral. Se repetă această procedură până când se consideră că nămolul nu mai conține substrat sau inhibitori în exces.
Imediat înainte de folosire, se prelevează o probă după ce nămolul este suspensionat complet sau, după caz, din nămol netratat, pentru a determina greutatea uscată a solidelor în suspensie.
O altă alternativă de obținere a inoculului este de a omogeniza nămolul activ (3-5 g solide în suspensie/l) într-un amestecător mecanic două minute la viteză medie; se lasă apoi timp de 30 minute, sau mai mult dacă este nevoie, la decantat și se prelevează supernatantul pentru a fi folosit ca inocul într-un raport de 10 ml/l de mediu mineral.
I.6.4.2. Alte surse de inocul
Inoculul se poate obține din efluentul secundar al unei instalații de tratare sau al unei instalații de laborator care se alimentează mai ales cu apă uzată menajeră. Se prelevează o probă proaspătă de apă uzată; se transportă în condiții aerobe. Se lasă să se decanteze timp de o oră sau se filtrează prin hârtie de filtru cu porozitate mare. Se menține efluentul decantat sau filtrat în condiții aerobe până în momentul folosirii. Până la 100 ml din acest tip de inocul se poate folosi pe litru de mediu mineral.
O altă sursă de inocul este apa de suprafață. În acest caz, se prelevează o probă de apă de suprafață adecvată (de exemplu, râu, lac) și se menține în condiții aerobe până în momentul folosirii. Dacă este nevoie, inoculul se concentrează prin filtrare sau centrifugare.
I.6.5. Precondiționarea inoculului
Inoculul poate fi precondiționare și adus în condițiile de testare, dar nu și preadaptat la substanța de testat. Precondiționarea constă în aerarea nămolului activ în mediu mineral sau efluent secundar timp de 5-7 zile, la temperatura de testare. Această precondiționare îmbunătățește uneori precizia metodelor prin reducerea valorilor din probele martor. Nu se consideră necesară precondiționarea inoculului în cazul testului MITI.
I.6.6. Martori abiotici
Dacă este necesar, posibila degradare abiotică a substanței de testat se verifică prin determinarea îndepărtării COD, a consumului de oxigen sau a eliminării bioxidului de carbon în probe martor sterile, care nu conțin inocul. Se sterilizează prin filtrare cu membrană filtrantă (0,2 - 0,45 μm) sau prin adăugarea unei substanțe toxice adecvate într-o concentrație corespunzătoare. Dacă se folosește filtrarea prin membrană, se prelevează probe în mod aseptic, pentru a menține sterilitatea. Dacă nu s-a realizat înainte adsorbția substanței de testat, testele care măsoară biodegradarea ca îndepărtare a COD, în special cele care folosesc ca inocul nămolul activ, trebuie să includă un martor abiotic care este inoculat și otrăvit.
I.6.7. Număr de vase
Numărul de vase într-un experiment tipic este prezentat în capitolul aferent fiecărui test.
Se pot folosi următoarele tipuri de vase:
— Suspensie de testare: conține substanță de testat și inocul
— Proba martor cu inocul: conține numai inocul
— Martor de metodă: conține substanță de referință și inocul
— Martor steril abiotic: conține substanță de testat, steril (a se vedea punctul I.6.6)
— Martor de adsorbție: conține substanță de testat, inocul și agentul de sterilizare
— Martor de toxicitate: conține substanță de testat, substanță de referință și inocul
Este obligatoriu ca testul propriu-zis și testul martor cu inocul să se facă în paralel. Este de dorit să se facă determinări și în alte vase, în paralel.
Acest lucru s-ar putea totuși să nu fie posibil întotdeauna. Se asigură suficiente probe sau citiri pentru a permite evaluarea procentului de degradare a substanței într-o perioadă de 10 zile.
I.7. DATE ȘI EVALUARE
Pentru calcularea lui Dt, degradarea procentuală, se folosesc valorile medii ale măsurătorilor duplicate ale parametrilor determinați atât în testul propriu-zis, cât și în proba martor cu inocul. Formulele matematice pentru calcularea Dt sunt prezentate în capitolele de mai jos pentru fiecare test. Evoluția degradării este ilustrată grafic și se indică fereastra de 10 zile. Se calculează și se consemnează procentul de eliminare a substanței obținut la sfârșitul perioadei de 10 zile și valoarea corespunzătoare aplatizării curbei de biodegradare sau sfârșitului testului, după caz.
La testele respirometrice, compușii care conțin azot pot afecta consumul de oxigen din cauza nitrificării (a se vedea apendicele 2 și 5).
I.7.1. Măsurarea degradării prin intermediul determinării COD
Pentru a se putea evalua validitatea testului (a se vedea punctul I.5.2), se calculează Dt, degradarea procentuală, de fiecare dată când se prelevează o probă, și anume se calculează separat pentru vasele conținând substanța de testat folosind media valorilor din măsurătorile COD duplicate. Se calculează folosind următoarea ecuație:

unde:
|
Dt |
= |
% degradare la timpul t |
|
Co |
= |
concentrația medie inițială a COD în mediul de cultură inoculat ce conține substanța de testat (mg COD/l) |
|
Ct |
= |
concentrația medie a COD la timpul t în mediul de cultură inoculat ce conține substanța de testat (mg COD/l) |
|
Cbo |
= |
concentrația medie inițială a COD în proba martor cu mediu mineral inoculat (mg COD/l) |
|
Cbt |
= |
concentrația medie a COD la timpul t în proba martor cu mediu mineral inoculat (mg COD/l) |
Toate concentrațiile se măsoară experimental.
I.7.2. Măsurarea degradării prin intermediul analizei specifice
Dacă sunt disponibile date analitice specifice, biodegradarea primară se calculează din:
![]()
unde:
|
Dt |
= |
% degradare la un timp t, în mod normal 28 zile |
|
Sa |
= |
cantitatea reziduală de substanță de testat în mediu inoculat, la sfârșitul testării (mg) |
|
Sb |
= |
cantitatea reziduală de substanță de testat în proba martor, cu apă/mediu mineral, la care s-a adăugat numai substanța de testat (mg) |
I.7.3. Degradarea abiotică
Dacă se folosește un martor steril, abiotic, degradarea abiotică se calculează în procente folosind formula:

unde:
|
Cs(o) |
= |
concentrația COD în martorul steril la ziua 0 |
|
C s(t) |
= |
concentrația COD în martorul steril în ziua t |
I.8. RAPORT
Raportul de testare cuprinde, dacă este posibil, următoarele date:
— substanțele chimice de testat și de referință, precum și puritatea lor;
— condițiile de testare;
— inocul: natura, locul de prelevare, concentrația și eventuala precondiționare;
— proporția și natura deșeurilor industriale prezente în nămol, dacă se cunosc;
— durata și temperatura testului;
— în cazul substanțelor greu solubile, tratamentul aplicat;
— metoda de testare aplicată; pentru orice modificare a modului de operare trebuie prezentate argumentele științifice și explicația;
— fișa de date;
— orice fenomene de inhibiție observate;
— orice degradare abiotică observată;
— date analitice specifice, dacă sunt disponibile;
— date analitice referitoare la produsele intermediare, dacă există;
— graficul degradării, exprimat în procente în funcție de timp pentru substanțele de testat și de referință; faza de latență, faza de degradare, fereastra de 10 zile și panta sunt indicate clar (apendicele 1). Dacă testul satisface criteriile de validare, la trasarea graficului se poate folosi media procentelor de eliminare ale vaselor ce conțin substanța de testat;
— eliminarea procentuală după fereastra de 10 zile și cea corespunzătoare aplatizării curbei de biodegradare sau sfârșitului testului.
PARTEA II. TESTUL DE EPUIZARE COD (Metoda C.4-A)
II.1. PRINCIPIUL METODEI
Un volum măsurat de mediu mineral inoculat care conține o concentrație cunoscută de substanță de testat (10-40 mg COD/l) ca singura sursă nominală de carbon organic, se aerează la întuneric sau lumină difuză la 22 ± 2 oC.
Degradarea este urmată de analiza COD la intervale frecvente pe o perioadă de 28 de zile. Gradul de biodegradare se calculează exprimând concentrația COD îndepărtată (corectată în funcție de cea din proba martor cu inocul) ca procent din concentrația prezentă inițial. Gradul de biodegradare primară poate fi, de asemenea, calculat din analiza chimică suplimentară făcută la începutul și la sfârșitul incubării.
II.2. DESCRIEREA METODEI
II.2.1. Aparatură
(a) vase conice, de exemplu, 250 ml-2 litri în funcție de volumul necesar pentru analiza COD;
(b) agitatoare pentru vase conice, fie cu control automat al temperaturii, fie fără acest control, dar folosite într-o încăpere cu temperatură constantă și având putere suficientă pentru a menține condițiile aerobe în toate vasele;
(c) aparatură de filtrare cu membrane adecvate;
(d) analizor COD;
(e) oxigenometru;
(f) centrifugă.
II.2.2. Prepararea mediului mineral
Pentru prepararea soluțiilor mamă, a se vedea I.6.2.
Se amestecă 10 ml de soluție (a) cu 800 ml apă de diluție, se adaugă câte 1 ml din soluțiile (b)-(d) și se completează până la 1 litru cu apă de diluție.
II.2.3. Prepararea și adaptarea inoculului
Inoculul poate proveni dintr-o varietate de surse: efluenți uzați, ape de suprafață, soluri sau dintr-un amestec al acestora.
A se vedea punctele I.6.4, I.6.4.1, I.6.4.2 și I.6.5.
II.2.4. Pregătirea vaselor
De exemplu, se introduc 800 ml de mediu mineral în vase conice de 2 litri și se adaugă volume suficiente de soluții mamă ale substanțelor de testat și de referință în fiecare vas pentru a obține o concentrație a substanței chimice echivalentă cu 10-40 mg COD/l. Se verifică valorile pH și se reglează, după caz, la 7,4. Se inoculează vasele cu nămol activ sau cu o altă sursă de inocul (a se vedea punctul I.6.4), pentru a obține o concentrație finală nu mai mare de 30 mg solide în suspensie/l. De asemenea, se prepară probe martor de inocul în mediu mineral, dar fără substanță de testat sau de referință.
După caz, se folosește un vas pentru a verifica efectul inhibitor posibil al substanței de testat, inoculând o soluție în mediu mineral având concentrații comparabile ale substanței de testat și ale celei de referință.
De asemenea, dacă este necesar, se pregătește încă un vas, steril, pentru a verifica dacă substanța de testat este degradată abiotic, folosind o soluție neinoculată a substanței de testat (a se vedea punctul I.6.6).
Suplimentar, dacă se presupune că substanța de testat este adsorbită în mod semnificativ pe sticlă, nămol etc., se face o estimare preliminară pentru a determina gradul probabil de adsorbție și, astfel, adecvarea testului la substanța respectivă (a se vedea tabelul 1). Se folosește un vas ce conține substanță de testat, inocul și agent de sterilizare.
Se completează volumele în toate vasele până la 1 litru cu mediu mineral și, după amestecare, se ia o probă din fiecare vas pentru a determina concentrația inițială a COD (a se vedea apendicele 2 punctul 4). Se acoperă gura vaselor, de exemplu, cu folie de aluminiu, astfel încât să se permită schimbul liber de aer între vas și atmosfera înconjurătoare. Apoi acestea se montează la agitatoare pentru începerea testului.
II.2.5. Numărul de vase într-o testare tipică
Vasele 1 și 2: suspensia de testare
Vasele 3 și 4: proba martor cu inocul
Vasul 5: martor de metodă
De preferință și când este necesar, se folosesc:
Vasul 6: martor steril abiotic
Vasul 7: martor de adsorbție
Vasul 8: martor de toxicitate
A se vedea și punctul I.6.7.
II.2.6. Efectuarea testului
Pe parcursul testului se determină concentrațiile COD în fiecare vas, în duplicat și la intervalele de timp cunoscute, suficient de frecvent pentru a putea determina începutul ferestrei de 10 zile și eliminarea procentuală la sfârșitul ferestrei de 10 zile. Se prelevează numai volumul minim de suspensie necesar pentru fiecare determinare.
Înainte de prelevarea probelor se completează pierderile cauzate de evaporare, adăugând apă de diluție (punctul 1.6.1) în cantitatea necesară, după caz. Se amestecă mediul de cultură foarte bine, verificând dacă materialul ce aderă pe pereții vaselor s-a dizolvat sau a trecut în suspensie. Se filtrează prin membrană sau se centrifughează proba (a se vedea apendicele 2 punctul 4), imediat după ce a fost prelevată. Probele filtrate sau centrifugate se analizează în aceeași zi sau se depozitează la 2-4 oC timp de maxim 48 de ore ori se mențin la temperaturi mai mici de – 18 oC pentru un timp mai îndelungat.
II.3. DATE ȘI RAPORT
II.3.1. Interpretarea rezultatelor
Se calculează degradarea în procente la timpul t conform punctului I.7.1 (determinare COD) și, opțional, punctului I.7.2. (analize specifice).
Se înregistrează toate rezultatele pe fișele de date prevăzute.
II.3.2. Validarea rezultatelor
A se vedea punctul I.5.2.
II.3.3. Raportul de testare
A se vedea punctul I.8.
II.4. FIȘA DE DATE
Un exemplu de fișă de date este prezentat mai jos.
TEST DE EPUIZARE COD
1. LABORATOR
2. DATA ÎNCEPERII TESTULUI
3. SUBSTANȚA DE TESTAT
Denumire:
Concentrația soluției mamă: mg/l substanță
Concentrația inițială în mediul de testare, t0: mg/l substanță
4. INOCUL
Sursa:
Tratament aplicat:
Precondiționare, dacă există:
Concentrația solidelor în suspensie în amestecul de reacție: mg/l
5. DETERMINĂRI DE CARBON
Analizor de carbon:
|
Vas nr. |
COD după n zile (mg/l) |
||||||
|
0 |
n1 |
n2 |
n3 |
n4 |
|||
|
Substanță de testat + inocul |
1 |
a1 |
|||||
|
a2 |
|||||||
|
a, medie Ca(t) |
|||||||
|
2 |
b1 |
||||||
|
b2 |
|||||||
|
b, medie Cb(t) |
|||||||
|
Probă martor cu inocul fără substanță de testat |
3 |
c1 |
|||||
|
c2 |
|||||||
|
c, medie Cc(t) |
|||||||
|
4 |
d1 |
||||||
|
d2 |
|||||||
|
d, medie Cd(t) |
|||||||
|
|
|||||||
6. EVALUAREA DATELOR BRUTE
|
Vas nr. |
% degradare după n zile |
|||||
|
0 |
n1 |
n2 |
n3 |
n4 |
||
|
1 |
|
0 |
||||
|
2 |
|
0 |
||||
|
Medie (1) |
|
0 |
||||
|
(1) D1 și D2 nu se exprimă ca medie, dacă există o diferență considerabilă. |
||||||
Notă: formate similare se pot folosi pentru substanțele de referință și pentru martorii de toxicitate.
7. MARTOR ABIOTIC (Opțional)
|
Timp (zile) |
||
|
0 |
t |
|
|
Conc. COD mg/l în martor steril |
Cs(0) |
Cs(t) |

8. ANALIZE CHIMICE SPECIFICE (Opțional)
|
Cantitatea reziduală a substanței de testat la sfârșitul testului (mg/l) |
% degradare primară |
|
|
Martor steril |
Sb |
|
|
Mediu de testare inoculat |
Sa |
|
PARTEA III. TESTUL DE SCREENING MODIFICAT OCDE (Metoda C.4-B)
III.1. PRINCIPIUL METODEI
Un volum măsurat de mediu mineral, cu o concentrație cunoscută de substanță de testat (10-40 mg COD/l) ca singura sursă nominală de carbon organic, se inoculează cu 0,5 ml efluent/litru de mediu. Amestecul se aerează la întuneric sau lumină difuză la 22 oC ± 2 oC.
Degradarea este urmată de analiza COD la intervale frecvente într-o perioadă de 28 de zile. Gradul de biodegradare este calculat exprimând concentrația COD eliminată (corectată în funcție de cea din proba martor cu inocul) ca procent din concentrația inițială. Gradul de biodegradare primară poate fi de asemenea calculat din analiza chimică suplimentară făcută la începutul și sfârșitul incubării.
III.2. DESCRIEREA METODEI
III.2.1. Aparatură
(a) vase conice, de exemplu, de la 250 ml la 2 litri, în funcție de volumul necesar pentru analiza COD;
(b) agitatoare pentru vase conice, fie cu control automat al temperaturii, fie fără acest control, dar folosite într-o încăpere cu temperatură constantă și având putere suficientă pentru a menține condițiile aerobe în toate vasele;
(c) aparatură de filtrare cu membrane adecvate;
(d) analizor COD;
(e) oxigenometru;
(f) centrifugă.
III.2.2. Prepararea mediului mineral
Pentru prepararea soluțiilor mamă a se vedea punctul I.6.2.
Se amestecă 10 ml de soluție (a) cu 800 ml apă de diluție, se adaugă câte 1 ml din soluțiile (b)-(d) și se completează până la 1 litru cu apă de diluție.
Această metodă folosește numai 0,5 ml efluent/litru ca inocul și prin urmare mediul poate necesita adăugarea de microelemente și factori de creștere. Acest lucru se face prin adăugarea câte unui mililitru din fiecare din următoarele soluții/litru de mediu final:
Soluție cu microelemente:
|
Sulfat de mangan tetrahidrat, MnSO4·4H2O |
39,9 mg |
|
Acid boric, H3BO3 |
57,2 mg |
|
Sulfat de zinc heptahidrat, ZnSO4·7H2O |
42,8 mg |
|
Heptamolibdat de amoniu, (NH4)6 Mo7O24 |
34,7 mg |
|
Chelați de fier (FeCl3 cu acid etilendiamin-tetraacetic) |
100,0 mg |
|
Se dizolvă și se aduce până la 1 000 ml cu apă de diluție |
|
|
Soluție de vitamine: |
|
|
Extract de drojdie |
15,0 mg |
Se dizolvă extractul de drojdie în 100 ml apă. Se sterilizează prin trecere printr-o membrană de 0,2 microni sau se pregătește proaspătă.
III.2.3. Prepararea și precondiționarea inoculului
Inoculul este obținut din efluentul secundar al unei instalații de tratare sau al unei instalații de laborator care folosește în special ape menajere (a se vedea punctele I.6.4.2 și I.6.5).
Se folosesc 0,5 ml/l de mediu mineral.
III.2.4. Pregătirea vaselor
De exemplu, se introduc câte 800 ml de mediu mineral în vase conice de 2 litri și se adaugă volume suficiente de soluții mamă ale substanțelor de testat și de referință, în vase separate, pentru a obține o concentrație a substanței echivalentă cu 10-40 mg COD/l. Se verifică valoarea pH-ului și se reglează, dacă este necesar, la 7,4. Se inoculează vasele cu 0,5 ml/l efluent de apă reziduală (a se vedea punctul I.6.4.2). De asemenea, se prepară probe de inocul pentru martor, în mediu mineral, fără substanță de testat sau de referință.
Dacă este necesar, se folosește un vas pentru a verifica posibilul efect inhibitor al substanței, inoculând o soluție în mediu mineral având concentrații comparabile ale substanței de testat și de referință.
De asemenea, dacă este necesar, se pregătește încă un vas, steril, pentru a se verifica dacă substanța de testat este degradată abiotic, folosind o soluție neinoculată a substanței de testat (a se vedea punctul I.6.6).
Suplimentar, dacă se presupune că substanța de testat este adsorbită în mod semnificativ pe sticlă, nămol etc., se face o estimare preliminară pentru a determina gradul probabil de adsorbție și, astfel, adecvarea testului la substanța respectivă (a se vedea tabelul 1). Se folosește un vas ce conține substanță de testat, inocul și agent de sterilizare.
Se completează volumele în toate vasele până la 1 litru cu mediu mineral și, după amestecare, se ia o probă din fiecare vas pentru a determina concentrația inițială a COD (a se vedea apendicele 2 punctul 4). Se acoperă gura vaselor, de exemplu, cu folie de aluminiu, astfel încât să se permită schimbul liber de aer între vas și atmosfera înconjurătoare. Apoi acestea se montează la agitatoare pentru începerea testului.
III.2.5. Numărul de vase într-un test tipic
Vasele 1 și 2: suspensia de testare
Vasele 3 și 4: probă martor cu inocul
Vasul 5: martor de metodă
De preferință și când este necesar, se folosesc:
Vasul 6: martor steril abiotic
Vasul 7: martor de adsorbție
Vasul 8: martor de toxicitate
A se vedea și punctul I.6.7.
III.2.6. Desfășurarea testului
Pe parcursul testului se determină concentrațiile COD în fiecare vas, în duplicat și la intervalele de timp cunoscute, suficient de frecvent pentru a putea determina începutul ferestrei de 10 zile și eliminarea procentuală la sfârșitul ferestrei de 10 zile. Se prelevează numai volumul minim de suspensie necesar pentru fiecare determinare.
Înainte de prelevarea probelor se completează pierderile cauzate de evaporare, adăugând apă de diluție (punctul I.6.1) în cantitatea necesară, după caz. Se amestecă mediul de cultură foarte bine, verificând dacă materialul ce aderă pe pereții vaselor s-a dizolvat sau a trecut în suspensie. Se filtrează prin membrană sau se centrifughează proba (a se vedea apendicele 2 punctul 4), imediat după ce a fost prelevată. Probele filtrate sau centrifugate se analizează în aceeași zi sau se depozitează la 2-4 oC timp de maxim 48 de ore ori se mențin la temperaturi mai mici de – 18 oC pentru un timp mai îndelungat.
III.3. DATE ȘI RAPORT
III.3.1. Interpretarea rezultatelor
Se calculează degradarea în procente la timpul t conform punctului I.7.1 (determinare COD) și, opțional, punctului I.7.2 (analize specifice).
Se înregistrează toate rezultatele pe fișele de date prevăzute.
III.3.2. Validarea rezultatelor
A se vedea punctul I.5.2.
III.3.3. Raportul de testare
A se vedea punctul I.8.
III.4. FIȘA DE DATE
Un exemplu de fișă de date este prezentat mai jos.
TEST DE SCREENING MODIFICAT OCDE
1. LABORATOR
2. DATA ÎNCEPERII TESTULUI
3. SUBSTANȚA DE TESTAT
Denumire:
Concentrația soluției mamă: mg/l substanță
Concentrația inițială în mediul de testare, t0: mg/l substanță
4. INOCUL
Sursa:
Tratament aplicat:
Precondiționare, dacă există:
Concentrația materiilor în suspensie în amestecul de reacție: mg/l
5. DETERMINĂRI DE CARBON
Analizor de carbon:
|
Vas nr. |
COD după n zile (mg/l) |
||||||
|
0 |
n1 |
n2 |
n3 |
n4 |
|||
|
Substanță de testat + inocul |
1 |
a1 |
|||||
|
a2 |
|||||||
|
a, medie Ca(t) |
|||||||
|
2 |
b1 |
||||||
|
b2 |
|||||||
|
b, medie Cb(t) |
|||||||
|
Probă martor cu inocul fără substanță de testat |
3 |
c1 |
|||||
|
c2 |
|||||||
|
c, medie Cc(t) |
|||||||
|
4 |
d1 |
||||||
|
d2 |
|||||||
|
d, medie Cd(t) |
|||||||
|
|
|||||||
6. EVALUAREA DATELOR BRUTE
|
Vas nr. |
% degradare după n zile |
|||||
|
0 |
n1 |
n2 |
n3 |
n4 |
||
|
1 |
|
0 |
||||
|
2 |
|
0 |
||||
|
Medie (1) |
|
0 |
||||
|
(1) D1 și D2 nu se exprimă ca medie, dacă există o diferență considerabilă. |
||||||
Notă: formate similare se pot folosi pentru substanțele de referință și pentru martorii de toxicitate.
7. MARTOR ABIOTIC (Opțional)
|
Timp (zile) |
||
|
0 |
t |
|
|
Conc. COD (mg/l) în martor steril |
Cs(0) |
Cs(t) |

8. ANALIZE CHIMICE SPECIFICE (Opțional)
|
Cantitatea reziduală a substanței de testat la sfârșitul testului (mg/l) |
% degradare primară |
|
|
Martor steril |
Sb |
|
|
Mediu de testare inoculat |
Sa |
|
PARTEA IV. TESTUL DE DEGAJARE A CO2 (Metoda C.4-C)
IV.1. PRINCIPIUL METODEI
Un volum măsurat de mediu mineral inoculat, cu o concentrație cunoscută de substanță de testat (10-20 mg COD sau TOC/l) ca unică sursă nominală de carbon organic, se aerează prin trecerea aerului fără dioxid de carbon, cu debit controlat, la întuneric sau la lumină difuză. Degradarea este urmărită timp de 28 zile prin determinarea dioxidului de carbon produs, care este absorbit pe hidroxid de bariu sau de sodiu și este măsurat prin titrarea hidroxidului rămas sau drept carbon anorganic. Cantitatea de dioxid de carbon produs de substanța de testat (corectată cu cea rezultată din proba martor cu inocul) este exprimată ca procent din CO2T. Gradul de biodegradare se poate de asemenea calcula din analizele COD suplimentare, făcute la începutul și la sfârșitul incubării.
IV.2. DESCRIEREA METODEI
IV.2.1. Aparatură
(a) vase de 2-5 litri, fiecare prevăzut cu un tub de aerare cu un capăt ajungând aproape de baza vasului și cu celălalt ieșind din vas;
(b) agitatoare magnetice, când se testează substanțe puțin solubile;
(c) vase pentru absorbția gazului;
(d) dispozitiv pentru controlul și măsurarea debitului de aer;
(e) aparatură pentru absorbția dioxidului de carbon, pentru prepararea aerului care nu conține dioxid de carbon; ca alternativă, se poate folosi un amestec de oxigen fără CO2 și azot fără CO2, din butelie, în proporția corectă (20 % O2: 80 % N2);
(f) dispozitiv pentru determinarea dioxidului de carbon, fie prin titrimetrie, fie printr-una din analizele cantitative ale carbonului anorganic;
(g) dispozitiv de filtrare cu membrană (opțional);
(h) analizor de COD (opțional).
IV.2.2. Prepararea mediului mineral
Pentru prepararea soluțiilor mamă, a se vedea punctul I.6.2.
Se amestecă 10 ml de soluție (a) cu 800 ml apă de diluție, se adaugă câte 1 ml din soluțiile (b)-(d) și se completează până la un 1 litru cu apă de diluție.
IV.2.3. Prepararea și precondiționarea inoculului
Inoculul poate proveni dintr-o varietate de surse: nămol activ, efluenți menajeri, ape de suprafață, soluri sau un amestec al acestora.
A se vedea punctele I.6.4, I.6.4.1, I.6.4.2 și I.6.5.
IV.2.4. Pregătirea vaselor
Ca exemplu, următoarele volume și cantități sunt indicate pentru vase de 5 litri ce conțin 3 l de suspensie. Dacă se folosesc volume mai mici, valorile se modifică în consecință, dar se asigură precizia măsurării dioxidului de carbon format.
În fiecare vas de 5 litri se introduc 2 400 ml mediu mineral. Se adaugă un volum adecvat de nămol activ preparat (a se vedea punctele I.6.4.1 și I.6.5) pentru a rezulta o concentrație de solide în suspensie de cel mult 30 mg/l în 3 l de amestec inoculat. Ca alternativă, mai întâi se diluează nămolul preparat pentru a rezulta o suspensie de 500-1 000 mg/l în mediu mineral, înainte de adăugarea unei cantități alicote la conținutul vasului de 5 litri astfel încât să se obțină o concentrație de 30 mg/l; astfel se asigură o precizie mai mare. Pot fi folosite alte surse de inocul (a se vedea punctul I.6.4.2).
Acest amestec inoculat se aerează peste noapte, cu aer fără CO2, pentru a elimina dioxidul de carbon din sistem.
Se adaugă volume cunoscute din soluțiile mamă ale materialului de testat și ale substanței de referință, separat, în vase de testare replicate, astfel încât concentrațiile de COD sau de COT provenite din substanțele adăugate să fie cuprinse între 10 și 20 mg/l; se lasă câteva vase fără adăugare de substanță de testat, fiind folosite drept martori pentru inocul. Substanțele de testat puțin solubile se adaugă direct în vas în funcție de greutate sau volum sau sunt tratate conform descrierii din apendicele 3.
Dacă este necesar, un vas se folosește pentru a verifica posibilul efect inhibitor al substanței de testat, prin adăugarea atât a substanței respective, cât și a substanței de referință, în aceleași concentrații ca și cele prezente în alte vase.
De asemenea, dacă este necesar, se folosește un vas steril pentru a verifica dacă substanța de testat este degradată abiotic, prin folosirea unei soluții neinoculate de substanță (a se vedea punctul I.6.6). Se sterilizează prin adăugarea unei substanțe toxice în concentrație adecvată.
Se aduc volumele de suspensii din toate vasele la 3 litri, prin adăugarea de mediu mineral înainte de aerare cu aer fără CO2. Opțional, pot fi luate probe pentru analiza COD (a se vedea apendicele 2 punctul 4) și/sau pentru analize specifice. Se conectează vasele de absorbție la aerisirile vaselor.
Dacă se folosește hidroxid de bariu, se conectează trei vase de absorbție, fiecare conținând 100 ml de soluție de hidroxid de bariu 0,0125 M, în serie cu fiecare dintre vasele de 5 litri. Soluția trebuie să nu conțină sulfat și carbonat precipitat, iar concentrația sa se determină imediat înainte de utilizare. Dacă se folosește hidroxid de sodiu, se conectează două vase în paralel, cel de-al doilea acționând ca martor pentru a demonstra că tot dioxidul de carbon a fost absorbit în primul. Sunt adecvate vase de absorbție cu sistemul de închidere al flacoanelor pentru ser. Se adaugă 200 ml de hidroxid de sodiu 0,05 M la fiecare vas, ceea ce este suficient pentru a absorbi cantitatea totală de dioxid de carbon degajată, când substanța de testat este complet degradată. Soluția de hidroxid de sodiu, chiar când este proaspăt preparată, conține urme de carbonați; aceasta este corectată prin deducerea carbonatului din proba martor.
IV.2.5. Numărul de vase pentru o testare tipică
Vasele 1 și 2: suspensie de testare
Vasele 3 și 4: probă martor cu inocul
Vasul 5: martor de metodă
De preferință și când este necesar, se folosesc:
Vasul 6: martor steril abiotic
Vasul 7: martor de toxicitate
A se vedea, de asemenea, punctul I.6.7.
IV.2.6. Desfășurarea testului
Testul începe cu barbotarea aerului fără CO2 prin suspensie la o viteză de 30-100 ml/min. Se prelevează periodic probe din absorbantul dioxidului de carbon, pentru analizarea conținutului de CO2. În timpul primelor zece zile este recomandat ca analizele să fie făcute în fiecare a doua sau a treia zi și apoi în fiecare a 5-a zi până la a 28-a zi, astfel încât perioada ferestrei de 10 zile să poată fi identificată.
În a 28-zi se prelevează probe (opțional) pentru determinarea COD și/sau analize specifice, se măsoară pH-ul suspensiei și se adaugă 1 ml acid clorhidric concentrat la fiecare vas; se aerează vasele peste noapte pentru a elimina dioxidul de carbon prezent în suspensii. În ziua a 29-a se face ultima analiză a dioxidului de carbon degajat.
În zilele în care se determină CO2, se deconectează vasul de absorbție cu hidroxid de bariu cel mai apropiat de vas și se titrează soluția de hidroxid cu HCl 0,05 M, folosind fenolftaleină ca indicator. Se mută vasele de absorbție rămase cu un loc mai aproape de vas și se adaugă un nou vas ce conține 100 ml hidroxid de bariu proaspăt 0,0125 M, ultimul în serie. Se fac titrări când e necesar, de exemplu când se observă un precipitat substanțial în primul vas de absorbție și înainte ca în cel de-al doilea să se observe ceva, sau cel puțin săptămânal. Ca alternativă, când se folosește NaOH ca absorbant, se ia cu o seringă o probă (depinzând de caracteristicile analizorului de carbon folosit) de soluție de hidroxid de sodiu din vasul de absorbție mai apropiat de vasul de testare. Se injectează proba în partea anorganică (CA) a analizorului de carbon pentru analiza directă a dioxidului de carbon degajat.
Se analizează conținutul celui de-al doilea vas de absorbție numai la sfârșitul testului, pentru a face corecția datelor în cazul în care dioxidul de carbon a pătruns și în acest vas.
IV.3. DATE ȘI RAPORT
IV.3.1. Interpretarea rezultatelor
Cantitatea de CO2 captată de absorbant și titrată este dată de formula:
mgCO2 = (100 × CB – 0,5 × V × CA) × 44
unde:
|
V |
= |
volumul de HCl folosit pentru titrarea a 100 ml de absorbant (ml) |
|
CB |
= |
concentrația soluției de hidroxid de bariu (M) |
|
CA |
= |
concentrația soluției de acid clorhidric (M) |
dacă CB este 0,0125 M, iar CA este 0,05 M, 100 ml hidroxid de bariu se titrează cu 50 ml, iar cantitatea de CO2 este dată de formula:
![]()
Astfel, în acest caz, pentru a converti volumul de HCl titrat în mg CO2 produs, factorul este 1,1.
Se calculează cantitățile de CO2 produs de inocul în sine și de inocul plus substanța de testat, folosind respectivele valori de titrare, diferența fiind cantitatea de CO2 produsă numai de substanța de testat.
De exemplu, dacă martorul cu inocul se titrează cu 48 ml și proba conținând inocul plus substanța de testat cu 45 ml,
CO2 de la inocul = 1,1 × (50 – 48) = 2,2 mg
CO2 de la inocul plus substanța de testat = 1,1 × (50 – 45) = 5,5 mg
Astfel, cantitatea de CO2 produsă de substanța de testat este de 3,3 mg.
Procentul de biodegradabilitate se calculează din formula:

sau

3,67 fiind factorul de conversie (44/12) de la carbon la dioxid de carbon.
Se calculează degradarea procentuală în orice moment ca sumă a procentelor teoretice de eliminare a CO2 (CO2T) calculate pentru fiecare din zilele în care eliminarea CO2 a fost măsurată.
Pentru vasele de absorbție cu hidroxid de sodiu se calculează cantitatea de dioxid de carbon produs, exprimat ca CI (mg), prin înmulțirea concentrației de CI în absorbant cu volumul de absorbant.
Se calculează procentul de degradare din:
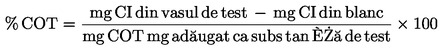
Se calculează COD eliminat (opțional) conform descrierii de la punctul I.7. Se înregistrează aceste rezultate și toate celelalte rezultate pe fișele de date prevăzute.
IV.3.2. Validarea rezultatelor
Conținutul de CI al suspensiei de substanță în mediul mineral la începutul testului trebuie să fie mai mic decât 5 % din CT, iar CO2 total din martorul cu inocul, la sfârșitul testului, nu va depăși în mod normal media de 40 mg/l. Dacă se obțin valori mai mari de 70 mg CO2/litru, datele și tehnica experimentală vor fi supuse unui examen critic.
A se vedea, de asemenea, I.5.2.
IV.3.3. Raportul de testare
A se vedea I.8.
IV.4. FIȘA DE DATE
Un exemplu de fișă de date este prezentat în continuare.
TEST DE DEGAJARE A DIOXIDULUI DE CARBON
1. LABORATOR
2. DATE LA ÎNCEPUTUL TESTULUI
3. SUBSTANȚA DE TESTAT
Denumire:
Concentrația soluției mamă: mg/litru substanță
Concentrația inițială în mediu: mg/litru substanță
C total adăugat în vas: mg C
CO2T: mg CO2
4. INOCUL
Sursa:
Tratament aplicat:
Precondiționare, dacă există:
Concentrația de solide în suspensie în amestecul de reacție: mg/litru
5. PRODUCEREA DIOXIDULUI DE CARBON ȘI DEGRADABILITATEA
Metodă: Ba(OH)2/NaOH/altele
|
Timpul |
CO2 format Test (mg) |
CO2 format Probă martor (mg) |
CO2 cumulat (mg) (media test minus proba martor) |
CO2T
|
|||||
|
1 2 |
media |
3 4 |
media |
1 |
2 |
1 |
2 |
media |
|
|
0 |
|||||||||
|
n1 |
|||||||||
|
n2 |
|||||||||
|
n3 |
|||||||||
|
28 |
|||||||||
Notă: Pentru substanțele de referință și pentru martorii de toxicitate pot fi folosite formate similare.
6. ANALIZA CARBONULUI (opțional)
Analizor de carbon:
|
Timpul (ziua) |
Proba martor mg/l |
Substanța de testat mg/l |
|
0 |
Cb(0) |
Co |
|
28 (1) |
Cb(t) |
Ct |
|
(1) sau la sfârșitul incubării. |
||

7. DEGRADAREA ABIOTICĂ (opțional)
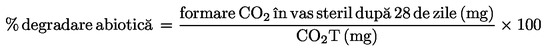
PARTEA V. TESTUL DE RESPIROMETRIE MANOMETRICĂ (Metoda C.4-D)
V.1. PRINCIPIUL METODEI
Un volum măsurat de mediu mineral inoculat, cu o concentrație cunoscută din substanța de testat (100 mg/litru de substanță testată, pentru a rezulta cel puțin 50-100 mg CTO/litru), ca unică sursă nominală de carbon organic, este agitat într-un vas închis, la o temperatură constantă (± 1 oC sau mai apropiat) timp de mai mult de 28 zile. Consumul de oxigen se determină fie prin măsurarea cantității de oxigen (produs electrolitic) necesare pentru menținerea constantă a volumului de gaz din vasul respirometrului, fie din schimbări ale volumului sau presiunii (sau o combinație a celor două) în aparatură. Dioxidul de carbon degajat este absorbit într-o soluție de hidroxid de potasiu sau într-un alt absorbant potrivit. Cantitatea de oxigen consumată de substanța de testat (corectată cu cea consumată de proba martor cu inocul testat în paralel) este exprimată ca procent de CTO sau CCO. Opțional, biodegradabilitatea primară poate fi de asemenea calculată prin analize specifice suplimentare, făcute la începutul și la sfârșitul incubării, iar biodegradabilitatea finală prin analiza COD.
V.2. DESCRIEREA METODEI
V.2.1. Aparatură
(a) respirometru adecvat;
(b) dispozitiv martor a temperaturii, menținută la ± 1 oC sau mai precis;
(c) dispozitiv de filtrare prin membrană (opțional);
(d) analizor de carbon (opțional).
V.2.2. Prepararea mediului mineral
Pentru prepararea soluțiilor mamă, a se vedea punctul I.6.2.
Se amestecă 10 ml soluție (a) cu 800 ml apă de diluție, se adaugă câte 1 ml din soluțiile (b)-(d) și se completează până la 1 litru cu apă de diluție.
V.2.3. Prepararea și precondiționarea inoculului
Inoculul poate proveni de la o varietate de surse: nămol activ, efluenți menajeri, ape de suprafață, soluri sau dintr-un amestec al acestora.
A se vedea punctele I.6.4, I.6.4.1, I.6.4.2 și I.6.5.
V.2.4. Pregătirea vaselor
Folosind soluții mamă, se prepară în șarje separate soluții ale substanțelor de testat și de referință în mediu mineral, astfel încât să rezulte, de regulă, o concentrație de 100 mg substanță/litru (rezultând cel puțin 50-100 mg CTO/litru).
Se calculează CTO pe baza formării sărurilor de amoniu, dacă nu se anticipează nitrificarea, caz în care calculul va fi bazat pe formarea nitraților (a se vedea apendicele 2 punctul 2).
Se determină valorile pH-ului și, dacă este necesar, se reglează la 7,4 ± 0,2.
Substanțele greu solubile vor fi adăugate în ultima etapă (a se vedea mai jos).
Dacă se determină toxicitatea substanței de testat, se prepară o altă soluție în mediu mineral ce conține atât substanță de testat, cât și substanță de referință, în concentrații similare cu cele ale soluțiilor individuale.
Dacă sunt necesare măsurători ale consumului fizico-chimic de oxigen se prepară o soluție a substanței de testat având de regulă 100 mg CTO/litru, care se sterilizează prin adăugarea unei substanțe toxice potrivite (a se vedea punctul I.6.6).
Se introduc volumele necesare de soluții ale substanței de testat și de referință, în cel puțin două vase. În alte vase se adaugă numai mediu mineral (pentru proba martor cu inocul) și, dacă este necesar, soluția comună de substanță de testat/substanță de referință și soluția sterilă.
Dacă substanța de testat este puțin solubilă, se adaugă direct în această etapă în funcție de cantitate sau volum sau este tratată conform descrierii din apendicele 3. Se adaugă hidroxid de potasiu, pelete de hidroxid de calciu sau alt absorbant în compartimentele vasului de absorbție a CO2.
V.2.5. Numărul de vase într-un test tipic
Vasele 1 și 2: suspensie de testare
Vasele 3 și 4: proba martor cu inocul
Vasul 5: martor de metodă
De preferință și când este necesar, se folosesc:
Vasul 6: martor steril
Vasul 7: martor de toxicitate
A se vedea, de asemenea, punctul I.6.7.
V.2.6. Desfășurarea testului
Se lasă vasele să atingă temperatura dorită, iar apoi se inoculează cu nămol activ preparat sau cu altă sursă de inocul, pentru a obține o concentrație de solide în suspensie nu mai mare de 30 mg/litru. Se asamblează echipamentul, se pornește agitatorul, se verifică etanșarea și se pornește măsurarea consumului de oxigen. De obicei, nu este necesară altă supraveghere în afara citirilor și verificărilor zilnice pentru a urmări menținerea unei temperaturi corecte și unei agitări adecvate.
Se calculează consumul de oxigen din citirile efectuate la intervale regulate și frecvente, folosind metodele date de producătorul echipamentului. La sfârșitul incubării, în mod normal după 28 zile, se măsoară pH-ul soluțiilor din vase, în special în cazul în care consumurile de oxigen sunt scăzute sau mai mici decât CTONH4 (pentru compușii care conțin azot).
Dacă este necesar, se prelevează probe inițiale și finale din vasele respirometrului, pentru analiza COD sau dozarea substanței (a se vedea apendicele 2 punctul 4). După prelevarea inițială, se înregistrează volumul suspensiei rămasă în vas. Când oxigenul este consumat de substanța de testat ce conține azot, se determină creșterea concentrației de nitrit și nitrat după 28 zile și se calculează corecția pentru oxigenul consumat prin nitrificare (apendicele 5).
V.3. DATE ȘI RAPORT
V.3.1. Interpretarea rezultatelor
Se împarte consumul de oxigen (mg) al substanței de testat după un timp dat (corectat cu acela al probei martor cu inocul după același timp) la cantitatea de substanță folosită. Rezultă CBO exprimat ca mg oxigen/mg substanță testată, după cum urmează:
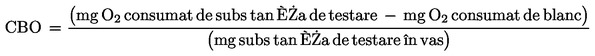
Procentul de biodegradare se calculează din:
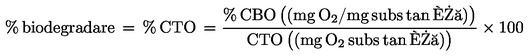
sau din:

Trebuie remarcat că aceste două metode nu dau în mod necesar aceeași valoare; este preferabil să fie folosită prima metodă.
Pentru substanțele de testat ce conțin azot, se folosește CTO adecvat (NH4 sau NO3), în conformitate cu datele cunoscute sau anticipate cu privire la incidența nitrificării (apendicele 2 punctul 2). Dacă nitrificarea are loc, dar nu este completă, se calculează corecția pentru oxigenul consumat prin nitrificare din schimbarea concentrațiilor de nitrit și nitrat (apendicele 5).
În cazul în care se fac determinări opționale ale carbonului organic și/sau ale unei substanțe specifice, se calculează degradarea procentuală, conform descrierii de la punctul I.7.
Se înregistrează toate rezultatele pe fișele de date anexate.
V.3.2. Validarea rezultatelor
Consumul de oxigen al martorului cu inocul este în mod normal de 20-30 mg O2/litru și nu este mai mare de 60 mg/litru în 28 zile. Valorile mai mari de 60 mg/litru necesită un examen critic al datelor și tehnicilor experimentale. Dacă valoarea pH-ului este în afara intervalului 6-8,5 iar consumul de oxigen de către substanța chimică de testat este mai mic de 60 %, testul se repetă cu o concentrație mai mică a substanței de testat.
A se vedea, de asemenea, punctul I.5.2.
V.3.3. Raport
A se vedea punctul I.8.
V.4. FIȘA DE DATE
Un exemplu de fișă de date este prezentat mai jos.
TEST DE RESPIROMETRIE MANOMETRICĂ
1. LABORATORUL
2. DATE LA ÎNCEPUTUL TESTULUI
3. SUBSTANȚA DE TESTAT
Denumire:
Concentrația soluției mamă: mg/litru
Concentrația inițială în mediu, C0: mg/litru
Volumul vasului de testare (V): ml
CTO sau CCO: mg O2/mg substanță testată (NH4, NO3)
4. INOCUL
Sursa:
Tratament aplicat:
Precondiționare, dacă există:
Concentrația de solide în suspensie în amestecul de reacție: mg/l
5. CONSUM DE OXIGEN: BIODEGRADABILITATE
|
Ziua |
|||||||||||||
|
0 |
7 |
14 |
21 |
28 |
|||||||||
|
Consumul de O2 (mg) al substanței de testat |
1 |
||||||||||||
|
2 |
|||||||||||||
|
a, medie |
|||||||||||||
|
Consumul de O2 (mg) al probei martor |
3 |
||||||||||||
|
4 |
|||||||||||||
|
b, medie |
|||||||||||||
|
CBO corectat (mg) |
(a1 – bm) |
||||||||||||
|
(a2 – bm) |
|||||||||||||
|
CBO (mg) substanță de testat |
|
||||||||||||
|
|
|||||||||||||
|
% degradare
|
D1 (a1) |
||||||||||||
|
D2 (a2) |
|||||||||||||
|
Media (1) |
|||||||||||||
|
(1) D1 și D2 nu se exprimă ca medie dacă există o diferență considerabilă. V = volumul mediului mineral din vasul de testare |
|||||||||||||
N.B.: Formate similare pot fi folosite pentru substanța de referință și pentru martorii de toxicitate.
6. CORECȚIA PENTRU NITRIFICARE (a se vedea apendicele 5)
|
Ziua |
0 |
28 |
Diferența |
|
(i) Concentrația de nitrat (mg N/litru) |
(N) |
||
|
(ii) Echivalentul de oxigen (4,57 × N × V) (mg) |
— |
— |
|
|
(iii) Concentrația de nitrat (mg N/litru) |
(N) |
||
|
(iv) Echivalentul de oxigen (3,43 × N × V) (mg) |
— |
— |
|
|
(ii) + (iv) Echivalentul oxigenului total |
— |
— |
7. ANALIZA CARBONULUI (opțional)
Analizorul de carbon:
|
Timpul (zile) |
Proba martor mg/litru |
Substanța de testat mg/litru |
|
0 |
(Cblo) |
(Co) |
|
28 (1) |
(Cblt) |
(Ct) |
|
(1) sau la sfârșitul incubării |
||
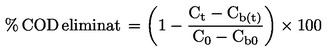
8. SUBSTANȚA SPECIFICĂ (opțional)
|
Sb |
= |
concentrația în controlul fizico-chimic (steril) după 28 zile |
|
Sa |
= |
concentrația în vasul inoculat după 28 zile |
![]()
9. DEGRADARE ABIOTICĂ (opțional)
|
a |
= |
consumul de oxigen din vasul steril după 28 zile, (mg) |
![]()
(a se vedea punctele 1 și 3)
![]()
PARTEA VI – TESTUL CU VAS ÎNCHIS (Metoda C.4-E)
VI.1. PRINCIPIUL METODEI DE TESTARE
Soluția de substanță de testat în mediu mineral, de obicei 2-5 mg/litru, se inoculează cu un număr relativ mic de microorganisme dintr-o populație bacteriană mixtă, în vase de testare complet pline, închise, ținute la întuneric, la temperatură constantă. Degradarea este urmată de analiza oxigenului dizolvat după o perioadă de 28 zile. Cantitatea de oxigen consumată de către substanța de testat, corectată cu consumul din proba martor cu inocul, testat în paralel, se exprimă ca procent de CTO sau CCO.
VI.2. DESCRIEREA METODEI
VI.2.1. Aparatură
(a) vase CBO, cu dopuri de sticlă, de exemplu de 250-300 ml;
(b) baie de apă sau incubator, pentru păstrarea vaselor la temperatură constantă (± 1 oC sau mai precis) și la întuneric;
(c) vase mari (2-5 litri) pentru prepararea mediului și pentru umplerea vaselor CBO;
(d) oxigenometru sau echipament și reactivi pentru titrarea Winkler.
VI.2.2. Prepararea mediului mineral
Pentru prepararea soluțiilor mamă, a se vedea punctul I.6.2.
Se amestecă câte 1 ml din soluțiile (a)-(d) și se aduce la 1 litru cu apă de diluție.
VI.2.3. Prepararea inoculului
Inoculul provine în mod normal din efluentul secundar al instalației de epurare sau din sedimentul provenit predominant de la apa uzată menajeră. O sursă alternativă de inocul este apa de suprafață. În mod normal, se folosește de la o picătură (0,05 ml) până la 5 ml de filtrat pe litru de mediu; pot fi necesare experimentări pentru a determina volumul optim pentru un efluent dat (a se vedea punctele I.6.4.2 și I.6.5).
VI.2.4. Pregătirea vaselor
Se aerează puternic mediul mineral timp de cel puțin 20 min. Fiecare serie de teste se efectuează cu mediu mineral provenit din același lot. În general, mediul este gata pentru folosire după păstrarea sa la temperatura de testare timp de 20 ore. Se determină concentrația oxigenului dizolvat pentru control; valoarea va fi de aproximativ 9 mg/litru la 20 oC. Toate operațiile de transfer și umplere se efectuează într-un mediu saturat cu oxigen, fără barbotare, prin folosirea sifoanelor.
Se pregătesc grupuri paralele de vase CBO cu substanță de testat și de referință pentru determinări în serii experimentale simultane. Se montează un număr suficient de vase CBO, inclusiv proba martor cu inocul, pentru a permite ca măsurătorile duplicate ale consumului de oxigen să fie făcute la intervalele de timp dorite, de exemplu, după 0, 7, 14, 21 și 28 de zile. Pentru a fi posibilă identificarea ferestrei de 10 zile, se folosesc mai multe vase.
Vasele mari se umplu o treime cu mediu mineral aerat. Apoi se adaugă soluții mamă de substanță testată și de referință în vase mari separate, în cantități suficiente pentru a obține o concentrație finală a substanțelor mai mică de 10 mg/litru. Nu se adaugă nicio substanță la mediul probei martor cu inocul, conținut într-un alt vas mare.
Pentru a nu limita activitatea inoculului, concentrația oxigenului dizolvat nu trebuie să scadă sub 0,5 mg/litru în vasele CBO. Aceasta limitează concentrația substanței de testat la aproximativ 2 mg/litru. Cu toate acestea, pentru compușii puțin degradabili și pentru aceia cu un CTO mic, se pot folosi 5-10 mg/litru. În unele cazuri, se recomandă să se efectueze serii paralele cu substanță de testat la două concentrații diferite, de exemplu, 2 și 5 mg/litru. În mod normal, se calculează CTO pe baza formării sărurilor de amoniu dar, dacă se presupune sau se știe că are loc nitrificarea, se calculează pe baza formării nitratului (CTONO3: a se vedea apendicele 2 punctul 2). Cu toate acestea, dacă nitrificarea nu este completă, dar are loc, se corectează cu modificările în concentrațiile de nitrit și de nitrat, determinate prin analiză (a se vedea apendicele 5).
Dacă trebuie determinată toxicitatea substanței de testat (de exemplu, în cazul în care au fost găsite anterior valori de biodegradabilitate scăzute), este necesară o altă serie de vase.
Se pregătește un alt vas mare ce conține mediu mineral aerat (aproximativ o treime din volumul său) plus substanță de testat și substanță de referință la aceleași concentrații finale ca și acelea din celelalte vase mari.
Se inoculează soluțiile din vasele mari cu efluent secundar (de la o picătură sau aproximativ 0,05 ml până la 5 ml/litru) sau cu o altă sursă cum ar fi apă de râu (a se vedea punctul I.6.4.2). În final, se aduc soluțiile la volum cu mediu mineral aerat folosind un furtun care ajunge la fundul vasului pentru a realiza o amestecare adecvată.
VI.2.5. Numărul de vase într-un test tipic
Într-un test tipic sunt folosite următoarele vase:
— cel puțin 10 conținând substanță de testat și inocul (suspensia de testare);
— cel puțin 10 conținând numai inocul (proba martor cu inocul);
— cel puțin 10 conținând substanța de referință și inocul (martor de metodă);
— și, dacă este necesar, 6 vase conținând substanță de testat, substanță de referință și inocul (martor de toxicitate). În plus, pentru a fi posibilă identificarea ferestrei de 10 zile, sunt necesare aproape de două ori mai multe vase.
VI.2.6. Desfășurarea testului
Fiecare soluție preparată se distribuie imediat în vasele CBO din grupul respectiv, prin furtun, din sfertul inferior (nu la bază) al vasului mare corespunzător, astfel încât toate vasele CBO să fie complet umplute. Se lovesc ușor pentru a îndepărta bulele de aer. Se analizează imediat, la momentul zero, oxigenul dizolvat din vase, prin metoda Winkler sau prin metoda electrodului. Conținutul vaselor poate fi păstrat pentru a fi analizat mai târziu, prin metoda Winkler, prin adăugarea de sulfat de magneziu (II) și de hidroxid de sodiu (primul reactiv Winkler). Se depozitează vasele închise cu grijă, ce conțin oxigen fixat ca oxid brun de magneziu (III) hidratat, la întuneric, la 10-20 oC, timp de cel mult 24 de ore, înainte de efectuarea etapelor rămase ale metodei Winkler. Se astupă cu dop vasele replicate rămase, urmărind să nu fie incluse bule de aer, și se incubează la 20 oC, la întuneric. Fiecare serie experimentală este însoțită de o serie paralelă completă, pentru determinarea probei martor inoculate. Se prelevează probe din vasele duplicate, din toate seriile, pentru analiza oxigenului dizolvat la intervale egale de timp (cel puțin săptămânal), de-a lungul celor 28 zile de incubare.
Probele prelevate săptămânal permit evaluarea procentului de eliminare în fereastra de 14 zile, în timp ce prelevarea de probe la 3-4 zile permite identificarea ferestrei de 10 zile, care necesită dublarea numărului celor mai multe vase.
Pentru substanțele de testat care conțin azot, se fac corecții ale consumului de oxigen necesar oricărei nitrificări care ar avea loc. În acest scop, se folosește metoda electrodului de O2 pentru determinarea concentrației oxigenului dizolvat și apoi se prelevează o probă din vasul CBO pentru analiza nitritului și nitratului. Din creșterea concentrației de nitrit și nitrat se calculează oxigenul folosit (a se vedea apendicele 5).
VI.3. DATE ȘI RAPORT
VI.3.1. Interpretarea rezultatelor
Mai întâi se calculează CBO la fiecare interval, scăzând cantitatea de oxigen consumat (mg O2/litru) de proba martor cu inocul din cantitatea consumată de substanța de testat. Se împarte acest consum corectat la concentrația substanței de testat (mg/litru), pentru a obține CBO specific ca mg oxigen pe mg substanță testată. Se calculează procentul de biodegradabilitate prin împărțirea CBO specific la CTO specific (calculat în conformitate cu apendicele 2 punctul 2) sau CCO (determinat prin analiză, a se vedea apendicele 2 punctul 3), după cum urmează:

= mg O2 pe mg substanță de testat

sau

Trebuie remarcat că aceste două metode nu conduc în mod necesar la aceeași valoare; este preferabil să se utilizeze prima metodă.
Pentru substanțele de testat ce conțin azot, se folosește CTO (NH4 sau NO3) în funcție de datele cunoscute sau anticipate privind incidența nitrificării (apendicele 2 punctul 2). Dacă nitrificarea are loc, dar nu este completă, se calculează corecția pentru oxigenul consumat la nitrificare din modificarea concentrațiilor de nitrit și nitrat (apendicele 5).
VI.3.2. Validarea rezultatelor
Scăderea conținutului de oxigen în martorul cu inocul nu trebuie să depășească 1,5 mg oxigen dizolvat/litru, după 28 zile. Valorile mai mari decât aceasta impun investigarea tehnicilor experimentale. Concentrațiile reziduale de oxigen din vasele de testare nu trebuie în niciun moment să scadă sub 0,5 mg/litru. Astfel, nivele de oxigen mai scăzute sunt valide numai dacă metoda de determinare a oxigenului dizolvat folosită este capabilă de măsurarea cu precizie a unor astfel de niveluri de concentrație.
A se vedea, de asemenea, punctul I.5.2.
VI.3.3. Raport
A se vedea punctul I.8.
VI.4. FIȘA DE DATE
Un exemplu de fișă de date este prezentat mai jos.
TEST ÎN VAS ÎNCHIS
1. LABORATOR
2. DATE LA ÎNCEPUTUL TESTULUI
3. SUBSTANȚA DE TESTAT
Denumire:
Concentrația soluției mamă: mg/litru
Concentrația inițială în vas: mg/litru
CTO sau CCO: mg O2/mg substanță testată
4. INOCUL
Sursă:
Tratamentul aplicat:
Precondiționare, dacă există:
Concentrația în amestecul de reacție: mg/litru
5. DETERMINAREA OD
Metoda: Winkler/electrod
Analizele vaselor
|
Timpul de incubare (zile) |
OD (mg/l) |
|||||
|
0 |
n1 |
n2 |
||||
|
Proba martor (fără substanță) |
1 |
C1 |
||||
|
2 |
C2 |
|||||
|
Media |
|
|||||
|
Substanța de testat |
1 |
a1 |
||||
|
2 |
a2 |
|||||
|
Media |
|
|||||
Notă: Un format similar poate fi folosit pentru substanța de referință și martorul de toxicitate.
6. CORECȚIA PENTRU NITRIFICARE (a se vedea apendicele 5)
|
Timpul de incubare (zile) |
0 |
n1 |
n2 |
n3 |
|
(i) Concentrația de nitrat (mg N/litru) |
||||
|
(ii) Modificarea concentrației de nitrat (mg N/litru) |
— |
|||
|
(iii) Echivalentul de oxigen (mg/litru) |
— |
|||
|
(iv) Concentrația de nitrit (mg N/litru) |
||||
|
(v) Modificarea concentrației de nitrat (mg N/litru) |
— |
|||
|
(vi) Echivalentul de oxigen (mg/litru) |
— |
|||
|
(iii) + (vi) Echivalentul de oxigen total (mg/litru) |
— |
7. CONSUM DE OD: % DEGRADARE
|
Îndepărtarea după n zile (mg/litru) |
||||
|
n1 |
n2 |
n3 |
||
|
VAS 1: (mto – mtx) – (mbo – mbx) |
||||
|
VAS 2: (mto – mtx) – (mbo – mbx) |
||||
|
VAS 1
|
||||
|
VAS 2
|
||||
|
% medie (1)=
|
||||
|
(1) Nu se va lua în considerare media dacă este o diferență considerabilă între replici. |
||||
|
mt0 |
= |
valoarea în vasul de testare la momentul 0 |
|
mtx |
= |
valoarea în vasul de testare la momentul x |
|
mb0 |
= |
valoarea medie a probei martor la momentul 0 |
|
mbx |
= |
valoarea medie a probei martor la momentul x |
Se aplică, de asemenea, corecții pentru nitrificare la punctul (iii) + (vi) în punctul 6.
8. CONSUM DE OD ÎN PROBA MARTOR
Consumul de oxigen al probei martor: (mb0 – mb28) mg/litru. Consumul este important pentru validarea testului. El trebuie să fie mai mic de 1,5 mg/litru.
PARTEA VII – TESTUL MITI (METODA C.4-F)
VII.1. PRINCIPIUL METODEI
Consumul de oxigen al soluției sau al suspensiei sub agitare de substanță de testat în mediu mineral, inoculată cu microorganisme mature, neadaptate, se măsoară automat după o perioadă de 28 zile într-un respirometru cu circuit închis, la întuneric, la 25 ± 1 oC. Dioxidul de carbon degajat este absorbit în calce sodică. Biodegradabilitatea este exprimată ca procent de oxigen absorbit (corectat cu absorbția în proba martor) față de absorbția teoretică (CTO). Procentul biodegradabilității primare se calculează de asemenea din analiza chimică specifică suplimentară realizată la începutul și la sfârșitul incubării și, opțional, prin analiza COD.
VII.2. DESCRIEREA METODEI
VII.2.1. Aparatură
(a) aparat automat de măsurare electrolitică a CBO sau respirometru normal echipat cu 6 vase de 300 ml fiecare și cu capsule ce conțin absorbant de CO2;
(b) cameră cu temperatură constantă și/sau baie de apă la 25 ± 1 oC sau mai mult;
(c) dispozitiv de filtrare cu membrană (opțional);
(d) analizor de carbon (opțional).
VII.2.2. Prepararea mediului mineral
Se prepară următoarele soluții mamă, folosind reactivi puri pentru analiză și apă (I.6.1):
|
(a) |
Ortofosfat diacid de potasiu, KH2PO4 |
8,50 g |
|
Ortofosfat monoacid de potasiu, K2HPO4 |
21,75 g |
|
|
Ortofosfat monoacid de sodiu dodecahidrat, Na2HPO4·12 H2O |
44,60 g |
|
|
Clorură de amoniu, NH4Cl |
1,70 g |
|
|
Se dizolvă în apă și se aduce la 1 litru. |
||
|
Valoarea pH-ului soluției va fi de 7,2. |
||
|
(b) |
Sulfat de magneziu heptahidrat, MgSO4·7 H2O |
22,50 g |
|
Se dizolvă în apă și se aduce la 1 litru. |
||
|
(c) |
Clorură de calciu anhidră, CaCl2 |
27,50 g |
|
Se dizolvă în apă și se aduce la 1 litru. |
||
|
(d) |
Clorură de fier (III) hexahidrat, FeCl3·6 H2O |
0,25 g |
|
Se dizolvă în apă și se aduce la 1 litru. |
Se iau 3 ml din fiecare soluție (a), (b), (c) și (d) și se aduce soluția la 1 litru.
VII.2.3. Prepararea inoculului
Se prelevează probe proaspete din cel puțin zece locuri, în principal din ariile unde sunt folosite și descărcate diferite substanțe chimice. Din locuri cum ar fi instalații de tratare a nămolurilor, stații de epurare ale apelor uzate industriale, râuri, lacuri, mări, se prelevează probe de 1 l de nămol, sol de suprafață, apă etc. și se amestecă bine. După îndepărtarea materiilor plutitoare și după decantare, se reglează pH-ul supernatantului la 7 ± 1 cu hidroxid de sodiu sau acid fosforic.
Se folosește un volum adecvat de supernatant filtrat pentru a umple cu nămol activ un vas de încărcare-descărcare și se aerează lichidul aproximativ 23 1/2 h. După treizeci de minute de la oprirea aerării se îndepărtează aproximativ o treime din întregul volum al supernatantului și se adaugă la materialul sedimentat un volum egal de soluție (pH 7) ce conține 0,1 % glucoză, 0,1 % peptonă și 0,1 % ortofosfat diacid de potasiu și se reîncepe aerarea. Se repetă această procedură o dată pe zi. Operarea instalației cu nămol se face conform bunelor practici de laborator: efluenții sunt limpezi, temperatura este menținută la 25 ± 2 oC, pH-ul este 7 ± 1, nămolul sedimentează bine, există suficientă aerare pentru a păstra amestecul în condiții aerobe tot timpul, protozoarele sunt prezente și activitatea nămolului este testată față de o substanță de referință cel puțin la fiecare trei luni. Nu se folosește nămolul ca inocul decât după cel puțin o lună de întreținere, dar nu după mai mult de patru luni. Prin urmare, se vor preleva probe din cel puțin 10 locuri la intervale egale, o dată la trei luni.
Pentru a menține nămolul proaspăt și pe cel vechi la aceeași activitate, se amestecă supernatantul filtrat de la nămolul activ în uz cu un volum egal de supernatant filtrat de la un amestec proaspăt prelevat din zece surse și se cultivă lichidul combinat ca mai sus. Se prelevează nămol pentru folosire ca inocul după 18-24 de ore de la alimentarea instalației.
VII.2.4. Pregătirea vaselor
Se pregătesc următoarele șase vase, astfel încât să conțină:
Nr. 1: substanța de testat în apă de diluție la 100 mg/l
Nr. 2, 3 și 4: substanța de testat în mediu mineral la 100 mg/l
Nr. 5: substanța de referință (de exemplu anilină) în mediu mineral la 100 mg/l
Nr. 6: numai mediu mineral
Substanțele de testat greu solubile se adaugă direct, în funcție de cantitate sau de volum, sau se tratează conform descrierii din apendicele 3, excepție făcând faptul că nu se folosesc solvenți și nici agenți de emulsionare. Se adaugă la toate vasele absorbanți de CO2 în capsulele speciale prevăzute în acest scop. Se reglează pH-ul din vasele 2, 3 și 4 la valoarea de 7,0.
VII.2.5. Efectuarea testului
Se inoculează vasele nr. 2, 3 și 4 (cu suspensie de testare), nr. 5 (martor de activitate) și nr. 6 (probă martor cu inocul) cu un mic volum de inocul pentru a rezulta o concentrație de 30 mg/l de solide în suspensie. Nu se adaugă inocul vasului nr. 1 care servește drept martor abiotic. Se montează echipamentul, se verifică etanșeitatea, se pornește agitarea și se încep măsurătorile de consum de oxigen la întuneric. Zilnic se verifică temperatura, agitatorul și înregistratorul oxigenului consumat și se notează orice schimbare a culorii conținutului vaselor. Se citește direct consumul de oxigen la șase vase, printr-o metodă adecvată, de exemplu, prin intermediul unui înregistrator cu diagramă cu șase puncte, care furnizează curba CBO. La sfârșitul incubării, în mod normal după 28 zile, se măsoară pH-ul conținutului vaselor și se determină concentrația substanței de testat rămasă și a oricărui intermediar și, în cazul substanțelor solubile în apă, concentrația de COD (apendicele 2 punctul 4). Este necesară o atenție deosebită în cazul substanțelor volatile. Dacă se anticipează nitrificarea, se determină concentrația de nitrat și de nitrit, dacă este posibil.
VII.3. DATE ȘI RAPORT
VII.3.1. Interpretarea rezultatelor
Se împarte consumul de oxigen (mg) al substanței de testat, corectat cu acela citit la proba martor cu inocul după același timp, la cantitatea substanței de testat folosită. Rezultă CBO, exprimat ca mg oxigen/mg substanță testată, după cum urmează:

= mg O2 pe mg substanță de testat
Procentul de biodegradare se obține apoi din:
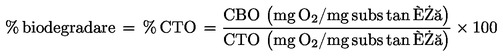
Pentru amestecuri se calculează CTO din analiza elementară, ca și pentru compușii simpli. Se folosește CTO adecvat (CTONH4 sau CTONO3) dacă nitrificarea este absentă sau este completă (apendicele 2 punctul 2). Dacă totuși nitrificarea are loc, dar este incompletă, se face o corecție pentru consumul de oxigen la nitrificare, calculat din modificarea concentrațiilor de nitrit și nitrat (apendicele 5).
Se calculează procentul de biodegradare primară cu ajutorul pierderii de substanță chimică inițială (a se vedea punctul I.7.2).
![]()
Dacă s-a înregistrat o pierdere de substanță în vasul nr. 1, care măsoară eliminarea fizico-chimică, această constatare se consemnează și se folosește concentrația de substanță (Sb) după 28 zile din acest vas pentru a se calcula biodegradarea procentuală.
Când se fac determinări de COD (opțional), se calculează biodegradarea procentuală finală din:

conform descrierii de la punctul I.7.1. Dacă s-a înregistrat o pierdere de COD în vasul nr. 1, care măsoară eliminarea fizico-chimică, concentrația de COD din acest vas se folosește pentru a calcula biodegradarea procentuală.
Se înregistrează toate rezultatele pe fișele de date atașate.
VII.3.2. Validarea rezultatelor
Consumul de oxigen în proba martor cu inocul este în mod normal 20-30 mg O2/l și nu trebuie să fie mai mare de 60 mg/l în timpul celor 28 de zile. Valorile mai mari de 60 mg/l necesită un examen critic al datelor și al tehnicilor experimentale. Dacă valoarea pH-ului este în afara intervalului 6-8,5 și consumul de oxigen al substanței de testat este mai mic de 60 %, testul se repetă cu o concentrație mai mică a substanței.
A se vedea, de asemenea, punctul I.5.2.
Dacă procentul de degradare al anilinei, calculat din consumul de oxigen, nu depășește 40 % după 7 zile și 65 % după 14 zile, testul este invalidat.
VII.3.3. Raport
A se vedea punctul I.8.
VII.4. FIȘA DE DATE
Un exemplu de fișă de date este prezentat mai jos.
TESTUL MITI (I)
1. LABORATORUL
2. DATE LA ÎNCEPUTUL TESTULUI
3. SUBSTANȚA DE TESTAT
Denumire:
Concentrația soluției mamă: mg/l substanță de testat
Concentrația inițială în mediul mineral, C0: mg/l substanță de testat
Volumul amestecului de reacție, V: ml
CTO: mg O2/l
4. INOCUL
Locurile de prelevare a probelor de nămol:
|
1) … |
6) … |
|
2) … |
7) … |
|
3) … |
8) … |
|
4) … |
9) … |
|
5) … |
10) … |
Concentrația materiilor solide în suspensie în nămolul activ după aclimatizare cu apă uzată sintetică = ... mg/l
Volumul de nămol activ pe litru de mediu mineral final = ...ml
Concentrația de nămol în mediul mineral final = ...mg/l
5. CONSUMUL DE OXIGEN: BIODEGRADABILITATEA
Tipul de respirometru folosit:
|
Ziua |
|||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
Consumul de O2 la substanța de testat |
a1 |
||||||
|
a2 |
|||||||
|
a3 |
|||||||
|
Consumul de O2 (mg) la proba martor |
b |
||||||
|
Consumul de O2 (mg) corectat |
(a1 – b) (a2 – b) (a3 – b) |
||||||
|
CBO/mg substanță de testat |
|
Vas 1 |
|||||
|
Vas 2 |
|||||||
|
Vas 3 |
|||||||
|
% degradare
|
1 |
||||||
|
2 |
|||||||
|
3 |
|||||||
|
media (1) |
|||||||
|
(1) Nu se face o medie dacă sunt diferențe considerabile între replici. |
|||||||
Notă: Formate similare pot fi folosite pentru substanța de referință.
6. ANALIZA DE CARBON (opțional)
Analizorul de carbon:
|
Vas |
COD |
Îndepărtat % COD |
Media |
|||
|
Măsurat |
Corectat |
|||||
|
Apă + substanță de testat |
a |
— |
— |
|||
|
Nămol + substanță de testat |
b1 |
b1 – c |
||||
|
Nămol + substanță de testat |
b2 |
b2 – c |
||||
|
Nămol + substanță de testat |
b3 |
b3 – c |
||||
|
Probă martor cu inocul |
c |
— |
— |
— |
||
![]()
7. DATE ANALITICE SPECIFICE SUBSTANȚEI
|
Cantitatea rămasă de substanță de testat la sfârșitul testului |
% de degradare |
|
|
probă martor cu apă |
Sb |
|
|
mediu inoculat |
Sa1 |
|
|
Sa2 |
||
|
Sa3 |
![]()
Se calculează % degradare pentru vasele a1, a2 și a3.
8. OBSERVAȚII
Se atașează curba CBO în funcție de timp, dacă este disponibilă.
Apendicele 1
ABREVIERI ȘI DEFINIȚII
|
OD |
: |
Oxigenul dizolvat (mg/l) este concentrația de oxigen dizolvat într-o probă de apă. |
|
CBO |
: |
Consumul biochimic de oxigen (g) este cantitatea de oxigen consumată de microorganisme când se metabolizează un compus de testat; de asemenea, se exprimă în g de oxigen consumat pe g substanță testată (a se vedea metoda C.5). |
|
CCO |
: |
Consumul chimic de oxigen (g) este cantitatea de oxigen consumată în timpul oxidării unui compus de testat cu dicromat acid fierbinte; el furnizează o măsură a cantității prezente de materie oxidabilă; se exprimă și ca g oxigen consumat pe g compus de testat (a se vedea metoda C.6). |
|
COD |
: |
Carbonul organic dizolvat este carbonul organic prezent în soluție sau acela care trece printr-un filtru de 0,45 microni sau rămâne în supernatant după centrifugare la 40 000 m· s–2 (± 4 000 g) timp de 15 min. |
|
CTO |
: |
Consumul teoretic de oxigen (mg) este cantitatea totală de oxigen necesară pentru a oxida complet substanța; este calculat din formula moleculară (a se vedea apendicele 2 punctul 2) și este de asemenea exprimat ca mg oxigen necesar pe mg compus de testat. |
|
CO2T |
: |
Cantitatea teoretică de dioxid de carbon (mg) este cantitatea de dioxid de carbon calculată din conținutul de carbon cunoscut sau măsurat al compusului de testat când acesta este complet mineralizat; se exprimă și ca mg dioxid de carbon degajat pe mg substanță. |
|
COT |
: |
Carbonul organic total al probei este suma carbonului organic în soluție și în suspensie. |
|
CA |
: |
Carbonul anorganic |
|
CT |
: |
Carbonul total este suma carbonului organic și anorganic prezent în eșantion. |
Biodegradarea primară:
este modificarea structurii chimice a substanței, produsă prin acțiune biologică, care are ca rezultat pierderea proprietăților specifice ale substanței.
Biodegradarea finală (aerobică):
este nivelul de degradare realizat când substanța de testat este complet folosită de microorganisme având ca rezultat producerea de dioxid de carbon, apă, săruri minerale și noi constituenți celulari microbieni (biomasă).
Ușor biodegradabil:
o clasificare arbitrară a substanțelor care au trecut anumite teste de screening specificate pentru biodegradabilitatea finală; aceste teste sunt atât de riguroase încât se admite că asemenea compuși se vor degrada biologic rapid și complet în medii acvatice în condiții aerobe.
Intrinsec biodegradabil:
o clasificare a substanțelor pentru care există probe neechivoce de biodegradare (primară sau finală) în orice test de biodegradabilitate recunoscut.
Tratabilitate:
este capacitatea substanțelor de a fi eliminate în timpul tratamentului biologic al apelor reziduale fără a afecta negativ funcționarea normală a procesului de tratare. În general, compușii ușor biodegradabili sunt tratabili, dar nu este cazul tuturor sunt compuși intrinsec biodegradabili. Se pot produce, de asemenea, și procese abiotice.
Timpul de latență
este timpul de la inoculare, în testul de epuizare, până când procentul de degradare crește cel puțin până la 10 %. Timpul de latență este adesea foarte variabil și slab reproductibil.
Timpul de degradare
este timpul de la sfârșitul perioadei de latență până în momentul în care se atinge 90 % din nivelul maxim de degradare.
Fereastra de 10 zile
este intervalul de 10 zile care urmează imediat după atingerea nivelului de 10 % degradare.
Apendicele 2
CALCULAREA ȘI DETERMINAREA UNOR PARAMETRI SINTETICI ADECVAȚI
În funcție de metoda aleasă, sunt necesari anumiți parametri sintetici. Următoarea secțiune descrie modul de obținere a acestor valori. Folosirea acestor parametri este descrisă la fiecare metodă.
1. Conținutul de carbon
Conținutul de carbon se calculează din compoziția elementară cunoscută sau determinată din analiza elementară a substanței de testat.
2. Consumul teoretic de oxigen (CTO)
Consumul teoretic de oxigen (CTO) poate fi calculat dacă este cunoscută compoziția elementară sau este determinată prin analiză elementară. Acesta este, pentru compusul
CcHhClclNnNanaOoPpSs
fără nitrificare,
![]()
mg/mg
sau cu nitrificare,
![]()
mg/mg
3. Consumul chimic de oxigen (CCO)
Consumul chimic de oxigen (CCO) se determină în conformitate cu metoda C.6.
4. Carbonul organic dizolvat (COD)
Carbonul organic dizolvat (COD) este prin definiție carbonul organic al unei substanțe sau al unui amestec în apă care trece prin filtrul de 0,45 microni.
Se iau probe din vasele de testare și se filtrează imediat în aparatul de filtrare, folosind un filtru cu membrana adecvată. Primii 20 ml (cantitatea poate fi redusă când se folosesc filtre mici) de filtrat sunt eliminați. Volume de 10-20 ml sau mai mici, dacă sunt injectate (volumul depinde de cantitatea necesară la analizorul de carbon) sunt reținute pentru analiza carbonului. Concentrația COD se determină cu ajutorul unui analizor de carbon organic care poate măsura exact o concentrație de carbon echivalentă sau mai mică de 10 % din concentrația inițială de COD folosită la test.
Probele filtrate care nu pot fi analizate în aceeași zi de lucru pot fi păstrate la frigider, la 2-4 o C, timp de 48 de ore sau sub – 18 oC pentru perioade mai lungi.
Observații:
Filtrele cu membrană sunt adesea impregnate cu agenți tensioactivi pentru hidrofilizare. Astfel, filtrul poate conține mai mult de câteva mg de carbon organic solubil care interferează cu determinările de biodegradabilitate. Agenții tensioactivi și alți compuși organici solubili sunt îndepărtați din filtre prin fierbere în apă deionizată timp de trei perioade a câte o oră fiecare. Filtrele pot fi apoi depozitate în apă timp de o săptămână. Dacă se folosesc cartușe de filtrare, fiecare lot trebuie verificat pentru a confirma că nu eliberează carbon organic solubil.
În funcție de tipul membranei de filtrare, substanța de testat poate fi reținută prin adsorbție. Prin urmare, este recomandabil să se ia măsuri pentru ca substanța să nu fie reținută pe filtru.
Centrifugarea la 40 000 m· sec-2 (4 000 g) timp de 15 minute se poate folosi în locul filtrării pentru a face diferența între COT și COD. Metoda nu este viabilă la concentrația inițială de < 10 mg COD/l deoarece fie că nu sunt îndepărtate toate bacteriile, fie că este redizolvat carbonul, ca parte a plasmei bacteriene.
REFERINȚE BILBIOGRAFICE
— Standard Methods for the Examination of Water and Wastewater, 12th ed., Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, p. 65.
— Wagner, R., Von Wasser, 1976, vol. 46, p. 139.
— DIN – Entwurf 38 409, Teil 41 – Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngrößen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuß Wasserwesen (NAW) in DIN Deutsches Institut für Normung e.V.
— Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol 13 (1), p. 169.
Apendicele 3
EVALUAREA BIODEGRADABILITĂȚII SUBSTANȚELOR PUȚIN SOLUBILE
În testele de biodegradabilitate aplicate la substanțe puțin solubile, se acordă o deosebită atenție următoarelor aspecte.
Lichidele omogene prezintă rareori probleme de eșantionare, dar în cazul materialelor solide se recomandă omogenizarea cu mijloace adecvate, pentru a evita erorile datorate neomogenității. Se impun precauții speciale în cazul în care sunt necesare eșantioane reprezentative de câteva miligrame din amestecuri sau substanțe cu cantități mari de impurități.
Pot fi folosite diferite forme de agitare în timpul testelor. Se folosește cu atenție numai agitarea suficientă pentru a ține substanța dispersată, evitându-se supraîncălzirea, spumarea excesivă și forțele mari de forfecare.
Poate fi folosit un agent de emulsionare care dă o dispersie stabilă a substanței. Acesta nu trebuie să fie toxic pentru bacterii, biodegradat sau să spumeze în condițiile de testare.
Solvenților li se aplică aceleași criterii ca și agenților de emulsionare.
Nu se recomandă să se folosească purtători solizi pentru substanțele de testat solide, dar pot fi potriviți pentru substanțele uleioase.
Dacă se folosesc substanțe auxiliare cum ar fi agenți de emulsionare, solvenți și purtători, se testează o probă martor ce conține substanța auxiliară.
Unul dintre testele de respirometrie CO2, CBO, MITI poate fi folosit pentru a studia biodegradabilitatea substanțelor greu solubile.
REFERINȚE BIBLIOGRAFICE
— de Morsier, A. et al., Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, vol. 16, p. 833.
— Gerike, P., The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, p. 169.
Apendicele 4
EVALUAREA BIODEGRADABILITATII SUBSTANTELOR SUSCEPTIBILE DE A FI TOXICE PENTRU INOCUL
Când o substanță este supusă testării pentru biodegradabilitate ușoară și pare a fi ne-biodegradabilă, se recomandă următoarea procedură dacă se urmărește distincția între inhibiție și inerție (Reynolds et al, 1987).
Se folosesc inoculi similari sau identici pentru testele de toxicitate și biodegradare.
Pentru a evalua toxicitatea substanțelor studiate în testele de biodegradabilitate ușoară, se aplică una dintre metodele următoare: metoda de inhibiție a vitezei de respirație a nămolului (testul de inhibiție a respirației nămolului activ – Directiva 87/302/CEE), CBO și/sau metodele de inhibiție a creșterii sau a unei combinații între acestea.
Dacă trebuie evitată inhibiția datorată toxicității, se propune ca valoarea concentrației substanței de testat folosită în testul de biodegradabilitate ușoară să fie mai mică decât 1/10 din valoarea CE50 (sau mai mică decât valoarea CE20) obținută în testul de toxicitate. Compușii cu un CE50 mai mare de 300 mg/l nu au, probabil, efecte toxice în testul de biodegradabilitate ușoară.
Valorile CE50 mai mici de 20 mg/l probabil pun serioase probleme pentru testările următoare. Se vor folosi concentrații de testare mici, ce necesită folosirea testului în vasului închis, riguros și sensibil, sau folosirea materialului marcat cu C. Ca alternativă, un inocul aclimatizat permite să fie folosite concentrații mai mari ale substanței de testat. În ultimul caz totuși criteriul specific al testului de biodegradabilitate ușoară este pierdut.
REFERINȚE BIBLIOGRAFICE
Reynolds, L. et al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, vol. 16, 2259.
Apendicele 5
CORECȚIA CONSUMULUI DE OXIGEN ÎN CAZUL INTERFERENȚEI CU NITRIFICAREA
Erorile datorate omiterii nitrificării la evaluarea consumului de oxigen necesar pentru biodegradarea substanței de testat care nu conține azot sunt minime (nu mai mari de 5 %), chiar dacă oxidarea azotului amoniacal în mediul de testare se produce ocazional atât în vasele cu substanță de testat, cât și în cele cu probă martor. Cu toate acestea, în cazul substanțelor care conțin azot, pot apărea erori grave.
Dacă nitrificarea are loc, dar nu este completă, consumul de oxigen observat al amestecului de reacție poate fi corectat prin cantitatea de oxigen folosită la oxidarea amoniului la nitrit sau la nitrat, dacă modificările concentrației în timpul incubării nitritului și nitratului sunt determinate luând în considerare următoarele ecuații:
|
2 NH4Cl + 3O2 = 2 HN O2 + 2 HCI + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Reacția globală este: |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Din ecuația (1), consumul de oxigen pentru ca 28 g azot conținut în clorura de amoniu (NH4Cl) să fie oxidat la nitrit este de 96 g, adică un factor de 3,43 (96/28). În același mod, din ecuația (3) rezultă un consum de oxigen de 128 g pentru ca 28 g de azot să fie oxidat la nitrat, adică un factor de 4,57 (128/28).
Deoarece reacțiile sunt succesive, fiind realizate în prezența unor specii distincte și diferite de bacterii, concentrația de nitrit crește sau descrește; în ultimul caz se formează o concentrație echivalentă de nitrat. Astfel, cantitatea de oxigen consumată pentru formarea nitratului este de 4,57 înmulțit cu creșterea concentrației de nitrat, în timp ce cantitatea de oxigen asociată cu formarea nitritului este de 3,43 înmulțit cu creșterea concentrației de nitrit sau pierderea de oxigen este de - 3,43 înmulțit cu descreșterea concentrației.
Aceasta este:
|
O2 consumat la formarea nitratului = 4,57 × creșterea concentrației de nitrat |
(4) |
|
și |
|
|
O2 consumat la formarea nitritului = 3,43 × creșterea concentrației de nitrit |
(5) |
|
și |
|
|
O2 consumat la dispariția nitritului = - 3,43 × descreșterea concentrației de nitrat |
(6) |
|
astfel încât: |
|
|
Consumul de O2 datorat nitrificării = ± 3,43 × modificarea concentrației de nitrit + 4,57 × creșterea concentrației de nitrat |
(7) |
|
și astfel |
|
|
Consumul de O2 datorat oxidării carbonului = consumul total observat – consumul datorită nitrificării |
(8) |
Ca alternativă, dacă se determină numai azotul total oxidat, consumul de oxigen datorat nitrificării poate fi considerat, ca primă aproximație, ca fiind de 4,57 × creșterea azotului oxidat.
Valoarea corectată a consumului de oxigen datorat oxidării carbonului este apoi comparată cu CTONH3, conform calculelor din apendicele 2.
C.5. DEGRADAREA – CONSUMUL BIOCHIMIC DE OXIGEN
1. METODĂ
1.1. INTRODUCERE
Scopul acestei metode este determinarea consumului biochimic de oxigen (CBO) al substanțelor organice solide sau lichide.
Prin această metodă se pot testa compuși solubili în apă; se pot testa totuși, cel puțin în principiu, și compușii volatili și cei puțin solubili în apă.
Metoda este aplicabilă numai acelor compuși organici care nu sunt inhibitori pentru bacterii la concentrația folosită în test. În cazul în care compusul testat nu este solubil la concentrația testată, se pot folosi măsuri speciale, precum utilizarea dispersiei ultrasonice, pentru a obține o dispersie bună a compusului de testat.
Informațiile despre toxicitatea substanței chimice pot fi utile pentru interpretarea rezultatelor cu valori scăzute și pentru selectarea unor concentrații adecvate la test.
1.2. DEFINIȚIE ȘI UNITĂȚI
CBO este cantitatea de oxigen dizolvat necesară pentru un volum specificat de soluție a substanței supusă procesului de oxidare biochimică în condiții definite.
Rezultatele se exprimă în grame de CBO pe gram de substanță.
1.3. SUBSTANȚE DE REFERINȚĂ
Se recomandă folosirea unei substanțe de referință adecvate pentru a verifica activitatea inoculului.
1.4. PRINCIPIUL METODEI DE TESTARE
O cantitate predeterminată de substanță, dizolvată sau dispersată într-un mediu adecvat bine aerat, este inoculată cu microorganisme și incubată la o temperatură constantă, definită, la întuneric.
CBO se determină prin diferența dintre concentrațiile de oxigen dizolvat la începutul și la sfârșitul testului. Durata testului este de minimum 5 zile și maximum 28 de zile.
Într-o testare paralelă se determină CBO pe o probă martor, care nu conține substanță de testat.
1.5. CRITERII DE CALITATE
Determinarea CBO nu poate fi considerată ca o determinare valabilă a biodegradabilității unei substanțe. Acest test este considerat doar test de triere.
1.6. DESCRIEREA METODEI DE TESTARE
Se prepară o soluție sau dispersie preliminară de substanță pentru a obține concentrația CBO compatibilă cu metoda folosită. Apoi, se determină CBO conform oricărei metode naționale sau internaționale standardizate.
2. DATE ȘI EVALUARE
CBO conținut în soluția preliminară se calculează conform metodei standardizate alese și se transformă în grame de CBO pe gram de substanță testată.
3. RAPORT
Trebuie consemnată metoda folosită.
Consumul biochimic de oxigen trebuie să fie o medie a cel puțin trei măsurători valabile.
Toate informațiile și observațiile importante pentru interpretarea rezultatelor trebuie consemnate, în special cu privire la impurități, starea fizică, efectele toxice și compoziția intrinsecă a substanței care ar afecta rezultatele.
Folosirea unui aditiv pentru inhibiția nitrificării biologice trebuie consemnată.
4. REFERINȚE BIBLIOGRAFICE
Listă de metode standardizate, de exemplu:
NF T 90 -103: Determination of the biochemical oxygen demand.
NBN 407: Biochemical oxygen demand.
NEN 32355.4: Bepaling van het biochemish zuurstofverbruik (BZV).
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London.
ISO 5815: Determination of biochemical oxygen demand after n days.
C.6. DEGRADAREA – CONSUMUL CHIMIC DE OXIGEN
1. METODĂ
1.1. INTRODUCERE
Scopul acestei metode este determinarea consumului chimic de oxigen (CCO) al substanțelor organice solide sau lichide prin aplicarea oricărei metode standardizate, în condiții de laborator stabilite.
Informațiile privind formula substanței sunt utile în realizarea acestui test și pentru interpretarea rezultatului obținut (de exemplu, halogenuri, săruri feroase ale compușilor organici, compuși organici clorurați).
1.2. DEFINIȚII ȘI UNITĂȚI
Consumul chimic de oxigen este o măsură a oxidabilității unei substanțe, exprimat prin cantitatea echivalentă de oxigen a unui reactiv oxidant consumat de substanță în condiții de laborator stabilite.
Rezultatul se exprimă în grame de CCO pe gram de substanță.
1.3. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință în toate cazurile în care se studiază o substanță nouă. Aceste substanțe se folosesc în primul rând pentru a calibra periodic metoda și pentru compararea rezultatelor atunci când se aplică altă metodă.
1.4. PRINCIPIUL METODEI DE TESTARE
O cantitate predeterminată de substanță, dizolvată sau dispersată în apă, se oxidează cu dicromat de potasiu, în prezența unui catalizator de argint (sulfat de argint) în mediu de acid sulfuric concentrat, cu reflux, timp de două ore. Dicromatul rezidual se determină prin titrare cu sulfat de amoniu și fier.
În cazul substanțelor care conțin clor se adaugă sulfat de mercur ( 25 ) pentru a reduce interferența acestuia.
1.5. CRITERII DE CALITATE
Datorită modului arbitrar de determinare, CCO este un „indicator de oxidabilitate” și se folosește ca atare ca metodă practică pentru determinarea conținutul de substanță organică.
Clorurile pot interfera în acest test; agenții anorganici reducători sau oxidanți pot de asemenea să interfereze la determinarea CCO.
Unii compuși ciclici și multe substanțe volatile (de exemplu, acizi grași inferiori) nu sunt oxidați complet în acest test.
1.6. DESCRIEREA METODEI DE TESTARE
Se prepară o soluție sau dispersie preliminară de substanță pentru a obține CCO între 250 și 600 mg/l.
Observații:
În cazul substanțelor puțin solubile și nedispersabile se poate cântări o cantitate de substanță fin pulverizată sau lichidă, corespunzând la aproximativ 5 mg CCO, care se introduce în aparatul experimental cu apă.
CCO se determină mai ușor, deseori și în special în cazul substanțelor puțin solubile, printr-o variantă a metodei, în sistem închis cu egalizator de presiune (H. Kelkenberg, 1975). Prin această variantă a metodei, compușii care sunt determinați cu dificultate prin metoda convențională – de exemplu acid acetic – pot fi adesea determinați cu succes. Metoda nu dă rezultate bune, însă, în cazul piridinei. Dacă, în conformitate cu referința bibliografică 1, concentrația de dicromat de potasiu crește la 0,25 N (0,0416 M), devine mai ușoară cântărirea directă a 5-10 mg de substanță, ceea ce este esențial pentru determinarea CCO la substanțele puțin solubile în apă (referința 2).
În alte cazuri, CCO se determină apoi după orice metodă adecvată națională sau internațională standardizată.
2. DATE ȘI EVALUARE
CCO conținut în vasul experimental se calculează după metoda standardizată aleasă și se convertește în grame de CCO pe gram de substanță.
3. RAPORT
Se consemnează metoda de referință folosită.
Consumul chimic de oxigen trebuie să fie media a cel puțin 3 măsurători. Trebuie prezentate toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cu privire la impurități, starea fizică, proprietățile intrinseci ale substanței (dacă se cunosc) care ar putea afecta rezultatele.
Trebuie consemnată utilizarea sulfatului de mercur pentru a reduce la minim interferența clorurilor.
4. REFERINȚE BIBLIOGRAFICE
1. Kelkenberg, H., Z. von Wasser und Abwasserforschung, 1975, vol. 8, p. 146.
2. Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, p. 169.
Lista metodelor standardizate, de exemplu:
NBN T 91-201 Determination of the chemical oxygen demand.
ISBN O 11 7512494 Chemical oxygen demand (dichromate value) of polluted and waste waters.
NF T 90-101 Determination of the chemical oxygen demand.
DS 217 = water analysis Determination of the chemical oxygen demand.
DIN 38409-H-41 Determination of the chemical oxygen demand (COD) within the range above 15 mg per litre.
NEN 3235 5.3 Bepaling van het chemisch zuurstofverbruik.
ISO 6060 Water quality: chemical oxygen demand dichromate methods.
C.7. DEGRADAREA – DEGRADAREA ABIOTICĂ: HIDROLIZA CA O FUNCȚIE A PH-ULUI
1. METODĂ
Această metodă de testare este echivalentă cu Orientarea 111 (2004) a OCDE.
1.1. INTRODUCERE
Substanțele chimice pot pătrunde în apele de suprafață prin următoarele căi: direct, prin pulverizare, prin spălare, prin sistemul de canalizare, prin depozitarea deșeurilor, prin deversări industriale, casnice sau agricole și prin depuneri din atmosferă. În apă, substanțele suferă procese chimice (de exemplu hidrolizare sau oxidare), procese fotochimice și/sau procese microbiologice de transformare. Această Orientare, bazată pe Orientările menționate la referințele 1, 2, 3, 4, 5, 6 și 7 existente, descrie o metodă de laborator prin care se evaluează transformarea prin hidroliză abiotică a substanțelor chimice în sistemele apoase, la o valoare a pH-ului găsită în mod normal în mediul înconjurător (pH = 4-9).
Experimentele sunt realizate pentru a determina (i) rata hidrolizării substanței test ca funcție a pH-ului și (ii) felul sau natura și ratele de formare și epurare a produșilor de hidroliză la care poate fi expus organismul. Asemenea studii pot fi necesare pentru substanțele chimice care pătrund în apă direct, sau care ajung în mediul înconjurător prin metodele descrise mai sus.
1.2. DEFINIȚII ȘI UNITĂȚI
A se vedea apendicele 2.
1.3. APLICABILITATEA METODEI
Această metodă este aplicabilă în general substanțelor chimice (marcate sau nu) pentru care este disponibilă o metodă analitică suficient de sensibilă și sigură. Este aplicabilă pentru compușii slab volatili sau nevolatili și care sunt suficient de solubili în apă. Testul nu trebuie aplicat substanțelor chimice puternic volatile din apă (de exemplu fumiganți, solvenți organici) care, din această cauză, nu pot fi menținuți în soluție, în condițiile experimentale ale acestui test. Pentru substanțele cu solubilitate mică în apă, testul este dificil de realizat (8).
1.4. PRINCIPIUL METODEI DE TESTARE
Soluțiile apoase tampon sterile, cu valori diferite ale pH-ului (pH de 4, 7 și 9), sunt tratate cu substanța testată și incubate la întuneric, în condiții controlate de laborator (la temperatură constantă). După un interval adecvat de timp, soluțiile tampon sunt analizate atât pentru substanța testată, cât și pentru produșii de hidroliză. În cazul substanțelor de testare marcate (de exemplu cu 14C), bilanțul maselor poate să fie calculat mai ușor.
Această metodă de testare este realizată secvențial, așa cum este arătat și explicat în apendicele 1. Fiecare secvență este declanșată de rezultatul celei anterioare.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Rata de hidroliză poate fi măsurată cu ajutorul substanțelor marcate sau nemarcate. Deși pentru studierea procesului de hidroliză și pentru stabilirea bilanțului maselor, este preferat în general materialul marcat, totuși, în unele cazuri, acesta nu este absolut necesar. Este recomandată marcarea cu 14C, însă este la fel de utilă și folosirea altor izotopi, cum ar fi 13C, 15N, 3H. Pe cât posibil, marcarea ar trebui făcută în porțiunea (porțiunile) cea mai stabilă a moleculei. De exemplu, dacă substanța testată are în structură un inel, este necesar ca marcarea să se facă la acest nivel. Dacă substanța testată conține două sau mai multe inele, sunt necesare studii separate pentru a evalua rezultatul marcării fiecărui inel în parte și pentru a obține informații adecvate despre formarea produșilor de hidroliză. Puritatea substanței testate trebuie să fie de cel puțin 95 %.
Înaintea desfășurării unui test de hidroliză, trebuie să fie disponibile următoarele informații despre substanța testată:
(a) solubilitatea în apă [Metoda de testare A.6];
(b) solubilitatea în solvenți organici;
(c) presiunea vaporilor [Metoda de Testare A.4] și/sau constanta lui Henry;
(d) coeficientul de partiție n-octanol/apă [Metoda de testare A.8];
(e) constanta de disociere (pKa) (Orientarea 112 a OCDE) (9);
(f) rata de fototransformare directă sau indirectă în apă, acolo unde este cazul.
Trebuie să fie disponibile metode analitice de cuantificare ale substanței testate și, dacă este relevant, metode de identificare și cuantificare ale produșilor de hidroliză în soluții apoase (a se vedea, de asemenea, punctul 1.7.2).
1.6. SUBSTANȚE DE REFERINȚĂ
Atunci când este posibil, substanțele de referință ar trebui utilizate pentru identificarea și cuantificarea produșilor de hidroliză prin metode spectroscopice, cromatografice sau prin alte metode sensibile adecvate.
1.7. CRITERII DE CALITATE
1.7.1. Randamentul de recuperare
Analizarea cel puțin a substanțelor tampon duplicate sau a produșilor lor de reacție rezultați imediat după adăugarea substanței testate oferă o primă concluzie asupra repetabilității metodei analitice și asupra uniformității procedurii pentru substanța experimentală. Randamentul de recuperare pentru stadiile mai avansate ale experimentelor este indicat de bilanțul maselor respectiv (când sunt folosite substanțe marcate). Pentru substanțele chimice marcate și nemarcate, randamentele de recuperare trebuie să aibă valori cuprinse între 90 % și 110 %. În cazul existenței dificultăților tehnice pentru atingerea acestor valori, un randament de 70 % este acceptat pentru substanțele chimice nemarcate, dar ar trebui oferite explicații suplimentare.
1.7.2. Repetabilitatea și sensibilitatea metodei analitice
Repetabilitatea metodei/metodelor analitice folosite pentru măsurarea în stadii avansate a substanței de testat și a produșilor de hidroliză poate fi verificată prin repetarea analizei aceleiași substanțe tampon (sau a produșilor ei de reacție), după ce s-a format o cantitate suficientă de produși de hidroliză pentru a putea fi măsurată.
Metoda analitică trebuie să fie suficient de sensibilă pentru cuantificarea substanței test la o concentrație de 10 % sau mai puțin din concentrația inițială. În anumite cazuri, metodele analitice ar trebui să fie suficient de sensibile pentru a măsura produșii de hidroliză reprezentând 10 % sau mai mult din substanța inițială (în orice moment al studiului) și până la 25 % sau mai puțin din concentrația maximă.
1.7.3. Intervalele de încredere pentru cinetica hidrolizei
Pentru toți coeficienții de regresie, constantele vitezei de reacție, timpii de înjumătățire și oricare alți parametri de cinetică (de exemplu DT50) trebuie calculate și prezentate intervalele de încredere.
1.8. DESCRIEREA METODEI DE TESTARE
1.8.1. Aparatură și echipament
Experimentul trebuie desfășurat în recipiente de sticlă (de exemplu tuburi de test, retorte mici) în condiții sterile, la întuneric dacă este necesar, cu excepția cazurilor în care informațiile preliminare (de exemplu coeficientul de partiție n-octanol/apă) au indicat că substanța testată este aderentă de sticlă. În asemenea cazuri, trebuie luate în considerare materialele alternative (cum ar fi teflonul). Problema aderenței la sticlă poate fi evitată și prin folosirea uneia sau mai multora dintre următoarele metode:
— determinarea masei substanței de testat și produșii de hidroliză absorbiți de recipientul testat;
— folosirea unei băi ultrasonice;
— asigurarea unei spălări pe bază de solvent a recipientelor de sticlă la fiecare interval de colectare a datelor;
— utilizarea produselor preparate;
— folosirea unei cantități crescute de cosolvent pentru adăugarea substanței de testat; dacă se folosește un cosolvent, acesta nu trebuie să hidrolizeze substanța de testat.
În mod normal, sunt necesare băi de apă termostatate cu sistem de vibrație sau incubatoare termostatate pentru incubarea diferitelor substanțe de testat.
Este necesară folosirea unui echipament de laborator standard, care să cuprindă în special următoarele:
— pH-metru;
— instrumente analitice cum ar fi echipament GC, HPLC, TLC, inclusiv sisteme adecvate de detectare pentru analiza substanțelor marcate radioactiv și a celor nemarcate sau a metodei de diluare izotopică inversă;
— instrumente folosite în scopul identificării (de exemplu MS, GC-MS, HPLC-MS, NMR etc.);
— contor de scintilație lichidă;
— pâlnii separatoare pentru extracția lichid-lichid;
— instrumente pentru concentrarea soluțiilor și a produșilor de reacție (de exemplu evaporator rotativ);
— dispozitiv de control al temperaturii (de exemplu baie de apă).
Reactanții chimici cuprind, de exemplu:
— solvenți organici, puri din punct de vedere chimic, cum ar fi hexanul, diclormetanul etc.;
— lichid de scintilație;
— soluție tampon (pentru detalii a se vedea punctul 1.8.3).
Toate recipientele din sticlă, apa pură și soluțiile tampon folosite în testele de hidroliză trebuie să fie sterilizate.
1.8.2. Utilizarea substanței de testare
Substanțele de testare trebuie folosite ca soluții apoase în diferite soluții tampon (a se vedea apendicele 3). Dacă este necesar pentru dizolvarea adecvată, este permisă folosirea unor cantități mici de solvenți care pot fi amestecați cu apa (cum sunt acetonitrilul, acetona, etanolul) în vederea aplicării și distribuției substanței testate, dar în mod normal nu ar trebui să se depășească 1 % v/v. Folosirea unei concentrații mai mari de solvent (de exemplu în cazul substanțelor de testare cu solubilitate mică în apă) nu este permisă decât atunci când se demonstrează că solventul nu are efect asupra hidrolizei substanței de testare.
Utilizarea unui produs preparat nu este recomandată în mod curent, deoarece nu se poate exclude că ingredientele de preparare pot influența procesul de hidroliză. Totuși, pentru substanțele de testare cu solubilitate mică în apă sau pentru substanțele aderente de sticlă (a se vedea punctul 1.8.1), folosirea substanțelor preparate constituie o alternativă adecvată.
Trebuie folosită o singură concentrație a substanței de testare; aceasta nu trebuie să depășească 0,01 M sau jumătate din concentrația de saturare (a se vedea apendicele 1).
1.8.3 Soluții tampon
Testul de hidroliză trebuie realizat la valori ale pH-ului de 4, 7 și 9. În acest scop, soluțiile tampon trebuie preparate folosind apă și substanțe chimice purificate. În apendicele 3 sunt prezentate câteva sisteme tampon folositoare. Trebuie avut în vedere că sistemele tampon pot influența rata de hidroliză; când acest lucru este observat trebuie folosit un alt sistem tampon ( 26 ).
PH-ul fiecărei soluții tampon trebuie să corespundă, cu o precizie de cel puțin 0,1, cu valoarea pH-ului măsurată de un pH-metru calibrat la temperatura cerută.
1.8.4. Condiții de testare
1.8.4.1. Temperatura de testare
Reacțiile de hidroliză din experiment trebuie efectuate la o temperatură constantă. În vederea extrapolării, este important ca temperatura să fie menținută la cel puțin ± 0,5 oC.
Dacă nu se cunoaște comportamentul hidrolitic al substanței test, trebuie efectuat un test preliminar (faza 1) la o temperatură de 50 oC. Testele cinetice de fază mai avansată ar trebui realizate la un minimum de trei temperaturi (incluzând testul la 50 oC), cu excepția cazului în care substanța este stabilă la hidroliză, așa cum s-a demonstrat în faza 1 a testului. Intervalul de temperatură sugerat este cuprins între 10 și 70 oC (preferabil cu utilizarea a cel puțin unei temperaturi sub 25 oC), care va include și temperatura raportată de 25 oC și cele mai multe dintre temperaturile întâlnite.
1.8.4.2. Lumina și oxigenul
Toate testele de hidroliză se vor desfășura prin folosirea unor metode adecvate care evită efectul fotolitic. Vor fi luate toate măsurile pentru evitarea oxigenului (de exemplu prin barbotarea heliului, a nitrogenului sau a argonului timp de 5 minute înaintea pregătirii soluției).
1.8.4.3. Durata testului
Testul preliminar trebuie să dureze 5 zile, în timp ce fazele mai avansate trebuie să se desfășoare fie până când hidroliza substanței test s-a produs în proporție de 90 %, fie timp de 30 de zile, în funcție de care din evenimente se produce primul.
1.8.5. Realizarea testului
1.8.5.1. Testul preliminar (faza 1)
Testul preliminar trebuie realizat la o temperatură de 50 ± 0,5 oC și la un pH de 4, 7 și 9. Dacă după 5 zile hidroliza s-a produs într-un procent mai mic de 10 % (t0,5 la 25 oC > 1 an), substanța testată este considerată stabilă la hidroliză și nu mai este necesar niciun test suplimentar. Dacă se cunoaște că substanța este instabilă la temperatura mediului înconjurător ( 27 ), testul preliminar nu mai este necesar. Metoda analitică trebuie să fie suficient de precisă și sensibilă pentru a detecta reducerea cu 10 procente din concentrația inițială.
1.8.5.2. Hidroliza substanțelor instabile (faza 2)
Fazele avansate ale testului trebuie să fie realizate la valori ale pH-ului la care substanțele test au fost găsite instabile, după cum s-a arătat în testul preliminar de mai sus. Soluțiile tampon ale substanței de testat trebuie să fie incubate la temperaturile selectate. Pentru a testa comportamentul primar, fiecare soluție din reacție trebuie să fie analizată în intervalele de timp care asigură un minimum de șase puncte de reper normale separate ale hidrolizării între 10 % și 90 % ale substanței de testat. Replicarea fiecărei probe a testului (minim dublarea probelor conținute în vase separate de reacție) trebuie înlăturată, iar conținutul trebuie analizat la fiecare din cel puțin șase momente de eșantionare (pentru un minimum de douăsprezece puncte de reper replicate). Utilizarea unui singur eșantion de mărime de la care s-au îndepărtat părțile alicote ale soluțiilor experimentale la fiecare moment de eșantionare, este considerată neadecvată deoarece, în acest fel nu este permisă analizarea variabilității datelor și se poate ajunge la probleme de contaminare a soluțiilor testate. La finalul fazei avansate a testului (adică la hidrolizarea în procent de 90 % sau după 30 de zile) trebuie efectuate teste de confirmare a sterilității. Totuși, testele de sterilitate nu sunt necesare dacă nu s-a observat nicio degradare (adică transformare).
1.8.5.3. Identificarea produșilor de hidroliză (faza 3)
Orice produși majori de hidroliză, cel puțin cei care reprezintă > 10 % din doza inițială, trebuie identificați prin metode analitice adecvate.
1.8.5.4. Teste opționale
Pentru substanțele test instabile la hidroliză pot fi necesare teste suplimentare la alte valori ale pH-ului decât 4, 7 și 9. De exemplu, în scopuri fiziologice, un test în condiții mai acide (de exemplu pH de 1,2) poate fi necesar prin înlocuirea unei singure temperaturi relevante fiziologic (37 oC).
2. DATE
Cantitățile de substanță test și de produși de hidroliză trebuie date ca procente din substanța folosită inițial, iar acolo unde este cazul, ca mg/L pentru fiecare interval de eșantionare și pentru fiecare pH și temperatură din test. În plus, bilanțul maselor trebuie calculat ca procent din concentrația inițială, atunci când s-au folosit substanțe test marcate.
Trebuie realizată reprezentarea grafică a transformării logaritmice a concentrației substanței test în funcție de timp. Trebuie identificați orice produși majori de hidroliză, cel puțin cei care reprezintă > 10 % din doza inițială, iar transformarea logaritmică a concentrației lor trebuie reprezentată în aceeași manieră ca pentru substanța inițială, pentru a arăta ratele de formare și de declin.
2.1. PRELUCRAREA REZULTATELOR
Se pot obține determinări mai precise ale timpilor de înjumătățire sau ale DT50 prin folosirea unor modele cinetice adecvate. Timpii de înjumătățire și/sau valoarea DT50 (inclusiv marjele de eroare) trebuie raportate pentru fiecare valoare a pH-ului sau a temperaturii, împreună cu descrierea modelului folosit, ordinul cinetic și coeficientul de determinare (r2). Acolo unde este cazul, aceste calcule trebuie să fie aplicate și asupra produșilor de hidroliză.
În cazul studierii vitezei de reacție desfășurate la temperaturi diferite, constantele vitezei de reacție (Kobs) ale hidrolizei cu cinetică de pseudo ordin I trebuie descrise în funcție de temperatură. Calculele trebuie să se bazeze atât pe separarea Kobs în constante ale vitezelor de reacție pentru hidroliza catalizată în mediu acid, neutru sau bazic (kH, kneutru și, respectiv kOH), cât și pe ecuația Arrhenius:
![]()
unde Ai și Bi sunt constantele de regresie pentru segment și respectiv pantă, ale liniilor de optimă ajustare, generate din regresia lineară ln ki reprezentată în funcție de inversul temperaturii absolute în grade Kelvin (T) Prin folosirea ecuației Arrhenius pentru hidroliza catalizată în mediu acid, neutru sau bazic, se pot calcula constantele vitezei de reacție cu cinetică de pseudo ordin I, și astfel timpii de înjumătățire pentru alte temperaturi, pentru care determinarea directă a constantei vitezei de reacție nu este posibilă (10).
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Majoritatea reacțiilor de hidroliză sunt aparent reacții de ordinul I și, de aceea, timpii de înjumătățire sunt independenți de concentrație (a se vedea ecuația 4 din apendicele 2) Acest lucru permite de obicei aplicarea rezultatelor de laborator, determinate de la 10–2 la 10–3 M, în condițiile mediului înconjurător (≤ 10–6 M) (10). Mabey și Mill au raportat câteva exemple de corespondență între vitezele de hidroliză atât în apă pură, cât și în apă naturală, pentru o varietate de substanțe chimice, cu condiția ca pH-ul și temperatura să fi fost măsurate.
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare trebuie să includă cel puțin următoarele informații:
Substanța de testare:
— numele obișnuit, numele chimic, numărul CAS, structura chimică (indicându-se poziția în care a fost marcată, atunci când se folosesc substanțe marcate radioactiv) și proprietățile fizico-chimice relevante (a se vedea punctul 1.5);
— puritatea (impuritățile) substanței experimentale;
— puritatea substanței de marcare pentru substanțele chimice marcate și activitatea molară (acolo unde este cazul).
— Soluțiile tampon:
— date și detalii despre preparare;
— soluțiile tampon și soluțiile apoase folosite;
— molaritatea și pH-ul soluțiilor tampon.
Condițiile de testare:
— date despre desfășurarea experimentelor;
— cantitatea de substanță de testare folosită;
— metodă și solvenți (tip și cantitate) folosiți pentru aplicarea substanței de testare;
— volumul soluțiilor tampon ale substanței de testare incubate;
— descrierea sistemelor de incubare folosite;
— pH-ul și temperatura în timpul experimentului;
— intervalele de eșantionare;
— metoda (metodele) de extracție;
— metode de cuantificare și identificare ale substanței de testare și ale produșilor de hidroliză în soluțiile tampon;
— număr de repetări.
Rezultate:
— repetabilitatea și sensibilitatea metodei analitice folosite;
— randamentele de recuperare (valorile procentuale pentru un experiment valabil sunt date în punctul 1.7.1);
— replicarea datelor și mijloacelor sub formă de tabel;
— bilanțul maselor în timpul și la sfârșitul experimentelor (când se folosesc substanțe test marcate);
— rezultatele testului preliminar;
— discuții și interpretarea rezultatelor;
— toate datele și cifrele originale.
Următoarele date sunt necesare doar în cazul în care viteza reacției de hidroliză este determinată:
— graficele concentrațiilor în funcție de timp pentru substanța de testare și, acolo unde este cazul, pentru produșii de hidroliză la fiecare valoare a pH-ului și a temperaturii;
— tabele cu rezultatele ecuației Arrhenius pentru temperaturi de 20 oC/25 oC, cu pH, constanta vitezei de reacție [ora–1 sau ziua–1], timpii de înjumătățire sau DT50, temperaturi [ oC], inclusiv intervalele de încredere și coeficienții de corelație (r2) sau informații similare;
— calea de hidroliză propusă.
4. REFERINȚE BIBLIOGRAFICE
1. OECD (1981), Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, adopted 12 May 1981.
2. US-Environmental Protection Agency (1982), 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
3. Agriculture Canada (1987), Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
4. Uniunea Europeană (UE) (1995), Directiva 95/36/CE a Comisiei din 14 iulie 1995 de modificare a Directivei 91/414/CEE a Consiliului privind introducerea pe piață a produselor fitosanitare. Apendicele V: Comportamentul în mediu.
5. Dutch Commission for Registration of Pesticides (1991), Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
6. BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980).
7. SETAC (1995), Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
8. OECD (2000), Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment No 23.
9. OECD (1993), Guidelines for the Testing of Chemicals. Paris. OECD (1994 – 2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
10. Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997), Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993).
11. Mabey, W. and Mill, T. (1978), Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383-415.
Apendicele 1
Schema secvențelor testului de hidroliză

Apendicele 2
Definiții și unități
Unitățile internaționale standard (SI) trebuie folosite în toate cazurile.
Substanța experimentală: orice substanță, fie compusul inițial, fie produșii de transformare relevanți.
Produși de transformare: toate substanțele care rezultă din reacțiile de transformare biotică sau abiotică a substanței experimentale.
Produși de hidroliză: toate substanțele care rezultă din reacțiile de hidroliză ale substanței experimentale.
Hidroliza se referă la reacția unei substanțe experimentale RX cu apa, cu schimbarea grupului X cu OH în timpul reacției:
|
RX + HOH → ROH + HX |
[1] |
Viteza cu care scade concentrația substanței RX în acest proces simplificat este dată de
|
viteza = k [H2O] [RX] |
reacție de ordin doi |
|
sau |
|
|
viteza = k [RX] |
reacție de ordinul întâi |
depinzând de viteza pasului determinant. Deoarece apa este prezentă în exces comparativ cu substanța test, acest tip de reacție este descrisă de obicei ca reacție de pseudo ordin întâi, în care constanta observată a vitezei de reacție este dată de relația
|
kobs = k [H2O] |
[2] |
și poate fi determinată din formula ( 28 )
|
|
[3] |
unde:
t = timp
și C0, Ct = concentrațiile RX la momentul 0 și t.
Unitățile de măsură ale acestei constante au dimensiunea (timp)–1, iar timpul de înjumătățire al reacției (timpul necesar pentru ca 50 % din substanța RX să reacționeze) este dat de
|
|
[4] |
Timpul de înjumătățire: (t0,5) este timpul necesar pentru hidroliza a 50 % din substanța test când reacția poate fi descrisă ca reacție cu cinetică de ordin întâi; este dependent de concentrație.
DT 50 (timp de dispariție 50) este timpul în care concentrația substanței experimentale este redusă cu 50 %; este diferit de timpul de înjumătățire t0,5 atunci când reacția nu se supune unei cinetici de ordinul întâi.
Determinarea constantei k la diferite temperaturi
Atunci când se cunosc constantele vitezei de reacție pentru două temperaturi, constantele pentru alte temperaturi se pot calcula folosind ecuația Arrhenius:
![]()
sau
![]()
Graficul ln k în funcție de 1/T este o dreaptă având panta de – E/R
unde:
|
k |
= |
constanta vitezei de reacție măsurată la diferite temperaturi |
|
E |
= |
energia de activare [kJ/mol] |
|
T |
= |
temperatura absolută [K] |
|
R |
= |
constanta gazului [8,314 J/mol.K] |
Energia de activare este calculată prin analiza regresiei sau prin următoarea ecuație:
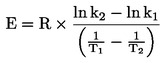
unde: T2 > T1.
Apendicele 3
Sisteme tampon
A. CLARK ȘI LUBS:
Amestecuri tampon tip CLARK și LUBS ( 29 )
|
Compoziție |
pH |
|
HCl 0,2 N și KCl 0,2 N la 20 oC |
|
|
47,5 ml HCl + 25 ml KCl dil. până la 100 ml |
1,0 |
|
32,25 ml HCL + 25 ml KCl dil. până la 100 ml |
1,2 |
|
20,75 ml HCl + 25 ml KCl dil. până la 100 ml |
1,4 |
|
13,15 ml HCl + 25 ml KCl dil. până la 100 ml |
1,6 |
|
8,3 ml HCl + 25 ml KCl dil. până la 100 ml |
1,8 |
|
5,3 ml HCl + 25 ml KCl dil. până la 100 ml |
2,0 |
|
3,35 ml HCl + 25 ml KCl dil. până la 100 ml |
2,2 |
|
Biftalat monopotasic 0,1 M + HCl 0,1 N la 20 oC |
|
|
46,70 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
2,2 |
|
39,60 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
2,4 |
|
32,95 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
2,6 |
|
26,42 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
2,8 |
|
20,32 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
3,0 |
|
14,70 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
3,2 |
|
9,90 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
3,4 |
|
5,97 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
3,6 |
|
2,63 ml HCl 0,1 N + 50 ml biftalat până la 100 ml |
3,8 |
|
Biftalat potasic 0,1 M + NaOH 0,1 N la 20 oC |
|
|
0,40 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
4,0 |
|
3,70 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
4,2 |
|
7,50 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
4,4 |
|
12,15 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
4,6 |
|
17,70 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
4,8 |
|
23,85 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
5,0 |
|
29,95 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
5,2 |
|
35,45 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
5,4 |
|
39,85 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
5,6 |
|
43,00 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
5,8 |
|
45,45 ml NaOH 0,1 N + 50 ml biftalat până la 100 ml |
6,0 |
Amestecuri tampon tip CLARK și LUBS (Continuare)
|
Fosfat monopotasic 0,1 M + NaOH 0,1 N la 20 oC |
|
|
5,70 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
6,0 |
|
8,60 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
6,2 |
|
12,60 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
6,4 |
|
17,80 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
6,6 |
|
23,45 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
6,8 |
|
29,63 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
7,0 |
|
35,00 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
7,2 |
|
39,50 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
7,4 |
|
42,80 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
7,6 |
|
45,20 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
7,8 |
|
46,80 ml NaOH 0,1 N + 50 ml fosfat până la 100 ml |
8,0 |
|
H3BO30,1 M în KCl 0,1 M + NaOH 0,1 N la 20 oC |
|
|
2,61 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
7,8 |
|
3,97 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
8,0 |
|
5,90 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
8,2 |
|
8,50 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
8,4 |
|
12,00 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
8,6 |
|
16,30 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
8,8 |
|
21,30 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
9,0 |
|
26,70 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
9,2 |
|
32,00 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
9,4 |
|
36,85 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
9,6 |
|
40,80 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
9,8 |
|
43,90 ml NaOH 0,1 N + 50 ml acid boric până la 100 ml |
10,0 |
B. KOLTHOFF ȘI VLEESCHHOUWER:
Sisteme tampon citrat tip KOLTHOFF și VLEESCHHOUWER
|
Compoziție |
pH |
|
Citrat monopotasic 0,1 M și HCl 0,1 N la 18 oC (1) |
|
|
49,7 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
2,2 |
|
43,4 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
2,4 |
|
36,8 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
2,6 |
|
30,2 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
2,8 |
|
23,6 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
3,0 |
|
17,2 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
3,2 |
|
10,7 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
3,4 |
|
4,2 ml HCl 0,1 N + 50 ml citrat până la 100 ml |
3,6 |
|
Citrat monopotasic 0,1 M și NaOH 0,1 N la 18 oC (1) |
|
|
2,0 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
3,8 |
|
9,0 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
4,0 |
|
16,3 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
4,2 |
|
23,7 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
4,4 |
|
31,5 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
4,6 |
|
39,2 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
4,8 |
|
46,7 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
5,0 |
|
54,2 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
5,2 |
|
61,0 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
5,4 |
|
68,0 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
5,6 |
|
74,4 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
5,8 |
|
81,2 ml NaOH 0,1 N + 50 ml citrat până la 100 ml |
6,0 |
|
(1) Se adaugă cristale mici de timol sau substanțe asemănătoare pentru a preveni creșterea mucegaiurilor. |
|
C. SÖRENSEN:
Amestecuri borate tip SÖRENSEN
|
Compoziție |
Sörensen 18 oC |
Walbum, pH la |
|||
|
ml Borax |
ml HCl/NaOH |
10 oC |
40 oC |
70 oC |
|
|
borax 0,05 M + HCl 0,1 N |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
borax 0,05 M + NaOH 0,1 N |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
Amestecuri fosfate tip SÖRENSEN
|
Compoziție |
pH |
|
Fosfat monopotasic 0,0667 M + Fosfat disodic 0,0667 M la 20 oC |
|
|
99,2 ml KH2PO4 + 0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml KH2PO4 + 1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml KH2PO4 + 2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml KH2PO4 + 4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml KH2PO4 + 7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml KH2PO4 + 11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml KH2PO4 + 17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml KH2PO4 + 24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml KH2PO4 + 34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml KH2PO4 + 46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml KH2PO4 + 58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml KH2PO4 + 70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml KH2PO4 + 80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml KH2PO4 + 87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml KH2PO4 + 92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml KH2PO4 + 96,3 ml Na2HPO4 |
8,0 |
C.8. TOXICITATEA LA RÂME
TEST PE SOL ARTIFICIAL
1. METODĂ
1.1. INTRODUCERE
În acest test de laborator substanța de testat se adaugă la un sol artificial în care se plasează râme timp de 14 zile. După această perioadă (și opțional după 7 zile) se examinează efectul letal al substanței pe râme. Testul reprezintă o metodă pentru determinarea pe termen relativ scurt a efectului substanțelor chimice pe râme prin absorbție cutanată și prin ingestie.
1.2. DEFINIȚIE ȘI UNITATE DE MĂSURĂ
CL50: concentrația unei substanțe care este statistic responsabilă pe parcursul unei expuneri de moartea a 50 % din animalele expuse pe durata testului.
1.3. SUBSTANȚA DE REFERINȚĂ
Se folosește periodic o substanță de referință ca modalitate de a demonstra că sensibilitatea sistemului de testare nu s-a schimbat semnificativ.
Se recomandă ca substanță de referință cloracetamida de puritate analitică.
1.4. PRINCIPIUL TESTULUI
Solul fiind un mediu variabil, pentru acest test se folosește un sol artificial de argilă cu caracteristici definite cu atenție. Râmele adulte din specia Eisenia foetida (a se vedea nota din apendice) sunt ținute într-un sol artificial, definit, tratat cu diferite concentrații ale substanței de testat. Conținutul recipientelor este așezat pe o tavă după 14 zile (opțional 7 zile) de la începerea testului și se numără râmele care au supraviețuit fiecărei concentrații.
1.5. CRITERII DE CALITATE
Testul este conceput astfel încât să fie cât se poate de reproductibil cu privire la substratul de testare și organism. Dacă mortalitatea în loturile martor depășește 10 % la sfârșitul testului, acesta este invalidat.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Materiale
1.6.1.1.
Ca substrat de bază se folosește un sol artificial definit.
(a) Substratul de bază (procente exprimate în greutate uscată):
— 10 % mușchi de turbă (cât se poate de aproape de pH 5,5-6,0 și pe cât posibil fără resturi vizibile de plante și pământ);
— 20 % argilă caolinică, de preferat cu mai mult de 50 % caolinit;
— aproximativ 69 % nisip industrial de cuarț (mai mult de 50 % nisip fin cu dimensiunea particulelor de 0,05-0,2 mm). Dacă substanța nu se dispersează suficient în apă, trebuie păstrată o cantitate de 10 g nisip/recipient de testare pentru amestecare ulterioară cu substanța de testat;
— aproximativ 1 % carbonat de calciu (CaCO3) pulbere, chimic pur, adăugat pentru a ajusta pH-ul la 6,0 ± 0,5.
(b) Substratul de testare
Substratul de testare conține substratul de bază, substanța de testat și apă deionizată.
Conținutul de apă este de aproximativ 25-42 % din greutatea uscată a substratului de bază. Conținutul de apă al substratului este determinat aducând la greutate constantă un eșantion, prin uscare la 105 oC. Criteriul cheie este acela că solul artificial trebuie udat așa încât apa să nu ajungă să băltească. Amestecarea se face cu grijă pentru a se obține o distribuție uniformă a substanței de testat și a substratului. Modul de introducere a substanței de testat în substrat trebuie trecut în raportul de testare.
(c) Substratul martor
Substratul martor conține substratul de bază și apă. Dacă se folosește un aditiv, se adaugă un substrat martor suplimentar care trebuie să conțină aceeași cantitate de aditiv.
1.6.1.2.
Recipiente de sticlă cu o capacitate de aproximativ 1 l (acoperite adecvat cu capace de plastic, discuri sau foi de plastic cu perforații de aerisire) umplute cu o cantitate de substrat de testare umed sau substrat martor umed, echivalent cu 500 g de substrat uscat.
1.6.2. Condiții de testare
Recipientele trebuie păstrate în incinte climatizate la o temperatură de 20 ± 2 oC cu lumină continuă. Intensitatea luminii trebuie să fie de 400-800 de lucși.
Perioada de testare este de 14 zile, dar mortalitatea poate fi evaluată opțional la 7 zile de la începerea testului.
1.6.3. Mod de operare
Concentrațiile substanței de testat sunt exprimate ca raport între masa substanței și masa substratului de bază uscat (mg/kg).
Intervalul de concentrații care provoacă mortalități de 0-100 % se poate determina printr-un test preliminar, care să ofere informații despre intervalul de concentrații ce trebuie folosite în testul definitiv.
Substanța trebuie testată la următoarele concentrații: 1 000; 100; 10; 1 și 0,1 mg substanță/kg substrat de testare (greutate uscată).
Dacă urmează să se efectueze un test final, complet, un lot per concentrație și un lot pentru martorul netratat, fiecare cu câte 10 râme, pot fi suficiente pentru testul preliminar.
Rezultatele testului preliminar se folosesc pentru a selecta cel puțin 5 concentrații într-o serie geometrică din domeniul 0-100 % mortalitate, care diferă cu un raport constant de maximum 1,8.
Testele în care se folosesc aceste serii de concentrații trebuie să permită, cu cea mai mare precizie posibilă, estimarea valorii CL50 și a limitelor de încredere.
În testul definitiv se folosesc 4 loturi de testare per concentrație și 4 loturi martor netratate, fiecare cu 10 râme. Rezultatele acestor loturi replicate se prezintă ca medie, precizându-se deviația standard.
Dacă două concentrații consecutive aflate în raport de 1,8 dau numai 0 % și 100 % mortalitate, aceste două valori sunt suficiente pentru a indica intervalul în care se află CL50.
Dacă este posibil, substratul de testare trebuie preparat fără agenți suplimentari alții decât apa. Imediat înainte de începerea testului, o emulsie sau dispersie de substanță de testat în apă deionizată sau alt solvent se amestecă cu substratul de bază sau este pulverizată uniform peste el, cu un pulverizator de cromatografie fină sau similar.
Dacă este insolubilă în apă, substanța de testat se poate dizolva într-un volum cât se poate de mic de solvent organic adecvat (de exemplu, hexan, acetonă sau cloroform).
Se pot folosi numai agenți care se volatilizează rapid pentru a solubiliza, dispersa sau emulsiona substanța de testat. Substratul trebuie aerisit înainte de utilizare. Cantitatea de apă evaporată trebuie înlocuită. Martorul trebuie să conțină aceeași cantitate din orice aditiv.
Dacă substanța de testat nu este solubilă, dispersabilă sau emulsionabilă în solvenți organici, se amestecă 10 g de nisip de cuarț fin măcinat cu o cantitate de substanță de testat necesară pentru a trata 500 g de sol artificial uscat cu 490 g de substrat de testare uscat.
Pentru fiecare lot, o cantitate de substrat de testare umed echivalent cu 500 g greutate uscată se plasează în fiecare recipient din sticlă și 10 râme, care au fost ținute 24 de ore într-un substrat de bază umed similar, apoi clătite rapid, surplusul de apă fiind absorbit pe hârtie de filtru, sunt așezate pe substratul de testare.
Recipientele se acoperă cu capace de plastic, discuri sau foi de plastic perforate pentru a împiedica uscarea substratului și sunt ținute în condiții de testare 14 zile.
Evaluările trebuie făcute după 14 zile (opțional 7 zile) de la începerea testului. Substratul se întinde pe o placă de sticlă sau oțel inoxidabil. Râmele se examinează și se determină numărul de râme supraviețuitoare. Râmele se consideră moarte dacă nu răspund la un stimul mecanic ușor, aplicat în extremitatea anterioară.
Dacă examinarea are loc la 7 zile, recipientul se reumple cu substrat, iar râmele supraviețuitoare se așează pe același substrat de testare.
1.6.4. Organisme de testare
Organismele de testare trebuie să fie Eisenia foetida adulte (a se vedea nota din apendice) (în vârstă de cel puțin 2 luni, cu clitellum) cu o greutate umedă de 300-600 mg (pentru metoda de reproducere, a se vedea apendicele).
2. DATE
2.1. INTERPRETAREA ȘI EVALUAREA REZULTATELOR
Concentrațiile substanței de testat se raportează la procentele corespunzătoare de mortalitate a râmelor.
Dacă datele sunt adecvate, valoarea CL50 și limitele de încredere (p = 0,05) se determină prin metode standard (Litchfield și Wilcoxon, 1949, pentru metoda echivalentă). CL50 se exprimă în mg de substanță de testat pe kg de substrat de testare (greutate uscată).
În cazurile în care panta curbei de concentrație este prea mare pentru a permite calculul CL50, este suficientă o estimare grafică a acestei valori.
Dacă două concentrații consecutive aflate în raport de 1,8 dau numai 0 % și 100 % mortalitate, cele două valori sunt suficiente pentru a indica intervalul în care se află CL50.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— declarația de conformitate a testului cu criteriile de calitate menționate mai sus;
— testul realizat (testul preliminar și/sau testul definitiv);
— descrierea exactă a condițiilor de testare sau a declarației de conformitate a testului cu metoda; trebuie raportată orice abatere;
— descrierea exactă a modului în care s-a amestecat substanța de testat în substratul de bază;
— informații despre organismele testate (specia, vârsta, media și gama de greutate, condiții de păstrare și reproducere, furnizor);
— metoda folosită pentru determinarea CL50;
— rezultatele testului, inclusiv toate datele folosite;
— descrierea simptomelor observate sau a modificărilor de comportament ale organismelor testate;
— mortalitatea la loturile martor;
— CL50 sau cea mai mare concentrație testată fără mortalitate și concentrația minimă testată cu mortalitate de 100 % la 14 zile (și opțional 7 zile) de la începerea testului;
— trasarea curbei concentrație/răspuns;
— rezultatele obținute cu substanța de referință, fie în cadrul testului de față, fie în cel al unor teste anterioare de control al calității.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 207, Decision of the Council C(81) 30 final.
2. Edwards, C. A. and Lofty, J. R., 1977, Biology of Earthworms, Chapman and Hall, London, p. 331
3. Bouche, M. B., 1972, Lombriciens de France, Ecologie et Systématique, Institut National de la Recherche Agronomique, p. 671
4. Litchfield, J. T. and Wilcoxon, F., A simplified method of evaluation dose effect experiments./. Pharm. Exp. Therap., vol. 96, 1949, p. 99.
5. Commission of the European Communities, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
6. Umweltbundesamt/Biologische Bundesanstalt fur Land- und Forstwirtschaft, Berlin, 1984, „Verfahrensvorschlag Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden”, in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986.
Apendice
Reproducerea și păstrarea râmelor înainte de testare
Pentru reproducerea organismelor, 30-50 de râme adulte sunt puse într-o cutie de reproducere, cu substrat proaspăt, și scoase după 14 zile. Aceste organisme se pot folosi ulterior pentru alte loturi de reproducere. Râmele scoase din coconi se folosesc pentru testare când ajung la maturitate (în condițiile cerute, după 2-3 luni).
Condiții de păstrare și reproducere
|
Incinta climatizată |
: |
temperatura 20 ± 2 oC de preferință cu lumină continuă (intensitatea 400-800 de lucși). |
|
Cutii de reproducere |
: |
recipiente puțin adânci, cu o capacitate de 10-20 l. |
|
Substrat |
: |
Eisenia foetida se poate reproduce în diferite excremente de animale. Se recomandă să se folosească ca mediu de reproducere un amestec de 50 % volum turbă și 50 % bălegar de vacă sau cal. Mediul trebuie să aibă o valoare a pH-ului de 6-7 (ajustată cu carbonat de calciu) și o conductivitate ionică scăzută (mai puțin de 6 mmhos sau 0,5 % concentrație de sare). Substratul trebuie să fie umed, dar nu foarte ud. Se pot folosi alte metode de succes pe lângă metoda prezentată mai sus. |
Notă: Unii taxonomiști au împărțit Eisenia foetida în două specii (Bouche, 1972). Acestea sunt morfologic similare, dar una, Eisenia foetida foetida prezintă dungi transversale tipice pe segmente, în timp ce a doua, Eisenia foetida andrei nu are aceste dungi și are o culoare roșiatică, cu pete. Dacă este posibil, se recomandă folosirea speciei Eisenia foetida andrei. Dacă este disponibilă metodologia necesară, se pot folosi alte specii.
C.9. BIODEGRADARE
METODA ZAHN-WELLENS
1. METODĂ
1.1. INTRODUCERE
Scopul acestei metode este evaluarea potențialului de biodegradabilitate totală al substanțelor organice nevolatile solubile în apă, atunci când sunt expuse la concentrații relativ mari de microorganisme într-un test static.
Pe materiile solide în suspensie poate avea loc adsorbția fizico-chimică, iar acest aspect trebuie luat în considerare la interpretarea rezultatelor (a se vedea punctul 3.2).
Substanțele de studiat se folosesc în concentrații corespunzătoare valorilor COD în intervalul 50-400 mg/l, sau valorilor CCO în intervalul 100-1 000 mg/l (COD = carbon organic dizolvat; CCO = consum chimic de oxigen). Aceste concentrații relativ mari garantează o bună fiabilitate analitică. Compușii cu proprietăți toxice pot întârzia sau inhiba procesul de degradare.
În această metodă se folosește măsurarea concentrației de carbon organic dizolvat sau a consumului chimic de oxigen pentru a evalua biodegradabilitatea totală a substanței de testat.
Folosirea simultană a unei metode analitice specifice permite evaluarea biodegradabilității primare a substanței (dispariția structurii chimice inițiale).
Metoda este aplicabilă numai acelor substanțe organice testate care la concentrația folosită în test:
— sunt solubile în apă în condițiile de testare;
— au o presiune a vaporilor neglijabilă în condițiile de testare;
— nu sunt inhibitoare pentru bacterii;
— sunt adsorbite în sistemul de testare numai în cantități limitate;
— nu se pierd prin spumare din soluția testată.
Informațiile despre proporțiile relative ale principalelor componente ale compusului testat se utilizează la interpretarea rezultatelor obținute, în special în cazurile în care rezultatele indică valori scăzute sau marginale.
Informațiile despre acțiunea toxică a substanței de testat asupra microorganismelor se folosesc pentru interpretarea rezultatelor cu valori scăzute și pentru selecția concentrațiilor testate corespunzătoare.
1.2. DEFINIȚII ȘI UNITĂȚI
Gradul de degradare atins la sfârșitul testului se raportează ca „Biodegradabilitate în testul Zahn-Wellens”:

unde:
|
DT |
= |
gradul de biodegradare exprimat în % la momentul T, |
|
CA |
= |
valori COD sau (CCO) în amestecul testat, măsurate la trei ore după începerea testului (mg/l) (COD = carbon organic dizolvat, CCO = consum chimic de oxigen), |
|
CT |
= |
valori COD sau CCO în amestecul testat la momentul prelevării probelor (mg/l), |
|
CB |
= |
valori COD sau CCO ale probei martor la momentul prelevării probelor (mg/l), |
|
CBA |
= |
valorile COD sau CCO ale probei martor, măsurate la trei ore de la începerea testului (mg/l). |
Gradul de degradare se rotunjește la cel mai apropiat procent întreg.
Procentul de degradare se exprimă ca procent de îndepărtare a COD (sau CCO) din substanța de testat.
Diferența dintre valoarea măsurată după trei ore și valoarea inițială calculată sau, de preferință, măsurată poate furniza informații utile cu privire la eliminarea substanței (a se vedea punctul 3.2 – Interpretarea rezultatelor).
1.3. SUBSTANȚE DE REFERINȚĂ
În anumite cazuri, când se studiază substanțe noi, substanțele de referință pot fi utile; cu toate acestea, nu se pot recomanda încă substanțe de referință specifice.
1.4. PRINCIPIUL METODEI DE TESTARE
Nămolul activ, substanțe nutritive minerale și substanța de testat – ca singură sursă de carbon în soluția apoasă – se introduc împreună într-un recipient din sticlă cu o capacitate de 1-4 l, prevăzut cu un dispozitiv de agitare și un aerator. Amestecul se agită și se aerează la 20-25 oC, în condiții de iluminare difuză sau într-o incintă întunecată, timp de până la 28 de zile. Procesul de degradare se monitorizează prin determinarea valorilor COD (sau CCO) în soluție filtrată, zilnic sau la alte intervale egale de timp adecvate. Raportul dintre COD (sau CCO) eliminat după fiecare interval și valoarea constatată la trei ore după începerea testului se exprimă ca procent de biodegradare și servește ca măsură a gradului de degradare în acel moment. Procentele se reprezintă grafic în funcție de timp, formând curba de biodegradare.
Atunci când se folosește o metodă analitică specifică, se pot măsura schimbările în concentrația moleculei primare datorate biodegradării (biodegradabilitate primară).
1.5. CRITERII DE CALITATE
Reproductibilitatea acestui test s-a dovedit a fi satisfăcătoare în cadrul unui test de comparație interlaboratoare.
Sensibilitatea metodei este determinată în mare măsură de variabilitatea probei martor și într-o mai mică măsură de precizia determinării carbonului organic dizolvat și nivelul compusului de testat în soluție.
1.6. DESCRIEREA MODULUI DE OPERARE
1.6.1. Pregătire
1.6.1.1.
Apa de testare: apă potabilă cu conținut de carbon organic < 5 mg/l. Concentrația de ioni de magneziu și calciu, luate împreună, nu trebuie să depășească 2,7 mmol/l, altfel este necesară o diluare adecvată cu apă deionizată sau distilată.
|
Acid sulfuric, puritate analitică (p.a.) |
50 g/l |
|
Soluție de hidroxid de sodiu p.a. |
40 g/l |
|
Soluție nutritivă minerală: dizolvare într-un litru de apă deionizată: |
|
|
Clorură de amoniu, NH4Cl, p.a. |
38,5 g |
|
Dihidrogenofosfat de sodiu, NaH2PO4.2H2O p.a.: |
33,4 g |
|
Dihidrogenofosfat de potasiu, KH2PO4 p.a.: |
8,5 g |
|
Dipotasiu mono-hidrogen fosfat K2HPO4, p.a.: |
21,75 g |
Amestecul servește atât ca substanță nutritivă, cât și ca soluție tampon.
1.6.1.2.
Recipiente din sticlă cu o capacitate de 1-4 l (de exemplu, recipiente cilindrice).
Dispozitiv de agitare cu agitator din sticlă sau metal, pe un ax adecvat (agitatorul trebuie să se rotească la aproximativ 5-10 cm deasupra bazei recipientului). Se poate folosi, alternativ, un agitator magnetic cu tijă lungă de 7-10 cm.
Tub de sticlă cu diametrul interior de 2-4 mm, folosit pentru a introduce aer. Deschiderea tubului trebuie să fie de aproximativ 1 cm înălțime de la baza recipientului.
Centrifugă (aproximativ 3 550 g).
Ph-metru.
Aparat pentru măsurarea oxigenului dizolvat.
Filtre de hârtie.
Aparat de filtrare cu membrană.
Membrane de filtrare, cu dimensiunea porilor de 0,45 μm. Membranele de filtrare sunt adecvate dacă nu elimină carbon și nu adsorb substanța în faza de filtrare.
Echipament analitic pentru determinarea conținutului de carbon organic și a consumului chimic de oxigen.
1.6.1.3.
Nămolul activ, provenit dintr-o stație de epurare biologică, se spală prin centrifugare (repetată) sau decantare în apa de testare (a se vedea mai sus).
Nămolul activ trebuie să fie în stare corespunzătoare. Acest nămol se poate preleva de la o stație de epurare a apei uzate aflată în bună stare de funcționare. Pentru a obține cât mai multe specii sau sușe bacteriene diferite, este preferabilă amestecarea de inocul provenit din diferite surse (de exemplu, diferite stații de epurare, extracte de sol, apă de râu etc.). Amestecul trebuie tratat conform descrierii de mai sus.
Pentru verificarea activității nămolului activ, a se vedea „Controlul funcțional” de mai jos.
1.6.1.4.
În recipientul de testare se adaugă: 500 ml apă de testare, 2,5 ml/l soluție nutritivă minerală, nămol activ într-o cantitate care să corespundă cu 0,2-1,0 g/l substanță uscată în amestecul final. Se adaugă suficientă soluție mamă de substanță de testat, astfel încât să se obțină în amestecul final o concentrație COD de 50-400 mg/l. Valorile CCO corespunzătoare sunt de 100-1 000 mg/l. Se adaugă apă până la un volum total de 1-4 l. Alegerea volumului total depinde de numărul de probe ce trebuie prelevate pentru determinările COD sau CCO și de volumele necesare pentru metoda analitică.
În mod normal, un volum de 2 litri poate fi considerat satisfăcător. Pentru fiecare serie de teste se prepară în paralel cel puțin un recipient cu probă martor; acesta conține numai nămol activ și soluție nutritivă minerală completată cu apă la același volum total ca în recipientele de testare.
1.6.2. Mod de operare
Recipientele de testare se agită cu agitatoare magnetice sau cu elice, în condiții de iluminare difuză, sau într-o incintă întunecată, la 20-25 oC. Aerarea se face cu aer comprimat, filtrat printr-un tampon de vată și, dacă este necesar, printr-un balon de spălare. Nămolul nu trebuie să se decanteze, iar concentrația de oxigen nu trebuie să scadă sub 2 mg/l.
Valoarea pH-ului se verifică periodic (de exemplu, zilnic) și, dacă este necesar, se ajustează la pH 7-8.
Pierderile prin evaporare se completează chiar înaintea fiecărei prelevări de probe, cu apă deionizată sau distilată în cantitățile necesare. O bună metodă este marcarea nivelului lichidului din recipientul de testare înainte de începerea testului. Noi marcaje se fac după fiecare prelevare de probe (fără aerare și amestecare). Primele probe se prelevează întotdeauna după trei ore de la începerea testului, pentru a se decela adsorbția substanței de testat pe nămolul activ.
Eliminarea substanței de testat este urmată de determinări COD sau CCO făcute zilnic sau la alte intervale egale. Probele din recipientul de testare și proba martor sunt filtrate printr-o hârtie de filtru spălată atent. Primii 5 ml de soluție filtrată se îndepărtează. Nămolurile greu de filtrat se pot înlătura anterior prin centrifugare timp de 10 minute. Determinările COD și CCO se fac cel puțin în duplicat. Testul durează 28 de zile.
Notă: Probele care rămân tulburi se filtrează prin filtrele cu membrană. Acestea nu trebuie să elimine sau să adsoarbă nicio substanță organică.
Pentru fiecare serie de teste, trebuie studiat în paralel un recipient ce conține o substanță cunoscută, astfel încât să se poată verifica capacitatea funcțională a nămolului activ. S-a observat că dietilenglicolul este util în acest scop.
Dacă analizele se efectuează la intervale relativ scurte (de exemplu, zilnic) adaptarea poate fi recunoscută în mod evident din curba de degradare (a se vedea figura 2). Din această cauză, testul nu trebuie să înceapă imediat înainte de sfârșitul săptămânii.
Dacă adaptarea are loc la sfârșitul perioadei, testul poate fi prelungit până când degradarea s-a încheiat.
Notă: Dacă sunt necesare cunoștințe mai ample despre comportamentul nămolului activ, același nămol activ se tratează din nou cu aceeași substanță de testat în conformitate cu metoda de mai jos:
Se oprește dispozitivul de agitare și aeratorul și se lasă nămolul activ să decanteze. Se elimină supernatantul, se umple cu până la 2 litri cu apă, se agită 15 minute și se lasă să decanteze din nou. După ce se elimină din nou supenatantul, cu nămolul rămas se repetă testul cu același compus în conformitate cu punctele 1.6.1.4 și 1.6.2 de mai sus. Nămolul activ poate fi izolat și prin centrifugare în loc de decantare.
Nămolul adaptat poate fi amestecat cu nămol proaspăt într-o concentrație de 0,2-1 g substanță uscată pe litru.
În mod normal, probele se filtrează printr-o hârtie de filtru spălată atent (pentru spălare se folosește apă deionizată).
Probele care rămân tulburi se filtrează prin filtre cu membrană (0,45 μm).
Concentrația COD se determină pe probe duplicate din eșantioanele filtrate (primii 5 ml sunt înlăturați) cu ajutorul analizorului TOC (total organic carbon). Dacă filtratul nu poate fi analizat în aceeași zi, acesta trebuie păstrat în frigider până în ziua următoare. Nu se recomandă o depozitare mai îndelungată.
Concentrația CCO se determină în proba filtrată prin metoda analitică CCO inițiată de procedura descrisă în referința bibliografică 2 de mai jos.
2. DATE ȘI EVALUARE
Concentrațiile COD și/sau CCO se determină cel puțin de două ori pe probe conform punctului 1.6.2 de mai sus. Degradarea la momentul T se calculează conform formulei (cu definiții) date la punctul 1.2 de mai sus.
Gradul de degradare se rotunjește la procentul întreg cel mai apropiat. Gradul de degradare atins la sfârșitul testului constituie „biodegradabilitatea Zahn Wellens”.
Notă: Dacă are loc o degradare completă înainte de expirarea duratei testului, iar acest rezultat este confirmat de o a doua analiză efectuată în ziua următoare, testul poate fi încheiat.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— concentrația inițială a substanței;
— toate celelalte informații și rezultatele experimentale privind substanța de testat, substanța de referință, după caz, și proba martor;
— concentrația după trei ore;
— curba de biodegradare cu descriere;
— data și locul de unde s-a prelevat nămolul activ, stadiul de adaptare, concentrația folosită etc.;
— argumentele științifice pentru orice modificare a metodei de testare.
3.2. INTERPRETAREA REZULTATELOR
Eliminarea COD (CCO) care are loc treptat după zile sau săptămâni indică faptul că substanța de testat se biodegradează.
Cu toate acestea, adsorbția fizico-chimică poate să joace un rol în unele cazuri și acest lucru este indicat de existența unei eliminări complete sau parțiale de la început, în primele trei ore, iar diferența dintre martor și supernatantul de testare rămâne la un nivel neașteptat de scăzut.
Dacă trebuie să se facă o distincție între biodegradare (sau biodegradare parțială) și adsorbție, sunt necesare teste suplimentare.
În acest scop există mai multe metode, însă cea mai convingătoare este utilizarea supernatantului sau a nămolului ca agent de inoculare într-un test din setul de bază (de preferință un test respirometric).
Substanțele de testat care duc la o eliminare avansată neadsorbtivă a COD (CCO) în acest test trebuie considerate ca potențial biodegradabile. Eliminarea parțială, neadsorbtivă, arată că substanța chimică este cel puțin biodegradabilă într-o anumită măsură. Eliminările reduse sau nule ale COD (CCO) se pot datora inhibării microorganismelor de către substanța de testat, acest lucru fiind indicat de liză și pierderea de nămol din care rezultă supernatanți tulburi. Testul se repetă cu o concentrație mai scăzută de substanță de testat.
Folosirea unei metode analitice specifice pentru compusul de testat sau a unei substanțe de testat marcate cu 14C permite o sensibilitate mai mare. În cazul compusului marcat cu 14C, recuperarea 14CO2 confirmă că biodegradarea a avut loc.
Dacă rezultatele sunt exprimate în termeni de biodegradare primară, trebuie să se furnizeze, în măsura în care este posibil, o explicație cu privire la modificarea structurii chimice care duce la diminuarea răspunsului substanței inițiale.
Validarea metodei analitice trebuie însoțită de rezultatul obținut de la proba martor.
4. REFERINȚE BIBLIOGRAFICE
1. OECD, Paris, 1981, Test Guideline 302 B, Decision of the Council (81) 30 final.
2. Anexa V C.6. Degradarea – Consumul chimic de oxigen. Directiva 92/69/CEE a Comisiei, Jurnalul Oficial al Comunităților Europene L 383, 29.12.1992, p. 1.
Apendice
EXEMPLU DE EVALUARE
|
Compus organic: |
4-acid etoxibenzoic |
|
Concentrația teoretică: |
600 mg/l |
|
COD teoretic: |
390 mg/l |
|
Inocul |
instalația de epurare a apei uzate … |
|
Concentrație: |
1 g material uscată/l |
|
Adaptare: |
neadaptat |
|
Analiza: |
determinarea DOC |
|
Cantitatea de probă: |
3 ml |
|
Substanța martor: |
dietilenglicol |
|
Toxicitatea compusului: |
niciun efect toxic sub 1 000 mg/l Metoda utilizată: test cu tuburi de fermentație |
|
Durata testului |
Substanța martor |
Substanța de testat |
|||||
|
Proba martor DOC (1) mg/l |
DOC (1) mg/l |
DOC net mg/l |
Degradare % |
DOC (1) mg/l |
DOC net mg/l |
Degradare % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 ore |
4,0 |
298,0 |
294,0 |
2,0 |
371,6 |
367,6 |
6 |
|
1 zi |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 zile |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 zile |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 zile |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 zile |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 zile |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 zile |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 zile |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
|
(1) Valori medii ale determinărilor efectuate de trei ori. |
|||||||
Figura 1
Exemple de curbe de biodegradabilitate

Figura 2
Exemple de adaptare a nămolului
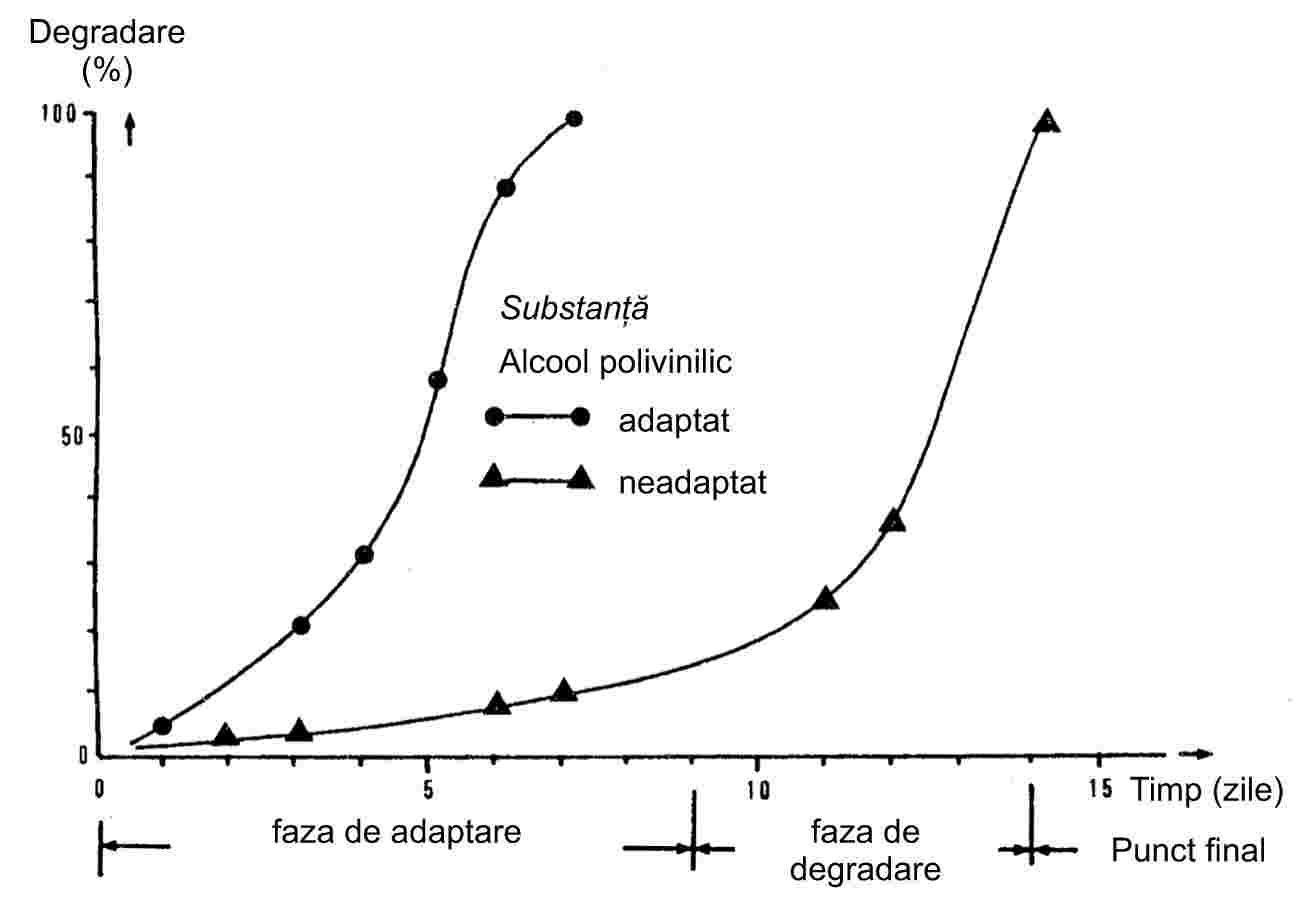
C.10. BIODEGRADARE
TESTE DE SIMULARE CU NĂMOL ACTIV
1. METODĂ
1.1. INTRODUCERE
1.1.1. Observații generale
Această metodă se aplică numai pentru acele substanțe organice care, la concentrația folosită la testare:
— sunt solubile în apă la nivelul necesar pentru pregătirea soluțiilor testate;
— au presiunea vaporilor neglijabilă în condițiile de testare;
— nu sunt inhibitoare pentru bacterii.
Informațiile cu privire la proporțiile relative ale principalelor componente ale compusului de testat se utilizează la interpretarea rezultatelor obținute, în special în cazurile în care rezultatele indică valori scăzute sau marginale.
Informațiile cu privire la toxicitatea substanței asupra microorganismelor se folosesc pentru interpretarea rezultatelor cu valori scăzute și pentru alegerea unor concentrații adecvate de testare.
1.1.2. Determinarea biodegradabilității totale (analiza COD/CCO)
Scopul metodei este de a determina biodegradabilitatea totală prin măsurarea eliminării substanței și a tuturor metaboliților dintr-un model de instalație de tratare a nămolului activ pornind de la o concentrație inițială corespunzătoare a > 12 mg COD/l (sau aproximativ 40 mg CCO/l); 20 mg COD/l se pare că este concentrația optimă. (COD = carbon organic dizolvat; CCO = consum chimic de oxigen).
Trebuie stabilit conținutul de carbon organic (sau consumul chimic de oxigen) al substanței de testat.
1.1.3. Determinarea biodegradabilității primare (analize specifice)
Scopul metodei este determinarea biodegradabilității primare a unei substanțe într-un model de instalație de tratare a nămolului activ în concentrație de aproximativ 20 mg/l, printr-o metodă analitică specifică (se pot folosi concentrații mai mari sau mai mici dacă metoda analitică și limitele de toxicitate permit acest lucru). Acest lucru permite evaluarea biodegradabilității primare a substanței (dispariția structurii chimice inițiale).
Scopul acestei metode nu este determinarea mineralizării substanței de testat.
Trebuie să fie disponibilă o metodă analitică corespunzătoare pentru determinarea substanței de testat.
1.2. DEFINIȚII ȘI UNITĂȚI
1.2.1. Analiza COD/CCO
Gradul de eliminare al substanței este dat de:
|
|
[1(a)] |
unde:
|
DR |
= |
gradul de eliminare în procente de COD (sau CCO) în cadrul timpului mediu de retenție dat, față de substanța de testat. |
|
T |
= |
concentrația substanței de testat în influentul instalației, în mg COD/l sau (mg CCO/l) |
|
E |
= |
concentrația COD (sau CCO) în efluentul instalației de testare, în mg COD/l sau (mg CCO/l) |
|
E0 |
= |
concentrația COD (sau CCO) în efluentul instalației martor, în mg COD/l sau (mg CCO/l) |
Degradarea se exprimă ca procent de eliminare COD (sau CCO) în timpul de retenție dat, față de substanța de testat.
1.2.2. Analiza specifică
Procentul de eliminare a substanței de testat din faza apoasă (RW) în timpul mediu de retenție dat se calculează cu ajutorul formulei:
|
|
[1(b)] |
unde:
|
C1 |
= |
concentrația substanței în influentul instalației de testare (mg de substanță/l determinată prin analize specifice) |
|
C0 |
= |
concentrația substanței în efluentul instalației de testare (mg de substanță/l determinată prin analize specifice) |
1.3. SUBSTANȚE DE REFERINȚĂ
În anumite cazuri, când se studiază o substanță nouă, substanțele de referință pot fi utile; cu toate acestea, nu se pot recomanda încă substanțe de referință specifice.
1.4. PRINCIPIUL METODELOR DE TESTARE
Pentru determinarea biodegradabilității totale se folosesc în paralel două instalații pilot de tratare a nămolului activ (testul de confirmare OCDE sau instalații de tip vas poros). Substanța de testat se adaugă în influentul (apă uzată sintetică sau menajeră) uneia dintre instalații, în timp ce cealaltă este alimentată numai cu apă uzată. Pentru determinarea biodegradabilității primare prin analize specifice ale influentului și efluentului, se folosește numai o instalație de testare.
Se măsoară concentrațiile COD (sau CCO) în efluenți sau se determină concentrațiile substanței prin analize specifice.
COD datorat substanței de testat nu se măsoară, ci doar se menționează.
În cazul în care se fac măsurători COD (sau CCO), se presupune că diferența dintre concentrațiile medii ale efluenților testați și ale efluenților martor se datorează substanței de testat nedegradate.
În cazul în care se fac analize specifice, se poate măsura modificarea concentrației moleculei de bază (biodegradare primară).
Aceste instalații pot funcționa în „regim cu instalații cuplate”, printr-o metodă de transinoculare.
1.5. CRITERII DE CALITATE
Concentrația inițială a substanței depinde de tipul și de limitele analizelor efectuate.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătire
1.6.1.1.
Sunt necesare două instalații de același tip, excepție făcând cazurile în care se efectuează analize specifice. Se pot folosi două tipuri de dispozitive:
Testul de confirmare OCDE
Echipamentul (apendicele 1) constă dintr-un vas de alimentare (A) pentru apa uzată sintetică, pompă dozatoare (B), vas de aerare (C), vas de decantare (D), pompă cu aer comprimat (E) pentru recircularea nămolului activ și vas colector (F) pentru efluentul tratat.
Vasele (A) și (F) trebuie să fie din sticlă sau din material plastic adecvat, cu un volum util de cel puțin 24 litri. Pompa (B) trebuie să asigure un debit constant de ape uzate sintetice în vasul de aerare; se poate folosi orice sistem corespunzător, cu condiția ca debitul de intrare și concentrația să fie asigurate. În timpul funcționării normale, nivelul vasului de decantare (D) este fixat astfel încât volumul din vasul de aerare să fie de 3 litri de soluție amestecată. Un sistem de aerare din material sinterizat (G) este suspendat în vasul (C) la vârful conului. Cantitatea de aer suflată prin aerator poate fi monitorizată cu ajutorul unui debitmetru.
Pompa cu aer comprimat (E) se reglează astfel încât nămolul activ din vasul de decantare să fie recirculat continuu și cu regularitate în vasul de aerare (C).
„Vas poros”
Vasul poros este construit din folii de polietilenă poroase (2 mm grosime, dimensiunea maximă a porilor 95 μm) sub formă de cilindri cu diametru de 14 cm cu bază conică la 45o (figurile 1 și 2 din apendicele 2). Vasul poros se așează într-un recipient impermeabil din material plastic, cu diametrul de 15 cm cu un orificiu la înălțimea de 17,2 cm pe partea cilindrică, care determină capacitatea vasului (3 litri). În partea de sus a vasului poros se găsește un inel de sprijin rigid, realizat din material plastic, care lasă un spațiu pentru efluent de 0,5 cm între vasul interior și cel exterior.
Vasele poroase pot fi montate la baza unei băi de apă cu control termostatic. La baza vasului poros există un flux de aer pe care se plasează difuzorii corespunzători.
Recipientele (A) și (E) trebuie să fie din sticlă sau material plastic adecvat și să aibă un volum util de cel puțin 24 litri. Pompa (B) trebuie să asigure un debit constant al apei uzate sintetice în vasul de aerare; se poate folosi orice sistem convenabil, cu condiția asigurării debitului de alimentare și a concentrației.
Sunt necesare vase poroase de rezervă, pentru a le înlocui pe cele care se blochează în timpul funcționării; vasele blocate se curăță prin imersare timp de 24 ore în soluție de hipoclorit, apoi se spală cu apă de la robinet.
1.6.1.2.
Aparatul de filtrare cu membrană și membrane de filtrare cu dimensiunea porilor de 0,45 μm. Membranele de filtrare se pot folosi dacă este sigur că ele nu evacuează carbon și nici nu adsorb substanța în faza de filtrare.
1.6.1.3.
Se poate folosi fie un efluent sintetic, fie apă uzată menajeră.
Exemplu de efluent sintetic
Dizolvați pentru fiecare litru de apă de la robinet:
|
Peptonă: |
160 mg, |
|
Extract de carne: |
110 mg, |
|
Uree: |
30 mg, |
|
NaCl: |
7 mg, |
|
CaCl2·2H2O: |
4 mg, |
|
MgSO4·7H2O: |
2 mg, |
|
K2HPO4: |
28 mg. |
Apă uzată menajeră
Aceasta se colectează proaspătă în fiecare zi, de la preaplinul vasului de decantare primară al instalației de tratare a apei uzate menajere.
1.6.1.4.
Se prepară o soluție a substanței de testat, de exemplu 1 %, care se adaugă în instalația de testare. Se determină concentrația substanței, astfel încât să se calculeze volumul corect care urmează să se adauge în apa uzată sau direct în instalație printr-o a doua pompă, astfel încât să se obțină concentrația de testare necesară.
1.6.1.5.
Observație: Dacă se folosește apă uzată menajeră, nu are niciun sens să se folosească un inocul cu concentrație bacteriană scăzută, dar se poate folosi nămol activ.
Se pot folosi mai multe tipuri de inocul.
Se dau trei exemple de inocul adecvat:
(a) Inocul pe bază de efluent secundar
Inoculul trebuie obținut dintr-un efluent secundar de bună calitate prelevat de la o instalație de tratare alimentată preponderent cu apă uzată menajeră. Efluentul trebuie menținut în condiții aerobe în perioada dintre prelevarea probei și folosirea ei. Pentru prepararea inoculului, proba se filtrează printr-un filtru cu porozitate mare, primii 200 ml eliminându-se. Filtratul se păstrează în condiții aerobe până la utilizare. Inoculul trebuie folosit în ziua prelevării. Pentru inoculare se folosesc cel puțin 3 ml.
(b) Inocul compus
Inocul provenit de la efluentul secundar:
A se vedea descrierea de mai sus.
Inocul pe bază de pământ:
Se pun în suspensie 100 g de sol de grădină (fertil, nu steril) în 1 000 ml apă potabilă fără clor. (Solurile cu o cantitate extrem de mare de argilă, nisip sau humus nu sunt adecvate). După agitare, suspensia se lasă să se decanteze timp de 30 minute. Supernatantul se filtrează printr-o hârtie de filtru cu porozitate mare, primii 200 ml eliminându-se. Filtratul se păstrează în condiții aerobe până la utilizare. Inoculul trebuie folosit în ziua prelevării.
Inocul pe bază de apă de suprafață:
Se prelevează un inocul dintr-o apă de suprafață mezosaprobă. Proba se filtrează printr-o hârtie de filtru cu porozitate mare, primii 200 ml eliminându-se. Filtratul se păstrează în condiții aerobe până la utilizare. Inoculul trebuie folosit în ziua prelevării.
Se amestecă cu grijă volume egale din cele tipuri de eșantioane de inoculi definiți anterior, astfel încât din acest amestec să se obțină inoculul final. Pentru inoculare, se folosesc cel puțin 3 ml.
(c) Inocul pe bază de nămol activ
Ca inocul se poate folosi un volum (nu mai mare de 3 l) de nămol activ (conținutul de materii solide în suspensie este de până la 2,5 g/l) prelevat din vasul de aerare al unei instalații în care se tratează cu preponderență apă uzată menajeră.
1.6.2. Mod de operare
Testul se realizează la temperatura incintei; aceasta trebuie menținută între 18 și 25 oC.
Dacă este necesar, testul se poate realiza la o temperatură mai joasă (până la 10 oC); dacă substanța este degradată, nu mai este necesară nicio altă acțiune. Cu toate acestea, dacă substanța nu este degradată, testul trebuie efectuat la o temperatură constantă de 18-25 oC.
1.6.2.1.
Perioada de formare a nămolului/stabilizare este perioada în care concentrația de materii solide în suspensie din nămolul activ și performanțele instalațiilor cresc până se atinge un regim constant în condițiile de funcționare dorite.
Perioada de pornire este perioada care durează din momentul în care se adaugă prima dată substanța de testat până în momentul în care curba valorilor de îndepărtare a acesteia se stabilizează (se ajunge la o valoare relativ constantă). Această perioadă nu trebuie să depășească șase săptămâni.
Perioada de evaluare este o perioadă de trei săptămâni, care începe în momentul în care îndepărtarea substanței de testat ajunge la o valoare relativ constantă și, de regulă, mare. Pentru substanțele care prezintă o degradare redusă sau nicio degradare în primele șase săptămâni, perioada de evaluare este considerată ca fiind următoarele trei săptămâni.
La început, instalațiile se alimentează cu cantitatea de inocul amestecat cu influent necesar pentru un singur test.
Dispozitivul de aerare [și pompa cu aer comprimat (E), în cazul instalațiilor pentru testul de confirmare OCDE] și pompa dozatoare (B) sunt puse apoi în funcțiune.
Influentul fără substanța de testat trebuie să treacă prin vasul de aerare (C) fie cu viteza de 1 l/h, fie cu viteza de ½ l/h; acest lucru dă un timp de retenție mediu de trei sau șase ore.
Viteza de aerare trebuie reglată astfel încât conținutul vasului de aerare (C) să fie menținut constant în suspensie, în timp ce conținutul de oxigen dizolvat să fie de cel puțin 2 mg/l.
Trebuie evitată spumarea cu mijloace adecvate. Nu trebuie folosiți agenți antispumare care inhibă nămolul activ.
Nămolul care s-a acumulat în partea de sus a vasului de aerare (C) [iar în cazul instalațiilor pentru testul de confirmare OCDE, la baza vasului de decantare (D) și în circuit] trebuie să fie recirculat în soluția amestecată cel puțin o dată pe zi, prin periere sau alte mijloace convenabile.
Dacă nămolul nu se decantează, densitatea acestuia se poate crește în mod repetat, de câte ori este nevoie, prin adăugarea a 2 ml de soluție de 5 % clorură ferică.
Efluentul se colectează în vasul (E) sau (F) timp de 20-24 ore și se prelevează o probă după amestecare. Vasul (E) sau (F) trebuie să fie curățat cu grijă.
Pentru a se monitoriza și controla eficiența procesului, consumul chimic de oxigen (CCO) sau carbonul organic dizolvat (COD) din filtratul de efluent acumulat, precum și cel din filtratul de influent se măsoară cel puțin de 2 ori pe săptămână [folosind o membrană cu dimensiunea porilor de 0,45 μm, primii (aproximativ) 20 ml eliminându-se].
Scăderea CCO sau COD se stabilizează atunci când se obține o degradare zilnică aproape uniformă.
Conținutul de substanță uscată al nămolului activ din vasul de aerare trebuie determinat de două ori pe săptămână (în g/l). Instalațiile pot funcționa în unul dintre următoarele două moduri: fie conținutul de substanță uscată din nămolul activ trebuie determinat de două ori pe săptămână, iar dacă este mai mare de 2,5 g/l, nămolul activ în exces trebuie eliminat; fie 500 ml de soluție amestecată se elimină zilnic din fiecare vas pentru a da un timp mediu de retenție a nămolului de 6 zile.
Când parametrii măsurați și estimați [eficiența procesului (în înlăturarea CCO sau COD), concentrația de nămol, capacitatea de sedimentare a nămolului, turbiditatea efluenților etc.] ai celor două instalații sunt suficient de stabili, substanța de testat se poate introduce în influentul uneia dintre instalații în conformitate cu punctul 1.6.2.2.
Alternativ, substanța de testat se poate adăuga la începutul perioadei de formare a nămolului (1.6.2.1), în special atunci când nămolul se adaugă ca inocul.
1.6.2.2.
Se mențin condițiile de funcționare din perioada de pornire și se adaugă suficientă soluție mamă (aproximativ 1 %) de substanță de testat în influentul instalației de testare, astfel încât să se obțină concentrația dorită de substanță de testat (aproximativ 10-20 mg COD/l sau 40 mg CCO/l) în apa uzată. Aceasta se poate obține prin amestecarea soluției mamă cu apă uzată zilnic sau cu ajutorul unui sistem de pompare separat. Această concentrație poate fi atinsă progresiv. Dacă nu există efecte toxice ale substanței de testat asupra nămolului activ, se pot testa concentrații mai mari.
Instalația martor se alimentează cu influent fără adaos de substanțe. Se iau pentru analiză volume adecvate de efluenți și se filtrează prin filtrele cu membrană (0,45 μm), iar primii 20 ml (aproximativ) de filtrat se elimină.
Probele filtrate trebuie analizate în aceeași zi, altfel acestea trebuie conservate prin orice metodă convenabilă, folosindu-se, de exemplu, 0,05 ml soluție de clorură de mercur 1 % (HgCl2) la fiecare 10 ml de filtrat sau prin depozitarea lor la 2-4 oC timp de 24 ore sau sub –18 oC pe perioade mai îndelungate.
Perioada de pornire, cu adăugarea substanței de testat, nu trebuie să depășească șase săptămâni, iar perioada de evaluare nu trebuie să fie mai scurtă de trei săptămâni, pentru calcularea rezultatului final fiind recomandabil să fie disponibile aproximativ 14-20 de determinări.
Regimul cu instalații cuplate
Cuplarea instalațiilor se realizează prin schimbul reciproc de 1,5 l de soluție amestecată (inclusiv nămol) din vasele de aerare a nămolului activ între cele două instalații, o dată pe zi. În cazul substanțelor de testat puternic absorbante, se scot 1,5 l numai de supernatant din vasele de decantare și se toarnă în vasul cu nămol activ al celeilalte instalații.
1.6.2.3.
Se efectuează 2 tipuri de analize pentru a urmări comportamentul substanței:
COD și CCO
Se determină concentrațiile CCO de două ori cu analizorul de carbon și/sau valorile CCO, conform referinței 2.
Analiza specifică
Concentrațiile substanței de testat se determină printr-o metodă analitică corespunzătoare. Dacă este posibil, se determină substanța absorbită de nămol.
2. DATE ȘI EVALUARE
2.1. CUPLAREA INSTALAȚIILOR
Când se folosește „regimul cu instalații cuplate”, gradele zilnice de eliminare (DR) se calculează în conformitate cu punctul 1.2.1.
Aceste grade zilnice de eliminare DR se corectează la DRc pentru transferul de soluție datorită metodei de transinoculare cu ecuația [2] pentru un timp de retenție mediu de trei ore și cu ecuația [3] pentru un timp de retenție mediu de șase ore.
|
|
[2] |
|
|
[3] |
Se calculează media seriilor valorilor DRc și, de asemenea, deviația standard conform ecuației [4]
|
|
[4] |
unde:
|
SDRc |
= |
deviația standard a seriilor valorilor DRc |
|
|
= |
media valorilor DRc |
|
n |
= |
numărul de determinări |
Valorile excepționale ale seriilor DRc se elimină prin metode statistice adecvate, de exemplu Nalimov (6), la nivelul de probabilitate de 95 %, și se recalculează media și deviația standard a setului de date DRc fără valorile excepționale.
Rezultatul final se calculează apoi cu ecuația [5] ca:
|
|
[5] |
unde:
|
tn – 1;α |
= |
valoarea din tabel a lui t pentru n perechi de valori E și Eo și încrederea statistică P (P = 1 – α), unde P reprezintă 95 % (1). |
Rezultatul este exprimat ca medie cu limite de toleranță la nivelul de probabilitate de 95 %, cu deviația standard respectivă și numărul de date din setul DRC fără valori excepționale, precum și numărul de valori excepționale, de exemplu:
|
DRc |
= |
98,6 ± 2,3 % eliminare COD |
|
s |
= |
4,65 % eliminare COD |
|
n |
= |
18 |
|
x |
= |
numărul de valori excepționale. |
2.2. REGIMUL CU INSTALAȚII NECUPLATE
Performanța instalațiilor se poate verifica după cum urmează:
![]()
Aceste eliminări zilnice se pot reprezenta grafic pentru a reliefa orice tendință, de exemplu la aclimatizare.
2.2.1. Folosirea determinărilor CCO/COD
Gradul zilnic de eliminare a DR se calculează conform punctului 1.2.1.
Se calculează media seriei de valori DR; în plus, se calculează deviația standard conform:
|
|
[6] |
unde:
|
SDR |
= |
deviația standard a seriilor de valori DRi |
|
|
= |
media valorilor DRi |
|
n |
= |
număr de determinări |
Valorile excepționale din seriile DR se elimină conform metodei statistice corespunzătoare, de exemplu Nalimov (6), la nivelul de probabilitate de 95 %, și se recalculează media și deviația standard a setului de date DRc fără valorile excepționale.
Rezultatul final este calculat apoi cu ecuația [7] ca:
|
|
[7] |
unde:
|
tn – 1;α |
= |
valoarea din tabel a lui t pentru n perechi de valori ale lui E și Eo și încrederea statistică P (P = 1 – α), unde P reprezintă 95 % (1). |
Rezultatul este exprimat ca medie cu limite de toleranță la nivel de probabilitate de 95 %, deviația standard respectivă și numărul de date din setul DRc fără valori excepționale, precum și numărul de valori excepționale, de exemplu:
|
DR |
= |
98,6 ± 2,3 % eliminare COD |
|
s |
= |
4,65 % eliminare COD |
|
n |
= |
18 |
|
x |
= |
numărul de valori excepționale. |
2.2.2. Folosirea analizei specifice
Procentul de eliminare a substanței de testat din faza apoasă (RW) se calculează în conformitate cu punctul 1.2.2.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— formularul din apendicele 3, indicând condițiile de funcționare ale testului;
— aparatul ales (testul de confirmare OCDE sau vasul poros);
— modul de funcționare ales: instalații cuplate sau nu;
— tipul apei uzate: sintetică sau menajeră – în cazul apei uzate menajere data și locul prelevării;
— inoculul cu data și locul prelevării;
— menționarea și descrierea metodei analitice, dacă se fac analize specifice;
— reprezentarea grafică a eliminării CCO sau COD în funcție de timp, inclusiv perioada de pornire și de evaluare;
— determinarea analitică a substanței de testat ca CCO sau COD din soluția mamă;
— dacă s-au făcut analize specifice, reprezentarea grafică a procentului de eliminare a substanței de testat din faza apoasă în funcție de timp (perioada de pornire și de evaluare);
— media eliminării COD sau CCO din substanța de testat și deviația standard se calculează din rezultatele perioadei de evaluare, dacă există o eliminare constantă a substanței de testat sau o perioadă de funcționare în regim constant;
— reprezentarea grafică a concentrației de nămol activ în funcție de timp;
— eventualele observații privind nămolul activ (eliminarea nămolului în exces, prezența unor aglomerate, FeCl3 etc.);
— concentrația substanței de testat;
— toate rezultatele privind analizele efectuate asupra nămolului;
— toate informațiile și rezultatele experimentale privind substanța de testat și substanța de referință, dacă s-a utilizat;
— argumente științifice pentru toate schimbările modului de operare.
3.2. INTERPRETAREA REZULTATELOR
Un grad scăzut de îndepărtare a substanței de testat din faza apoasă se poate datora faptului că substanța inhibă microorganismele. Acest lucru se poate observa prin liză și pierdere de nămol, rezultând un supernatant tulbure, și prin scăderea eficienței eliminării CCO (sau COD) din instalația pilot.
Adsorbția fizico-chimică poate să joace uneori un rol. Diferențele între acțiunea biologică asupra moleculei și adsorbția fizico-chimică se pot observa prin analizele efectuate pe nămol după o desorbție adecvată.
Dacă trebuie să se facă o distincție între biodegradare (sau biodegradare parțială) și adsorbție, sunt necesare teste suplimentare.
Aceasta se poate face în mai multe moduri, cel mai convingător fiind utilizarea supernatantului ca inocul într-un test din setul de bază (de preferință testul respirometric).
Dacă se observă eliminări mari ale COD sau CCO, aceasta se datorează biodegradării, în timp ce la eliminările reduse biodegradarea nu se distinge de eliminare. De exemplu, dacă un compus solubil prezintă o constantă de adsorbție ridicată, de 98 %, iar rata de pierdere a surplusului de nămol este de 10 % pe zi, este posibilă o eliminare de până la 40 %; la o rată de pierdere a surplusului de nămol de 30 %, eliminarea datorată adsorbției pe nămol și eliminării surplusului poate ajunge la 65 % (4).
În cazul în care se folosesc analize specifice, trebuie să se acorde atenție relației dintre structura substanței și analizele specifice folosite. În acest caz, fenomenul observat nu poate fi interpretat ca o mineralizare a substanței.
4. REFERINȚE BIBLIOGRAFICE
1. OCDE, Paris, 1981, Linii directoare privind testele 303 A, Decizia Consiliului C(81) 30 final.
2. Anexa V C.6. Degradarea – Consumul chimic de oxigen. Directiva 92/69/CEE a Comisiei, Jurnalul Oficial al Comunităților Europene L 383, 29.12.1992, p. 1.
3. Painter, H.A., King, ESTE.F., WRC Porous Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom.
4. Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, p. 161-171.
5. Directivele 82/242/CEE și 82/243/CEE ale Consiliului, Jurnalul Oficial al Comunităților Europene L 109, 22.4.1982, p. 1, de rectificare a Directivelor 73/404/CEE și 73/405/CEE ale Consiliului privind diodegradabilitatea detergenților, Jurnalul Oficial al Comunităților Europene L 347, 17.12.1973, p. 53.
6. Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreißertests, insbesondere bei Ringsversuchen zur Űberprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift für Analytische Chemie, 303 (1980), p. 406-408.
Apendicele 1
Figura 1
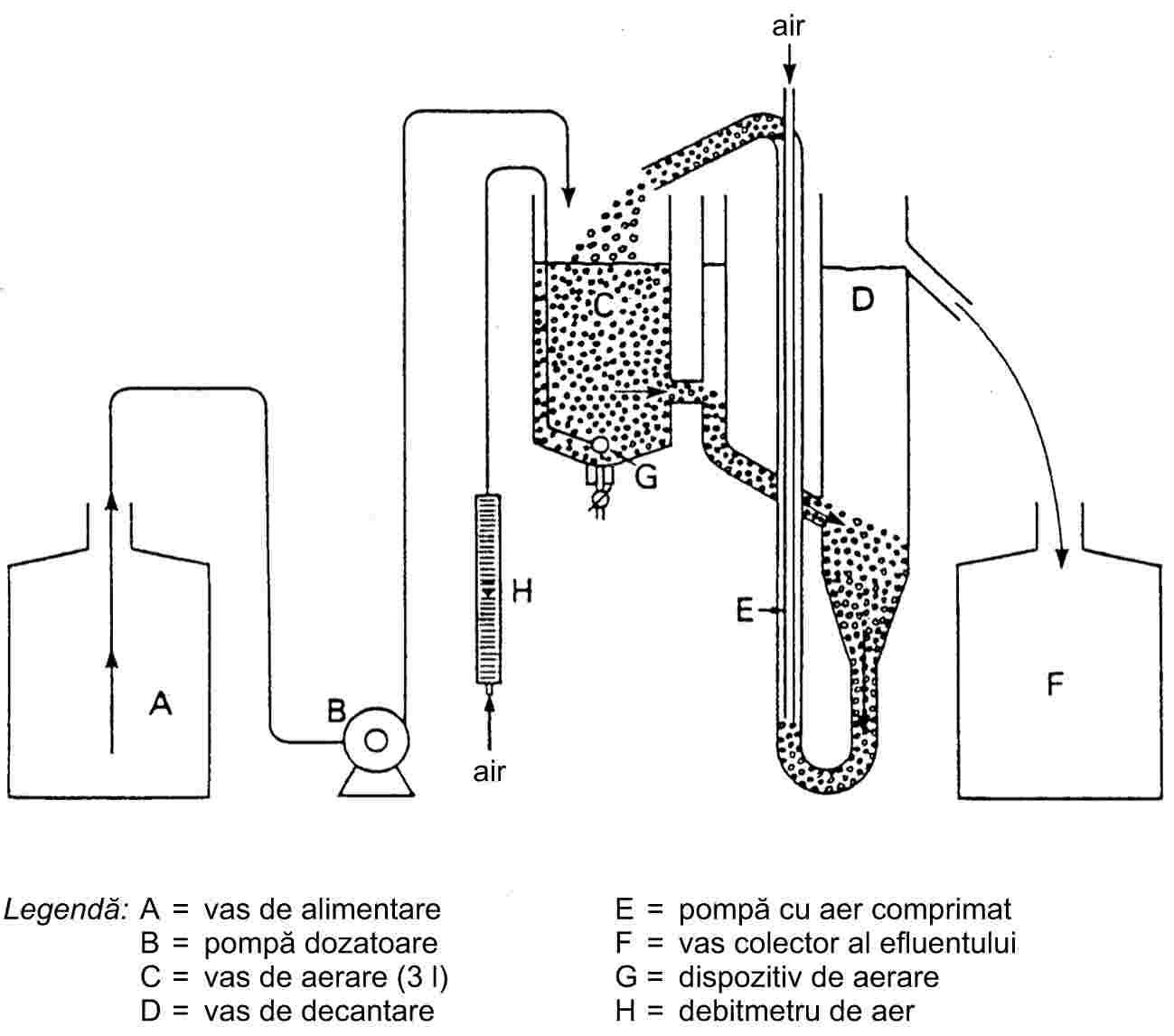
Figura 2

Apendicele 2
Figura 1
Echipament utilizat pentru evaluarea biodegradabilității

Figura 2
Detalii ale vasului poros de aerare de 3 l
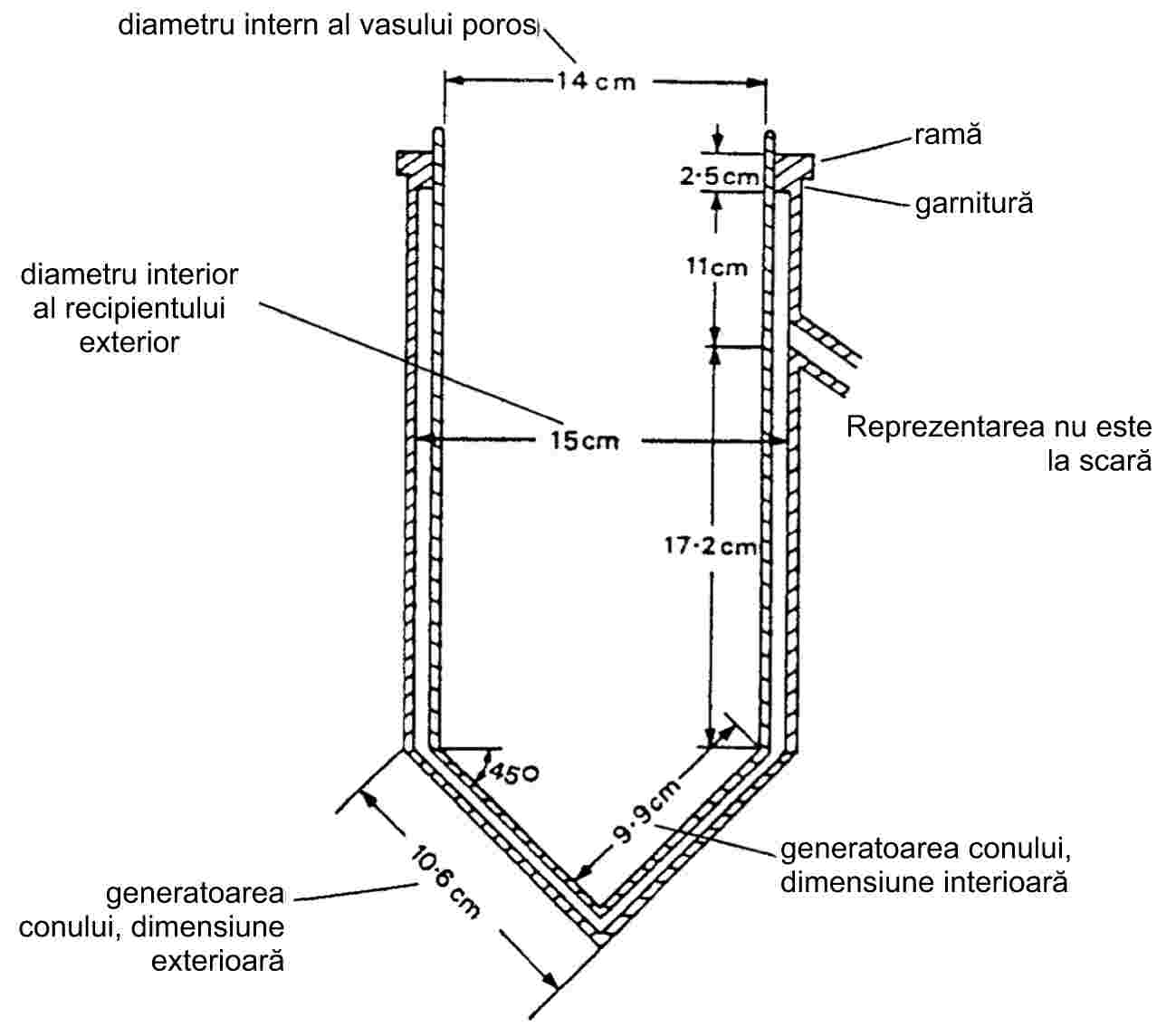
Apendicele 3
Condiții de operare pentru testele de simulare cu nămol activ
A se verifica fiecare grup
Aparatură
|
Test de confirmare OCDE |
|
|
Vas poros |
Mod de funcționare
|
O singură instalație |
|
|
Instalații cuplate |
|
|
Instalații necuplate |
Transinoculare
|
Niciuna |
|
|
Nămol activ |
|
|
Supernatant |
Timp de retenție mediu
|
Trei ore |
|
|
Șase ore |
Component de bază
|
Apă menajeră |
|
|
Apă sintetică |
Inocul
|
Efluent secundar |
|
|
Compozit |
|
|
Nămol activ |
Adăugare de material testat
|
La început |
|
|
Creștere în etape |
|
|
După formarea nămolului |
Analiză
|
Specială |
|
|
CCO |
|
|
COD |
C.11. BIODEGRADARE
NĂMOLUL ACTIV: TEST DE INHIBIȚIE A RESPIRAȚIEI
1. METODĂ
1.1. INTRODUCERE
Metoda descrisă evaluează efectul substanței de testat asupra microorganismelor măsurând rata respirației în condiții definite, în prezența unor concentrații diferite ale substanței de testat.
Scopul acestei metode este de a asigura o metodă de selecție rapidă prin care să se poată identifica substanțele care afectează negativ instalațiile de tratare microbiană aerobă și să se facă estimări asupra unor concentrații convenabile, neinhibitoare, ale substanțelor folosite în testele de biodegradabilitate.
Testul definitiv poate fi precedat de un test preliminar. Acesta poate oferi informații cu privire la intervalul de concentrații folosite în testul principal.
Testul este conceput astfel încât să cuprindă doi martori fără substanță testată, unul la începutul iar celălalt la sfârșitul seriei de teste. Fiecare lot de nămol activ trebuie apoi verificat cu o substanță de referință.
Această metodă se aplică substanțelor care, datorită solubilității în apă și volatilității reduse, pot să rămână în apă.
Pentru substanțele cu solubilitate limitată în mediul de testare nu se poate determina CE50.
Rezultatele bazate pe absorbția de oxigen pot conduce la concluzii eronate atunci când substanța de testat are tendința de a întrerupe lanțul metabolic de fosforilare oxidativă.
Pentru efectuarea testului sunt utile următoarele informații:
— solubilitatea în apă;
— presiunea vaporilor;
— formula structurală;
— puritatea substanței de testat.
Recomandare
Nămolul activ poate conține organisme potențial patogene și trebuie manipulat cu atenție.
1.2. DEFINIȚII ȘI UNITĂȚI
Rata respirației reprezintă consumul de oxigen al microorganismelor din apa uzată aflate în nămol aerob, exprimată, în general, ca mg O2 pe mg de nămol pe oră.
Pentru a calcula efectul inhibitor al substanței de testat la o anumită concentrație, rata respirației se exprimă ca procent din media celor două rate-martor

unde:
|
Rs |
= |
debitul consumului de oxigen la concentrația testată a substanței de testat; |
|
Rc1 |
= |
debitul consumului de oxigen, martorul 1; |
|
Rc2 |
= |
debitul consumului de oxigen, martorul 2, |
CE50 reprezintă în prezenta metodă concentrația substanței de testat la care rata respirației este de 50 % din cea rezultată în proba martor, în condițiile descrise în prezenta metodă.
1.3. SUBSTANȚE DE REFERINȚĂ
Se recomandă ca 3,5-diclorfenolul, cunoscut ca inhibitor al respirației, să fie folosit ca substanță de referință și să fie testat pentru CE50 pe fiecare lot de nămol activ, ca mijloc de verificare a faptului că sensibilitatea nămolului nu este anormală.
1.4. PRINCIPIUL METODEI DE TESTARE
Se măsoară rata respirației nămolului activ alimentat cu o cantitate standard de apă uzată sintetică, după un timp de contact de 30 minute sau trei ore sau ambele. Se măsoară și rata respirației aceluiași nămol activ în prezența diferitelor concentrații ale substanței de testat, toate celelalte condiții fiind identice. Efectul inhibitor al substanței de testat la o anumită concentrație se exprimă ca procent față de media celor două rate ale respirației din cei doi martori. Valoarea CE50 se calculează din determinări la diferite concentrații.
1.5. CRITERII DE CALITATE
Rezultatele testului sunt validate dacă:
— ratele de respirație în cei doi martori diferă în limita a 15 % una față de alta;
— CE50 (30 minute și/sau trei ore) a 3,5-diclorfenolului se găsește în intervalul acceptat de 5-30 mg/l.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Reactivi
1.6.1.1.
Se prepară soluții proaspete ale substanțelor de testat la începutul studiului, folosindu-se o soluție mamă. Dacă se urmează metoda recomandată mai jos, concentrația adecvată a soluției mamă este de 0,5 g/l.
1.6.1.2.
De exemplu, se poate pregăti o soluție de 3,5-diclorofenol astfel: se dizolvă 0,5 g de 3,5-diclorofenol în 10 ml NaOH 1M, se adaugă aproximativ 30 ml apă distilată, se adaugă sub agitare H2SO40,5M până în punctul precipitării incipiente (vor fi necesari aproximativ 8 ml de H2SO40,5 M) și, în final, se aduce amestecul la 1 l, folosind apă distilată. PH-ul trebuie să fie între 7 și 8.
1.6.1.3.
Se prepară un efluent sintetic prin dizolvarea următoarelor cantități de substanțe într-un litru de apă:
— 16 g peptonă
— 11 g extract de carne
— 3 g uree
— 0,7 g NaCl
— 0,4 g CaCl2·2H2O
— 0,2 g MgSO4·7H2O
— 2,8 g K2HPO4.
Nota 1: Această apă uzată sintetică este de 100 de ori mai concentrată decât cea descrisă în raportul tehnic al OCDE „Metodă propusă pentru determinarea biodegradabilității agenților tensioactivi folosiți la detergenții sintetici” (11 iunie 1976) cu adăugarea fosfatului acid de potasiu.
Nota 2: Dacă mediul preparat nu se folosește imediat, trebuie păstrat la întuneric la 0-4 oC, nu mai mult de o săptămână, în condiții care nu produc nicio schimbare în compoziția sa. Mediul poate fi și sterilizat înainte de depozitare sau peptona și extractul de carne se pot adăuga imediat înainte de începerea testului. Înainte de utilizare, mediul se agită bine și se ajustează pH-ul.
1.6.2. Aparatură
Aparate de măsurare: nu este important ca aparatul să aibă o formă precisă. Cu toate acestea, nu trebuie să rămână spațiu liber în recipientul de măsurare plin, iar electrodul trebuie să adere perfect la gâtul acestuia.
Sunt necesare echipamente de laborator normale și în special următoarele:
— aparatură de măsurare;
— dispozitiv de aerare;
— electrod de pH și aparatură adecvată pentru măsurarea pH-ului;
— electrod de oxigen.
1.6.3. Pregătirea inoculului
Se folosește nămol activ dintr-o instalație de tratare a apelor uzate preponderent menajere, ca inocul microbian pentru testare.
Dacă este necesar, la revenirea în laborator, particulele mari se pot înlătura prin sedimentare după o scurtă perioadă de timp, de exemplu 15 minute, iar stratul superior de materii solide fine poate fi decantat pentru utilizare. Alternativ, nămolul poate fi agitat folosind un amestecător timp de câteva secunde.
În plus, dacă se consideră că sunt prezente substanțe inhibitoare, nămolul trebuie spălat cu apă de la robinet sau cu o soluție izotonică. După centrifugare, se decantează supernatantul (acest procedeu se repetă de 3 ori).
O cantitate mică de nămol este cântărită și uscată. Pornind de la acest rezultat, se poate calcula cantitatea de nămol umed cu care se realizează suspensia apoasă așa încât să se obțină o soluție de nămol activ cu un conținut de materii solide în suspensie între 2 și 4 g/l. Acest nivel dă o concentrație între 0,8 și 1,6 g/l în mediul de testare dacă se urmează metoda recomandată mai jos.
Dacă nămolul nu poate fi folosit în ziua prelevării, se adaugă 50 ml apă uzată sintetică la fiecare litru de nămol activ pregătit conform descrierii de mai sus; acesta este apoi aerat peste noapte la 20 ± 2 oC. În continuare este păstrat în condiții de aerare în vederea utilizării în timpul zilei. Înainte de utilizare, se verifică și se ajustează pH-ul, dacă este necesar, la pH 6-8. Materiile solide în suspensie din soluția amestecată se determină după metoda descrisă în paragraful anterior.
Dacă este necesar ca același lot de nămol să fie folosit în zilele următoare (maximum patru zile), se adaugă 50 ml de apă uzată sintetică la 1 litru de nămol, la sfârșitul fiecărei zile de lucru.
1.6.4. Desfășurarea testului
|
Durată/timp de contact: |
30 de minute și/sau trei ore, cu aerare |
|
Apă: |
Apă potabilă (declorinată, dacă este necesar) |
|
Alimentare cu aer: |
Aer curat, fără uleiuri. Debit de aer de la 0,5 la 1 litru/minut |
|
Aparat de măsurare: |
Pahar de laborator cu fund plat, cum ar fi pahar de tip CBO (consum biochimic de oxigen) |
|
Oxigenometru: |
Electrod de oxigen adecvat, cu înregistrare |
|
Soluție nutritivă: |
Apă uzată sintetică (a se vedea mai sus) |
|
Substanță de testat: |
Soluția de testare se prepară imediat înainte de începerea testului |
|
Substanță de referință: |
de exemplu 3,5-diclorfenol (la cel puțin trei concentrații) |
|
Martori: |
Mostră inoculată fără substanță de testat |
|
Temperatură: |
20 ± 2 oC |
O metodă experimentală, care poate fi urmată atât pentru test cât și pentru substanța de referință, pe o perioadă de contact de trei ore, este prezentată mai jos:
Se folosesc câteva vase (de exemplu, pahare de laborator de 1 l).
Trebuie folosite cel puțin 5 concentrații într-o serie geometrică, cu un raport care este de preferat să nu depășească 3,2.
La momentul „0”, se aduc 16 ml apă de efluent sintetic care se completează până la 300 ml cu apă. Se adaugă 200 ml de inocul microbian, iar amestecul total (500 ml) se toarnă într-un prim vas (prima probă martor C1).
Vasele de testare trebuie aerate în permanență pentru ca O2 dizolvat să nu scadă sub 2,5 mg/litru și pentru ca, imediat înainte de măsurarea ratei respirației, concentrația de O2 să fie de aproximativ 6,5 mg/litru.
La momentul „15 minute” (15 minute este un interval arbitrar, dar convenabil) procedeul de mai sus se repetă, exceptând faptul că se adaugă 100 ml din soluția mamă de substanță de testat la 16 ml apă uzată sintetică înainte de a se adăuga apă până la 300 ml și inocul microbian, pentru a obține un volum de 500 ml. Acest amestec se toarnă apoi în al doilea vas și se aerează conform metodei de mai sus. Acest procedeu se repetă la intervale de 15 minute, cu adăugare de volume diferite de soluție mamă pentru a obține o serie de recipiente ce conțin concentrații diferite ale substanței de testat. În final, se pregătește un al doilea martor (C2).
După trei ore, se înregistrează pH-ul, iar la o probă bine amestecată din conținutul primului vas se măsoară rata respirației pe o perioadă de până la 10 minute.
Această determinare se repetă pentru conținutul fiecărui recipient la intervale de 15 minute, astfel încât timpul de contact în fiecare vas să fie de trei ore.
Substanța de referință se testează pe fiecare lot de inocul microbian în același mod.
Va fi necesar un regim diferit (de exemplu, mai mult de un oxigenometru) dacă măsurătorile trebuie să se facă după 30 minute de contact.
Dacă este necesară măsurarea consumului chimic de oxigen, se pregătesc alte recipiente ce conțin substanță de testat, efluent sintetic și apă, dar nu și nămol activ. Se măsoară consumul de oxigen și se înregistrează după un timp de aerare de 30 minute și/sau trei ore (timp de contact).
2. DATE ȘI EVALUARE
Rata respirației se calculează după înregistrările cuprinse între aproximativ 6,5 mg O2/l și 2,5 mg O2/l sau pe o perioadă de 10 minute, dacă viteza respirației este redusă. Porțiunea curbei de respirație pe care se măsoară ratei respirației trebuie să fie liniară.
Dacă ratele respirației la cele două probe martor diferă cu mai mult de 15 % sau CE50 a substanței de referință (la 30 minute și/sau trei ore) nu se găsește în intervalul acceptat (5-30 mg/l pentru 3,5-diclorfenol), testul este invalidat și trebuie repetat.
Procentul de inhibiție se calculează la fiecare concentrație de testare (a se vedea punctul 1.2). Procentul de inhibiție se reprezintă grafic în raport cu concentrația, pe hârtie lognormală (sau de logaritmică probit) și se obține valoarea CE50.
Limita de încredere de 95 % pentru valorile CE50 se poate determina folosindu-se metode standard.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— substanța de testat: datele de identificare chimică;
— sistemul de testare: sursa, concentrația și orice pretratare a nămolului activ;
— condiții de testare:
—— pH-ul amestecului de reacție înainte de măsurarea respirației;
— temperatura de testare;
— durata testului;
— substanța de referință și CE50 măsurat;
— absorbția abiotică de oxigen (după caz);
— rezultate:
—— toate datele măsurate;
— curba de inhibiție și metoda de calcul al CE50;
— CE50 și, dacă este posibil, la limita de încredere 95 %, CE20 și CE80;
— toate observațiile și abaterile de la această metodă care ar putea influența rezultatul.
3.2. INTERPRETAREA DATELOR
Valoarea CE50 trebuie considerată doar ca un indiciu al toxicității probabile a substanței de testat asupra nămolului activ utilizat la tratarea apei uzate sau asupra microorganismelor din apa uzată, deoarece interacțiunile complexe care au loc în mediu nu pot fi simulate precis în testul de laborator. De asemenea, substanțele de testat care pot avea un efect inhibitor asupra oxidării amoniacului pot produce și curbe de inhibiție atipice. De aceea, aceste curbe trebuie interpretate cu atenție.
4. REFERINȚE BIBLIOGRAFICE
1. International Standard ISO 8192-1986.
2. Broecker, B., Zahn, R., Water Research 11, 1977, p. 165.
3. Brown, D., Hitz, H.R., Schaefer, L., Chemosphere 10, 1981, p. 245.
4. ETAD (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, descrisă și de:
5. Robra, B., Wasser/Abwasser 117, 1976, p. 80.
6. Schefer, w., Textilveredlung 6, 1977, p. 247.
7. OECD, Paris, 1981, Test Guideline 209, Decision of the Council C (84) 30 final.
C.12. BIODEGRADARE
TESTUL SCAS MODIFICAT
1. METODĂ
1.1. INTRODUCERE
Scopul metodei este evaluarea biodegradabilității totale potențiale a substanțelor organice nevolatile și solubile în apă, când sunt expuse la concentrații relativ mari de microorganisme pe o perioadă lungă de timp. Viabilitatea microorganismelor se menține pe această perioadă prin aport zilnic de apă uzată decantată (pentru condițiile de sfârșit de săptămână, apa poate fi păstrată la 4 oC. Alternativ, se poate folosi apa uzată sintetică din testul de confirmare OCDE).
Poate avea loc adsorbția fizico-chimică pe materiile solide în suspensie, acest lucru trebuind luat în considerare la interpretarea rezultatelor (a se vedea punctul 3.2.).
Datorită perioadei de păstrare îndelungată a fazei apoase (36 de ore) și adăugării intermitente a substanțelor nutritive, testul nu simulează condițiile din mediul natural în stația de epurare a apei uzate. Rezultatele obținute cu diferite substanțe de testat arată că testul are un potențial mare de evaluare a biodegradabilității.
Condițiile prevăzute de test sunt extrem de favorabile selecției și/sau adaptării microorganismelor capabile să degradeze compusul de testare. (Procedura poate fi folosită și pentru a produce inoculi aclimatizați pentru utilizare în alte teste.)
În această metodă, măsurarea concentrației carbonului organic dizolvat se folosește pentru a evalua biodegradabilitatea totală a substanțelor de testat. Este preferabil să se determine COD după acidificare și purjare, nu ca diferență între Ctotal – Canorganic
Utilizarea simultană a metodei analitice specifice poate permite evaluarea biodegradării primare a substanței (dispariția structurii chimice inițiale).
Metoda se aplică numai pentru substanțele organice care, la concentrația folosită în test:
— sunt solubile în apă (cel puțin 20 mg carbon organic dizolvat/litru);
— au presiunea vaporilor neglijabilă;
— nu sunt inhibitoare pentru bacterii;
— nu se adsorb semnificativ în sistemul de testare;
— nu se pierd prin spumare din soluția testată.
Trebuie stabilit conținutul de carbon organic al compusului testat.
Informațiile despre proporțiile relative ale principalelor componente ale substanței de testat se utilizează la interpretarea rezultatelor obținute, în special în cazurile în care rezultatele indică valori scăzute sau marginale.
Informațiile despre toxicitatea substanței de testat asupra microorganismelor se folosesc pentru interpretarea rezultatelor cu valori scăzute și pentru alegerea unor concentrații adecvate de testare.
1.2. DEFINIȚII ȘI UNITĂȚI
|
CT |
= |
concentrația substanței de testat, exprimată în carbon organic prezent sau adăugat în apa uzată decantată la începutul perioadei de aerare (mg/l); |
|
Ct |
= |
concentrația de carbon organic dizolvat determinată în supernatantul soluției testate la sfârșitul perioadei de aerare (mg/l); |
|
Cc |
= |
concentrația de carbon organic dizolvat determinată în supernatantul soluției de control la sfârșitul perioadei de aerare (mg/l). |
Biodegradarea se definește în această metodă ca fiind dispariția carbonului organic. Biodegradarea poate fi exprimată ca:
1. Procentul de eliminare Dda al cantității de substanță adăugată zilnic:
|
|
[1] |
unde:
|
Dda |
= |
degradare/adaos zilnic. |
2. Procentul de eliminare Dssd a cantității de substanță prezente la începutul fiecărei zile:
|
|
[2(a)] |
|
|
[2(b)] |
unde
|
Dssd |
= |
degradare/substanță la începutul zilei; |
indicii i și (i + 1) se referă la ziua măsurării.
Se recomandă ecuația 2(a) dacă COD al efluentului variază de la zi la zi, în timp ce ecuația 2(b) se poate folosi când COD al efluentului rămâne relativ constant de la zi la zi.
1.3. SUBSTANȚE DE REFERINȚĂ
În unele cazuri, când se studiază o substanță nouă, pot fi utile substanțele de referință; cu toate acestea, nu se recomandă aici nicio substanță de referință specifică.
Datele despre mai mulți compuși evaluați în testele de comparație interlaboratoare (a se vedea apendicele 1) se prezintă în principal pentru a permite calibrarea periodică acestei metode și compararea rezultatelor dacă se folosește altă metodă.
1.4. PRINCIPIUL METODEI DE TESTARE
Nămolul activ din instalația de tratare a apei uzate se introduce într-o instalație de tratare cu nămol activ cu alimentare semicontinuă (SCAS). Se adaugă substanța de testat și apa uzată menajeră decantată, iar amestecul se aerează 23 de ore. Aerarea este apoi oprită, nămolul se lasă să se decanteze și se elimină supernatantul.
Nămolul care rămâne în vasul de aerare se amestecă apoi cu o parte din substanța de testat și de apă uzată, iar ciclul se repetă.
Biodegradarea se evaluează prin determinarea conținutului de carbon organic dizolvat în soluția de supernatant. Valoarea obținută se compară cu cea găsită pentru soluția dintr-un tub martor alimentat numai cu apă uzată decantată.
Dacă se folosește o metodă analitică specifică, se pot măsura schimbările din concentrația moleculei inițiale care se datorează biodegradării (biodegradabilitate primară).
1.5. CRITERII DE CALITATE
Nu s-a stabilit încă reproductibilitatea prezentei metode bazate pe eliminarea carbonului organic dizolvat. (Dacă se ia în considerare biodegradarea primară, se obțin date foarte exacte pentru substanțele care sunt foarte degradate).
Sensibilitatea acestei metode este determinată în mare parte de variabilitatea probei martor și într-o mai mică măsură de precizia determinării carbonului organic dizolvat și de nivelul substanței de testat în soluție la începutul fiecărui ciclu.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Pregătire
Se folosește un număr suficient de unități de aerare curate, alternativ cu unitatea originală de testare SCAS de 1,5 l și se montează tuburile de intrare a aerului (figura 1) pentru fiecare substanță testată și proba martor. Aerul comprimat care pătrunde în unitățile de testare, purificat printr-un filtru de vată hidrofilă, nu trebuie să conțină carbon organic și să fie deja saturat cu apă pentru a se reduce pierderile prin evaporare.
Se prelevează o probă de soluție mixtă ce conține 1-4 g materii solide în suspensie pe litru din stația de epurare a apei uzate cu nămol activ. Sunt necesari aproximativ 150 ml de soluție omogenă pentru fiecare instalație de aerare.
Soluțiile mamă se prepară cu apă distilată; în mod normal, concentrația necesară este de 400 mg/l exprimată în carbon organic, ceea ce dă o concentrație a substanței de testat de 20 mg/l carbon la începutul fiecărui ciclu de aerare, dacă nu se produce nicio biodegradare.
Sunt acceptabile concentrații mai mari dacă toxicitatea față de microorganisme permite acest lucru.
Se măsoară conținutul în carbon organic al soluțiilor mamă.
1.6.2. Condiții de testare
Testul trebuie realizat la 20-25 oC.
Se folosește o concentrație mare de microorganisme aerobe (1-4 g/l materii solide în suspensie), iar perioada de păstrare efectivă este de 36 ore. Carbonul organic din efluentul uzat este, în mod normal, oxidat puternic după 8 ore după începerea fiecărui ciclu de aerare. Apoi, nămolul respiră endogen în perioada rămasă de aerare, timp în care singurul substrat disponibil este substanța de testat, dacă aceasta nu se metabolizează ușor. Aceste caracteristici, combinate cu reinocularea zilnică a soluției de testat, dacă se folosește apă de uzată menajeră ca mediu, oferă condiții favorabile atât pentru aclimatizare, cât și pentru o biodegradare rapidă.
1.6.3. Desfășurarea testului
Se prelevează o probă de soluție omogenă din instalația de epurare a apei predominant menajere cu nămol activ sau dintr-o unitate de laborator și se păstrează în condiții aerobe până la folosirea în laborator. Fiecare unitate de aerare, precum și unitatea martor, se umple cu 150 ml de soluție omogenă (dacă se folosește unitatea de testare originală SCAS, volumele date se înmulțesc cu 10) și începe aerarea. După 23 de ore aerarea se oprește, iar nămolul se lasă să se decanteze timp de 45 de minute. Se deschide pe rând robinetul fiecărui recipient și se extrag 100 ml din supernatant. Se prelevează o probă de apă uzată menajeră decantată, imediat înainte de utilizare, și se adaugă 100 ml la nămolul rămas în fiecare unitate de aerare. Aerarea se pornește din nou. În această fază nu se adaugă nicio substanță de testat, iar unitățile se alimentează zilnic cu apă uzată menajeră până când la decantare se obține un supernatant limpede. De obicei, aceasta poate să dureze 2 săptămâni, timp în care carbonul organic dizolvat în supernatant, la sfârșitul fiecărui ciclu de aerare, se apropie de o valoare constantă.
La sfârșitul acestei perioade, nămolurile decantate individual se amestecă și se adaugă în fiecare unitate câte 50 ml din nămolul compozit rezultat.
În unitățile martor se adaugă 95 ml apă uzată decantată și 5 ml de apă, iar în unitățile de testare se adaugă 95 ml de apă uzată decantată și 5 ml de soluție mamă a substanței de testat corespunzătoare (400 mg/l). Aerarea începe din nou și continuă 23 de ore. Nămolul se lasă să se decanteze 45 minute, se scoate supernatantul și se analizează conținutul de carbon organic dizolvat.
Procedeul de mai sus, de umplere și scoatere, se repetă zilnic, pe toată perioada testului.
Înainte de decantare, poate fi necesară curățarea pereților unităților pentru a preveni acumularea de materii solide peste nivelul lichidului. Se folosește o racletă sau o perie pentru fiecare unitate, pentru a preveni contaminarea.
Ideal este să se determine zilnic conținutul de carbon organic dizolvat în supernatant. Înainte de analiză, soluțiile se filtrează prin filtre cu membrană de 0,45 μm, se spală sau se centrifughează. Filtrele cu membrană sunt acceptabile dacă se asigură că nu are loc nici eliminare de carbon, nici absorbție de substanță în faza de filtrare. Temperatura probei nu trebuie să depășească 40 oC când aceasta este în centrifugă.
Durata testului pentru substanțele care prezintă biodegradare scăzută sau nulă este nedeterminată, dar experiența arată că aceasta trebuie să fie de cel puțin 12 săptămâni, în general, dar nu mai mult de 26 săptămâni.
2. DATE ȘI EVALUARE
Valorile masei de carbon organic dizolvat în soluțiile de supernatant din unitățile de testare și din unitățile martor sunt reprezentate grafic în funcție de timp.
Pe măsură ce se realizează biodegradarea, nivelul constatat la testare se apropie de cel din proba martor. Când se constată că diferența dintre cele două niveluri este constantă la trei măsurări consecutive, se efectuează un număr suficient de măsurări suplimentare, pentru a permite interpretarea statistică a datelor și calcularea procentului de biodegradare al substanței de testat (Dda sau Dssd, a se vedea punctul 1.2).
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină, dacă este posibil, următoarele informații:
— toate informațiile despre tipul de apă uzată, tipul de unități folosite și rezultatele experimentale privind substanța de testat, substanța de referință (dacă s-a folosit) și proba martor;
— temperatura;
— curba de eliminare cu descriere și mod de calcul (a se vedea punctul 1.2);
— data și locul unde au fost prelevate probele de nămol activ și apă uzată, starea adaptării, concentrația etc.;
— argumentele științifice pentru eventualele modificări ale metodei de testare;
— semnătura și data.
3.2. INTERPRETAREA REZULTATELOR
Deoarece substanța care urmează să fie testată prin această metodă nu este ușor biodegradabilă, orice eliminare a COD datorată numai biodegradării este în mod normal treptată, în zile sau săptămâni, cu excepția cazurilor în care aclimatizarea este bruscă, așa cum indică dispariția bruscă care se petrece după câteva săptămâni.
Cu toate acestea, adsorbția fizico-chimică poate juca uneori un rol important; acesta se manifestă prin eliminarea completă sau parțială a COD-ului adăugat de la început. Ceea ce se întâmplă ulterior depinde de factori cum ar fi gradul de absorbție și concentrația materiilor solide în suspensie în efluentul eliminat. De obicei, diferența dintre concentrația COD în soluția martor și în supernatantul de testare crește treptat de la valoarea inițială redusă, această diferență rămânând apoi la noua valoare în restul experimentului, dacă nu are loc aclimatizarea.
Dacă trebuie să se facă o distincție între biodegradare (sau biodegradare parțială) și adsorbție, sunt necesare teste ulterioare. În acest scop există mai multe metode, cea mai convingătoare fiind utilizarea supernatantului sau a nămolului ca inocul într-un test din setul de bază (de preferință un test respirometric).
Substanțele de testat care dau valori mari de eliminare de COD neadsorbit în acest test trebuie considerate ca posibil biodegradabile. Eliminarea parțială neadsorbtivă arată că substanța chimică este supusă cel puțin unei degradări parțiale.
Eliminările reduse sau nule ale COD se pot datora inhibării microorganismelor de către substanța de testat și acest lucru poate fi dovedit prin liză și pierderea nămolului, rezultând supernatanți tulburi. Testul trebuie repetat folosindu-se o concentrație mai scăzută de substanță testată.
Utilizarea unei metode analitice specifice sau a unei substanțe de testat marcate cu 14C permite o sensibilitate mai mare. În cazul substanței de testat cu 14C, recuperarea 14CO2 va confirma că biodegradarea s-a produs.
În cazul în care rezultatele sunt exprimate în termeni de biodegradare primară, este necesar să se dea, în măsura în care este posibil, explicații cu privire la modificarea structurii chimice care duce la pierderea răspunsului substanței de testat inițiale.
Validarea metodei analitice trebuie însoțită de rezultatul obținut în mediului testului martor.
4. REFERINȚE BIBLIOGRAFICE
1. OCDE, Paris, 1981, Linii directoare privind testele 302 A, Decizia Consiliului C(81) 30 final.
Apendicele 1
Test SCAS: Exemple de rezultate
|
Substanță |
CT (mg/l) |
Ct – Cc (mg/l) |
Procent de biodegradare Dda |
Durata testului (zile) |
|
4-acetil aminobenzen sulfonat |
17,2 |
2,0 |
85 |
40 |
|
Tetra-propilen benzen sulfonat |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenol |
16,9 |
0,8 |
95,3 |
40 |
|
Dietilen glicol |
16,5 |
0,2 |
98,8 |
40 |
|
Anilină |
16,9 |
1,7 |
95,9 |
40 |
|
Ciclopentan tetra carboxilat |
16,9 |
3,2 |
81,1 |
120 |
Apendicele 2
Exemplu de aparatură de testare

C.13. BIOCONCENTRAREA: EXPERIENȚA CU REÎNNOIRE CONTINUĂ ASUPRA PEȘTILOR
1. METODĂ
Prezenta metodă de bioconcentrare reproduce Orientarea 305 (1996) a OCDE.
1.1. INTRODUCERE
Prezenta metodă descrie o procedură de caracterizare a potențialului de bioconcentrare, în cazul peștilor supuși la o reînnoire continuă a anumitor substanțe. Regimurile experimentale cu reînnoire continuă sunt de departe preferate, dar și cele semistatice sunt acceptate, în măsura în care sunt îndeplinite criteriile de validitate.
Metoda oferă toate informațiile necesare executării experimentului, însă lasă libertatea indispensabilă de adaptare a conceptului experimental, la condițiile specifice fiecărui laborator și nu impune în mod strict, caracteristicile substanțelor testate. În special, sunt indicate produsele organice stabile, pentru care valorile log Pow sunt cuprinse între 1,5 și 6,0 (1), însă metoda este aplicabilă și substanțelor superlipofile (log Pow > 6,0). Pentru acestea din urmă, estimarea prealabilă a factorului de bioconcentrare (BCF), denumit uneori KB, va fi probabil superioară valorii factorului de bioconcentrare în starea staționară (BCFSS), la care ne putem aștepta în cazul unei experiențe de laborator. Evaluările preliminare ale factorului de bioconcentrare, pentru produsele organice ale căror valori log Pow ajung până la aproximativ 9,0 pot fi calculate cu ajutorul ecuației Bintein et al (2). Potențialul de bioconcentrare se caracterizează pentru anumiți parametri, cum ar fi: constanta de viteză de absorbție (k1), constanta de viteză de eliminare (k2) și BCFSS.
Substanțele experimentale marcate radioactiv pot facilita analiza eșantioanelor de apă și de pești; de asemenea, pot servi la definirea degradării, dacă este necesar să o identificăm și să o cuantificăm. Dacă se măsoară totalul de reziduu radioactiv (de exemplu, prin combustia ori solubilizarea țesuturilor), BCF se bazează pe compusul de origine, toți metaboliții reținuți și carbonul asimilat. Factorii BCF care se bazează pe reziduurile radioactive totale nu pot fi, așadar, comparați direct cu un factor BCF derivat dintr-o analiză chimică particulară exclusiv a compusului de origine.
Pot fi utilizate proceduri de epurare, în cadrul studiilor cu markeri radioactivi, pentru determinarea BCF pe baza compusului original, iar principalii metaboliți vor fi determinați dacă se consideră necesar. De asemenea, există posibilitatea combinării unui studiu de metabolism al peștilor, cu un studiu de bioconcentrare, prin analiza și identificarea reziduurilor tisulare.
1.2. DEFINIȚII ȘI UNITĂȚI
Bioconcentrare/Bioacumulare: creșterea concentrației substanței testate la un sau într-un organism (țesuturile specifice ale acestuia) în raport cu concentrația acestei substanțe în mediul ambiant.
Factor de bioconcentrare (BCF sau KB): în orice moment din faza de absorbție a experienței de acumulare, concentrația substanței testate la/în pești, sau pe țesuturi determinate ale acestora, [Cf în μg/g (ppm)] raportată la concentrația substanței chimice din mediul ambiant [CW în μg/ml (ppm)].
Factor de bioconcentrare în stare staționară (BCFss sau KB): nu se modifică prea mult într-o perioadă mare de timp, concentrația substanței experimentale din mediul ambiant fiind constantă pentru aceeași perioadă de timp.
Platoul sau starea staționară: în reprezentarea grafică a substanței experimentale la pești (Cf), în funcție de timp, este de așteptat pentru curbă să devieze paralel față de axa timpului, iar pentru trei analize succesive ale Cf – realizate asupra unor eșantioane prelevate la intervale de cel puțin două zile – să rămână într-o plajă de 20 % una față de alta; nu există diferențe semnificative între cele trei perioade de eșantionare. Când se analizează eșantioane reunite, se efectuează minimum patru analize succesive. Dacă substanțele experimentale au caracteristici de absorbție lente, este preferabil să se opteze pentru intervale săptămânale.
Factori de bioconcentrare: se calculează direct, plecând de la constantele cinetice (k1/k2); se numesc factori de concentrare cinetică BCFk.
Coeficient de partiție octanol-apă (Pow): raportul de solubilitate a unui produs chimic în n-octanol și în apă, la echilibru (Metoda A.8), de asemenea desemnat prin Kow. Logaritmul lui Pow indică potențialul de bioconcentrare al unui produs chimic în organismele acvatice.
Faza de expunere sau de absorbție: timpul în care peștii sunt expuși la produsul chimic testat.
Constanta de viteză de absorbție (k1): valoare numerică ce definește viteza de creștere a concentrației substanței testate la/în pești (sau în țesuturile specifice ale acestora), atunci când sunt expuși la acea substanță chimică (k1 este exprimată în zile–1).
Faza de post-expunere sau de eliminare (pierdere): ca urmare a transferării peștilor dintr-un mediu care conține substanța testată, într-un mediu care nu conține acea substanță, timp în care eliminarea (sau pierderea netă) de substanță de către pești (sau de către țesuturile specifice) este studiată.
Constanta de viteză de eliminare (pierdere) (k2): valoare numerică ce definește viteza de scădere a concentrației substanței testate la/în pești (sau în țesuturile specifice ale acestora), ca urmare a transferării lor dintr-un mediu care conține substanța testată, într-un mediu care nu conține acea substanță (k2 este exprimată în zile–1).
1.3. PRINCIPIUL METODEI DE TESTARE
Experimentul se împarte în două faze: faza de expunere (absorbție) și de post-expunere (eliminare). În cursul fazei de absorbție, grupele separate de pești dintr-o specie sunt supuse la cel puțin două concentrații ale substanței totale. Apoi, aceștia sunt transferați într-un mediu care nu conține respectiva substanță, pentru faza de eliminare. Aceasta din urmă este întotdeauna necesară, în afară de cazul în care absorbția substanței în timpul fazei de absorbție a fost nesemnificativă (de exemplu, dacă BCF este mai mic de 10). Concentrația substanței testate la/în pești (sau în țesuturile specificate ale acestora) este urmărită de-a lungul celor două faze ale experimentului. În afară de cele două concentrații experimentale, un grup martor de pești este menținut în condiții identice, cu excepția substanței testate, care este absentă. Acest lucru este necesar pentru stabilirea eventualelor relații între efectele nefaste observate la testul de bioconcentrare și acest grup martor, precum și pentru deducerea concentrației de bază a substanței testate.
Faza de absorbție durează 28 de zile, în cazul în care nu se demonstrează mai devreme că a fost atins echilibrul. Se poate estima durata fazei de absorbție și timpul necesar pentru obținerea stării staționare, cu ajutorul ecuațiilor din apendicele 3. Perioada de epurare începe așadar, cu transferarea peștilor în alt recipient curat, conținând același mediu, cu excepția substanței testate. Atunci când devine posibil, se calculează factorul de bioconcentrare, de preferință sub formă de raport (BCFss) de concentrație de pești (Cf) și în apă (Cw), în starea de echilibru aparent și în calitate de factor de bioconcentrare cinetică; și BCFk ca raport al constantelor de viteză de absorbție (k1) și de epurare (k2), considerând o cinetică de ordinul întâi. Dacă se constată că nu a urmat o cinetică de ordinul întâi, trebuie utilizate modele mai complexe (apendicele 5).
Dacă nu se obține o stare staționară în 28 de zile, faza de absorbție se va prelungi până la obținerea acesteia sau timp de 60 de zile, preferându-se alternativa cea mai scurtă; apoi începe faza de eliminare.
Constanta de viteză de absorbție, constanta de viteză de epurare (pierdere) (sau constantele, atunci când este vorba de modele complexe), factorul de bioconcentrare și, dacă este posibil, limitele de încredere pentru fiecare dintre acești parametri, sunt calculate pornind de la modelul care descrie cel mai fidel măsurătorile de concentrație a substanței testate, în pești și în apă.
Factorul BCF se exprimă în funcție de greutatea totală umedă de pește. Totuși, pentru anumite studii, pot fi utilizate țesuturi sau organe specifice (de exemplu, mușchi, ficat), dacă peștii sunt suficient de mari sau dacă pot fi separați în părți comestibile (fileuri) și necomestibile (viscere). Existând o relație clară care leagă potențialul de bioconcentrare și lipofilia pentru numeroase substanțe organice, va exista și o relație corespunzătoare între conținutul lipidic la peștii pentru experiență și bioconcentrațiile observate pentru aceste substanțe. Așadar, pentru a elimina această variabilă din rezultatele experiențelor cu substanțe foarte lipofile (adică având log Pow > 3), bioconcentrarea trebuie exprimată în funcție de masa corporală totală și de conținutul lipidic.
Dacă este posibil, conținutul lipidic se va stabili folosind același material biologic care a servit la determinarea concentrației substanței testate.
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Înainte de a executa experiența de bioconcentrare, următoarele informații trebuie cunoscute despre substanța testată:
— solubilitatea în apă;
— coeficientul de partiție octanol-apă Pow (de asemenea, Kow, determinat printr-o metodă HPLC în A.8);
— hidroliza;
— fototransformarea în apă, la radiația solară sau solară artificială simulată și în condițiile de radiații ale experienței de bioconcentrare (3);
— tensiunea superficială (adică pentru substanțele la care log Pow nu a putut fi măsurat);
— presiunea de vapori;
— biodegradabilitatea numită „facilă” (dacă este cazul).
De asemenea, trebuie cunoscută toxicitatea relativă pentru specia de pești utilizată pentru experiență, de preferință CL50 asimptotică (adică, independentă de timp). Este indispensabil să se utilizeze o metodă analitică potrivită, cu exactitatea, precizia și sensibilitatea, cunoscute, pentru a cuantifica substanța testată în soluția experimentală și în materialul biologic, precum și informații precise legate de prepararea și păstrarea eșantioanelor. De asemenea, trebuie să fie cunoscută limita de detecție analitică a substanței testate, atât în apă cât și în țesuturile peștilor. Dacă se utilizează o substanță pentru testat marcată cu 14C, trebuie cunoscut procentajul de radioactivitate asociat impurităților.
1.5. VALIDITATEA TESTULUI
Pentru ca un test să fie valabil, trebuie îndeplinite următoarele condiții:
— variația de temperatură să fie mai mică de ± 2 oC;
— concentrația oxigenului dizolvat să nu coboare sub 60 % din nivelul de saturație;
— concentrația substanței testate în vase să fie menținută la ± 20 % din media valorilor măsurate în timpul fazei de absorbție;
— mortalitatea și alte efecte sau maladii indezirabile, înregistrate la peștii martor sau la cei supuși experimentului, să fie mai mici de 10 %, la sfârșitul experimentului; atunci când experimentul se prelungește pe mai multe săptămâni sau luni, mortalitatea sau alte efecte indezirabile, apărute la cele două grupe de pești, trebuie să fie mai mici de 5 % pe lună și să nu depășească 30 % în total.
1.6. COMPUȘI DE REFERINȚĂ
Utilizarea compușilor de referință, având un potențial de bioconcentrare cunoscut, ar putea sprijini controlul asupra procedurii experimentale, dacă este necesar. Totuși, nu se pot încă recomanda substanțe specifice.
1.7. DESCRIEREA METODEI DE TESTARE
1.7.1. Aparatură
Se vor evita materialele care pot prezenta un efect indezirabil de absorbție, de dizolvare sau de lesivaj asupra peștilor, și aceasta pentru toate echipamentele folosite. Se vor utiliza bazine standard rectangulare sau cilindrice, din materiale inerte chimic, de capacitate adaptată regimului de umplere. Se va reduce la minimum folosirea de țevi din plastic flexibil. Este preferabilă tubulatura din teflon (®), oțel inoxidabil și/sau sticlă. Experiențele au dovedit că, pentru substanțele cu coeficienți mari de absorbție, cum ar fi piretrinele de sinteză, poate fi necesară sticla silanizată. În acest caz, echipamentul se va arunca după utilizare.
1.7.2. Apa
În general, se utilizează apă naturală, provenită dintr-o sursă nepoluată și de calitate uniformă. Calitatea apei utilizate pentru diluție trebuie să permită supraviețuirea speciei de pești aleasă, în perioada de aclimatare și în cursul experimentului, fără apariția vreunui comportament anormal. În cazul ideal, ar trebui demonstrat că speciile supuse experimentului, pot supraviețui, crește și reproduce în apa de diluție (de exemplu, prin creștere în laborator sau printr-un studiu de toxicitate asupra unui ciclu biologic). Apa va fi caracterizată cel puțin prin pH, duritate, materii solide totale, carbon organic total și, de preferință, prin conținutul de substanțe amoniacale, nitrați și alcalinitate; pentru speciile marine, apa va fi caracterizată și prin salinitate. Se cunosc perfect principalii parametri optimi pentru pești, iar apendicele 1 indică concentrațiile maxime recomandate unui anumit număr de parametri, privind apa folosită la experiment, dulce și marină.
Pe toată perioada testării, apa trebuie să fie de calitate constantă. pH-ul se aduce la valori cuprinse între 6,0 și 8,5, însă pentru un experiment dat, pH-ul trebuie să rămână în interiorul unei plaje de ± 0,5 unități de pH. Pentru a avea siguranța că apa de diluție nu influențează rezultatele studiului (de exemplu, prin complexarea substanței testate) sau că nu afectează negativ performanțele stocului de pești, se vor preleva în mod regulat, eșantioane pentru analiză. De exemplu, este convenabil de făcut aceasta o dată la trei luni, interval în care o apă de diluție își păstrează calitățile, relativ constante; se determină metalele grele (de exemplu: Cu, Pb, Zn, Hg, Cd, Ni), anionii și cationii principali (de exemplu: Ca, Mg, Na, K, Cl, SO4), pesticidele (de exemplu: cele organofosforice totale și cele organoclorurate totale), carbonul organic total și solidele aflate în suspensie. Dacă se demonstrează constanța calităților apei, pe parcursul a cel puțin un an, aceste analize se pot rări, iar intervalele dintre ele pot fi distanțate (de exemplu, la șase luni).
Conținutul în particule naturale, precum și în carbon organic total (TOC) din apa de diluție, vor fi cât mai mici posibil, pentru a evita absorbția substanței testate în materiile organice, ceea ce i-ar putea reduce biodisponibilitatea (4). Valoarea maximă admisă este de 5 mg/l, pentru particulele de materie (materia uscată nu trece printr-un filtru de 0,45 μm) și de 2 mg/l, pentru carbonul organic total (a se vedea apendicele 1). Dacă este necesar, apa se va filtra înainte de utilizare. De asemenea, contribuțiile peștilor testați (excreții), a reziduurilor alimentare, ca și conținutul apei în carbon organic total – trebuie să fie cât mai mici posibil. De-a lungul întregului experiment, concentrația în carbon organic din recipient, nu trebuie să depășească cu mai mult de 10 mg/l (± 20 %), concentrația de carbon organic provenit din substanța testată și, eventual, pe cea a agentului de dizolvare.
1.7.3. Soluții de testat
Se prepară o soluție stoc de substanță de testat, la concentrația dorită. De preferință, soluția stoc va fi preparată prin simpla amestecare ori agitare a substanței testate, în apa de diluție. Nu este recomandată utilizarea solvenților sau a dispersanților (agenți de dizolvare); se poate totuși recurge la aceștia, în anumite situații, pentru producerea soluției stoc, la concentrația necesară. Solvenții susceptibili a fi utilizați sunt: etanol, metanol, eterul monometilic de etilen glicol, eterul dimetilic de etilen glicol, dimetilformamida și trietilen glicolul. Dispersanții utilizabili sunt: Cremophor RH40, Tween 80, metilceluloză 0,01 % și HCO-40. Se vor lua măsuri de precauție în cazul utilizării agenților ușor biodegradabili, aceștia putând provoca probleme de creștere bacteriană în testele cu reînnoire continuă. Substanța testată poate fi marcată radioactiv și trebuie să aibă cea mai mare puritate posibilă (de exemplu, de preferință, > 98 %).
Pentru experimentele cu reînnoire continuă, se va utiliza aparatură care să aducă și să dilueze în permanență, soluția stoc de substanță testată (cum ar fi: pompe dozatoare, diluator proporțional, sistem saturator), pentru a aduce concentrațiilor experimentale până la recipiente. Trebuie prevăzute minimum cinci volume de înlocuitor pe zi, pentru fiecare incintă experimentală. Se optează pentru metoda cu reînnoire continuă, însă dacă aplicarea acesteia devine imposibilă (de exemplu, organismele din cadrul experimentului suferă efecte nefaste), se poate recurge la o tehnică semistatică, în cazul în care criteriile de validare rămân satisfăcătoare. Debitul soluțiilor stoc și al apei de diluție va fi controlat cu 48 de ore înainte de experiment, iar în cursul derulării acestuia, cel puțin zilnic. Controlul comportă determinarea debitului în fiecare incintă experimentală, având grijă ca acesta să nu difere cu mai mult de 20 %, pentru fiecare dintre ele.
1.7.4. Alegerea speciilor
Printre criteriile importante de alegere a speciilor, figurează cel al facilității de procurare, dimensiunea și posibilitatea întreținerii ușoare în laborator. De asemenea, speciile de pești se aleg în funcție de importanța lor în materie de distracții, comerț sau ecologie. Speciile de pești trebuie să fie de sensibilitate comparabilă, care au produs rezultate bune anterior etc.
În apendicele 2 se află o listă de specii recomandate pentru experiențe. Pot fi utilizate și alte specii, însă atunci procedura experimentală ar putea avea nevoie de adaptări, pentru a se determina condiții de testare adecvate. Într-un asemenea caz, se expun motivațiile alegerii speciilor și a metodei de testare folosite.
1.7.5. Păstrarea peștilor
Populația de pești trebuie aclimatizată timp de cel puțin două săptămâni, în apă aflată la temperatura experimentală, oferindu-li-se hrană suficientă și de același tip cu cea folosită în cursul experimentului.
După o perioadă de instalare de 48 de ore, se înregistrează rata mortalității, aplicându-se următoarele criterii:
— mortalitate mai mare de 10 % din populație, în șapte zile: se renunță la întregul lot;
— mortalitate cuprinsă între 5 și 10 % din populație, în șapte zile: se prelungește perioada de aclimatare cu șapte zile;
— mortalitate mai mică de 5 % din populație, în șapte zile: se acceptă lotul – dacă mortalitatea depășește 5 % în următoarele șapte zile, se renunță la întregul lot.
Peștii utilizați pentru experimente nu trebuie să prezinte maladii și nici anomalii observabile. Se elimină toți peștii bolnavi. Peștii nu vor fi tratați contra niciunei maladii, două săptămâni înaintea experimentului și nici în cursul acestuia.
1.8. DESFĂȘURAREA TESTULUI
1.8.1. Testul preliminar
Se poate dovedi utilă o experimentare preliminară, pentru optimizarea condițiilor de execuție ale experimentului real, în ceea ce privește, de exemplu, selecția concentrațiilor substanței testate, duratele fazelor de absorbție și de eliminare.
1.8.2. Condiții de expunere
1.8.2.1.
Se poate estima durata fazei de absorbție, cu ajutorul unei experiențe preliminare (de exemplu, plecând de la un studiu anterior sau de la un produs chimic cu proprietăți de acumulare) sau pornind de la anumite relații empirice, bazate pe ceea ce se cunoaște despre solubilitatea în apă ori folosind coeficientul de partiție octanol/apă, al substanței testate (a se vedea apendicele 3).
Faza de absorbție va dura 28 de zile, exceptând cazul în care se poate demonstra că a fost atins un echilibru mai devreme. Dacă nu se ajunge la o stare staționară în decurs de 28 de zile, faza de echilibru se va prelungi și se vor face alte măsurători, până la obținerea stării staționare sau timp de 60 de zile (are întâietate alternativa cea mai scurtă).
1.8.2.2.
În general, jumătate din durata fazei de absorbție este suficient pentru a se produce o reducere convenabilă (de exemplu, 95 %) a conținutului corporal în substanță testată (a se vedea explicațiile privind estimarea, în apendicele 3). Dacă timpul necesar pentru realizarea unei pierderi de 95 % este prea lung, depășind, de exemplu, de două ori durata fazei de absorbție (adică mai mare de 56 de zile), se poate opta pentru o perioadă mai scurtă (respectiv, până ce concentrația substanței testate devine mai mică cu 10 % din concentrația stării staționare). Totuși, pentru substanțele având scheme de absorbție și eliminare mai complexe decât modelul peștilor în compartiment unic, după o cinetică de ordinul întâi, se utilizează faze de epurare mai lungi, pentru determinarea constantelor de viteză de eliminare. Această perioadă de timp poate fi totuși controlată prin intermediul perioadei în care concentrația substanței testate din pești se situează deasupra limitei de detecție analitice.
1.8.2.3.
Alegerea numărului de pești pentru concentrația experimentală, se face astfel încât să fie disponibili cel puțin patru pești per eșantion, la fiecare eșantionare. Dacă se dorește o statistică mai performantă, numărul peștilor per eșantion va fi mărit.
Dacă se folosesc pești adulți, se va indica dacă sunt masculi sau femele ori dacă ambele sexe servesc experimentului. În această ultimă situație, înainte de a începe expunerea, trebuie verificat ca diferențele de conținut lipidic să nu fie semnificative; s-ar putea dovedi necesară utilizarea de loturi distincte de masculi și femele.
Toate experiențele se fac utilizând pești de greutate asemănătoare, în sensul că cei mai mici nu vor avea o greutate mai mică decât 2/3 din cea a peștilor celor mai mari. Toți vor aparține aceleiași clase de vârstă și vor proveni din aceeași sursă. Greutatea și vârsta unui pește, având aparent efecte notabile asupra valorilor BCF (1), aceste informații vor fi înregistrate cu precizie. Este indicat ca un sub-eșantion din populația de pești să fie cântărit înainte de experiment, pentru estimarea greutății medii.
1.8.2.4.
Raporturile apă/pești se măresc, în scopul de a minimiza scăderea CW datorită adăugării peștilor, la începutul experimentului, dar și pentru a evita diminuarea concentrației în oxigen dizolvat. Este important ca regimul de încărcare să fie adaptat speciei utilizate pentru experiment. Un regim de încărcare de 0,1-1,0 g de pește (produs viu) la litru de apă și pe zi, este cel recomandat pentru toate cazurile experimentale. Se pot realiza încărcări mai rapide, dacă se demonstrează că se poate ajusta concentrația necesară de substanță testată, în limitele de ± 20 % și că, de asemenea, concentrația oxigenului dizolvat, nu coboară sub 60 % din nivelul de saturare.
La alegerea regimului de încărcare, se va ține cont de habitatul normal al speciei. De exemplu, peștii bentonici pot necesita un acvariu cu suprafața fundului mai mare, spre deosebire de speciile pelagice, la același volum de apă.
1.8.2.5.
Pe parcursul perioadelor de alimentare și experimentale, peștii vor fi hrăniți după un regim adecvat, cu un conținut cunoscut în lipide și proteine totale, în cantitate suficientă menținerii peștilor în stare bună de sănătate, astfel încât greutatea lor corporală să se conserve. Peștii vor fi alimentați zilnic, în perioadele de aclimatare și în cele experimentale, cu rații de aproximativ 1-2 % din greutatea lor corporală. Astfel, pentru cea mai mare parte dintre specii, se menține concentrația lipidică la un nivel relativ constant, de-a lungul experimentului. Cantitatea de hrană trebuie recalculată o dată pe săptămână, de exemplu, pentru menținerea greutății corporale și a conținutului lipidic la un nivel consistent. Pentru acest calcul, greutatea peștilor din fiecare incintă experimentală se va estima pornind de la greutatea peștilor eșantionați cel mai recent, din respectiva incintă. Nu se cântăresc peștii rămași în incintă.
Hrana neconsumată și excrementele vor fi evacuate zilnic, prin sifonarea incintelor experimentale, la puțin timp după alimentare (30 minute-1 oră). Incintele vor fi menținute cât mai curate posibil, în cursul întregului experiment, astfel încât concentrația de materie organică să fie cât mai mică, deoarece prezența carbonului organic poate limita biodisponibilitatea substanței testate (1).
Numeroase alimente fiind derivate din făină de pește, acestea vor fi analizate pentru determinarea conținutului în substanță testată. De asemenea, trebuie analizat conținutul hranei în pesticide și metale grele.
1.8.2.6.
În general, fotoperioada este de 12-16 ore, la temperatura (± 2 oC) corespunzătoare speciei utilizate (a se vedea apendicele 2). Tipul și caracteristicile iluminării vor fi clar definite. Se va ține seama de eventualele fototransformări ale substanței testate, în condițiile de iradiere ale studiului. Iluminarea nu trebuie să expună peștii la fotoproduse nenaturale. În anumite cazuri, poate fi esențială utilizarea de filtre, pentru blocarea radiației UV mai mică de 290 nm.
1.8.2.7.
Peștii sunt expuși la o reînnoire continuă de cel puțin două concentrații apoase ale substanței testate. În mod normal, concentrația mare (sau cea mai mare) a substanței testate, este stabilită la aproximativ 1 % din CL50 acută asimptotică și de cel puțin 10 ori mai mare decât limita sa de detecție în apă, prin metoda de analiză aleasă.
Cea mai mare concentrație testată poate fi stabilită și împărțind CL50 la 96 ore, printr-un raport procentual adecvat acut/cronic (rapoartele procentuale adecvate ale anumitor produși chimici pot varia de la 3 la 100). Dacă este posibil, se alege altă concentrație (alte concentrații), astfel încât diferența față de cea căreia îi este superioară, să atingă un factor zece. Dacă este imposibil, din cauza criteriului de 1 % al CL50 și a limitei analitice, poate fi utilizat un factor inferior celui de zece sau se poate accepta intervenția unei substanțe marcate radioactiv cu 14C. Niciuna dintre concentrațiile utilizate nu va depăși solubilitatea substanței testate.
Atunci când se utilizează un agent de dizolvare, concentrația acestuia nu va depăși 0,1 ml/l și trebuie să fie aceeași, în toate recipientele pentru experiment. Contribuția sa, adăugată celei a substanței testate, la conținutul global de carbon organic din apa pentru experiment, trebuie să fie cunoscute. Totuși, se va face tot posibilul să nu se recurgă la astfel de materiale.
1.8.2.8.
Apă de diluție martor sau, dacă este necesar, un martor conținând agentul de dizolvare va fi disponibil pentru seria de teste, în măsura în care a fost stabilit că agentul nu are niciun efect asupra peștilor. În caz contrar, se vor folosi doi martori.
1.8.3. Frecvența de măsurare a calității apei
În cursul experimentului, oxigenul dizolvat, COT, pH-ul și temperatura vor fi măsurate în toate recipientele. Duritatea totală și eventual, salinitatea, vor fi măsurate pe martori și la un recipient cu conținutul având concentrația mare (cea mai mare). Oxigenul dizolvat și eventual, salinitatea vor fi măsurate de cel puțin trei ori – la începutul, mijlocul și sfârșitul perioadei de absorbție – și cel puțin o dată pe săptămână, în perioada de eliminare. TOC se va măsura la începutul experimentului (24 și 48 ore înainte de demararea fazei de absorbție), înainte de adăugarea peștilor și cel puțin o dată pe săptămână, în perioadele de absorbție și de eliminare. Temperatura se va măsura zilnic, pH-ul – la începutul și la sfârșitul fiecărei perioade – iar duritatea, o dată pentru fiecare experiment. De preferință, temperatura va fi supravegheată continuu, cel puțin într-unul dintre recipiente.
1.8.4. Eșantionarea și analiza peștilor și a apei
1.8.4.1.
Se va preleva apă din incintele experimentale, pentru determinarea concentrației substanței testate, înainte de adăugarea peștilor și în cursul fazelor de absorbție și de epurare. Ca un minim, apa va fi prelevată în același timp cu prelevarea peștilor și înainte de hrănirea lor. În timpul fazei de absorbție, concentrațiile de substanță testată se determină pentru a verifica dacă ele satisfac criteriile de validitate.
În cursul fazei de absorbție, peștii sunt eșantionați de cel puțin cinci ori, iar în timpul fazei de epurare, de cel puțin patru ori. Uneori este dificil de calculat o valoare estimativă rezonabil de precisă pentru BCF, pe baza acestui număr de eșantioane, în special atunci când nu urmează o cinetică simplă de epurare, de ordinul întâi. În acest caz, se pot realiza eșantionările mai frecvent, pentru cele două perioade (a se vedea apendicele 4). Eșantioanele suplimentare sunt stocate și analizate numai dacă rezultatele primei serii de analize se dovedesc insuficiente pentru calculul BCF cu precizia dorită.
În apendicele 4 se găsește un exemplu de calendar acceptabil de eșantionare. Altele pot fi determinate cu ușurință, pe baza valorilor presupuse ale Pow, pentru a calcula timpul de expunere, corespunzător unei absorbții de 95 %.
Se continuă eșantionarea în cursul fazei de absorbție, până la obținerea unei stări staționare sau timp de 28 de zile, optându-se pentru varianta cea mai scurtă. Dacă nu se obține o stare staționară după 28 de zile, eșantionare continuă până la obținerea unei astfel de stări sau timp de 60 de zile, optându-se pentru alternativa cea mai scurtă. Înainte de începerea fazei de eliminare, peștii se transferă în rezervoare curate.
1.8.4.2.
Se prelevează eșantioane de apă pentru analize, de exemplu prin sifonare cu ajutorul unui tub inert, într-un punct central al incintei experimentale. Întrucât se pare că fracțiile non biodisponibile de substanță testată, nu pot fi separate de cele biodisponibile – nici prin filtrare și nici prin centrifugare – (în particular, în cazul produselor chimice super-lipofile, adică cele care au log Pow > 5) (1) (5), se poate renunța la supunerea eșantioanelor la astfel de tratamente.
În schimb, trebuie avut grijă ca rezervoarele să fie cât mai curate posibil, iar conținutul în carbon organic va fi supravegheat pe întreaga durată a fazelor de absorbție și de eliminare.
Un număr convenabil de pești (în mod normal, cel puțin patru), se prelevează din fiecare incintă experimentală, pentru fiecare eșantionare. Peștii prelevați vor fi clătiți rapid cu apă, uscați cu ajutorul hârtiei absorbante și sacrificați în mod instantaneu, într-o manieră cât mai umană posibil, după care se cântăresc.
Este preferabil să se analizeze peștii și apa, imediat după eșantionare, pentru a se evita orice degradare sau alte pierderi și pentru a calcula în mod aproximativ regimurile de absorbție și de purificare, în vreme ce experimentul continuă să se desfășoare. De asemenea, analiza imediată evită întârzierea constatării atingerii unui platou.
În lipsa unei analize imediate, eșantioanele se vor conserva după o metodă convenabilă. Înainte de începerea studiului, se vor aduna toate datele cu privire la metodele de stocare adecvate substanței testate; de exemplu: congelare, menținere la 4 oC, durata stocării, extracția etc.
1.8.4.3.
Integralitatea procedurii fiind determinată, în principal, de exactitatea, precizia și sensibilitatea metodei analitice utilizate pentru substanța testată, trebuie controlat în mod experimental, ca precizia și reproductivitatea analizei chimice, precum și recuperarea substanței testate – atât din apă cât și din pești – să fie pe deplin satisfăcătoare, în cazul particular al respectivei metode. De asemenea, se are în vedere ca substanța testată să nu fie detectabilă în apa de diluție folosită.
Dacă este necesar, valorile pentru Cw și Cf, derivate din experiment, vor fi corectate după compararea cu valorile furnizate de martori și cu concentrația naturală a substanței testate. Pe tot parcursul testării, eșantioanele de pești și de apă sunt astfel manipulate încât să se minimizeze contaminările și pierderile (rezultate, de exemplu, de absorbția prin materialul de eșantionare).
1.8.4.4.
Dacă se utilizează materiale marcate radioactiv, se poate analiza marcajul radioactiv total (respectiv, compușii de origine și metaboliții) sau purifica eșantioanele, astfel încât compusul de origine să poată fi analizat separat. În plus, principalii metaboliți pot fi caracterizați fie la starea staționară, fie la sfârșitul fazei de absorbție, optându-se pentru varianta cea mai scurtă. Dacă BCF, în funcție de reziduurile marcate radioactiv totale, este ≥ 1 000 %, ar fi indicat (și, pentru anumite categorii de produse chimice, cum ar fi pesticidele, chiar recomandat cu tărie), să se identifice și cuantifice produsele de degradare reprezentând ≥ 10 % reziduuri totale în țesuturile peștilor, în starea staționară. Dacă aceste produse reprezintă ≥ 10 % reziduuri totale marcate radioactiv, în țesuturile peștilor, ele vor fi identificate și cuantificate; apoi, este recomandat ca acestea să fie identificate și cuantificate, de asemenea, în apa pentru experiment.
În general, concentrația substanței testate trebuie să fie determinată pentru fiecare pește cântărit. Dacă nu este posibil, se pot pune în comun eșantioanele la fiecare testare, însă această metodă restrânge veridicitatea procedurilor statistice a rezultatelor. Dacă o anumită procedură și o finețe statistică specifică sunt urmărite, va fi convenabil să se folosească în experiment, un număr adecvat de pești, pentru satisfacerea procedurii de regrupare și precizia statistică dorită (6) (7).
BCF-ul va fi exprimat atât în funcție de greutatea totală de produs viu, cât și pentru substanțele puternic lipofile, în funcție de conținutul lipidic. Conținutul lipidic al peștilor se determină, dacă este posibil, la fiecare eșantionare. Pentru stabilirea conținutului lipidic, se vor utiliza metode bine adaptate (referințele 8 și 2 ale apendicelui 3). Se recomandă tehnici de extracție prin cloroform/metanol, ca metode standard (9). Metodele nu oferă rezultate identice (10), motiv pentru care este important să se precizeze care metodă s-a utilizat. Analiza lipidelor se va face, pe cât posibil, pe aceleași extracte consacrate și pentru analiza substanței testate, întrucât, adesea, lipidele trebuie scoase din extras înainte de a-l putea analiza prin cromatografie. Conținutul lipidic al peștilor (în mg/kg de produs proaspăt), la sfârșitul experienței, nu trebuie să difere față de cel inițial, cu mai mult de ± 25 %. De asemenea, se va indica procentajul de solide din țesuturi, pentru a permite conversia concentrației lipidice a bazei umede, la cea a bazei uscate.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Curba de absorbție a substanței testate va rezulta din traseul concentrației sale în funcție de timp, la/în pești (sau în țesuturile specifice), în perioada fazei de absorbție, folosind o scară aritmetică. Dacă curba atinge un platou, adică adoptă aproximativ un traseu asimptotic la axa timpului, starea staționară BCFSS se va calcula, după cum urmează:

Atunci când nu se obține nicio stare staționară, rămâne posibilitatea calculării unui BCFss de o precizie suficientă pentru evaluarea riscurilor, pornind de la o „stare staționară” la 80 % (1,6/k2) sau 95 % (3,0/k2) de echilibru.
În plus, factorul de concentrare (BCFk) va fi definit ca raport k1/k2 de două constante cinetice de ordinul întâi. Constanta de viteză de eliminare (k2) se determină, în general, plecând de la curba de eliminare (adică de la un traseu al descreșterii concentrației substanței testate din pești, în funcție de timp). Apoi, constanta de viteză de absorbție (k1) va fi calculată în funcție de k2 și de o valoare a Cf derivată din curba de absorbție (a se vedea și apendicele 5). Metoda cea mai bună pentru obținerea BCFk și a constantelor de viteză k1 și k2 este aceea care recurge la metode informatice neliniare de estimare a parametrilor (11). Alternativ, se pot utiliza metode grafice pentru calculul k1 și k2. Dacă curba de purificare se dovedește a nu fi de ordinul întâi, trebuie utilizate modele mai complexe (a se vedea referințele din apendicele 3) și să se ceară opinia unui biostatistician.
2.2. INTERPRETAREA REZULTATELOR
Rezultatele se vor interpreta cu precauție, atunci când concentrațiile măsurate de soluție experimentală se află la valori apropiate de limita de detecție a metodei de analiză.
Claritatea cu care sunt definite curbele de absorbție și de eliminare, dovedește buna calitate a datelor de bioconcentrare. Variația constantelor de absorbție/eliminare, între cele două concentrații experimentale, trebuie să fie mai mică de 20 %. Diferențele considerabile observate la ratele de absorbție/eliminare, între cele două experimente de concentrare, vor fi înregistrate și explicate, dacă este posibil. În general, limita de încredere pentru BCF se apropie de ± 20 %, în studiile bine concepute.
3. RAPORT
Procesul verbal al testării va cuprinde informațiile următoare:
3.1. SUBSTANȚA TESTATĂ:
— natura fizică și, eventual, proprietățile fizico-chimice;
— date de identificare chimică (inclusiv conținutul în carbon organic, dacă este necesar);
— în cazul marcării radioactive, poziția precisă a atomului (atomilor) marcat (marcați) și procentajul de radioactivitate asociată impurităților.
3.2. SPECIILE UTILIZATE:
— denumire științifică, sușă, sursă, orice tratament prealabil eventual, aclimatare, vârstă, gama de dimensiuni etc.
3.3. CONDIȚII DE TESTARE:
— procedura utilizată (de exemplu, reînnoirea continuă sau semistatică);
— tipul și caracteristicile iluminării utilizate și fotoperioada (fotoperioadele);
— conceptul experimental (de exemplu, numărul și dimensiunea incintelor experimentale, regimul de înlocuire al volumelor de apă, numărul de subeșantioane și de pești per subeșantion, număr de concentrații testate, durata fazelor de absorbție și de epurare, frecvența eșantionării pentru pești și pentru apă);
— metoda de preparare a soluțiilor mamă și frecvența de reînnoire (agentul de dizolvare, concentrația sa și contribuția sa la conținutul în carbon organic al apei pentru experiență – vor fi menționate, dacă este cazul);
— concentrațiile experimentale nominale, mediile valorilor măsurate și deviația standard a acestora în recipientele experimentale, precum și metoda de obținere;
— sursa de apă de diluție, descrierea tuturor tratamentelor prealabile, rezultatele tuturor demonstrațiilor de aptitudine a peștilor de supraviețuire în această apă și caracteristicile apei: pH, duritate, temperatură, concentrația în oxigen dizolvat, nivelul clorului rezidual (dacă este măsurat), carbonul organic total, solide în suspensie, salinitatea mediului experimental (dacă este cazul) și orice alte măsurători făcute;
— calitatea apei în recipientele experimentale, pH, duritate, temperatura și concentrația în oxigen dizolvat;
— informații precise legate de alimentație (de exemplu, tipul de hrană, sursă, compoziție – cel puțin conținutul în lipide și proteine dacă este posibil, cantitatea dată și frecvența);
— informații legate de tratamentul peștilor și al apei eșantionate, inclusiv detalii de preparare, stocare, extracție, proceduri (și precizia) de analiză a substanței testate și conținutul în lipide (dacă s-a măsurat).
3.4. REZULTATE:
— rezultatele studiilor preliminare efectuate;
— mortalitatea peștilor martor și a peștilor din fiecare incintă experimentală, precum și orice comportament anormal observat;
— conținutul lipidic al peștilor (dacă a fost determinat cu ocazia experimentului);
— curbele (din toate măsurătorile efectuate) exprimând absorbția și eliminarea produselor chimice experimentale la pești, timpul de acces la starea staționară;
— Cf și Cw (cu deviația standard și, eventual, intervalul) la momentul fiecărei eșantionări [Cf se exprimă în μg/g de produs viu (ppm), din întreg peștele sau din anumite țesuturi; de exemplu, lipidele și Cw se exprimă în μg/ml (ppm)]. Valorile Cw pentru seria martor (de asemenea, se indică concentrația de bază);
— factorul de bioconcentrare în starea staționară (BCFss) și/sau factorul de concentrare cinetică (BCFk) și, dacă este cazul, limitele de încredere la 95 % ale constantelor de viteză de absorbție și de eliminare (pierdere), toate exprimate în raport cu întregul corp și cu conținutul total de lipide, dacă acesta este măsurat, ale peștelui (ori ale anumitor țesuturi), limitele de încredere și deviația standard (dacă este disponibilă), metode de calcul/analiză ale rezultatelor, pentru fiecare concentrație a substanței test utilizate;
— atunci când se folosesc substanțe marcate radioactiv, poate fi semnalată acumularea tuturor metaboliților, dacă este necesar;
— toate situațiile neobișnuite legate de experiment, toate devierile de la aceste proceduri și orice alte informații pertinente.
Se minimizează rezultatele de tipul „nedetectabil la limita de detecție”, prin folosirea unei metode experimentale preliminare și elaborarea unui concept experimental, deoarece astfel de rezultate sunt inutile pentru calculul constantelor de viteză.
4. REFERINȚE BIBLIOGRAFICE
1. Connell D. W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, p. 117-156.
2. Bintein S., Devillers, J. and Karcher W. (1993). Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, 29-390.
3. OECD, Paris (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No 3.
4. Kristensen P. (1991). Bioconcentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
5. US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Doc. for the Procedure to Determine Bioaccumulation Factors. July 1994.
6. US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher’s Lane, Rockville, MD 20852, July 1975
7. US EPA (1974). Section 5, A(1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711.
8. Compaan H. (1980) in „The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulatio” Ch. 2.3, Part II. Government Publishing Office, Haga, Olanda.
9. Gardner et al., (1995) Limn. & Oceanogr. 30, 1099-1105.
10. Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, p. 1431-1436.
11. CEC, Bioconcentration of chemical substances in fish: the flow-through method – Ring Test Programme, 1984-1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm.
12. ASTM E-1022-84 (Reapproved 1988) Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs.
Apendicele 1
Caracteristici chimice acceptabile ale apei de diluție
|
Substanța |
Concentrația-limită |
|
|
1 |
Particule insolubile |
5 mg/l |
|
2 |
Carbon organic total |
2 mg/l |
|
3 |
Amoniac neionizat |
1 μg/l |
|
4 |
Clor rezidual |
10 μg/l |
|
5 |
Pesticide organofosforice totale |
50 ng/l |
|
6 |
Pesticide organofluorurate totale + policlorobifenili |
50 ng/l |
|
7 |
Clor organic total |
25 ng/l |
|
8 |
Aluminiu |
1 μg/l |
|
9 |
Arsen |
1 μg/l |
|
10 |
Crom |
1 μg/l |
|
11 |
Cobalt |
1 μg/l |
|
12 |
Cupru |
1 μg/l |
|
13 |
Fier |
1 μg/l |
|
14 |
Plumb |
1 μg/l |
|
15 |
Nichel |
1 μg/l |
|
16 |
Zinc |
1 μg/l |
|
17 |
Cadmiu |
100 ng/l |
|
18 |
Mercur |
100 ng/l |
|
19 |
Argint |
100 ng/l |
Apendicele 2
Specii de pești recomandate pentru experimente
|
Specii recomandate |
Intervalul de temperatură recomandat pentru testare (oC) |
Lungimea totală recomandată a animalului de experiență (cm) |
|
|
1 |
Danio rerio (1) (Teleostei, Cyprinidae) (Hamilton-Buchanan) Zebra |
20-25 |
3,0 ± 0,5 |
|
2 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) |
20-25 |
5,0 ± 2,0 |
|
3 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Crap |
20-25 |
5,0 ± 3,0 |
|
4 |
Oryzias lapites (Teleostei, Poeciliidae) (Temmink and Schlegel) Medaka |
20-25 |
4,0 ± 1,0 |
|
5 |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters) Guppy |
20-25 |
3,0 ± 1,0 |
|
6 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) Biban-soare |
20-25 |
5,0 ± 2,0 |
|
7 |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) Păstrăv curcubeu |
13-17 |
8,0 ± 4,0 |
|
8 |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) Ghidrin țepos |
18-20 |
3,0 ± 1,0 |
|
(1) Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B., Vol. 252, p. 231. |
|||
În anumite țări, au fost utilizate diverse specii marine și de estuar, de exemplu:
|
Leiostomus xanthurus |
|
|
Cyprinodon variegatus |
|
|
Menidia beryllina |
|
|
Cymatogaster aggregata |
|
|
Parophrys vetulus |
|
|
Leptocottus armatus |
|
|
Gasterosteus aculeatus |
Ghidrin țepos |
|
Dicentracus labrax |
Biban comun |
|
Alburnus alburnus |
Obleț |
Recoltare
Peștii de apă dulce, menționați în tabelul de mai sus, sunt ușor de crescut și/sau foarte disponibili, tot timpul anului, față de speciile marine sau de estuar, a căror disponibilitate este, în anumite țări, limitată. Ei se reproduc și trăiesc atât în fermele piscicole cât și în laboratoare, în condițiile în care maladiile și paraziții se află sub control; așadar, animalele utilizate vor fi în stare bună de sănătate, cu ascendență genetică cunoscută. Pot fi găsiți aproape în întreaga lume.
Apendicele 3
Estimarea duratei fazelor de absorbție și de eliminare
1. Prognoza pentru durata fazei de absorbție
Înainte de executarea testării, se poate estima k2 și deci, un procentaj de timp necesar pentru a ajunge la starea staționară, pornind de la relațiile empirice între k2 și coeficientul de separare n-octanol/apă (Pow) sau între k2 și solubilitatea în apă (s).
Se estimează k2 (zile–1) pornind, de exemplu, de la relația empirică următoare (1):
|
log10k2 = 0,414 log10(Pow) + 1,47 (r2 = 0,95) |
(ecuația 1) |
Pentru alte relații, a se vedea referința bibliografică 2.
Dacă coeficientul de partiție (Pow) nu este cunoscut, se va proceda la o estimare (3), plecând de la solubilitatea în apă (s) a substanței, după cum urmează:
|
log10(Pow) = 0,862 log10(s) + 0,710 (r2 = 0,994) |
(ecuația 2) |
unde:
s = solubilitatea (mol/l): (n = 36)
Aceste relații se aplică numai produselor chimice, ale căror valori log Pow se situează între 2 și 6,5 (4).
Timpul necesar pentru atingerea unui anumit procentaj din starea staționară va rezulta din ecuația cinetică generală, indicându-se absorbția și eliminarea (cinetica de ordinul I), prin aplicarea estimării k2:
![]()
unde, dacă Cw este constant:
|
|
(ecuația 3) |
Atunci când ne apropiem de starea staționară (t → ∞), ecuația 3 se reduce (5) (6) la:
![]()
Raportul k1/k2 · Cw se apropie astfel de concentrația substanței din pești, în „starea staționară” (Cf, s).
Așadar, ecuația 3 poate fi transcrisă:
|
|
(ecuația 4) |
Timpul necesar pentru atingerea unui anumit procentaj din starea staționară poate fi prevăzut grație ecuației 4, atunci când k2 a fost în prealabil estimat cu ajutorul ecuațiilor 1 sau 2.
Cu titlu informativ, durata optimă statistică a fazei de absorbție, care permite obținerea de rezultate statistice acceptabile (BCFk), este perioada necesară pentru ca curba logaritmului concentrației de substanță testată din pești, trasată în funcție de timp în scară lineară, să ajungă la punctul median, adică la 1,6/k2 sau la 80 % din starea staționară, fără a depăși 3,0/k2 sau 95 % din starea staționară (7).
Timpul până la atingerea a 80 % din starea staționară este (ecuația 4):
|
|
(ecuația 5) |
Similar, pentru 95 % din starea staționară:
|
|
(ecuația 6) |
De exemplu, durata fazei de absorbție (abs.) a unei substanțe testate, având un log Pow = 4, va fi (folosind ecuațiile 1, 5 și 6):
|
log10k2 = - 0,414.(4) + 1,47 |
k2 = 0,652 zile-1 |
abs. (80 %) = 1,6/0,652 adică 2,45 zile (59 ore)
sau abs. (95 %) = 3,0/0,652 adică 4,60 zile (110 ore)
În același mod, pentru o substanță testată cu s = 10–5 mol/l [log (s) = - 5,0], durata de absorbție va fi (folosind ecuațiile 1, 2, 5 și 6):
log10 (Pow) = 0,862 (- 5,0) + 0,710 = 5,02
log10 K2 = 0,414 (5,02) + 1,47
k2 = 0,246 zile -1
abs. (80 %) = 1,6/0,246 adică 6,5 zile (156 ore)
sau abs. (95 %) = 3,0/0,246 adică 12,2 zile (293 ore)
De asemenea, se poate utiliza expresia alternativă:
teq = 6,54 × 103 Pow + 55,31 (ore)
pentru calculul timpului de atingere a stării staționare (4).
2. Estimarea duratei fazei de eliminare
Se poate estima, de asemenea, timpul necesar pentru ca substanța testată ajunsă în corpul peștilor să se reducă la un anumit procentaj din concentrația inițială, grație ecuației generale, ilustrând absorbția și eliminarea (cinetica de ordinul I) (1) (8).
Pentru faza de eliminare Cw este considerată nulă. Ecuația poate fi redusă la:
![]()
sau
![]()
unde Cf, 0 este concentrația la începutul perioadei de eliminare. Se va obține apoi o eliminare de 50 %, la momentul (t50):

sau
![]()
În același mod, 95 % din faza de eliminare va fi atinsă la:
![]()
Dacă ne plasăm la 80 % din faza de absorbție pentru prima perioadă (1,6/k2) și la 95 % din pierderi pentru faza de eliminare (3,0/k2), atunci faza de eliminare este aproximativ dublul duratei fazei de absorbție.
Totuși, este important de menționat că aceste estimări se bazează pe ipoteza că schemele de absorbție și eliminare urmează o cinetică de ordinul întâi. Dacă nu este cazul, se vor folosi modele mai complexe (de exemplu, referința bibliografică 1).
Bibliografie (pentru apendicele 3)
1. Spacie A. and Hamelink J. L. (1982) Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, p. 309-320.
2. Kristensen P. (1991) Bioconcentration in fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
3. Chiou C. T. and Schmedding D. W. (1982) Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), p. 4-10.
4. Hawker D. W. and Connell D. W. (1988) Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), p. 701-707.
5. Branson D. R., Blau G.E., Alexander H. C. and Neely W. B. (1975) Transactions of the Aamerican Fisheries Society, 104 (4), p. 785-792.
6. Ernst W. (1985) Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehmann P., Korte F., Klein W. and Bourdeau P. H. Part 4.4 p. 243-255. SCOPE, 1985, John Wiley & Sons Ltd. N.Y.
7. Reilly P. M., Bajramovic R., Blau G. E., Branson D.R. and Sauerhoff M. W. (1977) Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, p. 614-622.
8. Könemann H. and Van Leeuwen K. (1980) Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, p. 3-19.
Apendicele 4
Exemple teoretice de grafice de eșantionare pentru testele de bioconcentrare ale substanțelor cu log Pow = 4
|
Prelevări de pești |
Calendar de eșantionare |
Număr eșantioane de apă |
Număr de pești per eșantion |
|
|
Frecvența minimă cerută (zile) |
Eșantionare suplimentară |
|||
|
Faza de absorbție |
– 1 0 |
2 (1) 2 |
se adaugă 45-80 de pești |
|
|
I |
0,3 |
0,4 |
2 (2) |
4 (4) |
|
II |
0,6 |
0,9 |
2 (2) |
4 (4) |
|
III |
1,2 |
1,7 |
2 (2) |
4 (4) |
|
IV |
2,4 |
3,3 |
2 (2) |
4 (4) |
|
V |
4,7 |
2 |
6 |
|
|
Faza de epurare |
Peștii se transferă într-o apă care nu conține produsul testat |
|||
|
VI |
5,0 |
5,3 |
4 (4) |
|
|
VII |
5,9 |
7,0 |
4 (4) |
|
|
VIII |
9,3 |
11,2 |
4 (4) |
|
|
IX |
14,0 |
17,5 |
4 (6) |
|
|
(1) Se prelevează apa după adăugarea a cel puțin 3 volume ale incintei experimentale. Valorile dintre paranteze sunt numere de eșantioane (apă, pești) care trebuie prelevate, dacă se procedează la o eșantionare suplimentară. Notă: Estimarea înaintea experimentului a lui k2, pentru un log Pow = 4,0 este de 0,652 zile–1. Durata totală a experimentului este fixată la: 3 × abs. = 3 × 4,6 zile, adică 14 zile. Pentru estimarea „abs.” se utilizează apendicele 3. |
||||
Apendicele 5
Deosebirile dintre modele
S-a presupus că majoritatea rezultatelor de bioconcentrare sunt „rezonabil” de bine descrise, printr-un model simplu cu două compartimente/doi parametri, respectiv printr-o curbă rectilinie ce reprezintă aproximativ punctele de măsură ale concentrațiilor de substanță testată din pești, în cursul fazei de eliminare, pe hârtie semilogaritmică. (Atunci când aceste puncte nu se pot reduce la o dreaptă, este indicat să se recurgă la modele mai complexe, a se vedea, de exemplu, Spacie and Hamelink, referința 1 din bibliografia apendicelui 3.)
Metoda grafică pentru determinarea constantei de viteză de eliminare (pierdere) k2
Se reprezintă, pe hârtie semilogaritmică, concentrația substanței testate, determinată la fiecare eșantion de pești, conform graficului de eșantionare. Panta acestei drepte este k2.
![]()
Atenție: abaterile față de această linie dreaptă pot indica o schemă de eliminare mai complexă decât cinetica de ordinul întâi. O metodă grafică poate rezolva acest tip de eliminare care se abate de la cinetica de ordinul întâi.
Metoda grafică pentru determinarea constantei de viteză de absorbție k1
k2 fiind determinat, se calculează k1 după cum urmează:
|
|
(ecuația 1) |
Se citește valoarea Cf în punctul median al curbei de absorbție netezite, aproximată cu o dreaptă, atunci când concentrația logaritmică este trasată în funcție de timp (pe o scară aritmetică).
Metoda de calcul informatic a constantelor de viteză de absorbție și de eliminare (pierdere)
Pentru obținerea factorului de bioconcentrare și a constantelor de viteză k1 și k2, se vor utiliza de preferință metode informatice neliniare de estimare parametrică. Aceste programe determină valorile pentru k1 și k2, utilizând un ansamblu de rezultate secvențiale ale concentrației în timp, în funcție de model:
|
|
(ecuația 2) |
|
|
(ecuația 3) |
unde tc = timpul la sfârșitul fazei de absorbție.
Această metodă furnizează estimarea deviațiilor standard a k1 și k2.
Întrucât, în majoritatea cazurilor, se poate estima k2 pornind de la curba de eliminare, și aceasta cu o precizie destul de mare, și întrucât există o strânsă corelare între cei doi parametri k1 și k2, este de dorit să se calculeze mai întâi k2, pornind numai de la datele de eliminare și după aceea să se calculeze k1, de la datele de absorbție, cu ajutorul unei regresii neliniare.
C.14. TESTUL DE CREȘTERE A PUIETULUI DE PEȘTE
1. METODĂ
Metoda de testare a influenței toxicității asupra creșterii reproduce Orientarea 215 (2000) a OCDE.
1.1. INTRODUCERE
Acest test urmărește să evalueze efectele expunerii prelungite la produse chimice asupra creșterii puietului de pește. Are la bază o metodă, elaborată și intercalibrată (1) (2) în Uniunea Europeană, de evaluare a efectelor produselor chimice asupra puietului de păstrăv-curcubeu (Oncorynchus mykiss) în regim dinamic. Pot fi folosite și alte specii, dacă au fost bine studiate. De exemplu, s-a câștigat experiență din testele de creștere cu peștele-zebră (Danio rerio) ( 30 ) (3) (4) și medaka (Oryzias latipes) (5) (6) (7).
A se vedea și Introducerea generală partea C.
1.2. DEFINIȚII
Concentrația minimă cu efect observabil (CMEO): este cea mai scăzută concentrație testată a substanței testate la care se constată un efect semnificativ (la p < 0,05) în comparație cu lotul martor. Toate concentrațiile mai mari decât CMEO trebuie să aibă efect nociv egal sau mai mare decât cel observat la CMEO.
Concentrația fără efecte observabile (CFEO): este concentrația testată imediat sub valoarea CMEO.
CE x : în această metodă de testare este concentrația substanței testate care provoacă o variație de x % în rata de creștere a peștelui în comparație cu lotul martor.
Rata de încărcare: este greutatea peștelui pe unitatea de volum de apă.
Densitatea populației: este numărul de pești pe unitatea de volum de apă.
Rata de creștere specifică individuală: exprimă rata de creștere a unui individ, prin raportare la greutatea sa inițială.
Rata de creștere specifică medie a bazinului: exprimă rata de creștere medie a populației din bazin la o concentrație dată.
Rata de creștere pseudospecifică: exprimă rata de creștere individuală raportată la greutatea inițială medie a populației din bazin.
1.3. PRINCIPIUL METODEI DE TESTARE
Puietul piscicol aflat în faza de creștere exponențială este pus, după ce este cântărit, în incintele experimentale și expus la o gamă de concentrații subletale din substanța testată, dizolvată în apă, de preferință în regim dinamic sau, dacă nu este posibil, în condiții semistatice adecvate (regim de curgere discontinuă) Durata testului este de 28 de zile. Peștii sunt hrăniți zilnic. Rația alimentară este în funcție de greutățile corporale inițiale și poate fi recalculată după 14 zile. La sfârșitul testului, peștii sunt cântăriți din nou. Efectele asupra ratelor de creștere sunt analizate folosind un model de regresie, pentru a estima acea concentrație care ar avea ca efect o variație a ratei de creștere de x %, adică a CEx (de exemplu CE10, CE20 sau CE30). O altă variantă este ca datele să fie comparate cu valorile lotului martor, în scopul de a determina concentrația minimă cu efecte observabile (CMEO) și, de aici, concentrația fără efecte observabile (CFEO).
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Trebuie să fie disponibile rezultatele unui test de toxicitate acută (a se vedea metoda de testare C.1), de preferință efectuat cu speciile alese pentru acest test. Aceasta înseamnă că se cunosc solubilitatea în apă și presiunea de vapori ale substanței testate, precum și că există o metodă analitică fiabilă și disponibilă pentru cuantificarea substanței în soluții, a cărei precizie și ale cărei limite de detecție sunt cunoscute și specificate în raport.
Informațiile utile cuprind: formula structurală, puritatea substanței, stabilitatea în apă și la lumină, pKa, Pow și rezultatele testului de biodegradabilitate rapidă (a se vedea metoda de testare C.4).
1.5. VALIDITATEA TESTULUI
Pentru ca testul să fie valid, trebuie să îndeplinească următoarele condiții:
— mortalitatea în lotul (loturile) martor nu trebuie să depășească 10 % la sfârșitul testului;
— greutatea medie a peștilor în lotul (loturile) martor trebuie să fi crescut suficient pentru a permite detectarea variației minime a ratei de creștere considerată ca semnificativă. Un test de intercalibrare (2) a arătat că în cazul păstrăvului-curcubeu greutatea medie a peștelui în lotul martor trebuie să fi crescut în 28 de zile cu cel puțin jumătate (adică 50 %) din greutatea inițială; de exemplu, greutatea inițială: 1 g/pește (= 100 %), greutatea finală, după 28 de zile: ≥ 1,5 g/pește (≥ 150 %);
— concentrația de oxigen dizolvat trebuie să fi fost pe toată durata testului de cel puțin 60 % din valoarea de saturație din aer (VSA);
— temperatura apei trebuie să nu difere cu mai mult de ± 1 oC între bazine în niciun moment pe durata testului și să fie menținută într-un interval de 2 oC în intervalele de temperatură specificate pentru speciile de pești (apendicele 1).
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Aparatură
Echipamentul obișnuit de laborator și în special următoarele:
— pH-metru și aparat de măsurare a oxigenului;
— echipament pentru determinarea durității și alcalinității apei;
— aparatură adecvată pentru controlul temperaturii, de preferat cu supraveghere continuă;
— bazine din material chimic inert și de capacitate adaptată la încărcarea și densitatea populației recomandate (a se vedea punctul 1.8.5 și apendicele 1);
— balanță de precizie adecvată (adică până la ± 0,5 %).
1.6.2. Apa
În test poate fi folosită orice apă în care specia testată prezintă o rată de supraviețuire și de creștere pe termen lung corespunzătoare. Trebuie să fie de calitate constantă pe durata testului. Apa trebuie să aibă un pH în intervalul 6,5-8,5, dar pe durata unui test dat trebuie să se încadreze într-un interval de ±0,5 unități de pH. Se recomandă o duritate (în CaCO3) de peste 140 mg/l. Pentru ca apa de diluare să nu influențeze în mod nepermis rezultatele testelor (de exemplu prin complexare cu substanța testată), trebuie luate probe la intervale egale pentru analiză. Acolo unde se cunoaște calitatea relativ constantă a apei de diluare, se măsoară la interval de trei luni conținutul în metale grele (de exemplu: Cu, Pb, Zn, Hg, Cd și Ni), anioni și cationi principali (de exemplu: Ca, Mg, Na, K, Cl și SO4), pesticide (de exemplu pesticide organofosforice totale și pesticide organoclorice totale), carbon organic total, solide în suspensie. Dacă s-a demonstrat că apa are calitate constantă pe o perioadă de cel puțin un an, analizele se pot face la intervale mai mari (de exemplu la fiecare șase luni). Câteva caracteristici chimice ale unei ape de diluare acceptabile sunt enumerate în apendicele 2.
1.6.3. Soluțiile de lucru
Soluțiile de lucru de concentrații date se prepară prin diluarea unei soluții de bază.
Soluția de bază se prepară de preferință prin simpla amestecare sau agitare a substanței testate în apa de diluare, folosind mijloace mecanice (de exemplu cu agitator sau ultrasunete). Pentru obținerea unei soluții de bază cu o concentrație corespunzătoare se pot folosi coloane de saturare (coloane de solubilitate).
În unele cazuri, folosirea solvenților sau a agenților de dispersie poate fi necesară pentru a realiza soluția de bază de concentrație corespunzătoare. Exemple de solvenți adecvați sunt acetona, etanolul, metanolul, dimetilsulfoxidul, dimetilformamida și trietilenglicolul. Exemple de agenți de dispersie adecvați sunt Cremophor RH40, Tween 80, metilceluloză 0,01 % și HCO-40. Folosirea compușilor ușor biodegradabili (de exemplu acetona) și a compușilor foarte volatili trebuie să se facă atent, deoarece aceștia pot antrena proliferarea bacteriană în testele cu regim dinamic. Când se folosește agent de dispersie, acesta trebuie, în demonstrația pe un lot martor tratat numai cu solventul, să nu provoace efecte semnificative asupra creșterii peștilor și nici efecte adverse vizibile asupra puietului.
La testele în regim dinamic este necesar un sistem care să distribuie și să dilueze continuu soluția de bază a substanței testate (de exemplu pompă dozatoare, diluator proporțional, sistem de saturație) pentru a asigura seria concentrațiilor din incintele experimentale. Debitele soluțiilor de bază și ale apei de diluare se verifică la intervale definite, de preferință zilnic, pe durata testului și trebuie să nu varieze cu mai mult de 10 % pe parcursul întregului test. Un test de intercalibrare (2) a demonstrat că, în cazul păstrăvului-curcubeu, o frecvență a schimbării apei de 6 litri/g de pește/zi este acceptabilă (a se vedea punctul 1.8.2.2).
La testele în regim semistatic (regim dinamic discontinuu), frecvența schimbării apei depinde de stabilitatea substanței testate, dar se recomandă schimbarea zilnică. Dacă testele de stabilitate preliminare (a se vedea punctul 1.4) arată o instabilitate a concentrației substanței testate (adică în afara intervalului de 80-120 % din concentrația nominală sau sub 80 % din concentrația măsurată inițial) pe parcursul schimbării apei, trebuie luată în considerare folosirea unui test în regim dinamic.
1.6.4. Alegerea speciilor
Păstrăvul-curcubeu (Oncorynchus mykiss) este specia recomandată pentru acest test deoarece de această specie se leagă cea mai mare parte a experienței câștigate în testele de intercalibrare (1) (2). Cu toate acestea, pot fi folosite și alte specii, bine studiate, dar metoda experimentală s-ar putea să necesite adaptări, pentru a asigura condiții de testare adecvate. De exemplu, există experiență disponibilă și cu peștele-zebră (Danio rerio) (3) (4) și cu medaka (Oryzias latipes) (5) (6) (7). În acest caz, justificarea alegerii speciei și a metodei de testare trebuie specificată în raport.
1.6.5. Îngrijirea peștilor
Peștii de laborator trebuie aleși din aceeași populație, de preferință din aceleași icre, care a fost îngrijită pentru cel puțin două săptămâni înainte de test în condiții de calitate a apei și de expunere la lumină similare cu acelea folosite la test. Peștii trebuie hrăniți cu o rație minimă zilnică reprezentând 2 % din greutatea corporală, de preferință 4 %, pe întreaga durată de îngrijire și testare.
După o perioadă de acomodare de 48 de ore, se înregistrează mortalitatea și se aplică următoarele criterii:
— mortalitate mai ridicată de 10 % din populație în șapte zile: se respinge întregul lot;
— mortalitate între 5 % și 10 % din populație: acomodare pentru încă șapte zile; dacă mortalitatea este peste 5 % în a doua perioadă de șapte zile, se respinge întregul lot;
— mortalitate mai scăzută de 5 % din populație în șapte zile: se acceptă lotul.
Peștii nu trebuie să primească tratament pentru boală în cele două săptămâni anterioare testului sau în timpul testului.
1.7. STRUCTURAREA TESTULUI
„Structurarea testului” se referă la alegerea numărului și a intervalelor de concentrații testate, la numărul de bazine pentru fiecare nivel al concentrației și la numărul de pești pe bazin. În mod ideal, structurarea testului ia în considerare:
— obiectivul studiului;
— metoda de analiză statistică urmând a fi folosită;
— disponibilitatea și costul resurselor alocate.
Enunțul obiectivului ar trebui, dacă este posibil, să specifice puterea statistică la care se cere să fie detectată mărimea unei diferențe date (de exemplu în rata creșterii) sau, alternativ, precizia cu care se cere estimarea CEx (de exemplu cu x = 10, 20 sau 30 și de preferință nu mai mic decât 10). În absența acestor informații, nu se poate indica în mod precis scara de desfășurare a studiului.
Este important să se accepte ideea că structurarea optimă (care folosește cel mai bine resursele) în raport cu o metodă de analiză statistică nu este în mod necesar optimă în raport cu altă metodă. Structurarea recomandată pentru estimarea CMEO/CFEO nu va fi aceeași cu cea recomandată pentru analiza prin regresie.
În cele mai multe cazuri, analiza de regresie este preferabilă analizei de varianță, din motivele discutate de Stephan și Rogers (8). Cu toate acestea, atunci când nu se găsește un model de regresie corespunzător (r2 < 0,9), ar trebui să se recurgă la CFEO/CMEO.
1.7.1. Structurarea pentru analiza de regresie
La structurarea unui test care urmează să fie interpretat cu ajutorul analizei de regresie, considerentele importante sunt:
(a) concentrațiile cu efect (de exemplu CE10,20,30) și intervalul de concentrații în care efectul substanței testate prezintă interes trebuie cu necesitate să fie cuprinse în test. Precizia cu care pot fi făcute estimările concentrațiilor cu efect va fi mai bună atunci când concentrația cu efect este la jumătatea intervalului de concentrații testate. În alegerea concentrațiilor adecvate pentru test este util un test preliminar de stabilire a intervalului;
(b) pentru a permite o modelare statistică satisfăcătoare, testul trebuie să includă cel puțin un bazin martor și alte cinci bazine la concentrații diferite. Unde este cazul, atunci când se folosește un agent de dispersie, se studiază, în afară de lotul testat, un lot martor dintr-un bazin conținând agentul de dispersie la concentrația maximă testată (a se vedea punctele 1.8.3 și 1.8.4);
(c) se poate folosi o serie geometrică sau una logaritmică adecvată (9) (a se vedea apendicele 3). Este de preferat seria logaritmică în definirea intervalelor între nivelurile concentrațiilor testate;
(d) dacă sunt disponibile mai mult de șase bazine, bazinele suplimentare ar trebui folosite fie la dublarea probelor, fie la distribuirea lor în intervalele de concentrații, în scopul îngustării acestora. Ambele măsuri sunt oportune în egală măsură.
1.7.2. Structurarea pentru CFEO/CMEO folosind analiza de varianță
Ar fi de preferat să existe bazine-dublură la fiecare concentrație, iar analiza statistică să se facă la nivelul fiecărui bazin (10). Fără bazine-dublură nu poate fi luată în considerare variabilitatea între bazine separat de variabilitatea de la un pește la altul. Cu toate acestea, experiența a arătat (11) că, în cazul examinat, variabilitatea între bazine a fost foarte scăzută comparativ cu cea din interiorul aceluiași bazin (adică între pești). Prin urmare, o alternativă relativ acceptabilă este efectuarea analizei statistice la nivelul fiecărui exemplar.
În mod convențional, se folosesc cel puțin cinci concentrații dispuse în serie geometrică, cu o rație care de preferință nu depășește 3,2.
În general, atunci când testele se fac cu bazine-dublură, numărul bazinelor martor, și prin urmare cel al peștilor, reprezintă dublul numărului de bazine testate la fiecare concentrație, iar acesta din urmă este același la toate concentrațiile (12) (13) (14). Dimpotrivă, în absența bazinelor-dublură, numărul peștilor din lotul martor este egal cu numărul peștilor folosiți la fiecare concentrație.
Dacă analiza de varianță urmează să pornească de la bazin și nu de la fiecare pește [ceea ce ar presupune fie marcarea individuală a peștilor, fie folosirea ratelor de creștere pseudospecifice (a se vedea punctul 2.1.2)], apare necesitatea folosirii unui număr suficient de dubluri pentru a se putea determina deviația standard a „bazinelor cu aceeași concentrație”. Aceasta înseamnă că gradele de libertate pentru erorile din analiza de varianță trebuie să fie de minimum 5 (10). Dacă sunt dublate numai bazinele martor, există pericolul ca variabilitatea erorilor să fie falsificată, deoarece ea poate crește odată cu valoarea medie a ratei de creștere în cauză. Deoarece este probabil ca rata de creștere să scadă odată cu creșterea concentrației, se poate ajunge la o variabilitate supraestimată.
1.8. MODUL DE LUCRU
1.8.1. Selectarea și cântărirea peștilor
Este important ca variația în cântărirea peștilor să fie redusă la minimum la începutul testului. În apendicele 1 se dau intervalele corespunzătoare pentru mărimea diferitelor specii recomandate în acest test. Pentru întregul lot de pești folosit, limitele greutăților corporale individuale la începutul testului sunt, în mod ideal, cuprinse în intervalul de ± 10 % din media aritmetică a greutăților și, în orice caz, trebuie să nu depășească 25 %. Se recomandă cântărirea unui sub-eșantion de pești înainte de testare, pentru a estima greutatea medie.
Peștii nu trebuie hrăniți timp de 24 de ore înainte de începerea testului. Apoi sunt aleși la întâmplare. Folosind un anestezic general [de exemplu o soluție apoasă de 100 mg/l de metansulfonat de tricaină (MS 222) neutralizată prin adăugarea a două părți bicarbonat de sodiu la o parte de MS 222], peștii sunt cântăriți individual ca greutate in vivo zvântați, la precizia indicată în apendicele 1. Se rețin peștii a căror greutate se află în intervalul dorit și apoi sunt distribuiți aleator în bazine. Trebuie înregistrată greutatea totală a peștilor din fiecare bazin. Folosirea anestezicului, precum și manipularea peștilor (inclusiv zvântarea și cântărirea) pot să streseze și să rănească puietul, în special pe cel din speciile de talie mică. Prin urmare, manipularea puietului trebuie făcută cu cea mai mare grijă pentru a evita stresarea și rănirea animalelor de experiență.
Peștii sunt cântăriți din nou în a 28-a zi a testului (a se vedea punctul 1.8.6). Cu toate acestea, dacă se consideră necesar să fie recalculată rația alimentară, peștii pot fi cântăriți din nou în ziua a 14-a a testului (a se vedea punctul 1.8.2.3). Altă metodă, cum ar fi metoda fotografică, poate fi folosită pentru a determina schimbările în dimensiunile peștilor pe baza cărora se pot ajusta rațiile alimentare.
1.8.2. Condițiile de expunere
1.8.2.1. Durata
Durata testului este de 28 de zile.
1.8.2.2. Rata de încărcare și densitatea populației
Este important ca rata de încărcare și densitatea populației să fie adecvate pentru specia folosită (a se vedea apendicele 1). Dacă densitatea populației este prea mare, apare stresul de supraaglomerație, conducând la reducerea ratei de creștere și, posibil, la boli. Dacă densitatea este prea mică, poate apărea un comportament teritorial care de asemenea să afecteze creșterea. În orice caz, rata de încărcare trebuie să fie suficient de redusă pentru ca o concentrație de oxigen dizolvat de cel puțin 60 % VSA să poată fi menținută fără aerare. Un test de intercalibrare (2) a arătat că, pentru păstrăvul-curcubeu, o rată de încărcare de 16 păstrăvi de 3-5 g într-un volum de 40 l este acceptabilă. Frecvența recomandată de schimbare a apei pe durata testului este de 6 l/g de pește/zi.
1.8.2.3. Hrănirea
Peștelui i se administrează o alimentație corespunzătoare (apendicele 1) într-o cantitate suficientă pentru a induce o rată de creștere acceptabilă. Se veghează la evitarea proliferării microbilor și a turbidității apei. Pentru păstrăvul-curcubeu, o rație zilnică reprezentând 4 % din greutatea corporală satisface aceste condiții (2) (15) (16) (17). Rația zilnică poate fi împărțită în două porții egale și dată în două etape, la interval de cel puțin 5 ore. Rația se calculează pornind de la greutatea totală a peștilor din fiecare bazin. Dacă peștii sunt cântăriți din nou în ziua a 14-a, rația se recalculează în acea zi. Peștii nu sunt hrăniți timp de 24 de ore înainte de cântărire.
Alimentele neconsumate și materiile fecale trebuie îndepărtate zilnic din bazine, prin curățarea atentă a fundului fiecărui bazin folosind o țeavă aspiratoare.
1.8.2.4. Lumina și temperatura
Perioada în care bazinul este expus la lumină și temperatura apei trebuie să fie adecvate speciei testate (apendicele 1).
1.8.3. Concentrațiile de lucru
În mod normal, sunt necesare cinci concentrații ale substanței testate, indiferent de structurarea testului (a se vedea punctul 1.7.2). Cunoașterea prealabilă a toxicității substanței testate (de exemplu dintr-un test de toxicitate acută și din studii de determinare a intervalelor) ajută la alegerea concentrațiilor adecvate. Trebuie justificată folosirea a mai puțin de cinci concentrații. Concentrația maximă testată nu trebuie să depășească limita de solubilitate a substanței în apă.
Când se folosește un agent de dispersie la prepararea soluției de bază, concentrația finală a acestuia nu trebuie să depășească 0,1 ml/l și este de preferat să fie aceeași în toate bazinele (a se vedea punctul 1.6.3). Recurgerea la astfel de produse trebuie totuși evitată pe cât posibil.
1.8.4. Bazinele martor
Numărul bazinelor martor cu apă de diluare depinde de structurarea testului (a se vedea punctele 1.7-1.7.2). Dacă se folosește agent de dispersie, trebuie cuprins în test și un număr de bazine martor cu agent de dispersie egal cu numărul bazinelor martor cu apă de diluare.
1.8.5. Frecvența măsurătorilor și determinărilor analitice
Pe durata testului concentrațiile substanței testate se determină cu regularitate (a se vedea în continuare).
La testele în regim dinamic, debitele diluantului și al soluției de bază conținând substanța toxică trebuie verificate cu regularitate, de preferință zilnic, și nu trebuie să varieze cu mai mult de 10 % pe întreaga durată a testului. Atunci când concentrațiile substanței testate se așteaptă să rămână în intervalul ± 20 % față de valoarea nominală (adică în intervalul 80-120 %; a se vedea punctele 1.6.2 și 1.6.3), se recomandă minimal analiza celei mai ridicate și a celei mai scăzute concentrații la începutul testului, iar apoi la intervale de o săptămână. În cazul testului la care concentrația substanței testate nu se așteaptă a rămâne în intervalul ± 20 % față de valoarea nominală (pe baza datelor de stabilitate privind substanța testată), este necesară analizarea tuturor concentrațiilor, dar urmând același procedeu.
La testele în regim semistatic (cu schimbarea apei) unde concentrația substanței testate este de așteptat să rămână în intervalul ± 20 % față de valoarea nominală, se recomandă ca, minimal, concentrația cea mai ridicată și cea mai scăzută să fie analizate imediat după preparare și imediat înainte de schimbarea apei la începutul studiului și săptămânal după aceea. La testele unde concentrația substanței testate nu este de așteptat să rămână în intervalul ± 20 % față de valoarea nominală, trebuie analizate toate concentrațiile urmând aceeași metodă ca și pentru substanțele mai stabile.
Se recomandă ca rezultatele să fie fundamentate pe concentrații măsurate. Cu toate acestea, atunci când, în mod demonstrabil, concentrația substanței testate în soluție a fost menținută pe parcursul întregului test în intervalul ± 20 % față de concentrația nominală sau concentrația măsurată inițial, rezultatele pot fi fundamentate pe valorile nominale sau măsurate.
Poate fi necesară filtrarea probelor (de exemplu cu ajutorul unui filtru cu pori de 0,45 μm) sau centrifugarea lor. Centrifugarea este metoda recomandată. Cu toate acestea, dacă mediul de lucru nu se adsoarbe pe filtru, filtrarea este în egală măsură acceptabilă.
În timpul testului, oxigenul dizolvat, pH-ul și temperatura se măsoară în toate bazinele. Duritatea totală, alcalinitatea și salinitatea se măsoară (dacă are relevanță) în bazinele martor și în bazinul cu cea mai ridicată concentrație. Minimal, oxigenul dizolvat și salinitatea (dacă are relevanță) se măsoară de trei ori (la început, la jumătatea și la sfârșitul testului). În testele în regim semistatic, se recomandă ca oxigenul dizolvat să se măsoare mai frecvent, de preferință înainte și după schimbarea apei sau cel puțin o dată pe săptămână. pH-ul se măsoară la începutul și la sfârșitul fiecărei schimbări a apei la testele în regim semistatic și cel puțin săptămânal la testele în regim dinamic. Duritatea și alcalinitatea se măsoară o dată la fiecare test. Este de preferat ca temperatura să fie monitorizată continuu cel puțin într-unul din bazine.
1.8.6. Observații
Greutatea: la sfârșitul testului toți peștii supraviețuitori trebuie cântăriți in vivo zvântați (blotted dry), fie în grupuri pe fiecare bazin, fie individual. Cântărirea în grup este preferată cântăririlor individuale, care necesită marcarea individuală a peștilor. În cazul măsurării greutății individuale în scopul determinării ratei de creștere specifice individuale, tehnica de marcare aleasă trebuie să evite stresarea animalelor (se poate folosi o metodă diferită de metoda crio-marcajului, de exemplu un fir de undiță subțire, colorat).
Peștii sunt examinați zilnic pe durata testului și se observă orice anomalii exterioare (cum ar fi hemoragia, decolorarea) și comportamente anormale. Se înregistrează cazurile de deces și se îndepărtează peștii morți cât mai repede posibil. Peștii morți nu sunt înlocuiți, rata de încărcare și densitatea populației fiind suficiente pentru a evita efectele asupra creșterii provocate de schimbarea numărului de pești din bazin. Este necesar totuși să se ajusteze rația alimentară.
2. DATE ȘI RAPORT
2.1. PRELUCRAREA REZULTATELOR
Se recomandă implicarea unui statistician atât în structurarea, cât și în analiza testului, deoarece această metodă de testare permite variații considerabile în modul de lucru, cum ar fi, de exemplu, variații în numărul de bazine, de concentrații folosite, de pești etc. Luând în considerare opțiunile disponibile în structurarea testului, nu sunt prezentate aici îndrumările specifice referitoare la metoda statistică.
Ratele de creștere nu se calculează pentru bazinele în care mortalitatea depășește 10 %. Cu toate acestea, rata mortalității trebuie indicată la toate concentrațiile folosite.
Oricare din metode este folosită la analizarea rezultatelor, conceptul central este rata r de creștere specifică între momentul t1 și momentul t2. Aceasta poate fi definită în câteva moduri, în funcție de prezența sau absența marcajului individual al peștilor sau în funcție de necesitatea aflării unei medii pe bazin.
![]()
![]()
![]()
unde:
|
r1 |
= rata de creștere specifică individuală |
|
r2 |
= rata de creștere specifică medie a bazinului |
|
r3 |
= rata de creștere pseudospecifică |
|
w1, w2 |
greutățile corporale ale unui anumit pește la momentele t1 și respectiv t2 |
|
logew1 |
= logaritmul greutății corporale a unui anumit pește la începutul perioadei de studiu |
|
logew2 |
= logaritmul greutății corporale a unui anumit pește la sfârșitul perioadei de studiu |
|
logeW1 |
= media logaritmilor valorilor w1 pentru peștii din bazin la începutul perioadei de studiu |
|
logeW2 |
= media logaritmilor valorilor w2 pentru peștii din bazin la sfârșitul perioadei de studiu |
r1, r2, r3 pot fi calculate pentru perioada cuprinsă între ziua 0 și ziua 28 și acolo unde este cazul (adică atunci când s-a făcut o măsurătoare în ziua 14) pentru perioadele dintre ziua 0 și ziua 14 și ziua 14 și ziua 28.
2.1.1. Analiza rezultatelor prin regresie (modelarea concentrație-răspuns)
Această metodă de analiză stabilește o relație matematică adecvată între ratele de creștere specifice și concentrație, ceea ce permite estimarea mărimii „CEx”, adică orice valoare CE necesară. Folosind această metodă nu mai este necesar calculul mărimii r pentru fiecare pește (r1) și în schimb analiza pornește de la valoarea medie pe bazin a lui r (r2). Această ultimă metodă este preferabilă. În plus, este și mai adecvată în cazul speciilor de talie mică.
Pentru a studia relația concentrație-răspuns, ratele de creștere specifice medii ale bazinelor (r2) se așează pe un grafic ca funcție de valorile concentrațiilor.
Pentru exprimarea relației dintre r2 și concentrație trebuie ales modelul adecvat, iar alegerea trebuie susținută de o justificare pertinentă.
Dacă peștii supraviețuitori sunt în număr diferit de la un bazin la altul, atunci procesul de ajustare a modelului, fie acesta simplu sau nelinear, se ponderează pentru a lua în considerare mărimile diferite ale grupurilor.
Metoda de ajustare a modelului trebuie să facă posibilă estimarea, de exemplu, a valorii CE20 și a dispersiei sale (fie eroare standard, fie interval de încredere). Graficul modelului ajustat este prezentat în relație cu rezultatele, așa încât să poată fi apreciat gradul de adecvare a modelului (8) (18) (19) (20).
2.1.2. Analiza rezultatelor pentru estimarea DMEO
Dacă testul a cuprins bazine-dublură la toate nivelurile de concentrație, estimarea CMEO poate fi făcută pe baza analizei de varianță a ratei de creștere specifice medii a bazinului (a se vedea punctul 2.1), urmată de o metodă pertinentă [de exemplu testul Dunnett sau testul William (12) (13) (14) (21)] de comparare a r medii corespunzătoare fiecărei concentrații cu r medie din bazinele martor, pentru a identifica valoarea cea mai scăzută a concentrației pentru care diferența este semnificativă la nivelul de probabilitate de 0,05. Dacă nu sunt îndeplinite condițiile impuse pentru metodele parametrice – distribuție nenormală (de exemplu testul Shapiro-Wilk) sau varianță heterogenă (testul Barlett) – trebuie luată în considerare transformarea datelor, în scopul omogenizării varianțelor înainte de efectuarea analizei de varianță, sau efectuarea unei analize de varianță ponderate.
Dacă testul nu a cuprins bazine-dublură la fiecare concentrație, o analiză de varianță pe baza rezultatelor pe bazin va fi insensibilă sau imposibilă. În această situație, un compromis acceptabil este să se efectueze analiza pornind de la rata de creștere pseudospecifică r3 pentru fiecare pește.
r3 medie de la fiecare nivel de concentrație se compară cu r3 medie din cazul bazinelor martor. CMEO poate fi identificată ca mai sus. Trebuie admis că această metodă nu ia în considerare variabilitatea între bazine în afară de ce se poate explica prin variabilitatea între pești, tratați individual, și nici nu oferă protecție în acest sens. Cu toate acestea, experiența a arătat (8) că variabilitatea între bazine a fost foarte mică în comparație cu variabilitatea în interiorul aceluiași bazin (adică între pești). Dacă analiza nu cuprinde fiecare pește, trebuie să se prezinte metoda de identificare a valorilor aberante și justificarea folosirii ei.
2.2. INTERPRETAREA REZULTATELOR
Rezultatele se interpretează cu precauție atunci când concentrațiile măsurate ale substanțelor toxice ajung la niveluri apropiate de limitele de detecție ale metodei analitice sau, la testele în regim semistatic, atunci când concentrația substanței testate scade între momentul preparării soluției și momentul schimbării apei.
2.3. RAPORTUL DE TESTARE
Raportul de testare trebuie să cuprindă următoarele informații:
2.3.1. Substanța testată:
— natura fizică și proprietățile fizico-chimice relevante;
— datele de identificare chimică, inclusiv puritatea și metoda analitică de cuantificare a substanței testate, după caz.
2.3.2. Specia testată:
— numele științific, dacă este posibil;
— sușa, mărimea, furnizorul, eventuale tratamente prealabile etc.
2.3.3. Condițiile de testare:
— metoda folosită (de exemplu: regim semistatic/schimbarea apei, regim dinamic, încărcare, densitatea populației etc.);
— structurarea testului (de exemplu: număr de bazine, concentrații folosite și dubluri, număr de pești pe bazin);
— metoda de preparare a soluțiilor de bază și frecvența schimbării apei (se specifică agentul de solubilizare și concentrația sa, atunci când este folosit);
— concentrațiile nominale, mediile valorilor măsurate și deviațiile lor standard în bazine și metoda prin care au fost obținute, precum și date care să demonstreze că măsurătorile se referă la concentrația substanței testate în soluția reală;
— caracteristicile apei de diluare: pH, duritate, alcalinitate, temperatură, concentrația oxigenului dizolvat, nivelul clorului rezidual (dacă se măsoară), carbon organic total, solide în suspensie, salinitatea mediului de lucru (dacă se măsoară) și orice alte măsurători efectuate;
— calitatea apei din bazine: pH, duritate, temperatură și concentrația oxigenului dizolvat;
— informații detaliate despre alimentație [de exemplu tipul alimentului (alimentelor), sursa, cantitatea administrată și frecvența].
2.3.4. Rezultatele:
— date demonstrând că loturile din bazinele martor au îndeplinit criteriile de validitate referitoare la supraviețuire și date privind mortalitatea de la fiecare nivel de concentrație;
— tehnicile de analiză statistică folosite, statistici întemeiate pe bazine-dublură sau pe fiecare pește, prelucrarea datelor și justificarea tehnicilor folosite;
— date tabelare privind greutățile corporale individuale și medii din zilele 0, 14 (dacă se măsoară) și 28, valorile ratelor de creștere specifice medii ale bazinelor sau pseudospecifice (după caz) pentru perioadele dintre ziua 0 și ziua 28 sau, posibil, dintre ziua 0 și ziua 14 și dintre ziua 14 și ziua 28;
— rezultatele analizei statistice (adică analiza prin regresie sau de varianță), de preferat în formă tabelară și grafică și CMEO (p = 0,05) și CFEO sau CEx cu erori standard când este posibil, după caz;
— incidența oricăror reacții neobișnuite a peștilor și orice efecte vizibile provocate de substanța testată.
3. REFERINȚE BIBLIOGRAFICE
1. Solbe J. F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No. PRD 1388-M/2.
2. Ashley S., Mallett M. J. and Grandy N. J. (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M.
3. Crossland N. O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, p. 1855-1870.
4. Nagel R., Bresh H., Caspers N., Hansen P. D., Market M., Munk R., Scholz N. and Höfte B.B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, p. 157-164.
5. Yamamoto, Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan.
6. Holcombe, G. W., Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R. D. (1995). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes).Arch. Environ. Conta. Toxicol. 28, p. 287-297.
7. Benoit, D. A., Holcombe, G. W. and Spehar, R. L. (1991). Guidelines for conducting early life toxicity tests with Japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3-91-063. U. S. Environmental Protection Agency, Duluth, Minnesota.
8. Stephan C.E. and Rogers J. W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R C Bahner and D J Hansen, Eds., American Society for Testing and Materials, Philadelphia, p. 328-338.
9. Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmon). Conservation and Protection, Ontario, Report EPS 1/RM/28, p. 81.
10. Cox D. R. (1958). Planning of experiments. Wiley Edt.
11. Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991.
12. Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc., 50, p. 1096-1121.
13. Dunnett C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, p. 482-491.
14. Williams D. A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, p. 103-117.
15. Johnston, W. L., Atkinson, J. L., Glanville N. T. (1994), A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, p. 123-133.
16. Quinton, J. C. and Blake, R. W. (1990), The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, p. 33-41.
17. Post, G. (1987), Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. 288 P.
18. Bruce, R. D. and Versteeg D.J. (1992), A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, p. 1485-1494.
19. DeGraeve, G. M., Cooney, J. M., Pollock, T. L., Reichenbach, J. H., Dean, Marcus, M. D. and McIntyre, D. O. (1989), Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. report EA-6189 (American Petroleum Institute Publication, n. 4468). Electric Power Research Institute, Palo alto, CA.
20. Norbert-King T. J. (1988), An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minnesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. p. 12.
21. Williams D. A. (1972), The comparison of several dose levels with a zero dose control. Biometrics 28, p. 510-531.
Apendice 1
SPECIILE DE PEȘTI RECOMANDATE PENTRU TESTARE ȘI CONDIȚIILE DE LUCRU ADECVATE
|
Specia |
Intervalul de temperatură recomandat ( oC) |
Perioada de expunere la lumină (ore) |
Intervalul recomandat pentru greutatea inițială a peștilor (g) |
Precizia obligatorie a măsurătorilor |
Rata de încărcare (g/l) |
Densitatea populației (pe litru) |
Alimentația |
Durata testului (zile) |
|
Specii recomandate: |
||||||||
|
Oncorhynchus mykiss păstrăv-curcubeu |
12,5 - 16,0 |
12-16 |
1-5 |
până la 100 mg |
1,2 - 2,0 |
4 |
Hrană uscată din larve salmonide (produsă sub licență) |
≥ 28 |
|
Alte specii bine studiate: |
||||||||
|
Danio rerio Peștele-zebră |
21-25 |
12-16 |
0,050 - 0,100 |
până la 1 mg |
0,2 - 1,0 |
5-10 |
Hrană vie (Brachionus Artemia) |
≥ 28 |
|
Oryzias latipes Medaka |
21-25 |
12-16 |
0,050 - 0,100 |
până la 1 mg |
0,2 - 1,0 |
5-20 |
Hrană vie (Brachionus Artemia) |
≥ 28 |
Apendice 2
UNELE CARACTERISTICI CHIMICE ALE UNEI APE DE DILUARE ACCEPTABILE
|
SUBSTANȚA |
CONCENTRAȚIILE |
|
materie în particule |
< 20 mg/l |
|
carbon organic total |
< 2 mg/l |
|
amoniac neionizat |
< 1 μg/l |
|
clor rezidual |
< 10 μg/l |
|
pesticide organofosforice totale |
< 50 ng/l |
|
pesticide organoclorice totale plus bifenili policlorinați |
< 50 ng/l |
|
clor organic total |
< 25 ng/l |
Apendice 3
Seriile logaritmice ale concentrațiilor adecvate pentru testul de toxicitate (9)
|
Coloană (număr de concentrații între 100 și 10 sau între 10 și 1) (1) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
||
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
||
|
1,6 |
3,2 |
5,2 |
7,5 |
|||
|
1,0 |
2,2 |
3,7 |
5,6 |
|||
|
1,5 |
2,7 |
4,2 |
||||
|
1,0 |
1,9 |
3,2 |
||||
|
1,4 |
2,4 |
|||||
|
1,0 |
1,8 |
|||||
|
1,3 |
||||||
|
1,0 |
||||||
|
(1) Dintr-o coloană poate fi aleasă o serie de cinci (sau mai multe) concentrații. Punctele de mijloc dintre concentrațiile din coloana (x) se găsesc în coloana (2x + 1). Valorile enumerate pot să reprezinte concentrații exprimate ca procente greutate pe unitatea de volum (mg/l sau μg/l). Valorile pot fi înmulțite sau împărțite cu orice putere a lui 10, după caz. Coloana 1 poate fi folosită dacă există o incertitudine semnificativă asupra nivelului de toxicitate. |
||||||
C.15. PEȘTII, TESTUL DE TOXICITATE PE TERMEN SCURT ÎN STADIILE DE EMBRION ȘI DE ALEVIN
1. METODĂ
Această metodă de testare a toxicității pe termen scurt reproduce Orientarea 212 (1998) a OCDE.
1.1. INTRODUCERE
Prezentul test de toxicitate pe termen scurt în stadiile de embrion și de alevin ale peștilor este un test în care sunt expuse toxicității stadiile de dezvoltare între începutul stadiului de ou fertilizat și sfârșitul stadiului de alevin. În acest test nu se administrează hrană și testul trebuie să se încheie când alevinii sunt încă hrăniți din sacul vitelin.
Testul urmărește să definească efectele letale și, în măsură limitată, efectele subletale ale produselor chimice asupra stadiilor de dezvoltare ale speciilor testate. Acest test furnizează informații utile, putând (a) să formeze o punte între testele letale și subletale, (b) să fie folosit ca test preliminar fie pentru un test de toxicitate complet în stadiile de viață timpurii, fie pentru testele de toxicitate cronică și (c) să fie folosit la testarea speciilor acolo unde tehnicile de creștere a animalelor de experiență nu sunt suficient de avansate pentru a acoperi perioada de trecere de la alimentația endogenă la cea exogenă.
Trebuie știut că numai testele care acoperă toate stadiile din ciclul de viață a peștelui sunt în general în măsură să prezinte o estimare corectă a toxicității cronice la pește a produselor chimice și orice expunere care omite vreunul din stadii poate reduce sensibilitatea și astfel poate subestima toxicitatea cronică. Prin urmare, este de așteptat ca testul pe embrioni și alevini să fie mai puțin sensibil decât un test complet în stadiile de viață timpurii, în special în privința produselor chimice puternic lipofile (log Pow > 4) și a celor având un mod specific de acțiune toxică. Cu toate acestea, este de așteptat ca diferențele de sensibilitate între cele două teste să fie mai mici în cazul produselor cu mod de acțiune nespecific, narcotic (1).
Înainte de publicarea acestui test, cea mai mare parte a experienței legate de testul pe embrioni și alevini s-a obținut cu peștii de râu Danio rerio Hamilton-Buchanan (Teleostei, Cyprinidae – nume popular peștele-zebră). Mai multe îndrumări detaliate asupra modului de lucru în cazul acestei specii sunt prezentate în apendicele 1. Aceasta nu exclude folosirea altor specii în cazul cărora există experiență acumulată (tabelele 1A și 1B)
1.2. DEFINIȚII
Concentrația minimă cu efect observabil (CMEO): este cea mai scăzută concentrație testată a substanței testate la care se constată un efect semnificativ (la p < 0,05) în comparație cu lotul martor. Cu toate acestea, toate concentrațiile mai mari decât CMEO trebuie să aibă efect nociv egal sau mai mare decât cel observat la CMEO.
Concentrația fără efecte observabile (CFEO): este concentrația testată imediat sub valoarea CMEO.
1.3. PRINCIPIUL METODEI DE TESTARE
Embrionii și alevinii sunt expuși la o serie de concentrații ale substanței testate dizolvate în apă. Protocolul de testare permite alegerea între regimul semistatic și cel dinamic. Alegerea depinde de natura substanței testate. Testul începe prin așezarea ouălor fertilizate în incintele experimentale și se încheie imediat înainte ca sacul vitelin al fiecărei larve din fiecare incintă să fi fost complet absorbit sau înainte de a apărea moartea prin inaniție la loturile martor. Efectele letale și subletale sunt evaluate și comparate cu valorile din loturile martor, pentru a determina concentrația minimă cu efect observabil și, de aici, concentrația fără efect observabil. O altă metodă este analiza folosind un model de regresie în scopul de a estima concentrația care ar provoca o variație procentuală dată (adică CL/CEx, unde x este definit ca % variație).
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA TESTATĂ
Ar trebui să fie disponibile rezultatele testului de toxicitate acută (a se vedea metoda C.1), de preferință efectuat pe specii alese pentru prezentul test. Rezultatele pot fi utile în alegerea intervalului adecvat de concentrații de lucru la testul în stadiile de viață timpurii. Ar trebui cunoscute solubilitatea în apă (inclusiv solubilitatea în apa folosită la test) și presiunea vaporilor substanței testate. Este oportun să fie disponibilă o metodă analitică fiabilă de cuantificare a substanței în soluții testate, a cărei precizie și ale cărei limite de detecție sunt cunoscute și menționate în raport.
Informațiile asupra substanței testate care sunt utile în fixarea condițiilor de lucru cuprind: formula structurală, puritatea substanței, stabilitatea la lumină, stabilitatea în condițiile testului, pKa, Pow și rezultatele unui test de biodegradabilitate rapidă (a se vedea metoda de testare C.4).
1.5. VALIDITATEA TESTULUI
Pentru ca testul să fie valid, trebuie îndeplinite următoarele condiții:
— supraviețuirea globală a ouălor fertilizate în loturile martor si, unde este cazul, în incintele conținând solvent, dar fără substanță testată, trebuie să fie mai mare sau egală cu limitele definite în apendicele 2 și 3;
— concentrația oxigenului dizolvat trebuie să fie între 60 % și 100 % din valoarea de saturație în aer (VSA), pe toată durata testului;
— temperatura apei nu trebuie să difere cu mai mult de ± 1,5 oC între incintele experimentale sau între zile succesive în orice moment al testului și trebuie să fie în intervalele de temperatură specificate pentru specia testată (apendicele 2 și 3).
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Incintele experimentale
Pot fi folosite orice recipiente de sticlă sau din alt material chimic inert. Dimensiunile recipientelor trebuie să fie suficient de mari pentru a permite respectarea ratei de încărcare (a se vedea punctul 1.7.1.2). Se recomandă poziționarea aleatoare a incintelor în laborator. La dispunerea incintelor, o schemă de randomizare a blocurilor de incinte, fiecare tratament fiind reprezentat în fiecare bloc, este preferabilă unei scheme de randomizare integrală a incintelor, dacă în laborator există efecte sistematice care pot fi controlate folosind gruparea incintelor. Gruparea în blocuri, dacă se folosește, trebuie să fie luată în considerare în analiza ulterioară a rezultatelor. Incintele experimentale trebuie protejate de orice perturbare nedorită.
1.6.2. Alegerea speciilor de pești
Speciile de pești recomandate sunt prezentate în tabelul 1A. Aceasta nu exclude folosirea altor specii (exemple sunt prezentate în tabelul 1B), dar modul de lucru trebuie adaptat pentru a asigura condiții corespunzătoare. În acest caz, justificarea alegerii speciei și a metodei de testare trebuie specificată în raport.
1.6.3. Îngrijirea peștilor reproducători
Detalii despre îngrijirea populației de pești reproducători în condiții satisfăcătoare se găsesc în Orientarea 210 a OCDE ( 31 ) și în referințele bibliografice 2, 3, 4, 5 și 6.
1.6.4. Manipularea embrionilor și a larvelor
Embrionii și larvele pot fi puse, în interiorul cuvei principale, în recipiente mai mici, cu laturile sau extremitățile din plasă, pentru a permite curgerea soluției prin recipient. Curgerea neturbulentă prin aceste recipiente mici poate fi indusă prin atașarea lor la un braț mobil, care deplasează vertical recipientele, dar așa încât să mențină organismele imersate; se poate folosi de asemenea un sistem sifon. Ouăle fertilizate de salmonide pot fi puse pe suporturi sau site cu ochiul suficient de mare pentru a permite larvelor să traverseze după eclozare. Folosirea pipetelor Pasteur este oportună pentru îndepărtarea embrionilor și a larvelor în testele semistatice cu schimbarea zilnică și completă a apei (a se vedea punctul 1.6.6).
Când au fost folosite recipiente, site sau plase pentru a păstra ouăle în cuva principală, acestea trebuie îndepărtate după eclozarea larvelor (31) , cu excepția plaselor care sunt păstrate pentru a împiedica peștii să scape. Dacă este necesar să se transfere larvele, acestea nu trebuie expuse la aer și nu trebuie folosite minciocuri pentru a scoate peștii din recipientele conținând ouăle (aceste precauții nu sunt necesare în cazul speciilor mai puțin fragile, cum este crapul). Momentul transferului variază în funcție de specie și transferul nu este întotdeauna necesar. În regim semistatic se pot folosi pahare de laborator sau vase cu înălțimea redusă și, dacă este necesar, echipate cu o sită la mică distanță de fundul paharului. Dacă volumul acestor recipiente este suficient pentru a respecta cerințele de încărcare (a se vedea 1.7.1.2) nu este necesar transferul embrionilor și larvelor.
1.6.5. Apa
Este corespunzătoare pentru test orice apă care respectă caracteristicile chimice ale unei ape de diluare enumerate în apendicele 4 și în care supraviețuirea loturilor martor din specia testată este cel puțin la fel de bună ca aceea prezentată în apendicele 2 și 3. Apa trebuie să își mențină calitatea constantă pe durata testului. pH-ul trebuie să rămână în intervalul de ± 0,5 unități. Pentru ca apa de diluare să nu influențeze în mod nepermis rezultatele testelor (de exemplu prin complexare cu substanța testată) sau să afecteze negativ comportamentul peștilor reproducători, trebuie luate probe la intervale egale pentru analiză. Acolo unde se cunoaște calitatea relativ constantă a apei de diluare, se măsoară, de exemplu, la interval de trei luni conținutul în metale grele (de exemplu: Cu, Pb, Zn, Hg, Cd și Ni), anioni și cationi principali (de exemplu: Ca, Mg, Na, K, Cl și SO4), pesticide (de exemplu pesticide organofosforice totale și pesticide organoclorice totale), carbon organic total, solide în suspensie. Dacă s-a demonstrat că apa are calitate constantă pe o perioadă de cel puțin un an, analizele se pot efectua la intervale mai mari (de exemplu la fiecare șase luni).
1.6.6. Soluțiile de lucru
Soluțiile de lucru de concentrații date se prepară prin diluarea unei soluții de bază.
Soluția de bază se prepară de preferință prin simpla amestecare sau agitare a substanței testate în apa de diluare, folosind mijloace mecanice (de exemplu cu agitator sau ultrasunete). Pentru obținerea unei soluții de bază cu o concentrație corespunzătoare se pot folosi coloane de saturare (coloane de solubilitate). Folosirea solvenților sau a agenților de dispersie trebuie evitată pe cât posibil; totuși, în unele cazuri, astfel de compuși pot fi necesari pentru a produce o soluție de bază cu o concentrație corespunzătoare. Exemple de solvenți adecvați sunt acetona, etanolul, metanolul, dimetilsulfoxidul, dimetilformamida și trietilenglicolul. Exemple de agenți de dispersie adecvați sunt Cremophor RH40, Tween 80, metilceluloză 0,01 % și HCO-40. Folosirea compușilor ușor biodegradabili (de exemplu acetona) și a compușilor foarte volatili trebuie să se facă atent, deoarece aceștia pot antrena proliferarea bacteriană în testele cu regim dinamic. Când se folosește un agent de dispersie, acesta trebuie, în demonstrația pe un lot martor tratat numai cu solventul, să nu provoace efecte semnificative asupra supraviețuirii și nici efecte adverse vizibile asupra stadiilor de viață timpurii.
La testele în regim semistatic, pot fi adoptate două moduri de lucru diferite: fie (i) se prepară soluții de lucru noi în recipiente curate, iar ouăle și larvele sunt transferate cu grijă în noile recipiente, într-un volum mic din vechea soluție evitând expunerea la aer fie (ii) organismele sunt păstrate în recipientele inițiale în timp ce o fracțiune (cel puțin trei sferturi) din apa de testare este schimbată. Frecvența schimbării apei depinde de stabilitatea substanței testate, dar se recomandă schimbarea zilnică. Dacă testele de stabilitate preliminare (a se vedea punctul 1.4) arată o instabilitate a concentrației substanței testate (adică în afara intervalului de 80-120 % din concentrația nominală sau sub 80 % din concentrația măsurată inițial) pe parcursul schimbării apei, trebuie luată în considerare folosirea unui test în regim dinamic. În oricare dintre cazuri, trebuie evitată stresarea larvelor în timpul operațiunii de schimbare a apei.
La testele în regim dinamic este necesar un sistem care să dozeze și să dilueze continuu soluția de bază a substanței testate (de exemplu pompă dozatoare, diluator proporțional, sistem de saturație) pentru a asigura seria concentrațiilor din incintele experimentale. Debitele soluțiilor de bază și ale apei de diluare trebuie verificate la intervale definite, de preferință zilnic, pe durata testului și trebuie să nu varieze cu mai mult de 10 % pe parcursul întregului test. Un debit echivalent cu cel puțin cinci volume de incintă în 24 de ore s-a dovedit adecvat (2)
1.7. DESFĂȘURAREA TESTULUI
Informații utile despre desfășurarea testelor pe embrioni de pește și alevini sunt disponibile în literatură, unele exemple fiind incluse în referințele bibliografice din prezentul text (7) (8) (9).
1.7.1. Condițiile de expunere
1.7.1.1. Durata
Testul este recomandabil să înceapă în următoarele 30 de minute după fertilizarea ouălor. Embrionii sunt imersați în soluția testată înainte sau cât de curând după începerea fazei de segmentare a blastodiscului și în orice caz înainte de debutul fazei de gastrulă. În cazul ouălor obținute de la furnizori comerciali, s-ar putea să nu fie posibilă începerea testului imediat după fertilizare. Deoarece amânarea începerii testului poate influența puternic sensibilitatea acestuia, testul trebuie inițiat în următoarele opt ore după fertilizare. Deoarece larvele nu sunt hrănite pe durata expunerii, testul trebuie să se încheie imediat înainte ca sacul vitelin al fiecărei larve din fiecare incintă să fi fost complet absorbit sau înainte de a apărea moartea prin inaniție la loturile martor. Durata depinde de specia folosită. Câteva durate recomandate sunt prezentate în apendicele 2 și 3.
1.7.1.2. Încărcarea
Numărul de ouă fertilizate la începutul testului trebuie să fie suficient pentru a îndeplini condițiile statistice. Ele trebuie distribuite aleator între tratamente și trebuie folosite la fiecare concentrație cel puțin 30 de ouă, împărțite în loturi egale (sau cât mai uniforme numeric, deoarece poate fi dificil să se obțină loturi egale când se folosesc unele specii) în cel puțin trei incinte identice. Rata de încărcare (biomasă pe volum de soluție de lucru) trebuie să fie suficient de scăzută pentru ca o concentrație a oxigenului dizolvat de minimum 60 % VSA să se poată menține fără aerare. La testele în regim dinamic a fost recomandată (2) o rată de încărcare nedepășind 0,5 g/l în 24 de ore și nedepășind 5 g/l de soluție în orice moment.
1.7.1.3. Lumina și temperatura
Perioada de expunere la lumină și temperatura apei trebuie să fie adecvate pentru specia testată (apendicele 2 și 3). În scopul monitorizării temperaturii, poate fi adecvată folosirea unui recipient martor suplimentar.
1.7.2. Concentrațiile de lucru
În mod normal, sunt necesare cinci valori de concentrații ale substanței testate, aflate în progresie geometrică cu o rație care să nu depășească 3,2. La alegerea intervalului de concentrații trebuie luată în considerare curba reprezentând CL50 în funcție de expunere, rezultată din studiul de toxicitate acută. Folosirea a mai puțin de cinci concentrații, de exemplu în testele la valori-limită, și un interval mai îngust se pot dovedi adecvate în unele cazuri. Trebuie justificată folosirea a mai puțin de cinci concentrații. Nu este necesară testarea concentrațiilor mai ridicate fie de CL50 la 96 de ore, fie mai ridicate de 100 mg/l (care valoare este mai scăzută dintre acestea) Concentrația maximă testată nu trebuie să depășească limita de solubilitate a substanței în apă.
Când se folosește un agent de dispersie la prepararea soluțiilor (a se vedea punctul 1.6.6), concentrația finală a acestuia în recipiente trebuie să nu depășească 0,1 ml/l și este de preferat să fie aceeași în toate recipientele.
1.7.3. Loturile martor
În paralel cu loturile tratate trebuie să fie studiate și loturile dintr-o incintă cu apă de diluare (cu dublură, dacă este cazul) și, dacă prezintă relevanță, dintr-o incintă cu agent de dispersie (cu dublură, dacă este cazul).
1.7.4. Frecvența măsurătorilor și a determinărilor analitice
Pe durata testului concentrațiile substanței testate se determină cu regularitate.
La testele în regim semistatic în care concentrația substanței testate este de așteptat să rămână în intervalul ± 20 % față de valoarea nominală (adică în intervalul 80-120 %; a se vedea punctele 1.4 și 1.6.6), se recomandă ca, minimal, concentrația cea mai ridicată și cea mai scăzută să fie analizate imediat după preparare și la schimbarea apei de cel puțin trei ori, la intervale egale pe durata testului (adică analizele trebuie efectuate pe o probă din aceeași soluție, o dată când este proaspăt preparată și o dată înainte de schimbarea apei).
La testele în care concentrațiile nu este de așteptat să rămână în intervalul ± 20 % față de valoarea nominală (pe baza datelor referitoare la stabilitatea substanței), trebuie analizate toate concentrațiile imediat după preparare și imediat înainte de schimbarea apei, dar urmând aceeași metodă (adică de cel puțin trei ori la intervale egale pe durata testului. Determinarea concentrațiilor substanței testate înainte de schimbarea apei este suficient să fie făcută numai la un singur recipient la fiecare concentrație. Determinările trebuie să nu fie făcute la intervale mai lungi de șapte zile. Se recomandă ca rezultatele să fie fundamentate pe concentrații măsurate. Cu toate acestea, atunci când, în mod demonstrabil, concentrația substanței testate în soluție a fost menținută pe parcursul întregului test în intervalul ± 20 % față de concentrația nominală sau concentrația măsurată inițial, rezultatele pot fi fundamentate pe valorile nominale sau măsurate inițial.
La testele în regim dinamic este adecvat un sistem de prelevare a probelor similar cu acela prescris pentru regimul semistatic (dar măsurarea soluțiilor „vechi” nu se aplică în acest caz). Cu toate acestea, dacă durata testului este mai mare de șapte zile, este recomandabilă creșterea numărului de prelevări în prima săptămână (de exemplu trei seturi de măsurători) pentru a se asigura stabilitatea concentrațiilor.
Se poate dovedi necesară centrifugarea probelor sau filtrarea lor (de exemplu cu ajutorul unui filtru cu pori de 0,45 μm). Cu toate acestea, deoarece se pare că nici centrifugarea nici filtrarea nu separă întotdeauna fracția non-biodisponibilă a substanței testate de fracțiunea biodisponibilă, se poate dovedi inutilă supunerea probelor la aceste tratamente.
În timpul testului, oxigenul dizolvat, pH-ul și temperatura se măsoară în toate bazinele. Duritatea totală și salinitatea (dacă are relevanță) se măsoară în incintele martor și în incinta cu cea mai ridicată concentrație. Minimal, oxigenul dizolvat și salinitatea (dacă are relevanță) se măsoară de trei ori (la începutul, la jumătatea și la sfârșitul testului). În testele în regim semistatic, se recomandă ca oxigenul dizolvat să se măsoare mai frecvent, de preferință înainte și după schimbarea apei sau cel puțin o dată pe săptămână. pH-ul trebuie măsurat la începutul și la sfârșitul fiecărei schimbări a apei la testele în regim semistatic și cel puțin săptămânal la testele în regim dinamic. Duritatea trebuie măsurată o dată la fiecare test. Temperatura se măsoară zilnic și este de preferat să fie monitorizată continuu cel puțin într-una din incinte.
1.7.5. Observații
1.7.5.1. Stadiul dezvoltării embrionare
Stadiul embrionar (adică stadiul de gastrulă) la începutul expunerii la substanța testată trebuie verificat cât mai exact posibil. Aceasta se poate face folosind un eșantion reprezentativ de ouă păstrate corespunzător și curățate până devin translucide. Pentru descrierea și ilustrarea stadiilor embrionare se poate consulta și literatura (2) (5) (10) (11).
1.7.5.2. Eclozarea și supraviețuirea
Observațiile referitoare la eclozare și supraviețuire trebuie să fie făcute cel puțin o dată pe zi și numărul ouălor eclozate și al supraviețuitorilor trebuie înregistrat. La începutul testului este de dorit ca observațiile să fie mai frecvente (de exemplu la fiecare 30 de minute în primele trei ore), deoarece în unele cazuri timpul de supraviețuire este mai relevant decât numărul deceselor (de exemplu când există efecte toxice acute). Embrionii și larvele moarte trebuie îndepărtate imediat ce sunt observate, fiindcă se pot descompune rapid. La îndepărtarea exemplarelor moarte trebuie să se manifeste o grijă extremă pentru a nu răni sau leza ouăle/larvele din vecinătate, acestea fiind extrem de delicate și de sensibile. Simptomele care indică moartea organismului variază în funcție de stadiul de viață:
— pentru ouă: în special în stadiile timpurii, o pierdere accentuată a translucidității și schimbarea colorației, provocată de coagularea și precipitarea proteinelor, conducând la un aspect alb-opac;
— pentru embrioni: absența mișcărilor corpului și absența bătăilor inimii și decolorarea opacă la speciile ai căror embrioni sunt în mod normal translucizi;
— pentru larve: imobilitatea și absența mișcărilor respiratorii și absența bătăilor inimii și colorația alb-opacă a sistemului nervos central și absența reacției la stimuli mecanici.
1.7.5.3. Aspectul anormal
Numărul larvelor prezentând anomalii ale formei corpului și pigmentare, precum și stadiul absorbției sacului vitelin trebuie înregistrate la intervale adecvate, în funcție de durata testului și de natura anomaliei în cauză. Trebuie spus că embrioni și larve anormale apar în mod natural și numărul lor poate reprezenta câteva procente în loturile martor ale unor specii. Animalele anormale nu trebuie îndepărtate din recipiente decât atunci când mor.
1.7.5.4. Comportamentul anormal
Anomaliile, de exemplu hiperventilarea, înotul necoordonat și imobilitatea neobișnuită, trebuie înregistrate la intervale adecvate, în funcție de durata testului. Aceste efecte, deși dificil de cuantificat, pot, atunci când sunt ținute sub observație, să ajute la interpretarea datelor privind mortalitatea, adică pot furniza informații despre modul de acțiune toxică a substanței.
1.7.5.5. Lungimea
La sfârșitul testului se recomandă măsurarea lungimilor individuale; poate fi folosită oricare din lungimile standard, până la scobitura caudală sau totală. Cu toate acestea, dacă se constată o putrefacție sau o rosătură la înotătoarea caudală, se folosesc lungimile standard. În general, într-un test efectuat corect, coeficientul de variație a lungimii în lotul martor este ≤ 20 %.
1.7.5.6. Greutatea
La încheierea testului poate fi măsurată greutatea corporală individuală; greutatea organismului uscat (24 de ore la 60 oC) este preferată greutății in vivo (pește zvântat). În general, într-un test efectuat corect, coeficientul de variație a lungimii în lotul martor este ≤ 20 %.
Aceste observații pun la dispoziția analizei statistice totalitatea datelor următoare sau unele dintre acestea:
— mortalitatea cumulată;
— numărul larvelor sănătoase la încheierea testului;
— momentele de început și sfârșit al eclozării (adică 90 % ouă eclozate în fiecare incintă de la același nivel al concentrației);
— numărul larvelor eclozate în fiecare zi;
— lungimea (și greutatea) animalelor supraviețuitoare la încheierea testului;
— numărul larvelor cu diformități sau cu aspect anormal;
— numărul larvelor prezentând comportament anormal.
2. DATE ȘI RAPORT
2.1. PRELUCRAREA REZULTATELOR
Se recomandă implicarea unui statistician atât în structurarea cât și în analiza testului, deoarece această metodă de testare permite variații considerabile în modul de lucru, cum ar fi, de exemplu, variații în numărul de incinte experimentale și de concentrații folosite, în numărul inițial de ouă fertilizate și în parametrii măsurați. Luând în considerare opțiunile disponibile în structurarea testului, nu sunt prezentate aici îndrumările specifice referitoare la metoda statistică.
Dacă urmează să fie estimate CMEO/CFEO, este necesar ca variațiile să fie estimate în cadrul fiecărui set de incinte de la aceeași concentrație, folosind analiza de variație sau metodele tabelelor de contingență. Metoda Dunnett se poate dovedi folositoare (12) (13) pentru a realiza o comparație multiplă între rezultatele obținute la concentrații individuale și rezultatele obținute în legătură cu loturile martor. De asemenea sunt disponibile și alte exemple utile (14) (15). Mărimea efectului detectabil folosind analiza de varianță sau alte metode (adică puterea testului) trebuie calculată și menționată în raport. Trebuie spus că nu toate observațiile enumerate la punctul 1.7.5.6 sunt adecvate pentru analiza statistică de varianță. De exemplu, mortalitatea cumulată și numărul larvelor sănătoase la încheierea testului pot fi analizate folosind metode probit.
Dacă urmează să fie estimate CL/CEx, una sau mai multe curbe, cum ar fi curba logistică, trebuie ajustate la datele studiate folosind o metodă precum metoda celor mai mici pătrate sau metoda celor mai mici pătrate neliniare. Curba (curbele) trebuie parametrizate astfel încât CL/CEx studiate și eroarea standard respectivă să poată fi estimate direct. Aceasta va ușura mult calculul intervalului de încredere din jurul CL/CEx. Dacă nu sunt motive întemeiate să fie preferate alte niveluri de încredere, ar trebui alese nivelurile de 95 % la ambele capete ale intervalului. Este de preferat ca metoda de ajustare să asigure un mijloc de a evalua semnificația neajustării. Pot fi folosite metode grafice de ajustare a curbelor. Analiza prin regresie este adecvată pentru toate observațiile enumerate la punctul 1.7.5.6.
2.2. INTERPRETAREA REZULTATELOR
Rezultatele se interpretează cu precauție atunci când concentrațiile măsurate ale substanțelor toxice ajung la niveluri apropiate de limitele de detecție ale metodei analitice. Rezultatele se interpretează de asemenea cu precauție în cazul concentrațiilor mai mari decât solubilitatea în apă a substanței.
2.3. RAPORTUL DE TESTARE
Raportul de testare trebuie să cuprindă următoarele informații:
2.3.1. Substanța testată:
— natura fizică și proprietățile fizico-chimice relevante,
— datele de identificare chimică, inclusiv puritatea și metoda analitică de cuantificare a substanței, după caz.
2.3.2. Specia testată:
— numele științific, sușa, numărul peștilor parentali (câte femele au fost folosite pentru a asigura numărul necesar de ouă), sursa și metoda de colectare a ouălor fertilizate și manipularea ulterioară.
2.3.3. Condițiile de testare:
— metoda folosită (de exemplu: regim semistatic, regim dinamic, timpul scurs de la fertilizare până la începerea testului, încărcare etc.);
— perioada (perioadele) de expunere la lumină;
— structurarea testului (de exemplu: număr de incinte și de dubluri, număr de embrioni pe incintă);
— metoda de preparare a soluțiilor de bază și frecvența schimbării apei (trebuie specificat agentul de solubilizare și concentrația acestuia, dacă se folosește);
— concentrațiile de lucru nominale, valorile măsurate, mediile lor și deviațiile lor standard în recipiente și metoda prin care au fost obținute, precum și, dacă substanța testată este solubilă în apă la concentrații mai reduse decât cele testate, date care să demonstreze că măsurătorile se referă la concentrațiile substanței testate în soluție reală;
— caracteristicile apei de diluare: pH, duritate, temperatură, concentrația oxigenului dizolvat, nivelul clorului rezidual (dacă se măsoară), carbon organic total, solide în suspensie, salinitatea mediului de lucru (dacă se măsoară) și orice alte măsurători efectuate;
— calitatea apei din recipiente: pH, duritate, temperatură și concentrația oxigenului dizolvat.
2.3.4. Rezultatele:
— rezultatele oricăror studii preliminare referitoare la stabilitatea substanței testate;
— date demonstrând că loturile din incintele martor au îndeplinit standardul de supraviețuire globală acceptabilă al speciei testate (apendicele 2 și 3);
— rezultate despre mortalitate/supraviețuire în stadiile de embrion și larvă și mortalitatea/supraviețuirea globală;
— zilele de eclozare și numărul eclozărilor;
— lungimea (și greutatea) corporală;
— incidența și descrierea anomaliilor morfologice, dacă există;
— incidența și descrierea efectelor comportamentale, dacă există;
— analiza statistică și prelucrarea datelor;
— la testele analizate folosind analiza de varianță, concentrația minimă cu efecte observabile (CMEO) la p = 0,05 și concentrația fără efecte observabile (CFEO) pentru fiecare răspuns evaluat, inclusiv descrierea metodelor statistice folosite și indicarea mărimii efectului care poate fi detectat;
— la testele analizate folosind analiza prin regresie, CL/CEx și intervalele de încredere, precum și un grafic al modelului ajustat folosit în calcule;
— explicații pentru orice abatere de la această metodă de testare.
3. REFERINȚE BIBLIOGRAFICE
1. Kristensen P. (1990) Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, p. 60, June 1990.
2. ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. p. 26.
3. Brauhn J. L. and Schoettger R.A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
4. Brungs W. A. and Jones B. R. (1977) Temperature Criteria for Freshwater Fish: Protocol and Procedures p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
5. Laale H. W. (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, p. 121-173.
6. Legault R. (1958) A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, p. 328-330.
7. Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, p. 61-71.
8. Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, p. 807-821.
9. Van Leeuwen C.J., Espeldoorn A. and Mol F. (1986) Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, p. 129-145.
10. Kirchen R.V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
11. Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina, p. 36.
12. Dunnett C. W. (1955) A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, p. 1096-1121.
13. Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, p. 482-491.
14. Mc Clave J. T., Sullivan J. H. and Pearson J. G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
15. Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, p. 321-334.
16. Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, p. 81.
17. Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, p. 126-134.
18. Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology – an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: p. 231-236.
19. Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, p. 19-28.
20. US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
21. US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
22. De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L., Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, p. 1189-1203.
23. Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
24. Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, p. 280.
25. Blaxter J. H. S. (1988). Pattern and variety in development, In: W. S. Hoar and D. J. Randall Eds., Fish Physiology, vol. XIA, Academic press, p. 1-58.
Tabelul 1a
Specii de pești recomandate pentru testare
|
APĂ DULCE |
|
Oncorhynchus mykiss Păstrăv-curcubeu (9) (16) |
|
Danio rerio Peștele-zebră (7) (17) (18) |
|
Cyprinus caprio Crap (8) (19) |
|
Oryzias latipes Medaka (20) (21) |
|
Pimephales promelas (8) (22) |
Tabelul 1b
Exemple de alte specii de pești bine studiate care au fost folosite
|
APĂ DULCE |
APĂ SĂRATĂ |
|
Carassius auratus Caras auriu (8) |
Menidia peninsulae (23) (24) (25) |
|
Lepomis macrochirus (8) |
Clupea harengus Herring (24) (25) |
|
Gadus morhua Cod (24) (25) |
|
|
Cyprinodon variegatus (23) (24) (25) |
Apendicele 1
GHID PENTRU EFECTUAREA UNUI TEST DE TOXICITATE LA EMBRIONI ȘI ALEVINI DE PEȘTE-ZEBRĂ (BRACHYDANIO RERIO)
INTRODUCERE
Peștele zebră provine de pe coasta Coromandel din India unde trăiește în apele repezi. Este un pește obișnuit de acvariu din familia crapului și datele referitoare la creșterea și îngrijirea acestuia se pot găsi în cărțile de specialitate privind peștii tropicali. Laale descrie biologia și utilizarea acestuia în studiul privind peștii (1).
Acest pește are rareori o lungime mai mare de 45 cm. Corpul este cilindric cu 7-9 dungi argintii orizontale de culoare albastru închis. Aceste dungi ajung până la înotătoarele caudale și anale. Spatele este de culoare verde-măsliniu. Masculii sunt mai subțiri decât femelele. Femelele sunt mai argintii și abdomenul este umflat, în special înainte de depunerea icrelor.
Peștii adulți pot să suporte fluctuații mari de temperatură, pH și duritate a apei. Cu toate acestea, pentru a obține pești sănătoși care să producă icre de bună calitate, trebuie asigurate condiții optime.
În timpul depunerii icrelor, masculii urmăresc și lovesc cu capul femelele și astfel se produce fecundarea icrelor atunci când sunt expulzate. Icrele, care sunt transparente și nelipicioase, cad la fund unde pot fi mâncate de părinți. Depunerea icrelor este influențată de lumină. Dacă lumina dimineții este corespunzătoare, peștele depune icrele de obicei în primele ore din zori.
O femelă poate să producă loturi de câteva sute de icre săptămânal.
CONDIȚII PENTRU PEȘTII PĂRINȚI, REPRODUCERE ȘI PRIMELE STADII DE VIAȚĂ
Se selectează un număr potrivit de pești sănătoși care se păstrează în apă corespunzătoare (de exemplu apendicele 4) cu cel puțin două săptămâni înainte de data preconizată pentru depunerea icrelor. Este necesar ca grupul de pești să fie lăsat să se reproducă cel puțin o dată înaintea producerii lotului de icre utilizate în test. Densitatea peștelui în perioada respectivă nu trebuie să depășească 1 gram de pește per litru. Schimbările regulate de apă sau utilizarea sistemelor de purificare permit o densitate mai mare. Temperatura din acvarii se menține la 25 ± 2 oC. Peștelui trebuie să i se asigure o alimentație variată, care poate să conțină, de exemplu hrana uscată specifică comercializată, Arthemia, chironomide, dafnia vii proaspăt ieșiți din ou, viermi albi (Enchytraeide).
În continuare, sunt prezentate două procedee, prin care s-a obținut în practică un lot suficient de icre fecundate, sănătoase pentru efectuarea unui test:
(i) 8 femele și 16 masculi se introduc într-un acvariu cu 50 litri apă de diluție, ecranat de lumina directă și se lasă cât se poate de liniștiți timp de 48 ore. La fundul vasului se așează o tavă pentru depunerea icrelor în după-amiaza zilei de dinaintea inițierii testului. Tava pentru depunerea icrelor este alcătuită dintr-un cadru (plexiglas sau alt material potrivit) înalt de 5-7 cm, prevăzut cu o plasă cu ochiuri mari, de 2-5 mm, fixată la partea superioară și o plasă fină, cu ochiuri de 10-30 μm, la partea inferioară. La plasele cu ochiuri mari ale cadrului, se atașează un număr de „pomi pentru depunerea icrelor” dintr-o frânghie de nylon nerăsucită. După ce peștii au fost lăsați în întuneric timp de 12 ore, se aprinde o lumină slabă care va iniția depunerea icrelor. La 2-4 ore după depunerea icrelor, se scoate tava pentru depunerea icrelor și se colectează icrele. Cu tava pentru depunerea icrelor se evită mâncarea icrelor de către pești și se facilitează colectarea icrelor. Este necesar ca grupul de pești să fi depus icre cel puțin o dată înaintea depunerii din care se iau icre pentru efectuarea testului.
(ii) Un număr de 5-10 masculi și femele se adăpostesc individual cu cel puțin două săptămâni înaintea depunerii icrelor. După 5-10 zile, abdomenele femelelor se umflă și papila genitală a acestora devine vizibilă. Masculii nu au papilă. Depunerea icrelor se realizează în acvarii de depunere a icrelor prevăzute cu un fund fals din plasă (cum s-a descris anterior). Acvariul este umplut cu apă de diluție, astfel încât, deasupra plasei apa să fie de 5-10 cm. O femelă și doi masculi se introduc în acvariu cu o zi înaintea datei preconizate pentru depunerea icrelor. Temperatura apei se crește treptat la o valoare cu un grad mai mare decât temperatura de aclimatizare. Se stinge lumina și acvariul se lasă cât se poate de liniștit. Dimineață, se aprinde o lumină slabă care va iniția depunerea icrelor. După 2-4 ore, peștele se scoate și se colectează icrele. Dacă sunt necesare loturi mai mari de icre decât se pot obține de la o femelă, se pot instala, în paralel, mai multe acvarii de depunere a icrelor. Prin înregistrarea rezultatului fiecărei femele înaintea testului (dimensiunea lotului și calitatea), se selectează pentru reproducere femelele cu cele mai bune rezultate la reproducere.
Este necesar ca icrele să fie transferate în vasele pentru efectuarea testului cu ajutorul unor tuburi de sticlă (diametrul interior de minimum 4 mm) prevăzute cu un bulb de aspirație flexibil. Cantitatea de apă care se transferă odată cu icrele trebuie să fie cât mai mică posibilă. Icrele sunt mai grele decât apa și ies pe la fundul tubului. Trebuie avut grijă pentru a preveni ca icrele (și larvele) să vină în contact cu aerul. Proba (probele) din lot(uri) se examinează la microscop pentru a se asigura că nu există anomalii în primele etape de dezvoltare a embrionului. Nu este permisă dezinfecția icrelor.
Rata mortalității icrelor atinge apogeul în primele 24 de ore după fecundare. În această perioadă, se întâlnește adesea o mortalitate de 5-40 %. Icrele degenerează ca urmare a unei fecundări nereușite sau a dezvoltării insuficiente a embrionului. Calitatea lotului de icre se pare că depinde de peștele femelă, deoarece unele femele produc în mod constant icre de bună calitate, iar altele niciodată. De asemenea, rata de dezvoltare a embrionului și rata de ieșire din ou variază de la un lot la altul. Icrele fecundate cu succes și larvele din sacul vitelin supraviețuiesc bine, în mod normal peste 90 %. La 25 oC, ieșirea din ou se produce la 3-5 zile de la fertilizare și sacul vitelin se absoarbe în aproximativ 13 zile după fecundare.
Hisaoka și Battle au descris bine dezvoltarea embrionului (2). Datorită transparenței icrelor și larvelor după ieșirea din ou, se poate urmări dezvoltarea peștelui și este posibilă observarea malformațiilor. La aproximativ patru ore după depunerea icrelor, icrele nefecundate se pot distinge de cele fecundate (3). Pentru a efectua această examinare, icrele și larvele se așează pe vase de laborator de volum mic și se studiază la microscop.
Condițiile de desfășurare a testului, care se aplică în primele etape de viață, sunt prezentate în lista din apendicele 2. Valorile optime ale pH-ului și durității apei de diluție sunt 7,8 și, respectiv, 250 mg CaCO3/l.
CALCULE ȘI STATISTICĂ
Se propune un procedeu în două etape. Mai întâi, se analizează statistic datele privind mortalitatea, dezvoltarea anormală și momentul ieșirii din ou. Apoi, pentru acele concentrații la care nu s-au observat efecte negative asupra oricăruia din parametrii menționați, se evaluează statistic lungimea corpului. Această abordare este recomandabilă deoarece toxicul poate să ucidă selectiv peștii mai mici, să întârzie momentul ieșirii din ou și să inducă malformații majore, obținându-se astfel măsurători viciate ale lungimii. În plus, pentru fiecare tratament, va exista același număr de pești ce urmează să se măsoare, asigurându-se validitatea statisticii testului.
DETERMINAREA CL50 ȘI CE50
Se calculează procentul de icre și larve supraviețuitoare și se corectează cu mortalitatea din probele martor conform formulei lui Abbott (4):

unde:
|
P |
= |
supraviețuirea corectată, % |
|
P' |
= |
supraviețuirea observată la concentrațiile experimentate, % |
|
C |
= |
supraviețuirea în cazul martorului, % |
Dacă este posibil, CL50 se determină printr-o metodă corespunzătoare la sfârșitul testului.
Dacă se dorește introducerea anomaliilor morfologice în statistica CE50, se poate folosi lucrarea lui Stephan (5) pentru orientare.
ESTIMAREA CMEO ȘI CFEO
Un obiectiv al testului efectuat pe icre și alevini este compararea concentrațiilor non-zero cu proba martor, adică determinarea CMEO. Pentru aceasta se utilizează multiple procedee de comparare (6) (7) (8) (9) (10).
REFERINȚE BIBLIOGRAFICE
1. Laale H. W. (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, p. 121-173.
2. Hisaoka K. K. and Battle H.I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, p. 311.
3. Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, p. 173-181.
4. Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, p. 1-333.
5. Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, p. 69-81.
6. Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, p. 1096-1121.
7. Dunnett C. W. (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, p. 482-491.
8. Williams D. A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, p. 103-117.
9. Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, p. 519-531.
10. Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W.H. Freeman and Co., San Francisco.
Apendicele 2
CONDIȚIILE, DURATA TESTULUI ȘI CRITERIILE DE SUPRAVIEȚUIRE PENTRU SPECIILE RECOMANDATE
|
Specia |
Temperatura (oC) |
Salinitatea (0/00) |
Perioada de expunere la lumină (ore) |
Durata etapelor (zile) |
Durata normală a testului |
Supraviețuirea martorului (minimum %) |
||
|
Embrion |
Alevin |
Reușita ieșirii din ou |
După ieșirea din ou |
|||||
|
Brachydanio rerio Peștele-zebră |
25 ± 1 |
— |
12-16 |
3-5 |
8-10 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 5 zile după ieșirea din ou (8-10 zile) |
80 |
90 |
|
Oncorhynchus mykiss Păstrăv-curcubeu |
10 ± 1 (1) 12 ± 1 (2) |
— |
0 () |
30-35 |
25-30 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 20 de zile după ieșirea din ou (50-55 zile) |
66 |
70 |
|
Cyprinus carpio Crap |
21-25 |
— |
12-16 |
5 |
> 4 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 4 zile după ieșirea din ou (8-9 zile) |
80 |
75 |
|
Oryzias latipes Medaka |
24 ± 1 (1) 23 ± 1 (2) |
— |
12-16 |
8-11 |
4-8 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 5 zile după ieșirea din ou (13-16 zile) |
80 |
80 |
|
Pimephales promelas |
25 ± 2 |
— |
16 |
4-5 |
5 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 4 zile după ieșirea din ou (8-9 zile) |
60 |
70 |
|
(1) Pentru embrioni. (2) Pentru larve. (3) Întuneric pentru embrioni și larve până la o săptămână după ieșirea din ou, cu excepția cazului în care se inspectează. Apoi se dă o lumină atenuată pe durata testului. |
||||||||
Apendicele 3
Condițiile, durata testului și criteriile de supraviețuire pentru alte specii bine studiate
|
Specii |
Temperatura (oC) |
Salinitatea (0/00) |
Perioada de expunere la lumină (ore) |
Durata etapelor (zile) |
Durata normală a testului |
Supraviețuirea martorului (minimum %) |
||
|
Embrion |
Alevin |
Reușita ieșirii din ou |
După ieșirea din ou |
|||||
|
APĂ DULCE |
||||||||
|
Carassius auratus Caras auriu |
24 ± 1 |
— |
— |
3-4 |
> 4 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 4 zile după ieșirea din ou (7 zile) |
— |
80 |
|
Leopomis macrochirus |
21 ± 1 |
— |
16 |
3 |
> 4 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 4 de zile după ieșirea din ou (7 zile) |
— |
75 |
|
APĂ SĂRATĂ |
||||||||
|
Menidia peninsulae |
22-25 |
15-22 |
12 |
1,5 |
10 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 5 zile după ieșirea din ou (6-7 zile) |
80 |
60 |
|
Clupea harengus Hering |
10 ± 1 |
8-15 |
12 |
20-25 |
3-5 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 3 zile după ieșirea din ou (23-27 de zile) |
60 |
80 |
|
Gadus morhua Cod |
5 ± 1 |
5-30 |
12 |
14-16 |
3-5 |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 3 zile după ieșirea din ou (18 zile) |
60 |
80 |
|
Cyprinodon variegatus |
25 ± 1 |
15-30 |
12 |
— |
— |
De îndată ce este posibil după fecundare (prima fază de gastrulă) până la 4/7 zile după ieșirea din ou (28 de zile) |
> 75 |
80 |
Apendicele 4
CÂTEVA CARACTERISTICI CHIMICE ALE UNEI APE DE DILUȚIE ADMISE
|
SUBSTANȚA |
CONCENTRAȚIILE |
|
Substanță impurificatoare |
< 20 mg/l |
|
Carbon organic total |
< 2 mg/l |
|
Amoniac neionizat |
< 1 μg/l |
|
Clor rezidual |
< 10 μg/l |
|
Totalul pesticidelor organofosforoase |
< 50 ng/l |
|
Totalul pesticidelor organoclorice și a bifenililor policlorurați |
< 50 ng/l |
|
Clorul organic total |
< 25 ng/l |
C.16. ALBINELE – TESTUL DE TOXICITATE ORALĂ ACUTĂ
1. METODĂ
Metoda de determinare a toxicității acute reproduce Orientarea 213 (1998) a OCDE.
1.1. INTRODUCERE
Prezentul test de toxicitate este o metodă de laborator, destinată determinării toxicității orale acute a produselor pentru protecția plantelor și a altor produse chimice la albinele lucrătoare adulte.
În aprecierea și evaluarea caracteristicilor toxice ale substanțelor, ar putea fi necesară determinarea toxicității orale acute la albine, de exemplu când este posibilă expunerea albinelor la un anumit produs chimic. Testul de toxicitate orală acută se efectuează pentru determinarea toxicității inerente a pesticidelor și altor produse chimice la albine. Rezultatele testului respectiv trebuie utilizate pentru a stabili necesitatea unei evaluări suplimentare. Prezenta metodă se poate utiliza în special în programele în mai multe etape pentru evaluarea pericolelor pesticidelor pentru albine, prin înaintare secvențială de la testele de toxicitate de laborator la experimentările de semi-teren și teren (1). Pesticidele se pot testa sub formă de substanțe active (s.a.) sau de preparate.
Pentru verificarea sensibilității albinelor și a preciziei metodei de testare este necesară utilizarea unui etalon de toxicitate.
1.2. DEFINIȚII
Toxicitatea orală acută: reprezintă efectele negative care apar în termen de maximum 96 ore (h) de la administrarea orală unei doze unice de substanță testată.
Doza: reprezintă cantitatea de substanță testată consumată. Doza se exprimă ca masa (μg) de substanță testată per animal experimental (μg/albină). Nu se poate calcula doza reală pentru fiecare albină, deoarece albinele sunt hrănite în colectiv, dar se poate estima o doză medie (substanța testată consumată în total/numărul de albine experimentale dintr-o cușcă).
DL 50 (doza letală medie) orală: este o doză unică, obținută statistic, dintr-o substanță care poate provoca moartea a 50 % din animale atunci când se administrează pe cale orală. Valoarea DL50 se exprimă în (μg) de substanță testată per albină. Pentru pesticide, substanța testată poate să fie sub formă de substanță activă (s.a.) sau de preparat ce conține una sau mai multe substanțe active.
Mortalitatea: un animal se înregistrează ca mort atunci când este complet imobil.
1.3. PRINCIPIUL METODEI DE TESTARE
Se procedează la expunerea albinelor lucrătoare adulte (Apis mellifera) la o serie de doze de substanță testată dispersată în soluție de zaharoză. Albinele primesc apoi aceeași hrană, fără substanța testată. Mortalitatea se înregistrează zilnic timp de cel puțin 48 h și se compară cu valorile pentru proba martor. Dacă rata mortalității crește în intervalul dintre 24 ore și 48 ore, în timp ce mortalitatea martorului rămâne la un nivel acceptabil, adică ≤ 10 %, este potrivit să se prelungească durata testului până la maximum 96 h. Se analizează rezultatele pentru a calcula valoarea DL50 la 24 h și 48 h și, dacă studiul se prelungește, la 72 h și 96 h.
1.4. VALIDITATEA TESTULUI
Pentru ca un test să fie valabil, trebuie să îndeplinească următoarele condiții:
— media mortalității pentru numărul total de martori trebuie să fie mai mică sau egală cu 10 % la sfârșitul testului;
— DL50 a etalonului de toxicitate să se încadreze în intervalul specificat.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Colectarea albinelor
Este necesar să se utilizeze albinele lucrătoare adulte tinere din același roi, adică albinele de aceeași vârstă, modalitate de hrană etc. Albinele se obțin din colonii hrănite în mod corespunzător, sănătoase, pe cât posibil fără boli și care provin din aceeași regină, cu antecedente și stare fiziologică cunoscute. Acestea se pot colecta în dimineața în care se utilizează sau în seara de dinaintea testului și ținute în condițiile de testare până în ziua următoare. Sunt potrivite albinele colectate din rame fără progenituri. Se evită colectarea primăvara devreme sau toamna târziu, deoarece albinele au o fiziologie modificată în perioadele menționate. Dacă este necesară efectuarea testelor la începutul primăverii sau sfârșitul toamnei, albinele se pot introduce într-un incubator și se hrănesc timp de o săptămână cu „pâinea albinelor” (polen recoltat din fagure) și soluție de zaharoză. Albinele tratate cu substanțe chimice, ca antibiotice, produse antivirale etc. nu se utilizează în testele de toxicitate timp de patru săptămâni din momentul terminării ultimului tratament.
1.5.2. Condiții de adăpost și hrană
Se utilizează cuști ușor de curățat și cu ventilație bună. Se poate utiliza orice material corespunzător, de exemplu oțel inoxidabil, plasă de sârmă, cuști din material plastic sau din lemn disponibile etc. Se preferă grupuri de 10 albine în fiecare cușcă. Dimensiunile cuștilor experimentale trebuie să corespundă numărului de albine, adică să asigure spațiul corespunzător.
Albinele se țin la întuneric într-o cameră experimentală la o temperatură de 25 ± 2 oC. Pe toată durata testului, se înregistrează umiditatea relativă, care este în mod normal de aproximativ 50-70 %. Manipularea, care include tratamentul și observațiile se efectuează la lumină (lumina zilei). Ca hrană se utilizează soluție apoasă de zaharoză cu o concentrație finală de 500 g/l (50 % g/v). După administrarea dozelor de testare, hrana se furnizează ad libitum. Este necesar ca sistemul de alimentare să permită înregistrarea hranei consumate în fiecare cușcă (1.6.3.1). Se poate utiliza o eprubetă (cu lungimea de aproximativ 50 mm și diametrul de aproximativ 10 mm cu capătul deschis îngustat până la un diametru de aproximativ 2 mm).
1.5.3. Pregătirea albinelor
Albinele colectate se repartizează în mod aleatoriu în cuștile experimentale, care se aranjează în mod aleatoriu în camera experimentală.
Albinele se pot înfometa timp de până la 2 ore înaintea începerii testului. Se recomandă ca albinele să fie lipsite de hrană înaintea tratamentului, astfel încât, la începutul testului, intestinele tuturor albinelor să aibă același conținut. Albinele muribunde se resping și se înlocuiesc cu albine sănătoase înaintea începerii testului.
1.5.4. Pregătirea dozelor
Dacă substanța testată este un compus miscibil cu apa, se poate dispersa direct în soluția de zaharoză 50 %. Pentru produsele și substanțele tehnice cu solubilitate mică în apă, se pot utiliza purtători care pot să fie solvenți organici, emulgatori sau agenți de dispersie cu toxicitate mică pentru albine (de exemplu acetone, dimetilformamidă, dimetilsulfoxid). Concentrația purtătorului depinde de solubilitatea substanței testate și ar trebui să fie aceeași pentru toate concentrațiile experimentate ale substanței. Cu toate acestea, în general, este potrivită o concentrație a purtătorului de 1 % care nu trebuie să fie depășită.
Se prepară soluțiile etalon corespunzătoare, adică, dacă se utilizează un solvent sau un agent de dispersie pentru solubilizarea substanței testate, trebuie să se utilizeze două grupe etalon separate: o soluție în apă și o soluție de zaharoză cu solventul/purtătorul la concentrația utilizată în soluțiile de dozare.
1.6. DESFĂȘURAREA TESTULUI
1.6.1. Grupele experimentale și cele martor
Numărul de doze și probe identice trebuie să satisfacă condițiile statistice pentru determinarea DL50 cu limite de încredere de 95 %. În mod normal, sunt necesare pentru test cinci doze în serie geometrică, cu un factor mai mic sau egal cu 2,2 și care să cuprindă valorile pentru DL50. Cu toate acestea, factorul de diluție și numărul de concentrații pentru dozare trebuie să se determine în funcție de panta curbei de toxicitate (doza în funcție de mortalitate) și ținând cont de metoda statistică aleasă pentru analiza rezultatelor. O probă pentru determinarea domeniului permite alegerea concentrațiilor potrivite pentru dozare.
La minimum trei grupe experimentale identice, fiecare de 10 albine, se administrează doze cu fiecare concentrație experimentată. În afară de seriile tratate cu concentrațiile experimentate, se urmăresc minimum trei serii martor, fiecare de 10 albine. Sunt prevăzute serii martor și pentru solvenții/purtătorii utilizați (1.5.4).
1.6.2. Etalonul de toxicitate
În seria de teste se include un etalon de toxicitate. Se selectează cel puțin trei doze pentru a cuprinde valorile preconizate ale DL50. Pentru fiecare doză testată se utilizează minimum trei cuști identice, fiecare conținând 10 albine. Etalonul de toxicitate preferat este dimetoatul, pentru care DL50 – 24 h semnalată se situează între valorile 0,10-0,35 μg s.a./albină (2). Cu toate acestea, dacă se pot furniza suficiente date pentru verificarea răspunsului preconizat la doză, se pot accepta alte etaloane de toxicitate (de exemplu, parationul).
1.6.3. Expunerea
1.6.3.1. Administrarea dozelor
Fiecărei grupe de albine i se administrează 100-200 μl soluție apoasă 50 % de zaharoză, ce conține substanța testată la concentrația corespunzătoare. Pentru produsele cu solubilitate mică, toxicitate mică sau concentrație mică în preparat este necesar un volum mare, deoarece trebuie să se utilizeze proporții mai mari din soluția de zaharoză. Se monitorizează cantitatea de hrană tratată consumată per grupă. După consumarea hranei (de obicei în 3-4 h), vasul de alimentare se scoate din cușcă și se înlocuiește cu unul care conține numai soluție de zaharoză. Soluțiile de zaharoză se furnizează apoi ad libitum. Pentru unii compuși, la concentrații mai mari, respingerea dozei testate poate să genereze un consum mic sau inexistent de hrană. După maximum 6 h, hrana tratată neconsumată se înlocuiește numai cu soluția de zaharoză. Se evaluează cantitatea de hrană tratată consumată (de exemplu prin măsurarea raportului volum/greutate pentru hrana tratată neconsumată).
1.6.3.2. Durata
Durata testului este de preferință de 48 ore după ce soluția de substanță testată este înlocuită cu soluția de zaharoză singură. Dacă mortalitatea continuă să crească cu mai mult de 10 % după primele 24 h, durata testului se prelungește la maximum 96 ore, cu condiția ca mortalitatea martorului să fie mai mică sau egală cu 10 %.
1.6.4. Observațiile
Mortalitatea se înregistrează la 4 h după începerea testului și apoi la 24 h și 48 h (adică după administrarea dozei). Dacă este necesară o perioadă prelungită de observare, se fac alte evaluări la intervale de 24 h, până la maximum 96 h, cu condiția ca mortalitatea martorului să fie mai mică sau egală cu 10 %.
Se estimează cantitatea de hrană consumată per grupă. Compararea cantităților consumate din hrana tratată și netratată în 6 ore de administrare poate furniza date referitoare la gustul plăcut al hranei tratate.
Se consemnează toate manifestările anormale observate în timpul desfășurării testului.
1.6.5. Testul la valori-limită
În unele cazuri (de exemplu când se preconizează că o substanță testată are o toxicitate mică) se poate efectua un test la valori-limită, utilizând 100 μg s.a./albină pentru a demonstra că DL50 este mai mare decât valoarea respectivă. Se utilizează același mod de lucru, care include trei grupe experimentale identice pentru dozele experimentate, martorii relevanți, evaluarea cantității de hrană consumată și utilizarea etalonului de toxicitate. Dacă apar mortalități, se efectuează un studiu complet. Dacă se observă efecte subletale (1.6.4), se consemnează.
2. DATE ȘI RAPORT
2.1. DATE
Rezultatele se sistematizează în tabele, care prezintă pentru fiecare grupă supusă tratamentului, precum și pentru grupele martor și cele tratate cu etalon de toxicitate, numărul de albine utilizate, mortalitatea în fiecare moment de observare și numărul de albine cu un comportament negativ. Datele privind mortalitatea se analizează prin metode statistice corespunzătoare (de exemplu analiza probit, media mobilă, probabilitatea binominală) (3) (4). Se trasează curbele doză-răspuns pentru fiecare observare recomandată și se calculează pantele curbelor și dozele letale medii (DL50) cu limite de încredere de 95 %. Sunt posibile corecții pentru mortalitatea martorului cu ajutorul corecției lui Abbott (4) (5). Dacă hrana tratată nu se consumă în întregime, se determină doza de substanță testată per grupă. DL50 se exprimă în μg de substanță testată per albină.
2.2. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele date:
2.2.1. Substanța testată:
— natura fizică și proprietățile fizico-chimice relevante (de exemplu stabilitatea în apă, presiunea vaporilor);
— datele de identificare chimică, care includ formula structurală, puritatea [adică pentru pesticide, identitatea și concentrația substanței (substanțelor) activ(e)].
2.2.2. Speciile experimentale:
— denumirea științifică, roiul, vârsta aproximativă (în săptămâni), metoda de colectare, data colectării;
— datele privind coloniile din care s-au colectat albinele experimentale, care includ starea de sănătate, eventuale boli ale adulților, tratamente prealabile etc.
2.2.3. Condiții de testare:
— temperatura și umiditatea relativă în camera experimentală;
— condițiile de adăpost care includ tipul, dimensiunea și materialul cuștilor;
— metodele de preparare a soluțiilor mamă și experimentate (se specifică solventul și concentrațiile acestuia, dacă se utilizează);
— metoda de preparare a soluțiilor mamă și frecvența reînnoirii (trebuie să se specifice agentul de solubilizare și concentrațiile acestuia, dacă se utilizează);
— protocolul testului, de exemplu numărul de încercări și concentrațiile experimentate, numărul de martori; pentru fiecare concentrație experimentată și martor, numărul de cuști identice și numărul de albine per cușcă;
— data efectuării testului.
2.2.4. Rezultatele
— rezultatele studiului preliminar de determinare a domeniului, dacă s-a efectuat;
— datele brute: mortalitatea la fiecare doză experimentată și fiecare moment de observare;
— trasarea curbelor doză-răspuns la sfârșitul testului;
— valorile DL50 cu limite de încredere de 95 %, la fiecare din momentele de observare recomandate, pentru substanța testată și etalonul de toxicitate;
— metodele statistice utilizate pentru determinarea DL50;
— mortalitatea la martori;
— alte efecte biologice observate sau măsurate, de exemplu comportamentul anormal al albinelor (inclusiv respingerea dozei cu substanța testată), rata consumului de hrană la grupele tratate și netratate;
— orice abatere de la modul de lucru descris și orice alte date relevante.
3. REFERINȚE BIBLIOGRAFICE
1. EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO Bulletin, vol. 23, N.1, p. 151-165. March 1993.
2. Gough, H. J., McIndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, p. 119-125.
3. Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99-113.
4. Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
5. Abbott, W.S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol.,18, p. 265-267.
C.17. ALBINELE – TESTUL DE TOXICITATE ACUTĂ PRIN CONTACT
1. METODĂ
Metoda de determinare a toxicității acute reproduce Orientarea 214 (1998) a OCDE.
1.1. INTRODUCERE
Prezentul test de toxicitate este o metodă de laborator, destinată determinării toxicității acute prin contact a produselor pentru protecția plantelor și a altor produse chimice la albinele lucrătoare adulte.
În evaluarea caracteristicilor toxice ale substanțelor, s-ar putea să fie necesară determinarea toxicității acute de contact la albine, de exemplu când este posibilă expunerea albinelor la un anumit produs chimic. Testul de toxicitate acută prin contact se efectuează pentru determinarea toxicității inerente a pesticidelor și altor produse chimice la albine. Rezultatele testului respectiv se utilizează pentru a stabili necesitatea unei evaluări suplimentare. Prezenta metodă se poate utiliza în special în programele în mai multe etape pentru evaluarea pericolelor pesticidelor pentru albine, prin înaintare secvențială de la testele de toxicitate de laborator la experimentările de semi-teren și teren (1). Pesticidele se pot testa sub formă de substanțe active (s.a.) sau de preparate.
Pentru verificarea sensibilității albinelor și a preciziei metodei de testare este necesară utilizarea unui etalon de toxicitate.
1.2. DEFINIȚII
Toxicitatea orală acută: reprezintă efectele negative care apar în termen de maximum 96 ore de la aplicarea locală a unei doze unice dintr-o substanță.
Doza: reprezintă cantitatea de substanță testată aplicată. Doza se exprimă ca masa (μg) de substanță testată per animal experimental (μg/albină).
DL 50 (doza letală medie) de contact: este o doză unică, obținută statistic, dintr-o substanță care poate provoca moartea a 50 % din animale atunci când se administrează prin contact. Valoarea DL50 se exprimă în (μg) de substanță testată per albină. Pentru pesticide, substanța testată poate să fie sub formă de substanță activă (s.a.) sau de preparat ce conține una sau mai multe substanțe active.
Mortalitatea: un animal se înregistrează ca mort atunci când este complet imobil.
1.3. PRINCIPIUL METODEI DE TESTARE
Se procedează la expunerea albinelor lucrătoare adulte (Apis mellifera) la o serie de doze de substanță testată dizolvată într-un purtător corespunzător, prin aplicare directă pe torace (picături). Durata testului este de 48 h. Dacă rata mortalității crește în intervalul dintre 24 ore și 48 ore în timp ce mortalitatea martorului rămâne la un nivel acceptabil, adică ≤ 10 %, este potrivit să se prelungească durata testului până la maximum 96 h. Mortalitatea se înregistrează zilnic și se compară cu valorile martorului. Se analizează rezultatele pentru a calcula valoarea DL50 la 24 h și 48 h și, dacă studiul se prelungește, la 72 h și 96 h.
1.4. VALIDITATEA TESTULUI
Pentru ca un test să fie valabil, trebuie să îndeplinească următoarele condiții:
— media mortalității pentru numărul total de martori trebuie să fie mai mică sau egală cu 10 % la sfârșitul testului;
— DL50 a etalonului de toxicitate să se încadreze în intervalul specificat.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Colectarea albinelor
Este necesar să se utilizeze albinele lucrătoare adulte tinere, adică albinele de aceeași vârstă, modalitate de hrană, din același roi etc. Albinele se obțin din colonii hrănite în mod corespunzător, sănătoase, pe cât posibil fără boli și care provin din aceeași regină, cu antecedente și stare fiziologică cunoscute. Acestea se pot colecta în dimineața în care se utilizează sau în seara de dinaintea testului și ținute în condițiile de testare până în ziua următoare. Sunt potrivite albinele colectate din rame fără progenituri. Se evită colectarea primăvara devreme sau toamna târziu, deoarece albinele au o fiziologie modificată în perioadele menționate. Dacă este necesară efectuarea testelor la începutul primăverii sau sfârșitul toamnei, albinele se pot introduce într-un incubator și se hrănesc timp de o săptămână cu „pâinea albinelor” (polen recoltat din fagure) și soluție de zaharoză. Albinele tratate cu substanțe chimice, ca antibiotice, produse antivirale etc. nu se utilizează în testele de toxicitate timp de patru săptămâni din momentul terminării ultimului tratament.
1.5.2. Condiții de adăpost și hrană
Se utilizează cuști ușor de curățat și cu ventilație bună. Se poate utiliza un material corespunzător, de exemplu oțel inoxidabil, plasă de sârmă, cuști din material plastic sau din lemn disponibile etc. Dimensiunile cuștilor experimentale trebuie să corespundă numărului de albine, adică să asigure spațiul corespunzător. Se preferă grupuri de 10 albine în fiecare cușcă.
Albinele se țin la întuneric într-o cameră experimentală la o temperatură de 25 ± 2 oC. Pe toată durata testului, se înregistrează umiditatea relativă, care este în mod normal de aproximativ 50-70 %. Manipularea, care include tratamentul și observațiile, se efectuează la lumină (lumina zilei). Ca hrană se utilizează soluție apoasă de zaharoză cu o concentrație finală de 500 g/l (50 % g/v) și se furnizează ad libitum pe durata testului, într-un vas de alimentare. Acesta poate să fie o eprubetă (cu lungimea de aproximativ 50 mm și diametrul de aproximativ 10 mm cu capătul deschis îngustat până la un diametru de aproximativ 2 mm).
1.5.3. Pregătirea albinelor
Albinele colectate se anesteziază cu bioxid de carbon sau azot pentru aplicarea substanței testate. Cantitatea de anestezic utilizat și durata expunerii trebuie să fie minime. Albinele muribunde se resping și se înlocuiesc cu albine sănătoase înaintea începerii testului.
1.5.4. Pregătirea dozelor
Substanța testată urmează să se aplice sub formă de soluție într-un purtător, adică un solvent organic sau o soluție apoasă cu un agent de umectare. Ca solvent organic, se preferă acetona, dar se pot utiliza și alți solvenți organici cu toxicitate mică pentru albine (de exemplu dimetilformamidă, dimetilsulfoxid). Pentru preparatele dispersate în apă și substanțele organice cu polaritate mare, care nu sunt solubile în solvenții organici purtători, soluțiile se pot aplica mai ușor, dacă se prepară într-o soluție slabă de agent de umectare comercializat (de exemplu Agral, Cittowett, Lubrol, Triton, Tween).
Se prepară soluțiile etalon corespunzătoare, adică, dacă se utilizează un solvent sau un agent de dispersie pentru solubilizarea substanței testate, trebuie să se utilizeze două grupe etalon separate: una tratată cu apă și una tratată cu solvent/agent de dispersie.
1.6. PROCEDURĂ
1.6.1. Grupele experimentale și cele martor
Numărul de doze și probe identice experimentate trebuie să satisfacă condițiile statistice pentru determinarea DL50 cu limite de încredere de 95 %. În mod normal, sunt necesare pentru test cinci doze în serie geometrică, cu un factor mai mic sau egal cu 2,2 și care să cuprindă valorile pentru DL50. Cu toate acestea, factorul de diluție și numărul de concentrații pentru dozare trebuie să se determine în funcție de panta curbei de toxicitate (doza în funcție de mortalitate) și ținând cont de metoda statistică aleasă pentru analiza rezultatelor. O probă pentru determinarea domeniului permite alegerea concentrațiilor potrivite pentru dozare.
La minimum trei grupe experimentale identice, fiecare de 10 albine, se administrează doze cu fiecare concentrație experimentată.
În afară de seriile tratate cu concentrațiile experimentate, se urmăresc minimum trei serii martor, fiecare de 10 albine. Dacă se utilizează un solvent organic sau un agent de umectare, trebuie să se includă trei serii martor suplimentare, de câte 10 albine fiecare.
1.6.2. Etalonul de toxicitate
În seria de teste se include un etalon de toxicitate. Se selectează cel puțin trei doze pentru a cuprinde valorile preconizate ale DL50. Pentru fiecare doză experimentată se utilizează minimum trei cuști identice, fiecare conținând 10 albine. Etalonul de toxicitate preferat este dimetoatul, pentru care DL50 – 24 h prin contact semnalată se situează între valorile 0,10-0,35 μg s.a./albină (2). Cu toate acestea, dacă se pot furniza suficiente date pentru verificarea răspunsului preconizat la doză, se pot accepta alte etaloane de toxicitate (de exemplu parationul).
1.6.3. Expunerea
1.6.3.1. Administrarea dozelor
Albinele anesteziate se tratează individual prin aplicare locală. Albinele se distribuie în mod aleatoriu pentru diferite doze experimentate și diferiți martori. Se aplică un volum de 1 μl soluție de substanță testată în concentrații potrivite cu o micropipetă pe partea dorsală a toracelui fiecărei albine. Dacă este necesar, se pot utiliza alte volume. După aplicare, albinele sunt repartizate în cuști și li se administrează soluții de zaharoză.
1.6.3.2. Durata
Durata testului este de preferință de 48 ore. Dacă mortalitatea crește cu mai mult de 10 % între 24 h și 48 h, durata testului se prelungește la maximum 96 ore, cu condiția ca mortalitatea martorului să fie mai mică sau egală cu 10 %.
1.6.4. Observațiile
Mortalitatea se înregistrează la 4 h după administrarea dozelor și apoi la 24 h și 48 h. Dacă este necesară o perioadă prelungită de observare, se fac alte evaluări la intervale de 24 h, până la maximum 96 h, cu condiția ca mortalitatea martorului să fie mai mică sau egală cu 10 %.
Se consemnează toate manifestările anormale observate în timpul desfășurării testului.
1.6.5. Testul la valori-limită
În unele cazuri (de exemplu când se preconizează că o substanță testată are o toxicitate mică) se poate efectua un test la valori-limită, utilizând 100 μg s.a./albină pentru a demonstra că DL50 este mai mare decât valoarea respectivă. Se utilizează același mod de lucru, care include trei grupe experimentale identice pentru dozele experimentate, martorii relevanți și utilizarea etalonului de toxicitate. Dacă se observă efecte subletale (a se vedea 1.6.4), se consemnează.
2. DATE ȘI RAPORT
2.1. DATE
Rezultatele se sistematizează în tabele, care prezintă pentru fiecare grupă supusă tratamentului, precum și pentru grupele martor și cele tratate cu etalon de toxicitate, numărul de albine utilizate, mortalitatea în fiecare moment de observare și numărul de albine cu un comportament negativ. Datele privind mortalitatea se analizează prin metode statistice corespunzătoare (de exemplu analiza probit, media mobilă, probabilitatea binominală) (3) (4). Se trasează curbele doză-răspuns pentru fiecare observare recomandată (adică la 24 h, 48 h și, dacă este relevant, 72 h, 96 h) și se calculează pantele curbelor și dozele letale medii (DL50) cu limite de încredere de 95 %. Sunt posibile corecții pentru mortalitatea martorului cu ajutorul corecției lui Abbott (4) (5). DL50 se exprimă în μg de substanță testată per albină.
2.2. RAPORT DE TESTARE
Raportul de testare trebuie să conțină următoarele date:
2.2.1. Substanța testată:
— natura fizică și proprietățile fizico-chimice relevante (de exemplu stabilitatea în apă, presiunea de vapori);
— datele de identificare chimică, care includ formula structurală, puritatea [adică pentru pesticide, identitatea și concentrația substanței (substanțelor) active].
2.2.2. Speciile experimentale:
— denumirea științifică, roiul, vârsta aproximativă (în săptămâni), metoda de colectare, data colectării;
— datele privind coloniile din care s-au colectat albinele experimentale, care includ starea de sănătate, eventuale boli ale adulților, tratamente prealabile etc.
2.2.3. Condiții de testare:
— temperatura și umiditatea relativă în camera experimentală;
— condițiile de adăpost care includ tipul, dimensiunea și materialul cuștilor;
— metodele de administrare a substanței testate, de exemplu solventul purtător utilizat, volumul soluției de substanță testată aplicat, anestezicele utilizate;
— protocolul testului, de exemplu numărul de încercări și concentrațiile testate, numărul de martori; pentru fiecare concentrație experimentată și martor, numărul de cuști identice, și numărul de albine per cușcă;
— data efectuării testului.
2.2.4. Rezultatele:
— rezultatele studiului preliminar de determinare a domeniului, dacă s-a efectuat;
— datele brute: mortalitatea la fiecare concentrație experimentată și fiecare moment de observare;
— trasarea curbelor doză-răspuns la sfârșitul testului;
— valorile DL50 cu limite de încredere de 95 %, la fiecare din momentele de observare recomandate, pentru substanța testată și etalonul de toxicitate;
— metodele statistice utilizate pentru determinarea DL50;
— mortalitatea la martori;
— alte efecte biologice observate sau măsurate și orice răspunsuri anormale ale albinelor;
— orice abatere de la modul de lucru descris și orice alte date relevante.
3. REFERINȚE BIBLIOGRAFICE
1. EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, vol. 23, N.1, p. 151-165. March, 1993.
2. Gough, H. J., McIndoe, E. C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, p. 119-125.
3. Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99-113.
4. Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
5. Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, p. 265-267.
C.18. ADSORBȚIA/DESORBȚIA PRINTR-O METODĂ DE STABILIRE A ECHILIBRULUI PROBELOR
1. METODĂ
Prezenta metodă reproduce Orientarea 106 a OCDE pentru determinarea adsorbției/desorbției printr-o metodă de stabilire a echilibrului probelor (2000).
1.1. INTRODUCERE
Metoda ia în considerare un test de intercalibrare și un schimb de experiență în vederea selecției solului pentru realizarea unei încercări de adsorbție (1) (2) (3) (4) și, de asemenea, liniile directoare existente la nivel național (5) (6) (7) (8) (9) (10) (11).
Studiile de adsorbție/desorbție sunt utile pentru obținerea de date esențiale privind mobilitatea substanțelor chimice și distribuția acestora în compartimentele solului, apei și aerului din biosferă (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Datele se pot utiliza pentru a prognoza sau estima, de exemplu, predispoziția unei substanțe chimice pentru degradare (22) (23), transformare sau asimilare de organisme (24); extracție prin spălare în profilul solului (16) (18) (19) (21) (25) (26) (27) (28); volatilitate din sol (21) (29) (30); scurgere de pe suprafața terenurilor în apele naturale (18) (31) (32). Rezultatele adsorbției se pot utiliza pentru comparare și modelare (19) (33) (34) (35).
Distribuția unei substanțe chimice între fazele solului și cea apoasă este un proces complex care depinde de o serie de factori diferiți: natura chimică a substanței (12) (36) (37) (38) (39) (40), caracteristicile solului (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49), factorii climatici cum sunt precipitațiile atmosferice, temperatura, lumina soarelui și vântul. Astfel, numeroasele fenomene și mecanisme implicate în procesul de adsorbție a unei substanțe chimice în sol nu se pot explica în întregime printr-un model simplificat de laborator, cum este prezenta metodă. Cu toate acestea, chiar dacă o experiență de acest fel nu poate să cuprindă toate cazurile posibile din mediu, poate furniza date valoroase privind relația dintre mediul înconjurător și adsorbția unei substanțe chimice.
A se vedea și introducerea generală.
1.2. DOMENIUL DE APLICARE
Metoda are ca obiect determinarea comportamentului de adsorbție/desorbție al unei substanțe pe diferite soluri. Scopul este obținerea unei valori a sorbției care să se poată utiliza la prognoza repartiției în condiții de mediu diferite; în acest scop, se determină coeficienții de adsorbție la echilibru pentru o substanță chimică pe diferite soluri în funcție de caracteristicile solului (de exemplu, conținutul de carbon organic, conținutul de argilă și structura și pH-ul solului). Trebuie să se utilizeze tipuri diferite de soluri pentru a cuprinde cât mai multe interacțiuni posibile ale unei anumite substanțe cu solurile existente în natură.
În prezenta metodă, adsorbția reprezintă procesul de legare a unei substanțe chimice la suprafețele solurilor; nu se poate face deosebire între diferitele procese de adsorbție (adsorbția fizică și chimică) și procese ca degradarea catalizată a suprafeței, adsorbția în grosime sau reacția chimică. Adsorbția care apare pe particulele coloidale (diametrul < 0,2 μm) generate de soluri nu se ia în considerare.
Parametrii solurilor considerați cei mai importanți pentru adsorbție sunt: conținutul de carbon organic (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48); conținutul de argilă și structura solului (3) (4) (41) (42) (43) (44) (45) (46) (47) (48) și valoarea pH-ului pentru compușii ionizabili (3) (4) (42). Alți parametri ai solurilor care pot să aibă un impact asupra adsorbției/desorbției unei anumite substanțe sunt: capacitatea efectivă de schimb de cationi (CESC), conținutul de oxizi de fier și aluminiu amorfi, în special pentru solurile vulcanice și tropicale (4), precum și suprafața specifică (49).
Testarea este destinată evaluării adsorbției unei substanțe chimice pe diferite tipuri de soluri cu valori diferite ale conținutului de carbon organic, ale conținutului de argilă și ale structurii solului și ale pH-ului. Aceasta conține trei etape:
Etapa 1: Studiu preliminar pentru determinarea:
— raportului sol/soluție;
— timpului de stabilire a echilibrului de adsorbție și a cantității de substanță testată adsorbită la echilibru;
— adsorbției substanței testate pe suprafața vaselor experimentale și stabilității substanței testate în timpul încercării.
Etapa 2: Proba de identificare: se studiază adsorbția pe cinci tipuri diferite de soluri cu ajutorul cineticii adsorbției la o singură concentrație și se determină coeficienții de distribuție Kd și Kco.
Etapa 3: Determinarea izotermelor de adsorbție Freundlich pentru stabilirea influenței concentrației asupra gradului de adsorbție pe soluri.
Studiul desorbției cu ajutorul cineticii de desorbție/izotermele de desorbție Freundlich (apendicele 1).
1.3. DEFINIȚII ȘI UNITĂȚI
|
Simbol |
Definiție |
Unități |
|
|
adsorbția la momentul ti |
% |
|
Aec |
adsorbția la stabilirea echilibrului de adsorbție |
% |
|
|
masa substanței testate adsorbite pe sol la momentul ti |
μg |
|
|
masa substanței testate adsorbite pe sol în intervalul de timp Δti |
μg |
|
|
masa substanței testate adsorbite pe sol la echilibrul de adsorbție |
μg |
|
m0 |
masa substanței testate din eprubetă, la începutul analizei de adsorbție |
μg |
|
|
masa substanței testate măsurate într-un alicot (
|
μg |
|
|
masa substanței testate în soluție la echilibrul de adsorbție |
μg |
|
msol |
cantitatea fazei de sol, exprimată în substanță uscată a solului |
g |
|
Csm |
concentrația masică a soluției mamă de substanță |
μg cm–3 |
|
C0 |
concentrația masică inițială a soluției testate în contact cu solul |
μg cm–3 |
|
|
concentrația masică a substanței în fază apoasă la momentul ti de efectuare a încercării |
μg cm–3 |
|
|
conținutul de substanță adsorbită pe sol la echilibrul de adsorbție |
μg g–1 |
|
|
concentrația masică a substanței în faza apoasă la echilibrul de adsorbție |
μg cm–3 |
|
V0 |
volumul inițial al fazei apoase în contact cu solul în timpul încercării de adsorbție |
cm3 |
|
|
volumul alicotului în care se măsoară substanța testată |
cm3 |
|
Kd |
coeficientul de distribuție pentru adsorbție |
cm3 g–1 |
|
Kco |
coeficientul de adsorbție normalizată a carbonului organic |
cm3 g–1 |
|
Kso |
coeficientul de distribuție normalizată a substanței organice |
cm3 g–1 |
|
|
coeficientul de adsorbție Freundlich |
μg 1–1/n (cm3) 1/n g–1 |
|
1/n |
exponentul Freundlich |
|
|
|
desorbția la momentul ti |
% |
|
|
desorbția corespunzătoare unui interval de timp Δti |
% |
|
Kdes |
coeficientul de desorbție aparentă |
cm3 g–1 |
|
|
coeficientul de desorbție Freundlich |
μg 1–1/n (cm3) 1/n g–1 |
|
|
masa substanței testate desorbite din sol la momentul ti |
μg |
|
|
masa substanței testate desorbite din sol în intervalul de timp Δti |
μg |
|
|
masa substanței, determinată analitic în fază apoasă la stabilirea echilibrului de desorbție |
μg |
|
|
masa totală a substanței testate desorbite la stabilirea echilibrului de desorbție |
μg |
|
|
masa substanței adsorbită în continuare pe sol după intervalul de timp Δti |
μg |
|
|
masa substanței rămase de la stabilirea echilibrului de adsorbție datorită înlocuirii incomplete a volumului |
μg |
|
|
conținutul de substanță testată adsorbită în continuare pe sol la stabilirea echilibrului de desorbție |
μg g–1 |
|
|
concentrația masică a substanței testate în fază apoasă la stabilirea echilibrului de desorbție |
μg cm–3 |
|
VT |
volumul total al fazei apoase în contact cu solul în timpul experimentării cineticii de desorbție prin metoda în serie |
cm3 |
|
VR |
volumul supernatantului scos din eprubetă după stabilirea echilibrului de adsorbție și înlocuit cu același volum dintr-o soluție 0,01 M de CaCl2 |
cm3 |
|
|
volumul unui alicot din care s-au luat probe pentru analiză la momentul (i), în timpul experimentării cineticii de desorbție prin metoda în serie |
cm3 |
|
|
volumul soluției luate din eprubeta (i) pentru determinarea substanței testate, în experimentarea cineticii de desorbție prin metoda paralelă |
cm3 |
|
|
volumul soluției luate din eprubetă pentru determinarea substanței testate, la stabilirea echilibrului de desorbție |
cm3 |
|
BM |
bilanțul masic |
% |
|
mE |
masa totală a substanței testate extrase din sol și pereții vasului experimental în două etape |
μg |
|
Vrec |
volumul supernatantului recuperat după stabilirea echilibrului de adsorpție |
cm3 |
|
Pow |
coeficientul de partiție octanol/apă |
|
|
pKa |
constanta de disociere |
|
|
Sa |
solubilitatea apei |
g l–1 |
1.4. PRINCIPIUL METODEI DE TESTARE
Se adaugă volume cunoscute de soluții ale substanței testate, nemarcate sau marcate radioactiv, în concentrații cunoscute în CaCl20,01 M, la probele de sol cu un conținut de substanță uscată cunoscut, care au fost aduse în prealabil la echilibru în CaCl20,01 M. Se agită amestecul un timp corespunzător. Suspensiile de sol se separă apoi prin centrifugare și, dacă se dorește, prin filtrare și se analizează faza apoasă. Se calculează cantitatea de substanță testată adsorbită pe proba de sol prin diferența dintre cantitatea de substanță testată prezentă inițial în soluție și cantitatea rămasă la sfârșitul experimentării (metoda indirectă).
Ca alternativă, cantitatea de substanță testată adsorbită se mai poate determina direct prin analiza solului (metoda directă). Această metodă, care include extracția treptată a solului cu un solvent potrivit, se recomandă în cazurile în care concentrația diferită în soluție a substanței nu se poate determina cu precizie. Exemple de asemenea cazuri sunt: adsorbția substanței testate pe suprafața vaselor experimentale, instabilitatea substanței testate pe durata experimentării, adsorbția slabă care generează doar modificări mici ale concentrației în soluție și adsorbția puternică care generează concentrații mici care nu se pot determina cu precizie. Dacă se utilizează o substanță marcată radioactiv, se poate evita extracția solului prin analiza fazei de sol prin calcinare și numărătoarea în scintilație lichidă. Cu toate acestea, numărătoarea în scintilație lichidă este un procedeu nespecific care nu poate să facă diferența dintre produsele de bază și cele de transformare; prin urmare, se utilizează numai în situația în care substanța chimică testată este stabilă pe durata studiului.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA TESTATĂ
Reactivii chimici trebuie să fie de tip analitic. Se recomandă utilizarea substanțelor de testare nemarcate cu o compoziție cunoscută și, de preferat, cu o puritate de minimum 95 % sau a substanțelor de testare marcate radioactiv cu o compoziție și puritate cunoscute. La indicatorii cu perioada de înjumătățire scurtă se aplică corecții de dezintegrare.
Înaintea realizării unei încercări de adsorbție/desorbție, trebuie să fie cunoscute datele referitoare de substanța testată, prezentate în continuare:
(a) solubilitatea în apă (A.6);
(b) presiunea de vapori (A.4) și constanta legii lui Henry;
(c) degradarea abiotică: hidroliza în funcție de pH (C.7);
(d) coeficientul de partiție (A.8);
(e) biodegradabilitatea imediată (C.4) sau transformarea aerobică și anaerobică în sol;
(f) pKa pentru substanțele ionizabile;
(g) fotoliza directă în apă (adică spectrul de absorbție UV-vizibil în apă, randamentul cuantic) și fotodegradarea pe sol.
1.6. APLICABILITATEA TESTULUI
Testarea se poate aplica substanțelor chimice pentru care este disponibilă o metodă analitică suficient de precisă. Un parametru important care influențează credibilitatea rezultatelor, în special atunci când se utilizează metoda indirectă, este stabilitatea substanței testate în scara de timp a probei. Prin urmare, este necesară verificarea stabilității într-un studiu preliminar; dacă, în scara de timp a încercării, se observă o modificare, se recomandă ca studiul principal să se realizeze prin analizarea atât a solului, cât și a fazelor apoase.
În realizarea prezentei încercări, pot să apară dificultăți pentru substanțele cu solubilitate mică în apă (Sw < 10–4 g l–1), precum și pentru substanțele cu sarcini mari, deoarece concentrația în faza apoasă nu se poate măsura analitic cu suficientă precizie. În situațiile de acest fel, trebuie să se ia măsuri suplimentare. Modalitatea de rezolvare a acestor probleme se indică, orientativ, la punctele respective ale prezentei metode.
La testarea substanțelor volatile, trebuie să se aibă grijă să se evite pierderile în timpul studiului.
1.7. DESCRIEREA METODEI
1.7.1. Aparatura și reactivii chimici
Aparatură standard de laborator, în special cea prezentată în continuare:
(a) Eprubete sau vase pentru realizarea experimentelor. Este important ca eprubetele și vasele respective:
— să fie instalate direct în centrifugă pentru a minimiza erorile de manipulare și transfer;
— să fie obținute dintr-un material inert, care minimizează adsorbția substanței testate pe suprafața acestora.
(b) Agitator: agitator acționat de sus sau un dispozitiv echivalent; agitatorul menține solul în suspensie în timpul agitării.
(c) Centrifugă: de preferință una de viteză mare, de exemplu forțele de centrifugare > 3 000 g, termoreglabilă, care să poată să separe particulele cu diametrul mai mare de 0,2 μm din soluția apoasă. Recipientele trebuie să fie închise în timpul agitării și centrifugării pentru a evita volatilizarea și pierderile de apă; pentru a minimiza adsorbția pe acestea, se recomandă utilizarea capacelor dezactivate, cum ar fi capacele cu filet căptușite cu teflon.
(d) Opțional: dispozitiv de filtrare; filtre cu o porozitate de 0,2 μm, sterile, de unică folosință. Trebuie să se acorde o atenție deosebită la alegerea materialului pentru filtru, pentru a evita pierderile de substanță testată pe acesta; pentru substanțele testate cu solubilitate mică, nu se recomandă un material de filtrare organic.
(e) Instrumente analitice, potrivite pentru măsurarea concentrației substanței testate.
(f) Etuvă de laborator care permite menținerea unei temperaturi de 103-110 oC.
1.7.2. Caracterizarea și selectarea solurilor
Solurile se caracterizează prin trei parametri de care se consideră că depinde în mare măsură capacitatea adsorbantă: carbonul organic, conținutul de argilă și structura solului și pH-ul. După cum s-a menționat deja (a se vedea Domeniul de aplicare), și alte proprietăți fizico-chimice ale solului pot să aibă impact asupra adsorbției/desorbției unei anumite substanțe și aceste cazuri trebuie avute în vedere.
Metodele utilizate pentru caracterizarea solului sunt foarte importante și pot avea o influență semnificativă asupra rezultatelor. Prin urmare, se recomandă ca pH-ul solului să se măsoare într-o soluție de CaCl20,01 M (adică soluția utilizată în testarea de adsorbție/desorbție) conform metodei ISO corespunzătoare (ISO-10390-1). Se mai recomandă determinarea altor proprietăți relevante ale solului conform metodelor standard (de exemplu „Îndreptarul pentru analiza solului” ISO); acest lucru permite ca analiza datelor privind sorbția să se facă pe baza parametrilor solului standardizați la nivel mondial. O orientare pentru metodele standard existente pentru analiza și caracterizarea solului este oferită în bibliografie (50-52). Pentru etalonarea metodelor de analiză a solului, se recomandă utilizarea solurilor de referință.
O orientare privind selecția solurilor pentru încercările de adsorbție/desorbție se prezintă în tabelul 1. Cele șapte soluri selectate cuprind tipurile de soluri întâlnite în zonele geografice temperate. Pentru substanțele testate ionizabile, solurile selectate trebuie să cuprindă un domeniu larg de pH, pentru a fi posibilă evaluarea adsorbției substanței în formele ionizată și neionizată ale acesteia. O orientare privind modul de utilizare a mai multor soluri diferite în diferite etape ale încercării se prezintă la punctul 1.9 Realizarea încercării.
Dacă se preferă alte tipuri de soluri, este necesar ca parametrii și variația proprietăților acestora să fie similare cu cele descrise în tabelul 1, chiar dacă nu satisfac criteriile cu exactitate.
Tabelul 1
Orientare pentru selectarea probelor de soluri pentru adsorbție-desorbție
|
Tipul solului |
Valorile pH-ului (în CaCl20,01 M) |
Conținutul de carbon organic ( %) |
Conținutul de argilă ( %) |
Structura solului (1) |
|
1 |
4,5 - 5,5 |
1,0 - 2,0 |
65-80 |
argilă |
|
2 |
> 7,5 |
3,5 - 5,0 |
20-40 |
pământ argilos-nisipos |
|
3 |
5,5 - 7,0 |
1,5 - 3,0 |
15-25 |
argilă nisipoasă din aluviuni |
|
4 |
4,0 - 5,5 |
3,0 - 4,0 |
15-30 |
argilă nisipoasă |
|
5 |
< 4,0 - 6,0 (2) |
< 10-15 (2) |
nisip argilos |
|
|
6 |
> 7,0 |
40-65 |
pământ argilos-nisipos/argilă |
|
|
7 |
< 4,5 |
> 10 |
< 10 |
nisip/nisip argilos |
|
(1) Conform FAO și sistemului SUA (85). (2) Este de preferat ca parametrii respectivi să prezinte valori în domeniul dat. Dacă, totuși, apar dificultăți în găsirea unui sol corespunzător, se acceptă valorile mai mici decât minimum indicat. (3) Solurile cu un conținut de carbon organic mai mic de 3 % pot schimba corelația dintre conținutul de substanțe organice și adsorbție. Astfel, se recomandă utilizarea solurilor cu un conținut minimum de carbon organic de 0,3 %. |
||||
1.7.3. Colectarea și depozitarea probelor de sol
1.7.3.1. Colectarea
Nu se recomandă tehnici de prelevare a probelor sau instrumente specifice; tehnica de prelevare a probelor depinde de scopul studiului (53) (54) (55) (56) (57) (58).
Se au în vedere cele menționate în continuare:
(a) este necesară o descriere detaliată a situației terenului; aceasta include poziția, acoperirea cu vegetație, tratamentul cu pesticide și îngrășăminte, adaosuri biologice sau contaminarea accidentală. Este necesar să se respecte recomandările standardelor ISO privind prelevarea probelor de sol (ISO 10381-6), referitoare la descrierea locului de prelevare a probelor;
(b) locul de prelevare a probelor trebuie să fie stabilit cu ajutorul UTM (proiecția Mercator transversală universală/cota convențională europeană) sau a coordonatelor geografice; astfel ar fi posibilă repetarea colectării unui anumit sol în viitor sau ar ajuta la încadrarea solului în diferite sisteme de clasificare utilizate în diferite țări. De asemenea, se recomandă să se colecteze sol numai din planul de referință A de până la 20 cm adâncime. În special pentru tipul de sol nr. 7, dacă există un plan de referință Oh ca parte a solului, acesta se include în prelevarea probelor.
Probele de sol se transportă în recipiente și în condiții de temperatură care să garanteze păstrarea proprietăților inițiale ale solului, nealterate în mare parte.
1.7.3.2. Depozitarea
Se preferă utilizarea solurilor proaspăt colectate de pe teren. Numai dacă acest lucru nu este posibil, solul se poate păstra la temperatura ambiantă și în aer uscat. Nu se recomandă termene-limită, dar solurile depozitate mai mult de trei ani se analizează din nou înaintea utilizării pentru determinarea conținutului de carbon organic, pH-ului și CSC (capacitatea de schimb de cationi).
1.7.3.3. Manipularea și pregătirea probelor de sol pentru testare
Solurile se usucă în aer la temperatura ambiantă (de preferință la 20-25 oC). Dezagregarea se realizează cu o forță minimă, astfel încât structura originală a solului să se modifice cât se poate de puțin. Solurile se cern până la dimensiuni ale particulelor ≤ 2 mm; se respectă recomandările standardului ISO privind prelevarea probelor de sol (ISO 10381-6), referitoare la cernere. Se recomandă omogenizarea atentă, deoarece aceasta crește reproductibilitatea rezultatelor. Conținutul de umiditate din fiecare sol se determină pe trei alicoți și încălzire la 105 oC până la greutate constantă (aproximativ 12 ore). În toate calculele, pentru masa de sol se consideră masa uscată în etuvă, adică greutatea solului la care se aplică corecția pentru conținutul de umiditate.
1.7.4. Pregătirea substanței testate pentru aplicarea pe sol
Substanța testată se dizolvă într-o soluție de CaCl20,01 M în apă distilată sau apă deionizată; soluția de CaCl2 se utilizează sub formă de fază apoasă de solvent pentru îmbunătățirea centrifugării și minimizarea schimbului de cationi. Concentrația soluției mamă este, de preferință, mai mare cu trei ordine de mărime decât limita de detecție a metodei analitice utilizate. Pragul menționat asigură măsurători precise pentru metodologia urmată în prezenta metodă; în afară de aceasta, concentrația soluției mamă trebuie să fie mai mică decât solubilitatea în apă a substanței testate.
Este de preferat ca soluția mamă să se prepare chiar înaintea aplicării pe probele de sol și să se păstreze închisă, la întuneric, la 4 oC. Durata depozitării depinde de stabilitatea substanței testate și de concentrația acesteia în soluție.
Numai pentru substanțele cu solubilitate mică (Sa < 10–4 g l–1), ar putea să fie necesar un agent de solubilizare corespunzător, dacă dizolvarea substanței testate este dificilă. Agentul de solubilizare respectiv: (a) trebuie să fie miscibil cu apa, de exemplu metanol sau acetonitril; (b) concentrația acestuia nu trebuie să fie mai mare de 1 % din volumul total al soluției mamă și să reprezinte mai puțin decât cea din soluția substanței testate care va veni în contact cu solul (de preferință mai mică de 0,1 %); și (c) nu trebuie să fie un agent tensioactiv sau să intre în reacții solvolitice cu substanța chimică testată. Utilizarea unui agent de solubilizare se stipulează și se justifică în raportarea rezultatelor.
O altă posibilitate pentru substanțele cu solubilitate mică constă în adăugarea substanței testate în sistemul experimental prin îmbogățire: substanța de testat se dizolvă într-un solvent organic, din care se ia un alicot care se adaugă în sistemul format din sol și soluție de CaCl20,01 M în apă distilată sau deionizată. Conținutul de solvent organic în faza apoasă se menține cât se poate de mic, de obicei mai mic sau egal cu 0,1 %. Se poate ca îmbogățirea dintr-o soluție organică să nu fie reproductibilă din punct de vedere al volumului. Astfel, se poate introduce încă o eroare, deoarece concentrația substanței testate și a cosolventului s-ar putea să nu fie aceleași în toate încercările.
1.8. CONDIȚII NECESARE PENTRU REALIZAREA TESTULUI DE ADSORBȚIE/DESORBȚIE
1.8.1. Metoda analitică
Parametrii importanți care pot să influențeze precizia măsurătorilor de sorbție includ acuratețea metodei analitice pentru analiza atât a fazei soluției, cât și a celei adsorbite, stabilitatea și puritatea substanței testate, realizarea echilibrului de sorpție, amploarea variației concentrației soluției, raportul sol/soluție și modificările din structura solului în timpul procesului de stabilire a echilibrului (35) (59)-(62). Câteva exemple privind problemele de acuratețe sunt prezentate în apendicele 2.
Trebuie să se verifice fiabilitatea metodei analitice pentru un domeniu de concentrații care se pot întâlni în timpul încercării. Cercetătorul trebuie să aibă libertatea de a elabora o metodă potrivită care să prezinte acuratețe, precizie, reproductibilitate, limite de detecție și recuperare optime. În continuare, se oferă o orientare privind modul de efectuare a acestei încercări.
Un volum potrivit de CaCl20,01 M, de exemplu 100 cm3, se supune agitării timp de 4 ore împreună cu o cantitate de sol, de exemplu 20 g, cu o capacitate mare de adsorbție, adică cu un conținut mare de carbon organic și argilă; greutățile și volumele menționate pot să varieze în funcție de necesitățile analitice, dar ca punct de plecare se preferă un raport sol/soluție de 1:5. Amestecul se supune centrifugării și faza apoasă se poate filtra. Se adaugă un volum determinat de soluție mamă a substanței testate la aceasta din urmă pentru a obține o concentrație nominală care să se încadreze în domeniul de concentrații care se pot întâlni în timpul încercării. Volumul respectiv trebuie să fie mai mic sau egal cu 10 % din volumul final al fazei apoase, pentru a modifica cât se poate de puțin natura soluției la preechilibru. Se analizează soluția.
Pentru verificarea artefactelor din metoda analitică și a efectelor de matrice provocate de sol, trebuie să se includă o probă oarbă care să conțină sistemul sol + soluție de CaCl20,01 M (fără substanța testată).
Metodele analitice care se pot utiliza pentru măsurători de sorbție includ cromatografia gaz-lichid (CGL), cromatografia lichidă de înaltă performanță (HPLC), spectrometria (de exemplu GC/spectrometrie de masă, HPLC/spectrometrie de masă) și numărătoare în scintilație lichidă (pentru substanțele marcate radioactiv). Indiferent de metoda analitică utilizată, se consideră că este bine, dacă recuperările se situează între 90 % și 110 % din valoarea nominală. Pentru a permite detectarea și evaluarea după ce a avut loc partiția, este necesar ca limitele de detecție ale metodei analitice să fie cu cel puțin două ordine de mărime mai mici decât concentrația nominală.
Caracteristicile și limitele de detecție ale metodei analitice disponibile pentru efectuarea studiilor de adsorbție joacă un rol important în stabilirea condițiilor de testare și în întreaga desfășurare a încercării. Metoda urmează o cale experimentală generală și oferă recomandări și orientare pentru alte soluții, dacă există posibilitatea impunerii unor restricții datorită metodei analitice și dotării laboratorului.
1.8.2. Selectarea raporturilor optime sol/soluție
Selectarea raporturilor optime sol/soluție pentru studiile se sorbție depinde de coeficientul de distribuție Kd și de gradul relativ al adsorbției dorite. Modificarea concentrației substanței în soluție determină acuratețea statistică a măsurătorii, datorită formei ecuației pentru adsorbție și limitei de detecție a metodologiei analitice, în determinarea concentrației substanței chimice în soluție. Prin urmare, în practica generală, este util să se stabilească câteva raporturi fixe, pentru care procentul adsorbit să fie mai mare de 20 % și de preferință > 50 % (62), având grijă în același timp să se mențină o concentrație suficient de mare a substanței testate în fază apoasă, pentru a fi măsurată cu acuratețe. Acest lucru este deosebit de important pentru cantitățile mari, în procente, adsorbite.
Un procedeu comod de selectare a raporturilor optime sol/apă constă în estimarea valorii Kd fie prin studii preliminare, fie prin tehnici de estimare stabilite (apendicele 3). Apoi, selectarea unui raport optim se poate realiza cu ajutorul reprezentării grafice a raportului sol/soluție în funcție de Kd pentru procente stabilite ale adsorbției (figura 1). În reprezentarea grafică menționată, se consideră că ecuația de adsorbție este lineară ( 32 ). Relația aplicabilă se obține printr-o ecuație de rearanjare (4) a Kd sub forma ecuației (1):
|
|
(1) |
sau sub forma sa logaritmică, considerând că R = msol/V0 și

|
|
(2) |
Figura 1 Relația dintre raporturile sol/soluție și Kd la diferite procente de substanță testată adsorbită
Figura 1 prezintă raporturile sol/soluție în funcție de Kd pentru diferite valori ale adsorbției. De exemplu, pentru un raport sol/soluție de 1:5 și o valoare a Kd de 20, ar avea loc o adsorbție de 80 %. Pentru a obține o adsorbție de 50 % pentru aceeași valoare a Kd, trebuie să se utilizeze un raport de 1:25. Acest procedeu pentru selectarea raporturilor optime sol/soluție oferă persoanei care efectuează studiul flexibilitatea de a satisface necesitățile experimentale.
Zonele care sunt mai greu de rezolvat sunt cele în care substanța chimică este puternic sau foarte puțin adsorbită. Dacă se produce o adsorbție slabă, se recomandă un raport sol/soluție de 1:1, deși s-ar putea ca pentru unele tipuri de soluri foarte organice să fie necesare raporturi mai mici pentru a obține un mâl. La metodologia analitică, trebuie să se acorde o atenție deosebită la măsurarea modificărilor mici ale concentrației soluției; în caz contrar, măsurarea adsorbției nu va fi exactă. Pe de altă parte, la valori foarte mari ale coeficienților de distribuție Kd, se poate merge până la un raport sol/soluție de 1:100 pentru a lăsa o cantitate importantă de substanță chimică în soluție. Cu toate acestea, trebuie mare grijă pentru asigurarea unei amestecări bune și sistemul trebuie lăsat un timp suficient pentru stabilirea echilibrului. Un alt procedeu utilizat pentru rezolvarea cazurilor extreme de acest tip, atunci când nu există o metodologie analitică specifică, constă în estimarea valorii Kd cu ajutorul unor procedee de estimare, de exemplu, cu ajutorul valorilor Pow (apendicele 3). Acesta ar putea să fie util, în special pentru substanțele chimice puțin adsorbite/polare, cu Pow < 20 și pentru substanțele chimice lipofile/care se adsorb puternic, cu Pow > 104.
1.9. DESFĂȘURAREA TESTULUI
1.9.1. Condiții de testare
Toate testele se realizează la temperatura ambiantă și, dacă este posibil, la o temperatură constantă între 20 oC și 25 oC.
Condițiile de centrifugare trebuie să permită eliminarea particulelor mai mari de 0,2 μm din soluție. Valoarea menționată activează particulele de cele mai mici dimensiuni care sunt considerate particule solide și reprezintă limita dintre particulele solide și coloidale. O orientare asupra modului de determinare a condițiilor de centrifugare se prezintă în apendicele 4.
Dacă dispozitivele de centrifugare nu pot să garanteze eliminarea particulelor mai mari de 0,2 μm, se poate utiliza o combinație de centrifugare cu filtrare, cu filtre de 0,2 μm. Filtrele de acest tip ar trebui realizate dintr-un material inert potrivit pentru a evita pierderile de substanță testată pe acestea. În orice caz, trebuie dovedit că nu se produc pierderi de substanță testată în timpul filtrării.
1.9.2. Etapa 1 – Studiu preliminar
Scopul realizării unui studiu preliminar a fost deja prezentat la punctul „Domeniu de aplicare”. O orientare privind inițierea unei încercări de acest tip se prezintă în experimentul propus în continuare.
1.9.2.1. Selectarea raporturilor optime sol/soluție
Se utilizează două tipuri de soluri și trei raporturi sol/soluție (șase probe). Un tip de sol are conținut mare de carbon organic și conținut mic de argilă și celălalt are conținut mic de carbon organic și conținut mare de argilă. Se propun următoarele raporturi sol/soluție:
— 50 g sol și 50 cm3 soluție apoasă de substanță testată (raport 1/1);
— 10 g sol și 50 cm3 soluție apoasă de substanță testată (raport 1/5);
— 2 g sol și 50 cm3 soluție apoasă de substanță testată (raport 1/25).
Cantitatea minimă de sol pe care se poate efectua testarea depinde de dotările din laborator și de performanța metodelor analitice utilizate. Cu toate acestea, se recomandă să se utilizeze cel puțin 1 g și, de preferință, 2 g, pentru a obține rezultate credibile în urma încercărilor.
O probă martor care conține numai substanța testată în soluție de CaCl20,01 M (fără sol) se supune unor etape precis identice cu cele ale sistemelor studiate, pentru a verifica stabilitatea substanței testate în soluție de CaCl2 și posibilitatea adsorbției acesteia pe suprafețele vaselor experimentale.
O probă oarbă pentru fiecare sol, care conține aceeași cantitate de sol și un volum total de 50 cm3 de soluție de CaCl20,01 M (fără substanța testată) se supune aceluiași procedeu de testare. Acesta reprezintă principalul control în timpul analizei pentru detectarea substanțelor care interferează sau a solurilor contaminate.
Toate încercările, inclusiv cele cu probă martor și probă oarbă, se realizează cel puțin de două ori. Numărul total de probe care trebuie pregătite pentru studiu se poate calcula ținând seama de metodologia care va fi urmată.
Metodele pentru studiul preliminar și studiul principal sunt, în general, aceleași, excepțiile fiind menționate, dacă este cazul.
Probele de sol uscate în aer se aduc la echilibru prin agitare cu un volum minim de 45 cm3 de soluție de CaCl20,01 M peste noapte (12 h) înaintea zilei în care se efectuează testarea. Apoi, se adaugă un volum determinat din soluția mamă a substanței testate pentru a aduce volumul final la 50 cm3. Volumul respectiv de soluție mamă adăugat: (a) nu trebuie să fie mai mare de 10 % din volumul final de 50 cm3 de fază apoasă pentru a modifica cât se poate de puțin natura soluției de prestabilire a echilibrului; (b) trebuie să dea, de preferință, o concentrație inițială a substanței testate în contact cu solul (C0) cu cel puțin două ordine de mărime mai mare decât limita de detecție a metodei analitice; pragul menționat asigură posibilitatea de a efectua măsurători exacte chiar și atunci când se produc adsorbții puternice (> 90 %) și de determinare a izotermelor de adsorbție. Se recomandă, dacă este posibil, ca și concentrația inițială a substanței (C0) să nu fie mai mare decât jumătate din limita de solubilitate a acesteia.
În continuare se prezintă un exemplu de mod de calcul al concentrației soluției mamă (Csm). Se consideră o limită de detecție de 0,01 μg cm–3 și o adsorbție de 90 %; astfel, concentrația inițială a substanței testate în contact cu solul este, de preferință, de 1 μg cm–3 (cu două ordine de mărime mai mare decât limita de detecție). Considerând că se adaugă volum maxim recomandat de soluție mamă, adică 5-45 cm3 soluție de echilibrare de CaCl20,01 M (= 10 % din soluția mamă până la 50 cm3 volumul total al fazei apoase), concentrația soluției mamă este de 10 μg cm–3; aceasta este cu trei ordine de mărime mai mare decât limita de detecție a metodei analitice.
Se măsoară valoarea pH-ului fazei apoase înainte și după contactul cu solul, deoarece joacă un rol important în întregul proces de adsorbție, în special pentru substanțele ionizabile.
Amestecul se agită până la stabilirea echilibrului de adsorbție. Momentul stabilirii echilibrului în sol variază în mare măsură, în funcție de substanța chimică și de sol; în general, este suficient un timp de 24 h (77). În studiul preliminar, probele se pot colecta la anumite intervale de timp din cele 48 de ore de amestecare (de exemplu la 4, 8, 24, 48 h). Cu toate acestea, momentele în care se fac determinările se stabilesc și în funcție de programul de lucru al laboratorului.
Există două opțiuni pentru analiza substanței testate în soluție apoasă: (a) metoda paralelă și (b) metoda în serie. Trebuie să se sublinieze că, deși metoda paralelă este mai incomodă din punct de vedere experimental, tratarea matematică a rezultatelor este mai simplă (apendicele 5). Cu toate acestea, alegerea metodologiei de urmat rămâne la latitudinea cercetătorului care trebuie să ia în considerare dotarea și resursele de care dispune laboratorul.
(a) Metoda paralelă: se pregătesc probe cu același raport sol/soluție, în număr egal cu intervalele de timp la care se dorește să se studieze cinetica adsorbției. După centrifugare și dacă se dorește filtrarea, se recuperează faza apoasă din prima eprubetă cât se poate de complet și se măsoară după, de exemplu, 4 h, cea din a doua eprubetă după 8 h, cea din a treia după 24 h etc.
(b) Metoda în serie: se prepară doar o probă dublă pentru fiecare raport sol/soluție. La intervale determinate de timp, amestecul se supune centrifugării pentru separarea fazelor. Se analizează imediat un mic alicot din faza apoasă pentru determinarea substanței testate; apoi testarea continuă cu amestecul inițial. Dacă se aplică filtrarea după centrifugare, laboratorul trebuie să dispună de dispozitivele pentru realizarea filtrării unor mici alicoți din soluția apoasă. Se recomandă ca volumul total al alicoților luați să nu fie mai mare de 1 % din volumul total al soluției, pentru nu a modifica semnificativ raportul sol/soluție și pentru a reduce masa substanței dizolvate care poate să fie adsorbită în timpul încercării.
Se calculează adsorbția
![]()
![]()
1.9.2.2. Determinarea momentului de stabilire a echilibrului de adsorbție și a cantității de substanță testată adsorbită la echilibru
După cum s-a menționat deja, reprezentările grafice ale
![]()
sau
![]()
în funcție de timp permit estimarea stabilirii echilibrului de adsorbție și a cantității de substanță testată adsorbită la echilibru. Figurile 1 și 2 din apendicele 5 prezintă exemple de asemenea reprezentări grafice. Momentul de stabilire a echilibrului reprezintă nevoia sistemului de a ajunge la un palier.
Dacă, pentru un anumit sol, nu se găsește un palier, ci o creștere constantă, acest lucru se poate datora unor factori care complică situația, cum ar fi biodegradarea sau difuzia lentă. Biodegradarea se poate pune în evidență prin repetarea încercării cu o probă sterilizată de sol. Dacă nici în acest caz nu se obține un palier, cercetătorul trebuie să caute alte fenomene care ar putea să fie implicate în studiile sale specifice; acest lucru se poate realiza prin modificări corespunzătoare ale condițiilor experimentale (temperatură, timpi de agitare, raporturi sol/soluție). Rămâne la latitudinea cercetătorului să decidă dacă să continue procedeul de testare, în ciuda unui posibil eșec în stabilirea echilibrului.
1.9.2.3. Adsorbția pe suprafața vasului experimental și stabilitatea substanței testate
Se pot obține date privind adsorbția substanței testate pe suprafața vaselor experimentale, precum și stabilitatea acesteia, prin analizarea probelor martor. Dacă se observă o epuizare mai mare decât eroarea standard a metodei analitice, se poate să fie implicată degradarea abiotică și adsorbția pe suprafața vasului experimental. Se poate face distincția dintre aceste două fenomene prin spălarea cu grijă a pereților vasului experimental cu un volum cunoscut dintr-un solvent potrivit și analizarea soluției de spălare pentru determinarea substanței testate. Dacă nu se observă adsorbție pe suprafața vaselor experimentale, epuizarea indică instabilitatea abiotică a substanței testate. Dacă se găsește adsorbție, este necesar ca vasul experimental să fie din alt material. Cu toate acestea, rezultatele încercării descrise anterior privind adsorbția pe suprafața vaselor experimentale nu pot fi extrapolate direct la testarea sol/soluție. Prezența solului va afecta adsorbția respectivă.
Se pot obține date suplimentare privind stabilitatea substanței testate prin determinarea bilanțului de masă original în timp. Aceasta înseamnă că se analizează faza apoasă, extractele de sol și pereții vaselor experimentale pentru determinarea substanței testate. Diferența dintre masa substanței chimice testate adăugate și suma maselor substanței chimice testate în faza apoasă, extractele de sol și de pe pereții vaselor experimentale este egală cu masa degradată și volatilizată și neextrasă. Pentru a determina bilanțul de masă, este necesar ca echilibrul de adsorbție să fi fost stabilit în timpul experimentării.
Bilanțul de masă se face pe ambele soluri și pentru un raport sol/soluție per sol care dă o epuizare de peste 20 % și, de preferință, > 50 % la echilibru. La terminarea încercării pentru găsirea raportului prin analiza ultimei probe de fază apoasă după 48 ore, fazele se separă prin centrifugare și, dacă se dorește, prin filtrare. Faza apoasă se recuperează atât cât este posibil și se adaugă solului un solvent de extracție potrivit (coeficientul de extracție de cel puțin 95 %) pentru extragerea substanței testate. Se recomandă cel puțin două extracții succesive. Se determină cantitatea de substanță din extractele din sol și de pe pereții vaselor experimentale și se calculează bilanțul de masă (Date și raport, ecuația 10). Dacă acesta este mai mic de 90 %, se consideră că substanța testată este instabilă pe scara timpului de testare. Cu toate acestea, studiile se mai pot continua, ținând seama de instabilitatea substanței testate; în cazul respectiv, se recomandă analizarea ambelor faze în studiul principal.
1.9.2.4. Etapa 2 – Cinetica de adsorbție la o concentrație a substanței testate
Se utilizează cinci soluri, selectate din tabelul 1. Este avantajoasă includerea unora sau a tuturor solurilor utilizate în studiul preliminar, dacă este cazul, printre cele cinci soluri. În cazul respectiv, pentru solurile utilizate în studiul preliminar, etapa 2 nu trebuie să se repete.
Momentul stabilirii echilibrului, raportul sol/soluție, greutatea probei de sol, volumul fazei apoase în contact cu solul și concentrația substanței testate în soluție se aleg în funcție de rezultatele studiului preliminar. Determinarea se face de preferință după aproximativ 2, 4, 6, 8 (posibil și 10) și 24 h timp de contact; timpul de agitare se poate prelungi la maximum 48 h, dacă o substanță chimică necesită un timp mai îndelungat pentru stabilirea echilibrului în privința rezultatelor încercării pentru găsirea raportului. Cu toate acestea, momentele de efectuare a determinărilor se pot stabili cu îngăduință.
Fiecare testare (un sol și o soluție) se realizează cel puțin dublu pentru a permite estimarea variației rezultatelor. Pentru fiecare testare se pregătește o probă oarbă. Aceasta conține solul și soluția de CaCl20,01 M, fără substanța testată și având greutatea și respectiv volumul identice cu cele din testare. O probă martor care conține numai substanța testată în soluția de CaCl20,01 M (fără sol) se supune aceluiași procedeu de testare, servind drept garanție pentru situații neprevăzute.
Se calculează adsorbția în procente la fiecare moment
![]()
![]()
Rezultatele determinării cineticii de adsorbție
Valoarea Kd linear este în general exactă pentru descrierea comportamentului de sorbție în sol (35) (78) și reprezintă o expresie a mobilității inerente a substanțelor chimice în sol. De exemplu, se consideră, în general, că substanțele chimice cu Kd ≤ 1 cm3 g–1 sunt mobile calitativ. În mod similar, MacCall et al. (16) au elaborat un sistem de clasificare a mobilității în funcție de valorile Kco. În afară de acesta, există sisteme de clasificare a extracției prin spălare în funcție de relația dintre Kco și TD-50 ( 34 ) (32) (79).
De asemenea, conform studiilor de analiză a erorii (61), valorile Kd mai mici de 0,3 cm3 g–1 nu se pot determina cu exactitate dintr-o scădere a concentrației în fază apoasă, chiar și atunci când se utilizează raportul sol/soluție cel mai favorabil (din punct de vedere al exactității), adică 1:1. Într-un asemenea caz, se recomandă analiza ambelor faze, sol și soluție.
Referitor la observațiile anterioare, se recomandă ca studiul privind comportamentul de adsorbție a unei substanțe chimice în sol și posibila mobilitate a acesteia să fie continuat prin determinarea izotermelor de adsorbție Freundlich pentru sistemele respective, pentru care este posibilă o determinare exactă a Kd după protocolul de testare din prezenta metodă de testare. Este posibilă o determinare exactă, dacă valoarea care rezultă prin amplificarea Kd cu raportul sol/soluție este > 0,3, când măsurătorile au la bază scăderea concentrației în faza apoasă (metoda indirectă) sau > 0,1, când se analizează ambele faze (metoda directă) (61).
1.9.2.5. Etapa 3 – Izotermele de adsorbție și cinetica de desorbție/izotermele de desorbție
1.9.2.5.1.
Se utilizează cinci concentrații ale substanței testate, care cuprind de preferință două ordine de mărime; în alegerea concentrațiilor respective, se ține seama de solubilitatea în apă și de concentrațiile în soluție apoasă rezultate la echilibru. Pe toată durata studiului se menține același raport sol/soluție. Testarea de adsorbție se realizează așa cum s-a descris anterior, cu singura diferență că faza apoasă se analizează doar o singură dată la timpul necesar pentru stabilirea echilibrului, cum s-a determinat mai înainte în etapa 2. Se determină concentrațiile la echilibru în soluție și se calculează cantitatea adsorbită din epuizarea substanței testate în soluție sau prin metoda directă. Se reprezintă grafic masa adsorbită per unitatea de masă de sol în funcție de concentrația la echilibru a substanței testate (a se vedea Date și raport).
Rezultatele determinării izotermelor de adsorbție
Printre modelele matematice pentru adsorbție propuse până în prezent, izoterma lui Freundlich este una utilizată frecvent pentru descrierea procesului de adsorbție. Date mai detaliate privind interpretarea și importanța modelelor de adsorbție se prezintă în bibliografie (41) (45) (80) (81) (82).
Notă: Trebuie să se menționeze că este posibilă o comparare a valorilor KF (coeficientul de adsorbție Freundlich) pentru diferite substanțe, dacă valorile KF respective se exprimă în aceleași unități (83).
1.9.2.5.2.
Scopul prezentei încercări este de a cerceta dacă o substanță chimică este adsorbită reversibil sau ireversibil pe un sol. Aceste date sunt importante, deoarece procesul de desorbție joacă un rol important și în comportamentul unei substanțe chimice în solul din teren. În plus, datele de desorbție sunt date de intrare importante în modelarea pe calculator a simulărilor pentru extracția prin spălarea și scurgerea substanțelor dizolvate. Dacă se dorește un studiu de desorbție, se recomandă să se efectueze studiul descris în continuare pentru fiecare sistem pentru care a fost posibilă o determinare exactă a Kd în testarea precedentă pentru determinarea cineticii de adsorbție.
Ca și în cazul studiului cineticii de adsorbție, există două opțiuni pentru continuarea încercării pentru determinarea cineticii de desorbție: (a) metoda paralelă și (b) metoda în serie. Alegerea metodologiei de urmat rămâne la latitudinea cercetătorului care trebuie să țină seama de dotarea și resursele laboratorului.
(a) Metoda paralelă: pentru fiecare sol care se alege pentru continuarea studiului de desorbție, se pregătesc probe cu același raport sol/soluție, în număr egal cu numărul intervalelor de timp la care se dorește să se studieze cinetica de desorbție. Este preferabil să se utilizeze aceleași intervale de timp ca în testarea pentru determinarea cineticii de adsorbție; totuși, timpul total se poate prelungi, dacă este cazul, pentru ca în sistem să se stabilească echilibrul de desorbție. Pentru orice testare (un sol, o soluție) se pregătește o probă oarbă. Aceasta conține solul și soluția de CaCl20,01 M, fără substanța testată și având greutatea și respectiv volumul identice cu cele din testare. Ca probă martor, substanța testată în soluție de CaCl20,01 M (fără sol) se supune aceleași proceduri de testare. Toate amestecurile de sol cu soluție se agită până se stabilește echilibrul de adsorbție (după cum s-a stabilit anterior în etapa 2). Apoi, fazele se separă prin centrifugare și se îndepărtează fazele apoase cât se poate de mult. Volumul soluției îndepărtate se înlocuiește cu un volum egal de soluție de CaCl20,01 M, fără substanța testată și noile amestecuri se agită din nou. Faza apoasă din prima eprubetă se recuperează cât se poate de mult și se măsoară după, de exemplu, 2 h, cea din a doua eprubetă după 4 h, cea din a treia după 6 h etc., până când se realizează echilibrul de desorbție.
(b) Metoda în serie: după testarea pentru determinarea cineticii de adsorbție, amestecul este supus centrifugării și se elimină faza apoasă cât se poate de mult. Volumul de soluție îndepărtat se înlocuiește cu un volum egal de soluție de CaCl20,01 M, fără substanța testată. Noul amestec se agită până când se stabilește echilibrul de desorbție. În acest timp, la intervale egale, amestecul se supune centrifugării pentru separarea fazelor. Se analizează imediat un mic alicot de fază apoasă pentru determinarea substanței testate; apoi, testarea continuă cu amestecul original. Volumul fiecărui alicot trebuie să fie mai mic de 1 % din volumul total. Se adaugă aceeași cantitate de soluție proaspătă de CaCl20,01 M la amestec pentru a menține raportul sol/soluție și se continuă agitarea până la următorul interval de timp.
Se calculează desorbția, în procente, la fiecare moment
![]()
![]()
Rezultatele încercării pentru determinarea cineticii de desorbție
Reprezentările grafice obișnuite ale desorbției
![]()
și adsorbției
![]()
, în procente, în funcție de timp, permit determinarea reversibilității procesului de adsorbție. Dacă echilibrul de desorbție se atinge chiar într-un timp dublu față de timpul necesar pentru atingerea echilibrului de adsorbție și desorbția totală este mai mare decât 75 % din cantitatea adsorbită, se consideră că adsorbția este reversibilă.
1.9.2.5.3.
Se determină izotermele de desorbție Freundlich pe solurile utilizate în testarea pentru izotermele de adsorbție. Testarea de desorbție se efectuează conform descrierii de la punctul „Cinetica de desorbție”, cu singura diferență că faza apoasă se analizează doar o singură dată, la echilibrul de desorbție. Se calculează cantitatea de substanță testată desorbită. Se reprezintă grafic conținutul de substanță testată, care rămâne adsorbită pe sol la atingerea echilibrul de desorbție, în funcție de concentrația la echilibru a substanței testate în soluție (a se vedea Date și raport și apendicele 5).
2. DATE ȘI RAPORT
Rezultatele analitice se prezintă sub formă de tabel (a se vedea apendicele 6). Se prezintă măsurătorile individuale și mediile calculate. Se prezintă reprezentările grafice ale izotermelor de adsorbție. Calculele se fac conform metodologiei descrise în continuare.
În sensul prezentei încercări, se consideră că greutatea pentru 1 cm3 de soluție apoasă este 1 g. Raportul sol/soluție se poate exprima în unități de greutate/greutate sau greutate/volum cu aceeași cifră.
2.1. ADSORPȚIA
Adsorbția (
![]()
![]()
|
|
(3) |
unde:
|
|
= |
adsorbția la momentul ti ( %) |
|
|
= |
masa substanței testate adsorbite pe sol la momentul ti (μg) |
|
m0 |
= |
masa substanței testate din eprubetă, la începutul încercării (μg). |
Date detaliate privind modul de calcul al adsorbției
![]()
, în procente, pentru metodele paralelă și în serie se prezintă în apendicele 5.
Coeficientul de distribuție Kd este raportul dintre conținutul de substanță din faza de sol și concentrația masică de substanță în soluția apoasă, în condițiile de testare, când se stabilește echilibrul de adsorbție.
|
|
(4) |
unde
|
|
= |
conținutul de substanță adsorbită pe sol la echilibrul de adsorbție (μg g–1); |
|
|
= |
concentrația masică a substanței în faza apoasă la echilibrul de adsorbție (μg cm–3). Concentrația respectivă se determină analitic ținând seama de valorile date de probele oarbe |
|
|
= |
masa substanței testate adsorbite pe sol la echilibrul de adsorbție (μg) |
|
|
= |
masa substanței testate în soluție la echilibrul de adsorbție (μg) |
|
msol |
= |
cantitatea de fază de sol, exprimată în masă uscată de sol (g) |
|
V0 |
= |
volumul inițial al fazei apoase în contact cu solul (cm3. |
Relația dintre Aec și Kd este dată de:
|
|
(5) |
unde:
|
Aec |
= |
adsorbția la echilibru, % |
Coeficientul de adsorbție normalizată a carbonului organic Kco reprezintă relația dintre coeficientul de distribuție Kd și conținutul de carbon organic din proba de sol:
|
|
(6) |
unde:
|
% co |
= |
procentajul de carbon organic în proba de sol (g g–1) |
Coeficientul Kco reprezintă o valoare unică ce caracterizează partiția în principal a substanțelor chimice organice nepolare între carbonul organic din sol sau sediment și apă. Adsorbția substanțelor chimice respective este corelată cu conținutul organic al solidului adsorbant (7); astfel, valorile Kco depind de caracteristicile specifice ale fracțiilor humice care au o capacitate de sorbție foarte diferită, datorită diferențelor de origine, geneză etc.
2.1.1. Izoterme de adsorbție
Ecuația izotermelor de adsorbție Freundlich reprezintă relația dintre cantitatea de substanță testată adsorbită și concentrația substanței testate în soluție la echilibru (ecuația 8).
Rezultatele sunt tratate ca la „Adsorbție” și, pentru fiecare eprubetă, se calculează conținutul de substanță testată adsorbită pe sol după testarea de adsorbție [
![]()
, indicată în altă parte ca x/m]. Se consideră că echilibrul a fost stabilit și că
![]()
reprezintă valoarea la echilibru:
|
|
(7) |
Ecuația de adsorbție Freundlich este prezentată la (8):
|
|
(8) |
sau sub formă lineară:
|
|
(9) |
unde:
|
|
= |
coeficientul de adsorbție Freundlich; se exprimă în cm3 g–1, numai dacă 1/n = 1; în toate celelalte cazuri, panta 1/n se introduce în dimensiunea
|
|
n |
= |
constanta de regresie, 1/n variază în general între 0,7-1,0, ceea ce indică faptul că rezultatele privind sorbția sunt în mod frecvent ușor nelineare. |
Ecuațiile (8) și (9) sunt reprezentate grafic și se calculează valorile pentru
![]()

Figura 2 Reprezentarea grafică a ecuației Freundlich, normală și linearizată
2.1.2. Bilanțul de masă
Bilanțul de masă (BM) se definește ca procentul de substanță care se poate recupera analitic după o testare de adsorbție în funcție de cantitatea de substanță la începutul încercării.
Prelucrarea rezultatelor va fi diferită, dacă solventul este complet miscibil cu apa. În cazul solventului miscibil cu apa, se poate aplica prelucrarea datelor descrise la „Desorbție” pentru determinarea cantității de substanță recuperată prin extracția solventului. Dacă solventul este mai puțin miscibil cu apa, trebuie să se determine cantitatea recuperată.
Bilanțul de masă BM pentru adsorbție se calculează după cum urmează: se consideră că termenul (mE) corespunde sumei maselor substanței chimice testate extrase din sol și de pe suprafața vasului experimental cu un solvent organic:
|
|
(10) |
unde:
|
BM |
= |
bilanțul de masă ( %); |
|
mE |
= |
masa totală a substanței testate extrase din sol și de pe pereții vasului experimental în două etape (μg); |
|
C0 |
= |
concentrația inițială în unități de masă a soluției experimentale în contact cu solul (μg cm–3); |
|
Vrec |
= |
volumul supernatantului recuperat după echilibrul de adsorbție (cm–3). |
2.2. DESORBȚIA
Desorbția (D) se definește ca fiind cantitatea de substanță testată desorbită, exprimată în procente, corelată cu cantitatea de substanță adsorbită anterior, în condițiile de testare:
|
|
(11) |
unde:
|
|
= |
desorbția la momentul ti ( %); |
|
|
= |
masa substanței testate desorbite din sol la momentul ti(μg); |
|
|
= |
masa substanței testate adsorbite pe sol la echilibrul de adsorbție (μg). |
Informații detaliate privind modul de calcul a desorbției
![]()
, în procente, pentru metodele paralelă și în serie, se prezintă în apendicele 5.
Coeficientul de desorbție aparentă (Kdes) este, în condițiile de testare, raportul dintre conținutul de substanță ce rămâne în faza de sol și concentrația masică a substanței desorbite în soluție apoasă, când se realizează echilibrul de desorbție.
|
|
(12) |
unde:
|
Kdes |
= |
coeficientul de desorbție (cm3 g–1) |
|
|
= |
masa totală a substanței testate desorbite din sol la echilibrul de desorbție (μg) |
|
VT |
= |
volumul total al fazei apoase în contact cu solul în timpul determinării cineticii de desorbție (cm3 |
Modul de calculare a
![]()
este prezentat în apendicele 5 la punctul „Desorbție”.
Observație:
Dacă testarea anterioară de adsorbție s-a realizat prin metoda paralelă, volumul VT din ecuația 12 se consideră egal cu V0.
2.2.1. Izotermele de desorbție
Ecuația pentru izotermele de desorbție Freundlich reprezintă corelația dintre conținutul de substanță testată care rămâne adsorbită pe sol și concentrația de substanță testată în soluție la echilibrul de desorbție (ecuația 16).
Pentru fiecare eprubetă, se calculează conținutul de substanță ce rămâne adsorbită pe sol la echilibrul de desorbție cu formula următoare:
|
|
(13) |
![]()
se definește prin relația:
|
|
(14) |
unde:
|
|
= |
conținutul de substanță testată ce rămâne adsorbită pe sol la echilibrul de desorbție (μg g–1); |
|
|
= |
masa substanței determinate analitic în fază apoasă la echilibrul de desorbție (μg); |
|
|
= |
masa substanței testate rămase de la echilibrul de adsorbție datorită înlocuirii incomplete a volumului (μg) |
|
|
= |
masa substanței din soluție la echilibrul de adsorbție (μg); |
|
|
(15) |
|
|
= |
volumul de soluție luat din eprubetă pentru determinarea substanței testate, la echilibrul de desorbție (cm3); |
|
VR |
= |
volumul supernatantului scos din eprubetă după atingerea echilibrului de adsorbție și înlocuit cu același volum de soluție de CaCl20,01 M (cm3). |
Ecuația de desorbție Freundlich este prezentată în ecuația 16:
|
|
(16) |
sau în forma lineară:
|
|
(17) |
unde:
|
|
= |
coeficientul de desorbție Freundlich; |
|
n |
= |
constanta de regresie; |
|
|
= |
concentrația masică de substanță în fază apoasă la echilibrul de desorbție (μg cm–3). |
Ecuațiile 16 și 17 se pot reprezenta grafic și se calculează valorile pentru
![]()
și 1/n prin analiza de regresie cu ajutorul ecuației 17.
Observație:
Dacă exponentul 1/n al adsorbției sau desorbției Freundlich este egal cu 1, constantele de legătură (
![]()
![]()
2.2.2. Raportul de testare
Raportul de testare trebuie să conțină următoarele date:
— Identificarea completă a probelor de sol utilizate, care include:
— definirea geografică a locului (latitudine, longitudine);
— data prelevării probelor;
— destinația terenului (de exemplu sol agricol, forestier etc.);
— adâncimea prelevării probelor;
— conținutul de nisip/mâl/argilă;
— valorile pH-ului (în soluție de CaCl20,01 M);
— conținutul de carbon organic;
— conținutul de substanțe organice;
— conținutul de azot;
— raportul C/N;
— capacitatea de schimb de cationi (mmol/kg);
— toate datele referitoare la colectarea și depozitarea probelor de sol;
— dacă este cazul, toate datele relevante pentru interpretarea adsorbției/desorbției substanței testate;
— specificarea metodelor utilizate pentru determinarea fiecărui parametru;
— date privind substanța testată, dacă este cazul;
— temperatura la care s-a efectuat testarea;
— condițiile de centrifugare;
— metoda analitică utilizată pentru determinarea substanței testate;
— justificarea oricărei utilizări a agentului de solubilizare pentru pregătirea soluției mamă a substanței testate;
— explicarea corecțiilor făcute în calcule, dacă este relevant;
— rezultatele conform formularului (apendicele 6) și prezentările grafice;
— toate datele și observațiile utile pentru interpretarea rezultatelor încercării.
3. REFERINȚE BIBLIOGRAFICE
1. Kukowski H. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02045, Part II.
2. Fränzle O., Kuhnt G. and Vetter L., (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02045, Part I.
3. Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication no. 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994.
4. OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995 (June 1995).
5. US-Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988.
6. US-Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-Fate, Transport and Transformation Test Guidelines, 0PPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996.
7. ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments.
8. Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987.
9. Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air.
10. Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment.
11. BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany.
12. Calvet R., (1989), „Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils”, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review).
13. Calvet R., (1980) „Adsorption-Desorption Phenomena” in Interactions between herbicides and the soil. (R.J. Hance ed.), Academic Press, London, p. 83-122.
14. Hasset J.J., and Banwart W.L., (1989), „The sorption of nonpolar organics by soils and sediments” in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, p. 31-44.
15. van Genuchten M. Th., Davidson J.M., and Wierenga P.J., (1974), „An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media”. Soil Sci. Soc. Am. Proc., Vol. 38(1), p. 29-35.
16. McCall P.J., Laskowski D.A., Swann R.L., and Dishburger H.J., (1981), „Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis”, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC.
17. Lambert S.M., Porter P.E., and Schieferrstein R.H., (1965), „Movement and sorption of chemicals applied to the soil”. Weeds, 13, p. 185-190.
18. Rhodes R.C., Belasco I.J., and Pease H.L., (1970) „Determination of mobility and adsorption of agrochemicals in soils”. J. Agric. Food Chem., 18, p. 524-528.
19. Russell M.H., (1995), „Recommended approaches to assess pesticide mobility in soil” in Environmental Behavior of Agrochemicals (ed. T.R. Roberts and P.C. Kearney). John Wiley & Sons Ltd.
20. Esser H.O., Hemingway R.J., Klein W., Sharp D.B., Vonk J.W. and Holland P.T., (1988), „Recommended approach to the evaluation of the environmental behavior of pesticides”, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, p. 901-932.
21. Guth J.A., Burkhard N., and D.O. Eberle, (1976), „Experimental models for studying the persistence of pesticides in soils”. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, p. 137-157, BCPC, Surrey, UK.
22. Furminge C.G.L., and Osgerby J.M., (1967), „Persistence of herbicides in soil”. J. Sci. Fd Agric., 18, p. 269-273.
23. Burkhard N., and Guth J.A., (1981), „Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-1,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption”. Pestic. Sci. 12, p. 45-52.
24. Guth J.A., Gerber H.R., and Schlaepfer T., (1977). „Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides”. Proc. Br. Crop Prot. Conf., 3, p. 961-971.
25. Osgerby J.M., (1973), „Process affecting herbicide action in soil”. Pestic. Sci., 4, p. 247-258.
26. Guth J.A., (1972), „Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden”. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, p. 143-154.
27. Hamaker J.W., (1975), „The interpretation of soil leaching experiments”, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed), p. 135-172, Plenum Press, NY.
28. Helling C.S., (1971), „Pesticide mobility in soils”. Soil Sci. Soc. Amer. Proc., 35, p. 732-210.
29. Hamaker J.W., (1972), „Diffusion and volatilization” in Organic chemicals in the soil environment (C.A.I. Goring and J.W. Hamaker eds), Vol. I, p. 49-143.
30. Burkhard N. and Guth J.A., (1981), „Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system”. Pestic. Sci. 12, p. 37-44.
31. Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G., (1984), „Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, p. 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC.
32. Gustafson D.I., (1989), „Groundwater ubiquity score: a simple method for assessing pesticide leachability”. J. Environ. Toxic. Chem., 8(4), p. 339-357.
33. Leistra M., and Dekkers W.A., (1976). „Computed effects of adsorption kinetics on pesticide movement in soils”. J. of Soil Sci., 28, p. 340-350.
34. Bromilov R.H., and Leistra M., (1980), „Measured and simulated behavior of aldicarb and its oxydation products in fallow soils”. Pest. Sci., 11, p. 389-395.
35. Green R.E., and Karickoff S.W., (1990), „Sorption estimates for modeling”, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, p. 80-101,
36. Lambert S.M., (1967), „Functional relationship between sorption in soil and chemical structure”. J. Agri. Food Chem., 15, p. 572-576.
37. Hance R.J., (1969), „An empirical relationship between chemical structure and the sorption of some herbicides by soils”. J. Agri. Food Chem., 17, p. 667-668.
38. Briggs G.G. (1969), „Molecular structure of herbicides and their sorption by soils”. Nature, 223, p. 1288.
39. Briggs G.G. (1981). „Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor”. J. Agric. Food Chem., 29, p. 1050-1059.
40. Sabljic A., (1984), „Predictions of the nature and strength of soil sorption of organic polutance by molecular topology”. J. Agric. Food Chem., 32, p. 243-246.
41. Bailey G.W., and White J.L., (1970), „Factors influencing the adsorption, desorption, and movement of pesticides in soil”. Residue Rev., 32, p. 29-92.
42. Bailey G.W., J.L. White and Y. Rothberg., (1968), „Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate”. Soil Sci. Soc. Amer. Proc. 32:222-234.
43. Karickhoff S.W., (1981) „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere 10, p. 833-846.
44. Paya-Perez A., Riaz M. and Larsen B., (1989), „Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners”. Environ. Toxicol. Safety 21, p. 1-17.
45. Hamaker J.W., and Thompson J.M., (1972). „Adsorption in organic chemicals” in Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, p. 49-143.
46. Deli J., and Warren G.F., 1971, „Adsorption, desorption and leaching of diphenamid in soils”. Weed Sci. 19:67-69.
47. Chu-Huang Wu, Buehring N., Davinson J.M. and Santelmann, (1975), „Napropamide Adsorption, desorption and Movement in soils”. Weed Science, Vol. 23, p. 454-457.
48. Haues M.H.B., Stacey M., and Thompson J.M., (1968) „Adsorption of s-triazine herbicides by soil organic preparations” in Isotopes and Radiation in Soil Organic Studies, p.75, International. Atomic Energy Agency, Vienna.
49. Pionke H.B., and Deangelis R.J., (1980), „Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase”, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report.
50. ISO Standard Compendium Environment: Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994).
51. Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition.
52. Black, Evans D.D., White J.L., Ensminger L.E., and Clark F.E., eds. „Methods of Soil Analysis”, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982.
53. ISO/DIS 10381-1 Soil Quality – Sampling – Part 1: Guidance on the design of sampling programmes.
54. ISO/DIS 10381-2 Soil Quality – Sampling – Part 2: Guidance on sampling techniques.
55. ISO/DIS 10381-3 Soil Quality – Sampling – Part 3: Guidance on safety of sampling.
56. ISO/DIS 10381-4 Soil Quality – Sampling – Part 4: Guidance on the investigation of natural and cultivated soils.
57. ISO/DIS 10381-5 Soil Quality – Sampling – Part 5: Guidance on the investigation of soil contamination of urban and industrial sites.
58. ISO 10381-6, 1993: Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
59. Green R.E., and Yamane V.K., (1970) „Precision in pesticide adsorption measurements”. Soil Sci. Am. Proc., 34, p. 353-354.
60. Grover R., and Hance R.J. (1970), „Effect of ratio of soil to water on adsorption of linuron and atrazine”. Soil Sci., p. 109-138.
61. Boesten, J.J.T.I, „Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system”. Pest. Sci. 1990, 30, 31-41.
62. Boesten, J.J.T.I. „Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106” Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26-29 April 1994.
63. Bastide J., Cantier J.M., et Coste C., (1980), „Comportement de substances herbicides dans le sol en fonction de leur structure chimique”. Weed Res. 21, p. 227-231.
64. Brown D.S., and Flagg E.W., (1981), „Empirical prediction of organic pollutants sorption in natural sediments”. J. Environ.Qual., 10(3), p. 382-386.
65. Chiou C.T., Porter P.E., and Schmedding D.W., (1983), „Partition equilibria of non-ionic organic compounds between soil organic matter and water”. Environ. Sci. Technol., 17(4), p. 227-231.
66. Gerstl Z., and Mingelgrin U., (1984), „Sorption of organic substances by soils and sediments”. J. Environm. Sci. Health, B19 (3), p. 297-312.
67. Vowles P.D., and Mantoura R.F.C., (1987), „Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons”. Chemosphere, 16(1), p. 109-116.
68. Lyman W.J., Reehl W.F.and Rosenblatt D.H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC.
69. Keniga E.E., and Goring, C.A.I. (1980). „Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota” in Aquatic Toxicology (eds J.G. Eaton, et al.), p. 78-115, ASTM STP 707, Philadelphia.
70. Chiou C.T., Peters L.J., and Freed V.H., (1979), „A physical concept of soil-water equilibria for non-ionic organic compounds”. Science, Vol. 206, p. 831-832.
71. Hassett J.J., Banwart W.I., Wood S.G., and Means J.C., (1981), „Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption”. Soil Sci. Soc. Am. J. 45, p. 38-42.
72. Karickhoff S.W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere, Vol. 10(8), 833-846.
73. Moreale A., van Bladel R., (1981), “Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité – reactivité. Revue de l’Agric., 34 (4), p. 319-322.
74. Müller M., Kördel W. (1996), „Comparison of screening methods for the determination/estimation of adsorption coefficients on soil”. Chemosphere, 32(12), p. 2493-2504.
75. Kördel W., Kotthoff G., Müller M. (1995), „HPLC – screening method for the determination of the adsorption coefficient on soil – results of a ring test”. Chemosphere 30 (7), p. 1373-1384.
76. Kördel W., Stutte J., Kotthoff G. (1993), “HPLC – screening method for the determination of the adsorption coefficient on soil – comparison of different stationary phases. Chemosphere 27 (12), p. 2341-2352.
77. Hance, R.J., (1967), „The speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides”. Weed Research, Vol. 7, p. 29-36.
78. Koskinen W.C., and Harper S.S., (1990), „The retention processes: mechanisms” in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin.
79. Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G. (1984), „Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, p.297-325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC.
80. Giles C.H., (1970), „Interpretation and use of sorption isotherms” in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, p. 14-32.
81. Giles, C.H.; McEwan J.H.; Nakhwa, S.N. and Smith, D, (1960), „Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils”. J. Chem. Soc., 3973-93.
82. Calvet R., Tercé M., and Arvien J.C., (1980), „Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l’adsorption”. Ann. Agron. 31: 239-251.
83. Bedbur E., (1996), „Anomalies in the Freundlich equation”, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, U.K.
84. Guth, J.A., (1985), „Adsorption/desorption”, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK.
85. Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
Apendicele 1
Protocolul testului
Apendicele 2
INFLUENȚA PRECIZIEI METODEI ANALITICE ȘI A VARIAȚIEI CONCENTRAȚIEI ASUPRA PRECIZIEI REZULTATELOR PRIVIND ADSORBȚIA
Din tabelul prezentat în continuare (84), este evident că atunci când diferența dintre masa inițială (m0 = 110 μg) și masa la echilibru [
![]()
![]()
|
Cantitatea de sol |
msol |
= 10 g |
|
Volumul soluției |
V0 |
= 100 cm3 |
|
(μg) |
(μg cm-3) |
R |
(μg) |
(μg g-1) |
R‡ |
Kd* |
R‡ |
|
|
PENTRU A = 9 % |
||||||||
|
m0 = 110 μg sau C0 = 1,100 μg/cm3 |
100 |
1,000 |
valoarea reală |
10 |
1,00 |
valoarea reală |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
PENTRU A = 55 % |
||||||||
|
m0 = 110 μg sau C0 = 1,100 μg/cm3 |
50,0 |
0,500 |
valoarea reală |
60,0 |
6,00 |
valoarea reală |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,550 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
PENTRU A = 99 % |
||||||||
|
m0 = 110 μg sau C0 = 1,100 μg/cm3 |
1,100 |
0,011 |
valoarea reală |
108,9 |
10,89 |
valoarea reală |
990 |
|
|
1,111 |
0,01111 |
1 % |
108,889 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 % |
899 |
9,2 % |
|
unde:
|
|
= |
|
|
|
= |
masa substanței testate în faza de sol la echilibru, μg |
|
|
= |
masa substanței testate în faza apoasă la echilibru, μg |
|
|
= |
conținutul de substanță testată în faza de sol la echilibru, μg g–1 |
|
|
= |
concentrația masică a substanței încercate în faza apoasă la echilibru, μg cm–3 |
|
R |
= |
eroarea analitică în determinarea
|
|
R‡ |
= |
eroarea calculată datorită erorii analitice R. |
Apendicele 3
METODE DE ESTIMARE PENTRU Kd
1. Metodele de estimare permit estimarea Kd din corelațiile cu, de exemplu, valorile Pow (12) (39) (63)-(68), datele privind solubilitatea apei (12) (19) (21) (39) (68-73) sau datele privind polaritatea, rezultate din aplicarea HPLC (cromatografia lichidă de înaltă performanță) la faza inversată (74-76). Conform celor prezentate în tabelele 1 și 2, Kco sau Kso se calculează din ecuațiile menționate și, apoi, Kd se calculează indirect din ecuațiile următoare:
|
|
|
2. Concepția corelațiilor prezentate are în vedere două ipoteze: (1) adsorbția și desorbția sunt influențate în principal de substanța organică din sol și (2) interacțiunile implicate sunt în principal nepolare. Ca urmare, corelațiile de acest tip: (1) nu se pot aplica sau se pot aplica într-o anumită măsură la substanțele polare și (2) nu se pot aplica pentru un conținut foarte mic de substanță organică în sol (12). În afară de aceasta, deși s-au găsit corelații satisfăcătoare între Pow și adsorbție (19), nu se poate spune același lucru pentru relația dintre solubilitatea apei și gradul de adsorbție (19) (21); până în prezent, studiile sunt foarte contradictorii.
3. În tabelele 1 și 2 se prezintă câteva exemple de corelații între coeficientul de adsorbție și coeficientul de partiție octanol-apă și respectiv solubilitatea în apă.
Tabelul 1
Exemple de corelație între coeficientul de distribuție a adsorbției și coeficientul de partiție octanol-apă; pentru alte exemple, a se vedea referințele 12 și 68
|
Substanțe |
Corelații |
Autori |
|
Urei substituite |
log Kso = 0,69 + 0,52 log Pow |
Briggs (1981) (39) |
|
Clorurate aromate |
log Kco = - 0,779 + 0,904 log Pow |
Chiou et al. (1983) (65) |
|
Diferite pesticide |
log Kso = 4,4 + 0,72 log Pow |
Gerstl și Mingelgrin (1984) (66) |
|
Hidrocarburi aromate |
log Kco = - 2,53 + 1,15 log Pow |
Vowles și Mantoura (1987) (67) |
Tabelul 2
Exemple de corelație între coeficientul de distribuție a adsorbției și solubilitatea în apă; pentru alte exemple, a se vedea referințele 68 și 69
|
Substanțe |
Corelații |
Autori |
|
Diferite pesticide |
log Kso = 3,8 - 0,561 log Sa |
Gerstl și Mingelgrin (1984) (66) |
|
Substanțe clorurate aromate, alifatice |
log Kso = (4,040 +/– 0,038) - (0,557+/-0,012) log Sa |
Chiou et al. (1979) (70) |
|
α-naftol |
logKco = 4,273 - 0,686 log Sa |
Hasset et al. (1981) (71) |
|
Substanțe aromate, alifatice ciclice |
logKco = - 1,405 - 0,921 log Sa - 0,00953 (mp-25) |
Karickhoff (1981) (72) |
|
Compuși diverși |
log Kso = 2,75 - 0,45 log Sa |
Moreale van Blade (1982) (73) |
Apendicele 4
CALCULE PENTRU STABILIREA CONDIȚIILOR DE CENTRIFUGARE
1. Timpul de centrifugare se obține cu formula următoare, considerând că particulele sunt sferice:
|
|
(1) |
Pentru simplificare, toți parametrii se exprimă în unități non-SI (g, cm).
unde:
|
ω |
= |
viteza rotațională (= 2 π rpm/60), rad s-1 |
|
rpm |
= |
rotații pe minut |
|
η |
= |
vâscozitatea soluției, g s-1 cm–1 |
|
rp |
= |
raza particulei, cm |
|
ρs |
= |
densitatea solului, g cm-3 |
|
ρap |
= |
densitatea soluției, g cm-3 |
|
Rt |
= |
distanța de la centrul rotorului centrifugei până la suprafața soluției din eprubeta din centrifugă, cm |
|
Rb |
= |
distanța de la centrul rotorului centrifugei până la fundul eprubetei din centrifugă, cm |
|
Rb – Rt |
= |
lungimea amestecului sol/soluție în eprubeta din centrifugă, cm |
În practică, se utilizează dublul timpilor calculați pentru a asigura separarea completă.
2. Ecuația (1) se mai poate simplifica, dacă se consideră că vâscozitatea (η) și densitatea (ρap) soluției sunt egale cu vâscozitatea și densitatea apei la 25 oC; astfel, η = 8,95 × 10-3 g s-1 cm-1 și ρap = 1,0 g cm-3.
Atunci, timpul de centrifugare se obține cu ecuația (2):
|
|
(2) |
3. Din ecuația 2 se vede că doi parametri sunt importanți pentru stabilirea condițiilor de centrifugare, adică timpul (t) și viteza (rpm), pentru a realiza separarea particulelor cu o anumită dimensiune (în cazul nostru cu raza de 0,1 μm): (1) densitatea solului și (2) lungimea amestecului în eprubeta din centrifugă (Rb – Rt), adică distanța parcursă de particula de sol de la suprafața soluției până la fundul eprubetei; evident, pentru un volum stabilit, lungimea amestecului din eprubetă va depinde de pătratul razei eprubetei din centrifugă.
4. Figura 1 prezintă variațiile timpului de centrifugare (t) în funcție de viteza de centrifugare (rpm) la diferite densități ale solului (ρs) (figura 1a) și diferite lungimi ale amestecului din eprubetele din centrifugă (figura 1b). Din figura 1a, este evidentă influența densității solului; de exemplu, pentru o centrifugare clasică de 3 000 rpm, timpul de centrifugare este de aproximativ 240 minute pentru o densitate a solului de 1,2 g cm3, și de numai 50 minute pentru o densitate a solului de 2,0 g cm3. În mod similar, din figura 1b, pentru o centrifugare clasică de 3 000 rpm timpul este de 50 minute pentru o lungime a amestecului de 10 cm și de numai 7 minute pentru o lungime de 1 cm. Cu toate acestea, este important să se găsească o relație optimă între centrifugare, care necesită o lungime cât se poate mai mică și ușurința manipulării de către executant la separarea fazelor după centrifugare.
5. În plus, la stabilirea condițiilor experimentale pentru separarea fazelor sol/soluție, este important să se ia în considerație posibilitatea existenței unei a treia „pseudo-faze”, coloizii. Particulele de acest tip, cu o dimensiune mai mică de 0,2 μm, pot să aibă un impact important asupra întregului mecanism de adsorbție a unei substanțe într-o suspensie de sol. Atunci când centrifugarea se realizează ca în descrierea anterioară, coloizii rămân în faza apoasă și se analizează împreună cu faza apoasă. Astfel, datele privind impactul acestora se pierd.
Dacă laboratorul executant posedă dispozitive de ultracentrifugare sau ultrafiltrare, ar putea fi posibil un studiu mai aprofundat al fenomenului de adsorbție/desorbție al unei substanțe în sol, care să includă date privind adsorbția substanței pe coloizi. În cazul respectiv, se aplică o ultracentrifugare la 60 000 rpm sau o ultrafiltrare cu un filtru cu porozitatea de 100 000 daltoni pentru separarea celor trei faze: sol, coloizi, soluție. Este necesar ca și protocolul testului să se modifice corespunzător, pentru ca la toate cele trei faze să se analizeze substanța.
Figura 1a.

Variațiile timpului de centrifugare (t) în funcție de viteza de centrifugare (rpm) pentru diferite densități ale solului (ρs). Rt = 10 cm, Rb – Rt = 10 cm, η = 8,95 × 10-3g s-1 cm-1 și ρap = 1,0 g cm-3 la 25 oC.
Figura 1b.

Variațiile timpului de centrifugare (t) în funcție de viteza de centrifugare (rpm) pentru diferite lungimi ale amestecului în eprubeta din centrifugă (Rb – Rt)= L; Rt = 10 cm, η = 8,95 × 10-3g s-1 cm-1, ρap = 1,0 g cm-3 la 25 oC și ρs = 2,0 g cm-3.
Apendicele 5
CALCULUL ADSORBȚIEI A (%) ȘI DESORBȚIEI D (%)
Diagrama timpului procedeului este:

În toate calculele se consideră să substanța testată este stabilă și nu se adsoarbe semnificativ pe pereții recipientului.
ADSORBȚIA A (A %)
(a) Metoda paralelă
Adsorbția, în procente, se calculează pentru fiecare eprubetă (i) și pentru fiecare moment (ti), conform ecuației:
|
|
(1) |
Termenii ecuației anterioare se pot calcula după cum urmează:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
unde:
|
|
= |
adsorbția în procente ( %) la momentul ti; |
|
|
= |
masa substanței testate pe sol la timpul ti la care se efectuează analiza (μg); |
|
m0 |
= |
masa substanței testate din eprubetă, la începutul încercării (μg); |
|
C0 |
= |
concentrația masică inițială a substanței din soluția de testare în contact cu solul (μg cm–3); |
|
|
= |
concentrația masică a substanței în faza apoasă la timpul ti la care se realizează analiza (μg cm–3); concentrația respectivă se determină analitic, ținând seama de valorile oferite de probele oarbe; |
|
V0 |
= |
volumul inițial al soluției testate în contact cu solul (cm3). |
Valorile adsorbției, în procente,
![]()
sau
![]()
se reprezintă grafic în funcție de timp și se determină timpul după care se atinge echilibrul de sorbție. Exemple cu aceste reprezentări grafice se prezintă în figurile 1 și, respectiv, 2.

Figura 1
Reprezentarea grafică a echilibrului de adsorbție

Figura 2
Concentrația masică a substanței testate în fază apoasă (Cap) în funcție de timp
(b) Metoda în serie
Ecuațiile prezentate în continuare țin seama de faptul că determinarea adsorbției se realizează prin măsurători ale substanței testate în mici alicoți de fază apoasă la anumite intervale de timp.
— În fiecare interval de timp, se calculează cantitatea de substanță adsorbită pe sol, după cum urmează:
—— pentru primul interval de timp Δt1 = t1 – t0
—
|
|
(4) |
— pentru al doilea interval de timp Δt2 = t2 – t1
—
|
|
(5) |
— pentru al treilea interval de timp Δt3 = t3 – t2
—
|
|
(6) |
— pentru al n-lea interval de timp Δtn = tn – tn-1
—
|
|
(7) |
— Adsorbția, în procente, la fiecare interval de timp,
![]()
|
|
(8) |
— în timp ce adsorbția, în procente, (
![]()
|
|
(9) |
— Valorile adsorbției
![]()
![]()
— La momentul echilibrului tec:
—— masa substanței testate adsorbite pe sol este:
—
|
|
(10) |
— masa substanței testate în soluție este:
—
|
|
(11) |
— și adsorbția, în procente, la echilibru este:
—
|
|
(12) |
Parametrii din ecuațiile anterioare se definesc după cum urmează:
|
|
= |
masa substanței adsorbite pe sol în intervalele de timp Δt1, Δt2,… și respectiv Δtn (μg) |
|
|
= |
masa substanței, măsurată într-un alicot
|
|
|
= |
masa substanței adsorbite pe sol la echilibrul de adsorbție (μg) |
|
|
= |
masa substanței în soluție la echilibrul de adsorbție (μg) |
|
|
= |
volumul alicotului în care se măsoară substanța testată (cm3) |
|
|
= |
adsorbția, în procente, ce corespunde la un interval de timp Δti (%) |
|
|
= |
adsorbția, în procente, la echilibrul de adsorbție (%) |
DESORBȚIA D (%)
Timpul t0, la care începe proba pentru cinetica de desorbție, se consideră ca momentul în care volumul maxim recuperat de soluție a substanței testate (după atingerea echilibrului de adsorbție) este înlocuit de un volum egal de soluție de CaCl20,01 M.
(a) Metoda paralelă
La momentul ti, se măsoară masa substanței testate în faza apoasă luată din eprubeta i
![]()
|
|
(13) |
La echilibrul de desorbție ti = tec și, prin urmare,
![]()
![]()
Masa substanței testate desorbite într-un interval (Δti) este dată de ecuația:
|
|
(14) |
Desorbția, în procente, se calculează:
la momentul ti din ecuația:
|
|
(15) |
și în intervalul de timp (Δti) din ecuația:
|
|
(16) |
unde:
|
|
= |
desorbția, în procente, la momentul ti (%) |
|
|
= |
desorbția, în procente, care corespunde unui interval Δti (%) |
|
|
= |
masa substanței testate desorbite la momentul ti, (μg) |
|
|
= |
masa substanței testate desorbite în intervalul de timp Δti (μg) |
|
|
= |
masa substanței testate măsurate analitic la timpul ti într-un volum de soluție
|
|
|
= |
masa substanței testate rămase de la echilibrul de adsorbție datorită înlocuirii incomplete a volumului (μg) |
|
|
(17) |
|
|
= |
masa substanței testate în soluție la echilibrul de adsorbție (μg) |
|
VR |
= |
volumul supernatantului scos din eprubetă după atingerea echilibrului de adsorbție și înlocuit de același volum de soluție de CaCl20,01 M (cm3) |
|
|
= |
volumul soluției luate din eprubeta (i) pentru măsurarea substanței testate, în proba pentru cinetica desorbției (cm3) |
Valorile desorbției
![]()
sau
![]()
(în funcție de necesitățile studiului) sunt reprezentate grafic în funcție de timp și se determină timpul după care se atinge echilibrul de desorbție.
(b) Metoda în serie
Ecuațiile prezentate în continuare țin seama de faptul că determinarea adsorbției, care a avut loc anterior, s-a realizat prin măsurarea substanței testate în alicoți mici
![]()
|
|
(18) |
La momentul ti:
— masa substanței testate se măsoară într-un alicot mic
![]()
|
|
(19) |
— la echilibrul de desorbție ti = tec și prin urmare
![]()
![]()
— desorbția
![]()
|
|
(20) |
La un interval de timp (Δti):
În fiecare interval de timp, se calculează cantitatea de substanță desorbită după cum urmează:
— pentru primul interval de timp Δt1 = t1 – t0
—
|
|
(21) |
— pentru al doilea interval de timp Δt2 = t2 – t1
—
|
|
(22) |
— pentru al n-lea interval de timp Δtn = tn – tn-1
—
|
|
(23) |
În sfârșit, desorbția, în procente, la fiecare interval de timp,
![]()
, se calculează cu următoarea ecuație:
|
|
(24) |
în timp ce desorbția, în procente,
![]()
|
|
(25) |
unde parametrii utilizați anterior se definesc după cum urmează:
|
|
= |
masa substanței adsorbite în continuare pe sol după intervalele de timp Δt1, Δt2, …, respectiv Δtn (μg) |
|
|
= |
masa substanței desorbite în intervalele de timp Δt1, Δt2, …, respectiv Δtn (μg) |
|
|
= |
masa substanței măsurată într-un alicot
|
|
VT |
= |
volumul total al fazei apoase în contact cu solul în timpul probei de cinetică a desorbției efectuate prin metoda în serie (cm3) |
|
|
= |
masa substanței testate rămase de la echilibrul de desorbție datorită înlocuirii incomplete a volumului (μg)
|
|
VR |
= |
volumul supernatantului scos din eprubetă după atingerea echilibrului de adsorbție și înlocuit cu același volum de soluție de CaCl20,01 M (cm3) |
|
|
= |
volumul alicotului luat pentru analiză din eprubeta (i) în timpul probei pentru cinetica desorbției realizate prin metoda în serie (cm3)
|
Apendicele 6
ADSORBȚIA – DESORBȚIA ÎN SOL: FORMULARE PENTRU RAPORTAREA DATELOR
Substanța testată:
Solul testat:
Conținutul de substanță uscată din sol (105 oC, 12 h): … %
Temperatura: … oC
Parametrii determinați prin metoda de analiză
|
Solul cântărit |
g |
|
|
Sol: substanța uscată |
g |
|
|
Volumul soluție de CaCl2 |
cm3 |
|
|
Concentrația nominală a soluției finale |
μg cm–3 |
|
|
Concentrația analitică a soluției finale |
μg cm–3 |
Principiul metodei analitice utilizate:
Etalonarea metodei analitice:
Substanța testată:
Solul testat:
Conținutul de substanță uscată din sol (105 oC, 12 h): … %
Temperatura: … oC
|
Metodologia analitică urmată: |
Indirectă |
|
Paralelă |
|
În serie |
|
|
Directă |
|
Testarea de adsorbție: eșantioanele
|
Simbol |
Unități |
Timpul de stabilire a echilibrului |
Timpul de stabilire a echilibrului |
Timpul de stabilire a echilibrului |
Timpul de stabilire a echilibrului |
|||||
|
Nr. de eprubete |
||||||||||
|
Solul cântărit |
— |
g |
||||||||
|
Solul: substanța uscată |
msol |
g |
||||||||
|
Volumul apei din solul cântărit (calculat) |
VAS |
cm3 |
||||||||
|
Volumul soluției de CaCl20,01 M pentru a aduce solul la echilibru |
cm3 |
|||||||||
|
Volumul soluției mamă |
cm3 |
|||||||||
|
Volumul total al fazei apoase în contact cu solul |
V0 |
cm3 |
||||||||
|
Concentrația inițială a soluției experimentale |
C0 |
μg cm–3 |
||||||||
|
Masa substanței testate la începutul încercării |
m 0 |
μg |
||||||||
|
După agitare și centrifugare |
||||||||||
|
METODA INDIRECTĂ |
||||||||||
|
Metoda paralelă |
||||||||||
|
Concentrația substanței testate în fază apoasă, inclusiv corecția probei martor |
|
μg cm–3 |
||||||||
|
Metoda în serie |
||||||||||
| Masa măsurată a substanței testate în alicot
|
|
μg |
||||||||
|
METODA DIRECTĂ |
||||||||||
|
Masa substanței testate adsorbite pe sol |
|
μg |
||||||||
|
Calculul adsorbției |
||||||||||
|
Adsorbția |
|
% |
||||||||
|
|
% |
|||||||||
|
Mijloacele |
||||||||||
|
Coeficientul de adsorbție |
Kd |
μg cm–1 |
||||||||
|
Mijloacele |
||||||||||
|
Coeficientul de adsorbție |
Kco |
μg cm–1 |
||||||||
|
Mijloacele |
||||||||||
Substanța testată:
Solul testat:
Conținutul de substanță uscată din sol (105 oC, 12 h): … %
Temperatura: … oC
Testarea de adsorbție: probe oarbe și martor
|
Simbol |
Unități |
Proba oarbă |
Proba oarbă |
Proba martor |
||||
|
Nr. de eprubete |
||||||||
|
Solurile cântărite |
g |
0 |
0 |
|||||
|
Volumul apei din solul cântărit (calculat) |
cm3 |
— |
— |
|||||
|
Volumul soluției de CaCl20,01 M adăugate |
cm3 |
|||||||
|
Volumul soluției mamă de substanță testată adăugată |
cm3 |
0 |
0 |
|||||
|
Volumul total al fazei apoase (calculat) |
cm3 |
— |
— |
|||||
|
Concentrația inițială a substanței testate în fază apoasă |
μg cm–3 |
|||||||
|
După agitare și centrifugare |
||||||||
|
Concentrația în fază apoasă |
μg cm–3 |
|||||||
Observație: Dacă este necesar, se adaugă coloane.
Substanța testată:
Solul testat:
Conținutul de substanță uscată din sol (105 oC, 12 h): …………………………………… %
Temperatura: … oC
Bilanțul de masă
|
Simbol |
Unități |
|||||
|
Nr. de eprubete |
||||||
|
Solul cântărit |
— |
g |
||||
|
Solul: substanța uscată |
msol |
g |
||||
|
Volumul apei în solul cântărit (calculat) |
VAS |
ml |
||||
|
Volumul soluției de CaCl20,01 M pentru a aduce solul la echilibru |
ml |
|||||
|
Volumul soluției mamă |
cm3 |
|||||
|
Volumul total al fazei apoase în contact cu solul |
V0 |
cm3 |
||||
|
Concentrația inițială a soluției experimentale |
C0 |
μg cm–3 |
||||
|
Timpul de realizare a echilibrului |
— |
h |
||||
|
După agitare și centrifugare |
||||||
|
Concentrația substanței testate în faza apoasă la adsorbție, inclusiv corecția probei oarbe la echilibru |
|
μg cm–3 |
||||
|
Timpul de realizare a echilibrului |
tec |
h |
||||
|
Prima diluție cu solvent |
||||||
|
Volumul fazei apoase îndepărtate |
Vrec |
cm3 |
||||
|
Volumul de solvent adăugat |
ΔV |
cm3 |
||||
|
Prima extracție cu solvent |
||||||
|
Semnalul analizat în solvent |
SEI |
var. |
||||
|
Concentrația substanței testate în solvent |
CEI |
μg cm–3 |
||||
|
Masa substanței extrase din sol și de pe pereții vaselor |
mEI |
μg |
||||
|
A doua diluție cu solvent |
||||||
|
Volumul de solvent îndepărtat |
ΔVs |
cm3 |
||||
|
Volumul de solvent adăugat |
ΔV' |
cm3 |
||||
|
A doua extracție cu solvent |
||||||
|
Semnalul analizat în solvent |
SE2 |
var. |
||||
|
Concentrația substanței testate în solvent |
CE2 |
μg cm–3 |
||||
|
Masa substanței extrase din sol și de pe pereții vaselor |
mE2 |
μg |
||||
|
Masa totală a substanței testate extrase în două etape |
mE |
μg |
||||
|
Bilanțul de masă |
BM |
% |
||||
Substanța testată:
Solul testat:
Conținutul de substanță uscată din sol (105 oC, 12 h): …………………………………… %
Temperatura: … oC
Izotermele de adsorbție
|
Simbol |
Unități |
|||||||||
|
Nr. de eprubete |
||||||||||
|
Solul cântărit |
— |
g |
||||||||
|
Solul; substanță uscată |
E |
g |
||||||||
|
Volumul de apă din solul cântărit (calculat) |
VAS |
cm3 |
||||||||
|
Volumul soluției de CaCl20,01 M pentru a aduce solul la echilibru |
cm3 |
|||||||||
|
Volumul soluției mamă adăugat |
cm3 |
|||||||||
|
Volumul total al fazei apoase în contact cu solul (calculat) |
V0 |
cm3 |
||||||||
|
Concentrația soluției |
C0 |
μg cm–3 |
||||||||
|
Timpul de realizare a echilibrului |
— |
h |
||||||||
|
După agitare și centrifugare |
||||||||||
|
Concentrația substanței în faza apoasă, inclusiv corecția probei oarbe |
|
μg cm–3 |
||||||||
|
Temperatura |
oC |
|||||||||
|
Masa adsorbită per unitatea de sol |
|
μg g–1 |
||||||||
Analiza de regresie:
valoarea Kf ads:
valoarea l/n:
coeficientul de regresie r2:
Substanța testată:
Solul testat:
Conținutul de substanță uscată din sol (105 oC, 12 h): …. %
Temperatura: … oC
|
Metodologia analitică urmată: |
Indirectă |
|
Paralelă |
|
În serie |
|
Testarea de desorbție
|
Simbol |
Unități |
Interval de timp |
Interval de timp |
Interval de timp |
Interval de timp |
||
|
Nr. de eprubete ce vin de la etapa de adsorbție |
|||||||
|
Masa substanței adsorbite pe sol la echilibrul de adsorbție |
|
μg |
|||||
|
Volumul fazei apoase îndepărtate, înlocuit cu soluție de CaCl20,01 M |
VR |
cm3 |
|||||
|
Volumul total al fazei apoase în contact cu solul |
MP |
V0 |
cm3 |
||||
|
MS |
VT |
cm3 |
|||||
|
Masa substanței testate rămase după echilibrul de adsorbție datorită înlocuirii incomplete a volumului |
|
μg |
|||||
|
Cinetica desorbției |
|||||||
|
Masa măsurată a substanței desorbite din sol la momentul ti |
|
μg |
|||||
|
Volumul soluției luate din eprubeta (i) pentru măsurarea substanței testate |
MP |
Vr i |
cm3 |
||||
|
MS |
Va D |
cm3 |
|||||
|
Masa substanței desorbite din sol la momentul ti (calculată) |
|
μg |
|||||
|
Masa substanței desorbite din sol în intervalul de timp Δti (calculată) |
|
μg |
|||||
|
Desorbția în procente |
|||||||
|
Desorbția la momentul ti |
Dti |
% |
|||||
|
Desorbția în intervalul de timp Δti |
|
% |
|||||
|
Coeficientul de desorbție aparent |
Kdes |
||||||
MP: Metoda paralelă
MS: Metoda în serie
C.19. ESTIMAREA COEFICIENTULUI DE ADSORBȚIE (KCO) PE SOL ȘI NĂMOL DE EPURARE CU AJUTORUL CROMATOGRAFIEI LICHIDE DE ÎNALTĂ PERFORMANȚĂ (HPLC)
1. METODĂ
Prezenta metodă este identică cu cea prevăzută în Orientarea 21 (2000) a OCDE.
1.1. INTRODUCERE
Comportarea la sorbție a substanțelor din soluri și nămolurile de epurare se poate descrie cu ajutorul parametrilor determinați experimental prin metoda de testare C.18. Un parametru important este coeficientul de adsorbție care reprezintă raportul dintre concentrația substanței din sol/nămol și concentrația substanței în fază apoasă la echilibrul de adsorbție. Coeficientul de adsorbție normalizat la conținutul de carbon organic al solului Kco este un indicator util al capacității de fixare a unei substanțe chimice pe o substanță organică din sol și din nămolul de epurare și permite compararea diferitelor substanțe chimice. Parametrul menționat se poate estima prin corelări cu solubilitatea apei și coeficientul de partiție n-octanol/apă (1) (2) (3) (4) (5) (6) (7).
Metoda experimentală descrisă în prezenta testare utilizează HPLC pentru estimarea coeficientului de adsorbție Kco în sol și în nămolul de epurare (8). Estimările prezintă o credibilitate mai mare decât cele din calculele de relație cantitativă structură-activitate [RCSA (QSAR)] (9). Ca metodă de estimare, aceasta nu poate înlocui în întregime încercările de realizare a echilibrului probelor utilizate în metoda de testare C.18. Cu toate acestea, Kco estimat poate fi util în alegerea parametrilor optimi de testare pentru studiile de adsorbție/desorbție conform metodei de testare C.18, prin calcularea Kd (coeficientul de distribuție) sau Kf (coeficientul de adsorbție Freundlich) conform ecuației 3 (punctul 1.2).
1.2. DEFINIȚII
K d : Coeficientul de distribuție este raportul dintre concentrațiile la echilibru, C, ale unei substanțe testate dizolvate într-un sistem bifazic ce conține un adsorbant (sol sau nămol de epurare) și o fază apoasă; este o valoare adimensională atunci când concentrațiile în ambele faze se exprimă în greutate/greutate. Pentru concentrația în faza apoasă exprimată în greutate/volum, unitățile sunt ml · g–1. Kd poate să varieze în funcție de proprietățile adsorbantului și poate să fie dependent de concentrație.
|
|
(1) |
unde:
|
Csol |
= |
concentrația substanței testate în sol la echilibru (μg · g–1) |
|
Cnămol |
= |
concentrația substanței testate în nămol la echilibru (μg · g–1) |
|
Cap |
= |
concentrația substanței testate în faza apoasă la echilibru (μg · g–1, μg · ml–1). |
K f : Coeficientul de adsorbție Freundlich este concentrația substanței testate în sol sau nămolul de epurare (x/m) atunci când concentrația la echilibru, Cap, în faza apoasă este egală cu unu; unitățile sunt μg g–1 adsorbant. Valoarea poate să varieze în funcție de proprietățile adsorbantului.
|
|
(2) |
unde:
|
x/m |
= |
cantitatea de substanță testată x (μg) adsorbită pe cantitatea de adsorbant m (g) la echilibru |
|
1/n |
= |
panta izotermei de adsorbție Freundlich |
|
Cap |
= |
concentrația substanței testate în fază apoasă la echilibru (μg · ml–1). |
Pentru
![]()
K co : Coeficientul de distribuție (Kd) sau coeficientul de adsorbție Freundlich (Kf) normalizat la conținutul de carbon organic (fco) al adsorbantului; în special pentru substanțele chimice neionizate, este un indicator aproximativ al gradului de adsorbție între o substanță și adsorbant și permite compararea diferitelor substanțe chimice. În funcție de dimensiunile Kd și Kf, Kco poate să fie adimensional sau să aibă unitățile ml g–1 sau μg g–1 substanță organică.
|
|
(3) |
Relația dintre Kco și Kd nu este lineară întotdeauna și, prin urmare, valorile Kco pot să varieze de la un sol la altul, dar gradul de variație a acestora este redus în mare măsură în comparație cu valorile Kd sau Kf.
Coeficientul de adsorbție (Kco) se obține din factorul de capacitate (k'), utilizând o curbă de etalonare obținută prin reprezentarea grafică a log k' în funcție de log Kco pentru compușii de referință selectați.
|
|
(4) |
unde:
|
tg |
= |
timpul de retenție HPLC pentru testare și substanța de referință (minute) |
|
t0 |
= |
timpul mort HPLC (minute) (a se vedea punctul 1.8.2). |
P ow : Coeficientul de partiție octanol-apă reprezintă raportul dintre concentrațiile substanței dizolvate în n-octanol și apă; este o mărime adimensională.
|
|
(5) |
1.3. SUBSTANȚE DE REFERINȚĂ
Înaintea utilizării metodei, este necesar să se cunoască formula structurală, puritatea și constanta de disociere (dacă este cazul). Sunt utile datele privind solubilitatea în apă și solvenți organici, coeficientul de partiție octanol-apă și caracteristicile hidrolizei.
Pentru a corela datele de retenție HPLC măsurate pentru o substanță testată cu coeficientul de adsorbție al acesteia Kco, trebuie să se reprezinte grafic curba de etalonare pentru log Kco în funcție de log k'. Trebuie să se utilizeze cel puțin șase puncte, cel puți unul peste și unul sub valoarea preconizată pentru substanța testată. Acuratețea metodei este mult îmbunătățită, dacă se utilizează substanțe de referință cu structura asemănătoare cu a substanței testate. Dacă astfel de date nu sunt disponibile, este la latitudinea utilizatorului să aleagă substanțele de etalonare potrivite. În acest caz, este necesar să se aleagă un set mai general de substanțe eterogene din punct de vedere structural. Substanțele și valorile Kco care se pot utiliza sunt prezentate în apendice, în tabelul 1 pentru nămolul de epurare și în tabelul 3 pentru sol. Alegerea altor substanțe de etalonare se justifică.
1.4. PRINCIPIUL METODEI DE TESTARE
HPLC se realizează pe o coloană analitică umplută cu o fază solidă de cianopropil care se comercializează și care conține grupe liofile și polare. Se utilizează o fază staționară polară din matrice de silice.
|
- O - Si |
- CH2 - CH2 - CH2 |
- CN |
|
silice |
distanțier nepolar |
grupă polară |
Principiul metodei de testare este similar cu cel al metodei de testare A.8 (coeficientul de partiție, metoda HPLC). Când trece prin coloană în lungul fazei mobile, substanța testată interacționează cu faza staționară. Ca urmare a partiției dintre faza mobilă și cea staționară, substanța testată este întârziată. Compoziția dublă a fazei staționare, care are porțiuni polare și nepolare, permite interacțiunea grupelor polare și nepolare dintr-o moleculă într-un mod similar cu cel pentru substanța organică din matricele de sol sau nămol de epurare. Aceasta permite stabilirea relației dintre timpul de retenție pe coloană și coeficientul de adsorbție pe substanța organică.
pH-ul are o influență importantă în mod deosebit asupra comportamentului de sorbție al substanțelor polare. Pentru solurile agricole sau rezervoarele stațiilor de tratare a apelor reziduale, pH-ul variază de obicei între 5,5 și 7,5. Pentru substanțele ionizabile, trebuie să se efectueze două testări, atât cu forma ionizată, cât și cu cea neionizată în soluții tampon corespunzătoare, dar numai pentru situațiile în care cel puțin 10 % din compusul testat se disociază între valorile pH-ului 5,5-7,5.
Deoarece pentru evaluare se utilizează doar relația dintre retenția pe coloana HPLC și coeficientul de adsorbție, nu este necesară o metodă analitică cantitativă, ci doar determinarea timpului de retenție. Dacă este disponibil un set corespunzător de substanțe de referință și se pot utiliza condițiile de testare standard, metoda oferă un mod rapid și eficient pentru estimarea coeficientului de adsorbție Kco.
1.5. APLICABILITATEA TESTULUI
Metoda HPLC se poate aplica substanțelor chimice (nemarcate și marcate) pentru care există un sistem corespunzător de detecție (de exemplu spectrofotometru, detector de radioactivitate) și care sunt suficient de stabile în timpul testării. Această metodă poate să fie deosebit de utilă pentru substanțele chimice dificil de studiat în alte sisteme experimentale (adică substanțele volatile; substanțe care nu sunt solubile în apă la o concentrație care să poată fi măsurată analitic; substanțe cu afinitate mare pentru suprafața sistemelor de incubare). Metoda se poate utiliza la amestecurile care dau benzi de eluție neseparate. În acest caz, este necesar să se stabilească limitele superioară și inferioară ale valorilor log Kco pentru compușii amestecului testat.
Impuritățile pot să creeze uneori probleme în interpretarea rezultatelor HPLC, dar sunt de importanță minoră atâta timp cât substanța testată se poate identifica și separa analitic în mod clar de impurități.
Metoda este validată pentru substanțele prezentate în tabelul 1 din apendice și a fost de asemenea aplicată pentru o serie de alte substanțe din următoarele clase de substanțe chimice:
— amine aromate (de exemplu trifluralin, 4-cloroanilină, 3,5-dinitroanilină, 4-metlanilină, N-metilanilină, 1-naftilamină), esterul etilic al acidului 3,5-dinitrobenzoic;
— esteri ai acizilor carboxilici aromați (de exemplu esterul metilic al acidului benzoic, esterul etilic al acidului 3,5-dinitrobenzoic);
— hidrocarburi aromate (de exemplu toluen, xilen, etilbenzen, nitrobenzen);
— esteri ai acizilor ariloxifenoxipropionici (de exemplu metil-diclofop, etil-fenoxaprop, p-etil-fenoxaprop);
— fungicide pe bază de benzimidazol sau imidazol (de exemplu carbendazim, fuberidazol, triazoxid);
— amide ale acizilor carboxilici (de exemplu 2-clorobenzamida, N,N-dimetilbenzamida, 3,5-dinitrobenzamida, N-metilbenzamida, 2-nitrobenzamida, 3-nitrobenzamida);
— hidrocarburi clorurate (de exemplu endosulfan, DDT, hexaclorobenzen, quintozen, 1,2,3-triclorobenzen);
— insecticide organofosforoase (de exemplu metil-azinfor, disulfoton, fenamifos, izofenfos, pirazofos, sulprofos, triazofos);
— fenoli (de exemplu fenol, 2-nitrofenol, 4-nitrofenol, pentaclorofenol, 2,4,6-triclorofenol, 1-naftol);
— derivați de feniluree (de exemplu izoproturon, monolinuron, pencycuron);
— pigmenți coloranți (de exemplu Acid Yellow 219, Basic Blue 41, Direct Red 81);
— hidrocarburi poliaromate (de exemplu acenaften, naftalen);
— ierbicide pe bază de 1,3,5-triazine (de exemplu prometrin, propazină, simazină, terbutrin);
— derivați de triazol (de exemplu tebuconazol, triadimefon, tradimenol, triapentenol).
Prezenta metodă nu se poate aplica la substanțele care reacționează fie cu eluentul, fie cu faza staționară. De asemenea, nu se aplică la substanțele care interacționează în mod specific cu componentele anorganice (de exemplu formarea de complecși ramificați cu mineralele din argilă). Este posibil ca metoda să nu funcționeze la substanțele tensioactive, compușii anorganici și acizii și bazele organici(e) moderați(e) sau puternici(e). Se pot determina valorile log Kco cuprinse între 1,5 și 5,0. Determinarea substanțelor ionizabile trebuie să se realizeze cu o fază mobilă tamponată, dar trebuie să se aibă grijă pentru a evita precipitarea componentelor tamponului sau a substanței testate.
1.6. CRITERII DE CALITATE
1.6.1. Acuratețea
De obicei, coeficientul de adsorbție al unei substanțe testate se poate estima cu o aproximație de ± 0,5 dintr-o unitate logaritmică din valoarea determinată prin metoda de stabilire a echilibrului probelor (tabelul 1 din apendice). Dacă substanțele de referință utilizate au structuri asemănătoare cu cea a substanței testate, se poate obține o acuratețe mai mare.
1.6.2. Repetabilitatea
Determinările trebuie să se facă cel puțin în dublu exemplar. Valorile log Kco obținute din măsurătorile individuale trebuie să se situeze într-un interval de 0,25 dintr-o unitate logaritmică.
1.6.3. Reproductibilitatea
Experiența acumulată până în prezent în aplicarea metodei susține valabilitatea acesteia. Un studiu prin metoda HPLC, în care s-au utilizat 48 substanțe (majoritatea pesticide) pentru care existau date credibile privind Kco pentru soluri, a dat un coeficient de corelare R = 0,95 (10) (11).
S-a realizat un studiu comparativ între laboratoare, cu participarea a 11 laboratoare, pentru îmbunătățirea și validarea metodei (12). Rezultatele sunt prezentate în tabelul 2 din apendice.
1.7. DESCRIEREA METODEI DE TESTARE
1.7.1. Estimarea preliminară a coeficientului de adsorbție
Coeficientul de partiție octanol-apă Pow (= Kow) și, într-o anumită măsură, solubilitatea în apă se pot utiliza ca indicatori pentru gradul de adsorbție, în special pentru substanțele neionizate și, prin urmare, se pot utiliza pentru aflarea preliminară a domeniului. Au fost publicate o serie de corelații utile pentru câteva grupe de substanțe chimice (1) (2) (3) (4) (5) (6) (7).
1.7.2. Aparatura
Este necesar un cromatograf lichid prevăzut cu o pompă fără impulsuri și cu un dispozitiv potrivit de detecție. Se recomandă utilizarea unui injector cu buclă de injecție. Se utilizează rășini pe bază de cianopropil fixat chimic pe suport de silice (de exemplu Hypersil și Zorax CN). O coloană de protecție din același material se poate instala între sistemul de injecție și coloana analitică. Coloanele provenite de la diverși furnizori pot să aibă randamente de separare foarte diferite. Pentru orientare, este necesar să se obțină următorii factori de capacitate k': log k' > 0,0 pentru log Kco = 3,0 și log k' > - 0,4 pentru log Kco = 2,0 atunci când se utilizează amestec metanol/apă 55/45 % ca fază mobilă.
1.7.3. Fazele mobile
Au fost testate câteva faze mobile și se recomandă următoarele două:
— metanol/apă (55/45 % v/v);
— metanol/tampon citrat 0,01 M, pH 6,0 (55/45 % v/v)
Se utilizează metanolul de tip HPLC și apă distilată sau tampon citrat pentru prepararea solventului de eluție. Amestecul se dezaerează înainte de utilizare. Se utilizează eluția izocratică. Dacă amestecurile metanol/apă nu sunt corespunzătoare, se pot încerca alte amestecuri solvent organic/apă, de exemplu amestecurile etanol/apă sau acrilonitril/apă. Pentru compușii ionizabili se recomandă utilizarea soluției tampon pentru stabilizarea pH-ului. Trebuie să se aibă grijă pentru a evita precipitarea sărurilor și deteriorarea coloanei, care pot să apară la unele amestecuri fază organică/tampon.
Nu se pot utiliza aditivi cum ar fi reactivi cu perechi de ioni, deoarece pot să afecteze proprietățile de sorbție ale fazei staționare. Astfel de modificări ale fazei staționare pot să fie ireversibile. Din acest motiv, este obligatoriu ca testele cu aditivi să se efectueze pe coloane separate.
1.7.4. Substanța dizolvată
Substanțele testate și de referință se dizolvă în faza mobilă.
1.8. DESFĂȘURAREA TESTULUI
1.8.1. Condiții de testare
Este necesară înregistrarea temperaturii în timpul măsurătorilor. Pentru asigurarea condițiilor constante în timpul etalonării și estimării și măsurării substanței testate, se recomandă cu stringență utilizarea unui compartiment termoreglabil pentru coloană.
1.8.2. Determinarea timpului mort t0
Pentru determinarea timpului mort t0, se pot utiliza două metode diferite (a se vedea și punctul 1.2).
1.8.2.1. Determinarea timpului mort t0 cu ajutorul seriilor omoloage
S-a dovedit că procedeul de acest tip dă valori t0 credibile și standardizate. Pentru detalii, a se vedea metoda de testare A.8 Coeficientul de partiție (n-octanol/apă), metoda HPLC.
1.8.2.2. Determinarea timpului mort t0 cu substanțe inerte care nu sunt reținute pe coloană
Procedeul menționat se bazează pe injecția soluțiilor de formamidă, uree sau nitrat de sodiu. Măsurătorile se realizează cel puțin de două ori.
1.8.3. Determinarea timpilor de retenție tR
Se procedează la selectarea substanțelor de referință conform punctului 1.3. Acestea se pot injecta ca amestec etalon pentru determinarea timpilor lor de retenție, cu condiția confirmării că timpul de retenție pentru fiecare etalon nu este afectat de prezența altor etaloane de referință. Etalonarea se face la intervale regulate, cel puțin de două ori pe zi, datorită modificărilor neașteptate în funcționarea coloanei. Pentru cea mai bună practică, injecțiile de etalonare se realizează înainte și după injecțiile de substanță testată pentru a confirma că timpii de retenție nu au fost deplasați. Substanțele testate se injectează separat în cantități cât se poate de mici (pentru a evita supraîncărcarea coloanei) și se determină timpii de retenție pentru acestea.
Pentru a crește încrederea în măsurători, trebuie să se realizeze cel puțin două determinări. Valorile log Kco obținute din măsurători individuale trebuie să se încadreze într-o valoare de 0,25 dintr-o unitate logaritmică.
1.8.4. Evaluarea
Se calculează factorii de capacitate k' din timpul mort t0 și timpii de retenție tR pentru substanțele de referință selectate conform ecuației 4 (punctul 1.2). Apoi, se reprezintă grafic valorile log k' ale substanțelor de referință în funcție de valorile log Kco ale acestora, obținute din testele cu realizarea echilibrului probelor, prezentate în tabelele 1 și 3 din apendice. Din reprezentarea grafică menționată, valoarea log k' a unei substanțe testate se utilizează apoi pentru determinarea valorii log Kco a acesteia. Dacă rezultatele reale indică o valoare a log Kco pentru substanța testată în afara domeniului de etalonat, testarea se repetă, utilizând alte substanțe de referință mai potrivite.
2. DATE ȘI RAPORT
Raportul de testare trebuie să conțină următoarele informații:
— identitatea testului și a substanțelor de referință și puritatea acestora și valorile pKa, dacă sunt importante;
— descrierea aparaturii și a condițiilor de operare, de exemplu tipul și dimensiunea coloanei analitice (și a celei de protecție), mijloacele de detecție, faza mobilă (raportul componentelor și valoarea pH), valorile temperaturii în timpul măsurătorilor;
— timpul mort și metoda utilizată pentru determinarea acestuia;
— cantitățile de substanțe testate și de referință introduse în coloană;
— timpii de retenție pentru compușii de referință utilizați la etalonare;
— detalii privind linia de regresie ajustată (log k' în funcție de log Kco) și un grafic al liniei de regresie;
— datele medii de retenție și valoarea estimată a log Kco pentru compusul testat;
— cromatogramele.
3. REFERINȚE BIBLIOGRAFICE
1. W.J. Lyman, W.F. Reehl, D.H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, chapt. 4, McGraw-Hill, New York.
2. J. Hodson, N.A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, p. 1-67.
3. G.G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, p. 1050-1059.
4. C.T. Chiou, P.E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, p. 227-231.
5. Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, p. 297-312.
6. C.T. Chiou, L.J. Peters, V. H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, p. 831-832.
7. S.W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, p. 833-846.
8. W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), p. 121-128.
9. M. Mueller, W. Kördel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), p. 2493-2504.
10. W. Kördel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), p. 2341-2352.
11. B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, p. 285-304.
12. W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), p. 1373-1384.
Apendice
Tabelul 1
Compararea valorilor Kco pentru soluri și nămoluri de epurare și valorile calculate cu ajutorul metodei selective HPLC (1) (2)
|
Substanța |
Nr. CAS |
Log Kco nămoluri de epurare |
Log Kco HPLC |
Δ |
Log Kco soluri |
Log Kco HPLC |
Δ |
|
Atrazină |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linuron |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fention |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monuron |
150-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantren |
85-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Esterul fenilic al acidului benzoic |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Benzamidă |
55-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-Nitrobenzamidă |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Acetanilidă |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Anilină |
62-53-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-Dicloroanilină |
95-82-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
|
(1) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), p. 121-128. (2) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), p. 107-119. |
|||||||
Tabelul 2
Rezultatele studiului comparativ între laboratoare (11 laboratoare participante) efectuat pentru îmbunătățirea și validarea metodei HPLC (1)
|
Substanța |
Nr. CAS |
Log Kco |
Kco |
log Kco |
|
(OCDE 106) |
metoda HPLC |
|||
|
Atrazină |
1912-24-9 |
1,81 |
78 ± 16 |
1,89 |
|
Monuron |
150-68-5 |
1,99 |
100 ± 8 |
2,00 |
|
Triapentenol |
77608-88-3 |
2,37 |
292 ± 58 |
2,47 |
|
Linuron |
330-55-2 |
2,59 |
465 ± 62 |
2,67 |
|
Fention |
55-38-9 |
3,31 |
2062 ± 648 |
3,31 |
|
(1) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), p. 1373-1384. |
||||
Tabelul 3
Substanțele de referință recomandate pentru metoda selectivă HPLC pe baza datelor de adsorbție pe sol
|
Substanța de referință |
Nr. CAS |
Valorile medii ale log Kco din echilibrul probelor |
Nr. de date Kco |
Log D. S. |
Sursa |
|
Acetanilidă |
103-84-4 |
1,25 |
4 |
0,48 |
|
|
Fenol |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-Nitrobenzamidă |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N, N-dimetilbenzamidă |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-Metilmenzamidă |
619-55-6 |
1,78 |
3 |
1,76 |
|
|
Metilbenzoat |
93-58-3 |
1,80 |
4 |
1,08 |
|
|
Atrazină |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
Izoproturon |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3-Nitrobenzamidă |
645-09-0 |
1,95 |
3 |
1,31 |
|
|
Anilină |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-Dinitrobenzamidă |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Carbendazim |
10605-21-7 |
2,35 |
3 |
1,37 |
|
|
Triadimenol |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triazoxid |
72459-58-6 |
2,44 |
3 |
1,66 |
|
|
Triazofos |
24017-47-8 |
2,55 |
3 |
1,78 |
|
|
Linuron |
330-55-2 |
2,59 |
3 |
1,97 |
|
|
Naftalen |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endosulfan-diol |
2157-19-9 |
3,07 |
5 |
2,29 |
|
|
Metiocarb |
2032-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
63405-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3-Triclorobenzen |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
γ-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Fention |
55-38-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red 81 |
2610-11-9 |
3,43 |
4 |
2,68 |
|
|
Pirazofos |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
α-Endosulfan |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Metil-diclofop |
51338-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantren |
85-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (amestec) |
26850-47-5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
|
|
(1) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No 106 01044 (1994). (2) B.V. Oepen, W. Kördel, W. Klein (1991). Chemosphere, 22, p. 285-304. (3) Date din industrie. |
|||||
C.20. TEST DE REPRODUCERE PENTRU DAPHNIA MAGNA
1. METODĂ
Prezenta metodă de testare a toxicității pentru reproducere reproduce Orientarea 211 (1998) a OCDE.
1.1. INTRODUCERE
Obiectivul principal al testului este evaluarea efectului produselor chimice asupra randamentului de reproducere al Daphnia magna.
1.2. DEFINIȚII ȘI UNITĂȚI
Animale părinți: sunt acele femele de dafnia prezente la începutul testului și al căror randament de reproducere constituie obiectul studiului.
Progenitură: exemplarele tinere de dafnia produse de animalele părinți în cursul testului.
Concentrația la care se observă cele mai mici efecte (CMEO): este concentrația cea mai mică experimentată la care se observă un efect important al substanței din punct de vedere statistic asupra reproducerii și mortalității părinților (la p < 0,05) în comparație cu martorul, într-un timp de expunere stabilit. Cu toate acestea, toate concentrațiile experimentate mai mari decât CMEO trebuie să aibă un efect nociv egal cu sau mai mare decât cele observate la CMEO. Când cele două condiții menționate nu pot fi satisfăcute, trebuie să se prezinte o explicație completă a modului de alegere a CMEO (și, prin urmare, CFEO).
Concentrația la care nu se observă niciun efect (CFEO): este concentrația experimentată imediat sub CMEO, care, în comparație cu martorul, nu are un efect important din punct de vedere statistic (p < 0,05), într-un timp de expunere stabilit.
CE x : este concentrația substanței testate dizolvate în apă care generează o reducere de x % a reproducerii la Daphnia magna într-un timp de expunere stabilit.
Rata intrinsecă de înmulțire: este o măsură a creșterii populației care cuprinde capacitatea de reproducere și mortalitatea specifică vârstei (20) (21) (22). La populațiile în stare stabilă, aceasta va fi egală cu zero. La populațiile în creștere, aceasta va fi pozitivă și la populațiile în scădere, va fi negativă. Este clar că aceasta din urmă nu este de susținut și în final va duce la dispariție.
Limita de detecție: este cea mai mică concentrație care se poate detecta dar nu se poate măsura.
Limita de determinare: este cea mai mică concentrație care se poate determina cantitativ.
Mortalitatea: un animal se înregistrează ca mort atunci când este imobil, adică atunci când nu poate să înoate sau dacă nu se observă o mișcare a organelor externe sau a post-abdomenului, în 15 secunde de la o ușoară agitare a recipientului experimental (dacă se utilizează o altă definiție, aceasta se specifică împreună cu sursa bibliografică).
1.3. PRINCIPIUL METODEI DE TESTARE
Femelele tinere de dafnia (animale părinți), în vârstă de mai puțin de 24 ore la începutul testului, sunt expuse la substanța testată, adăugată într-o o serie de concentrații diferite. Durata testului este de 21 de zile. La sfârșitul testului, se evaluează numărul total de progenituri în viață produse per animal părinte viu la sfârșitul testului. Aceasta înseamnă că tineretul produs de adulții care mor în timpul testului este exclus din calcule. Capacitatea de reproducere a animalelor părinți se poate exprima în alte moduri (de exemplu numărul de progenituri în viață produse per animal per zi, din prima zi în care s-au observat progeniturile), dar acestea se semnalează în afară de numărul total de tineret produs per părinte viu la sfârșitul testului. Capacitatea de reproducere a animalelor expuse la substanța testată se compară cu aceea a martorului (martorilor) pentru a determina concentrația la care se observă cele mai mici efecte (CMEO) și, din aceasta, concentrația la care nu se observă niciun efect (CFEO). În afară de aceasta și în măsura în care este posibil, rezultatele sunt analizate cu ajutorul unui model de regresie pentru estimarea concentrației care ar putea să provoace o reducere cu x % a capacității de reproducere (adică CE50, CE20 sau CE10).
De asemenea, se semnalează supraviețuirea animalelor părinți și timpul producerii primilor pui. Se mai pot studia alte efecte aferente substanței asupra unor parametri cum ar fi creșterea (de exemplu lungimea) și posibil rata intrinsecă de înmulțire.
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Datele unui test de toxicitate acută (metoda C.2, partea I) efectuat cu Daphnia magna trebuie să fie disponibile. Rezultatul poate să fie util la selectarea unui domeniu potrivit de concentrații experimentale în testele de reproducere. Este necesar să se cunoască solubilitatea în apă și presiunea de vapori a substanței testate și să existe o metodă analitică fiabilă pentru determinarea cantitativă a substanței în soluțiile experimentale, cu eficiența recuperării și limita de detecție specificate.
Datele privind substanța testată, care pot să fie utile în stabilirea condițiilor de testare, includ formula structurală, puritatea substanței, stabilitatea la lumină, stabilitatea în condițiile testului, pKa, Pow și rezultatele testului pentru biodegradabilitate imediată (a se vedea metoda C.4).
1.5. VALIDITATEA TESTULUI
Pentru ca un test să fie valid, martorul (martorii) trebuie să îndeplinească următoarele criterii de performanță:
— mortalitatea animalelor părinți (femele de dafnia) să nu depășească 20 % la sfârșitul testului;
— numărul mediu de progenituri vii produse per animal părinte supraviețuitor la sfârșitul testului să fie ≥ 60.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Aparatură
Vasele experimentale și altă aparatură care vine în contact cu soluțiile experimentale trebuie să fie realizate în întregime din sticlă sau alt material inert din punct de vedere chimic. De obicei, vasele experimentale sunt pahare de laborator.
În afară de acestea, mai sunt necesare următoarele aparate:
— contor de oxigen (cu microelectrod sau alt dispozitiv corespunzător pentru măsurarea oxigenului dizolvat în probe de volum mic);
— aparat specific pentru controlul temperaturii;
— pH-metru;
— aparat pentru determinarea durității apei;
— aparat pentru determinarea concentrației totale de carbon organic (COT) în apă sau aparat pentru determinarea consumului chimic de oxigen (CCO);
— aparat specific pentru controlul regimului de iluminare și măsurarea intensității luminii.
1.6.2. Organismul de testare
Specia utilizată în test este Daphnia magna Straus. Se pot utiliza și alte specii de dafnia, cu condiția ca acestea să îndeplinească criteriile de validitate după caz (criteriul de validitate referitor la capacitatea de reproducere la martori trebuie să fie relevant pentru speciile dafnia). Dacă se utilizează alte specii de dafnia, acestea trebuie să se identifice în mod clar și să se justifice utilizarea lor.
De preferință, clonul trebuie să fi fost identificat după genotip. Studiul (1) a arătat că performanța de reproducere a clonului A (care provine din IRCHA din Franța) (3) satisface complet criteriile de validitate pentru o medie de ≥ 60 progenituri per animal părinte supraviețuitor atunci când se cultivă în condițiile descrise în prezenta metodă. Cu toate acestea, se acceptă și alți cloni, cu condiția să se indice îndeplinirea criteriilor de validitate pentru test de către cultura de dafnia.
La începutul testului, animalele trebuie să fie mai tinere de 24 ore și nu trebuie să fie prima generație. Acestea trebuie să provină dintr-o colonie sănătoasă (adică fără semne de stres, cum ar fi mortalitatea mare, prezența masculilor și ephippia, întârziere în producerea primilor descendenți, animale decolorate etc.). Animalele din colonie trebuie ținute în condiții de cultură (lumină, temperatură, mediu, hrană și număr de animale per unitatea de volum) similare cu cele utilizate în test. Dacă mediul de cultură ce urmează să fie utilizat în test este diferit de cel pentru cultura obișnuită de dafnia, este o bună practică să se includă o perioadă de aclimatizare înaintea testului, de obicei de aproximativ trei săptămâni (adică o generație), pentru a evita stresarea animalelor părinți.
1.6.3. Mediul de testare
În prezentul test, se recomandă utilizarea unui mediu bine definit. Acesta poate să evite utilizarea aditivilor (de exemplu plante de mare, extract de sol etc.) a căror caracterizare este dificilă și, prin urmare, se îmbunătățesc posibilitățile de standardizare între laboratoare. S-a găsit că mediile Elendt M4 (4) și M7 (a se vedea apendicele 1) sunt potrivite în acest sens. Cu toate acestea, se pot accepta și alte medii [de exemplu (5) (6)], cu condiția să asigure realizarea unei culturi de dafnia care să întrunească criteriile de validitate pentru test.
Dacă se utilizează medii ce conțin aditivi care nu sunt caracterizați, este necesar ca aditivii respectivi să se specifice clar și, în raportul de testare, să se prezinte date privind compoziția, în special conținutul de carbon, deoarece acesta poate contribui la hrana furnizată. Se recomandă determinarea concentrației totale de carbonului organic (COT) și a consumului chimic de oxigen (CCO) la prepararea amestecului de aditivi organici și să se facă o estimare a contribuției rezultate la COT/CCO în mediul de testare. Se recomandă ca valorile COT în mediu (adică înainte de adăugarea algelor) să fie mai mici de 2 mg/l (7).
Când se testează substanțe cu conținut de metale, este important să se admită că proprietățile mediului de testare (de exemplu duritatea, capacitatea de chelatizare) ar putea să aibă legătură cu toxicitatea substanței studiate. De aceea, este de preferat un mediu bine caracterizat. Cu toate acestea, în prezent, singurele medii bine caracterizate care se cunosc ca fiind optime pentru cultura pe termen lung a Daphnia magna sunt Elendt M4 și M7. Ambele medii conțin agentul de chelatizare EDTA. Cercetările (2) arată că „toxicitatea aparentă” a cadmiului este în general mai mică atunci când testul de reproducere se realizează în mediile M4 și M7 decât în mediile cu conținut de EDTA. Prin urmare, M4 și M7 nu se recomandă pentru substanțele de probă ce conțin metale și, de asemenea, trebuie să se evite alte medii ce conțin agenți de chelatizare cunoscuți. Pentru substanțele cu conținut de metale, se poate recomanda utilizarea unui mediu alternativ, de exemplu apa dură proaspătă reconstituită conform ASTM (7), care nu conține EDTA, cu adaos de extract de plante de mare (8). Combinația menționată, de apă dură proaspătă reconstituită conform ASTM și extract de plante de mare, este potrivită și pentru cultura pe termen lung și testarea Daphnia magna (2), deși aceasta mai exercită o acțiune slabă de chelatizare datorită componentei organice din extractul de plante de mare adăugat.
La începutul și în timpul testului, concentrația oxigenului dizolvat trebuie să fie mai mare de 3 mg/l. pH-ul trebuie să aibă valori în domeniul 6-9 și, în mod normal, nu trebuie să varieze cu mai mult de 1,5 unități în oricare din încercări. Se recomandă o duritate mai mare de 140 mg/l (exprimată în CaCO3). Testele efectuate la această valoare și la valori mai mari au demonstrat o performanță a reproducerii conformă cu criteriile de validitate (9) (10).
1.6.4. Soluțiile de testare
Soluțiile de testare de concentrațiile alese se prepară de obicei prin diluarea unei soluții mamă. Soluțiile mamă se prepară de preferință prin dizolvarea substanței în mediul experimental.
În unele cazuri, s-ar putea să fie necesară utilizarea solvenților organici sau a agenților de dispersie pentru a obține o soluție mamă de concentrația indicată, dar trebuie făcut tot posibilul pentru a se evita utilizarea acestor materiale. Ca solvenți potriviți se pot utiliza acetona, etanolul, metanolul, dimetilformamida și trietilen glicolul. Exemple de agenți de dispersie potriviți sunt Cremophor RH40, metilceluloza 0,01 % și HCO-40. În orice caz, substanța testată în soluțiile experimentale nu trebuie să depășească limita de solubilitate în mediul de testare.
Se utilizează solvenți pentru a obține o soluție mamă care să se poată doza cu exactitate în apă. La concentrația recomandată a solventului în mediul de testare final (adică ≤ 0,1 ml/l), solvenții enumerați anterior nu sunt toxici și nu cresc solubilitatea în apă a unei substanțe.
Agenții de dispersie pot să faciliteze dozarea exactă și dispersia. La concentrația recomandată în mediul de testare final (≤ 0,1 ml/l), agenții de dispersie enumerați anterior nu sunt toxici și nu cresc solubilitatea în apă a unei substanțe.
1.7. PROTOCOLUL TESTULUI
Tratamentele se repartizează tuturor vaselor experimentale și toată manipularea ulterioară a vaselor experimentale se face în mod aleatoriu. Nerespectarea acestui principiu poate să aducă prejudicii care pot fi interpretate ca fiind un efect al concentrației. În special, dacă unitățile experimentale sunt manipulate în ordinea tratamentului sau a concentrației, atunci unele efecte care depind de timp, cum ar fi oboseala operatorului sau altă eroare, ar putea să genereze efecte mai mari la concentrații mai mari. În plus, dacă există posibilitatea ca rezultatele testului să fie influențate de o condiție inițială sau de mediu a testului, cum ar fi poziția în laborator, atunci trebuie să se aibă în vedere oprirea testului.
1.8. PROCEDURA DE TESTARE
1.8.1. Condiții de expunere
1.8.1.1. Durata
Durata testului este de 21 de zile.
1.8.1.2. Încărcarea
Animalele părinți se țin individual, câte unul în fiecare vas experimental, care conține 50-100 ml mediu.
Uneori, s-ar putea să fie necesare volume mai mari pentru a satisface condițiile procedeului analitic utilizat pentru determinarea concentrației substanței testate, deși este permisă și unirea probelor duble pentru analiza chimică. Dacă se utilizează volume mai mari de 100 ml, s-ar putea ca rația furnizată pentru dafnia să fie crescută pentru a asigura o alimentație adecvată și respectarea criteriilor de validitate. Pentru testele în flux continuu, se pot avea în vedere, din motive tehnice, alte protocoale (de exemplu patru grupe de 10 animale într-un volum de mediu experimental mai mare), dar se specifică orice modificări ale protocolului testului.
1.8.1.3. Numărul animalelor
Pentru testele semistatice, cel puțin 10 animale ținute fiecare la fiecare concentrație experimentată și cel puțin 10 animale ținute fiecare în seria martor.
Pentru testele în flux continuu, s-a dovedit că sunt necesare 40 de animale împărțite în patru grupe de câte 10 animale pentru fiecare concentrație experimentată (1). Se pot utiliza mai puține organisme experimentale și se recomandă un minimum de 20 de animale per concentrație, împărțite în două sau mai multe probe identice cu un număr egal de animale (de exemplu patru probe identice, fiecare cu cinci daphnide). De reținut că pentru testele în care animalele sunt ținute în grupe, nu va fi posibilă exprimarea capacității de reproducere sub forma numărului total de progenituri vii produse per animal părinte în viață la sfârșitul testului, dacă animalele părinți mor. În aceste cazuri, capacitatea de reproducere se exprimă prin „numărul total de progenituri vii produse per părinte prezent la începutul testului”.
1.8.1.4. Administrarea hranei
Pentru testele semistatice, hrana se administrează de preferință zilnic, dar cel puțin de trei ori pe săptămână (adică să corespundă modificărilor mediilor). Se consemnează orice abatere de la această regulă (de exemplu pentru testele în flux continuu).
Pe durata testului, hrana animalelor părinți este alcătuită de preferință din celule de alge vii din una sau mai multe din următoarele specii: Chlorella sp., Selenastrum capricornutum [acum Pseudokirchneriella subcapitata (11)] și Scenedesmus subspicatus. Regimul alimentar ia în considerație conținutul de carbon organic (C) administrat fiecărui animal părinte. Cercetările (12) au arătat că, pentru Daphnia magna, rațiile cuprinse între 0,1 și 0,2 mg C/dafnia/zi sunt suficiente pentru obținerea numărului necesar de progenituri care să satisfacă criteriile de validitate a testului. Rația se poate administra fie sub forma unei porții constante pe toată perioada testului sau, dacă se dorește, se administrează o porție mai mică la început și apoi se crește în timpul testului, ținând cont de creșterea animalelor părinți. În cazul menționat, rația tot trebuie să rămână între valorile recomandate de 0,1-0,2 mg C/dafnia/zi tot timpul.
Dacă urmează să se utilizeze măsuri înlocuitoare, de exemplu numărul de celule de alge sau absorbanța luminii, la administrarea rației (adică pentru ușurință, deoarece măsurarea conținutului de carbon durează mult), fiecare laborator trebuie să-și realizeze propria nomogramă referitoare la măsura înlocuitoare pentru conținutul de carbon al culturii de alge (a se vedea apendicele 2 pentru recomandarea privind realizarea nomogramei). Nomogramele se verifică cel puțin anual și mai frecvent, dacă au fost schimbate condițiile de cultură a algelor. S-a găsit că absorbanța luminii este un înlocuitor mai bun pentru conținutul de carbon decât numărul de celule (13).
Pentru a minimiza volumul mediului de cultură de alge transferat în vasele experimentale se administrează o suspensie de alge concentrată pentru dafnia. Concentrația de alge se poate obține prin centrifugare urmată de resuspensie în apă distilată, apă deionizată sau mediu de cultură pentru dafnia.
1.8.1.5. Lumina
16 ore de lumină la o intensitate de maximum 15-20 μE· m–2 · s–1.
1.8.1.6. Temperatura
Temperatura mediilor experimentale trebuie să fie cuprinsă între valorile 18 oC și 22 oC. Cu toate acestea, pentru niciun test, temperatura nu trebuie să varieze, dacă se poate, cu mai mult de 2 oC în limitele specificate (de exemplu 18-20, 19-21 sau 20-22 oC). S-ar putea să fie necesară utilizarea unui vas experimental suplimentar pentru urmărirea temperaturii.
1.8.1.7. Aerarea
Vasele experimentale nu se aerează în timpul testului.
1.8.2. Concentrația experimentată
În mod normal, trebuie să existe cel puțin cinci concentrații experimentate aranjate în serie geometrică cu un factor de separare de maximum 3,2 și trebuie să se utilizeze numărul optim de probe identice pentru fiecare concentrație experimentată (a se vedea punctul 1.8.1.3). Dacă se utilizează mai puțin de cinci concentrații, acest lucru se justifică. Substanțele nu se testează la concentrații mai mari decât limita de solubilitate a acestora în mediul experimental.
La stabilirea domeniului de concentrații, trebuie să se rețină următoarele:
(i) Dacă se urmărește obținerea CMEO/CFEO, cea mai mică concentrație experimentată trebuie să fie suficient de mică, astfel încât fecunditatea la această concentrație să nu fie cu mult mai mică decât aceea din martor. Dacă nu este așa, testul va trebui să fie repetat cu concentrația cea mai mică redusă.
(ii) Dacă se urmărește obținerea CMEO/CFEO, cea mai mare concentrație experimentată trebuie să fie suficient de mare, astfel încât fecunditatea la această concentrație să fie cu mult mai mică decât aceea din martor. Dacă nu este așa, testul va trebui să fie repetat cu concentrația cea mai mare sporită.
(iii) Dacă se determină CEx pentru efectele asupra reproducerii, se recomandă utilizarea unor concentrații suficiente pentru stabilirea CEx cu un nivel corespunzător de siguranță. Dacă se determină CE50 pentru efectele asupra reproducerii, se recomandă ca cea mai mare concentrație experimentată să fie mai mare decât CE50 menționat. În caz contrar, deși va fi posibilă încă determinarea CE50, intervalul de siguranță pentru CE50 va fi foarte larg și s-ar putea să nu fie posibil să se aprecieze dacă modelul este cel indicat.
(iv) Este de preferat ca valorile concentrației experimentate să nu includă concentrații care au efect important din punct de vedere statistic asupra supraviețuirii adulților, deoarece acest lucru ar modifica natura testului de la un test pur și simplu de reproducere la un test combinat de reproducere și mortalitate care necesită o analiză statistică mult mai complexă.
Cunoașterea în prealabil a toxicității substanței testate (de exemplu dintr-un test de toxicitate acută și din studii de găsire a domeniului) ar fi utilă în selectarea concentrațiilor optime pentru test.
Dacă se utilizează un solvent sau un agent de dispersie pentru a facilita prepararea soluțiilor experimentale (a se vedea punctul 1.6.4), concentrația acestuia în vasele experimentale nu trebuie să fie mai mare de 0,1 ml/l și trebuie să fie aceeași în toate vasele.
1.8.3. Probele martor
În afară de seria pentru test, se mai realizează o serie de probe martor pentru mediul experimental și, de asemenea, dacă este relevant, o serie de probe martor care conțin solventul sau agentul de dispersie. Dacă se utilizează, concentrația solventului sau agentului de dispersie trebuie să fie egală cu cea utilizată în vasele ce conțin substanța testată. Se utilizează numărul optim de probe identice (a se vedea punctul 1.8.1.3).
În general, într-un test bine realizat, coeficientul de variație în jurul numărului mediu de progenituri vii obținute per animal părinte în proba (probele) martor este ≤ 25 % și acest lucru se consemnează în protocoalele testului care utilizează animale ținute separat.
1.8.4. Reînnoirea mediului de testare
Frecvența reînnoirii mediului de testare depinde de stabilitatea substanței testate, dar trebuie să fie de cel puțin trei ori pe săptămână. Dacă, din testele preliminare de stabilitate (a se vedea punctul 1.4), concentrația substanței testate nu este stabilă (adică nu se încadrează în intervalul 80-120 %) din valoarea nominală sau este mai mică de 80 % din concentrația inițială măsurată) în perioada maximă de reînnoire (adică trei zile), trebuie să se aibă în vedere o reînnoire mai frecventă a mediului sau să se utilizeze un test în flux continuu.
Când un mediu este reînnoit în teste semistatice, se pregătește o a doua serie de vase experimentale și animalele părinți se transferă în acestea cu ajutorul, de exemplu, unei pipete de sticlă cu un diametru potrivit. Volumul mediului transferat cu dafnia trebuie să fie minim.
1.8.5. Observații
Rezultatele observațiilor făcute în timpul testului se consemnează în fișe tehnice (a se vedea exemple în apendicele 3 și 4). Dacă sunt necesare alte măsurători (a se vedea punctele 1.3 și 1.8.8), s-ar putea să fie necesare observații suplimentare.
1.8.6. Progenituri
Progeniturile produse de fiecare animal părinte se scot, de preferință, și se numără zilnic de la apariția primilor pui, pentru a preveni consumarea de către aceștia a hranei destinate adulților. În sensul prezentei metode, se numără doar numărul de progenituri vii, dar se consemnează și prezența ouălor avortate sau a progeniturilor decedate.
1.8.7. Mortalitate
Mortalitatea în rândul animalelor părinți se înregistrează de preferință zilnic, cel puțin de câte ori se numără progeniturile.
1.8.8. Alți parametri
Deși prezenta metodă este destinată în principal evaluării efectelor asupra reproducerii, este posibil să se poată măsura și alte efecte suficient pentru a permite o analiză statistică. Măsurătorile de creștere sunt de dorit în mare măsură, deoarece oferă date privind posibilele efecte subletale, care s-ar putea să fie mai utile decât determinarea doar a reproducerii; se recomandă măsurarea lungimii animalelor părinți (adică lungimea corpului, fără înotătoarea caudală, la sfârșitul testului. Alți parametri care se pot măsura sau calcula includ timpul de producere a primului pui (și a puilor ulteriori), numărul și dimensiunea puilor per animal, numărul de pui avortați, prezența masculilor sau ephippia și rata intrinsecă a creșterii populației.
1.8.9. Frecvența determinărilor și măsurătorilor analitice
Este necesar să se măsoare concentrația oxigenului, temperatura, duritatea și valorile pH-ului cel puțin o dată pe săptămână, în mediile proaspete și cele vechi, în proba (probele) martor și în concentrațiile cele mai mari de substanță testată.
În timpul testului, se determină concentrația substanței testate la intervale regulate.
În testele semistatice, unde se estimează o menținere a concentrației substanței testate în limitele de ± 20 % din cea nominală (adică în intervalul de 80-120 % – a se vedea punctele 1.4 și 1.8.4), se recomandă analizarea cel puțin a celei mai mari și a celei mai mici concentrații experimentate, atunci când soluțiile sunt proaspăt preparate și când sunt reînnoite în timpul primei săptămâni de testare (adică analizele se realizează pe o probă din aceeași soluție – atunci când este proaspăt preparată și la reînnoire). Ulterior, determinările respective se repetă la intervale de cel puțin o săptămână.
Pentru testele în care nu se estimează menținerea concentrației substanței testate în limitele de ± 20 % din cea nominală, este necesară analizarea tuturor concentrațiilor experimentate, atunci când soluțiile sunt proaspăt preparate și la reînnoire. Cu toate acestea, pentru acele teste în care concentrația inițială măsurată a substanței testate nu se situează în limitele de ± 20 % din cea nominală, dar se pot aduce dovezi care să indice repetabilitatea și stabilitatea concentrațiilor inițiale (adică în intervalul de 80-120 % din concentrațiile inițiale), determinarea chimică se poate reduce în săptămânile 2 și 3 de testare la cea mai mare și cea mai mică concentrație experimentată. În toate cazurile, este necesar să se determine concentrațiile substanței testate înaintea reînnoirii doar la un vas din cele identice pentru fiecare concentrație experimentată.
Dacă se utilizează un test cu flux continuu, se recomandă un regim de prelevare a probelor similar cu cel descris pentru testele semistatice (dar măsurarea soluțiilor „vechi” nu se aplică în acest caz). Cu toate acestea, ar putea fi recomandabil să se crească numărul prelevărilor de probe în prima săptămână (de exemplu trei seturi de măsurători) pentru a asigura menținerea stabilității concentrațiilor experimentale. La aceste tipuri de testări, trebuie verificat zilnic fluxul diluantului și al substanței testate.
Dacă se poate dovedi menținerea satisfăcătoare, pe toată durata testului, a concentrației substanței testate în limitele de ± 20 % din cea nominală sau măsurată inițial, atunci rezultatele se pot obține din valoarea nominală sau din cea măsurată inițial. Dacă abaterea de la concentrația nominală sau cea măsurată inițial este mai mare de ± 20 %, este necesar ca rezultatele să se exprime în funcție de media ponderată în timp (a se vedea apendicele 5).
2. DATE ȘI RAPORT
2.1. PRELUCRAREA REZULTATELOR
Scopul prezentului test îl constituie determinarea efectului substanței testate asupra numărului total de progenituri vii produse per animal părinte în viață la sfârșitul testului. Numărul total de progenituri per animal părinte se calculează pentru fiecare vas experimental (adică proba repetată). Dacă, în fiecare probă repetată, animalul părinte moare în timpul testului sau se dovedește a fi mascul, atunci proba repetată se exclude din analiză. Analiza se va face atunci pentru un număr redus de probe identice.
Pentru estimarea CMEO și, prin urmare, a CFEO, pentru efectele substanței chimice asupra capacității de reproducere, este necesar să se calculeze capacitatea medie de reproducere pentru toate probele identice pentru fiecare concentrație și deviație standard remanentă comună și acest lucru se poate realiza prin analiza de varianță (ANOVA). Apoi, media pentru fiecare concentrație se compară cu media probelor martor, utilizând o metodă potrivită de comparare multiplă. Ar putea să fie utile testele Dunnett sau Williams (14) (15) (16) (17). Este necesar să se verifice dacă estimarea ANOVA de varianță uniformă este valabilă. Se recomandă ca acest lucru să se facă mai degrabă grafic decât printr-un test de importanță oficială (18); o variantă potrivită este efectuarea unui test Barlett. Dacă această estimare (ANOVA) nu este valabilă, atunci ar trebui să se aibă în vedere transformarea datelor pentru a omogeniza varianțele înaintea efectuării ANOVA sau efectuarea unei ANOVA ponderate. Se calculează și se prezintă dimensiunea efectului detectabil prin utilizarea ANOVA (adică diferența cea mai puțin importantă).
Pentru estimarea concentrației care ar putea să genereze o reducere de 50 % a capacității de reproducere (adică CE50), trebuie să se realizeze o reprezentare grafică corespunzătoare a datelor, de exemplu printr-o curbă logaritmică, utilizând o metodă statistică cum ar fi metoda celor mai mici pătrate. Curba ar putea să fie bine caracterizată în funcție de parametri, astfel încât să se poată determina direct CE50 și eroarea sa standard. Aceasta ar ușura mult calcularea limitelor de încredere pentru CE50. Cu excepția cazului în care există motive întemeiate să se prefere limite de încredere diferite, se fixează limite de încredere de 95 % de ambele părți. Este preferabil ca procedeul de trasare a curbei să ofere un mijloc pentru evaluarea semnificației ajustării incomplete. Acest lucru se poate realiza grafic sau prin împărțirea sumei remanente de pătrate în „ajustare incompletă” și „componente de eroare pură” și prin efectuarea unui test de importanță pentru ajustarea incompletă. Deoarece există posibilitatea ca tratamentele care dau o fecunditate mare să aibă o varianță mai mare a numărului de animale tinere produse decât tratamentele care dau o fecunditate mică, trebuie să se aibă în vedere ponderarea valorilor observate pentru a reflecta varianțele diferite din grupele tratate diferit [a se vedea referința bibliografică (18) pentru date de bază].
Din analiza datelor din testul final de intercalibrare (2), s-a trasat o curbă logaritmică cu ajutorul modelului prezentat în continuare, deși se pot utiliza și alte modele:

unde:
|
Y |
= |
numărul total de animale tinere per animal părinte în viață la sfârșitul testului (calculat pentru fiecare vas) |
|
x |
= |
concentrația substanței |
|
c |
= |
numărul preconizat de animale tinere atunci când x = 0 |
|
x0 |
= |
CE50 în populație |
|
b |
= |
panta curbei |
Se pare că acest model este adecvat unui număr mare de situații, dar există teste pentru care nu este potrivit. Este necesară verificarea validității modelului recomandat anterior. În unele cazuri, se poate să fie potrivit modelul hormetic, în care concentrațiile mici generează efecte sporite (19).
Se mai pot estima și alte concentrații de efect, de exemplu CE10 sau CE20, deși ar fi preferabil să se utilizeze o caracterizare în funcție de parametri a modelului diferită de cea utilizată la determinarea CE50.
2.2. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele:
2.2.1. Substanța testată:
— natura fizică și proprietățile fizico-chimice relevante;
— date de identificare chimică, inclusiv puritatea.
2.2.2. Speciile experimentale:
— clonul (dacă a fost caracterizat genetic, astfel încât să corespundă speciei), furnizorul sau sursa (dacă se cunoaște) și condițiile de cultură utilizate. Dacă se utilizează o specie diferită de Daphnia magna, acest lucru se consemnează și se justifică.
2.2.3. Condițiile de testare:
— modul de lucru utilizat (de exemplu semistatic sau în flux continuu, volumul, încărcarea în număr de dafnia pe litru);
— timpul de expunere la lumină și intensitatea luminii;
— protocolul testului (de exemplu numărul de probe identice, numărul de părinți pentru fiecare probă repetată);
— detalii privind mediul de cultură utilizat;
— adaosurile de material organic, dacă se practică, inclusiv compoziția, sursa, metoda de preparare, raportul COT/CCO al amestecurilor preparate, determinarea raportului COT/CCO rezultat în mediul experimental;
— date detaliate privind hrana, inclusiv cantitatea (în mg C/dafnia/zi) și programul (de exemplu tipul hranei, care include pentru alge denumirea specifică (specia) și, dacă se cunoaște, familia, condițiile de cultură);
— metoda de preparare a soluțiilor mamă și frecvența reînnoirii (dacă se utilizează un solvent sau agent de dispersie, concentrația acestora).
2.2.4. Rezultatele:
— rezultatele oricăror studii preliminare privind stabilitatea substanței testate;
— concentrațiile nominale experimentate și rezultatele tuturor analizelor pentru determinarea concentrației substanței testate în vasele experimentale (a se vedea fișele tehnice din apendicele 4); de asemenea, se prezintă eficiența de regenerare a metodei și limita determinării;
— calitatea apei din vasele experimentale (adică pH, temperatura și concentrația oxigenului dizolvat, COT și CCO și duritatea, dacă este cazul (a se vedea exemplul de fișă tehnică din apendicele 3);
— fișa completă cu progeniturile vii pentru fiecare animal părinte (a se vedea exemplul de fișă tehnică din apendicele 3);
— numărul de decese printre animalele părinți și ziua în care au avut loc (a se vedea exemplul de fișă tehnică din apendicele 3);
— coeficientul de variație pentru fecunditatea martorului (pe baza numărului total de progenituri vii per animal părinte în viață la sfârșitul testului);
— reprezentarea grafică a numărului total de progenituri vii per animal părinte (pentru fiecare probă identică) în viață la sfârșitul testului în funcție de concentrația substanței testate;
— concentrația la care se observă cele mai mici efecte (CMEO) pentru reproducere, care include o descriere a metodelor statistice utilizate și indicarea dimensiunii efectului care ar putea să fie detectat și concentrația la care nu se observă niciun efect (CFEO) pentru reproducere; dacă este cazul, se consemnează și raportul CMEO/CFEO pentru mortalitatea animalelor părinți;
— dacă este cazul, CEx pentru reproducere cu intervalele de încredere și reprezentarea grafică a modelului utilizat pentru calculul acesteia, panta curbei doză-răspuns și erorile standard ale acesteia;
— alte efecte biologice observate sau măsurători: se consemnează orice alte efecte biologice care au fost observate sau măsurate (de exemplu, creșterea animalelor părinți), inclusiv o justificare corespunzătoare;
— explicarea oricărei abateri de la modul de lucru.
3. REFERINȚE BIBLIOGRAFICE
1. OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993.
2. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No.6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
3. Baird D. J., Barber J., Bradley M. C., Soares A. M. V. M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, p. 257-265.
4. Elendt B. P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, p. 25-33.
5. EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
6. Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, p. 775-782.
7. ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. p. 20.
8. Baird D. J., Soares A. M. V. M., Girling A., Barber J., Bradley M. C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen. Eds.) p. 144-148.
9. Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, p. 1-8.
10. Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), p. 185-196.
11. Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, p. 209.
12. Sims I. R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, p. 2053-2058.
13. Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, p. 459-466.
14. Dunnett C. W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, p. 1096-1121.
15. Dunnett C. W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, p. 482-491.
16. Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, p. 103-117.
17. Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, p. 510-531.
18. Draper N. R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
19. Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, p. 93-96.
20. Wilson E. O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
21. Poole R. W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, p. 532.
22. Meyer J. S., Ingersoll C.G., McDonald L. L. and Boyce M. S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, p. 1156-1166.
Apendicele 1
PREPARAREA MEDIILOR ELENDT M7 ȘI M4 COMPLET DETERMINATE
Adaptarea la mediile Elendt M7 și M4
Unele laboratoare au întâmpinat dificultăți la transferul direct al dafniei în mediile M4 (1) și M7. Cu toate acestea, s-au obținut unele succese în adaptarea treptată, adică transferul din mediul propriu în 30 % Elendt, apoi 60 % Elendt și apoi în 100 % Elendt. Perioadele de adaptare pot să fie de o lună.
PREPARAREA
Microelementele
Se prepară mai întâi soluții mamă separate (I) ale fiecărui microelement în apă de puritate corespunzătoare, de exemplu deionizată, distilată sau purificată prin osmoză inversă. Din soluțiile mamă menționate (I), se prepară o soluție mamă unică (II), care conține toate microelementele (soluție combinată), adică:
|
Soluțiile mamă I (o singură substanță) |
Cantitatea adăugată în apă (mg/l) |
Concentrația (în funcție de mediul M4) (multiplu) |
Pentru prepararea soluției mamă combinate II, se adaugă următoarea cantitate de soluție mamă I în apă (ml/l) |
|
|
M4 |
M7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 · 4 H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 · 6 H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 · 2 H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 · 2 H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 · 6 H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2 EDTA· 2 H2O |
5 000 |
2 000 |
— |
— |
|
Fe SO4 · 7 H2O |
1 991 |
2 000 |
— |
— |
|
Atât soluțiile de Na2EDTA cât și de FeSO4 se prepară separat, se toarnă împreună și se autoclavizează imediat. Rezultă: |
||||
|
soluția 21 Fe-EDTA |
1 000 |
20,0 |
5,0 |
|
Mediile M4 și M7
Mediile M4 și M7 se prepară din soluția mamă II, macroelemente nutritive și vitamine, după cum urmează:
|
Cantitatea adăugată în apă (mg/l) |
Concentrația (în funcție de mediul M4) (multiplu) |
Cantitatea de soluție mamă adăugată pentru prepararea mediului (ml/l) |
||
|
M4 |
M7 |
|||
|
Microelementele combinate în soluția mamă II |
20 |
50 |
50 |
|
|
Soluțiile mamă cu macroelemente nutritive (o singură substanță) |
||||
|
CaCl2 · 2 H2O |
293 800 |
1 000 |
1,0 |
1,0 |
|
MgSO4 · 7 H2O |
246 600 |
2 000 |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
|
Na2SiO3 · 9 H2O |
50 000 |
5 000 |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
|
Soluție combinată de vitamine |
— |
10 000 |
0,1 |
0,1 |
|
Soluția mamă combinată de vitamine se prepară prin adăugarea celor 3 vitamine la 1 litru de apă conform indicațiilor prezentate în continuare. |
||||
|
Clorhidrat de tiamină |
750 |
10 000 |
— |
— |
|
Cianocobalamină (B12) |
10 |
10 000 |
— |
— |
|
Biotină |
7,5 |
10 000 |
— |
— |
|
Soluția combinată de vitamine se păstrează înghețată în mici alicoți. Vitaminele se adaugă în medii cu puțin timp înaintea utilizării. Note: Pentru a evita precipitarea sărurilor în timpul preparării mediilor complete, se adaugă alicoți de soluții mamă în aproximativ 500-800 ml apă deionizată și apoi se aduce la un litru. Prima semnalare a mediului M4 se poate găsi în Elendt, B.P. (1990), Selenium deficiency in crustacea; an ultraastructural appropach to antennal demage in Daphnia magna Straus. Protoplasma, 154, p. 25-33. |
||||
Apendicele 2
ANALIZA CONȚINUTULUI DE CARBON ORGANIC TOTAL (COT) ȘI REALIZAREA UNEI NOMOGRAME PENTRU CONȚINUTUL COT DIN HRANA PE BAZĂ DE ALGE
Se acceptă ca măsurarea conținutului de carbon din hrana pe bază de alge să nu se măsoare în mod normal direct, ci din corelările (adică nomogramele) cu măsurile înlocuitoare, de exemplu numărul celulelor de alge sau absorbanța luminii).
Este necesar ca măsurarea COT să se efectueze mai degrabă prin oxidare la temperatură mare decât prin metodele UV sau cu persulfat. (A se vedea The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Pentru obținerea nomogramelor, algele se separă din mediul de cultură prin centrifugare urmată de resuspensie în apă distilată. Se determină parametrul înlocuitor și concentrația COT în fiecare probă de trei ori. Se analizează probele oarbe în apă distilată și concentrația COT se scade din concentrația COT din proba de alge.
Nomogramele trebuie să fie liniare în domeniul necesar de concentrații ale carbonului. Exemplele sunt prezentate în continuare.
NB: Nomogramele nu se utilizează pentru conversiune; este esențial ca laboratoarele să-și elaboreze propriile nomograme.



Apendicele 3
EXEMPLU DE FIȘĂ TEHNICĂ PENTRU ÎNREGISTRAREA REÎNNOIRII MEDIULUI, DATELE CONTROLULUI FIZIC/CHIMIC, ADMINISTRAREA HRANEI, REPRODUCEREA DAFNIEI ȘI MORTALITATEA ADULȚILOR
|
Nr. experiment: |
Început la data: |
Conul: |
Mediul: |
Tipul hranei: |
Substanța testată: |
Conc. nominală: |
||||||||||||||||||
|
Ziua |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
||
|
Reînnoirea mediului (se bifează) |
||||||||||||||||||||||||
|
PH (1) |
nou |
|||||||||||||||||||||||
|
vechi |
||||||||||||||||||||||||
|
O2 (mg/l) (1) |
nou |
|||||||||||||||||||||||
|
vechi |
||||||||||||||||||||||||
|
Temperatura (oC) (1) |
nou |
|||||||||||||||||||||||
|
vechi |
||||||||||||||||||||||||
|
Hrana administrată (se bifează) |
||||||||||||||||||||||||
|
Nr. progenituri vii (se bifează) (2) |
Total |
|||||||||||||||||||||||
|
Vasul 1 |
||||||||||||||||||||||||
|
2 |
||||||||||||||||||||||||
|
3 |
||||||||||||||||||||||||
|
4 |
||||||||||||||||||||||||
|
5 |
||||||||||||||||||||||||
|
6 |
||||||||||||||||||||||||
|
7 |
||||||||||||||||||||||||
|
8 |
||||||||||||||||||||||||
|
9 |
||||||||||||||||||||||||
|
10 |
||||||||||||||||||||||||
|
Total |
||||||||||||||||||||||||
|
Mortalitatea cumulativă a adulților (3) |
||||||||||||||||||||||||
|
(1) Se indică vasul care s-a utilizat pentru experimentare. (2) Mortalitatea animalelor adulte se consemnează cu „M” în căsuța respectivă. (3) Puii avortați se consemnează cu „AV” în căsuța respectivă. |
||||||||||||||||||||||||
Apendicele 4
EXEMPLU DE FIȘĂ TEHNICĂ PENTRU ÎNREGISTRAREA REZULTATELOR ANALIZEI CHIMICE
(a) Concentrațiile măsurate
|
Conc. nominală |
Proba din săptămâna 1 |
Proba din săptămâna 2 |
Proba din săptămâna 3 |
|||
|
Proaspătă |
Veche |
Proaspătă |
Veche |
Proaspătă |
Veche |
|
(b) Concentrațiile măsurate sub formă de procente din cea nominală
|
Conc. nominală |
Proba din săptămâna 1 |
Proba din săptămâna 2 |
Proba din săptămâna 3 |
|||
|
Proaspătă |
Veche |
Proaspătă |
Veche |
Proaspătă |
Veche |
|
Apendicele 5
CALCULAREA MEDIEI PONDERATE DE TIMP
Media ponderată de timp
Deoarece concentrația substanței testate poate să scadă în intervalul de timp dintre reînnoiri, este necesar să se aibă în vedere necesitatea alegerii unei concentrații reprezentative pentru domeniul de concentrații experimentate cu dafnia părinți. Alegerea se face pe principii atât biologice, cât și statistice. De exemplu, dacă se consideră că reproducerea este afectată cel mai mult de concentrația de vârf experimentată, atunci trebuie să se utilizeze concentrația maximă. Cu toate acestea, dacă se consideră că efectul acumulat sau pe termen lung al substanței toxice este mai important, atunci o concentrație medie este mai relevantă. În cazul respectiv, o medie potrivită pentru utilizare este concentrația medie ponderată de timp, deoarece ține seama de variația concentrației instantanee în timp.
Figura 1
Exemplu de medie ponderată de timp

Figura 1 prezintă un exemplu de test (simplificat) cu durata de șapte zile cu reînnoirea mediului în zilele 0, 2 și 4.
— Linia subțire în zig-zag reprezintă concentrația în orice punct în timp. Se consideră că scăderea concentrației este urmarea unui proces de descompunere exponențială.
— Cele șase puncte reprezentate grafic arată concentrațiile observate, măsurate la începutul și la sfârșitul fiecărei perioade de reînnoire.
— Linia continuă groasă indică poziția mediei ponderate de timp.
Media ponderată de timp se calculează, astfel încât aria de sub media ponderată de timp să fie egală cu aria de sub curba concentrațiilor. Calculul pentru exemplul anterior se prezintă în tabelul 1.
Tabelul 1
Calculul mediei ponderate de timp
|
Reînnoirea nr. |
Zile |
Conc0 |
Conc1 |
Ln(Conc0) |
Ln(Conc1) |
Aria |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Total zile: 7 |
Aria totală |
50,091 |
||||
|
Media PT |
7,156 |
|||||
|
„Zile” este numărul de zile din perioada de reînnoire. „Conc0” este concentrația măsurată la începutul fiecărei perioade de reînnoire. „Conc1” este concentrația măsurată la sfârșitul fiecărei perioade de reînnoire. „Ln(Conc0)” este logaritmul natural al Conc0. „Ln(Conc1)” este logaritmul natural al Conc1. „Aria” este aria de sub curba exponențială pentru fiecare perioadă de reînnoire. Se calculează cu:.
|
||||||
Media ponderată de timp („media PT”) este „Aria totală” împărțită la „Total zile”.
Desigur, pentru testul de reproducere a dafniei, tabelul trebuie mărit până la 21 de zile.
Este clar că atunci când observațiile se fac numai la începutul și sfârșitul fiecărei perioade de reînnoire, nu se poate confirma că procesul de descompunere este, de fapt, exponențial. O curbă diferită ar genera un calcul diferit pentru „Arie”. Cu toate acestea, un proces de descompunere exponențială nu este neverosimil și este probabil cea mai bună curbă de utilizat în absența altor date.
Cu toate acestea, este necesar să se procedeze cu prudență, dacă la analiza chimică nu se reușește să se găsească nicio substanță la sfârșitul perioadei I de reînnoire. Cu excepția cazului în care este posibil să se estimeze rapiditatea dispariției substanței din soluție, este imposibil să se obțină o arie realistă sub curbă și, prin urmare, este imposibil să se obțină o medie ponderată de timp rezonabilă.
C.21. MICROORGANISMELE DIN SOL: TESTUL DE TRANSFORMARE A AZOTULUI
1. METODĂ
Această metodă de testare reia Orientarea 216 (2000) a OCDE.
1.1. INTRODUCERE
Această metodă de testare constă dintr-o metodă de laborator elaborată pentru studierea efectelor pe termen lung ale substanțelor chimice, după o singură expunere, asupra activității de transformare a azotului de către microorganismele din sol. Testul se bazează în principal pe recomandările emise de Organizația Europeană și Mediteraneană pentru Protecția Plantelor (1). Cu toate acestea, au fost avute în vedere și alte linii directoare, inclusiv cele emise de Biologische Bundesanstalt din Germania (2), de Agenția pentru protecția mediului a Statelor Unite (3) din cadrul SETAC (4) și de Organizația Internațională de Standardizare (ISO) (5). Numărul și tipul solurilor utilizate în cadrul acestui test au fost definite cu ocazia unui atelier de lucru al OCDE privind selectarea solului/sedimentelor care a avut loc la Belgirate, Italia, în 1995 (6). Recomandările privind prelevarea, manipularea și depozitarea probelor de sol au la bază liniile directoare ISO (7) și recomandările atelierului de la Belgirate. Pentru determinarea și evaluarea caracteristicilor toxice ale substanțelor de testat este posibil să fie necesară determinarea efectelor acestora asupra activității microbiene din sol, de exemplu dacă sunt necesare date privind potențialele efecte secundare ale produselor fitosanitare asupra microflorei din sol sau în cazul riscurilor de expunere a microorganismelor din sol la alte substanțe chimice decât cele din produsele fitosanitare. Testul de transformare a azotului se efectuează pentru a determina efectele acestor substanțe chimice asupra microflorei din sol. Dacă se testează produse agrochimice (de exemplu produse fitosanitare, îngrășăminte, produse chimice de uz silvic) se efectuează atât testul de transformare a azotului cât și testul de transformare a carbonului. Dacă se testează alte produse decât cele agrochimice este suficient testul de transformare a azotului. Cu toate acestea, dacă valorile CE50 obținute în cadrul testului de transformare a azotului pentru substanțele în cauză se încadrează în intervalul de valori caracteristice inhibitorilor de nitrificare disponibili comercial (de exemplu nitrapirin), se poate efectua și un test de transformare a carbonului în vederea obținerii de informații suplimentare.
Solurile sunt formate din componente și vii și din componente non-vii care formează amestecuri complexe și eterogene. Microorganismele joacă un rol important în descompunerea și transformarea materiei organice în sol fertil, multe specii aducându-și contribuția la diferitele aspecte ale fertilizării solurilor. Orice interferență pe termen lung în aceste procese biochimice riscă să perturbe ciclul elementelor nutritive și, în consecință, să altereze fertilitatea solului. Deși coloniile microbiene care determină aceste procese diferă de la un sol la altul, căile de transformare sunt în mare aceleași.
Prezenta metodă de testare descrisă a fost elaborată în vederea detectării efectelor adverse pe termen lung ale unei substanțe asupra procesului de transformare a azotului asupra solurilor aerobe de suprafață. Metoda de test permite și estimarea efectelor substanțelor asupra transformării carbonului de către microflora din sol. Nitratul se formează ca urmare a degradării legăturilor carbon-azot. De aceea, dacă ratele de producere a azotatului pentru solurile tratate și pentru solurile martor sunt identice, este foarte probabil ca principalele căi de degradare a carbonului să fie intacte și funcționale. Raportul carbon-azot din substratul ales pentru test (praf de făină de lucernă) este adecvat (în general între 12/1 și 16/1). Astfel, carențele de carbon sunt reduse pe parcursul testului, iar în cazul în care comunitățile microbiene sunt afectate de o substanță chimică, ele se pot reface în termen de 100 de zile.
Testele pe baza cărora a fost elaborată această metodă de testare au fost concepute în primul rând pentru cazurile în care cantitatea de substanță care pătrunde în sol poate fi estimată. Este, de exemplu, cazul produselor fitosanitare a căror doză de aplicare pe sol este cunoscută. Pentru produsele agrochimice este suficient un test cu două doze reprezentative pentru aplicarea pe sol anticipată sau estimată. Produsele agrochimice pot fi testate ca principii active (p.a.) sau ca produse preparate. Cu toate acestea, testul nu se limitează la produse agrochimice. Modificând atât cantitatea de substanță de testat aplicată pe sol, cât și modul de evaluare a datelor, testul poate fi utilizat și pentru cazurile în care nu se cunoaște cantitatea de substanță care pătrunde în sol. Astfel, în cazul altor substanțe chimice decât cele din produsele agrochimice, se determină efectele unei serii de concentrații asupra transformării azotului. Datele obținute în cadrul acestor teste se folosesc pentru trasarea curbei doză-efect și pentru calcularea valorilor CEx unde x se definește ca fiind efectul procentual.
1.2. DEFINIȚII
Transformare a azotului: degradarea finală a materiei organice care conține azot de către microorganisme prin procesele de amonificare și de nitrificare până la produsul final, nitratul anorganic.
CE x (Concentrația efectivă): este concentrația substanței de testat în sol care inhibă cu x la sută transformarea azotului în nitrat.
CE 50 (Concentrația mediană efectivă): este concentrația substanței de testat în sol care inhibă cu 50 la sută (50 %) transformarea azotului în nitrat.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Se adaugă praf de făină vegetală în solul cernut, iar apoi fie se tratează cu substanța de testat, fie se lasă netratat (martor). Dacă testul vizează produse agrochimice, se recomandă utilizarea a cel puțin două concentrații, care trebuie alese în funcție de concentrația maximă previzibilă de pe teren. După 0, 7, 14 zile și după 28 de zile de incubare, probele de sol tratate și probele martor sunt supuse extracției cu un solvent adecvat și se determină cantitățile de nitrat din extrase. Rata de formare a nitratului pentru probele tratate se compară cu cea a probelor martor și se calculează deviația procentuală dintre probele tratate și probele martor. Toate testele durează cel puțin 28 de zile. Dacă în a 28-a zi diferențele dintre solurile tratate și cele netratate sunt mai mari sau egale cu 25 %, se continuă măsurătorile timp de cel mult 100 de zile. Dacă se testează alte produse decât cele agrochimice, în probele de sol se adaugă o serie de concentrații ale substanței de testat și se măsoară cantitățile de nitrat formate după 28 de zile de incubare. Rezultatele testelor cu mai multe concentrații se analizează cu ajutorul unui model bazat pe regresie și se calculează valorile CEx (de exemplu CE50, CE25 și/sau CE10). A se vedea definițiile.
1.5. VALABILITATEA TESTULUI
Evaluarea rezultatelor testelor efectuate asupra produselor agrochimice se bazează pe diferențe relativ mici (adică valori medii de ± 25 %) dintre concentrațiile de nitrat din probele martor și din probele de sol tratate, fapt care poate determina obținerea unor rezultate false dacă există variații mari între probele martor. De aceea variațiile dintre probele martor trebuie să fie mai mici de ± 15 %.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Aparatură
Se folosesc recipiente de testare confecționate din materiale inerte din punct de vedere chimic. Aceste recipiente trebuie să aibă o capacitate adecvată procedurii de incubare a solului utilizate, de exemplu incubare în vrac sau sub forma unei serii de probe individuale (a se vedea punctul 1.7.1.2). Pierderile de apă trebuie reduse la minimum și trebuie să se poată realiza schimbul de gaze (de exemplu, recipientele de testare se pot acoperi cu folie perforată de polietilenă). Dacă se testează substanțe volatile, se folosesc recipiente ermetice și etanșe la gaz. Dimensiunea recipientelor se alege astfel încât numai un sfert din volumul acestora să fie ocupat de proba de sol.
Se folosește echipament standard de laborator, inclusiv următoarele articole:
— agitator: dispozitiv mecanic de amestecare sau echipament echivalent;
— centrifugă (3 000 g) sau dispozitiv de filtrare (cu hârtie de filtru fără nitrați);
— instrument pentru analiza nitraților cu sensibilitate și reproductibilitate adecvată.
1.6.2. Selectarea solurilor și numărul acestora
Se folosește un singur sol. Caracteristicile recomandate ale acestuia sunt următoarele:
— conținut de nisip: cel puțin 50 % dar nu mai mult de 75 %;
— pH: 5,5-7,5;
— conținut de carbon organic: 0,5-1,5 %;
— se măsoară biomasa microbiană (8) (9), al cărei conținut de carbon trebuie să reprezinte cel puțin 1 % din carbonul organic total din sol.
În majoritatea cazurilor, un sol cu caracteristicile descrise anterior reprezintă cele mai nefavorabile condiții posibil, deoarece adsorbția substanței de testat este minimă, iar expunerea acesteia la microfloră este maximă. De aceea în general nu este necesar să se efectueze teste pe alte soluri. Cu toate acestea, în anumite situații, dacă principala utilizare preconizată a substanței de testat vizează în special soluri forestiere acide, sau în cazul substanțelor chimice cu sarcină electrostatică, poate fi necesară utilizarea unui sol suplimentar.
1.6.3. Prelevarea și depozitarea probelor de sol
1.6.3.1. Prelevare
Se furnizează informații detaliate privind istoricul locului din care se prelevează solul testat. Aceste informații includ localizarea exactă, acoperirea vegetală, date privind tratamentele cu produse fitosanitare, cu îngrășăminte organice și anorganice, adaosurile de material biologic sau contaminările accidentale. Locul ales pentru prelevarea solului trebuie să poată fi utilizat pe termen lung. Pășunile permanente, câmpurile plantate cu cereale anuale (cu excepția porumbului) sau semănături dese cu îngrășăminte vegetale sunt adecvate în acest sens. Locul de prelevare selectat trebuie să nu fi fost tratat cu produse fitosanitare timp de cel puțin un an înainte de prelevarea probelor. De asemenea, trebuie să nu fi fost aplicat niciun îngrășământ organic cel puțin pe parcursul ultimelor șase luni. Utilizarea îngrășămintelor minerale este acceptabilă numai dacă respectă cerințele de cultivare și dacă nu se prelevează probe de sol mai repede de trei luni de la aplicarea îngrășământului. Trebuie evitată utilizarea unor soluri tratate cu îngrășăminte cu efecte biocide cunoscute (de exemplu, cianamidă de calciu).
Se va evita prelevarea de probe în timpul sau imediat după perioadele lungi (de peste 30 de zile) de secetă sau de saturare cu apă. În cazul solurilor arate, probele se recoltează de la o adâncime situată între 0 și 20 cm. În cazul pășunilor sau al altor soluri care nu sunt arate pe parcursul unor perioade lungi (cel puțin pe parcursul unei perioade de creștere), adâncimea maximă de prelevare poate fi puțin mai mare de 20 cm (de exemplu, 25 cm).
Probele de sol se transportă în recipiente și în condiții de temperatură de natură să garanteze că proprietățile inițiale ale solului nu se modifică în mod semnificativ.
1.6.3.2. Depozitare
Este preferabil ca solurile utilizate să fie proaspăt prelevate de pe teren. Dacă nu se poate evita depozitarea în laborator, solurile se depozitează la întuneric, la temperaturi de 4 ± 2 oC timp de maximum trei luni. Pe parcursul depozitării solurilor trebuie asigurate condiții aerobe. Dacă solurile sunt prelevate dintr-o zonă în care sunt afectate de îngheț timp de cel puțin trei luni pe an, se poate avea în vedere depozitarea acestora timp de șase luni la temperaturi între minus 18 oC și minus 22 oC. Biomasa microbiană a solurilor depozitate se măsoară înaintea fiecărui experiment, iar conținutul de carbon din biomasă trebuie să fie de cel puțin 1 % din conținutul total de carbon organic al solului (a se vedea punctul 1.6.2).
1.6.4. Manipularea și pregătirea solului pentru test
1.6.4.1. Preincubarea
Dacă solul a fost depozitat (a se vedea punctul 1.6.3.2), se recomandă preincubarea timp de 2 până la 28 de zile. Temperatura și conținutul de umiditate al solului din perioada de pre-incubare trebuie să fie similare cu cele din cadrul testului (a se vedea punctele 1.6.4.2 și 1.7.1.3).
1.6.4.2. Proprietăți fizice și chimice
Se curăță manual solul de obiectele mari (de exemplu pietre, resturi vegetale etc.) apoi se cerne umed fără uscare excesivă pentru a se obține particule cu o dimensiune mai mică sau egală cu 2 mm. Conținutul de apă al probei de sol se ajustează cu apă distilată sau deionizată până la o valoare cuprinsă între 40 % și 60 % din capacitatea maximă de reținere a apei.
1.6.4.3. Adiționarea cu substrat organic
Solul se adiționează cu un substrat organic adecvat, de exemplu praf de făină de lucernă verde (component principal: Medicago sativa) cu un raport C/N între 12/1 și 16/1. Raportul lucernă-sol recomandat este de 5 g lucernă pe kilogram de sol (greutate uscată).
1.6.5. Pregătirea substanței de testat pentru aplicarea pe sol
Substanța de testat se aplică de obicei cu ajutorul unui excipient. Excipientul poate fi reprezentat de apă (în cazul substanțelor solubile în apă) sau de o substanță solidă inertă cum este nisipul cuarțos fin (dimensiunea particulelor: 0,1-0,5 mm). Se vor evita excipienții lichizi alții decât apa (de exemplu solvenții organici cum sunt acetona și cloroformul) deoarece pot afecta microflora. Dacă se folosește nisip ca excipient, acesta poate fi tratat cu substanța de testat dizolvată sau în suspensie într-un solvent adecvat. În acest caz, solventul se elimină prin evaporare înainte de amestecarea excipientului în sol. Pentru distribuirea optimă a substanței de testat în sol, se recomandă un raport de 10 g de nisip pe kilogram de sol (greutate uscată). Probele martor se tratează numai cu o cantitate echivalentă de apă și/sau de nisip cuarțos.
Pentru testarea substanțelor chimice volatile, se evită în cea mai mare măsură posibilă pierderile din perioada tratamentului și se încearcă repartizarea omogenă în sol (de exemplu, substanța de testat se injectează în sol în mai multe locuri).
1.6.6. Concentrațiile de testare
Dacă se testează produse agrochimice se folosesc cel puțin două concentrații. Concentrația mai mică trebuie să fie cel puțin egală cu cantitatea maximă susceptibilă să ajungă în sol în condiții reale, iar concentrația maximă trebuie să fie un multiplu al concentrației mai mici. Concentrațiile substanței de testat adăugate în sol se calculează presupunând că încorporarea se realizează uniform, la o adâncime de 5 cm, și că densitatea aparentă a solului este de 1,5. Pentru produsele agrochimice aplicate direct pe sol, sau în cazurile în care cantitatea de substanță chimică ce pătrunde în sol este previzibilă, concentrațiile de testare recomandate sunt concentrația maximă anticipată în mediu (PEC) și o concentrație de cinci ori mai mare. Pentru substanțele care se aplică pe sol de mai multe ori în același sezon, se testează concentrații calculate prin înmulțirea PEC cu numărul maxim de aplicări anticipate. Cu toate acestea, cea mai mare concentrație testată nu trebuie să depășească de mai mult de zece ori doza maximă aplicată o dată. Dacă se testează alte produse decât cele agrochimice, se folosește o serie geometrică de cel puțin cinci concentrații. Concentrațiile testate trebuie să acopere intervalul necesar pentru determinarea valorilor CEx.
1.7. DESFĂȘURAREA TESTULUI
1.7.1. Condiții de expunere
1.7.1.1 Lotul tratat și lotul martor
Dacă se testează produse agrochimice, solul se împarte în trei părți cu greutate egală. Două părți se amestecă cu excipient conținând produsul, iar cealaltă se amestecă cu excipient fără produs (martor). Se recomandă pregătirea a cel puțin trei duplicate, atât pentru solul tratat, cât și pentru cel netratat. Dacă se testează alte produse decât cele agrochimice, solul se împarte în șase părți cu greutate egală. Cinci probe se amestecă cu excipient conținând produsul, iar a șasea se amestecă cu excipient fără substanță. Se recomandă pregătirea a trei duplicate atât pentru probele tratate, cât și pentru probele martor. Se va acorda atenție repartizării omogene a substanței de testat în probele de sol tratate. În timpul amestecării se va evita comprimarea sau compactarea solului.
1.7.1.2. Incubarea probelor de sol
Incubarea probelor de sol se poate realiza în două moduri: în vrac pentru probele de sol tratat și netratat sau sub forma unor serii de subprobe individuale de dimensiuni identice de sol tratat și netratat. Cu toate acestea, dacă se testează substanțe volatile, testul se efectuează numai pe o serie de subprobe individuale. Dacă solul se incubează în vrac, se prepară cantități mari de sol tratat și netratat și se prelevează subprobe după cum este necesar pe parcursul testului. Cantitatea pregătită inițial atât pentru probele tratate, cât și pentru probele martor depinde de dimensiunea subprobelor, de numărul de duplicate utilizate pentru analiză și de numărul maxim de prelevări preconizat. Solurile incubate în vrac se amestecă bine înainte de prelevarea subprobelor. Dacă solurile se incubează sub forma unor serii de probe individuale, atât solul tratat cât și solul martor se împart în numărul de subprobe necesare, care se folosesc după cum este necesar. Pentru experimentele pentru care se preconizează mai mult de două prelevări se pregătește o cantitate de subprobe suficientă pentru toate duplicatele și pentru toate prelevările. Se incubează în mediu aerob cel puțin trei probe duplicat din solul testat (a se vedea punctul 1.7.1.1). În cadrul tuturor testelor se utilizează recipiente adecvate care asigură suficient spațiu liber pentru a evita apariția unor condiții anaerobe. Dacă se testează substanțe volatile, testul se realizează pe o singură serie de subprobe individuale.
1.7.1.3. Condițiile de testare și durata testului
Testul se realizează la întuneric și la o temperatură a camerei de 20 ± 2 oC. Pe parcursul testului conținutul de apă al probei de sol se menține la o valoare cuprinsă între 40 % și 60 % din capacitatea maximă de reținere a apei a solului respectiv (a se vedea punctul 1.6.4.2), cu o marjă de ± 5 %. Se poate adăuga apă distilată, deionizată, după cum este necesar.
Toate testele durează cel puțin 28 de zile. Dacă se testează produse agrochimice, se compară ratele de formare de nitrați în probele tratate și în probele martor. Dacă în a 28-a zi aceste diferențe sunt mai mari de 25 %, testul se continuă până la obținerea unei diferențe de 25 % sau mai mică, sau timp de cel mult 100 de zile. Pentru alte produse decât cele agrochimice, testul este oprit după 28 de zile. În ziua 28 se măsoară cantitățile de nitrat formate în probele de sol tratate și în probele de sol martor și se calculează valorile CEx.
1.7.2. Prelevarea și analiza solurilor
1.7.2.1. Programul de prelevare a probelor de sol
Dacă se testează produse agrochimice, se analizează nitratul din probele de sol în zilele 0, 7, 14 și 28. Dacă este necesară prelungirea testului, după ziua 28 se efectuează măsurători suplimentare la intervale de 14 zile.
Dacă se testează alte produse decât cele agrochimice, se folosesc cel puțin cinci concentrații și se analizează probele de sol în vederea măsurării nitratului la începutul (ziua 0) și la sfârșitul perioadei de expunere (28 de zile). Dacă se consideră necesar, se poate realiza o măsurătoare suplimentară, de exemplu în ziua 7. Datele obținute în ziua 28 se folosesc pentru determinarea valorii CEx a substanței chimice. Datele din ziua 0 privind probele martor pot fi utilizate pentru raportarea cantității inițiale de nitrat din sol.
1.7.2.2. Analiza probelor de sol
Cantitatea de nitrat formată în fiecare probă tratată și martor duplicat se determină la fiecare prelevare. Nitratul se extrage din sol prin agitarea probelor în prezența unui solvent de extracție, de exemplu o soluție 0,1 M de clorură de potasiu. Se recomandă utilizarea a 5 ml de soluție de KCl pe gram echivalent de greutate uscată de sol. Pentru optimizarea extracției, recipientele care conțin sol și soluție de extracție nu trebuie umplute mai mult de jumătate. Amestecul se agită la 150 rpm timp de 60 de minute. Amestecurile se centrifughează sau se filtrează și se analizează prezența nitratului în faza lichidă. Extractele lichide din care au fost eliminate particulele se pot depozita înainte de a fi supuse analizei la minus 20 ± 5 oC timp de până la șase luni.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Dacă se testează produse agrochimice, se înregistrează cantitatea de nitrat formată în fiecare probă de sol duplicat și se furnizează valorile medii pentru toate duplicatele într-un tabel. Ratele de transformare a azotului se evaluează prin metode statistice adecvate și general acceptate (de exemplu testul F, nivelul semnificativ de 5 %). Cantitățile de nitrat formate se exprimă în mg nitrat/kg greutate uscată/zi. Se compară rata formării de nitrat din fiecare probă tratată cu rata pentru proba martor și se calculează deviația procentuală față de această valoare.
Dacă se testează alte produse decât cele agrochimice, se determină cantitatea de nitrat formată în fiecare duplicat și se trasează curba doză-răspuns în vederea determinării valorilor CEx. Cantitățile de nitrat (adică mg nitrat/kg greutate uscată de sol) determinate în probele tratate după 28 de zile se compară cu cele determinate pentru proba martor. Pe baza acestor date se calculează valorile de inhibare exprimate procentual pentru fiecare concentrație de testare. Aceste procente sunt reprezentate în funcție de concentrație și se folosesc proceduri statistice pentru calcularea valorilor CEx. Se determină și pragurile de încredere (p = 0,95) pentru CEx calculate cu ajutorul procedurilor standard (10) (11) (12).
Substanțele de testat care conțin cantități mari de azot pot contribui la formarea de nitrat în timpul testului. Dacă aceste substanțe se testează în concentrații mari (de exemplu, în cazul substanțelor chimice care se anticipează că vor fi utilizate pentru aplicații repetate) trebuie incluși în cadrul testului martori adecvați (de exemplu sol plus substanță de testat, dar nu și făină vegetală). Datele obținute pentru aceste probe martor trebuie luate în considerare la calcularea CEx.
2.2. INTERPRETAREA REZULTATELOR
Dacă la evaluarea rezultatelor testelor pe substanțe agrochimice se constată că diferența dintre ratele de formare a nitratului pentru proba tratată cu concentrația cea mai mică (concentrația maximă previzibilă) și pentru proba martor este, după 28 de zile, mai mică sau egală cu 25 % indiferent de momentul recoltării, se consideră că produsul în cauză nu influențează pe termen lung transformarea azotului în sol. Pentru evaluarea rezultatelor testelor pe substanțe chimice altele decât produsele agrochimice se folosesc valorile CE50, CE25 și/sau CE10.
3. RAPORT
Raportul de testare trebuie să conțină următoarele informații:
Date complete de identificare a solului utilizat, inclusiv:
— coordonatele geografice ale locului (latitudine, longitudine);
— informații privind istoricul locului (de exemplu, acoperirea vegetală, date privind tratamentele cu produse fitosanitare, cu îngrășăminte organice și anorganice, contaminările accidentale etc.);
— tipul de utilizare (de exemplu sol agricol, forestier etc.);
— adâncimea de prelevare a probelor (cm);
— conținutul de nisip/aluviuni/argilă ( % greutate uscată);
— pH (în apă);
— conținut de carbon organic ( % greutate uscată);
— conținut de azot ( % greutate uscată);
— concentrație inițială de nitrat (mg nitrat/kg greutate uscată);
— capacitate de schimb de cationi (mmol/kg);
— biomasă microbiană ca procent de carbon organic total;
— metode de referință utilizate pentru determinarea fiecărui parametru;
— toate informațiile privind prelevarea și depozitarea probelor de sol;
— detalii privind preincubarea solului, dacă este cazul.
Substanța de testat:
— natura fizică și, dacă este cazul, proprietățile fizice și chimice;
— date de identificare a substanțelor chimice, dacă este cazul, inclusiv formula structurală, puritatea (pentru produsele fitosanitare procentul reprezentat de ingredientul activ), conținutul de azot.
Substrat:
— sursa substratului;
— compoziție (făină de lucernă, făină de lucernă verde);
— conținut de carbon, de azot ( % greutate uscată);
— dimensiunea sitei (mm).
Condiții de testare:
— detalii privind adiționarea solului cu substrat organic;
— numărul de concentrații ale substanței de testat utilizate și, dacă este cazul, justificarea concentrațiilor selectate;
— detalii privind aplicarea substanței de testat pe sol;
— temperatura de incubare;
— conținutul de apă al solului la începutul testului și pe parcursul derulării acestuia;
— metoda de incubare a solului utilizată (de exemplu, în vrac sau sub forma unei serii de subprobe individuale);
— numărul de duplicate;
— numărul de prelevări;
— metoda utilizată pentru extragerea nitratului din sol.
Rezultate:
— procedura analitică și echipamentul utilizate pentru analizarea nitratului;
— date sub formă de tabel privind valorile individuale și medii ale măsurătorilor privind nitratul;
— variațiile la nivelul duplicatelor probelor tratate și al duplicatelor probelor martor;
— explicații privind ajustările calculelor, dacă este cazul;
— variația procentuală a ratelor de formare a nitratului la fiecare prelevare sau, dacă este cazul, valoarea CE50 cu un prag de încredere de 95 la sută, celelalte valori CEx (CE25 sau CE10) cu pragurile de încredere, și un grafic al curbei doză-răspuns;
— tratamentul statistic aplicat rezultatului;
— toate informațiile și observațiile utile pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994.
2. BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
3. EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
4. SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M. R. Lynch, Pub. SETAC-Europe, Brussels.
5. ISO/DIS 14238 (1995). Soil Quality – Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality – Biological Methods.
6. OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
7. ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
8. ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method.
9. ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
10. Litchfield, J. T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99-113.
11. Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
12. Finney, D. J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.22. MICROORGANISMELE DIN SOL: TESTUL DE TRANSFORMARE A CARBONULUI
1. METODĂ
Această metodă de testare reia Orientarea 217 (2000) a OCDE.
1.1. INTRODUCERE
Această metodă de testare constă dintr-o metodă de laborator elaborată pentru studierea efectelor pe termen lung ale produselor fitosanitare și ale substanțelor chimice, după o singură expunere, asupra activității de transformare a carbonului de către microorganismele din sol. Testul se bazează în principal pe recomandările emise de Organizația europeană și mediteraneană pentru protecția plantelor (1). Cu toate acestea, au fost avute în vedere și alte linii directoare, inclusiv cele emise de Biologische Bundesanstalt din Germania (2) și de Agenția pentru protecția mediului a Statelor Unite (3) din cadrul SETAC (4). Numărul și tipul solurilor utilizate în cadrul acestui test au fost definite cu ocazia unui atelier de lucru al OCDE privind selectarea solului/sedimentelor care a avut loc la Belgirate, Italia, în 1995 (5). Recomandările privind prelevarea, manipularea și depozitarea probelor de sol au la bază liniile directoare ISO (6) și recomandările atelierului de la Belgirate.
Pentru determinarea și evaluarea caracteristicilor toxice ale substanțelor de testat, este posibil să fie necesară determinarea efectelor acestora asupra activității microbiene din sol, de exemplu dacă sunt necesare date privind potențialele efecte secundare ale produselor fitosanitare asupra microflorei din sol sau în cazul riscurilor de expunere a microorganismelor din sol la alte substanțe chimice decât cele din produsele fitosanitare. Testul de transformare a carbonului se efectuează pentru a determina efectele acestor substanțe chimice asupra microflorei din sol. Dacă se testează produse agrochimice (de exemplu produse fitosanitare, îngrășăminte, produse chimice de uz silvic) se efectuează atât testul de transformare a carbonului, cât și testul de transformare a azotului. Dacă se testează alte produse decât cele agrochimice este suficient testul de transformare a azotului. Cu toate acestea, dacă valorile CE50 obținute în cadrul testului de transformare a azotului pentru substanțele în cauză se încadrează în intervalul de valori caracteristice inhibitorilor de nitrificare disponibili comercial (de exemplu nitrapirin), se poate efectua și un test de transformare a carbonului în vederea obținerii de informații suplimentare.
Solurile sunt formate din componente vii și din componente non-vii care formează amestecuri complexe și eterogene. Microorganismele joacă un rol important în descompunerea și transformarea materiei organice în sol fertil, multe specii aducându-și contribuția la diferitele aspecte ale fertilizării solurilor. Orice interferență pe termen lung în aceste procese biochimice riscă să perturbe ciclul elementelor nutritive și, în consecință, să altereze fertilitatea solului. Transformarea azotului și transformarea carbonului se produc în toate solurile fertile. Deși coloniile microbiene care determină aceste procese diferă de la un sol la altul, căile de transformare sunt în mare aceleași.
Prezenta metodă de testare a fost elaborată în vederea detectării efectelor adverse pe termen lung ale unei substanțe asupra procesului de transformare a carbonului în solurilor aerobe de suprafață. Testul este sensibil la modificările dimensiunilor și activității coloniilor microbiene care determină transformarea carbonului deoarece supune aceste colonii atât unui stres chimic, cât și unor carențe de carbon. Se folosește un sol nisipos sărac în substanțe organice. Acesta se tratează cu substanța de testat și se incubează în condiții care permit un metabolism microbian rapid. În aceste condiții, sursele de carbon prezente în sol se epuizează rapid. Astfel sunt provocate carențe de carbon care produc moartea celulelor microbiene și induc o stare latentă/sporogeneză. Dacă durata testului depășește 28 de zile, se poate măsura suma acestor reacții la nivelul probelor martor (sol netratat) prin măsurarea dispariției progresive a biomasei microbiene cu activitate metabolică (7). Dacă biomasa dintr-un sol cu carențe de carbon este afectată în cadrul testului de prezența unei substanțe chimice, este posibil ca aceasta să nu ajungă la același nivel ca și proba martor. De aceea este adesea posibil ca perturbările provocate de substanța de testat în orice moment de pe parcursul testului să se mențină până la finalul testului.
Testele pe baza cărora a fost elaborată această metodă de testare au fost concepute în primul rând pentru cazurile în care cantitatea de substanță care pătrunde în sol poate fi estimată. Este, de exemplu, cazul produselor fitosanitare a căror doză de aplicare pe sol este cunoscută. Pentru produsele agrochimice este suficient un test cu două doze reprezentative pentru aplicarea pe sol anticipată sau estimată. Produsele agrochimice pot fi testate ca principii active (p.a.) sau ca produse preparate. Cu toate acestea, testul nu se limitează la produse cu concentrații anticipate în mediu previzibile. Modificând atât cantitatea de substanță de testat aplicată pe sol, cât și modul de evaluare a datelor, testul poate fi utilizat și pentru cazurile în care nu se cunoaște cantitatea de substanță care pătrunde în sol. Astfel, în cazul altor substanțe chimice decât produsele agrochimice, se determină efectele unei serii de concentrații asupra transformării carbonului. Datele obținute în cadrul acestor teste se folosesc pentru trasarea curbei doză-efect și pentru calcularea valorilor CEx, unde x se definește ca fiind efectul procentual.
1.2 DEFINIȚII
Transformare a carbonului: degradarea materiei organice de către microorganisme până la formarea produsului final, dioxidul de carbon.
CE x (Concentrația efectivă): este concentrația substanței de testat în sol care inhibă cu x la sută transformarea carbonului în dioxid de carbon.
CE 50 (Concentrația mediană efectivă): este concentrația substanței de testat în sol care inhibă cu 50 la sută (50 %) transformarea carbonului în dioxid de carbon.
1.3. SUBSTANȚE DE REFERINȚĂ
Niciuna.
1.4. PRINCIPIUL METODEI DE TESTARE
Solul cernut se tratează cu substanța de testat sau se lasă netratat (martor). Dacă testul vizează produse agrochimice, se recomandă utilizarea a cel puțin două concentrații, care trebuie alese în funcție de concentrația maximă previzibilă de pe teren. După 0, 7, 14 zile și 28 de zile de incubație, probele de sol tratate și probele martor se amestecă cu glucoză și se măsoară rata respirației induse de glucoză timp de 12 ore consecutiv. Rata respirației se exprimă ca dioxid de carbon degajat (mg dioxid de carbon/kg sol uscat/h) sau ca oxigen consumat (mg oxigen/kg sol/h). Rata medie de respirație a probelor de sol tratate se compară cu cea a probelor martor și se calculează deviația procentuală dintre probele tratate și probele martor. Toate testele durează cel puțin 28 de zile. Dacă în a 28-a zi diferențele dintre solurile tratate și cele netratate sunt mai mari sau egale cu 25 %, se continuă efectuarea de măsurători la intervale de 14 zile timp de cel mult 100 de zile. Dacă se testează alte produse decât cele agrochimice, în probele de sol se adaugă o serie de concentrații ale substanței de testat și se măsoară ratele de respirație induse de glucoză (de exemplu cantitățile medii de dioxid de carbon format sau de oxigen consumat) după 28 de zile. Rezultatele testelor cu mai multe concentrații se analizează cu ajutorul unui model bazat pe regresie și se calculează valorile CEx (de exemplu CE50, CE25 și/sau CE10). A se vedea definițiile.
1.5. VALABILITATEA TESTULUI
Evaluarea rezultatelor testelor efectuate asupra produselor agrochimice se bazează pe diferențe relativ mici (adică valori medii de ± 25 %) dintre dioxidul de carbon eliberat sau oxigenul consumat în (sau de către) probele martor și probele tratate de sol, fapt care poate determina obținerea unor rezultate false dacă există variații mari între probele martor. De aceea variațiile dintre probele martor trebuie să fie mai mici de ± 15 %.
1.6. DESCRIEREA METODEI DE TESTARE
1.6.1. Aparatură
Se folosesc recipiente de testare confecționate din materiale inerte din punct de vedere chimic. Aceste recipiente trebuie să aibă o capacitate adecvată procedurii de incubare a solului utilizate, de exemplu incubare în vrac sau sub forma unei serii de probe individuale (a se vedea punctul 1.7.1.2). Pierderile de apă trebuie reduse la minimum și trebuie să se poată realiza schimbul de gaze (de exemplu, recipientele de testare se pot acoperi cu folie perforată de polietilenă). Dacă se testează substanțe volatile, se folosesc recipiente ermetice și etanșe la gaz. Dimensiunea recipientelor se alege astfel încât numai un sfert din volumul acestora să fie ocupat de proba de sol.
Pentru determinarea respirației induse de glucoză sunt necesare sisteme de incubare și instrumente de măsurare a producției de dioxid de carbon și a consumului de oxigen. În literatură există exemple de astfel de sisteme și instrumente (8) (9) (10) (11).
1.6.2. Selectarea solurilor și numărul acestora
Se folosește un singur sol. Caracteristicile recomandate ale acestuia sunt următoarele:
— conținut de nisip: cel puțin 50 % dar nu mai mult de 75 %;
— pH: 5,5-7,5;
— conținut de carbon organic: 0,5-1,5 %;
— se măsoară biomasa microbiană (12) (13), al cărei conținut de carbon trebuie să reprezinte cel puțin 1 % din carbonul organic total din sol.
În majoritatea cazurilor, un sol cu caracteristicile descrise anterior reprezintă cele mai nefavorabile condiții posibil, deoarece adsorbția substanței de testat este minimă, iar expunerea acesteia la microfloră este maximă. De aceea în general nu este necesar să se efectueze teste pe alte soluri. Cu toate acestea, în anumite situații, dacă principala utilizare preconizată a substanței de testat vizează în special soluri de tipul solurilor forestiere acide, sau în cazul substanțelor chimice cu sarcină electrostatică, poate fi necesară utilizarea unui sol suplimentar.
1.6.3. Prelevarea și depozitarea probelor de sol
1.6.3.1. Prelevare
Se furnizează informații detaliate privind istoricul locului din care se prelevează solul testat. Aceste informații includ localizarea exactă, acoperirea vegetală, date privind tratamentele cu produse fitosanitare, cu îngrășăminte organice și anorganice, adaosurile de material biologic sau contaminările accidentale. Locul ales pentru prelevarea solului trebuie să poată fi utilizat pe termen lung. Pășunile permanente, câmpurile plantate cu cereale anuale (cu excepția porumbului) sau semănături dese cu îngrășăminte vegetale sunt adecvate în acest sens. Locul de prelevare selectat trebuie să nu fi fost tratat cu produse fitosanitare timp de cel puțin un an înainte de prelevarea probelor. De asemenea, trebuie să nu fi fost aplicat niciun îngrășământ organic cel puțin pe parcursul ultimelor șase luni. Utilizarea îngrășămintelor minerale este acceptabilă numai dacă respectă cerințele de cultivare și dacă nu se prelevează probe de sol mai repede de trei luni de la aplicarea îngrășământului. Trebuie evitată utilizarea unor soluri tratate cu îngrășăminte cu efecte biocide cunoscute (de exemplu cianamidă de calciu).
Se va evita prelevarea de probe în timpul sau imediat după perioadele lungi (de peste 30 de zile) de secetă sau de saturare cu apă. În cazul solurilor arate, probele se recoltează de la o adâncime situată între 0 și 20 cm. În cazul pășunilor sau al altor soluri care nu sunt arate pe parcursul unor perioade lungi (cel puțin pe parcursul unei perioade de creștere), adâncimea maximă de prelevare poate fi puțin mai mare de 20 cm (de exemplu 25 cm). Probele de sol se transportă în recipiente și în condiții de temperatură de natură să garanteze că proprietățile sale inițiale nu se modifică în mod semnificativ.
1.6.3.2. Depozitare
Este preferabil ca solurile utilizate să fie proaspăt prelevate de pe teren. Dacă nu se poate evita depozitarea în laborator, solurile se depozitează la întuneric, la temperaturi de 4 ± 2 oC timp de maximum trei luni. Pe parcursul depozitării solurilor trebuie asigurate condiții aerobe. Dacă solurile sunt prelevate dintr-o zonă în care sunt afectate de îngheț timp de cel puțin trei luni pe an, se poate avea în vedere depozitarea acestora timp de șase luni la minus 18 oC. Biomasa microbiană a solurilor depozitate se măsoară înaintea fiecărui experiment, iar conținutul de carbon din biomasă trebuie să fie de cel puțin 1 % din conținutul total de carbon organic al solului (a se vedea punctul 1.6.2).
1.6.4. Manipularea și pregătirea solului pentru test
1.6.4.1. Preincubarea
Dacă solul a fost depozitat (a se vedea punctele 1.6.4.2 și 1.7.1.3), se recomandă pre-incubarea timp de 2 până la 28 de zile. Temperatura și conținutul de umiditate al solului în perioada de pre-incubare trebuie să fie similare cu cele din cadrul testului (a se vedea punctele 1.6.4.2 și 1.7.1.3).
1.6.4.2. Proprietăți fizice și chimice
Se curăță manual solul de obiectele mari (de exemplu pietre, resturi vegetale etc.) apoi se cerne umed fără uscare excesivă pentru a se obține particule cu o dimensiune mai mică sau egală cu 2 mm. Conținutul de apă al probei de sol se ajustează cu apă distilată sau deionizată până la o valoare cuprinsă între 40 % și 60 % din capacitatea maximă de reținere a apei.
1.6.5. Pregătirea substanței de testat pentru aplicarea pe sol
Substanța de testat se aplică de obicei cu ajutorul unui excipient. Excipientul poate fi reprezentat de apă (în cazul substanțelor solubile în apă) sau de o substanță solidă inertă cum este nisipul cuarțos fin (dimensiunea particulelor: 0,1-0,5 mm). Se vor evita excipienții lichizi alții decât apa (de exemplu solvenții organici cum sunt acetona și cloroformul) deoarece pot afecta microflora. Dacă se folosește nisip ca excipient, acesta poate fi tratat cu substanța de testat dizolvată sau în suspensie într-un solvent adecvat. În acest caz, solventul se elimină prin evaporare înainte de amestecarea excipientului în sol. Pentru distribuirea optimă a substanței de testat în sol, se recomandă un raport de 10 g de nisip pe kilogram de sol (greutate uscată). Probele martor se tratează numai cu o cantitate echivalentă de apă și/sau de nisip cuarțos.
Pentru testarea substanțelor chimice volatile, se evită în cea mai mare măsură posibilă pierderile din perioada tratamentului și se încearcă repartizarea omogenă în sol (de exemplu, substanța de testat se injectează în sol în mai multe locuri).
1.6.6. Concentrațiile de testare
Dacă se testează produse fitosanitare sau alte produse chimice cu concentrații anticipate în mediu previzibile, se folosesc cel puțin două concentrații. Concentrația mai mică trebuie să fie cel puțin egală cu cantitatea maximă susceptibilă să ajungă în sol în condiții reale, iar concentrația maximă trebuie să fie un multiplu al concentrației mai mici. Concentrațiile substanței de testat adăugate în sol se calculează presupunând că încorporarea se realizează uniform, la o adâncime de 5 cm, și că densitatea aparentă a solului este de 1,5. Pentru produsele agrochimice aplicate direct pe sol, sau în cazurile în care cantitatea de substanță chimică ce pătrunde în sol este previzibilă, concentrațiile de testare recomandate sunt concentrația anticipată în mediu (PEC) și o concentrație de cinci ori mai mare. Pentru substanțele care se aplică pe sol de mai multe ori în același sezon, se testează concentrații calculate prin înmulțirea PEC cu numărul maxim de aplicări anticipate. Cu toate acestea, cea mai mare concentrație testată nu trebuie să depășească de mai mult de zece ori doza maximă aplicată o dată.
Dacă se testează alte produse decât cele agrochimice, se folosește o serie geometrică de cel puțin cinci concentrații. Concentrațiile testate trebuie să acopere intervalul necesar pentru determinarea valorilor CEx.
1.7. DESFĂȘURAREA TESTULUI
1.7.1. Condiții de expunere
1.7.1.1. Lotul tratat și lotul martor
Dacă se testează produse agrochimice, solul se împarte în trei părți cu greutate egală. Două părți se amestecă cu excipient conținând produsul, iar cealaltă se amestecă cu excipient fără produs (martor). Se recomandă pregătirea a cel puțin trei duplicate, atât pentru solul tratat, cât și pentru cel netratat. Dacă se testează alte produse decât cele agrochimice, solul se împarte în șase părți cu greutate egală. Cinci probe se amestecă cu excipient conținând substanța de testat, iar a șasea se amestecă cu excipient fără substanță. Se recomandă pregătirea a trei duplicate atât pentru probele tratate, cât și pentru probele martor. Se va acorda atenție repartizării omogene a substanței de testat în probele de sol tratate. În timpul amestecării se va evita comprimarea sau compactarea solului.
1.7.1.2. Incubarea probelor de sol
Incubarea probelor de sol se poate realiza în două moduri: în vrac pentru probele de sol tratat și netratat sau sub forma unor serii de subprobe individuale de dimensiuni identice de sol tratat și netratat. Cu toate acestea, dacă se testează substanțe volatile, testul se efectuează numai pe o serie de subprobe individuale. Dacă solul se incubează în vrac, se prepară cantități mari de sol tratat și netratat și se prelevează subprobe după cum este necesar pe parcursul testului. Cantitatea pregătită inițial atât pentru probele tratate cât și pentru probele martor depinde de dimensiunea subprobelor, de numărul de duplicate utilizate pentru analiză și de numărul maxim de prelevări preconizat. Solurile incubate în vrac se amestecă bine înainte de prelevarea subprobelor. Dacă solurile se incubează sub forma unor serii de probe individuale, atât solul tratat cât și solul martor se împart în numărul de subprobe adecvat, care se folosesc după cum este necesar. Pentru experimentele pentru care se preconizează mai mult de două prelevări se pregătește o cantitate de subprobe suficientă pentru toate duplicatele și pentru toate prelevările. Se incubează în mediu aerob cel puțin trei probe duplicat din solul testat (a se vedea punctul 1.7.1.1). În cadrul tuturor testelor se utilizează recipiente adecvate care asigură suficient spațiu liber pentru a evita apariția unor condiții anaerobe. Dacă se testează substanțe volatile, testul se realizează pe o singură serie de subprobe individuale.
1.7.1.3. Condițiile de testare și durata testului
Testul se realizează la întuneric și la o temperatură a camerei de 20 ± 2 oC. Pe parcursul testului conținutul de apă al probei de sol se menține la o valoare cuprinsă între 40 % și 60 % din capacitatea maximă de reținere a apei a solului respectiv (a se vedea punctul 1.6.4.2), cu o marjă de ± 5 %. Se poate adăuga apă distilată, deionizată, după cum este necesar.
Toate testele durează cel puțin 28 de zile. Dacă se testează produse agrochimice, se compară cantitățile de dioxid de carbon eliberat de probele tratate și de probele martor. Dacă în a 28-a zi aceste diferențe sunt mai mari de 25 %, testul se continuă până la obținerea unei diferențe de 25 % sau mai mică, sau timp de cel mult 100 de zile. Pentru alte produse decât cele agrochimice, testul este oprit după 28 de zile. În ziua 28 se măsoară cantitățile de dioxid de carbon eliberate sau de oxigen consumat de probele de sol tratate și de probele de sol martor și se calculează valorile CEx.
1.7.2. Prelevarea și analiza solurilor
1.7.2.1. Programul de prelevare a probelor de sol
Dacă se testează produse agrochimice, se analizează ratele respirației induse de glucoză în probele din sol în zilele 0, 7, 14 și 28. Dacă este necesară prelungirea testului, după ziua 28 se efectuează măsurători suplimentare la intervale de 14 zile.
Dacă se testează alte produse decât cele agrochimice, se folosesc cel puțin cinci concentrații și se analizează probele de sol în vederea măsurării nitratului la începutul (ziua 0) și la sfârșitul perioadei de expunere (28 de zile). Dacă se consideră necesar, se poate realiza o măsurătoare suplimentară, de exemplu în ziua 7. Datele obținute în ziua 28 se folosesc pentru determinarea valorii CEx a substanței chimice. Datele din ziua 0 privind probele martor pot fi utilizate pentru estimarea cantității inițiale de biomasă microbiană cu activitate metabolică din sol (12).
1.7.2.2. Măsurarea ratelor de respirație induse de glucoză
Rata respirației induse de glucoză se determină pentru fiecare probă de sol tratat și pentru fiecare probă martor la fiecare prelevare. Probele de sol se amestecă cu o cantitate de glucoză suficientă pentru a antrena o reacție respiratorie maximă imediată. Cantitatea de glucoză necesară pentru provocarea unei reacții respiratorii maxime într-un anumit sol se poate determina cu ajutorul unui test preliminar cu mai multe concentrații de glucoză (14). Cu toate acestea, în cazul solurilor nisipoase cu un conținut de carbon organic de 0,5-1,5 % sunt de obicei suficiente 2 000-4 000 mg de glucoză pe kg greutate uscată de sol. Glucoza se poate măcina în pulbere cu nisip cuarțos fin (10 g nisip/kg greutate uscată) și se amestecă omogen în sol.
Probele de sol adiționate cu glucoză se incubează într-un aparat adaptat pentru măsurarea continuă a ratei de respirație la fiecare oră sau la fiecare două ore (a se vedea punctul 1.6.1) la 20 ± 2 oC. Se măsoară dioxidul de carbon degajat sau oxigenul consumat timp de 12 ore consecutive, iar măsurătorile se inițiază cât mai repede posibil, adică după 1-2 ore de la adăugarea glucozei. Se măsoară cantitatea totală de dioxid de carbon degajat sau de oxigen consumat pe parcursul a 12 ore și se determină ratele medii de respirație.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Dacă se testează produse agrochimice, se înregistrează cantitatea de dioxid de carbon eliberat sau de oxigen consumat de fiecare probă de sol duplicat și se furnizează valorile medii pentru toate duplicatele într-un tabel. Rezultatele se evaluează prin metode statistice adecvate și general acceptate (de exemplu testul F, nivelul semnificativ de 5 %). Rata de respirație indusă de glucoză se exprimă în mg dioxid de carbon/kg greutate uscată de sol/h sau în mg oxigen/greutate uscată de sol/h. Se compară rata medie a formării dioxidului de carbon sau rata medie a consumului de oxigen pentru fiecare probă tratată cu rata pentru proba martor și se calculează deviația procentuală față de această valoare.
Dacă se testează alte produse decât cele agrochimice, se determină cantitatea de dioxid de carbon eliberat sau de oxigen consumat de fiecare duplicat și se trasează curba doză-răspuns în vederea determinării valorilor CEx. Ratele de respirație induse de glucoză (în mg dioxid de carbon/kg greutate uscată de sol/h sau în mg oxigen/greutate uscată de sol/h) determinate în probele tratate după 28 de zile se compară cu cele determinate pentru proba martor. Pe baza acestor date se calculează valorile de inhibare exprimate procentual pentru fiecare concentrație de testare. Aceste procente sunt reprezentate în funcție de concentrație, iar pentru calcularea valorilor CEx se folosesc proceduri statistice. Se determină și pragurile de încredere (p = 0,95) pentru CEx calculate cu ajutorul procedurilor standard (15) (16) (17).
2.2. INTERPRETAREA REZULTATELOR
Dacă la evaluarea rezultatelor testelor pe substanțe agrochimice se constată că diferența dintre ratele de respirație induse de glucoză pentru proba tratată cu concentrația cea mai mică (concentrația maximă previzibilă) și pentru proba martor este, după 28 de zile, mai mică sau egală cu 25 % indiferent de momentul recoltării, se consideră că produsul în cauză nu influențează pe termen lung transformarea carbonului în sol. Pentru evaluarea rezultatelor testelor pe substanțe chimice altele decât produsele agrochimice se folosesc valorile CE50, CE25 și/sau CE10.
3. RAPORT
RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Date complete de identificare a solului utilizat, inclusiv:
— coordonatele geografice ale locului (latitudine, longitudine);
— informații privind istoricul locului (de exemplu, acoperirea vegetală, date privind tratamentele cu produse fitosanitare, tratamentele cu îngrășăminte, contaminările accidentale etc.);
— tipul de utilizare (de exemplu sol agricol, forestier etc.);
— adâncimea de prelevare a probelor (cm);
— conținutul de nisip/aluviuni/argilă ( % greutate uscată);
— pH (în apă);
— conținut de carbon organic ( % greutate uscată);
— conținut de azot ( % greutate uscată);
— capacitate de schimb de cationi (mmol/kg);
— biomasă microbiană inițială ca procent de carbon organic total;
— metode de referință utilizate pentru determinarea fiecărui parametru;
— toate informațiile privind prelevarea și depozitarea probelor de sol;
— detalii privind pre-incubarea solului, dacă este cazul.
Substanța de testat:
— natura fizică și, dacă este cazul, proprietățile fizice și chimice;
— date de identificare a substanțelor chimice, dacă este cazul, inclusiv formula structurală, puritatea (pentru produsele fitosanitare procentul de ingredient activ), conținutul de azot.
Condiții de testare:
— detalii privind adiționarea solului cu substrat organic;
— numărul de concentrații ale substanței de testat utilizate și, dacă este cazul, justificarea concentrațiilor selectate;
— detalii privind aplicarea substanței de testat pe sol;
— temperatura de incubație;
— conținutul de apă al solului la începutul testului și pe parcursul derulării acestuia;
— metoda de incubare a solului utilizată (de exemplu în vrac sau sub forma unei serii de subprobe individuale);
— numărul de duplicate;
— numărul de prelevări.
Rezultate:
— metoda și echipamentul utilizate pentru măsurarea ratelor de respirație;
— date sub formă de tabel privind cantitățile individuale și medii de dioxid de carbon sau de oxigen;
— variațiile la nivelul duplicatelor probelor tratate și al duplicatelor probelor martor;
— explicații privind ajustările calculelor, dacă este cazul;
— variația procentuală a ratelor de respirație induse de glucoză la fiecare prelevare sau, dacă este cazul, valoarea CE50 cu un prag de încredere de 95 la sută, celelalte valori CEx (CE25 sau CE10) cu praguri de încredere și un grafic al curbei doză-răspuns;
— tratamentul statistic aplicat rezultatelor, dacă este cazul;
— toate informațiile și observațiile utile pentru interpretarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals, Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994.
2. BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
3. EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
4. SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M. R. Lynch, Pub. SETAC-Europe, Brussels.
5. OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
6. ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
7. Anderson, J. P. E. (1987). Handling and Storage of Soils for Pesticide Experiments, in „Pesticide Effects on Soil Microflora”. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45-60.
8. Anderson, J. P. E. (1982). Soil Respiration, in „Methods of Soil Analysis – Part 2: Chemical and Microbiological Properties”. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831-871.
9. ISO 11266-1. (1993). Soil Quality – Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions.
10. ISO 14239 (1997E). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
11. Heinemeyer O., Insam, H., Kaiser, E. A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81.
12. ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method.
13. ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
14. Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113-120.
15. Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99-113.
16. Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
17. Finney D. J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.23. TRANSFORMĂRI AEROBE ȘI ANAEROBE ÎN SOL
1. METODĂ
Această metodă de testare reia Orientarea 307 (2002) a OCDE.
1.1. INTRODUCERE
Această metodă de testare se bazează pe liniile directoare existente (1) (2) (3) (4) (5) (6) (7) (8) (9). Metoda descrisă în continuare a fost elaborată pentru măsurarea transformărilor aerobe și anaerobe ale substanțelor chimice în sol. Scopul experimentelor este acela de a determina (i) rata de transformare a substanței de testat și (ii) natura și ratele de formare și de epuizare ale produșilor de transformare la care pot fi expuse plantele și organismele din sol. Aceste studii sunt necesare pentru substanțele chimice aplicate direct pe sol sau susceptibile să ajungă în mediul din sol. Rezultatele acestor studii de laborator pot fi, de asemenea, utilizate pentru elaborarea de protocoale de prelevare de probe și de analiză pentru studii din domenii înrudite.
În general, pentru evaluarea căilor de transformare este suficientă realizarea de studii aerobe și anaerobe pe un singur tip de sol (8) (10) (11). Ratele de transformare se determină pentru încă cel puțin trei alte soluri (8) (10).
Numărul și tipul solurilor utilizate în cadrul acestui test au fost definite cu ocazia unui atelier de lucru al OCDE privind selectarea solului și a sedimentelor care a avut loc la Belgirate, Italia, în 1995 (10). Tipurile de sol testate trebuie să fie reprezentative pentru condițiile de mediu în care va fi utilizată sau eliberată substanța. De exemplu, substanțele chimice eliberate într-un climat subtropical sau tropical se testează cu Ferrasols sau Nitosols (sistemul FAO). În cadrul atelierului de lucru au fost de asemenea formulate recomandări privind prelevarea, manipularea și depozitarea probelor de sol bazate pe liniile directoare ISO (15). În cadrul acestei metode se studiază și utilizarea solurilor de orezărie.
1.2. DEFINIȚII
Substanță de testat: orice substanță, indiferent dacă este vorba despre substanța mamă sau despre produșii de transformare relevanți.
Produși de transformare: toate substanțele rezultate din reacțiile biotice sau abiotice de transformare a substanței de testat, în special CO2 și produșii din reziduurile legate.
Reziduuri legate:„reziduurile legate” sunt compuși vegetali sau animali din sol, care persistă în matrice după extracție sub forma substanței mamă sau a metabolitului (metaboliților)/produșilor de transformare ai acesteia. Metoda de extracție nu trebuie să modifice considerabil compușii înșiși sau structura matricei. Natura legăturii poate fi determinată parțial prin metode de extracție care modifică matricea și prin tehnici analitice complexe. Până în prezent a fost identificată în acest mod natura legăturilor covalente, ionice, de sorbție și de captare. În general, formarea reziduurilor legate reduce bioaccesibilitatea și biodisponibilitatea în mod considerabil (12) [modificare IUPAC 1984 (13)].
Transformare aerobă: reacție care se produce în prezența oxigenului molecular (14).
Transformare anaerobă: reacție care se produce în absența oxigenului molecular (14).
Sol: este un amestec de constituenți chimici minerali și organici, aceștia din urmă conținând compuși cu un conținut ridicat de carbon și azot și cu masă moleculară mare, care conțin mici organisme (în special microorganisme). Solul poate fi manipulat în două forme:
(a) nederanjat, așa cum s-a format în timp, în straturile caracteristice unui număr mare de tipuri de sol;
(b) deranjat, așa cum se găsește de obicei pe terenurile arabile când probele se prelevează prin săpare și se folosesc în cadrul prezentei metode de testare (14).
Mineralizare: degradarea completă a unui compus organic în CO2 și H2O în condiții aerobe și în CH4, CO2 și H2O în condiții anaerobe. În cadrul prezentei metode de testare, dacă se folosește un compus marcat cu 14C, mineralizare înseamnă o degradare considerabilă pe parcursul căreia un atom de carbon marcat este oxidat, degajându-se o cantitate adecvată de 14CO2 (14).
Timp de înjumătățire: t0,5 este timpul necesar pentru transformarea a 50 % dintr-o substanță de testat în cazul transformărilor care pot fi descrise printr-o cinetică de prim ordin; nu depinde de concentrație.
DT 50 (timp de degradare 50): este timpul în care concentrația substanței de testat se reduce cu 50 %; diferă de timpul de înjumătățire t0,5 dacă transformarea nu respectă o cinetică de prim ordin.
DT 75 (timp de degradare 75): este timpul în care concentrația substanței de testat se reduce cu 75 %.
DT 90 (timp de degradare 90): este timpul în care concentrația substanței de testat se reduce cu 90 %.
1.3. SUBSTANȚE DE REFERINȚĂ
Substanțele de referință se folosesc pentru caracterizarea și/sau identificarea produșilor de transformare prin metode spectroscopice și cromatografice.
1.4. APLICABILITATEA TESTULUI
Metoda se aplică tuturor substanțelor chimice (nemarcate sau marcate radioactiv) pentru care se poate utiliza o metodă analitică cu o precizie și o sensibilitate suficientă. Se aplică pentru compușii ușor volatili, nevolatili, solubili sau insolubili în apă. Testul nu se aplică substanțelor chimice puternic volatile în sol (de exemplu fumiganți, solvenți organici) care de aceea nu pot fi menținute în sol în condițiile experimentale din cadrul acestui test.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTAT
Pentru măsurarea ratei de transformare se poate utiliza o substanță de testat marcată sau nemarcată. Materialul marcat este necesar pentru studierea căilor de transformare și pentru stabilirea bilanțului masic. Se recomandă marcarea cu 14C dar poate fi utilă și utilizarea altor izotopi cum sunt 13C, 15N, 3H, 32P. În măsura în care este posibil, marcajul se amplasează în partea (părțile) cea (cele) mai stabilă (stabile) ale moleculei ( 35 ). Puritatea substanței de testat trebuie să fie de cel puțin 95 %.
Înainte de efectuarea unui test de transformare aerobă sau anaerobă în sol, sunt necesare următoarele informații privind substanța de testat:
(a) solubilitatea în apă (metoda A.6);
(b) solubilitatea în solvenți organici;
(c) presiunea vaporilor (metoda A.4) și constanta lui Henry;
(d) coeficientul de împărțire n-octanol/apă (metoda A.8);
(e) stabilitatea chimică la întuneric (hidroliză) (metoda C.7);
(f) coeficientul pKa dacă este posibil ca o moleculă să fie supusă unei protonări sau deprotonări (Orientarea 112 a OCDE) (16).
Este posibil să fie utile și informații privind toxicitatea substanței de testat asupra microorganismelor din sol (metodele de testare C.21 și C.22) (16).
Trebuie să fie disponibile metode analitice (inclusiv metode de extracție și de purificare) necesare pentru cuantificarea și identificarea substanței de testat și a produșilor de transformare ai acesteia.
1.6. PRINCIPIUL METODEI DE TESTARE
Probele de sol se tratează cu substanța de testat și se incubează la întuneric în baloane de tip biometric sau în sisteme cu circulație continuă în condiții de laborator controlate (la temperatură și umiditate constantă). După un interval de timp adecvat, se extrag și se analizează probele de sol în vederea măsurării substanței mamă și a produșilor de transformare. Și produșii volatili se colectează în vederea efectuării unei analize cu ajutorul unor dispozitive de absorbție adecvate. Cu ajutorul materialului marcat cu 14C se pot măsura diferitele rate de mineralizare a substanței de testat prin captarea 14CO2 degajat și se poate stabili bilanțul masic, inclusiv formarea reziduurilor legate de sol.
1.7. CRITERII DE CALITATE
1.7.1. Recuperare
Extracția și analizarea probelor de sol, cel puțin în duplicat, imediat după adăugarea substanței de testat, oferă o primă indicație privind repetabilitatea metodei analitice și uniformitatea procedurii de aplicare a substanței de testat. Ratele de recuperare din etapele ulterioare ale experimentelor sunt furnizate de bilanțurile masice respective. Aceste rate de recuperare variază între 90 % și 110 % pentru substanțele chimice marcate (8) și între 70 % și 110 % pentru substanțele chimice nemarcate (3).
1.7.2. Repetabilitatea și sensibilitatea metodei analitice
Repetabilitatea metodei analitice (cu excepția randamentului extracției inițiale) în ceea ce privește cuantificarea substanței de testat și a produșilor de transformare se poate controla prin efectuarea unei analize duplicat pe același extract de sol, incubat suficient timp pentru a se forma produșii de transformare.
Pragul de detecție (LOD) a substanței de testat și a produșilor de transformare din cadrul metodei analitice trebuie să fie de cel puțin 0,01 mg· kg–1 (substanță de testat) în sol sau de 1 % din doza aplicată, respectiv valoarea mai mică dintre acestea. Se precizează și pragul de cuantificare (LOQ).
1.7.3. Precizia datelor privind transformarea
Analiza de regresie a concentrațiilor substanței de testat în funcție de timp oferă informații adecvate privind fiabilitatea curbei de transformare și calcularea pragurilor de încredere pentru timpii de înjumătățire (în cazurile de cinetică de pseudo prim ordin) sau a valorilor DT50 și, dacă este cazul, a valorilor DT75 și DT90.
1.8. DESCRIEREA METODEI DE TESTARE
1.8.1. Echipament și reactivi chimici
Incubatoarele sunt formate din circuite statice închise sau din sisteme cu circulație continuă (7) (17). În figurile 1 și 2 sunt prezentate exemple de incubatoare cu circulație continuă și de baloane de tip biometric. Ambele tipuri de incubatoare prezintă avantaje și inconveniente (7) (17).
Este necesar echipament standard de laborator, în special următoarele:
— instrumente de analiză cum sunt: cromatografie în fază gazoasă sau lichidă (GLC), cromatografie în fază lichidă de înaltă performanță (HPLC), echipament TLC, inclusiv sisteme adecvate pentru analiza substanțelor marcate radioactiv și a substanțelor nemarcate sau metoda diluției izotopice inverse;
— instrumente de identificare (de exemplu MS, GC-MS, HPLC-MS, RMN etc.);
— contor de scintilație lichid;
— aparat de oxidare pentru combustia materialului radioactiv;
— centrifugă;
— aparat de extracție (de exemplu tuburi de centrifugare pentru extracția la rece și aparat Soxhlet pentru extracția continuă sub reflux);
— instrumente pentru concentrarea soluțiilor și a extractelor (evaporator rotativ);
— baie de aburi;
— dispozitiv mecanic de amestecare (de exemplu malaxor, amestecător rotativ).
Printre reactivii chimici utilizați se numără, de exemplu:
— NaOH, puritate analitică, 2 moli· dm–3, sau altă bază adecvată (de exemplu KOH, etanolamină);
— H2SO4, puritate analitică, 0,05 moli· dm–3,
— etilen glicol, puritate analitică;
— materiale de absorbție solide, de exemplu var sodat sau tampoane poliuretanice;
— solvenți organici, puritate analitică, cum sunt acetona, metanolul etc.;
— lichid de scintilație.
1.8.2. Aplicarea substanței de testat
Substanța de testat se poate dizolva în apă (deionizată sau distilată) în vederea încorporării sau a distribuirii în sol, sau, dacă este necesar, se poate dizolva într-o cantitate minimă de acetonă sau de alți solvenți organici (6) dacă este suficient de solubilă și de stabilă. Cu toate acestea, cantitatea de solvent selectată nu trebuie să aibă o influență semnificativă asupra activității microbiene din sol (a se vedea punctele 1.5 și 1.9.2-1.9.3). Trebuie evitată utilizarea unor solvenți care inhibă activitatea microbiană cum sunt cloroformul, diclormetanul și alți solvenți halogenați.
Substanța de testat se poate adăuga și sub formă solidă, amestecată cu nisip cuarțos (6) sau într-o subprobă de sol uscat cu aer și sterilizată de mici dimensiuni. Dacă substanța de testat se adaugă cu ajutorul unui solvent, acesta se lasă să se evaporeze înainte ca subproba tratată să fie adăugată în proba inițială de sol nesterilă.
În cazul substanțelor chimice obișnuite, pentru care principala cale de pătrundere în sol este prin nămolul de epurare sau prin tratamente agricole, se începe prin adăugarea substanței de testat în nămol, care se introduce apoi în proba de sol (a se vedea punctele 1.9.2 și 1.9.3)
Nu se recomandă utilizarea de materiale preparate în mod sistematic. Cu toate acestea, de exemplu în cazul substanțelor puțin solubile, utilizarea de materiale preparate poate fi o soluție bună.
1.8.3. Soluri
1.8.3.1. Selectarea solurilor
Pentru determinarea căii de transformare se poate utiliza un sol reprezentativ; se recomandă argila nisipoasă sau lutul nisipos fin sau argila sau nisipul lutos [conform clasificării FAO și USDA (18)] cu un pH de 5,5-8,0, cu conținut de carbon organic de 0,5-2,5 % și cu o biomasă microbiană de cel puțin 1 % din carbonul organic total (10).
Pentru studiile privind ratele de transformare se folosesc cel puțin trei soluri suplimentare reprezentative pentru gama de soluri în cauză. Solurile trebuie să aibă pH-uri, conținuturi de argilă și biomase microbiene diferite (10).
Toate solurile se clasifică, cel puțin din punctul de vedere al texturii (% nisip, % aluviuni, % argilă) [conform clasificării FAO și USDA (18)], al pH-ului, al capacității de schimb de cationi, al densității aparente, al caracteristicilor de reținere a apei ( 36 ) și al biomasei microbiene (numai pentru studiile aerobe). Pentru interpretarea rezultatelor pot fi utile informații suplimentare privind proprietățile solului. Pentru determinarea caracteristicilor solului se pot utiliza metodele recomandate la referințe (19) (20) (21) (22) (23). Masa microbiană se determină prin metoda respirației induse de substrat (SIR) (25) (26) sau prin metode alternative (20).
1.8.3.2. Prelevarea, manipularea și depozitarea solurilor
Se furnizează informații detaliate privind istoricul locului din care se prelevează solul testat. Aceste informații includ localizarea exactă, acoperirea vegetală, date privind tratamentele cu substanțe chimice, cu îngrășăminte organice și anorganice, adaosurile de material biologic sau alte contaminări. Solurile tratate cu substanța de testat sau cu substanțe cu structură analogă pe parcursul ultimilor patru ani nu se folosesc în studiile de transformare (10) (15).
Solurile utilizate trebuie să fie proaspăt prelevate de pe teren (din orizontul A sau din stratul de 20 cm de la suprafață), și trebuie să aibă un conținut de apă care facilitează cernerea. Pentru alte soluri decât cele de orezărie, se va evita prelevarea de probe în timpul sau imediat după perioadele lungi (> 30 zile) de secetă, de îngheț sau de inundații (14). Probele se transportă astfel încât să se reducă la minimum modificările conținutului de apă din sol și se păstrează la întuneric, asigurându-se circulația liberă a aerului în cea mai mare măsură posibil. În acest sens este în general adecvată o pungă de polietilenă care nu se închide ermetic.
Solul se prelucrează cât mai repede posibil după prelevare. Se scot resturile vegetale, animale și pietrele mari înainte de cernerea solului printr-o sită cu ochiuri de 2 mm care reține pietrele și resturile vegetale și animale de mici dimensiuni. Se va evita uscarea și măcinarea solului înainte de cernere (15).
În timpul iernii, când prelevarea de pe teren este dificilă (sol înghețat sau acoperit cu straturi de zăpadă) probele se pot preleva dintr-un lot de sol depozitat într-o seră cu acoperire vegetală (de exemplu un amestec de iarbă și trifoi). Sunt preferate în mod evident studiile efectuate pe sol proaspăt prelevat, dar dacă solul prelevat și prelucrat trebuie depozitat înainte de inițierea studiului, condițiile de depozitare trebuie să fie adecvate iar depozitarea să se realizeze pe parcursul unei perioade limitate (4 ± 2 oC timp de maximum trei luni) pentru menținerea activității microbiene ( 37 ). Referințele 8, 10, 15, 26 și 27) conțin instrucțiuni detaliate privind prelevarea, manipularea și depozitarea solurilor utilizate în cadrul experimentelor de biotransformare.
Înainte de a fi utilizat în cadrul acestui test, solul tratat se preincubează pentru a permite germinarea și eliminarea semințelor și restabilirea echilibrului metabolismului microbian după trecerea de la condițiile de prelevare sau de depozitare la condițiile de incubare. În general este adecvat să se prevadă o perioadă de preincubare de 2 până la 28 de zile, aproximativ în condițiile de temperatură și de umiditate din cadrul testului real (15). În general durata de depozitare și de preincubare însumate nu trebuie să depășească trei luni.
1.9. DESFĂȘURAREA TESTULUI
1.9.1. Condiții de testare
1.9.1.1 Temperatura de testare
Pe parcursul întregii perioade de testare, solurile se incubează la întuneric, la o temperatură constantă reprezentativă pentru condițiile climatice în care va fi utilizată sau eliberată substanța. Pentru toate substanțele testate care ajung în sol în climat temperat se recomandă o temperatură de 20 ± 2 oC. Temperatura se monitorizează.
În cazul substanțelor aplicate sau eliberate într-un climat mai rece (de exemplu în țările nordice, în perioade de toamnă/iarnă), se incubează probe suplimentare de sol la o temperatură mai mică (de exemplu 10 ± 2 oC).
1.9.1.2 Conținutul de umiditate
Pentru testele de transformare în mediu aerob, conținutul de umiditate al solului ( 38 ) se ajustează și se menține la un pF cuprins între 2,0 și 2,5 (3). Conținutul de umiditate al solului se exprimă ca masă de apă pe masă de sol uscat și se controlează în mod regulat (de exemplu la intervale de 2 săptămâni) prin cântărirea balonului de incubare, iar pierderile de apă se compensează prin adăugarea de apă (de preferință apă de la robinet sterilizată prin filtrare). Pierderile de substanță de testat și/sau de produși de transformare prin volatilizare și/sau fotodegradare (dacă este cazul) produse când se adaugă apă se vor evita sau se vor reduce la minimum.
Pentru testele de transformare în condiții aerobe și de orezărie solul se saturează cu apă prin inundare.
1.9.1.3 Condiții aerobe de incubare
În sistemele cu circulație continuă condițiile aerobe se mențin prin spălare intermitentă sau ventilare cu aer umezit. În baloanele de tip biometric, schimbul de aer se realizează prin difuziune.
1.9.1.4 Condiții aerobe sterile
Pentru obținerea de informații privind importanța transformării abiotice a unei substanțe de testat probele de sol pot fi sterilizate (pentru metode de sterilizare a se vedea referințele 16 și 29), tratate cu o substanță de testat sterilă (de exemplu prin adăugarea de soluție printr-un filtru steril) și aerate cu aer steril umed după cum se arată la punctul 1.9.1.3. În cazul solurilor de orezărie, solul și apa se sterilizează, iar incubarea se efectuează după cum se arată în punctul 1.9.1.6.
1.9.1.5. Condiții anaerobe de incubare
Pentru crearea și menținerea condițiilor anaerobe, solul tratat cu substanța de testat și incubat în condiții aerobe timp de 30 de zile sau pe parcursul unei perioade egale cu timpul de înjumătățire sau cu DT50 (aceea dintre ele care este mai scurtă) se acoperă apoi cu apă (strat de apă de 1-3 cm), iar sistemul de incubare se clătește cu un gaz inert (de exemplu azot sau argon) ( 39 ). Sistemul de testare trebuie să permită măsurarea pH-ului, a concentrației de oxigen și a potențialului redox și să conțină dispozitive de captare a produșilor volatili. Sistemul de tip biometric trebuie să fie închis pentru a evita orice intrare a aerului prin difuziune.
1.9.1.6. Condiții de incubare în solurile de orezărie
Pentru studierea transformării în solurile de orezărie, solul se inundă cu un strat de apă de 1-5 cm iar substanța de testat se introduce în faza apoasă (9). Se recomandă ca adâncimea stratului de sol să fie de cel puțin 5 cm. Sistemul se ventilează cu aer ca și în condiții aerobe. Se supraveghează și se înregistrează pH-ul, concentrația de oxigen și potențialul redox al stratului de apă. Înainte de începerea studiilor de transformare este necesară o perioadă de preincubare de cel puțin două săptămâni (a se vedea punctul 1.8.3.2).
1.9.1.7. Durata testului
În general, studiile privind rata și căile de transformare nu trebuie să depășească 120 de zile ( 40 ) (3) (6) (8), deoarece după acest termen sistemele artificiale de laborator în care nu se produce o reconstituire naturală sunt afectate în timp de o scădere a activității microbiene din sol. Dacă este necesară o caracterizare a epuizării substanței de testat și a formării și epuizării principalilor produși de transformare, studiile pot fi continuate pe parcursul unor perioade mai lungi (de exemplu între 6 și 12 luni) (8). Dacă se folosesc perioade de incubație mai lungi, acestea trebuie justificate în raportul de testare și trebuie menționate măsurătorile biomasei efectuate în timpul și la sfârșitul acestor perioade.
1.9.2. Efectuarea testului
Se introduc 50-200 g de sol (greutate uscată) în fiecare balon de incubare (a se vedea figurile 1 și 2 din apendicele 3) și se tratează cu substanța de testat cu ajutorul uneia dintre metodele descrise în punctul 1.8.2. Dacă pentru aplicarea substanței de testat se folosesc solvenți organici, aceștia se elimină din sol prin evaporare. În continuare, solul se mestecă bine cu o spatulă și/sau prin agitarea balonului. Dacă studiul se desfășoară în condiții de orezărie, solul și apa se amestecă bine după aplicarea substanței de testat. Se analizează substanța de testat prezentă în părți alicote mici (de exemplu 1 g) din solurile tratate pentru a verifica dacă repartizarea este uniformă. În continuare este prezentată o metodă alternativă.
Tratamentul aplicat trebuie să corespundă celei mai mari rate de aplicare a produsului fitosanitar recomandate în instrucțiunile de utilizare și să poată fi încorporat uniform și la o adâncime adecvată în sol de exemplu în stratul ( 41 ) format de primii 10 cm de la suprafața solului. De exemplu, pentru substanțele chimice aplicate pe frunze sau pe sol care nu sunt încorporate în sol, adâncimea adecvată pentru calcularea cantității de substanță chimică de adăugat în fiecare balon este de 2,5 cm. Pentru substanțele chimice încorporate în sol, adâncimea adecvată este adâncimea de încorporare menționată în instrucțiunile de utilizare. Pentru substanțele chimice obișnuite, doza aplicată se estimează având în vedere cea mai relevantă cale de intrare; de exemplu, dacă cea mai relevantă cale de intrare în sol este prin nămoluri de epurare, substanța chimică se dozează în nămol într-o concentrație egală cu concentrația anticipată din nămol, iar cantitatea de nămol adăugată în sol trebuie să fi egală cu cantitatea de nămol adăugată în mod obișnuit în solurile agricole. Dacă această concentrație nu este suficient de ridicată pentru identificarea principalilor produși de transformare, este utilă incubarea unor probe de sol separate care conțin rate mai mari de substanță, dar trebuie evitate ratele excesive care influențează funcțiile microbiene ale solului (a se vedea punctele 1.5 și 1.8.2).
Ca alternativă, se poate trata un lot mai mare de sol (1-2 kg) cu substanța de testat, amestecându-se bine într-un malaxor adecvat, și se transferă părți mici de 50-200 g în baloane de incubare (de exemplu cu ajutorul unor repartitoare de probe). Se analizează părți alicote mici (de exemplu de 1 g) din lotul de sol tratat pentru a verifica dacă repartizarea substanței de testat este uniformă. Această procedură este preferabilă, deoarece permite o repartizare mai uniformă a substanței de testat în sol.
Se incubează și probe de sol netratate în aceleași condiții (aerobe) ca și probele tratate cu substanța de testat. Aceste probe se utilizează pentru măsurarea biomasei pe parcursul studiilor și la finalul acestora.
Dacă substanța de testat se aplică pe sol dizolvată în unul sau mai mulți solvenți organici, se incubează probe de sol tratate cu aceeași cantitate de solvent sau solvenți în aceleași condiții (aerobe) ca și probele tratate cu substanța de testat. Aceste probe se folosesc pentru măsurarea biomasei la începutul, în timpul și la finalul studiilor pentru a se verifica efectele solventului sau solvenților asupra biomasei microbiene.
Baloanele care conțin sol tratat se conectează la un sistem cu circulație continuă de tipul celui descris în figura 1 sau se închid cu o coloană de absorbție de tipul celei prezentate în figura 2 (a se vedea apendicele 3).
1.9.3. Prelevare de probe și măsurători
Se scot baloane de incubare duplicat la intervale adecvate și se extrag probele de sol cu ajutorul unor solvenți adecvați cu polaritate diferită și se analizează în vederea măsurării substanței de testat și/sau a produșilor de transformare. Un studiu bine proiectat include suficiente baloane pentru ca două dintre acestea să poată fi sacrificate la fiecare prelevare. De asemenea, se scot soluții de absorbție sau materiale solide de absorbție la diferite intervale de timp (la intervale de 7 zile în prima lună, iar apoi la intervale de 17 zile) pe parcursul și la sfârșitul perioadei de incubare a fiecărei probe de sol și se analizează produșii volatili. De altfel, pe lângă proba de sol prelevată direct după aplicare (proba din ziua 0) trebuie să mai existe cel puțin 5 puncte suplimentare de prelevare. Intervalele de timp se aleg astfel încât să se poată determina modelul de epuizare pentru substanța de testat și modelele de formare și de epuizare a produșilor de transformare (de exemplu zilele 0, 1, 3, 7; 2, 3 săptămâni; 1, 2, 3 luni etc.).
Dacă substanța de testat este marcată cu 14C, radioactivitatea neextractibilă se cuantifică prin combustie și se calculează un bilanț masic pentru fiecare interval de prelevare.
În cazul incubării anaerobe sau în mediu de orezărie, faza de sol și faza apoasă se analizează împreună în vederea măsurării substanței de testat, iar produșii de transformare se separă prin filtrare sau centrifugare înainte de extracție și de analizare.
1.9.4. Teste facultative
Studiile aerobe nesterile la alte temperaturi și umidități ale solului pot fi utile pentru estimarea influenței temperaturii și umidității solului asupra ratelor de transformare a unei substanțe de testat și/sau a produșilor de transformare ai acesteia din sol.
Se poate încerca realizarea unei caracterizări suplimentare a radioactivității neextractibilă utilizându-se, de exemplu, extracția cu un lichid supercritic.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Cantitățile de substanță de testat, de produși de transformare, de substanțe volatile (exprimate numai în %) și de produși neextractibili se exprimă ca % din concentrația inițială aplicată și, dacă este cazul, ca mg· kg–1 de sol (ca greutate uscată a solului) pentru fiecare interval de prelevare. Se furnizează și un bilanț masic exprimat ca procent din concentrația aplicată inițial pentru fiecare interval de prelevare. Reprezentarea grafică a concentrațiilor substanței de testat în funcție de timp permite estimarea timpului de înjumătățire al transformării sau DT50. Se identifică principalii produși de transformare, iar concentrațiile acestora se reprezintă în funcție de timp astfel încât să fie ilustrate ratele de formare și de epuizare ale acestora. Este produs principal de transformare orice produs care reprezintă > 10 % din doza aplicată în orice moment de pe parcursul studiului.
Produsele volatile captate oferă indicații privind potențialul volatil al substanței de testat și produșii de transformare ai acesteia din sol.
Timpul de înjumătățire sau valorile DT50 și, dacă este cazul, valorile DT75 și DT90 se pot determina cu mai multă precizie utilizându-se metode de calcul bazate pe modele cinetice adecvate. Durata timpului de înjumătățire și valorile DT50 sunt incluse în raport, împreună cu o descriere a modelului cinetic utilizat, cu ordinul cineticii și cu coeficientul de determinare (r2. Este preferabilă cinetica de prim ordin, cu excepția cazurilor în care r2 < 0,7. Dacă este cazul, calculele se aplică și principalilor produși de transformare. Referințele 31-35 conțin exemple de modele adecvate.
În cazul studiilor privind ratele de transformare realizate la diferite temperaturi, acestea sunt descrise în funcție de temperatură în cadrul intervalului experimental de temperatură cu ajutorul relației lui Arrhenius:
![]()
sau
![]()
unde ln A și B sunt constantele de regresie, respectiv segmentul și panta dreptei de interpolare determinate de regresia liniară a ln k față de 1/T, unde k este constanta de viteză la temperatura T, iar T este temperatura în grade Kelvin. Dacă transformarea depinde de activitatea microbiană, trebuie acordată o atenție specială intervalului limitat de temperaturi în care se aplică relația Arrhenius.
2.2. EVALUAREA ȘI INTERPRETAREA REZULTATELOR
Deși studiile se realizează într-un sistem artificial de laborator, rezultatele permit estimarea ratei de transformare a substanței de testat, precum și rata de formare și de epuizare a produșilor de transformare în condiții de teren (36) (37).
Studiile asupra căilor de transformare a unei substanțe de testat oferă informații privind modul în care structura substanței aplicate se modifică în sol prin reacții chimice și microbiene.
3. RAPORT
RAPORT DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Substanța de testat:
— denumirea comună, denumirea chimică, numărul CAS, formula structurală [indicându-se poziția marcajului (marcajelor) radioactiv(e) dacă se folosește material marcat radioactiv] și proprietățile fizice și chimice relevante (a se vedea punctul 1.5);
— puritatea (impuritățile) substanței de testat;
— puritatea radiochimică a substanței chimice marcate și activitatea specifică (dacă este cazul).
Substanțe de referință:
— denumirea chimică și structura substanțelor de referință utilizate pentru caracterizarea și/sau identificarea produșilor de transformare.
Solurile de testare:
— detalii privind locul de colectare;
— data și procedura de prelevare a solului;
— proprietățile solului cum sunt pH-ul, conținutul de carbon organic, textura ( % nisip, % aluviuni, % argilă), capacitatea de schimb de cationi, densitatea aparentă, caracteristicile de reținere a apei și biomasa microbiană;
— durata depozitării solului și condițiile de depozitare (dacă este depozitat).
Condiții de testare:
— datele la care au fost realizate studiile;
— cantitatea de substanță de testat aplicată;
— solvenții utilizați și metoda de aplicare a substanței de testat;
— greutatea solului tratat inițial și prelevat la fiecare interval în vederea analizei;
— descrierea sistemului de incubare utilizat;
— debitul de aer (numai pentru sistemele cu circulație continuă);
— temperatura la începutul experimentului;
— conținutul de umiditate din sol pe parcursul incubării;
— biomasa microbiană inițială, de pe parcursul derulării și de la sfârșitul studiilor aerobe și în condiții de orezărie;
— pH-ul, concentrația de oxigen și potențialul redox inițiale, de pe parcursul derulării și de la sfârșitul studiilor aerobe și în condiții de orezărie;
— metoda (metodele) de extracție;
— metodele de identificare și de cuantificare a substanței de testat și principalii produși de transformare din sol și materialele de absorbție;
— numărul de duplicate și de probe martor.
Rezultate:
— rezultatul determinării activității microbiene;
— repetabilitatea și sensibilitatea metodelor analitice utilizate;
— ratele de recuperare (procentele acceptabile pentru ca un studiu să fie considerat valabil sunt prezentate la punctul 1.7.1);
— tabelul rezultatelor exprimate ca % din doza inițială aplicată și, dacă este cazul, în mg· kg–1 de sol (greutate uscată);
— bilanțul masic de pe parcursul și de la începutul studiilor;
— cuantificarea CO2 degajat și a altor compuși volatili;
— grafice ale concentrațiilor substanței de testat din sol în funcție de timp și, dacă este cazul, grafice pentru produșii importanți de transformare;
— timpul de înjumătățire sau DT50, DT75 și DT90 pentru substanța de testat și, dacă este cazul, pentru produșii principali de transformare, inclusiv pragurile de încredere;
— estimarea ratei de degradare abiotică în condiții sterile;
— o evaluare a cineticii de transformare a substanței de testat și, dacă este cazul, a principalilor produși de transformare;
— căile de transformare propuse, dacă este cazul;
— discutarea și interpretarea rezultatelor;
— date brute (de exemplu cromatogramele probelor, calculele privind viteza de transformare a probelor și mijloacele utilizate pentru identificarea produșilor de transformare).
4. REFERINȚE BIBLIOGRAFICE
1. US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
2. Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada.
3. Uniunea Europeană (UE) (1995). Directiva 95/36/CE din 14 iulie 1995 de modificare a Directivei 91/414/CEE a Consiliului privind introducerea pe piață a produselor fitosanitare, anexa II partea A și anexa III partea A: Transformarea și comportamentul în mediu.
4. Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
5. BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden – Abbau, Umwandlung und Metabolismus.
6. ISO/DIS 11266-1 (1994). Soil Quality -Guidance on laboratory tests for biodegradation of organic chemicals in soil – Part 1: Aerobic conditions.
7. ISO 14239 (1997). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
8. SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
9. MAFF – Japan 2000 – Draft Guidelines for transformation studies of pesticides in soil – Aerobic metabolism study in soil under paddy field conditions (flooded).
10. OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
11. Guth, J. A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157.
12. DFG: Pesticide Bound Residues in Soil. Wiley – VCH (1998).
13. T. R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
14. OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981)
15. ISO 10381-6 (1993). Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
16. Anexa V la Directiva 67/548/CEE.
17. Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, p. 85-114.
18. Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
19. Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition.
20. Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition.
21. ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
22. Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
23. Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
24. Anderson, J. P. E., Domsch, K.H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, p. 215-221.
25. ISO 14240-1 and 2 (1997). Soil Quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method.
26. Anderson, J. P. E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, p. 45-60.
27. Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and bio-transformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticides, p. 105-120.
28. Keuken O., Anderson J. P. E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, p. 59-63 (SETAC-Europe).
29. Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, p. 68-69 (SETAC-Europe).
30. Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, p. 197-200.
31. Anderson, J. P. E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, p. 141-146.
32. Hamaker, J. W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, p. 181-199.
33. Goring, C. A. I., Laskowski, D.A., Hamaker, J.W., Meikle, R. W. (1975). Principles of pesticide degradation in soil. In „Environmental Dynamics of Pesticides”. R. Haque and V. H. Freed, Eds., p. 135-172.
34. Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz – Nachrichten Bayer 39, p. 188-204.
35. Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz – Nachrichten Bayer 33, p. 47-60.
36. Gustafson D. I., Holden L. R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, p. 1032-1041.
37. Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, p. 83-122.
Apendicele 1
SUCȚIUNEA, CAPACITATEA CÂMPULUI (FC) ȘI CAPACITATEA DE REȚINERE A APEI (WRC) ( 42 )
|
Înălțimea coloanei de apă [cm] |
pF () |
Bari () |
Observații |
||
|
107 |
7 |
104 |
Sol uscat |
||
|
1,6 · 104 |
4,2 |
16 |
Punct de ofilire |
||
|
104 |
4 |
10 |
|||
|
103 |
3 |
1 |
|||
|
6· 102 |
2,8 |
0,6 |
|||
|
3,3 · 102 |
2,5 |
0,33 () |
|
||
|
102 |
2 |
0,1 |
|||
|
60 |
1,8 |
0,06 |
|||
|
33 |
1,5 |
0,033 |
|||
|
10 |
1 |
0,01 |
Capacitate de reținere a apei (aproximativă) |
||
|
1 |
0 |
0,001 |
Sol saturat de apă |
||
|
(1) pF = log din valoarea coloanei de apă exprimate în cm. (2) 1 bar = 105 Pa. (3) Corespunde unui conținut aproximativ de apă de 10 % în nisip, de 35 % în aluviuni și de 45 % în argilă. (4) Capacitatea câmpului nu este constantă, ci variază în funcție de tipul de sol de la pF 1,5 la 2,5. |
|||||
Sucțiunea se măsoară în cm coloană de apă sau în bari. Deoarece intervalul valorilor sucțiunii este foarte mare, se exprimă simplu ca valoare pF, adică echivalentul logaritmului din valoarea coloanei de apă exprimată în cm.
Capacitatea câmpului se definește ca fiind cantitatea de apă care poate fi stocată, având în vedere gravitația, de un sol natural după 2 zile de la încheierea unei perioade lungi de ploaie sau după ce a fost irigat suficient. Se determină în sol nederanjat, in situ, pe câmp. Această măsurătoare nu se poate realiza pe probe de sol de laborator deranjat. Valorile FC determinate pentru soluri deranjate pot prezenta variații sistematice considerabile.
Capacitatea de reținere a apei (WHC) se determină în laborator pe soluri deranjate și nederanjate prin saturarea unei coloane de sol cu apă prin transport capilar. Este extrem de utilă pentru solurile deranjate și poate fi cu până la 30 % mai mare decât capacitatea câmpului (1). Se determină experimental mai ușor decât se determină valori FC fiabile.
vide
Apendicele 2
Conținutul de umiditate (g de apă în 100 g sol uscat) al diferitelor tipuri de sol din diferite țări
|
Conținut de umiditate la |
||||
|
Tip de sol |
Țara |
|||
|
WHC (1) |
pF = 1,8 |
pF = 2,5 |
||
|
Nisip |
Germania |
28,7 |
8,8 |
3,9 |
|
Nisip lutos |
Germania |
50,4 |
17,9 |
12,1 |
|
Nisip lutos |
Elveția |
44,0 |
35,3 |
9,2 |
|
Lut nisipos fin |
Elveția |
72,8 |
56,6 |
28,4 |
|
Argilă lutoasă |
Brazilia |
69,7 |
38,4 |
27,3 |
|
Argilă lutoasă |
Japonia |
74,4 |
57,8 |
31,4 |
|
Argilă nisipoasă |
Japonia |
82,4 |
59,2 |
36,0 |
|
Lut nisipos fin |
Statele Unite |
47,2 |
33,2 |
18,8 |
|
Argilă nisipoasă |
Statele Unite |
40,4 |
25,2 |
13,3 |
|
(1) Capacitate de reținere a apei. |
||||
Apendicele 3
Figura 1
Exemplu de aparat cu circulație continuă pentru studiul transformării substanțelor chimice în sol ( 43 ) ( 44 )
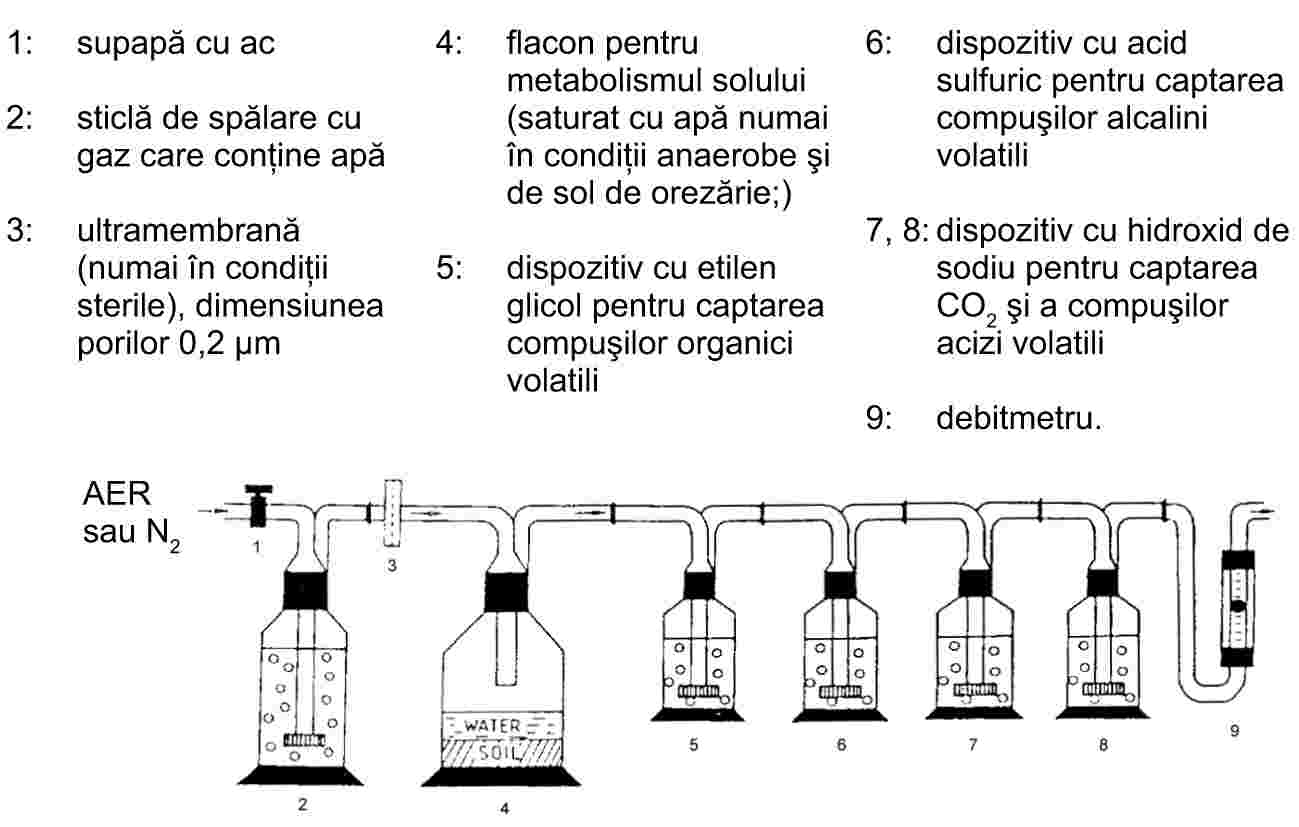
Figura 2
Exemplu de balon de tip biometric pentru studiul transformării substanțelor chimice în sol ( 45 )

C.24. TRANSFORMĂRI AEROBE ȘI ANAEROBE ÎN SISTEMELE DE SEDIMENTE ACVATICE
1. METODĂ
Această metodă de testare reia Orientarea 308 (2002) a OCDE.
1.1. INTRODUCERE
Substanțele chimice pot intra în apele de suprafață puțin adânci sau foarte adânci pe căi cum sunt aplicarea directă, pierderile la vaporizare, scurgerile, drenarea, eliminarea deșeurilor, efluenții industriali, menajeri sau agricoli și depunerile atmosferice. Această metodă de testare reia o metodă de laborator elaborată pentru măsurarea transformărilor aerobe și anaerobe ale substanțelor chimice din sedimentele acvatice. Se bazează pe liniile directoare existente (1) (2) (3) (4) (5) (6). Numărul și tipul sedimentelor utilizate în cadrul acestui test au fost definite cu ocazia unui atelier de lucru al OCDE privind selectarea solului/sedimentelor care a avut loc la Belgirate, Italia, în 1995 (7). În cadrul atelierului de lucru au fost de asemenea formulate recomandări privind prelevarea, manipularea și depozitarea probelor de sedimente bazate pe liniile directoare ISO (8). Aceste studii sunt necesare pentru substanțele chimice introduse direct în apă sau care ar putea ajunge în mediul acvatic pe căile descrise anterior.
Faza apoasă superioară a sistemelor naturale de sedimente acvatice asigură de obicei condiții aerobe. Stratul de sediment de la suprafață poate fi atât aerob, cât și anaerob, dar în adâncime sedimentele sunt în general anaerobe. Pentru a reflecta toate aceste posibilități, prezentul document descrie atât teste aerobe, cât și teste anaerobe. Testul aerob constă din simularea unei coloane aerobe de apă peste un strat aerob de sediment și un substrat cu gradient anaerob. Testul anaerob simulează un sistem apă-sediment complet anaerob. Dacă situația impune devieri semnificative de la aceste recomandări, de exemplu prin utilizarea de carote de sediment intact sau de sedimente care este posibil să fi fost expuse la substanța de testat, pot fi utilizate alte metode (9).
1.2. DEFINIȚII
Se folosesc întotdeauna unitățile standard internaționale (SI).
Substanță de testat: orice substanță, indiferent dacă este vorba despre substanța mamă sau despre produșii de transformare relevanți.
Produși de transformare: toate substanțele rezultate din reacțiile biotice sau abiotice de transformare a substanței de testat, în special CO2 și reziduurile legate.
Reziduuri legate:„reziduurile legate” sunt compuși vegetali sau animali din sol, care persistă în matrice după extracție sub forma substanței mamă sau a metabolitului (metaboliților) acesteia. Metoda de extracție nu trebuie să modifice considerabil compușii înșiși sau structura matricei. Natura legăturii poate fi determinată parțial prin metode de extracție care modifică matricea și prin tehnici analitice complexe. Până în prezent a fost identificată în acest mod natura legăturilor covalente, ionice, de sorbție și de captare. În general, formarea reziduurilor legate reduce bioaccesibilitatea și biodisponibilitatea în mod considerabil (10) [modificare IUPAC 1984 (11)].
Transformare aerobă: (oxidare): reacție care se produce în prezența oxigenului molecular (12).
Transformare anaerobă: (reducere): reacție care se produce în absența oxigenului molecular (12).
Ape naturale: sunt apele de suprafață obținute din lacuri, râuri, fluvii etc.
Sediment: este un amestec de constituenți chimici minerali și organici, aceștia din urmă conținând compuși cu un conținut ridicat de carbon și azot și cu masă moleculară mare. Este depus de apele naturale și formează interfața cu acestea.
Mineralizare: este degradarea completă a unui compus organic în CO2 și H2O în condiții aerobe și în CH4, CO2 și H2O în condiții anaerobe. În cadrul prezentei metode de test, dacă se folosește un compus marcat radioactiv, mineralizare înseamnă o degradare considerabilă pe parcursul căreia un atom de carbon marcat este oxidat sau redus cantitativ, degajându-se o cantitate adecvată de 14CO2 sau respectiv de 14CH4.
Timp de înjumătățire: t0,5 este timpul necesar pentru transformarea a 50 % dintr-o substanță de testat în cazul transformărilor care pot fi descrise printr-o cinetică de prim ordin; nu depinde de concentrația inițială.
DT 50 (timp de degradare 50): este timpul în care concentrația inițială a substanței de testat se reduce cu 50 %.
DT 75 (timp de degradare 75): este timpul în care concentrația inițială a substanței de testat se reduce cu 75 %.
DT 90 (timp de degradare 90): este timpul în care concentrația inițială a substanței de testat se reduce cu 90 %.
1.3. SUBSTANȚE DE REFERINȚĂ
Pentru identificarea și cuantificarea produșilor prin metode spectroscopice și cromatografice se folosesc substanțe de referință.
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTAT
Pentru măsurarea ratei de transformare se poate utiliza o substanță de testat marcată sau nemarcată, deși este preferabil materialul marcat. Materialul marcat este necesar pentru studierea căilor de transformare și pentru stabilirea bilanțului masic. Se recomandă marcarea cu 14C dar poate fi utilă și utilizarea altor izotopi cum sunt 13C, 15N, 3H, 32P. În măsura în care este posibil, marcajul se amplasează în partea sau părțile cele mai stabile ale moleculei ( 46 ). Puritatea chimică și/sau radiochimică a substanței de testat trebuie să fie de cel puțin 95 %.
Înainte de efectuarea unui test sunt necesare următoarele informații privind substanța de testat:
(a) solubilitatea în apă (metoda A.6);
(b) solubilitatea în solvenți organici;
(c) presiunea vaporilor (metoda A.4) și constanta lui Henry;
(d) coeficientul de împărțire n-octanol/apă (metoda A.8);
(e) coeficientul de adsorbție (Kd, Kr sau Koc, dacă este cazul) (metoda C.18);
(f) hidroliza (metoda C.7);
(g) constanta de disociere (pKa) [Orientarea 112 a OCDE] (13).
Notă: Se precizează și temperatura la care au fost efectuate aceste măsurători.
Este posibil să fie utile și informații privind toxicitatea substanței de testat asupra microorganismelor din sol, privind biodegradabilitatea imediată și/sau intrinsecă și date privind transformările aerobe și anaerobe din sol.
Trebuie să fie disponibile metode analitice (inclusiv metode de extracție și de purificare) necesare pentru cuantificarea și identificarea substanței de testat și a produșilor de transformare ai acesteia din apă și din sedimente (a se vedea punctul 1.7.2).
1.5. PRINCIPIUL METODEI DE TESTARE
În cadrul metodei descrise se folosește un sistem de sedimente acvatice aerobe și anaerobe (a se vedea apendicele 1) care permite:
(i) măsurarea ratei de transformare a substanței de testat într-un sistem apă-sediment;
(ii) măsurarea ratei de transformare a substanței de testat într-un sediment;
(iii) măsurarea ratei de mineralizare a substanței de testat și/sau a produșilor săi de transformare (dacă se folosește o substanță de testat marcată cu 14C);
(iv) identificarea și cuantificarea produșilor de transformare din faza apoasă și din faza sedimentară și în special realizarea bilanțului masic (dacă se testează o substanță marcată);
(v) măsurarea modului de repartizare a substanței de testat și a produșilor de transformare ai acesteia între cele două faze pe parcursul unei perioade de incubare la întuneric (pentru a evita, de exemplu, proliferarea algelor) la o temperatură constantă. Timpul de înjumătățire, valorile DT50, DT75 și DT90 se determină dacă datele permit acest lucru, dar nu trebuie extrapolate dincolo de perioada experimentală (a se vedea punctul 1.2).
Pentru studiul aerob și respectiv pentru studiul anaerob sunt necesare cel puțin două sedimente și fazele apoase asociate acestora (7). Cu toate acestea, este posibil ca în unele cazuri să fie necesară utilizarea a mai mult de două sedimente acvatice, de exemplu în cazul substanțelor care pot fi prezente în apă dulce și/sau în mediul marin.
1.6. APLICABILITATEA TESTULUI
Metoda se aplică tuturor substanțelor chimice (nemarcate sau marcate) pentru care se poate utiliza o metodă analitică cu o precizie și o sensibilitate suficientă. Se aplică pentru compușii ușor volatili, nevolatili, solubili sau insolubili în apă. Testul nu se aplică substanțelor chimice puternic volatile în apă (de exemplu fumiganți, solvenți organici) care de aceea nu pot fi menținute în apă și/sau în sedimente în condițiile experimentale din cadrul acestui test.
Metoda a fost utilizată până în prezent pentru studierea transformării substanțelor chimice în ape dulci și în sedimente, dar în principiu poate fi aplicată și sistemelor de estuar/marine. Metoda nu este adecvată pentru simularea condițiilor din ape curgătoare (de exemplu din râuri) sau din largul mării.
1.7. CRITERII DE CALITATE
1.7.1. Recuperare
Extracția și analizarea probelor de apă și de sediment, cel puțin în duplicat, imediat după adăugarea substanței de testat, oferă o primă indicație privind repetabilitatea metodei analitice și uniformitatea procedurii de aplicare a substanței de testat. Ratele de recuperare din etapele ulterioare ale experimentelor sunt furnizate de bilanțurile masice respective (dacă se folosește material marcat). Ratele de recuperare variază între 90 % și 110 % pentru substanțele chimice marcate (6) și între 70 % și 110 % pentru substanțele chimice nemarcate.
1.7.2. Repetabilitatea și sensibilitatea metodei analitice
Repetabilitatea metodei analitice (cu excepția randamentului extracției inițiale) în ceea ce privește cuantificarea substanței de testat și a produșilor de transformare se poate controla prin efectuarea unei analize duplicat pe același extract de apă sau de sediment, incubat suficient timp pentru a se forma produșii de transformare.
Pragul de detecție (LOD) a substanței de testat și a produșilor de transformare din cadrul metodei de analiză trebuie să fie de cel puțin 0,01 mg· kg–1 (substanță de testat) în apă sau în sediment sau de 1 % din doza inițială aplicată, respectiv valoarea mai mică dintre acestea. Se precizează și pragul de cuantificare (LOQ).
1.7.3. Precizia datelor privind transformarea
Analiza de regresie a concentrațiilor substanței de testat în funcție de timp oferă informații adecvate privind fiabilitatea curbei de transformare și permite calcularea pragurilor de încredere pentru timpii de înjumătățire (în cazurile de cinetică de pseudo prim ordin) sau a valorilor DT50 și, dacă este cazul, a valorilor DT75 și DT90.
1.8. DESCRIEREA METODEI DE TESTARE
1.8.1. Sistemul și aparatura de testare
Studiul se realizează în recipiente de sticlă (de exemplu sticle, tuburi de centrifugare), cu excepția cazurilor în care informațiile preliminare (coeficientul de împărțire n-octanol/apă, datele privind sorbția etc.) arată că este posibil ca substanța de testat să adere la sticlă, caz în care se poate lua în considerare utilizarea unui alt material (de exemplu Teflon). Dacă se știe că substanța de testat aderă la sticlă, problema poate fi evitată cu ajutorul uneia sau al mai multora dintre următoarele metode:
— determinarea masei de substanță de testat și/sau de produși de transformare ai acesteia absorbiți pe sticlă;
— spălarea tuturor vaselor de sticlă cu solvent la sfârșitul testului;
— utilizarea unor produse preparate (a se vedea și punctul 1.9.2);
— utilizarea unei cantități mai mari de co-solvent pentru adăugarea substanței de testat în sistem; dacă se folosește un co-solvent, acesta trebuie să nu producă o reacție de solvoliză a substanței de testat.
În apendicele 2 și 3 și în referința 14 sunt prezentate exemple de aparatură de testare tipică (sisteme cu flux continuu și de tip biometru). Alte sisteme utile de incubare sunt descrise la referința 15. Aparatura de experiment trebuie să permită schimbul de aer sau de azot și captarea produșilor volatili. Dimensiunile aparaturii trebuie să permită îndeplinirea cerințelor de testare (a se vedea punctul 1.9.1). Ventilarea se poate realiza fie prin barbotare ușoară, fie prin trecerea de aer sau de azot pe suprafața apei. În al doilea caz se recomandă amestecarea ușoară la suprafața apei pentru obținerea unei mai bune repartizări a oxigenului sau a azotului în apă. Nu se va utiliza aer fără CO2, deoarece acesta poate provoca o creștere a pH-ului apei. În ambele cazuri, deranjarea sedimentului trebuie evitată în cea mai mare măsură posibil. Substanțele chimice puțin volatile se testează într-un sistem de tip biometru prin amestecarea ușoară a apei de la suprafață. Pentru captarea produșilor volatili se pot utiliza, de asemenea, recipiente închise, cu un spațiu liber umplut fie cu aer atmosferic fie cu azot, și fiole interne (16). În cadrul testelor anaerobe este necesar un schimb regulat de gaz la suprafață pentru compensarea consumului de oxigen de către biomasă.
Pentru captarea produșilor volatili de transformare se pot utiliza, dar nu în mod limitativ, următoarele dispozitive: soluții de 1 mol· dm–3 de hidroxid de potasiu sau de hidroxid de sodiu pentru dioxidul de carbon ( 47 ) și etilen glicol, etanolamină sau parafină 2 % în xilen pentru compuși organici. Produșii volatili formați în condiții anaerobe, cum este metanul, se pot recupera, de exemplu cu ajutorul sitelor moleculare. Acești produși volatili se pot arde, de exemplu până la CO2, prin trecerea gazului printr-un tub cu cuarț umplut cu CuO la o temperatură de 900 oC și captarea CO2 format într-o coloană de absorbție conținând produși alcalini (17).
Sunt necesare instrumente de laborator pentru analiza chimică a substanței de testat și a produșilor de transformare [cromatografie în fază gazoasă sau lichidă (GLC), cromatografie în fază lichidă de înaltă performanță (HPLC), cromatografie în strat subțire (TLC), spectroscopie de masă (MS), cromatografie în fază gazoasă cuplată cu spectrometrie de masă (GC-MS), cromatografie în fază lichidă cuplată cu spectrometrie de masă (LC-MS), rezonanță magnetică nucleară (RMN) etc.] precum și, dacă este cazul, dispozitive de detectare a substanțelor chimice marcate radiologic sau nemarcate. Dacă se folosesc substanțe marcate radioactiv, sunt de asemenea necesare un contor de scintilație lichid și un aparat de oxidare pentru combustie (pentru combustia probelor de sediment înainte de analizarea radioactivității).
Pot fi necesare și alte echipamente standard de laborator pentru realizarea analizelor fizico-chimice și biologice (a se vedea tabelul 1 punctul 1.8.2.2), precum și sticlărie, substanțe chimice și reactivi.
1.8.2. Selectarea și numărul de sedimente acvatice
Locurile de prelevare se selectează în funcție de finalitatea testului în fiecare caz în parte. Pentru alegerea locurilor de prelevare trebuie avut în vedere istoricul eventualelor aporturi de natură agricolă, industrială sau menajeră în bazinul de captare și în apele din amonte. Nu se folosesc sedimente contaminate cu substanța de testat sau cu produși cu structură analogă pe parcursul ultimilor 4 ani.
1.8.2.1. Selectarea sedimentelor
Pentru studiile aerobe se folosesc de obicei două sedimente (7). Cele două sedimente selectate trebuie să fie diferite în ceea ce privește textura și conținutul de carbon organic. Un sediment trebuie să aibă un conținut ridicat de carbon organic (2,5-7,5 %) și textură fină, iar celălalt trebuie să aibă un conținut scăzut de carbon organic (0,5-2,5 %) și o textură grosieră. Diferența dintre conținuturile de carbon organic trebuie să fie de cel puțin 2 %. Prin „textură fină” se înțelege un conținut de [argilă + aluviuni] ( 48 ) > 50 %, iar prin „textură grosieră” se înțelege un conținut de [argilă + aluviuni] < 50 %. Diferența dintre conținuturile de [argilă + aluviuni] ale sedimentelor trebuie să fie în mod normal mai mare sau egală cu 20 %. Dacă este posibil ca o substanță chimică să ajungă și în ape marine, cel puțin unul dintre cele două sisteme apă-sediment trebuie să fie de origine marină.
Pentru studiile strict anaerobe se prelevează două probe de sediment (precum și faza apoasă asociată) din zonele anaerobe ale sistemelor de ape de suprafață (7). Sedimentele și fazele apoase se manipulează și se transportă cu atenție, evitându-se orice contact cu oxigenul.
Și alți parametri pot fi importanți pentru selectarea sedimentelor și trebuie avuți în vedere în fiecare caz în parte. De exemplu, pH-ul sedimentelor este important pentru testarea substanțelor chimice a căror transformare și/sau sorbție pot să depindă de pH. Dependența sorbției de pH poate fi provocată de pKa a substanței de testat.
1.8.2.2. Caracteristicile probelor de apă-sediment
Parametrii de importanță cheie care se măsoară și se notează în raport (precizându-se metoda utilizată) pentru apă și sediment, precum și etapa testului în care trebuie determinați sunt prezentate în rezumat în tabelul următor. Referințele (18) (19) (20) (21) conțin informații privind metodele de determinare a acestor parametri.
În plus, trebuie măsurați și înregistrați și alți parametri, după caz [pentru apă dulce: particule, alcalinitate, duritate, conductivitate, NO3/PO4 (raporturi și valori individuale); pentru sedimente: capacitatea de schimb de cationi, capacitatea de reținere a apei, carbonat, azot și fosfor total; pentru sisteme marine: salinitatea]. Și analiza sedimentelor și a apei în vederea identificării nitratului, sulfatului și a fierului biodisponibil precum și a altor primitori de electroni poate fi utilă pentru evaluarea condițiilor redox, în special în ceea ce privește transformările anaerobe.
Măsurarea parametrilor caracteristici probelor apă-sediment (7) (22) (23)
|
Parametru |
Etapele procedurii de testare |
|||||
|
prelevare pe teren |
post-manipulare |
inițierea aclimatizării |
inițierea testului |
pe parcursul testului |
la finalul testului |
|
|
Apă |
||||||
|
Origine/sursă |
x |
|||||
|
Temperatură |
x |
|||||
|
pH |
x |
x |
x |
x |
x |
|
|
COT |
x |
x |
x |
|||
|
Concentrație de O2 (1) |
x |
x |
x |
x |
x |
|
|
Potențial redox (1) |
x |
x |
x |
x |
||
|
Sediment |
||||||
|
Origine/sursă |
x |
|||||
|
Adâncimea stratului |
x |
|||||
|
pH |
x |
x |
x |
x |
x |
|
|
Repartizarea dimensiunii particulelor |
x |
|||||
|
COT |
x |
x |
x |
x |
x |
|
|
Biomasă microbiană (2) |
x |
x |
x |
|||
|
Potențial redox (1) |
Observație (culoare/miros) |
x |
x |
x |
x |
|
|
(1) Conform rezultatelor cercetărilor recente, măsurarea concentrațiilor de oxigen din apă și a potențialului redox nu au nici valoare mecanică, nici valoare predictivă în ceea ce privește creșterea și dezvoltarea coloniilor microbiene în apele de suprafață (24) (25). Determinarea consumului biochimic de oxigen (la prelevare, la începutul și la sfârșitul testului) și a concentrațiilor micro/macro elementelor nutritive Ca, Mg și Mn (la începutul și la sfârșitul testului) în apă și măsurarea N total și P total în sedimente (la prelevare și la sfârșitul testului) pot constitui instrumente mai bune de interpretare și de evaluare a ratelor și a căilor de biotransformare aerobă. (2) Metoda ratei de respirație microbiene (26), metoda fumigării (27) sau măsurători numerice (bacterii, actinomicete, ciuperci și total colonii) pentru studiile aerobe; rata metanogenezei pentru studiile anaerobe. |
||||||
1.8.3. Colectarea, manipularea și depozitarea
1.8.3.1 Colectarea
Pentru prelevarea de probe de sediment se folosește proiectul de linie directoare ISO privind prelevarea sedimentelor de fund (8). Probele de sediment se prelevează din întregul strat superior de 5-10 cm de sediment. Apa asociată se colectează din același loc și în același timp ca și sedimentele. Pentru studiile anaerobe, sedimentele și apa asociată se prelevează și se transportă evitându-se orice contact cu oxigenul (28) (a se vedea punctul 1.8.2.1). Câteva dintre dispozitivele de prelevare sunt descrise în literatură (8) (23).
1.8.3.2 Manipulare
Sedimentul se separă de apă prin filtrare și se trece printr-o sită de 2 mm utilizându-se apa în exces prelevată din același loc, care apoi se elimină. Se amestecă în proporția dorită cantități cunoscute de sedimente și de apă (a se vedea punctul 1.9.1) în flacoane de incubare și se prepară pentru perioada de aclimatizare (a se vedea punctul 1.8.4). În cazul studiului anaerobic, toate etapele de manipulare se efectuează în absența oxigenului (29) (30) (31) (32) (33).
1.8.3.3 Depozitare
Este preferabil ca probele de sediment și apă utilizate să fie proaspăt prelevate de pe teren, dar dacă este necesară depozitarea, sedimentul și apa se cern după cum s-a arătat anterior și se depozitează împreună, sub apă (sub un strat de apă de 6-10 cm), la întuneric, la temperaturi de 4 ± 2 oC timp de maximum 4 săptămâni (7) (8) (23). Probele destinate studiilor aerobe se depozitează astfel încât să beneficieze de un acces nestingherit al aerului (de exemplu în recipiente deschise), iar probele destinate studiilor anaerobe se depozitează în absența oxigenului. Sedimentele și apa nu trebuie să înghețe sau să se usuce în timpul transportului și al depozitării.
1.8.4. Pregătirea probelor de sediment/apă pentru test
Înainte de a se adăuga substanța de testat este necesară o perioadă de aclimatizare, pe parcursul căreia fiecare probă de sediment/apă se introduce în recipientul de incubare utilizat pentru testul principal, iar aclimatizarea se realizează exact în aceleași condiții ca și incubarea din cadrul testului (a se vedea punctul 1.9.1). Perioada de aclimatizare reprezintă timpul necesar pentru atingerea unei stabilități suficiente a sistemului în ceea ce privește pH-ul, concentrația de oxigen în apă, potențialul redox al sedimentului și al apei și separarea macroscopică a fazelor. Perioada de aclimatizare durează de obicei între una și două săptămâni și nu mai mult de patru săptămâni. Rezultatul determinărilor realizate pe parcursul acestei perioade se înregistrează.
1.9. DESFĂȘURAREA TESTULUI
1.9.1. Condiții de testare
Testul se efectuează într-un dispozitiv de incubare (a se vedea punctul 1.8.1) utilizându-se un raport al volumelor de apă și de sediment între 3:1 și 4:1 și un strat de sediment de 2,5 cm (± 0,5 cm) ( 49 ). Se recomandă utilizarea unei cantități de minimum 50 g sediment (greutate uscată) pentru fiecare recipient de incubare.
Testul se realizează la întuneric, la o temperatură constantă din intervalul 10-30 oC. Temperatura recomandată este de (20 ± 2) oC. Dacă este cazul, se pot utiliza temperaturi mai scăzute (de exemplu 10 oC), în funcție de informațiile care trebuie obținute prin test. Temperatura de incubare se controlează și se înregistrează.
1.9.2. Tratarea și aplicarea substanței de testat
Se folosește o singură concentrație a substanței de testat ( 50 ). Pentru produsele fitosanitare aplicate direct în mediul acvatic, se folosește doza maximă indicată în instrucțiunile de utilizare ca rată maximă de aplicare, iar calculele se efectuează având în vedere suprafața de apă din recipientul de test. În toate celelalte cazuri, concentrația care trebuie utilizată se bazează pe estimările privind emisiile din mediu. Concentrația de substanță de testat aplicată trebuie să fie adecvată pentru caracterizarea căii de transformare și a formării și epuizării produșilor de transformare. Este posibil să fie necesară aplicarea unor doze mai mari (de exemplu de 10 ori) în cazurile în care concentrațiile substanței de testat sunt apropiate de limita de detecție la începutul studiului și/sau dacă principalii produși de transformare nu au putut fi detectați cu ușurință la o rată egală cu 10 % din rata de aplicare a substanței de testat. Cu toate acestea, dacă se folosesc concentrații mai mari ale substanței de testat, acestea nu trebuie să aibă un efect advers important asupra activității microbiene din sistemul apă-sediment. Pentru obținerea unei concentrații constante a substanței de testat în recipiente de diferite dimensiuni, poate fi indicată ajustarea cantității de produs aplicat în funcție de adâncimea coloanei de apă din recipient față de adâncimea apei de pe teren (care se presupune a fi de 100 cm, dar se pot utiliza și alte valori). Pentru un exemplu de calcul, a se vedea apendicele 4.
Teoretic, substanța de testat se aplică sub forma unei soluții apoase în faza apoasă a sistemului testat. Dacă nu se poate proceda altfel, se pot utiliza cantități mici de solvenți miscibili în apă (cum sunt acetona sau etanolul) pentru repartizarea și aplicarea substanței de testat, dar aceștia nu trebuie să depășească 1 % v/v și nu trebuie să aibă efecte adverse asupra activității microbiene a sistemului de testare. Soluția apoasă de substanță de testat se prepară cu atenție – pentru a asigura o omogenizare totală se poate efectua o amestecare prealabilă cu ajutorul coloanelor de generator. După adăugarea soluției apoase în sistemul de testare se recomandă amestecarea ușoară a fazei apoase dar deranjând sedimentele cât mai puțin posibil.
În mod obișnuit nu se recomandă utilizarea de produse preparate, deoarece ingredientele preparate pot afecta repartizarea substanței de testat și/sau a produșilor de transformare între faza apoasă și faza sedimentară. Cu toate acestea, în cazul substanțelor puțin solubile în apă, utilizarea de materiale preparate poate constitui o alternativă adecvată.
Numărul de recipiente de incubare depinde de numărul de prelevări (a se vedea punctul 1.9.3). Trebuie prevăzut un număr suficient de sisteme de testare, astfel încât două astfel de sisteme să poată fi sacrificate la fiecare prelevare. Dacă se folosesc unități martor pentru fiecare sistem de sedimente acvatice, acestea nu se tratează cu substanța de testat. Unitățile martor pot fi utilizate pentru determinarea biomasei microbiene din sediment și a carbonului organic total din apă și din sediment la finalul studiului. Două dintre unitățile martor (de exemplu o unitate de martor din fiecare sediment acvatic) pot fi utilizate pentru monitorizarea parametrilor necesari privind sedimentul și apa pe parcursul perioadei de aclimatizare (a se vedea tabelul din punctul 1.8.2.2). Dacă substanța de testat se aplică cu ajutorul unui solvent se adaugă doi martori suplimentari pentru măsurarea efectelor negative asupra activității microbiene din sistemul de testare.
1.9.3. Durata testului și recoltarea probelor
Durata experimentului nu trebuie să depășească în mod normal 100 de zile (6) și trebuie să se desfășoare până la stabilirea căilor de degradare și a profilului de repartizare apă/sediment sau până la disiparea a 90 % din substanța de testat prin transformare și/sau volatilizare. Trebuie efectuate cel puțin șase recoltări (inclusiv timpul zero) și se realizează un studiu facultativ preliminar (a se vedea punctul 1.9.4) pentru stabilirea regimului de recoltare și a duratei testului, cu excepția cazurilor în care sunt disponibile din studii anterioare suficiente date privind substanța de testat. Pentru substanțele hidrofobe poate fi necesară instituirea unor puncte suplimentare de prelevare pe parcursul perioadei inițiale pentru determinarea ratei de repartizare între faza apoasă și faza sedimentară.
La fiecare prelevare, se iau pentru analiză recipiente de incubare (duplicat). Sedimentul și apa care îl acoperă se analizează separat ( 51 ). Se scoate cu atenție apa de la suprafață, evitându-se atingerea sedimentului. Extracția și caracterizarea substanței de testat și a produșilor de transformare se realizează în conformitate cu procedurile analitice adecvate. Se elimină materialele adsorbite pe pereții recipientului de incubare și în tuburile utilizate pentru captarea produșilor volatili.
1.9.4. Testul preliminar opțional
Dacă durata și regimul de prelevare a probelor nu pot fi estimate pe baza altor studii relevante asupra substanței de testat, poate fi adecvată efectuarea unui test preliminar în aceleași condiții ca și cele propuse pentru studiul definitiv. Dacă se efectuează acest test preliminar, se descriu pe scurt condițiile experimentale și rezultatele testului.
1.9.5. Măsurători și analiză
La fiecare prelevare se măsoară și se înregistrează concentrația substanței de testat și produșii de transformare din apă și din sediment (ca procent și concentrație de substanță aplicată). Ca regulă generală, se identifică toți produșii de transformare pentru care se detectează ≥ 10 % din radioactivitatea totală aplicată sistemului apă/sediment, indiferent de prelevare, cu excepția cazurilor în care există justificări rezonabile. Se identifică de asemenea produșii de transformare a căror concentrație crește constant pe durata studiului, chiar și în cazurile în care concentrațiile acestora nu depășesc limitele menționate anterior, deoarece este posibil ca acesta să fie un indiciu asupra persistenței. Procesul verbal trebuie să conțină justificări în acest sens.
Rezultatele privind sistemele de captare a gazelor/produșilor volatili (CO2 și alții, de exemplu compuși organici volatili) se înregistrează la fiecare prelevare. Se înregistrează și ratele de mineralizare. La fiecare prelevare se menționează și reziduurile (legate) care nu pot fi extrase.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
Se calculează bilanțul masic total și recuperarea (a se vedea punctul 1.7.1) radioactivității adăugate pentru fiecare prelevare. Rezultatele se înregistrează ca procent de radioactivitate adăugată. Repartizarea radioactivității între apă și sediment se înregistrează ca procent și concentrație pentru fiecare prelevare.
Se calculează timpii de înjumătățire, valorile DT50 și, dacă este cazul, valorile DT75 și DT90, precum și pragurile de încredere (a se vedea punctul 1.7.3). Se pot obține informații privind rata de disipare a substanței de testat în apă și în sediment cu ajutorul unor instrumente adecvate de evaluare. Acestea merg de la cinetica de pseudo-prim ordin, tehnici empirice de interpolare care folosesc soluții grafice sau numerice până la alte metode de evaluare care folosesc de exemplu modele cu unul sau mai multe compartimente. Literatura de specialitate conține detalii suplimentare în acest sens (35) (36) (37).
Toate abordările prezintă avantaje și inconveniente, iar complexitatea lor variază considerabil. Ipoteza unei cinetici de prim ordin constituie o simplificare excesivă a procesului de degradare și de repartizare dar, dacă se poate utiliza, oferă un termen (constanta vitezei sau timpul de înjumătățire) ușor de înțeles și foarte util pentru modelele de simulare și pentru calcularea concentrațiilor previzibile din mediu. Este posibil ca metodele empirice sau transformările liniare să producă o mai bună interpolare a curbelor și a datelor și să permită astfel o mai bună estimare a timpilor de înjumătățire, a valorilor DT50 și, dacă este cazul, a valorilor DT75 și DT90. Cu toate acestea, utilizarea constantelor derivate este limitată. Modelele cu compartimente pot genera constante utile pentru evaluarea riscurilor care descriu viteza de degradare din diferitele compartimente și repartizarea substanței chimice. Acestea se folosesc în general pentru estimarea constantelor de viteză pentru formarea și transformarea principalilor produși de transformare. Metoda aleasă trebuie justificată în toate cazurile, iar experimentatorul trebuie să demonstreze grafic și/sau statistic calitatea de ajustare.
3. RAPORT
3.1. RAPORT DE TESTARE
Raportul de testare trebuie să conțină următoarele informații:
Substanța de testat:
— denumirea comună, denumirea chimică, numărul CAS, formula structurală (indicându-se poziția marcajului dacă se folosește material marcat radioactiv) și proprietățile fizice și chimice relevante;
— puritatea (impuritățile) substanței de testat;
— puritatea radiochimică a substanței chimice marcate și activitatea molară (dacă este cazul).
Substanțe de referință:
— denumirea chimică și structura substanțelor de referință utilizate pentru caracterizarea și/sau identificarea produșilor de transformare.
Sedimente și apă de testare:
— localizarea și descrierea locului/locurilor din care au fost prelevate sedimentele acvatice și, dacă este posibil, istoricul contaminării;
— orice informații privind recoltarea, depozitarea (dacă este cazul) și aclimatizarea sistemelor apă-sediment;
— caracterizarea probelor apă-sediment în conformitate cu tabelul din punctul 1.8.2.2.
Condiții de testare:
— sistemul de testare utilizat (cu circulație continuă, biometru, mod de ventilare, metodă de amestecare, volum de apă, masă sedimentară, grosime a stratului de apă și a stratului de sediment, dimensiunea recipientelor de testare etc.);
— aplicarea substanței de testat în sistemul de testare: concentrația de testare, numărul de duplicate și martori, modul de aplicare a substanței de testat (de exemplu utilizarea unui solvent, dacă este cazul) etc.;
— temperatura de incubare;
— număr de prelevări;
— metode de extracție, randamente și praguri de detecție și metode analitice;
— metode de caracterizare/identificare a produșilor de transformare;
— devierile de la protocolul de test sau de la condițiile de testare pe parcursul studiului.
Rezultate:
— date brute privind analizele reprezentative (toate datele brute se păstrează în arhivele BPL);
— repetabilitatea și sensibilitatea metodelor analitice utilizate;
— ratele de recuperare (valorile procentuale acceptabile pentru ca un studiu să fie considerat valabil sunt prezentate la punctul 1.7.1);
— tabelul rezultatelor exprimate ca % din doza aplicată și în mg· kg–1 în apă, sedimente și în întregul sistem (numai %) din substanța de testat și, dacă este cazul, din produșii de transformare și din radioactivitatea neextractibilă;
— bilanțul masic de pe parcursul și de la începutul studiilor;
— reprezentări grafice ale transformării fracțiunilor apă/sediment și ale celor din întregul sistem (inclusiv mineralizarea);
— ratele de mineralizare;
— timpul de înjumătățire sau valorile DT50, DT75 și DT90 pentru substanța de testat și, dacă este cazul, pentru produșii principali de transformare, inclusiv pragurile de încredere în apă, sediment și în întregul sistem;
— o evaluare a cineticii de transformare a substanței de testat și, dacă este cazul, a principalilor produși de transformare;
— o cale de transformare propusă, dacă este cazul;
— discutarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany.
2. Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands.
3. MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United-Kingdom.
4. Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) – Anaerobic and aerobic. Canada. p. 35-37.
5. US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism.
6. SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
7. OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995.
8. ISO/DIS 5667-12, (1994). Water quality – Sampling – Part 12: Guidance on sampling of bottom sediments.
9. US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080.
10. DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
11. T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
12. OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
13. OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
14. Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC – Pests and Diseases, 3B-4, p. 149-158.
15. Guth, J. A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D. H. Hutson, T. R. Roberts, Eds.), Vol. 1, p. 85-114. J. Wiley & Sons.
16. Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, p. 631-637.
17. Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, p. 661-667.
18. Black, C. A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison.
19. APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
20. Rowell, D. L. (1994). Soil Science Methods and Applications, Longman.
21. Light, T. S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, p. 1038-1039.
22. SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop „A Meeting of Experts on Guidelines for Static Field Mesocosms Tests”, 3-4 July 1991.
23. SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I. R. Hill, P. Matthiessen and F. Heimbach.
24. Vink, J. P. M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, p. 2858-2868.
25. Vink, J. P. M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, p. 329-338.
26. Anderson, T. H., Domsch, K. H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, p. 97-203.
27. ISO-14240-2. (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
28. Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), p. 13-21.
29. Shelton, D. R. and Tiedje, J. M. (1984). General method for determining anaerobic biodegradation potential. Ap. Environ. Microbiol. 47, p. 850-857.
30. Birch, R. R., Biver, C., Campagna, R., Gledhill, W. E., Pagga, U., Steber, J., Reust, H. and Bontinck, W. J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, p. 1527-1550.
31. Pagga, U. and Beimborn, D. B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, p. 1499-1509.
32. Nuck, B. A. and Federle, T. W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, p. 3597-3603.
33. US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
34. Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, p. 961-968.
35. Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz – Nachrichten Bayer, 39, p.187 – 203.
36. Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz – Nachrichten Bayer, 33, p. 47-60.
37. Carlton, R. R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference – Pest and Diseases, p. 1349-1354.
Apendicele 1
INFORMAȚII PRIVIND SISTEMELE DE TESTARE AEROBE ȘI ANAEROBE
Sistemul aerob de testare
Sistemul aerob de testare descris în prezenta metodă de testare este format dintr-un strat aerob de apă (concentrațiile tipice ale oxigenului variază între 7 și 10 mg· l–1) și dintr-un strat de sediment aerob la suprafață și anaerob sub suprafață [potențialul redox mediu tipic (Eh) din zona anaerobă a sedimentului variază între – 80 și – 90 mV]. În fiecare unitate de incubare se trece aer umed pe suprafața apei pentru a asigura o cantitate suficientă de oxigen în spațiul liber.
Sistemul anaerob de testare
Metoda de test din cadrul sistemului anaerob de testare este practic aceeași cu cea din cadrul sistemului aerob, cu excepția faptului că se trece azot umed pe suprafața apei din fiecare unitate de incubare pentru a crea un spațiu liber cu azot. Sedimentele și apa se consideră anaerobe dacă potențialul redox (Eh) este sub – 100 mV.
În cadrul testului anaerob, evaluarea mineralizării cuprinde măsurarea dioxidului de carbon și a metanului degajat.
Apendicele 2
EXEMPLU DE APARAT CU CIRCULAȚIE CONTINUĂ

Apendicele 3
EXEMPLU DE BIOMETRU

Apendicele 4
EXEMPLU DE CALCULARE A DOZEI APLICATE RECIPIENTULUI DE TESTARE
|
Diametrul intern al cilindrului: |
= 8 cm |
|
Adâncimea coloanei de apă, fără sediment: |
= 12 cm |
|
Suprafață: 3,142 × 42 |
= 50,3 cm2 |
|
Rata de aplicare: 500 g substanță de testat/ha înseamnă 5 μg/cm2 |
|
|
Total în μg: 5 × 50,3 |
= 251,5 μg |
|
Ajustarea cantității pentru o adâncime de 100 cm: 12 × 251,5 ÷ 100 |
= 30,18 μg |
|
Volumul coloanei de apă: 50,3 × 12 |
= 603 ml |
|
Concentrația în apă: 30,18 ÷ 603 |
= 0,050 μg/ml sau μg/l |
C.25. MINERALIZAREA AEROBĂ ÎN APA DE SUPRAFAȚĂ – TEST DE SIMULARE A BIODEGRADĂRII
1. METODĂ
Această metodă este echivalentă cu orientările OECD privind testele nr. 309 (2004)(1)
1.1. INTRODUCERE
Obiectivul acestui test vizează măsurarea în timp a biodegradării unei substanțe de testat la concentrație scăzută în apă aerobă în mod natural și cuantificarea observațiilor sub formă de expresii cinetice. Acest test de simulare este un test de laborator în serie prin metoda agitării flaconului pentru determinarea vitezelor de biodegradare aerobă a substanțelor organice în eșantioane de apă naturală de suprafață (dulce, salmastră sau marină). Se bazează pe ISO/DIS 14592-1 (2) și include, de asemenea, elemente ale metodelor de testare C.23 și C.24 (3)(4). Opțional, dacă perioada de testare este lungă, testarea în loturi se înlocuiește cu testarea semicontinuă, în scopul prevenirii deteriorării mediului de testare. Principalul obiectiv al testului de simulare constă în determinarea mineralizării substanței testate în apă de suprafață, iar mineralizarea constituie baza de exprimare a cineticii degradării. Un obiectiv opțional secundar al testului vizează obținerea de informații privind degradarea primară și formarea produșilor principali de transformare. Identificarea produșilor de transformare și, dacă este posibil, cuantificarea concentrațiilor acestora sunt importante în special pentru substanțe care se mineralizează foarte lent (de exemplu, cu perioade de înjumătățire pentru 14C rezidual total care depășesc 60 de zile). Ca urmare a limitărilor analitice, pentru identificarea și cuantificarea produșilor principali de transformare se folosesc, în mod normal, concentrații mai mari de substanță de testat (> 100 μg/l).
O concentrație scăzută în acest test se referă la o concentrație (de exemplu mai mică de 1 μg/l la 100 μg/l) suficient de scăzută pentru ca cinetica biodegradării rezultate în urma testului să o reflecte pe cea prevăzută pentru mediul ambiant. Comparativ cu masa totală a substraturilor de carbon biodegradabil disponibile în apa naturală folosită pentru testare, substanța testată prezentă în concentrație scăzută va avea rolul de substrat secundar. Aceasta presupune că cinetica anticipată a biodegradării este de prim ordin (cinetică de „non-creștere”), iar substanța testată poate fi degradată prin „cometabolism”. Cinetica de prim ordin presupune că viteza de degradare (mg/l/zi) este proporțională cu concentrația substratului care descrește în timp. În cazul cineticii de prim ordin reale, constanta vitezei specifice de degradare k este independentă de timp și concentrație. Prin urmare, k nu variază apreciabil în cursul experimentului și nu se modifică în funcție de concentrația adăugată între experimente. Prin definiție, constanta vitezei specifice de degradare este egală cu modificarea relativă a concentrației în funcție de timp k = (1/C) · (dC/dt). Deși, în condițiile descrise, se prevede obținerea unei cinetici de prim ordin, se pot manifesta circumstanțe în care este adecvată o cinetică de un tip diferit. Dacă viteza de biotransformare este limitată ca urmare a unor fenomene de transfer de masă, cum ar fi viteza de difuzie, în locul vitezei reacției biologice, pot fi observate abateri de la cinetica de prim ordin. Cu toate acestea, datele pot fi aproape întotdeauna descrise prin cinetică de pseudo-prim ordin, care acceptă o constantă a vitezei dependentă de concentrație.
În scopul facilitării stabilirii planului experimental și interpretării rezultatelor, informațiile despre biodegrabilitatea la concentrații mari a substanței testate (obținute în urma testelor standard de triere), precum și cele privind abiotică, produșii de transformare și proprietățile fizico-chimice relevante trebuie să se cunoască înainte de test. Biodegradabilitatea finală poate fi stabilită ca urmare a folosirii substanțelor de testat marcate cu izotop 14C și determinarea distribuției fazice a 14C la sfârșitul testului. Dacă se folosește substanță de testat nemarcată, biodegradarea finală poate fi estimată doar dacă se testează o concentrație mai mare și se cunosc toți produșii principali de transformare.
1.2. DEFINIȚII
Biodegradare primară: Modificarea (transformarea) structurii unei substanțe chimice sub acțiunea unor microorganisme, având ca rezultat pierderea proprietăților chimice.
Biodegradare funcțională: Modificarea (transformarea) structurii unei substanțe chimice ca urmare a acțiunii unor microorganisme, având ca rezultat pierderea unei anumite proprietăți chimice.
Biodegradare aerobă finală: Descompunerea unei substanțe chimice în dioxid de carbon, apă și săruri minerale ale oricărui alt element prezent sub acțiunea unor microorganisme în prezența oxigenului (mineralizare) și obținerea de biomasă și produși noi de biosinteză microbiană organică.
Mineralizare: Descompunerea unei substanțe chimice sau materii organice în dioxid de carbon, apă și săruri minerale ale oricărui alt element prezent ca urmare a acțiunii unor microorganisme în prezența oxigenului.
Fază de latență: Perioada cuprinsă între începutul unui test și momentul în care se realizează adaptarea microorganismelor care produc degradarea, iar gradul de biodegradare al unei substanțe chimice sau materii organice a crescut la un nivel detectabil (de exemplu 10 % din biodegradarea teoretică maximă sau mai puțin, în funcție de precizia metodei de măsurare).
Nivel maxim de biodegradare: Gradul de biodegradare a unei substanțe chimice sau materii organice într-un test, înregistrat în procente, dincolo de care nu are loc biodegradare în timpul testului.
Substrat primar: Colecție de surse naturale de energie și carbon care asigură creșterea și menținerea biomasei microbiene.
Substrat secundar: Componenta unui substrat prezentă într-o concentrație atât de scăzută, încât, în urma degradării sale, microorganismele competente primesc doar cantități minime de carbon și energie comparativ cu carbonul și energia furnizate prin degradarea componentelor substratului principal (substraturi primare).
Constanta vitezei degradării: Constantă cinetică de prim ordin sau pseudo-prim ordin k (zi–1), indicând viteza procesului de degradare. Pentru un experiment în serie, k se estimează din partea inițială a curbei degradării obținute după încheierea fazei de latență.
Timp de înjumătățire, t1/2 (zi): Termen folosit pentru caracterizarea vitezei unei reacții de prim ordin. Este intervalul de timp care corespunde unei scăderi a concentrației de 2 ori. Timpul de înjumătățire și constanta vitezei de degradare sunt corelate de ecuația t1/2 = ln2/k.
Timp de înjumătățire a degradării, DT50 (zi): Termen utilizat pentru cuantificarea rezultatului testelor de biodegradare. Este intervalul de timp (inclusiv faza de latență) necesar pentru atingerea unei valori de 50 % a biodegradării.
Limita de detecție (LOD) și limita de cuantificare (LOQ): Limita de detecție (LOD) este concentrația unei substanțe sub nivelul căreia identitatea unei substanțe nu mai poate fi deosebită de artefactele analitice. Limita de cuantificare (LOQ) este concentrația unei substanțe sub nivelul căreia concentrația nu poate fi determinată cu o precizie acceptabilă.
Carbon organic dizolvat (COD): Acea parte a carbonului organic dintr-un eșantion de apă care nu poate fi eliminată prin separarea fazelor specificate, cum ar fi centrifugarea la 40 000 ms–2 timp de 15 minute sau filtrarea prin membrană cu pori de diametru 0,2 μm-0,45 μm.
Activitatea organică totală a 14C (TOA): Activitatea totală a 14C asociată cu carbonul organic.
Activitatea 14C organic dizolvat (DOA): Activitatea totală a 14C asociată cu carbonul organic dizolvat.
Activitatea 14C organic sub formă de particule (POA): Activitatea totală a 14C asociată cu carbonul organic sub formă de particule.
1.3. APLICABILITATEA TESTULUI
Acest test de simulare este aplicabil substanțelor organice nevolatile sau ușor volatile testate la concentrații scăzute. Folosind recipiente în care intră aerul (de exemplu acoperite cu vată hidrofilă), substanțele cu o constantă a legii lui Henry mai mică de aproximativ 1 Pa·m3/mol (aprox. 10–5 atm·m3/mol) pot fi considerate practic nevolatile. Testarea substanțelor puțin volatile (cu constante ale legii lui Henry < 100 Pa·m3/mol sau < 10–3 atm·m3/mol) poate avea loc fără pierderi din sistemul de testare dacă se folosesc recipiente închise cu volum tampon. CO2 se va îndepărta cu respectarea măsurilor de siguranță adecvate, în caz contrar putând avea loc pierderi de substanță marcată cu 14C. În astfel de situații, poate fi necesară capturarea CO2 într-o coloană de absorbție conținând compuși alcalini sau folosirea unui sistem absorbant extern de CO2 (determinare directă a 14CO2; a se vedea apendicele 3). Pentru determinarea cineticii biodegradării, concentrațiile de substanță de testat trebuie să fie inferioare solubilității acesteia în apă. Trebuie remarcat totuși că valorile solubilității în apă din lucrările științifice pot fi considerabil mai mari decât solubilitatea substanței testate în ape naturale. Opțional, solubilitatea substanțelor de testat cu grad scăzut de solubilitate în apă poate fi stabilită prin folosirea apelor naturale testate.
Metoda poate fi folosită pentru simularea biodegradării în apă de suprafață care nu conține particule mari (test pelagic) sau în apă de suprafață cu turbiditate, de exemplu care poate exista în apropierea unei interfețe apă/sedimente (test pe sedimente în suspensie).
1.4. PRINCIPIUL TESTULUI
Testul se efectuează în serii, prin incubarea substanței de testat exclusiv cu apă de suprafață (test pelagic) sau apă de suprafață combinată cu solide/sedimente în suspensie între 0,01-1 g/l greutate uscată (test pe sedimente suspendate) pentru simularea unui curs de apă cu solide în suspensie sau sedimente resuspendate. Concentrația solidelor/sedimentelor suspendate în intervalul inferior al acestui domeniu este reprezentativă pentru majoritatea apelor de suprafață. Recipientele de testare sunt incubate la întuneric, la temperatura mediului ambiant, în condiții aerobe, și sunt agitate. Pentru determinarea cineticii degradării se vor folosi cel puțin două concentrații diferite ale substanței testate. Concentrațiile trebuie să difere între ele cu un factor cuprins între 5-10, care trebuie să reprezinte intervalul așteptat de concentrații în mediul ambiant. Concentrația maximă a substanței testate nu trebuie să depășească 100 μg/l, dar sunt preferate concentrațiile de testare maxime inferioare 10 μg/l pentru ca biodegradarea să fie conformă cineticii de prim ordin. Concentrația minimă nu trebuie să depășească 10 μg/l, dar sunt preferate concentrațiile minime de 1-2 μg/l sau inferioare 1 μg/l. În mod normal, o analiză adecvată a unor concentrații atât de scăzute se poate realiza cu ajutorul substanțelor marcate 14C disponibile în comerț. Ca urmare a limitărilor analitice, măsurarea concentrației substanței testate cu precizia necesară este de cele mai multe ori imposibilă dacă substanța testată se aplică la o concentrație ≤ 100 μg/l (a se vedea punctul 1.7.2 al doilea paragraf). Concentrațiile mai mari ale substanței testate (> 100 μg/l și, uneori, > 1 mg/l) pot fi folosite pentru identificarea și cuantificarea produșilor principali de transformare sau dacă nu există o metodă specifică de analiză cu o limită scăzută a detectării. Dacă se testează concentrații mari ale substanței testate, este posibil ca rezultatele să nu poată fi folosite pentru estimarea constantei degradării de prim ordin și a timpului de înjumătățire, deoarece degradarea ar putea să nu respecte cinetica de prim ordin.
Degradarea se urmărește la intervale de timp regulate prin măsurarea 14C rezidual sau, dacă se folosește o analiză chimică specifică, prin măsurarea concentrației substanței testate. Marcarea cu 14C a celei mai stabile părți a moleculei permite determinarea mineralizării totale, în timp ce marcarea cu 14C a părții mai puțin stabile a moleculei, precum și folosirea analizei specifice permit doar evaluarea biodegradării primare. Cu toate acestea, porțiunea cea mai stabilă nu include în mod obligatoriu fracțiunea funcțională relevantă a moleculei (care poate fi corelată cu o proprietate specifică, cum ar fi toxicitatea, bioacumularea etc.). În acest caz, se recomandă folosirea în porțiunea funcțională a unei substanțe de testat marcate cu 14C în scopul urmăririi eliminării acelei proprietăți.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTAT
În acest test pot fi folosite deopotrivă substanțe de testat marcate sau nemarcate radioactiv. Se recomandă tehnica de marcare cu 14C, iar marcarea trebuie să aibă loc în porțiunea (porțiunile) cea (cele) mai stabilă (stabile) a (ale) moleculei (a se vedea și punctul 1.4). În cazul substanțelor care conțin mai mult de un inel aromatic, se preferă ca unul sau mai mulți atomi de carbon din fiecare inel să se marcheze cu 14C. În plus, se preferă ca unul sau mai mulți atomi de carbon de pe ambele părți ale legăturilor ușor de scindat să se marcheze cu 14C. Puritatea chimică și/sau radiochimică a substanței testate trebuie să fie > 95 %. În cazul substanțelor marcate radioactiv este preferată o activitate specifică de aproximativ 50 μCi/mg (1,85 MBq) sau mai mare, în scopul facilitării măsurării 14C în testele realizate la concentrații inițiale scăzute. Vor fi disponibile următoarele informații despre substanța testată:
— solubilitatea în apă [metoda de testare A.6];
— solubilitatea în solvent (solvenți) organic (organici) (substanțe folosite împreună cu solvent sau cu solubilitate scăzută în apă);
— constanta de disociere (pKa) dacă este posibil ca substanța să fie supusă unei protonări sau deprotonări [orientarea nr. 112 a OECD] (5);
— presiunea de vapori (metoda A.4) și constanta legii lui Henry;
— stabilitate chimică în apă și la întuneric (hidroliză) [metoda C.7].
Când substanțele cu solubilitate scăzută în apă se testează în apă de mare, este utilă cunoașterea constantei de desalifiere (sau „constanta Setschenow”) Ks, definită prin expresia log (S/S’) = Ks Cm, unde S și S’ sunt solubilitatea substanței în apă dulce și, respectiv, în apă de mare, iar Cm este concentrația molară de sare.
Dacă testul se desfășoară ca „test pe sedimente în suspensie”, următoarele informații vor fi disponibile:
— coeficientul de partiție n-octanol/apă [metoda A.8];
— coeficientul de adsorbție [metoda C.18].
Alte informații utile pot include:
— concentrația în mediu, dacă se cunoaște sau estimată;
— toxicitatea substanței testate asupra microorganismelor [metoda C.11];
— biodegradabilitatea imediată și/sau intrinsecă [metodele C.4 A-F, C.12, C.9, orientarea nr. 302 a OECD (5)];
— biodegradabilitatea aerobă sau anaerobă în sol și studii de transformare în sedimente/apă [metodele C.23, C.24].
1.6. SUBSTANȚĂ DE REFERINȚĂ
Se folosește ca substanță de referință o substanță în mod normal ușor degradabilă în condiții aerobe (de exemplu anilină sau benzoat de sodiu). Intervalul de timp preconizat pentru degradarea anilinei și benzoatului de sodiu este de obicei mai mic de două săptămâni. Scopul substanțelor de referință este de a asigura menținerea activității microbiene a apei de testare în anumite limite; de exemplu, se verifică dacă apa conține o populație microbiană activă.
1.7. CRITERII DE CALITATE
1.7.1. Recuperare
Imediat după adăugarea substanței de testat, fiecare concentrație inițială de testare se verifică prin măsurarea activității 14C sau prin analize chimice în cazul substanțelor nemarcate, în cel puțin eșantioane duble. Aceasta oferă informații privind aplicabilitatea și repetabilitatea metodei analitice, precum și omogenitatea distribuției substanței testate. În mod normal, activitatea 14C sau concentrația substanței testate măsurate inițial se folosesc în analizele ulterioare ale datelor, nu în concentrația nominală, deoarece pierderile provocate de sorbție și erorile de dozare sunt astfel compensate. În cazul substanței testate marcate cu 14C, nivelul de recuperare de la sfârșitul experimentului este dat de bilanțul maselor (a se vedea punctul 1.8.9.4 ultimul paragraf). În mod ideal, bilanțul maselor marcate radioactiv trebuie să fie cuprins între 90 % și 110 %, în timp ce precizia analitică trebuie să conducă la o recuperare inițială cuprinsă între 70 % și 110 % pentru substanțe de testat nemarcate. Aceste intervale se interpretează ca ținte și nu se folosesc sub formă de criterii pentru acceptabilitatea testului. Opțional, precizia analitică se poate determina pentru substanța testată la o concentrație mai mică decât cea inițială și pentru produșii de transformare.
1.7.2. Repetabilitatea și sensibilitatea metodei analitice
Repetabilitatea metodei analitice (cu excepția randamentului extracției inițiale) în ceea ce privește cuantificarea substanței de testat și a produșilor de transformare se poate controla prin efectuarea de cinci analize duplicate ale extraselor individuale de apă de suprafață.
Limita de detecție (LOD) a metodei analitice pentru substanța de testat și produșii de transformare trebuie să fie, dacă este posibil, de cel puțin 1 % din cantitatea inițială folosită în sistemul de testare. Limita de cuantificare (LOQ) trebuie să fie egală sau mai mică de 10 % din concentrația aplicată. Analizele chimice ale multor substanțe organice și produșii lor de transformare impun frecvent ca substanța de testat să fie folosită la o concentrație relativ mare, de exemplu > 100 μg/l.
1.8. DESCRIEREA METODEI DE TESTARE
1.8.1. Aparatură
Testul poate fi efectuat în recipiente conice sau cilindrice de capacitate corespunzătoare (de exemplu de 0,5 sau 1,0 l) acoperite cu dopuri de silicon sau cauciuc, sau în recipiente serologice închise ermetic (de exemplu cu membrană de cauciuc butilic). O altă opțiune de efectuare a testului constă în folosirea de recipiente multiple și recoltarea în întregime a conținutului acestora, cel puțin în duplicat, la fiecare interval de prelevare (a se vedea punctul 1.8.9.1 ultimul paragraf). În cazul substanțelor de testat nevolatile care nu sunt marcate radioactiv, dopurile sau capacele etanșe nu sunt necesare; sunt suficiente dopurile de vată care previn contaminarea din aer (a se vedea punctul 1.8.9.1 al doilea paragraf). Substanțele puțin volatile se testează într-un sistem de tip biometru, cu agitarea ușoară a suprafeței apei. În scopul prevenirii contaminării bacteriene, vasele pot fi sterilizate opțional prin încălzire sau autoclavare înainte de folosire. În plus, se folosesc următoarele echipamente standard de laborator:
— masă de agitare sau agitatoare magnetice pentru agitare continuă a recipientelor de testare;
— centrifugă;
— pH-metru;
— turbidimetru pentru măsurarea turbidității nefelometrice;
— etuvă sau cuptor cu microunde pentru determinarea greutății uscate;
— dispozitiv de filtrare cu membrană;
— autoclavă sau etuvă pentru sterilizarea la căldură a vaselor din sticlă;
— instrumente de manipulare a substanțelor marcate cu 14C;
— echipamente pentru cuantificarea activității 14C în eșantioane de soluții de captare a CO2 și, dacă este necesar, din eșantioane de sedimente;
— echipamente analitice pentru determinarea substanței testate (și de referință) dacă se folosește analiză chimică specifică (de exemplu cromatograf cu gaz, cromatograf cu lichid la înaltă presiune).
1.8.2. Soluțiile mamă ale substanței testate
Pentru pregătirea soluțiilor mamă ale substanțelor de testat și de referință se folosește apă deionizată (a se vedea punctul 1.8.7 primul paragraf). Apa deionizată nu trebuie să conțină substanțe toxice pentru microorganisme, iar carbonul organic dizolvat (COD) nu trebuie să depășească 1 mg/l (6).
1.8.3. Colectarea și transportul apei de suprafață
Locurile de prelevare pentru colectarea apei naturale se selectează în funcție de finalitatea testului în fiecare caz în parte. Pentru alegerea locurilor de prelevare trebuie avut în vedere istoricul eventualelor aporturi de natură agricolă, industrială sau menajeră. Dacă se cunoaște că un mediu acvatic a fost contaminat cu substanță de testat sau cu produși de natură analogă pe parcursul ultimilor 4 ani, acesta nu va fi folosit pentru prelevarea de apă, cu excepția cazului în care obiectivul expres al experimentatorului este cercetarea ratelor de degradare ale locurilor expuse anterior. pH-ul și temperatura apei se măsoară la locul de prelevare. În plus, adâncimea de prelevare și aspectul eșantionului de apă (de exemplu culoare și turbiditate) se înregistrează (a se vedea punctul 3). Concentrația de oxigen și/sau potențialul redox în apă și în stratul sedimentelor de suprafață se măsoară în scopul demonstrării condițiilor aerobe, cu excepția situației în care acestea sunt cunoscute ca urmare a observării aspectului și condițiilor anterioare de la locul de prelevare. Apa de suprafață se transportă într-un container care a fost curățat cu atenție. În timpul transportului, temperatura eșantionului nu trebuie să depășească semnificativ temperatura testului. Dacă durata transportului depășește 2-3 ore, se recomandă răcirea la 4 °C. Eșantionul de apă nu se congelează.
1.8.4. Stocarea și prepararea apei de suprafață
Se preferă ca textul să înceapă în termen de o zi de la colectarea eșantionului. Perioada de stocare a apei, dacă este necesară, se reduce la minimum și nu trebuie să depășească în niciun caz mai mult de 4 săptămâni. Eșantionul de apă se păstrează la 4 °C, în condiții de ventilație, până la folosire. Înainte de folosire, particulele mari se elimină, de exemplu prin filtrare cu ajutorul unui filtru de nailon cu o dimensiune a porilor de aproximativ 100 μm sau cu un filtru de hârtie cu porozitate mare sau prin sedimentare.
1.8.5. Prepararea apei tratate cu sedimente (opțional)
Pentru testul cu sedimente în suspensie, se adaugă sedimente de suprafață în recipiente conținând apă naturală (filtrată pentru eliminarea particulelor mari, conform descrierii de la punctul 1.8.4) pentru obținerea unei suspensii; concentrația solidelor în suspensie trebuie să fie între 0,01 și 1 g/l. Sedimentele de suprafață trebuie să provină din același loc de unde a fost prelevat eșantionul de apă. În funcție de mediul acvatic, sedimentele de suprafață pot fi caracterizate printr-un conținut ridicat de carbon organic (2,5-7,5 %) și o textură fină sau printr-un conținut scăzut de carbon organic (0,5-2,5 %) și o textură rugoasă (3). Sedimentele de suprafață se prepară după cum urmează: se extrag câteva carote de sediment intact folosind un tub de plastic transparent, se elimină straturile aerobe superioare (de la suprafață la o adâncime de max. 5 mm) imediat după prelevare și se combină. Eșantionul de sediment rezultat se transportă într-un recipient cu un volum mare al tamponului de aer pentru a menține sedimentul în condiții aerobe (răcit la 4 °C dacă durata transportului depășește 2-3 ore). Eșantionul de sediment se suspendă în apa de testare la un raport de 1:10 și se păstrează la 4 °C, în condiții de ventilare, până la folosire. Perioada de stocare a apei, dacă este necesară, se reduce la minimum și nu trebuie să depășească în niciun caz 4 săptămâni.
1.8.6. Procedura semicontinuă (opțional)
Dacă înainte ca substanța de testat să poată fi măsurată se manifestă o perioadă de latență lungă, poate fi necesară o incubare prelungită (câteva luni). Dacă acest aspect este cunoscut ca urmare a testării anterioare a unei substanțe, testul poate fi inițiat prin folosirea unei proceduri semicontinue, care permite reînnoirea periodică a unei porțiuni din apa sau suspensia de testare (a se vedea apendicele 2). Alternativ, dacă nu a avut loc o degradare a substanței de testat pe o perioadă de aproximativ 60 de zile de testare prin procedura în serii, testul normal în serii poate fi modificat într-un test semicontinuu (a se vedea punctul 1.8.8.3 al doilea paragraf).
1.8.7. Adăugarea substanței de testat (sau de referință)
Pentru substanțele cu solubilitate mare în apă (> 1 mg/l) și volatilitate scăzută (constante ale legii lui Henry < 1 Pa·m3/mol sau < 10–5 atm·m3/mol) se poate prepara o soluție mamă în apă deionizată (a se vedea punctul 1.8.2); în vasele de testare se adaugă volumul corespunzător de soluție mamă pentru obținerea concentrației dorite. Volumul oricărei soluții mamă adăugate se menține la minimul practic (< 10 % din volumul lichid final, dacă este posibil). O altă procedură constă în dizolvarea substanței de testat într-un volum mai mare de apă de testat, aceasta putând fi considerată o alternativă la folosirea de solvenți organici.
Dacă nu se poate evita, soluțiile mamă ale substanțelor nevolatile cu solubilitate scăzută în apă se prepară prin folosirea unui solvent organic volatil, dar cantitatea de solvent adăugată în sistemul de testare nu trebuie să depășească 1 % v/v și nu trebuie să aibă efecte adverse asupra activității microbiene. Solventul nu trebuie să afecteze stabilitatea substanței testate în apă. Solventul se elimină până ajunge la o cantitate extrem de mică, astfel încât să nu contribuie la creșterea semnificativă a concentrației COD a apei sau a suspensiei de testat. Aceasta se verifică prin intermediul unei analize specifice substanței sau, dacă este posibil, prin analiză COD (6). Se vor lua măsuri pentru limitarea la strictul necesar a cantității de solvent transferate și pentru asigurarea dizolvării substanței testate în volumul final de apă de testat. Alte tehnici de introducere a substanței testate în vasele de testare sunt descrise la notele (7) și (8). Atunci când la aplicarea substanței de testat se folosește un solvent organic, probele martor ale solventului conținând apa de testat (fără adăugări) și apa de testat cu substanța de referință adăugată sunt tratate similar cu vasele de testare activă în care s-a adăugat substanță de testat în solvent purtător. Rolul probelor martor ale solventului este de a examina posibilele efecte adverse ale solventului asupra populației microbiene, acestea fiind indicate de degradarea substanței de referință.
1.8.8. Condiții de testare
1.8.8.1. Temperatura de testare
Incubarea are loc la întuneric (preferabil) sau în condiții de lumină difuză, la temperatură controlată (± 2 °C), care poate fi temperatura ambientală sau o temperatură standard cuprinsă între 20-25 °C. Temperatura ambientală poate fi temperatura reală a eșantionului în momentul prelevării sau o temperatură ambientală medie la locul de prelevare.
1.8.8.2. Agitare
Agitarea (scuturare sau agitare continuă) are rolul de a menține particulele și microorganismele în suspensie. Agitarea facilitează, de asemenea, transferul de oxigen din volumul tampon către lichid, în scopul menținerii condițiilor aerobe adecvate. Recipientele se așază pe o masă de agitare (cu o frecvență de aprox. 100 rpm) sau se folosește agitare magnetică. Agitarea trebuie să fie continuă. Cu toate acestea, scuturarea sau agitarea vor fi cât mai ușoare posibil, menținându-se în același timp o suspensie omogenă.
1.8.8.3. Durata testului
În mod normal, durata testului nu trebuie să depășească 60 de zile, cu excepția cazului în care se aplică procedura semicontinuă cu reînnoire periodică a suspensiei de testat (a se vedea punctul 1.8.6 și apendicele 2). Cu toate acestea, dacă substanța testată a început să se degradeze în primele 60 de zile, perioada de testare a seriei poate fi extinsă la cel mult 90 de zile. Degradarea se monitorizează prin determinarea activității 14C rezidual sau a 14CO2 degajat (a se vedea punctul 1.8.9.4) și/sau prin analiză chimică (punctul 1.8.9.5) la intervale de timp adecvate. Perioada de incubare trebuie să fie suficient de lungă pentru a permite evaluarea procesului de degradare. Preferabil, nivelul degradării trebuie să depășească 50 %; în cazul substanțelor lent degradabile, nivelul degradării trebuie să fie suficient (în mod normal, mai mare de 20 %) pentru a permite estimarea constantei vitezei cineticii de degradare.
Se vor efectua măsurători periodice ale pH-ului și concentrației oxigenului în sistemul de testare, cu excepția cazurilor în care astfel de teste sunt inutile ca urmare a existenței unor date anterioare din teste similare cu eșantioane de apă și sedimente colectate din același loc. În unele condiții, metabolismul substraturilor primare la concentrații mult mai mari în apă sau sedimente poate provoca o degajare de CO2 și o epuizare a oxigenului suficient de mari pentru a modifica în mod semnificativ condițiile experimentale din timpul testului.
1.8.9. Procedură
1.8.9.1. Pregătirea recipientelor pentru testul pelagic
Se transferă un volum corespunzător de apă de testat în recipientele de testare, până la aproximativ o treime din volumul recipientului, nu mai puțin de 100 ml. Dacă se folosesc recipiente multiple (care permit recoltarea conținutului din întregul recipient la fiecare punct de prelevare), volumul corespunzător al apei de testat va fi tot de 100 ml, deoarece volumele mici ale eșantioanelor pot influența lungimea fazei de latență. Substanța de testat se adaugă dintr-o soluție mamă conform descrierii de la punctele 1.8.2 și 1.8.7. Pentru determinarea cineticii degradării și calcularea constantei vitezei cineticii de degradare se vor folosi cel puțin două concentrații de substanță de testat, diferența dintre acestea fiind un factor cuprins între 5 și 10. Ambele concentrații selectate trebuie să fie mai mici de 100 μg/l și, preferabil, să se situeze în intervalul < 1-10 μg/l.
Recipientele se astupă cu dopuri sau capace impermeabile la aer și CO2. În cazul substanțelor chimice de testat nevolatile care nu sunt marcate cu 14C, sunt suficiente dopurile de vată care previn contaminarea din aer (a se vedea punctul 1.8.1), dacă produșii majori de degradare sunt cunoscuți ca nevolatili și se folosește determinarea indirect a CO2 (a se vedea apendicele 3).
Recipientele se incubează la temperatura selectată (a se vedea punctul 1.8.8.1). Eșantioanele se retrag pentru analiză chimică sau măsurarea 14C la începutul testului (înainte de începerea biodegradării; a se vedea punctul 1.7.1), apoi la intervale adecvate în cursul testului. Recoltarea se efectuează prin retragerea subeșantioanelor (de exemplu alicote de 5 ml) din fiecare duplicat sau prin recoltarea întregului conținut al recipientelor la fiecare moment de prelevare. Mineralizarea substanței de testat poate fi determinată în mod direct sau indirect (a se vedea apendicele 3). În mod obișnuit, în timpul fazei de degradare (după terminarea fazei de latență) sunt necesare minimum cinci puncte de prelevare pentru estimarea unei constante precise a vitezei, cu excepția cazurilor când se poate demonstra că trei puncte de prelevare sunt suficiente pentru substanțele cu degradare rapidă. Pentru substanțele care nu se degradează rapid se pot face mai multe măsurători în timpul fazei de degradare și, prin urmare, se vor folosi mai multe puncte experimentale pentru estimarea k. Deoarece viteza de biodegradare variază, nu poate fi indicat un program fix de recoltare; cu toate acestea, dacă degradarea este lentă, se recomandă ca recoltarea să aibă loc o dată pe săptămână. Dacă substanța testată este rapid degradabilă, recoltarea trebuie să se efectueze o dată pe zi în primele trei zile, apoi la fiecare două sau trei zile. În anumite situații, cum ar fi cele în care se lucrează cu substanțe rapid hidrolizabile, recoltarea poate fi necesară la intervale de o oră. Se recomandă efectuarea unui studiu preliminar înainte de test, în scopul stabilirii intervalelor de recoltare adecvate. Dacă eșantioanele trebuie să fie disponibile și pentru alte analize specifice, se recomandă recoltarea mai multor eșantioane și selectarea celor care urmează să fie analizate la sfârșitul experimentului prin intermediul unei strategii inverse, prin care ultimele eșantioane se analizează prima dată (a se vedea punctul 1.8.9.5 al doilea paragraf, pentru recomandări privind stabilitatea eșantioanelor în timpul stocării).
1.8.9.2. Numărul recipientelor și eșantioanelor
Va fi disponibil un număr suficient de recipiente de testare pentru a avea:
— recipiente de testare: cel puțin două recipiente pentru fiecare concentrație a substanței de testat (preferabil, minimum 3) sau recipiente de testare multiple pentru fiecare concentrație, dacă se recoltează întregul conținut al recipientelor la fiecare moment de prelevare (reprezentate FT);
— recipiente de testare pentru calculul bilanțului masic; cel puțin două recipiente pentru fiecare concentrație de testare (reprezentate FM);
— probă martor, fără substanță de testat; cel puțin un recipient martor de testat conținând doar apa de testare (reprezentată FB);
— etalon de referință; două recipiente cu substanță de referință (de exemplu anilină sau benzoat de sodiu, la 10 μg/l) (reprezentat FC). Scopul etalonului de referință este de a confirma un minim de activitate microbiană. Dacă este util, se poate folosi o substanță de referință marcată radioactiv, folosită și în cazurile când degradarea substanței de testat este monitorizată prin analize chimice;
— etalon steril; unul sau două recipiente conținând apă de testare sterilizată necesară pentru examinarea posibilei degradări abiotice sau pentru altă procedură de eliminare prin mijloace nebiologice a substanței de testat (reprezentat FS). Activitatea biologică poate fi oprită prin autoclavarea (121 °C; 20 min.) apei de testare sau prin adăugarea unei substanțe toxice [de exemplu azidă de sodiu (NaN3), clorură de mercur (HgCl2) la 100 mg/l sau formol la 100 mg/l] sau prin radiații gama. Dacă se folosește HgCl2, acesta se va elimina conform procedurii pentru deșeuri toxice. Condițiile de sterilitate nu sunt ușor de obținut în cazul în care se adaugă apă cu sedimente în cantitate mare; în acest caz se recomandă autoclavarea repetată (de exemplu de trei ori). Trebuie avut în vedere că, prin autoclavare, caracteristicile de sorbție ale sedimentelor pot fi modificate;
— etaloane de solvent, conținând apă de testat și apă de testat cu substanță de referință; recipiente duble tratate cu aceeași cantitate de solvent și prin folosirea unei proceduri similare cu cea pentru aplicarea substanței de testat. Obiectivul este de a examina efectele adverse posibile ale solventului prin determinarea degradării substanței de referință.
În conceperea testului, experimentatorul trebuie să ia în considerare importanța relativă a creșterii duplicării experimentale comparativ cu creșterea numărului momentelor de recoltare. Numărul exact al recipientelor necesare va depinde de metoda folosită pentru măsurarea degradării (a se vedea punctul 1.8.9.1 al treilea paragraf, punctul 1.8.9.4 și apendicele 3).
În fiecare moment de prelevare, din fiecare recipient de testare se retrag două subeșantioane (de exemplu alicote de 5 ml). Dacă se folosesc mai multe recipiente pentru a fi posibilă recoltarea întregului conținut al recipientelor, în fiecare moment de prelevare se sacrifică cel puțin două recipiente (a se vedea punctul 1.8.9.1 primul paragraf).
1.8.9.3. Prepararea recipientelor pentru testul pe sedimente în suspensie [opțional]
Se adaugă volumele necesare de apă și sedimente de testare în vasele de testare, dacă este necesar (a se vedea punctul 1.8.5). Procedura de pregătire a recipientelor pentru testul pe sedimente în suspensie este similară cu cea pentru testul pelagic (a se vedea punctele 1.8.9.1 și 1.8.9.2). Se folosesc, preferabil, flacoane serologice sau recipiente de o formă asemănătoare. Sticlele (închise) se așază orizontal pe un agitator. Recipientele deschise pentru substanțe nevolatile care nu sunt marcate cu 14C se așază, evident, în poziție verticală; în astfel de situații se recomandă folosirea unui agitator magnetic și a unor tije magnetice căptușite cu sticlă. Dacă este necesar, sticlele se aerisesc pentru menținerea condițiilor aerobe adecvate.
1.8.9.4. Determinări radiochimice
14CO2 degajat se măsoară indirect sau direct (a se vedea apendicele 3). 14CO2 se determină indirect prin diferența între activitatea inițială a 14C în apa sau în suspensia de testat și activitatea reziduală totală în momentul prelevării, măsurată după acidifierea eșantionului la pH 2-3 și eliminarea CO2. Astfel, carbonul anorganic este îndepărtat, iar activitatea reziduală măsurată provine din materialul organic. Determinarea indirectă a 14CO2 nu se folosește dacă în timpul transformării substanței testate se formează produși majori volatili de transformare (a se vedea apendicele 3). Dacă este posibil, degajarea 14CO2 se măsoară direct (a se vedea apendicele 3) în fiecare moment de prelevare în cel puțin un recipient de testare; această procedură permite verificarea deopotrivă a bilanțului masic și a procesului de biodegradare, dar este limitată la teste efectuate cu recipiente închise.
Dacă 14CO2 degajat se măsoară direct în timpul testului, la începutul acestuia vor fi pregătite mai multe recipiente în acest scop. Dacă în timpul transformării substanței de testat se formează produși majori volatili de transformare, se recomandă determinarea directă a 14CO2. În fiecare punct de măsurare, recipientele de testare suplimentare se acidifiază la pH 2-3, iar 14CO2 se colectează într-un absorbant intern sau extern (a se vedea apendicele 3).
Opțional, concentrațiile substanței de testat marcate cu 14C și ale produșilor majori de transformare se pot determina prin folosirea radiocromatografiei (cromatografie în strat subțire, RAD-TLC) sau HPLC cu detectare radiochimică.
Opțional, se poate determina distribuția fazică a radioactivității rămase (a se vedea apendicele 1), a substanței de testat reziduale și a produșilor de transformare.
La sfârșitul testului, bilanțul masic se determină prin măsurare directă a 14CO2 folosind recipiente de testare separate, din care nu se recoltează eșantioane în cursul testului (a se vedea apendicele 3).
1.8.9.5. Analiză chimică specifică
Dacă există o metodă analitică specifică sensibilă, biodegradarea primară se poate evalua prin măsurarea concentrației reziduale totale a substanței testate, și nu prin folosirea tehnicilor de marcare radioactivă. Dacă se folosește o substanță de testat marcată radioactiv (pentru măsurarea mineralizării totale), se pot realiza în paralel analize chimice specifice care să ofere informații suplimentare utile și să contribuie la verificarea procedurii. Analizele chimice specifice mai pot fi folosite pentru măsurarea produșilor de transformare formați în timpul degradării substanței de testare, acestea fiind recomandate pentru substanțe care se mineralizează cu timpi de înjumătățire care depășesc 60 de zile. La fiecare prelevare se măsoară și se înregistrează concentrația substanței de testat și produșii de transformare (ca procent și concentrație de substanță aplicată). Ca regulă generală, se identifică toți produșii de transformare pentru care se detectează ≥ 10 % din concentrația aplicată, indiferent de momentul prelevării, cu excepția cazurilor în care există justificări rezonabile. Se identifică, de asemenea, produșii de transformare a căror concentrație crește constant pe durata studiului, chiar și în cazurile în care concentrațiile acestora nu depășesc limitele menționate mai sus, deoarece este posibil ca acesta să fie un indiciu asupra persistenței. Vor fi avute în vedere analize ale produșilor de transformare din etaloanele sterile dacă se consideră că sunt posibile transformări abiotice rapide ale substanței de testat (hidroliză). Nevoia de cuantificare și identificare a produșilor de transformare va fi examinată de la caz la caz, justificările fiind indicate în raport. Tehnicile de extracție cu solvent organic se aplică în conformitate cu îndrumările prezentate în procedura analitică respectivă.
Dacă analiza se desfășoară în 24 de ore (preferabil), toate eșantioanele se păstrează închise ermetic, la temperaturi între 2-4 °C. Pentru perioade mai lungi de stocare, eșantioanele se congelează sub – 18 °C sau se conservă prin metode chimice. Nu se recomandă metoda de păstrare prin acidifiere, deoarece eșantioanele acidifiate pot fi instabile. Dacă eșantioanele nu sunt analizate în termen de 24 de ore și se păstrează pentru o perioadă mai lungă, se va efectua un studiu privind stabilitatea la stocare, pentru a se determina dacă substanțele chimice de interes sunt stabile la temperaturi mai mici de – 18 °C sau în stare de conservare. Dacă metoda analitică presupune extracția cu solvent sau în fază solidă (SPE), extracția se efectuează imediat după recoltare sau după stocarea eșantionului la rece timp de maximum 24 de ore.
În funcție de sensibilitatea metodei analitice, pot fi necesare volume mai mari ale eșantionului decât cele indicate la punctul 1.8.1. Testul poate fi desfășurat cu ușurință cu volume de testare de un litru în recipiente cu un volum de 2-3 litri, ceea ce face posibilă recoltarea de eșantioane de aprox. 100 ml.
2. DATE ȘI RAPORT
2.1. PRELUCRAREA REZULTATELOR
2.1.1. Reprezentarea grafică a datelor
Timpii de recoltare se rotunjesc la un număr întreg de ore (cu excepția cazului în care substanța se degradează substanțial într-o perioadă de minute sau ore), dar nu la un număr întreg de zile. Se reprezintă estimările activității reziduale ale substanței de testat (pentru substanțe marcate cu 14C) sau concentrația reziduală (pentru substanțele nemarcate) în funcție de timp atât într-un grafic linear, cât și în unul semilogaritmic (a se vedea figurile 1a, 1b). Dacă degradarea a avut loc, se compară rezultatele recipientelor FT cu cele ale recipientelor FS. Dacă mediile rezultatelor pentru recipientele cu substanță de testat (FT) și pentru recipientele sterile (FS) deviază cu mai puțin de 10 %, se presupune că degradarea observată este predominant abiotică. Dacă degradarea din recipientele (FS) este mai scăzută, cifrele pot fi folosite pentru a le corecta pe cele obținute cu recipientele FT (prin scădere) în scopul estimării nivelului biodegradării. Când se efectuează analize opționale pentru produșii principali de transformare, formarea și declinul lor se reprezintă alături de graficul declinului substanței testate.
Durata tL a fazei de latență se estimează din curba degradării (grafic semilogaritmic) prin extrapolarea porțiunii sale lineare la degradare zero sau, alternativ, prin determinarea timpului pentru o degradare de aproximativ 10 % (figurile 1a și 1b). Constanta vitezei de prim ordin k se estimează pe baza graficului semilogaritmic, iar eroarea sa standard se stabilește prin regresia lineară a ln (activitatea reziduală a 14C sau concentrația substanței testate) în funcție de timp. În ceea ce privește măsurătorile 14C, în special, se folosesc doar date care aparțin porțiunii lineare inițiale a curbei după terminarea fazei de latență și se preferă selectarea de date mai puține, dar mai reprezentative, în locul selectării unui număr mare de date incerte. În acest caz, incertitudinea se referă la erori intrinseci legate de folosirea directă recomandată a activităților 14C rezidual măsurat (a se vedea mai jos). Dacă degradarea urmează un model bifazic, uneori poate fi utilă calcularea a două constante diferite ale vitezei. În acest scop, sunt definite două faze diferite ale curbei degradării. Calcularea constantei vitezei de degradare k și a timpului de înjumătățire t½ = ln2/k se realizează pentru fiecare dintre recipientele duplicate, dacă se extrag subeșantioane din același recipient, sau prin folosirea valorilor medii, când se recoltează întregul conținut al recipientelor la fiecare moment de prelevare (a se vedea punctul 1.8.9.2 ultimul paragraf). Când se folosește prima dintre procedurile menționate, constanta vitezei și timpul de înjumătățire se raportează pentru fiecare dintre recipientele duplicate ca valoare medie cu o eroare standard. Dacă au fost folosite concentrații mari ale substanțelor de testat, curba degradării poate devia considerabil de la o linie dreaptă (grafic semilogaritmic), iar cinetica de prim ordin poate să nu fie validă. Prin urmare, definirea timpului de înjumătățire nu are sens. Cu toate acestea, timpul de înjumătățire a degradării DT50 (perioada necesară pentru atingerea unei degradări de 50 %) poate fi estimat ca urmare a aplicării cineticii de pseudo-prim ordin pentru un interval limitat de date. Trebuie reținut totuși că perioada degradării dincolo de intervalul selectat de date nu poate fi previzionată folosind DT50, acesta fiind doar un indicator al unui set de date oferite. Oferta de instrumente analitice pentru facilitarea calculelor statistice și a interpolării este bogată, folosirea acestui tip de software fiind recomandată.
Dacă se realizează analize chimice specifice, constantele vitezei și timpii de înjumătățire pentru degradarea primară se estimează conform metodei de mai sus pentru mineralizarea totală. Dacă degradarea primară este procesul limitant, uneori pot fi folosite puncte experimentale din întregul proces de degradare. Aceasta se întâmplă deoarece, spre deosebire de măsurătorile activității 14C, măsurătorile sunt directe.
Dacă se folosesc substanțe marcate cu 14C, cel puțin la sfârșitul testului se va exprima un bilanț masic în procente din concentrația aplicată inițial.
2.1.2. Activitate reziduală
Când porțiunea marcată cu 14C a unei substanțe organice se biodegradează, porțiunea principală a 14C se transformă în 14CO2, în timp ce o altă porțiune este folosită pentru creșterea biomasei și/sau sinteza metaboliților extracelulari. Prin urmare, biodegradabilitatea „finală” completă a unei substanțe nu are ca rezultat transformarea în proporție de 100 % a carbonului său în 14CO2. 14C inclus în produse formate prin biosinteză este degajat lent ulterior ca 14CO2 ca urmare a „mineralizării secundare”. Din aceste cauze, graficele activității 14C organic rezidual (măsurat după îndepărtarea CO2) sau a 14CO2 produs în funcție de timp arată o „coadă” după ce degradarea s-a finalizat. Acest lucru complică interpretarea cinetică a datelor și, în acest scop, doar partea inițială a curbei (după terminarea fazei de latență și înainte de atingerea nivelului de 50 % degradare) se folosește în mod normal pentru estimarea unei constante a vitezei de degradare. Dacă substanța testată este degradată, activitatea 14C organic rezidual este întotdeauna mai mare decât activitatea 14C asociată cu substanța testată rămasă intactă. Dacă substanța testată se degradează ca urmare a unei reacții de prim ordin, iar o fracțiune constantă α se mineralizează în CO2, panta inițială a curbei de dispariție a 14C (14C total organic în funcție de timp) va fi α înmulțit cu panta curbei corespunzătoare concentrației substanței testate (sau, pentru precizie, partea substanței testate marcate cu 14C). Dacă se folosesc măsurătorile activității 14C organice totale necorectate, constanta calculată a vitezei degradării va fi conservativă. Proceduri de estimare a concentrațiilor substanței testate din activitățile radiochimice măsurate bazate pe diferite ipoteze de simplificare au fost descrise în literatura de specialitate (2)(9)(10)(11). Astfel de proceduri sunt cel mai ușor de aplicat pentru substanțele cu degradare rapidă.
2.2. INTERPRETAREA REZULTATELOR
Dacă se constată că valoarea k este independentă de concentrația adăugată (în cazul în care k obținut în urma calculelor este aproximativ egal la concentrații diferite ale substanței de testat), se presupune reprezentativitatea constantei vitezei de prim ordin pentru condițiile de testare folosite, cum ar fi substanța de testat, eșantionul de apă și temperatura de testare. Măsura în care rezultatele pot fi generalizate sau extrapolate către alte sisteme se evaluează de către experți. Dacă se folosește o concentrație mare a substanței de testat și, prin urmare, degradarea nu urmează cinetica de prim ordin, datele nu pot fi folosite pentru estimarea directă a unei constante a vitezei de prim ordin sau a timpului de înjumătățire corespunzător. Cu toate acestea, datele obținute în urma unui test folosind o concentrație mare a substanței de testat pot fi în continuare utile pentru estimarea gradului de mineralizare totală și/sau detectarea sau cuantificarea produșilor de transformare.
Dacă se cunosc vitezele unor procese de pierdere altele decât biodegradarea (de exemplu hidroliză sau volatilizare), acestea pot fi scăzute din viteza netă de pierdere observată în timpul testului, pentru a se obține o estimare aproximativă a vitezei de biodegradare. Datele pentru hidroliză pot fi obținute, printre altele, din etalonul steril sau în urma testării paralele cu o concentrație mai mare a substanței testate.
Determinarea directă și indirectă a 14CO2 (punctul 1.8.9.4 și apendicele 3) pot fi folosite doar pentru măsurarea gradului de mineralizare a substanței testate în CO2. Analiza concentrației substanței de testat marcate cu 14C și a formării produșilor majori de transformare se poate realiza cu ajutorul metodelor radiocromatografiei (RAD-TLC) sau HPLC (punctul 1.8.9.4 al treilea paragraf). Pentru a se permite estimarea directă a timpului de înjumătățire, nu trebuie să fie prezenți produși majori de transformare (definiți ca ≥ 10 % din cantitatea aplicată de substanță de testat). Dacă sunt prezenți produși majori de transformare care corespund definiției de mai sus, este necesară o evaluare detaliată a datelor. Aceasta poate include testarea și/sau identificarea repetată a produșilor de transformare (a se vedea punctul 1.8.9.5 primul paragraf), cu excepția situației în care evoluția produșilor de transformare poate fi evaluată cu un grad rezonabil de precizie pe baza experienței (de exemplu informații despre calea de degradare). Deoarece proporția carbonului din substanța de testat convertit în CO2 variază (depinzând în mare proporție de concentrația substanței de testat și a altor substraturi disponibile, condițiile de testare și populația microbiană), acest test nu permite o estimare clară a biodegradării finale, asemeni celei din testul de epuizare COD; totuși, rezultatele sunt similare cu cele obținute ca urmare a folosirii unui test respirometric. Astfel, gradul de mineralizare va fi mai mic sau egal cu nivelul minim al biodegradării finale. Pentru a se obține o imagine completă a biodegradării finale (mineralizarea și încorporarea în biomasă), la sfârșitul testului se efectuează analiza distribuției fazice a 14C (a se vedea apendicele 1).14C din amestecul de particule va consta în 14C încorporat în biomasa bacteriană și 14C absorbit în particule organice.
2.3. VALIDITATEA TESTULUI
Dacă substanța de referință nu se degradează în intervalul de timp prevăzut (pentru anilină și benzoat de sodiu, în mod normal, mai puțin de două săptămâni), validitatea testului poate fi pusă sub semnul întrebării și trebuie verificată sau, alternativ, testul se repetă cu un nou eșantion de apă. Într-un test interlaboratoare ISO al metodei, la care au participat șapte laboratoare din Europa, constantele adaptate ale vitezei de degradare pentru anilină s-au situat în intervalul 0,3-1,7 zi–1, cu o medie de 0,8 zi–1 la 20 oC și o eroare standard de ± 0,4 zi–1 (t½ = 0,9 zile). Timpii de latență tipici s-au situat între 1 și 7 zile. Pentru apele examinate a fost raportată o biomasă bacteriană corespunzând la 103-104 unități formatoare de colonii (UFC) per ml. Vitezele de degradare în apele central-europene bogate în nutrienți au fost mai mari decât în apele oligotrofe nordice, ceea ce se poate datora stării trofice diferite sau expunerii anterioare la substanțe chimice.
Recuperarea totală (bilanțul masic) la sfârșitul experimentului trebuie să fie cuprinsă între 90 % și 110 % pentru substanțele marcate radioactiv, în timp ce recuperarea inițială la începutul experimentului trebuie să fie cuprinsă între 70 % și 110 % pentru substanțele nemarcate. Cu toate acestea, intervalele indicate se interpretează doar ca ținte și nu se folosesc drept criterii de acceptare a testului.
3. RAPORT DE TESTARE
Tipul studiului (test pelagic sau pe sedimente în suspensie) se indică clar în raportul de testare, care va mai conține cel puțin următoarele informații:
Substanță(e) de testat și de referință:
— denumirile uzuale, numele substanțelor chimice (se recomandă numele IUPAC și/sau CAS), numerele CAS, formulele structurale (indicând poziția 14C dacă se folosește substanță marcată radioactiv) și proprietățile fizico-chimice relevante ale substanței de testat și de referință (a se vedea punctele 1.5 și 1.6);
— numele substanțelor chimice, numerele CAS, formulele structurale (indicând poziția 14C dacă se folosește substanță marcată radioactiv) și proprietățile fizico-chimice relevante ale substanțelor folosite ca standarde de identificare sau cuantificare a produșilor de transformare;
— puritatea (impuritățile) substanțelor de testat și de referință;
— puritatea radiochimică a substanței chimice marcate și activitatea specifică (dacă este cazul).
Apa de suprafață:
Se furnizează cel puțin următoarele informații despre eșantionul de apă:
— locația și descrierea locului de recoltare, inclusiv, dacă este posibil, istoricul contaminărilor;
— data și locul colectării eșantionului;
— nutrienți (N total, amoniu, azotit, azotat, P total, ortofosfat dizolvat);
— adâncimea de colectare;
— aspectul eșantionului (de exemplu culoare și turbiditate);
— DOC și COT;
— CBO;
— temperatura și pH-ul la momentul colectării;
— prezența oxigenului sau potențialul redox (obligatoriu doar dacă nu sunt evidente condiții aerobe);
— salinitatea sau conductivitatea (în cazul apei de mare sau al apei salmastre);
— solide în suspensie (în cazul unui eșantion tulbure);
— posibil, alte informații relevante despre locația de recoltare în momentul colectării (de exemplu informații actuale sau istorice despre viteza de curgere a râurilor sau a curentelor marine, deversările importante apropiate și tipul de deversare, condițiile meteorologice anterioare momentului recoltării);
și opțional:
— biomasa microbiană (de exemplu aprecierea directă a oranjului de acridină sau a unităților formatoare de colonii);
— carbonul anorganic;
— concentrația de clorofilă-a ca indicator specific al biomasei algelor.
În plus, dacă se efectuează testul pe sedimente suspendate, se furnizează următoarele informații despre sedimente:
— adâncimea de colectare a sedimentelor;
— aspectul sedimentului (colorat, noroios, nămolos sau nisipos);
— textura (de exemplu procentul de nisip grunjos, nisip fin, nămol și argilă);
— greutatea uscată în g/l a solidelor în suspensie, concentrația COT sau pierderea de greutate la calcinare ca metodă de măsurare a conținutului materiei organice;
— pH;
— prezența oxigenului sau potențialul redox (obligatoriu doar dacă nu sunt evidente condiții aerobe).
Condițiile de testare:
— intervalul între colectare și folosire în testul de laborator, păstrarea eșantionului și pretratarea eșantionului, datele efectuării studiilor;
— cantitatea de substanță de testat aplicată, concentrația de testare și substanța de referință;
— metoda de aplicare a substanței de testat, inclusiv folosirea de solvenți;
— volumul de apă de suprafață și de sedimente folosite (dacă sunt folosite) și volumul recoltat pentru analiză la fiecare moment;
— descrierea sistemului de testare folosit.
Dacă nu se păstrează întunericul, informații despre condițiile de „iluminare difuză”;
— informații despre metoda (metodele) folosite pentru stabilirea etaloanelor sterile (de exemplu temperatură, perioadă și număr de autoclavări);
— temperatura de incubare;
— informații despre tehnicile analitice și metoda (metodele) folosite pentru măsurătorile radiochimice, precum și pentru verificarea bilanțului masic și măsurarea distribuției fazice (dacă este cazul);
— numărul de duplicate.
Rezultate:
— procentele de recuperare (a se vedea punctul 1.7.1);
— repetabilitatea și sensibilitatea metodelor analitice folosite, inclusiv limita de detecție (LOD) și limita de cuantificare (LOQ) (a se vedea punctul 1.7.2);
— toate datele măsurate (inclusiv punctele de recoltare) și valorile calculate în formă tabelară, precum și curbele de degradare; pentru fiecare concentrație de testare și pentru fiecare recipient duplicat se raportează coeficientul de corelație lineară pentru panta logaritmică, faza de latență estimată și o constantă a vitezei de prim ordin sau pseudo-prim ordin (dacă este posibil) și timpul de înjumătățire corespunzător al degradării (sau perioada de înjumătățire, t50);
— valorile relevante se raportează ca medii ale rezultatelor observate la duplicatele individuale, cum ar fi durata fazei de latență, constanta vitezei degradării și timpul de înjumătățire a degradării (sau t50);
— sistemul este clasificat ca neadaptat sau adaptat pe baza aspectului curbei de degradare și a posibilei influențe a concentrației de testare;
— rezultatele verificării bilanțului masic final și rezultatele măsurării distribuției fazice (dacă există);
— fracțiunea 14C mineralizat și, dacă se folosesc analize specifice, nivelul final de degradare primară;
— identificarea, concentrația molară și procentajul de produși aplicați și produși majori de transformare (a se vedea punctul 1.8.9.5 primul paragraf), dacă este cazul;
— propunerea unei căi de transformare, dacă este cazul;
— discutarea rezultatelor.
4. REFERINȚE BIBLIOGRAFICE
1. OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test.
2. ISO/DIS 14592-1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions.
3. Metoda de testare C.23. Transformarea aerobă și anaerobă în sol.
4. Metoda de testare C.24. Transformarea aerobă și anaerobă în sedimente acvatice.
5. OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris.
6. ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
7. ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
8. OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22.
9. Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394-401.
10. Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274-283.
11. ISO/CD 14592-1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions.
Apendicele 1
Distribuția fazică a 14C
În scopul verificării procedurii, măsurătorile de rutină ale activității 14C organice totale (TOA) reziduale se completează cu măsurările bilanțului masic care presupun o determinare directă a 14CO2 degajat după captarea într-un absorbant (a se vedea apendicele 3). Formarea de 14CO2 este, în sine, o probă directă a biodegradării în contrast cu degradarea abiotică sau alte mecanisme de pierdere, cum ar fi volatilizarea sau absorbția. Informații utile suplimentare ce caracterizează biodegradabilitatea pot fi obținute în urma măsurării distribuției TOA între starea dizolvată (activitatea 14C organic dizolvat, DOA) și starea sub formă de particule (activitatea 14C sub formă de particule, POA) după separarea particulelor prin filtrarea prin membrană sau centrifugare. POA constă în substanță de testat absorbită în biomasa microbiană și în alte particule pe lângă carbonul substanței de testat care a fost folosit pentru sinteza noului material celular și, prin urmare, încorporat în fracțiunea biomasei sub formă de particule. Formarea de material organic 14C dizolvat poate fi estimată ca DOA la sfârșitul biodegradării (platou al curbei degradării în funcție de timp).
Distribuția fazică a 14C rezidual din eșantioanele selectate se estimează prin filtrarea acestora printr-o membrană filtrantă de 0,22 μm sau 0,45 μm dintr-un material care nu adsoarbe cantități semnificative ale substanței de testat (de exemplu filtrele din policarbonat). Dacă cantitatea de substanță de testat absorbită în filtru este prea mare pentru a fi neglijată (a se verifica înainte de experiment), în locul filtrării poate fi folosită metoda centrifugării la viteză mare (2 000 g; 10 min).
Filtratul sau centrifugatul se tratează conform metodei pentru eșantioane nefiltrate din apendicele 3. Membranele filtrante se dizolvă în fluid de scintilație corespunzător și se face numărarea în mod obișnuit, atenuarea fiind corectată de obicei doar prin folosirea metodei raportului față de standardul extern sau prin oxidarea eșantionului. Dacă s-a folosit metoda centrifugării, granulele formate din fracțiunea sub formă de particule se suspendă din nou în 1-2 ml de apă distilată și se transferă într-un flacon de scintilație. Se spală ulterior de două ori cu câte 1 ml apă distilată, care se transferă apoi în flacon. Dacă este necesar, suspensia poate fi introdusă într-un gel pentru numărarea scintilației lichide.
Apendicele 2
Procedura semicontinuă
Pentru degradarea substanțelor rezistente poate fi necesară o incubație prelungită, de până la câteva luni. În mod normal, durata testului nu trebuie să depășească 60 de zile, cu excepția cazului când caracteristicile eșantionului original de apă se mențin prin reînnoirea suspensiei de testat. Cu toate acestea, dacă substanța testată a început să se degradeze în primele 60 de zile, perioada de testare poate fi extinsă la cel mult 90 de zile fără reînnoirea suspensiei de testat.
În timpul incubației pentru perioade lungi, diversitatea populației microbiene poate să fie redusă ca urmare a diverse mecanisme de pierdere și a posibilei epuizări a nutrienților necesari și a substraturilor primare de carbon din eșantionul de apă. Se recomandă, prin urmare, efectuarea unui test semicontinuu în scopul determinării corecte a vitezei de degradare a substanțelor lent degradabile. Testul se inițiază prin folosirea procedurii semicontinue dacă, pe baza experienței anterioare, se crede că va fi necesară o perioadă de incubație de trei luni pentru obținerea unui procent de degradare a substanței de 20 %. Alternativ, dacă nu a avut loc degradarea substanței testate în aproximativ 60 de zile de testare prin metoda în serii, acesta poate fi modificat într-un test semicontinuu. Dacă a fost înregistrată o degradare substanțială (de exemplu > 20 %), procedura semicontinuă poate fi întreruptă, iar testul continuat ca experiment în serii.
În testul semicontinuu, la fiecare două săptămâni, aproximativ 1/3 din volumul suspensiei de testat se înlocuiește cu apă proaspăt colectată, substanța testată adăugându-se la concentrația inițială. În mod similar, dacă s-a efectuat testul opțional pe sedimente în suspensie, sedimentul se adaugă la apa de înlocuire până la atingerea concentrației inițiale (între 0,01 și 1 g/l). În ceea ce privește desfășurarea testului cu solide de sediment în suspensie, este important ca sistemul să fie menținut în suspensie completă și în timpul reînnoirii apei, iar timpul de reținere să fie identic pentru solide și apă, în caz contrar putându-se pierde similaritatea dorită cu un sistem omogen apos fără faze fixe. Din aceste motive, când se folosește procedura semicontinuă, se preferă o concentrație inițială a sedimentelor în suspensie aflată în intervalul inferior al domeniului specificat.
Adăugarea recomandată de substanță de testat presupune că concentrația inițială a substanței de testat nu este depășită de reînnoirea parțială a suspensiei de testat și, prin urmare, se evită adaptarea (care are loc frecvent la o concentrație mare a substanței de testat). Deoarece procedura include atât reinocularea, cât și compensarea nutrienților și substraturilor primare epuizate, diversitatea microbiană originală este refăcută, iar durata testului poate fi extinsă, în principiu, la infinit. Este important de observat că, atunci când se folosește procedura semicontinuă, concentrația reziduală a substanței de testat trebuie să fie corectată în funcție de cantitățile substanței de testat adăugate și îndepărtate la fiecare procedură de reînnoire. Concentrația de substanță de testat totală și dizolvată poate fi folosită alternativ pentru compușii slab absorbanți. Absorbția este nesemnificativă (< 5 %) în condițiile specificate (0,1-1 g solide/l) pentru substanțe cu log Kow < 3 (valabil pentru compuși neutri și lipofilici). Acest aspect este ilustrat prin următorul exemplu de calcul. 0,1 g/l de solide corespund aproximativ la 10 mg de carbon per litru (fracțiunea de carbon, fC = 0,01). Presupunând că:
Log Kow (din substanța de testat) = 3
Koc = 0,42 × Kow
Coeficient de partiție, Kd = fC × Koc
atunci fracțiunea dizolvată din concentrația totală C-apă (Cw)/C-total (Ct) este:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999
Apendicele 3
Determinarea 14CO2
Determinarea indirectă a 14CO2
În mod normal, pentru măsurătorile de rutină, metoda indirectă este cea mai rapidă și precisă metodă dacă substanța de testat este nevolatilă și nu se transformă în produși de transformare volatili. Se transferă eșantioane nefiltrate (de 5 ml) în flacoane de scintilație. Un nivel inițial adecvat al activității în eșantioane este de 5 000 dpm-10 000 dpm (80-170 Bq), iar activitatea inițială minimă este de aproximativ 1 000 dpm. CO2 se elimină după acidifiere la pH 2-3 cu 1-2 picături de H3PO4 sau HCl concentrat. Eliminarea CO2 poate fi efectuată prin barbotare cu aer timp de aproximativ ½-1 oră. Alternativ, flacoanele pot fi agitate cu putere timp de 1-2 ore (de exemplu pe un agitator pentru microplăci) sau lent, peste noapte. Eficiența procedurii de eliminare a CO2 se verifică (prin prelungirea perioadei de aerisire sau agitare). Se adaugă apoi un lichid de scintilație adecvat pentru numărarea eșantioanelor apoase, eșantionul se omogenizează pe un mixer turbionar, iar radioactivitatea se determină prin cuantificarea scintilației lichidului, scăzând activitatea de fond determinată în probele martor de testat (FB). Cu excepția cazului când apa de testat este foarte colorată sau conține o concentrație mare de particule, eșantioanele vor manifesta o atenuare uniformă, aceasta fiind suficientă pentru efectuarea corecțiilor atenuării folosind un standard extern. Dacă apa de testat este foarte colorată, corectarea atenuării se poate efectua cu ajutorul adăugării unui standard intern. Dacă concentrația particulelor este mare, nu este posibilă obținerea unei soluții sau gel omogen, variația atenuării între eșantioane fiind mare în caz contrar. În acest caz, poate fi folosită metoda de numărare pentru mâlurile de testare, descrisă mai jos. Dacă testul se desfășoară ca test pe sedimente în suspensie, măsurarea 14CO2 poate avea loc indirect, prin extragerea unui eșantion omogen de 10 ml apă/suspensie de testare și separarea fazelor prin centrifugare la o viteză corespunzătoare (de exemplu la 40 000 m/s2 timp de 15 minute). Faza apoasă se tratează apoi conform procedurii descrise mai sus. Activitatea 14C în faza de particule (POA) se determină prin resuspendarea sedimentului într-un volum mic de apă distilată, transferarea în flacoane de scintilație și adăugarea de lichid de scintilație pentru formarea unui gel (în acest scop, sunt disponibile lichide speciale de scintilație). În funcție de natura particulelor (de exemplu conținutul lor de material organic), eșantionul poate fi digerat în timpul nopții cu ajutorul unui dizolvant de țesuturi și apoi omogenizat pe un mixer turbionar înainte de adăugarea lichidului de scintilație. Alternativ, POA poate fi determinat prin combustie în exces de oxigen, folosind un oxidant al eșantionului. Pentru cuantificare, se includ întotdeauna standarde interne, corectarea atenuării putând fi efectuată, dacă este necesar, prin adăugarea unui standard intern pentru fiecare eșantion individual.
Determinarea directă a 14CO2
Dacă 14CO2 degajat este măsurat direct, aceasta se realizează prin folosirea unui număr mai mare de recipiente la începutul testului, recoltarea conținutului recipientelor de testare la fiecare punct de măsurare prin acidifierea recipientelor de testare la pH de 2-3 și captarea 14CO2 într-un absorbant intern (introdus în fiecare recipient de testare la începutul testului) sau extern. Ca mediu absorbant se pot folosi hidroxizi alcalini (de exemplu soluție 1 N de NaOH sau o granulă de NaOH), etanolamină sau absorbanți pe bază de etanolamină disponibili în comerț. Pentru măsurarea directă a 14CO2, recipientele se astupă (de exemplu cu o membrană din cauciuc butilic).
Figura 1a
Exemplu de reprezentare aritmetică a datelor (activitatea reziduală în funcție de timp)

Figura 1b
Exemplu de reprezentare semilogaritmică a datelor (ln al activității reziduale în funcție de timp)

C.26. TEST DE INHIBARE A CREȘTERII SPECIEI LEMNA
1. METODĂ
Prezenta metodă este echivalentă cu orientările OECD privind testele nr. 221 (2006)(1). La nivelul autorităților din statele membre ale UE există consens cu privire la faptul că testele pe Lemna constituie o soluție acceptabilă de substituție pentru testele pe alge pentru substanțele puternic colorate (2)(3).
1.1. INTRODUCERE
Prezenta metodă de testare este concepută pentru a evalua toxicitatea substanțelor față de plantele acvatice de apă dulce din genul Lemna (lintiță). Se bazează pe orientările (4)(5)(6)(7)(8)(9) existente, dar include modificări ale acestor metode pentru a reflecta cercetările și consultările recente într-un număr de aspecte cheie. Metoda propusă a fost validată printr-un test interlaboratoare internațional (10).
Prezenta metodă de testare descrie testarea toxicității prin folosirea Lemna gibba și Lemna minor, care au fost ambele studiate pe larg și fac obiectul standardelor menționate mai sus. Taxonomia speciilor de Lemna este dificilă, fiind complicată de existența unei game largi de fenotipuri. Deși în cazul Lemna se poate manifesta variabilitate genetică în ceea ce privește răspunsul față de substanțele toxice, în prezent nu există date suficiente despre această sursă de variabilitate pentru a se recomanda folosirea unei anumite clone pentru această metodă de testare. Trebuie reținut că testul nu se desfășoară în condiții axenice, dar sunt luate măsuri de reducere la minimum a contaminării cu alte organisme în timpul procedurii de testare.
Sunt descrise detaliile privind testarea cu reînnoire (semistatică și în regim dinamic) și fără reînnoire (statică) a soluției de testat. În funcție de obiectivele testului și de cerințele de reglementare, se recomandă aplicarea metodei semistatice și a metodei dinamice, de exemplu pentru substanțe care se pierd cu rapiditate din soluție ca urmare a volatilizării, fotodegradării, precipitării sau biodegradării. Alte îndrumări sunt disponibile la nota (11).
1.2. DEFINIȚII
Următoarele definiții și prescurtări se folosesc în cadrul prezentei metode de testare:
Biomasă: este greutatea uscată a materiei vii prezente într-o populație. În prezentul test, înlocuitorii pentru biomasă, cum ar fi numărul de fronde sau suprafața frondelor, se măsoară de obicei, iar folosirea termenului „biomasă” se referă așadar și la măsurarea acestor înlocuitori.
Cloroză: este îngălbenirea țesutului frondei.
Clon: este un organism sau celulă provenind de la un singur individ prin reproducere asexuată. Indivizii din același clon sunt, prin urmare, identici din punct de vedere genetic.
Colonie: înseamnă un agregat de fronde mamă și fiică (de obicei, între 2-4) atașate unele de altele. Uneori, este denumită plantă.
ECx : este concentrația substanței de testat dizolvate în mediul de testare care rezultă în x % (de exemplu 50 %) reducere în creșterea Lemna într-o anumită perioadă de expunere (care se menționează explicit în cazul în care deviază de la durata de testare completă sau normală). Pentru a se reprezenta în mod clar o valoare EC derivată din viteza de creștere sau randament, se folosesc simbolurile „ErC” pentru viteza de creștere, respectiv „EyC” pentru randament, urmate de variabila de măsurare folosită, de exemplu ErC (numărul de fronde).
Test în regim dinamic: este un test în care soluțiile de testat sunt înlocuite continuu.
Frondă: desemnează aparatul vegetativ al lintiței redus la o lamelă individuală, având forma unei frunze. Este cea mai mică unitate (individ) capabilă de reproducere.
Gibozitate: înseamnă fronde care prezintă o proeminență sau umflătură.
Creștere: este o sporire a variabilei de măsurare, cum ar fi numărul frondelor, greutatea uscată, greutatea umedă sau suprafața frondelor, în perioada de testare.
Viteza de creștere (viteza medie specifică de creștere): este creșterea logaritmică a biomasei în timpul perioadei de expunere.
Concentrația minimă cu efect observabil (CMEO): este cea mai scăzută concentrație testată la care se observă că substanța are un efect semnificativ din punct de vedere statistic asupra creșterii (la p < 0,05) în comparație cu lotul martor, la un anumit timp de expunere. Toate concentrațiile testate mai mari decât CMEO trebuie să aibă efect nociv egal sau mai mare decât cel observat la CMEO. Dacă aceste două condiții nu pot fi satisfăcute, se va furniza o explicație completă privind modul în care a fost selectat CMEO (și, prin urmare, CFEO).
Variabile de măsurare: sunt orice tipuri de variabile care se măsoară pentru a exprima punctul stoechiometric prin folosirea uneia sau a mai multor variabile de răspuns diferite. În prezenta metodă, numărul de fronde, suprafața frondelor, greutatea în stare proaspătă și greutatea uscată sunt variabile de măsurare.
Monocultură: este o cultură cu o singură specie de plante.
Necroză: este un țesut al frondei mort (alb sau îmbibat în apă).
Concentrația fără efecte observabile (CFEO): este concentrația testată imediat sub valoarea CMEO.
Fenotip: este caracteristica observabilă a unui organism determinată de interacțiunea genelor sale cu mediul său înconjurător.
Variabile de răspuns: sunt variabile pentru estimarea toxicității derivate din orice variabile măsurate care descriu biomasa prin diferite metode de calcul. În cazul acestei metode, vitezele de creștere și randamentul sunt variabile de răspuns derivate din variabile de măsurare precum numărul frondelor, suprafața frondelor, greutatea în stare proaspătă sau greutatea uscată.
Test semistatic (cu reînnoire): este un test în care soluția de testat se înlocuiește periodic, la intervale specifice în timpul testului.
Test static: este o metodă de testare care nu presupune reînnoirea soluției de testat în timpul testului.
Punct stoechiometric: descrie factorul general care va fi modificat de către substanța chimică testată, în funcție de proba martor, acesta fiind obiectivul testului. În prezenta metodă, punctul stoechiometric este inhibarea creșterii, care poate fi exprimată prin diferite variabile de răspuns bazate pe una sau mai multe variabile de măsurare.
Mediu de testare: este mediul de cultură complet sintetic în care plantele testate cresc când sunt expuse la substanța de testat. În mod normal, substanța de testat se dizolvă în mediul de testare.
Randament: este valoarea unei variabile de măsurare pentru exprimarea biomasei la sfârșitul perioadei de expunere minus variabila de măsurare la începutul perioadei de expunere.
1.3. PRINCIPIUL TESTULUI
Culturile de plante cu creștere exponențială din genul Lemna se lasă să crească în monoculturi, cu diferite concentrații ale substanței testate, timp de șapte zile. Obiectivul testului este de a cuantifica efectele substanței asupra creșterii vegetative în această perioadă, pe baza evaluărilor variabilelor de măsurare selectate. Numărul frondelor este variabila de măsurare principală. Se mai măsoară cel puțin încă o variabilă de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă), deoarece unele substanțe pot afecta alte variabile de măsurare considerabil mai mult decât numărul frondelor. Pentru cuantificarea efectelor substanței, creșterea în soluțiile de testat se compară cu cea a probelor martor, fiind determinată concentrația care provoacă o inhibare specificată de x % a creșterii (de exemplu 50 %) și exprimată ca ECx (de exemplu EC50).
Punctul stoechiometric este inhibarea creșterii, exprimată ca creștere logaritmică a variabilei de măsurare (viteza medie specifică de creștere) în timpul perioadei de expunere. Concentrația care provoacă o inhibare a vitezei de creștere specificată de x % (de exemplu 50 %) și exprimată ca ErCx (de exemplu ErC50) se determină din vitezele specifice medii de creștere înregistrate pentru o serie de soluții de testat.
O variabilă de răspuns suplimentară folosită în prezenta metodă de testare este randamentul, care poate fi necesar pentru îndeplinirea unor cerințe de reglementare specifice din unele țări. Acesta se definește ca variabilele de măsurare la sfârșitul perioadei de expunere minus variabilele de măsurare la începutul perioadei de expunere. Concentrația care provoacă o inhibare specificată de x % (de exemplu 50 %) a randamentului se calculează și se exprimă ca EyCx (de exemplu EyC50) pe baza randamentului înregistrat pentru o serie de soluții de testat.
În plus, concentrația minimă cu efect observabil (CMEO) și concentrația fără efecte observabile (CFEO) se pot determina statistic.
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Este necesară o metodă analitică cu sensibilitate specifică pentru cuantificarea substanței în mediul de testare.
Informațiile referitoare la substanța de testare, care pot fi utile pentru stabilirea condițiilor de testare, includ formula structurală, puritatea, solubilitatea în apă, stabilitatea în apă și la lumină, pKa, Kow, presiunea de vapori și biodegradabilitatea. Solubilitatea în apă și presiunea de vapori pot fi folosite pentru a calcula constanta legii lui Henry, care va arăta dacă sunt probabile pierderi semnificative ale substanței de testat în perioada de testare. Aceasta va indica dacă este necesară adoptarea anumitor măsuri pentru limitarea unor astfel de pierderi. Dacă informațiile privind solubilitatea și stabilitatea substanței de testat sunt incerte, se recomandă ca acestea să fie evaluate în condițiile testului, cum ar fi mediul de creștere, temperatura sau condițiile de iluminare din test.
Când este importantă controlarea pH-ului mediului de testare, de exemplu în cursul testării unor metale sau substanțe instabile din punct de vedere hidrolitic, se recomandă adăugarea unei substanțe tampon în mediul de creștere (a se vedea punctul 1.7.4 primul paragraf). Îndrumări suplimentare privind substanțele de testare cu proprietăți fizico-chimice care le fac dificil de testat sunt prezentate la nota (11).
1.5. SUBSTANȚA DE REFERINȚĂ
Substanța (substanțele) de referință folosită (folosite) în testul internațional interlaboratoare (10), cum ar fi 3-5 diclorofenol, poate (pot) fi testată (testate) ca mijloc de validare a procedurii de testare. Este recomandabil ca o substanță de referință să fie testată de cel puțin două ori pe an sau, dacă testarea se desfășoară la o frecvență mai joasă, în paralel cu determinarea toxicității unei substanțe de testat.
1.6. VALIDITATEA TESTULUI
Pentru ca un test să fie valid, perioada de dublare a numărului de fronde în proba de control trebuie să fie mai mică de 2,5 zile (60 de ore), corespunzând unei creșteri de aproximativ șapte ori într-o perioadă de șapte zile și unei viteze medii specifice de creștere de 0,275 zi–1. Folosind mediul și condițiile de testare descrise în prezenta metodă de testare, acest criteriu poate fi îndeplinit prin folosirea unui test static (8). Se consideră că acest criteriu poate fi îndeplinit în condiții de testare semistatică și dinamică. Calculul perioadei de dublare este prezentat la punctul 2.1.
1.7. DESCRIEREA METODEI
1.7.1. Aparatură
Toate echipamentele care intră în contact cu mediile de testare trebuie să fie confecționate din sticlă sau alt material chimic inert. Recipientele de sticlă folosite pentru cultură și testare trebuie să fie sterile și curățate de contaminanții chimici care se pot infiltra în mediul de testare. Vasele de testare trebuie să fie suficient de largi pentru ca frondele din diferitele colonii aflate în vasele de control să crească fără a se suprapune la sfârșitul testului. Nu este important dacă rădăcinile ating baza vaselor de testare, dar se recomandă o adâncime minimă de 20 mm și un volum minim de 100 ml în fiecare vas. Tipul de vase de testare nu influențează desfășurarea testului atât timp cât se respectă aceste cerințe. Pot fi folosite pahare de laborator, vase de cristalizare sau plăci Petri din sticlă de dimensiuni corespunzătoare. Vasele de testare trebuie să fie acoperite pentru a se reduce la minimum evaporarea și contaminarea accidentală, permițând în același timp trecerea aerului. Vasele de testare corespunzătoare, în special capacele, trebuie să prevină formarea umbrei sau modificarea caracteristicilor spectrale ale luminii.
Culturile și vasele de testare nu se păstrează în același loc. Această condiție poate fi îndeplinită prin folosirea unor spații, incubatoare sau camere de creștere care reproduc condițiile de mediu. Iluminarea și temperatura trebuie să fie controlabile și menținute la un nivel constant (a se vedea punctul 1.7.8).
1.7.2. Organismul de testare
Organismul folosit pentru acest test este Lemna gibba sau Lemna minor. Scurte descrieri ale speciilor de lintiță care au fost folosite pentru testarea toxicității sunt prezentate în apendicele 1. Plantele pot fi obținute dintr-o colecție de culturi, de la un alt laborator sau de pe teren. Dacă sunt colectate de pe teren, plantele se mențin în cultură într-un mediu similar cu cel folosit pentru testare timp de cel puțin opt săptămâni înainte de utilizare. Terenurile de pe care s-au colectat culturile inițiale trebuie să fie lipsite de surse vizibile de contaminare. Dacă au fost obținute de la un alt laborator sau dintr-o colecție de culturi, se vor menține în condiții similare timp de cel puțin trei săptămâni. Sursa plantelor, a speciilor și a clonului (dacă se cunoaște) folosite pentru testare se raportează întotdeauna.
Se vor folosi monoculturi care sunt vizibil necontaminate cu alte organisme, cum ar fi alge sau protozoare. Plantele sănătoase de L. minor vor consta în colonii cuprinzând între două și cinci fronde, în timp ce coloniile sănătoase de L. gibba pot conține până la șapte fronde.
Calitatea și uniformitatea plantelor folosite pentru testare vor avea o influență semnificativă asupra rezultatului testului și, prin urmare, se vor selecta cu atenție. Se vor folosi plante tinere, cu creștere rapidă, fără leziuni sau decolorări vizibile (cloroză). Culturile de bună calitate sunt indicate de numărul mare de colonii cuprinzând cel puțin două fronde. Un număr mare de fronde unice indică stres ambiental, cum ar fi o cantitate redusă de nutrienți, iar plantele din astfel de culturi nu se folosesc pentru testare.
1.7.3. Cultură
În scopul reducerii frecvenței de întreținere a culturii (de exemplu în situațiile în care nu sunt prevăzute teste cu Lemna pentru o anumită perioadă), culturile pot fi menținute în condiții de iluminare și temperatură scăzută (4-10 °C). Detalii privind culturile sunt prezentate în apendicele 2. Semnele vizibile de contaminare cu alge sau alte organisme necesită sterilizarea la suprafață a unui subeșantion de fronde de Lemna, urmată de transferul către un mediu proaspăt (a se vedea apendicele 2). În această situație, restul culturii contaminate se elimină.
Cu cel puțin șapte zile înainte de testare, se transferă un număr suficient de colonii în condiții aseptice într-un mediu steril proaspăt și se cultivă timp de 7-10 zile în condiții similare cu cele ale testului.
1.7.4. Mediul de testare
Pentru Lemna minor și Lemna gibba se recomandă medii diferite, conform descrierii de mai jos. Se va examina cu atenție includerea unei soluții tampon de pH în mediul de testare [MOPS (acid 4-morfolinpropansulfonic, CAS No: 1132-61-2; EINECS No: 214-478-5) în mediul L. minor și de NaHCO3 în mediul L. gibba] când se suspectează că va reacționa cu substanța de testat și va influența toxicitatea acesteia. Mediul Steinberg (12) este acceptabil dacă se îndeplinesc criteriile de validitate.
Pentru cultura și testarea cu L. minor se recomandă o modificare a mediului de creștere a Lemna prevăzut de standardul suedez (SIS). Compoziția acestui mediu este prezentată în apendicele 3.
Mediul de creștere 20X-AAP, descris în apendicele 3, este recomandat pentru cultura și testarea cu L. gibba.
Mediul Steinberg descris în apendicele 3 este, de asemenea, adecvat pentru L. minor, dar poate fi folosit și pentru L. gibba dacă se îndeplinesc criteriile de validitate.
1.7.5. Soluții de testat
Soluțiile de testat se prepară de obicei prin diluarea unei soluții mamă. Soluțiile mamă ale substanțelor de testat se prepară de preferință prin dizolvarea substanței în mediul de cultură.
Concentrația maximă testată a substanței de testat nu trebuie să depășească de preferință limita de solubilitate în apă a substanței în condițiile de testare. Cu toate acestea, trebuie remarcat că speciile de Lemna plutesc la suprafață și pot fi expuse la substanțe care se acumulează la interfața apă-aer (de exemplu substanțe cu solubilitate scăzută în apă, hidrofobe sau tensioactive). În astfel de circumstanțe, expunerea va rezulta de la alte materiale decât cele din soluție, iar concentrațiile de testare pot depăși nivelul de solubilitate în apă, în funcție de caracteristicile substanței de testat. În cazul substanțelor de testat cu solubilitate scăzută în apă, poate fi necesară prepararea unei soluții mamă concentrate sau dispersia substanței folosind un solvent sau agent de dispersie organic, pentru a facilita adăugarea de cantități exacte de substanță de testat în mediul de testare și a favoriza dispersia și dizolvarea sa. Se vor depune toate eforturile pentru evitarea folosirii unor astfel de materiale. Nu se vor folosi solvenți sau agenți de dispersie suplimentari în urma cărora să rezulte fitotoxicitate. De exemplu, solvenții obișnuiți care nu provoacă fitotoxicitate la concentrații de până la 100 μl·l–1 includ acetona și dimetilformamida. Dacă se folosește un solvent sau agent de dispersie, concentrația sa finală se raportează și se menține la minimum (≤ 100 μl·l–1), iar toate tratamentele și loturile martor trebuie să conțină aceeași concentrație de solvent sau agent de dispersie. Îndrumări suplimentare privind folosirea agenților de dispersie sunt prezentate la nota (11).
1.7.6. Grupele experimentale și cele martor
Cunoașterea prealabilă a toxicității substanței de testat față de Lemna, de exemplu ca urmare a unui test pentru stabilirea intervalului, va permite alegerea concentrațiilor potrivite de testare. În testul principal de stabilire a toxicității trebuie să existe cel puțin cinci concentrații de testare dispuse în serie geometrică. Se preferă ca factorul de separare între concentrațiile de testare să nu depășească 3,2, dar se poate folosi o valoare mai mare în cazul în care curba concentrație-răspuns este plană. În cazul în care se utilizează mai puțin de cinci concentrații, se vor aduce argumente pentru aceasta. Pentru fiecare concentrație de testare se folosesc cel puțin trei duplicate.
La stabilirea intervalului de concentrații de testare (pentru testul de stabilire a intervalului și/sau testul principal de stabilire a toxicității), trebuie să se rețină următoarele:
— pentru determinarea unui ECx, concentrațiile de testare trebuie să încadreze valoarea ECx în scopul asigurării unui nivel de încredere adecvat. De exemplu, dacă se estimează EC50, concentrația maximă testată trebuie să fie mai mare decât valoarea EC50. Dacă valoarea EC50 se află în afara intervalului concentrațiilor de testare, intervalele de încredere aferente vor fi mari și există riscul ca evaluarea corectă a adecvării statistice a modelului să nu fie posibilă;
— dacă se urmărește estimarea CMEO/CFEO, concentrația cea mai mică de testare trebuie să fie suficient de mică, astfel încât creșterea să nu fie cu mult mai mică decât cea a probei martor. În plus, concentrația maximă testată trebuie să fie suficient de mare pentru ca creșterea să fie cu mult mai mică decât cea a probei martor. Dacă nu este așa, testul se va repeta folosind un interval diferit de concentrații (cu excepția cazului în care cea mai mare concentrație se află la limita solubilității sau la concentrația limită maximă cerută, de exemplu 100 mg·l–1).
Fiecare test trebuie să includă probe martor constând în mediu nutritiv, număr de fronde și colonii, condiții ambientale și proceduri similare celor din vasele de testare, dar fără substanța de testat. Dacă se folosește un solvent sau agent de dispersie suplimentar, se va include o tratare suplimentară a probei martor cu acest solvent/agent de dispersie, prezent în aceeași concentrație cu cea din vasele cu substanța de testat. Numărul vaselor de control cu probe duplicat (și vasele cu solvenți, dacă este cazul) trebuie să fie cel puțin egal cu numărul de vase folosite pentru fiecare concentrație de testare; în mod ideal acest număr va fi de două ori mai mare.
Dacă determinarea CFEO nu este necesară, testul poate fi modificat în sensul creșterii numărului de concentrații și reducerii numărului de duplicate per concentrație. Cu toate acestea, numărul de duplicate martor trebuie să fie de cel puțin trei.
1.7.7. Expunere
Coloniile constând în 2-4 fronde vizibile se transferă din cultura de inocul și se distribuie aleatoriu în vasele de testare în condiții aseptice. Fiecare vas de testare va conține un total de 9-12 fronde. Numărul de fronde și colonii va fi același în fiecare vas de testare. Experiența dobândită în urma aplicării acestei metode și a testului interlaboatoare a indicat că folosirea a trei duplicate per tratament, fiecare duplicat conținând inițial 9-12 fronde, este suficientă pentru a detecta diferențe de creștere de aproximativ 4-7 % inhibare calculată în funcție de viteza de creștere (10-15 % calculată în funcție de randament) între tratamente (10).
Vasele de testare vor fi poziționate aleatoriu în incubator pentru a se minimiza influența diferențelor spațiale în intensitatea luminii sau în temperatură. Este nevoie, de asemenea, de o dispunere fixă sau aleatoare a vaselor (sau o repoziționare mai frecventă) atunci când se fac observații.
Dacă un test preliminar de stabilitate arată că nu poate fi menținută concentrația substanței de testat (concentrația măsurată scade sub 80 % din concentrația măsurată inițial) pe durata perioadei de testare (7 zile), se recomandă un test semistatic. În acest caz, coloniile se expun unor soluții proaspăt preparate de testare și soluții martor în cel puțin două ocazii în timpul testului (de exemplu ziua 3 și ziua 5). Frecvența expunerii la un mediu proaspăt va depinde de stabilitatea substanței de testat; pentru menținerea concentrațiilor cât mai aproape de nivelul constant în cazul substanțelor foarte instabile sau volatile, poate fi necesară o frecvență mai mare. În unele situații poate fi necesară o procedură dinamică (11)(13).
Scenariul de expunere prin pulverizare foliară (spray) nu este inclus în prezenta metodă de testare. Pentru aceasta, a se vedea nota (14).
1.7.8. Condiții de incubare
Se va asigura o lumină caldă sau fluorescentă alb-rece, cu o intensitate cuprinsă în intervalul 85-135 μE·m–2·s–1 măsurat în radiație activă fotosintetică (400-700 nm) în puncte aflate la distanțe egale de sursa de lumină cu distanțele la care se află frondele de Lemna (echivalent cu 6 500-10 000 lucși). Diferențele față de intensitatea selectată a luminii în zona de testare nu trebuie să depășească ± 15 %. Metoda de detectare și măsurare a luminii, în special tipul de senzor, va influența valoarea măsurată. Senzorii sferici (care răspund la lumina din toate unghiurile de deasupra și dedesubtul planului de măsurare) și senzorii „cosinus” (care răspund la lumina din toate unghiurile de deasupra planului de măsurare) sunt preferabili senzorilor unidirecționali și vor da valori mai mari pentru o sursă de lumină multipunct de tipul celei descrise aici.
Temperatura din vasele de testare trebuie să fie 24 ± 2 °C. pH-ul mediului de control nu trebuie să aibă o creștere mai mare de 1,5 unități în timpul testului. O deviație de peste 1,5 unități nu va invalida testul dacă se poate demonstra întrunirea criteriilor de validitate. Se va acorda o atenție sporită devierii pH-ului în cazuri speciale, cum ar fi în timpul testării de substanțe sau metale instabile. Pentru îndrumări suplimentare, consultați nota (11).
1.7.9. Durată
Testul se încheie după 7 zile de la transferul plantelor în vasele de testare.
1.7.10. Măsurători și determinări analitice
Numărul frondelor din vasele de testare se determină și se raportează la începutul testului, acordându-se atenție înregistrării frondelor proeminente și distincte. Numărul frondelor cu aspect normal sau anormal se stabilește la începutul testului, cel puțin o dată la fiecare trei zile în timpul perioadei de expunere (de exemplu în cel puțin două ocazii în timpul perioadei de 7 zile), precum și la încheierea testului. Se înregistrează modificările în dezvoltarea plantei, cum ar fi dimensiunea frondei, aspectul, indicațiile de necroză, cloroză sau gibozitate, separarea coloniilor sau pierderea de flotabilitate, precum și cele privind lungimea și aspectul rădăcinii. Se înregistrează, de asemenea, caracteristici semnificative ale mediului de testare (de exemplu prezența de material nedizolvat, creșterea de alge în vasul de testare).
Pe lângă determinările numărului de fronde în timpul testului, se evaluează și efectele substanței de testat asupra uneia (sau mai multor) dintre următoarele variabile de măsurare:
(i) suprafața totală a frondelor;
(ii) greutatea uscată;
(iii) greutatea în stare proaspătă.
Suprafața totală a frondelor are avantajul de a putea fi determinată pentru fiecare vas de testare și de control la începutul, în timpul și la sfârșitul testului. Greutatea uscată sau în stare proaspătă se determină la începutul testului, pe baza unui eșantion al culturii de inocul reprezentativ pentru substanța folosită la începutul testului și la sfârșitul testului, pe baza materialului din fiecare vas de testare și control. Dacă suprafața frondelor nu se măsoară, greutatea uscată este preferată în detrimentul greutății în stare proaspătă.
Suprafața totală a frondelor, greutatea uscată și greutatea în stare proaspătă se determină după cum urmează:
(i) Suprafața totală a frondelor: suprafața totală a frondelor din toate coloniile poate fi determinată prin analiza imaginilor. Se capturează o imagine a vasului de testare și a plantelor cu ajutorul unei camere de fotografiat digitale (de exemplu, prin așezarea vasului pe o cutie iluminată), iar imaginile rezultate se prelucrează digital. Suprafața totală a frondelor dintr-un vas de testare se poate determina prin calibrare cu forme plane de suprafețe cunoscute. Se vor exclude interferențele provocate de marginea vasului de testare. O metodă alternativă mai complicată constă în fotocopierea vasului de testare și a plantelor, decuparea siluetei rezultate a coloniilor și determinarea suprafeței folosind un analizor al suprafeței frunzelor sau hârtie milimetrică. Alte tehnici (de exemplu raportul între greutatea hârtiei corespunzătoare suprafeței siluetei coloniilor și greutatea hârtiei corespunzătoare suprafeței unei unități) pot fi, de asemenea, utile.
(ii) Greutatea uscată: se colectează toate coloniile din vasele de testare și se clătesc cu apă distilată sau deionizată. Se înlătură excesul de apă și se usucă la 60 °C, până se atinge o greutate constantă. Sunt incluse orice fragmente de rădăcină. Greutatea uscată se exprimă cu o precizie de cel puțin 0,1 mg.
(iii) Greutatea în stare proaspătă: se transferă toate coloniile în tuburi de poliestiren precântărit (sau alt material inert), cu mici orificii (1 mm) în bazele rotunjite. Tuburile se centrifughează apoi la 3 000 rpm la temperatura camerei, timp de 10 minute. Tuburile, care conțin acum coloniile uscate, se recântăresc, iar greutatea în stare proaspătă se calculează prin scăderea greutății tubului gol.
1.7.10.1. Frecvența măsurătorilor și determinărilor analitice
Dacă se folosește un test static, pH-ul fiecărui tratament se măsoară la începutul și sfârșitul testului. Dacă se folosește un test semistatic, pH-ul se măsoară în fiecare lot de soluție de testat „proaspătă” înainte de fiecare reînnoire, precum și în soluțiile corespunzătoare „uzate”.
Intensitatea luminii se măsoară în încăperea, incubatorul sau camera de creștere în puncte aflate la distanțe de sursa de lumină similare cu cele ale frondelor de Lemna. Măsurătorile se fac cel puțin o dată în timpul testului. Se înregistrează cel puțin o dată pe zi temperatura mediului într-un vas înlocuitor menținut în condiții similare în încăperea, incubatorul sau camera de creștere.
Concentrațiile substanței de testat se determină la intervale corespunzătoare în timpul testului. În testele statice, cerința minimă este de a determina concentrațiile la începutul și sfârșitul testului.
Pentru testele semistatice în care nu se estimează menținerea concentrației substanței testate în limitele de ± 20 % din cea nominală, este necesară analizarea tuturor soluțiilor de testat proaspăt preparate la fiecare reînnoire (a se vedea punctul 1.7.7 al treilea paragraf). Cu toate acestea, pentru acele teste în care concentrația inițială măsurată a substanței testate nu se situează în limitele de ± 20 % din valoarea nominală, dar se pot aduce dovezi care să indice repetabilitatea și stabilitatea concentrațiilor inițiale (adică în intervalul de 80-120 % din concentrațiile inițiale), determinarea chimică se va efectua doar la concentrațiile de testare cele mai mari și cele mai mici. În toate cazurile, este necesar să se determine concentrațiile substanței testate înaintea reînnoirii doar la un vas din cele duplicat, pentru fiecare concentrație de testare (sau la conținutul vaselor combinate în funcție de duplicat).
Dacă se folosește un test în regim dinamic, se recomandă un regim de recoltare a probelor similar cu cel descris pentru testele semistatice, inclusiv analiza la începutul, mijlocul și sfârșitul testului, dar măsurarea soluțiilor „uzate” nu convine în acest caz. La aceste tipuri de testări, trebuie verificat zilnic fluxul diluantului și al substanței testate sau al soluției mamă a substanței de testare.
Dacă se poate dovedi menținerea satisfăcătoare, pe toată durata testului, a concentrației substanței testate în limitele de ± 20 % din cea nominală sau măsurată inițial, atunci rezultatele se pot obține din valoarea nominală sau din cea măsurată inițial. Dacă abaterea de la concentrația nominală sau cea măsurată inițial este mai mare de ± 20 %, este necesar ca rezultatele să se exprime în funcție de media geometrică a concentrației în timpul expunerii sau de modelele care descriu declinul concentrației substanței de testat (11).
1.7.11. Testul la valori limită
În unele condiții, de exemplu atunci când un test preliminar arată că substanța de testat nu are efecte toxice la concentrații de până la 100 mg·l–1 sau până la limita solubilității în mediul de testare (oricare dintre ele este mai scăzută), se poate efectua un test la valori limită care presupune o comparare a răspunsurilor unui grup de control și ale unui grup supus tratamentului (100 mg·l–1 sau o concentrație egală cu limita solubilității). Se recomandă ca acest test să fie confirmat prin analizarea concentrației de expunere. Unui test la valori limită i se aplică toate condițiile de testare și criteriile de validitate descrise anterior, cu excepția celei privind numărul de duplicate supuse tratamentului, care trebuie să fie dublu. Creșterea în grupul de control și în cel supus tratamentului pot fi analizate folosind un test statistic de comparare a mediilor, cum ar fi un test-t (Student).
2. DATE ȘI RAPORT
2.1. TIMP DE DUPLICARE
Pentru determinarea timpului de duplicare (Td) a numărului de fronde și asigurarea respectării de către studiu a acestui criteriu de validitate (punctul 1.6), pentru datele obținute de la vasele de control se folosește următoarea formulă:
Td = ln 2/μ
unde μ este viteza medie specifică de creștere, astfel cum a fost descrisă în primul și al doilea paragraf de la punctul 2.2.1.
2.2. VARIABILE DE RĂSPUNS
Scopul testului este de a determina efectele substanței de testat asupra creșterii vegetative a Lemna. Prezenta metodă de testare descrie două variabile de răspuns, deoarece statele membre au preferințe și cerințe de reglementare diferite. Pentru ca rezultatele de testare să fie acceptabile în toate statele membre, efectele se evaluează folosind ambele variabile de răspuns (a) și (b) descrise mai jos.
(a) Viteza medie specifică de creștere: această variabilă de răspuns se calculează pe baza modificărilor logaritmilor numerelor frondelor și, în plus, pe baza modificărilor logaritmilor altui parametru de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) în funcție de timp (exprimat în zile) în probele martor și fiecare grup supus tratamentului. Este numită uneori viteză relativă de creștere (15).
(b) Randament: această variabilă de răspuns se calculează pe baza modificărilor numărului de fronde și, în plus, pe baza modificărilor unui alt parametru de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) în probele martor și în fiecare grup supus tratamentului, până la încheierea testului.
Trebuie remarcat că valorile de toxicitate calculate prin folosirea acestor două variabile de răspuns nu sunt comparabile, iar această diferență trebuie să fie recunoscută când se folosesc rezultatele testului. Valorile ECx bazate pe viteza medie specifică de creștere (ErCx) vor fi în general mai mari decât rezultatele bazate pe randament (EyCx) în cazul în care condițiile de testare din prezenta metodă de testare sunt respectate, ca urmare a bazei matematice a abordărilor respective. Aceasta nu se va interpreta ca o diferență de sensibilitate între cele două variabile de răspuns, valorile fiind diferite din punct de vedere matematic. Conceptul de viteză medie specifică de creștere se bazează pe modelul general al creșterii exponențiale a lintiței în culturi nelimitate, în care toxicitatea se estimează pe baza efectelor asupra vitezei de creștere, fără a fi dependentă de nivelul absolut al vitezei specifice de creștere a probei martor, de panta curbei concentrație-răspuns sau de durata testului. Prin contrast, rezultatele bazate pe variabila de răspuns-randament depind de toate aceste variabile. EyCx depinde de viteza specifică de creștere a speciilor de lintiță folosite pentru fiecare test și de viteza maximă specifică de creștere, care poate varia între specii și chiar între clone diferite. Această variabilă de răspuns nu se folosește pentru compararea sensibilității la substanțe toxice între specii de lintiță și chiar clone diferite. În timp ce folosirea vitezei medii specifice de creștere în scopul estimării toxicității este preferată din punct de vedere științific, estimările de toxicitate bazate pe randament sunt incluse în prezenta metodă de testare pentru a satisface cerințele de reglementare din unele țări.
Estimările toxicității trebuie să se bazeze pe numărul de fronde și pe o variabilă de măsurare suplimentară (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă), deoarece unele substanțe pot afecta alte variabile de măsurare în proporție considerabil mai mare decât o poate face numărul de fronde. Acest efect nu va putea fi detectat exclusiv în urma calculării numărului de fronde.
Numărul de fronde, precum și orice altă variabilă de măsurare înregistrată, cum ar fi suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă, sunt introduse într-un tabel împreună cu concentrațiile substanței de testat cu ocazia fiecărei măsurări. Analiza ulterioară a datelor, inclusiv pentru estimarea CMEO, CFEO sau ECx, trebuie să se bazeze pe valorile duplicatelor individuale, și nu pe mediile calculate pentru fiecare grup supus tratamentului.
2.2.1. Viteza medie specifică de creștere
Viteza medie specifică de creștere pentru o anumită perioadă se calculează ca fiind creșterea logaritmică a variabilelor de creștere – numărul frondelor și încă o variabilă de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) – pe baza formulei de mai jos pentru fiecare duplicat al probelor martor și probelor supuse tratamentului:
![]()
unde:
|
μi-j: |
viteza medie specifică de creștere de la momentul i la momentul j |
|
Ni: |
variabila de măsurare în vasul de testare sau control la momentul i |
|
Nj: |
variabila de măsurare în vasul de testare sau control la momentul j |
|
t: |
intervalul de timp între momentele i-j. |
Pentru fiecare grup de control și grup supus tratamentului, se calculează o valoare medie a vitezei de creștere în paralel cu estimarea varianței.
Viteza medie specifică de creștere se calculează pentru întreaga durată a testului (momentul „i” în formula de mai sus este începutul testului, iar momentul „j” este sfârșitul testului). Pentru fiecare concentrație de testare și probă martor se calculează o valoare medie pentru viteza medie specifică de creștere în paralel cu estimarea varianței. În plus, viteza de creștere pe secțiuni se evaluează în scopul evaluării efectelor substanței de testat care se produc în timpul perioadei de expunere (de exemplu prin verificarea curbelor de creștere transformate logaritmic). Diferențe substanțiale între viteza de creștere pe secțiuni și viteza medie de creștere indică o deviere de la creșterea exponențială constantă și impun verificarea atentă a curbelor de creștere. În acest caz, o metodă conservativă constă în compararea vitezelor specifice de creștere ale culturilor tratate în timpul perioadei de timp de inhibare maximă cu cele ale probelor martor, în aceeași perioadă.
Astfel, inhibarea procentuală a vitezei de creștere (Ir) se poate calcula pentru fiecare concentrație de testare (grup supus tratamentului) conform ecuației:
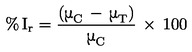
unde:
|
% Ir: |
inhibarea vitezei medii specifice de creștere, în procente |
|
μC: |
valoarea medie a μ în grupul de control |
|
μT: |
valoarea medie a μ în grupul supus tratamentului. |
2.2.2. Randament
Efectele asupra randamentului se determină pe baza a două variabile de măsurare, numărul frondelor și încă o variabilă de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) prezentă în fiecare vas de testare la începutul și sfârșitul testului. În cazul greutății uscate sau al greutății în stare proaspătă, biomasa inițială se determină pe baza unui eșantion de fronde recoltate din același lot folosit pentru inocularea vaselor de testare (a se vedea punctul 1.7.3 al doilea paragraf). Pentru fiecare concentrație de testare și probă martor, se calculează o valoare medie a randamentului în paralel cu estimările varianței. Procentul de inhibare medie a randamentului (% Iy) se poate calcula pentru fiecare grup supus tratamentului, după cum urmează:
![]()
unde:
|
% Iy: |
inhibarea randamentului, în procente |
|
bC: |
biomasa finală minus biomasa inițială pentru grupul de control |
|
bT: |
biomasa finală minus biomasa inițială în grupul supus tratamentului. |
2.2.3. Trasarea curbelor concentrație-răspuns
Se trasează curbe concentrație-răspuns care fac legătura între media inhibării procentuale a variabilei de răspuns (Ir, sau Iy calculate conform metodei de la punctul 2.2.1 ultimul paragraf sau de la punctul 2.2.2) și concentrația logaritmică a substanței de testat.
2.2.4. Estimarea ECx
Estimările ECx (de exemplu EC50) trebuie să se bazeze atât pe viteza medie specifică de creștere (ErCx), cât și pe randament (EyCx), fiecare dintre acestea trebuind să se bazeze pe numărul frondelor și o variabilă de măsurare suplimentară (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă). Aceasta se justifică deoarece există substanțe testate care au efecte diferite asupra numărului de fronde și a altor variabile de măsurare. Parametrii de toxicitate doriți sunt, prin urmare, patru valori ECx pentru fiecare nivel de inhibare x calculat: ErCx (numărul frondelor), ErCx (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă), EyCx (numărul frondelor) și EyCx (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă).
2.3. PROCEDURI STATISTICE
Obiectivul este de a se obține o relație cantitativă concentrație-răspuns prin metoda analizei regresiei. Este posibilă folosirea unei regresii lineare ponderate după ce s-a efectuat o transformare de linearizare a datelor de răspuns – de exemplu în funcția probit, logit sau unități Weibull (16), dar procedurile de regresie nelineară sunt tehnici preferate, care tratează mai bine inexactitățile inevitabile ale datelor și abaterile de la distribuțiile netede. Când se apropie de zero sau inhibiție totală, aceste inexactități se pot amplifica prin transformare, interferând cu analiza (16). Trebuie remarcat că metodele standard de analiză folosind transformatele probit, logit sau Weibull se folosesc în cazul datelor cantitative (de exemplu date privind mortalitate sau supraviețuire) și trebuie să fie modificate pentru a reflecta datele privind viteza de creștere și randament. Proceduri specifice de determinare a valorilor ECx pe baza datelor continue pot fi consultate la notele (17), (18) și (19).
Pentru fiecare variabilă de răspuns de analizat se utilizează relația concentrație-răspuns pentru calcularea estimărilor punctului valorilor ECx. Dacă este posibil, se vor determina limitele de încredere de 95 % pentru fiecare estimare. Calitatea de ajustare a datelor de răspuns la modelul de regresie se evaluează în mod grafic sau statistic. Analiza regresiei se efectuează folosind răspunsuri individuale ale duplicatului, nu medii ale grupului supus tratamentului.
Estimările și limitele de încredere ale EC50 pot fi obținute folosind interpolarea lineară cu „bootstrap” (20), dacă modelele/metodele disponibile de regresie sunt inadecvate pentru date.
Pentru estimarea CMEO și, prin urmare, a CFEO, este necesară compararea mediilor de tratare folosind tehnici de analiză a varianței (ANOVA). Media pentru fiecare concentrație se compară apoi cu media probei martor folosind o metodă de comparare multiplă adecvată sau de testare a tendinței. Testul lui Dunnett sau cel al lui Williams pot fi utile în acest sens (21)(22)(23)(24). Este necesar să se evalueze dacă ipoteza ANOVA de omogenitate a varianței se verifică. Această evaluare se poate efectua grafic sau printr-un test formal (25). Teste adecvate în acest sens sunt cele ale lui Levene sau Bartlett. Neîndeplinirea ipotezei de omogenitate a varianțelor poate fi corectată uneori prin transformarea logaritmică a datelor. Dacă eterogenitatea varianței este extremă și nu poate fi corectată prin transformare, se va lua în considerare analizarea prin metode precum testele Jonkheere regresive de stabilire a tendinței. Îndrumări suplimentare privind determinarea CFEO sunt prezentate la nota (19).
Progresele științifice recente au condus la recomandarea de abandonare a conceptului de CFEO și înlocuirea sa cu estimările punctului ECx bazate pe regresie. Nu a fost stabilită o valoare adecvată a x pentru acest test cu Lemna. Un interval cuprins între 10-20 % pare a fi adecvat (în funcție de variabilele de răspuns alese) și se recomandă raportarea atât a EC10, cât și a EC20.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele informații:
Substanța de testat:
— starea fizică și proprietățile fizico-chimice, inclusiv limita solubilității în apă;
— date de identificare a substanțelor chimice (de exemplu numărul CAS), inclusiv puritatea.
Speciile folosite pentru testare:
— denumirea științifică, clonul (dacă se cunoaște) și sursa.
Condițiile de testare:
— procedura de testare folosită (statică, semistatică sau în regim dinamic);
— data de începere a testului și durata sa;
— mediul de testare;
— descrierea protocolului testului: vasele de testare și capacele, volumele soluțiilor, numărul de colonii și fronde per vas de testare la începutul testului;
— concentrațiile de testare (nominale și măsurate corespunzător) și numărul de duplicate per concentrație;
— metodele de preparare a soluțiilor mamă și a soluțiilor de testat, inclusiv folosirea oricăror solvenți sau agenți de dispersie;
— temperatura în timpul testului;
— sursa de lumină, intensitatea luminii și omogenitatea;
— valorile pH-ului mediilor de testare și control;
— concentrațiile substanțelor de testat și metoda de analiză cu date adecvate de evaluare a calității (studii de validare, deviații standard sau limite de încredere ale analizelor);
— metodele de determinare a numărului de fronde și a altor variabile de măsurare, cum ar fi greutatea uscată, greutatea în stare proaspătă sau suprafața frondelor;
— orice deviere de la prezenta metodă de testare.
Rezultate:
— date brute: numărul de fronde și alte variabile de măsurare în fiecare vas de testare și de control, cu ocazia fiecărei observări sau analize;
— deviația medie și deviația standard pentru fiecare variabilă de măsurare;
— curbele de creștere pentru fiecare concentrație (recomandate cu variabila de măsurare transformată logaritmic, a se vedea punctul 2.2.1 al doilea paragraf);
— timpul de duplicare/viteza de creștere în grupul de control, pe baza numărului frondelor;
— variabilele de răspuns calculate pentru fiecare duplicat supus tratării, cu valori medii și coeficient de variație pentru duplicate;
— reprezentarea grafică a relației concentrație/efect;
— estimări ale punctelor stoechiometrice toxice pentru variabile de răspuns, cum ar fi EC50, EC10, EC20 și intervalele de încredere aferente. Dacă au fost calculate, CMEO și/sau CFEO și metodele statistice folosite pentru determinarea acestora;
— dacă s-a folosit ANOVA, dimensiunea efectului care poate fi detectat (de exemplu, diferența cea mai puțin semnificativă);
— orice stimulare a creșterii constatată în cazul oricărui tratament;
— orice indicii vizuale de fitotoxicitate, precum și observările soluțiilor de testat;
— discutarea rezultatelor, inclusiv orice influență asupra rezultatului testului manifestată ca urmare a abaterilor de la prezenta metodă de testare.
4. REFERINȚE BIBLIOGRAFICE
1. OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test
2. The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals
3. Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, available at
http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A
4. ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (Reapproved 1998). p. 733-742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
5. USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8 p.
6. AFNOR – Association Française de Normalisation. (1996). XP T 90-337: Détermination de l’inhibition de la croissance de Lemna minor. 10 p.
7. SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15 p. (în limba suedeză).
8. Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37-120 p.
9. Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145.
10. Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.
11. OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23.
12. ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test.
13. Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3-77 108. September 1977.
14. Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353-359.
15. Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481-483.
16. Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
17. Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
18. Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485-1494.
19. OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
20. Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN.
21. Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096-1121.
22. Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
23. Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
24. Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
25. Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
Apendicele 1
Descrierea speciilor de Lemna
Planta acvatică denumită uzual lintiță, specia Lemna, aparține familiei Lemnaceae, care conține un număr de specii grupate în patru genuri, răspândite în întreaga lume. Aspectul și taxonomia lor variate au fost descrise pe larg (1)(2). Lemna gibba și L. minor sunt specii reprezentative pentru zonele temperate, fiind folosite în mod obișnuit pentru teste de toxicitate. Ambele specii au o tulpină discoidală plutitoare sau submersă (frondă) și o rădăcină foarte subțire provenind din centrul suprafeței inferioare a fiecărei fronde. Speciile de Lemna înfloresc rareori, iar plantele se reproduc prin înmulțire vegetativă, producând fronde noi (3). În comparație cu plantele mai în vârstă, cele tinere tind să fie mai deschise la culoare, au rădăcini mai scurte și 2-3 fronde de dimensiuni diferite. Ca urmare a dimensiunii reduse a Lemna, structurii sale simple, reproducerii asexuate și duratei scurte a unei generații, plantele acestui gen sunt adecvate în mare măsură testelor de laborator (4)(5).
Ca urmare a variației probabile între specii în ceea ce privește sensibilitatea, sunt valide doar comparațiile de sensibilitate realizate în cadrul aceleiași specii.
Exemple ale speciilor de Lemna folosite pentru testare: referințe bibliografice privind speciile
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935-941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8 p.
Association Française de Normalisation (AFNOR). (1996). XP T 90-337: Détermination de l’inhibition de la croissance de Lemna minor. 10 p.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15 p. (în limba suedeză).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (Reapproved 1998). p. 733-742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8 p.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959-1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87-96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481-483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102-2111.
Surse ale speciilor de Lemna
Colecția de culturi de alge și cianobacterii a Universității din Toronto
Departamentul de botanică, Universitatea din Toronto
Toronto, Ontario, Canada, M5S 3 B2
Tel: +1-416-978-3641
Fax: +1-416-978-5878
e-mail: jacreman@botany.utoronto.ca
http://www.botany.utoronto.ca/utcc
Universitatea de stat din Carolina de Nord
Departamentul forestier
Colecția de culturi de lintiță
Campus Box 8002
Raleigh, NC 27695-8002
Statele Unite ale Americii
Telefon: 001 (919) 515-7572
astomp@unity.ncsu.edu
Institutul de cercetare aplicată a mediului (ITM), Universitatea din Stockholm
SE-106 91 STOCKHOLM
SUEDIA
Tel: +46 8 674 7240
Fax +46 8 674 7636
Agenția Federală de Mediu (UBA)
FG III 3.4
Schichauweg 58
12307 Berlin
Germania
e-mail: lemna@uba.de
http://www.umweltbundesamt.de/contact.htm
REFERINȚE BIBLIOGRAFICE
1. Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221-287.
2. Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland.
3. Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82-991150-0-0. Consiliul Norvegian pentru Cercetări în Agricultură, Universitatea din Oslo.
4. Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1-14.
5. Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7-22.
Apendicele 2
Întreținerea culturii mamă
Culturile mamă pot fi păstrate la temperaturi scăzute (4-10 °C) pentru perioade îndelungate de timp, fără a fi necesară refacerea. Mediul de cultură al Lemna poate fi similar celui folosit pentru testare, dar pentru culturile mamă pot fi folosite alte medii bogate în substanțe nutritive.
Un număr de plante tinere, de culoare verde-deschis, se transferă periodic, folosind o tehnică aseptică, în vase noi de cultură care conțin un mediu proaspăt. În condițiile de temperatură scăzută descrise anterior, subcultivarea poate avea loc la intervale de până la trei luni.
Se folosesc vase de cultură din sticlă, curate din punct de vedere chimic (curățate cu acid) și sterile, precum și tehnici de manipulare aseptică. În cazul contaminării culturii mamă, de exemplu cu alge sau ciuperci, organismele contaminante se elimină. În cazul algelor și al majorității celorlalte organisme contaminante, eliminarea are loc prin sterilizare de suprafață. Se recoltează un eșantion de material vegetal contaminat și se taie rădăcinile. Materialul se agită apoi energic în apă curată și se introduce într-o soluție de hipoclorit de sodiu 0,5 % (v/v) pentru o perioadă cuprinsă între 30 de secunde și 5 minute. Materialul vegetal se clătește apoi cu apă sterilă și se transferă, sub formă de loturi, în vase de cultură conținând mediu de cultură proaspăt. Un număr mare de fronde vor muri ca urmare a acestui tratament, în special dacă se folosesc perioade de expunere mai lungi, dar unele dintre cele care supraviețuiesc vor fi de obicei necontaminate. Acestea pot fi folosite ulterior pentru reinocularea noilor culturi.
Apendicele 3
Medii
Pentru L. minor și L. gibba se recomandă medii de cultură diferite. În cazul L. Minor se recomandă un mediu modificat conform standardului suedez (SIS), în timp ce pentru L. gibba se recomandă mediul 20X AAP. Compozițiile ambelor medii sunt prezentate mai jos. Pentru pregătirea acestor medii se folosesc reactivi sau substanțe chimice de puritate analitică și apă deionizată.
Mediul de cultură pentru Lemna conform standardului suedez (SIS)
— Soluțiile mamă nr. I-V se sterilizează prin autoclavare (120 °C, 15 minute) sau prin filtrare prin membrană (diametrul porilor de aproximativ 0,2 μm).
— Soluția mamă nr. VI (și, opțional, nr. VII) se sterilizează exclusiv prin filtrare prin membrană; aceste soluții nu se autoclavează.
— Soluțiile mamă sterile se păstrează la întuneric și temperaturi scăzute. Soluțiile mamă nr. I-V se elimină după șase luni, în timp ce soluțiile mamă nr. VI (și, opțional, nr. VII) au o perioadă de valabilitate de o lună.
—
|
Soluția mamă nr. |
Substanța |
Concentrația în soluția mamă (g·l–1) |
Concentrația în mediul preparat (mg·l–1) |
Mediu preparat |
|
|
Element |
Concentrație (mg·l–1) |
||||
|
I |
NaNO3 KH2PO4 |
8,50 1,34 |
85 13,4 |
Na; N K; P |
32; 14 6,0; 2,4 |
|
II |
MgSO4 · 7H2O |
15 |
75 |
Mg; S |
7,4; 9,8 |
|
III |
CaCl2 · 2H2O |
7,2 |
36 |
Ca; Cl |
9,8; 17,5 |
|
IV |
Na2CO3 |
4,0 |
20 |
C |
2,3 |
|
V |
H3BO3 MnCl2 · 4H2O Na2MoO4 · 2H2O ZnSO4 · 7H2O CuSO4 · 5H2O Co(NO3)2 · 6H2O |
1,0 0,20 0,010 0,050 0,0050 0,010 |
1,00 0,20 0,010 0,050 0,0050 0,010 |
B Mn Mo Zn Cu Co |
0,17 0,056 0,0040 0,011 0,0013 0,0020 |
|
VI |
FeCl3 · 6H2O Na2-EDTA·2H2O |
0,17 0,28 |
0,84 1,4 |
Fe — |
0,17 — |
|
VII |
MOPS (soluție tampon) |
490 |
490 |
— |
— |
— Pentru pregătirea unui litru de mediu SIS se adaugă următoarele soluții la 900 ml apă deionizată:
—— 10 ml de soluție mamă nr. I
— 5 ml de soluție mamă nr. II
— 5 ml de soluție mamă nr. III
— 5 ml de soluție mamă nr. IV
— 1 ml de soluție mamă nr. V
— 5 ml de soluție mamă nr. VI
— 1 ml de soluție mamă nr. VII (opțional).
—
Notă: O soluție mamă suplimentară nr. VII (soluție tampon MOPS) poate fi necesară pentru anumite substanțe testate (a se vedea punctul 1.4 ultimul paragraf).
— pH-ul se ajustează la valoarea de 6,5 ± 0,2 cu soluție de HCl sau NaOH 0,1 sau 1 mol, iar volumul se completează până la 1 litru cu apă deionizată.
Mediul de cultură 20X AAP
Soluțiile mamă se prepară în apă distilată sau deionizată sterilă.
Soluțiile mamă sterile se păstrează la întuneric și temperatură scăzută. În aceste condiții, soluțiile mamă au un termen de valabilitate de cel puțin 6-8 săptămâni.
Pentru mediul 20X-AAP se pregătesc cinci soluții mamă nutritive (A1, A2, A3, B și C), folosindu-se substanțe chimice de puritate analitică. Pentru obținerea mediului de cultură se adaugă 20 ml din fiecare soluție mamă nutritivă la aproximativ 850 ml apă deionizată. pH-ul este ajustat la 7,5 ± 0,1 cu soluție de HCl sau NaOH 0,1 sau 1 mol, iar volumul se completează până la 1 litru cu apă deionizată. Mediul se filtrează apoi într-un recipient steril printr-un filtru cu membrană de (aproximativ) 0,2 μm.
Pentru a permite stabilizarea pH-ului, mediul de cultură pentru testare se prepară cu 1-2 zile înainte de utilizare. pH-ul mediului de cultură se verifică înainte de utilizare și se reajustează, dacă este necesar, prin adăugarea de soluție de HCl sau NaOH 0,1 sau 1 mol, conform descrierii de mai sus.
|
Soluția mamă nr. |
Substanța |
Concentrația în soluția mamă (g·l–1) (1) |
Concentrația în mediul preparat (mg·l–1) (1) |
Mediu preparat |
|
|
Element |
Concentrație (mg·l–1) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4;3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
|
(1) În lipsa altor mențiuni. |
|||||
Notă: Concentrația finală de bicarbonat adecvată din punct de vedere teoretic (care va evita ajustarea semnificativă a pH-ului) este de 15 mg/l, nu de 300 mg/l. Cu toate acestea, utilizarea anterioară a mediului 20X-AAP, inclusiv testul interlaboratoare pentru această metodă, a luat în calcul concentrația de 300 mg/l. [I. Sims, P. Whitehouse și R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency].
Mediul STEINBERG (conform ISO 20079)
Concentrații și soluții mamă
— Mediul Steinberg modificat este prevăzut în ISO 20079 exclusiv pentru Lemna minor (deoarece doar Lemna minor este permisă în acest caz), dar testele au arătat că pot fi obținute bune rezultate și în cazul Lemna gibba.
— Pentru pregătirea acestui mediu se folosesc reactivi sau substanțe chimice de puritate analitică și apă deionizată.
— Se prepară mediul nutritiv din soluțiile mamă sau din mediul cu o concentrație de 10 ori mai mare care permite concentrarea maximă a mediului fără precipitare.
Tabelul 1
Mediu Steinberg cu pH stabilizat (modificat potrivit lui Altenburger)
|
Substanță |
Mediu nutritiv |
||
|
Macroelemente |
Masă molară |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Microelemente |
Masă molară |
μg/l |
μmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4 · 7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4 · 2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2 · 4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3 · 6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA disodic-dihidrat |
372,24 |
1 500,00 |
4,03 |
Tabelul 2
Soluții mamă (Macroelemente)
|
1. Macroelemente (concentrate de 50 de ori) |
g/l |
|
Soluție mamă nr. 1: |
|
|
KNO3 |
17,50 |
|
KH2PO4 |
4,5 |
|
K2HPO4 |
0,63 |
|
Soluție mamă nr. 2: |
|
|
MgSO4 · 7H2O |
5,00 |
|
Soluție mamă nr. 3: |
|
|
Ca(NO3)2 · 4H2O |
14,75 |
Tabelul 3
Soluții mamă (Microelemente)
|
2. Microelemente (concentrație de 1 000 de ori mai mare) |
mg/l |
|
Soluție mamă nr. 4: |
|
|
H3BO3 |
120,0 |
|
Soluție mamă nr. 5: |
|
|
ZnSO4 · 7H2O |
180,0 |
|
Soluție mamă nr. 6: |
|
|
Na2MoO4 · 2H2O |
44,0 |
|
Soluție mamă nr. 7: |
|
|
MnCl2 · 4H2O |
180,0 |
|
Soluție mamă nr. 8: |
|
|
FeCl3 · 6H2O |
760,00 |
|
EDTA Disodic-dihidrat |
1 500,00 |
— Soluțiile mamă nr. 2 și 3, pe de o parte, și 4-7, pe de altă parte, pot fi combinate (respectând concentrațiile prevăzute).
— Pentru obținerea unei perioade de valabilitate mai lungi, soluțiile mamă se autoclavează la 121 °C timp de 20 de minute sau, alternativ, se filtrează steril (0,2 μm). Filtrarea sterilă (0,2 μm) este ferm recomandată în cazul soluției mamă nr. 8.
Prepararea concentrației finale a mediului STEINBERG (modificat)
— Se adaugă 20 ml de soluții mamă nr. 1, 2 și 3 (a se vedea tabelul 2) la aproximativ 900 ml apă deionizată, pentru a se evita precipitarea.
— Se adaugă 1,0 ml de soluții mamă nr. 4, 5, 6, 7 și 8 (a se vedea tabelul 3).
— pH-ul trebuie să aibă valoarea de 5,5 ± 0,2 (se ajustează prin adăugarea unui volum minim de soluție de NaOH sau HCl).
— Se completează cu apă până la 1 000 ml.
— Dacă soluțiile mamă sunt sterilizate și se folosește cantitatea de apă adecvată, nu este necesară sterilizarea suplimentară. Dacă mediul final este sterilizat, soluția mamă nr. 8 se adaugă după autoclavare (121 °C, timp de 20 min.).
Prepararea mediului STEINBERG (modificat) de 10 ori mai concentrat pentru depozitare intermediară
— Se adaugă 20 ml de soluții mamă nr. 1, 2 și 3 (a se vedea tabelul 2) la aproximativ 30 ml apă deionizată pentru a se evita precipitarea.
— Se adaugă 1,0 ml de soluții mamă nr. 4, 5, 6, 7 și 8 (a se vedea tabelul 3). Se completează cu apă până la 100 ml.
— Dacă soluțiile mamă sunt sterilizate și se folosește cantitatea de apă adecvată, nu este necesară sterilizarea suplimentară. Dacă mediul final este sterilizat, soluția mamă nr. 8 se adaugă după autoclavare (la 121 °C, timp de 20 min).
— pH-ul mediului (concentrația finală) trebuie să aibă valoarea de 5,5 ± 0,2.
( 1 ) JO L 396, 30.12.2006, p. 1.
( 2 ) JO 196, 16.8.1967, p. 1. Directivă modificată ultima dată prin Directiva 2006/121/CE a Parlamentului European și a Consiliului (JO L 396, 30.12.2006, p. 850) – a se actualiza cu trimiterile corespunzătoare după publicarea celei de-a treizecea ATP.
( 3 ) Ca de exemplu în cadrul reglementărilor privind transportul.
( 4 ) Înainte de testare, acidul trebuie titrat pentru a i se confirma concentrația.
( 5 ) De exemplu: acid percloric 50 % (g/g) și clorat de sodiu 40 % (g/g) se utilizează în referința 1.
( 6 ) De exemplu, pudră de celuloză Whatman pentru cromatografie pe coloană CF11, nr. de catalog 4021 050.
( 7 ) Confirmat prin (de exemplu) titrare Karl-Fisher.
( 8 ) Alternativ, acest conținut de apă poate fi realizat prin (de exemplu) încălzire la 105 oC sub vid, timp de 24 h.
( 9 ) Amestecurile de oxidanți cu celuloză trebuie tratate ca fiind potențial explozive și manipulate cu atenția cuvenită.
( 10 ) În practică, aceste lucru se poate realiza prin prepararea unui amestec 1:1 din lichidul de testat și celuloză, într-o cantitate mai mare decât cea necesară pentru test și mutând 5 ± 0,1 g în vasul de presiune. Amestecul trebuie să fie proaspăt preparat pentru fiecare testare.
( 11 ) Trebuie să se evite, în special, contactul dintre spirele adiacente ale bobinei.
( 12 ) A se vedea referința 1 pentru interpretarea rezultatelor conform reglementărilor ONU privind transportul utilizând mai multe substanțe de referință.
( 13 ) Această valoare de grosisment este indicată pentru fibrele de 3 μm. Pentru fibrele de 6 μm, un grosisment de × 5 000 poate fi mai potrivit.
( 14 ) Pentru fibrele de 3 μm, a se vedea nota precedentă.
( 15 ) Se notează suprafața cu opacitate corneană.
( 16 ) La anumite măsurări în ser sau în plasmă, și în special pentru cele de glucoză, se recomandă ca animalele să fi fost flămânzite peste noapte. Dacă nu au fost flămânzite în prealabil, variabilitatea rezultatelor va fi mai mare și riscă să mascheze efectele mai subtile, precum și să îngreuneze interpretarea. În schimb, flămânzirea poate modifica metabolismul general al animalelor și, în special în cazul studiilor bazate pe alimentație, poate să perturbe expunerea cotidiană la substanța testată. Dacă probele sunt prelevate după o perioadă de flămânzire, măsurările trebuie efectuate după examinările funcționale din săptămâna a patra.
( 17 ) Pentru mai multe analize de ser și plasmă, în special pentru glucoză, este de preferat absența hranei în timpul nopții. Cel mai important motiv este că variația crescută care ar rezulta inevitabil în urma consumului de hrană ar putea să mascheze efectele mai subtile și ar face dificilă interpretarea. Pe de altă parte însă, lipsa hranei pe durata nopții poate să interfereze cu metabolismul general al animalelor și riscă, în special în studiile în care substanța testată este administrată în alimente, să perturbe expunerea zilnică la această substanță. Dacă se optează pentru lipsa hranei pe timpul nopții, trebuie efectuate analize de biochimie clinică după observațiile funcționale ale studiului.
( 18 ) În prezent cunoscută sub denumirea de alaninaminotransferază.
( 19 ) În prezent cunoscută sub denumirea de aspartataminotransferază.
( 20 ) Aceste organe se recoltează de la 10 animale/sex/lot în cazul rozătoarelor și de la toate nerozătoarele și se cântăresc.
( 21 ) Aceste organe se recoltează de la 10 animale/sex/lot în cazul rozătoarelor și de la toate nerozătoarele și se cântăresc.
( 22 ) În această metodă, prin lot de referință se înțelege un lot căreia substanța de testat i se administrează pe o altă cale garantându-se o disponibilitate completă a dozei.
( 23 ) Dimensiunile indicate se referă la un suport cornean utilizat pentru bovine a căror vârstă variază între 12 și 60 de luni. În cazul în care se folosesc animale cu vârsta cuprinsă între 6-12 luni, suportul trebuie să fie proiectat astfel încât volumul fiecărei camere să fie de 4 ml, iar fiecare dintre camerele interioare să aibă un diametru de 1,5 cm și o adâncime de 2,2 cm. Este foarte important ca raportul între suprafața zonei corneene expuse și volumul camerei posterioare a suporturilor corneene noi să fie identic cu raportul existent în cazul suportului cornean tradițional. Acest lucru este necesar pentru determinarea corectă a valorilor permeabilității, în scopul calculării IVIS prin formula propusă.
( 24 ) Rezultatele acestor teste între laboratoare, precum și un corringedum tehnic la ISO 6341 oferă un CE50 la 24 h al dicromatului de potasiu (K2Cr2O7) cuprins în intervalul 0,6-1,7 mg/l.
( 25 ) După folosire, soluțiile conținând săruri de mercur trebuie tratate pentru a evita pătrunderea mercurului în mediul înconjurător.
( 26 ) Mabey și Mill recomandă folosirea boratului și acetatului în locul fosfatului (11).
( 27 ) Astfel de informații pot veni din alte surse, precum informațiile despre hidroliza unor compuși cu structură similară, din literatură sau din alte teste de hidroliză semicantitativă cu substanțele experimentale într-un stadiu incipient de dezvoltare.
( 28 ) Dacă graficul transformării logaritmice în funcție de timp nu arată o funcție liniară (egalată de o viteză de reacție de ordin întâi), atunci folosirea ecuației [3] nu este adecvată pentru determinarea constantelor vitezelor de reacție ale compușilor experimentali.
( 29 ) Valorile pH-ului din aceste tabele au fost calculate pornind de la măsurătorile potențiale folosind ecuația Sörensen standard (1909). Valorile care corespund pH-ului sunt cu 0,04 unități mai mari decât valorile din tabel.
( 30 ) Meyer, A., Bierman, C. H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, p. 231-236.
( 31 ) OECD, Paris, 1992, Test Guideline 210, „Fish, Early-life Stage Toxicity Test”.
( 32 )
![]()
( 33 ) Reprezentările grafice ale concentrației substanței de testat în fază apoasă (
![]()
( 34 ) TD-50: timpul de degradare pentru 50 % din substanța testată.
( 35 ) De exemplu, dacă substanța de testat conține un ciclu, acesta trebuie marcat; dacă substanța de testat conține două sau mai multe cicluri, este posibil să fie necesare studii separate pentru evaluarea evoluției fiecărui ciclu și pentru a obține informații fiabile privind formarea produșilor de transformare.
( 36 ) Caracteristica de reținere a apei a unui sol se poate măsura ca fiind capacitatea câmpului, ca fiind capacitatea de reținere a apei sau ca potențial de sucțiune (pF). Pentru explicații a se vedea apendicele 1. În raportul de testare se precizează dacă densitatea aparentă și caracteristica de reținere a apei au fost determinate pe probe de sol nederanjat sau deranjat (prelucrat).
( 37 ) Cercetări recente au arătat că solurile din zonele cu climat temperat se pot depozita la – 20 oC timp de peste trei luni (18) (29) fără pierderi semnificative la nivelul activității microbiene.
( 38 ) Solul nu trebuie să fie nici prea umed, nici prea uscat, astfel încât să se asigure condiții adecvate de aerare și de nutriție pentru microflora din sol. Conținuturile de umiditate recomandat pentru o creștere microbiană optimă variază între 40-60 % din capacitatea de reținere de apă (WHC) și între 0,1-0,33 bari (6). Acest ultim interval corespunde unui interval de pF de 2,0-2,5. În apendicele 2 sunt prezentate conținuturile tipice de umiditate ale diferitelor tipuri de soluri.
( 39 ) Condițiile aerobe sunt predominante în solurile de suprafață și chiar în solurile subterane, după cum au arătat rezultatele unui proiect de cercetare finanțat de UE [K. Takagi et al. (1992), Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., p. 270-277, 17-21 August, Sigtuna, Suedia]. Producerea condițiilor anaerobe este posibilă ocazional în timpul inundării solurilor după ploi abundente sau în cazul condițiilor de orezărie.
( 40 ) Studiile aerobe pot fi încheiate în mai puțin de 120 de zile sub rezerva utilizării căii de transformare și a producerii mineralizării efective până la data respectivă. Testul poate fi încheiat după 120 de zile sau când cel puțin 90 % din substanța de testat este transformată, dar numai dacă s-a format cel puțin 5 % CO2.
( 41 ) Calculul concentrației inițiale în funcție de suprafață se realizează pe baza următoarei ecuații:

|
Csol |
= |
Concentrați inițială din sol [mg· kg–1] |
|
A |
= |
Rata de aplicare [mg· ha–1]; 1 = grosimea stratului de sol [m]; d = densitatea aparentă a solului uscat [kg· m–3]. |
Ca regulă generală, o rată de aplicare de 1 kg· ha–1 determină o concentrație de aproximativ 1 mg· kg–1 într-un strat de 10 cm (presupunând că densitatea aparentă este de g· cm–3).
( 42 ) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
( 43 ) Guth, J. A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R. J. Hance, Ed.), Academic Press, p. 123-157.
( 44 ) Guth, J. A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D. H. Hutson, T. R. Roberts, Eds. J. Wiley & Sons. Vol 1, p. 85-114.
( 45 ) Anderson, J. P. E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, p. 141-146.
( 46 ) De exemplu, dacă substanța de testat conține un ciclu, acesta trebuie marcat; dacă substanța de testat conține două sau mai multe cicluri, este posibil să fie necesare studii separate pentru evaluarea evoluției fiecărui ciclu și pentru a obține informații fiabile privind formarea produșilor de transformare.
( 47 ) Întrucât aceste soluții alcaline de absorbție absorb atât dioxidul de carbon din aerul utilizat pentru ventilație, cât și pe cel produs prin respirație în cadrul experiențelor aerobe, acestea trebuie înlocuite la intervale regulate pentru a evita saturarea lor și în consecință pierderea capacității de absorbție.
( 48 ) [Argilă + aluviuni] este fracțiunea minerală a sedimentului cu dimensiuni ale particulelor < 50 μm.
( 49 ) Studii recente au arătat că depozitarea la 4 oC poate determina o scădere a conținutului de carbon organic din sediment care poate duce la reducerea activității microbiene (34).
( 50 ) Efectuarea unui test pentru o a doua concentrație poate fi utilă pentru substanțele chimice care ajung în apele superficiale pe alte căi care determină concentrații considerabil diferite, în măsura în care concentrația cea mai mică poate fi analizată cu suficientă precizie.
( 51 ) În cazurile în care este posibil ca produșii rezultați din transformările anaerobe să se reoxideze foarte repede, se asigură condiții anaerobe și în timpul recoltării și al analizei.