EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32011D0214
2011/214/EU: Commission Decision of 1 April 2011 amending Annexes II to IV to Council Directive 2009/158/EC on animal health conditions governing intra-Community trade in, and imports from third countries of, poultry and hatching eggs (notified under document C(2011) 2068) Text with EEA relevance
2011/214/UE: Decizia Comisiei din 1 aprilie 2011 de modificare a anexelor II-IV la Directiva 2009/158/CE a Consiliului privind condițiile de sănătate animală care reglementează comerțul intracomunitar și importurile din țări terțe de păsări de curte și de ouă pentru incubație [notificată cu numărul C(2011) 2068] Text cu relevanță pentru SEE
2011/214/UE: Decizia Comisiei din 1 aprilie 2011 de modificare a anexelor II-IV la Directiva 2009/158/CE a Consiliului privind condițiile de sănătate animală care reglementează comerțul intracomunitar și importurile din țări terțe de păsări de curte și de ouă pentru incubație [notificată cu numărul C(2011) 2068] Text cu relevanță pentru SEE
OJ L 90, 6.4.2011, p. 27–49
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 03 Volume 020 P. 288 - 310
 No longer in force, Date of end of validity: 20/04/2021; abrogare implicită prin 32016R0429
No longer in force, Date of end of validity: 20/04/2021; abrogare implicită prin 32016R0429
|
6.4.2011 |
RO |
Jurnalul Oficial al Uniunii Europene |
L 90/27 |
DECIZIA COMISIEI
din 1 aprilie 2011
de modificare a anexelor II-IV la Directiva 2009/158/CE a Consiliului privind condițiile de sănătate animală care reglementează comerțul intracomunitar și importurile din țări terțe de păsări de curte și de ouă pentru incubație
[notificată cu numărul C(2011) 2068]
(Text cu relevanță pentru SEE)
(2011/214/UE)
COMISIA EUROPEANĂ,
având în vedere Tratatul privind funcționarea Uniunii Europene,
având în vedere Directiva 2009/158/CEE a Consiliului din 30 noiembrie 2009 privind condițiile de sănătate animală care reglementează comerțul intracomunitar și importurile din țări terțe de păsări de curte și de ouă pentru incubație (1), în special articolul 34,
întrucât:
|
(1) |
Directiva 2009/158/CE stabilește condițiile de sănătate animală care reglementează comerțul în interiorul Uniunii și importurile din țări terțe de păsări de curte și de ouă pentru incubație. Anexa II stabilește normele pentru aprobarea unităților în scopul comercializării acestor mărfuri în interiorul Uniunii. Capitolele II, III și IV din anexa respectivă stabilesc condițiile pentru instalațiile și funcționarea unităților, programele de control sanitar al bolilor și criteriile de suspendare sau retragere a aprobării unei unități, care cuprind testarea privind prezența anumitor microorganisme – Salmonella și Mycoplasma – care trebuie efectuate în unitățile aprobate pentru comerț în interiorul Uniunii. |
|
(2) |
Experiența dobândită în implementarea condițiilor pentru instalațiile și funcționarea unităților stabilite în capitolul II din anexa II la Directiva 2009/158/CE arată că este adecvat ca acestea să fie adaptate la practicile curente în industrie, în special în ceea ce privește comportamentele de ouare a diferitelor specii de păsări de curte. |
|
(3) |
În plus, capitolele III și IV din anexa II la Directiva 2009/158/CE ar trebui modificate pentru a se lua în considerare progresul științific în domeniul tehnicilor de diagnostic pentru Mycoplasma în conformitate cu capitolul 2.3.5 din Manualul de teste de diagnostic și vaccinuri al Organizației Mondiale pentru Sănătatea Animalelor, precum și modificările nomenclaturii referitoare la Salmonella potrivit Centrului de colaborare al Organizației Mondiale a Sănătății pentru referință și cercetare privind Salmonella în cadrul schemei White-Kauffmann-Le Minor pentru formulele antigenice ale serotipurilor de Salmonella din anul 2007 și în conformitate cu capitolul 2.3.11 din Manualul de teste de diagnostic și vaccinuri al Organizației Mondiale pentru Sănătatea Animalelor. |
|
(4) |
Anexa III la Directiva 2009/158/CE stabilește condițiile de vaccinare pentru păsări de curte. Aceasta ar trebui modificată pentru a include condițiile specifice de vaccinare împotriva Salmonella. |
|
(5) |
Este, de asemenea, necesar să se modifice anumite referințe în legătură cu vaccinarea împotriva gripei aviare în certificatele sanitar-veterinare stabilite în anexa IV la Directiva 2009/158/CE. |
|
(6) |
Regulamentul (CE) nr. 2160/2003 al Parlamentului European și al Consiliului din 17 noiembrie 2003 privind controlul salmonelei și al altor agenți zoonotici specifici, prezenți în rețeaua alimentară (2) stabilește norme pentru asigurarea adoptării de măsuri adecvate și eficiente pentru depistarea și controlul salmonelei și a altor agenți zoonotici. Aceasta prevede că efectivele de origine a anumitor specii enumerate în anexa I la respectivul regulament trebuie testate împotriva anumitor zoonoze și agenți zoonotici specifici înainte de orice expediere de animale vii sau ouă pentru incubație de la societatea alimentară de origine. Data și rezultatele testelor vor fi incluse în certificatele sanitar-veterinare relevante prevăzute de legislația Uniunii, inclusiv Directiva 2009/158/CE. |
|
(7) |
Anexa IV la Directiva 2009/158/CE stabilește modele de certificate sanitar-veterinare pentru comerțul cu păsări de curte și ouă pentru incubație în interiorul Uniunii. |
|
(8) |
Regulamentul (CE) nr. 584/2008 al Comisiei din 20 iunie 2008 de punere în aplicare a Regulamentului (CE) nr. 2160/2003 al Parlamentului European și al Consiliului în ceea ce privește obiectivul comunitar de diminuare a prevalenței Salmonella Enteritidis și Salmonella Typhimurium la curcani (3) stabilește faptul că cerințele de testare se aplică, de asemenea, efectivelor de curcani de la 1 ianuarie 2010, iar respectivele certificate sanitar-veterinare stabilite în anexa IV la Directiva 2009/158/CE ar trebui, prin urmare, modificate în consecință. |
|
(9) |
Prin urmare, anexele II, III și IV la Directiva 2009/158/CE ar trebui modificate în consecință. |
|
(10) |
Măsurile prevăzute în prezenta decizie sunt conforme cu avizul Comitetului permanent pentru lanțul alimentar și sănătatea animală, |
ADOPTĂ PREZENTA DECIZIE:
Articolul 1
Anexele II, III și IV la Directiva 2009/158/CE se modifică în conformitate cu anexa la prezenta decizie.
Articolul 2
Prezenta decizie se adresează statelor membre.
Adoptată la Bruxelles, 1 aprilie 2011.
Pentru Comisie
John DALLI
Membru al Comisiei
(1) JO L 343, 22.12.2009, p. 74.
(2) JO L 325, 12.12.2003, p. 1.
(3) JO L 162, 21.6.2008, p. 3.
ANEXĂ
Anexele II, III și IV la Directiva 2009/158/CE se modifică după cum urmează:
|
1. |
Anexa II se modifică după cum urmează:
|
|
2. |
Anexa III se modifică după cum urmează:
|
|
3. |
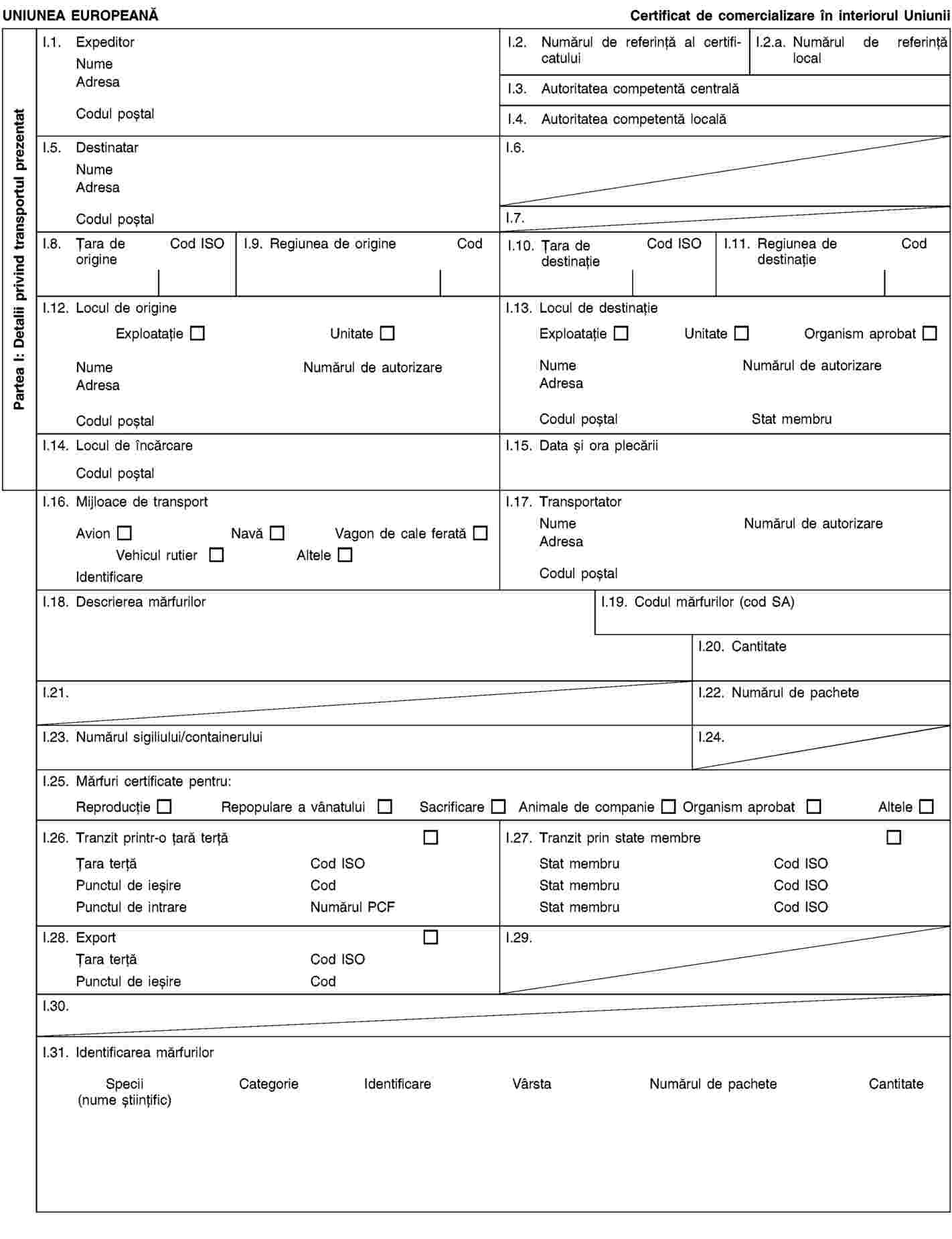
Anexa IV se înlocuiește cu următorul text: „ANEXA IV CERTIFICATE SANITAR VETERINARE PENTRU COMERCIALIZARE ÎN INTERIORUL UNIUNII (Modelele 1-6) MODEL 1
MODEL 2
MODEL 3
MODEL 4
MODEL 5
MODEL 6
|
(1) Salmonella Pullorum înseamnă Salmonella enterica, subspecia enterica, serovar Gallinarum, varianta biochimică (biovar) Pullorum.
(2) Salmonella Gallinarum înseamnă Salmonella enterica, subspecia enterica, serovar Gallinarum, varianta biochimică (biovar) Gallinarum.
(3) Salmonella arizonae înseamnă Salmonella enterica, subspecia arizonae, serogrupul K (O18) arizonae.
(4) A se nota faptul că testele serologice la specii de păsări altele decât găini pot avea uneori ca rezultat o proporție inacceptabilă de reacții pozitive false.
(5) A se nota că eșantioanele de mediu nu sunt, în general, adecvate pentru detectarea fiabilă a Salmonella Pullorum și Salmonella Gallinarum.
(6) A se nota faptul că etalarea directă a țesuturilor prelevate în mediu aseptic pe un mediu agar cu selectivitate minimă, ca de exemplu agarul MacConkey, este, de asemenea, utilă pentru diagnosticare.
(7) Salmonella Pullorum și Salmonella Gallinarum nu cresc de la sine în mediul semisolid modificat Rappaport Vassiliadis (MRSV) care este utilizat pentru monitorizarea Salmonella spp. zoonotice în Uniune.
(8) A se nota faptul că, în prezent, nu există niciun test care să diferențieze răspunsurile la infecțiile cu Salmonella Pullorum și Salmonella Gallinarum și vaccinarea pentru acest serotip.