ISSN 1977-0774
Jornal Oficial
da União Europeia
L 199

Edição em língua portuguesa
Legislação
59.° ano
26 de julho de 2016
|
ISSN 1977-0774 |
||
|
Jornal Oficial da União Europeia |
L 199 |
|

|
||
|
Edição em língua portuguesa |
Legislação |
59.° ano |
|
|
|
|
|
(1) Texto relevante para efeitos do EEE |
|
PT |
Os actos cujos títulos são impressos em tipo fino são actos de gestão corrente adoptados no âmbito da política agrícola e que têm, em geral, um período de validade limitado. Os actos cujos títulos são impressos em tipo negro e precedidos de um asterisco são todos os restantes. |
II Atos não legislativos
ACORDOS INTERNACIONAIS
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/1 |
DECISÃO (UE) 2016/1210 DO CONSELHO
de 18 de julho de 2016
relativa à celebração de um Protocolo ao Acordo de Parceria e Cooperação entre as Comunidades Europeias e os seus Estados-Membros, por um lado, e a República do Azerbaijão, por outro, sobre um Acordo-Quadro entre a União Europeia e a República do Azerbaijão relativo aos princípios gerais que regem a participação da República do Azerbaijão em programas da União
O CONSELHO DA UNIÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia, nomeadamente o artigo 212.o, conjugado com o artigo 218.o, n.o 6, segundo parágrafo, alínea a),
Tendo em conta a proposta da Comissão Europeia,
Tendo em conta a aprovação do Parlamento Europeu (1),
Considerando o seguinte:
|
(1) |
O Protocolo ao Acordo de Parceria e Cooperação entre as Comunidades Europeias e os seus Estados-Membros, por um lado, e a República do Azerbaijão, por outro, sobre um Acordo-Quadro entre a União Europeia e a República do Azerbaijão relativo aos princípios gerais que regem a participação da República do Azerbaijão em programas da União (o «Protocolo»), foi assinado em nome da União, em 14 de junho de 2014. |
|
(2) |
O objetivo do Protocolo é estabelecer as regras técnicas e financeiras que permitam à República do Azerbaijão participar em determinados programas da União. O quadro horizontal estabelecido pelo Protocolo constitui uma medida de cooperação económica, financeira e técnica que permite o acesso à assistência, em especial assistência financeira, a prestar pela União em conformidade com os esses programas da União. Esse quadro aplica-se unicamente aos programas da União cujos atos legais constitutivos preveem a possibilidade de participação da República do Azerbaijão. Por conseguinte, a celebração do Protocolo não implica o exercício de competências ao abrigo das várias políticas setoriais prosseguidas pelos programas, que são exercidas quando se estabelecem os programas. |
|
(3) |
O Protocolo deverá ser aprovado, |
ADOTOU A PRESENTE DECISÃO:
Artigo 1.o
É aprovado, em nome da União, o Protocolo ao Acordo de Parceria e Cooperação entre as Comunidades Europeias e os seus Estados-Membros, por um lado, e a República do Azerbaijão, por outro, sobre um Acordo-Quadro entre a União Europeia e a República do Azerbaijão relativo aos princípios gerais que regem a participação da República do Azerbaijão em programas da União (o «Protocolo») (2).
Artigo 2.o
O Presidente do Conselho procede, em nome da União, à notificação prevista no artigo 10.o do Protocolo (3).
Artigo 3.o
A presente decisão entra em vigor na data da sua adoção.
Feito em Bruxelas, em 18 de julho de 2016.
Pelo Conselho
A Presidente
F. MOGHERINI
(1) Aprovação em 6 de julho de 2016 (ainda não publicada no Jornal Oficial).
(2) O Protocolo foi publicado no JO L 19 de 24.1.2015, p. 4, juntamente com a decisão relativa à sua assinatura.
(3) A data de entrada em vigor do Protocolo será publicada no Jornal Oficial da União Europeia por intermédio do Secretariado-Geral do Conselho.
REGULAMENTOS
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/3 |
REGULAMENTO DE EXECUÇÃO (UE) 2016/1211 DA COMISSÃO
de 20 de julho de 2016
relativo à classificação de determinadas mercadorias na Nomenclatura Combinada
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta o Regulamento (UE) n.o 952/2013 do Parlamento Europeu e do Conselho, de 9 de outubro de 2013, que estabelece o Código Aduaneiro da União (1), nomeadamente o artigo 57.o, n.o 4, e o artigo 58.o, n.o 2,
Considerando o seguinte:
|
(1) |
A fim de assegurar a aplicação uniforme da Nomenclatura Combinada anexa ao Regulamento (CEE) n.o 2658/87 do Conselho (2), importa adotar disposições relativas à classificação das mercadorias que figuram no anexo do presente regulamento. |
|
(2) |
O Regulamento (CEE) n.o 2658/87 fixa as regras gerais para a interpretação da Nomenclatura Combinada. Essas regras aplicam-se igualmente a qualquer outra nomenclatura que retome a Nomenclatura Combinada total ou parcialmente ou acrescentando-lhe eventualmente subdivisões, e que esteja estabelecida por disposições específicas da União, com vista à aplicação de medidas pautais ou outras relativas ao comércio de mercadorias. |
|
(3) |
Em aplicação das referidas regras gerais, as mercadorias descritas na coluna 1 do quadro que figura no anexo devem ser classificadas nos códigos NC correspondentes, indicados na coluna 2, por força dos fundamentos estabelecidos na coluna 3 do referido quadro. |
|
(4) |
É oportuno que as informações pautais vinculativas emitidas em relação às mercadorias em causa no presente regulamento e que não estejam em conformidade com o disposto no presente regulamento possam continuar a ser invocadas pelos seus titulares, durante um determinado período, em conformidade com o artigo 34.o, n.o 9, do Regulamento (UE) n.o 952/2013. Esse período deve ser de três meses. |
|
(5) |
As medidas previstas no presente regulamento estão em conformidade com o parecer do Comité do Código Aduaneiro, |
ADOTOU O PRESENTE REGULAMENTO:
Artigo 1.o
As mercadorias descritas na coluna 1 do quadro em anexo devem ser classificadas na Nomenclatura Combinada nos códigos NC correspondentes, indicados na coluna 2 do referido quadro.
Artigo 2.o
As informações pautais vinculativas que não estejam em conformidade com o disposto no presente regulamento podem continuar a ser invocadas, em conformidade com o artigo 34.o, n.o 9, do Regulamento (UE) n.o 952/2013, por um período de três meses a contar da data de entrada em vigor do presente regulamento.
Artigo 3.o
O presente regulamento entra em vigor no vigésimo dia seguinte ao da sua publicação no Jornal Oficial da União Europeia.
O presente regulamento é obrigatório em todos os seus elementos e diretamente aplicável em todos os Estados-Membros.
Feito em Bruxelas, em 20 de julho de 2016.
Pela Comissão
Em nome do Presidente,
Stephen QUEST
Diretor-Geral da Fiscalidade e da União Aduaneira
(1) JO L 269 de 10.10.2013, p. 1.
(2) Regulamento (CEE) n.o 2658/87 do Conselho, de 23 de julho de 1987, relativo à nomenclatura pautal e estatística e à pauta aduaneira comum (JO L 256 de 7.9.1987, p. 1).
ANEXO
|
Descrição das mercadorias |
Classificação (Código NC) |
Fundamentos |
|
(1) |
(2) |
(3) |
|
Um artigo (denominado «cama de rede com suporte»), com as dimensões de aproximadamente 380 × 120 × 140 cm. Consiste num suporte de madeira concebido para assentar no solo, no qual está suspensa uma cama de rede de tecido de algodão com as dimensões de 240 × 120 cm. As extremidades da cama de rede terminam com varetas de madeira e dispõem de cordões para serem fixadas ao suporte. O artigo pesa aproximadamente 32 kg e pode ser utilizado por pessoas com um peso de até 150 kg. (*) Ver imagem. |
9403 60 90 |
A classificação é determinada pelas disposições das Regras Gerais 1, 3 b) e 6 para a interpretação da Nomenclatura Combinada, pela Nota 2 do Capítulo 94 e pelos descritivos dos códigos NC 9403 , 9403 60 e 9403 60 90 . Dadas as suas características, nomeadamente o peso e a de não poder ser facilmente desmontado, o artigo não pode ser facilmente transportado para uma utilização em atividades de campismo. Consequentemente, está excluída a classificação na posição 6306 como artigos para acampamento. O artigo é «móvel» e, tendo em conta as suas características objetivas, está concebido para assentar no solo. Serve para guarnecer, com um objetivo principalmente utilitário, zonas exteriores, como jardins de residências particulares, hotéis, restaurantes, etc. [ver também as Notas Explicativas do Sistema Harmonizado relativas ao Capítulo 94, Considerações Gerais, A)]. Por conseguinte, o artigo é considerado como «mobiliário» composto de matérias diferentes, devendo ser classificado na posição 9403 de acordo com a matéria de que é feito o suporte (estrutura) e que confere ao artigo a sua característica essencial. Por conseguinte, o produto classifica-se no código NC 9403 60 90 , como outros móveis de madeira. |

(*) A imagem destina-se a fins meramente informativos.
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/6 |
REGULAMENTO DE EXECUÇÃO (UE) 2016/1212 DA COMISSÃO
de 25 de julho de 2016
que estabelece normas técnicas de execução no que diz respeito aos procedimentos e formulários normalizados para a comunicação de informações em conformidade com a Diretiva 2009/65/CE do Parlamento Europeu e do Conselho
(Texto relevante para efeitos do EEE)
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta a Diretiva 2009/65/CE do Parlamento Europeu e do Conselho, de 13 de julho de 2009, que coordena as disposições legislativas, regulamentares e administrativas respeitantes a alguns organismos de investimento coletivo em valores mobiliários (OICVM) (1), nomeadamente o artigo 99.o-E, n.o 3,
Considerando o seguinte:
|
(1) |
Convém estabelecer procedimentos e formulários comuns para a apresentação de informações à Autoridade Europeia dos Valores Mobiliários e dos Mercados (ESMA) por parte das autoridades competentes no que respeita às sanções e medidas por elas impostas, conforme referido no artigo 99.o-E da Diretiva 2009/65/CE. |
|
(2) |
A fim de permitir à ESMA identificar e registar corretamente as informações sobre as sanções e medidas impostas em conformidade com o artigo 99.o da Diretiva 2009/65/CE, convém exigir às autoridades competentes que lhe prestem informações pormenorizadas e harmonizadas sobre as sanções e medidas notificadas. |
|
(3) |
É necessário evitar potenciais duplicações e conflitos de competências de teor negativo entre as diversas autoridades notificantes no âmbito de um Estado-Membro. A forma mais eficaz e menos onerosa de prosseguir esse objetivo consiste em designar em cada Estado-Membro um ponto de contacto único para a ESMA. |
|
(4) |
Com vista a assegurar a proficuidade das informações contidas no relatório anual sobre as sanções e medidas a ser publicado pela ESMA em conformidade com o artigo 99.o-E, n.o 1, da Diretiva 2009/65/CE, as autoridades competentes devem comunicar as informações mediante formulários específicos, indicando claramente quais os artigos da Diretiva 2009/65/CE que foram infringidos. |
|
(5) |
A comunicação, em conformidade com o artigo 99.o-E, n.o 2, da Diretiva 2009/65/CE, das sanções e medidas administrativas divulgadas ao público, deve identificar claramente as sanções e as medidas impostas, com um grau de pormenor suficiente. Convém, por conseguinte, elaborar um formulário a utilizar pelas autoridades competentes para o efeito. |
|
(6) |
O presente regulamento baseia-se nos projetos de normas técnicas de execução apresentados pela ESMA à Comissão. |
|
(7) |
A ESMA não procedeu a consultas públicas abertas sobre os projetos de normas técnicas de execução que servem de base ao presente regulamento, nem analisou os potenciais custos e benefícios de impor formulários e procedimentos normalizados às autoridades competentes, uma vez que tal teria sido desproporcionado em relação ao âmbito de aplicação e ao impacto das referidas normas técnicas de execução, atendendo a que apenas se dirigem às autoridades nacionais competentes dos Estados-Membros e não aos operadores no mercado. A ESMA solicitou o parecer do seu Grupo de Partes Interessadas do Setor dos Valores Mobiliários e dos Mercados, criado em conformidade com o artigo 37.o do Regulamento (UE) n.o 1095/2010 do Parlamento Europeu e do Conselho (2), |
ADOTOU O PRESENTE REGULAMENTO:
Artigo 1.o
Pontos de contacto
1. Para cada Estado-Membro, as autoridades competentes designam um ponto de contacto único para a transmissão das informações referidas nos artigos 2.o e 3.o, bem como para as comunicações sobre qualquer questão relacionada com a apresentação dessas informações.
2. As autoridades competentes notificam à Autoridade Europeia dos Valores Mobiliários e dos Mercados (ESMA) o ponto de contacto a que se refere o n.o 1.
3. A ESMA designa um ponto de contacto para a receção das informações referidas no artigo 2.o, bem como das comunicações sobre qualquer questão relacionada com a receção das informações referidas nos artigos 2.o e 3.o.
4. A ESMA publica o ponto de contacto a que se refere o n.o 3 no seu sítio web.
Artigo 2.o
Apresentação anual de informações agregadas
As autoridades competentes fornecem à ESMA as informações referidas no artigo 99.o-E, n.o 1, da Diretiva 2009/65/CE preenchendo o formulário constante do anexo I do presente regulamento.
Essas informações referem-se a todas as sanções e medidas impostas durante o ano civil transato.
Os formulários são preenchidos por via eletrónica e enviados à ESMA por correio eletrónico através do ponto de contacto referido no artigo 1.o, n.o 3, até 31 de março de cada ano.
Artigo 3.o
Procedimentos e formulários de comunicação
1. As autoridades competentes comunicam à ESMA as sanções e medidas administrativas a que se refere o artigo 99.o-E, n.o 2, da Diretiva 2009/65/CE, utilizando as interfaces existentes asseguradas pelo sistema informático, bem como a base de dados conexa, criada pela ESMA para gerir a receção, a armazenagem e a publicação de informações sobre as sanções e medidas administrativas em conformidade com o artigo 99.o-E da Diretiva 2009/65/CE.
2. As sanções e medidas administrativas são comunicadas à ESMA num ficheiro de relatório segundo o formato estabelecido no anexo II.
Artigo 4.o
Invalidação e atualização de relatórios
1. Se uma autoridade competente pretender invalidar um ficheiro de relatório existente, anteriormente transmitido à ESMA em conformidade com o artigo 3.o, anula o relatório existente e envia um novo ficheiro de relatório.
2. Se uma autoridade competente pretender atualizar um ficheiro de relatório existente, anteriormente transmitido à ESMA em conformidade com o artigo 3.o, transmite de novo o ficheiro de relatório com as informações atualizadas.
Artigo 5.o
Entrada em vigor e aplicação
O presente regulamento entra em vigor no vigésimo dia seguinte ao da sua publicação no Jornal Oficial da União Europeia.
O presente regulamento é obrigatório em todos os seus elementos e diretamente aplicável em todos os Estados-Membros.
Feito em Bruxelas, em 25 de julho de 2016.
Pela Comissão
O Presidente
Jean-Claude JUNCKER
(1) JO L 302 de 17.11.2009, p. 32.
(2) Regulamento (UE) n.o 1095/2010 do Parlamento Europeu e do Conselho, de 24 de novembro de 2010, que cria uma Autoridade Europeia de Supervisão (Autoridade Europeia dos Valores Mobiliários e dos Mercados), altera a Decisão n.o 716/2009/CE e revoga a Decisão 2009/77/CE da Comissão (JO L 331 de 15.12.2010, p. 84).
ANEXO I
Formulário para a apresentação anual de informações agregadas sobre todas as sanções e medidas impostas
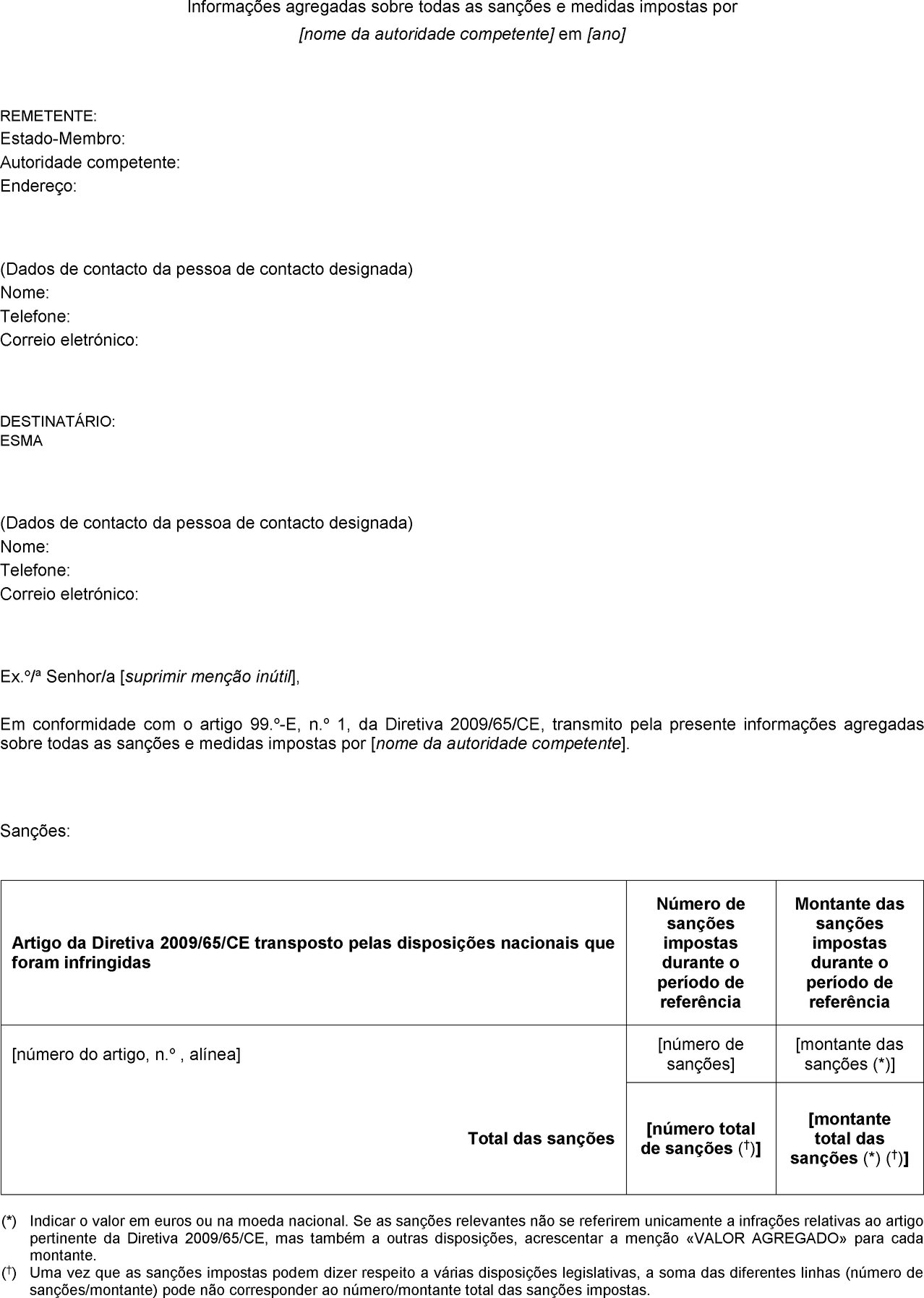

ANEXO II
Formulário de notificação das sanções ou medidas administrativas divulgadas ao público

|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/12 |
REGULAMENTO DE EXECUÇÃO (UE) 2016/1213 DA COMISSÃO
de 25 de julho de 2016
que estabelece os valores forfetários de importação para a determinação do preço de entrada de certos frutos e produtos hortícolas
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta o Regulamento (UE) n.o 1308/2013 do Parlamento Europeu e do Conselho, de 17 de dezembro de 2013, que estabelece uma organização comum dos mercados dos produtos agrícolas e que revoga os Regulamentos (CEE) n.o 922/72, (CEE) n.o 234/79, (CE) n.o 1037/2001, (CE) n.o 1234/2007 do Conselho (1),
Tendo em conta o Regulamento de Execução (UE) n.o 543/2011 da Comissão, de 7 de junho de 2011, que estabelece regras de execução do Regulamento (CE) n.o 1234/2007 do Conselho nos sectores das frutas e produtos hortícolas e das frutas e produtos hortícolas transformados (2), nomeadamente o artigo 136.o, n.o 1,
Considerando o seguinte:
|
(1) |
O Regulamento de Execução (UE) n.o 543/2011 estabelece, em aplicação dos resultados das negociações comerciais multilaterais do «Uruguay Round», os critérios para a fixação pela Comissão dos valores forfetários de importação dos países terceiros relativamente aos produtos e aos períodos indicados no Anexo XVI, parte A. |
|
(2) |
O valor forfetário de importação é calculado, todos os dias úteis, em conformidade com o artigo 136.o, n.o 1, do Regulamento de Execução (UE) n.o 543/2011, tendo em conta os dados diários variáveis. O presente regulamento deve, por conseguinte, entrar em vigor no dia da sua publicação no Jornal Oficial da União Europeia, |
ADOTOU O PRESENTE REGULAMENTO:
Artigo 1.o
Os valores forfetários de importação referidos no artigo 136.o do Regulamento de Execução (UE) n.o 543/2011 são fixados no anexo do presente regulamento.
Artigo 2.o
O presente regulamento entra em vigor na data da sua publicação no Jornal Oficial da União Europeia.
O presente regulamento é obrigatório em todos os seus elementos e diretamente aplicável em todos os Estados-Membros.
Feito em Bruxelas, em 25 de julho de 2016.
Pela Comissão
Em nome do Presidente,
Jerzy PLEWA
Diretor-Geral da Agricultura e do Desenvolvimento Rural
(1) JO L 347 de 20.12.2013, p. 671.
(2) JO L 157 de 15.6.2011, p. 1.
ANEXO
Valores forfetários de importação para a determinação do preço de entrada de certos frutos e produtos hortícolas
|
(EUR/100 kg) |
||
|
Código NC |
Código países terceiros (1) |
Valor forfetário de importação |
|
0702 00 00 |
MA |
164,1 |
|
ZZ |
164,1 |
|
|
0707 00 05 |
TR |
103,7 |
|
ZZ |
103,7 |
|
|
0709 93 10 |
TR |
137,2 |
|
ZZ |
137,2 |
|
|
0805 50 10 |
AR |
197,4 |
|
AU |
158,0 |
|
|
CL |
153,0 |
|
|
TR |
164,0 |
|
|
UY |
195,6 |
|
|
ZA |
178,4 |
|
|
ZZ |
174,4 |
|
|
0806 10 10 |
EG |
269,9 |
|
MA |
245,1 |
|
|
ZZ |
257,5 |
|
|
0808 10 80 |
AR |
121,6 |
|
BR |
101,0 |
|
|
CL |
132,0 |
|
|
CN |
74,5 |
|
|
NZ |
135,2 |
|
|
US |
157,1 |
|
|
ZA |
106,1 |
|
|
ZZ |
118,2 |
|
|
0808 30 90 |
AR |
109,8 |
|
CL |
135,7 |
|
|
NZ |
171,3 |
|
|
TR |
187,7 |
|
|
ZA |
119,2 |
|
|
ZZ |
144,7 |
|
|
0809 10 00 |
TR |
202,4 |
|
ZZ |
202,4 |
|
|
0809 29 00 |
TR |
244,3 |
|
US |
535,2 |
|
|
ZA |
271,2 |
|
|
ZZ |
350,2 |
|
|
0809 30 10 , 0809 30 90 |
TR |
120,5 |
|
ZZ |
120,5 |
|
(1) Nomenclatura dos países fixada pelo Regulamento (UE) n.o 1106/2012 da Comissão, de 27 de novembro de 2012, que executa o Regulamento (CE) n.o 471/2009 do Parlamento Europeu e do Conselho relativo às estatísticas comunitárias do comércio externo com países terceiros, no que respeita à atualização da nomenclatura dos países e territórios (JO L 328 de 28.11.2012, p. 7). O código «ZZ» representa «outras origens».
DIRETIVAS
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/14 |
DIRETIVA (UE) 2016/1214 DA COMISSÃO
de 25 de julho de 2016
que altera a Diretiva 2005/62/CE no que se refere a normas e especificações do sistema de qualidade dos serviços de sangue
(Texto relevante para efeitos do EEE)
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta a Diretiva 2002/98/CE do Parlamento Europeu e do Conselho, de 27 de janeiro de 2003, que estabelece normas de qualidade e segurança em relação à colheita, análise, processamento, armazenamento e distribuição de sangue humano e de componentes sanguíneos e que altera a Diretiva 2001/83/CE (1), nomeadamente o artigo 29.o, segundo parágrafo, alínea h),
Considerando o seguinte:
|
(1) |
O artigo 2.o da Diretiva 2005/62/CE da Comissão (2) determina que os Estados-Membros devem assegurar que o sistema de qualidade utilizado em todos os serviços de sangue observa as normas e especificações estabelecidas no anexo daquela diretiva. |
|
(2) |
O artigo 2.o da Diretiva 2005/62/CE determina ainda que a Comissão deve elaborar diretrizes em matéria de boas práticas, com vista à interpretação das normas e especificações referidas no mesmo artigo. |
|
(3) |
Foram desenvolvidas diretrizes de boas práticas («DBP») conjuntamente pela Comissão e pela Direção Europeia da Qualidade dos Medicamentos e Cuidados de Saúde do Conselho da Europa, as quais foram publicadas pelo Conselho da Europa (3). |
|
(4) |
As DBP foram desenvolvidas e são atualizadas tendo em conta conhecimentos científicos e técnicos. As DBP refletem plenamente os princípios e diretrizes de boas práticas de fabrico estabelecidos em conformidade com o artigo 47.o da Diretiva 2001/83/CE do Parlamento Europeu e do Conselho (4) que são relevantes para os serviços de sangue e respetivos sistemas de qualidade e são já utilizados com êxito nos serviços de sangue na União. Por conseguinte, devem ser tomadas em consideração aquando da aplicação das normas e especificações estabelecidas no anexo da Diretiva 2005/62/CE. O n.o 2 do artigo 2.o da referida diretiva deve, por conseguinte, ser alterado em conformidade. |
|
(5) |
A Comissão, que participa ativamente no processo de alteração das DBP em conjunto com peritos dos Estados-Membros, deve informar as autoridades competentes designadas pelos Estados-Membros de quaisquer alterações significativas às DBP que também devem ser tidas em conta. |
|
(6) |
As medidas previstas na presente diretiva estão em conformidade com o parecer do comité criado pela Diretiva 2002/98/CE, |
ADOTOU A PRESENTE DIRETIVA:
Artigo 1.o
No artigo 2.o da Diretiva 2005/62/CE, o n.o 2 passa a ter a seguinte redação:
«2. Os Estados-Membros devem assegurar, a fim de aplicar as normas e as especificações estabelecidas no anexo da presente diretiva, que existem diretrizes de boas práticas e que estas são utilizadas por todos os serviços de sangue, nos respetivos sistemas de qualidade, diretrizes estas que tenham plenamente em conta, quando pertinente para os serviços de sangue, os princípios e diretrizes de boas práticas de fabrico referidos no primeiro parágrafo do artigo 47.o da Diretiva 2001/83/CE. Ao fazê-lo, os Estados-Membros devem ter em conta as diretrizes de boas práticas desenvolvidas conjuntamente pela Comissão e pela Direção Europeia da Qualidade dos Medicamentos e Cuidados de Saúde do Conselho da Europa e publicadas pelo Conselho da Europa (*).
Artigo 2.o
1. Os Estados-Membros devem pôr em vigor, até 15 de fevereiro de 2018, as disposições legislativas, regulamentares e administrativas necessárias para dar cumprimento à presente diretiva. Os Estados-Membros devem comunicar imediatamente à Comissão o texto dessas disposições.
As disposições adotadas pelos Estados-Membros devem fazer referência à presente diretiva ou ser acompanhadas dessa referência aquando da sua publicação oficial. Os Estados-Membros estabelecem o modo como deve ser feita a referência.
2. Os Estados-Membros devem comunicar à Comissão o texto das principais disposições de direito interno que adotarem no domínio abrangido pela presente diretiva.
Artigo 3.o
A presente diretiva entra em vigor no vigésimo dia seguinte ao da sua publicação no Jornal Oficial da União Europeia.
Artigo 4.o
Os destinatários da presente diretiva são os Estados-Membros.
Feito em Bruxelas, em 25 de julho de 2016.
Pela Comissão
O Presidente
Jean-Claude JUNCKER
(1) JO L 33 de 8.2.2003, p. 30.
(2) Diretiva 2005/62/CE da Comissão, de 30 de setembro de 2005, que dá execução à Diretiva 2002/98/CE do Parlamento Europeu e do Conselho no que respeita às normas e especificações comunitárias relativas ao sistema de qualidade dos serviços de sangue (JO L 256 de 1.10.2005, p. 41).
(3) Diretrizes de boas práticas (Good Practice Guidelines), incluídas no Guia para a preparação, utilização e garantia da qualidade dos componentes do sangue, Apêndice da Recomendação n.o R (95) 15 do Comité de Ministros sobre a preparação, utilização e garantia da qualidade dos componentes do sangue [Guide to the preparation, use and quality assurance of blood components, Appendix to Recommendation No. R (95) 15 of the Committee of Ministers on the preparation, use and quality assurance of blood components], adotada em 12 de outubro de 1995.
(4) Diretiva 2001/83/CE do Parlamento Europeu e do Conselho, de 6 de novembro de 2001, que estabelece um código comunitário relativo aos medicamentos para uso humano (JO L 311 de 28.11.2001, p. 67).
DECISÕES
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/16 |
DECISÃO DE EXECUÇÃO (UE) 2016/1215 DA COMISSÃO
de 22 de julho de 2016
que autoriza a colocação no mercado de produtos que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada FG72 (MST-FGØ72-2) nos termos do Regulamento (CE) n.o 1829/2003 do Parlamento Europeu e do Conselho
[notificada com o número C(2016) 4576]
(Apenas faz fé o texto em língua alemã)
(Texto relevante para efeitos do EEE)
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta o Regulamento (CE) n.o 1829/2003 do Parlamento Europeu e do Conselho, de 22 de setembro de 2003, relativo a géneros alimentícios e alimentos para animais geneticamente modificados (1), nomeadamente o artigo 7.o, n.o 3, e o artigo 19.o, n.o 3,
Considerando o seguinte:
|
(1) |
Em 24 de junho de 2011, a empresa Bayer CropScience AG apresentou à autoridade competente da Bélgica um pedido, nos termos dos artigos 5.o e 17.o do Regulamento (CE) n.o 1829/2003, para colocar no mercado géneros alimentícios, ingredientes alimentares e alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja FG72 (o «pedido»). |
|
(2) |
O pedido abrange igualmente a colocação no mercado de soja geneticamente modificada FG72 em produtos por ela constituídos ou que a contenham, destinados a outras utilizações habituais da soja que não como géneros alimentícios ou alimentos para animais, à exceção do cultivo. |
|
(3) |
Em conformidade com o disposto no artigo 5.o, n.o 5, e no artigo 17.o, n.o 5, do Regulamento (CE) n.o 1829/2003, o pedido inclui os dados e informações exigidos pelos anexos III e IV da Diretiva 2001/18/CE do Parlamento Europeu e do Conselho (2), bem como informações e conclusões sobre a avaliação dos riscos, realizada em conformidade com os princípios estabelecidos no anexo II daquela diretiva. Inclui ainda um plano de monitorização dos efeitos ambientais nos termos do anexo VII da Diretiva 2001/18/CE. |
|
(4) |
Em 16 de julho de 2015, a Autoridade Europeia para a Segurança dos Alimentos («EFSA») emitiu um parecer favorável, nos termos dos artigos 6.o e 18.o do Regulamento (CE) n.o 1829/2003 (3). O parecer concluiu que a soja geneticamente modificada FG72, tal como descrita no pedido, é tão segura como a sua equivalente convencional e outras variedades de soja não geneticamente modificadas no que se refere aos potenciais efeitos negativos para a saúde humana e animal e para o ambiente, no contexto do âmbito do pedido. |
|
(5) |
No seu parecer, a EFSA tomou em conta todas as questões e preocupações específicas manifestadas pelos Estados-Membros no contexto da consulta às autoridades nacionais competentes prevista no artigo 6.o, n.o 4, e no artigo 18.o, n.o 4, do Regulamento (CE) n.o 1829/2003. |
|
(6) |
A EFSA concluiu igualmente no seu parecer que o plano de monitorização dos efeitos ambientais apresentado pelo requerente, consistindo num plano geral de vigilância, está de acordo com as utilizações previstas dos produtos. |
|
(7) |
Tendo em conta essas considerações, deve ser concedida autorização aos produtos que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada FG72. |
|
(8) |
Deve ser atribuído um identificador único a cada organismo geneticamente modificado (a seguir «OGM») nos termos do Regulamento (CE) n.o 65/2004 da Comissão (4). |
|
(9) |
Com base no parecer da EFSA, afigura-se não serem necessários, para os géneros alimentícios, ingredientes alimentares e alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada FG72, requisitos de rotulagem específicos para além dos previstos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003. Todavia, a fim de assegurar que os referidos produtos são utilizados dentro dos limites da autorização concedida na presente decisão, a rotulagem dos produtos que contenham ou sejam constituídos por soja FG72, exceto os produtos alimentares, deve ser complementada pela indicação clara de que os produtos em causa não se destinam ao cultivo. |
|
(10) |
O Regulamento (CE) n.o 1830/2003 do Parlamento Europeu e do Conselho (5) estabelece, no artigo 4.o, n.o 6, requisitos de rotulagem aplicáveis aos produtos que contenham ou sejam constituídos por OGM. Os requisitos de rastreabilidade para esses produtos constam do artigo 4.o, n.os 1 a 5, e os requisitos de rastreabilidade relativos aos géneros alimentícios e alimentos para animais produzidos a partir de OGM constam do artigo 5.o do referido regulamento. |
|
(11) |
O detentor da autorização deve apresentar relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização dos efeitos ambientais. Os referidos resultados devem ser apresentados em conformidade com o disposto na Decisão 2009/770/CE da Comissão (6). O parecer da EFSA não justifica a imposição de condições ou restrições específicas relativas à colocação no mercado e/ou à utilização e ao manuseamento dos géneros alimentícios e alimentos para animais, incluindo requisitos de monitorização após colocação no mercado, nem de condições específicas tendo em vista a proteção de determinados ecossistemas/ambientes e/ou zonas geográficas, tal como previsto no artigo 6.o, n.o 5, alínea e), e no artigo 18.o, n.o 5, alínea e), do Regulamento (CE) n.o 1829/2003. |
|
(12) |
Nos termos do Regulamento (CE) n.o 1829/2003, todas as informações pertinentes sobre a autorização dos produtos devem ser inscritas no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados. |
|
(13) |
A presente decisão deve ser notificada, através do Centro de Intercâmbio de Informações para a Segurança Biológica, às Partes no Protocolo de Cartagena sobre Segurança Biológica à Convenção sobre a Diversidade Biológica, nos termos do artigo 9.o, n.o 1, e do artigo 15.o, n.o 2, alínea c), do Regulamento (CE) n.o 1946/2003 do Parlamento Europeu e do Conselho (7). |
|
(14) |
O Comité Permanente dos Vegetais, Animais e Alimentos para Consumo Humano e Animal não emitiu parecer no prazo fixado pelo seu presidente. Considerou-se necessário um ato de execução, cujo projeto foi apresentado pelo presidente ao Comité de Recurso para nova deliberação. O Comité de Recurso não emitiu qualquer parecer, |
ADOTOU A PRESENTE DECISÃO:
Artigo 1.o
Organismo geneticamente modificado e identificador único
À soja [Glycine max (L.) Merr.] geneticamente modificada FG72, tal como se especifica na alínea b) do anexo da presente decisão, é atribuído, como previsto no Regulamento (CE) n.o 65/2004, o identificador único MST-FGØ72-2.
Artigo 2.o
Autorização
Para efeitos do artigo 4.o, n.o 2, e do artigo 16.o, n.o 2, do Regulamento (CE) n.o 1829/2003, são autorizados os seguintes produtos, de acordo com as condições fixadas na presente decisão:
|
a) |
Géneros alimentícios e ingredientes alimentares que contenham, sejam constituídos por, ou produzidos a partir de soja MST-FGØ72-2; |
|
b) |
Alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MST-FGØ72-2; |
|
c) |
Soja MST-FGØ72-2 em produtos por ela constituídos ou que a contenham, para quaisquer utilizações que não as indicadas nas alíneas a) e b), à exceção do cultivo. |
Artigo 3.o
Rotulagem
1. Para efeitos dos requisitos de rotulagem estabelecidos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003, bem como no artigo 4.o, n.o 6, do Regulamento (CE) n.o 1830/2003, o «nome do organismo» é «soja».
2. A menção «Não se destina ao cultivo» deve constar do rótulo assim como dos documentos de acompanhamento dos produtos que contenham ou sejam constituídos por soja MST-FGØ72-2, com exceção dos produtos referidos no artigo 2.o, alínea a).
Artigo 4.o
Monitorização dos efeitos ambientais
1. O detentor da autorização deve garantir a elaboração e a execução do plano de monitorização dos efeitos ambientais, de acordo com o disposto na alínea h) do anexo.
2. O detentor da autorização deve apresentar à Comissão relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização, em conformidade com a Decisão 2009/770/CE.
Artigo 5.o
Registo comunitário
Nos termos do artigo 28.o do Regulamento (CE) n.o 1829/2003, as informações contidas no anexo da presente decisão devem ser inscritas no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados.
Artigo 6.o
Detentor da autorização
O detentor da autorização é a empresa Bayer CropScience AG.
Artigo 7.o
Validade
A presente decisão é aplicável por um período de 10 anos a contar da data da sua notificação.
Artigo 8.o
Destinatária
A destinatária da presente decisão é a empresa Bayer CropScience AG, Alfred-Nobel-Strasse 50, D — 40789 Monheim am Rhein, Alemanha.
Feito em Bruxelas, em 22 de julho de 2016.
Pela Comissão
Vytenis ANDRIUKAITIS
Membro da Comissão
(1) JO L 268 de 18.10.2003, p. 1.
(2) Diretiva 2001/18/CE do Parlamento Europeu e do Conselho, de 12 de março de 2001, relativa à libertação deliberada no ambiente de organismos geneticamente modificados e que revoga a Diretiva 90/220/CEE do Conselho (JO L 106 de 17.4.2001, p. 1).
(3) Painel dos Organismos Geneticamente Modificados da EFSA (Painel OGM), 2015. Parecer científico sobre o pedido (EFSA-GMO-BE-2011-98), apresentado pela Bayer, para a colocação no mercado de soja FG72 geneticamente modificada, com tolerância aos herbicidas, para utilização como género alimentício e alimento para animais, assim como importação e transformação, ao abrigo do Regulamento (CE) n.o 1829/2003. EFSA Journal 2015; 13(7):4167, 29 pp. doi:10.2903/j.efsa.2015.4167.
(4) Regulamento (CE) n.o 65/2004 da Comissão, de 14 de janeiro de 2004, que estabelece um sistema para criação e atribuição de identificadores únicos aos organismos geneticamente modificados (JO L 10 de 16.1.2004, p. 5).
(5) Regulamento (CE) n.o 1830/2003 do Parlamento Europeu e do Conselho, de 22 de setembro de 2003, relativo à rastreabilidade e rotulagem de organismos geneticamente modificados e à rastreabilidade dos géneros alimentícios e alimentos para animais produzidos a partir de organismos geneticamente modificados e que altera a Diretiva 2001/18/CE (JO L 268 de 18.10.2003, p. 24).
(6) Decisão 2009/770/CE da Comissão, de 13 de outubro de 2009, que em conformidade com a Diretiva 2001/18/CE do Parlamento Europeu e do Conselho estabelece os modelos de relatórios normalizados para a apresentação dos resultados da monitorização das libertações deliberadas no ambiente de organismos geneticamente modificados, como produtos ou contidos em produtos destinados a ser colocados no mercado (JO L 275 de 21.10.2009, p. 9).
(7) Regulamento (CE) n.o 1946/2003 do Parlamento Europeu e do Conselho, de 15 de julho de 2003, relativo ao movimento transfronteiriço de organismos geneticamente modificados (JO L 287 de 5.11.2003, p. 1).
ANEXO
a) Requerente e detentor da autorização:
|
Nome |
: |
Bayer CropScience AG |
|
Endereço |
: |
Alfred-Nobel-Strasse 50, D — 40789 Monheim am Rhein — Alemanha. |
b) Designação e especificação dos produtos:
|
1) |
Géneros alimentícios e ingredientes alimentares que contenham, sejam constituídos por, ou produzidos a partir de soja MST-FGØ72-2. |
|
2) |
Alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MST-FGØ72-2. |
|
3) |
Soja MST-FGØ72-2 em produtos por ela constituídos ou que a contenham, para quaisquer utilizações que não as indicadas nos pontos 1 e 2, à exceção do cultivo. |
A soja geneticamente modificada MST-FGØ72-2, tal como descrita no pedido, exprime a proteína 2mEPSPS que confere tolerância aos herbicidas à base de glifosato e a proteína HPPD W336 que confere tolerância aos herbicidas à base de isoxaflutol.
c) Rotulagem:
|
1) |
Para efeitos dos requisitos de rotulagem estabelecidos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003, bem como no artigo 4.o, n.o 6, do Regulamento (CE) n.o 1830/2003, o «nome do organismo» é «soja». |
|
2) |
A menção «Não se destina ao cultivo» deve constar do rótulo assim como dos documentos de acompanhamento dos produtos que contenham ou sejam constituídos por soja MST-FGØ72-2, com exceção dos produtos referidos no artigo 2.o, alínea a). |
d) Método de deteção:
|
1) |
Método de deteção específico da ação com a técnica de PCR em tempo real para a quantificação da soja MST-FGØ72-2. |
|
2) |
Validado em ADN genómico, extraído de sementes de soja MST-FGØ72-2, pelo Laboratório de Referência da UE criado ao abrigo do Regulamento (CE) n.o 1829/2003, publicado em http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3) |
Materiais de referência: AOCS 0610-A3 e AOCS 0707-A6 acessíveis através da American Oil Chemists Society em http://www.aocs.org/LabServices/content.cfm?ItemNumber=19248 |
e) Identificador único:
MST-FGØ72-2
f) Informações requeridas nos termos do anexo II do Protocolo de Cartagena sobre Segurança Biológica à Convenção sobre a Diversidade Biológica:
[Centro de Intercâmbio de Informações para a Segurança Biológica, ID de registo: publicado no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados quando da notificação].
g) Condições ou restrições aplicáveis à colocação no mercado, utilização ou manuseamento dos produtos:
Não aplicável.
h) Plano de monitorização dos efeitos ambientais:
Plano de monitorização dos efeitos ambientais nos termos do anexo VII da Diretiva 2001/18/CE.
[Ligação: plano publicado no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados].
i) Requisitos de monitorização da utilização dos géneros alimentícios para consumo humano após colocação no mercado:
Não aplicável.
Nota: as ligações aos documentos pertinentes podem sofrer alterações ao longo do tempo. Essas alterações serão levadas ao conhecimento do público mediante a atualização do Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados.
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/22 |
DECISÃO DE EXECUÇÃO (UE) 2016/1216 DA COMISSÃO
de 22 de julho de 2016
que autoriza a colocação no mercado de produtos que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada MON 87708 × MON 89788 (MON-877Ø8-9 × MON-89788-1) nos termos do Regulamento (CE) n.o 1829/2003 do Parlamento Europeu e do Conselho
[notificada com o número C(2016) 4580]
(Apenas fazem fé os textos nas línguas francesa e neerlandesa)
(Texto relevante para efeitos do EEE)
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta o Regulamento (CE) n.o 1829/2003 do Parlamento Europeu e do Conselho, de 22 de setembro de 2003, relativo a géneros alimentícios e alimentos para animais geneticamente modificados (1), nomeadamente o artigo 7.o, n.o 3, e o artigo 19.o, n.o 3,
Considerando o seguinte:
|
(1) |
Em 23 de março de 2012, a empresa Monsanto Europe S.A. apresentou à autoridade competente dos Países Baixos um pedido, nos termos dos artigos 5.o e 17.o do Regulamento (CE) n.o 1829/2003, para colocar no mercado géneros alimentícios, ingredientes alimentares e alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MON 87708 × MON 89788 (o «pedido»). |
|
(2) |
O pedido abrange igualmente a colocação no mercado de soja geneticamente modificada MON 87708 × MON 89788 em produtos por ela constituídos ou que a contenham, destinados a outras utilizações habituais da soja, que não como géneros alimentícios ou alimentos para animais, à exceção do cultivo. |
|
(3) |
Em conformidade com o disposto no artigo 5.o, n.o 5, e no artigo 17.o, n.o 5, do Regulamento (CE) n.o 1829/2003, o pedido inclui os dados e informações exigidos pelos anexos III e IV da Diretiva 2001/18/CE do Parlamento Europeu e do Conselho (2), bem como informações e conclusões sobre a avaliação dos riscos, realizada em conformidade com os princípios estabelecidos no anexo II daquela diretiva. Inclui ainda um plano de monitorização dos efeitos ambientais nos termos do anexo VII da Diretiva 2001/18/CE. |
|
(4) |
Em 18 de junho de 2015, a Autoridade Europeia para a Segurança dos Alimentos («EFSA») emitiu um parecer favorável, nos termos dos artigos 6.o e 18.o do Regulamento (CE) n.o 1829/2003. O parecer concluiu que a soja geneticamente modificada MON 87708 × MON 89788, tal como descrita no pedido, é tão segura como a sua equivalente convencional e outras variedades de soja não geneticamente modificadas no que se refere aos potenciais efeitos negativos para a saúde humana e animal e para o ambiente, no contexto do âmbito do pedido (3). |
|
(5) |
No seu parecer, a EFSA atentou a todas as questões e preocupações específicas manifestadas pelos Estados-Membros no contexto da consulta às autoridades nacionais competentes prevista no artigo 6.o, n.o 4, e no artigo 18.o, n.o 4, do Regulamento (CE) n.o 1829/2003. |
|
(6) |
A EFSA concluiu igualmente no seu parecer que o plano de monitorização dos efeitos ambientais apresentado pelo requerente, consistindo num plano geral de vigilância, está de acordo com as utilizações previstas dos produtos. |
|
(7) |
Tendo em conta essas considerações, deve ser concedida autorização aos produtos que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada MON 87708 × MON 89788. |
|
(8) |
Deve ser atribuído um identificador único a cada organismo geneticamente modificado (a seguir «OGM») nos termos do Regulamento (CE) n.o 65/2004 da Comissão (4). |
|
(9) |
Com base no parecer da EFSA, afigura-se não serem necessários, para os géneros alimentícios, ingredientes alimentares e alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada MON 87708 × MON 89788, requisitos de rotulagem específicos para além dos previstos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003. Todavia, a fim de assegurar que os referidos produtos são utilizados dentro dos limites da autorização concedida na presente decisão, a rotulagem dos produtos que contenham ou sejam constituídos por soja MON 87708 × MON 89788, exceto os produtos alimentares, deve ser complementada pela indicação clara de que os produtos em causa não se destinam ao cultivo. |
|
(10) |
O Regulamento (CE) n.o 1830/2003 do Parlamento Europeu e do Conselho (5) estabelece, no artigo 4.o, n.o 6, requisitos de rotulagem aplicáveis aos produtos que contenham ou sejam constituídos por OGM. Os requisitos de rastreabilidade para esses produtos constam do artigo 4.o, n.os 1 a 5, e os requisitos de rastreabilidade relativos aos géneros alimentícios e alimentos para animais produzidos a partir de OGM constam do artigo 5.o do referido regulamento. |
|
(11) |
O detentor da autorização deve apresentar relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização dos efeitos ambientais. Os referidos resultados devem ser apresentados em conformidade com o disposto na Decisão 2009/770/CE da Comissão (6). O parecer da EFSA não justifica a imposição de condições ou restrições específicas relativas à colocação no mercado e/ou à utilização e ao manuseamento dos géneros alimentícios e alimentos para animais, incluindo requisitos de monitorização após colocação no mercado, nem de condições específicas tendo em vista a proteção de determinados ecossistemas/ambientes e/ou zonas geográficas, tal como previsto no artigo 6.o, n.o 5, alínea e), e no artigo 18.o, n.o 5, alínea e), do Regulamento (CE) n.o 1829/2003. |
|
(12) |
Nos termos do Regulamento (CE) n.o 1829/2003, todas as informações pertinentes sobre a autorização dos produtos devem ser inscritas no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados. |
|
(13) |
A presente decisão deve ser notificada, através do Centro de Intercâmbio de Informações para a Segurança Biológica, às Partes no Protocolo de Cartagena sobre Segurança Biológica à Convenção sobre a Diversidade Biológica, nos termos do artigo 9.o, n.o 1, e do artigo 15.o, n.o 2, alínea c), do Regulamento (CE) n.o 1946/2003 do Parlamento Europeu e do Conselho (7). |
|
(14) |
O Comité Permanente dos Vegetais, Animais e Alimentos para Consumo Humano e Animal não emitiu parecer no prazo fixado pelo seu presidente. Considerou-se necessário um ato de execução, cujo projeto foi apresentado pelo presidente ao comité de recurso para nova deliberação. O Comité de Recurso não emitiu qualquer parecer, |
ADOTOU A PRESENTE DECISÃO:
Artigo 1.o
Organismo geneticamente modificado e identificador único
À soja [Glycine max (L.) Merr.] geneticamente modificada MON 87708 × MON 89788, tal como se especifica na alínea b) do anexo da presente decisão, é atribuído, como previsto no Regulamento (CE) n.o 65/2004, o identificador único MON-877Ø8-9 × MON-89788-1.
Artigo 2.o
Autorização
Para efeitos do artigo 4.o, n.o 2, e do artigo 16.o, n.o 2, do Regulamento (CE) n.o 1829/2003, são autorizados os seguintes produtos, de acordo com as condições fixadas na presente decisão:
|
a) |
Géneros alimentícios e ingredientes alimentares que contenham, sejam constituídos por, ou produzidos a partir de soja MON-877Ø8-9 × MON-89788-1; |
|
b) |
Alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MON-877Ø8-9 × MON-89788-1; |
|
c) |
Soja MON-877Ø8-9 × MON-89788-1 em produtos por ela constituídos ou que a contenham, para quaisquer utilizações que não as indicadas nas alíneas a) e b), à exceção do cultivo. |
Artigo 3.o
Rotulagem
1. Para efeitos dos requisitos de rotulagem estabelecidos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003, bem como no artigo 4.o, n.o 6, do Regulamento (CE) n.o 1830/2003, o «nome do organismo» é «soja».
2. A menção «Não se destina ao cultivo» deve constar do rótulo assim como dos documentos de acompanhamento dos produtos que contenham ou sejam constituídos por soja MON-877Ø8-9 × MON-89788-1, com exceção dos produtos referidos no artigo 2.o, alínea a).
Artigo 4.o
Monitorização dos efeitos ambientais
1. O detentor da autorização deve garantir a elaboração e a execução do plano de monitorização dos efeitos ambientais, de acordo com o disposto na alínea h) do anexo.
2. O detentor da autorização deve apresentar à Comissão relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização, em conformidade com a Decisão 2009/770/CE.
Artigo 5.o
Registo comunitário
Nos termos do artigo 28.o do Regulamento (CE) n.o 1829/2003, as informações contidas no anexo da presente decisão devem ser inscritas no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados.
Artigo 6.o
Detentor da autorização
O detentor da autorização é a empresa Monsanto Europe S.A., Bélgica, em representação da Monsanto Company, Estados Unidos da América.
Artigo 7.o
Validade
A presente decisão é aplicável por um período de 10 anos a contar da data da sua notificação.
Artigo 8.o
Destinatária
A destinatária da presente decisão é a empresa Monsanto Europe S.A., Avenue de Tervuren 270-272, B-1150 Bruxelas, Bélgica.
Feito em Bruxelas, em 22 de julho de 2016.
Pela Comissão
Vytenis ANDRIUKAITIS
Membro da Comissão
(1) JO L 268 de 18.10.2003, p. 1.
(2) Diretiva 2001/18/CE do Parlamento Europeu e do Conselho, de 12 de março de 2001, relativa à libertação deliberada no ambiente de organismos geneticamente modificados e que revoga a Diretiva 90/220/CEE do Conselho (JO L 106 de 17.4.2001, p. 1).
(3) Parecer científico sobre o pedido (EFSA-GMO-NL-2012-108), apresentado pela Monsanto, para a colocação no mercado de soja MON 87708 × MON 89788 geneticamente modificada, com tolerância aos herbicidas, para utilização como género alimentício e alimento para animais, assim como importação e transformação, ao abrigo do Regulamento (CE) n.o 1829/2003. EFSA Journal 2015;13(6):4136, 26 pp. doi: 10.2903/j.efsa.2015.4136
(4) Regulamento (CE) n.o 65/2004 da Comissão, de 14 de janeiro de 2004, que estabelece um sistema para criação e atribuição de identificadores únicos aos organismos geneticamente modificados (JO L 10 de 16.1.2004, p. 5).
(5) Regulamento (CE) n.o 1830/2003 do Parlamento Europeu e do Conselho, de 22 de setembro de 2003, relativo à rastreabilidade e rotulagem de organismos geneticamente modificados e à rastreabilidade dos géneros alimentícios e alimentos para animais produzidos a partir de organismos geneticamente modificados e que altera a Diretiva 2001/18/CE (JO L 268 de 18.10.2003, p. 24).
(6) Decisão 2009/770/CE da Comissão, de 13 de outubro de 2009, que em conformidade com a Diretiva 2001/18/CE do Parlamento Europeu e do Conselho estabelece os modelos de relatórios normalizados para a apresentação dos resultados da monitorização das libertações deliberadas no ambiente de organismos geneticamente modificados, como produtos ou contidos em produtos destinados a ser colocados no mercado (JO L 275 de 21.10.2009, p. 9).
(7) Regulamento (CE) n.o 1946/2003 do Parlamento Europeu e do Conselho, de 15 de julho de 2003, relativo ao movimento transfronteiriço de organismos geneticamente modificados (JO L 287 de 5.11.2003, p. 1).
ANEXO
a) Requerente e detentor da autorização:
|
Nome |
: |
Monsanto Europe S.A. |
|
Endereço |
: |
Avenue de Tervuren 270-272, B-1150 Bruxelas — Bélgica |
Em nome da empresa Monsanto Company — 800 N. Lindbergh Boulevard — St. Louis, Missouri 63167, Estados Unidos da América.
b) Designação e especificação dos produtos:
|
1) |
Géneros alimentícios e ingredientes alimentares que contenham, sejam constituídos por, ou produzidos a partir de soja MON-877Ø8-9 × MON-89788-1. |
|
2) |
Alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MON-877Ø8-9 × MON-89788-1. |
|
3) |
Soja MON-877Ø8-9 × MON-89788-1 em produtos por ela constituídos ou que a contenham, para quaisquer utilizações que não as indicadas nos pontos 1 e 2, à exceção do cultivo. |
A soja geneticamente modificada MON-877Ø8-9 × MON-89788-1, tal como descrita no pedido, exprime as proteínas DMO que conferem tolerância aos herbicidas à base de dicamba e a proteína CP4 EPSPS que confere tolerância aos herbicidas à base de glifosato.
c) Rotulagem:
|
1) |
Para efeitos dos requisitos de rotulagem estabelecidos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003, bem como no artigo 4.o, n.o 6, do Regulamento (CE) n.o 1830/2003, o «nome do organismo» é «soja». |
|
2) |
A menção «Não se destina ao cultivo» deve constar do rótulo assim como dos documentos de acompanhamento dos produtos que contenham ou sejam constituídos por soja MON-877Ø8-9 × MON-89788-1, com exceção dos produtos referidos no artigo 2.o, alínea a). |
d) Método de deteção:
|
1) |
Métodos de deteção específicos da ação com a técnica de PCR quantitativa em tempo real para as sojas MON-877Ø8-9 e MON-89788-1; os métodos de deteção estão validados nas ações de transformação e verificados em ADN genómico extraído de sementes de soja MON-877Ø8-9 × MON-89788-1. |
|
2) |
Validado pelo Laboratório de Referência da UE criado ao abrigo do Regulamento (CE) n.o 1829/2003, publicado em http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3) |
Materiais de referência: AOCS 0311-A e AOCS 0906-A (para MON-877Ø8-9) e AOCS 0906-B e AOCS 0906-A (para MON-89788-1) acessíveis através da American Oil Chemists Society em http://www.aocs.org/LabServices/content.cfm?ItemNumber=19248 |
e) Identificador único:
MON-877Ø8-9 × MON-89788-1
f) Informações requeridas nos termos do anexo II do Protocolo de Cartagena sobre Segurança Biológica à Convenção sobre a Diversidade Biológica:
[Centro de Intercâmbio de Informações para a Segurança Biológica, ID de registo: publicado no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados quando da notificação].
g) Condições ou restrições aplicáveis à colocação no mercado, utilização ou manuseamento dos produtos:
Não aplicável.
h) Plano de monitorização dos efeitos ambientais:
Plano de monitorização dos efeitos ambientais nos termos do anexo VII da Diretiva 2001/18/CE.
[Ligação: plano publicado no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados].
i) Requisitos de monitorização da utilização dos géneros alimentícios para consumo humano após colocação no mercado:
Não aplicável.
Nota: as ligações aos documentos pertinentes podem sofrer alterações ao longo do tempo. Essas alterações serão levadas ao conhecimento do público mediante a atualização do Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados.
|
26.7.2016 |
PT |
Jornal Oficial da União Europeia |
L 199/28 |
DECISÃO DE EXECUÇÃO (UE) 2016/1217 DA COMISSÃO
de 22 de julho de 2016
que autoriza a colocação no mercado de produtos que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada MON 87705 × MON 89788 (MON-877Ø5-6 × MON-89788-1) nos termos do Regulamento (CE) n.o 1829/2003 do Parlamento Europeu e do Conselho
[notificada com o número C(2016) 4582]
(apenas fazem fé os textos nas línguas francesa e neerlandesa)
(Texto relevante para efeitos do EEE)
A COMISSÃO EUROPEIA,
Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
Tendo em conta o Regulamento (CE) n.o 1829/2003 do Parlamento Europeu e do Conselho, de 22 de setembro de 2003, relativo a géneros alimentícios e alimentos para animais geneticamente modificados (1), nomeadamente o artigo 7.o, n.o 3, e o artigo 19.o, n.o 3,
Considerando o seguinte:
|
(1) |
Em 11 de agosto de 2011, a empresa Monsanto Europe S.A. apresentou à autoridade competente dos Países Baixos um pedido, nos termos dos artigos 5.o e 17.o do Regulamento (CE) n.o 1829/2003, para colocar no mercado géneros alimentícios, ingredientes alimentares e alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MON 87705 × MON 89788 (o «pedido»). |
|
(2) |
O pedido abrange igualmente a colocação no mercado de soja geneticamente modificada MON 87705 × MON 89788 em produtos por ela constituídos ou que a contenham, destinados a outras utilizações habituais da soja, que não como géneros alimentícios ou alimentos para animais, à exceção do cultivo. |
|
(3) |
Em conformidade com o disposto no artigo 5.o, n.o 5, e no artigo 17.o, n.o 5, do Regulamento (CE) n.o 1829/2003, o pedido inclui os dados e informações exigidos pelos anexos III e IV da Diretiva 2001/18/CE do Parlamento Europeu e do Conselho (2), bem como informações e conclusões sobre a avaliação dos riscos, realizada em conformidade com os princípios estabelecidos no anexo II daquela diretiva. Inclui ainda um plano de monitorização dos efeitos ambientais nos termos do anexo VII da Diretiva 2001/18/CE. |
|
(4) |
Em 16 de julho de 2015, a Autoridade Europeia para a Segurança dos Alimentos («AESA») emitiu um parecer favorável, nos termos dos artigos 6.o e 18.o do Regulamento (CE) n.o 1829/2003 (3). O parecer concluiu que a soja geneticamente modificada MON 87705 × MON 89788, tal como descrita no pedido, é tão segura como a sua equivalente convencional e outras variedades de referência de soja não geneticamente modificadas no que se refere aos potenciais efeitos negativos para a saúde humana e animal e para o ambiente, no contexto do âmbito do pedido. |
|
(5) |
No seu parecer, a AESA atentou a todas as questões e preocupações específicas manifestadas pelos Estados-Membros no contexto da consulta às autoridades nacionais competentes prevista no artigo 6.o, n.o 4, e no artigo 18.o, n.o 4, do Regulamento (CE) n.o 1829/2003. |
|
(6) |
A AESA concluiu igualmente no seu parecer que o plano de monitorização dos efeitos ambientais apresentado pelo requerente, consistindo num plano geral de vigilância, está de acordo com as utilizações previstas dos produtos. |
|
(7) |
Além disso, a EFSA recomendou a implementação de um plano de monitorização após colocação no mercado, centrado na recolha de dados de consumo relativos à população europeia. |
|
(8) |
Tendo em conta essas considerações, deve ser concedida autorização aos produtos que contenham, sejam constituídos por, ou produzidos a partir de soja geneticamente modificada MON 87705 × MON 89788. |
|
(9) |
Deve ser atribuído um identificador único a cada organismo geneticamente modificado (a seguir «OGM») nos termos do Regulamento (CE) n.o 65/2004 da Comissão (4). |
|
(10) |
Os géneros alimentícios, ingredientes alimentares e alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MON 87705 × MON 89788 devem ser rotulados em conformidade com os requisitos previstos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003. |
|
(11) |
Com base no parecer da AESA, que confirma que a composição em ácidos gordos das sementes de soja MON 87705 × MON 89788 e do óleo derivado foi alterada em relação à sua equivalente convencional, afigura-se necessária uma rotulagem específica em conformidade com o artigo 13.o, n.o 2, alínea a), e o artigo 25.o, n.o 2, alínea c), do Regulamento (CE) n.o 1829/2003. |
|
(12) |
O Regulamento (CE) n.o 1830/2003 do Parlamento Europeu e do Conselho (5) estabelece, no artigo 4.o, n.o 6, requisitos de rotulagem aplicáveis aos produtos que contenham ou sejam constituídos por OGM. Os requisitos de rastreabilidade para esses produtos constam do artigo 4.o, n.os 1 a 5, e os requisitos de rastreabilidade relativos aos géneros alimentícios e alimentos para animais produzidos a partir de OGM constam do artigo 5.o do referido regulamento. |
|
(13) |
A fim de assegurar que os produtos são utilizados dentro dos limites da autorização prevista na presente decisão, a rotulagem dos produtos que contenham ou sejam constituídos pelo OGM para o qual se solicita a autorização, exceto os produtos alimentares, deve ser complementada pela indicação clara de que os produtos em causa não devem ser utilizados para cultivo. |
|
(14) |
O detentor da autorização deve apresentar relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização dos efeitos ambientais. Os referidos resultados devem ser apresentados em conformidade com o disposto na Decisão 2009/770/CE da Comissão (6). O parecer da AESA não justifica a imposição de condições ou restrições específicas relativas à colocação no mercado e/ou à utilização e ao manuseamento dos géneros alimentícios e alimentos para animais, incluindo requisitos de monitorização após colocação no mercado, nem de condições específicas tendo em vista a proteção de determinados ecossistemas/ambientes e/ou zonas geográficas, tal como previsto no artigo 6.o, n.o 5, alínea e), e no artigo 18.o, n.o 5, alínea e), do Regulamento (CE) n.o 1829/2003. |
|
(15) |
O detentor da autorização deve apresentar igualmente relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização após colocação no mercado. |
|
(16) |
Nos termos do Regulamento (CE) n.o 1829/2003, todas as informações pertinentes sobre a autorização dos produtos devem ser inscritas no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados. |
|
(17) |
A presente decisão deve ser notificada, através do Centro de Intercâmbio de Informações para a Segurança Biológica, às Partes no Protocolo de Cartagena sobre Segurança Biológica à Convenção sobre a Diversidade Biológica, nos termos do artigo 9.o, n.o 1, e do artigo 15.o, n.o 2, alínea c), do Regulamento (CE) n.o 1946/2003 do Parlamento Europeu e do Conselho (7). |
|
(18) |
O Comité Permanente dos Vegetais, Animais e Alimentos para Consumo Humano e Animal não emitiu parecer no prazo fixado pelo seu presidente. Considerou-se necessário um ato de execução, cujo projeto foi apresentado pelo presidente ao comité de recurso para nova deliberação. O Comité de Recurso não emitiu qualquer parecer, |
ADOTOU A PRESENTE DECISÃO:
Artigo 1.o
Organismo geneticamente modificado e identificador único
À soja (Glycine max (L.) Merr.) geneticamente modificada MON 87705 × MON 89788, tal como se especifica na alínea b) do anexo da presente decisão, é atribuído, como previsto no Regulamento (CE) n.o 65/2004, o identificador único MON-877Ø5-6 × MON-89788-1.
Artigo 2.o
Autorização
Para efeitos do artigo 4.o, n.o 2, e do artigo 16.o, n.o 2, do Regulamento (CE) n.o 1829/2003, são autorizados os seguintes produtos, de acordo com as condições fixadas na presente decisão:
|
a) |
géneros alimentícios e ingredientes alimentares que contenham, sejam constituídos por, ou produzidos a partir de soja MON-877Ø5-6 × MON-89788-1; |
|
b) |
alimentos para animais que contenham, sejam constituídos por, ou produzidos a partir de soja MON-877Ø5-6 × MON-89788-1; |
|
c) |
soja MON-877Ø5-6 × MON-89788-1 em produtos por ela constituídos ou que a contenham, para quaisquer utilizações que não as indicadas nas alíneas a) e b), à exceção do cultivo. |
Artigo 3.o
Rotulagem
1. Para efeitos dos requisitos de rotulagem estabelecidos no artigo 13.o, n.o 1, e no artigo 25.o, n.o 2, do Regulamento (CE) n.o 1829/2003, bem como no artigo 4.o, n.o 6, do Regulamento (CE) n.o 1830/2003, o «nome do organismo» é «soja».
2. Para efeitos dos requisitos de rotulagem estabelecidos no artigo 13.o, n.o 2, alínea a), e no artigo 25.o, n.o 2, alínea c), do Regulamento (CE) n.o 1829/2003, a expressão «Teor elevado de gorduras monoinsaturadas e teor reduzido de gorduras polinsaturadas» deve figurar após o nome do organismo no rótulo ou, quando adequado, nos documentos de acompanhamento dos produtos.
3. A menção «Não se destina ao cultivo» deve constar do rótulo assim como dos documentos de acompanhamento dos produtos que contenham ou sejam constituídos por soja MON-877Ø5-6 × MON-89788-1, com exceção dos produtos referidos no artigo 2.o, alínea a).
Artigo 4.o
Monitorização dos efeitos ambientais
1. O detentor da autorização deve garantir a elaboração e a execução do plano de monitorização dos efeitos ambientais, de acordo com o disposto na alínea h) do anexo.
2. O detentor da autorização deve apresentar à Comissão relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização, em conformidade com a Decisão 2009/770/CE.
Artigo 5.o
Monitorização após colocação no mercado, em conformidade com o artigo 6.o, n.o 5, alínea e), do Regulamento (CE) n.o 1829/2003
1. O detentor da autorização deve garantir a elaboração e a execução do plano de monitorização após colocação no mercado do óleo de soja MON-877Ø5-6 × MON-89788-1, de acordo com o disposto na alínea g) do anexo.
2. O detentor da autorização deve apresentar à Comissão relatórios anuais sobre a execução e os resultados das atividades constantes do plano de monitorização após colocação no mercado durante o período de autorização.
Artigo 6.o
Registo comunitário
Nos termos do artigo 28.o do Regulamento (CE) n.o 1829/2003, as informações contidas no anexo da presente decisão devem ser inscritas no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados.
Artigo 7.o
Detentor da autorização
O detentor da autorização é a empresa Monsanto Europe S.A., Bélgica, em representação da Monsanto Company, Estados Unidos da América.
Artigo 8.o
Validade
A presente decisão é aplicável por um período de 10 anos a contar da data da sua notificação.
Artigo 9.o
Destinatária
A destinatária da presente decisão é a empresa Monsanto Europe S.A., Avenue de Tervuren 270-272, B-1150 Bruxelas, Bélgica.
Feito em Bruxelas, em 22 de julho de 2016.
Pela Comissão
Vytenis ANDRIUKAITIS
Membro da Comissão
(1) JO L 268 de 18.10.2003, p. 1.
(2) Diretiva 2001/18/CE do Parlamento Europeu e do Conselho, de 12 de março de 2001, relativa à libertação deliberada no ambiente de organismos geneticamente modificados e que revoga a Diretiva 90/220/CEE do Conselho (JO L 106 de 17.4.2001, p. 1).
(3) Parecer científico sobre o pedido (EFSA-GMO-NL-2011-110), apresentado pela Monsanto, para a colocação no mercado da soja MON 87705 × MON 89788 geneticamente modificada, tolerante aos herbicidas e com teor elevado de ácido oleico, para utilização como género alimentício e alimento para animais, assim como importação e transformação ao abrigo do Regulamento (CE) n.o 1829/2003. EFSA Journal 2015; 13(7):4178, 30 p., doi:10.2903/j.efsa.2015.4178.
(4) Regulamento (CE) n.o 65/2004 da Comissão, de 14 de janeiro de 2004, que estabelece um sistema para criação e atribuição de identificadores únicos aos organismos geneticamente modificados (JO L 10 de 16.1.2004, p. 5).
(5) Regulamento (CE) n.o 1830/2003 do Parlamento Europeu e do Conselho, de 22 de setembro de 2003, relativo à rastreabilidade e rotulagem de organismos geneticamente modificados e à rastreabilidade dos géneros alimentícios e alimentos para animais produzidos a partir de organismos geneticamente modificados e que altera a Diretiva 2001/18/CE (JO L 268 de 18.10.2003, p. 24).
(6) Decisão 2009/770/CE da Comissão, de 13 de outubro de 2009, que em conformidade com a Diretiva 2001/18/CE do Parlamento Europeu e do Conselho estabelece os modelos de relatórios normalizados para a apresentação dos resultados da monitorização das libertações deliberadas no ambiente de organismos geneticamente modificados, como produtos ou contidos em produtos destinados a ser colocados no mercado (JO L 275 de 21.10.2009, p. 9).
(7) Regulamento (CE) n.o 1946/2003 do Parlamento Europeu e do Conselho, de 15 de julho de 2003, relativo ao movimento transfronteiriço de organismos geneticamente modificados (JO L 287 de 5.11.2003, p. 1).
ANEXO
|
a) |
Requerente e detentor da autorização:
Em nome da empresa Monsanto Company — 800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Estados Unidos da América. |
|
b) |
Designação e especificação dos produtos:
A soja geneticamente modificada MON-877Ø5-6 × MON-89788-1, tal como descrita no pedido, tem uma expressão reduzida das enzimas Δ12-dessaturase de ácidos gordos (FAD2) e tioesterase proteína transportadora de plamitoíl acilo (FATB), o que resulta num perfil de ácido oleico elevado e de ácido linoleico reduzido, e exprime a proteína CP4 EPSPS que confere tolerância aos herbicidas à base de glifosato. |
|
c) |
Rotulagem:
|
|
d) |
Método de deteção:
|
|
e) |
Identificador único: MON-877Ø5-6 × MON-89788-1 |
|
f) |
Informações requeridas nos termos do anexo II do Protocolo de Cartagena sobre Segurança Biológica à Convenção sobre a Diversidade Biológica: [Centro de Intercâmbio de Informações para a Segurança Biológica, ID de registo: publicado no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados quando da notificação]. |
|
g) |
Condições ou restrições aplicáveis à colocação no mercado, utilização ou manuseamento dos produtos: Monitorização após colocação no mercado, em conformidade com o artigo 6.o, n.o 5, alínea e), do Regulamento (CE) n.o 1829/2003
|
|
h) |
Plano de monitorização dos efeitos ambientais: Plano de monitorização dos efeitos ambientais nos termos do anexo VII da Diretiva 2001/18/CE. [Ligação: plano publicado no Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados]. |
Nota: as ligações aos documentos pertinentes podem sofrer alterações ao longo do tempo. Essas alterações serão levadas ao conhecimento do público mediante a atualização do Registo Comunitário dos Géneros Alimentícios e Alimentos para Animais Geneticamente Modificados.