ANEXO III
PARTE A
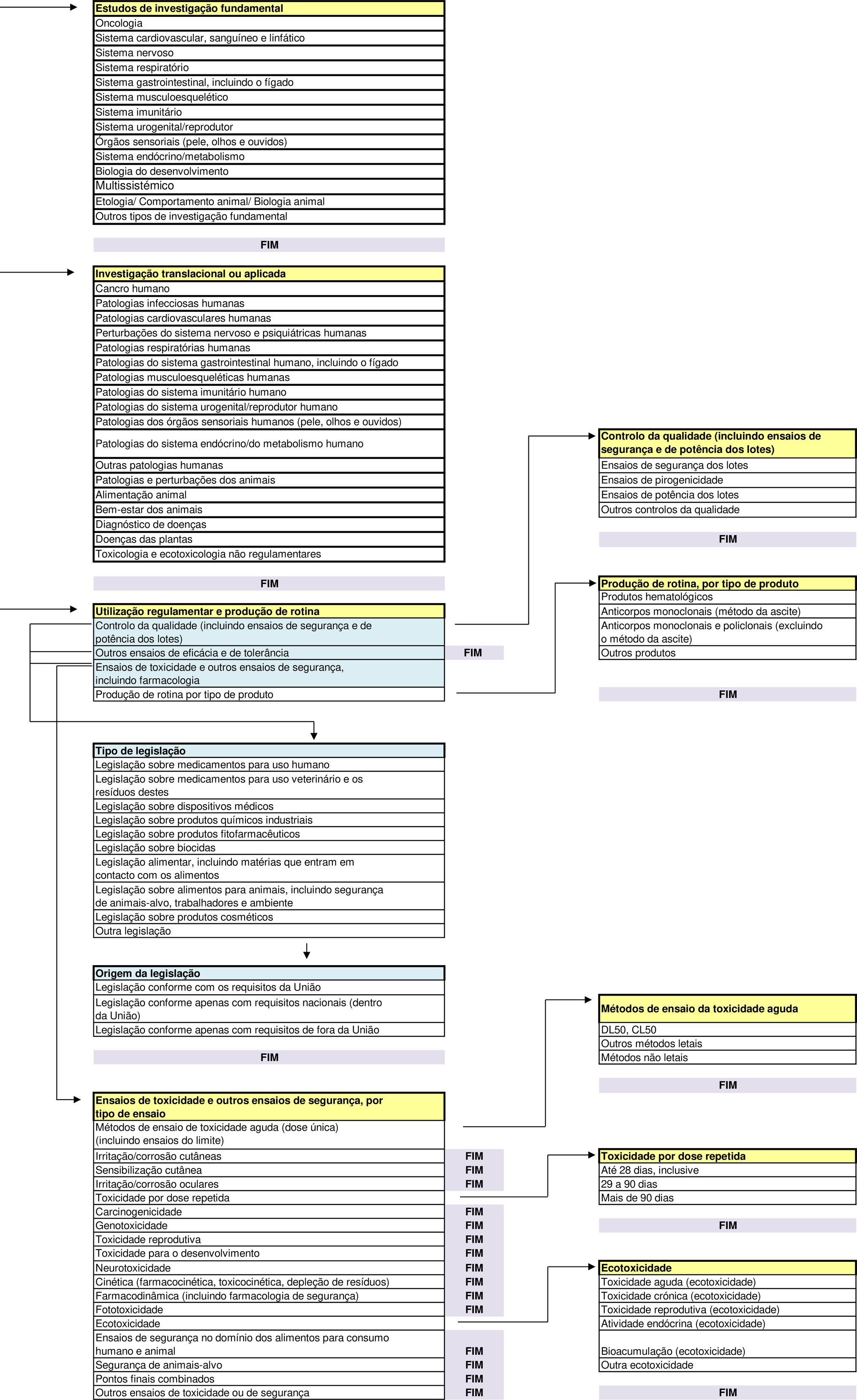
Fluxograma de categorias de dados estatísticos em conformidade com o artigo 54.o, N.o 2, da diretiva 2010/63/UE

PARTE B
Informações Referidas no Artigo 54.o, n.o 2, da Diretiva 2010/63/UE
A. DISPOSIÇÕES GERAIS
|
1. |
Comunicam-se os dados relativos a cada utilização de um animal. |
|
2. |
Ao comunicarem-se dados relativos a um animal, só pode ser selecionada uma única opção de determinada categoria. |
|
3. |
Animais occisados para extração de órgãos ou de tecidos
|
|
4. |
Animais criados e occisados sem serem utilizados em procedimentos
|
|
5. |
Os animais geneticamente normais nascidos durante a criação de uma nova linhagem genética não são incluídos na comunicação de dados estatísticos anuais, mas sim declarados no âmbito do relatório de execução quinquenal, em conformidade com o anexo II da presente decisão, a menos que o genótipo desses animais tenha sido determinado por um método invasivo. |
|
6. |
As formas larvares de animais são incluídas logo que se tornam autónomas em termos de alimentação. |
|
7. |
As formas fetais e embrionárias de espécies de mamíferos não são incluídas na comunicação de dados estatísticos anuais. Só se contam animais nascidos, ainda que por cesariana, e vivos. Quando os estudos dizem respeito tanto à mãe como à descendência, a mãe é declarada se tiver sido sujeita a procedimentos nos quais o limiar de dor, sofrimento, angústia ou danos duradouros mínimos tenha sido excedido. A descendência é declarada sempre que integre o procedimento. |
|
8. |
Se a utilização de um animal num procedimento, com ou sem autorização prévia, resultar em dor, sofrimento ou angústia severos e duradouros e estes efeitos não puderem ser aliviados, o animal é declarado na categoria «severa». Está prevista a inserção na secção C do presente anexo de observações descritivas do Estado-Membro sobre a espécie, o número de animais, a (eventual) autorização de isenção prévia, os detalhes da utilização e as razões por que foi excedida a classificação «severa». |
|
9. |
A comunicação dos dados relativos aos animais utilizados em procedimentos deve reportar-se ao ano em que termina o procedimento. No caso dos estudos que se estendem por dois anos civis, os animais podem ser todos contabilizados no ano em que o último procedimento termina, se esta exceção à comunicação anual for autorizada pela autoridade competente. No caso dos projetos que abrangem mais de dois anos civis, a comunicação dos dados relativos aos animais deve reportar-se ao ano da occisão ou morte dos mesmos. |
|
10. |
Em caso de utilização de categorias «Outro/a/os/as», deve incluir-se, na secção das observações, uma discriminação mais detalhada dos dados de cada uma dessas categorias. |
|
11. |
Animais geneticamente alterados
|
B. CATEGORIAS DOS DADOS INTRODUZIDOS
As secções que se seguem obedecem à mesma ordem das categorias e dos correspondentes títulos no fluxograma da parte A.
1. Tipo de animal
|
Murganho (Mus musculus) |
|
Rato (Rattus norvegicus) |
|
Cobaio (Cavia porcellus) |
|
Hámster-dourado (sírio) (Mesocricetus auratus) |
|
Hámster-chinês (Cricetulus griseus) |
|
Gerbo-da-mongólia (Meriones unguiculatus) |
|
Outros roedores (outros Rodentia) |
|
Coelho (Oryctolagus cuniculus) |
|
Gato (Felis catus) |
|
Cão (Canis familiaris) |
|
Furão (Mustela putorius furo) |
|
Outros carnívoros (outros Carnivora) |
|
Cavalo, burro e híbridos (Equidae) |
|
Porco (Sus scrofa domesticus) |
|
Caprinos (Capra aegagrus hircus) |
|
Ovinos (Ovis aries) |
|
Bovinos (Bos taurus) |
|
Prossímios (Prosimia) |
|
Saguis (p. ex. Callithrix jacchus) |
|
Macaco-caranguejeiro (Macaca fascicularis) |
|
Macaco-rhesus (Macaca mulatta) |
|
Macacos Chlorocebus spp. (normalmente pygerythrus ou sabaeus) |
|
Babuínos (Papio spp.) |
|
Macaco-de-cheiro (p. ex. Saimiri sciureus) |
|
Outras espécies de macacos do Novo Mundo (outras espécies de Ceboidea) |
|
Outras espécies de macacos do Velho Mundo (outras espécies de Cercopithecoidea) |
|
Antropóides (Hominoidea) |
|
Outros mamíferos (outros Mammalia) |
|
Galinha (Gallus gallus domesticus) |
|
Peru (Meleagris gallopavo) |
|
Outras aves (outras Aves) |
|
Répteis (Reptilia) |
|
Rãs (Rana temporaria e Rana pipiens) |
|
Rãs Xenopus spp. (Xenopus laevis e Xenopus tropicalis) |
|
Outros anfíbios (outros Amphibia) |
|
Peixe-zebra (Danio rerio) |
|
Robalo (spp. das famílias, por exemplo, Serranidae, Moronidae) |
|
Salmões, trutas, salvelinos e peixe-sombra (Salmonidae) |
|
Poecilia spp. (p. ex. gúpi) e Xiphophorus spp. (Poeciliidae) |
|
Outros peixes (outros Pisces) |
|
Cefalópodes (Cephalopoda) |
|
1.1. |
Os peixes são declarados a partir do estádio de alimentação autónoma, quando o tubo digestivo está aberto de uma extremidade à outra e o peixe pode alimentar-se normalmente. |
|
1.2. |
O momento do início da autonomia dos peixes em termos de alimentação é diferente para cada espécie e, em muitos casos, depende da temperatura a que os peixes são mantidos. A temperatura deve ser fixada de forma a manter o bem-estar ótimo, determinado pelo responsável pelo bem-estar e pelos cuidados prestados aos animais e com base em informações específicas da espécie em causa, em coordenação com o veterinário designado. As larvas de peixe-zebra, mantidas a aproximadamente +28 °C, são declaradas 5 dias após a fertilização. |
|
1.3. |
Devido ao pequeno tamanho de algumas espécies de peixes e de cefalópodes, a contagem pode ser feita por estimativa. |
|
1.4. |
Todas as espécies de cefalópodes são declaradas na rubrica «cefalópodes» a partir do estádio em que o animal se torna autónomo em termos de alimentação, ou seja, imediatamente após a eclosão. |
2. Reutilização
|
Reutilização (Não/Sim) |
|
2.1. |
Considerações gerais
|
|
2.2. |
Reutilização e utilização contínuas
Para determinar se há «reutilização», aplica-se o seguinte:
|
3. Espécies que não primatas não humanos — Local de nascimento
|
Animais nascidos na União num criador autorizado |
|
Animais nascidos na União, mas não num criador autorizado |
|
Animais nascidos no resto da Europa |
|
Animais nascidos noutros locais |
|
3.1. |
A origem tem por base o local de nascimento, correspondendo à expressão «nascido em», e não o local do qual é fornecido. |
|
3.2. |
A categoria «Animais nascidos na União num criador registado» refere-se a animais nascidos nas instalações de criadores autorizados e registados nos termos do artigo 20.o da Diretiva 2010/63/UE. |
|
3.3. |
A categoria «Animais nascidos na União, mas não num criador autorizado» abrange, entre outros, animais selvagens, animais de criação (a menos que o criador seja autorizado nos termos do artigo 20.o da Diretiva 2010/63/UE) e quaisquer isenções concedidas ao abrigo do artigo 10.o, n.o 3, da Diretiva 2010/63/UE. |
|
3.4. |
A categoria «Animais nascidos no resto da Europa» abrange, entre outros, o conjunto dos animais nascidos na Suíça, na Turquia, na Rússia e em Israel, independentemente de terem sido criados em estabelecimentos de criação registados ou noutros estabelecimentos, incluindo, entre outros, os animais capturados na natureza. |
|
3.5. |
A categoria «Animais nascidos no resto do mundo» abrange o conjunto dos animais dessa proveniência, independentemente de terem sido criados em estabelecimentos de criação registados ou noutros estabelecimentos, incluindo, entre outros, os animais capturados na natureza. |
4. Primatas não humanos (PNH) — local de nascimento
|
PNH nascidos na União num criador autorizado |
|
PNH nascidos na União, mas não num criador autorizado e PNH nascidos no resto da Europa |
|
PNH nascidos na Ásia |
|
PNH nascidos na América |
|
PNH nascidos em África |
|
PNH nascidos noutros locais |
|
4.1. |
A origem tem por base o local de nascimento, correspondendo à expressão «nascido em», e não o local do qual é fornecido. |
|
4.2. |
A categoria «PNH nascidos na União num criador autorizado» inclui a Noruega e refere-se aos PNH nascidos nas instalações de criadores autorizados e registados nos termos do artigo 20.o da Diretiva 2010/63/UE. |
|
4.3. |
A categoria «PNH nascidos na União, mas não num criador autorizado e PNH nascidos no resto da Europa» abrange, entre outros, os animais nascidos na Suíça, na Turquia, na Rússia e em Israel. |
|
4.4. |
A categoria «PNH nascidos na Ásia» abrange, entre outros, os animais nascidos na China. |
|
4.5. |
A categoria «PNH nascidos na América» refere-se aos animais nascidos nas Américas do Norte, Central e do Sul. |
|
4.6. |
A categoria «PNH nascidos em África» inclui, igualmente, os animais nascidos na Maurícia. |
|
4.7. |
A categoria «PNH nascidos noutros locais» inclui, igualmente, os animais nascidos na Australásia. Deve declarar-se a origem dos PNH nascidos noutros locais. |
5. Primatas não humanos — Tipo de colónia
|
Colónia autossuficiente (Não/Sim) |
A categoria «Colónia autossuficiente» abrange primatas não humanos obtidos de colónias em que só se criam animais da própria colónia ou provenientes de outras colónias autossuficientes, mas não animais capturados na natureza, nas quais os animais são mantidos de forma a assegurar que estão habituados aos seres humanos.
6. Primatas não humanos – geração
|
F0 |
|
F1 |
|
F2 ou superior |
|
6.1. |
«F0» refere-se a animais capturados na natureza. |
|
6.2. |
«F1» refere-se a animais nascidos em cativeiro de um ou dois progenitores capturados na natureza. |
|
6.3. |
«F2 ou superior» refere-se a animais nascidos em cativeiro de dois progenitores também eles nascidos em cativeiro. |
7. Estatuto genético
|
Não geneticamente alterados |
|
Geneticamente alterados sem fenótipo nocivo |
|
Geneticamente alterados com fenótipo nocivo |
|
7.1. |
A categoria «Não geneticamente alterados» refere-se a todos os animais que não sofreram alterações genéticas, incluindo os animais progenitores geneticamente normais utilizados para a criação de uma nova linhagem/estirpe de animais geneticamente alterados. |
|
7.2. |
A categoria «Geneticamente alterados sem fenótipo nocivo» refere-se a:
|
|
7.3. |
A categoria «Geneticamente alterados com fenótipo nocivo» refere-se a:
|
8. Criação de uma nova linhagem geneticamente alterada
|
Animais utilizados para a criação de uma nova linhagem/estirpe geneticamente alterada (Não/Sim) |
Os animais utilizados para a criação de uma nova linhagem/estirpe geneticamente alterada distinguem-se de outros animais utilizados para fins de «investigação fundamental» ou de «investigação translacional ou aplicada». Esta categoria abrange o cruzamento de linhagens diferentes com vista a criar uma nova linhagem geneticamente alterada, para a qual não é possível determinar antecipadamente o caráter não nocivo do fenótipo.
9. Severidade
|
Não recuperação |
|
Não mais que ligeira |
|
Moderada |
|
Severa |
|
9.1. |
A severidade real é declarada individualmente para cada animal, em função dos efeitos mais graves sofridos por esse animal durante todo o procedimento. Esses efeitos podem verificar-se em qualquer fase (não necessariamente a última) de um procedimento com várias fases. A severidade real pode ser superior ou inferior à classificação vaticinada. Na determinação da severidade real, deve também dar-se importância ao sofrimento cumulativo. |
|
9.2. |
Categorias de severidade
|
|
9.3. |
Animais encontrados mortos
|
|
9.4. |
Captura e transporte de animais capturados na natureza
A severidade real diz respeito apenas aos efeitos do procedimento científico ao qual se submeteu esse animal. Por isso, a captura e o transporte (exceto se estes constituírem o objetivo específico dos procedimentos científicos, ou um elemento desse objetivo) não podem ser tidos em conta na severidade real declarada, mesmo se o animal morrer durante a captura ou o transporte. |
10. Fins
|
Investigação fundamental |
|
Investigação translacional ou aplicada |
|
Utilização regulamentar e produção de rotina |
|
Proteção do ambiente natural no interesse da saúde ou do bem-estar humanos ou dos animais |
|
Preservação de espécies |
|
Ensino superior |
|
Formação para aquisição, manutenção ou melhoramento de qualificações profissionais |
|
Medicina legal |
|
Manutenção de colónias de animais geneticamente alterados estabelecidos, não utilizados noutros procedimentos |
|
10.1. |
Investigação fundamental
|
|
10.2. |
Investigação translacional ou aplicada
|
|
10.3. |
Utilização regulamentar e produção de rotina
|
|
10.4. |
Proteção do ambiente natural no interesse da saúde ou do bem-estar humanos ou dos animais
|
|
10.5. |
Ensino superior
Esta categoria refere-se a animais utilizados para a obtenção de conhecimentos teóricos no âmbito de programas de ensino superior. |
|
10.6. |
Formação para aquisição, manutenção ou melhoramento de qualificações profissionais
Esta categoria refere-se a animais utilizados na formação para aquisição e manutenção de competências profissionais práticas, como os animais utilizados na formação de médicos. |
|
10.7. |
Manutenção de colónias de animais geneticamente alterados estabelecidos, não utilizados noutros procedimentos
|
11. Estudos de investigação fundamental
|
Oncologia |
|
Sistema cardiovascular, sanguíneo e linfático |
|
Sistema nervoso |
|
Sistema respiratório |
|
Sistema gastrointestinal, incluindo o fígado |
|
Sistema musculoesquelético |
|
Sistema imunitário |
|
Sistema urogenital/reprodutor |
|
Órgãos sensoriais (pele, olhos e ouvidos) |
|
Sistema endócrino/metabolismo |
|
Biologia do desenvolvimento |
|
Multissistémico |
|
Etologia/Comportamento animal/Biologia animal |
|
Outros tipos de investigação fundamental |
|
11.1. |
Oncologia
Incluem-se nesta categoria todos os trabalhos de investigação sobre oncologia, independentemente do sistema-alvo. |
|
11.2. |
Sistema nervoso
Esta categoria inclui, entre outros, o sistema nervoso central e periférico, a neurociência e a psicologia. |
|
11.3. |
Sistema musculoesquelético
Esta categoria inclui, entre outras, a atividade de dentista. |
|
11.4. |
Órgãos sensoriais (pele, olhos e ouvidos)
Os estudos relativos ao nariz são indicados na categoria «Sistema respiratório»; os relativos à língua, na categoria «Sistema gastrointestinal, incluindo o fígado». |
|
11.5. |
A categoria «Biologia do desenvolvimento» abrange estudos de alterações associados a organismos, desde a embriogénese (quando realizados fora do âmbito do estudo da toxicidade reprodutiva), ao crescimento, ao envelhecimento e à morte, incluindo, entre outros, a diferenciação das células, a diferenciação dos tecidos e a organogénese. |
|
11.6. |
Multissistémico
Esta categoria abrange apenas estudos de investigação cujo interesse principal se centra em mais de um sistema, como os consagrados a determinadas doenças infecciosas, excluindo a oncologia. |
|
11.7. |
A categoria «Etologia/Comportamento animal/Biologia animal» abrange animais em estado selvagem e animais em cativeiro, com o objetivo principal de melhorar o conhecimento acerca da espécie em questão. |
|
11.8. |
Outros tipos de investigação fundamental
|
|
11.9. |
Observações
|
|
12. |
Investigação translacional ou aplicada
|
|
12.1. |
Incluem-se na categoria «Cancro humano» todos os trabalhos de investigação aplicada sobre cancro humano, independentemente do sistema-alvo. |
|
12.2. |
Incluem-se na categoria «Patologias infecciosas humanas» todos os trabalhos de investigação aplicada sobre qualquer investigação aplicada sobre doenças infecciosas humanas, independentemente do sistema-alvo. |
|
12.3. |
A utilização regulamentar de animais, como os estudos regulamentares de carcinogenicidade, não se inclui na categoria «Investigação translacional ou aplicada» e declara-se na categoria «Utilização regulamentar e produção de rotina». |
|
12.4. |
Os estudos relativos às patologias do nariz são indicados na categoria «Patologias respiratórias humanas»; os relativos às patologias da língua, na categoria «Patologias do sistema gastrointestinal humano, incluindo o fígado». |
|
12.5. |
Antes de recorrer à categoria «Outras patologias humanas», há que comprovar que não se pode utilizar nenhuma das categorias predefinidas. |
|
12.6. |
A categoria «Diagnóstico de doenças» abrange, entre outros, os animais utilizados no diagnóstico direto de doenças como a raiva ou o botulismo, excluindo porém os abrangidos pela utilização regulamentar. |
|
12.7. |
A categoria «Toxicologia e ecotoxicologia não regulamentares» refere-se à toxicologia exploratória e aos estudos de investigação destinados a preparar os requerimentos regulamentares e o desenvolvimento de métodos. Não inclui os estudos necessários para os requerimentos regulamentares – estudos preliminares, dose máxima tolerada (DMT). Os estudos de determinação das doses (DRF), quando realizados com vista a satisfazer exigências legais, estão também excluídos e abrangidos no campo «Outros ensaios de eficácia e tolerância» sob a categoria «Utilização regulamentar e produção de rotina». |
|
12.8. |
A categoria «Bem-estar dos animais» refere-se a estudos na aceção do artigo 5.o, alínea b), subalínea iii), da Diretiva 2010/63/UE. |
|
12.9. |
Observações
|
13. Utilização regulamentar e produção de rotina
|
Controlo da qualidade (incluindo ensaios de segurança e de potência dos lotes) |
|
Outros ensaios de eficácia e tolerância |
|
Ensaios de toxicidade e outros ensaios de segurança, incluindo farmacologia |
|
Produção de rotina por tipo de produto |
|
13.1. |
Esta categoria não abrange os ensaios da eficácia durante o desenvolvimento de novos medicamentos, os quais são indicados na categoria «Investigação translacional ou aplicada». |
|
13.2. |
A categoria «Controlo da qualidade» refere-se a animais utilizados nos ensaios de pureza, estabilidade, eficácia, potência e outros parâmetros de controlo da qualidade do produto final e dos seus constituintes, bem como eventuais controlos realizados durante o processo de fabrico para efeitos de registo, para cumprir quaisquer outros requisitos regulamentares nacionais ou internacionais ou para cumprir as normas internas do fabricante. Inclui, entre outros, os ensaios de pirogenicidade. |
|
13.3. |
Outros ensaios de eficácia e tolerância
Esta categoria abrange os ensaios de eficácia de biocidas e pesticidas, assim como os ensaios de tolerância de aditivos nos alimentos para animais. Abrange igualmente os estudos de determinação das doses, tendo em vista o cumprimento dos requisitos legislativos. |
|
13.4. |
Ensaios de toxicidade e outros ensaios de segurança (incluindo a avaliação da segurança de produtos e dispositivos utilizados em medicina humana e dentária e em medicina veterinária)
|
|
13.5. |
Produção de rotina, por tipo de produto
|
14. Controlo da qualidade (incluindo ensaios de segurança e de potência dos lotes)
|
Ensaios de segurança dos lotes |
|
Ensaios de pirogenicidade |
|
Ensaios de potência dos lotes |
|
Outros controlos da qualidade |
A categoria «Ensaios de segurança dos lotes» não abrange os ensaios de pirogenicidade, que se remetem para a categoria «Ensaios de pirogenicidade».
15. Ensaios de toxicidade e outros ensaios de segurança, por tipo de ensaio
|
Métodos de ensaio de toxicidade aguda (dose única) (incluindo ensaios do limite) |
|
Irritação/corrosão cutâneas |
|
Sensibilização cutânea |
|
Irritação/corrosão oculares |
|
Toxicidade por dose repetida |
|
Carcinogenicidade |
|
Genotoxicidade |
|
Toxicidade reprodutiva |
|
Toxicidade para o desenvolvimento |
|
Neurotoxicidade |
|
Cinética (farmacocinética, toxicocinética, depleção de resíduos) |
|
Farmacodinâmica (incluindo farmacologia de segurança) |
|
Fototoxicidade |
|
Ecotoxicidade |
|
Ensaios de segurança no domínio dos alimentos para consumo humano e animal |
|
Segurança de animais-alvo |
|
Pontos finais combinados |
|
Outros ensaios de toxicidade ou de segurança |
|
15.1. |
A categoria «Toxicidade por dose repetida» inclui, igualmente, os estudos de imunotoxicologia. |
|
15.2. |
A categoria «Toxicidade reprodutiva» inclui, entre outros, estudos alargados de toxicidade reprodutiva sobre uma geração, inclusive quando incluam coortes para o estudo da neurotoxicidade e da imunotoxicidade para o desenvolvimento. |
|
15.3. |
A categoria «Toxicidade para o desenvolvimento» inclui, igualmente, os estudos de neurotoxicidade para o desenvolvimento. Os estudos alargados de toxicidade reprodutiva sobre uma geração, que incluam coortes para o estudo da neurotoxicidade para o desenvolvimento, são indicados na categoria «Toxicidade reprodutiva». |
|
15.4. |
A categoria «Neurotoxicidade» abrange, entre outros, os efeitos retardados agudos (por exemplo neurotoxicidade retardada de substâncias organofosforadas na sequência de uma exposição aguda) e os estudos de dose repetida para efeitos de neurotoxicidade, mas não inclui a neurotoxicidade para o desenvolvimento. Os estudos alargados de toxicidade reprodutiva sobre uma geração, que incluam coortes para o estudo da neurotoxicidade para o desenvolvimento, são indicados na categoria «Toxicidade reprodutiva». |
|
15.5. |
A categoria «Cinética» refere-se à farmacocinética, à toxicocinética e à depleção de resíduos. Porém, se realizados no âmbito do estudo regulamentar da toxicidade por dose repetida, os ensaios de toxicocinética são indicados na categoria «Toxicidade por dose repetida». |
|
15.6. |
A categoria «Ensaios de segurança no domínio dos alimentos para consumo humano e animal» inclui, igualmente, os ensaios sobre a água potável (incluindo os ensaios sobre a segurança de animais-alvo). |
|
15.7. |
Na categoria «Segurança de animais-alvo» incluem-se os ensaios efetuados para garantir que um produto destinado a um animal específico possa ser utilizado com segurança nessa espécie (excluindo os ensaios de segurança dos lotes, que são abrangidos pelo controlo da qualidade). |
|
15.8. |
Na categoria «Pontos finais combinados» incluem-se, entre outros, combinações de estudos de carcinogenicidade e de toxicidade crónica, e estudos de rastreio que combinem a toxicidade reprodutiva e a toxicidade por dose repetida. |
16. Métodos de ensaio da toxicidade aguda
|
DL50, CL50 |
|
Outros métodos letais |
|
Métodos não letais |
|
16.1. |
A categoria é indicada em função do tipo de método utilizado e não em função do nível de severidade sofrido pelo animal em resultado desse método. |
|
16.2. |
«DL50, CL50» referem-se apenas aos métodos de ensaio que fornecem uma estimativa pontual da DL50/CL50, como as orientações de ensaio n.o 203, 403 e 425 da OCDE. |
|
16.3. |
A categoria «Outros métodos letais» refere-se aos métodos que classificam as substâncias numa classe, ou seja, aos métodos que preveem a determinação de um intervalo de valores no qual a DL50 se deve situar, como os métodos de dose fixa e os métodos de classe de toxicidade aguda. É provável que se verifiquem algumas mortes, mas não tantas quanto as esperadas em métodos do tipo DL50. |
17. Toxicidade por dose repetida
|
Até 28 dias, inclusive |
|
29 a 90 dias |
|
Mais de 90 dias |
18. Ecotoxicidade
|
Toxicidade aguda (ecotoxicidade) |
|
Toxicidade crónica (ecotoxicidade) |
|
Toxicidade reprodutiva (ecotoxicidade) |
|
Atividade endócrina (ecotoxicidade) |
|
Bioacumulação (ecotoxicidade) |
|
Outra ecotoxicidade |
|
18.1. |
Ecotoxicidade refere-se à toxicidade que afeta o meio ambiente aquático e terrestre. |
|
18.2. |
Os estudos de ecotoxicidade relativos à toxicidade a curto prazo para determinar a CL/DL50 são indicados na categoria «Toxicidade aguda (ecotoxicidade)». |
|
18.3. |
Os estudos de ecotoxicidade relativos à toxicidade a longo prazo, por exemplo os ensaios nas fases iniciais do ciclo de vida ou sobre o ciclo de vida completo, são indicados na categoria «Toxicidade crónica (ecotoxicidade)». |
|
18.4. |
Os estudos de ecotoxicidade realizados para avaliar, principalmente, as propriedades endócrinas das substâncias e analisar, por exemplo, a metamorfose, o desenvolvimento e o crescimento dos anfíbios e o desenvolvimento sexual e a reprodução de peixes, são indicados na categoria «Atividade endócrina (ecotoxicidade)». |
19. Tipo de legislação
|
Legislação sobre medicamentos para uso humano |
|
Legislação sobre medicamentos para uso veterinário e os resíduos destes |
|
Legislação sobre dispositivos médicos |
|
Legislação sobre produtos químicos industriais |
|
Legislação sobre produtos fitofarmacêuticos |
|
Legislação sobre biocidas |
|
Legislação alimentar, incluindo matérias que entram em contacto com os alimentos |
|
Legislação sobre alimentos para animais, incluindo segurança de animais-alvo, trabalhadores e ambiente |
|
Legislação sobre produtos cosméticos |
|
Outra legislação |
|
19.1. |
Não se indica o tipo de legislação em relação aos animais cuja utilização se inclua na categoria «Produção de rotina». |
|
19.2. |
O tipo de legislação é indicado por referência à utilização primária prevista. |
|
19.3. |
Os ensaios de qualidade da água, com exceção das águas residuais, são indicados na categoria «Legislação alimentar». Os ensaios de qualidade das águas residuais são indicados na categoria «Outra legislações». |
20. Origem da legislação
|
Legislação conforme com os requisitos da União |
|
Legislação conforme apenas com requisitos nacionais (dentro da União) |
|
Legislação conforme apenas com requisitos de fora da União |
|
20.1. |
Não se indica a origem da legislação em relação aos animais cuja utilização se inclua na categoria «Produção de rotina». |
|
20.2. |
A utilização é indicada em função da região para a qual o ensaio é realizado e não em função do local onde se realiza. |
|
20.3. |
Quando a legislação nacional deriva da legislação da União, a utilização é indicada na categoria «Legislação conforme com os requisitos da União». |
|
20.4. |
A categoria «Legislação conforme com os requisitos da União» inclui, igualmente, os requisitos internacionais que cumpram simultaneamente os requisitos da União (como os ensaios em conformidade com as monografias da Farmacopeia Europeia ou com as orientações da ICH (1), da VICH (2) ou da OCDE). |
|
20.5. |
Se o ensaio for realizado para cumprir a legislação de um ou mais Estados-Membros (não necessariamente aquele em que o ensaio é realizado), e o requisito não derive do direito da União, a utilização é indicada na categoria «Legislação conforme apenas com requisitos nacionais (dentro da União)». |
|
20.6. |
A categoria «Legislação conforme apenas com requisitos de fora da União» é escolhida apenas se, na legislação da União, não houver requisitos equivalentes para a realização do ensaio. |
21. Produção de rotina, por tipo de produto
|
Produtos hematológicos |
|
Anticorpos monoclonais (método da ascite) |
|
Anticorpos monoclonais e policlonais (excluindo o método da ascite) |
|
Outros produtos |
|
21.1. |
A categoria «Produção de rotina, por tipo do produto» abrange a produção de anticorpos e de produtos hematológicos por métodos estabelecidos. Exclui a imunização de animais com vista à produção subsequente de hibridomas para fins de investigação fundamental ou aplicada no quadro de um determinado projeto, a qual deve ser tida em conta na categoria adequada de investigação fundamental ou aplicada. |
|
21.2. |
Qualquer utilização do método da ascite para a cultura de anticorpos monoclonais é indicada na categoria «Anticorpos monoclonais (método da ascite)». |
|
21.3. |
A utilização de animais para produção de anticorpos para fins comerciais, incluindo a imunização para a produção subsequente de hibridomas, é indicada na categoria «Anticorpos monoclonais e policlonais (excluindo o método da ascite)». |
C. OBSERVAÇÕES DO ESTADO-MEMBRO
|
1. |
Os Estados-Membros devem fornecer explicações sobre os dados estatísticos, nomeadamente:
|
|
2. |
Para efeitos do ponto 1, subalínea g), são necessários os seguintes elementos:
|
(1) Conferência Internacional de harmonização dos requisitos técnicos para o registo de produtos farmacêuticos para uso humano.
(2) Cooperação internacional de harmonização dos requisitos técnicos para o registo de medicamentos veterinários.