ANEXO II
O anexo XV do Regulamento (UE) n.o 142/2011 é alterado do seguinte modo:
|
1) |
Os capítulos 1 a 3(F) passam a ter a seguinte redação: «CAPÍTULO 1 Certificado sanitário Para proteínas animais transformadas, exceto as provenientes de insetos de criação, não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas, destinadas a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. 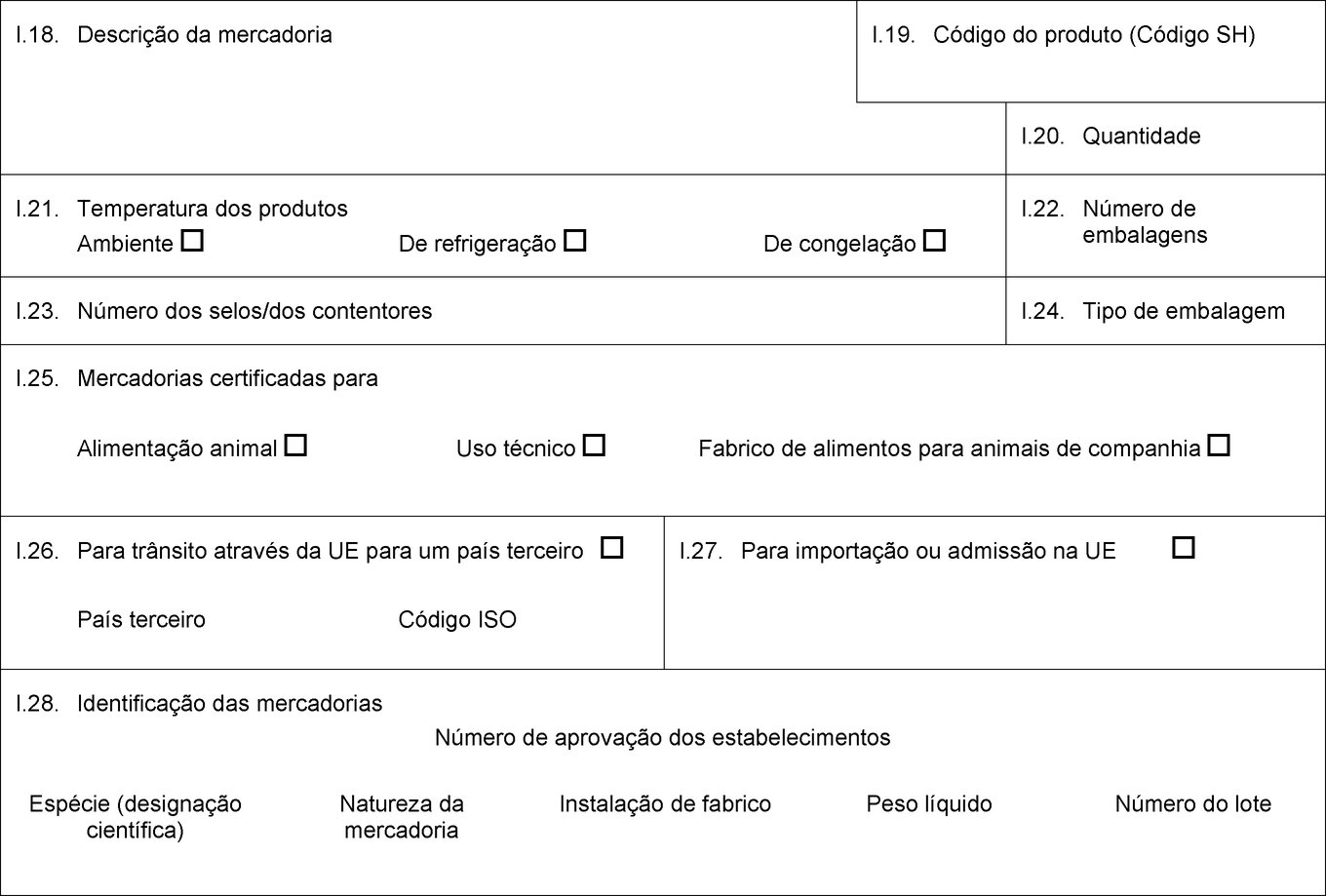 Texto de imagem
Texto de imagem
I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem I.25. Mercadorias certificadas para Alimentação animal Uso técnico Fabrico de alimentos para animais de companhia I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas, exceto as provenientes de insetos de criação, não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo X, capítulo II, secção 1, e o anexo XIV, capítulo I, e certifica que: II.1. Os produtos ou as proteínas animais transformadas descritos no presente certificado contêm exclusivamente proteínas animais transformadas não destinadas ao consumo humano que: a) foram preparadas e armazenadas em estabelecimentos ou unidades aprovados e supervisionados pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009; e b) foram preparadas exclusivamente a partir dos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de estabelecimentos ou instalações de fabrico de produtos destinados ao consumo humano;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas, exceto as provenientes de insetos de criação, não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- invertebrados aquáticos e terrestres, com exceção de espécies patogénicas para os seres humanos ou animais e de insetos;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), e de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do Regulamento (CE) n.o 1069/2009;] e c) obedeceram às seguintes normas de processamento: (2) quer [aquecimento até uma temperatura central superior a 133 °C durante, pelo menos, 20 minutos sem interrupção a uma pressão (absoluta) de, no mínimo, 3 bar produzida por vapor saturado, com uma dimensão das partículas, antes do processamento, não superior a 50 milímetros;] (2) quer [no caso das proteínas não provenientes de mamíferos, com exceção da farinha de peixe, o método de processamento 1-2-3-4-5-7 (indicar o método de processamento) estabelecido no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011;] (2) quer [no caso da farinha de peixe, o método de processamento 1-2-3-4-5-6-7 (in-dicar o método de processamento) estabelecido no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011;] (2) quer [no caso do sangue de suínos, o método de processamento 1-2-3-4-5-7 (indicar o método de processamento) estabelecido no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011, sendo que, no caso do método 7, foi aplicado um tratamento térmico a uma temperatura de, pelo menos, 80 °C em toda a massa.] II.2. A autoridade competente examinou uma amostra aleatória imediatamente antes da expedição, tendo verificado que esta respeitava as seguintes normas (3): Salmonella: ausência em 25 gramas: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 em 1 grama. II.3. O produto foi objeto de todas as precauções necessárias para evitar a recontaminação por agentes patogénicos após o tratamento. II.4. O produto final: (2) quer [foi embalado em sacos novos ou esterilizados;]  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas, exceto as provenientes de insetos de criação, não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [foi transportado a granel em contentores ou outros meios de transporte cuidadosamente limpos e desinfetados antes da utilização;] que ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO”. II.5. O produto final foi armazenado em armazéns fechados. (2) [II.6. O produto ou as proteínas animais transformadas descritos no presente certificado contêm ou derivam de subprodutos animais provenientes de ruminantes e: (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que não houve casos nativos de EEB; e]] (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que houve um caso nativo de EEB, e o subproduto animal ou produto derivado provém de animais nascidos após a data de aplicação efetiva, naquele país ou região, da proibição de alimentar ruminantes com farinha de carne e de ossos e com torresmos derivados de ruminantes, tal como definidos no Código Sanitário para os Animais Terrestres da OIE; e] (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (4); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (5), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.7. O produto ou as proteínas animais transformadas descritos no presente certificado: (2) quer [não contêm leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm leite ou produtos à base de leite de origem ovina ou caprina e destinam-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória,  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas, exceto as provenientes de insetos de criação, não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico, iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante pelo menos os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico: (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] II.8. Os produtos ou as proteínas animais transformadas descritos no presente certificado contêm ou derivam de subprodutos animais de origem não ruminante e, de acordo com a declaração do expedidor referido na casa I.1, (2) quer [não se destinam à produção de alimentos para animais de criação, à exceção de animais produtores de peles com pelo.] (2) (6) quer [destinam-se à produção de alimentos para animais de criação não ruminantes, à exceção de animais produtores de peles com pelo, e o expedidor tomou medidas para assegurar que o posto de inspeção fronteiriço de entrada vai receber os resultados das análises efetuadas de acordo com os métodos estabelecidos no anexo VI do Regulamento (CE) n.o 152/2009 da Comissão (7).] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento.  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas, exceto as provenientes de insetos de criação, não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. — Casa I.19: Utilizar o código SH adequado: 05.05; 05.06; 05.07; 05.11; 23.01 ou 23.09. — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. No caso dos peixes de viveiro, especificar a designação científica da espécie. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) Em que: n = número de amostras a testar; m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (4) JO L 147 de 31.5.2001, p. 1. (5) JO L 172 de 30.6.2007, p. 84. (6) A pessoa responsável pela remessa referida na casa I.6 deve assegurar que, se os produtos ou as proteínas animais transformadas descritos no presente certificado sanitário se destinarem a ser usados na produção de alimentos para não ruminantes de criação, à exceção de animais produtores de peles com pelo, a remessa deve ser analisada, em conformidade com os métodos estabelecidos no anexo VI do Regulamento (CE) n.o 152/2009, a fim de verificar a ausência de constituintes de origem animal não autorizados. As informações acerca dos resultados dessa análise devem ser anexadas ao presente certificado sanitário aquando da apresentação da remessa no posto de inspeção fronteiriço da UE. (7) JO L 54 de 26.2.2009, p. 1. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 1-A Certificado sanitário Para proteínas animais transformadas provenientes de insetos de criação não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas, destinadas a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem 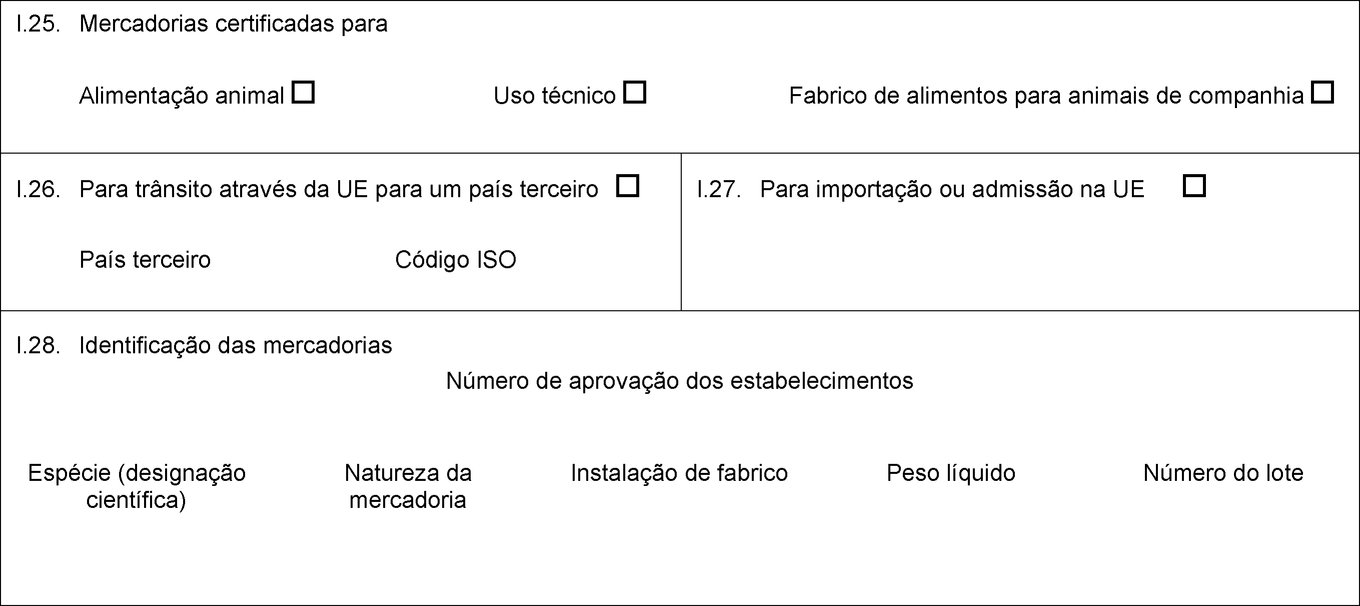 Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Uso técnico Fabrico de alimentos para animais de companhia I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas provenientes de insetos de criação não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo X, capítulo II, secção 1, e o anexo XIV, capítulo I, e certifica que: II.1. Os produtos ou as proteínas animais transformadas provenientes de insetos de criação descritos no presente certificado contêm exclusivamente proteínas animais transformadas não destinadas ao consumo humano que: a) foram preparadas e armazenadas em estabelecimentos ou unidades aprovados e supervisionados pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009; e b) foram preparadas exclusivamente a partir de insetos de criação das seguintes espécies: (2) quer [- mosca-soldado-negro (Hermetia illucens),] (2) e/quer [- mosca-doméstica (Musca domestica),] (2) e/quer [- tenébrio (Tenebrio molitor),] (2) e/quer [- tenebrião-pequeno (Alphitobius diaperinus),] (2) e/quer [- grilo-doméstico (Acheta domesticus),] (2) e/quer [- grilo-raiado (Gryllodes sigillatus),] (2) e/quer [- grilo-do-campo (Gryllus assimilis);] e c) foram processadas através do método [1]-[2]-[3]-[4]-[5]-[7] (2), como estabelecido no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011; e d) o substrato para a alimentação dos insetos de criação contém apenas produtos de origem não animal ou os seguintes produtos de origem animal de matérias da categoria 3: — farinha de peixe, — produtos derivados do sangue de não ruminantes, — fosfato dicálcico e fosfato tricálcico de origem animal, — proteínas hidrolisadas provenientes de não ruminantes, — proteínas hidrolisadas provenientes de couros e peles de ruminantes, — gelatina e colagénio provenientes de não ruminantes, — ovos e ovoprodutos, — leite, produtos à base de leite, produtos derivados do leite e colostro, — mel, — gorduras fundidas; Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas provenientes de insetos de criação não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. e e) o substrato para a alimentação dos insetos e os insetos ou as suas larvas não estiveram em contacto com quaisquer outras matérias de origem animal, com exceção das referidas na alínea d), e o substrato não continha chorume, restos de cozinha e de mesa ou outros resíduos. II.2. A autoridade competente examinou uma amostra aleatória imediatamente antes da expedição, tendo verificado que esta respeitava as seguintes normas (3): Salmonella: ausência em 25 gramas: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 em 1 grama. II.3. O produto foi objeto de todas as precauções necessárias para evitar a recontaminação por agentes patogénicos após o tratamento. II.4. O produto final: (2) quer [foi embalado em sacos novos ou esterilizados;] (2) quer [foi transportado a granel em contentores ou outros meios de transporte cuidadosamente limpos e desinfetados antes da utilização;] que ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO/PROTEÍNAS DE INSETOS TRANSFORMADAS – NÃO UTILIZAR NA ALIMENTAÇÃO DE ANIMAIS DE CRIAÇÃO, EXCETO ANIMAIS DESTINADOS À PRODUÇÃO DE PELES COM PELO E ANIMAIS DE AQUICULTURA”. II.5. O produto final foi armazenado em armazéns fechados. (2) [II.6. Os produtos ou as proteínas animais transformadas descritos no presente certificado contêm ou derivam de subprodutos animais provenientes de ruminantes e: (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que não houve casos nativos de EEB; e]] (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que houve um caso nativo de EEB, e o subproduto animal ou produto derivado provém de animais nascidos após a data de aplicação efetiva, naquele país ou região, da proibição de alimentar ruminantes com farinha de carne e de ossos e com torresmos derivados de ruminantes, tal como definidos no Código Sanitário para os Animais Terrestres da OIE; e]] (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB;  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas provenientes de insetos de criação não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.7. Os produtos ou as proteínas animais transformadas descritos no presente certificado: (2) quer [não contêm leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm leite ou produtos à base de leite de origem ovina ou caprina e destinam-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico, iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante pelo menos os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico: (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] II.8. [Os produtos ou as proteínas animais transformadas descritos no presente certificado contêm ou derivam de subprodutos animais de origem não ruminante e, de acordo com a declaração do expedidor referido na casa I.1,  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas provenientes de insetos de criação não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [não se destinam à produção de alimentos para animais de criação, à exceção de animais produtores de peles com pelo.] (2) (6) quer [destinam-se à produção de alimentos para animais de criação não ruminantes, à exceção de animais produtores de peles com pelo, e o expedidor tomou medidas para assegurar que o posto de inspeção fronteiriço de entrada na União Europeia vai receber os resultados das análises efetuadas de acordo com os métodos estabelecidos no anexo VI do Regulamento (CE) n.o 152/2009 da Comissão (7).] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento. — Casa I.19: Utilizar o código SH adequado: 05.11, 23.01 ou 23.09. — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: insetos, especificar a sua designação científica. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) Em que: n = número de amostras a testar; m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (4) JO L 147 de 31.5.2001, p. 1. (5) JO L 172 de 30.6.2007, p. 84.  Texto de imagem
Texto de imagem
PAÍS Proteínas animais transformadas provenientes de insetos de criação não destinadas ao consumo humano, incluindo misturas e produtos, com exceção dos alimentos para animais de companhia, que contenham essas proteínas II. Informação sanitária II.a. Número de referência do certificado II.b. (6) A pessoa responsável pela remessa referida na casa I.6 deve assegurar que, se os produtos ou as proteínas animais transformadas descritos no presente certificado sanitário se destinarem a ser usados na produção de alimentos para não ruminantes de criação, à exceção de animais produtores de peles com pelo, a remessa deve ser analisada, em conformidade com os métodos estabelecidos no anexo VI do Regulamento (CE) n.o 152/2009, a fim de verificar a ausência de constituintes de origem animal não autorizados. As informações acerca dos resultados dessa análise devem ser anexadas ao presente certificado sanitário aquando da apresentação da remessa no posto de inspeção fronteiriço da UE. (7) JO L 54 de 26.2.2009, p. 1. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 2(A) Certificado sanitário Para leite, produtos à base de leite e produtos derivados do leite não destinados ao consumo humano, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. Número(s) CITES I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem 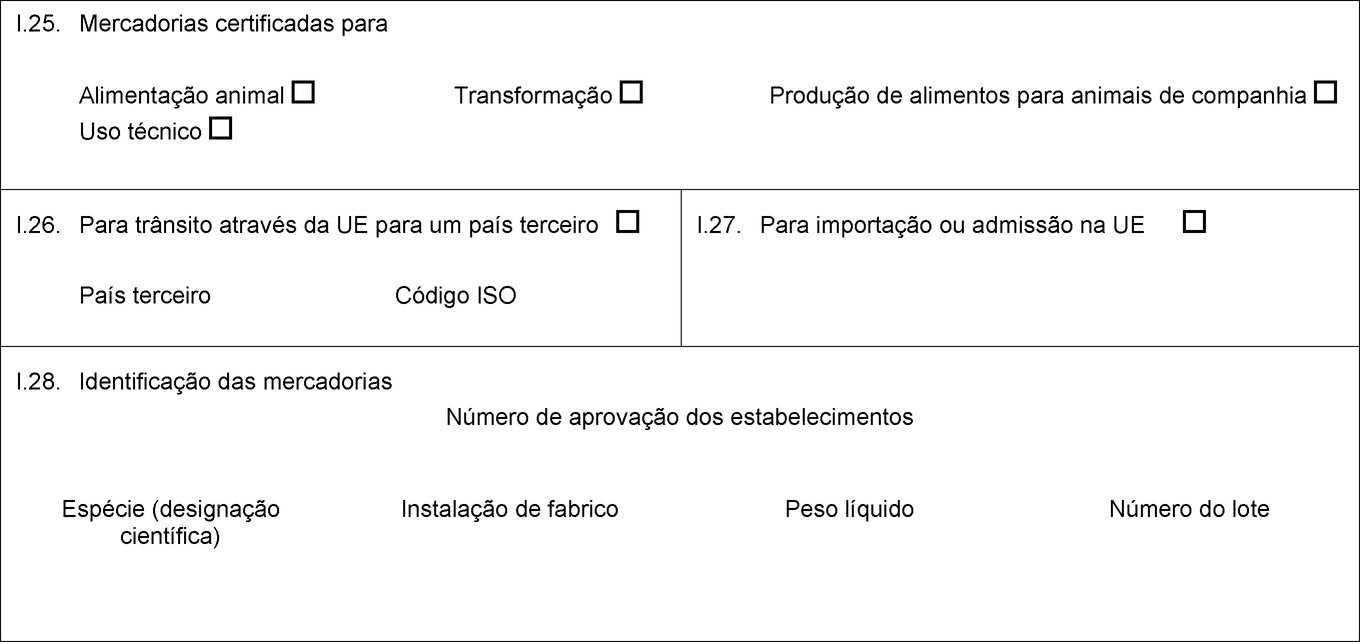 Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Transformação Produção de alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Leite, produtos à base de leite e produtos derivados do leite não destinados ao consumo humano II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo X, capítulo II, secção 4, e o anexo XIV, capítulo I, e certifica que o leite (2), os produtos à base de leite (2) e os produtos derivados do leite (2) referidos na casa I.28 cumprem as seguintes condições: II.1. Foram produzidos e obtidos em (inserir nome do país de exporta-ção) (3), (inserir nome da região) (3), cons-tante do anexo II, parte I, do Regulamento (UE) n.o 605/2010 da Comissão (4), que esteve indemne de febre aftosa e de peste bovina nos 12 meses imediatamente anteriores à exportação e não praticou a vacinação contra a peste bovina durante esse período. II.2. Foram produzidos a partir de leite cru proveniente de animais que, quando da ordenha, não apresentavam sinais clínicos de qualquer doença transmissível aos seres humanos ou aos animais por via do leite e que foram mantidos, pelo menos nos 30 dias anteriores à produção, em explorações que não estavam submetidas a restrições oficiais devido à febre aftosa ou à peste bovina. II.3. Trata-se de leite ou produtos à base de leite que: (2) quer [foram submetidos a um dos tratamentos ou combinações de tratamentos descritos no ponto II.4;] (2) quer [incluem soro de leite destinado à alimentação de animais de espécies sensíveis à febre aftosa, e este soro foi obtido de leite submetido a um dos tratamentos descritos no ponto II.4 e (2) quer [o soro de leite foi obtido não antes de decorridas 16 horas após a coagulação e apresenta um pH inferior a 6.] (2) (5) quer [o soro de leite foi produzido pelo menos 21 dias antes da expedição e, durante esse período, não se detetou qualquer caso de febre aftosa no país de exportação.] (2) (5) quer [o soro de leite foi produzido em / /…, sendo esta data, tendo em vista a duração da viagem prevista, pelo menos 21 dias anterior à apresentação da remessa num posto de inspeção fronteiriço na União Europeia.]] II.4. Foram submetidos a um dos seguintes tratamentos: (2) quer [pasteurização de curta duração a alta temperatura, a 72 °C durante pelo menos 15 segundos, ou pasteurização equivalente, que conduza a uma reação negativa no teste da fosfatase no leite de bovinos, combinada com: (2) quer [uma segunda pasteurização de curta duração a alta temperatura, a 72 °C durante pelo menos 15 segundos, ou pasteurização equivalente, que conduza, por si, a uma reação negativa no teste da fosfatase no leite de bovinos.] (2) quer [um processo de secagem subsequente que, no caso do leite destinado à alimentação animal, seja combinado com um aquecimento adicional a uma temperatura igual ou superior a 72 °C.] (2) quer [um processo subsequente pelo qual o pH seja reduzido e mantido durante, pelo menos, uma hora a um nível inferior a 6.] (2) (5) quer [a condição de que o leite/produto à base de leite tenha sido produzido pelo menos 21 dias antes da data de expedição e que, durante esse período, não se tenha detetado qualquer caso de febre aftosa no país de exportação.] (2) (5) quer [o leite/produto à base de leite foi produzido em / /… (inserir a data), sendo esta data, tendo em vista a duração da viagem prevista, pelo menos 21 dias anterior à data de apresentação da remessa num posto de inspeção fronteiriço na União Europeia.] (2) quer [esterilização a um nível F0 pelo menos igual a 3.]] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Leite, produtos à base de leite e produtos derivados do leite não destinados ao consumo humano II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [tratamento a temperatura ultra-alta de 132 °C durante pelo menos um segundo, combinado com: (2) quer [um processo de secagem subsequente que, no caso do leite destinado à alimentação animal, seja combinado com um aquecimento adicional a uma temperatura igual ou superior a 72 °C.] (2) quer [um processo subsequente pelo qual o pH seja reduzido e mantido durante, pelo menos, uma hora a um nível inferior a 6.] (2) (5) quer [a condição de que o leite/produto à base de leite tenha sido produzido pelo menos 21 dias antes da data de expedição e que, durante esse período, não se tenha detetado qualquer caso de febre aftosa no país de exportação.] (2) (5) quer [o leite/produto à base de leite foi produzido em / /… (inserir a data), sendo esta data, tendo em vista a duração da viagem prevista, pelo menos 21 dias anterior à data de apresentação da remessa num posto de inspeção fronteiriço na União Europeia.]] II.5. Foram tomadas todas as precauções para evitar a contaminação do leite/produto à base de leite/produto derivado do leite após o processamento. II.6. O leite/produto à base de leite/produto derivado do leite foi embalado: (2) quer [em contentores novos;] (2) quer [em veículos ou contentores para transporte a granel desinfetados antes do carregamento com um produto aprovado pela autoridade competente;] e os contentores estão marcados com a indicação da natureza do leite/produto à base de leite/produto derivado do leite, ostentando rótulos que indicam que se trata de matérias de categoria 3 e não se destinam ao consumo humano. II.7. O leite, os produtos à base de leite e os produtos derivados do leite descritos no presente certificado: (2) quer [não contêm leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm leite ou produtos à base de leite de origem ovina ou caprina e destinam-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico, iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET;  Texto de imagem
Texto de imagem
PAÍS Leite, produtos à base de leite e produtos derivados do leite não destinados ao consumo humano II. Informação sanitária II.a. Número de referência do certificado II.b. c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante pelo menos os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico: (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001 (6), em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento, o expedidor deve informar o posto de inspeção fronteiriço da União Europeia. — Casa I.19: Utilizar o código adequado do Sistema Harmonizado (SH) da Organização Mundial das Alfândegas: 04.01; 04.02; 04.03; 04.04; 23.09.10, 23.09.90, 35.01, 35.02 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: “Instalação de fabrico”: indicar o número de registo do estabelecimento de tratamento ou de processamento. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1.  Texto de imagem
Texto de imagem
PAÍS Leite, produtos à base de leite e produtos derivados do leite não destinados ao consumo humano II. Informação sanitária II.a. Número de referência do certificado II.b. (2) Riscar o que não interessa. (3) A preencher se a autorização de importação ou de trânsito na União Europeia estiver restringida a certas regiões do país terceiro em questão. (4) JO L 175 de 10.7.2010, p. 1. (5) Esta condição só é aplicável aos países terceiros enumerados na coluna “A” do anexo I do Regulamento (UE) n.o 605/2010. (6) JO L 147 de 31.5.2001, p. 1. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 2(B) Certificado sanitário Para colostro e produtos à base de colostro proveniente de bovinos não destinados ao consumo humano, destinados a expedição para ou a trânsito na (2) União Europeia 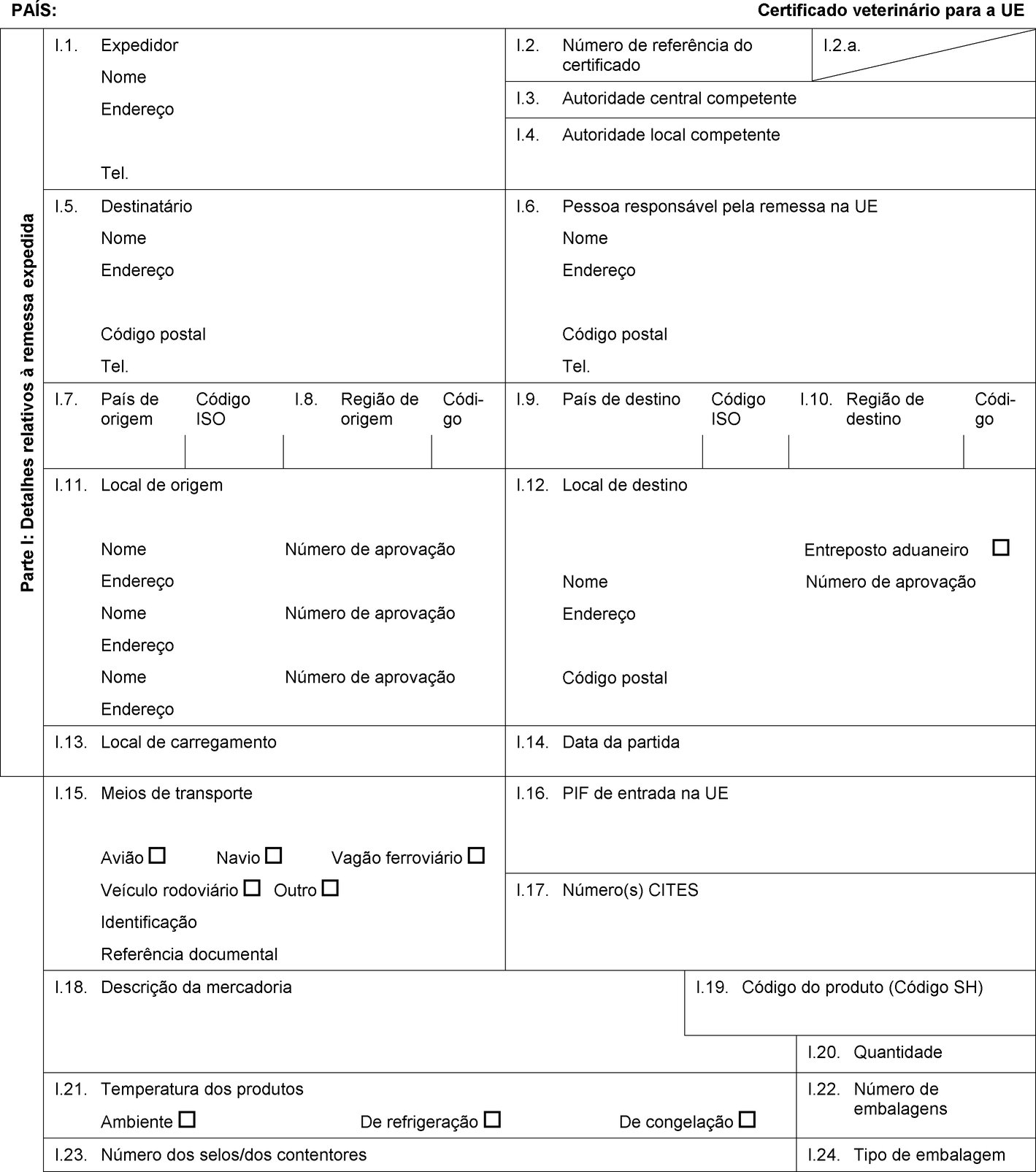 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. Número(s) CITES I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Transformação Produção de alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Colostro e produtos à base de colostro proveniente de bovinos não destinados ao consumo humano II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo X, capítulo II, secção 4, e o anexo XIV, capítulo I, e certifica que o colostro (2) ou os produtos à base de colostro (2) referidos na casa I.28 cumprem as seguintes condições: II.1. Foram produzidos e obtidos em (inserir nome do país de exporta-ção) (3), (inserir nome da região) (3), constan-te do anexo I do Regulamento (UE) n.o 605/2010 da Comissão(4), que esteve indemne de febre aftosa e de peste bovina nos 12 meses imediatamente anteriores à exportação e não praticou a vacinação contra a peste bovina durante esse período. II.2. Foram produzidos a partir de colostro proveniente de animais que, quando da ordenha, não apresentavam sinais clínicos de qualquer doença transmissível aos seres humanos ou aos animais por via do colostro e que foram mantidos, pelo menos nos 30 dias anteriores à data de produção, em explorações que não estavam submetidas a restrições oficiais devido à febre aftosa ou à peste bovina. II.3. Trata-se de colostro ou de produtos à base de colostro de bovinos, que foram submetidos a pasteurização de curta duração a alta temperatura, a 72 °C durante pelo menos 15 segundos, ou pasteurização equivalente, que conduza a uma reação negativa no teste da fosfatase no colostro de bovinos, combinada com: (2) (5) quer [a condição de que o colostro ou os produtos à base de colostro tenham sido produzidos pelo menos 21 dias antes da data de expedição e que, durante esse período, não se tenha detetado qualquer caso de febre aftosa no país de exportação;] (2) (5) quer [a condição de que o colostro ou os produtos à base de colostro tenham sido produzidosem / /… (inserir a data), sendo esta data, tendo em vista a duração da viagem prevista, pelo menos 21 dias anterior à apresentação da remessa num posto de inspeção fronteiriço na União Europeia;] e foram obtidos de animais sujeitos a inspeções veterinárias regulares para assegurar que são provenientes de explorações em que todos os efetivos de bovinos: (2) (5) quer [são reconhecidos como oficialmente indemnes de tuberculose e de brucelose (6);] (2) (5) quer [não são sujeitos a restrições ao abrigo da legislação nacional do país terceiro de origem no que diz respeito à erradicação da tuberculose e da brucelose;] e (2) (5) quer [são reconhecidos como oficialmente indemnes de leucose bovina enzoótica (6);] (2) (5) quer [são abrangidos por um sistema oficial de controlo da leucose bovina enzoótica, não tendo havido indícios, através de testes clínicos e laboratoriais, da presença desta doença no efetivo nos últimos dois anos.]] II.4. Foram tomadas todas as precauções para evitar a contaminação do colostro/produto à base de colostro após o processamento. II.5. O colostro ou produto à base de colostro foi embalado: (2) quer [em contentores novos;] (2) quer [em veículos ou contentores para transporte a granel desinfetados antes do carregamento com um produto aprovado pela autoridade competente;] e os contentores estão marcados com a indicação da natureza do colostro/produto à base de colostro, ostentando rótulos que indicam que se trata de matérias de categoria 3 e não se destinam ao consumo humano. II.6. O colostro ou produto à base de colostro não contém leite ou produtos à base de leite de origem ovina ou caprina. Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Colostro e produtos à base de colostro proveniente de bovinos não destinados ao consumo humano II. Informação sanitária II.a. Número de referência do certificado II.b. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento na União Europeia, o expedidor deve informar o posto de inspeção fronteiriço da União Europeia. — Casa I.19: Utilizar o código adequado do Sistema Harmonizado (SH) da Organização Mundial das Alfândegas: 04.04.90; 23.09.10, 23.09.90, 35.01, 35.02 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: “Instalação de fabrico”: indicar o número de registo do estabelecimento de tratamento ou processamento. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) A preencher se a autorização de introdução na União Europeia estiver restringida a certas regiões do país terceiro em questão. (4) JO L 175 de 10.7.2010, p. 1. (5) Esta condição só é aplicável aos países terceiros autorizados na coluna “A” do anexo I do Regulamento (UE) n.o 605/2010 da Comissão (JO L 175 de 10.7.2010, p. 1). (6) Efetivo oficialmente indemne de tuberculose e de brucelose conforme estabelecido no anexo A da Diretiva 64/432/CEE do Conselho (JO 121 de 29.7.1964, p. 1977/64) e efetivo oficialmente indemne de leucose bovina enzoótica conforme estabelecido no anexo D, capítulo I, da referida diretiva. — A assinatura e o selo devem ser de cor diferente da dos carateres impressos. — Nota para o importador: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço da União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 3(A) Certificado sanitário Para alimentos enlatados para animais de companhia, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) 23.09 I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Alimentos enlatados para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente os artigos 8.o e 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão(1b), nomeadamente o anexo XIII, capítulo II, e o anexo XIV, capítulo II, e certifica que os alimentos para animais de companhia descritos no presente certificado: II.1. Foram preparados e armazenados em estabelecimentos ou unidades aprovados e supervisionados pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009. II.2. Foram preparados exclusivamente a partir dos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- subprodutos animais de aves de capoeira e lagomorfos, abatidos em explorações agrícolas nos termos do artigo 1.o, n.o 3, alínea d), do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho (2a), que não apresentavam quaisquer sinais de doença transmissível aos seres humanos ou aos animais;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Alimentos enlatados para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- matérias provenientes de animais tratados com determinadas substâncias proibidas nos termos da Diretiva 96/22/CE do Conselho (2b), sendo a importação das matérias autorizada em conformidade com o artigo 35.o, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009.] II.3. Foram submetidos a um tratamento térmico que conduziu a um valor Fc igual ou superior a 3 em recipientes hermeticamente fechados. II.4. Foram analisados por amostragem aleatória de, pelo menos, cinco amostras de cada lote transformado, por meio de um método laboratorial de diagnóstico, a fim de assegurar um tratamento térmico adequado de toda a remessa, conforme previsto no ponto II.3. II.5. Foram objeto de todas as precauções necessárias para evitar a contaminação por agentes patogénicos após o tratamento. (2) [II.6. Os alimentos para animais de companhia descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]]  Texto de imagem
Texto de imagem
PAÍS Alimentos enlatados para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 139 de 30.4.2004, p. 55. (2b) JO L 125 de 23.5.1996, p. 3. (3) JO L 147 de 31.5.2001, p. 1. (4) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 3(B) Certificado sanitário Para alimentos transformados para animais de companhia, com exceção dos alimentos enlatados, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Alimentos transformados para animais de companhia, com exceção dos alimentos enlatados II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente os artigos 8.o e 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIII, capítulo II, e o anexo XIV, capítulo II, e certifica que os alimentos para animais de companhia descritos no presente certificado: II.1. Foram preparados e armazenados numa unidade aprovada e supervisionada pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009. II.2. Foram preparados exclusivamente a partir dos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- subprodutos animais de aves de capoeira e lagomorfos, abatidos em explorações agrícolas nos termos do artigo 1.o, n.o 3, alínea d), do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho (2a), que não apresentavam quaisquer sinais de doença transmissível aos seres humanos ou aos animais;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Alimentos transformados para animais de companhia, com exceção dos alimentos enlatados II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- matérias provenientes de animais tratados com determinadas substâncias proibidas nos termos da Diretiva 96/22/CE do Conselho (2b), sendo a importação das matérias autorizada em conformidade com o artigo 35.o, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009.] II.3. (2) quer [Foram submetidos a um tratamento térmico a uma temperatura de, pelo menos, 90 °C em toda a massa.] (2) quer [Foram produzidos, no que diz respeito aos ingredientes de origem animal, utilizando-se exclusivamente produtos que: a) no caso de subprodutos animais ou produtos derivados de carne ou de produtos à base de carne, foram submetidos a um tratamento térmico a uma temperatura de, pelo menos, 90 °C em toda a massa; b) no caso do leite e dos produtos à base de leite, i) se provieram de países terceiros ou de partes de países terceiros enumerados na coluna B do anexo I do Regulamento (UE) n.o 605/2010 da Comissão (3), foram submetidos a um tratamento de pasteurização suficiente para produzir um resultado negativo no teste da fosfatase, ii) com pH reduzido para valores inferiores a 6, se provieram de países terceiros ou de partes de países terceiros enumerados na coluna C do anexo I do Regulamento (UE) n.o 605/2010, foram primeiramente submetidos a um tratamento de pasteurização suficiente para produzir um resultado negativo no teste da fosfatase, iii) se provieram de países terceiros ou de partes de países terceiros enumerados na coluna C do anexo I do Regulamento (UE) n.o 605/2010, foram submetidos a uma esterilização ou a um duplo tratamento térmico, tendo sido cada um suficiente para produzir um resultado negativo no teste da fosfatase, iv) se provieram de países terceiros ou de partes de países terceiros enumerados na coluna C do anexo I do Regulamento (UE) n.o 605/2010, nos quais tenha ocorrido um foco de febre aftosa nos últimos 12 meses ou tenha sido realizada a vacinação contra a febre aftosa nos últimos 12 meses, foram submetidos quer — a um processo de esterilização conducente a um valor Fc igual ou superior a 3, ou — a um primeiro tratamento térmico com um efeito de aquecimento pelo menos equivalente ao alcançado através de um processo de pasteurização de, pelo menos, 72 °C durante um mínimo de 15 segundos e suficiente para conduzir a uma reação negativa no teste da fosfatase, seguido de  Texto de imagem
Texto de imagem
PAÍS Alimentos transformados para animais de companhia, com exceção dos alimentos enlatados II. Informação sanitária II.a. Número de referência do certificado II.b. quer — um segundo tratamento térmico com um efeito de aquecimento pelo menos equivalente ao obtido com o primeiro tratamento térmico e que seria suficiente para conduzir a uma reação negativa no teste da fosfatase, seguido, no caso do leite em pó ou de produtos em pó à base de leite, de um processo de secagem, ou — um processo de acidificação no qual o pH seja mantido a um valor inferior a 6 durante pelo menos uma hora; c) no caso da gelatina, foi produzida através de um processo que garanta que as matérias não transformadas da categoria 3 são submetidas a um tratamento com um ácido ou uma base, seguido de um ou mais enxaguamentos, do ajuste subsequente do pH e da subsequente extração pelo calor, repetida caso for necessário, seguidos de depuração por filtração e esterilização; d) no caso das proteínas hidrolisadas, foram produzidas através de um processo envolvendo as medidas adequadas para minimizar a contaminação das matérias-primas de categoria 3 e, no caso das proteínas hidrolisadas provenientes na sua totalidade ou em parte de couros ou peles de ruminantes, foram produzidas numa unidade de processamento dedicada exclusivamente à produção de proteínas hidrolisadas, utilizando apenas matérias com um peso molecular inferior a 10 000 Dalton e com recurso a um processo que envolva a preparação das matérias-primas de categoria 3 através de salga, calagem e lavagem intensiva, seguida de: i) exposição das matérias a um pH superior a 11 durante mais de três horas a uma temperatura superior a 80 °C, seguida de um tratamento térmico a mais de 140 °C durante 30 minutos a mais de 3,6 bar, ou ii) exposição das matérias a um pH de 1 a 2, seguido de um pH superior a 11 e de um tratamento térmico a 140 °C durante 30 minutos a 3 bar; e) no caso de ovoprodutos, foram submetidos a qualquer um dos métodos de processamento 1 a 5 ou 7 estabelecidos no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011; ou tratados em conformidade com o anexo III, secção X, capítulo II, do Regulamento (CE) n.o 853/2004; f) no caso do colagénio, foi submetido a um processo que garante que as matérias não transformadas de categoria 3 são submetidas a um tratamento que envolve a lavagem, o ajuste do pH utilizando um ácido ou uma base, seguindo-se um ou mais enxaguamentos, filtração e extrusão, sendo proibida a utilização de conservantes, com exceção dos autorizados pela legislação da União; g) no caso de produtos derivados de sangue, foram produzidos através de qualquer um dos métodos de processamento 1 a 5 ou 7 estabelecidos no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011; h) no caso de proteínas de mamíferos transformadas, foram submetidas a qualquer um dos métodos de processamento 1 a 5 ou 7 e, no caso de sangue de suínos, foi submetido a qualquer um dos métodos de processamento 1 a 5 ou 7, desde que, no caso do método 7, tenha sido aplicado um tratamento térmico a uma temperatura de, pelo menos, 80 °C em toda a massa; i) no caso de proteínas transformadas não provenientes de mamíferos, com exclusão da farinha de peixe, foram submetidas a qualquer um dos métodos de processamento 1 a 5 ou 7 estabelecidos no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011; j) no caso da farinha de peixe, foi submetida a qualquer um dos métodos de processamento 1 a 7 estabelecidos no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011, ou a um método e a parâmetros que asseguram que o produto cumpre as normas microbiológicas aplicáveis aos produtos derivados estabelecidas no anexo X, capítulo I, do Regulamento (UE) n.o 142/2011; k) no caso das gorduras fundidas, incluindo os óleos de peixe, foram submetidas a qualquer um dos métodos de processamento 1 a 5 ou 7 (e ao método 6 no caso do óleo de peixe) estabelecidos no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011 ou foram produzidas em conformidade com o anexo III, secção XII, capítulo II, do Regulamento (CE) n.o 853/2004; as gorduras fundidas provenientes de ruminantes devem ser depuradas, por forma a que as impurezas insolúveis totais presentes não representem mais de 0,15 % em peso;  Texto de imagem
Texto de imagem
PAÍS Alimentos transformados para animais de companhia, com exceção dos alimentos enlatados II. Informação sanitária II.a. Número de referência do certificado II.b. l) no caso do fosfato dicálcico, foi produzido através de um processo que i) assegura que todas as matérias ósseas de categoria 3 são finamente trituradas e desengorduradas com água quente e tratadas com ácido clorídrico diluído (a uma concentração não inferior a 4 % e com um pH inferior a 1,5) durante um período de, pelo menos, dois dias, ii) a seguir ao procedimento referido na subalínea i), aplica um tratamento com cal do licor fosfórico obtido, do qual resulta um precipitado de fosfato dicálcico a um pH de 4 a 7, e iii) por último, faz secar o precipitado de fosfato dicálcico com ar, com uma temperatura de admissão de 65 °C a 325 °C e uma temperatura final entre 30 °C e 65 °C; m) no caso do fosfato tricálcico, foi produzido através de um processo que assegura i) que todas as matérias ósseas de categoria 3 são finamente trituradas e desengorduradas em contracorrente com água quente (fragmentos de ossos com menos de 14 mm), ii) uma cozedura contínua com vapor a 145 °C durante 30 minutos a 4 bar, iii) a separação do caldo de proteína da hidroxiapatite (fosfato tricálcico) por centrifugação, e iv) a granulação do fosfato tricálcico após secagem num leito fluidizado com ar a 200 °C; n) no caso de vísceras organoléticas, foram produzidas em conformidade com um método de tratamento e parâmetros que asseguram que o produto cumpre as normas microbiológicas referidas no ponto II.4.] (2) quer [Foram submetidos a um tratamento como a secagem ou a fermentação, autorizado pela autoridade competente.] (2) quer [No caso de invertebrados aquáticos e terrestres, com exceção de espécies patogénicas para os seres humanos ou animais, foram submetidos a um tratamento que foi autorizado pela autoridade competente e que assegura que os alimentos para animais de companhia não representam riscos inaceitáveis para a saúde pública e animal.] II.4. Foram examinados, através de análise de, pelo menos, cinco amostras colhidas aleatoriamente em cada lote transformado, durante ou após o armazenamento, na unidade de processamento, estando em conformidade com as seguintes normas (4): Salmonella: ausência em 25 g: n = 5, c = 0, m = 0, M = 0, Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 em 1 grama. II.5. Foram objeto de todas as precauções necessárias para evitar a contaminação por agentes patogénicos após o tratamento. II.6. Foram acondicionados em embalagens novas que, se os alimentos para animais de companhia não forem expedidos em embalagens prontas para venda que indiquem claramente destinar-se o conteúdo apenas à alimentação de animais de companhia, comportam rótulos com a seguinte menção: “NÃO DESTINADO AO CONSUMO HUMANO”. (2) [II.7. Os alimentos para animais de companhia descritos no presente certificado: (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (5);  Texto de imagem
Texto de imagem
PAÍS Alimentos transformados para animais de companhia, com exceção dos alimentos enlatados II. Informação sanitária II.a. Número de referência do certificado II.b. b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (6), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento, o expedidor deve informar o posto de inspeção fronteiriço de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 04.01; 04.02; 04.03; 04.04; 04.08, 05.04, 05.05, 05.06; 05.11, 15.01, 15.02, 15.03, 15.04, 23.01, 23.09; 28.35.25; 28.35.26; 35.01; 35.02; 35.03 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 139 de 30.4.2004, p. 55. (2b) JO L 125 de 23.5.1996, p. 3. (3) JO L 175 de 10.7.2010, p. 1.  Texto de imagem
Texto de imagem
PAÍS Alimentos transformados para animais de companhia, com exceção dos alimentos enlatados II. Informação sanitária II.a. Número de referência do certificado II.b. (4) Em que: n = número de amostras a testar; m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (5) JO L 147 de 31.5.2001, p. 1. (6) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 3(C) Certificado sanitário Para ossos de couro destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Ossos de couro II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIII, capítulo II, e o anexo XIV, capítulo II, e certifica que os ossos de couro descritos no presente certificado: II.1. Foram preparados exclusivamente a partir dos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doença transmissível aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- matérias provenientes de animais tratados com determinadas substâncias proibidas nos termos da Diretiva 96/22/CE do Conselho (2a), sendo a importação das matérias autorizada em conformidade com o artigo 35.o, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009.] II.2. Foram submetidos: (2) quer [no caso dos ossos de couro feitos de couros e peles de ungulados ou de peixe, a um tratamento suficiente para destruir os organismos patogénicos (incluindo as salmonelas); os ossos de couro estão secos;] (2) e/quer [no caso dos ossos de couro feitos de subprodutos animais, com exceção dos couros e peles de ungulados, ou de peixe, a um tratamento térmico a uma temperatura de, pelo menos, 90 °C em toda a massa.] II.3. Foram examinados, através da análise de, pelo menos, cinco amostras colhidas aleatoriamente em cada lote transformado, durante ou após o armazenamento, na unidade de processamento, estando em conformidade com as seguintes normas (3): Salmonella: ausência em 25 g: n = 5, c = 0, m = 0, M = 0, Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 em 1 grama. Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Ossos de couro II. Informação sanitária II.a. Número de referência do certificado II.b. II.4. Foram objeto de todas as precauções necessárias para evitar a contaminação por agentes patogénicos após o tratamento. II.5. Foram embalados em embalagens novas. (2) [II.6. Os ossos de couro descritos no presente certificado: (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (4); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (5), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.19: 05.11, 23.09, 41.01 ou 42.05. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1.  Texto de imagem
Texto de imagem
PAÍS Ossos de couro II. Informação sanitária II.a. Número de referência do certificado II.b. (2) Riscar o que não interessa. (2a) JO L 125 de 23.5.1996, p. 3. (3) Em que: — n = número de amostras a testar; — m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; — M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e — c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (4) JO L 147 de 31.5.2001, p. 1. (5) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 3(D) Certificado sanitário Para alimentos crus para animais de companhia, para venda direta, ou subprodutos animais para alimentação de animais destinados à produção de peles com pelo, destinados a expedição para ou a trânsito na (2) União Europeia 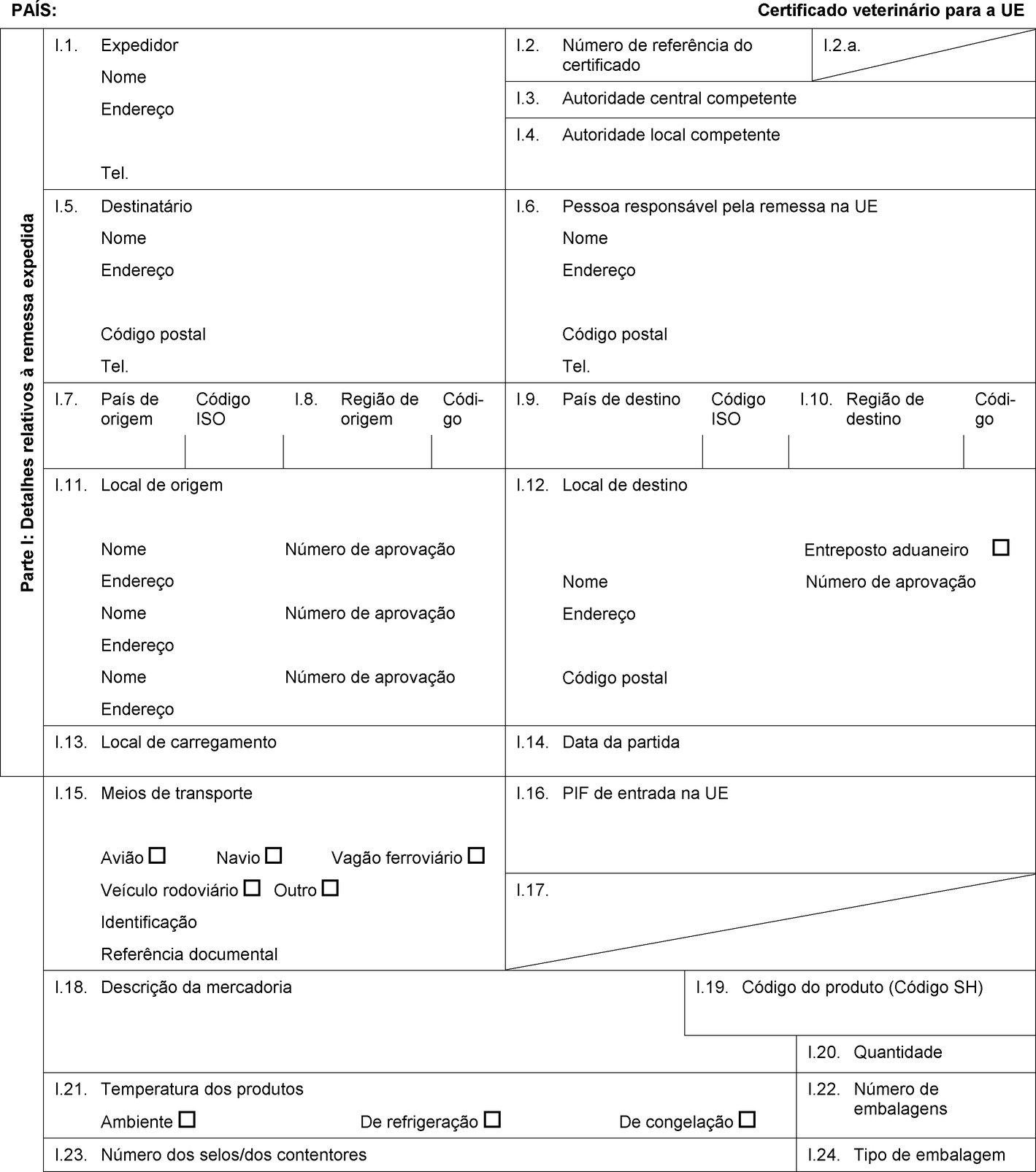 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Alimentos crus para animais de companhia, para venda direta, ou subprodutos animais para alimentação de animais destinados à produção de peles com pelo II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIII, capítulo II, e o anexo XIV, capítulo II, e certifica que os alimentos crus para animais de companhia ou os subprodutos animais descritos no presente certificado: II.1. Consistem em subprodutos animais que satisfazem os requisitos sanitários infra. II.2. Consistem em subprodutos animais: a) derivados de carne que satisfaz os requisitos de saúde animal e saúde pública pertinentes estabelecidos nos seguintes diplomas: — Regulamento (UE) n.o 206/2010 da Comissão (3) e desde que os animais de que a carne provém sejam originários dos países terceiros, territórios ou partes destes (código ISO no caso de um país ou códigos no caso de territórios ou partes destes), — e/ou Regulamento (CE) n.o 798/2008 da Comissão (4) e desde que os animais de que a carne provém sejam originários dos países terceiros, territórios ou partes destes … (código ISO no caso de um país ou códigos no caso de territórios ou partes destes), tal como enumerados nesse regulamento, que estiveram indemnes da doença de Newcastle e de gripe aviária nos últimos 12 meses, — e/ou Regulamento (CE) n.o 119/2009 da Comissão (5) e desde que os animais de que a carne provém sejam originários dos países terceiros, territórios ou partes destes (código ISO no caso de um país ou códigos no caso de territórios ou partes destes), tal como enumerados nesse regulamento, que estiveram indemnes de febre aftosa, peste bovina, peste suína clássica, peste suína africana, doença vesiculosa dos suínos, doença de Newcastle e gripe aviária nos últimos 12 meses e nos quais, durante esse período, não tenha sido efetuada uma vacinação (apenas se for pertinente para as espécies sensíveis); b) derivados de animais que, no matadouro, foram aprovados na inspeção sanitária ante mortem, realizada nas 24 horas anteriores ao abate, e que não apresentavam indícios das doenças referidas nos regulamentos indicados na alínea a) a que os animais sejam sensíveis; e c) derivados de animais que foram tratados no matadouro, antes e no momento do abate ou da occisão, em conformidade com as disposições pertinentes da legislação da União e cumpriam requisitos pelo menos equivalentes aos estabelecidos nos capítulos II e III do Regulamento (CE) n.o 1099/2009 do Conselho (6); ou d) no caso de alimentos para animais produtores de peles com pelo, derivados de animais aquáticos que satisfazem os requisitos de saúde animal e saúde pública pertinentes estabelecidos na Decisão 2006/766/CE da Comissão (7) e provêm dos países ou seus territórios (código ISO do país), tal como enumerados no anexo II da referida decisão. II.3.1. Consistem apenas nos seguintes subprodutos animais: a) carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, que foram considerados próprios para consumo humano de acordo com a legislação da União, até que, por motivos comerciais, foram irreversivelmente declarados como subprodutos animais; b) partes de animais abatidos, rejeitadas como impróprias para consumo humano, mas não afetadas por quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais e derivadas de carcaças próprias para consumo humano, de acordo com a legislação da União. II.3.2. No caso de alimentos para animais destinados à produção de peles com pelo, para além do indicado no pon-to II.3.1, consistem também nos seguintes subprodutos animais: (2) quer [- subprodutos animais de aves de capoeira e lagomorfos, abatidos em explorações agrícolas nos termos do artigo 1.o, n.o 3, alínea d), do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho (2a), que não apresentavam quaisquer sinais de doença transmissível aos seres humanos ou aos animais;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Alimentos crus para animais de companhia, para venda direta, ou subprodutos animais para alimentação de animais destinados à produção de peles com pelo II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento.] II.4. Foram obtidos e preparados sem que tenham estado em contacto com outras matérias não conformes com as condições estabelecidas no Regulamento (CE) n.o 1069/2009 e foram manuseados de modo a evitar a contaminação por agentes patogénicos. II.5. Foram embalados em embalagens finais que ostentam rótulos com as menções “ALIMENTOS CRUS PARA ANIMAIS DE COMPANHIA — NÃO DESTINADOS AO CONSUMO HUMANO” ou “SUBPRODUTOS ANIMAIS PARA ALIMENTAÇÃO DE ANIMAIS DESTINADOS À PRODUÇÃO DE PELES COM PELO — NÃO DESTINADOS AO CONSUMO HUMANO” e, em seguida, em caixas/recipientes estanques e oficialmente selados ou em embalagens novas que impedem quaisquer fugas e em caixas/recipientes oficialmente selados que ostentam rótulos com as menções “ALIMENTOS CRUS PARA ANIMAIS DE COMPANHIA — NÃO DESTINADOS AO CONSUMO HUMANO” ou “SUBPRODUTOS ANIMAIS PARA ALIMENTAÇÃO DE ANIMAIS DESTINADOS À PRODUÇÃO DE PELES COM PELO — NÃO DESTINADOS AO CONSUMO HUMANO”, o nome e o endereço do estabelecimento de destino. II.6. No caso dos alimentos crus para animais de companhia: a) Foram preparados e armazenados numa unidade aprovada e supervisionada pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009; e b) Foram examinados, através da análise de, pelo menos, cinco amostras colhidas aleatoriamente em cada lote durante o armazenamento (antes da expedição), estando em conformidade com as seguintes normas (8):  Texto de imagem
Texto de imagem
PAÍS Alimentos crus para animais de companhia, para venda direta, ou subprodutos animais para alimentação de animais destinados à produção de peles com pelo II. Informação sanitária II.a. Número de referência do certificado II.b. Salmonella: ausência em 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 5 000 em 1 grama. (2) [II.7. [Os alimentos para animais de companhia ou os subprodutos animais para alimentação de animais destinados à produção de peles com pelo descritos no presente certificado contêm ou derivam de subprodutos animais provenientes de ruminantes e: (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que não houve casos nativos de EEB; e]] (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que houve um caso nativo de EEB, e o subproduto animal ou produto derivado provém de animais nascidos após a data de aplicação efetiva, naquele país ou região, da proibição de alimentar ruminantes com farinha de carne e de ossos e com torresmos derivados de ruminantes, tal como definidos no Código Sanitário para os Animais Terrestres da OIE; e]] (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (9); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (10), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento, o expedidor deve informar o posto de inspeção fronteiriço de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 04.08; 05.06; 05.08; 05.11, 23.01 ou 23.09. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação.  Texto de imagem
Texto de imagem
PAÍS Alimentos crus para animais de companhia, para venda direta, ou subprodutos animais para alimentação de animais destinados à produção de peles com pelo II. Informação sanitária II.a. Número de referência do certificado II.b. — Casa I.28: Natureza da mercadoria: selecionar alimentos crus para animais de companhia ou subproduto animal. No caso das matérias-primas para o fabrico de alimentos crus para animais de companhia, indicar a designação científica da espécie. No caso das matérias-primas para o fabrico de alimentos para animais destinados à produção de peles com pelo, selecionar entre as seguintes espécies: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 139 de 30.4.2004, p. 55. (3) JO L 73 de 20.3.2010, p. 1. (4) JO L 226 de 23.8.2008, p. 1. (5) JO L 39 de 10.2.2009, p. 12. (6) JO L 303 de 18.11.2009, p. 1. (7) JO L 320 de 18.11.2006, p. 53. (8) Em que: n = número de amostras a testar; m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (9) JO L 147 de 31.5.2001, p. 1. (10) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço da União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 3(E) Certificado sanitário Para vísceras organoléticas a utilizar no fabrico de alimentos para animais de companhia, destinadas a expedição para ou a trânsito na (2) União Europeia 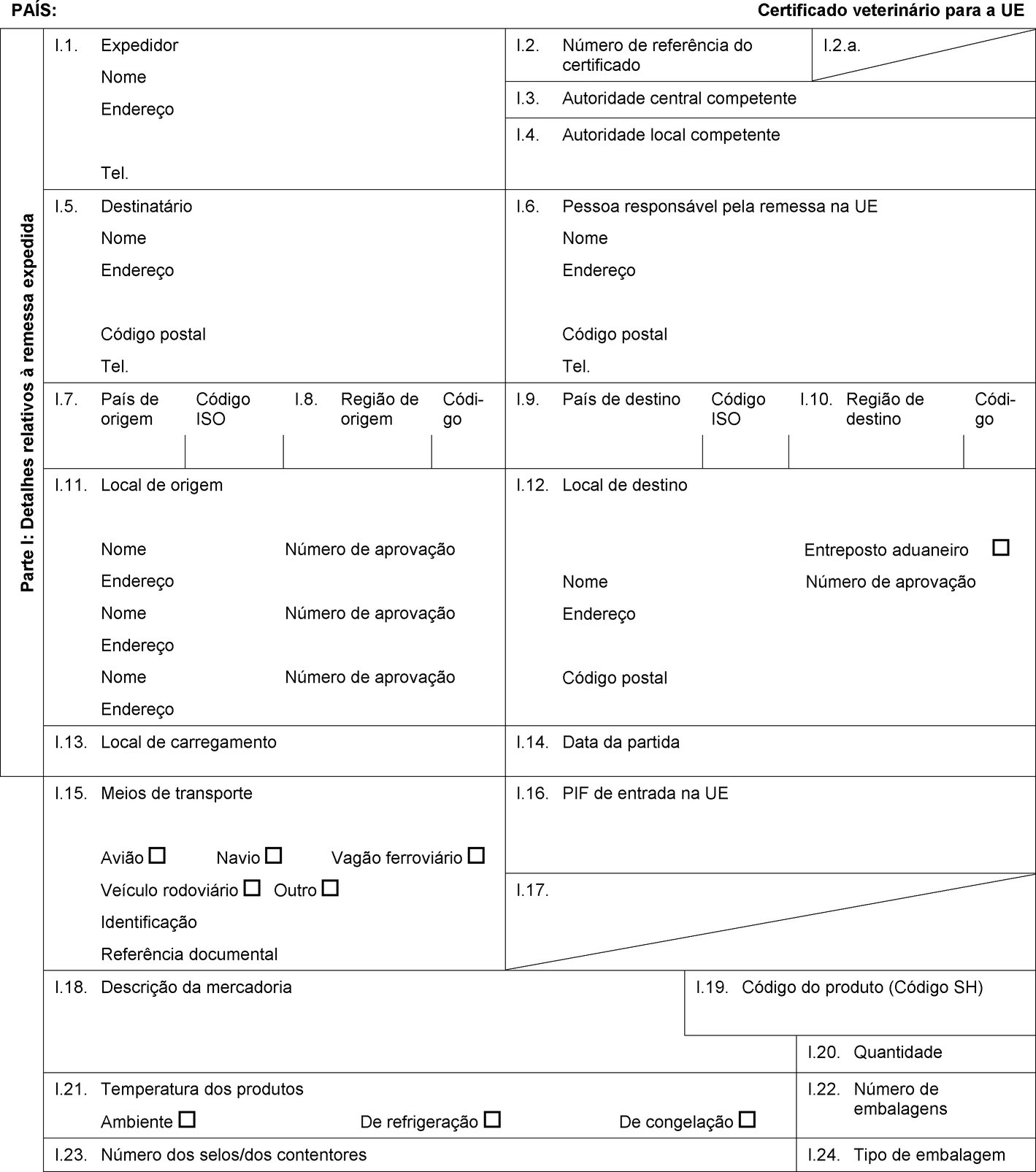 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem 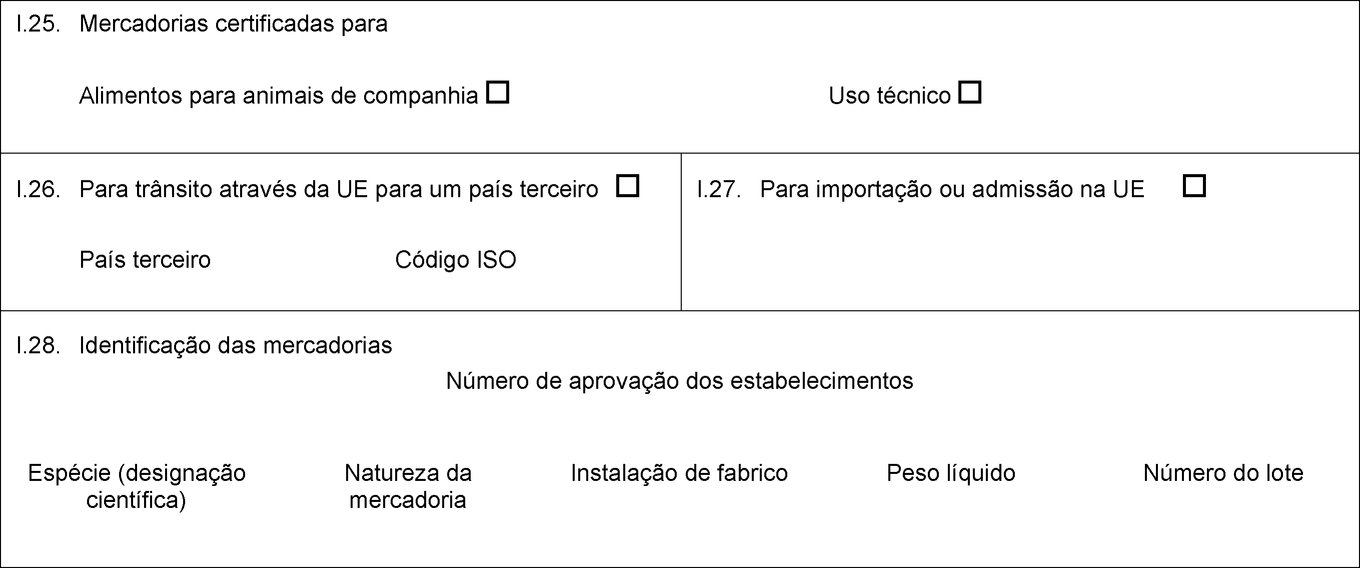 Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Peso líquido Número do lote 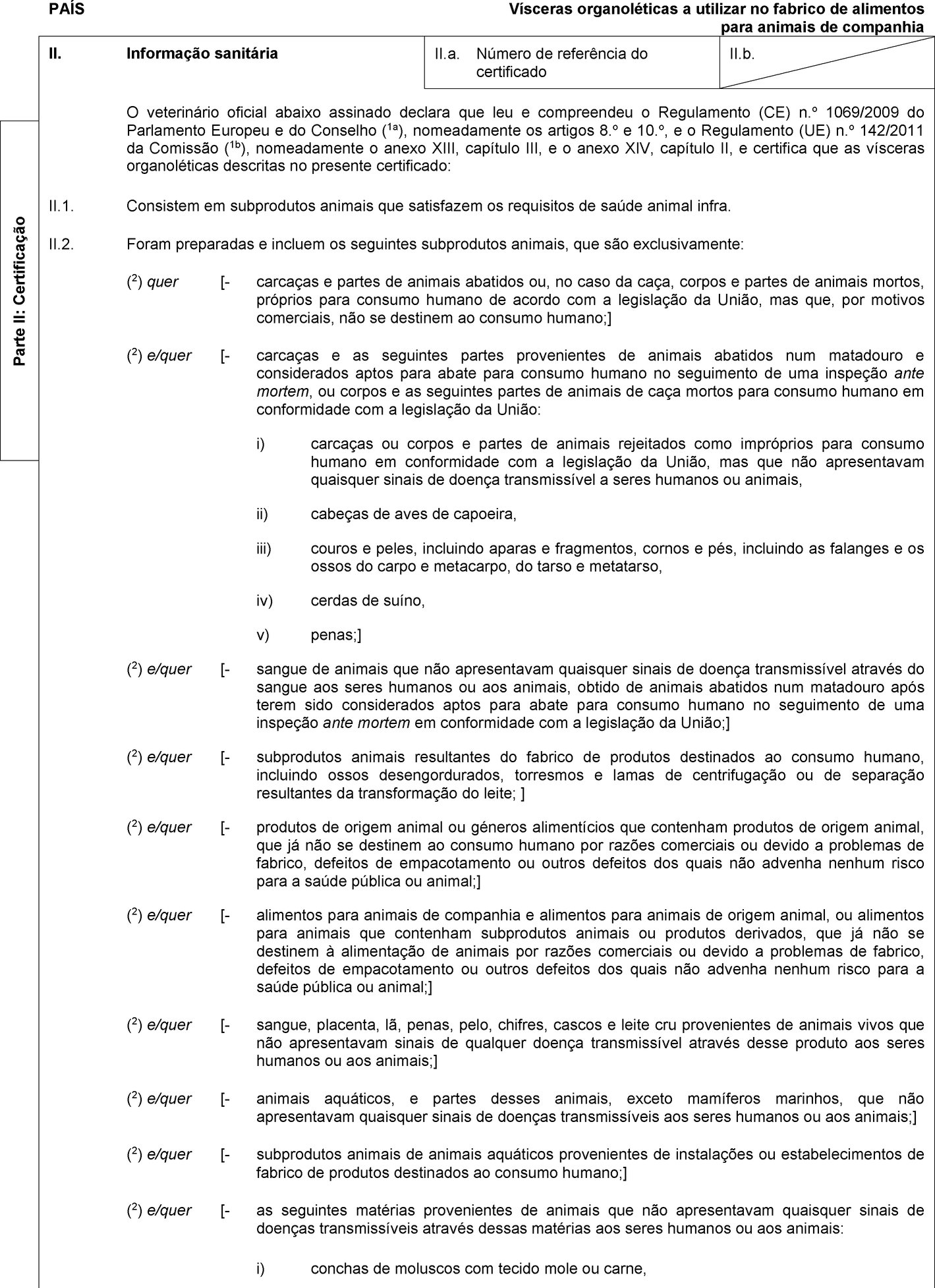 Texto de imagem
Texto de imagem
PAÍS Vísceras organoléticas a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente os artigos 8.o e 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIII, capítulo III, e o anexo XIV, capítulo II, e certifica que as vísceras organoléticas descritas no presente certificado: II.1. Consistem em subprodutos animais que satisfazem os requisitos de saúde animal infra. II.2. Foram preparadas e incluem os seguintes subprodutos animais, que são exclusivamente: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite; ] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Vísceras organoléticas a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. ii) os seguintes produtos provenientes de animais terrestres: – subprodutos de incubação, – ovos, – subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- matérias provenientes de animais tratados com determinadas substâncias proibidas nos termos da Diretiva 96/22/CE do Conselho (2a), sendo a importação das matérias autorizada em conformidade com o artigo 35.o, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009.] II.3. Foram submetidas a processamento em conformidade com o anexo XIII, capítulo III, do Regulamento (UE) n.o 142/2011, a fim de destruir os agentes patogénicos. II.4. Foram examinadas, através de análise de, pelo menos, cinco amostras colhidas aleatoriamente em cada lote transformado, durante ou após o armazenamento, na unidade de processamento, estando em conformidade com as seguintes normas (3): Salmonella: ausência em 25 g: n = 5, c = 0, m = 0, M = 0, Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 em 1 grama. II.5. O produto final foi: (2) quer [embalado em sacos novos ou esterilizados;] (2) quer [transportado a granel, em contentores ou outros meios de transporte cuidadosamente limpos e desinfetados, antes da utilização, com um desinfetante aprovado pela autoridade competente,] e que ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO”. II.6. O produto final foi armazenado em armazéns fechados. II.7. Os produtos foram objeto de todas as precauções necessárias para evitar a contaminação por agentes patogénicos após o tratamento. (2) [II.8. As vísceras organoléticas descritas no presente certificado: (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (4); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (5), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]]  Texto de imagem
Texto de imagem
PAÍS Vísceras organoléticas a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.19: Utilizar o código SH adequado: 05.04; 05.06, 05.11 ou 23.09. — Casa I.23: No caso de contentores para transporte a granel, indicar o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: — Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. — Definir o produto à base de vísceras. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 125 de 23.5.1996, p. 3. (3) Em que: n = número de amostras a testar; m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (4) JO L 147 de 31.5.2001, p. 1. (5) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 3(F) Certificado sanitário Para subprodutos animais (3) a utilizar no fabrico de alimentos para animais de companhia, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Fabrico de alimentos para animais de companhia Transformação Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Número de embalagens Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a) e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que os subprodutos animais descritos no presente certificado: II.1.1. Consistem em subprodutos animais que satisfazem os requisitos de saúde animal infra. II.1.2. Foram obtidos no território de: (1c) de animais que: (2) quer [a) permaneceram nesse território desde o seu nascimento ou, pelo menos, durante os três últimos meses antes da data de abate ou produção;] (2) quer [b) foram mortos no estado selvagem, nesse território (1d);] (2) quer [c) são derivados de roedores, lagomorfos, animais aquáticos ou animais invertebrados aquáticos ou terrestres.] II.1.3. Foram obtidos de animais ou produzidos por animais: (2) quer [a) provenientes de explorações: i) em que, no que diz respeito às seguintes doenças a que os animais são sensíveis, não se verificou qualquer caso/foco de peste bovina, doença vesiculosa dos suínos, doença de Newcastle ou gripe aviária de alta patogenicidade durante os 30 dias anteriores, ou de peste suína clássica ou peste suína africana durante os 40 dias anteriores, nem nas explorações situadas nas suas proximidades, num raio de 10 km, durante os 30 dias anteriores, e ii) em que não se verificou qualquer caso/foco de febre aftosa durante os 60 dias anteriores, nem nas explorações situadas nas suas proximidades, num raio de 25 km, durante os 30 dias anteriores; e b) que: i) não foram abatidos a fim de erradicar qualquer doença epizoótica, ii) permaneceram nas suas explorações de origem por um período de, pelo menos, 40 dias antes da data da partida e foram transportados diretamente para o matadouro, sem qualquer contacto com outros animais não conformes com as mesmas condições sanitárias, iii) no matadouro, foram aprovados na inspeção sanitária ante mortem, realizada nas 24 horas anteriores ao abate, e não apresentavam indícios das doenças referidas supra, a que os animais sejam sensíveis, e iv) foram tratados no matadouro, antes e no momento do abate ou da occisão, em conformidade com as disposições pertinentes da legislação da União e cumpriam requisitos pelo menos equivalentes aos estabelecidos nos capítulos II e III do Regulamento (CE) n.o 1099/2009 do Conselho (4);] (2) quer [a) capturados e mortos no estado selvagem numa área: i) em que, num raio de 25 km, não se verificou qualquer caso/foco de qualquer uma das doenças seguintes, a que os animais são sensíveis: febre aftosa, peste bovina, doença de Newcastle e gripe aviária de alta patogenicidade durante os 30 dias anteriores, nem de peste suína clássica ou peste suína africana durante os 40 dias anteriores, e ii) situada a uma distância de, pelo menos, 20 km de qualquer país ou de uma parte do território de um país que não tenham estado autorizados a exportar para a União Europeia matérias de aves de capoeira nos últimos 30 dias ou matérias de suínos nos últimos 40 dias; e b) que, após o abate, foram transportados no prazo de 12 horas, para refrigeração, quer para um centro de recolha e imediatamente a seguir para um estabelecimento de manuseamento de caça, quer diretamente para um estabelecimento de manuseamento de caça.] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. II.1.4. Foram obtidos num estabelecimento em redor do qual, num raio de 10 km, não ocorreu qualquer caso/foco das doenças referidas no ponto II.1.3, a que os animais são sensíveis, durante os 30 dias anteriores ou, na eventualidade de um caso de doença, em que a preparação das matérias-primas para exportação para a União Europeia tenha sido autorizada apenas após a remoção de toda a carne e a limpeza e a desinfeção totais do estabelecimento, sob controlo de um veterinário oficial. II.1.5. Foram obtidos e preparados sem que tenham estado em contacto com quaisquer outras matérias não conformes com as condições exigidas supra e foram manuseados de modo a evitar a contaminação por agentes patogénicos. II.1.6. Foram embalados em embalagens novas que impedem quaisquer fugas e em recipientes oficialmente selados que ostentam um rótulo com a menção “MATÉRIAS-PRIMAS DESTINADAS APENAS AO FABRICO DE ALIMENTOS PARA ANIMAIS DE COMPANHIA”, bem como o nome e endereço do estabelecimento de destino na União Europeia. II.1.7. Consistem apenas nos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, que foram considerados próprios para consumo humano de acordo com a legislação da União, até que, por motivos comerciais, foram irreversivelmente declarados como subprodutos animais;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos,  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- matérias provenientes de animais tratados com determinadas substâncias proibidas nos termos da Diretiva 96/22/CE do Conselho (4a), sendo a importação das matérias autorizada em conformidade com o artigo 35.o, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009.] II.1.8. Foram ultracongelados na unidade de origem ou preservados em conformidade com a legislação da União Europeia, de forma a evitar a deterioração entre a expedição e a entrega na unidade de destino na União Europeia ou durante o trânsito na União Europeia. II.1.9. No caso das matérias-primas derivadas de animais tratados com certas substâncias proibidas pela Diretiva 96/22/CE, destinadas à produção de alimentos para animais de companhia, cuja importação é permitida em conformidade com o artigo 35.°, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009: a) foram marcadas no país terceiro, antes da entrada no território da União Europeia, com uma cruz em carvão liquefeito ou carvão ativado, em cada um dos lados exteriores de cada bloco congelado, ou, quando a matéria-prima é transportada em paletes que não estão divididas em remessas separadas durante o transporte até à unidade de alimentos para animais de companhia de destino na União Europeia ou durante o trânsito na União Europeia, em cada um dos lados exteriores de cada palete, por forma a que a marcação cubra, pelo menos, 70 % do comprimento na diagonal do bloco congelado e tenha, pelo menos, 10 cm de largura; b) no caso das matérias que não estejam congeladas, as matérias-primas foram marcadas no país terceiro, antes da entrada no território da União Europeia, através da respetiva aspersão com carvão liquefeito ou da aplicação de carvão em pó, de forma a que esse carvão seja claramente visível nas matérias; e c) quando os subprodutos animais são constituídos por matérias-primas tratadas como acima referido e por outras matérias-primas não tratadas, todas as matérias-primas foram marcadas tal como se refere nas alíneas a) e b) supra. (2) (5) [II.2. Requisitos específicos (2) (6) [II.2.1. Os subprodutos da presente remessa são provenientes de animais que foram mantidos no território referido no ponto II.1.2, em que se realizam regularmente programas de vacinação contra a febre aftosa, controlados oficialmente, nos bovinos domésticos.] (2) (7) [II.2.2. Os subprodutos da presente remessa consistem apenas em subprodutos animais derivados de miudezas aparadas de ruminantes domésticos que foram submetidas a maturação a uma temperatura ambiente superior a + 2 °C durante pelo menos 3 horas ou, no caso dos músculos masséteres de bovinos e da carne desossada de animais domésticos, durante pelo menos 24 horas.]] (2) [II.3. Os subprodutos animais destinados ao fabrico de alimentos para animais de companhia contêm ou derivam de subprodutos animais provenientes de ruminantes e: (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que não houve casos nativos de EEB; e]] (2) quer [provêm de um país ou região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE e em que houve um caso nativo de EEB, e o subproduto animal ou produto derivado provém de animais nascidos após a data de aplicação efetiva, naquele país ou região, da proibição de alimentar ruminantes com farinha de carne e de ossos e com torresmos derivados de ruminantes, tal como definidos no Código Sanitário para os Animais Terrestres da OIE, e]] (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (8); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (9), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.19: Utilizar o código SH adequado: 05.04; 05.06; 05.07; 05.11.91 ou 05.11.99; 23.01; 41.01. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: — Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea. — Instalação de fabrico: indicar o número de controlo veterinário do estabelecimento aprovado; Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1.  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar no fabrico de alimentos para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. (1c) O nome e o número de código ISO do país de exportação, em conformidade com: — o anexo II, parte 1, do Regulamento (UE) n.o 206/2010, — o anexo I, parte 1, do Regulamento (CE) n.o 798/2008, e — o anexo I, parte 1, do Regulamento (CE) n.o 119/2009. Além disso, deve incluir-se o código ISO regional que figura nesses anexos (quando aplicável às espécies sensíveis em questão). (1d) Apenas para países a partir dos quais seja autorizada a importação, para a União Europeia, de carne de caça destinada ao consumo humano, da mesma espécie animal. (2) Riscar o que não interessa. (3) Excluindo sangue não tratado, leite cru, couros e peles, cascos e chifres, cerdas de suíno e penas (ver certificados específicos pertinentes naquele anexo, relativos à importação destes produtos). (4) JO L 303 de 18.11.2009, p. 1. (4a) JO L 125 de 23.5.1996, p. 3. (5) Garantias suplementares a fornecer quando as matérias provenientes de ruminantes domésticos forem originárias do território de um país da América do Sul ou da África Austral, ou de uma parte desses países, em que apenas a carne fresca desossada, submetida a maturação, de ruminantes domésticos para consumo humano esteja autorizada para exportação para a União Europeia. São também permitidos os músculos masséteres completos de bovinos, submetidos a incisão em conformidade com o anexo I, secção IV, capítulo I, parte B, ponto 1, do Regulamento (CE) n.o 854/2004 do Parlamento Europeu e do Conselho (JO L 139 de 30.4.2004, p. 206). (6) Apenas para certos países da América do Sul. (7) Apenas para certos países da América do Sul e da África Austral. (8) JO L 147 de 31.5.2001, p. 1. (9) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço da União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: |
|
2) |
Os capítulos 4(B) a 4(D) passam a ter a seguinte redação: «CAPÍTULO 4(B) Certificado sanitário Para produtos derivados de sangue não destinados ao consumo humano que possam ser utilizados como matérias para alimentação animal, destinados a expedição para ou a trânsito na (2) União Europeia 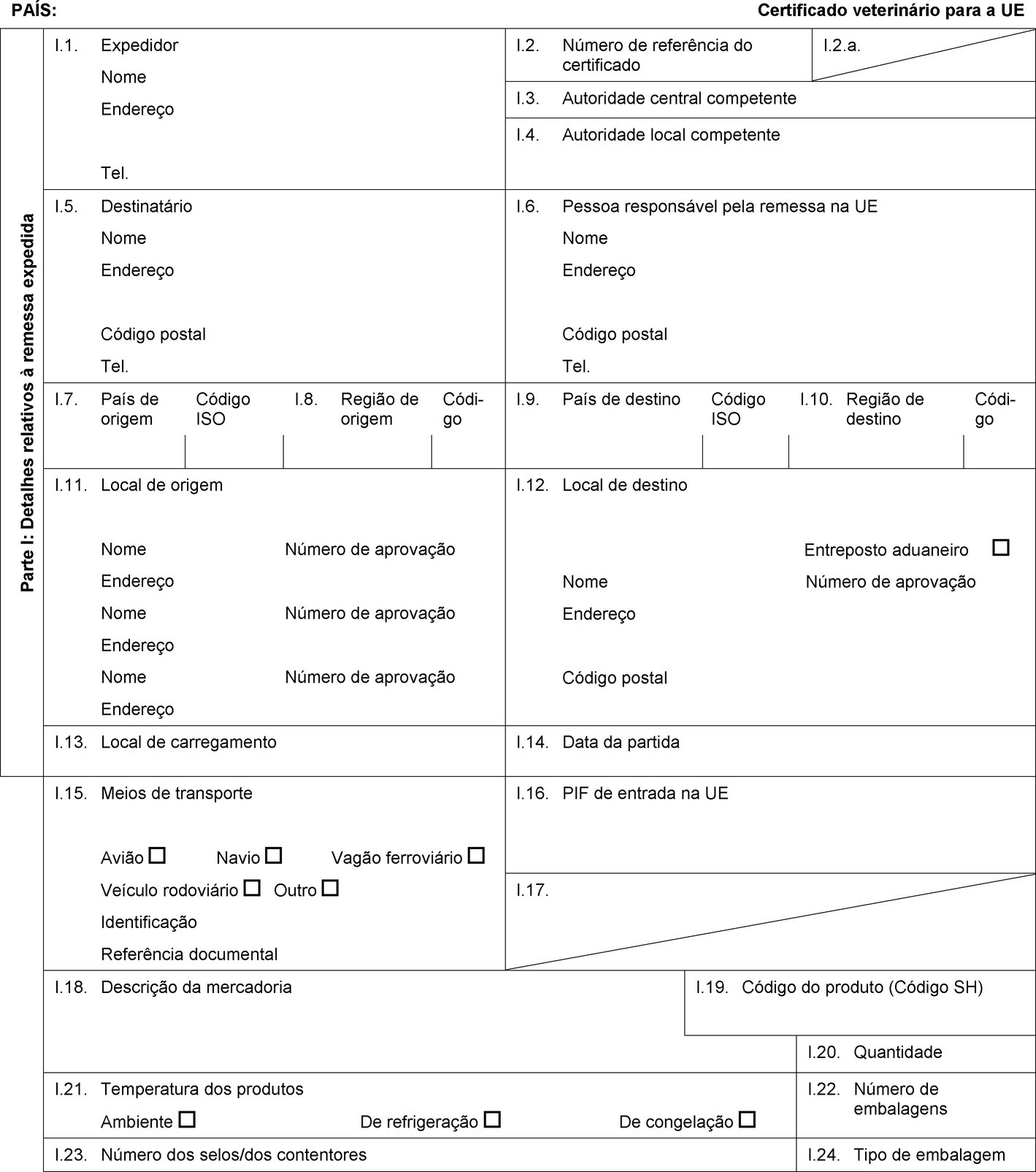 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Fabrico de alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Número do lote  Texto de imagem
Texto de imagem
PAÍS Produtos derivados de sangue não destinados ao consumo humano que possam ser utilizados como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a) e o Regulamento (UE) n.o 142/2011 da Comissão (1b) e certifica que os produtos derivados de sangue descritos no presente certificado: II.1. Consistem em produtos derivados de sangue que satisfazem os requisitos sanitários infra. II.2. Consistem exclusivamente em produtos derivados de sangue não destinados ao consumo humano. II.3. Foram preparados e armazenados numa unidade aprovada e supervisionada pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009. II.4. Foram preparados exclusivamente a partir dos seguintes subprodutos animais: (2) quer [sangue de animais abatidos, próprio para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destina ao consumo humano;] (2) e/quer [sangue de animais abatidos, que foi rejeitado como impróprio para consumo humano em conformidade com a legislação da União, mas que não apresenta quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais, obtido de carcaças de animais abatidos num matadouro que foram considerados próprios para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União.] II.5. A fim de inativar os agentes patogénicos, foram submetidos (2) quer [a processamento em conformidade com o método de processamento (3) como estabelecido no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011;] (2) quer [a um método e parâmetros que asseguram que o produto cumpre as normas microbiológicas estabelecidas no anexo X, capítulo I, do Regulamento (UE) n.o 142/2011;] (2) quer [no caso de produtos derivados de sangue, incluindo sangue e plasma sanguíneo de origem suína secos por atomização destinados à alimentação de suínos, a um tratamento térmico a uma temperatura de, pelo menos, 80 °C em toda a substância, e o sangue e o plasma sanguíneo secos contêm, no máximo, 8 % p/p de humidade, com uma atividade da água (aw) inferior a 0,60.] II.6. O produto final foi: (2) quer [embalado em sacos novos ou esterilizados.] (2) quer [transportado a granel, em contentores ou outros meios de transporte cuidadosamente limpos e desinfetados, antes da utilização, com um desinfetante aprovado pela autoridade competente,] e que ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO”. II.7. O produto final foi armazenado em armazéns fechados. II.8. Os produtos foram objeto de todas as precauções necessárias para evitar a contaminação por agentes patogénicos após o tratamento. (2) e [no caso de produtos derivados de sangue, incluindo sangue e plasma sanguíneo de origem suína secos por atomização destinados à alimentação de suínos, foram armazenados em condições de armazenagem secas, a temperatura ambiente, durante, pelo menos, 6 semanas.] II.9. Foram analisados, antes da expedição, sob a responsabilidade da autoridade competente através da colheita de uma amostra aleatória durante o período de armazenagem ou no seu termo, tendo-se verificado o respeito das seguintes normas (4): Salmonella: ausência em 25 g: n = 5, c = 0, m = 0, M = 0, Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 em 1 grama. Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Produtos derivados de sangue não destinados ao consumo humano que possam ser utilizados como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) [II.10. Os produtos derivados de sangue descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (5); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (6), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.11. Os produtos derivados de sangue descritos no presente certificado (2) quer [não contêm leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm leite ou produtos à base de leite de origem ovina ou caprina e destinam-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, que: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico, iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante pelo menos os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico:  Texto de imagem
Texto de imagem
PAÍS Produtos derivados de sangue não destinados ao consumo humano que possam ser utilizados como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] II.12. Os produtos derivados de sangue descritos no presente certificado contêm ou derivam de subprodutos animais de origem não ruminante e, de acordo com a declaração do expedidor referido na casa I.1, (2) quer [não se destinam à produção de alimentos para animais de criação, à exceção de animais produtores de peles com pelo.] (2) (7) quer [destinam-se à produção de alimentos para animais de criação não ruminantes, à exceção de animais produtores de peles com pelo, e o expedidor tomou medidas para assegurar que o posto de inspeção fronteiriço de entrada vai receber os resultados das análises efetuadas de acordo com os métodos estabelecidos no anexo VI do Regulamento (CE) n.o 152/2009 da Comissão (8).] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.19: Utilizar o código SH adequado: 05.11.91, 05.11.99, 35.02 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Reptilia.  Texto de imagem
Texto de imagem
PAÍS Produtos derivados de sangue não destinados ao consumo humano que possam ser utilizados como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) Indicar métodos 1 a 5 ou método 7, conforme aplicável. (4) Em que: n = número de amostras a testar; m = valor-limite para o número de bactérias; o resultado é considerado satisfatório se o número de bactérias em todas as amostras não exceder m; M = valor máximo para o número de bactérias; o resultado é considerado insatisfatório se o número de bactérias numa ou mais amostras for igual ou superior a M; e c = número de amostras cuja contagem de bactérias se pode situar entre m e M, sendo a amostra ainda considerada aceitável se a contagem de bactérias das outras amostras for igual ou inferior a m. (5) JO L 147 de 31.5.2001, p. 1. (6) JO L 172 de 30.6.2007, p. 84. (7) A pessoa responsável pela remessa referida na casa I.6 deve assegurar que, se os produtos derivados de sangue descritos no presente certificado sanitário se destinarem a ser usados na produção de alimentos para não ruminantes de criação, à exceção de animais produtores de peles com pelo, a remessa deve ser analisada, em conformidade com os métodos estabelecidos no anexo VI do Regulamento (CE) n.o 152/2009, a fim de verificar a ausência de constituintes de origem animal não autorizados. As informações acerca dos resultados dessa análise devem ser anexadas ao presente certificado sanitário aquando da apresentação da remessa no posto de inspeção fronteiriço da União Europeia. (8) JO L 54 de 26.2.2009, p. 1. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 4(C) Certificado sanitário Para produtos não tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação, destinados a expedição para ou a trânsito na (2) União Europeia 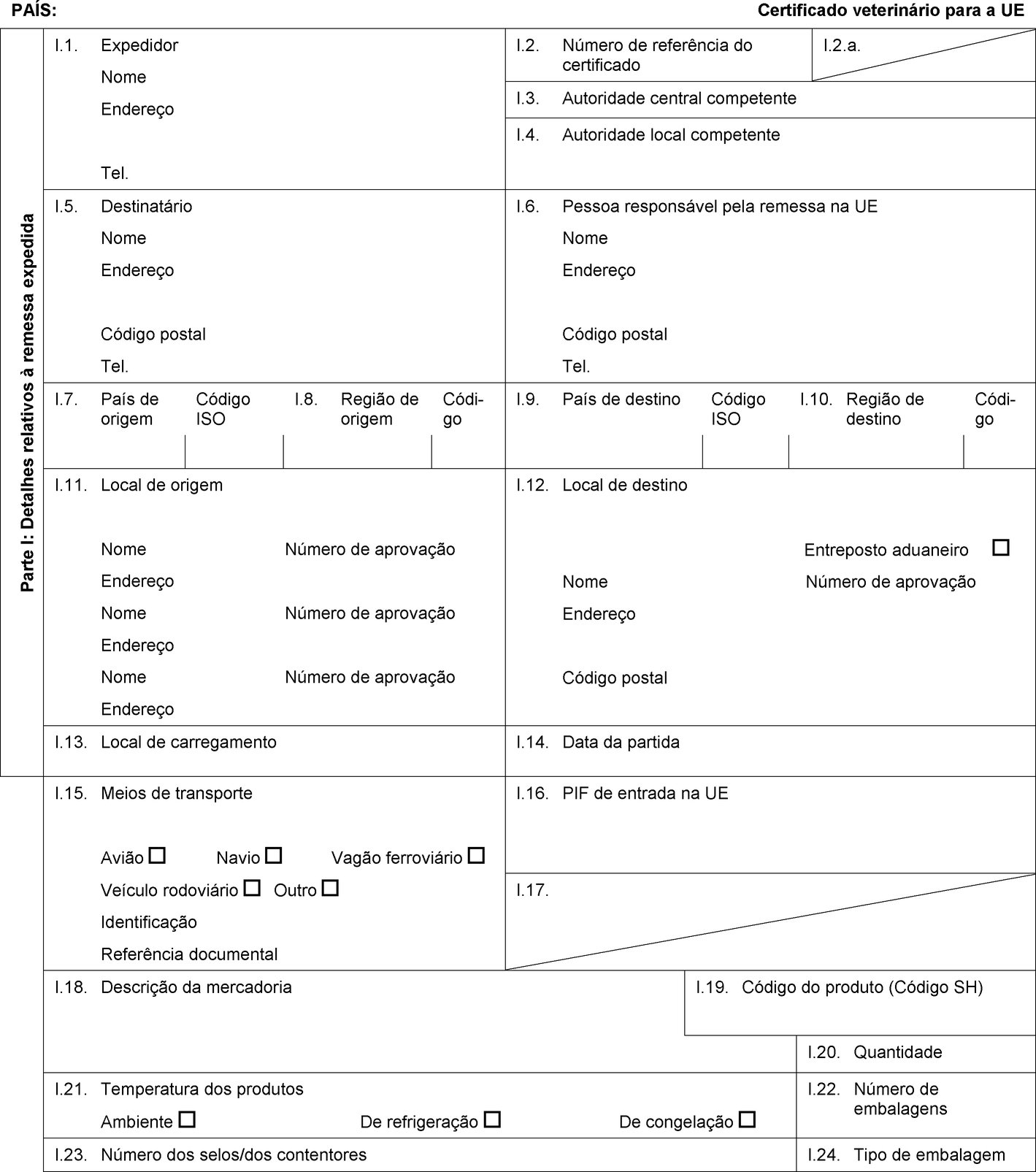 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Número do lote  Texto de imagem
Texto de imagem
PAÍS Produtos não tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 8.o, alínea c), o artigo 8.o, alínea d), e o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que: II.1. Os produtos derivados de sangue descritos no presente certificado consistem em produtos derivados de sangue que satisfazem os requisitos infra. II.2. Consistem exclusivamente em produtos derivados de sangue não destinados ao consumo humano ou animal. II.3. Foram preparados e armazenados numa unidade supervisionada pela autoridade competente ou no estabelecimento de colheita, exclusivamente com os seguintes subprodutos animais: (2) quer [- sangue de animais abatidos, próprio para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destina ao consumo humano;] (2) e/quer [- sangue de animais abatidos, rejeitado como impróprio para consumo humano em conformidade com a legislação da União, mas que não apresenta quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais, obtido de carcaças de animais abatidos num matadouro que foram considerados próprios para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- sangue de animais abatidos que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados próprios para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- sangue e produtos derivados de sangue, provenientes do fabrico de produtos destinados ao consumo humano;] (2) e/quer [- sangue e produtos derivados de sangue provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desses produtos aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais derivados de animais que foram submetidos a tratamento ilegal, na aceção do artigo 1.o, n.o 2, alínea d), da Diretiva 96/22/CE do Conselho (2a) ou do artigo 2.o, alínea b), da Diretiva 96/23/CE do Conselho (2b);] (2) e/quer [- subprodutos animais que contenham resíduos de outras substâncias e contaminantes do ambiente enumerados no anexo I, grupo B, ponto 3, da Diretiva 96/23/CE, se esses resíduos excederem o limite permitido estabelecido pela legislação da União ou, na ausência desta, pela legislação nacional.] II.4. O sangue com o qual esses produtos foram fabricados foi colhido em matadouros aprovados de acordo com a legislação da União ou em matadouros aprovados e supervisionados pela autoridade competente do país de colheita, ou de animais vivos em instalações aprovadas e supervisionadas pela autoridade competente do país de colheita. (2) [II.5. No caso dos produtos derivados de sangue obtidos de animais dos taxa Artiodactyla, Perissodactyla e Proboscidea, incluindo os híbridos entre espécies desses taxa, o sangue foi colhido num país ou região onde não se registou pelo menos durante os últimos 12 meses nenhum caso de peste bovina, peste dos pequenos ruminantes e febre do Vale do Rift, e não foi efetuada vacinação contra essas doenças durante pelo menos os últimos 12 meses; e (2) quer [nos países terceiros, territórios ou partes destes (inserir código ISO no caso de um país, ou códigos (3) no caso de territórios ou partes destes) onde não se registou durante pelo menos os últimos 12 meses nenhum caso de febre aftosa e no qual não foi efetuada vacinação contra esta doença durante pelo menos os últimos 12 meses; e] (2) quer [nos países terceiros, territórios ou partes destes (inserir código ISO no caso de um país, ou códigos (3) no caso de territórios ou partes destes) onde não se registou durante pelo menos os últimos 12 meses nenhum caso de febre aftosa e no qual estão a ser oficialmente executados e controlados programas de vacinação contra a febre aftosa em ruminantes domésticos durante pelo menos os últimos 12 meses (4); e]] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Produtos não tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. (2) [II.5.1. no caso de animais que não sejam Suidae nem Tayassuidae, em países terceiros ou regiões onde: (2) quer [não foi registado durante, pelo menos, os últimos 12 meses nenhum caso de estomatite vesiculosa nem de febre catarral (2) (incluindo a presença de animais seropositivos) e não foi efetuada vacinação contra essas doenças durante, pelo menos, os últimos 12 meses;] (2) quer [estão presentes animais seropositivos à estomatite vesiculosa e à febre catarral (2) (4);]] (2) [II.5.2. no caso dos Suidae e Tayassuidae, nos países terceiros ou regiões nos quais não se registou durante pelo menos os últimos 12 meses nenhum caso de doença vesiculosa dos suínos, peste suína clássica e peste suína africana e não foi efetuada vacinação contra essas doenças durante pelo menos os últimos 12 meses nas espécies sensíveis e: (2) quer [não foi registado durante, pelo menos, os últimos 12 meses nenhum caso de estomatite vesiculosa (incluindo a presença de animais seropositivos) e não foi efetuada vacinação contra essa doença durante, pelo menos, os últimos 12 meses;]] (2) quer [estão presentes animais seropositivos à estomatite vesiculosa (4).]]] (2) [II.6. No caso de produtos derivados de sangue provenientes de aves de capoeira ou de outras espécies avícolas, os animais e os produtos são provenientes do território do país ou região com o código (5) que tem permanecido indemne da doença de Newcastle e da gripe aviária de alta patogenicidade, tal como definido no Código Sanitário para os Animais Terrestres da OIE, que não efetuou vacinação contra a gripe aviária durante, pelo menos, os últimos 12 meses, onde os animais dos quais os produtos derivam não foram vacinados contra a doença de Newcastle com vacinas preparadas a partir de uma estirpe original da doença de Newcastle com uma patogenicidade mais elevada que estirpes lentogénicas do vírus.] II.7. Os produtos foram: (2) quer [embalados em sacos ou garrafas novos ou esterilizados;] (2) quer [transportados a granel, em contentores ou outros meios de transporte cuidadosamente limpos e desinfetados, antes da utilização, com um desinfetante aprovado pela autoridade competente;] a embalagem exterior ou os contentores ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO OU ANIMAL”. II.8. Os produtos foram armazenados em armazéns fechados. II.9. Foram tomadas todas as precauções para evitar a contaminação dos produtos por agentes patogénicos durante o transporte. (2) [II.10. Os produtos não tratados derivados de sangue descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (6); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (7), em que não houve casos nativos de EEB;  Texto de imagem
Texto de imagem
PAÍS Produtos não tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casas I.11 e I.12: Número de aprovação: o número de registo do estabelecimento ou da unidade emitido pela autoridade competente. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento na União Europeia, o expedidor deve informar o posto de inspeção fronteiriço do ponto de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 05.11; 30.02 ou 35.02. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Reptilia. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 125 de 23.5.1996, p. 3. (2b) JO L 125 de 23.5.1996, p. 10. (3) Código de território tal como consta do anexo II, parte 1, do Regulamento (UE) n.o 206/2010 (JO L 73 de 20.3.2010, p. 1). (4) Neste caso, após os controlos veterinários previstos na Diretiva 97/78/CE (JO L 24 de 30.1.1998, p. 9) e na observância das condições estabelecidas no artigo 8.o, n.o 4, dessa diretiva, os produtos devem ser transportados diretamente para o estabelecimento no local de destino.  Texto de imagem
Texto de imagem
PAÍS Produtos não tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. (5) Código de território tal como consta do anexo I, parte 1, do Regulamento (CE) n.o 798/2008 da Comissão (JO L 226 de 23.8.2008, p. 1). (6) JO L 147 de 31.5.2001, p. 1. (7) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 4(D) Certificado sanitário Para produtos tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação, destinados a expedição para ou a trânsito na (2) União Europeia 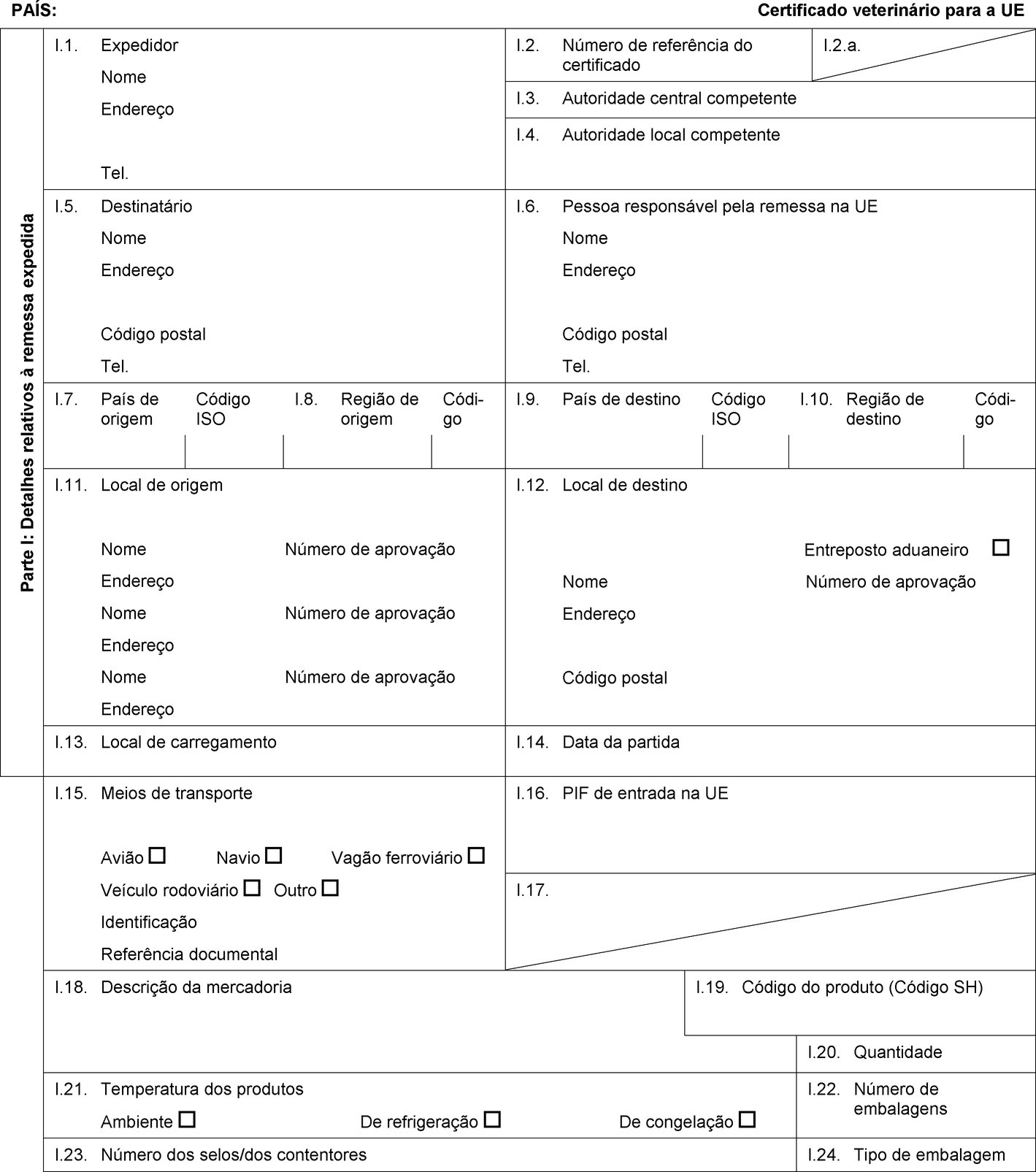 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Número do lote  Texto de imagem
Texto de imagem
PAÍS Produtos tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 8.o, alínea c), o artigo 8.o, alínea d), e o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que: II.1. Os produtos derivados de sangue descritos no presente certificado consistem em produtos derivados de sangue que satisfazem os requisitos infra. II.2. Consistem exclusivamente em produtos derivados de sangue não destinados ao consumo humano ou animal. II.3. Foram preparados e armazenados numa unidade supervisionada pela autoridade competente, exclusivamente com os seguintes subprodutos animais: (2) quer [- sangue de animais abatidos, próprio para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destina ao consumo humano;] (2) e/quer [- sangue de animais abatidos, rejeitado como impróprio para consumo humano em conformidade com a legislação da União, mas que não apresenta quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais, obtido de carcaças de animais abatidos num matadouro que foram considerados próprios para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- sangue de animais abatidos que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados próprios para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- sangue e produtos derivados de sangue provenientes de animais vivos que não apresentavam sinais clínicos de qualquer doença transmissível através desses produtos aos seres humanos ou aos animais;] (2) e/quer [- sangue e produtos derivados de sangue, provenientes do fabrico de produtos destinados ao consumo humano;] (2) e/quer [- subprodutos animais derivados de animais que foram submetidos a tratamento ilegal, na aceção do artigo 1.o, n.o 2, alínea d), da Diretiva 96/22/CE do Conselho (2a) ou do artigo 2.o, alínea b), da Diretiva 96/23/CE do Conselho (2b);] (2) e/quer [- subprodutos animais que contenham resíduos de outras substâncias e contaminantes do ambiente enumerados no anexo I, grupo B, ponto 3, da Diretiva 96/23/CE, se esses resíduos excederem o limite permitido estabelecido pela legislação da União ou, na ausência desta, pela legislação nacional.] II.4. O sangue com o qual esses produtos foram fabricados foi colhido em matadouros aprovados de acordo com a legislação da União ou em matadouros aprovados e supervisionados pela autoridade competente do país de colheita, ou de animais vivos em instalações aprovadas e supervisionadas pela autoridade competente do país de colheita. (2 )[II.5. No caso de produtos derivados de sangue provenientes de Artiodactyla, Perissodactyla e Proboscidea incluindo os seus híbridos, com exceção de Suidae e Tayassuidae, os produtos foram submetidos a um dos seguintes tratamentos, garantindo a ausência de organismos patogénicos de febre aftosa, estomatite vesiculosa, peste bovina, peste dos pequenos ruminantes, febre do Vale do Rift e febre catarral: (2) quer [tratamento térmico a uma temperatura de 65 °C durante, pelo menos, três horas, seguido de um ensaio de eficácia.] (2) e/quer [irradiação a 25 kGy por radiações gama, seguida de um ensaio de eficácia.] (2) e/quer [alteração do pH para 5 durante 2 horas, seguida de um ensaio de eficácia.] (2) e/quer [tratamento térmico a uma temperatura de, pelo menos, 80 °C em toda a massa, seguido de um ensaio de eficácia.]] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Produtos tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. (2) [II.6. No caso de produtos derivados de sangue provenientes de Suidae, Tayassuidae, aves de capoeira e de outras espécies avícolas, os produtos foram submetidos a um dos seguintes tratamentos que garantem a ausência de organismos patogénicos das seguintes doenças: febre aftosa, estomatite vesiculosa, doença vesiculosa dos suínos, peste suína clássica, peste suína africana, doença de Newcastle e gripe aviária de alta patogenicidade, conforme adequado às espécies: (2) quer [tratamento térmico a uma temperatura de 65 °C durante, pelo menos, três horas, seguido de um ensaio de eficácia.] (2) e/quer [irradiação a 25 kGy por radiações gama, seguida de um ensaio de eficácia.] (2) e/quer [tratamento térmico a uma temperatura de, pelo menos, 80 °C para Suidae/Tayassuidae (2) e de, pelo menos, 70 °C para aves de capoeira e outras espécies avícolas (2) em toda a massa do produto, seguido de um ensaio de eficácia.]] (2) [II.7. No caso de produtos derivados de sangue provenientes de outras espécies que não as enumeradas no ponto II.5 ou II.6, os produtos foram submetidos ao seguinte tratamento (especificar): ] II.8. Os produtos foram: (2) quer [embalados em sacos ou garrafas novos ou esterilizados;] (2) quer [transportados a granel, em contentores ou outros meios de transporte cuidadosamente limpos e desinfetados, antes da utilização, com um desinfetante aprovado pela autoridade competente;] e a embalagem exterior ou os contentores ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO OU ANIMAL”. II.9. Os produtos foram armazenados em armazéns fechados. II.10. Foram tomadas todas as precauções para evitar a contaminação dos produtos por agentes patogénicos depois do tratamento. (2) [II.11. Os produtos tratados derivados de sangue descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]]  Texto de imagem
Texto de imagem
PAÍS Produtos tratados derivados de sangue, excluindo os provenientes de equídeos, para o fabrico de produtos derivados utilizados para fins fora da cadeia alimentar dos animais de criação II. Informação sanitária II.a. Número de referência do certificado II.b. Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casas I.11 e I.12: Número de aprovação: o número de registo do estabelecimento ou da unidade emitido pela autoridade competente. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento na União Europeia, o expedidor deve informar o PIF de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 05.11, 30.02, 35.02 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: No caso da espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Reptilia. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 125 de 23.5.1996, p. 3. (2b) JO L 125 de 23.5.1996, p. 10. (3) JO L 147 de 31.5.2001, p. 1. (4) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço da União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: |
|
(3) |
O capítulo 6(B) passa a ter a seguinte redação: «CAPÍTULO 6(B) Certificado sanitário Para troféus de caça ou outras preparações de aves e de ungulados, constituídos por partes inteiras não tratadas, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. Número(s) CITES I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Espécie (designação científica) Número de embalagens  Texto de imagem
Texto de imagem
PAÍS Troféus de caça ou outras preparações de aves e de ungulados, constituídos por partes inteiras não tratadas II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a) e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que os troféus de caça descritos no presente certificado: (2) quer [II.1. No que diz respeito aos troféus de caça ou outras preparações de biungulados, com exceção dos suínos: a) (região) esteve indemne de febre aftosa e de peste bovina nos últimos 12 meses e durante esse período não foi efetuada a vacinação contra qualquer dessas doenças; e b) os troféus de caça ou outras preparações descritos no presente certificado: i) foram obtidos de animais abatidos no território dessa região, aprovado para a exportação para a União Europeia de carne fresca das espécies domésticas sensíveis correspondentes, no qual, durante os últimos 60 dias, não vigoraram restrições em matéria de saúde animal devido a focos de doenças a que as espécies cinegéticas são sensíveis, e ii) foram obtidos de animais abatidos a, pelo menos, 20 km de distância das fronteiras de outro país terceiro ou parte de país terceiro não autorizado a exportar troféus de caça não tratados de biungulados, com exceção de suínos, para a União Europeia.] (2) quer [II.1. No que diz respeito aos troféus de caça e outras preparações de suínos selvagens: a) (região) esteve, durante os últimos 12 meses, indemne de peste suína clássica, de peste suína africana, de doença vesiculosa dos suínos, de febre aftosa e de encefalomielite enteroviral dos suínos (doença de Teschen), não tendo sido efetuada durante esse período de 12 meses qualquer vacinação contra essas doenças; e b) os troféus de caça ou outras preparações descritos no presente certificado: i) foram obtidos de animais abatidos nesse território, aprovado para a exportação para a União Europeia de carne fresca das espécies domésticas sensíveis correspondentes, no qual, durante os últimos 60 dias, não vigoraram restrições em matéria de saúde animal devido a focos de doenças a que os suínos são sensíveis, e ii) foram obtidos de animais abatidos a, pelo menos, 20 km de distância das fronteiras de outro país terceiro ou parte de país terceiro não autorizado a exportar troféus de caça não tratados de suínos selvagens para a União Europeia.] (2) quer [II.1. No que diz respeito aos troféus de caça e outras preparações de solípedes, os troféus de caça ou outras preparações descritos no presente certificado foram obtidos de solípedes selvagens abatidos no território do país de exportação acima mencionado.] (2) quer [II.1. No que diz respeito aos troféus de caça ou outras preparações de aves de caça: a) (região) está indemne de gripe aviária de alta patogenicidade e de doença de Newcastle; e b) os troféus de caça ou outras preparações descritos no presente certificado foram obtidos de aves de caça selvagens abatidas nessa região, na qual durante os últimos 30 dias não vigoraram restrições em matéria de saúde animal devido a focos de doenças a que as aves selvagens são sensíveis.] II.2. Os troféus de caça ou outras preparações descritos no presente certificado foram embalados sem que tenham estado em contacto com outros produtos de origem animal suscetíveis de os contaminar, em embalagens individuais, transparentes e fechadas, a fim de evitar qualquer contaminação posterior. Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Troféus de caça ou outras preparações de aves e de ungulados, constituídos por partes inteiras não tratadas II. Informação sanitária II.a. Número de referência do certificado II.b. (2) [II.3. Os troféus de caça ou outras preparações descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casas I.11 e I.12: Número de aprovação: o número de registo do estabelecimento ou da unidade emitido pela autoridade competente. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.19: Utilizar o código SH adequado: 05.05; 05.06, 05.07, 05.11; 96.01 ou 97.05. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer uso que não o consumo animal. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Equidae, Tapiridae, Rhinoceritidae, Antilocaparidae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamindae, Moschidae, Suidae, Tayassuidae, Tragulidae e Elephantidae.  Texto de imagem
Texto de imagem
PAÍS Troféus de caça ou outras preparações de aves e de ungulados, constituídos por partes inteiras não tratadas II. Informação sanitária II.a. Número de referência do certificado II.b. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) JO L 147 de 31.5.2001, p. 1. (4) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: |
|
4) |
O capítulo 8 passa a ter a seguinte redação: «CAPÍTULO 8 Certificado sanitário Para subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2), destinados a expedição para ou a trânsito na (2) União Europeia 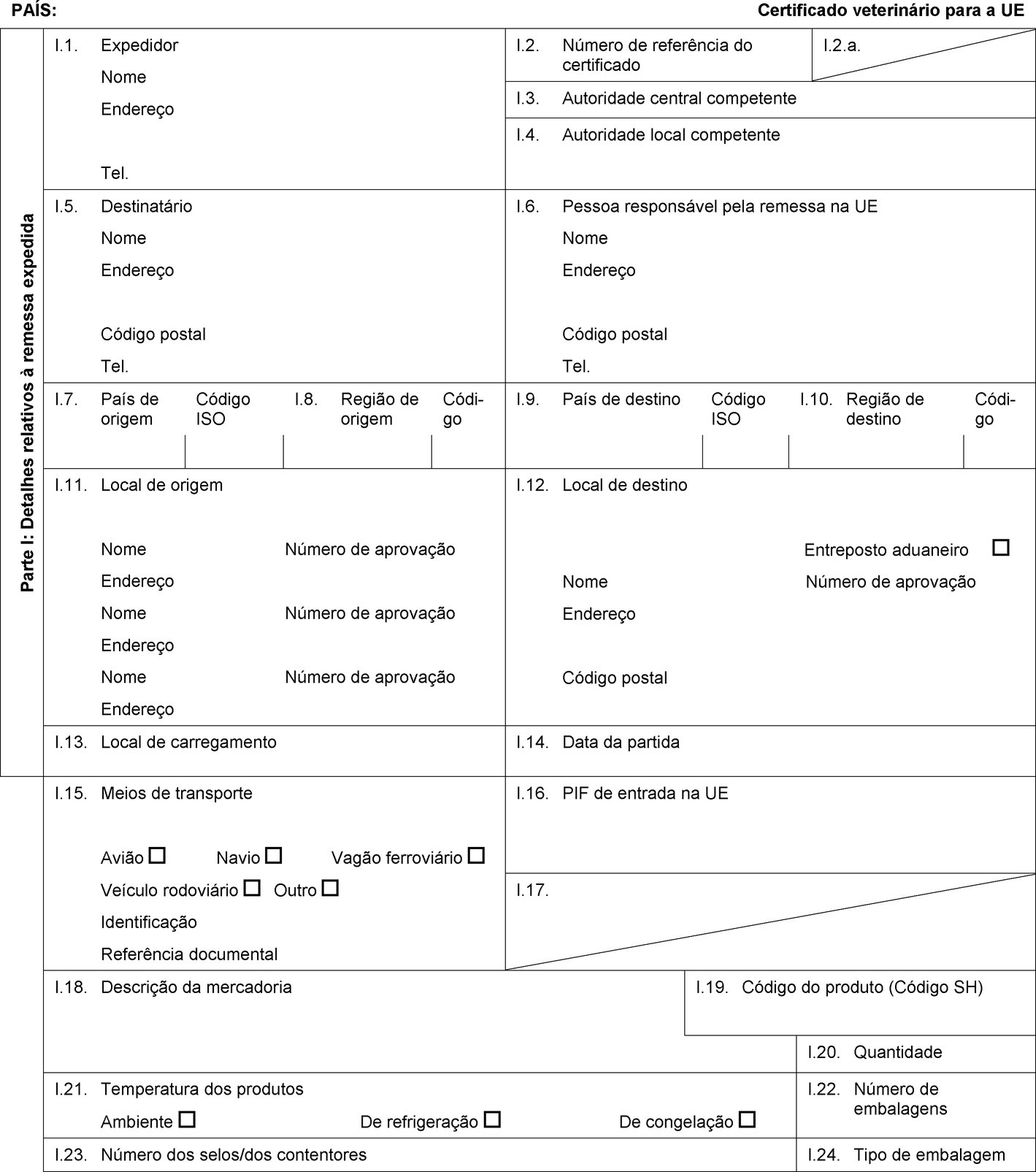 Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Número de embalagens Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2) II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a) e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que os subprodutos animais descritos no presente certificado: (2) quer [são amostras comerciais que consistem em subprodutos animais destinados a estudos ou análises especiais, como referido na definição de amostras comerciais no anexo I, ponto 39, do Regulamento (UE) n.o 142/2011 da Comissão, que ostentam o rótulo “AMOSTRA COMERCIAL NÃO DESTINADA AO CONSUMO HUMANO”;] (2) quer [satisfazem os requisitos de saúde animal estabelecidos no ponto II.1]; II.1. Os subprodutos animais descritos no presente certificado II.1.1. Foram (2) quer [a) obtidos de matérias importadas do país terceiro, território ou parte deste: (3) auto-rizado a exportar carne fresca para a União Europeia;] (2) e/quer [b) obtidos no país terceiro de exportação, território ou parte deste: (3) de ani-mais que quer: i) permaneceram nesse país terceiro, território ou parte deste elegível para exportar para a União Europeia carne fresca desde o nascimento ou, pelo menos, durante os três últimos meses antes da data do abate, e/ou ii) foram mortos no estado selvagem, nesse país terceiro, território ou parte deste (4);] (2) e/quer [c) são derivados de ovos, leite, roedores, lagomorfos ou animais aquáticos ou animais invertebrados aquáticos ou terrestres.] (2) [II.1.2. No caso de matérias que não são derivadas de ovos, leite, roedores, lagomorfos, suarda, animais aquáticos, animais invertebrados aquáticos ou terrestres e peles com pelo não transformadas, foram obtidas de animais: (2) quer [a) provenientes de explorações: i) em que, no que diz respeito às seguintes doenças a que os animais são sensíveis, não se verificou qualquer caso/foco de peste bovina, doença vesiculosa dos suínos, doença de Newcastle ou gripe aviária de alta patogenicidade durante os 30 dias anteriores, ou de peste suína clássica ou peste suína africana durante os 40 dias anteriores, nem nas explorações situadas nas suas proximidades, num raio de 10 km, durante os 30 dias anteriores, e ii) em que não se verificou qualquer caso/foco de febre aftosa durante os 60 dias anteriores, nem nas explorações situadas nas suas proximidades, num raio de 25 km, durante os 30 dias anteriores; e b) que: i) não foram abatidos a fim de erradicar qualquer doença epizoótica, ii) permaneceram nas suas explorações de origem durante um período de, pelo menos, 40 dias antes da data de partida e foram transportados diretamente para o matadouro, sem que tenham estado em contacto com outros animais não conformes com as mesmas condições sanitárias, iii) no matadouro, foram aprovados na inspeção sanitária ante mortem, realizada nas 24 horas anteriores ao abate, e não apresentavam indícios das doenças referidas supra, a que os animais sejam sensíveis, e iv) foram tratados no matadouro, antes e no momento do abate ou da occisão, em conformidade com as disposições pertinentes da legislação da União e cumpriam requisitos pelo menos equivalentes aos estabelecidos nos capítulos II e III do Regulamento (CE) n.o 1099/2009 do Conselho (5);] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2) II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [a) capturados e mortos no estado selvagem numa área: i) em que, num raio de 25 km, não se verificou qualquer caso/foco de qualquer uma das doenças seguintes, a que os animais são sensíveis: febre aftosa, peste bovina, doença de Newcastle e gripe aviária de alta patogenicidade durante os 30 dias anteriores, e de peste suína clássica ou peste suína africana durante os 40 dias anteriores, e ii) que se situe a uma distância superior a 20 km das fronteiras de outro território de um país terceiro ou de uma parte desse país, que não estejam autorizados nessas datas a exportar essas matérias para a União Europeia; e b) que, após o abate, foram transportados no prazo de 12 horas, para refrigeração, quer para um centro de recolha e imediatamente a seguir para um estabelecimento de caça, quer diretamente para um estabelecimento de caça.]] (2) [II.1.3. No caso de matérias que não matérias derivadas de peixes ou invertebrados capturados em meio selvagem, foram obtidas num estabelecimento em redor do qual, num raio de 10 km, não ocorreu qualquer caso/foco das doenças referidas no ponto II.1.2, a que os animais são sensíveis, durante os 30 dias anteriores ou, na eventualidade de um caso/foco de uma dessas doenças, em que a preparação das matérias-primas para exportação para a União Europeia foi autorizada apenas após a remoção de toda a carne e a limpeza e a desinfeção totais do estabelecimento, sob controlo de um veterinário oficial.] II.1.4. Foram obtidos e preparados sem que tenham estado em contacto com outras matérias não conformes com as condições exigidas supra e foram manuseados de modo a evitar a contaminação por agentes patogénicos. II.1.5. Foram embalados em embalagens novas que impedem quaisquer fugas ou em embalagens que foram limpas e desinfetadas antes de utilizadas e, no caso de remessas expedidas de outra forma que não por encomenda postal, em contentores selados sob a responsabilidade da autoridade competente, que ostentam rótulos com a menção “SUBPRODUTOS ANIMAIS EXCLUSIVAMENTE PARA O FABRICO DE PRODUTOS DERIVADOS PARA UTILIZAÇÕES FORA DA CADEIA ALIMENTAR ANIMAL”, bem como o nome e endereço do estabelecimento de destino na União Europeia. II.1.6. Consistem apenas nos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, que foram considerados próprios para consumo humano de acordo com a legislação da União, até que, por motivos comerciais, foram irreversivelmente declarados como subprodutos animais;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- subprodutos animais de aves de capoeira e lagomorfos, abatidos em explorações agrícolas nos termos do artigo 1.o, n.o 3, alínea d), do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho (2a), que não apresentavam quaisquer sinais de doença transmissível aos seres humanos ou aos animais;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;]  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2) II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de estabelecimentos ou instalações de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- peles com pelo originárias de animais mortos que não apresentavam sinais clínicos de qualquer doença transmissível através desse produto aos seres humanos ou aos animais.] II.1.7. Foram ultracongelados na unidade de origem ou preservados em conformidade com a legislação da União Europeia, de forma a evitar a deterioração entre o momento da expedição e o momento da entrega na unidade de destino. (2) (6) [II.1.8. (2) (7) quer [II.1.8.1. Os subprodutos animais da presente remessa são provenientes de animais obtidos no país, território ou parte deste referido no ponto II.1.1, em que se realizam regularmente programas de vacinação contra a febre aftosa, controlados oficialmente, nos bovinos domésticos.]]  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2) II. Informação sanitária II.a. Número de referência do certificado II.b. (2) (8) e/quer [II.1.8.2. Os subprodutos animais da presente remessa consistem em subprodutos animais derivados de miudezas ou carne desossada.]] (2) [II.1.9. Os subprodutos animais descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (9); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (10), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.1.10. Os subprodutos animais descritos no presente certificado (2) quer [não contêm leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm leite ou produtos à base de leite de origem ovina ou caprina e destinam-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico, iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico:  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2) II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.11: No caso de remessas para amostras comerciais ou análises: indicar apenas o nome e endereço do estabelecimento. — Casas I.11 e I.12: Número de aprovação: o número de registo do estabelecimento ou da unidade emitido pela autoridade competente. — Casa I.12: Local de destino: preencher esta casa: — produtos para o fabrico de produtos derivados para utilizações fora da cadeia alimentar animal: apenas se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros, — produtos para amostras comerciais ou análises: a unidade na União Europeia indicada na autorização da autoridade competente, se for caso disso. — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento na União Europeia, o expedidor deve informar o posto de inspeção fronteiriço do ponto de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 04.01; 04.02; 04.03; 04.04; 04.08; 05.05; 05.06, 05.07; 05.11.91; 05.11.99, 23.01 ou 30.01. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casa I.25: Para efeitos do presente certificado, “uso técnico” inclui a utilização como amostra comercial. — Casas I.26 e I.27: Exceto para amostras comerciais, que não são enviadas em trânsito, preencher em função de se tratar de um certificado de trânsito ou de importação. — Casa I.28: — produtos para o fabrico de produtos derivados para utilizações fora da cadeia alimentar animal: instalação de fabrico: indicar o número de controlo veterinário do estabelecimento aprovado, — produtos para estudos tecnológicos ou análises específicos: a unidade na União Europeia indicada na autorização da autoridade competente, se for caso disso, — Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea.  Texto de imagem
Texto de imagem
PAÍS Subprodutos animais a utilizar para fins fora da cadeia alimentar animal ou para amostras comerciais (2) II. Informação sanitária II.a. Número de referência do certificado II.b. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 139 de 30.4.2004, p. 55. (3) O nome e o número de código ISO do país de exportação, em conformidade com: — o anexo II, parte 1, do Regulamento (UE) n.o 206/2010 da Comissão (JO L 73 de 20.3.2010, p. 1), — o anexo I do Regulamento (CE) n.o 798/2008 da Comissão (JO L 226 de 23.8.2008, p. 1), e — o anexo I do Regulamento (CE) n.o 119/2009 da Comissão (JO L 39 de 10.2.2009, p. 12). Além disso, deve incluir-se, se for caso disso, o código ISO dos territórios e partes destes referidos nos anexos dos Regulamentos (UE) n.o 206/2010, (CE) n.o 798/2008 e (CE) n.o 119/2009 mencionados na presente nota (quando aplicável às espécies sensíveis em questão). (4) Apenas para países a partir dos quais seja autorizada a importação, para a União Europeia, de carne de caça destinada ao consumo humano, da mesma espécie animal. (5) JO L 303 de 18.11.2009, p. 1. (6) Garantias suplementares a fornecer quando as matérias provenientes de ruminantes domésticos forem originárias do território de um país da América do Sul ou da África Austral, ou de uma parte desses países, em que apenas a carne fresca desossada, submetida a maturação, de ruminantes domésticos para consumo humano esteja autorizada para exportação para a União Europeia. São também permitidos os músculos masséteres completos de bovinos, submetidos a incisão em conformidade com os requisitos do anexo I, secção IV, capítulo I, parte B, ponto 1, do Regulamento (CE) n.o 854/2004 do Parlamento Europeu e do Conselho (JO L 139 de 30.4.2004, p. 206). (7) Apenas para certos países da América do Sul. (8) Apenas para certos países da América do Sul e da África Austral. (9) JO L 147 de 31.5.2001, p. 1. (10) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: |
|
5) |
Os capítulos 10(A), 10(B), 11 e 12 passam a ter a seguinte redação: «CAPÍTULO 10(A) Certificado sanitário Para gorduras fundidas não destinadas ao consumo humano a utilizar como matérias para alimentação animal, destinadas a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Fabrico de alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Número de embalagens Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que as gorduras fundidas descritas no presente certificado: II.1. Consistem em gorduras fundidas que satisfazem os requisitos sanitários infra. II.2. Consistem em gorduras fundidas não destinadas ao consumo humano. II.3. Foram preparadas e armazenadas numa unidade aprovada e supervisionada pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009 ou em conformidade com o artigo 4.o, n.o 2, do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho (3), a fim de destruir os agentes patogénicos. II.4. Foram preparadas exclusivamente a partir dos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais.] II.5. (2) quer [- Em caso de matérias derivadas de suínos, são provenientes de um país ou de parte do território de um país indemne de febre aftosa nos últimos 24 meses e indemne de peste suína clássica e peste suína africana nos últimos 12 meses;] (2) e/quer [- em caso de matérias derivadas de aves de capoeira, são provenientes de um país ou de parte de um território de um país indemne da doença de Newcastle e de gripe aviária nos últimos 6 meses;] (2) e/quer [- em caso de matérias derivadas de ruminantes, são provenientes de um país ou de parte de um território de um país indemne de febre aftosa nos últimos 24 meses e indemne de peste bovina nos últimos 12 meses;] (2) e/quer [- caso tenha ocorrido um foco de uma das doenças mencionadas no ponto II.5 durante o período aí referido e caso as gorduras fundidas sejam derivadas de uma espécie sensível, foram submetidas a um tratamento térmico de pelo menos 70 °C durante 30 minutos ou de pelo menos 90 °C durante pelo menos 15 minutos, e os dados referentes aos pontos críticos de controlo são registados e mantidos de modo a que o proprietário, o operador ou seu representante e, se for caso disso, a autoridade competente, possam controlar o funcionamento das instalações; os dados a registar incluem a dimensão das partículas, a temperatura crítica e, quando necessário, o tempo absoluto, o perfil de pressão, o caudal de alimentação em matéria-prima e a taxa de reciclagem das gorduras.] II.6. Se derivarem de ruminantes, foram depuradas por forma a que as impurezas insolúveis totais presentes não representem mais de 0,15 % em peso. II.7. As gorduras fundidas: a) foram submetidas a processamento em conformidade com os requisitos do anexo X, capítulo II, secção 3, do Regulamento (UE) n.o 142/2011, ou a tratamento em conformidade com o anexo III, secção XII, do Regulamento (CE) n.o 853/2004, a fim de destruir os agentes patogénicos; e (2) quer [b) estão embaladas em contentores novos ou em contentores que tenham sido limpos e desinfetados, se necessário, para impedir a sua contaminação, tendo sido tomadas todas as precauções para evitar essa contaminação;] (2) quer [b) se se destinarem a ser transportadas a granel, os tubos, as bombas, as cisternas e os outros contentores para transporte a granel ou os camiões-cisterna utilizados para o transporte do produto a partir da instalação de fabrico, quer diretamente para o navio ou para cisternas de armazenamento em terra, quer diretamente para instalações, foram controlados sob a responsabilidade da autoridade competente e considerados limpos antes de serem utilizados;] e que ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO”.  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) [II.8. As gorduras fundidas descritas no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (4); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (5), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.9. As gorduras fundidas descritas no presente certificado (2) quer [não contêm leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm leite ou produtos à base de leite de origem ovina ou caprina e destinam-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico, iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico:  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.19: Utilizar o código SH adequado: 04.05; 15.01; 15.02; 15.03; 15.04; 15.05; 15.06; 15.16.10 ou 15.18. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo e de animais de companhia, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: — Espécie: selecionar entre as seguintes: Ruminantia, exceto Ruminantia — Instalação de fabrico: indicar o número de registo do estabelecimento de tratamento/processamento. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) JO L 139 de 30.4.2004, p. 55.  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar como matérias para alimentação animal II. Informação sanitária II.a. Número de referência do certificado II.b. (4) JO L 147 de 31.5.2001, p. 1. (5) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço da União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 10(B) Certificado sanitário Para gorduras fundidas não destinadas ao consumo humano a utilizar para certos fins fora da cadeia alimentar animal, destinadas a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie(designação científica) Instalação de fabrico Número de embalagens Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar para certos fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente os artigos 8.o, 9.o e 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que as gorduras fundidas descritas no presente certificado: II.1. Consistem em gorduras fundidas não destinadas ao consumo humano que satisfazem os requisitos sanitários infra. II.2. Foram preparadas exclusivamente a partir dos seguintes subprodutos animais: (2) [II.2.1. No caso de matérias destinadas à produção de combustíveis renováveis referidos no anexo IV, capítulo IV, secção 2, letra L, do Regulamento (UE) n.o 142/2011, de biodiesel ou de produtos oleoquímicos, os subprodutos animais referidos nos artigos 8.o, 9.o e 10.o do Regulamento (CE) n.o 1069/2009.] (2) [II.2.2. No caso de matérias destinadas à produção de combustíveis renováveis referidos no anexo IV, capítulo IV, secção 2, letra J, do Regulamento (UE) n.o 142/2011, as matérias foram preparadas exclusivamente a partir de subprodutos animais referidos nos artigos 9.o e 10.o do Regulamento (CE) n.o 1069/2009.] (2) [II.2.3. No caso de matérias destinadas a outros fins que não a produção de cosméticos, produtos farmacêuticos ou dispositivos médicos, as matérias foram preparadas exclusivamente a partir de: (2) quer [- subprodutos animais que contenham resíduos de substâncias autorizadas ou contaminantes que excedam os níveis permitidos, a que se refere o artigo 15.o, n.o 3, da Diretiva 96/23/CE do Conselho (2a);] (2) e/quer [- produtos de origem animal declarados impróprios para o consumo humano devido à presença de corpos estranhos nesses produtos;] (2) e/quer [- animais e partes de animais mortos, que não os referidos nos artigos 8.o e 10.o do Regulamento (CE) n.o 1069/2009, que não foram abatidos nem mortos para consumo humano, incluindo animais mortos para fins de controlo de doenças;] (2) e/quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar para certos fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- invertebrados aquáticos e terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- couros e peles, cascos, penas, lã, cornos, pelo e peles com pelo originários de animais mortos que não apresentavam quaisquer sinais de doença transmissível através desses produtos aos seres humanos ou aos animais;] (2) e/quer [- tecido adiposo de animais que não apresentavam quaisquer sinais de doença transmissível através dessa matéria aos seres humanos ou aos animais, abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem nos termos da legislação da União.]] (2) [II.2.4. No caso de matérias destinadas a outros fins que não a produção de fertilizantes orgânicos ou corretivos orgânicos do solo, cosméticos, produtos farmacêuticos ou dispositivos médicos: (2) quer [- matérias de risco especificadas tal como definidas no artigo 3.o, n.o 1, alínea g), do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (2b);] (2) e/quer [- corpos inteiros ou partes de animais mortos que, aquando da eliminação, contenham matérias de risco especificadas tal como definidas no artigo 3.o, n.o 1, alínea g), do Regulamento (CE) n.o 999/2001;] (2) e/quer [- subprodutos animais derivados de animais que foram submetidos a tratamento ilegal, na aceção do artigo 1.o, n.o 2, alínea d), da Diretiva 96/22/CE do Conselho (2a) ou do artigo 2.o, alínea b), da Diretiva 96/23/CE do Conselho;]  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar para certos fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- subprodutos animais que contenham resíduos de outras substâncias e contaminantes do ambiente enumerados no anexo I, grupo B, ponto 3, da Diretiva 96/23/CE, se esses resíduos excederem o limite permitido estabelecido pela legislação da União ou, na ausência desta, pela legislação do Estado-Membro de importação.]] II.3. As gorduras fundidas: a) foram submetidas a processamento em conformidade com o método (indicar o método de pro-cessamento), conforme estabelecido no anexo IV, capítulo III, do Regulamento (UE) n.o 142/2011, a fim de destruir os agentes patogénicos; b) foram marcadas antes da expedição para a União Europeia com tri-heptanoato de glicerol (GTH), de forma a atingir uma concentração mínima homogénea de pelo menos 250 mg de GTH por quilograma de gordura; c) no caso de gorduras fundidas provenientes de ruminantes, foi retirado o excesso de impurezas insolúveis acima de 0,15 % em peso; d) foram transportadas em condições que impedem a sua contaminação; e e) ostentam rótulos nas embalagens ou nos contentores com a menção “NÃO DESTINADO AO CONSUMO HUMANO OU ANIMAL”. (2) [II.4. No caso de matérias destinadas à produção de fertilizantes orgânicos, cosméticos, produtos farmacêuticos, dispositivos médicos ou corretivos orgânicos do solo, as gorduras fundidas descritas no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanente-mente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casas I.11 e I.12: Número de aprovação: o número de registo do estabelecimento ou da unidade emitido pela autoridade competente.  Texto de imagem
Texto de imagem
PAÍS Gorduras fundidas não destinadas ao consumo humano a utilizar para certos fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros, — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento na União Europeia, o expedidor deve informar o posto de inspeção fronteiriço do ponto de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 04.05; 15.01, 15.02; 15.03; 15.04; 15.05; 15.06; 15.16 ou 15.18. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo e de animais de companhia, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Ruminantia, exceto Ruminantia Instalação de fabrico: indicar o número de registo do estabelecimento de tratamento/processamento. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (2a) JO L 125 de 23.5.1996, p. 10. (2b) JO L 147 de 31.5.2001, p. 1. (2c) JO L 125 de 23.5.1996, p. 3. (3) JO L 147 de 31.5.2001, p. 1. (4) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 11 Certificado sanitário Para gelatina e colagénio não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Fabrico de alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Número de embalagens Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Gelatina e colagénio não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo I, e certifica que a gelatina/o colagénio (2) descrita(o) no presente certificado: II.1. Consiste em gelatina/colagénio (2) que satisfaz os requisitos sanitários infra. II.2. Consiste exclusivamente em gelatina/colagénio (2) não destinada(o) ao consumo humano. II.3. Foi preparada(o) e armazenada(o) numa unidade aprovada e supervisionada pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009, a fim de destruir os agentes patogénicos. II.4. Foi preparada(o) exclusivamente a partir dos seguintes subprodutos animais: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] II.5. A gelatina/O colagénio (2): a) foi acondicionada(o), embalada(o), armazenada(o) e transportada(o) em condições de higiene satisfatórias, tendo, em particular, o acondicionamento e a embalagem sido realizados numa sala destinada a esse efeito e utilizados apenas conservantes autorizados pela legislação da União. Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Gelatina e colagénio não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. Os invólucros e as embalagens que contenham gelatina/colagénio (2) ostentam a menção “GELATINA/COLAGÉNIO (2) ADEQUADA(O) AO CONSUMO ANIMAL”; e (2) quer [b) no caso da gelatina, foi produzida através de um processo que garante que as matérias não transformadas de categoria 3 são submetidas a um tratamento com um ácido ou uma base, seguido de um ou mais enxaguamentos, envolvendo o ajuste do pH, e extração por um ou vários aquecimentos sucessivos, seguidos de depuração por filtração e esterilização, a fim de destruir os agentes patogénicos.] (2) quer [b) no caso do colagénio, foi produzido através de um processo que garante que as matérias não transformadas de categoria 3 são submetidas a um tratamento que envolva a lavagem, o ajuste do pH utilizando um ácido ou uma base, seguindo-se um ou mais enxaguamentos, filtração e extrusão, a fim de destruir os agentes patogénicos.] (2) [II.6. No caso de gelatina/colagénio (2) proveniente de matérias que não couros e peles: (2) quer [deriva de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [deriva de bovinos, ovinos ou caprinos e não contém nem deriva de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.7. No caso de gelatina/colagénio (2) proveniente de matérias que não couros e peles descritos no presente certificado: (2) quer [não contém leite nem produtos à base de leite de origem ovina ou caprina ou não se destina à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contém leite ou produtos à base de leite de origem ovina ou caprina e destina-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico,  Texto de imagem
Texto de imagem
PAÍS Gelatina e colagénio não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico: (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros, — Casa I.15: Indicar o número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio). Em caso de descarregamento e recarregamento na União Europeia, o expedidor deve informar o posto de inspeção fronteiriço do ponto de entrada na União Europeia. — Casa I.19: Utilizar o código do Sistema Harmonizado (SH) adequado, nas seguintes rubricas: 35.03 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca.  Texto de imagem
Texto de imagem
PAÍS Gelatina e colagénio não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) JO L 147 de 31.5.2001, p. 1. (4) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: CAPÍTULO 12 Certificado sanitário Para proteínas hidrolisadas, fosfato dicálcico e fosfato tricálcico não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Alimentação animal Fabrico de alimentos para animais de companhia Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Natureza da mercadoria Instalação de fabrico Número de embalagens Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Proteínas hidrolisadas, fosfato dicálcico e fosfato tricálcico não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a), nomeadamente o artigo 10.o, e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo I, e certifica que as proteínas hidrolisadas/o fosfato dicálcico/o fosfato tricálcico (2) descritas/descrito no presente certificado: II.1. Consistem/Consiste em proteínas hidrolisadas/fosfato dicálcico/fosfato tricálcico (2) que satisfazem/satisfaz os requisitos sanitários infra. II.2. Consistem/Consiste exclusivamente em proteínas hidrolisadas/fosfato dicálcico/fosfato tricálcico (2) não des-tinadas/destinado ao consumo humano. II.3. Foram preparadas/Foi preparado e foram armazenadas/foi armazenado numa unidade aprovada e supervisionada pela autoridade competente, em conformidade com o artigo 24.o do Regulamento (CE) n.o 1069/2009, a fim de destruir os agentes patogénicos. II.4. Foram preparadas/Foi preparado exclusivamente a partir dos seguintes subprodutos animais: (2) quer [no caso de fosfato dicálcico derivado de ossos desengordurados, carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) quer [no caso de outras matérias: (2) quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;]] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso, iv) cerdas de suíno, v) penas;]] (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;]] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;]] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;]] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Proteínas hidrolisadas, fosfato dicálcico e fosfato tricálcico não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;]] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;]] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;]] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;]] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais.]] II.5. As proteínas hidrolisadas/O fosfato dicálcico/O fosfato tricálcico (2): a) foram acondicionadas/foi acondicionado e foram embaladas/foi embalado em embalagens que ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO”, e armazenadas/armazenado e transportadas/transportado em condições de higiene satisfatórias, tendo, em particular, o acondicionamento e a embalagem sido realizados numa sala destinada a esse efeito e utilizados apenas conservantes autorizados pela legislação da União; e (2) quer [b) no caso das proteínas hidrolisadas, foram produzidas através de um processo envolvendo as medidas adequadas para minimizar a contaminação das matérias-primas de categoria 3. No caso das proteínas hidrolisadas provenientes na sua totalidade ou em parte de couros ou peles de ruminantes, foram produzidas numa unidade de processamento dedicada exclusivamente à produção de proteínas hidrolisadas, com recurso a um processo que envolve a preparação das matérias-primas de categoria 3 através de salga, calagem e lavagem intensiva, seguida de: i) exposição das matérias a um pH superior a 11 durante mais de 3 horas a uma temperatura superior a 80 °C, seguida de um tratamento térmico a uma temperatura superior a 140 °C durante 30 minutos a mais de 3,6 bar, ou ii) exposição das matérias a um pH de 1 a 2, seguido de um pH superior a 11 e de um tratamento térmico a uma temperatura superior a 140 °C durante 30 minutos a 3 bar.] (2) quer [b) no caso do fosfato dicálcico, foi produzido através de um processo que: i) assegura que todas as matérias ósseas de categoria 3 são finamente trituradas e desengorduradas com água quente e tratadas com ácido clorídrico diluído (a uma concentração não inferior a 4 % e com um pH inferior a 1,5) durante um período de, pelo menos, dois dias, ii) seguido de um tratamento do licor fosfórico obtido com cal, do qual resulte um precipitado de fosfato dicálcico a um pH de 4 a 7, e  Texto de imagem
Texto de imagem
PAÍS Proteínas hidrolisadas, fosfato dicálcico e fosfato tricálcico não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. iii) finalmente, faça secar esse precipitado com ar, com uma temperatura de admissão de 65 °C a 325 °C e uma temperatura final entre 30 °C e 65 °C.] (2) quer [b) no caso do fosfato tricálcico, foi produzido através de um processo que garante: i) que todas as matérias ósseas de categoria 3 são finamente trituradas e desengorduradas em contracorrente com água quente (fragmentos de ossos com menos de 14 mm), ii) a cozedura contínua com vapor a 145 °C durante 30 minutos a 4 bar, iii) a separação do caldo de proteína da hidroxiapatite (fosfato tricálcico) por centrifugação, e iv) a granulação do fosfato tricálcico após secagem num leito fluidizado com ar a 200 °C.] (2) [II.6. As proteínas hidrolisadas/O fosfato dicálcico/O fosfato tricálcico (2) descritos no presente certificado: (2) quer [derivam/deriva de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam/deriva de bovinos, ovinos ou caprinos e não contêm/contém nem derivam/deriva de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] II.7. As proteínas hidrolisadas/O fosfato dicálcico/O fosfato tricálcico (2) descritos no presente certificado: (2) quer [não contêm/contém leite nem produtos à base de leite de origem ovina ou caprina ou não se destinam/destina à alimentação de animais de criação, à exceção de animais produtores de peles com pelo.] (2) quer [contêm/contém leite ou produtos à base de leite de origem ovina ou caprina e destinam-se/destina-se à alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e o leite ou os produtos à base de leite: a) provêm de ovinos e caprinos que permaneceram continuamente, desde o nascimento, num país em que são cumpridas as seguintes condições: i) o tremor epizoótico clássico é de notificação obrigatória, ii) está em funcionamento um sistema de sensibilização, vigilância e monitorização do tremor epizoótico clássico, iii) aplicam-se restrições oficiais às explorações de ovinos ou caprinos em caso de suspeita de EET ou de confirmação do tremor epizoótico clássico,  Texto de imagem
Texto de imagem
PAÍS Proteínas hidrolisadas, fosfato dicálcico e fosfato tricálcico não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. iv) os ovinos e caprinos afetados com tremor epizoótico clássico são mortos e destruídos, v) a alimentação de animais das espécies ovina e caprina com farinhas de carne e de ossos ou torresmos, tal como definidos no Código Sanitário para os Animais Terrestres da Organização Mundial da Saúde Animal (OIE), provenientes de ruminantes, foi proibida, tendo essa proibição sido aplicada de forma eficaz em todo o território do país, durante pelo menos os últimos sete anos; b) provêm de explorações que não estão sujeitas a restrições oficiais devido a uma suspeita de EET; c) provêm de explorações nas quais nenhum caso de tremor epizoótico clássico foi diagnosticado durante os últimos sete anos, ou, após a confirmação de um caso de tremor epizoótico clássico: (2) quer [todos os ovinos e caprinos da exploração foram mortos e destruídos ou abatidos, com exceção dos carneiros reprodutores do genótipo ARR/ARR, das fêmeas reprodutoras portadoras de pelo menos um alelo ARR e sem alelo VRQ e outros ovinos portadores de pelo menos um alelo ARR;] (2) quer [todos os animais em que o tremor epizoótico clássico foi confirmado foram mortos e destruídos, e a exploração esteve sujeita, pelo menos durante dois anos desde a data de confirmação do último caso de tremor epizoótico clássico, a uma vigilância reforçada das EET, incluindo a realização de testes com resultados negativos para detetar a presença de EET, em conformidade com os métodos laboratoriais enunciados no anexo X, capítulo C, ponto 3.2, do Regulamento (CE) n.o 999/2001, em todos os seguintes animais com mais de 18 meses, exceto ovinos com o genótipo ARR/ARR: — animais abatidos para consumo humano, e — animais que morreram ou foram mortos na exploração, mas que não foram mortos no âmbito de uma campanha de erradicação de uma doença.]] Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento. — Casa I.19: Utilizar o código SH adequado: 05.08, 28.35.25; 28.35.26, 29.22; 35.02; 35.03 ou 35.04. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer utilização para além da alimentação de animais de criação, à exceção de animais produtores de peles com pelo, e a produção ou fabrico de alimentos para animais de companhia. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: — Espécie: selecionar entre as seguintes: Aves, Ruminantia, Suidae, Mammalia exceto Ruminantia ou Suidae, Pesca, Mollusca, Crustacea, invertebrados exceto Mollusca e Crustacea.  Texto de imagem
Texto de imagem
PAÍS Proteínas hidrolisadas, fosfato dicálcico e fosfato tricálcico não destinados ao consumo humano a utilizar como matérias para alimentação animal ou para fins fora da cadeia alimentar animal II. Informação sanitária II.a. Número de referência do certificado II.b. — Natureza da mercadoria: especificar se se trata de proteínas hidrolisadas, fosfato dicálcico ou fosfato tricálcico. — Instalação de fabrico: indicar o número de registo do estabelecimento de tratamento/processamento. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) JO L 147 de 31.5.2001, p. 1. (4) JO L 94 de 1.4.2006, p. 28. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: |
|
6) |
O capítulo 18 passa a ter a seguinte redação: «CAPÍTULO 18 Certificado sanitário Para chifres e produtos à base de chifres, com exclusão da farinha de chifres, e cascos e produtos à base de cascos, com exclusão da farinha de cascos, destinados à produção de fertilizantes orgânicos ou corretivos orgânicos do solo, destinados a expedição para ou a trânsito na (2) União Europeia  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. Número(s) CITES I.18. Descrição da mercadoria I.19. Código do produto (Código SH) 05.07 I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Transformação Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Chifres e produtos à base de chifres, com exclusão da farinha de chifres, e cascos e produtos à base de cascos, com exclusão da farinha de cascos, destinados à produção de fertilizantes orgânicos ou corretivos orgânicos do solo II. Informação sanitária II.a. Número de referência do certificado II.b. O veterinário oficial abaixo assinado declara que leu e compreendeu o Regulamento (CE) n.o 1069/2009 do Parlamento Europeu e do Conselho (1a) e o Regulamento (UE) n.o 142/2011 da Comissão (1b), nomeadamente o anexo XIV, capítulo II, e certifica que os chifres e produtos à base de chifres, com exclusão da farinha de chifres, e os cascos e produtos à base de cascos, com exclusão da farinha de cascos (2), descritos no presente certificado II.1. provêm de animais (2) quer [que foram abatidos num matadouro, depois de submetidos a uma inspeção ante mortem da qual resultou que estão aptos para abate para consumo humano;] (2) quer [que não apresentavam sinais clínicos de qualquer doença transmissível através desses produtos aos seres humanos ou aos animais.] II.2. Os chifres, os produtos à base de chifres, os cascos e os produtos à base de cascos devem ter sido submetidos a um tratamento térmico durante uma hora a uma temperatura central de, pelo menos, 80 °C. II.3. Os chifres devem ter sido removidos sem se ter procedido à abertura da cavidade craniana. II.4. Em qualquer uma das fases de processamento, armazenagem ou transporte, foram tomadas todas as precauções necessárias para evitar a contaminação cruzada. II.5. Os chifres e produtos à base de chifres, com exclusão da farinha de chifres, e os cascos e produtos à base de cascos, com exclusão da farinha de cascos, foram embalados: (2) quer [em embalagens ou recipientes novos;] (2) quer [em veículos ou contentores para transporte a granel desinfetados antes do carregamento com um produto aprovado pela autoridade competente;] e a embalagem ou os contentores estão marcados por forma a indicar o tipo de subproduto animal (3) e ostentam rótulos com a menção “NÃO DESTINADO AO CONSUMO HUMANO OU ANIMAL” e o nome e endereço do estabelecimento de destino. (2) [II.6. Os chifres e produtos à base de chifres, com exclusão da farinha de chifres, e os cascos e produtos à base de cascos, com exclusão da farinha de cascos, descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.]] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (4); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (5), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Chifres e produtos à base de chifres, com exclusão da farinha de chifres, e cascos e produtos à base de cascos, com exclusão da farinha de cascos, destinados à produção de fertilizantes orgânicos ou corretivos orgânicos do solo II. Informação sanitária II.a. Número de referência do certificado II.b. Notas Parte I: — Casa I.6: Pessoa responsável pela remessa na União Europeia: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito através da União Europeia; pode ser preenchida se o certificado for para uma mercadoria a importar na União Europeia. — Casas I.11 e I.12: Número de aprovação: o número de registo do estabelecimento ou da unidade emitido pela autoridade competente. — Casa I.12: Local de destino: esta casa só deve ser preenchida se se tratar de um certificado para uma mercadoria em trânsito. Os produtos em trânsito só podem ser armazenados em zonas francas, entrepostos francos e entrepostos aduaneiros. — Casa I.15: Número de registo/matrícula (carruagens ferroviárias ou contentores e camiões), número do voo (avião) ou nome (navio); devem ser fornecidas informações em caso de descarregamento e recarregamento na União Europeia. — Casa I.23: No caso de contentores para transporte a granel, incluir o número do contentor e o número do selo (se aplicável). — Casa I.25: Uso técnico: qualquer uso que não o consumo animal. — Casas I.26 e I.27: Preencher consoante se tratar de um certificado de trânsito ou de importação. — Casa I.28: Natureza da mercadoria. Parte II: (1a) JO L 300 de 14.11.2009, p. 1. (1b) JO L 54 de 26.2.2011, p. 1. (2) Riscar o que não interessa. (3) Tipo de produto: chifres, produtos à base de chifres, cascos e produtos à base de cascos. (4) JO L 147 de 31.5.2001, p. 1. (5) JO L 172 de 30.6.2007, p. 84. — A assinatura e o carimbo devem ser de cor diferente da dos carateres impressos. — Nota para a pessoa responsável pela remessa na União Europeia: o presente certificado só é válido para efeitos veterinários, devendo acompanhar a remessa até ao posto de inspeção fronteiriço do ponto de entrada na União Europeia. Veterinário oficial/Inspetor oficial Nome (em maiúsculas): Cargo e título: Data: Assinatura: Carimbo: |
|
7) |
O capítulo 20 passa a ter a seguinte redação: «CAPÍTULO 20 Modelo de declaração Declaração para a importação a partir de países terceiros e para o trânsito (2) através da União Europeia de produtos intermédios a utilizar no fabrico de medicamentos, medicamentos veterinários, dispositivos médicos para fins médicos e veterinários, dispositivos medicinais implantáveis ativos, dispositivos médicos de diagnóstico in vitro para fins médicos e veterinários, reagentes de laboratório e produtos cosméticos  Texto de imagem
Texto de imagem
PAÍS: Certificado veterinário para a UE Parte I: Detalhes relativos à remessa expedida I.1. Expedidor Nome Endereço Tel. I.2. Número de referência do certificado I.2.a. I.3. Autoridade central competente I.4. Autoridade local competente I.5. Destinatário Nome Endereço Código postal Tel. I.6. Pessoa responsável pela remessa na UE Nome Endereço Código postal Tel. I.7. País de origem Código ISO I.8. Região de origem Códi-go I.9. País de destino Código ISO I.10. Região de destino Códi-go I.11. Local de origem Nome Número de aprovação Endereço Nome Número de aprovação Endereço Nome Número de aprovação Endereço I.12. Local de destino Entreposto aduaneiro Nome Número de aprovação Endereço Código postal I.13. Local de carregamento I.14. Data da partida I.15. Meios de transporte Avião Navio Vagão ferroviário Veículo rodoviário Outro Identificação Referência documental I.16. PIF de entrada na UE I.17. I.18. Descrição da mercadoria I.19. Código do produto (Código SH) I.20. Quantidade I.21. Temperatura dos produtos Ambiente De refrigeração De congelação I.22. Número de embalagens I.23. Número dos selos/dos contentores I.24. Tipo de embalagem  Texto de imagem
Texto de imagem
I.25. Mercadorias certificadas para Uso técnico I.26. Para trânsito através da UE para um país terceiro País terceiro Código ISO I.27. Para importação ou admissão na UE I.28. Identificação das mercadorias Número de aprovação dos estabelecimentos Espécie (designação científica) Instalação de fabrico Peso líquido Número do lote  Texto de imagem
Texto de imagem
PAÍS Produtos intermédios a utilizar no fabrico de medicamentos, medicamentos veterinários, dispositivos médicos para fins médicos e veterinários, dispositivos medicinais implantáveis ativos, dispositivos médicos de diagnóstico in vitro para fins médicos e veterinários, reagentes de laboratório e produtos cosméticos II. Informação sanitária II.a. Número de referência do certificado II.b. DECLARAÇÃO O abaixo assinado declara que o produto intermédio referido no presente certificado se destina a ser por si importado para a União Europeia ou a nela transitar e está em conformidade com a definição de produto intermédio estabelecida no anexo I, ponto 35, do Regulamento (UE) n.o 142/2011 da Comissão (1a), nomeadamente que: (1) se destina ao fabrico de: (2) quer [- medicamentos,] (2) e/quer [- medicamentos veterinários,] (2) e/quer [- dispositivos médicos para fins médicos e veterinários,] (2) e/quer [- dispositivos medicinais implantáveis ativos,] (2) e/quer [- dispositivos médicos de diagnóstico in vitro para fins médicos e veterinários,] (2) e/quer [- reagentes de laboratório,] (2) e/quer [- produtos cosméticos;] (2) as suas fases de conceção, transformação e fabrico foram suficientemente completadas de modo a qualificar o material diretamente ou como componente de um produto destinado a esse fim, embora necessite de fabrico ou transformação adicionais, tais como mistura, revestimento, montagem ou embalagem, por forma a garantir a sua adequação para colocação no mercado ou em serviço como medicamento, medicamento veterinário, dispositivo médico para fins médicos e veterinários, dispositivo medicinal implantável ativo, dispositivo médico de diagnóstico in vitro para fins médicos e veterinários ou produto cosmético, em conformidade com a legislação da União Europeia (1b) aplicável a esses produtos, ou como reagente de laboratório; (3) foi obtido a partir de: (2) quer [- matérias que podem ser provenientes de animais que foram submetidos a tratamento ilegal, na aceção do artigo 1.o, n.o 2, alínea d), da Diretiva 96/22/CE do Conselho (2a) ou do artigo 2.o, alínea b), da Diretiva 96/23/CE do Conselho (2b);] (2) e/quer [- carcaças e partes de animais abatidos ou, no caso da caça, corpos e partes de animais mortos, próprios para consumo humano de acordo com a legislação da União, mas que, por motivos comerciais, não se destinem ao consumo humano;] (2) e/quer [- carcaças e as seguintes partes provenientes de animais abatidos num matadouro e considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem, ou corpos e as seguintes partes de animais de caça mortos para consumo humano em conformidade com a legislação da União: i) carcaças ou corpos e partes de animais rejeitados como impróprios para consumo humano em conformidade com a legislação da União, mas que não apresentavam quaisquer sinais de doença transmissível a seres humanos ou animais, ii) cabeças de aves de capoeira, iii) couros e peles, incluindo aparas e fragmentos, cornos e pés, incluindo as falanges e os ossos do carpo e metacarpo, do tarso e metatarso de animais que não ruminantes, iv) cerdas de suíno, v) penas;] Parte II: Certificação  Texto de imagem
Texto de imagem
PAÍS Produtos intermédios a utilizar no fabrico de medicamentos, medicamentos veterinários, dispositivos médicos para fins médicos e veterinários, dispositivos medicinais implantáveis ativos, dispositivos médicos de diagnóstico in vitro para fins médicos e veterinários, reagentes de laboratório e produtos cosméticos II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- sangue de animais que não apresentavam quaisquer sinais de doença transmissível através do sangue aos seres humanos ou aos animais, obtido de animais que não ruminantes abatidos num matadouro após terem sido considerados aptos para abate para consumo humano no seguimento de uma inspeção ante mortem em conformidade com a legislação da União;] (2) e/quer [- subprodutos animais resultantes do fabrico de produtos destinados ao consumo humano, incluindo ossos desengordurados, torresmos e lamas de centrifugação ou de separação resultantes da transformação do leite;] (2) e/quer [- produtos de origem animal ou géneros alimentícios que contenham produtos de origem animal, que já não se destinem ao consumo humano por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- alimentos para animais de companhia e alimentos para animais de origem animal, ou alimentos para animais que contenham subprodutos animais ou produtos derivados, que já não se destinem à alimentação de animais por razões comerciais ou devido a problemas de fabrico, defeitos de empacotamento ou outros defeitos dos quais não advenha nenhum risco para a saúde pública ou animal;] (2) e/quer [- sangue, placenta, lã, penas, pelo, chifres, cascos e leite cru provenientes de animais vivos que não apresentavam sinais de qualquer doença transmissível através desse produto aos seres humanos ou aos animais;] (2) e/quer [- animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doenças transmissíveis aos seres humanos ou aos animais;] (2) e/quer [- subprodutos animais de animais aquáticos provenientes de instalações ou estabelecimentos de fabrico de produtos destinados ao consumo humano;] (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), e de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do Regulamento (CE) n.o 1069/2009;] (2) e/quer [- produtos derivados de ou gerados por: — animais aquáticos, e partes desses animais, exceto mamíferos marinhos, que não apresentavam quaisquer sinais de doença transmissível aos seres humanos ou aos animais, — invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais, — animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), e de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do Regulamento (CE) n.o 1069/2009;]  Texto de imagem
Texto de imagem
PAÍS Produtos intermédios a utilizar no fabrico de medicamentos, medicamentos veterinários, dispositivos médicos para fins médicos e veterinários, dispositivos medicinais implantáveis ativos, dispositivos médicos de diagnóstico in vitro para fins médicos e veterinários, reagentes de laboratório e produtos cosméticos II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- animais e partes de animais, que não os referidos no artigo 8.o ou no artigo 10.o do Regulamento (CE) n.o 1069/2009, i) mortos, mas não abatidos ou mortos para consumo humano, incluindo animais mortos para fins de controlo de doenças, ii) fetos, iii) oócitos, embriões e sémen que não se destinem a reprodução, e iv) aves mortas antes da eclosão;] (2) e/quer [- subprodutos animais, com exceção de matérias de categoria 1 ou matérias de categoria 3;] (4) a embalagem exterior ostenta um rótulo com a menção “DESTINADO EXCLUSIVAMENTE A MEDICAMENTOS / MEDICAMENTOS VETERINÁRIOS / DISPOSITIVOS MÉDICOS PARA FINS MÉDICOS E VETERINÁRIOS / DISPOSITIVOS MEDICINAIS IMPLANTÁVEIS ATIVOS / DISPOSITIVOS MÉDICOS DE DIAGNÓSTICO IN VITRO PARA FINS MÉDICOS E VETERINÁRIOS / REAGENTES DE LABORATÓRIO / PRODUTOS COSMÉTICOS” e o produto não se destina a ser utilizado, em fase alguma, dentro da União Europeia para outros fins; (5) a remessa será transportada diretamente para o local de destino na União Europeia indicado no ponto I.12 da presente declaração, sendo este (2) quer [um estabelecimento ou uma instalação destinados ao fabrico de medicamentos, medicamentos veterinários, dispositivos médicos para fins médicos e veterinários, dispositivos medicinais implantáveis ativos, dispositivos médicos de diagnóstico in vitro para fins médicos e veterinários, reagentes de laboratório ou produtos cosméticos, registados em conformidade com o artigo 23.o do Regulamento (CE) n.o 1069/2009;] (2) quer [um estabelecimento ou uma instalação aprovados em conformidade com o artigo 24.o, n.o 1, alínea i), do Regulamento (CE) n.o 1069/2009, de onde só pode ser expedida para um estabelecimento ou uma instalação referidos no anterior travessão.] Notas — Casa I.19: utilizar o código adequado do Sistema Harmonizado (SH) em conformidade com a Decisão 2007/275/CE da Comissão, de 17 de abril de 2007, relativa às listas de animais e produtos que devem ser sujeitos a controlos nos postos de inspeção fronteiriços em conformidade com as Diretivas 91/496/CEE e 97/78/CE do Conselho (JO L 116 de 4.5.2007, p. 9). — Casa I.25: Uso técnico: qualquer uso que não o consumo animal. (1a) JO L 54 de 26.2.2011, p. 1. (1b) Diretiva 2001/82/CE do Parlamento Europeu e do Conselho, de 6 de novembro de 2001, que estabelece um código comunitário relativo aos medicamentos veterinários (JO L 311 de 28.11.2001, p. 1), Diretiva 2001/83/CE do Parlamento Europeu e do Conselho, de 6 de novembro de 2001, que estabelece um código comunitário relativo aos medicamentos para uso humano (JO L 311 de 28.11.2001, p. 67), Diretiva 93/42/CEE do Conselho, de 14 de junho de 1993, relativa aos dispositivos médicos (JO L 169 de 12.7.1993, p. 1), Diretiva 98/79/CE do Parlamento Europeu e do Conselho, de 27 de outubro de 1998, relativa aos dispositivos médicos de diagnóstico in vitro (JO L 331 de 7.12.1998, p. 1) e Regulamento (CE) n.o 1223/2009 do Parlamento Europeu e do Conselho, de 30 de novembro de 2009, relativo aos produtos cosméticos (JO L 342 de 22.12.2009, p. 59), conforme adequado. (2) Riscar o que não interessa. (2a) JO L 125 de 23.5.1996, p. 3. (2b) JO L 125 de 23.5.1996, p. 10. O importador Nome (em maiúsculas): Endereço: Data: Assinatura: |