ANEXO III
PREPARAÇÃO DAS AMOSTRAS E REQUISITOS RESPEITANTES AOS MÉTODOS DE ANÁLISE UTILIZADOS NO CONTROLO DOS TEORES DE DIOXINAS (PCDD/F) E PCB SOB A FORMA DE DIOXINA EM DETERMINADOS GÉNEROS ALIMENTÍCIOS
1. ÂMBITO DE APLICAÇÃO
Os requisitos expostos no presente anexo devem ser aplicados quando se analisam géneros alimentícios para efeitos de controlo oficial dos teores de dibenzo-p-dioxinas policloradas e dibenzofuranos policlorados (PCDD/F) substituídos nas posições 2, 3, 7 e 8, e de bifenilos policlorados (PCB) sob a forma de dioxina, bem como no que se refere à preparação das amostras e aos requisitos analíticos para outros fins regulamentares, incluindo os controlos efetuados pelos operadores das empresas do setor alimentar para assegurar a conformidade com o disposto no artigo 4.o do Regulamento (CE) n.o 852/2004.
A monitorização da presença de PCDD/F e PCB sob a forma de dioxina nos géneros alimentícios pode ser realizada com dois tipos diferentes de métodos analíticos:
a) Métodos de pré-seleção
O objetivo dos métodos de pré-seleção é selecionar as amostras com teores de PCDD/F e PCB sob a forma de dioxina que excedam os teores máximos, ou os níveis de ação. Os métodos de pré-seleção devem assegurar uma elevada capacidade de processamento de amostras com uma boa relação custo-eficácia, aumentando assim a oportunidade de descobrir novos incidentes em que a elevada exposição pode originar riscos para a saúde dos consumidores. A sua aplicação deverá ter como objetivo evitar falsos resultados conformes. Podem incluir métodos bioanalíticos e métodos GC/MS.
Os métodos de pré-seleção comparam o resultado analítico com um valor-limite, fornecendo uma decisão de tipo sim/não sobre a eventual superação do teor máximo ou do nível de ação. É necessário que a concentração de PCDD/F e a soma de PCDD/F e de PCB sob a forma de dioxina em amostras suspeitas de não conformidade com o teor máximo seja determinada ou confirmada por um método de confirmação.
Além disso, os métodos de pré-seleção podem fornecer uma indicação dos teores de PCDD/F e de PCB sob a forma de dioxina presentes na amostra. Em caso de aplicação de métodos bioanalíticos de pré-seleção, o resultado é expresso em equivalentes bioanalíticos (BEQ) enquanto que em caso de aplicação de métodos físico-químicos GC-MS, o mesmo é expresso em equivalentes tóxicos (TEQ). Os resultados dos métodos de pré-seleção indicados numericamente são adequados para a demonstração da conformidade ou da suspeita de não conformidade ou da superação dos níveis de ação e fornecem uma indicação da gama de teores em caso de acompanhamento através de métodos de confirmação. Estes métodos não são adequados para fins como a avaliação dos níveis de base, a estimativa da ingestão, o seguimento das tendências ao longo do tempo dos teores ou a reavaliação dos níveis de ação e dos teores máximos.
b) Métodos de confirmação
Os métodos de confirmação permitem a identificação e a quantificação inequívocas de PCDD/F e PCB sob a forma de dioxina presentes numa amostra, e fornecem informações exaustivas com base nos congéneres. Por conseguinte, estes métodos permitem o controlo dos teores máximos e dos níveis de ação, incluindo a confirmação de resultados obtidos por métodos de pré-seleção. Além disso, os resultados podem ser utilizados para outros fins, como é o caso da determinação de níveis de base reduzidos na monitorização dos alimentos, o seguimento das tendências ao longo do tempo, a avaliação da exposição da população e a criação de uma base de dados para uma eventual reavaliação dos níveis de ação e dos teores máximos. São também importantes para o estabelecimento de padrões de congéneres com vista a identificar a fonte de uma eventual contaminação. Tais métodos utilizam GC-HRMS. Para confirmar a conformidade ou não conformidade com o teor máximo, também se pode utilizar a GC-MS/MS.
2. CONTEXTO
Para o cálculo de concentrações de TEQ, as concentrações de cada substância numa determinada amostra são multiplicadas pelos respetivos FET, definidos pela Organização Mundial de Saúde e enumerados no apêndice do presente anexo, sendo subsequentemente somadas para darem a concentração total de compostos sob a forma de dioxina expressos em TEQ.
Os métodos de pré-seleção e de confirmação apenas podem ser aplicados para o controlo de uma determinada matriz se os métodos forem suficientemente sensíveis para detetar de modo fiável o teor máximo ou o nível de ação.
3. REQUISITOS DE GARANTIA DA QUALIDADE
|
— |
Devem ser tomadas medidas para evitar a contaminação cruzada em cada etapa do procedimento de amostragem e de análise. |
|
— |
As amostras devem ser conservadas e transportadas em recipientes de vidro, alumínio, polipropileno ou polietileno, adequados para o armazenamento sem qualquer influência nos níveis de PCDD/F e PCB sob a forma de dioxina das amostras. Devem ser removidos do recipiente da amostra os vestígios de poeiras de papel. |
|
— |
O armazenamento e o transporte das amostras têm de ser realizados de modo a manter a integridade da amostra de alimentos. |
|
— |
Desde que relevante, triturar finamente e misturar cuidadosamente cada amostra de laboratório, mediante um processo relativamente ao qual se tenha demonstrado que possibilita uma homogeneização completa (por exemplo, trituração que permita passar por um crivo de 1 mm); as amostras devem ser exsicadas antes da trituração, caso o teor em humidade seja demasiado elevado. |
|
— |
É de importância geral o controlo dos reagentes, do material de vidro e do equipamento relativamente a uma possível influência nos resultados baseados em TEQ ou em BEQ. |
|
— |
Deve ser efetuada uma análise em branco através da realização de todo o procedimento analítico, excetuando apenas a presença da amostra. |
|
— |
Para os métodos bioanalíticos, é de grande importância que todo o material de vidro e solventes utilizados na análise sejam testados para verificar se estão livres de compostos que interfiram com a deteção de compostos-alvo na gama de trabalho. O material de vidro deve ser enxaguado com solventes ou/e aquecido a temperaturas adequadas para remover da sua superfície vestígios de PCDD/F, de compostos sob a forma de dioxina e de compostos interferentes. |
|
— |
A quantidade de amostra utilizada para a extração deve ser suficiente para cumprir os requisitos relativos a uma gama de trabalho suficientemente baixa, incluindo as concentrações dos teores máximos ou dos níveis de ação. |
|
— |
Os procedimentos específicos de preparação de amostras utilizados para os produtos em causa devem seguir orientações aceites internacionalmente. |
|
— |
No caso dos peixes, a pele tem de ser removida, dado que o teor máximo é aplicável à parte comestível sem pele. Contudo, é necessário que todos os restos da parte comestível e do tecido adiposo do lado interno da pele sejam cuidadosamente raspados e completamente separados da pele e sejam adicionados à amostra a analisar. |
4. REQUISITOS APLICÁVEIS AOS LABORATÓRIOS
|
— |
Em conformidade com o disposto no Regulamento (CE) n.o 882/2004, os laboratórios devem ser acreditados por um organismo reconhecido que opere em conformidade com o Guia ISO 58, a fim de assegurar que aplicam a garantia de qualidade analítica. Os laboratórios devem ser acreditados em conformidade com a norma EN ISO/IEC/17025. Devem seguir-se, quando aplicáveis, os princípios descritos nas orientações técnicas relativas à estimativa da incerteza de medição e dos limites de quantificação para a análise de PCDD/F e PCB (1). |
|
— |
A competência de um laboratório é comprovada mediante uma participação contínua e bem-sucedida em estudos interlaboratoriais para a determinação de PCDD/F e de PCB sob a forma de dioxina nas matrizes alimentares e nas gamas de concentrações relevantes. |
|
— |
Os laboratórios que aplicam métodos de pré-seleção para o controlo de rotina de amostras devem estabelecer uma estreita cooperação com os laboratórios que aplicam o método de confirmação, tanto para o controlo da qualidade como para a confirmação do resultado analítico das amostras suspeitas. |
5. REQUISITOS BÁSICOS A CUMPRIR PELO PROCEDIMENTO ANALÍTICO PARA DETERMINAÇÃO DE DIOXINAS (PCDD/F) E DE PCB SOB A FORMA DE DIOXINA
5.1. Gama de trabalho e limites de quantificação reduzidos
|
— |
Para os PCDD/F, as quantidades detetáveis devem situar-se na gama alta dos femtogramas (10– 15 g) devido à extrema toxicidade de alguns destes compostos. Para a maioria das congéneres de PCB, o limite de quantificação na gama dos nanogramas (10– 9 g) já é suficiente. No entanto, para a medição dos congéneres de PCB sob a forma de dioxina mais tóxicos (designadamente, os congéneres não-orto substituídos), o limite inferior da gama de trabalho deve atingir os valores inferiores dos picogramas (10– 12 g). |
5.2. Seletividade (especificidade) elevada
|
— |
É necessário estabelecer uma distinção entre PCDD/F e PCB sob a forma de dioxina e inúmeros compostos coextraídos e eventualmente interferentes, que estão presentes em concentrações que podem atingir várias ordens de grandeza superiores às dos analitos requeridos. Nos métodos de cromatografia gasosa/espetrometria de massa (GC-MS), é necessária uma diferenciação entre vários congéneres, nomeadamente entre congéneres tóxicos (por exemplo, os dezassete PCDD/F substituídos nas posições 2,3,7 e 8 e os doze PCB sob a forma de dioxina) e outros congéneres. |
|
— |
Os métodos bioanalíticos devem ser capazes de detetar os compostos-alvo como a soma de PCDD/F e/ou de PCB sob a forma de dioxina. A limpeza (clean-up) das amostras destina-se a remover compostos conducentes a falsos resultados não conformes ou compostos que possam diminuir a resposta, provocando falsos resultados conformes. |
5.3. Exatidão elevada (rigor e precisão, recuperação aparente do bioensaio)
|
— |
Para os métodos GC-MS, a determinação deve fornecer uma estimativa válida da verdadeira concentração numa amostra. É necessária uma exatidão elevada (exatidão da medição: proximidade da concordância entre o resultado de uma medição e o valor verdadeiro ou que se presume verdadeiro da grandeza medida) por forma a evitar a rejeição do resultado da análise de uma amostra com base na reduzida fiabilidade do valor TEQ determinado. A exatidão é expressa em termos de rigor (diferença entre o valor médio medido para um analito num material certificado e o respetivo valor certificado, expresso em percentagem deste valor) e de precisão (RSDR, desvio-padrão relativo, calculado a partir de resultados obtidos em condições de reprodutibilidade). |
|
— |
Para métodos bioanalíticos, deve ser determinada a recuperação aparente do bioensaio. |
5.4. Validação na gama do teor máximo e medidas gerais de controlo de qualidade
|
— |
Os laboratórios devem demonstrar o desempenho de um método na gama do teor máximo (por exemplo, 0,5 vezes, 1 vez e 2 vezes o teor máximo) com um coeficiente de variação aceitável para análises repetidas, durante o processo de validação e/ou durante a análise de rotina. |
|
— |
Os controlos regulares com ensaios em branco, com amostras enriquecidas ou análises de amostras de controlo (de preferência, se disponível, material de referência certificado) devem ser realizados como medidas internas de controlo da qualidade. Devem registar-se e verificar-se os gráficos de controlo de qualidade (CQ) para ensaios em branco, com amostras enriquecidas ou análises de amostras de controlo, a fim de garantir que o desempenho analítico está em conformidade com os requisitos. |
5.5. Limite de quantificação
|
— |
Para o método bioanalítico de pré-seleção, o estabelecimento do LOQ não é um requisito indispensável, mas deve provar-se que o método é capaz de distinguir entre o valor do branco e o valor-limite. Quando se transmite um valor BEQ, deve ser estabelecido um nível de notificação para lidar com as amostras com uma resposta abaixo desse nível. Deve demonstrar-se que o nível de notificação é diferente, pelo menos por um fator de três, das amostras em branco do procedimento com uma resposta inferior à gama de trabalho. Por conseguinte, deve ser calculado a partir das amostras que contenham os compostos-alvo próximos do teor mínimo exigido, e não a partir de um rácio S/R ou um ensaio em branco. |
|
— |
O limite de quantificação (LOQ) de um método de confirmação deve ser de cerca de um quinto do teor máximo. |
5.6. Critérios analíticos
|
— |
Para obter resultados fiáveis a partir dos métodos de confirmação ou de pré-seleção, devem ser satisfeitos os seguintes critérios na gama do teor máximo, para o valor TEQ ou o valor BEQ, quer determinado como valor TEQ total ou valor BEQ total (como a soma de PCDD/F e PCB sob a forma de dioxina) quer separadamente para PCDD/F e PCB sob a forma de dioxina. |
|
|
Pré-seleção com métodos bioanalíticos ou físico-químicos |
Métodos de confirmação |
|
Taxa de falsos resultados conformes (*1) |
< 5 % |
|
|
Rigor |
|
– 20 % a + 20 % |
|
Repetibilidade (RSDr) |
< 20 % |
|
|
Precisão intermédia (RSDR) |
< 25 % |
< 15 % |
5.7. Requisitos específicos para métodos de pré-seleção
|
— |
Para a pré-seleção tanto podem ser utilizados métodos bioanalíticos como GC-MS. Para os métodos GC-MS devem ser utilizados os requisitos descritos no ponto 6. Para os métodos bioanalíticos baseados em células, os requisitos específicos estão descritos no ponto 7. |
|
— |
Os laboratórios que aplicam métodos de pré-seleção para o controlo de rotina de amostras devem estabelecer uma estreita cooperação com os laboratórios que aplicam o método de confirmação. |
|
— |
A verificação do desempenho do método de pré-seleção é necessária durante a análise de rotina, por controlo da qualidade analítica e validação contínua do método. Deve existir um programa contínuo para o controlo dos resultados conformes. |
|
— |
Controlo da eventual supressão da resposta das células e da citotoxicidade. 20 % dos extratos de amostras devem ser medidos em pré-seleção de rotina com e sem adição de TCDD, correspondente ao teor máximo ou ao nível de ação, a fim de verificar se a resposta é eventualmente suprimida por substâncias interferentes presentes no extrato da amostra. A concentração medida da amostra enriquecida é comparada com a soma da concentração do extrato não enriquecido mais a concentração do enriquecimento. Se esta concentração medida for inferior à (soma da) concentração calculada em mais do que 25 %, tal é uma indicação de uma potencial supressão do sinal e a respetiva amostra deve ser submetida a análise de confirmação. Os resultados devem ser monitorizados através de gráficos de controlo de qualidade. |
|
— |
Controlo da qualidade de amostras conformes Aproximadamente 2 % a 10 % das amostras conformes, dependendo da matriz da amostra e da experiência do laboratório, devem ser confirmadas. |
|
— |
Determinação das taxas de falsos resultados conformes a partir de dados de controlo de qualidade A taxa de falsos resultados conformes obtidos na pré-seleção de amostras abaixo e acima do teor máximo ou do nível de ação deve ser determinada. As taxas reais de falsos resultados conformes devem ser inferiores a 5 %. Logo que o controlo de qualidade das amostras conformes revele, pelo menos, 20 resultados confirmados por matriz/grupo de matrizes, devem ser retiradas conclusões sobre a taxa de falsos resultados conformes a partir dessa base de dados. Os resultados das amostras analisadas em ensaios interlaboratoriais ou durante incidentes de contaminação, abrangendo uma gama de concentrações que pode atingir, por exemplo, duas vezes o teor máximo (TM), também podem ser incluídos no mínimo de 20 resultados para a avaliação da taxa de falsos resultados conformes. As amostras devem abranger os padrões de congéneres mais frequentes, que representem diferentes fontes. Embora os testes de pré-seleção devam, de preferência, ter como objetivo a deteção de amostras que excedem o nível de ação, o critério para determinar as taxas de falsos resultados conformes é o teor máximo, tendo em conta a incerteza de medição do método de confirmação. |
|
— |
Os resultados potencialmente não conformes na pré-seleção devem ser sempre verificados por uma reanálise completa da amostra inicial por um método de confirmação. Estas amostras podem também servir para avaliar a taxa de falsos resultados não conformes. Para os métodos de pré-seleção, a taxa de «falsos resultados não conformes» é a fração dos resultados conformes que foram confirmados por análises de confirmação, quando na pré-seleção realizada anteriormente a amostra tinha sido declarada suspeita de ser não conforme. No entanto, a avaliação da vantagem do método de pré-seleção deve basear-se na comparação das amostras com falsos resultados não conformes com o número total de amostras verificadas. Esta taxa deve ser suficientemente baixa para tornar vantajoso o uso do instrumento de pré-seleção. |
|
— |
Pelo menos nas condições de validação, os métodos bioanalíticos devem fornecer uma indicação válida do valor TEQ, calculado e expresso em BEQ. |
|
— |
Também em relação aos métodos bioanalíticos levados a cabo em condições de repetibilidade, a RSDr intralaboratorial devia tipicamente ser inferior à reprodutibilidade RSDR. |
6. REQUISITOS ESPECÍFICOS APLICÁVEIS AOS MÉTODOS GC-MS USADOS PARA FINS DE PRÉ-SELEÇÃO OU DE CONFIRMAÇÃO
6.1. Diferenças aceitáveis entre teores TEQ-OMS relativos ao limite superior e ao limite inferior
|
— |
A diferença entre os limites superior e inferior não deve ultrapassar 20 % para a confirmação da superação do teor máximo ou, em caso de necessidade, dos níveis de ação. |
6.2. Controlo das recuperações
|
— |
Logo no início do método analítico, por exemplo antes da extração, deve proceder-se à adição de padrões internos de PCDD/F marcados com 13C e substituídos com cloro nas posições 2,3,7 e 8 e de padrões internos de PCB sob a forma de dioxina marcados com 13C, por forma a validar o procedimento analítico. Deve ser adicionado, pelo menos, um congénere para cada grupo homólogo de PCDD/F tetra a octo-clorado e, pelo menos, um congénere para cada grupo homólogo de PCB sob a forma de dioxina (alternativamente, deve ser utilizado para o controlo de PCDD/F e de PCB sob a forma de dioxina, pelo menos, um congénere para cada função de registo de iões selecionados por espetrometria de massa). No caso dos métodos de confirmação, deve utilizar-se a totalidade dos 17 padrões internos de PCDD/F substituídos nas posições 2,3,7 e 8 e marcados com 13C e a totalidade dos 12 padrões internos de PCB sob a forma de dioxina marcados com 13C. |
|
— |
Também devem ser determinados fatores de resposta relativos no caso dos congéneres para os quais não se adiciona um composto análogo marcado com 13C, através da utilização de soluções de calibração adequadas. |
|
— |
Em relação aos géneros alimentícios de origem vegetal e aos géneros alimentícios de origem animal que contenham menos de 10 % de gorduras, a adição de padrões internos é obrigatória antes da extração. Em relação aos géneros alimentícios de origem animal que contenham mais de 10 % de gorduras, os padrões internos podem ser adicionados antes ou após a extração de gorduras. Deve ser efetuada uma validação adequada da eficácia da extração, dependendo da fase em que são introduzidos os padrões internos e de os resultados serem notificados com base no produto ou nas gorduras. |
|
— |
Antes da análise por GC-MS, devem ser adicionados 1 ou 2 padrões de recuperação (substitutos). |
|
— |
É necessário efetuar um controlo da recuperação. Para os métodos de confirmação, as recuperações de cada padrão interno devem situar-se na gama de 60 a 120 %. São aceitáveis recuperações inferiores ou superiores para congéneres individuais, nomeadamente para algumas dibenzo-p-dioxinas e alguns dibenzofuranos hepta- e octo-clorados, desde que a sua contribuição para o valor TEQ não exceda 10 % do valor TEQ total (com base na soma de PCDD/F e PCB sob a forma de dioxina). Para os métodos de pré-selecção GC-MS, as recuperações devem situar-se na gama de 30 a 140 %. |
6.3. Remoção de substâncias interferentes
|
— |
Deve proceder-se à separação entre PCDD/F e compostos clorados interferentes, tais como PCB não semelhantes a dioxina e éteres difenílicos clorados, através de técnicas cromatográficas adequadas (de preferência, com uma coluna de florisil, alumina e/ou carbono). |
|
— |
É suficiente a separação de isómeros por cromatografia gasosa (< 25 % de pico a pico entre 1,2,3,4,7,8-HxCDF e 1,2,3,6,7,8-HxCDF). |
6.4. Calibração com curva padrão
|
— |
A gama da curva de calibração deve abranger a gama relevante dos teores máximos ou dos níveis de ação. |
6.5. Critérios específicos para métodos de confirmação
|
— |
Para GC-HRMS:
|
|
— |
Para GC-MS/MS:
|
7. REQUISITOS ESPECÍFICOS PARA MÉTODOS BIOANALÍTICOS
Os métodos bioanalíticos são métodos baseados na utilização de princípios biológicos, como ensaios com células, ensaios com recetores ou imunoensaios. O presente ponto estabelece requisitos para os métodos bioanalíticos em geral.
Um método de pré-seleção, em princípio, classifica uma amostra como conforme ou suspeita de ser não conforme. Para tal, o valor BEQ calculado é comparado com o valor-limite (ver ponto 7.3). As amostras abaixo do valor-limite são declaradas conformes, as amostras iguais ou acima do valor-limite são declaradas suspeitas de ser não conformes e necessitam de uma análise por um método de confirmação. Na prática, um valor BEQ correspondente a dois terços do teor máximo pode servir como valor-limite, desde que se assegure uma taxa de falsos resultados conformes inferior a 5 % e uma taxa aceitável de falsos resultados não conformes. Com teores máximos distintos para os PCDD/F e para a soma dos PCDD/F e dos PCB sob a forma de dioxina, a verificação da conformidade das amostras sem fracionamento requer valores-limite de bioensaio adequados para os PCDD/F. Para a verificação de amostras que excedam os níveis de ação, o valor-limite poderia ser uma percentagem adequada do respetivo nível de ação.
Se um teor indicativo for expresso em BEQ, os resultados da amostra devem ser dados na gama de trabalho e excedendo o limite de notificação (ver pontos 7.1.1 e 7.1.6).
7.1. Avaliação da resposta ao teste
7.1.1. Requisitos gerais
|
— |
Ao calcular as concentrações a partir de uma curva de calibração da TCDD, os valores na extremidade superior da curva apresentam uma grande variação [coeficiente de variação (CV) elevado]. A gama de trabalho é a área em que este CV é inferior a 15 %. A extremidade inferior da gama de trabalho (limite de notificação) deve ainda ser estabelecida num nível significativamente superior (pelo menos, por um fator de três) ao dos ensaios em branco do procedimento. A extremidade superior da gama de trabalho é geralmente representada pelo valor EC70 (70 % da concentração efetiva máxima), mas deve ser inferior caso o CV seja superior a 15 % nesta gama. A gama de trabalho é estabelecida durante a validação. Os valores-limite (ver ponto 7.3) devem situar-se dentro da gama de trabalho. |
|
— |
As soluções-padrão e os extratos de amostras devem ser testados em triplicado ou, pelo menos, em duplicado. No caso de utilização de duplicados, uma solução-padrão ou um extrato-testemunha testado em quatro a seis cavidades repartidas ao longo da placa deve produzir uma resposta ou concentração (apenas possível na gama de trabalho) com base numa CV < 15 %. |
7.1.2. Calibração
7.1.2.1. Calibração com curva padrão
|
— |
Os teores nas amostras podem ser estimados por comparação da resposta ao teste com uma curva de calibração da TCDD (ou do PCB 126 ou de uma mistura-padrão de PCDD/F/PCB sob a forma de dioxina) para calcular o valor BEQ no extrato e, posteriormente, na amostra. |
|
— |
As curvas de calibração devem conter oito a 12 concentrações (pelo menos em duplicado), com concentrações suficientes na parte inferior da curva (gama de trabalho). Será dada especial atenção à qualidade de ajustamento da curva na gama de trabalho. Como tal, o valor R2 tem pouco ou nenhum valor para estimar a adequação do ajustamento em regressão não linear. Um melhor ajustamento será alcançado através de uma redução da diferença entre os teores calculados e os teores observados na gama de trabalho da curva (por exemplo, minimizando a soma dos quadrados dos desvios). |
|
— |
O teor estimado no extrato de amostra é posteriormente corrigido em função do valor BEQ calculado para uma amostra em branco de matriz ou solvente (para ter em conta as impurezas provenientes dos solventes e dos produtos químicos utilizados) e da recuperação aparente (calculada a partir do valor BEQ de amostras de referência adequadas com padrões de congéneres representativos próximos do teor máximo ou do nível de ação). Para a correção da recuperação, a recuperação aparente deve sempre situar-se dentro dos limites da gama exigida (ver ponto 7.1.4). As amostras de referência utilizadas para a correção da recuperação devem cumprir os requisitos indicados no ponto 7.2. |
7.1.2.2. Calibração com amostras de referência
Em alternativa, pode utilizar-se uma curva de calibração preparada a partir de, pelo menos, quatro amostras de referência (ver ponto 7.2): um ensaio em branco da matriz e três amostras de referência com 0,5 vezes, uma vez e duas vezes o teor máximo ou o nível de ação, eliminando a necessidade de correção em função do ensaio em branco e da recuperação se as propriedades da matriz das amostras de referência corresponderem às das amostras com teor desconhecido. Neste caso, a resposta do teste correspondente a dois terços do teor máximo (ver ponto 7.3) pode ser calculada diretamente a partir destas amostras e servir de valor-limite. Para a verificação de amostras que excedam os níveis de ação, o valor-limite poderia ser uma percentagem adequada destes níveis de ação.
7.1.3. Determinação em separado de PCDD/F e PCB sob a forma de dioxina
Os extratos podem ser divididos em frações contendo PCDD/F e PCB sob a forma de dioxina, permitindo uma indicação separada de valores TEQ (em BEQ) de PCDD/F e de PCB sob a forma de dioxina. Convém utilizar, de preferência, uma curva de calibração-padrão do PCB 126 para avaliar os resultados da fração que contém PCB sob a forma de dioxina.
7.1.4. Recuperações aparentes do bioensaio
A «recuperação aparente do bioensaio» deve ser calculada a partir de amostras de referência adequadas com padrões de congéneres representativos próximos do teor máximo ou do nível de ação e expressa em percentagem do valor BEQ em comparação com o valor TEQ. Em função do tipo de ensaio e dos FET utilizados (2), as diferenças entre os fatores FET e REP relativos aos PCB sob a forma de dioxina podem causar recuperações aparentes baixas para os PCB sob a forma de dioxina em comparação com os PCDD/F. Por conseguinte, no caso de uma determinação em separado de PCDD/F e de PCB sob a forma de dioxina, as recuperações aparentes do bioensaio devem ser: para os PCB sob a forma de dioxina, de 20 % a 60 %, para os PCDD/F, de 50 % a 130 % (as gamas aplicam-se à curva de calibração de TCDD). Como o contributo dos PCB sob a forma de dioxina para a soma de PCDD/F e PCB sob a forma de dioxina pode variar entre diferentes matrizes e amostras, as recuperações aparentes do bioensaio para o parâmetro da soma refletem estas gamas e devem situar-se entre 30 % e 130 %.
7.1.5. Controlo das recuperações para a limpeza (clean-up)
A perda de compostos durante a limpeza (clean-up) deve ser verificada durante a validação. Uma amostra em branco enriquecida com uma mistura dos diferentes congéneres deve ser submetida a limpeza (clean-up) (pelo menos, n = 3) e a recuperação e a variabilidade verificadas por um método de confirmação. A recuperação deve situar-se entre 60 % e 120 %, em especial para congéneres que contribuam mais de 10 % para o valor TEQ em várias misturas.
7.1.6. Limite de notificação
Ao notificar valores BEQ, deve ser determinado um limite de notificação a partir de amostras de matriz pertinentes que envolvam padrões de congéneres típicos, mas não a partir da curva de calibração dos padrões, devido à baixa precisão na gama inferior da curva. Devem ser tidos em conta os efeitos da extração e da limpeza (clean-up). O limite de notificação deve ser estabelecido significativamente acima (pelo menos por um fator de três) do valor dos ensaios em branco do procedimento.
7.2. Utilização de amostras de referência
|
— |
As amostras de referência representam a matriz da amostra, os padrões de congéneres e as gamas de concentrações dos PCDD/F e dos PCB sob a forma de dioxina próximos do teor máximo ou do nível de ação. |
|
— |
Cada série de testes deve comportar um ensaio em branco do procedimento, ou de preferência um ensaio em branco da matriz, bem como uma amostra de referência com o teor máximo ou o nível de ação. Estas amostras devem ser extraídas e testadas ao mesmo tempo e em condições idênticas. A amostra de referência deve apresentar uma resposta claramente elevada em comparação com a amostra em branco e, por conseguinte, assegurar a adequação do teste. Essas amostras podem servir para as correções em função do ensaio em branco e da recuperação. |
|
— |
As amostras de referência escolhidas para efetuar uma correção em função da recuperação devem ser representativas das amostras de ensaio, o que significa que os padrões de congéneres não devem conduzir a uma subestimação dos teores. |
|
— |
Podem incluir-se amostras de referência suplementares com teores, por exemplo, de 0,5 vezes e 2 vezes o teor máximo ou o nível de ação, para demonstrar o desempenho correto do teste dentro da gama requerida para o controlo do teor máximo ou do nível de ação. Combinadas, estas amostras podem servir para calcular os valores BEQ em amostras de ensaio (ver ponto 7.1.2.2). |
7.3. Determinação de valores-limite
A relação entre os resultados bioanalíticos em BEQ e os resultados dos métodos de confirmação em TEQ deve ser estabelecida [por exemplo, através de experiências de calibração ajustadas em função da matriz, envolvendo amostras de referência enriquecidas a 0, 0,5 vezes, 1 vez e 2 vezes o teor máximo (TM), com seis repetições em cada nível (n = 24)]. Os fatores de correção (branco e recuperação) podem ser estimados a partir desta relação, mas devem ser verificados em cada série de testes ao incluir ensaios em branco do procedimento/da matriz e amostras de recuperação (ver ponto 7.2).
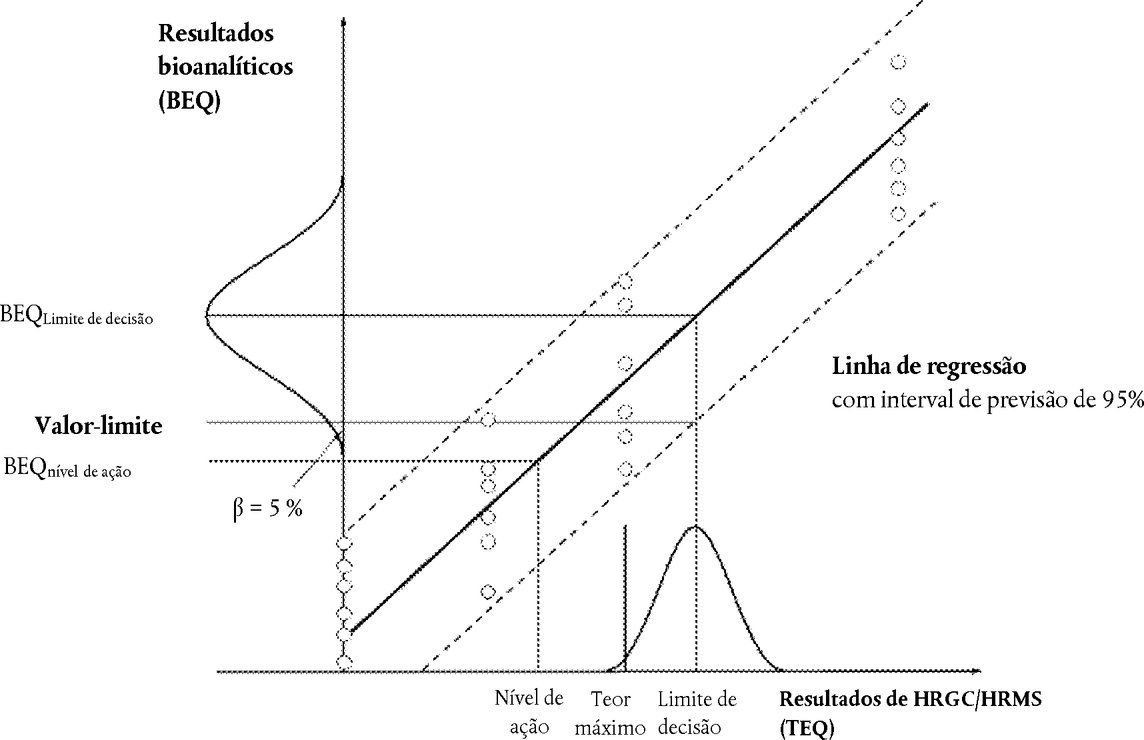
Devem ser estabelecidos valores-limite para decidir da conformidade da amostra com teores máximos ou para verificar se os níveis de ação, se relevantes, estão conformes aos respetivos teores máximos ou níveis de ação fixados tanto para os PCDD/F e os PCB sob a forma de dioxina, isoladamente, como para a soma dos PCDD/F e dos PCB sob a forma de dioxina. São representados pela extremidade inferior da distribuição dos resultados bioanalíticos (corrigidos em função do ensaio em branco e da recuperação) correspondendo ao limite de decisão do método de confirmação com base num nível de confiança de 95 %, o que implica uma taxa de falsos resultados conformes < 5 %, e uma RSDR < 25 %. O limite de decisão do método de confirmação é o teor máximo, tendo em conta a incerteza expandida de medição.
Na prática, o valor-limite (em BEQ) pode ser calculado a partir das seguintes abordagens (ver figura 1):
7.3.1. Utilização da faixa inferior do intervalo de previsão de 95 % no limite de decisão do método de confirmação
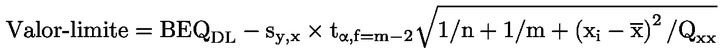
em que:
|
BEQDL |
BEQ correspondente ao limite de decisão do método de confirmação, trata-se do TM, tendo em conta a incerteza expandida de medição |
|
sy,x |
desvio-padrão residual |
|
t α,f = m – 2 |
fator de Student (α = 5 %, f = graus de liberdade, unilateral) |
|
m |
número total de pontos de calibração (índice j) |
|
n |
número de repetições para cada teor |
|
xi |
concentração da amostra (em TEQ) do ponto de calibração I, determinado por um método de confirmação |
|
|
média das concentrações (em TEQ) de todas as amostras de calibração |
 parâmetro do quadrado da soma
parâmetro do quadrado da soma
|
i |
= |
índice do ponto de calibração i |
7.3.2. Cálculo a partir dos resultados bioanalíticos (corrigidos em função do ensaio em branco e da recuperação) de múltiplas análises de amostras (n≥ 6), contaminadas no limite de decisão do método de confirmação, como a extremidade inferior da distribuição dos dados no valor BEQ médio correspondente:
Valor-limite = BEQDL – 1,64 × SDR
em que:
|
SDR |
desvio-padrão dos resultados do bioensaio no BEQDL, medidos em condições de reprodutibilidade intralaboratorial |
7.3.3. Cálculo como o valor médio dos resultados bioanalíticos (em BEQ, corrigido em função do ensaio em branco e da recuperação) a partir de análises múltiplas de amostras (n≥ 6) contaminadas a dois terços do teor máximo ou do nível de ação. Tal baseia-se na observação de que esse teor estará próximo do valor-limite determinado em conformidade com o ponto 7.3.1 ou 7.3.2.
Cálculo dos valores-limite com base num nível de confiança de 95 %, o que implica uma taxa de falsos resultados conformes < 5 %, e uma RSDR < 25 %:
|
1. |
a partir da faixa inferior do intervalo de previsão de 95 % no limite de decisão do método de confirmação, |
|
2. |
a partir de análises múltiplas de amostras (n≥ 6) contaminadas no limite de decisão do método de confirmação como a extremidade inferior da distribuição dos dados (representados na figura por uma curva em forma de sino) no valor BEQ médio correspondente. |
Figura 1
7.3.4. Restrições aos valores-limite
Os valores-limite baseados no valor BEQ, calculados a partir da RSDR obtida durante a validação utilizando um número limitado de amostras com matrizes/padrões de congéneres diferentes, podem ser superiores aos teores máximos ou aos níveis de ação baseados no valor TEQ, devido a uma melhor precisão do que a que é possível em análises de rotina quando tem de ser controlado um espetro desconhecido de possíveis padrões de congéneres. Em tais casos, os valores-limite devem ser calculados a partir de uma RSDR = 25 %, ou, de preferência, a dois terços do teor máximo ou do nível de ação.
7.4. Características de desempenho
|
— |
Uma vez que não se podem utilizar padrões internos nos métodos bioanalíticos, devem ser realizados testes de repetibilidade para se obter informações sobre o desvio-padrão numa série de testes e entre séries de testes. A repetibilidade deve ser inferior a 20 % e a reprodutibilidade intralaboratorial inferior a 25 %. Tal deve basear-se nos valores calculados em BEQ após correção em função do ensaio em branco e da recuperação. |
|
— |
Como parte do processo de validação, o teste deve demonstrar que discrimina entre uma amostra em branco e um teor no valor-limite, permitindo a identificação de amostras acima do valor-limite correspondente (ver ponto 7.1.2). |
|
— |
Devem ser definidos os compostos-alvo, as possíveis interferências e os teores máximos toleráveis para a amostra em branco. |
|
— |
O desvio-padrão percentual na resposta ou concentração calculada a partir da resposta (apenas possível na gama de trabalho) de uma determinação em triplicado de um extrato da amostra não deve ser superior a 15 %. |
|
— |
Os resultados não corrigidos das amostras de referência expressos em BEQ (ensaio em branco e teor máximo ou nível de ação) devem ser utilizados para a avaliação do desempenho do método bioanalítico durante um período de tempo constante. |
|
— |
Devem registar-se e verificar-se os gráficos de controlo de qualidade (CQ) para ensaios em branco do procedimento e para cada tipo de amostra de referência, a fim de garantir que o desempenho analítico está em conformidade com os requisitos, nomeadamente no tocante aos ensaios em branco do procedimento, no que respeita à diferença mínima requerida em relação à extremidade inferior da gama de trabalho e, no tocante às amostras de referência, no que respeita à reprodutibilidade intralaboratorial. Os ensaios em branco do procedimento devem ser bem controlados, a fim de evitar falsos resultados conformes, quando subtraídos. |
|
— |
Os resultados dos métodos de confirmação de amostras suspeitas e 2 % a 10 % das amostras conformes (mínimo de 20 amostras por matriz) devem ser recolhidos e utilizados para avaliar o desempenho do método de pré-seleção e a relação entre BEQ e TEQ. Esta base de dados pode ser utilizada para efeitos de reavaliação dos valores-limite aplicáveis às amostras de rotina para as matrizes validadas. |
|
— |
Os bons desempenhos do método podem também ser demonstrados pela participação em ensaios interlaboratoriais. Os resultados de amostras analisadas em ensaios interlaboratoriais, abrangendo uma gama de concentrações que pode atingir, por exemplo, duas vezes o TM, também podem ser incluídos na avaliação da taxa de falsos resultados conformes, se um laboratório estiver em condições de demonstrar os seus bons desempenhos. As amostras devem abranger os padrões de congéneres mais frequentes, que representem diferentes fontes. |
|
— |
Em caso de incidentes, os valores-limite podem ser reavaliados, refletindo a matriz e os padrões de congéneres específicos para cada incidente. |
8. NOTIFICAÇÃO DOS RESULTADOS
Métodos de confirmação
|
— |
Os resultados analíticos devem conter os teores de cada congénere de PCDD/F e PCB sob a forma de dioxina e os valores TEQ devem ser notificados em termos de limite inferior, limite superior e limite médio, a fim de incluir o máximo de informações possível na notificação dos resultados e, deste modo, permitir a interpretação dos resultados de acordo com requisitos específicos. |
|
— |
O relatório deve também incluir o método utilizado para a extração dos PCDD/F, dos PCB sob a forma de dioxina e dos lípidos. O teor de lípidos da amostra deve ser determinado e notificado para as matrizes de alimentos com teores máximos expressos com base na gordura e com uma concentração esperada de gorduras na gama de 0 % – 2 % (em função da legislação em vigor). Para as outras amostras, a determinação do teor de lípidos é facultativa. |
|
— |
As recuperações de cada padrão interno devem ser disponibilizadas se as recuperações se situarem fora da gama mencionada no ponto 6.2, se o teor máximo for excedido (neste caso, as recuperações para uma das duas análises duplicadas) e noutros casos mediante pedido. |
|
— |
Como a incerteza expandida de medição deve ser tida em conta ao decidir da conformidade de uma amostra, este parâmetro deve igualmente ser disponibilizado. Assim, os resultados analíticos devem ser notificados enquanto x ± U, em que x é o resultado analítico e U é a incerteza expandida de medição, utilizando um fator de expansão de 2, o que permite obter um nível de confiança de cerca de 95 %. No caso de uma determinação em separado dos PCDD/F e dos PCB sob a forma de dioxina, a soma da incerteza expandida estimada dos resultados analíticos separados dos PCDD/F e dos PCB sob a forma de dioxina tem de ser utilizada para a soma dos PCDD/F e dos PCB sob a forma de dioxina. |
|
— |
Os resultados devem ser expressos nas mesmas unidades e com o mesmo número de algarismos significativos que os teores máximos definidos no Regulamento (CE) n.o 1881/2006. |
Métodos bioanalíticos de pré-seleção
|
— |
O resultado da pré-seleção deve ser expresso como conforme ou suspeito de ser não conforme («suspeito»). |
|
— |
Além disso, pode ser dado um resultado indicativo de PCDD/F e/ou de PCB sob a forma de dioxina expresso em BEQ (não TEQ) (ver ponto 1). As amostras com uma resposta inferior ao limite de notificação devem ser indicadas como inferiores ao limite de notificação. As amostras com uma resposta acima da gama de trabalho devem ser indicadas como excedendo a gama de trabalho e o teor correspondente à extremidade superior da gama de trabalho deve ser dado em BEQ. |
|
— |
Para cada tipo de matriz da amostra, o relatório deve mencionar o teor máximo ou o nível de ação em que se baseia a avaliação. |
|
— |
O relatório deve mencionar o tipo de teste aplicado, o princípio de base do teste e o tipo de calibração. |
|
— |
O relatório deve também incluir o método utilizado para a extração dos PCDD/F, dos PCB sob a forma de dioxina e dos lípidos. O teor de lípidos da amostra deve ser determinado e notificado para as matrizes de alimentos com teores máximos expressos com base na gordura e com uma concentração esperada de gorduras na gama de 0 % – 2 % (em função da legislação em vigor). Para as outras amostras, a determinação do teor de lípidos é facultativa. |
|
— |
Em caso de amostras suspeitas de não conformidade, o relatório deve incluir uma nota sobre as medidas a adotar. A concentração de PCDD/F e a soma de PCDD/F e de PCB sob a forma de dioxina nas amostras com teores elevados tem de ser determinada/confirmada por um método de confirmação. |
|
— |
Os resultados não conformes só devem ser notificados a partir de análises de confirmação. |
Métodos físico-químicos de pré-seleção
|
— |
O resultado da pré-seleção deve ser expresso como conforme ou suspeito de ser não conforme («suspeito»). |
|
— |
Para cada tipo de matriz da amostra, o relatório deve mencionar o teor máximo ou o nível de ação em que se baseia a avaliação. |
|
— |
Além disso, podem ser indicados os teores de cada congénere de PCDD/F e PCB sob a forma de dioxina e os valores TEQ notificados em termos de limite inferior, limite superior e limite médio. Os resultados devem ser expressos nas mesmas unidades e com (pelo menos) o mesmo número de algarismos significativos que os teores máximos definidos no Regulamento (CE) n.o 1881/2006. |
|
— |
As recuperações de cada padrão interno devem ser disponibilizadas se se situarem fora da gama mencionada no ponto 6.2, e noutros casos mediante pedido. |
|
— |
O relatório deve mencionar o método GC-MS aplicado. |
|
— |
O relatório deve também incluir o método utilizado para a extração dos PCDD/F, dos PCB sob a forma de dioxina e dos lípidos. O teor de lípidos da amostra deve ser determinado e notificado para as matrizes de alimentos com teores máximos expressos com base na gordura e com uma concentração esperada de gorduras na gama de 0 % – 2 % (em função da legislação em vigor). Para as outras amostras, a determinação do teor de lípidos é facultativa. |
|
— |
Em caso de amostras suspeitas de não serem conformes, o relatório deve incluir uma nota sobre as medidas a adotar. A concentração de PCDD/F e a soma de PCDD/F e de PCB sob a forma de dioxina nas amostras com teores elevados tem de ser determinada/confirmada por um método de confirmação. |
|
— |
Só se pode decidir que existe incumprimento após a realização de análises de confirmação. |
(1) Documento de orientação sobre a incerteza de medição para laboratórios que efetuam análises de PCDD/F e PCB utilizando espetrometria de massa de diluição de isótopos (Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry) [ligação ao sítio Web], documento de orientação sobre a estimativa de LOD e LOQ para medições no domínio dos contaminantes nos géneros alimentícios e alimentos para animais (Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food) [ligação ao sítio Web].
(*1) No que diz respeito aos teores máximos.
(2) Os requisitos atuais baseiam-se nos FET publicados em: M. Van den Berg et al, Toxicol Sci 93 (2), 223-241 (2006).
Apêndice
FET-OMS para avaliação dos riscos para o ser humano com base nas conclusões da reunião de peritos do Programa Internacional de Segurança Química (IPCS) da OMS realizada em Genebra, em junho de 2005 (1).
|
Congénere |
Valor do FET |
Congénere |
Valor do FET |
||
|
Dibenzo-p-dioxinas («PCDD») |
PCB «sob a forma de dioxina» PCB não-orto + PCB mono-orto |
||||
|
2,3,7,8-TCDD |
1 |
|
|
||
|
1,2,3,7,8-PeCDD |
1 |
PCB não-orto |
|
||
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
||
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0003 |
||
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
||
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,03 |
||
|
OCDD |
0,0003 |
|
|
||
|
Dibenzofuranos («PCDF») |
PCB mono-orto |
||||
|
2,3,7,8-TCDF |
0,1 |
PCB 105 |
0,00003 |
||
|
1,2,3,7,8-PeCDF |
0,03 |
PCB 114 |
0,00003 |
||
|
2,3,4,7,8-PeCDF |
0,3 |
PCB 118 |
0,00003 |
||
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 123 |
0,00003 |
||
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 156 |
0,00003 |
||
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 157 |
0,00003 |
||
|
2,3,4,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00003 |
||
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
PCB 189 |
0,00003 |
||
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
||
|
OCDF |
0,0003 |
|
|
||
|
|||||
(1) Martin van den Berg et al., The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds (Reavaliação de 2005 pela OMS dos fatores de equivalência tóxica (FET) em humanos e mamíferos respeitantes às dioxinas e aos compostos sob a forma de dioxina). Toxicological Sciences 93(2), 223-241 (2006).
