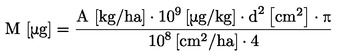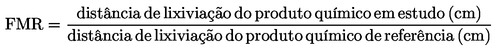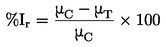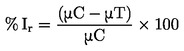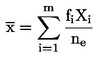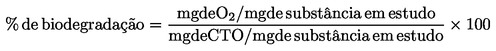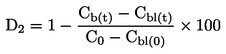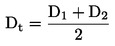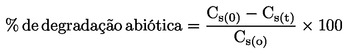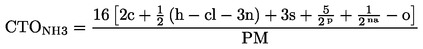|
(6)
|
São aditados os seguintes capítulos C.31 a C.46: «C.31. ENSAIO COM PLANTAS TERRESTRES: PROTOCOLO PARA O DESENVOLVIMENTO DE PLÂNTULAS A PARTIR DE SEMENTES
INTRODUÇÃO
|
1.
|
O presente protocolo é equivalente ao Test Guideline (TG) 208 (2006) da OCDE. Os protocolos são periodicamente revistos à luz dos últimos progressos científicos e dos resultados obtidos na aplicação de protocolos anteriores. Este melhoramento considera os potenciais efeitos da adição de produtos químicos na germinação de sementes e no desenvolvimento de plântulas. Como tal, não tem em conta os efeitos crónicos ou os efeitos na reprodução (isto é, a produção de sementes, a formação de flores, a maturação dos frutos). É necessário ter em conta a exposição ao produto químico e as propriedades deste, de modo a assegurar que o método prático escolhido é o mais adequado (por exemplo, quando se utilizam metais/compostos de metais deve ponderar-se o efeitos do pH, bem como da carga iónica associada) (1). O protocolo não é aplicável a plantas expostas a produtos químicos vaporizados. Aplica-se à generalidade dos produtos químicos, biocidas e produtos para a proteção de culturas para a alimentação (conhecidos, também, por pesticidas). Foi desenvolvido com base em protocolos já estabelecidos (2) (3) (4) (5) (6) (7), tendo sido tomadas em conta outras referências pertinentes para ensaios com plantas (8) (9) (10). As definições utilizadas figuram no apêndice 1.
|
PRINCÍPIO DO ENSAIO
|
2.
|
O presente protocolo avalia os efeitos no desenvolvimento das plântulas e nos primeiros estádios de crescimento das plantas superiores quando expostas ao produto químico em estudo no solo (ou qualquer outra matriz). As sementes são colocadas em contacto com o solo impregnado com o produto químico, sendo avaliados os efeitos deste durante 14 a 21 dias após a germinação de 50 % das sementes no solo-controlo. Os parâmetros determinados são a germinação observada visualmente, o peso seco dos rebentos (ou, em alternativa, o peso fresco dos rebentos) e, em alguns casos, o comprimento dos rebentos, bem como os efeitos nefastos nocivos observados visualmente nas diversas partes da planta. Estas medições e observações são depois comparadas com o solo-controlo.
|
|
3.
|
Consoante a via de exposição escolhida, o produto químico pode ser incorporado no solo (ou, eventualmente, numa matriz de solo artificial) ou aplicado à superfície, a qual representa efetivamente a via de exposição ao produto. A incorporação no solo é realizada em bloco. Depois da aplicação, o solo é colocado em vasos e as sementes da espécie estudada são semeadas. A aplicação do produto químico é realizada à superfície do solo, após a introdução das sementes. As unidades de ensaio (controlos e solos impregnados, com as sementes) são depois colocadas em condições adequadas à germinação ou ao crescimento das plantas.
|
|
4.
|
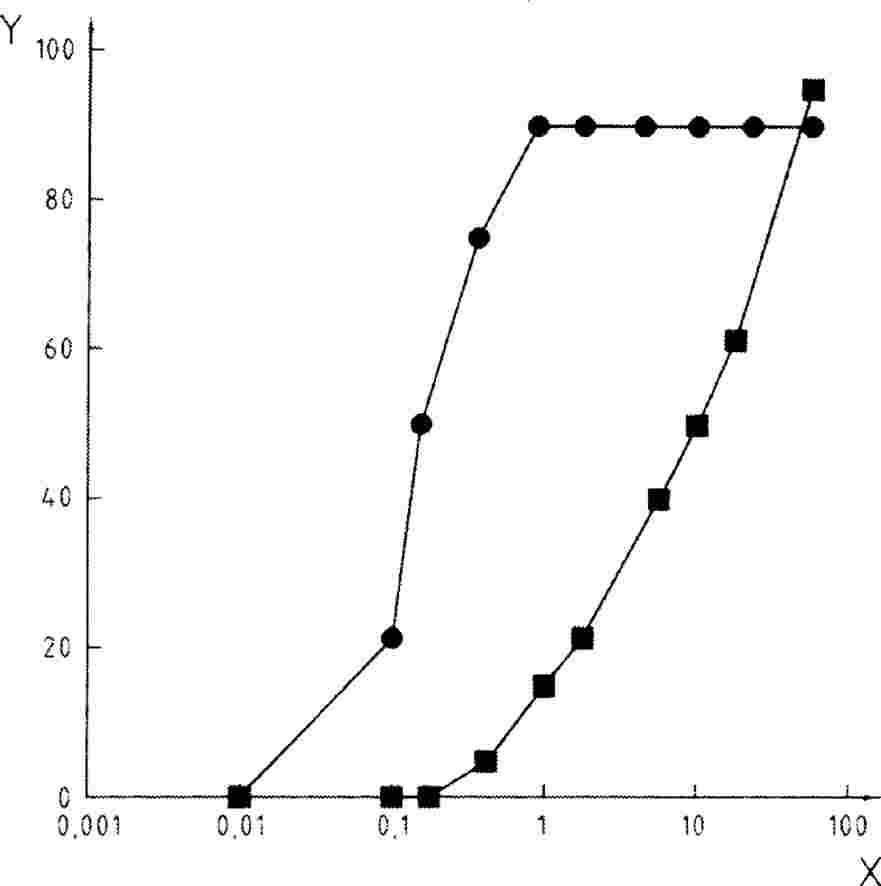
O protocolo pode ser utilizado para determinar a resposta ao longo do tempo a uma determinada dosagem ou a uma única concentração/dose como limite de tolerância, em função do objetivo do estudo. Se os resultados obtidos a partir de uma única concentração/dose excederem um certo nível de toxicidade (ou seja, se os efeitos observados forem superiores a uma determinada percentagem), é realizado um teste rápido para determinar os limites superiores e inferiores de toxicidade e, em seguida, é realizado um ensaio de determinação da gama de concentrações de modo a determinar a resposta à dosagem. Recorre-se a uma análise estatística apropriada para obter a concentração ECx ou a dose com efeitos, EDx (EC25, ED25, EC50, ED50). A concentração sem efeitos observáveis (NOEC) e a menor concentração com efeito (LOEC) podem igualmente ser determinadas com este ensaio.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
5.
|
As informações que se seguem são úteis na identificação da via de exposição esperada para o produto químico em estudo, devendo ser tomadas em conta para estabelecer o protocolo: fórmula estrutural, pureza, solubilidade em água, solubilidade em solventes orgânicos, coeficiente de partição 1-octanol/água, comportamento da absorção do solo, pressão de vapor de água, estabilidade química em água e à luz e biodegradação.
|
VALIDAÇÃO DO ENSAIO
|
6.
|
Para que o protocolo seja considerado válido, o solo-controlo deverá satisfazer os seguintes critérios:
|
—
|
a emergência das sementes tem de ser na ordem dos 70 %;
|
|
—
|
as plântulas não podem exibir efeitos tóxicos visíveis (ou seja, clorose, necrose, murchidão e alterações morfológicas nas folhas e nos pecíolos). As plantas só devem apresentar variações normais de crescimento e de morfologia, no contexto da espécie em causa;
|
|
—
|
as plântulas têm de apresentar, em média, pelo menos, 90 % de taxa de sobrevivência durante o estudo em questão;
|
|
—
|
as condições ambientais para uma dada espécie têm de ser idênticas e os meios de cultura experimentados devem ter quantidades iguais de solo, de meio de cultura ou de substrato a partir da mesma fonte.
|
|
PRODUTO QUÍMICO DE REFERÊNCIA
|
7.
|
O produto químico de referência deve ser experimentado a intervalos regulares, para avaliar a validade do protocolo e a resposta das plantas em estudo, bem como para verificar que as condições experimentais não se alteraram significativamente ao longo do tempo. Em alternativa, podem ser utilizados dados de crescimento e medidas de biomassa do controlo obtidos por pesquisa bibliográfica para avaliar a validade do protocolo, que podem também ser utilizados como medida de controlo de qualidade no próprio laboratório onde se realiza o estudo.
|
DESCRIÇÃO DO MÉTODO
Solo natural — Substrato artificial
|
8.
|
As plantas podem crescer em vasos utilizando um solo limoso-arenoso, arenoso-limoso ou limoso-arenoso-argiloso que contenha até 1,5 % de carbono orgânico (aproximadamente 3 % da matéria orgânica). Pode utilizar-se um solo comercial ou misturas de solo sintéticas que contenham até 1,5 % de carbono orgânico. Não devem ser utilizados solos argilosos se o produto químico em estudo tiver uma elevada afinidade para as argilas. O solo natural deve ser crivado até se obterem partículas de 2 mm, com vista a uniformizá-lo e remover as partículas de maiores dimensões (> 2 mm). Devem registar-se as características do solo final no que se refere ao seu tipo e textura, à percentagem de carbono orgânico, ao pH e ao teor de sais como medida da condutividade. O solo deve ser classificado de acordo com a classificação geral de solos (11). Pode ser pasteurizado ou esterilizado por calor para reduzir o efeito de eventuais agentes patogénicos presentes.
|
|
9.
|
A utilização de solo natural pode dificultar a interpretação dos resultados e aumentar a variabilidade devido à alteração das propriedades físico-químicas e das populações microbianas. Estas variáveis alteram a capacidade de retenção da água, a capacidade de troca iónica, o arejamento e o teor de nutrientes e de elementos vestigiais. Para além da variação destes fatores físicos, haverá também alterações das propriedades químicas como o pH e o potencial redox, o qual pode afetar a biodisponibilidade do produto químico experimentado (12) (13) (14).
|
|
10.
|
Em geral, os substratos artificiais não são utilizados no ensaio de produtos para proteção de plantas cultivadas, mas podem ser utilizados para testar produtos químicos em geral ou quando se pretende minimizar a variabilidade de solos naturais e aumentar a reprodutibilidade dos resultados. Os substratos utilizados devem ser constituídos por materiais inertes que minimizem a interação com o produto químico experimentado, o solvente utilizado ou ambos. As partículas de areia de quartzo lavadas com ácido, a lã mineral e as esferas de vidro (0,35 a 0,85 mm de diâmetro) são consideradas materiais inertes que minimizam a absorção do produto químico (15), assegurando a total disponibilidade deste para ser absorvido pela raiz e participar no desenvolvimento das plântulas. Os substratos indesejáveis incluem a vermiculite, a pertite ou outros materiais muito absorventes. Os nutrientes para o crescimento das plantas devem ser adicionados de modo a evitar o stress das plantas devido a deficiências nutricionais, o que se pode verificar por análise química ou pelo comportamento das plantas do controlo.
|
Critérios de seleção das espécies
|
11.
|
As espécies selecionadas devem escolhidas aleatoriamente, isto é, tendo em conta a sua diversidade taxonómica no reino vegetal, a sua distribuição, abundância, características específicas do ciclo de vida e a região da sua ocorrência natural (8) (10) (16) (17) (18) (19) (20). Na seleção das espécies, há que atender às seguintes características:
|
—
|
as espécies devem ter sementes uniformes que estejam disponíveis a partir de uma fonte de sementes credível e que tenham um comportamento consistente, fiável, possam germinar e apresentem um crescimento consistente das plântulas;
|
|
—
|
a planta em estudo deve poder ser testada em laboratório e oferecer resultados fiáveis e reprodutíveis durante as condições experimentais;
|
|
—
|
a sensibilidade da espécie em estudo ao produto químico deve ser compatível com as respostas das plantas dadas na natureza;
|
|
—
|
as espécies devem ter sido utilizadas regularmente em protocolos de toxicidade e utilizadas para isso mesmo — por exemplo, para ensaios com herbicidas, estudos com metais pesados, estudos de salinidade ou de stress com minerais ou estudos de alelopatia que indiquem possuírem sensibilidade para uma gama alargada de elementos de stress;
|
|
—
|
as espécies têm de ser compatíveis com as condições de crescimento experimentadas;
|
|
—
|
as espécies têm de satisfazer os critérios de validação do protocolo.
|
O apêndice 2 lista as espécies mais utilizadas neste protocolo; o apêndice 3 listada as espécies não cultivadas.
|
|
12.
|
O número de espécies a testar é dependente das condições requeridas e, por isso, não é específico do presente protocolo.
|
Aplicação do produto químico em estudo
|
13.
|
O produto químico deve ser dissolvido no solvente adequado (por exemplo, água, acetona, etanol, polietilenoglicol, goma arábica, areia). Podem também utilizar-se misturas (compostos ou fórmulas conhecidas) que contenham outros elementos e alguns coadjuvantes.
|
Incorporação no solo ou num substrato artificial
|
14.
|
Os produtos químicos solúveis em água podem ser dissolvidos nesta; a solução final é misturada com o solo por meio de um misturador. Este tipo de protocolo é, em geral, adequado quando a exposição ao produto químico se faz através do solo ou de solo poroso e isso é importante para a absorção pela raiz. A capacidade de absorção do solo não deve ser excedida ao adicionar-se o produto químico. O volume de água adicionado deve ser igual para todos os tratamentos, mas deve ser limitado de forma a evitar a formação de aglomerados no solo.
|
|
15.
|
Os produtos químicos com baixa solubilidade na água devem ser dissolvidos num solvente volátil adequado (por exemplo, acetona, etanol) e misturados com areia. O solvente pode depois ser removido borbulhando ar enquanto se remexe a areia. A areia tratada é misturada com o solo a utilizar. É necessário um segundo controlo que contenha apenas areia e solvente. São adicionadas quantidades iguais de areia, com ou sem solvente, a todos os tratamentos e ao segundo controlo. No caso de produtos químicos sólidos e insolúveis, o solo seco e o produto químico são misturados num misturador. Em seguida, o solo é colocado nos vasos e as sementes semeadas imediatamente.
|
|
16.
|
Quando é utilizado um substrato artificial em vez de solo, os produtos químicos solúveis em água devem ser adicionados à solução de nutrientes antes do início do ensaio. Os produtos químicos insolúveis em água, mas que podem ficar em suspensão por recurso a um solvente apropriado, devem ser adicionados com este à solução de nutrientes. Os produtos químicos insolúveis em água para os quais não existe um solvente não tóxico solúvel em água, devem ser dissolvidos no solvente orgânico apropriado. A solução é misturada com areia ou esferas de vidro, colocada num aparelho de vácuo e evaporada, deixando um revestimento na areia ou nas esferas. Uma porção conhecida de esferas deve ser retirada com o mesmo solvente orgânico e o produto químico analisado antes de serem colocadas nos vasos.
|
Aplicação à superfície
|
17.
|
Para a generalidade dos produtos para proteção de plantas cultivadas, o método que consiste em espalhar a solução na superfície do solo é comumente utilizado em tratamentos químicos. Todos os equipamentos utilizados no ensaio, incluindo os equipamentos utilizados na preparação e adição do produto químico, devem ser preparados e concebidos de forma a assegurar a reprodutibilidade efetiva do ensaio. A cobertura deve ser uniforme ao longo de toda a superfície. Devem tomar-se cuidados para evitar que o produto químico fique retido ou reaja com o equipamento utilizado (p. ex., vasos de plástico e produtos químicos lipófilos ou materiais inox). O produto químico é espalhado à superfície do solo de forma a simular a aplicação por pulverização. Geralmente, o volume aplicado deve ser o que se utiliza na agricultura, devendo ficar registado em pormenor (quantidade de água, etc.). Devem utilizar-se terminações em bico para assegurar a cobertura uniforme de toda a superfície. Se forem utilizados solventes e transportadores, deve preparar-se um segundo grupo de controlos, nos quais só é aplicado o solvente ou transportador. Tal não é necessário para a generalidade dos produtos para proteção de plantas cultivadas experimentados como formulações.
|
Verificação da concentração ou dose de produto químico a aplicar
|
18.
|
As concentrações/doses de aplicação devem ser confirmadas por uma análise adequada. No que respeita aos produtos químicos solúveis em água, a verificação de todas as concentrações/doses experimentadas pode ser confirmada pela análise da solução com a concentração mais elevada utilizada durante o ensaio, tendo em conta as diluições utilizadas e o eventual recurso a equipamentos de aplicação calibrados (material de vidro e outros equipamentos calibrados). No caso dos produtos químicos insolúveis, a verificação pode ser assegurada pelo peso do produto adicionado ao solo. Se for pedida a homogeneização do solo utilizado, pode ser necessária uma análise do solo.
|
PROCEDIMENTO
Planeamento do ensaio
|
19.
|
As sementes de uma dada espécie são colocadas nos vasos. O número de sementes semeadas por vaso depende da espécie, das dimensões do vaso e da duração do ensaio. O número de plantas por vaso deve proporcionar o crescimento normal das mesmas nas condições experimentais utilizadas e evitar a sobrelotação no período experimental. O máximo de sementes por vaso deve ser de 3-10 por 100 cm2, em função do tamanho das mesmas. Como exemplo, uma a duas sementes de milho, soja, tomate, pepino ou beterraba por cada 15 cm; 3 plantas de ervilha ou de colza por cada 15 cm e 5 a 10 de cebola, trigo ou outras sementes pequenas por cada 15 cm, é o recomendado. O número de sementes e de replicados (o replicado é definido como um vaso, pelo que as plantas colocadas no mesmo vaso não são consideradas replicados) deve ser adequado à análise estatística (21). A variabilidade é maior para as espécies que apresentem sementes maiores por vaso (replicado), quando comparada com as espécies com sementes mais pequenas e, por isso, apresentem mais sementes por vaso. Esta variabilidade pode ser minimizada colocando o mesmo número de sementes em cada vaso.
|
|
20.
|
Recorre-se aos controlos para estabelecer se os efeitos observados estão associados, única e exclusivamente, ao produto químico em estudo. Os controlos devem ser exatamente iguais aos vasos experimentais, exceto no que se refere à presença do produto químico em estudo. Para um dado protocolo, todas as plantas experimentadas — inclusive os controlos — devem ter a mesma origem. Para evitar resultados tendenciosos, é necessária uma distribuição aleatória de todos os vasos, inclusive dos controlos.
|
|
21.
|
Deve evitar-se a utilização de sementes tratadas (revestidas por um inseticida ou fungicida). No entanto, algumas autoridades reguladoras permitem a utilização de certos fungicidas não-sistémicos, como, p. ex., a captana e o tirame (22). Se as sementes apresentarem agentes patogénicos, devem ser lavadas com uma solução diluída de hipoclorito de sódio a 5 % e, depois, abundantemente, com água corrente, e secas. Não é permitido qualquer tratamento com outro produto para proteção de plantas cultivadas.
|
Condições experimentais
|
22.
|
As condições experimentais devem ser próximas das condições necessárias ao bom crescimento das espécies e variedades experimentadas (o apêndice 4 apresenta exemplos destas condições). As plantas devem ser mantidas em boas condições de horticultura, em câmaras com condições controladas, fitoclimas ou estufas. Esta prática inclui, geralmente, o controlo diário das condições programadas, o registo da temperatura, humidade, a concentração de dióxido de carbono, a luz (intensidade, comprimento de onda, radiação fotossinteticamente ativa), o fotoperíodo, etc., de forma a assegurar um bom crescimento das plantas, comprovado pelo crescimento observado nas plantas do controlo. As temperaturas nas estufas devem ser controladas por ventilação, aquecimento ou sistemas de arrefecimento. As seguintes condições são geralmente recomendadas para ensaios em estufas:
|
—
|
temperatura: 22 °C ± 10 °C;
|
|
—
|
fotoperíodo: mínimo 16 horas de luz;
|
|
—
|
intensidade luminosa: 350 ± 50 μE/m2/s. Será necessária iluminação adicional se a intensidade luminosa descer abaixo dos 200 μE/m2/s, o comprimento de onda deve estar entre os 400-700 nm, exceto para certas espécies cujas necessidades são menores.
|
As condições ambientais devem ser monitorizadas e registadas durante todo o estudo. As plantas devem crescer em vasos de plástico que não sejam porosos, com um prato por baixo. Os vasos devem ser reposicionados periodicamente para minimizar a variabilidade no crescimento das plantas (devido às diferenças nas condições experimentais no respeitante ao crescimento). Os vasos devem ser grandes, com dimensões suficientes para permitir um crescimento normal.
|
|
23.
|
Podem ser adicionados nutrientes ao solo de forma a manter um bom crescimento. A necessidade e o momento da adição dos nutrientes devem ser avaliados pela observação das plantas do controlo. Recomenda-se regar a base dos vasos (por exemplo, utilizando fibra de vidro). No entanto, pode efetuar-se uma lavagem inicial para estimular a germinação das sementes, e quando o produto químico for aplicado à superfície do solo, para facilitar a sua absorção.
|
|
24.
|
As condições de crescimento devem ser específicas das espécies em estudo e do produto químico. O controlo e as plantas tratadas devem ser mantidos nas mesmas condições ambientais; contudo, devem tomar-se medidas para evitar interferências (p. ex., por meio dos compostos voláteis) entre os diferentes tratamentos e o controlo.
|
Ensaio com uma única concentração/dose
|
25.
|
De forma a determinar as concentrações adequadas do produto químico para realizar um teste com uma única concentração ou dose (limite de dosagem), importa ter em conta um certo número de fatores. Para a maioria parte dos produtos químicos, esses fatores incluem as propriedades físico-químicas. No que respeita à generalidade dos produtos para proteção de plantas cultivadas, devem ter-se em conta as propriedades físico-químicas dos produtos e o seu uso em tratamentos químicos, a sua máxima concentração ou taxa de aplicação, o número de aplicações por estação do ano e/ou a sua persistência/permanência no solo. Para determinar se um produto químico qualquer possui propriedades fitotóxicas, pode ser apropriado testá-lo numa concentração máxima de 1 000 mg/kg de solo seco.
|
Ensaio de determinação da gama de concentrações
|
26.
|
Quando necessário, pode ser realizado um teste de determinação da gama de concentrações para obter um intervalo de concentrações/doses a utilizar no ensaio. Neste teste, as concentrações experimentadas devem ser bastante alargadas (por exemplo, 0,1, 1,0,10, 100 e 1 000 mg/kg de solo seco). No respeitante aos produtos para proteção de plantas cultivadas, as concentrações/dose podem basear-se nas concentrações máximas ou recomendadas ou nas doses de aplicação, por exemplo, 1/100, 1/10, 1/1 da concentração máxima/recomendada ou da dose de aplicação.
|
Ensaio com várias concentrações/doses
|
27.
|
O objetivo de um estudo com várias concentrações/doses consiste em estabelecer a relação entre a dosagem e a resposta e determinar a ECx ou a EDx, um valor para a germinação, biomassa e/ou efeitos observáveis comparados com os controlos, como requerido pelas autoridades competentes.
|
|
28.
|
O número e o intervalo entre as concentrações ou quantidades devem ser suficientes para produzir uma resposta adequada, estabelecer uma equação de regressão e estimar a ECx e a EDx. As concentrações/doses selecionadas devem abranger os valores de ECx e EDx que se pretende determinar. Por exemplo, se se pretender determinar uma EC50, o ensaio deve abranger valores que assegurem 20 a 80 % de efeitos. O número recomendado de concentrações/doses para tal é, pelo menos, 5, numa série geométrica, acrescido dos controlos, com um fator de espaçamento que não deve exceder 3. Para cada tratamento e controlo, o número de replicados deve ser, pelo menos, 4 e o número total de sementes, pelo menos, de 20. Para plantas com uma taxa de germinação baixa ou condições ambientais de crescimento muito variáveis, podem ser necessários mais replicados, de forma a aumentar a reprodutibilidade do tratamento estatístico. Se for necessário um grande número de concentrações/doses, o número de replicados pode ser reduzido. Se se pretender estimar a NOEC, são necessários mais replicados para fortalecer a reprodutibilidade do tratamento estatístico (23).
|
Observações
|
29.
|
Durante o período de observação, isto é, 14 a 21 dias depois de 50 % das plantas do controlo (também do controlo/solvente, for caso disso) terem germinado, as plantas são observadas frequentemente — pelo menos, uma vez por semana e, se possível, diariamente -, para averiguar o desenvolvimento, os eventuais efeitos fitotóxicos e a mortalidade. Para o fim da experiência, devem registar-se as medidas da porção germinada e da biomassa das plantas sobreviventes, assim como os efeitos de alteração nas diferentes partes da planta. Estes efeitos incluem anomalias na morfologia das plântulas, crescimento incompleto, clorose, descoloração, mortalidade e efeitos no desenvolvimento da planta. A biomassa final pode ser medida utilizando o peso seco das plantas sobreviventes, colhendo a parte aérea das plantas e secando-a até peso constante a 60 °C. A biomassa final pode, também, ser calculada pelo peso fresco dos rebentos. O comprimento dos rebentos pode também ser utilizado, se requerido pelas autoridades competentes. Para as alterações morfológicas deve ser utilizado um sistema uniforme de critérios que permita discernir os efeitos tóxicos observados na planta. A bibliografia (23) (24) apresenta exemplos de avaliações qualitativas e quantitativas.
|
DADOS E RELATÓRIOS
Análise estatística
Ensaio com uma única concentração/dose
|
30.
|
Os dados relativos a cada espécie devem ser analisados com um método estatístico adequado. Deve registar-se o nível do efeito para uma dada concentração/dose deve ser registado, bem como a ausência de efeitos para uma dada concentração/dose (p. ex., < x % de efeitos observados a uma concentração ou dose).
|
Ensaio com várias concentrações/doses
|
31.
|
A relação dose/resposta é estabelecida por uma equação de regressão. Pode recorrer-se a vários modelos: por exemplo, para estimar a ECx ou a EDx (ou EC25, ED25, EC50, ED50) e os respetivos limites de confiança na germinação, podem utilizar-se, entre outros, os seguintes métodos: dados quantitativos, modelos de variável dependente binária (logit ou probit), Weibull, Spearman-Karber. Para o crescimento das plântulas (peso e comprimento), em que a ECx ou a EDx representam os estádios finais, os limites de confiança podem ser estimados por recurso a um método de regressão adequado — p. ex., análise de regressão não linear de Bruce-Versteeg (25). Sempre que possível, R2 deve ser 0,7 — ou maior — para as espécies mais sensíveis; as concentrações selecionadas devem produzir efeitos de 20 % a 80 %. Caso se pretenda estimar a NOEC, é aconselhável a aplicação de testes estatísticos mais complexos, a selecionar com base na distribuição dos dados (26).
|
Relatório do ensaio
|
32.
|
O relatório deve apresentar os resultados do estudo efetuado, assim como uma descrição pormenorizada das condições experimentais, uma discussão dos resultados, a análise dos dados e as conclusões retiradas da análise realizada. Devem também apresentar-se um sumário em forma tabular e um resumo dos resultados. O relatório deve incluir o seguinte:
|
|
Produto químico em estudo:
|
—
|
caracterização do produto químico, suas propriedades mais relevantes (por exemplo, coeficiente de partição (log Pow), solubilidade em água, pressão de vapor de água e informação sobre o seu comportamento e presença no meio ambiente, se disponível);
|
|
—
|
detalhes sobre a preparação da solução e verificação das concentrações testadas, como especificado no ponto 18.
|
|
|
|
Espécies:
|
—
|
detalhes sobre o organismo selecionado: espécie/variedade, família a que pertence, nome comum e científico e história da aquisição da semente de forma tão detalhada quanto possível (isto é, nome do fornecedor, percentagem de germinação, dimensões da semente, número do lote, ano da semente ou em que altura do ano foi colhida, dados sobre a sua capacidade de germinação), viabilidade, etc.;
|
|
—
|
número de espécies mono ou dicotiledóneas experimentadas;
|
|
—
|
critérios de seleção das espécies;
|
|
—
|
descrição da forma de armazenamento, tratamento e manutenção das sementes.
|
|
|
|
Condições de ensaio:
|
—
|
equipamento experimental (câmaras de crescimento, fitotrões e estufas);
|
|
—
|
descrição das condições experimentais (p. ex., dimensões e características dos vasos e quantidades de solo);
|
|
—
|
características do solo: textura e tipo de solo: distribuição das partículas do solo, classificação física e propriedades químicas, matéria orgânica (em %), carbono orgânico (em %) e pH;
|
|
—
|
forma de preparação do solo/substrato (solo artificial, areia e outros);
|
|
—
|
descrição do meio de cultura utilizado;
|
|
—
|
aplicação do produto químico: descrição do método de aplicação, descrição do equipamento, dose e volumes aplicados — incluindo a verificação do produto químico —, descrição do método de calibração e das condições ambientais durante a aplicação;
|
|
—
|
condições de crescimento: intensidade luminosa (isto é, PAR, radiação fotossinteticamente ativa), fotoperíodo, temperaturas máxima e mínima, método e esquema de rega, fertilização;
|
|
—
|
número de sementes por vaso, número de plantas por dose, número de replicados (vasos) por concentração experimentada;
|
|
—
|
tipo e número de controlos (controlo negativo/positivo, controlo do solvente se utilizado);
|
|
|
|
Resultados:
|
—
|
tabela de todos os extremos para cada replicado, concentração/dose experimentada e espécies;
|
|
—
|
número e percentagem de plantas germinadas comparados com o controlo;
|
|
—
|
medições de biomassa (peso seco ou fresco dos rebentos) das plantas, expressa em percentagem relativa ao controlo;
|
|
—
|
comprimento dos rebentos das plantas, expressa em percentagem relativa ao controlo, se aplicável;
|
|
—
|
percentagem das alterações morfológicas observáveis e uma descrição quantitativa e qualitativa das alterações morfológicas (clorose, necrose, murchidão, deformações das folhas e dos pecíolos, assim como, a ausência de efeitos) provocadas pelo produto químico, em comparação com o controlo;
|
|
—
|
descrição dos critérios e dos seus intervalos utilizados para qualificar os danos observados, se isso for possível;
|
|
—
|
no caso dos ensaios com uma única concentração, deve apresentar-se a percentagem de dados observados;
|
|
—
|
valores de ECx ou EDx (por exemplo, EC25, ED25, EC50, ED50) e seus limites de confiança. Quando se realiza uma análise de regressão, apresentar o erro-padrão da equação de regressão e o erro-padrão de cada parâmetro individual (por exemplo, declive, ordenada na origem);
|
|
—
|
valores de NOEC (e LOEC), se calculados;
|
|
—
|
descrição dos métodos estatísticos e pressupostos utilizados;
|
|
—
|
gráficos de dados e relação dose/resposta para as espécies testadas.
|
|
Devem também referir-se quaisquer desvios aos procedimentos descritos neste protocolo e alguma ocorrência anómala durante o ensaio.
|
REFERÊNCIAS
|
(1)
|
Schrader G., Metge K., & Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
International Organisation of Standards. (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora — Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards. (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora — Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 & 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850,4000 Background — Non-target Plant Testing;
|
|
—
|
850,4025 Target Area Phytotoxicity;
|
|
—
|
850,4100 Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850,4200 Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850,4225 Seedling Emergence, Tier II;
|
|
—
|
850,4230 Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. & Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., & Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms — A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., & Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistryof Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. & Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. & Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. & Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. & Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C., & Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides — An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
(19)
|
Boutin, C. & Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. & Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OCDE (2006). Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A guidance to application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K.K. & Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. & G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. & Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. & Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Capítulo C.33 do presente anexo (Ensaio de reprodução de minhocas Eisenia fetida/ Eisenia andrei).
|
Apêndice 1
Definições
Ingrediente ativo (ou substância ativa)
: material destinado a produzir um efeito biológico específico (p. ex., combate aos insetos e às doenças das plantas, controlo das sementes na zona de tratamento); também designado por ingrediente tecnicamente ativo ou substância tecnicamente ativa.
Produto químico
: uma substância ou mistura.
Produtos para proteção de plantas, ou produtos fitofarmacêuticos, ou pesticidas
: produtos com uma actividade biológica específica, utilizados intencionalmente para proteger as culturas alimentares das pestes (p. ex., doenças provocadas por fungos, insectos e plantas competidoras).
ECx (concentração com x % de efeitos) ou ERx (dose com x % de efeitos)
: concentração ou dose que produz uma alteração indesejável de x % no parâmetro-alvo do ensaio, relativamente ao controlo (p. ex., uma redução de 25 % ou de 50 % na germinação, no peso dos rebentos, no número de plantas presentes no final, ou um aumento dos danos observados, constituem, respetivamente, uma EC25/ER25 ou EC50/ER50).
Germinação
: aparecimento dos cotilédones acima da superfície do solo.
Formulação
: produto de formulação comercial que contém a substância ativa (ingrediente ativo); também designado por preparação final (8) ou produto para utilização final.
LOEC (menor concentração comnefeitos observados)
: concentração mais baixa do produto químico em estudo à qual se observa um efeito. No presente ensaio, a concentração correspondente à LOEC tem um efeito estatisticamente significativo (p < 0,05) num dado período de exposição, comparativamente com o controlo, e é mais elevada que a NOEC.
Plantas não-alvo
: plantas exteriores à zona-alvo. No caso dos produtos para proteção de plantas cultivadas destinadas à alimentação, refere-se às plantas situadas fora da zona de tratamento.
NOEC (concentração sem efeitos observados)
: concentração mais elevada do produto químico em estudo à qual não se observam efeitos. No presente ensaio, a concentraçao correspondente à NOEC não produz efeitos estatisticamante significativos (p < 0,05), num dado período de exposição, comparativamente com o controlo.
Fitotoxicidade
: Desvios prejudiciais (medidos e por constatação visual) à morfologia e ao crescimento normais da planta em resposta a um determinado produto químico.
Replicado
: unidade experimental que representa o controlo e/ou os tratamentos. Nestes estudos, o vaso é definido como o replicado.
Avaliação visual
: classificação das alterações visuais com base em observações da planta, vigor, malformações, clorose, necrose e sua aparência geral, quando comparada com o controlo.
Produto químico em estudo
: Qualquer substância ou mistura testada pelo presente protocolo.
Apêndice 2
Lista de espécies tradicionalmente utilizadas em ensaios com plantas
|
Família
|
Espécie
|
Nome comum
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Cenoura
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Girassol
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Alface
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Mostarda-branca
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Couve-da-china
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Colza
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Couve-roxa
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Nabo
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Agrião
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Rabanete
|
|
Chenopodiaceae
|
Beta vulgaris
|
Beterraba
|
|
Cucurbitaceae
|
Cucumis sativus
|
Pepino
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Soja
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Feijão preto
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Feijão-comum
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Ervilha
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Feno-grego
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Cornichão
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Trevo-vermelho
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Ervilhaca
|
|
Linaceae
|
Linum usitatissimum
|
Linho
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Trigo-sarraceno
|
|
Solanaceae
|
Solanum lycopersicon
|
Tomate
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Cebola
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Aveia
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Cevada
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Azevém-perene
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Arroz
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Centeio
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Sorgo-forrageiro
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Trigo
|
|
Poaceae (Gramineae)
|
Zea mays
|
Milho
|
Apêndice 3
Lista de potenciais espécies não cultivadas
OCDE Espécies vegetais que podem ser utilizadas em ensaios de toxicidade
Nota: O quadro seguinte apresenta informações sobre 52 espécies não cultivadas (as referências estão entre parêntesis para cada entrada). As taxas de germinação apresentadas provêm de artigos já publicados e só podem ser utilizadas como referência geral. As experiências podem variar em função da origem das sementes e de outros fatores.
|
FAMÍLIA Nome científico
(nome comum, quando existente)
|
Longevidade (9) e Habitat
|
Peso das sementes
(mg)
|
Fotoperíodo para germinação ou crescimento (10)
|
Profundidade de plantação
(mm) (11)
|
Tempo de germinação
(dias) (12)
|
Tratamentos epeciais (13)
|
Ensaio de toxicidade (14)
|
Fornecedores de sementes (15)
|
Outras referências (16)
|
|
APIACEAE
Torilis japonica
|
А, В zonas perturbadas, sebes, pastagens (16, 19)
|
1.7-1.9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
Estratificação a frio (7, 14, 18, 19); pode ser necessária maturação (19); germinação inibida pela escuridão (1, 19); sem tratamentos especiais (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(Margarida-vulgar)
|
Ρ
pradarias, terras aráveis, relvados (16, 19)
|
0.09-0.17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
Germinação não afetada pela irradiância (18, 19); sem tratamentos especiais (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(Centáurea)
|
A
campos, beiras de estradas, habitats abertos (16)
|
4.1-4.9 (4, 14)
|
L = D (14)
|
0-3 (2, 4, 14)
|
14-21 (100 %) (14)
|
Sem tratamentos especiais (2, 4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
|
Ρ
campos, beiras de estradas, habitats abertos (16, 19)
|
2.4-2.6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
Pode ser necessária maturação (18, 19); germinação inibida pela escuridão (19) sem tratamentos especiais (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(Helénio)
|
Ρ
terrenos húmidos, zonas perturbadas
(16)
|
1-1.3 (4, 14, 29)
|
|
0
(4, 29)
|
|
Sem tratamentos especiais (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(Leituga-dos-montes)
|
Ρ
campos, beiras de estradas, zonas perturbadas (16, 19)
|
0.85-1.2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
Germinação inibida pela escuridão (17, 18, 19); sem tratamentos especiais (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(Margarida-amarela)
|
Β, Ρ zonas perturbadas
(16)
|
0.3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
Sem tratamentos especiais
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(Tango)
|
Ρ
pastagens, zonas abertas (16)
|
0.06-0.08 (4, 14)
|
L = D (11)
|
0
(4)
|
14-21
(11)
|
Misturar em partes iguais com areia e embeber em 500 ppm GA durante 24 h (11); sem tratamentos especiais (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
|
A
campos, habitats abertos (16)
|
25-61 (14, 29)
|
|
0(1)
5(29)
|
|
Germinação pode ser inibida pela escuridão (1); embeber em água quente durante 12 h (29)
|
PRE & POST (31)
|
A
|
|
|
Xanthium spinosum
(Bardana-menor)
|
A
habitats abertos (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
Escarificação (14); sem tratamentos especiais (6)
|
PRE & POST (6)
|
A
|
|
|
Xanthium strumarium
(Carrapichão)
|
A
campos, habitats abertos (16)
|
67.4 (14)
|
L = D (14)
|
10-20 (6, 21)
|
|
Sem tratamentos especiais
(6, 14, 21)
|
PRE & POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(Agrião-dos-prados)
|
Ρ
campos, beiras de estradas, relvados (16, 19)
|
0.6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
Germinação inibida pela escuridão (18, 19); sem tratamentos especiais (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
|
Ρ
(16)
|
0.21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
Pode ser necessária maturação (18); sem tratamentos especiais (5, 14, 15, 22-26)
|
POST (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(Ansarina-branca)
|
A
estremas de campos, zonas perturbadas (16, 19)
|
0.7-1.5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
Tratamento difere consoante a cor da semente (19); dormência por armazenamento a seco (19); germinação inibida pela escuridão (1, 18, 19); estratificação a frio (18); sem tratamentos especiais (14, 34)
|
PRE & POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(Erva-de-são-joão)
|
Ρ
campos, terras aráveis, habitats abertos (16, 19)
|
0.1-0.23
(14, 19)
|
L= D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
Germinação inibida pela escuridão (1, 18, 19);
sem tratamentos especiais (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(Corda-de-viola)
|
A
beiras de estradas, habitats abertos, milharais (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10-20
(6, 10, 21)
|
4 (100 %)
(10)
|
Germinação não afetada pela irradiância (1);
sem tratamentos especiais (6, 21)
|
PRE & POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(Junça-de-conta)
|
Ρ
terras aráveis, pastagens, beiras de estradas (16, 30)
|
0,2
(14)
|
L= D
(14)
|
0 (1)
10-20 (6, 10)
|
12 (91 %)
(10)
|
Germinação inibida pela escuridão (1);
sem tratamentos especiais (6, 10, 14)
|
PRE & POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(Cornichão-loto)
|
Ρ
zonas relvadas, beiras de estradas, habitats abertos (16, 19)
|
1-1.67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
Escarificação (14, 19)
germinação não afetada pela irradiância (18, 19); sem tratamentos especiais (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(Senna-chinês)
|
A
florestas húmidas (16)
|
23-28
(9)
|
L = D (14)
L > D (9)
|
10-20
(6,9)
|
|
Embeber as sementes em água durante 24 horas (9);
escarificação (14); a viabilidade das sementes difere consoante a sua cor (1); sem tratamentos especiais (6)
|
POST
(6,9)
|
A
|
|
|
Sesbania exaltata
(Sesbania)
|
A
aluviões (16)
|
11-13
(9, 14)
|
L > D (9)
|
10-20
(9, 21)
|
|
Embeber as sementes em água durante 24 horas (9);
germinação não afetada pela irradiância (1); sem tratamentos especiais (21)
|
PRE & POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(Trevo-comum)
|
Ρ
campos, beiras de estradas, terras aráveis (16, 19)
|
1.4-1.7
(14, 19)
|
L= D (14)
|
|
1 (50 %)
(19)
|
Escarificação (14, 18)
pode ser necessária maturação (19); germinação não afetada pela irradiância (1, 19); sem tratamentos especiais (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(Agripalma)
|
Ρ
zonas abertas (16)
|
0.75-1.0
(4, 14)
|
L= D (14)
|
0
(4)
|
|
Sem tratamentos especiais
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(Hortelã-vulgar)
|
Ρ
zonas húmidas (16)
|
2,21
(4)
|
|
0
(4)
|
|
Sem tratamentos especiais
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(Nêveda-dos-gatos)
|
Ρ
zonas perturbadas (16)
|
0,54
(4, 14)
|
L= D (14)
|
0
(4)
|
|
Sem tratamentos especiais
(2, 4, 14)
|
POST
(2,4)
|
F
|
|
|
Prunella vulgaris
(Prunela)
|
Ρ
campos aráveis, zonas relvadas, zonas perturbadas (16, 19)
|
0.58-1.2
(4, 14, 19)
|
L= D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
Germinação inibida pela escuridão (18, 19);
germinação maior com sementes maiores (1 ); sem tratamentos especiais (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(Betónica)
|
Ρ
pastagens, estremas de campos (19)
|
14-18
(14, 19)
|
L= D (14)
|
|
7 (50 %)
(19)
|
Sem tratamentos especiais
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
|
A
campos, habitats abertos (16)
|
8,8
(14)
|
L= D (14)
|
10-20
(6, 10, 21)
|
4 (84 %)
(10)
|
Escarificação (14);
sem tratamentos especiais (5, 10, 21)
|
PRE & POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(Guanxuma-de-espinho)
|
A
campos, beiras de estradas (16)
|
3,8
(14)
|
L= D (14)
|
10-20
(6, 21)
|
|
Escarificação (14)
germinação não afetada pela irradiância (1); sem tratamentos especiais (6, 21 )
|
PRE & POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(Papoila)
|
A
campos, terras aráveis, zonas perturbadas (16, 19)
|
0.1-0.3
(4, 14, 19, 29)
|
L= D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
Estratificação a frio e escarificação (1, 19, 32);
sem tratamentos especiais (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(Agrostide-ténue)
|
relvados, pastagens (16)
|
0.07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
Germinação inibida pela escuridão (1, 17-19); sem tratamentos especiais (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(Rabo-de-raposa)
|
A
campos, habitats abertos (16)
|
0.9-1.6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
Escarificação (14); tratamento com 101 mg/L KNO3 (14); estratificação a quente (1); germinação inibida pela escuridão (1); sem tratamentos especiais (34)
|
PRE & POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(Aveia-doida)
|
A
zonas cultivadas, habitats abertos (16)
|
7-37.5 (14, 30)
|
L = D (14)
L > D (6)
|
10-20 (6, 10)
|
3 (70 %) (18)
|
Escarificação (7, 32); germinação inibida pela escuridão (1);
estratificação a frio (1, 18); sem tratamentos especiais (6, 10, 14)
|
PRE & POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(Bromo)
|
A
campos, beiras de estradas, terras aráveis (16)
|
0.45-2.28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
Período de maturação (1, 7, 32) germinação inibida pela luz (1); sem tratamentos especiais (14)
|
PRE & POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(Rabo-de-cão)
|
P
campos, beiras de estradas, habitats abertos (16, 19)
|
0.5-0.7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
Germinação não afetada pela irradiância (19); sem tratamentos especiais (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinaiis
(Milhã)
|
A
campos, relvados, habitats abertos (16)
|
0.52-0.6 (14, 30)
|
L = D (14)
|
10-20 (21)
|
7 (75 %)
14 (94 %) (7)
|
Escarificação, estratificação a frio e maturação (1, 7, 14, 32) tratamento com 101 mg/l KNO3 (14); germinação inibida pela escuridão (1); sem tratamentos especiais (21)
|
PRE & POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(Capim-arroz)
|
A
(16)
|
1.5 (14)
|
L = D (14)
L > D (3)
|
10-20 (7, 21)
|
|
Escarificação (7, 32); germinação não afetada pela irradiância (1); sem tratamentos especiais (3, 14, 21)
|
PRE & POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
|
P
ribeiros, zonas perturbadas (16)
|
4-5 (14, 30)
|
L = D (11)
|
1
(11)
|
14-28
(11)
|
Sem tratamentos especiais
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(Festuca-encamada)
|
P
campos, zonas húmidas (16, 19)
|
1.53-2.2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
Sem tratamentos especiais
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
(Cevada-pequena)
|
A
pastagens, beiras de estradas, habitats abertos (16)
|
3.28 (14)
|
|
|
|
Estratificação a quente (1); germinação não afetada pela irradiância (1)
|
PRE (31)
|
|
7
|
|
Phieum pratense
|
P
pastagens, terras aráveis, zonas perturbadas (16, 19)
|
0.45 (14, 19)
|
L > D (10, 14)
|
0-10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
Germinação inibida pela escuridão (19) germinação não afetada pela irradiância (17); sem tratamentos especiais (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(Erva-pessegueira)
|
A
habitats abertos, beiras de estradas (16)
|
5-8 (4, 14, 29)
|
L = D (20)
|
0-2 (4, 29)
|
|
Estratificação a frio durante 4 — 8 semanas (1, 2, 4, 20, 29); germinação não afetada pela irradiância (1)
|
PRE & POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(Erva-bastarda)
|
A
zonas húmidas (16)
|
1.8-2.5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
Germinação não afetada pela irradiância (1); germinação inibida pela escuridão (18); estratificação a frio (1); sem tratamentos especiais (5)
|
PRE & POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
|
A
campos, habitats abertos (16)
|
3.6-7 (14, 29)
|
|
2 (29)
|
|
Estratificação a frio durante 4 semanas a 0 — 5 °C (1, 29); germinação inibida pela escuridão (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(Cristas)
|
A
zonas perturbadas, terras aráveis (16, 19)
|
2.1 -2.3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
Escarificação, estratificação a frio, tratamento com GA (14); estratificação a frio, maturação (17-19); germinação inibida pela escuridão (19); sem tratamentos especiais (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(Cata-cruz)
|
P
terras aráveis, beiras de estradas, zonas abertas (16, 19)
|
1.3-1.5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
Germinação inibida pela escuridão (18, 19); pode ser necessária maturação (18); sem tratamentos especiais (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(Erva-do-garrotilho)
|
A
terras aráveis, zonas abertas, zonas perturbadas (16, 19)
|
0.4-0.5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
Estratificação a frio, tratamento com GA (1,14, 18, 19, 32); luz necessária para a germinação (1); sem tratamentos especiais (2, 4)
|
POST (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(Ranúnculo)
|
Ρ
terras aráveis, beiras de estradas, zonas abertas (16, 19)
|
1.5-2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 -56 (19, 29)
|
Sem tratamentos especiais
(5, 14, 22, 24 -26)
|
POST (5, 22, 24-26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(Cariofilada)
|
Ρ
sebes, zonas húmidas
(16, 19)
|
0.8-1.5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
Germinação inibida pela escuridão (18, 19); estratificação a quente (1); sem tratamentos especiais (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(Amor-de-hortelão)
|
A
terras aráveis, zonas húmidas, zonas perturbadas (16, 19)
|
7-9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
Estratificação a frio (1, 18, 19) germinação não afetada pela irradiância (18, 19); germinação inibida pela luz (1); sem tratamentos especiais (6, 14)
|
PRE & POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(Aspérula)
|
Ρ
sebes, zonas abertas (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
Sem tratamentos especiais
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(Dedaleira)
|
Β, Ρ sebes, zonas abertas (16, 19)
|
0.1-0.6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
Germinação inibida pela escuridão (1, 17-19); sem tratamentos especiais (4, 22-26)
|
POST (4, 22 — 26)
|
D, G, F
|
|
|
Veronica persica
(Verónica-da-pérsia)
|
A
terras aráveis, zonas abertas, zonas perturbadas (16, 19)
|
0.5-0.6 (14, 19)
|
L = D (14)
|
0 (19)
|
3(19)
5 (96 %) (18)
|
Germinação inibida pela escuridão (18, 19) estratificação a frio (18); sem tratamentos especiais (14)
|
PRE & POST (28)
|
A
|
32
|
Fornecedores de sementes citados
|
Identificação do fornecedor
|
Informações gerais sobre o fornecedor
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344 — 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla — Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 — 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 — 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873 — 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 — 7333
|
|
www.thompson-morgan.com
|
|
REFERÊNCIAS
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 — 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC — Weeds. pp. 151 — 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC — Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Apêndice 4
Exemplos de condições ótimas de crescimento de algumas plantas cultivadas
As condições a seguir descritas são adequadas para 10 espécies de plantas e podem ser utilizadas nos ensaios, a título de orientação, juntamente com algumas outras espécies:
|
|
Concentração de dióxido de carbono: 350 ± 50 ppm;
|
|
|
Humidade relativa: 70 ± 5 % durante os períodos de iluminação e 90 ± 5 % durante os períodos de obscuridade;
|
|
|
Temperatura: 25 ± 3 °C durante o dia, 20 ± 3 °C durante a noite;
|
|
|
Fotoperíodo: 16 h luz/8 h obscuridade, com um intervalo de comprimentos de onda de 400 a 700 nm;
|
|
|
Luz: luminosidade 350 ± 50 μE/m2/s, medida no topo da cobertura.
|
As plantas cultivadas são as seguintes:
|
—
|
Tomate (Solanum lycopersicon);
|
|
—
|
Pepino (Cucumis sativus);
|
|
—
|
Alface (Lactuca sativa);
|
|
—
|
Couve-roxa (Brassica oleracea var. capitata);
|
|
—
|
Cenoura (Daucus carota);
|
|
—
|
Azevém-perene (Lolium perenne);
|
C.32. ENSAIO DE REPRODUÇÃO COM ENQUITREÍDEOS
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 220 (2004) da OCDE. Destina-se a avaliar os efeitos de produtos químicos na reprodução de vermes da espécie Enchytraeus albidus Henle 1873, no solo. Baseia-se essencialmente num método desenvolvido pelo Umweltbundesamt da Alemanha (1), sujeito a um estudo interlaboratorial comparativo (2). Foram ponderados outros métodos para avaliar a toxicidade das substâncias químicas para os enquitreídeos e para as minhocas (3) (4) (5) (6) (7) (8).
|
CONSIDERAÇÕES INICIAIS
|
2.
|
Os anelídeos do género Enchytraeus, que vivem no solo, são espécies ecologicamente relevantes para ensaios ecotoxicológicos. Embora os enquitreídeos se encontrem geralmente em solos com minhocas, abundam também, com frequência, em solos isentos destas. Podem ser utilizados em ensaios laboratoriais, bem como em estudos total ou parcialmente de campo. Do ponto de vista prático, muitas espécies de enquitreídeos são de manuseamento e reprodução fáceis, sendo o seu tempo de geração significativamente inferior ao das minhocas. Assim, a duração de um ensaio de reprodução com enquitreídeos é de apenas 4 a 6 semanas, enquanto, no caso das minhocas (Eisenia fetida), é de 8 semanas.
|
|
3.
|
As informações de base sobre a ecologia e a ecotoxicologia dos enquitreídeos no ambiente terrestre podem ser consultadas em (9) (10) (11) (12).
|
PRINCÍPIO DO ENSAIO
|
4.
|
Expõem-se vermes adultos da família Enchytraeidae a uma gama de concentrações do produto químico em estudo misturado num solo artificial. O ensaio pode ser dividido em duas etapas: a) caso não estejam disponíveis informações suficientes, um ensaio de determinação da gama de concentrações, no qual a mortalidade, determinada após duas semanas de exposição, é o principal ponto final e b) um ensaio de reprodução definitivo no qual se avalia o número total de juvenis produzidos pelos progenitores, bem como a sobrevivência destes últimos. A duração do ensaio definitivo é de seis semanas. Após as primeiros três semanas, retiram-se os vermes adultos e registam-se as alterações morfológicas. Após um período suplementar de três semanas, contabiliza-se o número de descendentes provenientes da eclosão dos ovos postos pelos adultos. A taxa de reprodução dos animais expostos ao produto químico em estudo é comparada com a taxa de reprodução do(s) controlo(s), a fim de determinar i) a concentração sem efeitos observáveis (NOEC) e/ou ii) a ECx (por exemplo, EC10, EC50), por recurso a um modelo de regressão linear de estimativa da concentração que induza um decréscimo de x % na taxa de reprodução. As concentrações de ensaio devem abranger a ECx (por exemplo, EC10, EC50), para que a ECx possa ser obtida por interpolação em vez de extrapolação.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
5.
|
De preferência, devem conhecer-se a solubilidade em água, o log Kow, o coeficiente de partição solo-água (ver, por exemplo, os capítulos C.18 ou C.19 do presente anexo) e a pressão de vapor do produto químico em estudo. É desejável dispor de informações adicionais sobre o destino do produto químico no solo, nomeadamente as taxas de fotólise e de hidrólise.
|
|
6.
|
O presente método de ensaio pode ser utilizado com produtos químicos solúveis ou insolúveis em água. No entanto, o modo de aplicação do produto químico em estudo varia consoante o caso. O método não é aplicável a produtos químicos voláteis, ou seja, produtos cuja constante de Henry ou cujo coeficiente de partição ar/água forem superiores a 1, nem a produtos químicos cuja pressão de vapor exceda 0,0133 Pa a 25 °C.
|
VALIDADE DO ENSAIO
|
7.
|
Para que um ensaio seja válido, devem ser satisfeitos os seguintes critérios relativamente aos controlos:
|
—
|
a mortalidade dos animais adultos não deve exceder 20 % no final do ensaio de determinação da gama de concentrações e decorridas as primeiras três semanas do ensaio de reprodução
|
|
—
|
pressupondo que, no ensaio, foram utilizados 10 adultos por recipiente, é de esperar que, no final, haja, em média, pelo menos, 25 juvenis
|
|
—
|
o coeficiente de variação da média do número de juvenis não deve ser superior a 50 % no final do ensaio de reprodução.
|
Quando um ensaio não satisfaz os critérios de validade atrás referidos, deve ser suspenso, a não ser que exista uma justificação para o prosseguir. Essa justificação deve obrigatoriamente constar do relatório do ensaio.
|
PRODUTO QUÍMICO DE REFERÊNCIA
|
8.
|
Deve submeter-se a ensaios regulares, ou utilizar-se em todos os ensaios, um produto químico de referência, a fim de verificar se a resposta dos organismos em estudo não varia significativamente ao longo do tempo. O carbendazime é adequado como substância química de referência, tendo sido provado que afeta a sobrevivência e a reprodução dos enquitreídeos (13) (14); podem também utilizar-se outros produtos químicos cujos dados de toxicidade sejam bem conhecidos. Num estudo interlaboratorial comparativo (2), foi utilizada uma formulação de carbendazime conhecida pela designação comercial de Derosal™, fornecida pela empresa AgrEvo (Frankfurt, Alemanha), com 360 g/l (32,18 %) de ingrediente ativo. A EC50 para a reprodução, determinada no estudo interlaboratorial, situava-se no intervalo 1,2 ± 0,8 mg de ingrediente ativo por quilograma de massa seca (2). Se a série de ensaios incluir um padrão tóxico positivo, utiliza-se uma concentração, devendo o número de replicados ser o mesmo que nos controlos. Para o ensaio do carbendazime em formulação líquida, recomenda-se a utilização de 1,2 mg de ingrediente ativo por kg de peso seco.
|
DESCRIÇÃO DO ENSAIO
Equipamento
|
9.
|
Os recipientes de ensaio devem ser de vidro ou de outro material quimicamente inerte. Podem utilizar-se frascos de vidro (por exemplo, volume: 0,20-0,25 litros; diâmetro: ≈ 6 cm). Os recipientes devem ter tampas transparentes (por exemplo, de vidro ou polietileno) concebidas para reduzir a evaporação de água, mas permitindo a troca de gases entre o solo e a atmosfera. As tampas devem ser transparentes, para permitir a transmissão da luz.
|
|
10.
|
Utiliza-se material de laboratório de uso corrente, nomeadamente o seguinte:
|
—
|
microscópio estereoscópico;
|
|
—
|
medidor de pH e fotómetro;
|
|
—
|
balanças de precisão adequadas;
|
|
—
|
equipamentos adequados para o controlo da temperatura;
|
|
—
|
equipamentos adequados para controlo da humidade (não essencial se os recipientes de exposição tiverem tampas);
|
|
—
|
incubadora ou pequena câmara com sistema de ar condicionado;
|
|
—
|
pinças, ganchos ou laços;
|
|
Preparação do solo artificial
|
11.
|
O presente ensaio utiliza um solo artificial (5) (7) com a seguinte composição (peso seco, com secagem até à obtenção de um peso constante, a 105 °C ):
|
—
|
10 % de turfa de esfagno, seca ao ar e finamente moída (é aceitável uma granulometria de 2 ± 1 mm); recomenda-se verificar se um solo preparado com um novo lote de turfa é adequado à cultura dos vermes antes de estes serem utilizados num ensaio;
|
|
—
|
20 % de argila caulínica, de preferência com teor de caulinite superior a 30 %;
|
|
—
|
aproximadamente 0,3 a 1,0 % de carbonato de cálcio (CaCO3) pulverizado, de pureza analítica, de forma a obter um pH de 6,0 ± 0,5; a quantidade de carbonato de cálcio a utilizar pode depender principalmente da qualidade ou da natureza da turfa;
|
|
—
|
Cerca de 70 % de areia de quartzo seca ao ar (em função da quantidade de CaCO3 necessária), com predominância de areia fina com mais de 50 % de partículas de granulometria compreendida entre 50 e 200 μm.
|
Antes de utilizar um solo artificial num ensaio definitivo, é conveniente demonstrar sua adequação à cultura dos vermes e averiguar se satisfaz os critérios de validade do ensaio. Estas verificações são especialmente recomendadas para garantir que o desempenho do ensaio não é afetado se o teor de carbono orgânico do solo artificial for reduzido (por exemplo, baixando o teor de turfa para 4-5 % e aumentando concomitantemente o teor de areia). A redução do teor de carbono orgânico permite diminuir as possibilidades de adsorção do produto químico em estudo (carbono orgânico) no solo, podendo, além disso, aumentar a disponibilidade do produto para os vermes. Foi demonstrado que os espécimes de Enchytraeus albidus podem cumprir os critérios de validade relativos à reprodução quando sujeitos a ensaio em solos naturais com teor de carbono orgânico inferior ao referido — por exemplo, 2,7 % (15). Embora limitada, a experiência adquirida revela que o mesmo se pode também conseguir em solo artificial com 5 % de turfa.
Nota: Se o solo natural for utilizado em ensaios complementares (por exemplo, ensaios de nível superior), deve também demonstrar-se a sua adequação ao cumprimento dos critérios de validade do ensaio.
|
|
12.
|
Misturam-se cuidadosamente (por exemplo, num misturador laboratorial de grandes dimensões) os componentes secos do solo. Esta operação deve ser executada cerca de uma semana antes do início do ensaio. O solo deve ser armazenado durante dois dias, para equilibrar ou estabilizar a acidez. Para determinar o pH, utiliza-se uma mistura de solo com uma solução de cloreto de potássio (KCl) 1 M ou de cloreto de cálcio (CaCl2) 0,01 M, numa proporção de 1:5 (ver ponto 16 e apêndice 3). Se a acidez do solo exceder a gama necessária (ver ponto 11), pode ser ajustada por adição de uma quantidade adequada de CaCO3. Se o solo for demasiado alcalino, o pH pode ser corrigido adicionando uma quantidade suplementar da mistura referida no ponto 11, excluindo o CaCO3.
|
|
13.
|
A capacidade máxima do solo artificial para reter água é determinada de acordo com os procedimentos descritos no apêndice 2. Um ou dois dias antes do início do ensaio, o solo artificial seco é humedecido por adição de uma quantidade de água desionizada suficiente para obter cerca de metade do teor final de água, ou seja, 40 a 60 % da capacidade máxima de retenção de água. No início do ensaio, o solo humedecido é dividido em porções correspondentes ao número de concentrações de ensaio (e do produto química de referência, se for caso disso) e de controlos utilizados. O teor de humidade é ajustado para 40-60 % da capacidade máxima de retenção de água com a solução do produto químico em estudo e/ou com água destilada ou desionizada (ver pontos 19 a 21). O teor de humidade é determinado no início e no final do ensaio, por secagem a peso constante, a 105 °C, devendo situar-se no intervalo de valores ideal para a sobrevivência dos vermes. Pode proceder-se a uma verificação simples do teor de humidade do solo esmagando suavemente uma amostra na mão; se o teor de humidade for correto, observam-se gotículas de água entre os dedos.
|
Seleção e preparação dos animais para ensaio
|
14.
|
A espécie recomendada para os ensaios é a Enchytraeus albidus (Henle 1837), membro da família Enchytraeidae (ordem Oligochaeta, filo Annelida). A E. albidus é uma das espécies da família Enchytraeidae cujos indivíduos apresentam maiores dimensões, tendo sido observados alguns com 35 mm de comprimento (17) (18). A E. albidus está distribuída por toda a Terra, ocorrendo em habitats marinhos, de água doce e terrestres, sobretudo em matéria orgânica em decomposição (algas e produtos de compostagem) e, mais raramente, em prados (9). A sua ampla tolerância ecológica e algumas variações morfológicas indicam a possível existência de diversas subespécies.
|
|
15.
|
A E. albidus encontra-se disponível no comércio, na forma de alimento para peixes. Deve verificar-se se a cultura está contaminada por outras espécies, normalmente de menores dimensões (1) (19). Se houver contaminação, lavam-se todos os vermes numa placa de Petri. Devem então selecionar-se, por meio de um microscópio estereoscópico, indivíduos adultos de E. albidus de grandes dimensões, com vista a iniciar uma nova cultura, rejeitando-se todos os restantes indivíduos. Os espécimes de E. albidus podem ser facilmente cultivados numa vasta gama de matérias orgânicas (ver apêndice 4). O ciclo de vida da E. albidus é curto, pois a maturidade ocorre entre os 33 dias (a 18 °C) e os 74 dias (a 12 °C). Devem utilizar-se nos ensaios apenas culturas mantidas no laboratório, sem problemas, durante, pelo menos, 5 semanas (uma geração).
|
|
16.
|
São igualmente adequadas outras espécies do género Enchytraeus, como, por exemplo, E. buchholzi Vejdovsky 1879 ou E. crypticus Westheide & Graefe 1992 (ver apêndice 5). Se se utilizarem outras espécies de Enchytraeus, importa identificá-las claramente e justificar a seleção.
|
|
17.
|
Os animais utilizados nos ensaios são vermes adultos. Devem conter ovos (malhas brancas) na região clitelial e as suas dimensões devem ser aproximadamente idênticas (cerca de 1 cm de comprimento). Não é necessário sincronizar a cultura de reprodução.
|
|
18.
|
Se os espécimes não forem criados no mesmo tipo de solo e nas condições (inclusive de alimentação) utilizadas para o ensaio final, devem ser aclimatados durante, pelo menos, 24 horas, até três dias. Deve-se começar por aclimatar um número de adultos superior ao necessário para a realização do ensaio, de forma a proporcionar uma margem para a rejeição de espécimes danificados ou que, de alguma forma, se revelem inadequados. No final do período de aclimatação, apenas são selecionados para o ensaio vermes que contenham ovos e não apresentem anomalias comportamentais (como, por exemplo, tentar escapar do solo). Os vermes são removidos cuidadosamente, por recurso a pinças de joalheiro, ganchos ou laços, e colocados numa placa de Petri com uma pequena quantidade de água doce. Para este efeito, é preferível utilizar água doce reconstituída, como proposto no capítulo C.20 do presente anexo (ensaio de reprodução com Daphnia magna), uma vez que a água desionizada, desmineralizada ou da torneira pode ser prejudicial para os vermes. Os vermes são inspecionados com um microscópio estereoscópico, rejeitando-se os que não contenham ovos. Importa remover e eliminar quaisquer ácaros ou espécimes de Collembola que possam ter contaminado as culturas. Os vermes saudáveis não utilizados no ensaio são devolvidos à cultura de reserva.
|
Preparação das concentrações de ensaio
Produtos químicos em estudo solúveis em água
|
19.
|
Prepara-se uma solução do produto químico em estudo em água desionizada numa quantidade suficiente para todos os replicados de uma concentração de ensaio. Recomenda-se a utilização de uma quantidade de água suficiente para obter o teor de humidade necessário, isto é, 40 a 60 % da capacidade máxima de retenção de água (ver ponto 13). Cada solução do produto químico é misturada de forma homogénea num lote de solo previamente humedecido, antes da introdução deste no recipiente de ensaio.
|
Produtos químicos insolúveis em água
|
20.
|
Os produtos químicos insolúveis em água mas solúveis em solventes orgânicos podem ser dissolvidos no volume mais baixo possível de um solvente adequado (por exemplo, acetona). Só devem utilizar-se solventes voláteis. O solvente é aspergido sobre uma pequena quantidade (por exemplo, 2,5 g) de areia de quartzo fina ou misturado com ela. É eliminado por evaporação num exaustor durante, pelo menos, uma hora. Esta mistura de areia de quartzo e produto químico é misturada com o solo previamente humedecido, procedendo-se a uma homogeneização cuidadosa após a adição de uma quantidade de água desionizada adequada para obter o teor de humidade necessário. Introduz-se a mistura final nos recipientes de ensaio.
|
|
21.
|
No caso de produtos químicos pouco solúveis em água ou em solventes orgânicos, mistura-se o equivalente de 2,5 g de areia de quartzo finamente moída por cada recipiente de ensaio com a quantidade do produto químico em estudo, até se obter a concentração de ensaio desejada. Esta mistura de areia de quartzo e produto químico é adicionada ao solo previamente humedecido, procedendo-se a uma homogeneização cuidadosa após a adição de uma quantidade de água desionizada adequada para obter o teor de humidade necessário. Divide-se a mistura final pelos recipientes de ensaio. Repete-se o procedimento para cada concentração de ensaio, preparando-se também um controlo adequado.
|
|
22.
|
Os produtos químicos não devem, normalmente, ser ensaiados a concentrações superiores a 1 000 mg por kg de massa seca de solo. Pode ser, contudo, necessário efetuar ensaios a concentrações mais elevadas, consoante os objetivos específicos do ensaio.
|
REALIZAÇÃO DO ENSAIO
Grupos de ensaio e grupos de controlo
|
23.
|
Para cada uma das concentrações de ensaio, coloca-se no recipiente uma quantidade de solo de ensaio correspondente a 20 g de peso seco (ver pontos 19 a 21). Preparam-se igualmente amostras de controlo sem o produto químico em estudo. Introduzem-se alimentos em cada recipiente, de acordo com os procedimentos descritos no ponto 29. Distribuem-se aleatoriamente 10 vermes por cada recipiente de ensaio. Com o auxílio, por exemplo, de pinças de ourives, ganchos ou laços, os vermes são cuidadosamente transferidos para os recipientes de ensaio e colocados à superfície do solo. O número de replicados das concentrações de ensaio e dos controlos depende do planeamento do ensaio (ver ponto 34). Os recipientes de ensaio são posicionados na incubadora de forma aleatória, sendo as suas posições alteradas, também aleatoriamente, uma vez por semana.
|
|
24.
|
Se se utilizar um solvente para a aplicação do produto químico em estudo, deve utilizar-se, além das séries de ensaio, uma série de controlo que contenha areia de quartzo pulverizada ou misturada com o solvente. A concentração dos solventes ou dispersantes deve ser igual à utilizada nos recipientes com o produto químico em estudo. No caso de produtos químicos que tenham de ser administrados de acordo com os procedimentos descritos no ponto 21, deve submeter-se a ensaio uma série de controlo com uma quantidade adicional de areia de quartzo (2,5 g por recipiente).
|
Condições de realização do ensaio
|
25.
|
A temperatura de ensaio é de 20 ± 2 °C. Para evitar a fuga de vermes do solo, o ensaio é efetuado em ciclos luz/obscuridade (de preferência, 16 horas de luz e 8 horas de obscuridade), com iluminação de 400 a 800 lux na zona dos recipientes de ensaio.
|
|
26.
|
Para verificar a humidade do solo, os recipientes são pesados no início do ensaio e, posteriormente, uma vez por semana. A perda de peso é compensada por adição de uma quantidade adequada de água desionizada. De notar que as perdas de água podem ser reduzidas mantendo níveis elevados de humidade do ar (> 80 %) na incubadora.
|
|
27.
|
O teor de humidade e o pH devem ser medidos no início e no final do ensaio de determinação da gama de concentrações e do ensaio definitivo. As medições devem ser feitas em amostras de solo de controlo e tratadas (com todas as concentrações), preparadas e mantidas nas mesmas condições que as culturas de ensaio, mas sem a presença de vermes. O alimento só deve ser adicionado às amostras de solo no início do ensaio, para facilitar a atividade microbiana. A quantidade de alimento deve ser a mesma que no caso das culturas de ensaio. Não é necessário colocar mais alimento nos recipientes durante o ensaio.
|
Alimentação
|
28.
|
Pode utilizar-se qualquer alimento adequado aos enquitreídeos. Verificou-se que os flocos de aveia, de preferência tratados em autoclave antes da utilização, para evitar a contaminação microbiana (também é possível proceder a um aquecimento simples), constituem um alimento adequado.
|
|
29.
|
O alimento é fornecido pela primeira vez dispersando 50 mg de flocos de aveia no solo de cada recipiente, antes da introdução dos vermes. Em seguida, os alimentos são fornecidos semanalmente até ao 21.o dia. Não é fornecida alimentação no 28.o dia, uma vez que, nessa fase, os adultos foram já removidos e que os juvenis têm necessidades alimentares relativamente reduzidas. A alimentação durante o ensaio é constituída por 25 mg de flocos de aveia moídos por recipiente, colocados cuidadosamente à superfície do solo, a fim de evitar ferimentos nos vermes. Para reduzir o desenvolvimento de fungos, os flocos de aveia devem ser enterrados sob pequenas quantidades de solo. Se subsistirem alimentos não consumidos, a ração deve ser reduzida.
|
Conceção do ensaio de determinação da gama de concentrações
|
30.
|
Se necessário, efetua-se um ensaio de determinação da gama de concentrações com, por exemplo, cinco concentrações do produto químico em estudo, respetivamente 0,1, 1,0, 10, 100 e 1 000 mg/kg (peso seco de solo). Basta um replicado para cada ensaio de tratamento e de controlo.
|
|
31.
|
O ensaio de determinação da gama de concentrações tem a duração de duas semanas. No final do ensaio, avalia-se a mortalidade dos vermes. Um verme é considerado morto se não reagir a um estímulo mecânico na extremidade anterior. Quaisquer informações adicionais sobre mortalidade podem ser úteis para estabelecer a gama de concentrações a utilizar no ensaio definitivo. As alterações de comportamento (por exemplo, incapacidade de se enterrar no solo ou imobilização junto da parede do recipiente) e de morfologia (por exemplo, presença de feridas abertas) entre os adultos devem, pois, ser registadas, juntamente com a eventual presença de juvenis. Esta última pode ser determinada utilizando o método de coloração descrito no apêndice 6.
|
|
32.
|
A LC50 pode ser determinada com aproximação através do cálculo da média geométrica dos dados de mortalidade. Na fixação da gama de concentrações a utilizar no ensaio definitivo, presume-se que os efeitos na reprodução são inferiores ao valor LC50 num fator máximo de 10. Trata-se, contudo, de uma relação empírica, que pode divergir em certos casos específicos. Quaisquer outras observações registadas no ensaio de determinação da gama de concentrações, como a ocorrência de juvenis, podem contribuir para uma definição mais precisa da gama de concentrações do produto químico em estudo a utilizar para o ensaio definitivo.
|
|
33.
|
Para uma determinação precisa do valor LC50, recomenda-se que se utilizem no ensaio, pelo menos, quatro replicados de cada concentração do produto químico em estudo e um número adequado de concentrações que produzam, pelo menos, quatro respostas significativamente diferentes do ponto de vista estatístico. Deve utilizar-se um número semelhante de concentrações e de replicados nos ensaios de controlo, caso estes tenham lugar.
|
Conceção do ensaio de reprodução definitivo
|
34.
|
Com base nas recomendações resultantes de um estudo interlaboratorial comparativo (2), propõem-se três conceções:
|
—
|
Para determinar a NOEC, devem submeter-se a ensaio, pelo menos, cinco concentrações em progressão geométrica. Recomenda-se a preparação de quatro replicados de cada concentração de ensaio, além de oito controlos. As concentrações devem diferir num fator não superior a 1,8.
|
|
—
|
Para a determinação de ECx (por exemplo EC10, EC50), importa submeter a ensaio, pelo menos, cinco concentrações, que devem abranger o valor ECx, de forma a permitir a interpolação de ECx em vez da extrapolação. Recomenda-se que sejam utilizados, pelo menos, quatro replicados para cada concentração de ensaio e quatro replicados de controlo. O fator de espaçamento pode ser inferior ou igual a 1,8 na gama com efeitos esperados e superior a 1,8 no caso das concentrações mais e menos elevadas.
|
|
—
|
A adoção de uma abordagem combinada permite determinar simultaneamente os parâmetros NOEC e ECx. Para tal, utilizam-se oito concentrações de ensaio em progressão geométrica. Recomenda-se a preparação de quatro replicados de cada concentração de ensaio, além de oito controlos. As concentrações devem diferir num fator não superior a 1,8.
|
|
|
35.
|
Utilizar 10 vermes adultos por recipiente de ensaio (ver ponto 23). O alimento é colocado nos recipientes no início do ensaio e, em seguida, uma vez por semana (ver ponto 29), até ao 21.o dia. No 21.o dia de ensaio, revistam-se cuidadosamente à mão as amostras de solo, observam-se e contam-se os vermes adultos vivos e registam-se as suas mudanças de comportamento (por exemplo, incapacidade de se enterrar no solo ou imobilização junto da parede do recipiente) e de morfologia (por exemplo, presença de feridas abertas). Todos os vermes adultos são então retirados dos recipientes e do solo de ensaio. Os solos de ensaio que contenham casulos são incubados durante três semanas suplementares nas mesmas condições de ensaio, com exceção da alimentação (25 mg de flocos de aveia moídos por recipiente), que só tem lugar no 35.o dia.
|
|
36.
|
Após um prazo de seis semanas, procede-se à contagem dos vermes eclodidos. Recomenda-se o método baseado na coloração com vermelho de Bengala (ver apêndice 6), embora também se tenham revelado adequadas outras técnicas de extração e flutuação por via húmida, mas não a quente (ver apêndice 6) — (4) (10) (11) (20). A recomendação deve-se ao facto de a extração por via húmida a partir de um substrato edáfico poder ser dificultada pela turbidez decorrente de partículas de argila em suspensão.
|
Ensaio do limite
|
37.
|
Se não forem observados efeitos com a concentração mais elevada no ensaio de determinação da gama de concentrações (1 000 mg/kg), o ensaio da reprodução pode ser executado como ensaio do limite, utilizando 1 000 mg/kg, com vista a demonstrar que a NOEC para a reprodução é superior a este valor.
|
Resumo e calendário do ensaio
|
38.
|
As etapas do ensaio podem ser resumidas da seguinte forma:
|
Momento
|
Ensaio de determinação da gama de concentrações
|
Ensaio definitivo
|
|
Dia -7 ou anterior
|
|
—
|
Preparação do solo artificial (mistura dos componentes secos)
|
|
|
—
|
Preparação do solo artificial (mistura dos componentes secos)
|
|
|
Dia -5
|
|
—
|
Verificação do pH do solo artificial
|
|
—
|
Medição da capacidade máxima de retenção de água do solo
|
|
|
—
|
Verificação do pH do solo artificial
|
|
—
|
Medição da capacidade máxima de retenção de água do solo
|
|
|
Dias -5 a -3
|
|
—
|
Seleção dos vermes para aclimatação
|
|
|
—
|
Seleção dos vermes para aclimatação
|
|
|
Dias -3 a 0
|
|
—
|
Aclimatação dos vermes durante, pelo menos, 24 horas
|
|
|
—
|
Aclimatação dos vermes durante, pelo menos, 24 horas
|
|
|
Dia -1
|
|
—
|
Humedecimento do solo artificial e distribuição em lotes
|
|
|
—
|
Humedecimento do solo artificial e distribuição em lotes
|
|
|
Dia 0
|
|
—
|
Preparação das soluções de reserva
|
|
—
|
Aplicação do produto químico em estudo
|
|
—
|
Pesagem do substrato de ensaio para os recipientes de ensaio
|
|
—
|
Medição do pH e do teor de humidade do solo
|
|
|
—
|
Preparação das soluções de reserva
|
|
—
|
Aplicação do produto químico em estudo
|
|
—
|
Pesagem do substrato de ensaio para os recipientes de ensaio
|
|
—
|
Medição do pH e do teor de humidade do solo
|
|
|
Dia 7
|
|
—
|
Verificação do teor de humidade do solo
|
|
|
—
|
Verificação do teor de humidade do solo
|
|
|
Dia 14
|
|
—
|
Determinação da mortalidade dos adultos
|
|
—
|
Estimativa do número de juvenis
|
|
—
|
Medição do pH e do teor de humidade do solo
|
|
|
—
|
Verificação do teor de humidade do solo
|
|
|
Dia 21
|
|
|
—
|
Observação do comportamento dos adultos
|
|
—
|
Determinação da mortalidade dos adultos
|
|
—
|
Verificação do teor de humidade do solo
|
|
|
Dia 28
|
|
|
—
|
Verificação do teor de humidade do solo
|
|
—
|
Suspensão da alimentação
|
|
|
Dia 35
|
|
|
—
|
Verificação do teor de humidade do solo
|
|
|
Dia 42
|
|
|
—
|
Contagem dos vermes juvenis
|
|
—
|
Medição do pH e do teor de humidade do solo
|
|
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
39.
|
Embora o apêndice 7 apresente um resumo, o presente método de ensaio não fornece orientações estatísticas definitivas para a análise dos resultados do ensaio.
|
|
40.
|
No ensaio de determinação do intervalo de concentrações, o principal ponto final é a mortalidade. As alterações de comportamento (por exemplo, incapacidade de se enterrar no solo; imobilização junto da parede do recipiente) e de morfologia (por exemplo, presença de feridas abertas) entre os adultos devem, porém, ser também registadas, juntamente com a eventual presença de juvenis. Para determinar a LC50, efetua-se em geral uma análise probit (21) ou uma regressão logística. Contudo, nos casos em que este método de análise não for adequado (por exemplo, se se tiverem utilizado menos de três concentrações parcialmente letais), podem aplicar-se métodos alternativos. De entre esses métodos, destacam-se as médias móveis (22), o método abreviado de Spearman-Karber (23) e a simples interpolação (por exemplo, média geométrica de LC0 e LC100, calculada através da raiz quadrada de LC0 multiplicada por LC100).
|
|
41.
|
No ensaio definitivo, o ponto final é a fecundidade (ou seja, o número de juvenis produzidos). Contudo, tal como no ensaio de determinação da gama de concentrações, todos os outros sinais de nocividade devem constar do relatório final. A análise estatística exige o cálculo da média aritmética e do desvio-padrão para cada amostra de tratamento e cada amostra de controlo, no ensaio de reprodução.
|
|
42.
|
Se tiver sido realizada uma análise de variância, o desvio-padrão, s, e os graus de liberdade, df, podem ser substituídos, respetivamente, por estimativas agregadas da variância obtidas pelo método ANOVA e pelos graus de liberdade destas, desde que a variância não dependa da concentração. Neste caso, utilizam-se as variâncias simples das amostras de controlo e de tratamento. Esses valores são geralmente calculados por recurso a um software estatístico comercial, utilizando os resultados por recipiente como replicados. Caso se afigure razoável proceder ao agrupamento de dados relativos aos controlos negativos e aos controlos com solvente em vez de repetir os ensaios, deve averiguar-se se apresentam diferenças significativas (para ensaios adequados, ver ponto 45 e apêndice 7).
|
|
43.
|
A realização de uma análise estatística e de uma inferência mais aprofundadas depende da normalidade da distribuição dos valores relativos aos replicados, bem como da sua homogeneidade em termos de variância.
|
Estimativa da NOEC
|
44.
|
Deve preferir-se o recurso a ensaios potentes. Para averiguar se os dados exibem uma distribuição aproximadamente normal, devem usar-se, por exemplo, informações provenientes da experiência anterior com estudos interlaboratoriais comparativos ou outros dados históricos. A homogeneidade da variância é mais crítica. A experiência revela que, muitas vezes, a variância aumenta com a média. Nestes casos, a transformação dos dados pode conduzir à homogeneidade da variância. No entanto, essa transformação deve basear-se na experiência adquirida com os dados históricos e não nos dados do ensaio. Com dados homogéneos, devem realizar-se testes t múltiplos, como o teste de Williams (α = 0,05, unilateral) (24) (25) ou, em, certos casos, o teste de Dunnett (26) (27). De notar que, em caso de replicação desigual, os valores t do quadro devem ser corrigidos, como sugerido por Dunnett e Williams. Por vezes, devido a uma grande variação, as respostas não exibem aumento ou diminuição regulares. O teste de Dunnett é mais adequado em caso de grandes desvios relativamente à monotonicidade. Se existirem desvios à homogeneidade da variância, pode justificar-se investigar de forma mais aprofundada os possíveis efeitos nesta, de forma a decidir se os testes t podem ser executados sem perda apreciável do seu significado (28). Em alternativa, pode executar-se um teste U múltiplo, como, por exemplo, o teste de Bonferroni na versão de Holm (29), ou, se os dados apresentarem homogeneidade da variância mas forem compatíveis com uma relação dose-resposta monótona subjacente, um outro ensaio não paramétrico [por exemplo, de Jonckheere-Terpstra (30) (31) ou de Shirley (32) (33)], geralmente de preferência a testes t de variância desigual (ver também o esquema do apêndice 7).
|
|
45.
|
Se for realizado um ensaio do limite e estiverem preenchidos os pré-requisitos dos procedimentos aplicáveis aos ensaios paramétricos (normalidade, homogeneidade), pode utilizar-se o teste t de Student par a par ou, em alternativa, o teste U de Mann-Whitney (29).
|
Estimativa da ECx
|
46.
|
Para o cálculo do valor ECx, efetua-se uma análise por regressão linear e não linear da média das séries, após a obtenção de uma função adequada dose-resposta. No caso do crescimento dos vermes como resposta contínua, os valores de ECx podem ser estimados através de uma análise de regressão adequada (35). De entre as funções de dados quantais (mortalidade/sobrevivência e número de descendentes produzidos) adequadas citam-se as funções sigmoide normal, logística e de Weibull, com dois a quatro parâmetros, alguns dos quais se adaptam também às respostas de hormese. Se uma função dose-resposta tiver sido ajustada por análise de regressão linear, deve determinar-se, com base nessa análise, um valor r2 significativo (coeficiente de determinação ) e/ou um declive, para estimar o valor de ECx, inserindo um valor correspondente a x % da média dos controlos na equação estabelecida por análise de regressão. Os limites dos intervalos de confiança de 95 % são calculados de acordo com Fieller (citado em Finney — referência 21) ou por outros métodos modernos adequados.
|
|
47.
|
Em alternativa, a resposta é modelizada em termos de percentagem ou proporção do parâmetro do modelo que é interpretado como a resposta média. Nestes casos, é possível ajustar facilmente aos resultados a curva sigmoide normal (curva logística ou de Weibull), por recurso ao método de regressão probit (21). Nestes casos, a função de ponderação tem de ser ajustada para ter em conta as respostas métricas — cf. Christensen (36). No entanto, se tiver ocorrido hormese, a análise probit deve ser substituída por uma função logística de quatro parâmetros ou função de Weibull, no contexto de um método de regressão não linear (36). Se não for possível adaptar os dados a uma função adequada dose-resposta, podem utilizar-se métodos alternativos para estimar o valor ECx e os seus limites de confiança, como as médias móveis de Thompson (22) e o método abreviado de Spearman-Karber (23).
|
RELATÓRIO DO ENSAIO
|
48.
|
O relatório do ensaio deve incluir as seguintes informações:
|
|
Produto químico em estudo:
|
—
|
natureza física e, se pertinente, propriedades físico-químicas (por exemplo, solubilidade em água, pressão de vapor);
|
|
—
|
identificação química do produto em estudo, de acordo com a nomenclatura IUPAC, número CAS, lote, fórmula estrutural e grau de pureza;
|
|
—
|
prazo de validade da amostra.
|
|
|
|
Espécies sujeitas a ensaio:
|
—
|
animais utilizados no ensaio: espécie, nome científico, origem dos organismos e condições de reprodução.
|
|
|
|
Condições de realização dos ensaios:
|
—
|
ingredientes e preparação do solo artificial;
|
|
—
|
método de aplicação do produto químico em estudo;
|
|
—
|
descrição das condições de ensaio, incluindo temperatura, teor de humidade, pH, etc.;
|
|
—
|
descrição completa do planeamento experimental e dos procedimentos.
|
|
|
|
Resultados do ensaio:
|
—
|
mortalidade dos vermes adultos após duas semanas e número de juvenis no final do ensaio de determinação da gama de concentrações;
|
|
—
|
mortalidade dos vermes adultos após duas semanas e número de juvenis no final do ensaio definitivo;
|
|
—
|
quaisquer sinais físicos ou sintomas patológicos e alterações comportamentais observadas nos organismos de ensaio;
|
|
—
|
os valores de LC50, NOEC e/ou ECx (por exemplo, EC50, EC10) para a reprodução, caso alguns deles sejam aplicáveis, com intervalos de confiança, e um gráfico do modelo utilizado para o seu cálculo, bem como todas as informações e observações úteis para a interpretação dos resultados.
|
|
Desvios aos procedimentos descritos no presente método de ensaio e quaisquer ocorrências anómalas durante o mesmo.
|
REFERÊNCIAS
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen — Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. & Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
(3)
|
Westheide, W. & Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. & Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. & Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Capítulo C.8 do presente anexo (Toxicidade em relação às minhocas).
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
ISO (International Organization for Standardization) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction (11268)]. ISO, Geneve.
|
|
(8)
|
Rundgren, S. & A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. & C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley & Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF — Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. & Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen — Prüfungskategorien der Forschung. UWSF — Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. & Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. & Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. & Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. & Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo & R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11 7 16 714 -719 Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 665-70
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. & F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman & Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. & J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Apêndice 1
Definições
No âmbito do presente método de ensaio, aplicam-se as seguintes definições:
Produto químico
: substância ou mistura.
ECx
(concentração com x % de efeitos): concentração que causa efeitos em x % dos organismos ensaiados durante um determinado período de exposição, comparativamente ao grupo de controlo. No presente ensaio, as concentrações são expressas em massa do produto químico em estudo por massa seca de solo utilizado.
LC0
(concentração não letal): concentração de um produto químico em estudo que não mata nenhum dos organismos de ensaio expostos durante um determinado período. No presente ensaio, os valores de LC0 são expressos em massa do produto químico em estudo por massa seca de solo utilizado.
LC50
(concentração letal mediana): concentração de um produto químico em estudo que mata 50 % dos organismos de ensaio expostos num determinado período. No presente ensaio, os valores de LC50 são expressos em massa do produto químico em estudo por massa seca de solo utilizado.
LC100
(concentração letal total): concentração de um produto químico em estudo que mata 100 % dos organismos de ensaio expostos num determinado período. No presente ensaio, os valores de LC100 são expressos em massa do produto químico em estudo por massa seca de solo utilizado.
LOEC (menor concentração com efeitos observáveis): a menor concentração da substância química em estudo que tem um efeito estatisticamente significativo (p < 0,05). No presente ensaio, os valores de LOEC são expressos em massa do produto químico em estudo por massa seca de solo utilizado. Em geral, todas as concentrações de ensaio superiores à LOEC devem apresentar um efeito estatisticamente diferente das amostras de controlo. Quaisquer desvios em relação às condições referidas para a identificação da LOEC devem ser justificados no relatório de ensaio.
NOEC (concentração sem efeitos observáveis): a concentração mais elevada do produto químico em estudo imediatamente abaixo da LOEC à qual não se observa nenhum efeito. Neste ensaio, a concentração NOEC não tem nenhum efeito com significância estatística (p < 0,05) num determinado período de exposição, comparativamente ao grupo de controlo.
Taxa de reprodução
: média do número de juvenis produzidos por um dado número de vermes adultos, no período de ensaio.
Produto químico em estudo
: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
Apêndice 2
Determinação da capacidade máxima de retenção de água
Determinação da capacidade de retenção de água do solo artificial
O método que se segue foi considerado adequado. É descrito no anexo C da norma ISO DIS 11268-2.
Recolher uma determinada quantidade (por exemplo, 5 g) de substrato de solo de ensaio com o auxílio de um instrumento adequado (tubo Auger, etc.). Cobrir o fundo do tubo com um pedaço de papel de filtro e, após o enchimento com água, introduzi-lo num suporte de banho-maria. O tubo deve ser submergido gradualmente, até que o nível de água se situe acima do topo da camada de solo. Deixar o tubo no banho-maria durante cerca de três horas. Dado não ser possível reter toda a água absorvida por capilaridade, deve deixar-se a amostra de solo escorrer durante duas horas, colocando o tubo num leito de areia de quartzo finamente moída e muito húmida, contido num recipiente fechado (para evitar a secagem). A amostra deve, em seguida, ser pesada e seca até massa constante à temperatura de 105 °C. A capacidade de retenção de água (WHC) pode ser calculada do seguinte modo:

em que:
|
S
|
=
|
substrato saturado de água + massa do tubo + massa do papel de filtro
|
|
T
|
=
|
tara (massa do tubo + massa do papel de filtro)
|
|
D
|
=
|
massa seca de substrato
|
REFERÊNCIAS:
ISO (Organização Internacional de Normalização) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
Apêndice 3
Determinação do pH do solo
O seguinte método de determinação do pH de uma amostra de solo baseia-se na descrição constante da norma ISO 10390 (Qualidade do solo — Determinação de pH).
Uma determinada quantidade de solo é seca à temperatura ambiente durante, pelo menos, 12 horas. A uma suspensão de solo que contenha, pelo menos, 5 g de solo adiciona-se cinco vezes o seu volume de uma solução 1 M de cloreto de potássio (KCl) de qualidade analítica ou de uma solução 0,01 M de cloreto de cálcio (CaCl2) também de qualidade analítica. A suspensão é agitada vigorosamente durante cinco minutos. Após a agitação, deixa-se a suspensão em repouso durante, pelo menos, 2 horas, mas não mais de 24 horas. O pH da fase líquida é então medido por recurso a um medidor de pH, calibrado, antes de cada medição, com uma série adequada de soluções-tampão (por exemplo, pH 4,0 e 7,0).
REFERÊNCIAS:
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
Apêndice 4
Condições de cultura de Enchytraeus sp.
Os enquitreídeos da espécie Enchytraeus albidus (bem como de outras espécies de Enchytraeus) podem ser cultivados em grandes caixas de plástico (por exemplo, 30 × 60 × 10 cm) cheias com uma mistura na proporção 1:1 de solo artificial e solo natural para jardinagem, não contaminado. Devem evitar-se materiais de compostagem, pois podem conter produtos químicos tóxicos, como metais pesados. Antes da utilização, deve remover-se qualquer fauna do solo (por exemplo, por ultracongelamento). É também possível utilizar um substrato que contenha apenas solo artificial, caso em que a taxa de reprodução pode ser mais baixa do que a obtida com um substrato de solo misto. O substrato para cultura deve ter um pH de 6,0 ± 0,5.
A cultura é mantida na obscuridade, a uma temperatura de 15 a 20 °C ± 2 °C. Devem evitar-se temperaturas superiores a 23 °C O solo deve estar apenas ligeiramente húmido. O teor correto de humidade do solo é indicado pelo surgimento de gotículas de água entre os dedos ao espremer ligeiramente o solo. Deve evitar-se o surgimento de condições anóxicas, garantindo que as coberturas dos recipientes de cultura permitem uma permuta adequada de gases com o ar ambiente. O solo deve ser cuidadosamente remexido todas as semanas, para facilitar o arejamento.
Os vermes podem ser alimentados com flocos de aveia. Os flocos de aveia devem ser guardados em recipientes herméticos e tratados em autoclave ou aquecidos antes da sua ministração, para evitar a infestação com ácaros (– por exemplo, Glyzyphagus sp., Astigmata, Acarina) ou Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina]. Após o tratamento a quente, os flocos devem ser moídos, para poderem ser facilmente espalhados na superfície do solo. Periodicamente, os flocos de aveia podem ser complementados pela adição de vitaminas, leite e óleo de fígado de bacalhau. O fermento de padaria e a comida para peixes TetraMin constituem outras fontes adequadas de alimento.
A alimentação tem lugar, aproximadamente, duas vezes por semana. Espalha-se uma quantidade adequada de flocos de aveia na superfície do solo e mistura-se cuidadosamente com o substrato ao remexer o solo para facilitar o arejamento. A quantidade de alimento fornecida, em termos absolutos, depende do número de vermes presentes no substrato. A título indicativo, deve aumentar-se a quantidade de alimentos se os mesmos tiverem sido totalmente consumidos um dia após o seu fornecimento. Reciprocamente, se subsistirem alimentos à superfície no momento da segunda alimentação (uma semana mais tarde), esta deve ser reduzida. Os alimentos contaminados com fungos devem ser removidos e substituídos. Decorridos três meses, transferem-se os vermes para um substrato recém-preparado.
As condições de cultura são consideradas satisfatórias se os vermes: a) não tentarem escapar do substrato de solo, b) se movimentarem com rapidez no solo, c) exibirem uma superfície exterior luzidia, sem aderirem às partículas do solo, d) apresentarem cor esbranquiçada, e) exibirem uma diversidade de gamas etárias nas culturas e f) se reproduzirem em permanência.
Apêndice 5
Desempenho do ensaio com outras espécies Enchytraeus
Seleção das espécies
Podem ser utilizadas outras espécies além da E. albidus, mas o procedimento de ensaio e os critérios de validade têm de ser adaptados em conformidade. Dado que muitas espécies Enchytraeus são facilmente acessíveis e podem ser conservadas de forma satisfatória nos laboratórios, o critério mais importante na seleção de espécies diferentes da E. albidus reside na importância ecológica e ainda na sensibilidade comparável. Pode também haver motivos de ordem formal para utilizar outra espécie. Por exemplo, nos países em que a E. albidus não ocorra e não possa ser importada — devido, por exemplo, a restrições de quarentena –, será necessário recorrer a outra espécie Enchytraeus.
Exemplos de espécies alternativas adequadas
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): nos últimos anos, esta espécie foi frequentemente utilizada em estudos ecotoxicológicos, dada a simplicidade da sua criação e da sua sujeição a ensaio. Contudo, as suas pequenas dimensões relativamente à E. albidus dificultam a manipulação, em especial nas etapas que precedem o método de coloração. Não está provado que a E. crypticus ocorra no campo, uma vez que tem sido descrita apenas em culturas de minhocas. Por conseguinte, desconhecem-se as suas exigências ecológicas.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): esta designação abrange provavelmente um grupo de espécies muito próximas que são morfologicamente difíceis de distinguir. Não se recomenda a sua utilização nos ensaios até que a espécie a que pertencem os indivíduos seja identificada. A E. buchholzi encontra-se geralmente em prados e locais movimentados, como a proximidade de estradas.
|
|
—
|
Enchytraeus luxuriosus: Esta espécie, recentemente descrita (1), foi inicialmente designada por E. “minutus”. Foi descoberta por U. Graefe, de Hamburgo, em pastagens na zona de St. Peter-Ording (Schleswig-Holstein, Alemanha). A E. luxuriosus tem aproximadamente metade do comprimento da E. albidus, mas é maior do que as outras espécies mencionadas neste contexto; pode constituir uma boa alternativa à E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): tem sido referida a ocorrência desta espécie em solos minerais na Alemanha e em Espanha, onde é comum mas, geralmente, não muito abundante. Em comparação com outras espécies pequenas do seu género, é relativamente fácil de identificar. Não são conhecidos o seu comportamento em testes laboratoriais nem a sua sensibilidade a produtos químicos. Verificou-se, contudo, que a sua cultura é fácil (E. Belotti, comunicação pessoal).
|
Condições de reprodução
Todas as espécies Enchytraeus atrás referidas podem ser cultivadas nos substratos utilizados para a E. albidus. Devido às suas dimensões mais reduzidas, os recipientes de cultura podem ser menores. Embora se possam utilizar os mesmos alimentos, as rações têm de ser ajustadas. Estas espécies têm um ciclo de vida mais curto do que o da E. albidus e precisam de ser alimentadas com maior frequência.
Condições de realização do ensaio
As condições de ensaio são, em geral, as mesmas que no caso da E. albidus,, exceto que:
|
—
|
o recipiente de ensaio pode ser menor;
|
|
—
|
a duração do ensaio de reprodução pode ser mais curta (por exemplo, quatro semanas em vez de seis); contudo, a duração do ensaio de determinação da gama de concentrações deve permanecer inalterada;
|
|
—
|
atendendo às pequenas dimensões dos vermes juvenis, recomenda-se vivamente o recurso ao método de coloração para a sua contagem;
|
|
—
|
o critério de validade relativo ao “número de juvenis em cada recipiente de ensaio nos controlos” deve ser alterado para “50”.
|
REFERÊNCIAS
|
(1)
|
Schmelz, R.M. & Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
Apêndice 6
Descrição pormenorizada das técnicas de extração
Coloração com vermelho de Bengala
Este método, desenvolvido originalmente no contexto da ecologia de sistemas limosos (1), foi proposto por W. de Coen (Universidade de Gante, Bélgica) para a contagem de enquitreídeos juvenis no ensaio de reprodução. Independentemente, foi elaborada por RIVM Bilthoven (2) (3) uma versão modificada, que utiliza vermelho de Bengala misturado com formaldeído em vez de etanol.
No final do ensaio definitivo (ou seja, decorridas seis semanas), os solos dos recipientes de ensaio são transferidos para um recipiente pouco profundo. Para o efeito, é adequado um recipiente Bellaplast ou uma bacia de fotografia de fundo rugoso, dado que as nervuras restringem a circulação dos vermes no campo de observação. Os juvenis são fixados com etanol (cerca de 5 ml por replicado). Os recipientes são enchidos com água até uma altura de 1 a 2 cm. Adicionam-se algumas gotas (200 to 300 μl) de vermelho de Bengala (solução a 1 % em etanol), ou, em alternativa, de eosina a 0,5 %, e misturam-se cuidadosamente os dois componentes. Após 12 horas, os vermes devem apresentar-se avermelhados, sendo fáceis de contar, pois estarão sobre a superfície do substrato. Em alternativa, a mistura substrato/álcool pode ser lavada através de uma peneira (dimensão da malha: 0,250 mm) antes da contagem dos vermes. Em consequência deste processo, a caulinite, a turfa e uma parte da areia são eliminadas, o que faz com que os vermes, de coloração avermelhada, se tornem mais visíveis e fáceis de contar. O recurso a lentes iluminadas (de dimensões mínimas 100 × 75 mm, com uma ampliação de 2 a 3 vezes) também facilita a contagem.
A técnica de coloração reduz o tempo de contagem a alguns minutos por recipiente; a título de orientação, deve ser possível a uma única pessoa proceder à avaliação de todos os recipientes de um ensaio num prazo máximo de dois dias.
Extração por via húmida
A extração por via húmida deve ter início imediatamente após o termo do ensaio. O solo de cada recipiente de ensaio é colocado em crivos de plástico com malha de cerca de 1 mm. Os crivos são seguidamente suspensos em recipientes de plástico, sem contacto com o fundo. Os recipientes são cuidadosamente enchidos com água até que as amostras nos crivos estejam totalmente imersas. Para garantir uma taxa de recuperação superior a 90 % do número total de vermes presentes, é conveniente utilizar um período de extração de 3 dias, a 20 °C ± 2 °C. No final do período de extração, retiram-se os crivos e decanta-se lentamente a água (com exceção de uma pequena quantidade), devendo ter-se o cuidado de não perturbar os sedimentos na parte inferior dos recipientes. Agitam-se em seguida ligeiramente os recipientes de plástico, com o objetivo de suspender os sedimentos na água sobrenadante. Transfere-se a água para uma placa de Petri. Quando as partículas de solo tiverem assentado, os enquitreídeos podem ser identificados, retirados e contabilizados, com o auxílio de um microscópio estereoscópico e de uma pequena pinça de aço.
Flutuação
Existe um método baseado na flutuação, descrito numa nota de R. Kuperman (4). Após a fixação com etanol do conteúdo de um recipiente de ensaio, o solo é embebido em Ludox (suspensão aquosa de sílica coloidal AM-30 a 30 % em massa) até 10 a 15 mm acima da superfície. Após homogeneização do solo com o agente de flutuação durante 2 a 3 minutos, podem contar-se facilmente os vermes juvenis que flutuam à superfície.
REFERÊNCIAS
|
(1)
|
Korinkova, J. & Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. & Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. & Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. & Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
Apêndice 7
Resumo da avaliação estatística dos dados (determinação da NOEC)
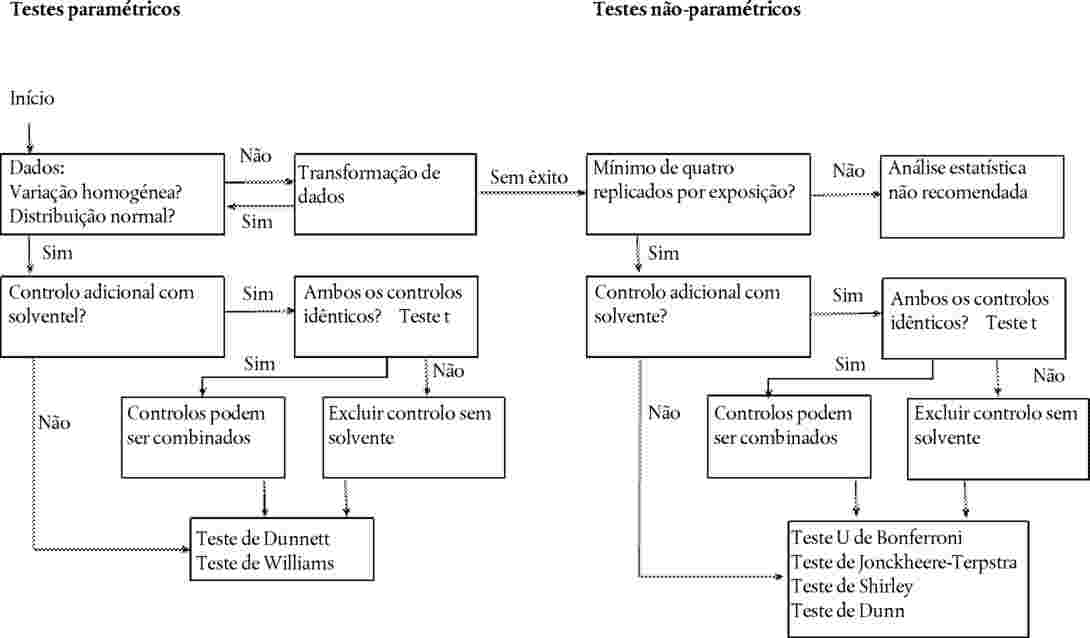
C.33. ENSAIO DE REPRODUÇÃO DE MINHOCAS (EISENIA FETIDA/ EISENIA ANDREI)
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 222 (2004) da OCDE. Destina-se a avaliar os efeitos que produtos químicos presentes no solo têm na reprodução (e em outros parâmetros subletais) de minhocas das espécies Eisenia fetida (Savigny 1826) e Eisenia andrei (Andre 1963) (1) (2). Foi submetido a um estudo interlaboratorial comparativo (3). Existe já um método de ensaio para a toxicidade aguda em minhocas (4). Foram publicadas diversas diretrizes internacionais e nacionais para a realização de ensaios de toxicidade aguda e crónica em minhocas (5) (6) (7) (8).
|
|
2.
|
A Eisenia fetida/ Eisenia andrei é considerada representativa da fauna do solo e, em particular, das minhocas. Estão disponíveis informações de base sobre a ecologia das minhocas e a sua utilização em ensaios ecotoxicológicos (7) (9) (10) (11) (12).
|
PRINCÍPIO DO ENSAIO
|
3.
|
Os vermes adultos são expostos a uma gama de concentrações do produto químico, quer em mistura com o solo quer, no caso dos pesticidas, em aplicação no interior ou à superfície do solo, através de procedimentos compatíveis com o padrão de utilização do produto químico. O método de aplicação é específico da finalidade do ensaio. A gama de concentrações de ensaio é selecionada de forma a englobar as concentrações suscetíveis de causarem efeitos subletais e letais num período de oito semanas. A mortalidade e os efeitos no crescimento das minhocas adultas são determinados após 4 semanas de exposição. Decorrido um novo período de 4 semanas, os adultos são retirados do solo, avaliando-se os efeitos na reprodução por contagem do número de descendentes presentes no solo. A taxa de reprodução dos vermes expostos ao produto químico em estudo é comparada com a taxa de reprodução do(s) controlo(s), a fim de determinar i) a concentração sem efeitos observáveis (NOEC) e/ou ii) a ECx (por exemplo, EC10, EC50), por recurso a um modelo de regressão linear para estimar a concentração que induz um decréscimo de x % na taxa de reprodução. As concentrações de ensaio devem abranger a ECx (por exemplo, EC10, EC50), para que a ECx possa ser obtida por interpolação em vez de extrapolação (ver definições no apêndice 1).
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
4.
|
Tendo em vista a elaboração de procedimentos de ensaio adequados, deve dispor-se das seguintes informações relativas ao produto químico em estudo:
|
—
|
informações sobre o destino e o comportamento no ambiente, sempre que possível (por exemplo, taxa de fotólise e taxa de hidrólise, quando pertinente para os padrões de aplicação).
|
|
|
5.
|
O presente método de ensaio é aplicável a todos os produtos químicos, independentemente da sua solubilidade em água. O método não é aplicável a produtos químicos voláteis, definidos como produtos químicos cuja constante de Henry ou cujo coeficiente de partição ar/água são superiores a 1, nem a produtos químicos cuja pressão de vapor excede 0,0133 Pa a 25 °C.
|
|
6.
|
Não é tida em conta uma eventual degradação do produto químico em estudo durante o período de ensaio. Por conseguinte, não se pode presumir que as concentrações de exposição se manterão ao longo de todo o ensaio. Em tais casos, recomenda-se uma análise química do produto químico, no início e no final do ensaio.
|
PRODUTO QUÍMICO DE REFERÊNCIA
|
7.
|
É necessário determinar a NOEC e/ou a ECx de um produto químico de referência, de forma a garantir que as condições de ensaio laboratoriais são adequadas e a averiguar se, do ponto de vista estatístico, a resposta dos organismos de ensaio não sofre alterações ao longo do tempo. É aconselhável proceder ao ensaio de um produto químico de referência pelo menos uma vez por ano ou, se os ensaios forem realizados com menor frequência, em paralelo com a determinação da toxicidade do produto químico em estudo. O carbendazime e o benomil são produtos de referência adequados, tendo-se demonstrado que afetam a reprodução (3). Devem observar-se efeitos significativos com concentrações a) entre 1 e 5 mg de ingrediente ativo por quilograma de massa seca ou b) entre 250 e 500 g/ha ou 25 e 50 mg/m2. Se a série de ensaios incluir um padrão tóxico positivo, utiliza-se uma concentração, devendo o número de replicados ser o mesmo que nos controlos.
|
VALIDADE DO ENSAIO
|
8.
|
Para que os resultados de um ensaio sejam considerados válidos, os controlos devem satisfazer os seguintes critérios:
|
—
|
cada replicado (com 10 animais adultos) deve produzir um número de juvenis ≥ 30 no final do ensaio;
|
|
—
|
o coeficiente de variação da taxa de reprodução deve ser ≤30 %;
|
|
—
|
a mortalidade dos adultos nas quatro primeiras semanas do teste deve ser ≤10 %.
|
Quando um ensaio não satisfaz os critérios de validade atrás referidos, deve ser suspenso, a não ser que exista uma justificação para o prosseguir. Essa justificação deve obrigatoriamente constar do relatório do ensaio.
|
DESCRIÇÃO DO ENSAIO
Equipamento
|
9.
|
Devem utilizar-se recipientes de vidro ou de outro material quimicamente inerte, com capacidade aproximada de 1 a 2 litros. Os recipientes devem ter uma secção transversal de cerca de 200 cm2, para que a adição de 500 a 600 g de massa seca de substrato produza um substrato húmido com cerca de 5 a 6 cm de profundidade. A conceção da tampa do recipiente deve permitir trocas gasosas entre o substrato e a atmosfera, bem como a entrada de luz (por exemplo, através de uma cobertura transparente perfurada), evitando, simultaneamente, a fuga dos vermes. Se a quantidade de substrato utilizada no ensaio for bastante superior a 500-600 g por recipiente, o número de vermes deve ser aumentado proporcionalmente.
|
|
10.
|
Utiliza-se material de laboratório de uso corrente, nomeadamente o seguinte:
|
—
|
microscópio estereoscópico;
|
|
—
|
medidor de pH e fotómetro;
|
|
—
|
balanças de precisão adequadas;
|
|
—
|
equipamentos adequados para o controlo da temperatura;
|
|
—
|
equipamentos adequados para controlo da humidade (não essencial se os recipientes de exposição tiverem tampas);
|
|
—
|
incubadora ou pequena câmara com sistema de ar condicionado;
|
|
—
|
pinças, ganchos ou laços;
|
|
Preparação do solo artificial
|
11.
|
O presente ensaio utiliza um solo artificial (5) (7) com a seguinte composição (peso seco, com secagem até à obtenção de um peso constante, a 105 °C):
|
—
|
10 % de turfa de esfagno, com um pH tão próximo quanto possível de 5,5-6,0, sem resíduos vegetais visíveis, finamente moída, seca até um determinado teor de humidade);
|
|
—
|
20 % de argila caulínica, de preferência com teor de caulinite superior a 30 %;
|
|
—
|
0,3 a 1,0 % de carbonato de cálcio (CaCO3) pulverizado, de pureza analítica, de forma a que o pH inicial seja de 6,0 ± 0,5;
|
|
—
|
70 % de areia de quartzo seca ao ar (em função da quantidade de CaCO3 necessária), com predominância de areia fina com mais de 50 % de partículas de granulometria compreendida entre 50 e 200 μm.
|
Nota 1: A quantidade necessária de CaCO3 depende dos componentes do substrato edáfico, incluindo os alimentos, e deve ser determinada através de medições em pequenas amostras de solo imediatamente antes do ensaio. O pH é medido com uma amostra mista, numa solução 1 M de cloreto de potássio (KCl) ou numa solução 0,01 M de cloreto de cálcio (CaCl2) (13).
Nota 2: Pode reduzir-se o teor de carbono orgânico do solo artificial — por exemplo, baixando o teor de turfa para 4-5 % e aumentando correspondentemente o teor de areia. A redução do teor de carbono orgânico permite diminuir as possibilidades de adsorção do produto químico em estudo (carbono orgânico) no solo, podendo, além disso, aumentar a disponibilidade do produto para os vermes. Foi demonstrado que a espécie Eisenia fetida pode cumprir os critérios de validade relativos à reprodução quando sujeita a ensaio em solos naturais com teor de carbono orgânico inferior — por exemplo, 2,7 % (14). A experiência adquirida revela que o mesmo se pode também conseguir num solo artificial com 5 % de turfa. Por conseguinte, antes da utilização de um solo artificial num ensaio definitivo, não é necessário demonstrar a sua adequação aos critérios de validade do ensaio, exceto se o teor de turfa for inferior ao atrás referido.
Nota 3: Se se utilizar solo natural em ensaios complementares (por exemplo, ensaios de nível superior), deve também demonstrar-se a sua adequação ao cumprimento dos critérios de validade do ensaio.
|
|
12.
|
Misturam-se cuidadosamente os componentes secos do solo (por exemplo, com auxílio de um misturador laboratorial de grandes dimensões), numa zona bem arejada. Antes do início do ensaio, o solo artificial seco é humedecido por adição de uma quantidade de água desionizada suficiente para a obtenção de cerca de metade do teor final de água, ou seja, 40 a 60 % da capacidade máxima de retenção de água (correspondente a massa seca humedecida a 50 ± 10 %). Produz-se assim um substrato isento de água fixa ou livre, quando comprimido na mão. A capacidade máxima do solo artificial para reter água é determinada de acordo com os procedimentos descritos no apêndice 2, na norma ISO 11274 (15) ou numa norma equivalente da UE.
|
|
13.
|
Se o produto químico em estudo for aplicado na superfície do solo ou misturado neste sem utilizar água, a quantidade final de água pode ser misturada no solo artificial durante a preparação deste último. Se o produto químico em estudo for misturado no solo juntamente com água, a água pode ser adicionada juntamente com o produto químico em estudo (ver ponto 19).
|
|
14.
|
O teor de humidade do solo é determinado no início e no final do ensaio, em conformidade com a norma ISO 11465 ou uma norma equivalente da UE (16), sendo o pH do solo determinado em conformidade com o apêndice 3, com a norma ISO 10390 (13) ou com uma norma equivalente da UE. As determinações devem ser realizadas com uma amostra de controlo do solo e uma amostra de solo com cada concentração de ensaio. O pH do solo não deve ser ajustado quando se sujeitem a ensaio produtos químicos ácidos ou básicos. O teor de humidade deve ser monitorizado durante o ensaio, mediante pesagem periódica dos recipientes (ver pontos 26 e 30).
|
Seleção e preparação dos animais para ensaio
|
15.
|
As espécies utilizadas no ensaio são a Eisenia fetida ou a Eisenia andrei (1) (2). O ensaio deve iniciar-se com vermes adultos, providos de clitelo, com idade entre dois meses e um ano. Os vermes devem ser selecionados a partir de uma cultura sincronizada com estrutura etária relativamente homogénea (apêndice 4). Em cada grupo de ensaio, a idade dos indivíduos não deve diferir em mais de quatro semanas.
|
|
16.
|
Os vermes selecionados devem ser aclimatados durante, pelo menos, um dia ao tipo de substrato de solo artificial a utilizar no ensaio. Durante este período, os vermes devem ser alimentados com o alimento a utilizar no ensaio (ver pontos 31 a 33).
|
|
17.
|
Pesam-se individualmente grupos de 10 vermes, que se colocam de forma aleatória nos recipientes no início do ensaio. Os vermes são lavados com água desionizada antes da pesagem; remove-se o excesso de água colocando os vermes por breves instantes sobre papel de filtro. A massa húmida de cada verme deve ser da ordem de 250 a 600 mg.
|
Preparação das concentrações de ensaio
|
18.
|
Podem utilizar-se dois métodos para a aplicação do produto químico em estudo: mistura do produto químico no solo (ver pontos 19 a 21) ou aplicação na superfície do solo (ver pontos 22 a 24). A seleção do método adequado depende da finalidade do ensaio. Em geral, recomenda-se a mistura do produto químico no solo. No entanto, pode ser necessário utilizar processos de aplicação compatíveis com as práticas agrícolas comuns (por exemplo, pulverização de formulações líquidas ou utilização de formulações pesticidas especiais, como grânulos ou formulações para tratamento de sementes). Os solventes utilizados como auxiliares do tratamento do solo com o produto químico em estudo devem ser selecionados em função da sua baixa toxicidade para as minhocas, devendo o procedimento de ensaio incluir um controlo adequado do solvente (ver ponto 27).
|
Mistura do produto químico no solo
Produtos químicos solúveis em água
|
19.
|
Imediatamente antes do início do ensaio, prepara-se uma solução do produto químico em água desionizada numa quantidade suficiente para todos os replicados de uma concentração. Pode ser necessário um cossolvente para facilitar a preparação da solução de ensaio. É conveniente preparar a quantidade de solução necessária para atingir o teor de humidade final (40 a 60 % da capacidade máxima de retenção de água). A solução é misturada cuidadosamente com o substrato do solo antes da sua introdução num recipiente de ensaio.
|
Produtos químicos insolúveis em água
|
20.
|
O produto químico em estudo é dissolvido num pequeno volume de um solvente orgânico adequado (por exemplo, acetona) e, em seguida, aspergido ou misturado numa pequena quantidade de areia de quartzo fina. Seguidamente, o solvente é eliminado por evaporação num exaustor durante, pelo menos, alguns minutos. A areia tratada é então misturada cuidadosamente com o solo artificial previamente humedecido. Adiciona-se a quantidade de água desionizada necessária para atingir um teor final de humidade de 40 a 60 % da capacidade máxima de retenção de água, misturando bem. O solo está então pronto para ser colocado nos recipientes de ensaio. Dado que alguns solventes podem ser tóxicos para as minhocas, há que tomar os devidos cuidados.
|
Produtos químicos insolúveis em água e em solventes orgânicos
|
21.
|
Prepara-se uma mistura constituída por 10 g de areia de quartzo industrial finamente moída e a quantidade do produto químico em estudo necessária para obter a concentração de ensaio no solo. A mistura é homogeneizada no solo artificial previamente humedecido. Adiciona-se a quantidade de água desionizada necessária para atingir um teor final de humidade de 40 a 60 % da capacidade máxima de retenção de água, misturando bem. O solo está então pronto para ser colocado nos recipientes de ensaio.
|
Aplicação do produto químico na superfície do solo
|
22.
|
O solo é tratado após a adição dos vermes. Os recipientes de ensaio são enchidos com o substrato de solo humedecido e colocam-se as minhocas, previamente pesadas, na superfície. Em geral, os vermes saudáveis começam de imediato a enterrar-se no substrato, pelo que quaisquer espécimes que permaneçam à superfície ao cabo de 15 minutos são considerados anómalos e devem ser substituídos. Se houver substituição de vermes, devem-se pesar quer os substituintes quer os substituídos, para se conhecer o peso total do grupo de vermes vivos expostos e o peso total do recipiente com vermes no início do ensaio.
|
|
23.
|
Procede-se à aplicação do produto químico em estudo. Esta não deve ter lugar na meia hora subsequente à introdução das minhocas (ou se houver vermes na superfície do solo), de modo a evitar qualquer exposição direta ao produto por contacto com a pele. Se o produto químico em estudo for um pesticida, pode justificar-se aplicá-lo na superfície do solo por pulverização. O produto químico em estudo deve ser aplicado na superfície do solo de forma tão uniforme quanto possível, por recurso a um dispositivo adequado de pulverização à escala laboratorial que simule a pulverização em campo. Antes da aplicação, a tampa do recipiente de ensaio deve ser removida e substituída por um invólucro que proteja da pulverização as paredes laterais do recipiente. O invólucro pode ser constituído por um recipiente de ensaio ao qual se removeu a base. A aplicação deve ter lugar a uma temperatura de 20 ± 2 ?C e, no caso das soluções aquosas, emulsões e dispersões em água, a uma taxa compreendida entre 600 e 800 μl/m2. Esta taxa deve ser verificada por recurso a uma técnica de calibração adequada. As formulações especiais, como grânulos ou formulações para tratamento de sementes, devem ser aplicadas de modo compatível com a utilização para fins agrícolas.
|
|
24.
|
Os recipientes de ensaio devem ser deixados descobertos durante uma hora, para permitir a evaporação de qualquer solvente volátil utilizado na aplicação do produto químico em estudo. Devem tomar-se os devidos cuidados para que, nesse período, nenhum espécime saia dos recipientes de ensaio.
|
PROCEDIMENTO
Grupos de ensaio e grupos de controlo
|
25.
|
Recomenda-se uma carga de 10 minhocas em 500-600 g de massa seca de solo artificial (ou seja, 50-60 g de solo por minhoca). Se se utilizarem quantidades maiores de solo, como no caso do ensaio de pesticidas com modos especiais de aplicação (por exemplo, formulações para tratamento de sementes), deve manter-se a carga de 50-60 g de solo por verme aumentando o número de indivíduos. Preparam-se 10 vermes por cada recipiente de controlo e de exposição. Os vermes são lavados com água e limpa e colocados sobre papel absorvente durante um curto período, para permitir a remoção da água em excesso.
|
|
26.
|
A fim de evitar erros sistemáticos na distribuição dos vermes nos recipientes de ensaio, a homogeneidade da população a testar deve ser determinada por pesagem individual de 20 indivíduos colhidos aleatoriamente da população-fonte. Uma vez assegurada a homogeneidade, selecionam-se e pesam-se lotes de vermes, a distribuir aleatoriamente pelos recipientes de ensaio. Após a adição dos vermes, pesa-se cada recipiente de ensaio, para assegurar a existência de um peso inicial que pode servir de base para a monitorização do teor de humidade do solo durante todo o ensaio, como descrito no ponto 30. Os recipientes de ensaio são cobertos de acordo com o ponto 9 e colocados na câmara de ensaio.
|
|
27.
|
Preparam-se amostras-controlo adequadas para cada um dos métodos de aplicação do produto químico em estudo descritos nos pontos 18 a 24. Seguem-se os procedimentos descritos para preparar os controlos, exceto que não é adicionado o produto químico em estudo. Assim, quando necessário, são aplicadas aos controlos solventes orgânicos, areia de quartzo ou outros veículos, em concentrações ou quantidades compatíveis com as utilizadas nas amostras de ensaio. Se se adicionar um solvente ou outro veículo ao produto químico em estudo, deve preparar-se e submeter-se a ensaio uma amostra-controlo suplementar de controlo sem o veículo ou o produto químico em estudo, de forma a garantir que o veículo não influi nos resultados.
|
Condições de realização do ensaio
|
28.
|
A temperatura de ensaio é de 20 ± 2 °C. O ensaio é efetuado em ciclos luz/obscuridade (de preferência, 16 horas de luz e 8 horas de obscuridade), com iluminação de 400 a 800 lux na zona dos recipientes de ensaio.
|
|
29.
|
Os recipientes não são arejados durante o ensaio, mas a conceção das suas coberturas deve permitir trocas gasosas, embora limitando a evaporação da humidade (ver ponto 9).
|
|
30.
|
O teor em água do substrato edáfico nos recipientes de ensaio é mantido ao longo do ensaio, através da repesagem periódica dos recipientes de ensaio (excluindo as coberturas). As perdas são compensadas, na medida do necessário, com água desionizada. O teor de água não deve variar mais de 10 % em relação ao início do ensaio.
|
Alimentação
|
31.
|
Considera-se aceitável qualquer alimento que se tenha revelado adequado para, no mínimo, manter o peso dos vermes durante o ensaio. A experiência demonstra que a farinha de aveia e o estrume de cavalo ou bovino constituem alimentos adequados. Devem realizar-se controlos para garantir que os bovinos ou equinos que produzem o estrume não são alvo de tratamento com medicamentos ou produtos químicos, como promotores de crescimento, nematicidas ou produtos veterinários semelhantes que possam afetar os vermes durante o ensaio. Recomenda-se a utilização de estrume de bovino recolhido, dado a experiência mostrar que o estrume disponível no comércio sob a forma de adubo para jardinagem pode ter efeitos adversos nos vermes. O estrume deve ser seco ao ar, finamente triturado e pasteurizado antes da utilização.
|
|
32.
|
Para garantir a qualidade adequada, cada novo lote de alimentos deve ser fornecido a uma cultura de vermes não utilizada no ensaio antes da sua utilização neste. O crescimento e a produção de casulos não devem ser reduzidos em comparação com os vermes mantidos num substrato desprovido do novo lote de alimentos, conforme descrito no método de ensaio C.8 (4).
|
|
33.
|
O alimento é fornecido pela primeira vez no dia seguinte ao da colocação dos vermes e da aplicação do produto químico no solo. Espalham-se na superfície do solo de cada recipiente cerca de 5 g de alimento, que se humidificam com água desionizada (5 ml a 6 ml por recipiente). Posteriormente, durante o período de ensaio de 4 semanas, o alimento é fornecido uma vez por semana. Se o alimento não for consumido, a ração deve ser reduzida, de modo a evitar o desenvolvimento de fungos e bolores. Os adultos são retirados do solo no 28.o dia de ensaio. Colocam-se então mais 5 g de alimento em cada recipiente de ensaio. Não é fornecida qualquer alimentação nas restantes 4 semanas do ensaio.
|
Seleção das concentrações de ensaio
|
34.
|
O conhecimento prévio da toxicidade do produto químico em estudo (por exemplo, com base num ensaio de toxicidade aguda (4) e/ou em ensaios de determinação da gama de concentrações) constitui um bom contributo para a seleção das concentrações de ensaio adequadas. Se necessário, efetua-se um ensaio de determinação da gama de concentrações com, por exemplo, cinco concentrações do produto químico em estudo, respetivamente 0,1, 1,0, 10, 100 e 1 000 mg/kg (massa seca do solo). Basta um replicado para cada ensaio de tratamento e de controlo. A duração do ensaio de determinação da gama de concentrações é de duas semanas, sendo a mortalidade avaliada no final do ensaio.
|
Conceção experimental
|
35.
|
Uma vez que não é possível prescrever um único parâmetro estatístico, o presente método de ensaio prevê a determinação dos parâmetros NOEC e ECx. É provável que a NOEC seja exigida pelas autoridades reguladoras num futuro previsível. Num futuro próximo, pode preconizar-se uma utilização mais vasta da ECx, com base em considerandos de natureza estatística e ecológica. Portanto, propõem-se três conceções, baseadas nas recomendações resultantes do estudo interlaboratorial comparativo de um método de reprodução com enquitreídeos (17).
|
|
36.
|
Na escolha da gama de concentrações, importa ter presente o seguinte:
|
—
|
Para a determinação da NOEC, devem submeter-se a ensaio, pelo menos, cinco a doze concentrações em progressão geométrica. Recomenda-se a preparação de quatro replicados de cada concentração de ensaio, além de oito controlos. As concentrações devem diferir num fator não superior a 2,0.
|
|
—
|
Para a determinação da ECx (por exemplo: EC10, EC50), recomenda-se um número adequado de concentrações passíveis de induzir, pelo menos, quatro respostas médias com diferenças estatisticamente significativas. Recomenda-se também preparar, pelo menos, dois replicados de cada concentração de ensaio e seis replicados de controlo. O fator de espaçamento pode ser inferior ou igual a 1,8 na gama com efeitos esperados e superior a 1,8 no caso das concentrações mais e menos elevadas.
|
|
—
|
Uma abordagem combinada permite a determinação simultânea da NOEC e da ECx. Devem utilizar-se oito concentrações de ensaio em progressão geométrica. Recomenda-se a preparação de quatro replicados de cada concentração de ensaio, além de oito controlos. As concentrações devem diferir num fator não superior a 1,8.
|
|
Duração do ensaio e medições
|
37.
|
No 28.o dia, observam-se e contam-se os vermes adultos vivos. Registam-se também alterações insólitas de comportamento (por exemplo, incapacidade de se enterrar no solo ou imobilização) e de morfologia (por exemplo, presença de feridas abertas). Seguidamente, retiram-se dos recipientes de ensaio, contam-se e pesam-se todos os vermes adultos. A transferência do solo com os vermes para um recipiente limpo, antes da avaliação, pode facilitar a pesquisa dos indivíduos adultos. Os vermes retirados do solo são lavados com água desionizada antes da pesagem; o excesso de água é removido colocando os vermes por breves instantes sobre papel de filtro. Os vermes não encontrados neste momento devem ser registados como mortos, pressupondo-se que morreram e se decompuseram antes da avaliação.
|
|
38.
|
O solo que tiver sido retirado dos recipientes é então reposto, sem os vermes adultos mas com os eventuais casulos produzidos. Em seguida, o solo é incubado durante mais quatro semanas nas mesmas condições, exceto que a alimentação tem lugar apenas uma vez, no início desta fase do ensaio (ver ponto 33).
|
|
39.
|
No termo do segundo período de 4 semanas, determinam-se, utilizando os procedimentos descritos no apêndice 5, o número de juvenis provenientes da eclosão dos casulos no solo de ensaio e o número de casulos. Registam-se também, ao longo do ensaio, quaisquer sinais de danos apresentados pelos vermes.
|
Ensaio do limite
|
40.
|
Se não se observarem efeitos com a concentração mais elevada no ensaio de determinação da gama de concentrações (1 000 mg/kg), o ensaio da reprodução é executado como ensaio do limite, utilizando uma concentração de ensaio de 1 000 mg/kg. Um ensaio do limite representa uma oportunidade para demonstrar que a NOEC para a reprodução é superior à concentração-limite, minimizando, ao mesmo tempo, o número de vermes utilizados no ensaio. Devem utilizar-se oito replicados tanto no caso das amostras de ensaio como das amostras de controlo.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
41.
|
Embora o apêndice 6 apresente um resumo, o presente método de ensaio não fornece orientações estatísticas definitivas para a análise dos resultados do ensaio.
|
|
42.
|
Um dos pontos finais é a mortalidade. As alterações de comportamento (por exemplo, incapacidade de se enterrar no solo; imobilização junto da parede do recipiente) e de morfologia (por exemplo, presença de feridas abertas) entre os adultos devem, porém, ser também registadas, juntamente com a eventual presença de juvenis. Para determinar a LC50, efetua-se em geral uma análise probit (18) ou uma regressão logística. Contudo, nos casos em que este método de análise não for adequado (por exemplo, se tiverem sido utilizadas menos de três concentrações parcialmente letais), podem aplicar-se métodos alternativos. De entre esses métodos, destacam-se as médias móveis (19), o método abreviado de Spearman-Karber (20) e a simples interpolação (por exemplo, média geométrica de LC0 e LC100, calculada através da raiz quadrada de LC0 multiplicada por LC100).
|
|
43.
|
O outro ponto final é a fecundidade (ou seja, o número de juvenis produzidos). Contudo, tal como no ensaio de determinação da gama de concentrações, todos os outros sinais de nocividade devem constar do relatório final. A análise estatística exige o cálculo da média aritmética

e do desvio-padrão para cada amostra de tratamento e cada amostra de controlo, no ensaio de reprodução. |
|
44.
|
Se se tiver realizado uma análise de variância, o desvio-padrão, s, e os graus de liberdade, df, podem ser substituídos, respetivamente, por estimativas agregadas da variância obtidas pelo método ANOVA e pelos graus de liberdade destas, desde que a variância não dependa da concentração. Neste caso, utilizam-se as variâncias simples das amostras de controlo e de tratamento. Esses valores são geralmente calculados por recurso a um software estatístico comercial, utilizando os resultados por recipiente como replicados. Caso se afigure razoável proceder ao agrupamento de dados relativos aos controlos negativos e aos controlos com solventes em vez de repetir os ensaios, deve averiguar-se se apresentam diferenças significativas (para definir o ensaio adequado, ver ponto 47 e apêndice 6).
|
|
45.
|
A realização de uma análise estatística e de uma inferência mais aprofundadas depende da normalidade da distribuição dos valores relativos aos replicados, bem como da sua homogeneidade em termos de variância.
|
Estimativa da NOEC
|
46.
|
Deve preferir-se o recurso a ensaios potentes. Para averiguar se os dados exibem uma distribuição aproximadamente normal, devem usar-se, por exemplo, informações provenientes da experiência anterior com estudos interlaboratoriais comparativos ou outros dados históricos. A homogeneidade da variância é mais crítica. A experiência revela que, muitas vezes, a variância aumenta com a média. Nestes casos, a transformação dos dados pode conduzir à homogeneidade da variância. No entanto, essa transformação deve basear-se na experiência adquirida com os dados históricos e não nos dados do ensaio. Com dados homogéneos, devem realizar-se testes t múltiplos, como o teste de Williams (α = 0,05, unilateral) (21) (22) ou, em, certos casos, o teste de Dunnett (23) (24). De notar que, em caso de replicação desigual, os valores t do quadro devem ser corrigidos, como sugerido por Dunnett e Williams. Por vezes, devido a uma grande variação, as respostas não exibem aumento ou diminuição regulares. O teste de Dunnett é mais adequado em caso de grandes desvios relativamente à monotonicidade. Se existirem desvios à homogeneidade da variância, pode justificar-se investigar de forma mais aprofundada os possíveis efeitos nesta, de forma a decidir se os testes t podem ser executados sem perda apreciável do seu significado (25). Em alternativa, pode executar-se um teste U múltiplo, como, por exemplo, o teste de Bonferroni na versão de Holm (26), ou, se os dados apresentarem homogeneidade da variância mas forem compatíveis com uma relação dose-resposta monótona subjacente, um outro ensaio não paramétrico [por exemplo, de Jonckheere-Terpstra (27) (28) ou de Shirley (29) (30)], geralmente de preferência a testes t de variância desigual (ver também o esquema do apêndice 6).
|
|
47.
|
Se se realizar um ensaio do limite e se preencherem os pré-requisitos dos procedimentos aplicáveis aos ensaios paramétricos (normalidade, homogeneidade), pode utilizar-se o teste t de Student par a par ou, em alternativa, o teste U de Mann-Whitney (31).
|
Estimativa da ECx
|
48.
|
Para o cálculo do valor ECx, efetua-se uma análise por regressão linear e não linear da média das séries, após a obtenção de uma função adequada dose-resposta. No caso do crescimento dos vermes como resposta contínua, os valores de ECx podem ser estimados através de uma análise de regressão adequada (32). De entre as funções de dados quantais (mortalidade/sobrevivência e número de descendentes produzidos) adequadas citam-se as funções sigmoide normal, logística e de Weibull, com dois a quatro parâmetros, alguns dos quais se adaptam também às respostas de hormese. Se uma função dose-resposta tiver sido ajustada por análise de regressão linear, deve determinar-se, com base nessa análise, um valor r2 significativo (coeficiente de determinação ) e/ou um declive, para estimar o valor de ECx, inserindo um valor correspondente a x % da média dos controlos na equação estabelecida por análise de regressão. Os limites dos intervalos de confiança de 95 % são calculados de acordo com Fieller (citado em Finney — referência 18) ou por outros métodos modernos adequados.
|
|
49.
|
Em alternativa, a resposta é modelizada em termos de percentagem ou proporção do parâmetro do modelo que é interpretado como a resposta média. Nestes casos, é possível ajustar facilmente aos resultados a curva sigmoide normal (curva logística ou curva de Weibull), por recurso ao método de regressão probit (18). Nestes casos, a função de ponderação tem de ser ajustada para ter em conta as respostas métricas — cf. Christensen (33). No entanto, se tiver ocorrido hormese, a análise probit deve ser substituída por uma função logística de quatro parâmetros ou função de Weibull, no contexto de um método de regressão não linear (34). Se não for possível adaptar os dados a uma função adequada dose-resposta, podem utilizar-se métodos alternativos para estimar o valor ECx e os seus limites de confiança, como as médias móveis de Thompson (19) e o método abreviado de Spearman-Karber (20).
|
RELATÓRIO DO ENSAIO
|
50.
|
O relatório do ensaio deve incluir as seguintes informações:
|
|
Produto químico em estudo:
|
—
|
descrição definitiva do produto químico em estudo, lote e número CAS, grau de pureza;
|
|
—
|
propriedades do produto químico em estudo (por exemplo, log Kow, hidrossolubilidade, pressão de vapor, constante de Henry (H) e informações sobre o destino e comportamento).
|
|
|
|
Organismos sujeitos a ensaio
|
—
|
animais utilizados no ensaio: espécie, nome científico, origem dos organismos e condições de reprodução;
|
|
—
|
idade, gama de tamanhos (massa) dos organismos.
|
|
|
|
Condições de realização do ensaio
|
—
|
dados sobre a preparação do solo para o ensaio;
|
|
—
|
capacidade máxima de retenção de água do solo;
|
|
—
|
descrição da técnica utilizada para aplicar no solo o produto químico em estudo;
|
|
—
|
informações sobre produtos químicos adjuvantes utilizados para administrar o produto químico em estudo;
|
|
—
|
dados de calibração do equipamento de pulverização, se for caso disso;
|
|
—
|
descrição completa do método experimental e dos procedimentos;
|
|
—
|
dimensão dos recipientes de ensaio e volume de solo utilizado;
|
|
—
|
condições de ensaio: intensidade luminosa, duração dos ciclos luz/obscuridade, temperatura;
|
|
—
|
descrição do regime alimentar, tipo e quantidade de alimentos utilizados no ensaio, datas de alimentação;
|
|
—
|
pH e o teor de humidade do solo no início e no final do ensaio.
|
|
|
|
Resultados do ensaio:
|
—
|
mortalidade dos adultos ( %) em cada recipiente de ensaio no final das primeiras quatro semanas;
|
|
—
|
massa total de adultos no início do ensaio, em cada recipiente;
|
|
—
|
alterações no peso corporal dos animais vivos adultos ( % do peso inicial) em cada recipiente, após as primeiras quatro semanas do ensaio;
|
|
—
|
número de juvenis produzidos em cada recipiente, no final do ensaio;
|
|
—
|
descrição dos sintomas ou patologias evidentes ou das alterações comportamentais evidentes;
|
|
—
|
resultados obtidos com o produto químico de referência;
|
|
—
|
valores de LC50, NOEC e/ou ECx (por exemplo, EC50, EC10) para a reprodução, caso alguns deles sejam aplicáveis, com intervalos de confiança, e um gráfico do modelo utilizado para o seu cálculo, bem como todas as informações e observações úteis para a interpretação dos resultados;
|
|
—
|
representação gráfica da relação dose-resposta;
|
|
—
|
resultados de cada recipiente de ensaio;
|
|
desvios aos procedimentos descritos no presente método de ensaio e quaisquer ocorrências anómalas durante o mesmo.
|
REFERÊNCIAS
|
(1)
|
Jaenicke, J. (1982). “Eisenia foetida” is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N. & J. Stenerson (1984). Esterases of earthworm — III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277-282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei — comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
(4)
|
Capítulo C.8 do presente anexo, Toxicidade em relação às minhocas.
|
|
(5)
|
ISO (International Organization for Standardization) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., & L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards & F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. & J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman & Hall, London.
|
|
(13)
|
(ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
(16)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis — Gravimetric method, No. 11465. ISO, Geneve.
|
|
(17)
|
Römbke, J. & Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay — Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo & R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11 7 16 714 -719 Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 665-70
|
|
(27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. & F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman & Company. New York.
|
|
(32)
|
Bruce R.D. & Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. & J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Apêndice 1
Definições
Para efeitos do presente método, entende-se por:
Produto químico
: uma substância ou mistura.
ECx
(concentração com x % de efeitos): concentração que causa efeitos em x % dos organismos ensaiados num determinado período de exposição, comparativamente ao grupo de controlo. Por exemplo, a EC50 é a concentração que se estima que, num ponto final do ensaio, terá efeito em 50 % da população exposta, durante um período de exposição definido. No presente ensaio, as concentrações são expressas em massa do produto químico em estudo por massa seca de solo utilizado no ensaio ou em massa de produto químico em estudo por unidade de superfície do solo.
LC0
(concentração não letal): concentração de um produto químico em estudo que não mata nenhum dos organismos de ensaio expostos durante um determinado período. No presente ensaio, os valores de LC0 são expressos em massa do produto químico em estudo por massa seca de solo utilizado.
LC50
(concentração letal mediana): concentração de um produto químico em estudo que mata 50 % dos organismos de ensaio expostos num determinado período. No presente ensaio, a LC50 é expressa em massa do produto químico em estudo por massa seca de solo utilizado no ensaio ou em massa de produto químico em estudo por unidade de superfície do solo.
LC100
(concentração letal total): concentração de um produto químico em estudo que mata 100 % dos organismos de ensaio expostos num determinado período. No presente ensaio, os valores de LC100 são expressos em massa do produto químico em estudo por massa seca de solo utilizado.
LOEC (menor concentração com efeito observável): menor concentração do produto químico em estudo que tem um efeito estatisticamente significativo (p < 0,05). No presente ensaio, a LOEC é expressa em massa do produto químico em estudo por massa seca de solo utilizado ou em massa de produto químico em estudo por unidade de superfície do solo. Em geral, todas as concentrações de ensaio superiores à LOEC devem apresentar um efeito estatisticamente diferente das amostras de controlo. Quaisquer desvios em relação às condições referidas devem ser justificados no relatório de ensaio.
NOEC (concentração sem efeitos observáveis): a concentração mais elevada do produto químico em estudo imediatamente abaixo da LOEC à qual não se observa nenhum efeito. Neste ensaio, a concentração NOEC não tem nenhum efeito com significância estatística (p < 0,05) num determinado período de exposição, comparativamente ao grupo de controlo.
Taxa de reprodução
: Média do número de juvenis produzidos por um dado número de vermes adultos, no período de ensaio.
Produto químico em estudo
: qualquer substância ou mistura sujeita a ensaio segundo o presente método.
Apêndice 2
Determinação da capacidade máxima do solo para reter água (capacidade máxima de retenção de água)
O método que se segue foi considerado adequado para determinar a capacidade máxima de retenção de água. É descrito no anexo C da norma ISO DIS 11268-2 (1).
Recolher uma determinada quantidade (por exemplo, 5 g) de substrato do solo de ensaio com o auxílio de um instrumento adequado (tubo Auger, etc.). Cobrir o fundo do tubo com um pedaço de papel de filtro e, após o enchimento com água, introduzi-lo num suporte de banho-maria. O tubo deve ser submergido gradualmente, até que o nível de água se situe acima do topo da camada de solo. Deixar o tubo no banho-maria durante cerca de três horas. Dado não ser possível reter toda a água absorvida por capilaridade, deve deixar-se a amostra de solo escorrer durante duas horas, colocando o tubo num leito de areia de quartzo finamente moída e muito húmida, contido num recipiente coberto (para evitar a secagem). Seguidamente, pesar a amostra, seca até massa constante, a 105 °C. A capacidade de retenção de água (WHC) é calculada do seguinte modo:

em que:
|
S
|
=
|
substrato saturado de água + massa do tubo + massa do papel de filtro
|
|
T
|
=
|
tara (massa do tubo + massa do papel de filtro)
|
|
D
|
=
|
massa seca de substrato
|
REFERÊNCIAS:
|
(1)
|
ISO (Organização Internacional de Normalização) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
Apêndice 3
Determinação do pH do solo
O seguinte método de determinação do pH de uma amostra de solo baseia-se na descrição constante da norma ISO 10390 (Qualidade do solo — Determinação de pH).
Uma determinada quantidade de solo é seca à temperatura ambiente durante, pelo menos, 12 horas. A uma suspensão de solo que contenha, pelo menos, 5 g de solo adiciona-se cinco vezes o seu volume de uma solução 1 M de cloreto de potássio (KCl) de qualidade analítica ou de uma solução 0,01 M de cloreto de cálcio (CaCl2) também de qualidade analítica. A suspensão é agitada vigorosamente durante cinco minutos. Após a agitação, deixa-se a suspensão em repouso durante, pelo menos, 2 horas, mas não mais de 24 horas. O pH da fase líquida é então medido por recurso a um medidor de pH, calibrado, antes de cada medição, com uma série adequada de soluções-tampão (por exemplo, pH 4,0 e 7,0).
REFERÊNCIAS:
|
(1)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
Apêndice 4
Cultura de Eisenia fetida e Eisenia andrei
A cultura deve ser efetuada, de preferência, numa câmara climatizada a 20 °C ± 2 °C. A esta temperatura, com uma alimentação suficiente, os vermes tornam-se adultos ao termo de 2 a 3 meses.
Ambas as espécies podem ser criadas numa vasta gama de resíduos de origem animal. O meio de cultura recomendado é uma mistura 50:50 de estrume de equino ou de bovino com turfa. Devem realizar-se controlos para garantir que os bovinos ou equinos que produzem o estrume não são alvo de tratamento com medicamentos ou produtos químicos, como promotores de crescimento, nematicidas ou produtos veterinários semelhantes que possam afetar os vermes durante o ensaio. Recomenda-se a utilização de estrume de origem “biológica”, dado a experiência mostrar que o estrume disponível no comércio sob a forma de adubos para jardinagem pode ter efeitos adversos nos vermes. O meio deve ter um pH de 6 a 7 (ajustado com carbonato de cálcio) e baixa condutividade iónica (menos de 6 mS/cm ou 0,5 % de concentração salina) e não deve estar excessivamente contaminado com amoníaco ou urina. O substrato deve estar húmido, mas não encharcado. São adequadas caixas de cultura de 10 a 50 litros.
A melhor forma de obter minhocas de idade e tamanho (massa) normalizados consiste em iniciar a cultura com casulos. Uma vez iniciada, a cultura é mantida mediante a colocação de minhocas adultas, durante 14 a 28 dias, numa caixa de reprodução com substrato fresco, para permitir a produção de novos casulos. Retiram-se os adultos e utilizam-se os juvenis eclodidos dos casulos como base para a próxima cultura. Os vermes são alimentados permanentemente com resíduos animais e transferidos periodicamente para um substrato fresco. A experiência demonstra que o estrume de bovino ou de equino moído e a farinha de aveia constituem alimentos adequados. Deve garantir-se que os bovinos ou equinos que produzem o estrume não são alvo de tratamento com medicamentos ou produtos químicos, como promotores de crescimento, que possam afetar os vermes em culturas a longo prazo. Os vermes eclodidos dos casulos são utilizados nos ensaios entre 2 e 12 meses de idade, altura em que se consideram adultos.
Os vermes podem ser considerados saudáveis se se movimentarem através do substrato, não tentarem abandoná-lo e se reproduzirem continuamente. O substrato acusa exaustão se os vermes se deslocarem muito lentamente e tiverem a extremidade posterior amarela, caso em que se recomenda a aplicação de substrato fresco e/ou uma redução da densidade populacional.
Apêndice 5
Técnicas para a contagem de vermes juvenis eclodidos dos casulos
A triagem manual de vermes do substrato edáfico é muito morosa. Recomendam-se, por isso, dois métodos alternativos:
|
a)
|
Os recipientes de ensaio são colocados em banho-maria a uma temperatura inicial de 40 °C, com aumento até 60 °C. Após um período de cerca de 20 minutos, os vermes juvenis devem aparecer à superfície do solo, podendo então ser facilmente retirados e contados.
|
|
b)
|
O solo utilizado no ensaio é lavado num crivo, por recurso ao método desenvolvido por van Gestel et al. (1), desde que a turfa e o estrume ou a farinha de aveia adicionados ao solo sejam finamente moídos. Sobrepõem-se dois crivos com 0,5 mm de malha e diâmetro de 30 cm. O conteúdo de um recipiente de ensaio é lavado nos crivos sob um fluxo forte de água da torneira; os vermes jovens e os casulos são retidos principalmente no crivo superior. É importante notar que toda a superfície do crivo superior deve ser mantida húmida durante a operação, para que os juvenis flutuem numa película de água que os impeça de passar através dos poros. Os melhores resultados obtêm-se utilizando uma cabeça de chuveiro.
|
Uma vez lavado todo o substrato, os juvenis e os casulos podem ser transferidos, por enxaguamento, do crivo superior para um recipiente. Deixa-se repousar o conteúdo do recipiente, de forma a permitir a flutuação dos casulos vazios à superfície da água, enquanto os casulos cheios e os vermes juvenis se precipitam para o fundo. A água pode, então, ser decantada, transferindo-se os juvenis e os casulos para uma placa de Petri com um pouco de água. Retiram-se os vermes para contagem por meio de uma agulha ou de um par de pinças.
A experiência demonstra que o método a) é mais adequado para a extração de juvenis que possam ser lavados num crivo de 0,5 mm.
Deve determinar-se sempre a eficiência do método utilizado para remover os vermes (e os eventuais casulos) do substrato edáfico. Se os juvenis forem retirados por triagem manual, é aconselhável realizar duas vezes a operação com todas as amostras.
REFERÊNCIAS:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Apêndice 6
Resumo da avaliação estatística dos dados (determinação da NOEC)

C.34. DETERMINAÇÃO DA INIBIÇÃO DA ATIVIDADE DE BACTÉRIAS ANAERÓBIAS — REDUÇÃO DA PRODUÇÃO DE GÁS A PARTIR DE LAMAS DIGERIDAS EM CONDIÇÕES DE ANAEROBIOSE
INTRODUÇÃO
|
1.
|
O presente método é equivalente ao Test Guideline (TG) 224 (2007) da OCDE. Os produtos químicos descarregados nos meios aquáticos atingem as zonas aeróbia e anaeróbia, onde podem ser degradados e/ou podem inibir a atividade bacteriana; em certos casos, podem permanecer na zona anaeróbia, sem serem degradados, durante décadas ou ainda mais tempo. Nos processos de tratamento de águas residuais, o primeiro passo (primeira eliminação), é aeróbio no líquido sobrenadante e anaeróbio na lama depositada. Este tratamento é seguido de um segundo passo em que se estabelece uma zona aeróbia no tanque de arejamento de lamas ativadas e uma zona anaeróbia nas lamas depositadas no tanque de decantação secundário. A lama presente nestes dois tratamentos é, normalmente, sujeita a um tratamento anaeróbio, produzindo metano e dióxido de carbono, os quais são comumente utilizados na produção de eletricidade. No meio ambiente, os produtos químicos que se depositam nos sedimentos de baías, estuários e no mar ficam retidos indefinidamente nessas zonas anaeróbias, se não forem biodegradados. Grandes quantidades de certos produtos químicos depositam-se nessas zonas devido às suas propriedades físicas, como uma baixa solubilidade em água, elevada capacidade de adsorção em sólidos em suspensão e incapacidade de serem biodegradados em condições de aerobiose.
|
|
2.
|
Embora seja desejável que os produtos químicos descarregados no meio ambiente sejam biodegradáveis, quer em condições de aerobiose quer de anaerobiose, é essencial que não inibam a atividade dos microrganismos presentes nessas zonas. No Reino Unido, observaram-se alguns casos de completa inibição da produção de metano devido a descargas industriais de pentaclorofenol, obrigando à remoção bastante dispendiosa das lamas e à importação de lamas digeridas saudáveis de instalações vizinhas. Têm-se registado casos menos graves de toxicidade por outros produtos químicos, incluindo hidrocarbonetos alifáticos halogenados (produtos de lavagem a seco) e detergentes, que originaram prejuízos significativos na eficiência da digestão.
|
|
3.
|
Apenas um método C.11 (1) se refere à inibição da atividade bacteriana (respiração de lamas ativadas), e avalia o efeito de produtos químicos na taxa de absorção de oxigénio na presença de um substrato. Este método é largamente utilizado na prevenção de possíveis efeitos nocivos de produtos químicos no tratamento aeróbio de águas residuais, bem como como indicador das concentrações não inibitórias de produtos químicos, que podem ser utilizadas nos vários testes de biodegradabilidade. O método C.43 (2) oferece uma oportunidade limitada para determinar a toxicidade de produtos químicos na produção de gás por lamas anaeróbias, diluídas 10 vezes em relação à sua concentração normal de sólidos, para permitir a precisão necessária à avaliação da biodegradação percentual. E porque as lamas diluídas podem ser mais sensíveis a produtos químicos inibitórios, o grupo ISO decidiu preparar um método utilizando lamas não diluídas. Foram analisados, pelo menos, três textos (Dinamarca, Alemanha e Reino Unido), tendo finalmente sido elaboradas duas normas ISO, uma utilizando lamas não diluídas, ISO 13 641-1 83) e outra utilizando uma diluição de 100x para as lamas, ISO 13 641-2 (4), para responder aos tipos de lodos e sedimentos que apresentam baixas concentrações de populações bacterianas. Ambos os métodos foram sujeitos a um teste de intercalibração (5): a primeira norma foi bem aceite, mas tem havido desacordo quanto à segunda. O Reino Unido considera que, dado uma proporção significativa dos participantes referir uma pequena ou nenhuma produção de gás — devido, em parte, ao facto de percentagem de espaço de gás ser muito elevada (até 75 %) para permitir uma sensibilidade aceitável -, este protocolo necessita de uma investigação mais aprofundada.
|
|
4.
|
Trabalhos realizados anteriormente no Reino Unido (6) (7) descrevem um método manométrico que utiliza, como substrato, lamas digeridas não diluídas e lodo de esgoto em bruto, em frascos de 500 ml; contudo, o aparelho era pesado e o cheiro do lodo tornava o trabalho desagradável. Mais tarde, Shelton e Tiedje (8) apresentaram um aparelho mais conveniente e leve, desenvolvido por Batterrsby e Wilson (9) e utilizado por Wilson et al. (10) com sucesso. Kawahara et al. (11) prepararam com sucesso em laboratório outros padrões de lamas, para utilizar em testes de biodegradabilidade anaeróbica e inibição de uma série de produtos químicos. O lodo de esgoto em bruto como substrato foi, também, substituído nos testes por lodo anaeróbio diluído 100x ou por lamas, sedimentos, etc., de baixa atividade bacteriana.
|
|
5.
|
Este método pode fornecer informações úteis para a antevisão do efeito do produto químico em estudo na produção de gás em digestores anaeróbios. No entanto, só realizando testes e simulando condições em digestores, se pode indicar se há adaptação dos microrganismos ao produto químico em estudo ou se o produto químico, que será absorvido ou adsorvido pelo lodo, pode dar origem a concentrações tóxicas que ultrapassem a duração permitida pelo presente teste.
|
PRINCÍPIO DO MÉTODO
|
6.
|
Alíquotas de uma mistura de lamas digeridas em condições de anaerobiose (20 g/l a 40 g/l de sólidos totais) e uma solução do substrato degradável são incubados sozinhos e simultaneamente com uma série de concentrações do produto químico em estudo, em garrafas vedadas, durante três dias. A quantidade de gás produzido (metano e dióxido de carbono) é medida pelo aumento de pressão (Pa) nas garrafas. A inibição percentual na produção do gás para as várias concentrações do produto químico em estudo é calculada a partir das quantidades produzidas nas garrafas do controlo e da experiência em si. A EC50 e outras concentrações pertinentes são calculadas a partir de curvas traçadas com a inibição percentual em função da concentração do produto químico ou, mais comumente, em função do seu logaritmo.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
7.
|
Os produtos químicos em estudo devem ser, normalmente, utilizados na sua forma química mais pura, pois algumas impurezas presentes, como os clorofenóis, podem ser mais tóxicos do que o próprio produto químico em estudo. No entanto, deve ponderar-se a necessidade de utilizar o produto químico na forma comercial disponível. Não se recomenda a utilização rotineira de produtos preparados, mas, no caso de produtos químicos pouco solúveis, pode constituir o melhor método. Devem ser conhecidas as propriedades do produto químico em estudo, nomeadamente a sua solubilidade em água e em alguns solventes orgânicos, a pressão de vapor de água, o coeficiente de adsorção, a hidrólise e biodegradabilidade em condições de anaerobiose.
|
APLICABILIDADE DO MÉTODO
|
8.
|
O presente método é válido para produtos químicos solúveis e insolúveis em água, incluindo produtos voláteis. Devem tomar-se cuidados particulares com materiais de baixa solubilidade em água (12) e alta volatilidade. Podem, também, ser utilizados inóculos de outros locais anaeróbios, como lodos, solos saturados e sedimentos. Os sistemas bacterianos anaeróbios que tenham sido previamente expostos a produtos químicos tóxicos podem ser adaptados para manterem a sua atividade na presença de produtos químicos xenobióticos. Estes inóculos podem apresentar uma elevada tolerância aos produtos químicos em estudo quando comparados com inóculos obtidos em sistemas que não tenham sofrido essa adaptação.
|
PRODUTOS QUÍMICOS DE REFERÊNCIA
|
9.
|
Para verificar o procedimento, um produto químico de referência é testado em paralelo em recipientes apropriados como parte da experiência: o 3,5-diclorofenol mostrou ser um bom inibidor da produção anaeróbia de gás, assim como para o consumo de oxigénio por lamas ativadas e outras reações bioquímicas. Outros produtos químicos mostraram se mais efetivos na inibição da produção de metano que o 3,5-diclorofenol — é o caso, nomeadamente, do bis-tiocianato de metileno (MBT) e do pentaclorofenol –, mas os resultados obtidos com estes produtos químicos ainda não foram validados. O pentaclorofenol não é recomendado, pois não se encontra disponível na forma pura.
|
REPRODUTIBILIDADE DOS RESULTADOS
|
10.
|
Um teste interlaboratorial mostrou haver, entre os 10 participantes, uma reprodutibilidade muito baixa nos valores de EC50 para o 3,5-diclorofenol e o 2-bromoetanossulfonato (a concentração do primeiro variou entre 32 mg/l e 502 mg/l e a do segundo entre 220 mg/l e 2 190 mg/l).
|
Número de laboratórios
|
mg/l
|
mg/g de lama
|
|
Média
|
Desvio-padrão
|
Coeficiente de variação (%)
|
Média
|
Desvio-padrão
|
Coeficiente de variação (%)
|
|
|
3,5-Diclorofenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
Ácido 2-bromoetanossulfónico
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Dados de EC50 do teste interlaboratorial — lamas não diluídas
|
11.
|
Os elevados coeficientes de variação entre os laboratórios refletem, em grande medida, as diferenças de sensibilidade dos microrganismos presentes nas lamas devido a uma pré-exposição ou à não-exposição ao produto químico em estudo ou outros produtos químicos afins. A precisão do valor de EC50, com base na concentração de lamas, revelou-se pouco melhor que o valor “volumétrico” (mg/l). Os três laboratórios que comunicaram os valores mais precisos para o 3,5-diclofenol apresentaram os coeficientes de variação mais baixos (22, 9, e 18 %, respetivamente, para a EC50, expressa em mg/g) do que a média de todos os laboratórios. As médias individuais dos três laboratórios foram 3,1, 3,2 e 2,8 mg/g, respetivamente. Os coeficientes de variação mais baixos e aceitáveis entre os laboratórios comparados com os coeficientes de variação mais elevados entre os laboratórios, nomeadamente, 9-22 % e 92 %, indicam existirem diferenças significativas nas propriedades das lamas estudadas.
|
DESCRIÇÃO DO MÉTODO
Equipamento
|
12.
|
Utiliza-se o equipamento usual de laboratório, nomeadamente o seguinte:
|
a)
|
Incubadora — à prova de faíscas e com controlo de temperatura (35 °C ± 2 °C);
|
|
b)
|
Recipientes de vidro resistentes à pressão de dimensões apropriadas (17), cada um revestido com uma membrana à prova de gás que possa resistir a pressões entre 2 bar e 2 × 105 Pa (para revestimento utilizar, por exemplo, PTFE — politetrafluoretileno). Recomendam-se, em especial, frascos de soro com 125 ml, com um volume real de 160 ml, vedados com membranas (18) e anéis de alumínio; podem, também, ser utilizadas garrafas com um volume total de 0,1 e 1 l;
|
|
c)
|
Medidor de pressão de precisão
(19), com agulha acoplada
A produção de gás total (metano mais dióxido de carbono) medido com um medidor de pressão adaptado para permitir medições e ventilação do gás produzido. Um exemplo de um aparelho adequado é um medidor de pressão de mão ligado a uma seringa com agulha; uma válvula de gás com três vias facilita a libertação da pressão em excesso (apêndice 1). É necessário manter o volume da tubagem do transdutor e da válvula o mais pequeno possível, para que os erros introduzidos pelo volume do equipamento, que não é contabilizado, sejam insignificantes;
|
|
d)
|
Recipientes isolantes para transporte das lamas digeridas;
|
|
e)
|
Válvulas de gás de três vias;
|
|
f)
|
Crivo com malha de 1 mm quadrado;
|
|
g)
|
Reservatório para as lamas digeridas, um vidro ou uma garrafa de polietileno com capacidade de 5 litros, equipado com um agitador e com a possibilidade de introduzir azoto gasoso (ver parágrafo 13) no volume livre de líquido;
|
|
h)
|
Filtros de membrana (0,2 μm), para esterilizar o substrato;
|
|
i)
|
Microsseringas, para a ligação do transdutor de pressão [ver ponto 12, alínea c)] ao volume livre de líquido [ver ponto 12, alínea b)]; também, para adicionar líquidos insolúveis às garrafas, se for esse o caso em estudo;
|
|
j)
|
Câmara de fluxo laminar com luvas, opcional mas recomendada, com uma ligeira pressão positiva de azoto.
|
|
Reagentes
|
13.
|
Utilizar sempre reagentes de qualidade analítica. O azoto gasoso utilizado durante todo o teste deve ser de elevada pureza, com um teor de oxigénio inferior a 5μ/l.
|
Água
|
14.
|
Se for necessário realizar alguma diluição, utilizar água desionizada previamente arejada. Não é necessário efetuar controlos analíticos dessa água, mas deve garantir-se a verificação regular do aparelho da água desionizada. Utilizar também água desionizada na preparação das soluções-mãe. Antes da adição do inóculo anaeróbio a qualquer solução ou diluição do material em estudo, importa assegurar que estas estão isentas de oxigénio. Para tal, borbulhar azoto gasoso na água com de diluição (ou nas próprias diluições) durante 1 h, antes de adicionar o inóculo ou, alternativamente, aquecer a água à fervura e deixar arrefecer à temperatura ambiente numa atmosfera isenta de oxigénio.
|
Lamas para digestão
|
15.
|
Recolher lamas digeridas num digestor de uma estação de tratamento de esgotos ou, alternativamente, recolher as lamas de um digestor laboratorial de esgotos de origem doméstica. Informação prática sobre lamas de digestores de laboratório pode ser encontrada na bibliografia (11). Caso se pretenda utilizar um inóculo diferente, devem preferir-se lamas digeridas de uma estação de tratamento de esgotos industriais. Para colher as lamas, utilizar garrafas de boca larga de polietileno ou de um material semelhante. Adicionar as lamas às garrafas até ao topo, deixando 1 cm, vedá-las bem, preferencialmente com uma válvula de segurança [ponto 12, alínea e)] e colocá-las em contentores isolantes [ponto 12, alínea d)], para minimizar as diferenças de temperatura até serem transferidas para a incubadora e mantidas a 35 °C ± 2 °C. Ao abrir as garrafas, libertar o excesso de gás afrouxando a rolha ou abrindo a válvula [ponto 12, alínea e)]. É preferível utilizar as lamas após a sua colheita, mas se tal não for possível, guardá-las a 35 °C ± 2 °C durante três dias e borbulhar azoto gasoso no volume livre de líquido das garrafas, para diminuir a atividade da mistura.
Aviso — A digestão das lamas liberta gases inflamáveis, o que representa risco de fogo e de explosão; as lamas contêm, também, organismos patogénicos. Devem, assim, tomar-se as devidas precauções ao trabalhar com as lamas. Por razões de segurança, não se devem utilizar recipientes de vidro na colheita das lamas.
|
Inóculo
|
16.
|
Imediatamente antes de utilizar as lamas, misturá-las agitando suavemente e crivá-las através do crivo de malha de 1 mm2 [ponto 12, alínea f)] para a garrafa apropriada [ponto 12, alínea g)], através da entrada pela qual vai passar a amostra de azoto. Retirar uma amostra para determinar a concentração de sólidos em peso seco (ver, por exemplo, a norma ISO 11 923 (13) ou um norma equivalente da UE). Preferencialmente, utilizar as lamas sem serem diluídas. A concentração de sólidos situa-se, em geralmente, entre os 2 % e 4 % (v/v). Verificar o pH das lamas e, se necessário, ajustá-lo para 7 ± 0,5.
|
Substrato
|
17.
|
Dissolver em água desionizada 10 g de meio nutritivo (por exemplo, Oxoid), 10 g de extrato de levedura e 10 g de D-glucose e misturar até obter um volume final de 100 ml. Esterilizar por filtração com um filtro de membrana 0,2 μm [ponto 12, alínea h)] e utilizar imediatamente, ou guardar a 4 °C não mais do que um dia.
|
Produto químico em estudo
|
18.
|
Preparar soluções-mãe de cada um dos produtos químicos em estudo, que contenham, por exemplo, 10 g/l do produto químico em água isenta de oxigénio (ponto 14). Utilizar os volumes apropriados nas soluções-mãe, de forma a preparar as misturas de reação com as concentrações desejadas. Preparar a série de diluições para cada solução-mãe, de modo a que o volume adicionado a cada garrafa seja o mesmo para cada concentração. O pH das soluções-mãe deve ser ajustado para 7 ± 0,2, se necessário.
|
|
19.
|
No caso de produtos químicos pouco solúveis em água, consultar a norma ISO 10 634 (12) ou uma norma equivalente da UE. Se for necessário utilizar um solvente orgânico, devem evitar-se solventes como clorofórmio e o tetracloreto de carbono, que inibem fortemente a produção de metano. Preparar a solução de uma determinada concentração do produto químico insolúvel com um solvente volátil — por exemplo, acetona ou éter etílico. Adicionar os volumes necessários da solução do solvente a garrafas vazias [ponto 12, alínea b)] e evaporar o solvente antes de adicionar as lamas. Para outros tratamentos, consulte a norma ISO 10 634 (12) ou uma norma equivalente da UE, tendo porém em conta que qualquer agente tensioativo utilizado para produzir emulsões pode ser inibidor da produção anaeróbia de gás. Caso se considere que a presença de solventes orgânicos e de agentes emulsionantes produz efeitos indesejados, o produto químico em estudo pode ser adicionado diretamente à mistura na forma de pó ou líquido. Os produtos químicos voláteis e líquidos insolúveis em água podem ser injetados e inoculados através da membrana das garrafas, utilizando as microsseringas [ponto 12, alínea i)].
|
|
20.
|
Adicionar o produto químico em estudo às garrafas de forma a obter uma série geométrica de concentrações, por exemplo, 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l e 15,6 mg/l. Se não forem conhecidos limites de toxicidade de produtos químicos afins, realizar um teste preliminar de despistagem desses limites, com concentrações de 1 000 mg/l, 100 mg/l e 10 mg/l.
|
Produto químico de referência
|
21.
|
Preparar uma solução aquosa de 3,5-diclorofenol (10 g/l), adicionando gradualmente e agitando pequenas quantidades de uma solução de hidróxido de sódio 5 mol/l, até se dissolver. Depois, adicionar a água isenta de oxigénio (ponto 14) até ao volume requerido; o recurso a ultrassons pode ajudar a dissolução. Podem utilizar-se outros produtos químicos de referência se os limites médios da EC50 já tiverem sido estabelecidos em três testes com inóculos diferentes (origens ou momentos de recolha diferentes).
|
INTERFERÊNCIAS/ERROS
|
22.
|
Alguns componentes das lamas podem reagir com inibidores, tornando-os indisponíveis para os microrganismos e produzindo assim uma inibição baixa ou nula. Por outro lado, se as lamas contiverem já um produto químico inibidor, os resultados podem ser erróneos quando esse produto químico é testado. Existe um certo número de outros fatores que podem originar resultados erróneos. Estes fatores estão listados no apêndice 3, juntamente com os métodos destinados a eliminar ou reduzir os seus efeitos.
|
PROCEDIMENTO EXPERIMENTAL
|
23.
|
O número de replicados necessários depende do grau de precisão requerido para os índices de inibição. Se as rolhas das garrafas fornecerem garantias para toda a duração do ensaio, preparar só um conjunto de garrafas (pelo menos, 3 triplicados) para cada concentração requerida. Do mesmo modo, preparar um conjunto de garrafas com o produto químico de referência e um conjunto com os controlos. No entanto, se a vedação das garrafas só for fiável para uma ou poucas perfurações, preparar um conjunto de garrafas (por exemplo, um triplicado) para cada intervalo (t) no qual são requeridos resultados para todas as concentrações do produto químico em estudo. Preparar, igualmente, um conjunto de garrafas “t” para o produto químico de referência e os controlos.
|
|
24.
|
É aconselhável a utilização de uma câmara de fluxo laminar com luvas [ponto 12, alínea j)]. Pelo menos, 30 minutos antes de iniciar o teste, colocar na câmara todo o material e equipamento necessário e injetar azoto gasoso. Confirmar que a temperatura das lamas se mantém nos 35 °C ± 2 °C durante o manuseamento e a selagem das garrafas.
|
Ensaio preliminar
|
25.
|
Se a atividade das lamas for desconhecida, recomenda-se a realização de um ensaio preliminar. Preparar um conjunto de controlos que tenham, por exemplo, concentrações de sólidos de 10 g/l, 20 g/l e 40 g/l mais o substrato, mas não tenham o produto químico. Utilizar, também, volumes diferentes da mistura de reação, de modo a ter 3 a 4 partes de espaço de volume vazio em relação ao volume de líquido. A partir dos resultados de volume de gás produzido em intervalos de tempo diferentes, as condições selecionadas permitem duas medições diárias para determinar o rendimento e a libertação de pressão por dia1, sem provocar risco de explosões.
|
Adição do produto químico em estudo
|
26.
|
Introduzir nas garrafas os produtos químicos em estudo solúveis [ponto 12, alínea b)], na forma de soluções aquosas (ponto 18). Utilizar um conjunto de três replicados para cada intervalo de concentrações (ponto 20). No caso de produtos químicos insolúveis ou pouco solúveis em água, injetar nas garrafas vazias, com uma microsseringa, soluções destes em solventes orgânicos, preparando um conjunto de replicados de cinco concentrações para cada produto químico em estudo. Evaporar o solvente borbulhando azoto gasoso à superfície da solução nas garrafas. Alternativamente, introduzir diretamente nas garrafas os produtos químicos insolúveis, na forma de sólidos.
|
|
27.
|
Se um produto químico insolúvel ou pouco solúvel em água for adicionado sem a utilização de um solvente, introduzi-lo diretamente com uma microsseringa nas garrafas após a adição do inóculo e do substrato (ver ponto 30). Os produtos químicos voláteis podem ser manipulados da mesma forma.
|
Adição do inóculo e do substrato
|
28.
|
Colocar numa garrafa de 5 litros [ponto 12, alínea g)], sob agitação, um volume conhecido de lamas crivadas (ver ponto 16), fazendo passar uma corrente de azoto gasoso pelo volume vazio da garrafa. Passar também uma corrente de azoto gasoso, durante 2 min, pelas garrafas que contêm as soluções aquosas ou as soluções do produto químico com o solvente já evaporado, para remoção do ar. Distribuir pelas garrafas alíquotas de 100 ml das lamas, bem misturadas, utilizando uma pipeta de boca larga ou uma proveta. É essencial que se encha a pipeta de uma só vez, para evitar que a amostra assente. Se não for esse o caso, voltar a agitar a amostra e a encher a pipeta.
|
|
29.
|
Em seguida, adicionar uma solução de substrato suficiente para obter uma concentração final de 2 g/l do meio nutritivo, do extrato de levedura e da D-glucose na mistura, enquanto o azoto é ainda adicionado. O quadro seguinte apresenta alguns exemplos de testes que pode levar a cabo.
|
Concentração final do produto químico nas garrafas
(mg/l)
|
Volume do produto químico
(ml)
|
Reagentes e meios de cultura
(ml)
|
|
Solução-mãe a)10 g/lponto 18
|
Solução-mãe b)1 g/lponto 18
|
Diluição
ponto 14
|
Inóculo
ponto 16
|
Substrato
ponto 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Volume total da garrafa = 160 ml. Volume de líquido = 103 ml
Volume do gás = 57 ml, ou 35,6 % do volume total.
|
|
|
30.
|
Da mesma forma, lavar com azoto gasoso garrafas de teste vazias para trabalhar com qualquer produto químico insolúvel ou pouco solúvel em água (ponto 27).
|
Controlos e produto químico de referência
|
31.
|
Preparar, pelo menos, três conjuntos de garrafas que contenham só as lamas e o substrato, que constituirão os controlos. Preparar, ainda, replicados de garrafas que contenham as lamas, o substrato e a solução-mãe do produto químico de referência, 3,5-diclorofenol (parágrafo 21), para uma concentração final de 150 mg/l. Esta concentração deve inibir a produção de gás em 50 %. Alternativamente, estabelecer um intervalo de concentrações para o produto químico de referência. Devem preparar-se, ainda, mais quatro garrafas para as medições do pH que contenham as lamas, a água livre de oxigénio e o substrato. Introduzir em duas dessas garrafas a concentração mais elevada de produto químico utilizada e adicionar água isenta de oxigénio às duas garrafas restantes.
|
|
32.
|
Assegurar que todas as garrafas contêm o mesmo volume de líquido (VR) dos produtos químicos em estudo, dos produtos químicos de referência e dos controlos; se necessário, adicionar água desionizada, isenta de oxigénio (parágrafo 14), para perfazer o volume. O volume vazio do recipiente deve situar-se entre os 10 % e os 40 % em relação à sua capacidade total; este valor deve ser escolhido com base nos resultados obtidos com o ensaio preliminar. Após introduzir todos os componentes nas garrafas, remover a agulha de aporte do gás e vedar cada garrafa com uma rolha de borracha e uma tampa de alumínio [ponto 12, alínea b)], humedecendo a rolha com água desionizada para ajudar à sua colocação. Misturar o conteúdo de cada garrafa agitando suavemente.
|
Incubação das garrafas
|
33.
|
Transferir as garrafas para a incubadora, preferencialmente com agitação, e colocá-las a 35 °C ± 2 °C. As garrafas são incubadas na obscuridade. Depois de 1 h, equilibrar a pressão das garrafas com a pressão atmosférica, inserindo uma agulha de seringa, ligada a um medidor de pressão [ponto 12, alínea c)], através da rolha de cada garrafa. Abrir a válvula até que a pressão chegue a zero e voltar a fechar a válvula. A agulha deve estar inserida com um ângulo de cerca de 45.o, para impedir a perda de gás. Se as garrafas forem incubadas sem agitação, agitar manualmente duas vezes por dia durante todo o período de incubação, para equilibrar o sistema. Ao incubar as garrafas, colocá-las invertidas para impedir a libertação de gás através da rolha. Nos casos em que os produtos químicos em estudo são insolúveis, a inversão das garrafas não é aconselhável devido à possível aderência dos mesmos à base das garrafas.
|
Medições de pressão
|
34.
|
Quando as garrafas estão a 35 °C ± 2 °C, medir e registar o pH de duas das quatro garrafas, descartando o seu conteúdo; deixar as restantes na incubadora, na obscuridade. Medir e registar a pressão das garrafas, duas vezes por dia, nas 48 h a 72 h seguintes, inserindo a agulha ligada ao medidor de pressão através da rolha. Ligar a agulha entre cada medição. Manter as garrafas à temperatura de incubação durante as medições, que devem ser realizadas tão rapidamente quanto possível. Deixar a pressão estabilizar e registá-la. Abrir a válvula para equilibrar, fechando-a quando atingir o zero. Prosseguir o ensaio durante as 48 h subsequentes à primeira leitura, a qual é designada como “tempo 0”. O número de leituras e de aberturas para produtos químicos voláteis deve ser só um (no final do período de incubação) ou dois, para minimizar a perda do produto químico em estudo (10).
|
|
35.
|
Se a leitura de pressão for negativa, não abrir a válvula. A mistura pode, por vezes, acumular-se na agulha e na tubagem, dado origem a uma leitura de pressão negativa. Se for este o caso, remover a agulha, agitar a tubagem, secar com um pano e introduzir uma agulha nova.
|
Medições de pH
|
36.
|
Medir e registar o pH dos conteúdos de cada garrafa após a medição da pressão final.
|
DADOS E RELATÓRIOS
Expressão dos resultados
|
37.
|
Calcular a soma e a média das pressões registadas em cada intervalo de tempo em cada conjunto de replicados, bem como a sua média cumulativa para cada pressão de gás. Traçar os gráficos da produção de gás (Pa) (média cumulativa) em função do tempo, para o controlo, as garrafas de referência e de ensaio. Selecionar um tempo na zona linear da curva, geralmente nas 48 h, e calcular a inibição percentual (I) para cada concentração, a partir da seguinte equação [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
em que
|
I
|
inibição, expressa em percentagem;
|
|
Pt
|
pressão do gás produzido com o material em estudo para um determinado tempo, em Pascal (Pa);
|
|
Pc
|
pressão do gás produzido no controlo para um determinado tempo em Pascal (Pa).
|
É aconselhável traçar duas curvas, isto é, a curva I, em função da concentração, e a curva II, em função do logaritmo da concentração; deve selecionar-se a zona da curva mais próxima da linearidade. Determinar a EC50 (mg/l) visualmente ou por cálculo da regressão linear. Em estudos comparativos, pode ser mais útil expressar a concentração do produto químico em mg/g de sólidos totais (peso seco). Para obter esta concentração, dividir a concentração volumétrica (mg/l) pela concentração volumétrica das lamas sólidas secas (g/l) (ponto16).
|
|
38.
|
Calcular a inibição percentual para cada concentração do produto químico de referência utilizado, ou a EC50, se tiver sido estudado um número significativo de concentrações.
|
|
39.
|
Converter em volume a pressão média do gás produzido no controlo Pc (Pa), com base na curva de calibração do medidor de pressão (apêndice 2); a partir desse valor, calcular o rendimento de gás, expresso em volume produzido em 48 h a partir de 100 ml de lamas não diluídas, numa concentração de 2 g/l (20 g/l) a 4 % (40 g/l).
|
Critérios de validação
|
40.
|
Os resultados obtidos o estudo interlaboratorial da ISO (5) mostraram que o produto químico de referência (3,5-diclorofenol) causa 50 % de inibição na produção de gás num intervalo de concentrações entre 32 mg/l e 510 mg/l, com a média nos 153 mg/l (parágrafo 10). Este intervalo de concentrações é tão vasto que é impossível de estabelecer com razoabilidade os limites de inibição; tal só será possível quando os inóculos se tornarem mais reprodutíveis. Os volumes de gás produzido nos controlos em 48 h variam entre 21 ml/g de peso seco de lamas e 149 ml/g (média 72 ml/g). Não há uma relação consistente entre o volume de gás produzido e o valor de EC50 correspondente. O pH final varia entre 6,1 e 7,5.
|
|
41.
|
O ensaio é considerado válido quando se obtém uma inibição superior a 20 % no controlo de referência (150 mg/l de 3,5-diclorofenol), o branco produz mais de 50 ml de gás por g de peso seco e o pH, no final, se situa entre 6,2 e 7,5.
|
Relatório do ensaio
|
42.
|
O relatório deve obrigatoriamente incluir as seguintes informações:
|
|
Produto químico em estudo
|
—
|
nome vulgar, denominação química, número CAS, fórmula estrutural e principais propriedades fisico-químicas;
|
|
—
|
pureza (teor de impurezas).
|
|
|
|
Condições experimentais
|
—
|
volume do líquido e do espaço vazio dos recipientes utilizados;
|
|
—
|
descrição dos recipientes utilizados e da forma de medição do gás (por exemplo, tipo de medidor de gás);
|
|
—
|
forma de aplicação do produto químico em estudo e do produto químico de referência, concentrações utilizadas e quais os solventes;
|
|
—
|
descrição detalhada do inóculo utilizado; nome da estação de tratamento de esgoto, descrição da origem das águas residuais tratadas (por exemplo, temperatura, tempo de retenção das lamas, predominantemente, de origem doméstica ou industrial, etc.), concentração de sólidos, atividade de produção de gás no digestor anaeróbio, possível exposição ou pré-tratamento com produtos químicos tóxicos ou local de colheita do lodo, sedimento, etc.;
|
|
—
|
temperatura de incubação e sua variação etc.;
|
|
—
|
temperatura de incubação, com o respetivo intervalo de variação;
|
|
|
|
Resultados
|
—
|
valores de pH no final do ensaio;
|
|
—
|
todas as medições realizadas nos recipientes de teste, de controlo, do branco e do produto químico de referência, em forma de quadro (por exemplo, pressão em Pa ou milibares;
|
|
—
|
inibição, em percentagem, determinada nas garrafas de ensaio e de referência; curvas concentração versus inibição;
|
|
—
|
cálculo dos valores de EC50, expressos em mg/l e mg/g;
|
|
—
|
produção de gás por grama de lamas, em 48 horas;
|
|
—
|
motivos para a rejeição de algum dos resultados obtidos;
|
|
—
|
discussão dos resultados, incluindo alguma alteração efetuada ao método descrito, nomeadamente com base em interferências e erros ocorridos que se desviem do esperado;
|
|
—
|
referir se a finalidade do teste consistiu, também, em medir a toxicidade para microrganismos nunca expostos ou pré-expostos ao produto químico em estudo.
|
|
|
REFERÊNCIAS
|
(1)
|
Capítulo C.11 do presente anexo (Lamas ativadas — ensaio de inibição da respiração).
|
|
(2)
|
Capítulo C.43 do presente anexo (Ensaio de biodegradabilidade anaeróbia de substâncias orgânicas em lamas digeridas: método por medição da produção gasosa).
|
|
(3)
|
Organização Internacional de Normalização (2003) ISO 13 641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1: General Test.
|
|
(4)
|
Organização Internacional de Normalização (2003) ISO 13 641-2 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 & ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS & Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA & Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C & Kettrup A, pp117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T, & Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
Organização Internacional de Normalização (1995) ISO 10 634 Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
Organização Internacional de Normalização (1997) ISO 11 923 Water Quality — Determination of suspended solids by filtration through glass-fibre filters.
|
Apêndice 1
Exemplo de uma montagem para medir a produção de biogás utilizando a pressão do gás

Legenda:
|
1
|
—
|
Medidor de pressão
|
|
2
|
—
|
Válvula de gás de três vias
|
|
3
|
—
|
Agulha da seringa
|
|
4
|
—
|
Vedante à prova de gás (tampa metálica e rolha)
|
|
5
|
—
|
Volume livre
|
|
6
|
—
|
Inóculo
|
As garrafas são colocadas num ambiente a 35 °C ± 2 °C
Apêndice 2
Conversão do medidor de pressão
As leituras no medidor de pressão podem estar relacionadas com o volume do gás por intermédio de uma curva-padrão; pode, assim, calcular-se o volume do gás produzido por g de lama seca durante 48 h. Este índice de atividade é utilizado com um dos critérios de validação dos resultados obtidos. A curva de calibração é definida injetando volume conhecidos de gás a 35 °C ± 2 °C em frascos de soro que contêm um volume de água igual ao da mistura de reação, VR;
|
—
|
Colocar VR ml de alíquotas de água, mantidas a 35 °C ± 2 °C, em cinco frascos de soro. Vedar as garrafas e colocá-las num banho de água a 35 °C ± 2 °C durante 1h, para uniformizar;
|
|
—
|
Ligar o medidor de pressão, deixá-lo estabilizar e ajustar o zero;
|
|
—
|
Inserir a agulha da seringa através da tampa de uma das garrafas, abrir a válvula até que o medidor de pressão chegue a zero e depois fechar a válvula;
|
|
—
|
Repetir o procedimento com as restantes garrafas;
|
|
—
|
Injetar 1 ml de ar a 35 °C ± 2 °C em cada uma das garrafas. Inserir a agulha (no medidor) através da tampa de uma das garrafas e deixar a pressão estabilizar. Registar a pressão, abrir a válvula até que a pressão chegue a zero e depois fechar a válvula;
|
|
—
|
Repetir o procedimento com as restantes garrafas;
|
|
—
|
Repetir todo o procedimento utilizando 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml, e 50 ml de ar;
|
|
—
|
Traçar uma curva de conversão da pressão (Pa) em função do volume do gás injetado (ml). A resposta do aparelho é linear para o intervalo de pressão entre 0 Pa e 70 000 Pa e entre 0 ml e 50 ml de gás produzido.
|
Apêndice 3
Fatores identificados que podem originar resultados falseados
a) Qualidade das tampas das garrafas
Estão disponíveis no comércio diferentes tipos de vedantes dos frascos de soro, muitos dos quais — inclusive a borracha de butilo — perdem a firmeza quando são espetados com a agulha nas condições experimentais do presente ensaio. Por vezes, a pressão baixa muito lentamente quando a tampa é espetada com a agulha da seringa. A utilização de tampas estanque para os gases é recomendada para obviar estas falhas [ponto 12, alínea b)].
b) Humidade na agulha da seringa
Por vezes, a humidade acumula-se na agulha da seringa e na tubagem, o que pode ser detetado ao ler-se uma ligeira pressão negativa. Para suprir este problema, remover a agulha e agitar a tubagem; secar com um pano e colocar uma nova agulha (pontos 12, alínea c), e 35).
c) Contaminação com oxigénio
Os métodos anaeróbios estão sujeitos a erros por contaminação com oxigénio, o qual pode causar uma menor produção de gás. No presente método, essa possibilidade deve ser minimizada pela utilização de técnicas estritamente anaeróbias, inclusive a utilização de um porta-luvas.
d) Substrato mais grosseiro nas lamas
A produção anaeróbia de gás e a sensibilidade das lamas são influenciadas pelos substratos transferidos com o inóculo para as garrafas. As lamas digeridas em digestores anaeróbios domésticos contêm, frequentemente, pelos e resíduos vegetais de celulose, o que torna difícil retirar amostras representativas. Ao crivar as lamas, promove-se a remoção das matérias insolúveis mais grosseiras, o que permite colher amostras representativas (ponto 16).
e) Produtos químicos voláteis
Os produtos químicos voláteis acumulam-se no espaço vazio das garrafas de ensaio. Podem, por isso, registar-se perdas de produto após as medições de pressão, originando valores de EC50 erroneamente elevados. O problema pode ser suprido ajustando a relação entre o volume de espaço vazio e o volume de líquido e não efetuar purgas após as medições de pressão (10).
f) Produção não linear de gás
Se a curva da média cumulativa de produção de gás em função do tempo de incubação não for aproximadamente linear no período de 48 h, a precisão do teste pode baixar. Para ultrapassar este problema, é aconselhável utilizar lamas de uma origem diferente e/ou aumentar a concentração do meio nutritivo, do extrato de levedura e da glucose (ponto 29).
Apêndice 4
Aplicação a amostras naturais com biomassas baixas — lodos anaeróbios, sedimentos, etc.
Introdução
A.1 Geralmente, a atividade microbiana específica que ocorre naturalmente em lodos anaeróbicos, sedimentos, solos, etc.. é bastante mais baixa do que a que ocorre em lamas anaeróbicas derivadas de esgotos. Por isso, quando são medidos os efeitos inibitórios de produtos químicos nestas amostras de lamas menos reativas, algumas das condições experimentais podem ser modificadas. Para estas lamas menos reativas, pode proceder-se de duas formas:
|
a)
|
Alterar o teste preliminar (ponto 25) com uma amostra de lama, solo, etc., a 35 °C ± 2 °C ou mantendo a temperatura do local onde foi recolhida para uma simulação mais precisa (como indicado na parte 1 da norma ISO 13 641);
|
|
b)
|
Realizar o teste com a lama diluída (1 para 100), para estimular a esperada baixa atividade da amostra natural, mas mantendo a temperatura a 35 °C ± 2 °C (como indicado na parte 2 da norma ISO 13 641).
|
A.2 A opção (a) pode ser executada pelo método aqui descrito (equivalente à parte 1 da ISO 13 641); porém, é essencial realizar um teste preliminar (parágrafo 25) para estabelecer as condições ótimas, a não ser se estas já tenham sido descritas em testes anteriores. A amostra de lodo ou de sedimento deve ser minuciosamente misturada utilizando, por exemplo, um liquidificador e, se necessário, diluindo com água arejada (ponto 14), de modo que possa ser utilizada uma pipeta de ponta grossa ou uma proveta. Caso se considere que faltam nutrientes, a amostra de lodo pode ser centrifugada (em condições anaeróbicas) e ressuspendida num meio de cultura mineral contendo extrato de levedura (A.11).
A.3 Opção (b). Este procedimento imita razoavelmente a baixa atividade das amostras naturais, mas carece da alta concentração de sólidos suspensos presentes nessas amostras. O papel dos sólidos suspensos na inibição não é conhecido, mas é possível que a reação entre o produto químico em estudo e os constituintes do lodo, assim como a adsorção do produto químico em estudo nestes sólidos, possa resultar numa diminuição da toxicidade do produto químico em estudo.
A.4 A temperatura é outro fator importante: em simulações rigorosas, os ensaios devem ser realizados à temperatura do local de colheita, pois é sabido que os diferentes tipos de bactérias produtoras de metano preferem gamas de temperaturas muito diversas — podendo classificar-se, nomeadamente, em termófilas (~ 30-35 °C), mesófilas (20-25 °C) e psicrófilas (< 20 °C) –, o que origina padrões de inibição muito variados.
A.5 Duração. Na parte 1 do ensaio normalizado, que utiliza lamas não diluídas, a produção de gás nos primeiros 2-4 dias é sempre suficiente, enquanto na parte 2, com uma amostra diluída 100 vezes, a quantidade de gás produzido no teste interlaboratorial é insuficiente ou nula. Na sua descrição do ensaio, Madsen et al. (1996) recomendam que a duração do ensaio seja de, pelo menos, 7 dias.
Concentrações baixas de biomassa (opção b)
É necessário efetuar as seguintes modificações e alterações, aditando ou substituindo alguns pontos do texto principal.
A.6 Aditar ao ponto 6: Princípio do ensaio
“Esta técnica pode ser utilizada com 1 em 100 lamas anaeróbias diluídas, para estimular parcialmente a baixa atividade dos lodos e dos sedimentos. A temperatura de incubação pode ser 35 °C ou a do local onde a amostra foi recolhida. Como a atividade bacteriana é muto inferior quando comparada com a amostra não diluída, o período de incubação deve ser aumentado para, pelo menos, 7 dias.”
A.7 Aditar ao ponto 12, alínea a):
“A incubadora deve poder funcionar a 15 °C.”
A.8 No final do ponto 13, aditar um reagente suplementar:
“Ácido fosfórico (H3PO4), solução em água a 85 %, em massa.”
A.9 No final do ponto 16, aditar o seguinte:
“Utilizar uma concentração final de 0,20 ± 0,05 g/l de peso seco de sólidos totais.”
A.10 Ponto 17. Substrato em estudo
Este substrato não pode ser utilizado e deve ser substituído por extrato de levedura (ver pontos 17; A.11, A.12, A.13).
A.11 É necessário um meio de cultura mineral, incluindo os elementos vestigiais, sendo conveniente adicionar um substrato orgânico, como o extrato de levedura.
No final do ponto 17, aditar o seguinte:
|
“a)
|
Meio mineral em estudo, com extrato de levedura.
|
É preparado a partir de meio de cultura concentrado [ponto 17, alínea b); A. 12] com uma solução de elementos vestigiais (ponto 17, alínea c); A.13). Utilizar sulfureto de sódio não hidratado recente [ponto 17, alínea b); A.12], ou lavá-lo e secá-lo antes da utilização, para garantir que mantém a sua capacidade de redução. Se o ensaio for realizado sem a câmara de fluxo laminar com luvas [ponto 12, alínea j)], a concentração de sulfureto de sódio na solução-mãe deve ser aumentada para 2 g/l (de 1g/l). O sulfureto de sódio deve, também, ser adicionado através da rolha das garrafas, com vista a reduzir o risco de oxidação, para uma concentração final de 0,2 g/l. Alternativamente, pode utilizar-se citrato de titânio (III) [parágrafo 17 (b)]. Neste caso, adicioná-lo através da rolha da garrafa, para uma concentração entre os 0,8 mmol/l e 1,0 mmol/l. O citrato de titânio (III) é muito eficaz; é um agente de reduzida toxicidade que se prepara da seguinte forma: dissolver 2,94 g de citrato trissódico di-hidratado em 50 ml de água sem oxigénio (ponto 14) — o que resulta numa solução de 200 mmol/l — e adicionar 5 ml de solução de cloreto de titânio (III) (15 g/100 ml em água). Neutralizar até pH 7 ± 0,5 com carbonato de sódio e colocar num frasco de soro sob fluxo de azoto gasoso. A concentração final de citrato de titânio (III) na solução-mãe é de 164 mmol/l. Utilizá-la imediatamente ou guardá-la a 4 °C, não mais do que um dia.
|
A.12
|
(b)
|
Meio de ensaio concentrado dez vezes, preparado com os seguintes compostos:
|
Di-hidrogenofosfato de potássio anidro (KH2PO4)
|
2,7 g
|
|
Hidrogenofosfato dissódico (Na2HPO4)
|
4,4 g
|
|
(ou 11,2 g de deca-hidratado)
Cloreto de amónio (NH4Cl)
|
5,3 g
|
|
Cloreto de cálcio di-hidratado (CaCl2·2H2O)
|
0,75 g
|
|
Cloreto de magnésio hexa-hidratado (MgCl2·6H2O)
|
1,0 g
|
|
Cloreto de ferro (II) tetra-hidratado (FeSO4·4H2O)
|
0,2 g
|
|
Resazurina (indicador redox)
|
0,01 g
|
|
Sulfato de sódio nona-hidratado (Na2S·9H2O)
|
1,0 g
|
|
[ou citrato de titânio (III)] conc.final
|
0,8 mmol/l a 1,0 mmol/l
|
|
Solução de elementos vestigiais [ver ponto 17, c); A.13]
|
10,0 ml
|
|
Extrato de levedura
|
100 g
|
|
Dissolver em água de diluição (ponto 14) e perfazer até
|
1 000 ml
|
|
|
A.13
|
(c)
|
Solução de elementos vestigiais, preparada com os seguintes compostos:
|
Cloreto de manganês (II) tetra-hidratado (MnCl2·4H2O)
|
0,5 g
|
|
Ácido ortobórico (H3BO3)
|
0,05 g
|
|
Cloreto de zinco (ZnCl2)
|
0,05 g
|
|
Cloreto de cobre (II) (CuCl2)
|
0,03 g
|
|
Molibdato de sódio di-hidratado (Na2MoO4·2H2O)
|
0,01 g
|
|
Cloreto de cobalto (II) hexa-hidratado (CoCl2·6H2O)
|
1,0 g
|
|
Cloreto de níquel (II) hexa-hidratado (NiCl2·6H2O)
|
0,1 g
|
|
Selenito dissódico (Na2SeO3)
|
0,05 g
|
|
Dissolver em água de diluição (ponto 14) e perfazer até
|
1 000 ml”.
|
|
A.14 Ponto 25: Ensaio preliminar
É essencial que o ensaio preliminar seja realizado de acordo com o ponto 24, exceto se a concentração sólida das lamas for 100 vezes superior à apresentada. Então, o teste deve ser realizado com 0,1g/l, 0,2g/l e 0,4g/l. A duração da incubação deve ser de, pelo menos, 7 dias.
Nota: se, no teste de intercalibração (5), o volume livre de líquido foi da ordem de 75 % do volume total, é recomendável que se mantenha na ordem dos 10 %-40 %. O que importa reter é que o volume de gás produzido para 80 5 de inibição deve ser medido com uma precisão aceitável (por exemplo, ±5 % a ±10 %).
A.15 Pontos 26 a 30: Adição do produto químico em estudo, do inóculo e do substrato
As adições são realizadas com descrito nos pontos respetivos, mas a solução de substrato (ponto 17) é substituída pelo meio de cultura com o extrato de levedura (A.11).
Para além disso, a concentração final das lamas em peso seco é reduzida de 2 g/l — 4 g/l para 0,2 ± 0,05 g/l (A.9). Dois exemplos da adição de constituintes à mistura de reação são apresentados no quadro A.1, que substitui o quadro constante do ponto 29.
A.16 Ponto 33: Incubação das garrafas
Dado a taxa de produção de gás ser mais baixa, o tempo de incubação é aumentado para 7 dias.
A.17 Ponto 34: Medições de pressão
Se forem necessárias as quantidades de gás na fase gasosa, utiliza-se o procedimento descrito no ponto 34 para medir a pressão. Se forem medidas as quantidades de CO2 e CH4, o pH da fase líquida é reduzido para 2 por injeção de H3PO4 em cada uma das garrafas que se achar adequado, sendo a pressão medida após 30 minutos. No entanto, é mais útil medir a pressão em cada uma das garrafas, antes e após a acidificação. Por exemplo, se a taxa de produção de CO2 for muito mais alta que a do metano, a sensibilidade das bactérias fermentativas pode ser alterada e/ou as bactérias metanogénicas são mais afetadas pelo produto químico em estudo.
A.18 Ponto 36: Medições de pH
Se se utilizar H3PO4, são necessários controlos aos quais não é adicionado H3PO4, especialmente para as medições de pH.
REFERÊNCIA:
Madsen, T, Rasmussen, HB; & Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhaga.
Quadro A.1.
Exemplos de condições experimentais em ensaios descontínuos
|
Componentes das misturas de reação
|
Exemplo 1
|
Exemplo 2
|
Ordem de adição
|
|
Concentração de inóculo (g/l)
|
0,42
|
2,1
|
—
|
|
Volume de inóculo (ml)
|
45
|
9
|
4
|
|
Concentração de inóculo nas garrafas de ensaio (g/l)
|
0,20
|
0,20
|
—
|
|
Volume de meio de cultura adicionado (ml)
|
9
|
9
|
2
|
|
Volume de água de diluição adicionada (ml)
|
36
|
72
|
3
|
|
Concentração do extrato de levedura nas garrafas de ensaio (g/l)
|
9,7
|
9,7
|
—
|
|
Volume da solução-mãe do produto químico (ml)
|
3
|
3
|
1
|
|
Volume total de líquido (ml)
|
93
|
93
|
—
|
Apêndice 5
Definições
No âmbito do presente método de ensaio, aplicam-se as seguintes definições:
Produto químico
: uma substância ou mistura.
Produto químico em estudo
: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
C.35 ENSAIO DE TOXICIDADE PARA LUMBRICULUS NUM SISTEMA SEDIMENTO-ÁGUA COM SEDIMENTO ENRIQUECIDO
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 225 (2007) da OCDE. Os animais endobentónicos que ingerem sedimentos estão sujeitos a uma exposição potencialmente elevada aos produtos químicos presentes nesses sedimentos, devendo, por isso, ser objeto de especial atenção — ver, por exemplo, (1) (2) (3). De entre as espécies em causa, os oligoquetas aquáticos desempenham um papel importante nos sedimentos dos sistemas aquáticos. Dado causarem bioturvação dos sedimentos e constituírem presas, estes animais podem ter grande influência na biodisponibilidade dos produtos químicos em causa para outros organismos, como, por exemplo, os peixes bentívoros. Contrariamente aos organismos epibentónicos, os oligoquetas aquáticos endobentónicos (como Lumbriculus variegatus) enterram-se nos sedimentos e ingerem partículas destes abaixo da superfície. Garante-se assim a exposição dos organismos de ensaio ao produto químico em estudo por todas as vias de absorção possíveis (por exemplo, contacto e ingestão de partículas de sedimentos contaminados e também através da água ocluída e sobrenadante).
|
|
2.
|
O presente método de ensaio foi concebido para avaliar os efeitos da exposição prolongada do oligoqueta endobentónico Lumbriculus variegatus (Müller) a produtos químicos associados aos sedimentos. Baseia-se nos atuais protocolos de ensaios de toxicidade e bioacumulação em sedimentos — por exemplo, (3) (4) (5) (6) (7) (8) (9) (10). O método é descrito para condições de ensaio estáticas. O cenário de exposição utilizado neste método de ensaio consiste no enriquecimento dos sedimentos com o produto químico em estudo. A utilização de um sedimento enriquecido tem por objetivo simular a sua contaminação com o produto químico em estudo.
|
|
3.
|
Os produtos químicos a ensaiar com organismos que vivem nos sedimentos persistem, em geral, neste compartimento por longos períodos. A exposição dos referidos organismos pode ter lugar por várias vias. A importância relativa de cada via de exposição, bem como o tempo de contribuição de cada uma delas para os efeitos tóxicos globais, depende das propriedades físico-químicas do produto químico em causa e do seu destino final no espécime. No caso de substâncias fortemente adsorventes (por exemplo, com log Kow > 5) ou de substâncias fixas aos sedimentos por ligações covalentes, a ingestão de alimentos contaminados pode constituir uma via de exposição significativa. Para não subestimar a toxicidade dos produtos químicos, o alimento necessário à reprodução e ao crescimento dos organismos de ensaio é adicionado aos sedimentos antes da aplicação do produto químico em estudo (11). O método descrito é suficientemente pormenorizado para que, na realização do ensaio, possam efetuar-se adaptações na conceção experimental, em função das condições, nomeadamente laboratoriais, e das características dos produtos químicos.
|
|
4.
|
O método de ensaio tem por objetivo determinar os efeitos do produto químico em estudo na reprodução e na biomassa dos organismos sujeitos ao ensaio. Os parâmetros biológicos medidos são o número total de vermes sobreviventes e a biomassa (peso seco) no final da exposição. Estes dados são analisados por um método de regressão, com vista a estimar a concentração que causa um efeito de x % (por exemplo, EC50, EC25 ou EC10), ou por recurso a hipóteses estatísticas, com vista a determinar a concentração sem efeitos observáveis (NOEC) e a menor concentração com efeitos observáveis (LOEC).
|
|
5.
|
O capítulo C.27 do presente anexo (Ensaio de toxicidade com quironomídeos num sistema água-sedimento com sedimentos enriquecidos) (6) apresenta muitas informações essenciais e úteis para a execução do método de ensaio de toxicidade dos sedimentos. Por conseguinte, o presente documento constitui a base a partir da qual se introduziram as modificações necessárias à realização de ensaios de toxicidade de sedimentos com Lumbriculus variegatus. Os outros documentos a que é feita referência são, por exemplo, o guia da ASTM para determinação da bioacumulação de contaminantes associados aos sedimentos com invertebrados bentónicos (3), os métodos da EPA (E.U.A) para determinar a toxicidade e a bioacumulação de contaminantes associados aos sedimentos com invertebrados de água doce (7) e o guia da ASTM para a recolha, a armazenagem, a caracterização e a manipulação de sedimentos para ensaios toxicológicos e para a seleção de amostras, a utilizar na recolha de invertebrados bentónicos (12). Por sua vez, a experiência obtida com a validação do método de ensaio (relatório de estudo interlaboratorial comparativo — 13) e os dados provenientes da literatura constituem importantes fontes de informação para a elaboração do presente documento.
|
REQUISITOS PRÉVIOS E DADOS DE ORIENTAÇÃO
|
6.
|
Antes do início do ensaio, devem obter-se informações sobre o produto químico, como precauções em matéria de segurança, condições de armazenagem e métodos de análise adequados. As orientações para o ensaio de produtos cujas propriedades físico-químicas dificultam a realização dos ensaios constam da referência (14).
|
|
7.
|
Antes de se proceder ao ensaio, deve dispor-se das seguintes informações sobre o produto químico em estudo:
|
—
|
nome comum, denominação química (preferivelmente a denominação IUPAC), fórmula estrutural, número de registo CAS, grau de pureza;
|
|
|
8.
|
Considera-se também útil dispor das seguintes informações adicionais antes do início do ensaio:
|
—
|
coeficiente de partição octanol/água, Kow;
|
|
—
|
coeficiente de partição carbono orgânico/água, (Koc);
|
|
—
|
fototransformação na água;
|
|
|
9.
|
Antes do início do ensaio, devem também obter-se informações sobre determinadas características dos sedimentos a utilizar (7). Para mais pormenores, ver pontos 22 a 25.
|
PRINCÍPIO DO ENSAIO
|
10.
|
Expõem-se vermes num estado fisiológico idêntico (sincronizados como descrito no apêndice 5) a uma série de concentrações da substância tóxica, aplicada à fase sedimentar de um sistema sedimentos-água. Como meios, devem utilizar-se sedimentos artificiais e água reconstituída. Os controlos são feitos em recipientes de ensaio sem adição do produto químico em estudo. Os sedimentos são enriquecidos com o produto químico em várias concentrações, a fim de minimizar a variabilidade entre os replicados de cada concentração; os organismos de ensaio são subsequentemente introduzidos em recipientes nos quais as concentrações de sedimentos e de água tenham sido equilibradas (ver ponto 29). Os animais são expostos aos sistemas sedimento-água por um período de 28 dias. Atendendo ao baixo teor de nutrientes dos sedimentos artificiais, estes últimos devem ser modificados mediante a adição de uma fonte de alimento (ver pontos 22 a 23 e apêndice 4), para assegurar que os vermes se desenvolvem e se reproduzem em condições controladas. Garante-se, assim, a exposição dos animais através da água e dos sedimentos, bem como da alimentação.
|
|
11.
|
O ponto final preferido deste tipo de estudo é a ECx (por exemplo, EC50, EC25 e EC10, concentração com efeitos sobre x % dos organismos de ensaio) para a reprodução e a biomassa, respetivamente, em comparação com os controlos. Importa contudo referir que, perante a elevada incerteza associada aos valores baixos de ECx (por exemplo, EC10 e EC25) com limites de confiança a 95 % extremamente elevados (ver, por exemplo, a referência 15) e a representatividade estatística determinada nos testes de hipóteses, o parâmetro EC50 é considerado o ponto final mais adequado. Além disso, no que respeita à biomassa e à reprodução, é possível calcular a concentração sem efeitos observáveis (NOEC) e a menor concentração com efeitos observáveis (LOEC) se a conceção do ensaio e os dados apoiarem os cálculos (ver pontos 34 a 38). A conceção do ensaio depende do objetivo do estudo (determinação da ECx ou da NOEC).
|
ENSAIOS DE REFERÊNCIA
|
12.
|
O desempenho dos organismos de controlo deve demonstrar suficientemente a capacidade do laboratório para realizar o ensaio e, caso se disponha de dados históricos, a repetibilidade do ensaio. Podem também realizar-se ensaios de toxicidade de referência a intervalos regulares, utilizando uma substância tóxica de referência para avaliar a sensibilidade dos organismos de ensaio. Os ensaios de toxicidade de referência com água (96 h) apenas permitem demonstrar de forma satisfatória a sensibilidade e o estado dos animais — (4) (7). O apêndice 6 e o relatório do estudo interlaboratorial comparativo (13) apresentam informações sobre a toxicidade do pentaclorofenol (PCP) em ensaios completos (exposição a sedimentos enriquecidos durante 28 dias). A toxicidade aguda do PCP em ensaios realizados unicamente com água é descrita, por exemplo, em (16). Estas informações podem ser utilizadas para efeitos de comparação da sensibilidade do organismo de ensaio em ensaios de referência em que o PCP é o produto tóxico. O cloreto de potássio (KCl) e o sulfato de cobre (CuSO4) foram recomendados como substâncias tóxicas de referência em ensaios com L. variegatus (4) (7). Até à data, afigura-se difícil estabelecer critérios de qualidade com base em dados de toxicidade do KCl, devido à escassez de dados bibliográficos relativos à espécie L. variegatus. As referências (17) a (21) contêm informações sobre a toxicidade do cobre para a L. variegatus.
|
VALIDADE DO ENSAIO
|
13.
|
Um ensaio é considerado válido quando satisfaz os seguintes critérios:
|
—
|
Um estudo interlaboratorial comparativo (13) demonstrou que, no caso da espécie Lumbriculus variegatus, o número médio de indivíduos vivos por replicado nos controlos deve ter aumentado, no final da exposição, num fator mínimo de 1,8 relativamente ao número de indivíduos por replicado no início da exposição.
|
|
—
|
O pH da água sobrenadante está compreendido entre 6 e 9, durante todo o ensaio.
|
|
—
|
A concentração de oxigénio na água sobrenadante não é inferior a 30 % do valor da saturação no ar (VSA), à temperatura de ensaio, durante o mesmo.
|
|
DESCRIÇÃO DO MÉTODO DE ENSAIO
Sistema de ensaio
|
14.
|
São recomendados os sistemas estáticos, sem renovação da água sobrenadante. Se o rácio sedimento-água (ver ponto 15) for adequado, bastará, em geral, um arejamento ligeiro para manter a qualidade da água a níveis aceitáveis para os organismos de ensaio (por exemplo, maximização dos teores de oxigénio dissolvido, minimização da acumulação de produtos de excreção). Os sistemas semiestáticos ou de escoamento com renovação intermitente ou contínua da água sobrenadante devem ser utilizados apenas em casos excecionais, uma vez que a renovação regular da água sobrenadante pode afetar o equilíbrio químico, causando, por exemplo, perdas do produto químico no sistema de ensaio.
|
Recipientes e aparelhos
|
15.
|
A exposição deve ter lugar em copos de vidro, por exemplo, de 250 ml e 6 cm de diâmetro. Podem utilizar-se outros recipientes, mas importa que assegurem uma espessura adequada de água sobrenadante e de sedimentos. Deve colocar-se em cada recipiente uma camada de 1,5 a 3 cm de sedimento formulado. O rácio entre a espessura da camada de sedimento e a espessura da água sobrenadante deve ser de 1:4. Os recipientes devem ter capacidade adequada à carga, isto é, ao número de minhocas utilizadas por unidade de peso do sedimento (ver também ponto 39).
|
|
16.
|
Os recipientes de ensaio e o restante equipamento que entre em contacto com o produto químico em estudo devem ser exclusivamente de vidro ou de outro material quimicamente inerte. Deve evitar-se a utilização, em qualquer parte do equipamento, de materiais que possam dissolver ou absorver o produto químico em estudo ou permitir fugas de outros produtos químicos, ou que tenham um efeito nocivo nos animais sujeitos ao ensaio. Pode utilizar-se politetrafluoroetileno (PTFE), aço inoxidável e/ou vidro em qualquer equipamento que entre em contacto com os meios de ensaio. No caso de produtos químicos orgânicos que se saiba serem adsorvidos pelo vidro, pode ser necessário utilizar vidro silanizado. Em tais casos, o equipamento deve ser descartado após o uso.
|
Espécies sujeitas ao ensaio
|
17.
|
A espécie utilizada neste tipo de estudo é o oligoqueta de água doce Lumbriculus variegatus (Müller). Esta espécie, tolerante a uma vasta gama de tipos de sedimentos, é amplamente utilizada em ensaios de bioacumulação e toxicidade de sedimentos [ver, por exemplo, (3) (5) (7) (9) (13) (15) (16) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35)]. Devem comunicar-se a origem dos animais de ensaio, a confirmação da identidade da espécie [por exemplo, (36)] e as condições de cultura. Se os organismos forem provenientes de uma cultura interna do laboratório, não é necessário proceder à sua identificação antes de cada ensaio.
|
Cultura dos organismos a submeter a ensaio
|
18.
|
A fim de dispor de um número suficiente de animais para a realização dos ensaios de toxicidade no sedimento, é útil manter uma cultura permanente de vermes no laboratório. O apêndice 5 contém orientações sobre métodos de cultura laboratorial de Lumbriculus variegatus, bem como fontes de culturas de arranque. Para mais informações sobre a cultura desta espécie, consultar as referências (3) (7) (27).
|
|
19.
|
Para assegurar que os ensaios são realizados com animais da mesma espécie, recomenda-se vivamente a cultura de uma única espécie. Deve garantir-se que as culturas e, em especial, os animais utilizados nos ensaios são isentos de doenças ou perturbações observáveis.
|
Água
|
20.
|
Nos ensaios, recomenda-se a utilização, como água sobrenadante, de água reconstituída [cf. capítulo C.1 (37)]; essa água pode também ser utilizada para a cultura laboratorial dos vermes (para a sua preparação, ver apêndice 2). Se necessário, pode utilizar-se água natural. A qualidade da água escolhida deve permitir que, durante os períodos de aclimatação e de ensaio, os vermes cresçam e se reproduzam sem apresentarem aspetos ou comportamentos anormais. Demonstrou-se que a espécie Lumbriculus variegatus sobrevive, desenvolve-se e reproduz-se neste tipo de água (30), pressupondo uma normalização máxima das condições de ensaio e cultura. Se se utilizar água reconstituída, a sua composição deve ser indicada. Antes da utilização, a água deve ser caracterizada, pelo menos, pelos seguintes parâmetros: pH, teor de oxigénio e dureza (expressos em mg CaCO3/l). A análise da água, antes da utilização, para averiguar a presença de micropoluentes, pode proporcionar informações úteis (ver, por exemplo, apêndice 3).
|
|
21.
|
O pH da água sobrenadante deve situar-se no intervalo de 6,0 a 9,0 (ver ponto 13). Caso se preveja um aumento da libertação de amoníaco, é conveniente manter o pH na gama de 6,0 a 8,0. Para o ensaio de ácidos orgânicos fracos, é conveniente ajustar o pH por tamponamento da água, como descrito, por exemplo, na referência (16). A dureza total da água a utilizar no ensaio deve situar-se entre 90 e 300 mg CaCO3 por litro (água natural). O apêndice 3 resume os critérios adicionais que deve satisfazer uma água de diluição aceitável, em conformidade com a diretriz n.o 210 da OCDE (38).
|
Sedimento
|
22.
|
Uma vez que os sedimentos naturais não contaminados de uma dada origem podem não estar disponíveis todo o ano, e que a presença de organismos autóctones e de micropoluentes pode influenciar o ensaio, devem utilizar-se, de preferência, sedimentos formulados (também designados como reconstituídos, artificiais ou sintéticos). A utilização de sedimentos formulados minimiza a variabilidade das condições de ensaio e a introdução de fauna autóctone. Os sedimentos formulados cuja composição se segue baseiam-se nos sedimentos artificiais descritos em (6) (39) (40). Recomenda-se a sua utilização neste tipo de ensaio [(6) (10) (30) (41) (42) (43)]:
|
a)
|
4-5 % (peso seco) de turfa de esfagno; é importante utilizar turfa na forma pulverulenta, com grau de decomposição “médio”, finamente moída (granulometria ≤ 0,5 mm) e seca unicamente ao ar.
|
|
b)
|
20 ± 1 % (peso seco) de argila caulínica, de preferência com teor de caulinite superior a 30 %;
|
|
c)
|
75-76 % (peso seco) de areia de quartzo (fina, com granulometria ≤ 2 mm, mas > 50 % das partículas na gama 50-200 μm).
|
|
d)
|
Água desionizada, 30-50 % de sedimento (peso seco), além dos componentes secos do sedimento.
|
|
e)
|
Carbonato de cálcio (CaCO3) quimicamente puro, para ajustar o pH da mistura final do sedimento.
|
|
f)
|
O teor de carbono orgânico da mistura final deve ser de 2 % (± 0,5 %) do peso seco do sedimento, ajustando-se o seu valor por recurso a quantidades adequadas de turfa e areia, em conformidade com as alíneas a) e c).
|
|
g)
|
O alimento — por exemplo, folhas pulverizadas de ortiga (Urtica sp. para consumo humano, conforme com normas farmacêuticas) ou uma mistura de folhas pulverizadas de Urtica sp. com α-celulose (1:1), em 0,4-0,5 % de sedimento (peso seco), além dos componentes do sedimento seco; para mais informações, ver apêndice 4.
|
|
|
23.
|
As fontes da turfa, da argila caulínica, do alimento e da areia devem ser conhecidas. Além da alínea g), o capítulo C.27 do presente anexo (6) enumera produtos de origem vegetal alternativos a utilizar como fonte de alimentação: folhas desidratadas de amoreira (Morus alba), trevo branco (Trifolium repens), espinafre (Spinacia oleracea) ou forragem de cereais.
|
|
24.
|
O alimento escolhido deve ser adicionado antes ou durante o enriquecimento do sedimento com o produto químico em estudo. A fonte de alimentação deve permitir, pelo menos, uma reprodução aceitável nos controlos. A pesquisa de micropoluentes no sedimento artificial ou nos seus componentes, antes da utilização, pode proporcionar informações úteis. No apêndice 4, apresenta-se um exemplo de preparação do sedimento formulado. Também é aceitável uma mistura de componentes secos caso se demonstre que, após a adição da água sobrenadante, não ocorre separação de componentes dos sedimentos (por exemplo, partículas de turfa flutuantes) e que a turfa ou os sedimentos estão suficientemente acondicionados (ver também ponto 25 e apêndice 4). Os sedimentos artificiais devem ser caracterizados, pelo menos, pelos seguintes parâmetros: origem dos componentes, distribuição granulométrica (percentagem de areia, de limo e de argila), teor de carbono orgânico total (COT), teor de água e pH. A medição do potencial redox é facultativa.
|
|
25.
|
Se necessário, nomeadamente para certas finalidades específicas, podem ser utilizados nos ensaios e/ou para cultura sedimentos naturais de locais não poluídos (3). Contudo, se se utilizarem sedimentos naturais, estes devem ser caracterizados, no mínimo, pelos seguintes parâmetros: origem (local de recolha), pH e teor de amoníaco da água dos poros, teor de carbono orgânico total (COT) e teor de azoto, distribuição granulométrica (percentagem de areia, de limo e de argila) e teor percentual de água (7); devem estar isentos de qualquer contaminação e de outros organismos que possam competir com os organismos sujeitos ao ensaio ou predá-los. A medição do potencial redox e da capacidade de troca catiónica é facultativa. Recomenda-se igualmente que, antes de ser enriquecido com o produto químico em estudo, o sedimento natural seja acondicionado durante sete dias em condições semelhantes às do ensaio subsequente. No final deste período de acondicionamento, remove-se e rejeita-se a água sobrenadante.
|
|
26.
|
A qualidade do sedimento a utilizar deve permitir que, durante o período de exposição, os organismos de controlo sobrevivam e se reproduzam sem apresentarem características ou comportamentos anormais. Os animais de controlo devem enterrar-se no sedimento e ingeri-lo. A reprodução nos controlos deve satisfazer, pelo menos, o critério de validade descrito no ponto 13. Deve registar-se a presença ou ausência de péletes fecais à superfície dos sedimentos, indicativos da ingestão de sedimento pelos vermes, dado poderem ser úteis para a interpretação dos resultados do ensaio no que respeita às vias de exposição. Podem obter-se informações adicionais sobre a ingestão de sedimentos por recurso aos métodos descritos em (24) (25) (44) (45), que especificam a ingestão de sedimentos e a seleção de partículas pelos organismos de ensaio.
|
|
27.
|
Os procedimentos de manipulação dos sedimentos naturais antes da sua utilização no laboratório são descritos em (3) (7) (12). A preparação e a armazenagem dos sedimentos artificiais cuja utilização é recomendada no ensaio com Lumbriculus são descritas no apêndice 4.
|
Aplicação do produto químico em estudo
|
28.
|
O produto químico em estudo é incorporado no solo. É de prever que a maioria dos produtos químicos em estudo tenha baixa solubilidade em água; por isso, devem ser dissolvidos num solvente orgânico adequado (por exemplo, acetona, n-hexano, ciclo-hexano) com volume tão baixo quanto possível para preparar a solução de reserva. Esta solução deve ser diluída com o mesmo solvente utilizado na preparação das soluções de ensaio. A toxicidade e a volatilidade do solvente e a solubilidade do produto químico em estudo no solvente escolhido devem ser os principais critérios para a seleção de um agente solubilizante adequado. Para cada concentração, deve utilizar-se o mesmo volume da solução correspondente. O sedimento deve ser enriquecido em abundância para cada concentração, a fim de minimizar a variabilidade da concentração do produto químico em estudo entre replicados. Mistura-se então cada uma das soluções de ensaio com areia de quartzo, do modo descrito no ponto 22 (por exemplo, 10 g de areia por recipiente de ensaio). Para embeber completamente a areia, considera-se suficiente um volume de 0,20 a 0,25 ml por g de areia. De seguida, é necessário evaporar o solvente à secura. Para minimizar as perdas do produto químico em estudo por coevaporação (devido à pressão de vapor do produto), a areia impregnada deve ser utilizada imediatamente após a secagem. A areia seca é misturada com a quantidade adequada de sedimento formulado correspondente à concentração em causa. Ao preparar o sedimento, importa ter em conta a quantidade de areia misturada com o produto químico em estudo (ou seja, deve utilizar-se menos areia na preparação do sedimento). A principal vantagem deste procedimento consiste em que não se introduz praticamente nenhum solvente no sedimento (7). Em alternativa (por exemplo, no caso de sedimentos recolhidos no campo), o produto químico em estudo pode ser adicionado, pelo método atrás descrito para a areia de quartzo, a uma porção de sedimento seco e finamente moído ou misturado no solo húmido, com subsequente evaporação do agente solubilizante eventualmente utilizado. Deve ter-se o cuidado de assegurar a distribuição total e uniforme do produto químico no sedimento. Se necessário, podem analisar-se subamostras, a fim de confirmar as concentrações-alvo no sedimento e determinar o grau de homogeneidade. Pode também ser útil analisar subamostras das soluções de ensaio, para confirmar as concentrações-alvo no sedimento. Uma vez que se recorre a um solvente para impregnar a areia de quartzo com o produto químico em estudo, deve utilizar-se um controlo com solvente, preparado com uma quantidade de solvente igual à dos sedimentos de ensaio. Deve indicar-se o método utilizado para o enriquecimento, bem como as razões da escolha de um procedimento de enriquecimento diverso do descrito. O método de enriquecimento pode ser adaptado às propriedades físico-químicas do produto em estudo, nomeadamente para evitar perdas por volatilização durante o enriquecimento ou a fase de equilíbrio. O documento Environment Canada (1995) (46) fornece orientações adicionais sobre os procedimentos de enriquecimento.
|
|
29.
|
Quando o sedimento enriquecido estiver preparado, distribuído pelos recipientes de replicação e coberto com a água de ensaio, é conveniente permitir a partição do produto químico em estudo entre o sedimento e a fase aquosa [ver, por exemplo, (3) (7) (9)]. Esta partição deve ocorrer, de preferência, às condições de temperatura e arejamento utilizadas no ensaio. O tempo necessário para atingir o equilíbrio depende do sedimento e do produto químico, podendo variar de algumas horas a vários dias e mesmo, em casos raros, a 4 ou 5 semanas [ver, por exemplo, (27) (47)]. No presente ensaio, não se pretende atingir o equilíbrio, mas recomenda-se um período de equilibração de 48 horas a 7 dias. Minimiza-se, assim, o tempo necessário à degradação do produto químico em estudo. Consoante o objetivo do estudo (por exemplo, se for necessário simular condições ambientais), os sedimentos enriquecidos podem ser equilibrados ou “envelhecidos” por um período mais longo.
|
|
30.
|
No final do período de equilibração, devem ser colhidas, no mínimo, amostras da água sobrenadante e do sedimento a granel, pelo menos nas concentrações mais elevada e mais baixa, para análise da concentração do produto químico em estudo. Estas determinações analíticas do produto químico em estudo permitem o cálculo do balanço de massas e a expressão dos resultados com base nas concentrações iniciais medidas. Em geral, a amostragem perturba ou destrói o sistema sedimento/água. Por conseguinte, não é, em geral, possível utilizar os mesmos replicados para a colheita de amostras de sedimentos e de animais. Devem preparar-se para análise recipientes adicionais de dimensões adequadas, que são tratados da mesma forma (inclusive no que respeita à presença dos organismos de ensaio), mas não se utilizam para observações biológicas. As dimensões dos recipientes devem ser selecionadas de forma a poderem ser produzidas as quantidades de amostras requeridas pelo método analítico. O ponto 53 contém mais informação sobre as técnicas de amostragem.
|
REALIZAÇÃO DO ENSAIO
Ensaio preliminar
|
31.
|
Se não se dispuser de informações sobre a toxicidade do produto químico em estudo para a Lumbriculus variegatus, pode ser útil efetuar um ensaio preliminar para determinar a gama de concentrações a utilizar no ensaio definitivo e para otimizar as condições do ensaio definitivo. Para o efeito, recorre-se a uma série de concentrações espaçadas do produto químico em estudo. Os vermes são expostos às várias concentrações do produto químico por um período que permita estimar as concentrações de ensaio adequadas (por exemplo, 28 dias, como no ensaio definitivo); não são necessários replicados. Nos ensaios preliminares, importa observar e registar quaisquer comportamentos dos vermes — por exemplo, o evitarem o sedimento — que possam ser causados pelo produto químico em estudo e/ou pelo sedimento. Não se devem utilizar no ensaio preliminar concentrações superiores a 1 000 mg/kg de peso seco de sedimento.
|
Ensaio definitivo
|
32.
|
No ensaio definitivo, devem utilizar-se, pelo menos, cinco concentrações, selecionadas, por exemplo, com base nos resultados do ensaio preliminar (ponto 31) e em conformidade com os pontos 35, 36, 37 e 38.
|
|
33.
|
Além das séries de ensaio, deve preparar-se uma amostra de controlo (no que respeita aos replicados, ver pontos 36, 37 e 38) com todos os componentes, exceto o produto químico em estudo. Se, para a aplicação do produto químico em estudo, for utilizado um agente solubilizante, este não deve ter efeitos significativos nos organismos de ensaio, revelados por recurso a outra amostra de controlo contendo apenas o solvente.
|
Planeamento do ensaio
|
34.
|
O planeamento do ensaio consiste na escolha do número e dos intervalos das concentrações de ensaio, do número de recipientes para cada concentração e do número de minhocas colocadas em cada recipiente. Os procedimentos para a estimativa da ECx e da NOEC, bem como para a realização de ensaios do limite, são descritos nos pontos 35, 36, 37 e 38.
|
|
35.
|
As concentrações testadas no ensaio devem incluir as concentrações às quais se observam efeitos (por exemplo, EC50, EC25, EC10) e abranger a gama de concentrações para as quais os efeitos do produto químico em estudo são significativos. Devem evitar-se extrapolações muito abaixo da menor concentração que afeta os organismos de ensaio ou muito acima da concentração de ensaio mais elevada. Se — excecionalmente — se efetuar uma tal extrapolação, é necessário apresentar uma justificação pormenorizada no relatório.
|
|
36.
|
Caso se pretenda estimar a ECx, devem utilizar-se, pelo menos, cinco concentrações e três replicados de cada concentração; para melhorar a estimativa da variabilidade, recomenda-se a utilização de seis replicados para o controlo ou, se for caso disso, o controlo com solvente. Em qualquer caso, para obter uma boa estimativa, é aconselhável ensaiar um número suficiente de concentrações. O fator entre as concentrações não deve ser superior a 2, salvo se a curva de resposta à concentração tiver declive reduzido. Pode reduzir-se o número de replicados de cada concentração se se aumentar o número de concentrações de ensaio com respostas na gama 5-95 %. O aumento do número de replicados ou a redução dos intervalos entre concentrações produz, em geral, intervalos de confiança mais estreitos.
|
|
37.
|
Caso se pretenda estimar os valores da LOEC ou da NOEC, devem utilizar-se, pelo menos, cinco concentrações de ensaio, com um mínimo de quatro replicados (para melhorar a estimativa da variabilidade, recomenda-se a utilização de seis replicados para o controlo ou, se for caso disso, o controlo com solvente), não devendo o fator entre as concentrações ser superior a 2. O apêndice 6 apresenta algumas informações sobre a representatividade estatística observada nos testes de hipóteses no contexto do estudo interlaboratorial comparativo do método de ensaio.
|
|
38.
|
Pode ser efetuado um ensaio do limite (utilizando uma concentração de ensaio e os respetivos controlos) se não se previrem efeitos a concentrações da ordem de 1 000 mg/kg de sedimentos (peso seco) (por exemplo, de um ensaio preliminar de determinação da gama de concentrações) ou se o ensaio a uma única concentração for adequado para confirmar um valor significativo da NOEC. Neste último caso, o relatório do ensaio deve incluir uma justificação pormenorizada da escolha da concentração-limite. O objetivo consiste em realizar um ensaio com uma concentração suficientemente elevada para permitir aos decisores excluir a possibilidade de efeitos tóxicos do produto químico em estudo, sendo o limite fixado a uma concentração cuja ocorrência não se prevê em caso algum. Recomenda-se a utilização de 1 000 mg/kg (peso seco). Em geral, são necessários, pelo menos, seis replicados dos organismos expostos e de controlo. O apêndice 6 apresenta algumas informações sobre a representatividade estatística observada nos testes de hipóteses no contexto do estudo interlaboratorial comparativo do método de ensaio.
|
Condições de exposição
Organismos sujeitos aos ensaios
|
39.
|
O ensaio é realizado com um mínimo de 10 animais por cada replicado utilizado para a determinação dos parâmetros biológicos. Este número de animais corresponde a cerca de 50-100 mg de biomassa húmida. Pressupondo um teor de biomassa seca de 17,1 % (48), obtém-se aproximadamente 9-17 mg de biomassa seca por recipiente. A EPA dos EUA (2000 (7)) recomenda a utilização de uma taxa de carga não superior a 1:50 (biomassa seca: COT). Para os sedimentos formulados descritos no ponto 22, este valor corresponde a cerca de 43 g de sedimento (peso seco) por 10 animais, com um teor de COT de 2,0 % do sedimento seco. Nos casos em que são utilizados mais de 10 animais por recipiente, a quantidade de sedimentos e de água sobrenadante deve ser ajustada em conformidade.
|
|
40.
|
Os vermes utilizados num ensaio devem provir da mesma fonte e encontrar-se num estado fisiológico semelhante (ver apêndice 5). Devem selecionar-se animais de dimensões semelhantes (ver ponto 39). Recomenda-se a pesagem de uma subamostra do lote de vermes, de modo a calcular o peso médio.
|
|
41.
|
Os vermes a utilizar no ensaio são retirados da cultura (ver apêndice 5 para mais pormenores). Os animais de maiores dimensões (adultos) que não mostrem sinais de fragmentação recente são transferidos para placas de vidro (por exemplo, placas de Petri) contendo água limpa. São posteriormente sincronizados como descrito no apêndice 5. Após regeneração por um período de 10 a 14 dias, devem utilizar-se para o ensaio animais completos e intactos de dimensões semelhantes, que nadem ou rastejem ativamente após um ligeiro estímulo mecânico. Se as condições de ensaio diferirem das condições de cultura (nomeadamente no que respeita à temperatura, ao regime de iluminação e à fase aquosa sobrenadante), deverá bastar para adaptar os vermes às condições de ensaio uma fase de aclimatação de, por exemplo 24 h, às mesmas condições de temperatura e iluminação e utilizando a mesma água sobrenadante que no ensaio. Os oligoquetas adaptados devem ser repartidos de forma aleatória pelos recipientes de ensaio.
|
Alimentação
|
42.
|
Uma vez que os alimentos são adicionados aos sedimentos antes (ou durante) a aplicação do produto químico em estudo, não são fornecidos mais alimentos aos animais durante o ensaio.
|
Luz e temperatura
|
43.
|
O período de exposição à luz da cultura e do ensaio é, geralmente, de 16 horas (3) (7). A intensidade luminosa deve ser mantida a níveis baixos (por exemplo, 100-500 lx), de forma a imitar as condições naturais à superfície dos sedimentos, e medida, pelo menos, uma vez durante o período de exposição. A temperatura deve ser de 20 ± 2 °C ao longo de todo o ensaio. Numa determinada data de medição, a diferença de temperatura entre recipientes de ensaio não deverá ser superior a ±1 °C. Os recipientes de ensaio devem ser colocados na incubadora ou na zona de ensaio de uma forma aleatória, por exemplo, para minimizar condicionalismos na reprodução decorrentes da localização dos recipientes.
|
Arejamento
|
44.
|
A água sobrenadante dos recipientes de ensaio deve ser ligeiramente arejada (por exemplo, 2-4 bolhas por segundo) por recurso a uma pipeta de Pasteur, posicionada cerca de 2 cm acima da superfície do sedimento, de modo a minimizar a perturbação deste. Deve evitar-se que a concentração de oxigénio dissolvido seja inferior a 30 % do valor da saturação com ar (VSA). O fornecimento de ar deve ser controlado e, se necessário, ajustado, pelo menos, uma vez por dia, nos dias de ensaio.
|
Qualidade da água
|
45.
|
Devem ser medidos os seguintes parâmetros de qualidade da água sobrenadante:
|
Temperatura
|
Pelo menos um recipiente de ensaio de cada concentração e um recipiente de ensaio de controlo, uma vez por semana e no início e no final do período de exposição; se possível, deve também registar-se a temperatura do meio circundante (ar ambiente ou banho-maria), por exemplo, com uma periodicidade horária;
|
|
Teor de oxigénio dissolvido
|
Pelo menos um recipiente de ensaio de cada concentração e um recipiente de ensaio de controlo, uma vez por semana e no início e no final do período de exposição; expresso em mg/l e em % VSA (valor da saturação com ar);
|
|
Fornecimento de ar
|
Deve ser controlado, pelo menos, uma vez por dia, durante o ensaio e, se necessário, ajustada;
|
|
pH
|
Pelo menos um recipiente de ensaio de cada concentração e um recipiente de ensaio de controlo, uma vez por semana e no início e no final do período de exposição;
|
|
Dureza total da água
|
Pelo menos, num replicado dos controlos e num recipiente de ensaio à concentração mais elevada, no início e no final do período de exposição; expressa em mg/l CaCO3;
|
|
Teor de amoníaco total
|
Pelo menos, num replicado dos controlos e num recipiente de ensaio a cada concentração, no início do período de exposição e, posteriormente, três vezes por semana; expresso em mg/l NH4
+, NH3 ou azoto amoniacal total.
|
Se a medição dos parâmetros de qualidade da água implicar a colheita de amostras importantes de água dos recipientes, pode ser aconselhável dispor de recipientes separados para as medições da qualidade da água, para não alterar o rácio volúmico água-sedimento.
|
Observações biológicas
|
46.
|
Durante a exposição, os recipientes de ensaio devem ser observados a fim de identificar visualmente quaisquer anomalias comportamentais nos vermes (por exemplo, fuga dos sedimentos, deposição de péletes fecais à superfície destes) em comparação com os controlos. As observações devem ser registadas.
|
|
47.
|
No final do ensaio, procede-se ao exame de cada replicado (os recipientes suplementares destinados à análise química podem ser excluídos do exame). Deve utilizar-se um método adequado para retirar todos os vermes do recipiente de ensaio. Devem tomar-se precauções para que todos os vermes sejam recuperados sem danos. Um dos métodos possíveis consiste na crivagem dos vermes a partir do sedimento. Pode utilizar-se um crivo de aço inoxidável com malha de dimensão adequada. A maior parte da água sobrenadante é decantada cuidadosamente; a parte restante do sedimento e da água é agitada para formar uma lama que possa passar através do crivo. Utilizando uma malha de 500 μm, a maior parte das partículas de sedimentos passa pelo crivo com grande facilidade; no entanto, a crivagem deve ser feita rapidamente, para evitar que os vermes escapem para a malha ou através desta. Uma malha de 250 μm impedirá que os vermes escapem para a malha ou através desta; deve contudo, agir-se de forma a que fique retida na malha a menor quantidade possível de partículas de sedimento. A lama crivada de recipiente replicado pode passar pelo crivo uma segunda vez, a fim de assegurar que todos os vermes são recuperados. Um método alternativo consiste no aquecimento do sedimento por colocação dos recipientes de ensaio num banho-maria a 50-60 °C; nessas condições, os vermes abandonam o sedimento e podem ser recolhidos da superfície deste por meio de uma pipeta de boca larga polida à chama. Outro método alternativo consiste em produzir uma lama de sedimento e vertê-la numa superfície rasa de dimensão adequada. Os vermes podem ser retirados da camada fina de lama por recurso a uma agulha de aço ou uma pinça de relojoeiro (a utilizar como um garfo em vez de um fórceps, para evitar causar danos aos vermes) e transferidos para água limpa. Os vermes retirados da lama são lavados com o meio de ensaio e contados.
|
|
48.
|
Independentemente do método utilizado, os laboratórios devem demonstrar que o seu pessoal tem capacidade para recolher, em média, pelo menos 90 % dos organismos da quantidade total de sedimentos. Pode, por exemplo, adicionar-se um determinado número de organismos de ensaio ao sedimento ou aos sedimentos de ensaio, determinando-se a recuperação após 1 hora (7).
|
|
49.
|
Importa avaliar e registar o número total de indivíduos vivos e mortos por replicado. Os vermes são considerados mortos nos seguintes casos:
|
a)
|
Ausência de reação a um ligeiro estímulo mecânico;
|
|
b)
|
Existência de sinais de decomposição [juntamente com “a)”]
|
Além disso, os vermes vivos podem ser repartidos por três grupos:
|
a)
|
Vermes completos de grandes dimensões (adultos), que não exibam partes do corpo regeneradas;
|
|
b)
|
Vermes completos com partes do corpo regeneradas (ou seja, partes posteriores regeneradas, partes anteriores regeneradas ou ambas as partes regeneradas), que exibem uma coloração mais clara;
|
|
c)
|
Vermes incompletos (ou seja, recentemente fragmentados, com partes do corpo não regeneradas)
|
Estas observações adicionais não são obrigatórias, mas podem ser utilizadas para uma interpretação complementar dos resultados biológicos (por exemplo, a existência de um elevado número de vermes classificados no grupo C pode indicar um atraso na reprodução ou na regeneração, na exposição a um determinado produto). Além disso, devem registar-se quaisquer eventuais diferenças de aspeto (por exemplo, lesões no tegumento, edemas em determinadas partes do corpo) entre os vermes expostos ao produto químico em estudo e os vermes de controlo.
|
|
50.
|
Imediatamente após a contagem ou a avaliação, os animais vivos presentes em cada replicado são transferidos para cápsulas de pesagem secas, taradas e rotuladas (uma cápsula por replicado) e mortos por adição de uma gota de etanol por recipiente de pesagem. As cápsulas são colocadas de um dia para o outro numa estufa a 100 ± 5 °C, para secagem, sendo pesadas após arrefecimento num exsicador, após o que se determina o peso seco (de preferência em gramas, com, pelo menos, 4 casas decimais).
|
|
51.
|
Além do peso seco total, pode determinar-se o peso seco isento de cinzas, como descrito em (49), a fim de ter em conta os componentes inorgânicos provenientes de sedimentos ingeridos presentes no tubo digestivo dos vermes.
|
|
52.
|
A biomassa é determinada na forma de biomassa total por replicado, incluindo vermes adultos e jovens. Os vermes mortos não devem ser tidos em conta para efeitos de determinação da biomassa por replicado.
|
Verificação da concentração do produto químico em estudo
Amostragem
|
53.
|
Devem colher-se amostras para análise química do produto químico em estudo, pelo menos, à concentração máxima e a uma concentração menor, pelo menos, no final da fase de equilibração (antes da introdução dos organismos de ensaio) e no final do ensaio. Devem colher-se amostras, pelo menos, do sedimento a granel e da água sobrenadante, para análise. Devem colher-se, pelo menos, duas amostras por matriz e amostra de tratamento, para cada data de amostragem. Uma das amostras em duplicado pode ser guardada como reserva (para análise, por exemplo, caso o resultado da primeira análise se situe fora da gama de ± 20 % da concentração nominal). Em caso de propriedades químicas específicas, nomeadamente se for de prever uma degradação rápida do produto químico em estudo, o calendário analítico pode ser refinado (por exemplo, amostragem mais frequente, análise de mais concentrações), com base numa análise circunstanciada. Nesse caso, as amostras podem ser colhidas em datas intermédias — por exemplo, no sétimo dia após o início da exposição.
|
|
54.
|
As amostras de água sobrenadante devem ser colhidas por decantação ou sifonagem cuidadosas, de forma a minimizar perturbações do sedimento. Deve registar-se o volume das amostras.
|
|
55.
|
Após a colheita de amostras de água sobrenadante, o sedimento deve ser homogeneizado e transferido para um recipiente adequado. Regista-se o peso da amostra de sedimento húmido.
|
|
56.
|
Se for também necessário proceder à análise do produto químico em estudo na água dos poros, as amostras de sedimento homogeneizadas e pesadas devem ser centrifugadas, para extração da água em causa. Pode, por exemplo, introduzir-se cerca de 200 ml de sedimento húmido em frascos de centrifugação de 250 ml. Em seguida, as amostras são centrifugadas, sem filtração, para isolar a água dos poros, por exemplo, a 10 000 ± 600 x g, durante 30 a 60 minutos, a uma temperatura que não exceda a temperatura de ensaio. Após a centrifugação, o sobrenadante é decantado ou pipetado cuidadosamente, para que não sejam introduzidas partículas de sedimentos, e regista-se o volume. Regista-se também o peso das péletes de sedimento remanescentes, que pode facilitar a estimativa do balanço de massas ou da recuperação do produto químico em estudo no sistema água-sedimento, caso o peso a seco do sedimento seja determinado em cada data de amostragem. Em alguns casos, se a amostra for demasiado pequena, poderá não ser possível analisar as concentrações da água dos poros.
|
|
57.
|
Caso não se proceda à análise imediata, as amostras devem ser armazenadas por um método adequado, por exemplo, nas condições de armazenamento recomendadas com vista a uma degradação mínima do produto químico em estudo (geralmente a – 18 °C, na obscuridade). Antes de iniciar o estudo, devem obter-se informações sobre as condições de armazenagem adequadas ao produto químico em causa, nomeadamente duração e temperatura, processos de extração, etc.
|
Método analítico
|
58.
|
Uma vez que o processo global é condicionado essencialmente pela exatidão, precisão e sensibilidade do método analítico utilizado, deve comprovar-se experimentalmente a adequação ao mesmo da precisão e reprodutibilidade deste último, bem como do método de recuperação do produto químico em estudo a partir de amostras de água e dos sedimentos, pelo menos, às concentrações de ensaio mais baixa e mais elevada. É também necessário verificar que, nos recipientes de controlo, o produto químico em estudo não é detetável em concentrações superiores ao limite de quantificação. Se necessário, corrigir a concentração nominal para as recuperações dos picos de controlo de qualidade — por exemplo, se a recuperação estiver fora da gama de 80-120 % da quantidade enriquecida. Ao longo de todo o ensaio, as amostras devem ser manipuladas de modo a minimizar contaminações e perdas, resultantes, por exemplo, da adsorção do produto químico em estudo no dispositivo de colheita das amostras.
|
|
59.
|
A recuperação do produto químico em estudo, o limite de quantificação e o limite de deteção nos sedimentos e na água devem ser registados e comunicados.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
60.
|
As principais variáveis de resposta a que devem obrigatoriamente ser objeto de avaliação estatística são a biomassa e o número total de vermes por replicado. A título facultativo, podem também avaliar-se a reprodução (aumento do número de vermes) e o crescimento (aumento de biomassa seca). Neste caso, importa obter uma estimativa do peso seco dos vermes no início da exposição, nomeadamente por medição do peso seco de uma subamostra representativa do lote de vermes sincronizados utilizado no ensaio.
|
|
61.
|
Embora a mortalidade não constitua um ponto final do ensaio, deve ser estimada sempre que possível. Para tal, consideram-se mortos os vermes que não reagirem a um ligeiro estímulo mecânico ou revelem sinais de decomposição, bem como os vermes ausentes. A mortalidade deve, no mínimo, ser registada e tida em conta na interpretação dos resultados dos ensaios.
|
|
62.
|
As concentrações com efeitos são expressas em mg/kg de massa seca de sedimento. Se a recuperação do produto químico determinada nos sedimentos, ou nos sedimentos e da água sobrenadante, no início da exposição se situar entre 80 e 120 % da concentração nominal, as concentrações com efeitos (ECx, LOEC, NOEC) podem ser expressas em concentrações nominais. Se a recuperação se desviar da concentração nominal em mais de ± 20 %, as concentrações sem efeitos (ECx, NOEC, LOEC) devem basear-se nas as concentrações medidas no início da exposição, tendo em conta, nomeadamente, o balanço de massas do produto químico em estudo no sistema de ensaio (ver ponto 30). Nestes casos, podem obter-se informações complementares a partir da análise da solução de reserva e/ou das soluções aplicadas, para confirmar que os sedimentos de ensaio foram preparados de forma correta.
|
ECx
|
63.
|
Os valores dos parâmetros ECx, descritos no ponto 60 são calculados por recurso a métodos estatísticos adequados (análise da função probit, função logística ou de Weibull, método abreviado de Spearman-Karber ou simples interpolação). Para mais orientações a avaliação estatística, consultar as referências bibliográficas (15) (50). Determina-se a ECx inserindo o valor correspondente a x % da média do grupo de controlo na equação obtida. Para calcular a EC50 ou qualquer outra ECx, procede-se a uma análise de regressão da média das séries (

). |
NOEC/LOEC
|
64.
|
Caso se pretenda determinar a NOEC ou LOEC por análise estatística, é necessário dispor de dados estatísticos por recipiente (sendo cada recipiente considerado um replicado). Devem utilizar-se métodos estatísticos adequados. Em geral, investigam-se os efeitos nocivos do produto químico em estudo, comparativamente ao grupo de controlo, testando a hipótese unilateral (mais reduzida) para p ≤ 0,05. Os pontos que se seguem apresentam vários exemplos. As referências bibliográficas (15) (50) fornecem orientações para a seleção dos métodos estatísticos adequados.
|
|
65.
|
A distribuição normal dos dados pode ser sujeita, por exemplo, ao teste de ajustamento de Kolmogorov-Smirnov, ao teste de rácio gama-desvio padrão (teste R/s) ou ao teste dual de Shapiro-Wilk (p ≤ 0,05). Para avaliar a homogeneidade da variância, pode recorrer-se aos testes de Cochran, de Levene ou de Bartlett (dual, p ≤ 0,05). Se forem cumpridos as requisitos dos testes paramétricos (normalidade homogeneidade da variância), podem realizar-se uma análise ANOVA e os testes multicomparativos subsequentes. Para averiguar se existem diferenças significativas (p < 0,05) entre os controlos e a várias concentrações de ensaio do produto, podem utilizar-se, comparações par-a-par (por exemplo, teste de Dunnett) ou testes de tendência regressiva (epor exemplo, teste de Williams). Alternativamente, pode recorrer-se a métodos não paramétricos (por exemplo, teste U de Bonferroni na versão de Holm ou teste de tendências de Jonckheere-Terpstra) para determinar a NOEC ou a LOEC.
|
Ensaio do limite
|
66.
|
Se for realizado um ensaio do limite (comparação de apenas uma amostra de controlo e uma amostra tratada com o produto) e forem cumpridos os requisitos dos testes paramétricos (normalidade homogeneidade), as respostas métricas (número total de vermes e biomassa, expressa na massa seca de vermes) podem ser avaliadas por um teste t de Student. Se estes requisitos não forem preenchidos, pode recorrer-se a um teste t de variância desigual (teste de Welch) ou a um teste não paramétrico, como o teste U de Mann-Whitney. O apêndice 6 apresenta algumas informações sobre a representatividade estatística observada nos testes de hipóteses no contexto do estudo interlaboratorial comparativo do método de ensaio.
|
|
67.
|
Para detetar diferenças significativas entre os controlos (ensaio de controlo e controlo do solvente), os replicados de cada controlo podem ser testados da forma descrita para o ensaio do limite. Se esses testes não detetarem diferenças significativas, podem agrupar-se todos replicados. Caso contrário, todas as amostras tratadas com o produto devem ser comparadas com o controlo com solvente.
|
Interpretação dos resultados
|
68.
|
Os resultados devem ser interpretados com precaução caso se tenham registado desvios ao presente método de ensaio e sempre que as concentrações determinadas das soluções de ensaio sejam próximas do limite de deteção do método analítico utilizado. Devem indicar-se quaisquer desvios em relação ao presente método de ensaio.
|
Relatório de ensaio
|
69.
|
O relatório de ensaio deve incluir pelo menos as seguintes informações:
|
—
|
Produto químico em estudo:
|
—
|
dados de identificação química (denominação comum, denominação química, fórmula estrutural, número CAS, etc.), incluindo o grau de pureza e o método analítico de quantificação do produto químico em estudo; proveniência do produto químico em estudo, identidade e concentração dos solventes eventualmente utilizados;
|
|
—
|
quaisquer informações disponíveis sobre a natureza física e as propriedades físico-químicas, obtidas antes do início do ensaio — por exemplo, hidrossolubilidade, pressão de vapor, coeficiente de partição no solo (ou nos sedimentos, se disponível), log Kow, estabilidade na água, etc.;
|
|
|
—
|
Espécies sujeitas a ensaio:
|
—
|
denominação científica, origem, pré-tratamentos eventuais, aclimatação, condições de cultura, etc.
|
|
|
—
|
Condições de ensaio:
|
—
|
procedimento de ensaio utilizado (estático, semiestático ou contínuo);
|
|
—
|
conceção do ensaio (número, material constituinte e dimensões das células de ensaio, volume de água por recipiente, massa e volume de sedimento por recipiente; no caso dos ensaios dinâmicos ou semiestáticos, taxa de renovação do volume de água), eventual arejamento utilizado antes e durante o ensaio, número de replicados, número de vermes por replicado no início da exposição, número de concentrações de ensaio, duração do condicionamento, períodos de equilibração e de exposição, frequência da colheita de amostras);
|
|
—
|
espessura dos sedimentos e da água sobrenadante;
|
|
—
|
método de pré-tratamento e de enriquecimento ou aplicação do produto químico em estudo;
|
|
—
|
concentrações de ensaio nominais, pormenores sobre a colheita de amostras para análise química, métodos analíticos através dos quais foram obtidas as concentrações do produto químico em estudo;
|
|
—
|
características dos sedimentos, como descrito nos ponto 24-25, e quaisquer outras medições efetuadas; preparação dos sedimentos formulados;
|
|
—
|
preparação da água para o ensaio — caso seja utilizada água reconstituída — e respetivas características (concentração de oxigénio, pH, condutividade, dureza e quaisquer outros parâmetros medidos) antes do início do ensaio;
|
|
—
|
informações pormenorizadas sobre a alimentação dos organismos, incluindo o tipo de alimentos, a preparação, a quantidade e o regime alimentar;
|
|
—
|
intensidade luminosa e período(s) de iluminação;
|
|
—
|
métodos utilizados para a determinação de todos os parâmetros biológicos (por exemplo, para a amostragem, inspeção e pesagem dos organismos de ensaio) e de todos os parâmetros abióticos (por exemplo, os parâmetros de qualidade da água e dos sedimentos);
|
|
—
|
volume e/ou peso de todas as amostras para análise química;
|
|
—
|
explicação detalhada do tratamento de todas as amostras para análise química, incluindo pormenores sobre a preparação, a armazenagem, os procedimentos de enriquecimento do solo com o produto químico em estudo, a extração, os procedimentos de análise do produto químico (com a respetiva precisão) e a recuperação do mesmo.
|
|
|
—
|
Resultados:
|
—
|
qualidade da água nos recipientes de ensaio (pH, temperatura, concentração de oxigénio dissolvido, dureza, concentração de amoníaco e quaisquer outros parâmetros medidos);
|
|
—
|
teor de carbono orgânico total (COT), rácio massa seca/massa húmida, pH dos sedimentos e quaisquer outros parâmetros medidos;
|
|
—
|
número total e, se determinado, número de vermes completos e incompletos em cada câmara de ensaio, no final do mesmo;
|
|
—
|
peso seco dos vermes em cada câmara de ensaio no final do ensaio, e caso tenha sido medido, o peso seco de uma subamostra dos vermes no início do ensaio;
|
|
—
|
qualquer comportamento anómalo em comparação com os controlos (por exemplo, fuga dos sedimentos, presença ou ausência de péletes fecais);
|
|
—
|
estimativas de parâmetros de toxicidade, (por exemplo ECx, NOEC e/ou LOEC) e métodos estatísticos utilizados para a sua determinação;
|
|
—
|
concentrações de ensaio nominais, concentrações de ensaio medidas e resultados de todas as análises efetuadas para determinar a concentração do produto químico em estudo nos recipientes de ensaio;
|
|
—
|
quaisquer desvios aos critérios de validade.
|
|
|
—
|
Avaliação dos resultados:
|
—
|
coerência dos resultados com os critérios de validade referidos no ponto 13;
|
|
—
|
discussão dos resultados, incluindo qualquer influência sobre os resultado do ensaio que decorra das alterações em relação ao presente método de ensaio.
|
|
|
REFERÊNCIAS
|
(1)
|
OCDE (2003). Documento técnico de orientação sobre a Diretiva 93/67/CEE da Comissão que estabelece os princípios para a avaliação dos riscos para o homem e para o ambiente das substâncias notificadas em conformidade com a Directiva 67/548/CEE do Conselho, o Regulamento (CE) n.o 1488/94 da Comissão que estabelece os princípios para a avaliação dos riscos para o homem e para o ambiente associados às substâncias existentes e a Diretiva 98/8/EC do Parlamento Europeu e do Conselho relativa à colocação de produtos biocidas no mercado; partes I-IV. Serviço de Publicações da UE, Luxemburgo.
|
|
(2)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. & Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Capítulo C.27 do presente anexo (Ensaio de toxicidade em quironomídeos num sistema sedimentos-água com sedimentos enriquecidos).
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I. R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
OCDE (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke & H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 20267429
|
|
(14)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, & A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14; 2 1556-1557.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 26257-63
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. & Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42 1556-1557.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35191-201
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. & Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 321503-1508
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Capítulo C.1 do presente anexo (Ensaio de toxicidade aguda para os peixes).
|
|
(38)
|
OCDE (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OCDE, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel & B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. & Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. & C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23588-595
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OCDE (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Bibliografia suplementar sobre métodos estatísticos:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo & R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11 7 16 714 -719 Correction: Environ. Sci. Technol. 121998417
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 665-70
Sokal, R.R. & F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman & Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
Apêndice 1
Definições
No âmbito do presente método de ensaio, aplicam-se as seguintes definições:
Produto químico
: uma substância ou mistura.
Período de acondicionamento
: período utilizado para estabilizar a componente microbiana do sedimento e eliminar, por exemplo, o amoníaco proveniente dos componentes deste; tem lugar antes do enriquecimento do sedimento com o produto químico em estudo. Geralmente, a água sobrenadante é eliminada após o condicionamento.
ECx
: concentração do produto químico em estudo no sedimento que resulta num efeito de x % (por exemplo: 50 %) num parâmetro biológico, num determinado período de exposição.
Período de equilibração
: período utilizado para permitir a distribuição do produto químico em estudo entre a fase sólida, a água dos poros e a água sobrenadante; tem lugar após o enriquecimento dos sedimentos com o produto químico em estudo e antes da introdução dos organismos de ensaio.
Fase de exposição
: período durante o qual os organismos de ensaio são expostos ao produto químico em estudo.
Sedimentos formulados (também conhecidos por reconstituídos, artificiais ou sintéticos): mistura de matérias utilizadas para simular os componentes físicos de sedimentos naturais.
Menor concentração com efeitos observáveis (LOEC)
: menor concentração de ensaio do produto químico em estudo para a qual se observa um efeito significativo (a p ≤ 0,05), comparativamente com o controlo. No entanto, todas as concentrações de ensaio superiores à LOEC devem ter um efeito igual ou superior ao verificado com a LOEC. Se estas duas condições não puderem ser satisfeitas, deve fornecer-se uma explicação pormenorizada sobre a forma como se determinou a LOEC (e, consequentemente, a NOEC).
Concentração sem efeitos observáveis (NOEC)
: a mais elevada concentração ensaiada que, quando comparada com o controlo, não tem qualquer efeito estatisticamente significativo (p ≤ 0,05), durante um determinado período de exposição.
Coeficiente de partição octanol/água (Kow; também representado por Pow): quociente entre a solubilidade de um produto químico em n-octanol e em água, em condições de equilíbrio, representando a lipofilia desse produto químico (capítulo A.24 do presente anexo). O valor Kow ou o logaritmo de Kow (log Kow) é utilizado como indicador do potencial de bioacumulação de um produto químico em organismos aquáticos.
Coeficiente de partição carbono orgânico-água (Koc): quociente entre a concentração de um produto químico no interior ou à superfície da fração de carbono orgânico de um sedimento e a concentração do mesmo produto químico na água, em condições de equilíbrio.
Água sobrenadante
: água que cobre o sedimento, no recipiente de ensaio.
Água intersticial ou água dos poros: água que ocupa o espaço entre as partículas do sedimento ou do solo.
Sedimento enriquecido
: sedimento ao qual foi adicionado o produto químico em estudo.
Produto químico em estudo
: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
Apêndice 2
Composição da água reconstituída recomendada
[adoção a partir do capítulo C.1 do presente anexo (1)]
|
a)
|
Solução de cloreto de cálcio
Dissolver 11,76 g CaCl2·2H2O em água desionizada; completar o volume até 1 litro com água desionizada.
|
|
b)
|
Solução de sulfato de magnésio
Dissolver 4,93 g MgSO4·7H2O em água desionizada; completar o volume até 1 litro com água desionizada.
|
|
c)
|
Solução de bicarbonato de sódio
Dissolver 2,59 g de NaHCO3 em água desionizada; completar o volume até 1 litro com água desionizada.
|
|
d)
|
Solução de cloreto de potássio
Dissolver 0,23 g de KCl em água desionizada; completar o volume até 1 litro com água desionizada.
|
Os produtos químicos devem ser todos de qualidade analítica.
A condutividade da água destilada ou desionizada não deve exceder 10 μScm-1.
Misturam-se 25 ml de cada uma das soluções a) a d), sendo o volume total completado até 1 litro com água desionizada. A soma das concentrações de iões cálcio e magnésio destas soluções é de 2,5 mmol/l.
A proporção iónica Ca:Mg é de 4:1 e a proporção iónica Na:K é de 10:1. A capacidade de acidificação, KS4.3, desta solução é de 0,8 mmol/l.
Arejar a água de diluição até à saturação com oxigénio e armazená-la durante cerca de dois dias, sem mais arejamento, antes da utilização.
REFERÊNCIA
|
(1)
|
Capítulo C.1 do presente anexo (Ensaio de toxicidade aguda para os peixes).
|
Apêndice 3
Características fisico-químicas de uma água de diluição adequada
|
Componente
|
Concentrações
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 μg/l
|
|
Amoníaco não ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
|
(adaptação a partir de OCDE (1992) (1))
|
REFERÊNCIA
|
(1)
|
OCDE (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OCDE, Paris.
|
Apêndice 4
Sedimentos artificiais recomendados — orientações para a preparação e a armazenagem
Componentes dos sedimentos
|
Componente
|
Características
|
% do sedimento peso seco
|
|
Turfa
|
Turfa de esfagno, grau de decomposição: “médio”, seca ao ar, sem resíduos vegetais visíveis, finamente moída (granulometria ≤ 0,5 mm)
|
5 ± 0.5
|
|
Areia de quartzo
|
Granulometria: ≤ 2 mm, mas > 50 % das partículas de granulometria na gama 50-200 μm
|
75 - 76
|
|
Argila caulínica
|
Teor de caulinite ≥ 30 %
|
20 ± 1
|
|
Fonte de alimentação
|
Por exemplo, ortiga pulverizada (Folia urticae), folhas de Urtica dioica finamente trituradas (partículas ≤ 0,5 mm); para consumo humano, conforme com as normas farmacêuticas; em adição ao sedimento seco
|
0,4 - 0,5 %
|
|
Carbono orgânico
|
Ajustado por adição de turfa e areia
|
2 ± 0,5
|
|
Carbonato de cálcio
|
CaCO3 pulverizado, quimicamente puro, em adição ao sedimento seco
|
0,05 - 1
|
|
Água desionizada
|
Condutividade ≤ 10 μS/cm, em adição ao sedimento seco
|
30 - 50
|
Nota: Caso se prevejam concentrações elevadas de amoníaco (por exemplo, se o produto químico em estudo for um inibidor de nitrificação conhecido), pode ser útil substituir 50 % do pó de urticáceas, rico em azoto, por α-celulose em pó, quimicamente pura, com granulometria ≤ 0,5 mm; (1) (2).
Preparação
A turfa é seca ao ar e moída até se obter um pó fino. Prepara-se uma suspensão da quantidade necessária de turfa pulverizada em água desionizada, por recurso a um dispositivo de homogeneização de alta eficiência. O pH desta suspensão é ajustado para 5,5 ± 0,5 com CaCO3. A suspensão é acondicionada durante, pelo menos, dois dias, com agitação ligeira a 20 ± 2 °C, para estabilizar o pH e estabelecer um perfil microbiano estável. Findo este período, determina-se novamente o pH, que deve ser de 6,0 ± 0,5. A suspensão de turfa é então misturada com os outros componentes (areia e argila caulínica) e água desionizada, de forma a obter sedimentos homogéneos com teor de água na ordem de 30 %–50 % da massa seca dos sedimentos. O pH da mistura final é determinado uma vez mais e, se necessário, ajustado para 6,5-7,5 com CaCO3. No entanto, se for de prever a libertação de amoníaco, pode ser útil manter o pH do sedimento a um valor inferior a 7,0 (por exemplo, entre 6,0 e 6,5). Colhem-se amostras do sedimento para determinar o peso seco e o teor de carbono orgânico. Se for de prever a libertação de amoníaco, o sedimento formulado pode ser acondicionado durante sete dias em condições semelhantes às do ensaio subsequente (por exemplo, 1:4 para o rácio sedimentos-água; altura da camada de sedimento tal como nos recipientes de ensaio) antes do enriquecimento com o produto químico em estudo, ou seja, deve ser complementado com água que, por sua vez, deve ser arejada. No final do período de acondicionamento, remove-se e rejeita-se a água sobrenadante. Posteriormente, a areia de quartzo enriquecida é misturada com o sedimento para cada concentração de produto, sendo o sedimento distribuído pelos recipientes dos replicados e coberto com a água de ensaio. Os recipientes são, em seguida, incubados em condições idênticas às do ensaio subsequente. Inicia-se aqui o período de equilibração. A água sobrenadante deve ser arejada.
O alimento escolhido deve ser adicionado antes ou durante o enriquecimento do sedimento com o produto químico em estudo. Pode começar por ser misturado com a suspensão de turfa (ver supra). É possível, contudo, evitar uma degradação excessiva da fonte alimentar antes da introdução dos organismos de ensaio (por exemplo, em caso de um longo período de equilíbrio), reduzindo ao mínimo possível o período entre o fornecimento do alimento e o início da exposição. Para assegurar que o alimento é impregnado com o produto químico em estudo, a fonte alimentar deve ser misturada com o sedimento, o mais tardar no dia em que o produto químico em estudo é aplicado no sedimento.
Armazenamento
Os componentes secos dos sedimentos artificiais podem ser armazenados num local seco e fresco ou à temperatura ambiente. Os sedimentos impregnados com o produto químico em estudo devem ser imediatamente utilizados no ensaio. Podem então ser armazenadas amostras de sedimento enriquecido, respeitando as condições recomendadas para o produto químico em estudo, até à realização das análises.
REFERÊNCIAS
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel & B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 20267429
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Apêndice 5
Métodos de cultura de Lumbriculus variegatus
A espécie Lumbriculus variegatus (MÜLLER), oligoqueta da família Lumbriculidae, coloniza os sedimentos de água doce e é amplamente utilizada em ensaios ecotoxicológicos. Pode ser facilmente cultivada em condições laboratoriais. Descrevem-se em seguida os métodos de cultura.
Métodos de cultura
As condições de cultura de Lumbriculus variegatus são descritas em pormenor em Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3) e U.S. EPA (2000) (4). Apresenta-se em seguida uma breve síntese dessas condições. Uma das grandes vantagens da espécie L. variegatus reside na sua reprodução rápida, que resulta num rápido aumento da biomassa das populações cultivadas em laboratório [por exemplo, (1) (3) (4) (5)].
Os vermes podem ser cultivados em aquários de grandes dimensões (57-80 l) a 23 °C, com um fotoperíodo de 16 dias de luz para 8 de obscuridade (100-1 000 lx) e renovação diária da água natural (45-50 l por aquário). O substrato é preparado mediante o corte, em tiras, de toalhas de papel pardo, seguidamente embebidas em água de cultura durante alguns segundos, de forma a obter pequenos fragmentos de substrato de papel. O substrato pode ser diretamente utilizado no aquário de cultura de Lumbriculus como cobertura do fundo do reservatório, ou armazenado congelado em água desionizada, para utilização posterior. Os novos substratos colocados no reservatório duram, em geral, cerca de dois meses.
As culturas de vermes iniciam-se com 500-1 000 animais, alimentados três vezes por semana com uma suspensão de 10 ml que contém 6 g de alimento para trutas, aquando da renovação ou em condições dinâmicas. As culturas estáticas ou semiestáticas devem ser alvo de taxas de alimentação mais baixas, para evitar a proliferação de bactérias e fungos.
Nestas condições, o número de indivíduos na cultura duplica, em geral, cada 10 a 14 dias.
A espécie Lumbriculus variegatus pode também ser cultivada, alternativamente, num sistema constituído por uma camada de areia de quartzo — como no caso dos sedimentos artificiais (1-2 cm de profundidade) — e água reconstituída. Como recipientes de cultura, podem utilizar-se recipientes de aço inoxidável ou de vidro com uma altura de 12 a 20 cm. O corpo de água deve ser ligeiramente arejado (por exemplo, 2 bolhas por segundo) por recurso a uma pipeta de Pasteur, posicionada cerca de 2 cm acima da superfície do sedimento. Para evitar, por exemplo, a acumulação de amoníaco, a água sobrenadante deve ser renovada por recurso a um sistema de fluxo ou (pelo menos uma vez por semana) manualmente. Os oligoquetas são conservados à temperatura ambiente, com 16 horas de exposição à luz (100-1 000 lx) e 8 horas de obscuridade. Na cultura semiestática (renovação da água uma vez por semana), os vermes são alimentados com TetraMin duas vezes por semana (por exemplo, 0,6-0,8 mg/cm2 de superfície de sedimento), podendo aplicar-se como suspensão de 50 mg de TetraMin por ml de água desionizada.
Para transferir os espécimes de Lumbriculus variegatus das culturas, remover substrato com uma malha fina ou remover os organismos com uma pipeta de vidro larga moldada a quente (5 mm de diâmetro, aproximadamente) para um copo. Se também passar substrato para o copo, este, com os animais e o substrato, é deixado de um dia para o outro em condições dinâmicas, o que permite eliminar o substrato, enquanto os vermes permanecem no fundo do copo. Os animais podem, então, ser introduzidos em tanques de cultura recém-preparados ou ser alvo de uma preparação complementar para o ensaio, como referido em (3) (4), ou do modo seguinte:
Ao utilizar a espécie L. variegatus em ensaios com sedimentos, o seu modo de reprodução [arquitomia ou morfalaxe — ver, por exemplo, (6)] constitui um aspeto crítico. A reprodução assexuada resulta em dois fragmentos, que não se alimentam durante um certo período até a cabeça ou a cauda estarem regeneradas [ver, por exemplo, (7) (8)]. Isto significa que, no caso da L. variegatus, a exposição por ingestão de sedimentos contaminados não ocorre de modo contínuo.
Por conseguinte, importa proceder a uma sincronização para minimizar reprodução e regeneração descontroladas e a consequente variação dos resultados do ensaio. Esta variação pode ocorrer quando alguns indivíduos, por terem sofrido fragmentação e, consequentemente, não se terem alimentado durante um dado período, estão menos expostos ao produto químico em estudo do que outros indivíduos que não sofreram fragmentação durante o ensaio [(9) (10) (11)]. Entre 10 e 14 dias antes do início da exposição, os vermes devem ser fragmentados artificialmente (sincronização). Devem selecionar-se para sincronização espécimes de grandes dimensões (adultos), de preferência que não mostrem sinais de morfalaxe recente. Colocam-se os vermes sobre uma lâmina de vidro com uma gota de água de cultura, seccionando-os em seguida com um bisturi na região mediana do corpo. As extremidades posteriores devem ser de dimensão semelhante. Deixa-se que as extremidades posteriores regenerem novas cabeças, num recipiente com o mesmo substrato utilizado na cultura e com água reconstituída, até ao início da exposição. A regeneração de novas cabeças é indicada pelo facto de os vermes sincronizados se enterrarem no substrato (a presença de cabeças regeneradas pode ser confirmada pela inspeção de uma subamostra representativa com um microscópio binocular). Considera-se então que os organismos de ensaio se encontram em estado fisiológico idêntico. Isto significa que, quando ocorre reprodução por morfalaxe de vermes sincronizados durante o ensaio, praticamente todos os animais sofrem uma exposição idêntica ao sedimento enriquecido. A alimentação dos vermes sincronizados deve ter lugar logo que os mesmos comecem a enterrar-se no substrato ou no sétimo dia após o seccionamento. O regime alimentar deve ser idêntico ao das culturas regulares, embora possa afigurar-se aconselhável fornecer aos vermes sincronizados os mesmos alimentos que no ensaio. Os animais devem ser mantidos à temperatura de ensaio, ou seja, 20 ± 2 °C. Após a regeneração, devem utilizar-se para o ensaio animais completos e intactos, que nadem ou rastejem ativamente após um ligeiro estímulo mecânico. Devem evitar-se lesões ou autotomia dos vermes: por exemplo, utilizando pipetas polidas a quente ou palitos dentários de aço inoxidável, para a sua manipulação.
Fontes de culturas de arranque de Lumbriculus variegatus (endereços nos EUA adaptados a partir de (4))
|
Europa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Alemanha
|
|
|
Bayer Crop Science AG
|
|
Development — Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Alemanha
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finlândia
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Alemanha
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
EUA
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
REFERÊNCIAS
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. & Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35191-201
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. & Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Apêndice 6
Resumo dos resultados dos estudos interlaboratoriais comparativos
Ensaio de toxicidade nos sedimentos com Lumbriculus variegatus
Quadro 1
Resultados dos estudos interlaboratoriais comparativos: Número médio de vermes nos controlos e nos controlos com solvente, no final do ensaio; SD = desvio-padrão; CV = coeficiente de variação.
|
|
Número médio de vermes nos controlos
|
SD
|
CV (%)
|
n
|
Número médio de vermes nos controlos com solvente
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Média interlabora-torial
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
mín.
|
16,3
|
|
|
|
15,0
|
|
|
|
|
máx.
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Quadro 2
Resultados dos estudos interlaboratoriais comparativos: Média do peso seco dos vermes por replicado nos controlos e nos controlos com solvente, no final do ensaio; SD = desvio-padrão; CV = coeficiente de variação.
|
|
Peso seco total de vermes por replicado (controlos)
|
SD
|
CV (%)
|
n
|
Peso seco total de vermes por replicado (controlos com solvente)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Média interlabora-torial
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
mín.
|
12,9
|
|
|
|
10,5
|
|
|
|
|
máx.
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Quadro 3
Toxicidade do PCP: Resumo dos pontos finais do estudo interlaboratorial comparativo; médias interlaboratoriais de EC50, NOEC e LOEC SD = desvio-padrão; CV = coeficiente de variação.
|
Parâmetro biológico
|
|
Média interlabora-torial (mg/kg)
|
mín.
|
máx.
|
Fator interlabo-ratorial
|
SD
|
CV (%)
|
Média geomé-trica (mg/kg)
|
|
Número total de vermes
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Peso seco total de vermes
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
Mortalidade/sobrevivência
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
Reprodução (aumento do número de vermes por replicado)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
Crescimento (aumento de biomassa por replicado)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: Diferença mínima detetável entre os valores de controlo, durante os testes de hipóteses; parâmetro utilizado como medida do poder estatístico.
|
REFERÊNCIA
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel & B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 ENSAIO DE REPRODUÇÃO NO SOLO DO ÁCARO PREDADOR HYPOASPIS (GEOLAELAPS) ACULEIFER
INTRODUÇÃO
|
1.
|
Este método de ensaio é equivalente ao Test Guideline TG 226 (2008) da OCDE. Foi concebido para avaliar os efeitos na produção de descendência da espécie de ácaro Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae) em consequência da presença de produtos químicos no solo, desse modo permitindo estimar a inibição da taxa de crescimento específico da população (1,2). Neste contexto, “produção de descendência” indica o número de juvenis no final do período de ensaio. H. aculeifer representa um nível trófico adicional relativamente às espécies para as quais se dispõe já de métodos de ensaio. Para efeitos do presente método de ensaio, considera-se adequado um ensaio de reprodução sem discriminação e quantificação das diversas fases do ciclo reprodutor. No caso de produtos químicos com cenários de exposição diversos da exposição através do solo, podem justificar-se outras abordagens (3).
|
|
2.
|
A espécie Hypoaspis (Geolaelaps) aculeifer é considerada representativa da fauna do solo, nomeadamente dos ácaros predadores. Com distribuição mundial (5), pode ser facilmente obtida e criada em laboratório. O apêndice 7 contém um resumo da biologia da H. aculeifer. Estão disponíveis informações de base sobre a ecologia deste ácaro e a sua utilização em ensaios ecotoxicológicos: (4) (5) (6) (7) (8) (9) (10) (11) (12).
|
PRINCÍPIO DO ENSAIO
|
3.
|
Expõem-se fêmeas adultas a uma gama de concentrações do produto químico em estudo misturado no solo. O ensaio inicia-se com 10 fêmeas adultas por recipiente de replicação. Não se introduzem machos, pois a experiência mostrou que, quando há machos presentes, as fêmeas acasalam imediatamente ou pouco tempo após a eclosão da fase de deuteroninfa. Além disso, a inclusão de machos prolongaria o ensaio por tal forma que tornaria necessária a discriminação de faixas etárias. Portanto, o acasalamento, em si, não faz parte do ensaio. As fêmeas são introduzidas 28 a 35 dias após o início do período de postura na sincronização (ver apêndice 4), dado considerar-se que foram já fecundadas e passaram a fase que precede a oviposição. A 20 °C, o ensaio termina no 14.o dia após a introdução de fêmeas (dia 0), o que permite que os primeiros descendentes controlados atinjam a fase de deuteroninfa (ver apêndice 4). Como principal variável mensurada, determina-se o número de juvenis por recipiente de ensaio e, adicionalmente, o número de fêmeas sobreviventes. A reprodução dos ácaros expostos ao produto químico em estudo é comparada com a dos controlos, a fim de determinar a ECx (por exemplo EC10, EC50) ou a concentração sem efeitos observáveis (NOEC — ver definição no anexo 1), consoante a conceção experimental (ver ponto 29). O apêndice 8 apresenta uma panorâmica geral do programa de ensaio.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
4.
|
De preferência, devem conhecer-se a solubilidade em água, o log Kow, o coeficiente de partição solo-água e a pressão de vapor do produto químico em estudo. É aconselhável dispor de informações adicionais sobre o destino do produto químico no solo, nomeadamente as taxas de degradação biótica e abiótica.
|
|
5.
|
O presente método de ensaio pode ser utilizado com produtos químicos solúveis ou insolúveis em água. No entanto, o modo de aplicação do produto químico em estudo varia consoante o caso. O método não é aplicável a produtos químicos voláteis, ou seja, produtos cuja constante de Henry ou cujo coeficiente de partição ar/água forem superiores a 1, nem a produtos químicos cuja pressão de vapor exceda 0,0133 Pa a 25 °C.
|
VALIDADE DO ENSAIO
|
6.
|
Para que os resultados de um ensaio sejam considerados válidos, os controlos sem o produto químico em estudo devem satisfazer os seguintes critérios:
|
—
|
A mortalidade média das fêmeas adultas não pode exceder 20 % no final do ensaio;
|
|
—
|
O número médio de juvenis por replicado (com 10 fêmeas adultas introduzidas) deve ser, pelo menos, de 50 no final do ensaio;
|
|
—
|
O coeficiente de variação calculado para o número de juvenis por replicado não pode ser superior a 30 % no final do ensaio definitivo.
|
|
PRODUTO QUÍMICO DE REFERÊNCIA
|
7.
|
É necessário determinar a ECx e/ou a NOEC de um produto químico de referência, para garantir que as condições de ensaio laboratoriais são adequadas e averiguar se a resposta dos organismos de ensaio não sofreu alterações ao longo do tempo. O dimetoato (n.o CAS 60-51-5) é um produto químico de referência adequado, por ter sido demonstrado que afeta a dimensão da população (4). O ácido bórico (n.o CAS 10043-35-3) pode ser utilizado como alternativa. Há, contudo, menos experiência com este produto químico. São possíveis duas opções:
|
—
|
O produto químico de referência é ensaiado em paralelo com a determinação da toxicidade de cada produto químico em estudo a uma dada concentração, devendo ser previamente demonstrado num estudo dose-resposta que essa concentração provoca um efeito de redução da descendência > 50 %. Neste caso, o número de replicados deve ser o mesmo que nos controlos (ver ponto 29).
|
|
—
|
Em alternativa, o produto químico de referência é ensaiado 1-2 vezes por ano num ensaio de dose-resposta. Consoante a conceção selecionada, o número de concentrações e replicados e o fator de espaçamento diferem (ver ponto 29), devendo, contudo, alcançar-se uma resposta de 10-90 % de efeito (fator de espaçamento: 1,8). A EC50 para o dimetoato, com base no número de juvenis, deve situar-se na gama de 3,0 a 7,0 mg s.a./kg de solo (peso seco). A partir dos resultados já obtidos com o ácido bórico, a EC50, com base no número de juvenis, deve situar-se na gama de 100 a 500 mg/kg de solo (peso seco).
|
|
DESCRIÇÃO DO ENSAIO
Recipientes e equipamentos
|
8.
|
Devem utilizar-se recipientes de ensaio de 3-5 cm de diâmetro (altura do solo ≥ 1,5 cm), de vidro ou de outro material quimicamente inerte, com tampa hermética. São preferíveis as tampas de rosca, caso em que os recipientes podem ser arejados duas vezes por semana. Em alternativa, podem utilizar-se coberturas que permitam a troca de gases entre o substrato e a atmosfera (por exemplo, gaze). Dado que o teor de humidade deve ser mantido a um nível suficientemente elevado durante o ensaio, é essencial controlar o peso de cada recipiente durante o ensaio e, se necessário, acrescentar água. Isto pode ser especialmente importante quando não se dispuser de tampas de rosca. Se se utilizar um recipiente de ensaio não transparente, a tampa deve ser de um material que permita o acesso da luz (por exemplo, cobertura transparente perfurada), evitando, em simultâneo, a fuga de ácaros. A dimensão e o tipo de recipiente de ensaio dependem do método de extração (ver apêndice 5 para mais pormenores). Se se aplicar extração de calor diretamente ao recipiente de ensaio, pode colocar-se no fundo um crivo de malha adequada (selado até à extração), devendo a profundidade do solo ser suficiente para permitir gradientes de temperatura e de humidade.
|
|
9.
|
É necessário material laboratorial de uso corrente, nomeadamente o seguinte:
|
—
|
de preferência, recipientes de vidro com tampas de rosca;
|
|
—
|
microscópio estereoscópico;
|
|
—
|
escovas para a transferência dos ácaros;
|
|
—
|
medidor de pH e de luz;
|
|
—
|
balanças de precisão adequadas;
|
|
—
|
equipamentos adequados para o controlo da temperatura;
|
|
—
|
equipamentos adequados ao controlo da humidade atmosférica (não essencial se os recipientes de exposição estiverem cobertos com tampas);
|
|
—
|
incubadora ou pequena câmara, com controlo de temperatura;
|
|
—
|
equipamento de extração (ver apêndice 5) (13)
|
|
—
|
painel superior de controlo da luz;
|
|
—
|
boiões para a recolha dos ácaros extraídos.
|
|
Preparação do solo artificial
|
10.
|
Este ensaio utiliza um solo artificial. O solo artificial é constituído pelos seguintes elementos (todos os valores são baseados em massa seca):
|
—
|
5 % de turfa de esfagno, seca ao ar e finamente moída (é aceitável uma granulometria de 2 ± 1 mm);
|
|
—
|
20 % de argila caulínica, de preferência com teor de caulinite superior a 30 %;
|
|
—
|
cerca de 74 % de areia industrial seca ao ar (em função da quantidade de CaCO3 necessária), com predominância de areia fina com mais de 50 % de partículas de granulometria compreendida entre 50 e 200 μm. A quantidade exata de areia depende da quantidade de CaCO3 (ver abaixo), devendo, no seu conjunto, totalizar 75 %.
|
|
—
|
< 1,0 % de carbonato de cálcio (CaCO3) pulverizado, de qualidade analítica, a fim de obter um pH de 6,0 ± 0,5; a quantidade de carbonato de cálcio a utilizar pode depender principalmente da qualidade ou da natureza da turfa (ver nota 1);
|
Nota 1: A quantidade necessária de CaCO3 depende dos componentes do substrato edáfico e deve ser determinada através de medições do pH de subamostras de solo imediatamente antes do ensaio (14).
Nota 2: O teor de turfa do solo artificial difere de outros métodos de ensaio com organismos do solo, na maioria dos quais se utiliza 10 % de turfa [por exemplo (15)]. No entanto, em conformidade com a referência (16), um solo agrícola típico não tem mais de 5 % de matéria orgânica, pelo que a redução do teor de turfa reflete a redução da capacidade de sorção do produto químico a carbono orgânico num solo natural.
Nota 3: Se necessário, designadamente para certas finalidades, podem utilizar-se como substrato de ensaio e/ou de cultura solos naturais de locais não poluídos. No entanto, se se utilizar solo natural, devem conhecer-se, no mínimo, a origem (local de recolha), o pH, a textura (granulometria) e o teor de matéria orgânica. Devem referir-se, se disponíveis, o tipo e a designação do solo de acordo com as normas de classificação. Os solos devem estar isentos de qualquer contaminação. Se o produto químico em estudo for um metal ou um composto organometálico, deve também determinar-se a capacidade de troca catiónica do solo natural. Deve dar-se especial atenção ao cumprimento dos critérios de validade, dado que, em geral, raramente se dispõe de informações de base sobre os solos naturais.
|
|
11.
|
Misturam-se cuidadosamente (por exemplo, num misturador laboratorial de grandes dimensões) os componentes secos do solo. Para determinar o pH, utiliza-se uma mistura de solo com uma solução de cloreto de potássio (KCl) 1 M ou de cloreto de cálcio (CaCl2) 0,01 M, numa proporção de 1:5 (ver ponto 14 e apêndice 3). Se a acidez do solo exceder a gama necessária (ver ponto 10), pode ser ajustada por adição de uma quantidade adequada de CaCO3. Se o solo for demasiado alcalino, o pH pode ser corrigido mediante a adição de uma porção da mistura dos três primeiros componentes referidos no ponto 10, excluindo o CaCO3.
|
|
12.
|
A capacidade máxima do solo artificial para reter água é determinada de acordo com os procedimentos descritos no apêndice 2. Dois a sete dias antes do início do ensaio, o solo artificial seco é humedecido por adição de uma quantidade de água destilada ou desionizada suficiente para a obtenção de cerca de metade do teor final de água, ou seja, 40 a 60 % da capacidade máxima de retenção de água. O teor de humidade é ajustado para 40-60 % da capacidade máxima de retenção de água com a solução do produto químico em estudo e/ou com água destilada ou desionizada (ver pontos 16 a 18). Pode proceder-se a uma verificação complementar simples do teor de humidade do solo comprimindo delicadamente uma amostra na mão; se o teor de humidade for correto, observam-se gotículas de água entre os dedos.
|
|
13.
|
O teor de humidade do solo é determinado no início e no final do ensaio por secagem a peso constante, a 105 °C, em conformidade com a norma ISO 11465 (17), sendo o pH do solo determinado em conformidade com o apêndice 3 ou com a norma ISO 10390 (14). Estas medições devem ser efetuadas em amostras adicionais sem ácaros, tanto do solo de controlo como do solo de cada concentração de ensaio. O pH do solo não deve ser ajustado quando se sujeitem a ensaio produtos químicos ácidos ou básicos. O teor de humidade deve ser monitorizado durante o ensaio, pesando periodicamente os recipientes (ver pontos 20 e 24).
|
Seleção e preparação dos animais para ensaio
|
14.
|
A espécie utilizada no ensaio é a Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). O ensaio inicia-se com fêmeas adultas recolhidas de uma coorte sincronizada. Os ácaros devem ser introduzidos cerca de 7 a 14 dias após se tornarem adultos, 28 a 35 dias após o início da postura dos ovos na sincronização (ver ponto 3 e apêndice 4). Devem registar-se a proveniência ou o fornecedor dos ácaros e a manutenção da cultura laboratorial. Se for mantida uma cultura laboratorial, recomenda-se que a identidade da espécie seja confirmada pelo menos uma vez por ano. O apêndice 6 apresenta um modelo de ficha de identificação.
|
Preparação das concentrações de ensaio
|
15.
|
O produto químico é incorporado no solo. Os solventes orgânicos utilizados como auxiliares do tratamento do solo com o produto químico em estudo devem ser selecionados em função da sua baixa toxicidade para os ácaros, devendo o procedimento de ensaio incluir um controlo adequado do solvente (ver ponto 29).
|
Produtos químicos solúveis em água
|
16.
|
Prepara-se uma solução do produto químico em estudo em água desionizada numa quantidade suficiente para todos as replicados de uma concentração de ensaio. Recomenda-se a utilização de uma quantidade de água suficiente para obter o teor de humidade necessário, isto é, 40 a 60 % da capacidade máxima de retenção de água (ver ponto 12). Cada solução do produto químico é misturada de forma homogénea num lote de solo previamente humedecido, antes da introdução deste no recipiente de ensaio.
|
Produtos químicos insolúveis em água
|
17.
|
Os produtos químicos insolúveis em água mas solúveis em solventes orgânicos podem ser dissolvidos no volume mais baixo possível de um solvente adequado (por exemplo, acetona). Só devem utilizar-se solventes voláteis. Se forem utilizados tais veículos, todas as concentrações de ensaio e controlo devem conter a mesma quantidade mínima do veículo. O veículo é aspergido sobre uma pequena quantidade (por exemplo, 10 g) de areia de quartzo fina ou misturado com ela. O teor total de areia do substrato deve ser corrigido para esta quantidade. O veículo é eliminado por evaporação num exaustor durante, pelo menos, uma hora. Esta mistura de areia de quartzo e produto químico é misturada com o solo previamente humedecido, procedendo-se a uma homogeneização cuidadosa após a adição da quantidade de água desionizada adequada para obter o teor de humidade necessário. Introduz-se a mistura final nos recipientes de ensaio. De notar que alguns solventes podem ser tóxicos para os ácaros. Recomenda-se, por conseguinte, a utilização de um controlo suplementar com água sem o veículo, caso não seja conhecida a toxicidade do solvente para os ácaros. Se for devidamente demonstrado que, nas concentrações a aplicar, o solvente não tem efeitos, pode suprimir-se o controlo com água.
|
Produtos químicos em estudo pouco solúveis em água e em solventes orgânicos
|
18.
|
No caso de produtos químicos pouco solúveis em água ou em solventes orgânicos, mistura-se o equivalente de 2,5 g de areia de quartzo finamente moída por cada recipiente de ensaio (por exemplo, 10 g de areia de quartzo fina para quatro replicados) com a quantidade do produto químico em estudo, até obter a concentração de ensaio desejada. O teor total de areia do substrato deve ser corrigido para esta quantidade. Esta mistura de areia de quartzo e produto químico é misturada com o solo previamente humedecido, procedendo-se a uma homogeneização cuidadosa após a adição de uma quantidade de água desionizada adequada para obter o teor de humidade necessário. Divide-se a mistura final pelos recipientes de ensaio. Repete-se o procedimento para cada concentração de ensaio, preparando-se também um controlo adequado.
|
PROCEDIMENTO
Grupos de ensaio e grupos de controlo
|
19.
|
Recomenda-se a utilização de 10 fêmeas adultas por 20 g de massa seca de solo artificial, para cada recipiente de controlo e de exposição. Os organismos de ensaio devem ser adicionados nas duas horas subsequentes à preparação do substrato de ensaio final, ou seja, após aplicação do produto químico em estudo. Em certos casos específicos (quando, por exemplo, o envelhecimento da população é considerado um fator determinante), o tempo decorrido entre a preparação do substrato de ensaio final e a adição dos ácaros pode ser prolongado [para mais pormenores, ver (18)]. Nesses casos, contudo, é necessário fornecer uma justificação científica.
|
|
20.
|
Após a colocação dos ácaros no solo, fornece-se-lhes alimento, devendo determinar-se o peso inicial de cada frasco de ensaio, a utilizar como referência para o controlo do teor de humidade do solo durante o ensaio, como descrito no ponto 24. Os recipientes de ensaio são cobertos de acordo com o ponto 8 e colocados na câmara de ensaio.
|
|
21.
|
Preparam-se amostras-controlo adequadas para cada um dos métodos de aplicação do produto químico em estudo descritos nos pontos 15 a 18. Seguem-se os procedimentos descritos para preparar os controlos, exceto que não é adicionado o produto químico em estudo. Assim, quando necessário, aplicam-se aos controlos solventes orgânicos, areia de quartzo ou outros veículos, em concentrações ou quantidades semelhantes às utilizadas nas amostras de ensaio. Se se adicionar um solvente ou outro veículo ao produto químico em estudo, deve-se também preparar e submeter a ensaio uma amostra suplementar de controlo sem o veículo ou o produto químico em estudo, caso a toxicidade do solvente não seja conhecida (ver ponto 17).
|
Condições de realização do ensaio
|
22.
|
A temperatura de ensaio deve ser de 20 ± 2 °C. Deve ser registada, pelo menos, diariamente e, se necessário, ajustada. O ensaio é efetuado em ciclos luz/obscuridade (de preferência, 16 horas de luz e 8 horas de obscuridade), com iluminação de 400 a 800 lux na zona dos recipientes de ensaio. Por razões de comparabilidade, estas condições são idênticas às dos outros ensaios ecotoxicológicos com solo [por exemplo, (15)].
|
|
23.
|
Caso se utilizem tampas de rosca, deve garantir-se o intercâmbio de gases mediante o arejamento dos recipientes de ensaio, pelo menos duas vezes por semana. Se forem utilizadas coberturas de gaze, importa dar especial atenção à manutenção do teor de humidade do solo (ver pontos 8 e 24).
|
|
24.
|
O teor em água do substrato edáfico nos recipientes de ensaio é mantido ao longo do ensaio, através de pesagem e, se necessário, de reidratação periódica (por exemplo, uma vez por semana) dos recipientes. As perdas são compensadas, na medida do necessário, com água desionizada. O teor de humidade durante o ensaio não deve diferir do valor inicial em mais de 10 %.
|
Alimentação
|
25.
|
Os ácaros-do-queijo [Tyrophagus putrescentiae (Schrank, 1781)] revelaram ser uma fonte alimentar adequada. São também adequados colêmbolos de prequenas dimensões [por exemplo, juvenis de Folsomia candida Willem, 1902 ou Onychiurus fimatus (19) (20)], enquitreídeos (por exemplo, Enchytraeus crypticus Westheide & Graefe, 1992) ou nemátodos (por exemplo, Turbatrix silusiae de Man, 1913) (21). É aconselhável verificar o alimento antes da sua utilização no ensaio. O tipo e a quantidade de alimento devem assegurar um número adequado de juvenis, a fim de cumprir os critérios de validade (ponto 6). Para a seleção das presas, deve ter-se em conta o modo de ação do produto químico em estudo (um acaricida, por exemplo, pode ser também tóxico para os ácaros presentes nos alimentos — ver ponto 26).
|
|
26.
|
O alimento deve ser fornecido ad libitum (ou seja, uma pequena quantidade de cada vez, com a ponta de uma espátula). Para o efeito, pode também utilizar-se um exaustor de baixa aspiração, como se propõe no ensaio com colêmbolos, ou uma escova fina. Em geral, bastará fornecer alimento no início do ensaio e, posteriormente, duas ou três vezes por semana. Se o produto químico em estudo se afigurar tóxico para as presas, deve ponderar-se fornecer uma maior quantidade de alimento e/ou uma fonte de alimentação alternativa.
|
Seleção das concentrações de ensaio
|
27.
|
O conhecimento prévio da toxicidade do produto químico em estudo (por exemplo, com base em ensaios de determinação da gama de concentrações) contribui para a seleção das concentrações de ensaio adequadas. Quando necessário, efetua-se um ensaio preliminar de determinação da gama de concentrações com cinco concentrações do produto químico em estudo na gama 0,1-1 000 mg por kg de solo seco, prevendo-se, pelo menos, um replicado para as amostras de ensaio com o produto e os controlos. A duração do ensaio de determinação da gama de concentrações é de 14 dias, após o que se determina a mortalidade dos ácaros adultos e o número de juvenis. A gama de concentrações no ensaio final deve ser escolhida, de preferência, de forma a abranger as concentrações às quais, contrariamente à sobrevivência da geração materna, o número de juvenis é afetado. Contudo, isso poderá não ser possível no caso de produtos químicos que produzam efeitos letais e subletais a concentrações muito próximas. As concentrações testadas no ensaio devem incluir as concentrações às quais se observam efeitos (por exemplo, EC50, EC25, EC10) e abranger a gama de concentrações para as quais os efeitos do produto químico em estudo são significativos. As extrapolações muito abaixo da menor concentração que afeta os organismos de ensaio ou muito acima da concentração de ensaio mais elevada devem ser feitas apenas em casos excecionais, a justificar circunstanciadamente no relatório.
|
Conceção experimental
Ensaios dose/resposta
|
28.
|
Propõem-se três conceções, baseadas nas recomendações resultantes de outro estudo interlaboratorial comparativo — o método de reprodução com enquitreídeos (22). A adequação geral de todas essas conceções foi confirmada pelos resultados da validação com H. aculeifer.
|
|
29.
|
Na escolha da gama de concentrações, importa ter presente o seguinte:
|
—
|
Para a determinação da ECx (por exemplo EC10, EC50), importa submeter a ensaio doze concentrações. Recomenda-se também preparar, pelo menos, dois replicados de cada concentração de ensaio e seis replicados de controlo. O fator de espaçamento pode ser inferior ou igual a 1,8 na gama com efeitos esperados e superior a 1,8 no caso das concentrações mais e menos elevadas.
|
|
—
|
Para determinar a NOEC, devem submeter-se a ensaio, pelo menos, cinco concentrações em progressão geométrica. Recomenda-se a preparação de quatro replicados de cada concentração de ensaio, além de oito controlos. O fator de espaçamento entre as concentrações não pode ser superior a 2,0.
|
|
—
|
Uma abordagem combinada permite determinar simultaneamente a NOEC e a ECx. Devem utilizar-se oito concentrações de ensaio em progressão geométrica. Recomenda-se a preparação de quatro replicados de cada concentração de ensaio, além de oito controlos. O fator de espaçamento entre as concentrações não pode ser superior a 1,8.
|
|
Ensaio do limite
|
30.
|
Se não se observarem efeitos com a concentração mais elevada no ensaio de determinação da gama de concentrações (1 000 mg por kg de peso seco de solo), o ensaio de reprodução definitivo pode ser executado como ensaio do limite, utilizando uma concentração de ensaio de 1 000 mg por kg de peso seco de solo. Um ensaio do limite representa uma oportunidade para demonstrar que a NOEC ou a EC10 para a reprodução é superior à concentração-limite, minimizando, ao mesmo tempo, o número de ácaros utilizados no ensaio. Devem utilizar-se oito replicados tanto para as amostras de ensaio como para as amostras de controlo.
|
Duração do ensaio e medições
|
31.
|
Devem registar-se quaisquer diferenças de comportamento e de morfologia entre os ácaros dos recipientes de controlo e dos recipientes de exposição ao produto.
|
|
32.
|
No 14.o dia, extraem-se do solo os ácaros sobreviventes, por ação de calor ou luz ou por outro método adequado (ver apêndice 5). Contabiliza-se separadamente o número de juvenis (larvas, protoninfas e deuteroninfas) e de adultos. Os adultos não detetados neste momento devem ser registados como mortos, pressupondo-se que morreram e se decompuseram antes da avaliação. A eficiência da extração deve ser validada uma ou duas vezes por ano, utilizando amostras de controlos com números conhecidos de adultos e juvenis. A eficiência deve ser superior a 90 % (média combinada para todas as fases de desenvolvimento — ver apêndice 5). Não se efetuam ajustamentos de eficiência com base nos adultos e nos juvenis.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
33.
|
Os pontos 36 a 41 apresentam informações sobre os métodos estatísticos que se podem utilizar na análise dos resultados do ensaio. Deve também consultar-se o documento n.o 54 da OCDE intitulado “Current approaches in the statistical analysis of ecotoxicity data: a Guidance to Application” (31).
|
|
34.
|
O principal parâmetro final é a produção de descendência, traduzida no número de juvenis produzidos por replicado (recipiente no qual se introduziram 10 fêmeas adultas). A análise estatística exige o cálculo da média aritmética (X) e da variância (s2) da produção de descendência, por recipiente de exposição e de controlo. Os valores de X e s2 são utilizados em métodos ANOVA como o teste t de Student e os testes de Dunnett ou de Williams, bem como para o cálculo de intervalos de confiança de 95 %.
Nota: O principal ponto final equivale à fecundidade, traduzida no número de juvenis vivos produzidos durante o ensaio, dividido pelo número de fêmeas progenitoras introduzidas no início do ensaio.
|
|
35.
|
O número de fêmeas sobreviventes nas amostras de controlo não expostas ao produto constitui um importante critério de validade, pelo que deve ser documentado. Tal como no ensaio de determinação da gama de concentrações, todos os outros sinais de nocividade devem constar do relatório final.
|
ECx
|
36.
|
Os valores de ECx, assim como os correspondentes limites de confiança a 95 % do parâmetro descrito no ponto 34, são calculados por recurso a métodos estatísticos adequados (análise da função probit, função logística ou de Weibull, método abreviado de Spearman-Karber ou simples interpolação). Determina-se a ECx inserindo na equação obtida o valor correspondente a x % da média do grupo de controlo. Para calcular a EC50 ou qualquer outra ECx, procede-se a uma análise de regressão da média das séries (X).
|
NOEC/LOEC
|
37.
|
Caso se pretenda determinar a NOEC ou a LOEC por análise estatística, é necessário dispor de dados estatísticos por recipiente (sendo cada recipiente considerado um replicado). Devem utilizar-se métodos estatísticos adequados, de acordo com o documento n.o 54 da OCDE intitulado Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Em geral, investigam-se os efeitos nocivos do produto químico em estudo, comparativamente ao grupo de controlo, testando a hipótese unilateral (mais reduzida) para p ≤ 0,05. Os pontos que se seguem apresentam vários exemplos.
|
|
38.
|
A distribuição normal dos dados pode ser sujeita, por exemplo, ao teste de ajustamento de Kolmogorov-Smirnov, ao teste de rácio gama-desvio-padrão (teste R/s) ou ao teste dual de Shapiro-Wilk (p ≤ 0,05). Para avaliar a homogeneidade da variância, pode recorrer-se aos testes de Cochran, de Levene ou de Bartlett (dual, p ≤ 0,05). Se se cumprirem os requisitos dos testes paramétricos (normalidade homogeneidade da variância), podem realizar-se uma análise ANOVA e os testes multicomparativos subsequentes. Para averiguar se existem diferenças significativas (p < 0,05) entre os controlos e as várias concentrações de ensaio do produto, podem utilizar-se comparações múltiplas (por exemplo, teste t de Dunnett) ou testes de tendência regressiva (por exemplo, teste de Williams no caso de uma relação monótona dose-resposta) (a seleção do teste recomendado é em conformidade com o documento n.o 54 da OCDE Current Approaches in the Statistical Analysis of Ecotoxicity Data: A guidance to application. Alternativamente, pode recorrer-se a métodos não paramétricos (por exemplo, teste U de Bonferroni na versão de Holm ou teste de tendências de Jonckheere-Terpstra) para determinar a NOEC ou a LOEC.
|
Ensaio do limite
|
39.
|
Se se realizar um ensaio do limite (comparação de apenas uma amostra de controlo e uma amostra tratada com o produto) e se cumprirem os requisitos dos testes paramétricos (normalidade, homogeneidade), as respostas métricas podem ser avaliadas por um teste t de Student. Se não se cumprirem aqueles requisitos, pode recorrer-se a um teste t de variância desigual (teste de Welch) ou a um teste não paramétrico, como o teste U de Mann-Whitney.
|
|
40.
|
Para detetar diferenças significativas entre os controlos (controlo e controlo com solvente), os replicados de cada controlo podem ser testados da forma descrita para o ensaio do limite. Se estes testes não detetarem diferenças significativas, podem agrupar-se todos os replicados de controlo e replicados de controlo com solvente. Caso contrário, todas as amostras tratadas com o produto devem ser comparadas com o controlo com solvente.
|
Relatório do ensaio
|
41.
|
Os elementos mínimos que devem constar do relatório do ensaio são os seguintes:
|
—
|
Produto químico em estudo
|
—
|
identidade, nome, lote e número CAS, grau de pureza;
|
|
—
|
propriedades físico-químicas (por exemplo, log Kow, hidrossolubilidade, pressão de vapor, constante de Henry (H) e, de preferência, informações sobre o destino do produto químico no solo);
|
|
|
—
|
Organismos sujeitos a ensaio
|
—
|
identificação e fornecedor dos organismos de ensaio, descrição das condições de cultura;
|
|
—
|
gama etária dos organismos.
|
|
|
—
|
Condições de realização do ensaio
|
—
|
descrição completa do método experimental e dos procedimentos;
|
|
—
|
dados sobre a preparação do solo para o ensaio; se se utilizar solo natural, especificações pormenorizadas (origem, história, distribuição granulométrica, pH, teor de matéria orgânica e, se disponível, classificação do solo);
|
|
—
|
capacidade máxima do solo para reter água;
|
|
—
|
descrição da técnica utilizada para aplicar no solo o produto químico em estudo;
|
|
—
|
informações sobre produtos químicos adjuvantes utilizados para administrar o produto químico em estudo;
|
|
—
|
dimensões dos recipientes de ensaio e massa seca de solo por cada recipiente de ensaio;
|
|
—
|
condições de ensaio: intensidade luminosa, duração dos ciclos luz/obscuridade, temperatura;
|
|
—
|
descrição do regime alimentar, tipo e quantidade de alimento utilizado no ensaio, datas de alimentação;
|
|
—
|
pH e teor de humidade do solo no início e ao longo do ensaio (amostras de controlo e de exposição ao produto);
|
|
—
|
descrição pormenorizada do método de extração e eficiência da extração.
|
|
|
—
|
Resultados do ensaio
|
—
|
número de juvenis contados em cada recipiente, no final do ensaio;
|
|
—
|
número de fêmeas adultas e mortalidade dos adultos ( %) em cada recipiente, no final do ensaio;
|
|
—
|
descrição de sintomas evidentes ou de alterações comportamentais evidentes;
|
|
—
|
resultados obtidos com o produto químico de referência;
|
|
—
|
estatísticas sumárias (ECx e/ou NOEC), incluindo limites de confiança a 95 % e descrição do método de cálculo;
|
|
—
|
representação gráfica da relação concentração-resposta;
|
|
—
|
desvios aos procedimentos descritos no presente método e quaisquer ocorrências anómalas durante o ensaio.
|
|
|
REFERÊNCIAS
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. & van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS — Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: 241-249
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: 621-628
|
|
(8)
|
Krogh, P.H. & Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. & van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. & Van Straalen, N.M. (2002). Soil Toxicity Tests — Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. & Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. & Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. & Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. & Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(15)
|
Capítulo C.8 do presente anexo (Toxicidade em relação às minhocas).
|
|
(16)
|
OCDE (2003). EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis — Gravimetric method, No. 11465. ISO, Geneve.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. & Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34 3 16 395 -433
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. & Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Capítulo C.32 do presente anexo (Ensaio de reprodução com enquitreídeos).
|
|
(23)
|
ISO (Organização Internacional de Normalização) (1994). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction (11268)]. ISO, Geneve.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
(25)
|
Dunger, W. & Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
(26)
|
Lesna, I. & Sabelis, M.W. (1999). Diet-dependent female choice for males with “good genes” in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. & Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A guidance to application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
Apêndice 1
Definições
Para efeitos do presente método de ensaio, aplicam-se as definições que se seguem (neste ensaio, as concentrações com efeitos são expressas em massa do produto químico em estudo por massa seca de solo utilizado):
Produto químico
: uma substância ou mistura.
NOEC (concentração sem efeitos observáveis)
: concentração do produto químico em estudo à qual não se observa nenhum efeito do mesmo. Neste ensaio, a concentração NOEC não tem nenhum efeito com significância estatística (p < 0,05) num determinado período de exposição, comparativamente ao grupo de controlo.
LOEC (menor concentração com efeito observável): menor concentração do produto químico em estudo que tem um efeito estatisticamente significativo (p < 0,05) num determinado período de exposição, comparativamente ao grupo de controlo.
ECx
(concentração com x % de efeitos): concentração que causa efeitos em x % dos organismos ensaiados num determinado período de exposição, comparativamente ao grupo de controlo. Por exemplo, a EC50 é a concentração que se estima que, num ponto final do ensaio, terá efeito em 50 % da população exposta, num período de exposição definido.
Produto químico em estudo
: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
Apêndice 2
Determinação da capacidade máxima do solo para reter água (capacidade máxima de retenção de água)
O método que se segue é considerado adequado para determinar a capacidade máxima de retenção de água do solo. Está descrito no anexo C da norma ISO DIS 11268-2 [Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction (23)].
Recolher uma determinada quantidade (por exemplo, 5 g) de substrato do solo de ensaio com o auxílio de um instrumento adequado (tubo Auger, etc.). Cobrir o fundo do tubo com um pedaço de papel de filtro e, após o enchimento com água, introduzi-lo num suporte de banho-maria. O tubo deve ser submergido gradualmente, até que o nível de água se situe acima do topo da camada de solo. Deixar o tubo no banho-maria durante cerca de três horas. Dado não ser possível reter toda a água absorvida por capilaridade, deve deixar-se a amostra de solo escorrer durante duas horas, colocando o tubo num leito de areia de quartzo finamente moída e muito húmida, contido num recipiente coberto (para evitar a secagem). A amostra deve, em seguida, ser pesada e seca até massa constante à temperatura de 105 °C. A capacidade de retenção de água (WHC) pode ser calculada do seguinte modo:

em que:
S= substrato saturado de água + massa do tubo + massa do papel de filtro
T= tara (massa do tubo + massa do papel de filtro)
D= massa seca de substrato
Apêndice 3
Determinação do ph do solo
O seguinte método de determinação do pH de uma amostra de solo baseia-se na descrição da norma ISO DIS 10390: Qualidade do solo – Determinação do pH (16).
Seca-se uma determinada quantidade de solo à temperatura ambiente, durante, pelo menos, 12 h. Prepara-se então uma suspensão que contenha, pelo menos, 5 g de solo, à qual se adiciona cinco vezes o seu volume de uma solução 1 M de cloreto de potássio (KCl) de qualidade analítica ou de uma solução 0,01 M de cloreto de cálcio (CaCl2) também de qualidade analítica. Agita-se a suspensão vigorosamente durante cinco minutos, deixando-se de seguida em repouso durante, pelo menos, 2 horas, mas não mais de 24 horas. O pH da fase líquida é então medido por recurso a um medidor de pH, calibrado, antes de cada medição, com uma série adequada de soluções-tampão (por exemplo, pH 4,0 e 7,0).
Apêndice 4
Criação de ácaros da espécie Hypoaspis (Geolaelaps ) aculeifer e sincronização da cultura
Criação de Hypoaspis (Geolaelaps) aculeifer
As culturas podem ser mantidas em recipientes de plástico ou frascos de vidro com uma mistura de gesso de Paris e carvão vegetal em pó (9:1). Para manter o gesso húmido, acrescentar algumas gotas de água destilada ou desionizada, se necessário. A temperatura ótima é da ordem de 20 ± 2 °C; o regime luz/obscuridade não é relevante para a espécie em causa. As presas podem ser das espécies Typrophagus putrescentiae ou Caloglyphus sp. (os ácaros dos alimentos devem ser manipulados com cuidado, dado poderem provocar alergias no homem); nemátodos, enquitreídeos e colêmbolos são também presas adequadas. A sua origem deve ser registada. A proliferação da população pode ter início com uma única fêmea, dado que se desenvolvem machos a partir de ovos não fecundados. Regista-se uma ampla sobreposição de gerações. As fêmeas vivem, pelo menos, 100 dias, durante os quais põem cerca de 100 ovos. A taxa de postura máxima é atingida 10 a 40 dias após se tornarem adultas, sendo da ordem de 2,2 ovos fêmea–1 dia–1. O desenvolvimento das fêmeas adultas a partir dos ovos dura cerca de 20 dias, a 20 °C. Deve manter-se mais de uma cultura.
Criação de Tyrophagus putrescentiae
Os ácaros são mantidos num recipiente de vidro contendo levedura de cerveja finamente pulverizada, colocado num balde de plástico cheio de uma solução de KNO3, para que não possam escapar. Os ácaros dos alimentos são colocados no topo da levedura pulverizada. De seguida, com o auxílio de uma espátula, são cuidadosamente misturados com esta última (que tem de ser substituída duas vezes por semana).
Sincronização da cultura
Os espécimes utilizados no ensaio devem ter aproximadamente a mesma idade (cerca de 7 dias depois de atingirem a fase adulta). À temperatura de 20 °C, o procedimento é o seguinte:
Transferem-se as fêmeas para um recipiente limpo e fornece-se-lhes uma quantidade suficiente de alimento.
|
—
|
Após dois ou três dias de postura, removem-se as fêmeas;
|
|
—
|
Recolhem-se as fêmeas adultas para os ensaios entre o 28.o e o 35.o dias após a sua colocação nos recipientes limpos.
|
As fêmeas adultas distinguem-se facilmente dos machos e dos espécimes em outras fases de desenvolvimento pela sua maior dimensão, forma inflada e cor acastanhada da cutícula dorsal (os machos são mais finos e aplanados); os espécimes imaturos têm cor branca a creme. A 20 °C, o desenvolvimento dos ácaros segue aproximadamente o modelo que se descreve em seguida (ver figura): postura dos ovos: 5 dias; fase de larva: 2 dias; fase de protoninfa: 5 dias; fase de deuteroninfa: 7 dias; período de pré-postura das fêmeas: 2 dias. Decorridas estas fases, os ácaros são adultos.
Figura
Desenvolvimento da espécie Hypoaspis (Geolaelaps) aculeifer a 20 °C (remoção = fêmeas utilizadas para ensaio)

Retiram-se da cultura sincronizada os animais adultos para ensaio e introduzem-se nos recipientes de ensaio entre o 28.o e o 35.o dias após o início da postura das fêmeas progenitoras (ou seja, 7 a 14 dias depois de se terem tornado adultos). Garante-se assim que as fêmeas a utilizar nos ensaios tenham ultrapassado o período de pré-postura e sido fecundadas pelos machos também presentes no recipiente. As observações de culturas em laboratório sugerem que, se estiverem presentes machos, as fêmeas acasalam imediatamente ou pouco depois de se tornarem adultas (Ruf, Vaninnen, obs. pes.). O período de sete dias foi escolhido para facilitar a integração na rotina laboratorial e atenuar a variabilidade individual no desenvolvimento dos ácaros. A postura deve ter início com um número de fêmeas, pelo menos, igual ao que for necessário para o ensaio (por exemplo, se forem necessárias 400 fêmeas, deve garantir-se a postura de, no mínimo, 400 fêmeas, durante dois a três dias). Como ponto de partida para a sincronização da população, deve dispor-se, pelo menos, de 1 200 ovos (rácio entre os sexos cerca de 0,5; mortalidade cerca de 0,2). Para evitar o canibalismo, é mais fácil manter num recipiente um máximo de 20 a 30 fêmeas em postura.
Apêndice 5
Métodos de extração
No caso dos microartrópodes, a extração com calor constitui um método adequado para retirar os espécimes do solo ou do substrato (ver figura abaixo). O método baseia-se na atividade dos organismos, pelo que apenas os espécimes móveis têm a possibilidade de ser registados. O princípio da extração com calor consiste em criar condições progressivamente mais inóspitas para os organismos na amostra até eles abandonarem o substrato, caindo num líquido de fixação (por exemplo, etanol). Os pontos cruciais são a duração da extração e o gradiente de condições boas a moderadas e más para os organismos. A duração da extração para ensaios ecotoxicológicos tem de ser tão curta quanto possível, uma vez que qualquer crescimento da população durante a extração falsifica os resultados. Por outro lado, as condições de temperatura e humidade da amostra devem situar-se sempre numa gama que permita a movimentação dos ácaros. O aquecimento de uma amostra de solo conduz à secagem do substrato. Se a secagem for demasiado rápida, alguns ácaros podem também sofrer dessecação antes de conseguirem escapar.
Nesta conformidade, o procedimento proposto é o seguinte [(24) (25)]:
|
|
Equipamento: funil de Tullgren ou métodos comparáveis, como, por exemplo, o de McFadyen (aquecimento vindo de cima, sendo a amostra colocada num funil).
|
|
|
Regime de aquecimento: 25 °C durante 12 horas, 35 °C durante 12 horas e 45 °C durante 24 horas (no total, 48 horas). A temperatura do substrato deve ser medida.
|
|
|
Líquido de fixação: etanol a 70 %.
|
|
|
Procedimento: Utilizar o recipiente de vidro de ensaio. Remover a tampa e colocar uma rede ou um pedaço de tecido em torno da abertura. O tecido deve ter uma malha de 1,0 a 1,5 mm. Fixá-lo com um elástico. Inverter cuidadosamente o recipiente de ensaio e introduzi-lo no dispositivo de extração. O tecido impede o substrato de passar para o líquido de fixação, mas permite que os ácaros abandonem a amostra. Iniciar o aquecimento quando todos os recipientes estiverem inseridos no dispositivo. Terminar a extração após 48 horas. Remover os recipientes de fixação e contar os ácaros por meio de um microscópio de dissecação.
|
A eficácia da extração do método escolhido deve ser comprovada uma ou duas vezes por ano, por recurso a recipientes que contenham um número conhecido de ácaros juvenis e adultos mantidos em substrato de ensaio não tratado. A eficiência deve ser ≥ 90 % (média combinada para todos as fases de desenvolvimento).
Dispositivo de extração do tipo Tullgren

Como preparar o recipiente após a conclusão do ensaio, antes da extração

Apêndice 6
Identificação de Hypoaspis (Geolaelaps) aculeifer
|
Subclasse/ ordem/ subordem
|
|
Família
|
|
Género/ subgénero/ espécie
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autor e data:
|
F. Faraji, Ph.D. (MITOX), 23.01.2007
|
|
Bibliografia:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2nd revised edition: 1-523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Características morfológicas:
|
Epistoma com arestas arredondadas denticuladas; ranhuras hipostomáticas com mais de 6 dentículos; sedas dorsais caudais de Z4 não muito longas; sedas dorsais setiformes; cutícula genital normal, não muito alargada e não alcançando a cutícula anal; metade posterior da cutícula dorsal sem sedas desemparelhadas; pernas II e IV com algumas macrossedas espessas; sedas dorsais Z5 com comprimento aproximadamente duplo de J5; nas quelíceras, dedos fixos com 12 a 14 dentes e dedos móveis com 2 dentes; idiossoma com comprimento 520-685 μm.
A Hypoaspis miles também é utilizada em ensaios biológicos e pode confundir-se com a H. aculeifer. Principal diferença:
A H. miles pertence ao subgénero Cosmolaelaps e apresenta sedas dorsais anguladas, enquanto a H. aculeifer pertence ao subgénero Geolaelaps e apresenta sedas dorsais setiformes.
|

Apêndice 7
Informações de base sobre a biologia de Hypoaspis (Geolaelaps) aculeifer
A espécie Hypoaspis aculeifer pertence à família Lealapidae, ordem Acari (ácaros), classe Arachnida, filo Arthropoda. Vive em todos os tipos de solo e alimenta-se de outros ácaros, nemátodos, enquitreídeos e colêmbolos (26). Em caso de escassez de alimentos, pode manifestar canibalismo (27). O corpo dos ácaros predadores divide-se em idiossoma e gnatossoma. Não existe diferenciação clara do idiossoma em prossoma (cabeça) e opistossoma (abdómen). O gnatossoma (cutícula da cabeça) contém os instrumentos de alimentação, designadamente palpos e quelíceras. As quelíceras são trifurcadas e munidas de dentes de formas diferentes. Para além da ingestão, os machos utilizam as quelíceras principalmente para transferir os espermatóforos para as fêmeas. A cutícula dorsal cobre quase completamente o idiossoma. Uma grande parte do idiossoma das fêmeas é ocupada pelos órgãos reprodutores, particularmente salientes antes da postura dos ovos. Na face ventral, encontram-se duas cutículas, a esternal e a genital. Todas as patas estão munidas de sedas e espinhos. As sedas servem para fixação, quando o animal se desloca no solo. O primeiro par de patas é utilizado principalmente como antena. O segundo par é utilizado, não só para locomoção, mas também para agarrar as presas. Os espinhos do quarto par de patas podem servir de proteção, bem como de “motores” de locomoção (28). Os machos têm 0,55 a 0,65 mm de comprimento e 10 a 15 μg de peso. As fêmeas têm 0,8 a 0,9 mm de comprimento e 50 a 60 μg de peso, (8) (28) (figura 1).
Figura 1
Fêmea, macho, protoninfa e larvas de H. aculeifer

A 23 °C, os ácaros atingem a maturidade sexual ao cabo de 16 dias (fêmeas) e 18 dias (machos) (6). As fêmeas recolhem os espermatozóides pelo solenostoma, do qual os espermatozóides passam para o ovário, onde sofrem maturação e são armazenados. A fertilização ocorre apenas após maturação dos espermatozóides no ovário. Os ovos, fecundados ou não, são postos pelas fêmeas em conjuntos ou separadamente, de preferência em fendas e orifícios. As fêmeas fecundadas produzem juvenis de ambos os sexos, enquanto as fêmeas não fecundadas produzem apenas juvenis machos. Durante o desenvolvimento até se tornarem adultos, os ácaros predadores passam por quatro fases — ovos, larvas, protoninfas, deuteroninfas e adultos.
Os ovos têm uma coloração branca leitosa, hialina; são de forma elítica e têm cerca de 0,37 mm de comprimento, com um manto sólido. De acordo com a referência (8), as dimensões das larvas oscilam entre 0,42 e 0,45 mm. Têm apenas três pares de patas. Na região da cabeça, os palpos e as quelíceras estão já desenvolvidos. As quelíceras, munidas de pequenos dentículos, são utilizadas para a eclosão do ovo. As protoninfas desenvolvem-se na sequência da primeira metamorfose, 1 a 2 dias após a eclosão. Têm igualmente cor branca; as suas dimensões são da ordem de 0,45 a 0,62 mm (8) e têm quatro pares de patas. Nas quelíceras, os dentes estão já presentes na totalidade. Os ácaros começam a procurar alimento nesta fase. A cutícula das presas é furada com as quelíceras, sendo a presa impregnada de uma secreção para digestão extraintestinal. O ácaro aspira em seguida o bolo alimentar. As quelíceras também podem ser utilizadas para fragmentar partículas alimentares de maiores dimensões (28). Após uma nova metamorfose, desenvolvem-se as deuteroninfas. Têm 0,60 a 0,80 mm (8) de comprimento e coloração amarela a castanha clara. Nesta fase, são distinguíveis fêmeas e machos. Após nova metamorfose (com cerca de 14 dias de duração), no decurso da qual estão inativos e se desenvolve a cutícula acastanhada, os ácaros tornam-se adultos (28) (29) (30). A sua esperança de vida varia de 48 a 100 dias, a 25 °C (27).
Apêndice 8
Resumo e calendário das principais ações a executar no ensaio com Hypoaspis
|
Tempo (dias)
início do ensaio = dia 0
|
Atividade / tarefa
|
|
Dia – 35
a – 28
|
Transferência das fêmeas provenientes da cultura de reserva para recipientes limpos, para o início da sincronização
2 dias depois: remoção das fêmeas
Duas ou três vezes por semana: fornecimento de alimento em quantidade suficiente
|
|
Dia – 5 (+/- 2)
|
Preparação do solo artificial
|
|
Dia – 4 (+/- 2)
|
Determinação da capacidade de retenção de água do solo artificial
Secagem de um dia para o outro
Dia seguinte: pesagem das amostras e cálculo da capacidade de retenção de água
|
|
Dia – 4 (+/- 2)
|
Pré-humedecimento do solo artificial, até totalizar 20 - 30 % da capacidade de retenção de água
|
|
Dia 0
|
Início do ensaio: mistura do produto químico em estudo no solo artificial
Introdução de 10 fêmeas por replicado
Pesagem dos replicados
Preparação dos controlos abióticos do teor de humidade e do pH (2 replicados por cada amostra de exposição)
Controlos de humidade a seco de um dia para o outro
Dia seguinte: Controlos de humidade a seco
Dia seguinte: Medição do pH dos controlos abióticos a seco
|
|
Dias 3, 6, 9 e 12 (aproximadamente)
|
Fornecimento a cada replicado de uma quantidade suficiente de presas
Pesagem de cada replicado e adição de água evaporada
|
|
Dia 14
|
Finalização do ensaio, preparação da extração com todos os replicados e amostras de controlo da eficiência de extração
Controlos do teor de água a seco de um dia para o outro
Dia seguinte: pesagem das amostras de controlo do teor de água
Dia seguinte: medição do pH das amostras de controlo a seco
|
|
Dia 16
|
Fim da extração
|
|
Dias 16+
|
Registo do número de adultos e juvenis nos materiais extraídos
Registo dos resultados em quadros-modelo
Registo do procedimento de ensaio em folhas de protocolo
|
C.37. ENSAIO A 21 DIAS EM PEIXES: DESPISTAGEM A CURTO PRAZO DE ATIVIDADE ESTROGÉNICA E ANDROGÉNICA E DE INIBIÇÃO DA AROMATASE
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 230 (2009) da OCDE. A necessidade de desenvolver e validar um ensaio em peixes capaz de detetar determinados produtos químicos com atividade endócrina decorre dos receios acerca da possibilidade de os níveis ambientais dos produtos químicos em causa serem passíveis de ter efeitos indesejados nas populações humanas e na fauna e flora selvagens, devido a interações dos referidos produtos químicos com o sistema endócrino. Em 1998, a OCDE deu início a uma ação de elevada prioridade com vista à revisão das orientações existentes e à elaboração de novas orientações para despistagem e ensaio de potenciais desreguladores do sistema endócrino. Um dos elementos dessa ação foi a elaboração de um Test Guideline para a despistagem de produtos químicos com atividade no sistema endócrino de espécies de peixes. O Ensaio de Despistagem de Atividade Endócrina a 21 dias em Peixes foi objeto de um vasto programa de validação, que consistiu na realização de estudos interlaboratoriais com determinados produtos químicos para demonstrar a pertinência e a fiabilidade do ensaio na deteção de produtos químicos com atividade estrogénica e inibidora da aromatase (1)(2)(3)(4)(5) nas três espécies de peixes investigadas — o vairão-de-cabeça-gorda (Pimephales promelas), o peixe-do-arroz-japonês (Oryzias latipes) e o peixe-zebra (Danio rerio). É possível detetar atividade androgénica no vairão-de-cabeça-gorda e no peixe-do-arroz-japonês, mas não no peixe-zebra, sendo que o método de ensaio também não permite detetar produtos químicos com atividade antiandrogénica. O trabalho de validação foi objeto de uma avaliação por pares no âmbito de um painel de peritos nomeados pelos coordenadores nacionais do programa de Test Guidelines (6). Este ensaio não visa identificar mecanismos específicos de desregulação hormonal, pois os animais ensaiados possuem um eixo hipotálamo-hipófise-gónadas intacto e são passíveis de reagir a diversos níveis aos produtos químicos com efeitos nesse eixo. O Ensaio a curto prazo da Reprodução em Peixes (Test Guideline 229 da OCDE) inclui a fecundidade e a histopatologia das gónadas (no vairão-de-cabeça-gorda), assim como todos os parâmetros incluídos no presente método. O Test Guideline 229 da OCDE possibilita a despistagem dos produtos químicos que afetam a reprodução através de diversos mecanismos, nomeadamente de cariz endócrino. Há que ter estas diferenças em conta ao selecionar o método mais adequado.
|
|
2.
|
Este método descreve um ensaio de despistagem in vivo que compreende a exposição de grupos mistos de machos sexualmente maduros e fêmeas reprodutoras ao produto químico durante um período limitado (21 dias) do ciclo de vida dos peixes utilizados. Ao terminar o período de 21 dias de exposição, consoante a espécie ensaiada, medem-se nos machos e fêmeas um ou dois parâmetros biomarcadores indicativos de atividade estrogénica, de inibição da aromatase ou androgénica do produto químico em estudo, designadamente a vitelogenina e caracteres sexuais secundários. Mede-se a vitelogenina no vairão-de-cabeça-gorda, no peixe-do-arroz-japonês e no peixe-zebra; medem-se os caracteres sexuais secundários no vairão-de-cabeça-gorda e no peixe-do-arroz-japonês.
|
|
3.
|
Este bioensaio serve de ensaio de despistagem in vivo para determinados modos de ação no sistema endócrino, enquadrando-se a sua aplicação no contexto do Quadro conceptual da OCDE para ensaio e avaliação de produtos químicos desreguladores do sistema endócrino (28).
|
CONSIDERAÇÕES INICIAIS E LIMITAÇÕES
|
4.
|
As fêmeas de vertebrados ovíparos produzem normalmente vitelogenina como reação aos estrogénios endógenos em circulação. Trata-se se um precursor das proteínas do vitelo que, uma vez produzido no fígado, é transportado na corrente sanguínea até aos ovários, onde é absorvido e modificado pelos ovócitos em desenvolvimento. A vitelogenina é quase indetetável no plasma de peixes machos ou fêmeas imaturos, que não têm estrogénios suficientes em circulação. Porém, o fígado é capaz de sintetizar e segregar vitelogenina como reação a uma estimulação estrogénica exógena.
|
|
5.
|
A medição da vitelogenina serve para detetar produtos químicos com vários modos de ação estrogénica. É possível detetar produtos químicos estrogénicos medindo a indução de vitelogenina em peixes machos, método documentado em numerosas publicações científicas pré-avaliadas por especialistas — por exemplo (7). Também se demonstrou a indução de vitelogenina após exposição a androgénios aromatizáveis (8)(9). A diminuição do nível de estrogénios em circulação nas fêmeas, por exemplo através da inibição da aromatase, que converte o androgénio endógeno no estrogénio natural 17β-estradiol, provoca uma diminuição do nível de vitelogenina, efeito que é utilizado para detetar produtos químicos com propriedades inibidoras da aromatase (10)(11). As consequências biológicas de uma inibição estrogénica/da aromatase no nível de vitelogenina são um facto assente e estão amplamente documentadas. Todavia, a produção de vitelogenina nas fêmeas também pode ser afetada por toxicidade generalizada e por modos de ação tóxica não-endócrinos, por exemplo hepatotoxicidade.
|
|
6.
|
Foram desenvolvidos e normalizados com êxito vários métodos de medição para ensaios de rotina. É o caso dos métodos ELISA específicos para uma determinada espécie que recorrem a processos imunoquímicos para quantificar a vitelogenina produzida em pequenas amostras hepáticas ou de sangue colhidas em peixes da espécie em causa (12)(13)(14)(15)(16)(17)(18). Para a medição da vitelogenina, colhem-se amostras de sangue (vairão-de-cabeça-gorda), de sangue ou de homogeneizado da cabeça e da cauda (peixe-zebra) ou do fígado (peixe-do-arroz-japonês). No peixe-do-arroz-japonês existe boa correlação entre a vitelogenina medida no sangue e no fígado (19). Descrevem-se no apêndice 6 os procedimentos recomendados para a colheita de amostras destinadas à análise da vitelogenina. É fácil encontrar kits para medição da vitelogenina, os quais, porém, devem basear-se num método ELISA validado para a espécie em causa.
|
|
7.
|
Em determinadas espécies de peixes, os caracteres sexuais secundários dos machos são visíveis exteriormente, são quantificáveis e reagem aos níveis de androgénios endógenos em circulação. É o caso no vairão-de-cabeça-gorda e no peixe-do-arroz-japonês, mas não no peixe-zebra, que não possui caracteres sexuais secundários quantificáveis. As fêmeas conservam a capacidade de desenvolver caracteres sexuais secundários masculinos quando expostas a produtos químicos androgénicos na água. Estão disponíveis na literatura científica vários estudos que documentam este tipo de resposta no vairão-de-cabeça-gorda (20) e no peixe-do-arroz-japonês (21). Por razões de baixa representatividade estatística, um decréscimo dos caracteres sexuais secundários nos machos deve ser interpretado com precaução, com base na apreciação de especialistas na matéria e na ponderação da suficiência da prova. A utilização do peixe-zebra neste ensaio tem as suas limitações, por não existirem caracteres sexuais secundários quantificáveis que reagem a produtos químicos com atividade androgénica.
|
|
8.
|
No vairão-de-cabeça-gorda, o principal indicador de exposição a androgénios exógenos é o número de tubérculos nupciais existentes no focinho das fêmeas. No peixe-do-arroz-japonês, é o número de processos papilares que constitui o principal marcador da exposição exógena de fêmeas a produtos químicos androgénicos. Descrevem-se nos apêndices 5A e 5B os procedimentos recomendados para avaliar caracteres sexuais no vairão-de-cabeça-gorda e no peixe-do-arroz-japonês.
|
|
9.
|
No apêndice 1 definem-se alguns conceitos utilizados neste método.
|
PRINCÍPIO DO MÉTODO
|
10.
|
Expõem-se conjuntamente nas cubas de ensaio peixes machos e fêmeas em estádio reprodutor. Tratando-se de animais adultos reprodutores, é possível distinguir claramente um sexo do outro, o que possibilita uma análise em função do sexo de cada parâmetro, e garante-se a sensibilidade dos animais aos produtos químicos exógenos. No final do ensaio, confirma-se o sexo por exame macroscópico das gónadas, após incisão abdominal com uma tesoura. O apêndice 2 recapitula as condições experimentais relevantes do bioensaio. Normalmente inicia-se o ensaio com uma amostra de peixes de uma população de animais capazes de procriar. Não se utilizam peixes senescentes. O ponto que aborda adiante a seleção dos peixes dá indicações sobre a idade dos peixes e o estado reprodutivo dos mesmos. Realiza-se o ensaio com três concentrações de exposição ao produto químico em estudo, uma cuba de controlo da água e, se necessário, uma cuba de controlo do solvente. No caso do peixe-do-arroz-japonês e do peixe-zebra, utilizam-se duas cubas (replicados) por concentração de exposição (contendo cada cuba cinco machos e cinco fêmeas); no caso do vairão-de-cabeça-gorda, utilizam-se quatro cubas (replicados) por concentração de exposição (contendo cada cuba dois machos e quatro fêmeas). Tem-se, assim, em conta o comportamento territorial do vairão-de-cabeça-gorda macho, garantindo concomitantemente suficiente representatividade estatística do ensaio. A exposição prolonga-se por 21 dias, procedendo-se à colheita das amostras dos peixes ao vigésimo primeiro dia.
|
|
11.
|
Todos os peixes são eutanasiados no vigésimo primeiro dia. Medem-se os caracteres sexuais secundários no vairão-de-cabeça-gorda e no peixe-do-arroz-japonês (ver os apêndices 5A e 5B). No caso do peixe-zebra e do vairão-de-cabeça-gorda, colhem-se amostras de sangue para determinação da vitelogenina; no caso do peixe-zebra, podem colher-se, em alternativa, amostras da cabeça e da cauda, para determinação da vitelogenina no correspondente homogeneizado (apêndice 6). No caso do peixe-do-arroz-japonês, colhem-se amostras do fígado para a análise da vitelogenina (apêndice 6).
|
CRITÉRIOS DE ACEITAÇÃO DO ENSAIO
|
12.
|
Para que os resultados do ensaio possam considerar-se aceitáveis, têm de ser cumpridas as seguintes condições:
|
—
|
mortalidade verificada nas cubas de controlo (água ou solvente), no final da exposição, não superior a 10 %;
|
|
—
|
concentração de oxigénio dissolvido ao longo do período de exposição igual ou superior a 60 % do valor da saturação com ar (VSA);
|
|
—
|
diferença de temperatura da água entre as diversas cubas de ensaio não superior a ±1,5 °C em qualquer momento do período de exposição, não se afastando a temperatura da água de cada cuba mais de 2 °C da temperatura especificada para a espécie utilizada no ensaio (apêndice 2);
|
|
—
|
existência de dados demonstrativos de que a concentração em solução do produto químico em estudo se manteve satisfatoriamente num intervalo de ±20 % relativamente à média dos valores medidos.
|
|
DESCRIÇÃO DO MÉTODO
Material e aparelhagem
|
13.
|
Equipamento normal de laboratório, designadamente o seguinte:
|
a)
|
Medidores de oxigénio e de pH;
|
|
b)
|
Equipamento para determinação da alcalinidade e da dureza da água;
|
|
c)
|
Aparelhagem apropriada para controlo da temperatura, de preferência com monitorização contínua;
|
|
d)
|
Cubas de um material quimicamente inerte e de capacidade adequada à carga e à densidade de ocupação recomendadas (ver o apêndice 2);
|
|
e)
|
Substrato de desova para o vairão-de-cabeça-gorda e o peixe-zebra (ver os pormenores necessários no apêndice 4);
|
|
f)
|
Balança de precisão apropriada (isto é, com uma aproximação de ±0,5 mg).
|
|
Água
|
14.
|
Pode ser utilizada no ensaio qualquer água na qual a espécie em estudo apresente taxas adequadas de crescimento e de sobrevivência a longo prazo. A qualidade da água deve manter-se constante durante o ensaio. O pH da água deve situar-se entre 6,5 e 8,5, mas, durante um ensaio, não deve sofrer variações superiores a ±0,5 unidades de pH. Para assegurar que a água de diluição não influencia indevidamente os resultados do ensaio (por exemplo, por complexação do produto químico em estudo), devem ser colhidas regularmente amostras para análise. Deve determinar-se o teor de metais pesados (Cu, Pb, Zn, Hg, Cd, Ni etc.), dos principais aniões e catiões (Ca2+, Mg2+, Na+, K+, Cl-, SO4
2– etc.), de pesticidas (pesticidas organofosforados totais, pesticidas organoclorados totais etc.), de carbono orgânico total e de sólidos em suspensão. Se a qualidade da água de diluição se mantiver relativamente constante, estas medições podem realizar-se, por exemplo, de três em três meses. Caso se demonstre que a qualidade da água se mantém inalterada durante, pelo menos, um ano, estas determinações podem ser menos frequentes (de seis em seis meses, por exemplo). No apêndice 3 apresentam-se algumas características químicas de uma água de diluição aceitável.
|
Soluções utilizadas no ensaio
|
15.
|
Preparam-se as soluções a utilizar no ensaio por diluição de uma solução de reserva. Preferencialmente, prepara-se a solução de reserva por simples mistura ou agitação do produto químico em estudo na água de diluição, utilizando meios mecânicos (agitação ou dispersão ultrassónica, por exemplo). Podem ser utilizadas colunas de saturação (colunas de solubilidade) para obter soluções de reserva de concentração adequada. Não se recomenda a utilização de solventes, mas, se for necessário um solvente, há que realizar em paralelo um ensaio deste, com a mesma concentração de solvente que nos casos da exposição ao produto químico em estudo. No caso dos produtos químicos difíceis de ensaiar, tecnicamente a melhor solução poderá ser o recurso a um solvente, devendo consultar-se o documento de orientações da OCDE sobre ensaios de toxicidade em meio aquático de substâncias e misturas difíceis (22). A escolha do solvente a utilizar depende das propriedades químicas do produto químico em causa. O documento de orientações da OCDE recomenda que não seja ultrapassada a concentração de 100 μl/l, o que deve ser respeitado. Importa, porém, referir que um estudo recente (23) veio acentuar as dúvidas acerca da utilização de solventes em ensaios de atividade endócrina. Por conseguinte, recomenda-se que se minimize, tanto quanto tecnicamente possível, a concentração do solvente que eventualmente seja necessário utilizar (a qual depende das propriedades físico-químicas do produto químico em estudo).
|
|
16.
|
Os ensaios devem decorrer em fluxo contínuo. Neste sistema, tendo em vista a manutenção da série pretendida de concentrações nas cubas utilizadas no ensaio, é fornecida e diluída continuamente (por exemplo por meio de uma bomba doseadora, de um diluidor proporcional ou de um sistema saturador) uma solução de reserva do produto químico em estudo. Os caudais da solução de reserva e da água de diluição devem ser verificados regularmente durante o ensaio, de preferência diariamente, e não devem variar mais de 10 % ao longo do ensaio. Não deve utilizar-se tubagem de plástico de baixa qualidade ou outros materiais que possam conter produtos químicos biologicamente ativos. Ao selecionar o material para o sistema de fluxo contínuo, há que ter em conta a possibilidade de adsorção do produto químico em estudo ao material utilizado.
|
Aclimatação dos peixes
|
17.
|
Selecionam-se os peixes a utilizar no ensaio a partir de uma população do laboratório (de preferência proveniente do mesmo lote) que tenha sido mantida durante, pelo menos, as duas semanas anteriores ao ensaio em condições de qualidade da água e de iluminação idênticas às que nele serão utilizadas. É importante que a taxa de carga e a densidade de ocupação (ver definições no apêndice 1) se adequem à espécie utilizada no ensaio (ver o apêndice 2).
|
|
18.
|
Após um período de aclimatação de 48 horas, regista-se a mortalidade e aplicam-se os seguintes critérios:
|
—
|
mortalidade superior a 10 % da população num período de sete dias: rejeição da totalidade do lote;
|
|
—
|
mortalidade de 5 % a 10 % da população: aclimatação durante um período adicional de sete dias: caso se verifique mortalidade superior a 5 % durante este segundo período de sete dias, rejeita-se a totalidade do lote;
|
|
—
|
mortalidade inferior a 5 % da população num período de sete dias: aceitação do lote.
|
|
|
19.
|
Durante o período de aclimatação, o período de pré-exposição e o período de exposição não é ministrado aos peixes nenhum tratamento contra doenças.
|
Pré-exposição e seleção dos peixes
|
20.
|
Recomenda-se um período de pré-exposição de uma semana, durante o qual os peixes são mantidos em cubas semelhantes às que serão utilizadas no ensaio. Durante o período de aclimatação e na fase de exposição, os peixes devem ser alimentados ad libitum. Inicia-se a fase de exposição utilizando peixes adultos com dimorfismo sexual provenientes de uma população do laboratório de peixes sexualmente maduros (que apresentem, por exemplo caracteres sexuais secundários claramente visíveis, no caso do vairão-de-cabeça-gorda e do peixe-do-arroz-japonês) e efetivamente em procriação. Como orientação geral unicamente (que não deve ser seguida sem ser complementada pela observação do estado reprodutivo real do lote de peixes em causa), os vairões-de-cabeça-gorda devem ter cerca de 20 (±2) semanas de idade, admitindo que foram mantidos a 25±2 °C durante todo o seu tempo de vida; os peixes-do-arroz-japoneses devem ter cerca de 16 (±2) semanas de idade, admitindo que foram mantidos a 25±2 °C durante todo o seu tempo de vida; os peixes-zebra devem ter cerca de 16 (±2) semanas de idade, admitindo que foram mantidos a 26±2 °C durante todo o seu tempo de vida.
|
PLANEAMENTO DO ENSAIO
|
21.
|
Utilizam-se três concentrações do produto químico em estudo, uma cuba de controlo da água e, se necessário, uma cuba de controlo do solvente. É necessário analisar os dados para determinar eventuais diferenças com significância estatística entre as reações verificadas nas cubas expostas ao produto químico em estudo e na(s) cuba(s) de controlo. Mais do que servirem para a avaliação dos riscos, essas análises são úteis para determinar se é necessário pesquisar efeitos indesejados (ao nível da sobrevivência, do desenvolvimento, do crescimento e da reprodução) do produto químico em estudo através de ensaios mais longos (24).
|
|
22.
|
No caso do peixe-zebra e do peixe-do-arroz-japonês, recolhem-se amostras no 21.o dia do ensaio dos machos e fêmeas expostos a cada nível de concentração (5 machos e 5 fêmeas de cada duplicado) e da(s) cuba(s) de controlo, para determinação da vitelogenina e, se for caso disso, dos caracteres sexuais secundários. No caso do vairão-de-cabeça-gorda, recolhem-se amostras no 21.o dia de exposição dos machos e fêmeas expostos a cada nível de concentração (2 machos e 4 fêmeas de cada quadruplicado) e da(s) cuba(s) de controlo, para determinação da vitelogenina e dos caracteres sexuais secundários.
|
Escolha das concentrações a utilizar no ensaio
|
23.
|
A concentração mais elevada a utilizar neste ensaio é a mais baixa das seguintes concentrações: concentração máxima tolerada (CMT), obtida num ensaio preliminar de determinação da gama de concentrações a utilizar ou a partir de outros dados de toxicidade; 10 mg/l; solubilidade máxima em água. Define-se a concentração máxima tolerada como a concentração mais elevada do produto químico em estudo que, quando ensaiada, gera menos de 10 % de mortalidade. Esta abordagem pressupõe a existência de dados empíricos de toxicidade aguda ou outros dados de toxicidade a partir dos quais se pode estimar a concentração máxima tolerada. A estimativa da concentração máxima tolerada pode ser inexata e, normalmente, requer uma certa capacidade de apreciação na matéria.
|
|
24.
|
Utilizam-se no ensaio três concentrações do produto químico em estudo, intervaladas por um fator constante não superior a 10, uma cuba de controlo da água de diluição e, se necessário, uma cuba de controlo do solvente. Recomenda-se que o fator que define o intervalo entre concentrações se situe entre 3,2 e 10.
|
PROCEDIMENTO DE ENSAIO
Seleção e pesagem dos peixes a utilizar no ensaio
|
25.
|
É importante minimizar a variabilidade dos pesos dos peixes no início do ensaio. Indicam-se no apêndice 2 as gamas de pesos adequadas recomendadas para as várias espécies neste ensaio. Se possível, no início do ensaio, o peso de cada peixe macho e de cada peixe fêmea que constituem os peixes utilizados no ensaio não deve afastar-se mais de 20 % da média aritmética dos pesos do sexo correspondente. A fim de estimar o peso médio, recomenda-se a pesagem de uma subamostra do lote de peixes antes de iniciar o ensaio.
|
Condições de exposição
Duração
|
26.
|
O ensaio prolonga-se por 21 dias, após um período de pré-exposição. Recomenda-se que este último tenha a duração de uma semana.
|
Alimentação
|
27.
|
Fornece-se aos peixes, ad libitum, uma alimentação adequada (apêndice 2), em quantidade e com frequência suficientes para os manter em boas condições físicas. Devem ser tomadas as precauções necessárias para evitar a proliferação de microrganismos e a turvação da água. Como indicação geral, a ração diária, em vez de ser fornecida de uma só vez, pode ser dividida em duas ou três doses iguais, a serem fornecidas com, pelo menos, três horas de intervalo. É aceitável uma dose única maior, nomeadamente nos fins de semana. Não se fornecem alimentos aos peixes nas doze horas que antecedem a colheita de amostras/a necropsia.
|
|
28.
|
É necessário verificar se, nos alimentos fornecidos aos peixes, estão presentes contaminantes como pesticidas organoclorados, hidrocarbonetos aromáticos policíclicos e bifenilos policlorados. Importa não utilizar alimentos com teor elevado de fitoestrogénios, que comprometeriam a reação obtida no ensaio a um agonista de estrogénios conhecido (por exemplo, o 17beta-estradiol).
|
|
29.
|
Removem-se os alimentos não ingeridos e as matérias fecais das cubas de ensaio pelo menos duas vezes por semana, por exemplo limpando cuidadosamente o fundo de cada cuba com um sifão.
|
Luz e temperatura
|
30.
|
O fotoperíodo e a temperatura da água devem ser adequados à espécie utilizada no ensaio (ver o apêndice 2).
|
Frequência das medições e das determinações analíticas
|
31.
|
Antes de iniciar o período de exposição, é necessário verificar se o sistema de distribuição do produto químico está a funcionar bem. Todos os métodos analíticos necessários devem estar bem estabelecidos, incluindo um conhecimento suficiente da estabilidade do produto químico estudo no sistema de ensaio. Durante o ensaio, determinam-se as concentrações do produto químico em estudo a intervalos regulares, do seguinte modo: de preferência diariamente, mas, pelo menos, duas vezes por semana, verificam-se os caudais do diluente e da solução de reserva do produto químico tóxico, os quais não devem variar mais de 10 % ao longo do ensaio. Recomenda-se a medição das concentrações reais do produto químico em estudo, em todas as cubas, no início do ensaio e, em seguida, semanalmente.
|
|
32.
|
Recomenda-se que os resultados se baseiem em concentrações medidas. Todavia, se, durante todo o ensaio, as concentrações em solução do produto químico em estudo não se tiverem desviado mais de 20 % das concentrações nominais, os resultados podem basear-se nos valores nominais ou nos valores medidos.
|
|
33.
|
As amostras podem precisar de ser centrifugadas ou filtradas (utilizando filtros com porosidade de 0,45 μm, por exemplo). Se for necessária uma destas operações, recomenda-se a centrifugação. No entanto, se o produto químico em estudo não se adsorver ao filtro, também é aceitável a filtração.
|
|
34.
|
Durante o ensaio, mede-se, pelo menos, uma vez por semana o oxigénio dissolvido, a temperatura e o pH de cada cuba. Pelo menos uma vez por semana, medem-se a alcalinidade e a dureza total na(s) cuba(s) de controlo e numa das cubas com a concentração mais elevada. De preferência, monitoriza-se a temperatura continuamente em, pelo menos, um recipiente de ensaio.
|
Exames
|
35.
|
Avaliam-se uma série de reações biológicas genéricas (por exemplo a sobrevivência) e específicas (por exemplo os níveis de vitelogenina) durante o ensaio e no termo do mesmo. Descreve-se a seguir o modo de medição e de avaliação desses parâmetros e a utilidade dos mesmos.
|
Sobrevivência
|
36.
|
Examinam-se diariamente os peixes ao longo do ensaio, registam-se os casos de mortalidade e retiram-se os peixes mortos o mais rapidamente possível. Os peixes mortos em qualquer das cubas não são substituídos. Determina-se o sexo dos peixes que morrerem durante o ensaio, por observação macroscópica das gónadas.
|
Comportamento e aspeto
|
37.
|
Registam-se todos os comportamentos anormais (relativamente aos peixes de controlo), nomeadamente sinais de toxicidade generalizada como hiperventilação, natação descoordenada, perda de equilíbrio e alimentação ou inatividade atípicas. Registam-se igualmente as anomalias externas (tais como hemorragias e descoloração). Estes sinais de toxicidade devem ser cuidadosamente tidos em conta na interpretação dos dados, pois podem indiciar concentrações às quais os biomarcadores de atividade endócrina não são fiáveis. Estes exames comportamentais também podem fornecer informações qualitativas úteis que permitam justificar futuramente determinadas exigências nos ensaios com peixes. Por exemplo, observou-se agressividade territorial em machos normais ou fêmeas masculinizadas de vairões-de-cabeça-gorda expostos a androgénios; em peixes-zebra expostos a estrogénios ou a antiandrogénios, verificou-se uma redução ou perturbação do comportamento de acasalamento e de desova característico após a alvorada.
|
|
38.
|
Dado que a manipulação dos peixes pode modificar rapidamente determinadas características do aspeto dos mesmos (nomeadamente a cor), é importante que os exames qualitativos sejam realizados antes de retirar os animais do sistema de ensaio. A experiência recolhida até à data com vairões-de-cabeça-gorda aponta para que alguns produtos químicos com atividade endócrina podem começar por induzir alterações das seguintes características externas: cor do corpo (clara ou escura), padrões de coloração (ocorrência de bandas verticais) e forma do corpo (cabeça e região peitoral). Por conseguinte, o aspeto físico dos peixes deve ser examinado ao longo do ensaio e no termo do estudo.
|
Eutanásia dos peixes
|
39.
|
No 21.o dia, ou seja, no final da exposição, eutanasiam-se os peixes com quantidades adequadas de tricaína — solução 100-500 mg/l de metanossulfonato de tricaína (metacaína, MS-222, CAS 886-86-2), tamponada com solução 300 mg/l de NaHCO3 (bicarbonato de sódio, CAS 144-55-8) –, para reduzir a irritação das mucosas. Em seguida, colhem-se amostras de sangue ou de tecidos para determinação da vitelogenina, como se explica no item correspondente.
|
Exame de caracteres sexuais secundários
|
40.
|
Alguns produtos químicos com atividade endócrina podem induzir alterações em caracteres sexuais secundários especializados (número de tubérculos nupciais no vairão-de-cabeça-gorda, processos papilares no peixe-do-arroz-japonês macho). Determinados produtos químicos com determinados modos de ação podem, nomeadamente, ser responsáveis pela ocorrência anormal de caracteres sexuais secundários em animais do sexo oposto. Por exemplo, agonistas dos recetores de androgénios, como a trembolona, a metiltestosterona e a di-hidro-testosterona, podem provocar o aparecimento de tubérculos nupciais pronunciados no vairão-de-cabeça-gorda fêmea ou de processos papilares no peixe-do-arroz-japonês fêmea (11)(20)(21). Também há registo de que os agonistas dos recetores de estrogénios podem reduzir o número de tubérculos nupciais e o volume da massa adiposa dorsal situada na base da cabeça dos machos adultos (25)(26). Estes exames morfológicos macroscópicos podem fornecer informações qualitativas e quantitativas úteis que permitam justificar futuramente determinadas exigências nos ensaios com peixes. O número e a dimensão dos tubérculos nupciais no vairão-de-cabeça-gorda e dos processos papilares no peixe-do-arroz-japonês podem ser imediatamente quantificados ou — o que é mais prático — sê-lo em espécimes conservados. Nos apêndices 5A e 5B recomendam-se procedimentos para a avaliação dos caracteres sexuais secundários respetivamente do vairão-de-cabeça-gorda e do peixe-do-arroz-japonês.
|
Vitelogenina (VTG)
|
41.
|
Colhe-se uma amostra de sangue na artéria/veia caudal com um microtubo capilar heparinizado para determinação do hematócrito ou, em alternativa, por punção cardíaca com uma seringa. O volume de sangue colhido depende do tamanho do peixe e geralmente situa-se entre 5 μl e 60 μl por peixe no caso do vairão-de-cabeça-gorda e entre 5 μl e 15 μl por peixe no caso do peixe-do-arroz-japonês. Separa-se o plasma do resto do sangue por centrifugação e armazena-se a – 80 °C com inibidores das proteases, até à determinação analítica da vitelogenina. Em alternativa, como fonte de tecidos para determinação da vitelogenina, pode utilizar-se o fígado no caso do peixe-do-arroz-japonês e homogeneizado da cabeça e da cauda no caso do peixe-zebra (apêndice 6). A determinação da vitelogenina é efetuada por um método ELISA homólogo validado, utilizando anticorpos homólogos e um padrão homólogo de vitelogenina. Recomenda-se o recurso a um método que permita detetar níveis de vitelogenina da ordem de alguns nanogramas por mililitro de plasma (ou nanogramas por miligrama de tecido), correspondentes ao nível de fundo dos peixes machos não-expostos.
|
|
42.
|
O controlo de qualidade da análise da vitelogenina assenta na utilização de padrões, brancos e, pelo menos, duplicados. É necessário realizar um ensaio do efeito da matriz (efeito da diluição da amostra) em cada método ELISA, a fim de determinar o fator de diluição mínimo das amostras. Cada placa utilizada num método ELISA para determinação da vitelogenina deve incluir as seguintes amostras de controlo da qualidade: pelo menos 6 padrões de calibração que cubram o intervalo das concentrações previstas de vitelogenina e, pelo menos, um branco de ligações inespecíficas (analisado em duplicado). A absorvância destes brancos deve ser inferior a 5 % da absorvância máxima dos padrões de calibração. Analisam-se, pelo menos, duas alíquotas (alvéolos duplicados) de cada diluição da amostra. Reanalisam-se os alvéolos duplicados cujos resultados difiram mais de 20 %.
|
|
43.
|
O coeficiente de correlação (R2) das curvas de calibração deve ser superior a 0,99. Todavia, uma correlação elevada não é, por si só, garantia suficiente de capacidade de previsão adequada da concentração em toda a gama de concentrações. Além da correlação suficientemente elevada da curva de calibração, é necessário que a concentração de cada padrão, calculada a partir da curva de calibração, se situe entre 70 % e 120 % da concentração nominal correspondente. Se as concentrações nominais evidenciarem uma tendência de afastamento da reta de regressão de calibração (por exemplo a baixas concentrações), pode ser necessário dividir a curva de calibração numa gama alta e numa gama baixa ou recorrer a um modelo não linear que se ajuste adequadamente aos dados de absorvância. Se a curva for dividida, é necessário que, em ambos os segmentos de reta, R2 > 0,99.
|
|
44.
|
Define-se “limite de deteção” como a concentração do padrão analítico de concentração mais baixa e “limite de quantificação” como a concentração do padrão analítico de concentração mais baixa, multiplicada pelo fator de diluição mais baixo.
|
|
45.
|
Em cada dia em que se realizem determinações da vitelogenina, analisa-se uma amostra enriquecida com um padrão de referência interno (apêndice 7). Juntamente com os resultados de cada série de ensaios realizados no dia, indica-se no relatório a relação entre a concentração esperada e a concentração medida.
|
DADOS E RELATÓRIOS
Avaliação das reações dos biomarcadores por análise da variância (ANOVA)
|
46.
|
A fim de identificar a atividade endócrina potencial do produto químico em estudo, comparam-se as reações obtidas para os grupos expostos e para os grupos de controlo por meio de uma análise de variância (ANOVA). Caso se utilize uma cuba de controlo do solvente, é necessário efetuar, para cada parâmetro, um teste estatístico adequado de comparação entre a cuba de controlo da água de diluição e a cuba de controlo do solvente. A referência (27) [OCDE (2006c)] fornece orientações sobre o tratamento de análise estatística a dar aos dados relativos à cuba de controlo da água de diluição e à cuba de controlo do solvente. Os dados relativos às reações biológicas analisam-se e apresentam-se no relatório separadamente por sexo. Se as exigências dos métodos paramétricos não forem satisfeitas — distribuição não-normal (teste de Shapiro-Wilk, por exemplo) ou variância heterogénea (teste de Bartlett ou teste de Levene) –, deve equacionar-se a possibilidade de proceder a uma transformação dos dados, para homogeneizar as variâncias antes da análise de variância, ou de optar por uma análise de variância ponderada. Se a relação entre a dose fornecida e a reação obtida não for monótona, pode aplicar-se o teste (paramétrico) de Dunnett a múltiplas comparações par a par ou recorrer-se ao teste (não-paramétrico) de Mann-Whitney com ajustamento de Bonferroni. Se a relação entre a dose fornecida e a reação obtida for aproximadamente monótona, pode recorrer-se a outros testes, por exemplo o teste de Jonckheere-Terpstra ou o teste de Williams. O fluxograma do apêndice 8 visa facilitar a escolha do teste estatístico mais adequado. O documento da OCDE sobre as abordagens atuais na análise estatística de dados de ecotoxicidade (27) contém informações complementares.
|
Relatório dos resultados do ensaio
|
47.
|
Dados do estudo a fornecer:
|
|
Instalações nas quais se realizaram os ensaios
|
—
|
pessoal responsável e responsabilidades de cada um no estudo;
|
|
—
|
competência técnica do laboratório, previamente demonstrada para uma gama de produtos químicos representativos.
|
|
|
|
Produto químico em estudo
|
—
|
caracterização do produto químico;
|
|
—
|
estado físico e propriedades físico-químicas pertinentes;
|
|
—
|
método e frequência de preparação das concentrações utilizadas no ensaio;
|
|
—
|
informações sobre estabilidade e biodegradabilidade.
|
|
|
|
Solvente
|
—
|
caracterização do solvente (natureza, concentração utilizada);
|
|
—
|
justificação da escolha do solvente (se não for água).
|
|
|
|
Animais utilizados no ensaio
|
—
|
fornecedor e instalações específicas do fornecedor;
|
|
—
|
idade dos peixes no início do ensaio e estado reprodutivo/de procriação dos peixes;
|
|
—
|
elementos relativos ao processo de aclimatação dos peixes;
|
|
—
|
peso corporal dos peixes no início da exposição (determinado a partir de uma subamostra do lote de peixes).
|
|
|
|
Condições de realização do ensaio
|
—
|
protocolo experimental utilizado (tipo de ensaio, taxa de carga, densidade de ocupação etc.);
|
|
—
|
método de preparação das soluções de reserva e caudal;
|
|
—
|
concentrações de ensaio nominais, concentrações medidas semanalmente das soluções utilizadas no ensaio e métodos analíticos utilizados para isso, médias dos valores medidos nas cubas e desvios-padrão correspondentes e elementos comprovativos de que as medições dizem respeito às concentrações reais em solução do produto químico em estudo;
|
|
—
|
características da água de diluição (pH, dureza, alcalinidade, temperatura, concentração de oxigénio dissolvido, níveis de cloro residuais, carbono orgânico total, sólidos em suspensão e outras medições efetuadas);
|
|
—
|
qualidade da água nas cubas de ensaio: pH, dureza, temperatura e concentração de oxigénio dissolvido;
|
|
—
|
informações pormenorizadas sobre a alimentação dos peixes — por exemplo, tipo(s) de alimento, proveniência do(s) mesmo(s), quantidade e frequência do fornecimento de alimento e resultados das análises de contaminantes relevantes (por exemplo, bifenilos policlorados, hidrocarbonetos aromáticos policíclicos e pesticidas organoclorados), se disponíveis.
|
|
|
|
Resultados
|
—
|
elementos comprovativos de que as cubas de controlo respeitaram os critérios de aceitação do ensaio;
|
|
—
|
dados relativos à mortalidade ocorrida para cada concentração ensaiada e nas cubas de controlo;
|
|
—
|
técnicas de análise estatística utilizadas, tratamento dos dados e justificação das técnicas utilizadas;
|
|
—
|
dados relativos ao exame biológico da morfologia macroscópica, incluindo os caracteres sexuais secundários, e à vitelogenina;
|
|
—
|
resultados das análises dos dados, de preferência reunidos em quadros e sob a forma de gráficos;
|
|
—
|
incidência de quaisquer reações inabituais manifestadas pelos peixes e de quaisquer efeitos visíveis do produto químico em estudo.
|
|
|
ORIENTAÇÕES PARA INTERPRETAÇÃO E ACEITAÇÃO DOS RESULTADOS DO ENSAIO
|
48.
|
Nesta secção reflete-se sobre a interpretação dos resultados obtidos no ensaio para os diversos parâmetros medidos. Se o produto químico em estudo parecer ter efeitos tóxicos manifestos ou influenciar o estado geral dos animais ensaiados, os resultados obtidos devem ser interpretados com precaução.
|
|
49.
|
Ao escolher a gama de concentrações a utilizar num ensaio, não deve exceder-se a concentração máxima tolerada, a fim de possibilitar uma interpretação com significado dos dados. É importante que, pelo menos, uma das concentrações de exposição não gere sinais de efeitos tóxicos. Os sintomas de doenças e os sinais de efeitos tóxicos devem ser cuidadosamente avaliados e descritos no relatório. Por exemplo, a produção de vitelogenina nas fêmeas também pode ser influenciada por toxicidade generalizada e por modos de ação tóxica não-endócrinos, caso da hepatotoxicidade. Porém, a interpretação dos efeitos pode ser facilitada por outros níveis de exposição, cujos efeitos não sejam perturbados por toxicidade sistémica.
|
|
50.
|
Há vários aspetos a ponderar na aceitação dos resultados de um ensaio. Como orientação, os níveis de vitelogenina de machos e fêmeas nos grupos de controlo devem diferir entre si, pelo menos, de três ordens de grandeza, no caso do vairão-de-cabeça-gorda e do peixe-zebra, e cerca de uma ordem de grandeza, no caso do peixe-do-arroz-japonês. Os relatórios de validação (1)(2)(3)(4) apresentam exemplos de valores determinados em grupos de controlo e grupos expostos. Se os machos de controlo apresentarem valores de vitelogenina elevados, podem ficar comprometidas a sensibilidade do ensaio e a capacidade de deteção de agonistas fracos de estrogénios. Se as fêmeas de controlo apresentarem valores de vitelogenina baixos, podem ficar comprometidas a sensibilidade do ensaio e a capacidade de deteção de inibidores da aromatase e de antagonistas de estrogénios. Estas orientações baseiam-se nos estudos de validação.
|
|
51.
|
Se o laboratório nunca tiver realizado este ensaio ou se tiverem sido efetuadas alterações substanciais (mudança do fornecedor ou da estirpe dos peixes, por exemplo), é aconselhável realizar um estudo de competência técnica. Nesse caso, recomenda-se que o estudo abranja produtos químicos que cubram diversos modos de ação ou efeitos em vários dos parâmetros avaliados no ensaio. Na prática, incentiva-se cada laboratório a constituir um registo de dados históricos de controlo de machos e fêmeas e a realizar um ensaio de controlo positivo de um produto químico com atividade estrogénica (por exemplo 17β-estradiol a 100 ng/l ou um agonista fraco conhecido) que aumente o nível de vitelogenina nos peixes machos, um ensaio de controlo positivo da inibição da aromatase (por exemplo fadrozole ou procloraz a 300 μg/l) que diminua a vitelogenina nos peixes fêmeas e um ensaio de controlo positivo de um produto químico com atividade androgénica (por exemplo 17β-trembolona a 5 μg/l) que induza caracteres sexuais secundários no vairão-de-cabeça-gorda e no peixe-do-arroz-japonês fêmeas. Para ajuizar da competência do laboratório, comparam-se os dados assim obtidos com os dados provenientes dos estudos de validação (1)(2)(3).
|
|
52.
|
Em geral, na ausência de sinais de toxicidade generalizada, considera-se positivo um resultado obtido em medições de vitelogenina caso se verifique um aumento com significância estatística da vitelogenina nos machos (p<0,05) ou uma diminuição com significância estatística da vitelogenina nas fêmeas (p<0,05), pelo menos para a maior dose ensaiada, comparativamente ao grupo de controlo. Corrobora ainda um resultado positivo a demonstração de uma relação biologicamente plausível entre a dose e a curva de resposta às doses. Como já se referiu, a diminuição do nível de vitelogenina pode não ser de origem totalmente endócrina. Porém, um resultado positivo deve, geralmente, ser interpretado como prova de atividade endócrina in vivo e, normalmente, deve dar lugar a uma pesquisa mais aprofundada.
|
REFERÊNCIAS
|
1)
|
OCDE (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications. Series on Testing and Assessment, No. 60, ENV/JM/MONO(2006)27.
|
|
2)
|
OCDE (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1 B). OECD Environmental Health and Safety Publications. Series on Testing and Assessment, No. 61, ENV/JM/MONO(2006)29.
|
|
3)
|
OCDE (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications. Series on Testing and Assessment, No. 78, ENV/JM/MONO(2007)25.
|
|
4)
|
Owens, J.W. (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine (http://www.cefic-lri.org/index.php?page=projects — acesso em 18/9/2008).
|
|
5)
|
US EPA (2007). Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Relatório não publicado, datado de 15 de dezembro de 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
|
|
6)
|
OCDE 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications. Series on Testing and Assessment, No. 94, ENV/JM/MONO(2008)21.
|
|
7)
|
Sumpter, Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives, 103 Suppl. 7:173-8 Review.
|
|
8)
|
Pawlowski, S., Sauer, A., Shears, J.A., Tyler, C.R., Braunbeck, T. (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology, 68(3):277-91.
|
|
9)
|
Andersen, L., Goto-Kazato, R., Trant, J.M., Nash, J.P., Korsgaard, B., Bjerregaard, P. (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology, 76(3-4):343-52.
|
|
10)
|
Ankley, G.T., Kahl, M.D., Jensen, K.M., Hornung, M.W., Korte, J.J., Makynen, E.A., Leino, R.L. (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences, 67(1):121-30.
|
|
11)
|
Panter, G.H., Hutchinson, T.H., Hurd, K.S., Sherren, A., Stanley, R.D., Tyler, C.R. (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology, 70(1):11-21.
|
|
12)
|
Parks, L.G., Cheek, A.O., Denslow, N.D., Heppell, S.A., McLachlan, J.A., LeBlanc, G.A., Sullivan, C.V. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C: Pharmacology, toxicology and endocrinology, 123(2):113-25.
|
|
13)
|
Panter, G.H., Tyler, C.R., Maddix, S., Campbell, P.M., Hutchinson, T.H., Länge, R., Lye, C., Sumpter, J.P. (1999). Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Bruxelas, Bélgica.
|
|
14)
|
Fenske, M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H. (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton-Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys., C 129 (3):217-232.
|
|
15)
|
Holbech, H., Andersen, L., Petersen, G.I., Korsgaard, B., Pedersen, K.L., Bjerregaard, P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C: Pharmacology, toxicology and endocrinology, 130:119-131.
|
|
16)
|
Rose, J., Holbech, H., Lindholst, C., Noerum, U., Povlsen, A., Korsgaard, B., Bjerregaard, P. (2002). Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol., C, 131:531-539.
|
|
17)
|
Brion, F., Nilsen, B.M., Eidem, J.K., Goksoyr, A., Porcher, J.M. Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry, vol. 21:1699-1708.
|
|
18)
|
Yokota, H., Morita, H., Nakano, N., Kang, I.J., Tadokoro, H., Oshima, Y., Honjo, T., Kobayashi, K. (2001). Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn. J. Environ. Toxicol., 4:87–98.
|
|
19)
|
Tatarazako, N., Koshio, M., Hori, H., Morita, M., Iguchi, T. (2004). Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science, 50:301-308.
|
|
20)
|
Ankley, G.T., Jensen, K.M., Makynen, E.A., Kahl, M.D., Korte, J.J., Homung, M.W., Henry, T.R., Denny, J.S., Leino, R.L., Wilson, V.S., Cardon, M.C., Hartig, P.C., Gray, L.E. (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry, 22(6):1350-60.
|
|
21)
|
Seki, M., Yokota, H., Matsubara, H., Maeda, M., Tadokoro, H., Kobayashi, K. (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry, 23(3):774-81.
|
|
22)
|
OCDE 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 23. Paris.
|
|
23)
|
Hutchinson, T.H., Shillabeer, N., Winter, M.J., Pickford, D.B. (2006a). Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp. 69-92.
|
|
24)
|
Hutchinson, T.H., Ankley, G.T., Segner, H., Tyler, C.R. (2006b). Screening and testing for endocrine disruption in fish-biomarkers as “signposts”, not “traffic lights”, in risk assessment. Environmental Health Perspectives, 114 Suppl. 1:106-14.
|
|
25)
|
Miles-Richardson, S.R., Kramer, V.J., Fitzgerald, S.D., Render, J.A., Yamini, B., Barbee, S.J., Giesy, J.P. (1999). Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol., 47, 129-145.
|
|
26)
|
Martinovic, D., Blake, L.S., Durhan, E.J., Greene, K.J., Kahl, M.D., Jensen, K.M., Makynen, E.A., Villeneuve, D.L., Ankley, G.T. (2008). Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem., 27, 478-488.
|
|
27)
|
OCDE (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. ENV/JM/MONO(2006)18.
|
|
28)
|
OCDE (2012). OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment, No. 150. ENV/JM/MONO(2012)22.
|
Apêndice 1
Abreviaturas e definições
Produto químico
: Substância ou mistura.
CV
: Coeficiente de variação.
ELISA (Enzyme-Linked Immunosorbent Assay): Ensaio de imunossorção com ligação enzimática.
Taxa de carga
: Peso húmido de peixe por volume de água.
Densidade de ocupação
: Número de peixes por volume de água.
Vitelogenina (VTG)
: Fosfolipoglicoproteína precursora das proteínas do vitelo que normalmente ocorre nas fêmeas sexualmente ativas de todas as espécies ovíparas.
Eixo HHG
: Eixo hipotálamo-hipófise-gónadas.
CMT
: Concentração máxima tolerada; representa cerca de 10 % da CL50.
Produto químico em estudo
: Qualquer substância ou mistura à qual seja aplicado este método de ensaio.
Apêndice 2
Condições experimentais do ensaio de despistagem de atividade endócrina em peixes
|
|
Vairão-de-cabeça-gorda
(Pimephales promelas)
|
Peixe-do-arroz-japonês
(Oryzias latipes)
|
Peixe-zebra
(Danio rerio)
|
|
|
Fluxo contínuo
|
Fluxo contínuo
|
Fluxo contínuo
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
|
Lâmpadas fluorescentes (espetro largo)
|
Lâmpadas fluorescentes (espetro largo)
|
Lâmpadas fluorescentes (espetro largo)
|
|
|
10-20 μE/m2/s, 540-1 000 lux ou 50-100 ft-c (níveis ambientes no laboratório)
|
10-20 μE/m2/s, 540-1 000 lux ou 50-100 ft-c (níveis ambientes no laboratório)
|
10-20 μE/m2/s, 540-1 000 lux ou 50-100 ft-c (níveis ambientes no laboratório)
|
|
6.
|
Fotoperíodo (as transições alvorada e crepúsculo não são consideradas necessárias e são facultativas)
|
|
16 horas de luz seguidas de 8 horas de escuridão
|
12-16 horas de luz seguidas de 12-8 horas de escuridão
|
12-16 horas de luz seguidas de 12-8 horas de escuridão
|
|
|
<5 g por litro
|
<5 g por litro
|
<5 g por litro
|
|
|
10 l (mínimo)
|
2 l (mínimo)
|
5 l (mínimo)
|
|
9.
|
Volume de solução em cada cuba
|
|
8 l (mínimo)
|
1,5 l (mínimo)
|
4 l (mínimo)
|
|
10.
|
Substituição total do volume de solução em cada cuba
|
|
Mínimo 6 diárias
|
Mínimo 5 diárias
|
Mínimo 5 diárias
|
|
11.
|
Idade dos organismos utilizados no ensaio
|
|
Ver o ponto 20.
|
Ver o ponto 20.
|
Ver o ponto 20.
|
|
12.
|
Peso húmido aproximado de um peixe adulto (g)
|
|
Fêmeas: 1,5 ± 20 %
Machos: 2,5 ± 20 %
|
Fêmeas: 0,35 ± 20 %
Machos: 0,35 ± 20 %
|
Fêmeas: 0,65 ± 20 %
Machos: 0,4 ± 20 %
|
|
13.
|
Número de peixes por cuba
|
|
6 (2 machos e 4 fêmeas)
|
10 (5 machos e 5 fêmeas)
|
10 (5 machos e 5 fêmeas)
|
|
14.
|
Número de concentrações de exposição
|
|
3 (mais as cubas de controlo adequadas)
|
3 (mais as cubas de controlo adequadas)
|
3 (mais as cubas de controlo adequadas)
|
|
15.
|
Número de cubas por concentração de exposição
|
|
Mínimo 4
|
Mínimo 2
|
Mínimo 2
|
|
16.
|
Número de peixes por concentração ensaiada
|
|
16 fêmeas adultas e 8 machos adultos (4 fêmeas e 2 machos em cada cuba replicada)
|
10 fêmeas adultas e 10 machos adultos (5 fêmeas e 5 machos em cada cuba replicada)
|
10 fêmeas adultas e 10 machos adultos (5 fêmeas e 5 machos em cada cuba replicada)
|
|
|
Artémias adultas ou náuplios de artémias, vivos ou congelados, duas ou três vezes por dia (ad libitum), alimento para peixes disponível no comércio ou uma combinação dos dois
|
Náuplios de artémias duas ou três vezes por dia (ad libitum), alimento para peixes disponível no comércio ou uma combinação dos dois
|
Náuplios de artémias duas ou três vezes por dia (ad libitum), alimento para peixes disponível no comércio ou uma combinação dos dois
|
|
|
Nenhum, salvo se a concentração de oxigénio dissolvido descer abaixo de 60 % do valor da saturação com ar
|
Nenhum, salvo se a concentração de oxigénio dissolvido descer abaixo de 60 % do valor da saturação com ar
|
Nenhum, salvo se a concentração de oxigénio dissolvido descer abaixo de 60 % do valor da saturação com ar
|
|
|
Água de superfície, de poço ou reconstituída, ou água da torneira desclorada, limpa
|
Água de superfície, de poço ou reconstituída, ou água da torneira desclorada, limpa
|
Água de superfície, de poço ou reconstituída, ou água da torneira desclorada, limpa
|
|
20.
|
Período de pré-exposição
|
|
7 dias (recomendado)
|
7 dias (recomendado)
|
7 dias (recomendado)
|
|
21.
|
Duração da exposição ao produto químico
|
|
21 dias
|
21 dias
|
21 dias
|
|
22.
|
Parâmetros biológicos
|
|
sobrevivência
comportamento
caracteres sexuais secundários
vitelogenina
|
sobrevivência
comportamento
caracteres sexuais secundários
vitelogenina
|
sobrevivência
comportamento
vitelogenina
|
|
23.
|
Aceitabilidade do ensaio
|
|
concentração de oxigénio dissolvido >60 % do valor de saturação; temperatura média de 25 ± 2 °C; 90 % de peixes sobreviventes nas cubas de controlo; concentrações medidas no ensaio situadas num intervalo de ±20 % relativamente à média dos valores medidos para cada nível de exposição.
|
concentração de oxigénio dissolvido >60 % do valor de saturação; temperatura média de 24 ± 2 °C; 90 % de peixes sobreviventes nas cubas de controlo; concentrações medidas no ensaio situadas num intervalo de ±20 % relativamente à média dos valores medidos para cada nível de exposição.
|
concentração de oxigénio dissolvido >60 % do valor de saturação; temperatura média de 26 ± 2 °C; 90 % de peixes sobreviventes nas cubas de controlo; concentrações medidas no ensaio situadas num intervalo de ±20 % relativamente à média dos valores medidos para cada nível de exposição.
|
Apêndice 3
Algumas características químicas de uma água de diluição aceitável
|
Componente
|
CONCENTRAÇÃO
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 mg/l
|
|
Amoníaco não-ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados, totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
Apêndice 4A
Substrato de desova para peixes-zebra
Placa de desova
: Tabuleiro de instrumentos totalmente em vidro, por exemplo com 22 cm de comprimento, 15 cm de largura e 5,5 cm de profundidade, coberto com uma grelha amovível de arame de aço inoxidável (malha de 2 mm de largura). A base desta grelha de cobertura está a um nível inferior ao rebordo do tabuleiro.

Fixa-se um substrato de desova à grelha, de modo a formar uma estrutura na qual os peixes possam penetrar. São adequadas, por exemplo, plantas de aquário artificiais de plástico verde (nota: deve avaliar-se a possibilidade de adsorção do produto químico em estudo ao plástico). Mergulham-se os elementos de plástico num volume de água tépida suficiente, durante tempo suficiente para que deles não passem produtos químicos para a água utilizada nos ensaios. Caso sejam utilizados objetos de vidro, esses objetos não devem poder ferir os peixes nem tolhê-los quando os peixes executarem movimentos vigorosos.
A distância entre a placa e as paredes do tabuleiro de vidro não deve ser inferior a 3 cm, para que a desova não possa ocorrer fora daquela. Os ovos postos sobre a placa atravessam a grelha e podem ser colhidos 45 a 60 minutos após o início da iluminação. Os ovos são transparentes e não-aderentes, podendo ser contados com facilidade utilizando luz lateral. Quando cada cuba alberga cinco fêmeas, pode considerar-se baixo um número diário de ovos até 20, médio entre 20 e 100 e alto superior a 100. O mais tarde possível à noite ou de manhã muito cedo, retira-se a placa de desova, colhem-se os ovos e recoloca-se a placa na cuba de ensaio. A recolocação da placa na cuba não deve tardar mais de uma hora; caso contrário, o ressurgimento do substrato de desova pode induzir acasalamentos e desova fora de tempo. Se for necessário recolocar a placa de desova mais tarde do que uma hora passada, deve a mesma ser recolocada pelo menos nove horas após o início da iluminação. A essa hora tardia do dia já não haverá indução de desova.
Apêndice 4B
Substrato de desova para vairões-de-cabeça-gorda
Colocam-se em cada cuba de ensaio duas ou três combinações de placa e cobertura de desova de plástico/cerâmica/vidro ou aço inoxidável (por exemplo, uma secção de caleira cinzenta com 80 mm de comprimento pousada numa placa de 130 mm de comprimento com rebordos — ver a fotografia). Verificou-se que coberturas de PVC ou cerâmicas adequadamente tratadas podem servir de substrato de desova (Thorpe et al, 2007).
Recomenda-se que as coberturas sejam raspadas para melhorar a aderência. A placa também deve ter uma proteção que impeça os peixes de alcançarem os ovos que caiam, a menos que tenha sido demonstrado que os ovos aderem eficazmente ao substrato de desova utilizado.

A base destina-se a receber os ovos que, por não aderirem à superfície da cobertura, cairão no fundo da cuba (ou os ovos diretamente depositados na base plana de plástico do conjunto). Antes de serem utilizados, mergulham-se os substratos de desova em água de diluição durante, pelo menos, 12 horas.
REFERÊNCIAS
Thorpe, K.L., Benstead, R., Hutchinson, T.H., Tyler, C.R. (2007) An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Apêndice 5A
Avaliação de caracteres sexuais secundários no vairão-de-cabeça-gorda para deteção de determinados produtos químicos com atividade endócrina
Resumo
No vairão-de-cabeça-gorda adulto, entre as características físicas que podem ter importância nos ensaios de desreguladores do sistema endócrino contam-se as seguintes: cor do corpo (clara ou escura), padrões de coloração (ocorrência ou ausência de bandas verticais), forma do corpo (forma da cabeça e da região peitoral, distensão do abdómen) e caracteres sexuais secundários específicos (número e tamanho dos tubérculos nupciais, volume da massa adiposa dorsal e ovipositor)
No vairão-de-cabeça-gorda, os tubérculos nupciais localizam-se na (massa adiposa dorsal da) cabeça dos machos reprodutores, em geral com simetria bilateral (Jensen et al., 2001). Nas fêmeas de controlo e nos machos e fêmeas juvenis não se desenvolvem tubérculos (Jensen et al., 2001). Podem existir até oito tubérculos distintos em volta dos olhos e das narinas dos machos. O maior número de tubérculos e os tubérculos maiores localizam-se em duas linhas paralelas imediatamente abaixo das narinas e acima da boca. Em muitos peixes surgem grupos de tubérculos abaixo da mandíbula. O grupo mais próximo da boca é normalmente constituído por um só par, ao passo que o grupo em posição mais ventral pode compreender até quatro tubérculos. O número de tubérculos raramente excede 30 (intervalo: 18-28; Jensen et al., 2001). Os tubérculos (numericamente) predominantes formam uma estrutura arredondada e a sua altura é aproximadamente igual ao raio. A maior parte dos machos reprodutores também evidenciam, pelo menos, alguns tubérculos dilatados e salientes, não sendo possível individualizar a estrutura de cada tubérculo.
Alguns tipos de produtos químicos desreguladores do sistema endócrino podem provocar a ocorrência anormal de determinados caracteres sexuais secundários no sexo oposto. Por exemplo, agonistas dos recetores de androgénios, como a 17β-metiltestosterona ou a 17β-trembolona, podem provocar o aparecimento de tubérculos nupciais no vairão-de-cabeça-gorda fêmea (Smith, 1974; Ankley et al., 2001, 2003) e os agonistas dos recetores de estrogénios podem reduzir o número ou a dimensão dos tubérculos nupciais nos machos (Miles-Richardson et al., 1999; Harries et al., 2000).
Segue-se uma descrição da caracterização dos tubérculos nupciais no vairão-de-cabeça-gorda, com base no protocolo seguido no laboratório da Agência de Proteção do Ambiente dos E.U.A. (Duluth, MN). Os produtos e equipamentos indicados podem ser substituídos por equivalentes disponíveis.
Para melhor visualização, pode utilizar-se uma lupa com iluminação ou um microscópio de dissecação com iluminação (3X). Examinam-se os peixes em posição dorsal, com a parte anterior para a frente (cabeça orientada para o observador).
|
a)
|
Coloca-se o peixe numa placa de Petri (por exemplo numa placa com 100 mm de diâmetro) com a parte anterior para a frente e o ventre para baixo. Foca-se o dispositivo ótico, a fim de identificar os tubérculos. Roda-se com cuidado o peixe lateralmente, para identificar as zonas tuberculizadas. Contam-se e classificam-se os tubérculos.
|
|
b)
|
Repete-se o exame na parte ventral da cabeça, colocando o peixe na placa de Petri com a parte anterior para a frente e o dorso para baixo.
|
|
c)
|
O tempo necessário para examinar cada peixe é normalmente de 2 minutos.
|
Contagem e classificação dos tubérculos
Identificaram-se seis zonas específicas para avaliação da presença e do grau de desenvolvimento de tubérculos no vairão-de-cabeça-gorda adulto. Para localizar e quantificar os tubérculos presentes criou-se a matriz apresentada no final deste apêndice. Regista-se o número de tubérculos e estabelece-se a seguinte classificação dimensional para cada organismo: 0-ausente, 1-presente, 2-dilatado, 3-saliente (figura 1).
Classe 0: nenhum tubérculo presente; classe 1: tubérculo cuja altura é quase equivalente ao raio (diâmetro) apenas num ponto; classe 2: tubérculo dilatado, identificável por tecidos de aspeto semelhante a um asterisco, normalmente com uma base larga em todo o perímetro e estrias ou rugas a divergir do centro; a altura é muitas vezes mais irregular, mas o tubérculo também pode ser arredondado; classe 3: tubérculo saliente, normalmente bastante grande e arredondado, com estrutura menos definida; por vezes, estes tubérculos coalescem e formam uma massa única numa zona ou ocupando várias zonas (B, C e D na descrição infra); a cor e a forma destes tubérculos são semelhantes às da classe 2, mas, por vezes, os tubérculos são difíceis de individualizar nesta base. Utilizando este sistema de classificação de tubérculos, normalmente a pontuação atribuída é inferior a 50, no caso de um macho de controlo normal com 18 a 20 tubérculos (Jensen et al., 2001).
Figura 1
Em alguns peixes, o número real de tubérculos numa determinada zona de classificação pode exceder as casas previstas na matriz (apêndice A). Se isso suceder, podem ser acrescentados números de classificação adicionais entre casas ou à esquerda ou direita destas. A matriz não tem, portanto, de ser simétrica. Outra técnica, para localização de tubérculos emparelhados ou que coalescem na vertical no plano horizontal da boca, compreende a indicação na mesma caixa da classificação correspondente a cada tubérculo de um par.
Regiões da localização:
A— Tubérculos situados em volta dos olhos. Localizados em volta do lado anterior do contorno dos olhos, indicam-se na matriz do lado dorsal para o lado ventral. É comum serem múltiplos nos machos maduros de controlo, não estão presentes nas fêmeas de controlo e geralmente ocorre um par (um tubérculo próximo de cada olho) ou um único tubérculo nas fêmeas expostas a androgénios.
B— Tubérculos situados entre as narinas (poros dos canais sensoriais). Ocorrem normalmente aos pares nos machos de controlo, com os níveis de desenvolvimento mais elevados — 2 ( dilatados) ou 3 (salientes). Ausentes nas fêmeas de controlo, mas por vezes presentes e desenvolvidos em fêmeas expostas a androgénios.
C— Tubérculos situados em posição imediatamente anterior às narinas, paralelamente à boca. Nos machos maduros de controlo são geralmente dilatados ou salientes. Presentes ou dilatados em machos menos desenvolvidos e nas fêmeas expostas a androgénios.
D— Tubérculos situados paralelamente, ao longo da linha definida pela boca. Nos machos de controlo, normalmente recebem uma classificação de desenvolvidos. Ausentes nas fêmeas de controlo, mas presentes nas fêmeas expostas a androgénios.
E— Tubérculos situados na mandíbula, perto da boca, normalmente pequenos e frequentemente aos pares. Variáveis nos machos de controlo e nos machos e fêmeas expostos.
F— Tubérculos situados em posição ventral relativamente à zona E. Geralmente pequenos e aos pares. Presentes nos machos de controlo e nas fêmeas expostas a androgénios.
REFERÊNCIAS
|
1)
|
Ankley, G.T., Jensen, K.M., Kahl, M.D., Korte, J.J., Makynen, M.E. (2001). Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ. Toxicol. Chem., 20:1276-1290.
|
|
2)
|
Ankley, G.T., Jensen, K.M., Makynen, E.A., Kahl, M.D., Korte, J.J., Hornung, M.W., Henry, T.R., Denny, J.S., Leino, R.L., Wilson, V.S., Cardon, M.C., Hartig, P.C., Gray, E.L. (2003). Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ. Toxicol. Chem., 22:1350-1360.
|
|
3)
|
Harries, J.E., Runnalls, T., Hill, E., Harris, C.A., Maddix, S., Sumpter, J.P., Tyler, C.R. (2000). Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ. Sci. Technol., 34:3003-3011.
|
|
4)
|
Jensen, K.M., Korte, J.J., Kahl, M.D., Pasha, M.S., Ankley, G.T. (2001). Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp. Biochem. Physiol., C, 128:127-141.
|
|
5)
|
Kahl, M.D., Jensen, K.M., Korte, J.J., Ankley, G.T. (2001). Effects of handling on endocrinology and reproductive performance of the fathead minnow. J. Fish Biol., 59:515-523.
|
|
6)
|
Miles-Richardson, S.R., Kramer, V.J., Fitzgerald, S.D., Render, J.A., Yamini, B., Barbee, S.J., Giesy, J.P. (1999). Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat. Toxicol., 47:129-145.
|
|
7)
|
Smith, R.J.F. (1974). Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can. J. Zool., 52:1031-1038.
|
|
Matriz de localização de tubérculos
|
Pontuação
|
|
Identificação
|
1-presente
|
|
Data
|
2-dilatado
|
|
Pontuação total
|
3-saliente
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Apêndice 5B
Avaliação de caracteres sexuais secundários no peixe-do-arroz-japonês para deteção de determinados produtos químicos com atividade endócrina
Descreve-se a seguir o protocolo de medição dos processos papilares (20), que constituem os caracteres sexuais secundários do peixe-do-arroz-japonês (Oryzias latipes).
|
1)
|
Após excisão do fígado (apêndice 6), coloca-se a carcaça num tubo cónico com 10 ml de formol a 10 % tamponado a pH neutro (cabeça para cima, cauda para baixo). Se a gónada for fixada numa solução que não seja formol a 10 % tamponado a pH neutro, corta-se a carcaça transversalmente com uma lâmina, entre a região anterior da barbatana anal e o ânus, tendo o cuidado de não lesionar o gonóporo nem a gónada (figura 3). Coloca-se o lado da cabeça do corpo do peixe na solução fixadora, para conservar a gónada, e o lado da cauda em formol a 10 % tamponado a pH neutro, como se referiu.
|
|
2)
|
Depois de colocar o corpo do peixe em formol a 10 % tamponado a pH neutro, segura-se a região anterior da barbatana anal com uma pinça e estende-se a barbatana durante cerca de 30 segundos, para a manter aberta. A fim de não lesionar os processos papilares com a pinça, puxa-se a barbatana anal segurando-a com a pinça numa extensão de alguns raios apenas da região anterior da barbatana.
|
|
3)
|
Após manter a barbatana anal aberta durante cerca de 30 segundos, guarda-se o corpo do peixe à temperatura ambiente em formol a 10 % tamponado a pH neutro, até à medição dos processos papilares (a efetuar depois de um período de fixação mínimo de 24 horas).
|
Medição
|
1)
|
Depois de fixar o corpo do peixe durante, pelo menos, 24 horas em formol a 10 % tamponado a pH neutro, retira-se a carcaça do peixe do tubo cónico e enxuga-se o formal com papel de filtro ou com um toalhete de papel.
|
|
2)
|
Coloca-se o peixe com o abdómen para cima e corta-se cuidadosamente a barbatana anal utilizando uma pequena tesoura de dissecação (é preferível cortar a barbatana anal com uma pequena quantidade de pterigióforo).
|
|
3)
|
Pega-se na barbatana anal assim cortada com uma pinça, segurando-a pela região anterior, e coloca-se a barbatana numa lâmina de vidro com algumas gotas de água. Cobre-se a barbatana anal com uma lamela de vidro. Há que ter o cuidado de não lesionar os processos papilares ao pegar na barbatana anal com a pinça.
|
|
4)
|
Contam-se os segmentos de raio com processos papilares, utilizando o contador de um microscópio biológico (microscópio vertical ou microscópio invertido). Reconhece-se um processo papilar pela formação de um pequeno processo visível na margem posterior do segmento de raio. Inscreve-se o número de segmentos com processos papilares em cada raio de barbatana na folha de registo do ensaio (por exemplo primeiro raio: 0, segundo raio: 10, terceiro raio: 12 etc.) e depois a soma desses números na folha Excel correspondente a cada peixe. Se necessário, fotografa-se a barbatana anal e contam-se na fotografia os segmentos de raio que têm processos papilares.
|
|
5)
|
Depois das contagens, coloca-se a barbatana anal no tubo cónico referido em 1 e guarda-se o tubo.
|
Figura 1.
Diferenças entre os sexos na forma e no tamanho da barbatana anal. A: macho; B: fêmea. [Oka, T.B. (1931). On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Universidade de Tóquio, IV, 2: 209-218.]

Figura 2.
A: processos em segmentos de raios de barbatana anal; J.P.: segmento de raio; A.S.: espaço axial; P.: processo; B: extremidade distal do raio de barbatana. As actinotríquias (Act.) estão assinaladas na extremidade. [Oka, T.B. (1931). On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Universidade de Tóquio, IV, 2: 209-218.]
Figura 3.
Fotografia do corpo de um peixe mostrando o sítio do corte a efetuar quando a gónada é fixada com uma solução diversa de formol a 10 % tamponado a pH neutro. Nesse caso, separa-se o resto do corpo através de um corte com uma lâmina, efetuado entre a região anterior da barbatana anal e o ânus (traço vermelho), após o que se coloca a parte do corpo do lado da cabeça na solução fixadora da gónada e a parte do corpo do lado da cauda em formol a 10 % tamponado a pH neutro.

Apêndice 6
Protocolos recomendados para a colheita de amostras destinadas à análise da vitelogenina
É necessário tomar precauções para evitar contaminações cruzadas entre amostras de machos e fêmeas para determinação da vitelogenina.
Protocolo 1A: Colheita de sangue na artéria/veia caudal do vairão-de-cabeça-gorda
Após anestesia, secciona-se parcialmente o pedúnculo caudal com um bisturi e recolhe-se sangue da veia/artéria caudal num microtubo capilar heparinizado para determinação do hematócrito. Depois de colhido o sangue, separa-se rapidamente o plasma por centrifugação durante 3 minutos a 15 000 g (ou, em alternativa, 15 000 g durante 10 minutos, a 4 °C). Caso se pretenda fazê-lo, pode determinar-se a percentagem de hematócrito depois da centrifugação. Transfere-se o plasma do microtubo capilar para um tubo de centrifugação que já contenha 0,13 unidades de aprotinina (um inibidor de proteases), conservando-o a – 80 °C até à determinação da vitelogenina. A quantidade de plasma depende do tamanho do vairão-de-cabeça-gorda e este do sexo do peixe; o volume que pode ser colhido situa-se, em geral, entre 5 e 60 microlitros por peixe (Jensen et al., 2001).
Protocolo 1B: Colheita de sangue no coração do vairão-de-cabeça-gorda
Em alternativa, também pode colher-se sangue por punção cardíaca, utilizando uma seringa heparinizada (1 000 unidades de heparina por mililitro). Transfere-se o sangue para tubos de Eppendorf (conservados em gelo) e centrifuga-se (7 000 g durante 5 minutos, à temperatura ambiente). Transfere-se o plasma para tubos de Eppendorf limpos (constituindo alíquotas, se o volume de plasma o permitir) e congela-se imediatamente a – 80 °C, até à realização das análises (Panter et al., 1998).
Protocolo 2A: Excisão do fígado no peixe-do-arroz-japonês
Retirada dos peixes das cubas de ensaio
|
1)
|
Retiram-se os peixes das cubas com um pequeno coador de rede, tendo o cuidado de não deixar cair nenhum peixe noutra cuba.
|
|
2)
|
Em princípio, retiram-se os peixes pela ordem seguinte: cuba de controlo, cuba de controlo do solvente (se for o caso), cuba com a concentração mais baixa, cuba com a concentração média, cuba com a concentração mais elevada e cuba de controlo positivo. Além disso, numa determinada cuba, retiram-se todos os machos antes de se retirarem as fêmeas.
|
|
3)
|
Determina-se o sexo de cada peixe com base nos caracteres sexuais secundários externos (por exemplo a forma da barbatana caudal).
|
|
4)
|
Coloca-se cada peixe num recipiente de transporte e leva-se para a bancada onde se procederá à excisão dos fígados. Verifica-se se a etiqueta aposta no recipiente de transporte é conforme com a etiqueta aposta na cuba de ensaio e confirma-se se o número de peixes removidos da cuba e o número de peixes que nela restam corresponde ao esperado.
|
|
5)
|
Se não for possível determinar o sexo com base no aspeto físico dos peixes, retiram-se todos os peixes da cuba. Nesse caso, determina-se o sexo por exame da gónada ou dos caracteres sexuais secundários ao microscópio estereoscópico.
|
Excisão do fígado
|
1)
|
Utilizando o pequeno coador de rede, transferem-se os peixes do recipiente de transporte para a solução anestesiante.
|
|
2)
|
Uma vez os peixes anestesiados, transferem-se para um papel de filtro (ou para um toalhete de papel) com uma pinça de modelo normal. Ao pegar em cada peixe com a pinça, segura-se pela cabeça, para não lhe partir a cauda.
|
|
3)
|
Enxuga-se a água à superfície do peixe com o papel de filtro (ou com o toalhete de papel).
|
|
4)
|
Coloca-se o peixe com o abdómen para cima. Utilizando uma tesoura de dissecação, efetua-se uma pequena incisão transversal na região ventral, entre a base da cabeça e a zona média do abdómen.
|
|
5)
|
Insere-se a tesoura de dissecação nessa pequena incisão e faz-se outra incisão, ao longo da linha média do abdómen, entre um ponto caudal relativamente aos opérculos branquiais e o lado craniano do ânus. Não inserir a tesoura de dissecação demasiado profundamente, para não lesionar o fígado e a gónada.
|
|
6)
|
Efetuam-se as operações seguintes, utilizando um microscópio estereoscópico.
|
|
7)
|
Coloca-se o peixe com o abdómen para cima num toalhete de papel (ou então numa placa de Petri de vidro ou numa lâmina de vidro).
|
|
8)
|
Afastam-se as paredes da cavidade abdominal com pinças de precisão e expõem-se os órgãos internos. Se necessário, os órgãos internos também podem ser expostos após remoção de um dos lados da parede abdominal.
|
|
9)
|
Utilizando outro par de pinças de precisão, expõe-se a zona de ligação do fígado e da vesícula biliar. Segura-se o canal biliar e efetua-se um corte para separar a vesícula biliar, tendo o cuidado de não a romper.
|
|
10)
|
Segura-se o esófago e separa-se do mesmo modo o aparelho digestivo do fígado, tendo o cuidado de não derramar o conteúdo daquele. Procede-se à excisão, do ânus, da parte caudal do aparelho digestivo e retira-se o aparelho digestivo da cavidade abdominal.
|
|
11)
|
Retira-se a massa adiposa e de outros tecidos que rodeiam o fígado, tendo o cuidado de não lesionar o fígado.
|
|
12)
|
Segura-se a zona portal hepática com pinças de precisão e retira-se o fígado da cavidade abdominal.
|
|
13)
|
Coloca-se o fígado na lâmina de vidro. Utilizando pinças de precisão, retira-se da superfície do fígado o tecido adiposo e outro que ainda reste (por exemplo, tecido da parede abdominal interna).
|
|
14)
|
Pesa-se o fígado num microtubo de 1,5 ml previamente tarado, numa balança analítica eletrónica. Regista-se a leitura na folha de registo do ensaio (aproximação de 0,1 mg). Confirmam-se as informações identificadoras no rótulo do microtubo.
|
|
15)
|
Coloca-se a tampa no microtubo que contém o fígado e guarda-se o tubo num suporte refrigerador (ou num suporte gelado).
|
|
16)
|
Após a excisão de cada fígado, limpam-se os instrumentos de dissecação ou substituem-se estes por instrumentos limpos.
|
|
17)
|
Retira-se do mesmo modo o fígado a todos os peixes guardados nos recipientes de transporte.
|
|
18)
|
Uma vez efetuada a excisão do fígado a todos os peixes guardados nos recipientes de transporte (ou seja, a todos os machos ou fêmeas de uma cuba), colocam-se os espécimes hepáticos num suporte de tubos, com uma etiqueta de identificação, e guardam-se no congelador. Se os fígados prosseguirem para o pré-tratamento pouco depois da excisão, levam-se os espécimes para a bancada correspondente num suporte refrigerador (ou num suporte gelado).
|
Após a excisão dos fígados, pode proceder-se à medição dos caracteres sexuais secundários nas carcaças de peixe.
Espécimes
Se os espécimes de fígado retirados dos peixes não passarem ao pré-tratamento pouco depois da excisão, guardam-se os espécimes a uma temperatura ≤ – 70 °C.
Figura 1
Corte com tesoura em posição imediatamente anterior às barbatanas peitorais.

Figura 2
Incisão com tesoura ao longo da linha média abdominal, até um ponto cerca de 2 mm anterior ao ânus.

Figura 3
Afastamento das paredes abdominais com uma pinça, de modo a expor o fígado e outros órgãos internos. (Em alternativa, as paredes abdominais também podem ser afastadas lateralmente e ser mantidas nessa posição com alfinetes.)

Figura 4
Dissecação e excisão do fígado com uma pinça, sem efetuar cortes.

Figura 5
Retirada cuidadosa dos intestinos com uma pinça.

Figura 6
Corte com tesoura das duas extremidades dos intestinos e das aderências do mesentério.

Figura 7 (fêmea)
O procedimento é idêntico para as fêmeas.

Figura 8
Procedimento concluído.

Protocolo 2B: Pré-tratamento do fígado para análise da vitelogenina no paixe-do-arroz-japonês (Oryzias latipes)
Retira-se o frasco de tampão do homogeneizado do kit ELISA e refrigera-se o mesmo com gelo moído (temperatura da solução: ≤4 °C). Caso se utilize tampão do homogeneizado do sistema ELISA da EnBio, deixa-se descongelar a solução à temperatura ambiente e depois refrigera-se o frasco com gelo moído.
Calcula-se o volume de tampão do homogeneizado para o fígado com base no peso deste (adicionam-se 50 μl de tampão do homogeneizado por miligrama de fígado a homogeneizar). Por exemplo, se o fígado pesar 4,5 mg, utilizam-se para o efeito 225 μl de tampão do homogeneizado. Elabora-se uma lista com o volume de tampão do homogeneizado correspondente a cada fígado.
Preparação do fígado para o pré-tratamento
|
1)
|
Imediatamente antes do pré-tratamento, retira-se do congelador o microtubo de 1,5 ml que contém o fígado.
|
|
2)
|
Para evitar contaminações com vitelogenina, efetua-se o pré-tratamento dos fígados dos machos antes das fêmeas. Além disso, procede-se ao pré-tratamento dos vários grupos ensaiados pela ordem seguinte: cuba de controlo, cuba de controlo do solvente (se for o caso), cuba com a concentração mais baixa, cuba com a concentração média, cuba com a concentração mais elevada e cuba de controlo positivo.
|
|
3)
|
O número de microtubos de 1,5 ml com amostras de fígado retirados do congelador numa dada ocasião não pode exceder o número de tubos que podem ser centrifugados de imediato.
|
|
4)
|
Colocam-se os microtubos de 1,5 ml com as amostras de fígado no suporte gelado por ordem de numeração dos espécimes (não é necessário descongelar o fígado).
|
Pré-tratamento
1. Adição do tampão de homogeneização
|
1)
|
Verifica-se na lista o volume de tampão do homogeneizado a utilizar para a amostra de fígado e regula-se a micropipeta (100-1 000 μl) no volume adequado. Coloca-se uma ponta limpa na micropipeta.
|
|
2)
|
Retira-se tampão do homogeneizado do frasco onde está guardado e adiciona-se ao microtubo de 1,5 ml que contém a amostra de fígado.
|
|
3)
|
Procedendo do mesmo modo, adiciona-se tampão do homogeneizado a todos os microtubos de 1,5 ml que contém as amostras de fígado. Não é necessário substituir a ponta da micropipeta, a menos que fique contaminada ou se suspeite disso.
|
2. Homogeneização do fígado
|
1)
|
Fixa-se um novo pilão de homogeneização no homogeneizador do microtubo.
|
|
2)
|
Insere-se o pilão no microtubo de 1,5 ml. Segura-se o homogeneizador do microtubo e comprime-se o fígado entre a superfície do pilão e a parede interna do microtubo.
|
|
3)
|
Faz-se funcionar o homogeneizador do microtubo durante 10 a 20 segundos. Durante esta operação, mantém-se o microtubo de 1,5 ml refrigerado com gelo moído.
|
|
4)
|
Retira-se o pilão do microtubo e deixa-se este em repouso durante cerca de 10 segundos. Em seguida, avalia-se visualmente o estado da suspensão.
|
|
5)
|
Caso se detetem fragmentos de fígado na suspensão, repetem-se as operações 3 e 4 para obter um homogeneizado de fígado satisfatório.
|
|
6)
|
Mantém-se a suspensão de homogeneizado de fígado no suporte gelado até à centrifugação.
|
|
7)
|
É necessário utilizar um pilão novo para cada homogeneizado.
|
|
8)
|
Homogeneízam-se todos os fígados com tampão do homogeneizado conforme se descreveu.
|
3. Centrifugação da suspensão de homogeneizado hepático
|
1)
|
Confirma-se que a temperatura da câmara de centrifugação refrigerada é ≤ 5 °C.
|
|
2)
|
Introduzem-se os microtubos de 1,5 ml com a suspensão de homogeneizado hepático na câmara de centrifugação refrigerada (se necessário, reequilibra-se).
|
|
3)
|
Centrifuga-se a suspensão de homogeneizado hepático a 13 000 g durante 10 minutos, a temperatura ≤ 5 °C. Se os sobrenadantes se separarem convenientemente, a força centrífuga e o tempo de centrifugação podem, se necessário, ser ajustados.
|
|
4)
|
Após a centrifugação, verifica-se se os sobrenadantes se separaram convenientemente (superfície: lípidos; camada intermédia: sobrenadante; camada inferior: tecido hepático). Se a separação não for adequada, procede-se a nova centrifugação da suspensão nas mesmas condições.
|
|
5)
|
Retiram-se todos os espécimes da câmara de centrifugação refrigerada e dispõem-se no suporte gelado por ordem de numeração dos espécimes. Há que ter cuidado para, depois da centrifugação, não ressuspender as camadas separadas.
|
4. Recolha do sobrenadante
|
1)
|
Colocam-se num suporte de tubos quatro microtubos de 0,5 ml para recolha de sobrenadante.
|
|
2)
|
Utilizando a micropipeta, retiram-se 30 μl de um dos sobrenadantes (fase intermédia separada) e transferem-se para um dos microtubos de 0,5 ml. Há que ter cuidado para não recolher lípidos da camada superior nem tecido hepático da camada inferior.
|
|
3)
|
Procedendo do modo descrito, transfere-se mais sobrenadante para dois outros microtubos de 0,5 ml.
|
|
4)
|
Recolhe-se o resto do sobrenadante com a micropipeta (se possível, ≥ 100 μl) e transfere-se o mesmo para o último microtubo de 0,5 ml. Há que ter cuidado para não recolher lípidos da camada superior nem tecido hepático da camada inferior.
|
|
5)
|
Tapam-se os microtubos de 0,5 ml e escreve-se o volume de sobrenadante no rótulo respetivo. Refrigeram-se imediatamente os microtubos no suporte gelado.
|
|
6)
|
Substitui-se a ponta da micropipeta para cada sobrenadante. Caso fique agarrada à ponta da micropipeta uma grande quantidade de lípidos, substitui-se a ponta imediatamente, para evitar a contaminação do extrato de fígado com gorduras.
|
|
7)
|
Transfere-se todo o sobrenadante centrifugado para quatro microtubos de 0,5 ml conforme se descreveu.
|
|
8)
|
Uma vez transferido todo o sobrenadante para microtubos de 0,5 ml, colocam-se os microtubos com um rótulo identificador no suporte de tubos e coloca-se este imediatamente no congelador. Se a determinação das concentrações de vitelogenina decorrer logo a seguir ao pré-tratamento, mantém-se um microtubo de 0,5 ml (com 30 μl de sobrenadante) refrigerado no suporte de tubos e transfere-se esse microtubo para a bancada onde irá realizar-se o ensaio ELISA. Nesse caso, colocam-se os outros microtubos no suporte de tubos e coloca-se este no congelador.
|
|
9)
|
Uma vez recolhido o sobrenadante, eliminam-se convenientemente os resíduos.
|
Conservação dos espécimes
Até serem utilizados no método ELISA, conservam-se os microtubos de 0,5 ml que contêm o sobrenadante do homogeneizado hepático a temperatura ≤ – 70 °C.
Protocolo 3A: Colheita de sangue na artéria/veia caudal do peixe-zebra
Imediatamente após a anestesia, corta-se transversalmente o pedúnculo caudal e colhe-se sangue da artéria/veia caudal para um microtubo capilar heparinizado para determinação do hematócrito. O volume de sangue depende do tamanho do peixe e varia entre 5 e 15 μl. Adiciona-se ao microtubo capilar volume idêntico de tampão aprotinina (6 μg/ml em tampão fosfato, PBS) e separa-se o plasma do sangue por centrifugação (5 minutos a 600 g). Transfere-se o plasma para tubos de ensaio e conservam-se estes a – 20 °C até à determinação analítica da vitelogenina ou de outras proteínas relevantes.
Protocolo 3B: Colheita de sangue por punção cardíaca no peixe-zebra
Para evitar a coagulação do sangue e a degradação proteica, colhem-se as amostras numa solução de tampão fosfato (PBS) com 1 000 unidades de heparina por mililitro e 2 TIU (unidades de inibidor da tripsina) do inibidor das proteases aprotinina por mililitro. Recomenda-se a utilização de heparina (sal de amónio) e de aprotinina liofilizada como ingredientes do tampão. Para colher as amostras, recomenda-se a utilização de seringas (de 1 ml) com uma agulha fina fixa (por exemplo Braun Omnikan-F). Enchem-se previamente as seringas com tampão (aproximadamente 100 μl), para eluir completamente os pequenos volumes de sangue colhidos em cada peixe. Colhem-se as amostras de sangue por punção cardíaca. Começa-se por anestesiar o peixe com MS-222 (100 mg/l). Um plano de anestesia correto permitirá ao utilizador distinguir o batimento cardíaco do peixe-zebra. Ao efetuar a punção cardíaca, mantém-se o pistão da seringa sob ligeira tensão. O volume de sangue que pode ser recolhido situa-se entre 20 e 40 microlitros. Após a punção cardíaca, transfere-se a mistura de sangue e tampão para um tubo de ensaio. Separa-se o plasma do resto do sangue por centrifugação (20 minutos a 5 000 g) e conserva-se o plasma a – 80 °C até às análises.
Protocolo 3C: Procedimento normalizado de homogeneização da cabeça e da cauda do peixe-zebra
|
1)
|
Anestesia-se e eutanasia-se cada peixe conforme consta da descrição do ensaio.
|
|
2)
|
Cortam-se a cabeça e a cauda de cada peixe como ilustrado na figura 1.
|
Importante: Para evitar que machos não-induzidos sejam contaminados por vitelogenina proveniente de fêmeas ou de machos induzidos, é necessário lavar e limpar corretamente (por exemplo com etanol a 96 %) os instrumentos de dissecação e a placa de corte antes de passar ao peixe seguinte.
Figura 1

|
3)
|
Pesa-se com aproximação de 1 mg o conjunto da cabeça e da cauda de cada peixe.
|
|
4)
|
Após pesagem, colocam-se ambas as partes em tubos adequados (por exemplo tubos de Eppendorf de 1,5 ml) e congela-se a – 80 °C até à homogeneização ou procede-se a homogeneização imediata sobre gelo com dois pilões de plástico. (Podem ser utilizados outros métodos, se forem realizados sobre gelo e deles resultar uma massa homogénea). Importante: É necessário numerar corretamente os tubos, a fim de que a cabeça e a cauda de cada peixe possam ser relacionadas com o resto do corpo correspondente, utilizado na histologia das gónadas.
|
|
5)
|
Uma vez homogeneizada a massa, adiciona-se uma quantidade de tampão de homogeneização (21) gelado correspondente a quatro vezes o peso dos tecidos. A mistura deve continuar a ser homogeneizada com os pilões até o estar completamente. Nota importante: É necessário utilizar pilões novos para cada peixe.
|
|
6)
|
Colocam-se as amostras em gelo até à centrifugação a 4 °C, durante 30 minutos, a 50 000 g.
|
|
7)
|
Por meio de uma pipeta, transferem-se volumes de 20 μl do sobrenadante para, pelo menos, dois tubos, mergulhando para o efeito a ponta da pipeta através da camada superficial lipídica e aspirando cuidadosamente sobrenadante sem resíduos da fração lipídica nem da camada depositada.
|
|
8)
|
Armazenam-se os tubos a – 80 °C até serem utilizados.
|
Apêndice 7
Amostras enriquecidas com vitelogenina e padrão de referência interno
Em cada dia em que se realizem determinações da vitelogenina, analisa-se uma amostra enriquecida com um padrão de referência interno. Na preparação do padrão de referência interno é necessário utilizar vitelogenina de um lote diferente do utilizado na preparação dos padrões de calibração para o ensaio em curso.
Prepara-se a amostra enriquecida adicionando uma quantidade conhecida do padrão interno a uma amostra de plasma de machos de controlo. Enriquece-se a amostra de modo a obter uma concentração de vitelogenina 10 a 100 vezes maior do que a concentração de vitelogenina esperada nos peixes machos de controlo. A amostra de plasma macho de controlo a enriquecer pode provir de um só peixe ou ser composta a partir de vários peixes.
Analisa-se uma subamostra de plasma de machos de controlo não-enriquecido em, pelo menos, dois alvéolos duplicados. Analisa-se a amostra enriquecida igualmente em, pelo menos, dois alvéolos duplicados. A fim de determinar a concentração esperada, adiciona-se a quantidade média de vitelogenina determinada nas duas amostras de plasma de machos de controlo não-enriquecido à quantidade de vitelogenina adicionada para enriquecer as amostras. Juntamente com os resultados de cada série de ensaios realizados no dia, indica-se no relatório a relação entre esta concentração esperada e a concentração medida.
Apêndice 8
Fluxograma de decisão para a análise estatística

C.38. ENSAIO DE METAMORFOSE EM ANFÍBIOS
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 231 (2009) da OCDE. A necessidade de desenvolver e validar um ensaio capaz de detetar produtos químicos com atividade no sistema tiróideo de vertebrados decorre dos receios acerca da possibilidade de os níveis ambientais dos produtos químicos em causa serem passíveis de ter efeitos indesejados nas populações humanas e na fauna e flora selvagens. Em 1998, a OCDE deu início a uma ação de elevada prioridade com vista à revisão dos Test Guidelines existentes e à elaboração de novos Test Guidelines para despistagem e ensaio de potenciais desreguladores do sistema endócrino. Um dos elementos dessa ação foi a elaboração de um Test Guideline para despistagem de produtos químicos com atividade no sistema tiróideo de espécies de vertebrados. Foram propostos uma versão aperfeiçoada do Estudo da Toxicidade Oral por Dose Repetida durante 28 dias em Roedores (capítulo B.7 deste anexo) e o Ensaio de Metamorfose em Anfíbios. O método de ensaio B.7 aperfeiçoado foi objeto de um processo de validação, tendo sido publicado o correspondente método de ensaio revisto. O Ensaio de Metamorfose em Anfíbios foi objeto de um vasto programa de validação, que compreendeu a realização de estudos intralaboratoriais e interlaboratoriais para demonstrar a pertinência e a fiabilidade do ensaio (1)(2). Subsequentemente, o trabalho de validação do ensaio foi objeto de uma avaliação por pares no âmbito de um painel de peritos independentes (3). O presente método constitui o corolário da experiência adquirida durante os estudos de validação da deteção de produtos químicos com atividade na tiroide, assim como dos trabalhos realizados noutros âmbitos nos países membros da OCDE.
|
PRINCÍPIO DO MÉTODO
|
2.
|
O Ensaio de Metamorfose em Anfíbios é um ensaio de despistagem para identificação empírica de produtos químicos passíveis de interferirem no funcionamento normal do eixo hipotálamo-hipófise-tiroide. Na medida em que se baseia nas funções e estruturas conservadas desse eixo, este ensaio constitui um modelo geral para vertebrados. É um ensaio importante, porque a metamorfose dos anfíbios é um processo dependente da tiroide bem estudado, reativo aos produtos químicos com atividade no eixo hipotálamo-hipófise-tiroide, sendo atualmente o único ensaio capaz de detetar atividade tiróidea em animais em processo de evolução morfológica.
|
|
3.
|
O esquema experimental geral compreende a exposição de girinos de Xenopus laevis no estádio 51, durante 21 dias, a, no mínimo, três concentrações diferentes de um produto químico e a um ensaio de controlo da água de diluição. Cada concentração é ensaiada em quatro replicados. No início do ensaio, a densidade de espécimes é de 20 girinos por cuba de ensaio em todos os grupos expostos. Os parâmetros a examinar são o comprimento das patas traseiras, a distância entre a boca e a cloaca, o estádio de desenvolvimento, o peso húmido, a histologia da tiroide e a mortalidade diária.
|
DESCRIÇÃO DO MÉTODO
Espécies ensaiadas
|
4.
|
A Xenopus laevis é criada sem dificuldades em laboratórios de todo o mundo e também é fácil de obter através dos fornecedores comerciais. A reprodução desta espécie é facilmente induzida ao longo de todo o ano por meio de injeções de gonadotropina coriónica humana (hCG), podendo criar-se sem dificuldades, em grande número, as larvas resultantes até um estádio de desenvolvimento que possibilite a aplicação de um protocolo de ensaio específico para esse estádio. É preferível que as larvas utilizadas no ensaio provenham de adultos criados no mesmo laboratório. Em alternativa, embora não seja o método preferido, podem aclimatar-se no laboratório onde irá realizar-se o ensaio ovos ou embriões de outra proveniência. Não é, porém, admissível a utilização neste ensaio de animais em estado larvar não provenientes do próprio laboratório.
|
Equipamento e fornecimentos
|
5.
|
São necessários os seguintes fornecimentos e equipamento para a realização deste ensaio:
|
a)
|
Sistema de exposição (adiante descrito);
|
|
b)
|
Aquários de vidro ou de aço inoxidável (adiante descritos);
|
|
c)
|
Tanques de reprodução;
|
|
d)
|
Aparelhos de controlo de temperatura (dispositivos de aquecimento ou de arrefecimento, reguláveis a 22 °C ± 1 °C);
|
|
f)
|
Microscópio binocular de dissecação;
|
|
g)
|
Máquina fotográfica digital com resolução mínima de 4 megapixels e função micro;
|
|
h)
|
Software de digitalização de imagens;
|
|
i)
|
Placas de Petri (por exemplo 100 mm × 15 mm) ou cubas de plástico transparente de tamanho semelhante;
|
|
j)
|
Balança analítica com uma aproximação de três casas decimais (mg).
|
|
k)
|
Aparelho de medição do oxigénio dissolvido;
|
|
m)
|
Aparelho de medição (em lux) da intensidade luminosa;
|
|
n)
|
Diversos utensílios e material de vidro de laboratório;
|
|
o)
|
Pipetas reguláveis (de 10 μl a 5 000 μl) ou série de pipetas dos volumes equivalentes;
|
|
p)
|
Quantidade do produto químico em estudo suficiente para a realização deste, de preferência de um único lote;
|
|
q)
|
Instrumentação analítica adequada para o produto químico em estudo ou contratação dos serviços analíticos necessários.
|
|
Possibilidade de ensaiar o produto químico em estudo
|
6.
|
O Ensaio de Metamorfose em Anfíbios baseia-se num protocolo de exposição em fase aquosa que passa pela introdução do produto químico em estudo nas cubas de ensaio por meio de um sistema de fluxo contínuo. Porém, os métodos de fluxo contínuo condicionam os tipos de produtos químicos que podem ser ensaiados, em função das propriedades físico-químicas dos mesmos. Antes de aplicar este protocolo é, portanto, necessário obter informações de base acerca do produto químico em causa que permitam determinar se o mesmo pode ou não ser-lhe aplicado, bem como consultar o documento de orientações da OCDE sobre ensaios de toxicidade em meio aquático de substâncias e misturas difíceis (4). Entre as características indicadoras de que um produto químico pode ser difícil de ensaiar em sistemas aquáticos contam-se as seguintes: coeficiente de partição n-octanol/água (log Kow) elevado, volatilidade elevada, tendência para hidrólise e tendência para fotólise nas condições de iluminação ambiente do laboratório. Ao verificar se é possível realizar o ensaio, pode ser pertinente ter em conta outros fatores, a avaliar caso a caso. Se não for possível realizar um ensaio de fluxo contínuo do produto químico em estudo, pode recorrer-se a um sistema de renovação estático. Se o produto químico em causa não se adaptar a nenhum destes sistemas, em princípio não se lhe poderá aplicar o presente protocolo.
|
Sistema de exposição
|
7.
|
Sempre que possível, prefere-se um sistema de diluição de fluxo contínuo a um sistema de renovação estático. Se as propriedades físicas e/ou químicas do produto químico em estudo não se adaptarem a um sistema de diluição de fluxo contínuo, pode utilizar-se um sistema de exposição alternativo (por exemplo um sistema de renovação estático). Os componentes do sistema em contacto com a água devem ser de vidro, de aço inoxidável e/ou de politetrafluoroetileno. No entanto, podem ser utilizados plásticos adequados que não perturbem o estudo. As cubas de exposição devem ser aquários de vidro ou de aço inoxidável equipados com colunas (standpipes) que permitam manter o volume entre 4,0 l e 10,0 l e a profundidade mínima entre 10 cm e 15 cm. O sistema deve suportar todas as concentrações de exposição, assim como os ensaios de controlo, estando previstos quatro replicados por nível de exposição. O caudal que aflui a cada cuba deve ser constante (por exemplo 25 ml/minuto), a fim de que as condições biológicas e a exposição ao produto químico se mantenham estáveis. Para reduzir potenciais efeitos posicionais, nomeadamente ligeiras variações de temperatura, da intensidade luminosa etc., distribuem-se as cubas com as diversas concentrações de exposição de modo aleatório no sistema de exposição. Utiliza-se iluminação fluorescente para gerar um fotoperíodo de 12 horas de luz seguidas de 12 horas de escuridão, devendo a intensidade à superfície da água estar compreendida entre 600 e 2 000 lux (lúmen/m2). Em cada cuba de ensaio, é necessário manter a temperatura da água a 22 °C ± 1 °C e o pH entre 6,5 e 8,5, tendo a concentração de oxigénio dissolvido de ser superior a 3,5 mg/l (> 40 % da saturação com ar). Medem-se a temperatura, o pH e a concentração de oxigénio dissolvido pelo menos uma vez por semana. De preferência, mede-se a temperatura continuamente em, pelo menos, uma cuba de ensaio. Descrevem-se no apêndice 1 as condições experimentais de execução do protocolo. Para mais informações sobre a constituição de sistemas de exposição de fluxo contínuo e/ou de sistemas de renovação estáticos, ver o guia da ASTM para a realização de ensaios de toxicidade aguda em peixes, macroinvertebrados e anfíbios (5) e os ensaios gerais de toxicidade em meio aquático.
|
Qualidade da água
|
8.
|
Pode utilizar-se qualquer água disponível no local (por exemplo água de nascente ou água da torneira filtrada por carvão) que permita o crescimento e o desenvolvimento normais de girinos de Xenopus Laevis. Visto que a qualidade da água pode diferir substancialmente de uma zona para outra, é necessário analisar a qualidade da água, sobretudo no caso de não se dispor de dados históricos sobre a utilização da mesma na criação de Xenopus. Importa, em especial, que a água não contenha cobre, cloro ou cloraminas, que são tóxicos para as rãs e os girinos. Recomenda-se igualmente a determinação analítica dos níveis de fundo de fluoretos, percloratos e cloratos (subprodutos da desinfeção realizada para tornar a água potável) na água, pois estes aniões são substratos do transportador de iodo da glândula tiroide e níveis elevados de qualquer deles podem perturbar os resultados do estudo. Analisa-se a água antes de iniciar o ensaio e, normalmente, a água deve estar isenta destes aniões.
|
Concentração de iodo na água utilizada no ensaio
|
9.
|
Para que a glândula tiroide possa sintetizar as hormonas tiróideas, as larvas têm de dispor de iodo suficiente, proveniente da água e dos alimentos. Não existem ainda recomendações empíricas sobre concentrações mínimas de iodetos. Todavia, a disponibilidade de iodetos pode afetar a capacidade de resposta do sistema tiróideo aos agentes com atividade na tiroide e sabe-se que influencia a atividade basal da glândula tiroide, aspeto a ter em conta na interpretação de resultados histopatológicos da tiroide. Há, portanto, que incluir no relatório as concentrações de iodetos medidas na água utilizada no ensaio. Com base nos dados provenientes dos estudos de validação, comprovou-se que o protocolo funciona bem quando a concentração de iodetos (I-) na água utilizada nos ensaio se situa entre 0,5 μg/l e 10 μg/l. Idealmente, a concentração de iodetos nessa água não deve ser inferior a 0,5 μg/l. Se a água utilizada no ensaio for obtida por reconstituição de água desionizada, é necessário adicionar iodo de modo a obter uma concentração não inferior a 0,5 μg/l. É necessário mencionar no relatório qualquer outro suplemento de iodetos ou de outros sais incorporado na água utilizada no ensaio.
|
Manutenção dos animais
Tratamento e reprodução dos adultos
|
10.
|
O tratamento a dar aos adultos e a reprodução dos mesmos pautam-se por orientações genéricas. Para mais informações, pode consultar-se o guia geral para a realização de ensaios de teratogénese em embriões de rãs (FETAX) (6). Esse guia apresenta um exemplo de métodos adequados de tratamento e de reprodução, mas não é obrigatória uma observância estrita. Para induzir a reprodução, injeta-se gonadotropina coriónica humana (hCG) em (3 a 5) pares de machos e fêmeas adultos. Injetam-se fêmeas e machos com 800 UI a 1 000 UI e 600 UI a 800 UI, respetivamente, de hCG dissolvida em soro fisiológico 0,6-0,9 %. Para estimular o amplexo, colocam-se os pares reprodutores em tanques grandes, em condições estáticas, não os perturbando. No fundo de cada tanque de reprodução, deve existir uma rede de aço inoxidável ou de plástico, para que as massas de ovos possam cair para o fundo falso assim constituído. Normalmente, as rãs injetadas ao fim da tarde porão a maior parte dos ovos a meio da manhã do dia seguinte. Logo que se disponha de uma quantidade suficiente de ovos fertilizados, retiram-se os adultos dos tanques de reprodução.
|
Tratamento e seleção das larvas
|
11.
|
Depois de se retirarem os adultos dos tanques de reprodução, recolhem-se os ovos e avalia-se a viabilidade dos mesmos numa amostra representativa dos embriões colhida em cada tanque. Escolhem-se a melhor ou as melhores posturas (recomendam-se duas a três para avaliar a qualidade das posturas) com base na viabilidade dos embriões e na presença de um número adequado deles (mínimo 1 500). Os organismos utilizados no estudo devem provir da mesma postura (ou seja, não pode haver mistura de organismos provenientes de posturas diferentes). Transferem-se os embriões para um prato ou tabuleiro grande e retiram-se os ovos manifestamente mortos ou anormais [ver definições na referência (5)], utilizando para o efeito uma pipeta ou um conta-gotas. Transferem-se separadamente os embriões sãos de cada uma das três posturas para três tanques de eclosão. Quatro dias após esta transferência, seleciona-se a melhor postura, com base em critérios de viabilidade e de êxito da eclosão, após o que se repartem as larvas dessa postura por um número adequado de tanques de criação a 22 °C ± 1 °C. Transferem-se larvas adicionais para tanques suplementares, a fim de servirem de substitutas caso haja mortes nos tanques de criação durante a primeira semana. Este processo permite manter uma densidade de organismos coerente, o que reduz as divergências de desenvolvimento no universo de uma dada postura. Procede-se diariamente a uma aspiração de limpeza por sifonagem dos tanques de criação. Por precaução, preferem-se luvas de vinilo ou nitrilo a luvas de látex. Retiram-se diariamente os indivíduos mortos e substituem-se por larvas do grupo de substituição, a fim de manter uma densidade de organismos constante durante a primeira semana. Alimentam-se as larvas pelo menos duas vezes por dia.
|
|
12.
|
Durante a fase de pré-exposição, aclimatam-se os girinos às condições reais da fase de exposição, designadamente ao tipo de alimentos, à temperatura, ao ciclo luz-escuridão e ao meio de criação. Recomenda-se, portanto, a utilização da mesma água de criação/diluição na fase de pré-exposição e na fase de exposição. Caso os girinos sejam mantidos num sistema de criação estático na fase de pré-exposição, é necessário substituir completamente o meio de criação pelo menos duas vezes por semana. Importa evitar a sobrepopulação causada por uma densidade de larvas elevada durante o período de pré-exposição, dado que, por efeito desta, o desenvolvimento dos girinos poderia ser depois fortemente afetado na fase de ensaio. Por conseguinte, a densidade de criação não deve exceder, aproximadamente, quatro girinos por litro de meio de criação (no sistema de exposição estático) ou 10 girinos por litro de meio de criação (considerando um caudal de, por exemplo, 50 ml/minuto no sistema de pré-exposição ou de criação). Nestas condições, os girinos desenvolvem-se dos estádios 45/46 para o estádio 51 em doze dias. Diariamente, examinam-se girinos representativos desta população de reserva a fim de determinar o estádio de desenvolvimento em que se encontram, para definir o momento adequado para início da exposição. Há que procurar minimizar a tensão e os traumas causados aos girinos, em especial durante as movimentações, a limpeza dos aquários e a manipulação das larvas. Há que evitar situações e ações que possam gerar tensão, como ruídos fortes e/ou continuados, batimentos ou vibrações nos aquários, excesso de atividade no laboratório e variações rápidas de condições do meio (iluminação, temperatura, pH, oxigénio dissolvido, caudais de água etc.). Se os girinos não atingirem o estádio 51 nos 17 dias posteriores à fertilização, a causa poderá ter sido um excesso de tensão.
|
Criação e alimentação das larvas
|
13.
|
Alimentam-se os girinos durante o período de pré-exposição [após o estádio 45/46 segundo Nieuwkoop e Faber, referência (8)] e todo o período de ensaio de 21 dias recorrendo, por exemplo, ao alimento comercial para girinos utilizado nos estudos de validação (ver também o apêndice 1) ou fornecendo-lhes outro alimento comprovadamente equiparável para efeitos do Ensaio de Metamorfose em Anfíbios. Durante o período de pré-exposição, é necessário adaptar cuidadosamente o regime alimentar às necessidades de desenvolvimento dos girinos. Ou seja, fornecem-se pequenas quantidades de alimento várias vezes por dia (pelo menos duas vezes) aos girinos recém-eclodidos. A fim de manter a qualidade da água e de não colmatar os filtros branquiais com partículas de alimentos e detritos, não deve fornecer-se uma quantidade excessiva de alimentos. Caso se recorra ao alimento para girinos utilizado nos estudos de validação, é necessário aumentar a ração diária em concomitância com o crescimento dos girinos, atingindo 30 mg diários por animal pouco antes do início do ensaio. Mostrou-se nos estudos de validação que este alimento disponível no comércio sustenta um crescimento e desenvolvimento adequados dos girinos de Xenopus laevis. Constituído por partículas finas, mantém-se em suspensão na coluna de água durante bastante tempo e é evacuado com o fluxo através do sistema. Por conseguinte, subdivide-se a quantidade diária de alimento e alimentam-se os girinos pelo menos duas vezes por dia. O regime correspondente a este alimento é descrito no quadro 1. Registam-se as quantidades de alimento fornecidas e a frequência com que o são. Este alimento pode ser fornecido seco ou sob a forma de uma solução de reserva em água de diluição. Prepara-se uma solução de reserva fresca de dois em dois dias e guarda-se esta solução a 4 °C.
Quadro 1.
Regime alimentar de girinos de Xenopus laevis com o alimento comercial para girinos utilizado nos estudos de validação, fornecido após a eclosão no Ensaio de Metamorfose em Anfíbios em condições de fluxo contínuo.
|
Dia do estudo
|
Dose de alimento (mg diários de alimento por animal)
|
|
0-4
|
30
|
|
5-7
|
40
|
|
8-10
|
50
|
|
11-14
|
70
|
|
15-21
|
80
|
|
Análises químicas
|
14.
|
Antes de iniciar o estudo, é necessário avaliar a estabilidade do produto químico com base nas informações disponíveis sobre a solubilidade, degradabilidade e volatilidade do mesmo. No início do ensaio (dia 0) e uma vez por semana durante o ensaio, com um mínimo de quatro amostras, colhem-se amostras das soluções em estudo, para as análises químicas, em cada cuba replicada de cada concentração. Para verificar o funcionamento do sistema, recomenda-se igualmente que cada concentração a ensaiar seja analisada antes de se iniciar o ensaio, durante a preparação do sistema. Recomenda-se ainda que as soluções de reserva sejam analisadas sempre que sejam renovadas, especialmente se o volume da solução de reserva não fornecer a quantidade do produto químico necessária para a totalidade de cada período a que se reportam as colheitas de amostras de rotina. Se o produto químico for indetetável a algumas ou a todas as concentrações utilizadas no ensaio, é necessário analisar as soluções de reserva e registar os caudais através do sistema, a fim de calcular as concentrações nominais.
|
Modo de incorporação do produto químico em estudo
|
15.
|
O método utilizado para introduzir no sistema o produto químico em estudo depende das propriedades físico-químicas do mesmo. Os produtos químicos hidrossolúveis podem ser dissolvidos em alíquotas da água utilizada no ensaio, numa concentração que permita a incorporação no sistema de fluxo contínuo à concentração de ensaio visada. Os produtos químicos líquidos à temperatura ambiente e pouco solúveis em água podem ser introduzidos no sistema recorrendo a métodos de saturação líquido-líquido. Os produtos químicos sólidos à temperatura ambiente e pouco solúveis em água podem ser introduzidos no sistema recorrendo a colunas de saturação com enchimento de fibra de vidro (7). Preferem-se sistemas de ensaio que não façam uso de um veículo, mas os diferentes produtos químicos possuem propriedades físico-químicas diversas, que presumivelmente exigirão abordagens distintas na preparação das soluções aquosas de exposição. As razões pelas quais se deve evitar a utilização de solventes ou de veículos são as seguintes: i) alguns solventes podem gerar eles próprios toxicidade e/ou reações endócrinas indesejadas ou inesperadas; ii) o ensaio de produtos químicos a concentrações superiores à correspondente hidrossolubilidade (como sucede frequentemente ao utilizar um solvente) pode falsear a determinação das concentrações efetivas; iii) a utilização de solventes nos ensaios mais longos pode resultar na formação significativa de biofilmes associados a atividade microbiana. No caso dos produtos químicos difíceis de ensaiar, pode, em último recurso, utilizar-se um solvente, devendo consultar-se o documento de orientações da OCDE sobre ensaios de toxicidade em meio aquático de substâncias e misturas difíceis (4) para determinar o melhor método. A escolha do solvente a utilizar depende das propriedades químicas do produto químico em causa. Entre os solventes que se revelaram adequados para ensaios de toxicidade em meio aquático contam-se a acetona, o etanol, o metanol, a dimetilformamida e o trietilenoglicol. Caso se utilize um solvente como veículo, as concentrações do solvente devem ser inferiores à concentração sem efeitos observáveis (NOEC) — o documento de orientações da OCDE recomenda que não seja ultrapassada a concentração de 100 μl/l, mas uma revisão recente recomenda concentrações de solventes da ordem dos 20 μl por litro de água de diluição (12). Caso se utilize um solvente como veículo, é necessário efetuar um ensaio de controlo adequado do solvente, além do ensaio dos outros grupos de controlo (água limpa). Se não for possível introduzir o produto químico através da água, quer devido às características físico-químicas (baixa solubilidade) do mesmo quer em virtude da reduzida disponibilidade do produto químico, pode ponderar-se a introdução por via alimentar. Realizaram-se alguns trabalhos preliminares sobre a exposição pela via alimentar, mas esta via não é habitualmente utilizada. A escolha do método deve ser justificada por via documental e ser objeto de uma verificação analítica.
|
Escolha das concentrações a utilizar no ensaio
Definição da concentração mais elevada
|
16.
|
A concentração mais elevada a ensaiar é a mais baixa das seguintes concentrações: limite de solubilidade do produto químico em estudo, concentração máxima tolerada (CMT, no caso dos produtos químicos com efeitos tóxicos agudos) ou 100 mg/l.
|
|
17.
|
Define-se a concentração máxima tolerada como a concentração mais elevada do produto químico em estudo que gera menos de 10 % de mortalidade aguda. Esta abordagem pressupõe a existência de dados empíricos de mortalidade devida a toxicidade aguda a partir dos quais se pode estimar a concentração máxima tolerada. A estimativa da concentração máxima tolerada pode ser inexata e, normalmente, requer uma certa capacidade de apreciação na matéria. Embora, tecnicamente, a utilização de modelos de regressão seja o melhor método de estimativa da concentração máxima tolerada, pode obter-se uma aproximação útil a partir de dados de toxicidade aguda utilizando o valor correspondente a 1/3 da CL50. Todavia, pode dar-se o caso de não estarem disponíveis dados de toxicidade aguda para a espécie em estudo. Se assim for, pode realizar-se um ensaio de CL50 às 96 horas com girinos representativos (isto é, que se encontrem no mesmo estádio) dos ensaiados pelo Ensaio de Metamorfose em Anfíbios. Caso se disponha de dados relativos a outras espécies aquáticas (por exemplo estudos de CL50 em peixes ou noutras espécies de anfíbios), é igualmente possível, com base na experiência profissional, recorrer a uma extrapolação interespécies para estimar o valor provável da concentração máxima tolerada.
|
|
18.
|
Se o produto químico não tiver efeitos tóxicos agudos e se mantiver solúvel acima de 100 mg/l, pode, como alternativa, considerar-se esta concentração a concentração mais elevada a ensaiar, dado que, normalmente, a mesma é considerada “praticamente não-tóxica”.
|
|
19.
|
Embora não constituam o procedimento recomendado, podem utilizar-se métodos de renovação estáticos se os métodos de fluxo contínuo forem inadequados para atingir a concentração máxima tolerada. Caso se utilize um método de renovação estático, é necessário justificar por via documental a estabilidade do produto químico à concentração em causa, que deve respeitar o limite estabelecido nos critérios de desempenho. Recomenda-se que os períodos de renovação tenham a duração de 24 horas, não sendo aceitáveis períodos de renovação que se prolonguem por mais de 72 horas. No final de cada período de renovação, imediatamente antes desta, medem-se parâmetros de qualidade da água como o oxigénio dissolvido, a temperatura e o pH.
|
Gama de concentrações a ensaiar
|
20.
|
Constitui requisito mínimo o ensaio de três concentrações e um ensaio de controlo da água limpa (assim como, se necessário, um ensaio de controlo do veículo). A relação entre as concentrações ensaiadas mais elevada e mais baixa deve ser, no mínimo, de aproximadamente uma ordem de grandeza. O fator que relaciona duas quaisquer doses consecutivas deve estar compreendido entre 0,1 (separação máxima) e 0,33 (separação mínima).
|
PROCEDIMENTO DE ENSAIO
Início e prosseguimento do ensaio
Dia 0
|
21.
|
Inicia-se a exposição quando o número de girinos da população de reserva pré-exposição que atingiram o estádio de desenvolvimento 51, segundo Nieuwkoop e Faber (8), for suficiente, sendo a idade dos mesmos inferior ou igual a 17 dias após a fertilização. Tendo em vista a seleção dos animais a utilizar no ensaio, reúnem-se girinos saudáveis e de aparência normal da população de reserva numa cuba única com um volume adequado de água de diluição. Para se determinar o estádio de desenvolvimento, retiram-se os girinos um a um do tanque de reunião, utilizando uma pequena rede ou um pequeno coador, e transferem-se para uma célula de medição transparente (por exemplo uma placa de Petri de 100 mm) contendo água de diluição. Para se determinar o estádio de desenvolvimento, é preferível não utilizar anestesia, embora se possa anestesiar um a um os girinos, antes de os manipular, com uma solução a 100 mg/l de metanossulfonato de tricaína (por exemplo MS-222), adequadamente tamponada com bicarbonato de sódio (pH 7,0). Caso se recorra a anestesia, é necessário obter de um laboratório experiente a metodologia adequada para utilizar, por exemplo, o MS-222 e descrevê-la no relatório juntamente com os resultados do ensaio. Importa manipular os animais com cuidado durante esta transferência, a fim de minimizar a tensão associada à manipulação e de evitar causar-lhes alguma lesão.
|
|
22.
|
Determina-se o estádio de desenvolvimento dos animais utilizando um microscópio binocular de dissecação. Para reduzir a variabilidade final do estádio de desenvolvimento, é importante que este estádio seja determinado com o máximo de exatidão possível. Segundo Nieuwkoop e Faber (8), o primeiro referencial de desenvolvimento para a seleção de organismos que se encontrem no estádio 51 é a morfologia das patas traseiras. Examinam-se as características morfológicas das patas traseiras ao microscópio. Embora deva consultar-se na íntegra o guia de Nieuwkoop e Faber (8) para obter informações completas sobre a determinação do estádio de desenvolvimento dos girinos, este pode ser determinado com fiabilidade com base em referenciais morfológicos claros. Pode utilizar-se o quadro seguinte para simplificar e normalizar o processo de determinação do estádio de desenvolvimento ao longo do estudo, identificando os referenciais morfológicos claramente associados aos diferentes estádios num processo de desenvolvimento normal.
Quadro 2.
Referenciais morfológicos claros para determinação do estádio de desenvolvimento, segundo as orientações de Neuwkoop e Faber.
|
Referencial morfológico
|
Estádio de desenvolvimento
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Patas traseiras
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Patas dianteiras
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Estrutura craniofacial
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morfologia do nervo olfativo
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Comprimento da cauda
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Os girinos com os quais se inicia o ensaio devem estar no estádio 51. O referencial morfológico mais claro para determinação desse estádio de desenvolvimento é a morfologia das patas traseiras, mostrada na figura 1.
Figura 1.
Morfologia das patas traseiras num girino de Xenopus laevis no estádio de desenvolvimento 51.

|
|
24.
|
Além da seleção em função do estádio de desenvolvimento, os animais a utilizar no ensaio também podem ser selecionados com base no seu tamanho. Para o efeito, mede-se no dia 0 o comprimento total do corpo (não a distância entre a boca e a cloaca) dos animais de uma subamostra de aproximadamente 20 girinos no estádio de desenvolvimento 51 segundo Neuwkoop e Faber. Uma vez calculado o comprimento médio do corpo dos animais deste subgrupo, podem ser estabelecidos um limite mínimo e um limite máximo para o comprimento do corpo dos animais a utilizar no ensaio, admitindo um desvio máximo de 3 mm em relação ao valor médio (os valores médios do comprimento do corpo dos girinos no estádio de desenvolvimento 51 variam entre 24,0 mm e 28,1 mm). No entanto, o estádio de desenvolvimento continua a ser o parâmetro principal para determinar a aptidão de um animal para o ensaio. Excluem-se do ensaio os girinos com lesões ou deformações manifestas.
|
|
25.
|
Os girinos que satisfaçam o critério do estádio de desenvolvimento supra conservam-se num tanque de água de criação limpa até ao termo do processo de determinação daquele estádio. Uma vez concluído este processo, distribuem-se aleatoriamente as larvas pelos tanques de exposição até que cada um contenha 20 larvas. Em seguida, verifica-se se há animais com aspeto anómalo (por exemplo lesões, natação anormal etc.) em algum tanque. Removem-se dos tanques de exposição os girinos claramente com aspeto pouco saudável e substituem-se por novas larvas retiradas do tanque de reunião.
|
Exames
|
26.
|
Para informações mais aprofundadas sobre a conclusão do ensaio e o tratamento dos girinos, consultar o documento de orientações da OCDE sobre a histologia da tiroide em anfíbios (9).
|
Medições a efetuar no dia 7
|
27.
|
No dia 7, retiram-se de cada tanque de ensaio cinco girinos escolhidos aleatoriamente em cada replicado. O processo de escolha aleatória utilizado deve garantir a cada organismo que participa no ensaio a mesma probabilidade de ser selecionado. Para isso, pode utilizar-se qualquer método de aleatorização, mas todos os girinos têm de ser capturados com uma rede. Os girinos não selecionados são repostos no tanque de origem; os girinos selecionados são eutanasiados sem sofrimento, por exemplo numa solução com a concentração de 150-200 mg/l de MS-222, adequadamente tamponada com bicarbonato de sódio para pH 7,0. Lavam-se com água os girinos eutanasiados e enxugam-se, determinando-se em seguida o peso de cada um com a aproximação de 1 mg. Determinam-se em cada girino o comprimento das patas traseiras, a distância entre a boca e a cloaca e o estádio de desenvolvimento (utilizando um microscópio binocular de dissecação).
|
Medições a efetuar no dia 21 (termo do ensaio)
|
28.
|
No final do ensaio (dia 21), retiram-se os girinos restantes dos tanques de ensaio e eutanasiam-se sem sofrimento, como anteriormente indicado (por exemplo numa solução com a concentração de 150-200 mg/l de MS-222, adequadamente tamponada com bicarbonato de sódio para pH 7,0). Lavam-se os girinos com água e enxugam-se, determinando-se em seguida o peso de cada um com a aproximação de 1 mg. Determinam-se em cada girino o estádio de desenvolvimento, a distância entre a boca e a cloaca e o comprimento das patas traseiras.
|
|
29.
|
Tendo em vista as avaliações histológicas, colocam-se todas as larvas durante 48 a 72 horas em fixador de Davidson, sob a forma de amostras de corpo inteiro ou sob a forma de amostras unicamente da cabeça, incluindo a mandíbula. Retira-se de cada tanque de replicação uma amostra de cinco girinos para a histopatologia. Dado que a espessura de células foliculares da tiroide depende do estádio de desenvolvimento (10), o método de amostragem mais adequado para as análises histológicas consiste em selecionar indivíduos que se encontrem, o mais possível, no mesmo estádio. A fim de selecionar girinos nessas condições, começa-se por determinar o estádio de desenvolvimento de cada larva antes da seleção de larvas e do tratamento posterior das mesmas para recolha de dados e conservação. É necessário proceder deste modo porque as diferenças normais de desenvolvimento traduzem-se na ocorrência de diferentes estádios de desenvolvimento em cada tanque de replicação.
|
|
30.
|
Sempre que possível, os animais selecionados para a histopatologia (n = 5 de cada replicado) devem corresponder à mediana dos estádios de desenvolvimento em que se encontram os girinos de controlo (todos os replicados de controlo reunidos). Nos tanques de replicação em que existam mais de cinco larvas no estádio adequado, selecionam-se aleatoriamente cinco delas.
|
|
31.
|
Nos tanques de replicação com menos de cinco larvas no estádio adequado, selecionam-se aleatoriamente indivíduos no estádio de desenvolvimento imediatamente inferior ou superior, de modo a completar uma amostra de cinco larvas por replicado. De preferência, a decisão de incorporar na amostra larvas do estádio de desenvolvimento imediatamente inferior ou superior deve basear-se numa avaliação global da distribuição por estádios nos grupos de controlo e nos grupos expostos ao produto químico em estudo. Ou seja, se à exposição ao produto químico em estudo estiver associado um atraso de desenvolvimento, as larvas adicionais a incorporar na amostra devem provir do estádio imediatamente inferior. Em contrapartida, se à exposição ao produto químico em estudo estiver associada uma aceleração do desenvolvimento, as larvas adicionais a incorporar na amostra devem provir do estádio imediatamente superior.
|
|
32.
|
Caso a exposição ao produto químico em estudo altere fortemente o desenvolvimento dos girinos, pode não haver nenhuma sobreposição entre a distribuição por estádios nos grupos expostos ao produto químico em estudo e a mediana calculada dos estádios de desenvolvimento dos girinos de controlo. Unicamente nesses casos, modifica-se o processo de seleção, utilizando um estádio diferente da mediana dos estádios em que se encontram os girinos de controlo para estabelecer uma correspondência com o estádio em que se encontram as larvas que integram as amostras destinadas à histopatologia da tiroide. Se os estádios forem indeterminados (no caso de assincronia), selecionam-se aleatoriamente para as análises histológicas cinco girinos de cada replicado. As razões que tiverem justificado a incorporação nas amostras de larvas cujo estádio de desenvolvimento não seja equivalente à mediana dos estádios de desenvolvimento em que se encontram os girinos de controlo devem constar do relatório.
|
Determinação dos parâmetros biológicos
|
33.
|
Durante a fase de exposição de 21 dias, medem-se os parâmetros principais nos dias 7 e 21, mas é necessário examinar diariamente os animais que participam no ensaio. O quadro 3 resume os parâmetros a medir e o momento em que os exames correspondentes devem ser efetuados. Os documentos de orientações da OCDE (9) contêm informações mais pormenorizadas sobre as técnicas de medição dos parâmetros apicais e de avaliação histológica.
Quadro 3.
Momento da realização dos exames correspondentes ao parâmetros principais do Ensaio de Metamorfose em Anfíbios.
|
Parâmetro apical
|
Diariamente
|
Dia 7
|
Dia 21
|
|
|
·
|
|
|
|
—
|
Estádio de desenvolvimento
|
|
|
·
|
·
|
|
—
|
Comprimento das patas traseiras
|
|
|
·
|
·
|
|
—
|
Distância entre a boca e a cloaca
|
|
|
·
|
·
|
|
|
|
·
|
·
|
|
|
|
|
·
|
|
Parâmetros apicais
|
34.
|
O estádio de desenvolvimento, o comprimento das patas traseiras, a distância entre a boca e a cloaca e o peso corporal húmido constituem os parâmetros apicais do Ensaio de Metamorfose em Anfíbios. Descrevem-se resumidamente a seguir. Os documentos de orientações referidos contêm informações técnicas suplementares sobre a recolha destes dados, incluindo os métodos recomendados de análise assistida por computador.
|
Estádio de desenvolvimento
|
35.
|
Determina-se o estádio de desenvolvimento dos girinos de Xenopus laevis com base nos critérios estabelecidos por Nieuwkoop e Faber (8) para classificar esses estádios. Utilizam-se os dados relativos ao estádio de desenvolvimento para determinar se o desenvolvimento é acelerado, assíncrono ou retardado ou não é afetado. Determinam-se as acelerações e os atrasos de desenvolvimento por comparação da mediana dos estádios atingidos pelos grupos expostos e pelos grupos de controlo. Considera-se que existe uma assincronia de desenvolvimento quando os tecidos examinados não apresentam nenhuma anomalia ou malformação, mas se verifica um desfasamento relativo da morfogénese ou do desenvolvimento entre os diferentes tecidos do girino examinado.
|
Comprimento das patas traseiras
|
36.
|
A diferenciação e o crescimento das patas traseiras são regulados pelas hormonas da tiroide e constituem referenciais de desenvolvimento importantes, já utilizados na determinação do estádio de desenvolvimento. O desenvolvimento das patas traseiras é utilizado como elemento qualitativo na determinação do estádio de desenvolvimento, mas neste item é considerado um parâmetro quantitativo. Mede-se, portanto, o parâmetro comprimento das patas traseiras para detetar efeitos no eixo tiróideo (figura 2). Por razões de coerência, mede-se o comprimento da pata traseira esquerda. Determina-se este comprimento nos dias 7 e 21 do ensaio. No dia 7, a medição deste comprimento não oferece dificuldades, como se ilustra na figura 2. Porém, no dia 21, a medição é mais complicada, devido às curvas existentes nas patas. As medições do comprimento das patas traseiras realizadas no dia 21 são, portanto, efetuadas a partir da parede corporal, ao longo da linha média do membro e absorvendo todos os desvios angulares. Mesmo que as alterações verificadas no comprimento das patas traseiras ao dia 7 já não sejam identificáveis ao dia 21, não deixam de ser consideradas um indicador de atividade potencial sobre a tiroide. Utilizando software de análise de imagem, medem-se estes comprimentos em fotografias digitalizadas, conforme de explica no documento de orientações da OCDE sobre a histologia da tiroide em anfíbios (9).
|
Comprimento e peso húmido do corpo
|
37.
|
O protocolo do ensaio compreende a determinação da distância entre a boca e a cloaca (figura 2) e do peso húmido para avaliar eventuais efeitos do produto químico em estudo na taxa de crescimento dos girinos, comparativamente ao grupo de controlo, sendo ambos úteis na deteção de toxicidade generalizada do produto químico em estudo. Uma vez que a eliminação da água à superfície dos girinos para a realização das pesagens pode causar-lhes tensão e lesionar-lhes a pele, as medições realizam-se, no dia 7, na subamostra de girinos então constituída, no final do ensaio (dia 21), em todos os girinos restantes. Por razões de coerência, considera-se para extremo caudal da medição o lado cranial da cloaca.
|
|
38.
|
A distância entre a boca e a cloaca que serve para avaliar o crescimento dos girinos é ilustrada na figura 2.
Figura 2.
Tipos de medições de comprimento no corpo (A) e medição do comprimento das patas traseiras (B), em girinos de Xenopus laevis (1).

|
Histologia da tiroide
|
39.
|
Embora o estádio de desenvolvimento e o comprimento das patas traseiras sejam parâmetros importantes para avaliar alterações do desenvolvimento metamórfico causadas pela exposição, não pode considerar-se que, por si só, um atraso de desenvolvimento seja indicador de atividade antitiróidea. Algumas alterações só são observáveis através de análises histopatológicas de rotina. Entre os critérios de diagnóstico contam-se a atrofia/hipertrofia da tiroide, a hipertrofia ou hiperplasia das células foliculares da tiroide e os seguintes critérios qualitativos adicionais: superfície do lúmen folicular, qualidade do coloide e espessura/forma das células foliculares da tiroide. Indicam-se no relatório os graus de intensidade (4 níveis). A referência (9) (Amphibian Metamorphosis Assay: Part 1 — Technical guidance for morphologic sampling and histological preparation e Amphibian Metamorphosis Assay: Part 2 — Approach to reading studies, diagnostic criteria, severity grading and atlas) contém informações relativas à obtenção e ao tratamento de amostras destinadas a análise histológica e sobre a realização de análises histológicas a amostras de tecidos. Antes de efetuarem análises e avaliações histológicas da tiroide, os laboratórios que realizem o ensaio pela primeira vez (ou nas primeiras vezes que o realizarem) devem aconselhar-se com patologistas experientes a fim de obterem formação neste domínio. A ocorrência de alterações importantes e manifestas dos parâmetros apicais que indiciem assincronias ou acelerações do desenvolvimento podem dispensar a realização de análises histopatológicas da tiroide. Todavia, a ausência de alterações morfológicas manifestas ou a ocorrência de atrasos de desenvolvimento justifica a realização das análises.
|
Mortalidade
|
40.
|
Verifica-se diariamente em todos os tanques de ensaio se neles morreram girinos e regista-se a mortalidade por tanque. Registam-se igualmente a data, a concentração e o número de tanque correspondentes a cada constatação de mortalidade. Logo que sejam detetados, retiram-se os animais mortos do tanque de ensaio. Taxas de mortalidade superiores a 10 % podem indiciar condições experimentais inadequadas ou efeitos tóxicos do produto químico em estudo.
|
Exames adicionais
|
41.
|
Registam-se os casos de comportamento anormal e de lesões e malformações visíveis por exame macroscópico. Registam-se igualmente a data, a concentração e o número de tanque correspondentes a cada constatação de comportamento anormal ou de lesões ou malformações visíveis por exame macroscópico. O comportamento normal dos girinos caracteriza-se pela suspensão dos mesmos na coluna de água com a cauda a um nível superior à cabeça, pelo batimento rítmico regular da barbatana caudal, por emersões periódicas, pelos opérculos em movimento e pela reação a estímulos. Constituem comportamentos anormais, por exemplo, a flutuação à superfície, a imobilização no fundo do tanque, natação invertida ou irregular, falta de atividade à superfície e ausência de reação aos estímulos. Registam-se ainda as diferenças importantes de consumo de alimentos entre grupos expostos ao produto químico em estudo. Entre as lesões ou malformações visíveis por exame macroscópico contam-se, nomeando apenas algumas, anomalias morfológicas (por exemplo deformações nos membros), lesões hemorrágicas e infeções bacterianas ou fúngicas. A determinação destes casos é qualitativa, efetua-se por comparação com os animais dos grupos de controlo e a ocorrência dos mesmos equipara-se à de sinais clínicos de doença ou de tensão. Se a ocorrência ou a taxa de ocorrência destes casos nos tanques expostos ao produto químico em estudo for superior à verificada nos grupos de controlo, fica comprovada a existência de toxicidade manifesta.
|
DADOS E RELATÓRIOS
Recolha de dados
|
42.
|
Todos os sistemas (manuais ou eletrónicos) de recolha de dados devem ser conformes com as boas práticas de laboratório. Os dados a obter no estudo são os seguintes:
|
|
Produto químico em estudo
|
—
|
caracterização do produto químico: propriedades físico-químicas; informações sobre estabilidade e biodegradabilidade;
|
|
—
|
informações e dados sobre o produto químico: método e frequência de preparação das diluições. Entre estas informações contam-se as concentrações reais e nominais do produto químico em estudo e, nos casos em que se justifique, de produtos químicos não-parentais. As medições do produto químico em estudo podem incidir tanto nas soluções de reserva como nas soluções ensaiadas;
|
|
—
|
solvente (se não for água): justificação da escolha e caracterização do solvente (natureza, concentração utilizada).
|
|
|
|
Condições de realização do ensaio
|
—
|
registos operacionais: trata-se de observações relativas ao funcionamento do sistema de ensaio, bem como à infraestrutura e ao ambiente de apoio. Os registos abrangem, habitualmente, a temperatura ambiente, a temperatura de ensaio, o fotoperíodo, o estado dos componentes cruciais do sistema de exposição (por exemplo bombas, contadores de ciclos e manómetros), os caudais, os níveis de água, a renovação dos frascos de soluções de reserva e a alimentação fornecida. Os parâmetros gerais de qualidade de água incluem o pH, o oxigénio dissolvido, a condutividade, o iodo total, a alcalinidade e a dureza;
|
|
—
|
desvios do método de ensaio: contempla todas as informações sobre desvios do método de ensaio e a descrição dos mesmos.
|
|
|
|
Resultados
|
—
|
exames e dados biológicos: compreendem o exame diário da mortalidade, do consumo de alimentos, de comportamentos anormais de natação, dos casos de letargia, das perdas de equilíbrio, das malformações, das lesões etc. Exames a intervalos predefinidos e dados coligidos nesse âmbito: compreendem o estádio de desenvolvimento, o comprimento das patas traseiras, a distância entre a boca e a cloaca e o peso húmido;
|
|
—
|
técnicas de análise estatística utilizadas e justificação da escolha; resultados da análise estatística, de preferência sob a forma de quadros;
|
|
—
|
dados histológicos: compreendem a descrição dos mesmos, assim como o grau de intensidade e a taxa de incidência das observações, como se explica no documento de orientações sobre histopatologia;
|
|
—
|
observações ad hoc: compreendem as descrições do estudo que não se enquadram nas outras categorias referidas.
|
|
|
Relatório dos dados
|
43.
|
O apêndice 2 compreende quadros de recolha diária de dados que podem servir de orientação para a recolha de dados brutos e para o cálculo dos parâmetros estatísticos de síntese. Inclui igualmente quadros destinados a facilitar a comunicação de resumos dos dados correspondentes aos diversos parâmetros. Compreende ainda quadros para as avaliações histológicas.
|
Especificações e aceitabilidade/validade do ensaio
|
44.
|
Em geral, grandes desvios do método de ensaio geram dados inaceitáveis, que não cabe interpretar nem deles redigir relatório. Elaboraram-se, portanto, os critérios de orientação enunciados no quadro 4 para determinar a qualidade do ensaio realizado e dos resultados gerais obtidos para os organismos de controlo.
Quadro 4
Especificações do Ensaio de Metamorfose em Anfíbios.
|
Critério
|
Limite de aceitabilidade
|
|
Concentrações ensaiadas
|
Variabilidade, ao longo dos 21 dias do ensaio, da concentração de ensaio medida ≤ 20 %
|
|
Mortalidade no grupo de controlo
|
≤ 10 %; em nenhum dos replicados de controlo morrem mais de 2 girinos
|
|
Valor mínimo da mediana dos estádios de desenvolvimento em que se encontram os girinos de controlo no final do ensaio
|
57
|
|
Dispersão do estádio de desenvolvimento no grupo de controlo
|
Os indivíduos do décimo e do nonagésimo percentil da distribuição do estádio de desenvolvimento não diferem de mais de 4 estádios
|
|
Oxigénio dissolvido
|
≥ 40 % da saturação com ar (22)
|
|
pH
|
Mantém-se entre 6,5 e 8,5. As diferenças entre replicados e entre níveis de exposição não excedem 0,5
|
|
Temperatura da água
|
22 °C ± 1 °C; as diferenças entre replicados e entre níveis de exposição não excedem 0,5 °C.
|
|
Concentrações ensaiadas que não geram toxicidade manifesta
|
≥ 2
|
|
Função dos replicados
|
Fica comprometida a função no ensaio de não mais de dois replicados
|
|
Condições especiais relativas à utilização de um solvente
|
Caso se utilize um solvente, constitui-se um grupo de controlo do solvente e um grupo de controlo da água limpa, sendo os resultados correspondentes inseridos no relatório
|
|
As diferenças com significância estatística entre o grupo de controlo do solvente e o grupo de controlo da água têm um tratamento específico. Figuram adiante mais informações.
|
|
Condições especiais relativas à utilização de um sistema de renovação estático
|
Figuram no relatório os resultados de análises químicas representativas efetuadas antes e depois da renovação
|
|
Mede-se o teor de amoníaco imediatamente antes da renovação
|
|
Medem-se imediatamente antes da renovação todos os parâmetros de qualidade da água indicados no quadro 1 do apêndice 1
|
|
O período de renovação não se prolonga por mais de 72 horas
|
|
Programa de alimentação adequado (50 % da ração diária constituídos por alimento comercial para girinos)
|
|
Validade do ensaio
|
45.
|
Para que um teste possa ser considerado aceitável/válido, é necessário que estejam preenchidos os seguintes requisitos:
|
|
Condições de validade de um ensaio para que possa considerar-se que a atividade na tiroide deu resultado negativo:
|
1)
|
A mortalidade não excede 10 % em nenhum grupo exposto ao produto químico em estudo (nem no grupo de controlo). Em nenhum replicado a mortalidade excede três girinos; caso contrário, considera-se que o replicado ficou comprometido.
|
|
2)
|
Estão disponíveis para as análises pelo menos dois níveis de exposição, não estando comprometido nenhum dos quatro replicados (de cada um deles).
|
|
3)
|
Estão disponíveis para as análises pelo menos dois níveis de exposição que não geram toxicidade manifesta.
|
|
|
|
Condições de validade de um ensaio para que possa considerar-se que a atividade na tiroide deu resultado positivo:
|
1)
|
A mortalidade máxima admissível no grupo de controlo é de dois girinos por replicado.
|
|
|
Fluxograma de decisão para a condução do Ensaio de Metamorfose em Anfíbios
|
46.
|
Elaborou-se para o Ensaio de Metamorfose em Anfíbios um fluxograma de decisão destinado a facilitar a condução do bioensaio e a interpretação dos resultados deste (ver o fluxograma que constitui a figura 3). Essencialmente, a lógica de decisão baseia-se numa ponderação dos parâmetros, sendo esta elevada no caso do desenvolvimento acelerado, do desenvolvimento assíncrono e da histopatologia da tiroide e mais reduzida no caso do desenvolvimento retardado, da distância entre a boca e a cloaca e do peso corporal húmido (estes últimos parâmetros suscetíveis de também serem afetados pela toxicidade generalizada).
Figura 3.
Fluxograma de decisão para a condução do Ensaio de Metamorfose em Anfíbios (EMA).
|
Desenvolvimento acelerado (determinado com base no estádio de desenvolvimento, na distância entre a boca e a cloaca e no comprimento das patas traseiras)
|
47.
|
Tanto quanto se sabe, só ocorre desenvolvimento acelerado devido a efeitos relacionados com as hormonas da tiroide. Pode tratar-se de efeitos nos tecidos periféricos, nomeadamente devido a interação direta com os recetores das hormonas tiróideas (como a T4), ou de efeitos que alteram os níveis de hormonas tiróideas em circulação. Em qualquer dos casos, considera-se existir indício suficiente de atividade do produto químico na tiroide. Avalia-se o desenvolvimento acelerado de uma de duas maneiras. A primeira passa pela avaliação do estádio de desenvolvimento geral segundo o método normalizado de Nieuwkoop e Faber (8). A segunda passa pela quantificação de determinadas características morfológicas, como o comprimento das patas traseiras, ao sétimo e ao vigésimo primeiro dias, critério que reage positivamente a efeitos agonistas nos recetores das hormonas tiróideas. Caso se detete uma aceleração com significância estatística do desenvolvimento ou do comprimento das patas traseiras, conclui-se que o ensaio revela atividade do produto químico na tiroide.
|
|
48.
|
A avaliação da ocorrência de desenvolvimento acelerado, em relação à população de controlo, nos animais ensaiados baseia-se nos resultados de análises estatísticas realizadas aos seguintes quatro parâmetros:
|
—
|
comprimento das patas traseiras (normalizado em função da distância entre a boca e a cloaca) ao dia 7 do ensaio;
|
|
—
|
comprimento das patas traseiras (normalizado em função da distância entre a boca e a cloaca) ao dia 21 do ensaio;
|
|
—
|
estádio de desenvolvimento ao dia 7 do ensaio;
|
|
—
|
estádio de desenvolvimento ao dia 21 do ensaio.
|
|
|
49.
|
Realizam-se as análises estatísticas do comprimento das patas traseiras com base em comprimentos medidos na pata esquerda. Normaliza-se o comprimento das patas traseiras tomando em consideração a razão entre esse comprimento e a distância entre a boca e a cloaca de cada indivíduo. Comparam-se em seguida as médias dos valores normalizados obtidos para os diversos níveis de exposição. Um aumento com significância estatística do valor médio do comprimento das patas traseiras (normalizado) num grupo exposto ao produto químico em estudo, comparativamente ao grupo de controlo, ao dia 7 e/ou ao dia 21 do ensaio, revela aceleração do desenvolvimento (ver o apêndice 3).
|
|
50.
|
Realizam-se as análises estatísticas do estádio de desenvolvimento com base na determinação desses estádios de acordo com os critérios morfológicos descritos por Nieuwkoop e Faber (8). A deteção, numa análise multiquantal, de um aumento com significância estatística dos valores do estádio de desenvolvimento num grupo exposto ao produto químico em estudo, comparativamente ao grupo de controlo, ao dia 7 e/ou ao dia 21 do ensaio, revela aceleração do desenvolvimento.
|
|
51.
|
No Ensaio de Metamorfose em Anfíbios, considera-se que um efeito com significância estatística em qualquer dos quatro parâmetros referidos é suficiente para se concluir pela ocorrência de desenvolvimento acelerado. Ou seja, a deteção de efeitos com significância estatística no comprimento das patas traseiras num determinado momento não tem de ser corroborada por efeitos com significância estatística no comprimento das patas traseiras noutro momento do ensaio nem por efeitos com significância estatística no estádio de desenvolvimento no mesmo momento determinado. Analogamente, a deteção de efeitos com significância estatística no estádio de desenvolvimento num determinado momento não tem de ser corroborada por efeitos com significância estatística no estádio de desenvolvimento noutro momento do ensaio nem por efeitos com significância estatística no comprimento das patas traseiras no mesmo momento determinado. Todavia, a deteção de efeitos com significância estatística em mais do que um parâmetro reforça as provas reunidas a favor da ocorrência de desenvolvimento acelerado.
|
Desenvolvimento assíncrono (determinado com base em critérios de estádio de desenvolvimento)
|
52.
|
Um desenvolvimento assíncrono caracteriza-se por um desfasamento relativo da morfogénese ou do desenvolvimento entre os diferentes tecidos do girino examinado. A impossibilidade de determinar claramente o estádio de desenvolvimento de um organismo com base na série de parâmetros morfológicos considerados típicos de cada estádio é reveladora de desenvolvimento assíncrono dos tecidos no processo de metamorfose. O desenvolvimento assíncrono constitui um indicador de atividade na tiroide. Os únicos modos de ação conhecidos causadores de desenvolvimento assíncrono manifestam-se através dos efeitos do produto químico na ação periférica das hormonas tiróideas e/ou no metabolismo dessas hormonas nos tecidos em desenvolvimento, como se observa com os inibidores da desiodinase.
|
|
53.
|
A avaliação da ocorrência de desenvolvimento assíncrono nos animais sujeitos ao ensaio baseia-se no exame morfológico macroscópico dos mesmos nos dias 7 e 21 do estudo, comparativamente à população de controlo.
|
|
54.
|
A descrição do desenvolvimento normal do Xenopus laevis segundo Nieuwkoop e Faber (8) permite identificar a ordem sequencial normal de remodelação dos tecidos. O termo “desenvolvimento assíncrono” refere-se, especificamente, aos desvios no desenvolvimento morfológico macroscópico dos girinos que impedem a determinação definitiva de um estádio de desenvolvimento com base nos critérios de Nieuwkoop e Faber (8), devido ao facto de haver referenciais morfológicos fundamentais que revelam características indicadoras de estádios diferentes.
|
|
55.
|
Como está implícito no termo “desenvolvimento assíncrono”, apenas se consideram os casos que evidenciem desvios no progresso da remodelação de determinados tecidos comparativamente ao progresso evidenciado na remodelação de outros tecidos. Entre os fenótipos clássicos, contam-se atrasos ou ausência total na emergência das patas dianteiras, em contraste com o desenvolvimento normal ou acelerado dos tecidos das patas traseiras e da cauda, ou a reabsorção precoce das guelras, comparativamente ao estádio de morfogénese das patas traseiras ou de reabsorção da cauda. Considera-se que um animal evidencia desenvolvimento assíncrono se não for possível classificá-lo em nenhum estádio, por não satisfazer a maior parte dos critérios de referenciais de desenvolvimento correspondentes a cada estádio definido por Nieuwkoop e Faber (8), ou se uma ou mais características fundamentais evidenciarem um atraso ou uma aceleração extremos (por exemplo cauda completamente absorvida, mas patas dianteiras ausentes). Esta avaliação é qualitativa e assenta no exame da totalidade dos referenciais caracterizadores enumerados por Nieuwkoop e Faber (8). Não é necessário conservar registo do estádio de desenvolvimento correspondente aos vários referenciais caracterizadores dos animais examinados. Aos animais registados com desenvolvimento assíncrono não é atribuído nenhum estádio de desenvolvimento segundo Nieuwkoop e Faber (8).
|
|
56.
|
Por conseguinte, um critério central para a atribuição da classificação “desenvolvimento assíncrono” a casos de desenvolvimento morfológico anormal é a ocorrência de desfasamentos relativos na remodelação e morfogénese dos tecidos, sem que a morfologia dos tecidos afetados seja abertamente anómala. Um exemplo ilustrativo desta interpretação das anomalias morfológicas macroscópicas é que um atraso na morfogénese das patas traseiras, comparativamente ao desenvolvimento de outros tecidos, satisfaz o critério de “desenvolvimento assíncrono”, ao passo que casos em que o animal simplesmente não possua patas traseiras, evidencie anomalias digitais (por exemplo ectrodactilia ou polidactilia) ou tenha qualquer outra malformação manifesta das patas não são considerados “desenvolvimento assíncrono”.
|
|
57.
|
Neste contexto, os principais referenciais morfológicos cuja coordenação, em termos de progresso metamórfico, importa avaliar compreendem a morfogénese das patas traseiras, a morfogénese das patas dianteiras, a emergência das patas dianteiras, o estádio de reabsorção da cauda (em especial a reabsorção da barbatana caudal) e a morfologia da cabeça (tamanho das guelras, estádio de reabsorção das guelras, morfologia da mandíbula, protrusão da cartilagem de Meckel etc.).
|
|
58.
|
Podem ocorrer diversos fenótipos morfológicos macroscópicos, consoante o modo de ação do produto químico em causa. Entre os fenótipos clássicos, contam-se atrasos ou ausência total na emergência das patas dianteiras, em contraste com o desenvolvimento normal ou acelerado dos tecidos das patas traseiras e da cauda, ou a reabsorção precoce das guelras, comparativamente à remodelação das patas traseiras e da cauda.
|
Histopatologia
|
59.
|
Se o produto químico em estudo não apresentar toxicidade manifesta e não acelerar o desenvolvimento nem causar desenvolvimento assíncrono, procede-se à avaliação histopatológica da tiroide com base no documento de orientações adequado (9). Na ausência de toxicidade, os atrasos de desenvolvimento constituem forte indicador de atividade antitiróidea, pese embora a análise do estádio de desenvolvimento ser menos sensível, e menos eficaz na orientação do diagnóstico, do que a análise histopatológica da tiroide. Neste caso, é, portanto, necessário efetuar análises histopatológicas à tiroide. Foi demonstrada a ocorrência de efeitos na histologia da tiroide sem correspondência em efeitos no desenvolvimento. Caso se detetem alterações na histopatologia da tiroide, considera-se que o produto químico tem atividade na tiroide. Caso não se observem atrasos de desenvolvimento nem lesões histológicas na tiroide, considera-se que o produto químico não tem atividade na tiroide. A razão desta decisão é que a tiroide está sob a influência da TSH e que qualquer produto químico que altere as hormonas tiróideas em circulação em grau suficiente para alterar a secreção de TSH provocará alterações histopatológicas na tiroide. Há vários modos e mecanismos de alteração das hormonas tiróideas em circulação. Por conseguinte, embora o nível de hormonas tiróideas constitua um indicador de efeitos na tiroide, é insuficiente para determinar o modo ou mecanismo de reação subjacente.
|
|
60.
|
Uma vez que este parâmetro não se presta à aplicação de métodos estatísticos básicos, a associação de um efeito à exposição a um produto químico assenta necessariamente no parecer especializado de um patologista.
|
Desenvolvimento retardado (determinado com base no estádio de desenvolvimento, no comprimento das patas traseiras, no peso corporal e na distância entre a boca e a cloaca)
|
61.
|
Podem ocorrer atrasos de desenvolvimento através de mecanismos antitiróideos ou de toxicidade indireta. A conjugação de atrasos de desenvolvimento moderados com sinais manifestos de toxicidade constitui provavelmente indício de um efeito tóxico inespecífico. Para reduzir a probabilidade de falsos positivos, a avaliação da toxicidade não associada à tiroide é elemento essencial do ensaio. Uma mortalidade excessiva constitui indicação óbvia da ocorrência de outros mecanismos tóxicos. Analogamente, uma redução moderada do crescimento, determinada com base no peso corporal e/ou na distância entre a boca e a cloaca, também sugere toxicidade não associada à tiroide. Observa-se frequentemente um aumento evidente do crescimento por ação de produtos químicos que perturbam o desenvolvimento normal, pelo que a presença de animais de maior porte não constitui necessariamente um indicador de toxicidade não associada à tiroide. A ocorrência de toxicidade na tiroide não pode, portanto, ser determinada unicamente com base no crescimento. A existência de atividade na tiroide deve, sim, ser determinada com base na conjugação do crescimento com o estádio de desenvolvimento e a histopatologia da tiroide. Para se determinar a existência de toxicidade manifesta recorre-se igualmente a outros parâmetros, como a ocorrência de edemas, lesões hemorrágicas ou letargia, um consumo reduzido de alimentos, comportamentos natatórios erráticos ou alterados etc. Se todas as concentrações ensaiadas gerarem sinais de toxicidade manifesta, reavalia-se a concentrações inferiores o produto químico em estudo, antes de tirar conclusões sobre a potencial atividade ou inatividade do mesmo na tiroide.
|
|
62.
|
Na ausência de outros sinais de toxicidade manifesta, a ocorrência de atrasos de desenvolvimento com significância estatística é reveladora de que o produto químico tem atividade (antagonista) na tiroide. Na ausência de uma resposta estatística inequívoca, esta conclusão pode ser corroborada pelos resultados da histopatologia da tiroide.
|
Análises estatísticas
|
63.
|
De preferência, as análises estatísticas dos dados realizam-se pelos processos descritos no documento Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application (11). No que respeita aos parâmetros quantitativos contínuos (comprimento das patas traseiras, distância entre a boca e a cloaca e peso húmido) cuja relação dose-resposta seja monótona, aplica-se o teste de Jonckheere-Terpstra de forma regressiva para determinar se existe algum efeito com significância estatística da exposição ao produto químico.
|
|
64.
|
No caso dos parâmetros contínuos cuja relação dose-resposta não seja monótona, avalia-se a normalidade (de preferência por meio do teste de Shapiro-Wilk ou do teste de Anderson-Darling) e a homogeneidade da variância (recorrendo preferencialmente ao teste de Levene) dos dados. Os dados a utilizar em ambos os testes são os resíduos de uma análise de variância (ANOVA). Embora seja preferível realizar os testes formais de normalidade e de homogeneidade da variância, estes podem substituir-se pela apreciação de um especialista na matéria. Em caso de não-normalidade ou de heterogeneidade da variância, deve recorrer-se a uma transformação normalizadora e estabilizadora da variância. Se a distribuição dos dados for normal com variância homogénea (eventualmente após a transformação a que se aludiu), recorre-se ao teste de Dunnett para determinar se existe algum efeito com significância estatística da exposição ao produto químico. Se a distribuição dos dados for normal com variância heterogénea (eventualmente após a transformação a que se aludiu), recorre-se ao teste de Tamhane-Dunnett (ou T3) ou ao teste U de Mann-Whitney-Wilcoxon para determinar se existe algum efeito com significância estatística da exposição ao produto químico. Caso não se consiga realizar nenhuma transformação normalizadora, recorre-se ao teste U de Mann-Whitney-Wilcoxon, com aplicação do ajustamento de Bonferroni-Holm aos valores p, para determinar se existe algum efeito com significância estatística da exposição ao produto químico. Aplica-se o teste de Dunnett independentemente de qualquer teste F de análise de variância e o teste de Mann-Whitney independentemente de qualquer teste global de Kruskall-Wallis.
|
|
65.
|
Não é de esperar mortalidade com significância estatística. Porém, se os dados traduzirem uma relação dose-resposta monótona, recorre-se ao teste de Cochran-Armitage regressivo para avaliar a mortalidade. Caso contrário, recorre-se ao teste exato de Fisher com ajustamento de Bonferroni-Holm.
|
|
66.
|
Para determinar se existe algum efeito com significância estatística no estádio de desenvolvimento, resultante da exposição ao produto químico, aplica-se o teste de Jonckheere-Terpstra de forma regressiva às medianas dos replicados. Uma técnica alternativa para determinar se existe algum efeito desse tipo — e preferível, pois tem em conta variações do perfil de distribuição — consiste em aplicar o teste de Jonckheere com análise multiquantal entre o 20.o e o 80.o percentis.
|
|
67.
|
A unidade de análise adequada é o replicado. Por conseguinte, aplicam-se o teste de Jonckheere-Terpstra e o teste U de Mann-Whitney às medianas dos replicados e o teste de Dunnett às médias dos replicados. Pode avaliar-se se existe ou não uma relação monótona dose-resposta examinando simplesmente as médias ou medianas dos replicados e dos níveis de exposição ou então realizando os testes formais já referidos (11). Caso o número de replicados por nível de exposição ou por grupo de controlo seja inferior a cinco, deve recorrer-se, se possível, às versões de permutação exata do teste de Jonckheere-Terpstra e do teste de Mann-Whitney. Em todos os testes referidos, o nível de significância a considerar para ajuizar da significância estatística é 0,05.
|
|
68.
|
O fluxograma da figura 4 serve para determinar que testes estatísticos aplicar a dados contínuos.
Figura 4.
Fluxograma para determinar que método estatístico aplicar a dados de resposta contínuos.

|
Considerações especiais relativas à análise dos dados
Níveis de exposição que ficam comprometidos
|
69.
|
Há vários fatores a ponderar para determinar se um replicado ou todo um nível de exposição gera toxicidade manifesta e deve ser excluído da análise. Considera-se que existe toxicidade manifesta num replicado se a mortalidade unicamente explicável por toxicidade — e não por erro técnico — nele for superior a 2 indivíduos. As hemorragias, comportamentos anómalos, natação anómala, anorexia e quaisquer outros sinais clínicos de doença são indícios adicionais de toxicidade manifesta. No tocante a sinais de toxicidade subletais, pode ser necessário efetuar uma avaliação qualitativa, comparativamente ao grupo de controlo da água limpa.
|
Grupo de controlo do solvente
|
70.
|
A utilização de um solvente deve ser sempre considerada uma solução de último recurso, quando todas as outras possibilidades de distribuição do produto químico já tiverem sido ponderadas. Caso se utilize um solvente, é necessário incluir no ensaio um grupo de controlo da água limpa. No termo de ensaio, avaliam-se os efeitos potenciais do solvente. Para isso, efetua-se uma comparação estatística do grupo de controlo do solvente com o grupo de controlo da água limpa. Uma vez que podem ser afetados por toxicidades não associadas à tiroide, os parâmetros mais importantes a ter em conta neste âmbito são o estádio de desenvolvimento, a distância entre a boca e a cloaca e o peso húmido. Caso se detetem diferenças com significância estatística nestes parâmetros, por comparação entre o grupo de controlo da água limpa e o grupo de controlo do solvente, determinam-se os valores dos parâmetros de resposta medidos no estudo utilizando o grupo de controlo da água limpa. Caso não se detetem diferenças com significância estatística entre o grupo de controlo da água limpa e o grupo de controlo do solvente em nenhuma das variáveis de resposta medidas, determinam-se os valores dos parâmetros de resposta medidos no estudo utilizando os grupos de controlo da água de diluição e do solvente reunidos.
|
Grupos expostos que atingem um estádio de desenvolvimento igual ou superior a 60
|
71.
|
Após o estádio 60, o tamanho e o peso dos girinos diminuem, devido à reabsorção de tecidos e à redução da massa de água total que contêm. Por conseguinte, não é adequado utilizar medições de peso húmido e de distância entre a boca e a cloaca na análise estatística de diferenças de taxas de crescimento. O peso húmido e os dados dimensionais dos organismos cujo estádio de desenvolvimento segundo Nieuwkoop e Faber seja maior que 60 devem, portanto, ser excluídos e deixam de poder ser utilizados na análise de médias ou medianas de replicados. Nesse caso, há duas maneiras de analisar estes parâmetros relacionados com o crescimento.
|
|
72.
|
Uma delas consiste em considerar nas análises estatísticas do peso húmido e/ou da distância entre a boca e a cloaca apenas os girinos cujo estádio de desenvolvimento não exceda 60. Considera-se que esta abordagem permite gerar informações suficientemente robustas acerca da intensidade dos eventuais efeitos no crescimento, desde que seja pequena (≤ 20 %) a proporção de animais sujeitos ao ensaio que são excluídos das análises. Se o número de girinos num estádio de desenvolvimento superior a 60 for maior do que 20 % para uma ou mais concentrações nominais, é necessário efetuar uma análise de variância bifatorial hierarquizada que abranja todos os girinos para avaliar os efeitos da exposição ao produto químico no crescimento, tendo neste caso em conta o efeito dos estádios de desenvolvimento avançados no crescimento. O apêndice 3 contém orientações relativas à análise de variância bifatorial do peso e do comprimento.
|
REFERÊNCIAS
|
1)
|
OCDE (2004). Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 — Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 77. Paris.
|
|
2)
|
OCDE (2007). Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 — Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 76. Paris.
|
|
3)
|
OCDE (2008). Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 92. Paris.
|
|
4)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 23. Paris.
|
|
5)
|
ASTM (2002). Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials. ASTM E729-96(2002). Philadelphia, PA.
|
|
6)
|
ASTM (2004). Standard Guide for Conducting the Frog Embryo Teratogenesis Assay — Xenopus (FETAX). E 1439-98.
|
|
7)
|
Kahl, M.D., Russom, C.L., DeFoe, D.L., Hammermeister, D.E. (1999). Saturation units for use in aquatic bioassays. Chemosphere, 39, pp. 539-551.
|
|
8)
|
Nieuwkoop, P.D., Faber, J. (1994). Normal Table of Xenopus laevis. Garland Publishing. New York.
|
|
9)
|
OCDE (2007). Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 82. Paris.
|
|
10)
|
Dodd, M.H.I., Dodd, J.M. (1976). Physiology of Amphibia. Lofts, B. (ed.). Academic Press, New York, pp. 467-599.
|
|
11)
|
OCDE (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paris.
|
|
12)
|
Hutchinson, T.H., Shillabeer, N., Winter, M.J., Pickford, D.B. (2006). Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp. 69–92.
|
Apêndice 1
Quadro 1
Condições experimentais do Ensaio de Metamorfose em Anfíbios a 21 dias
|
Animais sujeitos ao ensaio
|
Larvas de Xenopus laevis
|
|
Estado larvar inicial
|
Estádio 51 segundo Nieuwkoop e Faber
|
|
Período de exposição
|
21 dias
|
|
Critérios de seleção das larvas
|
Estádio de desenvolvimento e comprimento total (facultativo)
|
|
Concentrações ensaiadas
|
Pelo menos 3 concentrações, abrangendo aproximadamente uma ordem de grandeza
|
|
Regime de exposição
|
Fluxo contínuo (preferido) e/ou estático com renovação
|
|
Caudal no sistema de ensaio
|
25 ml/minuto (renovação completa do volume aproximadamente cada 2,7 horas)
|
|
Parâmetros principais / Dias das determinações
|
Mortalidade
|
Diariamente
|
|
Estádio de desenvolvimento
|
Dias 7 e 21
|
|
Comprimento das patas traseiras
|
Dias 7 e 21
|
|
Distância entre a boca e a cloaca
|
Dias 7 e 21
|
|
Peso corporal húmido
|
Dias 7 e 21
|
|
Histologia da tiroide
|
Dia 21
|
|
Água de diluição / Controlo do laboratório
|
Água da torneira desclorada (filtrada por carvão vegetal) ou fonte laboratorial equivalente
|
|
Densidade de larvas
|
20 larvas por cuba de ensaio (5 por litro)
|
|
Solução de ensaio por cuba de ensaio
|
4-10 l (altura mínima de água de 10-15 cm) por cuba de ensaio de vidro ou de aço inoxidável (por exemplo 22,5 cm x 14 cm x 16,5 cm)
|
|
Replicados
|
4 cubas de replicação de cada concentração ensaiada e 4 replicados de controlo
|
|
Taxa de mortalidade aceitável nas cubas de controlo
|
≤ 10 % em cada cuba de replicação
|
|
Fixação da tiroide
|
Número fixado
|
Todos os girinos (avaliam-se inicialmente 5 girinos por replicado)
|
|
Zona
|
Cabeça ou todo o corpo
|
|
Fluido de fixação
|
Fixador de Davidson
|
|
Alimentação
|
Alimento
|
Micron® da SERA ou equivalente
|
|
Quantidade / Frequência
|
Ver no quadro 1 o regime alimentar para o produto Micron® da SERA
|
|
Iluminação
|
Fotoperíodo
|
12 horas de luz seguidas de 12 horas de escuridão
|
|
Intensidade
|
600 a 2 000 lux (medidos à superfície da água)
|
|
Temperatura da água
|
22 °C ± 1 °C
|
|
pH
|
6,5 a 8,5
|
|
Concentração de oxigénio dissolvido
|
>3,5 mg/l (>40 % da saturação com ar)
|
|
Colheita de amostras para as análises químicas
|
Uma vez por semana (4 colheitas de amostras por ensaio)
|
Apêndice 2
Quadros para apresentação de dados brutos e de dados de síntese
Quadro 1
Informações gerais sobre o produto químico em estudo.
|
Informações sobre o produto químico
|
|
|
Indicar o produto químico em estudo, as unidades de concentração e as concentrações de exposição
|
|
|
Produto químico em estudo:
|
|
|
|
|
Unidades de concentração:
|
|
|
|
|
Exposição 1
|
|
|
|
|
Exposição 2
|
|
|
|
|
Exposição 3
|
|
|
|
|
Exposição 4
|
|
|
|
|
|
|
|
|
|
Data (dia 0):
|
|
Indicar a data (mm/dd/aa)
|
|
|
Data (dia 7):
|
|
Indicar a data (mm/dd/aa)
|
|
|
Data (dia 21):
|
|
Indicar a data (mm/dd/aa)
|
Quadro 2
Folha de registo de dados brutos para os dias 7 e 21.
|
DIA X
DATA 00/00/00
|
|
|
Concentração
|
Número da exposição
|
Número do replicado
|
Número do indivíduo
|
Identificador do indivíduo
|
Estádio de desenvolvimento
|
Distância entre a boca e a cloaca (mm)
|
Comprimento das patas traseiras (mm)
|
Peso húmido do organismo completo (mg)
|
|
ROW
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
STAGE
|
BL
|
HLL
|
WEIGHT
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Quadro 3
Resumo dos valores calculados para os diversos parâmetros relativos aos dias 7 e 21.
|
|
|
Estádio de desenvolvimento
|
Distância entre a boca e a cloaca (mm)
|
Comprimento das patas traseiras (mm)
|
Peso (mg)
|
|
Nível de exposição
|
Replicado
|
Mínimo
|
Mediana
|
Máximo
|
Média
|
Desvio-padrão
|
Média
|
Desvio-padrão
|
Média
|
Desvio-padrão
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Nota: Efetuam-se os cálculos por casa com base nos dados constantes do quadro 2.
|
Quadro 4
Mortalidade diária.
|
Dia do ensaio
|
Data
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Soma por replicado
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Soma por nível de exposição
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Nota: Efetuam-se os cálculos por casa com base nos dados constantes do quadro 1.
|
Quadro 5
Critérios de qualidade da água.
Sistema de exposição (fluxo contínuo/estático com renovação):
Temperatura:
Intensidade luminosa:
Ciclo luz-escuridão:
Alimentos:
Quantidade e frequência da alimentação:
pH da água:
Concentração de iodo na água utilizada no ensaio:
Quadro 6
Síntese dos dados químicos.
|
Denominação do produto químico:
|
|
Número CAS:
|
|
Dia do ensaio
|
Data
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: Efetuam-se os cálculos por casa com base nos dados constantes do quadro 1.
|
Quadro 7
Quadros de resultados para os critérios histopatológicos fundamentais.
|
Data:
|
Produto químico:
|
|
|
Patologista:
|
|
|
Hipertrofia da tiroide
|
Atrofia da tiroide
|
Hipertrofia das células foliculares da tiroide
|
Hiperplasia das células foliculares da tiroide
|
|
Hipertrofia da tiroide
|
Atrofia da tiroide
|
Hipertrofia das células foliculares da tiroide
|
Hiperplasia das células foliculares da tiroide
|
|
Identificação do animal de controlo — replicado 1
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal de controlo — replicado 2
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
|
|
Hipertrofia da tiroide
|
Atrofia da tiroide
|
Hipertrofia das células foliculares da tiroide
|
Hiperplasia das células foliculares da tiroide
|
|
|
Hipertrofia da tiroide
|
Atrofia da tiroide
|
Hipertrofia das células foliculares da tiroide
|
Hiperplasia das células foliculares da tiroide
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
Quadro 8
Outros critérios histopatológicos.
|
Data:
|
Produto químico:
|
|
|
Patologista:
|
|
|
|
|
|
|
|
|
Aumento da superfície do lúmen folicular
|
Diminuição da superfície do lúmen folicular
|
Aumento da superfície do lúmen folicular
|
Diminuição da superfície do lúmen folicular
|
|
Identificação do animal de controlo — replicado 1
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal de controlo — replicado 2
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
|
|
Aumento da superfície do lúmen folicular
|
Diminuição da superfície do lúmen folicular
|
|
|
Aumento da superfície do lúmen folicular
|
Diminuição da superfície do lúmen folicular
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
Quadro 9
Descrição das observações histopatológicas.
|
Data:
|
|
Produto químico:
|
|
Patologista:
|
|
|
Descrição
|
|
Identificação do animal de controlo — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal de controlo — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Identificação do animal exposto à dose — replicado 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Quadro 10
Quadro-resumo para o dia × (7 ou 21) do Ensaio de Metamorfose em Anfíbios.
|
|
|
Grupo de controlo
|
Nível de exposição 1
|
Nível de exposição 2
|
Nível de exposição 3
|
|
Parâmetro
|
Replicado
|
Média
|
Desvio-padrão
|
CV
|
N
|
Média
|
Desvio-padrão
|
CV
|
N
|
Valor p
|
Média
|
Desvio-padrão
|
CV
|
N
|
Valor p
|
Média
|
Desvio-padrão
|
CV
|
N
|
Valor p
|
|
Comprimento das patas traseiras
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Média:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Distância entre a boca e a cloaca
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Média:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Peso húmido
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Média:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Quadro 11
Quadro-resumo dos dados do estádio de desenvolvimento no dia × (7 ou 21) do Ensaio de Metamorfose em Anfíbios.
|
|
|
Grupo de controlo
|
Nível de exposição 1
|
Nível de exposição 2
|
Nível de exposição 3
|
|
|
Replicado
|
Mediana
|
Mín.
|
Máx.
|
N
|
Mediana
|
Mín.
|
Máx.
|
N
|
Valor p
|
Mediana
|
Mín.
|
Máx.
|
N
|
Valor p
|
Mediana
|
Mín.
|
Máx.
|
Mediana
|
Valor p
|
|
Estádio de desenvolvimento
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Média:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Apêndice 3
Análise alternativa do peso e do comprimento quando mais de 20 % dos girinos se encontram num estádio de desenvolvimento avançado no caso de uma ou mais concentrações
Se o número de girinos num estádio de desenvolvimento superior a 60 for maior do que 20 % para uma ou mais concentrações nominais, é necessário efetuar uma análise de variância bifatorial hierarquizada que abranja todos os girinos para avaliar os efeitos da exposição ao produto químico no crescimento, tendo neste caso em conta o efeito dos estádios de desenvolvimento avançados no crescimento.
Trata-se de utilizar todos os dados, tendo em conta o efeito dos estádios de desenvolvimento avançados. Para isso, pode recorrer-se a uma análise de variância bifatorial hierarquizada. Define-se o critério Estádio avançado = «Sim» para os animais cujo estádio de desenvolvimento seja igual ou superior a 61. Caso contrário, define-se Estádio avançado = «Não». Em seguida, realiza-se uma análise de variância bifatorial da concentração e do estádio avançado e da interação destes, utilizando Rep(Conc) como fator aleatório e girino(Rep) como outro efeito aleatório. Esta metodologia continua a tratar o replicado como unidade de análise e gera essencialmente os mesmos resultados que uma análise das médias replicado*estádio avançado ponderada pelo número de animais considerados na média. Se os dados não satisfizerem os requisitos da análise de variância no tocante a normalidade ou a homogeneidade da variância, pode resolver-se o problema por meio de uma transformada de ordenamento normalizada.
Além do teste F de análise de variância clássico dos efeitos da concentração, do estádio avançado e das interações destes, pode cindir-se o teste F das interações em dois testes F de análise de variância suplementares, o primeiro aplicado às respostas médias correspondentes às diversas concentrações para Estádio Avançado = «Não» e o segundo aplicado às respostas médias correspondentes às diversas concentrações para Estádio Avançado = «Sim». Realizam-se para cada nível de Estádio Avançado comparações suplementares das médias correspondentes às diversas concentrações de exposição e ao grupo de controlo. Caso se evidencie uma relação dose-resposta não-monótona em algum dos níveis da variável Estádio Avançado, pode efetuar-se uma análise de tendência utilizando os contrastes adequados ou comparações par a par simples. Procede-se a um ajustamento de Bonferroni-Holm dos valores p apenas se a parte correspondente do teste F resultante da referida cisão não tiver significância. Estas operações podem ser realizadas por SAS e, presumivelmente, por outros softwares estatísticos. A situação pode complicar-se se, para algumas concentrações, nenhum animal estiver num estádio avançado. Porém, esses casos podem resolver-se sem dificuldade.
Apêndice 4
Definições
Produto químico
: Substância ou mistura.
Produto químico em estudo
: Qualquer substância ou mistura à qual seja aplicado este método de ensaio.
C.39. ENSAIO DE REPRODUÇÃO DE COLÊMBOLOS NO SOLO
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 232 (2009) da OCDE. Destina-se a avaliar os efeitos de produtos químicos na reprodução de colêmbolos no solo. Baseia-se em procedimentos estabelecidos (1)(2). A Folsomia candida, que se reproduz por partenogénese, e a Folsomia fimetaria, que se reproduz por via sexual, são duas das espécies mais acessíveis de colêmbulos, pois é possível criá-las e estão disponíveis no comércio. Quando é necessário avaliar habitats não abrangidos por nenhuma destas espécies, o método é extensível a outras espécies de colêmbolos que cumpram os critérios de validade do ensaio.
|
|
2.
|
Os colêmbolos, que vivem no solo, são espécies com interesse ecológico para ensaios de ecotoxicidade. Trata-se de hexápodes com um exosqueleto fino muito permeável ao ar e à água e constituem espécies de artrópodes caracterizadas por uma via e uma taxa de exposição distintas das correspondentes às minhocas e aos vermes da família Enchytraeidae.
|
|
3.
|
Em muitos ecossistemas terrestres, a densidade populacional de colêmbulos é habitualmente da ordem de 105 m-2 no solo e na manta morta (3)(4). Os adultos medem normalmente 0,5 a 5 mm e é baixa a contribuição destes animais para a respiração e a biomassa animal totais do solo, apontando as estimativas para valores entre 1 % e 5 % (5). O papel mais importante que desempenham poderá, portanto, ser o de reguladores potenciais de determinados processos através da predação de microrganismos e da microfauna. Uma grandes variedade de invertebrados endogeicos e epigeicos, como os ácaros, as centopeias, as aranhas, os carabídeos e os estafilinídeos, são predadores dos colêmbolos. Os colêmbolos participam nos processos de decomposição nos solos ácidos, nos quais, juntamente com os enquitraídeos, podem ser os invertebrados mais importantes do solo, dada a ausência habitual das minhocas e dos diplópodes nesses casos.
|
|
4.
|
A Folsomia fimetaria tem uma distribuição planetária e é comum em muitos tipos de solo, desde os solos arenosos aos francos e dos solos húmicos doces (mull) aos ácidos (mor). Trata-se de um colêmbolo sem olhos e sem pigmentação que se encontra em solos agrícolas de toda a Europa (6). É um animal omnívoro, de cuja alimentação fazem parte hifas fúngicas, bactérias, protozoários e detritos. Por via da pastagem dos animais, interage com infeções imputáveis a fungos fitopatogénicos (7) e pode influenciar micorrizas, como se sabe ser o caso da Folsomia candida. Tal como sucede com a maior parte dos colêmbulos, esta espécie reproduz-se por via sexual, sendo necessária a presença permanente de machos para fertilização dos ovos.
|
|
5.
|
A Folsomia candida tem igualmente uma distribuição planetária. Embora não seja comum na maior parte dos solos naturais, ocorre frequentemente em grande número em locais ricos em húmus. Trata-se também de um colêmbolo sem olhos e sem pigmentação. Dispõem de uma furca (órgão de salto) bem desenvolvida, correm com desenvoltura e saltam facilmente se forem perturbados. Embora viva em solos mais ricos em matéria orgânica, o papel ecológico da Folsomia candida é semelhante ao da Folsomia fimetaria. Reproduz-se por partenogénese e a ocorrência de machos pode ser inferior a 1 em mil indivíduos.
|
PRINCÍPIO DO MÉTODO
|
6.
|
Expõem-se colêmbolos adultos (Folsomia fimetaria) ou juvenis (Folsomia candida) a uma gama de concentrações do produto químico em estudo incorporado num solo artificial modificado (8), com teor de matéria orgânica de 5 % (ou num solo alternativo). Pode estabelecer-se uma subdivisão em duas etapas:
|
—
|
Um ensaio exploratório da gama de concentrações a utilizar, caso não se disponha de informações de toxicidade suficientes, no qual os principais parâmetros avaliados são a mortalidade e a reprodução — após duas semanas na Folsomia fimetaria e após três semanas na Folsomia candida.
|
|
—
|
Um ensaio de reprodução definitivo, no qual se avaliam o número de juvenis gerados pelos progenitores e a sobrevivência destes últimos. Este ensaio prolonga-se por três semanas no caso da Folsomia fimetaria e por quatro semanas no caso da Folsomia candida.
|
Exprime-se o efeito tóxico do produto químico em estudo ao nível da mortalidade e da reprodução dos adultos pelos valores CLx e CEx, efetuando, por regressão não-linear, um ajustamento dos dados obtidos a um modelo adequado, a fim de estimar a concentração que causaria x % de mortalidade ou de redução da reprodução ou, em alternativa, o valor NOEC ou LOEC (9).
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
7.
|
É preferível conhecer previamente as propriedades físicas, a hidrossolubilidade, o log Kow, o coeficiente de partição entre a água e o solo e a pressão de vapor do produto químico em estudo. É ainda desejável ter conhecimento do devir no solo do produto químico em estudo, nomeadamente as taxas de fotólise, hidrólise e biodegradação. Caso se disponha dessas informações, devem ser também indicados a identificação do produto químico segundo a nomenclatura da IUPAC, o número CAS, o lote de fabrico, o lote de acondicionamento, a fórmula estrutural e o grau de pureza.
|
|
8.
|
Este método de ensaio serve para produtos químicos hidrossolúveis ou insolúveis em água, embora o modo como se aplica ao produto químico em causa varie concomitantemente. O método não é aplicável a produtos químicos voláteis, isto é, a produtos químicos cuja constante de Henry ou cujo coeficiente de partição ar/água seja superior a um, nem a produtos químicos cuja pressão de vapor a 25 °C exceda 0,0133 Pa.
|
VALIDADE DO ENSAIO
|
9.
|
Para que os resultados do ensaio sejam considerados válidos, os grupos de controlo, não expostos, devem satisfazer os seguintes critérios:
|
—
|
Mortalidade média dos adultos no final do ensaio inferior a 20 %;
|
|
—
|
Número médio de juvenis por recipiente no final do ensaio não inferior a 100;
|
|
—
|
Coeficiente de variação, calculado para o número de juvenis no final do ensaio definitivo, inferior a 30 %.
|
|
PRODUTO QUÍMICO DE REFERÊNCIA
|
10.
|
A fim de verificar se os organismos ensaiados no sistema de ensaio estão a responder dentro dos níveis normais, ensaia-se periodicamente, ou inclui-se em todos os ensaios, um produto químico de referência à concentração CE50 para o tipo de solo escolhido para o ensaio. Um produto químico de referência adequado é o ácido bórico, que, a cerca de 100 mg/kg de resíduo seco de solo, deve reduzir a reprodução de ambas as espécies em 50 % (10)(11).
|
DESCRIÇÃO DO ENSAIO
Recipientes e equipamento
|
11.
|
São recipientes adequados para o ensaio os que puderem conter 30 g de solo húmido. Podem ser de vidro ou de plástico inerte (não-tóxico). Todavia, não devem ser utilizados recipientes de plástico que, devido a fenómenos de sorção, reduzam a exposição ao produto químico. A superfície do fundo do recipiente deve permitir que a profundidade do solo seja de 2 a 4 cm. Os recipientes devem dispor de tampas (de vidro ou de polietileno, por exemplo) destinadas a reduzir a evaporação de água, mas que não impeçam as permutas gasosas entre o solo e a atmosfera. Para possibilitar a passagem de luz, os recipientes devem ser, pelo menos, translúcidos.
|
|
12.
|
É necessário o equipamento normal de laboratório, designadamente o seguinte:
|
—
|
microscópio estereoscópico;
|
|
—
|
medidor de pH e fotómetro;
|
|
—
|
balanças de precisão adequadas;
|
|
—
|
equipamento adequado de regulação da temperatura;
|
|
—
|
equipamento adequado de regulação da humidade do ar (não essencial se os recipientes de exposição tiverem tampa);
|
|
—
|
incubador ou pequena câmara com temperatura controlada;
|
|
—
|
pinças ou um dispositivo aspirador de baixa sucção.
|
|
Preparação do solo a ensaiar
|
13.
|
Utiliza-se um solo artificial modificado (8) com teor de matéria orgânica de 5 %. Caso um solo artificial não se assemelhe ao solo natural, pode utilizar-se como alternativa um solo natural. A composição recomendada do solo artificial (pesos secos, após secagem até peso constante a 105 °C) é a seguinte:
|
—
|
5 % de turfa Sphagnum seca ao ar e finamente moída (granulometria aceitável: 2 ± 1 mm);
|
|
—
|
20 % de argila caulínica (de preferência com teor de caulinite superior a 30 %);
|
|
—
|
aproximadamente 74 % de areia industrial seca ao ar (em função da quantidade de CaCO3 necessária), com predominância de areia fina constituída por mais de 50 % de partículas de 50 a 200 micra. A quantidade exata de areia depende da quantidade de CaCO3 (ver a seguir); juntos, devem representar 75 %;
|
|
—
|
1,0 % de carbonato de cálcio (CaCO3 de qualidade analítica pulverizado), a fim de obter um pH de 6,0 ± 0,5; a quantidade de carbonato de cálcio a adicionar depende sobretudo da qualidade/natureza da turfa (ver a nota 1).
|
Nota 1: A quantidade de CaCO3 necessária depende dos componentes do substrato de solo e determina-se medindo imediatamente antes do ensaio o pH de subamostras de solo húmido pré-incubado.
Nota 2: Tendo em vista a normalização ulterior e uma melhor interpretação dos resultados, recomenda-se a medição do pH e, facultativamente, da razão C/N, da capacidade de permuta catiónica e do teor de matéria orgânica do solo.
Nota 3: Se necessário, por exemplo para determinadas finalidades de ensaio, também podem ser utilizados como substrato de ensaio e/ou de cultura solos naturais não-poluídos. Porém, caso se utilizem solos naturais, estes devem estar isentos de qualquer contaminação e é necessário caracterizá-los, pelo menos, quanto à origem (local de proveniência), ao pH, à textura (distribuição granulométrica), à capacidade de permuta catiónica e ao teor de matéria orgânica. Antes de utilizar um solo natural num ensaio definitivo, é aconselhável demonstrar que o mesmo é adequado para o ensaio e que permite cumprir os critérios de validade do ensaio.
|
|
14.
|
Misturam-se cuidadosamente os componentes secos do solo (por exemplo num misturador laboratorial grande). Determina-se a capacidade máxima de retenção de água do solo artificial como se descreve no apêndice 5. Otimiza-se o teor de humidade do solo utilizado no ensaio de modo a obter uma estrutura solta porosa que permita aos colêmbolos penetrarem nos poros. Este teor situa-se, normalmente, entre 40 % e 60 % da capacidade máxima de retenção de água.
|
|
15.
|
Para equilibrar/estabilizar a acidez do solo, 2 a 7 dias antes do início do ensaio pré-humedece-se o solo artificial seco com a quantidade de água desionizada suficiente para obter aproximadamente metade do teor final de humidade. Para determinar o pH, utiliza-se (como se explica no apêndice 6) uma mistura 1:5 de solo com solução 1 M de cloreto de potássio (KCl) ou com solução 0,01 M de cloreto de cálcio (CaCl2). Se o solo for mais ácido do que o intervalo admitido, pode ajustar-se a acidez adicionando uma quantidade adequada de CaCO3. Se o solo for demasiado alcalino, pode ajustar-se a alcalinidade como um ácido inorgânico inócuo para os colêmbolos.
|
|
16.
|
Divide-se o solo pré-humedecido num número de porções correspondente ao número de concentrações e de grupos de controlo a ensaiar (acrescidos do produto químico de referência, se for o caso). Adicionam-se os produtos químicos em estudo e regula-se o teor de água de acordo com o ponto 24.
|
Seleção e preparação dos animais a utilizar no ensaio
|
17.
|
Dado que o estudo interlaboratorial comparativo deste método de ensaio (11) revelou que a Folsomia candida cumpre os critérios de validade relativos à sobrevivência mais frequentemente do que a Folsomia fimetaria, a espécie recomendada é a primeira (reprodução por partenogénese). Caso se utilize outra espécie, terá a mesma de cumprir os critérios de validade indicados no ponto 9. No início do ensaio, os animais devem apresentar-se bem alimentados e ter idade compreendida entre 23 e 26 dias (Folsomia fimetaria) ou 9 e 12 dias (Folsomia candida). O número de animais por replicado é o seguinte: 10 machos e 10 fêmeas no caso da Folsomia fimetaria; 10 fêmeas no caso da Folsomia candida (ver o apêndice 2 e o apêndice 3). Para cada replicado, selecionam-se aleatoriamente animais síncronos das placas e verifica-se o estado físico e de saúde em que os mesmos se encontram. Deposita-se cada grupo de 10 ou 20 indivíduos num recipiente de ensaio selecionado aleatoriamente, escolhendo-se fêmeas grandes de Folsomia fimetaria, de modo que possam distinguir-se facilmente dos machos da mesma espécie.
|
Preparação das concentrações a utilizar no ensaio
|
18.
|
São quatro os métodos de aplicação do produto químico em estudo que podem ser utilizados: 1) incorporação do produto químico no solo utilizando água como veículo; 2) incorporação do produto químico no solo utilizando um solvente orgânico como veículo; 3) incorporação do produto químico no solo utilizando areia como veículo; ou 4) aplicação do produto químico na superfície do solo. A escolha do método mais adequado depende das características do produto químico e da finalidade do ensaio. Em geral, recomenda-se a mistura do produto químico em estudo com o solo. Pode, no entanto, exigir-se um método de aplicação coerente com a utilização prática do produto químico (por exemplo pulverização de formulações líquidas ou utilização de formulações pesticidas especiais, como grânulos ou produtos de tratamento de sementes). A menos que seja aplicado à superfície do solo, aplica-se o produto químico em estudo antes de se transferirem o colêmbolos para o solo e de os deixar penetrar em seguida neste.
|
Produtos químicos hidrossolúveis
|
19.
|
Prepara-se uma solução do produto químico em estudo em água desionizada, em quantidade suficiente para todos os replicados de cada concentração a ensaiar. Mistura-se cuidadosamente cada solução do produto químico em estudo com um lote de solo pré-humedecido, após o que se transferem as misturas para os recipientes de ensaio.
|
Produtos químicos insolúveis em água
|
20.
|
No caso dos produtos químicos insolúveis em água, mas solúveis em solventes orgânicos, pode dissolver-se o produto químico em estudo no volume mínimo de um solvente adequado (por exemplo acetona) que permita uma boa mistura do produto químico com o solo, misturando-o em seguida com uma parte da areia quartzítica necessária. Apenas podem ser utilizados solventes orgânicos voláteis. Caso se utilize um solvente orgânico, todas as concentrações a ensaiar e o grupo adicional de controlo negativo do solvente devem conter a mesma quantidade mínima de solvente. Para que o solvente utilizado na aplicação do produto químico tóxico em estudo se possa evaporar, deixam-se algum tempo sem tampa os recipientes onde aquele foi aplicado, mas inviabilizando qualquer dissipação do produto químico durante esse período.
|
Produtos químicos fracamente solúveis em água e em solventes orgânicos
|
21.
|
No caso dos produtos químicos fracamente solúveis em água e em solventes orgânicos, mistura-se uma parte da areia quartzítica de constituição do solo com a quantidade do produto químico em estudo necessária para obter a concentração pretendida no ensaio. Mistura-se cuidadosamente esta mistura de areia quartzítica e produto químico com o solo previamente humedecido por adição da quantidade de água desionizada adequada para obter o teor de humidade necessário. Distribui-se a mistura final pelos recipientes de ensaio. Repete-se o processo para cada concentração a ensaiar, preparando-se igualmente um grupo de controlo adequado.
|
Aplicação na superfície do solo do produto químico em estudo
|
22.
|
Caso o produto químico em estudo seja um pesticida, pode justificar-se aplicá-lo por pulverização na superfície do solo. Nesta eventualidade, procede-se à aplicação do produto químico depois de os colêmbolos serem transferidos para o solo. Começa-se por colocar o substrato de solo humedecido nos recipientes de ensaio, transferem-se os animais para os recipientes e, em seguida, pesam-se estes um a um. Para evitar a exposição direta dos animais ao produto químico por contacto direto daqueles com este, aplica-se o produto químico em estudo pelo menos meia hora antes da transferência dos colêmbolos para o solo. Utilizando um pulverizador de laboratório que permita simular adequadamente a pulverização no terreno, aplica-se, o mais uniformemente possível, o produto químico em estudo na superfície do solo. A aplicação deve decorrer dentro de uma margem de temperatura de ± 2 °C e, no caso das soluções, emulsões ou dispersões aquosas, em observância da taxa de aplicação de água prevista nas recomendações de avaliação de riscos (a verificar por uma técnica de calibração adequada). O método de aplicação de formulações especiais como grânulos ou produtos de tratamento de sementes pode ser coerente com a prática agrícola. Fornece-se o alimento depois da pulverização.
|
PROCEDIMENTO DE ENSAIO
Condições de realização do ensaio
|
23.
|
Realiza-se o ensaio à temperatura média de 20 °C ± 1 °C, sendo a gama de temperaturas admitida de 20 °C ± 2 °C. Durante o ensaio sucedem-se ciclos controlados de luz-escuridão (12 horas de luz seguidas de 12 horas de escuridão), devendo a iluminação da zona onde se encontram os recipientes de ensaio situar-se entre 400 lux e 800 lux.
|
|
24.
|
Para verificar a humidade do solo, pesam-se os recipientes no início, a meio e no final do ensaio. Caso se detetem perdas de peso superiores a 2 %, adiciona-se água desionizada para as compensar. Note-se que as perdas de água podem ser reduzidas mantendo uma humidade do ar elevada no incubador utilizado no ensaio.
|
|
25.
|
Mede-se o pH no início e no final do ensaio exploratório da gama de concentrações e do ensaio definitivo. Efetuam-se as medições numa amostra de controlo suplementar e numa amostra suplementar de solo exposto por cada concentração do produto químico em estudo, preparadas e mantidas do mesmo modo que as culturas ensaiadas, mas sem para elas transferir os colêmbolos.
|
Procedimento de ensaio e medições
|
26.
|
A quantidade de solo a transferir para os recipientes de ensaio de cada concentração é de 30 g (peso fresco) por recipiente. Preparam-se igualmente recipientes de controlo da água, sem incorporação do produto químico em estudo. Caso se utilize um veículo para a aplicação do produto químico em estudo, procede-se ao ensaio, paralelamente à série exposta àquele, de uma série de controlo apenas com o veículo. Se forem utilizados solventes ou dispersantes, a sua concentração deve ser igual à utilizada nos recipientes de ensaio que contêm o produto químico em estudo.
|
|
27.
|
Transfere-se com cuidado cada colêmbolo para o recipiente de ensaio que lhe foi atribuído aleatoriamente, colocando-se o animal na superfície do solo. Para melhor transferir os colêmbolos, pode recorrer-se a um dispositivo aspirador de ar de baixa sucção. O número de replicados das concentrações ensaiadas e de replicados de controlo depende do tipo de ensaio utilizado. Dispõem-se os recipientes de ensaio aleatoriamente no incubador e modifica-se aleatoriamente a posição de cada recipiente uma vez por semana.
|
|
28.
|
Nos ensaios com Folsomia fimetaria, utilizam-se em cada recipiente vinte adultos (10 machos e 10 fêmeas) com 23 a 26 dias de idade. Ao 21.o dia, retiram-se os colêmbolos do solo e contam-se. O sexo dos Folsomia fimetaria que integram o lote de animais sincronizados utilizado no ensaio distingue-se pelo tamanho. Com efeito, as fêmeas são nitidamente maiores do que os machos (ver o apêndice 3).
|
|
29.
|
Nos ensaios com Folsomia candida utilizam-se em cada recipiente dez juvenis com 9 a 12 dias. Ao 28.o dia, retiram-se os colêmbolos do solo e contam-se.
|
|
30.
|
Como fonte alimentar adequada, adiciona-se no início do ensaio e após cerca de duas semanas a cada recipiente uma quantidade suficiente (por exemplo 2 a 10 mg) de levedura de padeiro desidratada granulada, disponível no comércio para uso doméstico.
|
|
31.
|
No final do ensaio, determina-se a mortalidade e a reprodução. Após 3 semanas (Folsomia fimetaria) ou 4 semanas (Folsomia candida), retiram-se os colêmbolos do solo utilizado no ensaio (ver o apêndice 4) e contam-se (12). Contam-se como mortos os colêmbulos que não sejam retirados. Os métodos de retirada e de contagem carecem de validação. Para que um método de retirada possa ser validado, a extração de juvenis tem de ser superior a 95 %, o que pode ser avaliado adicionando um número conhecido de indivíduos ao solo.
|
|
32.
|
No apêndice 2, resumem-se e estabelece-se a cronologia das diversas etapas do procedimento de ensaio.
|
Planeamento do ensaio
Ensaio exploratório da gama de concentrações
|
33.
|
Se necessário, realiza-se um ensaio exploratório da gama de concentrações a utilizar ensaiando, por exemplo, dois replicados de cada uma de cinco concentrações do produto químico em estudo (0,1, 1,0, 10, 100 e 1 000 mg/kg de peso seco de solo ) e de cada grupo de controlo. Para tomar decisões acerca das concentrações a utilizar neste ensaio exploratório, pode ser útil dispor de informações adicionais acerca da mortalidade e reprodução dos colêmbolos, provenientes de ensaios de produtos químicos semelhantes ou de referências bibliográficas.
|
|
34.
|
Para garantir o surgimento de uma geração de juvenis, a duração do ensaio exploratório é de duas semanas no caso da Folsomia fimetaria e de três semanas no caso da Folsomia candida. No final do ensaio, determina-se a mortalidade e a reprodução dos colêmbolos. Registam-se o número de adultos e o número de juvenis.
|
Ensaio definitivo
|
35.
|
Para determinar uma CEx (por exemplo CE10 ou CE50), ensaiam-se doze concentrações. Recomenda-se a utilização de, pelo menos, dois replicados de cada concentração de exposição ensaiada e de seis replicados de controlo. O intervalo entre as diversas concentrações utilizadas varia em função da relação dose-resposta.
|
|
36.
|
Para determinar a NOEC/LOEC, é necessário ensaiar, pelo menos, cinco concentrações em série geométrica. Recomenda-se a utilização de quatro replicados de cada concentração de exposição ensaiada e de oito replicados de controlo. O intervalo entre concentrações consecutivas deve ser expresso por um fator não superior a 1,8.
|
|
37.
|
É possível determinar conjuntamente a NOEC/LOEC e a CEx, utilizando para o efeito oito concentrações de exposição em série geométrica. Recomenda-se, neste caso, a utilização de quatro replicados de cada concentração de exposição ensaiada e de oito replicados de controlo. O intervalo entre concentrações consecutivas deve ser expresso por um fator não superior a 1,8.
|
|
38.
|
Se não for observado nenhum efeito para a concentração mais elevada do ensaio exploratório da gama de concentrações a utilizar (1 000 mg/kg), pode assimilar-se o ensaio da reprodução a um ensaio do limite, utilizando uma concentração de exposição de 1 000 mg/kg e o grupo de controlo. Um ensaio do limite permitirá demonstrar a inexistência de efeitos com significância estatística à concentração limite. Nesse caso, utilizam-se oito replicados do solo exposto e oito replicados de controlo.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
39.
|
O principal parâmetro é a produção de descendência (número de juvenis produzido por recipiente de ensaio). Efetua-se uma análise estatística, por exemplo uma análise de variância (ANOVA), para estabelecer uma comparação por meio do teste t de Student, do teste de Dunnett ou do teste de Williams entre os níveis de exposição. Calculam-se os intervalos de confiança a 95 % para as médias correspondentes a cada nível de exposição.
|
|
40.
|
O número de adultos sobreviventes nos grupos de controlo, não-expostos ao produto químico em estudo, é um critério de validação fundamental de que é necessário guardar registo. Tal como no ensaio exploratório da gama de concentrações a utilizar, também devem ser referidos no relatório final todos os outros indícios de efeitos nocivos.
|
CLx e CEx
|
41.
|
Calculam-se os valores de CEx, assim como os correspondentes limites de confiança a 95 % superior e inferior deste parâmetro, recorrendo a métodos estatísticos adequados (função logística ou de Weibull, método simplificado de Spearman-Karber ou interpolação simples). Determina-se a CEx inserindo na equação obtida o valor correspondente a x % da média do grupo de controlo. Para calcular a CE50 ou qualquer outra CEx, procede-se a uma análise de regressão da série completa de dados. A CL50 é normalmente estimada por análise da função probit ou por análises similares que tenham em conta a distribuição binomial dos dados de mortalidade.
|
NOEC/LOEC
|
42.
|
Caso se pretenda determinar a NOEC/LOEC por análise estatística, é necessário dispor de dados estatísticos por recipiente (sendo cada recipiente considerado um replicado). Devem ser utilizados métodos estatísticos adequados, de acordo com o documento n.o 54 da OCDE intitulado Current approaches in the statistical analysis of ecotoxicity data: a guidance to application (9). Em geral, investigam-se os efeitos adversos do produto químico em estudo, comparativamente ao grupo de controlo, efetuando testes de hipóteses unilaterais para p≤0,05.
|
|
43.
|
Pode testar-se a normalidade da distribuição e a homogeneidade da variância recorrendo a um teste estatístico adequado, por exemplo o teste de Shapiro-Wilk e o teste de Levene, respetivamente (p≤0,05). Podem também ser efetuados uma análise de variância unifatorial e os subsequentes testes de múltiplas comparações. Pode recorrer-se a múltiplas comparações (por exemplo o teste de Dunnett) ou a testes de tendência regressivos (por exemplo o teste de Williams) para determinar se há diferenças com significância estatística (p≤0,05) entre os grupos de controlo e as diversas concentrações do produto químico em estudo — para escolher o teste recomendado, consultar o documento n.o 54 da OCDE (9). Alternativamente, pode recorrer-se a métodos não-paramétricos (por exemplo, o teste U com ajustamento de Bonferroni-Holm ou o teste de tendência de Jonckheere-Terpstra) para determinar a NOEC e a LOEC.
|
Ensaio do limite
|
44.
|
Caso se tenha realizado um ensaio do limite (comparação do grupo de controlo unicamente com um nível de exposição) e estejam preenchidos os requisitos para a realização de testes paramétricos (no tocante a normalidade e homogeneidade), pode efetuar-se uma avaliação das respostas mensuráveis recorrendo ao teste t de Student. Se aqueles requisitos não estiverem preenchidos, pode utilizar-se um teste t de variância desigual (teste t de Welch) ou um teste não-paramétrico, como o teste U de Mann-Whitney.
|
|
45.
|
Para verificar se existem diferenças com significância entre grupos de controlo (grupo de controlo e grupo de controlo do solvente), pode efetuar-se um teste aos replicados de cada grupo de controlo como se explicou para o ensaio do limite. Caso os testes realizados não detetem diferenças com significância estatística, podem agregar-se todos os replicados do grupo de controlo e do grupo de controlo do solvente. Caso contrário, é necessário comparar cada nível de exposição com o grupo de controlo do solvente.
|
Relatório do ensaio
|
46.
|
Elementos mínimos a constar do relatório do ensaio:
|
|
Produto químico em estudo
|
—
|
identidade, lote de fabrico, lote de acondicionamento, número CAS, grau de pureza;
|
|
—
|
propriedades físico-químicas (por exemplo log Kow, hidrossolubilidade, pressão de vapor, constante de Henry (H) e, de preferência, informações sobre o devir no solo do produto químico em estudo) conhecidas;
|
|
—
|
formulação do produto químico e aditivos, caso não se ensaie o produto químico puro.
|
|
|
|
Organismos utilizados no ensaio
|
—
|
identificação da espécie e do fornecedor, descrição das condições de criação e faixa etária.
|
|
|
|
Condições de realização do ensaio
|
—
|
descrição do esquema e do protocolo experimental;
|
|
—
|
pormenores da preparação do solo ensaiado; caso se utilize um solo natural, especificações pormenorizadas do mesmo (origem, história, distribuição granulométrica, pH, teor de matéria orgânica);
|
|
—
|
capacidade de retenção de água do solo;
|
|
—
|
descrição da técnica utilizada para aplicar ao solo o produto químico em estudo;
|
|
—
|
condições de realização do ensaio: intensidade luminosa, duração dos ciclos luz-escuridão, temperatura;
|
|
—
|
descrição do regime alimentar, tipo e quantidade do alimento utilizado no ensaio, datas de alimentação;
|
|
—
|
pH e teor de humidade do solo no início e no final do ensaio (grupo de controlo e cada nível de concentração);
|
|
—
|
descrição pormenorizada do método de retirada dos animais dos recipientes e eficiência desta.
|
|
|
|
Resultados do ensaio
|
—
|
número de juvenis determinado em cada recipiente de ensaio no final do ensaio;
|
|
—
|
número de adultos determinado em cada recipiente de ensaio no final do ensaio e mortalidade correspondente ( %);
|
|
—
|
descrição dos sintomas fisiológicos ou patológicos manifestos e das alterações comportamentais evidentes;
|
|
—
|
resultados obtidos com o produto químico de referência;
|
|
—
|
valores NOEC/LOEC, CLx referente à mortalidade e CEx referente à reprodução (principalmente CL50, CL10, CE50 e CE10) e respetivos intervalos de confiança a 95 %; gráfico do modelo de ajustamento utilizado no cálculo, equação da função correspondente e parâmetros do mesmo — ver (9);
|
|
—
|
todas as informações e constatações úteis para a interpretação dos resultados;
|
|
—
|
poder do teste realizado, caso se tenham efetuado testes de hipóteses (9);
|
|
—
|
desvios dos procedimentos descritos neste método de ensaio e ocorrências inabituais durante o ensaio;
|
|
—
|
relativamente à NOEC, quando estimada, diferença mínima detetável.
|
|
|
REFERÊNCIAS
|
1)
|
Wiles, J.A., Krogh, P.H. (1998). Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (Løkke, H., Van Gestel, C.A.M., editores), pp. 131-156. John Wiley & Sons, Ltd., Chichester.
|
|
2)
|
ISO (1999). Soil Quality — Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. n.o 11267. Organização Internacional de Normalização, Genebra.
|
|
3)
|
Burges, A., Raw, F. (editores) (1967). Soil Biology. Academic Press. Londres.
|
|
4)
|
Petersen, H., Luxton, M. (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos, 39:287-388.
|
|
5)
|
Petersen, H. (1994). A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica, 195:111-118.
|
|
6)
|
Hopkin, S.P. (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 pp. (ISBN 0-19-854084-1).
|
|
7)
|
Ulber, B. (1983). Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun, Ph., André, H.M., De Medts, A., Grégoire-Wibo, C., Wauthy, G. (editores), Proceedings of the VI. international colloquium on soil zoology. Louvain-la-neuve (Bélgica), 30 de agosto a 2 de setembro de 1982. I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268.
|
|
8)
|
Capítulo C.36 deste anexo: Ensaio de reprodução no solo do ácaro predador Hypoaspis (Geolaelaps) aculeifer.
|
|
9)
|
OCDE (2006). Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment, No. 54. ENV/JM/MONO(2006)18. OCDE, Paris.
|
|
10)
|
Scott-Fordsmand, J.J., Krogh, P.H. (2005). Background report on prevalidation of an OECD springtail test guideline. Environmental Project No. 986. Miljøstyrelsen, Agência de Proteção do Ambiente, Ministério do Ambiente da Dinamarca, 61 pp.
|
|
11)
|
Krogh, P.H. (2009). Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Environmental Project n.o 1256, 66 pp. Agência de Proteção do Ambiente da Dinamarca.
|
|
12)
|
Krogh, P.H., Johansen, K., Holmstrup, M. (1998). Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol., 7, 201-205.
|
|
13)
|
Fjellberg, A. (1980). Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
14)
|
Edwards, C.A. (1955). Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan, D.K. McE., editor), pp. 412-416. Butterworths. Londres.
|
|
15)
|
Goto, H.E. (1960). Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine, 96:138-140.
|
Apêndice 1
Definições
Aplicam-se neste método as seguintes definições (neste ensaio, as concentrações definidas com base nos efeitos que lhes estão associados exprimem-se em termos de massa do produto químico em estudo por massa de resíduo seco do solo ensaiado):
Produto químico
: substância ou mistura.
NOEC (concentração sem efeitos observáveis): concentração do produto químico em estudo à qual não se observa nenhum efeito do mesmo. Neste ensaio, a concentração NOEC não tem nenhum efeito com significância estatística (p < 0,05) num determinado período de exposição, comparativamente ao grupo de controlo.
LOEC (menor concentração com efeitos observáveis): menor concentração do produto químico em estudo que tem algum efeito com significância estatística (p < 0,05) num determinado período de exposição, comparativamente ao grupo de controlo.
CEx
(concentração com x % de efeitos): concentração que causa efeitos em x % dos organismos sujeitos a ensaio num determinado período de exposição, comparativamente ao grupo de controlo. Por exemplo, a CE50 é uma concentração que causa efeitos, num parâmetro ensaiado, em 50 % da população exposta durante o período definido.
Produto químico em estudo
: qualquer substância ou mistura à qual seja aplicado este método de ensaio.
Apêndice 2
Principais etapas do ensaio com colêmbolos e cronologia das mesmas
As etapas do ensaio podem ser resumidas da seguinte forma:
|
Cronologia (dia)
|
Ação
|
|
-23 a -26
|
Preparação de uma cultura síncrona de Folsomia fimetaria.
|
|
-14
|
Preparação do solo artificial (mistura dos componentes secos).
Verificação do pH do solo artificial e ajustamento eventualmente necessário.
Medição da capacidade máxima de retenção de água do solo.
|
|
-9 a -12
|
Preparação de uma cultura síncrona de Folsomia candida.
|
|
-2 a -7
|
Pré-humedecimento do solo.
|
|
–1
|
Repartição dos juvenis por lotes.
Preparação das soluções de reserva e aplicação do produto químico em estudo, caso a aplicação seja por meio de um solvente orgânico.
|
|
0
|
Preparação das soluções de reserva e aplicação do produto químico em estudo, caso se trate da aplicação de um produto químico sólido ou hidrossolúvel ou se o mesmo for aplicado à superfície do solo.
Medição do pH do solo e pesagem de cada recipiente.
Fornecimento de alimento. Introdução dos colêmbolos.
|
|
14
|
Ensaio exploratório da gama de concentrações a utilizar no caso da Folsomia fimetaria: termo do ensaio, retirada dos animais, medição do pH do solo e da perda de água (peso) do solo.
Ensaios definitivos: medição do teor de humidade, reposição de água e adição de 2-10 mg de leveduras.
|
|
21
|
Ensaio definitivo da Folsomia fimetaria: termo do ensaio, retirada dos animais, medição do pH do solo e da perda de água (peso) do solo.
Ensaio exploratório da gama de concentrações a utilizar no caso da Folsomia candida: termo do ensaio, retirada dos animais, medição do pH do solo e da perda de água (peso) do solo.
|
|
28
|
Ensaio definitivo da Folsomia candida: termo do ensaio, retirada dos animais, medição do pH do solo e da perda de água (peso) do solo.
|
Apêndice 3
Orientações relativas à criação e sincronização de Folsomia fimetaria e de Folsomia candida
A cronologia e as durações aqui indicadas devem ser verificadas para cada estirpe de colêmbolos, a fim de garantir que os tempos previstos são suficientes para que se disponha do número necessário de juvenis sincronizados. Basicamente, são a postura de ovos após transferência dos adultos para um substrato fresco e a subsequente eclosão dos mesmos que determinam o dia adequado de recolha de ovos e de juvenis síncronos.
Recomenda-se a existência em permanência de uma cultura de reserva, constituída, por exemplo, por 50 recipientes/placas de Petri. Deve manter-se a cultura de reserva em boas condições de alimentação, fornecendo-lhe semanalmente alimentos e água e dela retirando o alimento velho e as carcaças. Se o número de colêmbolos presentes no substrato for demasiado pequeno, pode haver um acréscimo de desenvolvimento fúngico com consequências em termos de inibição. Caso se utilize muito frequentemente a cultura de reserva na produção de ovos, a cultura pode esgotar-se. Constituem sinais de esgotamento a presença de adultos mortos e de bolores no substrato. Os ovos sobejantes da produção de animais síncronos podem ser utilizados para rejuvenescer a cultura.
Numa cultura síncrona de Folsomia fimetaria, distinguem-se os machos das fêmeas em primeiro lugar pelo tamanho. Os machos são claramente mais pequenos do que as fêmeas e deslocam-se mais rapidamente do que estas. Não é necessária grande experiência para determinar corretamente o sexo, podendo este ser confirmado por inspeção da zona genital ao microscópio (13).
1. Criação
1.a) Preparação do substrato de cultura
O substrato de cultura é constituído por gesso de paris (sulfato de cálcio) com carvão vegetal ativado. Esta mistura proporciona um substrato húmido, sendo a função do carvão vegetal absorver as excreções e os gases gerados (14)(15). Podem ser utilizadas diversas formas de carvão vegetal para facilitar o exame dos colêmbolos. Por exemplo, utiliza-se carvão vegetal em pó para a Folsomia candida e a Folsomia fimetaria (obtendo-se um gesso de paris negro ou cinzento):
Componentes do substrato:
|
—
|
20 ml de carvão vegetal ativado,
|
|
—
|
200 ml de água destilada,
|
|
—
|
200 ml de gesso de paris;
|
ou
|
—
|
50 g de carvão vegetal ativado em pó,
|
|
—
|
260-300 ml de água destilada,
|
|
—
|
400 g de gesso de paris.
|
Deixa-se a mistura constituinte do substrato repousar antes de a utilizar.
1.b) Reprodução
Mantêm-se os colêmbolos em recipientes — por exemplo placas de Petri (90 mm × 13 mm) — com o fundo coberto por uma camada de 0,5 cm de substrato de gesso e de carvão vegetal. Criam-se os animais à temperatura de 20 °C ± 1 °C com ciclos de 12 horas de luz seguidos de 12 horas de escuridão (400-800 lux). Mantêm-se os recipientes sempre húmidos, de modo que a humidade relativa do ar dentro deles seja de 100 %. Para isso, pode haver água livre no interior do gesso (poroso), mas não uma película de água à superfície deste. Podem ser evitadas perdas de água mantendo húmido o ar ambiente. Removem-se dos recipientes todos os indivíduos mortos e o alimento bolorento. Para estimular a produção de ovos, é necessário transferir espécimes adultos para placas de Petri guarnecidas com substrato fresco de gesso de paris e carvão vegetal.
1.c) Fonte alimentar
A única fonte alimentar utilizada para a Folsomia candida e a Folsomia fimetaria é um granulado de levedura de padeiro desidratada. Para evitar a formação de bolores, prepara-se alimento novo uma ou duas vezes por semana. Coloca-se o alimento à superfície do gesso de paris, formando um pequeno montículo. Ajusta-se a quantidade de levedura de padeiro à dimensão da população de colêmbolos; em geral, são suficientes 2-15 mg.
2. Sincronização
A fim de obter animais homogéneos, no mesmo estádio de desenvolvimento e com o mesmo tamanho, é necessário realizar o ensaio com animais sincronizados. Além disso, a sincronização permite distinguir os machos das fêmeas de Folsomia fimetaria a partir das três semanas de idade, com base no dimorfismo sexual refletido na diferença de tamanhos. Descreve-se a seguir uma maneira de obter animais sincronizados (as etapas práticas são meras sugestões).
2.a) Sincronização
|
—
|
Preparam-se recipientes com uma camada de substrato de gesso de paris e carvão vegetal com 0,5 cm de espessura.
|
|
—
|
Para a postura, transferem-se para novos recipientes 150 a 200 adultos de Folsomia fimetaria e 50 a 100 adultos de Folsomia candida dos melhores 15 a 20 recipientes da cultura de reserva com substrato de 4 a 8 semanas e fornece-se-lhes 15 mg de levedura de padeiro. Não transferir juvenis juntamente com os adultos, pois a presença de juvenis pode inibir a produção de ovos.
|
|
—
|
Mantém-se a cultura à temperatura de 20 °C ± 1 °C (média de 20 °C), com ciclos de 12 horas de luz seguidos de 12 horas de escuridão (400-800 lux). É necessário que haja alimento fresco e que o ar esteja saturado de humidade. A falta de alimento pode levar os animais a defecarem nos ovos, com formação de fungos à superfície destes; no caso da Folsomia candida, os animais podem comer os próprios ovos. Após 10 dias, recolhem-se cuidadosamente os ovos com uma agulha e uma espátula e transferem-se para pequenos pedaços de papel de filtro previamente embebido numa calda de gesso de paris e carvão vegetal, colocados num recipiente com substrato fresco de gesso e carvão vegetal. Para atrair os juvenis e fazê-los sair do papel de filtro, adicionam-se alguns grânulos de levedura. É importante que o papel de filtro e o substrato estejam húmidos, para que os ovos não se desidratem. Outra possibilidade é remover os adultos das caixas de cultura sincronizada depois de produzirem ovos durante 2 ou 3 dias.
|
|
—
|
Após três dias, a maior parte dos ovos à superfície do papel de filtro terão eclodido, podendo encontrar-se alguns juvenis por debaixo desse papel.
|
|
—
|
Para que a idade dos juvenis seja homogénea, retira-se com uma pinça da placa de Petri o papel de filtro com os ovos ainda não eclodidos. Deixam-se os juvenis (que têm 0 a 3 dias) na placa de Petri e alimentam-se com levedura de padeiro. Descartam-se os ovos não eclodidos.
|
|
—
|
Cultivam-se os ovos e os juvenis do mesmo modo que os adultos. No caso da Folsomia fimetaria, procede-se do seguinte modo: fornece-se alimento fresco em quantidade suficiente e retira-se o alimento velho bolorento; após uma semana, distribuem-se os juvenis por novas placas de Petri, mantendo uma densidade superior a 200.
|
2.b) Manipulação dos colêmbolos no início do ensaio
|
—
|
Recolhem-se os animais (com 9 a 12 dias no caso da Folsomia candida ou com 23 a 26 dias no caso da Folsomia fimetaria), por exemplo por aspiração, e transferem-se para um pequeno recipiente guarnecido com substrato humedecido de gesso e de carvão vegetal; verifica-se ao microscópio o estado físico em que se encontram, descartando-se os animais feridos ou lesionados. Realizam-se todas as etapas mantendo os colêmbolos numa atmosfera húmida — utilizando superfícies húmidas, por exemplo — para evitar stress hídrico.
|
|
—
|
Vira-se o recipiente ao contrário e dão-se pequenas pancadas nele para transferir os colêmbolos para o solo. É necessário descarregar a eletricidade estática, caso contrário os animais poderiam ficar suspensos no ar ou aderentes ao recipiente de ensaio, acabando por secar. Para descarregar a eletricidade estática, pode colocar-se um ionizador ou um tecido húmido debaixo do recipiente.
|
|
—
|
Distribui-se o alimento à superfície do solo, sem o amontoar.
|
|
—
|
Durante o transporte e o ensaio é conveniente não dar pancadas nos recipientes de ensaio nem os perturbar de qualquer outro modo, pois isso poderia aumentar a compactação do solo e dificultar as interações dos colêmbolos.
|
3. Outras espécies de colêmbolos possíveis
Para a realização deste ensaio, podem ser utilizadas outras espécies de colêmbolos, como a Proisotoma minuta, a Isotoma viridis, a Isotoma anglicana, a Orchesella cincta, a Sinella curviseta, a Paronychiurus kimi, a Orthonychiurus folsomi e a Mesaphorura macrochaeta. A utilização de espécies alternativas está subordinada aos seguintes requisitos:
|
—
|
identificação inequívoca da espécie;
|
|
—
|
fundamentação da utilização da espécie;
|
|
—
|
inclusão da biologia reprodutiva na fase de ensaio, para que a mesma possa constituir um alvo potencial durante a exposição;
|
|
—
|
ciclo de vida conhecido: idade de maturação, duração do desenvolvimento dos ovos e estádios de desenvolvimento expostos;
|
|
—
|
condições ótimas de crescimento e de reprodução proporcionadas pelo substrato utilizado no ensaio e pela alimentação fornecida;
|
|
—
|
variabilidade suficientemente reduzida, para que possa estimar-se a toxicidade com precisão e exatidão.
|
Apêndice 4
Retirada e contagem dos animais
1. Distinguem-se dois métodos de retirada dos animais:
|
1.a)
|
Primeiro método: Utiliza-se um extrator com gradiente de temperatura regulado baseado nos princípios de MacFayden (1). O calor provém de um elemento térmico existente na parte superior da caixa de extração e é regulado por um termístor colocado na superfície da amostra de solo. A temperatura do líquido refrigerado que rodeia o recipiente de recolha é regulada por um termístor existente na superfície da caixa de recolha (situado abaixo do solo). Os termístores estão ligados a uma unidade reguladora programável que aumenta a temperatura segundo um programa pré-definido. Recolhem-se os animais na caixa de recolha arrefecida (2 °C), em cujo fundo se colocou uma camada de gesso de paris e carvão vegetal. Inicia-se a retirada a 25 °C e aumenta-se automaticamente a temperatura 5 °C de 12 em 12 horas, durante 48 horas. Após 12 horas a 40 °C, dá-se a retirada por terminada.
|
|
1.b)
|
Segundo método: Após o período de incubação experimental, avalia-se pelo método de flutuação o número de colêmbolos juvenis presentes. Para isso, realiza-se o ensaio em recipientes com volume aproximado de 250 ml. No final do ensaio, adicionam-se aproximadamente 200 ml de água destilada. Para que os colêmbolos fiquem a flutuar, mexe-se suavemente o solo com um pequeno pincel. Para facilitar a contagem, aumentando o contraste entre a água e os colêmbolos (que são brancos), pode adicionar-se à água uma pequena quantidade (aproximadamente 0,5 ml) de pigmento fotográfico negro Kentmere. O pigmento não é tóxico para os colêmbolos.
|
2. Contagem:
Pode efetuar-se a contagem a olho nu ou com um microscópio ótico, após colocação de uma grelha por cima do recipiente de flutuação, ou fotografando a superfície de cada recipiente e contando posteriormente os colêmbolos em fotografias ampliadas ou diapositivos projetados. Também pode efetuar-se a contagem recorrendo a técnicas de digitalização de imagem (12). É necessário validar a técnica utilizada.
Apêndice 5
Determinação da capacidade máxima de retenção de água do solo
Considera-se adequado o método a seguir descrito de determinação da capacidade máxima de retenção de água do solo. Consta do anexo C da norma ISO DIS 11268-2 [Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Parte 2: Determination of effects on reproduction].
Utilizando um instrumento adequado (tubo helicoidal para recolha de amostras ou outro), recolhe-se uma quantidade definida (por exemplo 5 g) do solo que serve de substrato para o ensaio. Cobre-se o fundo do tubo com um pedaço de papel de filtro humedecido e coloca-se o tubo num suporte dentro de um banho de água. Imerge-se o tubo gradualmente, até que o nível da água fique acima do nível do solo. Deixa-se o tubo em água durante cerca de três horas. Uma vez que nem toda a água absorvida pelo solo por capilaridade pode ficar retida, deixa-se escorrer a amostra de solo durante duas horas, colocando o tubo em cima de um leito de areia quartzítica finamente moída muito humedecida, dentro de um recipiente tapado (para evitar a secagem). Em seguida, pesa-se a amostra e seca-se a mesma a 105 °C até massa constante. Calcula-se a capacidade de retenção de água (CRA) do seguinte modo:

em que:
|
S
|
=
|
massa do substrato saturado de água + massa do tubo + massa do papel de filtro,
|
|
T
|
=
|
tara (massa do tubo + massa do papel de filtro),
|
|
D
|
=
|
massa do resíduo seco do substrato.
|
Apêndice 6
Determinação do pH do solo
O método de determinação do pH do solo a seguir descrito baseia-se na norma ISO DIS 10390: Soil Quality — Determination of pH.
Deixa-se secar à temperatura ambiente uma quantidade definida de solo durante, pelo menos, 12 horas. Prepara-se uma suspensão de, pelo menos, 5 g de solo em cinco vezes o volume deste de solução 1 M de cloreto de potássio (KCl) de qualidade analítica ou de solução 0,01 M de cloreto de cálcio (CaCl2) de qualidade analítica. Agita-se vigorosamente a suspensão durante cinco minutos e deixa-se decantar durante, pelo menos, duas horas, mas não mais de 24 horas. Em seguida, mede-se o pH da fase líquida com um medidor de pH — previamente calibrado antes de cada medição, utilizando uma série adequada de soluções tampão (pH 4,0 e 7,0, por exemplo).
C.40. ENSAIO DE TOXICIDADE NO CICLO DE VIDA EM QUIRONOMÍDEOS NUM SISTEMA SEDIMENTOS-ÁGUA COM SEDIMENTOS OU ÁGUA ENRIQUECIDOS
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 233 (2010) da OCDE. Foi concebido para avaliar os efeitos de uma exposição ao longo de todo o ciclo de vida dos dípteros de água doce Chironomus sp. a produtos químicos e cobre toda a 1.a geração (geração P) e a fase inicial da vida da 2.a geração (geração F1). Constitui uma extensão dos métodos de ensaio C.28 (1) ou C.27 (15), cujo cenário de exposição compreende, respetivamente, água enriquecida e sedimentos enriquecidos. Baseia-se nos atuais protocolos de ensaios de toxicidade para as espécies Chironomus riparius e Chironomus dilutus — anteriormente Chironomus tentans (2) –, que foram desenvolvidos na Europa e na América do Norte (3)(4)(5)(6)(7)(8)(9) e subsequentemente sujeitos a estudos interlaboratoriais comparativos (1)(7)(10)(11)(12). Podem também ser utilizadas outras espécies de quironomídeos bem documentadas, como a Chironomus yoshimatsui (13)(14). A duração da exposição completa é de cerca 44 dias no caso da Chironomus riparius e de cerca de 100 dias no caso da Chironomus dilutus.
|
|
2.
|
Este método descreve tanto o cenário de exposição na água como o cenário de exposição nos sedimentos. A seleção do cenário de exposição adequado depende da finalidade do ensaio. O cenário de exposição na água, que envolve o enriquecimento da coluna de água no produto químico em estudo, tem por objetivo simular as perdas por dispersão na aplicação de pesticidas e abrange o pico de concentração inicial nas águas de superfície. O processo de enriquecimento da água também é útil para outros tipos de exposição (incluindo o derrame de produtos químicos), mas não se aplica a processos de acumulação em sedimentos mais demorados do que o período de ensaio. Neste último caso e também quando a principal via de chegada dos pesticidas às massas de água é por via de escorrências, pode ser mais adequado um cenário de sedimentos enriquecidos. Caso se perspetivem outros cenários de exposição, o planeamento do ensaio pode ser adaptado com facilidade. Por exemplo, se a repartição do produto químico em estudo entre a fase aquosa e a camada de sedimentos não for relevante e for necessário minimizar a adsorção aos sedimentos, pode utilizar-se em alternativa um sedimento artificial (areia quartzítica etc.).
|
|
3.
|
Os produtos químicos a ensaiar em organismos que vivem nos sedimentos persistem, em geral, nos sedimentos por longos períodos. A exposição dos referidos organismos pode ter lugar por várias vias. A importância relativa de cada via de exposição, bem como o tempo de contribuição de cada uma delas para o efeito tóxico global, depende das propriedades físico-químicas do produto químico em causa. No caso de produtos químicos fortemente adsorventes e dos produtos químicos que se ligam aos sedimentos por ligações covalentes, a ingestão de alimentos contaminados pode constituir uma via de exposição significativa. Para não subestimar a toxicidade dos produtos químicos muito lipófilos, pode ponderar-se a adição de alimentos aos sedimentos antes da aplicação do produto químico em estudo (ver o ponto 31). Por conseguinte, podem ser contempladas todas as vias de exposição e todos os estádios do ciclo de vida.
|
|
4.
|
Os parâmetros medidos são o número total de indivíduos adultos emergidos (da primeira e da segunda gerações), a taxa de desenvolvimento (idem), o rácio sexual dos indivíduos adultos totalmente emergidos e vivos (idem), o número de aglomerados de ovos por fêmea (unicamente da primeira geração) e a fertilidade desses aglomerados de ovos (unicamente da primeira geração).
|
|
5.
|
Recomenda-se vivamente a utilização de sedimentos formulados, que apresentam várias vantagens relativamente aos sedimentos naturais:
|
—
|
variabilidade experimental reduzida, porque os sedimentos passam a constituir uma matriz “normalizada” reprodutível, eliminando-se a necessidade de encontrar fontes de sedimentos limpos e não-contaminados;
|
|
—
|
possibilidade de iniciar os ensaios em qualquer momento, sem nenhuma variabilidade sazonal dos sedimentos ensaiados, não sendo também necessário pré-tratá-los para remover a fauna indígena;
|
|
—
|
custo reduzido, comparativamente à colheita no terreno de quantidades suficientes de sedimentos para os ensaios de rotina;
|
|
—
|
possibilidade de efetuar comparações de toxicidade entre vários estudos e de escalonar os produtos químicos em conformidade (3).
|
|
|
6.
|
Definem-se no apêndice 1 alguns conceitos utilizados.
|
PRINCÍPIO DO MÉTODO
|
7.
|
Expõem-se larvas de quironomídeos do primeiro estádio larvar a uma gama de concentrações do produto químico em estudo num sistema sedimentos-água. Inicia-se o ensaio com a colocação de larvas do primeiro estádio larvar (1.a geração) em copos de ensaio que contêm os sedimentos enriquecidos, ou então adiciona-se o produto químico em estudo à água depois de introduzidas as larvas nos copos. Determinam-se a emergência de quironomídeos, o tempo de emergência e o rácio sexual dos insetos totalmente emergidos e vivos. A fim de facilitar a enxameação, o acasalamento e a postura, transferem-se os adultos emergidos para gaiolas de criação. Determinam-se o número de aglomerados de ovos produzidos e a fertilidade dos mesmos. A partir desses aglomerados de ovos, obtêm-se larvas de 2.a geração no primeiro estádio larvar. Colocam-se estas larvas em copos de ensaio preparados de fresco (procedimento de enriquecimento idêntico ao da 1.a geração), para determinar a viabilidade da 2.a geração por meio de uma avaliação da emergência, do tempo de emergência e do rácio sexual dos insetos totalmente emergidos e vivos (esquematiza-se no apêndice 5 este ensaio no ciclo de vida). Analisam-se os dados por recurso a um modelo de regressão, de forma a estimar a concentração que causaria uma redução de x % do parâmetro considerado, ou recorrendo a testes de hipóteses para determinar a NOEC. Este último método passa pela comparação, mediante testes estatísticos, das respostas à exposição ao produto químico em estudo com as respostas obtidas para o grupo de controlo adequado. Note-se que, no cenário da água enriquecida e no caso dos produtos químicos que se degradam rapidamente, os estádios do ciclo de vida mais adiantados de cada geração (por exemplo a fase de ninfa) podem estar expostos a concentrações consideravelmente mais baixas na água sobrenadante do que as larvas do primeiro estádio larvar. Nesta eventualidade e caso seja necessário um nível de exposição comparável em cada estádio do ciclo de vida, são de ponderar as seguintes adaptações do método de ensaio:
|
—
|
realização de experiências paralelas, procedendo ao enriquecimento com o produto químico em estudo em diversos estádios do ciclo de vida, ou
|
|
—
|
repetição do enriquecimento (ou renovação da água sobrenadante) do sistema de ensaio durante ambas as fases do ensaio (1.a e 2.a gerações), adaptando os intervalos entre enriquecimentos (renovações) ao devir característico do produto químico em estudo.
|
Estas adaptações só são realizáveis no cenário da água enriquecida; não o são no cenário dos sedimentos enriquecidos.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
8.
|
É necessário conhecer a hidrossolubilidade, a pressão de vapor e o log K
ow do produto químico em estudo, a partição deste nos sedimentos, medida ou calculada, e a estabilidade do mesmo na água e nos sedimentos. É necessário dispor de um método analítico fiável, com exatidão e limite de deteção conhecidos e referidos no relatório, para a determinação quantitativa do produto químico em estudo na água sobrenadante, na água dos poros e nos sedimentos. A fórmula estrutural e o grau de pureza do produto químico constituem igualmente informações úteis. O devir químico do produto químico em estudo (dissipação, degradação biótica ou abiótica etc.) é outra informação útil. Para mais orientações sobre o ensaio de produtos químicos cujas propriedades físico-químicas dificultam a realização dos ensaios, pode consultar-se a referência (16).
|
PRODUTOS QUÍMICOS DE REFERÊNCIA
|
9.
|
Para ter a certeza de que a sensibilidade da população do laboratório não sofreu alterações, pode proceder-se ao ensaio periódico de produtos químicos de referência. Tal como no caso das dáfnias, seria suficiente um ensaio de toxicidade aguda às 48 horas (17). Todavia, enquanto não se dispõe de orientações validadas para o ensaio de toxicidade aguda, é de ponderar a realização de um ensaio de toxicidade crónica de acordo com o capítulo C.28 deste anexo. São exemplos de produtos químicos tóxicos de referência utilizados com êxito em estudos interlaboratoriais comparativos e estudos de validação o lindano, a trifluralina, o pentaclorofenol, o cloreto de cádmio e o cloreto de potássio (1)(3)(6)(7)(18).
|
VALIDADE DO ENSAIO
|
10.
|
Para que um ensaio possa considerar-se válido, têm de ser cumpridas as seguintes condições:
|
—
|
a emergência média no grupo de controlo no final do período de exposição é, pelo menos, de 70 % para ambas as gerações (1)(7);
|
|
—
|
no caso da Chironomus riparius e da Chironomus yoshimatsui, 85 % do total de emersões de insetos adultos no grupo de controlo ocorrem, em ambas as gerações, 12 a 23 dias após a introdução, nos recipientes de ensaio, das larvas do primeiro estádio larvar; no caso da Chironomus dilutus, é aceitável um período de 20 a 65 dias;
|
|
—
|
o rácio sexual médio dos indivíduos adultos totalmente emergidos e vivos (proporção de fêmeas ou de machos) no grupo de controlo é, pelo menos, de 0,4, mas não superior a 0,6, em ambas as gerações;
|
|
—
|
em cada gaiola de criação dos grupos de controlo da 1.a geração, o número de aglomerados de ovos é, pelo menos, de 0,6 por fêmea nela introduzida;
|
|
—
|
em cada gaiola de criação dos grupos de controlo da 1.a geração, a fração de aglomerados de ovos férteis é, pelo menos, de 0,6;
|
|
—
|
no termo do período de exposição de ambas as gerações, medem-se em cada recipiente de ensaio o pH e a concentração de oxigénio dissolvido; em todos os recipientes de ensaio, a concentração de oxigénio é, pelo menos, de 60 % do valor da saturação com ar (VSA (23)) e o pH da água sobrenadante está compreendido entre 6 e 9;
|
|
—
|
a temperatura da água não varia mais de ±1,0 °C.
|
|
DESCRIÇÃO DO MÉTODO
Recipientes de ensaio e gaiolas de criação
|
11.
|
Expõem-se as larvas em copos de vidro de 600 ml com cerca de 8,5 cm de diâmetro (ver o apêndice 5). Podem ser utilizados outros recipientes que possibilitem uma espessura adequada da água sobrenadante e dos sedimentos. A superfície dos sedimentos deve ser suficiente para proporcionar 2 a 3 cm2 por larva. A razão entre a espessura da camada de sedimentos e a espessura da água sobrenadante deve ser de aproximadamente 1:4. Utilizam-se gaiolas de criação (mínimo de 30 cm para cada uma das três dimensões) dotadas de uma tela (malha de aproximadamente 1 mm) na parte superior e, pelo menos, num dos lados (ver o apêndice 5). Tendo em vista a postura dos ovos, coloca-se em cada gaiola uma placa de cristalização de 2 l com os sedimentos e a água preparados para o ensaio. Também na placa de cristalização a razão entre a espessura da camada de sedimentos e a espessura da água sobrenadante deve ser de aproximadamente 1:4. Transferem-se os aglomerados de ovos da placa de cristalização para placas de microtitulação com doze alvéolos (um aglomerado de ovos por alvéolo, contendo este pelo menos 2,5 ml de água enriquecida proveniente da placa de cristalização) e cobrem-se as placas de microtitulação com uma tampa, para evitar que ocorra evaporação significativa. Podem ser utilizados outros recipientes para conservar os aglomerados de ovos. Com exceção das placas de microtitulação, os recipientes de ensaio e os outros equipamentos que entram em contacto com o sistema de ensaio devem ser exclusivamente de vidro ou de outro material quimicamente inerte (por exemplo politetrafluoroetileno).
|
Escolha da espécie
|
12.
|
De preferência, utiliza-se no ensaio a espécie Chironomus riparius, embora também possa utilizar-se a Chironomus yoshimatsui. A espécie Chironomus dilutus também é adequada, mas é mais difícil de manipular e exige um período de ensaio mais longo. O apêndice 2 descreve o método de cultura da Chironomus riparius. Dispõe-se igualmente de informações sobre as condições de cultura da Chironomus dilutus (5) e da Chironomus yoshimatsui (14). Deve confirmar-se a identidade da espécie antes de cada ensaio, exceto se os organismos provierem de uma cultura interna do laboratório.
|
Sedimentos
|
13.
|
De preferência, utilizam-se sedimentos formulados (igualmente designados por sedimentos reconstituídos, artificiais ou sintéticos). Contudo, se forem utilizados sedimentos naturais, estes devem ser caracterizados (pelo menos pH e teor de carbono orgânico, recomendando-se a determinação de outros parâmetros, como a razão C/N e a granulometria) e devem estar isentos de qualquer contaminação e de outros organismos que possam competir com as larvas de quironomídeos ou comê-las. Recomenda-se igualmente que os sedimentos sejam mantidos durante sete dias em condições idênticas às que se verificarão durante o ensaio a realizar. Recomenda-se (1)(20)(21) a seguinte composição de sedimentos formulados, descrita em (1):
|
a)
|
4-5 % (peso seco) de turfa: pH tão próximo quanto possível de 5,5 a 6,0; é importante utilizar turfa em pó finamente moída (granulometria ≤1 mm), seca unicamente ao ar;
|
|
b)
|
20 % (peso seco) de argila caulínica, de preferência com teor de caulinite superior a 30 %;
|
|
c)
|
75-76 % (peso seco) de areia quartzítica (com predominância de areia fina, com mais de 50 % de partículas de granulometria compreendida entre 50 μm e 200 μm);
|
|
d)
|
quantidade de água desionizada necessária para que o teor de humidade da mistura final se situe na gama 30–50 %;
|
|
e)
|
quantidade de carbonato de cálcio (CaCO3) quimicamente puro necessária para ajustar o pH da mistura final dos sedimentos a 7,0 ± 0,5;
|
|
f)
|
teor de carbono orgânico da mistura final: 2 % ± 0,5 %, a ajustar por recurso a quantidades adequadas de turfa e areia, em conformidade com as alíneas a) e c).
|
|
|
14.
|
As origens da turfa, da argila caulínica e da areia devem ser conhecidas. Deve confirmar-se a ausência de contaminação química (metais pesados, compostos organoclorados, compostos organofosforados etc.) nos componentes dos sedimentos. Exemplifica-se no apêndice 3 a preparação de sedimentos formulados. Uma mistura de componentes secos também é aceitável caso se demonstre que, após a adição da água sobrenadante, não ocorre separação de componentes dos sedimentos (por exemplo, partículas de turfa flutuantes) e que a turfa ou os sedimentos são suficientemente condicionados.
|
Água
|
15.
|
Qualquer água com as características químicas de uma água de diluição aceitável enunciadas nos apêndices 2 e 4 é adequada para o ensaio. Para a cultura e o ensaio, é aceitável qualquer água adequada, seja água natural (superficial ou subterrânea), água reconstituída (ver o apêndice 2) ou água da torneira desclorada, desde que os quironomídeos nela sobrevivam durante todo o período de cultura e de ensaio sem evidenciarem sinais de stress. No início do ensaio, o pH da água nele utilizada deve estar compreendido entre 6 e 9 e a dureza total da água, expressa em CaCO3, não deve exceder 400 mg/l. No entanto, caso se suspeite de uma interação entre os iões responsáveis pela dureza e o produto químico em estudo, deve utilizar-se uma água mais macia (nessa eventualidade, não pode utilizar-se o meio Elendt M4). Deve utilizar-se o mesmo tipo de água em todo o estudo. As características de qualidade da água indicadas no apêndice 4 devem ser determinadas, pelo menos, duas vezes por ano ou sempre que se suspeite que tenham mudado significativamente.
|
Soluções de reserva — água enriquecida
|
16.a)
|
Calculam-se as concentrações de ensaio com base nas concentrações da água da coluna de água, ou seja, da água sobrenadante aos sedimentos. De modo geral, preparam-se as soluções de ensaio com as concentrações escolhidas por diluição de uma solução de reserva. De preferência, preparam-se as soluções de reserva por dissolução, na água utilizada no ensaio, do produto químico em estudo. Em alguns casos, pode ser necessário utilizar solventes ou dispersantes para obter uma solução de reserva com a concentração adequada. A acetona, os éteres mono e dimetílico do etilenoglicol, a dimetilformamida e o trietilenoglicol constituem exemplos de solventes adequados. No que respeita aos dispersantes, podem ser utilizados o Cremophor RH40, o Tween 80, a metilcelulose a 0,01 % e o HCO-40. A concentração do agente solubilizante no meio de ensaio final deve ser mínima (ou seja, ≤ 0,1 ml/l) e deve ser a mesma para todas as concentrações de exposição. Caso se utilize um agente solubilizante, o agente em causa não deve ter efeitos com significância na sobrevivência, a confirmar por comparação de um grupo de controlo do solvente com um grupo de controlo negativo (da água) No entanto, deve evitar-se ao máximo utilizar tais produtos.
|
Soluções de reserva — sedimentos enriquecidos
|
16.b)
|
O enriquecimento dos sedimentos nas concentrações escolhidas é geralmente efetuado por adição direta aos sedimentos de uma solução do produto químico em estudo. Com o auxílio de um moinho de rolos ou de um misturador de alimentos, ou manualmente, misturam-se os sedimentos formulados com solução de reserva do produto químico em estudo dissolvido em água desionizada. Se o produto químico for pouco solúvel em água, pode dissolver-se o mesmo no menor volume possível de um solvente orgânico adequado (por exemplo hexano, acetona ou clorofórmio). Seguidamente, mistura-se esta solução com 10 g de areia quartzítica fina por recipiente de ensaio. Deixa-se evaporar o solvente até ser totalmente removido da areia e mistura-se então esta com a quantidade adequada de sedimentos. Para solubilizar, dispersar ou emulsionar o produto químico em estudo, apenas podem ser utilizados agentes muito voláteis. Ao preparar os sedimentos, há que ter em conta a areia que é misturada com o produto químico (ou seja, deve utilizar-se menos areia na preparação dos sedimentos). Deve ter-se o cuidado de assegurar uma distribuição completa e uniforme do produto químico nos sedimentos aos quais este é adicionado. Se necessário, pode recorrer-se à análise de subamostras para determinar o grau de homogeneidade.
|
PLANEAMENTO DO ENSAIO
|
17.
|
Consiste na escolha do número de concentrações a ensaiar e do intervalo entre elas, do número de recipientes para cada concentração, do número de larvas por recipiente e do número de placas de cristalização e de gaiolas de criação. Descreve-se a seguir o protocolo de determinação de CEx e de NOEC, bem como de realização de ensaios do limite.
|
Análise por regressão
|
18.
|
O ensaio deve abranger a concentração com efeitos CEx e a gama de concentrações na qual o produto químico em estudo tem efeitos significativos, de modo que o parâmetro escolhido não seja obtido por extrapolação além dos limites dos dados obtidos. São de evitar extrapolações muito abaixo da concentração mais baixa ou muito acima da concentração mais elevada. Para escolher uma gama adequada de concentrações a ensaiar, pode ser útil realizar um ensaio exploratório preliminar da gama de concentrações a utilizar.
|
|
19.
|
Para determinar uma CEx, são necessários, pelo menos, cinco concentrações diferentes e oito replicados de cada uma delas. Utilizam-se duas gaiolas de criação (A e B) para cada concentração. Dividem-se os oito replicados em dois grupos de quatro, sendo um associado a uma das gaiolas e o outro à outra. Procede-se a esta agregação de replicados devido ao número de insetos que é necessário ter em cada gaiola para uma avaliação fiável da reprodução. Constituem-se igualmente oito replicados na 2.a geração, obtidos a partir das populações expostas nas gaiolas de criação. O fator entre concentrações consecutivas não deve ser superior a dois (salvo se a curva dose-resposta tiver um declive reduzido). Caso se ensaie um número maior de concentrações com respostas diferentes, pode reduzir-se a seis o número de replicados correspondente a cada nível de exposição (três replicados em cada gaiola de criação). O aumento do número de replicados ou a redução do intervalo entre concentrações consecutivas ensaiadas tende a estreitar o intervalo de confiança em volta da CEx.
|
Estimativa da NOEC/LOEC
|
20.
|
Para determinar uma NOEC, são necessários cinco concentrações diferentes e, pelo menos, oito replicados de cada uma delas (4 para a gaiola de criação A e 4 para a gaiola de criação B) e o fator entre concentrações consecutivas não deve ser superior a dois. O número de replicados deve ser suficiente para detetar estatisticamente uma diferença de 20 % relativamente ao grupo de controlo, com um grau de significância de 5 % (α = 0,05). Para a taxa de desenvolvimento, a fecundidade e a fertilidade, é normalmente adequada uma análise de variância (ANOVA), seguida de um teste de Dunnett ou de um teste de Williams (22)(23)(24)(25). Para a taxa de emergência e o rácio sexual, podem ser adequados o teste de Cochran-Armitage, o teste exato de Fisher (com a correção de Bonferroni) ou o teste de Mantel-Haentzal.
|
Ensaio do limite
|
21.
|
Caso não se observem efeitos à concentração máxima no ensaio exploratório facultativo preliminar da gama de concentrações a utilizar, pode efetuar-se um ensaio do limite (ensaio de uma concentração e de ou mais grupos de controlo). O objetivo do ensaio do limite consiste em obter a indicação de que os eventuais efeitos tóxicos do produto químico em estudo ocorrem a concentrações superiores à concentração-limite ensaiada. As concentrações recomendadas são 100 mg/l para a água e 1 000 mg/kg (peso seco) para os sedimentos. Em geral, são necessários, pelo menos, oito replicados de exposição e oito replicados de controlo. Deve demonstrar-se ser possível detetar estatisticamente uma diferença de 20 % relativamente ao grupo de controlo, com um grau de significância de 5 % (α = 0,05). No caso das respostas mensuráveis (por exemplo a taxa de desenvolvimento), o teste t é um método estatístico adequado se os dados satisfizerem os requisitos deste teste (normalidade, variâncias homogéneas). Se esses requisitos não estiverem preenchidos, pode utilizar-se um teste t de variância desigual ou um teste não-paramétrico, como o teste de Wilcoxon-Mann-Whitney. O teste exato de Fisher é adequado para a taxa de emergência.
|
PROCEDIMENTO DE ENSAIO
Condições de exposição
Preparação do sistema água-sedimentos (enriquecimento da água)
|
22.a)
|
Coloca-se em cada recipiente de ensaio e em cada placa de cristalização a quantidade de sedimentos formulados (ver os pontos 13 e 14 e o apêndice 3) necessária para constituir uma camada de espessura compreendida entre 1,5 cm (podendo ser um pouco menos nas placas de cristalização) e 3 cm. Adiciona-se água (ver o ponto 15) de modo que a razão entre a espessura da camada de sedimentos e a espessura da camada de água não exceda 1:4. Depois da preparação dos recipientes de ensaio e antes de neles se introduzirem as larvas do primeiro estádio larvar da 1.a ou 2.a gerações, deixam-se os sistemas sedimentos-água sob arejamento ligeiro durante aproximadamente sete dias (ver o ponto 14 e o apêndice 3). Durante o ensaio, não se areja o sistema sedimentos-água das placas de cristalização, pois este não tem de sustentar a sobrevivência das larvas (recolhem-se os aglomerados de ovos antes da eclosão). Para evitar a separação de componentes dos sedimentos e a ressuspensão de finos durante a criação da coluna de água, enquanto a água é vertida os sedimentos podem ser cobertos com um disco de plástico, que se remove imediatamente a seguir. Podem ser igualmente adequados outros dispositivos.
|
Preparação do sistema água-sedimentos (enriquecimento dos sedimentos)
|
22.b)
|
Colocam-se nos recipientes de ensaio e nas placas de cristalização os sedimentos enriquecidos preparados de acordo com o ponto 16.b) e adiciona-se água de modo a formar uma camada sobrenadante com a razão volúmica 1:4 entre os sedimentos e a água. A espessura da camada de sedimentos deve estar compreendida entre 1,5 cm e 3 cm (podendo ser um pouco menos nas placas de cristalização). Para evitar a separação de componentes dos sedimentos e a ressuspensão de finos durante a criação da coluna de água, enquanto a água é vertida os sedimentos podem ser cobertos com um disco de plástico, que se remove imediatamente a seguir. Podem ser igualmente adequados outros dispositivos. Uma vez preparados os sedimentos enriquecidos com a fase aquosa sobrenadante, é conveniente permitir a repartição do produto químico em estudo entre a fase aquosa e os sedimentos (4)(5)(7)(18). Esta repartição deve ocorrer, de preferência, às condições de temperatura e arejamento utilizadas no ensaio. O tempo necessário para atingir o equilíbrio depende dos sedimentos e do produto químico em causa, podendo variar de algumas horas a vários dias e mesmo, em casos raros, chegar a ser de 5 semanas. Dado que, nesse período, muitos produtos químicos poderiam degradar-se, não se espera até atingir o equilíbrio, recomendando-se um período de equilibração de 48 horas. Todavia, quando se sabe que o período de semidegradação do produto químico em causa nos sedimentos é longo (ver o ponto 8), pode dilatar-se o período de equilibração. No final deste período de equilibração, mede-se a concentração do produto químico em estudo na água sobrenadante, na água dos poros e nos sedimentos, pelo menos no caso da concentração mais elevada e de uma concentração menor (ver o ponto 38). Estas determinações analíticas do produto químico permitem efetuar o balanço de massas e exprimir os resultados com base em concentrações medidas.
|
|
23.
|
Cobrem-se os recipientes de ensaio (por exemplo com placas de vidro). Se necessário, o nível inicial de água pode ser reposto durante o ensaio, para compensar a evaporação. Para tal, utiliza-se água destilada ou desionizada, de modo a evitar a acumulação de sais. Não é necessário cobrir as placas de cristalização colocadas nas gaiolas de criação, embora possa repor-se o nível inicial de água para compensar as perdas durante o período de ensaio; porém, esta reposição não é indispensável, porque os aglomerados de ovos só estão em contacto com a água cerca de um dia e estas placas só são utilizadas durante uma curta fase do ensaio.
|
Introdução dos organismos utilizados no ensaio
|
24.
|
Quatro a cinco dias antes da introdução das larvas do primeiro estádio larvar da 1.a geração, transferem-se os aglomerados de ovos da cultura para pequenos recipientes com meio de cultura. Pode utilizar-se meio proveniente da cultura de reserva ou um meio preparado recentemente. Em qualquer dos casos, adiciona-se uma pequena quantidade de alimento ao meio de cultura, por exemplo algumas gotículas de filtrado de uma suspensão de flocos de alimento para peixes finamente moídos (ver o apêndice 2). Apenas devem ser utilizados aglomerados de ovos de postura recente. Normalmente, as larvas começam a eclodir alguns dias após a postura dos ovos (2 a 3 dias no caso da Chironomus riparius a 20 °C e 1 a 4 dias no caso da Chironomus dilutus a 23 °C e da Chironomus yoshimatsui a 25 °C), e passam depois por quatro estádios de crescimento, cada um dos quais com a duração de 4 a 8 dias. Utilizam-se no ensaio larvas do primeiro estádio larvar (máximo 48 h após a eclosão). O estádio de desenvolvimento larvar em que se encontram as larvas pode, eventualmente, ser verificado por exame da largura da cápsula cefálica (7).
|
|
25.
|
Com o auxílio de uma pipeta embotada, colocam-se vinte larvas do primeiro estádio larvar da 1.a geração, escolhidas aleatoriamente, em cada recipiente de ensaio já com o sistema sedimentos-água. Suspende-se o arejamento da água durante a transferência das larvas para os recipientes de ensaio e as 24 horas subsequentes (ver o ponto 32). Consoante o tipo de ensaio realizado (ver os pontos 19 e 20), o número mínimo de larvas por nível de concentração é de 120 (6 replicados por nível de concentração) para a determinação da CEx e de 160 para a determinação da NOEC (8 replicados por nível de concentração). No protocolo de ensaio com sedimentos enriquecidos, a exposição inicia-se com a transferência das larvas para os recipientes de ensaio.
|
Enriquecimento da água sobrenadante
|
26.
|
Vinte e quatro horas após a transferência das larvas do primeiro estádio larvar da 1.a geração, adiciona-se o produto químico em estudo à coluna de água sobrenadante e reinicia-se um arejamento ligeiro (para possíveis adaptações do protocolo de ensaio, ver o ponto 7). Com o auxílio de uma pipeta, injetam-se na água, abaixo da superfície, pequenos volumes da solução de reserva do produto químico em estudo. Em seguida, homogeneíza-se a água sobrenadante com cuidado, para não revolver os sedimentos. No protocolo de ensaio com água enriquecida, a exposição inicia-se com o enriquecimento da água (ou seja, um dia após a transferência das larvas para os recipientes de ensaio).
|
Recolha dos adultos emergidos
|
27.
|
Utilizando um aspirador, um exaustor ou dispositivo semelhante (ver o apêndice 5), retiram-se dos recipientes de ensaio os insetos emergidos da 1.a geração uma ou, de preferência, duas vezes por dia (ver o ponto 36). Devem ser tomadas as precauções necessárias para não lesionar os insetos. Transferem-se os insetos retirados de quatro dos recipientes de ensaio com o mesmo nível de exposição para a gaiola de criação à qual foram previamente destinados. No dia em que emergem os primeiros insetos (machos), enriquece-se a água das placas de cristalização injetando na água com uma pipeta, abaixo da superfície, um pequeno volume da solução de reserva do produto químico em estudo (protocolo com água enriquecida). Em seguida, homogeneíza-se a água sobrenadante com cuidado, para não revolver os sedimentos. O valor nominal da concentração do produto químico em estudo em cada placa de cristalização é idêntico ao da concentração do mesmo nos recipientes de exposição associados à gaiola de criação em causa. No caso do protocolo dos sedimentos enriquecidos, preparam-se as placas de cristalização cerca de 11 dias após o início da exposição (ou seja, da transferência das larvas da 1.a geração), a fim de que possa estabelecer-se um equilíbrio durante cerca de 48 horas, antes da postura dos primeiros aglomerados de ovos.
|
|
28.
|
Utilizando uma pinça ou uma pipeta embotada, retiram-se os aglomerados de ovos das placas de cristalização da gaiola de criação. Transfere-se cada aglomerado de ovos para um recipiente onde se colocou meio de cultura da placa de cristalização de proveniência dos ovos (por exemplo um alvéolo de uma placa de microtitulação com 12 alvéolos, no qual se colocaram, pelo menos, 2,5 ml de meio de cultura). Para evitar evaporação significativa, tapam-se com uma tampa os recipientes nos quais foram introduzidos os aglomerados de ovos. Mantêm-se os aglomerados de ovos sob observação durante, pelo menos, seis dias após a postura, para que se lhes possa atribuir a classificação de férteis ou inférteis.
Para iniciar a 2.a geração, selecionam-se em cada gaiola de criação pelo menos três, mas de preferência seis, aglomerados férteis de ovos, que se deixam eclodir na presença de um pouco de alimento. A postura destes aglomerados de ovos deve ter ocorrido no pico da postura, o qual, nos recipientes de controlo, normalmente ocorre cerca do 19.o dia de ensaio. O ideal é que a 2.a geração se inicie no mesmo dia para todos os níveis de exposição; porém, devido aos efeitos do produto químico no desenvolvimento das larvas, isto nem sempre é possível. Nesse caso, pode começar-se pelas concentrações mais baixas e pelo grupo de controlo (do solvente), passando depois às concentrações mais elevadas.
|
|
29.a)
|
No protocolo com água enriquecida, prepara-se o sistema sedimentos-água para a 2.a geração injetando o produto químico em estudo na coluna de água sobrenadante cerca de uma hora antes da transferência das larvas do primeiro estádio larvar para os recipientes de ensaio. Com o auxílio de uma pipeta, injetam-se na água, abaixo da superfície, pequenos volumes das soluções do produto químico em estudo. Em seguida, homogeneíza-se a água sobrenadante com cuidado, para não revolver os sedimentos. Depois do enriquecimento da água, dá-se início a um ligeiro arejamento.
|
|
29.b)
|
No protocolo com sedimentos enriquecidos, preparam-se os recipientes de exposição com o sistema sedimentos-água para a 2.a geração do mesmo modo que para a 1.a geração.
|
|
30.
|
Com o auxílio de uma pipeta embotada, colocam-se vinte larvas do primeiro estádio larvar (no máximo 48 h após a eclosão) da 2.a geração, escolhidas aleatoriamente, em cada recipiente de ensaio já com o sistema sedimentos-água enriquecido. Suspende-se o arejamento da água durante a transferência das larvas do primeiro estádio larvar para os recipientes de ensaio e as 24 horas subsequentes. Consoante o tipo de ensaio realizado (ver os pontos 19 e 20), o número mínimo de larvas por nível de concentração é de 120 (6 replicados por nível de concentração) para a determinação da CEx e de 160 para a determinação da NOEC (8 replicados por nível de concentração).
|
Alimentação
|
31.
|
É necessário alimentar as larvas dos recipientes de ensaio, de preferência diariamente, mas, pelo menos, três vezes por semana. Uma quantidade diária por larva de 0,25 mg a 0,5 mg (0,35 mg a 0,5 mg no caso da Chironomus yoshimatsui) de alimento para peixes (suspenso em água ou finamente moído, por exemplo Tetra Min ou Tetra Phyll — para mais informações, ver o apêndice 2) é adequada para larvas jovens, nos primeiros dez dias de desenvolvimento. Após este período, as larvas podem precisar de mais alimento: 0,5 mg a 1,0 mg diários por larva devem ser suficientes durante o resto do ensaio. Deve reduzir-se a ração alimentar de todos os grupos expostos e de controlo nos quais se observe desenvolvimento de fungos ou caso se verifique mortalidade nos grupos de controlo. Se não for possível eliminar o desenvolvimento de fungos, deve repetir-se o ensaio.
A relevância toxicológica da via de exposição por ingestão é geralmente maior no caso dos produtos químicos com elevada afinidade por carbono orgânico e dos produtos químicos que formem ligações covalentes com os sedimentos. Portanto, ao ensaiar produtos químicos com essas propriedades, pode adicionar-se a quantidade de alimento necessária para a sobrevivência e o crescimento natural das larvas aos sedimentos formulados antes do período de estabilização, conforme o imponha a regulamentação. Para evitar a deterioração da qualidade da água, devem ser utilizadas matérias vegetais em vez de alimentos para peixes; por exemplo, 0,5 % (peso seco) de folhas finamente moídas de espécies como a urtiga comum (Urtica dioica), a amoreira (Morus alba), o trevo branco (Trifolium repens) ou o espinafre (Spinacia oleracea) ou outras matérias de origem vegetal (Cerophyl ou α-celulose). A incorporação nos sedimentos da quantidade total de um alimento orgânico antes do enriquecimento daqueles com o produto químico em estudo não deixa de influenciar a qualidade da água e as funções biológicas (21) nem é método normalizado, mas estudos recentes revelaram que funciona (19)(26). Os insetos adultos das gaiolas de criação normalmente não necessitam de alimentação, mas a fecundidade e a fertilidade são favorecidas quando se coloca na gaiola, como fonte alimentar para os adultos emergidos, um tampão de algodão embebido numa solução saturada de sacarose (34).
|
Condições de incubação
|
32.
|
Inicia-se um arejamento ligeiro da água sobrenadante nos recipientes de ensaio 24 horas após a introdução das larvas do primeiro estádio larvar, de ambas as gerações, o qual se mantém até ao final do ensaio (a concentração de oxigénio dissolvido não pode descer abaixo de 60 % do valor da saturação com ar). Procede-se ao arejamento à razão de algumas bolhas por segundo, mergulhando a ponta de uma pipeta de Pasteur de vidro 2 cm a 3 cm acima da camada de sedimentos. Quando se ensaiam produtos químicos voláteis, é de ponderar não arejar o sistema sedimentos-água, mas sem que deixe de ser cumprido o critério de validade mínimo de 60 % do valor da saturação com ar (ponto 10). Para mais orientações, pode consultar-se a referência (16).
|
|
33.
|
Os ensaios com a espécie Chironomus riparius realizam-se à temperatura constante de 20 °C (± 2 °C). No caso das espécies Chironomus tentans e Chironomus yoshimatsui, as temperaturas recomendadas são 23 °C e 25 °C (± 2 °C), respetivamente. Utiliza-se um fotoperíodo de 16 horas, com uma intensidade luminosa de 500 lux a 1 000 lux. No caso das gaiolas de criação, pode incluir-se uma fase de alvorada e uma fase de crepúsculo com a duração de uma hora.
|
Período de exposição
|
34.
|
Protocolo com água enriquecida: O período de exposição da 1.a geração tem início quando se injeta o produto químico em estudo na água sobrenadante dos recipientes de ensaio (operação realizada um dia após a introdução das larvas — ver no ponto 7 eventuais alterações do protocolo de exposição). A exposição das larvas da 2.a geração inicia-se imediatamente, uma vez que aquelas são inseridas num sistema sedimentos-água já enriquecido no produto químico em estudo. Nos ensaios com as espécies Chironomus riparius ou Chironomus yoshimatsui, o período máximo de exposição é de 27 dias, no caso da 1.a geração, e de 28 dias, no caso da 2.a geração (as larvas da 1.a geração passam nos recipientes um dia sem serem expostas). Tendo em conta a sobreposição parcial, a duração total do ensaio é de aproximadamente 44 dias. No caso da espécie Chironomus dilutus, o período máximo de exposição é de 64 dias para a 1.a geração e de 65 dias para a 2.a geração. A duração total do ensaio é de 100 dias, aproximadamente.
Protocolo com sedimentos enriquecidos: A exposição inicia-se com a introdução das larvas; no caso de ambas as gerações das espécies Chironomus riparius e Chironomus yoshimatsui, prolonga-se, no máximo, por 28 dias; no caso de ambas as gerações da espécie Chironomus dilutus, prolonga-se, no máximo, por 65 dias.
|
Exames
Emergência
|
35.
|
Determinam-se para ambas as gerações o tempo de desenvolvimento e o número de insetos machos e fêmeas totalmente emergidos e vivos. Distinguem-se facilmente os machos pelas suas antenas plumosas e pelo seu corpo fino.
|
|
36.
|
Pelo menos três vezes por semana, examinam-se visualmente os recipientes de ensaio correspondentes a ambas as gerações para verificar se as larvas manifestam algum comportamento anormal (saída dos sedimentos, natação inabitual etc.) comparativamente ao grupo de controlo. Durante o período de emergência, iniciado cerca de 12 dias após a introdução das larvas de Chironomus riparius e Chironomus yoshimatsui e cerca de 20 dias após a introdução das larvas de Chironomus dilutus, contam-se os insetos emergidos e determina-se o sexo de cada um deles pelo menos uma vez por dia, mas, de preferência, duas vezes por dia (de manhã cedo e ao fim da tarde). Após a identificação, transferem-se cuidadosamente os insetos da 1.a geração para a gaiola de criação. Depois de identificados, retiram-se e matam-se os insetos da 2.a geração. Transfere-se cada um dos aglomerados de ovos depositados nos recipientes de ensaio da 1.a geração, juntamente com, pelo menos, 2,5 ml de água nativa, para placas de microtitulação de 12 alvéolos (ou outros recipientes adequados), que em seguida se cobrem com uma tampa, para evitar evaporação significativa. Regista-se igualmente o número de larvas mortas e de ninfas visíveis que não emergiram. O apêndice 5 apresenta exemplos de uma gaiola de criação, de um recipiente de ensaio e de um exaustor.
|
Reprodução
|
37.
|
Avaliam-se os efeitos na reprodução através do número de aglomerados de ovos produzidos pela 1.a geração de insetos e da fertilidade desses aglomerados. Uma vez por dia, recolhem-se os aglomerados da placa de cristalização colocada em cada gaiola de criação. Transferem-se os aglomerados de ovos juntamente com, pelo menos, 2,5 ml de água nativa, para placas de microtitulação de 12 alvéolos (um aglomerado por alvéolo) ou outros recipientes adequados, que em seguida se cobrem com uma tampa, para evitar evaporação significativa. Registam-se as seguintes características de cada aglomerado: dia de produção, tamanho (normal, ou seja, 1,0 cm ± 0,3 cm, ou pequeno, normalmente ≤ 0,5 cm), estrutura (normal: cordão espiralado de ovos em forma de banana; ou anormal: por exemplo cordão de ovos não espiralado) e fertilidade (fértil ou infértil). Avalia-se a fertilidade de cada aglomerado de ovos durante o período de seis dias subsequente à postura. Considera-se um aglomerado fértil se, pelo menos, um terço dos ovos eclodir. Utiliza-se o número de fêmeas transferidas para a gaiola de criação para calcular o número de aglomerados de ovos por fêmea e o número de aglomerados de ovos férteis por fêmea. Se necessário, pode determinar-se o número de ovos de um aglomerado pelo método não destrutivo da contagem em anéis — descrito nas referências (32) e (33).
|
Determinações analíticas
Concentração do produto químico em estudo
|
38.
|
No mínimo, analisam-se amostras da água sobrenadante, da água dos poros e dos sedimentos, correspondentes à concentração mais elevada e a uma concentração inferior, no início da exposição (no caso do protocolo de enriquecimento da água, de preferência uma hora após a injeção do produto químico em estudo) e no final do ensaio. Esta recomendação aplica-se aos recipientes de ambas as gerações. Das placas de cristalização das gaiolas de criação apenas se analisa a água sobrenadante, pois é com esta que os aglomerados de ovos entram em contacto (no caso do protocolo dos sedimentos enriquecidos, é de ponderar uma confirmação analítica da concentração dos sedimentos). Durante o ensaio, podem ser realizadas outras determinações consideradas necessárias aos sedimentos, à água dos poros e à água sobrenadante. Estas determinações da concentração do produto químico em estudo proporcionam informações sobre o comportamento deste e/ou a repartição do mesmo no sistema água-sedimentos. A colheita de amostras dos sedimentos e da água dos poros no início e no decurso do ensaio (ver o ponto 39) exige recipientes de ensaio adicionais para as determinações analíticas. Se a repartição do produto químico em estudo entre a água e os sedimentos tiver sido determinada com clareza num estudo água/sedimentos em condições comparáveis (no tocante a proporção relativa de água e de sedimentos, tipo de aplicação, teor de carbono orgânico dos sedimentos etc.) ou se as concentrações medidas da água sobrenadante se mantiverem comprovadamente entre 80 % e 120 % das concentrações nominais ou medidas iniciais, pode não ser necessário efetuar determinações nos sedimentos no caso do protocolo da água enriquecida.
|
|
39.
|
Quando se efetuam medições intermédias (por exemplo no 7.o e/ou no 14.o dias) e a análise necessita de amostras grandes que não possam ser colhidas dos recipientes de ensaio sem influenciar o sistema de ensaio, as determinações analíticas devem ser realizadas com amostras colhidas de recipientes de ensaio adicionais tratados da mesma forma (incluindo a presença dos organismos), mas não utilizados nos exames biológicos.
|
|
40.
|
A centrifugação a 10 000 g, a 4 °C, durante 30 minutos, por exemplo, é o procedimento recomendado para isolar a água intersticial (água dos poros). No entanto, caso se demonstre que o produto químico em estudo não é adsorvido pelos filtros, a filtragem também é aceitável. Em alguns casos, se a amostra for demasiado pequena, pode não ser possível analisar concentrações na água dos poros.
|
Parâmetros físico-químicos
|
41.
|
Determinam-se de modo adequado (ver o ponto 10) o pH, o oxigénio dissolvido na água utilizada no ensaio e a temperatura da água nos recipientes de ensaio e nas placas de cristalização. No início e no final do ensaio, determinam-se a dureza e o teor de amoníaco nos grupos de controlo, bem como num dos recipientes de ensaio e numa placa de cristalização correspondentes à concentração mais elevada.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
42.
|
Este ensaio de ciclo de vida visa determinar o efeito do produto químico em estudo na reprodução e, em duas gerações, na taxa de desenvolvimento e no número de insetos machos e fêmeas totalmente emergidos e vivos. Para a determinação da taxa de emergência, agregam-se os dados correspondentes a machos e fêmeas. Caso não haja diferenças de sensibilidade com significância estatística entre os dois sexos ao nível de taxa de desenvolvimento, os resultados correspondentes a machos e fêmeas podem ser agregados para análise estatística.
|
|
43.
|
Em geral, calculam-se as concentrações com efeitos, expressas em concentração na água sobrenadante (protocolo da água enriquecida) ou nos sedimentos (protocolo dos sedimentos enriquecidos), com base nas concentrações medidas no início da exposição (ver o ponto 38). Portanto, no caso do protocolo da água enriquecida, determina-se a média correspondente a cada concentração de exposição das concentrações normalmente medidas no início da exposição na água sobrenadante dos recipientes de ambas as gerações e das placas de cristalização. No caso do protocolo dos sedimentos enriquecidos, determina-se a média correspondente a cada concentração de exposição das concentrações normalmente medidas no início da exposição nos recipientes de ambas as gerações (e, facultativamente, nas placas de cristalização).
|
|
44.
|
Para efetuar uma estimativa pontual, ou seja, para determinar uma CEx, os dados estatísticos por recipiente e por gaiola de criação podem equiparar-se a replicados reais. No cálculo de um intervalo de confiança para qualquer valor CEx, é necessário ter em conta a variabilidade entre recipientes, ou deve demonstrar-se que essa variabilidade é tão reduzida que pode ser ignorada. Se o modelo for ajustado pelo método dos mínimos quadrados, deve aplicar-se uma transformação aos dados estatísticos por recipiente, para melhorar a homogeneidade da variância. Contudo, os valores de CEx só devem ser calculados após retransformação da resposta no valor original (31).
|
|
45.
|
Se a análise estatística tiver por objetivo determinar a NOEC recorrendo a testes de hipóteses, é necessário ter em conta a variabilidade entre recipientes, o que fica garantido pelo recurso a métodos de análise de variância (por exemplo os testes de Williams e de Dunnett). O teste de Williams é adequado quando, teoricamente, é de esperar uma relação dose-resposta monótona; caso contrário, é adequado um teste de Dunnett. Se não se verificarem os pressupostos habituais da análise de variância, testes mais robustos (27) podem constituir uma alternativa adequada (31).
|
Taxa de emergência
|
46.
|
Os dados relativos às taxas de emergência são dados quantais, que podem ser analisados através de um teste de Cochran-Armitage aplicado de forma regressiva, nos casos em que se prevê uma relação dose-resposta monótona e os dados são compatíveis com a previsão. Caso contrário, pode recorrer-se a um teste exato de Fisher ou a um teste de Mantel-Haentzal com valores p ajustados segundo o método de Bonferroni-Holm. Se, para a mesma concentração, houver indícios de uma maior variabilidade entre replicados do que a sugerida por uma distribuição binomial (frequentemente referida como variação “extrabinomial”), deve utilizar-se um teste exato de Fisher ou um teste de Cochran-Armitage robusto, como proposto na referência (27).
Determina-se a soma dos insetos (machos e fêmeas) vivos emergidos por recipiente, ne
, e divide-se esse número pelo número de larvas introduzidas, na
:

em que:
|
TE
|
=
|
taxa de emergência,
|
|
ne
|
=
|
número de insetos vivos emergidos no recipiente,
|
|
na
|
=
|
número de larvas introduzidas no recipiente (normalmente 20).
|
Quando ne
é superior a na
(ou seja, quando foi introduzido involuntariamente um número de larvas maior do que o previsto), considera-se na
igual a ne
.
|
|
47.
|
Uma alternativa mais adequada a amostras grandes, quando se regista variância extrabinomial, consiste em tratar a taxa de emergência como uma resposta contínua e aplicar métodos compatíveis com os dados de taxa de emergência em causa. Neste contexto, uma amostra “grande” é definida como aquela em que o número total de insetos emergidos e não emergidos é, cada um deles, superior a cinco por replicado (recipiente).
|
|
48.
|
A aplicação de métodos de análise de variância implica a aplicação prévia aos valores de taxa de emergência de uma transformada de arco-seno da raiz quadrada ou de uma transformada de Tukey-Freeman, de forma a obter uma distribuição aproximadamente normal e uniformizar as variâncias. Quando se utilizam as frequências absolutas, podem ser aplicados os testes de Cochran-Armitage, exato de Fisher (com ajustamento de Bonferroni) e de Mantel-Haentzal. A transformação arco-seno da raiz quadrada consiste em calcular o inverso do seno (sin-1) da raiz quadrada do valor da taxa de emergência.
|
|
49.
|
No respeitante às taxas de emergência, calculam-se os valores CEx por análise de regressão — por exemplo por recurso aos modelos probit, logit ou Weibull (28). Se a análise de regressão não resultar (por exemplo se o número de respostas parciais for inferior a dois), utilizam-se outros métodos não-paramétricos, como a média móvel ou interpolação simples.
|
Taxa de desenvolvimento
|
50.
|
O tempo de desenvolvimento médio representa o tempo médio decorrido entre a introdução das larvas (dia 0 do ensaio) e a emergência dos insetos correspondentes (para o cálculo do tempo de desenvolvimento real, é necessário ter em conta a idade das larvas no momento da introdução). A taxa de desenvolvimento é o inverso do tempo de desenvolvimento (unidade: 1/dia) e representa a quantidade de desenvolvimento larvar que ocorre por dia. A taxa de desenvolvimento é o parâmetro preferido para a avaliação destes estudos de toxicidade de sedimentos, dado que a sua variância é mais baixa que a do tempo de desenvolvimento, sendo também mais homogénea e mais próxima da distribuição normal. Os testes paramétricos mais potentes adaptam-se, portanto, à taxa de desenvolvimento, mas não ao tempo de desenvolvimento. Tratando a taxa de desenvolvimento como uma resposta contínua, os valores de CEx podem ser estimados por recurso a uma análise de regressão — por exemplo como descrito em (29)(30). Os métodos de análise de variância (por exemplo o teste de Williams ou o teste de Dunnett) permitem determinar uma NOEC correspondente à taxa de desenvolvimento média. Dado que os insetos machos emergem antes das fêmeas, isto é, têm uma taxa de desenvolvimento maior, é conveniente calcular uma taxa de desenvolvimento para cada sexo, além da correspondente a todos os insetos.
|
|
51.
|
Para efeitos dos testes estatísticos, considera-se que o número de insetos observados no dia de inspeção x emergiu no ponto médio do intervalo de tempo compreendido entre o dia x e o dia x–d (d = duração do intervalo de inspeção, em geral 1 dia). A taxa de desenvolvimento média por recipiente (

) é calculada com base na seguinte equação:
em que:
|
|
:
|
taxa de desenvolvimento média por recipiente,
|
|
i
|
:
|
índice do intervalo de inspeção,
|
|
m
|
:
|
número máximo de intervalos de inspeção,
|
|
fi
|
:
|
número de insetos emergidos no intervalo de inspeção i,
|
|
ne
|
:
|
número de insetos emergidos no final do ensaio (),
|
|
xi
|
:
|
taxa de desenvolvimento dos insetos emergidos no intervalo i,
|

dia
|
diai
|
:
|
dia de inspeção (dias decorridos desde a introdução das larvas),
|
|
di
|
:
|
duração do intervalo de inspeção i (número de dias, normalmente 1 dia).
|
|
Rácio sexual
|
52.
|
Os rácios sexuais são dados quantais, pelo que devem ser avaliados por recurso ao teste exato de Fisher ou a outro método adequado. O rácio sexual natural da Chironomus riparius tem o valor um, o que significa que a abundância dos machos é igual à das fêmeas. O tratamento dos dados de rácio sexual deve ser o mesmo para as duas gerações. Uma vez que o número máximo de insetos por recipiente (ou seja, 20) é demasiado pequeno para possibilitar análises com significância estatística, determina-se o número total de insetos de cada sexo totalmente emergidos e vivos em todos os recipientes correspondentes à mesma concentração. Comparam-se numa tabela de contingência 2 × 2 esses dados não-transformados com os dados correspondentes ao grupo de controlo (do solvente) ou com os dados de controlo agregados.
|
Reprodução
|
53.
|
Calcula-se a reprodução, expressa em fecundidade, como o número de aglomerados de ovos por fêmea. Mais concretamente, divide-se o número de aglomerados de ovos produzidos numa gaiola de criação pelo número de fêmeas vivas não-lesionadas nela introduzidas. Os métodos de análise de variância (por exemplo o teste de Williams ou o teste de Dunnett) permitem determinar uma NOEC correspondente à fecundidade.
|
|
54.
|
A fertilidade dos aglomerados de ovos serve para quantificar o número de aglomerados de ovos férteis por fêmea. Divide-se o número de aglomerados de ovos férteis produzidos numa gaiola de criação pelo número de fêmeas vivas não-lesionadas nela introduzidas. Os métodos de análise de variância (por exemplo o teste de Williams ou o teste de Dunnett) permitem determinar uma NOEC correspondente à fertilidade.
|
Relatório do ensaio
|
55.
|
Elementos a constar do relatório do ensaio:
|
|
Produto químico em estudo
|
—
|
estado físico e propriedades físico-químicas (hidrossolubilidade, pressão de vapor, log K
ow, coeficiente de partição no solo — ou nos sedimentos, se disponível –, estabilidade na água e nos sedimentos etc.);
|
|
—
|
dados de identificação química (denominação comum, denominação química, fórmula estrutural, número CAS etc.), incluindo o grau de pureza e o método analítico de determinação quantitativa do produto químico.
|
|
|
|
Espécie utilizada no ensaio
|
—
|
organismos utilizados no ensaio: espécie, nome científico, origem e condições de criação;
|
|
—
|
informações sobre o modo de manipulação dos aglomerados de ovos e das larvas;
|
|
—
|
informações sobre a manipulação dos adultos emergidos da 1.a geração com um exaustor etc. (ver o apêndice 5);
|
|
—
|
idade dos organismos ao serem introduzidos nos recipientes de ensaio da 1.a e 2.a gerações.
|
|
|
|
Condições de realização do ensaio
|
—
|
sedimentos utilizados — de origem natural ou formulados (artificiais);
|
|
—
|
sedimentos naturais: localização e descrição do local de colheita dos sedimentos, incluindo, se possível, o historial de contaminação; características dos sedimentos: pH, teor de carbono orgânico, razão C/N e granulometria (se pertinente);
|
|
—
|
sedimentos formulados: preparação, ingredientes e características (teor de carbono orgânico, pH, humidade etc. medidos no início do ensaio);
|
|
—
|
preparação da água para os ensaios, caso seja utilizada água reconstituída, e características da mesma (concentração de oxigénio, pH, dureza etc. medidos no início do ensaio);
|
|
—
|
espessura dos sedimentos e da camada de água sobrenadante nos recipientes de ensaio e nas placas de cristalização;
|
|
—
|
volume da água sobrenadante e da água dos poros; peso dos sedimentos húmidos (com e sem a água dos poros) dos recipientes de ensaio e das placas de cristalização;
|
|
—
|
recipientes de ensaio (material e dimensões);
|
|
—
|
placas de cristalização (material e dimensões);
|
|
—
|
gaiolas de criação (material e dimensões);
|
|
—
|
método de preparação das soluções de reserva e concentrações ensaiadas nos recipientes de ensaio e nas placas de cristalização;
|
|
—
|
aplicação do produto químico em estudo nos recipientes de ensaio e nas placas de cristalização: concentrações ensaiadas, número de replicados e (se necessários) solventes;
|
|
—
|
condições de incubação nos recipientes de ensaio: temperatura, ciclo de iluminação e intensidade luminosa, arejamento (bolhas por segundo);
|
|
—
|
condições de incubação nas gaiolas de criação e nas placas de cristalização: temperatura, ciclo de iluminação e intensidade luminosa;
|
|
—
|
condições de incubação dos aglomerados de ovos nas placas de microtitulação (ou noutros recipientes): temperatura, ciclo de iluminação e intensidade luminosa;
|
|
—
|
informações pormenorizadas sobre a alimentação dos organismos, incluindo o tipo de alimentos, a preparação destes e a quantidade e frequência da alimentação.
|
|
|
|
Resultados
|
—
|
concentrações de ensaio nominais, concentrações de ensaio medidas e resultados de todas as análises efetuadas para determinar a concentração do produto químico em estudo nos recipientes de ensaio e nas placas de cristalização;
|
|
—
|
qualidade da água nos recipientes de ensaio e nas placas de cristalização (pH, temperatura, oxigénio dissolvido, dureza e amoníaco);
|
|
—
|
água evaporada no ensaio eventualmente reposta nos recipientes de ensaio;
|
|
—
|
número de insetos machos e fêmeas emergidos diariamente por recipiente (1.a e 2.a gerações separadamente);
|
|
—
|
rácio sexual de insetos totalmente emergidos e vivos por nível de exposição (1.a e 2.a gerações separadamente);
|
|
—
|
número de larvas, por recipiente, que não emergiram como insetos adultos (1.a e 2.a gerações separadamente);
|
|
—
|
percentagem/fração de emergência por replicado e por concentração ensaiada (insetos machos e fêmeas agregados) (1.a e 2.a gerações separadamente);
|
|
—
|
taxa de desenvolvimento média dos insetos totalmente emergidos e vivos por replicado e por concentração ensaiada (insetos machos e fêmeas separados e também agregados) (1.a e 2.a gerações separadamente);
|
|
—
|
número de aglomerados de ovos depositados diariamente nas placas de cristalização, por gaiola de criação;
|
|
—
|
características dos aglomerados de ovos (dimensão, forma e fertilidade de cada um);
|
|
—
|
fecundidade — número de aglomerados de ovos dividido pelo número de fêmeas introduzidas na gaiola de criação;
|
|
—
|
fertilidade — número de aglomerados de ovos férteis dividido pelo número de fêmeas introduzidas na gaiola de criação;
|
|
—
|
estimativas de parâmetros de toxicidade, por exemplo CEx (e os intervalos de confiança associados) e NOEC, e métodos estatísticos utilizados para a determinação dos mesmos;
|
|
—
|
discussão dos resultados, incluindo qualquer influência nos resultados do ensaio decorrente de alterações efetuadas ao método de ensaio.
|
|
|
REFERÊNCIAS
|
1)
|
Capítulo C.28 deste anexo: Ensaio de toxicidade em quironomídeos num sistema sedimentos-água com água enriquecida.
|
|
2)
|
Shobanov, N.A., Kiknadze, I.I., Butler, M.G. (1999). Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30:311-322.
|
|
3)
|
Fleming, R. et al. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Final Report to the European Commission. Relatório n.o EC 3738. Agosto de 1994. WRc, Reino Unido.
|
|
4)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. Do workshop WOSTA realizado nos Países Baixos.
|
|
5)
|
ASTM International (2009). E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates., In Annual Book of ASTM Standards, volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International. West Conshohocken, PA.
|
|
6)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method, Report SPE 1/RM/32, dezembro de 1997.
|
|
7)
|
US EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Segunda edição, EPA 600/R-99/064, março de 2000. Revisão da primeira edição, de junho de 1994.
|
|
8)
|
US EPA/OPPTS 850.1735 (1996). Whole Sediment Acute Toxicity Invertebrates.
|
|
9)
|
US EPA/OPPTS 850.1790 (1996). Chironomid Sediment Toxicity Test.
|
|
10)
|
Milani, D., Day, K.E., McLeay, D.J., Kirby, R.S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report. Environment Canada, National Water Research Institute. Burlington, Ontário, Canadá.
|
|
11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R., Rowland, C.D. (2006). Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests. Environ. Toxicol. Chem., 25:2662-2674.
|
|
12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V., Weltje, L. (2007). Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides. Ecotoxicology, 16:221-230.
|
|
13)
|
Sugaya, Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool., 48:345-350.
|
|
14)
|
Kawai, K. (1986). Fundamental studies on chironomid allergy. I. Culture methods of some Japanese chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool., 37:47-57.
|
|
15)
|
Capítulo C.27 deste anexo: Ensaio de toxicidade em quironomídeos num sistema sedimentos-água com sedimentos enriquecidos.
|
|
16)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environment, Health and Safety Publications. Series on Testing and Assessment, No. 23, ENV/JM/MONO(2000)6. OCDE, Paris.
|
|
17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M., Hamer, M. (2010). The chironomid acute toxicity test: development of a new test system. Integr. Environ. Assess. Management.
|
|
18)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Relatório EPS 1/RM/30, setembro de 1995.
|
|
19)
|
Oetken, M., Nentwig, G., Löffler, D., Ternes, T., Oehlmann, J. (2005). Effects of pharmaceuticals on aquatic invertebrates. Part I, The antiepileptic drug carbamazepine. Arch. Environ. Contam. Toxicol., 49:353-361.
|
|
20)
|
Suedel, B.C., Rodgers, J.H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem., 13:1163-1175.
|
|
21)
|
Naylor, C., Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere, 31:3291-3303.
|
|
22)
|
Dunnett, C.W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50:1096-1121.
|
|
23)
|
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics, 20:482-491.
|
|
24)
|
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27:103-117.
|
|
25)
|
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28:510-531.
|
|
26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L., Maes, H.M. (2009). Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J. Soils Sediments, 9:94-102.
|
|
27)
|
Rao, J.N.K., Scott, A.J. (1992). A simple method for the analysis of clustered binary data. Biometrics, 48:577-585.
|
|
28)
|
Christensen, E.R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Res., 18:213-221.
|
|
29)
|
Bruce, R.D., Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem., 11:1485-1494.
|
|
30)
|
Slob, W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci., 66:298-312.
|
|
31)
|
OCDE (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to application. OECD Series on Testing and Assessment, No. 54, 146 pp., ENV/JM/MONO(2006)18. OCDE, Paris.
|
|
32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L., Ankley, G.T. (1997). Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments. Environ. Toxicol. Chem., 16:1165-1176.
|
|
33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M., Oehlmann, J. (2007). Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) — baseline experiments for future multi-generation studies. J. Environ. Sci. Health, Parte A, 42:1-9.
|
|
34)
|
OCDE (2010). Validation report of the Chironomid full life-cycle toxicity test. A publicar na “Series on Testing and Assessment”. OCDE, Paris.
|
Apêndice 1
Definições
Aplicam-se neste método de ensaio as seguintes definições:
Produto químico
: substância ou mistura.
Sedimentos formulados ou reconstituídos ou artificiais ou sintéticos: mistura de matérias utilizadas para simular os componentes de sedimentos naturais.
Água sobrenadante
: água à superfície dos sedimentos, no recipiente de ensaio.
Água intersticial ou água dos poros: água que ocupa o espaço entre as partículas de sedimentos e de solo.
Água enriquecida
: água utilizada no ensaio, à qual foi adicionado o produto químico em estudo.
Produto químico em estudo
: qualquer substância ou mistura à qual seja aplicado este método de ensaio.
Apêndice 2
Recomendações para a cultura de Chironomus riparius
|
1.
|
As larvas de Chironomus podem ser criadas em placas de cristalização ou em recipientes de maiores dimensões. Espalha-se no fundo do recipiente areia quartzítica fina de modo a constituir uma camada fina com 5 mm a 10 mm de espessura. Verificou-se que o kieselguhr (por exemplo o artigo Merck 8117) é também um substrato adequado; neste caso, pode utilizar-se uma camada mais fina, da ordem de poucos milímetros. Adiciona-se em seguida uma camada de vários centímetros de uma água adequada. Se necessário, os níveis de água podem ser repostos para compensar a evaporação e evitar a dessecação. Se necessário, a água pode ser substituída. Deve efetuar-se um arejamento ligeiro. Os recipientes de criação das larvas devem ser mantidos em gaiolas adequadas, de forma a evitar fugas de adultos emergentes. A gaiola deve ser suficientemente grande (no mínimo cerca de 30 cm × 30 cm × 30 cm) para permitir a enxameação dos adultos emergidos, sem o que poderá não ocorrer copulação.
|
|
2.
|
As gaiolas devem ser mantidas à temperatura ambiente ou a uma temperatura constante de 20 °C ± 2 °C, com um período de luminosidade (cerca de 1 000 lux de intensidade) de 16 horas seguido de oito horas de escuridão. Existem indicações de que uma humidade relativa do ar inferior a 60 % pode impedir a reprodução.
|
Água de diluição
|
3.
|
Pode utilizar-se qualquer água natural ou sintética adequada. Utiliza-se, em geral, água de poços, água da torneira desclorada ou meios artificiais (por exemplo meio M4 de Elendt ou meio M7; ver adiante). A água tem de ser arejada antes da utilização. Se necessário, a água das culturas pode ser renovada por vazamento ou sifonagem cuidadosos da água usada dos recipientes de cultura sem destruir os tubos das larvas.
|
Alimentação das larvas
|
4.
|
As larvas de Chironomus são alimentadas com cerca de 250 mg por recipiente e por dia de um alimento floculado para peixes (Tetra Min®, Tetra Phyll® ou outra marca registada semelhante). Os alimentos podem ser fornecidos na forma de um pó seco obtido por moagem ou de uma suspensão em água (adiciona-se 1,0 g de alimento floculado a 20 ml de água de diluição e mistura-se, de modo a obter uma mistura homogénea). A suspensão pode ser fornecida à razão aproximada de 5 ml diários por recipiente (agitar antes de utilizar). As larvas com mais idade podem receber mais alimento.
|
|
5.
|
Ajusta-se a alimentação em função da qualidade da água. Se o meio de cultura se tornar turvo, deve reduzir-se a alimentação. O fornecimento de alimentos deve ser cuidadosamente vigiado. A escassez de alimentos causaria a migração das larvas para a coluna de água, enquanto uma alimentação demasiado rica aumentaria a atividade microbiana e reduziria a concentração de oxigénio. Ambas as situações podem resultar na redução das taxas de crescimento.
|
|
6.
|
Ao preparar novos recipientes de cultura, podem também ser adicionadas algumas células de algas verdes (por exemplo Scenedesmus subspicatus ou Chlorella vulgaris).
|
Alimentação dos adultos emergidos
|
7.
|
Alguns experimentadores sugeriram que um tampão de algodão embebido numa solução saturada de sacarose pode servir de alimento para os adultos emergidos.
|
Emergência
|
8.
|
À temperatura de 20 °C ± 2 °C, os adultos começam a emergir dos recipientes de criação das larvas decorridos 13 a 15 dias. Distinguem-se facilmente os machos pelas suas antenas plumosas e pelo seu corpo fino.
|
Aglomerados de ovos
|
9.
|
A partir do momento em que estejam presentes adultos nas gaiolas de criação, deve verificar-se três vezes por semana se ocorre a deposição de aglomerados gelatinosos de ovos nos recipientes de criação das larvas. Se tal suceder, esses aglomerados devem ser transferidos com cuidado para uma pequena cápsula que já contenha um pouco de água de criação. Utilizam-se os aglomerados de ovos para iniciar novas culturas noutros recipientes (por exemplo 2 a 4 aglomerados de ovos por recipiente) ou em ensaios de toxicidade.
|
|
10.
|
Decorridos 2 a 3 dias, devem eclodir larvas no primeiro estádio larvar.
|
Preparação de novos recipientes de cultura
|
11.
|
Uma vez estabelecidas as culturas, deve ser possível preparar um novo recipiente de cultura de larvas por semana, ou menos frequentemente (consoante as necessidades do ensaio), removendo-se os recipientes mais antigos após a emergência dos insetos adultos. O recurso a este sistema permite um aprovisionamento regular de insetos adultos com uma gestão mínima.
|
Preparação das soluções de ensaio M4 e M7
|
12.
|
O meio M4 foi descrito por Elendt (1990). Prepara-se o meio M7 do mesmo modo que o M4, exceto no que respeita às substâncias indicadas no quadro 1, cujas concentrações são quatro vezes inferiores às do meio M4. A solução de ensaio não deve ser preparada segundo Elendt e Bias (1990), pois as concentrações de NaSiO3×5H2O, NaNO3, KH2PO4 e K2HPO4 indicadas para a preparação das soluções de reserva não são adequadas.
|
Preparação do meio M7
|
13.
|
Prepara-se cada solução de reserva (I) separadamente e, em seguida, a partir destas, uma solução de reserva combinada (II) (ver o quadro 1). Prepara-se o meio M7 diluindo para 1 litro, com água desionizada, 50 ml da solução de reserva combinada (II) e as quantidades de cada solução de reserva de macronutrientes indicadas no quadro 2. Prepara-se uma solução de reserva de vitaminas juntando três vitaminas a água desionizada como indicado no quadro 3; adiciona-se 0,1 ml da solução de reserva combinada de vitaminas ao meio M7 final pouco antes da utilização (a solução de reserva de vitaminas é conservada congelada, em pequenas alíquotas). Areja-se e estabiliza-se o meio.
|
Quadro 1
Soluções de reserva de elementos vestigiais para os meios M4 e M7.
|
Soluções de reserva (I)
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Para preparar a solução de reserva combinada (II), misturam-se as seguintes quantidades (ml) de soluções de reserva (I) e diluiu-se para 1 litro com água desionizada
|
Concentrações finais nas soluções de ensaio (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(24)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2×4H2O (24)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (24)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (24)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2×6H2O (24)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (24)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 × 2H2O (24)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2×2H2O (24)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2×6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA × 2H2O (24)
(25)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 × 7H2O (24)
(25)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Quadro 2
Soluções de reserva de macronutrientes para os meios M4 e M7.
|
|
Quantidade diluída para 1 litro com água desionizada
(mg)
|
Quantidade de cada solução de reserva de macronutrientes adicionada para preparar os meios M4 e M7
(ml/l)
|
Concentrações finais nas soluções de ensaio M4 e M7
(mg/l)
|
|
CaCl2 × 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 × 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 × 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Quadro 3
Soluções de reserva de vitaminas para os meios M4 e M7.
Combinam-se as três soluções de vitaminas numa única solução de reserva de vitaminas.
|
|
Quantidade diluída para 1 litro com água desionizada
(mg)
|
Quantidade de cada solução de reserva de vitaminas adicionada para preparar os meios M4 e M7
(ml/l)
|
Concentrações finais nas soluções de ensaio M4 e M7
(mg/l)
|
|
Cloridrato de tiamina
|
750
|
0,1
|
0,075
|
|
Cianocobalamina (B12)
|
10
|
0,1
|
0,0010
|
|
Biotina
|
7,5
|
0,1
|
0,00075
|
REFERÊNCIAS
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Editado por M. Streloke e H. Köpp, Berlim.
Elendt, B.P. (1990). Selenium deficiency in Crustacea. Protoplasma, 154:25-33.
Elendt, B.P., Bias, W.-R. (1990).Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna. Water Research, 24:1157-1167.
Apêndice 3
Preparação de sedimentos formulados
COMPOSIÇÃO DOS SEDIMENTOS
Composição dos sedimentos formulados:
|
Componente
|
Características
|
Percentagem do peso seco dos sedimentos
|
|
Turfa
|
Turfa de Sphagnum, com pH tão próximo quanto possível do intervalo 5,5-6,0, sem restos visíveis de plantas, finamente moída (granulometria ≤ 1 mm) e seca ao ar
|
4 - 5
|
|
Areia quartzítica
|
Granulometria: > 50 % das partículas de granulometria na gama 50-200 μm
|
75 - 76
|
|
Argila caulínica
|
Teor de caulinite ≥ 30 %
|
20
|
|
Carbono orgânico
|
Ajustado por adição de turfa e areia
|
2 (± 0,5)
|
|
Carbonato de cálcio
|
CaCO3 pulverizado quimicamente puro
|
0,05 - 0,1
|
|
Água
|
Condutividade ≤ 10 μS/cm
|
30 - 50
|
PREPARAÇÃO
Seca-se a turfa ao ar e mói-se até se obter um pó fino. Prepara-se uma suspensão da quantidade necessária de turfa pulverizada em água desionizada, por recurso a um dispositivo de homogeneização de alta eficiência. Ajusta-se o pH desta suspensão a 5,5 ± 0,5 com CaCO3. Condiciona-se a suspensão durante, pelo menos, dois dias, com agitação ligeira a 20 °C ± 2 °C, para estabilizar o pH e estabelecer um perfil microbiano estável. Findo este período, determina-se novamente o pH, que deve ser de 6,0 ± 0,5. Mistura-se então a suspensão de turfa com os outros componentes (areia e argila caulínica) e água desionizada, de forma a obter sedimentos homogéneos com teor de água da ordem de 30–50 % do peso seco dos sedimentos. Determina-se uma vez mais o pH da mistura final e, se necessário, ajusta-se a 6,5-7,5 com CaCO3. Colhem-se amostras dos sedimentos para determinar o peso seco e o teor de carbono orgânico. Recomenda-se que, antes de serem utilizados em ensaios de toxicidade em quironomídeos, os sedimentos formulados sejam mantidos durante sete dias em condições idênticas às do ensaio subsequente.
CONSERVAÇÃO
Os componentes secos para a preparação de sedimentos artificiais podem ser conservados à temperatura ambiente num local seco e fresco. Os sedimentos formulados (húmidos) não devem ser armazenados antes de serem utilizados nos ensaios. Devem ser utilizados imediatamente após o período de condicionamento de sete dias que conclui a sua preparação.
REFERÊNCIAS
OCDE (1984). Earthworm, Acute Toxicity Test. Test Guideline No. 207. Guidelines for the Testing of Chemicals. OCDE, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R., Streit, B. (1998). Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media. Ecotox. Environ. Safety, 39:10-20.
Apêndice 4
Características químicas de uma água de diluição adequada
|
COMPONENTE
|
CONCENTRAÇÃO
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 mg/l
|
|
Amoníaco não–ionizado
|
< 1 μg/l
|
|
Dureza, expressa em CaCO3
|
< 400 mg/l (26)
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados, totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
Apêndice 5
Orientações para a realização do ensaio
Exemplo de gaiola de criação:
|
A
|
:
|
tela na face superior e, pelo menos, num dos lados da gaiola (malha de aproximadamente 1 mm);
|
|
B
|
:
|
abertura para introdução, na gaiola de criação, dos adultos emergidos e para remoção dos aglomerados de ovos das placas de cristalização (não representadas na figura);
|
|
C
|
:
|
dimensões mínimas da gaiola de criação: 30 cm de comprimento, 30 cm de altura e 30 cm de largura.
|
Exemplo de recipiente de ensaio:

|
A
|
:
|
pipeta de Pasteur para arejamento da água sobrenadante;
|
|
B
|
:
|
tampa de vidro para evitar fugas de insetos emergidos;
|
|
C
|
:
|
superfície da água;
|
|
D
|
:
|
recipiente de ensaio (copo de vidro com, pelo menos, 600 ml de capacidade);
|
|
E
|
:
|
camada de sedimentos.
|
Exemplo de exaustor de captura de insetos adultos (as setas indicam o sentido do fluxo de ar):
|
A
|
:
|
tubo de vidro (diâmetro interno de aproximadamente 5 mm) ligado a uma bomba autoferrante;
|
|
B
|
:
|
rolha de borracha vulcanizada, atravessada pelo tubo A; para não lesionar os insetos sugados para o exaustor, a abertura interior do tubo de vidro A está coberta com algodão e uma tela (malha de aproximadamente 1 mm);
|
|
C
|
:
|
recipiente transparente (de plástico ou de vidro, com cerca de 15 cm de altura) para os insetos capturados;
|
|
D
|
:
|
rolha de borracha vulcanizada, atravessada pelo tubo E; para transferir os insetos para a gaiola de criação, retira-se a rolha D do recipiente C;
|
|
E
|
:
|
tubo (de plástico ou de vidro, com diâmetro interno de aproximadamente 8 mm) para recolha de insetos adultos dos recipientes.
|
Representação esquemática de um ensaio de ciclo de vida:

|
A
|
:
|
1.a geração — recipientes de ensaio com um sistema sedimentos-água; oito replicados; 20 larvas no primeiro estádio larvar por recipiente;
|
|
B
|
:
|
associação de quatro recipientes de ensaio a cada gaiola de criação (A e B);
|
|
C
|
:
|
gaiolas de criação A e B, para enxameação, acasalamento e postura de ovos;
|
|
D
|
:
|
placas de cristalização para deposição dos aglomerados de ovos;
|
|
E
|
:
|
placas de microtitulação; um aglomerado de ovos por alvéolo;
|
|
F
|
:
|
2.a geração — recipientes de ensaio com um sistema sedimentos-água; oito replicados; 20 larvas no primeiro estádio larvar por recipiente.
|
C.41. ENSAIO DE DESENVOLVIMENTO SEXUAL EM PEIXES
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 234 (2011) da OCDE. Baseia-se numa decisão de 1998 com vista à elaboração de métodos de ensaio atualizados ou novos para despistagem e ensaio de potenciais desreguladores do sistema endócrino. O Ensaio de Desenvolvimento Sexual em Peixes foi considerado um método de ensaio prometedor com incidência numa fase da vida dos peixes sensível a produtos químicos estrogénicos e androgénicos. Este método de ensaio foi objeto de um exercício de validação interlaboratorial que decorreu de 2006 a 2010, tendo sido validado para o peixe-do-arroz-japonês (Oryzias latipes), o peixe-zebra (Danio rerio) e o esgana-gata (Gasterosteus aculeatus) e parcialmente validado para o vairão-de-cabeça-gorda (Pimephales promelas) (41)(42)(43). O presente protocolo aplica-se ao peixe-do-arroz-japonês, ao esgana-gata e ao peixe-zebra. Constitui, em princípio, um aperfeiçoamento do Test Guideline 210 da OCDE (1), um ensaio de toxicidade aplicável aos primeiros estádios da vida dos peixes, prosseguindo a exposição até à diferenciação sexual dos peixes — a qual ocorre cerca de 60 dias após a eclosão no caso do peixe-do-arroz-japonês, do esgana-gata e do peixe-zebra (o período de exposição poderá ser mais curto ou mais longo no caso de outras espécies que venham a ser validadas) — e tendo sido incluídos parâmetros de sensibilidade endócrina. O Ensaio de Desenvolvimento Sexual em Peixes avalia efeitos nos primeiros estádios de vida e possíveis consequências indesejadas de produtos químicos potencialmente desreguladores do sistema endócrino (por exemplo, estrogénios, androgénios e inibidores da esteroidogénese) no desenvolvimento sexual. A combinação dos dois parâmetros endócrinos principais — concentração de vitelogenina e rácio sexual fenotípico — possibilita que o ensaio revele o modo de ação do produto químico em estudo. Dado que as variações do rácio sexual fenotípico são características da população em causa, pode utilizar-se o Ensaio de Desenvolvimento Sexual em Peixes para avaliar perigos e riscos. Todavia, caso se pretenda recorrer a este ensaio para avaliar perigos e riscos, não deve utilizar-se o esgana-gata, pois os dados de validação atualmente disponíveis mostram que, no caso desta espécie, não são comuns alterações do rácio sexual fenotípico induzidas por produtos químicos.
|
|
2.
|
O protocolo baseia-se na exposição de peixes a produtos químicos através da água durante o período sexual lábil, no decurso do qual os peixes são previsivelmente mais sensíveis aos efeitos dos produtos químicos desreguladores do sistema endócrino que interferem no desenvolvimento sexual. Medem-se dois parâmetros principais indicadores de aberrações de desenvolvimento de carácter endócrino: as concentrações de vitelogenina e os rácios sexuais (proporção de cada sexo) determinados por histologia das gónadas. A histopatologia das gónadas (avaliação e classificação do estádio de desenvolvimento dos ovócitos e das células espermatogénicas) é facultativa. Sempre que possível, também se determina o sexo genético (designadamente no peixe-do-arroz-japonês e no esgana-gata). A presença de um marcador do sexo genético constitui uma vantagem considerável, pois este aumenta o poder estatístico dos efeitos no rácio sexual e permite individualizar as inversões de sexo fenotípico. Outros parâmetros apicais a medir são a taxa de eclosão, a sobrevivência, o comprimento dos peixes e o peso corporal destes. Este método de ensaio poderá ser adaptado a espécies diferentes das mencionadas, desde que as espécies pretendidas sejam objeto de uma validação equivalente à efetuada para o peixe-do-arroz-japonês, o esgana-gata e o peixe-zebra, que os peixes de controlo se apresentem sexualmente diferenciados no final do ensaio, que os níveis de vitelogenina sejam suficientemente elevados para que possam detetar-se variações significativas devidas ao produto químico em estudo e que se determine a sensibilidade do sistema de ensaio utilizando determinados produtos químicos com atividade endócrina de referência — (anti)estrogénios, (anti)androgénios, inibidores da aromatase etc. Além disso, é necessário que a OCDE examine os relatórios de validação do Ensaio de Desenvolvimento Sexual em Peixes noutras espécies e que o resultado dessas validações seja considerado satisfatório.
|
Considerações iniciais e limitações
|
3.
|
As fêmeas de vertebrados ovíparos produzem normalmente vitelogenina como reação aos estrogénios endógenos em circulação (2). Trata-se se um precursor das proteínas do vitelo que, uma vez produzido no fígado, é transportado na corrente sanguínea até aos ovários, onde é absorvido e modificado pelos ovócitos em desenvolvimento. A síntese de vitelogenina é muito reduzida, embora seja detetável, nos peixes imaturos e nos peixes machos adultos, que não têm estrogénios suficientes em circulação. Porém, o fígado é capaz de sintetizar e segregar vitelogenina como reação a uma estimulação estrogénica exógena (3)(4)(5).
|
|
4.
|
A medição da vitelogenina serve para detetar produtos químicos com modos de ação estrogénicos, antiestrogénicos ou androgénicos e produtos químicos (como os inibidores da aromatase) que interferem com a esteroidogénese. É possível detetar produtos químicos estrogénicos medindo a indução de vitelogenina em peixes machos, método documentado em numerosas publicações científicas pré-avaliadas por especialistas. Também se demonstrou a indução de vitelogenina após exposição a androgénios aromatizáveis (6)(7). A diminuição do nível de estrogénios em circulação nas fêmeas, por exemplo através da inibição da aromatase, que converte o androgénio endógeno no estrogénio natural 17β-estradiol, provoca uma diminuição da concentração de vitelogenina, efeito que é utilizado para detetar produtos químicos com propriedades inibidoras da aromatase ou, mais genericamente, inibidores da esteroidogénese (33). As consequências biológicas de uma inibição estrogénica/da aromatase no nível de vitelogenina são um facto assente e estão amplamente documentadas (8)(9). Todavia, a produção de vitelogenina nas fêmeas também pode ser afetada por toxicidade generalizada e por modos de ação tóxica não-endócrinos.
|
|
5.
|
Foram desenvolvidos e normalizados com êxito vários métodos de medição para ensaios de rotina com vista à determinação quantitativa da vitelogenina em amostras de sangue, do fígado, do corpo inteiro e de homogeneizado da cabeça e da cauda, colhidas individualmente em peixes. No caso do peixe-zebra, do esgana-gata e do peixe-do-arroz-japonês, bem como da espécie parcialmente validada vairão-de-cabeça-gorda, existem métodos ELISA específicos para cada espécie que recorrem a processos imunoquímicos para quantificar a vitelogenina (5)(10)(11)(12)(13)(14)(15)(16). No peixe-do-arroz-japonês e no peixe-zebra, existe boa correlação entre a vitelogenina determinada em amostras de plasma sanguíneo, fígado e homogeneizado, embora os valores medidos no homogeneizado tendam a ser ligeiramente inferiores aos valores medidos no plasma (17)(18)(19). Descrevem-se no apêndice 5 os procedimentos recomendados para a colheita de amostras destinadas à análise da vitelogenina.
|
|
6.
|
A variação do rácio sexual fenotípico (proporção de cada sexo) é um parâmetro indicador da inversão de sexo. Em princípio, os estrogénios, os antiestrogénios, os androgénios, os antiandrogénios e os produtos químicos inibidores da esteroidogénese podem afetar o rácio sexual dos peixes em desenvolvimento (20). Mostrou-se que esta inversão de sexo é parcialmente reversível no peixe-zebra (21) após exposição a produtos químicos de tipo estrogénico, ao passo que a inversão de sexo após exposição a produtos químicos de tipo androgénico é permanente (30). O sexo é determinado em cada peixe por exame histológico das gónadas e define-se como feminino, masculino, intersexual (ovócitos e células espermatogénicas presentes simultaneamente na mesma gónada) ou indiferenciado. O apêndice 7 e o documento de orientações da OCDE sobre o diagnóstico de histopatologias de tipo endócrino em gónadas de peixes (22) contêm orientações neste domínio.
|
|
7.
|
Examina-se o sexo genético por meio dos marcadores genéticos eventualmente existentes na espécie de peixes em causa. No peixe-do-arroz-japonês, os genes femininos XX ou masculinos XY podem ser detetados por reação em cadeia da polimerase (PCR) e o gene do domínio DM ligado ao cromossoma Y (DMY) pode ser analisado (DMY negativo ou positivo) conforme se descreve nas referências (23)(24). Descreve-se no apêndice 10 um método PCR equivalente para a determinação do sexo genético no esgana-gata. O poder estatístico do ensaio sai reforçado quando é possível relacionar individualmente o sexo genético com o sexo fenotípico, pelo que deve determinar-se o sexo genético nas espécies que possuam marcadores documentados de sexo genético.
|
|
8.
|
A combinação dos dois parâmetros endócrinos principais — concentração de vitelogenina e rácio sexual fenotípico — permite demonstrar o modo de ação endócrina (MAE) do produto químico em estudo (quadro 1). Dado que o rácio sexual é um biomarcador característico da população em causa (25)(26), no caso de alguns modos de ação bem definidos, os resultados obtidos pelo Ensaio de Desenvolvimento Sexual em Peixes podem ser utilizados para avaliar perigos e riscos, quando a autoridade reguladora o considerar adequado. Presentemente, esses modos de ação são os dos estrogénios, dos androgénios e dos inibidores da esteroidogénese.
Quadro 1
Reação dos parâmetros endócrinos a diversos modos de ação de produtos químicos:
↑= aumento, ↓= diminuição, — = não investigado.
|
Modo de ação
|
VTG ♂
|
VTG ♀
|
Rácio sexual
|
Referências
|
|
Agonista fraco dos estrogénios
|
↑
|
↑
|
↑♀ ou ↑indiferenciado
|
(27)(40)
|
|
Agonista forte dos estrogénios
|
↑
|
↑
|
↑♀ ou ↑indiferenciado, nulo♂
|
(28)(40)
|
|
Antagonista dos estrogénios
|
—
|
—
|
↓♀, ↑indiferenciado
|
(29)
|
|
Agonista dos androgénios
|
↓ ou —
|
↓ ou —
|
↑♂, nulo♀
|
(28)(30)
|
|
Antagonistas dos androgénios
|
—
|
—
|
↑♀,
↑intersexual
|
(31)
|
|
Inibidor da aromatase
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
O Ensaio de Desenvolvimento Sexual em Peixes não abrange o estádio reprodutivo da vida dos peixes. Por esse motivo, os produtos químicos suspeitos de afetarem a reprodução a concentrações inferiores às que afetam o desenvolvimento sexual devem ser examinados num ensaio que abranja a reprodução.
|
|
10.
|
No apêndice 1 definem-se alguns conceitos utilizados neste método.
|
|
11.
|
O Ensaio de Desenvolvimento Sexual em Peixes visa detetar produtos químicos com propriedades androgénicas e estrogénicas, bem como com propriedades antiandrogénicas, antiestrogénicas e de inibição da esteroidogénese. As fases (1 e 2) de validação do Ensaio de Desenvolvimento Sexual em Peixes abrangeram produtos químicos estrogénicos, androgénicos e inibidores da esteroidogénese. O quadro 1 contempla os efeitos de antagonistas dos estrogénios e de antagonistas dos androgénios no Ensaio de Desenvolvimento Sexual em Peixes, mas estes modos de ação ainda estão pouco documentados.
|
PRINCÍPIO DO MÉTODO
|
12.
|
Neste ensaio, expõem-se os peixes, desde o ovo recentemente fecundado até ao termo da diferenciação sexual, a, pelo menos, três concentrações do produto químico em estudo dissolvido em água. O ensaio decorre em fluxo contínuo, a menos que não seja possível realizá-lo nessas condições por motivos ligados à disponibilidade ou à natureza (solubilidade reduzida, por exemplo) do produto químico em estudo. Inicia-se o ensaio com a colocação de ovos recentemente fertilizados (antes da segmentação do blastodisco) nas cubas de ensaio. A carga das cubas é descrita para cada espécie no ponto 27. Para as espécies de peixes validadas (peixe-do-arroz-japonês, esgana-gata e peixe-zebra), o ensaio termina 60 dias após a eclosão. Eutanasiam-se sem sofrimento os peixes no final do ensaio. Colhe-se uma amostra biológica (plasma sanguíneo, fígado ou homogeneizado da cabeça e da cauda) de cada peixe para a análise da vitelogenina, procedendo-se à fixação do restante para avaliação histológica das gónadas com vista à determinação do sexo fenotípico. A histopatologia (por exemplo classificação do estádio de desenvolvimento das gónadas, grau de intersexualidade) é facultativa. Nas espécies que possuem biomarcadores adequados, colhe-se uma amostra biológica (barbatana anal ou dorsal) para determinação do sexo genético (apêndices 9 e 10).
|
|
13.
|
O apêndice 2 recapitula as condições experimentais relevantes para as espécies validadas (peixe-do-arroz-japonês, esgana-gata e peixe-zebra).
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
14.
|
É necessário dispor de resultados de um ensaio de toxicidade aguda ou de outro ensaio de toxicidade a curto prazo [por exemplo o método de ensaio C.14 (34) e o Test Guideline 210 da OCDE (1)], de preferência realizado com a espécie escolhida para este ensaio. Isto implica que a hidrossolubilidade e a pressão de vapor do produto químico em estudo são conhecidas e que se dispõe de um método analítico fiável de determinação quantitativa daquele nas cubas de ensaio, sendo que a exatidão e o limite de deteção desse método são conhecidos e estão documentados.
|
|
15.
|
A fórmula estrutural, o grau de pureza, a estabilidade em água e à luz, o pKa, o Pow e os resultados de um ensaio de biodegradabilidade “fácil” (método de ensaio C.4) do produto químico em estudo constituem outras informações úteis (35).
|
Critérios de aceitação do ensaio
|
16.
|
Para que os resultados do ensaio possam considerar-se aceitáveis, têm de ser cumpridas as seguintes condições:
|
—
|
concentração de oxigénio dissolvido ao longo do ensaio igual ou superior a 60 % do valor da saturação com ar (VSA);
|
|
—
|
diferença de temperatura da água entre as diversas cubas de ensaio não superior a ±1,5 °C em qualquer momento do período de exposição, mantendo-se a temperatura da água de cada cuba sempre na gama de temperaturas especificada para a espécie utilizada no ensaio (apêndice 2);
|
|
—
|
disponibilidade de um método validado de análise do produto químico ao qual a espécie utilizada no ensaio é exposta, com limite de deteção bastante abaixo da concentração nominal mais baixa, e existência de dados demonstrativos de que a concentração em solução do produto químico em estudo se manteve satisfatoriamente num intervalo de ±20 % relativamente à média dos valores medidos;
|
|
—
|
taxa global de sobrevivência dos ovos fertilizados do grupo de controlo e, quando aplicável, do grupo de controlo do solvente igual ou superior aos limites definidos no apêndice 2;
|
|
—
|
critérios de aceitação relativos ao crescimento e à proporção de cada sexo no termo do ensaio, baseados nos dados dos grupos de controlo (grupos de controlo do solvente e da água agregados, a menos que os resultados sejam significativamente diferentes, caso em que prevalecem os resultados do grupo do solvente):
|
|
Peixe-do-arroz-japonês
|
Peixe-zebra
|
Esgana-gata
|
|
Crescimento
|
Peso húmido de peixe (enxuto)
|
>150 mg
|
>75 mg
|
>120 mg
|
|
Comprimento (padrão)
|
>20 mm
|
>14 mm
|
>20 mm
|
|
Rácio sexual (percentagem de machos ou fêmeas)
|
30-70 %
|
30-70 %
|
30-70 %
|
|
|
—
|
solvente eventualmente utilizado sem efeitos com significância estatística na sobrevivência e sem nenhum efeito desregulador do sistema endócrino nem outros efeitos indesejados nos primeiros estádios de vida, comprovado por um grupo de controlo do solvente.
|
Caso se observe algum desvio dos critérios de aceitação do ensaio, ponderam-se as consequências na fiabilidade dos dados do ensaio e inclui-se essa análise no relatório.
|
DESCRIÇÃO DO MÉTODO DE ENSAIO
Cubas de ensaio
|
17.
|
Podem ser utilizadas quaisquer cubas de vidro, de aço inoxidável ou de outro material quimicamente inerte. As dimensões das cubas devem ser suficientes para que possam ser cumpridos os requisitos relativos à taxa de carga adiante enunciados. É desejável que as cubas de ensaio sejam posicionadas de forma aleatória na área de ensaio. Porém, em vez de uma disposição completamente aleatória, é preferível uma organização por blocos e uma disposição aleatória em cada bloco, estando todas as concentrações presentes em cada bloco. As cubas de ensaio devem estar protegidas contra perturbações indesejadas.
|
Escolha da espécie
|
18.
|
O apêndice 2 refere as espécies recomendadas. O processo de inclusão de novas espécies é descrito no ponto 2.
|
Manutenção dos peixes progenitores
|
19.
|
O Test Guideline 210 da OCDE (1) descreve o modo de manutenção dos peixes progenitores em condições satisfatórias. Devem ser fornecidos aos peixes progenitores alimentos adequados uma ou duas vezes por dia.
|
Manipulação de embriões e de larvas
|
20.
|
Inicialmente, os embriões e larvas podem ser expostos em cubas de vidro ou de aço inoxidável mais pequenas, dispostas no interior da cuba principal e cujos lados ou extremidades sejam constituídos por uma rede que possibilite o fluxo do produto químico em estudo através de cada cuba. Uma forma de criar um fluxo não-turbulento através dessas cubas mais pequenas consiste em pendurá-las num braço que as movimente para cima e para baixo, mas mantenha os organismos sempre submersos.
|
|
21.
|
Quando se utilizam recipientes, grelhas ou malhas para confinar os ovos na cuba principal de ensaio, esses dispositivos de confinamento devem ser removidos após a eclosão das larvas, com exceção das malhas necessárias para evitar que os peixes escapem. Caso seja necessário transferir larvas, estas não devem ser expostas ao ar. Também não devem ser utilizadas redes para retirar peixes de recipientes de ovos. O momento adequado para efetuar esta transferência (que nem sempre é necessária) varia de espécie para espécie.
|
Água
|
22.
|
A água utilizada no ensaio pode ser qualquer água na qual a taxa de sobrevivência do grupo de controlo da espécie ensaiada seja, pelo menos, tão elevada quanto a verificada na água caracterizada no apêndice 3. A qualidade da água deve manter-se constante durante o ensaio. Para assegurar que a água de diluição não influencia indevidamente o resultado do ensaio (por exemplo por reação com o produto químico em estudo) nem afeta negativamente o desempenho da progenitura, colhem-se regularmente amostras para análise. De três em três meses, por exemplo, caso se saiba que a qualidade da água de diluição se mantém aproximadamente constante, medem-se o carbono orgânico total, a condutividade, o pH e os sólidos em suspensão. Se a qualidade da água suscitar dúvidas, medem-se as concentrações de metais pesados (por exemplo Cu, Pb, Zn, Hg, Cd, Ni), dos principais catiões e aniões (por exemplo Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) e de pesticidas. O ponto 34 dá mais pormenores sobre a análise química e as amostras de água colhidas.
|
Soluções utilizadas no ensaio
|
23.
|
Se isso for possível do ponto de vista prático, deve utilizar-se um sistema de fluxo contínuo. Nos ensaios de fluxo contínuo, tendo em vista a manutenção da série pretendida de concentrações nas cubas utilizadas no ensaio, é necessário um sistema que forneça e dilua continuamente (por exemplo por meio de uma bomba doseadora, de um diluidor proporcional ou de um sistema saturador) uma solução de reserva do produto químico em estudo. Os caudais das soluções de reserva e da água de diluição devem ser verificados regularmente durante o ensaio e não devem variar mais de 10 % ao longo do ensaio. Considera-se adequado um caudal equivalente a, pelo menos, o volume de cinco cubas de ensaio em 24 horas (1). Não deve utilizar-se tubagem de plástico ou outros materiais que possam conter produtos químicos biologicamente ativos ou adsorver o produto químico em estudo.
|
|
24.
|
Preferencialmente, prepara-se a solução de reserva sem utilizar solventes, por simples mistura ou agitação do produto químico em estudo na água de diluição, utilizando meios mecânicos (agitação ou dispersão ultrassónica, por exemplo). Caso seja difícil dissolver em água o produto químico em estudo, procede-se como é descrito no documento de orientações da OCDE sobre ensaios de toxicidade em meio aquático de substâncias e misturas difíceis (36). Deve evitar-se a utilização de solventes, embora estes possam ser necessários em alguns casos, para obter uma solução de reserva com a concentração adequada. A referência (36) indica alguns solventes adequados.
|
|
25.
|
Os ensaios não devem ser realizados em condições semiestáticas, a menos que possam ser apresentadas razões ponderosas associadas ao produto químico em estudo (por exemplo estabilidade, disponibilidade reduzida, custo elevado ou perigo associado). Na técnica semiestática, podem adotar-se dois métodos de renovação diferentes: ou se preparam novas soluções de ensaio em cubas limpas e se transferem cautelosamente os ovos e larvas sobreviventes para as novas cubas ou se mantêm os organismos em estudo nas cubas de ensaio e se renova diariamente uma parte (pelo menos dois terços) da água utilizada no ensaio.
|
PROCEDIMENTO DE ENSAIO
Condições de exposição
Colheita de ovos e duração do ensaio
|
26.
|
Para evitar distorções estatísticas de cariz genético, colhem-se ovos de, pelo menos, três casais ou grupos reprodutores, misturam-se todos os ovos e selecionam-se aleatoriamente os ovos necessários para iniciar o ensaio. Ver no apêndice 11 a descrição da fertilização artificial no caso do esgana-gata. Inicia-se o ensaio o mais rapidamente possível após a fertilização dos ovos, sendo preferível imergir os embriões nas soluções em estudo antes de iniciada a segmentação do blastodisco ou o mínimo de tempo possível após esse estádio, mas não mais de 12 horas após a fertilização. Prossegue-se o ensaio até terminar a diferenciação sexual no grupo de controlo (60 dias após a eclosão no caso do peixe-do-arroz-japonês, do esgana-gata e do peixe-zebra).
|
Carga
|
27.
|
O número mínimo de ovos fertilizados no início do ensaio é de 120 por nível de concentração, repartidos por, pelo menos, quatro replicados (admite-se uma atribuição por raiz quadrada ao grupo de controlo). Utilizando tabelas estatísticas de aleatorização, distribuem-se os ovos aleatoriamente pelos grupos expostos. A taxa de carga (ver a definição no apêndice 1) tem de ser suficientemente baixa para que, sem necessidade de arejamento direto das cubas, possa manter-se uma concentração de oxigénio dissolvido não inferior a 60 % do valor da saturação com ar. Para os ensaios de fluxo contínuo, recomenda-se uma taxa de carga não superior a 0,5 g/l em 24 horas e sempre não superior a 5 g/l de solução. O mais tardar 28 dias após a fertilização, redistribuem-se os peixes por replicado em função do número de efetivos, de modo que todos os replicados passem a conter um número de peixes o mais idêntico possível. Se morrerem peixes devido à exposição, reduz-se em conformidade o número de replicados, de modo que a densidade de peixes seja o mais possível idêntica em todos os níveis de exposição.
|
Luz e temperatura
|
28.
|
O fotoperíodo e a temperatura da água devem ser adequados à espécie utilizada no ensaio (ver no apêndice 2 as condições experimentais para este ensaio).
|
Alimentação
|
29.
|
O regime alimentar dos peixes é um aspeto da maior importância, sendo essencial fornecer o alimento correto para cada estádio a intervalos adequados e em quantidade suficiente para um crescimento normal. O alimento deve ser fornecido ad libitum, mas minimizando os excedentes. Para obter um crescimento normal, alimentam-se os peixes pelo menos duas vezes por dia (é aceitável uma dose diária única nos fins de semana), com, pelo menos, três horas de intervalo entre cada fornecimento de alimento. Para evitar a acumulação de resíduos, removem-se o excesso de alimento e as fezes sempre que necessário. Deve procurar aperfeiçoar-se continuamente o regime alimentar em função da experiência adquirida, de modo a melhorar a taxa de sobrevivência e otimizar o crescimento. Deve, portanto, procurar obter-se de peritos reconhecidos a confirmação do regime proposto. Suspende-se a alimentação dos peixes 24 horas antes do termo do ensaio. Indicam-se no apêndice 2 alguns exemplos de regimes alimentares adaptados [ver igualmente a referência (39) da OCDE, relativa a aspetos gerais dos ensaios de toxicidade em peixes].
|
Concentrações ensaiadas
|
30.
|
As concentrações do produto químico em estudo devem relacionar-se conforme se indica no apêndice 4. O mínimo a ensaiar são quatro replicados de cada uma de três concentrações diferentes. Na escolha da gama de concentrações a ensaiar, deve atender-se à curva que relaciona a CL50 com o período de exposição nos estudos de toxicidade aguda disponíveis. Caso os dados se destinem à avaliação de riscos, recomenda-se o ensaio de cinco concentrações diferentes.
|
|
31.
|
Não é necessário ensaiar concentrações do produto químico que excedam 10 % do valor da CL50 aguda em adultos ou 10 mg/l, prevalecendo como critério o valor mais baixo. A concentração mais elevada a ensaiar deve corresponder a 10 % da CL50 na fase larvar/juvenil.
|
Grupos de controlo
|
32.
|
Além do ensaio das concentrações de exposição, deve realizar-se um ensaio de controlo da água de diluição (pelo menos 4 replicados) e, se for caso disso, um ensaio de controlo do solvente (pelo menos 4 replicados). Apenas devem ser utilizados nestes ensaios solventes que, comprovadamente, não tenham nenhuma influência com significância estatística nos parâmetros ensaiados.
|
|
33.
|
Caso seja utilizado um solvente, a concentração final do mesmo não deve exceder 0,1 ml/l (36) e a concentração de solvente deve ser idêntica em todas as cubas de ensaio, exceto nas do grupo de controlo da água de diluição. No entanto, deve evitar-se o mais possível utilizar solventes; se for utilizado um solvente, a concentração do mesmo deve ser reduzida ao mínimo.
|
Frequência das medições e das determinações analíticas
|
34.
|
A fim de verificar a observância dos critérios de aceitação, antes de iniciar o ensaio procede-se à determinação, por análise química, da concentração do produto químico em estudo. No início e no termo do ensaio, analisam-se individualmente todos os replicados. Durante o ensaio, analisa-se, pelo menos uma vez por semana, um replicado de cada concentração ensaiada, percorrendo sistematicamente todos os replicados (1,2,3,4,1,2….). Caso se guardem amostras para análise posterior, é necessário que o método de armazenagem das amostras tenha sido previamente validado. Para garantir que as determinações do produto químico se realizam na verdadeira solução do mesmo, filtram-se (utilizando filtros com porosidade de 0,45 μm, por exemplo) ou centrifugam-se as amostras.
|
|
35.
|
Durante o ensaio, medem-se em todas as cubas o oxigénio dissolvido, o pH, a dureza total, a condutividade, a salinidade (se tiver interesse) e a temperatura. O oxigénio dissolvido, a salinidade (se tiver interesse) e a temperatura são medidos, pelo menos, semanalmente; o pH, a condutividade e a dureza, pelo menos no início e no final do ensaio. De preferência, monitoriza-se a temperatura continuamente em, pelo menos, uma das cubas de ensaio.
|
|
36.
|
Recomenda-se que os resultados se baseiem em concentrações medidas. Todavia, se, durante todo o ensaio, as concentrações em solução do produto químico em estudo não se tiverem satisfatoriamente desviado mais de 20 % das concentrações nominais, os resultados podem basear-se nos valores nominais ou nos valores medidos.
|
Exames e medições
Estádio do desenvolvimento embrionário
|
37.
|
Inicia-se a exposição o mais rapidamente possível após a fertilização, antes de iniciada a segmentação do blastodisco e não mais de 12 horas após a fertilização, a fim de que haja exposição durante as primeiras fases do desenvolvimento embrionário.
|
Eclosão e sobrevivência
|
38.
|
O exame da eclosão e da sobrevivência deve ser, pelo menos, diário, registando-se os números apurados. Removem-se os embriões, larvas e peixes juvenis mortos logo que sejam detetados, pois podem decompor-se rapidamente e ser despedaçados pelos outros peixes. A remoção dos indivíduos mortos deve ser extremamente cuidadosa, de modo a não tocar nos ovos e larvas vizinhos e a não os danificar, pois são extremamente frágeis e sensíveis. Os critérios de morte variam de acordo com o estádio vital:
|
—
|
ovos: particularmente nos estádios iniciais, acentuada perda de translucidez e alteração da coloração, causadas por coagulação e/ou precipitação de proteínas e conduzindo a um aspeto branco opaco;
|
|
—
|
larvas e peixes juvenis: imobilidade e/ou ausência de movimentos respiratórios e/ou ausência de batimentos cardíacos e/ou coloração branca opaca do sistema nervoso central e/ou ausência de reação a estímulos mecânicos.
|
|
Aspeto anómalo
|
39.
|
Regista-se o número de larvas e de peixes cuja forma do corpo seja anormal e descreve-se o aspeto e a natureza da anomalia. A ocorrência de embriões e larvas com anomalias é um fenómeno natural, podendo, nalgumas espécies, afetar alguns pontos percentuais dos efetivos do(s) grupo(s) de controlo. Os animais com aspeto anómalo só são retirados das cubas de ensaio quando morrerem. Todavia, em conformidade com a Diretiva 2010/623/UE do Parlamento Europeu e do Conselho, de 22 de setembro de 2010, relativa à proteção dos animais utilizados para fins científicos, se das anomalias resultarem dor, sofrimento, angústia ou dano duradouro e a previsão de morte for segura, os animais em causa devem ser anestesiados, eutanasiados conforme se descreve no ponto 44 e tratados como mortalidade na análise dos dados.
|
Comportamento anómalo
|
40.
|
Registam-se as anomalias a este nível (por exemplo hiperventilação, natação descoordenada, inatividade atípica e comportamento alimentar atípico) logo que surjam.
|
Peso
|
41.
|
No termo do ensaio, eutanasiam-se os peixes sobreviventes (sendo primeiro anestesiados se estiver prevista a colheita de amostras de sangue) e pesam-se um a um (peso húmido de cada peixe enxuto).
|
Comprimento
|
42.
|
No termo do ensaio, mede-se cada peixe (comprimento padrão).
|
|
43.
|
Estes exames permitem obter e inserir no relatório alguns ou a totalidade dos seguintes dados:
|
—
|
número de peixes saudáveis no final do ensaio,
|
|
—
|
tempo decorrido até ao início e até ao final da eclosão,
|
|
—
|
comprimento e peso dos sobreviventes,
|
|
—
|
número de larvas deformadas,
|
|
—
|
número de peixes com comportamento anómalo.
|
|
Colheita de amostras de peixes
|
44.
|
No final do ensaio procede-se à colheita de amostras dos peixes. Eutanasiam-se os peixes que integram as amostras, por exemplo com MS-222 (100-500 mg por litro, tamponado com 200 mg de NaHCO3 por litro) ou FA-100 (4-alil-2-metoxifenol, sinónimo de eugenol), medem-se um a um e pesam-se individualmente (peso húmido enxuto); ou então anestesiam-se, se for necessário colher uma amostra de sangue (ver o ponto 49).
|
Colheita de amostras para análise da vitelogenina e determinação do sexo por avaliação histológica
|
45.
|
Todos os peixes vão integrar as amostras e ser preparados para a determinação do sexo e a análise da vitelogenina. Procede-se em todos os peixes a uma análise histológica para determinação do sexo. Para a análise da vitelogenina, aceita-se a constituição de subamostras compostas por, pelo menos, 16 peixes de cada replicado. Se os resultados obtidos para as subamostras forem pouco claros, é necessário efetuar a análise da vitelogenina a mais peixes.
|
|
46.
|
A constituição das amostras para análise da vitelogenina e para determinação do sexo depende do método de análise da vitelogenina.
|
Método do homogeneizado da cabeça e da cauda para análise da vitelogenina
|
47.
|
Eutanasiam-se os peixes. Separam-se do corpo a cabeça e a cauda de cada peixe efetuando os cortes com um bisturi imediatamente atrás das barbatanas peitorais e imediatamente atrás da barbatana dorsal (ver a figura 1). Reúnem-se a cabeça e a cauda de cada peixe, pesa-se este conjunto e numera-se cada conjunto de cabeça e cauda, após o que se congela em azoto líquido e se conserva a – 70 °C, ou a temperatura inferior, para a análise da vitelogenina. Numera-se o resto do corpo de cada peixe e fixa-se essa parte com um fixador apropriado para avaliação histológica (22). O recurso a este método permite determinar a vitelogenina e efetuar uma avaliação histopatológica em cada peixe, pelo que pode relacionar-se uma variação do nível de vitelogenina com o sexo fenotípico ou (no caso do peixe-do-arroz-japonês e do esgana-gata) com o sexo genético do peixe. Para mais informações, ver as orientações relativas à homogeneização (apêndice 5) e as orientações relativas à determinação quantitativa da vitelogenina (apêndice 6).
|
Método do homogeneizado hepático para análise da vitelogenina
|
48.
|
Eutanasiam-se os peixes. Disseca-se o fígado e conserva-se a – 70 °C ou a temperatura inferior. O Test Guideline 229 da OCDE (37) e o capítulo C.37 deste anexo (38) descrevem procedimentos recomendados para a excisão e o pré-tratamento dos fígados. Em seguida, homogeneíza-se separadamente cada fígado como se explica no Test Guideline 229 da OCDE (37) ou no capítulo C.37 deste anexo. Utiliza-se o sobrenadante para determinar a vitelogenina recorrendo a uma técnica ELISA homóloga — ver exemplos de determinação quantitativa no apêndice 6 (peixe-zebra) ou no Test Guideline 229 da OCDE (37) (peixe-do-arroz-japonês). Por esta via, também é possível obter dados por peixe da vitelogenina e da histologia das gónadas.
|
Método do plasma sanguíneo para análise da vitelogenina
|
49.
|
Colhe-se sangue do peixe anestesiado, por punção cardíaca, na veia caudal ou por corte da cauda, e centrifuga-se a amostra a 4 °C para separar o plasma. Conserva-se o plasma a – 70 °C ou a temperatura inferior até ser utilizado. Eutanasia-se o peixe e fixa-se o peixe inteiro para a histologia. Numeram-se individualmente as amostras de plasma e os peixes, para se poder relacionar o nível de vitelogenina com o sexo do peixe correspondente.
Figura 1:
Modo de cortar um peixe para a determinação da vitelogenina no homogeneizado da cabeça e da cauda e para a avaliação histológica da secção intermédia (corte atrás da barbatana dorsal e atrás da barbatana peitoral).

|
Determinação do sexo genético
|
50.
|
Nas espécies para as quais existem marcadores adequados, colhe-se uma amostra biológica em cada peixe para determinação do sexo genético. No caso do peixe-do-arroz-japonês, colhe-se a barbatana anal ou a barbatana dorsal. O apêndice 9 apresenta uma descrição pormenorizada, nomeadamente da colheita dos tecidos e da determinação do sexo por um método PCR. No apêndice 10, apresenta-se igualmente uma descrição da colheita dos tecidos e da determinação do sexo por um método PCR no caso do esgana-gata.
|
Determinação quantitativa da vitelogenina
|
51.
|
A determinação quantitativa da vitelogenina deve ser realizada por um método analítico quantitativo validado. Deve dispor-se de informações sobre a variabilidade do método utilizado nos ensaios realizados num laboratório, bem como sobre a variabilidade de ensaio para ensaio no mesmo laboratório. A variabilidade interlaboratorial e intralaboratorial depende (muito provavelmente) do estádio de desenvolvimento (variável) da população de peixes. Dada a variabilidade da determinação quantitativa da vitelogenina, há que ser prudente na interpretação de concentrações sem efeitos observáveis (NOEC) baseadas unicamente neste parâmetro. Existem vários métodos que permitem avaliar a produção de vitelogenina da espécie de peixes utilizada no ensaio. O método ELISA é uma técnica quantitativa relativamente sensível e específica de determinação de concentrações proteicas. É necessário utilizar anticorpos homólogos (ativos em relação a vitelogenina da mesma espécie) e, especialmente importante, padrões homólogos.
|
Determinação do sexo
|
52.
|
Consoante o método de constituição da amostra destinada à determinação da vitelogenina, coloca-se cada peixe inteiro ou a secção intermédia restante de cada peixe numa caixinha de tratamento pré-rotulada e procede-se à fixação com um fixador adequado para a determinação histológica do sexo (facultativamente também para a avaliação do estádio de desenvolvimento das gónadas). O apêndice 7 e o documento de orientações da OCDE sobre o diagnóstico de histopatologias de tipo endócrino em gónadas de peixes (22) contêm orientações sobre a fixação e o embebimento. Depois de tratado, embebe-se cada peixe num bloco de parafina. Dispõem-se os peixes longitudinalmente nos blocos de parafina. Efetuam-se em cada peixe, pelo menos, seis cortes longitudinais, com 3 a 5 μm de espessura, segundo um plano frontal, que abranjam tecido de ambas as gónadas. O intervalo entre esses cortes é de aproximadamente 50 μm nos machos e 250 μm nas fêmeas. Todavia, dado que é frequente estarem presentes machos e fêmeas no mesmo bloco (caso sejam embebidos vários peixes em cada bloco), o intervalo entre os cortes realizados por bloco deve ser de aproximadamente 50 μm, até se obterem, pelo menos, seis cortes das gónadas de cada macho. Em seguida, pode ampliar-se o intervalo entre os cortes para 250 μm, para as fêmeas. Coloram-se os cortes com hematoxilina e eosina e examinam-se com um microscópio ótico, para determinação do sexo (macho, fêmea, intersexual ou indiferenciado). A intersexualidade é definida pela presença de mais de um ovócito nos testículos por conjunto de seis cortes examinados ou pela presença (sim ou não) de células espermatogénicas nos ovários. A histopatologia e a classificação do estádio de desenvolvimento dos ovários e dos testículos é facultativa, mas, se forem realizadas, os resultados obtidos devem ser analisados estatisticamente e incluídos no relatório. É de referir que algumas espécies de peixes não têm, na natureza, um par de gónadas totalmente desenvolvido, podendo estar presente apenas uma gónada (caso do peixe-do-arroz-japonês e, por vezes, do peixe-zebra). É conservado registo dos resultados de todos estes exames.
|
|
53.
|
A determinação do sexo genético no peixe-do-arroz-japonês baseia-se na presença ou ausência do gene DMY, que determina o sexo masculino nesta espécie, localizado no cromossoma Y. Pode determinar-se o sexo genotípico de exemplares de peixe-do-arroz-japonês por sequenciação do gene DMY a partir de ADN extraído, por exemplo, de um fragmento de barbatana anal ou de barbatana dorsal. A presença do gene DMY indica que se trata de um indivíduo do sexo masculino (XY), independentemente do fenótipo que evidencie; a ausência do gene DMY indica que se trata de um indivíduo do sexo feminino (XX), independentemente do fenótipo que evidencie (23). O apêndice 9 fornece orientações sobre a preparação dos tecidos e o método PCR. A determinação do sexo genético de esgana-gatas também se faz por um método PCR, descrito no apêndice 10.
|
|
54.
|
Os casos de intersexualidade (ver a definição no apêndice 1) devem ser referidos no relatório.
|
Caracteres sexuais secundários
|
55.
|
Em espécies como o peixe-do-arroz-japonês, os caracteres sexuais secundários estão sob controlo do sistema endócrino. Por conseguinte, o exame do aspeto físico de cada peixe deve, se possível, ser efetuado no final da exposição. No peixe-do-arroz-japonês, a formação de tubérculos papilares na parte posterior da barbatana anal das fêmeas é sensível aos androgénios. O capítulo C.37 deste anexo (38) contém fotografias elucidativas dos caracteres sexuais secundários masculinos e de fêmeas androgenisadas.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
56.
|
É importante recorrer ao teste estatístico válido mais poderoso para determinar o valor do parâmetro em causa. A unidade experimental é o replicado, mas é necessário ter em conta no teste estatístico a variabilidade interna dos replicados. O fluxograma de decisão do apêndice 8 visa facilitar a escolha do teste estatístico mais adequado a utilizar, com base nas características dos dados obtidos no ensaio. O nível de significância estatística é de 0,05 para todos os parâmetros contemplados.
|
Proporção de cada sexo e sexo genético
|
57.
|
Se a resposta à dosagem for uma função monótona, recorre-se ao teste de Jonckheere-Terpstra (teste de tendência) para ajuizar da existência de efeitos com significância (abordagem NOEC/LOEC) da exposição na proporção dos sexos. Se a relação não for monótona, utiliza-se um teste de comparações par a par: em caso de normalidade e de variância homogénea, utiliza-se o teste de Dunnett; em caso de variância heterogénea, utiliza-se o teste de Tamhane-Dunnett; nos outros casos, utiliza-se um teste exato de Mann-Whitney com ajustamento de Bonferroni-Holm. O apêndice 8 contém um fluxograma para a análise estatística das proporções dos sexos. Estas apresentam-se em quadros de proporção de concentração ± desvio-padrão de machos, fêmeas, peixes intersexuais e peixes de sexo indiferenciado. Deve destacar-se a significância estatística. Apresentam-se exemplos no relatório de validação da fase 2 do Ensaio de Desenvolvimento Sexual em Peixes (42). O sexo genético é referido no relatório em percentagem de inversão do sexo fenotípico em machos, fêmeas, peixes intersexuais e peixes indiferenciados.
|
Concentrações de vitelogenina
|
58.
|
Analisam-se as concentrações de vitelogenina para ajuizar da existência de efeitos com significância (abordagem NOEC/LOEC) da exposição. É preferível o teste de Dunnett ao teste t com correção de Bonferroni. Caso se utilize uma correção de Bonferroni, é preferível a correção de Bonferroni-Holm. Tendo em vista a normalidade e uma variância homogénea, admite-se uma transformação logarítmica da concentração de vitelogenina. Se a resposta à concentração for coerente com uma função monótona, é preferível o teste de Jonckheere-Terpstra a qualquer dos já referidos. Caso se utilize um teste t ou o teste de Dunnett, é desnecessário um teste F de significância (análise de variância) para prosseguir. Ver mais pormenores no fluxograma do apêndice 8. Os resultados apresentam-se em quadros de média de concentração ± desvio-padrão de machos, fêmeas, peixes intersexuais e peixes de sexo indiferenciado, separadamente. Deve destacar-se a significância estatística associada às fêmeas fenotípicas e aos machos fenotípicos. Apresentam-se exemplos no relatório de validação da fase 2 do Ensaio de Desenvolvimento Sexual em Peixes (42).
|
Concentrações reais do produto químico em estudo
|
59.
|
As frequências de análise da concentração real, nas cubas, do produto químico em estudo são indicadas no ponto 34. Os resultados apresentam-se em quadros de concentração média ± desvio-padrão por replicado e por concentração, destacando o número de amostras e os resultados aberrantes relativamente à concentração média de exposição ± 20 %. Apresentam-se exemplos no relatório de validação da fase 2 do Ensaio de Desenvolvimento Sexual em Peixes (42).
|
Interpretação dos resultados
|
60.
|
Os resultados do ensaio devem ser interpretados com prudência quando as concentrações do produto químico em estudo medidas nas soluções de ensaio são próximas do limite de deteção do método analítico.
|
Relatório do ensaio
|
61.
|
Elementos a constar do relatório do ensaio:
|
|
Produto químico em estudo
|
—
|
propriedades físico-químicas pertinentes, dados de identificação química, incluindo o grau de pureza e o método analítico de determinação quantitativa do produto químico em estudo.
|
|
|
|
Condições de realização do ensaio
|
—
|
protocolo experimental utilizado (fluxo contínuo, semiestático/com renovação); planeamento do ensaio, incluindo as concentrações ensaiadas, o método de preparação das soluções de reserva (em anexo) e a frequência de renovação (indicar o agente de solubilização e a concentração deste, quando utilizado);
|
|
—
|
concentrações nominais ensaiadas, médias dos valores medidos nas cubas de ensaio e desvios-padrão correspondentes, bem como o método utilizado para os obter (o método analítico utilizado deve ser descrito em anexo); elementos comprovativos de que as medições dizem respeito às concentrações reais em solução do produto químico em estudo;
|
|
—
|
qualidade da água nas cubas de ensaio: pH, dureza, temperatura e concentração de oxigénio dissolvido;
|
|
—
|
informações pormenorizadas sobre a alimentação dos peixes — por exemplo, tipo(s) de alimento, proveniência do(s) mesmo(s), quantidade e frequência do fornecimento de alimento e, se for caso disso, resultados das análises de contaminantes (por exemplo bifenilos policlorados, hidrocarbonetos aromáticos policíclicos e pesticidas organoclorados).
|
|
|
|
Resultados
|
—
|
elementos comprovativos de que os grupos de controlo satisfizeram os critérios de validade do ensaio: os dados relativos à eclosão são apresentados em quadros de percentagem por replicado e por concentração, destacando os resultados aberrantes relativamente aos critérios de aceitação (nos grupos de controlo); os dados relativos à sobrevivência são apresentados em percentagem por replicado e por concentração, destacando os resultados aberrantes relativamente aos critérios de validação (nos grupos de controlo);
|
|
—
|
indicação clara dos resultados obtidos para os diversos parâmetros examinados: sobrevivência dos embriões e êxito da eclosão; anomalias externas; comprimento e peso; medições da vitelogenina (ng/g de homogeneizado, ng/ml de plasma ou ng/mg de fígado); dados relativos à histologia das gónadas, ao rácio sexual e ao sexo genético; incidência de quaisquer reações inabituais dos peixes e de quaisquer efeitos visíveis gerados pelo produto químico em estudo.
|
|
|
|
62.
|
Apresentam-se os resultados sob a forma de valor médio ± desvio-padrão ou valor médio ± erro-padrão. Os resultados estatísticos mínimos são o NOEC (concentração sem efeitos observáveis), o LOEC (menor concentração com efeitos observáveis) e os intervalos de confiança. Deve utilizar-se o fluxograma estatístico do apêndice 8.
|
REFERÊNCIAS
|
1)
|
OCDE (1992). Fish, Early Life Stage Toxicity Test. Test Guideline No. 210, Guidelines for the Testing of Chemicals. OCDE, Paris.
|
|
2)
|
Jobling, S., Sheahan, D., Osborne, J.A., Matthiessen, P., Sumpter, J.P. (1996). Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals. Environmental Toxicology and Chemistry, 15, pp. 194-202.
|
|
3)
|
Sumpter, J.P., Jobling, S. (1995). Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment. Environmental Health Perspectives, 103, pp. 173-178.
|
|
4)
|
Tyler, C.R., van Aerle, R., Hutchinson, T.H., Maddix, S., Trip, H. (1999). An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin. Environmental Toxicology and Chemistry, 18, pp. 337-347.
|
|
5)
|
Holbech, H., Andersen, L., Petersen, G.I., Korsgaard, B., Pedersen, K.L., Bjerregaard, P. (2001a). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology, C-Toxicology & Pharmacology, 130, pp. 119-131.
|
|
6)
|
Andersen, L., Bjerregaard, P., Korsgaard, B. (2003). Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters. Fish Physiology and Biochemistry, 28, pp. 319-321.
|
|
7)
|
Orn, S., Holbech, H., Madsen, T.H., Norrgren, L., Petersen, G.I. (2003) Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone. Aquatic Toxicology, 65, pp. 397-411.
|
|
8)
|
Panter, G.H., Hutchinson, T.H., Lange, R., Lye, C.M., Sumpter, J.P., Zerulla, M., Tyler, C.R. (2002). Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances. Environmental Toxicology and Chemistry, 21, pp. 319-326.
|
|
9)
|
Sun, L.W., Zha, J.M., Spear, P.A., Wang, Z.J. (2007). Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults. Comparative Biochemistry and Physiology, C-Toxicology & Pharmacology, 145, pp. 533-541.
|
|
10)
|
Parks, L.G., Cheek, A.O., Denslow, N.D., Heppell, S.A., McLachlan, J.A., LeBlanc, G.A., Sullivan, C.V. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology, C-Toxicology & Pharmacology, 123, pp. 113-125.
|
|
11)
|
Brion, F., Nilsen, B.M., Eidem, J.K., Goksoyr, A., Porcher, J.M. (2002). Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry, 21, pp. 1699-1708.
|
|
12)
|
Nishi, K., Chikae, M., Hatano, Y., Mizukami, H., Yamashita, M., Sakakibara, R., Tamiya, E. (2002). Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin. Comparative Biochemistry and Physiology, C-Toxicology & Pharmacology, 132, pp. 161-169.
|
|
13)
|
Hahlbeck, E., Katsiadaki, I., Mayer, I., Adolfsson-Erici, M., James, J., Bengtsson, B.E. (2004). The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption — II — kidney hypertrophy, vitellogenin and spiggin induction. Aquatic Toxicology, 70, pp. 311-326.
|
|
14)
|
Tatarazako, N., Koshio, M., Hori, H., Morita, M., Iguchi, T. (2004). Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka. Journal of Health Science, 50, pp. 301-308.
|
|
15)
|
Eidem, J.K., Kleivdal, H., Kroll, K., Denslow, N., van Aerle, R., Tyler, C., Panter, G., Hutchinson, T., Goksoyr, A. (2006). Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology, 78, pp. 202-206.
|
|
16)
|
Jensen, K.M., Ankley, G.T. (2006). Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas). Ecotoxicology and Environmental Safety, 64, pp. 101-105.
|
|
17)
|
Holbech, H., Petersen, G.I., Norman, A., Örn, S., Norrgren, L., Bjerregaard, P. (2001b). Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss). Nordic Council of Ministers. TemaNord, 2001:597, pp. 48-51.
|
|
18)
|
Nilsen, B.M., Berg, K., Eidem, J.K., Kristiansen, S.I., Brion, F., Porcher, J.M., Goksoyr, A. (2004). Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening. Analytical and Bioanalytical Chemistry, 378, pp. 621-633.
|
|
19)
|
Orn, S., Yamani, S., Norrgren, L. (2006). Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone. Archives of Environmental Contamination and Toxicology, 51, pp. 237-243.
|
|
20)
|
Scholz, S., Kluver, N. (2009). Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish. Sexual Development, 3, pp. 136-151.
|
|
21)
|
Fenske, M., Maack, G., Schafers, C., Segner, H. (2005). An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio. Environmental Toxicology and Chemistry, 24, pp. 1088-1098.
|
|
22)
|
OCDE (2010). Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads. Series on Testing and Assessment, No. 123, ENV/JM/MONO(2010)14. OCDE, Paris.
|
|
23)
|
Kobayashi, T., Matsuda, M., Kajiura-Kobayashi, H., Suzuki, A., Saito, N., Nakamoto, M., Shibata, N., Nagahama, Y. (2004). Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes. Developmental Dynamics, 231, pp. 518-526.
|
|
24)
|
Shinomiya, A., Otake, H., Togashi, K., Hamaguchi, S., Sakaizumi, M. (2004). Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations. Zoological Science, 21, pp. 613-619.
|
|
25)
|
Kidd, K.A., Blanchfield, P.J., Mills, K.H., Palace, V.P., Evans, R.E., Lazorchak, J.M., Flick, R.W. (2007). Collapse of a fish population after exposure to a synthetic estrogen. Proceedings of the National Academy of Sciences of the United States of America, 104, pp. 8897-8901.
|
|
26)
|
Palace,V.P., Evans, R.E. Wautier, K.G., Mills, K.H., Blanchfield, P.J., Park, B.J., Baron, C.L., Kidd, K.A. (2009). Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake. Canadian Journal of Fisheries and Aquatic Sciences, 66, pp. 1920-1935.
|
|
27)
|
Panter, G.H., Hutchinson, T.H., Hurd, K.S., Bamforth, J., Stanley, R.D., Duffell, S., Hargreaves, A., Gimeno, S., Tyler, C.R. (2006). Development of chronic tests for endocrine active chemicals — Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas). Aquatic Toxicology, 77, pp. 279-290.
|
|
28)
|
Holbech, H., Kinnberg, K., Petersen, G.I., Jackson, P., Hylland, K., Norrgren, L., Bjerregaard, P. (2006). Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT). Comparative Biochemistry and Physiology, C-Toxicology & Pharmacology, 144, pp. 57-66.
|
|
29)
|
Andersen, L., Kinnberg, K., Holbech, H., Korsgaard, B., Bjerregaard, P. (2004). Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio). Fish Physiology and Biochemistry, 30, pp. 257-266.
|
|
30)
|
Morthorst, J.E., Holbech, H., Bjerregaard, P. (2010). Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations. Aquatic Toxicology, 98, pp. 336-343.
|
|
31)
|
Kiparissis,Y., Metcalfe, T.L., Balch, G.C., Metcalf, C.D. (2003). Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes). Aquatic Toxicology, 63, pp. 391-403.
|
|
32)
|
Panter, G.H., Hutchinson, T.H. Hurd, K.S., Sherren, A., Stanley, R.D., Tyler, C.R. (2004). Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology, 70, pp. 11-21.
|
|
33)
|
Kinnberg, K., Holbech, H., Petersen, G.I., Bjerregaard, P. (2007). Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio). Comparative Biochemistry and Physiology, C-Toxicology & Pharmacology, 145, pp. 165-170.
|
|
34)
|
Capítulo C.14 deste anexo: Ensaio de crescimento juvenil em peixes.
|
|
35)
|
Capítulo C.4 deste anexo: Biodegradabilidade “fácil”.
|
|
36)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Series on Testing and Assessment, No. 23. OCDE, Paris.
|
|
37)
|
OCDE (2009). Fish Short Term Reproduction Assay. Test Guideline No. 229. Guidelines for the Testing of Chemicals. OCDE, Paris.
|
|
38)
|
Capítulo C.37 deste anexo: Ensaio a 21 dias em peixes: Despistagem a curto prazo de atividade estrogénica e androgénica e de inibição da aromatase.
|
|
39)
|
OCDE (2012). Fish Toxicity Testing Framework, Series on Testing and Assessment, No. 171. OCDE, Paris.
|
|
40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H. (2007). Concentration- and time-dependent effects of the synthetic estrogen, 17alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio. Journal of Toxicology and Environmental Health-Part A, 70, 9-10, pp. 768-779.
|
|
41)
|
OCDE (2011). Validation Report (Phase 1) for the Fish Sexual Development Test. Series on Testing and Assessment, No. 141, ENV/JM/MONO(2011)22. OCDE, Paris.
|
|
42)
|
OCDE (2011). Validation Report (Phase 2) for the Fish Sexual Development Test. Series on Testing and Assessment, No. 142, ENV/JM/MONO(2011)23. OCDE, Paris.
|
|
43)
|
OCDE (2011). Peer Review Report of the validation of the Fish Sexual Development Test. Series on Testing and Assessment, No. 143, ENV/JM/MONO(2011)24. OCDE, Paris.
|
|
44)
|
Diretiva 2010/63/UE do Parlamento Europeu e do Conselho, de 22 de setembro de 2010, relativa à proteção dos animais utilizados para fins científicos. JO L 276 de 20.10.2010, p. 33.
|
Apêndice 1
Abreviaturas e definições
Parâmetro apical
: Indicador de efeitos ao nível de toda a população.
VSA
: Valor da saturação com ar.
Biomarcador
: Indicador de efeitos ao nível individual.
Produto químico
: Substância ou mistura.
Dae
: Dias após a eclosão.
DMY
: Gene do domínio DM específico do cromossoma Y, necessário ao desenvolvimento masculino no peixe-do-arroz-japonês.
ELISA (Enzyme-Linked Immunosorbent Assay): Ensaio de imunossorção com ligação enzimática.
Peso de peixe
: Peso húmido de peixe (enxuto).
EDSP
: Ensaio de desenvolvimento sexual em peixes.
Eixo HHG
: Eixo hipotálamo-hipófise-gónadas.
Peixe intersexual
: Peixe com mais de um ovócito nos testículos (por série de seis cortes analisados) ou com células espermatogénicas nos ovários (ocorrência ou não).
Taxa de carga
: Peso húmido de peixe por volume de água.
MDA
: Modo de ação.
RT-PCR
: Reação em cadeia da polimerase após transcriptase inversa.
Produto químico em estudo
: Qualquer substância ou mistura à qual seja aplicado este método de ensaio.
Peixe indiferenciado
: Peixe cujas gónadas não apresentam células germinativas visíveis.
VTG
: Vitelogenina.
Apêndice 2
Condições experimentais do ensaio de desenvolvimento sexual em peixes (espécies de água doce)
|
|
Peixe-do-arroz-japonês (Oryzias latipes)
|
Peixe-zebra (Danio rerio)
|
Esgana-gata (Gasterostreus aculeatus)
|
|
|
Fluxo contínuo ou ensaio semiestático
|
Fluxo contínuo ou ensaio semiestático
|
Fluxo contínuo ou ensaio semiestático
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Lâmpadas fluorescentes (espetro largo)
|
Lâmpadas fluorescentes (espetro largo)
|
Lâmpadas fluorescentes (espetro largo)
|
|
|
10-20 μE/m2/s, 540-1 080 lux ou 50-100 ft-c (níveis ambientes no laboratório)
|
10-20 μE/m2/s, 540-1 080 lux ou 50-100 ft-c (níveis ambientes no laboratório)
|
10-20 μE/m2/s, 540-1 080 lux ou 50-100 ft-c (níveis ambientes no laboratório)
|
|
|
12-16 horas de luz seguidas de 8-12 horas de escuridão
|
12-16 horas de luz seguidas de 8-12 horas de escuridão
|
16 horas de luz seguidas de 8 horas de escuridão
|
|
7.
|
Volume mínimo das cubas
|
|
7 litros de água por cuba
|
7 litros de água por cuba
|
7 litros de água por cuba
|
|
8.
|
Substituição total do volume de solução em cada cuba
|
|
Mínimo 5 diárias
|
Mínimo 5 diárias
|
Mínimo 5 diárias
|
|
9.
|
Idade dos organismos utilizados no ensaio, no início da exposição
|
|
Ovos recentemente fertilizados (estádio de blástula inicial)
|
Ovos recentemente fertilizados (estádio de blástula inicial)
|
Ovos recentemente fertilizados
|
|
10.
|
Número de ovos por concentração de exposição
|
|
Mínimo 120
|
Mínimo 120
|
Mínimo 120
|
|
11.
|
Número de concentrações de exposição
|
|
Mínimo 3 (mais as cubas de controlo adequadas)
|
Mínimo 3 (mais as cubas de controlo adequadas)
|
Mínimo 3 (mais as cubas de controlo adequadas)
|
|
12.
|
Número de replicados por concentração de exposição
|
|
Mínimo 4 (exceto atribuição por raiz quadrada ao grupo de controlo)
|
Mínimo 4 (exceto atribuição por raiz quadrada ao grupo de controlo)
|
Mínimo 4 (exceto atribuição por raiz quadrada ao grupo de controlo)
|
|
|
Artémias vivas, artémias adultas congeladas, alimento em flocos para peixes etc. Recomenda-se que os peixes sejam alimentados duas vezes por dia.
|
Alimento especial para alevins, artémias vivas, artémias adultas congeladas, alimento em flocos para peixes etc. Recomenda-se que os peixes sejam alimentados duas vezes por dia.
|
Artémias vivas, artémias adultas congeladas, alimento em flocos para peixes etc. Recomenda-se que os peixes sejam alimentados duas vezes por dia.
|
|
|
Nenhum, salvo se a concentração de oxigénio dissolvido descer abaixo de 60 % do valor de saturação
|
Nenhum, salvo se a concentração de oxigénio dissolvido descer abaixo de 60 % do valor de saturação
|
Nenhum, salvo se a concentração de oxigénio dissolvido descer abaixo de 70 % do valor de saturação
|
|
|
Água de superfície, de poço ou reconstituída, limpa
|
Água de superfície, de poço ou reconstituída, limpa
|
Água de superfície, de poço ou reconstituída, limpa
|
|
16.
|
Duração da exposição ao produto químico em estudo
|
|
60 dias após a eclosão
|
60 dias após a eclosão
|
60 dias após a eclosão
|
|
17.
|
Parâmetros biológicos
|
|
Êxito da eclosão, sobrevivência, morfologia macroscópica, vitelogenina, histologia das gónadas, sexo genético, rácio sexual
|
Êxito da eclosão, sobrevivência, morfologia macroscópica, vitelogenina, histologia das gónadas, rácio sexual
|
Êxito da eclosão, sobrevivência, morfologia macroscópica, vitelogenina, histologia das gónadas, rácio sexual
|
|
18.
|
Critérios de aceitabilidade do ensaio aplicados aos replicados de controlo reunidos
|
|
Êxito da eclosão > 80 %
|
Êxito da eclosão > 80 %
|
Êxito da eclosão > 80 %
|
|
Sobrevivência após a eclosão ≥ 70 %
|
Sobrevivência após a eclosão ≥ 70 %
|
Sobrevivência após a eclosão ≥ 70 %
|
|
Crescimento (peso húmido de peixe enxuto) > 150 mg
|
Crescimento (peso húmido de peixe enxuto) > 75 mg
|
Crescimento (peso húmido de peixe enxuto) > 120 mg
|
|
Comprimento (padrão) > 20 mm
|
Comprimento (padrão) > 14 mm
|
Comprimento (padrão) > 20 mm
|
|
Rácio sexual (percentagem de machos ou de fêmeas):
30-70 %
|
Rácio sexual (percentagem de machos ou de fêmeas): 30-70 %
|
Rácio sexual (percentagem de machos ou de fêmeas): 30-70 %
|
Apêndice 3
Características químicas de uma água de diluição aceitável
|
COMPONENTE
|
CONCENTRAÇÃO
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 mg/l
|
|
Amoníaco não-ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados, totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
Apêndice 4
Orientações relativas às concentrações a utilizar nos ensaios (extraídas do método C.14)
|
Coluna (número de concentrações entre 100 e 10 ou entre 10 e 1) (27)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Apêndice 5
Orientações relativas à homogeneização da cabeça e da cauda de peixes-zebra, vairões-de-cabeça-gorda, esgana-gatas e peixes-do-arroz-japoneses juvenis
Este apêndice visa descrever os procedimentos que precedem a determinação quantitativa da concentração de vitelogenina. Podem ser aplicados outros protocolos, desde que o resultado da determinação quantitativa da vitelogenina seja comparável. Em alternativa à determinação no homogeneizado da cabeça e da cauda, pode determinar-se a concentração de vitelogenina no plasma sanguíneo ou no fígado.
Procedimento de ensaio
|
1.
|
Anestesia-se e eutanasia-se cada peixe conforme consta da descrição do ensaio.
|
|
2.
|
Cortam-se a cabeça e a cauda de cada peixe conforme consta da descrição do ensaio. Importante: Para evitar que machos não-induzidos sejam contaminados por vitelogenina proveniente de fêmeas ou de machos induzidos, é necessário lavar e limpar corretamente (por exemplo com etanol a 96 %) os instrumentos de dissecação e a placa de corte antes de passar ao peixe seguinte.
|
|
3.
|
Pesa-se com aproximação de 1 mg o conjunto da cabeça e da cauda de cada peixe.
|
|
4.
|
Após pesagem, colocam-se ambas as partes em tubos adequados (por exemplo tubos de Eppendorf de 1,5 ml) e congela-se a – 80 °C até à homogeneização ou procede-se a homogeneização imediata sobre gelo com dois pilões de plástico. (Podem ser utilizados outros métodos, se forem realizados sobre gelo e deles resultar uma massa homogénea). Importante:
É necessário numerar corretamente os tubos, a fim de que a cabeça e a cauda de cada peixe possam ser relacionadas com o resto do corpo correspondente, utilizado na histologia das gónadas.
|
|
5.
|
Uma vez homogeneizada a massa, adiciona-se uma quantidade de tampão de homogenização
(28) gelado correspondente a quatro a dez vezes o peso dos tecidos. A mistura deve continuar a ser homogeneizada com os pilões até o estar completamente. Nota importante:
É necessário utilizar pilões novos para cada peixe.
|
|
6.
|
Colocam-se as amostras em gelo até à centrifugação a 4 °C, durante 30 minutos, a 50 000 g.
|
|
7.
|
Por meio de uma pipeta, transferem-se volumes de 20 a 50 μl (anotar o volume) do sobrenadante para, pelo menos, dois tubos, mergulhando para o efeito a ponta da pipeta através da camada superficial lipídica e aspirando cuidadosamente sobrenadante sem resíduos da fração lipídica nem da camada depositada.
|
|
8.
|
Armazenam-se os tubos a – 80 °C até serem utilizados.
|
Nota: O tampão de homogeneização tem de ser utilizado no próprio dia de preparação e de ser mantido em gelo durante esse período.
Apêndice 6
Orientações relativas à determinação quantitativa da vitelogenina em homogeneizados da cabeça e da cauda de peixes-zebra (Danio rerio) (modificado a partir de Holbech et al., 2001) — admite-se o recurso a outros protocolos que utilizem padrões e anticorpos homólogos
|
1.
|
Descongelam-se placas de microtitulação (Maxisorp F96 certificadas da Nunc, Roskilde, Dinamarca) previamente revestidas com IgG antilipovitelina de peixe-zebra a 5 μg/ml e lavam-se três vezes com tampão de lavagem (*).
|
|
2.
|
Dilui-se padrão de vitelogenina de peixe-zebra purificada (29) a 0,2, 0,5, 1, 2, 5, 10 e 20 ng/ml com tampão de diluição (**) e diluem-se as amostras pelo menos 200 vezes (para evitar o efeito da matriz) em tampão de diluição, após o que se aplicam padrões e amostras às placas. Constitui-se nas placas um controlo do ensaio em duplicado. Introduz-se um volume de 150 μl em cada alvéolo. Dos padrões constituem-se duplicados; das amostras, triplicados. Incuba-se de um dia para o outro a 4 °C num agitador.
|
|
3.
|
Lavam-se as placas 5 vezes com tampão de lavagem (*).
|
|
4.
|
Diluem-se em tampão de lavagem HRP (peroxidase de raiz-forte) acoplado a uma cadeia de dextrano (por exemplo da AMDEX A/S, Dinamarca) e anticorpos conjugados. A diluição a utilizar depende do lote e da idade. Introduzem-se 150 μl em cada alvéolo e incubam-se as placas num agitador, durante uma hora, à temperatura ambiente.
|
|
5.
|
Lavam-se as placas 5 vezes com tampão de lavagem (*) e limpa-se cuidadosamente o fundo das placas com etanol.
|
|
6.
|
Introduz-se um volume de 150 μl de TMB plus (***) em cada alvéolo. Protegem-se as placas da luz com folha de alumínio e acompanha-se a evolução da cor num agitador.
|
|
7.
|
Uma vez obtida a curva de calibração, para-se a atividade enzimática adicionando a cada alvéolo 150 μl de H2SO4 0,2 M.
|
|
8.
|
Mede-se a absorvância a 450 nm (por exemplo num leitor de placas Thermomax da Molecular Devices). Analisam-se os dados com o software associado (Softmax, por exemplo).
|
|
(*)
|
Tampão de lavagem:
|
Tampão fosfato (PBS) de reserva (****)
|
500,0
|
ml
|
|
Albumina sérica bovina (BSA)
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Ajusta-se o pH a 7,3 e completa-se o volume até 5 litros com água Millipore. Guarda-se a 4 °C.
|
|
|
(**)
|
Tampão de diluição:
|
Tampão fosfato (PBS) de reserva****
|
100,0
|
ml
|
|
Albumina sérica bovina (BSA)
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Ajusta-se o pH a 7,3 e completa-se o volume até um litro com água Millipore. Guarda-se a 4 °C.
|
|
|
(***)
|
TMB plus é um substrato pronto a utilizar produzido pela KemEnTec (Dinamarca). É fotossensível. Guarda-se a 4 °C.
|
|
(****)
|
Tampão fosfato (PBS) de reserva
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4×2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Ajusta-se o pH a 6,8 e completa-se o volume até 2 litros com água Millipore. Guarda-se à temperatura ambiente.
|
|
Apêndice 7
Orientações relativas à preparação de cortes de tecido para determinação do sexo e classificação do estádio de desenvolvimento das gónadas
Este apêndice visa descrever os procedimentos que precedem a avaliação dos cortes histológicos. Podem ser aplicados outros protocolos, desde que o sexo determinado e a classificação do estádio de desenvolvimento das gónadas sejam idênticos.
Salvo algumas exceções, estes protocolos são iguais para o peixe-do-arroz-japonês e o peixe-zebra.
Eutanásia, necropsia e fixação dos tecidos
Objetivos:
|
1.
|
Eutanásia sem sofrimento dos peixes.
|
|
2.
|
Obtenção dos pesos corporais e medições necessários.
|
|
3.
|
Avaliação dos caracteres sexuais secundários.
|
|
4.
|
Dissecação de tecidos para análise da vitelogenina.
|
Procedimentos:
|
1.
|
Eutanasiam-se os peixes imediatamente antes da necropsia. Por conseguinte, a menos que estejam disponíveis muitos prossetores, não se eutanasiam muitos peixes simultaneamente.
|
|
2.
|
Recorrendo a um pequeno coador de rede, retira-se um peixe da cuba de ensaio e transfere-se num recipiente de transporte para a bancada onde vai realizar-se a necropsia.
|
|
3.
|
Introduz-se o peixe na solução eutanasiante. Retira-se o peixe desta solução quando deixar de respirar e de reagir a estímulos externos.
|
|
4.
|
Determina-se o peso húmido do peixe.
|
|
5.
|
Para a preparação dos tecidos para análise da vitelogenina, pode colocar-se o peixe numa placa de cortiça na plataforma destinada a esse fim de um microscópio de dissecação.
|
a)
|
No caso do peixe-zebra, corta-se a cabeça imediatamente atrás da barbatana peitoral e a cauda imediatamente atrás da barbatana dorsal.
|
|
b)
|
No caso do peixe-do-arroz-japonês, abre-se o abdómen por meio de uma incisão efetuada cuidadosamente ao longo da linha média ventral, entre a cintura escapular e um ponto imediatamente anterior ao ânus. Remove-se cuidadosamente o fígado com uma pequena pinça e uma pequena tesoura.
|
|
|
6.
|
Colocam-se os espécimes para análise da vitelogenina em tubos de Eppendorf e congela-se imediatamente em azoto líquido.
|
|
7.
|
Coloca-se a carcaça, incluindo as gónadas, numa caixinha de plástico para tecidos previamente rotulada, após o que se mergulha em fixador de Davidson ou de Bouin. O volume de fixador deve ser, pelo menos, dez vezes maior do que o volume aproximado dos tecidos. Agita-se suavemente o recipiente do fixador durante cinco segundos, para soltar as bolhas de ar da caixinha de tecidos.
|
|
8.
|
|
a)
|
Deixam-se os tecidos no fixador de Davidson de um dia para o outro, após o que se transferem para recipientes individuais contendo formol a 10 % tamponado a pH neutro. Agitam-se suavemente os recipientes com as caixinhas durante cinco segundos, para que o formol nelas penetre adequadamente.
|
|
b)
|
No caso do fixador de Bouin, deixam-se os tecidos mergulhados no fixador durante 24 horas, após o que se transferem as caixinhas para etanol a 70 %.
|
|
Tratamento dos tecidos
Objetivos:
|
1.
|
Desidratação dos tecidos para boa penetração da parafina.
|
|
2.
|
Impregnação dos tecidos com parafina, para manter a integridade dos tecidos e criar uma superfície firme para a microtomia.
|
Procedimentos:
|
3.
|
Retiram-se as caixinhas de tecidos rotuladas do formol ou do etanol e colocam-se no(s) cesto(s) de tratamento. Introduz(em)-se o(s) cesto(s) no aparelho de tratamento dos tecidos.
|
|
4.
|
Escolhe-se o programa de tratamento.
|
|
5.
|
Quando o aparelho de tratamento dos tecidos terminar o ciclo de tratamento, o(s) cesto(s) pode(m) ser transferido(s) para a bancada de embebimento.
|
Embebimento
Objetivo:
Orientação adequada dos espécimes em parafina sólida para realização da microtomia.
Procedimentos:
|
1.
|
Retira(m)-se o(s) cesto(s) das caixinhas de tecidos do aparelho de tratamento e mergulha(m)-se no compartimento frontal, cheio de parafina, da consola térmica da unidade de embebimento, ou introduzem-se as caixinhas num aquecedor de parafina autónomo.
|
|
2.
|
Retira-se a primeira caixinha a embeber do compartimento frontal da consola térmica ou do aquecedor de parafina. Retira-se e descarta-se a tampa da caixinha e confronta-se o rótulo da caixinha com os registos dos peixes, a fim de resolver eventuais discrepâncias antes do embebimento.
|
|
3.
|
Seleciona-se um molde de embebimento de dimensões adequadas.
|
|
4.
|
Coloca-se o molde junto do bico da consola de distribuição e enche-se o molde com parafina fundida.
|
|
5.
|
Retira-se o espécime da caixinha e introduz-se o espécime na parafina fundida do molde. Repete-se este procedimento com 4 a 8 espécimes em cada molde cheio de parafina. Marca-se a posição dos peixes, colocando o peixe n.o 1 a 180.o relativamente aos peixes 2 a 4/8.
|
|
6.
|
Acrescenta-se parafina, para cobrir os espécimes.
|
|
7.
|
Coloca-se o molde, com a base da caixinha, na placa fria da consola criogénica.
|
|
8.
|
Uma vez solidificada a parafina, retira-se o bloco (isto é, a parafina endurecida contendo os tecidos e a base da caixinha) do molde.
|
Microtomia
Objetivo:
Obtenção e montagem de cortes histológicos para serem corados.
Procedimentos:
|
1.
|
Realiza-se do seguinte modo a primeira fase da microtomia (faceado):
|
a)
|
Coloca-se o bloco de parafina no porta-blocos do micrótomo.
|
|
b)
|
Faz-se avançar o porta-blocos girando a roda do micrótomo e efetuam-se cortes espessos na superfície da parafina do bloco, até a lâmina atingir aos tecidos embebidos.
|
|
c)
|
Regula-se a espessura de corte do micrótomo entre 3 e 5 micra. Faz-se avançar o porta-blocos e efetuam-se vários cortes no bloco, para eliminar os artefactos eventualmente criados na superfície de corte dos tecidos durante o desbaste grosseiro.
|
|
d)
|
Retira-se o bloco do porta-blocos e coloca-se o bloco em gelo, virado para baixo, para pôr os tecidos em contacto com gelo.
|
|
|
2.
|
A fase seguinte da microtomia compreende o corte final e a montagem dos cortes de tecido nas lâminas. Procede-se do seguinte modo:
|
a)
|
Se o bloco tiver sido colocado em gelo, retira-se o bloco do gelo e recoloca-se no porta-blocos do micrótomo.
|
|
b)
|
Regula-se a espessura de corte do micrótomo entre 3 e 5 micra e faz-se avançar o porta-blocos girando a roda do micrótomo. Vai-se cortando o bloco até obter uma fita que contenha, pelo menos, um corte aceitável que inclua as gónadas. (Se necessário, durante o corte do bloco, pode retirar-se este do porta-blocos e colocar-se o bloco em gelo, para pôr novamente os tecidos em contacto com gelo, recolocando-se depois o bloco no porta-blocos.)
|
|
c)
|
Colocam-se os cortes a flutuar à superfície de um banho de água, para os aplanar. Deve procurar obter-se pelo menos um corte sem rugas e sem bolhas de ar aprisionadas por debaixo dele.
|
|
d)
|
Imerge-se uma lâmina de microscópio por debaixo do melhor corte e retira-se este da água com a ajuda da lâmina. Este processo designa-se por montagem do corte na lâmina.
|
|
e)
|
Preparam-se três cortes por conjunto de peixes. Após o primeiro corte, efetuam-se o segundo e o terceiro com intervalos de 50 micra. Se os peixes (com as gónadas) não estiverem embebidos no mesmo nível de corte, é necessário efetuar mais cortes, para obter, pelo menos, seis cortes, com gónadas, de cada peixe.
|
|
f)
|
Utilizando uma caneta marcadora, escreve-se em cada lâmina o bloco de que provém.
|
|
g)
|
Coloca-se a lâmina num suporte de coloração.
|
|
h)
|
Retira-se o bloco do porta-blocos e guarda-se voltado para baixo.
|
|
Coloração, cobertura com lamelas e identificação das lâminas
Objetivos:
|
—
|
Coloração dos cortes para o exame histopatológico.
|
|
—
|
Confinamento permanente dos tecidos montados e corados.
|
|
—
|
Identificação duradoura dos cortes corados, de modo a garantir perfeita rastreabilidade.
|
Procedimentos:
|
1.
|
Coloração
|
a)
|
Antes da coloração, secam-se as lâminas ao ar de um dia para o outro.
|
|
b)
|
Coram-se os cortes com hematoxilina-eosina.
|
|
|
2.
|
Cobertura com lamelas
|
a)
|
As lamelas de cobertura podem ser aplicadas manualmente ou automaticamente.
|
|
b)
|
Mergulha-se a lâmina em xileno ou em Tissue-Clear® e sacode-se cuidadosamente o excesso de xileno ou Tissue-Clear® da lâmina.
|
|
c)
|
Aplica-se cerca de 0,1 ml de meio de montagem junto da extremidade da lâmina oposta à extremidade esmerilada, ou sobre a lamela de cobertura.
|
|
d)
|
Inclinando ligeiramente a lamela relativamente à horizontal, aplica-se a lamela à lâmina.
|
|
|
3.
|
Identificação
|
a)
|
Elementos identificativos a figurar em cada lâmina:
|
iii.
|
Número do espécime / Número da lâmina;
|
|
iv.
|
Produto químico / Grupo de exposição;
|
|
|
Apêndice 8
Fluxograma estatístico para a análise da vitelogenina

Fluxograma estatístico para a determinação do rácio sexual
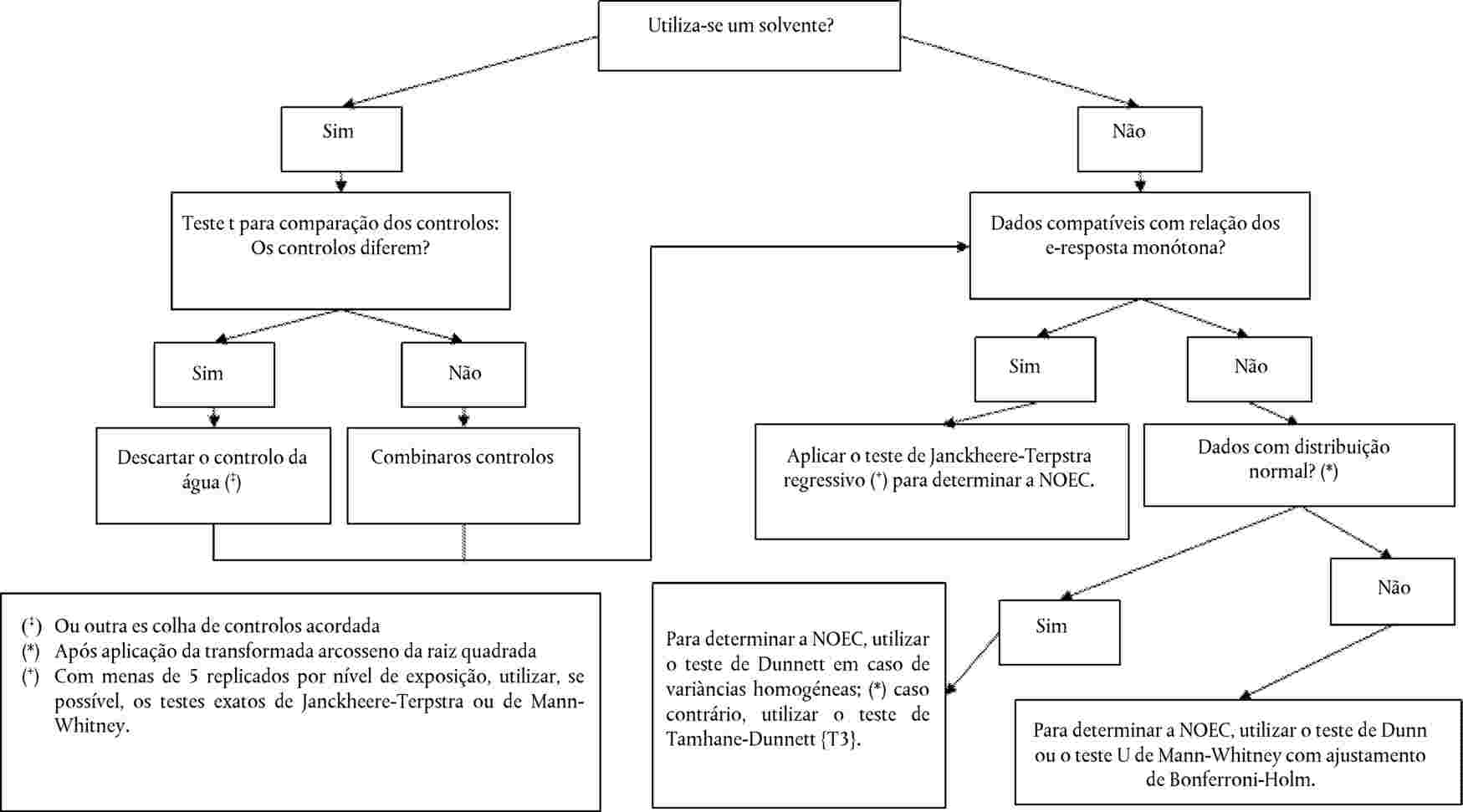
Apêndice 9
Orientações relativas à colheita de amostras de tecidos para determinação do sexo genético e à determinação do sexo genético pelo método PCR
Colheita de amostras, preparação e conservação de tecidos antes da determinação do sexo genético pelo método PCR no peixe-do-arroz (elaborado pelo laboratório dos organismos aquáticos da Bayer CropScience AG)
|
1.
|
Utilizando uma tesoura fina, corta-se a barbatana anal ou a barbatana dorsal de cada peixe e coloca-se a barbatana num tubo com 100 μl de tampão de extração 1 (ver adiante a preparação deste tampão). Após cada peixe, lava-se a tesoura num copo de água destilada e seca-se com papel absorvente.
|
|
2.
|
Homogeneízam-se os tecidos da barbatana com um pilão de teflon para microtubos, de modo a obter a lise das células. A fim de evitar contaminações, utiliza-se um pilão novo para cada tubo. Deixam-se os pilões numa solução 0,5 M de NaOH de um dia para o outro; lavam-se durante 5 minutos com água destilada e guardam-se em etanol até à utilização, ou esterilizam-se em autoclave antes de serem utilizados.
|
|
3.
|
Os tecidos de barbatana também podem ser conservados em neve carbónica, sem o tampão de extração 1, e, em seguida, ser refrigerados a – 80 °C, para impedir a degeneração do ADN. Porém, a extração do ADN resulta melhor se for imediata (ver acima o modo de proceder). Antes de introduzir o tampão nos tubos, descongelam-se sobre gelo as amostras conservadas a – 80 °C.
|
|
4.
|
Depois da homogeneização, colocam-se os tubos num banho de água e mantêm-se a 100 °C durante 15 minutos.
|
|
5.
|
Em seguida, pipetam-se para cada tubo 100 μl do tampão de extração 2 (ver adiante a preparação deste tampão). Conservam-se as amostras à temperatura ambiente durante 15 minutos, agitando-as suavemente, de vez em quando, à mão.
|
|
6.
|
Colocam-se de novo os tubos no banho de água e mantêm-se a 100 °C durante mais 15 minutos.
|
|
7.
|
Em seguida, conservam-se os tubos a – 20 °C até ao prosseguimento das análises.
|
Preparação dos tampões
Tampão 1 para PCR:
|
|
500 mg de N-Lauroilsarcosina (por exemplo Merck KGaA, Darmstadt, Alemanha);
|
|
|
2 ml de solução 5 M de NaCl;
|
|
|
100 ml de água destilada;
|
Tampão 2 para PCR:
|
|
20 g de Chelex (por exemplo da Biorad, Munique, Alemanha);
|
|
|
Hidratar em 100 ml de água destilada;
|
Determinação do sexo genético pelo método PCR no peixe-do-arroz (elaborado pelo laboratório dos organismos aquáticos da Bayer CropScience AG e pelo Biozentrum da Universidade de Würzburg )
Descongelam-se sobre gelo os tubos preparados e congelados como se descreveu. Em seguida, centrifugam-se numa centrifugadora de Eppendorf (30 s à velocidade máxima, à temperatura ambiente). Utiliza-se no método PCR o sobrenadante límpido separado do precipitado. É indispensável evitar qualquer participação do Chelex (por transferência do precipitado, onde está presente) na reação PCR, dado que isso interferiria na atividade da Taq-polimerase. Pode utilizar-se imediatamente o sobrenadante ou pode-se guardá-lo congelado (a – 20 °C) e descongelá-lo e recongelá-lo várias vezes, sem impacto negativo no ADN nas análises ulteriores.
1. Preparação da designada “mistura reacional” (25 μl por amostra):
|
|
Volume
|
Concentração final
|
|
ADN modelo
|
0,5 μl-2 μl
|
|
|
Tampão 10x para PCR, com MgCl2
|
2,5 μl
|
1x
|
|
Nucleótidos (dATP, dCTP, dGTP e dTTP)
|
4μl (5 mM)
|
200 μM
|
|
Iniciador direto (10 μM) (ver os pontos 3 a 5 infra)
|
0,5 μl
|
200 nM
|
|
Iniciador inverso (10 μM) (ver os pontos 3 a 5 infra)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Água para PCR
|
completar o volume até 25 μl
|
|
|
Taq-E polimerase
|
0,3 μl
|
1,5 U
|
|
Tampão 10x para PCR, com MgCl2: 670 mM de Tris/HCl (pH 8,8 a 25 °C), 160 mM de (NH4)2SO4, 25 mM de MgCl2, 0,1 % de Tween 20.
|
São necessários para cada PCR (ver os pontos 3 a 5 infra) o iniciador especial, constituído por uma nova combinação de “mistura reacional”, e a quantidade de ADN modelo adequada a cada amostra (ver acima). Pipetam-se os volumes correspondentes para tubos novos. Em seguida, tapam-se os tubos, agitam-se (cerca de 10 s) e centrifugam-se (10 s à temperatura ambiente), após o que pode dar-se início aos programas PCR. Utilizam-se ainda em cada programa PCR um controlo positivo (uma amostra de ADN de atividade conhecida e com resultados claros) e um controlo negativo (1 μl de água destilada).
2. Preparação do gel de agarose a 1 % — durante a execução dos programas PCR:
|
—
|
Dissolvem-se 3 g de agarose em 300 ml de tampão TAE 1 × (gel de agarose a 1 %).
|
|
—
|
Leva-se esta solução à ebulição num forno de micro-ondas (2 a 3 minutos).
|
|
—
|
Transfere-se a solução quente para um molde especial colocado sobre gelo.
|
|
—
|
Após cerca de 20 minutos, o gel de agarose está pronto a utilizar.
|
|
—
|
Guarda-se o gel de agarose em tampão TAE 1 × até ao final dos programas PCR.
|
3. Programa PCR para a actina:
Esta reação PCR visa demonstrar que o ADN da amostra não está danificado.
|
—
|
Iniciador especial:
|
—
|
“Mact1(superior/direto)” → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
“Mact2(inferior/inverso)” → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Programa:
|
—
|
Ciclo (35 vezes):
|
Desnaturação
|
→ 45 s a 95 °C
|
|
Hibridização
|
→ 45 s a 56 °C
|
|
Extensão
|
→ 1 minuto a 68 °C
|
|
|
4. Programa PCR para os genes X e Y:
Neste programa PCR, utilizam-se as amostras com ADN intacto para detetar os genes X e Y. Após coloração e eletroforese em gel, o ADN masculino evidencia uma banda dupla e o ADN feminino uma banda singela. Inclui-se neste programa um controlo positivo masculino (amostra XY) e um controlo positivo feminino (amostra XX).
|
—
|
Iniciador especial:
|
—
|
“PG 17.5” (superior/direto) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
“PG 17.6” (inferior/indireto) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Programa:
|
—
|
Ciclo (40 vezes):
|
Desnaturação
|
→ 45 s a 95 °C
|
|
Hibridização
|
→ 45 s a 55 °C
|
|
Extensão
|
→ 1 minuto e 30 s a 68 °C
|
|
|
5. Programa PCR para o gene Y utilizado como controlo do programa PCR para os genes X e Y:
Este programa PCR serve para verificar os resultados do “programa PCR para os genes X e Y”. Após coloração e eletroforese em gel, as amostras “masculinas” evidenciam uma banda singela e as amostras “femininas” nenhuma.
|
—
|
Iniciador especial:
|
—
|
“DMTYa (superior/direto)” → GGC CGG GTC CCC GGG TG
|
|
—
|
“DMTYd (inferior/indireto)” → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Programa:
|
—
|
Ciclo (40 vezes):
|
Desnaturação
|
→ 45 s a 95 °C
|
|
Hibridização
|
→ 45 s a 56 °C
|
|
Extensão
|
→ 1 minuto a 68 °C
|
|
|
6. Coloração das amostras para o método PCR:
Solução de coloração:
|
|
0,25 % de azul de bromofenol
|
Pipeta-se 1 μl da solução corante para cada tubo.
7. Eletroforese em gel:
|
—
|
Transfere-se o gel de agarose a 1 % preparado para uma tina de eletroforese em gel cheia de tampão TAE 1 ×.
|
|
—
|
Pipetam-se 10 a 15 μl de cada amostra para PCR corada para a fenda correspondente do gel de agarose.
|
|
—
|
Pipetam-se 5 a 15 μl de escada de 1 kb (Invitrogen) para outra fenda no gel.
|
|
—
|
Inicia-se a eletroforese, aplicando 200 V.
|
|
—
|
Termina-se a eletroforese após 30 a 45 minutos.
|
8. Determinação das bandas:
|
—
|
Lava-se o gel de agarose com água destilada.
|
|
—
|
Mergulha-se o gel de agarose em brometo de etídio durante 15 a 30 minutos.
|
|
—
|
Em seguida, fotografa-se o gel de agarose numa caixa de luz ultravioleta.
|
|
—
|
Analisam-se as amostras comparando-as com a banda ou bandas de controlo positivo e com a escada de ADN.
|
Apêndice 10
Orientações relativas à colheita de amostras de tecidos no esgana-gata para determinação do sexo genético pelo método PCR
Colheita de amostras de tecidos e extração do ADN
Pode extrair-se o ADN utilizando diversos reagentes comercializados e um sistema de extração manual ou automático. Descreve-se a seguir o protocolo utilizado no laboratório de Weymouth do Cefas, complementado por métodos alternativos em alguns casos.
|
1.
|
Utilizando uma tesoura fina, corta-se em cada peixe um pequeno pedaço de tecido (10-20 mg) da zona dorsal lateral, após remoção da cabeça e da cauda para análise da vitelogenina,. Transfere-se o tecido para um tubo e coloca-se o tubo em azoto líquido (para armazenagem a – 80 °C) ou enche-se o tubo com etanol a 70 % (para transporte e subsequente conservação a 4 °C). Após cada peixe, limpa-se a tesoura, primeiro em etanol a 70 % e depois em água destilada, secando-se em seguida com papel absorvente.
|
|
2.
|
Por meio de aspiração, remove-se o etanol eventualmente presente e, em seguida, digere-se o tecido de um dia para o outro com proteinase K em 400 μl de tampão ATL (Qiagen). Transfere-se uma alíquota (200 μl) do produto da digestão para um bloco S de 96 alvéolos da Qiagen e extrai-se o ADN para 96 alvéolos utilizando o sistema BioRobot Universal da Qiagen e o kit QIamp “Investigator BioRobot”. Elui-se o ADN para 50 μl de água isenta de DNase e RNase. Caso se utilizem tecidos duros para extrair o ADN (como um espinho ou uma barbatana peitoral), pode ser necessário homogeneizar a amostra no tampão de lise recorrendo ao sistema FastPrep® de lise de tecidos ou a um sistema equivalente de rotura de tecidos.
Em alternativa:
|
a)
|
Digere-se o tecido de um dia para o outro com proteínase K em 400 μl de tampão de lise G2 da Qiagen e extrai-se o ADN de 200 μl do produto da digestão, utilizando o kit EZ-1 “DNA easy tissue” e o biorrobô EZ-1 ou o minikit“DNA easy tissue”. Elui-se o ADN para 50 μl.
|
|
b)
|
Tratam-se os tecidos com o reagente DNAzol. Em resumo, procede-se à lise das amostras de tecidos em 1 ml de DNAzol, durante 10 minutos, num microtubo de centrifugação de 1,5 ml, e centrifuga-se a 13 000 rpm durante 5 minutos, para remover as partículas eventualmente presentes. Em seguida, transfere-se o produto da lise para novo microtubo de centrifugação de 1,5 ml, contendo 500 μl de etanol a 100 % para biologia molecular, e centrifuga-se a 13 000 rpm, durante 10 minutos, para precipitar o ADN. Remove-se o etanol e substitui-se por 400 μl de etanol a 70 % para biologia molecular, centrifuga-se a 13 000 rpm, durante 5 minutos, e dissolve-se o depósito de ADN com 50 μl de água isenta de DNase e RNase para biologia molecular. Novamente, caso se utilizem tecidos duros (barbatana peitoral), pode ser necessário homogeneizar a amostra no tampão de lise recorrendo ao sistema FastPrep® de lise de tecidos, ou a um sistema equivalente de rotura de tecidos, para extrair o ADN.
|
|
|
3.
|
Guarda-se o ADN a – 20 °C até ser utilizado.
|
Nota importante: É necessário utilizar luvas durante estas manipulações.
Análise pelo método da reação em cadeia da polimerase (PCR)
Realizaram-se as amplificações utilizando 2,5 μl do extrato de ADN num volume reacional de 50 μl e recorrendo aos iniciadores do locus IDH [conforme descrito em Peichel et al. (2004). Current Biology, 1:1416-1424]:
|
Iniciador direto
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Iniciador inverso
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Há numerosos fornecedores de reagentes adequados para PCR. O método a seguir descrito é o atualmente utilizado no laboratório de Weymouth do Cefas.
1. Preparação da designada “mistura reacional” (50 μl por amostra)
Prepara-se uma mistura reacional como se indica a seguir. Pode preparar-se antecipadamente e guardar-se congelada a – 20 °C até ser utilizada. Deve preparar-se uma quantidade de mistura reacional de reserva suficiente para um controlo negativo (apenas água para biologia molecular).
|
|
Volume (solução de reserva concentrada)/amostra
|
Concentração final
|
|
Tampão reacional 5x GoTaq®
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nucleótidos (dATP, dCTP, dGTP e dTTP)
|
0,5 μl (25 mM cada um)
|
250 μM cada um
|
|
Iniciador direto
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Iniciador inverso
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Água para biologia molecular
|
30,75 μl
|
|
|
Polimerase GoTaq
|
0,25 μl
|
1,25 U
|
|
—
|
Transferem-se 47,5 μl para um tubo de parede fina de 0,5 ml para PCR, rotulado.
|
|
—
|
Adicionam-se 2,5 μl do ADN purificado para o tubo convenientemente identificado. Repete-se esta operação para todas as amostras e o controlo negativo.
|
|
—
|
Constitui-se uma sobrecamada em cada tubo adicionando 2 gotas de óleo mineral. Em alternativa, pode utilizar-se um termociclador com tampa aquecida.
|
|
—
|
Desnaturaram-se as amostras num termociclador Peltier PTC-225 a 94 ± 2 °C durante 5 minutos, seguindo-se 39 ciclos de 94 ± 2 °C durante 1 minuto, 55 ± 2 °C durante 1 minuto, 72 ± 2 °C durante 1 minuto e um prolongamento final de 72 ± 2 °C durante 10 minutos.
|
2. Preparação do gel de agarose (2 %)
Normalmente, procede-se à resolução dos produtos da PCR num gel de agarose a 20 % contendo brometo de etídio.
Também podem ser utilizados sistemas de eletroforese capilar.
|
—
|
Pesam-se 2 g de agarose e adicionam-se a 100 ml de tampão TAE 1 ×.
|
|
—
|
Aquece-se num forno de micro-ondas (2 a 3 minutos) para dissolver a agarose.
|
|
—
|
Adicionam-se duas gotas de brometo de etídio, para obter a concentração final de 0,5 μg/ml.
|
|
—
|
Transfere-se a solução quente para o molde do gel.
|
|
—
|
Aguarda-se que o gel endureça.
|
3. Eletroforese em gel
|
—
|
Transfere-se o gel de agarose para o equipamento de eletroforese e mergulha-se no tampão TAE 1 ×.
|
|
—
|
Transferem-se 20 μl de todas as amostras para alvéolos separados e um marcador de peso molecular (escada de ADN 100 bp da Promega) para um alvéolo livre.
|
|
—
|
Realiza-se a eletroforese a 120 V durante 30 a 45 minutos.
|
4. Visualização dos produtos da amplificação
Caso tenha sido incorporado brometo de etídio no gel de agarose como se referiu, visualizam-se os produtos de ADN sob luz ultravioleta. Em alternativa, procede-se à coloração do gel antes da visualização, cobrindo-o durante 30 minutos com uma solução aquosa diluída de brometo de etídio (0,5 μg/ml).
Apêndice 11
Orientações relativas à fertilização artificial no Esgana-Gata
Este apêndice descreve o método de obtenção de ovos fertilizados de esgana-gata para serem utilizados no Ensaio de Desenvolvimento Sexual em Peixes.
Procedimento
Obtenção de esperma
|
1.
|
Eutanasia-se um macho com boas cores da população pretendida.
|
|
2.
|
Dissecam-se os testículos de cada um dos lados do peixe. Os testículos são, geralmente, estruturas muito pigmentadas em forma de bastonete, facilmente identificáveis na linha média lateral do corpo. Escolhe-se um dos seguintes métodos:
|
|
3.
|
Com uma tesoura fina, efetua-se de uma só vez uma incisão de 1 a 1,5 cm a cerca de 45 °C, com início na cloaca.
|
|
4.
|
Utiliza-se um bisturi para efetuar uma pequena incisão lateral no peixe, ligeiramente posterior à pélvis e em posição ligeiramente ventral em relação às placas laterais.
|
|
5.
|
Retiram-se os testículos com uma pinça fina e colocam-se numa placa de Petri.
|
|
6.
|
Cobre-se cada testículo com 100 μl de solução final de Hank
(30) preparada de fresco.
|
|
7.
|
Utilizando uma lâmina de barbear ou um bisturi, cortam-se os testículos em pequenos cubos. Esta operação provoca a libertação de esperma e confere à solução de Hank um aspeto leitoso.
|
|
8.
|
Pipeta-se o fluido que contém o esperma para um tubo, procurando não transferir fragmentos dos testículos nesta operação.
|
|
9.
|
Transferem-se para o tubo 800 μl de solução final de Hank e mistura-se bem.
|
|
10.
|
Se necessário, pode conservar-se o peixe fixando-o com etanol a 100 % ou com outro fixador. Este aspeto é especialmente importante se o estudo visa associar o progenitor às progenituras.
|
Nota importante:
Embora a maior parte das soluções de reserva possam ser preparadas antecipadamente, a
solução 5
e a
solução final
devem ser preparadas no próprio dia da utilização.
|
Solução de reserva 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Água destilada
|
100 ml
|
|
Solução de reserva 2
|
|
Na2HPO4 (anidro)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Água destilada
|
100 ml
|
|
Solução de reserva 3
|
|
CaCl2
|
0,72 g
|
|
Água destilada
|
50 ml
|
|
Solução de reserva 4
|
|
MgSO4 × 7H2O
|
1,23 g
|
|
Água destilada
|
50 ml
|
|
Solução de reserva 5 (preparada de fresco)
|
|
NaHCO3
|
0,35 g
|
|
Água destilada
|
10 ml
|
Nota: Caso o laboratório já disponha dos sais indicados, mas com teor de água diferente (por exemplo, com duas moléculas de água de hidratação em vez de sais anidros), esses sais não deixam de poder ser utilizados; porém, é necessário ajustar primeiro o peso com base no peso molecular.
Prepara-se a solução final de Hank do seguinte modo:
|
Solução de reserva 1
|
1,0 ml
|
|
Solução de reserva 2
|
0,1 ml
|
|
Solução de reserva 3
|
0,1 ml
|
|
Água destilada
|
8,6 ml
|
|
Solução de reserva 4
|
0,1 ml
|
|
Solução de reserva 5
|
0,1 ml
|
Misturar bem antes de utilizar.
Fertilização
|
1.
|
Identificam-se fêmeas grávidas grandes na população pretendida. As fêmeas só estão prontas para serem espremidas quando forem visíveis ovos protuberantes na cloaca. As fêmeas nessa situação apresentam a postura característica de cabeça para cima.
|
|
2.
|
Passa-se suavemente com um dedo ao longo do peixe, lateralmente no sentido da cauda, para facilitar a expulsão de um saco de ovos para uma placa de Petri fresca. Repete-se do outro lado e repõe-se o peixe do aquário.
|
|
3.
|
Para espalhar os ovos, pode utilizar-se um pincel fino de modo a formar uma monocamada. É importante propiciar a exposição ao esperma do máximo número de ovos possível, pelo que é vantajoso maximizar a superfície dos ovos. Nota importante: Os ovos devem ser mantidos húmidos por contacto com um tecido humedecido (não devem entrar em contacto direto com água, pois isso poderia provocar o endurecimento prematuro do córion, inviabilizando a fertilização). É grande a diversidade do número de ovos que cada fêmea pode produzir, mas, em média, podem ser facilmente obtidos cerca de 150 de uma fêmea grávida.
|
|
4.
|
Utilizando o pincel, espalham-se uniformemente 25 μl de esperma em mistura de Hank sobre toda a superfície dos ovos. Uma vez iniciada a fertilização, os ovos endurecem e mudam de cor rapidamente (um minuto). Se o número estimado de ovos exceder 150, repete-se esta operação. Se os ovos não tiverem endurecido ao fim de um minuto, adiciona-se um pouco mais de esperma. Nota importante: A adição de mais esperma não faz necessariamente aumentar a taxa de fertilização.
|
|
5.
|
Deixam-se os ovos e a solução de esperma interagir durante, pelo menos, 15 minutos; colocam-se os ovos fertilizados no aquário de exposição antes de transcorridas 1,5 horas após a fertilização.
|
|
6.
|
Repete-se a operação com outra fêmea até se colher o número pretendido de ovos.
|
|
7.
|
Reservam-se alguns dos últimos ovos, que se fixam com solução a 10 % de ácido acético.
|
Contagem dos ovos e distribuição dos ovos pelos aquários de exposição
|
1.
|
Para evitar distorções de cariz genético, distribuem-se os ovos uniformemente pelos níveis de exposição. Utilizando um instrumento sem pontas nem gumes (por exemplo uma pinça de entomologia de lâminas largas ou uma ansa de inoculação), divide-se cada lote de ovos fertilizados em grupos com o mesmo número de ovos (tantos grupos quantos os níveis de exposição). Caso se pretenda ter 4 replicados por nível de exposição, cada um dos quais com 20 ovos, será necessário introduzir 80 ovos em cada aquário de exposição. Nota importante: Até se ter a certeza de obter taxas de fertilização de 100 %, é aconselhável adicionar um suplemento de 20 % (ou seja, 96 ovos por nível de exposição).
|
|
2.
|
Os ovos de esgana-gata são muito propensos a infeções fúngicas fora do ninho protegido pelo macho. Por esse motivo, é fundamental tratar os ovos com azul de metileno nos primeiros dias do ensaio. Prepara-se uma solução de reserva de 1 miligrama de azul de metileno por mililitro e adiciona-se a cada aquário de exposição o volume necessário para obter uma concentração máxima final de 2,125 mg/l. Nota importante: Depois da eclosão, os esgana-gatas não devem ser expostos ao azul de metileno, pelo que, a partir do sexto dia, o sistema não deve conter azul de metileno.
|
|
3.
|
Examinam-se os ovos diariamente, registando-se como tal os ovos mortos ou não fertilizados. Nota importante: Em nenhum momento, até à eclosão, os ovos podem estar emersos, mesmo por períodos muito curtos.
|
C.42 BIODEGRADABILIDADE NA ÁGUA DO MAR
INTRODUÇÃO GERAL
|
1.
|
Este método é equivalente ao Test Guideline TG 306 (1992) da OCDE. Quando foram elaborados os primeiros métodos de ensaio, desconhecia-se em que medida os resultados dos ensaios de despistagem da biodegradabilidade fácil em água doce, utilizando inóculos de efluentes de depuração ou de lamas ativadas, podiam ser aplicados ao ambiente marinho. Têm sido publicados resultados variáveis sobre esta questão (por exemplo (1)).
|
|
2.
|
Muitas águas residuais industriais, com uma diversidade de produtos químicos, atingem o mar por descarga direta ou através de estuários ou de rios, nos quais os tempos de residência são baixos comparativamente ao período necessário para a biodegradação completa de muitos dos produtos químicos nelas presentes. Devido à sensibilização crescente para a necessidade de proteger o ambiente marinho de cargas cada vez maiores de produtos químicos e porque é necessário estimar a concentração provável dos produtos químicos no mar, elaboraram-se métodos de ensaio da biodegradabilidade na água do mar.
|
|
3.
|
Os métodos aqui descritos utilizam água do mar natural como fase aquosa e como fonte de microrganismos. Tendo em vista a aproximação aos métodos de determinação da biodegradabilidade fácil na água doce, investigou-se a utilização de água do mar ultrafiltrada e centrifugada, bem como de sedimentos marinhos como inóculos. Estes estudos revelaram-se infrutíferos. Por conseguinte, o meio de ensaio é água do mar natural, previamente tratada para remoção das partículas grosseiras.
|
|
4.
|
Para determinar a biodegradabilidade total pelo método do balão agitado, são necessárias concentrações relativamente elevadas da substância em estudo, devido à baixa sensibilidade do método analítico de determinação do carbono orgânico dissolvido (COD). Esta circunstância requer, por sua vez, a adição à água do mar de nutrientes minerais (N e P); caso contrário, as baixas concentrações destes nutrientes limitariam a remoção do carbono orgânico dissolvido. É igualmente necessário adicionar os nutrientes no método do frasco fechado, devido à concentração da substância em estudo adicionada.
|
|
5.
|
Nenhum dos dois métodos é, portanto, um ensaio de biodegradabilidade fácil, pois não se adiciona nenhum inóculo aos microrganismos presentes na água do mar. Nenhum dos ensaios simula também o ambiente marinho, pois adicionam-se nutrientes e a concentração da substância em estudo é muito superior à que estaria presente na água do mar. Por estas razões, propõem-se estes métodos na nova subsecção “Biodegradabilidade na água do mar”.
|
APLICAÇÃO
|
6.
|
Os ensaios são efetuados no caso de as condições de utilização e de eliminação da substância indicarem o caminho do mar e os resultados neles obtidos dão uma primeira indicação da biodegradabilidade na água do mar. Se o resultado for positivo (mais de 70 % de remoção do carbono orgânico dissolvido; mais de 60 % da carência teórica de oxigénio — CTO), pode concluir-se pela existência de um potencial de biodegradação no ambiente marinho. Porém, um resultado negativo não exclui esse potencial, mas aponta para a necessidade de mais estudos, por exemplo reduzindo o mais possível a concentração da substância em estudo.
|
|
7.
|
Em qualquer dos casos, se for necessário um valor mais definitivo da taxa ou do grau de biodegradação na água do mar num determinado local, terá de se recorrer a métodos mais complexos, mais sofisticados e, consequentemente, mais dispendiosos. Por exemplo, pode efetuar-se um ensaio de simulação utilizando uma concentração da substância em estudo mais próxima da concentração provável desta no ambiente. Também pode utilizar-se água do mar não-enriquecida, sem pré-tratamento, colhida no local em estudo, acompanhando-se a biodegradação primária por meio de uma análise química específica. Para determinar a biodegradabilidade total, são necessárias substâncias marcadas com carbono 14, a fim de se poderem medir as taxas de desaparecimento do carbono 14 orgânico solúvel e de produção de14CO2 a concentrações realistas em termos ambientais.
|
ESCOLHA DO MÉTODO
|
8.
|
A escolha do método a utilizar depende de vários fatores, facultando-se o quadro seguinte para facilitar essa escolha. As substâncias cuja hidrossolubilidade seja inferior ao equivalente a cerca de 5 mg de C/litro não podem ser ensaiadas pelo método do balão agitado, mas as substâncias fracamente solúveis podem, em princípio, ser ensaiadas pelo método do frasco fechado.
Quadro:
Vantagens e desvantagens do ensaio do balão agitado e do ensaio do frasco fechado.
|
MÉTODO
|
VANTAGENS
|
DESVANTAGENS
|
|
BALÃO AGITADO
|
|
—
|
material simples, exceto o analisador de C;
|
|
—
|
a duração de 60 dias não constitui um problema;
|
|
—
|
sem interferência da nitrificação;
|
|
—
|
adaptável a substâncias voláteis.
|
|
|
—
|
necessidade de um analisador de C;
|
|
—
|
concentração de carbono orgânico dissolvido, eventualmente inibidora, na gama 4-50 mg/l;
|
|
—
|
difícil determinação de baixas concentrações de carbono orgânico dissolvido na água do mar (efeito dos cloretos);
|
|
—
|
concentração por vezes elevada de carbono orgânico dissolvido na água do mar.
|
|
|
FRASCO FECHADO
|
|
—
|
determinação simples do final;
|
|
—
|
baixa concentração da substância em estudo (2 mg/l), logo menos probabilidade de inibição;
|
|
—
|
facilmente adaptável a substâncias voláteis.
|
|
|
—
|
pode ser difícil manter os frascos estanques ao ar;
|
|
—
|
a proliferação de bactérias nas paredes pode falsear os resultados;
|
|
—
|
possibilidade de valores elevados de absorção de O2 no branco, especialmente após 28 dias; pode ser ultrapassado envelhecendo a água do mar;
|
|
—
|
possibilidade de interferência da absorção de O2 na nitrificação.
|
|
|
MÉTODO DO BALÃO AGITADO
INTRODUÇÃO
|
1.
|
Este método constitui uma variante para água do mar do Teste de Despiste da OCDE Modificado descrito no capítulo C.4-B deste anexo (2). Foi finalizado no seguimento do estudo interlaboratorial comparativo organizado para a Comissão Europeia pelo Instituto da Qualidade da Água da Dinamarca (3).
|
|
2.
|
Tal como sucede relativamente aos resultados do método do frasco fechado para a água do mar, os resultados deste ensaio não devem ser considerados indicadores de biodegradabilidade fácil, destinando-se especificamente a obter informações sobre a biodegradabilidade de substâncias em ambientes marinhos.
|
PRINCÍPIO DO MÉTODO
|
3.
|
Dissolve-se no meio de ensaio uma quantidade predeterminada da substância em estudo, de modo a obter uma concentração de carbono orgânico dissolvido compreendida entre 5 mg e 40 mg por litro. Se os limites de sensibilidade das análises do carbono orgânico forem melhorados, pode ser vantajoso utilizar concentrações mais baixas da substância em estudo, em especial no caso das substâncias inibidoras. Incuba-se a solução da substância em estudo no meio de ensaio, na obscuridade ou com iluminação difusa, em condições aeróbias, sob agitação e a uma dada temperatura (com variação contida a ± 2 °C), normalmente compreendida entre 15 °C e 20 °C. Se o objetivo do estudo for simular situações ambientais, o ensaio pode estender-se a temperaturas fora deste intervalo normal. A duração máxima recomendada do ensaio é de aproximadamente 60 dias. Acompanha-se a degradação determinando o carbono orgânico dissolvido (degradação total) e, em alguns casos, realizando uma análise específica (degradação primária).
|
INFORMAÇÕES SOBRE A SUBSTÂNCIA EM ESTUDO
|
4.
|
Para avaliar se o ensaio é aplicável a uma determinada substância, há que conhecer algumas propriedades da mesma. É necessário conhecer o teor de carbono orgânico da substância, a volatilidade desta não deve dar azo a perdas significativas durante o ensaio e a hidrossolubilidade da substância deve exceder o equivalente a 25-40 mg C/l. Além disso, não deve ser significativa a adsorção da substância em estudo às superfícies de vidro. Para que seja possível interpretar os resultados, é necessário dispor igualmente de informações sobre a pureza ou as proporções relativas dos principais componentes da substância em estudo, especialmente quando os resultados estiverem próximos do limiar de aceitação.
|
|
5.
|
Para selecionar as concentrações adequadas para o ensaio, pode ser útil dispor de informações sobre a toxicidade da substância em estudo para as bactérias, determinada, por exemplo, em ensaios de taxa de respiração de curta duração (4), podendo essas informações ser mesmo essenciais para a correta interpretação de valores de biodegradação baixos. Porém, nem sempre estas informações são suficientes para interpretar os resultados dos ensaios de biodegradação, sendo mais adequado o processo descrito no ponto 18.
|
SUBSTÂNCIAS DE REFERÊNCIA
|
6.
|
Utilizam-se substâncias de referência adequadas para verificar a atividade microbiana das amostras de água do mar. O benzoato de sódio, o acetato de sódio e a anilina são exemplos de substâncias utilizáveis para este fim. As substâncias de referência devem degradar-se num período relativamente curto; caso contrário, recomenda-se a repetição do ensaio com outra amostra de água do mar.
|
|
7.
|
No estudo interlaboratorial comparativo realizado na UE, foram colhidas amostras de água do mar em diversos locais e em diversos períodos do ano (3), tendo a fase de latência (tL) e o tempo necessário, após a fase de latência, para atingir 50 % de degradação (t50) sido de 1 a 4 dias e de 1 a 7 dias, respetivamente, para o benzoato de sódio. No caso da anilina, o tL variou entre 0 e 10 dias e o t50 entre 1 e 10 dias.
|
REPRODUTIBILIDADE E SENSIBILIDADE DO MÉTODO
|
8.
|
A reprodutibilidade do método foi determinada no estudo interlaboratorial comparativo (3). A concentração mínima da substância em estudo que permite utilizar este método com a análise do carbono orgânico dissolvido depende, em grande medida, do limite de deteção da análise do carbono orgânico (presentemente cerca de 0,5 mg C/l) e da concentração de carbono orgânico dissolvido da água do mar utilizada (normalmente 3-5 mg/l, no caso de água do mar colhida ao largo). A concentração de fundo de carbono orgânico dissolvido não deve exceder cerca de 20 % da concentração total de carbono orgânico dissolvido após a adição da substância em estudo. Caso isso não seja exequível, por vezes pode reduzir-se a concentração de fundo de carbono orgânico dissolvido envelhecendo a água do mar antes do ensaio. Se o método for utilizado apenas com uma análise química específica (para determinação da degradação primária), o investigador deve comprovar, fornecendo informações adicionais, se é de esperar degradabilidade total. Estas informações adicionais podem consistir de resultados de outros ensaios, de biodegradabilidade fácil ou intrínseca.
|
DESCRIÇÃO DO MÉTODO
Material e aparelhagem
|
9.
|
Material corrente de laboratório e:
|
a)
|
Agitador para balões de Erlenmeyer de 0,5-2 litros de capacidade, com regulação automática de temperatura ou colocado num recinto à temperatura constante de 15 °C a 20 °C, com variação contida a ± 2 °C;
|
|
b)
|
Balões de Erlenmeyer de gargalo estreito, de 0,5-2 litros de capacidade;
|
|
c)
|
Aparelho de filtração por membrana, ou centrifugadora;
|
|
d)
|
Filtros de membrana, com porosidade de 0,2 μm a 0,45 μm;
|
|
e)
|
Analisador de carbono;
|
|
f)
|
Equipamento para a análise específica (facultativo).
|
|
Água do mar
|
10.
|
Colhe-se uma amostra de água do mar num recipiente cuidadosamente limpo e transporta-se a amostra para o laboratório, de preferência não mais de um a dois dias após a colheita. Durante o transporte, a temperatura da amostra não pode exceder significativamente a temperatura do ensaio. É necessário identificar com precisão o local de colheita da amostra e caracterizá-lo em termos de estado de poluição e de nutrientes presentes. Sobretudo no caso das águas costeiras, esta caracterização deve compreender uma contagem das colónias de microrganismos heterotróficos e a determinação das concentrações de nitratos, amónio e fosfatos dissolvidos.
|
|
11.
|
Informações a fornecer relativamente à amostra de água do mar:
|
—
|
profundidade da colheita;
|
|
—
|
aspeto da amostra — turva etc.;
|
|
—
|
temperatura no momento da colheita;
|
|
—
|
carbono orgânico dissolvido;
|
|
—
|
período compreendido entre a colheita e a utilização no ensaio.
|
|
|
12.
|
Caso se determine um teor elevado de carbono orgânico dissolvido na amostra de água do mar (pontos 8), recomenda-se o envelhecimento desta durante cerca de uma semana, antes da utilização. O envelhecimento processa-se por conservação da amostra na obscuridade ou com iluminação difusa, em condições aeróbias, à temperatura do ensaio. Se necessário, mantêm-se condições aeróbias efetuando um arejamento ligeiro. Durante o envelhecimento, diminui o teor da matéria orgânica facilmente degradável. No estudo interlaboratorial comparativo (3), não foi detetada nenhuma diferença de potencial de degradação entre amostras de água do mar envelhecidas e amostras de água do mar colhidas recentemente. Antes de utilizar as amostras, procede-se a um tratamento prévio da água do mar para retirar as partículas grosseiras, por exemplo por filtração através de um filtro de nylon ou de um filtro de papel para filtrações grosseiras (não utilizar filtros de membrana nem filtros GF-C), ou por sedimentação seguida de decantação. O processo utilizado deve ser referido no relatório. O eventual envelhecimento deve preceder o tratamento prévio.
|
Soluções de reserva de nutrientes minerais
|
13.
|
Preparam-se as seguintes soluções de reserva, utilizando reagentes da qualidade analítica:
|
a)
|
Di-hidrogeno-ortofosfato de potássio (KH2PO4)
|
8,50 g
|
|
Hidrogeno-ortofosfato de dipotássio (K2HPO4)
|
21,75 g
|
|
Hidrogeno-ortofosfato de dissódio di-hidratado (Na2HPO4×2H2O)
|
33,30 g
|
|
Cloreto de amónio (NH4Cl)
|
0,50 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
|
b)
|
Cloreto de cálcio (CaCl2)
|
27,50 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
|
c)
|
Sulfato de magnésio hepta-hidratado (MgSO4×7H2O)
|
22,50 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
|
d)
|
Cloreto de ferro (III) hexa-hidratado (FeCl3×6H2O)
|
0,25 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
Para evitar a precipitação na solução d) pode adicionar-se uma gota de HCl concentrado ou 0,4 g do sal dissódico do ácido etilenodiaminotetraacético (EDTA) por litro. Caso se forme algum precipitado numa solução de reserva, há que substituí-la por solução fresca.
|
Preparação do meio a utilizar no ensaio
|
14.
|
Adiciona-se 1 ml de cada uma das soluções de reserva acima indicadas por litro de água do mar pré-tratada.
|
Inóculo
|
15.
|
Não se adiciona nenhum inóculo aos microrganismos já presentes na água do mar. Para determinar (facultativamente) o número de colónias de microrganismos heterotróficos no meio de água do mar ensaiado (e, de preferência, também nas amostras originais de água do mar), efetua-se, por exemplo, uma contagem em placa de ágar marinho. Este procedimento é especialmente desejável no caso das amostras provenientes de locais costeiros ou poluídos. Verifica-se a atividade microbiana heterotrófica na água do mar realizando um ensaio com uma substância de referência.
|
Preparação dos balões
|
16.
|
Antes de ser utilizado, para evitar contaminações por resíduos de ensaios anteriores, o material de vidro tem de ser escrupulosamente limpo (utilizando, por exemplo, uma solução alcoólica de ácido clorídrico), mas não necessariamente esterilizado, após o que é enxaguado e seco. Os balões também têm de ser limpos antes de serem utilizados pela primeira vez.
|
|
17.
|
Utilizam-se simultaneamente balões em duplicado para a avaliação da substância em estudo e um balão para a substância de referência. Para determinação dos brancos analíticos, realiza-se um ensaio em branco, em duplicado, sem a substância em estudo nem a substância de referência. Dissolve-se a substância em estudo no meio de ensaio — é prático adicioná-la recorrendo a uma solução de reserva concentrada — de modo a obter as concentrações iniciais pretendidas, normalmente 5 mg a 40 mg de carbono orgânico dissolvido por litro. Procede-se ao ensaio da substância de referência utilizando, normalmente, uma concentração inicial correspondente a 20 mg de carbono orgânico dissolvido por litro. Caso se utilizem soluções de reserva da substância em estudo e/ou da substância de referência, é importante que a salinidade do meio de água do mar não seja muito alterada.
|
|
18.
|
Se forem previsíveis ou não forem de excluir efeitos tóxicos, pode ser aconselhável incluir no ensaio uma experiência, em duplicado, de inibição. Para isso, adicionam-se as substâncias em estudo e de referência a um mesmo recipiente, sendo a concentração desta última normalmente igual à do ensaio de controlo (ou seja, 20 mg de carbono orgânico dissolvido por litro), para permitir comparações.
|
|
19.
|
Transferem-se volumes adequados das soluções em estudo para balões de Erlenmeyer (são aceitáveis volumes até metade do volume do balão) e tapa-se cada balão de modo não-hermético (por exemplo com folha de alumínio), a fim de possibilitar permutas gasosas entre os balões e o ar circundante. (Caso se recorra à análise do carbono orgânico dissolvido, é inadequado utilizar tampões de algodão). Colocam-se os recipientes no agitador e agita-se continuamente a baixa velocidade (por exemplo a 100 rpm) ao longo de todo o ensaio. É necessário manter a temperatura constante (15-20 °C, com variação contida a ± 2 °C) e proteger os recipientes da luz, a fim de evitar o crescimento de algas. É igualmente necessário que o ar esteja isento de matérias tóxicas.
|
Ensaio de controlo físico-químico (facultativo)
|
20.
|
Se houver suspeitas de degradação abiótica ou de mecanismos de perdas, como hidrólise (problemático apenas no caso de uma análise específica), volatilização ou adsorção, é aconselhável realizar uma experiência de controlo físico-químico. Para o efeito, a fim de suspender a atividade microbiana, pode adicionar-se cloreto de mercúrio (II) (HgCl2) (31) (50-100 mg/l) a recipientes que contenham a substância em estudo. Uma diminuição significativa, neste ensaio de controlo físico-químico, do carbono orgânico dissolvido ou da concentração da substância específica indicia mecanismos de remoção abióticos. (Caso se utilize cloreto de mercúrio, é necessário ter presente a possibilidade de interferências ou de envenenamento catalítico na análise do carbono orgânico dissolvido.)
|
Número de balões
|
21.
|
Utilizam-se normalmente num ensaio os seguintes balões:
|
Balões 1 e 2
|
contêm a substância em estudo (suspensão ensaiada);
|
|
Balões 3 e 4
|
contêm apenas água do mar (branco);
|
|
Balão 5
|
contém a substância de referência (controlo do método);
|
|
Balão 6
|
contém a substância em estudo e a substância de referência (experiência de verificação da toxicidade) — facultativo;
|
|
Balão 7
|
contém a substância em estudo e o agente esterilizante (experiência em meio estéril de verificação de ação abiótica) — facultativo.
|
|
Análise do carbono orgânico dissolvido
|
22.
|
No decurso do ensaio, colhem-se amostras a intervalos adequados para a análise do carbono orgânico dissolvido (apêndice 1). Colhem-se sempre amostras no início do ensaio (dia 0) e no dia 60. São necessárias pelo menos cinco amostras para descrever a evolução da degradação. Dada a variação das taxas de biodegradação, não é possível estabelecer uma cronologia fixa de colheita de amostras. Determina-se em duplicado o carbono orgânico dissolvido em cada amostra.
|
Amostras
|
23.
|
O volume necessário das amostras depende do método analítico (análise específica), do analisador de carbono utilizado e do processo (filtração por membrana ou centrifugação) escolhido para o tratamento prévio das amostras antes da determinação do carbono (pontos 25 e 26). Antes de colher as amostras, é necessário misturar bem o meio de ensaio e dissolver ou suspender quaisquer matérias aderentes às paredes do balão.
|
|
24.
|
Filtra-se por membrana ou centrifuga-se cada amostra imediatamente após a colheita. Se necessário, conservam-se as amostras filtradas ou centrifugadas a 2-4 °C por períodos não superiores a 48 horas ou abaixo de – 18 °C por períodos mais longos (caso se saiba que isso não afetará a substância em causa, acidificam-se as amostras a pH 2 antes de serem armazenadas).
|
|
25.
|
Os filtros de membrana (0,2-0,45 μm) são adequados se, comprovadamente, não libertarem carbono nem adsorverem a substância durante a filtração (por exemplo membranas filtrantes de policarbonatos). Alguns filtros de membrana estão impregnados de substâncias tensioativas para hidrofilação e podem libertar quantidades consideráveis de carbono dissolvido. Preparam-se esses filtros fervendo-os em água desionizada durante três períodos consecutivos de uma hora cada. Depois de fervidos, guardam-se os filtros em água desionizada. Eliminam-se os primeiros 20 ml do filtrado.
|
|
26.
|
A centrifugação das amostras constitui uma alternativa à filtração por membranas. Centrifuga-se a 40 000 m.s-2 (~ 4 000 g) durante 15 minutos, de preferência numa centrifugadora refrigerada.
Nota: Aparentemente, a concentrações muito baixas, não é possível diferenciar por centrifugação o carbono orgânico total (TOC) do carbono orgânico dissolvido (DOC), pois ou as bactérias não são todas removidas ou há redissolução de carbono constituinte do plasma bacteriano. A concentrações de ensaio mais elevadas (> 10 mg C por litro), o erro associado à centrifugação parece ser comparativamente pequeno.
|
Frequência da colheita de amostras
|
27.
|
Caso as análises sejam realizadas logo após a colheita das amostras, determina-se o momento da próxima colheita de amostras em função do resultado da determinação analítica.
|
|
28.
|
Caso as amostras sejam conservadas (ponto 24) para serem analisadas mais tarde, é necessário colher mais amostras do que o mínimo exigido de cinco. Analisam-se primeiro as amostras mais recentes, seguindo-se, uma a uma, a análise de amostras adequadamente escolhidas das mais recentes para as mais antigas, de modo a obter uma boa descrição da curva de biodegradação com um número relativamente pequeno de determinações analíticas. Se não se verificar nenhuma degradação até ao final do ensaio, não é necessário analisar mais nenhuma amostra — nesta eventualidade, o processo retrógrado preconizado permite reduzir consideravelmente os custos analíticos.
|
|
29.
|
Caso a curva de degradação atinja um patamar antes do dia 60, põe-se fim ao ensaio. Se, ao dia 60, a degradação já tiver manifestamente tido início, mas ainda não tiver atingido um patamar, será necessário prolongar o ensaio.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
30.
|
Registam-se os resultados analíticos na folha de dados apensa (apêndice 2) e calculam-se os valores de biodegradação para a substância em estudo e a substância de referência por meio da seguinte equação

em que:
|
Dt
|
=
|
degradação em percentagem de remoção de carbono orgânico dissolvido, ou percentagem de remoção da substância específica, no instante t;
|
|
Co
|
=
|
concentração inicial de carbono orgânico dissolvido ou da substância específica, no meio de ensaio;
|
|
Ct
|
=
|
concentração de carbono orgânico dissolvido ou da substância específica, no meio de ensaio, no instante t;
|
|
Cbr(0)
|
=
|
concentração inicial de carbono orgânico dissolvido ou da substância específica, no branco;
|
|
Cbr(t)
|
=
|
concentração de carbono orgânico dissolvido ou da substância específica, no branco, no instante t.
|
|
|
31.
|
Indica-se a degradação em percentagem de remoção de carbono orgânico dissolvido (degradação total), ou percentagem de remoção da substância específica (degradação primária), no instante t. Calculam-se as concentrações de carbono orgânico dissolvido com a aproximação de 0,1 mg/l e arredondam-se as médias dos valores de Dt para o valor de percentagem inteiro mais próximo.
|
|
32.
|
Traça-se a curva da degradação em função do tempo como se ilustra na figura inserida no item “Validade e interpretação dos resultados”. Caso se disponha de dados suficientes, calcula-se a partir da curva a fase de latência (tL) e o tempo decorrido, após o termo dessa fase, até se atingir 50 % de remoção (t50).
|
Relatório do ensaio
|
33.
|
Elementos a constar do relatório do ensaio:
|
|
Substância em estudo
|
—
|
estado físico e propriedades físico-químicas pertinentes;
|
|
—
|
dados de identificação.
|
|
|
|
Condições de realização do ensaio
|
—
|
localização e descrição do local de colheita das amostras; estado de poluição e nutrientes presentes (contagem de colónias, nitratos, amónio, fosfatos, se for caso disso);
|
|
—
|
características da amostra — data e profundidade da colheita, aspeto, temperatura, salinidade, carbono orgânico dissolvido (facultativo), tempo decorrido entre a colheita e a utilização da amostra no ensaio;
|
|
—
|
método eventualmente utilizado para envelhecer a água do mar;
|
|
—
|
método utilizado no tratamento prévio da água do mar (filtração/sedimentação);
|
|
—
|
método utilizado na determinação do carbono orgânico dissolvido;
|
|
—
|
método utilizado na análise específica (facultativo);
|
|
—
|
método utilizado na determinação do número de microrganismos heterotróficos na água do mar (contagem em placas ou outro método) (facultativo);
|
|
—
|
outros métodos (facultativos) utilizados para caracterizar a água do mar (medições de ATP etc.).
|
|
|
|
Resultados
|
—
|
registo dos resultados analíticos numa folha de dados (apêndice 2);
|
|
—
|
traçado da curva de degradação em função do tempo num diagrama que mostre a fase de latência (tL), o declive e o tempo decorrido, após o termo daquela fase, até se atingir 50 % de remoção (t50). Pode estimar-se graficamente a fase de latência como se ilustra na figura inserida no item “Validade e interpretação dos resultados” ou considerar-se corresponder essa fase ao período decorrido até se atingir 10 % de degradação;
|
|
—
|
percentagem de degradação medida após 60 dias ou no final do ensaio.
|
|
|
|
Discussão dos resultados.
|
|
Validade e interpretação dos resultados
|
34.
|
Os resultados obtidos com as substâncias de referência (por exemplo benzoato de sódio, acetato de sódio ou anilina) devem ser comparáveis aos obtidos no estudo interlaboratorial comparativo (3) (ver o ponto 7 do item “Substâncias de referência”). Se os resultados obtidos com as substâncias de referência forem atípicos, deve repetir-se o ensaio com outra amostra de água do mar. Embora nem sempre seja fácil interpretar os resultados dos ensaios de inibição, devido ao carbono orgânico dissolvido proveniente da substância em estudo, uma diminuição significativa da taxa de remoção do carbono orgânico dissolvido total, comparativamente à experiência de controlo, constitui uma indicação de efeitos tóxicos.
|
|
35.
|
Dadas as concentrações relativamente elevadas utilizadas neste ensaio comparativamente à maior parte dos sistemas naturais (e à consequente relação desfavorável entre as concentrações da substância em estudo e das outras fontes de carbono), deve encarar-se este método como um ensaio preliminar destinado a avaliar se uma substância é ou não facilmente biodegradável. Nessa perspetiva, um resultado baixo não significa necessariamente que a substância em estudo não é biodegradável em ambientes marinhos, mas antes que é necessário mais trabalho para tirar conclusões acerca disso.
Apresenta-se na figura seguinte um exemplo de uma experiência de degradação teórica que ilustra um modo de estimar os valores de tL (duração da “fase de latência”) e de t50 (tempo decorrido após tL até se atingir 50 % de remoção).

|
MÉTODO DO FRASCO FECHADO
INTRODUÇÃO
|
1.
|
Este método constitui uma variante para água do mar do Ensaio em Frasco Fechado (5). Foi finalizado no seguimento do estudo interlaboratorial comparativo organizado para a Comissão Europeia pelo Instituto da Qualidade da Água da Dinamarca (3).
|
|
2.
|
Tal como sucede relativamente aos resultados do método do balão agitado para a água do mar, os resultados deste ensaio não devem ser considerados indicadores de biodegradabilidade fácil, destinando-se especificamente a obter informações sobre a biodegradabilidade de substâncias em ambientes marinhos.
|
PRINCÍPIO DO MÉTODO
|
3.
|
Dissolve-se no meio de ensaio uma quantidade predeterminada da substância em estudo, de modo a obter uma concentração desta normalmente compreendida entre 2 mg e 10 mg por litro (pode utilizar-se uma ou mais concentrações). Conserva-se a solução na obscuridade, num frasco cheio fechado, num banho ou numa câmara termostática a uma temperatura compreendida entre 15 °C e 20 °C, com variação contida a ± 1 °C. Se o objetivo do estudo for simular situações ambientais, o ensaio pode estender-se a temperaturas fora deste intervalo normal, desde que se ajuste convenientemente a regulação de temperatura. Acompanha-se o processo de degradação por meio de análises de oxigénio durante 28 dias.
|
|
4.
|
O estudo interlaboratorial comparativo revelou que, se o ensaio for prolongado além de 28 dias, na maior parte dos casos não se obtêm informações úteis, devido a fortes interferências. Os valores de carência bioquímica de oxigénio do branco eram excessivamente elevados, provavelmente devido a crescimento nas paredes do recipiente (causado por falta de agitação) e a nitrificação. A duração recomendada é, pois, de 28 dias, mas, se o valor de carência bioquímica de oxigénio do branco se mantiver dentro do limite de 30 % (pontos 15 e 40), pode prolongar-se o ensaio.
|
INFORMAÇÕES SOBRE A SUBSTÂNCIA EM ESTUDO
|
5.
|
Para avaliar se o ensaio é aplicável a uma determinada substância, há que conhecer algumas propriedades da mesma. A fim de calcular a carência teórica de oxigénio (ver o apêndice 3), é necessário conhecer a fórmula empírica; caso contrário, determina-se a carência química de oxigénio (CQO) da substância, para servir de valor de referência. O recurso à carência química de oxigénio é menos satisfatório, pois algumas substâncias não se oxidam completamente no ensaio no qual aquela é determinada.
|
|
6.
|
A solubilidade da substância não deve ser inferior a 2 mg/l, embora, em princípio, possam ensaiar-se substâncias menos solúveis (por exemplo utilizando ultrassons), bem como substâncias voláteis. Para que seja possível interpretar os resultados, é necessário dispor igualmente de informações sobre a pureza ou as proporções relativas dos principais componentes da substância em estudo, especialmente quando os resultados estiverem próximos do limiar de aceitação.
|
|
7.
|
Para selecionar as concentrações adequadas para o ensaio, pode ser muito útil dispor de informações sobre a toxicidade da substância em estudo para as bactérias, determinada, por exemplo, em ensaios de respiração de curta duração (4), podendo essas informações ser mesmo essenciais para a correta interpretação de valores de biodegradação baixos. Porém, nem sempre estas informações são suficientes para interpretar os resultados dos ensaios de biodegradação, sendo mais adequado o processo descrito no ponto 27.
|
SUBSTÂNCIAS DE REFERÊNCIA
|
8.
|
Utilizam-se substâncias de referência adequadas para verificar a atividade microbiana das amostras de água do mar. A anilina, o acetato de sódio e o benzoato de sódio são exemplos de substâncias utilizáveis para este fim. As substâncias de referência devem degradar-se pelo menos 60 % (da carência teórica de oxigénio) num período relativamente curto; caso contrário, recomenda-se a repetição do ensaio com outra amostra de água do mar.
|
|
9.
|
No estudo interlaboratorial comparativo realizado na UE, foram colhidas amostras de água do mar em diversos locais e em diversos períodos do ano, tendo a fase de latência (tL) e o tempo necessário, após a fase de latência, para atingir 50 % de degradação (t50) sido de 0 a 2 dias e de 1 a 4 dias, respetivamente, para o benzoato de sódio. Para a anilina, os valores de tL e de t50 foram, respetivamente, de 0 a 7 e de 2 a 12 dias.
|
REPRODUTIBILIDADE
|
10.
|
A reprodutibilidade dos métodos foi determinada no estudo interlaboratorial comparativo (3).
|
DESCRIÇÃO DO MÉTODO
Material e aparelhagem
|
11.
|
Equipamento normal de laboratório e:
|
a)
|
Frascos de 250 ml a 300 ml para determinação da carência bioquímica de oxigénio ou balões de 250 ml de gargalo estreito, em ambos os casos com tampa de vidro;
|
|
b)
|
Vários frascos de 2, 3 e 4 litros graduados em litros, para a preparação da experiência e o enchimento dos frascos para determinação da carência bioquímica de oxigénio;
|
|
c)
|
Banho de água ou recinto a temperatura constante para conservação dos frascos a temperatura constante (± 1 °C), ao abrigo da luz;
|
|
d)
|
Equipamento para análise do oxigénio dissolvido;
|
|
e)
|
Filtros de membrana, com porosidade de 0,2 μm a 0,45 μm (facultativo);
|
|
f)
|
Equipamento para a análise específica (facultativo).
|
|
Água do mar
|
12.
|
Colhe-se uma amostra de água do mar num recipiente cuidadosamente limpo e transporta-se a amostra para o laboratório, de preferência não mais de um a dois dias após a colheita. Durante o transporte, a temperatura da amostra não pode exceder significativamente a temperatura do ensaio.
|
|
13.
|
É necessário identificar com precisão o local de colheita da amostra e caracterizá-lo em termos de estado de poluição e de nutrientes presentes. Sobretudo no caso das águas costeiras e das águas poluídas, esta caracterização deve compreender uma contagem das colónias de microrganismos heterotróficos e a determinação das concentrações de nitratos, amónio e fosfatos dissolvidos.
|
|
14.
|
Informações a fornecer relativamente à amostra de água do mar:
|
—
|
profundidade da colheita;
|
|
—
|
aspeto da amostra — turva etc.;
|
|
—
|
temperatura no momento da colheita;
|
|
—
|
carbono orgânico dissolvido;
|
|
—
|
período compreendido entre a colheita e a utilização no ensaio.
|
|
|
15.
|
Se o teor de carbono orgânico dissolvido da amostra for elevado ou a carência bioquímica de oxigénio do branco após 28 dias for previsivelmente superior a 30 % da carência bioquímica de oxigénio das substâncias de referência, recomenda-se que a água do mar seja envelhecida durante uma semana antes de ser utilizada.
|
|
16.
|
O envelhecimento da amostra processa-se por conservação desta na obscuridade ou com iluminação difusa, em condições aeróbias, à temperatura do ensaio. Se necessário, mantêm-se condições aeróbias efetuando um arejamento ligeiro. Durante o envelhecimento, diminui o teor da matéria orgânica facilmente degradável. No estudo interlaboratorial comparativo (3), não foi detetada nenhuma diferença de potencial de degradação entre amostras de água do mar envelhecidas e amostras de água do mar colhidas recentemente.
|
|
17.
|
Antes de utilizar as amostras, procede-se a um tratamento prévio da água do mar para retirar as partículas grosseiras, por exemplo por filtração através de um filtro de nylon ou de um filtro de papel para filtrações grosseiras (não utilizar filtros de membrana nem filtros GF-C), ou por sedimentação seguida de decantação. O processo utilizado deve ser referido no relatório. O eventual envelhecimento deve preceder o tratamento prévio.
|
Soluções de reserva de nutrientes minerais
|
18.
|
Preparam-se as seguintes soluções de reserva, utilizando reagentes da qualidade analítica:
|
a)
|
Di-hidrogeno-ortofosfato de potássio (KH2PO4)
|
8,50 g
|
|
Hidrogeno-ortofosfato de dipotássio (K2HPO4)
|
21,75 g
|
|
Hidrogeno-ortofosfato de dissódio di-hidratado (Na2HPO4 × 2H2O)
|
33,30 g
|
|
Cloreto de amónio (NH4Cl)
|
0,50 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
|
b)
|
Cloreto de cálcio (CaCl2)
|
27,50 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
|
c)
|
Sulfato de magnésio hepta-hidratado (MgSO4 × 7H2O)
|
22,50 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
|
d)
|
Cloreto de ferro (III) hexa-hidratado (FeCl3 × 6H2O)
|
0,25 g
|
|
Dissolver em água destilada e completar o volume até um litro.
|
|
Para evitar a precipitação na solução d) pode adicionar-se uma gota de HCl concentrado ou 0,4 g do sal dissódico do ácido etilenodiaminotetraacético (EDTA) por litro. Caso se forme algum precipitado numa solução de reserva, há que substituí-la por solução fresca.
|
Preparação do meio a utilizar no ensaio
|
19.
|
Adiciona-se 1 ml de cada uma das soluções de reserva acima indicadas por litro de água do mar pré-tratada. Satura-se o meio de ensaio com ar à temperatura do ensaio efetuando um arejamento durante 20 minutos com ar comprimido limpo. Para efeitos de controlo, determina-se a concentração de oxigénio dissolvido. Pode obter-se a concentração de saturação de oxigénio dissolvido em função da salinidade e da temperatura por leitura no ábaco inserido no apêndice 4 deste método de ensaio.
|
Inóculo
|
20.
|
Não se adiciona nenhum inóculo aos microrganismos já presentes na água do mar. Para determinar (facultativamente) o número de colónias de microrganismos heterotróficos no meio de água do mar ensaiado (e, de preferência, também na amostra original de água do mar), efetua-se, por exemplo, uma contagem em placa de ágar marinho. Este procedimento é especialmente desejável no caso das amostras provenientes de locais costeiros ou poluídos. Verifica-se a atividade microbiana heterotrófica na água do mar realizando um ensaio com uma substância de referência.
|
Preparação dos frascos a utilizar no ensaio
|
21.
|
As manipulações necessárias, incluindo o envelhecimento e o tratamento prévio da água do mar, são realizadas à temperatura escolhida para o ensaio, entre 15 °C e 20 °C; o material de vidro deve estar limpo, mas não é necessário esterilizá-lo.
|
|
22.
|
Preparam-se grupos de frascos para CBO para determinar a carência bioquímica de oxigénio da substância em estudo e da substância de referência em séries experimentais simultâneas. Preparam-se dois frascos para cada determinação, a fim de realizar todas as análises (branco, substância em estudo e substância de referência) em frascos duplicados. Realizam-se as análises, pelo menos, nos dias 0, 5, 15 e 28 (quatro determinações). Para as análises do oxigénio, são necessários 3 × 2 × 4 = 24 frascos para quatro determinações (branco, substância em estudo e substância de referência) e, portanto, cerca de 8 litros de meio de ensaio (para cada concentração da substância em estudo).
|
|
23.
|
Preparam-se separadamente soluções da substância em estudo e da substância de referência em frascos grandes de volume suficiente (ponto 11), começando por adicionar a substância em causa, diretamente ou recorrendo a uma solução de reserva concentrada, a frascos parcialmente cheios. Acrescenta-se o meio de ensaio necessário para obter as concentrações finais pretendidas. Caso se utilizem soluções de reserva da substância em estudo e/ou da substância de referência, é importante que a salinidade do meio de água do mar não seja significativamente alterada.
|
|
24.
|
Selecionam-se as concentrações da substância em estudo e da substância de referência tendo em atenção os seguintes aspetos:
|
a)
|
solubilidade do oxigénio dissolvido na água do mar, à temperatura e com a salinidade a que se realiza o ensaio (ver o ábaco do apêndice 4);
|
|
b)
|
carência bioquímica de oxigénio do branco de água do mar; e
|
|
c)
|
biodegradabilidade esperada da substância em estudo.
|
|
|
25.
|
A 15 °C e 20 °C e com 32 partes por mil de salinidade (água oceânica), a solubilidade do oxigénio dissolvido é, respetivamente, de cerca de 8,1 mg/l e de cerca de 7,4 mg/l. Se a água do mar não for envelhecida, o consumo de oxigénio da própria água (respiração do branco) pode atingir 2 mg ou mais de O2 por litro. Por conseguinte, a fim de que a concentração de oxigénio restante após a oxidação da substância em estudo ainda seja significativa, utiliza-se uma concentração inicial desta de 2 mg/l a 3 mg/l (em função da carência teórica de oxigénio) no caso das substâncias que (como as substâncias de referência) previsivelmente se degradarão completamente nas condições de realização do ensaio. Desde que não ocorram efeitos tóxicos, ensaiam-se as substâncias menos degradáveis a concentrações mais elevadas, até cerca de 10 mg/l. Pode ser útil realizar em paralelo um ensaio com uma concentração baixa da substância em estudo (cerca de 2 mg/l) e um ensaio com uma concentração elevada da mesma (cerca de 10 mg/l).
|
|
26.
|
Realiza-se em paralelo um ensaio em branco do oxigénio, em frascos sem a substância em estudo nem a substância de referência.
|
|
27.
|
Caso se pretenda determinar efeitos inibidores, prepara-se a seguinte série de soluções em frascos grandes (ver o ponto 13):
|
a)
|
concentração de 2 mg por litro de uma substância facilmente degradável, por exemplo uma das substâncias de referência mencionadas;
|
|
b)
|
concentração de x mg por litro da substância em estudo (x tem normalmente o valor 2);
|
|
c)
|
concentração de 2 mg por litro de uma substância facilmente degradável e de x mg por litro da substância em estudo.
|
|
Ensaio de controlo físico-químico (facultativo)
|
28.
|
Caso se opte por realizar análises específicas, pode realizar-se uma experiência físico-química para verificar se a substância em estudo é removida por mecanismos abióticos, por exemplo hidrólise ou adsorção. Pode realizar-se um ensaio de controlo físico-químico adicionando cloreto de mercúrio (II) (HgCl2) (32) (50-100 mg/l), a fim de suspender a atividade microbiana, a frascos em duplicado que contenham a substância em estudo. Uma diminuição significativa, neste ensaio de controlo físico-químico, da concentração da substância específica indicia mecanismos de remoção abióticos.
|
Número de frascos para determinação da carência bioquímica de oxigénio normalmente utilizados num ensaio
|
29.
|
Utilizam-se normalmente num ensaio os seguintes frascos:
|
—
|
pelo menos 8 com a substância em estudo;
|
|
—
|
pelo menos 8 apenas com água do mar enriquecida com nutrientes;
|
|
—
|
pelo menos 8 com a substância de referência; e, se necessário,
|
|
—
|
6 frascos de verificação da toxicidade, com a substância em estudo e a substância de referência.
|
|
PROCEDIMENTO DE ENSAIO
|
30.
|
Após a preparação, sifona-se de imediato o volume necessário de cada solução, a partir do quarto de volume inferior (mas não do fundo) do frasco grande adequado, para o grupo correspondente de frascos para determinação da carência bioquímica de oxigénio. Analisa-se de imediato o oxigénio dissolvido nos frascos de controlo do instante zero (ponto 33) ou conservam-se estes frascos efetuando uma precipitação com MnCl2 (cloreto de manganês (II)) e NaOH (hidróxido de sódio), para análise química ulterior.
|
|
31.
|
Incubam-se na obscuridade, à temperatura de ensaio (15-20 °C), os restantes frascos para determinação da carência bioquímica de oxigénio ensaiados em paralelo, retirando-os da zona de incubação a intervalos adequados (pelo menos após 5, 15 e 28 dias, por exemplo) e neles analisando em seguida o oxigénio dissolvido (ponto 33).
|
|
32.
|
Filtram-se por membrana (0,2-0,45 μm) ou centrifugam-se durante 15 minutos as amostras destinadas a análises específicas (facultativo). Se não forem analisadas imediatamente, conservam-se estas amostras filtradas ou centrifugadas a 2-4 °C por períodos não superiores a 48 horas ou a -18 °C por períodos mais longos (caso se saiba que isso não afetará a substância em estudo, acidificam-se as amostras a pH 2 antes de serem armazenadas).
|
Determinação do oxigénio dissolvido
|
33.
|
Determina-se a concentração de oxigénio dissolvido por meio de um método químico ou eletroquímico reconhecido a nível nacional ou internacional.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
34.
|
Registam-se os resultados analíticos na folha de dados apensa (apêndice 5).
|
|
35.
|
Calcula-se a carência bioquímica de oxigénio como a diferença no consumo de oxigénio entre um branco e uma solução da substância em estudo nas condições de ensaio. Divide-se esse consumo líquido de oxigénio pela concentração (peso/volume) da substância, a fim de exprimir a carência bioquímica de oxigénio em mg de CBO/mg da substância em estudo. Define-se a degradação como a razão, expressa em percentagem, entre (de preferência) a carência bioquímica de oxigénio e a carência teórica de oxigénio ou então entre a carência bioquímica de oxigénio e a carência química de oxigénio (ver o ponto 36).
|
|
36.
|
Calculam-se os valores de biodegradação correspondentes a cada momento de colheita de amostras e às substâncias em estudo e de referência por meio de uma das seguintes equações:
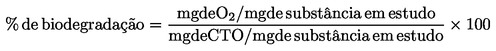

em que:
|
CTO
|
=
|
carência teórica de oxigénio (ver o cálculo no apêndice 3);
|
|
CQO
|
=
|
carência química de oxigénio, determinada experimentalmente.
|
Nota: Por vezes, as duas formas de cálculo (percentagem da CTO ou percentagem da CQO) não dão os mesmos resultados. É preferível utilizar a carência teórica de oxigénio, pois algumas substâncias não se oxidam completamente no ensaio de carência química de oxigénio.
|
|
37.
|
Traça-se a curva da degradação em função do tempo como se ilustra na figura inserida no item “Validade e interpretação dos resultados”. Caso se disponha de dados suficientes, calcula-se, a partir da curva de biodegradação, a fase de latência (tL) e o tempo decorrido, após o termo dessa fase, até se atingir 50 % de remoção (t50).
|
|
38.
|
Caso se opte por realizar uma análise específica (facultativo), a percentagem de degradação primária corresponde à percentagem de remoção da substância específica no período de ensaio (após correção em função dos brancos analíticos).
|
Relatório do ensaio
|
39.
|
Elementos a constar do relatório do ensaio:
|
|
Substância em estudo
|
—
|
estado físico e propriedades físico-químicas pertinentes;
|
|
—
|
dados de identificação.
|
|
|
|
Condições de realização do ensaio
|
—
|
localização e descrição do local de colheita das amostras; estado de poluição e nutrientes presentes (contagem de colónias, nitratos, amónio, fosfatos, se for caso disso);
|
|
—
|
características da amostra — data e profundidade da colheita, aspeto, temperatura, salinidade, carbono orgânico dissolvido (facultativo), tempo decorrido entre a colheita e a utilização da amostra no ensaio;
|
|
—
|
método eventualmente utilizado para envelhecer a água do mar;
|
|
—
|
método utilizado no tratamento prévio da água do mar (filtração/sedimentação);
|
|
—
|
método de determinação da carência química de oxigénio (se efetuada);
|
|
—
|
método utilizado nas medições de oxigénio;
|
|
—
|
processo de dispersão das substâncias fracamente solúveis nas condições do ensaio;
|
|
—
|
método utilizado na determinação do número de microrganismos heterotróficos na água do mar (contagem em placas ou outro método);
|
|
—
|
método utilizado na determinação do carbono orgânico dissolvido na água do mar (facultativo);
|
|
—
|
método utilizado na análise específica (facultativo);
|
|
—
|
outros métodos facultativos utilizados para caracterizar a água do mar (medições de ATP etc.).
|
|
|
|
Resultados
|
—
|
registo dos resultados analíticos numa folha de dados (apêndice 5);
|
|
—
|
traçado da curva de degradação em função do tempo num diagrama que mostre a fase de latência (tL), o declive e o tempo decorrido, após o termo daquela fase, até se atingir 50 % do consumo final de oxigénio devido à oxidação da substância em estudo (t50). Pode estimar-se graficamente a fase de latência como se ilustra na figura inserida adiante ou considerar-se corresponder essa fase ao período decorrido até se atingir 10 % de degradação;
|
|
—
|
percentagem de degradação medida após 28 dias.
|
|
|
|
Discussão dos resultados.
|
|
Validade e interpretação dos resultados
|
40.
|
A respiração no branco não deve exceder 30 % do oxigénio do frasco correspondente. Se não for possível satisfazer este critério utilizando amostras de água do mar colhidas recentemente, é necessário envelhecer (estabilizar) a água do mar antes de utilizar as amostras.
|
|
41.
|
Há que ponderar a possibilidade de os resultados serem influenciados por substâncias azotadas.
|
|
42.
|
Os resultados obtidos com as substâncias de referência benzoato de sódio e anilina devem ser comparáveis aos obtidos no estudo interlaboratorial comparativo (3) (ver o ponto 9). Se os resultados obtidos com as substâncias de referência forem atípicos, deve repetir-se o ensaio com outra amostra de água do mar.
|
|
43.
|
Pode considerar-se que (à concentração utilizada) a substância em estudo inibe as bactérias se a carência bioquímica de oxigénio da mistura da substância de referência e da substância em estudo for inferior à soma das carências bioquímicas de oxigénio das soluções separadas das duas substâncias.
|
|
44.
|
Dadas as concentrações relativamente elevadas utilizadas neste ensaio comparativamente à maior parte dos sistema naturais (e à consequente relação desfavorável entre as concentrações da substância em estudo e das outras fontes de carbono), deve encarar-se este método como um ensaio preliminar destinado a avaliar se uma substância é ou não facilmente biodegradável. Nessa perspetiva, um resultado baixo não significa necessariamente que a substância em estudo não é biodegradável em ambientes marinhos, mas antes que é necessário mais trabalho para tirar conclusões acerca disso.
Apresenta-se na figura seguinte um exemplo de uma experiência de degradação teórica que ilustra um modo de estimar os valores de tL (duração da “fase de latência”) e de t50 (tempo decorrido após tL até se atingir 50 % do consumo final de oxigénio devido à oxidação da substância em estudo).

|
REFERÊNCIAS
|
1)
|
de Kreuk J.F., Hanstveit, A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
2)
|
Capítulo C.4-B deste anexo: Determinação da biodegradabilidade “fácil” — Parte III, Teste de despiste da OCDE modificado.
|
|
3)
|
Nyholm, N., Kristensen, P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, março de 1987. Comissão das Comunidades Europeias.
|
|
4)
|
Capítulo C.11 deste anexo: Biodegradação — Lamas activadas: ensaios de inibição da respiração.
|
|
5)
|
Capítulo C.4-E deste anexo: Determinação da biodegradabilidade “fácil” — Parte VI, Ensaio em frasco fechado.
|
Apêndice 1
Determinação do carbono orgânico na água do mar
MÉTODO DO BALÃO AGITADO
Para determinar o carbono orgânico de uma amostra de água, oxidam-se os compostos orgânicos da amostra a dióxido de carbono. Em geral, utiliza-se uma das seguintes técnicas:
|
—
|
oxidação por via húmida com persulfatos/irradiação UV;
|
|
—
|
oxidação por via húmida com persulfatos/temperatura elevada (116-130 °C);
|
Mede-se a quantidade libertada de CO2 por espetrometria de infravermelhos ou titulação. Outra possibilidade consiste na redução do CO2 a metano e na determinação quantitativa deste com um detetor de ionização de chama.
Recorre-se habitualmente ao método dos persulfatos/UV para analisar águas “limpas”, com baixo teor de partículas. Os outros dois métodos são aplicáveis à maior parte das amostras de água: o método de oxidação pela via dos persulfatos/temperatura elevada é mais adequado para amostras com baixo teor de carbono orgânico; a técnica de combustão é aplicável a amostras com teor de carbono orgânico não-volátil bem acima de 1 mg de C/l.
Interferências
Em qualquer dos três métodos é necessário eliminar ou contrabalançar o carbono inorgânico presente da amostra. O método mais frequentemente utilizado para eliminar o carbono inorgânico consiste na purga do CO2 da amostra acidificada, embora neste processo também se verifiquem perdas de compostos orgânicos voláteis (1). É necessário eliminar ou contrabalançar completamente o carbono inorgânico em todas as matrizes de amostras e, consoante o tipo de amostra, determinar o carbono orgânico volátil além do carbono orgânico não-volátil.
Concentrações elevadas de cloretos reduzem a eficiência oxidativa do método persulfatos/UV (2). Este interferência pode, no entanto, ser eliminada utilizando um reagente de oxidação modificado pela adição de nitrato de mercúrio (II). Quando se avaliem amostras que contenham cloretos, recomenda-se a utilização do máximo volume de amostra possível. No método de combustão, a presença de concentrações elevadas de sais nas amostras analisadas pode provocar a formação de depósitos salinos no catalisador e uma corrosão excessiva do tubo de combustão. É necessário tomar as precauções recomendadas no manual do fabricante.
No método dos persulfatos/UV, a oxidação de amostras muito turvas ou com partículas pode revelar-se incompleta.
Exemplo de um método adequado
Determina-se o carbono orgânico não-volátil por oxidação com persulfatos/irradiação UV e quantifica-se o CO2 libertado por espetrometria de infravermelhos não-dispersiva.
Modifica-se o reagente de oxidação de acordo com as sugestões constantes da referência (2) e o referido no manual do fabricante:
|
a)
|
Dissolvem-se 8,2 g de HgCl2 e 9,6 g de Hg(NO3)2.H2O em algumas centenas de mililitros de água com baixo teor de carbono;
|
|
b)
|
Dissolvem-se 20 g de K2S2O8 na solução de sais de mercúrio;
|
|
c)
|
Adicionam-se à mistura 5 ml de HNO3 (concentrado);
|
|
d)
|
Completa-se o volume do reagente com água até 1 000 ml.
|
Elimina-se a interferência dos cloretos utilizando um volume de amostra de 40 μl para 10 % de cloretos e um volume de amostra de 200 μl para 1,9 % de cloretos. É possível analisar por este método amostras com concentrações elevadas de cloretos e/ou maiores volumes de amostra, desde que se impeça a acumulação de cloretos no recipiente de oxidação. Caso se justifique para o tipo de amostra em causa, pode, em seguida, determinar-se o carbono orgânico volátil.
REFERÊNCIAS
|
1)
|
ISO, Water quality — determination of total organic carbon. Draft International Standard ISO/DIS 8245, 16 de janeiro de 1986.
|
|
2)
|
American Public Health Association. Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16.a edição, 1985.
Também com interesse (descreve um sistema de autoanálise):
|
|
3)
|
Schreurs, W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin, 12, 137-142.
|
Apêndice 2
Biodegradação na água do mar
MÉTODO DO BALÃO AGITADO
FOLHA DE DADOS
|
2.
|
DATA DE INÍCIO DO ENSAIO:
|
|
3.
|
SUBSTÂNCIA EM ESTUDO:
Nome:
|
Concentração da solução de reserva:
|
mg da substância/l
|
|
Concentração inicial no meio (to):
|
mg da substância/l
|
|
:
|
mg de carbono orgânico dissolvido/l
|
|
|
4.
|
ÁGUA DO MAR:
Origem:
Data da colheita:
Profundidade da colheita:
Aspeto no momento da colheita (por exemplo turva etc.):
|
Salinidade no momento da colheita:
|
‰
|
|
Temperatura no momento da colheita:
|
°C
|
|
Carbono orgânico dissolvido “x” horas após a colheita:
|
mg/l
|
Tratamento prévio antes do ensaio (por exemplo filtração, sedimentação, envelhecimento etc.):
|
Contagem de colónias microbianas
|
|
colónias/ml
|
|
|
|
colónias/ml
|
|
Outras características:
|
|
|
|
|
5.
|
DETERMINAÇÕES DE CARBONO:
Analisador de carbono:
|
|
N.o do balão
|
|
Carbono orgânico dissolvido após n dias (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Ensaio de: água do mar com a substância em estudo, enriquecida com nutrientes
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
média, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
média, Cb(t)
|
|
|
|
|
|
|
Branco de: água do mar sem a substância em estudo, enriquecida com nutrientes
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
média, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
média, Cd(t)
|
|
|
|
|
|
| média,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
AVALIAÇÃO DOS DADOS BRUTOS:
|
N.o do balão
|
Cálculo dos resultados
|
% de degradação após n dias
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|
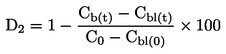
|
0
|
|
|
|
|
|
Média (33)
|
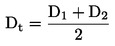
|
0
|
|
|
|
|
|
Nota:
|
Podem ser utilizados quadros semelhantes quando se realizar uma análise específica para acompanhar a degradação, bem como para a substância de referência e a experiência de verificação da toxicidade.
|
|
|
7.
|
DEGRADAÇÃO ABIÓTICA (facultativo)
|
|
Tempo (dias)
|
|
0
|
t
|
|
Concentração de carbono orgânico dissolvido (mg/l) no frasco de controlo estéril
|
Cce(o)
|
Cce(t)
|
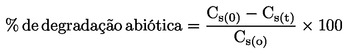
|
Apêndice 3
Cálculo da carência bioquímica de oxigénio teórica
MÉTODO DO FRASCO FECHADO
Calcula-se do seguinte modo a carência teórica de oxigénio (CTO) da substância CcHhClclNnNanaOoPpSs de peso molecular PM:
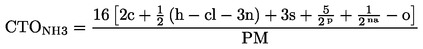
Este cálculo pressupõe a mineralização do C a CO2, do H a H2O, do P a P2O5 e do Na a Na2O. Os halogéneos são eliminados sob a forma de halogenetos de hidrogénio e o azoto sob a forma de amoníaco.
Exemplo:
Glucose: C6H12O6, PM = 180
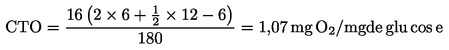
Calculam-se os pesos moleculares dos sais que não sejam de metais alcalinos pressupondo a hidrólise dos mesmos.
Considera-se que o enxofre é oxidado ao estado de oxidação +6.
Exemplo:
n-Dodecilbenzenossulfonato de sódio: C18H29SO3Na, PM = 348
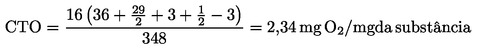
No caso das substâncias azotadas, o azoto pode ser eliminado sob a forma de amoníaco, nitritos ou nitratos, correspondentes a diferentes carências bioquímicas de oxigénio teóricas.


Admitindo que, no caso de uma amina secundária, a análise revelou a conversão total em nitratos:
(C12H25)2NH, PM = 353

Apêndice 4

Apêndice 5
Biodegradação na água do mar
MÉTODO DO FRASCO FECHADO
FOLHA DE DADOS
|
2.
|
DATA DE INÍCIO DO ENSAIO:
|
|
3.
|
SUBSTÂNCIA EM ESTUDO:
Nome:
|
Concentração da solução de reserva:
|
mg/l
|
|
Concentração inicial do meio de água do mar:
|
mg/l
|
|
CTO ou CQO:
|
mg de 02/mg de substância em estudo
|
|
|
4.
|
ÁGUA DO MAR:
Origem:
Data da colheita:
Profundidade da colheita:
Aspeto no momento da colheita (por exemplo turva etc.):
|
Salinidade no momento da colheita:
|
‰
|
|
Temperatura no momento da colheita:
|
°C
|
|
Carbono orgânico dissolvido “x” horas após a colheita:
|
mg/l
|
Tratamento prévio antes do ensaio (por exemplo filtração, sedimentação, envelhecimento etc.):
|
Contagem de colónias microbianas
|
|
colónias/ml
|
|
|
|
colónias/ml
|
|
Outras características:
|
|
|
|
|
5.
|
MEIO DE ENSAIO:
|
Temperatura após arejamento:
|
°C
|
|
Concentração de O2 após o arejamento e antes do início do ensaio:
|
mg O2/l
|
|
|
6.
|
DETERMINAÇÃO DO OXIGÉNIO DISSOLVIDO:
Método: Método de Winkler/elétrodo
|
|
N.o do frasco
|
|
mg de O2/l após n dias
|
|
0
|
5
|
15
|
28
|
|
Ensaio de: água do mar com a substância em estudo, enriquecida com nutrientes
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Média dos ensaios
|

|
|
|
|
|
|
Branco de: água do mar sem a substância em estudo, enriquecida com nutrientes
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Média dos brancos
|

|
|
|
|
|
Nota: Podem ser utilizados quadros semelhantes para a substância de referência e a experiência de verificação da toxicidade.
|
|
7.
|
DIMINUIÇÃO DO OXIGÉNIO DISSOLVIDO: % DE DEGRADAÇÃO ( % D):
|
|
Diminuição do oxigénio dissolvido após n dias
|
|
5
|
15
|
28
|
|
(mb
– mt
) (34)
|
|
|
|
|

|
|
|
|
|
C.43. ENSAIO DE BIODEGRADABILIDADE ANAERÓBIA DE SUBSTÂNCIAS ORGÂNICAS EM LAMAS DIGERIDAS: MÉTODO POR MEDIÇÃO DA PRODUÇÃO GASOSA
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 311 (2006) da OCDE. Existem vários ensaios de despistagem para avaliação da biodegradabilidade aeróbia de substâncias orgânicas (métodos de ensaio C.4, C.9, C.10 e C.11 (1) e Test Guideline TG 302C da OCDE (2)), cujos resultados têm sido utilizados com êxito para prever o devir de substâncias em meio aeróbio, em especial nos estádios aeróbios do tratamento de águas residuais. Proporções variáveis de substâncias insolúveis em água, bem como de substâncias adsorvidas aos sólidos das águas residuais, são igualmente sujeitas a tratamento aeróbio, pois estão presentes nas águas residuais decantadas. Porém, na sua maior parte, estas substâncias estão associadas às lamas de decantação primária, que são separadas das águas residuais não tratadas em tanques de decantação antes de o sobrenadante de águas residuais ser sujeito a tratamento aeróbio. Em seguida, as lamas, cujo líquido intersticial contém parte das substâncias solúveis, passam para digestores aquecidos, onde são sujeitas a tratamento anaeróbio. Até à data, não fazia parte desta série de métodos de ensaio nenhum método de avaliação da biodegradabilidade anaeróbia em digestores anaeróbios. O presente ensaio vem colmatar esta lacuna, mas não é necessariamente aplicável a outros compartimentos ambientais anóxicos.
|
|
2.
|
Têm sido utilizadas com êxito na avaliação da biodegradabilidade anaeróbia técnicas respirométricas que medem a quantidade de gases produzida em condições anaeróbias, sobretudo metano (CH4) e dióxido de carbono (CO2). Birch et al (3) passaram em revista esses métodos e concluíram que os trabalhos mais completos eram os de Shelton e Tiedje (4), que se baseavam em estudos anteriores (5)(6)(7). O método (4), que foi aperfeiçoado por outros investigadores (8) e foi adotado nas normas dos E.U.A. (9)(10), não resolveu os problemas relacionados com a diferença de solubilidade do CO2 e do CH4 no meio de ensaio e com o cálculo da produção teórica de gases da substância em estudo. Ao recomendar a medição suplementar do teor de carbono inorgânico dissolvido (CID) do líquido sobrenadante, o relatório do ECETOC (3) veio alargar o campo de aplicação desta técnica. O método do ECETOC foi objeto de um exercício de calibração internacional (estudo interlaboratorial comparativo) e foi adotado como norma ISO 11734 (11).
|
|
3.
|
O presente método de ensaio baseia-se na norma ISO 11734 (11) e descreve um método de despistagem para avaliação da biodegradabilidade anaeróbia potencial de substâncias orgânicas em condições específicas (num digestor anaeróbio, para um tempo definido e para uma gama determinada de concentrações de microrganismos). Dado que se utilizam lamas diluídas com uma concentração relativamente elevada da substância em estudo e que a duração do ensaio é normalmente maior do que o tempo de retenção nos digestores anaeróbios, as condições de ensaio não correspondem necessariamente às condições dos digestores anaeróbios nem o método é aplicável na avaliação da biodegradabilidade anaeróbia de substâncias orgânicas noutras condições ambientais. Expõem-se as lamas à substância em estudo durante um período que pode estender-se por 60 dias — mais longo, portanto, do que o tempo de retenção normal das lamas nos digestores anaeróbios (25 a 30 dias), embora os tempos de retenção possam ser muito mais longos em instalações industriais. Os resultados deste ensaio não permitem fazer previsões tão plausíveis como no caso da biodegradação aeróbia, pois os elementos recolhidos acerca do comportamento das substâncias estudadas em ensaios de biodegradabilidade aeróbia fácil e em ensaios de simulação e no ambiente aeróbio são suficientes para ter confiança na existência de uma conexão entre eles, ao passo que são escassos os elementos análogos relativamente ao ambiente anaeróbio. Pode considerar-se que a biodegradação anaeróbia é completa ao atingirem-se 75 % a 80 % da produção teórica de gases. As percentagens elevadas da substância em estudo relativamente à biomassa que são utilizadas neste ensaio implicam que, se uma substância se revelar biodegradável no ensaio, a probabilidade de se degradar num digestor anaeróbio será ainda maior. Por outro lado, as substâncias que não são convertidas em gases no ensaio podem não ser necessariamente persistentes em condições de percentagem da substância em relação à biomassa mais próximas da realidade ambiental. Além disso, ocorrem outras reações anaeróbias — por exemplo a descloração — que podem degradar as substâncias pelo menos parcialmente, mas este ensaio não as deteta. Porém, o recurso a determinados métodos analíticos de determinação da substância em estudo permite seguir o desaparecimento desta (ver os pontos 6, 30, 44 e 53).
|
PRINCÍPIO DO MÉTODO
|
4.
|
Diluem-se cerca de dez vezes lamas digeridas e lavadas (35) com baixa concentração (<10 mg/l) de carbono inorgânico (CI), de modo a obter uma concentração total de sólidos de 1 g/l a 3 g/l. Em seguida, incubam-se com a substância em estudo (na concentração de 20-100 mg C/l), em recipientes hermeticamente fechados, a 35 °C ± 2 °C, durante um período que pode estender-se por 60 dias. Mede-se a atividade das lamas em brancos do inóculo de lamas ensaiados em paralelo no mesmo meio, mas sem a substância em estudo.
|
|
5.
|
Mede-se o aumento de pressão no espaço livre acima da superfície do líquido nos recipientes, resultante da produção de dióxido de carbono e de metano. Nas condições do ensaio, muito do CO2 produzido dissolve-se na fase líquida ou transforma-se em carbonatos ou hidrogenocarbonatos. Determina-se este carbono inorgânico no final do ensaio.
|
|
6.
|
Calcula-se a quantidade de carbono (inorgânico e metano) resultante da biodegradação da substância em estudo a partir do excesso de produção de gases e do excesso de formação de carbono inorgânico na fase líquida, comparativamente aos valores apurados para os brancos. Calcula-se a biodegradação a partir do carbono metânico e do carbono inorgânico total produzidos, exprimindo-se o grau de biodegradação em percentagem da quantidade medida ou calculada de carbono incorporada pela substância em estudo. Pode acompanhar-se a evolução da biodegradação efetuando medições intermédias unicamente da produção de gases. Pode ainda determinar-se a biodegradação primária por meio de análises específicas efetuadas no início e no final do ensaio.
|
INFORMAÇÕES SOBRE A SUBSTÂNCIA EM ESTUDO
|
7.
|
Para uma interpretação correta dos resultados, há que conhecer o grau de pureza, a hidrossolubilidade, a volatilidade e as características de adsorção da substância em estudo. É necessário conhecer o teor de carbono orgânico (percentagem ponderal) da substância, seja a partir da estrutura química desta seja por medição. No caso das substâncias voláteis, é útil dispor de uma constante de Henry medida ou calculada para decidir se o ensaio é aplicável ou não. Dispor de informações sobre a toxicidade da substância em estudo para bactérias anaeróbias facilita a escolha de uma concentração de ensaio adequada e a interpretação de resultados indicadores de baixa biodegradabilidade. A menos que se saiba que a substância em estudo não inibe a atividade de microrganismos anaeróbios, recomenda-se a inclusão no ensaio de uma experiência de verificação do poder inibidor da substância [ver o ponto 21 e a norma ISO 13641-1 (12)].
|
APLICABILIDADE DO MÉTODO DE ENSAIO
|
8.
|
Este método de ensaio é aplicável a substâncias hidrossolúveis, mas pode ser igualmente aplicado a substâncias pouco solúveis e a substâncias insolúveis, desde que se utilize um método de dosagem exato [ver, por exemplo, a norma ISO 10634 (13)]. No caso das substâncias voláteis, há, em geral, que decidir caso a caso. Pode ser necessário tomar medidas especiais, por exemplo evitar a libertação de gases durante o ensaio.
|
SUBSTÂNCIAS DE REFERÊNCIA
|
9.
|
Para verificar o funcionamento do protocolo, ensaia-se em paralelo uma substância de referência, incluindo recipientes adequados no ensaio normal. O fenol, o benzoato de sódio e o poli(etilenoglicol) 400 são exemplos de substâncias de referência: em 60 dias, a degradação destas substâncias deve exceder 60 % da produção teórica de gases (metano e carbono inorgânico) (3)(14).
|
REPRODUTIBILIDADE DOS RESULTADOS DO ENSAIO
|
10.
|
Num estudo interlaboratorial comparativo internacional (14) houve boa reprodutibilidade das medições de pressão gasosa efetuadas em recipientes em triplicado. O desvio-padrão relativo (coeficiente de variação) foi quase sempre inferior a 20 %, embora tenha excedido com frequência 20 % na presença de substâncias tóxicas ou para o final do período de incubação de 60 dias. Os desvios também foram maiores nos recipientes de volume inferior a 150 ml. Os valores finais de pH do meio de ensaio situaram-se na gama 6,5-7,0.
|
|
11.
|
Obtiveram-se os seguintes resultados no estudo interlaboratorial comparativo:
|
Substância em estudo
|
N.o total de resultados
n1
|
Degradação média
(com base na totalidade dos resultados)
(%)
|
Desvio-padrão relativo
(com base na totalidade dos resultados)
(%)
|
Resultados válidos
n2
|
Degradação média
(com base nos resultados válidos)
(%)
|
Desvio-padrão relativo
(com base nos resultados válidos)
(%)
|
Degradação superior a 60 % nos ensaios válidos
n3
|
|
Ácido palmítico
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (36)
|
|
Poli(etilenoglicol) 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (36)
|
|
|
12.
|
Os coeficientes de variação da média de todos os valores obtidos com ácido palmítico e com poli(etilenoglicol) 400 atingiram, respetivamente, 45 % (n = 36) e 35 % (n = 38). Pondo de parte os valores de degradação inferiores a 40 % e superiores a 100 % (os primeiros atribuídos a condições sub-ótimas e os segundos a causas desconhecidas), os coeficientes de variação diminuem para 26 % e 23 %, respetivamente. A proporção de valores “válidos” que atingiram pelo menos 60 % de degradação foi de 70 % no caso do ácido palmítico e de 83 % no caso do poli(etilenoglicol) 400. A proporção das percentagens de biodegradação obtidas a partir de medições de carbono inorgânico dissolvido foi variável, mas relativamente baixa. No caso do ácido palmítico, variaram entre 0 e 35 %, com 12 % de média e 92 % de coeficiente de variação; no caso do poli(etilenoglicol) 400, variaram entre 0 e 40 %, com 24 % de média e 54 % de coeficiente de variação.
|
DESCRIÇÃO DO MÉTODO DE ENSAIO
Material e aparelhagem
|
13.
|
Além do equipamento normal de laboratório, é necessário o seguinte:
|
a)
|
Incubador à prova de faíscas e termostatizado a 35 °C ± 2 °C;
|
|
b)
|
Recipientes de ensaio de vidro resistentes à pressão, de capacidade nominal adequada (37), cada um dos quais dotado de um septo estanque a gases e capaz de suportar cerca de 2 bar. O volume acima da superfície do líquido deve representar 10 % a 30 % do volume total. Se a libertação de biogás for regular, é adequado um volume acima da superfície do líquido de aproximadamente 10 %; se a libertação de gases se verificar apenas no final do ensaio, é adequado um volume acima da superfície do líquido de 30 %. Se a pressão for libertada de cada vez que se colhem amostras, recomenda-se a utilização de garrafas de soro de vidro com 125 ml de volume nominal e volume total de aproximadamente 160 ml, seladas com septos próprios (38) fixados com sobrecápsulas de alumínio;
|
|
c)
|
Dispositivo de medição da pressão (39) adaptado à medição e à evacuação dos gases produzidos, por exemplo um manómetro manual de precisão ligado a uma agulha de seringa adequada. Uma válvula de três vias estanque aos gases facilita a libertação do excesso de pressão (apêndice 1). É necessário que o volume interno das tubagens e da válvula do transdutor de pressão seja o menor possível, para que os erros resultantes de não se considerar o volume do equipamento sejam insignificantes;
Nota: Utilizam-se as leituras de pressão para calcular diretamente a quantidade de carbono produzido presente no espaço livre acima da superfície do líquido (pontos 42 a 44). Outra possibilidade é a conversão, por meio de um gráfico de conversão, das leituras de pressão em volumes (a 35 °C e à pressão atmosférica) de gases produzidos. Traça-se este gráfico a partir de dados obtidos por injeção de volumes conhecidos de azoto numa série de recipientes de ensaio (por exemplo garrafas de soro) a 35 °C +/- 2 °C e registo das leituras de pressão resultantes, uma vez estabilizadas (ver o apêndice 2). Explica-se o modo de cálculo na nota do ponto 44.
Precaução: Ao utilizar microsseringas, é necessário ter cuidado para evitar picadas das agulhas.
|
|
d)
|
Analisador de carbono adequado para determinação direta de carbono inorgânico entre 1 mg/l e 200 mg/l;
|
|
e)
|
Seringas de elevada precisão para amostras gasosas e líquidas;
|
|
f)
|
Agitadores magnéticos com as respetivas barras de agitação (facultativo);
|
|
g)
|
Câmara com luvas (recomendado).
|
|
Reagentes
|
14.
|
Utilizam-se reagentes de qualidade analítica em todo o ensaio.
|
Água
|
15.
|
Água destilada ou desionizada (desoxigenada por borbulhamento com azoto que contenha menos de 5 μl de oxigénio por litro), com menos de 2 mg de carbono orgânico dissolvido por litro.
|
Meio de ensaio
|
16.
|
Prepara-se um meio de diluição com as seguintes quantidades dos componentes indicados:
|
Di-hidrogenofosfato de potássio anidro (KH2PO4)
|
0,27 g
|
|
Hidrogenofosfato de dissódio dodeca-hidratado (Na2HPO4 × 12H2O)
|
1,12 g
|
|
Cloreto de amónio (NH4Cl)
|
0,53 g
|
|
Cloreto de cálcio di-hidratado (CaC12 × 2H2O)
|
0,075 g
|
|
Cloreto de magnésio hexa-hidratado (MgCl2 × 6H2O)
|
0,10 g
|
|
Cloreto de ferro (II) tetra-hidratado (FeCl2 × 4H2O)
|
0,02 g
|
|
Resazurina (indicador de oxigénio)
|
0,001 g
|
|
Sulfureto de sódio nona-hidratado (Na2S × 9H2O)
|
0,10 g
|
|
Solução de reserva de elementos vestigiais (facultativo; ver o ponto 18)
|
10 ml
|
|
Água desoxigenada (ponto 15)
|
completar o volume até 1 litro
|
Nota: Para garantir suficiente capacidade redutora, é necessário utilizar sulfureto de sódio recente ou então é necessário lavá-lo e secá-lo antes de o utilizar. Este ensaio pode ser realizado sem recorrer a uma câmara com luvas (ver o ponto 26). Nesse caso, aumenta-se a concentração final de sulfureto de sódio do meio para 0,20 g de Na2S×9H2O por litro. Pode igualmente adicionar-se o sulfureto de sódio utilizando uma solução de reserva anaeróbia adequada, injetando-o através do septo dos recipientes de ensaio fechados, processo que diminui o risco de oxidação. Pode substituir-se o sulfureto de sódio por citrato de titânio (III), a injetar através do septo dos recipientes de ensaio fechados de modo a obter uma concentração final de 0,8-1,0 mmol/l. O citrato de titânio (III) é um agente redutor muito eficaz e de baixa toxicidade. Prepara-se dissolvendo 2,94 g de citrato de trissódio di-hidratado em 50 ml de água desoxigenada (de modo a obter uma solução com a concentração de 200 mmol/l) e adicionando 5 ml de solução a 15 % (m/v) de cloreto de titânio (III); neutraliza-se a pH 7 ± 0,2 com uma base mineral e transfere-se para um recipiente adequado sob corrente de azoto. A concentração de citrato de titânio (III) nesta solução de reserva é de 164 mmol/l.
|
|
17.
|
Misturam-se os componentes do meio de ensaio (exceto o agente redutor — sulfureto de sódio ou citrato de titânio) e, imediatamente antes da utilização, faz-se borbulhar azoto na solução durante 20 minutos, para remover o oxigénio. Em seguida, mesmo antes de utilizar o meio, adiciona-se o volume adequado de solução do agente redutor preparada de fresco (em água desoxigenada). Se necessário, ajusta-se o pH do meio a 7 ± 0,2 com uma base ou um ácido mineral diluído.
|
Solução de reserva de elementos vestigiais (facultativo)
|
18.
|
Para melhorar o processo de degradação anaeróbia, em especial se a concentração do inóculo for baixa (por exemplo 1 g/l), recomenda-se que o meio de ensaio contenha os seguintes elementos vestigiais (11):
|
Cloreto de manganês tetra-hidratado (MnCl2 × 4H2O)
|
50 mg
|
|
Ácido bórico (H3BO3)
|
5 mg
|
|
Cloreto de zinco (ZnCl2)
|
5 mg
|
|
Cloreto de cobre (II) (CuCl2)
|
3 mg
|
|
Molibdato de dissódio di-hidratado (Na2MoO4 × 2H2O)
|
1 mg
|
|
Cloreto de cobalto hexa-hidratado (CoCl2 × 6H2O)
|
100 mg
|
|
Cloreto de níquel hexa-hidratado (NiCl2 × 6H2O)
|
10 mg
|
|
Selenito de dissódio (Na2SeO3)
|
5 mg
|
|
Água desoxigenada (ponto 15)
|
completar o volume até 1 litro
|
|
Substância em estudo
|
19.
|
Adiciona-se a substância em estudo por meio de uma solução, suspensão ou emulsão de reserva ou diretamente no estado sólido ou líquido ou ainda adsorvida num filtro de fibras de vidro, de modo a obter uma concentração não superior a 100 mg de carbono orgânico por litro. Caso se recorra a soluções de reserva, prepara-se uma solução aquosa adequada (água previamente desoxigenada por borbulhamento com azoto, ponto 15) cuja concentração permita adicionar um volume inferior a 5 % do volume total da mistura reacional. Se necessário, ajusta-se o pH da solução de reserva a 7 ± 0,2. Caso o estudo incida em substâncias insuficientemente solúveis em água, deve consultar-se a norma ISO 10634 (13). Se for utilizado um solvente, realiza-se uma experiência de controlo adicional, adicionando ao meio inoculado apenas o solvente. Não podem ser utilizados solventes orgânicos que reconhecidamente inibam a produção de metano, como clorofórmio ou tetracloreto de carbono.
Precaução: As substâncias em estudo tóxicas e aquelas cujas propriedades sejam desconhecidas devem ser manuseadas com cuidado.
|
Substâncias de referência
|
20.
|
Para verificar o funcionamento do protocolo, foram utilizadas com êxito substâncias de referência como o benzoato de sódio, o fenol e o poli(etileno glicol) 400, que se degradam mais de 60 % em 60 dias. Prepara-se uma solução de reserva (em água desoxigenada) da substância de referência escolhida do mesmo modo que para a substância em estudo e, se necessário, ajusta-se o pH a 7 ± 0,2.
|
Experiência de verificação do poder inibidor (facultativo)
|
21.
|
A fim de obter informações sobre a toxicidade da substância em estudo para microrganismos anaeróbios e de determinar a concentração mais adequada a utilizar no ensaio, adiciona-se a substância em estudo e a substância de referência a um recipiente no qual se introduziu previamente o meio de ensaio (ver o ponto 16), de modo a obter concentrações daquelas idênticas às utilizadas no ensaio [ver os pontos 19 e 20 e a norma ISO 13641-1 (12)].
|
Lamas digeridas
|
22.
|
Colhem-se amostras de lamas digeridas no digestor de uma estação de tratamento de águas residuais que trate predominantemente efluentes domésticos. É necessário caracterizar completamente as lamas e inscrever no relatório as informações pertinentes relativas à origem das mesmas (ver o ponto 54). Caso se pretenda utilizar um inóculo adaptado, pode ponderar-se a colheita das lamas digeridas numa estação de tratamento de efluentes industriais. Para a colheita das lamas digeridas, utilizam-se garrafas expansíveis de gargalo largo, de polietileno de alta densidade ou de matéria similar. Enchem-se os recipientes de lamas até cerca de 1 cm da abertura dos mesmos e fecham-se hermeticamente, de preferência com uma válvula de segurança. Depois de transportadas para o laboratório, as lamas podem ser utilizadas diretamente ou ser colocadas num digestor laboratorial. Liberta-se o excesso de gases abrindo as garrafas de lamas cuidadosamente. Em alternativa, podem ser utilizadas como fonte inoculadora lamas anaeróbias produzidas no laboratório, mas o espetro de atividade destas pode estar alterado.
Precaução: As lamas digeridas comportam um risco de incêndio e de explosão, devido aos gases inflamáveis que produzem. Contêm ainda organismos potencialmente patogénicos. Por conseguinte, são necessárias precauções especiais ao manusear lamas. Por razões de segurança, não é conveniente utilizar recipientes de vidro para colher amostras de lamas.
|
|
23.
|
A fim de reduzir a produção de fundo de gases e de diminuir a influência dos brancos, é de ponderar a digestão prévia das lamas. Caso se considere necessária uma digestão prévia, deixam-se as lamas em processo de digestão a 35 °C ± 2 °C, durante um período não superior a 7 dias, sem lhes adicionar nenhum nutriente ou substrato. No caso de um pequeno número de substâncias, verificou-se nos ensaios que uma digestão prévia de cerca de 5 dias normalmente otimiza a redução da produção gasosa do branco, sem dilatação inaceitável do período de latência ou do período de incubação durante o ensaio nem perdas de atividade.
|
|
24.
|
No caso do estudo de substâncias que sejam ou se preveja que sejam pouco biodegradáveis, é de ponderar a exposição prévia das lamas à substância em estudo, a fim de obter um inóculo mais adaptado. Nessa eventualidade, adiciona-se a substância em estudo, à razão de 5-20 mg de carbono orgânico por litro, às lamas digeridas e incuba-se a mistura durante um período não superior a duas semanas. Antes de as utilizar, lavam-se cuidadosamente as lamas pré-expostas (ver o ponto 25). As condições desta exposição prévia devem constar do relatório do ensaio.
|
Inóculo
|
25.
|
Para reduzir a menos de 10 mg/l a concentração de carbono inorgânico na suspensão final a ensaiar, lavam-se as lamas (ver os pontos 22 a 24) imediatamente antes da utilização. Centrifugam-se as lamas em tubos hermeticamente fechados (por exemplo 3 000 g durante 5 minutos) e descarta-se o sobrenadante. Prepara-se uma suspensão do depósito em meio desoxigenado (pontos 16 e 17), centrifuga-se esta nova suspensão e descarta-se o líquido sobrenadante. Se o teor de carbono inorgânico não for suficientemente diminuído, pode repetir-se esta lavagem das lamas ainda por duas vezes, no máximo. Esta operação parece não prejudicar os microrganismos. No final, prepara-se nova suspensão do depósito no volume requerido de meio de ensaio e determina-se a concentração total de sólidos (ver, por exemplo, a norma ISO 11923 (15)]. A concentração final de sólidos totais nos recipientes de ensaio deve situar-se entre 1 g/l e 3 g/l (ou cerca de 10 % da dita concentração nas lamas digeridas não-diluídas). Estas operações devem ser realizadas de modo a evitar ao máximo o contacto das lamas com oxigénio (por exemplo, pode utilizar-se uma atmosfera de azoto).
|
PROTOCOLO DE ENSAIO
|
26.
|
Nas etapas iniciais a seguir descritas, é importante utilizar técnicas que reduzam ao mínimo praticável o contacto entre as lamas digeridas e oxigénio; por exemplo, pode ser necessário trabalhar em atmosfera de azoto numa câmara com luvas e/ou purgar as garrafas com azoto (4).
|
Preparação dos recipientes de ensaio e dos recipientes de controlo
|
27.
|
Preparam-se, pelo menos, recipientes em triplicado [ver o ponto 13, alínea b)] para a substância em estudo, o branco, a substância de referência e a experiência de verificação do poder inibidor (se for caso disso), assim como das câmaras de controlo da pressão (facultativo) (ver os pontos 7 e 19 a 21). Podem igualmente ser preparados recipientes adicionais para avaliação da biodegradação primária por meio de análises específicas da substância em estudo. Desde que os volumes livres acima da superfície do líquido sejam homogéneos, pode utilizar-se a mesma série de brancos para estudar várias substâncias no mesmo ensaio.
|
|
28.
|
Prepara-se o inóculo diluído antes de o transferir para os recipientes (recorrendo, por exemplo, a uma pipeta de boca larga). Transferem-se alíquotas de inóculo bem misturado (ponto 25), para que a concentração total de sólidos seja a mesma em todos os recipientes (entre 1 g/l e 3 g/l). Ajusta-se, se necessário, o pH a 7 ± 0,2 e adicionam-se em seguida as soluções de reserva da substância em estudo e da substância de referência, pela via mais adequada (ponto 19).
|
|
29.
|
A concentração experimental de carbono orgânico situa-se normalmente entre 20 mg/l e 100 mg/l (ponto 4). Se a substância em estudo for tóxica, reduz-se a concentração experimental a 20 mg de C/l — ou mesmo mais, caso se pretenda medir apenas a biodegradação primária, por meio de análises específicas. Importa ter presente que a variabilidade dos resultados do ensaio aumenta a baixas concentrações experimentais.
|
|
30.
|
Nos recipientes do branco, em vez de solução, suspensão ou emulsão de reserva, adiciona-se uma quantidade equivalente do veículo utilizado para a substância em estudo. Se a substância em estudo tiver sido adicionada por meio de filtros de fibra de vidro ou de solventes orgânicos, adiciona-se aos brancos um filtro ou um volume de solvente equivalente ao evaporado. Prepara-se um replicado adicional com a substância em estudo para determinação do valor do pH. Se necessário, ajusta-se o pH a 7 ± 0,2 com pequenas quantidades de um ácido ou de uma base minerais diluídos. Adicionam-se as mesmas quantidades de agentes neutralizantes a todos os recipientes de ensaio. Estas adições não devem ser necessárias porque o pH das soluções de reserva da substância em estudo e da substância de referência foi previamente ajustado (ver os pontos 19 e 20). Caso se pretenda medir a biodegradação primária, colhe-se uma amostra adequada no recipiente destinado à verificação do pH, ou num recipiente de ensaio adicional, e determina-se a concentração da substância em estudo por meio de análises específicas. Se as misturas reacionais forem agitadas (facultativo), colocam-se barras magnéticas revestidas em todos os recipientes.
|
|
31.
|
É necessário que o volume total de líquido, V1, e o volume do espaço livre acima da superfície do líquido, Vh, sejam idênticos em todos os recipientes (anotar e registar os valores de V1 e Vh). Fecha-se hermeticamente cada recipiente com um septo estanque a gases e transferem-se os recipientes da câmara de luvas (ver o ponto 26) para o incubador [ver o ponto 13, alínea a)].
|
Estudo de substâncias insolúveis
|
32.
|
No caso das substâncias pouco hidrossolúveis, pesam-se quantidades adequadas das substâncias em causa e adicionam-se diretamente aos recipientes já preparados. Se for necessário utilizar um solvente (ver o ponto 19), transfere-se a solução ou suspensão da substância em estudo para recipientes vazios. Se possível, evapora-se o solvente passando uma corrente de azoto através dos recipientes e adicionam-se em seguida os outros ingredientes, nomeadamente as lamas diluídas (ponto 25) e a água desoxigenada necessárias. Prepara-se igualmente uma experiência adicional de controlo do solvente (ver o ponto 19). A norma ISO 10634 (13) apresenta outros métodos de adição de substâncias insolúveis. Se for de prever que o pH inicial não exceda 7 ± 1, as quantidades necessárias de substâncias em estudo líquidas podem ser introduzidas com uma seringa em recipientes já completamente preparados e hermeticamente fechados; caso contrário, procede-se como foi descrito (ponto 19).
|
Incubação e medições da pressão gasosa
|
33.
|
Incubam-se os recipientes preparados, a 35 °C ± 2 °C, durante cerca de uma hora, para que atinjam o equilíbrio, e liberta-se o excesso de gases para a atmosfera, por exemplo agitando os recipientes um a um, introduzindo a seringa do manómetro [ponto 13, alínea c)] através do septo e abrindo a válvula, até o manómetro indicar o valor zero. Se, nesta fase, ou quando das medições intermédias, a pressão no espaço livre acima da superfície do líquido for inferior à pressão atmosférica, é necessário injetar azoto para restabelecer a pressão atmosférica. Em seguida, fecha-se a válvula [ponto 13, alínea c)] e continua a incubar-se na obscuridade, procedendo de modo que todas as partes dos recipientes sejam mantidas à temperatura de digestão. Após 24-48 horas de incubação, examinam-se os recipientes. Rejeitam-se os que apresentem uma coloração rosa distinta no líquido sobrenadante, reveladora da mudança de cor da resazurina (ponto 16), indicativa da presença de oxigénio (ver o ponto 50). Embora o sistema possa tolerar pequenas quantidades de oxigénio, concentrações mais elevadas podem inibir fortemente a biodegradação anaeróbia. É aceitável a rejeição esporádica de um dos recipientes de um triplicado, mas a necessidade de rejeições mais frequentes exige uma verificação dos protocolos experimentais e a repetição do ensaio.
|
|
34.
|
Mistura-se cuidadosamente o conteúdo de cada recipiente por meio do agitador magnético ou agitando o próprio recipiente, durante alguns minutos, pelo menos duas ou três vezes por semana e pouco antes de cada medição de pressão. A agitação volta a dispersar o inóculo na suspensão e promove o equilíbrio gasoso. É necessário que as medições de pressão sejam efetuadas com rapidez, para evitar que a temperatura dos recipientes de ensaio baixe e origine leituras erradas. Ao medir a pressão, há que manter a totalidade do recipiente de ensaio, incluindo o espaço livre acima da superfície do líquido, à temperatura de digestão. Para medir a pressão gasosa, pode, por exemplo, introduzir-se através do septo a agulha de uma seringa [ponto 13, alínea c] ligada ao manómetro. Há que tomar as precauções necessárias para evitar a entrada de água na agulha. Se isso acontecer, secam-se as partes húmidas e utiliza-se outra agulha. Mede-se a pressão em milibares (ponto 42). Pode medir-se periodicamente a pressão gasosa nos recipientes (por exemplo semanalmente) e, facultativamente, libertar-se o excesso de gases para a atmosfera. Em alternativa, mede-se a pressão apenas no final do ensaio, para determinar a quantidade de biogás produzida.
|
|
35.
|
Recomenda-se a realização de leituras intermédias da pressão gasosa, pois o aumento da pressão dá indicações quanto ao momento de pôr termo ao ensaio e permite seguir a cinética do processo (ver o ponto 6).
|
|
36.
|
Normalmente, põe-se termo ao ensaio após 60 dias de incubação, a menos que a curva de biodegradação obtida a partir das medições de pressão atinja antes um patamar (fase na qual a degradação máxima já foi atingida e a curva de biodegradação estabilizou). Se o valor correspondente ao patamar for inferior a 60 %, a interpretação é problemática, pois um resultado deste tipo é indicativo de mineralização parcial da molécula ou da ocorrência de um erro. Se, no final do período normal de incubação, persistir a produção de gases mas não se tiver manifestamente atingido um patamar, é de ponderar a continuação do ensaio, para verificar se a curva de biodegradação atinge um patamar (>60 %).
|
Medição do carbono inorgânico
|
37.
|
No final do ensaio, após a última medição de pressão gasosa, deixam-se as lamas decantar. Abrem-se os recipientes um a um e colhe-se de imediato em cada um deles uma amostra para determinação da concentração (mg/l) de carbono inorgânico no líquido sobrenadante. Não se centrifuga nem filtra o líquido sobrenadante, pois haveria uma perda inaceitável de dióxido de carbono dissolvido. Caso não seja possível analisar o líquido sobrenadante logo após a colheita das amostras, guarda-se o mesmo durante um máximo de dois dias em frascos hermeticamente fechados totalmente cheios, refrigerados a cerca de 4 °C. Depois de medido o carbono inorgânico, mede-se e regista-se o valor do pH.
|
|
38.
|
Em alternativa, pode determinar-se indiretamente o carbono inorgânico no líquido sobrenadante através da medição, no espaço livre acima da superfície do líquido, do dióxido de carbono libertado pelo carbono inorgânico dissolvido. Para isso, após a última medição de pressão gasosa, ajusta-se a pressão em cada recipiente de ensaio à pressão atmosférica. Em seguida, adicionando através do septo dos recipientes hermeticamente fechados um ácido mineral concentrado (por exemplo H2SO4), acidifica-se o conteúdo de cada recipiente a pH aproximadamente 1. Agitam-se os recipientes e incubam-se a 35 °C ± 2 °C durante aproximadamente 24 horas, medindo-se em seguida com o manómetro a pressão gasosa resultante do dióxido de carbono libertado.
|
|
39.
|
Efetuam-se leituras análogas nos recipientes dos brancos e da substância de referência e, se for o caso, nos recipientes de verificação do poder inibidor (ver o ponto 21).
|
|
40.
|
Em alguns casos, em especial se forem utilizados os mesmos recipientes de controlo para várias substâncias em estudo, é de ponderar a realização de medições intermédias das concentrações de carbono inorgânico nos recipientes de ensaio e de controlo. Nessa eventualidade, é necessário preparar um número de recipientes suficiente para as medições intermédias. É preferível proceder assim, em vez de colher todas as amostras no mesmo recipiente. Esta última possibilidade só é admissível se o volume necessário para a análise do carbono inorgânico dissolvido não for demasiado elevado. Para medir o carbono inorgânico dissolvido, não se liberta o excesso de gases após medição da pressão gasosa e procede-se do seguinte modo:
|
—
|
sem abrir os recipientes e introduzindo uma seringa através do septo, colhe-se o menor volume possível de amostra do líquido sobrenadante e determina-se o carbono inorgânico de cada amostra;
|
|
—
|
depois de colhida a amostra, pode ou não evacuar-se o excesso de gases;
|
|
—
|
há que ter em conta que mesmo um pequeno decréscimo do volume do líquido sobrenadante (por exemplo 1 %) pode aumentar significativamente o volume (Vh) dos gases existentes no espaço livre acima da superfície desse líquido;
|
|
—
|
se necessário, corrigem-se as equações (ver o ponto 44) aumentando Vh na equação 3.
|
|
Análises específicas
|
41.
|
Caso se pretenda determinar a degradação anaeróbia primária (ver o ponto 30), colhe-se no início e no final do ensaio, para a realização de análises específicas, um volume adequado de amostra nos recipientes que contêm a substância em estudo. Ao proceder-se deste modo, os volumes do espaço livre acima da superfície do líquido (Vh) e o volume de líquido (Vl) modificar-se-ão e é necessário tê-lo em conta no cálculo dos resultados da produção de gases. Em alternativa, as amostras para realização de análises específicas podem ser colhidas em misturas adicionais previamente preparadas para este efeito (ponto 30).
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
42.
|
Por razões práticas, mede-se a pressão gasosa em milibares (1 mbar = 1 hPa = 102 Pa; 1 Pa = 1 N/m2), o volume em litros e a temperatura em graus Celsius.
|
Carbono presente no espaço livre acima da superfície do líquido
|
43.
|
Dado que uma mole de metano e uma mole de dióxido de carbono contêm, cada uma, 12 g de carbono, pode exprimir-se do seguinte modo a massa de carbono num determinado volume de gases libertado:
|
m= 12 × 103×n
|
Equação [1]
|
em que:
|
m
|
=
|
massa de carbono (mg) num dado volume de gases libertado;
|
|
12
|
=
|
massa atómica relativa do carbono;
|
|
n
|
=
|
número de moles de gases no volume em causa.
|
Caso seja gerado em quantidades consideráveis outro gás além do metano e do dióxido de carbono (por exemplo N2O), é necessário alterar a equação [1] de modo a descrever os efeitos potenciais dos gases gerados.
|
|
44.
|
De acordo com a lei dos gases perfeitos, pode exprimir-se n do seguinte modo:
|
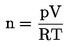
|
Equação [2]
|
em que:
|
p
|
=
|
pressão gasosa (em pascal);
|
|
V
|
=
|
volume dos gases (m3);
|
|
R
|
=
|
constante universal dos gases perfeitos [8,314 J/(molK)];
|
|
T
|
=
|
temperatura de incubação (kelvin).
|
Combinando as equações [1] e [2] e introduzindo as adaptações necessárias para ter em conta a produção gasosa do branco, obtém-se:
|
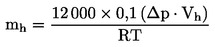
|
Equação [3]
|
em que:
|
mh
|
=
|
massa líquida de carbono gasoso no espaço livre acima da superfície do líquido (mg);
|
|
Dp
|
=
|
resultado da subtração, à média da diferença entre as pressões inicial e final nos recipientes de ensaio, da média correspondente nos recipientes do branco (milibar);
|
|
Vh
|
=
|
volume do espaço livre acima da superfície do líquido (l);
|
|
0,1
|
=
|
fator de conversão de newton/m2 em milibar e de m3 em litro.
|
Para a temperatura de incubação normal (35 °C = 308 K), utiliza-se a equação [4]:
|
mh
= 0,468(Δp·Vh
)
|
Equação [4]
|
Nota: Cálculo alternativo do volume — Conversão das leituras manométricas em mililitros de gases produzidos utilizando a curva de referência obtida por representação das leituras manométricas em função do volume injetado (ml) (apêndice 2). Calcula-se o número de moles (n) de gases presentes no espaço livre acima da superfície do líquido de cada recipiente dividindo a produção gasosa acumulada (ml) por 25 286 ml/mole, que representa o volume ocupado por uma mole de gases à pressão atmosférica normal e 35 °C. Dado que uma mole de CH4 e uma mole de CO2 contêm, cada uma, 12 g de carbono, pode exprimir-se pela equação [5] a quantidade de carbono (mh
, em miligrama) presente no espaço livre acima da superfície do líquido:
|
mh
= 12 × 103×n
|
Equação [5]
|
Adaptando esta equação de modo a ter em conta a produção gasosa do branco, obtém-se a seguinte equação:
|

|
Equação [6]
|
em que:
|
mh
|
=
|
massa líquida de carbono gasoso no espaço livre acima da superfície do líquido (mg);
|
|
DV
|
=
|
média da diferença entre o volume de gases no espaço livre acima da superfície do líquido nos recipientes de ensaio e nos recipientes do branco;
|
|
25 286
|
=
|
volume ocupado por uma mole de gases a 35 °C e a uma atmosfera.
|
|
|
45.
|
Pode acompanhar-se a biodegradação representando o aumento de pressão acumulado, Dp (milibar), em função do tempo. A partir desta curva, identifica-se e regista-se a fase de latência (dias). A fase de latência é a que decorre desde o início do ensaio até começar uma degradação significativa (ver exemplo no apêndice 3). Caso tenham sido colhidas e analisadas amostras intermédias do líquido sobrenadante (ver os pontos 40, 46 e 47), pode representar-se graficamente a função do carbono total produzido (acumulado na fase gasosa e na fase líquida), em vez da pressão acumulada unicamente.
|
Carbono presente no líquido
|
46.
|
Despreza-se a quantidade de metano no líquido, pois sabe-se que a hidrossolubilidade deste gás é muito baixa. Calcula-se a massa de carbono inorgânico no líquido dos recipientes de ensaio por meio da seguinte equação:
em que:
|
ml
|
=
|
massa de carbono inorgânico no líquido (mg);
|
|
Cnet
|
=
|
diferença entre a concentração de carbono inorgânico nos recipientes de ensaio e a concentração de carbono inorgânico nos recipientes de controlo, no final do ensaio (mg/l);
|
|
Vl
|
=
|
volume de líquido no recipiente (l).
|
|
Carbono gaseificado total
|
47.
|
Calcula-se a massa total de carbono gaseificado em cada recipiente por meio da seguinte equação:
em que:
|
|
mt = massa total de carbono gaseificado (mg);
|
|
|
mh
e ml
são definidos acima.
|
|
Carbono da substância em estudo
|
48.
|
Calcula-se a massa de carbono em cada recipiente de ensaio, proveniente da substância em estudo adicionada, por meio da seguinte equação:
em que:
|
mv
|
=
|
massa de carbono proveniente da substância em estudo (mg);
|
|
Cc
|
=
|
concentração de carbono proveniente da substância em estudo no recipiente de ensaio (mg/l);
|
|
Vl
|
=
|
volume de líquido no recipiente de ensaio (l).
|
|
Grau de biodegradação
|
49.
|
Por meio da equação [10], calcula-se a percentagem de biodegradação a partir dos gases presentes no espaço livre acima da superfície do líquido; por meio da equação [11], calcula-se a percentagem total de biodegradação:
|
Dh
= (mh
/mv
) × 100
|
Equação [10]
|
|
Dt
= (mt
/mv
) × 100
|
Equação [11]
|
em que:
|
|
Dh = biodegradação com base nos gases presentes no espaço livre acima da superfície do líquido ( %);
|
|
|
Dt = biodegradação total ( %);
|
|
|
mh
, mv
e mt
são definidas acima.
|
Calcula-se o grau de biodegradação primária por meio da equação [12], a partir de medições (facultativas) da concentração da substância em estudo no início e no final da incubação:
|
Dp
= (1 –Se
/Si
) × 100
|
Equação [12]
|
em que:
|
Dp
|
=
|
degradação primária da substância em estudo ( %);
|
|
Si
|
=
|
concentração inicial da substância em estudo (mg/l);
|
|
Sf
|
=
|
concentração final da substância em estudo (mg/l).
|
Se o método de análise indicar concentrações significativas da substância em estudo no inóculo inalterado de lamas anaeróbias, utiliza-se a equação [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Equação [13]
|
em que:
|
Dp
1
|
=
|
degradação primária corrigida da substância em estudo ( %);
|
|
Sib
|
=
|
concentração inicial “aparente” da substância em estudo nos brancos (mg/l);
|
|
Sfb
|
=
|
concentração final “aparente” da substância em estudo nos brancos (mg/l).
|
|
Validade dos resultados
|
50.
|
Apenas se podem utilizar leituras de pressão relativas a recipientes que não evidenciem coloração rosa (ver o ponto 33). Minimiza-se a contaminação por oxigénio recorrendo a técnicas adequadas de manipulação anaeróbia.
|
|
51.
|
Pode considerar-se o ensaio válido se a substância de referência atingir um patamar que represente mais de 60 % de biodegradação (40).
|
|
52.
|
Se, no final do ensaio, o pH não estiver compreendido no intervalo 7 ± 1 e a percentagem de biodegradação verificada for insuficiente, repete-se o ensaio aumentando o poder de tamponamento do meio.
|
Inibição da degradação
|
53.
|
A produção de gases nos recipientes que contêm a substância em estudo e a substância de referência tem de ser, pelo menos, igual à produção de gases nos recipientes que contêm apenas a substância de referência. A situação contrária indicia inibição da produção gasosa. Em alguns casos, a produção de gases nos recipientes que contêm a substância em estudo, mas não a substância de referência, pode ser inferior à produção de gases dos brancos, constituindo isso indício de poder inibidor da substância em estudo.
|
Relatório do ensaio
|
54.
|
Elementos a constar do relatório do ensaio:
|
|
Substância em estudo
|
—
|
denominação comum, denominação química, número CAS, fórmula estrutural e propriedades físico-químicas pertinentes;
|
|
—
|
grau de pureza da substância (presença de impurezas);
|
|
|
|
Condições de realização do ensaio
|
—
|
volume do líquido diluído do digestor (Vl
) e volume do espaço livre acima da superfície do líquido (Vh
) em cada recipiente;
|
|
—
|
descrição dos recipientes de ensaio, das principais características da medição do biogás (por exemplo o tipo de manómetro) e do analisador de carbono inorgânico;
|
|
—
|
aplicação da substância em estudo e da substância de referência ao sistema de ensaio: concentrações utilizadas no ensaio e eventual utilização de solventes;
|
|
—
|
caracterização do inóculo utilizado: nome da estação de tratamento de águas residuais, descrição da fonte de águas residuais tratada (por exemplo temperatura de funcionamento, tempo de retenção das lamas, origem predominantemente doméstica ou não etc.), concentração, informações necessárias para fundamentar o que precede e informações sobre eventuais tratamentos prévios do inóculo (por exemplo digestão ou exposição prévias);
|
|
—
|
temperatura de incubação;
|
|
|
|
Resultados
|
—
|
valores de pH e do carbono inorgânico no final do ensaio;
|
|
—
|
caso tenham sido efetuadas medições específicas, concentração da substância em estudo no início e no final do ensaio;
|
|
—
|
quadros com todos os dados medidos nos recipientes de ensaio, dos brancos e da substância de referência e, se for caso disso, nos recipientes de verificação do poder inibidor (por exemplo pressão em milibar e concentração de carbono inorgânico em mg/l); os dados relativos ao espaço livre acima da superfície do líquido indicam-se separadamente dos dados relativos ao líquido;
|
|
—
|
tratamento estatístico dos dados, duração do ensaio e diagrama da biodegradação da substância em estudo, da substância de referência e na experiência de verificação do poder inibidor;
|
|
—
|
percentagem de biodegradação da substância em estudo e da substância de referência;
|
|
—
|
motivos das eventuais rejeições de resultados do ensaio;
|
|
—
|
discussão dos resultados.
|
|
|
REFERÊNCIAS
|
1)
|
Os seguintes capítulos deste anexo:
|
|
C.4: Determinação da biodegradabilidade “fácil”;
|
|
|
C.9: Biodegradação — Ensaio de Zahn e Wellens;
|
|
|
C.10: Ensaio de simulação do tratamento aeróbio de efluentes:
A: Unidades de lamas ativadas, B: Biofilmes;
|
|
|
C.11: Biodegradação — Lamas ativadas: ensaios de inibição da respiração.
|
|
|
2)
|
OCDE (2009). Inherent Biodegradability: Modified MITI Test (II). OECD Guideline for Testing of Chemicals, No. 302C. OCDE, Paris.
|
|
3)
|
Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H., Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere, 19, 1527-1550. (Igualmente publicado como Relatório Técnico do ECETOC n.o 28, junho de 1988).
|
|
4)
|
Shelton, D.R., Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. Appl. Environ. Microbiology, 47, 850-857.
|
|
5)
|
Owen, W.F., Stuckey, D.C., Healy J.B., Jr., Young, L.Y., McCarty, P.L. (1979). Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res., 13, 485-492.
|
|
6)
|
Healy, J.B., Jr., Young, L.Y. (1979). Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol., 38, 84-89.
|
|
7)
|
Gledhill, W.E. (1979). Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 No. 35.24. American Society for Testing Materials, Filadélfia.
|
|
8)
|
Battersby, N.S., Wilson, V. (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Filadélfia.
|
|
10)
|
US EPA (1998). Fate, Transport and Transformation Test Guidelines: OPPTS 835.3400, Anaerobic Biodegradability of Organic Chemicals.
|
|
11)
|
International Organization for Standardization (1995). ISO 11 734: Water Quality — Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge — Method by measurement of the biogas production.
|
|
12)
|
International Organization for Standardization (2003). ISO 13 641-1: Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1, General Test.
|
|
13)
|
International Organization for Standardization (1995). ISO 10 634: Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
14)
|
Pagga, U., Beimborn, D.B. (1993). Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
15)
|
International Organization for Standardization (1997). ISO 11 923: Water Quality — Determination of suspended solids by filtration through glass-fibre filters.
|
Apêndice 1
Exemplo de montagem para medição da produção de biogás a partir da pressão gasosa

Legenda:
|
1
|
—
|
Manómetro;
|
|
2
|
—
|
Válvula de três vias estanque a gases;
|
|
3
|
—
|
Agulha de seringa;
|
|
4
|
—
|
Tampa estanque a gases (septo e sobrecápsula de aperto);
|
|
5
|
—
|
Espaço livre acima da superfície do líquido (Vh
);
|
|
6
|
—
|
Inóculo de lamas digeridas (Vl
).
|
Mantêm-se os recipientes de ensaio a 35 °C ± 2 °C.
Apêndice 2
Conversão das medições manométricas
As leituras manométricas podem ser relacionadas com volumes de gases por meio de uma curva-padrão gerada com base na injeção de volumes conhecidos de ar a 35 °C ± 2 °C em frascos de soro com um volume de água igual ao da mistura reacional, V
R:
|
—
|
Transferem-se alíquotas de V
R ml de água, mantidas a 35 °C ± 2 °C, para cinco frascos de soro. Fecham-se hermeticamente os frascos e colocam-se estes num banho de água a 35 °C durante uma hora, para que atinjam o equilíbrio;
|
|
—
|
Liga-se o manómetro, deixa-se estabilizar e regula-se a zero;
|
|
—
|
Insere-se uma agulha de seringa através do septo de um dos frascos, abre-se a válvula até a leitura do manómetro ser zero e fecha-se a válvula;
|
|
—
|
Repete-se este procedimento com os outros frascos;
|
|
—
|
Injeta-se 1 ml de ar a 35 °C ± 2 °C em cada frasco. Insere-se a agulha (montada no manómetro) através do septo de um dos frascos e deixa-se estabilizar a leitura de pressão. Regista-se a pressão, abre-se a válvula até a leitura de pressão ser zero e volta a fechar-se a válvula;
|
|
—
|
Repete-se este procedimento com os outros frascos;
|
|
—
|
Repete-se o procedimento descrito utilizando 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml e 50 ml de ar;
|
|
—
|
Traça-se uma curva de pressão (Pa) em função do volume gasoso injetado, Vb (ml). A resposta do instrumento é linear entre 0 Pa e 70 000 Pa e entre 0 ml e 50 ml de produção gasosa.
|
Apêndice 3
Exemplo de uma curva de degradação (aumento líquido de pressão acumulado)

Apêndice 4
Exemplo de quadro de dados relativo a um ensaio de biodegradação anaeróbia — quadro da substância em estudo
|
Laboratório:
|
Substância em estudo:
|
N.o do ensaio:
|
|
Temperatura de ensaio: (°C)
|
Volume do espaço livre acima da superfície do líquido (V
h): …(l)
|
Volume de líquido (V
l): …(l)
|
|
Carbono presente na substância em estudo (C
c,v): …(mg/l)
|
mv
(41): …(mg)
|
|
|
Dia
|
p
1 (subst. em estudo)
(mbar)
|
p
2 (subst. em estudo)
(mbar)
|
p
3 (subst. em estudo)
(mbar)
|
p média (subst.
em estudo)
(mbar)
|
p
4 (branco)
(mbar)
|
p
5 (branco)
(mbar)
|
p
6 (branco)
(mbar)
|
p média
(brancos)
(mbar)
|
p (líquida)
média da subst. em estudo — média dos brancos
(mbar)
|
D
p (líquida)
acumulada
(mbar)
|
m
h
C no espaço livre (42)
(mg)
|
D
h
Biodegradação (43)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
CI,1
subst. em estudo
(mg)
|
C
CI,2
subst. em estudo
(mg)
|
C
CI,3
subst. em estudo
(mg)
|
C
CI
média da subst. em estudo
(mg)
|
C
CI,4
Branco
(mg)
|
C
CI,5
Branco
(mg)
|
C
CI,6
Branco
(mg)
|
C
CI
média dos brancos
(mg)
|
C
CI,líquida
média da subst. em estudo —
média dos brancos
(mg)
|
m
l
C no líquido (44)
(mg)
|
m
t
C total (45)
(mg)
|
D
t
Biodegradação (46)
(%)
|
|
CI (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratório: …
|
Substância de referência: …
|
N.o do ensaio: …
|
|
Temperatura de ensaio: (°C) …
|
Volume do espaço livre acima da superfície do líquido (V
h): …(l)
|
Volume de líquido (V
l): …(l)
|
|
Carbono presente na substância de referência (C
c,v): …(mg/l)
|
mv
(47): (mg)
|
|
|
Dia
|
p
1 (ref.a)
(mbar)
|
p
2 (ref.a)
(mbar)
|
p
3 (ref.a)
(mbar)
|
p média
(ref.a)
(mbar)
|
p
4 (inib.)
(mbar)
|
p
5 (inib.)
(mbar)
|
p
6 (inib.)
(mbar)
|
p média
(inib.)
(mbar)
|
p (ref.a)
ref.a — branco
(mbar)
|
D
p (ref.a)
acumulada
(mbar)
|
m
h
C no espaço livre (48)
(mg)
|
D
h
Biodegradação (49)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
CI,1
ref.a
(mg)
|
C
CI,2
ref.a
(mg)
|
C
CI,3
ref.a
(mg)
|
C
CI
média da ref.a
(mg)
|
C
CI,4
inib.
(mg)
|
C
CI,5
inib.
(mg)
|
C
CI,6
inib.
(mg)
|
C
CI
média da inib.
(mg)
|
C
CI,líquida
ref.a — inib.
(mg)
|
m
l
C no líquido (50)
(mg)
|
m
t
C total (51)
(mg)
|
D
t
Biodegradação (52)
(%)
|
|
CI (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. LIXIVIAÇÃO EM COLUNAS DE SOLO
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 312 (2004) da OCDE. Os produtos químicos produzidos artificialmente podem atingir o solo por via direta, por aplicação deliberada (agroquímicos, por exemplo), ou por vias indiretas (por exemplo através de águas residuais → lamas de depuração → solo ou ar → deposição húmida/seca). Para avaliar os riscos que lhes estão associados, é importante estimar o potencial de transformação destes produtos químicos no solo, bem como de migração (lixiviação) dos mesmos para camadas mais profundas do solo e finalmente para as águas subterrâneas.
|
|
2.
|
Existem diversos métodos de medição do potencial de lixiviação de produtos químicos no solo em condições laboratoriais controladas: cromatografia em camada fina de solo, cromatografia em camada espessa de solo, cromatografia em coluna de solo e medições de adsorção-dessorção (1)(2). No caso dos produtos químicos não-ionizados, a determinação do coeficiente de partição n-octanol/água (Pow) permite uma primeira estimativa do potencial de adsorção e lixiviação dos mesmos (3)(4)(5).
|
|
3.
|
O processo descrito neste método de ensaio baseia-se numa cromatografia de um solo revolvido em coluna de solo (ver a definição no apêndice 1). Realizam-se dois tipos de experiências para determinar o potencial de lixiviação do produto químico em estudo e o potencial de lixiviação dos correspondentes produtos de transformação (estudo com resíduos envelhecidos) nos solos em condições laboratoriais controladas (53). O método de ensaio baseia-se em métodos existentes (6)(7)(8)(9)(10)(11).
|
|
4.
|
As orientações respeitantes ao número e tipo de solos a utilizar neste método de ensaio são as acordadas na reunião de trabalho da OCDE sobre Seleção de Solos/Sedimentos que decorreu em Belgirate, Itália, em 1995 (12). Nessa reunião de trabalho foram igualmente formuladas recomendações acerca da colheita, manipulação e conservação de amostras de solo para experiências de lixiviação.
|
PRINCÍPIO DO MÉTODO DE ENSAIO
|
5.
|
Enchem-se de solo colunas de uma matéria inerte adequada (vidro, aço inoxidável, alumínio, teflon, PVC etc.). Em seguida, saturam-se com uma solução de chuva artificial (ver a definição no apêndice 1) e deixa-se atingir o equilíbrio, após o que se deixa escoar o excesso de líquido. Seguidamente, trata-se a superfície de cada coluna de solo com o produto químico em estudo e/ou com resíduos envelhecidos deste. Segue-se a aplicação de chuva artificial às colunas de solo e a recolha do lixiviado. Depois de concluída a lixiviação, retira-se o solo das colunas e procede-se ao seccionamento do mesmo no número de segmentos adequado, em função das informações que se pretendam extrair do estudo. Finalmente, pesquisa-se o produto químico em estudo em cada segmento de solo e no lixiviado; se for caso disso, pesquisam-se igualmente os produtos de transformação e outros produtos químicos de interesse.
|
APLICABILIDADE DO MÉTODO DE ENSAIO
|
6.
|
Este método de ensaio é aplicável a produtos químicos (não-marcados ou marcados radioativamente, por exemplo com14C) para os quais se disponha de um método analítico suficientemente exato e sensível. O método não se destina a produtos químicos que sejam voláteis no solo ou na água e que, portanto, não permaneçam no solo e/ou no lixiviado nas condições experimentais do método.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
7.
|
Podem ser utilizados produtos químicos não-marcados ou marcados radioativamente para medir comportamentos de lixiviação em colunas de solo. São necessárias matérias radioativas para estudar a lixiviação de produtos de transformação (resíduos envelhecidos do produto químico em estudo) e para realizar balanços de massa. Recomenda-se a marcação radioativa com13C, mas outros isótopos (como14C,15N,3H e32P) podem ser igualmente úteis. Na medida do possível, a marcação deve ser inserida na parte ou partes mais estáveis da molécula. O grau de pureza mínimo do produto químico em estudo é de 95 %.
|
|
8.
|
Na sua maior parte, os produtos químicos aplicam-se sob a forma de uma substância. Porém, no caso das substâncias ativas de produtos fitofarmacêuticos, podem ser utilizados produtos formulados para estudar a lixiviação da substância parental, constituindo o ensaio daqueles mesmo um requisito quando for previsível que a mistura afete a taxa de libertação (caso se trate de formulações granuladas ou de libertação regulada, por exemplo). No que respeita à adaptação do protocolo de ensaio especificamente às misturas, pode ser útil consultar as autoridades reguladoras antes de realizar o ensaio. Caso o estudo incida na lixiviação de resíduos envelhecidos, utiliza-se a substância parental em estudo pura.
|
|
9.
|
Antes de realizar ensaios de lixiviação em colunas de solo, é preferível dispor das seguintes informações sobre o produto químico em estudo:
|
1)
|
Solubilidade em água [método de ensaio A.6] (13);
|
|
2)
|
Solubilidade em solventes orgânicos;
|
|
3)
|
Pressão de vapor [método de ensaio A.4] (13) e constante de Henry;
|
|
4)
|
Coeficiente de partição n-octanol/água [métodos de ensaio A.8 e A.24] (13);
|
|
5)
|
Coeficiente de adsorção (Kd, Kf ou KCO) [métodos de ensaio C.18 e/ou C.19] (13);
|
|
6)
|
Hidrólise [método de ensaio C.7] (13);
|
|
7)
|
Constante de dissociação (pKa) [Test Guideline TG 112 da OCDE] (25);
|
|
8)
|
Transformação aeróbia e anaeróbia no solo [método de ensaio C.23] (13).
|
Nota: O relatório do ensaio correspondente deve mencionar a temperatura de realização de cada uma destas medições.
|
|
10.
|
A quantidade de produto químico em estudo aplicada às colunas de solo deve ser suficiente para a deteção, em cada segmento, de, pelo menos, 0,5 % da dose aplicada. No caso das substâncias ativas de produtos fitofarmacêuticos, a quantidade de produto químico em estudo aplicada pode corresponder à dose máxima recomendada (numa aplicação).
|
|
11.
|
É necessário dispor de um método analítico adequado cuja exatidão, precisão e sensibilidade se conheçam para a determinação quantitativa, no solo e no lixiviado, do produto químico em estudo e, se for caso disso, dos produtos de transformação deste. É necessário conhecer igualmente o limite de deteção analítica do produto químico em estudo e dos produtos de transformação significativos deste (normalmente pelo menos todos os produtos de transformação observados em estudos da via de transformação cuja concentração seja ≥10 % da dose aplicada, mas, de preferência, todos os produtos de transformação com interesse) (ver o ponto 17).
|
PRODUTOS QUÍMICOS DE REFERÊNCIA
|
12.
|
Utilizam-se na avaliação da mobilidade relativa no solo do produto químico em estudo produtos químicos de referência cujo comportamento de lixiviação seja conhecido, por exemplo a atrazina ou o monurão, que podem considerar-se substâncias moderadamente lixiviáveis no terreno (1)(8)(11). A fim de confirmar as propriedades hidrodinâmicas da coluna de solo, também pode ser útil recorrer a um produto químico de referência polar não-sorvente e não-degradável (por exemplo trítio, brometo, fluoresceína ou eosina) para seguir o movimento da água na coluna.
|
|
13.
|
O recurso a produtos químicos que constituam padrões analíticos também pode ter utilidade na caracterização e/ou identificação de produtos de transformação presentes nos segmentos de solo e nos lixiviados por métodos cromatográficos ou espetroscópicos ou por outros métodos adequados.
|
DEFINIÇÕES E UNIDADES
CRITÉRIOS DE QUALIDADE
Recuperação
|
15.
|
A recuperação obtida numa experiência de lixiviação corresponde à soma das percentagens do produto químico em estudo determinadas nos segmentos de solo e no lixiviado da coluna após a lixiviação. Os valores de recuperação devem variar entre 90 % e 110 %, no caso de produtos químicos com marcação radioativa (11), e entre 70 % e 110 %, no caso de produtos químicos sem marcação radioativa (8).
|
Repetibilidade e sensibilidade do método analítico
|
16.
|
Pode verificar-se a repetibilidade do método analítico na determinação quantitativa do produto químico em estudo e dos produtos de transformação efetuando uma análise em duplicado do mesmo extrato de um segmento de solo ou de um lixiviado (ver o ponto 11).
|
|
17.
|
O limite de deteção do método analítico no tocante ao produto químico em estudo e aos produtos de transformação deve corresponder ao mais baixo dos seguintes critérios: pelo menos 0,01 mg · kg-1 em cada segmento de solo ou lixiviado (em termos do produto químico em estudo) ou pelo menos 0,5 % da dose aplicada em qualquer segmento. É igualmente necessário especificar o limite de quantificação (LQ).
|
DESCRIÇÃO DO MÉTODO DE ENSAIO
Sistema de ensaio
|
18.
|
Utilizam-se no ensaio colunas de lixiviação (seccionáveis ou não) de uma matéria inerte adequada (por exemplo vidro, aço inoxidável, alumínio, teflon, PVC etc.), com, pelo menos, 4 cm de diâmetro interno e não menos de 35 cm de altura. É necessário verificar se existe alguma interação entre as matérias constituintes das colunas e o produto químico em estudo e/ou os produtos de transformação deste. No apêndice 2 apresentam-se um exemplo adequado de uma coluna seccionável e um exemplo adequado de uma coluna não-seccionável.
|
|
19.
|
São necessários colheres, um êmbolo e um vibrador para o enchimento e a compactação das colunas de solo.
|
|
20.
|
Para aplicar a chuva artificial às colunas de solo, podem ser utilizados bombas de pistão ou peristálticas, cabeças de chuveiro, frascos de Mariotte ou simples ampolas gotejantes.
|
Equipamento de laboratório e produtos químicos
|
21.
|
É necessário o equipamento normal de laboratório, designadamente o seguinte:
|
1)
|
equipamento de análise, tal como aparelhos de cromatografia gás-líquido, HPLC e cromatografia em camada fina, incluindo sistemas adequados de deteção, para a análise de produtos químicos marcados ou não-marcados ou para aplicação do método de diluição isotópica inversa;
|
|
2)
|
equipamento de identificação (espetrometria de massa, cromatografia em fase gasosa-espetrometria de massa, HPLC-espetrometria de massa, RMN etc.);
|
|
3)
|
contador da cintilação em fase líquida para produtos químicos em estudo com marcação radioativa;
|
|
4)
|
dispositivo de oxidação para combustão das matérias com marcação radioativa;
|
|
5)
|
equipamento de extração (por exemplo tubos de centrifugação para extração a frio e aparelho de Soxhlet para extração contínua sob refluxo);
|
|
6)
|
equipamento para concentração de soluções e de extratos (por exemplo evaporador rotativo).
|
|
|
22.
|
Entre os produtos químicos utilizados contam-se os seguintes: solventes orgânicos de qualidade analítica, tais como acetona, metanol etc.; líquido de cintilação; solução 0,01 M de CaCl2 em água destilada ou desionizada (chuva artificial).
|
Produto químico em estudo
|
23.
|
É necessário dissolver em água (destilada ou desionizada) o produto químico em estudo para o aplicar à coluna de solo. Se o produto químico for pouco hidrossolúvel, pode ser aplicado incorporado num produto formulado (se necessário após suspensão ou emulsão em água) ou dissolvido num solvente orgânico. Caso se utilize um solvente orgânico, o volume deste deve ser o mínimo possível e é necessário evaporar o solvente em causa da superfície da coluna de solo antes de iniciar a lixiviação. As formulações sólidas, como os granulados, aplicam-se no estado sólido, sem água. Nesse caso, para melhor distribuição pela superfície da coluna de solo, antes da aplicação pode misturar-se o produto formulado com uma pequena quantidade de areia quartzítica (por exemplo 1 g).
|
|
24.
|
A quantidade de produto químico em estudo aplicada às colunas de solo deve ser suficiente para a deteção, em cada segmento, de, pelo menos, 0,5 % da dose aplicada. No caso dos produtos químicos ativos de produtos fitofarmacêuticos, a quantidade de produto químico em estudo aplicada às colunas de solo pode corresponder à dose máxima recomendada (numa aplicação) e, quer se trate da lixiviação da substância parental ou de resíduos envelhecidos, deve ser proporcional à superfície da coluna de solo utilizada (54).
|
Produto químico de referência
|
25.
|
Utiliza-se um produto químico de referência nas experiências de lixiviação (ver o ponto 12). Aplica-se este à superfície da coluna de solo do mesmo modo que o produto químico em estudo, utilizando uma quantidade que permita detetá-lo convenientemente, seja como padrão interno juntamente com o produto químico em estudo, na mesma coluna de solo, seja isoladamente, noutra coluna de solo. A menos que ambos os produtos químicos estejam marcados do mesmo modo, é preferível aplicá-los na mesma coluna.
|
Solos
Escolha dos solos
|
26.
|
Nos estudos de lixiviação com produtos químicos parentais, utilizam-se 3 ou 4 solos com pH, teor de carbono orgânico e textura distintos (12). O quadro 1 contém orientações relativas à escolha de solos para experiências de lixiviação. No caso dos produtos químicos em estudo ionizáveis, os solos escolhidos devem abranger uma faixa de pH larga, a fim de avaliar a mobilidade do produto químico nas formas ionizada e não-ionizada. Nesse caso, pelo menos 3 solos devem ter um pH ao qual o produto químico em estudo se apresente na sua forma móvel.
Quadro 1
Orientações para a escolha de solos para estudos de lixiviação.
|
N.o do solo
|
Valor do pH
|
Carbono orgânico
(%)
|
Teor de argilas
(%)
|
Textura (55)
|
|
1
|
>7,5
|
3,5 - 5,0
|
20 - 40
|
franco-argilosa
|
|
2
|
5,5 - 7,0
|
1,5 - 3,0
|
15 - 25
|
franco-limosa
|
|
3
|
4,0 - 5,5
|
3,0 - 4,0
|
15 - 30
|
franca
|
|
4
|
< 4,0 - 6,0 (56)
|
< 0,5 - 1,5 (56)
(57)
|
< 10 - 15 (56)
|
areno-franca
|
|
5
|
< 4,5
|
> 10 (58)
|
< 10
|
areno-franca/arenosa
|
|
|
27.
|
Por vezes, é necessário recorrer a outros tipos de solo para representar regiões frias, temperadas ou tropicais. Caso se opte por outros tipos de solo, estes, mesmo que não satisfaçam exatamente os critérios especificados nas orientações para a escolha de solos para estudos de lixiviação (ver o quadro 1 supra), devem ser caracterizados pelos mesmos parâmetros e as suas propriedades devem ter o mesmo tipo de variações que os tipos de solo nelas descritos.
|
|
28.
|
Nos estudos de lixiviação com resíduos envelhecidos, deve utilizar-se unicamente um tipo de solo (12), com teor de areia superior a 70 % e teor de carbono orgânico compreendido entre 0,5 % e 1,5 % (por exemplo o solo n.o 4 do quadro 1). Pode, porém, ser necessário utilizar mais tipos de solo caso seja importante obter dados sobre os produtos de transformação.
|
|
29.
|
É necessário caracterizar todos os solos, pelo menos, em termos de textura [percentagem de areias, de limos e de argilas segundo os sistemas de classificação da FAO e do Departamento de Agricultura dos Estados Unidos da América (14)], pH, capacidade de permuta catiónica, teor de carbono orgânico, densidade aparente (no caso dos solos revolvidos) e capacidade de retenção de água. A medição da biomassa microbiana apenas é necessária no caso dos solos utilizados no período de envelhecimento/incubação que precede os ensaios de lixiviação com resíduos envelhecidos. Para a interpretação dos resultados deste estudo, pode ser útil dispor de informações sobre outras propriedades do solo (por exemplo classificação do solo, mineralogia das argilas ou superfície específica). Para determinar as características do solo, podem ser utilizados os métodos recomendados nas referências (15)(16)(17)(18)(19).
|
Colheita e conservação de amostras de solos
|
30.
|
Colhem-se as amostras de solo na camada superior (horizonte A), até à profundidade máxima de 20 cm. Removem-se os vestígios de vegetação, a macrofauna e as pedras. Secam-se as amostras de solo (exceto as destinadas ao envelhecimento do produto químico em estudo) ao ar, à temperatura ambiente (de preferência entre 20 °C e 25 °C). As forças de desagregação aplicadas devem ser as mínimas possíveis, de modo a manter, tanto quanto possível, a textura original do solo. Peneiram-se as amostras de solo através de uma malha ≤2 mm. Recomenda-se uma homogeneização cuidadosa, de modo a aumentar a reprodutibilidade dos resultados. Antes de serem utilizadas, as amostras de solo podem ser conservadas à temperatura ambiente, secas ao ar (12). Não se recomenda nenhum período-limite de armazenagem; contudo, no caso das amostras de solo armazenadas há mais de três anos, deve voltar a determinar-se o teor de carbono orgânico e o pH antes da utilização.
|
|
31.
|
Deve dispor-se de informação pormenorizada sobre a história do local de colheita das amostras de solo, designadamente: localização exata [definida com exatidão pela Projeção Universal Transversa de Mercator (UTM)/Dados Horizontais Europeus ou por coordenadas geográficas], coberto vegetal, tratamentos com produtos fitofarmacêuticos, tratamentos com fertilizantes biológicos ou minerais, adições de matérias biológicas e contaminações acidentais (12). Não devem ser utilizados em estudos de lixiviação solos que tenham sido tratados com o produto químico em estudo ou com análogos estruturais deste nos quatro anos anteriores.
|
Condições de realização do ensaio
|
32.
|
Durante o ensaio, é necessário manter as colunas de solo destinadas à lixiviação na obscuridade e à temperatura ambiente, sendo que esta não deve variar mais de ±2 °C. Recomendam-se temperaturas entre 18 °C e 25 °C.
|
|
33.
|
Aplica-se continuamente chuva artificial (solução 0,01 M de CaCl2) na superfície de cada coluna de solo à razão de 200 mm num período de 48 horas (59), que corresponde à aplicação de 251 ml numa coluna com diâmetro interno de 4 cm. Se o objetivo do ensaio o exigir, podem ser adicionalmente utilizadas outras taxas de aplicação da chuva artificial e períodos mais longos.
|
Realização do ensaio
Lixiviação de um produto químico parental
|
34.
|
Enchem-se pelo menos duas colunas de lixiviação (duplicado) com solo não-tratado, seco ao ar e peneirado (<2 mm) até cerca de 30 cm de altura. Para que o enchimento seja uniforme, adiciona-se o solo às colunas em pequenas quantidades com uma colher e compacta-se o solo com um êmbolo, enquanto se faz vibrar suavemente a coluna, até que a parte superior da coluna de solo deixe de afundar. Para que os resultados obtidos com as colunas de lixiviação sejam reprodutíveis, é necessário que os enchimentos sejam uniformes. As referências (20), (21) e (22) descrevem em pormenor técnicas de enchimento de colunas. Para garantir a reprodutibilidade do processo de enchimento determina-se o peso total do solo introduzido em cada coluna (60), sendo que o peso de solo deve ser o mesmo em cada coluna do duplicado utilizado.
|
|
35.
|
Após o enchimento, humedecem-se as colunas de solo com chuva artificial (solução 0,01 M de CaCl2) da base para o topo, para que o ar retido nos poros do solo seja desalojado pela água. Em seguida, deixa-se que as colunas de solo atinjam o equilíbrio e escoa-se por gravidade o excesso de água. A referência (23) recapitula vários métodos de saturação de colunas.
|
|
36.
|
A seguir, aplica-se nas colunas de solo o produto químico em estudo e/ou o produto químico de referência (ver igualmente os pontos 23 a 25). Para obter uma distribuição homogénea, aplicam-se as soluções, suspensões ou emulsões do produto químico em estudo e/ou do produto químico de referência uniformemente na superfície das colunas de solo. Caso a incorporação no solo seja a forma recomendada de aplicação de um determinado produto químico em estudo, este deve ser misturado com uma pequena quantidade de solo (por exemplo 20 g), depositando-se em seguida a mistura na superfície da coluna de solo.
|
|
37.
|
Cobre-se então a superfície de cada uma das colunas de solo com um disco de vidro sinterizado, esférulas de vidro, um filtro de fibra de vidro ou um disco de papel de filtro, de modo a distribuir a chuva artificial uniformemente pela superfície do solo e para que esta não seja perturbada pelas gotas de chuva. Quanto maior for o diâmetro da coluna, maior cuidado haverá que ter com a aplicação da chuva artificial nas colunas de solo, de modo a distribuí-la uniformemente pela superfície do solo. A seguir, adiciona-se a chuva artificial gota a gota às colunas de solo, recorrendo a uma bomba de êmbolo, a uma bomba peristáltica ou a uma ampola gotejante. De preferência, recolhe-se o lixiviado de cada coluna em frações e registam-se os volumes correspondentes (61).
|
|
38.
|
Após a lixiviação e o escoamento das colunas, seccionam-se as colunas de solo num número de segmentos adequado, em função das informações a obter no estudo, procede-se à extração dos segmentos com solventes ou misturas de solventes adequados e efetuam-se as análises com vista à determinação do produto químico em estudo e, se for caso disso, dos produtos de transformação, da radioatividade total e do produto químico de referência. Analisam-se os mesmos produtos nos lixiviados ou frações de lixiviados diretamente ou depois de estes serem sujeitos a extração. Caso se estude um produto químico com marcação radioativa, é necessário identificar todas as frações que contenham ≥10 % da radioatividade aplicada.
|
Lixiviação de resíduos envelhecidos
|
39.
|
Trata-se solo fresco (não sujeito anteriormente a secagem ao ar) com uma dose do produto químico em estudo marcado radioativamente proporcional à superfície da coluna de solo (ver o ponto 24) e incuba-se em condições aeróbias de acordo com o método de ensaio C.23 (13). A duração do período de incubação (envelhecimento) deve ser suficiente para que sejam geradas quantidades significativas dos produtos de transformação; recomenda-se um período de envelhecimento correspondente à meia-vida do produto químico em estudo (62), com um máximo de 120 dias. Antes da lixiviação, analisa-se o solo envelhecido para determinar o produto químico em estudo e os produtos de transformação deste.
|
|
40.
|
Enchem-se as colunas de lixiviação até 28 cm de altura, com o mesmo solo (mas seco ao ar) utilizado no envelhecimento, conforme se descreveu no ponto 34, determinando-se também o peso total das colunas de solo cheias. Em seguida, humedecem-se as colunas de solo como se descreveu no ponto 35.
|
|
41.
|
Aplicam-se então o produto químico em estudo e os seus produtos de transformação na superfície das colunas de solo sob a forma de resíduos no solo envelhecidos (ver o ponto 39), de modo a formar um segmento de solo com 2 cm de espessura. De preferência, a altura total das colunas de solo (solo não-tratado + solo envelhecido) não deve exceder 30 cm (ver o ponto 34).
|
|
42.
|
Efetua-se a lixiviação como se descreveu no ponto 37.
|
|
43.
|
Após a lixiviação, analisam-se os segmentos de solo e os lixiviados como se indicou no ponto 38, a fim de determinar o produto químico em estudo, os produtos de transformação deste e a radioatividade não-extraída. Para que possa determinar-se a quantidade de resíduo envelhecido que, após a lixiviação, permanece na camada superior com 2 cm de espessura, analisa-se separadamente este segmento.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
44.
|
As quantidades de produto químico em estudo, produtos de transformação, produtos não-extraíveis e, se for caso disso, produto químico de referência são indicadas em percentagem da dose inicial aplicada, por segmento de solo e por fração de lixiviado. Traça-se uma representação gráfica por coluna com indicação das percentagens determinadas em função da profundidade no solo.
|
|
45.
|
Caso o estudo de lixiviação em coluna compreenda um produto químico de referência, pode avaliar-se a lixiviação de produtos químicos numa escala relativa por recurso a fatores de mobilidade relativa (FMR; ver a definição no apêndice 3) (1)(11), que permitem comparar dados de lixiviação de vários produtos químicos obtidos com diferentes tipos de solo. Constam do apêndice 3 vários exemplos de valores de FMR para diversos produtos fitofarmacêuticos.
|
|
46.
|
É igualmente possível obter estimativas de Kco (coeficiente normalizado de adsorção de carbono orgânico) e de Kmo (coeficiente normalizado de repartição de matéria orgânica) a partir de resultados de lixiviação em coluna, com base na distância média de lixiviação ou em correlações estabelecidas entre o FMR e Kco ou Kmo (4) ou por aplicação de teoria cromatográfica simples (24). Este último método deve, porém, ser utilizado com prudência, sobretudo tendo em atenção que o processo de lixiviação não decorre unicamente em condições de saturação, caracterizando-se os sistemas mais por condições de insaturação.
|
Interpretação dos resultados
|
47.
|
Os estudos de lixiviação em coluna descritos neste método permitem determinar o potencial de lixiviação ou de mobilidade no solo do produto químico em estudo (no estudo de lixiviação da substância parental) e/ou dos produtos de transformação deste (no estudo de lixiviação de resíduos envelhecidos). Estes ensaios não permitem prever quantitativamente comportamentos de lixiviação no terreno, mas podem ser utilizados para comparar a lixiviabilidade de um produto químico com a de outros, dos quais se conheça o comportamento de lixiviação (24). Analogamente, também não permitem quantificar a percentagem do produto químico aplicado que é suscetível de atingir as águas subterrâneas (11). Todavia, no caso dos produtos químicos que revelem elevado potencial de mobilidade nos ensaios laboratoriais, os resultados dos estudos de lixiviação em coluna podem orientar a decisão de realizar ou não ensaios adicionais no terreno ou parcialmente no terreno.
|
Relatório do ensaio
|
48.
|
Elementos a constar do relatório do ensaio:
|
|
Produto químico em estudo e produto químico de referência (quando utilizado)
|
—
|
denominação comum, denominação química (nomenclaturas IUPAC e CAS), número CAS, estrutura química (indicando a localização do marcador, caso se utilize marcação radioativa) e propriedades físico-químicas pertinentes;
|
|
—
|
grau de pureza do produto químico em estudo (presença de impurezas);
|
|
—
|
pureza radioquímica do produto químico marcado e atividade específica (se for caso disso).
|
|
|
|
Solos utilizados no ensaio
|
—
|
elementos relativos ao local de colheita das amostras de solo;
|
|
—
|
propriedades do solo tais como o pH, o teor de carbono orgânico, o teor de argila, a textura e a densidade aparente (no caso dos solos revolvidos);
|
|
—
|
atividade microbiana do solo (apenas no caso do solo utilizado para envelhecer o produto químico em estudo);
|
|
—
|
duração e condições da conservação de amostras de solo.
|
|
|
|
Condições de realização do ensaio
|
—
|
datas da realização dos estudos;
|
|
—
|
comprimento e diâmetro das colunas de lixiviação;
|
|
—
|
peso total do solo das colunas;
|
|
—
|
quantidade de produto químico em estudo aplicada e, se for caso disso, do produto químico de referência aplicado.
|
|
—
|
quantidade, frequência e duração da aplicação de chuva artificial;
|
|
—
|
temperatura do dispositivo experimental;
|
|
—
|
número de replicados (pelo menos dois);
|
|
—
|
métodos de análise do produto químico em estudo, dos produtos de transformação e, se for caso disso, do produto químico de referência nos vários lixiviados e segmentos de solo;
|
|
—
|
métodos de caracterização e de identificação dos produtos de transformação nos lixiviados e nos segmentos de solo.
|
|
|
|
Resultados do ensaio
|
—
|
quadros dos resultados correspondentes aos lixiviados e aos segmentos de solo, expressos em concentração e em percentagem da dose aplicada;
|
|
—
|
balanço de massa, se for caso disso;
|
|
—
|
distâncias de lixiviação e, se for caso disso, fatores de mobilidade relativa;
|
|
—
|
representação gráfica da percentagem detetada nos segmentos de solo em função da profundidade do segmento de solo;
|
|
—
|
discussão e interpretação dos resultados.
|
|
|
REFERÊNCIAS
|
1)
|
Guth, J.A., Burkhard, N., Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In Progress in Pesticide Biochemistry and Toxicology, volume 9 (Environmental Behaviour of Agrochemicals — Roberts, T.R., Kearney, P.C., editores). J. Wiley & Sons.
|
|
3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, 1050-1059.
|
|
4)
|
Chiou, C.T., Porter, P.E., Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, 227-231.
|
|
5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz, 7, 26-33.
|
|
6)
|
US Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
8)
|
Anexo I da Diretiva 95/36/CE da Comissão, de 14 de julho de 1995, que altera a Diretiva 91/414/CEE relativa à colocação dos produtos fitofarmacêuticos no mercado (JO L 172 de 22.7.1995, p. 8).
|
|
9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Secção G: Behaviour of the product and its metabolites in soil, water and air.
|
|
10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, parte IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, editor.
|
|
12)
|
OCDE (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Itália, 18-20 de janeiro de 1995.
|
|
13)
|
Os seguintes capítulos deste anexo:
|
|
Capítulo A.4 — Pressão de vapor;
|
|
|
Capítulo A.6 — Solubilidade em água;
|
|
|
Capítulo A.8 — Coeficiente de partição: método do “frasco agitado”;
|
|
|
Capítulo A.24 — Coeficiente de partição: método por HPLC;
|
|
|
Capítulo C.7 — Degradação — Degradação abiótica: hidrólise em função do pH;
|
|
|
Capítulo C.18 — Adsorção/dessorção por recurso a um método de equilíbrio por lotes de solos;
|
|
|
Capítulo C.23 — Transformações aeróbias e anaeróbias no solo.
|
|
|
14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, suplemento 1 (1985) e Soil Sci. Soc. Amer. Proc., 26, 305 (1962).
|
|
15)
|
Methods of Soil Analysis (1986). Parte 1, Physical and Mineralogical Methods (Klute, A., editor). Agronomy Series, n.o 9, 2.a edição.
|
|
16)
|
Methods of Soil Analysis (1982). Parte 2, Chemical and Microbiological Properties (Page, A.L., Miller, R.H., Kelney, D.R., editores). Agronomy Series, n.o 9, 2.a edição.
|
|
17)
|
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. Primeira Edição.
|
|
18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt am Main.
|
|
19)
|
Scheffer, F., Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Estugarda.
|
|
20)
|
Weber, J.B., Peeper, T.F. (1977). In Research Methods in Weed Science, 2.a edição (Truelove, B., editor). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
21)
|
Weber, J.B., Swain, L.R., Strek, H.J., Sartori, J.L. (1986). In Research Methods in Weed Science, 3.a edição (Camper, N.D., editor). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J., 60(1):49-53.
|
|
23)
|
Shackelford, C.D. (1991). Laboratory diffusion testing for waste disposal — A review. J. Contam. Hydrol., 7, 177-217.
|
|
24)
|
Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (Haque, R., Freed, V.H., editores), 115-133. Plenum Press, Nova Iorque.
|
|
25)
|
OCDE (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112. OCDE, Paris.
|
Apêndice 1
Definição e unidades
Resíduo no solo envelhecido
: Produto químico em estudo e produtos de transformação deste presentes no solo após a aplicação, decorrido um período suficientemente longo para que os processos de transporte, adsorção, metabolismo e dissipação possam alterar a distribuição e a natureza química de parte do produto químico aplicado (1).
Chuva artificial
: Solução 0,01 M de CaCl2 em água destilada ou desionizada.
Distância média de lixiviação
: Fundo da secção do solo na qual a recuperação acumulada do produto químico corresponde a 50 % do produto químico em estudo recuperado total [experiência de lixiviação normal] ou (fundo da secção do solo na qual a recuperação acumulada do produto químico corresponde a 50 % do produto químico em estudo recuperado total) — (espessura da camada de resíduos envelhecidos)/2 [estudo de lixiviação de resíduos envelhecidos].
Produto químico
: Substância ou mistura.
Lixiviado
: Fase aquosa após percolação através de um perfil de solo ou de uma coluna de solo (1).
Lixiviação
: Processo de migração de um produto químico para baixo num perfil de solo ou numa coluna de solo (1).
Distância de lixiviação
: Segmento mais profundo do solo no qual, após o processo de lixiviação, se encontra ≥ 0,5 % do produto químico em estudo aplicado ou do resíduo envelhecido (equivale à profundidade de penetração).
Limite de deteção (LD) e limite de quantificação (LQ)
: o limite de deteção (LOD) é a concentração de um produto químico abaixo da qual a identidade do mesmo não pode ser distinguida dos artefactos analíticos. O limite de quantificação (LQ) é a concentração de um produto químico abaixo da qual a concentração do mesmo não pode ser determinada com exatidão aceitável.
Fator de mobilidade relativa (FMR)
: [distância de lixiviação do produto químico em estudo (cm)] / [distância de lixiviação do produto químico de referência (cm)].
Produto químico em estudo
: Qualquer substância ou mistura à qual seja aplicado este método de ensaio.
Produto de transformação
: Todos os produtos químicos resultantes de reações de transformação bióticas ou abióticas do produto químico em estudo, incluindo CO2 e produtos ligados aos resíduos.
Solo
: Mistura de componentes químicos minerais e orgânicos (compreendo estes últimos compostos com teor elevado de carbono e de azoto e peso molecular elevado) povoada de pequenos organismos, maioritariamente microrganismos. O solo pode apresentar-se em dois estados distintos:
|
—
|
não-revolvido, tal como se desenvolveu ao longo do tempo, com as camadas características dos vários tipos de solo;
|
|
—
|
revolvido, tal como é normalmente encontrado nas terras aráveis ou como se apresenta quando a recolha de amostras para utilização no presente método de ensaio é feita por escavação (2).
|
|
1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem., 68, 1167-1193.
|
|
2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adotado a 12 de maio de 1981).
|
Apêndice 2
Figura 1:
Exemplo de colunas de vidro não-seccionáveis de lixiviação
com 35 cm de comprimento e 5 cm de diâmetro interno (1).

|
1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden — 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Colónia.
|
Figura 2:
Exemplo de uma coluna metálica seccionável com 4 cm de diâmetro interno (1).

|
1)
|
Burkhard, N., Eberle D.O., Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
Apêndice 3
Exemplos de fatores de mobilidade relativa
(63)
(FMR) correspondentes a diversos produtos fitofarmacêuticos (1)(2) e respetivas classes de mobilidade
(65)
|
Intervalo do FMR
|
Produto químico (FMR)
|
Classe de mobilidade
|
|
≤ 0,15
|
Paratião (< 0,15), flurodifena (0,15)
|
I
imóvel
|
|
0,15 — 0,8
|
Profenofos (0,18), propiconazol (0,23), diazinão (0,28), diurão (0,38), terbutilazina (0,52), metidatião (0,56), prometrina (0,59), propazina (0,64), alacloro (0,66), metolacloro (0,68)
|
II
ligeiramente móvel
|
|
0,8 — 1,3
|
Monurão (64) (1,00), atrazina (1,03), simazina (1,04), fluometurão (1,18)
|
III
moderadamente móvel
|
|
1,3 — 2,5
|
Prometão (1,67), cianazina (1,85), bromacil (1,91), carbutilato (1,98)
|
IV
bastante móvel
|
|
2,5 — 5,0
|
Carbofurão (3,00), dioxacarbe (4,33)
|
V
móvel
|
|
> 5,0
|
Monocrotofos (> 5,0), dicrotofos (> 5,0)
|
VI
muito móvel
|
|
1)
|
Guth, J.A. (1985). Adsorção/dessorção In Joint International Symposium “Physicochemical Properties and their Role in Environmental Hazard Assessment”. Canterbury, Reino Unido, 1-3 de julho de 1985.
|
|
2)
|
Guth, J.A., Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr. Reihe Verein WaBoLu, 68, 91-106.
|
|
3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds,15, 214-216.
|
|
4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc., 35, 743-748.
|
|
5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L., Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47, Pesticides in Soil and Water, 165-174.
|
C.45. ESTIMATIVA DAS EMISSÕES PARA O AMBIENTE DE MADEIRAS TRATADAS COM PRODUTOS DE PRESERVAÇÃO DA MADEIRA: MÉTODO LABORATORIAL PARA ARTIGOS DE MADEIRA SEM COBERTURA E EM CONTACTO COM ÁGUA DOCE OU COM ÁGUA DO MAR
INTRODUÇÃO
|
1.
|
Este método é equivalente ao Test Guideline TG 313 (2007) da OCDE. Para que possam avaliar-se os riscos para o ambiente decorrentes das madeiras tratadas é necessário quantificar as emissões para o ambiente das madeiras tratadas com produtos de preservação da madeira. Este protocolo de ensaio descreve um método laboratorial de estimativa das emissões de madeiras tratadas com produtos de preservação da madeira em duas situações suscetíveis de gerar emissões para o ambiente:
|
—
|
provenientes de madeira tratada em contacto com água doce, caso em que a superfície da madeira pode gerar emissões para a água doce;
|
|
—
|
provenientes de madeira tratada em contacto com água do mar, caso em que a superfície da madeira pode gerar emissões para a água do mar.
|
|
|
2.
|
Este método de ensaio destina-se a ser aplicado às emissões provenientes de madeiras e de artigos de madeira sem cobertura e que entram em contacto com água doce ou com água do mar. Foram estabelecidas a nível internacional classes de utilização que definem as categorias dos perigos biológicos aos quais os artigos tratados estão sujeitos. As classes de utilização também definem as situações nas quais os artigos tratados são utilizados e delimitam os compartimentos ambientais (atmosfera, águas, solo) potencialmente colocados em risco pelas madeiras tratadas com produtos de preservação da madeira.
|
|
3.
|
Este método de ensaio constitui um protocolo laboratorial para a obtenção de amostras da água (emissado) na qual é imersa a madeira tratada, a intervalos crescentes após a exposição. Relaciona-se a quantidade emitida para o emissado com a superfície da madeira e a duração da exposição, a fim de determinar um fluxo em mg/m2/dia. Pode assim estimar-se o fluxo (taxa de lixiviação) após períodos crescentes de exposição.
|
|
4.
|
As quantidades emitidas podem ser utilizadas na avaliação dos riscos para o ambiente associados à madeira tratada.
|
CONSIDERAÇÕES INICIAIS
|
5.
|
Considera-se que o mecanismo de lixiviação da superfície da madeira por água doce não é idêntico, em termos de natureza e intensidade, ao mecanismo de lixiviação da superfície da madeira por água salgada. Por conseguinte, é necessário um estudo de lixiviação da madeira por água do mar aplicável aos produtos ou misturas de preservação da madeira destinados ao tratamento de madeiras utilizadas nas proximidades do mar.
|
|
6.
|
A madeira utilizada num estudo de madeiras tratadas com produtos de preservação da madeira deve ser representativa das madeiras comercializadas e ser tratada de acordo com as instruções do fabricante do produto de preservação e em observância das normas e especificações pertinentes. É ainda necessário especificar os parâmetros do condicionamento a realizar à madeira após o tratamento, antes de iniciar o ensaio.
|
|
7.
|
As amostras de madeira utilizadas devem ser representativas dos artigos existentes (designadamente no tocante a espécies, densidade e outras características).
|
|
8.
|
O ensaio é aplicável a madeiras tratadas por processos penetrantes ou de aplicação superficial e a madeiras tratadas sujeitas a um tratamento de superfície obrigatório adicional (por exemplo pintura exigida para a utilização comercial da madeira).
|
|
9.
|
A composição, a quantidade, o pH e o estado físico da água são importantes para determinar a quantidade, o teor e a natureza das emissões de uma madeira.
|
PRINCÍPIO DO MÉTODO DE ENSAIO
|
10.
|
Para a realização do ensaio, mergulham-se em água provetes de madeira tratada com o produto de preservação da madeira. Recolhem-se e analisam-se quimicamente amostras sucessivas da água (emissado) ao longo do período de exposição, as vezes necessárias para efetuar cálculos estatísticos. A partir dos resultados das análises, calculam-se as taxas de emissão em mg/m2/dia. Regista-se o período decorrido até à colheita de cada amostra. Os ensaios com amostras de madeiras não-tratadas podem ser interrompidos caso não se detetem níveis de fundo nos três primeiros pontos de dados.
|
|
11.
|
A inclusão no ensaio de provetes de madeira não-tratada permite determinar, nos emissados, os níveis de fundo associados à madeira em causa, não provenientes do produto de preservação utilizado.
|
CRITÉRIOS DE QUALIDADE
Exatidão
|
12.
|
A exatidão do método de ensaio na estimativa de emissões depende da representatividade dos provetes ensaiados relativamente à madeira tratada comercializada, da representatividade da água utilizada relativamente à água real e da representatividade do regime de exposição relativamente às condições naturais.
|
|
13.
|
Antes de realizar o ensaio, é necessário determinar a exatidão, a precisão e a repetibilidade do método analítico.
|
Reprodutibilidade
|
14.
|
Colhem-se e analisam-se três amostras de água e toma-se o correspondente valor médio como valor da emissão. A reprodutibilidade inter e intralaboratorial dos resultados depende do regime de imersão e da madeira que constitui os provetes ensaiados.
|
Latitude aceitável dos resultados
|
15.
|
A latitude dos resultados do ensaio é aceitável se a diferença entre os valores máximo e mínimo for inferior a uma ordem de grandeza.
|
CONDIÇÕES DE REALIZAÇÃO DO ENSAIO
Água
|
16.
|
Cenários de lixiviação por água doce: Quando se pretende avaliar a exposição de madeira a água doce, recomenda-se a utilização de água desionizada (por exemplo ASTM D 1193, tipo II) no ensaio de lixiviação. A temperatura da água deve ser de 20 °C +/- 2 °C; os valores medidos do pH e da temperatura da água devem constar do relatório do ensaio. A análise de amostras da água utilizada, colhidas antes da imersão dos provetes tratados, permite estimar depois o teor dos produtos químicos analisados na água. Trata-se de análises de controlo que permitem determinar os níveis de fundo dos produtos químicos analisados em seguida.
|
|
17.
|
Cenários de lixiviação por água do mar: Quando se pretende avaliar a exposição de madeira a água do mar, recomenda-se a utilização de água artificial (por exemplo ASTM D 1141, sucedânea da água do mar, sem metais pesados) no ensaio de lixiviação. A temperatura da água deve ser de 20 °C +/- 2 °C; os valores medidos do pH e da temperatura da água devem constar do relatório do ensaio. A análise de amostras da água utilizada, colhidas antes da imersão dos provetes tratados, permite estimar depois o teor dos produtos químicos analisados na água. Trata-se de análises de controlo que permitem determinar os níveis de fundo dos produtos químicos importantes.
|
Provetes de madeira ensaiados
|
18.
|
Para que o ensaio dos produtos de preservação da madeira seja eficaz, a espécie de madeira ensaiada deve ser representativa das espécies habitualmente utilizadas. As espécies recomendadas são a Pinus sylvestris L. (pinheiro da escócia), a Pinus resinosa Ait. (pinheiro vermelho) e o pinheiro americano dito Southern pine (Pinus spp). Podem ser realizados ensaios adicionais com outras espécies.
|
|
19.
|
Deve utilizar-se madeira com fio direito, sem nós e sem aspeto resinoso. A madeira utilizada deve ser representativa das madeiras comercializadas. Registam-se a proveniência, a densidade e o número de anéis anuais por 10 mm.
|
|
20.
|
Recomenda-se a utilização no ensaio de séries de cinco provetes de madeira constituídos por blocos de dimensões conformes com a norma europeia EN 113 (25 mm × 50 mm × 15 mm) e faces longitudinais paralelas ao fio da madeira, embora possam utilizar-se outras dimensões (por exemplo 50 mm × 150 mm × 10 mm). Mergulham-se completamente na água os provetes ensaiados. Os provetes devem ser constituídos exclusivamente por alburno. Identifica-se individualmente cada provete, a fim de poder identificá-lo ao longo do ensaio.
|
|
21.
|
Os provetes devem apresentar-se aplanados ou cortados em planos, mas não lixados.
|
|
22.
|
Utilizam-se nas análises efetuadas durante o ensaio pelo menos cinco séries de provetes de madeira: tratam-se três séries com o produto de preservação da madeira, uma não se trata e a outra serve para estimar o teor de humidade antes do tratamento, determinado por secagem em estufa, dos provetes ensaiados. Prepara-se para o ensaio um número de provetes suficiente para se selecionarem três séries de provetes cuja retenção do produto de preservação da madeira não se afaste mais de 5 % do valor médio desse parâmetro no conjunto dos provetes preparados para o ensaio.
|
|
23.
|
Procede-se à selagem das extremidades de cada provete com um produto químico que impeça tanto a penetração do produto de preservação da madeira pelas faces transversais dos provetes como a lixiviação destes pela mesma zona. Ao aplicar o agente selante das extremidades, há que distinguir os provetes correspondentes a processos de aplicação superficial dos provetes correspondentes a processos de aplicação penetrante. O agente selante só tem de ser aplicado antes do tratamento no caso dos processos de aplicação superficial.
|
|
24.
|
No caso dos tratamentos por processos de penetração, as faces transversais dos provetes têm de estar expostas. Por conseguinte, neste caso, as extremidades dos provetes só podem ser seladas após o período de condicionamento. Estimam-se as emissões apenas para as superfícies longitudinais. Verificam-se e, se necessário, reaplicam-se as selagens antes de dar início à lixiviação, não podendo aplicar-se selantes depois desta iniciada.
|
Recipiente de imersão
|
25.
|
Este recipiente deve ser de material inerte e suficientemente grande para nele caberem 5 provetes de madeira conformes com a norma EN 113 mergulhados em 500 ml de água, sendo a razão entre a superfície da madeira e o volume de água de 0,4 cm2/ml.
|
Suporte para ensaio dos provetes
|
26.
|
Dispõem-se os provetes utilizados no ensaio num suporte que permita o contacto com a água de todas as superfícies expostas dos provetes.
|
PROTOCOLO DO TRATAMENTO POR APLICAÇÃO DE UM PRODUTO DE PRESERVAÇÃO DA MADEIRA
Preparação dos provetes tratados a utilizar no ensaio
|
27.
|
Para realizar o ensaio, tratam-se os provetes de madeira com o produto de preservação em estudo pelo método especificado para este último, ou seja, por um processo de tratamento penetrante ou por um processo de aplicação superficial, que pode ser por imersão, pulverização ou pincelagem.
|
Produtos de preservação a aplicar por processos de tratamento penetrantes
|
28.
|
Prepara-se uma solução do produto de preservação que permita atingir a absorção ou retenção especificada após aplicação da solução pelo processo de tratamento penetrante. Pesa-se cada provete de madeira destinado ao ensaio e determinam-se, por medição, as dimensões do provete. O processo de tratamento penetrante a utilizar é o especificado para a aplicação do produto de preservação à madeira tendo em vista as classes de utilização 4 ou 5. Após o tratamento, volta a pesar-se cada provete e calcula-se a retenção do produto de preservação (em kg/m3) por meio da seguinte equação:

|
|
29.
|
Pode utilizar-se neste ensaio madeira tratada industrialmente (por exemplo por impregnação sob vácuo). Nesse caso, registam-se os protocolos seguidos e analisa-se e regista-se a retenção da madeira tratada deste modo.
|
Produtos de preservação a aplicar por processos de aplicação superficial
|
30.
|
Os processos de aplicação superficial compreendem a imersão, a pulverização e a pincelagem dos provetes de madeira utilizados no ensaio. O processo e a taxa de aplicação (por exemplo litros por metro quadrado) devem ser os especificados para a aplicação em superfície do produto de preservação.
|
|
31.
|
Também neste caso pode utilizar-se no ensaio madeira tratada industrialmente. Registam-se os protocolos seguidos e analisa-se e regista-se a retenção da madeira tratada deste modo.
|
Condicionamento após o tratamento dos provetes a utilizar no ensaio
|
32.
|
Após o tratamento, condicionam-se os provetes tratados destinados ao ensaio de acordo com as recomendações do fornecedor do produto de preservação em estudo constantes da rotulagem deste, de acordo com as práticas de tratamento habituais ou de acordo com a norma EN 252.
|
Preparação e seleção dos provetes a ensaiar
|
33.
|
Após o condicionamento que se seguiu ao tratamento, calcula-se a retenção média do conjunto dos provetes preparados para o ensaio e selecionam-se aleatoriamente para as medições de lixiviação três séries representativas de provetes cuja retenção não se afaste mais de 5 % do valor médio de retenção do conjunto dos provetes.
|
PROTOCOLO DE MEDIÇÃO DE EMISSÕES DE PRODUTOS DE PRESERVAÇÃO DA MADEIRA
Método por imersão
|
34.
|
Pesam-se os provetes ensaiados e mergulham-se totalmente em água, registando-se a data e a hora. Tapa-se o recipiente, para reduzir a evaporação.
|
|
35.
|
Substitui-se a água no termo dos seguintes períodos: 6 horas, 1 dia, 2 dias, 4 dias, 8 dias, 15 dias, 22 dias e 29 dias (trata-se de tempos acumulados e não de intervalos entre substituições da água). Registam-se a hora e a data da substituição da água e a massa de água retirada do recipiente.
|
|
36.
|
Após cada substituição de água, conserva-se, para ulterior análise química, uma amostra da água na qual a série de provetes ensaiados esteve imersa.
|
|
37.
|
Esta colheita de amostras permite calcular o perfil das quantidades emitidas em função do tempo. Conservam-se as amostras em condições que permitam preservar o analito, por exemplo num frigorífico e na obscuridade, a fim de reduzir a proliferação microbiana nas amostras antes das análises.
|
MEDIÇÕES DAS EMISSÕES
Amostras tratadas
|
38.
|
Analisam-se quimicamente as amostras de água efetuando a pesquisa da substância ativa e/ou, se for caso disso, dos produtos de degradação/transformação correspondentes.
|
Amostras não-tratadas
|
39.
|
A colheita de amostras de água (emissado) neste sistema e a subsequente análise dos produtos químicos lixiviados das amostras de madeira não-tratada permitem estimar eventuais emissões do produto de preservação originárias dessa madeira. A colheita e análise de amostras do emissado após períodos crescentes de exposição permitem estimar a evolução das quantidades emitidas em função do tempo. Estas análises constituem um procedimento de controlo que permite determinar os níveis de fundo do produto químico em estudo na madeira não-tratada, a fim de confirmar que a madeira de proveniência das amostras não foi anteriormente tratada com o produto de preservação em estudo.
|
DADOS E RELATÓRIOS
Análises químicas
|
40.
|
Analisam-se quimicamente as amostras de água colhidas e exprimem-se os resultados dessas análises em unidades adequadas, por exemplo μg/l.
|
Relatório dos dados
|
41.
|
Registam-se todos os resultados. Sugerem-se em apêndice um modelo de registo para o ensaio de uma série de provetes tratados e um quadro de síntese para cálculo dos valores médios de emissão correspondentes a cada período transcorrido até à colheita das amostras.
|
|
42.
|
Calcula-se o fluxo emissivo diário em mg/m2/dia determinando a média das três medições correspondentes aos três replicados e dividindo pelo número de dias de imersão.
|
Relatório do ensaio
|
43.
|
Elementos mínimos a constar do relatório do ensaio:
|
—
|
nome do fornecedor do produto de preservação em estudo;
|
|
—
|
nome ou código específico e único do produto de preservação em estudo;
|
|
—
|
nome comercial ou comum do(s) ingrediente(s) ativo(s), descrição genérica dos coformulantes (por exemplo cossolvente ou resina) e percentagem mássica dos ingredientes na composição do produto;
|
|
—
|
valor pertinente de retenção ou de aplicação (em kg/m3 ou l/m2, respetivamente) especificado para madeiras utilizadas em contacto com água;
|
|
—
|
espécie de madeira utilizada, com indicação da sua densidade e da velocidade de crescimento em anéis por 10 mm;
|
|
—
|
valor da taxa de aplicação ou de retenção do produto de preservação ensaiado, expressa em l/m2 ou kg/m3, e fórmula de cálculo dessa taxa;
|
|
—
|
método de aplicação do produto de preservação, especificando o programa de tratamento utilizado, no caso de um processo de penetração, ou o método de tratamento à superfície, se tiver sido este o tipo de aplicação;
|
|
—
|
data de aplicação do produto de preservação e estimativa do teor de humidade dos provetes ensaiados, expresso em percentagem;
|
|
—
|
protocolo de condicionamento seguido, especificando o tipo, as condições e a duração;
|
|
—
|
agente selante utilizado nas extremidades e número de aplicações deste;
|
|
—
|
indicação de qualquer tratamento subsequente da madeira, por exemplo precisando o fornecedor, o tipo, as características e a taxa de aplicação de uma tinta;
|
|
—
|
data e hora de cada imersão, quantidade de água utilizada em cada imersão de provetes ensaiados e quantidade de água absorvida pela madeira durante a imersão;
|
|
—
|
qualquer alteração do método descrito e quaisquer fatores suscetíveis de terem influenciado os resultados.
|
|
REFERÊNCIAS
|
1)
|
Norma Europeia EN 84 — 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
2)
|
Norma Europeia EN 113/A1 — 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
3)
|
Norma Europeia EN 252 — 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
4)
|
Norma Europeia EN 335 / Parte 1 — 2006. Durability of wood and wood-based products — Definition of use classes — Part 1: General.
|
|
5)
|
American Society for Testing and Materials Standards, ASTM D 1141 — 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, volume 11.02.
|
|
6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77, Type II — 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, volume 11.01.
|
Apêndice 1
Modelo de registos para este método
Estimativa das emissões para o ambiente de madeiras tratadas com produtos de preservação da madeira: método laboratorial para artigos de madeira sem cobertura e em contacto com água doce ou com água do mar
|
Local do ensaio
|
|
|
Produto de preservação da madeira
|
|
Fornecedor do produto
|
|
|
Nome ou código específico e único do produto
|
|
|
Nome comercial ou comum do produto
|
|
|
Coformulantes
|
|
|
Retenção para madeira utilizada em contacto com água
|
|
|
Aplicação
|
|
Método de aplicação
|
|
|
Data da aplicação
|
|
|
Fórmula utilizada para calcular a retenção
|
|
|
Protocolo de condicionamento
|
|
|
Duração do condicionamento
|
|
|
Selante das extremidades e número de aplicações
|
|
|
Tratamento subsequente
|
se for caso disso
|
|
Provetes ensaiados
|
|
Espécie de madeira
|
|
|
Densidade da madeira
|
(mínimo … valor médio … máximo)
|
|
Velocidade de crescimento (anéis por 10 mm)
|
(mínimo … valor médio … máximo)
|
|
Teor de humidade
|
|
|
Conjuntos ensaiados
(66)
|
Retenção (por exemplo em kg/m3)
|
|
Com tratamento “x”
|
Valor médio e desvio-padrão, ou intervalo, correspondentes aos 5 provetes
|
|
Com tratamento “y”
|
Valor médio e desvio-padrão, ou intervalo, correspondentes aos 5 provetes
|
|
Com tratamento “z”
|
Valor médio e desvio-padrão, ou intervalo, correspondentes aos 5 provetes
|
|
Sem tratamento
|
|
|
Alterações de parâmetros do método de ensaio
|
Por exemplo, qualidade da água, dimensão dos provetes ensaiados etc.
|
|
Cronologia
|
Substituição da água
|
Massa do provete
|
Absorção de água
|
Amostras de água
|
|
Com tratamento (média)
|
Sem tratamento
|
Com tratamento (média)
|
Sem tratamento
|
|
Água utilizada no ensaio
|
x
|
y
|
z
|
|
|
Data
|
g
|
g
|
g
|
g
|
n.o
|
pH
|
pH
|
pH
|
pH
|
|
início
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 dias
|
|
|
|
|
|
3
|
|
|
|
|
|
4 dias
|
|
|
|
|
|
4
|
|
|
|
|
|
8 dias
|
|
|
|
|
|
5
|
|
|
|
|
|
15 dias
|
|
|
|
|
|
6
|
|
|
|
|
|
22 dias
|
|
|
|
|
|
7
|
|
|
|
|
|
29 dias
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Um quadro para cada ingrediente ativo
|
Cronologia
|
Substituição da água
|
Resultados analíticos
|
|
Provetes sem tratamento
|
Provetes com tratamento
|
|
Concentração do ingrediente ativo na água
mg/l
|
Quantidade emitida
mg/m2
|
Taxa de emissão
mg/m2/dia
|
Concentração do ingrediente ativo na água
|
Quantidade emitida
|
Taxa de emissão
|
|
x
|
y
|
z
|
Média
|
x
|
y
|
z
|
Média
|
x
|
y
|
z
|
Média
|
|
|
Data
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/dia
|
mg/m2/dia
|
mg/m2/dia
|
mg/m2/dia
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 dias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 dias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 dias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 dias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 dias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 dias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: Dado que os valores correspondentes aos provetes sem tratamento podem ter de ser utilizados para corrigir as emissões das amostras tratadas, os resultados correspondentes aos provetes sem tratamento devem ser indicados em primeiro lugar, sendo “valores corrigidos” todos os valores correspondentes às amostras com tratamento. Pode haver também uma correção decorrente da análise inicial da água.
Apêndice 2
Definições
Produto químico
: Substância ou mistura.
Produto químico em estudo
: Qualquer substância ou mistura à qual seja aplicado este método de ensaio.
C.46. BIOACUMULAÇÃO EM OLIGOQUETAS BENTÓNICOS SEDIMENTARES
INTRODUÇÃO
|
1.
|
Este método de ensaio é equivalente ao Test Guideline TG 315 (2008) da OCDE. Os animais endobentónicos que ingerem sedimentos podem ser expostos a substâncias ligadas aos sedimentos (1). Entre esses animais que ingerem sedimentos, os oligoquetas aquáticos desempenham um papel importante na base dos sistemas aquáticos. Vivem nos sedimentos e representam, frequentemente, as espécies mais abundantes, sobretudo nos habitats com condições ambientais adversas para outros animais. Através da bioturbação dos sedimentos e ao servirem de presa, estes animais podem influenciar fortemente a biodisponibilidade das referidas substâncias para outros organismos, por exemplo os peixes bentívoros. Ao contrário dos organismos epibentónicos, os oligoquetas aquáticos endobentónicos enterram-se nos sedimentos e ingerem partículas dos sedimentos abaixo da superfície destes. Estes organismos estão, portanto, expostos às ditas substâncias através de várias vias de absorção, como o contacto direto, a ingestão de partículas de sedimentos contaminadas, a água dos poros e a água sobrenadante. No apêndice 6 referem-se algumas espécies de oligoquetas bentónicos atualmente utilizadas em ensaios ecotoxicológicos.
|
|
2.
|
Entre os parâmetros que caracterizam a bioacumulação de uma substância contam-se, em primeiro lugar, o fator de bioacumulação (FBA), a constante de velocidade de absorção dos sedimentos (ks) e a constante de velocidade de eliminação (ke). O apêndice 1 define em pormenor estes parâmetros.
|
|
3.
|
É necessário um método de ensaio específico do compartimento ambiental em causa para avaliar em termos gerais o potencial de bioacumulação das substâncias e para investigar a bioacumulação das substâncias que tenham tendência a distribuir-se pelos sedimentos (1)(2)(3)(4).
|
|
4.
|
Este método de ensaio destina-se a avaliar a bioacumulação de substâncias associadas aos sedimentos em vermes oligoquetas endobentónicos. Enriquecem-se os sedimentos na substância em estudo. A utilização de sedimentos enriquecidos pretende simular sedimentos contaminados.
|
|
5.
|
O método baseia-se em métodos existentes de ensaio da toxicidade e da bioacumulação em sedimentos (1)(4)(5)(6)(7)(8)(9). Outros documentos úteis são os debates e as conclusões de um grupo de trabalho internacional (11) e os resultados de um estudo interlaboratorial comparativo internacional (12).
|
|
6.
|
O ensaio é aplicável a substâncias orgânicas neutras estáveis com tendência a associarem-se aos sedimentos. O método pode igualmente servir para medir a bioacumulação de compostos organometálicos estáveis associados aos sedimentos (12). Não é aplicável a metais nem a outros elementos vestigiais (11) sem adaptações do protocolo de ensaio no tocante a volumes de substrato e de água e, possivelmente, à quantidade das amostras de tecidos.
|
PRÉ-REQUISITOS E INFORMAÇÕES SOBRE A SUBSTÂNCIA EM ESTUDO
|
7.
|
São ainda em pequeno número as relações quantitativas estrutura-atividade (QSAR) bem assentes relativamente a processos de bioacumulação (14). A relação mais amplamente utilizada é a correlação entre a bioacumulação e bioconcentração de substâncias orgânicas estáveis, por um lado, e a lipofilia das mesmas (expressa pelo logaritmo do coeficiente de partição octanol-água, log Kow; ver a definição deste no apêndice 1), por outro, que foi desenvolvida para descrever a repartição de substâncias entre a água e os peixes. Esta relação também permitiu estabelecer correlações para o compartimento dos sedimentos (15)(16)(17)(18). A correlação log Kow-log FBC, importante relação quantitativa estrutura-atividade, pode ser útil para uma primeira estimativa, preliminar, do potencial de bioacumulação de substâncias associadas aos sedimentos. Porém, o fator de bioacumulação pode ser influenciado pelo teor de lípidos do organismo sujeito ao ensaio e pelo teor de carbono orgânico dos sedimentos. Também pode, portanto, utilizar-se o coeficiente de partição carbono orgânico-água (Kco) como fator indicativo determinante da bioacumulação de substâncias orgânicas associadas aos sedimentos.
|
|
8.
|
Este ensaio aplica-se a:
|
—
|
substâncias orgânicas estáveis com valores de log Kow compreendidos entre 3,0 e 6,0 (5)(19) e substâncias superlipófilas com log Kow superior a 6,0 (5);
|
|
—
|
substâncias pertencentes a classes de substâncias orgânicas conhecidas pelo seu potencial de bioacumulação em organismos vivos, por exemplo substâncias tensioativas ou fortemente adsorventes (por exemplo com Kco elevado).
|
|
|
9.
|
Antes de iniciar o estudo, é necessário dispor de determinadas informações sobre a substância em estudo, nomeadamente ao nível de precauções de segurança, de condições adequadas de conservação e de estabilidade, bem como dos métodos analíticos necessários. As referências (20) e (21) contêm orientações sobre o ensaio de substâncias cujas propriedades físico-químicas dificultam o ensaio das mesmas. Antes de proceder a um ensaio de bioacumulação com oligoquetas aquáticos, é necessário dispor das seguintes informações sobre a substância em estudo:
|
—
|
denominação comum, denominação química (de preferência a denominação IUPAC), fórmula estrutural, número de registo CAS, grau de pureza;
|
|
—
|
hidrossolubilidade [método de ensaio A.6 (22)];
|
|
—
|
coeficiente de partição octanol-água, Kow [métodos de ensaio A.8 e A.24 (22)];
|
|
—
|
coeficiente de partição sedimentos-água, expresso por Kd ou Kco [método de ensaio C.19 (22)];
|
|
—
|
hidrólise [método de ensaio C.7 (22)];
|
|
—
|
fototransformação na água (23);
|
|
—
|
pressão de vapor [método de ensaio A.4 (22)];
|
|
—
|
biodegradabilidade fácil [métodos de ensaio C.4 e C.29 (22)];
|
|
—
|
tensão superficial [método de ensaio A.5 (22)];
|
|
—
|
concentração micelar crítica (24).
|
Quando disponíveis, têm também importância as seguintes informações:
|
—
|
biodegradação no meio aquático [métodos de ensaio C.24 e C.25 (22)];
|
|
|
10.
|
A marcação radioativa das substâncias em estudo pode facilitar a análise das amostras de água e de sedimentos e das amostras biológicas, podendo recorrer-se a esta via para determinar se é ou não necessário identificar e quantificar produtos de degradação. O método aqui descrito foi validado num estudo interlaboratorial comparativo internacional (12) aplicável a substâncias marcadas com14C. Caso se determinem os resíduos radioativos totais, o fator de bioacumulação baseia-se na substância parental e nos produtos de degradação considerados. É igualmente possível combinar um estudo metabólico com um estudo de bioacumulação, procedendo para o efeito à análise, e à determinação quantitativa da percentagem, da substância parental e dos produtos de degradação desta em amostras colhidas no final da fase de absorção ou coincidentes com o nível máximo de bioacumulação. Em qualquer dos casos, recomenda-se que o cálculo do fator de bioacumulação se baseie na concentração da substância parental nos organismos e não apenas nos resíduos radioativos totais.
|
|
11.
|
Além das propriedades da substância em estudo, outra informação necessária é a toxicidade para a espécie de oligoquetas a utilizar no ensaio, como uma concentração letal mediana (CL50) correspondente ao período da fase de absorção, para que as concentrações de exposição escolhidas sejam muito inferiores aos níveis tóxicos. Se possível, deve ser dada preferência a valores de toxicidade derivados de estudos de longa duração de parâmetros subletais (CE50). Caso não se disponha desses dados, um ensaio de toxicidade aguda em condições idênticas às do ensaio de bioacumulação ou dados toxicológicos relativos a espécies alternativas podem fornecer informações úteis.
|
|
12.
|
Deve dispor-se de um método de análise adequado, cujas exatidão, precisão e sensibilidade sejam conhecidas, para determinar quantitativamente a substância nas soluções de ensaio, nos sedimentos e nas matérias biológicas e devem conhecer-se os pormenores da preparação e da conservação das amostras. Deve dispor-se também das correspondentes fichas de dados de segurança. É necessário conhecer igualmente os limites de deteção analítica da substância em estudo na água, nos sedimentos e nos tecidos dos vermes. Se for utilizado no ensaio uma substância com marcação radioativa, devem ser também conhecidas a radioatividade específica (em Bq.mol-1), a localização do átomo marcador e a percentagem de radioatividade associada a impurezas. Para que possam detetar-se no ensaio concentrações o mais baixas possível, a radioatividade específica da substância em estudo deve ser o mais elevada possível (11).
|
|
13.
|
Deve dispor-se ainda de informações sobre as características dos sedimentos que serão utilizados [por exemplo a origem dos sedimentos ou dos componentes destes, o pH e a concentração de amoníaco da água dos poros (sedimentos naturais), o teor de carbono orgânico total, a distribuição granulométrica das partículas (percentagem de areias, de limos e de argilas) e a percentagem de resíduo seco] (6).
|
PRINCÍPIO DO MÉTODO
|
14.
|
O ensaio compreende duas fases: a fase de absorção (exposição) e a fase de eliminação (após a exposição). Durante a primeira, expõem-se os vermes a sedimentos enriquecidos na substância em estudo, imersos em água reconstituída e convenientemente equilibrados (11). Ensaiam-se grupos de vermes de controlo em condições idênticas, mas sem a substância em estudo.
|
|
15.
|
Para a fase de eliminação, transferem-se os vermes para um sistema sedimentos-água isento da substância em estudo. A fase de eliminação é necessária para obter informações sobre a velocidade à qual a substância é excretada pelos organismos sujeitos ao ensaio (19)(25). A menos que a absorção da substância em estudo durante a fase de exposição seja insignificante (isto é, caso não se verifique nenhuma diferença com significância estatística entre a concentração da substância em estudo nos vermos sujeitos ao ensaio e nos vermes de controlo), é sempre necessária uma fase de eliminação. Se, durante a fase de absorção, não tiver sido atingido um estado estacionário, a determinação dos parâmetros cinéticos — fator de bioacumulação cinético (FBAk), constante de velocidade de absorção e constante de velocidade de eliminação — pode basear-se nos resultados da fase de eliminação. Monitorizam-se as variações de concentração da substância em estudo nos vermes ao longo de ambas as fases do ensaio.
|
|
16.
|
Durante a fase de absorção, efetuam-se medições até o fator de bioacumulação atingir um patamar ou um estado estacionário. Salvo indicação em contrário, a duração da fase de absorção é de 28 dias. A prática revelou que, no caso de várias substâncias orgânicas neutras estáveis, uma fase de absorção de 12 a 14 dias é suficiente para atingir o estado estacionário (6)(8)(9).
|
|
17.
|
Porém, mesmo que não se atinja o estado estacionário em 28 dias, dá-se início à fase de eliminação transferindo os oligoquetas expostos para recipientes nos quais foi introduzido o mesmo meio, mas sem a substância em estudo. Dá-se a fase de eliminação por terminada quando se atingir um nível de concentração correspondente a 10 % da concentração medida nos vermes no dia 28 da fase de absorção, ou após transcorrido um período máximo de 10 dias. O nível de resíduos nos vermes no final da fase de eliminação constitui um parâmetro adicional a inscrever no relatório, por exemplo como “resíduos não-eliminados”. Preferencialmente, calcula-se o fator de bioacumulação como a razão entre a concentração nos vermes (Ca) e nos sedimentos (Cs) em estado estacionário aparente (FBAEE) e, admitindo uma cinética de primeira ordem, também como a razão FBAk (fator de bioacumulação cinético) entre a constante de velocidade de absorção a partir dos sedimentos (ks) e a constante de velocidade de eliminação (ke). Caso não se atinja um estado estacionário em 28 dias, calcula-se FBAk a partir da constante de velocidade de absorção e da constante de velocidade de eliminação. Ver o detalhe dos cálculos no apêndice 2. Caso a cinética não seja de primeira ordem, será necessário recorrer a modelos mais complexos (ver o apêndice 2 e a referência 25).
|
|
18.
|
Caso não se atinja um estado estacionário em 28 dias, pode eventualmente prolongar-se a fase de absorção, efetuando medições suplementares a grupos de vermes expostos (se ainda os houver) até se atingir o estado estacionário. Paralelamente, dá-se, no entanto, início à fase de eliminação no dia 28 da fase de absorção.
|
|
19.
|
A constante de velocidade de absorção, a constante (ou constantes, se forem utilizados modelos mais complexos) de velocidade de eliminação, o fator de bioacumulação cinético FBAk) e, se possível, os limites de confiança de cada um destes parâmetros são calculados a partir das equações dos correspondentes modelos informáticos (ver os modelos no apêndice 2). A adequação de um modelo pode ser determinada a partir do coeficiente de correlação ou do coeficiente de determinação (coeficientes próximos de 1 indicam boa adequação).
|
|
20.
|
Para reduzir a variabilidade dos resultados do ensaio no caso das substâncias orgânicas muito lipofílicas, exprimem-se ainda os fatores de bioacumulação em relação ao teor de lípidos dos organismos sujeitos ao ensaio e ao teor de carbono orgânico total dos sedimentos (fator de acumulação biota-sedimentos, FABS, em kg de carbono orgânico total nos sedimentos por kg de lípidos nos vermes). Esta abordagem baseia-se em correlações teóricas e resultados experimentais para o compartimento aquático, no qual — para algumas classes químicas — existe uma relação clara entre o potencial de bioacumulação da substância e a sua lipofilia, bem estabelecida utilizando peixes como organismos-modelo (14)(25)(27). Existe igualmente uma relação entre o teor de lípidos dos peixes sujeitos aos ensaios e a bioacumulação das substâncias em causa. Detetaram-se correlações similares para organismos bentónicos (15)(16)(17)(18). Caso se disponha de tecido suficiente, pode determinar-se o teor de lípidos dos vermes sujeitos ao ensaio na mesma matéria biológica utilizada para determinar a concentração da substância em estudo. Porém, para medir o teor de lípidos, é mais prático utilizar animais de controlo aclimatados, pelo menos no início ou, de preferência, no final da fase de absorção, teores esses que depois podem ser utilizados para normalizar os valores de FBA.
|
VALIDADE DO ENSAIO
|
21.
|
Para que um ensaio possa considerar-se válido, têm de ser cumpridas as seguintes condições:
|
—
|
Mortalidade acumulada de vermes (vermes de controlo e vermes expostos) até ao final do ensaio não superior a 20 % dos efetivos iniciais de vermes;
|
|
—
|
Enterramento comprovado dos vermes nos sedimentos, para garantir a exposição máxima. Para mais informações, ver o ponto 28.
|
|
DESCRIÇÃO DO MÉTODO
Espécies ensaiadas
|
22.
|
O ensaio pode realizar-se com várias espécies de oligoquetas aquáticos. Indicam-se no apêndice 6 as espécies mais frequentemente utilizadas.
|
|
23.
|
Devem ser realizados ensaios de toxicidade (96 h apenas em água) a intervalos regulares (por exemplo todos os meses) com uma substância tóxica de referência, como o cloreto de potássio (KCl) ou o sulfato de cobre (CuSO4) (1), para comprovar o estado sanitário dos animais sujeitos ao ensaio (1)(6). Caso não se realizem ensaios de toxicidade com substâncias tóxicas de referência a intervalos regulares, será necessário verificar o lote de organismos destinados ao ensaio de bioacumulação em sedimentos recorrendo a uma substância tóxica de referência. A determinação do teor de lípidos também pode fornecer informações úteis sobre o estado dos animais.
|
Cultura dos organismos a ensaiar
|
24.
|
A fim de se dispor de um número suficiente de vermes para a realização dos ensaios de bioacumulação, pode ser necessário manter no laboratório uma cultura permanente da espécie em causa. Resumem-se no apêndice 6 alguns métodos de cultura em laboratório das espécies escolhidas para os ensaios. Ver mais pormenores nas referências (8)(9)(10)(18)(28)(29)(30)(31)(32).
|
Material e aparelhagem
|
25.
|
Não deve utilizar-se, em nenhuma parte do equipamento, nenhuma matéria suscetível de dissolver ou de absorver a substância em estudo ou de libertar outras substâncias ou que tenha efeitos adversos nos animais sujeitos ao ensaio. Podem ser utilizadas câmaras normalizadas retangulares ou cilíndricas, de matérias quimicamente inertes e com capacidade adequada à carga, isto é, com capacidade adequada ao número de vermes sujeitos ao ensaio. É de evitar a utilização de tubos de plástico flexíveis para administrar água ou ar. As partes que entram em contacto com os meios de ensaio devem ser de politetrafluoroetileno, aço inoxidável e/ou vidro. No caso de substâncias com coeficiente de adsorção elevado, como os piretroides sintéticos, pode ser necessário utilizar vidro silanizado. Nessas situações, descarta-se o equipamento utilizado (5). No caso do estudo de substâncias com marcação radioativa e de substâncias voláteis, é necessário evitar a evaporação e a consequente perda dessas substâncias. Devem ser utilizadas armadilhas (por exemplo garrafas de vidro para lavagem de gases) que contenham absorventes capazes de reter os resíduos que se evaporem das câmaras de ensaio (11).
|
Água
|
26.
|
A qualidade da água sobrenadante deve permitir a sobrevivência da espécie sujeita ao ensaio durante os períodos de aclimatação e de ensaio, sem que os animais adquiram uma aparência anormal nem tenham comportamentos anormais. Como água sobrenadante, recomenda-se a utilização nos ensaios, bem como nas culturas laboratoriais de vermes, de água reconstituída de acordo com o método C.1 (25). Demonstrou-se que várias espécies utilizadas nos ensaios podem sobreviver, crescer e reproduzir-se nesta água (8), que maximiza igualmente a normalização das condições de cultura dos vermes e de realização dos ensaios. É necessário caracterizar a água pelo menos em termos de pH, condutividade e dureza. A pesquisa de micropoluentes na água antes da utilização pode fornecer informações úteis (apêndice 4).
|
|
27.
|
A qualidade da água deve manter-se constante durante o ensaio. O pH da água sobrenadante deve manter-se entre 6 e 9. No início do ensaio, a dureza total deve estar compreendida entre 90 mg e 400 mg de CaCO3 por litro (7). O método C.1 (25) indica intervalos de pH e de dureza na referida água reconstituída. Caso se suspeite de alguma interação entre os iões responsáveis pela dureza da água e a substância em estudo, deve utilizar-se uma água menos dura. O apêndice 4 resume critérios adicionais de aceitação de uma água de diluição, de acordo com o Test Guideline TG 210 da OCDE (34).
|
Sedimentos
|
28.
|
A qualidade dos sedimentos deve permitir a sobrevivência e, de preferência, a reprodução dos organismos sujeitos ao ensaio durante os períodos de aclimatação e de ensaio, sem que os animais adquiram uma aparência anormal nem tenham comportamentos anormais. É necessário que os vermes se enterrem nos sedimentos. O comportamento de enterramento pode influenciar a exposição e, consequentemente, o fator de bioacumulação. Por conseguinte, se a turbidez da água sobrenadante o permitir, deve registar-se o comportamento dos organismos sujeitos ao ensaio em termos de tendência de afastamento dos sedimentos ou de enterramento. Os vermes de controlo e os vermes expostos devem enterrar-se nos sedimentos no prazo máximo de 24 h após a transferência para os recipientes de ensaio. Caso se observe que há vermes que definitivamente não se enterram nos sedimentos ou deles se afastam (por exemplo mais de 20 % nessas condições em mais de metade da fase de absorção), esta constatação indicia que as condições de realização do ensaio não são adequadas, que os vermes não estão saudáveis ou que a concentração da substância em estudo induz o comportamento observado. Nesse caso, interrompe-se o ensaio e repete-se este em melhores condições. É possível obter informações adicionais sobre a ingestão de sedimentos recorrendo aos métodos descritos nas referências (35) e (36), que se reportam à ingestão de sedimentos e à seleção de partículas pelos organismos sujeitos ao ensaio. Caso seja observável, deve registar-se e ter-se em conta na interpretação dos resultados do ensaio, no tocante às vias de exposição, pelo menos a presença ou ausência de excrementos à superfície dos sedimentos, a qual, a ocorrer, é reveladora de que os vermes ingeriram sedimentos.
|
|
29.
|
Uma vez que podem não estar disponíveis durante todo o ano sedimentos naturais de qualidade adequada, recomenda-se a utilização, nos ensaios e nas culturas laboratoriais de vermes, de sedimentos artificiais baseados no solo artificial descrito no método de ensaio C.8 (40). Além disso, o ensaio pode ser influenciado pelos organismos indígenas dos sedimentos naturais e pelos micropoluentes eventualmente presentes nestes. Várias espécies sobrevivem, crescem e reproduzem-se nos sedimentos artificiais, podendo ser utilizadas nos ensaios (8).
|
|
30.
|
É necessário caracterizar os sedimentos artificiais pelo menos em termos de origem dos componentes, distribuição granulométrica (percentagem de areias, de limos e de argilas), de teor de carbono orgânico total, de humidade e de pH. A medição do potencial redox é facultativa. Contudo, também sedimentos naturais de locais não-poluídos podem servir para o ensaio e/ou para a cultura (1). É necessário caracterizar os sedimentos naturais pelo menos em termos de origem (local de recolha), pH e teor de amoníaco da água dos poros, teor de carbono orgânico total, distribuição granulométrica (percentagem de areias, de limos e de argilas) e percentagem de humidade (6). Caso seja de prever a formação de amoníaco nos sedimentos naturais, recomenda-se que, antes do enriquecimento destes com a substância em estudo, os sedimentos sejam mantidos durante sete dias em condições idênticas às do ensaio a realizar a seguir. Remove-se e descarta-se a água sobrenadante depois deste período de condicionamento. A pesquisa de micropoluentes nos sedimentos ou nos componentes destes antes da utilização pode fornecer informações úteis.
|
Preparação
|
31.
|
As referências (1), (6) e (44) descrevem a manipulação de sedimentos naturais antes da utilização dos mesmos em laboratório. Descreve-se no apêndice 5 a preparação de sedimentos artificiais.
|
Conservação
|
32.
|
A conservação de sedimentos naturais em laboratório deve ser o mais curta possível. A Agência de Proteção do Ambiente dos E.U.A (6) recomenda um período de conservação máximo de 8 semanas, na obscuridade, a 4 °C ± 2 °C. Não deve existir nenhum espaço livre acima da superfície dos sedimentos nos recipientes de conservação. No apêndice 5 estabelecem-se algumas recomendações para a conservação de sedimentos artificiais.
|
Aplicação da substância em estudo
|
33.
|
Enriquecem-se os sedimentos com a substância em estudo. O enriquecimento consiste no revestimento de um ou mais componentes dos sedimentos com a substância em estudo. Por exemplo, pode embeber-se a areia quartzítica (ou uma parte dela, por exemplo 10 g de areia em cada recipiente de ensaio) com uma solução da substância em estudo num solvente adequado, que, em seguida, é lentamente evaporado até à secura. A fração revestida pode, então, ser misturada com os sedimentos humedecidos. Ao preparar os sedimentos, é necessário ter em conta a quantidade de areia da mistura de areia e de substância em estudo (ou seja, utiliza-se menos areia na preparação dos sedimentos) (6).
|
|
34.
|
No caso de sedimentos naturais, pode adicionar-se a substância em estudo enriquecendo, pelo método descrito para sedimentos artificiais, uma porção seca dos sedimentos, ou misturando a substância em estudo com sedimentos húmidos, evaporando em seguida o agente solubilizante eventualmente utilizado. São solventes adequados para o enriquecimento de sedimentos húmidos o etanol, o metanol, os éteres mono e dimetílico do etilenoglicol, a dimetilformamida e o trietilenoglicol (5)(34). A toxicidade e a volatilidade do solvente e a solubilidade da substância em estudo no solvente escolhido são os critérios principais para a seleção de um agente solubilizante adequado. A referência (41) [Environment Canada (1995)] contém mais orientações sobre o processo de enriquecimento. Deve ter-se o cuidado de assegurar uma distribuição completa e uniforme da substância em estudo nos sedimentos aos quais é adicionada. Analisam-se subamostras replicadas dos sedimentos enriquecidos para verificar as concentrações da substância em estudo nos sedimentos e determinar o grau de homogeneidade da distribuição da substância nestes.
|
|
35.
|
Uma vez preparados os sedimentos enriquecidos com a fase aquosa sobrenadante, é conveniente permitir a repartição da substância em estudo entre a fase aquosa e os sedimentos. A repartição deve ocorrer, de preferência, às condições de temperatura e arejamento utilizadas no ensaio. O tempo necessário para atingir o equilíbrio depende dos sedimentos e da substância, podendo variar de algumas horas a vários dias e mesmo, em casos raros, chegar a ser de 4 ou 5 semanas (28)(42). Neste ensaio, não se espera até se atingir o equilíbrio, mas recomenda-se um período de equilibração de 48 horas a 7 dias. Consoante a finalidade do estudo — por exemplo caso se pretenda simular condições ambientais –, pode dilatar-se o período de equilibração ou de envelhecimento dos sedimentos enriquecidos (11).
|
REALIZAÇÃO DO ENSAIO
Ensaio preliminar
|
36.
|
Poderá ser útil efetuar um ensaio preliminar com o objetivo de otimizar as condições do ensaio definitivo no que respeita, nomeadamente, à seleção da concentração ou concentrações da substância em estudo e à duração das fases de absorção e de eliminação. Durante esse ensaio preliminar, observa-se e regista-se o comportamento dos vermes, verificando se, por exemplo, os vermes se afastam dos sedimentos, reação que pode dever-se à substância em estudo e/ou aos próprios sedimentos. O afastamento dos vermes dos sedimentos também pode ser utilizado como parâmetro subletal num ensaio preliminar de estimativa da concentração ou concentrações da substância em estudo a utilizar no ensaio de bioacumulação.
|
Condições de exposição
Duração da fase de absorção
|
37.
|
Os organismos sujeitos a ensaio são expostos à substância em estudo durante a fase de absorção. Colhe-se a primeira amostra entre 4 h e 24 horas após o início desta fase. A fase de absorção deve prolongar-se por não mais de 28 dias (1)(6)(11), a menos que se demonstre que já foi atingido o equilíbrio. Atinge-se o estado estacionário quando: i) a representação gráfica do fator de bioacumulação correspondente a cada período a que se reporta uma colheita de amostras, em função do tempo, é paralela ao eixo dos tempos; ii) três análises sucessivas do FBA, em amostras colhidas a intervalos de, pelo menos, dois dias entre elas, não diferem mais de 20 % entre si; e iii) não há diferenças com significância estatística entre os três períodos a que se reportam as colheitas de amostras (com base em comparações estatísticas, por exemplo análise de variância e análise de regressão). Caso não se atinja o estado estacionário em 28 dias, pode pôr-se termo à fase de absorção dando início à fase de eliminação e pode calcular-se o fator de bioacumulação FBAk a partir da constante de velocidade de absorção e da constante de velocidade de eliminação (ver igualmente os pontos 16 a 18).
|
Duração da fase de eliminação
|
38.
|
Colhe-se a primeira amostra 4 h a 24 horas após o início da fase de eliminação, pois os resíduos presentes nos tecidos podem variar rapidamente no período inicial. Recomenda-se que se ponha termo à fase de eliminação quando a concentração da substância em estudo for inferior a 10 % da concentração em estado estacionário ou após um período máximo de 10 dias. O nível de resíduos nos vermes no final da fase de eliminação constitui um parâmetro secundário a inscrever no relatório. O referido período pode, porém, ser condicionado pelo período em que a concentração da substância em estudo nos vermes é superior ao limite de deteção analítica.
|
Organismos utilizados no ensaio
Número de vermes utilizado no ensaio
|
39.
|
A massa de tecido correspondente ao número de vermes de cada amostra deve ser tal que a massa de substância em estudo por amostra no início da fase de absorção e no final da fase de eliminação seja significativamente maior do que o limite de deteção da substância em estudo na matéria biológica. Nesses estádios das fases de absorção e de eliminação, em geral a concentração nos animais sujeitos ao ensaio é relativamente baixa (6)(8)(18). Dado que, em muitas espécies de oligoquetas aquáticos, o peso de um indivíduo é muito baixo (5-10 mg de peso húmido por indivíduo no caso da Lumbriculus variegatus e da Tubifex tubifex), podem reunir-se os vermes de uma dada câmara de ensaio replicada para as pesagens e a análise da substância em estudo. No caso das espécies cujos indivíduos sejam mais pesados (por exemplo a Branchiura sowerbyi), podem utilizar-se replicados com apenas um indivíduo, mas, nessa eventualidade, deve aumentar-se o número de replicados para cinco por ponto de colheita de amostras (11). Importa, porém, referir que a Branchiura sowerbyi não foi incluída no estudo interlaboratorial comparativo (12), pelo que não se recomenda a utilização preferencial desta espécie no método.
|
|
40.
|
Os vermes utilizados devem ter dimensões semelhantes (ver no apêndice 6 o caso da Lumbriculus variegatus). Devem provir da mesma origem e ser animais adultos ou crescidos da mesma classe etária (ver o apêndice 6). O peso e a idade do animal podem influenciar os valores dos fatores de bioacumulação (por exemplo devido a teores de lípidos diferentes e/ou à presença de ovos), pelo que estes parâmetros devem ser registados com exatidão. Para determinar o peso médio húmido e seco, pesa-se uma subamostra de vermes antes de iniciar o ensaio.
|
|
41.
|
No caso da Tubifex tubifex e da Lumbriculus variegatus, é de prever reprodução durante o período de ensaio. Caso não haja reprodução durante o ensaio de bioacumulação, regista-se esse facto, que deve ser tido em conta na interpretação dos resultados do ensaio.
|
Taxa de carga
|
42.
|
A fim de minimizar a redução da concentração da substância em estudo nos sedimentos durante a fase de absorção e para evitar que a concentração de oxigénio dissolvido diminua, as razões sedimentos/verme e água/verme devem ser elevadas. A taxa de carga escolhida também deve corresponder às densidades populacionais da espécie em causa observadas na natureza (43). Por exemplo, no caso da Tubifex tubifex, recomenda-se uma taxa de carga de 1-4 mg de tecido de vermes (peso húmido) por grama de sedimentos húmidos (8)(11). No caso da Lumbriculus variegatus, as referências (1) e (6) recomendam uma taxa de carga ≤1 g de peso seco de tecido de vermes por 50 g de carbono orgânico dos sedimentos.
|
|
43.
|
Retiram-se da cultura os vermes a utilizar no ensaio por peneiração dos sedimentos de cultura. Transferem-se os animais (adultos ou animais crescidos sem sinais de fragmentação recente) para placas de vidro (por exemplo placas de Petri) já com água limpa. Se as condições de realização do ensaio diferirem das condições de cultura, deverá ser suficiente uma fase de aclimatação de 24 horas. Antes de pesar os vermes, é necessário retirar deles o excesso de água. Para isso, os vermes podem ser colocados com cuidado sobre papel absorvente previamente humedecido. Não se recomenda a secagem dos vermes com papel absorvente, pois isso poderia pô-los numa situação de tensão ou lesioná-los. Brunson et al. (1998) recomendam a utilização de vermes não-enxutos cuja massa represente aproximadamente 1,33 vezes a biomassa pretendida. Estes 33 % adicionais correspondem à diferença entre os vermes enxutos e não-enxutos (28).
|
|
44.
|
No início da fase de absorção (dia 0 do ensaio), retiram-se os organismos a ensaiar da câmara de aclimatação e distribuem-se aleatoriamente por recipientes (por exemplo placas de Petri) que contenham água reconstituída, transferindo dois vermes para cada recipiente de cada vez até cada um deles ter dez vermes. Em seguida, transfere-se aleatoriamente cada um desses grupos de vermes para um de vários recipientes de ensaio, utilizando, por exemplo, uma pinça de aço flexível. Segue-se a incubação dos recipientes de ensaio nas condições previstas.
|
Alimentação
|
45.
|
Dado o baixo teor de nutrientes dos sedimentos artificiais, tem de ser incorporada nestes uma fonte alimentar. Para não subestimar a exposição dos organismos sujeitos ao ensaio, por exemplo fornecendo seletivamente uma alimentação não-contaminada, os alimentos necessários à reprodução e ao crescimento desses organismos devem ser adicionados aos sedimentos, de uma só vez, antes ou durante a aplicação da substância em estudo (ver o apêndice 5).
|
Proporção entre sedimentos e água
|
46.
|
Recomenda-se uma proporção 1:4 entre os sedimentos e a água (45). Considera-se esta proporção adequada para manter níveis apropriados de concentração de oxigénio e evitar a acumulação de amoníaco na água sobrenadante. Deve manter-se a concentração de oxigénio na água sobrenadante a 40 % ou mais da concentração de saturação. Areja-se suavemente a água sobrenadante dos recipientes de ensaio (por exemplo 2 a 4 bolhas por segundo) com uma pipeta de Pasteur cuja ponta é colocada cerca de 2 cm acima da superfície dos sedimentos, para minimizar a perturbação destes.
|
Luz e temperatura
|
47.
|
O fotoperíodo da cultura e do ensaio é de 16 horas (1)(6). Deve manter-se a intensidade luminosa na zona onde decorre o ensaio a cerca de 500-1 000 lux. A temperatura deve ser de 20 °C ± 2 °C ao longo de todo o ensaio.
|
Concentrações ensaiadas
|
48.
|
Para determinar a cinética da absorção, utiliza-se uma das concentrações ensaiadas (a mais baixa possível), mas pode utilizar-se também para o efeito uma segunda concentração (mais elevada) — ver, por exemplo, (46). Nessa eventualidade, analisam-se amostras colhidas em estado estacionário ou após 28 dias, para confirmar o fator de bioacumulação medido à concentração mais baixa (11). A escolha dessa concentração mais elevada deve excluir a ocorrência de efeitos indesejados (escolhendo, por exemplo, 1 % da concentração com efeitos crónicos, CEx, mais baixa conhecida, obtida a partir de estudos pertinentes de toxicidade crónica). A concentração ensaiada mais baixa deve estar significativamente acima do limite de deteção nos sedimentos e nas amostras biológicas do método analítico utilizado. Se a concentração com efeitos da substância em estudo for próxima do limite de deteção analítica, recomenda-se o estudo de uma substância marcada radioativamente, com elevada radioatividade específica.
|
Replicados expostos e de controlo
|
49.
|
O número mínimo de replicados expostos a utilizar para medições cinéticas é de três por ponto de colheita de amostras (11) das fases de absorção e de eliminação. Para datas adicionais de colheita de amostras com caráter facultativo, por exemplo, devem ser utilizados replicados suplementares. Para a fase de eliminação, prepara-se o número conveniente de replicados com sedimentos não-enriquecidos e água sobrenadante, de modo que, no final da fase de absorção, os vermes expostos possam ser transferidos dos recipientes de exposição a isso destinados para recipientes não-expostos. O número de replicados expostos deve ser suficiente para a fase de absorção e a fase de eliminação.
|
|
50.
|
Em alternativa, os vermes destinados à colheita de amostras durante a fase de eliminação podem ser expostos num recipiente grande que contenha sedimentos enriquecidos do mesmo lote utilizado para o estudo cinético da fase de absorção. É necessário demonstrar que as condições de realização do ensaio (designadamente a espessura de sedimentos, a proporção sedimentos/água, a taxa de carga, a temperatura e a qualidade da água) são comparáveis às dos replicados destinados à fase de absorção. No final da fase de absorção, colhem-se naquele recipiente, para análise, amostras de água, de sedimentos e de vermes, retirando-se cuidadosamente e transferindo um número suficiente de vermes crescidos, sem sinais de fragmentação recente, para os replicados preparados para a fase de eliminação (por exemplo dez organismos por recipiente replicado).
|
|
51.
|
Caso apenas se utilize água como solvente, devem ser constituídos, pelo menos, 9 replicados de controlo negativo (colhendo-se amostras em, pelo menos, 3 no início do ensaio, 3 no final da fase de absorção e 3 no final da fase de eliminação) para análises biológicas e dos níveis de fundo. Se for utilizado um qualquer agente solubilizante para a aplicação da substância em estudo, é necessário proceder a um controlo do solvente (colheita de amostras em, pelo menos, 3 replicados no início da fase de absorção, 3 no final da fase de absorção e 3 no final da fase de eliminação). Nesse caso, devem ser preparados, pelo menos, 4 replicados de controlo negativo (sem solvente), para que neles sejam colhidas amostras no final da fase de absorção. A fim de obter informações sobre a eventual influência do solvente nos organismos sujeitos ao ensaio, pode efetuar-se uma comparação, em termos biológicos, entre estes últimos replicados e o controlo do solvente. Para mais pormenores, ver o apêndice 3.
|
Frequência das determinações da qualidade da água
|
52.
|
Durante a fase de absorção e a fase de eliminação, é necessário medir, pelo menos, os seguintes parâmetros de qualidade da água na água sobrenadante:
|
Temperatura
|
num recipiente correspondente a cada nível de exposição por data de colheita de amostras, num recipiente de controlo uma vez por semana, no início e no final do período de absorção e no início e no final do período de eliminação; pode igualmente registar-se a temperatura no meio circundante (ar ambiente ou banho de água) ou num recipiente de ensaio representativo, por exemplo de hora a hora ou continuamente;
|
|
Teor de oxigénio dissolvido
|
num recipiente correspondente a cada nível de exposição e num recipiente de controlo, por data de colheita de amostras, expresso em mg/l e em % do valor da saturação com ar (VSA);
|
|
Fornecimento de ar
|
a verificar pelo menos uma vez por dia (dias úteis) e a regular se necessário;
|
|
pH
|
num recipiente correspondente a cada nível de exposição por data de colheita de amostras, num recipiente de controlo uma vez por semana, no início e no final do período de absorção e no início e no final do período de eliminação;
|
|
Dureza total da água
|
pelo menos num recipiente exposto e num recipiente de controlo no início e no final do período de absorção e no início e no final do período de eliminação, expressa em mg de CaCO3 por litro;
|
|
Teor total de amoníaco
|
pelo menos num recipiente exposto e num recipiente de controlo no início e no final do período de absorção e no início e no final do período de eliminação, expresso em mg de NH4
+, NH3 ou azoto amoniacal total por litro.
|
|
Colheita de amostras e análise dos vermes, dos sedimentos e da água
Programa de colheita de amostras
|
53.
|
O apêndice 3 contém exemplos de programação da colheita de amostras para uma fase de absorção de 28 dias e uma fase de eliminação de 10 dias.
|
|
54.
|
Antes da introdução dos vermes, durante a fase de absorção e durante a fase de eliminação, colhem-se amostras da água e dos sedimentos das câmaras de ensaio para determinar a concentração da substância em estudo. Durante o ensaio, determinam-se as concentrações da substância em estudo nos vermes, nos sedimentos e na água, para monitorizar a distribuição daquela pelos diversos compartimentos do sistema de ensaio.
|
|
55.
|
Colhem-se amostras dos vermes, dos sedimentos e da água pelo menos seis vezes durante a fase de absorção e pelo menos seis vezes durante a fase de eliminação.
|
|
56.
|
Prossegue-se a colheita de amostras até se atingir um patamar (estado estacionário, ver o apêndice 1) ou durante 28 dias. Se, depois de transcorridos 28 dias, o patamar não tiver sido atingido, dá-se início à fase de eliminação. No início desta fase, transferem-se os vermes a isso destinados para câmaras replicadas não quais já se introduziram água e sedimentos não-expostos (ver também os pontos 17 e 18).
|
Colheita e preparação das amostras
|
57.
|
Colhem-se amostras de água decantando, sifonando ou pipetando um volume de água suficiente para determinar quantitativamente a substância em estudo na amostra.
|
|
58.
|
Remove-se cuidadosamente, por decantação ou sifonagem, a restante água sobrenadante da câmara ou câmaras de ensaio. Colhem-se em seguida cuidadosamente amostras dos sedimentos, de modo a perturbar os vermes o mínimo possível.
|
|
59.
|
Retiram-se todos os vermes de cada replicado em causa no momento da colheita das amostras, por exemplo pondo os sedimentos em suspensão com a água sobrenadante, espalhando o conteúdo de cada replicado numa tina pouco profunda e recolhendo os vermes com uma pinça de aço flexível. Enxaguam-se rapidamente os vermes com água numa tina pouco profunda de vidro ou de aço. Elimina-se o excesso de água. Transferem-se os vermes cuidadosamente para um recipiente previamente tarado e determina-se o peso dos vermes. Matam-se os vermes por congelação (por exemplo ≤ -18 °C). Regista-se se estão presentes casulos e/ou animais jovens e o número respetivo.
|
|
60.
|
Em geral, os vermes devem ser pesados e mortos imediatamente após a colheita das amostras, sem fase de purga intestinal, para obter fatores de bioacumulação prudentes, que incluam o conteúdo contaminado do intestino, e para evitar perdas de fluidos corporais durante uma eventual purga intestinal unicamente em água (8). Não é de esperar que as substâncias com log Kow superior a 5 sejam significativamente eliminadas durante uma eventual purga intestinal unicamente em água; porém as perdas de substâncias com log Kow inferior a 4 podem ser apreciáveis (47).
|
|
61.
|
Durante a fase de eliminação, os vermes purgam o intestino nos sedimentos limpos. Significa isto que as medições efetuadas imediatamente antes da fase de eliminação incluem sedimentos intestinais contaminados, ao passo que, após as 4 a 24 horas iniciais da fase de eliminação, a maior parte do conteúdo intestinal contaminado foi supostamente substituído por sedimentos limpos (11)(47). Pode então considerar-se que a concentração nos vermes desta amostra é a concentração nos tecidos após purga intestinal. Para atender à diluição da concentração da substância em estudo por sedimentos não-contaminados verificada durante a fase de eliminação, pode estimar-se o peso do conteúdo intestinal a partir do quociente entre o peso húmido de vermes e o peso das cinzas dos vermes ou do quociente entre o peso seco de vermes e o peso das cinzas dos vermes.
|
|
62.
|
Se o objetivo de um determinado estudo for medir a biodisponibilidade e os resíduos reais nos tecidos dos organismos em causa, será necessário pesar, pelo menos, uma subamostra dos animais expostos (proveniente, por exemplo, de três recipientes replicados suplementares), de preferência constituída em estado estacionário, purgá-la em água limpa durante 6 horas (47) e pesá-la novamente antes das análises. Em seguida, os dados de peso de vermes e de concentração corporal correspondentes a esta subamostra podem ser comparados com os valores obtidos para vermes não-purgados. Para minimizar a tensão dos animais, os vermes destinados à medição da eliminação não são purgados antes de serem transferidos para sedimentos limpos.
|
|
63.
|
De preferência, analisam-se as amostras de água, de sedimentos e de vermes imediatamente após a colheita (ou seja, no prazo de 1 a 2 dias), a fim de evitar degradações ou outras perdas e de calcular as velocidades aproximadas de absorção e de eliminação no decurso do próprio ensaio. A análise imediata também permite identificar prontamente o início de um patamar.
|
|
64.
|
Se não forem imediatamente analisadas, é necessário conservar as amostras em condições adequadas. Para isso, antes de iniciar o estudo, é importante obter informações sobre a estabilidade e as condições adequadas de conservação da substância em causa (por exemplo duração e temperatura de conservação, processos de extração etc.). Caso não se disponha dessas informações e se considere necessário obtê-las, podem ser estudados em paralelo tecidos enriquecidos de controlo, para determinar a estabilidade de conservação.
|
Qualidade do método analítico
|
65.
|
Uma vez que, na sua globalidade, o método de ensaio é essencialmente condicionado pela exatidão, pela precisão e pela sensibilidade do método analítico utilizado para determinar a substância em estudo, é necessário verificar experimentalmente se a precisão e a reprodutibilidade da análise química, bem como a recuperação da substância em estudo a partir das amostras de água, de sedimentos e de vermes, se adequam ao método em causa. Importa ainda confirmar que a substância em estudo não é detetável nas câmaras de controlo em concentrações superiores ao nível de fundo. Se necessário, corrigem-se os valores de Cw (concentração na água), Cs (concentração nos sedimentos) e Ca (concentração nos vermes) em função das recuperações e dos valores de fundo correspondentes aos recipientes de controlo. Manipulam-se as amostras durante o ensaio de maneira a minimizar as contaminações e as perdas (resultantes, por exemplo, da adsorção da substância em estudo ao dispositivo de colheita de amostras).
|
|
66.
|
Registam-se e indicam-se no relatório a recuperação global da substância em estudo e a recuperação da mesma nos vermes, nos sedimentos, na água e em eventuais armadilhas com absorventes para retenção da substância em estudo evaporada.
|
|
67.
|
Uma vez que se recomenda a utilização de substâncias com marcação radioativa, pode analisar-se a radioatividade total (substância parental e produtos de degradação desta). Todavia, se for viável do ponto de vista analítico, a determinação quantitativa separada da substância parental e dos produtos de degradação em estado estacionário ou no final da fase de absorção pode fornecer informações importantes. Caso se pretenda realizar essas medições, será necessário submeter as amostras a processos de extração adequados, para que possa determinar-se quantitativamente a substância parental por si só. Recomenda-se que se proceda à identificação de cada produto de degradação que represente uma percentagem significativa (por exemplo > 10 %) da radioatividade medida nos organismos sujeitos ao ensaio, em estado estacionário ou no final da fase de absorção (5).
|
|
68.
|
Dado que a biomassa de cada indivíduo é pequena, é frequente não ser possível determinar a concentração da substância em estudo em cada verme, a menos que se utilize no ensaio a espécie Branchiura sowerbyi (40-50 mg de peso líquido por verme) (11). Nesses casos, é aceitável que se reúnam os espécimes que integram a amostra colhida em cada recipiente de ensaio, separadamente para cada recipiente, mas este procedimento restringe os métodos estatísticos aplicáveis aos dados correspondentes. Se um determinado método estatístico e um determinado poder estatístico forem importantes, o ensaio terá de incidir num número de animais e/ou de câmaras de ensaio replicadas compatível com a reunião de espécimes e com o método e poder estatísticos pretendidos.
|
|
69.
|
Recomenda-se que o fator de bioacumulação seja expresso em função do peso húmido total, do peso seco total e, quando necessário (por exemplo no caso de substâncias muito lipófilas), também em função do teor de lípidos e do teor de carbono orgânico total dos sedimentos. Na determinação do teor de lípidos devem ser utilizados métodos adequados (48)(49). Como método-padrão, pode recomendar-se a extração com clorofórmio/metanol (48)(50). No entanto, para evitar os solventes clorados, pode utilizar-se a versão modificada do método de Bligh e Dyer (50) descrita na referência (51), que foi objeto de um estudo interlaboratorial comparativo. Como os vários métodos não conduzem a resultados idênticos (48), importa explicar o método utilizado. Sempre que possível, isto é, quando se dispõe de tecido de vermes suficiente, determina-se o teor de lípidos na amostra ou extrato utilizado para a análise da substância em estudo, porquanto os lípidos têm frequentemente de ser removidos do extrato antes de este poder ser analisado cromatograficamente (5). Porém, para medir o teor de lípidos, é prático utilizar animais de controlo aclimatados, pelo menos no início ou, de preferência, no final da fase de absorção, por exemplo em três amostras.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
70.
|
Obtém-se a curva de absorção da substância em estudo exprimindo em função do tempo, numa escala aritmética, a concentração da substância nos vermes durante a fase de absorção. Se a curva tiver atingido um patamar, calcula-se do seguinte modo o fator de bioacumulação em estado estacionário (FBAEE):

|
|
71.
|
Determina-se o fator de bioacumulação cinético (FBAk) como o quociente ks/ke. Normalmente, determina-se a constante de velocidade de eliminação (ke) a partir da curva de eliminação (ou seja, da linha que representa a concentração da substância em estudo nos vermes durante a fase de eliminação). Em seguida, calcula-se a constante de velocidade de absorção, ks, a partir da cinética da curva de absorção. Para obter o fator FBAk e as constantes de velocidade ks e ke, é preferível recorrer a métodos informáticos de estimativa de parâmetros não-linear (ver o apêndice 2). Se, manifestamente, a curva de eliminação não obedecer a uma cinética de primeira ordem, devem ser utilizados modelos mais complexos (25)(27)(52).
|
|
72.
|
Determina-se o fator de acumulação biota-sedimentos (FABS) por normalização do FBAk em função do teor de lípidos dos vermes e do teor de carbono orgânico total dos sedimentos.
|
Interpretação dos resultados
|
73.
|
Sempre que os valores determinados para as concentrações de ensaio sejam próximos do limite de deteção do método analítico utilizado, os resultados devem ser interpretados com precaução.
|
|
74.
|
A obtenção de curvas de absorção e de eliminação bem definidas constitui um indicador de boa qualidade dos dados de bioacumulação. Em geral, em estudos bem concebidos, os limites de confiança dos valores do FBA não excedem 25 % (5).
|
Relatório do ensaio
|
75.
|
Elementos a constar do relatório do ensaio:
|
|
Substância em estudo
|
—
|
estado físico e propriedades físico-químicas, por exemplo log Kow e hidrossolubilidade;
|
|
—
|
dados de identificação química; proveniência da substância em estudo, identidade e concentração dos solventes eventualmente utilizados;
|
|
—
|
em caso de marcação radioativa, localização exata dos átomos marcadores, radioatividade específica e percentagem de radioatividade associada a impurezas.
|
|
|
|
Espécies ensaiadas
|
—
|
denominação científica, estirpe, origem, pré-tratamentos eventuais, aclimatação, idade, gama de dimensões etc.
|
|
|
|
Condições de realização do ensaio
|
—
|
tipo de ensaio (estático, semiestático ou de fluxo contínuo);
|
|
—
|
tipo e características da iluminação utilizada e fotoperíodo(s);
|
|
—
|
protocolo do ensaio [por exemplo número, matéria e dimensão das câmaras de ensaio, volume de água, massa e volume de sedimentos, taxa de renovação da água (ensaios de fluxo contínuo ou semiestático), eventual arejamento antes do ensaio e durante o ensaio, número de replicados, número de vermes por replicado, número de concentrações ensaiadas, duração da fase de absorção e da fase de eliminação, frequência de colheita de amostras];
|
|
—
|
método de preparação e de aplicação da substância em estudo e razões da escolha desse método;
|
|
—
|
concentrações nominais ensaiadas;
|
|
—
|
origem dos componentes da água e dos sedimentos artificiais ou — caso se utilizem meios naturais — origem da água e dos sedimentos, descrição dos eventuais tratamentos prévios, resultados de eventuais demonstrações da capacidade dos animais sujeitos ao ensaio de viverem e/ou de se reproduzirem nos meios utilizados, características dos sedimentos [pH e teor de amoníaco da água dos poros (no caso dos sedimentos naturais), teor de carbono orgânico total, distribuição granulométrica (percentagem de areias, de limos e de argilas), percentagem de humidade e outras medições efetuadas] e características da água [pH, dureza, condutividade, temperatura, concentração de oxigénio dissolvido, teores de cloro residual (se for medido) e outras medições efetuadas];
|
|
—
|
peso seco nominal e medido, em percentagem do peso húmido (ou razão peso seco/peso húmido), dos sedimentos artificiais; peso seco medido, em percentagem do peso húmido (ou razão peso seco/peso húmido), dos sedimentos naturais;
|
|
—
|
qualidade da água nas câmaras de ensaio, caracterizada pela temperatura, pelo pH, pelo teor de amónio, pela dureza total e pela concentração de oxigénio dissolvido;
|
|
—
|
informações pormenorizadas sobre o tratamento das amostras de água, de sedimentos e de vermes, nomeadamente elementos sobre a preparação, a conservação, o enriquecimento com a substância em estudo, a extração e as análises (incluindo a precisão destas) da substância em estudo e do teor de lípidos, bem como as recuperações da substância em estudo.
|
|
|
|
Resultados
|
—
|
mortalidade dos vermes de controlo e dos vermes de cada câmara de ensaio e eventuais efeitos subletais observados, incluindo comportamentos anormais (por exemplo afastamento dos vermes relativamente aos sedimentos, presença ou ausência de excrementos, ausência de reprodução);
|
|
—
|
peso seco medido, em percentagem do peso húmido (ou razão peso seco/peso húmido), dos sedimentos e dos organismos sujeitos ao ensaio (útil para a normalização);
|
|
—
|
teor de lípidos dos vermes;
|
|
—
|
curvas que evidenciem a cinética da absorção e da eliminação da substância em estudo nos vermes e tempo decorrido até ao estado estacionário;
|
|
—
|
Ca, Cs e Cw (com o desvio-padrão e o intervalo de variação, se for caso disso) para todos os momentos de colheita de amostras (Ca expressa em g/kg de peso húmido e peso seco de todo o corpo, Cs expressa em g/kg de peso húmido e peso seco de sedimentos e Cw em mg/l). Se (por exemplo para comparação dos resultados de dois ou mais ensaios realizados em animais com teores de lípidos diferentes) for necessário um fator de acumulação biota-sedimentos (FABS, ver a definição no apêndice 1), Ca deve igualmente ser expressa em g/kg de lípidos do organismo e Cs em g/kg de carbono orgânico dos sedimentos;
|
|
—
|
FBA (expresso em kg de sedimentos húmidos/kg de vermes húmidos), constante de velocidade de absorção a partir dos sedimentos, ks (expressa em g de sedimentos húmidos/kg de vermes húmidos/dia) e constante de velocidade de eliminação, ke (expressa em dia-1); adicionalmente, pode indicar-se no relatório o fator de acumulação biota-sedimentos (FABS, expresso em kg de carbono orgânico dos sedimentos/kg de lípidos dos vermes);
|
|
—
|
resíduos não-eliminados no final da fase de eliminação;
|
|
—
|
caso tenham sido medidas: percentagens da substância parental, dos produtos de degradação desta e dos resíduos ligados (ou seja, percentagem da substância em estudo que não pode ser extraída por métodos de extração correntes) detetadas nos animais sujeitos ao ensaio;
|
|
—
|
métodos utilizados na análise estatística dos dados.
|
|
|
|
Avaliação dos resultados
|
—
|
coerência dos resultados com os critérios de validade enumerados no ponto 21;
|
|
—
|
resultados inesperados ou inabituais, por exemplo eliminação incompleta da substância em estudo pelos animais sujeitos ao ensaio; nesses casos, os resultados de estudos preliminares podem fornecer informações úteis.
|
|
|
Apêndice 1
Definições e unidades
|
|
Sedimentos artificiais, formulados, reconstituídos ou sintéticos são uma mistura de matérias utilizadas para simular os componentes de sedimentos naturais.
|
|
|
Bioacumulação é o aumento que a concentração da substância em estudo sofre num organismo, relativamente à concentração da substância no meio circundante. A bioacumulação resulta dos processos de bioconcentração e de bioamplificação (ver adiante).
|
|
|
O fator de bioacumulação (FBA) em qualquer momento da fase de absorção deste ensaio de bioacumulação é o quociente entre a concentração da substância em estudo no organismo sujeito ao ensaio (Ca — em g por kg de peso húmido ou seco) e a concentração da substância no meio circundante (Cs — em g por kg de peso húmido ou seco de sedimentos). Por razões de coerência com as unidades de Ca e de Cs, a unidade do fator de bioacumulação é kg de sedimentos por kg de verme (15).
|
|
|
Quando calculado diretamente pelo quociente entre a constante de velocidade de absorção a partir dos sedimentos e a constante de velocidade de eliminação (respetivamente ks e ke — ver adiante), o fator de bioacumulação é designado por fator de bioacumulação cinético (FBAk).
|
|
|
Bioconcentração é o aumento que a concentração da substância em estudo sofre num organismo, exclusivamente por absorção através da superfície do corpo, relativamente à concentração da substância no meio circundante.
|
|
|
Bioamplificação é o aumento que a concentração da substância em estudo sofre num organismo, sobretudo em consequência de absorção a partir de alimentos ou de presas contaminados, relativamente à concentração da substância nesses alimentos ou presas. A bioamplificação pode conduzir à transferência ou à acumulação da substância em estudo nas redes tróficas.
|
|
|
Fator de acumulação biota-sedimentos (FABS) é o quociente entre a concentração em estado estacionário da substância em estudo no organismo sujeito ao ensaio, normalizada relativamente ao teor de lípidos, e a concentração em estado estacionário da substância nos sedimentos, normalizada relativamente ao teor de carbono orgânico. Por conseguinte, Ca é expressa em g por kg de lípidos do organismo e Cs em g por kg de carbono orgânico dos sedimentos.
|
|
|
O período de condicionamento serve para estabilizar a componente microbiana dos sedimentos e remover, por exemplo, o amoníaco proveniente dos componentes dos sedimentos; antecede o enriquecimento dos sedimentos com a substância em estudo. Em geral, depois do condicionamento descarta-se a água sobrenadante.
|
|
|
Eliminação de uma substância em estudo é a perda dessa substância pelos tecidos do organismo sujeito ao ensaio, mediante processos ativos ou passivos, perda essa que ocorre independentemente da presença ou ausência da substância no meio circundante.
|
|
|
Fase de eliminação é o período, após a transferência dos organismos sujeitos ao ensaio de um meio contaminado para um meio isento da substância em estudo, durante o qual é estudada a eliminação (ou perda líquida) da substância por esses organismos.
|
|
|
Constante de velocidade de eliminação (ke) é o valor numérico que define a taxa de redução da concentração da substância em estudo no organismo sujeito ao ensaio, depois da transferência dos organismos de um meio que contém a substância em estudo para um meio dela isento; ke é expressa em d-1.
|
|
|
O período de equilibração serve para possibilitar a repartição da substância em estudo pela fase sólida, pela água dos poros e pela água sobrenadante; ocorre após o enriquecimento dos sedimentos com a substância em estudo e antes da adição dos organismos sujeitos ao ensaio.
|
|
|
Coeficiente de partição octanol-água (Kow, por vezes também representado por Pow) é o quociente entre a solubilidade da substância em n-octanol e a hidrossolubilidade da mesma substância, em condições de equilíbrio. O logaritmo de Kow (log Kow) é utilizado como indicador do potencial de bioacumulação de substâncias em organismos aquáticos.
|
|
|
Coeficiente de partição carbono orgânico-água (Kco) é o quociente entre a concentração da substância na fração de carbono orgânico dos sedimentos e a concentração da substância na água, em condições de equilíbrio.
|
|
|
Água sobrenadante é a água à superfície dos sedimentos, no recipiente de ensaio.
|
|
|
Patamar ou estado estacionário é o equilíbrio atingido entre os processos de absorção e de eliminação que ocorrem simultaneamente durante a fase de exposição. No gráfico do FBA correspondente a cada período a que se reporta uma colheita de amostras, em função do tempo, atinge-se o estado estacionário quando a curva se torna uma linha paralela ao eixo do tempo e três cálculos sucessivos do FBA, em amostras colhidas a intervalos de, pelo menos, dois dias entre elas, não diferem mais de 20 % entre si, sem que haja diferenças com significância estatística entre os três períodos a que se reportam as colheitas de amostras. No caso de substâncias de absorção lenta, são mais adequados intervalos de sete dias (5).
|
|
|
Água dos poros ou água intersticial é a água que ocupa o espaço entre as partículas de sedimentos ou de solo.
|
|
|
Constante de velocidade de absorção a partir dos sedimentos (ks) é o valor numérico que define a taxa de aumento da concentração da substância em estudo no organismo sujeito ao ensaio, em resultado de absorção em proveniência dos sedimentos; ks é expressa em g de sedimentos por kg de vermes por dia.
|
|
|
Sedimentos enriquecidos são sedimentos aos quais foi adicionada a substância em estudo.
|
|
|
Fator de bioacumulação em estado estacionário (FBAee) é o fator de bioacumulação nesse estado; não sofre variação significativa ao longo de um período prolongado, durante o qual a concentração da substância em estudo no meio circundante (Cs — em g por kg de peso húmido ou seco de sedimentos) se mantém constante.
|
|
|
Fase de absorção ou de exposição é o período durante o qual os organismos sujeitos ao ensaio estão expostos à substância em estudo.
|
Apêndice 2
Cálculo dos parâmetros de absorção e de eliminação
O principal parâmetro de um ensaio de bioacumulação é o fator de bioacumulação — FBA. Pode calcular-se o fator de bioacumulação dividindo a concentração da substância em estudo no organismo sujeito ao ensaio, Ca, pela concentração da substância em estudo nos sedimentos, Cs, em estado estacionário. Caso não se atinja um estado estacionário na fase de absorção, calcula-se o FBA da mesma maneira para o dia 28. Deve, porém, indicar-se se o FBA se baseia ou não em concentrações no estado estacionário.
A via preferida para a obtenção do fator de bioacumulação cinético (FBAk), da constante de velocidade de absorção a partir dos sedimentos (ks) e da constante de velocidade de eliminação (ke) é o recurso a métodos informáticos de estimativa de parâmetros não-linear. A partir de uma série temporal de fatores de acumulação médios (valores médios de Ca correspondentes a cada data de colheita de amostras/valores médios de Cs correspondentes a cada data de colheita de amostras = FA) da fase de absorção, com base no peso húmido dos vermes e dos sedimentos e na equação de modelo
|
AF(t) = FBA × (1 – eke × t)
|
[equação 1]
|
em que AF(t) é a razão entre a concentração da substância em estudo nos vermes e a concentração da substância em estudo nos sedimentos no instante t da fase de absorção, os programas informáticos utilizados calculam valores de FBAk, ks e ke.
Se, durante a fase de absorção, for atingido o estado estacionário (ou seja, se t = ∞), a equação 1 pode simplificar-se do seguinte modo:
|

|
[equação 2]
|
em que:
|
ks
|
=
|
constante de velocidade de absorção dos tecidos [expressa em g de sedimentos por kg de vermes por dia];
|
|
ke
|
=
|
constante de velocidade de eliminação [dia-1].
|
Nestas condições, ks/ke × Cs é uma aproximação da concentração da substância em estudo nos tecidos dos vermes em estado estacionário (Ca,ee).
Calcula-se o fator de acumulação biota-sedimentos (FABS) do seguinte modo:
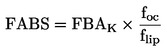
em que fco é a fração de carbono orgânico dos sedimentos e flip é a fração de lípidos dos vermes, ambos com base no peso seco ou no peso húmido.
Dispondo de uma série temporal de valores de concentração, pode estabelecer-se um modelo da cinética de eliminação utilizando as equações de modelo a seguir indicadas e recorrendo a um método informático de estimativa de parâmetros não-linear.
Salvo indicação em contrário, recomenda-se que o ponto de partida seja o valor médio do resíduo corporal medido no final da fase de absorção. Apenas deve utilizar-se o valor modelado/estimado a partir da fase de absorção se, por exemplo, o valor medido se desviar significativamente do resíduo corporal previsto no modelo. Ver igualmente no ponto 50 uma alternativa de exposição prévia dos vermes destinados à fase de eliminação. Nessa abordagem, considera-se que as amostras desses vermes pré-expostos colhidas no dia 0 da fase de eliminação fornecem valores realistas dos resíduos corporais, para servirem de ponto de partida da cinética de eliminação.
Se o traçado gráfico dos dados em função do tempo indicar um decréscimo exponencial constante da concentração da substância em estudo nos animais, pode utilizar-se um modelo monocompartimental (equação 4) para descrever a eliminação ao longo do tempo.
|
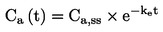
|
[equação 3]
|
Os processos de eliminação revelam-se por vezes bifásicos, com rápido decréscimo de Ca no início da eliminação e perda mais lenta da substância em estudo no final desta (8)(19)(25). Estas duas fases podem ser interpretadas admitindo que há dois compartimentos distintos no organismo, que eliminam a velocidades diferentes a substância em estudo. Nesses casos, deve consultar-se literatura específica (15)(16)(17)(25).
Esta eliminação bicompartimental pode ser descrita, por exemplo, pela seguinte equação (25):
|

|
[equação 4]
|
em que A e B representam a dimensão dos compartimentos (em percentagem do resíduo total nos tecidos), sendo A o compartimento que elimina rapidamente a substância em estudo e B o compartimento que a elimina lentamente. A soma de A e B corresponde a 100 % do volume total do compartimento animal em estado estacionário; ka e kb representam as constantes de eliminação correspondentes [d-1]. Se o modelo bicompartimental se ajustar aos dados de depuração, pode determinar-se a constante de velocidade de absorção, ks, do seguinte modo (53)(54):
|

|
[equação 5]
|
Estas equações de modelo devem, porém, ser utilizadas com precaução, em especial se, durante o ensaio, ocorrerem alterações da biodisponibilidade da substância em estudo (42).
Em alternativa ao recurso às equações de modelo supra, os parâmetros cinéticos (ks e ke) também podem ser calculados de uma só vez, aplicando o modelo de cinética de primeira ordem simultaneamente a todos os dados da fase de absorção e da fase de eliminação. Para a descrição de um método que permite esse cálculo combinado das constantes de velocidade de absorção e de eliminação, consultem-se as referências (55), (56) e (57).
Calculam-se os resíduos não-eliminados (RNE), como parâmetro secundário, multiplicando por 100 a razão entre a concentração média nos vermes (Ca) no dia 10 da fase de eliminação e a concentração média nos vermes (Ca) em estado estacionário (dia 28 da fase de absorção):

Apêndice 3
Exemplo de um programa de colheita de amostras num ensaio de bioacumulação com a duração de 28 dias
a) Fase de absorção (incluindo uma fase de equilibração de 4 dias)
|
Dia
|
Ações
|
|
-6
|
Preparação de uma suspensão de turfa para os sedimentos; condicionamento da suspensão durante 48 h.
|
|
-4
|
Enriquecimento dos sedimentos ou de uma fração dos sedimentos; mistura dos componentes dos sedimentos; colheita de amostras de sedimentos dos sedimentos expostos e dos sedimentos do controlo do solvente para determinação da concentração da substância em estudo; adição da água sobrenadante; incubação nas condições de realização do ensaio (fase de equilibração).
|
|
-3/-2
|
Separação, da cultura, dos organismos destinados ao ensaio, para aclimatação.
|
|
0
|
Medição da qualidade da água (ver o ponto 52); separação de replicados para colheita de amostras de água e de sedimentos para determinação da concentração da substância em estudo; distribuição aleatória dos vermes pelas câmaras de ensaio; conservação de um número de subamostras de vermes suficiente para a determinação dos valores analíticos de fundo; verificação da alimentação de ar, caso se utilize um sistema de ensaio fechado.
|
|
1
|
Separação de replicados para colheita de amostras; verificação da alimentação de ar, do comportamento dos vermes, da qualidade da água (ver o ponto 56); colheita de amostras de água, de sedimentos e de vermes para determinação da concentração da substância em estudo.
|
|
2
|
Verificação da alimentação de ar, do comportamento dos vermes e da temperatura.
|
|
3
|
O mesmo que no dia 1.
|
|
4 — 6
|
O mesmo que no dia 2.
|
|
7
|
O mesmo que no dia 1; compensação da água evaporada, se necessário.
|
|
8 — 13
|
O mesmo que no dia 2.
|
|
14
|
O mesmo que no dia 1; compensação da água evaporada, se necessário.
|
|
15 — 20
|
O mesmo que no dia 2.
|
|
21
|
O mesmo que no dia 1; compensação da água evaporada, se necessário.
|
|
22 — 27
|
O mesmo que no dia 2.
|
|
28
|
O mesmo que no dia 1; medição da qualidade da água (ver o ponto 52); termo da fase de absorção; conservação de um número de subamostras de vermes suficiente para a determinação dos valores analíticos de fundo, do peso húmido, do peso seco e do teor de lípidos; transferência dos vermes dos replicados expostos restantes para os recipientes com sedimentos limpos destinados à fase de eliminação (sem purga intestinal); colheita de amostras de água, de sedimentos e de vermes dos recipientes de controlo do solvente; colheita de amostras das soluções de retenção, se for caso disso.
|
|
|
Na programação das ações anteriores à exposição (fase de estabelecimento do equilíbrio) devem ser tidas em conta as propriedades da substância em estudo. Se necessário, condicionam-se durante 7 dias os sedimentos preparados, mantendo-os cobertos com uma camada de água sobrenadante a 20 °C ± 2 °C; nesse caso, é necessário preparar previamente os sedimentos.
|
|
|
As ações descritas para o dia 2 devem ser executadas diariamente (pelo menos nos dias úteis).
|
b) Fase de eliminação
|
Dia
|
Ações
|
|
-6
|
Preparação de uma suspensão de turfa para os sedimentos; condicionamento da suspensão durante 48 h.
|
|
-4
|
Mistura dos componentes dos sedimentos; colheita de amostras de sedimentos dos sedimentos expostos e dos sedimentos do controlo do solvente para determinação da concentração da substância em estudo; adição da água sobrenadante; incubação nas condições de realização do ensaio.
|
|
0 (dia 28 da fase de absorção)
|
Medição da qualidade da água (ver o ponto 52); transferência dos vermes dos replicados expostos restantes para recipientes com sedimentos limpos; após 4 a 6 horas, separação de replicados para colheita de amostras de água, de sedimentos e de vermes para determinação da concentração da substância em estudo; distribuição aleatória dos vermes pelas câmaras de ensaio.
|
|
1
|
Separação de replicados para colheita de amostras; verificação da alimentação de ar, do comportamento dos vermes, da qualidade da água (ver o ponto 52); colheita de amostras de água, de sedimentos e de vermes para determinação da concentração da substância em estudo.
|
|
2
|
Verificação da alimentação de ar, do comportamento dos vermes e da temperatura.
|
|
3
|
O mesmo que no dia 1.
|
|
4
|
O mesmo que no dia 2.
|
|
5
|
O mesmo que no dia 1.
|
|
6
|
O mesmo que no dia 2.
|
|
7
|
O mesmo que no dia 1; compensação da água evaporada, se necessário.
|
|
8 — 9
|
O mesmo que no dia 2.
|
|
10
|
O mesmo que no dia 1; termo da fase de eliminação; medição da qualidade da água (ver o ponto 52); colheita de amostras de água, de sedimentos e de vermes dos recipientes de controlo do solvente; colheita de amostras das soluções de retenção, se for caso disso.
|
|
|
A preparação dos sedimentos antes do início da fase de eliminação deve ser realizada do mesmo modo que a preparação dos sedimentos antes do início da fase de absorção.
|
|
|
As ações descritas para o dia 2 devem ser executadas diariamente (pelo menos nos dias úteis).
|
Apêndice 4
Algumas características físico-químicas de uma água de diluição aceitável
|
COMPONENTE
|
CONCENTRAÇÃO
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 μg/l
|
|
Amoníaco não-ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados, totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
COMPOSIÇÃO DA ÁGUA RECONSTITUÍDA RECOMENDADA
|
a)
|
Solução de cloreto de cálcio
Dissolvem-se em água desionizada 11,76 g de CaCl2×2H2O; completa-se o volume até 1 litro com água desionizada.
|
|
b)
|
Solução de sulfato de magnésio
Dissolvem-se em água desionizada 4,93 g de MgSO4×7H2O; completa-se o volume até 1 litro com água desionizada.
|
|
c)
|
Solução de bicarbonato de sódio
Dissolvem-se em água desionizada 2,59 g de NaHCO3; completa-se o volume até 1 litro com água desionizada.
|
|
d)
|
Solução de cloreto de potássio
Dissolvem-se em água desionizada 0,23 g de KCl; completa-se o volume até 1 litro com água desionizada.
|
Os produtos químicos devem ser todos de qualidade analítica.
A condutividade da água destilada ou desionizada não deve exceder 10 μScm– 1.
Misturam-se 25 ml de cada uma das soluções a) a d) e completa-se o volume até 1 litro com água desionizada. A soma da concentração dos iões cálcio e da concentração dos iões magnésio nesta solução é de 2,5 mmol/l.
A relação entre os iões Ca e Mg é de 4:1; entre os iões Na e K, é de 10:1. A capacidade ácida KS 4,3 desta solução é de 0,8 mmol/l.
Areja-se a água de diluição até esta ficar saturada de oxigénio; em seguida, conserva-se durante aproximadamente dois dias, sem mais arejamento, até ser utilizada.
Para uma água de diluição ser aceitável, o seu pH tem de estar compreendido entre 6 e 9.
Apêndice 5
Sedimentos artificiais — recomendações relativas à preparação e à conservação
Contrastando com o estabelecido no caso do método de ensaio C.8 (40), recomenda-se que o teor de turfa dos sedimentos artificiais seja de 2 %, em vez de 10 %, do peso húmido, de modo a corresponder ao que seria um teor orgânico baixo a moderado no caso de sedimentos naturais (58)
Percentagens dos componentes secos de sedimentos artificiais:
|
Componente
|
Características
|
Percentagem dos sedimentos secos
|
|
Turfa
|
Turfa de Sphagnum com grau de decomposição médio, seca ao ar, sem restos visíveis de plantas, finamente moída (granulometria ≤ 0,5 mm)
|
2 ± 0,5
|
|
Areia quartzítica
|
Granulometria: ≤ 2 mm, mas >50 % das partículas de granulometria na gama 50-200 μm
|
76
|
|
Argila caulínica
|
Teor de caulinite ≥ 30 %
|
22 ± 1
|
|
Fonte alimentar
|
Folia urticae, folhas de Urtica sp. (urtiga comum) finamente moídas (granulometria ≤ 0,5 mm) ou mistura (1:1) de folhas moídas de Urtica sp. com alfa-celulose; conformes com as normas farmacêuticas para consumo humano; suplemento aos sedimentos secos
|
0,4 — 0,5 %
|
|
Carbonato de cálcio
|
CaCO3 pulverizado quimicamente puro; suplemento aos sedimentos secos
|
0,05 — 1
|
|
Água desionizada
|
Condutividade ≤ 10 μS/cm; suplemento aos sedimentos secos
|
30 — 50
|
Caso seja de esperar uma concentração elevada de amoníaco, por exemplo se a substância em estudo for reconhecidamente inibidora da nitrificação, pode ser útil substituir 50 % do pó de urtiga, rico em azoto, por celulose (por exemplo α-celulose em pó quimicamente pura com granulometria ≤ 0,5 mm).
Preparação
Seca-se a turfa ao ar e mói-se até se obter um pó fino (granulometria ≤ 0,5 mm, sem restos visíveis de plantas). Utilizando um dispositivo homogeneizador de elevada eficácia, prepara-se uma suspensão da quantidade necessária de turfa em pó em parte da água desionizada a adicionar aos sedimentos secos [verificou-se que um volume de água equivalente a 11,5 vezes o peso seco de turfa permite obter uma suspensão de turfa que pode misturar-se (8)].
Ajusta-se o pH desta suspensão a 5,5 ± 0,5 com CaCO3. Condiciona-se a suspensão durante, pelo menos, dois dias, com agitação ligeira a 20 °C ± 2 °C, para estabilizar o pH e estabelecer um perfil microbiano estável. Determina-se outra vez o pH e, se necessário, ajusta-se a 6,0 ± 0,5 com CaCO3. Em seguida, mistura-se a totalidade da suspensão com os outros componentes secos, não esquecendo a parte eventualmente utilizada para o enriquecimento. Adiciona-se a água desionizada restante e homogeneízam-se os sedimentos. Determina-se uma vez mais o pH e, se necessário, ajusta-se este entre 6,5 e 7,5 com CaCO3. No entanto, se for de esperar formação de amoníaco, pode ser útil manter o pH dos sedimentos abaixo de 7,0 (por exemplo entre 6,0 e 6,5). Colhem-se amostras dos sedimentos para determinar o peso seco e o teor de carbono orgânico. Se for de esperar formação de amoníaco, os sedimentos artificiais podem ser mantidos durante sete dias em condições idênticas às do ensaio ulterior (por exemplo relação 1:4 entre os sedimentos e a água e espessura da camada de sedimentos como nos recipientes de ensaio) antes de os enriquecer com a substância em estudo — os sedimentos devem ser cobertos com água e esta deve ser arejada. Terminado o período de condicionamento, remove-se e descarta-se a água sobrenadante. Colhem-se amostras (por exemplo três) dos sedimentos para determinar o peso seco e o teor de carbono orgânico total.
Em seguida, mistura-se a areia quartzítica enriquecida com os sedimentos, para cada nível de exposição, distribuem-se os sedimentos daí resultantes pelos recipientes de ensaio replicados e acrescenta-se-lhes água, da água utilizada para o ensaio (por exemplo relação 1:4 entre os sedimentos e a água e espessura da camada de sedimentos como nos recipientes de ensaio). Incubam-se depois os recipientes em condições idênticas às do ensaio ulterior. Inicia-se aqui o período de estabelecimento do equilíbrio. Areja-se a água sobrenadante.
Adiciona-se a fonte alimentar escolhida antes do enriquecimento dos sedimentos com a substância em estudo ou durante este enriquecimento. Pode misturar-se a fonte alimentar no início, com a suspensão de turfa (ver acima). No entanto, para evitar uma degradação excessiva da fonte alimentar antes da adição dos organismos sujeitos ao ensaio — por exemplo no caso de um período longo de estabelecimento de equilíbrio –, pode reduzir-se ao mínimo possível o período compreendido entre a adição dos alimentos e o início da exposição. Para que os alimentos e a substância em estudo estejam suficientemente em contacto, deve misturar-se a fonte alimentar com os sedimentos o mais tardar no dia do enriquecimento dos sedimentos com a dita substância. Admitem-se exceções se a duração do período de estabelecimento de equilíbrio provocar uma degradação microbiana excessiva dos alimentos antes da adição dos organismos sujeitos ao ensaio. Colhem-se amostras dos sedimentos (por exemplo três dos sedimentos enriquecidos e três dos sedimentos de controlo) para determinar o peso seco e o teor de carbono orgânico total.
O peso seco dos componentes (turfa, areia, caulino) deve ser expresso em grama e em percentagem do peso seco total.
O volume de água a adicionar aos componentes secos durante a preparação dos sedimentos também deve ser expresso em percentagem do peso seco total (por exemplo “100 % de peso seco + 46 % de água” significa que são adicionados 460 ml de água a 1 000 g de peso seco, daí resultando 1 460 g de sedimentos húmidos).
Conservação
Os componentes secos dos sedimentos artificiais podem ser conservados num local seco e fresco, à temperatura ambiente. Os sedimentos húmidos, uma vez preparados, podem ser conservados (unicamente para utilização ulterior em cultura) na obscuridade, a 4 °C ± 2 °C, durante 2 a 4 semanas a contar do dia da preparação (8).
Utilizam-se de imediato os sedimentos enriquecidos com a substância em estudo, a menos que haja indicações de que os sedimentos em questão podem ser conservados sem afetar a toxicidade e a biodisponibilidade da substância em causa. As amostras de sedimentos enriquecidos podem ser conservadas, respeitando as condições recomendadas para a substância em estudo, até à realização das análises.
Apêndice 6
Espécies de oligoquetas recomendadas para ensaios de bioacumulação
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
O oligoqueta tubificídeo (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) vive em sedimentos da água doce, em tubos revestidos de muco. Os vermes alojam-se de cabeça para baixo nesses tubos e ingerem partículas dos sedimentos, alimentando-se dos detritos orgânicos e microrganismos associados a estes últimos. A parte posterior do animal geralmente ondula na água sobrenadante, postura associada à respiração. Embora esta espécie viva numa grande diversidade de sedimentos em todo o hemisfério norte, a Tubifex tubifex prefere granulometrias relativamente finas (59). As razões da adequação desta espécie aos ensaios ecotoxicológicos são descritas, por exemplo, em (8)(29)(31)(39)(60)(62)(63).
Métodos de cultura
A fim de se dispor de um número suficiente de Tubifex tubifex para a realização dos ensaios de bioacumulação, é necessário manter no laboratório uma cultura permanente destes vermes. Para a cultura de Tubifex tubifex, recomenda-se um sistema constituído por sedimentos artificiais obtidos a partir do solo artificial descrito no método de ensaio C.8 (40) e de água reconstituída de acordo com o método de ensaio C.1 (8).
Como recipientes de cultura, podem ser utilizados recipientes de vidro ou de aço inoxidável com 12 cm a 20 cm de altura. Coloca-se em cada recipiente de cultura uma camada de sedimentos artificiais húmidos preparados de acordo com o apêndice 5. A espessura da camada de sedimentos deve ser suficiente para que os vermes possam expressar o seu comportamento normal de enterramento (no caso da Tubifex tubifex, a espessura mínima dos sedimentos é de 2 cm). Adiciona-se água reconstituída ao sistema. Devem ser tomadas as precauções necessárias para minimizar a perturbação dos sedimentos. Areja-se suavemente a camada de água (por exemplo duas bolhas por segundo de ar filtrado a 0,45 μm), inserindo a ponta de uma pipeta de Pasteur 2 cm acima da superfície dos sedimentos. A temperatura de cultura recomendada é de 20 °C ± 2 °C.
A densidade máxima dos vermes transferidos para o meio de cultura é de 20 000 indivíduos por metro quadrado de superfície de sedimentos. Densidades maiores podem reduzir as taxas de crescimento e de reprodução (43).
Nas culturas realizadas em sedimentos artificiais, é necessário alimentar os vermes. Um regime constituído por um alimento para peixes finamente moído, por exemplo TetraMin®, pode fornecer os nutrientes adicionais necessários — (8) e comunicação pessoal de Klerks, 1994. A quantidade e a frequência da alimentação devem ser suficientes para o crescimento e a reprodução dos vermes e reduzir ao mínimo a formação de amoníaco e o crescimento fúngico no meio de cultura. O alimento pode ser fornecido duas vezes por semana (por exemplo 0,6 mg a 0,8 mg por cm2 de superfície de sedimentos). A experiência prática mostrou que o fornecimento do alimento sob a forma de uma suspensão homogénea em água desionizada pode facilitar uma distribuição homogénea do mesmo pela superfície dos sedimentos nos recipientes de cultura.
A fim de evitar a acumulação de amoníaco, é necessário renovar a água sobrenadante recorrendo a um sistema de fluxo contínuo ou manualmente, neste último caso pelo menos uma vez por semana. Os sedimentos das culturas de reserva devem ser substituídos de três em três meses.
No caso de apenas se pretenderem animais adultos, a colheita de vermes do meio de cultura pode realizar-se por tamisagem dos sedimentos através de um crivo com 1 mm de malha. Para reter os casulos, é adequada uma malha de 0,5 mm; para reter os vermes juvenis, uma malha de 0,25 mm. Depois da passagem dos sedimentos através dos crivos, estes podem ser colocados em água reconstituída. Os vermes saem dos crivos e podem ser recolhidos da água com uma pinça de aço flexível ou com uma pipeta cuja extremidade tenha sido embotada a quente.
Para iniciar ensaios ou novas culturas apenas se utilizam espécimes intactos e claramente identificados de Tubifex tubifex [por exemplo (64)]. Descartam-se os vermes doentes ou lesionados e os casulos atacados por hifas fúngicas.
Uma cultura sincronizada pode fornecer vermes da idade e com a periodicidade pretendidas. Constituem-se novos recipientes de cultura com a periodicidade pretendida (por exemplo de duas em duas semanas), iniciando a cultura com animais de uma determinada idade (por exemplo casulos). Nas condições de cultura aqui descritas, os vermes atingem o estádio adulto após 8 a 10 semanas. Pode efetuar-se a colheita nas culturas quando os vermes tiverem gerado novos casulos, por exemplo após 10 semanas. Os adultos colhidos podem ser utilizados nos ensaios; os casulos, para iniciar novas culturas.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
A espécie Lumbriculus variegatus (Lumbriculidae, Oligochaeta) também vive em sedimentos da água doce, tem uma distribuição planetária e é amplamente utilizada em ensaios ecotoxicológicos. As referências (1)(6)(9)(36) contêm informações sobre a biologia, as condições de cultura e a sensibilidade desta espécie. Embora com algumas limitações, a Lumbriculus variegatus também pode ser cultivada nos sedimentos artificiais recomendados para a Tubifex tubifex de acordo com a referência (8). Uma vez que, na natureza, a Lumbriculus variegatus prefere sedimentos mais grosseiros que a Tubifex tubifex (59), as culturas laboratoriais nos sedimentos artificiais utilizados para a Tubifex tubifex podem cessar após 4 a 6 meses. A experiência prática mostrou que a Lumbriculus variegatus pode ser mantida vários anos sem renovação do substrato num sistema de fluxo contínuo com substrato arenoso (por exemplo areia quartzítica ou gravilha fina), utilizando como fonte nutricional um alimento para peixes. Uma vantagem importante da Lumbriculus variegatus em relação às outras espécies de oligoquetas aquáticos é a rapidez da sua reprodução, que faz aumentar rapidamente a biomassa das populações cultivadas em laboratório (1)(6)(9)(10).
Métodos de cultura
As referências Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1) e U.S. EPA (2000) (6) descrevem pormenorizadamente as condições de cultura da Lumbriculus variegatus. Resumem-se brevemente a seguir essas condições.
Estes vermes podem ser cultivados em aquários grandes (57-80 litros), à temperatura de 23 °C, com um fotoperíodo de 16 horas de luz seguidas de 8 horas de escuridão (100-1 000 lux) e renovando todos os dias a água natural utilizada (45-50 litros por aquário). Prepara-se o substrato cortando em tiras toalhetes de papel pardo não branqueado, que podem em seguida ser misturadas com a água de cultura durante alguns segundos, de modo a obter pequenos pedaços de substrato de papel. Este substrato pode ser diretamente utilizado nos aquários de cultura de Lumbriculus, cobrindo com ele o fundo do recipiente, ou ser conservado congelado em água desionizada, para utilização ulterior. Em geral, um substrato novo introduzido num recipiente tem a duração de cerca de dois meses.
Inicia-se cada cultura de vermes com 500 a 1 000 indivíduos e fornecem-se-lhe como alimento, três vezes por semana, 10 ml de uma suspensão com 6 g de alimento inicial para trutas, num sistema com renovação ou de fluxo contínuo. A alimentação das culturas estáticas ou semiestáticas deve ser mais escassa e menos frequente, para evitar a proliferação de bactérias e de fungos. É necessário analisar o alimento e o substrato de papel para verificar se neles estão presentes as substâncias utilizadas nos ensaios de bioacumulação.
Nestas condições, o número de indivíduos na cultura geralmente duplica em 10 a 14 dias.
Os espécimes de Lumbriculus variegatus podem ser retirados da cultura, por exemplo, transferindo substrato com uma rede de malha fina, ou os próprios organismos com uma pipeta de vidro de ponta larga (cerca de 5 mm de diâmetro) embotada a quente, para um copo. Caso se transfira também substrato para esse copo, deixa-se o copo com os vermes e o substrato de um dia para o outro em condições de fluxo contínuo, que permitirão remover o substrato do copo e deixarão os vermes no fundo do recipiente. Em seguida, os vermes podem ser transferidos para recipientes de cultura recém-preparados ou ser aprontados para o ensaio, como se descreve em (1) e (6). Há que evitar lesionar os vermes ou provocar-lhes reações de autotomia, manipulando-os para isso com pipetas de extremidade embotada a quente ou com pinças de aço inoxidável.
Um aspeto a que deve ser dada especial atenção quando se utiliza a Lumbriculus variegatus em ensaios de bioacumulação em sedimentos é o modo de reprodução desta espécie (arquitomia seguida de morfalaxia). Este modo de reprodução assexual origina dois fragmentos, que não se alimentam enquanto a cabeça ou a cauda não forem regeneradas [por exemplo (36)(37)]. Significa isto que, quando se utiliza a Lumbriculus variegatus, a absorção de sedimentos e contaminantes por ingestão pode não ocorrer continuamente, ao contrário do que sucede no caso dos tubificídeos, que não se reproduzem por fragmentação.
É, pois necessária, uma sincronização, para minimizar processos de reprodução e de regeneração descontrolados, que redundariam em grande variabilidade dos resultados dos ensaios. As variações a que se alude podem ocorrer quando alguns indivíduos, por se terem fragmentado e, portanto, não se alimentarem durante um certo tempo, são menos expostos à substância em estudo do que outros, que não se fragmentaram durante o ensaio — ver, por exemplo, (38). Fragmentam-se os vermes artificialmente (sincronização) 10 dias a 14 dias antes do início da exposição (65). Utilizam-se vermes crescidos, de preferência sem sinais de fragmentação recente. Esses vermes podem ser colocados numa lâmina de vidro juntamente com uma gota da água de cultura, seccionando-os em seguida com um bisturi ao nível da região média do corpo. É necessário que todas as extremidades posteriores tenham igual comprimento. Depois disto, deixam-se as extremidades posteriores regenerar a parte da cabeça, num recipiente de cultura com o mesmo substrato utilizado na cultura de proveniência e com água reconstituída, até ao início da exposição. A regeneração da parte da cabeça é revelada quando os vermes sincronizados começam a enterrar-se no substrato (pode confirmar-se a presença de novas cabeças examinando uma subamostra representativa com um microscópio binocular). Considera-se que, desta fase em diante, os organismos sujeitos ao ensaio se encontram no mesmo estado fisiológico. Significa isto que, quando, durante o ensaio, os vermes sincronizados se regeneram por morfalaxia, é de esperar que a exposição de todos os animais aos sedimentos enriquecidos seja praticamente igual. Os vermes devem começar a ser alimentados quando começarem a enterrar-se no substrato, ou sete dias após a dissecação. O regime alimentar deve ser comparável ao das culturas normais, mas pode ser aconselhável fornecer aos vermes sincronizados a mesma fonte de alimento utilizada no ensaio. Conservam-se os vermes à temperatura de ensaio (20 °C ± 2 °C). Depois da regeneração da parte da cabeça, utilizam-se no ensaio vermes completos intactos de tamanho semelhante, que nadem ou rastejem ativamente após ligeiro estímulo mecânico. Há que evitar lesionar os vermes ou de lhes provocar reações de autotomia, manipulando-os para isso com pipetas de extremidade embotada a quente ou com pinças de aço inoxidável.
Quando se utilizam Lumbriculus variegatus no ensaio, devido ao modo particular de reprodução desta espécie, o número de vermes deve aumentar durante o ensaio, se as condições forem adequadas (6). Caso não haja reprodução durante um ensaio de bioacumulação com Lumbriculus variegatus, regista-se esse facto, que deve ser tido em conta na interpretação dos resultados do ensaio.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (não validado em estudo interlaboratorial comparativo)
A espécie Branchiura sowerbyi vive em diversos tipos de sedimentos de albufeiras, lagos, lagoas e rios, originalmente nas regiões tropicais, mas também pode ser encontrada em águas tépidas do hemisfério norte. No entanto, a espécie é mais abundante em sedimentos constituídos por lamas argilosas com teor elevado de matéria orgânica. Estes vermes vivem na camada de sedimentos, pois mesmo a parte posterior dos mesmos está normalmente enterrada. Esta espécie é facilmente identificável pelos filamentos branquiais existentes na parte posterior do corpo. Os adultos podem atingir 9 cm a 11 cm de comprimento e 40 mg a 50 mg de peso húmido. A taxa de reprodução é elevada; nas condições de temperatura e de alimentação adiante descritas, a população duplica em menos de duas semanas [Aston et al., 1982, (65)]. A Branchiura sowerbyi tem vindo a ser utilizada em estudos de toxicidade e de bioacumulação [Marchese, Brinkhurst 1996 (31) e Roghair et al. 1996 (67), respetivamente].
Métodos de cultura
Apresenta-se a seguir uma descrição resumida das condições de cultura da Branchiura sowerbyi, fornecida por Mercedes R. Marchese, INALI, Argentina, e Carla J. Roghair, RIVM, Países Baixos.
Não está estabelecida uma técnica única para a cultura dos organismos a utilizar nos ensaios, podendo os mesmos ser cultivados em sedimentos naturais não-contaminados (31). A experiência prática revelou que um meio constituído por areia e sedimentos naturais melhora o estado dos vermes, comparativamente aos sedimentos naturais puros (32)(67). Podem utilizar-se para a cultura copos de 3 litros com 1 500 ml de meio constituído por sedimentos e água: 375 ml de sedimentos naturais não-contaminados (cerca de 10 % de carbono orgânico total, cerca de 17 % das partículas ≤ 63 μm), 375 ml de areia limpa (M32) e 750 ml de água reconstituída ou de água da torneira desclorada (31)(32)(67). Como substrato de cultura, também podem ser utilizados toalhetes de papel, mas, nesse caso, o crescimento populacional é inferior ao registado em sedimentos naturais. Em sistemas semiestáticos, areja-se lentamente a camada de água dos copos e renova-se semanalmente a água sobrenadante.
Começa-se com 25 vermes jovens em cada copo. Transcorridos dois meses, retiram-se os vermes crescidos dos sedimentos com uma pinça e transferem-se para um novo copo, no qual se introduziu meio de sedimentos e água preparado de fresco. O copo inicial também contém casulos e vermes jovens. É possível recolher até 400 vermes jovens em cada copo. Os vermes adultos podem ser utilizados como reprodutores durante, pelo menos, um ano.
As culturas devem ser mantidas a uma temperatura compreendida entre 21 °C e 25 °C. A variação de temperatura deve ser inferior a ± 2 °C. A 25 °C, o tempo necessário para o desenvolvimento embrionário, desde a postura do ovo até à saída do juvenil do casulo, é de aproximadamente três semanas. Em lama a 25 °C, verificou-se que a produção de ovos por verme de Branchiura sowerbyi sobrevivente oscila entre 6,36 (31) e 11,2 (30). O número de ovos por casulo oscila entre “1,8 a 2,8” (66)(69) e “até 8” (68).
É necessário medir semanalmente o oxigénio dissolvido, a dureza da água, a temperatura e o pH. Pode fornecer-se ad libitum um alimento para peixes (por exemplo TetraMin®), sob a forma de suspensão, duas ou três vezes por semana. Os vermes também podem ser alimentados com alface descongelada, ad libitum.
Uma vantagem importante desta espécie é a biomassa elevada por indivíduo (até 40 mg a 50 mg de peso húmido por espécime). Pode, portanto, utilizar-se esta espécie em ensaios de bioacumulação de substâncias sem marcação radioativa. A exposição pode realizar-se nos sistemas utilizados para a Tubifex tubifex ou a Lumbriculus variegatus, mas com apenas um espécime por replicado (11). A menos que se utilizem câmaras de ensaio maiores, deve, portanto, aumentar-se o número de replicados (11). É igualmente necessário adaptar a esta espécie o critério de validade relativo ao comportamento de enterramento.
REFERÊNCIAS
|
1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
2)
|
Comissão Europeia (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market — partes I a IV. Serviço das Publicações Oficiais das Comunidades Europeias, Luxemburgo.
|
|
3)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. Monografia n.o 60 da OCDE. Organização de Cooperação e de Desenvolvimento Económicos (OCDE), Paris.
|
|
4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P.F., Norberg-King, T.J., Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem., 14, 1885-1894.
|
|
5)
|
Capítulo C.13 deste anexo: Bioconcentração: ensaio dinâmico com peixes.
|
|
6)
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. 2.a edição. EPA 600/R-99/064. U.S. Environmental Protection Agency, Duluth, MN, março de 2000.
|
|
7)
|
Capítulo C.27 deste anexo: Ensaio de toxicidade em quironomídeos num sistema sedimentos-água com sedimentos enriquecidos.
|
|
8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G., Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere, 35, 835-852.
|
|
9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J., Landrum, P.F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete Lumbriculus variegatus. Environmental Toxicology and Chemistry, 22, 872-885.
|
|
10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A., Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ. Toxicol. Chem., 12, 269-279.
|
|
11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C., Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes” — 26-27.4.1999, Hochheim am Main, Alemanha. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlim.
|
|
12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J., Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T., Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries, 13, 301-310.
|
|
14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: Nagel, R., Loskill, R. (editores): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlim, 1990. VCH, Weinheim.
|
|
15)
|
Landrum, P.F., Lee II, H., Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem., 11, 1709-1725.
|
|
16)
|
Markwell, R.D., Connell, D.W., Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res., 23, 1443-1450.
|
|
17)
|
Gabric, A.J., Connell, D.W., Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res., 24, 1225-1231.
|
|
18)
|
Kukkonen, J., Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem., 13, 1457-1468.
|
|
19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D., Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere, 29, 1501-1514.
|
|
20)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications. Series on Testing and Assessment, No. 23.
|
|
21)
|
US EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. Agência de Protecção do Ambiente dos E.U.A.
|
|
22)
|
Os seguintes capítulos deste anexo:
|
|
Capítulo A.4: Pressão de vapor;
|
|
|
Capítulo A.5: Tensão superficial;
|
|
|
Capítulo A.6: Solubilidade em água;
|
|
|
Capítulo A.8: Coeficiente de partição: método do “frasco agitado”;
|
|
|
Capítulo A.24: Coeficiente de partição: método por HPLC;
|
|
|
Capítulo C.7: Degradação — Degradação abiótica: hidrólise em função do pH;
|
|
|
Capítulo C.4: Determinação da biodegradabilidade “fácil”, métodos A a F;
|
|
|
Capítulo C.19: Estimativa do valor do coeficiente de adsorção (KOC) em solos e em lamas de depuração por cromatografia líquida de alta eficiência (HPLC);
|
|
|
Capítulo C.29: Biodegradabilidade “fácil” — CO2 em recipientes fechados.
|
|
|
23)
|
OCDE (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals, No. 3. OCDE, Paris.
|
|
24)
|
Antoine, M.D., Dewanathan, S., Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J., 43, 165-172.
|
|
25)
|
Beek, B., Boehling, S., Bruckmann, U., Franke, C., Joehncke, U., Studinger, G. (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, volume 2, parte J (editor do volume: B. Beek): Bioaccumulation — New Aspects and Developments. Springer-Verlag, Berlim, Heidelberg, 235-276.
|
|
26)
|
Spacie, A., Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem., 1, 309-320.
|
|
27)
|
Hawker, D.W., Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res., 22, 701-707.
|
|
28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J., Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol., 35, 191-201.
|
|
29)
|
Reynoldson, T.B., Thompson, S.P., Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem., 10, 1061-1072.
|
|
30)
|
Aston, R.J., Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture, 26, 155-160.
|
|
31)
|
Marchese, M.R., Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia, 334, 163-168.
|
|
32)
|
Roghair, C.J., Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
33)
|
Capítulo C.1 deste anexo: Toxicidade aguda para os peixes.
|
|
34)
|
OCDE (1992c). Guidelines for Testing of Chemicals, No. 210. Fish, Early-life Stage Toxicity Test. OCDE, Paris.
|
|
35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J., Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia, 11, 181-184.
|
|
36)
|
Leppänen, M.T., Kukkonen, J.V.K. (1998). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia, 377: 183-194.
|
|
37)
|
Leppänen, M.T., Kukkonen, J.V.K. (1998). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem., 17: 2196-2202.
|
|
38)
|
Leppänen M.T., Kukkonen, J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol., 32, 1503-1508.
|
|
39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I., Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology, 8, 111-124.
|
|
40)
|
Capítulo C.8 deste anexo: Toxicidade em relação às minhocas.
|
|
41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol., 23, 588-595.
|
|
43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In Brinkhurst, R.O., Cook, D.G. (editores), Aquatic Oligochaeta Biology, 175-184. Plenum Press, Nova Iorque.
|
|
44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
45)
|
Hooftman, R.N., van de Guchte, K., Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere, 32, 1897-1905.
|
|
47)
|
Mount, D.R., Dawson, T.D., Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem., 18, 1244-1249.
|
|
48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L., Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ. Toxicol. Chem., 10, 1431-1436.
|
|
49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A., Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
50)
|
Bligh, E.G., Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol., 37, 911-917.
|
|
51)
|
De Boer, J., Smedes, F., Wells, D., Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU Standards, Measurement and Testing Programme.
|
|
52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Dinamarca.
|
|
53)
|
Zok, S., Görge, G., Kalsch, W., Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment, 109/110, 411-421.
|
|
54)
|
Nagel, R. (1988). Umweltchemikalien und Fische — Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Alemanha.
|
|
55)
|
Janssen, M.P.M., Bruins, A., De Vries, T.H., Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol., 20:305-312.
|
|
56)
|
Van Brummelen, T.C., Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol., 31:277-285.
|
|
57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M., Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry, 22:1167-1171.
|
|
58)
|
Suedel, B.C., Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem., 13, 1163-1175.
|
|
59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr., 63, 310-386.
|
|
60)
|
Oliver, B.G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol., 21, 785-790.
|
|
61)
|
Chapman, P.M., Farrell, M.A., Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology, 2, 47-67.
|
|
62)
|
Chapman, P.M., Farrell, M.A., Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology, 2, 69-78.
|
|
63)
|
Rodriguez, P., Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In Mudroch, A., Azcue, J.M., Mudroch, P. (editores), Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J., Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. Em colaboração com Nagel, R., e Karaoglan, B. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No. 202 67 429.
|
|
66)
|
Aston, R.J., Sadler, K., Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture, 29, 137-145.
|
|
67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E., Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture, 40, 89-94.
|
|
69)
|
Bonacina, C., Pasteris, A., Bonomi, G., Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274.
|
» |