ANEXO II

MODELO PARA TRANSMISSÃO DAS INFORMAÇÕES REFERIDAS NO ARTIGO 54.o, N.o 2, DA DIRETIVA 2010/63/UE
|
1. |
Devem ser introduzidos os dados relativos a cada utilização de um animal. |
|
2. |
Aquando da introdução dos dados relativos a um animal, só pode ser selecionada uma única opção dentro de determinada categoria. |
|
3. |
Os animais occisados para extração de órgãos ou tecidos, assim como os animais-sentinela, são excluídos da apresentação de dados estatísticos, a menos que a occisão tenha lugar ao abrigo de uma autorização de projeto, por um método não incluído no anexo IV ou se o animal tiver sido sujeito a uma intervenção prévia à sua occisão, com ultrapassagem do limiar mínimo de dor, sofrimento, angústia ou dano duradouro. |
|
4. |
Os animais excedentários occisados não são incluídos nos dados estatísticos, à parte os animais geneticamente alterados que exibam fenótipo nocivo intencional e manifesto. |
|
5. |
As formas larvares de animais são contadas logo que se tornam autónomas em termos de alimentação. |
|
6. |
As formas fetais e embrionárias de mamíferos não são contadas. Só se contam animais nascidos, ainda que por cesariana, e vivos. |
|
7. |
Se a classificação «severa» for excedida, com ou sem autorização prévia, os animais em causa e a sua utilização devem ser comunicados normalmente, como qualquer outra utilização e dentro da categoria «severa». Na secção relativa às observações dos Estados-Membros, devem ser acrescentados comentários, incidindo na espécie, nos números, numa eventual autorização de isenção prévia, nos detalhes da utilização e nas razões por que foi excedida a classificação «severa». |
|
8. |
Os dados comunicados devem reportar-se ao ano em que o procedimento termina. No caso dos estudos que se estendem por dois anos civis, os animais podem ser todos tidos em conta conjuntamente no ano em que o último procedimento termina, se esta exceção à comunicação anual tiver sido autorizada pela autoridade competente. No caso dos projetos que abrangem mais de dois anos civis, a comunicação dos animais deve ser feita em relação ao ano da occisão ou morte dos mesmos. |
|
9. |
A utilização da categoria «Outro/a/s» obriga à inclusão de informações complementares nas observações. |
A. ANIMAIS GENETICAMENTE ALTERADOS
|
1. |
Para efeitos de comunicação estatística, os «animais geneticamente alterados» incluem os geneticamente modificados (transgénicos, com inativação de genes ou com outras formas de alteração genética) e os mutantes por fenómeno natural ou induzido. |
|
2. |
Os animais geneticamente alterados são comunicados:
|
|
3. |
Todos os animais portadores da alteração genética devem ser comunicados durante a criação de uma nova linhagem. Os animais utilizados para superovulação, vasectomia e implantação de embriões devem igualmente ser comunicados (quer sejam geneticamente alterados ou não). Os animais geneticamente normais (descendência de tipo selvagem) produzidos no âmbito da criação de uma nova linhagem geneticamente alterada não devem ser comunicados. |
|
4. |
Na categoria «Fins», os animais utilizados para a criação de uma nova linhagem geneticamente alterada devem ser comunicados no âmbito da «Investigação fundamental» ou da «Investigação translacional ou aplicada», na categoria para a qual a linhagem está a ser criada. |
|
5. |
Uma nova estirpe ou linhagem de animais geneticamente alterados é considerada «estabelecida» se a transmissão da alteração genética for estável, o que significa um mínimo de duas gerações, e tiver sido realizada uma avaliação de bem-estar. |
|
6. |
A avaliação de bem-estar determina se se prevê que a nova linhagem criada tenha um fenótipo nocivo intencional, caso em que os animais a partir desse ponto devem ser comunicados na categoria «Manutenção de colónias de animais geneticamente alterados estabelecidos, não utilizados noutros procedimentos» – ou, eventualmente, nos outros procedimentos para os quais estejam a ser utilizados. Se a avaliação de bem-estar concluir que não se prevê que a linhagem tenha um fenótipo nocivo, a reprodução da linhagem em causa extravasa o âmbito de um procedimento e não tem de ser comunicada. |
|
7. |
A categoria «Manutenção de colónias de animais geneticamente alterados estabelecidos, não utilizados noutros procedimentos» abrange os animais necessários para a manutenção de colónias de animais geneticamente alterados de linhagens estabelecidas, com fenótipo nocivo intencional e que manifestam dor, sofrimento, angústia ou dano duradouro em consequência do genótipo nocivo. O fim para o qual a linhagem é mantida não é registado. |
|
8. |
Todos os animais geneticamente alterados que são utilizados noutros procedimentos (isto é, não para criação ou manutenção de uma linhagem geneticamente alterada) devem ser comunicados no âmbito dos respetivos fins (o mesmo para os animais não geneticamente alterados). Estes animais podem exibir ou não um fenótipo nocivo. |
|
9. |
Os animais geneticamente alterados que exibem um fenótipo nocivo e que são occisados para extração de órgãos ou tecidos devem ser comunicados no âmbito dos fins principais respetivos para os quais os órgãos ou tecidos foram utilizados. |
B. CATEGORIAS DE DADOS
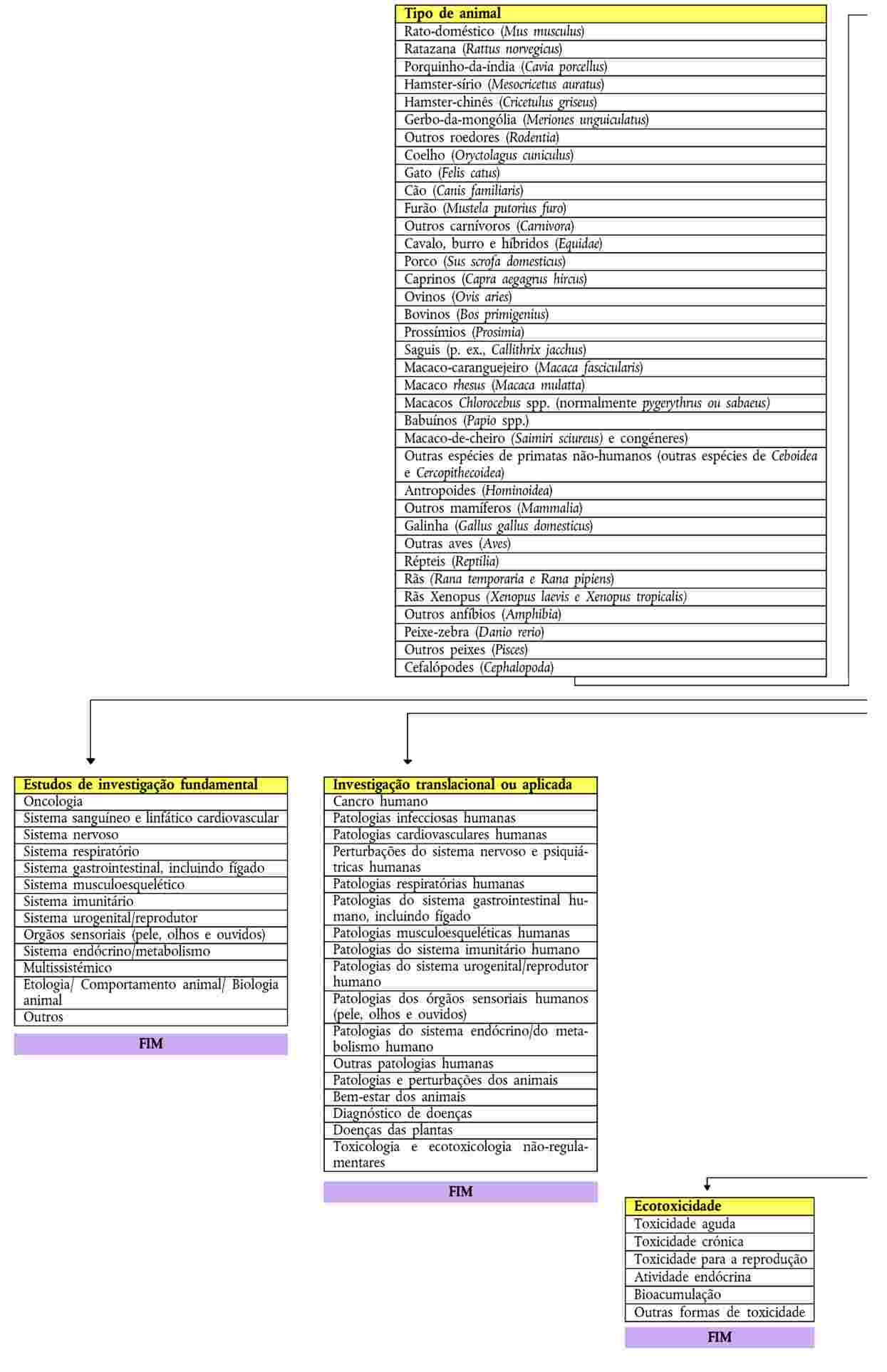
As secções que se seguem obedecem à mesma ordem das categorias e dos correspondentes títulos no diagrama.
1. Tipo de animal
|
i. |
Todas as espécies de cefalópodes devem ser comunicadas sob o título Cefalópodes a partir da fase em que o animal se torna autónomo em termos de alimentação, ou seja, imediatamente após a eclosão, no caso dos polvos e das lulas, e cerca de sete dias após a eclosão, no caso dos chocos. |
|
ii. |
Os peixes devem ser contados a partir da fase em que se tornam autónomos em termos de alimentação. Os peixes-zebra mantidos em condições de reprodução ótimas (aproximadamente +28 °C) devem ser contados 5 dias após a fertilização. |
|
iii. |
Devido ao pequeno tamanho de algumas espécies de peixes e cefalópodes, a contagem pode ser feita por estimativa. |
2. Reutilização
|
i. |
Cada utilização do animal deve ser comunicada no final de cada procedimento. |
|
ii. |
As estatísticas apresentam o número de animais «virgens» (animais utilizados pela primeira vez) apenas em relação às respetivas espécies e locais de nascimento. Por conseguinte, no caso dos animais reutilizados, o «local de nascimento» não é registado. |
|
iii. |
Quaisquer categorias subsequentes devem indicar o número de utilizações de animais em procedimentos. Portanto, estes números não podem ser cruzados com os números totais de animais virgens. |
|
iv. |
O número de animais reutilizados não pode ser deduzido dos dados, porque alguns animais podem ser reutilizados mais de uma vez. |
|
v. |
Deve ser comunicado o sofrimento real do animal no procedimento. Em alguns casos, este poderá ter sido influenciado por uma utilização anterior. Contudo, a severidade nem sempre se acentuará numa utilização subsequente, podendo mesmo diminuir em alguns casos (habituação). Deve, pois, evitar-se acumular automaticamente os graus de severidade das utilizações precedentes. Este aspeto deve ser sempre considerado caso a caso. |
Reutilização e utilização contínua
Por «procedimento» entende-se a utilização de um animal para um único fim científico, experimental, educativo ou de formação. Uma utilização «única» vai do momento em que a primeira técnica é aplicada ao animal até ao momento em que a recolha de dados, as observações ou o objetivo educativo estão concluídos. Trata-se normalmente da experiência, do ensaio ou da preparação, uma só vez, de uma técnica.
Um procedimento único pode conter diversas etapas (técnicas), todas necessariamente visando alcançar um resultado único e exigindo a utilização do mesmo animal.
O utilizador final comunica o procedimento integral, incluindo qualquer preparativo (independentemente do local em que tenha ocorrido) e tendo em conta a severidade associada aos preparativos.
São exemplos de preparativos alguns procedimentos cirúrgicos (canulação, implantação de telemetria, ovariectomia, castração, hipofisectomia, etc.) e não cirúrgicos (ministração de dietas modificadas, indução de diabetes, etc.). O mesmo se aplica à reprodução de animais geneticamente alterados, isto é, quando o animal é utilizado no procedimento pretendido, o utilizador final comunica o procedimento integral, tendo em conta a severidade associada ao fenótipo. Para mais pormenores, consultar a secção relativa aos animais geneticamente alterados.
Se, por razões excecionais, um animal preparado não for utilizado para um fim científico, o estabelecimento que o preparou deve comunicar os elementos dos preparativos como procedimento independente nas estatísticas relativas ao fim pretendido, desde que a preparação do animal tenha excedido o limiar mínimo de dor, sofrimento, angústia ou dano duradouro.
3. Local de nascimento
|
i. |
A origem tem por base o local de nascimento do animal, e não o local que o fornece. |
|
ii. |
A categoria Animais nascidos na UE num criador registado abrange os animais nascidos nas instalações de criadores autorizados e registados de acordo com o artigo 20.o da Diretiva 2010/63/UE. |
|
iii. |
A categoria Animais nascidos na UE, mas não num criador registado abrange os animais nascidos fora das instalações de criadores registados, como os animais selvagens e os animais de explorações pecuárias (a menos que o criador esteja autorizado e registado), bem como quaisquer isenções concedidas ao abrigo do artigo 10.o, n.o 3, da Diretiva 2010/63/UE. |
|
iv. |
As categorias Animais nascidos no resto da Europa e Animais nascidos no resto do mundo abrangem todos os animais, independentemente de terem sido criados em estabelecimentos de criação registados ou noutros estabelecimentos, e incluem os animais capturados na natureza. |
4. Primatas não-humanos – fonte
Para efeitos do presente relatório:
|
i. |
A categoria Animais nascidos no resto da Europa deve incluir os animais nascidos na Turquia, na Rússia e em Israel. |
|
ii. |
A categoria Animais nascidos na Ásia deve incluir os animais nascidos na China. |
|
iii. |
A categoria Animais nascidos na América deve incluir os animais nascidos nas Américas do Norte, Central e do Sul. |
|
iv. |
A categoria Animais nascidos em África deve incluir os animais nascidos na Maurícia. |
|
v. |
A categoria Animais nascidos noutros locais deve incluir os animais nascidos na Australásia. |
As origens dos animais inscritos na categoria Animais nascidos noutros locais devem ser especificadas à autoridade competente, aquando da transmissão dos dados.
5. Primata não-humano – geração
|
i. |
Enquanto a colónia não for autossuficiente, a comunicação dos animais nela nascidos deve fazer-se nos campos F0, F1 ou F2 ou maior, consoante a sua geração por linha materna. |
|
ii. |
Logo que a colónia se torne autossuficiente, a comunicação dos animais nela nascidos deve fazer-se no campo Colónia autossuficiente, independentemente da sua geração por linha materna. |
6. Estatuto genético
|
i. |
A categoria Não geneticamente alterados abrange os animais que não sofreram alterações genéticas, incluindo os animais progenitores geneticamente normais utilizados para a criação de uma nova linhagem/estirpe de animais geneticamente alterados. |
|
ii. |
A categoria Geneticamente alterados, sem fenótipo nocivo inclui os animais utilizados para a criação de uma nova linhagem, portadores da alteração genética mas que não exibam fenótipo nocivo, e os animais geneticamente alterados utilizados noutros procedimentos (não para criação ou manutenção) mas que não exibam fenótipo nocivo. |
|
iii. |
A categoria Geneticamente alterados, com fenótipo nocivo inclui:
|
7. Criação de uma nova linhagem geneticamente alterada
A categoria Animais utilizados para a criação de uma nova linhagem/estirpe geneticamente alterada identifica os animais que são utilizados para criar uma nova linhagem/estirpe geneticamente alterada, separando-os dos outros animais utilizados para fins de «investigação fundamental» ou de «investigação translacional ou aplicada».
8. Severidade
|
i. |
Não-recuperação – Devem ser incluídos na categoria de severidade Não-recuperação os animais sujeitos a procedimentos inteiramente sob anestesia geral na sequência da qual não recuperaram a consciência. |
|
ii. |
Não mais que ligeira – Devem ser incluídos na categoria de severidade Não mais que ligeira os animais sujeitos a procedimentos em consequência dos quais experimentaram dor, sofrimento ou angústia de curta duração e em grau não superior ao ligeiro ou a procedimentos que não comprometeram significativamente o seu bem-estar ou o seu estado geral. NOTA: Devem incluir-se também nesta categoria os animais utilizados em projetos autorizados mas em relação aos quais, em última instância, não se constatou que tenham experimentado dor, sofrimento, angústia ou dano duradouro em grau equivalente ao causado pela introdução de uma agulha de acordo com as boas práticas veterinárias, com exceção dos animais necessários para a manutenção de colónias de animais geneticamente alterados de linhagens estabelecidas com fenótipo nocivo intencional e que não manifestaram dor, sofrimento, angústia ou dano duradouro em consequência do genótipo nocivo. |
|
iii. |
Moderada – Devem ser incluídos na categoria de severidade Moderada os animais sujeitos a procedimentos em consequência dos quais experimentaram dor, sofrimento ou angústia de curta duração e em grau moderado, ou dor, sofrimento ou angústia em grau ligeiro mas de longa duração, bem como os animais sujeitos a procedimentos que comprometeram moderadamente o seu bem-estar ou o seu estado geral. |
|
iv. |
Severa – Devem ser incluídos na categoria de severidade Severa os animais sujeitos a procedimentos em consequência dos quais experimentaram dor, sofrimento ou angústia em grau severo, ou dor, sofrimento ou angústia em grau moderado mas de longa duração, bem como os animais sujeitos a procedimentos que comprometeram severamente o seu bem-estar ou o seu estado geral. |
|
v. |
Se a classificação «severa» for excedida, com ou sem autorização prévia, os animais em causa e a sua utilização devem ser incluídos na categoria de severidade Severa. Na secção para observações do Estado-Membro, devem ser acrescentados comentários, incidindo na espécie, nos números, numa eventual autorização de isenção prévia, nos detalhes da utilização e nas razões por que foi excedida a classificação «severa». |
9. Fins
i. Investigação fundamental
A investigação fundamental compreende: estudos de natureza fundamental, inclusive de fisiologia; estudos destinados a melhorar os conhecimentos em matéria de estrutura, funcionamento e comportamento normais e anormais dos organismos vivos e do ambiente, incluindo estudos fundamentais no domínio da toxicologia; investigação e análise orientadas para uma compreensão mais perfeita ou completa de um tema, de um fenómeno ou de uma lei básica da natureza, e não para uma aplicação prática específica dos resultados.
Os animais utilizados para a criação de uma nova linhagem geneticamente alterada (incluindo o cruzamento de duas linhagens) destinada a fins de investigação fundamental (p. ex., biologia do desenvolvimento, imunologia) devem ser registados de acordo com o fim para o qual estão a ser criados. Devem também ser comunicados no âmbito da «Criação de uma nova linhagem genética – Animais utilizados para a criação de uma nova linhagem/estirpe geneticamente alterada».
Todos os animais portadores da alteração genética devem ser comunicados durante a criação de uma nova linhagem. Devem ser também comunicados aqui os animais utilizados em criação para, por exemplo, superovulação, vasectomia e implantação de embriões. Na comunicação, devem ser excluídos os descendentes não geneticamente alterados (de tipo selvagem).
Uma nova estirpe ou linhagem de animais geneticamente alterados é considerada «estabelecida» se a transmissão da alteração genética for estável, o que significa um mínimo de duas gerações, e tiver sido realizada uma avaliação do bem-estar.
ii. Investigação translacional ou aplicada
A investigação translacional ou aplicada compreende os animais utilizados para os fins referidos no artigo 5.o, alíneas b) e c), excluindo qualquer utilização regulamentar.
Compreende também a toxicologia exploratória e a investigação destinada a preparar os requerimentos regulamentares e o desenvolvimento de métodos. Não inclui os estudos necessários para os requerimentos regulamentares.
Os animais utilizados para a criação de uma nova linhagem geneticamente alterada (incluindo o cruzamento de duas linhagens) destinada a fins de investigação translacional ou aplicada (p. ex., investigação oncológica, desenvolvimento de vacinas) devem ser registados de acordo com o fim para o qual estão a ser criados. Devem também ser comunicados no âmbito da «Criação de uma nova linhagem genética – Animais utilizados para a criação de uma nova linhagem/estirpe geneticamente alterada».
Todos os animais portadores da alteração genética devem ser comunicados durante a criação de uma nova linhagem. São também comunicados aqui os animais utilizados em criação para, por exemplo, superovulação, vasectomia e implantação de embriões. Na comunicação, devem ser excluídos os descendentes não geneticamente alterados (de tipo selvagem).
Uma nova estirpe ou linhagem de animais geneticamente alterados é considerada «estabelecida» se a transmissão da alteração genética for estável, o que significa um mínimo de duas gerações, e tiver sido realizada uma avaliação de bem-estar.
iii. Utilização regulamentar e produção de rotina, por tipo
Utilização de animais em procedimentos com vista a satisfazer requisitos legais relativos à produção e à colocação e manutenção de produtos/substâncias no mercado, incluindo a avaliação da segurança e do risco de alimentos para consumo humano ou animal. Inclui ensaios sobre produtos/substâncias que acabam por não ser objeto do requerimento regulamentar, caso fizessem parte desse requerimento eventualmente apresentado (ou seja, ensaios efetuados a produtos/substâncias que não chegam ao termo do processo de desenvolvimento).
Inclui também os animais utilizados no fabrico de produtos cujo processo requeira aprovação regulamentar (p. ex., devem ser incluídos nesta categoria os animais utilizados no fabrico de medicamentos à base de soro).
O ensaio da eficácia durante o desenvolvimento de novos medicamentos é excluído, devendo ser comunicado na categoria «Investigação translacional ou aplicada».
iv. Proteção do ambiente natural no interesse da saúde ou do bem-estar do homem ou dos animais
Inclui estudos destinados a investigar e compreender fenómenos como a poluição ambiental ou a perda de biodiversidade e estudos epidemiológicos em animais selvagens.
Exclui qualquer utilização regulamentar de animais para fins de ecotoxicologia.
v. Ensino superior ou formação para aquisição, manutenção ou melhoramento de qualificações profissionais
Inclui formação para a aquisição e a manutenção de competência prática para as funções referidas no artigo 23.o, n.o 2.
vi. Manutenção de colónias de animais geneticamente alterados estabelecidos, não utilizados noutros procedimentos
Compreende o número de animais necessários para a manutenção de colónias de animais geneticamente alterados de linhagens estabelecidas com fenótipo nocivo intencional e que manifestaram dor, sofrimento, angústia ou dano duradouro em consequência do genótipo nocivo. O objetivo para o qual a linhagem está a ser criada não é registado.
Exclui os animais necessários para a criação de novas linhagens geneticamente alteradas e os utilizados noutros procedimentos (que não criação ou reprodução).
10. Estudos de investigação fundamental
i. Oncologia
Devem ser aqui incluídos todos os trabalhos de investigação sobre oncologia, independentemente do sistema-alvo.
ii. Sistema nervoso
Esta categoria inclui a neurociência, o sistema nervoso periférico ou central e a psicologia.
iii. Órgãos sensoriais (pele, olhos e ouvidos)
Os estudos relativos ao nariz devem ser comunicados no âmbito do «Sistema respiratório»; os relativos à língua, no âmbito do «Sistema gastrointestinal, incluindo fígado».
iv. Multissistémico
Deve incluir apenas investigação em que o interesse principal se centra em mais de um sistema, como a relativa a algumas doenças infecciosas, mas excluindo a oncologia.
v. A categoria Etologia/ Comportamento animal/ Biologia animal abrange animais em estado selvagem e animais em cativeiro, com o objetivo principal de melhorar o conhecimento acerca da espécie em questão.
vi. Outros
Estudos não relativos a um dos órgãos/sistemas da lista supra ou que não incidem em órgãos/sistemas específicos.
vii. Observações
Os animais utilizados para a produção e a manutenção de agentes infecciosos, vetores e neoplasias, os animais utilizados para a obtenção de outras matérias biológicas e os animais utilizados para a produção de anticorpos policlonais para fins de investigação translacional ou aplicada, mas excluindo a produção de anticorpos policlonais pelo método da ascite (que pertence à categoria «Utilização regulamentar e produção de rotina, por tipo»), devem ser comunicados nos correspondentes campos das categorias «Estudos de investigação fundamental» ou «Investigação translacional ou aplicada». Os fins dos estudos têm de ser cuidadosamente determinados, porque poderão ser aplicáveis várias possibilidades das listas associadas às duas categorias e só o fim principal deve ser comunicado.
11. Investigação translacional ou aplicada
i. Devem ser incluídos todos os trabalhos de investigação aplicada sobre cancro humano e patologias infecciosas humanas, independentemente do sistema-alvo.
ii. Deve ser excluída qualquer utilização regulamentar de animais, como estudos regulamentares de carcinogenicidade.
iii. Os estudos relativos às patologias do nariz devem ser comunicados no âmbito das «Patologias respiratórias humanas»; os relativos às patologias da língua, no âmbito das patologias do «Sistema gastrointestinal, incluindo fígado».
iv. O diagnóstico de doenças inclui os animais utilizados no diagnóstico direto de doenças como a raiva ou o botulismo, excluindo porém os abrangidos pela utilização regulamentar.
v. A toxicologia não-regulamentar compreende a toxicologia exploratória e a investigação destinada a preparar os requerimentos regulamentares e o desenvolvimento de métodos. Não inclui os estudos necessários para os requerimentos regulamentares – estudos preliminares, dose máxima tolerada (DMT).
vi. O bem-estar dos animais deve abranger os estudos a que se refere o artigo 5.o, alínea b), subalínea iii), da Diretiva 2010/63/UE.
vii. Observações
Os animais utilizados para a produção e a manutenção de agentes infecciosos, vetores e neoplasias, os animais utilizados para a obtenção de outras matérias biológicas e os animais utilizados para a produção de anticorpos policlonais para fins de investigação translacional ou aplicada, mas excluindo a produção de anticorpos policlonais pelo método da ascite (que pertence à categoria «Utilização regulamentar e produção de rotina, por tipo»), devem ser comunicados nos correspondentes campos das categorias «Estudos de investigação fundamental» ou «Investigação translacional ou aplicada». Os fins dos estudos têm de ser cuidadosamente determinados, porque poderão ser aplicáveis várias possibilidades das listas associadas às duas categorias e só o fim principal deve ser comunicado.
12. Utilização regulamentar e produção de rotina
|
i. |
Utilização de animais em procedimentos com vista a satisfazer requisitos legais relativos à produção e à colocação e manutenção de produtos/substâncias no mercado, incluindo a avaliação da segurança e do risco de alimentos para consumo humano ou animal. |
|
ii. |
Inclui ensaios sobre produtos/substâncias que não são objeto do requerimento regulamentar (ou seja, ensaios efetuados a produtos/substâncias que careciam de requerimento regulamentar mas cujo promotor acabou por considerar inadequados para o mercado e que, portanto, não chegaram ao termo do processo de desenvolvimento). |
|
iii. |
Inclui também os animais utilizados no fabrico de produtos cujo processo requeira aprovação regulamentar (p. ex., devem ser incluídos nesta categoria os animais utilizados no fabrico de medicamentos à base de soro). |
13. Utilização regulamentar e produção de rotina, por tipo
|
i. |
O ensaio da eficácia durante o desenvolvimento de novos medicamentos é excluído, devendo ser comunicado na categoria «Investigação translacional ou aplicada». |
|
ii. |
O Controlo da qualidade abrange os animais utilizados nos ensaios de pureza, estabilidade, eficácia, potência e outros parâmetros relativos ao controlo da qualidade do produto final e dos seus constituintes, bem como quaisquer controlos realizados durante o processo de fabrico para efeitos de registo, para satisfazer outros eventuais requisitos regulamentares nacionais ou internacionais ou para satisfazer as normas internas do fabricante. Inclui os ensaios de pirogenicidade. |
|
iii. |
Outros ensaios de eficácia e tolerância: são abrangidos por esta categoria os ensaios de eficácia de biocidas e pesticidas, assim como os ensaios de tolerância de aditivos nos alimentos para animais. |
|
iv. |
A Produção de rotina abrange a produção de anticorpos monoclonais (pelo método da ascite) e de produtos hematológicos, incluindo antissoros policlonais por métodos estabelecidos. Esta categoria exclui a imunização de animais para produção de hibridomas, que deve ser incluída na categoria adequada de investigação fundamental ou aplicada. |
|
v. |
Os Ensaios de toxicidade e outros ensaios de segurança (incluindo a avaliação da segurança de produtos e dispositivos utilizados em medicina humana e dentária e em medicina veterinária) abrangem os estudos sobre produtos ou substâncias a fim de determinar o seu potencial para causar efeitos perigosos ou indesejáveis no homem ou nos animais devido à sua utilização intencional ou anormal, ao seu fabrico ou à sua contaminação potencial ou real do meio ambiente. |
14. Controlo da qualidade (incluindo ensaios de segurança e de potência dos lotes)
Os Ensaios de segurança dos lotes excluem os ensaios de pirogenicidade, que são remetidos para a categoria Ensaios de pirogenicidade.
15. Ensaios de toxicidade e outros ensaios de segurança, exigidos por legislação
|
i. |
O requisito legislativo a inserir é o correspondente à utilização principal pretendida. |
|
ii. |
Qualidade da água: se se referir, p. ex., à água da torneira, deve ser inserida no âmbito da Legislação alimentar. |
16. Requisitos legislativos
|
i. |
Esta categoria permite identificar o nível de harmonização entre diferentes requisitos legislativos. O fator determinante não é quem requer a realização do ensaio, mas a legislação que é satisfeita, dando prioridade ao mais elevado grau de harmonização. |
|
ii. |
Se a legislação nacional derivar da legislação da UE, deve ser escolhida apenas a Legislação que estabelece os requisitos da UE. |
|
iii. |
A Legislação que estabelece os requisitos da UE inclui também qualquer requisito internacional que simultaneamente estabelece os requisitos da UE (como os ensaios em conformidade com a ICH, a VICH, as orientações da OCDE ou as monografias da Farmacopeia europeia). |
|
iv. |
A categoria Legislação que estabelece apenas requisitos nacionais (dentro da UE) só deve ser escolhida se o ensaio for efetuado para satisfazer os requisitos de um ou mais Estados-Membros (não necessariamente aquele em que o trabalho é realizado), não havendo, porém, requisito equivalente na UE. |
|
v. |
A categoria Legislação que estabelece apenas requisitos que não são da UE deve ser escolhida se não houver requisito equivalente da UE para a realização do ensaio. |
17. Ensaios de toxicidade e outros ensaios de segurança, por tipo de ensaio
|
i. |
Os estudos de imunotoxicologia devem ser inseridos no âmbito da Toxicidade por dose repetida. |
|
ii. |
Cinética (farmacocinética, toxicocinética, depleção de resíduos): se forem realizados no âmbito do estudo regulamentar da toxicidade por dose repetida, os ensaios de toxicocinética devem ser comunicados no âmbito desta última. |
|
iii. |
A categoria Ensaios de segurança no domínio dos alimentos para consumo humano e animal abrange os ensaios sobre a água potável (incluindo os ensaios sobre a segurança dos animais-alvo). |
|
iv. |
Segurança de animais-alvo: ensaios que visam garantir que um produto destinado a um animal específico pode ser utilizado com segurança nessa espécie (excluindo os ensaios de segurança dos lotes, que são abrangidos pelo controlo da qualidade). |
18. Métodos de ensaio de toxicidade aguda e subaguda
19. Toxicidade por dose repetida
20. Utilização de animais para produção regulamentada, por tipo de produto
21. Ecotoxicidade
C. OBSERVAÇÕES DOS ESTADOS-MEMBROS
|
1. |
Informação geral sobre alterações de tendências, constatadas desde o anterior período de relatório. |
|
2. |
Informação sobre aumento ou diminuição consideráveis da utilização de animais em qualquer dos domínios específicos e análise das correspondentes razões. |
|
3. |
Informação sobre alterações de tendências da severidade real e análise das correspondentes razões. |
|
4. |
Esforços especiais para promover o princípio de substituição, redução e refinamento e seus eventuais impactos nas estatísticas. |
|
5. |
Especificação das categorias «outro/a/s», se nelas forem comunicadas utilizações de animais em percentagem significativa. |
|
6. |
Informação detalhada sobre os casos em que a classificação «severa» é excedida, com ou sem autorização prévia, incidindo na espécie, nos números, numa eventual autorização de isenção prévia, nos detalhes da utilização e nas razões por que foi excedida a classificação «severa». |