|
5.5.2009
|
PT
|
Jornal Oficial da União Europeia
|
L 111/31
|
DECISÃO DA COMISSÃO
de 28 de Abril de 2009
que autoriza a colocação no mercado de licopeno de Blakeslea trispora como novo ingrediente alimentar, nos termos do Regulamento (CE) n.o 258/97 do Parlamento Europeu e do Conselho
[notificada com o número C(2009) 3039]
(Apenas faz fé o texto em língua espanhola)
(2009/365/CE)
A COMISSÃO DAS COMUNIDADES EUROPEIAS,
Tendo em conta o Tratado que institui a Comunidade Europeia,
Tendo em conta o Regulamento (CE) n.o 258/97 do Parlamento Europeu e do Conselho, de 27 de Janeiro de 1997, relativo a novos alimentos e ingredientes alimentares (1), nomeadamente o artigo 7.o,
Considerando o seguinte:
|
(1)
|
Em 30 de Agosto de 2007, a empresa Vitatene apresentou um pedido às autoridades competentes do Reino Unido para colocar no mercado licopeno de Blakeslea trispora como novo ingrediente alimentar; em 17 de Outubro de 2007, o organismo competente do Reino Unido para a avaliação de alimentos emitiu o seu relatório de avaliação preliminar. Nesse relatório, o referido organismo concluía que, tendo em conta outros pedidos pendentes relativos ao licopeno, era necessária uma avaliação adicional a fim de assegurar que a autorização da utilização dos vários licopenos como novos ingredientes alimentares seja concedida nos mesmos termos.
|
|
(2)
|
A Comissão transmitiu o relatório de avaliação preliminar a todos os Estados-Membros em 11 de Fevereiro de 2008.
|
|
(3)
|
A Autoridade Europeia para a Segurança dos Alimentos (AESA) foi consultada em 2008, tendo emitido o seu parecer em 4 de Dezembro de 2008.
|
|
(4)
|
No referido parecer, a AESA conclui que, visto que o licopeno pode sofrer alterações por oxidação, tem de ser formulado sob a forma de suspensões em óleos alimentares ou pós directamente compressíveis ou dispersáveis em água. Deve ser assegurada protecção antioxidante suficiente.
|
|
(5)
|
A AESA conclui igualmente que o consumo de licopeno pelo utilizador médio se situará abaixo da dose diária admissível (DDA), mas que alguns utilizadores de licopeno poderão exceder a DDA. Por conseguinte, é igualmente adequado recolher dados sobre a ingestão durante alguns anos após a autorização, a fim de a reexaminar à luz de quaisquer informações complementares sobre a segurança do licopeno e do respectivo consumo. Deve ser dada especial atenção à recolha de dados relativamente aos níveis de licopeno nos cereais de pequeno-almoço. Todavia, esta exigência, estabelecida pela presente decisão, é aplicável à utilização de licopeno como novo ingrediente alimentar, mas não à utilização de licopeno como corante alimentar, a qual é abrangida pelo âmbito de aplicação da Directiva 89/107/CEE do Conselho, de 21 de Dezembro de 1988, relativa à aproximação das legislações dos Estados-Membros respeitantes aos aditivos que podem ser utilizados nos géneros destinados à alimentação humana (2).
|
|
(6)
|
Com base na avaliação científica, ficou estabelecido que o licopeno de Blakeslea trispora cumpre os critérios enunciados no n.o 1 do artigo 3.o do Regulamento (CE) n.o 258/97.
|
|
(7)
|
A empresa Vitatene concordou com a revogação da Decisão 2006/721/CE da Comissão (3).
|
|
(8)
|
As medidas previstas na presente decisão estão em conformidade com o parecer do Comité Permanente da Cadeia Alimentar e da Saúde Animal,
|
ADOPTOU A PRESENTE DECISÃO:
Artigo 1.o
O licopeno de Blakeslea trispora, tal como especificado no anexo I, a seguir denominado «o produto», pode ser colocado no mercado comunitário enquanto novo ingrediente alimentar para utilização nos alimentos enumerados no anexo II.
Artigo 2.o
A designação do novo ingrediente alimentar autorizado pela presente decisão a utilizar na rotulagem do género alimentício que o contenha será «licopeno».
Artigo 3.o
A Vitatene deve estabelecer um programa de vigilância para o acompanhamento da comercialização do produto. Este programa deve abranger informações sobre os níveis de utilização do licopeno nos alimentos, conforme especificado no anexo III.
Os dados recolhidos devem ser disponibilizados à Comissão e aos Estados-Membros. A utilização do licopeno como ingrediente alimentar deve ser revista o mais tardar em 2014, à luz das novas informações e de um relatório da AESA.
Artigo 4.o
É revogada a Decisão 2006/721/CE.
Artigo 5.o
A Vitatene S.A.U. Avda. Antibióticos 59-61, E-24009 León, Espanha, é a destinatária da presente decisão.
Feito em Bruxelas, em 28 de Abril de 2009.
Pela Comissão
Androulla VASSILIOU
Membro da Comissão
(1) JO L 43 de 14.2.1997, p. 1.
(2) JO L 40 de 11.2.1989, p. 27.
(3) JO L 296 de 26.10.2006, p. 13.
ANEXO I
Especificações do licopeno de Blakeslea trispora
DESCRIÇÃO
O licopeno de Blakeslea trispora purificado é composto por ≥ 95 % de licopeno e ≤ 5 % de outros carotenóides. É apresentado quer como pó numa matriz adequada, quer como dispersão em óleo. A sua cor é o vermelho escuro ou vermelho-violeta. Deve ser assegurada protecção antioxidante.
ESPECIFICAÇÃO
|
Denominação química
|
:
|
Licopeno
|
|
Número CAS
|
:
|
502-65-8 (licopeno totalmente trans)
|
|
Fórmula química
|
:
|
C40H56
|
|
Fórmula estrutural
|
:
|
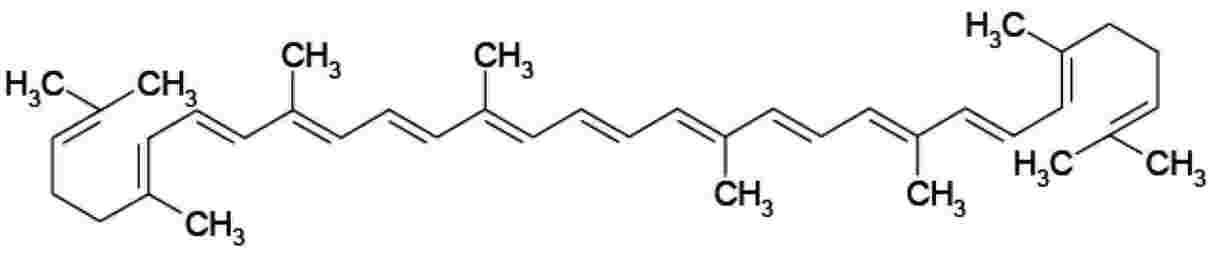
|
|
Massa molecular
|
:
|
536,85
|
ANEXO II
Lista de alimentos aos quais se pode adicionar licopeno de Blakeslea trispora
|
Categoria de alimentos
|
Teor máximo de licopeno
|
|
Bebidas à base de sumos de frutas/produtos hortícolas (incluindo concentrados)
|
2,5 mg/100 g
|
|
Bebidas adaptadas a um esforço muscular intenso, sobretudo para os desportistas
|
2,5 mg/100 g
|
|
Alimentos destinados a serem utilizados em dietas de restrição calórica para redução do peso
|
8 mg/substituto de refeição
|
|
Cereais de pequeno-almoço
|
5 mg/100 g
|
|
Gorduras e guarnições
|
10 mg/100 g
|
|
Sopas, excepto sopa de tomate
|
1 mg/100 g
|
|
Pão (incluindo tostas)
|
3 mg/100 g
|
|
Alimentos dietéticos para fins medicinais específicos
|
De acordo com as necessidades nutricionais específicas
|
|
Suplementos alimentares
|
15 mg por dose diária, tal como recomendado pelo fabricante
|
ANEXO III
Vigilância pós-comercialização do licopeno de Blakeslea trispora
INFORMAÇÕES A RECOLHER
Quantidades de licopeno de Blakeslea trispora fornecidas pela Vitatene aos seus clientes para o fabrico de produtos alimentares finais para colocação no mercado na União Europeia.
Resultados de pesquisas em bases de dados sobre a comercialização de alimentos com licopeno de Blakeslea trispora adicionado, por Estado-Membro, indicando os níveis de fortificação e o tamanho das doses por cada alimento.
COMUNICAÇÃO DAS INFORMAÇÕES
As informações acima referidas devem ser comunicadas à Comissão Europeia anualmente, de 2009 a 2012. O primeiro relatório, referente ao período de 1 de Julho de 2009 a 30 de Junho de 2010, deve ser transmitido até 31 de Outubro de 2010, aplicando-se períodos de referência idênticos no que se refere aos dois anos seguintes.
INFORMAÇÕES SUPLEMENTARES
Quando adequado, devem igualmente ser comunicados os mesmos dados no que respeita à ingestão de licopeno utilizado como corante alimentar, caso a Vitatene disponha de tais informações.
A Vitatene deve fornecer as novas informações científicas eventualmente disponíveis para o reexame dos níveis máximos de segurança aplicáveis à ingestão de licopeno.
AVALIAÇÃO DOS NÍVEIS DE INGESTÃO DE LICOPENO
Com base nas informações recolhidas e comunicadas, a Vitatene procederá a uma avaliação actualizada da ingestão.
REEXAME
A Comissão consultará a AESA em 2013 a fim de reexaminar as informações fornecidas pela indústria.
