EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02005R2074-20140601
Commission Regulation (EC) No 2074/2005 of 5 December 2005 laying down implementing measures for certain products under Regulation (EC) No 853/2004 of the European Parliament and of the Council and for the organisation of official controls under Regulation (EC) No 854/2004 of the European Parliament and of the Council and Regulation (EC) No 882/2004 of the European Parliament and of the Council, derogating from Regulation (EC) No 852/2004 of the European Parliament and of the Council and amending Regulations (EC) No 853/2004 and (EC) No 854/2004 (Text with EEA relevance)
Consolidated text: Regulamento (CE) n. o 2074/2005 da Comissão de 5 de Dezembro de 2005 que estabelece medidas de execução para determinados produtos ao abrigo do Regulamento (CE) n. o 853/2004 do Parlamento Europeu e do Conselho e para a organização de controlos oficiais ao abrigo dos Regulamentos (CE) n. o 854/2004 do Parlamento Europeu e do Conselho e n. o 882/2004 do Parlamento Europeu e do Conselho, que derroga o Regulamento (CE) n. o 852/2004 do Parlamento Europeu e do Conselho e altera os Regulamentos (CE) n. o 853/2004 e (CE) n. o 854/2004 (Texto relevante para efeitos do EEE)
Regulamento (CE) n. o 2074/2005 da Comissão de 5 de Dezembro de 2005 que estabelece medidas de execução para determinados produtos ao abrigo do Regulamento (CE) n. o 853/2004 do Parlamento Europeu e do Conselho e para a organização de controlos oficiais ao abrigo dos Regulamentos (CE) n. o 854/2004 do Parlamento Europeu e do Conselho e n. o 882/2004 do Parlamento Europeu e do Conselho, que derroga o Regulamento (CE) n. o 852/2004 do Parlamento Europeu e do Conselho e altera os Regulamentos (CE) n. o 853/2004 e (CE) n. o 854/2004 (Texto relevante para efeitos do EEE)
2005R2074 — PT — 01.06.2014 — 008.001
Este documento constitui um instrumento de documentação e não vincula as instituições
|
REGULAMENTO (CE) N.o 2074/2005 DA COMISSÃO de 5 de Dezembro de 2005 que estabelece medidas de execução para determinados produtos ao abrigo do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho e para a organização de controlos oficiais ao abrigo dos Regulamentos (CE) n.o 854/2004 do Parlamento Europeu e do Conselho e n.o 882/2004 do Parlamento Europeu e do Conselho, que derroga o Regulamento (CE) n.o 852/2004 do Parlamento Europeu e do Conselho e altera os Regulamentos (CE) n.o 853/2004 e (CE) n.o 854/2004 (Texto relevante para efeitos do EEE) (JO L 338, 22.12.2005, p.27) |
Alterado por:
|
|
|
Jornal Oficial |
||
|
No |
page |
date |
||
|
Regulamento (CE) n.o 1664/2006 da Comissão de 6 de Novembro de 2006 |
L 320 |
13 |
18.11.2006 |
|
|
Regulamento (CE) n.o 1244/2007 da Comissão de 24 de Outubro de 2007 |
L 281 |
12 |
25.10.2007 |
|
|
Regulamento (CE) n.o 1022/2008 da Comissão de 17 de Outubro de 2008 |
L 277 |
18 |
18.10.2008 |
|
|
Regulamento (CE) n.o 1250/2008 da Comissão de 12 de Dezembro de 2008 |
L 337 |
31 |
16.12.2008 |
|
|
Regulamento (UE) n.o 15/2011 da Comissão de 10 de Janeiro de 2011 |
L 6 |
3 |
11.1.2011 |
|
|
Regulamento de Execução (UE) n.o 809/2011 da Comissão de 11 de Agosto de 2011 |
L 207 |
1 |
12.8.2011 |
|
|
Regulamento de Execução (UE) n.o 1012/2012 da Comissão de 5 de novembro de 2012 |
L 306 |
1 |
6.11.2012 |
|
|
Regulamento (UE) n.o 218/2014 da Comissão de 7 de março de 2014 |
L 69 |
95 |
8.3.2014 |
|
Rectificado por:
REGULAMENTO (CE) N.o 2074/2005 DA COMISSÃO
de 5 de Dezembro de 2005
que estabelece medidas de execução para determinados produtos ao abrigo do Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho e para a organização de controlos oficiais ao abrigo dos Regulamentos (CE) n.o 854/2004 do Parlamento Europeu e do Conselho e n.o 882/2004 do Parlamento Europeu e do Conselho, que derroga o Regulamento (CE) n.o 852/2004 do Parlamento Europeu e do Conselho e altera os Regulamentos (CE) n.o 853/2004 e (CE) n.o 854/2004
(Texto relevante para efeitos do EEE)
A COMISSÃO DAS COMUNIDADES EUROPEIAS,
Tendo em conta o Tratado que institui a Comunidade Europeia,
Tendo em conta o Regulamento (CE) n.o 852/2004 do Parlamento Europeu e do Conselho, de 29 de Abril de 2004, relativo à higiene dos géneros alimentícios ( 1 ), nomeadamente o n.o 2 do artigo 13.o,
Tendo em conta o Regulamento (CE) n.o 853/2004 do Parlamento Europeu e do Conselho, de 29 de Abril de 2004, que estabelece regras específicas de higiene aplicáveis aos géneros alimentícios de origem animal ( 2 ), nomeadamente os artigos 9.o, 10.o e 11.o,
Tendo em conta o Regulamento (CE) n.o 854/2004 do Parlamento Europeu e do Conselho, de 29 de Abril de 2004, que estabelece regras específicas de organização dos controlos oficiais de produtos de origem animal destinados ao consumo humano ( 3 ), nomeadamente os artigos 16.o, 17.o e 18.o,
Tendo em conta o Regulamento (CE) n.o 882/2004 do Parlamento Europeu e do Conselho, de 29 de Abril de 2004, relativo aos controlos oficiais realizados para assegurar a verificação do cumprimento da legislação relativa aos alimentos para animais e aos géneros alimentícios e das normas relativas à saúde e ao bem-estar dos animais ( 4 ), nomeadamente o artigo 63.o,
Considerando o seguinte:|
(1) |
O Regulamento (CE) n.o 853/2004 estabelece requisitos específicos relativos às regras de higiene aplicáveis aos alimentos de origem animal. É necessário estabelecer determinadas medidas de execução para a carne, os moluscos bivalves vivos, os produtos da pesca, o leite, os ovos, as coxas de rã e os caracóis e respectivos produtos transformados. |
|
(2) |
O Regulamento (CE) n.o 854/2004 estabelece regras específicas de organização dos controlos oficiais de produtos de origem animal destinados ao consumo humano. É necessário desenvolver determinadas regras e especificar outros requisitos. |
|
(3) |
O Regulamento (CE) n.o 882/2004 estabelece a nível comunitário um quadro harmonizado de regras gerais para a organização dos controlos oficiais. É necessário desenvolver determinadas regras e especificar outros requisitos. |
|
(4) |
A Decisão 20XX/.../CE da Comissão ( 5 ) revoga determinadas decisões relativas a medidas de execução previstas nas directivas revogadas pela Directiva 2004/41/CE do Parlamento Europeu e do Conselho, de 21 de Abril de 2004, que revoga certas directivas relativas à higiene dos géneros alimentícios e às regras sanitárias aplicáveis à produção e à comercialização de determinados produtos de origem animal destinados ao consumo humano e altera as Directivas 89/662/CEE e 92/118/CEE do Conselho e a Decisão 95/408/CE do Conselho ( 6 ). Certas partes das decisões em causa devem, por conseguinte, ser mantidas no presente regulamento. |
|
(5) |
O Regulamento (CE) n.o 852/2004 requer que os operadores das empresas do sector alimentar mantenham e conservem registos e que ponham à disposição da autoridade competente e dos operadores das empresas do sector alimentar receptoras, a seu pedido, as informações pertinentes contidas nesses registos. |
|
(6) |
O Regulamento (CE) n.o 853/2004 também requer que os operadores responsáveis por matadouros solicitem, recebam, verifiquem e actuem em função das informações relativas à cadeia alimentar sobre todos os animais, excluindo a caça selvagem, enviados ou destinados ao matadouro. Além disso, devem assegurar-se de que as informações relativas à cadeia alimentar contenham todos os pormenores exigidos pelo Regulamento (CE) n.o 853/2004. |
|
(7) |
As informações relativas à cadeia alimentar ajudam o operador responsável pelo matadouro a organizar as operações de abate e o veterinário oficial a determinar os procedimentos de inspecção requeridos. As informações relativas à cadeia alimentar devem ser analisadas pelo veterinário oficial e utilizadas como parte integrante dos procedimentos de inspecção. |
|
(8) |
Os sistemas de fluxo de informação existentes devem ser utilizados o mais possível e ser adaptados a fim de cumprirem os requisitos em matéria de informações relativas à cadeia alimentar estabelecidos no Regulamento (CE) n.o 854/2004. |
|
(9) |
De modo a melhorar a gestão animal ao nível das explorações e em conformidade com o Regulamento (CE) n.o 854/2004, o veterinário oficial deve registar e, se necessário, comunicar ao operador do sector alimentar da exploração de origem e a qualquer veterinário que assista a exploração de origem ou a qualquer autoridade competente envolvida, qualquer doença ou afecção observadas no matadouro no que diz respeito a cada animal ou ao efectivo/bando e que possa afectar a saúde pública ou animal ou comprometer o bem-estar dos animais. |
|
(10) |
Os Regulamentos (CE) n.o 853/2004 e n.o 854/2004 fixam os requisitos que regem os controlos parasitários durante o manuseamento dos produtos da pesca em terra e a bordo dos navios. Compete aos operadores das empresas do sector alimentar efectuarem os seus próprios controlos em todas as fases da produção de produtos da pesca em conformidade com as regras da parte D do capítulo V da secção VIII do anexo III do Regulamento (CE) n.o 853/2004, de forma a que os peixes obviamente infestados de parasitas não sejam libertados para consumo humano. A adopção de regras pormenorizadas relacionadas com as inspecções visuais exige a definição do conceito de parasitas visíveis e de inspecção visual, bem como a determinação do tipo e a frequência das observações. |
|
(11) |
Os controlos previstos no Regulamento (CE) n.o 853/2004 para evitar a colocação no mercado de produtos da pesca impróprios para consumo humano podem incluir determinados controlos químicos, nomeadamente a determinação do azoto básico volátil total (ABVT). É necessário estabelecer níveis de ABVT que não podem ser ultrapassados no caso de determinadas categorias de espécies, bem como especificar os métodos de análise a utilizar. Os métodos de análise reconhecidos cientificamente para controlar o ABVT devem continuar a ser utilizados por rotina, mas deve ser especificado um método de referência a utilizar sempre que houver dúvidas relativamente aos resultados ou em caso de litígio. |
|
(12) |
Os limites para as toxinas paralisantes («Paralytic Shellfish Poison» — PSP), as toxinas amnésicas («Amnesic Shellfish Poison» — ASP) e as toxinas lipofílicas estão fixados no Regulamento (CE) n.o 853/2004. Os bioensaios constituem o método de referência para detectar determinadas toxinas e impedir a colheita de moluscos bivalves tóxicos. Os níveis máximos e os métodos de análise devem ser harmonizados e aplicados pelos Estados-Membros para proteger a saúde humana. Além dos métodos de ensaio biológicos, deverão ser permitidos métodos de detecção alternativos, tais como métodos químicos e ensaios in vitro, caso se demonstre que o desempenho dos métodos seleccionados é pelo menos tão eficaz como o método biológico e que a sua aplicação proporciona um nível equivalente de protecção da saúde pública. Os limites máximos propostos para as toxinas lipofílicas têm por base dados provisórios e devem ser reavaliados assim que se encontrarem disponíveis novos dados científicos. A falta de material de referência e a utilização apenas de testes que não sejam de bioensaio significa actualmente que o nível de protecção da saúde pública proporcionado relativamente a todas as toxinas especificadas não é equivalente à proporcionada pelos testes biológicos. Convém providenciar, o mais depressa possível, a substituição dos testes biológicos. |
|
(13) |
A carne separada mecanicamente produzida com técnicas que não alteram a estrutura dos ossos utilizados na produção da referida carne deve ser tratada de modo diferente da carne separada mecanicamente com técnicas que alteram a estrutura dos ossos. |
|
(14) |
A carne separada mecanicamente do tipo anterior produzida em condições específicas e de composição específica deve ser autorizada em preparados de carne que, claramente, não se destinem a ser consumidos sem serem primeiro submetidos a tratamento térmico. Estas condições estão ligadas, em particular, ao teor de cálcio da carne separada mecanicamente, o qual deve ser especificado em conformidade com o n.o 2 do artigo 11.o do Regulamento (CE) n.o 853/2004. Deve ser feito um ajustamento ao teor máximo de cálcio especificado fixado no presente regulamento assim que estiverem disponíveis informações detalhadas sobre as variações que ocorrem quando se utilizam diferentes tipos de matérias-primas. |
|
(15) |
O n.o 2, alínea f), do artigo 31.o do Regulamento (CE) n.o 882/2004 prevê que os Estados-Membros mantenham listas actualizadas dos estabelecimentos acreditados. Deve ser estabelecido um quadro comum para a apresentação das informações pertinentes aos outros Estados-Membros e ao público. |
|
(16) |
A secção XI do anexo III do Regulamento (CE) n.o 853/2004 fixa os requisitos que regulam a preparação de coxas de rã e de caracóis destinados ao consumo humano. Devem ser também estabelecidos requisitos específicos, incluindo modelos de certificados sanitários, para as importações de coxas de rã e de caracóis destinados ao consumo humano provenientes de países terceiros. |
|
(17) |
As secções XIV e XV do anexo III do Regulamento (CE) n.o 853/2004 fixam as regras relativas à produção e à colocação no mercado de gelatina e colagénio destinados ao consumo humano. Devem ser também estabelecidos requisitos específicos, incluindo modelos de certificados sanitários, para as importações de gelatina e colagénio e de matérias-primas para a produção de gelatina e colagénio destinados ao consumo humano provenientes de países terceiros. |
|
(18) |
Para que os alimentos com características tradicionais possam continuar a ser produzidos é necessário flexibilidade. Os Estados-Membros já concederam derrogações a uma vasta gama desses alimentos ao abrigo da legislação em vigor antes de 1 de Janeiro de 2006. Os operadores das empresas do sector alimentar devem poder continuar a aplicar sem interrupção, após essa data, as práticas existentes. Os Regulamentos (CE) n.o 852/2004, n.o 853/2004 e n.o 854/2004 prevêem um procedimento que permite aos Estados-Membros exercerem flexibilidade. No entanto, dado que, na maioria dos casos em que já foram concedidas derrogações, se trata apenas de continuar as práticas estabelecidas, a aplicação de um procedimento de notificação integral, incluindo uma análise completa dos riscos, pode constituir um encargo desnecessário e desproporcionado para os Estados-Membros. Por conseguinte, devem ser definidos alimentos com características tradicionais e estabelecidas condições gerais aplicáveis aos mesmos, em derrogação aos requisitos estruturais definidos no Regulamento (CE) n.o 852/2004, tendo devidamente em conta os objectivos de saúde alimentar. |
|
(19) |
Tendo sido adoptados antes da adesão de 1 de Maio de 2004, os Regulamentos (CE) n.o 853/2004 e n.o 854/2004 não faziam referência aos novos Estados-Membros. Por conseguinte, os códigos ISO para esses Estados-Membros e as abreviaturas para a Comunidade Europeia nas suas línguas devem ser acrescentados às disposições pertinentes desses regulamentos. |
|
(20) |
A secção I do anexo III do Regulamento (CE) n.o 853/2004 fixa as regras relativas à produção e colocação no mercado de carne de ungulados domésticos. As excepções à esfola completa da carcaça e outras partes do corpo destinadas ao consumo humano estão estabelecidas no ponto 8 do capítulo IV dessa secção. Devem ser previstas disposições para alargar estas excepções aos pés de bovinos adultos, desde que cumpram as mesmas condições aplicáveis aos pés dos vitelos. |
|
(21) |
Certas práticas podem induzir em erro o consumidor no que diz respeito à composição de determinados produtos. Sobretudo de forma a não decepcionar as expectativas do consumidor, deve ser proibida a venda, como carne fresca, de carne de aves de capoeira tratada com agentes de retenção de água. |
|
(22) |
O parecer da Autoridade Europeia para a Segurança dos Alimentos, adoptado em 30 de Agosto de 2004, demonstrou que os produtos da pesca pertencentes à família Gempylidae, em particular Ruvettus pretiosus e Lepidocybium flavobrunneum, podem ter efeitos gastrointestinais adversos se consumidos em certas condições. Os produtos da pesca pertencentes a esta família devem, por conseguinte, ser sujeitos a condições de comercialização. |
|
(23) |
A secção IX do anexo III do Regulamento (CE) n.o 853/2004 fixa regras de higiene específicas para o leite cru e os produtos lácteos. De acordo com a alínea e) do ponto 1 da parte II B do capítulo I, os líquidos para as tetas ou outros produtos de limpeza do úbere só podem ser utilizados se a autoridade competente os tiver aprovado. No entanto, a referida parte não prevê um regime de autorização pormenorizado. É portanto necessário, de modo a assegurar uma abordagem harmonizada pelos Estados-Membros, clarificar os procedimentos que devem reger a concessão dessas autorizações. |
|
(24) |
O Regulamento (CE) n.o 853/2004 requer que os operadores das empresas do sector alimentar assegurem que os tratamentos térmicos utilizados para a transformação de leite cru e dos produtos lácteos devem respeitar uma norma reconhecida internacionalmente. No entanto, devido à especificidade de certos tratamentos térmicos utilizados neste sector e ao seu impacto na segurança alimentar e na saúde animal, devem ser dadas aos operadores das empresas do sector alimentar orientações mais claras a este respeito. |
|
(25) |
O Regulamento (CE) n.o 853/2004 introduz uma nova definição que abrange produtos derivados de ovos que, após remoção da casca, ainda não foram transformados. É portanto necessário clarificar as regras aplicáveis a esses produtos e alterar em conformidade o capítulo II da secção X do anexo III do Regulamento (CE) n.o 853/2004. |
|
(26) |
A secção XIV do anexo III do Regulamento (CE) n.o 853/2004 fixa regras de higiene específicas para a gelatina. Essas regras incluem requisitos que abrangem o tipo de matérias-primas que podem ser utilizadas para produzir gelatina e o transporte e armazenagem dessas matérias. Também estabelecem especificações aplicáveis ao fabrico de gelatina. No entanto, também devem ser fixadas as regras aplicáveis à rotulagem de gelatina. |
|
(27) |
O progresso científico levou ao estabelecimento da norma ISO 16649-3 como método de referência acordado para a análise de E. Coli nos moluscos bivalves. O método de referência já foi estabelecido para os moluscos bivalves vivos das áreas A, em conformidade com o Regulamento (CE) n.o 2073/2005 da Comissão relativo ao critérios microbiológicos aplicáveis aos géneros alimentícios ( 7 ). Consequentemente, a norma ISO 16649-3 deve ser especificada como o método de referência NMP (número mais provável) para a análise de E. Coli nos moluscos bivalves originários também de áreas B e C. A utilização de métodos alternativos só deve ser permitida se estes forem considerados equivalentes ao método de referência. |
|
(28) |
Os Regulamentos (CE) n.o 853/2004 e n.o 854/2004 devem, pois, ser alterados em conformidade. |
|
(29) |
As medidas previstas no presente regulamento estão em conformidade com o parecer do Comité Permanente da Cadeia Alimentar e da Saúde Animal, |
ADOPTOU O PRESENTE REGULAMENTO:
Artigo 1.o
Requisitos respeitantes às informações relativas à cadeia alimentar para efeitos dos Regulamentos (CE) n.o 853/2004 e n.o 854/2004
Os requisitos respeitantes às informações relativas à cadeia alimentar, tal como se refere na secção III do anexo II do Regulamento (CE) n.o 853/2004 e na secção I, capítulo II, parte A, do anexo I do Regulamento (CE) n.o 854/2004, são estabelecidos no anexo I do presente regulamento.
Artigo 2.o
Requisitos respeitantes aos produtos da pesca para efeitos dos Regulamentos (CE) n.o 853/2004 e n.o 854/2004
Os requisitos respeitantes aos produtos da pesca, tal como se refere no n.o 9 do artigo 11.o do Regulamento (CE) n.o 853/2004 e nos n.o s 14 e 15 do artigo 18.o do Regulamento (CE) n.o 854/2004, são estabelecidos no anexo II do presente regulamento.
Artigo 3.o
Métodos de teste reconhecidos respeitantes às biotoxinas marinhas para efeitos dos Regulamentos (CE) n.o 853/2004 e n.o 854/2004
Os métodos de teste reconhecidos para detecção de biotoxinas marinhas, tal como se refere no n.o 4 do artigo 11.o do Regulamento (CE) n.o 853/2004 e no n.o 13, alínea a), do artigo 18.o do Regulamento (CE) n.o 854/2004, são os estabelecidos no anexo III do presente regulamento.
Artigo 4.o
Teor de cálcio de carne separada mecanicamente para efeitos do Regulamento (CE) n.o 853/2004
O teor de cálcio de carne separada mecanicamente, tal como se refere no n.o 2 do artigo 11.o do Regulamento (CE) n.o 853/2004, é o estabelecido no anexo IV do presente regulamento.
Artigo 5.o
Lista de estabelecimentos para efeitos do Regulamento (CE) n.o 882/2004
Os requisitos respeitantes às listas de estabelecimentos, tal como se refere no n.o 2, alínea f), do artigo 31.o do Regulamento (CE) n.o 882/2004, são estabelecidos no anexo V do presente regulamento.
Artigo 6.o
Modelos de certificados sanitários e de documentos para as importações de determinados produtos de origem animal para efeitos do Regulamento (CE) n.o 853/2004 e (CE) n.o 854/2004
1. Os modelos de certificados sanitários e de documentos, tal como se refere no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004, a utilizar aquando da importação de produtos de origem animal enumerados no anexo VI do presente regulamento, são estabelecidos nesse mesmo anexo.
2. O modelo de documento a assinar pelo comandante do navio, que pode substituir o documento exigido no artigo 14.o do Regulamento (CE) n.o 854/2004 aquando da importação de produtos da pesca directamente de um navio congelador, tal como disposto no n.o 3 do artigo 15.o desse regulamento, está estabelecido no anexo VI do presente regulamento.
Artigo 6.oA
Métodos de análise para o leite cru e o leite tratado termicamente
As autoridades competentes e, se for o caso, os operadores das empresas do sector alimentar devem utilizar os métodos analíticos indicados no anexo VI-A do presente regulamento para verificar o cumprimento dos limites estabelecidos na secção IX, capítulo I, parte III, do anexo III do Regulamento (CE) n.o 853/2004, bem como para assegurar que foi adequadamente aplicado um processo de pasteurização aos produtos lácteos, tal como referido na secção IX, capítulo II, parte II, do anexo III desse mesmo regulamento.
Artigo 6.o-B
Requisitos relativos aos controlos oficiais de inspecção da carne para efeitos do Regulamento (CE) n.o 854/2004
No anexo VI B estabelecem-se os requisitos relativos aos controlos oficiais de inspecção da carne.
Artigo 7.o
Derrogação ao Regulamento (CE) n.o 852/2004 relativamente aos alimentos com características tradicionais
1. Para efeitos do presente regulamento, por «alimentos com características tradicionais» entende-se os alimentos que, nos Estados-Membros onde são fabricados tradicionalmente, são:
a) Reconhecidos historicamente como produtos tradicionais; ou
b) Fabricados de acordo com referências técnicas codificadas ou registadas ao processo tradicional, ou de acordo com métodos de produção tradicionais; ou
c) Protegidos como produtos tradicionais por legislação comunitária, nacional, regional ou local.
2. Os Estados-Membros podem conceder aos estabelecimentos que fabricam alimentos com características tradicionais derrogações individuais ou gerais aos requisitos estabelecidos:
a) Na parte 1 do capítulo II do anexo II do Regulamento (CE) n.o 852/2004, no que se refere às instalações onde esses produtos estão expostos a um ambiente necessário ao desenvolvimento de parte das suas características. Essas instalações podem, nomeadamente, compreender paredes, tectos e portas que não sejam lisas, impermeáveis, não absorventes ou de materiais resistentes à corrosão e paredes, tectos e pavimentos geologicamente naturais;
b) Na parte 1, alínea f) do capítulo II e na parte 1 do capítulo V do anexo II do Regulamento (CE) n.o 852/2004, no que se refere ao tipo de materiais de que são feitos os instrumentos e o equipamento utilizados especificamente para a preparação, embalagem e acondicionamento desses produtos.
As medidas de limpeza e desinfecção das instalações referidas na alínea a), bem como a frequência com que são realizadas, devem ser adaptadas à actividade de forma a ter em conta a respectiva flora ambiente específica.
Os instrumentos e o equipamento referidos na alínea b) devem ser mantidos permanentemente num estado de higiene satisfatório e ser limpos e desinfectados regularmente.
3. Os Estados-Membros que concedem as derrogações previstas no n.o 2 devem notificar deste facto a Comissão e os outros Estados-Membros, o mais tardar 12 meses depois da concessão de derrogações individuais ou gerais. De cada notificação deve constar:
a) Uma curta descrição dos requisitos que foram adaptados;
b) A descrição dos géneros alimentícios e dos estabelecimentos em causa; e
c) Quaisquer outras informações relevantes.
Artigo 8.o
Alterações ao Regulamento (CE) n.o 853/2004
Os anexos II e III do Regulamento (CE) n.o 853/2004 são alterados em conformidade com o disposto no anexo VII do presente regulamento.
Artigo 9.o
Alterações ao Regulamento (CE) n.o 854/2004
Os anexos I, II e III do Regulamento (CE) n.o 854/2004 são alterados em conformidade com o anexo VIII do presente regulamento.
Artigo 10.o
Entrada em vigor e aplicabilidade
O presente regulamento entra em vigor no vigésimo dia seguinte ao da sua publicação no Jornal Oficial da União Europeia.
É aplicável a partir de 1 de Janeiro de 2006, excepto no que se refere aos capítulos II e III do anexo V, que são aplicáveis a partir de 1 de Janeiro de 2007.
O presente regulamento é obrigatório em todos os seus elementos e directamente aplicável em todos os Estados-Membros.
ANEXO I
INFORMAÇÕES RELATIVAS À CADEIA ALIMENTAR
SECÇÃO I
OBRIGAÇÕES DOS OPERADORES DAS EMPRESAS DO SECTOR ALIMENTAR
Os operadores das empresas do sector alimentar que criam animais destinados a expedição para abate devem assegurar que as informações relativas à cadeia alimentar referidas no Regulamento (CE) n.o 853/2004 são devidamente incluídas na documentação referente aos animais expedidos, de forma a que o operador responsável pelo matadouro em causa a elas tenha acesso.
SECÇÃO II
OBRIGAÇÕES DAS AUTORIDADES COMPETENTES
CAPÍTULO I
PRESTAÇÃO DE INFORMAÇÕES RELATIVAS À CADEIA ALIMENTAR
1. A autoridade competente no local de expedição deve comunicar ao operador expedidor do sector alimentar os elementos mínimos das informações relativas à cadeia alimentar a prestar ao matadouro, em conformidade com a secção III do anexo II do Regulamento (CE) n.o 853/2004.
a) Existe uma comunicação regular e eficaz de informações relativas à cadeia alimentar entre o operador do sector alimentar que criou ou manteve os animais antes da expedição e o operador responsável pelo matadouro;
b) As informações relativas à cadeia alimentar são válidas e fiáveis;
c) A exploração recebe em resposta, se for caso disso, as informações relevantes.
3. Quando os animais são expedidos para abate para outro Estado-Membro, as autoridades competentes do local de expedição e do local de abate devem cooperar para assegurar que as informações prestadas pelo operador expedidor do sector alimentar sejam facilmente acessíveis ao operador responsável pelo matadouro.
CAPÍTULO II
INFORMAÇÕES ENVIADAS À EXPLORAÇÃO DE ORIGEM
1. O veterinário oficial pode usar o modelo de documento incluído no apêndice I para registar os resultados de inspecção pertinentes que devem ser comunicados à exploração quando os animais tiverem sido criados antes do abate no mesmo Estado‐Membro, em conformidade com a secção II, capítulo I, do anexo I do Regulamento (CE) n.o 854/2004.
2. A autoridade competente é responsável por comunicar os resultados de inspecção pertinentes nos casos em que os animais são criados numa exploração noutro Estado‐Membro e deve usar uma versão do modelo de documento incluído no apêndice na língua do país de expedição e na língua do país de destino.
APÊNDICE ao anexo I
MODELO DE DOCUMENTO
|
1. |
Identificação |
||
|
1.1. |
exploração de origem (por exemplo, proprietário ou gerente) |
||
|
nome/número |
|||
|
endereço completo |
|||
|
número de telefone |
|||
|
1.2. |
números de identificação (anexar lista separada) |
||
|
número total de animais (por espécie) |
|||
|
problemas de identificação (se for o caso) |
|||
|
1.3. |
identificação do efectivo/do bando/da gaiola (se aplicável) |
||
|
1.4. |
espécie animal |
||
|
1.5. |
número de referência do certificado sanitário |
||
|
2. |
Resultados do exame ante mortem |
||
|
2.1. |
bem-estar |
||
|
número de animais afectados |
|||
|
tipo/classe/idade |
|||
|
observações (por exemplo, mordedura das caudas) |
|||
|
2.2. |
os animais foram entregues sujos |
||
|
2.3. |
constatações clínicas (doença) |
||
|
número de animais afectados |
|||
|
tipo/classe/idade |
|||
|
observações |
|||
|
data de inspecção |
|||
|
2.4. |
resultados laboratoriais () |
||
|
3. |
Resultados do exame post mortem |
||
|
3.1. |
constatações (macroscópicas) |
||
|
número de animais afectados |
|||
|
tipo/classe/idade |
|||
|
órgão ou parte do(s) animal(ais) afectados |
|||
|
data de abate |
|||
|
3.2. |
doença (podem ser usados códigos) () |
||
|
número de animais afectados |
|||
|
tipo/classe/idade |
|||
|
órgão ou parte do(s) animal(ais) afectados |
|||
|
carcaça parcialmente ou totalmente rejeitada (indicar a razão) |
|||
|
data de abate |
|||
|
3.3. |
resultados laboratoriais () |
||
|
3.4. |
outros resultados (por exemplo, parasitas, corpos estranhos, etc.) |
||
|
3.5. |
constatações de bem-estar (por exemplo, pernas partidas) |
||
|
4. |
Outras informações |
||
|
5. |
Contactos |
||
|
5.1. |
matadouro (número de aprovação) |
||
|
nome |
|||
|
endereço completo |
|||
|
número de telefone |
|||
|
5.2 |
endereço electrónico (se disponível) |
||
|
6. |
Veterinário oficial (imprimir o nome) |
||
|
assinatura e carimbo |
|||
|
7. |
Data |
||
|
8. |
Número de folhas anexas ao presente formulário |
||
|
(1) Microbiológicos, químicos, serológicos, etc. (anexar resultados). (2) As autoridades competentes podem introduzir os seguintes códigos: código A para as doenças constantes da lista do OIE; códigos B100 e B200 para questões de bem-estar (secção I, capítulo II, parte C, do anexo I do Regulamento (CE) n.o 854/2004) e C100 a C290 para decisões respeitantes à carne (secção II, capítulo V, ponto 1, alíneas a) a u), do anexo I do Regulamento (CE) n.o 854/2004). O sistema de codificação pode, se necessário, incluir mais subdivisões (p. ex., C141 para uma doença generalizada de gravidade média, C142 para uma doença mais grave, etc.). Se se utilizarem códigos, estes devem ser prontamente postos à disposição dos operadores das empresas do sector alimentar com uma explicação adequada quanto ao seu significado. (3) Microbiológicos, químicos, serológicos, etc. (anexar resultados). |
|||
ANEXO II
PRODUTOS DA PESCA
SECÇÃO I
OBRIGAÇÕES DOS OPERADORES DAS EMPRESAS DO SECTOR ALIMENTAR
A presente secção estabelece as regras pormenorizadas relacionadas com as inspecções visuais para detectar parasitas nos produtos da pesca.
CAPÍTULO I
DEFINIÇÕES
1. Por «parasita visível» entende-se um parasita ou um grupo de parasitas que tem uma dimensão, cor ou textura claramente distinguível dos tecidos do peixe.
2. Por «inspecção visual» entende-se o exame não destrutivo de peixes ou de produtos da pesca com ou sem meios ópticos de amplificação e em boas condições de iluminação para a visão humana, incluindo, se necessário, a transiluminação.
3. Por «transiluminação» entende-se, no que se refere a peixes chatos ou a filetes de peixe, observar o peixe contra uma fonte de iluminação numa sala escurecida para detectar parasitas.
CAPÍTULO II
INSPECÇÃO VISUAL
1. A inspecção visual deve ser efectuada num número representativo de amostras. As pessoas encarregadas dos estabelecimentos em terra e as pessoas qualificadas a bordo de navios-fábrica devem determinar a dimensão e a frequência das inspecções em função do tipo de produto da pesca, da sua origem geográfica e da sua utilização. Durante a produção, a inspecção visual dos peixes eviscerados deve ser realizada por pessoas qualificadas, na cavidade abdominal, nos fígados e nas ovas destinados ao consumo humano. Dependendo do sistema de evisceração utilizado, a inspecção visual deve ser realizada:
a) No caso de evisceração manual, de forma contínua pelo manipulador no momento da evisceração e lavagem;
b) No caso de evisceração mecânica, por amostragem efectuada num número representativo de amostras não inferior a 10 peixes por lote.
2. A inspecção visual dos filetes ou das postas de peixe deve ser realizada por pessoas qualificadas, no momento em que os peixes são aparados e depois da filetagem ou do corte das postas. Quando não for possível efectuar um exame individual devido ao tamanho dos filetes ou às operações de filetagem, deve ser elaborado um plano de amostragem que deve manter-se à disposição da autoridade competente em conformidade com a secção VIII, capítulo II, ponto 4, do anexo III do Regulamento (CE) n.o 853/2004. Sempre que, do ponto de vista técnico, a transiluminação dos filetes seja necessária, deverá ser incluída no plano de amostragem.
SECÇÃO II
OBRIGAÇÕES DAS AUTORIDADES COMPETENTES
CAPÍTULO I
VALORES-LIMITE DO AZOTO BÁSICO VOLÁTIL TOTAL (ABVT) PARA DETERMINADAS CATEGORIAS DE PRODUTOS DA PESCA E MÉTODOS DE ANÁLISE A UTILIZAR
1. Os produtos da pesca não transformados são considerados impróprios para consumo humano nos casos em que o exame organoléptico tenha suscitado dúvidas quanto à sua frescura e o controlo químico mostre que estão ultrapassados os seguintes limites de ABVT:
a) 25 mg de azoto/100 g de tecido muscular para as espécies referidas no ponto 1 do capítulo II;
b) 30 mg de azoto/100 g de tecido muscular para as espécies referidas no ponto 2 do capítulo II;
c) 35 mg de azoto/100 g de tecido muscular para as espécies referidas no ponto 3 do capítulo II;
d) 60 mg de azoto/100 g de produtos da pesca inteiros utilizados directamente na preparação de óleo de peixe para consumo humano referidos no segundo parágrafo do ponto 1 da parte B do capítulo IV da secção VIII do anexo III do Regulamento (CE) n.o 853/2004; contudo, sempre que a matéria-prima cumprir o disposto nas alíneas a), b) e c) da parte B, ponto 1, do mesmo capítulo, os Estados-Membros podem fixar limites superiores aplicáveis a determinadas espécies, na pendência do estabelecimento de legislação comunitária específica.
O método de referência a utilizar para o controlo dos limites de ABVT consiste na destilação de um extracto desproteinizado com ácido perclórico, como descrito no capítulo III.
2. A destilação referida no ponto 1 deve ser efectuada num aparelho conforme ao esquema que se apresenta no capítulo IV.
3. Os métodos de rotina utilizáveis para o controlo do valor-limite de ABVT são os seguintes:
— método de microdifusão descrito por Conway e Byrne (1933),
— método de destilação directa descrito por Antonacopoulos (1968),
— método de destilação de um extracto desproteinizado com ácido tricloroacético [Comité do Codex Alimentarius para o peixe e os produtos da pesca (1968)].
4. A amostra deve consistir em cerca de 100 g de tecido muscular, retirados de, pelo menos, três pontos diferentes e misturados por trituração.
Os Estados-Membros devem recomendar que os laboratórios oficiais utilizem, por rotina, o método de referência acima referido. Quando existirem dúvidas quanto aos resultados ou em caso de litígio em relação aos resultados da análise realizada por um dos métodos de rotina, só o método de referência pode ser utilizado para verificar os resultados.
CAPÍTULO II
CATEGORIAS DE ESPÉCIES PARA AS QUAIS SE ENCONTRAM ESTABELECIDOS VALORES-LIMITE DE ABVT
1. Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis.
2. Espécies que pertencem à família Pleuronectidae (à excepção do alabote: Hippoglossus spp.).
3. Salmo salar, espécies que pertencem à família Merluccidae, espécies que pertencem à família Gadidae.
CAPÍTULO III
DETERMINAÇÃO DA CONCENTRAÇÃO DE ABVT NO PEIXE E EM PRODUTOS DA PESCA
Procedimento de referência
1. Objectivo e âmbito de aplicação
O presente método descreve um procedimento de referência para a determinação da concentração de ABVT em peixe e produtos da pesca. O método é aplicável a concentrações de ABVT compreendidas entre 5 mg/100 g e, pelo menos, 100 mg/100 g.
2. Definição
Por «concentração de ABVT» entende-se o teor de azoto, sob a forma de bases azotadas voláteis, determinado pelo procedimento descrito.
A concentração será expressa em mg/100 g.
3. Descrição sumária
As bases azotadas voláteis são extraídas da amostra com uma solução de ácido perclórico a 0,6 mol. Após alcalinização, o extracto é submetido a destilação por arrastamento de vapor, sendo os componentes de base volátil absorvidos pelo ácido receptor. A concentração de ABVT é determinada por titulação das bases absorvidas.
4. Reagentes
Salvo indicação em contrário, devem utilizar-se reagentes de qualidade analítica. A água utilizada deve ser ou destilada ou desmineralizada e ter, pelo menos, o mesmo grau de pureza. Salvo indicação em contrário, por «solução» entende-se uma solução aquosa como se segue:
a) Solução de ácido perclórico = 6 g/100 ml;
b) Solução de hidróxido de sódio = 20 g/100 ml;
c) Solução-padrão de ácido clorídrico a 0,05 mol/l ((0,05 N);
|
Nota: |
caso se utilize um dispositivo de destilação automática, a titulação deve efectuar-se com uma solução-padrão de ácido clorídrico a 0,01 mol/l ((0,01 N). |
d) Solução de ácido bórico = 3 g/100 ml;
e) Agente antiespuma à base de silicone;
f) Solução de fenolftaleína = 1 g/100 ml em etanol a 95 %;
g) Solução indicadora (indicador misto de Tashiro) — dissolver 2 g de vermelho de metilo e 1 g de azul de metileno em 1 000 ml de etanol a 95 %.
5. Instrumentos e acessórios
a) Triturador de carne adequado para obter um triturado suficientemente homogéneo;
b) Misturador de alta velocidade funcionando entre 8 000 e 45 000 rotações por minuto;
c) Filtro de pregas de 150 mm de diâmetro, para filtração rápida;
d) Bureta de 5 ml, graduada em 0,01 ml;
e) Dispositivo de destilação por arrastamento de vapor. O dispositivo deve permitir a regulação de diversos fluxos de vapor e deve produzir um fluxo de vapor constante num determinado intervalo de tempo. Deve também impedir a fuga das bases livres resultantes da adição de substâncias alcalinizantes.
6. Procedimento
Aviso: O manuseamento de ácido perclórico, fortemente corrosivo, necessita de precauções e medidas de prevenção adequadas. As amostras devem ser preparadas, se viável, o mais depressa possível depois da sua recepção, em conformidade com as seguintes instruções:
a) Preparação da amostra
A amostra a analisar deve ser cuidadosamente triturada usando um triturador de carne do tipo descrito na alínea a) do ponto 5. Pesar com rigor, num recipiente adequado, 10 g +0,1 g de amostra triturada. Misturar com 90,0 ml da solução de ácido perclórico, como especificada na alínea a) do ponto 4, homogeneizar durante 2 minutos num misturador do tipo descrito na alínea b) do ponto 5 e filtrar.
O extracto assim obtido pode manter-se, durante pelo menos sete dias, a uma temperatura compreendida entre 2 oC e 6 oC, aproximadamente;
b) Destilação por arrastamento de vapor
Colocar 50,0 ml do extracto obtido em conformidade com a alínea a) num dispositivo de destilação por arrastamento de vapor, como descrito na alínea e) do ponto 5. A alcalinização do extracto é verificada mediante a adição de várias gotas de solução de fenolftaleína, como especificada na alínea f) do ponto 4. Depois de adicionar algumas gotas de agente antiespuma à base de silicone, iniciar destilação imediata adicionando 6,5 ml de solução de hidróxido de sódio, como especificada na alínea b) do ponto 4.
Regular o dispositivo de destilação de modo a obter cerca de 100 ml de destilado em 10 minutos. O tubo de saída é imerso num recipiente com 100 ml de solução de ácido bórico, como especificada na alínea d) do ponto 4, à qual se adicionaram três a cinco gotas de solução indicadora, como descrita na alínea g) do ponto 4. A destilação é concluída após exactamente 10 minutos, procedendo-se à remoção do tubo da solução receptora e à lavagem do mesmo com água. O teor de bases voláteis contidas na solução receptora é determinado por titulação com solução‐padrão de ácido clorídrico, como especificada na alínea c) do ponto 4.
O pH no ponto final deve ser 5,0+0,1;
c) Titulação
As análises devem ser efectuadas em duplicado. O método é considerado correcto se a diferença entre ambos os resultados não exceder 2 mg/100 g;
d) Ensaio em branco
Efectuar um ensaio em branco de acordo com o procedimento descrito na alínea b). Utilizar, em vez do extracto, 50,0 ml de solução de ácido perclórico, como especificada na alínea a) do ponto 4.
7. Cálculo do ABVT
A concentração de ABVT é calculada com base no resultado da titulação da solução receptora com ácido clorídrico, como descrito na alínea c) do ponto 4, utilizando a seguinte equação:
![]()
V1 = Volume de solução de ácido clorídrico a 0,01 mol utilizado na titulação da amostra, expresso em ml;
V0 = Volume de solução de ácido clorídrico a 0,01 mol utilizado no ensaio em branco, expresso em ml;
M = Peso da amostra, expresso em g.
Observações
1. As análises devem ser efectuadas em duplicado. O método aplicado é considerado correcto se a diferença entre ambos os resultados não exceder 2 mg/100 g.
2. Testar o equipamento mediante a destilação de soluções de NH4Cl com teor de azoto equivalente a 50 mg de ABVT/100 g.
3. Desvio-padrão da reprodutibilidade Sr = 1,20 mg/100 g. Desvio-padrão da repetibilidade SR = 2,50 mg/100 g.
CAPÍTULO IV
DISPOSITIVO DE DESTILAÇÃO POR ARRASTAMENTO DE VAPOR DO ABVT

ANEXO III
MÉTODOS DE ANÁLISE RECONHECIDOS PARA DETECTAR BIOTOXINAS MARINHAS
Os seguintes métodos analíticos devem ser usados pelas autoridades competentes para verificar o cumprimento dos limites fixados na secção VII, capítulo V, ponto 2, do anexo III do Regulamento (CE) n.o 853/2004 e, quando apropriado, pelos operadores das empresas do sector alimentar.
Em conformidade com os n.o s 2 e 3 do artigo 7.o da Directiva 86/609/CEE do Conselho ( 8 ), devem ser tidos em conta elementos de substituição, aperfeiçoamento e redução quando sejam utilizados métodos biológicos.
CAPÍTULO I
MÉTODO DE DETECÇÃO DAS TOXINAS PARALISANTES («PARALYTIC SHELLFISH POISON» — PSP)
1. O teor de toxinas paralisantes («paralytic shellfish poison» — PSP) das partes comestíveis dos moluscos (o corpo inteiro ou qualquer parte comestível separadamente) deve ser detectado em conformidade com o método de teste biológico ou com qualquer outro método reconhecido a nível internacional. O denominado método Lawrence também pode ser utilizado como método alternativo para a detecção das referidas toxinas, tal como publicado no método oficial 2005.06 (Paralytic Shellfish Poisoning Toxins in Shellfish) da AOAC.
2. Em caso de contestação dos resultados, o método de referência deverá ser o método biológico.
3. Os pontos 1 e 2 serão revistos uma vez completada com sucesso a harmonização das fases de aplicação do método Lawrence pelo laboratório comunitário de referência para as biotoxinas marinhas.
CAPÍTULO II
MÉTODO DE DETECÇÃO DAS TOXINAS AMNÉSICAS («AMNESIC SHELLFISH POISON» — ASP)
O teor total de toxinas amnésicas («amnesic shellfish poison» — ASP) das partes comestíveis dos moluscos (o corpo inteiro ou qualquer parte comestível separadamente) deve ser detectado utilizando o método de cromatografia líquida de alta resolução (HPLC) ou qualquer outro método reconhecido a nível internacional.
Todavia, pode também usar-se, para efeitos de rastreio, o método 2006.02 ASP ELISA, tal como publicado no Journal of AOAC de Junho de 2006, para a detecção do teor total de ASP nas partes comestíveis dos moluscos.
Em caso de contestação dos resultados, o método de referência deverá ser o método HPLC.
CAPÍTULO III
MÉTODOS DE DETECÇÃO DAS TOXINAS LIPOFÍLICAS
A. Metodologia química
1. O método LC-MS/MS do LR-UE é o método de referência a utilizar na detecção das toxinas marinhas referidas no anexo III, secção VII, capítulo V, ponto 2, alíneas c), d) e e), do Regulamento (CE) n.o 853/2004. Este método deve determinar, pelo menos, os seguintes compostos:
|
— |
toxinas do grupo do ácido ocadaico : OA, DTX1, DTX2, DTX3 e respectivos ésteres, |
|
— |
toxinas do grupo das pectenotoxinas : PTX1 e PTX2, |
|
— |
toxinas do grupo das iessotoxinas : YTX, 45 OH YTX, homo YTX e 45 OH homo YTX, |
|
— |
toxinas do grupo dos azaspirácidos : AZA1, AZA2 e AZA3. |
2. Deve calcular-se a equivalência da toxicidade total, utilizando os factores de toxicidade equivalente (TEF) recomendados pela AESA.
3. Caso sejam descobertos novos análogos significativos para a saúde pública, os mesmos devem ser incluídos na análise. Deve calcular-se a equivalência da toxicidade total utilizando os factores de toxicidade equivalente (TEF) recomendados pela AESA.
4. Podem utilizar-se, alternativa ou complementarmente ao método LC-MS/MS do LR-UE, outros métodos, como o método de cromatografia líquida (LC) associado à espectrometria de massa (MS), a cromatografia líquida de alta resolução (HPLC) com detecção adequada, os imunoensaios e os ensaios funcionais, como o ensaio de inibição de fosfatase, desde que:
a) Individualmente ou combinados, sejam capazes de detectar, pelo menos, os análogos identificados na parte A, ponto 1, do presente capítulo; devem definir-se, se necessário, critérios mais adequados;
b) Cumpram os critérios de desempenho estabelecidos para o método pelo LR-UE. Esses métodos devem ser validados intralaboratorialmente e apresentar resultados positivos em ensaios realizados no âmbito de um esquema reconhecido de testes de proficiência. O LR-UE deve apoiar as actividades conducentes à validação interlaboratorial da técnica, de modo a permitir uma normalização formal;
c) A sua aplicação proporcione um nível equivalente de protecção da saúde pública.
B. Métodos biológicos
1. Pode ainda utilizar-se, até 31 de Dezembro de 2014, um conjunto de procedimentos de bioensaio em ratos, que diferem na parte submetida a teste (hepato-pâncreas ou corpo inteiro) e nos solventes utilizados na extracção e purificação, na detecção das toxinas marinhas referidas no anexo III, secção VII, capítulo V, ponto 2, alíneas c), d) e e), do Regulamento (CE) n.o 853/2004, a fim de permitir que os Estados-Membros adaptem os seus métodos ao método LC-MS/MS definido na parte A, ponto 1, do presente capítulo.
2. A sensibilidade e a selectividade dependem da escolha dos solventes utilizados na extracção e na purificação, o que deve ser tido em consideração ao decidir-se sobre o método a utilizar, por forma a abranger toda a gama de toxinas.
3. Pode utilizar-se um único bioensaio, em ratos, recorrendo à extracção com acetona para detectar o ácido ocadaico, as dinofisistoxinas, os azaspirácidos, as pectenotoxinas e as iessotoxinas. Este ensaio pode ser complementado, se necessário, com uma operação de partição líquido-líquido com acetato de etilo/água ou diclorometano/água, a fim de remover potenciais interferentes.
4. Devem utilizar-se três ratos para cada teste. Se dois dos três ratos morrerem no prazo de 24 horas após a inoculação com um extracto equivalente a 5 g de hepato-pâncreas ou a 25 g de corpo inteiro, o resultado deve considerar-se positivo quanto à presença, a níveis superiores aos estabelecidos, de uma ou mais toxinas referidas no anexo III, secção VII, capítulo V, ponto 2, alíneas c), d) e e), do Regulamento (CE) n.o 853/2004.
5. Pode utilizar-se um bioensaio, em ratos, recorrendo à extracção com acetona seguido de uma operação de partição líquido-líquido com éter dietílico para detectar o ácido ocadaico, as dinofisistoxinas, as pectenotoxinas e os azaspirácidos, mas este bioensaio não pode utilizar-se para detectar as iessotoxinas, dado que podem ocorrer perdas destas toxinas durante a fase de partição. Devem utilizar-se três ratos para cada teste. Se dois dos três ratos morrerem no prazo de 24 horas após a inoculação com um extracto equivalente a 5 g de hepato-pâncreas ou a 25 g de corpo inteiro, o resultado deve considerar-se positivo quanto à presença de ácido ocadaico, dinofisistoxinas, pectenotoxinas e azaspirácidos a níveis superiores aos estabelecidos no anexo III, secção VII, capítulo V, ponto 2, alíneas c), e e), do Regulamento (CE) n.o 853/2004.
6. Pode utilizar-se um bioensaio, em ratazanas, para detectar o ácido ocadaico, as dinofisistoxinas e os azaspirácidos. Devem utilizar-se três ratazanas para cada teste. Uma reacção diarreica em qualquer uma das três ratazanas é considerada como um resultado positivo à presença de ácido ocadaico, dinofisistoxinas e azaspirácidos a níveis superiores aos estabelecidos no anexo III, secção VII, capítulo V, ponto 2, alíneas c), e e), do Regulamento (CE) n.o 853/2004.
|
C. |
Após o período estabelecido na parte B, ponto 1, do presente capítulo, deve utilizar-se o bioensaio em ratos apenas durante a monitorização periódica de zonas de produção e de afinação para detecção de toxinas marinhas novas ou desconhecidas, com base nos programas de controlo nacionais elaborados pelos Estados-Membros. |
ANEXO IV
TEOR DE CÁLCIO DA CARNE SEPARADA MECANICAMENTE
O teor de cálcio da carne separada mecanicamente como referido no Regulamento (CE) n.o 853/2004:
1. Não deve exceder 0,1% (= 100 mg/100 g ou 1 000 ppm) de produto fresco.
2. Deve ser determinado por um método normalizado internacional.
ANEXO V
LISTA DE ESTABELECIMENTOS ALIMENTARES APROVADOS
CAPÍTULO I
ACESSO ÀS LISTAS DE ESTABELECIMENTOS ALIMENTARES APROVADOS
A fim de ajudar os Estados-Membros a elaborar listas actualizadas de estabelecimentos alimentares aprovados, disponíveis aos outros Estados-Membros e ao público, a Comissão criará um sítio web no qual cada Estado-Membro incluirá uma ligação ao seu sítio web nacional.
CAPÍTULO II
FORMATO DOS SÍTIOS WEB NACIONAIS
A. Lista geral
1. Cada Estado-Membro dará à Comissão um endereço de ligação a um único sítio web nacional que contenha a lista geral das listas de estabelecimentos alimentares aprovados de produtos de origem animal como definidos no ponto 8.1 do anexo I do Regulamento (CE) n.o 853/2004.
2. A lista geral referida no ponto 1 deve ser constituída por uma folha e preenchida numa ou mais línguas oficiais da Comunidade.
B. Diagrama operacional
1. O sítio web que contém a lista geral será desenvolvido pela autoridade competente ou, se for o caso, por uma das autoridades competentes referidas no artigo 4.o do Regulamento (CE) n.o 882/2004.
2. A lista geral deve incluir ligações:
a) A outras páginas web localizadas no mesmo sítio web;
b) A sítios web geridos por outras autoridades competentes, unidades ou, se for o caso, organismos, caso certas listas de estabelecimentos alimentares aprovados não sejam mantidas pela autoridade competente referida no ponto 1.
CAPÍTULO III
MODELOS E CÓDIGOS PARA AS LISTAS DE ESTABELECIMENTOS APROVADOS
Devem ser estabelecidos modelos, com as informações pertinentes e os códigos, para assegurar uma ampla disponibilidade das informações referentes aos estabelecimentos alimentares aprovados e melhorar a legibilidade das listas.
CAPÍTULO IV
ESPECIFICAÇÕES TÉCNICAS
As tarefas e actividades referidas nos capítulos II e III devem ser realizadas em conformidade com as especificações técnicas publicadas pela Comissão.
ANEXO VI
MODELOS DE CERTIFICADOS SANITÁRIOS E DE DOCUMENTOS PARA AS IMPORTAÇÕES DE DETERMINADOS PRODUTOS DE ORIGEM ANIMAL
SECÇÃO I
CAPÍTULO I
COXAS DE RÃ E CARACÓIS
Os certificados sanitários referidos no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004 para as importações de coxas de rã e caracóis devem ser conformes aos modelos estabelecidos, respectivamente, na parte A e na parte B do apêndice I do presente anexo.
CAPÍTULO II
GELATINA
Sem prejuízo de outra legislação específica da União, em particular da legislação relativa às encefalopatias espongiformes transmissíveis e às hormonas, os certificados sanitários referidos no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004 para as importações de gelatina e de matérias-primas para a produção de gelatina devem ser conformes aos modelos estabelecidos, respectivamente, na parte A e na parte B do apêndice II do presente anexo.
CAPÍTULO III
COLAGÉNIO
Sem prejuízo de outra legislação específica da União, em particular da legislação relativa às encefalopatias espongiformes transmissíveis e às hormonas, os certificados sanitários referidos no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004 para as importações de colagénio e de matérias-primas para a produção de colagénio devem ser conformes aos modelos estabelecidos, respectivamente, na parte A e na parte B do apêndice III do presente anexo.
CAPÍTULO IV
PRODUTOS DA PESCA
O certificado sanitário referido no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004 para as importações de produtos da pesca deve ser conforme ao modelo estabelecido no apêndice IV do presente anexo.
CAPÍTULO V
MOLUSCOS BIVALVES VIVOS
O certificado sanitário referido no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004 para as importações de moluscos bivalves vivos deve ser conforme ao modelo estabelecido no apêndice V do presente anexo.
CAPÍTULO VI
MEL E OUTROS PRODUTOS DA APICULTURA
O certificado sanitário referido no n.o 1, alínea d), do artigo 6.o do Regulamento (CE) n.o 853/2004 para as importações de mel e outros produtos da apicultura deve ser conforme ao modelo estabelecido no apêndice VI do presente anexo.
SECÇÃO II
MODELO DE DOCUMENTO A ASSINAR PELO COMANDANTE DO NAVIO
O modelo de documento a assinar pelo comandante do navio, que pode substituir o documento exigido no artigo 14.o do Regulamento (CE) n.o 854/2004 aquando da importação de produtos da pesca directamente de um navio congelador, tal como disposto no n.o 3 do artigo 15.o desse regulamento, deve ser conforme ao modelo de documento estabelecido no apêndice VII do presente anexo.
Apêndice I do anexo VI
PARTE A
MODELO DE CERTIFICADO SANITÁRIO PARA IMPORTAÇÕES DE COXAS DE RÃ REFRIGERADAS, CONGELADAS OU PREPARADAS DESTINADAS AO CONSUMO HUMANO


PARTE B
MODELO DE CERTIFICADO SANITÁRIO PARA IMPORTAÇÕES DE CARACÓIS REFRIGERADOS, CONGELADOS, SEM CONCHA, COZINHADOS, PREPARADOS OU EM CONSERVA DESTINADOS AO CONSUMO HUMANO


Apêndice II do anexo VI
PARTE A
MODELO DE CERTIFICADO SANITÁRIO PARA AS IMPORTAÇÕES DE GELATINA DESTINADA AO CONSUMO HUMANO


PARTE B
MODELO DE CERTIFICADO SANITÁRIO PARA AS IMPORTAÇÕES DE MATÉRIAS-PRIMAS PARA A PRODUÇÃO DE GELATINA DESTINADA AO CONSUMO HUMANO


Apêndice III do anexo VI
PARTE A
MODELO DE CERTIFICADO SANITÁRIO PARA AS IMPORTAÇÕES DE COLAGÉNIO DESTINADO AO CONSUMO HUMANO


PARTE B
MODELO DE CERTIFICADO SANITÁRIO PARA AS IMPORTAÇÕES DE MATÉRIAS-PRIMAS PARA A PRODUÇÃO DE COLAGÉNIO DESTINADO AO CONSUMO HUMANO


Apêndice IV do anexo VI
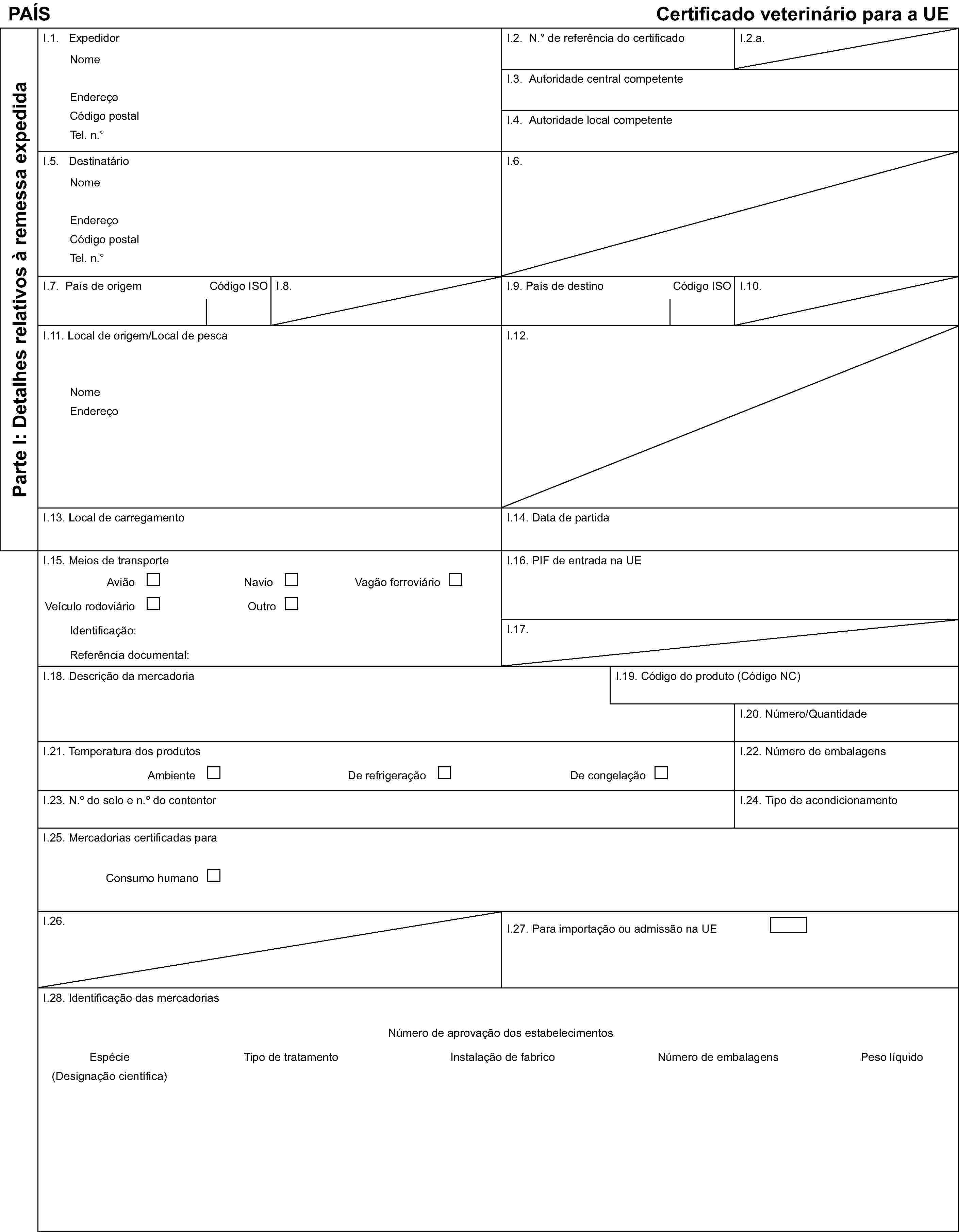
Modelo de certificado sanitário para as importações de produtos da pesca destinados ao consumo humano

Parte I: Detalhes relativos à remessa expedida
Certificado veterinário para a UE
I.1. Expedidor
Nome
Endereço
Tel.
I.2. Número de referência do certificado
I.2.a.
I.3. Autoridade central competente
I.4. Autoridade local competente
I.5. Destinatário
Nome
Endereço
Código postal
Tel.
I.6.
I.7. País de origem
Código ISO
I.8. Região de origem
Código
I.9. País de destino
Código ISO
I.10
I.11. Local de origem
Nome
Número de aprovação
Endereço
I.12.
I.13. Local de carregamento
I.14. Data da partida
I.15. Meios de transporte
Avião
Navio
Vagão ferroviário
Veículo rodoviário
Outro
Identificação
Referência documental
I.16. PIF de entrada na UE
I.17.
I.18. Descrição da mercadoria
I.19. Código do produto (Código SH)
I.20. Quantidade
I.21. Temperatura dos produtos
Ambiente
De refrigeração
De congelação
I.22. Número de embalagens
I.23. Número do selo/do contentor
I.24. Tipo de embalagem
I.25. Mercadorias certificadas para:
Consumo humano
I.26.
I.27. Para importação ou admissão na UE
I.28. Identificação das mercadorias
Espécie
(designação científica)
Natureza da mercadoria
Tipo de tratamento
Número de aprovação do estabelecimento
Instalação de fabrico
Número de embalagens
Peso líquido



Apêndice V do anexo VI
PARTE A
MODELO DE CERTIFICADO SANITÁRIO PARA AS IMPORTAÇÕES DE MOLUSCOS BIVALVES, EQUINODERMES, TUNICADOS E GASTRÓPODES MARINHOS VIVOS DESTINADOS AO CONSUMO HUMANO



PARTE B
MODELO DE ATESTADO SANITÁRIO ADICIONAL PARA MOLUSCOS BIVALVES TRANSFORMADOS DA ESPÉCIE ACANTHOCARDIA TUBERCULATUM
O inspector oficial certifica que os moluscos bivalves transformados da espécie Acanthocardia tuberculatum, objecto do certificado sanitário com o n.o de referência:….
1. Foram colhidos em zonas de produção claramente identificadas, controladas e autorizadas pela autoridade competente para efeitos da Decisão 2006/766/CE da Comissão ( 9 ), e onde o teor de toxina PSP nas partes comestíveis dos moluscos é inferior a 300 μg por 100 g.
2. Foram transportados em contentores ou veículos selados pela autoridade competente, directamente para o estabelecimento:
…
…
(nome e número de aprovação oficial do estabelecimento especialmente autorizado pela autoridade competente a realizar o tratamento).
3. Durante o transporte para este estabelecimento, foram acompanhados por um documento emitido pela autoridade competente que autoriza o transporte e atesta a natureza e quantidade do produto, a zona de origem e o estabelecimento de destino.
4. Foram submetidos ao tratamento térmico definido no anexo da Decisão 96/77/CE.
5. Não contêm um teor de toxina PSP detectável pelo método do bioensaio, tal como demonstrado pelo(s) relatório(s) analítico(s), em anexo, dos testes realizados a cada um dos lotes que constituem a remessa abrangida pelo presente atestado.
O inspector oficial certifica que a autoridade competente verificou que os «autocontrolos sanitários» implementados no estabelecimento referido no ponto 2 são especificamente aplicados ao tratamento térmico referido no ponto 4.
O abaixo assinado, inspector oficial, declara ter conhecimento das disposições fixadas pela Decisão 96/77/CE e que o(s) relatório(s) analítico(s) em anexo corresponde(m) aos testes realizados aos produtos após a sua transformação.
|
Inspector oficial |
|
|
Nome (em maiúsculas): Data: Carimbo: |
Qualificações e cargo: Assinatura: |
Apêndice VI do anexo VI
MODELO DE CERTIFICADO SANITÁRIO PARA AS IMPORTAÇÕES DE MEL E OUTROS PRODUTOS DA APICULTURA DESTINADOS AO CONSUMO HUMANO

Apêndice VII do anexo VI
MODELO DE DOCUMENTO, A ASSINAR PELO COMANDANTE DO NAVIO, QUE ACOMPANHA OS PRODUTOS DA PESCA CONGELADOS QUANDO IMPORTADOS DIRECTAMENTE PARA A UNIÃO EUROPEIA A PARTIR DE UM NAVIO CONGELADOR



ANEXO VI-A
MÉTODOS DE ANÁLISE PARA O LEITE CRU E O LEITE TRATADO TERMICAMENTE
CAPÍTULO I
DETERMINAÇÃO DA CONTAGEM EM PLACAS E DA CONTAGEM DE CÉLULAS SOMÁTICAS
1. Para efeitos de verificação dos critérios estabelecidos na secção IX, capítulo I, parte III, do anexo III do Regulamento (CE) n.o 853/2004, devem ser aplicadas como métodos de referência as seguintes normas:
a) EN/ISO 4833 para a contagem em placas a 30oC;
b) ISO 13366-1 para a contagem das células somáticas.
2. É aceitável a utilização de métodos analíticos alternativos:
a) Para a contagem em placas a 30oC, quando os métodos são validados em função do método de referência mencionado na alínea a) do ponto 1, em conformidade com o protocolo indicado na norma EN/ISO 16140 ou outros protocolos semelhantes internacionalmente aceites.
Em particular, a relação de conversão entre um método alternativo e o método de referência mencionado na alínea a) do ponto 1 é estabelecida em conformidade com a norma ISO 21187;
b) Para a contagem de células somáticas, quando os métodos são validados em função do método de referência mencionado na alínea b) do ponto 1, em conformidade com o protocolo indicado na norma ISO 8196 e quando são realizados de acordo com a norma ISO 13366-2 ou outros protocolos semelhantes internacionalmente aceites.
CAPÍTULO II
DETERMINAÇÃO DA ACTIVIDADE DA FOSFATASE ALCALINA
1. Ao determinar a actividade da fosfatase alcalina, deve aplicar-se como método de referência a norma ISO 11816-1.
2. A actividade de fosfatase alcalina é expressa em miliunidades de actividade enzimática por litro (mU/l). Uma unidade de actividade da fosfatase alcalina é a quantidade de enzima fosfatase alcalina que cataliza a transformação de um micromole de substrato por minuto.
3. Um teste de fosfatase alcalina é considerado negativo se a actividade medida no leite da vaca não for superior a 350 mU/l.
4. A utilização de métodos analíticos alternativos é aceitável quando os métodos são validados em função do método de referência mencionado no ponto 1, em conformidade com protocolos aceites internacionalmente.
ANEXO VI B
REQUISITOS APLICÁVEIS AOS CONTROLOS OFICIAIS DE INSPECÇÃO DA CARNE
|
1. |
Para efeitos do presente anexo, entende-se por: a) «Condições de habitação controladas e sistemas de produção integrada»: um tipo de pecuária em que os animais são permanentemente mantidos em condições conformes com os critérios definidos no apêndice; b) «Bovino jovem»: um bovino, macho ou fêmea, de idade inferior a oito meses; c) «Ovino jovem»: um ovino, macho ou fêmea, que não apresente um incisivo permanente que tenha perfurado a gengiva e de idade inferior a 12 meses; d) «Caprino jovem»: um caprino, macho ou fêmea, de idade inferior a seis meses; e) «Efectivo»: animal ou conjunto de animais mantidos numa exploração, como unidade epidemiológica; se existir mais do que um efectivo numa exploração, cada um dos efectivos presentes constitui uma unidade epidemiológica distinta; f) «Exploração»: qualquer estabelecimento, construção ou, no caso de uma exploração agrícola ao ar livre, qualquer local situado no território de um Estado-Membro, em que os animais sejam alojados, mantidos ou manuseados; g) «Estabelecimento que efectua, de forma descontínua, actividades de abate ou de manuseamento de caça»: um matadouro ou um estabelecimento de manuseamento de caça, designado pela autoridade competente com base numa análise dos riscos, no qual, especificamente, as actividades de abate ou de manuseamento de caça não se realizam durante uma jornada de trabalho completa ou ao longo de dias úteis consecutivos. |
|
2. |
Inspecções post mortem em estabelecimentos que efectuam, de forma descontínua, actividades de abate ou de manuseamento de caça.
|
|
3. |
Requisitos aplicáveis a uma inspecção da carne sem incisão baseada nos riscos. ▼M8 —————
|
|
4. |
Requisitos adicionais para o exame post mortem de solípedes.
|
Apêndice ao anexo VI B
Para efeitos do presente anexo, por «condições de habitação controladas e sistemas de produção integrada» entende-se que o operador da empresa do sector alimentar deve cumprir os critérios enunciados infra:
a) Todos os alimentos para animais provêm de uma instalação que produz esses alimentos em conformidade com os requisitos previstos nos artigos 4.o e 5.o do Regulamento (CE) n.o 183/2005 do Parlamento Europeu e do Conselho ( 10 ); se os animais forem alimentados com forragens ou vegetais cultivados, estes devem ser adequadamente tratados e, sempre que possível, secos e/ou granulados;
b) Sempre que possível, deve aplicar-se um sistema «tudo-dentro-tudo-fora». Quando forem integrados animais no efectivo, devem manter-se em isolamento pelo tempo estipulado pelos serviços veterinários, a fim de evitar a introdução de doenças;
c) Nenhum animal tem acesso a instalações ao ar livre, a menos que o operador da empresa do sector alimentar possa demonstrar, através de uma análise dos riscos, a contento da autoridade competente, que o período, as instalações e as circunstâncias do acesso ao ar livre não representam um perigo de introdução de doenças no efectivo;
d) Estão disponíveis informações pormenorizadas sobre os animais, desde o nascimento até ao abate, e sobre as condições da sua gestão, tal como previsto na secção III do anexo II do Regulamento (CE) n.o 853/2004;
e) Se os animais dispuserem de material de cama, é evitada a presença ou a introdução de doenças mediante um tratamento adequado desse material;
f) O pessoal da exploração respeita as disposições gerais em matéria de higiene tal como previstas no anexo I do Regulamento (CE) n.o 852/2004;
g) Estão em vigor procedimentos de controlo do acesso às instalações onde se encontram os animais;
h) A exploração não dispõe de instalações para o turismo ou o campismo, a menos que o operador da empresa do sector alimentar possa demonstrar, através de uma análise dos riscos, a contento da autoridade competente, que as instalações estão suficientemente separadas das unidades de criação de animais de modo a impossibilitar qualquer contacto directo ou indirecto entre humanos e animais;
i) Os animais não têm acesso a lixeiras nem ao lixo doméstico;
j) Está em vigor um plano de gestão e controlo de pragas;
k) Os animais não são alimentados com silagem, a menos que o operador da empresa do sector alimentar possa demonstrar, através de uma análise dos riscos, a contento da autoridade competente, que esses alimentos não representam qualquer perigo para os animais;
l) Não são libertados para as zonas acessíveis aos animais quaisquer efluentes ou sedimentos de unidades de tratamento de águas residuais nem são usados como fertilizantes de culturas destinadas à alimentação dos animais, a menos que sejam adequadamente tratados, a contento da autoridade competente.
ANEXO VII
ALTERAÇÕES AO REGULAMENTO (CE) N.o 853/2004
Os anexos II e III do Regulamento (CE) n.o 853/2004 são alterados da seguinte forma:
1. A secção I, parte B, do anexo II é alterada do seguinte modo:
a) O segundo parágrafo do ponto 6 passa a ter a seguinte redacção:
«BE, CZ, DK, DE, EE, GR, ES, FR, IE, IT, CY, LV, LT, LU, HU, MT, NL, AT, PL, PT, SI, SK, FI, SE e UK.»;
b) O ponto 8 passa a ter a seguinte redacção:
«8. Quando aplicada num estabelecimento situado na Comunidade, a marca deve ser de forma oval e incluir a abreviatura CE, EC, EF, EG, EK, EY, ES, EÜ, EK, EB ou WE.».
2. O anexo III é alterado do seguinte modo:
a) No capítulo IV da secção I, o ponto 8 passa a ter a seguinte redacção:
«8. As carcaças e outras partes do corpo destinadas ao consumo humano devem ser completamente esfoladas, excepto no caso dos suínos, das cabeças dos ovinos, caprinos e vitelos e dos pés dos bovinos, ovinos e caprinos. As cabeças e os pés devem ser manuseados de forma a evitar a contaminação.»;
b) Na secção II, é aditado o seguinte capítulo VII:
«CAPÍTULO VII: AGENTES DE RETENÇÃO DE ÁGUA
Os operadores das empresas do sector alimentar devem assegurar que a carne de aves de capoeira que foi tratada especificamente para promover a retenção de água não seja colocada no mercado como carne fresca, mas como preparados de carne ou para utilização na produção de produtos transformados.»;
c) Na secção VIII, capítulo V, parte E, o ponto 1 passa a ter a seguinte redacção:
«1. Não deverão ser colocados no mercado os produtos da pesca derivados de peixes venenosos das seguintes famílias: Tetraodontidae, Molidae, Diodontidae e Canthigasteridae. Os produtos da pesca frescos, preparados e transformados pertencentes à família Gempylidae, em especial Ruvettus pretiosus e Lepidocybium flavobrunneum, só podem ser colocados no mercado acondicionados ou embalados e devem ser adequadamente rotulados de modo a fornecer informações ao consumidor sobre as formas de preparar/cozinhar e sobre o risco relacionado com a presença de substâncias com efeitos gastrointestinais adversos. O nome científico deve acompanhar o nome comum no rótulo.»;
d) A secção IX é alterada do seguinte modo:
i) No capítulo I (II) (B) (1), a alínea e) passa a ter a seguinte redacção:
«e) Os líquidos ou aerossóis para as tetas só são utilizados após autorização ou registo em conformidade com os procedimentos estabelecidos na Directiva 98/8/CE do Parlamento Europeu e do Conselho, de 16 de Fevereiro de 1998, relativa à colocação de produtos biocidas no mercado ( 11 ).
ii) No capítulo II (II), o ponto 1 passa a ter a seguinte redacção:
«1. Sempre que o leite cru ou um produto lácteo seja submetido a um tratamento térmico, os operadores das empresas do sector alimentar devem assegurar que ele satisfaz os requisitos estabelecidos no capítulo XI do anexo II do Regulamento (CE) n.o 852/2004. Em particular, devem assegurar que, ao utilizar os processos a seguir indicados, cumprem as especificações mencionadas:
a) A pasteurização é realizada através de um tratamento que implica:
i) uma temperatura elevada durante um curto período (pelo menos 72 oC durante 15 segundos),
ii) uma temperatura baixa durante um longo período (pelo menos 63 oC durante 30 minutos), ou
iii) qualquer combinação de condições de tempo e temperatura para obter um efeito equivalente,
de modo a que os produtos mostrem, se for o caso, uma reacção negativa a um teste de fosfatase alcalina imediatamente após tal tratamento;
b) O tratamento a temperatura ultra-elevada (UHT) é realizado por um tratamento:
i) que implica o aquecimento em fluxo contínuo a alta temperatura durante um curto período (não inferior a 135 oC, em combinação com um tempo de retenção adequado) por forma a que nenhum microrganismo ou esporo viáveis sejam capazes de crescer no produto tratado quando mantido num recipiente asséptico fechado a temperatura ambiente, e
ii) suficiente para assegurar que os produtos se mantêm estáveis do ponto de vista microbiológico depois de incubarem durante 15 dias a 30 oC em recipientes fechados ou durante 7 dias a 55 oC em recipientes fechados, ou depois de submetidos a qualquer outro método que demonstre que foi aplicado o tratamento térmico adequado.»;
e) Na secção X, o capítulo II é alterado do seguinte modo:
i) Na parte III, o ponto 5 passa a ter a seguinte redacção:
«5. Depois de partidos os ovos, todas as partículas do ovo líquido devem ser submetidas, tão rapidamente quanto possível, a uma transformação destinada a eliminar riscos microbiológicos ou a reduzi-los para um nível aceitável. Os lotes cuja transformação tenha sido insuficiente devem ser submetidos imediatamente a uma nova transformação no mesmo estabelecimento, na condição de o novo tratamento os tornar próprios para consumo humano. Caso se verifique que um lote é impróprio para consumo humano, deve ser desnaturado por forma a assegurar-se que não é utilizado para esse fim.»;
ii) Na parte V, o ponto 2 passa a ter a seguinte redacção:
«2. No caso dos ovos líquidos, o rótulo referido no ponto 1 deve também ostentar a seguinte indicação: «ovos líquidos não pasteurizados — a tratar no local de destino» e mencionar a data e a hora a que os ovos foram partidos.»;
f) Na secção XIV, é aditado o seguinte capítulo V:
«CAPÍTULO V: ROTULAGEM
O acondicionamento e as embalagens que contenham gelatina devem ostentar a expressão «gelatina própria para consumo humano» e mencionar a data de preparação.».
ANEXO VIII
ALTERAÇÕES AO REGULAMENTO (CE) N.o 854/2004
Os anexos I, II e III do Regulamento (CE) n.o 854/2004 são alterados do seguinte modo:
1. A secção I, capítulo III, ponto 3, do anexo I é alterada do seguinte modo:
a) O segundo parágrafo da alínea a) passa a ter a seguinte redacção:
«BE, CZ, DK, DE, EE, GR, ES, FR, IE, IT, CY, LV, LT, LU, HU, MT, NL, AT, PL, PT, SI, SK, FI, SE e UK.»;
b) A alínea c) passa a ter a seguinte redacção:
«c) Quando aplicada num matadouro situado na Comunidade, a marca deve incluir a abreviatura CE, EC, EF, EG, EK, EY, ES, EÜ, EK, EB ou WE.».
2. No capítulo II, parte A, do anexo II, os pontos 4 e 5 passam a ter a seguinte redacção:
«4. A autoridade competente pode classificar como pertencendo à classe B as zonas a partir das quais os moluscos bivalves vivos podem ser colhidos e colocados no mercado para consumo humano unicamente após tratamento num centro de depuração ou após afinação, de modo a cumprir as regras sanitárias referidas no ponto 3. Os moluscos bivalves vivos provenientes dessas zonas não devem exceder 4 600E. Coli por 100 gramas de tecido muscular e líquido intra-valvar. O método de referência para esta análise é o teste do número mais provável (NMP) de 5 tubos e 3 diluições especificado na norma ISO 16649-3. Podem ser utilizados métodos alternativos se tiverem sido validados com base neste método de referência em conformidade com os critérios da norma EN/ISO 16140.
5. A autoridade competente pode classificar como pertencendo à classe C as zonas a partir das quais os moluscos bivalves vivos podem ser colhidos e colocados no mercado unicamente após afinação durante um período prolongado, de modo a cumprir as regras sanitárias referidas no ponto 3. Os moluscos bivalves vivos provenientes dessas zonas não devem exceder 46 000E. Coli por 100 gramas de tecido muscular e líquido intra-valvar. O método de referência para esta análise é o teste do número mais provável (NMP) de 5 tubos e 3 diluições especificado na norma ISO 16649-3. Podem ser utilizados métodos alternativos se tiverem sido validados com base neste método de referência em conformidade com os critérios da norma EN/ISO 16140.».
3. No capítulo II, parte G, do anexo III, o ponto 1 passa a ter a seguinte redacção:
«1. Não deverão ser colocados no mercado os produtos da pesca derivados de peixes venenosos das seguintes famílias: Tetraodontidae, Molidae, Diodontidae e Canthigasteridae. Os produtos da pesca frescos, preparados e transformados pertencentes à família Gempylidae, em especial Ruvettus pretiosus e Lepidocybium flavobrunneum, só podem ser colocados no mercado acondicionados ou embalados e devem ser adequadamente rotulados de modo a fornecer informações ao consumidor sobre as formas de preparar/cozinhar e sobre o risco relacionado com a presença de substâncias com efeitos gastrointestinais adversos. O nome científico deve acompanhar o nome comum no rótulo.».
( 1 ) JO L 139 de 30.4.2004, p. 1 (Rectificação: JO L 226 de 25.6.2004, p. 3).
( 2 ) JO L 139 de 30.4.2004, p. 55 (Rectificação: JO L 226 de 25.6.2004, p. 22).
( 3 ) JO L 139 de 30.4.2004, p. 206 (Rectificação: JO L 226 de 25.6.2004, p. 83).
( 4 ) JO L 165 de 30.4.2004, p. 1 (Rectificação: JO L 191 de 28.5.2004, p. 1).
( 5 ) Ainda não publicada no Jornal Oficial..
( 6 ) JO L 157 de 30.4.2004, p. 33 (Rectificação: JO L 195 de 2.6.2004, p. 12.
( 7 ) Ver página 1 deste Jornal Oficial.
( 8 ) JO L 358 de 18.12.1986, p. 1.
( 9 ) Ver página 53 do presente Jornal Oficial.
( 10 ) JO L 35 de 8.2.2005, p. 1.
( 11 ) JO L 123 de 24.04.1998, p. 1.»;


