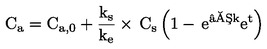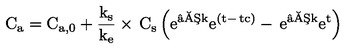|
10)
|
São aditados os capítulos C.27, C.28, C.29 e C.30:
«C.27. ENSAIO DE TOXICIDADE EM QUIRONOMÍDEOS NUM SISTEMA SEDIMENTOS-ÁGUA COM SEDIMENTOS ENRIQUECIDOS
INTRODUÇÃO
|
1.
|
O presente método de ensaio é equivalente ao Test Guideline TG 218 da OCDE (2004). Foi concebido para avaliar os efeitos nas larvas dos dípteros de água doce Chironomus sp., que vivem nos sedimentos, de uma exposição prolongada a determinados produtos químicos. Baseia-se nos atuais protocolos de ensaios de toxicidade para as espécies Chironomus riparius e Chironomus tentans que foram desenvolvidos na Europa (1)(2)(3) e na América do Norte (4)(5)(6)(7)(8) e foram sujeitos a um ensaio interlaboratorial (1)(6)(9). Pode também utilizar-se outras espécies de quironomídeos bem documentadas, como a Chironomus yoshimatsui (10)(11).
|
|
2.
|
O cenário de exposição utilizado neste método de ensaio passa pelo enriquecimento dos sedimentos na substância em estudo. A seleção do cenário de exposição adequado depende da finalidade do ensaio. A adição da substância em estudo aos sedimentos tem por objetivo simular a acumulação de produtos químicos persistentes nos sedimentos. Este sistema de exposição utiliza um sistema de ensaio sedimentos-água no qual os sedimentos foram enriquecidos no produto químico em estudo.
|
|
3.
|
As substâncias a ensaiar com organismos que vivem nos sedimentos persistem, em geral, neste compartimento durante longos períodos. A exposição dos referidos organismos pode ter lugar por várias vias. A importância relativa de cada via de exposição, bem como o tempo de contribuição de cada uma delas para os efeitos tóxicos globais, depende das propriedades físico-químicas do produto químico em causa. No caso de substâncias fortemente adsorventes (por exemplo, com log Kow > 5) ou de substâncias ligadas aos sedimentos por ligações covalentes, a ingestão de alimentos contaminados pode constituir uma via de exposição significativa. Para não subestimar a toxicidade das substâncias altamente lipófilas, pode ponderar-se a utilização de alimentos adicionados aos sedimentos antes da aplicação da substância em estudo. De forma a ter em conta todas as vias de exposição potenciais, o presente método de ensaio focaliza-se na exposição a longo prazo. A duração do ensaio é de 20 a 28 dias para C. riparius e C. yoshimatsui e de 28 a 65 dias para C. tentans. Se forem necessários dados a curto prazo para uma finalidade específica (por exemplo, para investigar os efeitos de um produto químico), é possível utilizar replicados adicionais, a remover após dez dias.
|
|
4.
|
Os parâmetros medidos são o número total de indivíduos adultos emergidos e o tempo necessário para tal. Se forem necessários dados adicionais a curto prazo, recomenda-se que as determinações da sobrevivência e do crescimento das larvas apenas sejam efetuadas após um período de dez dias, recorrendo aos replicados adicionais que se justifiquem.
|
|
5.
|
Recomenda-se a utilização de sedimentos formulados. Estes apresentam várias vantagens relativamente aos sedimentos naturais:
|
—
|
a variabilidade experimental é reduzida porque os sedimentos constituem uma matriz "normalizada" reprodutível, eliminando-se a necessidade de encontrar fontes de sedimentos limpos e não contaminados,
|
|
—
|
os ensaios podem ser iniciados em qualquer momento, eliminando-se assim a variabilidade sazonal dos sedimentos ensaiados, não havendo necessidade de pré-tratar os sedimentos para remover a fauna indígena; a utilização de sedimentos formulados reduz também o custo associado à colheita no terreno de quantidades suficientes de sedimentos para os ensaios de rotina,
|
|
—
|
a utilização de sedimentos formulados permite ainda efetuar comparações de toxicidade e classificar as substâncias em conformidade.
|
|
|
6.
|
Definem-se no apêndice 1 alguns conceitos utilizados.
|
PRINCÍPIO DO MÉTODO
|
7.
|
São expostas larvas de quironomídeos do primeiro estádio larvar a uma gama de concentrações do produto químico em estudo em sistemas sedimentos-água. Os sedimentos são enriquecidos na substância em estudo, sendo as larvas do primeiro estádio larvar subsequentemente introduzidas em copos de ensaio nos quais as concentrações de sedimentos e da água foram estabilizadas. A emergência de quironomídeos e as respetivas taxas de desenvolvimento são medidas no final do ensaio. Se necessário, a sobrevivência e o peso das larvas podem também ser determinados decorridos 10 dias, utilizando os replicados adicionais que se justifiquem. Os dados são analisados por recurso a um modelo de regressão, de forma a estimar a concentração que causaria uma redução de x% na emergência, na sobrevivência ou no crescimento das larvas (por exemplo, CE15, CE50, etc.), ou utilizando hipóteses estatísticas, para determinar o NOEC/LOEC. Este último método exige a comparação de valores que produzem efeitos com valores de controlo, por recurso a testes estatísticos.
|
INFORMAÇÕES SOBRE A SUBSTÂNCIA EM ESTUDO
|
8.
|
Devem ser conhecidas a solubilidade em água e a pressão de vapor da substância em estudo, bem como a partição nos sedimentos medida ou calculada e a estabilidade na água e nos sedimentos. Para a quantificação da substância em estudo na água sobrenadante, na água dos poros e nos sedimentos, deve dispor-se de um método analítico fiável, com exatidão e limite de deteção conhecidos e documentados. A fórmula estrutural e o grau de pureza da substância constituem igualmente informações úteis. O comportamento químico da substância em estudo (p. ex.: dissipação, degradação abiótica ou biótica, etc.) é também uma informação importante. Para mais orientações sobre o ensaio de substâncias cujas propriedades físico-químicas dificultam a realização dos ensaios, consultar a referência bibliográfica (12).
|
PRODUTOS QUÍMICOS DE REFERÊNCIA
|
9.
|
Pode testar-se periodicamente produtos químicos de referência com o objetivo de garantir a fiabilidade do protocolo e das condições de ensaio. As seguintes substâncias constituem exemplos de substâncias tóxicas de referência utilizadas com êxito em ensaios interlaboratoriais e em estudos de validação: lindano, trifluralina, pentaclorofenol, cloreto de cádmio e cloreto de potássio (1)(2)(5)(6)(13).
|
VALIDADE DO ENSAIO
|
10.
|
Um ensaio é considerado válido se forem cumpridas as seguintes condições:
|
—
|
a emergência nos controlos deve ser de, pelo menos, 70 % no final do ensaio (1)(6),
|
|
—
|
a emergência de indivíduos adultos das espécies C. riparius e C. yoshimatsui nos recipientes de controlo deve ocorrer 12 a 23 dias após a inserção destas espécies nos recipientes; no caso da C. tentans, é necessário um período de 20 a 65 dias,
|
|
—
|
no final do ensaio, devem determinar-se o pH e a concentração de oxigénio dissolvido em cada recipiente. A concentração de oxigénio deve ser de, pelo menos, 60 % do valor da saturação com ar (VSA) à temperatura utilizada e o pH da água sobrenadante deve estar compreendido entre 6 e 9, em todos os recipientes de ensaio,
|
|
—
|
a temperatura da água não deve variar mais de ± 1,0 °C. Esta temperatura pode ser controlada numa sala isotérmica, caso em que a temperatura ambiente deve ser confirmada a intervalos adequados.
|
|
DESCRIÇÃO DO MÉTODO
Recipientes de ensaio
|
11.
|
O estudo é realizado em copos de vidro de 600 ml, com 8 cm de diâmetro. Pode utilizar-se outros recipientes, devendo contudo assegurar-se uma espessura adequada da água sobrenadante e dos sedimentos. A superfície dos sedimentos deve proporcionar 2 a 3 cm2 por cada larva. O rácio entre a espessura da camada de sedimentos e a espessura da água sobrenadante deve ser de 1:4. Os recipientes de ensaio e o restante equipamento que entre em contacto com o sistema de ensaio devem ser exclusivamente de vidro ou de outro material quimicamente inerte (p. ex. Teflon).
|
Seleção das espécies
|
12.
|
A espécie a utilizar de preferência no ensaio é a Chironomus riparius. A espécie Chironomus tentans também é adequada, mas é mais difícil de manipular e exige um período de ensaio mais longo. Pode igualmente utilizar-se a Chironomus yohimatsui. O apêndice 2 apresenta informações sobre os métodos de cultura de Chironomus riparius. Estão também disponíveis informações sobre as condições de cultura das espécies Chironomus tentans (4) e Chironomus yoshimatsui (11). A identidade das espécies deve ser confirmada antes do ensaio, exceto no caso de organismos provenientes de uma cultura interna do laboratório.
|
Sedimentos
|
13.
|
Devem ser utilizados, de preferência, sedimentos formulados (também chamados sedimentos reconstituídos, artificiais ou sintéticos). Contudo, se forem utilizados sedimentos naturais, estes devem ser caracterizados (pelo menos pH e teor de carbono orgânico, recomendando-se a determinação de outros parâmetros, tais como a razão C/N e a granulometria) e devem estar isentos de qualquer contaminação e de outros organismos que possam competir com os quironomídeos ou consumi-los. Recomenda-se igualmente que, antes de ser utilizados num ensaio de toxicidade em quironomídeos, os sedimentos naturais sejam acondicionados durante sete dias em condições semelhantes às do ensaio subsequente. Recomenda-se que sejam utilizados no presente ensaio (1)(15)(16) sedimentos formulados com a seguinte composição, baseada na do solo artificial utilizado no método C.8 (14):
|
a)
|
4-5 % (massa seca) de turfa: pH tão próximo quanto possível do intervalo 5,5-6,0; é importante utilizar turfa em pó, finamente moída (granulometria das partículas ≤ 1 mm), unicamente seca ao ar;
|
|
b)
|
20 % (massa seca) de argila caulinítica, de preferência com teor de caulinite superior a 30 %;
|
|
c)
|
75-76 % (massa seca) de areia quartzítica, com predominância de areia fina com mais de 50 % de partículas de granulometria compreendida entre 50 e 200 μm;
|
|
d)
|
A quantidade de água desionizada necessária para que o teor de humidade da mistura final se situe na gama 30-50 %;
|
|
e)
|
A quantidade de carbonato de cálcio (CaCO3) quimicamente puro necessária para ajustar o pH da mistura final dos sedimentos a 7,0 ± 0,5. O teor de carbono orgânico da mistura final deve ser de 2 % ± 0,5 %, devendo ser ajustado por recurso a quantidades adequadas de turfa e areia, em conformidade com as alíneas a) e c).
|
|
|
14.
|
As origens da turfa, da argila caulinítica e da areia devem ser conhecidas. Deve verificar-se a ausência de contaminação química (p. ex., metais pesados, compostos organoclorados, compostos organofosforados, etc.) nos componentes dos sedimentos. No apêndice 3, apresenta-se um exemplo de preparação de sedimentos formulados. Uma mistura de componentes secos também é aceitável caso se demonstre que, após a adição da água sobrenadante, não ocorre separação de componentes dos sedimentos (por exemplo, partículas de turfa flutuantes) e que a turfa ou os sedimentos estão suficientemente acondicionados.
|
Água
|
15.
|
Qualquer água com as características químicas de uma água de diluição aceitável enunciadas nos apêndices 2 e 4 é adequada para o ensaio. Para a cultura e o ensaio, pode utilizar-se qualquer água adequada, água natural (superficial ou subterrânea), água reconstituída (ver o apêndice 2) ou água da rede de abastecimento desclorada, desde que os quironomídeos nela sobrevivam durante todo o período de cultura e de ensaio sem evidenciarem sinais de stress. No início do ensaio, o pH da água de ensaio deve estar compreendido entre 6 e 9 e a dureza total da água, expressa em CaCO3, não deve exceder 400 mg/l. No entanto, caso se suspeite de uma interação entre os iões responsáveis pela dureza e a substância em estudo, deve utilizar-se uma água de dureza inferior (nessa eventualidade, o meio Elendt M4 não pode ser utilizado). Deve utilizar-se o mesmo tipo de água em todo o estudo. As características de qualidade da água enumeradas no apêndice 4 devem ser determinadas pelo menos duas vezes por ano, ou sempre que se suspeite que tenham mudado significativamente.
|
Soluções-mãe — sedimentos enriquecidos
|
16.
|
O enriquecimento dos sedimentos na concentração escolhida é geralmente efetuado por adição direta de uma solução da substância em estudo. Com o auxílio de um moinho de rolos ou de um misturador de alimentos, ou manualmente, adiciona-se aos sedimentos formulados uma solução-mãe da substância em estudo, dissolvida em água desionizada. Se a substância for pouco solúvel em água, pode ser dissolvida num volume tão baixo quanto possível de um solvente orgânico adequado (por exemplo, hexano, acetona ou clorofórmio). Seguidamente, esta solução é misturada com 10 g de areia quartzítica fina por recipiente de ensaio. Deixa-se evaporar o solvente até à sua eliminação total da areia; adiciona-se, então, esta à quantidade adequada de sedimentos por cada copo de ensaio. Para solubilizar, dispersar ou emulsionar a substância em estudo apenas podem utilizar-se agentes de fácil volatilização. Ao preparar os sedimentos, importa ter em conta a areia associada à substância em estudo e a mistura de areia (ou seja, utiliza-se menos areia na preparação dos sedimentos). Deve ter-se o cuidado de assegurar que a substância em estudo adicionada aos sedimentos se encontra total e uniformemente distribuída nestes. Se necessário, podem analisar-se subamostras, a fim de determinar o grau de homogeneidade.
|
PLANEAMENTO DO ENSAIO
|
17.
|
O planeamento do ensaio consiste na escolha do número e dos intervalos das concentrações de ensaio, do número de recipientes para cada concentração e do número de larvas por recipiente. Descreve-se de seguida o método de estimativa dos pontos CE e do NOEC, bem como de realização de ensaios do limite.
|
Análise por regressão
|
18.
|
As concentrações testadas no ensaio deverão incluir as concentrações às quais se observam efeitos (por exemplo, CE15 e CE50) e abranger a gama de concentrações para as quais o efeito da substância em estudo é significativo. De modo geral, é possível melhorar a exatidão e, em especial, a validade das estimativas das concentrações que produzem efeitos (CEx) se essas concentrações se situarem na gama de concentrações ensaiadas. Devem evitar-se extrapolações muito abaixo da concentração positiva mais baixa ou acima da concentração mais elevada. É útil efetuar um ensaio exploratório preliminar para a escolha da gama de concentrações a utilizar no ensaio (ver o ponto 27).
|
|
19.
|
Caso se pretenda estimar uma CEx, devem ser utilizados, pelo menos, cinco concentrações e três replicados de cada concentração. Em qualquer caso, para obter uma boa estimativa, é aconselhável ensaiar um número suficiente de concentrações. O fator entre as concentrações não deve ser superior a dois (se a curva de resposta à dose tiver um declive reduzido). Pode reduzir-se o número de replicados de cada concentração se for aumentado o número de concentrações de ensaio com respostas diferentes. O aumento do número de replicados ou a redução dos intervalos entre concentrações produz, em geral, intervalos de confiança mais estreitos. Caso se pretenda estimar a sobrevivência e o crescimento das larvas a 10 dias, é necessário utilizar mais replicados.
|
Estimativa de NOEC/LOEC
|
20.
|
Caso se pretenda estimar o NOEC ou o LOEC, devem ensaiar-se cinco concentrações com, pelo menos, quatro replicados, não devendo o fator entre as concentrações ser superior a dois. O número de replicados deverá ser suficiente para garantir a possibilidade estatística de detetar de forma adequada uma diferença de 20 % relativamente ao controlo, com um grau de significância de 5 % (p = 0,05). No respeitante às taxas de desenvolvimento, é geralmente adequada uma análise de variância (ANOVA), como o teste de Dunnett ou o teste de Williams (17)(18)(19)(20). Quanto à taxa de emergência, podem utilizar-se os testes de Cochran-Armitage, o teste exato de Fisher (com a correção de Bonferroni) ou o teste de Mantel-Haentzal.
|
Ensaio do limite
|
21.
|
Caso não sejam detetados efeitos no ensaio exploratório preliminar de seleção das concentrações, pode proceder-se a um ensaio do limite (uma concentração de ensaio e uma de controlo). O objetivo consiste em realizar um ensaio numa concentração suficientemente elevada para permitir aos decisores excluir a possibilidade de efeitos tóxicos da substância em estudo, sendo o limite fixado a uma concentração cuja ocorrência não se prevê em caso algum. Recomenda-se a utilização de 1 000 mg/kg (massa seca). Em geral, são necessários, pelo menos, seis replicados dos organismos expostos e de controlo. Deve comprovar-se existir a possibilidade estatística de detetar de forma adequada uma diferença de 20 % relativamente ao controlo, com um grau de significância de 5 % (p = 0,05). No que respeita ao efeito nas taxas de desenvolvimento e na massa, o teste t é um método estatístico adequado se os dados cumprirem os requisitos do teste (normalidade e variâncias homogéneas). Se estes requisitos não forem preenchidos, pode utilizar-se um teste t de variância desigual ou um teste não paramétrico, como o de Wilcoxon-Mann-Whithey. No que respeita à taxa de emergência, o teste exato de Fisher é adequado.
|
PROCEDIMENTO
Condições de exposição
Preparação do sistema sedimentos enriquecidos-água
|
22.
|
Na aplicação da substância em estudo, recomenda-se o procedimento de enriquecimento descrito no método de ensaio C.8: "Toxicidade em relação às minhocas" (14). Coloca-se nos recipientes os sedimentos enriquecidos, adicionando-se água sobrenadante de forma a obter uma razão volúmica sedimentos-água de 1:4 (ver os pontos 11 e 15). A espessura da camada de sedimentos deve situar-se na gama 1,5-3 cm. Para evitar a separação de componentes dos sedimentos e a ressuspensão de materiais finos durante a criação da coluna de água, os sedimentos podem ser cobertos, enquanto a água é vertida, com um disco de plástico que se remove imediatamente depois. Podem também utilizar-se outros dispositivos.
|
|
23.
|
Os recipientes de ensaio devem ser cobertos (por exemplo, com placas de vidro). Se necessário, o nível inicial de água pode ser reposto durante o ensaio, para compensar a evaporação. Para tal, deve utilizar-se água destilada ou desionizada, de modo a evitar a acumulação de sais.
|
Estabilização
|
24.
|
Quando estiverem preparados os sedimentos enriquecidos e a fase aquosa sobrenadante, é conveniente permitir a partição da substância em estudo entre a fase aquosa e os sedimentos (3)(4)(6)(13). A partição deve ocorrer, de preferência, às condições de temperatura e arejamento utilizadas no ensaio. O tempo necessário para atingir o equilíbrio depende dos sedimentos e do produto químico, podendo variar de algumas horas a vários dias e mesmo, em casos raros, a 4 ou 5 semanas. Dado que, nesse período, muitos produtos químicos são passíveis de sofrer degradação, não se espera até o equilíbrio total ser alcançado, recomendando-se a adoção de um período de equilíbrio de 48 horas. No final deste período, deve medir-se a concentração da substância em estudo na água sobrenadante, na água dos poros e nos sedimentos, pelo menos no caso da concentração máxima e de uma concentração menor (ver o ponto 38). Estas determinações analíticas da substância em estudo permitem o cálculo do balanço de massas e a expressão dos resultados com base nas concentrações medidas.
|
Introdução dos organismos em estudo
|
25.
|
Quatro a cinco dias antes da introdução dos organismos em estudo nos recipientes de ensaio, devem colher-se aglomerados de ovos das culturas e colocá-los em pequenos recipientes com o meio de cultura. Pode utilizar-se meio proveniente da cultura-mãe ou um meio recentemente preparado. Neste último caso, importa adicionar ao meio de cultura uma pequena quantidade de alimentos, como, por exemplo, algas verdes e/ou algumas gotas de filtrado de uma suspensão de alimento para peixes finamente moído (ver o apêndice 2). Apenas devem ser utilizados aglomerados de ovos de postura recente. Normalmente, as larvas começam a eclodir alguns dias após a postura dos ovos (2 a 3 dias, a 20 °C, no caso das Chironomus riparius, e 1 a 4 dias no caso das Chironomus tentans, a 23 °C, e das Chironomus yoshimatsui, a 25 °C); o crescimento das larvas ocorre em quatro estádios larvares, cada um com a duração de 4 a 8 dias. Utilizar no ensaio larvas do primeiro estádio larvar (2-3 ou 1-4 dias após a eclosão). O estádio larvar dos insetos pode, eventualmente, ser verificado por exame da largura da cápsula cefálica (6).
|
|
26.
|
Com o auxílio de uma pipeta embotada, coloca-se aleatoriamente vinte larvas do primeiro estádio larvar em cada recipiente de ensaio contendo os sedimentos enriquecidos e a água. O arejamento da água tem de ser suspenso durante a colocação das larvas nos recipientes de ensaio, assim permanecendo nas 24 horas subsequentes a esta operação (ver os pontos 25 e 32). Consoante o tipo de ensaio realizado (ver os pontos 19 e 20), o número de larvas por concentração deve ser, no mínimo, de 60, no caso de estimativas de pontos CE, e de 80, no caso das determinações de NOEC.
|
Concentrações de ensaio
|
27.
|
Pode ser útil efetuar um ensaio exploratório para a determinação da gama de concentrações a utilizar no ensaio definitivo. Para o efeito, recorre-se a uma série de concentrações espaçadas da substância em estudo. Garantindo que a densidade de quironomídeos por unidade de superfície seja idêntica à utilizada no ensaio definitivo, os quironomídeos são expostos a cada concentração da substância em estudo por um período que permita uma estimativa das concentrações de ensaio adequadas, não sendo necessários replicados.
|
|
28.
|
As concentrações a utilizar no ensaio definitivo são decididas com base nos resultados do ensaio exploratório. Devem ser utilizadas pelo menos cinco concentrações, selecionadas do modo descrito nos pontos 18 a 20.
|
Controlos
|
29.
|
Deve utilizar-se no ensaio um número adequado de recipientes de controlo sem a substância em estudo, mas com os sedimentos (ver os pontos 19-20). Caso se recorra a um solvente para a incorporação da substância em estudo (ver o ponto 16), deve efetuar-se um controlo utilizando sedimentos com solvente.
|
Sistema de ensaio
|
30.
|
São utilizados sistemas estáticos. Em casos excecionais, pode utilizar-se sistemas semiestáticos ou sistemas de escoamento com renovação intermitente ou contínua da água sobrenadante, por exemplo, se as características de qualidade da água se tornarem inadequadas ao organismo em estudo ou afetarem o equilíbrio químico (isto é, se os teores de oxigénio dissolvido baixarem demasiado, se a concentração de produtos de excreção aumentar demasiado, se ocorrer lixiviação de minerais dos sedimentos que afete o pH e/ou dureza da água, etc.). Deve preferir-se, contudo, o recurso a outros métodos para melhorar a qualidade da água sobrenadante, como o arejamento, que é, em geral, suficiente.
|
Alimentação
|
31.
|
É necessário alimentar as larvas, de preferência diariamente ou, no mínimo, três vezes por semana. Utilizar alimento para peixes (suspensão em água ou finamente moído, por exemplo, Tetra-Min or Tetra-Phyllou; ver pormenores no apêndice 2); a quantidade de 0,25-0,5 mg (0,35-0,5 mg no caso de C. yoshimatsui) por larva e dia afigura-se adequada para as larvas jovens, nos primeiros 10 dias. Após este período, pode ser necessária uma quantidade ligeiramente superior: 0,5-1 mg por larva e dia deve bastar para o resto do ensaio. A ração alimentar deve ser reduzida a todos os organismos expostos e aos controlos caso se observe crescimento fúngico ou se verifique mortalidade nos controlos. Se não for possível impedir o crescimento fúngico, deve repetir-se o ensaio. Quando se estuda substâncias fortemente adsorventes (por exemplo, com log Kow > 5) ou substâncias ligadas aos sedimentos por ligações covalentes, a quantidade de alimentos necessária para assegurar a sobrevivência e o crescimento natural dos organismos pode ser adicionada aos sedimentos formulados, antes do período de estabilização. Para esse fim, devem ser utilizados matérias vegetais em vez de alimentos para peixes; a título de exemplo, 0,5 % (massa seca) de folhas finamente moídas de espécies como a urtiga comum (Urtica dioeca), a amoreira (Morus alba), o trevo branco (Trifolium repens), o espinafre (Spinacia oleracea) ou outras matérias de origem vegetal (Cerophyl ou α-celulose).
|
Condições de incubação
|
32.
|
O arejamento ligeiro da água sobrenadante nos recipientes de ensaio deve iniciar-se, de preferência, 24 horas após a introdução das larvas, prosseguindo ao longo de todo o ensaio (deve evitar-se que a concentração de oxigénio dissolvido baixe para valores inferiores a 60 % do VSA). O arejamento é efetuado por intermédio de uma pipeta de Pasteur de vidro, fixada 2-3 cm acima da camada de sedimentos (caudal: uma ou poucas bolhas por segundo). No ensaio de produtos químicos voláteis, pode optar-se por não arejar o sistema sedimentos-água.
|
|
33.
|
O ensaio é realizado a temperatura constante (20 °C ± 2 °C). No caso das espécies C. tentans e C. yoshimatsui, as temperaturas recomendadas são 23 °C e 25 °C (± 2 °C), respetivamente. Utiliza-se um período de irradiação de 16 horas, com uma intensidade luminosa de 500 a 1 000 lux.
|
Duração da exposição
|
34.
|
A exposição começa com a introdução das larvas nos recipientes enriquecidos e nos recipientes de controlo. A duração máxima da exposição é de 28 dias para a C. riparius e a C. yoshimatsui e de 65 dias para a C. tentans. Se os insetos emergirem precocemente, pode pôr-se termo ao ensaio, no mínimo, cinco dias após a emergência do último indivíduo adulto nos recipientes de controlo.
|
Observações
Emergência
|
35.
|
Determina-se o tempo de desenvolvimento e o número total de insetos machos e fêmeas totalmente emergidos. Os machos são facilmente identificados pelas suas antenas plumosas.
|
|
36.
|
Os recipientes de ensaio devem ser observados pelo menos três vezes por semana, a fim de apreciar visualmente qualquer comportamento anormal (por exemplo, saída dos sedimentos, natação anormal) em relação aos recipientes de controlo. Durante o período de emergência previsto, é necessário proceder à contagem diária dos insetos emergidos. O sexo e o número de insetos totalmente emergidos são registados diariamente. Após a identificação, remove-se os insetos dos recipientes. Quaisquer aglomerados de ovos postos antes do termo do ensaio devem ser registados e, de seguida, removidos, para evitar a reintrodução de larvas nos sedimentos. Regista-se também o número de ninfas visíveis que não emergiram. O apêndice 5 contém orientações sobre a mensuração da emergência.
|
Crescimento e sobrevivência
|
37.
|
Se for necessário obter dados sobre a sobrevivência e o crescimento das larvas em dez dias, devem prever-se recipientes de ensaio suplementares desde o início, para que possam ser utilizados posteriormente. Os sedimentos destes recipientes são passados por um crivo com abertura de malha de 250 μm, para reter as larvas. Os critérios de morte são a imobilidade e a ausência de reação a estímulos mecânicos. As larvas não recuperadas devem também ser contadas como mortas (as larvas que morreram no início do ensaio podem ter sido degradadas por micróbios). Determina-se a massa seca, isenta de cinzas, de larvas sobreviventes em cada recipiente de ensaio, calculando-se a massa seca média por recipiente. É útil determinar o estádio larvar das larvas sobreviventes; para tal, pode recorrer-se à medição da largura da cápsula cefálica de cada indivíduo.
|
Determinações analíticas
Concentração da substância em estudo
|
38.
|
Antes do início do ensaio (isto é, da introdução das larvas), procede-se à colheita de amostras da massa de sedimentos de, pelo menos, um recipiente por exposição, para a determinação analítica da concentração da substância em estudo. Recomenda-se que sejam analisadas, no início (ver o ponto 24) e no final do ensaio, no mínimo, amostras da água sobrenadante, da água dos poros e dos sedimentos correspondentes à concentração mais elevada e a uma concentração inferior. Estas determinações da concentração da substância em estudo proporcionam informações sobre o comportamento e/ou a partição da mesma no sistema água-sedimentos.
|
|
39.
|
Quando se efetuam medições intermédias (por exemplo, no 7.o dia) e a análise necessita de amostras grandes que não podem ser colhidas dos recipientes de ensaio sem influenciar o sistema em estudo, as determinações analíticas devem ser realizadas com amostras colhidas de recipientes de ensaio suplementares tratados da mesma forma (incluindo a presença dos organismos em estudo), mas que não são alvo de observações biológicas.
|
|
40.
|
A centrifugação a cerca de 10 000 g e 4 oC, durante 30 minutos, é o procedimento recomendado para isolar a água intersticial. No entanto, caso se demonstre que a substância em estudo não é adsorvida aos filtros, a filtragem também é aceitável. Em alguns casos, se a amostra for demasiado pequena, poderá não ser possível analisar concentrações na água dos poros.
|
Parâmetros físico-químicos
|
41.
|
O pH e a temperatura dos recipientes de ensaio devem ser medidos de forma adequada (ver o ponto 10). A dureza e o ião amónio devem ser medidos nos recipientes de controlo e num recipiente de ensaio com a concentração mais elevada, no início e no final do ensaio.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
42.
|
O objetivo deste ensaio consiste em determinar o efeito da substância em estudo nas taxas de desenvolvimento e no número total de insetos machos e fêmeas totalmente emergidos ou, no caso dos ensaios de 10 dias, os efeitos na sobrevivência e no peso das larvas. Se não houver indicação de sensibilidades estatisticamente diferentes entre os sexos, os resultados relativos aos machos e às fêmeas podem ser agrupados para efeitos de análise estatística. As diferenças de sensibilidade entre os sexos podem ser avaliadas estatisticamente, por exemplo, recorrendo a um ensaio de tabela de contingência χ2-r x 2. Se necessário, determina-se a sobrevivência das larvas e a massa seca por recipiente após 10 dias.
|
|
43.
|
As concentrações com efeitos, expressas em relação à massa seca, são calculadas de preferência a partir das concentrações medidas nos sedimentos no início do ensaio (ver o ponto 38).
|
|
44.
|
Para efetuar uma estimativa pontual do valor CE50 ou de qualquer valor CEx, podem equiparar-se os dados estatísticos por recipiente aos de ensaios idênticos reais. No cálculo de um intervalo de confiança para qualquer valor CEx, importa ter em conta a variabilidade entre recipientes, ou deve demonstrar-se que essa variabilidade é tão reduzida que pode ser ignorada. Se o modelo for ajustado pelo método dos mínimos quadrados, deve aplicar-se uma transformação aos dados estatísticos por recipiente, para melhorar a homogeneidade da variância. Contudo, os valores de CEx só devem ser calculados após retransformação da resposta no valor inicial.
|
|
45.
|
Se a análise estatística tiver por objetivo determinar o NOEC/LOEC utilizando hipóteses estatísticas, importa ter em conta a variabilidade entre recipientes, por exemplo, aplicando um método ANOVA hierarquizado. Se não se verificarem os pressupostos comuns do método ANOVA, testes mais robustos podem constituir uma alternativa adequada (21).
|
Taxa de emergência
|
46.
|
As taxas de emergência são dados de "tudo ou nada", que podem ser analisados através de um teste de Cochran-Armitage aplicado de forma regressiva, nos casos em que se prevê uma relação monótona entre a dose fornecida e a resposta e os dados são compatíveis com a previsão. Caso contrário, pode recorrer-se a um teste exato de Fisher ou a um teste de Mantel-Haentzal com valores p ajustados segundo o método de Bonferroni-Holm. Se, para a mesma concentração, houver indícios de uma maior variabilidade entre replicados do que a sugerida por uma distribuição binomial (frequentemente referida como variação "extrabinomial"), deve utilizar-se um teste exato de Fisher ou um teste de Cochran-Armitage robusto, como proposto na referência 21.
Determina-se a soma dos insetos emergidos por recipiente, ne, que é seguidamente dividida pelo número de larvas nele introduzidas, na:

em que:
|
ER
|
=
|
Taxa de emergência
|
|
ne
|
=
|
Número de insetos emergidos no recipiente
|
|
na
|
=
|
Número de larvas introduzidas no recipiente
|
|
|
47.
|
Uma alternativa mais adequada a amostras grandes, quando se regista variância extrabinomial, consiste em considerar a taxa de emergência uma resposta contínua e aplicar procedimentos como o teste de William, caso se preveja uma relação monótona entre a dose fornecida e a resposta, compatível com os dados de taxa de emergência em causa. Por seu turno, o teste de Dunnett é adequado aos casos em que não se regista uma relação monótona. Neste contexto, uma amostra "grande" é definida como aquela em que o número total de insetos emergidos e não emergidos é, em ambos os casos, superior a cinco por replicado (recipiente).
|
|
48.
|
A aplicação de métodos ANOVA implica que os valores de taxa de emergência sejam sujeitos a uma transformação de arco-seno da raiz quadrada ou a uma transformação de Tukey-Freeman, de forma a obter uma distribuição aproximadamente normal e uniformizar as variâncias. Os testes de Cochran-Armitage, exato de Fisher (Bonferroni) e Mantel-Haentzal podem ser aplicados quando se utilizam frequências absolutas. A transformação de arco-seno da raiz quadrada consiste em calcular o inverso do seno (sin-1) da raiz quadrada do valor da taxa de emergência.
|
|
49.
|
No respeitante às taxas de emergência, os valores de CEx são calculados por análise de regressão – por exemplo, por recurso aos modelos probit (22), logit ou Weibull ou a programas informáticos comerciais adequados. Em caso de fracasso da análise de regressão (por exemplo, se o número de respostas parciais for inferior a dois), utilizam-se outros métodos não paramétricos, como a média móvel ou a simples interpolação.
|
Taxa de desenvolvimento
|
50.
|
O tempo médio de desenvolvimento representa o tempo médio decorrido entre a introdução das larvas (dia 0 do ensaio) e a emergência da coorte experimental de insetos (para o cálculo do tempo de desenvolvimento real, é necessário ter em conta a idade das larvas no momento da introdução). A taxa de desenvolvimento é o inverso do tempo de desenvolvimento (unidade: 1/dia) e representa a quantidade de desenvolvimento larvar que ocorre por dia. A taxa de desenvolvimento é o parâmetro preferido para a avaliação destes estudos de toxicidade dos sedimentos, dado que a sua variância é mais baixa que a do tempo de desenvolvimento, sendo também mais homogénea e mais próxima da distribuição normal. Os testes paramétricos mais potentes estão mais adaptados à taxa de desenvolvimento do que ao tempo de desenvolvimento. Considerando a taxa de desenvolvimento uma resposta contínua, os valores de CEx podem ser estimados por recurso a uma análise de regressão – por exemplo, como descrito em (23)(24).
|
|
51.
|
No contexto dos testes estatísticos que se seguem, considera-se que o número de insetos observado no dia de inspeção x emergiu no ponto médio do intervalo de tempo compreendido entre o dia x e o dia x-d (d = duração do intervalo de inspeção, em geral 1 dia). A taxa de desenvolvimento média por recipiente (é calculada com base nas seguintes equações:

em que:
|

|
:
|
Taxa de desenvolvimento média por recipiente
|
|
i
|
:
|
Índice do intervalo de inspeção
|
|
m
|
:
|
Número máximo de intervalos de inspeção
|
|

|
:
|
Número de insetos emergidos no intervalo de inspeção i
|
|
ne
|
:
|
Número total de insetos emergidos no final do ensaio (=  ) )
|
|
xi
|
:
|
Taxa de desenvolvimento dos insetos emergidos no intervalo i
|

em que:
|
diai
|
:
|
Dia da inspeção (n.o de dias decorridos desde a introdução dos organismos)
|
|
di
|
:
|
Duração do intervalo de inspeção i (dias, em geral 1 dia)
|
|
Relatório dos ensaios
|
52.
|
O relatório dos ensaios deve incluir, no mínimo, as seguintes informações:
|
|
Substância em estudo:
|
—
|
natureza física e, quando pertinente, propriedades físico-químicas (solubilidade na água, pressão de vapor, coeficiente de partição no solo — ou nos sedimentos, se disponível —, estabilidade em água, etc.),
|
|
—
|
dados de identificação química (denominação comum, denominação química, fórmula estrutural, número CAS, etc.), incluindo o grau de pureza e o método analítico de quantificação da substância.
|
|
|
|
Espécies utilizadas nos ensaios:
|
—
|
animais: espécie, nome científico, origem dos organismos e condições de reprodução,
|
|
—
|
informações sobre o manuseamento dos aglomerados de ovos e das larvas,
|
|
—
|
idade dos animais quando introduzidos nos recipientes de ensaio.
|
|
|
|
Condições experimentais:
|
—
|
sedimentos utilizados, isto é, de origem natural ou formulados,
|
|
—
|
no caso dos sedimentos naturais, localização e descrição do local de colheita, incluindo, se possível, o historial de contaminação; características: pH, teor de carbono orgânico, razão C/N e granulometria (se pertinente),
|
|
—
|
preparação dos sedimentos formulados: ingredientes e características (teor de carbono orgânico, pH, humidade, etc., no início dos ensaios),
|
|
—
|
preparação da água para os ensaios, caso seja utilizada água reconstituída, e respetivas características (concentração de oxigénio, pH, condutividade, dureza, etc., no início dos ensaios),
|
|
—
|
espessura dos sedimentos e da água sobrenadante,
|
|
—
|
volume de água sobrenadante e de água dos poros; massa do sedimento húmido com e sem a água dos poros,
|
|
—
|
recipientes de ensaio (material e dimensões),
|
|
—
|
método de enriquecimento dos sedimentos: concentrações de ensaio utilizadas, número de replicados e solvente utilizado, se for o caso,
|
|
—
|
fase de estabilização do sistema sedimentos enriquecidos-água: duração e condições,
|
|
—
|
condições de incubação: temperatura, ciclo de luz e intensidade luminosa, arejamento (frequência e intensidade),
|
|
—
|
informações pormenorizadas sobre a alimentação dos organismos, incluindo o tipo de alimentos, a preparação, a quantidade e o regime alimentar.
|
|
|
|
Resultados:
|
—
|
concentrações de ensaio nominais, concentrações de ensaio medidas e resultados de todas as análises efetuadas para determinar a concentração da substância em estudo nos recipientes de ensaio,
|
|
—
|
qualidade da água nos recipientes de ensaio (pH, temperatura, oxigénio dissolvido, dureza e teor de ião amónio),
|
|
—
|
renovação da água evaporada nos ensaios, se for o caso,
|
|
—
|
número de insetos machos e fêmeas emergidos por recipiente e dia,
|
|
—
|
número de larvas que não originaram insetos, por recipiente,
|
|
—
|
massa seca média de larvas por recipiente e, se for caso disso, por estádio larvar,
|
|
—
|
percentagem de emergência por replicado e por concentração de ensaio (machos e fêmeas no seu conjunto),
|
|
—
|
taxa média de desenvolvimento de insetos totalmente emergidos por replicado e por concentração de ensaio (machos e fêmeas no seu conjunto),
|
|
—
|
estimativas de parâmetros de toxicidade, como, por exemplo, CEx (e os intervalos de confiança associados), NOEC e/ou LOEC e métodos estatísticos utilizados para a determinação dos mesmos,
|
|
—
|
discussão dos resultados, incluindo qualquer influência nos resultados do ensaio decorrente de alterações efetuadas ao presente método de ensaio.
|
|
|
REFERÊNCIAS:
|
(1)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Editado por M. Streloke e H. Köpp. Berlim, 1995.
|
|
(2)
|
Fleming R. et al. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Final Report to the European Commission. Report No: EC 3738. Agosto de 1994. WRc, Reino Unido.
|
|
(3)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. WOSTA Workshop realizado nos Países Baixos.
|
|
(4)
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. p. 1125-1241. In ASTM International 2002 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International. West Conshohocken, PA.
|
|
(5)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. Dezembro de 1997.
|
|
(6)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Segunda edição. EPA 600/R-99/064. Março de 2000. Revisão da primeira edição de junho de 1994.
|
|
(7)
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
(8)
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
(9)
|
Milani D., Day K.E., McLeay D.J., Kirby R.S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontário, Canadá.
|
|
(10)
|
Sugaya Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345-350.
|
|
(11)
|
Kawai K. (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47-57.
|
|
(12)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(13)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. Setembro de 1995.
|
|
(14)
|
Capítulo C.8 deste anexo: Toxicidade em relação às minhocas.
|
|
(15)
|
Suedel B.C., Rodgers J.H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163-1175.
|
|
(16)
|
Naylor C., Rodrigues C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(17)
|
Dunnett C.W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc. 50: 1096-1121.
|
|
(18)
|
Dunnett C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482-491.
|
|
(19)
|
Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117.
|
|
(20)
|
Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510-531.
|
|
(21)
|
Rao J.N.K., Scott A.J. (1992). A simple method for the analysis of clustered binary data. Biometrics 48: 577-585.
|
|
(22)
|
Christensen E.R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213-221.
|
|
(23)
|
Bruce, Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485-1494.
|
|
(24)
|
Slob W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298-312.
|
Apêndice 1
DEFINIÇÕES
No âmbito do presente método de ensaio, aplicam-se as seguintes definições:
|
|
Sedimentos formulados ou reconstituídos, artificiais ou sintéticos: mistura de matérias utilizadas para simular os componentes físicos de sedimentos naturais.
|
|
|
Água sobrenadante: água situada acima da superfície dos sedimentos, no recipiente de ensaio.
|
|
|
Água intersticial ou água dos poros: água que ocupa o espaço entre as partículas de sedimentos e de solo.
|
|
|
Sedimentos enriquecidos: sedimentos aos quais foi adicionada a substância em estudo.
|
|
|
Produto químico em estudo: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
|
Apêndice 2
Recomendações para a cultura de chironomus riparius
|
1.
|
As larvas de Chironomus podem ser criadas em caixas de cristalização ou recipientes de maiores dimensões. Espalha-se no fundo do recipiente areia quartzítica fina de modo a constituir uma camada fina com 5 a 10 mm de espessura. Verificou-se que o kieselguhr (p. ex. Merck 8117) é também um substrato adequado; neste caso, pode utilizar-se uma camada mais fina, da ordem de poucos milímetros. Adiciona-se de seguida uma coluna de vários centímetros de uma água adequada. Se necessário, os níveis de água podem ser repostos para compensar a evaporação e evitar a dessecação. A água pode ser substituída, se necessário. Deve efetuar-se um arejamento ligeiro. Os recipientes de criação das larvas devem ser mantidos em gaiolas adequadas, de forma a evitar fugas de adultos emergentes. A gaiola deve ser suficientemente grande (no mínimo, cerca de 30 x 30 x 30 cm), para permitir a enxameação dos adultos emergidos, sem o que poderá não ocorrer copulação.
|
|
2.
|
As gaiolas devem ser mantidas à temperatura ambiente ou a uma temperatura constante de 20 ± 2 °C, com um período de luminosidade (cerca de 1 000 lux) de 16 horas e oito horas de escuridão. Existem referências documentais de que um teor de humidade relativa do ar inferior a 60 % pode impedir a reprodução.
|
Água de diluição
|
3.
|
Pode utilizar-se qualquer água natural ou reconstituída adequada. Utiliza-se em geral água de poços, água da rede de abastecimento desclorada e meios artificiais (por exemplo, meio Elendt M4 ou M7; ver abaixo). A água tem de ser arejada antes da utilização. Se necessário, a água das culturas pode ser renovada por vazamento ou sifonagem cuidadoso da água dos recipientes de cultura, para não destruir os tubos das larvas.
|
Alimentação das larvas
|
4.
|
As larvas de Chironomus são alimentadas com cerca de 250 mg por recipiente e por dia de um alimento floculado para peixes (Tetra Min®, Tetra Phyll® ou outra marca semelhante). Os alimentos podem ser administrados na forma de um pó seco finamente moído ou de uma suspensão em água: adicionar 1,0 g de alimento floculado a 20 ml de água de diluição e misturar de modo a obter uma mistura homogénea. Esta preparação pode ser administrada ao caudal aproximado de 5 ml por recipiente e por dia (agitar antes da utilização). Pode administrar-se às larvas de idade superior uma maior quantidade de alimento.
|
|
5.
|
A alimentação é ajustada em função da qualidade da água. Se o meio de cultura se tornar turvo, deve reduzir-se a alimentação. A administração de alimentos deve ser objeto de um registo minucioso. A escassez de alimentos causaria migração das larvas para a coluna de água, enquanto uma alimentação demasiado rica aumentaria a atividade microbiana e reduziria a concentração de oxigénio. Ambas estas condições podem resultar numa redução das taxas de crescimento.
|
|
6.
|
Ao preparar novos recipientes de cultura, podem também adicionar-se algumas células de algas verdes (por exemplo, Scenedesmus subspicatus e Chlorella vulgaris).
|
Alimentação dos adultos emergidos
|
7.
|
Alguns experimentadores sugeriram que um tampão de algodão embebido numa solução saturada de sacarose pode servir de alimento para os adultos emergidos.
|
Emergência
|
8.
|
À temperatura de 20 ± 2 °C, os adultos começam a emergir dos recipientes de criação das larvas decorridos 13 a 15 dias. Os machos são facilmente distinguidos pelas suas antenas plumosas.
|
Aglomerados de ovos
|
9.
|
Quando se encontrarem presentes adultos nas gaiolas de criação, deve verificar-se três vezes por semana se ocorre a deposição de aglomerados gelatinosos de ovos nos recipientes de criação das larvas. Se tal suceder, devem ser removidos com cuidado e transferidos para uma pequena cápsula com uma amostra da água de incubação. Os aglomerados de ovos são utilizados para iniciar novas culturas noutros recipientes (p. ex., 2-4 aglomerados de ovos por recipiente) ou em ensaios de toxicidade.
|
|
10.
|
As larvas do primeiro estádio larvar devem eclodir decorridos 2-3 dias.
|
Preparação de novos recipientes de cultura
|
11.
|
Quando as culturas estiverem estabelecidas, deverá ser possível preparar um novo recipiente de cultura de larvas por semana, ou com uma frequência menor (consoante os requisitos dos ensaios), removendo os recipientes mais antigos após a emergência dos insetos adultos. O recurso a este sistema permite obter um aprovisionamento regular de insetos adultos com uma gestão mínima.
|
Preparação das soluções de ensaio M4 e M7
|
12.
|
O meio M4 foi descrito por Elendt (1990). O meio M7 é preparado do mesmo modo que o M4, exceto no que respeita às substâncias indicadas no quadro 1, cujas concentrações são quatro vezes inferiores às do meio M4. Encontra-se em preparação um artigo sobre o meio M7 (Elendt, comunicação pessoal). A solução de ensaio não deve ser preparada em conformidade com as indicações de Elendt e Bias (1990), dado as concentrações de NaSiO3.5H2O, NaNO3, KH2PO4 e K2HPO4 apresentadas para a preparação das soluções-mãe não serem adequadas.
|
Preparação do meio M7
|
13.
|
Cada solução-mãe (I) é preparada individualmente, sendo preparada uma solução-mãe combinada (II) a partir dessas soluções (I) (ver o quadro 1). O meio M7 é preparado diluindo para 1 l, com água desionizada, 50 ml da solução-mãe combinada (II) e as quantidades de cada solução-mãe de macronutrientes indicadas no quadro 2. Prepara-se uma solução-mãe de vitaminas juntando três vitaminas a água desionizada, como indicado no quadro 3; adiciona-se 0,1 ml da solução-mãe combinada de vitaminas ao meio M7 final pouco antes da utilização (a solução-mãe de vitaminas é armazenada por congelação, em pequenas alíquotas). O meio é arejado e estabilizado.
|
REFERÊNCIAS
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Editado por M. Streloke e H.Köpp. Berlim, 1995.
Quadro 1
Soluções-mãe de elementos vestigiais para os meios M4 e M7
|
Soluções-mãe (I)
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Para preparar a solução-mãe combinada (II), misturar as seguintes quantidades (ml) de soluções-mãe (I) e diluir para 1 litro com água desionizada
|
Concentrações finais nas soluções de ensaio (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(15)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (15)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (15)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (15)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (15)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (15)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (15)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (15)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (15)
(16)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (15)
(16)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Quadro 2
Soluções-mãe de macronutrientes para os meios M4 e M7
|
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Quantidade de soluções-mãe de macronutrientes adicionada para preparar os meios M4 e M7
(ml/l)
|
Concentrações finais nas soluções de ensaio M4 e M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Quadro 3
Soluções-mãe de vitaminas para os meios M4 e M7. As três soluções de vitaminas são combinadas para originar uma única solução-mãe.
|
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Quantidade de solução-mãe de vitaminas adicionada para preparar os meios M4 e M7
(ml/l)
|
Concentrações finais nas soluções de ensaio M4 e M7
(mg/l)
|
|
Cloridrato de tiamina
|
750
|
0,1
|
0,075
|
|
Cianocobalamina (B12)
|
10
|
0,1
|
0,0010
|
|
Biotina
|
7,5
|
0,1
|
0,00075
|
REFERÊNCIAS
Elendt B.P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25-33.
Elendt B.P., Bias W.-R. (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157-1167.
Apêndice 3
PREPARAÇÃO DOS SEDIMENTOS FORMULADOS
Composição dos sedimentos
A composição dos sedimentos formulados deve ser a seguinte:
|
Componente
|
Características
|
% da massa
seca dos sedimentos
|
|
Turfa
|
Turfa de Sphagnum, com pH tão próximo quanto possível do intervalo 5,5-6,0, sem restos visíveis de plantas, finamente moída (granulometria ≤ 1 mm) e seca ao ar
|
4-5
|
|
Areia quartzítica
|
Granulometria: > 50 % das partículas de granulometria na gama 50-200 μm
|
75-76
|
|
Argila caulinítica
|
Teor de caulinite ≥ 30 %
|
20
|
|
Carbono orgânico
|
Ajustado por adição de turfa e areia
|
2 (±0,5)
|
|
Carbonato de cácio
|
CaCO3 pulverizado quimicamente puro
|
0,05-0,1
|
|
Água
|
Condutividade ≤ 10 μS/cm
|
30-50
|
Preparação
A turfa é seca ao ar e moída até se obter um pó fino. Prepara-se uma suspensão da quantidade necessária de turfa pulverizada em água desionizada, por recurso a um dispositivo de homogeneização de alta eficiência. O pH desta suspensão é ajustado para 5,5 ± 0,5 com CaCO3. A suspensão é acondicionada durante, pelo menos, dois dias, com agitação ligeira a 20 ± 2 °C, para estabilizar o pH e estabelecer um perfil microbiano estável. Findo este período, determina-se novamente o pH, que deve ser de 6,0 ± 0,5. A suspensão de turfa é então misturada com os outros componentes (areia e argila caulinítica) e água desionizada, de forma a obter sedimentos homogéneos com um teor de água da ordem de 30 %-50 % da massa seca dos sedimentos. O pH da mistura final é determinado uma vez mais e, se necessário, ajustado para 6,5-7,5 com CaCO3. São colhidas amostras dos sedimentos para determinar o resíduo seco e o teor de carbono orgânico. Recomenda-se que, antes de ser utilizados num ensaio de toxicidade em quironomídeos, os sedimentos formulados sejam acondicionados durante sete dias em condições idênticas às do ensaio subsequente.
Armazenagem
Os componentes secos para a preparação dos sedimentos artificiais podem ser armazenados num local seco e fresco, à temperatura ambiente. Os sedimentos formulados (húmidos) não devem ser armazenados antes da sua utilização nos ensaios. Devem ser utilizados imediatamente após o período de acondicionamento de sete dias que conclui a sua preparação.
REFERÊNCIAS
Capítulo C.8 deste anexo: Toxicidade em relação às minhocas.
Meller M., Egeler P., Rombke J., Schallnass H., Nagel R., Streit B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10-20.
Apêndice 4
Características químicas de uma água de diluição adequada
|
Substância
|
Concentrações
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 mg/l
|
|
Amoníaco não ionizado
|
< 1 μg/l
|
|
Dureza expressa em CaCO3
|
< 400 mg/l (17)
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados, totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
Apêndice 5
Orientações para a monitorização da emergência das larvas de quironomídeos
Os copos de ensaio são munidos de armadilhas de emergência. Estas armadilhas são necessárias a partir do vigésimo dia, até ao final do ensaio. A título de exemplo, pode utilizar-se o dispositivo abaixo ilustrado:

A: tela de nylon
B: copo de plástico invertido
C: copo de exposição sem bico
D: aberturas recobertas, para renovação da água
E: água
F: sedimentos
C.28. ENSAIO DE TOXICIDADE EM QUIRONOMÍDEOS NUM SISTEMA SEDIMENTOS-ÁGUA COM ÁGUA ENRIQUECIDA
INTRODUÇÃO
|
1.
|
O presente método de ensaio é equivalente ao Test Guideline TG 219 da OCDE (2004). Foi concebido para avaliar os efeitos nas larvas dos dípteros de água doce Chironomus sp., que vivem nos sedimentos, de uma exposição prolongada a determinados produtos químicos. Baseia-se principalmente nas orientações da BBA, utilizando um sistema de ensaio sedimentos-água num cenário de exposição com solo artificial e coluna de água (1). Tem também em conta os atuais protocolos de ensaios de toxicidade para as espécies Chironomus riparius e Chironomus tentans que foram desenvolvidos na Europa (1)(2)(3) e na América do Norte (2)(3)(4)(5)(6)(7)(8) e foram sujeitos a um ensaio interlaboratorial (1)(6)(9). Podem também utilizar-se outras espécies de quironomídeos bem documentadas, como a Chironomus yoshimatsui (10)(11).
|
|
2.
|
O cenário de exposição utilizado neste método de ensaio passa pelo enriquecimento da água na substância em estudo. A seleção do cenário de exposição adequado depende da finalidade do ensaio. O cenário de exposição na água, que envolve o enriquecimento da coluna de água na substância em estudo, tem por objetivo simular as perdas por dispersão na aplicação de pesticidas e abrange o pico de concentrações inicial na água dos poros. É também útil para outros tipos de exposições (incluindo o derrame de produtos químicos), com exceção dos processos de acumulação mais demorados do que o período do ensaio.
|
|
3.
|
As substâncias a ensaiar com organismos que vivem nos sedimentos persistem, em geral, neste compartimento durante longos períodos. A exposição dos referidos organismos pode ter lugar por várias vias. A importância relativa de cada via de exposição, bem como o tempo de contribuição de cada uma delas para os efeitos tóxicos globais, depende das propriedades físico-químicas do produto químico em causa. No caso de substâncias fortemente adsorventes (por exemplo, com log Kow > 5) ou de substâncias ligadas aos sedimentos por ligações covalentes, a ingestão de alimentos contaminados pode constituir uma via de exposição significativa. Para não subestimar a toxicidade das substâncias altamente lipófilas, pode ponderar-se a utilização de alimentos adicionados aos sedimentos antes da aplicação da substância em estudo. De forma a ter em conta todas as vias de exposição potenciais, o presente método de ensaio focaliza-se na exposição a longo prazo. A duração do ensaio é de 20 a 28 dias para C. riparius e C. yoshimatsui e de 28 a 65 dias para C. tentans. Se forem necessários dados a curto prazo para uma finalidade específica (por exemplo, para investigar os efeitos de um produto químico instável), é possível utilizar replicados adicionais a remover após de dez dias.
|
|
4.
|
Os parâmetros medidos são o número total de indivíduos adultos emergidos e o tempo necessário para tal. Se forem necessários dados adicionais a curto prazo, recomenda-se que as determinações da sobrevivência e do crescimento das larvas apenas sejam efetuadas após um período de dez dias, recorrendo aos replicados adicionais que se justifiquem.
|
|
5.
|
Recomenda-se a utilização de sedimentos formulados. Estes apresentam várias vantagens relativamente aos sedimentos naturais:
|
—
|
a variabilidade experimental é reduzida porque os sedimentos constituem uma matriz "normalizada" reprodutível, eliminando-se a necessidade de encontrar fontes de sedimentos limpos e não contaminados,
|
|
—
|
os ensaios podem ser iniciados em qualquer momento, eliminando-se assim a variabilidade sazonal dos sedimentos ensaiados, não havendo necessidade de pré-tratar os sedimentos para remover a fauna indígena; a utilização de sedimentos formulados reduz também os custos associados à colheita no terreno de quantidades suficientes de sedimentos para os ensaios de rotina,
|
|
—
|
a utilização de sedimentos formulados permite ainda efetuar comparações de toxicidade e classificar as substâncias em conformidade. Os dados de toxicidade obtidos a partir de ensaios com sedimentos naturais e artificiais mostraram-se comparáveis para vários produtos químicos (2).
|
|
|
6.
|
São definidos no apêndice 1 alguns conceitos utilizados.
|
PRINCÍPIO DO MÉTODO
|
7.
|
Expõe-se larvas de quironomídeos do primeiro estádio larvar a uma gama de concentrações da substância em estudo em sistemas sedimentos-água. O ensaio inicia-se com a colocação de larvas do primeiro estádio larvar nos copos de ensaio com o sistema sedimentos-água, adicionando-se posteriormente a substância em estudo à água. A emergência de quironomídeos e as respetivas taxas de desenvolvimento são medidas no final do ensaio. Se necessário, a sobrevivência e o peso das larvas podem também ser determinados decorridos 10 dias, utilizando os replicados adicionais que se justifiquem. Os dados são analisados por recurso a um modelo de regressão, de forma a estimar a concentração que causaria uma redução de x% na emergência, na sobrevivência ou no crescimento das larvas (por exemplo, CE15, CE50, etc.), ou utilizando hipóteses estatísticas, para determinar a NOEC/LOEC. Este último método exige a comparação de valores que produzem efeitos com valores de controlo, por recurso a testes estatísticos.
|
INFORMAÇÕES SOBRE A SUBSTÂNCIA EM ESTUDO
|
8.
|
Devem ser conhecidas a solubilidade em água e a pressão de vapor da substância em estudo, bem como a partição nos sedimentos medida ou calculada e a estabilidade na água e nos sedimentos. Para a quantificação da substância em estudo na água sobrenadante, na água dos poros e nos sedimentos, deve dispor-se de um método analítico fiável, com exatidão e limite de deteção conhecidos e documentados. A fórmula estrutural e o grau de pureza da substância constituem igualmente informações úteis. O comportamento químico da substância em estudo (p. ex.: dissipação, degradação abiótica ou biótica, etc.) é também uma informação importante. Para mais orientações sobre o ensaio de substâncias cujas propriedades físico-químicas dificultam a realização dos ensaios, consultar a referência bibliográfica (12).
|
PRODUTOS QUÍMICOS DE REFERÊNCIA
|
9.
|
Pode testar-se periodicamente produtos químicos de referência com o objetivo de garantir a fiabilidade do protocolo e das condições de ensaio. As seguintes substâncias constituem exemplos de substâncias tóxicas de referência utilizadas com êxito em ensaios interlaboratoriais e em estudos de validação: lindano, trifluralina, pentaclorofenol, cloreto de cádmio e cloreto de potássio (1)(2)(5)(6)(13).
|
VALIDADE DO ENSAIO
|
10.
|
Um ensaio é considerado válido se forem cumpridas as seguintes condições:
|
—
|
a emergência nos controlos deve ser de, pelo menos, 70 % no final do ensaio (1)(6),
|
|
—
|
a emergência de indivíduos adultos das espécies C. riparius e C. yoshimatsui nos recipientes de controlo deve ocorrer 12 a 23 dias após a inserção destas espécies nos recipientes; no caso da C. tentans, é necessário um período de 20 a 65 dias,
|
|
—
|
no final do ensaio, devem determinar-se o pH e a concentração de oxigénio dissolvido em cada recipiente. A concentração de oxigénio deve ser de, pelo menos, 60 % do valor da saturação com ar (VSA) à temperatura utilizada e o pH da água sobrenadante deve estar compreendido entre 6 e 9, em todos os recipientes de ensaio,
|
|
—
|
a temperatura da água não deve variar mais de ± 1,0 °C. Esta temperatura pode ser controlada numa sala isotérmica, caso em que a temperatura ambiente deve ser confirmada a intervalos adequados.
|
|
DESCRIÇÃO DO MÉTODO
Recipientes de ensaio
|
11.
|
O estudo é realizado em copos de vidro de 600 ml, com 8 cm de diâmetro. Podem utilizar-se outros recipientes, devendo contudo assegurar-se uma espessura adequada da água sobrenadante e dos sedimentos. A superfície dos sedimentos deve proporcionar 2 a 3 cm2 por cada larva. O rácio entre a espessura da camada de sedimentos e a espessura da água sobrenadante deve ser de 1:4. Os recipientes de ensaio e o restante equipamento que entre em contacto com o sistema de ensaio devem ser exclusivamente de vidro ou de outro material quimicamente inerte (p. ex., Teflon).
|
Seleção das espécies
|
12.
|
A espécie a utilizar de preferência no ensaio é a Chironomus riparius. A espécie Chironomus tentans também é adequada, mas é mais difícil de manipular e exige um período de ensaio mais longo. Pode igualmente utilizar-se a Chironomus yoshimatsui. O apêndice 2 apresenta informações sobre os métodos de cultura de Chironomus riparius. Estão também disponíveis informações sobre as condições de cultura das espécies Chironomus tentans (4) e Chironomus yoshimatsui (11). A identidade das espécies deve ser confirmada antes do ensaio, exceto no caso de organismos provenientes de uma cultura interna do laboratório.
|
Sedimentos
|
13.
|
Devem ser utilizados, de preferência, sedimentos formulados (reconstituídos, artificiais ou sintéticos). Contudo, se forem utilizados sedimentos naturais, estes devem ser caracterizados (pelo menos pH e teor de carbono orgânico, recomendando-se a determinação de outros parâmetros, tais como a razão C/N e a granulometria) e devem estar isentos de qualquer contaminação e de outros organismos que possam competir com os quironomídeos ou consumi-los. Recomenda-se igualmente que, antes de serem utilizados num ensaio de toxicidade em quironomídeos, os sedimentos naturais sejam acondicionados durante sete dias em condições semelhantes às do ensaio subsequente. Recomenda-se que sejam utilizados no presente ensaio (1)(15)(16) sedimentos formulados com a seguinte composição, baseada na do solo artificial utilizado no método C.8 (14):
|
a)
|
4-5 % (massa seca) de turfa: pH tão próximo quanto possível do intervalo 5,5-6,0; é importante utilizar turfa em pó, finamente moída (granulometria das partículas ≤ 1 mm), unicamente seca ao ar;
|
|
b)
|
20 % (massa seca) de argila caulinítica, de preferência com teor de caulinite superior a 30 %;
|
|
c)
|
75-76 % (massa seca) de areia quartzítica, com predominância de areia fina com mais de 50 % de partículas de granulometria compreendida entre 50 e 200 μm;
|
|
d)
|
a quantidade de água desionizada necessária para que o teor de humidade da mistura final se situe na gama 30-50 %;
|
|
e)
|
a quantidade de carbonato de cálcio (CaCO3) quimicamente puro necessária para ajustar o pH da mistura final dos sedimentos a 7,0 ± 0,5;
|
|
f)
|
teor de carbono orgânico da mistura final: 2 % ± 0,5 %, devendo ser ajustado por recurso a quantidades adequadas de turfa e areia, em conformidade com as alíneas a) e c).
|
|
|
14.
|
As origens da turfa, da argila caulinítica e da areia devem ser conhecidas. Deve verificar-se a ausência de contaminação química (p. ex., metais pesados, compostos organoclorados, compostos organofosforados, etc.) nos componentes dos sedimentos. No apêndice 3, apresenta-se um exemplo de preparação de sedimentos. Uma mistura de componentes secos também é aceitável caso se demonstre que, após a adição da água sobrenadante, não ocorre separação de componentes dos sedimentos (por exemplo, partículas de turfa flutuantes) e que a turfa ou os sedimentos estão suficientemente acondicionados.
|
Água
|
15.
|
Qualquer água com as características químicas de uma água de diluição aceitável enunciadas nos apêndices 2 e 4 é adequada para o ensaio. Para a cultura e o ensaio, pode utilizar-se qualquer água adequada, água natural (superficial ou subterrânea), água reconstituída (ver o apêndice 2) ou água da rede de abastecimento desclorada, desde que os quironomídeos nela sobrevivam durante todo o período de cultura e de ensaio sem evidenciarem sinais de stress. No início do ensaio, o pH da água de ensaio deve estar compreendido entre 6 e 9 e a dureza total da água, expressa em CaCO3, não deve exceder 400 mg/l. No entanto, caso se suspeite de uma interação entre os iões responsáveis pela dureza e a substância em estudo, deve utilizar-se uma água de dureza inferior (nessa eventualidade, o meio Elendt M4 não pode ser utilizado). Deve utilizar-se o mesmo tipo de água em todo o estudo. As características de qualidade da água enumeradas no apêndice 4 devem ser determinadas pelo menos duas vezes por ano, ou sempre que se suspeite que tenham mudado significativamente.
|
Soluções-mãe — água enriquecida
|
16.
|
As concentrações de ensaio são calculadas com base nas concentrações da água da coluna de água, ou seja, da água sobrenadante dos sedimentos. De um modo geral, as soluções de ensaio com as concentrações escolhidas são preparadas por diluição de uma solução-mãe. As soluções-mãe devem ser preparadas, de preferência, por dissolução da substância em estudo no meio de ensaio. Em alguns casos, pode ser necessária a utilização de solventes ou dispersantes para produzir uma solução-mãe com a concentração adequada. A acetona, o etanol, o metanol, os éteres mono e dimetílico do etilenoglicol, a dimetilformamida e o trietilenoglicol constituem exemplos de solventes que podem ser utilizados. No que respeita aos dispersantes, podem utilizar-se o Cremophor RH40, o Tween 80, a metilcelulose a 0,01 % e o HCO-40. A concentração do agente solubilizante no meio de ensaio final deve ser mínima (ou seja, ≤ 0,1 ml/l) e deve ser a mesma para todas as concentrações de exposição. Sempre que se utilize um agente solubilizante, este não deve apresentar efeitos significativos na sobrevivência das larvas de quironomídeos, nem efeitos adversos observáveis nas mesmas, a confirmar por meio de um controlo do solvente. No entanto, como se referiu acima, devem fazer-se todos os esforços para evitar utilizar tais produtos.
|
PLANEAMENTO DO ENSAIO
|
17.
|
O planeamento do ensaio consiste na escolha do número e dos intervalos das concentrações de ensaio, do número de recipientes para cada concentração e do número de larvas por recipiente. Descreve-se de seguida o método de estimativa de pontos CE e do NOEC, bem como de realização de ensaios do limite. A análise por regressão linear é preferível à abordagem por testes de hipóteses.
|
Análise por regressão linear
|
18.
|
As concentrações testadas no ensaio deverão incluir as concentrações às quais se observam efeitos (por exemplo, CE15 e CE50) e abranger a gama de concentrações para as quais o efeito da substância em estudo é significativo. De modo geral, é possível melhorar a exatidão e, em especial, a validade das estimativas das concentrações que produzem efeitos (CEx) se essas concentrações se situarem na gama de concentrações ensaiadas. Devem evitar-se extrapolações muito abaixo da concentração positiva mais baixa ou acima da concentração mais elevada. É útil efetuar um ensaio exploratório preliminar para a escolha da gama de concentrações a utilizar no ensaio (ver o ponto 27).
|
|
19.
|
Caso se pretenda estimar uma CEx, devem ser utilizados, pelo menos, cinco concentrações e três replicados de cada concentração. Em qualquer caso, para obter uma boa estimativa, é aconselhável ensaiar um número suficiente de concentrações. O fator entre as concentrações não deve ser superior a dois (salvo se a curva de resposta à dose tiver um declive reduzido). Pode reduzir-se o número de replicados de cada concentração se for aumentado o número de concentrações de ensaio com respostas diferentes. O aumento do número de replicados ou a redução dos intervalos entre concentrações intervalos produz, em geral, intervalos de confiança mais estreitos. Caso se pretenda estimar a sobrevivência e o crescimento das larvas a 10 dias, é necessário utilizar mais replicados.
|
Estimativa do NOEC/LOEC
|
20.
|
Caso se pretenda estimar o NOEC ou o LOEC, devem ensaiar-se cinco concentrações com, pelo menos, quatro replicados, não devendo o fator entre as concentrações ser superior a dois. O número de replicados deverá ser suficiente para garantir a possibilidade estatística de detetar de forma adequada uma diferença de 20 % relativamente à concentração de controlo, com um grau de significância de 5 % (p = 0,05). No respeitante às taxas de desenvolvimento, é geralmente adequada uma análise de variância (ANOVA), como o teste de Dunnett ou o teste de Williams (17)(18)(19)(20). Quanto à taxa de emergência, podem utilizar-se o teste de Cochran-Armitage, o teste exato de Fisher (com a correção de Bonferroni) ou o teste de Mantel-Haentzal.
|
Ensaio do limite
|
21.
|
Caso não sejam detetados efeitos no ensaio exploratório preliminar de seleção das concentrações, pode proceder-se a um ensaio do limite (uma concentração de ensaio e uma de controlo). O objetivo do ensaio do limite consiste em provar que as concentrações tóxicas da substância em estudo são superiores à concentração máxima ensaiada. No âmbito do presente método de ensaio, não é possível sugerir nenhuma concentração a recomendar; esse critério é deixado à apreciação das entidades regulamentadoras. Em geral, são necessários, pelo menos, seis replicados dos organismos expostos e de controlo. Deve comprovar-se existir a possibilidade estatística de detetar de forma adequada uma diferença de 20 % relativamente ao controlo, com um grau de significância de 5 % (p = 0,05). No que respeita ao efeito nas taxas de desenvolvimento e na massa, o teste t é um método estatístico adequado se os dados cumprirem os requisitos do teste (normalidade e variâncias homogéneas). Se estes requisitos não forem preenchidos, pode utilizar-se um teste t de variância desigual ou um teste não paramétrico, como o de Wilcoxon-Mann-Whithey. No que respeita à taxa de emergência, o teste exato de Fisher é adequado.
|
PROCEDIMENTO
Condições de exposição
Preparação do sistema água enriquecida-sedimentos
|
22.
|
Coloca-se nos recipientes de ensaio quantidades adequadas de sedimentos formulados (ver os pontos 13-14 e o apêndice 3), de modo a formar uma camada com, pelo menos, 1,5 cm de espessura. Junta-se água numa espessura de 6 cm (ver o ponto 15). A razão entre a espessura da camada de sedimentos e a espessura da camada de água não deve exceder 1:4; a espessura da camada de sedimentos não deve exceder 3 cm. O sistema sedimentos-água deve ser sujeito a um arejamento ligeiro durante sete dias, antes da introdução dos organismos em estudo (ver o ponto 14 e o apêndice 3). Para evitar a separação de componentes dos sedimentos e a ressuspensão de materiais finos durante a criação da coluna de água, os sedimentos podem ser cobertos, enquanto a água é vertida, com um disco de plástico que se remove imediatamente depois. Podem também utilizar-se outros dispositivos.
|
|
23.
|
Os recipientes de ensaio devem ser cobertos (por exemplo, com placas de vidro). Se necessário, o nível inicial de água pode ser reposto durante o ensaio, para compensar a evaporação. Para tal, deve utilizar-se água destilada ou desionizada, de modo a evitar a acumulação de sais.
|
Introdução dos organismos em estudo
|
24.
|
Quatro a cinco dias antes da introdução dos organismos em estudo nos recipientes de ensaio, deve colher-se aglomerados de ovos das culturas e colocá-los em pequenos recipientes com o meio de cultura. Pode utilizar-se meio proveniente da cultura-mãe ou um meio recentemente preparado. Neste último caso, importa adicionar ao meio de cultura uma pequena quantidade de alimentos, como, por exemplo, algas verdes e/ou algumas gotas de filtrado de uma suspensão de alimento para peixes finamente moído (ver o apêndice 2). Apenas devem ser utilizados aglomerados de ovos de postura recente. Normalmente, as larvas começam a eclodir alguns dias após a postura dos ovos (2 a 3 dias, a 20 °C, no caso das Chironomus riparius, e 1 a 4 dias no caso das Chironomus tentans, a 23 °C, e das Chironomus yoshimatsui, a 25 °C); o crescimento das larvas ocorre em quatro estádios larvares, cada um com a duração de 4 a 8 dias. Utilizar no ensaio larvas do primeiro estádio larvar (2-3 ou 1-4 dias após a eclosão). O estádio larvar dos insetos pode, eventualmente, ser verificado por exame da largura da cápsula cefálica (6).
|
|
25.
|
Com o auxílio de uma pipeta embotada, coloca-se aleatoriamente vinte larvas do primeiro estádio larvar em cada recipiente de ensaio contendo os sedimentos e a água. O arejamento da água tem de ser suspenso durante a colocação das larvas nos recipientes de ensaio, assim permanecendo nas 24 horas subsequentes a esta operação (ver os pontos 24 e 32). Consoante o tipo de ensaio realizado (ver os pontos 19 e 20), o número de larvas por concentração deve ser, no mínimo, de 60, no caso de estimativas de pontos CE, e de 80, no caso das determinações de NOEC.
|
|
26.
|
Vinte e quatro horas após a introdução das larvas, a coluna de água sobrenadante é enriquecida com a substância em estudo, retomando-se um arejamento ligeiro. Com o auxílio de uma pipeta, introduzem-se pequenos volumes da solução da substância em estudo abaixo da superfície da água. A água sobrenadante deve, em seguida, ser homogeneizada com cuidado, para não perturbar os sedimentos.
|
Concentrações de ensaio
|
27.
|
Pode ser útil efetuar um ensaio exploratório para a determinação da gama de concentrações a utilizar no ensaio definitivo. Para o efeito, recorre-se a uma série de concentrações espaçadas da substância em estudo. Garantido que a densidade de quironomídeos por unidade de superfície seja idêntica à utilizada no ensaio definitivo, os quironomídeos são expostos a cada concentração da substância em estudo por um período que permita uma estimativa das concentrações de ensaio adequadas, não sendo necessários replicados.
|
|
28.
|
As concentrações a utilizar no ensaio definitivo são decididas com base nos resultados do ensaio exploratório. Devem ser utilizadas pelo menos cinco concentrações, selecionadas do modo descrito nos pontos 18 a 20.
|
Controlos
|
29.
|
Deve utilizar-se no ensaio um número adequado de recipientes de controlo sem a substância em estudo, mas com os sedimentos (ver os pontos 19-20). Caso se recorra a um solvente para a incorporação da substância em estudo (ver o ponto 16), deve efetuar-se um controlo utilizando sedimentos com solvente.
|
Sistema de ensaio
|
30.
|
São utilizados sistemas estáticos. Em casos excecionais, pode utilizar-se sistemas semiestáticos ou sistemas de escoamento com renovação intermitente ou contínua da água sobrenadante, por exemplo, se as características de qualidade da água se tornarem inadequadas ao organismo em estudo ou afetarem o equilíbrio químico (isto é, se os teores de oxigénio dissolvido baixarem demasiado, se a concentração de produtos de excreção aumentar demasiado, se ocorrer lixiviação de minerais dos sedimentos que afete o pH e/ou dureza da água, etc.). Deve preferir-se, contudo, o recurso a outros métodos para melhorar a qualidade da água sobrenadante, como o arejamento, que é, em geral, suficiente.
|
Alimentação
|
31.
|
É necessário alimentar as larvas, de preferência diariamente ou, no mínimo, três vezes por semana. Utilizar alimento para peixes (suspensão em água ou finamente moído, por exemplo, Tetra Min or Tetra-Phyll; ver pormenores no apêndice 2); a quantidade de 0,25-0,5 mg (0,35-0,5 mg no caso de C. yoshimatsui) por larva e dia afigura-se adequada para as larvas jovens, nos primeiros 10 dias. Após este período, pode ser necessária uma quantidade ligeiramente superior: 0,5-1 mg por larva e dia deve bastar para o resto do ensaio. A ração alimentar deve ser reduzida a todos os organismos expostos e aos controlos caso se observe crescimento fúngico ou se verifique mortalidade nos controlos. Se não for possível impedir o crescimento fúngico, deve repetir-se o ensaio. Quando se estuda substâncias fortemente adsorventes (por exemplo, com log Kow > 5) ou substâncias ligadas aos sedimentos por ligações covalentes, a quantidade de alimentos necessária para assegurar a sobrevivência e o crescimento natural dos organismos pode ser adicionada aos sedimentos formulados, antes do período de estabilização. Para esse fim, devem ser utilizados matérias vegetais em vez de alimentos para peixes; a título de exemplo, 0,5 % (massa seca) de folhas finamente moídas de espécies como a urtiga comum (Urtica dioeca), a amoreira (Morus alba), o trevo branco (Trifolium repens), o espinafre (Spinacia oleracea) ou outras matérias de origem vegetal (Cerophyl ou α-celulose).
|
Condições de incubação
|
32.
|
O arejamento ligeiro da água sobrenadante nos recipientes de ensaio deve iniciar-se, de preferência, 24 horas após a introdução das larvas, prosseguindo ao longo de todo o ensaio (deve evitar-se que a concentração de oxigénio dissolvido baixe para valores inferiores a 60 % do VSA). O arejamento é efetuado por intermédio de uma pipeta de Pasteur de vidro, fixada 2-3 cm acima da camada de sedimentos (caudal: uma ou poucas bolhas por segundo). No ensaio de produtos químicos voláteis, pode optar-se por não arejar o sistema sedimentos-água.
|
|
33.
|
O ensaio é realizado a temperatura constante (20 °C ± 2 °C). No caso das espécies C. tentans e C. yoshimatsui, as temperaturas recomendadas são 23 °C e 25 °C (± 2 °C), respetivamente. Utiliza-se um período de irradiação de 16 horas, com uma intensidade luminosa de 500 a 1 000 lux.
|
Duração da exposição
|
34.
|
A exposição começa com a introdução das larvas nos recipientes enriquecidos e nos recipientes de controlo. A duração máxima da exposição é de 28 dias para a C. riparius e a C. yoshimatsui e de 65 dias para a C. tentans. Se os insetos emergirem precocemente, pode pôr-se termo ao ensaio, no mínimo, cinco dias após a emergência do último indivíduo adulto nos recipientes de controlo.
|
OBSERVAÇÕES
Emergência
|
35.
|
Determina-se o tempo de desenvolvimento e o número total de insetos machos e fêmeas totalmente emergidos. Os machos são facilmente identificados pelas suas antenas plumosas.
|
|
36.
|
Os recipientes de ensaio devem ser observados pelo menos três vezes por semana, a fim de apreciar visualmente qualquer comportamento anormal (por exemplo, saída dos sedimentos, natação anormal) em relação aos recipientes de controlo. Durante o período de emergência previsto, é necessário proceder à contagem diária dos insetos emergidos. O sexo e o número de insetos totalmente emergidos são registados diariamente. Após a identificação, removem-se os insetos dos recipientes. Quaisquer aglomerados de ovos postos antes do termo do ensaio devem ser registados e, de seguida, removidos, para evitar a reintrodução de larvas nos sedimentos. Regista-se também o número de ninfas visíveis que não emergiram. O apêndice 5 contém orientações sobre a mensuração da emergência.
|
Crescimento e sobrevivência
|
37.
|
Se for necessário obter dados sobre a sobrevivência e o crescimento das larvas em dez dias, deve prever-se recipientes de ensaio suplementares desde o início, para que possam ser utilizados posteriormente. Os sedimentos destes recipientes são passados por um crivo com abertura de malha de 250 μm, para reter as larvas. Os critérios de morte são a imobilidade e a ausência de reação a estímulos mecânicos. As larvas não recuperadas devem também ser contadas como mortas (as larvas que morreram no início do ensaio podem ter sido degradadas por micróbios). Determina-se a massa seca, isenta de cinzas, de larvas sobreviventes em cada recipiente de ensaio, calculando-se a massa seca média por recipiente. É útil determinar o estádio larvar das larvas sobreviventes; para tal, pode recorrer-se à medição da largura da cápsula cefálica de cada indivíduo.
|
Determinações analíticas
Concentração da substância em estudo
|
38.
|
No início (de preferência uma hora após a aplicação da substância) e no final do ensaio, é necessário analisar, no mínimo, amostras da água sobrenadante, da água dos poros e dos sedimentos correspondentes à concentração mais elevada e a uma concentração inferior. Estas determinações da concentração da substância em estudo proporcionam informações sobre o comportamento e/ou a partição da mesma no sistema água-sedimentos. A colheita de amostras dos sedimentos no início do ensaio pode influenciar o sistema (por exemplo, remoção de larvas), pelo que devem ser utilizados recipientes de ensaio adicionais para a realização das determinações analíticas no início e durante o ensaio, se pertinente (ver o ponto 39). Pode não ser necessário efetuar medições nos sedimentos, caso a partição da substância em estudo entre a água e os sedimentos tenha sido claramente determinada num estudo em condições comparáveis (por exemplo, coeficiente de partição sedimentos/água, tipo de aplicação, teor de carbono orgânico dos sedimentos).
|
|
39.
|
Quando se efetua medições intermédias (por exemplo, no 7.o dia) e a análise necessita de amostras grandes que não podem ser colhidas dos recipientes de ensaio sem influenciar o sistema em estudo, as determinações analíticas devem ser realizadas com amostras colhidas de recipientes de ensaio suplementares tratados da mesma forma (incluindo a presença dos organismos em estudo), mas que não são alvo de observações biológicas.
|
|
40.
|
A centrifugação a cerca de 10 000 g e 4 oC, durante 30 minutos, é o procedimento recomendado para isolar a água intersticial. No entanto, caso se demonstre que a substância em estudo não é adsorvida aos filtros, a filtragem também é aceitável. Em alguns casos, se a amostra for demasiado pequena, poderá não ser possível analisar concentrações na água dos poros.
|
Parâmetros físico-químicos
|
41.
|
O pH, o teor de oxigénio dissolvido na água e a temperatura dos recipientes de ensaio devem ser medidos de forma adequada (ver o ponto 10). A dureza e o ião amónio devem ser medidos nos recipientes de controlo e num recipiente de ensaio com a concentração mais elevada, no início e no final do ensaio.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
42.
|
O objetivo deste ensaio consiste em determinar o efeito da substância em estudo nas taxas de desenvolvimento e no número total de insetos machos e fêmeas totalmente emergidos ou, no caso dos ensaios de 10 dias, os efeitos na sobrevivência e no peso das larvas. Se não houver indicação de sensibilidades estatisticamente diferentes entre os sexos, os resultados relativos aos machos e às fêmeas podem ser agrupados para efeitos de análise estatística. As diferenças de sensibilidade entre os sexos podem ser avaliadas estatisticamente, por exemplo, recorrendo a um ensaio de tabela de contingência χ2-r x 2. Se necessário, determina-se a sobrevivência das larvas e a massa seca por recipiente após 10 dias.
|
|
43.
|
As concentrações com efeitos, expressas em relação à água sobrenadante, são calculadas de preferência a partir das concentrações medidas nos sedimentos no início do ensaio (ver o ponto 38).
|
|
44.
|
Para efetuar uma estimativa pontual do valor CE50 ou de qualquer valor CEx, podem equiparar-se os dados estatísticos por recipiente aos de ensaios idênticos reais. No cálculo de um intervalo de confiança para qualquer valor CEx, importa ter em conta a variabilidade entre recipientes, ou deve demonstrar-se que essa variabilidade é tão reduzida que pode ser ignorada. Se o modelo for ajustado pelo método dos mínimos quadrados, deve aplicar-se uma transformação aos dados estatísticos por recipiente, para melhorar a homogeneidade da variância. Contudo, os valores de CEx só devem ser calculados após retransformação da resposta no valor original.
|
|
45.
|
Se a análise estatística tiver por objetivo determinar o NOEC/LOEC utilizando hipóteses estatísticas, importa ter em conta a variabilidade entre recipientes, por exemplo, aplicando um método ANOVA hierarquizado. Se não se verificarem os pressupostos comuns do método ANOVA, testes mais robustos podem constituir uma alternativa adequada (21).
|
Taxa de emergência
|
46.
|
As taxas de emergência são dados de "tudo ou nada", que podem ser analisados através de um teste de Cochran-Armitage aplicado de forma regressiva, nos casos em que se prevê uma relação monótona entre a dose fornecida e a resposta e os dados são compatíveis com a previsão. Caso contrário, pode recorrer-se a um teste exato de Fisher ou a um teste de Mantel-Haentzal com valores p ajustados segundo o método de Bonferroni-Holm. Se, para a mesma concentração, houver indícios de uma maior variabilidade entre replicados do que a sugerida por uma distribuição binomial (frequentemente referida como variação "extrabinomial"), deve utilizar-se um teste exato de Fisher ou um teste de Cochran-Armitage robusto, como proposto na referência 21.
|
|
47.
|
Determina-se a soma dos insetos emergidos por recipiente, ne, que é seguidamente dividida pelo número de larvas nele introduzidas, na:

em que:
|
ER
|
=
|
Taxa de emergência
|
|
ne
|
=
|
Número de insetos emergidos no recipiente
|
|
na
|
=
|
Número de larvas introduzidas no recipiente
|
|
|
48.
|
Uma alternativa mais adequada a amostras grandes, quando se regista variância extrabinomial, consiste em considerar a taxa de emergência uma resposta contínua e aplicar procedimentos como o teste de William, caso se preveja uma relação monótona entre a dose fornecida e a resposta, compatível com os dados de taxa de emergência em causa. Por seu turno, o teste de Dunnett é adequado aos casos em que não se regista uma relação monótona. Neste contexto, uma amostra "grande" é definida como aquela em que o número total de insetos emergidos e não emergidos é superior a cinco por replicado (recipiente).
|
|
49.
|
A aplicação de métodos ANOVA implica que os valores de taxa de emergência sejam sujeitos a uma transformação de arco-seno da raiz quadrada ou a uma transformação de Tukey-Freeman, de forma a obter uma distribuição aproximadamente normal e uniformizar as variâncias. Os testes de Cochran-Armitage, exato de Fisher (Bonferroni) e Mantel-Haentzal podem ser aplicados quando se utilizam frequências absolutas. A transformação de arco-seno da raiz quadrada consiste em calcular o inverso do seno (sin–1) da raiz quadrada do valor da taxa de emergência.
|
|
50.
|
No respeitante às taxas de emergência, os valores de CEx são calculados por análise de regressão — por exemplo, por recurso aos modelos probit (22), logit ou Weibull ou a programas informáticos comerciais adequados). Em caso de fracasso da análise de regressão (por exemplo, se o número de respostas parciais for inferior a dois), utilizam-se outros métodos não paramétricos, como a média móvel ou a simples interpolação.
|
Taxa de desenvolvimento
|
51.
|
O tempo médio de desenvolvimento representa o tempo médio decorrido entre a introdução das larvas (dia 0 do ensaio) e a emergência da coorte experimental de insetos (para o cálculo do tempo de desenvolvimento real, é necessário ter em conta a idade das larvas no momento da introdução). A taxa de desenvolvimento é o inverso do tempo de desenvolvimento (unidade: 1/dia) e representa a quantidade de desenvolvimento larvar que ocorre por dia. A taxa de desenvolvimento é o parâmetro preferido para a avaliação destes estudos de toxicidade dos sedimentos, dado que a sua variância é mais baixa que a do tempo de desenvolvimento, sendo também mais homogénea e mais próxima da distribuição normal. Os testes paramétricos mais potentes estão mais adaptados à taxa de desenvolvimento do que ao tempo de desenvolvimento. Considerando a taxa de desenvolvimento uma resposta contínua, os valores de CEx podem ser estimados por recurso a uma análise de regressão – por exemplo, como descrito em 23 e 24.
|
|
52.
|
No contexto dos testes estatísticos que se seguem, considera-se que o número de insetos observado no dia de inspeção x emergiu no ponto médio do intervalo de tempo compreendido entre o dia x e o dia x-d (d = duração do intervalo de inspeção, em geral 1 dia). A taxa de desenvolvimento média por recipiente (é calculada com base nas seguintes equações:

em que:
|

|
:
|
Taxa de desenvolvimento média por recipiente
|
|
i
|
:
|
Índice do intervalo de inspeção
|
|
m
|
:
|
Número máximo de intervalos de inspeção
|
|

|
:
|
Número de insetos emergidos no intervalo de inspeção i
|
|
ne
|
:
|
Número de insetos emergidos no final do ensaio (=  ) )
|
|
xi
|
:
|
Taxa de desenvolvimento dos insetos emergidos no intervalo i
|

em que:
|
diai
|
:
|
Dia de inspeção (n.o de dias decorridos desde a introdução dos organismos)
|
|
di
|
:
|
Duração do intervalo de inspeção i (dias, normalmente 1 dia)
|
|
Relatório dos ensaios
|
53.
|
O relatório dos ensaios deve incluir, no mínimo, as seguintes informações:
|
|
Substância em estudo:
|
—
|
natureza física e, quando pertinente, propriedades físico-químicas (solubilidade na água, pressão de vapor, coeficiente de partição no solo — ou nos sedimentos, se disponível —, estabilidade em água, etc.),
|
|
—
|
dados de identificação química (denominação comum, denominação química, fórmula estrutural, número CAS, etc.), incluindo o grau de pureza e o método analítico de quantificação da substância.
|
|
|
|
Espécies utilizadas nos ensaios:
|
—
|
animais: espécie, nome científico, origem dos organismos e condições de reprodução,
|
|
—
|
informações sobre o manuseamento dos aglomerados de ovos e das larvas,
|
|
—
|
idade dos animais quando introduzidos nos recipientes de ensaio.
|
|
|
|
Condições experimentais:
|
—
|
sedimentos utilizados, isto é, de origem natural ou formulados,
|
|
—
|
no caso dos sedimentos naturais, localização e descrição do local de colheita, incluindo, se possível, o historial de contaminação; características: pH, teor de carbono orgânico, razão C/N e granulometria (se pertinente),
|
|
—
|
preparação dos sedimentos formulados: ingredientes e características (teor de carbono orgânico, pH, humidade, etc., no início dos ensaios),
|
|
—
|
preparação da água para os ensaios, caso seja utilizada água reconstituída, e respetivas características (concentração de oxigénio, pH, condutividade, dureza, etc., no início dos ensaios);
|
|
—
|
espessura dos sedimentos e da água sobrenadante,
|
|
—
|
volume de água sobrenadante e de água dos poros; massa do sedimento húmido com e sem a água dos poros,
|
|
—
|
recipientes de ensaio (material e dimensões),
|
|
—
|
método de preparação das soluções-mãe e concentrações de ensaio,
|
|
—
|
aplicação da substância em estudo: concentrações de ensaio utilizadas, número de replicados e solvente utilizado, se for o caso,
|
|
—
|
condições de incubação: temperatura, ciclo de luz e intensidade luminosa, arejamento (frequência e intensidade),
|
|
—
|
informações pormenorizadas sobre a alimentação dos organismos, incluindo o tipo de alimentos, a preparação, a quantidade e o regime alimentar.
|
|
|
|
Resultados:
|
—
|
concentrações de ensaio nominais, concentrações de ensaio medidas e resultados de todas as análises efetuadas para determinar a concentração da substância em estudo nos recipientes de ensaio,
|
|
—
|
qualidade da água nos recipientes de ensaio (pH, temperatura, oxigénio dissolvido, dureza e teor de ião amónio),
|
|
—
|
renovação da água evaporada nos ensaios, se for o caso,
|
|
—
|
número de insetos machos e fêmeas emergidos por recipiente e dia,
|
|
—
|
número de larvas que não originaram insetos, por recipiente,
|
|
—
|
massa seca média de larvas por recipiente e, se for caso disso, por estádio larvar,
|
|
—
|
percentagem de emergência por replicado e por concentração de ensaio (machos e fêmeas no seu conjunto),
|
|
—
|
taxa média de desenvolvimento de insetos totalmente emergidos por replicado e por concentração de ensaio (machos e fêmeas no seu conjunto),
|
|
—
|
estimativas de parâmetros de toxicidade, como, por exemplo, CEx (e os intervalos de confiança associados), NOEC e/ou LOEC, e métodos estatísticos utilizados para a determinação dos mesmos,
|
|
—
|
discussão dos resultados, incluindo qualquer influência nos resultados do ensaio decorrente de alterações efetuadas ao presente método de ensaio.
|
|
|
REFERÊNCIAS:
|
(1)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Editado por M. Streloke e H. Köpp. Berlim, 1995.
|
|
(2)
|
Fleming R. et al. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Final Report to the European Commission. Report No: EC 3738. Agosto de 1994. WRc, Reino Unido.
|
|
(3)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. WOSTA Workshop realizado nos Países Baixos.
|
|
(4)
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. p. 1125-1241. In ASTM International 2002 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International. West Conshohocken, PA.
|
|
(5)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. Dezembro de 1997.
|
|
(6)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Segunda edição. EPA 600/R-99/064. Março de 2000. Revisão da primeira edição, de junho de 1994.
|
|
(7)
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
(8)
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
(9)
|
Milani D., Day K.E., McLeay D.J., Kirby R.S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontário, Canadá.
|
|
(10)
|
Sugaya Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345-350.
|
|
(11)
|
Kawai K. (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47-57.
|
|
(12)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(13)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. Setembro de 1995.
|
|
(14)
|
Capítulo C.8 deste anexo: Toxicidade em relação às minhocas.
|
|
(15)
|
Suedel B.C., Rodgers J.H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163-1175.
|
|
(16)
|
Naylor C., Rodrigues C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(17)
|
Dunnett C.W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc. 50: 1096-1121.
|
|
(18)
|
Dunnett C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482-491.
|
|
(19)
|
Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117.
|
|
(20)
|
Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510-531.
|
|
(21)
|
Rao J.N.K., Scott A.J. (1992). A simple method for the analysis of clustered binary data. Biometrics 48:577-585.
|
|
(22)
|
Christensen E.R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213-221.
|
|
(23)
|
Bruce, Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494.
|
|
(24)
|
Slob W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298-312.
|
Apêndice 1
DEFINIÇÕES
No âmbito do presente método, aplica-se as seguintes definições:
|
|
Sedimentos formulados ou reconstituídos, artificiais ou sintéticos: mistura de matérias utilizadas para simular os componentes físicos de sedimentos naturais.
|
|
|
Água sobrenadante: água situada acima da superfície dos sedimentos, no recipiente de ensaio.
|
|
|
Água intersticial ou água dos poros: água que ocupa o espaço entre as partículas de sedimentos e de solo.
|
|
|
Água enriquecida: água utilizada no ensaio, à qual foi adicionada a substância em estudo.
|
|
|
Produto químico em estudo: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
|
Apêndice 2
Recomendações para a cultura de Chironomus riparius
|
1.
|
As larvas de Chironomus podem ser criadas em caixas de cristalização ou recipientes de maiores dimensões. Espalha-se no fundo do recipiente areia quartzítica fina de modo a constituir uma camada fina com 5 a 10 mm de espessura. Verificou-se que o kieselguhr (p. ex. Merck 8117) é também um substrato adequado; neste caso, pode utilizar-se uma camada mais fina, da ordem de poucos milímetros. Adiciona-se de seguida uma coluna de vários centímetros de uma água adequada. Se necessário, os níveis de água podem ser repostos para compensar a evaporação e evitar a dessecação. A água pode ser substituída, se necessário. Deve efetuar-se um arejamento ligeiro. Os recipientes de criação das larvas devem ser mantidos em gaiolas adequadas, de forma a evitar fugas de adultos emergentes. A gaiola deve ser suficientemente grande (no mínimo, cerca de 30 x 30 x 30 cm), para permitir a enxameação dos adultos emergidos, sem o que poderá não ocorrer copulação.
|
|
2.
|
As gaiolas devem ser mantidas à temperatura ambiente ou a uma temperatura constante de 20 ± 2 °C, com um período de luminosidade (cerca de 1 000 lux) de 16 horas e oito horas de escuridão. Existem referências documentais de que um teor de humidade relativa do ar inferior a 60 % pode impedir a reprodução.
|
Água de diluição
|
3.
|
Pode utilizar-se qualquer água natural ou reconstituída adequada. Utiliza-se em geral água de poços, água da rede de abastecimento desclorada e meios artificiais (por exemplo, meio Elendt M4 ou M7; ver abaixo). A água tem de ser arejada antes da utilização. Se necessário, a água das culturas pode ser renovada por vazamento ou sifonagem cuidadoso da água dos recipientes de cultura, para não destruir os tubos das larvas.
|
Alimentação das larvas
|
4.
|
As larvas de Chironomus são alimentadas com cerca de 250 mg por recipiente e por dia de um alimento floculado para peixes (Tetra Min®, Tetra Phyll® ou outra marca semelhante). Os alimentos podem ser administrados na forma de um pó seco finamente moído ou de uma suspensão em água: adicionar 1,0 g de alimento floculado a 20 ml de água de diluição e misturar de modo a obter uma mistura homogénea. Esta preparação pode ser administrada ao caudal aproximado de 5 ml por recipiente e por dia (agitar antes da utilização). Pode administrar-se às larvas de idade superior uma maior quantidade de alimento.
|
|
5.
|
A alimentação é ajustada em função da qualidade da água. Se o meio de cultura se tornar turvo, deve reduzir-se a alimentação. A administração de alimentos deve ser objeto de um registo minucioso. A escassez de alimentos causaria a migração das larvas para a coluna de água, enquanto uma alimentação demasiado rica aumentaria a atividade microbiana e reduziria a concentração de oxigénio. Ambas estas condições podem resultar numa redução das taxas de crescimento.
|
|
6.
|
Ao preparar novos recipientes de cultura, podem também adicionar-se algumas células de algas verdes (por exemplo, Scenedesmus subspicatus e Chlorella vulgaris).
|
Alimentação dos adultos emergidos
|
7.
|
Alguns experimentadores sugeriram que um tampão de algodão embebido numa solução saturada de sacarose pode servir de alimento para os adultos emergidos.
|
Emergência
|
8.
|
À temperatura de 20 ± 2 °C, os adultos começam a emergir dos recipientes de criação das larvas decorridos 13 a 15 dias. Os machos são facilmente distinguidos pelas suas antenas plumosas.
|
Aglomerados de ovos
|
9.
|
Quando se encontrarem presentes adultos nas gaiolas de criação, deve verificar-se três vezes por semana se ocorre a deposição de aglomerados gelatinosos de ovos nos recipientes de criação das larvas. Se tal suceder, devem ser removidos com cuidado e ser transferidos para uma pequena cápsula com uma amostra da água de incubação. Os aglomerados de ovos são utilizados para iniciar novas culturas noutros recipientes (p. ex., 2-4 aglomerados de ovos por recipiente) ou em ensaios de toxicidade.
|
|
10.
|
As larvas do primeiro estádio larvar devem eclodir decorridos 2-3 dias.
|
Preparação de novos recipientes de cultura
|
11.
|
Quando as culturas estiverem estabelecidas, deverá ser possível preparar um novo recipiente de cultura de larvas por semana, ou com uma frequência menor (consoante os requisitos dos ensaios), removendo os recipientes mais antigos após a emergência dos insetos adultos. O recurso a este sistema permitirá obter um aprovisionamento regular de insetos adultos com uma gestão mínima.
|
Preparação das soluções de ensaio M4 e M7
|
12.
|
O meio M4 foi descrito por Elendt (1990). O meio M7 é preparado do mesmo modo que o M4, exceto no que respeita às substâncias indicadas no quadro 1, cujas concentrações são quatro vezes inferiores às do meio M4. Encontra-se em preparação um artigo sobre o meio M7 (Elendt, comunicação pessoal). A solução de ensaio não deve ser preparada em conformidade com as indicações de Elendt e Bias (1990), dado as concentrações de NaSiO3.5H2O, NaNO3, KH2PO4 e K2HPO4 apresentadas para a preparação das soluções-mãe não serem adequadas.
|
Preparação do meio M7
|
13.
|
Cada solução-mãe (I) é preparada individualmente, sendo preparada uma solução-mãe combinada (II) a partir dessas soluções (I) (ver o quadro 1). O meio M7 é preparado diluindo para 1 l, com água desionizada, 50 ml da solução-mãe combinada (II) e as quantidades de cada solução-mãe de macronutrientes indicadas no quadro 2. Prepara-se uma solução-mãe de vitaminas juntando três vitaminas a água desionizada, como indicado no quadro 3; adiciona-se 0,1 ml da solução-mãe combinada de vitaminas ao meio M7 final pouco antes da utilização (a solução-mãe de vitaminas é armazenada por congelação, em pequenas alíquotas). O meio é arejado e estabilizado.
Quadro 1
Soluções-mãe de elementos vestigiais para os meios M4 e M7
|
Soluções-mãe (I)
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Para preparar a solução-mãe combinada (II), misturar as seguintes quantidades (ml) de soluções-mãe (I) e diluir para 1 litro com água desionizada
|
Concentrações finais nas soluções de ensaio (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(18)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (18)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (18)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (18)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (18)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (18)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (18)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (18)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (18)
(19)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (18)
(19)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Quadro 2
Soluções-mãe de macronutrientes para os meios M4 e M7
|
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Quantidade de soluções-mãe de macronutrientes adicionada para preparar os meios M4 e M7
(ml/l)
|
Concentrações finais nas soluções de ensaio M4 e M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Quadro 3
Soluções-mãe de vitaminas para os meios M4 e M7
As três soluções de vitaminas são combinadas para originar uma única solução-mãe.
|
|
Quantidade (mg) diluída para 1 litro com água desionizada
|
Quantidade de solução-mãe de vitaminas adicionada para preparar os meios M4 e M7
(ml/l)
|
Concentrações finais nas soluções de ensaio M4 e M7
(mg/l)
|
|
Cloridrato de tiamina
|
750
|
0,1
|
0,075
|
|
Cianocobalamina (B12)
|
10
|
0,1
|
0,0010
|
|
Biotina
|
7,5
|
0,1
|
0,00075
|
|
REFERÊNCIAS
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Editado por M. Streloke e H. Köpp. Berlim, 1995.
Elendt B.P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25-33.
Elendt B.P., Bias W.-R. (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157-1167.
Apêndice 3
PREPARAÇÃO DOS SEDIMENTOS FORMULADOS
Composição dos sedimentos
A composição dos sedimentos formulados deve ser a seguinte:
|
Componente
|
Características
|
% da massa
seca dos sedimentos
|
|
Turfa
|
Turfa de Sphagnum, com pH tão próximo quanto possível do intervalo 5,5-6,0, sem restos visíveis de plantas, finamente moída (granulometria ≤ 1 mm) e seca ao ar
|
4-5
|
|
Areia quartzítica
|
Granulometria: > 50 % das partículas de granulometria na gama 50-200 μm
|
75-76
|
|
Argila caulinítica
|
Teor de caulinite ≥ 30 %
|
20
|
|
Carbono orgânico
|
Ajustado por adição de turfa e areia
|
2 (±0,5)
|
|
Carbonato de cácio
|
CaCO3 pulverizado quimicamente puro
|
0,05-0,1
|
|
Água
|
Condutividade ≤ 10 μS/cm
|
30-50
|
Preparação
A turfa é seca ao ar e moída até se obter um pó fino. Prepara-se uma suspensão da quantidade necessária de turfa pulverizada em água desionizada, por recurso a um dispositivo de homogeneização de alta eficiência. O pH desta suspensão é ajustado para 5,5 ± 0,5 com CaCO3. A suspensão é acondicionada durante, pelo menos, dois dias, com agitação ligeira a 20 ± 2 °C, para estabilizar o pH e estabelecer um perfil microbiano estável. Findo este período, determina-se novamente o pH, que deve ser de 6,0 ± 0,5. A suspensão de turfa é então misturada com os outros componentes (areia e argila caulinítica) e água desionizada, de forma a obter sedimentos homogéneos com um teor de água da ordem de 30 %-50 % da massa seca dos sedimentos. O pH da mistura final é determinado uma vez mais e, se necessário, ajustado para 6,5-7,5 com CaCO3. São colhidas amostras dos sedimentos para determinar o resíduo seco e o teor de carbono orgânico. Recomenda-se que, antes de ser utilizados num ensaio de toxicidade em quironomídeos, os sedimentos formulados sejam acondicionados durante sete dias em condições idênticas às do ensaio subsequente.
Armazenagem
Os componentes secos para a preparação dos sedimentos artificiais podem ser armazenados num local seco e fresco, à temperatura ambiente. Os sedimentos formulados (húmidos) não devem ser armazenados antes da sua utilização nos ensaios. Devem ser utilizados imediatamente após o período de acondicionamento de sete dias que conclui a sua preparação.
REFERÊNCIAS:
Capítulo C.8 deste anexo: Toxicidade em relação às minhocas.
Meller M., Egeler P., Rombke J., Schallnass H., Nagel R., Streit B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10-20.
Apêndice 4
Características químicas de uma água de diluição adequada
|
Substância
|
Concentrações
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgânico total
|
< 2 mg/l
|
|
Amoníaco não ionizado
|
< 1 μg/l
|
|
Dureza expressa em CaCO3
|
< 400 mg/l (20)
|
|
Cloro residual
|
< 10 μg/l
|
|
Pesticidas organofosforados totais
|
< 50 ng/l
|
|
Soma dos pesticidas organoclorados e dos bifenilos policlorados, totais
|
< 50 ng/l
|
|
Cloro orgânico total
|
< 25 ng/l
|
Apêndice 5
Orientações para a monitorização da emergência das larvas de quironomídeos
Os copos de ensaio são munidos de armadilhas de emergência. Estas armadilhas são necessárias a partir do vigésimo dia, até ao final do ensaio. A título de exemplo, pode utilizar-se o dispositivo abaixo ilustrado:
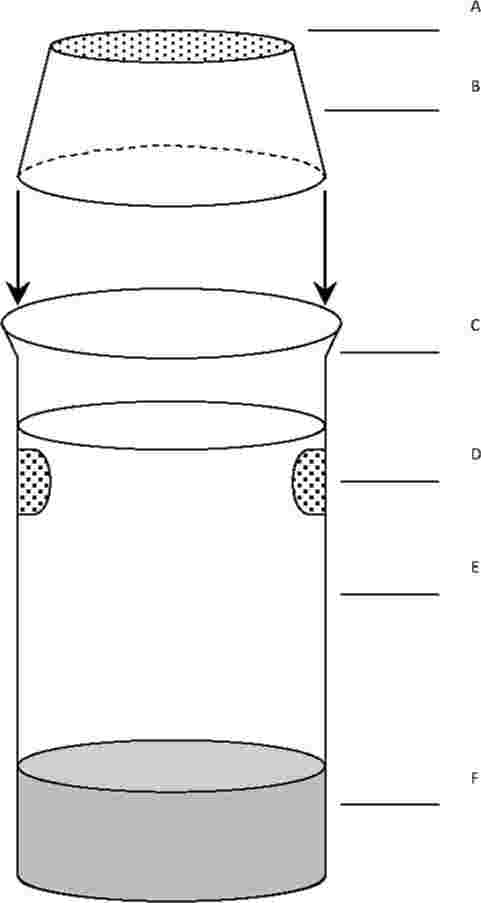
|
A
|
:
|
tela de nylon
|
|
B
|
:
|
copo de plástico invertido
|
|
C
|
:
|
copo de exposição sem bico
|
|
D
|
:
|
aberturas recobertas, para renovação da água
|
|
E
|
:
|
água
|
|
F
|
:
|
sedimentos
|
C.29. BIODEGRADABILIDADE "FÁCIL" — CO2 EM RECIPIENTES FECHADOS (Ensaio do espaço livre)
INTRODUÇÃO
|
1.
|
O presente método de ensaio é equivalente ao Test Guideline TG 310 da OCDE (2006). Consiste num método exploratório para a avaliação da biodegradabilidade "fácil" dos produtos químicos e proporciona informações semelhantes às dos seis métodos de ensaio descritos no capítulo C.4 do presente anexo (A a F). Assim, um produto químico com resultados positivos neste método de ensaio pode ser considerado facilmente biodegradável e, por conseguinte, rapidamente degradável no ambiente.
|
|
2.
|
O método do dióxido de carbono (CO2) (1), que se encontra bem implantado, baseia-se no ensaio original de Sturm (2) para a avaliação da biodegradabilidade de produtos químicos orgânicos através da medição do dióxido de carbono produzido pela ação microbiana e tem constituído, em geral, a primeira opção para o ensaio de produtos químicos pouco solúveis e de produtos químicos muito adsorventes. É também aplicado a produtos químicos solúveis (mas não voláteis), uma vez que a libertação de dióxido de carbono é frequentemente considerada a única prova inequívoca de atividade microbiana. A remoção do carbono orgânico dissolvido pode ter lugar por processos físico-químicos, como a adsorção, a volatilização, a precipitação e a hidrólise, bem como pela ação microbiana e por muitas reações não biológicas que consomem oxigénio; o CO2 raramente é produzido a partir de produtos químicos orgânicos por via abiótica. Nos ensaios original e modificado de Sturm (1)(2), o CO2 é removido da fase líquida para os recipientes de absorção por borbulhamento, no meio líquido, de ar tratado com o objetivo de remover o CO2; na versão de Larson (3)(4), é transferido do recipiente de reação para os absorventes introduzindo um fluxo de ar isento de CO2 no espaço livre acima da superfície ("headspace"), com agitação contínua do recipiente de ensaio. O recipiente só é agitado no caso da modificação de Larson; a agitação é prescrita, apenas para produtos químicos insolúveis, na norma ISO 9439 (5) e na versão original dos EUA (6), que preconizam ambas o borbulhamento em vez da substituição do ar no espaço livre acima da superfície. Em outro método oficial da EPA — Estados Unidos da América (7) —, que se baseia no método de Gledhill (8), o recipiente de reação, sob agitação, encontra-se estanque e o CO2 produzido é recolhido, diretamente a partir da fase gasosa, num coletor interno com uma substância alcalina, como nos respirómetros clássicos de Warburg/Barcroft.
|
|
3.
|
Contudo, no caso da aplicação do ensaio de Sturm modificado a vários produtos químicos (9), demonstrou-se que, durante o ensaio, se acumula no meio carbono inorgânico (CI). Na degradação de 20 mg C/l de anilina, por exemplo, observou-se uma concentração de carbono inorgânico da ordem de 8 mg/l. Assim, a recolha de CO2 em coletores com substâncias alcalinas traduz a quantidade real daquele gás produzida microbiologicamente nas fases intermédias da degradação. Por conseguinte, a exigência de mais de 60 % da produção máxima teórica de CO2 (CO2Te) ser recolhida nos dez dias imediatamente após ser alcançado um nível de 10 % de biodegradação ("período de dez dias"), para que um produto químico seja classificado de facilmente biodegradável, não é cumprida no caso de alguns produtos químicos, que teriam essa classificação utilizando como critério a remoção do carbono orgânico dissolvido (COD).
|
|
4.
|
Se a percentagem de degradação for inferior ao previsto, ter-se-á possivelmente acumulado carbono inorgânico na solução de ensaio. A biodegradabilidade pode, então, ser avaliada por recurso aos outros ensaios de biodegradabilidade "fácil".
|
|
5.
|
Outros inconvenientes do método de Sturm (complexidade, morosidade, propensão para a ocorrência de erros experimentais e impossibilidade de aplicação a produtos químicos voláteis) tinham já levado à procura de uma técnica com recipientes selados diversa da de Gledhill, sem fluxo de gás (10)(11). Boatman et al. (12) analisaram os métodos mais antigos e adotaram um sistema fechado com libertação de CO2 no espaço livre no final da incubação, por acidificação do meio. O CO2 foi determinado através da análise do carbono inorgânico por cromatografia em fase gasosa a partir de amostras colhidas automaticamente no espaço livre, sem ter em conta o carbono inorgânico dissolvido (CID) na fase líquida. Além disso, foram utilizados recipientes muito pequenos (20 ml), com apenas 10 ml de meio, o que causou problemas, por exemplo, ao adicionar as quantidades necessariamente muito reduzidas de produtos químicos insolúveis e/ou no caso da inexistência ou insuficiência, no meio inoculado, de microrganismos para a degradação dos produtos químicos em estudo.
|
|
6.
|
Essas dificuldades foram superadas pelos estudos independentes de Struijs e Stoltenkamp (13) e de Birch e Fletcher (14), sendo os destes últimos inspirados pela experiência dos autores com dispositivos utilizados em ensaios de biodegradação anaeróbia (15). No método dos primeiros (13), o CO2 é determinado no espaço livre após acidificação e equilíbrio, enquanto no segundo método (14) é determinado o carbono inorgânico dissolvido das fases gasosa e líquida, sem tratamento; mais de 90 % do carbono inorgânico formado encontra-se na fase líquida. Ambos os métodos têm vantagens relativamente ao ensaio de Sturm, na medida em que o sistema de ensaio é mais compacto e mais gerível, podem estudar-se produtos químicos voláteis e evita-se a possibilidade de demoras na determinação do CO2 produzido.
|
|
7.
|
Ambas as abordagens foram combinadas na norma ISO com a referência 16, que foi sujeita a um ensaio interlaboratorial (17) e constitui a base do presente método de ensaio. O método da EPA dos Estados Unidos da América (18) utiliza também as duas abordagens. Foram recomendados dois métodos de determinação do CO2, designadamente a determinação no espaço livre após acidificação (13) e a determinação do carbono inorgânico na fase líquida após adição de um agente alcalino em excesso. Este último método foi introduzido por Peterson, no decurso do ensaio interlaboratorial da CONCAWE (19) do presente método de espaço livre modificado para determinar biodegradabilidades intrínsecas. As alterações introduzidas na revisão de 1992 dos métodos do capítulo C.4 deste anexo, relativos à determinação da biodegradabilidade "fácil" (20), foram incorporadas no presente método de ensaio, pelo que, além disso, as condições (meio, duração, etc.) são as mesmas que as do ensaio de Sturm revisto (20). Birch e Fletcher (14) referiram ter obtido com este ensaio de espaço livre resultados muito semelhantes aos obtidos, para os mesmos produtos químicos, no ensaio interlaboratorial dos métodos de ensaio revistos promovido pela OCDE (21).
|
PRINCÍPIO DO MÉTODO
|
8.
|
O produto químico em estudo, em geral na concentração de 20 mg C/l, que constitui a única fonte de carbono e energia, é incubado num tampão de sais minerais previamente inoculado com uma população mista de microrganismos. O ensaio é realizado em recipientes selados, com ar no espaço livre acima do líquido, que proporciona uma reserva de oxigénio para a biodegradação aeróbia. A libertação de CO2 resultante da biodegradação aeróbia total do produto químico em estudo é determinada pela medição do excesso de carbono inorgânico produzido nos recipientes de ensaio relativamente ao produzido em recipientes de ensaio em branco que contêm apenas o meio inoculado. A extensão da biodegradação é expressa em percentagem da produção máxima teórica de carbono inorgânico (CITe), com base na quantidade de produto químico em estudo, expressa em carbono orgânico, inicialmente adicionada.
|
|
9.
|
Pode também determinar-se (20) a remoção de COD e/ou o grau de biodegradação primária do produto químico em estudo.
|
INFORMAÇÕES SOBRE O PRODUTO QUÍMICO EM ESTUDO
|
10.
|
Para o cálculo da percentagem de degradação, é necessário conhecer o teor de carbono orgânico (% ponderal) do produto químico em estudo, quer a partir da sua estrutura química quer por análise. No caso dos produtos químicos voláteis, o conhecimento da constante da lei de Henry, por medição ou cálculo, é útil para determinar uma razão adequada entre o espaço livre e o volume de líquido. É útil dispor de informações sobre a toxicidade do produto químico em estudo para os microrganismos, a fim de selecionar as concentrações de ensaio adequadas e para interpretar resultados de baixa biodegradabilidade: recomenda-se a realização de controlos de inibição, exceto se se souber que o produto químico não inibe a atividade microbiana (ver o ponto 24).
|
APLICABILIDADE DO MÉTODO
|
11.
|
O ensaio é aplicável a produtos químicos solúveis e insolúveis em água, embora deva assegurar-se uma boa dispersão do produto químico. Utilizando a proporção recomendada de 1:2 entre o espaço livre e o volume de líquido, podem utilizar-se produtos químicos voláteis com uma constante da lei de Henry não superior a 50 Pa.m3.mol–1, dado que a percentagem do produto químico no espaço livre não excederá 1 % (13). Pode utilizar-se um volume menor de espaço livre no ensaio de produtos químicos mais voláteis, cuja biodisponibilidade possa ser um fator limitante, em especial se forem pouco solúveis em água. No entanto, os utilizadores devem assegurar que a razão entre o espaço livre e o volume de líquido, bem como a concentração do produto químico, proporcionam uma quantidade suficiente de oxigénio para permitir a biodegradação aeróbia completa, evitando, por exemplo, o recurso a uma concentração elevada de substrato e a um espaço livre reduzido. As referências (13) e (23) contêm orientações nesta matéria.
|
PRODUTOS QUÍMICOS DE REFERÊNCIA
|
12.
|
A fim de verificar o procedimento, deve submeter-se a ensaio, em paralelo, uma substância de referência de biodegradabilidade conhecida. Para o efeito, a anilina, o benzoato de sódio e o etilenoglicol podem ser utilizados com produtos químicos solúveis em água, podendo utilizar-se o 1-octanol no caso de produtos químicos pouco solúveis (13). A biodegradação destes produtos químicos deve ser superior a 60 % do carbono inorgânico teórico, em 14 dias.
|
REPRODUTIBILIDADE
|
13.
|
No ensaio interlaboratorial do método, promovido pela ISO (17), foram obtidos os seguintes resultados utilizando as condições recomendadas, nomeadamente uma concentração do produto químico em estudo de 20 mg C/l.
|
Produto químico
|
Percentagem média de biodegradação
(28 dias)
|
Coeficiente de variação
(%)
|
Número de laboratórios
|
|
Anilina
|
90
|
16
|
17
|
|
1-Octanol
|
85
|
12
|
14
|
Com anilina, a variabilidade interna dos ensaios (indicador de replicabilidade) foi reduzida, não excedendo os coeficientes de variabilidade 5 % em quase todas as séries de ensaios. Nos dois casos em que a replicabilidade foi pior, a variabilidade mais elevada deveu-se provavelmente à elevada produção de carbono inorgânico nos ensaios em branco. Com 1-octanol, registou-se uma replicabilidade mais baixa, embora com variabilidade inferior a 10 % em 79 % das séries de ensaios. Esta maior variabilidade interna dos ensaios pode ter sido devida a erros de dosagem, dado que foi necessário injetar um pequeno volume (3 a 4 μl) de 1-octanol nos recipientes de ensaio selados. Obtém-se coeficientes de variação superiores quando se utilizam concentrações mais baixas do produto químico em estudo, nomeadamente inferiores a 10 mg C/l. Este problema pode ser parcialmente superado reduzindo a concentração de carbono inorgânico total (CIT) no inóculo.
|
|
14.
|
Num ensaio interlaboratorial promovido pela UE (24) de cinco produtos químicos tensioativos adicionadas na concentração de 10 mg C/l, foram obtidos os seguintes resultados:
|
Produto químico
|
Percentagem média de biodegradação
(28 dias)
|
Coeficiente de variação
(%)
|
Número de laboratórios
|
|
Benzenossulfonato de tetrapropileno
|
17
|
45
|
10
|
|
Di-iso-octilssulfosuccinato
(aniónico)
|
72
|
22
|
9
|
|
Cloreto de hexadeciltrimetil-amónio (21)
(catiónico)
|
75
|
13
|
10
|
|
(Etoxilato)9 de isononilfenol
(não iónico)
|
41
|
32
|
10
|
|
Amidopropil de coco-dimetil-hidroxissulfobetaína
(anfotérico)
|
60
|
23
|
11
|
Os resultados mostram que, de um modo geral, a variabilidade foi superior no caso dos tensioativos menos degradados. A variabilidade interna dos ensaios foi inferior a 15 % em mais de 90 % dos casos; o maior valor registado foi da ordem de 30 % a 40 %.
|
NOTA:
|
Na sua maioria, os tensioativos não são espécies moleculares simples, mas misturas de isómeros, homólogos, etc., com tempos de degradação característicos diferentes e constantes cinéticas diferentes, que produzem curvas mal definidas e atenuadas. Poderá, portanto, não ser possível atingir o limiar de 60 % no período de 10 dias, embora cada espécie molecular ultrapasse esse valor em 10 dias se for ensaiada isoladamente. Este facto também pode ser observado com outras misturas complexas.
|
|
DESCRIÇÃO DO MÉTODO
Equipamento
|
15.
|
Material corrente de laboratório, nomeadamente:
|
a)
|
frascos de soro de vidro, selados com rolhas de borracha butílica e cápsulas de alumínio. A capacidade recomendada é "125 ml", a que corresponde um volume total de cerca de 160 ml (neste caso, o volume de cada frasco deve ser comprovadamente de 160 ± 1 ml). Se os resultados satisfizerem as condições descritas nos pontos 66 e 67, pode utilizar-se recipientes de capacidade inferior;
|
|
b)
|
analisador de carbono ou outro instrumento (p. ex. cromatógrafo de gás) para a determinação do carbono inorgânico;
|
|
c)
|
seringas de elevada precisão para amostras gasosas e líquidas;
|
|
d)
|
agitador orbital num ambiente com controlo de temperatura;
|
|
e)
|
fonte de ar isento de CO2 — este ar pode ser preparado fazendo passar uma corrente de ar por grânulos de cal sodada ou utilizando uma mistura gasosa com 80 % N2/20 % 02 (opcional) (ver o ponto 28);
|
|
f)
|
dispositivo de filtração com membrana de porosidade 0,20-0,45 μm (opcional);
|
|
g)
|
analisador de carbono orgânico (opcional).
|
|
Reagentes
|
16.
|
Utilizar reagentes de qualidade analítica em todo o processo.
|
Água
|
17.
|
Deve utilizar-se água destilada ou desionizada com teor de carbono orgânico total não superior a 1 mg/l. Este valor não excede 5 % do teor de carbono orgânico inicial introduzido pela dose recomendada do produto químico em estudo.
|
Soluções-mãe para o meio de sais minerais
|
18.
|
As soluções-mãe e o meio de sais minerais são semelhantes aos utilizados nos ensaios ISO 14593 (16) e C.4 ("Biodegradabilidade 'fácil'") (20). A utilização de uma concentração mais elevada de cloreto de amónio (2,0 g/l em vez de 0,5 g/l) só é necessária em casos muito excecionais, por exemplo, se a concentração do produto químico em estudo exceder 40 mg de C/l. As soluções-mãe devem ser armazenadas com refrigeração e eliminadas após seis meses (ou antes, se existirem indícios de precipitação ou de crescimento microbiano). Preparar as seguintes soluções-mãe:
|
a)
|
di-hidrogenofosfato de potássio (KH2PO4) 8,50g
hidrogenofosfato de dipotássio (K2HPO4) 21,75g
hidrogenofosfato de dissódio di-hidratado (Na2HPO4.2H2O) 33,40g
cloreto de amónio (NH4Cl) 0,50g
Dissolver em água e ajustar para 1 litro. O pH desta solução deve ser de 7,4 (± 0,2). Se tal não for o caso, preparar uma solução nova;
|
|
b)
|
cloreto de cálcio di-hidratado (CaCl2.2H2O) 36,40g
Dissolver em água e ajustar para 1 litro;
|
|
c)
|
sulfato de magnésio hepta-hidratado (MgSO4.7H2O) 22,50g
Dissolver em água e ajustar para 1 litro;
|
|
d)
|
cloreto de ferro (III) hexa-hidratado (FeCl3.6H20) 0,25g
Dissolver em água e ajustar para 1 litro, adicionando de seguida uma gota de ácido concentrado.
|
|
Preparação do meio de sais minerais
|
19.
|
Dissolver 10 ml de solução (a) em cerca de 800 ml de água (ponto 17), adicionando de seguida 1 ml das soluções (b), (c) e (d), e ajustar o volume para 1 litro com água (ponto 17).
|
Outros reagentes
|
20.
|
Ácido ortofosfórico (H3PO4) concentrado (> 85 %, em massa por volume).
|
Solução de hidróxido de sódio 7 M
|
21.
|
Dissolver 280 g de hidróxido de sódio (NaOH) em 1 litro de água (ponto 17). Determinar a concentração de carbono inorgânico dissolvido da solução e ter em conta este valor no cálculo do resultado do ensaio (ver os pontos 55 e 61), nomeadamente à luz do critério de validade que consta do ponto 66, alínea b). Se a concentração de carbono inorgânico dissolvido for demasiado elevada, preparar uma solução nova.
|
Produto químico em estudo
|
22.
|
Preparar uma solução-mãe de um produto químico suficientemente hidrossolúvel, em água (ponto 17) ou no meio de ensaio (ponto 19), a uma concentração de preferência 100 vezes superior à concentração final a utilizar no ensaio; pode ser necessário ajustar o pH da solução-mãe. Esta solução deve ser adicionada ao meio mineral, de modo a obter uma concentração final de carbono orgânico compreendida entre 2 e 40 mg C/l (de preferência 20 mg C/l). A utilização de concentrações inferiores a estas pode comprometer a precisão dos resultados. Os produtos químicos líquidos solúveis e insolúveis podem ser diretamente introduzidos nos recipientes por meio de seringas de alta precisão. Os produtos químicos pouco solúveis e insolúveis podem exigir um tratamento especial (25). As opções nesta matéria são as seguintes:
|
a)
|
adição direta de quantidades pesadas conhecidas;
|
|
b)
|
dispersão por meio de ultrassons antes da adição;
|
|
c)
|
dispersão com o auxílio de agentes emulsionantes, sendo necessário determinar antes da adição se os mesmos têm efeitos inibidores ou estimulantes da atividade microbiana;
|
|
d)
|
adsorção do produto químico líquido, ou de uma solução num solvente volátil adequado, num meio ou suporte inerte (por exemplo, filtro de fibra de vidro), seguida de evaporação do solvente, se utilizado, e adição direta de quantidades conhecidas;
|
|
e)
|
colocação no recipiente de ensaio vazio de um volume conhecido de uma solução do produto químico em estudo num solvente muito volátil, seguida de evaporação do solvente.
|
É necessário verificar se os agentes ou solventes utilizados nas alíneas c), d) e e) têm efeitos estimulantes ou inibidores da atividade microbiana — ver o ponto 42, alínea b).
|
Produto químico de referência
|
23.
|
Preparar uma solução-mãe do produto químico (solúvel) de referência em água (ponto 17), com uma concentração, de preferência, 100 vezes superior à concentração final a utilizar no ensaio (20 mg C/l).
|
Verificação da inibição
|
24.
|
Frequentemente, os produtos químicos estudados não sofrem degradação significativa nas condições utilizadas nas avaliações de biodegradabilidade "fácil". Uma das causas possíveis deste facto reside no efeito inibidor, para o inóculo, do produto químico em estudo, às concentrações em que é utilizado no ensaio. A verificação da inibição pode ser incluída no procedimento de ensaio, para facilitar a identificação (a posteriori) da inibição como causa possível ou fator contribuinte. A verificação da inibição também permite excluir essas interferências e demonstrar que a ausência de degradação ou a ocorrência de uma degradação ligeira é apenas atribuível a condições de ensaio pouco propícias à ação microbiana. A fim de obter informações sobre a toxicidade do produto químico em estudo para microrganismos (aeróbios), preparar uma solução, no meio de ensaio, do produto químico em estudo e do produto químico de referência (ponto 19), cada um nas concentrações utilizadas no ensaio (ver os pontos 22 e 23).
|
Inóculo
|
25.
|
O inóculo pode ter várias origens: lamas ativadas, efluentes de águas residuais (não clorados), águas de superfície e solos ou uma mistura destes (20). A atividade de biodegradação da fonte do inóculo deve ser verificada por recurso a um produto químico de referência. Independentemente da fonte, não devem ser utilizados microrganismos anteriormente expostos ao produto químico em estudo para ensaios de determinação da biodegradabilidade "fácil".
|
Atenção:
|
As lamas ativadas, e as águas residuais ou os efluentes de águas residuais, contêm organismos patogénicos, pelo quem devem ser manipulados com cuidado.
|
|
|
26.
|
De acordo com a experiência adquirida, o volume ótimo de inóculo satisfaz as seguintes condições:
|
—
|
é suficiente para proporcionar uma atividade de biodegradação adequada,
|
|
—
|
degrada o produto químico de referência na percentagem estabelecida (ver o ponto 66),
|
|
—
|
origina 102 a 105 unidades formadoras de colónias por mililitro, na mistura final,
|
|
—
|
origina, em geral, uma concentração de 4 mg/l de sólidos em suspensão na mistura final quando se utilizam lamas ativadas; é possível utilizar concentrações até 30 mg/l, que podem, contudo, aumentar significativamente a produção de CO2 nos ensaios em branco (26),
|
|
—
|
representa menos de 10 % da concentração inicial de carbono orgânico introduzida pelo produto químico em estudo,
|
|
—
|
é, geralmente, da ordem de 1-10 ml por litro de solução de ensaio.
|
|
Lamas ativadas
|
27.
|
As lamas ativadas são recolhidas do frasco no tanque de arejamento de uma estação de tratamento de águas residuais, ou unidade à escala laboratorial, que trate essencialmente esgotos domésticos. Se necessário, as partículas grosseiras devem ser removidas por crivagem (p. ex., através de um crivo de malha de 1 mm2); as lamas devem ser mantidas em condições aeróbias até à sua utilização.
|
|
28.
|
Em alternativa, após a remoção das partículas grosseiras eventualmente presentes, deixar sedimentar ou centrifugar (por exemplo, a 1 100 g durante 10 minutos). Remover o líquido sobrenadante. As lamas podem ser lavadas na solução de sais minerais. Preparar uma suspensão das lamas concentradas no meio de sais minerais, de forma a obter uma concentração de 3-5 g de sólidos em suspensão/l. Proceder de seguida ao arejamento enquanto for necessário.
|
|
29.
|
As lamas devem ser obtidas numa estação de tratamento convencional em bom estado de funcionamento. Se forem obtidas numa estação de tratamento de débito elevado ou se nelas se admitir a presença de inibidores, devem ser lavadas. Após obter uma mistura homogénea, deixar sedimentar ou centrifugar as lamas repostas em suspensão, rejeitar o sobrenadante e preparar nova suspensão das lamas lavadas num novo volume de meio de sais minerais. Repetir este procedimento até que as lamas possam considerar-se isentas de substrato em excesso ou de inibidor.
|
|
30.
|
Quando a nova suspensão estiver preparada, ou no caso de se utilizarem lamas não tratadas, colher uma amostra imediatamente antes da utilização, para determinar a massa seca dos sólidos em suspensão.
|
|
31.
|
A homogeneização das lamas ativadas (3-5 g de sólidos em suspensão/l) constitui uma alternativa. Tratar as lamas num misturador de Waring durante dois minutos, a velocidade média. Deixar sedimentar a mistura de lamas durante 30 minutos ou, se necessário, por um período mais longo, e decantar o líquido, para utilização das lamas como inóculo na proporção de 10 mg/l de meio de sais minerais.
|
|
32.
|
É possível obter uma redução ainda maior do CO2 libertado no ensaio em branco através do arejamento das lamas durante a noite com ar isento de CO2. Utilizar como inóculo no presente ensaio 4 mg de sólidos das lamas ativadas por litro (13).
|
Efluente secundário de águas residuais
|
33.
|
Em alternativa, o inóculo pode ser colhido num efluente secundário de uma estação de tratamento, ou unidade à escala laboratorial, que trate essencialmente esgotos domésticos. Manter a amostra em condições aeróbias e utilizar no dia da colheita, ou efetuar um pré-acondicionamento, se necessário. Deve utilizar-se um filtro para remover as partículas grosseiras do efluente, determinando-se também o pH.
|
|
34.
|
Para reduzir o teor de carbono inorgânico do filtrado, borbulha-se neste ar isento de CO2 — ponto 15, alínea e) — durante 1 h, mantendo o pH a 6,5 com o auxílio de ácido ortofosfórico (ponto 20). O pH inicial é reposto com o auxílio de uma solução de hidróxido de sódio (ponto 21); após sedimentação durante cerca de 1 h, toma-se uma alíquota do sobrenadante para inoculação. Este procedimento permite reduzir o teor de carbono inorgânico do inóculo. Por exemplo, quando se utiliza como inóculo o volume máximo recomendado de efluente filtrado borbulhado (100 ml) por litro, a quantidade de carbono inorgânico presente nos recipientes de ensaio em branco é da ordem de 0,4 a 1,3 mg/l (14), o que representa 2 % a 6,5 % do carbono do produto químico em estudo, relativamente a uma concentração de 20 mg C/l, e 4 % a 13 %, relativamente a uma concentração de 10 mg C/l.
|
Águas de superfície
|
35.
|
Colher uma amostra de uma água de superfície adequada. A amostra deve ser mantida em condições aeróbias e ser utilizada no dia da colheita. Se necessário, deve ser concentrada por filtração ou centrifugação. O volume de inóculo a utilizar em cada recipiente de ensaio deve satisfazer as condições enunciadas no ponto 26.
|
Solos
|
36.
|
Colhe-se uma amostra de um solo adequado, a uma profundidade não superior a 20 cm. Deve remover-se da amostra pedras, restos vegetais e invertebrados, após o que a amostra é peneirada através de uma malha de 2 mm (se a amostra estiver demasiado húmida para ser peneirada de imediato, secá-la parcialmente ao ar para facilitar a operação). A amostra deve ser mantida em condições aeróbias e ser utilizada no dia da colheita (se for transportada num saco de polietileno negro não hermético, pode ser armazenada nesse saco, a uma temperatura de 2 a 4 °C, pelo período máximo de um mês).
|
Pré-acondicionamento do inóculo
|
37.
|
Os inóculos podem ser pré-acondicionados para as condições experimentais, mas não podem ser pré-adaptados ao produto químico em estudo. O pré-acondicionamento pode reduzir a libertação de CO2 nos recipientes de ensaio em branco. A operação consiste em arejar as lamas ativadas, durante cinco a sete dias, com ar húmido isento de CO2, à temperatura de ensaio, após diluição para 30 mg/l no meio de ensaio.
|
PROCEDIMENTO
Número de frascos
|
38.
|
O número de frascos — ponto 15, alínea a) — necessários depende da frequência das análises e da duração do ensaio.
|
|
39.
|
Recomenda-se a análise de frascos em triplicado após um número suficiente de períodos, de modo a permitir a identificação do período de 10 dias. Devem também analisar-se, pelo menos, cinco frascos — ponto 15, alínea a) — das séries a), b) e c) (ver o ponto 42), no final do ensaio, para permitir o cálculo de intervalos de confiança de 95 % para a percentagem média de biodegradação.
|
Meio inoculado
|
40.
|
O inóculo é utilizado numa concentração de 4 mg de sólidos secos de lamas ativadas por litro. Preparar, imediatamente antes da utilização, uma quantidade suficiente de meio inoculado, por exemplo, adicionando 2 ml de lamas ativadas sujeitas a um tratamento adequado (pontos 27 a 32), à concentração de 2 000 mg/l, a 1 litro de meio de sais minerais (ponto 19). Se forem utilizados efluentes secundários de águas residuais, adicionar 100 ml de efluente (ponto 33) a 900 ml de meio de sais minerais (ponto 19) e diluir para 1 litro com o meio.
|
Preparação dos frascos
|
41.
|
Coloca-se alíquotas de meio inoculado em séries de frascos replicados, de forma a obter uma proporção espaço livre/líquido de 1:2 (colocar, por exemplo, 107 ml em frascos de 160 ml de capacidade). Pode utilizar-se outras proporções, atendendo, contudo, às recomendações que constam do ponto 11. Qualquer que seja o tipo de inóculo utilizado, deve assegurar-se que o meio inoculado está devidamente homogeneizado, tendo em vista a sua distribuição uniforme nos frascos de ensaio.
|
|
42.
|
Prepara-se as seguintes séries de frascos – ponto 15, alínea a):
|
a)
|
recipientes de ensaio (assinalados por FT), que contêm o produto químico em estudo;
|
|
b)
|
recipientes de ensaio em branco (assinalados por FB) que contêm apenas o meio de ensaio e o inóculo; devem adicionar-se também quaisquer produtos químicos, solventes, agentes ou filtros de fibra de vidro utilizados para a introdução do produto químico em estudo nos recipientes de ensaio;
|
|
c)
|
recipientes para controlo do processo (assinalados por FC), que contêm o produto químico de referência;
|
|
d)
|
se necessário, recipientes destinados à verificação do possível efeito inibidor do produto químico em estudo (assinalados por FI), que contêm este e o produto químico de referência nas mesmas concentrações que, respetivamente, os frascos FT e FC (ponto 24);
|
|
e)
|
recipientes (assinalados por FS) destinados à verificação da possível degradação abiótica, preparados como descrito na alínea a), mas contendo, além disso, 50 mg/l de HgCl2 ou esterilizados por outros meios (por exemplo, tratamento em autoclave).
|
|
|
43.
|
Os produtos químicos em estudo e de referência hidrossolúveis são adicionados na forma de soluções-mãe aquosas (pontos 22, 23 e 24), de modo a obter uma concentração de 10 a 20 mg C/l.
|
|
44.
|
Os produtos químicos em estudo e de referência insolúveis em água são introduzidos nos frascos de diversas formas — ver o ponto 22, alíneas a)-e) —, consoante a sua natureza, antes ou depois da adição do meio inoculado, em função do método de tratamento do produto químico em estudo. Se for utilizado um dos métodos indicados no ponto 22, alíneas a) a e), os frascos FB — ponto 42, alínea b) — devem ser tratados de forma idêntica, mas sem o produto químico em estudo e o produto químico de referência.
|
|
45.
|
Os produtos químicos em estudo voláteis devem ser injetados nos frascos selados (ponto 47) com o auxílio de uma microsseringa. A dose é calculada com base no volume injetado e na densidade do produto.
|
|
46.
|
Quando necessário, deve acrescentar-se água aos recipientes, de forma que o volume de líquido seja idêntico em todos eles. Deve garantir-se que a razão entre o espaço livre e o volume de líquido (geralmente 1:2), bem como a concentração do produto químico em estudo, sejam tais que a quantidade de oxigénio presente no espaço livre seja suficiente para permitir a biodegradação completa.
|
|
47.
|
Seguidamente, todas as garrafas são seladas, por exemplo, com rolhas de borracha butílica e cápsulas de alumínio. Os produtos químicos em estudo voláteis devem ser introduzidos nesta fase (ponto 45). Caso se pretenda monitorizar o decréscimo da concentração de COD da solução de ensaio e efetuar análises da concentração inicial de carbono inorgânico — controlos "estéreis"; ponto 42, alínea e) — ou outras determinações, colher uma amostra adequada do recipiente de ensaio. O recipiente de ensaio e o seu conteúdo são, em seguida, eliminados.
|
|
48.
|
Os frascos selados são colocados num agitador rotativo — ponto 15, alínea d) —, com uma agitação suficiente para manter o conteúdo homogeneizado e em suspensão (por exemplo, 150 a 200 rpm), e incubados, no escuro, à temperatura de 20 °C ± 1 °C.
|
Amostragem
|
49.
|
O padrão de amostragem depende do período de latência e da taxa cinética de biodegradação do produto químico em estudo. Retiram-se frascos para análise no dia da colheita de amostras, que deve ocorrer, pelo menos, uma vez por semana, ou, caso se pretenda obter uma curva de degradação completa, com uma frequência superior (por exemplo, duas vezes por semana). Retira-se do agitador o número necessário de frascos replicados, designadamente FT, FB e FC e, se for caso disso, FI e FS (ver o ponto 42). O ensaio prolonga-se, geralmente, por 28 dias. Se a curva de biodegradação exibir um patamar antes do 28.o dia, o ensaio pode ser concluído. Colher, para análise, amostras dos cinco frascos reservados para o 28.o dia e utilizar os resultados para calcular os limites de confiança ou o coeficiente de variação da percentagem de biodegradação. Os frascos respeitantes ao controlo da inibição e da degradação abiótica não necessitam de amostragem tão frequente quanto os restantes frascos; basta colher amostras no 1.o e no 28.o dia.
|
Análise do carbono inorgânico
|
50.
|
A produção de CO2 nos frascos é determinada através da medição do aumento da concentração de carbono inorgânico (CI) durante a incubação. Recomendam-se dois métodos para a medição da quantidade de carbono inorgânico produzida no ensaio, que se descrevem a seguir. Dado que os métodos podem conduzir a resultados ligeiramente diferentes, deve ser utilizado apenas um deles por série de ensaios.
|
|
51.
|
O método a) é recomendado se for provável que o meio contenha resíduos, nomeadamente, de filtros de fibra de vidro e/ou de produtos químicos em estudo insolúveis. Caso não se disponha de um analisador de carbono, esta análise poderá ser realizada por recurso a um cromatógrafo em fase gasosa. É importante que os frascos se encontrem à temperatura de ensaio, ou a uma temperatura próxima desta, quando se procede à análise do gás presente no espaço livre. O método b) pode ser de utilização mais fácil para os laboratórios que utilizam analisadores de carbono para determinar o carbono inorgânico. É importante que a solução de hidróxido de sódio (ponto 21) utilizada para converter o CO2 em carbonato seja preparada na altura ou que o seu teor de carbono inorgânico seja conhecido, a fim de que este parâmetro possa ser tido em conta no cálculo dos resultados dos ensaios — ver o ponto 66, alínea b).
|
Método a): acidificação a pH < 3
|
52.
|
Antes de efetuar cada série de análises, o analisador de carbono inorgânico é calibrado utilizando uma substância com um teor-padrão de carbono inorgânico — por exemplo, mistura a 1 % (m/m) de CO2 em N2. Injeta-se ácido ortofosfórico concentrado (ponto 20) através do septo de cada frasco de amostra, de forma a reduzir o pH do meio para menos de 3 (adicionar, por exemplo, 1 ml a 107 ml de meio de ensaio). Os frascos são então recolocados no agitador. Após agitação durante uma hora à temperatura de ensaio, os frascos são removidos do agitador, colhendo-se alíquotas (por exemplo, 1 ml) de gás no espaço livre de cada frasco, que se injetam no analisador de carbono inorgânico. As concentrações de carbono inorgânico são registadas em mg C/l.
|
|
53.
|
O princípio deste método reside em que, após acidificação a pH < 3 e equilíbrio a 20 °C, a constante de partição do CO2 entre as fases gasosa e líquida nos frascos de ensaio, determinada em termos de concentração, ser de 1,0 (13). Este facto deve ser comprovado, para o sistema de ensaio, pelo menos uma vez, do seguinte modo:
Preparar frascos com teores de carbono inorgânico de 5 e 10 mg/l, por recurso a uma solução de carbonato de sódio (Na2CO3) anidro em água isenta de CO2, preparada por acidificação de água a pH 6,5 com ácido ortofosfórico concentrado (ponto 20), na qual se fez borbulhar, de um dia para o outro, ar isento de CO2, e se neutralizou depois o pH com álcalis. Assegurar que a proporção entre o espaço livre e o volume de líquido é a mesma que nos ensaios (por exemplo, 1:2). Acidificar e deixar estabilizar do modo descrito no ponto 52, determinando de seguida as concentrações de carbono inorgânico no espaço livre e na fase líquida. Verificar se as concentrações são iguais, dentro dos limites do erro experimental. Se não forem, o operador deve reexaminar os procedimentos. Não é necessário verificar em cada ensaio a partição do carbono inorgânico entre as fases gasosa e líquida. A verificação pode, em geral, ser efetuada aquando da calibração.
|
|
54.
|
Caso se pretenda determinar a remoção do COD (apenas no caso de produtos químicos solúveis em água), devem colher-se amostras da fase líquida de frascos distintos (não acidificados), que são filtradas por uma membrana e injetadas no analisador de COD. Estes frascos podem ser utilizados para outras análises, consoante necessário, com o objetivo de determinar a biodegradação primária.
|
Método b): conversão de CO2 a carbonato
|
55.
|
Antes de cada série de análises, o analisador de carbono inorgânico é calibrado com um padrão adequado — por exemplo, uma solução de bicarbonato de sódio (NaHCO3) em água isenta de CO2 (ver o ponto 53), na gama de concentrações de carbono inorgânico de 0 a 20 mg/l. Injeta-se através do septo de cada frasco no qual se colhe uma amostra uma solução de hidróxido de sódio 7 M (ponto 21) — por exemplo, 1 ml em 107 ml de meio —, sendo esses frascos agitados durante 1 h à temperatura de ensaio. Utilizar a mesma solução de NaOH em todos os frascos retirados num determinado dia, mas não obrigatoriamente em todas as colheitas destas amostras ao longo do ensaio. Se forem necessários valores absolutos de concentrações de carbono inorgânico das amostras em branco quando de todas as colheitas de amostras, é necessário determinar o teor de carbono inorgânico da solução de NaOH em cada utilização. Remover os frascos em causa do agitador e colocá-los em repouso. Retirar com uma seringa volumes adequados (por exemplo, 50 a 1 000 μl) da fase líquida de cada frasco. Injetar as amostras no analisador de carbono inorgânico, registando as concentrações deste obtidas. Deve assegurar-se que o aparelho é adequado às amostras alcalinas produzidas no presente método.
|
|
56.
|
O princípio do método reside em que, após a adição de solução alcalina e a agitação, o teor de carbono inorgânico no espaço livre é insignificante. Este facto deve ser comprovado para cada sistema de ensaio pelo menos uma vez, por recurso a padrões de carbono inorgânico, mediante a adição de uma solução alcalina, estabilização e a determinação da concentração de carbono inorgânico no espaço livre e nas fases líquidas (ver o ponto 53). A concentração no espaço livre deve ser praticamente nula. Não é necessário verificar a absorção quase completa do CO2 em cada ensaio.
|
|
57.
|
Caso se pretenda determinar a remoção do COD (apenas no caso de produtos químicos solúveis em água), devem colher-se amostras da fase líquida de frascos distintos sem solução alcalina adicionada, que são filtradas por uma membrana e injetadas no analisador de COD. Estes frascos podem ser utilizados para outras análises, consoante necessário, com o objetivo de determinar a biodegradabilidade primária.
|
DADOS E RELATÓRIOS
Cálculo dos resultados
|
58.
|
Pressupondo que a mineralização do produto químico em estudo em CO2 é de 100 %, o teor de carbono inorgânico teórico (CITe) superior ao produzido nos frascos de ensaio em branco é igual ao COT adicionado a cada frasco no início dos ensaios, isto é:

A massa total (mg) de carbono inorgânico (CIT) em cada frasco é:
|
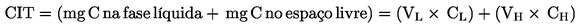
|
Equação 1
|
em que:
|
VL
|
=
|
volume de líquido no frasco (litros);
|
|
CL
|
=
|
concentração de carbono inorgânico no líquido (mg/l, expressa em carbono);
|
|
VH
|
=
|
volume do espaço livre (litros);
|
|
CH
|
=
|
concentração de carbono inorgânico no espaço livre (mg/l, expressa em carbono).
|
O cálculo do CIT em ambos os métodos de análise utilizados para a determinação do carbono inorgânico no presente ensaio é descrito nos pontos 60 e 61. A percentagem de biodegradação (% D), em ambos os casos, é dada por:
|
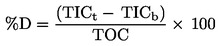
|
Equação 2
|
em que:
|
CITt
|
=
|
mg de CIT no frasco de ensaio, no instante t;
|
|
CITb
|
=
|
mg de CIT (em média) nos frascos de ensaio em branco, no instante t;
|
|
COT
|
=
|
mg de COT almente no recipiente de ensaio.
|
A percentagem de biodegradação (% D) é calculada para os frascos de ensaio (FT), de referência (FC) e, caso tenham sido incluídos, de controlo da inibição (FI), com base nas quantidades respetivas de CIT produzidas até ao instante da colheita de cada amostra.
|
|
59.
|
Caso se observe um aumento significativo do teor de CIT nos frascos de controlo estéreis (FS) no período de ensaio, pode concluir-se ter ocorrido degradação abiótica do produto químico em estudo, devendo este facto ser tido em conta no cálculo do parâmetro D na equação 2.
|
Acidificação para pH < 3
|
60.
|
Uma vez que a acidificação para pH < 3 e o posterior equilíbrio resultam na uniformização da concentração de carbono inorgânico total nas fases gasosa e líquida, apenas é necessário determinar a concentração de carbono inorgânico na fase gasosa. Aplica-se a equação 1

, em que VB é o volume do frasco de soro. |
Conversão do CO2 em carbonato
|
61.
|
No presente método, os cálculos são realizados como na equação 1, sem ter em conta a quantidade insignificante de carbono inorgânico na fase gasosa, ou seja,

e
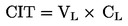
. |
Expressão dos resultados
|
62.
|
A curva de biodegradação é obtida através da representação gráfica da percentagem de biodegradação (D) em função do tempo de incubação, indicando-se, se possível, a fase de latência, a fase de degradação, o período de 10 dias e a fase de patamar, que é a fase na qual já se atingiu a degradação máxima e a curva de biodegradação estabilizou. Se forem obtidos resultados comparáveis (diferença inferior a 20 %) para os recipientes de ensaio em paralelo, FT, representa-se graficamente uma curva média (ver o apêndice 2, figura 1); se tal não for o caso, representam-se as curvas relativas a cada recipiente. Determina-se o valor médio da percentagem de biodegradação na fase de patamar ou identifica-se o valor mais elevado da mesma (por exemplo, quando a curva começa a infletir, na fase de patamar), mas, neste último caso, é importante verificar se o valor em causa não é anómalo. No relatório dos ensaios, este nível máximo de biodegradação deve ser expresso como "grau de biodegradação do produto químico em estudo". Se o número de recipientes de ensaio se tiver revelado insuficiente para definir uma fase de patamar, utilizam-se os dados determinados no último dia do ensaio para calcular um valor médio. Este valor (média de cinco replicados), serve de indicador da precisão de determinação da percentagem de biodegradação. Indicar também o valor obtido no final do período de 10 dias.
|
|
63.
|
Representar, do mesmo modo, a curva correspondente ao produto químico de referência (FC), bem como, se for caso disso, a curva relativa ao controlo da eliminação abiótica (FS) e a curva relativa ao controlo da inibição (FI).
|
|
64.
|
Registar os teores de carbono inorgânico total presentes nos ensaios em branco (FB), bem como, se for caso disso, os teores de CIT presentes nos frascos FS (controlo da eliminação abiótica).
|
|
65.
|
Calcular a degradação (D) para os recipientes FI a partir do rendimento teórico de carbono inorgânico previsto apenas com base no componente de referência da mistura. Se, no dia 28, [(DFC
(22) – DFI
(23))/DFC] x 100 > 25 %, pode presumir-se que o produto químico em estudo inibe a atividade do inóculo, facto que permite justificar os valores reduzidos de DFT obtidos nas condições de ensaio. Neste caso, pode repetir-se o ensaio com uma concentração mais baixa, reduzindo, de preferência, o CID no inóculo e o CIT formado nos ensaios em branco, dado que, se assim não for, a redução da concentração reduzirá a precisão do método. Em alternativa, pode utilizar-se outro inóculo. Se, no frasco FS (controlo da eliminação abiótica), se observar um aumento significativo (> 10 %) da quantidade de CIT, é possível que tenham ocorrido processos de degradação abiótica.
|
Validade dos resultados
|
66.
|
Um ensaio é considerado válido se:
|
a)
|
a percentagem média de degradação nos recipientes que contêm o produto químico de referência (FC) for superior a 60 % até ao 14.o dia de incubação; e
|
|
b)
|
a quantidade média de CIT presente nos ensaios em branco (FB) no final do ensaio for superior a 3 mg C/l.
|
Se estes valores-limite não forem satisfeitos, repetir o ensaio com um inóculo proveniente de outra fonte e/ou rever os procedimentos utilizados. Por exemplo, caso se registe uma elevada produção de carbono inorgânico no ensaio em branco, deve seguir-se o procedimento indicado nos pontos 27 a 32.
|
|
67.
|
Se o produto químico em estudo não gerar 60 % do teor de carbono inorgânico teórico e tiver sido demonstrado que não tem efeitos inibidores (ponto 65), pode repetir-se o ensaio com uma concentração mais elevada de inóculo (até 30 mg de lamas ativadas por litro e 100 ml de efluente por litro) ou com inóculos provenientes de outras fontes, nomeadamente nos casos em que a degradação se tenha situado na gama de 20 a 60 %.
|
Interpretação dos resultados
|
68.
|
A obtenção de uma biodegradação superior a 60 % do carbono inorgânico teórico no período de 10 dias do presente ensaio demonstra que o produto químico em estudo é facilmente biodegradável em condições aeróbias.
|
|
69.
|
Se o referido valor de 60 % não for atingido, determinar o pH no meio presente nos frascos que não tenham sido acidificados nem alcalinizados; um valor inferior a 6,5 pode indicar a ocorrência de nitrificação. Nesse caso, repetir o ensaio com uma solução-tampão de concentração mais elevada.
|
Relatório dos ensaios
|
70.
|
Elaborar um quadro com a percentagem de degradação para cada frasco de ensaio (FT), de referência (FC) e, se for caso disso, de controlo da inibição (FI), para cada dia de colheita de amostras. Se forem obtidos resultados comparáveis para os frascos replicados, traçar a curva da percentagem média de degradação (% D) em função do tempo. Registar o CIT nos frascos correspondentes aos ensaios em branco (FB) e aos controlos estéreis (FS), bem como o COD e/ou outros parâmetros, além da percentagem de remoção.
|
|
71.
|
Determinar o valor médio da percentagem de degradação na fase de patamar, ou utilizar o valor mais elevado, se a curva de biodegradação começar a infletir na fase de patamar, e apresentar um deles como "grau de biodegradação do produto químico em estudo". Neste último caso, importa garantir que o valor mais elevado não é um resultado anómalo.
|
|
72.
|
O relatório do ensaio deve incluir as seguintes informações:
|
|
Produto químico em estudo:
|
—
|
denominação comum, denominação química, número CAS, fórmula estrutural e propriedades físico-químicas pertinentes,
|
|
—
|
grau de pureza do produto químico (presença de impurezas).
|
|
|
|
Condições experimentais:
|
—
|
referência ao presente método,
|
|
—
|
descrição do sistema de ensaio utilizado (por exemplo, volume dos recipientes, proporção espaço livre/volume de líquido, método de agitação, etc.),
|
|
—
|
introdução do produto químico em estudo e do produto químico de referência no sistema de ensaio: concentração de ensaio utilizada, e quantidade de carbono introduzida, em cada frasco de ensaio, bem como os solventes eventualmente utilizados,
|
|
—
|
pormenores relativos ao inóculo utilizado, bem como a qualquer pré-tratamento e pré-acondicionamento,
|
|
—
|
temperatura de incubação,
|
|
—
|
validação do princípio de análise do carbono inorgânico,
|
|
—
|
principais características do analisador de carbono inorgânico (e de quaisquer outros métodos analíticos utilizados),
|
|
|
|
Resultados:
|
—
|
dados não tratados e valores de biodegradabilidade calculados, na forma de quadros,
|
|
—
|
gráfico da percentagem de degradação em função do tempo, para o produto químico em estudo e o produto químico de referência, fase de latência, fase de degradação, período de 10 dias e declive,
|
|
—
|
percentagem de remoção na fase de patamar, no final do ensaio e após o período de 10 dias,
|
|
—
|
motivos de uma eventual rejeição de resultados dos ensaios,
|
|
—
|
quaisquer outros factos relevantes ligados ao procedimento seguido,
|
|
—
|
discussão dos resultados.
|
|
|
REFERÊNCIAS:
|
(1)
|
Capítulo C.4 deste anexo: "Determinação da biodegradabilidade 'fácil' — Ensaio da libertação de CO2" (método C.4-C).
|
|
(2)
|
Sturm R.N. (1973): Biodegradability of Nonionic surfactants: screening test for predicting rate and ultimate biodegradation. J. A. Oil Chem. Soc. 50: 159-167.
|
|
(3)
|
Larson R.J. (1979): Estimation of biodegradation potential of xenobiotic organic chemicals. Appl. Env. Microbiol. 38: 1153-1161.
|
|
(4)
|
Larson R.J., Hansmann M.A., Bookland E.A. (1996): Carbon dioxide recovery in ready biodegradability tests: mass transfer and kinetic constants. Chemosphere 33: 1195-1210.
|
|
(5)
|
ISO 9439 (1990; revista em 1999). Water Quality — Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium — Carbon dioxide evolution Test (Sturm).
|
|
(6)
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3110 Carbon dioxide evolution test. Office Prevention Pesticides and Toxic Substances. Washington, DC.
|
|
(7)
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3100. Aerobic aquatic biodegradation. Office Prevention Pesticides and Toxic Substances. Washington, DC.
|
|
(8)
|
Gledhill W.E. (1975). Screening test for assessment of biodegradability: Linear alkyl benzene sulfonate. Appl. Microbiol. 30: 922-929.
|
|
(9)
|
Weytjens D., Van Ginneken I., Painter H.A. (1994): The recovery of carbon dioxide in the Sturm test for ready biodegradability. Chemosphere 28: 801-812.
|
|
(10)
|
Ennis D.M., Kramer A. (1975): A rapid microtechnique for testing biodegradability of nylons and polyamides. J. Food Sci. 40: 181-185.
|
|
(11)
|
Ennis D.M., Kramer A., Jameson C.W., Mazzoccki P.H., Bailey P. (1978). Appl. Env. Microbiol. 35: 51-53.
|
|
(12)
|
Boatman R., Cunningham S.L., Ziegler D.A. (1986). A method for measuring the biodegradation of organic chemicals. Env. Toxicol. Chem. 5: 233-243.
|
|
(13)
|
Struijs J., Stoltenkamp J. (1990): Head space determination of evolved carbon dioxide in a biodegradability screening test. Ecotox. Env. Safety 19: 204-211.
|
|
(14)
|
Birch R.R., Fletcher R.J. (1991): The application of dissolved inorganic carbon measurements to the study of aerobic biodegradability. Chemosphere 23: 507-524.
|
|
(15)
|
Birch R.R., Biver C., Campagna R., Gledhill W.E., Pagga U., Steber J., Reust H., Bontinck W.J. (1989): Screening of chemicals for anaerobic biodegradation. Chemosphere 19: 1527-1550.
|
|
(16)
|
ISO 14593 (1999) Water Quality — Evaluation of ultimate aerobic biodegradability of organic compounds in an aerobic medium-method by analysis of inorganic carbon in sealed vessels (C02 headspace test).
|
|
(17)
|
Battersby N.S. (1997): The ISO headspace C02 biodegradation test. Chemosphere 34: 1813-1822.
|
|
(18)
|
US EPA (1996). Fate, Transport and Transportation. 835.3120. Sealed vessel carbon dioxide production test. Office, Prevention Pesticides and Toxic Substance. Washington, DC.
|
|
(19)
|
Battersby N.S., Ciccognani D., Evans M.R., King D., Painter H.A., Peterson D.R., Starkey M. (1999): An "inherent" biodegradability test for oil products: description and results of an international ring test. Chemosphere 38: 3219-3235.
|
|
(20)
|
Capítulo C.4 deste anexo: "Determinação da biodegradabilidade 'fácil'".
|
|
(21)
|
OCDE (1988). OECD Ring-test of methods for determining ready biodegradability: Chairman’s report (M. Hashimoto; MITI) and final report (Kitano, M., Takatsuki, M.; CITI). Paris.
|
|
(22)
|
Capítulo C.11 deste anexo: "Biodegradação — Lamas Ativadas: Ensaios de Inibição da Respiração".
|
|
(23)
|
Struijs J., Stoltenkamp-Wouterse M.J., Dekkers A.L.M. (1995): A rationale for the appropriate amount of inoculum in ready biodegradability tests. Biodegradation 6: 319-327.
|
|
(24)
|
UE (1999). Ring-test of the ISO Headspace CO2 method: application to surfactants: Surfactant Ring Test-1, Report EU4697. Water Research Centre, Maio de 1999. Medmenham, SL7 2HD, Reino Unido.
|
|
(25)
|
ISO 10634 (1996). Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
Apêndice 1
ABREVIATURAS E DEFINIÇÕES
CI: carbono inorgânico.
CO2Te: o dióxido de carbono teórico (mg) é a quantidade calculada do dióxido de carbono que seria produzido a partir do teor de carbono medido ou conhecido do produto químico em estudo, quando totalmente mineralizado; também pode ser expresso em mg de dióxido de carbono libertado por mg de produto químico em estudo.
COD: o carbono orgânico dissolvido é o carbono orgânico presente na solução ou que passa através de um filtro de 0,45 micra ou que permanece no sobrenadante após centrifugação a cerca de 4 000 g (aproximadamente 40 000 ms-2) durante 15 minutos.
CID: carbono inorgânico dissolvido.
CITe: carbono inorgânico teórico.
CIT: carbono inorgânico total.
Facilmente biodegradável: classificação arbitrária atribuída aos produtos químicos que satisfazem os critérios de determinados ensaios específicos de verificação da biodegradabilidade total; dado o grau de exigência destes ensaios, presume-se que esses produtos químicos são fácil e completamente biodegradados num ambiente aquático, em condições aeróbias.
Período de dez dias: período de dez dias imediatamente após ter sido alcançado o nível de biodegradação de 10 %.
Biodegradabilidade inerente: classificação atribuída aos produtos químicos para os quais existem provas inequívocas de biodegradação (primária ou total) num ensaio de biodegradabilidade.
Biodegradação aeróbia total: nível de degradação alcançado quando o produto químico em estudo é totalmente consumido pelos microrganismos, produzindo dióxido de carbono, água, sais minerais e novos componentes celulares microbianos (biomassa).
Mineralização: degradação completa de um produto químico orgânico em CO2 e H2O, em condições aeróbias, ou em CH4, CO2 e H2O, em condições anaeróbias.
Fase de latência: período que decorre do início do ensaio até à aclimatação e/ou adaptação dos microrganismos responsáveis pela degradação e ao surgimento de um grau detetável de biodegradação do produto químico ou matéria orgânica em estudo (p. ex.: 10 % da biodegradação teórica máxima, ou menos, consoante a precisão da técnica de medição).
Fase de degradação: período que decorre do final da fase de latência até ao momento em que se atinge 90 % da degradação máxima.
Fase de patamar: fase na qual já se atingiu a degradação máxima e a curva de biodegração estabiliza.
Produto químico em estudo: qualquer substância ou mistura à qual seja aplicado o presente método de ensaio.
Apêndice 2
Exemplo de curva de biodegradação
Figura 1
Biodegradação do 1-octanol no ensaio do CO2 no espaço livre
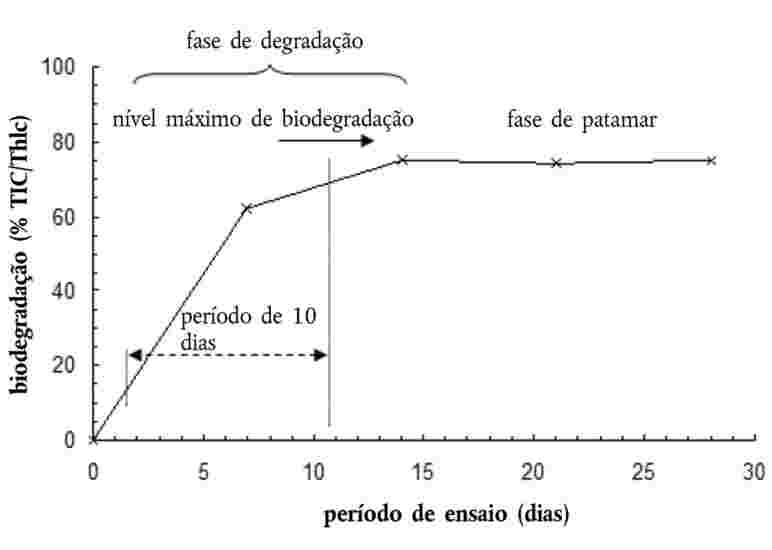
Glossário
biodegradação
fase de degradação
nível máximo de biodegradação
fase de patamar
período de 10 dias
período de ensaio (dias)
C.30. BIOACUMULAÇÃO EM OLIGOQUETAS TERRESTRES
INTRODUÇÃO
|
1.
|
Este método de ensaio é equivalente ao da Test Guideline 317 (TG 317) da OCDE (2010). Entre os métodos de ensaio relativos ao destino ambiental, foram publicados, respetivamente em 1996 e em 2008, "Bioconcentração: ensaio dinâmico no peixe" — capítulo C.13 deste anexo (49) e "Bioacumulação em oligoquetas bentónicos sedimentares" (53). A extrapolação dos dados de bioacumulação em meio aquático para organismos terrestres como as minhocas é difícil, senão impossível. São atualmente utilizados modelos de cálculo baseados na lipofilia do produto químico — p. ex., 14 e 37 — para avaliar a bioacumulação de produtos químicos no solo, tal como consta, por exemplo, do documento de orientação técnica da UE (19). A necessidade de um método de ensaio aplicável ao compartimento específico foi já abordada — p. ex., 55. Um tal método é particularmente importante para avaliar o envenenamento secundário nas cadeias alimentares terrestres (4). Há diversos métodos de ensaio nacionais que têm por objeto a bioacumulação noutros organismos que não os peixes — p. ex., 2 e 72. A American Society for Testing and Materials preparou um método de medição da bioacumulação causada por solos contaminados em minhocas (Eisenia fetida, Savigny) e oligoquetas da família Enchytraeidae (3). Um método internacionalmente aceite para a determinação da bioacumulação num solo enriquecido com determinado produto químico irá melhorar a avaliação dos riscos dos produtos químicos nos ecossistemas terrestres — p. ex., 25 e 29.
|
|
2.
|
Os invertebrados geófagos estão expostos aos produtos químicos presentes no solo. Entre eles, os oligoquetas terrestres desempenham um papel importante na estrutura e na função dos solos (15)(20). Vivem no solo e, em parte, à superfície (sobretudo na manta morta) e representam frequentemente as espécies mais abundantes em termos de biomassa (54). Por causarem bioturbação do solo e por servirem de presa, estes animais podem ter grande influência na biodisponibilização de produtos químicos a outros organismos predadores, quer invertebrados — p. ex., ácaros e coleópteros, cf. 64 —, quer vertebrados — p. ex., raposas e gaivotas, cf. 18 e 62. No apêndice 5 são referidas algumas espécies de oligoquetas terrestres atualmente utilizadas em ensaios ecotoxicológicos.
|
|
3.
|
O guia da ASTM para ensaios laboratoriais de toxicidade do solo e de bioacumulação na minhoca Eisenia fetida e no oligoqueta Enchytraeus albidus (3) fornece muitas informações essenciais e úteis para a execução deste método de ensaio da bioacumulação no solo. Outros documentos referidos neste método de ensaio são o capítulo C.13 — "Bioconcentração: ensaio dinâmico no peixe" (49) — deste anexo e o Test Guideline 315 da OCDE — Bioaccumulation on Sediment-dwelling Benthic Oligochaetes (bioacumulação em oligoquetas bentónicos sedimentares), (53). Os resultados práticos referidos em estudos e publicações sobre bioacumulação no solo — p. ex., 1, 5, 11, 12, 28, 40, 43, 45, 57, 59, 76, 78 e 79 — são também uma importante fonte de informação para este método de ensaio.
|
|
4.
|
O método é maioritariamente aplicável a produtos químicos orgânicos neutros e estáveis, que têm tendência para ser adsorvidos no solo. Permite estudar a bioacumulação de compostos organometálicos estáveis que se associam ao solo e é também aplicável a metais e outros oligoelementos.
|
CONDIÇÃO PRÉVIA
|
5.
|
Para medir a bioacumulação de um produto químico em oligoquetas terrestres, foram realizados ensaios com metais pesados — p. ex., 63 — e com produtos químicos orgânicos persistentes que acusam valores de log Kow entre 3,0 e 6,0 — p. ex., 40. Esses ensaios também se aplicam a:
|
—
|
produtos químicos com log Kow superior a 6,0 (superidrofóbicos),
|
|
—
|
produtos químicos pertencentes a classes de produtos químicos orgânicos com potencial reconhecido de bioacumulação em organismos vivos (por exemplo, produtos químicos tensioativos ou altamente adsorvíveis),
|
|
—
|
produtos químicos com potencial de bioacumulação dedutível das suas características estruturais (por exemplo, análogos de produtos químicos com potencial de bioacumulação conhecido) e
|
|
|
6.
|
Antes de se iniciar o estudo, devem ser obtidos elementos identificativos do produto químico em causa, como: nome comum, denominação química (preferivelmente a denominação IUPAC), fórmula estrutural, número de registo CAS, grau de pureza, precauções de segurança, condições de conservação adequadas e métodos de análise. Devem também ser conhecidos os seguintes dados:
|
b)
|
coeficiente de partição octanol/água, Kow;
|
|
c)
|
coeficiente de partição solo-água, expresso como Koc;
|
|
e)
|
degradabilidade (por exemplo, no solo e na água);
|
|
f)
|
metabolitos conhecidos.
|
|
|
7.
|
Podem ser utilizados no estudo produtos químicos com ou sem marcação radioativa. No entanto, para facilitar a análise, recomenda-se a utilização dos primeiros. A decisão deve ser tomada com base nos limites de deteção ou na obrigatoriedade de medir o produto químico parental e os seus metabolitos. Se for utilizado um produto químico com marcação radioativa e forem medidos os resíduos radioativos totais, importa que os resíduos com marcador radioativo presentes quer no solo quer nos organismos em estudo sejam caracterizados em termos de percentagem de produto químico parental e de percentagens de produtos químicos marcados não parentais — por exemplo, em amostras recolhidas em estado estacionário ou no final da fase de absorção — para permitir calcular o fator de bioacumulação (BAF) do produto químico parental e dos metabolitos pertinentes deste no solo (cf. ponto 50). O método aqui descrito poderá ter de ser modificado — por exemplo, a fim de se dispor de biomassa suficiente — para medir produtos químicos orgânicos sem marcação radioativa ou metais. Na medição dos resíduos radioativos totais (por contagem de cintilação em meio líquido após extração, combustão ou solubilização dos tecidos), o fator de bioacumulação baseia-se no produto químico parental e nos metabolitos deste. O cálculo do BAF deve preferencialmente ter por base a concentração do produto químico parental nos organismos e os resíduos radioativos totais. Seguidamente, por razões de comparabilidade entre os resultados dos diversos ensaios de bioacumulação, calcula-se a partir do BAF o fator de acumulação biota-solo (BSAF), normalizado em relação ao teor de lípidos dos vermes e ao teor de carbono orgânico do solo.
|
|
8.
|
A toxicidade do produto químico em estudo para as espécies utilizadas no ensaio deve ser conhecida: por exemplo, a concentração com efeitos (CEx) ou a concentração letal (CLx) relativas ao tempo de duração da fase de absorção — p. ex., 19. A concentração do produto químico em estudo deve ser, preferencialmente, cerca de 1 % da CL50 aguda assintótica do mesmo e pelo menos dez vezes superior ao limite de deteção do prosuto químico no solo pelo método de análise utilizado. Se possível, deve ser dada preferência a valores de toxicidade derivados de estudos de longa duração a efeitos subletais (51)(52). Se não estiverem disponíveis tais dados, um teste de toxicidade aguda dará informações úteis — p. ex., 23.
|
|
9.
|
Deve dispor-se de um método de análise adequado, com exatidão, precisão e sensibilidade conhecidas, para determinar quantitativamente o produto químico nas soluções de ensaio, no solo e na matéria biológica, juntamente com os pormenores da preparação e da armazenagem das amostras e as correspondentes fichas de dados de segurançal. Devem também ser conhecidos os limites analíticos de deteção do produto químico no solo e nos tecidos dos vermes. Se for utilizado no ensaio um produto químico marcado com 14C, devem ser conhecidas a radioatividade específica (em Bq.mol–1) e a percentagem de radioatividade associada a impurezas. A radioatividade específica do produto químico em estudo deve ser suficientemente elevada para facilitar as análises, e as concentrações de ensaio não devem induzir efeitos tóxicos.
|
|
10.
|
O ensaio pode ser executado com solo artificial ou natural. Antes de se iniciar o ensaio, importa conhecer as características do solo natural utilizado, como, por exemplo, a origem ou os componentes do solo, o pH, o teor de carbono orgânico, a distribuição granulométrica (percentagem de areia, de limo e de argila) e a capacidade de retenção de água — (3)(48).
|
PRINCÍPIO DO ENSAIO
|
11.
|
Os parâmetros que caracterizam a bioacumulação de um produto químico incluem o fator de bioacumulação (BAF), a constante de velocidade de absorção (ks) e a constante de velocidade de eliminação (ke). Estes parâmetros são definidos no apêndice 1.
|
|
12.
|
O ensaio compreende duas fases: a fase de absorção (exposição) e a fase de eliminação (pós-exposição). Durante a fase de absorção, são expostos ao solo, previamente enriquecido com o produto químico em estudo, grupos replicados de vermes. Paralelamente aos vermes cobaias, mantêm-se em condições idênticas, mas sem o produto químico em estudo, grupos de vermes de controlo. Mede-se a massa seca e o teor de lípidos dos organismos sujeitos ao ensaio. Para o efeito, podem utilizar-se vermes do grupo de controlo. Os valores de fundo analíticos (ensaios em branco) podem ser obtidos analisando amostras dos vermes de controlo e do solo. Para a fase de eliminação, os vermes são transferidos para um solo isento do produto químico em estudo. É sempre necessária uma fase de eliminação, a menos que a absorção do produto químico durante a fase de exposição tenha sido insignificante. A fase de eliminação fornece informações sobre a velocidade à qual o produto químico é excretado pelos organismos sujeitos ao ensaio — p. ex., 27. Se, durante a fase de absorção, não tiver sido atingido um estado estacionário, a determinação dos parâmetros cinéticos — fator de bioacumulação cinético BAFk, constante de velocidade de absorção e constante de velocidade de eliminação — deve basear-se preferencialmente num ajustamento simultâneo aos resultados das fases de absorção e de eliminação. A concentração do produto químico no interior ou à superfície dos vermes é monitorizada ao longo de ambas as fases do ensaio.
|
|
13.
|
Durante a fase de absorção, são feitas medições a intervalos de amostragem que podem chegar a 14 dias (família Enchytraeidae) ou a 21 dias (minhocas) até ser atingido o estado estacionário (11)(12)(67). O estado estacionário ocorre quando o gráfico da concentração nos vermes em função do tempo é paralelo ao eixo do tempo, e três análises sucessivas da concentração feitas em amostras colhidas a intervalos de pelo menos dois dias variam entre si, no máximo, 20 %, com base em comparações estatísticas (p. ex., análise da variância, análise de regressão).
|
|
14.
|
A fase de eliminação consiste em transferir os organismos sujeitos ao ensaio para recipientes que contêm o mesmo substrato, mas sem o produto químico em estudo. Durante a fase de eliminação, são feitas medições a intervalos de amostragem que podem chegar a 14 dias (família Enchytraeidae) ou a 21 dias (minhocas), a menos que determinações analíticas anteriores tenham mostrado uma redução de 90 % dos resíduos do produto químico nos vermes. A concentração do produto químico nos vermes no final da fase de eliminação é indicada como correspondente a resíduos não eliminados. O fator de bioacumulação em estado estacionário (BAFss) é calculado preferencialmente como quociente entre a concentração nos vermes (Ca) e a concentração no solo (Cs) em estado estacionário aparente e também como fator de bioacumulação cinético, BAFK, dado pelo quociente entre a constante de velocidade de absorção do solo (ks) e a constante de velocidade de eliminação (ke) (ver definições no apêndice 1), assumindo uma cinética de primeira ordem (ver cálculos no apêndice 2). Se a cinética de primeira ordem for manifestamente inaplicável, devem ser empregues outros modelos.
|
|
15.
|
A constante de velocidade de absorção, a constante de velocidade de eliminação (ou as constantes, se forem utilizados outros modelos), o fator de bioacumulação cinético (BAFK) e, se possível, os limites de confiança de cada um destes parâmetros são calculados por meios informáticos a partir de equações de modelo (ver orientações no apêndice 2). A adequação de um modelo pode ser determinada a partir, por exemplo, do coeficiente de correlação ou do coeficiente de determinação (coeficientes próximos de 1 indicam boa adequação) ou da lei do qui-quadrado. A amplitude do erro-padrão ou do limite de confiança dos parâmetros estimados pode também dar uma boa indicação da adequação do modelo.
|
|
16.
|
Para reduzir a variabilidade dos resultados dos ensaios de produtos químicos muito lipofílicos, os fatores de bioacumulação devem ser expressos em relação ao teor de lípidos e ao teor de carbono orgânico (kg de carbono orgânico no solo. kg–1 de lípidos nos vermes). Esta abordagem baseia-se no facto de que, para algumas classes de produtos químicos, há uma relação clara entre o potencial de bioacumulação e a lipofilia, relação essa bem estabelecida no caso dos peixes (47). Há uma relação entre o teor de lípidos dos peixes e a bioacumulação dos produtos químicos em causa. Em organismos bentónicos, foram descobertas correlações similares — p. ex., 30 e 44. Esta correlação foi igualmente demonstrada em oligoquetas terrestres — p. ex., 5, 6, 7 e 14. Se se dispuser de tecido suficiente, o teor de lípidos dos vermes sujeitos ao ensaio pode ser determinado na mesma matéria biológica utilizada para determinar a concentração do produto químico em estudo. Alternativamente, podem utilizar-se animais de controlo para medir o teor de lípidos.
|
VALIDADE DOS ENSAIOS
|
17.
|
Para que um ensaio seja válido, devem ser cumpridos os seguintes critérios, quer por parte dos organismos de controlo quer por parte dos organismos expostos:
|
—
|
no final do ensaio, a mortalidade total durante as fases de absorção e de eliminação não pode exceder 10 % (minhocas) ou 20 % (família Enchytraeidae) do número total de vermes introduzidos;
|
|
—
|
para Eisenia fetida e E. andrei, a perda média de massa, medida no final da fase de absorção e no final da fase de eliminação, não pode exceder 20 % da massa fresca inicial da respetiva fase.
|
|
DESCRIÇÃO DO MÉTODO
Espécies sujeitas a ensaio
|
18.
|
Para estudar a bioacumulação, recomenda-se várias espécies de oligoquetas terrestres. As mais utilizadas — Eisenia fetida ou E. andrei (família Lumbricidae) e Enchytraeus albidus, E. crypticus ou E. luxuriosus (família Enchytraeidae) — são descritas no apêndice 5.
|
Dispositivos
|
19.
|
Deve ser evitada a utilização, em qualquer parte do equipamento, de materiais capazes de dissolver ou adsorver o produto químico em estudo ou de permitir fugas de outros produtos químicos ou que tenham um efeito adverso nos animais sujeitos ao ensaio. Servem recipientes normalizados retangulares ou cilíndricos, de materiais quimicamente inertes e com capacidade adequada à carga, isto é, ao número de vermes sujeitos ao ensaio. Pode ser utilizado aço inoxidável, plástico ou vidro em qualquer equipamento que entre em contacto com os meios de ensaio. Os recipientes de ensaio devem ser adequadamente cobertos para impedir a fuga dos vermes, mas permitindo uma entrada de ar suficiente. No caso de produtos químicos com coeficiente de adsorção elevado, como os piretroides sintéticos, pode ser necessário vidro silanizado. Em tais situações, importa descartar o equipamento após a utilização (49). Devem ser impedidas fugas de produtos químicos com marcação radioativa e de produtos químicos voláteis. Devem ser utilizadas armadilhas (por exemplo, garrafas de vidro para lavagem de gases) contendo absorventes capazes de reter os resíduos que se evaporem dos recipientes de ensaio.
|
Solo
|
20.
|
A qualidade do solo ensaiado deve permitir a sobrevivência e, preferivelmente, a reprodução dos organismos durante os períodos de aclimatação e de ensaio, sem apresentarem aspeto ou comportamento anormal. É necessário que os vermes se enterrem no solo.
|
|
21.
|
Como substrato para o ensaio é recomendado o solo artificial descrito no capítulo C.8 deste anexo — (48). No apêndice 4 é descrita a preparação do solo artificial a utilizar nos ensaios de bioacumulação e são feitas recomendações sobre a armazenagem de solos artificiais. O solo artificial seco ao ar pode ser armazenado à temperatura ambiente até à sua utilização.
|
|
22.
|
Contudo, também solos naturais de locais não poluídos podem servir para ensaio e/ou para cultura. Devem conhecer-se, no mínimo, as suas características seguintes: origem (local de recolha), pH, teor de carbono orgânico, distribuição granulométrica (percentagem de areia, de limo e de argila), capacidade máxima de retenção de água (WHCmax) e teor percentual de água (3). A pesquisa de micropoluentes no solo ou nos seus componentes antes da utilização deverá proporcionar informações úteis. Caso se utilize solo natural proveniente de terras agrícolas, as amostras não devem ser colhidas menos de um ano após o último tratamento com produtos fitofarmacêuticos ou da última aplicação de estrume de animais, nem menos de seis meses após o último tratamento com fertilizantes orgânicos (50). Na referência 3 são descritos procedimentos de manipulação de solos naturais antes da sua utilização em ensaios laboratoriais de ecotoxicologia com oligoquetas. O tempo de armazenagem de solos naturais em laboratório deve ser o mais curto possível.
|
Aplicação do produto químico em estudo
|
23.
|
O produto químico é incorporado no solo. As suas propriedades físico-químicas devem ser tidas em conta. Os produtos químicos hidrossolúveis devem ser completamente dissolvidos em água antes da sua mistura com o solo. O procedimento de enriquecimento recomendado para produtos químicos pouco hidrossolúveis consiste em incorporar o produto químico em estudo num ou mais dos componentes do solo (artificial). Por exemplo, a areia quartzítica (ou uma parte dela) pode ser embebida numa solução do produto químico com um solvente orgânico adequado que, em seguida, é lentamente evaporado até a areia secar. A fração impregnada pode então ser misturada com o solo humedecido. A grande vantagem deste procedimento é que não se introduz nenhum solvente no solo. Se for utilizado solo natural, o produto químico em estudo pode ser adicionado enriquecendo, pelo método atrás descrito para solo artificial, uma porção do solo seca ao ar, ou misturando o produto químico no solo húmido, com subsequente evaporação se se tiver utilizado um agente solubilizante. Em geral, deve evitar-se o mais possível o contacto de solo húmido com solventes. Ter em conta o seguinte (3):
|
—
|
se se utilizar um solvente que não água, importa que seja hidromiscível e/ou possa ser removido (por evaporação, por exemplo,), deixando no solo apenas o produto químico em estudo,
|
|
—
|
se se recorrer a um controlo do solvente, não é necessário controlo negativo. O controlo do solvente deve conter a mais elevada concentração de solvente adicionado ao solo e utilizar solvente do mesmo lote que serviu para preparar a solução-mãe. A toxicidade e a volatilidade do solvente e a solubilidade do produto químico em estudo no solvente escolhido devem ser os critérios principais para a seleção de um agente solubilizante adequado.
|
|
|
24.
|
No caso dos produtos químicos pouco solúveis em água ou em solventes orgânicos, podem misturar-se (com almofariz e pilão, por exemplo,) 2,0-2,5 g de areia quartzítica finamente moída por cada recipiente de ensaio com a quantidade do produto químico em estudo, até obter a concentração de ensaio desejada. Esta mistura de areia quartzítica e produto químico é misturada cuidadosamente com o solo previamente humedecido, adicionando água desionizada até obter o teor de humidade necessário. A mistura final é distribuída pelos recipientes de ensaio. Repete-se o procedimento para cada concentração de ensaio e prepara-se também um controlo adequado, com 2,0-2,5 g de areia quartzítica finamente moída em cada recipiente.
|
|
25.
|
Após o enriquecimento, determina-se a concentração do produto químico no solo. A distribuição homogénea do produto no solo deve ser verificada antes de se introduzirem os organismos que vão ser sujeitos ao ensaio. Deve indicar-se o método utilizado para o enriquecimento, bem como as razões da escolha de um determinado procedimento de enriquecimento (24).
|
|
26.
|
Antes de se adicionar os organismos, deve, idealmente, estabelecer-se um equilíbrio entre o solo e a água intersticial, para o que se recomenda um período de quatro dias a 20 °C. Para muitos produtos químicos orgânicos pouco hidrossolúveis, o tempo necessário para alcançar um verdadeiro equilíbrio entre as frações adsorvida e dissolvida pode ser de dias ou meses. Dependendo da finalidade do estudo — por exemplo, quando se trata de imitar as condições ambientais —, o solo enriquecido poderá ter de ser "envelhecido" por um período mais longo — por exemplo, no caso dos metais, três semanas a 20 °C (22).
|
Cultura dos organismos a ensaiar
|
27.
|
De preferência, deve ter-se uma cultura permanente dos vermes no laboratório. O apêndice 5 dá orientações sobre métodos de cultura laboratorial de Eisenia fetida e de E. andrei, bem como de espécies da família Enchytraeidae — ver também 48, 51 e 52.
|
|
28.
|
Os vermes utilizados nos ensaios devem estar isentos de doenças, anomalias e parasitas visíveis.
|
REALIZAÇÃO DO ENSAIO
|
29.
|
Os organismos sujeitos a ensaio são expostos ao produto químico em estudo durante a fase de absorção, que deve durar 14 dias (família Enchytraeidae) ou 21 dias (minhocas), a menos que se demonstre que o estado estacionário foi alcançado.
|
|
30.
|
Para a fase de eliminação, os vermes são transferidos para um solo isento do produto químico em estudo. A primeira amostra deve ser colhida entre 4 e 24 horas após o início da fase de eliminação. O apêndice 3 contém exemplos de programação da colheita de amostras para uma fase de absorção de 21 dias e uma fase de eliminação de 21 dias.
|
Organismos sujeitos aos ensaios
|
31.
|
Em muitas espécies terrestres da família Enchytraeidae, a massa individual é bastante baixa (por exemplo, 5-10 mg de massa húmida por indivíduo no caso de Enchytraeus albidus e menos no caso de E. crypticus ou E. luxuriosus). Para efetuar as pesagens e as análises químicas, pode ser necessário juntar os vermes de cada recipiente de replicação (ou seja, todos os vermes de um recipiente de replicação para se obter um resultado único de análise de tecido). A cada replicado são adicionados vinte espécimes de Enchytraeidae, devendo ser utilizados pelo menos três replicados. Se o limite de deteção analítico do produto químico em estudo for elevado, poderão ser necessários mais vermes. Para as espécies com maior massa individual (Eisenia fetida e E. andrei), podem ser utilizados recipientes de replicação com um só espécime.
|
|
32.
|
As minhocas utilizadas num ensaio devem ter massa similar (por exemplo, cada espécime de Eisenia fetida e E. andrei deve ter massa de 250-600 mg). Os espécimes da família Enchytraeidae (por exemplo, da espécie Enchytraeus albidus) devem ter um comprimento de aproximadamente 1 cm. Todos os vermes utilizados num ensaio devem provir da mesma fonte e ser adultos com clitélio (ver apêndice 5). Uma vez que a massa e a idade do animal podem ter influência nos valores do BAF (por exemplo, devido a variações no teor de lípidos e/ou à presença de ovos), tais parâmetros devem ser registados com exatidão e tidos em conta na interpretação dos resultados. Por outro lado, durante o período de exposição, podem surgir casulos de ovos, o que terá também efeito nos valores do BAF. Recomenda-se a pesagem de uma subamostra dos vermes antes do ensaio, a fim de estimar os valores médios da massa húmida e da massa seca.
|
|
33.
|
Deve utilizar-se um rácio elevado solo/vermes, a fim de minimizar o decréscimo da concentração do produto químico no solo durante a fase de absorção. Para as espécies Eisenia fetida e E. andrei, recomenda-se um valor mínimo de 50 g de massa seca de solo por cada verme e, para a família Enchytraeidae, um mínimo de 10-20 g de massa seca de solo por cada recipiente de ensaio. Os recipientes devem conter uma camada de solo de 2-3 cm no caso de vermes da família Enchytraeidae ou de 4-5 cm no caso das minhocas.
|
|
34.
|
Os vermes a ensaiar são retirados da cultura (no caso da família Enchytraeidae, por exemplo, com recurso a pinças de joalheiro). Transfere-se animais adultos para solo não tratado, para aclimatação, e alimentam-se (cf. ponto 36). Se as condições de ensaio diferirem das condições de cultura, deverá ser suficiente uma fase de aclimatação de 24-72 horas para adaptar os vermes às condições de ensaio. Terminada a aclimatação, os vermes são transferidos para vasos de vidro (por exemplo, placas de Petri) com água limpa, para ser lavados, e em seguida são pesados, antes da sua colocação no solo de ensaio. Antes da pesagem, a água em excesso deve ser removida dos vermes, percutindo-os delicadamente contra as bordas da placa ou secando-os com cuidado por meio de um toalhete de papel ligeiramente humedecido.
|
|
35.
|
Deve observar-se e registar-se o comportamento dos organismos sujeitos a ensaio, em termos de enterramento no solo. Nos ensaios com minhocas, os animais (de controlo ou expostos) enterram-se normalmente ao cabo de algumas horas; este comportamento deve ser confirmado, o mais tardar, 24 h após a colocação dos vermes nos recipientes de ensaio. Se as minhocas não se enterrarem (por exemplo, mais de 10 % delas ao cabo de mais de metade da fase de absorção), é sinal de que as condições do ensaio não são adequadas ou de que as minhocas não estão saudáveis. Nesse caso, o ensaio deve ser interrompido e repetido. Os vermes da família Enchytraeidae vivem sobretudo nos poros intersticiais do solo e é frequente o seu tegumento estar só parcialmente em contacto com o substrato circundante; considera-se que, nesta família, a exposição dos vermes que se enterram é equivalente à dos que não se enterram, pelo que a ausência de enterramento não exige necessariamente a repetição do ensaio.
|
Alimentação
|
36.
|
É necessário alimentar os vermes quando se utiliza um solo com baixo teor de carbono orgânico total. Caso se utilize um solo artificial, recomenda-se uma frequência de alimentação semanal (ou seja, os vermes são alimentados uma vez por semana), com 7 mg de esterco seco por 1 g de solo seco no caso das minhocas e com 2-2,5 mg de flocos de aveia moídos por 1 g de solo seco no caso da família Enchytraeidae (11). A primeira ração alimentar deve ser misturada com o solo imediatamente antes da colocação dos organismos a ensaiar. É preferível utilizar o mesmo tipo de alimento que nas culturas (ver apêndice 5).
|
Luz e temperatura
|
37.
|
Os ensaios devem ser realizados segundo um ciclo controlado de 16 horas de luz e 8 de obscuridade, preferencialmente com uma intensidade de 400-800 lx na zona dos recipientes de ensaio (3). A temperatura deve ser de 20 ± 2 °C ao longo de todo o ensaio.
|
Concentrações de ensaio
|
38.
|
É utilizada uma única concentração. As situações em que se exijam concentrações adicionais devem ser justificadas. Se a toxicidade (CEx) do produto químico em estudo for próxima do limite de deteção analítico, recomenda-se a utilização de um produto químico marcado radioativamente com elevada radioatividade específica. Para metais, a concentração deve ser superior ao nível de fundo nos tecidos e no solo.
|
Replicados
|
39.
|
Para as medições cinéticas (fase de absorção e fase de eliminação), o número mínimo de recipientes de replicação expostos é de três por cada ponto de amostragem. O número total de replicados preparados deve ser suficiente para abranger todos os tempos de amostragem durante a fase de absorção e a fase de eliminação.
|
|
40.
|
Para as observações e medições biológicas (quociente entre massa seca e massa húmida, teor de lípidos, etc.) e para a análise das concentrações de fundo nos vermes e no solo, devem ser constituídos pelo menos doze recipientes de replicação de um controlo negativo (colheita de amostras em quatro recipientes no início da fase de absorção, em quatro no final da fase de absorção e em quatro no final da fase de eliminação), se não tiver sido utilizado outro solvente além da água. Se for utilizado um qualquer agente solubilizante para a aplicação do produto químico em estudo, deve-se ensaiar, além dos replicados expostos, um controlo do solvente (colheita de amostras em quatro recipientes de replicação no início da fase de absorção, em quatro no final da fase de absorção e em quatro no final da fase de eliminação), contendo todos os componentes, com exceção do produto químico em estudo. Neste caso, podem também ser constituídos quatro recipientes de replicação adicionais de um controlo negativo (sem solvente), para amostragem opcional no final da fase de absorção. Estes replicados podem ser comparados biologicamente com o controlo do solvente a fim de obter informações sobre uma eventual influência do solvente nos organismos sujeitos ao ensaio. Recomenda-se a constituição de um número suficiente de recipientes de replicação adicionais de reserva (por exemplo, oito) para exposição e controlo(s).
|
Frequência das medições da qualidade do solo
|
41.
|
No início e no final da fase de absorção e da fase de eliminação medem-se o pH e o teor de humidade do solo. A temperatura no local do ensaio é medida continuamente. O teor de humidade do solo deve ser verificado uma vez por semana, pesando os recipientes de ensaio e comparando as massas obtidas com as massas iniciais (isto é, no início do ensaio). As perdas de água devem ser repostas com água desionizada.
|
Colheita de amostras e análise dos vermes e do solo
|
42.
|
O apêndice 3 contém exemplos de programação da colheita de amostras para a fase de absorção e para a fase de eliminação em ensaios de bioacumulação realizados com minhocas e com vermes da família Enchytraeidae.
|
|
43.
|
Antes da colocação dos vermes, durante a fase de absorção e durante a fase de eliminação, colhe-se amostras de solo dos recipientes de ensaio para determinar a concentração do produto químico em estudo. Durante o ensaio, determina-se as concentrações do produto químico nos vermes e no solo. Em geral, mede-se as concentrações totais no solo. Facultativamente, pode medir-se as concentrações na água intersticial, caso em que, antes do início do estudo, deve conhecer-se os fundamentos disso e deve dispor-se dos métodos adequados (elementos a incluir posteriormente no relatório).
|
|
44.
|
Colhe-se amostras dos vermes e do solo em, pelo menos, seis ocasiões durante a fase de absorção e a fase de eliminação. Se a estabilidade do produto químico em estudo for demonstrada, pode reduzir-se o número de análises ao solo. Recomenda-se a análise de, pelo menos, três replicados no início e no final da fase de absorção. Se a concentração no solo medida no final da fase de absorção diferir em mais de 30 % da medida no início, devem também ser analisadas as amostras de solo colhidas noutras datas.
|
|
45.
|
A cada tempo de colheita de amostras, os vermes do replicado em causa são retirados do solo (por exemplo, espalhando o solo do replicado sobre um tabuleiro raso e colhendo os vermes com pinças de joalheiro) e lavados rapidamente em água num tabuleiro raso de vidro ou aço. Remove-se a água em excesso (cf. ponto 34). Transfere-se os vermes cuidadosamente para um recipiente previamente tarado e pesando-se de imediato, incluindo o conteúdo do trato digestivo.
|
|
46.
|
No caso das minhocas (Eisenia sp.), deixam-se evacuar o trato digestivo de um dia para o outro — por exemplo, sobre papel de filtro humedecido, numa placa de Petri coberta (cf. ponto 34). Após essa purga, determina-se a massa dos vermes, a fim de avaliar um eventual decréscimo da biomassa durante o ensaio (ver critérios de validade no ponto 17). No caso dos vermes da família Enchytraeidae, a pesagem e a análise de tecidos são efetuadas sem purga do trato digestivo, por esta ser tecnicamente difícil devido às pequenas dimensões destes animais. Terminada a pesagem final, os vermes devem ser occisados de imediato, pelo método mais adequado (por exemplo, com azoto líquido ou por congelamento a temperaturas inferiores a -18 °C).
|
|
47.
|
Durante a fase de eliminação, os vermes substituem o conteúdo contaminado do trato digestivo por solo limpo. Quer isto dizer que, no caso de animais que não purgaram o trato digestivo (vermes da família Enchytraeidae, neste caso) integrantes de amostras colhidas imediatamente antes da fase de eliminação, as medições incluem solo contaminado presente no trato digestivo. Em relação aos oligoquetas aquáticos, considera-se que, após as primeiras 4 a 24 horas da fase de eliminação, a maior parte do conteúdo contaminado do trato digestivo foi substituída por sedimento limpo — p. ex., 46. Observou-se o mesmo em minhocas em estudos sobre a acumulação de cádmio e zinco com marcação radioativa (78). Nos vermes da família Enchytraeidae, que não purgaram o trato digestivo, a concentração desta primeira amostra da fase de eliminação pode ser considerada como concentração nos tecidos após purga do trato digestivo. Para atender à diluição da concentração do produto químico em estudo por solo não contaminado, durante a fase de eliminação, a massa do conteúdo do trato digestivo pode ser estimada a partir do quociente entre a massa húmida de vermes e a massa das suas cinzas ou do quociente entre a massa seca de vermes e a massa das suas cinzas.
|
|
48.
|
As amostras de solo e de vermes devem, de preferência, ser analisadas imediatamente após a remoção (ou seja, no prazo de um a dois dias), a fim de evitar degradações ou outras perdas, e é recomendável calcular as velocidade aproximadas de absorção e de eliminação no decurso do ensaio. Se a análise for adiada, as amostras devem ser armazenadas por um método adequado — por exemplo, ultracongelamento (≤ -18 °C).
|
|
49.
|
Deve confirmar-se se a precisão e a reprodutibilidade da análise química, bem como a recuperação do produto químico em estudo das amostras de solo e das amostras de vermes, são satisfatórias para o método em questão. Devem indicar-se a eficácia da extração, o limite de deteção e o limite de quantificação. Do mesmo modo, deve confirmar-se que o produto químico em estudo não é detetável nos recipientes de controlo em concentrações superiores ao nível de fundo. A concentração do produto químico em estudo (Ca), se for > 0 nos vermes de controlo, deve ser incluída no cálculo dos parâmetros cinéticos (cf. apêndice 2). Ao longo de todo o ensaio, as amostras devem ser manipuladas de modo a minimizar contaminações e perdas (resultantes, por exemplo, da adsorção do produto químico em estudo no dispositivo de colheita das amostras).
|
|
50.
|
Caso se estude um produto químico com marcação radioativa, é possível analisar o produto químico parental e os seus metabolitos. A determinação quantitativa do produto químico parental e dos seus metabolitos em estado estacionário ou no final da fase de absorção fornece informações importantes. As amostras devem então ser limpas, para que possa determinar-se quantitativamente apenas o produto químico parental. Se a um único metabolito corresponderem mais de 10 % da radioatividade total na(s) amostra(s) analisada(s), é recomendável identificá-lo.
|
|
51.
|
Devem ser registadas e indicadas a recuperação global e a recuperação do produto químico nos vermes, no solo e em eventuais armadilhas com absorventes para reter o produto químico evaporado.
|
|
52.
|
O agrupamento dos espécimes que constituem a amostra colhida num determinado recipiente de ensaio é aceitável em relação aos vermes da família Enchytraeidae, que são menores do que as minhocas. Se o agrupamento implicar a redução do número de replicados, os procedimentos estatísticos aplicáveis aos dados sofrerão limitações. Se forem exigíveis um procedimento estatístico e uma representatividade estatística específicos, deve ser utilizado no ensaio um número de recipientes de replicação adequado ao agrupamento, ao procedimento e à representatividade pretendidos.
|
|
53.
|
Recomenda-se que o BAF seja expresso em função da massa seca total e, quando necessário (ou seja, no caso de produtos químicos muito hidrofóbicos), também em função do teor de lípidos. Devem ser utilizados métodos adequados para determinar o teor de lípidos (alguns dos métodos existentes — p. ex., 31 e 58 — têm de ser adaptados para o efeito). Estes métodos recorrem a uma técnica de extração com clorofórmio/metanol. No entanto, para evitar os solventes clorados, deve utilizar-se uma versão modificada do método de Bligh e Dyer (9), descrita na referência (17). Como os vários métodos podem não conduzir a resultados idênticos, importa explicar o método utilizado. Sempre que possível, isto é, quando se dispuser de tecido suficiente, a análise dos lípidos deve, idealmente, ser feita na mesma amostra ou no mesmo extrato que a análise do produto químico em estudo, porquanto os lípidos têm frequentemente de ser removidos do extrato antes de este poder ser analisado cromatograficamente (49). Alternativamente, pode utilizar-se animais de controlo para medir o teor de lípidos, que serve em seguida para normalizar os valores do BAF. Esta última metodologia reduz a contaminação do equipamento com o produto químico em estudo.
|
DADOS E RELATÓRIOS
Tratamento dos resultados
|
54.
|
A curva de absorção do produto químico em estudo é obtida exprimindo em função do tempo a concentração do produto no interior ou à superfície dos vermes durante a fase de absorção, em escalas aritméticas. Quando a curva atinge um patamar ou estado estacionário (ver definições no apêndice 1), calcula-se o fator de bioacumulação em estado estacionário BAFss pela seguinte fração:

Ca Ca é a concentração do produto químico em estudo no organismo sujeito ao ensaio;
Cs é a concentração do produto químico em estudo no solo.
|
|
55.
|
Se não for atingido estado estacionário (ou seja, se a curva não atingir um patamar), deve ser determinado o BAFK, baseado nas constantes de velocidade, em vez do BAFss, como se segue:
|
—
|
determina-se o fator de acumulação (BAFK) como quociente ks/ke,
|
|
—
|
de preferência, as velocidades de absorção e de eliminação calculam-se simultaneamente (cf. equação 11 no apêndice 2),
|
|
—
|
a constante de velocidade de eliminação (ke) é normalmente determinada a partir da curva de eliminação (ou seja, da linha que representa a concentração do produto químico nos vermes durante a fase de eliminação). A constante de velocidade de absorção (ks) é então calculada em função de ke e de um valor de Ca derivado da curva de absorção — ver no apêndice 2 uma descrição destes métodos. Para obter o fator BAFK e as constantes de velocidade ks e ke, é preferível recorrer a métodos informáticos de estimativa de parâmetros não lineares. Se, manifestamente, a curva de eliminação não obedecer a uma cinética de primeira ordem, devem ser utilizados modelos mais complexos.
|
|
Relatório dos ensaios
|
56.
|
Elementos a constar do relatório dos ensaios:
|
|
Produto químico em estudo:
|
—
|
todas as informações disponíveis sobre toxicidade aguda e a longo prazo (p. ex., CEx, CLx, NOEC) para oligoquetas que vivem no solo,
|
|
—
|
grau de pureza, estado físico e propriedades físico-químicas — p. ex., log Kow, hidrossolubilidade,
|
|
—
|
dados de identificação química: proveniência do produto químico em estudo, identidade e concentração dos solventes eventualmente utilizados,
|
|
—
|
se o produto químico tiver marcação radioativa, a posição precisa dos átomos marcados, a radioatividade específica e a pureza radioquímica.
|
|
|
|
Espécies sujeitas ao ensaio:
|
—
|
denominação científica, estirpe, origem, pré-tratamentos eventuais, aclimatação, idade, gama de dimensões, etc.
|
|
|
|
Condições de realização dos ensaios:
|
—
|
procedimento de ensaio utilizado,
|
|
—
|
tipo e características da iluminação utilizada e fotoperíodo(s),
|
|
—
|
protocolo do ensaio (por exemplo, número e tamanho dos recipientes, massa de solo e espessura da camada de solo, número de replicados, número de vermes por replicado, número de concentrações de ensaio, duração da fase de absorção e da fase de eliminação, frequência da colheita de amostras),
|
|
—
|
justificação da escolha do material dos recipientes de ensaio,
|
|
—
|
método de preparação e aplicação do produto químico em estudo e razões da escolha desse método,
|
|
—
|
concentrações de ensaio nominais, bem como as médias e os desvios-padrão dos valores medidos nos recipientes de ensaio e o método de obtenção desses valores,
|
|
—
|
origem dos componentes do solo artificial ou — se se utilizar um meio natural — origem do solo, descrição de eventuais pré-tratamentos, resultados dos controlos (sobrevivência, evolução da biomassa, reprodução), características do solo — pH, teor de carbono orgânico total, distribuição granulométrica (percentagem de areia, de limo e de argila), capacidade máxima de retenção de água, teor percentual de água no início e no final do ensaio e quaisquer outras medições efetuadas,
|
|
—
|
explicação do tratamento das amostras de solo e de vermes, incluindo elementos sobre a preparação, a armazenagem, os procedimentos de enriquecimento do solo com o produto químico em estudo, a extração, os procedimentos de análise (e sua precisão) do produto químico nos vermes e no solo, o teor de lípidos (se for medido) e as recuperações do produto químico em estudo.
|
|
|
|
Resultados:
|
—
|
mortalidade dos vermes de controlo e dos vermes de cada recipiente de ensaio e eventuais comportamentos anormais observados (por exemplo, os vermes evitam o solo, não se verifica a reprodução de vermes da família Enchytraeidae num ensaio de bioacumulação, etc.),
|
|
—
|
quociente entre massa seca e massa húmida, quer do solo quer dos organismos sujeitos ao ensaio (útil para a normalização),
|
|
—
|
massa húmida dos vermes em cada tempo de colheita de amostras; no caso das minhocas, a massa húmida no início do ensaio e em cada tempo de colheita de amostras antes e depois da purga do trato digestivo,
|
|
—
|
teor de lípidos dos organismos sujeitos ao ensaio (se for medido),
|
|
—
|
curvas indicando a cinética de absorção e de eliminação do produto químico nos vermes e o intervalo de tempo até ao estado estacionário,
|
|
—
|
Ca e Cs (com desvio-padrão e intervalo, se for caso disso) para cada tempo de colheita de amostras (Ca expressa em g por kg de massa húmida e de massa seca do corpo inteiro; Cs expressa em g por kg de massa húmida e por kg de massa seca do solo). Se for necessário um fator de acumulação biota-solo (BSAF) (por exemplo, para comparação dos resultados de dois ou mais ensaios realizados em animais com diferentes teores de lípidos), Ca pode também ser expressa em g por kg de lípidos do organismo e Cs pode ser expressa em g por kg de carbono orgânico do solo,
|
|
—
|
BAF (expresso em kg de solo por kg de vermes), constante de velocidade de absorção do solo (ks, expressa em g de solo por kg de vermes por dia) e constante de velocidade de eliminação (ke, expressa em dia–1); adicionalmente, pode indicar-se o BSAF (expresso em kg de carbono orgânico do solo por kg de lípidos dos vermes),
|
|
—
|
se tiverem sido medidas: percentagens do produto químico parental, dos metabolitos deste e dos resíduos ligados (ou seja, percentagem do produto químico em estudo que não pode ser extraído por métodos de extração comuns) detetadas no solo e nos animais sujeitos ao ensaio,
|
|
—
|
métodos utilizados para as análises estatísticas dos dados.
|
|
|
|
Avaliação dos resultados:
|
—
|
coerência dos resultados com os critérios de validade referidos no ponto 17,
|
|
—
|
resultados inesperados ou inabituais — por exemplo, eliminação incompleta do produto químico pelos animais sujeitos ao ensaio.
|
|
|
REFERÊNCIAS:
|
(1)
|
Amorim M. (2000). Chronic and toxicokinetic behavior of Lindane (γ-HCH) in the Enchytraeid Enchytraeus albidus. Tese de mestrado, Universidade de Coimbra.
|
|
(2)
|
ASTM (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates. American Society for Testing and Materials, E 1688-00a.
|
|
(3)
|
ASTM International (2004). Standard guide for conducting laboratory soil toxicity or bioaccumulation tests with the Lumbricid earthworm Eisenia fetida and the Enchytraeid potworm Enchytraeus albidus. ASTM International, E1676-04: 26 pp.
|
|
(4)
|
Beek B., Boehling S., Bruckmann U., Franke C., Joehncke U., Studinger G. (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, vol. 2, parte J (editordo volume: B. Beek): Bioaccumulation — New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
(5)
|
Belfroid A., Sikkenk M., Seinen W., Van Gestel C., Hermens J. (1994). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in soil. Environ. Toxicol. Chem. 13: 93-99.
|
|
(6)
|
Belfroid A., Van Wezel A., Sikkenk M., Van Gestel C., Seinen W. e Hermens J. (1993). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in water. Ecotox. Environ. Safety 25: 154-165.
|
|
(7)
|
Belfroid A., Meiling J., Drenth H., Hermens J., Seinen W., Van Gestel C. (1995). Dietary uptake of superlipophilic compounds by earthworms (Eisenia andrei). Ecotox. Environ. Safety 31: 185-191.
|
|
(8)
|
Bell AW (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902: 1-13.
|
|
(9)
|
Bligh E.G. e Dyer W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Pysiol. 37: 911-917.
|
|
(10)
|
Bouche M. (1972). Lombriciens de France. Écologie et Systématique. INRA, Annales de Zoologie-Écologie animale, Paris, 671 p.
|
|
(11)
|
Bruns E., Egeler Ph., Moser T., Römbke J., Scheffczyk A., Spörlein P. (2001a). Standardisierung und Validierung eines Bioakkumulationstests mit terrestrischen Oligochaeten. Relatório à Agência Federal Alemã do Ambiente (Umweltbundesamt Berlin), R&D No.: 298 64 416.
|
|
(12)
|
Bruns E., Egeler Ph., Römbke J., Scheffczyk A., Spörlein P. (2001b). Bioaccumulation of lindane and hexachlorobenzene by the oligochaetes Enchytraeus luxuriosus and Enchytraeus albidus (Enchytraeidae, Oligochaeta, Annelida). Hydrobiologia 463: 185-196.
|
|
(13)
|
Conder J.M. e Lanno R.P. (2003). Lethal critical body residues as measures of Cd, Pb, and Zn bioavailability and toxicity in the earthworm Eisenia fetida. J. Soils Sediments 3: 13-20.
|
|
(14)
|
Connell D.W. e Markwell R.D. (1990). Bioaccumulation in the Soil to Earthworm System. Chemosphere 20: 91-100.
|
|
(15)
|
Didden W.A.M. (1993). Ecology of Terrestrial Enchytraeidae. Pedobiologia 37: 2-29.
|
|
(16)
|
Didden W. (2003). Oligochaeta, In: Bioindicators and biomonitors. Markert B.A., Breure A.M. e Zechmeister H.G. (eds.). Elsevier Science Ltd., Países Baixos, p. 555-576.
|
|
(17)
|
De Boer J., Smedes F., Wells D., Allan A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2, Exercise 1000, EU, Standards, Measurement and Testing Programme.
|
|
(18)
|
Dietrich D.R., Schmid P., Zweifel U., Schlatter C., Jenni-Eiermann S., Bachmann H., Bühler U., Zbinden N. (1995). Mortality of birds of prey following field application of granular carbofuran: A Case Study. Arch. Environ. Contam. Toxicol. 29: 140-145.
|
|
(19)
|
Regulamento (CE) n.o 1907/2006 do Parlamento Europeu e do Conselho, de 18 de dezembro de 2006, relativo ao registo, avaliação, autorização e restrição dos produtos químicos (REACH), que cria a Agência Europeia dos Produtos Químicos, que altera a Directiva 1999/45/CE e que revoga o Regulamento (CEE) n.o 793/93 do Conselho e o Regulamento (CE) n.o 1488/94 da Comissão, bem como a Diretiva 76/769/CEE do Conselho e as Diretivas 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE da Comissão (JO L 396 de 30.12.2006, p. 1).
|
|
(20)
|
Edwards C.A. e Bohlen P.J. (1996). Biology and ecology of earthworms. Terceira edição, Chapman & Hall, Londres, 426 pp.
|
|
(21)
|
OCDE (2008), Bioaccumulation in Sediment-dwelling Benthic Oligochaetes, Guideline No 315, Guidelines for the testing of chemicals. OCDE, Paris
|
|
(22)
|
Egeler Ph., Gilberg D., Scheffczyk A., Moser Th. e Römbke J. (2009). Validierung einer Methode zur standardisierten Messung der Bioakkumulation mit terrestrischen Oligochaeten. Relatório à Agência Federal Alemã do Ambiente (Umweltbundesamt Dessau-Rosslau), R&D No.: 204 67 458: 149 pp. Disponível em: http://www.oecd.org/dataoecd/12/20/42552727.pdf.
|
|
(23)
|
Elmegaard N. e Jagers op Akkerhuis G.A.J.M. (2000). Safety factors in pesticide risk assessment, Differences in species sensitivity and acute-chronic relations. National Environmental Research Institute, NERI Technical Report 325: 57 pp.
|
|
(24)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Relatório de série sobre a proteção do ambiente EPS 1/RM/30.
|
|
(25)
|
EPPO (2003). Environmental Risk Assessment scheme for plant protection products. Soil organisms and functions, Normas da EPPO (European Plant Protection Organization), Bull, OEPP/EPPO 33: 195-208.
|
|
(26)
|
Franke C. (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32: 1897-1905.
|
|
(27)
|
Franke C., Studinger G., Berger G., Böhling S., Bruckmann U., Cohors-Fresenborg D., Jöhncke U. (1994). The assessment of bioaccumulation. Chemosphere 29: 1501-1514.
|
|
(28)
|
Füll C. (1996). Bioakkumulation und Metabolismus von -1,2,3,4,5,6-Hexachlorcyclohexan (Lindan) und 2-(2,4-Dichlorphenoxy)-propionsäure (Dichlorprop) beim Regenwurm Lumbricus rubellus (Oligochaeta, Lumbricidae). Dissertação na Universidade de Mogúncia, 156 pp.
|
|
(29)
|
Füll C., Schulte C., Kula C. (2003). Bewertung der Auswirkungen von Pflanzenschutzmitteln auf Regenwürmer. UWSF-Z. Umweltchem, Ökotox. 15: 78-84.
|
|
(30)
|
Gabric A.J., Connell D.W., Bell P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24: 1225-1231.
|
|
(31)
|
Gardner W.S., Frez W.A., Cichocki E.A., Parrish C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography 30: 1099-1105.
|
|
(32)
|
Hawker D.W. e Connell D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22: 701-707.
|
|
(33)
|
Hund-Rinke K. e Wiechering H. (2000). Earthworm avoidance test for soil assessments: An alternative for acute and reproduction tests. J. Soils Sediments 1: 15-20.
|
|
(34)
|
Hund-Rinke K., Römbke J., Riepert F., Achazi R. (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden S., Erb R., Dott W., Eisentraeger A. (eds.), Spektrum Verl., Heidelberga, 59-81.
|
|
(35)
|
ISO 11268-2 (1998) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction.
|
|
(36)
|
Jaenike J. (1982). Eisenia foetida is two biological species. Megadrilogica 4: 6-8.
|
|
(37)
|
Jager T. (1998). Mechanistic approach for estimating bioconcentration of organic chemicals in earthworms (Oligochaeta). Environ. Toxicol. Chem. 17: 2080-2090.
|
|
(38)
|
Jager T., Sanchez P.A., Muijs B., van der Welde E., Posthuma L. (2000). Toxicokinetics of polycyclic aromatic hydrocarbons in Eisenia andrei (Oligochaeta) using spiked soil. Environ. Toxicol. Chem. 19: 953-961.
|
|
(39)
|
Jager T., Baerselman R., Dijkman E., De Groot A.C., Hogendoorn E.A., De Jong A., Kruitbosch J.A.W., Peijnenburg W.J.G. M. (2003a). Availability of polycyclic aromatic hydrocarbons to earthworms (Eisenia andrei, Oligochaeta) in field-polluted soils and soil-sediment mixtures. Environ. Toxicol. Chem. 22: 767-775.
|
|
(40)
|
Jager T., Fleuren R.L.J., Hoogendoorn E., de Korte G. (2003b). Elucidating the routes of exposure for organic chemicals in the earthworm, Eisenia andrei (Oligochaeta). Environ. Sci. Technol. 37: 3399-3404.
|
|
(41)
|
Janssen M.P.M., Bruins A., De Vries T.H., Van Straalen N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(42)
|
Kasprzak K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23: 217-232.
|
|
(43)
|
Khalil A.M. (1990). Aufnahme und Metabolismus von 14C-Hexachlorbenzol und 14C-Pentachlornitrobenzol in Regenwürmern. Dissertação na Universidade de Munique, 137 pp.
|
|
(44)
|
Landrum P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23: 588-595.
|
|
(45)
|
Marinussen M.P.J.C., Van der Zee S.E.A.T.M., De Haan F.A. (1997). Cu accumulation in Lumbricus rubellus under laboratory conditions compared with accumulation under field conditions. Ecotox. Environ. Safety 36: 17-26.
|
|
(46)
|
Mount D.R., Dawson T.D., Burkhard L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegates. Environ. Toxicol. Chem. 18: 1244-1249.
|
|
(47)
|
Nendza M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations, In: R. Nagel e R. Loskill (eds.): Bioaccumulation in aquatic systems, Contributions to the assessment, Proceedings of an international workshop, Berlim 1990, VCH, Weinheim.
|
|
(48)
|
Capítulo C.8 deste anexo — Toxicidade em relação às minhocas.
|
|
(49)
|
Capítulo C.13 deste anexo — Bioconcentração: ensaio dinâmico com peixe.
|
|
(50)
|
Capítulo C.21 deste anexo — Microorganismos no solo: ensaio de transformação de azoto.
|
|
(51)
|
OCDE (2004a), Enchytraeid reproduction test, Test Guideline No 220, Guidelines for the testing of chemicals, OCDE, Paris.
|
|
(52)
|
OCDE (2004b), Earthworm reproduction test (Eisenia fetida/Eisenia Andrei), Test Guideline No 222, Guidelines for the testing of chemicals, OCDE, Paris.
|
|
(53)
|
OCDE (2008), Bioaccumulation in Sediment-dwelling Benthic Oligochates, Test Guideline No 315, Diretrizes para os ensaios a produtos químicos, OCDE, Paris.
|
|
(54)
|
Petersen H. e Luxton M. (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388.
|
|
(55)
|
Phillips D.J.H. (1993). Bioaccumulation. In: Handbook of Ecotoxicology Vol. 1. Calow P. (ed.). Blackwell Scientific Publ., Oxford. 378-396.
|
|
(56)
|
Pflugmacher J. (1992). Struktur-Aktivitätsbestimmungen (QSAR) zwischen der Konzentration von Pflanzenschutzmitteln und dem Octanol-Wasser-Koeffzienten UWSF- Z. Umweltchem. Ökotox. 4: 77-81.
|
|
(57)
|
Posthuma L., Weltje L., Anton-Sanchez F.A. (1996). Joint toxic effects of cadmium and pyrene on reproduction and growth of the earthworm Eisenia fetida. Relatório do RIVM n.o 607506001, Bilthoven.
|
|
(58)
|
Randall R.C., Lee II H., Ozretich R.J., Lake J.L., Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10: 1431-1436.
|
|
(59)
|
Römbke J., Egele P., Füll C. (1998). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. UBA-Texte 28/98, 84 S.
|
|
(60)
|
Römbke J. e Moser Th. (1999). Organisation and performance of an international ring-test for the validation of the Enchytraeid reproduction test. UBA-Texte 4/99: 373 pp.
|
|
(61)
|
Römbke J., Riepert F., Achazi R. (2000). Enchytraeen als Testorganismen, In: Toxikologische Beurteilung von Böden. Heiden S., Erb R., Dott W. e Eisentraeger A. (eds.). Spektrum Verl., Heidelberga. 105-129.
|
|
(62)
|
Romijn C.A.F.M., Luttik R., Van De Meent D., Slooff W., Canton J.H. (1993). Presentation of a General Algorithm to Include Effect Assessment on Secondary Poisoning in the Derivation of Environmental Quality Criteria, Part 2: Terrestrial food chains. Ecotox. Envir. Safety 27: 107-127.
|
|
(63)
|
Sample B.E., Suter D.W., Beauchamp J.J., Efroymson R.A. (1999). Literature-derived bioaccumulation models for earthworms: Development and validation. Environ. Toxicol. Chem. 18: 2110-2120.
|
|
(64)
|
Schlosser H.-J. e Riepert F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina), Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. NF 34: 413-433.
|
|
(65)
|
Schmelz R. e Collado R. (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeide, Clitellata, Annelida). Carolinea 57: 93–100.
|
|
(66)
|
Sims R.W. e Gerard B.M. (1985). Earthworms, In: Kermack D.M. e Barnes R.S.K. (Hrsg.): Synopses of the British Fauna (New Series) No. 31. 171 S. Londres: E. J. Brill/Dr. W. Backhuys.
|
|
(67)
|
Sousa J.P., Loureiro S., Pieper S., Frost M., Kratz W., Nogueira A.J.A., Soares A.M.V.M. (2000). Soil and plant diet exposure routes and toxicokinetics of lindane in a terrestrial isopod. Environ. Toxicol. Chem. 19: 2557–2563.
|
|
(68)
|
Spacie A. e Hamelink J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(69)
|
Stephenson G.L., Kaushik A., Kaushik N.K., Solomon K.R., Steele T., Scroggins R.P. (1998). Use of an avoidance-response test to assess the toxicity of contaminated soils to earthworms. In: Advances in earthworm ecotoxicology. S. Sheppard, J. Bembridge, M. Holmstrup, L. Posthuma (eds.). Setac Press, Pensacola, 67-81.
|
|
(70)
|
Sterenborg I., Vork N.A., Verkade S.K., Van Gestel C.A.M., Van Straalen N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
(71)
|
UBA (Umweltbundesamt) (1991). Bioakkumulation – Bewertungskonzept und Strategien im Gesetzesvollzug. UBA-Texte 42/91. Berlim.
|
|
(72)
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Segunda edição, EPA 600/R-99/064, US, Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(73)
|
Van Brummelen TC e Van Straalen NM (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
(74)
|
Van Gestel C.A.M. (1992). The influence of soil characteristics on the toxicity of chemicals for earthworms; a review, In: Ecotoxicology of Earthworms (Ed. Becker, H. Edwards, P.J. Greig-Smith, P.W. & Heimbach F.). Intercept Press, Andover (GB).
|
|
(75)
|
Van Gestel C.A. e Ma W.-C. (1990). An approach to quantitative structure-activity relationships (QSARs) in earthworm toxicity studies. Chemosphere 21: 1023-1033.
|
|
(76)
|
Van Straalen N.M., Donker M.H., Vijver M.G., van Gestel C.A.M. (2005). Bioavailability of contaminants estimated from uptake rates into soil invertebrates. Environmental Pollution 136: 409-417.
|
|
(77)
|
Venter J.M. e Reinecke A.J. (1988). The life-cycle of the compost-worm Eisenia fetida (Oligochaeta). South African J. Zool. 23: 161-165.
|
|
(78)
|
Vijver M.G., Vink J.P.M., Jager T., Wolterbeek H.T., van Straalen N.M., van Gestel C.A.M. (2005). Biphasic elimination and uptake kinetics of Zn and Cd in the earthworm Lumbricus rubellus exposed to contaminated floodplain soil. Soil Biol, Biochem. 37: 1843-1851.
|
|
(79)
|
Widianarko B. e Van Straalen N.M. (1996). Toxicokinetics-based survival analysis in bioassays using nonpersistent chemicals, Environ. Toxicol. Chem. 15: 402-406.
|
Apêndice 1
DEFINIÇÕES
|
|
Bioacumulação é o aumento que a concentração do produto químico em estudo sofre no interior ou à superfície de um organismo, relativamente à concentração do mesmo produto no meio circundante. A bioacumulação resulta dos processos de bioconcentração e bioamplificação (cf. infra).
|
|
|
Bioconcentração é o aumento que a concentração do produto químico em estudo sofre no interior ou à superfície de um organismo, em consequência da absorção do produto exclusivamente a partir do meio circundante (ou seja, através da superfície do corpo e através do solo ingerido), relativamente à concentração do mesmo produto no meio circundante.
|
|
|
Bioamplificação é o aumento que a concentração do produto químico em estudo sofre no interior ou à superfície de um organismo, sobretudo em consequência da absorção de alimentos ou presas contaminados, relativamente à concentração do mesmo produto nesses alimentos ou presas. A bioamplificação pode conduzir à transferência do produto químico para as cadeias alimentares, com acumulação.
|
|
|
Eliminação de um produto químico em estudo é a perda desse produto pelos tecidos do organismo sujeito ao ensaio, mediante processos ativos ou passivos, perda essa que ocorre independentemente da presença ou ausência do produto químico no meio circundante.
|
|
|
Fator de bioacumulação (BAF) em qualquer momento da fase de absorção deste ensaio de bioacumulação é o quociente entre a concentração do produto químico no interior ou à superfície do organismo sujeito ao ensaio (Ca — em g por kg de massa seca de verme) e a concentração do produto químico no meio circundante (Cs — em g por kg de massa seca de solo); as unidades em que se exprime o BAF são kg de solo por kg de verme.
|
|
|
Fator de bioacumulação em estado estacionário (BAFss) é o BAF em estado estacionário, sem variação significativa ao longo de um período prolongado, mantendo-se constante durante esse período a concentração do produto químico no meio circundante (Cs — em g por kg de massa seca de solo).
|
|
|
O fator de bioacumulação, quando calculado diretamente pelo quociente entre a constante de velocidade de absorção do solo e a constante de velocidade de eliminação do solo (ks e ke — cf. infra), é designado fator de bioacumulação cinético (BAFK).
|
|
|
Fator de acumulação biota-solo (BSAF) é o quociente entre a concentração do produto químico em estudo no interior ou à superfície do organismo sujeito ao ensaio, normalizada relativamente ao teor de lípidos, e a concentração do mesmo produto químico no solo, normalizada relativamente ao teor de carbono orgânico, em estado estacionário. Ca é então expressa em g por kg de lípidos do organismo e Cs em g por kg de teor orgânico do solo; as unidades em que se exprime o BSAF são kg de carbono orgânico por kg de lípidos.
|
|
|
Patamar ou estado estacionário é o equilíbrio entre os processos de absorção e de eliminação que ocorrem simultaneamente durante a fase de exposição. No gráfico do BAF em função do tempo, o estado estacionário é atingido quando a curva se torna uma linha paralela ao eixo do tempo e três cálculos sucessivos do BAF em amostras colhidas com intervalos de, pelo menos, dois dias não diferem mais de 20 % entre si, sem que haja diferenças significativas entre os três períodos de amostragem. No caso de produtos químicos de absorção lenta, são mais adequados intervalos de sete dias (49).
|
|
|
Coeficiente de partição carbono orgânico-água (Koc) é o quociente entre a concentração de um produto químico no interior ou à superfície da fração de carbono orgânico de um solo e a concentração do mesmo produto químico na água, em condições de equilíbrio.
|
|
|
Coeficiente de partição octanol-água (Kow, por vezes também representado por Pow), é o quociente entre a solubilidade de um produto químico em n-octanol e a solubilidade do mesmo produto químico na água, em condições de equilíbrio. O logaritmo de Kow (log Kow) é utilizado como indicador do potencial de bioacumulação de produtos químicos em organismos aquáticos.
|
|
|
Fase de absorção ou de exposição é o período durante o qual os organismos sujeitos ao ensaio estão expostos ao produto químico em estudo.
|
|
|
Constante de velocidade de absorção do solo (ks) é o valor numérico que define o ritmo (ou taxa) de aumento da concentração do produto químico em estudo no interior ou à superfície do organismo sujeito ao ensaio, em resultado da fase de absorção de solo; ks é expressa em g de solo por kg de verme por dia.
|
|
|
Fase de eliminação é o período, depois de os organismos sujeitos ao ensaio serem transferidos de um meio contaminado para um meio isento do produto químico em estudo, durante o qual é estudada a eliminação (ou perda líquida) do produto químico por esses organismos.
|
|
|
Constante de velocidade de eliminação (ke) é o valor numérico que define o ritmo (ou taxa) de redução da concentração do produto químico em estudo no interior ou à superfície do organismo sujeito ao ensaio, depois de o organismo sujeito ao ensaio ser transferido de um meio que contém o produto químico para um meio dele isento; ke é expressa em dia-1.
|
|
|
Produto químico em estudo é qualquer substância ou mistura à qual seja aplicado este método de ensaio.
|
Apêndice 2
Cálculo dos parâmetros de absorção e de eliminação
O principal parâmetro final de um ensaio de bioacumulação é o fator de bioacumulação — BAF. O BAF pode ser calculado dividindo a concentração no organismo sujeito ao ensaio, Ca, pela concentração no solo, Cs, em estado estacionário. Se não se atingir o estado estacionário durante a fase de absorção, calcula-se o BAFK a partir das constantes de velocidade, em vez do BAFss. Deve, porém, indicar-se se o BAF é ou não baseado nas concentrações em estado estacionário.
O meio habitual para obter o fator de bioacumulação cinético (BAFK), a constante de velocidade de absorção do solo (ks) e a constante de velocidade de eliminação (ke) são métodos informáticos de estimativa de parâmetros não lineares — por exemplo, com base nos modelos descritos na referência (68). Dado um conjunto de dados sequenciais de concentração em função do tempo e as equações de modelo:
|
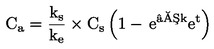
|
0 < t < tc
|
(equação 1)
|
ou
|

|
t > tc
|
(equação 2)
|
em que
|
Ca
|
=
|
concentração do produto químico nos vermes [g por kg de massa húmida ou seca]
|
|
ks
|
=
|
constante de velocidade de absorção nos tecidos [g de solo por kg de verme por dia]
|
|
Cs
|
=
|
concentração do produto químico no solo [g por kg de massa húmida ou seca]
|
|
ke
|
=
|
constante de velocidade de eliminação [dia-1]
|
|
tc
|
=
|
tempo decorrido até ao final da fase de absorção,
|
esses programas informáticos calculam os valores de BAFK, ks e ke.
Se a concentração de fundo nos vermes não expostos — por exemplo, no dia 0 — diferir significativamente de zero (pode, por exemplo, ser o caso relativamente aos metais), essa concentração de fundo (Ca,0) deve ser incluída nas equações, transformando-as em:
|
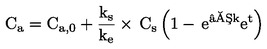
|
0 < t < tc
|
(equação 3)
|
e
|
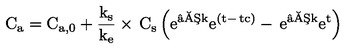
|
t > tc
|
(equação 4)
|
Nos casos em que, durante a fase de absorção, se observa ao longo do tempo um decréscimo significativo da concentração do produto químico no solo, podem utilizar-se os seguintes modelos — p. ex., 67 e 79:
|

|
(equação 5)
|
em que
|
Cs
|
=
|
concentração do produto químico no solo [g por kg de massa húmida ou seca]
|
|
k0
|
=
|
constante de velocidade de degradação no solo [dia-1]
|
|
C0
|
=
|
concentração inicial do produto químico no solo [g por kg de massa húmida ou seca]
|
|

|
0 < t < tc
|
(equação 6)
|
|

|
t > tc
|
(equação 7)
|
em que
|
Ca
|
=
|
concentração do produto químico nos vermes [g por kg de massa húmida ou seca]
|
|
ks
|
=
|
constante de velocidade de absorção nos tecidos [g de solo por kg de verme por dia]
|
|
k0
|
=
|
constante de velocidade de degradação no solo [dia-1]
|
|
ke
|
=
|
constante de velocidade de eliminação [dia-1]
|
|
tc
|
=
|
tempo decorrido até ao final da fase de absorção.
|
Se durante a fase de absorção for atingido o estado estacionário (ou seja, se t = ∞), a equação 1
|

|
0 < t < tc
|
(equação 1)
|
pode ser reduzida a:

ou
|

|
(equação 8)
|
Então ks/ke x Cs é uma aproximação à concentração do produto químico nos tecidos dos vermes em estado estacionário (Ca,ss).
O fator de acumulação biota-solo (BSAF) pode ser calculado pela seguinte fórmula:
|

|
(equação 9)
|
em que foc é a fração de carbono orgânico do solo e flip é a fração de lípidos dos vermes, ambas preferencialmente determinadas em amostras colhidas no âmbito do ensaio e baseadas, ambas, na massa seca ou na massa húmida.
As constantes cinéticas de eliminação podem ser modelizadas utilizando os dados da fase de eliminação e aplicando a equação de modelo infra e um método informático de estimativa de parâmetros não lineares. Se o gráfico dos dados em função do tempo indicar um decréscimo exponencial constante da concentração do produto químico nos animais, pode utilizar-se um modelo monocompartimental (equação 9) para descrever a eliminação ao longo do tempo.
|

|
(equação 10)
|
Os processos de eliminação revelam-se por vezes bifásicos, com rápido decréscimo de Ca durante as primeiras fases da eliminação e perda mais lenta do produto químico em estudo nas fases posteriores — p. ex., 27 e 68. As duas fases podem ser interpretadas admitindo que há dois compartimentos distintos no organismo, que eliminam a velocidades diferentes o produto químico em estudo. Nestes casos, deve consultar-se literatura específica — p. ex., 38, 39, 40 e 78.
Por meio das equações de modelo supra, os parâmetros cinéticos (ks e ke) podem também ser calculados de uma só vez aplicando o modelo de cinética de primeira ordem simultaneamente a todos os dados da fase de absorção e da fase de eliminação. Para a descrição de um método que permita esse cálculo combinado das constantes de velocidade de absorção e de eliminação, consultar, por exemplo, as referências 41, 73 e 70.
|

|
(equação 11)
|
|
Nota:
|
Se os parâmetros de absorção e de eliminação forem estimados simultaneamente a partir dos dados combinados de absorção e de eliminação, o "m" que aparece na equação 11 é um descritor que permite ao programa informático associar os subtermos da equação aos conjuntos de dados da fase respetiva e efetuar corretamente os cálculos (m = 1 para a fase de absorção, m = 2 para a fase de eliminação).
|
Estas equações de modelo devem, porém, ser utilizadas com precaução, em especial se, durante o ensaio, ocorrerem alterações da biodisponibilidade ou da (bio)degradação do produto químico em estudo — p. ex., (79).
Apêndice 3
EXEMPLOS DE PROGRAMAÇÃO DE ENSAIOS DE BIOACUMULAÇÃO NO SOLO
Ensaio em minhocas
|
a)
|
Fase de absorção, com oito datas de colheita de amostras para cálculo dos parâmetros cinéticos
|
Dia
|
Atividade
|
|
– 6
|
O solo preparado é condicionado durante 48 h;
|
|
– 4
|
A fração de solo é enriquecida com a solução do produto químico em estudo; deixa-se evaporar os solventes; misturam-se os componentes do solo; distribui-se o solo pelos recipientes de ensaio; estabelece-se o equilíbrio com as condições do ensaio durante quatro dias (três semanas no caso de solo enriquecido com metais);
|
|
– 3 a – 1
|
Os organismos que vão ser sujeitos ao ensaio são separados da cultura, para aclimatação; os componentes do solo são preparados e humedecidos;
|
|
0
|
Mede-se a temperatura e o pH do solo; são retiradas amostras de solo dos recipientes enriquecidos e dos controlos do solvente, para determinar a concentração do produto químico em estudo; adiciona-se ração alimentar; as minhocas são pesadas e distribuídas aleatoriamente pelos recipientes de ensaio; separa-se subamostras suficientes de minhocas para determinar os valores analíticos de fundo, a massa húmida, a massa seca e o teor de lípidos; pesa-se todos os recipientes de ensaio, para verificar o teor de humidade do solo; verifica-se a alimentação de ar, se for utilizado um sistema de ensaio fechado;
|
|
1
|
Verifica-se a alimentação de ar e regista-se o comportamento das minhocas e a temperatura; colhe-se amostras do solo e das minhocas para determinar a concentração do produto químico em estudo;
|
|
2
|
O mesmo que no dia 1;
|
|
3
|
Verifica-se a alimentação de ar, o comportamento das minhocas e a temperatura;
|
|
4
|
O mesmo que no dia 1;
|
|
5 - 6
|
O mesmo que no dia 3;
|
|
7
|
O mesmo que no dia 1; adiciona-se ração alimentar; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio; repõe-se a água evaporada;
|
|
8 - 9
|
O mesmo que no dia 3;
|
|
10
|
O mesmo que no dia 1;
|
|
11 - 13
|
O mesmo que no dia 3;
|
|
14
|
O mesmo que no dia 1; adiciona-se ração alimentar; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio; repõe-se a água evaporada;
|
|
15 - 16
|
O mesmo que no dia 3;
|
|
17
|
O mesmo que no dia 1;
|
|
18 - 20
|
O mesmo que no dia 3;
|
|
21
|
O mesmo que no dia 1; mede-se a temperatura e o pH do solo; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio; termina a fase de absorção; transfere-se as minhocas dos replicados expostos restantes para recipientes contendo solo limpo, com vista à fase de eliminação (sem purga do trato digestivo); colhe-se amostras de solo e de minhocas dos controlos do solvente.
|
|
|
As atividades de pré-exposição (fase de estabelecimento do equilíbrio) devem ser programadas tendo em conta as propriedades do produto químico em estudo.
|
|
|
As atividades descritas para o dia 3 devem ser executadas diariamente (pelo menos em dias úteis).
|
|
|
b)
|
Fase de eliminação
|
Dia
|
Atividade
|
|
– 6
|
Os componentes do solo são preparados e humedecidos; o solo preparado é condicionado durante 48 h;
|
|
– 4
|
Mistura-se os componentes do solo; distribui-se o solo pelos recipientes de ensaio; incuba-se nas condições de ensaio durante 4 dias;
|
|
0 (final da fase de absorção)
|
Mede-se a temperatura e o pH do solo; as minhocas são pesadas e distribuídas aleatoriamente pelos recipientes de ensaio; adiciona-se ração alimentar; transferem-se as minhocas dos replicados expostos restantes para recipientes contendo solo limpo; colhem-se amostras do solo e das minhocas quatro a seis horas mais tarde, para determinar a concentração do produto químico em estudo;
|
|
1
|
Verifica-se a alimentação de ar e regista-se o comportamento das minhocas e a temperatura; colhe-se amostras do solo e das minhocas para determinar a concentração do produto químico em estudo;
|
|
2
|
O mesmo que no dia 1;
|
|
3
|
Verificam-se a alimentação de ar, o comportamento das minhocas e a temperatura;
|
|
4
|
O mesmo que no dia 1;
|
|
5 - 6
|
O mesmo que no dia 3;
|
|
7
|
O mesmo que no dia 1; adiciona-se ração alimentar; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio; repõe-se a água evaporada;
|
|
8 - 9
|
O mesmo que no dia 3;
|
|
10
|
O mesmo que no dia 1;
|
|
11 - 13
|
O mesmo que no dia 3;
|
|
14
|
O mesmo que no dia 1; adiciona-se ração alimentar; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio e compensando a água evaporada;
|
|
15 - 16
|
O mesmo que no dia 3;
|
|
17
|
O mesmo que no dia 1;
|
|
18 - 20
|
O mesmo que no dia 3;
|
|
21
|
O mesmo que no dia 1; mede-se a temperatura e o pH do solo; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio; colhe-se amostras de solo e de minhocas dos controlos do solvente.
|
|
|
Antes de se iniciar a fase de eliminação, o solo deve ser preparado do mesmo modo que antes de se iniciar a fase de absorção.
|
|
|
As atividades descritas para o dia 3 devem ser executadas diariamente (pelo menos em dias úteis).
|
|
Ensaio em vermes da família Enchytraeidae
|
a)
|
Fase de absorção, com oito datas de colheita de amostras, para cálculo dos parâmetros cinéticos
|
Dia
|
Atividade
|
|
– 6
|
O solo preparado é condicionado durante 48 h;
|
|
– 4
|
A fração de solo é enriquecida com a solução do produto químico em estudo; deixa-se evaporar os solventes; mistura-se os componentes do solo; distribui-se o solo pelos recipientes de ensaio; estabelece-se o equilíbrio com as condições do ensaio durante quatro dias (três semanas no caso de solo enriquecido com metais);
|
|
– 3 a – 1
|
Os organismos que vão ser sujeitos ao ensaio são separados da cultura, para aclimatação; prepara-se e humedece-se os componentes do solo;
|
|
0
|
Mede-se a temperatura e o pH do solo; colhe-se amostras de solo dos recipientes enriquecidos e dos controlos do solvente, para determinar a concentração do produto químico em estudo; adiciona-se ração alimentar ao solo; os vermes são pesados e distribuídos aleatoriamente pelos recipientes de ensaio; separa-se subamostras suficientes de vermes para determinar os valores analíticos de fundo, a massa húmida, a massa seca e o teor de lípidos; pesa-se todos os recipientes de ensaio, para verificar o teor de humidade do solo; verifica-se a alimentação de ar, se for utilizado um sistema de ensaio fechado;
|
|
1
|
Verifica-se a alimentação de ar e regista-se o comportamento dos vermes e a temperatura; colhe-se amostras do solo e dos vermes, para determinar a concentração do produto químico em estudo;
|
|
2
|
O mesmo que no dia 1;
|
|
3
|
Verifica-se a alimentação de ar, o comportamento dos vermes e a temperatura;
|
|
4
|
O mesmo que no dia 1;
|
|
5 - 6
|
O mesmo que no dia 3;
|
|
7
|
O mesmo que no dia 1; adiciona-se ração alimentar ao solo; verifica-se o teor de humidade do solo, pesando novamente os recipientes; repõe-se a água evaporada;
|
|
9
|
O mesmo que no dia 1;
|
|
10
|
O mesmo que no dia 3;
|
|
11
|
O mesmo que no dia 1;
|
|
12 - 13
|
O mesmo que no dia 3;
|
|
14
|
O mesmo que no dia 1; adiciona-se ração alimentar ao solo; mede-se a temperatura e o pH do solo; verifica-se o teor de humidade do solo, pesando novamente os recipientes de ensaio; termina a fase de absorção; transfere-se os vermes dos replicados expostos restantes para recipientes contendo solo limpo, com vista à fase de eliminação (sem purga do trato digestivo); colhe-se amostras de solo e de vermes dos controlos do solvente.
|
|
|
As atividades de pré-exposição (fase de estabelecimento do equilíbrio) devem ser programadas tendo em conta as propriedades do produto químico em estudo.
|
|
|
As atividades descritas para o dia 3 devem ser executadas diariamente (pelo menos em dias úteis).
|
|
Apêndice 4
Solo artificial — recomendações de preparação e armazenagem
Dado que podem não estar disponíveis ao longo de todo o ano solos naturais de uma determinada origem e que a presença de organismos indígenas e de micropoluentes pode influenciar o ensaio, recomenda-se para este um substrato artificial, o solo artificial a que se refere o capítulo C.8 deste anexo — Toxicidade em relação às minhocas (48). Várias espécies cobaias podem sobreviver, desenvolver-se e reproduzir-se neste solo, garantindo-se uma estandardização máxima e a comparabilidade intralaboratorial e interlaboratorial das condições de ensaio e de cultura.
Componentes do solo
|
Turfa:
|
10 %
|
Turfa de Sphagnum, em conformidade com o Test Guideline 207 da OCDE (48);
|
|
Areia quartzítica:
|
70 %
|
Areia quartzítica industrial (seca ao ar); granulometria: mais de 50 % das partículas devem situar-se no intervalo 50-200 μm, mas todas devem ser ≤ 2 mm;
|
|
Argila caulinítica:
|
20 %
|
Teor de caulinite ≥ 30 %;
|
|
Carbonato de cálcio:
|
≤ 1 %
|
CaCO3, pulverizado, quimicamente puro.
|
Opcionalmente, pode reduzir-se o teor de carbono orgânico do solo artificial — por exemplo, baixando o teor de turfa para 4-5 % do solo seco e subindo correspondentemente o teor de areia. Com esta redução do teor de carbono orgânico, podem diminuir-se as possibilidades de adsorção do produto químico em estudo ao solo (carbono orgânico) e pode favorecer-se a disponibilização do produto aos vermes (74). Foi demonstrado que as espécies Enchytraeus albidus e Eisenia fetida podem cumprir os critérios de validade relativos à reprodução quando sujeitas a ensaio em solos naturais com teor de carbono orgânico inferior — p. ex., 2,7 % (33)(61). A experiência adquirida revela que o mesmo se pode também conseguir em solo artificial com 5 % de turfa.
Preparação
Os componentes secos do solo são misturados cuidadosamente (por exemplo, num misturador laboratorial grande). Esta operação deve ser executada cerca de uma semana antes do início do ensaio. Depois de misturados, os componentes secos devem ser humedecidos com água desionizada pelo menos 48 horas antes da aplicação do produto químico em estudo, a fim de equilibrar ou estabilizar a acidez. Para determinar o pH, utiliza-se uma mistura 1:5 de solo com uma solução 1 M de KCl. Se o valor do pH não estiver dentro do intervalo requerido (6,0 ± 0,5), adiciona-se ao solo uma quantidade suficiente de CaCO3 ou prepara-se um novo lote de solo.
A capacidade máxima de retenção de água do solo artificial é determinada de acordo com a norma ISO 11268-2 (35). Pelo menos dois dias antes do início do ensaio, o solo artificial seco é humedecido, adicionando água desionizada ou reconstituída até se obter aproximadamente metade do teor final de água. O teor final de água deve situar-se entre 40 % e 60 % da capacidade máxima de retenção de água. No início do ensaio, o solo previamente humedecido é dividido em tantos lotes quantas as concentrações e os controlos utilizados no ensaio, e o teor de humidade é ajustado para 40 % a 60 % da capacidade máxima de retenção de água com a solução do produto químico em estudo e/ou adicionando água desionizada ou reconstituída. O teor de humidade é determinado no início e no final do ensaio (a 105 °C). Deve ser o teor ótimo para a espécie sujeita ao ensaio (o teor de humidade pode também ser verificado do seguinte modo: espremendo o solo delicadamente na mão, devem aparecer pequenas gotas de água entre os dedos).
Armazenagem
Os componentes secos do solo artificial podem ser armazenados à temperatura ambiente do laboratório até à sua utilização. O solo preparado e previamente humedecido pode ser armazenado em local fresco até três dias antes do seu enriquecimento; deve minimizar-se a evaporação de água. O solo enriquecido com o produto químico em estudo deve ser utilizado de imediato, a menos que haja indicações de que o solo em questão pode ser armazenado sem afetar a toxicidade e a biodisponibilidade do produto químico em causa. Podem então ser armazenadas amostras do solo enriquecido, respeitando as condições recomendadas para o produto químico em estudo, até à realização das análises.
Apêndice 5
Espécies de oligoquetas terrestres recomendadas para ensaios de bioacumulação no solo
Minhocas
A espécie recomendada para os ensaios é a Eisenia fetida (Savigny 1826), pertencente à família Lumbricidae e dividida desde 1972 em duas subespécies — Eisenia fetida e Eisenia andrei (10). Segundo Jaenike (36), trata-se de duas espécies separadas. A Eisenia fetida é facilmente identificável pelas listras amarelas brilhantes intersegmentais, ao passo que a Eisenia andrei tem cor vermelha escura uniforme. Originárias provavelmente da região do Mar Negro, estão hoje distribuídas por todo o mundo, sobretudo em habitats antropogenicamente modificados, como as montureiras de compostagem. Ambas podem ser utilizadas para ensaios ecotoxicológicos e de bioacumulação.
A Eisenia fetida e a E. andrei são comercializadas, por exemplo, como isco para pesca. Em comparação com outros vermes da família Lumbricidae, têm um ciclo de vida curto, atingindo a maturidade por volta dos 2 ou 3 meses (à temperatura ambiente do laboratório). A temperatura ótima para elas é de 20 a 24 °C. Preferem substratos relativamente húmidos, com pH próximo da neutralidade e teor elevado de matéria orgânica. Como estas espécies têm sido amplamente utilizadas em ensaios ecotoxicológicos estandardizados desde há uns 25 anos, a sua criação em cultura está bem estabelecida (48)(77).
Ambas as espécies podem ser cultivadas numa ampla gama de resíduos de origem animal. O meio de cultura recomendado pela ISO é uma mistura 50:50 de esterco de cavalo ou de bovino com turfa (35). O meio deve ter um pH de 6 a 7 (regulado com carbonato de cálcio) e baixa condutividade iónica (menos de 6 mS/cm ou menos de 0,5 % de concentração salina) e não deve estar excessivamente contaminado com amoníaco ou urina. Pode também ser utilizado um solo comercial para jardinagem, sem aditivos, solo artificial correspondente à norma da OCDE (48) ou uma mistura 50:50 de ambos. O substrato deve estar húmido, mas não encharcado. São adequadas caixas de cultura de 10 a 50 litros.
Para obter minhocas de idade e massa normalizadas, é melhor iniciar a cultura com casulos de ovos. Por conseguinte, junta-se minhocas adultas a uma caixa de cultura com substrato fresco, para produzir casulos. A experiência demonstra que uma densidade populacional próxima dos 100 vermes adultos por kg de substrato (massa húmida) conduz a boas taxas de reprodução. Ao cabo de 28 dias, retira-se as minhocas adultas. Os vermes provenientes da eclosão dos ovos são utilizados nos ensaios quando atingem a maturidade, ou seja, a partir dos dois meses de idade, mas não ultrapassando os 12 meses.
Os vermes destas duas espécies podem ser considerados saudáveis se se movimentarem através do substrato, não tentarem abandoná-lo e se reproduzirem continuamente. Movimentos muito lentos ou um posterior de cor amarelada (no caso da Eisenia fetida) indicam exaustão do substrato. Nesse caso, recomenda-se substrato fresco e/ou um número mais reduzido de animais por caixa.
Referências selecionadas adicionais
Gerard B.M. (1964). Synopsis of the British fauna. No. 6 Lumbricidae. Linnean Soc. London, 6: 1-58.
Graff O. (1953). Die Regenwürmer Deutschlands. Schr. Forsch. Anst. Landwirtsch. 7: 1-81.
Römbke J., Egeler P., Füll C. (1997). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. Bericht für das UBA F + E 206 03 909, 86 S.
Rundgren S. (1977). Seasonality of emergence in lumbricids in southern Sweden. Oikos 28: 49-55.
Satchell J.E. (1955). Some aspects of earthworm ecology. Soil Zoology (Kevan): 180-201.
Sims R.W. e Gerard B.M. (1985). A synopsis of the earthworms. Linnean Soc. London 31: 1-171.
Tomlin A.D. (1984). The earthworm bait market in North America. In: Earthworm Ecology - from Darwin to vermiculture. Satchell J.E. (ed.), Chapman & Hall, Londres. 331-338 pp.
Vermes da família Enchytraeidae
A espécie recomendada para os ensaios é a Enchytraeus albidus (Henle 1837), uma das maiores da família Enchytraeidae de anelídeos oligoquetas (pode atingir 15 mm) e com distribuição mundial — p. ex., 8. A Enchytraeus albidus encontra-se em habitats marinhos, limosos ou terrestres, sobretudo em matéria orgânica em decomposição (algas, produtos de compostagem) e raramente em prados (42). Esta ampla tolerância ecológica e algumas variações morfológicas indicam que poderá haver diversas raças ou subespécies.
A Enchytraeus albidus é comercializada como alimento para peixes. Deve verificar-se se a cultura está contaminada por outras espécies, normalmente menores (60). Se houver contaminação, lavam-se todos os vermes numa placa de Petri e selecionam-se em seguida, por meio de um estereomicroscópio, grandes espécimes adultos de Enchytraeus albidus, para iniciar uma nova cultura. Rejeitam-se todos os restantes indivíduos. O ciclo de vida da espécie é curto, pois a maturidade é atingida entre os 33 dias (a 18 °C) e os 74 dias (a 12 °C). Somente culturas mantidas no laboratório sem problemas durante pelo menos cinco semanas (uma geração) devem ser utilizadas nos ensaios.
Há outras espécies do género Enchytraeus igualmente adequadas, com destaque para a Enchytraeus luxuriosus, que tem o seu habitat verdadeiramente no solo e que foi descrita pela primeira vez na referência (65). Se forem utilizadas outras espécies de Enchytraeus, importa identificá-las claramente e justificar a seleção.
A Enchytraeus crypticus (Westheide & Graefe 1992) é uma espécie pertencente ao mesmo grupo da Enchytraeus luxuriosus. Não está provado que ocorra no campo, tendo sido descrita apenas em culturas de minhocas e montureiras de compostagem (Römbke 2003). Por conseguinte, desconhece-se as suas exigências ecológicas originais. Contudo, estudos laboratoriais recentes em vários solos naturais confirmaram que esta espécie tem uma tolerância ampla em relação a propriedades do solo como o pH e a textura (Jänsch et al. 2005). Em anos recentes, foi frequentemente utilizada em estudos ecotoxicológicos, dada a simplicidade da sua criação e da sua sujeição a ensaio (p. ex., Kuperman et al. 2003). É, porém, pequena (3-12 mm, com 7 mm em média — Westheide e Müller 1996), o que dificulta a sua manipulação, a comparar com a Enchytraeus albidus. Se esta espécie for utilizada em vez da Enchytraeus albidus, o recipiente de ensaio pode ser menor. Por outro lado, deve ter-se em conta que esta espécie se reproduz muito rapidamente, tendo um período de geração inferior a 20 dias a 20 ± 2 °C (Achazi et al. 1999) ou mesmo mais curto se a temperatura for mais elevada.
Os vermes da espécie Enchytraeus albidus (bem como de outras espécies congéneres) podem ser criados em grandes caixas de plástico (por exemplo, de 30 × 60 × 10 cm ou de 20 × 12 × 8 cm, as dimensões adequadas para a cultura de vermes de pequeno tamanho), cheias com uma mistura de solo artificial e de solo para jardinagem, não contaminado e sem aditivos. O material de compostagem deve ser evitado, pois pode conter produtos químicos tóxicos, como metais pesados. Antes da utilização, deve remover-se qualquer fauna do solo de cultura, mediante três ciclos de ultracongelamento. Pode também utilizar-se solo artificial puro, mas a taxa de reprodução poderá ser mais lenta, em comparação com a obtida com substratos mistos. O substrato deve ter um pH de 6,0 ± 0,5. A cultura é mantida numa incubadora à temperatura de 15 ± 2 °C, sem luz. Devem evitar-se sempre temperaturas superiores a 23 °C. O solo, artificial ou natural, deve estar húmido, mas não encharcado. Pressionando o solo suavemente com a mão, devem aparecer apenas gotículas de água. Devem evitar-se sempre condições anóxicas (por exemplo, se se utilizar uma tampa, esta deve ter orifícios em número suficiente para uma boa renovação do ar). Deve arejar-se o solo da cultura, mexendo-o cuidadosamente uma vez por semana.
Os vermes devem ser alimentados pelo menos uma vez por semana, ad libitum, com flocos de aveia, que se colocam numa cavidade da superfície e se cobrem em seguida com solo. Se no recipiente restar alimento da última ministração, a quantidade distribuída deve ser ajustada em conformidade. Se se tiverem desenvolvido fungos, o alimento restante deve ser substituído por uma nova porção de flocos. A fim de estimular a reprodução, a aveia pode ser complementada, de duas em duas semanas, com proteínas em pó enriquecidas com vitaminas (à venda no comércio). Ao cabo de três meses, os animais são transferidos para uma cultura ou um substrato de reprodução, recentemente preparados. Os flocos de aveia, que têm de ser guardados em recipientes herméticos, devem ser tratados em autoclave ou aquecidos antes da sua ministração, para evitar infeções por ácaros — p. ex., Glyzyphagus sp., Astigmata, Acarina, ou Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina. Após a desinfeção, os flocos são moídos, para poderem ser facilmente espalhados na superfície do solo. Uma outra fonte possível de alimento é o fermento de padaria ou a comida para peixes TetraMin®.
Em geral, as condições de cultura são satisfatórias se os vermes não tentarem abandonar o substrato, se movimentarem rapidamente através do solo, exibirem uma superfície externa brilhante, sem partículas de solo pegadas, e tiverem uma coloração mais ou menos esbranquiçada e se forem visíveis vermes de diferentes idades. Na verdade, os vermes podem ser considerados saudáveis se se reproduzirem continuamente.
Referências selecionadas adicionais
Achazi R.K., Fröhlich E., Henneken M., Pilz C. (1999). The effect of soil from former irrigation fields and of sewage sludge on dispersal activity and colonizing success of the annelid Enchytraeus crypticus (Enchytraeidae, Oligochaeta). Newsletter on Enchytraeidae 6: 117-126.
Jänsch S., Amorim M.J.B., Römbke J. (2005). Identification of the ecological requirements of important terrestrial ecotoxicological test species. Environ. Reviews 13: 51-83.
Kuperman R.G., Checkai R.T., Simini M., Phillips C.T., Kolakowski J.E., Kurnas C.W., Sunahara G.I. (2003). Survival and reproduction of Enchytraeus crypticus (Oligochaeta, Enchytraeidae) in a natural sandy loam soil amended with the nitro-heterocyclic explosives RDX and HMX. Pedobiologia 47: 651-656.
Römbke J. (2003). Ecotoxicological laboratory tests with enchytraeids: A review. Pedobiologia 47: 607-616.
Westheide W. e Graefe U. (1992). Two new terrestrial Enchytraeus species (Oligochaeta, Annelida). J. Nat. Hist. 26: 479-488.
Westheide W. e Müller M.C. (1996). Cinematographic documentation of enchytraeid morphology and reproductive biology. Hydrobiologia 334: 263-267.
» |

 In force
In force


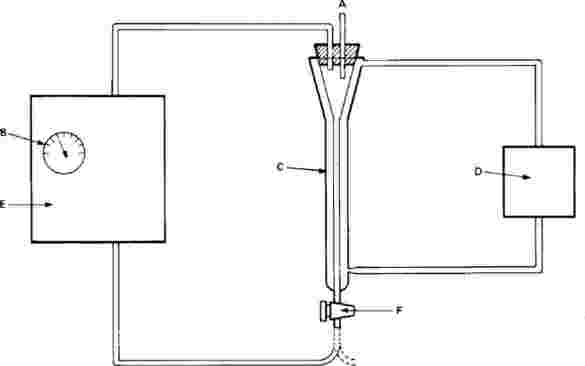
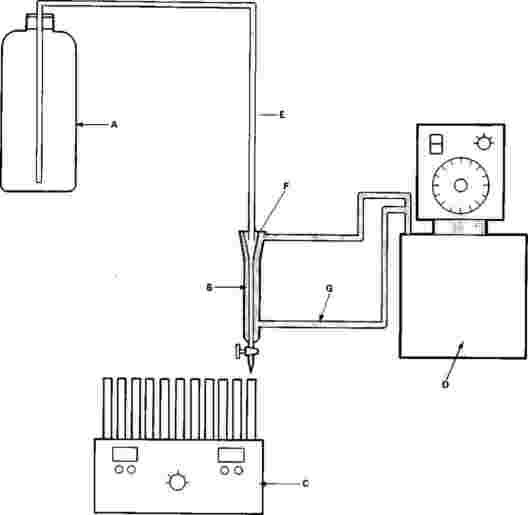


 (em molaridade),
(em molaridade),
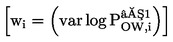 .
.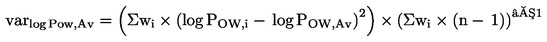
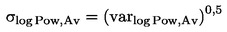
 . Se a concentração for mais baixa, serão necessários volumes maiores.
. Se a concentração for mais baixa, serão necessários volumes maiores.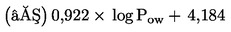
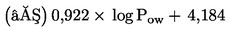


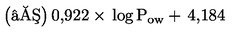


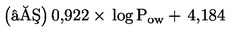
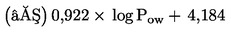




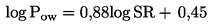
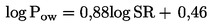
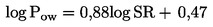


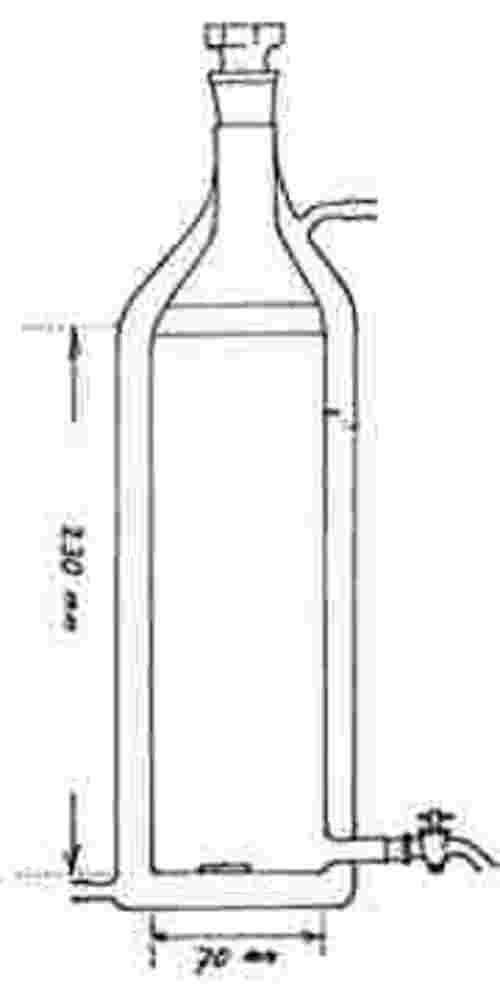






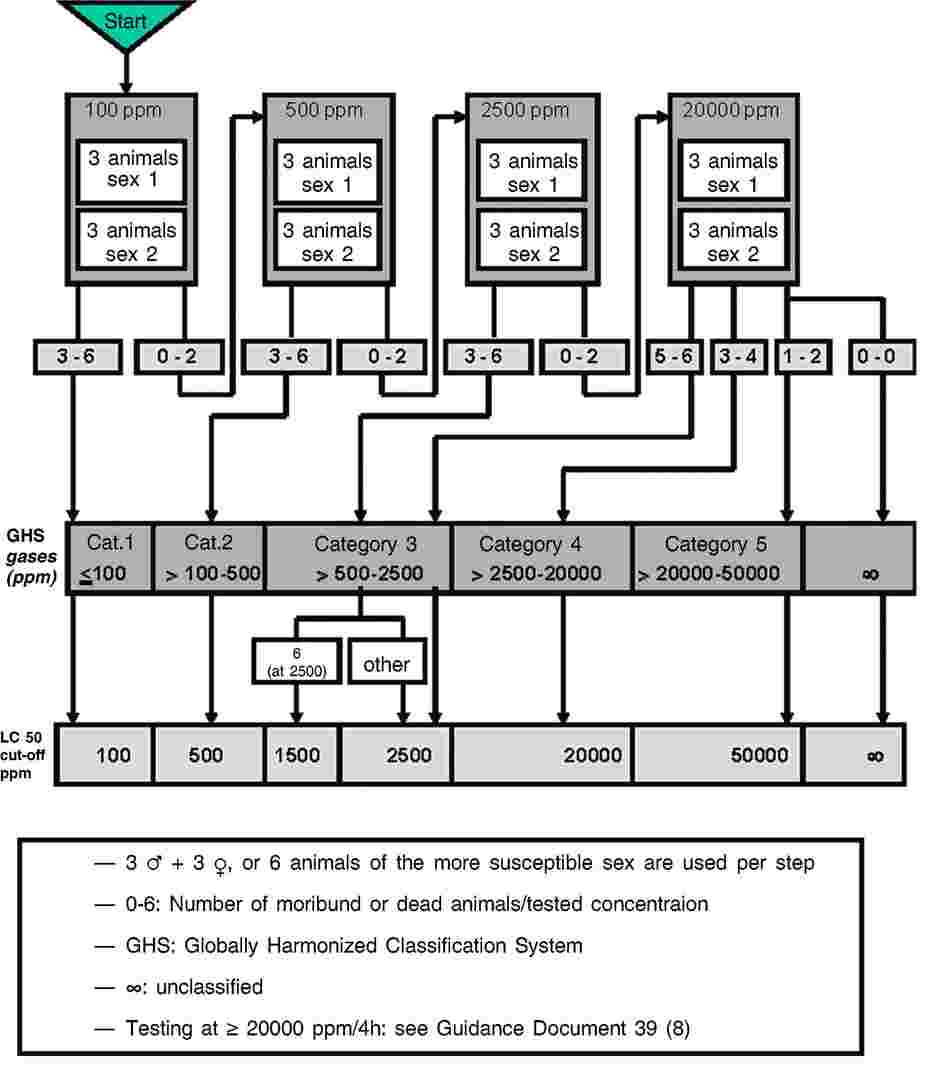







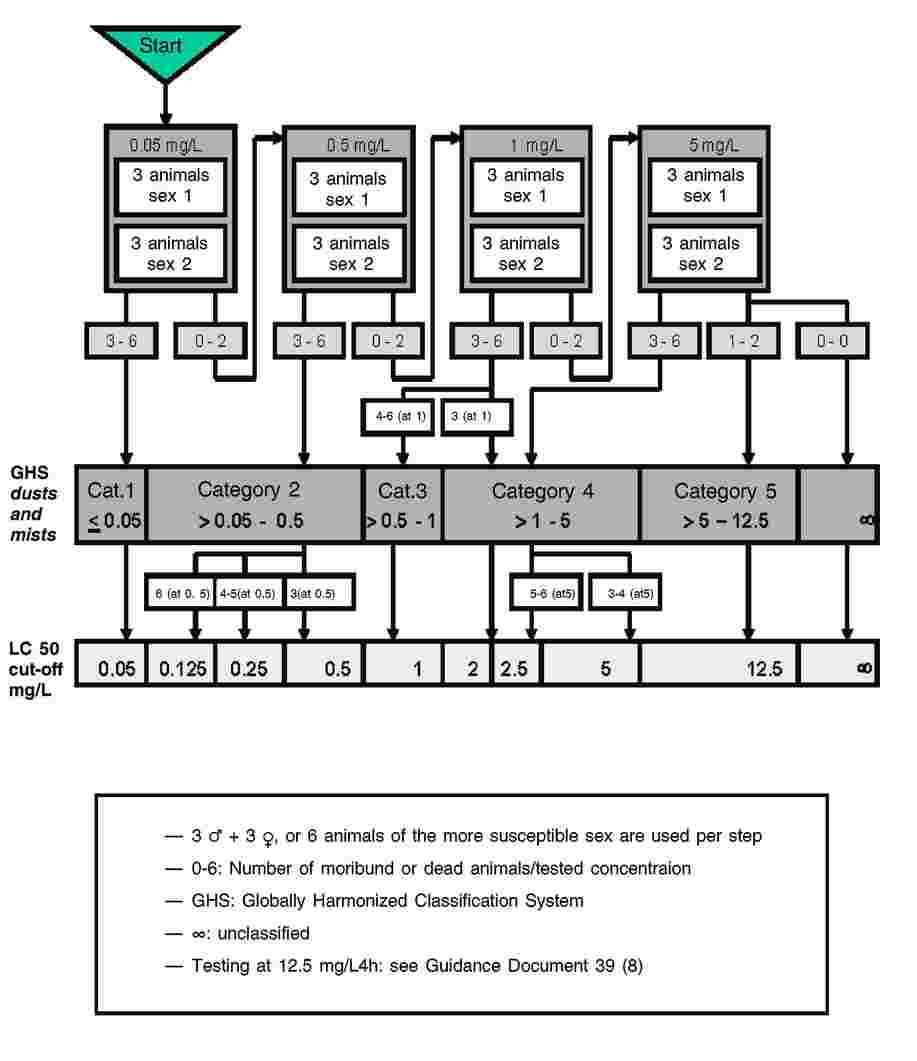
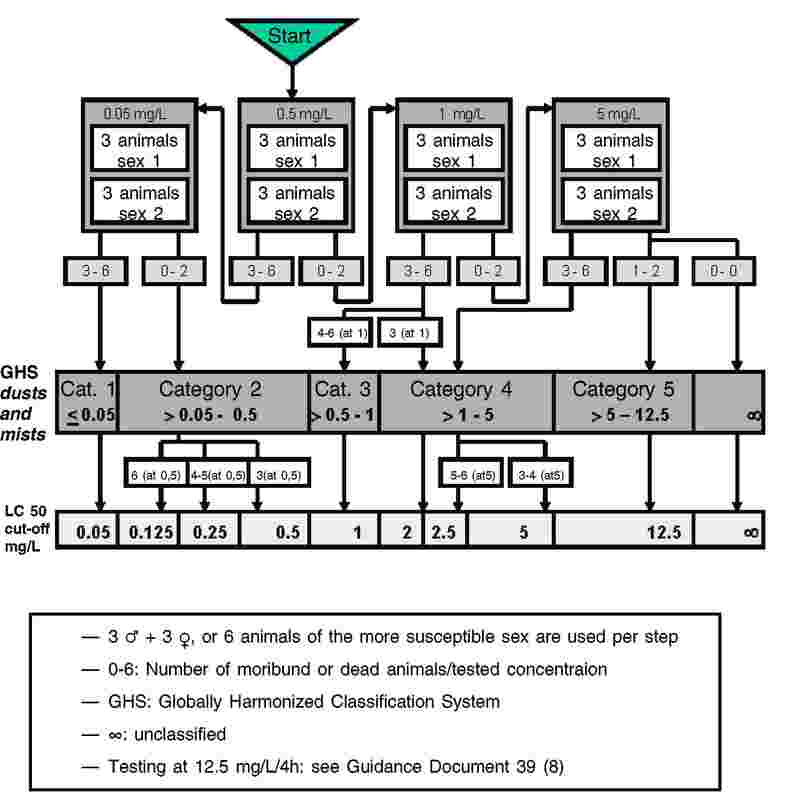








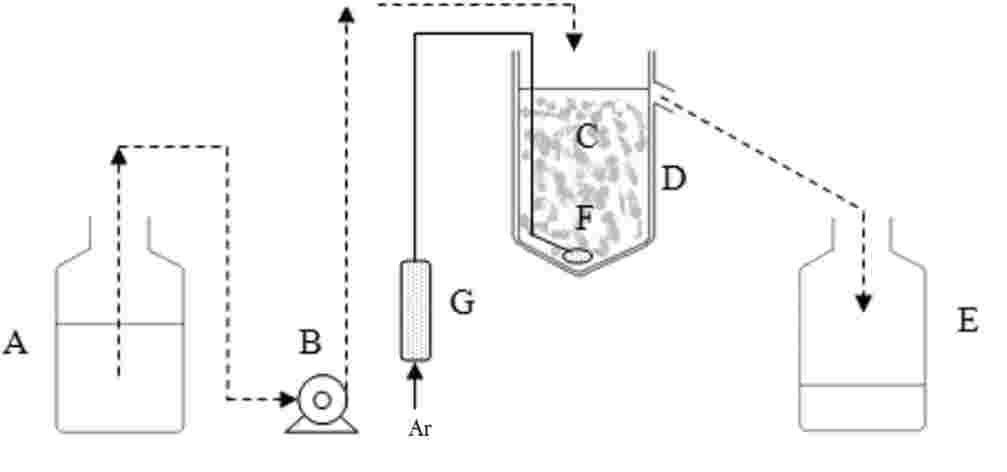
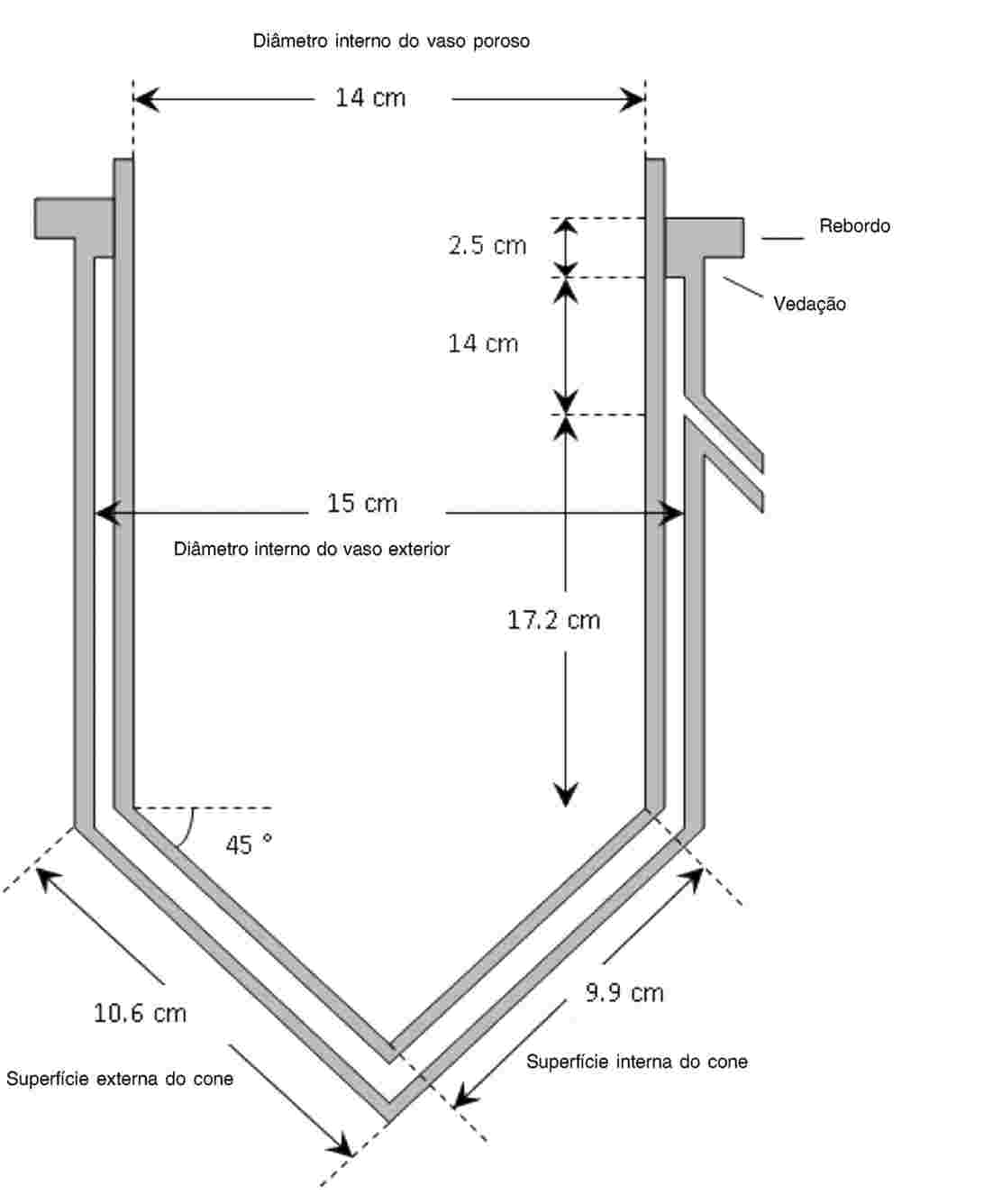


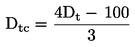

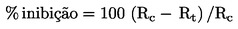



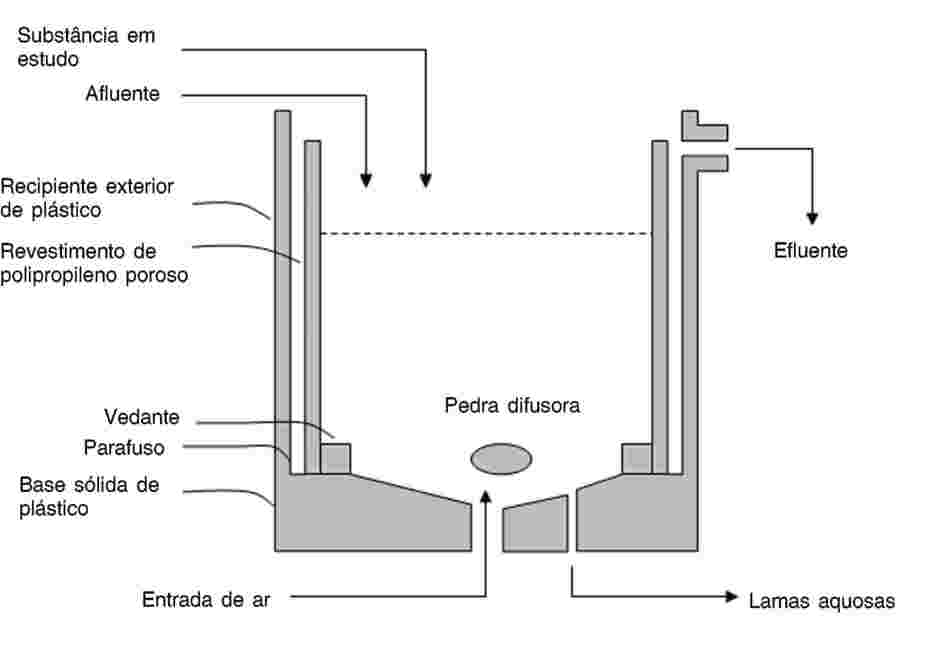


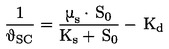


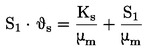
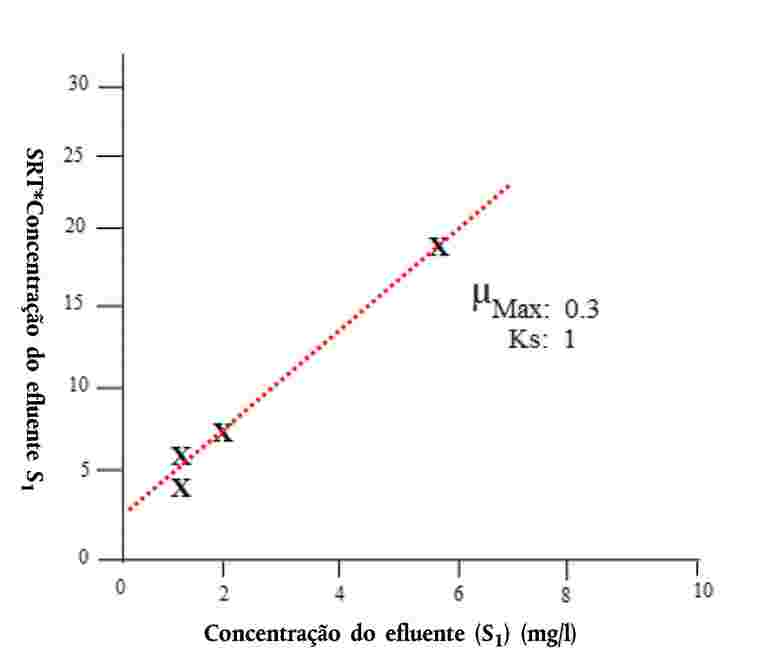
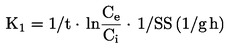










 )
)





 )
)