ISSN 1977-0766
Dziennik Urzędowy
Unii Europejskiej
L 199

Wydanie polskie
Legislacja
Tom 59
26 lipca 2016
|
ISSN 1977-0766 |
||
|
Dziennik Urzędowy Unii Europejskiej |
L 199 |
|

|
||
|
Wydanie polskie |
Legislacja |
Tom 59 |
|
|
|
|
|
(1) Tekst mający znaczenie dla EOG |
|
PL |
Akty, których tytuły wydrukowano zwykłą czcionką, odnoszą się do bieżącego zarządzania sprawami rolnictwa i generalnie zachowują ważność przez określony czas. Tytuły wszystkich innych aktów poprzedza gwiazdka, a drukuje się je czcionką pogrubioną. |
II Akty o charakterze nieustawodawczym
UMOWY MIĘDZYNARODOWE
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/1 |
DECYZJA RADY (UE) 2016/1210
z dnia 18 lipca 2016 r.
dotycząca zawarcia Protokołu do Umowy o partnerstwie i współpracy między Wspólnotami Europejskimi i ich państwami członkowskimi, z jednej strony, a Republiką Azerbejdżanu, z drugiej strony, w sprawie umowy ramowej między Unią Europejską a Republiką Azerbejdżanu dotyczącej zasad udziału Republiki Azerbejdżanu w programach unijnych
RADA UNII EUROPEJSKIEJ,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej, w szczególności jego art. 212 w związku z art. 218 ust. 6 lit. a) akapit drugi,
uwzględniając wniosek Komisji Europejskiej,
uwzględniając zgodę Parlamentu Europejskiego (1),
a także mając na uwadze, co następuje:
|
(1) |
Protokół do Umowy o partnerstwie i współpracy między Wspólnotami Europejskimi i ich państwami członkowskimi, z jednej strony, a Republiką Azerbejdżanu, z drugiej strony, w sprawie umowy ramowej między Unią Europejską a Republiką Azerbejdżanu dotyczącej ogólnych zasad udziału Republiki Azerbejdżanu w programach unijnych (zwany dalej „Protokołem”) został podpisany w imieniu Unii Europejskiej dnia 14 czerwca 2014 r. |
|
(2) |
Celem Protokołu jest ustanowienie zasad finansowych i technicznych umożliwiających Azerbejdżanowi uczestniczenie w niektórych programach unijnych. Ramy horyzontalne ustanowione na mocy Protokołu tworzą gospodarczy, finansowy i techniczny środek współpracy, który umożliwia dostęp do pomocy, w szczególności pomocy finansowej, dostarczanej przez Unię w kontekście tych programów unijnych. Ramy te mają zastosowanie wyłącznie do tych programów unijnych, w odniesieniu do których odpowiednie akty prawne przewidują możliwość udziału Republiki Azerbejdżanu. Zawarcie Protokołu nie oznacza zatem wykonywania uprawnień w ramach różnych polityk sektorowych realizowanych na mocy programów, które to uprawnienia wykonywane są przy ustanawianiu programów. |
|
(3) |
Protokół należy zatwierdzić, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Niniejszym zatwierdza się w imieniu Unii Protokół do Umowy o partnerstwie i współpracy między Wspólnotami Europejskimi i ich państwami członkowskimi, z jednej strony, a Republiką Azerbejdżanu, z drugiej strony, w sprawie umowy ramowej między Unią Europejską a Republiką Azerbejdżanu dotyczącej ogólnych zasad udziału Republiki Azerbejdżanu w programach unijnych (zwany dalej „Protokołem”) (2).
Artykuł 2
Przewodniczący Rady dokonuje, w imieniu Unii Europejskiej, notyfikacji przewidzianej w art. 10 Protokołu (3).
Artykuł 3
Niniejsza decyzja staje się skuteczna z dniem jej przyjęcia.
Sporządzono w Brukseli dnia 18 lipca 2016 r.
W imieniu Rady
F. MOGHERINI
Przewodniczący
(1) Zgoda z dnia 6 lipca 2016 r. (dotychczas nieopublikowana w Dzienniku Urzędowym).
(2) Protokół został opublikowany w Dz.U. L 19 z 24.1.2015, s. 4 wraz z decyzją w sprawie jego podpisania.
(3) Data wejścia w życie Protokołu zostanie opublikowana przez Sekretariat Generalny Rady w Dzienniku Urzędowym Unii Europejskiej.
ROZPORZĄDZENIA
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/3 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/1211
z dnia 20 lipca 2016 r.
dotyczące klasyfikacji niektórych towarów według Nomenklatury scalonej
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 952/2013 z dnia 9 października 2013 r. ustanawiające unijny kodeks celny (1), w szczególności jego art. 57 ust. 4 i art. 58 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
W celu zapewnienia jednolitego stosowania Nomenklatury scalonej, stanowiącej załącznik do rozporządzenia Rady (EWG) nr 2658/87 (2), konieczne jest przyjęcie środków dotyczących klasyfikacji towaru określonego w załączniku do niniejszego rozporządzenia. |
|
(2) |
Rozporządzeniem (EWG) nr 2658/87 ustanowiono Ogólne reguły interpretacji Nomenklatury scalonej. Reguły te stosuje się także do każdej innej nomenklatury, która jest w całości lub w części oparta na Nomenklaturze scalonej, bądź która dodaje do niej jakikolwiek dodatkowy podpodział i która została ustanowiona szczególnymi przepisami unijnymi, w celu stosowania środków taryfowych i innych środków odnoszących się do obrotu towarowego. |
|
(3) |
Stosownie do wymienionych wyżej ogólnych reguł towar opisany w kolumnie 1 tabeli zamieszczonej w załączniku należy klasyfikować do kodu CN wskazanego w kolumnie 2, na mocy uzasadnień określonych w kolumnie 3 tej tabeli. |
|
(4) |
Należy zagwarantować, aby wiążąca informacja taryfowa wydana odnośnie do towarów, o których mowa w niniejszym rozporządzeniu, która nie jest zgodna z niniejszym rozporządzeniem, mogła być nadal przywoływana przez osobę, której udzielono tej informacji, przez pewien okres, zgodnie z art. 34 ust. 9 rozporządzenia (UE) nr 952/2013. Okres ten powinien wynosić trzy miesiące. |
|
(5) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Komitetu Kodeksu Celnego, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Towar opisany w kolumnie 1 tabeli zamieszczonej w załączniku klasyfikuje się w Nomenklaturze scalonej do kodu CN wskazanego w kolumnie 2 tej tabeli.
Artykuł 2
Wiążąca informacja taryfowa, która nie jest zgodna z niniejszym rozporządzeniem, może być nadal przywoływana przez okres trzech miesięcy od daty wejścia w życie niniejszego rozporządzenia, zgodnie z art. 34 ust. 9 rozporządzenia (UE) nr 952/2013.
Artykuł 3
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 20 lipca 2016 r.
W imieniu Komisji,
za Przewodniczącego,
Stephen QUEST
Dyrektor Generalny ds. Podatków i Unii Celnej
(1) Dz.U. L 269 z 10.10.2013, s. 1.
(2) Rozporządzenie Rady (EWG) nr 2658/87 z dnia 23 lipca 1987 r. w sprawie nomenklatury taryfowej i statystycznej oraz w sprawie Wspólnej Taryfy Celnej (Dz.U. L 256 z 7.9.1987, s. 1).
ZAŁĄCZNIK
|
Opis towarów |
Klasyfikacja (kod CN) |
Uzasadnienie |
|
(1) |
(2) |
(3) |
|
Artykuł (tzw. hamak z ze stojakiem) o wymiarach w przybliżeniu 380 cm × 120 cm × 140 cm. Artykuł składa się z drewnianego stojaka umieszczanego na ziemi, na którym zawieszony jest hamak, o wymiarach 240 cm × 120 cm, wykonany z tkaniny bawełnianej. Krótsze boki hamaka są wykończone drewnianymi drążkami i wyposażone w sznurki do przymocowania do stojaka. Artykuł waży w przybliżeniu 32 kg i może utrzymać osoby o masie do 150 kg. (*) Zob. ilustracja. |
9403 60 90 |
Klasyfikacja wyznaczona jest przez reguły 1, 3 b) i 6 Ogólnych reguł interpretacji Nomenklatury scalonej, uwagę 2 do działu 94 oraz brzmienie kodów CN 9403 , 9403 60 i 9403 60 90 . Ze względu na swoje cechy charakterystyczne, a mianowicie masę i niemożliwość łatwego demontażu, artykuł nie może być łatwo przewożony do używania podczas wyjazdu na kemping. W związku z tym wykluczona jest klasyfikacja do pozycji 6306 jako wyposażenie kempingowe. Artykuł jest „ruchomy”, a ze względu na swoje obiektywne cechy charakterystyczne jest skonstruowany do umieszczenia na podłodze lub na ziemi. Jest on używany, głównie w celu użytkowym, do wyposażania obszarów zewnętrznych, takich jak ogrody prywatnych mieszkań, hoteli, restauracji itp. (zob. również Noty wyjaśniające do Systemu Zharmonizowanego do działu 94, Uwagi ogólne, pkt (A)). W związku z tym artykuł jest uważany za „mebel” wykonany z różnych materiałów i należy klasyfikować go do pozycji 9403 zgodnie z materiałem, z którego wykonana jest podpora (stojak) i który nadaje artykułowi jego zasadniczy charakter. Artykuł należy zatem klasyfikować do kodu CN 9403 60 90 jako pozostałe meble drewniane. |

(*) Ilustracja ma charakter wyłącznie informacyjny.
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/6 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/1212
z dnia 25 lipca 2016 r.
ustanawiające wykonawcze standardy techniczne w odniesieniu do standardowych procedur i formularzy na potrzeby przedkładania informacji zgodnie z dyrektywą Parlamentu Europejskiego i Rady 2009/65/WE
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę Parlamentu Europejskiego i Rady 2009/65/WE z dnia 13 lipca 2009 r. w sprawie koordynacji przepisów ustawowych, wykonawczych i administracyjnych odnoszących się do przedsiębiorstw zbiorowego inwestowania w zbywalne papiery wartościowe (UCITS) (1), w szczególności jej art. 99e ust. 3,
a także mając na uwadze, co następuje:
|
(1) |
Zgodnie z art. 99e dyrektywy 2009/65/WE należy ustanowić wspólne procedury i formularze na potrzeby przedkładania informacji Europejskiemu Urzędowi Nadzoru Giełd i Papierów Wartościowych (ESMA) przez właściwe organy w odniesieniu do sankcji i środków, które te właściwe organy nakładają. |
|
(2) |
W celu umożliwienia ESMA właściwego identyfikowania i rejestrowania informacji o sankcjach i środkach nałożonych zgodnie z art. 99 dyrektywy 2009/65/WE właściwe organy należy zobowiązać do tego, by przekazywane ESMA informacje o zgłaszanych sankcjach i środkach były szczegółowe i ujednolicone. |
|
(3) |
Należy unikać powielania wpisów oraz negatywnych sporów kompetencyjnych między licznymi organami przekazującymi informacje w poszczególnym państwie członkowskim. Wyznaczenie jednego punktu kontaktowego w każdym państwie członkowskim, który byłby odpowiedzialny za kontakty z ESMA, jest najbardziej skutecznym i najmniej uciążliwym sposobem realizacji tego celu. |
|
(4) |
W celu uwzględnienia istotnych informacji w rocznym sprawozdaniu na temat sankcji i środków, które ma być publikowane przez ESMA zgodnie z art. 99e ust. 1 dyrektywy 2009/65/WE, właściwe organy powinny przedstawiać informacje z wykorzystaniem specjalnych formularzy, wyraźnie wskazując, które artykuły dyrektywy 2009/65/WE zostały naruszone. |
|
(5) |
Przy przedstawianiu informacji o sankcjach i środkach administracyjnych podanych do publicznej wiadomości zgodnie z art. 99e ust. 2 dyrektywy 2009/65/WE należy jasno określić sankcje i środki, podając odpowiednie informacje szczegółowe. Należy zatem określić formularz, który byłby w tym celu wypełniany przez właściwe organy. |
|
(6) |
Podstawę niniejszego rozporządzenia stanowi projekt wykonawczych standardów technicznych przedłożony Komisji przez ESMA. |
|
(7) |
ESMA nie przeprowadził otwartych konsultacji publicznych na temat projektu wykonawczych standardów technicznych, który stanowi podstawę niniejszego rozporządzenia, ani też nie przeanalizował potencjalnych kosztów i korzyści związanych z wprowadzeniem standardowych formularzy i procedur dla właściwych organów, ponieważ byłoby to nieproporcjonalne w stosunku do zakresu i skutków tych formularzy i procedur, biorąc pod uwagę, że adresatami niniejszych wykonawczych standardów technicznych są jedynie właściwe organy krajowe państw członkowskich, a nie uczestnicy rynku. ESMA zasięgnął opinii Grupy Interesariuszy z Sektora Giełd i Papierów Wartościowych powołanej zgodnie z art. 37 rozporządzenia Parlamentu Europejskiego i Rady (UE) nr 1095/2010 (2), |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Punkty kontaktowe
1. Właściwe organy wyznaczają dla każdego państwa członkowskiego pojedynczy punkt kontaktowy na potrzeby przekazywania informacji, o których mowa w art. 2 i 3, oraz na potrzeby zgłaszania wszelkich kwestii dotyczących przedkładania takich informacji.
2. Właściwe organy powiadamiają Europejski Urząd Nadzoru Giełd i Papierów Wartościowych (ESMA) o punktach kontaktowych, o których mowa w ust. 1.
3. ESMA wyznacza punkt kontaktowy odpowiedzialny za przyjmowanie informacji, o których mowa w art. 2, oraz za zawiadamianie o wszelkich kwestiach dotyczących przyjmowania informacji określonych w art. 2 i 3.
4. ESMA publikuje dane punktu kontaktowego, o którym mowa w ust. 3, na swojej stronie internetowej.
Artykuł 2
Coroczne przedkładanie informacji zbiorczych
Właściwe organy przedstawiają ESMA informacje, o których mowa w art. 99e ust. 1 dyrektywy 2009/65/WE, wypełniając formularz określony w załączniku I do niniejszego rozporządzenia.
Informacje te dotyczą wszystkich sankcji i środków nałożonych w poprzednim roku kalendarzowym.
Formularz ten wypełniany jest elektronicznie i przesyłany do ESMA pocztą elektroniczną z wykorzystaniem punktu kontaktowego, o którym mowa w art. 1 ust. 3, nie później niż do dnia 31 marca każdego roku.
Artykuł 3
Procedury i formularze przedkładania informacji
1. Właściwe organy zgłaszają ESMA sankcje i środki administracyjne, o których mowa w art. 99e ust. 2 dyrektywy 2009/65/WE, wykorzystując istniejące interfejsy zapewnione przez systemy technologii informatycznych oraz odpowiednią bazę danych, ustanowione przez ESMA w celu zarządzania przyjmowaniem, przechowywaniem i publikacją informacji dotyczących tych sankcji i środków administracyjnych zgodnie z art. 99e dyrektywy 2009/65/WE.
2. Informacje o sankcjach i środkach administracyjnych przedkładane są ESMA w sprawozdaniu w formacie określonym w załączniku II.
Artykuł 4
Unieważnianie i aktualizacja sprawozdań
1. Jeżeli właściwy organ pragnie unieważnić sprawozdanie, które uprzednio przedstawił ESMA zgodnie z art. 3, unieważnia on istniejące sprawozdanie i przesyła nowe.
2. Jeżeli właściwy organ pragnie zaktualizować sprawozdanie, które uprzednio przedstawił ESMA zgodnie z art. 3, ponownie przedstawia on sprawozdanie po zaktualizowaniu informacji.
Artykuł 5
Wejście w życie i stosowanie
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 25 lipca 2016 r.
W imieniu Komisji
Jean-Claude JUNCKER
Przewodniczący
(1) Dz.U. L 302 z 17.11.2009, s. 32.
(2) Rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1095/2010 z dnia 24 listopada 2010 r. w sprawie ustanowienia Europejskiego Urzędu Nadzoru (Europejskiego Urzędu Nadzoru Giełd i Papierów Wartościowych), zmiany decyzji nr 716/2009/WE i uchylenia decyzji Komisji 2009/77/WE (Dz.U. L 331 z 15.12.2010, s. 84).
ZAŁĄCZNIK I
Formularz na potrzeby corocznego przedkładania zbiorczych informacji dotyczących wszystkich nałożonych sankcji i środków
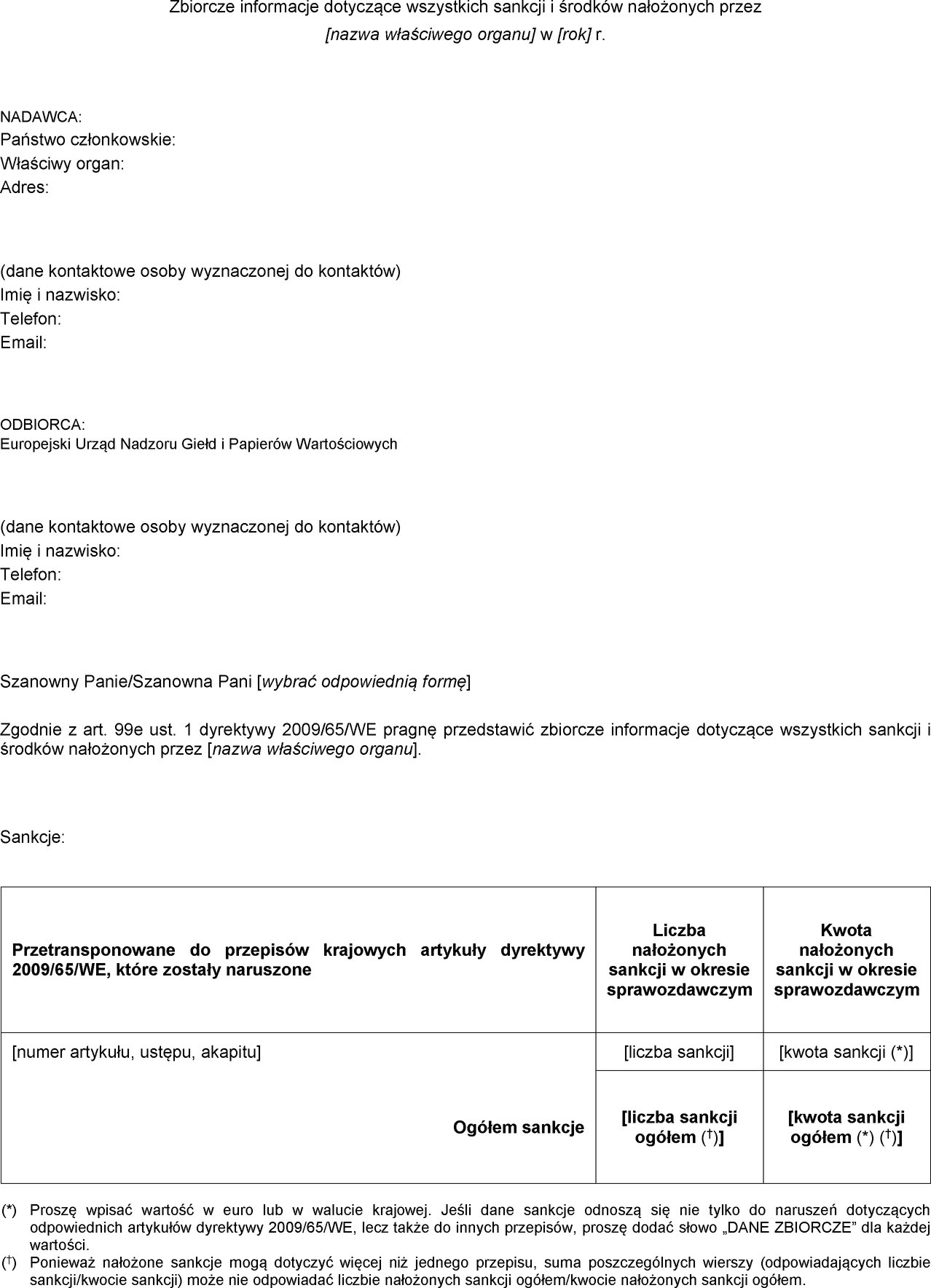

ZAŁĄCZNIK II
Formularz na potrzeby przedstawiania informacji o sankcjach i środkach administracyjnych podanych do publicznej wiadomości

|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/12 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/1213
z dnia 25 lipca 2016 r.
ustanawiające standardowe wartości w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1308/2013 z dnia 17 grudnia 2013 r. ustanawiające wspólną organizację rynków produktów rolnych oraz uchylające rozporządzenia Rady (EWG) nr 922/72, (EWG) nr 234/79, (WE) nr 1037/2001 i (WE) nr 1234/2007 (1),
uwzględniając rozporządzenie wykonawcze Komisji (UE) nr 543/2011 z dnia 7 czerwca 2011 r. ustanawiające szczegółowe zasady stosowania rozporządzenia Rady (WE) nr 1234/2007 w odniesieniu do sektorów owoców i warzyw oraz przetworzonych owoców i warzyw (2), w szczególności jego art. 136 ust. 1,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie wykonawcze (UE) nr 543/2011 przewiduje – zgodnie z wynikami wielostronnych negocjacji handlowych Rundy Urugwajskiej – kryteria, na których podstawie Komisja ustala standardowe wartości dla przywozu z państw trzecich, w odniesieniu do produktów i okresów określonych w części A załącznika XVI do wspomnianego rozporządzenia. |
|
(2) |
Standardowa wartość w przywozie jest obliczana każdego dnia roboczego, zgodnie z art. 136 ust. 1 rozporządzenia wykonawczego (UE) nr 543/2011, przy uwzględnieniu podlegających zmianom danych dziennych. Niniejsze rozporządzenie powinno zatem wejść w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Standardowe wartości celne w przywozie, o których mowa w art. 136 rozporządzenia wykonawczego (UE) nr 543/2011, są ustalone w załączniku do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 25 lipca 2016 r..
W imieniu Komisji,
za Przewodniczącego,
Jerzy PLEWA
Dyrektor Generalny ds. Rolnictwa i Rozwoju Obszarów Wiejskich
(1) Dz.U. L 347 z 20.12.2013, s. 671.
(2) Dz.U. L 157 z 15.6.2011, s. 1.
ZAŁĄCZNIK
Standardowe wartości w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
|
(EUR/100 kg) |
||
|
Kod CN |
Kod państw trzecich (1) |
Standardowa wartość w przywozie |
|
0702 00 00 |
MA |
164,1 |
|
ZZ |
164,1 |
|
|
0707 00 05 |
TR |
103,7 |
|
ZZ |
103,7 |
|
|
0709 93 10 |
TR |
137,2 |
|
ZZ |
137,2 |
|
|
0805 50 10 |
AR |
197,4 |
|
AU |
158,0 |
|
|
CL |
153,0 |
|
|
TR |
164,0 |
|
|
UY |
195,6 |
|
|
ZA |
178,4 |
|
|
ZZ |
174,4 |
|
|
0806 10 10 |
EG |
269,9 |
|
MA |
245,1 |
|
|
ZZ |
257,5 |
|
|
0808 10 80 |
AR |
121,6 |
|
BR |
101,0 |
|
|
CL |
132,0 |
|
|
CN |
74,5 |
|
|
NZ |
135,2 |
|
|
US |
157,1 |
|
|
ZA |
106,1 |
|
|
ZZ |
118,2 |
|
|
0808 30 90 |
AR |
109,8 |
|
CL |
135,7 |
|
|
NZ |
171,3 |
|
|
TR |
187,7 |
|
|
ZA |
119,2 |
|
|
ZZ |
144,7 |
|
|
0809 10 00 |
TR |
202,4 |
|
ZZ |
202,4 |
|
|
0809 29 00 |
TR |
244,3 |
|
US |
535,2 |
|
|
ZA |
271,2 |
|
|
ZZ |
350,2 |
|
|
0809 30 10 , 0809 30 90 |
TR |
120,5 |
|
ZZ |
120,5 |
|
(1) Nomenklatura krajów ustalona w rozporządzeniu Komisji (UE) nr 1106/2012 z dnia 27 listopada 2012 r. w sprawie wykonania rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 471/2009 w sprawie statystyk Wspólnoty dotyczących handlu zagranicznego z państwami trzecimi, w odniesieniu do aktualizacji nazewnictwa państw i terytoriów (Dz.U. L 328 z 28.11.2012, s. 7). Kod „ZZ” odpowiada „innym pochodzeniom”.
DYREKTYWY
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/14 |
DYREKTYWA KOMISJI (UE) 2016/1214
z dnia 25 lipca 2016 r.
zmieniająca dyrektywę 2005/62/WE w odniesieniu do norm i specyfikacji systemu jakości w placówkach służby krwi
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę 2002/98/WE Parlamentu Europejskiego i Rady z dnia 27 stycznia 2003 r. ustanawiającą normy jakości i bezpiecznego pobierania, badania, preparatyki, przechowywania, wydawania krwi ludzkiej i składników krwi oraz zmieniającą dyrektywę 2001/83/WE (1), w szczególności jej art. 29 akapit drugi lit. h),
a także mając na uwadze, co następuje:
|
(1) |
W art. 2 dyrektywy Komisji 2005/62/WE (2) wymaga się od państw członkowskich zapewnienia, aby system jakości obowiązujący we wszystkich placówkach służby krwi był zgodny z normami i specyfikacjami wymienionymi w załączniku do tej dyrektywy. |
|
(2) |
Art. 2 dyrektywy 2005/62/WE zobowiązuje również Komisję do opracowania wytycznych dotyczących dobrych praktyk w celu zinterpretowania norm i specyfikacji, o których mowa w tym artykule. |
|
(3) |
Wytyczne dotyczące dobrych praktyk (zwane dalej „wytycznymi”) zostały opracowane wspólnie przez Komisję i Europejską Dyrekcję ds. Jakości Leków i Opieki Zdrowotnej Rady Europy oraz opublikowane przez Radę Europy (3). |
|
(4) |
Wytyczne zostały opracowane i są aktualizowane z uwzględnieniem wiedzy naukowej i technicznej. Wytyczne w pełni odzwierciedlają szczegółowe zasady i wytyczne dobrej praktyki wytwarzania określone w art. 47 dyrektywy 2001/83/WE Parlamentu Europejskiego i Rady (4), które są istotne dla placówek służby krwi i ich systemów jakości oraz są już z powodzeniem stosowane w placówkach służby krwi w Unii. Należy je więc uwzględniać przy wdrażaniu norm i specyfikacji określonych w załączniku do dyrektywy 2005/62/WE. Należy zatem odpowiednio zmienić art. 2 ust. 2 tej dyrektywy. |
|
(5) |
Komisja, która wraz z ekspertami z państw członkowskich aktywnie uczestniczy w procesie prowadzącym do zmiany wytycznych, powinna poinformować właściwe organy wyznaczone przez państwa członkowskie o wszelkich znaczących zmianach wytycznych, które powinny również być wzięte pod uwagę. |
|
(6) |
Środki przewidziane w niniejszej dyrektywie są zgodne z opinią komitetu ustanowionego dyrektywą 2002/98/WE, |
PRZYJMUJE NINIEJSZĄ DYREKTYWĘ:
Artykuł 1
Art. 2 ust. 2 dyrektywy 2005/62/WE otrzymuje brzmienie:
„2. Państwa członkowskie zapewniają, aby – do celów wdrożenia norm i specyfikacji określonych w załączniku do niniejszej dyrektywy – dla wszystkich placówek służby krwi dostępne były wytyczne dotyczące dobrych praktyk i aby były one stosowane przez te placówki, w ich systemie jakości, przy czym w wytycznych tych należy w pełni uwzględnić, w zakresie odnoszącym się do placówek służby krwi, szczegółowe zasady i wytyczne dobrej praktyki wytwarzania, o których mowa w art. 47 akapit pierwszy dyrektywy 2001/83/WE. W ten sposób państwa członkowskie uwzględniają wytyczne dotyczące dobrych praktyk opracowane wspólnie przez Komisję i Europejską Dyrekcję ds. Jakości Leków i Opieki Zdrowotnej Rady Europy oraz opublikowane przez Radę Europy (*).
Artykuł 2
1. Państwa członkowskie wprowadzają w życie przepisy ustawowe, wykonawcze i administracyjne niezbędne do wykonania niniejszej dyrektywy najpóźniej do dnia 15 lutego 2018 r. Niezwłocznie przekazują Komisji tekst tych przepisów.
Przepisy przyjęte przez państwa członkowskie zawierają odniesienie do niniejszej dyrektywy lub odniesienie takie towarzyszy ich urzędowej publikacji. Metody dokonywania takiego odniesienia określane są przez państwa członkowskie.
2. Państwa członkowskie przekazują Komisji tekst podstawowych przepisów prawa krajowego, przyjętych w dziedzinie objętej niniejszą dyrektywą.
Artykuł 3
Niniejsza dyrektywa wchodzi w życie dwudziestego dnia po jej opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Artykuł 4
Niniejsza dyrektywa skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 25 lipca 2016 r.
W imieniu Komisji
Jean-Claude JUNCKER
Przewodniczący
(1) Dz.U. L 33 z 8.2.2003, s. 30.
(2) Dyrektywa Komisji 2005/62/WE z dnia 30 września 2005 r. wykonująca dyrektywę 2002/98/WE Parlamentu Europejskiego i Rady w zakresie norm i specyfikacji wspólnotowych odnoszących się do systemu jakości obowiązującego w placówkach służby krwi (Dz.U. L 256 z 1.10.2005, s. 41).
(3) Good Practice Guidelines, zawarte w: Guide to the preparation, use and quality assurance of blood components [Przewodnik dotyczący przygotowania, wykorzystania i zapewnienia jakości składników krwi], załącznik do zalecenia nr R (95) 15 komisji ministrów do spraw przygotowania, wykorzystania i zapewnienia jakości składników krwi, przyjętego w dniu 12 października 1995 r.
(4) Dyrektywa 2001/83/WE Parlamentu Europejskiego i Rady z dnia 6 listopada 2001 r. w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi (Dz.U. L 311 z 28.11.2001, s. 67).
DECYZJE
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/16 |
DECYZJA WYKONAWCZA KOMISJI (UE) 2016/1215
z dnia 22 lipca 2016 r.
zezwalająca na wprowadzenie do obrotu, na podstawie rozporządzenia (WE) nr 1829/2003 Parlamentu Europejskiego i Rady, produktów zawierających genetycznie zmodyfikowaną soję FG72 (MST-FGØ72-2), składających się z niej lub z niej wyprodukowanych
(notyfikowana jako dokument nr C(2016) 4576)
(Jedynie tekst w języku niemieckim jest autentyczny)
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1829/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie genetycznie zmodyfikowanej żywności i paszy (1), w szczególności jego art. 7 ust. 3 i art. 19 ust. 3,
a także mając na uwadze, co następuje:
|
(1) |
W dniu 24 czerwca 2011 r. przedsiębiorstwo Bayer CropScience AG zwróciło się, zgodnie z art. 5 i 17 rozporządzenia (WE) nr 1829/2003, do właściwego organu Belgii z wnioskiem o wprowadzenie do obrotu żywności, składników żywności i paszy zawierających soję FG72, składających się z niej lub z niej wyprodukowanych („wniosek”). |
|
(2) |
Wniosek odnosi się również do wprowadzenia do obrotu zmodyfikowanej genetycznie soi FG72 w produktach z niej się składających lub ją zawierających, do zastosowań innych niż w żywności i paszy na równi z innymi rodzajami soi, z wyjątkiem uprawy. |
|
(3) |
Zgodnie z art. 5 ust. 5 i art. 17 ust. 5 rozporządzenia (WE) nr 1829/2003 do wniosku załączono dane i informacje wymagane na podstawie załączników III i IV do dyrektywy 2001/18/WE Parlamentu Europejskiego i Rady (2), a także informacje i ustalenia dotyczące oceny ryzyka przeprowadzonej według zasad określonych w załączniku II do tej dyrektywy. Wniosek zawiera również plan monitorowania skutków dla środowiska zgodny z załącznikiem VII do dyrektywy 2001/18/WE. |
|
(4) |
W dniu 16 lipca 2015 r. Europejski Urząd ds. Bezpieczeństwa Żywności („EFSA”) wydał pozytywną opinię zgodnie z art. 6 i 18 rozporządzenia (WE) nr 1829/2003 (3). Uznał on, że zmodyfikowana genetycznie soja FG72, zgodna z opisem we wniosku, jest równie bezpieczna jak jej konwencjonalny odpowiednik i inne niezmodyfikowane genetycznie odmiany soi pod względem potencjalnego negatywnego wpływu na zdrowie ludzi i zwierząt i na środowisko, w kontekście zakresu wniosku. |
|
(5) |
W swojej opinii EFSA rozpatrzył wszystkie szczegółowe pytania i wątpliwości zgłaszane przez państwa członkowskie w ramach konsultacji z właściwymi organami krajowymi, jak przewidziano w art. 6 ust. 4 i art. 18 ust. 4 rozporządzenia (WE) nr 1829/2003. |
|
(6) |
EFSA stwierdził także we wspomnianej opinii, że złożony przez wnioskodawcę plan monitorowania skutków dla środowiska, obejmujący plan ogólnego nadzoru, jest zgodny z zamierzonymi zastosowaniami produktów. |
|
(7) |
W związku z powyższym należy wydać zezwolenie na produkty zawierające genetycznie zmodyfikowaną soję FG72, składające się z niej lub z niej wyprodukowane. |
|
(8) |
Każdemu organizmowi zmodyfikowanemu genetycznie („GMO”) należy przypisać niepowtarzalny identyfikator zgodnie z rozporządzeniem Komisji (WE) nr 65/2004 (4). |
|
(9) |
Według opinii EFSA nie są konieczne żadne szczegółowe wymagania dotyczące etykietowania żywności, składników żywności i paszy zawierających zmodyfikowaną genetycznie soję FG72, składających się z niej lub z niej wyprodukowanych, inne niż wymogi ustanowione w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003. Aby jednak zapewnić wykorzystanie produktów w granicach zezwolenia przyznanego niniejszą decyzją, etykiety produktów zawierających soję FG72 lub składających się z niej, z wyjątkiem produktów spożywczych, powinny zostać uzupełnione o wyraźne wskazanie, że dane produkty nie są przeznaczone do uprawy. |
|
(10) |
W art. 4 ust. 6 rozporządzenia (WE) nr 1830/2003 Parlamentu Europejskiego i Rady (5) ustanowiono wymogi dotyczące etykietowania w odniesieniu do produktów zawierających GMO lub składających się z nich. Wymogi dotyczące możliwości śledzenia tych produktów zawarto w art. 4 ust. 1–5, natomiast wymogi dotyczące możliwości śledzenia żywności i paszy wyprodukowanych z GMO ustanowiono w art. 5 tego rozporządzenia. |
|
(11) |
Posiadacz zezwolenia powinien przedkładać coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania skutków dla środowiska. Wyniki te należy przedstawić zgodnie z decyzją Komisji 2009/770/WE (6). Opinia wydana przez EFSA nie uzasadnia nałożenia specjalnych wymogów lub ograniczeń na wprowadzanie do obrotu żywności i paszy ani na ich wykorzystanie i obchodzenie się z nimi, w tym wymagań dotyczących monitorowania po wprowadzeniu do obrotu, czy też specjalnych wymogów dotyczących ochrony poszczególnych ekosystemów/środowiska naturalnego lub poszczególnych obszarów geograficznych, przewidzianych w art. 6 ust. 5 lit. e) oraz art. 18 ust. 5 lit. e) rozporządzenia (WE) nr 1829/2003. |
|
(12) |
Wszelkie stosowne informacje dotyczące zezwolenia na te produkty powinny zostać wprowadzone do wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy, jak przewidziano w rozporządzeniu (WE) nr 1829/2003. |
|
(13) |
Niniejszą decyzję należy przekazać stronom Protokołu kartageńskiego o bezpieczeństwie biologicznym do Konwencji o różnorodności biologicznej za pośrednictwem Systemu Wymiany Informacji o Bezpieczeństwie Biologicznym, zgodnie z art. 9 ust. 1 i art. 15 ust. 2 lit. c) rozporządzenia (WE) nr 1946/2003 Parlamentu Europejskiego i Rady (7). |
|
(14) |
Stały Komitet ds. Roślin, Zwierząt, Żywności i Pasz nie wydał opinii w terminie ustalonym przez jego przewodniczącego. Uznano, że niezbędny jest akt wykonawczy, i przewodniczący przedłożył komitetowi odwoławczemu projekt aktu wykonawczego do dalszego rozpatrzenia. Komitet odwoławczy nie wydał opinii, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Organizm zmodyfikowany genetycznie i niepowtarzalny identyfikator
Genetycznie zmodyfikowana soja (Glycine max (L.) Merr.) FG72, określona w lit. b) załącznika do niniejszej decyzji, otrzymuje niepowtarzalny identyfikator MST-FGØ72-2, jak przewidziano w rozporządzeniu (WE) nr 65/2004.
Artykuł 2
Zezwolenie
Niniejszym udziela się zezwolenia na wprowadzanie do obrotu, do celów art. 4 ust. 2 i art. 16 ust. 2 rozporządzenia (WE) nr 1829/2003, zgodnie z warunkami określonymi w niniejszej decyzji, następujących produktów:
|
a) |
żywności i składników żywności zawierających soję MST-FGØ72-2, składających się z niej lub z niej wyprodukowanych; |
|
b) |
paszy zawierającej soję MST-FGØ72-2, składającej się z niej lub z niej wyprodukowanej; |
|
c) |
soi MST-FGØ72-2 w produktach ją zawierających lub z niej się składających, do innych zastosowań niż wymienione w lit. a) i b), z wyjątkiem uprawy. |
Artykuł 3
Etykietowanie
1. Zgodnie z wymaganiami dotyczącymi etykietowania, określonymi w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003 oraz w art. 4 ust. 6 rozporządzenia (WE) 1830/2003, „nazwą organizmu” jest „soja”.
2. Na etykietach i w dokumentach dołączonych do produktów zawierających soję MST-FGØ72-2 lub składających się z niej, z wyjątkiem produktów, o których mowa w art. 2 lit. a), zamieszcza się zwrot „nieprzeznaczone do uprawy”.
Artykuł 4
Monitorowanie skutków dla środowiska
1. Posiadacz zezwolenia zapewnia wdrożenie planu monitorowania skutków dla środowiska, określonego w lit. h) załącznika.
2. Posiadacz zezwolenia składa Komisji coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania zgodnie z decyzją 2009/770/WE.
Artykuł 5
Rejestr wspólnotowy
Informacje zawarte w załączniku do niniejszej decyzji wprowadza się do wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy zgodnie z art. 28 rozporządzenia (WE) nr 1829/2003.
Artykuł 6
Posiadacz zezwolenia
Posiadaczem zezwolenia jest przedsiębiorstwo Bayer CropScience AG.
Artykuł 7
Okres ważności
Niniejszą decyzję stosuje się przez 10 lat od daty jej notyfikacji.
Artykuł 8
Adresat
Niniejsza decyzja skierowana jest do przedsiębiorstwa Bayer CropScience AG, Alfred-Nobel-Strasse 50, 40789 Monheim am Rhein, Niemcy.
Sporządzono w Brukseli dnia 22 lipca 2016 r.
W imieniu Komisji
Vytenis ANDRIUKAITIS
Członek Komisji
(1) Dz.U. L 268 z 18.10.2003, s. 1.
(2) Dyrektywa 2001/18/WE Parlamentu Europejskiego i Rady z dnia 12 marca 2001 r. w sprawie zamierzonego uwalniania do środowiska organizmów zmodyfikowanych genetycznie i uchylająca dyrektywę Rady 90/220/EWG (Dz.U. L 106 z 17.4.2001, s. 1).
(3) Panel EFSA ds. GMO (panel EFSA ds. organizmów modyfikowanych genetycznie), 2015 r. Opinia naukowa dotycząca przedłożonego przez przedsiębiorstwo Bayer wniosku (EFSA-GMO-BE-2011-98) o wydanie zezwolenia na wprowadzenie do obrotu tolerującej herbicydy genetycznie zmodyfikowanej soi FG72 z przeznaczeniem na żywność i pasze oraz na jej przywóz i przetwarzanie na podstawie rozporządzenia (WE) nr 1829/2003. Dziennik EFSA 2015; 13(7):4167, 29 s. doi:10.2903/j.efsa.2015.4167.
(4) Rozporządzenie Komisji (WE) nr 65/2004 z dnia 14 stycznia 2004 r. ustanawiające system ustanawiania oraz przypisywania niepowtarzalnych identyfikatorów organizmom zmodyfikowanym genetycznie (Dz.U. L 10 z 16.1.2004, s. 5).
(5) Rozporządzenie (WE) nr 1830/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. dotyczące możliwości śledzenia i etykietowania organizmów zmodyfikowanych genetycznie oraz możliwości śledzenia żywności i produktów paszowych wyprodukowanych z organizmów zmodyfikowanych genetycznie i zmieniające dyrektywę 2001/18/WE (Dz.U. L 268 z 18.10.2003, s. 24).
(6) Decyzja Komisji 2009/770/WE z dnia 13 października 2009 r. ustanawiająca standardowe formaty sprawozdań na potrzeby przedstawiania wyników monitorowania zamierzonego uwalniania do środowiska organizmów zmodyfikowanych genetycznie jako produktów lub w ich składzie w celu wprowadzania do obrotu, zgodnie z dyrektywą 2001/18/WE Parlamentu Europejskiego i Rady (Dz.U. L 275 z 21.10.2009, s. 9).
(7) Rozporządzenie (WE) nr 1946/2003 Parlamentu Europejskiego i Rady z dnia 15 lipca 2003 r. w sprawie transgranicznego przemieszczania organizmów genetycznie zmodyfikowanych (Dz.U. L 287 z 5.11.2003, s. 1).
ZAŁĄCZNIK
a) Wnioskodawca i posiadacz zezwolenia:
|
Nazwa |
: |
Bayer CropScience AG |
|
Adres |
: |
Alfred-Nobel-Strasse 50, 40789 Monheim am Rhein – Niemcy. |
b) Opis i specyfikacja produktów:
|
1) |
żywność i składniki żywności zawierające soję MST-FGØ72-2, składające się z niej lub z niej wyprodukowane; |
|
2) |
pasza zawierająca soję MST-FGØ72-2, składająca się z niej lub z niej wyprodukowana; |
|
3) |
soja MST-FGØ72-2 w produktach ją zawierających lub z niej się składających, do innych zastosowań niż wymienione w pkt 1 i 2, z wyjątkiem uprawy. |
Opisana we wniosku zmodyfikowana genetycznie soja MST-FGØ72-2 wykazuje ekspresję białka 2mEPSPS nadającego tolerancję na herbicydy zawierające glifosat oraz białka HPPD W336 nadającego tolerancję na herbicydy zawierające izoksaflutol.
c) Etykietowanie:
|
1) |
Zgodnie z wymaganiami dotyczącymi etykietowania, ustanowionymi w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003 oraz w art. 4 ust. 6 rozporządzenia (WE) nr 1830/2003, „nazwą organizmu” jest „soja”. |
|
2) |
Na etykietach i w dokumentach dołączonych do produktów zawierających soję MST-FGØ72-2 lub składających się z niej, z wyjątkiem produktów, o których mowa w art. 2 lit. a), zamieszcza się zwrot „nieprzeznaczone do uprawy”. |
d) Metoda wykrywania:
|
1) |
specyficzna dla soi MST-FGØ72-2 technika ilościowego oznaczania metodą PCR w czasie rzeczywistym; |
|
2) |
zwalidowana przez laboratorium referencyjne UE ustanowione na mocy rozporządzenia (WE) nr 1829/2003, na DNA genomowym, ekstrahowanym z nasion soi MST-FGØ72-2, opublikowana pod następującym adresem: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
materiał referencyjny: AOCS 0610-A3 i AOCS 0707-A6 dostępny za pośrednictwem strony internetowej American Oil Chemists Society pod adresem: http://www.aocs.org/LabServices/content.cfm?ItemNumber=19248. |
e) Niepowtarzalny identyfikator:
MST-FGØ72-2
f) Informacje wymagane zgodnie z załącznikiem II do Protokołu kartageńskiego o bezpieczeństwie biologicznym do Konwencji o różnorodności biologicznej:
[Identyfikator zapisu Systemu Wymiany Informacji o Bezpieczeństwie Biologicznym: po ogłoszeniu publikowany we wspólnotowym rejestrze genetycznie zmodyfikowanej żywności i paszy]
g) Warunki lub ograniczenia dotyczące wprowadzania produktów do obrotu, ich stosowania lub obchodzenia się z nimi:
Brak.
h) Plan monitorowania skutków dla środowiska:
Plan monitorowania skutków dla środowiska zgodny z załącznikiem VII do dyrektywy 2001/18/WE.
[Odsyłacz: plan publikowany we wspólnotowym rejestrze genetycznie zmodyfikowanej żywności i paszy]
i) Wymogi dotyczące monitorowania stosowania żywności przeznaczonej do spożycia przez ludzi po jej wprowadzeniu do obrotu:
Brak.
Uwaga: Z czasem odsyłacze do odpowiednich dokumentów mogą wymagać aktualizacji. Zmiany te będą udostępnione publicznie w postaci aktualizacji wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy.
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/22 |
DECYZJA WYKONAWCZA KOMISJI (UE) 2016/1216
z dnia 22 lipca 2016 r.
zezwalająca na wprowadzenie do obrotu, na podstawie rozporządzenia (WE) nr 1829/2003 Parlamentu Europejskiego i Rady, produktów zawierających genetycznie zmodyfikowaną soję MON 87708 × MON 89788 (MON-877Ø8-9 × MON-89788-1), składających się z niej lub z niej wyprodukowanych
(notyfikowana jako dokument nr C(2016) 4580)
(Jedynie teksty w języku francuskim i niderlandzkim są autentyczne)
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1829/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie genetycznie zmodyfikowanej żywności i paszy (1), w szczególności jego art. 7 ust. 3 i art. 19 ust. 3,
a także mając na uwadze, co następuje:
|
(1) |
W dniu 23 marca 2012 r. przedsiębiorstwo Monsanto Europe SA zwróciło się, zgodnie z art. 5 i 17 rozporządzenia (WE) nr 1829/2003, do właściwego organu Niderlandów z wnioskiem o wprowadzenie do obrotu żywności, składników żywności i paszy zawierających soję MON 87708 × MON 89788, składających się z niej lub z niej wyprodukowanych („wniosek”). |
|
(2) |
Wniosek odnosi się również do wprowadzenia do obrotu zmodyfikowanej genetycznie soi MON 87708 × MON 89788 w produktach składających się z niej lub ją zawierających, do zastosowań innych niż w żywności i paszy na równi z innymi rodzajami soi, z wyjątkiem uprawy. |
|
(3) |
Zgodnie z art. 5 ust. 5 i art. 17 ust. 5 rozporządzenia (WE) nr 1829/2003 do wniosku załączono dane i informacje wymagane na podstawie załączników III i IV do dyrektywy Parlamentu Europejskiego i Rady 2001/18/WE (2), a także informacje i ustalenia dotyczące oceny ryzyka przeprowadzonej według zasad określonych w załączniku II do tej dyrektywy. Wniosek zawiera również plan monitorowania skutków dla środowiska zgodny z załącznikiem VII do dyrektywy 2001/18/WE. |
|
(4) |
W dniu 18 czerwca 2015 r. Europejski Urząd ds. Bezpieczeństwa Żywności („EFSA”) wydał pozytywną opinię zgodnie z art. 6 i 18 rozporządzenia (WE) nr 1829/2003. Uznał on, że zmodyfikowana genetycznie soja MON 87708 × MON 89788, zgodna z opisem we wniosku, jest równie bezpieczna jak jej konwencjonalny odpowiednik i inne niezmodyfikowane genetycznie odmiany soi pod względem potencjalnego negatywnego wpływu na zdrowie ludzi i zwierząt i na środowisko, w kontekście zakresu wniosku (3). |
|
(5) |
W swojej opinii EFSA rozpatrzył wszystkie szczegółowe pytania i wątpliwości zgłaszane przez państwa członkowskie w ramach konsultacji z właściwymi organami krajowymi, jak przewidziano w art. 6 ust. 4 i art. 18 ust. 4 rozporządzenia (WE) nr 1829/2003. |
|
(6) |
EFSA stwierdził także we wspomnianej opinii, że złożony przez wnioskodawcę plan monitorowania skutków dla środowiska, obejmujący plan ogólnego nadzoru, jest zgodny z zamierzonymi zastosowaniami produktów. |
|
(7) |
W związku z powyższym należy wydać zezwolenie na produkty zawierające genetycznie zmodyfikowaną soję MON 87708 × MON 89788, składające się z niej lub z niej wyprodukowane. |
|
(8) |
Każdemu organizmowi zmodyfikowanemu genetycznie („GMO”) należy przypisać niepowtarzalny identyfikator zgodnie z rozporządzeniem Komisji (WE) nr 65/2004 (4). |
|
(9) |
Według opinii EFSA nie są konieczne żadne szczegółowe wymagania dotyczące etykietowania żywności, składników żywności i paszy zawierających zmodyfikowaną genetycznie soję MON 87708 × MON 89788, składających się z niej lub z niej wyprodukowanych, inne niż wymogi ustanowione w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003. Aby jednak zapewnić wykorzystanie produktów w granicach zezwolenia przyznanego niniejszą decyzją, etykiety produktów zawierających soję MON 87708 × MON 89788 lub składających się z niej, z wyjątkiem produktów spożywczych, powinny zostać uzupełnione o wyraźne wskazanie, że dane produkty nie są przeznaczone do uprawy. |
|
(10) |
W art. 4 ust. 6 rozporządzenia (WE) nr 1830/2003 Parlamentu Europejskiego i Rady (5) ustanowiono wymogi dotyczące etykietowania w odniesieniu do produktów zawierających GMO lub składających się z nich. Wymogi dotyczące możliwości śledzenia tych produktów zawarto w art. 4 ust. 1–5, natomiast wymogi dotyczące możliwości śledzenia żywności i paszy wyprodukowanych z GMO ustanowiono w art. 5 tego rozporządzenia. |
|
(11) |
Posiadacz zezwolenia powinien przedkładać coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania skutków dla środowiska. Wyniki te należy przedstawić zgodnie z decyzją Komisji 2009/770/WE (6). Opinia wydana przez EFSA nie uzasadnia nałożenia specjalnych wymogów lub ograniczeń na wprowadzanie do obrotu żywności i paszy ani na ich wykorzystanie i obchodzenie się z nimi, w tym wymagań dotyczących monitorowania po wprowadzeniu do obrotu, czy też specjalnych wymogów dotyczących ochrony poszczególnych ekosystemów/środowiska naturalnego lub poszczególnych obszarów geograficznych, przewidzianych w art. 6 ust. 5 lit. e) oraz art. 18 ust. 5 lit. e) rozporządzenia (WE) nr 1829/2003. |
|
(12) |
Wszelkie stosowne informacje dotyczące zezwolenia na te produkty powinny zostać wprowadzone do wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy, jak przewidziano w rozporządzeniu (WE) nr 1829/2003. |
|
(13) |
Niniejszą decyzję należy przekazać stronom Protokołu kartageńskiego o bezpieczeństwie biologicznym do Konwencji o różnorodności biologicznej za pośrednictwem Systemu Wymiany Informacji o Bezpieczeństwie Biologicznym, zgodnie z art. 9 ust. 1 i art. 15 ust. 2 lit. c) rozporządzenia (WE) nr 1946/2003 Parlamentu Europejskiego i Rady (7). |
|
(14) |
Stały Komitet ds. Roślin, Zwierząt, Żywności i Pasz nie wydał opinii w terminie ustalonym przez jego przewodniczącego. Uznano, że niezbędny jest akt wykonawczy, i przewodniczący przedłożył komitetowi odwoławczemu projekt aktu wykonawczego do dalszego rozpatrzenia. Komitet odwoławczy nie wydał opinii, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Organizm zmodyfikowany genetycznie i niepowtarzalny identyfikator
Genetycznie zmodyfikowana soja (Glycine max (L.) Merr.) MON 87708 × MON 89788, określona w lit. b) załącznika do niniejszej decyzji, otrzymuje niepowtarzalny identyfikator MON-877Ø8-9 × MON-89788-1, jak przewidziano w rozporządzeniu (WE) nr 65/2004.
Artykuł 2
Zezwolenie
Niniejszym udziela się zezwolenia na wprowadzanie do obrotu, do celów art. 4 ust. 2 i art. 16 ust. 2 rozporządzenia (WE) nr 1829/2003, zgodnie z warunkami określonymi w niniejszej decyzji, następujących produktów:
|
a) |
żywności i składników żywności zawierających soję MON- 877Ø8-9 × MON-89788-1, składających się z niej lub z niej wyprodukowanych; |
|
b) |
paszy zawierającej soję MON- 877Ø8-9 × MON-89788-1, składającej się z niej lub z niej wyprodukowanej; |
|
c) |
soi MON-877Ø8-9 × MON-89788-1 w produktach ją zawierających lub z niej się składających, do innych zastosowań niż wymienione w lit. a) i b), z wyjątkiem uprawy. |
Artykuł 3
Etykietowanie
1. Zgodnie z wymaganiami dotyczącymi etykietowania, określonymi w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003 oraz w art. 4 ust. 6 rozporządzenia (WE) 1830/2003, „nazwą organizmu” jest „soja”.
2. Na etykietach i w dokumentach dołączonych do produktów zawierających soję MON-877Ø8-9 × MON-89788-1 lub składających się z niej, z wyjątkiem produktów, o których mowa w art. 2 lit. a), zamieszcza się zwrot „nieprzeznaczone do uprawy”.
Artykuł 4
Monitorowanie skutków dla środowiska
1. Posiadacz zezwolenia zapewnia wdrożenie planu monitorowania skutków dla środowiska, określonego w lit. h) załącznika.
2. Posiadacz zezwolenia składa Komisji coroczne sprawozdanie z realizacji i wyników działań przewidzianych w planie monitorowania zgodnie z decyzją 2009/770/WE.
Artykuł 5
Rejestr wspólnotowy
Informacje zawarte w załączniku do niniejszej decyzji wprowadza się do wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy zgodnie z art. 28 rozporządzenia (WE) nr 1829/2003.
Artykuł 6
Posiadacz zezwolenia
Posiadaczem zezwolenia jest przedsiębiorstwo Monsanto Europe SA z siedzibą w Belgii, występujące w imieniu Monsanto Company, Stany Zjednoczone Ameryki.
Artykuł 7
Okres ważności
Niniejszą decyzję stosuje się przez 10 lat od daty jej notyfikacji.
Artykuł 8
Adresat
Niniejsza decyzja skierowana jest do przedsiębiorstwa Monsanto Europe SA, Avenue de Tervuren 270–272, 1150 Bruxelles, Belgia.
Sporządzono w Brukseli dnia 22 lipca 2016 r.
W imieniu Komisji
Vytenis ANDRIUKAITIS
Członek Komisji
(1) Dz.U. L 268 z 18.10.2003, s. 1.
(2) Dyrektywa Parlamentu Europejskiego i Rady 2001/18/WE z dnia 12 marca 2001 r. w sprawie zamierzonego uwalniania do środowiska organizmów zmodyfikowanych genetycznie i uchylająca dyrektywę Rady 90/220/EWG (Dz.U. L 106 z 17.4.2001, s. 1).
(3) Opinia naukowa dotycząca przedłożonego przez przedsiębiorstwo Monsanto wniosku (EFSA-GMO-NL-2012-108) o wydanie zezwolenia na wprowadzenie do obrotu tolerującej herbicydy genetycznie zmodyfikowanej soi MON 87708 × MON 89788 z przeznaczeniem na żywność i pasze oraz na jej przywóz i przetwarzanie na podstawie rozporządzenia (WE) nr 1829/2003. Dziennik EFSA 2015,13(6):4136, 26 s., doi: 10.2903/j.efsa.2015.4136.
(4) Rozporządzenie Komisji (WE) nr 65/2004 z dnia 14 stycznia 2004 r. ustanawiające system ustanawiania oraz przypisywania niepowtarzalnych identyfikatorów organizmom zmodyfikowanym genetycznie (Dz.U. L 10 z 16.1.2004, s. 5).
(5) Rozporządzenie (WE) nr 1830/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. dotyczące możliwości śledzenia i etykietowania organizmów zmodyfikowanych genetycznie oraz możliwości śledzenia żywności i produktów paszowych wyprodukowanych z organizmów zmodyfikowanych genetycznie i zmieniające dyrektywę 2001/18/WE (Dz.U. L 268 z 18.10.2003, s. 24).
(6) Decyzja Komisji 2009/770/WE z dnia 13 października 2009 r. ustanawiająca standardowe formaty sprawozdań na potrzeby przedstawiania wyników monitorowania zamierzonego uwalniania do środowiska organizmów zmodyfikowanych genetycznie jako produktów lub w ich składzie w celu wprowadzania do obrotu, zgodnie z dyrektywą 2001/18/WE Parlamentu Europejskiego i Rady (Dz.U. L 275 z 21.10.2009, s. 9).
(7) Rozporządzenie (WE) nr 1946/2003 Parlamentu Europejskiego i Rady z dnia 15 lipca 2003 r. w sprawie transgranicznego przemieszczania organizmów genetycznie zmodyfikowanych (Dz.U. L 287 z 5.11.2003, s. 1).
ZAŁĄCZNIK
a) Wnioskodawca i posiadacz zezwolenia:
|
Nazwa |
: |
Monsanto Europe SA |
|
Adres |
: |
Avenue de Tervuren 270–272, 1150 Bruxelles, Belgia |
W imieniu Monsanto Company, 800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Stany Zjednoczone Ameryki
b) Opis i specyfikacja produktów:
|
1) |
żywność i składniki żywności zawierające soję MON-877Ø8-9 × MON-89788-1, składające się z niej lub z niej wyprodukowane; |
|
2) |
pasza zawierająca soję MON-877Ø8-9 × MON-89788-1, składająca się z niej lub z niej wyprodukowana; |
|
3) |
soja MON-877Ø8-9 × MON-89788-1 w produktach ją zawierających lub z niej się składających, do innych zastosowań niż wymienione w pkt 1 i 2, z wyjątkiem uprawy. |
Opisana we wniosku zmodyfikowana genetycznie soja MON-877Ø8-9 × MON-89788-1 wykazuje ekspresję białek DMO nadających tolerancję na herbicydy na bazie dikamby oraz białka CP4 EPSPS nadającego tolerancję na herbicydy na bazie glifosatu.
c) Etykietowanie:
|
1) |
Zgodnie z wymaganiami dotyczącymi etykietowania, ustanowionymi w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003 oraz w art. 4 ust. 6 rozporządzenia (WE) 1830/2003, „nazwą organizmu” jest „soja”. |
|
2) |
Na etykietach i w dokumentach dołączonych do produktów zawierających soję MON-877Ø8-9 × MON-89788-1 lub składających się z niej, z wyjątkiem produktów, o których mowa w art. 2 lit. a), zamieszcza się zwrot „nieprzeznaczone do uprawy”. |
d) Metoda wykrywania:
|
1) |
specyficzna dla soi MON-877Ø8-9 i MON-89788-1 technika ilościowego oznaczania metodą PCR w czasie rzeczywistym; metody wykrywania są walidowane przy wykorzystaniu pojedynczej modyfikacji genetycznej i weryfikowane na DNA genomowym, ekstrahowanym z nasion soi MON-877Ø8-9 × MON-89788-1; |
|
2) |
zwalidowana przez laboratorium referencyjne UE ustanowione na mocy rozporządzenia (WE) nr 1829/2003, opublikowana pod następującym adresem: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
materiał referencyjny: AOCS 0311-A i AOCS 0906-A (dla MON-877Ø8-9), oraz AOCS 0906-B i AOCS 0906-A (dla MON-89788-1) dostępny za pośrednictwem strony internetowej American Oil Chemists Society pod adresem: http://www.aocs.org/LabServices/content.cfm?ItemNumber=19248. |
e) Niepowtarzalny identyfikator:
MON-877Ø8-9 × MON-89788-1
f) Informacje wymagane zgodnie z załącznikiem II do Protokołu kartageńskiego o bezpieczeństwie biologicznym do Konwencji o różnorodności biologicznej:
(Identyfikator zapisu Systemu Wymiany Informacji o Bezpieczeństwie Biologicznym: po ogłoszeniu publikowany we wspólnotowym rejestrze genetycznie zmodyfikowanej żywności i paszy).
g) Warunki lub ograniczenia dotyczące wprowadzania produktów do obrotu, ich stosowania lub obchodzenia się z nimi:
Brak.
h) Plan monitorowania skutków dla środowiska:
Plan monitorowania skutków dla środowiska zgodny z załącznikiem VII do dyrektywy 2001/18/WE.
(Odsyłacz: plan publikowany we wspólnotowym rejestrze genetycznie zmodyfikowanej żywności i paszy)
i) Wymogi dotyczące monitorowania stosowania żywności przeznaczonej do spożycia przez ludzi po jej wprowadzeniu do obrotu:
Brak.
Uwaga: Z czasem odsyłacze do odpowiednich dokumentów mogą wymagać aktualizacji. Zmiany te będą udostępnione publicznie w postaci aktualizacji wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy.
|
26.7.2016 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 199/28 |
DECYZJA WYKONAWCZA KOMISJI (UE) 2016/1217
z dnia 22 lipca 2016 r.
zezwalająca na wprowadzenie do obrotu, na podstawie rozporządzenia (WE) nr 1829/2003 Parlamentu Europejskiego i Rady, produktów zawierających genetycznie zmodyfikowaną soję MON 87705 × MON 89788 (MON-877Ø5-6 × MON-89788-1), składających się z niej lub z niej wyprodukowanych
(notyfikowana jako dokument nr C(2016) 4582)
(Jedynie teksty w języku francuskim i niderlandzkim są autentyczne)
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1829/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie genetycznie zmodyfikowanej żywności i paszy (1), w szczególności jego art. 7 ust. 3 i art. 19 ust. 3,
a także mając na uwadze, co następuje:
|
(1) |
W dniu 11 sierpnia 2011 r. przedsiębiorstwo Monsanto Europe SA zwróciło się, zgodnie z art. 5 i 17 rozporządzenia (WE) nr 1829/2003, do właściwego organu Niderlandów z wnioskiem o wprowadzenie do obrotu żywności, składników żywności i paszy zawierających soję MON 87705 × MON 89788, składających się z niej lub z niej wyprodukowanych („wniosek”). |
|
(2) |
Wniosek odnosi się również do wprowadzenia do obrotu zmodyfikowanej genetycznie soi MON 87705 × MON 89788 w produktach z niej się składających lub ją zawierających, do zastosowań innych niż w żywności i paszy na równi z innymi rodzajami soi, z wyjątkiem uprawy. |
|
(3) |
Zgodnie z art. 5 ust. 5 i art. 17 ust. 5 rozporządzenia (WE) nr 1829/2003 do wniosku załączono dane i informacje wymagane na podstawie załączników III i IV do dyrektywy Parlamentu Europejskiego i Rady 2001/18/WE (2), a także informacje i ustalenia dotyczące oceny ryzyka przeprowadzonej według zasad określonych w załączniku II do tej dyrektywy. Wniosek zawiera również plan monitorowania skutków dla środowiska zgodny z załącznikiem VII do dyrektywy 2001/18/WE. |
|
(4) |
W dniu 16 lipca 2015 r. Europejski Urząd ds. Bezpieczeństwa Żywności („EFSA”) wydał pozytywną opinię zgodnie z art. 6 i 18 rozporządzenia (WE) nr 1829/2003 (3). Uznał on, że zmodyfikowana genetycznie soja MON 87705 × MON 89788, zgodna z opisem we wniosku, jest równie bezpieczna jak jej niezmodyfikowany genetycznie odpowiednik i inne niezmodyfikowane genetycznie odmiany soi pod względem potencjalnego negatywnego wpływu na zdrowie ludzi i zwierząt i na środowisko, w kontekście zakresu wniosku. |
|
(5) |
W swojej opinii EFSA rozpatrzył wszystkie szczegółowe pytania i wątpliwości zgłaszane przez państwa członkowskie w ramach konsultacji z właściwymi organami krajowymi, jak przewidziano w art. 6 ust. 4 i art. 18 ust. 4 rozporządzenia (WE) nr 1829/2003. |
|
(6) |
EFSA stwierdził także we wspomnianej opinii, że złożony przez wnioskodawcę plan monitorowania skutków dla środowiska, obejmujący plan ogólnego nadzoru, jest zgodny z zamierzonymi zastosowaniami produktów. |
|
(7) |
Ponadto EFSA zalecił wdrożenie planu monitorowania po wprowadzeniu do obrotu, ze szczególnym uwzględnieniem danych dotyczących spożycia odnoszących się do populacji w Europie. |
|
(8) |
W związku z powyższym należy wydać zezwolenie na produkty zawierające genetycznie zmodyfikowaną soję MON 87705 × MON 89788, składające się z niej lub z niej wyprodukowane. |
|
(9) |
Każdemu organizmowi zmodyfikowanemu genetycznie („GMO”) należy przypisać niepowtarzalny identyfikator zgodnie z rozporządzeniem Komisji (WE) nr 65/2004 (4). |
|
(10) |
Żywność, paszę oraz składniki żywności zawierające soję MON 87705 × MON 89788, składające się z niej lub z niej wyprodukowane należy etykietować zgodnie z wymaganiami określonymi w art. 13 ust. 1 i w art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003. |
|
(11) |
Na podstawie opinii EFSA, w której potwierdzono, że skład kwasów tłuszczowych w nasionach soi MON 87705 × MON 89788 oraz w wytworzonym z nich oleju został zmieniony w porównaniu z ich konwencjonalnym odpowiednikiem, konieczne jest specjalne etykietowanie zgodnie z art. 13 ust. 2 lit. a) i art. 25 ust. 2 lit. c) rozporządzenia (WE) nr 1829/2003. |
|
(12) |
W art. 4 ust. 6 rozporządzenia (WE) nr 1830/2003 Parlamentu Europejskiego i Rady (5) ustanowiono wymogi dotyczące etykietowania w odniesieniu do produktów zawierających GMO lub składających się z nich. Wymogi dotyczące możliwości śledzenia tych produktów zawarto w art. 4 ust. 1–5, natomiast wymogi dotyczące możliwości śledzenia żywności i paszy wyprodukowanych z GMO ustanowiono w art. 5 tego rozporządzenia. |
|
(13) |
Aby zapewnić wykorzystanie produktów w granicach zezwolenia przyznanego niniejszą decyzją, etykiety produktów zawierających GMO, którego dotyczy wniosek o zezwolenie, lub składających się z niego, z wyjątkiem produktów spożywczych, powinny zostać uzupełnione o wyraźne wskazanie, że danych produktów nie wolno stosować do celów uprawy. |
|
(14) |
Posiadacz zezwolenia powinien przedkładać coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania skutków dla środowiska. Wyniki te należy przedstawić zgodnie z decyzją Komisji 2009/770/WE (6). Opinia wydana przez EFSA nie uzasadnia nałożenia specjalnych wymogów lub ograniczeń na wprowadzanie do obrotu żywności i paszy, ani na ich wykorzystanie i obchodzenie się z nimi, w tym wymagań dotyczących monitorowania po wprowadzeniu do obrotu, czy też specjalnych wymogów dotyczących ochrony poszczególnych ekosystemów/środowiska naturalnego lub poszczególnych obszarów geograficznych, przewidzianych w art. 6 ust. 5 lit. e) oraz art. 18 ust. 5 lit. e) rozporządzenia (WE) nr 1829/2003. |
|
(15) |
Posiadacz zezwolenia powinien również przedkładać coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania po wprowadzeniu do obrotu. |
|
(16) |
Wszelkie stosowne informacje dotyczące zezwolenia na te produkty powinny zostać wprowadzone do wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy przewidzianego w rozporządzeniu (WE) nr 1829/2003. |
|
(17) |
Niniejszą decyzję należy przekazać stronom Protokołu kartageńskiego o bezpieczeństwie biologicznym do Konwencji o różnorodności biologicznej za pośrednictwem Systemu Wymiany Informacji o Bezpieczeństwie Biologicznym, zgodnie z art. 9 ust. 1 i art. 15 ust. 2 lit. c) rozporządzenia (WE) nr 1946/2003 Parlamentu Europejskiego i Rady (7). |
|
(18) |
Stały Komitet ds. Roślin, Zwierząt, Żywności i Pasz nie wydał opinii w terminie ustalonym przez jego przewodniczącego. Uznano, że niezbędny jest akt wykonawczy, i przewodniczący przedłożył komitetowi odwoławczemu projekt aktu wykonawczego do dalszego rozpatrzenia. Komitet odwoławczy nie wydał opinii, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Organizm zmodyfikowany genetycznie i niepowtarzalny identyfikator
Genetycznie zmodyfikowana soja (Glycine max (L.) Merr.) MON 87705 × MON 89788, określona w lit. b) załącznika do niniejszej decyzji, otrzymuje niepowtarzalny identyfikator MON-877Ø5-6 × MON-89788-1, jak przewidziano w rozporządzeniu (WE) nr 65/2004.
Artykuł 2
Zezwolenie
Niniejszym udziela się zezwolenia na wprowadzanie do obrotu, do celów art. 4 ust. 2 i art. 16 ust. 2 rozporządzenia (WE) nr 1829/2003, zgodnie z warunkami określonymi w niniejszej decyzji, następujących produktów:
|
a) |
żywności i składników żywności zawierających soję MON-877Ø5-6 × MON-89788-1, składających się z niej lub z niej wyprodukowanych; |
|
b) |
paszy zawierającej soję MON-877Ø5-6 × MON-89788-1, składającej się z niej lub z niej wyprodukowanej; |
|
c) |
soi MON-877Ø5-6 × MON-89788-1 w produktach ją zawierających lub z niej się składających, do innych zastosowań niż wymienione w lit. a) i b), z wyjątkiem uprawy. |
Artykuł 3
Etykietowanie
1. Zgodnie z wymaganiami dotyczącymi etykietowania, określonymi w art. 13 ust. 1 i art. 25 ust. 2 rozporządzenia (WE) nr 1829/2003 oraz w art. 4 ust. 6 rozporządzenia (WE) nr 1830/2003, „nazwą organizmu” jest „soja”.
2. Do celów wymogów dotyczących etykietowania, określonych w art. 13 ust. 2 lit. a) i art. 25 ust. 2 lit. c) rozporządzenia (WE) nr 1829/2003 po nazwie organizmu na etykietach lub, w stosownych przypadkach, w dokumentach dołączonych do produktów po nazwie organizmu zamieszcza się zwrot „o zwiększonej zawartości tłuszczów jednonienasyconych i zmniejszonej zawartości tłuszczów wielonienasyconych”.
3. Na etykietach i w dokumentach dołączonych do produktów zawierających soję MON-877Ø5-6 × MON-89788-1 lub składających się z niej, z wyjątkiem produktów, o których mowa w art. 2 lit. a), zamieszcza się zwrot „nieprzeznaczone do uprawy”.
Artykuł 4
Monitorowanie skutków dla środowiska
1. Posiadacz zezwolenia zapewnia wdrożenie planu monitorowania skutków dla środowiska, określonego w lit. h) załącznika.
2. Posiadacz zezwolenia składa Komisji coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania zgodnie z decyzją 2009/770/WE.
Artykuł 5
Monitorowanie po wprowadzeniu do obrotu zgodnie z art. 6 ust. 5 lit. e) rozporządzenia (WE) nr 1829/2003
1. Posiadacz zezwolenia zapewnia wdrożenie planu monitorowania po wprowadzeniu do obrotu oleju sojowego z soi MON-877Ø5-6 × MON-89788-1, określonego w lit. g) załącznika.
2. Posiadacz zezwolenia składa Komisji coroczne sprawozdania z realizacji i wyników działań przewidzianych w planie monitorowania po wprowadzeniu do obrotu za okres obowiązywania zezwolenia.
Artykuł 6
Rejestr wspólnotowy
Informacje zawarte w załączniku do niniejszej decyzji wprowadza się do wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy zgodnie z art. 28 rozporządzenia (WE) nr 1829/2003.
Artykuł 7
Posiadacz zezwolenia
Posiadaczem zezwolenia jest przedsiębiorstwo Monsanto Europe SA z siedzibą w Belgii, występujące w imieniu Monsanto Company, Stany Zjednoczone Ameryki.
Artykuł 8
Okres ważności
Niniejszą decyzję stosuje się przez 10 lat od daty jej notyfikacji.
Artykuł 9
Adresat
Niniejsza decyzja skierowana jest do przedsiębiorstwa Monsanto Europe SA, Avenue de Tervuren 270-272, 1150 Bruxelles/Brussel, Belgique/België.
Sporządzono w Brukseli dnia 22 lipca 2016 r.
W imieniu Komisji
Vytenis ANDRIUKAITIS
Członek Komisji
(1) Dz.U. L 268 z 18.10.2003, s. 1.
(2) Dyrektywa Parlamentu Europejskiego i Rady 2001/18/WE z dnia 12 marca 2001 r. w sprawie zamierzonego uwalniania do środowiska organizmów zmodyfikowanych genetycznie i uchylająca dyrektywę Rady 90/220/EWG (Dz.U. L 106 z 17.4.2001, s. 1).
(3) Opinia naukowa dotycząca przedłożonego przez przedsiębiorstwo Monsanto wniosku (EFSA-GMO-NL-2011-110) o wydanie zezwolenia na wprowadzenie do obrotu tolerującej herbicydy genetycznie zmodyfikowanej soi MON 87705 × MON 89788, o zwiększonej zawartości kwasu oleinowego, z przeznaczeniem na żywność i pasze oraz na jej przywóz i przetwarzanie na podstawie rozporządzenia (WE) nr 1829/2003. Dziennik EFSA 2015; 13(7):4178, 30 s. doi:10.2903/j.efsa.2015.4178.
(4) Rozporządzenie Komisji (WE) nr 65/2004 z dnia 14 stycznia 2004 r. ustanawiające system ustanawiania oraz przypisywania niepowtarzalnych identyfikatorów organizmom zmodyfikowanym genetycznie (Dz.U. L 10 z 16.1.2004, s. 5).
(5) Rozporządzenie (WE) nr 1830/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. dotyczące możliwości śledzenia i etykietowania organizmów zmodyfikowanych genetycznie oraz możliwości śledzenia żywności i produktów paszowych wyprodukowanych z organizmów zmodyfikowanych genetycznie i zmieniające dyrektywę 2001/18/WE (Dz.U. L 268 z 18.10.2003, s. 24).
(6) Decyzja Komisji 2009/770/WE z dnia 13 października 2009 r. ustanawiająca standardowe formaty sprawozdań na potrzeby przedstawiania wyników monitorowania zamierzonego uwalniania do środowiska organizmów zmodyfikowanych genetycznie jako produktów lub w ich składzie w celu wprowadzania do obrotu, zgodnie z dyrektywą 2001/18/WE Parlamentu Europejskiego i Rady (Dz.U. L 275 z 21.10.2009, s. 9).
(7) Rozporządzenie (WE) nr 1946/2003 Parlamentu Europejskiego i Rady z dnia 15 lipca 2003 r. w sprawie transgranicznego przemieszczania organizmów genetycznie zmodyfikowanych (Dz.U. L 287 z 5.11.2003, s. 1).
ZAŁĄCZNIK
|
a) |
Wnioskodawca i posiadacz zezwolenia:
W imieniu Monsanto Company – 800 N. Lindbergh Boulevard – St. Louis, Missouri 63167 – Stany Zjednoczone Ameryki. |
|
b) |
Opis i specyfikacja produktów:
Zmodyfikowana genetycznie soja MON-877Ø5-6 × MON-89788-1, zgodna z opisem we wniosku, wykazuje zmniejszoną ekspresję kwasu tłuszczowego Δ12-desaturazy (FAD2) oraz enzymów tioesterazy palmitoilo-ACP (FATB), co skutkuje zwiększoną zawartością kwasu oleinowego i zmniejszoną zawartością kwasu linolowego; wykazuje także ekspresję białka CP4 EPSPS, nadającego tolerancję na herbicydy zawierające glifosat. |
|
c) |
Etykietowanie:
|
|
d) |
Metoda wykrywania:
|
|
e) |
Niepowtarzalny identyfikator: MON-877Ø5-6 × MON-89788-1 |
|
f) |
Informacje wymagane zgodnie z załącznikiem II do Protokołu kartageńskiego o bezpieczeństwie biologicznym do Konwencji o różnorodności biologicznej: [Identyfikator zapisu Systemu Wymiany Informacji o Bezpieczeństwie Biologicznym: po ogłoszeniu publikowany we wspólnotowym rejestrze genetycznie zmodyfikowanej żywności i paszy]. |
|
g) |
Warunki lub ograniczenia dotyczące wprowadzania produktów do obrotu, ich stosowania lub obchodzenia się z nimi: Monitorowanie po wprowadzeniu do obrotu zgodnie z art. 6 ust. 5 lit. e) rozporządzenia (WE) nr 1829/2003
|
|
h) |
Plan monitorowania skutków dla środowiska: Plan monitorowania skutków dla środowiska, zgodny z załącznikiem VII do dyrektywy 2001/18/WE. [Odsyłacz: plan publikowany we wspólnotowym rejestrze genetycznie zmodyfikowanej żywności i paszy] |
Uwaga: Z czasem odsyłacze do odpowiednich dokumentów mogą wymagać aktualizacji. Zmiany te będą udostępnione publicznie w postaci aktualizacji wspólnotowego rejestru genetycznie zmodyfikowanej żywności i paszy.