ISSN 1977-0766
doi:10.3000/19770766.L_2013.289.pol
Dziennik Urzędowy
Unii Europejskiej
L 289

Wydanie polskie
Legislacja
Tom 56
31 października 2013
|
ISSN 1977-0766 doi:10.3000/19770766.L_2013.289.pol |
||
|
Dziennik Urzędowy Unii Europejskiej |
L 289 |
|

|
||
|
Wydanie polskie |
Legislacja |
Tom 56 |
|
|
|
Sprostowania |
|
|
|
* |
|
|
|
|
|
(1) Tekst mający znaczenie dla EOG |
|
PL |
Akty, których tytuły wydrukowano zwykłą czcionką, odnoszą się do bieżącego zarządzania sprawami rolnictwa i generalnie zachowują ważność przez określony czas. Tytuły wszystkich innych aktów poprzedza gwiazdka, a drukuje się je czcionką pogrubioną. |
II Akty o charakterze nieustawodawczym
UMOWY MIĘDZYNARODOWE
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/1 |
DECYZJA RADY
z dnia 22 października 2013 r.
dotycząca zawarcia Umowy między Unią Europejską a Republiką Armenii o ułatwieniach w wydawaniu wiz
(2013/628/UE)
RADA UNII EUROPEJSKIEJ,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej, w szczególności jego art. 77 ust. 2 lit. a) w związku z art. 218 ust. 6 lit. a) akapit drugi,
uwzględniając wniosek Komisji Europejskiej,
uwzględniając zgodę Parlamentu Europejskiego,
a także mając na uwadze, co następuje:
|
(1) |
Zgodnie z decyzją Rady 2013/2/UE (1) Umowa między Unią Europejską a Republiką Armenii o ułatwieniach w wydawaniu wiz („umowa”) została podpisana w dniu 17 grudnia 2012 r., z zastrzeżeniem jej zawarcia w późniejszym terminie. |
|
(2) |
Umowa powinna zostać przyjęta. |
|
(3) |
Niniejsza decyzja stanowi rozwinięcie przepisów dorobku Schengen, które nie mają zastosowania do Zjednoczonego Królestwa, zgodnie z decyzją Rady 2000/365/WE z dnia 29 maja 2000 r. dotyczącą wniosku Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej o zastosowanie wobec niej niektórych przepisów dorobku Schengen (2); Zjednoczone Królestwo nie uczestniczy w związku z tym w jej przyjęciu i nie jest nią związane ani jej nie stosuje. |
|
(4) |
Niniejsza decyzja stanowi rozwinięcie przepisów dorobku Schengen, które nie mają zastosowania do Irlandii, zgodnie z decyzją Rady 2002/192/WE z dnia 28 lutego 2002 r. dotyczącą wniosku Irlandii o zastosowanie wobec niej niektórych przepisów dorobku Schengen (3); Irlandia nie uczestniczy w związku z tym w jej przyjęciu i nie jest nią związana ani jej nie stosuje. |
|
(5) |
Zgodnie z art. 1 i 2 Protokołu w sprawie stanowiska Danii, załączonego do Traktatu o Unii Europejskiej i do Traktatu o funkcjonowaniu Unii Europejskiej, Dania nie uczestniczy w przyjęciu niniejszej decyzji i nie jest nią związana ani jej nie stosuje, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Umowa między Unią Europejską i Republika Armenii o ułatwieniach w wydawaniu wiz zostaje niniejszym zatwierdzona w imieniu Unii.
Tekst umowy dołącza się do niniejszej decyzji.
Artykuł 2
Przewodniczący Rady dokonuje w imieniu Unii zawiadomienia, o którym mowa w art. 14 ust. 1 umowy (4).
Artykuł 3
Niniejsza decyzja wchodzi w życie z dniem jej przyjęcia.
Sporządzono w Luksemburgu dnia 22 października 2013 r.
W imieniu Rady
L. LINKEVIČIUS
Przewodniczący
(1) Dz.U. L 3 z 8.1.2013, s. 1.
(2) Dz.U. L 131 z 1.6.2000, s. 43.
(3) Dz.U. L 64 z 7.3.2002, s. 20.
(4) Data wejścia w życie umowy zostanie opublikowana w Dzieniku Urzędowym Unii Europejskiej przez Sekretariat Generalny Rady.
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/2 |
UMOWA
między Unią Europejską a Republiką Armenii o ułatwieniach w wydawaniu wiz
UNIA EUROPEJSKA, zwana dalej „Unią”,
oraz
REPUBLIKA ARMENII, zwana dalej „Armenią”,
zwane dalej „Stronami”,
PRAGNĄC ułatwić bezpośrednie kontakty między ludźmi, będące ważnym warunkiem stałego rozwoju więzi gospodarczych, humanitarnych, kulturalnych, naukowych i innych, poprzez wprowadzenie ułatwień w wydawaniu wiz dla obywateli Armenii,
MAJĄC NA UWADZE Umowę o partnerstwie i współpracy między Unią i jej państwami członkowskimi, z jednej strony, a Armenią, z drugiej strony, jak również zamiar zawarcia przez Strony układu o stowarzyszeniu między UE a Armenią,
UWZGLĘDNIAJĄC wspólne deklaracje przyjęte podczas szczytów Partnerstwa Wschodniego w Pradze i w Warszawie odpowiednio w dniach 7 maja 2009 r. i 30 września 2011 r., w których wyrażono poparcie polityczne dla liberalizacji systemu wizowego w bezpiecznym środowisku,
POTWIERDZAJĄC ponownie zamiar podjęcia w odpowiednim czasie stopniowych kroków w kierunku wprowadzenia ruchu bezwizowego dla swoich obywateli, pod warunkiem spełnienia warunków bezpiecznej mobilności i odpowiedniego zarządzania nią,
BIORĄC POD UWAGĘ fakt, że od dnia 10 stycznia 2013 r. wszyscy obywatele Unii są zwolnieni z obowiązku wizowego w przypadku podróży do Armenii nieprzekraczających 90 dni bądź tranzytu przez terytorium Armenii,
UZNAJĄC, że w przypadku ponownego wprowadzenia przez Armenię obowiązku wizowego dla obywateli Unii lub ich pewnych kategorii takie same ułatwienia przewidziane w niniejszej umowie dla obywateli Armenii automatycznie stosują się na zasadzie wzajemności do obywateli Unii,
BIORĄC POD UWAGĘ fakt, że wspomniany obowiązek wizowy może zostać ponownie wprowadzony jedynie w odniesieniu do wszystkich obywateli Unii lub pewnych kategorii obywateli Unii,
UZNAJĄC, że ułatwienia wizowe nie powinny prowadzić do nielegalnej migracji, oraz przykładając szczególną wagę do kwestii bezpieczeństwa i readmisji,
BIORĄC POD UWAGĘ Protokół w sprawie stanowiska Zjednoczonego Królestwa i Irlandii w odniesieniu do przestrzeni wolności, bezpieczeństwa i sprawiedliwości oraz Protokół włączający dorobek Schengen w ramy Unii Europejskiej, dołączone do Traktatu o Unii Europejskiej oraz Traktatu o funkcjonowaniu Unii Europejskiej, a także potwierdzając, że postanowienia niniejszej umowy nie mają zastosowania do Zjednoczonego Królestwa i Irlandii,
BIORĄC POD UWAGĘ Protokół w sprawie stanowiska Danii, dołączony do Traktatu o Unii Europejskiej oraz Traktatu o funkcjonowaniu Unii Europejskiej, i potwierdzając, że postanowienia niniejszej umowy nie mają zastosowania do Królestwa Danii,
UZGADNIAJĄ, CO NASTĘPUJE:
Artykuł 1
Cel i zakres stosowania
1. Celem niniejszej umowy jest wprowadzenie ułatwień w wydawaniu wiz obywatelom Armenii planującym pobyt nie dłuższy niż 90 dni w ciągu każdego 180-dniowego okresu.
2. W przypadku ponownego wprowadzenia przez Armenię obowiązku wizowego dla obywateli Unii lub ich pewnych kategorii takie same ułatwienia przewidziane w niniejszej umowie dla obywateli Armenii automatycznie stosują się na zasadzie wzajemności do obywateli Unii.
Artykuł 2
Postanowienia ogólne
1. Ułatwienia wizowe, o których mowa w niniejszej umowie, mają zastosowanie do obywateli Armenii jedynie w takim zakresie, w jakim nie są oni zwolnieni z obowiązku wizowego na mocy przepisów ustawowych i wykonawczych Unii lub państw członkowskich, postanowień niniejszej umowy lub innych umów międzynarodowych.
2. W odniesieniu do zagadnień nieobjętych postanowieniami niniejszej umowy, takich jak: odmowa wydania wizy, uznawanie dokumentów podróży, dowód posiadania wystarczających środków utrzymania, odmowa wjazdu oraz procedury wydalania osób, stosuje się prawo krajowe Armenii, prawo państw członkowskich bądź prawo unijne.
Artykuł 3
Definicje
Do celów niniejszej umowy:
|
a) |
„państwo członkowskie” oznacza każde państwo członkowskie Unii Europejskiej, z wyjątkiem Królestwa Danii, Republiki Irlandii oraz Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej; |
|
b) |
„obywatel Unii” oznacza każdego obywatela państwa członkowskiego zgodnie z definicją zawartą w lit. a); |
|
c) |
„obywatel Armenii” oznacza każdą osobę, która posiada obywatelstwo Armenii zgodnie z prawodawstwem Republiki Armenii; |
|
d) |
„wiza” oznacza zezwolenie wydane przez państwo członkowskie na tranzyt przez terytorium państw członkowskich lub planowany pobyt na terytorium państw członkowskich nie dłuższy niż 90 dni w ciągu każdego 180-dniowego okresu; |
|
e) |
„osoba zamieszkująca legalnie” oznacza każdego obywatela Armenii, który został upoważniony lub uprawniony na podstawie prawa unijnego lub przepisów krajowych do pobytu na terytorium jednego z państw członkowskich przez okres dłuższy niż 90 dni. |
Artykuł 4
Dokumenty potwierdzające cel podróży
1. W odniesieniu do niżej wymienionych kategorii obywateli Armenii za wystarczające uznaje się następujące dokumenty uzasadniające cel podróży na terytorium drugiej Strony:
|
a) |
w przypadku bliskich krewnych – współmałżonków, dzieci (w tym przysposobionych), rodziców (w tym opiekunów), dziadków, wnuków – odwiedzających obywateli Armenii legalnie zamieszkujących na terytorium państw członkowskich lub obywateli Unii zamieszkujących na terytorium państwa członkowskiego, którego są obywatelami:
|
|
b) |
w przypadku członków oficjalnych delegacji, w tym stałych członków takich delegacji, którzy na oficjalne zaproszenie skierowane do Armenii uczestniczą w spotkaniach, konsultacjach, negocjacjach lub programach wymiany, a także w wydarzeniach organizowanych na terytorium jednego z państw członkowskich przez organizacje międzyrządowe:
|
|
c) |
w przypadku uczniów, studentów, słuchaczy studiów podyplomowych oraz towarzyszących im nauczycieli, którzy odbywają podróż w celu podjęcia nauki lub odbycia szkoleń, w tym w ramach programów wymiany oraz innych działań szkolnych:
|
|
d) |
w przypadku osób podróżujących w celach medycznych i – w razie konieczności – osób im towarzyszących:
|
|
e) |
w przypadku dziennikarzy i członków ekipy technicznej towarzyszących im w celach zawodowych:
|
|
f) |
w przypadku uczestników międzynarodowych imprez sportowych i osób im towarzyszących w celach zawodowych:
|
|
g) |
w przypadku przedsiębiorców i przedstawicieli organizacji branżowych:
|
|
h) |
w przypadku przedstawicieli wolnych zawodów biorących udział w międzynarodowych wystawach, konferencjach, sympozjach, seminariach lub innych podobnych imprezach:
|
|
i) |
w przypadku przedstawicieli organizacji społeczeństwa obywatelskiego oraz osób zaproszonych przez organizacje niekomercyjne wspólnoty ormiańskiej zarejestrowane w państwach członkowskich, którzy odbywają podróż w celu odbycia szkoleń, wzięcia udziału w seminariach i konferencjach, w tym w ramach programów wymiany lub programów wsparcia wspólnoty panormiańskiej i ormiańskiej:
|
|
j) |
w przypadku osób biorących udział w działaniach naukowych, akademickich, kulturalnych lub artystycznych, w tym programach uniwersyteckich i innych programach wymiany:
|
|
k) |
w przypadku kierowców przewożących ładunki w ruchu międzynarodowym i świadczących usługi transportu pasażerskiego, przemieszczających się na terytorium państw członkowskich pojazdami zarejestrowanymi w Armenii:
|
|
l) |
w przypadku uczestników oficjalnych programów wymiany organizowanych przez miasta partnerskie i inne jednostki komunalne:
|
|
m) |
w przypadku osób pragnących odwiedzić cmentarz wojskowy lub cywilny:
|
2. Do celów niniejszego artykułu pisemny wniosek musi zawierać następujące informacje:
|
a) |
w przypadku osoby zaproszonej: imię i nazwisko, datę urodzenia, płeć, obywatelstwo, numer paszportu, czas i cel podróży, liczbę poprzednich wjazdów oraz w stosownych przypadkach imiona i nazwiska małżonka i dzieci towarzyszących osobie zaproszonej; |
|
b) |
w przypadku osoby zapraszającej: imię, nazwisko i adres; |
|
c) |
w przypadku gdy strona zapraszająca jest osobą prawną, spółką lub organizacją: pełną nazwę i adres oraz
|
3. W przypadku osób, o których mowa w ust. 1 niniejszego artykułu, wszystkie kategorie wiz wydaje się według procedury uproszczonej, nie wymagając żadnego innego uzasadnienia, zaproszenia ani zatwierdzenia dotyczącego celu podróży, przewidzianego w ustawodawstwie Stron.
Artykuł 5
Wydawanie wiz wielokrotnego wjazdu
1. Misje dyplomatyczne oraz urzędy konsularne państw członkowskich wydają wizy wielokrotnego wjazdu o okresie ważności pięciu lat następującym kategoriom osób:
|
a) |
współmałżonkom, dzieciom (w tym przysposobionym) poniżej 21. roku życia lub pozostającym na utrzymaniu rodziców, rodzicom (w tym opiekunom) – odwiedzającym obywateli Armenii legalnie zamieszkujących na terytorium państw członkowskich lub obywateli Unii zamieszkujących na terytorium państwa członkowskiego, którego są obywatelami; |
|
b) |
członkom rządów krajowych i regionalnych, Trybunałów Konstytucyjnych i Sądów Najwyższych wykonującym swoje obowiązki, w przypadku gdy nie są oni zwolnieni z obowiązku wizowego na mocy niniejszej umowy; |
|
c) |
stałym członkom oficjalnych delegacji, którzy na oficjalne zaproszenie wystosowane do Armenii uczestniczą regularnie w spotkaniach, konsultacjach, negocjacjach lub programach wymiany, a także w imprezach organizowanych na terytorium państw członkowskich przez organizacje międzyrządowe. |
W drodze odstępstwa, w przypadkach gdy konieczność lub zamiar częstego lub regularnego podróżowania są wyraźnie ograniczone do krótszego okresu, okres ważności wizy wielokrotnego wjazdu ogranicza się do tego okresu, w szczególności gdy:
|
— |
w przypadku osób wymienionych w lit. a) – okres ważności zezwolenia na legalny pobyt obywateli Armenii legalnie zamieszkujących w Unii, |
|
— |
w przypadku osób wymienionych w lit. b) – okres ich kadencji, |
|
— |
w przypadku osób wymienionych w lit. c) – okres pełnienia funkcji stałego członka oficjalnej delegacji |
jest krótszy niż pięć lat.
2. Misje dyplomatyczne oraz urzędy konsularne państw członkowskich wydają wizy wielokrotnego wjazdu o okresie ważności jednego roku następującym kategoriom osób, pod warunkiem że w roku poprzednim osoby takie otrzymały przynajmniej jedną wizę i z której skorzystały zgodnie z przepisami prawnymi dotyczącymi wjazdu do danego państwa i pobytu w nim:
|
a) |
członkom oficjalnych delegacji, którzy na oficjalne zaproszenie wystosowane do Armenii uczestniczą regularnie w spotkaniach, konsultacjach, negocjacjach lub programach wymiany, a także w imprezach organizowanych na terytorium państw członkowskich przez organizacje międzyrządowe; |
|
b) |
przedstawicielom organizacji społeczeństwa obywatelskiego oraz osobom zaproszonym przez organizacje niekomercyjne wspólnoty ormiańskiej zarejestrowane w państwach członkowskich, którzy odbywają podróże do państw członkowskich w celu odbycia szkoleń, wzięcia udziału w seminariach i konferencjach, w tym w ramach programów wymiany lub programów wsparcia wspólnoty panormiańskiej i ormiańskiej; |
|
c) |
przedstawicielom wolnych zawodów biorącym udział w międzynarodowych wystawach, konferencjach, sympozjach, seminariach lub innych podobnych imprezach, którzy odbywają regularne podróże do państw członkowskich; |
|
d) |
osobom biorącym udział w działaniach naukowych, kulturalnych lub artystycznych, w tym programach uniwersyteckich i innych programach wymiany, odbywającym regularne podróże do państw członkowskich; |
|
e) |
studentom oraz słuchaczom studiów podyplomowych, którzy odbywają regularne podróże w celu podjęcia nauki lub odbycia szkoleń, w tym w ramach programów wymiany; |
|
f) |
uczestnikom oficjalnych programów wymiany organizowanych przez miasta partnerskie i inne jednostki komunalne; |
|
g) |
osobom zmuszonym do odbywania regularnych podróży w celach medycznych i – w razie konieczności – osobom im towarzyszącym; |
|
h) |
dziennikarzom i członkom ekipy technicznej towarzyszącym im w celach zawodowych: |
|
i) |
przedsiębiorcom i przedstawicielom organizacji branżowych, którzy odbywają regularne podróże do państw członkowskich; |
|
j) |
uczestnikom międzynarodowych imprez sportowych i osobom towarzyszącym im w celach zawodowych; |
|
k) |
kierowcom przewożącym ładunki w ruchu międzynarodowym i świadczącym usługi transportu pasażerskiego, przemieszczającym się na terytorium państw członkowskich pojazdami zarejestrowanymi w Armenii. |
W drodze odstępstwa od zdania pierwszego, w przypadkach gdy konieczność lub zamiar częstego lub regularnego podróżowania są wyraźnie ograniczone do krótszego okresu, okres ważności wizy wielokrotnego wjazdu ogranicza się do tego okresu.
3. Misje dyplomatyczne oraz urzędy konsularne państw członkowskich wydają wizy wielokrotnego wjazdu o okresie ważności co najmniej dwóch lat i maksymalnie pięciu lat osobom należącym do kategorii wymienionych w ust. 2 niniejszego artykułu, pod warunkiem że w poprzednich dwóch latach osoby takie skorzystały z jednorocznych wiz wielokrotnego wjazdu zgodnie z przepisami prawnymi dotyczącymi wjazdu do danego państwa i pobytu w nim, chyba że konieczność lub zamiar częstego lub regularnego podróżowania jest wyraźnie ograniczony do krótszego okresu, w którym to przypadku okres ważności wizy wielokrotnego wjazdu ogranicza się do tego okresu.
4. Całkowity czas pobytu osób, o których mowa w ust. 1–3 niniejszego artykułu, na terytorium państw członkowskich nie może przekraczać 90 dni w każdym 180-dniowym okresie.
Artykuł 6
Opłaty za rozpatrzenie wniosku wizowego
1. Opłata za rozpatrzenie wniosku wizowego wynosi 35 EUR.
Wyżej wymieniona kwota może ulec zmianie zgodnie z procedurą ustanowioną w art. 14 ust. 4.
2. Bez uszczerbku dla ust. 3 niniejszego artykułu w odniesieniu do niżej wymienionych kategorii obywateli odstępuje się od pobierania opłaty za rozpatrzenie wniosku wizowego:
|
a) |
emeryci i renciści; |
|
b) |
dzieci poniżej 12. roku życia; |
|
c) |
członkowie rządów krajowych i regionalnych, Trybunałów Konstytucyjnych i Sądów Najwyższych, w przypadku gdy nie są oni zwolnieni z obowiązku wizowego na mocy niniejszej umowy; |
|
d) |
osoby niepełnosprawne i – w razie konieczności – ich opiekunowie; |
|
e) |
bliscy krewni – współmałżonkowie, dzieci (w tym przysposobione), rodzice (w tym opiekunowie), dziadkowie lub wnuki – obywateli Armenii legalnie zamieszkujących na terytorium państw członkowskich lub obywateli Unii zamieszkujących na terytorium państwa członkowskiego, którego są obywatelami; |
|
f) |
członkowie oficjalnych delegacji, w tym stali członkowie oficjalnych delegacji, którzy na oficjalne zaproszenie skierowane do Armenii uczestniczą w spotkaniach, konsultacjach, negocjacjach lub programach wymiany, a także w wydarzeniach organizowanych na terytorium jednego z państw członkowskich przez organizacje międzyrządowe: |
|
g) |
uczniowie, studenci, słuchacze studiów podyplomowych oraz towarzyszący im nauczyciele, którzy odbywają podróż w celu podjęcia nauki lub odbycia szkoleń, w tym w ramach programów wymiany oraz innych działań szkolnych; |
|
h) |
dziennikarze i członkowie ekipy technicznej towarzyszący im w celach zawodowych; |
|
i) |
uczestnicy międzynarodowych imprez sportowych i osoby towarzyszące im w celach zawodowych; |
|
j) |
przedstawiciele organizacji społeczeństwa obywatelskiego oraz osoby zaproszone przez organizacje niekomercyjne wspólnoty ormiańskiej zarejestrowane w państwach członkowskich, którzy odbywają podróż w celu odbycia szkoleń, wzięcia udziału w seminariach i konferencjach, w tym w ramach programów wymiany lub programów wsparcia wspólnoty panormiańskiej i ormiańskiej; |
|
k) |
osoby biorące udział w działaniach naukowych, akademickich, kulturalnych lub artystycznych, w tym programach uniwersyteckich i innych programach wymiany; |
|
l) |
osoby, które przedstawiły dowody potwierdzające konieczność wyjazdu z przyczyn humanitarnych, w tym w celu podjęcia pilnego leczenia, oraz osoby im towarzyszące, lub w celu wzięcia udziału w pogrzebie bliskiego krewnego albo odwiedzenia ciężko chorego bliskiego krewnego. |
3. Jeśli państwo członkowskie współpracuje z zewnętrznym usługodawcą w zakresie wystawiania wiz, zewnętrzny usługodawca może pobierać opłatę za usługę. Ta opłata za usługę jest proporcjonalna do kosztów ponoszonych przez usługodawcę zewnętrznego z tytułu wykonywania swoich zadań i nie przekracza 30 EUR. Państwa członkowskie utrzymują możliwość składania wniosków przez wszystkie osoby ubiegające się o wizę bezpośrednio w ich konsulatach.
Usługodawca zewnętrzny wykonuje swoje działania na rzecz Unii zgodnie z kodeksem wizowym i w pełnym poszanowaniu przepisów prawa Armenii.
Artykuł 7
Czas trwania procedur rozpatrywania wniosków wizowych
1. Misje dyplomatyczne oraz urzędy konsularne państw członkowskich podejmują decyzję w sprawie wniosku o wydanie wizy w ciągu 10 dni kalendarzowych od dnia wpłynięcia wniosku i dokumentów wymaganych do wydania wizy.
2. W indywidualnych przypadkach, szczególnie w razie konieczności przeprowadzenia dokładniejszej analizy wniosku, okres na podjęcie decyzji w sprawie wniosku wizowego można przedłużyć do 30 dni kalendarzowych.
3. W nagłych przypadkach termin na podjęcie decyzji w sprawie wniosku wizowego można skrócić do dwóch dni roboczych lub mniej.
4. Jeśli od osób ubiegających się o wizę wymaga się umówienia się na spotkanie w celu złożenia wniosku, spotkanie takie odbywa się z reguły w ciągu dwóch tygodni od dnia, w którym zażądano spotkania. W uzasadnionych przypadkach nagłych konsulaty mogą zezwolić osobom ubiegającym się o wizę na złożenie wniosku bez umówionego spotkania albo wyznaczają takie spotkanie w trybie natychmiastowym.
Artykuł 8
Wyjazd w przypadku zgubienia lub kradzieży dokumentów
Obywatel Unii lub Armenii, który zgubił swój dowód tożsamości lub któremu taki dokument skradziono podczas pobytu na terytorium Armenii lub państw członkowskich, może opuścić terytorium Armenii lub państw członkowskich na podstawie ważnego dowodu tożsamości upoważniającego do przekroczenia granicy, wydanego przez misję dyplomatyczną lub urząd konsularny danego państwa członkowskiego lub Armenii, bez konieczności posiadania wizy lub innego rodzaju upoważnienia.
Artykuł 9
Przedłużenie okresu ważności wizy w wyjątkowych okolicznościach
Obywatelom Armenii, którzy z powodu siły wyższej lub z powodów humanitarnych nie mogą opuścić terytorium państw członkowskich przed upływem terminu ważności wizy, okres ważności wizy przedłuża się nieodpłatnie zgodnie z przepisami prawa państwa członkowskiego, w którym przebywają, na czas niezbędny dla przywrócenia możliwości powrotu do państwa zamieszkania.
Artykuł 10
Paszporty dyplomatyczne
1. Obywatele Armenii posiadający ważny paszport dyplomatyczny mogą wjechać na terytorium państw członkowskich, opuścić to terytorium lub przejechać przez nie bez wizy.
2. Osoby, o których mowa w ust. 1 niniejszego artykułu, mogą pozostać na terytorium państw członkowskich bez wizy nie dłużej niż przez 90 dni w każdym 180-dniowym okresie.
Artykuł 11
Ważność terytorialna wiz
Z zastrzeżeniem krajowych zasad i uregulowań państw członkowskich dotyczących bezpieczeństwa narodowego oraz z zastrzeżeniem unijnych zasad dotyczących wiz z ograniczoną ważnością terytorialną obywatele Armenii uprawnieni są do podróżowania w granicach terytorium państw członkowskich na takich samych zasadach, jak obywatele Unii.
Artykuł 12
Wspólny Komitet ds. Zarządzania Umową
1. Strony powołują Wspólny Komitet ekspertów (dalej zwany „komitetem”), w skład którego wchodzą przedstawiciele Unii oraz Armenii. Unię reprezentuje Komisja Europejska, którą wspomagają eksperci z państw członkowskich.
2. Komitet wykonuje zadania obejmujące w szczególności:
|
a) |
monitorowanie wykonania niniejszej umowy; |
|
b) |
proponowanie zmian lub uzupełnień do niniejszej umowy; |
|
c) |
rozstrzyganie sporów dotyczących interpretacji bądź stosowania postanowień niniejszej umowy. |
3. Posiedzenia komitetu odbywają się w miarę potrzeby na wniosek jednej ze Stron, przynajmniej raz w roku.
4. Komitet uchwala swój regulamin wewnętrzny.
Artykuł 13
Stosunek niniejszej umowy do umów dwustronnych między państwami członkowskimi a Armenią
Od momentu wejścia w życie niniejsza umowa staje się nadrzędna wobec postanowień dwustronnych lub wielostronnych umów lub porozumień zawartych między poszczególnymi państwami członkowskimi a Armenią w zakresie, w jakim postanowienia tych umów lub porozumień dotyczą zagadnień objętych niniejszą umową.
Artykuł 14
Postanowienia końcowe
1. Strony ratyfikują lub zatwierdzają niniejszą umowę zgodnie ze swoimi wewnętrznymi procedurami, a umowa wchodzi w życie pierwszego dnia drugiego miesiąca następującego po dniu, w którym Strony zawiadomią się wzajemnie o zakończeniu wyżej wymienionych procedur.
2. W drodze odstępstwa od ust. 1 niniejszego artykułu niniejsza umowa wchodzi w życie dopiero w dniu wejścia w życie umowy o readmisji między Unią Europejską a Armenią, jeśli dzień ten przypada po dniu, o którym mowa w ust. 1 niniejszego artykułu.
3. Niniejsza umowa zostaje zawarta na czas nieokreślony z zastrzeżeniem możliwości jej wypowiedzenia zgodnie z ust. 6 niniejszego artykułu.
4. Niniejszą umowę można zmieniać za pisemnym porozumieniem Stron. Zmiany wchodzą w życie po dokonaniu przez Strony wzajemnych zawiadomień o zakończeniu koniecznych w tym celu procedur wewnętrznych.
5. Każda ze Stron może zawiesić wykonywanie części lub wszystkich postanowień niniejszej umowy ze względu na porządek publiczny, ochronę bezpieczeństwa narodowego lub ochronę zdrowia publicznego. O decyzji w sprawie zawieszenia należy zawiadomić drugą Stronę nie później niż 48 godzin przed jej wejściem w życie. Z chwilą ustania powodów zawieszenia umowy Strona, która zawiesiła stosowanie niniejszej umowy, bezzwłocznie zawiadamia o tym drugą Stronę.
6. Każda ze Stron może wypowiedzieć niniejszą umowę w drodze pisemnego powiadomienia drugiej Strony. Niniejsza umowa przestaje obowiązywać po upływie 90 dni od daty takiego zawiadomienia.
Niniejszą umowę sporządzono w Brukseli, dnia 17 grudnia 2012 r., w dwóch egzemplarzach w każdym z języków: angielskim, bułgarskim, czeskim, duńskim, estońskim, fińskim, francuskim, greckim, hiszpańskim, litewskim, łotewskim, maltańskim, niderlandzkim, niemieckim, polskim, portugalskim, rumuńskim, słowackim, słoweńskim, szwedzkim, węgierskim, włoskim i ormiańskim, przy czym każdy z tych tekstów jest na równi autentyczny.
За Европейския съюз
Por la Unión Europea
Za Evropskou unii
For Den Europæiske Union
Für die Europäische Union
Euroopa Liidu nimel
Για την Ευρωπαϊκή Ένωση
For the European Union
Pour l'Union européenne
Per l'Unione europea
Eiropas Savienības vārdā –
Europos Sąjungos vardu
Az Európai Unió részéről
Għall-Unjoni Ewropea
Voor de Europese Unie
W imieniu Unii Europejskiej
Pela União Europeia
Pentru Uniunea Europeană
Za Európsku úniu
Za Evropsko unijo
Euroopan unionin puolesta
För Europeiska unionen
![]()


За Pепублика Армения
Por la República de Armenia
Za Arménskou republiku
For Republikken Armenien
Für die Republik Armenien
Armeenia Vabariigi nimel
Για τη Δημοκρατία της Αρμενίας
For the Republic of Armenia
Pour la République d'Arménie
Per la Repubblica di Armenia
Armēnijas Republikas vārdā –
Armėnijos Respublikos vardu
Örmény Köztársaság részéről
Għar-Repubblika tal-Armenja
Voor de Republiek Armenië
W imieniu Republiki Armenii
Pela República da Arménia
Pentru Republica Armenia
Za Arménsku republiku
Za Republiko Armenijo
Armenian tasavallan puolesta
För Republiken Armenien


PROTOKÓŁ
do umowy dotyczący państw członkowskich, które nie w pełni stosują dorobek Schengen
Państwa członkowskie, które są związane dorobkiem Schengen, ale które nie wydają jeszcze wiz Schengen, w oczekiwaniu na stosowne decyzje Rady w tej kwestii, wydają wizy krajowe, których ważność ogranicza się do ich własnego terytorium.
Zgodnie z decyzją Parlamentu Europejskiego i Rady nr 582/2008/WE z dnia 17 czerwca 2008 r. wprowadzającą uproszczony system kontroli osób na granicach zewnętrznych oparty na jednostronnym uznawaniu przez Bułgarię, Cypr i Rumunię niektórych dokumentów za równorzędne z ich wizami krajowymi do celów przejazdu tranzytem przez ich terytoria (1) podjęto zharmonizowane środki w celu ułatwienia tranzytu osób posiadających wizę Schengen lub zezwolenie na pobyt w obszarze Schengen przez terytorium państw członkowskich, które jeszcze nie w pełni stosują dorobek Schengen.
Wspólna Deklaracja w sprawie Art. 10 umowy dotyczącego paszportów dyplomatycznych
Unia lub Armenia mogą skorzystać z prawa do częściowego zawieszenia umowy, a w szczególności jej art. 10, zgodnie z procedurą ustanowioną w art. 14 ust. 5, jeśli druga Strona nadużywa praw wynikających z art. 10 lub jeśli jego stosowanie prowadzi do zagrożenia bezpieczeństwa publicznego.
Jeśli wykonanie art. 10 zostaje zawieszone, obie Strony rozpoczynają konsultacje na forum Wspólnego Komitetu powołanego na mocy umowy celem rozwiązania problemów, które doprowadziły do zawieszenia.
Obie strony deklarują w pierwszym rzędzie gotowość zapewnienia wysokiego poziomu zabezpieczeń paszportów dyplomatycznych, w szczególności poprzez zastosowanie identyfikatorów biometrycznych. Unia zapewnia ze swojej strony takie zabezpieczenia zgodnie z wymogami określonymi w rozporządzeniu Rady (WE) nr 2252/2004 z dnia 13 grudnia 2004 r. w sprawie norm dotyczących zabezpieczeń i danych biometrycznych w paszportach i dokumentach podróży wydawanych przez państwa członkowskie (1).
Deklaracja Unii Europejskiej dotycząca dokumentów, jakie należy złożyć wraz z wnioskiem o wizę krótkoterminową
Unia Europejska nasili starania na rzecz sporządzenia przed wejściem w życie umowy między Unią Europejską a Republiką Armenii o ułatwieniach w wydawaniu wiz, wykazu minimalnych wymogów, by zapewnić wnioskodawcom armeńskim spójne i jednolite informacje podstawowe zgodnie z art. 47 ust. 1 lit. a) kodeksu wizowego oraz stosować wobec nich zasadniczo te same wymogi dotyczące dokumentów uzupełniających
Informacje, o których mowa powyżej, należy szeroko rozpowszechnić (na tablicach informacyjnych w urzędach konsularnych, w ulotkach, na stronach internetowych itp.).
Wspólna deklaracja Dotycząca Danii
Strony przyjmują do wiadomości, że niniejsza umowa nie ma zastosowania do procedur wydawania wiz przez misje dyplomatyczne i służby konsularne Danii.
W związku z tym wskazane jest, aby władze Danii i Armenii zawarły niezwłocznie dwustronną umowę o ułatwieniach w wydawaniu wiz krótkoterminowych na warunkach podobnych do zawartych w umowie między Unią a Armenią.
Wspólna deklaracja dotycząca Zjednoczonego Królestwa oraz Irlandii
Strony przyjmują do wiadomości, że niniejsza umowa nie ma zastosowania do terytorium Zjednoczonego Królestwa ani Irlandii.
W związku z tym wskazane jest, aby władze Zjednoczonego Królestwa, Irlandii oraz Armenii zawarły dwustronne umowy o ułatwieniach w wydawaniu wiz.
Wspólna deklaracja dotycząca Islandii, Norwegii, Szwajcarii oraz Liechtensteinu
Strony przyjmują do wiadomości ścisłe związki między Unią a Szwajcarią, Islandią, Liechtensteinem i Norwegią, w szczególności na mocy umów z dnia 18 maja 1999 r. i 26 października 2004 r. dotyczących włączenia tych krajów we wprowadzanie, stosowanie i rozwijanie dorobku Schengen.
W związku z tym wskazane jest, aby władze Szwajcarii, Islandii, Liechtensteinu, Norwegii oraz Armenii zawarły niezwłocznie dwustronne umowy o ułatwieniach w wydawaniu wiz krótkoterminowych na warunkach podobnych do zawartych w umowie między Unią a Armenią.
Wspólna deklaracja w sprawie współpracy w zakresie dokumentów podróży
Strony są zgodne, że Wspólny Komitet ustanowiony na mocy art. 12 umowy powinien w ramach monitorowania wykonania umowy oceniać wpływ poziomu zabezpieczeń odpowiednich dokumentów podróży na funkcjonowanie umowy. W tym celu Strony zgadzają się regularnie informować się nawzajem o środkach podejmowanych w celu zapobiegania mnożeniu dokumentów podróży oraz rozwijania technicznych aspektów zabezpieczeń dokumentów podróży, a także o środkach dotyczących procesu personalizacji wydawania dokumentów podróży.
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/12 |
DECYZJA RADY
z dnia 22 października 2013 r.
w sprawie zawarcia Umowy między Unią Europejską a Republiką Armenii o readmisji osób przebywających nielegalnie
(2013/629/UE)
RADA UNII EUROPEJSKIEJ,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej, w szczególności jego art. 79 ust. 3 w związku z art. 218 ust. 6 lit. a) akapit drugi,
uwzględniając wniosek Komisji Europejskiej,
uwzględniając zgodę Parlamentu Europejskiego,
a także mając na uwadze, co następuje:
|
(1) |
Zgodnie z decyzją Rady 2013/156/UE (1) Umowa między Unią Europejską a Republiką Armenii o readmisji osób przebywających nielegalnie („Umowa”) została podpisana w dniu 19 kwietnia 2013 r., z zastrzeżeniem jej zawarcia w późniejszym terminie. |
|
(2) |
Umowa powinna zostać zatwierdzona. |
|
(3) |
Na mocy umowy ustanawia się Wspólny Komitet ds. Readmisji, który może przyjąć swój regulamin wewnętrzny. Właściwe jest wprowadzenie uproszczonej procedury ustalania stanowiska Unii w tym przypadku. |
|
(4) |
Zgodnie z art. 1 i 2 Protokołu nr 21 w sprawie stanowiska Zjednoczonego Królestwa i Irlandii w odniesieniu do przestrzeni wolności, bezpieczeństwa i sprawiedliwości, załączonego do Traktatu o Unii Europejskiej i do Traktatu o funkcjonowaniu Unii Europejskiej, te dwa państwa członkowskie nie uczestniczą w przyjęciu niniejszej decyzji i nie są nią związane ani jej nie stosują. |
|
(5) |
Zgodnie z art. 1 i 2 Protokołu nr 22 w sprawie stanowiska Danii, załączonego do Traktatu o Unii Europejskiej oraz do Traktatu o funkcjonowaniu Unii Europejskiej, Dania nie uczestniczy w przyjęciu niniejszej decyzji, nie jest nią związana ani jej nie stosuje, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Umowa między Unią Europejską a Republiką Armenii o readmisji osób przebywających nielegalnie zostaje niniejszym zatwierdzona w imieniu Unii.
Tekst umowy dołącza się do niniejszej decyzji.
Artykuł 2
Przewodniczący Rady dokonuje w imieniu Unii zawiadomienia, o którym mowa w art. 23 ust. 2 Umowy (2).
Artykuł 3
Komisja, wspomagana przez ekspertów z państw członkowskich, reprezentuje Unię we Wspólnym Komitecie ds. Readmisji ustanowionym na mocy art. 19 Umowy.
Artykuł 4
Niniejsza decyzja wchodzi w życie z dniem jej przyjęcia.
Sporządzono w Luksemburgu dnia 22 października 2013 r.
W imieniu Rady
L. LINKEVIČIUS
Przewodniczący
(1) Dz.U. L 87 z 27.3.2013, s. 1.
(2) Data wejścia w życie Umowy zostanie opublikowana w Dzienniku Urzędowym Unii Europejskiej przez Sekretariat Generalny Rady.
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/13 |
UMOWA
między Unią Europejską a Republiką Armenii o readmisji osób przebywających nielegalnie
UMAWIAJĄCE SIĘ STRONY,
UNIA EUROPEJSKA, zwana dalej „Unią”,
oraz
REPUBLIKA ARMENII, zwana dalej „Armenią”,
KIERUJĄC SIĘ chęcią zacieśnienia współpracy w celu skuteczniejszego zwalczania nielegalnej imigracji,
PRAGNĄC ustanowić w drodze niniejszej umowy oraz na zasadzie wzajemności szybkie i skuteczne procedury ustalania tożsamości i organizowania bezpiecznego i zgodnego z przepisami powrotu osób, które nie spełniają warunków wjazdu, przebywania lub pobytu na terytorium Armenii bądź jednego z państw członkowskich Unii Europejskiej lub przestały spełniać te warunki, a także ułatwić tranzyt takich osób w duchu współpracy,
PODKREŚLAJĄC, że niniejsza umowa nie narusza praw, obowiązków i zakresu odpowiedzialności Unii, jej państw członkowskich ani Armenii, wynikających z prawa międzynarodowego oraz w szczególności z Konwencji dotyczącej statusu uchodźców z z dnia 28 lipca 1951 r., zmienionej protokołem z dnia 31 stycznia 1967 r., oraz Konwencji o ochronie praw człowieka i podstawowych wolności z dnia 4 listopada 1950 r.,
MAJĄC NA UWADZE, że zgodnie z art. 21 Protokołu w sprawie stanowiska Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej oraz Irlandii w odniesieniu do przestrzeni wolności, bezpieczeństwa i sprawiedliwości, dołączonego do Traktatu o Unii Europejskiej i do Traktatu o funkcjonowaniu Unii Europejskiej, Zjednoczone Królestwo Wielkiej Brytanii i Irlandii Północnej oraz Irlandia nie będą uczestniczyć w niniejszej umowie, o ile nie powiadomią o swojej chęci takiego uczestnictwa zgodnie z tym Protokołem,
ZWAŻYWSZY, że postanowienia niniejszej umowy wchodzącej w zakres tytułu V części trzeciej Traktatu o funkcjonowaniu Unii Europejskiej nie mają zastosowania do Królestwa Danii zgodnie z Protokołem nr 22 w sprawie stanowiska Królestwa Danii dołączonym do Traktatu o Unii Europejskiej i Traktatu o funkcjonowaniu Unii Europejskiej,
UZGADNIAJĄ, CO NASTĘPUJE:
Artykuł 1
Definicje
Do celów niniejszej umowy:
|
a) |
„Umawiające się Strony” oznaczają Armenię i Unię; |
|
b) |
„obywatel Armenii” oznacza każdą osobę, która posiada obywatelstwo Armenii zgodnie z prawodawstwem Republiki Armenii; |
|
c) |
„obywatel państwa członkowskiego” oznacza każdą osobę, która posiada obywatelstwo państwa członkowskiego w rozumieniu definicji przyjętej na potrzeby Unii; |
|
d) |
„państwo członkowskie” oznacza każde państwo członkowskie Unii Europejskiej związane niniejszą umową; |
|
e) |
„obywatel państwa trzeciego” oznacza każdą osobę, która posiada obywatelstwo inne niż Armenii czy jednego z państw członkowskich; |
|
f) |
„bezpaństwowiec” oznacza każdą osobę nieposiadającą obywatelstwa; |
|
g) |
„dokument pobytowy” oznacza wszelkiego rodzaju zezwolenie wydane przez Armenię lub jedno z państw członkowskich, uprawniające daną osobę do przebywania na ich terytorium. Pojęcie to nie obejmuje czasowych zezwoleń na pobyt na terytorium tych państw w związku z rozpatrywaniem wniosku o azyl lub dokument pobytowy; |
|
h) |
„wiza” oznacza zezwolenie wydane lub decyzję podjętą przez Armenię lub jedno z państw członkowskich, w przypadku gdy wydanie zezwolenia lub podjęcie decyzji jest wymagane w związku z wjazdem na terytorium Armenii lub jednego z państw członkowskich albo tranzytem przez to terytorium. Niniejsza definicja nie obejmuje lotniskowej wizy tranzytowej; |
|
i) |
„państwo składające wniosek” oznacza państwo (Armenię lub jedno z państw członkowskich), które składa wniosek o readmisję zgodnie z art. 8 lub wniosek tranzytowy zgodnie z art. 15 niniejszej umowy; |
|
j) |
„państwo rozpatrujące wniosek” oznacza państwo (Armenię lub jedno z państw członkowskich), do którego skierowany jest wniosek o readmisję zgodnie z art. 8 lub wniosek tranzytowy zgodnie z art. 15 niniejszej umowy; |
|
k) |
„właściwy organ” oznacza krajowy organ Armenii lub jednego z państw członkowskich, któremu powierzono zadanie wykonania niniejszej umowy zgodnie z jej art. 20 ust. 1 lit. a); |
|
l) |
„tranzyt” oznacza przejazd obywatela państwa trzeciego lub bezpaństwowca przez terytorium państwa rozpatrującego wniosek podczas podróży z państwa składającego wniosek do państwa przeznaczenia; |
|
m) |
„rejon przygraniczny” oznacza obszar w zasięgu 15 kilometrów od terenu portów morskich wraz ze strefami celnymi i od terenu międzynarodowych portów lotniczych państw członkowskich i Armenii. |
Artykuł 2
Podstawowe zasady
Wzmacniając współpracę w zakresie zapobiegania nielegalnej migracji i zwalczania jej, państwo rozpatrujące wniosek i państwo składające wniosek zapewniają w ramach stosowania niniejszej umowy wobec osób objętych jej zakresem poszanowanie praw człowieka oraz przestrzeganie obowiązków i zakresu odpowiedzialności wynikających z następujących instrumentów międzynarodowych mających do nich zastosowanie, w szczególności:
|
— |
Powszechnej deklaracji praw człowieka z dnia 10 grudnia 1948 r., |
|
— |
Konwencji o ochronie praw człowieka i podstawowych wolności z dnia 4 listopada 1950 r., |
|
— |
Międzynarodowego paktu praw obywatelskich i politycznych z dnia 16 grudnia1966 r., |
|
— |
Konwencji ONZ w sprawie zakazu stosowania tortur oraz innego okrutnego, nieludzkiego lub poniżającego traktowania albo karania z dnia 10 grudnia1984 r., |
|
— |
Konwencji z dnia 28 lipca 1951 r. dotyczącej statusu uchodźców i protokołu z dnia 31 stycznia 1967 r. dotyczącego statusu uchodźców. |
Państwo rozpatrujące wniosek zapewnia w szczególności, zgodnie ze swoimi zobowiązaniami wynikającymi z instrumentów międzynarodowych wymienionych powyżej, ochronę praw osób podlegających readmisji na jego terytorium.
Państwo składające wniosek powinno przedkładać dobrowolny powrót nad wymuszony powrót, gdy nie ma powodów, by uważać, że zakłóciłoby to powrót danej osoby do państwa rozpatrującego wniosek.
SEKCJA I
OBOWIĄZKI ARMENII W ZAKRESIE READMISJI
Artykuł 3
Readmisja własnych obywateli
1. Na wniosek państwa członkowskiego i bez żadnych dodatkowych formalności, innych niż te przewidziane w niniejszej umowie, Armenia dokonuje readmisji wszystkich osób, które nie spełniają obowiązujących warunków wjazdu, przebywania lub pobytu na terytorium państwa członkowskiego składającego wniosek lub przestały spełniać te warunki, o ile zostało udowodnione lub istnieje uzasadnione domniemanie na podstawie dostarczonych dowodów prima facie, że osoby te są obywatelami Armenii.
2. Armenia dokonuje również readmisji:
|
— |
niebędących w związku małżeńskim nieletnich dzieci osób, o których mowa w ust. 1, niezależnie od ich miejsca urodzenia czy obywatelstwa, chyba że mają one niezależne prawo pobytu w państwie członkowskim składającym wniosek lub posiadają ważny dokument pobytowy wydany przez inne państwo członkowskie, |
|
— |
legitymujących się innym obywatelstwem lub będących bezpaństwowcami współmałżonków osób, o których mowa w ust. 1, o ile mają oni prawo wjazdu i pobytu bądź przyznaje się im prawo wjazdu i pobytu na terytorium Armenii, chyba że mają oni niezależne prawo pobytu w państwie członkowskim składającym wniosek lub posiadają ważny dokument pobytowy wydany przez inne państwo członkowskie. |
3. Armenia dokonuje także readmisji osób, które wraz z wjazdem na terytorium państwa członkowskiego zrzekły się obywatelstwa Armenii, chyba że osoby takie otrzymały ze strony tego państwa członkowskiego co najmniej zapewnienie uzyskania naturalizacji.
4. Po pozytywnym rozpatrzeniu wniosku o readmisję przez Armenię właściwe przedstawicielstwo dyplomatyczne lub konsularne Armenii (niezależnie od woli osoby podlegającej readmisji) bezzwłocznie, bezpłatnie i nie później niż w ciągu trzech dni roboczych wydaje dokument podróży wymagany do powrotu osoby podlegającej readmisji, którego okres ważności wynosi 120 dni. Jeśli w ciągu trzech dni roboczych Armenia nie wyda dokumentu podróży, uznaje się, że akceptuje ona standardowy dokument podróży UE do celów wydalenia z kraju (1).
5. Jeżeli z przyczyn prawnych lub faktycznych dana osoba nie może zostać przekazana w okresie ważności pierwotnie wydanego dokumentu podróży, właściwe przedstawicielstwo dyplomatyczne lub konsularne Armenii w ciągu trzech dni roboczych i bezpłatnie wydaje nowy dokument podróży z takim samym okresem ważności. Jeśli w ciągu trzech dni roboczych Armenia nie wyda nowego dokumentu podróży, uznaje się, że akceptuje ona standardowy dokument podróży UE do celów wydalenia z kraju (2).
Artykuł 4
Readmisja obywateli państw trzecich i bezpaństwowców
1. Na wniosek państwa członkowskiego i bez żadnych dodatkowych formalności, innych niż przewidziane w niniejszej umowie, Armenia dokonuje readmisji wszystkich obywateli państw trzecich lub bezpaństwowców, którzy nie spełniają obowiązujących warunków wjazdu, przebywania i pobytu na terytorium państwa członkowskiego składającego wniosek lub przestali spełniać te warunki, o ile zostało udowodnione lub istnieje uzasadnione domniemanie na podstawie dostarczonych dowodów prima facie, że osoby te:
|
a) |
posiadają w chwili składania wniosku o readmisję ważną wizę lub dokument pobytowy wydany przez Armenię; lub |
|
b) |
nielegalnie i bezpośrednio wjechały na terytorium danego państwa członkowskiego po pobycie na terytorium Armenii bądź po tranzycie przez jej terytorium. |
2. Obowiązek readmisji, o którym mowa w ust. 1, nie ma zastosowania, gdy obywatel państwa trzeciego lub bezpaństwowiec znalazł się na terenie międzynarodowego portu lotniczego Armenii jedynie w związku z tranzytem lotniczym.
3. Nie naruszając przepisów art. 7 ust. 2, po pozytywnym rozpatrzeniu przez Armenię wniosku o readmisję państwo członkowskie składające wniosek wydaje osobie, na której readmisję wyrażono zgodę, standardowy dokument podróży UE do celów wydalenia z kraju (3).
SEKCJA II
OBOWIĄZKI UNII W ZAKRESIE READMISJI
Artykuł 5
Readmisja własnych obywateli
1. Na wniosek Armenii i bez żadnych dodatkowych formalności, innych niż przewidziane w niniejszej umowie, państwo członkowskie dokonuje readmisji wszystkich osób, które nie spełniają obowiązujących warunków wjazdu, przebywania lub pobytu na terytorium Armenii lub przestały spełniać takie warunki, o ile zostało udowodnione lub istnieje uzasadnione domniemanie na podstawie dostarczonych dowodów prima facie, że osoby te są obywatelami tego państwa członkowskiego.
2. Państwo członkowskie dokonuje również readmisji:
|
— |
niebędących w związku małżeńskim nieletnich dzieci osób, o których mowa w ust. 1, niezależnie od ich miejsca urodzenia czy obywatelstwa, chyba że mają one niezależne prawo pobytu w Armenii, |
|
— |
legitymujących się innym obywatelstwem lub będących bezpaństwowcami współmałżonków osób, o których mowa w ust. 1, o ile mają oni prawo wjazdu i pobytu bądź przyznaje się im prawo wjazdu i pobytu na terytorium państwa członkowskiego rozpatrującego wniosek, chyba że mają oni niezależne prawo pobytu w Armenii. |
3. Państwo członkowskie dokonuje także readmisji osób, które wraz z wjazdem na terytorium Armenii zrzekły się obywatelstwa państwa członkowskiego, chyba że osoby takie otrzymały ze strony Armenii co najmniej zapewnienie uzyskania naturalizacji.
4. Po pozytywnym rozpatrzeniu wniosku o readmisję przez państwo członkowskie rozpatrujące wniosek, właściwe przedstawicielstwo dyplomatyczne lub konsularne tego państwa członkowskiego, niezależnie od woli osoby podlegającej readmisji,bezzwłocznie, bezpłatnie i nie później niż w ciągu trzech dni roboczych wydaje dokument podróży wymagany do powrotu osoby podlegającej readmisji, którego okres ważności wynosi 120 dni.
5. Jeżeli z przyczyn prawnych lub faktycznych dana osoba nie może zostać przekazana w okresie ważności pierwotnie wydanego dokumentu podróży, właściwe przedstawicielstwo dyplomatyczne lub konsularne tego państwa członkowskiego w ciągu trzech dni roboczych i bezpłatnie wydaje nowy dokument podróży z takim samym okresem ważności.
Artykuł 6
Readmisja obywateli państw trzecich i bezpaństwowców
1. Na wniosek Armenii i bez żadnych dodatkowych formalności, innych niż przewidziane w niniejszej umowie, państwo członkowskie dokonuje readmisji wszystkich obywateli państw trzecich lub bezpaństwowców, którzy nie spełniają obowiązujących warunków wjazdu, przebywania lub pobytu na terytorium Armenii lub przestały spełniać takie warunki, o ile zostało udowodnione lub istnieje uzasadnione domniemanie na podstawie dostarczonych dowodów prima facie, że osoby te:
|
a) |
posiadają w chwili składania wniosku o readmisję ważną wizę lub dokument pobytowy wydany przez państwo rozpatrujące wniosek; lub |
|
b) |
bezprawnie i bezpośrednio wjechały na terytorium Armenii po pobycie na terytorium państwa członkowskiego rozpatrującego wniosek bądź po tranzycie przez jego terytorium. |
2. Obowiązek readmisji, o którym mowa w ust. 1, nie ma zastosowania, gdy obywatel państwa trzeciego lub bezpaństwowiec znalazł się na terenie międzynarodowego portu lotniczego państwa członkowskiego rozpatrującego wniosek jedynie w związku z tranzytem lotniczym.
3. Obowiązek readmisji, o którym mowa w ust. 1, dotyczy tego państwa członkowskiego, które wydało wizę lub dokument pobytowy. Jeśli wizę lub dokument pobytowy wydały dwa państwa członkowskie lub większa ich liczba, obowiązek readmisji określony w ust. 1 stosuje się do tego państwa członkowskiego, które wydało dokument o dłuższym okresie ważności, lub – jeśli okres ważności jednego lub kilku z takich dokumentów upłynął – dokument, który jest nadal ważny. Jeżeli upłynął okres ważności wszystkich dokumentów, obowiązek readmisji określony w ust. 1 stosuje się do tego państwa członkowskiego, które wydało dokument z najpóźniejszym terminem ważności. Jeżeli nie da się tego ustalić, obowiązek readmisji określony w ust. 1 stosuje się do tego państwa członkowskiego, które dana osoba opuściła najpóźniej.
4. Nie naruszając przepisów art. 7 ust. 2, po pozytywnym rozpatrzeniu przez dane państwo członkowskie wniosku o readmisję Armenia wydaje osobie, na readmisję której wyrażono zgodę, dokument podróży wymagany do powrotu tej osoby.
SEKCJA III
PROCEDURA READMISJI
Artykuł 7
Zasady ogólne
1. Z zastrzeżeniem postanowień ust. 2 przekazanie osoby, która ma podlegać readmisji na podstawie jednego ze zobowiązań określonych w art. 3–6, wymaga złożenia wniosku o readmisję do właściwego organu państwa rozpatrującego wniosek.
2. Jeśli osoba, która ma podlegać readmisji posiada ważny dokument podróży lub dokument tożsamości i, w przypadku obywateli państw trzecich lub bezpaństwowców, ważną wizę lub dokument pobytowy państwa rozpatrującego wniosek, przekazanie tej osoby może nastąpić bez konieczności złożenia przez państwo składające wniosek wniosku o readmisję lub pisemnego zawiadomienia, zgodnie z art. 12 ust. 1, do właściwego organu państwa rozpatrującego wniosek.
3. Nie naruszając przepisów ust. 2, jeśli daną osobę zatrzymano w rejonie przygranicznym, w tym w portach lotniczych, państwa składającego wniosek po tym, jak nielegalnie przekroczyła granicę, przybywając bezpośrednio z terytorium państwa rozpatrującego wniosek, państwo składające wniosek może złożyć wniosek o readmisję w ciągu dwóch dni roboczych od chwili zatrzymania tej osoby (procedura przyspieszona).
Artykuł 8
Wniosek o readmisję
1. Wniosek o readmisję, w zakresie, w jakim jest to możliwe, powinien zawierać następujące informacje:
|
a) |
dane określające tożsamość osoby, która ma podlegać readmisji (np. imiona, nazwiska, datę i – o ile to możliwe – miejsce urodzenia oraz ostatnie miejsce pobytu), a w stosownych przypadkach także dane określające tożsamość nieletnich dzieci niebędących w związku małżeńskim lub małżonków; |
|
b) |
w przypadku własnych obywateli: wskazanie środków stanowiących dowód lub dowód prima facie potwierdzający obywatelstwo, zgodnie z, odpowiednio, załącznikami 1 i 2; |
|
c) |
w przypadku obywateli państw trzecich i bezpaństwowców: wskazanie środków stanowiących dowód lub dowód prima facie potwierdzający spełnienie warunków readmisji obywateli państw trzecich i bezpaństwowców, zgodnie z, odpowiednio, załącznikami 3 i 4; |
|
d) |
zdjęcie osoby, która ma podlegać readmisji. |
2. Wniosek o readmisję, w zakresie, w jakim jest to możliwe, powinien również zawierać następujące informacje:
|
a) |
oświadczenie stwierdzające, że osoba, która ma być przekazana, może potrzebować pomocy lub opieki, pod warunkiem że osoba ta wyraziła jednoznaczną zgodę na takie oświadczenie; |
|
b) |
wszelkie inne środki ochrony, bezpieczeństwa bądź informacje dotyczące stanu zdrowia danej osoby, jakie mogą być niezbędne w poszczególnych przypadkach przekazywania. |
3. Wspólny wzór, z którego należy korzystać przy sporządzaniu wniosków o readmisję, zamieszczono w załączniku 5 do niniejszej umowy.
4. Wnioski o readmisję można składać za pośrednictwem różnych środków porozumiewania się na odległość, w tym elektronicznych środków przekazu.
Artykuł 9
Środki dowodowe potwierdzające obywatelstwo
1. Dowód potwierdzający obywatelstwo zgodnie z art. 3 ust. 1 i art. 5 ust. 1 można przedstawić w szczególności za pomocą dokumentów wymienionych w załączniku 1 do niniejszej umowy, w tym dokumentów, których okres ważności upłynął nie wcześniej niż sześć miesięcy wcześniej. Jeżeli przedstawiono takie dokumenty, państwa członkowskie oraz Armenia wzajemnie uznają obywatelstwo bez prowadzenia dalszego dochodzenia. Dowód potwierdzający obywatelstwo nie może być oparty na fałszywych dokumentach.
2. Na mocy art. 3 ust. 1 i art. 5 ust. 1 dowód prima facie potwierdzający obywatelstwo można w szczególności przedstawić za pomocą dokumentów wymienionych w załączniku 2 do niniejszej umowy, nawet gdy upłynął ich okres ważności. Jeżeli przedstawiono takie dokumenty, państwa członkowskie i Armenia uznają, że obywatelstwo zostało ustalone, chyba że posiadają dowody przeciwne. Dowód prima facie potwierdzający obywatelstwo nie może być oparty na fałszywych dokumentach.
3. Jeśli nie można okazać żadnego z dokumentów wymienionych w załączniku 1 lub 2, właściwe przedstawicielstwa dyplomatyczne lub konsularne danego państwa rozpatrującego wniosek przeprowadzają na prośbę państwa składającego wniosek, którą należy ująć we wniosku o readmisję, bez zbędnej zwłoki, najpóźniej w ciągu pięciu dni roboczych od daty złożenia wniosku zgodnie z art. 11 ust. 2, rozmowę z osobą, która ma podlegać readmisji, w celu ustalenia jej obywatelstwa. Procedurę dotyczącą takich rozmów można ustalić w protokołach wykonawczych, o których mowa w art. 20 niniejszej umowy.
Artykuł 10
Środki dowodowe dotyczące obywateli państw trzecich i bezpaństwowców
1. Dowody potwierdzające warunki readmisji obywateli państw trzecich i bezpaństwowców ustanowione w art. 4 ust. 1 i art. 6 ust. 1 oparte są w szczególności na środkach dowodowych wymienionych w załączniku 3 do niniejszej umowy; nie mogą się one opierać na fałszywych dokumentach. Państwa członkowskie oraz Armenia wzajemnie uznają wszelkie takie dowody bez prowadzenia dalszego dochodzenia.
2. Dowody prima facie potwierdzające warunki readmisji obywateli państw trzecich i bezpaństwowców ustanowione w art. 4 ust. 1 i art. 6 ust. 1 oparte są w szczególności na środkach dowodowych wymienionych w załączniku 4 do niniejszej umowy; nie mogą się one opierać na fałszywych dokumentach. W przypadku przedstawienia takich dowodów prima facie państwa członkowskie i Armenia uznają warunki za ustalone, chyba że posiadają dowody przeciwne.
3. O bezprawnym charakterze wjazdu, przebywania lub pobytu decyduje brak, w dokumentach podróży danej osoby, koniecznej wizy lub innego zezwolenia na pobyt na terytorium państwa składającego wniosek. Dowodem prima facie bezprawnego wjazdu, przebywania lub pobytu jest także oświadczenie państwa składającego wniosek, że dana osoba nie posiada niezbędnych dokumentów podróży, wizy lub dokumentu pobytowego.
Artykuł 11
Terminy
1. Właściwy organ państwa składającego wniosek musi złożyć wniosek o readmisję do właściwego organu państwa rozpatrującego wniosek w ciągu dziewięciu miesięcy od daty uzyskania informacji, że obywatel państwa trzeciego lub bezpaństwowiec nie spełnia obowiązujących warunków wjazdu, przebywania lub pobytu bądź przestał spełniać te warunki. Jeśli istnieją prawne lub faktyczne przeszkody uniemożliwiające złożenie wniosku w terminie, na wniosek państwa składającego wniosek termin ten przedłuża się, ale wyłącznie do czasu ustąpienia przeszkód.
2. Odpowiedź na wniosek o readmisję musi być udzielona na piśmie
|
— |
w ciągu dwóch dni roboczych, w przypadku gdy wniosek złożono w ramach procedury przyspieszonej (art. 7 ust. 3), |
|
— |
w ciągu dwunastu dni kalendarzowych w pozostałych przypadkach. |
Bieg terminu na udzielenie odpowiedzi rozpoczyna się od daty otrzymania wniosku o readmisję. W przypadku braku odpowiedzi w tym terminie zgodę na przekazanie danej osoby uważa się za udzieloną.
Odpowiedź na wnioski o readmisję można składać za pośrednictwem różnych środków porozumiewania się na odległość, w tym elektronicznych środków przekazu.
3. Odrzucenie wniosku o readmisję musi mieć formę pisemną i zawierać uzasadnienie.
4. Po uzyskaniu zgody bądź w stosownych przypadkach po upływie terminów określonych w ust. 2 przekazanie danej osoby następuje w ciągu trzech miesięcy. Na prośbę państwa składającego wniosek termin ten może zostać przedłużony o czas potrzebny do usunięcia przeszkód prawnych lub praktycznych.
Artykuł 12
Formy przekazania i rodzaje transportu
1. Nie naruszając przepisów art. 7 ust. 2, przed przekazaniem danej osoby właściwe organy państwa składającego wniosek powiadamiają – na piśmie z wyprzedzeniem co najmniej dwóch dni roboczych – właściwe organy państwa rozpatrującego wniosek o dacie przekazania, miejscu wjazdu i ewentualnej eskorcie oraz podają inne informacje związane z przekazaniem.
2. Transport może się odbyć dowolnym środkiem transportu, w tym drogą powietrzną. W przypadku przekazania danej osoby drogą powietrzną nie ma obowiązku korzystania z usług krajowych przewoźników Armenii lub państw członkowskich, można korzystać z regularnych lub czarterowych połączeń lotniczych. W przypadku przekazania odbywającego się pod eskortą nie musi się ona ograniczać do uprawnionych osób z państwa składającego wniosek, pod warunkiem że osoby te są upoważnione przez Armenię lub jedno z państw członkowskich.
3. Jeśli tranzyt odbywa się drogą powietrzną, ewentualne osoby eskortujące są zwolnione z obowiązku uzyskania niezbędnych wiz.
Artykuł 13
Omyłkowa readmisja
Państwo składające wniosek przyjmuje z powrotem każdą osobę przyjętą w ramach readmisji przez państwo rozpatrujące wniosek, jeżeli w okresie sześciu miesięcy od przekazania tej osoby ustalono, że wymogi określone w art. 3–6 niniejszej umowy nie są spełnione.
W takich przypadkach postanowienia proceduralne niniejszej umowy stosuje się z uwzględnieniem niezbędnych zmian oraz przekazuje wszystkie dostępne informacje dotyczące rzeczywistej tożsamości i obywatelstwa osoby, która ma być przyjęta z powrotem.
SEKCJA IV
OPERACJE TRANZYTU
Artykuł 14
Zasady ogólne
1. Państwa członkowskie i Armenia powinny ograniczyć tranzyt obywateli państw trzecich lub bezpaństwowców do przypadków, gdy nie można ich przewieźć bezpośrednio do państwa przeznaczenia.
2. Armenia zezwala na tranzyt obywateli państw trzecich lub bezpaństwowców przez swoje terytorium na wniosek państwa członkowskiego, a państwo członkowskie zezwala na tranzyt obywateli państw trzecich lub bezpaństwowców przez swoje terytorium na wniosek Armenii, pod warunkiem że zapewniono dalszą podróż przez ewentualne inne państwa tranzytu oraz readmisję przez kraj przeznaczenia.
3. Armenia lub państwo członkowskie mogą odmówić zgody na tranzyt przez swoje terytorium:
|
a) |
jeśli obywatel państwa trzeciego lub bezpaństwowiec narażony jest w państwie będącym miejscem przeznaczenia lub w innym państwie tranzytu na realne ryzyko tortur, nieludzkiego lub poniżającego traktowania czy ukarania, karę śmierci lub prześladowania ze względu na rasę, religię, narodowość, przynależność do określonej grupy społecznej lub przekonania polityczne; lub |
|
b) |
jeśli obywatel państwa trzeciego lub bezpaństwowiec podlega sankcjom karnym w państwie rozpatrującym wniosek lub innym państwie tranzytu; lub |
|
c) |
ze względu na zdrowie publiczne, bezpieczeństwo wewnętrzne, porządek publiczny lub inne narodowe interesy państwa rozpatrującego wniosek. |
4. Armenia lub państwo członkowskie mogą cofnąć każde zezwolenie, jeśli po jego wydaniu wystąpią lub wyjdą na jaw okoliczności wymienione w ust. 3, stanowiące przeszkodę w przeprowadzeniu operacji tranzytu, lub jeśli nie będzie zapewniona dalsza podróż przez inne państwa tranzytu lub readmisja przez państwo będące miejscem przeznaczenia. W takim przypadku państwo składające wniosek, w razie konieczności bezzwłocznie, przyjmuje z powrotem danego obywatela państwa trzeciego lub bezpaństwowca.
Artykuł 15
Procedura tranzytowa
1. Wniosek tranzytowy musi zostać złożony na piśmie do właściwego organu państwa rozpatrującego wniosek i musi zawierać następujące informacje:
|
a) |
rodzaj tranzytu (powietrzny, morski lub lądowy), inne możliwe państwa tranzytu i przewidziany końcowy cel podróży; |
|
b) |
szczegółowe informacje o danej osobie (np. imię, nazwisko, nazwisko panieńskie, inne używane imiona/nazwiska lub imiona/nazwiska, pod jakimi dana osoba jest znana lub pseudonimy, datę urodzenia, płeć i – jeśli to możliwe – miejsce urodzenia, obywatelstwo, język ojczysty, rodzaj i numer dokumentu podróży); |
|
c) |
przewidywane miejsce wjazdu, termin przekazania osoby i ewentualną możliwość użycia eskorty; |
|
d) |
oświadczenie, że z punktu widzenia państwa składającego wniosek spełnione są warunki określone w art. 14 ust. 2 oraz że nie są znane żadne powody mogące uzasadniać odmowę zgodnie z art. 14 ust. 3. |
Wspólny formularz wniosku tranzytowego znajduje się w załączniku 6 do niniejszej umowy.
Wnioski tranzytowe można składać za pośrednictwem różnych środków porozumiewania się na odległość, w tym elektronicznych środków przekazu.
2. Państwo rozpatrujące wniosek powiadamia na piśmie państwo składające wniosek w ciągu trzech dni roboczych o jego przyjęciu, potwierdzając nazwę miejsca wjazdu i planowany czas odebrania danej osoby, lub też powiadamia o odmowie przyjęcia wniosku, podając powody takiej decyzji. W przypadku braku odpowiedzi w ciągu trzech dni roboczych zgodę na tranzyt uważa się za udzieloną.
Odpowiedzi na wnioski tranzytowe można udzielać za pośrednictwem różnych środków porozumiewania się na odległość, w tym elektronicznych środków przekazu.
3. Jeśli tranzyt odbywa się drogą powietrzną, osoba, która podlega readmisji, oraz osoby ją eskortujące są zwolnione z obowiązku uzyskania lotniskowych wiz tranzytowych.
4. Właściwe organy państwa rozpatrującego wniosek, pod warunkiem przeprowadzenia wzajemnych konsultacji, udzielają niezbędnej pomocy przy tranzycie, w szczególności poprzez nadzorowanie osób podlegających readmisji oraz zapewnienie właściwych do tego celu udogodnień.
5. Tranzyt osób następuje w ciągu 30 dni od daty otrzymania zgody na złożony wniosek.
SEKCJA V
KOSZTY
Artykuł 16
Koszty transportu oraz tranzytu
Bez uszczerbku dla prawa właściwych organów do dochodzenia zwrotu kosztów związanych z readmisją od osoby, która ma jej podlegać, lub od osób trzecich, wszystkie koszty transportu poniesione w związku z readmisją i tranzytem do granicy państwa przeznaczenia zgodnie z niniejszą umową ponosi państwo składające wniosek.
SEKCJA VI
OCHRONA DANYCH I STOSOWANIE UMOWY W KONTEKŚCIE INNYCH ZOBOWIĄZAŃ MIĘDZYNARODOWYCH
Artykuł 17
Ochrona danych
Przekazanie danych osobowych może nastąpić jedynie wówczas, gdy jest konieczne do wykonania niniejszej umowy przez właściwe organy Armenii lub państwa członkowskiego, zależnie od przypadku. Przetwarzanie i obsługa danych osobowych w indywidualnych przypadkach podlega krajowemu ustawodawstwu Armenii lub też, gdy kontrolerem jest właściwy organ państwa członkowskiego, przepisom dyrektywy 95/46/WE oraz ustawodawstwu krajowemu tego państwa członkowskiego przyjętemu zgodnie z tą dyrektywą. Dodatkowo stosuje się następujące zasady:
|
a) |
dane osobowe muszą być przetwarzane uczciwie i zgodnie z prawem; |
|
b) |
dane osobowe muszą być zbierane w określonym, jednoznacznym i prawnie dopuszczonym celu związanym z wykonaniem niniejszej umowy i nie mogą być dalej przetwarzane przez organ przekazujący ani organ, który je przyjmuje, w sposób niezgodny z tym celem; |
|
c) |
dane osobowe muszą być adekwatne do potrzeb i istotne dla danej sprawy oraz nie mogą wykraczać poza cel, w jakim są gromadzone lub przetwarzane; w szczególności przekazywane dane osobowe mogą dotyczyć wyłącznie:
|
|
d) |
dane osobowe muszą być dokładne i w razie konieczności aktualizowane; |
|
e) |
dane osobowe należy przechowywać w formie umożliwiającej identyfikację osób, których dane te dotyczą, przez okres nie dłuższy niż jest to konieczne do realizacji celu, w jakim zostały zebrane lub w jakim są przetwarzane; |
|
f) |
zarówno organ, który przekazuje dane osobowe, jak i ten, który je przyjmuje, podejmują wszelkie uzasadnione kroki w celu zapewnienia, odpowiednio, sprostowania, usunięcia lub zablokowania danych osobowych, w przypadku gdy ich przetwarzanie nie jest zgodne z przepisami niniejszego artykułu, zwłaszcza w przypadku gdy nie są one adekwatne do potrzeb, istotne dla danej sprawy lub wykraczają poza cel ich przetwarzania. Dotyczy to także zgłaszania drugiej Stronie wszelkich przypadków sprostowania, usunięcia lub zablokowania danych; |
|
g) |
organ, który przyjmuje dane, powiadamia organ przekazujący dane na wniosek tego ostatniego o sposobie wykorzystania przekazanych danych i uzyskanych wynikach; |
|
h) |
dane osobowe mogą być przekazywane wyłącznie właściwym organom. Udostępnienie otrzymanych danych innym organom wymaga uprzedniej zgody organu przekazującego; |
|
i) |
właściwe organy przekazujące i otrzymujące dane osobowe są zobowiązane do prowadzenia pisemnego rejestru przekazywanych i otrzymanych danych. |
Artykuł 18
Stosowanie umowy w kontekście innych zobowiązań międzynarodowych
1. Niniejsza umowa nie ma wpływu na prawa, obowiązki i zakres odpowiedzialności Unii, jej państw członkowskich ani Armenii, wynikające z prawa międzynarodowego, w tym z konwencji międzynarodowych, których są one stroną, w szczególności z instrumentów międzynarodowych wymienionych w artykule 2, oraz:
|
— |
konwencji międzynarodowych określających państwo odpowiedzialne za badanie złożonych wniosków o azyl, |
|
— |
konwencji międzynarodowych dotyczących ekstradycji i tranzytu, |
|
— |
wielostronnych międzynarodowych konwencji i umów o readmisji cudzoziemców. |
2. Postanowienia niniejszej umowy nie uniemożliwiają zorganizowania powrotu danej osoby na mocy innych formalnych lub nieformalnych uzgodnień.
SEKCJA VII
WPROWADZENIE W ŻYCIE I STOSOWANIE
Artykuł 19
Wspólny Komitet ds. Readmisji
1. Umawiające się Strony udzielają sobie wzajemnie pomocy prawnej w stosowaniu i ustalaniu wykładni niniejszej umowy. W tym celu Strony ustanawiają Wspólny Komitet ds. Readmisji (dalej zwany „komitetem”), którego zadania obejmują w szczególności:
|
a) |
monitorowanie i wymianę informacji dotyczących stosowania niniejszej umowy, z wyłączeniem danych osobowych; |
|
b) |
zajmowanie się kwestiami wynikającymi z interpretacji lub stosowania postanowień niniejszej umowy; |
|
c) |
podejmowanie decyzji w sprawie zasad wykonawczych niezbędnych do jednolitego stosowania niniejszej umowy; |
|
d) |
prowadzenie regularnej wymiany informacji na temat protokołów wykonawczych sporządzanych przez poszczególne państwa członkowskie i Armenię zgodnie z art. 20; |
|
e) |
zalecanie wprowadzania zmian do niniejszej umowy i jej załączników. |
2. Decyzje komitetu są wiążące dla Umawiających się Stron.
3. W skład komitetu wchodzą przedstawiciele Unii i Armenii.
4. Komitet zbiera się w razie potrzeby na wniosek jednej z Umawiających się Stron.
5. Komitet uchwala swój regulamin wewnętrzny.
Artykuł 20
Protokoły wykonawcze
1. Nie naruszając bezpośredniej wykonalności niniejszej umowy, na wniosek państwa członkowskiego lub Armenii, Armenia i państwo członkowskie sporządzają protokół wykonawczy dotyczący między innymi:
|
a) |
wyznaczania właściwych organów, przejść granicznych i wymiany punktów kontaktowych; |
|
b) |
warunków powrotu osób pod eskortą, w tym tranzytu eskortowanych obywateli państw trzecich i bezpaństwowców; |
|
c) |
środków i dokumentów uzupełniających te wymienione w załącznikach 1–4 do niniejszej umowy; |
|
d) |
zasad readmisji w przypadku procedury przyspieszonej; |
|
e) |
procedury przeprowadzania rozmów. |
2. Protokoły wykonawcze określone w ust. 1 wchodzą w życie dopiero po ich zgłoszeniu wspólnemu komitetowi ds. readmisji, o którym mowa w art. 19.
3. Armenia zgadza się stosować wszelkie postanowienia protokołu wykonawczego uzgodnionego z jednym państwem członkowskim również w jej stosunkach z każdym innym państwem członkowskim, na wniosek tego ostatniego. Państwa członkowskie zgadzają się stosować wszelkie postanowienia protokołu wykonawczego zawartego przez jedno z nich również w swoich stosunkach z Armenią na wniosek tej ostatniej, z zastrzeżeniem praktycznej wykonalności ich stosowania w odniesieniu do innych państw członkowskich.
Artykuł 21
Związek z dwustronnymi umowami o readmisji lub uzgodnieniami państw członkowskich
Postanowienia niniejszej umowy stają się nadrzędne wobec postanowień wszelkich dwustronnych umów lub innych uzgodnień dotyczących readmisji osób przebywających bez zezwolenia, które zostały zawarte lub mogą zgodnie z art. 20 niniejszej umowy zostać zawarte przez poszczególne państwa członkowskie i Armenię w zakresie, w jakim takie postanowienia nie są zgodne z postanowieniami niniejszej umowy.
SEKCJA VIII
POSTANOWIENIA KOŃCOWE
Artykuł 22
Terytorialny zakres stosowania
1. Z zastrzeżeniem ust. 2 niniejszą umowę stosuje się na terytorium Armenii oraz wszędzie tam, gdzie mają zastosowanie Traktat o Unii Europejskiej i Traktat o funkcjonowaniu Unii Europejskiej.
2. Niniejszą umowę stosuje się na terytorium Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej oraz Irlandii wyłącznie na podstawie odpowiedniego zawiadomienia skierowanego przez Unię Europejską do Armenii. Niniejszej umowy nie stosuje się na terytorium Królestwa Danii.
Artykuł 23
Wejście w życie, okres obowiązywania i rozwiązanie
1. Umawiające się Strony ratyfikują lub zatwierdzają niniejszą umowę zgodnie ze swoimi wewnętrznymi procedurami.
2. Niniejsza umowa wchodzi w życie pierwszego dnia drugiego miesiąca następującego po dniu, w którym ostatnia z Umawiających się Stron zawiadamia drugą Stronę o zakończeniu procedur określonych w ust.1.
3. Niniejsza umowa ma zastosowanie do Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej oraz Irlandii od pierwszego dnia drugiego miesiąca następującego po dacie zawiadomienia, o którym mowa w art. 22 ust. 2.
4. Umowa zostaje zawarta na czas nieokreślony.
5. Niniejszą umowę można zmieniać za obopólną zgodą Umawiających się Stron. Zmian dokonuje się poprzez sporządzenie osobnych protokołów, które stanowią integralną część umowy i wchodzą w życie zgodnie z procedurą określoną w niniejszym artykule.
6. Każda z Umawiających się Stron może, w drodze oficjalnego powiadomienia drugiej Umawiającej się Strony i po wcześniejszych konsultacjach z komitetem, o którym mowa w art. 19, całkowicie lub częściowo tymczasowo zawiesić stosowanie niniejszej umowy. Zawieszenie wchodzi w życie drugiego dnia po dniu powiadomienia o takiej decyzji.
7. Każda z Umawiających się Stron może rozwiązać niniejszą umowę w drodze oficjalnego wypowiedzenia przekazanego drugiej Umawiającej się Stronie. Niniejsza umowa przestaje obowiązywać po upływie sześciu miesięcy od dokonania wypowiedzenia.
Artykuł 24
Załączniki
Załączniki 1–6 stanowią integralną część niniejszej umowy.
Sporządzono w Brukseli dnia dziewiętnastego kwietnia dwa tysiące trzynastego roku w dwóch egzemplarzach w języku angielskim, bułgarskim, czeskim, duńskim, estońskim, fińskim, francuskim, greckim, hiszpańskim, litewskim, łotewskim, maltańskim, niderlandzkim, niemieckim, polskim, portugalskim, rumuńskim, słowackim, słoweńskim, szwedzkim, węgierskim, włoskim i ormiańskim, przy czym każda wersja językowa jest na równi autentyczna.
За Европейския съюз
Por la Unión Europea
Za Evropskou unii
For Den Europæiske Union
Für die Europäische Union
Euroopa Liidu nimel
Για την Ευρωπαϊκή Ένωση
For the European Union
Pour l'Union européenne
Per l'Unione europea
Eiropas Savienības vārdā –
Europos Sąjungos vardu
Az Európai Unió részéről
Għall-Unjoni Ewropea
Voor de Europese Unie
W imieniu Unii Europejskiej
Pela União Europeia
Pentru Uniunea Europeană
Za Európsku úniu
Za Evropsko unijo
Euroopan unionin puolesta
För Europeiska unionen
![]()

За Pепублика Армения
Por la República de Armenia
Za Arménskou republiku
For Republikken Armenien
Für die Republik Armenien
Armeenia Vabariigi nimel
Για της Δημοκρατίας της Αρμενίας
For the Republic of Armenia
Pour la République d'Arménie
Per la Repubblica di Armenia
Armēnijas Republikas vārdā –
Armėnijos Respublikos vardu
Örmény Köztársaság részéről
Għall-Repubblika tal-Armenja
Voor de Republiek Armenië
W imieniu Republiki Armenii
Pela República da Arménia
Pentru Republica Armenia
Za Arménsku republiku
Za Republiko Armenijo
Armenian tasavallan puolesta
För Republiken Armenien


(1) W formie określonej w zaleceniu Rady UE z dnia 30 listopada 1994 r.
(2) Tamże.
(3) Tamże.
ZAŁĄCZNIK 1
WSPÓLNY WYKAZ DOKUMENTÓW, KTÓRYCH PRZEDSTAWIANIE UZNAWANE JEST ZA DOWÓD OBYWATELSTWA
(Art. 3 ust. 1, art. 5 ust. 1 oraz art. 9 ust. 1)
|
— |
paszporty każdego rodzaju (paszporty krajowe, paszporty dyplomatyczne, paszporty służbowe, paszporty zbiorowe i paszporty zastępcze, włącznie z paszportami dla dzieci), |
|
— |
dokumenty tożsamości każdego rodzaju (w tym dokumenty wystawione na czas określony i dokumenty tymczasowe), |
|
— |
zaświadczenia o obywatelstwie lub inne urzędowe dokumenty, w których wymieniono lub wskazano obywatelstwo. |
ZAŁĄCZNIK 2
WSPÓLNY WYKAZ DOKUMENTÓW, KTÓRYCH PRZEDSTAWIANIE UZNAWANE JEST ZA DOWÓD PRIMA FACIE OBYWATELSTWA
(Art. 3 ust. 1, art. 5 ust. 1 oraz art. 9 ust. 2)
|
— |
dokumenty wymienione w załączniku 1, których okres ważności upłynął ponad sześć miesięcy wcześniej, |
|
— |
fotokopie dokumentów wymienionych w załączniku 1 do niniejszej umowy, |
|
— |
prawa jazdy lub ich fotokopie, |
|
— |
akty urodzenia lub ich fotokopie, |
|
— |
identyfikatory wydane przez przedsiębiorstwa lub ich fotokopie, |
|
— |
oświadczenia świadków, |
|
— |
oświadczenia złożone przez daną osobę oraz język, jakim się ona posługuje, włącznie z wynikiem oficjalnego testu, |
|
— |
wszelkie inne dokumenty mogące pomóc w ustaleniu obywatelstwa danej osoby, |
|
— |
odciski palców, |
|
— |
laissez-passer wydane przez państwo rozpatrujące wniosek, |
|
— |
legitymacje służbowe i książeczki wojskowe, |
|
— |
książeczki żeglarskie, legitymacje służbowe kapitanów jednostek morskich, |
|
— |
potwierdzenie tożsamości w wyniku wyszukiwania w wizowym systemie informacyjnym (1), |
|
— |
w przypadku państw członkowskich, które nie korzystają z wizowego systemu informacyjnego, pozytywna identyfikacja dokonana na podstawie danych z rejestru wniosków wizowych tych państw członkowskich. |
(1) Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 767/2008 z dnia 9 lipca 2008 r. w sprawie wizowego systemu informacyjnego (VIS) oraz wymiany danych pomiędzy państwami członkowskimi na temat wiz krótkoterminowych (rozporządzenie w sprawie VIS) (Dz.U. L 218 z 13.8.2008, s. 60).
ZAŁĄCZNIK 3
WSPÓLNY WYKAZ DOKUMENTÓW, KTÓRE SĄ UZNAWANE ZA DOWÓD POTWIERDZAJĄCY SPEŁNIENIE WARUNKÓW READMISJI OBYWATELI PAŃSTW TRZECICH I BEZPAŃSTWOWCÓW
(Art. 4 ust. 1, art. 6 ust. 1 oraz art. 10 ust. 1)
|
— |
wiza lub dokument pobytowy wydany przez państwo rozpatrujące wniosek, |
|
— |
stempel wjazdu/wyjazdu lub podobne potwierdzenie w dokumencie podróży danej osoby lub inny dowód wjazdu/wyjazdu (np. fotograficzny). |
ZAŁĄCZNIK 4
WSPÓLNY WYKAZ DOKUMENTÓW, KTÓRE SĄ UZNAWANE ZA DOWÓD PRIMA FACIE POTWIERDZAJĄCY SPEŁNIENIE WARUNKÓW READMISJI OBYWATELI PAŃSTW TRZECICH I BEZPAŃSTWOWCÓW
(Art. 4 ust. 1, art. 6 ust. 1 oraz art. 10 ust. 2)
|
— |
wydany przez właściwe organy państwa składającego wniosek opis miejsca i okoliczności, w których dana osoba została przejęta po wjeździe na terytorium tego państwa, |
|
— |
informacje odnoszące się do tożsamości lub pobytu danej osoby, dostarczone przez organizację międzynarodową (np. Wysokiego Komisarza Organizacji Narodów Zjednoczonych ds. Uchodźców (UNHCR)), |
|
— |
zgłoszenia/potwierdzenia informacji przez członków rodziny, współtowarzyszy podróży itd., |
|
— |
oświadczenie danej osoby, |
|
— |
odciski palców, |
|
— |
dokumenty oraz wszelkiego rodzaju zaświadczenia lub rachunki (np. rachunki za hotel, karty wizyt u lekarzy/dentystów, karty wstępu do instytucji publicznych/prywatnych, umowy wynajmu samochodów, potwierdzenia płatności kartą kredytową itd.), które jednoznacznie wskazują, że dana osoba pozostawała na terytorium państwa rozpatrującego wniosek, |
|
— |
imienne bilety kolejowe lub listy pasażerów podróżujących samolotem, pociągiem, autokarem lub statkiem, które wskazują na obecność i przedstawiają trasę podróży danej osoby po terytorium państwa rozpatrującego wniosek, |
|
— |
informacje, które wskazują, że dana osoba korzystała z usług kurierskich lub usług biura podróży, |
|
— |
oficjalne oświadczenie złożone w szczególności przez pracowników służby granicznej lub innych świadków, którzy mogą potwierdzić, że dana osoba przekroczyła granicę, |
|
— |
oficjalne oświadczenie zainteresowanej osoby złożone w postępowaniu sądowym lub administracyjnym. |
ZAŁĄCZNIK 5



ZAŁĄCZNIK 6


Wspólna deklaracja dotycząca art. 3 ust. 3 i art. 5 ust. 3
Umawiające się Strony przyjmują do wiadomości, że – zgodnie z przepisami prawnymi Republiki Armenii i państw członkowskich regulującymi kwestię obywatelstwa – obywatela Republiki Armenii lub Unii Europejskiej nie można pozbawić obywatelstwa.
Strony zgadzają się przeprowadzić z odpowiednim wyprzedzeniem wzajemne konsultacje, w przypadku gdyby taka sytuacja prawna miała ulec zmianie.
Wspólna deklaracja dotycząca Republiki Islandii
Umawiające się Strony przyjmują do wiadomości ścisłe związki między Unią Europejską a Republiką Islandii, w szczególności na mocy umowy z dnia 18 maja 1999 r. dotyczącej włączenia tego państwa we wprowadzanie w życie, stosowanie i rozwijanie dorobku Schengen. W związku z tym wskazane jest, by Armenia zawarła umowę o readmisji z Republiką Islandii na takich samych warunkach jak niniejsza umowa.
ROZPORZĄDZENIA
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/30 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1059/2013
z dnia 29 października 2013 r.
dotyczące zezwolenia na stosowanie preparatu Saccharomyces cerevisiae MUCL 39885 jako dodatku paszowego dla bydła opasowego oraz zmieniające rozporządzenie (WE) nr 492/2006 (posiadacz zezwolenia Prosol SpA)
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1831/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie dodatków stosowanych w żywieniu zwierząt (1), w szczególności jego art. 9 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
W rozporządzeniu (WE) nr 1831/2003 przewidziano udzielanie zezwoleń na stosowanie dodatków w żywieniu zwierząt oraz określono sposób uzasadniania i procedury przyznawania takich zezwoleń. Artykuł 10 tego rozporządzenia przewiduje ponowną ocenę dodatków dopuszczonych na mocy dyrektywy Komisji 70/524/EWG (2). |
|
(2) |
Rozporządzeniem Komisji (WE) nr 492/2006 (3), zgodnie z dyrektywą 70/524/EWG, udzielono zezwolenia bez ograniczeń czasowych na stosowanie preparatu Saccharomyces cerevisiae MUCL 39885 jako dodatku paszowego dla bydła opasowego. Preparat ten został następnie wpisany do rejestru dodatków paszowych jako istniejący produkt zgodnie z art. 10 ust. 1 lit. b) rozporządzenia (WE) nr 1831/2003. |
|
(3) |
Rozporządzeniem Komisji (WE) nr 896/2009 (4) udzielono zezwolenia na dziesięć lat na stosowanie preparatu Saccharomyces cerevisiae MUCL 39885 u macior, rozporządzeniem Komisji (UE) nr 1119/2010 (5) — u krów mlecznych i koni oraz rozporządzeniem Komisji (UE) nr 170/2011 (6) — u prosiąt odsadzonych od maciory. |
|
(4) |
Zgodnie z art. 10 ust. 2 rozporządzenia (WE) nr 1831/2003 w związku z art. 7 tego rozporządzenia złożony został wniosek o ponowną ocenę tego preparatu jako dodatku paszowego dla bydła opasowego, celem sklasyfikowania go w kategorii „dodatki zootechniczne”. Do wniosku dołączone zostały dane szczegółowe oraz dokumenty wymagane na mocy art. 7 ust. 3 rozporządzenia (WE) nr 1831/2003. |
|
(5) |
Europejski Urząd ds. Bezpieczeństwa Żywności („Urząd”) stwierdził w opinii z dnia 13 marca 2013 r. (7), że preparat Saccharomyces cerevisiae MUCL 39885 w proponowanych warunkach stosowania nie ma negatywnego wpływu na zdrowie zwierząt i ludzi ani na środowisko, a jego stosowanie może poprawić końcową masę ciała, przyrost masy ciała w stosunku do paszy oraz średni przyrost dzienny. Zdaniem Urzędu nie ma potrzeby wprowadzania szczegółowych wymogów dotyczących monitorowania po wprowadzeniu do obrotu. Urząd poddał również weryfikacji sprawozdanie dotyczące metody analizy dodatku paszowego w paszy, przedłożone przez laboratorium referencyjne ustanowione rozporządzeniem (WE) nr 1831/2003. |
|
(6) |
Ocena preparatu Saccharomyces cerevisiae MUCL 39885 dowodzi, że warunki udzielenia zezwolenia przewidziane w art. 5 rozporządzenia (WE) nr 1831/2003 są spełnione. W związku z tym należy zezwolić na stosowanie preparatu, jak określono w załączniku do niniejszego rozporządzenia. |
|
(7) |
W związku z udzieleniem nowego zezwolenia na mocy rozporządzenia (WE) nr 1831/2003 przepisy dotyczące Saccharomyces cerevisiae MUCL 39885 zawarte w rozporządzeniu (WE) nr 492/2006 powinny zostać skreślone. Należy zatem odpowiednio zmienić rozporządzenie (WE) nr 492/2006. |
|
(8) |
Ponieważ względy bezpieczeństwa nie wymagają natychmiastowego zastosowania zmian w warunkach zezwolenia, należy przewidzieć okres przejściowy, aby umożliwić zainteresowanym stronom przygotowanie się do spełnienia nowych wymogów wynikających z zezwolenia. |
|
(9) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Preparat wyszczególniony w załączniku, należący do kategorii „dodatki zootechniczne” i do grupy funkcjonalnej „stabilizatory flory jelitowej”, zostaje dopuszczony jako dodatek stosowany w żywieniu zwierząt zgodnie z warunkami określonymi w załączniku.
Artykuł 2
W załączniku II do rozporządzenia (WE) nr 492/2006 skreśla się pozycję E 1710, Saccharomyces cerevisiae MUCL 39 885.
Artykuł 3
Preparat wyszczególniony w załączniku oraz pasza zawierająca ten preparat, wyprodukowane i opatrzone etykietami przed dniem 19 maja 2014 r. zgodnie z przepisami obowiązującymi przed dniem 19 listopada 2013 r. mogą być nadal wprowadzane do obrotu i stosowane aż do wyczerpania istniejących zapasów.
Artykuł 4
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 29 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 268 z 18.10.2003, s. 29.
(2) Dyrektywa Komisji 70/524/EWG z dnia 23 listopada 1970 r. dotycząca dodatków paszowych (Dz.U. L 270 z 14.12.1970, s. 1).
(3) Rozporządzenie Komisji (WE) nr 492/2006 z dnia 27 marca 2006 r. dotyczące tymczasowego i stałego zezwolenia na niektóre dodatki paszowe (Dz.U. L 89 z 28.3.2006, s. 6).
(4) Rozporządzenie Komisji (WE) nr 896/2009 z dnia 25 września 2009 r. dotyczące zezwolenia na nowe zastosowanie preparatu Saccharomyces cerevisiae MUCL 39885 jako dodatku paszowego dla macior (posiadacz zezwolenia Prosol SpA) (Dz.U. L 256 z 29.9.2009, s. 6).
(5) Rozporządzenie Komisji (UE) nr 1119/2010 z dnia 2 grudnia 2010 r. dotyczące zezwolenia na stosowanie Saccharomyces cerevisiae MUCL 39885 jako dodatku paszowego dla krów mlecznych i koni oraz zmieniające rozporządzenie (WE) nr 1520/2007 (posiadacz zezwolenia Prosol SpA) (Dz.U. L 317 z 3.12.2010, s. 9).
(6) Rozporządzenie Komisji (UE) nr 170/2011 z dnia 23 lutego 2011 r. dotyczące zezwolenia na stosowanie Saccharomyces cerevisiae MUCL 39885 jako dodatku paszowego dla prosiąt (odsadzonych od maciory) oraz zmieniające rozporządzenie (WE) nr 1200/2005 (posiadacz zezwolenia Prosol SpA) (Dz.U. L 49 z 24.2.2011, s. 8).
(7) Dziennik EFSA 2013; 11(4):3174.
ZAŁĄCZNIK
|
Numer identyfikacyjny dodatku |
Nazwa posiadacza zezwolenia |
Dodatek |
Skład, wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Minimalna zawartość |
Maksymalna zawartość |
Inne przepisy |
Data ważności zezwolenia |
||||||||||||
|
CFU/kg mieszanki paszowej pełnoporcjowej o wilgotności 12 % |
|||||||||||||||||||||
|
Kategoria dodatków zootechnicznych. Grupa funkcjonalna: stabilizatory flory jelitowej |
|||||||||||||||||||||
|
4b1710 |
Prosol SpA |
Saccharomyces cerevisiae MUCL 39885 |
|
Bydło opasowe |
— |
4 × 109 |
— |
|
19 listopada 2023 r. |
||||||||||||
(1) Szczegóły dotyczące metod analitycznych można uzyskać pod następującym adresem laboratorium referencyjnego: http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/33 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1060/2013
z dnia 29 października 2013 r.
dotyczące zezwolenia na stosowanie bentonitu jako dodatku paszowego dla wszystkich gatunków zwierząt
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1831/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie dodatków stosowanych w żywieniu zwierząt (1), w szczególności jego art. 9 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
W rozporządzeniu (WE) nr 1831/2003 przewidziano udzielanie zezwoleń na stosowanie dodatków w żywieniu zwierząt oraz określono sposób uzasadniania i procedury przyznawania takich zezwoleń. W art. 10 tego rozporządzenia przewidziano ponowną ocenę dodatków dopuszczonych na podstawie dyrektywy Rady 70/524/EWG (2). |
|
(2) |
Dyrektywą Komisji 82/822/EWG (3) udzielono bezterminowo zezwolenia na stosowanie bentonitu, należącego do grupy spoiw, środków przeciwzbrylających i koagulantów, jako dodatku paszowego dla wszystkich gatunków zwierząt, zgodnie z dyrektywą 70/524/EWG. Dodatek ten został następnie wpisany do rejestru dodatków paszowych jako istniejący produkt zgodnie z art. 10 ust. 1 lit. b) rozporządzenia (WE) nr 1831/2003. |
|
(3) |
Zgodnie z art. 10 ust. 2 rozporządzenia (WE) nr 1831/2003 w związku z art. 7 tego rozporządzenia złożony został wniosek o ponowną ocenę bentonitu jako dodatku paszowego z grupy spoiw i środków przeciwzbrylających dla wszystkich gatunków zwierząt oraz, zgodnie z art. 7 tego rozporządzenia, o udzielenie nowego zezwolenia na stosowanie jako substancji służącej do kontroli zanieczyszczenia radionuklidami dla wszystkich gatunków zwierząt. Ponadto zgodnie z art. 7 rozporządzenia (WE) nr 1831/2003 złożony został wniosek o udzielenie nowego zezwolenia na stosowanie bentonitu jako substancji redukującej zanieczyszczenie paszy mikotoksynami dla wszystkich gatunków zwierząt. We wnioskach tych zwrócono się o zaklasyfikowanie tego dodatku w kategorii „dodatki technologiczne” i dołączono do nich dane szczegółowe oraz dokumenty wymagane na mocy art. 7 ust. 3 rozporządzenia (WE) nr 1831/2003. |
|
(4) |
Europejski Urząd ds. Bezpieczeństwa Żywności („Urząd”) stwierdził w swoich opiniach z dnia 2 lutego 2011 r. (4), 14 czerwca 2011 r. (5) i 14 czerwca 2012 r. (6), że w proponowanych warunkach stosowania bentonit nie ma negatywnego wpływu na zdrowie zwierząt, zdrowie ludzi ani na środowisko naturalne oraz że może być skuteczny jako spoiwo, środek przeciwzbrylający oraz jako substancja służąca do kontroli zanieczyszczenia radionuklidami dla wszystkich gatunków zwierząt. Uznano także, że bentonit może być skuteczny jako spoiwo aflatoksyn dla krów mlecznych i że wniosek ten może zostać rozszerzony na wszystkie przeżuwacze. Zdaniem Urzędu nie ma potrzeby wprowadzania szczegółowych wymogów dotyczących monitorowania po wprowadzeniu do obrotu. Urząd poddał również weryfikacji sprawozdanie dotyczące metody analizy dodatku paszowego w paszy, przedłożone przez laboratorium referencyjne ustanowione rozporządzeniem (WE) nr 1831/2003. |
|
(5) |
Ponieważ przedstawione badania in vitro spełniają warunki wykazania skuteczności dodatków technologicznych określone rozporządzeniem Komisji (WE) nr 429/2008 (7), w szczególności w pkt 4 załącznika II i w pkt 1.4 załącznika III do tego rozporządzenia, oraz ponieważ uznano, że badania te wskazują wyraźne dowody na wiązanie aflatoksyny B1 (AfB), a ponadto zdolność wiązania, ograniczona do aflatoksyny B1, została określona jako cecha betonitu, wniosek o jego skuteczności jako substancji redukującej zanieczyszczenie paszy mikotoksynami można uznać za wystarczający do rozszerzenia jego zastosowania na drób i świnie. |
|
(6) |
Ocena betonitu dowodzi, że warunki udzielenia zezwolenia przewidziane w art. 5 rozporządzenia (WE) nr 1831/2003 są spełnione. W związku z tym należy zezwolić na stosowanie tego dodatku, jak określono w załącznikach do niniejszego rozporządzenia. |
|
(7) |
Ponieważ względy bezpieczeństwa nie wymagają natychmiastowego zastosowania zmian w warunkach zezwolenia na stosowanie betonitu jako spoiwa i środka przeciwzbrylającego, należy przewidzieć okres przejściowy, aby umożliwić zainteresowanym stronom przygotowanie się do spełnienia nowych wymogów wynikających z zezwolenia. |
|
(8) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Bentonit wyszczególniony w załącznikach, należący do kategorii „dodatki technologiczne” i do grup funkcjonalnych „substancje redukujące zanieczyszczenie paszy mikotoksynami”, „spoiwa”, „środki przeciwzbrylające” i „substancje służące do kontroli zanieczyszczenia radionuklidami”, zostaje dopuszczony jako dodatek stosowany w żywieniu zwierząt zgodnie z warunkami określonymi w tych załącznikach.
Artykuł 2
Dodatek wyszczególniony w załączniku II należący do grup funkcjonalnych „spoiwa” i „środki przeciwzbrylające” oraz pasza zawierająca ten dodatek, wyprodukowane i opatrzone etykietami przed dniem 19 listopada 2015 r., zgodnie z przepisami obowiązującymi przed dniem 19 listopada 2013 r., mogą być nadal wprowadzane do obrotu i stosowane aż do wyczerpania istniejących zapasów.
Artykuł 3
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 29 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 268 z 18.10.2003, s. 29.
(2) Dyrektywa Rady 70/524/EWG z dnia 23 listopada 1970 r. dotycząca dodatków paszowych (Dz.U. L 270 z 14.12.1970, s. 1).
(3) Czterdziesta pierwsza dyrektywa Komisji 82/822/EWG z dnia 19 listopada 1982 r. zmieniająca załączniki do dyrektywy Rady 70/524/EWG dotyczącej dodatków paszowych (Dz.U. L 347 z 7.12.1982, s. 16).
(4) Dziennik EFSA 2011; 9(2):2007.
(5) Dziennik EFSA 2011; 9(6):2276.
(6) Dziennik EFSA 2012; 10(7):2787.
(7) Rozporządzenie Komisji (WE) nr 429/2008 z dnia 25 kwietnia 2008 r. w sprawie szczegółowych zasad wykonania rozporządzenia (WE) nr 1831/2003 Parlamentu Europejskiego i Rady w zakresie sporządzania i przedstawiania wniosków oraz oceny dodatków paszowych i udzielania zezwoleń na dodatki paszowe (Dz.U. L 133 z 22.5.2008, s. 1).
ZAŁĄCZNIK I
|
Numer identyfikacyjny dodatku |
Dodatek |
Wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Minimalna zawartość |
Maksymalna zawartość |
Inne przepisy |
Data ważności zezwolenia |
||||||||||||||||||||
|
mg substancji czynnej/kg mieszanki paszowej pełnoporcjowej o wilgotności 12 % |
||||||||||||||||||||||||||||
|
Kategoria dodatków technologicznych. Grupa funkcjonalna: substancje redukujące zanieczyszczenie paszy mikotoksynami: aflatoksyna B1 |
||||||||||||||||||||||||||||
|
1m558 |
Bentonit |
|
Przeżuwacze Drób Świnie |
— |
|
20 000 |
|
19 listopada 2023 r. |
||||||||||||||||||||
(1) Szczegóły dotyczące metod analitycznych można uzyskać pod następującym adresem laboratorium referencyjnego Unii Europejskiej ds. dodatków paszowych: http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx
ZAŁĄCZNIK II
|
Numer identyfikacyjny dodatku |
Dodatek |
Wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Minimalna zawartość |
Maksymalna zawartość |
Inne przepisy |
Data ważności zezwolenia |
||||||||||||||||||||
|
mg substancji czynnej/kg mieszanki paszowej pełnoporcjowej o wilgotności 12 % |
||||||||||||||||||||||||||||
|
Kategoria dodatków technologicznych. Grupa funkcjonalna: spoiwa |
||||||||||||||||||||||||||||
|
1m558i |
Bentonit |
|
Wszystkie gatunki zwierząt |
— |
|
20 000 |
|
19 listopada 2023 r. |
||||||||||||||||||||
|
Kategoria: dodatki technologiczne. Grupa funkcjonalna: środki przeciwzbrylające |
||||||||||||||||||||||||||||
|
1m558i |
Bentonit |
|
Wszystkie gatunki zwierząt |
— |
|
20 000 |
|
19 listopada 2023 r. |
||||||||||||||||||||
|
Kategoria dodatków technologicznych. Grupa funkcjonalna: substancje służące do kontroli zanieczyszczenia radionuklidami (134/137Cs) |
||||||||||||||||||||||||||||
|
1m558i |
Bentonit |
|
Wszystkie gatunki zwierząt |
— |
|
— |
|
19 listopada 2023 r. |
||||||||||||||||||||
(1) Szczegóły dotyczące metod analitycznych można uzyskać pod następującym adresem laboratorium referencyjnego Unii Europejskiej ds. dodatków paszowych: http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/38 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1061/2013
z dnia 29 października 2013 r.
dotyczące zezwolenia na stosowanie preparatu Enterococcus faecium NCIMB 10415 jako dodatku paszowego dla cieląt, koźląt, kotów i psów oraz zmieniające rozporządzenie (WE) nr 1288/2004 (posiadacz zezwolenia: DSM Nutritional Products Ltd reprezentowany przez DSM Nutritional Products Sp. z o.o.)
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1831/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie dodatków stosowanych w żywieniu zwierząt (1), w szczególności jego art. 9 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
W rozporządzeniu (WE) nr 1831/2003 przewidziano udzielanie zezwoleń na stosowanie dodatków w żywieniu zwierząt oraz określono sposób uzasadniania i procedury przyznawania takich zezwoleń. W art. 10 tego rozporządzenia przewidziano ponowną ocenę dodatków dopuszczonych na mocy dyrektywy Rady 70/524/EWG (2). |
|
(2) |
Zgodnie z dyrektywą 70/524/EWG udzielono bezterminowego zezwolenia na stosowanie preparatu Enterococcus faecium NCIMB 10415 jako dodatku paszowego dla cieląt rozporządzeniem Komisji (WE) nr 1288/2004 (3), dla macior rozporządzeniem Komisji (WE) nr 1200/2005 (4), dla prosiąt rozporządzeniem Komisji (WE) nr 252/2006 (5), dla tuczników rozporządzeniem Komisji (WE) nr 943/2005 (6) oraz dla kotów i psów rozporządzeniem Komisji (WE) nr 102/2009 (7). Preparat ten został następnie wpisany do rejestru dodatków paszowych jako istniejący produkt zgodnie z art. 10 ust. 1 lit. b) rozporządzenia (WE) nr 1831/2003. |
|
(3) |
Rozporządzeniem wykonawczym Komisji (UE) nr 361/2011 stosowanie tego preparatu zostało również dopuszczone w żywieniu kurcząt rzeźnych na okres dziesięciu lat (8). |
|
(4) |
Zgodnie z art. 10 ust. 2 rozporządzenia (WE) nr 1831/2003 w związku z art. 7 tego rozporządzenia złożony został wniosek o ponowną ocenę preparatu Enterococcus faecium NCIMB 10415 jako dodatku paszowego dla cieląt, kotów i psów oraz, zgodnie z art. 7 tego rozporządzenia, o nowe zastosowanie u koźląt celem sklasyfikowania dodatku w kategorii „dodatki zootechniczne”. Do wniosku dołączone zostały dane szczegółowe oraz dokumenty wymagane na mocy art. 7 ust. 3 rozporządzenia (WE) nr 1831/2003. |
|
(5) |
Europejski Urząd ds. Bezpieczeństwa Żywności („Urząd”) stwierdził w opiniach z dnia 29 stycznia 2013 r. (9), że w proponowanych warunkach stosowania preparat Enterococcus faecium NCIMB 10415 nie ma negatywnego wpływu na zdrowie zwierząt i ludzi ani na środowisko, jego stosowanie zwiększa końcową masę ciała lub dzienny przyrost masy u cieląt przeznaczonych do dalszego chowu i u cieląt opasowych, a wniosek ten można rozszerzyć na koźlęta przeznaczone do dalszego chowu i na koźlęta rzeźne. Urząd uznał również, że preparat oddziałuje korzystnie w przypadku psów poprzez zwiększanie stężenia IgA w jelicie lub surowicy krwi. Zdaniem Urzędu nie ma potrzeby wprowadzania szczegółowych wymogów dotyczących monitorowania po wprowadzeniu do obrotu. Urząd poddał również weryfikacji sprawozdanie dotyczące metody analizy dodatku paszowego w paszy, przedłożone przez laboratorium referencyjne ustanowione rozporządzeniem (WE) nr 1831/2003. |
|
(6) |
Zaobserwowano niewielki, ale znaczący wpływ na jakość odchodów u kotów, co uznano za wystarczające, aby potwierdzić skuteczność w odniesieniu do tego gatunku. |
|
(7) |
Ocena preparatu Enterococcus faecium NCIMB 10415 dowodzi, że warunki udzielenia zezwolenia przewidziane w art. 5 rozporządzenia (WE) nr 1831/2003 są spełnione. W związku z tym należy zezwolić na stosowanie tego dodatku, jak określono w załączniku do niniejszego rozporządzenia. |
|
(8) |
W związku z udzieleniem nowego zezwolenia na mocy rozporządzenia (WE) nr 1831/2003 należy uchylić rozporządzenie (WE) nr 102/2009 i odpowiednio zmienić rozporządzenie (WE) nr 1288/2004. |
|
(9) |
Ponieważ względy bezpieczeństwa nie wymagają natychmiastowego zastosowania zmian w warunkach zezwolenia, należy przewidzieć okres przejściowy, aby umożliwić zainteresowanym stronom przygotowanie się do spełnienia nowych wymogów wynikających z zezwolenia. |
|
(10) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Zezwolenie
Preparat wyszczególniony w załączniku, należący do kategorii „dodatki zootechniczne” i do grup funkcjonalnych „stabilizatory flory jelitowej” i „inne dodatki zootechniczne”, zostaje dopuszczony jako dodatek stosowany w żywieniu zwierząt zgodnie z warunkami określonymi w załączniku.
Artykuł 2
Uchylenie rozporządzenia (WE) nr 102/2009
Rozporządzenie (WE) nr 102/2009 traci moc.
Artykuł 3
Zmiana w rozporządzeniu (WE) nr 1288/2004
W załączniku I do rozporządzenia (WE) nr 1288/2004 skreśla się pozycję dotyczącą E 1705, Enterococcus faecium NCIMB 10415.
Artykuł 4
Środki przejściowe
Dodatek wyszczególniony w załączniku do stosowania u cieląt oraz pasza zawierająca ten dodatek, wyprodukowane i opatrzone etykietami przed dniem 19 maja 2014 r. zgodnie z przepisami obowiązującymi przed dniem 19 listopada 2013 r., mogą być nadal wprowadzane do obrotu i stosowane aż do wyczerpania istniejących zapasów.
Dodatek wyszczególniony w załączniku do stosowania u kotów i psów oraz pasza zawierająca ten dodatek, wyprodukowane i opatrzone etykietami przed dniem 19 listopada 2015 r. zgodnie z przepisami obowiązującymi przed dniem 19 listopada 2013 r., mogą być nadal wprowadzane do obrotu i stosowane aż do wyczerpania istniejących zapasów.
Artykuł 5
Wejście w życie
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 29 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 268 z 18.10.2003, s. 29.
(2) Dyrektywa Komisji 70/524/EWG z dnia 23 listopada 1970 r. dotycząca dodatków paszowych (Dz.U. L 270 z 14.12.1970, s. 1).
(3) Rozporządzenie Komisji (WE) nr 1288/2004 z dnia 14 lipca 2004 r. w sprawie stałego dopuszczenia niektórych dodatków oraz tymczasowego dopuszczenia nowego zastosowania dodatku już dopuszczonego do użycia w paszach (Dz.U. L 243 z 15.7.2004, s. 10).
(4) Rozporządzenie Komisji (WE) nr 1200/2005 z dnia 26 lipca 2005 r. w sprawie stałego zezwolenia na niektóre dodatki paszowe oraz tymczasowego zezwolenia na nowe zastosowanie już dopuszczonego dodatku paszowego (Dz.U. L 195 z 27.7.2005, s. 6).
(5) Rozporządzenie Komisji (WE) nr 252/2006 z dnia 14 lutego 2006 r. w sprawie stałego zezwolenia na niektóre dodatki paszowe oraz tymczasowych zezwoleń na nowe zastosowanie niektórych już dopuszczonych dodatków paszowych (Dz.U. L 44 z 15.2.2006, s. 3).
(6) Rozporządzenie Komisji (WE) nr 943/2005 z dnia 21 czerwca 2005 r. dotyczące stałego zezwolenia na niektóre dodatki paszowe (Dz.U. L 159 z 22.6.2005, s. 6).
(7) Rozporządzenie Komisji (WE) nr 102/2009 z dnia 3 lutego 2009 r. dotyczące stałego zezwolenia na dodatek paszowy (Dz.U. L 34 z 4.2.2009, s. 8).
(8) Rozporządzenie wykonawcze Komisji (UE) nr 361/2011 z dnia 13 kwietnia 2011 r. dotyczące zezwolenia na stosowanie Enterococcus faecium NCIMB 10415 jako dodatku paszowego dla kurcząt rzeźnych (posiadacz zezwolenia DSM Nutritional Products Ltd, reprezentowany przez DSM Nutritional Products Sp. z o.o.) oraz zmieniające rozporządzenie (WE) nr 943/2005 (Dz.U. L 100 z 14.4.2011, s. 22).
(9) Dziennik EFSA 2013; 11(2):3097 i 3098.
ZAŁĄCZNIK
|
Numer identyfikacyjny dodatku |
Nazwa posiadacza zezwolenia |
Dodatek |
Skład, wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Minimalna zawartość |
Maksymalna zawartość |
Inne przepisy |
Data ważności zezwolenia |
||||||
|
CFU/kg mieszanki paszowej pełnoporcjowej o wilgotności 12 % |
|||||||||||||||
|
Kategoria dodatków zootechnicznych. Grupa funkcjonalna: stabilizatory flory jelitowej |
|||||||||||||||
|
4b1705 |
DSM Nutritional Products Ltd, reprezentowany przez DSM Nutritional Products Sp. z o.o. |
Enterococcus faecium NCIMB 10415 |
|
Cielęta Koźlęta |
— |
1 × 109 |
— |
W informacjach na temat stosowania dodatku i premiksu wskazać warunki przechowywania oraz stabilność granulowania. |
19 listopada 2023 r. |
||||||
|
4b1705 |
DSM Nutritional Products Ltd, reprezentowany przez DSM Nutritional Products Sp. z o.o. |
Enterococcus faecium NCIMB 10415 |
|
Koty |
— |
7 × 109 |
— |
W informacjach na temat stosowania dodatku i premiksu wskazać warunki przechowywania oraz stabilność granulowania. |
19 listopada 2023 r. |
||||||
|
Kategoria dodatków zootechnicznych. Grupa funkcjonalna: inne dodatki zootechniczne (poprawa warunków jelitowych) |
|||||||||||||||
|
4b1705 |
DSM Nutritional Products Ltd, reprezentowany przez DSM Nutritional Products Sp. z o.o. |
Enterococcus faecium NCIMB 10415 |
|
Psy |
— |
2,5 × 109 |
|
W informacjach na temat stosowania dodatku i premiksu wskazać warunki przechowywania oraz stabilność granulowania. |
19 listopada 2023 r. |
||||||
(1) Szczegóły dotyczące metod analitycznych można uzyskać pod następującym adresem laboratorium referencyjnego Unii Europejskiej ds. dodatków paszowych: http://irmm.jrc.ec.europa.eu/EURLs/EURL_feed_additives/Pages/index.aspx
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/42 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1062/2013
z dnia 30 października 2013 r.
w sprawie formatu europejskiej oceny technicznej dla wyrobów budowlanych
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 305/2011 z dnia 9 marca 2011 r. ustanawiające zharmonizowane warunki wprowadzania do obrotu wyrobów budowlanych i uchylające dyrektywę Rady 89/106/EWG (1), w szczególności jego art. 26 ust. 3,
po konsultacji ze Stałym Komitetem ds. Budownictwa,
a także mając na uwadze, co następuje:
|
(1) |
Europejska ocena techniczna jest niezbędna w celu umożliwienia producentowi wyrobu budowlanego sporządzania deklaracji właściwości użytkowych wyrobu budowlanego, który nie jest objęty lub w pełni objęty normą zharmonizowaną. |
|
(2) |
Artykuł 26 ust. 2 rozporządzenia (UE) nr 305/2011 ustanawia wymogi dotyczące treści europejskiej oceny technicznej. Ponieważ zasady zakładowej kontroli produkcji, która ma być stosowana, określa się w odpowiednim europejskim dokumencie oceny, europejska ocena techniczna powinna zawierać tylko takie szczegóły techniczne, które uznano za niezbędne w tych zasadach w ramach tego dokumentu i które zostaną zdefiniowane na tym poziomie w celu wdrożenia systemu oceny i weryfikacji stałości właściwości użytkowych. |
|
(3) |
Biorąc pod uwagę dużą różnorodność wyrobów budowlanych, format europejskiej oceny technicznej powinien w wystarczająco elastyczny sposób definiować formę opisu technicznego danego wyrobu. |
|
(4) |
Europejska ocena techniczna powinna również zapewnić wystarczającą elastyczność opisu właściwości użytkowych wyrobu w celu umożliwienia producentowi sprawnego złożenia dokładnej deklaracji właściwości użytkowych opierającej się na tej ocenie. |
|
(5) |
W celu ochrony poufnych informacji technicznych dotyczących wyrobu producent powinien mieć możliwość wskazania odpowiedzialnej jednostce ds. oceny technicznej, które części opisu wyrobu są poufne i nie mogą być ujawniane wraz z europejską oceną techniczną. Poufne informacje należy umieścić w oddzielnych załącznikach do europejskich ocen technicznych. |
|
(6) |
W celu zwiększenia efektywności rynku wewnętrznego i konkurencyjności europejskiego sektora budownictwa ogółem europejskie oceny techniczne powinny być wydawane jak najszybciej po złożeniu wniosku przez producenta, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Format europejskiej oceny technicznej określono w załączniku.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie trzeciego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 88 z 4.4.2011, s. 5.
ZAŁĄCZNIK
EUROPEJSKA OCENA TECHNICZNA
Nr … z dnia … r. [data]
Część ogólna
|
1. |
Jednostka ds. oceny technicznej wydająca europejską ocenę techniczną: … |
|
2. |
Nazwa handlowa wyrobu budowlanego: … |
|
3. |
Rodzina wyrobów, do której należy wyrób budowlany: … |
|
4. |
Producent: … |
|
5. |
Zakład(-y) produkcyjny(-e): … |
|
6. |
Niniejsza europejska ocena techniczna zawiera … stron, w tym … załącznik(-ów), który(-e) stanowi(-ą) integralną część oceny. Załącznik(-i) … zawiera(-ją) informacje poufne i nie jest (są) włączony(-e) do europejskiej oceny technicznej, gdy taka ocena jest publicznie rozpowszechniana. |
|
7. |
Niniejszą europejską ocenę techniczną wydaje się zgodnie z rozporządzeniem (UE) nr 305/2011, na podstawie … … |
Części szczegółowe
|
8. |
Opis techniczny wyrobu: … |
|
9. |
Określenie zamierzonego zastosowania zgodnie ze stosownym europejskim dokumentem oceny (EDO): … |
|
10. |
Właściwości użytkowe wyrobu oraz odniesienia do metod zastosowanych do ich oceny: … |
|
11. |
Zastosowany system oceny i weryfikacji stałości właściwości użytkowych (AVCP) wraz z odesłaniem do jego podstawy prawnej: … |
|
12. |
Szczegóły techniczne niezbędne do wdrożenia systemu AVCP zgodnie ze stosownym EDO: … |
Wydana w … dnia … 20…. r.
przez …
Załącznik(-i)
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/44 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1063/2013
z dnia 30 października 2013 r.
zmieniające rozporządzenie (EWG) nr 2454/93 ustanawiające przepisy w celu wykonania rozporządzenia Rady (EWG) nr 2913/92 ustanawiającego Wspólnotowy kodeks celny w odniesieniu do stosowania systemu ekwiwalencji w sektorze cukru
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (EWG) nr 2913/92 z dnia 12 października 1992 r. ustanawiające Wspólnotowy kodeks celny (1), w szczególności jego art. 247,
a także mając na uwadze, co następuje:
|
(1) |
W załączniku 74 pkt 3 do rozporządzenia Komisji (EWG) nr 2454/93 (2) zezwala się na stosowanie systemu ekwiwalencji między surowym cukrem trzcinowym (kod CN 1701 11 90) oraz surowym cukrem buraczanym (kod CN 1701 12 90), pod warunkiem że uzyskiwane są produkty kompensacyjne objęte kodem 1701 99 10 (cukier biały). |
|
(2) |
Nie można jednak prawidłowo zastosować załącznika 74 pkt 3 do rozporządzenia (EWG) nr 2454/93, ponieważ nie istnieje w Unii rynek surowego cukru buraczanego. |
|
(3) |
Należy znaleźć rozwiązanie, które zapewni pewność prawną w związku ze stosowaniem towarów ekwiwalentnych w sektorze cukru. |
|
(4) |
Cukier biały zazwyczaj otrzymuje się z buraków cukrowych w procesie ciągłym. W procesie tym surowy cukier buraczany nie jest produkowany jako odrębny produkt i w związku z tym nie może być wprowadzany do obrotu. Z tego powodu należy zezwolić na używanie buraków cukrowych zamiast surowego cukru buraczanego jako towarów ekwiwalentnych. |
|
(5) |
Uzysk surowego cukru trzcinowego powinien być obliczany zgodnie z załącznikiem IV cz. B pkt III. 3 do rozporządzenia Rady (WE) nr 1234/2007 (3), ponieważ jest to szczególna metoda obliczeniowa w sektorze cukru. |
|
(6) |
Ze względu na zmiany w Nomenklaturze scalonej należy uaktualnić odniesienia do kodów Nomenklatury scalonej (CN) w załączniku 74 pkt 3 do rozporządzenia (EWG) nr 2454/93. |
|
(7) |
Należy zatem odpowiednio zmienić załącznik 74 pkt 3 do rozporządzenia (EWG) nr 2454/93. |
|
(8) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Komitetu Kodeksu Celnego, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Załącznik 74 pkt 3 do rozporządzenia (EWG) nr 2454/93 otrzymuje brzmienie:
„3. Cukier
Skorzystanie ze stosowania towarów ekwiwalentnych jest dozwolone między surowym cukrem trzcinowym nieunijnym (kody CN 1701 13 90 lub 1701 14 90) oraz burakami cukrowymi (kod CN 1212 91 80), pod warunkiem że uzyskiwane są produkty kompensacyjne objęte kodem CN 1701 99 10 (cukier biały).
Równoważną ilość surowego cukru trzcinowego standardowej jakości określonej w załączniku IV cz. B pkt III do rozporządzenia Rady (WE) nr 1234/2007 (4) oblicza się poprzez pomnożenie ilości cukru białego przez współczynnik 1,0869565.
Równoważną ilość surowego cukru trzcinowego niestandardowej jakości oblicza się poprzez pomnożenie ilości cukru białego przez współczynnik otrzymany przez podzielenie liczby 100 przez uzysk surowego cukru trzcinowego. Uzysk surowego cukru trzcinowego jest obliczany zgodnie z załącznikiem IV cz. B pkt III.3 do rozporządzenia (WE) nr 1234/2007.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 302 z 19.10.1992, s. 1.
(2) Rozporządzenie Komisji (EWG) nr 2454/93 z dnia 2 lipca 1993 r. ustanawiające przepisy w celu wykonania rozporządzenia Rady (EWG) nr 2913/92 ustanawiającego Wspólnotowy kodeks celny (Dz.U. L 253 z 11.10.1993, s. 1).
(3) Rozporządzenie Rady (WE) nr 1234/2007 z dnia 22 października 2007 r. ustanawiające wspólną organizację rynków rolnych oraz przepisy szczegółowe dotyczące niektórych produktów rolnych („rozporządzenie o jednolitej wspólnej organizacji rynku”) (Dz.U. L 299 z 16.11.2007, s. 1).
(4) Rozporządzenie Rady (WE) nr 1234/2007 z dnia 22 października 2007 r. ustanawiające wspólną organizację rynków rolnych oraz przepisy szczegółowe dotyczące niektórych produktów rolnych („rozporządzenie o jednolitej wspólnej organizacji rynku”) (Dz.U. L 299 z 16.11.2007, s. 1).”.
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/46 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1064/2013
z dnia 30 października 2013 r.
ustalające współczynniki mające zastosowanie do zbóż wywożonych w postaci szkockiej whisky na okres 2013/2014
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (WE) nr 1234/2007 z dnia 22 października 2007 r. ustanawiające wspólną organizację rynków rolnych oraz przepisy szczegółowe dotyczące niektórych produktów rolnych („rozporządzenie o jednolitej wspólnej organizacji rynku”) (1),
uwzględniając rozporządzenie Komisji (WE) nr 1670/2006 z dnia 10 listopada 2006 r. ustanawiające niektóre szczegółowe zasady stosowania rozporządzenia Rady (WE) nr 1784/2003 w zakresie ustalania i udzielania dostosowanych refundacji w odniesieniu do zbóż wywożonych w postaci niektórych napojów spirytusowych (2), w szczególności jego art. 5,
a także mając na uwadze, co następuje:
|
(1) |
Artykuł 4 ust. 1 rozporządzenia (WE) nr 1670/2006 przewiduje, że ilościami zbóż, dla których przyznawana jest refundacja wywozowa, są ilości objęte kontrolą i poddane destylacji oraz ważone przy zastosowaniu współczynnika ustalanego corocznie w stosunku do każdego zainteresowanego państwa członkowskiego. Współczynnik ten wyraża stosunek między całkowitymi ilościami wywiezionymi i całkowitymi ilościami wprowadzonymi do obrotu danego napoju spirytusowego na podstawie tendencji odnotowanych w odniesieniu do tych ilości w okresie odpowiadającym przeciętnemu okresowi dojrzewania tego napoju spirytusowego. |
|
(2) |
W świetle informacji przedstawionych przez Zjednoczone Królestwo i dotyczących okresu od dnia 1 stycznia do dnia 31 grudnia 2012 r. przeciętny okres dojrzewania w 2012 r. dla szkockiej whisky wynosił siedem lat. |
|
(3) |
Rozporządzenie wykonawcze Komisji (UE) nr 745/2012 (3) nie wywołuje już skutków, gdyż dotyczyło współczynników stosowanych w okresie 2012/2013. W związku z powyższym należy ustalić współczynniki na okres od dnia 1 października 2013 r. do dnia 30 września 2014 r. |
|
(4) |
Artykuł 10 protokołu 3 do Porozumienia o Europejskim Obszarze Gospodarczym wyklucza przyznawanie refundacji przy wywozie do Liechtensteinu, Islandii i Norwegii. Ponadto Unia zawarła z niektórymi państwami trzecimi umowy znoszące refundacje wywozowe. W związku z tym oraz w zastosowaniu art. 7 ust. 2 rozporządzenia (WE) nr 1670/2006 należy to uwzględnić przy obliczaniu współczynnika na okres 2013/2014, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
W okresie od dnia 1 października 2013 r. do dnia 30 września 2014 r. wartość współczynników przewidzianych w art. 4 rozporządzenia (WE) nr 1670/2006, mających zastosowanie do zbóż wykorzystywanych w Zjednoczonym Królestwie do wytwarzania szkockiej whisky, jest równa wartości określonej w załączniku do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie stosuje się od dnia 1 października 2013 r. do dnia 30 września 2014 r.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 299 z 16.11.2007, s. 1.
(2) Dz.U. L 312 z 11.11.2006, s. 33.
(3) Rozporządzenie wykonawcze Komisji (UE) nr 745/2012 z dnia 16 sierpnia 2012 r. ustalające współczynniki mające zastosowanie do zbóż wywożonych w postaci szkockiej whisky na okres 2012/2013 (Dz.U. L 219 z 17.8.2012, s. 13).
ZAŁĄCZNIK
|
Współczynniki mające zastosowanie do Zjednoczonego Królestwa |
||
|
Okres obowiązywania |
Współczynnik stosowany do |
|
|
jęczmienia przetworzonego na słód wykorzystywanego do wytwarzania whisky słodowej |
zbóż wykorzystywanych do wytwarzania whisky zbożowej |
|
|
Od dnia 1 października 2013 r. do dnia 30 września 2014 r. |
0,667 |
0,515 |
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/48 |
ROZPORZĄDZENIE KOMISJI (UE) NR 1065/2013
z dnia 30 października 2013 r.
zmieniające załącznik III do rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 110/2008 w sprawie definicji, opisu, prezentacji, etykietowania i ochrony oznaczeń geograficznych napojów spirytusowych
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 110/2008 z dnia 15 stycznia 2008 r. w sprawie definicji, opisu, prezentacji, etykietowania i ochrony oznaczeń geograficznych napojów spirytusowych oraz uchylające rozporządzenie Rady (EWG) nr 1576/89 (1), w szczególności jego art. 17 ust. 8,
a także mając na uwadze, co następuje:
|
(1) |
Republika Peru złożyła wniosek o rejestrację nazwy „Pisco” jako chronionego oznaczenia geograficznego w załączniku III do rozporządzenia (WE) nr 110/2008 zgodnie z procedurą określoną w art. 17 ust. 1 wzmiankowanego rozporządzenia. „Pisco” jest okowitą owocową tradycyjnie produkowaną w Peru za pomocą fermentacji i destylacji winogron. |
|
(2) |
Podstawowe specyfikacje dokumentacji technicznej dla „Pisco” zostały opublikowane w Dzienniku Urzędowym Unii Europejskiej (2) do celów procedury zgłaszania zastrzeżeń, zgodnie z art. 17 ust. 6 rozporządzenia (WE) nr 110/2008. Jako że do Komisji nie wpłynęły żadne zastrzeżenia zgodnie z art. 17 ust. 7 rozporządzenia (WE) nr 110/2008, nazwę należy włączyć do załącznika III do wzmiankowanego rozporządzenia. |
|
(3) |
Zgodnie z Układem ustanawiającym stowarzyszenie między Wspólnotą Europejską i jej państwami członkowskimi, z jednej strony, a Republiką Chile, z drugiej strony, zatwierdzonym decyzją 2002/979/WE (3), „Pisco” jest chronioną nazwą napojów spirytusowych pochodzących z Chile. Dlatego też należy wyjaśnić, że ochrona oznaczenia geograficznego „Pisco” w odniesieniu do produktów pochodzących z Peru nie stanowi przeszkody dla używania takiej nazwy w odniesieniu do produktów pochodzących z Chile. |
|
(4) |
Należy zatem odpowiednio zmienić rozporządzenie (WE) nr 110/2008. |
|
(5) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Komitetu ds. Napojów Spirytusowych, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
W załączniku III do rozporządzenia (WE) nr 110/2008, w kategorii wyrobu „9. Okowita z owoców”, dodaje się pozycję w brzmieniu:
|
|
„Pisco (4) |
Peru |
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie następnego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 39 z 13.2.2008, s. 16.
(2) Dz.U. C 141 z 12.5.2011, s. 16.
(3) Dz.U. L 352 z 30.12.2002, s. 1.
(4) Ochrona oznaczenia geograficznego »Pisco« na mocy niniejszego rozporządzenia pozostaje bez uszczerbku dla używania nazwy »Pisco« w odniesieniu do produktów pochodzących z Chile chronionych na mocy układu z 2002 r. ustanawiającego stowarzyszenie między Unią a Chile.”.
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/49 |
ROZPORZĄDZENIE KOMISJI (UE) NR 1066/2013
z dnia 30 października 2013 r.
w sprawie odmowy udzielenia zezwolenia na niektóre oświadczenia zdrowotne dotyczące żywności inne niż odnoszące się do zmniejszenia ryzyka choroby oraz rozwoju i zdrowia dzieci
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 1924/2006 Parlamentu Europejskiego i Rady z dnia 20 grudnia 2006 r. w sprawie oświadczeń żywieniowych i zdrowotnych dotyczących żywności (1) w szczególności jego art. 18 ust. 5,
a także mając na uwadze, co następuje:
|
(1) |
Na podstawie rozporządzenia (WE) nr 1924/2006 zabronione jest stosowanie oświadczeń zdrowotnych dotyczących żywności, chyba że Komisja udzieliła zezwolenia na takie oświadczenia zgodnie z tym rozporządzeniem i zostały one włączone do wykazu dozwolonych oświadczeń. |
|
(2) |
Rozporządzenie (WE) nr 1924/2006 stanowi ponadto, że wnioski o udzielenie zezwolenia na stosowanie oświadczeń zdrowotnych mogą być składane przez podmioty prowadzące przedsiębiorstwo spożywcze do właściwego organu krajowego danego państwa członkowskiego. Właściwy organ krajowy przekazuje prawidłowe wnioski Europejskiemu Urzędowi ds. Bezpieczeństwa Żywności (EFSA), zwanemu dalej „Urzędem”, z prośbą o dokonanie oceny naukowej oraz Komisji i państwom członkowskim do wiadomości. |
|
(3) |
Urząd wydaje opinię na temat danego oświadczenia zdrowotnego. |
|
(4) |
Komisja decyduje o udzieleniu zezwolenia na stosowanie oświadczeń zdrowotnych, uwzględniając opinię wydaną przez Urząd. |
|
(5) |
W następstwie wniosku złożonego przez przedsiębiorstwo Béres Pharmaceuticals Ltd. na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem glukozaminy na utrzymywanie stawów (pytanie nr EFSA-Q-2011-00907) (2). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Glukozamina przyczynia się do ochrony chrząstek stawowych narażonych na nadmierny ruch lub nadmierne obciążenie oraz zwiększa zasięg stawów”. |
|
(6) |
Dnia 5 grudnia 2011 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem glukozaminy a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(7) |
W następstwie wniosku złożonego przez przedsiębiorstwo Merck Consumer Healthcare na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem glukozaminy na utrzymywanie prawidłowych chrząstek stawowych (pytanie nr EFSA-Q-2011-01113) (3). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Glukozamina przyczynia się do utrzymywania prawidłowych chrząstek stawowych”. |
|
(8) |
Dnia 16 maja 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem glukozaminy a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(9) |
W następstwie wniosku złożonego przez przedsiębiorstwo Extraction Purification Innovation France na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego ze spożywaniem wyciągu z lipidów polarnych pszenicy na ochronę skóry przed odwodnieniem (pytanie nr EFSA-Q-2011-01122) (4). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Przyczynia się do polepszenia uwodnienia skóry”. |
|
(10) |
Dnia 5 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem wyciągu z lipidów polarnych pszenicy a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(11) |
W następstwie wniosku złożonego przez przedsiębiorstwo Lesaffre International/Lesaffre Human Care na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem Saccharomyces cerevisiae var. boulardii CNCM I-3799 na zmniejszenie dolegliwości żołądkowo-jelitowych (pytanie nr EFSA-Q-2012-00271) (5). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Saccharomyces cerevisiae var. boulardii CNCM I-3799 pomaga utrzymać komfort jelitowy”. |
|
(12) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że wykazanie związku przyczynowo-skutkowego pomiędzy spożywaniem Saccharomyces cerevisiae var. boulardii CNCM I-3799 a deklarowanym efektem nie było możliwe. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(13) |
W następstwie dwóch wniosków złożonych przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem połączenia tiaminy, ryboflawiny, niacyny, kwasu pantotenowego, pirydoksyny, D-biotyny i oleju z pestek dyni (Cucurbita pepo L.) na utrzymanie zdrowych włosów (pytania nr EFSA-Q-2012-00334 oraz EFSA-Q-2012-00335) (6). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Pomaga zwiększyć ilość włosów”. |
|
(14) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem połączenia tiaminy, ryboflawiny, niacyny, kwasu pantotenowego, pirydoksyny, D-biotyny i oleju z pestek dyni (Cucurbita pepo L.) a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(15) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem wyciągu z Rhodiola rosea L. na zmniejszenie zmęczenia psychicznego (pytanie nr EFSA-Q-2012-00336) (7). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Pomaga zmniejszyć zmęczenie w przypadku stresu”. |
|
(16) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem wyciągu z Rhodiola rosea L. a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(17) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem połączenia oleju z nasion lnu i witaminy E na funkcjonowanie bariery przepuszczalności skóry (pytanie nr EFSA-Q-2012-00337) (8). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Przyczynia się do utrzymania funkcjonowania bariery przepuszczalności skóry”. |
|
(18) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem połączenia oleju z nasion lnu i witaminy E a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(19) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem produktu Opti EFAX™ na utrzymanie prawidłowego stężenia cholesterolu LDL we krwi (pytanie nr EFSA-Q-2012-00339) (9). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Opti EFAX™ pomaga utrzymać korzystny dla zdrowia poziom cholesterolu LDL we krwi”. |
|
(20) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem produktu Opti EFAX™ a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(21) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem Opti EFAX™ na utrzymanie prawidłowego stężenia cholesterolu HDL w krwi (pytanie nr EFSA-Q-2012-00340) (10). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Opti EFAX™ pomaga utrzymać korzystny dla zdrowia poziom cholesterolu HDL we krwi”. |
|
(22) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem produktu Opti EFAX™ a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(23) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem spożywania preparatu KF2BL20, będącego połączeniem keratyny, miedzi, cynku, niacyny, kwasu pantotenowego, pirydoksyny i D-biotyny na utrzymanie zdrowych włosów (pytanie nr EFSA-Q-2012-00381) (11). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Pomaga utrzymać wytrzymałość włosów”. |
|
(24) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem KF2BL20 a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(25) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem kwasu hialuronowego na ochronę skóry przed odwodnieniem (pytanie nr EFSA-Q-2012-00382) (12). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Pomaga utrzymać dobre uwodnienie skóry”. |
|
(26) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem kwasu hialuronowego a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(27) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem produktu Opti EFAX™ na utrzymanie prawidłowego stężenia triglicerydów we krwi (pytanie nr EFSA-Q-2012-00383) (13). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Opti EFAX™ pomaga utrzymać korzystny dla zdrowia poziom triglicerydów we krwi”. |
|
(28) |
Dnia 17 lipca 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem produktu Opti EFAX™ a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(29) |
W następstwie wniosku złożonego przez przedsiębiorstwo Vivatech na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem produktu Transitech®, brzmiącego „polepsza tranzyt i go trwale reguluje” (pytanie nr EFSA-Q-2012-00296) (14). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Polepsza tranzyt i go trwale reguluje”. |
|
(30) |
Dnia 26 września 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że wykazanie związku przyczynowo-skutkowego pomiędzy spożywaniem produktu Transitech® a deklarowanym efektem nie było możliwe. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(31) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem produktu Femilub® na utrzymanie wilgotności pochwy (pytanie nr EFSA-Q-2012-00571) (15). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Pomaga zmniejszyć suchość pochwy”. |
|
(32) |
Dnia 26 września 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem produktu Femilub® a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(33) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem połączenia likopenu, witaminy E, luteiny i selenu na ochronę skóry przez uszkodzeniem spowodowanym przez promieniowanie UV (pytanie nr EFSA-Q-2012-00592) (16). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Pomaga przygotować czułą skórę od wewnątrz w celu polepszenia tolerancji na promieniowanie słoneczne”. |
|
(34) |
Dnia 27 września 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że nie wykazano związku przyczynowo-skutkowego pomiędzy spożywaniem połączenia likopenu, witaminy E, luteiny i selenu a deklarowanym efektem. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(35) |
W następstwie wniosku złożonego przez przedsiębiorstwo Glanbia Nutritionals plc na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem produktu Prolibra®, brzmiącego „pomaga zmniejszyć ilość tkanki tłuszczowej przy jednoczesnym zachowaniu chudej tkanki mięśniowej” (pytanie nr EFSA-Q-2012-00001) (17). Oświadczenie zaproponowane przez wnioskodawcę brzmiało następująco: „Pomaga zmniejszyć ilość tkanki tłuszczowej przy jednoczesnym zachowaniu chudej tkanki mięśniowej”. |
|
(36) |
Dnia 8 listopada 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której na podstawie przedstawionych danych stwierdzono, że wykazanie związku przyczynowo-skutkowego pomiędzy spożywaniem produktu Prolibra® a deklarowanym efektem nie było możliwe. W związku z powyższym, ponieważ oświadczenie nie spełnia wymogów rozporządzenia (WE) nr 1924/2006, nie należy udzielić zezwolenia na jego stosowanie. |
|
(37) |
W następstwie wniosku złożonego przez przedsiębiorstwo Nutrilinks Sarl na podstawie art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006 zwrócono się do Urzędu o wydanie opinii dotyczącej oświadczenia zdrowotnego związanego z wpływem produktu Eff EXT™, brzmiącego „przyczynia się do wspomagania funkcjonowania stawów, utrzymując niski poziom białka C-reaktywnego w osoczu” (pytanie nr EFSA-Q-2012-00386) (18). Oświadczenie zaproponowane przez wnioskodawcę brzmiało m.in. następująco: „Przyczynia się do wspomagania funkcjonowania stawów, utrzymując niski poziom białka C-reaktywnego w osoczu”. |
|
(38) |
Dnia 27 września 2012 r. Komisja i państwa członkowskie otrzymały od Urzędu opinię naukową, w której wskazano, że oświadczenie odnosi się do złagodzenia stanu zapalnego objawiającego się zmniejszonym stężeniem białka C-reaktywnego w osoczu, i w której na podstawie przedstawionych danych stwierdzono, że zmniejszenie stanu zapalnego w kontekście takich chorób jak zwyrodnienie stawów czy reumatoidalne zapalenie stawów jest celem terapeutycznym w ramach leczenia choroby. |
|
(39) |
Rozporządzenie (WE) nr 1924/2006 uzupełnia ogólne zasady zawarte w dyrektywie 2000/13/WE Parlamentu Europejskiego i Rady z dnia 20 marca 2000 r. w sprawie zbliżenia ustawodawstw państw członkowskich w zakresie etykietowania, prezentacji i reklamy środków spożywczych (19). W art. 2 ust. 1 lit. b) dyrektywy 2000/13/WE przewiduje się, że etykietowanie nie może przypisywać jakiemukolwiek środkowi spożywczemu właściwości zapobiegania chorobom lub leczenia chorób ludzi bądź też odwoływać się do takich właściwości. W związku z powyższym, ponieważ przypisywanie właściwości leczniczych środkom spożywczym jest zabronione, nie należy udzielić zezwolenia na stosowanie oświadczenia związanego z wpływem Eff EXT™. |
|
(40) |
Oświadczenie zdrowotne związane z wpływem produktu Eff EXT™ o brzmieniu „przyczynia się do wspomagania funkcjonowania stawów, utrzymując niski poziom białka C-reaktywnego w osoczu” przypisuje właściwości lecznicze środkowi spożywczemu będącemu przedmiotem oświadczenia i jest z tego powodu zabronione dla środków spożywczych. |
|
(41) |
Oświadczenie zdrowotne dotyczące produktu Prolibra®, brzmiące „Pomaga zmniejszyć ilość tkanki tłuszczowej przy jednoczesnym zachowaniu chudej tkanki mięśniowej” należy do oświadczeń zdrowotnych, o których mowa w art. 13 ust. 1 lit. c) rozporządzenia (WE) nr 1924/2006 i które są objęte okresem przejściowym określonym w art. 28 ust. 6 tego rozporządzenia. Ponieważ jednak wniosku nie złożono przed dniem 19 stycznia 2008 r., wymóg ustanowiony w art. 28 ust. 6 lit. b) wspomnianego rozporządzenia nie został spełniony, w związku z czym do oświadczenia tego nie można zastosować okresu przejściowego przewidzianego w tym artykule. |
|
(42) |
Pozostałe oświadczenia zdrowotne będące przedmiotem niniejszego rozporządzenia należą do oświadczeń zdrowotnych, o których mowa w art. 13 ust. 1 lit. a) rozporządzenia (WE) nr 1924/2006 i które są objęte okresem przejściowym określonym w art. 28 ust. 5 tego rozporządzenia do dnia przyjęcia wykazu dopuszczonych oświadczeń zdrowotnych, o ile są zgodne z przepisami wspomnianego rozporządzenia. |
|
(43) |
Wykaz dopuszczonych oświadczeń zdrowotnych ustanowiono rozporządzeniem Komisji (UE) nr 432/2012 (20) i jest on stosowany od dnia 14 grudnia 2012 r. W odniesieniu do oświadczeń, o których mowa w art. 13 ust. 5 rozporządzenia (WE) nr 1924/2006, w przypadku których Urząd nie zakończył procesu weryfikacji lub Komisja nie zakończyła procesu rozpatrywania do dnia 14 grudnia 2012 r. i które na mocy niniejszego rozporządzenia nie zostały włączone do wykazu dopuszczonych oświadczeń zdrowotnych, należy ustanowić okres przejściowy, w trakcie którego oświadczenia te mogą być nadal stosowane, aby umożliwić podmiotom prowadzącym przedsiębiorstwo spożywcze oraz właściwym organom krajowym dostosowanie się do zakazu stosowania takich oświadczeń. |
|
(44) |
Przy ustanawianiu środków przewidzianych w niniejszym rozporządzeniu uwzględniono uwagi wnioskodawców oraz przedstawicieli opinii publicznej zgłoszone Komisji na podstawie art. 16 ust. 6 rozporządzenia (WE) nr 1924/2006. |
|
(45) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt i ani Parlament Europejski, ani Rada nie wyraziły wobec nich sprzeciwu, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
1. Oświadczeń wymienionych w załączniku do niniejszego rozporządzenia nie włącza się do unijnego wykazu dopuszczonych oświadczeń, o którym mowa w art. 13 ust. 3 rozporządzenia (WE) nr 1924/2006.
2. Oświadczenia zdrowotne, o których mowa w ust. 1, stosowane przed wejściem w życie niniejszego rozporządzenia, mogą być mimo to nadal stosowane przez okres nieprzekraczający sześciu miesięcy od daty wejścia w życie niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 404 z 30.12.2006, s. 9.
(2) Dziennik EFSA 2011; 9(12):2476.
(3) Dziennik EFSA 2012; 10(5):2691.
(4) Dziennik EFSA 2012; 10(7):2773.
(5) Dziennik EFSA 2012; 10(7):2801.
(6) Dziennik EFSA 2012; 10(7):2807.
(7) Dziennik EFSA 2012; 10(7):2805.
(8) Dziennik EFSA 2012; 10(7):2819.
(9) Dziennik EFSA 2012; 10(7):2802.
(10) Dziennik EFSA 2012; 10(7):2803.
(11) Dziennik EFSA 2012; 10(7):2808.
(12) Dziennik EFSA 2012; 10(7):2806.
(13) Dziennik EFSA 2012; 10(7):2804.
(14) Dziennik EFSA 2012; 10(9):2887.
(15) Dziennik EFSA 2012; 10(9):2888.
(16) Dziennik EFSA 2012; 10(9):2890.
(17) Dziennik EFSA 2012; 10(11):2949.
(18) Dziennik EFSA 2012; 10(9):2889.
(19) Dz.U. L 109 z 6.5.2000, s. 29.
(20) Dz.U. L 136 z 25.5.2012, s. 1.
ZAŁĄCZNIK
Odrzucone oświadczenia zdrowotne
|
Wniosek – odpowiednie przepisy rozporządzenia (WE) nr 1924/2006 |
Składnik odżywczy, substancja, żywność lub kategoria żywności |
Oświadczenie |
Odniesienie do opinii EFSA |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Glukozamina |
Glukozamina przyczynia się do ochrony chrząstek stawowych narażonych na nadmierny ruch lub nadmierne obciążenie oraz zwiększa zasięg stawów |
Q-2011-00907 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Glukozamina |
Glukozamina przyczynia się do utrzymywania prawidłowych chrząstek stawowych |
Q-2011-01113 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Wyciąg z lipidów polarnych pszenicy |
Przyczynia się do polepszenia uwodnienia skóry |
Q-2011-01122 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Saccharomyces cerevisiae var. boulardii CNCM I-3799 |
Saccharomyces cerevisiae var. boulardii CNCM I-3799 pomaga utrzymać komfort jelitowy |
Q-2012-00271 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Połączenie tiaminy, ryboflawiny, niacyny, kwasu pantotenowego, pirydoksyny, D-biotyny i oleju z pestek dyni (Cucurbita pepo L.) |
Pomaga zwiększyć ilość włosów |
Q-2012-00334 oraz Q-2012-00335 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Wyciąg z Rhodiola rosea L. |
Pomaga zmniejszyć zmęczenie w przypadku stresu |
Q-2012-00336 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Połączenie oleju z nasion lnu i witaminy E |
Przyczynia się do utrzymania funkcjonowania bariery przepuszczalności skóry |
Q-2012-00337 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Opti EFAX™ |
Opti EFAX™ pomaga utrzymać korzystny dla zdrowia poziom cholesterolu LDL we krwi |
Q-2012-00339 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Opti EFAX™ |
Opti EFAX™ pomaga utrzymać korzystny dla zdrowia poziom cholesterolu HDL we krwi |
Q-2012-00340 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
KF2BL20 |
Pomaga utrzymać wytrzymałość włosów |
Q-2012-00381 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Kwas hialuronowy |
Pomaga utrzymać dobre uwodnienie skóry |
Q-2012-00382 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Opti EFAX™ |
Opti EFAX™ pomaga utrzymać korzystny dla zdrowia poziom triglicerydów we krwi |
Q-2012-00383 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Transitech® |
Polepsza tranzyt i go trwale reguluje |
Q-2012-00296 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Femilub® |
Pomaga zmniejszyć suchość pochwy |
Q-2012-00571 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Połączenie likopenu, witaminy E, luteiny i selenu |
Pomaga przygotować czułą skórę od wewnątrz w celu polepszenia tolerancji na promieniowanie słoneczne |
Q-2012-00592 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Prolibra® |
Pomaga zmniejszyć ilość tkanki tłuszczowej przy jednoczesnym zachowaniu chudej tkanki mięśniowej |
Q-2012-00001 |
|
Artykuł 13 ust. 5 – oświadczenie zdrowotne w oparciu o nowo uzyskane dowody naukowe lub wniosek o ochronę zastrzeżonych danych |
Eff EXT™ |
Przyczynia się do wspomagania funkcjonowania stawów utrzymując niski poziom białka C-reaktywnego w osoczu |
Q-2012-00386 |
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/56 |
ROZPORZĄDZENIE KOMISJI (UE) NR 1067/2013
z dnia 30 października 2013 r.
zmieniające rozporządzenie (WE) nr 1881/2006 w odniesieniu do najwyższych dopuszczalnych poziomów zanieczyszczeń: dioksyn, polichlorowanych bifenyli o właściwościach podobnych do dioksyn i polichlorowanych bifenyli o właściwościach niepodobnych do dioksyn w wątrobie zwierząt lądowych
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (EWG) nr 315/93 z dnia 8 lutego 1993 r. ustanawiające procedury Wspólnoty w odniesieniu do substancji skażających w żywności (1), w szczególności jego art. 2 ust. 3,
a także mając na uwadze, co następuje:
|
(1) |
W rozporządzeniu Komisji (WE) nr 1881/2006 z dnia 19 grudnia 2006 r. ustalającym najwyższe dopuszczalne poziomy niektórych zanieczyszczeń w środkach spożywczych (2) określono najwyższe dopuszczalne poziomy dioksyn i polichlorowanych bifenyli (PCB) o właściwościach podobnych do dioksyn w szeregu środków spożywczych, włącznie z wątrobą zwierząt lądowych. |
|
(2) |
Na wniosek Komisji Europejskiej panel ds. środków trujących w łańcuchu żywnościowym Europejskiego Urzędu ds. Bezpieczeństwa Żywności (EFSA) przyjął w dniu 5 lipca 2011 r. opinię w sprawie zagrożenia dla zdrowia publicznego związanego z obecnością wysokich poziomów dioksyn i dioksynopodobnych PCB w wątrobie owiec i jeleniowatych (3). |
|
(3) |
Komisja zażądała, by w opinii wskazano, czy zagrożenie dla zdrowia konsumentów może być większe dla podgrup populacji spożywających te produkty (np. konsumentów spożywających znaczne ilości tych produktów, osób stosujących specjalne diety itd.). W opinii należy także zbadać możliwe przyczyny stwierdzonych wysokich poziomów dioksyn i PCB w wątrobie owiec i jeleniowatych, a także przedstawić dane naukowe dotyczące stosowności ustanowienia w przyszłości regulacyjnych poziomów w wątrobie w przeliczeniu na produkt, a nie w przeliczeniu na tłuszcz. |
|
(4) |
Panel stwierdził, że regularne spożywanie wątroby owiec prowadzi do wzrostu narażenia na działanie dioksyn i dioksynopodobnych PCB średnio o 20 %. W indywidualnych przypadkach konsumpcja wątroby owiec może powodować wysokie pobranie przekraczające tolerowane tygodniowe pobranie (TWI) tych zanieczyszczeń. Panel uznał, że częste spożywanie wątroby owiec, w szczególności przez kobiety w wieku rozrodczym oraz dzieci, może stanowić potencjalne zagrożenie dla zdrowia. |
|
(5) |
Panel uznał ponadto, że gleba oraz osady naturalnie zawierają dioksyny i PCB. Przenoszenie dioksyn i PCB z gleby do roślin za pośrednictwem korzeni ma na ogół niewielkie znaczenie. W ostatnich latach w wielu próbkach wątroby owiec z różnych krajów europejskich wykryto wysokie stężenia dioksyn i PCB, chociaż nie powiązano ich z konkretnymi źródłami zanieczyszczenia. W przypadku owiec głównym czynnikiem narażenia jest wypas. Podczas wypasu może nastąpić pobranie gleby poprzez cząsteczki znajdujące się na warzywach lub bezpośrednio, w przypadku wyjadania traw pastwiskowych w pobliżu powierzchni podłoża. Pobranie gleby jest niezwykle zmienne i zdecydowanie sezonowe: odnotowano średnie pobranie gleby w wysokości około 8 % w suchej masie pobrania. Ogólnie rzecz biorąc, pobranie gleby może w znacznym stopniu przyczynić się do narażenia owiec na dioksyny i PCB. Dostępne są jedynie ograniczone dane dotyczące przenoszenia dioksyn lub PCB z paszy do wątroby owiec. W zależności od rozpatrywanych kongenerów: polichlorowanych dibenzo-p-dioksyn (PCDD), polichlorowanego dibenzofuranu (PCDF) lub PCB zgłaszane wskaźniki przenoszenia mieściły się w przedziale od 5 do 175 i były około 4 razy wyższe dla wątroby niż dla mięsa lub nerek. |
|
(6) |
EFSA stwierdził również, że wątroba owiec jest ważnym narządem magazynowania dioksyn i PCB. Stosunkowo wysokie magazynowanie dioksyn i związków pokrewnych w wątrobie owiec w porównaniu do wątroby bydła może częściowo tłumaczyć różnice w metabolizmie. |
|
(7) |
EFSA stwierdził, że nawet gdyby możliwa była sekwestracja w wątrobie, tzn. dioksyny i PCB nie byłyby całkowicie wiązane z frakcją tłuszczową wątroby, nie miałoby to wpływu na wynik wyrażony w przeliczeniu na tłuszcz ani na świeżą masę, ponieważ w trakcie procedury analitycznej ekstrahowane są wszystkie dioksyny i PCB, niezależnie od kompartmentu wątroby, w którym się znajdują. |
|
(8) |
Komisja wezwała laboratorium referencyjne Unii Europejskiej ds. dioksyn i PCB w paszy i żywności do zbadania, w jaki sposób różne metody ekstrakcji wpływają na poziom dioksyn i PCB w wątrobie owiec w odniesieniu do podawania wyniku analitycznego w przeliczeniu na tłuszcz lub na świeżą masę. Laboratorium referencyjne UE stwierdziło, że zmiany stężeń dioksyn i PCB są znacznie wyższe w przeliczeniu na tłuszcz niż na świeżą masę. Stężenia dioksyn i PCB w przeliczeniu na tłuszcz w wątrobie owiec zależały od zastosowanej metody ekstrakcji lub rozpuszczalników, a w związku z tym od wynikającej z nich zawartości tłuszczu. Przy porównywaniu wyników w świeżej masie poziomy dioksyn i PCB były dość porównywalne. |
|
(9) |
Dlatego też, aby zapewnić porównywalność wyników i jednolite podejście w całej UE w odniesieniu do dioksyn i PCB w wątrobie zwierząt lądowych, należy ustanowić najwyższe dopuszczalne poziomy w przeliczeniu na świeżą masę, jak te już ustanowione dla wątroby rybiej i produktów z niej pochodzących. |
|
(10) |
Należy wprowadzić przepis, zgodnie z którym te najwyższe dopuszczalne poziomy nie mają zastosowania do środków spożywczych wprowadzonych zgodnie z prawem do obrotu przed datą rozpoczęcia stosowania. |
|
(11) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Przepisy zmieniające
W załączniku do rozporządzenia (WE) nr 1881/2006 pkt 5.2 otrzymuje brzmienie:
|
„5.2 |
Wątroba zwierząt lądowych, o których mowa w pkt 5.1, z wyjątkiem owiec, i produkty z niej pochodzące |
0,30 pg/g świeżej masy |
0,50 pg/g świeżej masy |
3,0 ng/g świeżej masy |
|
|
Wątroba owiec i produkty z niej pochodzące |
1,25 pg/g świeżej masy |
2,00 pg/g świeżej masy |
3,0 ng/g świeżej masy” |
Artykuł 2
Przepisy przejściowe
1. Niniejsze rozporządzenie nie ma zastosowania do produktów, które zostały wprowadzone do obrotu przed dniem 1 stycznia 2014 r. zgodnie z przepisami obowiązującymi w dniu wprowadzenia do obrotu.
2. Ciężar udowodnienia, kiedy produkty zostały wprowadzone do obrotu, spoczywa na przedsiębiorcy branży spożywczej.
Artykuł 3
Wejście w życie i stosowanie
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie stosuje się od dnia 1 stycznia 2014 r.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 37 z 13.2.1993, s. 1.
(2) Dz.U. L 364 z 20.12.2006, s. 5.
(3) Panel EFSA ds. środków trujących w łańcuchu żywnościowym (Contam); „Scientific Opinion on the risk to public health related to the presence of high levels of dioxins and dioxin-like PCBs in liver from sheep and deer” (Opinia naukowa na temat ryzyka dla zdrowia publicznego związanego z obecnością wysokich poziomów dioksyn i dioksynopodobnych PCB w wątrobie owiec i jeleniowatych). Dziennik EFSA 2011; 9(7):2297 [71 ss.]. doi:10.2903/j.efsa.2011.2297. Dostępne na stronie internetowej: www.efsa.europa.eu/efsajournal
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/58 |
ROZPORZĄDZENIE KOMISJI (UE) NR 1068/2013
z dnia 30 października 2013 r.
zmieniające załącznik II do rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 1333/2008 w odniesieniu do stosowania difosforanów (E 450), trifosforanów (E 451) oraz polifosforanów (E 452) w rybach solonych na mokro
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 1333/2008 z dnia 16 grudnia 2008 r. w sprawie dodatków do żywności (1), w szczególności jego art. 10 ust. 3 oraz art. 30 ust. 5,
a także mając na uwadze, co następuje:
|
(1) |
W załączniku II do rozporządzenia (WE) nr 1333/2008 ustanowiono unijny wykaz dodatków do żywności dopuszczonych do stosowania w żywności oraz warunki ich stosowania. |
|
(2) |
Wykaz ten może zostać zmieniony zgodnie z procedurą, o której mowa w rozporządzeniu Parlamentu Europejskiego i Rady (WE) nr 1331/2008 z dnia 16 grudnia 2008 r. ustanawiającym jednolitą procedurę wydawania zezwoleń na stosowanie dodatków do żywności, enzymów spożywczych i środków aromatyzujących (2). |
|
(3) |
Zgodnie z art. 3 ust. 1 rozporządzenia (WE) nr 1331/2008 unijny wykaz dodatków do żywności może być aktualizowany z inicjatywy Komisji albo na podstawie wniosku. |
|
(4) |
W dniu 19 czerwca 2009 r. złożono wniosek o zezwolenie na stosowanie difosforanów (E 450), trifosforanów (E 451) oraz polifosforanów (E 452) w rybach solonych na mokro i udostępniono go państwom członkowskim. |
|
(5) |
Ryby można peklować i konserwować poprzez dodanie do surowca dużej ilości soli. Proces solenia rozwinięto z jednoetapowego do wieloetapowego procesu obejmującego etap solenia wstępnego, który umożliwia skrócenie okresu solenia i uzyskanie stosunkowo jednolitego stężenia soli w mięsie ryb. W tym celu ryby soli się wstępnie poprzez wstrzyknięcie lub zanurzenie w przygotowanej solance o kontrolowanym stężeniu soli. Następnie ryby soli się na sucho (rodzaj peklowania), aby uzyskać odpowiednie stężenie soli w produkcie końcowym. |
|
(6) |
W tym długim procesie konserwacji nadal może występować utlenianie, zwłaszcza w przypadku lipidów obecnych w mięsie ryb. Prowadzi to do zmiany koloru, smaku i zapachu. Utlenianie przyspiesza działanie jonów metali obecnych w mięsie ryb i stosowanej soli. Udowodniono, że difosforany (E 450), trifosforany E 451) i polifosforany (E 452), które tworzą związki chemiczne z jonami metali, są najbardziej skuteczne w ochronie ryb solonych przed utlenianiem. Większość dodanych fosforanów i soli usuwa się poprzez moczenie w wodzie przed spożyciem. Zawartość wody w ostatecznym produkcie solonym na mokro nie zwiększa się poprzez stosowanie fosforanów. Szczególnie duży popyt na ryby solone o zachowanym oryginalnym kolorze i smaku występuje na rynkach Hiszpanii, Włoch i Grecji. |
|
(7) |
Zgodnie z art. 3 w związku z art. 6 ust. 4 dyrektywy 2000/13/WE Parlamentu Europejskiego i Rady z dnia 20 marca 2000 r. w sprawie zbliżenia ustawodawstw państw członkowskich w zakresie etykietowania, prezentacji i reklamy środków spożywczych (3) stosowanie fosforanów w rybach solonych na mokro musi być oznakowane w wykazie składników. Przedsiębiorstwa sektora spożywczego mogą również oznaczać na swoich produktach, że nie stosowano polifosforanów. |
|
(8) |
Ponieważ większość dodanych fosforanów usuwa się podczas moczenia w wodzie, narażenie konsumenta na fosforany będzie minimalne i dlatego też nie mają one wpływu na zdrowie ludzi. Należy zatem zezwolić na stosowanie difosforanów (E 450), trifosforanów (E 451) oraz polifosforanów (E 452) do konserwacji ryb solonych na mokro. |
|
(9) |
Zgodnie z art. 3 ust. 2 rozporządzenia (WE) nr 1331/2008 Komisja powinna zasięgnąć opinii Europejskiego Urzędu ds. Bezpieczeństwa Żywności w celu uaktualnienia unijnego wykazu dodatków do żywności określonego w załączniku II do rozporządzenia (WE) nr 1333/2008, z wyjątkiem przypadków gdy dana aktualizacja nie ma wpływu na zdrowie człowieka. Ponieważ zezwolenie na stosowanie difosforanów (E 450), trifosforanów (E 451) oraz polifosforanów (E 452) do konserwacji ryb solonych na mokro stanowi aktualizację tego wykazu niemającą wpływu na zdrowie ludzkie, zasięgnięcie opinii Europejskiego Urzędu ds. Bezpieczeństwa Żywności nie jest konieczne. |
|
(10) |
Bacalhau, czyli dorsz portugalski, jest produkowany poprzez dalsze suszenie ryb solonych na mokro. Stosowanie polifosforanów może mieć wpływ na ten proces suszenia. Ponadto ich stosowanie mogłoby również utrudniać uzyskanie typowego koloru i smaku bacalhau. Ryby solone, w przypadku których stosowano fosforany, nie są w związku z tym pożądane przez producentów tradycyjnego bacalhau. W celu umożliwienia producentom tradycyjnego bacalhau dostosowania się do sytuacji, w której można wprowadzać do obrotu ryby poddane działaniu fosforanów, należy zaproponować okres przejściowy. W okresie tym producenci tradycyjnego bacalhau mogą zawierać umowy z dostawcami oraz zapoznawać się z metodami analitycznymi, które można stosować do kontroli obecności dodanych fosforanów w rybach. |
|
(11) |
Aby dokładniej ocenić wpływ na dostępność ryb solonych na mokro do produkcji bacalhau, Komisja, w ciągu trzech lat będzie monitorować stosowanie polifosforanów w głównych państwach produkujących dorsza solonego. |
|
(12) |
Należy zatem odpowiednio zmienić załącznik II do rozporządzenia (WE) nr 1333/2008. |
|
(13) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
W załączniku II do rozporządzenia (WE) nr 1333/2008 wprowadza się zmiany zgodnie z załącznikiem do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 354 z 31.12.2008, s. 16.
(2) Dz.U. L 354 z 31.12.2008, s. 1.
(3) Dz.U. L 109 z 6.5.2000, s. 29.
ZAŁĄCZNIK
W części E załącznika II do rozporządzenia (WE) nr 1333/2008 w kategorii żywności 09.2 „Przetworzone ryby i produkty rybołówstwa, w tym mięczaki i skorupiaki” po wpisie dotyczącym E 392 dodaje się następujące wpisy:
|
|
„E 450 |
Difosforany |
5 000 |
(4), (79) |
Tylko ryby solone z rodziny Gadidae, które poddano soleniu wstępnemu poprzez wstrzyknięcie lub zanurzenie w solance o stężeniu soli co najmniej 18 %, po którym często następuje solenie na sucho |
Okres stosowania: Od dnia 31 grudnia 2013 r. |
||
|
|
E 451 |
Trifosforany |
5 000 |
(4), (79) |
Tylko ryby solone z rodziny Gadidae, które poddano soleniu wstępnemu poprzez wstrzyknięcie lub zanurzenie w solance o stężeniu soli co najmniej 18 %, po którym często następuje solenie na sucho |
Okres stosowania: od dnia 31 grudnia 2013 r. |
||
|
|
E 452 |
Polifosforany |
5 000 |
(4), (79) |
Tylko ryby solone z rodziny Gadidae, które poddano soleniu wstępnemu poprzez wstrzyknięcie lub zanurzenie w solance o stężeniu soli co najmniej 18 %, po którym często następuje solenie na sucho |
Okres stosowania: Od dnia 31 grudnia 2013 r. |
||
|
|
|
|||||||
|
||||||||
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/61 |
ROZPORZĄDZENIE KOMISJI (UE) NR 1069/2013
z dnia 30 października 2013 r.
zmieniające załącznik II do rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 1333/2008 w odniesieniu do stosowania fosforanów sodu (E 339) w osłonkach naturalnych do kiełbas
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 1333/2008 z dnia 16 grudnia 2008 r. w sprawie dodatków do żywności (1), w szczególności jego art. 10 ust. 3 oraz art. 30 ust. 5,
a także mając na uwadze, co następuje:
|
(1) |
W załączniku II do rozporządzenia (WE) nr 1333/2008 ustanowiono unijny wykaz dodatków do żywności dopuszczonych do stosowania w żywności oraz warunki ich stosowania. |
|
(2) |
Wykaz ten może zostać zmieniony, z inicjatywy Komisji albo na podstawie wniosku, zgodnie z jednolitą procedurą, o której mowa w art. 3 ust. 1 rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 1331/2008 z dnia 16 grudnia 2008 r. ustanawiającego jednolitą procedurę wydawania zezwoleń na stosowanie dodatków do żywności, enzymów spożywczych i środków aromatyzujących (2). |
|
(3) |
W dniu 26 sierpnia 2010 r. złożono wniosek o zezwolenie na stosowanie fosforanów sodu (E 339) jako regulatora kwasowości w osłonkach naturalnych do kiełbas i udostępniono go państwom członkowskim. |
|
(4) |
Fosforany sodu (E 339) są włączone do unijnego wykazu dodatków do żywności i zezwolono na ich stosowanie w określonej żywności, która nie obejmuje osłonek naturalnych do kiełbas. |
|
(5) |
Istotną cechą mechaniczną osłonek naturalnych do kiełbas, zmniejszającą ich skuteczność i stwarzającą problemy wytwórcom kiełbas, jest pękanie osłonek podczas napełniania i zmniejszenie poślizgu (zwiększona lepkość) osłonek na nadziewarce do kiełbas. |
|
(6) |
Udowodniono, że fosforany sodu (E 339) stosowane jako regulator kwasowości są odpowiednie do poprawy poślizgu osłonek naturalnych, ułatwiając proces napełniania kiełbas i zmniejszając maksymalną siłę i naprężenie zrywające osłonki. |
|
(7) |
Najwyższe tolerowane dzienne pobranie fosforanów określone przez Komitet Naukowy ds. Żywności (3) wynosi 70 mg/kg masy ciała. Najwyższy dopuszczalny poziom proponowany przez wnioskodawcę wynosi 12 600 mg/kg osłonki, co prowadzi do maksymalnej zawartości fosforanów w produkcie końcowym (wynikającej z przeniesienia z osłonki) wynoszącej 250 mg/kg. Maksymalny odsetek fosforanów przeniesionych za pośrednictwem osłonek naturalnych, do których je zastosowano, wyniesie 2,1 % najwyższego tolerowanego dziennego pobrania. Należy zatem zezwolić na stosowanie fosforanów sodu jako regulatora kwasowości w celu poprawy właściwości mechanicznych osłonek do kiełbas. |
|
(8) |
Zgodnie z art. 3 ust. 2 rozporządzenia (WE) nr 1331/2008 Komisja powinna zasięgnąć opinii Europejskiego Urzędu ds. Bezpieczeństwa Żywności w celu uaktualnienia unijnego wykazu dodatków do żywności określonego w załączniku II do rozporządzenia (WE) nr 1333/2008, z wyjątkiem przypadków gdy dana aktualizacja nie ma wpływu na zdrowie człowieka. Ponieważ zezwolenie na stosowanie fosforanów sodu (E 339) do poprawy właściwości mechanicznych osłonek naturalnych do kiełbas stanowi aktualizację tego wykazu niemającą wpływu na zdrowie człowieka, zasięgnięcie opinii Europejskiego Urzędu ds. Bezpieczeństwa Żywności nie jest konieczne. |
|
(9) |
Należy zatem odpowiednio zmienić załącznik II do rozporządzenia (WE) nr 1333/2008. |
|
(10) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
W załączniku II do rozporządzenia (WE) nr 1333/2008 wprowadza się zmiany zgodnie z załącznikiem do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 354 z 31.12.2008, s. 16.
(2) Dz.U. L 354 z 31.12.2008, s. 1.
(3) Sprawozdania Komitetu Naukowego ds. Żywności, seria dwudziesta piąta (s. 13), 1991 r., dostępne na stronie http://ec.europa.eu/food/fs/sc/scf/reports/scf_reports_25.pdf
ZAŁĄCZNIK
W części E załącznika II do rozporządzenia (WE) nr 1333/2008 w kategorii żywności 08.2.3 „Osłonki i powłoki oraz dekoracje mięsa” po pozycji dotyczącej E 338-452 dodaje się następującą pozycję:
|
|
„E 339 |
Fosforany sodu |
12 600 |
(4) (80) |
tylko w naturalnych osłonkach do kiełbas |
||
|
|
|
|
|||||
|
|
|
|
|||||
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/63 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 1070/2013
z dnia 30 października 2013 r.
ustanawiające standardowe wartości w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (WE) nr 1234/2007 z dnia 22 października 2007 r. ustanawiające wspólną organizację rynków rolnych oraz przepisy szczegółowe dotyczące niektórych produktów rolnych („rozporządzenie o jednolitej wspólnej organizacji rynku”) (1),
uwzględniając rozporządzenie wykonawcze Komisji (UE) nr 543/2011 z dnia 7 czerwca 2011 r. ustanawiające szczegółowe zasady stosowania rozporządzenia Rady (WE) nr 1234/2007 w odniesieniu do sektorów owoców i warzyw oraz przetworzonych owoców i warzyw (2), w szczególności jego art. 136 ust. 1,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie wykonawcze (UE) nr 543/2011 przewiduje – zgodnie z wynikami wielostronnych negocjacji handlowych Rundy Urugwajskiej – kryteria, na których podstawie ustalania Komisja ustala standardowe wartości dla przywozu z państw trzecich, w odniesieniu do produktów i okresów określonych w części A załącznika XVI do wspomnianego rozporządzenia. |
|
(2) |
Standardowa wartość w przywozie jest obliczana każdego dnia roboczego, zgodne z art. 136 ust. 1 rozporządzenia wykonawczego (UE) nr 543/2011, przy uwzględnieniu podlegających zmianom danych dziennych. Niniejsze rozporządzenie powinno zatem wejść w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Standardowe wartości celne w przywozie, o których mowa w art. 136 rozporządzenia wykonawczego (UE) nr 543/2011, są ustalone w załączniku do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji, za Przewodniczącego,
Jerzy PLEWA
Dyrektor Generalny ds. Rolnictwa i Rozwoju Obszarów Wiejskich
(1) Dz.U. L 299 z 16.11.2007, s. 1.
(2) Dz.U. L 157 z 15.6.2011, s. 1.
ZAŁĄCZNIK
Standardowe wartości w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
|
(EUR/100 kg) |
||
|
Kod CN |
Kod państw trzecich (1) |
Standardowa wartość w przywozie |
|
0702 00 00 |
AL |
41,5 |
|
MA |
43,1 |
|
|
MK |
43,1 |
|
|
TR |
75,3 |
|
|
ZZ |
50,8 |
|
|
0707 00 05 |
EG |
207,6 |
|
MK |
69,6 |
|
|
TR |
139,0 |
|
|
ZZ |
138,7 |
|
|
0709 93 10 |
TR |
112,3 |
|
ZZ |
112,3 |
|
|
0805 50 10 |
AR |
12,9 |
|
CL |
81,7 |
|
|
TR |
76,3 |
|
|
ZA |
55,9 |
|
|
ZZ |
56,7 |
|
|
0806 10 10 |
BR |
220,8 |
|
TR |
170,3 |
|
|
ZZ |
195,6 |
|
|
0808 10 80 |
CL |
216,7 |
|
NZ |
142,8 |
|
|
US |
154,3 |
|
|
ZA |
141,7 |
|
|
ZZ |
163,9 |
|
|
0808 30 90 |
CN |
76,9 |
|
TR |
120,5 |
|
|
ZZ |
98,7 |
|
(1) Nomenklatura krajów ustalona w rozporządzeniu Komisji (WE) nr 1833/2006 (Dz.U. L 354 z 14.12.2006, s. 19). Kod „ZZ” odpowiada „innym pochodzeniom”.
DECYZJE
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/65 |
DECYZJA WYKONAWCZA KOMISJI
z dnia 29 października 2013 r.
zatwierdzająca ograniczenia dotyczące zezwolenia dla jednego produktu biobójczego zawierającego bromadiolon, zgłoszone przez Niemcy zgodnie z dyrektywą 98/8/WE Parlamentu Europejskiego i Rady
(notyfikowana jako dokument nr C(2013) 7034)
(Jedynie tekst w języku niemieckim jest autentyczny)
(2013/630/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę 98/8/WE Parlamentu Europejskiego i Rady z dnia 16 lutego 1998 r. dotyczącą wprowadzania do obrotu produktów biobójczych (1), w szczególności jej art. 4 ust. 4,
a także mając na uwadze, co następuje:
|
(1) |
Załącznik I do dyrektywy 98/8/WE zawiera wykaz substancji czynnych zatwierdzonych na szczeblu unijnym do stosowania w produktach biobójczych. Dyrektywą Komisji 2009/92/WE (2), dodano substancję czynną bromadiolon do stosowania w produktach typu 14, „rodentycydy”, zgodnie z definicją w załączniku V do dyrektywy 98/8/WE. |
|
(2) |
Bromadiolon jest antykoagulującym rodentycydem, który stanowi zagrożenie związane z przypadkowymi zdarzeniami z udziałem dzieci, a także zagrożenie dla zwierząt innych niż docelowe i środowiska. Został on określony jako potencjalnie trwały, podatny na bioakumulację i toksyczny („PBT”) lub bardzo trwały i bardzo podatny na bioakumulację („vPvB”). |
|
(3) |
Ze względów zdrowia publicznego i higieny uznano jednak za zasadne włączenie bromadiolonu i innych antykoagulujących rodentycydów do załącznika I do dyrektywy 98/8/WE, umożliwiając państwom członkowskim udzielanie zezwoleń dla produktów opartych na bromadiolonie. Dyrektywa 2009/92/WE zobowiązuje jednak państwa członkowskie do zminimalizowania zagrożenia związanego z pierwotnym i wtórnym narażeniem ludzi, zwierząt innych niż docelowe i środowiska poprzez uwzględnienie i zastosowanie wszystkich stosownych i dostępnych środków ograniczających zagrożenie przy udzielaniu zezwolenia dla produktów zawierających bromadiolon. W związku z tym środki ograniczające zagrożenie, o których mowa w dyrektywie 2009/92/WE, obejmują, między innymi, ograniczenie wyłącznie do celów profesjonalnych. |
|
(4) |
Przedsiębiorstwo Lipha Tech S.A.S. („wnioskodawca”) przedłożyło w Niderlandach, zgodnie z art. 8 dyrektywy 98/8/WE, wniosek dotyczący zezwolenia dla jednego rodentycydu zawierającego bromadiolon („produkt”). Nazwa i numery referencyjne produktu w rejestrze produktów biobójczych wymieniono w załączniku do niniejszej decyzji. |
|
(5) |
Niderlandy wydały zezwolenie w dniu 2 listopada 2012 r. Zezwolenie dla produktu obejmowało ograniczenia, których celem było spełnienie warunków art. 5 dyrektywy 98/8/WE w Niderlandach. Ograniczenia te nie obejmowały ograniczenia polegającego na stosowaniu produktów wyłącznie przez wyszkolonych użytkowników profesjonalnych lub użytkowników profesjonalnych posiadających licencję. |
|
(6) |
W dniu 20 grudnia 2012 r. wnioskodawca złożył w Niemczech kompletny wniosek dotyczący wzajemnego uznania pierwszego zezwolenia dla produktu. |
|
(7) |
W dniu 10 kwietnia 2013 r. Niemcy powiadomiły Komisję, pozostałe państwa członkowskie i wnioskodawcę o swoim wniosku dotyczącym ograniczenia pierwszego zezwolenia zgodnie z art. 4 ust. 4 dyrektywy 98/8/WE. Niemcy zaproponowały nałożenie na produkt ograniczenia polegającego na stosowaniu go wyłącznie przez wyszkolonych użytkowników profesjonalnych lub użytkowników profesjonalnych posiadających licencję. |
|
(8) |
Komisja zwróciła się do pozostałych państw członkowskich i wnioskodawcy o przedłożenie pisemnych uwag dotyczących powiadomienia w terminie 90 dni zgodnie z art. 27 ust. 1 dyrektywy 98/8/WE. Nie przedłożono żadnych uwag w tym terminie. Powiadomienie zostało również omówione przez przedstawicieli Komisji i właściwych organów państw członkowskich ds. produktów biobójczych podczas spotkania grupy ds. zatwierdzania i wzajemnego uznawania produktów w dniu 14 maja 2013 r. |
|
(9) |
Zgodnie z dyrektywą 2009/92/WE zezwolenia dla produktów biobójczych zawierających bromadiolon podlegają wszystkim stosownym i dostępnym środkom ograniczającym zagrożenie, w tym ograniczeniu stosowania produktu wyłącznie do celów profesjonalnych. W ocenie naukowej, zgodnie z którą przyjęto dyrektywę 2009/92/WE, stwierdzono, że jedynie od użytkowników profesjonalnych można oczekiwać stosowania się do instrukcji mających na celu ograniczenie zagrożenia wtórnego zatrucia zwierząt innych niż docelowe i stosowania produktów w sposób, który zapobiega wystąpieniu i rozprzestrzenianiu się odporności na te środki. Ograniczenie do użytkowników profesjonalnych należy zatem zasadniczo uznać za stosowny środek ograniczający zagrożenie, w szczególności w państwach członkowskich, w których występuje oporność na bromadiolon. |
|
(10) |
Przy braku przeciwwskazań ograniczenie do użytkowników profesjonalnych jest zatem stosownym i dostępnym środkiem ograniczającym zagrożenie w odniesieniu do udzielania zezwoleń na produkty zawierające bromadiolon w Niemczech. Wniosek ten potwierdzają argumenty przedstawione przez Niemcy, zgodnie z którymi stwierdzono odporność na bromadiolon u szczurów i uważa się, że rozwija się ona w tym kraju. Ponadto Niemcy mają dobrze funkcjonującą infrastrukturę wyszkolonych służb zwalczania szkodników, a także użytkowników profesjonalnych posiadających licencję, takich jak rolnicy, ogrodnicy i leśnicy, którzy przeszli szkolenie zawodowe, co oznacza, że proponowane ograniczenie nie będzie utrudniać zapobiegania zakażeniom. |
|
(11) |
Środki przewidziane w niniejszej decyzji są zgodne z opinią Stałego Komitetu ds. Produktów Biobójczych, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Niemcy mogą ograniczyć zezwolenie udzielone zgodnie z art. 4 dyrektywy 98/8/WE w odniesieniu do produktu wymienionego w załączniku do niniejszej decyzji do stosowania wyłącznie przez wyszkolonych użytkowników profesjonalnych lub użytkowników profesjonalnych posiadających licencję.
Artykuł 2
Niniejsza decyzja skierowana jest do Republiki Federalnej Niemiec.
Sporządzono w Brukseli dnia 29 października 2013 r.
W imieniu Komisji
Janez POTOČNIK
Członek Komisji
(1) Dz.U. L 123 z 24.4.1998, s. 1.
(2) Dyrektywa Komisji 2009/92/WE z dnia 31 lipca 2009 r. zmieniająca dyrektywę 98/8/WE Parlamentu Europejskiego i Rady w celu włączenia bromadiolonu jako substancji czynnej do załącznika I do tej dyrektywy (Dz.U. L 201 z 1.8.2009, s. 43).
ZAŁĄCZNIK
Produkty, w odniesieniu do których Niemcy mogą ograniczyć zezwolenia udzielone zgodnie z art. 4 dyrektywy 98/8/WE do stosowania wyłącznie przez wyszkolonych użytkowników profesjonalnych lub użytkowników profesjonalnych posiadających licencję:
|
Nazwa produktu w Niderlandach |
Numer referencyjny wniosku Niderlandów w rejestrze produktów biobójczych |
Nazwa produktu w Niemczech |
Numer referencyjny wniosku Niemiec w rejestrze produktów biobójczych |
|
Maki Pat’ |
2011/4329/10506/NL/AA/20379 |
Maki Pat’ |
2011/4329/10506/de/ma/20799 |
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/68 |
DECYZJA KOMISJI
z dnia 29 października 2013 r.
w sprawie ustalenia zgodności stawek jednostkowych w strefach pobierania opłat na rok 2014 na podstawie art. 17 rozporządzenia wykonawczego Komisji (UE) nr 391/2013
(notyfikowana jako dokument nr C(2013) 7095)
(2013/631/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 550/2004 Parlamentu Europejskiego i Rady z dnia 10 marca 2004 r. w sprawie zapewniania służb żeglugi powietrznej w Jednolitej Europejskiej Przestrzeni Powietrznej (rozporządzenie w sprawie zapewniania służb) (1), w szczególności jego art. 15,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie wykonawcze Komisji (UE) nr 391/2013 (2) ustanawia wspólny system opłat za korzystanie ze służb żeglugi powietrznej. Wspólny system opłat jest integralnym elementem realizacji celów systemu skuteczności działania ustanowionego na mocy art. 11 rozporządzenia (WE) nr 549/2004 Parlamentu Europejskiego i Rady (3) oraz rozporządzenia wykonawczego Komisji (UE) nr 390/2013 (4). |
|
(2) |
Decyzja Komisji 2011/121/UE (5) ustanawia ogólnounijne docelowe parametry skuteczności działania, w tym cel w zakresie efektywności pod względem kosztów dla zapewniania służb żeglugi powietrznej na lata 2012–2014. Pismami z dnia 19 lipca 2012 r. i 17 grudnia 2012 r. Komisja poinformowała państwa członkowskie, że ich zrewidowane plany skuteczności działania i docelowe parametry są spójne z przyjętymi ogólnounijnymi docelowymi parametrami skuteczności działania oraz wnoszą odpowiedni wkład na rzecz ich realizacji. Docelowe parametry efektywności kosztowej wyrażane są w określonych stawkach jednostkowych. |
|
(3) |
Art. 17 ust. 1 lit. c) rozporządzenia wykonawczego (UE) nr 391/2013 przewiduje dokonanie przez Komisję oceny stawek jednostkowych w strefach pobierania opłat na rok 2014, przedłożonych jej przez państwa członkowskie do dnia 1 czerwca 2013 r. zgodnie z wymogami art. 9 ust. 1 i 2 wspomnianego rozporządzenia. W ramach tej oceny sprawdzana jest zgodność stawek jednostkowych na rok 2014 z przepisami rozporządzeń wykonawczych (UE) nr 390/2013 i (UE) nr 391/2013. |
|
(4) |
Komisja przeprowadziła ocenę stawek jednostkowych w strefach pobierania opłat na rok 2014 przy wsparciu ze strony organu weryfikującego skuteczność działania (PRB) i Centralnego Biura Opłat Trasowych organizacji Eurocontrol oraz z wykorzystaniem danych i dodatkowych informacji dostarczonych przez państwa członkowskie do czerwca 2013 r. Przy ocenie uwzględniono również wyjaśnienia i korekty dokonane przed spotkaniem konsultacyjnym, które odbyło się w dniu 26 czerwca 2013 r., w zastosowaniu art. 9 ust. 1 rozporządzenia wykonawczego (UE) nr 391/2013, jak również późniejszą korespondencję między Komisją a Danią, Estonią, Irlandią, Hiszpanią, Francją, Włochami, Węgrami, Maltą, Niderlandami, Rumunią, Szwecją i Zjednoczonym Królestwem. |
|
(5) |
Dania, Francja, Włochy, Niderlandy i Rumunia zaproponowały częściowe lub pełne skompensowanie korekt przewidzianych zgodnie z rozporządzeniem wykonawczym (UE) nr 391/2013, czego skutkiem będzie obniżenie lub utrzymanie określonego poziomu stawki jednostkowej, co leży w interesie użytkowników przestrzeni powietrznej. W związku z tym przedmiotowe kwoty nie powinny być odzyskiwane w kolejnych latach. |
|
(6) |
Komisja odnotowuje, że Hiszpania zamierza zastosować przepis przejściowy zgodnie z art. 2 rozporządzenia Komisji (UE) nr 1191/2010 (6). Komisja zweryfikowała informacje przedstawione w tym względzie przez Hiszpanię i zgadza się, że Hiszpania spełnia warunki określone w art. 2 rozporządzenia (UE) nr 1191/2010 i może podjąć decyzję o wyłączeniu ustalonych kosztów instytucji zapewniających służby żeglugi powietrznej spod art. 11a ust. 3 rozporządzenia Komisji (WE) nr 1794/2006 (7). W związku z tym mechanizm podziału ryzyka związanego z ruchem między instytucjami zapewniającymi służby żeglugi powietrznej i użytkownikami przestrzeni powietrznej w stosunku 30/70 odnośnie do zysków lub strat, które wynikają z różnicy między faktycznymi jednostkami usługowymi a prognozowanymi jednostkami usługowymi, należy stosować już od progu 0 % różnicy zamiast 2 % różnicy. Zgodnie z art. 2 rozporządzenia (UE) nr 1191/2010 oraz z uwzględnieniem redukcji stawki jednostkowej podjętej przez Hiszpanię dla roku 2012, przedmiotowe wyłączenie jest ograniczone do podziału ryzyka związanego z ruchem w odniesieniu do dochodów ze wspomnianego roku. Hiszpania zamierza rozłożyć wynikające z powyższego przeniesienie na kolejne lata, począwszy od roku 2015. |
|
(7) |
Artykuł 17 ust. 1 lit. d) rozporządzenia wykonawczego (UE) nr 391/2013 stanowi, że w przypadku gdy stawki jednostkowe są zgodne z przepisami rozporządzeń wykonawczych (UE) nr 390/2013 i (UE) nr 391/2013, Komisja powiadamia o tym zainteresowane państwa członkowskie. |
|
(8) |
Powiadomienie o zgodności stawek jednostkowych w strefach pobierania opłat z przepisami rozporządzeń wykonawczych (UE) nr 390/2013 i (UE) nr 391/2013 powinno pozostawać bez uszczerbku dla art. 16 rozporządzenia (WE) nr 550/2004, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Stawki jednostkowe w strefach pobierania opłat na rok 2014 określone w załączniku do niniejszej decyzji są zgodne z przepisami rozporządzeń wykonawczych (UE) nr 390/2013 i (UE) nr 391/2013.
Artykuł 2
Powiadomienie o zgodności stawek jednostkowych w strefach pobierania opłat z przepisami rozporządzeń wykonawczych (UE) nr 390/2013 i (UE) nr 391/2013 pozostaje bez uszczerbku dla art. 16 rozporządzenia (WE) nr 550/2004.
Artykuł 3
Niniejsza decyzja skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 29 października 2013 r.
W imieniu Komisji
Siim KALLAS
Wiceprzewodniczący
(1) Dz.U. L 96 z 31.3.2004, s. 10.
(2) Rozporządzenie wykonawcze Komisji (UE) nr 391/2013 z dnia 3 maja 2013 r. ustanawiające wspólny system opłat za korzystanie ze służb żeglugi powietrznej (Dz.U. L 128 z 9.5.2013, s. 31).
(3) Rozporządzenie (WE) nr 549/2004 Parlamentu Europejskiego i Rady z dnia 10 marca 2004 r. ustanawiające ramy tworzenia Jednolitej Europejskiej Przestrzeni Powietrznej (rozporządzenie ramowe) (Dz.U. L 96 z 31.3.2004, s. 1).
(4) Rozporządzenie wykonawcze Komisji (UE) nr 390/2013 z dnia 3 maja 2013 r. ustanawiające system skuteczności działania dla służb żeglugi powietrznej i funkcji sieciowych (Dz.U. L 128 z 9.5.2013, s. 1).
(5) Decyzja Komisji 2011/121/UE z dnia 21 lutego 2011 r. ustanawiająca ogólnounijne cele w zakresie skuteczności działania oraz stany alarmowe dla zapewniania służb żeglugi powietrznej na lata 2012–2014 (Dz.U. L 48 z 23.2.2011, s. 16).
(6) Rozporządzenie Komisji (UE) nr 1191/2010 z dnia 16 grudnia 2010 r. zmieniające rozporządzenie (WE) nr 1794/2006 ustanawiające wspólny schemat opłat za korzystanie ze służb żeglugi powietrznej (Dz.U. L 333 z 17.12.2010, s. 6).
(7) Rozporządzenie Komisji (WE) nr 1794/2006 z dnia 6 grudnia 2006 r. ustanawiające wspólny schemat opłat za korzystanie ze służb żeglugi powietrznej (Dz.U. L 341 z 7.12.2006, s. 3).
ZAŁĄCZNIK
|
Strefa pobierania opłat |
Trasowa stawka jednostkowa na rok 2014 w walucie krajowej (1) (kod ISO) |
|
Belgia/Luksemburg |
72,04 EUR |
|
Bułgaria |
73,50 BGN |
|
Republika Czeska |
1 198,16 CZK |
|
Dania |
537,56 DKK |
|
Niemcy |
77,32 EUR |
|
Estonia |
23,97 EUR |
|
Irlandia |
30,62 EUR |
|
Grecja |
34,53 EUR |
|
Hiszpania kontynentalna |
71,69 EUR |
|
Hiszpania – Wyspy Kanaryjskie |
58,36 EUR |
|
Francja |
65,77 EUR |
|
Włochy |
78,83 EUR |
|
Cypr |
38,41 EUR |
|
Łotwa |
19,99 LVL |
|
Litwa |
162,08 LTL |
|
Węgry |
13 190,76 HUF |
|
Malta |
27,61 EUR |
|
Niderlandy |
66,47 EUR |
|
Austria |
73,39 EUR |
|
Polska |
148,89 PLN |
|
Portugalia – Lizbona |
38,74 EUR |
|
Rumunia |
168,83 RON |
|
Słowenia |
67,46 EUR |
|
Słowacja |
60,04 EUR |
|
Finlandia |
52,06 EUR |
|
Szwecja |
638,85 SEK |
|
Zjednoczone Królestwo |
70,46 GBP |
(1) Niniejsze stawki jednostkowe nie uwzględniają administracyjnej stawki jednostkowej, o której mowa w art. 18 rozporządzenia wykonawczego (UE) nr 391/2013 i która ma zastosowanie do tych państw, które są stronami Umowy wielostronnej w sprawie opłat trasowych w ramach organizacji Eurocontrol.
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/71 |
DECYZJA WYKONAWCZA KOMISJI
z dnia 30 października 2013 r.
potwierdzająca średnie indywidualne poziomy emisji CO2 oraz docelowe indywidualne poziomy emisji dla producentów samochodów osobowych w roku kalendarzowym 2012 zgodnie z rozporządzeniem Parlamentu Europejskiego i Rady (WE) nr 443/2009
(Tekst mający znaczenie dla EOG)
(2013/632/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 443/2009 z dnia 23 kwietnia 2009 r. określające normy emisji dla nowych samochodów osobowych w ramach zintegrowanego podejścia Wspólnoty na rzecz zmniejszenia emisji CO2 z lekkich pojazdów dostawczych (1), w szczególności jego art. 8 ust. 5 akapit drugi oraz art. 10 ust. 1,
a także mając na uwadze, co następuje:
|
(1) |
Zgodnie z art. 8 ust. 5 rozporządzenia (WE) nr 443/2009 Komisja jest zobowiązana do corocznego potwierdzania średniego indywidualnego poziomu emisji CO2 oraz docelowego indywidualnego poziomu emisji dla każdego producenta samochodów osobowych w UE oraz dla każdej grupy producentów powstałej zgodnie z art. 7 ust. 1 powyższego rozporządzenia. Na podstawie powyższego potwierdzenia Komisja stwierdza, czy producenci i grupy producentów spełnili wymogi określone w art. 4 omawianego rozporządzenia. |
|
(2) |
Zgodnie z art. 4 rozporządzenia (WE) nr 443/2009 docelowe poziomy emisji są wiążące dla producentów i grup producentów ze skutkiem od roku 2012. Średnie indywidualne poziomy emisji producentów na 2012 r. są obliczane zgodnie z akapitem drugim wymienionego artykułu i uwzględniają 65 % nowych samochodów danego producenta zarejestrowanych w tym roku. |
|
(3) |
Szczegółowe dane, które mają zostać wykorzystane do obliczenia średnich indywidualnych poziomów emisji oraz docelowych poziomów emisji, znajdują się w pkt 1 części A i w części C załącznika II do rozporządzenia (WE) nr 443/2009; dane te są oparte na rejestracjach nowych samochodów osobowych w państwach członkowskich w poprzednim roku kalendarzowym. Dane pochodzą ze świadectw zgodności wydawanych przez producentów albo z dokumentów zawierających informacje równoważne zgodnie z art. 3 ust. 1 rozporządzenia Komisji (UE) nr 1014/2010 (2). |
|
(4) |
Wszystkie państwa członkowskie przedłożyły Komisji dane za 2012 r. do dnia 28 lutego 2013 r., zgodnie z art. 8 ust. 2 rozporządzenia (WE) nr 443/2009. W przypadkach, w których weryfikacja przez Komisję wyraźnie wykazała brak pewnych danych lub rażące nieprawidłowości, Komisja kontaktowała się z odnośnymi państwami członkowskimi i, za zgodą tych państw członkowskich, odpowiednio korygowała lub uzupełniała dane. Jeżeli osiągnięcie porozumienia z państwem członkowskim nie było możliwe, wstępne dane z danego państwa członkowskiego nie były korygowane. |
|
(5) |
Dnia 30 kwietnia 2013 r. Komisja opublikowała, zgodnie z art. 8 ust. 4 rozporządzenia (WE) nr 443/2009, wstępne dane i powiadomiła 85 producentów o wynikach wstępnych obliczeń średnich indywidualnych poziomów emisji CO2 w 2012 r. oraz o docelowych poziomach emisji. Producentów poproszono o weryfikację danych oraz powiadomienie Komisji o ewentualnych błędach w terminie trzech miesięcy od daty otrzymania powiadomienia zgodnie z art. 8 ust. 5 akapit pierwszy tego rozporządzenia i art. 9 ust. 3 rozporządzenia (UE) nr 1014/2010. Ośmiu producentów przyjęło wstępne dane bez korekt, a 40 producentów złożyło powiadomienia o błędach w wyznaczonym terminie. |
|
(6) |
W przypadku pozostałych 37 producentów, którzy nie powiadomili o żadnych błędach w danych ani nie przedłożyli innej odpowiedzi, wstępne dane i wstępne obliczenia średnich indywidualnych poziomów emisji oraz docelowych indywidualnych poziomów emisji należy zatwierdzić bez wprowadzania poprawek. |
|
(7) |
Komisja zweryfikowała poprawki zgłoszone przez producentów i odpowiednie uzasadnienia wyrażone kodami błędów określonymi w art. 9 ust. 3 rozporządzenia (UE) nr 1014/2010, a zbiory danych zostały odpowiednio dostosowane. |
|
(8) |
W przypadku zapisów, które zostały oznaczone przez producentów kodem błędu B, jak określono w art. 9 ust. 3 rozporządzenia (UE) nr 1014/2010, należy wziąć pod uwagę fakt, że producenci nie mogą odpowiednio zweryfikować lub skorygować tych zapisów, ze względu na brakujące lub niepoprawne parametry identyfikacji. W związku z tym należy uwzględnić pewien margines błędu w odniesieniu do wartości emisji CO2 i masy w tych zapisach. |
|
(9) |
Margines błędu należy obliczyć jako różnicę pomiędzy odległościami do docelowego indywidualnego poziomu emisji wyrażoną jako średni poziom emisji odjęty od docelowego indywidualnego poziomu emisji obliczonego z uwzględnieniem i z wykluczeniem rejestracji, których producenci nie mogą zweryfikować. Margines błędu zawsze powinien poprawiać odległość do docelowego poziomu emisji producenta, niezależnie od tego, czy powyższa różnica jest wartością dodatnią, czy ujemną. |
|
(10) |
Zgodnie z art. 10 ust. 2 rozporządzenia (WE) nr 443/2009 należy uznać, że producent spełnia wymogi dotyczące docelowego indywidualnego poziomu emisji, o których mowa w art. 4 tego rozporządzenia, jeżeli średni poziom emisji podany w niniejszej decyzji jest niższy od docelowego indywidualnego poziomu emisji i wyraża się ujemną wartością odległości do poziomu docelowego. W przypadku gdy średni poziom emisji przekracza docelowy indywidualny poziom emisji, zgodnie z art. 9 rozporządzenia (WE) nr 443/2009 należy nałożyć opłatę z tytułu przekroczenia poziomu emisji, chyba że dany producent korzysta ze zwolnienia z tego docelowego poziomu lub jest członkiem grupy producentów zgodnie z art. 7 tego rozporządzenia, zaś grupa spełnia wymóg dotyczący docelowego indywidualnego poziomu emisji. |
|
(11) |
Należy w związku z tym potwierdzić średni indywidualny poziom emisji CO2 dla nowych samochodów osobowych zarejestrowanych w 2012 r., docelowe indywidualne poziomy emisji oraz różnicę pomiędzy dwoma powyższymi wartościami, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Potwierdza się następujące wartości określone w załączniku w przypadku każdego producenta samochodów osobowych oraz każdej grupy producentów w odniesieniu do roku kalendarzowego 2012:
|
a) |
docelowy indywidualny poziom emisji; |
|
b) |
średni indywidualny poziom emisji CO2, w odpowiednich przypadkach skorygowany o odpowiedni margines błędu; |
|
c) |
różnicę pomiędzy wartościami, o których mowa w lit. a) i b); |
|
d) |
średni indywidualny poziom emisji CO2 w przypadku wszystkich nowych samochodów osobowych w Unii; |
|
e) |
średnią masę w przypadku wszystkich nowych samochodów osobowych w Unii. |
Artykuł 2
Niniejsza decyzja wchodzi w życie trzeciego dnia po jej opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Sporządzono w Brukseli dnia 30 października 2013 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 140 z 5.6.2009, s. 1.
(2) Rozporządzenie Komisji (UE) nr 1014/2010 z dnia 10 listopada 2010 r. w sprawie monitorowania i sprawozdawczości danych dotyczących rejestracji nowych samochodów osobowych na mocy rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 443/2009 (Dz.U. L 293 z 11.11.2010, s. 15).
ZAŁĄCZNIK
Tabela 1
Wartości odnoszące się do wyników producentów potwierdzone zgodnie z art. 10 rozporządzenia (WE) nr 443/2009
|
A |
B |
C |
D |
E |
F |
G |
H |
I |
|
Nazwa producenta |
Grupy producentów i odstępstwa |
Liczba rejestracji |
Skorygowany średni poziom emisji CO2 (65 %) |
Docelowy indywidualny poziom emisji |
Odległość do poziomu docelowego |
Skorygowana odległość do poziomu docelowego |
Średnia masa |
Średni poziom emisji CO2 (100 %) |
|
ALPINA BURKARD BOVENSIEPEN GMBH E CO., KG |
|
459 |
156,768 |
152,125 |
4,643 |
4,643 |
1 856,13 |
183,037 |
|
ARTEGA AUTOMOBIL GMBH E CO., KG |
|
4 |
223,000 |
126,024 |
96,976 |
96,976 |
1 285,00 |
223,000 |
|
ASTON MARTIN LAGONDA LTD |
D |
1 549 |
296,355 |
320,000 |
–23,645 |
–23,645 |
1 774,48 |
321,944 |
|
AUDI AG |
P12 |
657 068 |
122,411 |
139,473 |
–17,062 |
–17,110 |
1 579,29 |
137,786 |
|
AUDI HUNGARIA MOTOR KFT |
P12 |
11 241 |
137,324 |
133,613 |
3,711 |
3,573 |
1 451,07 |
149,057 |
|
AUTOMOBILES CITROEN |
|
654 993 |
108,718 |
129,703 |
–20,985 |
–20,985 |
1 365,51 |
122,566 |
|
AUTOMOBILES PEUGEOT |
|
773 864 |
107,648 |
130,413 |
–22,765 |
–22,765 |
1 381,03 |
121,489 |
|
AVTOVAZ JSC |
P8 |
2 298 |
207,903 |
125,748 |
82,155 |
82,155 |
1 278,96 |
213,899 |
|
BENTLEY MOTORS LTD |
P12 |
1 992 |
310,230 |
181,440 |
128,790 |
128,790 |
2 497,60 |
338,040 |
|
BAYERISCHE MOTOREN WERKE AG |
P1 |
762 027 |
123,643 |
138,696 |
–15,053 |
–15,111 |
1 562,28 |
137,515 |
|
BMW M GMBH |
P1 |
6 375 |
231,079 |
151,103 |
79,976 |
78,034 |
1 833,77 |
247,941 |
|
BUGATTI AUTOMOBILES S.A.S |
P12 |
2 |
539,000 |
156,689 |
382,311 |
382,311 |
1 956,00 |
539,000 |
|
CATERHAM CARS LIMITED |
D |
139 |
174,178 |
210,000 |
–35,822 |
–35,822 |
704,32 |
188,921 |
|
CECOMP S.P.A. |
|
1 001 |
0,000 |
123,282 |
– 123,282 |
– 123,282 |
1 225,00 |
0,000 |
|
CHEVROLET ITALIA SPA |
P5 |
4 948 |
110,000 |
114,681 |
–4,681 |
–4,681 |
1 036,80 |
110,284 |
|
CHRYSLER GROUP LLC |
P3 |
57 034 |
177,442 |
159,650 |
17,792 |
17,295 |
2 020,79 |
192,882 |
|
CNG-TECHNIK GMBH |
P4 |
75 |
113,938 |
118,091 |
–4,153 |
–4,153 |
1 111,40 |
113,960 |
|
AUTOMOBILE DACIA SA |
P8 |
232 256 |
125,132 |
126,664 |
–1,532 |
–1,534 |
1 299,01 |
136,899 |
|
DAIHATSU MOTOR CO LTD |
P11 |
3 397 |
131,952 |
120,887 |
11,065 |
11,065 |
1 172,58 |
148,590 |
|
DAIMLER AG |
P2 |
631 475 |
123,873 |
139,576 |
–15,703 |
–15,716 |
1 581,53 |
142,842 |
|
DONGFENG MOTOR CORPORATION |
|
2 |
184,000 |
118,758 |
65,242 |
65,242 |
1 126,00 |
187,000 |
|
DR MOTOR COMPANY SRL |
|
645 |
126,489 |
122,520 |
3,969 |
3,969 |
1 208,33 |
141,574 |
|
FERRARI S.P.A |
D |
2 330 |
298,539 |
303,000 |
–4,461 |
–4,461 |
1 733,67 |
316,739 |
|
FIAT GROUP AUTOMOBILES S.P.A |
P3 |
686 449 |
109,841 |
118,886 |
–9,045 |
–9,171 |
1 128,80 |
117,233 |
|
FISKER AUTOMOTIVE INC |
|
166 |
53,000 |
181,778 |
– 128,778 |
– 128,778 |
2 505,00 |
53,000 |
|
FORD-WERKE GMBH |
P4 |
917 725 |
116,480 |
127,832 |
–11,352 |
–11,359 |
1 324,57 |
128,685 |
|
FUJI HEAVY INDUSTRIES LTD |
ND |
29 381 |
150,266 |
164,616 |
–14,350 |
–14,350 |
1 561,77 |
160,599 |
|
GENERAL MOTORS COMPANY |
P5 |
2 673 |
130,061 |
154,444 |
–24,383 |
–24,383 |
1 906,87 |
253,869 |
|
GM ITALIA SRL |
P5 |
2 |
119,000 |
123,968 |
–4,968 |
–4,968 |
1 240,00 |
119,000 |
|
GM KOREA COMPANY |
P5 |
161 153 |
124,248 |
131,444 |
–7,196 |
–7,196 |
1 403,59 |
141,050 |
|
GREAT WALL MOTOR COMPANY LIMITED |
D |
309 |
168,000 |
195,000 |
–27,000 |
–27,000 |
1 184,23 |
169,049 |
|
HONDA AUTOMOBILE CHINA CO., LTD |
P6 |
17 668 |
123,408 |
119,912 |
3,496 |
3,496 |
1 151,26 |
124,855 |
|
HONDA MOTOR CO., LTD |
P6 |
71 717 |
121,571 |
130,995 |
–9,424 |
–9,424 |
1 393,77 |
138,965 |
|
HONDA TURKIYE AS |
P6 |
2 207 |
154,787 |
128,725 |
26,062 |
26,062 |
1 344,10 |
157,874 |
|
HONDA OF THE UK MANUFACTURING LTD |
P6 |
40 779 |
139,093 |
136,324 |
2,769 |
2,769 |
1 510,38 |
156,169 |
|
HYUNDAI MOTOR COMPANY |
|
416 987 |
118,808 |
128,266 |
–9,458 |
–9,458 |
1 334,05 |
132,203 |
|
IVECO S.P.A |
P3 |
6 |
143,333 |
224,310 |
–80,977 |
–80,977 |
3 435,67 |
146,667 |
|
JAGUAR |
ND; P10 |
22 621 |
150,844 |
178,025 |
–27,181 |
–27,409 |
1 910,74 |
168,970 |
|
JIANGLING MOTOR HOLDING CO., LTD |
|
39 |
144,480 |
130,348 |
14,132 |
14,132 |
1 379,62 |
147,897 |
|
KIA MOTORS CORPORATION |
|
329 474 |
114,489 |
127,175 |
–12,686 |
–12,686 |
1 310,18 |
129,464 |
|
KTM-SPORTMOTORCYCLE AG |
D |
18 |
180,000 |
200,000 |
–20,000 |
–20,000 |
875,00 |
183,000 |
|
AUTOMOBILI LAMBORGHINI S.P.A |
P12 |
413 |
343,683 |
144,315 |
199,368 |
199,021 |
1 685,23 |
364,295 |
|
LAND ROVER |
ND; P10 |
98 731 |
167,445 |
178,025 |
–10,580 |
–10,583 |
2 123,81 |
190,922 |
|
LOTUS CARS LIMITED |
D |
335 |
163,447 |
280,000 |
– 116,553 |
– 116,553 |
1 181,82 |
185,857 |
|
MAGYAR SUZUKI CORPORATION LTD |
P9 |
84 045 |
118,669 |
120,317 |
–1,648 |
–1,654 |
1 160,12 |
128,118 |
|
MAHINDRA & MAHINDRA LTD |
D |
64 |
179,000 |
205,000 |
–26,000 |
–26,000 |
1 915,08 |
182,234 |
|
MARUTI SUZUKI INDIA LTD |
P9 |
21 574 |
101,217 |
109,891 |
–8,674 |
–8,674 |
931,97 |
102,884 |
|
MASERATI S.P.A |
P3 |
883 |
343,492 |
158,286 |
185,206 |
184,578 |
1 990,95 |
351,072 |
|
MAZDA MOTOR CORPORATION |
|
113 565 |
128,793 |
129,494 |
–0,701 |
–0,701 |
1 360,93 |
141,779 |
|
MCLAREN AUTOMOTIVE LIMITED |
D |
335 |
279,000 |
285,000 |
–6,000 |
–6,000 |
1 511,50 |
279,475 |
|
MERCEDES-AMG GMBH |
P2 |
2 939 |
177,053 |
151,465 |
25,588 |
25,305 |
1 841,70 |
222,641 |
|
MG MOTOR UK LIMITED |
D |
755 |
176,147 |
184,000 |
–7,853 |
–7,853 |
1 585,69 |
178,914 |
|
MIA ELECTRIC S.A.S |
|
494 |
0,000 |
107,916 |
– 107,916 |
– 107,916 |
888,76 |
0,000 |
|
MICRO-VETT S.P.A |
|
5 |
0,000 |
130,091 |
– 130,091 |
– 130,091 |
1 374,00 |
0,000 |
|
MITSUBISHI MOTORS CORPORATION MMC |
P7 |
48 688 |
126,281 |
140,924 |
–14,643 |
–15,397 |
1 611,04 |
151,332 |
|
MITSUBISHI MOTORS EUROPE BV MME |
P7 |
18 604 |
117,601 |
118,511 |
–0,910 |
–0,981 |
1 120,59 |
126,014 |
|
MITSUBISHI MOTORS THAILAND CO LTD MMTH |
P7 |
15 |
97,778 |
123,575 |
–25,797 |
–26,331 |
1 231,40 |
125,667 |
|
MORGAN MOTOR CO LTD |
D |
398 |
156,050 |
180,000 |
–23,950 |
–23,950 |
1 120,11 |
184,078 |
|
NISSAN INTERNATIONAL SA |
|
423 818 |
122,253 |
131,177 |
–8,924 |
–8,924 |
1 397,75 |
137,341 |
|
OMCI SRL |
|
21 |
148,000 |
116,656 |
31,344 |
31,344 |
1 080,00 |
156,667 |
|
ADAM OPEL AG |
P5 |
814 229 |
119,708 |
133,821 |
–14,113 |
–14,114 |
1 455,62 |
133,002 |
|
PERODUA MANUFACTURING SDN BHD |
|
372 |
136,934 |
113,647 |
23,287 |
23,287 |
1 014,16 |
140,785 |
|
DR ING HCF PORSCHE AG |
P12 |
42 299 |
187,954 |
152,535 |
35,419 |
35,419 |
1 865,10 |
205,379 |
|
PERUSAHAAN OTOMOBIL NASIONAL SDN BHD |
D |
206 |
146,511 |
185,000 |
–38,489 |
–38,489 |
1 311,58 |
154,942 |
|
QUATTRO GMBH |
P12 |
3 904 |
219,136 |
147,404 |
71,732 |
70,977 |
1 752,84 |
243,966 |
|
RADICAL MOTORSPORT LTD |
|
6 |
229,000 |
106,145 |
122,855 |
122,855 |
850,00 |
229,000 |
|
RENAULT S.A.S |
P8 |
800 674 |
105,396 |
126,744 |
–21,348 |
–21,353 |
1 300,76 |
120,796 |
|
ROLLS-ROYCE MOTOR CARS LTD |
P1 |
417 |
317,376 |
181,976 |
135,400 |
135,377 |
2 509,34 |
329,930 |
|
SAAB AUTOMOBILE AB |
|
1 297 |
151,696 |
144,382 |
7,314 |
7,314 |
1 686,71 |
170,266 |
|
SEAT SA |
P12 |
252 173 |
114,757 |
127,124 |
–12,367 |
–12,521 |
1 309,07 |
127,191 |
|
SECMA S.A.S |
|
40 |
131,000 |
97,370 |
33,630 |
33,630 |
658,00 |
131,000 |
|
SHIJIAZHUANG SHUANGHUAN AUTOMOBILE COMPANY |
|
10 |
269,667 |
154,130 |
115,537 |
115,537 |
1 900,00 |
269,800 |
|
SKODA AUTO AS |
P12 |
460 603 |
120,028 |
126,655 |
–6,627 |
–7,026 |
1 298,81 |
132,247 |
|
SPYKER AUTOMOBIELEN BV |
D |
2 |
340,000 |
340,000 |
0,000 |
0,000 |
1 730,00 |
340,000 |
|
SSANGYONG MOTOR COMPANY |
D |
4 967 |
167,641 |
180,000 |
–12,359 |
–12,359 |
1 812,62 |
186,532 |
|
SUZUKI MOTOR CORPORATION |
P9 |
46 255 |
131,108 |
124,115 |
6,993 |
6,891 |
1 243,22 |
148,213 |
|
TATA MOTORS LIMITED |
ND; P10 |
592 |
134,367 |
178,025 |
–43,658 |
–43,658 |
1 336,03 |
141,978 |
|
TESLA MOTORS LTD |
|
159 |
0,000 |
128,309 |
– 128,309 |
– 128,309 |
1 335,00 |
0,000 |
|
THINK |
|
52 |
0,000 |
118,360 |
– 118,360 |
– 118,360 |
1 117,29 |
0,000 |
|
TOYOTA MOTOR EUROPE NV SA |
P11 |
515 028 |
103,613 |
127,912 |
–24,299 |
–24,371 |
1 326,30 |
121,862 |
|
VEHICULES ELECTRIQUES PININFARINA-BOLLORE S.A.S. |
|
542 |
0,000 |
123,282 |
– 123,282 |
– 123,282 |
1 225,00 |
0,000 |
|
VOLKSWAGEN AG |
P12 |
1 535 755 |
119,343 |
131,203 |
–11,860 |
–11,952 |
1 398,32 |
132,965 |
|
VOLVO CAR CORPORATION |
|
204 539 |
121,944 |
144,736 |
–22,792 |
–22,792 |
1 694,44 |
142,116 |
|
WIESMANN GMBH |
D |
53 |
284,294 |
274,000 |
10,294 |
10,294 |
1 490,38 |
289,566 |
|
ZHEJIANG ZOTYE AUTOMOBILE MANUFACTURING CO., LTD |
|
2 |
0,000 |
128,172 |
– 128,172 |
– 128,172 |
1 332,00 |
75,000 |
Tabela 2
Wartości odnoszące się do wyników grup producentów potwierdzone zgodnie z art. 10 rozporządzenia (WE) nr 443/2009
|
A |
B |
C |
D |
E |
F |
G |
H |
I |
|
Nazwa grupy |
Grupa |
Liczba rejestracji |
Skorygowany średni poziom emisji CO2 (65 %) |
Docelowy indywidualny poziom emisji |
Odległość do poziomu docelowego |
Skorygowana odległość do poziomu docelowego |
Średnia masa |
Średni poziom emisji CO2 (100 %) |
|
BMW GROUP |
P1 |
768 819 |
123,824 |
138,822 |
–14,998 |
–15,052 |
1 565,05 |
138,535 |
|
DAIMLER AG |
P2 |
634 414 |
123,949 |
139,630 |
–15,681 |
–15,694 |
1 582,73 |
143,212 |
|
FIAT GROUP AUTOMOBILES SPA |
P3 |
744 372 |
110,597 |
122,056 |
–11,459 |
–11,468 |
1 198,18 |
123,307 |
|
FORD-WERKE GMBH |
P4 |
917 800 |
116,479 |
127,832 |
–11,353 |
–11,361 |
1 324,55 |
128,684 |
|
GENERAL MOTORS |
P5 |
983 005 |
119,853 |
133,391 |
–13,538 |
–13,539 |
1 446,21 |
134,536 |
|
HONDA MOTOR EUROPE LTD |
P6 |
132 371 |
125,014 |
131,120 |
–6,106 |
–6,106 |
1 396,5 |
142,697 |
|
MITSUBISHI MOTORS |
P7 |
67 307 |
122,126 |
134,725 |
–12,599 |
–13,121 |
1 475,39 |
144,328 |
|
POOL RENAULT |
P8 |
1 035 228 |
109,427 |
126,724 |
–17,297 |
–17,301 |
1 300,32 |
124,615 |
|
SUZUKI |
P9 |
151 874 |
115,511 |
119,993 |
–4,482 |
–4,498 |
1 153,02 |
130,654 |
|
TATA MOTORS LTD, JAGUAR CARS LTD, LAND ROVER |
P10 |
121 944 |
162,825 |
178,025 |
–15,200 |
–15,307 |
2 080,46 |
186,612 |
|
TOYOTA -DAIHATSU GROUP |
P11 |
518 425 |
103,694 |
127,865 |
–24,171 |
–24,239 |
1 325,29 |
122,037 |
|
VW GROUP PC |
P12 |
2 965 450 |
120,108 |
132,353 |
–12,245 |
–12,508 |
1 423,48 |
134,841 |
Objaśnienia do tabel 1 i 2
Kolumna A:
Tabela 1: „Nazwa producenta” oznacza nazwę producenta zgłoszoną Komisji przez zainteresowanego producenta lub, w przypadku braku takiego zgłoszenia, nazwę zarejestrowaną przez organ rejestrujący państwa członkowskiego.
Tabela 2: „Nazwa grupy” oznacza nazwę grupy zadeklarowaną przez zarządzającego grupą.
Kolumna B:
„D” oznacza odstępstwo dotyczące drobnego producenta przyznane zgodnie z art. 11 ust. 3 rozporządzenia (WE) nr 443/2009 ze skutkiem od 2012 r.
„ND” oznacza odstępstwo dotyczące producenta niszowego przyznane zgodnie z art. 11 ust. 4 rozporządzenia (WE) nr 443/2009 ze skutkiem od 2012 r.
„P” oznacza, że producent jest członkiem jednej z grup producentów (wymienionych w tabeli 2) utworzonych zgodnie z art. 7 rozporządzenia (WE) nr 443/2009, a porozumienie o utworzeniu grupy jest ważne na rok kalendarzowy 2012.
Kolumna C:
„Liczba rejestracji” oznacza całkowitą liczbę nowych samochodów zarejestrowanych przez państwa członkowskie w ciągu roku kalendarzowego, nie licząc tych rejestracji, które odnoszą się do zapisów, w przypadku których brakuje wartości masy lub CO2, a także zapisów, których producent nie uznaje (oznaczone w powiadomieniu o błędach kodem błędu C, jak określono w art. 9 ust. 3 rozporządzenia (UE) nr 1014/2010). Liczba rejestracji przekazanych przez państwa członkowskie nie może zostać zmieniona z żadnego innego powodu.
Kolumna D:
„Skorygowany średni indywidualny poziom emisji CO2 (65 %)” oznacza średni indywidualny poziom emisji CO2, który został obliczony na podstawie 65 % pojazdów o najniższych emisjach we flocie danego producenta zgodnie z art. 4 akapit drugi tiret pierwsze rozporządzenia (WE) nr 443/2009 oraz sekcją 4 komunikatu Komisji COM(2010) 657 final. W stosownych przypadkach średni indywidualny poziom emisji skorygowano w celu uwzględnienia poprawek zgłoszonych Komisji przez zainteresowanego producenta. Zapisy wykorzystywane do obliczeń obejmują zapisy zawierające prawidłowe wartości w odniesieniu do masy oraz emisji CO2.
Kolumna E:
„Docelowy indywidualny poziom emisji” oznacza docelowy poziom emisji obliczony na podstawie średniej masy wszystkich pojazdów przypisanych do danego producenta z wykorzystaniem wzoru znajdującego się w załączniku I do rozporządzenia (WE) nr 443/2009.
Kolumna F:
„Odległość do poziomu docelowego” oznacza różnicę między średnim indywidualnym poziomem emisji podanym w kolumnie D a docelowym indywidualnym poziomem emisji w kolumnie E. Jeżeli wartość w kolumnie F jest dodatnia, oznacza to, że średni poziom emisji przekracza poziom docelowy.
Kolumna G:
„Skorygowana odległość do poziomu docelowego” oznacza, że w przypadku gdy wartości w tej kolumnie są różne od wartości w kolumnie F, wartości w tej kolumnie skorygowano z uwzględnieniem marginesu błędu. Margines błędu ma zastosowanie wyłącznie, jeżeli producent powiadomił Komisję o błędach w zapisach z kodem błędu B, jak określono w art. 9 ust. 3 rozporządzenia (UE) nr 1014/2010. Margines błędu jest obliczany zgodnie z następującym wzorem:
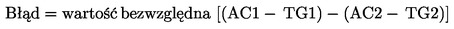
AC1= średni indywidualny poziom emisji CO2 uwzględniający pojazdy, których nie można zidentyfikować (jak określono w kolumnie D),
TG1= docelowy indywidualny poziom emisji uwzględniający pojazdy, których nie można zidentyfikować (jak określono w kolumnie E),
AC2= średni indywidualny poziom emisji CO2 z wyłączeniem pojazdów, których nie można zidentyfikować,
TG2= docelowy indywidualny poziom emisji z wyłączeniem pojazdów, których nie można zidentyfikować.
Kolumna I:
„Średni poziom emisji CO2 (100 %)” oznacza średni indywidualny poziom emisji CO2, który został obliczony na podstawie 100 % pojazdów przypisanych do producenta. W stosownych przypadkach średni indywidualny poziom emisji skorygowano w celu uwzględnienia poprawek zgłoszonych Komisji przez zainteresowanego producenta. Zapisy wykorzystywane do obliczeń obejmują zapisy zawierające prawidłowe wartości w odniesieniu do masy oraz emisji CO2, ale nie uwzględniają superjednostek, o których mowa w art. 5 rozporządzenia (WE) nr 443/2009.
Sprostowania
|
31.10.2013 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 289/80 |
Sprostowanie do rozporządzenia Komisji (UE) nr 142/2011 z dnia 25 lutego 2011 r. w sprawie wykonania rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 1069/2009 określającego przepisy sanitarne dotyczące produktów ubocznych pochodzenia zwierzęcego, nieprzeznaczonych do spożycia przez ludzi, oraz w sprawie wykonania dyrektywy Rady 97/78/WE w odniesieniu do niektórych próbek i przedmiotów zwolnionych z kontroli weterynaryjnych na granicach w myśl tej dyrektywy
( Dziennik Urzędowy Unii Europejskiej L 54 z dnia 26 lutego 2011 r. )
Strona 18, załącznik I pkt 4:
zamiast:
|
„4. |
»produkty z krwi« oznaczają produkty otrzymane z krwi lub jej frakcji, z wyłączeniem mączki z krwi; obejmują one osocze suszone, mrożone lub płynne, mączkę z krwi pełnej, krwinki czerwone suszone, mrożone lub płynne bądź ich frakcje oraz mieszaniny;”, |
powinno być:
|
„4. |
»produkty z krwi« oznaczają produkty otrzymane z krwi lub jej frakcji, z wyłączeniem mączki z krwi; obejmują one osocze suszone, mrożone lub płynne, suszoną pełną krew, krwinki czerwone suszone, mrożone lub płynne bądź ich frakcje oraz mieszaniny;”. |