ISSN 1725-5139
doi:10.3000/17255139.L_2010.228.pol
Dziennik Urzędowy
Unii Europejskiej
L 228

Wydanie polskie
Legislacja
Tom 53
31 sierpnia 2010
|
ISSN 1725-5139 doi:10.3000/17255139.L_2010.228.pol |
||
|
Dziennik Urzędowy Unii Europejskiej |
L 228 |
|

|
||
|
Wydanie polskie |
Legislacja |
Tom 53 |
|
|
|
|
|
(1) Tekst mający znaczenie dla EOG |
|
PL |
Akty, których tytuły wydrukowano zwykłą czcionką, odnoszą się do bieżącego zarządzania sprawami rolnictwa i generalnie zachowują ważność przez określony czas. Tytuły wszystkich innych aktów poprzedza gwiazdka, a drukuje się je czcionką pogrubioną. |
II Akty o charakterze nieustawodawczym
ROZPORZĄDZENIA
|
31.8.2010 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 228/1 |
ROZPORZĄDZENIE RADY (UE) NR 768/2010
z dnia 26 sierpnia 2010 r.
dotyczące ustalenia współczynników korygujących stosowanych od dnia 1 lipca 2009 r. do wynagrodzeń urzędników, pracowników zatrudnionych na czas określony i pracowników kontraktowych Unii Europejskiej pełniących służbę w krajach trzecich
RADA UNII EUROPEJSKIEJ,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej, w szczególności jego art. 336,
uwzględniając regulamin pracowniczy urzędników Unii Europejskiej i warunki zatrudnienia innych pracowników Unii Europejskiej, określone w rozporządzeniu Rady (EWG, Euratom, EWWiS) nr 259/68 (1), w szczególności art. 13 akapit pierwszy załącznika X do tego rozporządzenia,
uwzględniając wniosek Komisji Europejskiej,
a także mając na uwadze, co następuje:
|
(1) |
Należy uwzględnić zmiany kosztów utrzymania w krajach poza Unią i odpowiednio ustalić współczynniki korygujące, stosowane od dnia 1 lipca 2009 r. do wynagrodzeń wypłacanych w walucie kraju zatrudnienia urzędnikom, pracownikom zatrudnionym na czas określony i pracownikom kontraktowym Unii pełniącym służbę w krajach trzecich. |
|
(2) |
Współczynniki korygujące zastosowane do wypłat na podstawie rozporządzenia Rady (WE) nr 613/2009 (2) mogą powodować korekty wynagrodzeń in plus lub in minus ze skutkiem wstecznym. |
|
(3) |
W przypadku wzrostu wynagrodzeń wskutek zastosowania nowych współczynników korygujących należy przewidzieć wyrównania. |
|
(4) |
W przypadku obniżki wynagrodzeń wskutek zastosowania nowych współczynników korygujących powinno się przewidzieć potrącenie nadpłaty za okres od dnia 1 lipca 2009 r. do dnia wejścia w życie niniejszego rozporządzenia. |
|
(5) |
Należy również ustalić, że każde takie potrącenie nadpłaty będzie mogło dotyczyć co najwyżej sześciomiesięcznego okresu poprzedzającego wejście w życie niniejszego rozporządzenia oraz że jego skutki mogą być rozłożone na okres nieprzekraczający dwunastu miesięcy, począwszy od tej daty, analogicznie do zasad przewidzianych dla współczynników korygujących mających zastosowanie w Unii do wynagrodzeń i świadczeń emerytalnych dla urzędników i pozostałych pracowników Unii, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Ze skutkiem od dnia 1 lipca 2009 r. mającymi zastosowanie współczynnikami korygującymi stosowanymi do wypłacanych w walucie kraju zatrudnienia wynagrodzeń urzędników, pracowników zatrudnionych na czas określony oraz pracowników kontraktowych Unii pełniących służbę w krajach trzecich są współczynniki wskazane w załączniku.
Kursy walutowe wykorzystywane do naliczenia tych wynagrodzeń są ustalane zgodnie z przepisami wykonawczymi do rozporządzenia Rady (WE, Euratom) nr 1605/2002 z dnia 25 czerwca 2002 r. w sprawie rozporządzenia finansowego mającego zastosowanie do budżetu ogólnego Wspólnot Europejskich (3) i odpowiadają dacie 1 lipca 2009 r.
Artykuł 2
1. W przypadku wzrostu wynagrodzeń wskutek zastosowania nowych współczynników korygujących określonych w załączniku instytucje dokonują wypłaty wyrównań.
2. W przypadku obniżki wynagrodzeń wskutek zastosowania współczynników korygujących określonych w załączniku instytucje dokonują korekty wynagrodzeń in minus za okres od dnia 1 lipca 2009 r. do dnia 31 sierpnia 2010 r.
Korekty, które skutkują koniecznością potrącenia nadpłaty, dotyczą co najwyżej sześciomiesięcznego okresu poprzedzającego datę 31 sierpnia 2010 r. Potrącenie nadpłat rozkłada się na okres nieprzekraczający dwunastu miesięcy, począwszy od tej daty.
Artykuł 3
Niniejsze rozporządzenie wchodzi w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 26 sierpnia 2010 r.
W imieniu Rady
S. VANACKERE
Przewodniczący
(1) Dz.U. L 56 z 4.3.1968, s. 1.
(2) Dz.U. L 181 z 14.7.2009, s. 1.
(3) Dz.U. L 248 z 16.9.2002, s. 1.
ZAŁĄCZNIK
|
MIEJSCE ZATRUDNIENIA |
Współczynniki korygujące lipiec 2009 r. |
|
Afganistan (1) |
0 |
|
Albania |
73,9 |
|
Algieria |
76,5 |
|
Angola |
115,8 |
|
Arabia Saudyjska |
85,2 |
|
Argentyna |
57,1 |
|
Armenia |
68,7 |
|
Australia |
102,3 |
|
Azerbejdżan |
93,7 |
|
Bangladesz |
50,8 |
|
Barbados |
111 |
|
Belize |
65,9 |
|
Benin |
93,1 |
|
Białoruś |
61,5 |
|
Boliwia |
58,4 |
|
Bośnia i Hercegowina (Banja Luka) |
62,5 |
|
Bośnia i Hercegowina (Sarajewo) |
73,2 |
|
Botswana |
53,2 |
|
Brazylia |
87,4 |
|
Burkina Faso |
95,8 |
|
Burundi (1) |
0 |
|
Była Jugosłowiańska Republika Macedonii |
68,1 |
|
Chile |
61,9 |
|
Chiny |
85,6 |
|
Chorwacja |
92,3 |
|
Czad |
122,8 |
|
Czarnogóra |
68,1 |
|
Demokratyczna Republika Konga (Kinszasa) |
125,3 |
|
Dżibuti |
97,1 |
|
Egipt |
39,2 |
|
Ekwador |
70,3 |
|
Erytrea |
50,1 |
|
Etiopia |
83,8 |
|
Fidżi |
61,9 |
|
Filipiny |
62,7 |
|
Gabon |
104,4 |
|
Gambia |
60,7 |
|
Ghana |
53,1 |
|
Gruzja |
86,5 |
|
Gujana |
59,3 |
|
Gwatemala |
75,5 |
|
Gwinea (Konakry) |
63,5 |
|
Gwinea Bissau |
107,7 |
|
Haiti |
107,4 |
|
Honduras |
70,2 |
|
Hongkong |
95 |
|
Indie |
54,5 |
|
Indonezja (Banda Aceh) |
51,2 |
|
Indonezja (Dżakarta) |
74,3 |
|
Irak (1) |
0 |
|
Izrael (Tel Awiw) |
102,5 |
|
Jamajka |
84,8 |
|
Japonia (Tokio) |
126,3 |
|
Jemen |
66,6 |
|
Jordania |
81,5 |
|
Kambodża |
71,5 |
|
Kamerun |
95,6 |
|
Kanada |
74,6 |
|
Kazachstan (Ałmaty) |
76,3 |
|
Kazachstan (Astana) |
68,1 |
|
Kenia |
75,1 |
|
Kirgistan |
85,9 |
|
Kolumbia |
76 |
|
Kongo (Brazzaville) |
118,2 |
|
Korea Południowa |
82,8 |
|
Kosowo (Prisztina) |
54,6 |
|
Kostaryka |
75,1 |
|
Kuba |
83,2 |
|
Laos |
85,7 |
|
Lesotho |
57,3 |
|
Liban |
81,9 |
|
Liberia |
90,8 |
|
Madagaskar |
83,9 |
|
Malawi |
76 |
|
Malezja |
70,1 |
|
Mali |
84,9 |
|
Maroko |
76,1 |
|
Mauretania |
61,1 |
|
Mauritius |
69,7 |
|
Meksyk |
65,1 |
|
Mozambik |
73,4 |
|
Namibia |
71,2 |
|
Nepal |
77,7 |
|
Niger |
85,9 |
|
Nigeria |
87,5 |
|
Nikaragua |
55,5 |
|
Norwegia |
125,2 |
|
Nowa Kaledonia |
125,9 |
|
Nowa Zelandia |
86,4 |
|
Pakistan |
43,9 |
|
Panama |
57,6 |
|
Papua - Nowa Gwinea |
94,2 |
|
Paragwaj |
66,5 |
|
Peru |
75,1 |
|
Republika Dominikany |
64,4 |
|
Republika Mołdowy |
64,3 |
|
Republika Południowej Afryki |
57,5 |
|
Republika Środkowoafrykańska |
106,7 |
|
Rosja |
97,1 |
|
Rwanda |
84,6 |
|
Salwador |
70,2 |
|
Samoa |
70,5 |
|
Senegal |
90,3 |
|
Serbia (Belgrad) |
66,5 |
|
Sierra Leone |
75,1 |
|
Singapur |
97,3 |
|
Sri Lanka |
62,9 |
|
Stany Zjednoczone (Nowy Jork) |
92 |
|
Stany Zjednoczone (Waszyngton) |
87,4 |
|
Suazi |
58,2 |
|
Sudan (Chartum) |
52,5 |
|
Sudan Południowy (Dżuba) |
91,6 |
|
Surinam |
45,9 |
|
Syria |
77,1 |
|
Szwajcaria (Berno) |
109 |
|
Szwajcaria (Genewa) |
109,5 |
|
Tadżykistan |
56,9 |
|
Tajlandia |
55,6 |
|
Tajwan |
76,6 |
|
Tanzania |
67,6 |
|
Timor Wschodni |
67,8 |
|
Togo |
87,9 |
|
Trynidad i Tobago |
74,6 |
|
Tunezja |
68,7 |
|
Turcja |
76,6 |
|
Uganda |
63,4 |
|
Ukraina |
75,1 |
|
Urugwaj |
71,3 |
|
Uzbekistan |
50,9 |
|
Vanuatu |
102,2 |
|
Wenezuela |
92,4 |
|
Wietnam |
47,4 |
|
Wybrzeże Kości Słoniowej |
99,5 |
|
Wyspy Salomona |
90,3 |
|
Zachodni Brzeg Jordanu - Strefa Gazy |
100,7 |
|
Zambia |
49,2 |
|
Zielony Przylądek |
73,1 |
|
Zimbabwe (1) |
0 |
(1) Brak danych.
|
31.8.2010 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 228/8 |
ROZPORZĄDZENIE KOMISJI (UE) NR 769/2010
z dnia 30 sierpnia 2010 r.
ustanawiające standardowe wartości celne w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (WE) nr 1234/2007 z dnia 22 października 2007 r. ustanawiające wspólną organizację rynków rolnych oraz przepisy szczegółowe dotyczące niektórych produktów rolnych („rozporządzenie o jednolitej wspólnej organizacji rynku”) (1),
uwzględniając rozporządzenie Komisji (WE) nr 1580/2007 z dnia 21 grudnia 2007 r. ustanawiające przepisy wykonawcze do rozporządzeń Rady (WE) nr 2200/96, (WE) nr 2201/96 i (WE) nr 1182/2007 w sektorze owoców i warzyw (2), w szczególności jego art. 138 ust. 1,
a także mając na uwadze, co następuje:
Rozporządzenie (WE) nr 1580/2007 przewiduje, w zastosowaniu wyników wielostronnych negocjacji handlowych Rundy Urugwajskiej, kryteria do ustalania przez Komisję standardowych wartości celnych dla przywozu z krajów trzecich, w odniesieniu do produktów i okresów określonych w części A załącznika XV do wspomnianego rozporządzenia,
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Standardowe wartości celne w przywozie, o których mowa w art. 138 rozporządzenia (WE) nr 1580/2007, są ustalone w załączniku do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie z dniem 31 sierpnia 2010 r.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 30 sierpnia 2010 r.
W imieniu Komisji, za Przewodniczącego,
Jean-Luc DEMARTY
Dyrektor Generalny ds. Rolnictwa i Rozwoju Obszarów Wiejskich
(1) Dz.U. L 299 z 16.11.2007, s. 1.
(2) Dz.U. L 350 z 31.12.2007, s. 1.
ZAŁĄCZNIK
Standardowe wartości celne w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
|
(EUR/100 kg) |
||
|
Kod CN |
Kod krajów trzecich (1) |
Standardowa stawka celna w przywozie |
|
0702 00 00 |
MK |
38,5 |
|
TR |
103,0 |
|
|
ZZ |
70,8 |
|
|
0707 00 05 |
TR |
141,2 |
|
ZZ |
141,2 |
|
|
0709 90 70 |
TR |
125,9 |
|
ZZ |
125,9 |
|
|
0805 50 10 |
AR |
86,0 |
|
CL |
145,6 |
|
|
TR |
149,6 |
|
|
UY |
141,2 |
|
|
ZA |
158,5 |
|
|
ZZ |
136,2 |
|
|
0806 10 10 |
BA |
91,2 |
|
EG |
132,3 |
|
|
IL |
126,0 |
|
|
TR |
115,3 |
|
|
ZA |
149,9 |
|
|
ZZ |
122,9 |
|
|
0808 10 80 |
AR |
106,6 |
|
BR |
70,5 |
|
|
CL |
93,5 |
|
|
CN |
65,6 |
|
|
NZ |
99,6 |
|
|
US |
127,5 |
|
|
UY |
95,9 |
|
|
ZA |
89,2 |
|
|
ZZ |
93,6 |
|
|
0808 20 50 |
AR |
115,4 |
|
CL |
150,5 |
|
|
CN |
76,3 |
|
|
TR |
133,1 |
|
|
ZA |
110,7 |
|
|
ZZ |
117,2 |
|
|
0809 30 |
TR |
143,4 |
|
ZZ |
143,4 |
|
|
0809 40 05 |
BA |
53,9 |
|
IL |
161,0 |
|
|
XS |
52,3 |
|
|
ZZ |
89,1 |
|
(1) Nomenklatura krajów ustalona w rozporządzeniu Komisji (WE) nr 1833/2006 (Dz.U. L 354 z 14.12.2006, s. 19). Kod „ZZ” odpowiada „innym pochodzeniom”.
DYREKTYWY
|
31.8.2010 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 228/10 |
DYREKTYWA KOMISJI 2010/60/UE
z dnia 30 sierpnia 2010 r.
przewidująca pewne odstępstwa dotyczące wprowadzania do obrotu mieszanek materiału siewnego roślin pastewnych przeznaczonych do wykorzystania w ramach ochrony środowiska naturalnego
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę Rady 66/401/EWG z dnia 14 czerwca 1966 r. w sprawie obrotu materiałem siewnym roślin pastewnych (1), w szczególności jej art. 13 ust. 1 akapit czwarty,
a także mając na uwadze, co następuje:
|
(1) |
W ostatnich latach kwestie związane z różnorodnością biologiczną i ochroną zasobów genetycznych roślin zyskują coraz większe znaczenie, co pokazują różne zmiany zachodzące na poziomie międzynarodowym i unijnym. Przykładami są tu między innymi decyzja Rady 93/626/EWG z dnia 25 października 1993 r. dotycząca zawarcia Konwencji o różnorodności biologicznej (2), decyzja Rady 2004/869/WE z dnia 24 lutego 2004 r. w sprawie zawarcia w imieniu Wspólnoty Europejskiej Międzynarodowego Traktatu o Zasobach Genetycznych Roślin dla Żywności i Rolnictwa (3), rozporządzenie Rady (WE) nr 870/2004 z dnia 26 kwietnia 2004 r. ustanawiające wspólnotowy program w sprawie ochrony, opisu, zbierania i wykorzystania zasobów genetycznych w rolnictwie i uchylające rozporządzenie (WE) nr 1467/94 (4) oraz rozporządzenie Rady (WE) nr 1698/2005 z dnia 20 września 2005 r. w sprawie wsparcia rozwoju obszarów wiejskich przez Europejski Fundusz Rolny na rzecz Rozwoju Obszarów Wiejskich (EFRROW) (5). W celu uwzględnienia tych kwestii należy ustanowić szczegółowe warunki w ramach prawodawstwa unijnego regulującego obrót mieszankami materiału siewnego roślin pastewnych, tj. dyrektywy 66/401/EWG. |
|
(2) |
Aby umożliwić obrót mieszankami materiału siewnego roślin pastewnych przeznaczonymi do wykorzystania w ramach ochrony środowiska naturalnego w kontekście ochrony zasobów genetycznych (zwanymi dalej „mieszankami dla ochrony środowiska”), nawet w przypadku gdy składniki tych mieszanek nie są zgodne z niektórymi ogólnymi wymogami dotyczącymi obrotu przewidzianymi w dyrektywie 66/401/EWG, konieczne jest określenie pewnych odstępstw. |
|
(3) |
Aby zapewnić zgodność mieszanek wprowadzonych do obrotu jako mieszanki dla ochrony środowiska z wymogami tych odstępstw, konieczne jest wprowadzenie przepisu, że obrót takimi mieszankami podlega zezwoleniu. Zezwolenie powinno być udzielane na podstawie wniosku. |
|
(4) |
Jednakże jeżeli chodzi o mieszanki dla ochrony środowiska, zawierające odmiany dla zachowania bioróżnorodności w rozumieniu dyrektywy Komisji 2008/62/WE z dnia 20 czerwca 2008 r. przewidującej pewne odstępstwa w odniesieniu do rejestracji populacji miejscowych i odmian roślin rolniczych przystosowanych naturalnie do warunków lokalnych i regionalnych i zagrożonych erozją genetyczną oraz obrót materiałem siewnym i sadzeniakami ziemniaka tych populacji miejscowych i odmian (6), niniejsza dyrektywa nie powinna naruszać przepisów dyrektywy 2008/62/WE. |
|
(5) |
Na specjalnych obszarach ochrony wyznaczonych przez państwa członkowskie zgodnie z dyrektywą Rady 92/43/EWG z dnia 21 maja 1992 r. w sprawie ochrony siedlisk przyrodniczych oraz dzikiej fauny i flory (7) znajdują się siedliska naturalne i półnaturalne, które należy chronić. Obszary takie należy uznać za obszary źródłowe mieszanek dla ochrony środowiska. Państwa członkowskie powinny również mieć możliwość wyznaczania innych obszarów przyczyniających się do ochrony zasobów genetycznych roślin, jeżeli są one zgodne z porównywalnymi przepisami. |
|
(6) |
Należy zapewnić, aby w zezwoleniu i na etykiecie składniki mieszanki dla ochrony środowiska były opisywane jako gatunki i, w odpowiednich przypadkach, jako podgatunki. Należy również określić konkretną zdolność kiełkowania w odniesieniu do składników mieszanki ujętych w dyrektywie 66/401/EWG, które nie spełniają wymogów dotyczących kiełkowania określonych w załączniku II do tej dyrektywy. Jeśli chodzi o te wymogi, w przypadku mieszanek dla ochrony środowiska zbieranych bezpośrednio konieczne jest uwzględnienie metody zbioru. |
|
(7) |
Konieczne jest określenie odstępstw dotyczących badania mieszanki dla ochrony środowiska przez państwa członkowskie przed dopuszczeniem jej do obrotu. Sposób badania mieszanek powinien w niektórych przypadkach uwzględniać również różnice pomiędzy metodami zbioru uprawianych i bezpośrednio zbieranych mieszanek dla ochrony środowiska. |
|
(8) |
Aby zagwarantować, że obrót mieszankami dla ochrony środowiska odbywa się w kontekście ochrony zasobów genetycznych, należy określić ograniczenia, w szczególności w odniesieniu do regionu pochodzenia i obszaru źródłowego. |
|
(9) |
W odniesieniu do obrotu mieszankami dla ochrony środowiska należy ustalić ilość maksymalną. Aby zapewnić przestrzeganie tej ilości maksymalnej, państwa członkowskie powinny wymagać, aby producenci powiadamiali je o ilościach mieszanek dla ochrony środowiska, o jakie zamierzają wnioskować we wniosku o zezwolenie, a państwa członkowskie powinny, w razie konieczności, określać dla producentów odpowiednie ilości. |
|
(10) |
Należy zapewnić identyfikowalność mieszanek dla ochrony środowiska poprzez odpowiednie wymogi dotyczące plombowania i etykietowania. |
|
(11) |
Aby zapewnić właściwe stosowanie zasad określonych w niniejszej dyrektywie, należy prowadzić urzędowe monitorowanie. |
|
(12) |
Po odpowiednim okresie Komisja powinna ocenić, czy środki przewidziane w niniejszej dyrektywie są skuteczne. |
|
(13) |
Środki przewidziane w niniejszej dyrektywie są zgodne z opinią Stałego Komitetu ds. Nasion i Materiału Rozmnożeniowego dla Rolnictwa, Ogrodnictwa I Leśnictwa, |
PRZYJMUJE NINIEJSZĄ DYREKTYWĘ:
Artykuł 1
Definicje
Do celów niniejszej dyrektywy stosuje się następujące definicje:
|
a) |
„obszar źródłowy” oznacza:
|
|
b) |
„miejsce zbioru” oznacza część obszaru źródłowego, gdzie zebrano materiał siewny; |
|
c) |
„mieszanka zbierana bezpośrednio” oznacza mieszankę siewną wprowadzaną do obrotu jako oczyszczona lub nieczyszczona mieszanka zebrana w miejscu zbioru; |
|
d) |
„mieszanka uprawiana” oznacza mieszankę siewną wyprodukowaną w ramach poniższego procesu:
|
Artykuł 2
Mieszanki dla ochrony środowiska
1. W drodze odstępstwa od art. 3 ust. 1 i 2 dyrektywy 66/401/EWG państwa członkowskie mogą udzielać zezwoleń na wprowadzanie do obrotu mieszanek różnych rodzajów, gatunków i, w odpowiednich przypadkach, podgatunków, przeznaczonych do wykorzystania w ramach ochrony środowiska naturalnego w kontekście ochrony zasobów genetycznych, o których mowa w art. 22a ust. 1 lit. b) tej dyrektywy.
Mieszanki takie mogą zawierać materiał siewny roślin pastewnych ujętych w dyrektywie 66/401/EWG oraz ponadto materiał siewny roślin, które nie są roślinami pastewnymi w rozumieniu wspomnianej dyrektywy.
Mieszanki takie zwane są dalej „mieszankami dla ochrony środowiska”.
2. W przypadku gdy mieszanka dla ochrony środowiska zawiera odmianę dla zachowania bioróżnorodności, zastosowanie ma dyrektywa 2008/62/WE.
3. Jeżeli niniejsza dyrektywa nie przewiduje inaczej, stosuje się dyrektywę 66/401/EWG.
Artykuł 3
Region pochodzenia
W przypadku gdy państwo członkowskie zezwala na obrót mieszankami dla ochrony środowiska, określa ono region, z którym mieszanka ta jest naturalnie związana, zwany dalej „regionem pochodzenia”. Państwo członkowskie uwzględnia informacje pochodzące z urzędów lub organizacji odpowiedzialnych za zasoby genetyczne roślin uznanych do tego celu przez państwa członkowskie. W przypadku gdy region pochodzenia znajduje się w więcej niż jednym państwie członkowskim, wówczas wszystkie państwa członkowskie, których to dotyczy, wspólnie identyfikują taki region.
Artykuł 4
Zezwolenia
1. Państwa członkowskie mogą zezwalać na wprowadzanie mieszanek dla ochrony środowiska do obrotu w ich regionie pochodzenia, pod warunkiem że mieszanki te spełniają wymogi określone w art. 5 w przypadku mieszanek dla ochrony środowiska zbieranych bezpośrednio lub w art. 6 w przypadku uprawianych mieszanek dla ochrony środowiska.
2. Zezwolenie zawiera następujące informacje:
|
a) |
nazwa i adres producenta; |
|
b) |
metoda zbioru: zbiór bezpośredni lub uprawa; |
|
c) |
wagowy skład procentowy składników, takich jak gatunki i, w odpowiednich przypadkach, podgatunki; |
|
d) |
w przypadku uprawianych mieszanek dla ochrony środowiska konkretna zdolność kiełkowania w odniesieniu do składników mieszanki ujętych w dyrektywie 66/401/EWG, które nie spełniają wymogów dotyczących kiełkowania określonych w załączniku II do tej dyrektywy; |
|
e) |
ilość mieszanki, do której ma zastosowanie zezwolenie; |
|
f) |
region pochodzenia; |
|
g) |
ograniczenie w zakresie wprowadzania do obrotu w regionie pochodzenia; |
|
h) |
obszar źródłowy; |
|
i) |
miejsce zbioru, a w przypadku uprawianych mieszanek dla ochrony środowiska, dodatkowo, miejsce rozmnażania; |
|
j) |
rodzaj siedliska występujący w miejscu zbioru; oraz |
|
k) |
rok zbioru. |
3. W odniesieniu do ust. 2 lit. c) w przypadku mieszanek dla ochrony środowiska zbieranych bezpośrednio wystarczy podać te składniki, takie jak gatunki i, w odpowiednich przypadkach, podgatunki, które są typowe dla rodzaju siedliska występującego w miejscu zbioru oraz które, jako składniki mieszanki, mają istotne znaczenie dla ochrony środowiska naturalnego w kontekście ochrony zasobów genetycznych.
Artykuł 5
Wymogi dotyczące zezwoleń w odniesieniu do mieszanek dla ochrony środowiska zbieranych bezpośrednio
1. Mieszanka dla ochrony środowiska zbierana bezpośrednio zostaje zebrana na obszarze źródłowym w miejscu zbioru, który nie był obsiewany przez okres 40 lat poprzedzających datę wniosku złożonego przez producenta, o którym mowa w art. 7 ust. 1. Obszar źródłowy znajduje się w regionie pochodzenia.
2. Procentowa ilość składników zbieranej bezpośrednio mieszanki dla ochrony środowiska, którymi są gatunki i, w odpowiednich przypadkach, podgatunki typowe dla rodzaju siedliska występującego w miejscu zbioru oraz które, jako składniki mieszanki, mają istotne znaczenie dla ochrony środowiska naturalnego w kontekście ochrony zasobów genetycznych, jest wystarczająca, aby odtworzyć rodzaj siedliska występującego w miejscu zbioru.
3. Zdolność kiełkowania składników, o których mowa w ust. 2, jest wystarczająca, aby odtworzyć rodzaj siedliska występującego w miejscu zbioru.
4. Maksymalna zawartość gatunków i, w odpowiednich przypadkach, podgatunków, które nie są zgodne z przepisami ust. 2, nie przekracza wagowo 1 %. Mieszanka dla ochrony środowiska zbierana bezpośrednio nie zawiera Avena fatua, Avena sterilis ani Cuscuta spp. Maksymalna zawartość Rumex spp. innych niż Rumex acetosella i Rumex maritimus nie przekracza wagowo 0,05 %.
Artykuł 6
Wymogi dotyczące zezwoleń w odniesieniu do uprawianych mieszanek dla ochrony środowiska
1. W przypadku uprawianych mieszanek dla ochrony środowiska zebrany materiał siewny, z którego wytwarza się uprawianą mieszankę materiału siewnego, zostaje zebrany na obszarze źródłowym w miejscu zbioru, który nie był obsiewany przez okres 40 lat poprzedzających datę zastosowania przez producenta, o którym mowa w art. 7 ust. 1. Obszar źródłowy znajduje się w regionie pochodzenia.
2. Materiał siewny uprawianej mieszanki dla ochrony środowiska składa się z gatunków i, w odpowiednich przypadkach, podgatunków, które są typowe dla rodzaju siedliska występującego w miejscu zbioru oraz które, jako składniki mieszanki, mają istotne znaczenie dla ochrony środowiska naturalnego w kontekście ochrony zasobów genetycznych.
3. Składniki uprawianej mieszanki dla ochrony środowiska, które są materiałem siewnym roślin pastewnych w rozumieniu dyrektywy 66/401/EWG, muszą przed zmieszaniem spełniać wymogi dotyczące handlowego materiału siewnego określone w sekcji III załącznika II do dyrektywy 66/401/EWG pod względem czystości analitycznej zgodnie z kolumnami 4–11 tabeli w sekcji I pkt 2A tego załącznika; pod względem maksymalnej zawartości innych gatunków roślin w próbce o wadze określonej w kolumnie 4 załącznika III do tej dyrektywy (łącznie dla kolumny) zgodnie z kolumnami 12, 13 i 14 tabeli w sekcji I pkt 2A załącznika II do tej dyrektywy; oraz pod względem warunków dotyczących materiału siewnego Lupin zgodnie z kolumną 15 tabeli w sekcji I pkt 2A tego załącznika.
4. Rozmnażanie może odbywać się przez pięć pokoleń.
Artykuł 7
Wymogi proceduralne
1. Zezwolenie udzielane jest na wniosek producenta.
Do wniosku należy dołączyć informacje konieczne do zweryfikowania zgodności z art. 4 i 5 w przypadku mieszanek dla ochrony środowiska zbieranych bezpośrednio oraz z art. 4 i 6 w przypadku uprawianych mieszanek dla ochrony środowiska.
2. W odniesieniu do mieszanek dla ochrony środowiska zbieranych bezpośrednio państwo członkowskie, w którym znajduje się miejsce zbioru, przeprowadza kontrole wizualne.
Kontrole wizualne prowadzone są w miejscu zbioru w okresie wzrostu z wystarczającą częstotliwością, aby zapewnić zgodność mieszanki przynajmniej z wymogami dotyczącymi zezwoleń przewidzianymi w art. 5 ust. 2 i 4.
Państwo członkowskie, które przeprowadziło kontrole wizualne, dokumentuje ich wyniki.
3. W odniesieniu do uprawianych mieszanek dla ochrony środowiska przy rozpatrywaniu wniosku państwo członkowskie przeprowadza badania lub badania są prowadzone w ramach urzędowego nadzoru państwa członkowskiego, aby sprawdzić zgodność mieszanki dla ochrony środowiska przynajmniej z wymogami dotyczącymi zezwoleń przewidzianymi w art. 6 ust. 2 i 3.
Badania te przeprowadza się zgodnie z obowiązującą metodyką międzynarodową lub, w przypadku gdy brak takiej metodyki, zgodnie z inną odpowiednią metodyką.
W przypadku przedmiotowych badań zainteresowane państwo członkowskie gwarantuje, że próbki są pobierane z partii jednorodnych. Państwo członkowskie zapewnia stosowanie przepisów dotyczących wagi partii i wagi próbki przewidzianych w art. 7 ust. 2 dyrektywy 66/401/EWG.
Artykuł 8
Ograniczenie ilościowe
Każde państwo członkowskie gwarantuje, że całkowita ilość materiału siewnego mieszanek dla ochrony środowiska w obrocie w jednym roku nie przekracza 5 % całkowitej wagi wszystkich mieszanek materiału siewnego roślin pastewnych objętych dyrektywą 66/401/EWG i wprowadzonych do obrotu w danym roku w danym państwie członkowskim.
Artykuł 9
Zastosowanie ograniczeń ilościowych
1. W przypadku mieszanek dla ochrony środowiska zbieranych bezpośrednio państwa członkowskie zapewniają, aby producenci powiadamiali je przed rozpoczęciem każdego sezonu wegetacyjnego o ilości materiału siewnego mieszanek dla ochrony środowiska, o jaką zamierzają wnioskować we wniosku o zezwolenie, oraz o wielkości i lokalizacji przewidzianych(-ego) miejsc(-a) zbioru.
W przypadku uprawianych mieszanek dla ochrony środowiska państwa członkowskie zapewniają, aby producenci powiadamiali je przed rozpoczęciem każdego sezonu wegetacyjnego o ilości materiału siewnego mieszanek dla ochrony środowiska, o jaką zamierzają wnioskować we wniosku o zezwolenie, jak również o wielkości i lokalizacji przewidzianych(-ego) miejsc(-a) zbioru oraz wielkości i lokalizacji przewidzianych(-ego) miejsc(-a) rozmnażania.
2. Jeżeli z powiadomień, o których mowa w ust. 1, wynika, że ilości określone w ust. 8 mogą być przekroczone, państwa członkowskie określają dla każdego zainteresowanego producenta ilość, którą dany producent może wprowadzić do obrotu w danym sezonie wegetacyjnym.
Artykuł 10
Plombowanie opakowań i pojemników
1. Państwa członkowskie gwarantują, że mieszanki dla ochrony środowiska mogą być wprowadzane do obrotu jedynie w zamkniętych opakowaniach lub pojemnikach posiadających plomby.
2. W celu zabezpieczenia opieczętowania system plombujący obejmuje przynajmniej etykietę lub przytwierdzoną plombę.
3. Opakowania i pojemniki, o których mowa w ust. 1, powinny być zaplombowane w taki sposób, aby nie można było ich otworzyć bez uszkodzenia systemu plombującego lub pozostawienia śladu manipulowania przy etykiecie producenta, opakowaniu lub pojemniku.
Artykuł 11
Etykietowanie
1. Państwa członkowskie gwarantują, że opakowania i pojemniki z mieszankami dla ochrony środowiska mają etykietę producenta lub nadruk albo stempel zawierający przynajmniej następujące informacje:
|
a) |
sformułowanie „przepisy i normy UE”; |
|
b) |
imię i nazwisko oraz adres osoby odpowiedzialnej za umieszczanie etykiet lub znak identyfikacyjny tej osoby; |
|
c) |
metoda zbioru: zbiór bezpośredni lub uprawa; |
|
d) |
rok zaplombowania określony w następujący sposób: „zaplombowano w …” (rok); |
|
e) |
region pochodzenia; |
|
f) |
obszar źródłowy; |
|
g) |
miejsce zbioru; |
|
h) |
rodzaj siedliska występujący w miejscu zbioru; |
|
i) |
sformułowanie „mieszanka materiału siewnego roślin pastewnych dla ochrony środowiska przeznaczona do wykorzystania na obszarze o tym samym rodzaju siedliska, który występuje w miejscu zbioru, nie uwzględniając warunków biotycznych”; |
|
j) |
numer referencyjny partii nadany przez osobę odpowiedzialną za etykietowanie; |
|
k) |
procent wagowy składników, takich jak gatunki i, w odpowiednich przypadkach, podgatunki; |
|
l) |
deklarowana waga netto lub brutto; |
|
m) |
w przypadku zastosowania otoczkowania pestycydami, inkrustacji zaprawami nasiennymi lub innymi dodatkami stałymi należy wskazać rodzaj zastosowanego dodatku oraz przybliżony stosunek wagi kłębków lub czystego materiału siewnego do wagi całkowitej; oraz |
|
n) |
w przypadku uprawianych mieszanek dla ochrony środowiska – konkretna zdolność kiełkowania w odniesieniu do składników mieszanki ujętych w dyrektywie 66/401/EWG, które nie spełniają wymogów dotyczących kiełkowania określonych w załączniku II do tej dyrektywy. |
2. W odniesieniu do ust. 1 lit. k) wystarczy wskazać składniki mieszanek dla ochrony środowiska zbieranych bezpośrednio, o których mowa w art. 4 ust. 3.
3. W odniesieniu do ust. 1 lit. n) wystarczy wskazać wartość średnią tych wymaganych konkretnych zdolności kiełkowania, gdy ilość wymaganych konkretnych zdolności kiełkowania przekracza pięć.
Artykuł 12
Monitorowanie
Państwa członkowskie zapewniają przestrzeganie niniejszej dyrektywy w drodze urzędowego monitorowania.
Artykuł 13
Sprawozdawczość
Państwa członkowskie gwarantują, że producenci działający na ich terytorium zawiadamiają o ilości mieszanek dla ochrony środowiska wprowadzonych do obrotu dla każdego sezonu wegetacyjnego.
Państwa członkowskie informują na żądanie Komisję i inne państwa członkowskie o ilości mieszanek dla ochrony środowiska wprowadzonych do obrotu na ich terytorium.
Artykuł 14
Powiadamianie o uznanych organizacjach odpowiedzialnych za zasoby genetyczne roślin
Państwa członkowskie powiadamiają na żądanie Komisję o urzędach lub organizacjach odpowiedzialnych za zasoby genetyczne roślin uznanych do tego celu przez państwa członkowskie.
Artykuł 15
Ocena
Komisja dokonuje oceny wdrażania niniejszej dyrektywy do dnia 31 grudnia 2014 r.
Artykuł 16
Transpozycja
1. Państwa członkowskie wprowadzają w życie, najpóźniej do dnia 30 listopada 2011 r., przepisy ustawowe, wykonawcze i administracyjne niezbędne do wykonania niniejszej dyrektywy. Państwa członkowskie niezwłocznie przekazują Komisji tekst tych przepisów oraz tabelę korelacji między tymi przepisami a niniejszą dyrektywą.
Przepisy przyjęte przez państwa członkowskie zawierają odesłanie do niniejszej dyrektywy lub odesłanie takie towarzyszy ich urzędowej publikacji. Metody dokonania takiego odesłania określane są przez państwa członkowskie.
2. Państwa członkowskie przekazują Komisji teksty podstawowych przepisów prawa krajowego, przyjętych w dziedzinie objętej niniejszą dyrektywą.
Artykuł 17
Wejście w życie
Niniejsza dyrektywa wchodzi w życie dwudziestego dnia po jej opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Artykuł 18
Adresaci
Niniejsza dyrektywa skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 30 sierpnia 2010 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. 125 z 11.7.1966, s. 2298/66.
(2) Dz.U. L 309 z 13.12.1993, s. 1.
(3) Dz.U. L 378 z 23.12.2004, s. 1.
(4) Dz.U. L 162 z 30.4.2004, s. 18.
(5) Dz.U. L 277 z 21.10.2005, s. 1.
(6) Dz.U. L 162 z 21.6.2008, s. 13.
(7) Dz.U. L 206 z 22.7.1992, s. 7.
DECYZJE
|
31.8.2010 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 228/15 |
DECYZJA KOMISJI
z dnia 26 sierpnia 2010 r.
ustanawiająca wzory świadectw zdrowia w wewnątrzunijnym handlu nasieniem, komórkami jajowymi i zarodkami zwierząt z rodziny koniowatych, owiec i kóz, a także komórkami jajowymi i zarodkami świń
(notyfikowana jako dokument nr C(2010) 5779)
(Tekst mający znaczenie dla EOG)
(2010/470/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę Rady 92/65/EWG z dnia 13 lipca 1992 r. ustanawiającą wymagania dotyczące zdrowia zwierząt regulujące handel i przywóz do Wspólnoty zwierząt, nasienia, komórek jajowych i zarodków nieobjętych wymaganiami dotyczącymi zdrowia zwierząt ustanowionymi w szczególnych zasadach Wspólnoty określonych w pkt I załącznika A do dyrektywy 90/425/EWG (1), w szczególności jej art. 11 ust. 2 tiret czwarte i art. 11 ust. 3 tiret trzecie,
a także mając na uwadze, co następuje:
|
(1) |
W dyrektywie 92/65/EWG ustanowiono wymagania dotyczące zdrowia zwierząt regulujące wewnątrzunijny handel zwierzętami, nasieniem, komórkami jajowymi i zarodkami nieobjętymi wymaganiami dotyczącymi zdrowia zwierząt ustanowionymi w szczegółowych aktach prawa unijnego. Wymagania te obejmują wymagania dotyczące handlu nasieniem, komórkami jajowymi i zarodkami zwierząt z rodziny koniowatych, owiec i kóz, a także komórkami jajowymi i zarodkami świń („towary”). Ponadto w dyrektywie tej przewidziano ustanowienie świadectw zdrowia do stosowania w wewnątrzunijnym handlu towarami. |
|
(2) |
W załączniku D do dyrektywy 92/65/EWG, zmienionym rozporządzeniem Komisji (UE) nr 176/2010 (2), ustanowiono pewne nowe wymogi dotyczące towarów, mające zastosowanie od dnia 1 września 2010 r. |
|
(3) |
W załączniku D do dyrektywy 92/65/EWG, zmienionym rozporządzeniem (UE) nr 176/2010, wprowadzono przepisy dotyczące centrów przechowywania nasienia oraz szczegółowych warunków ich zatwierdzania i nadzoru. W załączniku tym ustanowiono również szczegółowe warunki zatwierdzania i nadzoru zespołów pozyskiwania i produkcji zarodków, dotyczące pozyskiwania i przetwarzania zarodków pochodzących z zapłodnienia in vivo, produkcji i przetwarzania zarodków zapłodnionych in vitro, a także produkcji i przetwarzania zarodków poddanych mikromanipulacji. W zmienionym załączniku D zmieniono także warunki mające zastosowanie do zwierząt-dawców nasienia, komórek jajowych i zarodków w odniesieniu do zwierząt z rodziny koniowatych, owiec i kóz oraz zwierząt-dawców komórek jajowych i zarodków w odniesieniu do świń. |
|
(4) |
Uwzględniając wymogi dotyczące zdrowia zwierząt ustanowione w załączniku D do dyrektywy 92/65/EWG, zmienionej rozporządzeniem (UE) nr 176/2010, należy ustanowić nowe wzory świadectw zdrowia do stosowania w wewnątrzunijnym handlu towarami. |
|
(5) |
Ponadto należy ustanowić przepis dotyczący istniejących w Unii zapasów towarów, zgodnych z przepisami dyrektywy 92/65/EWG ustanowionymi przed wejściem w życie zmian wprowadzonych rozporządzeniem (UE) nr 176/2010. W związku z powyższym zachodzi konieczność ustanowienia odrębnych wzorów świadectw zdrowia do stosowania w wewnątrzunijnym handlu nasieniem, komórkami jajowymi i zarodkami zwierząt z rodziny koniowatych, owiec i kóz oraz świadectw stosowanych w handlu komórkami jajowymi i zarodkami świń, pozyskanymi lub wyprodukowanymi, przetwarzanymi i przechowywanymi zgodnie z załącznikiem D do dyrektywy 92/65/EWG przed dniem 1 września 2010 r. |
|
(6) |
Możliwość przechowywania tych towarów przez długi czas uniemożliwia wyznaczenie w chwili obecnej daty wyczerpania istniejących zapasów. Dlatego nie można wyznaczyć daty zakończenia korzystania z wzorów świadectw zdrowia dla istniejących zapasów. |
|
(7) |
W interesie spójności i uproszczenia prawa unijnego wzory świadectw zdrowia należy ustanowić w jednej decyzji z uwzględnieniem rozporządzenia Komisji (WE) nr 599/2004 z dnia 30 marca 2004 r. dotyczącego przyjęcia zharmonizowanego wzoru świadectwa i sprawozdania z kontroli związanych z wewnątrzwspólnotowym handlem zwierzętami i produktami pochodzenia zwierzęcego (3). |
|
(8) |
Aby zapewnić pełne śledzenie drogi pochodzenia towarów, w niniejszej decyzji należy ustanowić wzory świadectw zdrowia do stosowania w wewnątrzunijnym handlu nasieniem zwierząt z rodziny koniowatych, owiec i kóz, pozyskiwanym w zatwierdzonych centrach pozyskiwania nasienia i wysyłanym z zatwierdzonego centrum przechowywania nasienia, które może, ale nie musi stanowić część centrum pozyskiwania nasienia zatwierdzonego pod innymi numerem. |
|
(9) |
W interesie przejrzystości prawa unijnego należy wyraźnie uchylić akty prawa unijnego ustanawiające wzory świadectw zdrowia do stosowania w wewnątrzunijnym handlu odnośnymi towarami. W związku z powyższym należy uchylić decyzję Komisji 95/294/WE z dnia 24 lipca 1995 r. określającą wzór świadectwa zdrowia zwierząt w odniesieniu do handlu komórkami jajowymi i zarodkami zwierząt z gatunku koniowatych (4), decyzję Komisji 95/307/WE z dnia 24 lipca 1995 r. określającą wzór świadectwa zdrowia zwierząt stosowanego w handlu nasieniem różnych gatunków koniowatych (5), decyzję Komisji 95/388/WE z dnia 19 września 1995 r. określającą wzór świadectwa stosowanego w wewnątrzwspólnotowym handlu nasieniem, komórkami jajowymi i zarodkami owiec i kóz (6) oraz decyzję Komisji 95/483/WE z dnia 9 listopada 1995 r. określającą wzór świadectwa stosowanego w wewnątrzwspólnotowym handlu komórkami jajowymi i zarodkami trzody chlewnej (7). |
|
(10) |
Środki przewidziane w niniejszej decyzji są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Przedmiot
W niniejszej decyzji ustanawia się wzory świadectw zdrowia do stosowania w wewnątrzunijnym handlu następującymi towarami:
|
a) |
nasienie zwierząt z rodziny koniowatych; |
|
b) |
komórki jajowe i zarodki zwierząt z rodziny koniowatych; |
|
c) |
nasienie owiec i kóz; |
|
d) |
komórki jajowe i zarodki owiec i kóz; |
|
e) |
komórki jajowe i zarodki świń. |
Artykuł 2
Handel nasieniem zwierząt z rodziny koniowatych
Przesyłkom nasienia zwierząt z rodziny koniowatych podczas transportu z jednego państwa członkowskiego do innego towarzyszy świadectwo zdrowia zgodne z jednym z następujących wzorów ustanowionych w załączniku I:
|
a) |
wzór świadectwa zdrowia IA, ustanowiony w części A, dla przesyłek nasienia pozyskanego po dniu 31 sierpnia 2010 r. i wysyłanego z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano; |
|
b) |
wzór świadectwa zdrowia IB, ustanowiony w części B, dla przesyłek zapasów nasienia pozyskanego, przetwarzanego i przechowywanego przed dniem 1 września 2010 r. i wysyłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano; |
|
c) |
wzór świadectwa zdrowia IC, ustanowiony w części C, dla przesyłek nasienia i zapasów nasienia, o których mowa w lit. a) i b), wysyłanych z zatwierdzonego centrum przechowywania nasienia. |
Artykuł 3
Handel komórkami jajowymi i zarodkami zwierząt z rodziny koniowatych
Przesyłkom komórek jajowych i zarodków zwierząt z rodziny koniowatych podczas transportu z jednego państwa członkowskiego do innego towarzyszy świadectwo zdrowia zgodne z jednym z następujących wzorów ustanowionych w załączniku II:
|
a) |
wzór świadectwa zdrowia IIA, ustanowiony w części A, dla przesyłek komórek jajowych i zarodków pozyskanych lub wyprodukowanych po dniu 31 sierpnia 2010 r. i wysyłanych przez zatwierdzony zespół pozyskiwania lub produkcji zarodków, który pozyskał lub wyprodukował te komórki jajowe lub zarodki; |
|
b) |
wzór świadectwa zdrowia IIB, ustanowiony w części B, dla przesyłek zapasów komórek jajowych i zarodków pozyskanych, przetwarzanych i przechowywanych przed dniem 1 września 2010 r. i wysyłanych po dniu 31 sierpnia 2010 r. przez zatwierdzony zespół pozyskiwania zarodków, który pozyskał te komórki jajowe lub zarodki. |
Artykuł 4
Handel nasieniem owiec i kóz
Przesyłkom nasienia owiec i kóz podczas transportu z jednego państwa członkowskiego do innego towarzyszy świadectwo zdrowia zgodne z jednym z następujących wzorów ustanowionych w załączniku III:
|
a) |
wzór świadectwa zdrowia IIIA, ustanowiony w części A, dla przesyłek nasienia pozyskanego po dniu 31 sierpnia 2010 r. i wysyłanego z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano; |
|
b) |
wzór świadectwa zdrowia IIIB, ustanowiony w części B, dla przesyłek zapasów nasienia pozyskanego, przetwarzanego i przechowywanego przed dniem 1 września 2010 r. i wysyłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano; |
|
c) |
wzór świadectwa zdrowia IIIC, ustanowiony w części C, dla przesyłek nasienia i zapasów nasienia, o których mowa w lit. a) i b), wysyłanych z zatwierdzonego centrum przechowywania nasienia. |
Artykuł 5
Handel komórkami jajowymi i zarodkami owiec i kóz
Przesyłkom komórek jajowych i zarodków owiec i kóz podczas transportu z jednego państwa członkowskiego do innego towarzyszy świadectwo zdrowia zgodne z jednym z następujących wzorów ustanowionych w załączniku IV:
|
a) |
wzór świadectwa zdrowia IVA, ustanowiony w części A, dla przesyłek komórek jajowych i zarodków pozyskanych lub wyprodukowanych po dniu 31 sierpnia 2010 r. i wysyłanych przez zatwierdzony zespół pozyskiwania lub produkcji zarodków, który pozyskał lub wyprodukował te komórki jajowe lub zarodki; |
|
b) |
wzór świadectwa zdrowia IVB, ustanowiony w części B, dla przesyłek zapasów komórek jajowych i zarodków pozyskanych, przetwarzanych i przechowywanych przed dniem 1 września 2010 r. i wysyłanych po dniu 31 sierpnia 2010 r. przez zatwierdzony zespół pozyskiwania zarodków, który pozyskał te komórki jajowe lub zarodki. |
Artykuł 6
Handel komórkami jajowymi i zarodkami świń
Przesyłkom komórek jajowych i zarodków świń podczas transportu z jednego państwa członkowskiego do innego towarzyszy świadectwo zdrowia zgodne z jednym z następujących wzorów ustanowionych w załączniku V:
|
a) |
wzór świadectwa zdrowia VA, ustanowiony w części A, dla przesyłek komórek jajowych i zarodków pozyskanych lub wyprodukowanych po dniu 31 sierpnia 2010 r. i wysyłanych przez zatwierdzony zespół pozyskiwania lub produkcji zarodków, który pozyskał lub wyprodukował te komórki jajowe lub zarodki; |
|
b) |
wzór świadectwa zdrowia VB, ustanowiony w części B, dla przesyłek zapasów komórek jajowych i zarodków pozyskanych, przetwarzanych i przechowywanych przed dniem 1 września 2010 r. i wysyłanych po dniu 31 sierpnia 2010 r. przez zatwierdzony zespół pozyskiwania zarodków, który pozyskał te komórki jajowe lub zarodki. |
Artykuł 7
Uchylenia
Decyzje 95/294/WE, 95/307/WE, 95/388/WE oraz 95/483/WE tracą moc.
Artykuł 8
Stosowanie
Niniejszą decyzję stosuje się od dnia 1 września 2010 r.
Artykuł 9
Adresaci
Niniejsza decyzja skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 26 sierpnia 2010 r.
W imieniu Komisji
John DALLI
Członek Komisji
(1) Dz.U. L 268 z 14.9.1992, s. 54.
(2) Dz.U. L 52 z 3.3.2010, s. 14.
(3) Dz.U. L 94 z 31.3.2004, s. 44.
(4) Dz.U. L 182 z 2.8.1995, s. 27.
(5) Dz.U. L 185 z 4.8.1995, s. 58.
(6) Dz.U. L 234 z 3.10.1995, s. 30.
(7) Dz.U. L 275 z 18.11.1995, s. 30.
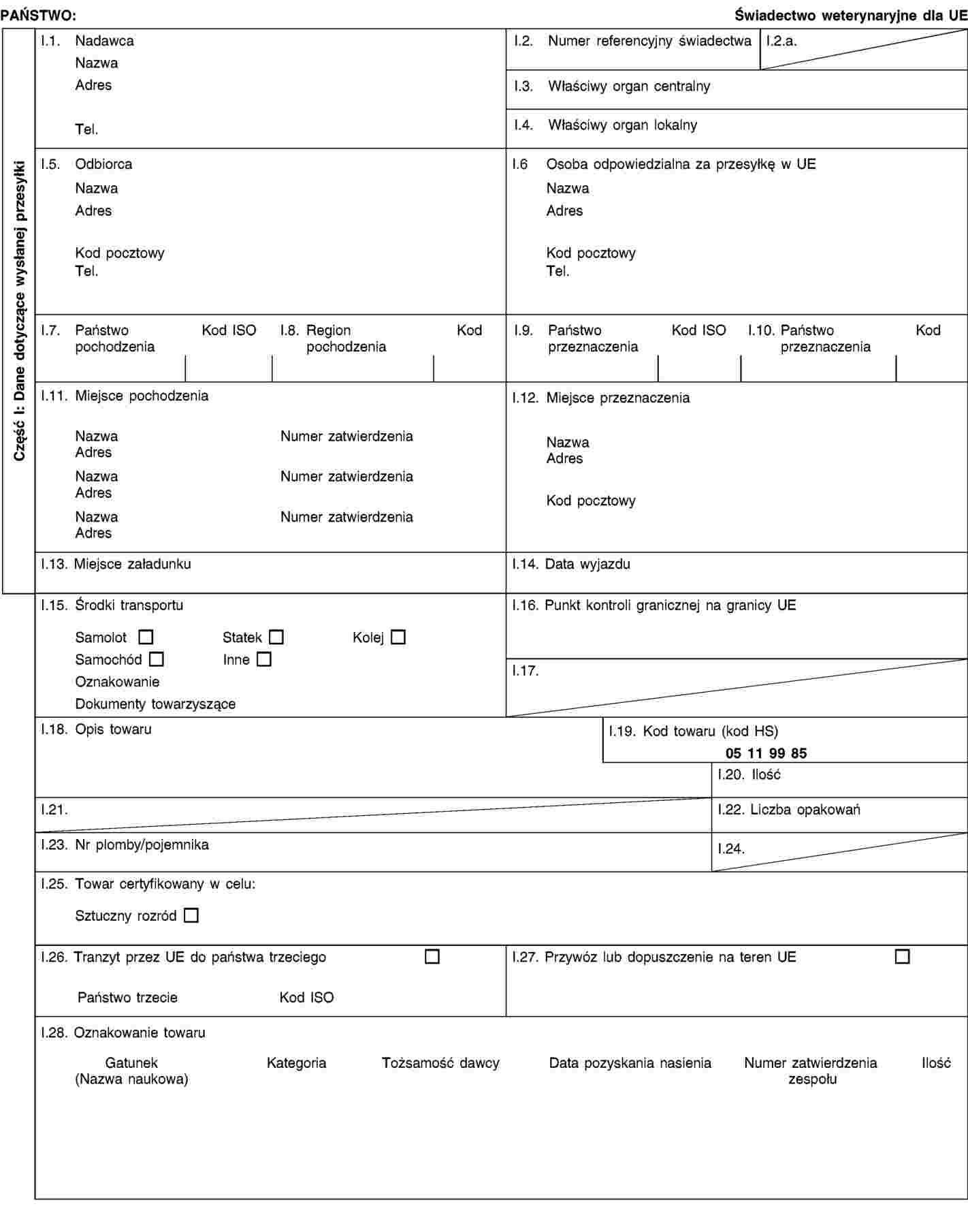
ZAŁĄCZNIK I
Wzory świadectw zdrowia do stosowania w wewnątrzunijnym handlu przesyłkami nasienia zwierząt z rodziny koniowatych
CZĘŚĆ A
Wzór świadectwa zdrowia IA do stosowania w wewnątrzunijnym handlu przesyłkami nasienia zwierząt z rodziny koniowatych, pozyskanego zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysyłanego z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano





CZĘŚĆ B
Wzór świadectwa zdrowia IB do stosowania w wewnątrzunijnym handlu przesyłkami nasienia zwierząt z rodziny koniowatych, pozyskanego, przetwarzanego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano



CZĘŚĆ C
Wzór świadectwa zdrowia IC do stosowania w wewnątrzunijnym handlu przesyłkami nasienia zwierząt z rodziny koniowatych, pozyskanego, przetwarzanego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. oraz przesyłkami zapasów nasienia zwierząt z rodziny koniowatych, pozyskanego, przetwarzanego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum przechowywania nasienia



ZAŁĄCZNIK II
Wzór świadectwa zdrowia do stosowania w wewnątrzunijnym handlu przesyłkami komórek jajowych i zarodków zwierząt z rodziny koniowatych
CZĘŚĆ A
Wzór świadectwa zdrowia IIA do stosowania w wewnątrzunijnym handlu przesyłkami komórek jajowych i zarodków zwierząt z rodziny koniowatych, pozyskanych lub wyprodukowanych zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysyłanych przez zatwierdzony zespół pozyskiwania lub produkcji zarodków, który pozyskał lub wyprodukował te komórki jajowe lub zarodki


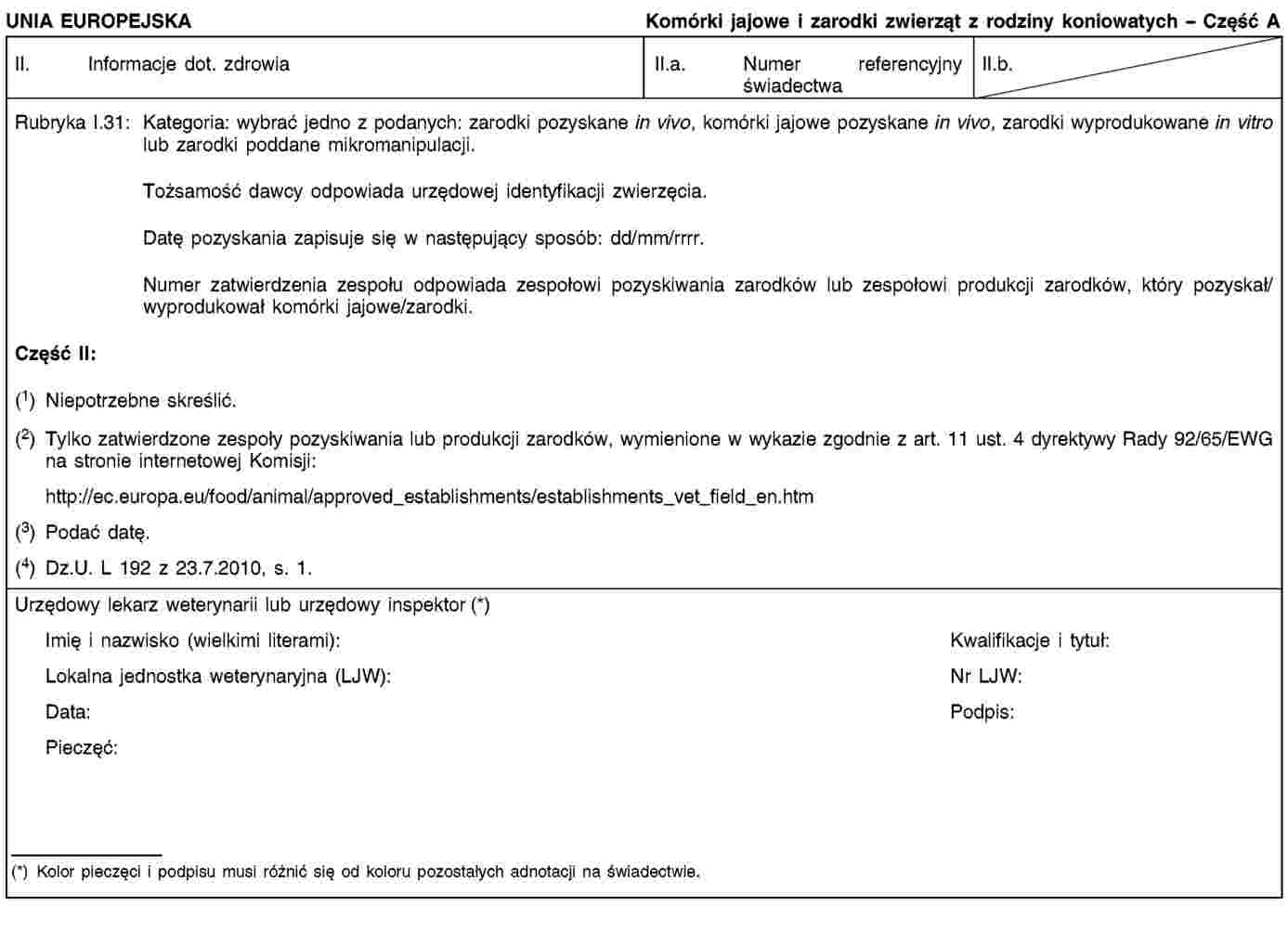
CZĘŚĆ B
Wzór świadectwa zdrowia IIB do stosowania w wewnątrzunijnym handlu przesyłkami zapasów komórek jajowych i zarodków zwierząt z rodziny koniowatych, pozyskanych, przetwarzanych i przechowywanych zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanych po dniu 31 sierpnia 2010 r. przez zatwierdzony zespół pozyskiwania zarodków, który pozyskał te komórki jajowe lub zarodki



ZAŁĄCZNIK III
Wzory świadectw zdrowia do stosowania w handlu przesyłkami nasienia owiec i kóz
CZĘŚĆ A
Wzór świadectwa zdrowia IIIA do stosowania w wewnątrzunijnym handlu przesyłkami nasienia owiec i kóz, pozyskanego zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysyłanego z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano


CZĘŚĆ B
Wzór świadectwa zdrowia IIIB do stosowania w wewnątrzunijnym handlu przesyłkami zapasów nasienia owiec i kóz, pozyskanego, przetwarzanego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum pozyskiwania nasienia, w którym nasienie to pozyskano


CZĘŚĆ C
Wzór świadectwa zdrowia IIIC do stosowania w wewnątrzunijnym handlu przesyłkami nasienia owiec i kóz, pozyskanego, przetwarzanego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. oraz przesyłkami zapasów nasienia owiec i kóz, pozyskanego, przetwarzanego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum przechowywania nasienia
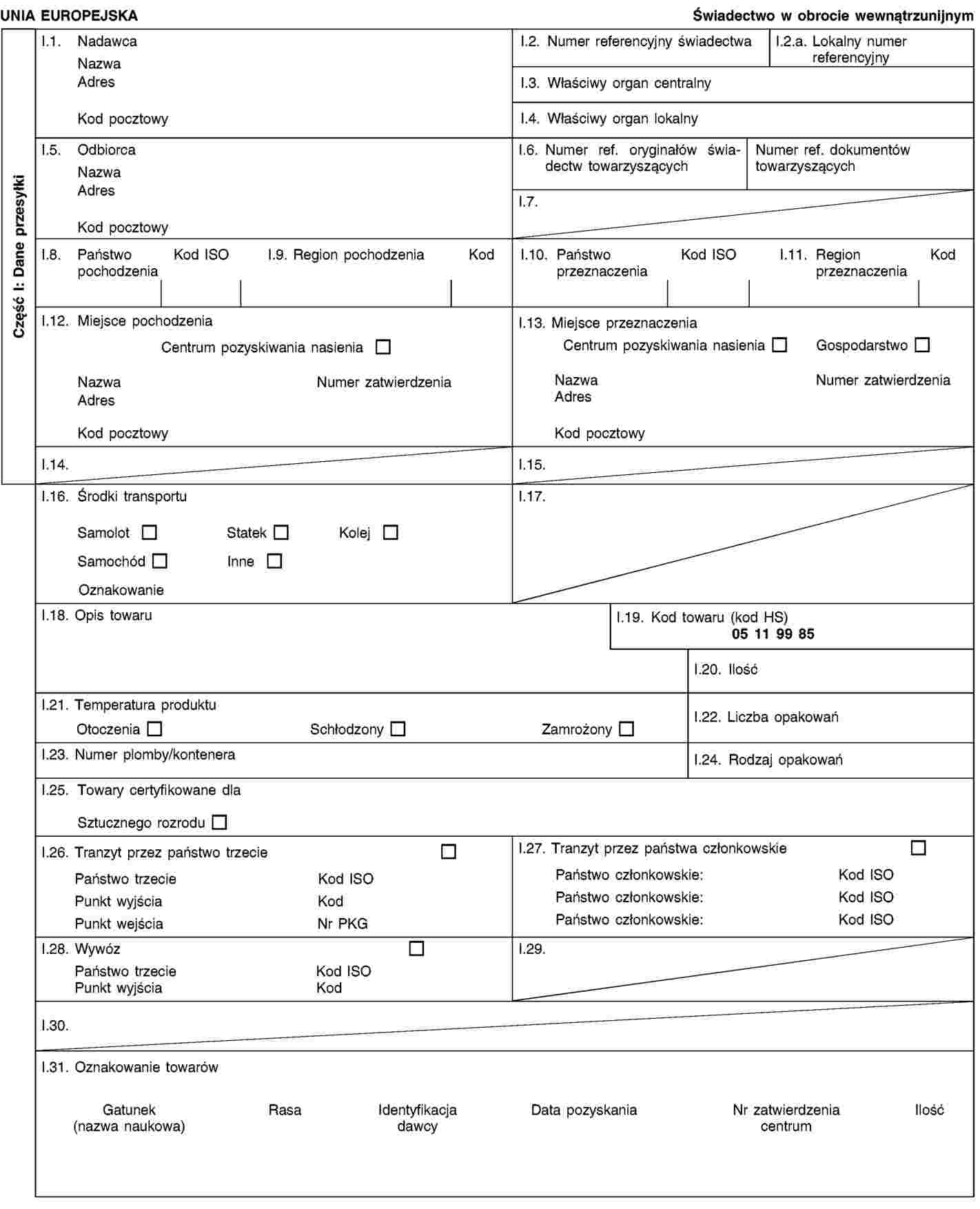


ZAŁĄCZNIK IV
Wzór świadectwa zdrowia do stosowania w wewnątrzunijnym handlu przesyłkami komórek jajowych i zarodków owiec i kóz
CZĘŚĆ A
Wzór świadectwa zdrowia IVA do stosowania w wewnątrzunijnym handlu przesyłkami komórek jajowych i zarodków owiec i kóz, pozyskanych lub wyprodukowanych zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysyłanych przez zatwierdzony zespół pozyskiwania lub produkcji zarodków, który pozyskał lub wyprodukował te komórki jajowe lub zarodki



CZĘŚĆ B
Wzór świadectwa zdrowia IVB do stosowania w wewnątrzunijnym handlu przesyłkami zapasów komórek jajowych i zarodków owiec i kóz, pozyskanych, przetwarzanych i przechowywanych zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanych po dniu 31 sierpnia 2010 r. przez zatwierdzony zespół pozyskiwania zarodków, który pozyskał te komórki jajowe lub zarodki


ZAŁĄCZNIK V
Wzór świadectwa zdrowia do stosowania w wewnątrzunijnym handlu przesyłkami komórek jajowych lub zarodków świń
CZĘŚĆ A
Wzór świadectwa zdrowia VA do stosowania w wewnątrzunijnym handlu przesyłkami komórek jajowych i zarodków świń, pozyskanych lub wyprodukowanych zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysyłanych przez zatwierdzony zespół pozyskiwania lub produkcji zarodków, który pozyskał lub wyprodukował te komórki jajowe lub zarodki



CZĘŚĆ B
Wzór świadectwa zdrowia VB do stosowania w wewnątrzunijnym handlu przesyłkami zapasów komórek jajowych i zarodków świń, pozyskanych, przetwarzanych i przechowywanych zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysyłanych po dniu 31 sierpnia 2010 r. przez zatwierdzony zespół pozyskiwania zarodków, który pozyskał te komórki jajowe lub zarodki


|
31.8.2010 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 228/52 |
DECYZJA KOMISJI
z dnia 26 sierpnia 2010 r.
w sprawie przywozu do Unii nasienia, komórek jajowych i zarodków zwierząt z rodziny koniowatych w odniesieniu do wykazu centrów pozyskiwania i przechowywania nasienia, wykazu zespołów pozyskiwania i produkcji zarodków oraz wymogów dotyczących wystawiania świadectw
(notyfikowana jako dokument nr C(2010) 5781)
(Tekst mający znaczenie dla EOG)
(2010/471/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę Rady 92/65/EWG z dnia 13 lipca 1992 r. ustanawiającą wymagania dotyczące zdrowia zwierząt regulujące handel i przywóz do Wspólnoty zwierząt, nasienia, komórek jajowych i zarodków nieobjętych wymaganiami dotyczącymi zdrowia zwierząt ustanowionymi w szczegółowych zasadach Wspólnoty określonych w pkt I załącznika A do dyrektywy 90/425/EWG (1), w szczególności art. 17 ust. 2 lit. b), art. 17 ust. 3, art. 18 ust. 1 tiret pierwsze oraz zdanie wprowadzające i lit. b) art. 19,
a także mając na uwadze, co następuje:
|
(1) |
Dyrektywa 92/65/EWG ustanawia wymagania dotyczące zdrowia zwierząt, regulujące przywóz do Unii nasienia, komórek jajowych i zarodków zwierząt z rodziny koniowatych („towary”). Zgodnie z tymi przepisami do Unii mogą być przywożone tylko towary, które pochodzą z państw trzecich lub części państw trzecich wymienionych w wykazie państw trzecich sporządzonym zgodnie z tą dyrektywą, oraz są opatrzone świadectwem zdrowia odpowiadającym wzorowi ustalonemu zgodnie z tą dyrektywą. Świadectwo zdrowia musi poświadczać, że towary pochodzą z zatwierdzonych centrów pozyskiwania i przechowywania lub zespołów pozyskiwania i produkcji oferujących gwarancje co najmniej równoważne z określonymi w rozdziale I załącznika D do tej dyrektywy. |
|
(2) |
W decyzji Komisji 2004/211/WE z dnia 6 stycznia 2004 r. ustanawiającej wykaz państw trzecich oraz części ich terytoriów, z których państwa członkowskie dopuszczają przywóz żywych zwierząt z rodziny koniowatych, nasienia, komórek jajowych i zarodków koni (2) ustalono wykaz państw trzecich lub ich części, z których państwa członkowskie mogą zezwalać na przywóz towarów. Dla zachowania spójności prawodawstwa Unii, należy uwzględnić wspomniany wykaz w niniejszej decyzji. |
|
(3) |
W dyrektywie 92/65/EWG zmienionej dyrektywą Rady 2008/73/WE (3) wprowadzono uproszczoną procedurę dotyczącą sporządzania wykazu centrów pozyskiwania i przechowywania nasienia oraz zespołów pozyskiwania i produkcji zarodków w państwach trzecich, zatwierdzonych do przywozu towarów do Unii. |
|
(4) |
W załączniku D do dyrektywy 92/65/EWG, zmienionym rozporządzeniem Komisji (UE) nr 176/2010 (4), określono niektóre nowe wymagania wobec towarów, obowiązujące od dnia 1 września 2010 r. Wprowadzono zasady dotyczące centrów przechowywania nasienia oraz szczegółowe warunki ich zatwierdzania i nadzoru nad nimi. Ustalono także szczegółowe warunki zatwierdzania i nadzoru w odniesieniu do zespołów pozyskiwania i produkcji zarodków, pozyskiwania i przetwarzania zarodków uzyskiwanych metodą in vivo, produkcji i przetwarzania zarodków uzyskanych w drodze zapłodnienia in vitro oraz zarodków poddanych mikromanipulacji. Zmieniono również warunki mające zastosowanie do zwierząt dawców nasienia, komórek jajowych i zarodków koniowatych oprócz warunków określonych w dyrektywie Rady 2009/156/WE z dnia 30 listopada 2009 r. w sprawie warunków zdrowotnych zwierząt, regulujących przemieszczanie i przywóz zwierząt z rodziny koniowatych z państw trzecich wersja ujednolicona (5). |
|
(5) |
Należy zatem określić nowe wzory świadectw zdrowia na potrzeby przywozu towarów do Unii z uwzględnieniem zmian w dyrektywie 92/65/EWG wprowadzonych dyrektywą 2008/73/WE oraz rozporządzeniem (UE) nr 176/2010. |
|
(6) |
Ponadto należy zapewnić przywóz do Unii istniejących zapasów towarów, które spełniają wymogi dyrektywy 92/65/EWG ustanowione przed wejściem w życie zmian wprowadzonych rozporządzeniem (UE) nr 176/2010. Należy zatem określić osobne wzory świadectw zdrowia na potrzeby przywozu przesyłek towarów pozyskiwanych lub produkowanych, przetwarzanych i przechowywanych zgodnie z załącznikiem D do dyrektywy 92/65/EWG przed dniem 1 września 2010 r. |
|
(7) |
Z uwagi na możliwość długotrwałego przechowywania takich towarów nie można w tej chwili określić daty wyczerpania istniejących zapasów. Z tego względu niemożliwe jest ustalenie daty ważności stosowania wspomnianych wzorów świadectw zdrowia w odniesieniu do istniejących zapasów. |
|
(8) |
Dla zagwarantowania pełnej identyfikowalności towarów należy w niniejszej decyzji określić wzory świadectw zdrowia na potrzeby przywozu do Unii nasienia zwierząt z rodziny koniowatych pozyskanego w zatwierdzonych centrach pozyskiwania nasienia i wysłanego z zatwierdzonego centrum przechowywania nasienia, bez względu na to, czy centrum przechowywania nasienia stanowi część centrum pozyskiwania nasienia zatwierdzonego pod innym numerem zatwierdzenia, czy też nie. |
|
(9) |
Mając na względzie spójność i uproszczenie prawodawstwa Unii, we wzorach świadectw zdrowia odnoszących się do przywozu towarów należy uwzględnić decyzję Komisji 2007/240/WE (6), zgodnie z którą różne świadectwa weterynaryjne, świadectwa zdrowia zwierząt i świadectwa zdrowia publicznego wymagane przy przywozie do Unii żywych zwierząt, nasienia, zarodków, komórek jajowych oraz produktów pochodzenia zwierzęcego należy sporządzać na podstawie standardowych wzorów świadectw weterynaryjnych określonych w załączniku I do tej decyzji. |
|
(10) |
Ponadto uznaje się za właściwe, aby przesyłkom towarów przywożonych do Unii ze Szwajcarii towarzyszyły świadectwa zdrowia sporządzane zgodnie z wzorami stosowanymi w wewnątrzunijnym handlu nasieniem, komórkami jajowymi i zarodkami zwierząt z rodziny koniowatych, określonymi w decyzji Komisji 2010/470/UE z dnia 26 sierpnia 2010 r. ustanawiającej wzory świadectw zdrowia w wewnątrzunijnym handlu nasieniem, komórkami jajowymi i zarodkami koni, owiec i kóz, a także komórkami jajowymi i zarodkami świń (7), z uwzględnieniem dostosowań określonych w dodatku 2 rozdział IX lit. B pkt 8 i 9 w załączniku 11 do Umowy między Wspólnotą Europejską a Konfederacją Szwajcarską dotyczącej handlu produktami rolnymi, zatwierdzonej decyzją 2002/309/WE/Euratom Rady i – w odniesieniu do umowy w sprawie współpracy naukowej i technologicznej – Komisji z dnia 4 kwietnia 2002 r. w sprawie zawarcia siedmiu umów z Konfederacją Szwajcarską (8). |
|
(11) |
Przy stosowaniu niniejszej decyzji należy uwzględnić szczególne wymogi dotyczące świadectw i wzory poświadczeń zdrowia, które mogą zostać określone zgodnie z umową między Wspólnotą Europejską a rządem Kanady o środkach sanitarnych dla ochrony zdrowia ludzi i zwierząt w związku z handlem żywymi zwierzętami i produktami pochodzenia zwierzęcego (9), zatwierdzoną decyzją Rady 1999/201/WE (10). |
|
(12) |
Przy stosowaniu niniejszej decyzji należy również uwzględnić szczególne wymogi dotyczące świadectw i wzory poświadczeń zdrowia, które mogą zostać określone zgodnie z umową między Wspólnotą Europejską a Nową Zelandią w sprawie środków sanitarnych stosowanych w handlu żywymi zwierzętami i produktami zwierzęcymi (11), zatwierdzoną decyzją Rady 97/132/WE (12). |
|
(13) |
Dla zachowania przejrzystości prawodawstwa Unii należy uchylić unijne akty prawne obecnie ustanawiające warunki wydawania świadectw dotyczących przywozu towarów do Unii. Należy zatem uchylić decyzję Komisji 96/539/WE z dnia 4 września 1996 r. w sprawie wymagań dotyczących zdrowia zwierząt i świadectw weterynaryjnych przy przywozie do Wspólnoty nasienia koni (13) oraz decyzję Komisji 96/540/WE z dnia 4 września 1996 r. w sprawie wymagań dotyczących zdrowia zwierząt i świadectw weterynaryjnych przy przywozie do Wspólnoty komórek jajowych i zarodków zwierząt z gatunku koniowatych (14). |
|
(14) |
Ponadto należy uchylić nieaktualną już decyzję Komisji 2004/616/WE z dnia 26 lipca 2004 r. w sprawie ustanowienia wykazu zatwierdzonych punktów pobierania nasienia przy przywozie nasienia koni z państw trzecich (15). |
|
(15) |
Środki przewidziane w niniejszej decyzji są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Przedmiot
W niniejszej decyzji określono niektóre wymagania w zakresie zdrowia zwierząt dotyczące przywozu do Unii przesyłek nasienia, komórek jajowych i zarodków zwierząt z rodziny koniowatych.
Ustanowiono wzory świadectw zdrowia, które mają być stosowane przy przywozie tych towarów do Unii.
Artykuł 2
Przywóz nasienia
Państwa członkowskie zezwalają na przywóz przesyłek nasienia zwierząt z rodziny koniowatych pod warunkiem, że spełniają one następujące warunki:
|
a) |
pochodzą z państw trzecich lub części terytoriów państw trzecich, wymienionych odpowiednio w kolumnach 2 i 4 załącznika I do decyzji 2004/211/WE, z których zezwala się na stały przywóz zarejestrowanych koni, zarejestrowanych koniowatych lub koniowatych przeznaczonych do hodowli i produkcji; |
|
b) |
pochodzą z zatwierdzonego centrum pozyskiwania lub przechowywania nasienia wymienionego w wykazie zgodnie z art. 17 ust. 3 lit. b) dyrektywy 92/65/EWG; |
|
c) |
są opatrzone świadectwem zdrowia sporządzonym zgodnie z jednym z następujących wzorów określonych w załączniku I część 2 i wypełnionym zgodnie z notami wyjaśniającymi przedstawionymi w części 1 tego załącznika:
W przypadku gdy w umowach dwustronnych między Unią Europejską a państwami trzecimi określono szczególne wymogi dotyczące świadectw, stosuje się te wymogi. |
|
d) |
spełniają wymogi określone w świadectwie zdrowia, o którym mowa w lit. c). |
Artykuł 3
Przywóz komórek jajowych i zarodków
Państwa członkowskie zezwalają na przywóz przesyłek komórek jajowych i zarodków zwierząt z rodziny koniowatych pod warunkiem, że spełniają one następujące warunki:
|
a) |
pochodzą z państw trzecich lub części terytoriów państw trzecich, wymienionych odpowiednio w kolumnach 2 i 4 załącznika I do decyzji 2004/211/WE, z których zezwala się na stały przywóz zarejestrowanych koni, zarejestrowanych koniowatych lub koniowatych przeznaczonych do hodowli i produkcji; |
|
b) |
pochodzą z zatwierdzonego zespołu pozyskiwania lub produkcji zarodków wymienionego w wykazie zgodnie z art. 17 ust. 3 lit. b) dyrektywy 92/65/EWG; |
|
c) |
są opatrzone świadectwem zdrowia sporządzonym zgodnie ze wzorem świadectwa zdrowia określonym w załączniku II część 2 i wypełnionym zgodnie z notami wyjaśniającymi przedstawionymi w załączniku II część 1. W przypadku gdy w umowach dwustronnych między Unią Europejską a państwami trzecimi określono szczególne wymogi dotyczące świadectw, stosuje się te wymogi. |
|
d) |
spełniają wymogi określone w świadectwie zdrowia, o którym mowa w lit. c). |
Artykuł 4
Ogólne warunki dotyczące transportu przesyłek nasienia, komórek jajowych i zarodków do Unii Europejskiej
1. Przesyłki nasienia, komórek jajowych i zarodków nie są przewożone w tych samych pojemnikach, w których przewożone są przesyłki nasienia, komórek jajowych i zarodków:
|
a) |
nieprzeznaczone do wprowadzenia do Unii, lub |
|
b) |
gorsze pod względem stanu zdrowia. |
2. Podczas transportu do Unii przesyłki nasienia, komórek jajowych i zarodków są umieszczone w zamkniętych i zaplombowanych pojemnikach, a plomba nie może zostać naruszona podczas transportu.
Artykuł 5
Uchylenie
Uchyla się decyzje 96/539/WE, 96/540/WE i 2004/616/WE.
Artykuł 6
Stosowanie
Niniejszą decyzję stosuje się od dnia 1 września 2010 r.
Artykuł 7
Adresaci
Niniejsza decyzja skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 26 sierpnia 2010 r.
W imieniu Komisji
John DALLI
Członek Komisji
(1) Dz.U. L 268 z 14.9.1992, s. 54.
(2) Dz.U. L 73 z 11.3.2004, s. 1.
(3) Dz.U. L 219 z 14.8.2008, s. 40.
(4) Dz.U. L 52 z 3.3.2010, s. 14.
(5) Dz.U. L 192 z 23.7.2010, s. 1.
(6) Dz.U. L 104 z 21.4.2007, s. 37.
(7) Zob. s. 15 niniejszego Dziennika Urzędowego.
(8) Dz.U. L 114 z 30.4.2002, s. 1.
(9) Dz.U. L 71 z 18.3.1999, s. 3.
(10) Dz.U. L 71 z 18.3.1999, s. 1.
(11) Dz.U. L 57 z 26.2.1997, s. 5.
(12) Dz.U. L 57 z 26.2.1997, s. 4.
(13) Dz.U. L 230 z 11.9.1996, s. 23.
(14) Dz.U. L 230 z 11.9.1996, s. 28.
(15) Dz.U. L 278 z 27.8.2004, s. 64.
ZAŁĄCZNIK I
Wzory świadectw zdrowia na przywóz nasienia zwierząt z rodziny koniowatych
CZĘŚĆ 1
Noty wyjaśniające dotyczące wystawiania świadectw
|
a) |
Świadectwa zdrowia wystawia właściwy organ państwa trzeciego wywozu zgodnie z wzorem określonym w załączniku I część 2. Jeśli państwo członkowskie przeznaczenia stawia dodatkowe wymogi dotyczące wystawiania świadectw, do oryginału świadectwa zdrowia włącza się poświadczenia spełnienia tych wymogów. |
|
b) |
Oryginał świadectwa zdrowia składa się z pojedynczego arkusza papieru lub, w przypadku obszerniejszego tekstu, musi mieć taką formę, aby wszystkie wymagane arkusze papieru stanowiły integralną, niepodzielną całość. |
|
c) |
Jeżeli wzór świadectwa przewiduje pozostawienie stosownych oświadczeń i skreślenie nieistotnych, te nieistotne oświadczenia mogą zostać przekreślone, parafowane i opatrzone pieczęcią przez urzędnika wystawiającego świadectwo, albo całkowicie wykreślone ze świadectwa. |
|
d) |
Świadectwo weterynaryjne sporządza się w co najmniej jednym urzędowym języku państwa członkowskiego, w którym znajduje się punkt kontroli granicznej będący miejscem wprowadzania przesyłki do Unii Europejskiej, oraz w języku urzędowym państwa członkowskiego przeznaczenia. Państwa członkowskie mogą jednak zezwolić na sporządzenie świadectwa w języku urzędowym innego państwa członkowskiego, w razie potrzeby wraz z jego urzędowym tłumaczeniem. |
|
e) |
Jeśli w celu oznakowania poszczególnych elementów przesyłki (według schematu w rubryce I.28 wzoru świadectwa zdrowia) do świadectwa zdrowia dołączone są dodatkowe kartki papieru, są one traktowane jako część oryginału świadectwa zdrowia po podpisaniu i opieczętowaniu każdej ze stron przez urzędnika wystawiającego świadectwo. |
|
f) |
Jeżeli świadectwo zdrowia wraz z dodatkowymi elementami, o których mowa w lit. e), składa się z dwóch lub więcej stron, każda ze stron musi być ponumerowana – (numer strony) z (całkowitej liczby stron) – na dole strony oraz musi być opatrzona na górze strony numerem danego świadectwa nadanym przez właściwy organ. |
|
g) |
Oryginał świadectwa zdrowia musi być wypełniony i podpisany przez urzędowego lekarza weterynarii najpóźniej ostatniego dnia roboczego przed załadunkiem przesyłki do wywozu do Unii Europejskiej. Właściwe organy państwa trzeciego wywozu dopilnowują, aby spełnione były wymogi dotyczące wystawiania świadectw, równoważne z wymogami określonymi w dyrektywie Rady 96/93/WE (1). Podpis i pieczęć urzędowego lekarza weterynarii muszą być w innym kolorze niż druk na świadectwie zdrowia. Wymóg ten dotyczy również pieczęci innych niż pieczęci tłoczone lub znaki wodne. |
|
h) |
Oryginał świadectwa zdrowia musi towarzyszyć przesyłce do punktu kontroli granicznej w miejscu jej wprowadzenia do Unii Europejskiej. |
|
i) |
Numer świadectwa zdrowia, o którym mowa w rubrykach I.2 i II.a wzoru świadectwa zdrowia, musi być nadany przez właściwy organ państwa trzeciego wywozu. |
CZĘŚĆ 2
Sekcja A
|
WZÓR 1 – |
Wzór świadectwa zdrowia na przywóz przesyłek nasienia zwierząt z rodziny koniowatych pozyskanego, przetworzonego lub przechowywanego zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysłanego z zatwierdzonego centrum pozyskiwania nasienia, z którego to nasienie pochodzi |
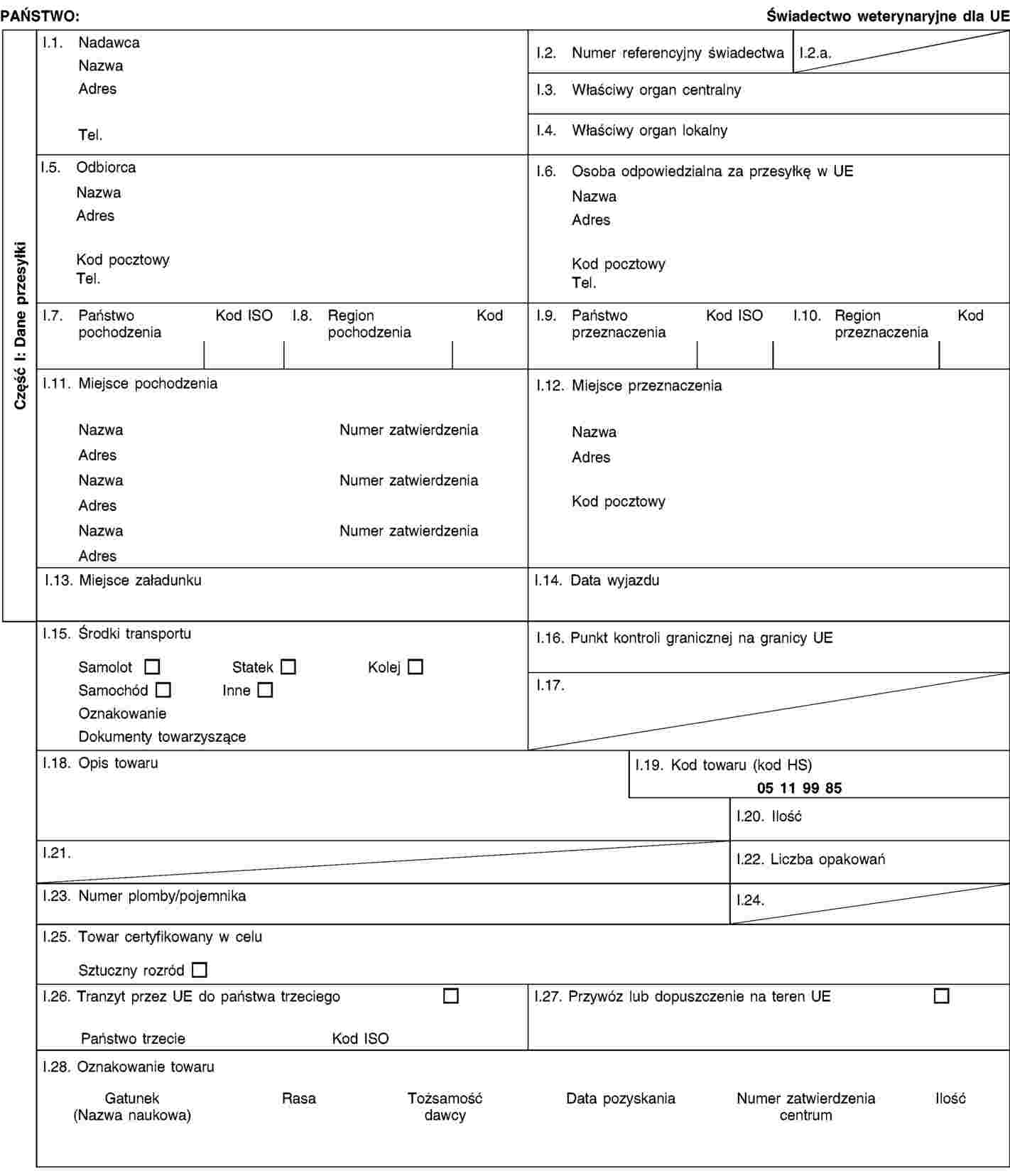





Sekcja B
|
WZÓR 2 – |
Wzór świadectwa zdrowia na przywóz przesyłek zapasów nasienia zwierząt z rodziny koniowatych pozyskanego, przetworzonego lub przechowywanego zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum pozyskiwania nasienia, z którego to nasienie pochodzi |




Sekcja C
|
WZÓR 3 – |
wzór świadectwa zdrowia na przywóz przesyłek nasienia zwierząt z rodziny koniowatych pozyskanego, przetworzonego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. oraz przesyłek zapasów nasienia zwierząt z rodziny koniowatych pozyskanego, przetworzonego i przechowywanego zgodnie z dyrektywą Rady 92/65/EWG przed dniem 1 września 2010 r. i wysłanego po dniu 31 sierpnia 2010 r. z zatwierdzonego centrum przechowywania nasienia |



ZAŁĄCZNIK II
Wzór świadectwa zdrowia na przywóz komórek jajowych i zarodków koniowatych
CZĘŚĆ 1
Noty wyjaśniające dotyczące wystawiania świadectw
|
a) |
Świadectwa zdrowia wystawia właściwy organ państwa trzeciego wywozu zgodnie z wzorem określonym w załączniku II część 2. Jeśli państwo członkowskie przeznaczenia stawia dodatkowe wymogi dotyczące wystawiania świadectw, do oryginału świadectwa zdrowia włącza się poświadczenia spełnienia tych wymogów. |
|
b) |
Oryginał świadectwa zdrowia składa się z pojedynczego arkusza papieru lub, w przypadku obszerniejszego tekstu, musi mieć taką formę, aby wszystkie wymagane arkusze papieru stanowiły integralną, niepodzielną całość. |
|
c) |
Jeżeli wzór świadectwa przewiduje pozostawienie stosownych oświadczeń i skreślenie nieistotnych, te nieistotne oświadczenia mogą zostać przekreślone, parafowane i opatrzone pieczęcią przez urzędnika wystawiającego świadectwo, albo całkowicie wykreślone ze świadectwa. |
|
d) |
Świadectwo weterynaryjne sporządza się w co najmniej jednym urzędowym języku państwa członkowskiego, w którym znajduje się punkt kontroli granicznej będący miejscem wprowadzania przesyłki do Unii Europejskiej, oraz w języku urzędowym państwa członkowskiego przeznaczenia. Państwa członkowskie mogą jednak zezwolić na sporządzenie świadectwa w języku urzędowym innego państwa członkowskiego, w razie potrzeby wraz z jego urzędowym tłumaczeniem. |
|
e) |
Jeśli w celu oznakowania poszczególnych elementów przesyłki (według schematu w rubryce I.28 wzoru świadectwa zdrowia) do świadectwa zdrowia dołączone są dodatkowe kartki papieru, są one traktowane jako część oryginału świadectwa zdrowia po podpisaniu i opieczętowaniu każdej ze stron przez urzędnika wystawiającego świadectwo. |
|
f) |
Jeżeli świadectwo zdrowia wraz z dodatkowymi elementami, o których mowa w lit. e), składa się z dwóch lub więcej stron, każda ze stron musi być ponumerowana – (numer strony) z (całkowitej liczby stron) – na dole strony oraz musi być opatrzona na górze strony numerem danego świadectwa nadanym przez właściwy organ. |
|
g) |
Oryginał świadectwa zdrowia musi być wypełniony i podpisany przez urzędowego lekarza weterynarii najpóźniej ostatniego dnia roboczego przed załadunkiem przesyłki do wywozu do Unii Europejskiej. Właściwe organy państwa trzeciego wywozu dopilnowują, aby spełnione były wymogi dotyczące wystawiania świadectw, równoważne z wymogami określonymi w dyrektywie Rady 96/93/WE (1). Podpis i pieczęć urzędowego lekarza weterynarii muszą być w innym kolorze niż druk na świadectwie zdrowia. Wymóg ten dotyczy również pieczęci innych niż pieczęci tłoczone lub znaki wodne. |
|
h) |
Oryginał świadectwa zdrowia musi towarzyszyć przesyłce do punktu kontroli granicznej w miejscu jej wprowadzenia do Unii Europejskiej. |
|
i) |
Numer świadectwa zdrowia, o którym mowa w rubrykach I.2 i II.a wzoru świadectwa zdrowia, musi być nadany przez właściwy organ państwa trzeciego wywozu. |
CZĘŚĆ 2
Wzór świadectwa zdrowia na przywóz komórek jajowych i zarodków zwierząt z rodziny koniowatych, pozyskanych, przetworzonych i przechowywanych zgodnie z dyrektywą Rady 92/65/EWG po dniu 31 sierpnia 2010 r. i wysłanych z zatwierdzonego zespołu pozyskiwania lub produkcji zarodków




|
31.8.2010 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 228/74 |
DECYZJA KOMISJI
z dnia 26 sierpnia 2010 r.
w sprawie przywozu do Unii nasienia, komórek jajowych i zarodków owiec i kóz
(notyfikowana jako dokument nr C(2010) 5780)
(Tekst mający znaczenie dla EOG)
(2010/472/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę Rady 92/65/EWG z dnia 13 lipca 1992 r. ustanawiającą wymagania dotyczące zdrowia zwierząt regulujące handel i przywóz do Wspólnoty zwierząt, nasienia, komórek jajowych i zarodków nieobjętych wymaganiami dotyczącymi zdrowia zwierząt ustanowionymi w szczegółowych zasadach Wspólnoty określonych w załączniku A pkt I do dyrektywy 90/425/EWG (1), w szczególności jej art. 17 ust. 2 lit. b), art. 17 ust. 3, art. 18 ust. 1 tiret pierwsze oraz zdanie wprowadzające i lit. b) jej art. 19,
a także mając na uwadze, co następuje:
|
(1) |
Dyrektywa 92/65/EWG ustanawia warunki dotyczące zdrowia zwierząt, regulujące przywóz do Unii nasienia, komórek jajowych i zarodków owiec i kóz („towary”). Zgodnie z tymi przepisami do Unii mogą być przywożone tylko towary, które pochodzą z państwa trzeciego wymienionego w wykazie państw trzecich sporządzonym zgodnie z tą dyrektywą, oraz są opatrzone świadectwem zdrowia odpowiadającym wzorowi ustalonemu zgodnie z tą dyrektywą. Świadectwo zdrowia musi poświadczać, że towary pochodzą z zatwierdzonych centrów pozyskiwania i przechowywania lub zespołów pozyskiwania i produkcji oferujących gwarancje co najmniej równoważne z określonymi w rozdziale I załącznika D do tej dyrektywy. |
|
(2) |
Decyzja Komisji 2008/635/WE z dnia 22 lipca 2008 r. w sprawie przywozu do Wspólnoty nasienia, komórek jajowych i zarodków owiec i kóz w odniesieniu do wykazów państw trzecich i punktów pobierania nasienia oraz zespołów pobierania zarodków i wymagań dotyczących wydawania świadectw (2) obecnie ustanawia wykaz państw trzecich z których państwa członkowskie zezwalają na przywóz towarów. |
|
(3) |
W dyrektywie 92/65/EWG zmienionej dyrektywą Rady 2008/73/WE (3) wprowadzono uproszczoną procedurę dotyczącą sporządzania wykazu centrów pozyskiwania i przechowywania nasienia oraz zespołów pozyskiwania i produkcji zarodków w państwach trzecich, zatwierdzonych do przywozu towarów do Unii. |
|
(4) |
W załączniku D do dyrektywy 92/65/EWG, zmienionym rozporządzeniem Komisji (UE) nr 176/2010 (4), określono ponadto niektóre nowe wymogi dotyczące towarów, obowiązujące od dnia 1 września 2010 r. Wprowadzono zasady dotyczące centrów przechowywania nasienia oraz szczegółowe warunki ich zatwierdzania i nadzoru nad nimi. Ustalono także szczegółowe warunki zatwierdzania i nadzoru w odniesieniu do zespołów pozyskiwania i produkcji zarodków, pozyskiwania i przetwarzania zarodków uzyskiwanych metodą in vivo, produkcji i przetwarzania zarodków uzyskanych w drodze zapłodnienia in vitro oraz zarodków poddanych mikromanipulacji. Zmieniono również warunki mające zastosowanie do zwierząt dawców nasienia, komórek jajowych i zarodków owiec i kóz. |
|
(5) |
Należy zatem określić nowe wzory świadectw zdrowia w odniesieniu do przywozu towarów do Unii z uwzględnieniem zmian w dyrektywie 92/65/EWG wprowadzonych dyrektywą 2008/73/WE oraz rozporządzeniem (UE) nr 176/2010. |
|
(6) |
Ponadto uznaje się za właściwe, aby przesyłkom towarów przywożonych do Unii ze Szwajcarii towarzyszyły świadectwa zdrowia sporządzane zgodnie z wzorami stosowanymi w wewnątrzunijnym handlu nasieniem, komórkami jajowymi i zarodkami określonymi w decyzji Komisji 2010/470/UE z dnia 26 sierpnia 2010 r. ustanawiającej wzory świadectw zdrowia w wewnątrzunijnym handlu nasieniem, komórkami jajowymi i zarodkami koni, owiec i kóz, a także komórkami jajowymi i zarodkami świń (5), z uwzględnieniem dostosowań określonych w dodatku 2 rozdział IX lit. B pkt 7 załącznika 11 do Umowy między Wspólnotą Europejską a Konfederacją Szwajcarską dotyczącej handlu produktami rolnymi, zatwierdzonej decyzją 2002/309/WE, Euratom Rady i – w odniesieniu do umowy w sprawie współpracy naukowej i technologicznej – Komisji z dnia 4 kwietnia 2002 r. w sprawie zawarcia siedmiu umów z Konfederacją Szwajcarską (6). |
|
(7) |
Przy stosowaniu niniejszej decyzji należy uwzględnić szczególne wymogi dotyczące świadectw i wzory poświadczeń zdrowia, które mogą zostać określone zgodnie z umową między Wspólnotą Europejską a rządem Kanady o środkach sanitarnych dla ochrony zdrowia ludzi i zwierząt w związku z handlem żywymi zwierzętami i produktami pochodzenia zwierzęcego (7), zatwierdzoną decyzją Rady 1999/201/WE (8). |
|
(8) |
Przy stosowaniu niniejszej decyzji należy również uwzględnić szczególne wymogi dotyczące świadectw i wzory poświadczeń zdrowia, które mogą zostać określone zgodnie z umową między Wspólnotą Europejską a Nową Zelandią w sprawie środków sanitarnych stosowanych w handlu żywymi zwierzętami i produktami zwierzęcymi (9), zatwierdzoną decyzją Rady 97/132/WE (10). |
|
(9) |
W celu zachowania jasności i spójności prawodawstwa Unii należy uchylić decyzję 2008/635/WE i zastąpić ją niniejszą decyzją. |
|
(10) |
Aby uniknąć wszelkich zakłóceń handlu, należy zezwolić, pod pewnymi warunkami, na stosowanie w okresie przejściowym świadectw zdrowia wystawionych zgodnie z decyzją 2008/635/WE. |
|
(11) |
Środki przewidziane w niniejszej decyzji są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Przedmiot
W niniejszej decyzji ustanawia się wykaz państw trzecich lub części terytoriów państw trzecich z których państwa członkowskie zezwalają na przywóz do Unii przesyłek nasienia, komórek jajowych i zarodków owiec i kóz.
Ustanawia się w niej również wymogi dotyczące świadectw, które mają być stosowane przy przywozie tych towarów do Unii.
Artykuł 2
Przywóz nasienia
Państwa członkowskie zezwalają na przywóz przesyłek nasienia owiec i kóz pod warunkiem, że spełniają one następujące warunki:
|
a) |
pochodzą z państw trzecich lub ich części wymienionych w załączniku I; |
|
b) |
pochodzą z zatwierdzonego centrum pozyskiwania lub przechowywania nasienia wymienionego w wykazie zgodnie z art. 17 ust. 3 lit. b) dyrektywy 92/65/EWG; |
|
c) |
są zaopatrzone w świadectwo zdrowia sporządzone zgodnie z wymienionymi poniżej wzorami świadectw zdrowia określonymi w załączniku II część 2 i wypełnione zgodnie z notami wyjaśniającymi zamieszczonymi w części 1 tego załącznika:
W przypadku gdy w umowach dwustronnych między Unią Europejską a państwami trzecimi określono szczególne wymogi dotyczące świadectw, stosuje się te wymogi. |
|
d) |
spełniają wymogi określone w świadectwach zdrowia, o których mowa w lit. c). |
Artykuł 3
Przywóz komórek jajowych i zarodków
Państwa członkowskie zezwalają na przywóz przesyłek komórek jajowych i zarodków owiec i kóz pod warunkiem, że spełniają one następujące warunki:
|
a) |
pochodzą z państw trzecich lub ich części wymienionych w załączniku III; |
|
b) |
pochodzą z zatwierdzonego zespołu pozyskiwania lub produkcji zarodków wymienionego w wykazie zgodnie z art. 17 ust. 3 lit. b) dyrektywy 92/65/EWG; |
|
c) |
są zaopatrzone w świadectwo zdrowia sporządzone zgodnie z wzorem określonym w załączniku IV część 2 i wypełnione zgodnie z notami wyjaśniającymi zamieszczonymi w części 1 tego załącznika. W przypadku gdy w umowach dwustronnych między Unią Europejską a państwami trzecimi określono szczególne wymogi dotyczące świadectw, stosuje się te wymogi. |
|
d) |
spełniają wymogi określone w świadectwie zdrowia, o którym mowa w lit. c). |
Artykuł 4
Ogólne warunki dotyczące transportu przesyłek nasienia, komórek jajowych i zarodków do Unii
1. Przesyłki nasienia, komórek jajowych i zarodków owiec i kóz nie są przewożone w tych samych pojemnikach, w których przewożone są przesyłki nasienia, komórek jajowych i zarodków:
|
a) |
nieprzeznaczone do wprowadzenia do Unii, lub |
|
b) |
o niższym statusie zdrowotnym. |
2. Podczas transportu do Unii Europejskiej przesyłki nasienia, komórek jajowych i zarodków są umieszczone w zamkniętych i zaplombowanych pojemnikach, a plomba nie może zostać naruszona podczas transportu.
Artykuł 5
Uchylenie
Decyzja 2008/635/WE traci moc.
Artykuł 6
Przepisy przejściowe
W okresie przejściowym, do dnia 31 sierpnia 2011 r., państwa członkowskie zezwalają na przywóz z państw trzecich zapasów następujących towarów:
|
a) |
nasienia owiec i kóz pozyskanego, przetworzonego i przechowywanego zgodnie z dyrektywą 92/65/EWG do dnia 31 sierpnia 2010 r., które zaopatrzone jest w świadectwo zdrowia wystawione nie później niż dnia 31 maja 2011 r., zgodnie ze wzorem ustanowionym w załączniku II do decyzji 2008/635/WE; |
|
b) |
komórek jajowych owiec i kóz pozyskanych lub wyprodukowanych, przetworzonych i przechowywanych zgodnie z dyrektywą 92/65/EWG do dnia 31 sierpnia 2010 r., które zaopatrzone są w świadectwo zdrowia wystawione nie później niż dnia 31 maja 2011 r., zgodnie ze wzorem ustanowionym w załączniku VI do decyzji 2008/635/WE. |
Artykuł 7
Stosowanie
Niniejszą decyzję stosuje się od dnia 1 września 2010 r.
Artykuł 8
Adresaci
Niniejsza decyzja skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 26 sierpnia 2010 r.
W imieniu Komisji
John DALLI
Członek Komisji
(1) Dz.U. L 268 z 14.9.1992, s. 54.
(2) Dz.U. L 206 z 2.8.2008, s. 17.
(3) Dz.U. L 219 z 14.8.2008, s. 40.
(4) Dz.U. L 52 z 3.3.2010, s. 14.
(5) Zob. 15 s. niniejszego Dziennika Urzędowego.
(6) Dz.U. L 114 z 30.4.2002, s. 1.
(7) Dz.U. L 71 z 18.3.1999, s. 3.
(8) Dz.U. L 71 z 18.3.1999, s. 1.
(9) Dz.U. L 57 z 26.2.1997, s. 5.
(10) Dz.U. L 57 z 26.2.1997, s. 4.
ZAŁĄCZNIK I
Wykaz państw trzecich lub części ich terytoriów, z których państwa członkowskie zezwalają na przywóz przesyłek nasienia owiec i kóz
|
Kod ISO |
Nazwa państwa trzeciego |
Uwagi |
|
|
Opis terytorium (jeżeli dotyczy) |
Dodatkowe gwarancje |
||
|
AU |
Australia |
|
Dodatkowe gwarancje dotyczące badań określonych w pkt II.4.9 i II.4.10 świadectwa zdrowia ustanowionego w załączniku II część 2 sekcja A są obowiązkowe. |
|
CA |
Kanada |
Terytorium zgodne z opisem zawartym w części 1 załącznika I do rozporządzenia Komisji (UE) nr 206/2010 (1). |
Dodatkowa gwarancja dotycząca badań określonych w pkt II.4.9 świadectwa zdrowia ustanowionego w załączniku II część 2 sekcja A jest obowiązkowa. |
|
CH |
Szwajcaria (2) |
|
|
|
CL |
Chile |
|
|
|
GL |
Grenlandia |
|
|
|
HR |
Chorwacja |
|
|
|
IS |
Islandia |
|
|
|
NZ |
Nowa Zelandia |
|
|
|
PM |
Saint-Pierre i Miquelon |
|
|
|
US |
Stany Zjednoczone |
|
Dodatkowa gwarancja dotycząca badań określonych w pkt II.4.9 świadectwa zdrowia ustanowionego w załączniku II część 2 sekcja A jest obowiązkowa. |
(1) Dz.U. L 73 z 20.3.2010, s. 1.
(2) Świadectwa zgodne z Umową między Wspólnotą Europejską i Konfederacją Szwajcarską dotyczącą handlu produktami rolnymi, zatwierdzoną decyzją 2002/309/WE, Euratom Rady i – w odniesieniu do umowy w sprawie współpracy naukowej i technologicznej – Komisji z dnia 4 kwietnia 2002 r. w sprawie zawarcia siedmiu umów z Konfederacją Szwajcarską (Dz.U. L 114 z 30.4.2002, s. 132).
ZAŁĄCZNIK II
CZĘŚĆ 1
Noty wyjaśniające dotyczące wystawiania świadectw
|
a) |
Świadectwa zdrowia wystawia właściwy organ państwa trzeciego wywozu zgodnie z wzorem określonym w załączniku II część 2. Jeśli państwo członkowskie przeznaczenia stawia dodatkowe wymogi dotyczące wystawiania świadectw, do oryginału świadectwa zdrowia włącza się poświadczenia spełnienia tych wymogów. |
|
b) |
Oryginał świadectwa zdrowia składa się z pojedynczego arkusza papieru lub, w przypadku obszerniejszego tekstu, musi mieć taką formę, aby wszystkie wymagane arkusze papieru stanowiły integralną, niepodzielną całość. |
|
c) |
Jeżeli wzór świadectwa przewiduje pozostawienie stosownych oświadczeń i skreślenie nieistotnych, te nieistotne oświadczenia mogą zostać przekreślone, parafowane i opatrzone pieczęcią przez urzędnika wystawiającego świadectwo, albo całkowicie wykreślone ze świadectwa. |
|
d) |
Świadectwo weterynaryjne sporządza się w co najmniej jednym urzędowym języku państwa członkowskiego, w którym znajduje się punkt kontroli granicznej będący miejscem wprowadzania przesyłki do Unii Europejskiej, oraz w języku urzędowym państwa członkowskiego przeznaczenia. Państwa członkowskie mogą jednak zezwolić na sporządzenie świadectwa w języku urzędowym innego państwa członkowskiego, w razie potrzeby wraz z jego urzędowym tłumaczeniem. |
|
e) |
Jeśli w celu oznakowania poszczególnych elementów przesyłki (według schematu w rubryce I.28 wzoru świadectwa zdrowia) do świadectwa zdrowia dołączone są dodatkowe kartki papieru, są one traktowane jako część oryginału świadectwa zdrowia po podpisaniu i opieczętowaniu każdej ze stron przez urzędnika wystawiającego świadectwo. |
|
f) |
Jeżeli świadectwo zdrowia wraz z dodatkowymi elementami, o których mowa w lit. e), składa się z dwóch lub więcej stron, każda ze stron musi być ponumerowana – (numer strony) z (całkowitej liczby stron) – na dole strony oraz musi być opatrzona na górze strony numerem danego świadectwa nadanym przez właściwy organ. |
|
g) |
Oryginał świadectwa zdrowia musi być wypełniony i podpisany przez urzędowego lekarza weterynarii najpóźniej ostatniego dnia roboczego przed załadunkiem przesyłki do wywozu do Unii Europejskiej. Właściwe organy państwa trzeciego wywozu dopilnowują, aby spełnione były wymogi dotyczące wystawiania świadectw, równoważne z wymogami określonymi w dyrektywie Rady 96/93/WE (1). Podpis i pieczęć urzędowego lekarza weterynarii muszą być w innym kolorze niż druk na świadectwie zdrowia. Wymóg ten dotyczy również pieczęci innych niż pieczęci tłoczone lub znaki wodne. |
|
h) |
Oryginał świadectwa zdrowia musi towarzyszyć przesyłce do punktu kontroli granicznej w miejscu jej wprowadzenia do Unii Europejskiej. |
|
i) |
Numer świadectwa zdrowia, o którym mowa w rubryce I.2 i II.a wzoru świadectwa zdrowia, musi być nadany przez właściwy organ państwa trzeciego wywozu. |
CZĘŚĆ 2
Wzory świadectw zdrowia do stosowania w przywozie nasienia owiec i kóz
Sekcja A
|
WZÓR 1 – |
świadectwo zdrowia do stosowania w przywozie nasienia wysłanego z zatwierdzonego centrum pozyskiwania nasienia, z którego to nasienie pochodzi |





Sekcja B
|
WZÓR 2 – |
świadectwo zdrowia na przywóz nasienia wysłanego z zatwierdzonego centrum przechowywania nasienia |



ZAŁĄCZNIK III
Wykaz państw trzecich lub części ich terytoriów, z których państwa członkowskie dopuszczają przywóz przesyłek komórek jajowych i zarodków owiec i kóz
|
Kod ISO |
Nazwa państwa trzeciego |
Uwagi |
|
|
Opis terytorium (jeżeli dotyczy) |
Dodatkowe gwarancje |
||
|
AU |
Australia |
|
Dodatkowe gwarancje dotyczące badania określonego w pkt II.2.6 i II.2.7 świadectwa zdrowia ustanowionego w załączniku IV część 2 są obowiązkowe. |
|
CA |
Kanada |
Terytorium zgodne z opisem zawartym w części 1 załącznika I do rozporządzenia Komisji (UE) nr 206/2010 (1), z ostatnimi zmianami. |
Dodatkowa gwarancja dotycząca badania określonego w pkt II.2.7 świadectwa zdrowia ustanowionego w załączniku IV część 2 jest obowiązkowa. |
|
CH |
Szwajcaria (2) |
|
|
|
CL |
Chile |
|
|
|
GL |
Grenlandia |
|
|
|
HR |
Chorwacja |
|
|
|
IS |
Islandia |
|
|
|
NZ |
Nowa Zelandia |
|
|
|
PM |
Saint-Pierre i Miquelon |
|
|
|
US |
Stany Zjednoczone |
|
Dodatkowa gwarancja dotycząca badania określonego w pkt II.2.7 świadectwa zdrowia ustanowionego w załączniku IV część 2 jest obowiązkowa. |
(1) Dz.U. L 73 z 20.3.2010, s. 1.
(2) Świadectwa zgodne z Umową między Wspólnotą Europejską i Konfederacją Szwajcarską dotyczącą handlu produktami rolnymi, zatwierdzoną decyzją 2002/309/WE, Euratom Rady i – w odniesieniu do umowy w sprawie współpracy naukowej i technologicznej – Komisji z dnia 4 kwietnia 2002 r. w sprawie zawarcia siedmiu umów z Konfederacją Szwajcarską (Dz.U. L 114 z 30.4.2002, s. 132).
ZAŁĄCZNIK IV
CZĘŚĆ 1
Noty wyjaśniające dotyczące wystawiania świadectw
|
a) |
Świadectwa zdrowia wystawia właściwy organ państwa trzeciego wywozu zgodnie z wzorem określonym w załączniku IV część 2. Jeśli państwo członkowskie przeznaczenia stawia dodatkowe wymogi dotyczące wystawiania świadectw, do oryginału świadectwa zdrowia włącza się poświadczenia spełnienia tych wymogów. |
|
b) |
Oryginał świadectwa zdrowia składa się z pojedynczego arkusza papieru lub, w przypadku obszerniejszego tekstu, musi mieć taką formę, aby wszystkie wymagane arkusze papieru stanowiły integralną, niepodzielną całość. |
|
c) |
Jeżeli wzór świadectwa przewiduje pozostawienie stosownych oświadczeń i skreślenie nieistotnych, te nieistotne oświadczenia mogą zostać przekreślone, parafowane i opatrzone pieczęcią przez urzędnika wystawiającego świadectwo, albo całkowicie wykreślone ze świadectwa. |
|
d) |
Świadectwo weterynaryjne sporządza się w co najmniej jednym urzędowym języku państwa członkowskiego, w którym znajduje się punkt kontroli granicznej będący miejscem wprowadzania przesyłki do Unii Europejskiej, oraz w języku urzędowym państwa członkowskiego przeznaczenia. Państwa członkowskie mogą jednak zezwolić na sporządzenie świadectwa w języku urzędowym innego państwa członkowskiego, w razie potrzeby wraz z jego urzędowym tłumaczeniem. |
|
e) |
Jeśli w celu oznakowania poszczególnych elementów przesyłki (według schematu w rubryce I.28 wzoru świadectwa zdrowia) do świadectwa zdrowia dołączone są dodatkowe kartki papieru, są one traktowane jako część oryginału świadectwa zdrowia po podpisaniu i opieczętowaniu każdej ze stron przez urzędnika wystawiającego świadectwo. |
|
f) |
Jeżeli świadectwo zdrowia wraz z dodatkowymi elementami, o których mowa w lit. e), składa się z dwóch lub więcej stron, każda ze stron musi być ponumerowana – (numer strony) z (całkowitej liczby stron) – na dole strony oraz musi być opatrzona na górze strony numerem danego świadectwa nadanym przez właściwy organ. |
|
g) |
Oryginał świadectwa zdrowia musi być wypełniony i podpisany przez urzędowego lekarza weterynarii najpóźniej ostatniego dnia roboczego przed załadunkiem przesyłki do wywozu do Unii Europejskiej. Właściwe organy państwa trzeciego wywozu dopilnowują, aby spełnione były wymogi dotyczące wystawiania świadectw, równoważne z wymogami określonymi w dyrektywie Rady 96/93/WE (1). Podpis i pieczęć urzędowego lekarza weterynarii muszą być w innym kolorze niż druk na świadectwie zdrowia. Wymóg ten dotyczy również pieczęci innych niż pieczęci tłoczone lub znaki wodne. |
|
h) |
Oryginał świadectwa zdrowia musi towarzyszyć przesyłce do punktu kontroli granicznej w miejscu jej wprowadzenia do Unii Europejskiej. |
|
i) |
Numer świadectwa zdrowia, o którym mowa w rubryce I.2 i II.a. wzoru świadectwa zdrowia, musi być nadany przez właściwy organ państwa trzeciego wywozu. |
CZĘŚĆ 2
Wzór świadectwa zdrowia na przywóz przesyłek komórek jajowych i zarodków owiec i kóz