ISSN 1725-5139
Dziennik Urzędowy
Unii Europejskiej
L 73

Wydanie polskie
Legislacja
Tom 50
13 marca 2007
|
ISSN 1725-5139 |
||
|
Dziennik Urzędowy Unii Europejskiej |
L 73 |
|

|
||
|
Wydanie polskie |
Legislacja |
Tom 50 |
|
|
|
|
|
(1) Tekst mający znaczenie dla EOG |
|
PL |
Akty, których tytuły wydrukowano zwykłą czcionką, odnoszą się do bieżącego zarządzania sprawami rolnictwa i generalnie zachowują ważność przez określony czas. Tytuły wszystkich innych aktów poprzedza gwiazdka, a drukuje się je czcionką pogrubioną. |
I Akty przyjęte na mocy Traktatów WE/Euratom, których publikacja jest obowiązkowa
ROZPORZĄDZENIA
|
13.3.2007 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 73/1 |
ROZPORZĄDZENIE KOMISJI (WE) NR 242/2007
z dnia 6 marca 2007 r.
dotyczące zezwolenia na stosowanie endo-1,4-beta-ksylanazy EC 3.2.1.8 (Belfeed B1100MP i Belfeed B1100ML) jako dodatku do pasz
(Tekst mający znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Wspólnotę Europejską,
uwzględniając rozporządzenie (WE) nr 1831/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie dodatków stosowanych w żywieniu zwierząt (1), w szczególności jego art. 9 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie (WE) nr 1831/2003 przewiduje wydawanie zezwoleń na stosowanie dodatków w żywieniu zwierząt oraz określa podstawy i procedury wydawania takich zezwoleń. |
|
(2) |
Zgodnie z art. 7 rozporządzenia (WE) nr 1831/2003 złożony został wniosek w celu uzyskania zezwolenia na środek określony w załączniku. Wnioskowi towarzyszyły dane szczegółowe oraz dokumenty wymagane na mocy art. 7 ust. 3 tego rozporządzenia. |
|
(3) |
Wniosek dotyczy nowego zastosowania preparatu endo-1,4-beta-ksylanazy EC 3.2.1.8 wytwarzanej przez Bacillus subtilis (LMG S-15136) jako dodatku do pasz dla kaczek, celem sklasyfikowania go w kategorii „dodatki zootechniczne”. |
|
(4) |
Metoda analizy zawarta we wniosku o zezwolenie zgodnie z art. 7 ust. 3 lit. c) rozporządzenia (WE) nr 1831/2003 dotyczy ustalenia substancji czynnej dodatku paszowego w paszy. Zatem metody analizy, o której mowa w załączniku do tego rozporządzenia, nie należy interpretować jako wspólnotowej metody analizy w rozumieniu art. 11 rozporządzenia (WE) nr 882/2004 Parlamentu Europejskiego i Rady z dnia 29 kwietnia 2004 r. w sprawie kontroli urzędowych przeprowadzanych w celu sprawdzenia zgodności z prawem paszowym i żywnościowym oraz regułami dotyczącymi zdrowia zwierząt i dobrostanu zwierząt (2). |
|
(5) |
Wykorzystanie endo-1,4-beta-ksylanazy EC 3.2.1.8, wytwarzanej przez Bacillus subtilis (LMG S-15136), zostało dopuszczone bez ograniczeń czasowych rozporządzeniem Komisji (WE) nr 1206/2005 (3) dla prosiąt odstawionych od maciory oraz rozporządzeniem Komisji (WE) nr 1259/2004 (4) dla kurcząt przeznaczonych na tucz. Przedstawiono nowe dane popierające wniosek o zezwolenie w przypadku kaczek. Europejski Urząd ds. Bezpieczeństwa Żywności („Urząd”) w ocenie wydanej dnia 15 czerwca 2006 r. (5) stwierdził, że bezpieczeństwo tego dodatku dla konsumenta, użytkownika i środowiska zostało już ustalone i nie ulegnie zmianie w wyniku proponowanego nowego zastosowania. Ponadto uznał on, iż stosowanie preparatu nie ma niekorzystnego wpływu na tę dodatkową kategorię zwierząt i że stosowanie wspomnianego preparatu może poprawić parametry zootechniczne kaczek. Zdaniem Urzędu nie ma potrzeby wprowadzania konkretnych wymogów dotyczących monitorowania rynku po wprowadzeniu preparatu do obrotu. Urząd poddał również weryfikacji sprawozdanie z metody analizy dodatku paszowego w paszy, przedłożone przez wspólnotowe laboratorium referencyjne określone w rozporządzeniu (WE) nr 1831/2003. |
|
(6) |
Ocena preparatu pokazuje, że warunki zezwolenia przewidziane w art. 5 rozporządzenia (WE) nr 1831/2003 są spełnione. W związku z tym należy dopuścić stosowanie preparatu, zgodnie z załącznikiem do niniejszego rozporządzenia. |
|
(7) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Udziela się zezwolenia na stosowanie preparatu wyszczególnionego w załączniku, należącego do kategorii dodatków „dodatki zootechniczne” i do grupy funkcjonalnej „substancje polepszające strawność”, jako dodatku w żywieniu zwierząt przy zachowaniu warunków określonych w załączniku.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli, dnia 6 marca 2006 r.
W imieniu Komisji
Markos KYPRIANOU
Członek Komisji
(1) Dz.U. L 268 z 18.10.2003, str. 29. Rozporządzenie zmienione rozporządzeniem Komisji (WE) nr 378/2005 (Dz.U. L 59 z 5.3.2005, str. 8).
(2) Dz.U. L 165 z 30.4.2004, str. 1. Rozporządzenie zmienione rozporządzeniem Rady (WE) nr 1791/2006 (Dz.U. L 363 z 20.12.2006, str. 1).
(3) Dz.U. L 197 z 28.7.2005, str. 12.
(4) Dz.U. L 239 z 9.7.2004, str. 8.
(5) Opinia panelu naukowego ds. dodatków paszowych oraz środków lub substancji wykorzystywanych w paszach dla zwierząt dotycząca bezpieczeństwa i skuteczności preparatu enzymatycznego Belfeed B1100MP i Belfeed B1100ML (endo-1,4-beta-ksylanaza) dopuszczonego do stosowania jako dodatek paszowy zgodnie z dyrektywą Rady 70/524/EWG. Przyjęta w dniu 15 czerwca 2006 r. Dziennik EFSA (2006) 368, 1–7.
ZAŁĄCZNIK
|
Numer identyfikacyjny dodatku |
Nazwisko/nazwa posiadacza zezwolenia |
Dodatek (nazwa handlowa) |
Skład, wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Minimalna zawartość |
Maksymalna zawartość |
Inne postanowienia |
Data ważności zezwolenia |
||||||||
|
Jednostki aktywności/kg mieszanki paszowej pełnoporcjowej o wilgotności 12 % |
|||||||||||||||||
|
Kategoria dodatków zootechnicznych. Grupa funkcjonalna: substancje polepszające strawność |
|||||||||||||||||
|
4a1606 |
Beldem SA |
endo-1,4-beta-ksylanaza: EC 3.2.1.8 (Belfeed B1100MP Belfeed B1100ML) |
Skład dodatku: Preparat endo-1,4-beta-ksylanazy EC 3.2.1.8 o minimalnej aktywności w formie stałej i płynnej 100 IU (1) /g lub ml Charakterystyka substancji czynnej endo-1,4-beta-ksylanaza EC 3.2.1.8 wytwarzana przez Bacillus subtilis (LMG S-15136) Metoda analityczna (2) Metoda kolorymetryczna – pomiar barwnika rozpuszczalnego w wodzie, uwolnionego przez enzym z usieciowanego azuryną podłoża arabinoksylanu pszenicy |
Kaczki |
— |
10 IU |
— |
|
2.4.2017 |
||||||||
(1) 1 IU to ilość enzymu, która uwalnia 1 mikromol cukrów redukujących (odpowiedników ksylozy) z ksylanu z drzewa brzozowego w ciągu minuty przy pH 4,5 oraz temperaturze 30 oC.
(2) Szczegóły dotyczące metod analitycznych można uzyskać pod następującym adresem wspólnotowego laboratorium referencyjnego: www.irmm.jrc.be/html/crlfaa/.
|
13.3.2007 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 73/4 |
ROZPORZĄDZENIE KOMISJI (WE) NR 243/2007
z dnia 6 marca 2007 r.
dotyczące zezwolenia na dodatek paszowy 3-fitaza (Nautuphos)
(Tekst mający znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Wspólnotę Europejską,
uwzględniając rozporządzenie (WE) nr 1831/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie dodatków stosowanych w żywieniu zwierząt (1), w szczególności jego art. 9 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie (WE) nr 1831/2003 przewiduje udzielanie zezwoleń na dodatki stosowane w żywieniu zwierząt, a także podstawy i procedury wydawania takich zezwoleń. |
|
(2) |
Zgodnie z art. 7 rozporządzenia (WE) nr 1831/2003 wniosek był składany w celu uzyskania zezwolenia na preparat określony w załączniku. Wnioskowi towarzyszyły dane szczegółowe oraz dokumenty wymagane na mocy art. 7 ust. 3 tego rozporządzenia. |
|
(3) |
Wniosek dotyczy wydania zezwolenia dla preparatu enzymatycznego 3-fitazy wytwarzanej przez Aspergillus niger (CBS 101.672) jako dodatku paszowego dla prosiąt odstawionych od maciory, tuczników oraz kurcząt przeznaczonych do tuczu, celem sklasyfikowania go w kategorii „dodatki zootechniczne”. |
|
(4) |
Europejski Urząd ds. Bezpieczeństwa Żywności („Urząd”) stwierdził w swoich opiniach z dnia 15 czerwca 2006 r. oraz 17 maja 2006 r., że 3-fitaza wytwarzana przez Aspergillus niger (CBS 101.672) nie ma negatywnego oddziaływania na zdrowie zwierząt, człowieka ani na środowisko naturalne (2). Ponadto stwierdził, że preparat enzymatyczny 3-fitazy wytwarzanej przez Aspergillus niger (CBS 101.672) nie stanowi żadnego innego zagrożenia, które zgodnie z art. 5 ust. 2 rozporządzenia (WE) nr 1831/2003 wykluczałoby wydanie zezwolenia. Urząd w swojej opinii zaleca podjęcie odpowiednich środków zapewniających bezpieczeństwo użytkownika. Jego zdaniem nie ma potrzeby wprowadzania konkretnych wymogów dotyczących monitorowania rynku po wprowadzeniu preparatu do obrotu. Opinia ta również weryfikuje sprawozdanie z metody analitycznej zastosowanej w przypadku danego dodatku paszowego w paszy, przedłożone przez wspólnotowe laboratorium referencyjne ustanowione rozporządzeniem (WE) nr 1831/2003. Ocena tego preparatu dowodzi, że warunki udzielenia zezwolenia przewidziane w art. 5 rozporządzenia (WE) nr 1831/2003 są spełnione. W związku z tym należy zezwolić na stosowanie preparatu, zgodnie z załącznikiem do niniejszego rozporządzenia. |
|
(5) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Preparat wyszczególniony w załączniku, należący do kategorii „dodatek zootechniczny” i do grupy funkcjonalnej „substancje polepszające strawność”, otrzymuje zezwolenie jako dodatek stosowany w żywieniu zwierząt przy zachowaniu warunków określonych w załączniku.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli, dnia 6 marca 2007 r.
W imieniu Komisji
Markos KYPRIANOU
Członek Komisji
(1) Dz.U. L 268 z 18.10.2003, str. 29. Rozporządzenie zmienione rozporządzeniem Komisji (WE) nr 378/2005 (Dz.U. L 59 z 5.3.2005, str. 8).
(2) Opinia panelu naukowego ds. dodatków paszowych oraz środków lub substancji wykorzystywanych w paszach dla zwierząt (panel FEEDAP) oraz panelu naukowego ds. organizmów zmodyfikowanych genetycznie (panel GMO) (dotycząca bezpieczeństwa i skuteczności preparatu enzymatycznego Natuphos® (3-fitaza) wytwarzanego przez Aspergillus niger. Przyjęta przez panel FEEDAP) w dniu 15 czerwca 2006 r. oraz przez panel GMO w dniu 17 maja 2006 r., The EFSA Journal (2006) 369, str. 1–19.
ZAŁĄCZNIK
|
Numer identyfikacyjny dodatku |
Nazwisko/nazwa posiadacza zezwolenia |
Dodatek (nazwa handlowa) |
Skład, wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Zawartość minimalna |
Zawartość maksymalna |
Inne przepisy |
Data ważności zezwolenia |
||||||||
|
Jednostek czynnych/kg mieszanki paszowej pełnoporcjowej o wilgotności 12 % |
|||||||||||||||||
|
Kategoria dodatków zootechnicznych. Grupa funkcjonalna: substancje polepszające strawność. |
|||||||||||||||||
|
4a 1600 |
BASF Aktiengesellschaft |
3-phytase EC 3.1.3.8 (Natuphos 5 000 G Natuphos 5 000 L Natuphos 10 000 G Natuphos 10 000 L) |
Skład dodatku: 3-fitaza wytwarzana przez Aspergillus niger (CBS 101.672) o aktywności minimalnej równej: Postać stała: 5 000 FTU/g Postać płynna: 5 000 FTU/ml Charakterystyka substancji czynnej: 3-fitaza wytwarzana przez Aspergillus niger (CBS 101.672) Metoda analityczna (1) Metoda kolorymetryczna – pomiar nieorganicznego fosforanu uwolnionego przez enzym z substratu zawierającego fitynian |
Prosięta (odstawione od maciory) |
— |
500 FTU |
|
|
2.4.2017 |
||||||||
|
Tuczniki |
|
280 FTU |
|
|
|||||||||||||
|
Kurczęta przeznaczone na tucz |
— |
375 FTU |
|
|
|||||||||||||
(1) Informacje szczegółowe dotyczące metod analitycznych można znaleźć pod następującym adresem wspólnotowego laboratorium referencyjnego: www.irmm.jrc.be/html/crlfaa/
|
13.3.2007 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 73/6 |
ROZPORZĄDZENIE KOMISJI (WE) NR 244/2007
z dnia 7 marca 2007 r.
dotyczące zezwolenia na stosowanie monohydrochlorku L-histydyny monohydratu jako dodatku paszowego
(Tekst mający znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Wspólnotę Europejską,
uwzględniając rozporządzenie (WE) nr 1831/2003 Parlamentu Europejskiego i Rady z dnia 22 września 2003 r. w sprawie dodatków stosowanych w żywieniu zwierząt (1), w szczególności jego art. 9 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie (WE) nr 1831/2003 przewiduje wydawanie zezwoleń na stosowanie dodatków w żywieniu zwierząt oraz określa podstawy i procedury wydawania takich zezwoleń. |
|
(2) |
Wniosek o zezwolenie został złożony dla monohydrochlorku L-histydyny monohydratu jako aminokwasu. |
|
(3) |
Ponieważ wniosek o zezwolenie został złożony przed terminem stosowania rozporządzenia (WE) nr 1831/2003, podstawą jego złożenia była dyrektywa Rady 82/471/EWG z dnia 30 czerwca 1982 r. dotycząca niektórych produktów stosowanych w żywieniu zwierząt (2). Od dnia 18 października 2004 r. aminokwasy, ich sole i podobne produkty są objęte zakresem rozporządzenia (WE) nr 1831/2003. Wniosek należy zatem uważać za wniosek na podstawie art. 7 rozporządzenia (WE) nr 1831/2003. |
|
(4) |
W celu spełnienia wymogów określonych w art. 7 rozporządzenia (WE) nr 1831/2003 na poparcie wniosku przedłożono dodatkowe informacje. |
|
(5) |
Wniosek dotyczy zezwolenia na stosowanie monohydrochlorku L-histydyny monohydratu jako dodatku paszowego dla łososiowatych, celem sklasyfikowania go w kategorii dodatku „dodatki dietetyczne” i grupie funkcjonalnej „aminokwasy, ich sole i produkty podobne”. |
|
(6) |
Europejski Urząd ds. Bezpieczeństwa Żywności („Urząd”) stwierdził w opiniach z dnia 2 marca 2005 r. (3) i z 18 października 2006 r. (4), że monohydrochlorek L-histydyny monohydrat nie ma negatywnego oddziaływania na zdrowie zwierząt, ludzi ani na środowisko naturalne. Ponadto stwierdził, że monohydrochlorek L-histydyny monohydrat nie stanowi żadnego innego zagrożenia, które zgodnie z art. 5 ust. 2 rozporządzenia (WE) nr 1831/2003 wykluczałoby wydanie zezwolenia. Zgodnie z tą opinią aminokwas ten jest niezbędny także dla ryb i wykazano, że stosowanie tego preparatu zapobiegało w warunkach hodowlanych zaćmie u łososiowatych. Urząd w swojej opinii zaleca podjęcie odpowiednich środków zapewniających bezpieczeństwo użytkownika. Jego zdaniem nie ma potrzeby wprowadzania konkretnych wymogów dotyczących monitorowania po wprowadzeniu preparatu do obrotu. Sprawozdanie z metody analizy dodatku paszowego w paszy zostało przedłożone Urzędowi przez laboratorium referencyjne Wspólnoty określone w rozporządzeniu (WE) nr 1831/2003. Ocena preparatu dowodzi, że warunki udzielenia zezwolenia przewidziane w art. 5 rozporządzenia (WE) nr 1831/2003 są spełnione. W związku z tym należy dopuścić stosowanie preparatu określonego w załączniku do niniejszego rozporządzenia. |
|
(7) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Zezwala się na stosowanie preparatu wyszczególnionego w załączniku, należącego do kategorii dodatku „dodatki dietetyczne” i grupy funkcjonalnej „aminokwasy, ich sole i produkty podobne”, jako dodatku w żywieniu zwierząt przy zachowaniu warunków określonych w załączniku.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli, dnia 7 marca 2007 r.
W imieniu Komisji
Markos KYPRIANOU
Członek Komisji
(1) Dz.U. L 268 z 18.10.2003, str. 29. Rozporządzenie zmienione rozporządzeniem Komisji (WE) nr 378/2005 (Dz.U. L 59 z 5.3.2005, str. 8).
(2) Dz.U. L 213 z 21.7.1982, str. 8. Dyrektywa ostatnio zmieniona dyrektywą Komisji 2004/116/WE (Dz.U. L 379 z 24.12.2004, str. 81).
(3) Opinia panelu naukowego ds. dodatków paszowych oraz środków lub substancji wykorzystywanych w paszach dla zwierząt dotycząca bezpieczeństwa i bioprzyswajalności produktu monohydrochlorku L-histydyny monohydratu dla łososiowatych. Przyjęta dnia 2 marca 2005 r. Dziennik EFSA (2005) 195, str. 1–10.
(4) Opinia panelu naukowego ds. dodatków paszowych oraz środków lub substancji wykorzystywanych w paszach dla zwierząt zgodnie z rozporządzeniem (WE) 1831/2003 monohydrochlorku L-histydyny monohydratu jako dodatku paszowego dla łososiowatych. Przyjęta dnia 18 października 2006 r. Dziennik EFSA (2006) 407, str. 1–5.
ZAŁĄCZNIK
|
Numer identyfikacyjny dodatku |
Nazwisko/nazwa posiadacza zezwolenia |
Dodatek |
Skład, wzór chemiczny, opis, metoda analityczna |
Gatunek lub kategoria zwierzęcia |
Maksymalny wiek |
Minimalna zawartość |
Maksymalna zawartość |
Inne postanowienia |
Data ważności zezwolenia |
|
Maksymalna zawartośćw mg na 1 kg mieszanki paszowej pełnoporcjowej |
|||||||||
|
Kategoria dodatków dietetycznych. Grupa funkcjonalna: aminokwasy, ich sole i produkty podobne |
|||||||||
|
3c3.5.1 |
— |
monohydrochlorek L-histydyny monohydrat |
Charakterystyka dodatku: monohydrochlorek L-histydyny monohydrat 98 % wytwarzany przez Escherichia coli (ATCC 9637) C3H3N2-CH2-CH(NH2)-COOH·HCl·H2O Metoda analityczna Wspólnotowa metoda do oznaczenia aminokwasów (dyrektywa Komisji 98/64/WE zmieniająca dyrektywę 71/393/EWG (1) |
Łososiowate |
— |
— |
— |
— |
2.4.2017 |
|
13.3.2007 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 73/9 |
ROZPORZĄDZENIE KOMISJI (WE) NR 245/2007
z dnia 8 marca 2007 r.
zmieniające załącznik II do rozporządzenia (WE) nr 998/2003 Parlamentu Europejskiego i Rady w odniesieniu do Bułgarii, Rumunii i Malezji
(Tekst mający znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Wspólnotę Europejską,
uwzględniając Traktat o przystąpieniu Bułgarii i Rumunii, w szczególności jego art. 4 ust. 3,
uwzględniając Akt przystąpienia Bułgarii i Rumunii, w szczególności jego art. 56,
uwzględniając rozporządzenie (WE) nr 998/2003 Parlamentu Europejskiego i Rady z dnia 26 maja 2003 r. w sprawie wymogów dotyczących zdrowia zwierząt, stosowanych do przemieszczania zwierząt domowych o charakterze niehandlowym i zmieniające dyrektywę Rady 92/65/EWG (1), w szczególności jego art. 10 i 19,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie (WE) nr 998/2003 ustanawia wymogi dotyczące zdrowia zwierząt stosowane do przemieszczania zwierząt domowych o charakterze niehandlowym oraz zasady stosowane do kontroli takiego przemieszczania. |
|
(2) |
Rozporządzenie (WE) nr 998/2003 ustanawia, że wykaz państw trzecich, z których przemieszczanie zwierząt domowych do Wspólnoty może być dopuszczone pod warunkiem, że spełnione są pewne wymogi, należy umieścić w części C załącznika II do tego rozporządzenia. |
|
(3) |
Wykaz w części C załącznika II do rozporządzenia (WE) nr 998/2003 obejmuje państwa trzecie i terytoria, w których nie występuje wścieklizna, oraz państwa trzecie i terytoria, w odniesieniu do których ryzyko pojawienia się wścieklizny we Wspólnocie na skutek wprowadzenia do Wspólnoty zwierząt domowych z tych państw trzecich i terytoriów nie jest wyższe niż ryzyko związane z przemieszczaniem zwierząt domowych pomiędzy państwami członkowskimi. |
|
(4) |
Z informacji dostarczonych przez właściwe władze Malezji wynika, że ryzyko pojawienia się wścieklizny we Wspólnocie na skutek przemieszczania zwierząt domowych z tego kraju nie jest wyższe niż ryzyko związane z przemieszczaniem zwierząt domowych pomiędzy państwami członkowskimi lub z państw trzecich już wymienionych w rozporządzeniu (WE) nr 998/2003. Należy zatem włączyć Malezję do wykazu ustanowionego w części C załącznika II do rozporządzenia (WE) nr 998/2003. |
|
(5) |
Mając na względzie, że z dniem 1 stycznia 2007 r. Bułgaria i Rumunia stały się państwami członkowskimi, konieczne jest, w celu zachowania przejrzystości prawodawstwa wspólnotowego, usunięcie odesłań do tych krajów z części C załącznika II do rozporządzenia (WE) nr 998/2003 z mocą od dnia przystąpienia. |
|
(6) |
Należy zatem odpowiednio zmienić rozporządzenie (WE) nr 998/2003. |
|
(7) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
W części C załącznika II do rozporządzenia (WE) nr 998/2003 wprowadza się następujące zmiany:
|
1) |
skreśla się zapisy: „BG – Bułgaria RO – Rumunia”; |
|
2) |
dodaje się zapis w brzmieniu: „MY – Malezja”. |
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie trzeciego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Artykuł 1 ust. 1 stosuje się od dnia 1 stycznia 2007 r.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli, dnia 8 marca 2007 r.
W imieniu Komisji
Markos KYPRIANOU
Członek Komisji
(1) Dz.U. L 146 z 13.6.2003, str. 1. Rozporządzenie ostatnio zmienione rozporządzeniem Komisji (WE) nr 1467/2006 (Dz.U. L 274 z 5.10.2006, str. 3).
DYREKTYWY
|
13.3.2007 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 73/10 |
DYREKTYWA KOMISJI 2007/13/WE
z dnia 7 marca 2007 r.
zmieniająca załącznik II do dyrektywy Rady 71/316/EWG w sprawie zbliżenia ustawodawstw państw członkowskich odnoszących się do wspólnych przepisów dotyczących przyrządów pomiarowych oraz metod kontroli metrologicznej
(Tekst mający znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Wspólnotę Europejską,
uwzględniając dyrektywę Rady 71/316/EWG z dnia 26 lipca 1971 r. w sprawie zbliżenia ustawodawstw państw członkowskich odnoszących się do wspólnych przepisów dotyczących przyrządów pomiarowych oraz metod kontroli metrologicznej (1), w szczególności jej art. 16 zdanie pierwsze,
a także mając na uwadze, co następuje:
|
(1) |
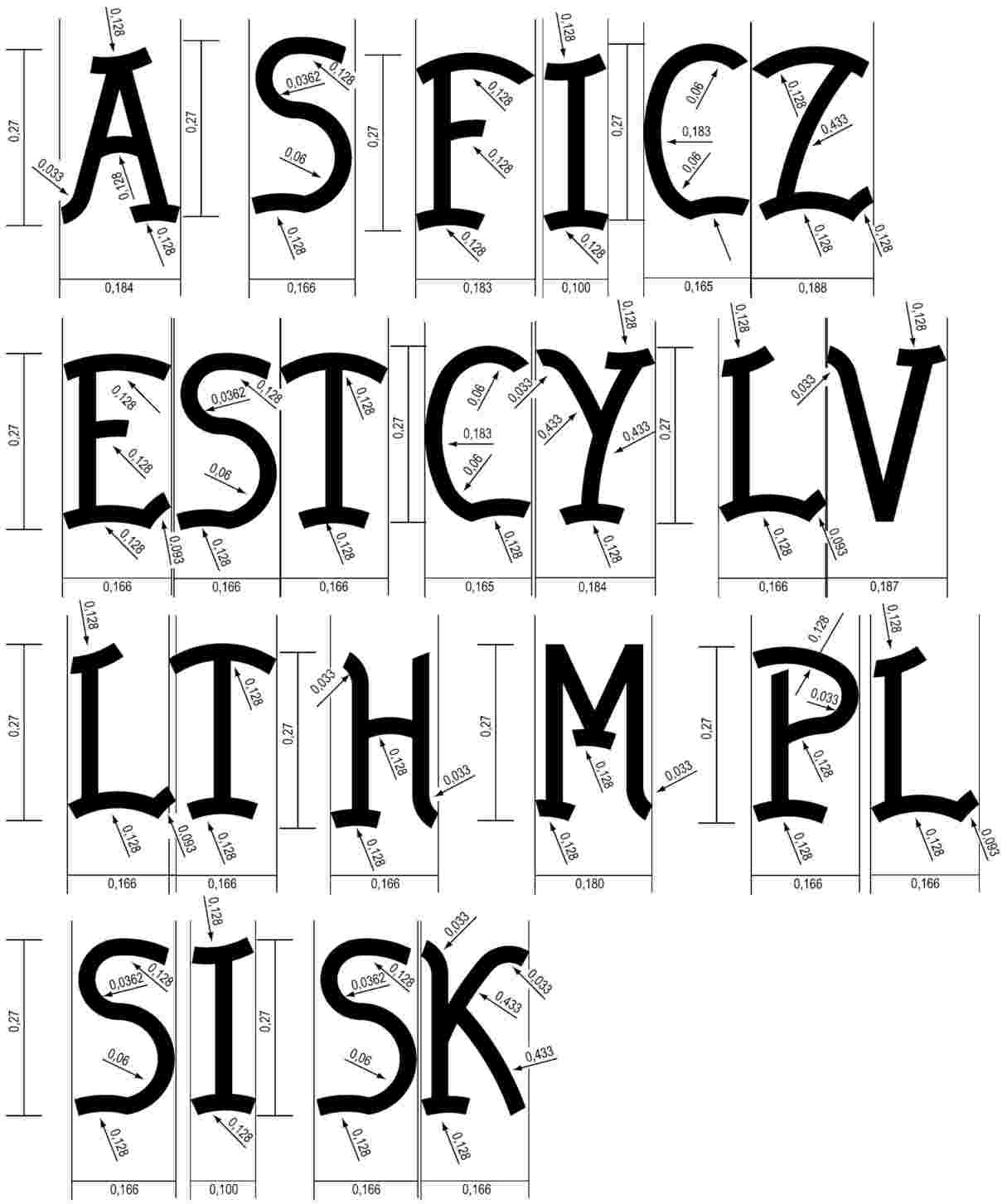
Dyrektywa 71/316/EWG ustanawia, w ppkt 3.1.1.1 lit. a) załącznika II, wzory dużych liter określających państwa członkowskie wpisywanych w znak legalizacji pierwotnej EWG świadczący o spełnieniu przez nie wymagań EWG, jakim opatruje się przyrządy pomiarowe. |
|
(2) |
Dyrektywa 71/316/EWG ustanawia, w ppkt 3.2.1 załącznika II, wzory pokazujące kształt, rozmiary i szkice liter dla znaków legalizacji pierwotnej EWG określonych w ppkt 3.1 tegoż załącznika. |
|
(3) |
Wzory liter określających państwa członkowskie nie zostały zamieszczone w Akcie przystąpienia Austrii, Finlandii i Szwecji ani w Akcie przystąpienia z 2003 r. Wzory, o których mowa w załączniku II ppkt 3.2.1 do dyrektywy 71/316/EWG, zostały uzupełnione o konieczne litery zgodnie z załącznikiem II, rozdział 1 pkt D1.b do Aktu przystąpienia Austrii, Finlandii i Szwecji i Aktu przystąpienia z 2003 r. |
|
(4) |
Konieczne jest zatem wprowadzenie zmian w załączniku II ppkt 3.2.1 do dyrektywy 71/316/EWG celem włączenia wzorów liter określających państwa. |
|
(5) |
Środki przewidziane w niniejszej dyrektywie są zgodne z opinią Komitetu ds. Dostosowania do Postępu Technicznego powołanego na mocy art. 17 dyrektywy 71/316/EWG, |
PRZYJMUJE NINIEJSZĄ DYREKTYWĘ:
Artykuł 1
W załączniku II do dyrektywy 71/316/EWG wprowadza się zmiany zgodnie z załącznikiem do niniejszej dyrektywy.
Artykuł 2
1. Państwa członkowskie wprowadzają w życie przepisy ustawowe, wykonawcze i administracyjne niezbędne do wykonania niniejszej dyrektywy najpóźniej do dnia 10 marca 2008 r. Państwa członkowskie niezwłocznie przekazują tekst tych przepisów Komisji.
Przepisy przyjęte przez państwa członkowskie zawierają odesłanie do niniejszej dyrektywy lub odesłanie takie towarzyszy ich urzędowej publikacji. Sposób dokonania takiego odniesienia ustalany jest przez państwa członkowskie.
2. Państwa członkowskie przedstawiają Komisji teksty najważniejszych przepisów prawa krajowego, które przyjmują w dziedzinie objętej niniejszą dyrektywą.
Artykuł 3
Niniejsza dyrektywa wchodzi w życie dwudziestego dnia po jej opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Artykuł 4
Niniejsza dyrektywa skierowana jest do państw członkowskich.
Sporządzono w Brukseli, dnia 7 marca 2007 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
(1) Dz.U. L 202 z 6.9.1971, str. 1. Dyrektywa ostatnio zmieniona Aktem przystąpienia z 2003 r.
ZAŁĄCZNIK
W pierwszym rysunku zamieszczonym w załączniku II do dyrektywy 71/316/EWG litery „A, S, FI, CZ, EST, CY, LV, LT, H, M, PL, SI, SK” uzupełnia się następującymi wzorami: