ISSN 1977-0758
Publicatieblad
van de Europese Unie
L 204

Uitgave in de Nederlandse taal
Wetgeving
62e jaargang
2 augustus 2019
|
ISSN 1977-0758 |
||
|
Publicatieblad van de Europese Unie |
L 204 |
|

|
||
|
Uitgave in de Nederlandse taal |
Wetgeving |
62e jaargang |
|
|
|
Rectificaties |
|
|
|
* |
|
|
|
|
|
(1) Voor de EER relevante tekst. |
|
NL |
Besluiten waarvan de titels mager zijn gedrukt, zijn besluiten van dagelijks beheer die in het kader van het landbouwbeleid zijn genomen en die in het algemeen een beperkte geldigheidsduur hebben. Besluiten waarvan de titels vet zijn gedrukt en die worden voorafgegaan door een sterretje, zijn alle andere besluiten. |
II Niet-wetgevingshandelingen
VERORDENINGEN
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/1 |
UITVOERINGSVERORDENING (EU) 2019/1292 VAN DE RAAD
van 31 juli 2019
tot uitvoering van artikel 21, lid 2, van Verordening (EU) 2016/44 betreffende beperkende maatregelen in het licht van de situatie in Libië
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) 2016/44 van de Raad van 18 januari 2016 betreffende beperkende maatregelen in het licht van de situatie in Libië en tot intrekking van Verordening (EU) nr. 204/2011 (1), en met name artikel 21, lid 2,
Gezien het voorstel van de hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid,
Overwegende hetgeen volgt:
|
(1) |
De Raad heeft op 18 januari 2016 Verordening (EU) 2016/44 vastgesteld. |
|
(2) |
Overeenkomstig artikel 21, lid 6, van Verordening (EU) 2016/44 heeft de Raad de lijst van personen en entiteiten in bijlage III bij die verordening opnieuw bezien. |
|
(3) |
De vermeldingen voor twee personen moeten worden geschrapt van de lijst van personen en entiteiten in bijlage III bij Verordening (EU) 2016/44. |
|
(4) |
Bijlage III bij Verordening (EU) 2016/44 moet bijgevolg dienovereenkomstig worden gewijzigd, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Bijlage III bij Verordening (EU) 2016/44 wordt gewijzigd overeenkomstig de bijlage bij deze verordening.
Artikel 2
Deze verordening treedt in werking op de dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 31 juli 2019.
Voor de Raad
De voorzitter
T. TUPPURAINEN
BIJLAGE
In bijlage III (Lijst van natuurlijke personen, rechtspersonen, entiteiten en lichamen als bedoeld in artikel 6, lid 2) bij Verordening (EU) 2016/44 worden de vermeldingen 1 (betreffende ABDUSSALAM, Abdussalam Mohammed) en 14 (betreffende AL-BAGHDADI, Dr Abdulqader Mohammed) geschrapt van de lijst in deel A (Personen) en worden de overige vermeldingen dienovereenkomstig hernummerd.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/3 |
UITVOERINGSVERORDENING (EU) 2019/1293 VAN DE COMMISSIE
van 29 juli 2019
tot wijziging van Uitvoeringsverordening (EU) nr. 577/2013 wat betreft de lijst van gebieden en derde landen in bijlage II en het modeldiergezondheidscertificaat voor honden, katten en fretten in bijlage IV
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) nr. 576/2013 van het Europees Parlement en de Raad van 12 juni 2013 betreffende het niet-commerciële verkeer van gezelschapsdieren en tot intrekking van Verordening (EG) nr. 998/2003 (1), en met name artikel 13, lid 2, en artikel 25, lid 2,
Overwegende hetgeen volgt:
|
(1) |
Uitvoeringsverordening (EU) nr. 577/2013 (2) van de Commissie voorziet onder meer in de lijsten van gebieden en derde landen zoals bedoeld in artikel 13 van Verordening (EU) nr. 576/2013 en in het diergezondheidscertificaat dat vereist is voor het niet-commerciële verkeer naar een lidstaat van honden, katten en fretten uit gebieden en derde landen. |
|
(2) |
Uitvoeringsverordening (EU) nr. 577/2013 is opgenomen in de Overeenkomst betreffende de Europese Economische Ruimte (EER) bij Besluit nr. 66/2016 van het Gemengd Comité van de EER (3) en is volledig van toepassing op Noorwegen, op dezelfde wijze als op de EU-lidstaten. |
|
(3) |
Noorwegen is opgenomen in de lijst in bijlage II, deel 1, bij Uitvoeringsverordening (EU) nr. 577/2013. Besluit nr. 66/2016 van het Gemengd Comité van de EER bevat voorschriften voor het niet-commerciële verkeer naar een lidstaat van honden, katten en fretten uit Noorwegen. Daarom moet Noorwegen worden geschrapt van de lijst van gebieden en derde landen in bijlage II, deel 1, bij Uitvoeringsverordening (EU) nr. 577/2013. |
|
(4) |
Het is tevens noodzakelijk in de lijst van gebieden en derde landen in bijlage II, deel 2, bij Uitvoeringsverordening (EU) nr. 577/2013 rekening te houden met de nieuwe naam van de voormalige Joegoslavische Republiek Macedonië. |
|
(5) |
In Verordening (EU) nr. 576/2013 is onder meer bepaald dat honden, katten en fretten die uit een gebied of derde land naar een andere lidstaat worden verplaatst, moeten voldoen aan preventieve gezondheidsmaatregelen voor andere ziekten of infecties dan rabiës die zijn vastgesteld uit hoofde van artikel 19, lid 1, en vergezeld moeten gaan van een identificatiedocument met het formaat van een diergezondheidscertificaat. Bijlage IV, deel 1, bij Uitvoeringsverordening (EU) nr. 577/2013 van de Commissie bevat het model voor het diergezondheidscertificaat. |
|
(6) |
Bovendien heeft de Commissie na de verplichte heroverweging van Gedelegeerde Verordening (EU) nr. 1152/2011 van de Commissie (4) Gedelegeerde Verordening (EU) 2018/772 (5) aangenomen, die onder meer voorziet in de regels voor de indeling van de lidstaten of delen daarvan, aan de hand van de vraag of zij in aanmerking komen voor de toepassing van preventieve gezondheidsmaatregelen voor de bestrijding van infecties met Echinococcus multilocularis bij honden. Met Gedelegeerde Verordening 2018/772 werd Gedelegeerde Verordening (EU) nr. 1152/2011 met ingang van 1 juli 2018 ingetrokken. |
|
(7) |
De lijst van lidstaten die voldoen aan de voorschriften voor indeling die zijn opgenomen in Gedelegeerde Verordening (EU) 2018/772 voor heel hun grondgebied of delen ervan is opgenomen in de bijlage bij Uitvoeringsverordening (EU) 2018/878 van de Commissie (6). |
|
(8) |
Daarom moeten de verwijzingen naar Gedelegeerde Verordening (EU) nr. 1152/2011 worden vervangen door verwijzingen naar Gedelegeerde Verordening (EU) 2018/772 en naar Uitvoeringsverordening (EU) 2018/878 in het modelgezondheidscertificaat in bijlage IV bij Uitvoeringsverordening (EU) nr. 577/2013. |
|
(9) |
De bijlagen II en IV bij Uitvoeringsverordening (EU) nr. 577/2013 moeten derhalve dienovereenkomstig worden gewijzigd. |
|
(10) |
Ter vermijding van verstoringen van het verkeer van honden, katten en fretten moet het gebruik van de diergezondheidscertificaten die zijn afgegeven overeenkomstig bijlage IV, deel 1, bij Uitvoeringsverordening (EU) nr. 577/2013, zoals gewijzigd bij Uitvoeringsverordening (EU) 2016/561 van de Commissie (7), worden toegestaan tot en met 28 februari 2020. |
|
(11) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Uitvoeringsverordening (EU) nr. 577/2013 wordt als volgt gewijzigd:
|
1. |
Bijlage II, deel 1, wordt vervangen door de tekst in bijlage I bij deze verordening. |
|
2. |
Bijlage II, deel 2, wordt vervangen door de tekst in bijlage II bij deze verordening. |
|
3. |
Bijlage IV, deel 1, wordt vervangen door de tekst in bijlage III bij deze verordening. |
Artikel 2
Gedurende een overgangsperiode die eindigt op 28 februari 2020 moeten de lidstaten honden, katten en fretten toelaten die voor niet-commerciële doeleinden van een gebied of derde land naar een lidstaat worden gebracht en die vergezeld gaan van een diergezondheidscertificaat dat uiterlijk op 31 oktober 2019 is afgegeven overeenkomstig het model in bijlage IV, deel 1, bij Uitvoeringsverordening (EU) nr. 577/2013, zoals gewijzigd bij Uitvoeringsverordening (EU) 2016/561.
Artikel 3
Deze verordening treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Zij is van toepassing vanaf 1 november 2019.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 29 juli 2019.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 178 van 28.6.2013, blz. 1.
(2) Uitvoeringsverordening (EU) nr. 577/2013 van de Commissie van 28 juni 2013 inzake de modelidentificatiedocumenten voor het niet-commerciële verkeer van honden, katten en fretten, de vaststelling van de lijsten van gebieden en derde landen en de voorschriften betreffende de vorm, de opmaak en de taal van de verklaringen ten bewijze van de naleving van bepaalde voorwaarden die zijn vastgelegd in Verordening (EU) nr. 576/2013 van het Europees Parlement en de Raad (PB L 178 van 28.6.2013, blz. 109).
(3) Besluit van het Gemengd Comité van de EER nr. 66/2016 van 29 april 2016 tot wijziging van bijlage I (Veterinaire en fytosanitaire aangelegenheden) bij de EER-overeenkomst [2017/2017] (PB L 300 van 16.11.2017, blz. 1).
(4) Gedelegeerde Verordening (EU) nr. 1152/2011 van de Commissie van 14 juli 2011 tot aanvulling van Verordening (EG) nr. 998/2003 van het Europees Parlement en de Raad inzake preventieve gezondheidsmaatregelen voor de bestrijding van infecties met Echinococcus multilocularis bij honden (PB L 296 van 15.11.2011, blz. 6).
(5) Gedelegeerde Verordening (EU) 2018/772 van de Commissie van 21 november 2017 tot aanvulling van Verordening (EU) nr. 576/2013 van het Europees Parlement en de Raad met betrekking tot preventieve gezondheidsmaatregelen voor de bestrijding van infecties met Echinococcus multilocularis bij honden en tot intrekking van Gedelegeerde Verordening (EU) nr. 1152/2011 (PB L 130 van 28.5.2018, blz. 1).
(6) Uitvoeringsverordening (EU) 2018/878 van de Commissie van 18 juni 2018 tot vaststelling van een lijst van lidstaten of delen van het grondgebied van lidstaten die voldoen aan de voorschriften voor indeling overeenkomstig artikel 2, leden 2 en 3, van Gedelegeerde Verordening (EU) 2018/772 betreffende de toepassing van preventieve gezondheidsmaatregelen voor de bestrijding van infecties met Echinococcus multilocularis bij honden (PB L 155 van 19.6.2018, blz. 1).
(7) Uitvoeringsverordening (EU) 2016/561 van de Commissie van 11 april 2016 tot wijziging van bijlage IV bij Uitvoeringsverordening (EU) nr. 577/2013 wat betreft het modeldiergezondheidscertificaat voor honden, katten en fretten die voor niet-commerciële doeleinden van een gebied of derde land naar een lidstaat worden gebracht (PB L 96 van 12.4.2016, blz. 26).
BIJLAGE I
“DEEL 1
Lijst van gebieden en derde landen zoals bedoeld in artikel 13, lid 1, van Verordening (EU) nr. 576/2013
|
ISO-code |
Gebied of derde land |
|
AD |
Andorra |
|
CH |
Zwitserland |
|
FO |
Faeröer |
|
GI |
Gibraltar |
|
GL |
Groenland |
|
IS |
IJsland |
|
LI |
Liechtenstein |
|
MC |
Monaco |
|
SM |
San Marino |
|
VA |
Staat Vaticaanstad” |
BIJLAGE II
“DEEL 2
Lijst van gebieden en derde landen zoals bedoeld in artikel 13, lid 2, van Verordening (EU) nr. 576/2013
|
ISO-code |
Gebied of derde land |
Opgenomen gebieden |
|
AC |
Ascension |
|
|
AE |
Verenigde Arabische Emiraten |
|
|
AG |
Antigua en Barbuda |
|
|
AR |
Argentinië |
|
|
AU |
Australië |
|
|
AW |
Aruba |
|
|
BA |
Bosnië en Herzegovina |
|
|
BB |
Barbados |
|
|
BH |
Bahrein |
|
|
BM |
Bermuda |
|
|
BQ |
Bonaire, Sint-Eustatius en Saba (de BES-eilanden) |
|
|
BY |
Belarus |
|
|
CA |
Canada |
|
|
CL |
Chili |
|
|
CW |
Curaçao |
|
|
FJ |
Fiji |
|
|
FK |
Falklandeilanden |
|
|
HK |
Hongkong |
|
|
JM |
Jamaica |
|
|
JP |
Japan |
|
|
KN |
Saint Kitts en Nevis |
|
|
KY |
Kaaimaneilanden |
|
|
LC |
Saint Lucia |
|
|
MS |
Montserrat |
|
|
MK |
Noord-Macedonië |
|
|
MU |
Mauritius |
|
|
MX |
Mexico |
|
|
MY |
Maleisië |
|
|
NC |
Nieuw-Caledonië |
|
|
NZ |
Nieuw-Zeeland |
|
|
PF |
Frans-Polynesië |
|
|
PM |
Saint-Pierre en Miquelon |
|
|
RU |
Rusland |
|
|
SG |
Singapore |
|
|
SH |
Sint-Helena |
|
|
SX |
Sint-Maarten |
|
|
TT |
Trinidad en Tobago |
|
|
TW |
Taiwan |
|
|
US |
Verenigde Staten van Amerika |
AS — Amerikaans-Samoa GU — Guam MP — Noordelijke Marianen PR — Puerto Rico VI — Amerikaanse Maagdeneilanden” |
|
VC |
Saint Vincent en de Grenadines |
|
|
VG |
Britse Maagdeneilanden |
|
|
VU |
Vanuatu |
|
|
WF |
Wallis en Futuna |
|
BIJLAGE III
“DEEL 1
Modeldiergezondheidscertificaat voor het niet-commerciële verkeer van honden, katten of fretten naar een lidstaat uit een gebied of derde land overeenkomstig artikel 5, leden 1 en 2, van Verordening (EU) nr. 576/2013
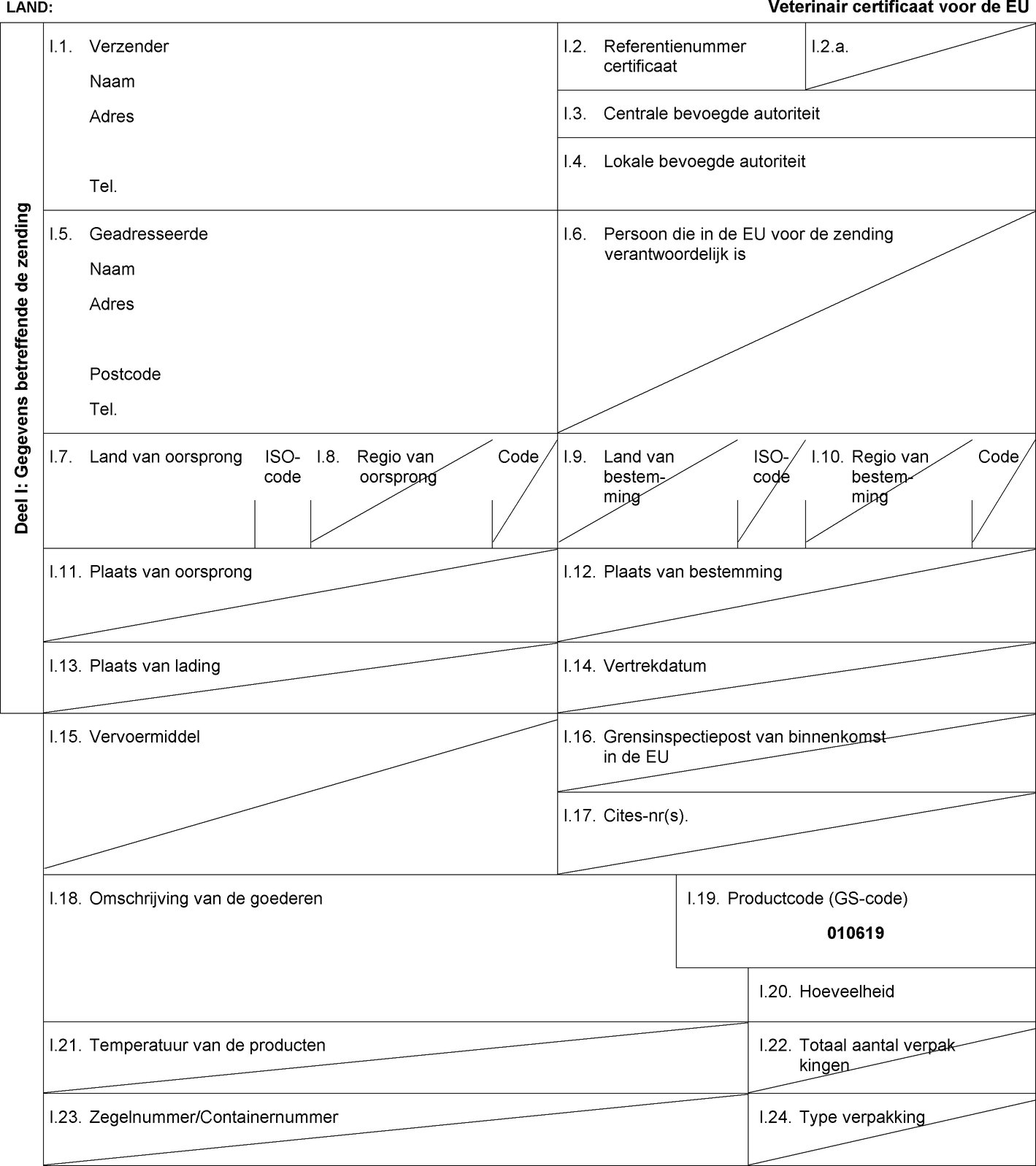 Tekst van het beeld
Tekst van het beeld
 Tekst van het beeld
Tekst van het beeld
 Tekst van het beeld
Tekst van het beeld
 Tekst van het beeld
Tekst van het beeld
 Tekst van het beeld
Tekst van het beeld
 Tekst van het beeld
Tekst van het beeld
 Tekst van het beeld
”
Tekst van het beeld
”|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/16 |
UITVOERINGSVERORDENING (EU) 2019/1294 VAN DE COMMISSIE
van 1 augustus 2019
tot toelating van het in de handel brengen van betaïne als nieuw voedingsmiddel krachtens Verordening (EU) 2015/2283 van het Europees Parlement en de Raad en tot wijziging van Uitvoeringsverordening (EU) 2017/2470 van de Commissie
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) 2015/2283 van het Europees Parlement en de Raad van 25 november 2015 betreffende nieuwe voedingsmiddelen, tot wijziging van Verordening (EU) nr. 1169/2011 van het Europees Parlement en de Raad en tot intrekking van Verordening (EG) nr. 258/97 van het Europees Parlement en de Raad en Verordening (EG) nr. 1852/2001 van de Commissie (1), en met name artikel 12,
Overwegende hetgeen volgt:
|
(1) |
Bij Verordening (EU) 2015/2283 is vastgesteld dat alleen nieuwe voedingsmiddelen die zijn toegelaten en in de Unielijst zijn opgenomen, in de Unie in de handel mogen worden gebracht. |
|
(2) |
Overeenkomstig artikel 8 van Verordening (EU) 2015/2283 is Uitvoeringsverordening (EU) 2017/2470 van de Commissie (2) vastgesteld, waarin een Unielijst van toegelaten nieuwe voedingsmiddelen is vastgesteld. |
|
(3) |
Krachtens artikel 12 van Verordening (EU) 2015/2283 moet de Commissie beslissen over de toelating en het in de Unie in de handel brengen van een nieuw voedingsmiddel en over de bijwerking van de Unielijst. |
|
(4) |
Op 12 juni 2015 heeft het bedrijf DuPont Nutrition Biosciences ApS (hierna “de aanvrager” genoemd) bij de bevoegde Finse autoriteit een aanvraag ingediend om betaïne in de Unie in de handel te brengen als nieuw voedselingrediënt in de zin van artikel 1, lid 2, onder e), van Verordening (EG) nr. 258/97 van het Europees Parlement en de Raad (3). De aanvraag betreft het gebruik van betaïne in graan- en eiwitrepen, poederdranken en isotone drinkklare dranken voor personen van tien jaar of ouder die sporten en in graan- en eiwitrepen bedoeld als voeding voor medisch gebruik en/of de dagelijkse voeding volledig vervangende producten zoals omschreven in Verordening (EU) nr. 609/2013 van het Europees Parlement en de Raad (4), met uitzondering van levensmiddelen voor zuigelingen en peuters. |
|
(5) |
Krachtens artikel 35, lid 1, van Verordening (EU) 2015/2283 worden alle uit hoofde van artikel 4 van Verordening (EG) nr. 258/97 bij een lidstaat ingediende aanvragen om een nieuw voedingsmiddel in de Unie in de handel te brengen waarover vóór 1 januari 2018 nog geen definitief besluit is genomen, behandeld als uit hoofde van Verordening (EU) 2015/2283 ingediende aanvragen. |
|
(6) |
Het verzoek om betaïne als nieuw voedingsmiddel in de Unie in de handel te mogen brengen, is overeenkomstig artikel 4 van Verordening (EG) nr. 258/97 bij een lidstaat ingediend en voldoet ook aan de voorwaarden van Verordening (EU) 2015/2283. |
|
(7) |
Op 21 oktober 2015 heeft de bevoegde Finse autoriteit haar verslag van de eerste beoordeling uitgebracht. In dat verslag heeft zij geconcludeerd dat betaïne voldoet aan de in artikel 3, lid 1, van Verordening (EG) nr. 258/97 vastgestelde criteria voor nieuwe voedselingrediënten. |
|
(8) |
Op 23 oktober 2015 heeft de Commissie het verslag van de eerste beoordeling doorgestuurd naar de overige lidstaten. Binnen de in artikel 6, lid 4, eerste alinea, van Verordening (EG) nr. 258/97 vastgestelde termijn van zestig dagen hebben andere lidstaten met redenen omklede bezwaren ingediend in verband met schadelijke effecten die werden waargenomen bij het door de aanvrager voor de studie inzake chronische orale toxiciteit en carcinogeniteit voorgestelde niveau zonder waarneembaar schadelijk effect (NOAEL) en met de geringe blootstellingsmarge tussen de betaïnedoseringen waarbij in de toxicologische studies effecten werden waargenomen enerzijds en de voorgestelde dagelijkse inname van betaïne anderzijds. |
|
(9) |
In het licht van die met redenen omklede bezwaren heeft de Commissie op 4 april 2016 de Europese Autoriteit voor voedselveiligheid (EFSA) geraadpleegd en haar verzocht om overeenkomstig Verordening (EG) nr. 258/97 een aanvullende beoordeling van betaïne als nieuw voedselingrediënt te verrichten. |
|
(10) |
Op 25 oktober 2017 heeft de EFSA haar wetenschappelijk advies “Safety of Betaine as a novel food pursuant to Regulation (EC) No 258/97” (5) uitgebracht. Hoewel dit advies door de EFSA op grond van Verordening (EG) nr. 258/97 is opgesteld en uitgebracht, strookt het met de voorschriften van artikel 11 van Verordening (EU) 2015/2283. |
|
(11) |
In haar wetenschappelijke advies heeft de EFSA met behulp van een benadering op basis van de benchmarkdosis (BMD) (6) geconcludeerd dat betaïne veilig is voor de beoogde bevolkingsgroepen, indien aan levensmiddelen toegevoegd met een maximale dagelijkse dosis van 400 mg/dag (6 mg/kg lichaamsgewicht per dag). In dat advies heeft de EFSA geconcludeerd dat de veiligheid van betaïne bij de door de aanvrager voorgestelde toepassingen en gebruiksniveaus, die zouden leiden tot een inname van 2 500 mg betaïne per dag, niet is vastgesteld. |
|
(12) |
Op 25 januari 2018 heeft de aanvrager de Commissie verzocht om bescherming van door eigendomsrechten beschermde gegevens voor negen studies die ter ondersteuning van de aanvraag zijn ingediend, namelijk verslagen van de studie inzake acute orale toxiciteit (7), twee studies inzake subacute orale toxiciteit (14 dagen (8) en 28 dagen (9)) en één studie inzake subchronische orale toxiciteit (42 dagen) (10), drie studies inzake mutageniteit en genotoxiciteit (11), een studie inzake chronische orale toxiciteit en carcinogeniteit (12) en een studie inzake de chronische blootstelling van mensen via de voeding (zes maanden) (13). |
|
(13) |
Op 18 februari 2018 heeft de EFSA opgemerkt (14) dat zij zich bij het opstellen van haar advies over betaïne als nieuw voedingsmiddel heeft gebaseerd op de gegevens uit de studie inzake chronische orale toxiciteit en carcinogeniteit voor de BMD-analyse en voor het bepalen van voor de doelpopulatie veilige innameniveaus van betaïne, op de gegevens uit de studie inzake chronische blootstelling van mensen via de voeding voor het bepalen van de voor de doelpopulatie veilige inname van betaïne, en op de gegevens uit drie genotoxiciteitsstudies voor het wegnemen van de bezorgdheid over de mogelijke genotoxiciteit van betaïne. Daarom is geoordeeld dat de conclusies over de veiligheid van betaïne niet mogelijk waren geweest zonder de gegevens van de ongepubliceerde verslagen van deze studies. |
|
(14) |
Naar aanleiding van de overwegingen van de EFSA heeft de Commissie de aanvrager verzocht om de onderbouwing van zijn claim dat de studie inzake chronische orale toxiciteit en carcinogeniteit, de studie inzake chronische blootstelling van mensen via de voeding en de drie studies inzake mutageniteit en genotoxiciteit door eigendomsrechten zijn beschermd, nader toe te lichten, en om de claim op het exclusieve recht om naar deze studies te verwijzen, zoals bedoeld in artikel 26, lid 2, onder b), van Verordening (EU) 2015/2283, te verduidelijken. |
|
(15) |
De aanvrager heeft ook aangevoerd dat hij op het moment van de indiening van de aanvraag de exclusieve eigendomsrechten op de studies bezat op grond van nationaal recht en dat derden dus geen rechtmatige toegang tot deze studies hadden en er geen rechtmatig gebruik van konden maken. |
|
(16) |
De Commissie heeft alle door de aanvrager ingediende informatie beoordeeld en heeft geoordeeld dat de aanvrager de vervulling van de voorschriften van artikel 26, lid 2, van Verordening (EU) 2015/2283 voldoende heeft onderbouwd. Daarom is het de EFSA gedurende een periode van vijf jaar vanaf de datum van inwerkingtreding van deze verordening niet toegestaan om de studie inzake chronische orale toxiciteit en carcinogeniteit, de studie inzake chronische blootstelling van mensen via de voeding en de drie studies inzake genotoxiciteit in het dossier van de aanvrager te gebruiken ten voordele van een volgende aanvrager. Het in de Unie in de handel brengen van betaïne zoals toegelaten bij deze verordening moet derhalve gedurende die periode tot de aanvrager worden beperkt. |
|
(17) |
De beperking van de toelating van betaïne en van het verwijzen naar de studies in het dossier van de aanvrager tot uitsluitend de aanvrager verhindert evenwel niet dat andere aanvragers om toelating kunnen vragen om hetzelfde nieuwe voedingsmiddel in de handel te brengen op voorwaarde dat hun aanvraag is gebaseerd op rechtmatig verkregen gegevens ter ondersteuning van de toelating krachtens deze verordening. |
|
(18) |
Op 2 november 2018 heeft de aanvrager bij de Commissie een aanvraag in de zin van artikel 10, lid 1, van Verordening (EU) 2015/2283 ingediend tot wijziging van de gebruiksvoorwaarden voor betaïne, zoals die waren opgenomen in de op 12 juni 2015 door de aanvrager bij de bevoegde Finse autoriteit ingediende aanvraag om betaïne in de Unie in de handel te brengen als nieuw voedselingrediënt. De gevraagde wijzigingen hebben betrekking op aanpassingen van de beoogde toepassingen en gebruiksconcentraties van betaïne in poederdranken, isotone dranken, eiwit- en graanrepen en maaltijdvervangende voedingsmiddelen voor sportbeoefenaars, alsmede van de toepassingen van betaïne in de dagelijkse voeding volledig vervangende voedingsmiddelen voor gewichtsbeheersing en in voeding voor medisch gebruik zoals omschreven in Verordening (EU) nr. 609/2013, met uitzondering van levensmiddelen voor zuigelingen en peuters. Die gevraagde wijzigingen zouden ervoor zorgen dat de inname van betaïne door de algemene bevolking niet de 400 mg/dag (6 mg/kg lichaamsgewicht per dag) overschrijdt die de EFSA in haar advies uit 2017 als veilig heeft aangemerkt. |
|
(19) |
Op 12 december 2018 heeft de Commissie de EFSA geraadpleegd en haar verzocht een aanvullende beoordeling uit te voeren voor de wijzigingen van de beoogde toepassingen en gebruiksconcentraties van betaïne als nieuw voedingsmiddel overeenkomstig artikel 10, lid 3, van Verordening (EU) 2015/2283. |
|
(20) |
Op 14 maart 2019 heeft de EFSA haar wetenschappelijk advies “Safety of Betaine as a novel food pursuant to Regulation (EU) 2015/2283” (15) uitgebracht. Dat wetenschappelijk advies is in overeenstemming met de voorschriften van artikel 11 van Verordening (EU) 2015/2283. |
|
(21) |
In dat advies heeft de EFSA geconcludeerd dat betaïne onder de nieuwe voorgestelde gebruiksvoorwaarden veilig is. In dat wetenschappelijk advies worden dan ook voldoende redenen gegeven om vast te stellen dat betaïne bij de voorgestelde toepassingen en gebruiksconcentraties als ingrediënt in poederdranken, isotone dranken, eiwit- en graanrepen en maaltijdvervangende voedingsmiddelen voor sportbeoefenaars, alsmede in de dagelijkse voeding volledig vervangende voedingsmiddelen voor gewichtsbeheersing en in voeding voor medisch gebruik zoals omschreven in Verordening (EU) nr. 609/2013, met uitzondering van levensmiddelen voor zuigelingen en peuters, voldoet aan de criteria van artikel 12, lid 1, van Verordening (EU) 2015/2283. |
|
(22) |
Het veilige innameniveau van betaïne kan worden overschreden wanneer betaïne bevattende voedingsmiddelen worden gebruikt in combinatie met betaïne bevattende voedingssupplementen. Daarom moeten de consumenten met een passend etiket worden ingelicht over het feit dat betaïne bevattende voedingsmiddelen niet mogen worden gebruikt als op dezelfde dag ook betaïne bevattende voedingssupplementen worden geconsumeerd. |
|
(23) |
Het gebruik van betaïne moet worden toegelaten onverminderd Verordening (EU) nr. 609/2013, waarin voorschriften zijn vastgesteld met betrekking tot voor zuigelingen en peuters bedoelde levensmiddelen, voeding voor medisch gebruik en de dagelijkse voeding volledig vervangende producten voor gewichtsbeheersing. |
|
(24) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
1. Betaïne, zoals gespecificeerd in de bijlage bij deze verordening, wordt opgenomen in de bij Uitvoeringsverordening (EU) 2017/2470 vastgestelde Unielijst van toegelaten nieuwe voedingsmiddelen.
2. Gedurende een periode van vijf jaar vanaf de datum van inwerkingtreding van deze verordening heeft alleen de oorspronkelijke aanvrager:
|
|
onderneming: DuPont Nutrition Biosciences ApS; |
|
|
adres: Langebrogade 1 DK-1411 Kopenhagen K, Denemarken, |
de toelating om het in lid 1 bedoelde nieuwe voedingsmiddel in de Unie in de handel te brengen, tenzij een volgende aanvrager een toelating voor het nieuwe voedingsmiddel verkrijgt zonder naar de op grond van artikel 2 van deze verordening beschermde gegevens te verwijzen of met instemming van DuPont Nutrition Biosciences ApS.
3. De in lid 1 bedoelde vermelding in de Unielijst omvat de gebruiksvoorwaarden en de etiketteringsvoorschriften zoals vastgesteld in de bijlage bij deze verordening.
4. De in dit artikel bedoelde toelating doet geen afbreuk aan de bepalingen van Richtlijn (EU) nr. 609/2013.
Artikel 2
De studies in het aanvraagdossier op basis waarvan het in artikel 1 bedoelde nieuwe voedingsmiddel door de EFSA is beoordeeld, die volgens de aanvrager door eigendomsrechten worden beschermd en zonder welke het nieuwe voedingsmiddel niet had kunnen worden toegelaten, worden gedurende een periode van vijf jaar vanaf de datum van inwerkingtreding van deze verordening niet zonder toestemming van DuPont Nutrition Biosciences ApS ten voordele van een volgende aanvrager gebruikt.
Artikel 3
De bijlage bij Uitvoeringsverordening (EU) 2017/2470 wordt gewijzigd overeenkomstig de bijlage bij deze verordening.
Artikel 4
Deze verordening treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 1 augustus 2019.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 327 van 11.12.2015, blz. 1.
(2) Uitvoeringsverordening (EU) 2017/2470 van de Commissie van 20 december 2017 tot vaststelling van de Unielijst van nieuwe voedingsmiddelen overeenkomstig Verordening (EU) 2015/2283 van het Europees Parlement en de Raad betreffende nieuwe voedingsmiddelen (PB L 351 van 30.12.2017, blz. 72).
(3) Verordening (EG) nr. 258/97 van het Europees Parlement en de Raad van 27 januari 1997 betreffende nieuwe voedingsmiddelen en nieuwe voedselingrediënten (PB L 43 van 14.2.1997, blz. 1).
(4) Verordening (EU) nr. 609/2013 van het Europees Parlement en de Raad van 12 juni 2013 inzake voor zuigelingen en peuters bedoelde levensmiddelen, voeding voor medisch gebruik en de dagelijkse voeding volledig vervangende producten voor gewichtsbeheersing, en tot intrekking van Richtlijn 92/52/EEG van de Raad, Richtlijnen 96/8/EG, 1999/21/EG, 2006/125/EG en 2006/141/EG van de Commissie, Richtlijn 2009/39/EG van het Europees Parlement en de Raad en de Verordeningen (EG) nr. 41/2009 en (EG) nr. 953/2009 van de Commissie (PB L 181 van 29.6.2013, blz. 35).
(5) EFSA Journal 2017; 15(11):5057.
(6) EFSA Journal 2017; 15(1):4658.
(7) Life Science Research Limited, 1990, ongepubliceerd.
(8) TNO BIBRA, 2001, ongepubliceerd.
(9) TNO BIBRA, 2001, ongepubliceerd.
(10) Imasde Aglomentaria, 2012, ongepubliceerd.
(11) Asquith 1989 a, b, c. Ongepubliceerd.
(12) Hatano Research Institute, 2002, ongepubliceerde studies.
(13) Ongepubliceerd verslag, zonder datum.
(14) Panel voor dieetproducten, voeding en allergieën van de EFSA; notulen van de 83e plenaire zitting gehouden op 7-8 februari 2018, goedgekeurd op 18 februari 2018 (https://www.efsa.europa.eu/sites/default/files/event/180207-1-m.pdf).
(15) EFSA Journal 2019; 17(4):5658.
BIJLAGE
De bijlage bij Uitvoeringsverordening (EU) 2017/2470 wordt als volgt gewijzigd:
|
1) |
In tabel 1 (Toegelaten nieuwe voedingsmiddelen) wordt de volgende vermelding in alfabetische volgorde ingevoegd:
|
||||||||||||||||||||||
|
2) |
In tabel 2 (Specificaties) wordt de volgende vermelding in alfabetische volgorde ingevoegd:
|
||||||
(*1) Maximale gebruiksconcentraties in het gebruiksklare eindproduct, als zodanig verkocht of na oplossen volgens de instructies van de fabrikant”
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/22 |
UITVOERINGSVERORDENING (EU) 2019/1295 VAN DE COMMISSIE
van 1 augustus 2019
tot wijziging van Uitvoeringsverordening (EU) 2018/1469 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Rusland en Oekraïne, naar aanleiding van een gedeeltelijk tussentijds nieuw onderzoek op grond van artikel 11, lid 3, van Verordening (EU) 2016/1036
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) 2016/1036 van het Europees Parlement en de Raad van 8 juni 2016 betreffende beschermende maatregelen tegen invoer met dumping uit landen die geen lid zijn van de Europese Unie (1) (“basisverordening”), en met name artikel 11, lid 3,
Overwegende hetgeen volgt:
1. PROCEDURE
1.1. Geldende maatregelen
|
(1) |
Bij Verordening (EG) nr. 954/2006 (2) heeft de Raad naar aanleiding van een onderzoek (“het oorspronkelijke onderzoek”) een definitief antidumpingrecht ingesteld op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Kroatië, Rusland en Oekraïne. De maatregelen bestonden in een ad-valoremantidumpingrecht van 12,3 % tot 25,7 % voor bij name genoemde producenten-exporteurs in Oekraïne en een residueel recht van 25,7 % voor alle andere ondernemingen in Oekraïne. Het definitieve antidumpingrecht voor de producent-exporteur waarop het onderhavige nieuwe onderzoek betrekking heeft, CJSC Nikopolsky Seamless Tubes Plant Niko Tube en OJSC Nizhnedneprovsky Tube Rolling Plant, thans LLC Interpipe Niko Tube en OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant genaamd (“de indiener van het verzoek” of “Interpipe”), bedroeg 25,1 %. |
|
(2) |
Nadat Interpipe beroep tot nietigverklaring van Verordening (EG) nr. 954/2006 van de Raad had ingesteld, heeft het Gerecht van de Europese Unie artikel 1 van Verordening (EG) nr. 954/2006 van de Raad nietig verklaard voor zover het voor Interpipe vastgestelde antidumpingrecht hoger was dan het geval zou zijn geweest indien op de uitvoerprijs geen correctie wegens commissie was toegepast wanneer de verkopen via de aangesloten handelsmaatschappij Sepco SA waren afgewikkeld (3). Op 16 februari 2012 heeft het Hof van Justitie van de Europese Unie het arrest van het Gerecht bevestigd (4). |
|
(3) |
Naar aanleiding van deze arresten heeft de Raad Verordening (EG) nr. 954/2006 gewijzigd bij Uitvoeringsverordening (EU) nr. 540/2012 (5), teneinde het voor Interpipe geldende antidumpingrecht te corrigeren voor zover dit onjuist was vastgesteld. Bijgevolg werd het voor Interpipe geldende recht gewijzigd in 17,7 %. |
|
(4) |
Bij Uitvoeringsverordening (EU) nr. 585/2012 (6) heeft de Raad naar aanleiding van een nieuw onderzoek in verband met het vervallen van de maatregelen de bij Verordening (EG) nr. 954/2006 ingestelde maatregelen ten aanzien van de invoer van naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Rusland en Oekraïne gehandhaafd. |
|
(5) |
Naar aanleiding van een verzoek van Interpipe op grond van artikel 11, lid 3, van de basisverordening heeft de Raad bij Uitvoeringsverordening (EU) nr. 795/2012 (7) de bij Uitvoeringsverordening (EU) nr. 585/2012 ingestelde definitieve maatregelen gewijzigd voor zover het Interpipe betreft (“het laatste tussentijdse nieuwe onderzoek”). Bijgevolg werd het voor Interpipe geldende recht gewijzigd in 13,8 %. |
|
(6) |
Bij Uitvoeringsverordening (EU) 2018/1469 (8) heeft de Commissie naar aanleiding van een nieuw onderzoek in verband met het vervallen van de maatregelen de bij Uitvoeringsverordening (EG) nr. 585/2012 van de Raad, laatstelijk gewijzigd bij Uitvoeringsverordening (EU) nr. 795/2012 en Uitvoeringsverordening (EU) nr. 1269/2012 van de Raad (9), ingestelde maatregelen ten aanzien van de invoer van naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Rusland en Oekraïne gehandhaafd (“het nieuwe onderzoek in verband met het vervallen van de maatregelen”). |
|
(7) |
De thans geldende antidumpingrechten variëren van 35,8 % tot 24,1 % voor de invoer van oorsprong uit Rusland en van 25,7 % tot 12,3 % voor invoer van oorsprong uit Oekraïne. |
1.2. Verzoek om een gedeeltelijk tussentijds nieuw onderzoek
|
(8) |
De Commissie heeft op 7 mei 2018 door middel van een bericht in het Publicatieblad van de Europese Unie (“het bericht van opening”) (10) de opening bekendgemaakt van een gedeeltelijk tussentijds nieuw onderzoek van de antidumpingmaatregelen die van toepassing zijn op de invoer van bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Oekraïne overeenkomstig artikel 11, lid 3, van de basisverordening. |
|
(9) |
Het nieuwe onderzoek, dat beperkt is tot dumping door de producent-exporteur Interpipe, werd geopend naar aanleiding van een met bewijsmateriaal gestaafd verzoek van deze onderneming. Interpipe verstrekte in dit verzoek voldoende bewijsmateriaal waaruit blijkt dat de omstandigheden op grond waarvan de bestaande maatregelen waren ingesteld, gewijzigd zijn en dat deze wijzigingen van blijvende aard zijn. |
1.3. Onderzoek
|
(10) |
Het onderzoek naar het niveau van de dumping had betrekking op de periode van 1 april 2017 tot en met 31 maart 2018 (“het tijdvak van het nieuwe onderzoek”). |
|
(11) |
De Commissie heeft de indiener van het verzoek, de autoriteiten van het land van uitvoer en de bedrijfstak van de Unie officieel van de opening van het gedeeltelijke tussentijdse nieuwe onderzoek in kennis gesteld. De belanghebbenden werden in de gelegenheid gesteld om binnen de in het bericht van opening vastgelegde termijn hun standpunt schriftelijk kenbaar te maken en te verzoeken te worden gehoord. |
|
(12) |
Om de inlichtingen te verkrijgen die zij voor haar onderzoek nodig achtte, heeft de Commissie de indiener van het verzoek een vragenlijst toegezonden, die binnen de daarvoor gestelde termijn is beantwoord. |
|
(13) |
De Commissie heeft alle informatie ingewonnen en gecontroleerd die zij voor de bepaling van het niveau van de dumping nodig achtte. Bij de indiener van het verzoek en zijn verbonden handelsondernemingen LLC Interpipe Ukraine, Interpipe Europe SA en Interpipe Central Trade GmbH werden ter plaatse controles verricht. |
2. ONDERZOCHT PRODUCT EN SOORTGELIJK PRODUCT
2.1. Onderzocht product
|
(14) |
Het onderzochte product is hetzelfde als het product dat is gedefinieerd in Uitvoeringsverordening (EU) 2018/1469 van de Commissie waarbij de geldende maatregelen zijn ingesteld, dat wil zeggen naadloze buizen en pijpen, van ijzer of van staal (“NBP”), met rond profiel, met een uitwendige diameter van niet meer dan 406,4 mm en een koolstofequivalent (carbon equivalent value, CEV) van niet meer dan 0,86 volgens de formule en chemische analyse van het Internationaal Instituut voor Lastechniek (International Institute of Welding, IIW) (11), van oorsprong uit onder meer Oekraïne, momenteel ingedeeld onder de GN-codes ex 7304 11 00, ex 7304 19 10, ex 7304 19 30, ex 7304 22 00, ex 7304 23 00, ex 7304 24 00, ex 7304 29 10, ex 7304 29 30, ex 7304 31 80, ex 7304 39 58, ex 7304 39 92, ex 7304 39 93, ex 7304 51 89, ex 7304 59 92 en ex 7304 59 93 (“het onderzochte product”). |
2.2. Soortgelijk product
|
(15) |
Het onderhavige onderzoek bevestigde wat in het oorspronkelijke onderzoek en de daaropvolgende nieuwe onderzoeken al was vastgesteld, namelijk dat het in Oekraïne vervaardigde en naar de EU uitgevoerde product, het in Oekraïne vervaardigde en daar op de binnenlandse markt verkochte product alsook het in de EU door de producenten in de Unie vervaardigde en verkochte product dezelfde fysieke en technische basiskenmerken en hetzelfde eindgebruik hebben. Deze producten worden dan ook beschouwd als soortgelijke producten in de zin van artikel 1, lid 4, van de basisverordening. |
3. BLIJVENDE AARD VAN DE GEWIJZIGDE OMSTANDIGHEDEN
|
(16) |
Overeenkomstig artikel 11, lid 3, van de basisverordening werd onderzocht of de gewijzigde omstandigheden met betrekking tot dumping als van blijvende aard konden worden aangemerkt. |
|
(17) |
Ten tijde van het oorspronkelijke antidumpingonderzoek in 2006 en het meest recente tussentijdse nieuwe onderzoek met betrekking tot Interpipe in 2012, dat het tijdvak van het nieuwe onderzoek van 1 oktober 2010 tot en met 30 september 2011 bestreek, betrok Interpipe de voornaamste grondstof voor de productie van het onderzochte product, d.w.z. ronde stalen billets, van onafhankelijke leveranciers. |
|
(18) |
In zijn verzoek om een gedeeltelijk tussentijds nieuw onderzoek voerde de indiener van het verzoek aan dat de verticale integratie van LLC Metallurgical Plant “Dneprosteel” in 2013 ertoe heeft geleid dat de belangrijkste grondstof (stalen billets) intern wordt geproduceerd, wat een aanzienlijke kostenvermindering en een wijziging van het productassortiment tot gevolg heeft gehad. Hij voerde eveneens aan dat hij, in vergelijking met de productsoorten die hij in het onderzoektijdvak van het laatste tussentijdse nieuwe onderzoek had vervaardigd en uitgevoerd, namelijk staal van “standaard”kwaliteit, inmiddels nieuwe en meer geavanceerde producten (“hooggelegeerd” staal, staal voor “leidingbuizen en mechanische buizen”) aan zijn productassortiment heeft toegevoegd, die een aanzienlijk deel uitmaakten van de totale uitvoer naar de EU in het huidige tijdvak van het nieuwe onderzoek (1 april 2017 tot en met 31 maart 2018). |
|
(19) |
In het onderzoek werd bevestigd dat de belangrijkste grondstof door de indiener van het verzoek intern werd geproduceerd en dat deze wijziging heeft geleid tot een aanzienlijke wijziging van de kosten en het productassortiment. Daarnaast is in het kader van het onderzoek bevestigd dat de door Interpipe naar de EU uitgevoerde productsoorten aanmerkelijk verschilden van de productsoorten die tijdens het onderzoektijdvak van het laatste tussentijdse nieuwe onderzoek waren uitgevoerd. Op grond hiervan en gezien de structurele aard van deze wijzigingen werd geconcludeerd dat de in overweging 17 beschreven wijzigingen van blijvende aard zijn en dat deze situatie in de nabije toekomst waarschijnlijk niet zal veranderen. Bijgevolg werd geoordeeld dat de toepassing van de bestaande maatregelen op hun huidige niveau opnieuw moet worden beoordeeld. |
|
(20) |
Een verdere wijziging die de indiener van het verzoek na de opening van dit nieuwe onderzoek had aangevoerd, namelijk het bestaan/de oprichting van een joint venture tussen Interpipe en Vallourec Tubes, werd niet in aanmerking genomen, aangezien die wijziging zich pas heeft voorgedaan nadat het onderhavige tussentijdse nieuwe onderzoek was geopend. |
4. DUMPING
4.1.1. Ondernemingsstructuur en voor berekening van dumping gebruikte methode
|
(21) |
Tijdens het tijdvak van het nieuwe onderzoek waren er twee producenten-exporteurs die volledig in handen waren van en onder zeggenschap stonden van Interpipe (“de productie-entiteiten”), te weten LLC Interpipe Niko Tube (“NIKO”) en OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (“NTRP”). |
|
(22) |
Aangezien het boekhoudsysteem van de indiener van het verzoek het niet mogelijk maakte te achterhalen welke van de productie-entiteiten welk deel van de verkoop voor haar rekening nam, werd in het kader van het oorspronkelijke onderzoek een gemeenschappelijke dumpingmarge berekend door alle gegevens met betrekking tot productie, winstgevendheid en verkoop in de EU van de twee productie-entiteiten samen te voegen. |
|
(23) |
Na een duidelijke wijziging in de bedrijfsstructuur van de groep waardoor het mogelijk was te achterhalen welke van de productie-entiteiten welk deel van de verkoop en de productie voor haar rekening nam, heeft de Commissie vanaf het laatste tussentijdse nieuwe onderzoek, in overeenstemming met artikel 2, leden 11 en 12, van de basisverordening, de gegevens voor de productie-entiteiten niet langer samengevoegd, maar van de standaardmethode gebruikgemaakt. Deze standaardmethode bestond erin voor de twee producenten-exporteurs een gemeenschappelijke dumpingmarge te berekenen door eerst voor elke individuele producent-exporteur het bedrag van de dumping te berekenen en vervolgens voor beide ondernemingen één enkele gewogen gemiddelde dumpingmarge vast te stellen. |
|
(24) |
In het kader van het huidige onderzoek was het eveneens mogelijk te achterhalen welke van de productie-entiteiten welk deel van de verkoop voor haar rekening nam. In overeenstemming met artikel 2, leden 11 en 12, van de basisverordening en in lijn met de vaste praktijk van de instellingen van de Unie werd dus dezelfde methode toegepast als in het laatste tussentijdse nieuwe onderzoek. |
4.1.2. Normale waarde
|
(25) |
In overeenstemming met artikel 2, lid 2, van de basisverordening heeft de Commissie eerst onderzocht of voor elk van de producent-exporteurs de totale omvang van de binnenlandse verkoop van het soortgelijke product aan onafhankelijke afnemers representatief was in vergelijking met de totale omvang van de verkoop bij uitvoer naar de EU, d.w.z. of de totale op de binnenlandse markt verkochte hoeveelheid ten minste 5 % van de totale naar de EU uitgevoerde hoeveelheid van het onderzochte product bedroeg. Uit het onderzoek is gebleken dat de binnenlandse verkoop voor beide producenten-exporteurs representatief was. |
|
(26) |
Vervolgens heeft zij in overeenstemming met artikel 2, lid 2, van de basisverordening onderzocht of de binnenlandse verkoop door Interpipe van de productsoort die identiek is aan of vergelijkbaar is met de productsoort die naar de Unie wordt uitgevoerd, representatief was. De binnenlandse verkoop van een productsoort is representatief als de totale binnenlandse verkoop van die productsoort aan onafhankelijke afnemers in het onderzoektijdvak ten minste 5 % bedraagt van de totale uitvoer van de identieke of vergelijkbare productsoort naar de Unie. De Commissie heeft vastgesteld dat de binnenlandse verkoop van de productsoort die identiek is aan of vergelijkbaar is met de productsoort die naar de Unie wordt uitgevoerd, in het onderzoektijdvak grotendeels representatief was, aangezien 60 tot 80 % (12) van de uitgevoerde soorten in representatieve hoeveelheden op de binnenlandse markt bleek te zijn verkocht. |
|
(27) |
Daarna is in overeenstemming met artikel 2, lid 4, van de basisverordening onderzocht of de verkoop van elke productsoort in representatieve hoeveelheden op de binnenlandse markt kon worden geacht in het kader van normale handelstransacties te hebben plaatsgevonden. Hiertoe werd voor elke uitgevoerde soort van het onderzochte product het aandeel van de winstgevende binnenlandse verkoop aan onafhankelijke afnemers op de binnenlandse markt in het tijdvak van het nieuwe onderzoek vastgesteld. |
|
(28) |
Voor productsoorten waarvan meer dan 80 % van de op de binnenlandse markt verkochte hoeveelheid werd verkocht tegen prijzen die hoger waren dan de productiekosten en waarvan de gewogen gemiddelde verkoopprijs gelijk was aan of hoger was dan de productiekosten per eenheid, werd de normale waarde per productsoort berekend als het gewogen gemiddelde van de werkelijke binnenlandse prijzen van de totale verkoop van de productsoort in kwestie, ongeacht of die verkoop al dan niet winstgevend was. |
|
(29) |
Wanneer de winstgevende verkoop van een productsoort 80 % of minder van de totale verkoop van die productsoort bedroeg, of de gewogen gemiddelde prijs van die productsoort lager was dan de productiekosten per eenheid, werd de normale waarde gebaseerd op de werkelijke binnenlandse prijs, berekend als de gewogen gemiddelde prijs van uitsluitend de winstgevende verkoop op de binnenlandse markt van die productsoort tijdens het tijdvak van het nieuwe onderzoek. |
|
(30) |
Uit de analyse van de binnenlandse verkoop bleek dat 35 tot 55 % (13) van de totale binnenlandse verkoop van de productsoort die identiek was aan of vergelijkbaar was met de naar de Unie uitgevoerde productsoort, winstgevend was en dat de gewogen gemiddelde verkoopprijs hoger was dan de productiekosten. De normale waarde werd bijgevolg berekend als gewogen gemiddelde van de prijzen van uitsluitend de winstgevende verkoop. |
|
(31) |
De normale waarde voor de niet-representatieve productsoorten (d.w.z. die waarvan de binnenlandse verkoop minder dan 5 % van de verkoop bij uitvoer naar de EU uitmaakte of die helemaal niet op de binnenlandse markt werden verkocht) werd berekend aan de hand van de productiekosten per productsoort, vermeerderd met een bedrag voor verkoopkosten, algemene kosten en administratiekosten en voor winst. Was er sprake van binnenlandse verkoop, dan werd voor de betrokken productsoorten gebruikgemaakt van de winst van de normale handelstransacties op de binnenlandse markt per productsoort. Was er geen sprake van binnenlandse verkoop, dan werd gebruikgemaakt van een gemiddelde winst (14). |
|
(32) |
Na de mededeling van de definitieve bevindingen betwistte Interpipe Group een aantal elementen die de Commissie bij het berekenen van de normale waarde had gebruikt. Haar argumenten hadden betrekking op de volgende aspecten: i) de berekening van de verkoopkosten, algemene kosten en administratiekosten; ii) de vermeende uitsluiting van andere exploitatiekosten; iii) het gebruik van financiële kosten; iv) de dubbeltelling met betrekking tot de correcties voor verkoopkosten, algemene kosten en administratiekosten. |
|
(33) |
Na de gegevens in het dossier te hebben onderzocht, besloot de Commissie de bovenstaande argumenten ii) en iv) te aanvaarden en de bovenstaande argumenten i) en iii) van de hand te wijzen. Wegens het vertrouwelijke karakter van de bedrijfsinformatie in de argumenten van Interpipe Group en de analyse van deze argumenten door de Commissie stuurde de Commissie Interpipe Group op de datum van vaststelling van deze verordening een aanvullende mededeling van feiten en overwegingen met daarin een gedetailleerde motivering. |
|
(34) |
Aangezien zij de argumenten ii) en iv) had aanvaard, herzag de Commissie de dumpingmarge van Interpipe. De onderneming ontving een aanvullende mededeling van feiten en overwegingen met daarin een beschrijving van het effect op de dumpingmarge en werd om opmerkingen verzocht. De Commissie informeerde tevens de bedrijfstak van de Unie omtrent de wijziging van de dumpingmarge van de onderneming. |
|
(35) |
Na ontvangst van de aanvullende mededeling van feiten en overwegingen handhaafde Interpipe de door de Commissie van de hand gewezen argumenten, zonder daaraan nieuwe elementen toe te voegen die voor de Commissie aanleiding zouden kunnen zijn om haar aan de onderneming meegedeelde conclusies te wijzigen. |
4.1.3. Uitvoerprijs
|
(36) |
Bij de uitvoer van het onderzochte product naar de EU waren verschillende entiteiten binnen Interpipe Group betrokken, te weten de fabrieken, een in Oekraïne gevestigde coördinatiemaatschappij (“Interpipe Ukraine” of “IPU”), een in Duitsland gevestigde verbonden importeur (“Interpipe Central Trade GmbH” of “IPCT”) en een in Zwitserland gevestigde aangesloten handelsmaatschappij (“Interpipe Europe SA” of “IPE”). |
|
(37) |
De uitvoerprijs werd vastgesteld overeenkomstig artikel 2, lid 8, van de basisverordening, behalve voor transacties via de verbonden onderneming die als importeur optreedt, IPCT. In dit geval werd de uitvoerprijs overeenkomstig artikel 2, lid 9, van de basisverordening vastgesteld op basis van de prijs waartegen het ingevoerde product voor het eerst aan onafhankelijke afnemers in de EU was doorverkocht. Er werden derhalve prijscorrecties toegepast voor alle tussen de invoer en de wederverkoop gemaakte kosten en voor een redelijke winst. Deze correcties werden berekend op basis van de verkoopkosten, algemene kosten en administratiekosten van de verbonden handelaar en van een fictieve winst als behaald door een niet-verbonden importeur (2,5 % van de omzet). |
4.1.4. Vergelijking
|
(38) |
De normale waarde en de uitvoerprijs van de twee producenten-exporteurs werden vergeleken af fabriek. Met het oog op een billijke vergelijking van de normale waarde met de uitvoerprijs werden overeenkomstig artikel 2, lid 10, van de basisverordening correcties toegepast om rekening te houden met verschillen die van invloed zijn op de prijzen en de vergelijkbaarheid van de prijzen. Op grond hiervan werden correcties toegepast voor kosten van vervoer, verzekering, lading, overlading, lossing en aanverwante kosten, invoerheffingen, douanerechten, commissies en kredietkosten. |
|
(39) |
In het tijdvak van het nieuwe onderzoek voerde Interpipe het onderzochte product via twee verschillende verkoopkanalen naar de EU uit, te weten via dezelfde, in Zwitserland gevestigde aangesloten handelsmaatschappij als ten tijde van het laatste tussentijdse nieuwe onderzoek (IPE) en via een in de EU gevestigd verbonden invoerbedrijf (IPCT), dat in 2014 is opgericht. Het laatstbedoelde distributiekanaal bestond ten tijde van het laatste tussentijdse nieuwe onderzoek niet. Wegens het vertrouwelijke karakter van de bedrijfsinformatie in haar analyse stuurde de Commissie Interpipe Group op de datum van vaststelling van deze verordening een aanvullende mededeling van feiten en overwegingen met daarin een gedetailleerde motivering. |
|
(40) |
De Commissie was derhalve van oordeel dat een correctie uit hoofde van artikel 2, lid 10, onder i), van de basisverordening gerechtvaardigd was. Deze correctie werd berekend door de verkoopkosten, algemene kosten en administratiekosten van de aangesloten handelsmaatschappij, die niet als correcties werden vermeld, alsmede een fictieve winst als behaald door een niet-verbonden handelaar (2,5 % van de omzet) in mindering te brengen op de verkoopprijs aan de eerste niet-verbonden afnemer. |
|
(41) |
Na ontvangst van de mededeling van de definitieve bevindingen betwistte Interpipe Group de conclusie van de Commissie dat IPE niet moet worden geacht deel uit te maken van één enkele economische eenheid met de andere entiteiten NIKO, NTRP en IPU. Na de gegevens in het dossier opnieuw te hebben onderzocht, besloot de Commissie dit argument van de hand te wijzen. Zoals vermeld in overweging 34, ontving de onderneming een aanvullende mededeling van feiten en overwegingen met daarin een beschrijving van het effect op de dumpingmarge en werd zij om opmerkingen verzocht. In haar reactie handhaafde Interpipe de door de Commissie van de hand gewezen argumenten. De Commissie ontving hieromtrent geen verdere opmerkingen. |
|
(42) |
Wegens het vertrouwelijke karakter van de bedrijfsinformatie in de argumenten van Interpipe Group en de analyse van deze argumenten door de Commissie stuurde de Commissie Interpipe Group op de datum van vaststelling van deze verordening een aanvullende mededeling van feiten en overwegingen met daarin een gedetailleerde motivering. |
4.1.5. Dumpingmarge
|
(43) |
Ingevolge artikel 2, leden 11 en 12, van de basisverordening werd voor elk van de twee producenten-exporteurs afzonderlijk en per productsoort de gewogen gemiddelde normale waarde vergeleken met de gewogen gemiddelde uitvoerprijs op het niveau af fabriek. Vervolgens werd voor Interpipe een gemeenschappelijke dumpingmarge vastgesteld door voor beide producenten-exporteurs binnen Interpipe één enkele gewogen gemiddelde dumpingmarge te berekenen. |
|
(44) |
De aldus vastgestelde dumpingmarge, uitgedrukt als percentage van de cif-prijs, grens Unie, vóór inklaring, bedraagt 8,1 %. |
|
(45) |
Na ontvangst van de aanvullende mededeling van feiten en overwegingen voerde ESTA aan dat de verlaging van de dumpingmarge van Interpipe extra schade zou veroorzaken voor de bedrijfstak van naadloze stalen buizen en pijpen van de EU. De Commissie merkt op dat overeenkomstig artikel 9, lid 4, van de basisverordening het antidumpingrecht niet hoger mag zijn dan de dumpingmarge, die in dit geval is vastgesteld op 8,1 %. |
|
(46) |
Het bij artikel 15, lid 1, van de basisverordening ingestelde comité heeft geen advies uitgebracht, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De vermelding met betrekking tot LLC Interpipe Niko Tube en OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) in de tabel in artikel 1, lid 2, van Uitvoeringsverordening (EU) nr. 585/2012 wordt vervangen door:
|
“LLC Interpipe Niko Tube en OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) |
8,1 % |
A743” |
Artikel 2
Deze verordening treedt in werking op de dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 1 augustus 2019.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 176 van 30.6.2016, blz. 21.
(2) Verordening (EG) nr. 954/2006 van de Raad van 27 juni 2006 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, uit Kroatië, Oekraïne, Roemenië en Rusland, tot intrekking van de Verordeningen (EG) nr. 2320/97 en (EG) nr. 348/2000 van de Raad, tot beëindiging van de tussentijdse procedure en de procedure bij het vervallen van de maatregelen voor de eventuele herziening van de antidumpingrechten op bepaalde naadloze buizen en pijpen, van ijzer of van niet-gelegeerd staal, uit onder meer Roemenië en Rusland en tot beëindiging van de tussentijdse procedures voor de eventuele herziening van de antidumpingrechten op bepaalde naadloze buizen en pijpen, van ijzer of van niet-gelegeerd staal, uit onder meer Roemenië en Rusland en uit Kroatië en Oekraïne (PB L 175 van 29.6.2006, blz. 4).
(3) Arrest van 10 maart 2009, Interpipe Niko Tube en Interpipe NTRP/Raad, T-249/06, ECLI:EU:T:2009:62.
(4) Arrest van 16 februari 2012, Raad en Commissie/Interpipe Niko Tube en Interpipe NTRP, C-191/09 P en C-200/09 P, ECLI:EU:C:2012:78.
(5) Uitvoeringsverordening (EU) nr. 540/2012 van de Raad van 21 juni 2012 tot wijziging van Verordening (EG) nr. 954/2006 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Kroatië, Oekraïne, Roemenië en Rusland (PB L 165 van 26.6.2012, blz. 1).
(6) Uitvoeringsverordening (EU) nr. 585/2012 van de Raad van 26 juni 2012 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Rusland en Oekraïne, naar aanleiding van een nieuw onderzoek in verband met het vervallen van de maatregelen op grond van artikel 11, lid 2, van Verordening (EG) nr. 1225/2009, en tot beëindiging van de procedure van het nieuwe onderzoek in verband met het vervallen van de maatregelen die van toepassing zijn op de invoer van bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Kroatië (PB L 174 van 4.7.2012, blz. 5).
(7) Uitvoeringsverordening (EU) nr. 795/2012 van de Raad van 28 augustus 2012 tot wijziging van Uitvoeringsverordening (EU) nr. 585/2012 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Rusland en Oekraïne, naar aanleiding van een gedeeltelijk tussentijds nieuw onderzoek op grond van artikel 11, lid 3, van Verordening (EG) nr. 1225/2009 (PB L 238 van 4.9.2012, blz. 1).
(8) Uitvoeringsverordening (EU) 2018/1469 van de Commissie van 1 oktober 2018 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit Rusland en Oekraïne, naar aanleiding van een nieuw onderzoek in verband met het vervallen van de maatregelen op grond van artikel 11, lid 2, van Verordening (EU) 2016/1036 van het Europees Parlement en de Raad (PB L 246 van 2.10.2018, blz. 20).
(9) Uitvoeringsverordening (EU) nr. 1269/2012 van de Raad van 21 december 2012 tot wijziging van Uitvoeringsverordening (EU) nr. 585/2012 tot instelling van een definitief antidumpingrecht op bepaalde naadloze buizen en pijpen, van ijzer of van staal, van oorsprong uit onder meer Rusland, naar aanleiding van een gedeeltelijk tussentijds nieuw onderzoek op grond van artikel 11, lid 3, van Verordening (EG) nr. 1225/2009 (PB L 357 van 28.12.2012, blz. 1).
(10) PB C 159 van 7.5.2018, blz. 18.
(11) Het CEV wordt bepaald volgens het Technisch Verslag van 1967, IIW doc. IX-555-67, gepubliceerd door het Internationaal Instituut voor Lastechniek.
(12) Het exacte cijfer wordt niet verstrekt omdat dit bedrijfsspecifieke gegevens betreft.
(13) Het exacte cijfer wordt niet verstrekt omdat dit bedrijfsspecifieke gegevens betreft.
(14) Deze verandering van methode valt te herleiden tot het na het oorspronkelijke onderzoek uitgebrachte en door het Orgaan voor Geschillenbeslechting van de WTO aangenomen verslag van een WTO-panel in het geschil Europese Gemeenschappen — Antidumpingmaatregel ten aanzien van gekweekte zalm uit Noorwegen (European Communities — Anti-dumping Measure on Farmed Salmon from Norway), volgens hetwelk niet mag worden voorbijgegaan aan de feitelijke winstmarge die is vastgesteld voor de normale handelstransacties betreffende de relevante productsoorten waarvoor de normale waarde moet worden berekend. Zie WT/DS337/R van 16 november 2007 — op 15 januari 2008 aangenomen door het Orgaan voor Geschillenbeslechting, punten 7.289 tot en met 7.319.
BESLUITEN
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/29 |
BESLUIT (GBVB) 2019/1296 VAN DE RAAD
van 31 juli 2019
ter ondersteuning van de aanscherping van de biologische veiligheid en beveiliging in Oekraïne in overeenstemming met de uitvoering van Resolutie 1540 (2004) van de Veiligheidsraad van de Verenigde Naties inzake de non-proliferatie van massavernietigingswapens en de overbrengingsmiddelen daarvoor
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de Europese Unie, en met name artikel 28, lid 1, en artikel 31, lid 1,
Gezien het voorstel van de hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid,
Overwegende hetgeen volgt:
|
(1) |
De Europese Raad heeft op 12 december 2003 de EU-strategie tegen de verspreiding van massavernietigingswapens vastgesteld, met in hoofdstuk II een lijst van maatregelen ter bestrijding van deze verspreiding. Dergelijke maatregelen dienen zowel binnen de Unie als in derde landen te worden genomen. |
|
(2) |
De Unie geeft momenteel actief uitvoering aan die strategie en aan de in hoofdstuk III daarvan genoemde maatregelen, met name door middelen vrij te maken ter ondersteuning van specifieke projecten die worden uitgevoerd door multilaterale instellingen, door aan landen technische bijstand en deskundigheid te verstrekken met betrekking tot een veelheid van non-proliferatiemaatregelen, en door de rol van de Veiligheidsraad van de Verenigde Naties (VN-Veiligheidsraad) te bevorderen. |
|
(3) |
De VN-Veiligheidsraad heeft op 28 april 2004 Resolutie 1540 (2004) aangenomen; dit is het eerste internationale instrument dat op geïntegreerde en alomvattende wijze massavernietigingswapens, de overbrengingsmiddelen daarvoor en de daarvoor bestemde materialen behandelt. In Resolutie 1540 (2004) van de VN-Veiligheidsraad werden voor alle staten dwingende verplichtingen vastgesteld die erop gericht waren niet-statelijke actoren te verhinderen en af te schrikken om dergelijke wapens en daarmee verband houdend materialen te bemachtigen. De VN-Veiligheidsraad heeft ook besloten dat alle staten effectieve maatregelen moeten nemen en handhaven om nationale controles in te stellen ter voorkoming van de proliferatie van nucleaire, chemische of biologische wapens en hun overbrengingsmiddelen, onder meer door adequate controles op hiermee verband houdende materialen in te voeren. |
|
(4) |
Op 11 mei 2017 heeft de Raad Besluit (GBVB) 2017/809 (1) ter ondersteuning van de uitvoering van Resolutie 1540 (2004) van de VN-Veiligheidsraad vastgesteld. De technische uitvoering van de op grond van Besluit (GBVB) 2017/809 uit te voeren projecten is toevertrouwd aan het VN-Bureau voor ontwapeningszaken (Unoda), in samenwerking met bevoegde regionale internationale organisaties, en met name de Organisatie voor Veiligheid en Samenwerking in Europa (OVSE). |
|
(5) |
Op 11 juli 2017 nam de Raad Besluit (GBVB) 2017/1252 (2) van de Raad aan ter ondersteuning van de aanscherping van de chemische veiligheid en beveiliging in Oekraïne in overeenstemming met de uitvoering van Resolutie 1540 (2004) van de VN-Veiligheidsraad. De technische uitvoering van de op grond van Besluit (GBVB) 2017/1252 uit te voeren activiteiten is toevertrouwd aan het OVSE-secretariaat. |
|
(6) |
De universele naleving en de volledige uitvoering van het Verdrag inzake biologische en toxinewapens (BTWC) en Resolutie 1540 (2004) van de VN-Veiligheidsraad behoren tot de voornaamste prioriteiten van Oekraïne op het gebied van de non-proliferatie van massavernietigingswapens. |
|
(7) |
Op 21 maart en 27 juni 2014 ondertekenden de Unie en Oekraïne een associatieovereenkomst (3) die onder meer voorziet in de versnelde harmonisatie van de Oekraïense wetgeving met de desbetreffende Uniewetgeving, ook wat betreft de opheffing van belemmeringen voor de volledige uitvoering in Oekraïne van Resolutie 1540 (2004) van de VN-Veiligheidsraad. Sinds 1 november 2014 wordt reeds een aantal onderdelen van de associatieovereenkomst voorlopig toegepast. De associatieovereenkomst tussen de EU en Oekraïne is op 1 september 2017 in werking getreden. |
|
(8) |
Volgens het actieplan van de Oekraïense regering voor de uitvoering van de associatieovereenkomst EU-Oekraïne voor de periode 2018-2020 heeft Oekraïne zich ertoe verbonden voorschriften en mechanismen op het gebied van biologische veiligheid en beveiliging te ontwikkelen en te verbeteren overeenkomstig de verplichtingen van Oekraïne uit hoofde van het BTWC en Resolutie 1540 (2004) van de VN-Veiligheidsraad, alsmede uit hoofde van internationale normen en standaarden, en met name de toepasselijke EU-wetgeving. |
|
(9) |
In dit kader heeft het OVSE-secretariaat drie projectvoorstellen ter versterking van de algemene biologische veiligheid en beveiliging in Oekraïne opgesteld, in nauwe samenwerking met de bevoegde instanties van Oekraïne. |
|
(10) |
Het OVSE-secretariaat moet worden belast met de technische uitvoering van de projecten die moeten worden gerealiseerd in het kader van dit besluit. |
|
(11) |
De projecten moeten worden uitgevoerd overeenkomstig de bepalingen van het actieplan van de Oekraïense regering voor de uitvoering van de associatieovereenkomst tussen de EU-Oekraïne. Bij de activiteiten moet rekening worden gehouden met goede praktijken en lessen die zijn geleerd bij de uitvoering van Besluit (GBVB) 2017/1252. |
|
(12) |
Het OVSE-secretariaat moet efficiënt samenwerken met bevoegde internationale organisaties en organen als de ondersteunende eenheid voor de uitvoering van het BTWC, het krachtens Resolutie 1540 (2004) van de VN-Veiligheidsraad opgerichte VN-comité, de Wereldorganisatie voor diergezondheid (OIE), en het wereldwijd partnerschap tegen de verspreiding van massavernietigingswapens en -materialen. Het OVSE-secretariaat moet tevens zorgen voor de complementariteit en synergie van ingevolge dit besluit ondernomen projecten met eerdere en lopende desbetreffende projecten en activiteiten in Oekraïne die steun krijgen van EU-lidstaten en met andere door de Unie gefinancierde programma's op dit gebied, waaronder het instrument voor bijdrage aan stabiliteit en vrede en de EU-kenniscentra op het gebied van chemische, biologische, radiologische en nucleaire risicobestrijding, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
1. Ter bevordering van vrede en veiligheid en van effectief multilateralisme op mondiaal en regionaal niveau streeft de Unie naar:
|
— |
het versterken van de biologische veiligheid en beveiliging in Oekraïne door het verbeteren van de wet- en regelgeving van Oekraïne en van zijn volks- en diergezondheidsstelsels, en dor het vergroten van het bewustzijn onder levenswetenschappers; |
|
— |
het ondersteunen van effectief multilateralisme op regionaal niveau, door de maatregelen van de OVSE ter vergroting van de capaciteit van de bevoegde instanties van Oekraïne om, in overeenstemming met de verplichtingen uit hoofde van Resolutie 1540 (2004) van de VN-Veiligheidsraad en het BTWC te steunen. |
2. Ter verwezenlijking van de in lid 1 genoemde doelstellingen, onderneemt de Unie de volgende projecten:
|
— |
harmonisatie van de Oekraïense bioveiligheids- en biobeveiligingsvoorschriften met internationale normen; |
|
— |
instellen van een duurzaam veterinair toezichtssysteem in Oekraïne voor aan bijzonder gevaarlijke ziekteverwekkers gerelateerde ziekten; |
|
— |
bewustmaking, onderwijs en opleiding voor biowetenschappers op het gebied van bioveiligheid en biobeveiliging. |
De bijlage bevat een nadere omschrijving van de bovenbedoelde projecten.
Artikel 2
1. De hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid (“de hoge vertegenwoordiger”) is verantwoordelijk voor de uitvoering van dit besluit.
2. De technische uitvoering van de in artikel 1, lid 2, bedoelde projecten wordt toevertrouwd aan het Secretariaat van de OVSE. Zij verricht haar taken onder de verantwoordelijkheid van de hoge vertegenwoordiger. De hoge vertegenwoordiger treft hiertoe de nodige regelingen met het OVSE-secretariaat.
Artikel 3
1. Het financieel referentiebedrag voor de uitvoering van de in artikel 1, lid 2, bedoelde projecten bedraagt 1 913 900 EUR.
2. Voor het beheer van de uitgaven die uit het in lid 1 bepaalde bedrag worden gefinancierd, gelden de procedures en voorschriften die van toepassing zijn op de algemene begroting van de Unie.
3. De Commissie ziet erop toe dat de in lid 1 bedoelde uitgaven correct worden beheerd. Zij sluit hiertoe een financieringsovereenkomst met het OVSE-secretariaat. In die overeenkomst wordt bepaald dat het OVSE-secretariaat er zorg voor moet dragen dat de bijdrage van de Unie zichtbaar is in verhouding tot de omvang van die bijdrage.
4. De Commissie streeft ernaar om de in lid 3 bedoelde financieringsovereenkomst zo spoedig mogelijk na de inwerkingtreding van dit besluit te sluiten. De Commissie stelt de Raad in kennis van eventuele moeilijkheden die zich daarbij voordoen en van de datum van sluiting van de financieringsovereenkomst.
Artikel 4
De hoge vertegenwoordiger brengt aan de Raad verslag uit over de uitvoering van dit besluit, op basis van de geregelde verslagen die worden opgesteld door het OVSE-secretariaat. Deze verslagen vormen de basis voor de evaluatie door de Raad. De Commissie verstrekt informatie over de financiële aspecten van de in artikel 1, lid 2, bedoelde projecten.
Artikel 5
1. Dit besluit treedt in werking op de datum waarop het wordt vastgesteld.
2. Dit besluit vervalt 36 maanden na de sluiting van de in artikel 3, lid 3, bedoelde financieringsovereenkomst of zes maanden na de datum van de vaststelling ervan indien binnen die periode geen financieringsovereenkomst is gesloten.
Gedaan te Brussel, 31 juli 2019.
Voor de Raad
De Voorzitter
T. TUPPURAINEN
(1) Besluit (GBVB) 2017/809 van de Raad van 11 mei 2017 ter ondersteuning van de uitvoering van Resolutie 1540 (2004) van de Veiligheidsraad van de Verenigde Naties inzake de non-proliferatie van massavernietigingswapens en de overbrengingsmiddelen daarvoor (PB L 121 van 12.5.2017, blz. 39).
(2) Besluit (GBVB) 2017/1252 van de Raad van 11 juli 2017 ter ondersteuning van de aanscherping van de chemische veiligheid en beveiliging in Oekraïne in overeenstemming met de uitvoering van Resolutie 1540 (2004) van de Veiligheidsraad van de Verenigde Naties inzake de non-proliferatie van massavernietigingswapens en de overbrengingsmiddelen daarvoor (PB L 179 van 12.7.2017, blz. 8).
(3) Associatieovereenkomst tussen de Europese Unie en de Europese Gemeenschap voor Atoomenergie en hun lidstaten, enerzijds, en Oekraïne, anderzijds (PB L 161 van 29.5.2014, blz. 3).
BIJLAGE
Versterking van de biologische veiligheid en beveiliging in Oekraïne overeenkomstig Resolutie 1540 (2004) van de VN-Veiligheidsraad
1. Achtergrond
De Oekraïense wet- en regelgeving, die biologische wapens verbiedt, is gedetailleerd en uitgebreid. Een groot deel hiervan is echter achterhaald en voldoet niet aan internationale normen. Herziening en modernisering zijn daarom dringend geboden: de Oekraïense wet- en regelgeving moet meer op één lijn worden gebracht met mondiale normen.
Er bestaat geen kaderwet voor bioveiligheid en biobeveiliging in Oekraïne die een regeling geeft voor de instelling van een systeem voor bioveiligheid en biobeveiliging en het goede functioneren daarvan (waarbij bijvoorbeeld een centraal uitvoerend orgaan voor bioveiligheid en biobeveiliging wordt aangewezen dat de nodige expertise heeft om controles uit te voeren). Voorts bestaat er momenteel geen uitgebreide samenwerking tussen de betrokken ministeries en andere instanties en organisaties ter preventie van en in reactie op noodsituaties in verband met biologische bedreigingen.
Ook ontbreken er mechanismen waarmee de naleving van voorschriften voor biobeveiliging kan worden gecontroleerd in situaties waar met biologische agentia wordt gewerkt. Er is geen register van economische en niet-economische actoren die met gevaarlijke biologische agentia werken. Bovendien zijn zij niet wettelijk verplicht de relevante vergunningen te hebben om met deze agentia te werken. Er was wel een vergunningensysteem, maar dat is opgeheven, wat ertoe geleid heeft dat er thans geen melding wordt gemaakt van de niet-naleving, of toezicht wordt gehouden op het wél naleven, van voorschriften inzake bioveiligheid en biobeveiliging in microbiologische laboratoria - waarvan ook niet bekend is hoeveel er eigenlijk zijn. Een normatief document dat ooit bestond om de verrekening, het vervoer, de opslag en de overbrenging van gevaarlijke biologische materialen te regelen, werd ingetrokken. In de toepasselijke documenten wordt weinig aandacht geschonken aan overige aspecten van biobeveiliging, zoals de betrouwbaarheid van personeel en de bescherming van vertrouwelijke informatie.
Het groeitempo van de landbouwproductie, de biologische productie, transport en externe handelsbetrekkingen in de wereld van vandaag heeft ertoe geleid dat ook de mens- en diergeneeskunde vandaag de dag zich voor allerlei problemen geplaatst ziet die met name verband houden met het risico van proliferatie van biologische materialen, met name besmettelijke en parasitaire ziekten die veel voorkomen bij mens en dier.
Momenteel vormen de Afrikaanse varkenspest, de vogelgriep, mond-en-klauwzeer, en multiresistente bacteriële ziekteverwekkers de belangrijkste bedreigingen in verband met de biologische en voedselveiligheid in Oekraïne. Ook zijn er natuurlijke risico's, zoals uitbraken van antrax, hondsdolheid, klassieke varkenspest en tularemie. Het waarborgen van voedsel- en biologische veiligheid is een netelige kwestie die niet kan worden geregeld zonder betrouwbare methoden voor toezicht, voorspelling en vroegtijdige diagnose van nieuwe en economisch significante besmettingen van dieren, waaronder zoönotische infecties. De biologische en voedselveiligheid in Oekraïne kan alleen worden aangepakt door in de dier- en mensgeneeskunde en -diagnostiek ook fundamenteel onderzoek te doen in de genetica en de moleculaire biotechnologie.
In de meeste Oekraïense laboratoria voor biowetenschappen is het personeel ervaren in het omgaan met gevaarlijke biologische materialen. Moderne principes, praktijken en technieken inzake bioveiligheid en biobeveiliging, en gedragscodes voor een moderne, verantwoorde omgang bestaan echter nauwelijks in deze laboratoria. Een aantal laboratoria in de biowetenschappen beschikt over bescheiden moderne uitrusting, maar door gebrek aan operationele training, gebruikt het personeel aldaar deze uitrusting niet, of op een verkeerde manier. Daar komt bij dat in bestaande geavanceerde opleidingen voor bepaalde biowetenschappers niet alle bioveiligheid- en biobeveiligingissues aan bod komen. Om al die redenen komt het voor dat in laboratoria waar met gevaarlijke biologische materialen worden gewerkt, het niveau van de bioveiligheid en biobeveiliging minder wordt.
In reactie op deze situatie heeft de OVSE drie projecten opgesteld om de algehele biologische veiligheid en beveiliging in Oekraïne te verbeteren. Deze projecten zijn ontwikkeld in samenwerking met de relevante Oekraïense instanties. Het is de bedoeling dat deze projecten worden uitgevoerd volgens het actieplan van de Oekraïense regering voor de uitvoering van de associatieovereenkomst tussen de Europese Unie en Oekraïne.
De uitvoering moet geschieden met inachtneming van goede praktijken en lessen die geleerd zijn bij de huidige uitvoering van Besluit (GBVB) 2017/1252 ter ondersteuning van de aanscherping van de chemische veiligheid en beveiliging in Oekraïne.
2. Doel
Het algehele doel van het Raadsbesluit is steun verlenen aan OVSE-projecten ter verbetering van de biologische veiligheid en beveiliging in Oekraïne, overeenkomstig de verplichtingen die het land heeft uit hoofde van het BTWC, van Resolutie 1540 (2004) van de VN-Veiligheidsraad, en van de associatieovereenkomst tussen de EU en Oekraïne.
3. Beschrijving van de projecten
3.1. Harmonisatie van bestaande regels voor bioveiligheid en biobeveiliging in Oekraïne met internationale normen
3.1.1. Doel van het project
|
— |
Verbeteren van de basis in de wet- en regelgeving voor biologische veiligheid en beveiliging in Oekraïne, overeenkomstig de verplichtingen die het land heeft uit hoofde van Resolutie 1540 (2004) van de VN-Veiligheidsraad. Dit houdt in: het goedkeuren en implementeren van effectieve wetgeving die het iedere niet-statelijke actor verbiedt, biologische wapens en de overbrengingsmiddelen daarvoor te vervaardigen, te verwerven, in bezit te hebben, te ontwikkelen, te vervoeren, over te brengen of te gebruiken, met name indien dit geschiedt voor terroristische doeleinden. |
3.1.2. Beschrijving van het project
|
— |
De dringendste specifieke maatregelen ter verbetering van de wet- en regelgeving voor bioveiligheid en biobeveiliging, zullen rechtstreeks door het project worden gesteund, en behelzen onder meer:
|
3.1.3 Verwachte resultaten van het project
|
— |
Verbetering van het Oekraïense systeem voor bioveiligheid en biobeveiliging door het aanscherpen van het nationale wet- en regelgevingskader; |
|
— |
Betere samenwerking tussen de verschillende instanties die verantwoordelijk zijn voor bioveiligheid en biobeveiliging; |
|
— |
Duurzame zorg voor het systeem voor bioveiligheid en biobeveiliging in Oekraïne. |
3.1.4. Voor wie is het project bedoeld?
|
— |
Het Ministerie van Volksgezondheid. |
3.2. Duurzaam diergeneeskundig toezicht op BTP-ziekten in Oekraïne
3.2.1. Doel van het project
|
— |
Verbetering van de bioveiligheid en de biobeveiliging door de zorg voor gezondheid van mens en dier in Oekraïne te versterken, overeenkomstig de verplichtingen die het land heeft uit hoofde van Resolutie 1540 (2004) van de VN-Veiligheidsraad, en met name de handhaving van maatregelen voor binnenlandse controles om de proliferatie van biologische wapens en de overbrengingsmiddelen daarvoor te voorkomen, onder meer door controles op de materialen die hiervoor gebruikt worden. |
3.2.2. Beschrijving van het project
|
— |
Doeltreffend toezicht op mens- en dierziekten door het oprichten van een centrum voor gemeenschappelijk gebruik voor sequentie-analyse en genetische karakterisering van bepaalde agentia, en de instellingen die van het centrum gebruik zullen maken, voorzien van machines voor omgekeerde transcriptiepolymerasekettingreactie (reverse-transcription polymerase chain reaction - RT-PCR); |
|
— |
Het opstellen van interne, door Oekraïne zelf te ontwikkelen protocollen voor een snelle respons in noodsituaties, en het invoeren van snelle diagnoses van bijzonder gevaarlijke dierziekten door RT-PCR-diagnose-instrumenten voor de opsporing van bepaalde agentia te ontwikkelen, zoals vogelgriepverwekkers, ziekte van Newcastle, multiresistente tuberculose, nodulaire dermatose, tularemie, Afrikaanse varkenspest, klassieke varkenspest, mond-en-klauwzeer, brucellose, multiresistente salmonella's en antrax; |
|
— |
Ontwikkeling van veilige opslagplekken voor ziekteverwekkers in laboratoria en bewaarinstellingen door het opzetten van registratiedossiers voor RT-PCR-gebaseerde kits, onder meer voor zoönotische, virale en bacteriële ziekteverwekkers; |
|
— |
Eenduidig technisch beleid voor conformiteitsbeoordelingen door testlaboratoria, het winnen van vertrouwen op nationaal en internationaal niveau, zorgen voor voorwaarden voor de wederzijdse erkenning van prestaties en transparantie, en zorgen voor bewustmaking en deskundigheid op het gebied van biologische bescherming; |
|
— |
Vermogensopbouw voor de moleculaire diagnostiek van ziekten die door bijzonder gevaarlijke ziekteverwekkers worden veroorzaakt. |
3.2.3. Verwachte resultaten van het project
|
— |
Een grotere nationale capaciteit voor diergeneeskundige bewaking en prognose; |
|
— |
Ontwikkeling van doeltreffende nationale diagnose- en toezichtinstrumenten, die gebaseerd zijn op RT-PCR-instrumenten en isotherme PCR-instrumenten (O&O, validering en implementatie in de laboratoria); |
|
— |
Verrichten van doeltreffende monitoring van dierziekten (met inbegrip van zoönotische ziekten); |
|
— |
Creëren van personele middelen voor de moleculaire diagnostiek van ziekten die door bijzonder gevaarlijke ziekteverwekkers worden veroorzaakt (scholing van laboratoria in PCR-technieken). |
3.2.4. Voor wie is het project bedoeld?
|
— |
Oekraïense dienst voor voedselveiligheid en consumentenbescherming |
|
— |
Steunontvanger: Nationaal wetenschappelijk instituut voor experimentele en klinische diergeneeskunde (Charkov, Oekraïne) |
3.3. Bewustmaking, onderwijs en opleiding voor biowetenschappers op het gebied van bioveiligheid en -beveiliging
3.3.1. Doel van het project
|
— |
Verbeteren van de bioveiligheid, -beveiliging en -ethiek in Oekraïne door bewustmaking onder biowetenschappers overeenkomstig de verplichtingen uit hoofde van Resolutie 1540 (2004) van de VN-Veiligheidsraad, onder andere de handhaving van doeltreffende binnenlandse maatregelen om de proliferatie van biologische wapens en de overbrengingsmiddelen daarvoor te voorkomen. |
3.3.2. Beschrijving van het project
|
— |
Oprichting van een opleidingsteam waarvan de leden van verschillende Oekraïense biowetenschapscentra afkomstig zijn. Het team moet up-to-date kennis delen over de beginselen van bioveiligheid, -beveiliging en bio-ethiek, en over goede praktijken, en -technieken en -methoden voor het omgaan met biologische gevaren in laboratoria; |
|
— |
Betere middelen voor kennisdeling en bewustmaking over bioveiligheid, -beveiliging en -ethiek onder docenten, studenten en onderzoekers in de biowetenschappen en andere betrokken belanghebbenden, rekening houdend met project P633 “Onderwijs en bewustmaking in Oekraïne” van het Oekraïens Centrum voor Wetenschap en Technologie; |
|
— |
Opleidingscapaciteiten behouden na afloop van het project. |
3.3.3. Verwachte resultaten van het project
|
— |
Groter besef van het belang van bioveiligheid en -beveiliging onder nationale en lokale betrokkenen; |
|
— |
Biowetenschappers zullen veiliger kunnen omgaan met gevaarlijke biologische materialen; |
|
— |
Oekraïense biowetenschappers zullen het risico op verkeerd gebruik van materialen en apparatuur tijdens onderzoeken beter kunnen beperken, evenals het verkeerde gebruik van hun kennis en van resultaten; |
|
— |
Oprichting van een sterk opleidingsteam voor bioveiligheid en -beveiliging voor biowetenschappers; |
|
— |
Betere en duurzame middelen voor kennisdeling op het gebied van bioveiligheid, biobeveiliging en bio-ethiek. |
3.4. Voor wie is het project bedoeld?
|
— |
Het Ministerie van Volksgezondheid |
4. Administratieve ondersteuning voor de uitvoering van de projecten
Speciaal personeel in het OVSE-secretariaat en in het kantoor van de projectcoördinator van de OVSE in Oekraïne zal de tenuitvoerlegging van de in punt 3 vermelde projectactiviteiten coördineren en beheren, met het oog op het nader ontwikkelen van het kader voor samenwerking tussen de Oekraïense partners, onder meer via de ontwikkeling van nieuwe projectvoorstellen en nationale maatregelen daaromtrent.
Het ondersteunend personeel zal de volgende taken uitvoeren:
|
— |
Projectbeheer in alle fasen van de projectcyclus; |
|
— |
Dagelijkse financiële controle van de projecten; |
|
— |
Bieden van technische en juridische deskundigheid, ondersteunen van grotere aankopen, betrekken van andere internationale organisaties, zorgen voor kwaliteitsborging en kwaliteitscontrole van de resultaten van de goedgekeurde projecten, verslagleggen aan de Europese Unie. |
5. Duur
De totale looptijd van de projecten wordt op 36 maanden geraamd.
6. Technische uitvoeringsinstantie
De technische uitvoering van dit besluit wordt toevertrouwd aan het Centrum voor conflictpreventie van het OVSE-secretariaat en de OVSE-projectcoördinator in Oekraïne. De OVSE zal de activiteiten in het kader van dit besluit uitvoeren in samenwerking met andere internationale organisaties en agentschappen, vooral om voor effectieve synergie te zorgen en dubbel werk te voorkomen.
7. Verslaglegging
Het OVSE-secretariaat zal regelmatig verslagen opstellen, evenals na afloop van elk van de beschreven activiteiten. De verslagen zullen uiterlijk zes weken na afloop van de betrokken activiteiten bij de Europese Unie worden ingediend.
8. Stuurcomité
Het stuurcomité voor deze projecten bestaat uit een vertegenwoordiger van de hoge vertegenwoordiger en een vertegenwoordiger van het uitvoeringsorgaan vermeld in punt 6 van deze bijlage. Het stuurcomité zal de uitvoering van dit besluit regelmatig en ten minste elk half jaar evalueren, onder meer met behulp van elektronische communicatiemiddelen.
9. Totale geraamde kosten van de projecten en financiële bijdrage van de Europese Unie
De totale kosten van de projecten bedragen 1 913 900 EUR.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/36 |
BESLUIT (GBVB) 2019/1297 VAN DE RAAD
van 31 juli 2019
tot wijziging van Besluit (GBVB) 2016/2382 tot oprichting van een Europese Veiligheids- en Defensieacademie (EVDA)
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de Europese Unie, en met name artikel 28, lid 1, artikel 42, lid 4, en artikel 43, lid 2,
Gezien het voorstel van de hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid,
Overwegende hetgeen volgt:
|
(1) |
De Raad heeft op 21 december 2016 Besluit (GBVB) 2016/2382 (1) vastgesteld, waarbij een Europese Veiligheids- en defensieacademie (EVDA) werd opgericht. |
|
(2) |
De Raad heeft op 14 mei 2018 Besluit (GBVB) 2018/712 (2) vastgesteld, waarbij de EVDA werd opgedragen een platform voor onderwijs, opleiding, evaluatie en oefeningen op cybergebied (Cyber Education, Training, Evaluation and Exercise platform, of ETEE-platform op cybergebied) op te zetten, daarbij wijzend op de behoefte aan complementariteit met andere Unie-inspanningen en -initiatieven. |
|
(3) |
De Raad heeft op 6 november 2018 Besluit (GBVB) 2018/1655 (3) vastgesteld, waarbij Besluit (GBVB) 2016/2382 werd gewijzigd en waarbij een financieel referentiebedrag voor de periode van 1 januari 2019 tot en met 31 december 2019 werd vastgesteld. |
|
(4) |
Het Politiek en Veiligheidscomité heeft op 20 september 2018 het mandaat vastgesteld voor de EU-groep voor civiele opleiding, een speciale samenstelling van het Comité voor de civiele aspecten van crisisbeheersing. |
|
(5) |
De lidstaten hebben op 15 maart 2019, tijdens de vergadering van de EU-groep voor civiele opleiding, erop aangedrongen dat de civiele opleidingscoördinatoren financiële ondersteuning door de Unie moet worden geboden. |
|
(6) |
De stuurgroep van de EVDA heeft op 3 juni 2019 besloten dat de EVDA de reis- en verblijfskosten van de civiele opleidingscoördinatoren moet regelen en beheren. |
|
(7) |
Besluit (GBVB) 2016/2382 moet derhalve dienovereenkomstig worden gewijzigd, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
In artikel 4, lid 3, van Besluit (GBVB) 2016/2382 wordt het volgende punt toegevoegd:
|
“j) |
het Comité voor de civiele aspecten van crisisbeheersing en de EU-groep voor civiele opleiding ondersteunen door het regelen en beheren van de reis- en verblijfskosten in verband met de activiteiten van de civiele opleidingscoördinatoren.”. |
Artikel 2
Dit besluit treedt in werking op de datum waarop het wordt vastgesteld.
Gedaan te Brussel, 31 juli 2019.
Voor de Raad
De voorzitter
T. TUPPURAINEN
(1) Besluit (GBVB) 2016/2382 van de Raad van 21 december 2016 tot oprichting van een Europese Veiligheids- en defensieacademie (EVDA) en houdende intrekking van Besluit 2013/189/GBVB (PB L 352 van 23.12.2016, blz. 60).
(2) Besluit (GBVB) 2018/712 van de Raad van 14 mei 2018 tot wijziging van Besluit (GBVB) 2016/2382 tot oprichting van een Europese Veiligheids- en defensieacademie (EVDA) (PB L 119 van 15.5.2018, blz. 37).
(3) Besluit (GBVB) 2018/1655 van de Raad van 6 november 2018 tot wijziging van Besluit (GBVB) 2016/2382 tot oprichting van een Europese Veiligheids- en defensieacademie (EVDA) (PB L 276 van 7.11.2018, blz. 9).
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/37 |
BESLUIT (GBVB) 2019/1298 VAN DE RAAD
van 31 juli 2019
ter ondersteuning van de dialoog en de samenwerking tussen Afrika, China en Europa over het voorkomen van de omleiding van wapens en munitie in Afrika
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de Europese Unie, en met name artikel 28, lid 1, en artikel 31, lid 1,
Gezien het voorstel van de hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid,
Overwegende hetgeen volgt:
|
(1) |
Het wapenhandelsverdrag (WHV) is op 24 december 2014 in werking getreden en alle lidstaten zijn daar partij bij. Met het WHV wordt beoogd de hoogst mogelijke gemeenschappelijke internationale normen vast te stellen om de legale handel in conventionele wapens te reguleren en de illegale handel in conventionele wapens te voorkomen en uit te bannen en de omleiding van die wapens te voorkomen. |
|
(2) |
Op 19 november 2018 heeft de Raad de EU-strategie tegen illegale vuurwapens, handvuurwapens en lichte wapens en munitie daarvoor, getiteld “Wapens beveiligen, burgers beschermen” aangenomen (de “strategie”). Hoofddoel van de strategie is de volledige en effectieve uitvoering van het VN-actieprogramma ter voorkoming, bestrijding en uitbanning van de illegale handel in handvuurwapens en lichte wapens uit 2001 in al zijn aspecten. In de strategie wordt verklaard dat de EU verantwoorde en doeltreffende wapenuitvoercontrole in de buurlanden van de EU zal blijven bevorderen en dat zij de universalisering en uitvoering van het WHV zal blijven ondersteunen. In de strategie staat ook dat de EU steun zal blijven verlenen aan de Afrikaanse Unie en aan regionale economische gemeenschappen in hun strijd tegen de illegale handel in handvuurwapens en lichte wapens en de munitie daarvoor. |
|
(3) |
In januari 2017 heeft de Algemene Vergadering van de Afrikaanse Unie tijdens de 28e gewone zitting haar goedkeuring gehecht aan de “African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020”, waarin de lidstaten van de Afrikaanse Unie toezeggen de illegale instroom en verspreiding van illegale wapens aan banden te leggen, te verhinderen dat rebellen/opstandelingen toegang krijgen tot wapens, en de banden met leveranciers en ontvangers van illegale wapens door te snijden, onder meer door het opleggen van verboden, in overeenstemming met het WHV. |
|
(4) |
In zijn conclusies over een EU-strategie voor China van 18 juli 2016 steunt de Raad de totstandbrenging van een reguliere en inhoudelijke dialoog van de EU met China om samen met de lidstaten te zoeken naar een groter gemeenschappelijk draagvlak inzake ontwapening, non-proliferatie, terrorismebestrijding, migratie en cyberveiligheid. |
|
(5) |
Op 30 juni 2018 heeft de derde conferentie van de Verenigde Naties over de voortgang van de uitvoering van het actieprogramma van de Verenigde Naties tegen illegale handvuurwapens en lichte wapens een slotdocument aangenomen waarin de landen opnieuw toezeggen de omleiding van handvuurwapens en lichte wapens te voorkomen en te bestrijden. De landen verklaren opnieuw bereid te zijn de internationale samenwerking voort te zetten en de regionale samenwerking te versterken door verbetering van coördinatie, overleg, informatie-uitwisseling en operationele samenwerking, met de betrokkenheid van de bevoegde regionale en subregionale organisaties en van de voor rechtshandhaving, grenscontrole en uitvoer- en invoervergunningen bevoegde autoriteiten. De landen zeggen ook toe om, overeenkomstig hun nationale wettelijke kaders en veiligheidsvoorschriften, ervaringen, geleerde lessen en beste praktijken uit te wisselen met betrekking tot de controle op de uitvoer, invoer en doorvoer van handvuurwapens en lichte wapens, met inbegrip van certificeringsprocessen en eindgebruikerscertificaten. |
|
(6) |
In de Agenda 2030 voor duurzame ontwikkeling wordt bevestigd dat de bestrijding van de illegale handel in handvuurwapens en lichte wapens noodzakelijk is voor de verwezenlijking van vele duurzameontwikkelingsdoelstellingen, waaronder die met betrekking tot vrede, justitie en sterke instellingen, armoedebestrijding, economische groei, gezondheid, gendergelijkheid en veilige steden. Daarom hebben alle staten met duurzameontwikkelingsdoelstelling 16.4 toegezegd de illegale stromen van geldmiddelen en wapens aanzienlijk te verminderen. |
|
(7) |
Op 27 februari 2012 heeft de Raad Besluit 2012/121/GBVB (1) ter ondersteuning van activiteiten ter bevordering van de EU-China-Afrika-dialoog en de samenwerking inzake conventionele wapenbeheersing vastgesteld. Dat project werd met succes door Saferworld uitgevoerd, maar er zijn meer inspanningen op dit gebied nodig om de in dat besluit gestelde doelen te bereiken. |
|
(8) |
Sinds 2008 heeft de Raad elf besluiten vastgesteld ter ondersteuning van het bereiken van een verantwoordelijke controle op de uitvoer van wapens overeenkomstig het WHV en Gemeenschappelijk Standpunt 2008/944/GBVB van de Raad (2), maar de betrokkenheid van China op dit gebied is beperkt gebleven, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
1. Doel van dit besluit is bij te dragen tot het voorkomen en het bestrijden van de omleiding van wapens en munitie in Afrika.
2. Op grond van lid 1 steunt de Unie de volgende doelstellingen:
|
a) |
belanghebbenden in Afrika, China en de Unie ervan bewust maken dat de illegale stroom van wapens, met name handvuurwapens en lichte wapens (SALW) en munitie daarvoor, aan onbevoegde actoren, de onveiligheid en het geweld in verschillende delen van Afrika sterk doet toenemen, waardoor de sociale cohesie, de openbare veiligheid, de sociaaleconomische ontwikkeling en de efficiënte werking van overheidsinstellingen worden ondermijnd; |
|
b) |
verantwoordingsplicht en verantwoordelijkheid bevorderen met betrekking tot de legale wapenhandel, mede door belanghebbenden in Afrika, China en de Unie te tonen hoe effectieve controle op wapenuitvoer het risico van omleiding van wapens naar de illegale markt kan helpen beperken. |
3. Om deze doelstellingen te bereiken, ondersteunt dit besluit de oprichting en ontwikkeling van een gezamenlijke, niet-gouvernementele werkgroep van deskundigen inzake beheersing van conventionele wapens tussen Afrika, China en Europa (de “deskundigenwerkgroep”), waarvan de belangrijkste taken zullen bestaan in het vergroten van het bewustzijn en de betrokkenheid van en het nemen van maatregelen door de beleidsgemeenschappen in Afrika, China en de Unie, en het intensiveren van de regionale en internationale samenwerking om de omleiding van wapens en munitie in Afrika te voorkomen.
4. De verwachte resultaten van dit besluit zijn de volgende:
|
a) |
een beter inzicht in de gevolgen van de omleiding en het misbruik van wapens in Afrika door gezamenlijk onderzoek en actiegerichte analyse door onderzoekers en academici uit Afrika, China en de Unie, met aanbevelingen voor specifieke door China gesteunde projecten; |
|
b) |
meer bewustzijn bij de belanghebbenden in Afrika, China en de Unie van de rol van effectieve controle op de wapenuitvoer bij het beperken van het risico op omleiding en de negatieve gevolgen van illegale wapens en munitie in Afrika; |
|
c) |
een grotere bijdrage van China aan internationale en regionale initiatieven ter zake, waaronder het Silencing the Guns in Africa by 2020-initiatief van de Afrikaanse Unie en de uitvoering van het WHV; |
|
d) |
het ter sprake brengen van de controle van handvuurwapens in het Forum voor Chinees-Afrikaanse samenwerking (FOCAC); |
|
e) |
het opzetten van nieuwe fora met deskundigen van de overheid, het maatschappelijk middenveld, het bedrijfsleven en de academische wereld van Afrika, China en de Unie die zullen bijdragen aan de strategische dialoog op hoog niveau tussen de EU en China; |
5. De directe begunstigden van de projecten zullen naar schatting 500 actoren uit de beleidsgemeenschap in Afrika, China en de Unie zijn, waaronder niet-gouvernementele organisaties, denktanks, vertegenwoordigers van het bedrijfsleven, voor beheersing van conventionele wapens verantwoordelijke overheidsfunctionarissen en parlementariërs. De indirecte begunstigden zijn de bevolking, gemeenschappen, groepen en individuen in Afrika die te lijden hebben onder de proliferatie van illegale wapens en munitie op het continent.
6. Een nadere omschrijving van het project is opgenomen in de bijlage bij dit besluit.
Artikel 2
1. De hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid (“HV”) is belast met de uitvoering van dit besluit.
2. De niet-gouvernementele organisatie Saferworld is belast met de technische uitvoering van het in artikel 1 bedoelde project.
3. Saferworld voert zijn taken uit onder de verantwoordelijkheid van de HV. Daartoe treft de HV de nodige regelingen met Saferworld.
Artikel 3
1. Het financieel referentiebedrag voor de uitvoering van het in artikel 1 bedoelde, door de EU gefinancierde project bedraagt 994 007 EUR.
2. Voor het beheer van de uit het in lid 1 genoemde referentiebedrag gefinancierde uitgaven gelden de procedures en voorschriften die van toepassing zijn op de begroting van de Unie.
3. De Commissie ziet erop toe dat de in lid 1 bedoelde uitgaven correct worden beheerd. Daartoe sluit zij de noodzakelijke financieringsovereenkomst met Saferworld. In de financieringsovereenkomst wordt bepaald dat Saferworld er zorg voor moet dragen dat de bijdrage van de Unie zichtbaar is in een mate die overeenstemt met haar omvang.
4. De Commissie streeft ernaar om de in lid 3 bedoelde financieringsovereenkomst zo spoedig mogelijk na de inwerkingtreding van dit besluit te sluiten. Zij stelt de Raad in kennis van eventuele moeilijkheden in dat verband, en van de datum van sluiting van de financieringsovereenkomst.
Artikel 4
1. De HV brengt verslag uit aan de Raad over de uitvoering van dit besluit, op basis van regelmatige kwartaalverslagen die door Saferworld worden opgesteld. Deze verslagen vormen de basis voor de evaluatie door de Raad.
2. De Commissie brengt verslag uit over de financiële aspecten van het in artikel 1 bedoelde project.
Artikel 5
1. Dit besluit treedt in werking op de datum waarop het wordt vastgesteld.
2. Het besluit verstrijkt 36 maanden na de datum van sluiting van de in artikel 3, lid 3, bedoelde financieringsovereenkomst. Het verstrijkt echter zes maanden na de datum van inwerkingtreding indien er binnen die termijn nog geen overeenkomst is gesloten.
Gedaan te Brussel, 31 juli 2019.
Voor de Raad
De Voorzitter
T. TUPPURAINEN
(1) Besluit 2012/121/GBVB van de Raad van 27 februari 2012 betreffende de ondersteuning van activiteiten ter bevordering van de EU-China-Afrika-dialoog en de samenwerking inzake conventionele wapenbeheersing (PB L 54 van 28.2.2012, blz. 8).
(2) Gemeenschappelijk Standpunt 2008/944/GBVB van de Raad van 8 december 2008 tot vaststelling van gemeenschappelijke voorschriften voor de controle op de uitvoer van militaire goederen en technologie (PB L 335 van 13.12.2008, blz. 99).
BIJLAGE
DIALOOG EN SAMENWERKING TUSSEN AFRIKA, CHINA EN EUROPA OVER HET VOORKOMEN VAN DE OMLEIDING VAN WAPENS EN MUNITIE IN AFRIKA
1. Beschrijving van project en activiteiten
Het project bestaat uit twee hoofdfasen, die hierna worden samengevat in hoofdstuk 1.1 over de oprichting van een deskundigenwerkgroep en hoofdstuk 1.2 over het leggen van contacten met belanghebbenden in Afrika, China en de Unie, ter bevordering van maatregelen ter voorkoming van de omleiding van wapens en munitie in Afrika.
1.1. Fase 1: Oprichting en ontwikkeling van een gezamenlijke niet-gouvernementele werkgroep van deskundigen uit Afrika, China en Europa op het gebied van de preventie van omleiding van wapens en munitie in Afrika.
1.1.1. Doelstellingen
Oprichten van een gezamenlijke niet-gouvernementele Afrikaans-Chinees-Europese deskundigenwerkgroep, die Afrikaanse, Chinese en uit de Unie afkomstige niet-gouvernementele deskundigen bijeenbrengt, die zich bezighoudt met het leggen van contacten met de belanghebbenden in Afrika, China en de Unie, en die de trilaterale dialoog en samenwerking ter voorkoming van omleiding van wapens en munitie in Afrika zal ondersteunen, met de volgende doelen:
|
a) |
verduidelijken wat de beveiligings-, sociaal-economische en humanitaire kosten van de omleiding van wapens, met name handvuurwapens en lichte wapens en munitie daarvoor, in Afrika zijn en aantonen hoe een verbeterde controle op de overdracht van wapens, ook aan de aanbodzijde, het risico van omleiding van wapens naar onbevoegde partijen kan helpen verminderen; |
|
b) |
bouwstenen leveren voor de strategische dialoog op hoog niveau tussen de EU en China, met name over samenwerking op het gebied van veiligheid en wapenbeheersing in Afrika; |
|
c) |
delen van informatie, ideeën, expertise en onderzoek onder de leden en beoordelen van de effectiviteit van het huidige beleid en de huidige initiatieven; |
|
d) |
actief benaderen van en aanbevelingen doen aan belanghebbenden op overheidsniveau. De Afrikaanse en Chinese ambtenaren, en die van de Unie en de lidstaten, zullen worden uitgenodigd om de werkzaamheden van de deskundigenwerkgroep te observeren en ertoe bij te dragen. |
1.1.2. Activiteiten
Activiteiten die moeten worden ondersteund bij de uitvoering van de in fase 1 genoemde taken omvatten:
|
a) |
door Saferworld in kaart laten brengen en ontwikkelen van een betrokkenheidsbenadering ten aanzien van belangrijke partners en belanghebbenden bij overheden, het bedrijfsleven, maatschappelijke organisaties, academische instellingen, multilaterale agentschappen, alsook actoren op regionaal en gemeenschapsniveau, die van cruciaal belang zullen zijn voor het welslagen en de duurzaamheid van het project; |
|
b) |
voortbouwend op de resultaten van het uit hoofde van Besluit 2012/121/GBVB ondersteund Unie-project: i) organiseren van maximaal 20 voorbereidende en vervolgvergaderingen in Afrika, China en Europa om het project beter bekend te maken, met inbegrip van de structuur en het tijdschema, en zorgen voor de ondersteuning van bevoegde autoriteiten ii) inventariseren van de belangrijkste deskundigen in Afrika, China en de Unie die bij de deskundigenwerkgroep zullen worden betrokken; iii) ontwikkelen van gedetailleerde werkplannen voor het instellen en operationeel maken van de deskundigenwerkgroep; iv) oprichten van een team voor projectcoördinatie; v) afbakenen en verdelen van de verantwoordelijkheden van het team; en vi) monitoren en evalueren van de vooruitgang bij de uitvoering van de activiteiten. |
|
c) |
instellen van de deskundigenwerkgroep die de trilaterale dialoog en samenwerking ondersteunt. De deskundigenwerkgroep zal naar verwachting negen Afrikaanse, Chinese en Europese deskundigen op het gebied van beheersing van handvuurwapens omvatten die afkomstig zijn van denktanks, onderzoekscentra en academische instellingen, en zullen worden gekozen voor deelname aan het project op basis van hun belangstellingsvelden, deskundigheid en bekwaamheid; |
|
d) |
opzetten van een website van de deskundigenwerkgroep, die zal fungeren als onlineplatform voor de openbare interface van de deskundigenwerkgroep; |
|
e) |
drie vergaderingen van de deskundigenwerkgroep (één in Afrika, één in China en één in Europa), om interactie en gedeeld leren tussen leden van de groep en ambtenaren uit Afrika, China, de Unie en de lidstaten mogelijk te maken, en om sturing te geven aan de uitvoering van bewustmakings- en onderzoeksactiviteiten. |
1.1.3. Resultaten
De deskundigenwerkgroep wordt de hoeksteen voor de dialoog die wordt bevorderd door dit besluit, en zij speelt een cruciale rol bij het samenbrengen van Afrikaanse, Chinese en Europese deskundigen op het gebied van beheersing van handvuurwapens, helpt de kloof tussen de onderzoeks- en de beleidsgemeenschap te dichten en zorgt ervoor dat de output van het project daadwerkelijk wordt doorgegeven aan de regeringen in Afrika, China, Europa en aan de instellingen van de Unie.
1.2. Fase 2: Leggen van contacten met belanghebbenden in Afrika, China en de Unie om omleiding te voorkomen en illegaal bezit, illegale overdracht en illegaal gebruik van wapens en munitie in Afrika te bestrijden.
1.2.1 Doelstellingen
|
a) |
terugdringen van de omleiding van wapens en munitie op het Afrikaanse continent, om zo de bedreigingen voor de menselijke veiligheid te verminderen en bij te dragen tot een vreedzaam en veilig klimaat voor Afrikaanse burgers en ontwikkeling te bevorderen; |
|
b) |
ondersteunen van Afrikaanse staten bij de uitvoering van de Master Roadmap of Practical Steps to Silence the Guns in Africa by 2020 van de Afrikaanse Unie en uitvoeren van de betreffende strategieën van de regionale economische gemeenschappen; |
|
c) |
bevorderen van synergie met de uitvoering van andere internationale en regionale initiatieven op dit vlak, waaronder het WHV, het VN-actieprogramma inzake SALW en het VN-protocol inzake vuurwapens; |
|
d) |
coördineren en creëren van synergie met door de Unie gesteunde initiatieven in Afrika op dit gebied, met inbegrip van de door de EU gesteunde projecten voor de controle op wapenuitvoer en toenaderingsprojecten in het kader van het WHV, ondersteund door Besluiten (GBVB) 2018/299 (1) en (GBVB) 2018/101 (2) van de Raad, en het door Besluit (GBVB) 2017/2283 (3) van de Raad ondersteunde iTrace-project van Conflict Armament Research Ltd. (CAR); |
|
e) |
deelnemen aan de meerjarige juridische evaluatie die momenteel in China aan de gang is, en die zal leiden tot de goedkeuring van een nieuwe wet inzake uitvoercontrole; |
|
f) |
ondersteunen van werkzaamheden inzake de beheersing van handvuurwapens op communautair niveau, door mensen aan de basis te bereiken en hen de gelegenheid te bieden om zich uit te drukken, en bieden van manieren om de menselijke kosten van illegale wapens en munitie te verminderen; |
|
g) |
ondersteunen van gezamenlijke onderzoeks- en actiegerichte analyses door deskundigen uit Afrika, China en de Unie over de problemen in verband met de omleiding en het misbruik van wapens en munitie in Afrika, met aanbevelingen voor specifieke acties om de gevaren in verband met illegale wapens en munitie aan te pakken en te verminderen. Daarbij kan het onder meer, maar niet uitsluitend, gaan om: uitvoercontrole, veilige en beveiligde opslag van wapens en munitie, vernietiging van overtollige wapens en munitie, markering, registratie en tracering, met inbegrip van samenwerking met missies van de Verenigde Naties die zijn belast met het identificeren en traceren van illegale wapens, monitoring en handhaving van wapenembargo's, en de uitwisseling van operationele informatie om de netwerken van wapenhandelaars te verstoren. |
1.2.2 Activiteiten
Activiteiten die moeten worden ondersteund bij de uitvoering van de in fase 2 genoemde taken omvatten:
|
a) |
twee seminars (één in Afrika en één in China) over “Het bevorderen van de verantwoordingsplicht en de verantwoordelijkheid met betrekking tot de wapenhandel en het voorkomen van de omleiding van wapens en munitie naar onbevoegde en destabiliserende actoren in Afrika” onder de auspiciën van de deskundigenwerkgroep, waarvan de leden Saferworld zullen assisteren en ook aan de evenementen zullen deelnemen; |
|
b) |
productie en verspreiding van een voorlichtingsdocument over “Bestrijding van de verspreiding van illegale wapens en munitie in Afrika: aanbevelingen aan het FOCAC”, voorafgaand aan de bijeenkomst van FOCAC in 2021; |
|
c) |
productie en verspreiding van een briefingdocument in het Engels en Chinees over “Proliferatie van illegale wapens en munitie in Afrika: wat kunnen de staten die optreden als leverancier doen om het risico op omleiding te beperken?”; |
|
d) |
drie bezoeken met het oog op veldonderzoek door de deskundigenwerkgroep in drie geselecteerde Afrikaanse landen met een duur van telkens tien dagen om problemen in verband met de proliferatie en onbeheerste verspreiding van illegale wapens en illegale munitie aan te pakken (met inbegrip van de complexiteit van omleiding uit toegestane overdrachten of toegestaan bezit; en problematische grensoverschrijdende fenomenen, zoals veediefstal, die worden gevoed door de verspreiding van illegale wapens en munitie); |
|
e) |
opstellen van drie onderzoeksdocumenten (in het Chinees, Engels en Frans) door de deskundigenwerkgroep over het veldonderzoek, met aanbevelingen voor praktische maatregelen om illegale wapens en munitie aan te pakken, met bijzondere aandacht voor de rol van wapenleveranciers in Afrika, China en de Unie bij het verminderen van het risico op omleiding; |
|
f) |
ongeveer 20 bilaterale bijeenkomsten met ambtenaren uit Afrika, China en de lidstaten om de aanbevelingen van de deskundigenwerkgroep te delen en daadwerkelijk mee te delen, om samenwerkingsprojecten bekendheid te geven op ambtelijk niveau en er politieke steun voor te verzamelen; |
|
g) |
opstellen en verspreiden van één onderzoeksrapport (in het Chinees, Engels en Frans) over de verspreiding van illegale wapens en munitie in Afrika, waarin de effectiviteit van de huidige acties zal worden beoordeeld en aanbevelingen zullen worden gedaan voor uitvoerbare projecten die zullen helpen illegale wapens en munitie beter aan te pakken, en zo de schadelijke gevolgen ervan te beperken en bij te dragen tot een betere nationale, regionale en internationale vrede en veiligheid. In het verslag zal bijzondere aandacht worden besteed aan de rol van wapenleveranciers in Afrika, China en de Unie bij het verminderen van het risico van omleiding van wapens in Afrika; |
|
h) |
organiseren van een afsluitend seminar in China om de aanbevelingen van het onderzoeks- en dialoogproces mee te delen en de voordelen van de samenwerking tussen Afrika, China en de Unie en de lidstaten en de deelname aan gezamenlijke activiteiten aan te tonen, en processen in te voeren ter ondersteuning van de dialoog in de toekomst. |
1.2.3 Resultaten
|
— |
Meer bewustzijn, kennis en inzicht bij 500 actoren van de beleidsgemeenschap uit Afrika, China en de Unie, inclusief onder ambtenaren die belast zijn met de controle op de uitvoer van conventionele wapens, academici, parlementariërs, niet-gouvernementele organisaties, vertegenwoordigers van het bedrijfsleven en journalisten, inzake de factoren die bijdragen tot de ruime beschikbaarheid van illegale wapens en munitie in Afrika, de belangrijkste kwesties en effecten op de grond en de rol en verantwoordelijkheid van staten die optreden als wapenleverancier om het risico op omleiding bij de overdracht van wapens te beperken. |
|
— |
Een betere dialoog, interactie en samenwerking op het gebied van het voorkomen en bestrijden van omleiding van wapens en munitie tussen 60 ambtenaren en actoren uit het maatschappelijk middenveld uit Afrika, China, de Unie en de lidstaten, onder meer door middel van de vaststelling van gebieden voor praktische samenwerking tussen Afrika, China en de Unie, hetgeen zal bijdragen tot een vermindering van de omleiding van wapens en munitie in Afrika. |
|
— |
Vermindering van het aantal gevallen dat wapens en munitie worden omgeleid naar onbevoegde en destabiliserende actoren in Afrika. |
|
— |
Steun voor de uitvoering van de “Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020” van de Afrikaanse Unie en het VN-actieprogramma ter bestrijding van illegale SALW in Afrika. |
|
— |
Grotere afstemming van de nationale normen en regelgeving in Afrika en China op de internationale normen voor controle op de uitvoer van wapens, zoals het WHV, om het risico op omleiding bij de wapenhandel te beperken. |
|
— |
De terugkeer van wapenbeheersing op de agenda van het FOCAC als cruciaal punt voor de intensivering van de dialoog en de samenwerking tussen Afrika en China ter voorkoming van de omleiding van wapens naar onbevoegde en destabiliserende actoren in Afrika. |
|
— |
Het opstellen van een op feiten gebaseerde analyse van het probleem van illegale wapens en munitie in Afrika, uitgaande van gezamenlijk veldonderzoek door Afrikaanse, Chinese en Unie-deskundigen, die zal bijdragen tot een beter, alomvattend begrip van het omleiden en opnieuw overdragen van wapens naar onbevoegde en destabiliserende actoren in Afrika, en het bieden van een sterkere gemeenschappelijke basis voor Afrika, China en de Unie om samen het probleem efficiënter aan te pakken. |
|
— |
De identificatie van praktische middelen om de dreigingen in verband met de verspreiding van illegale wapens en munitie aan te pakken en tegemoet te komen aan de behoefte aan collectieve en coöperatieve internationale antwoorden, in overeenstemming met belangrijke internationale en regionale verbintenissen en beleidsinitiatieven, zoals het VN-actieprogramma ter bestrijding van illegale SALW, het internationaal traceringsinstrument, de Agenda 2030 voor duurzame ontwikkeling, het Wapenhandelsverdrag, de strategie van de Afrikaanse Unie ter beheersing van illegale proliferatie en illegaal verkeer van en illegale handel in handvuurwapens en lichte wapens, de strategische agenda voor samenwerking tussen de EU en China voor 2020, en de EU-strategie tegen illegale vuurwapens, handvuurwapens en lichte wapens en munitie daarvoor en de betreffende strategieën en actieplannen van de regionale economische gemeenschappen. |
|
— |
Verhoogde capaciteit van Afrikaanse nationale autoriteiten en regionale organisaties om specifieke behoeften aan technische bijstand en geschikte platforms in kaart brengen voor hun dialoog met China en de EU zodat middelen kunnen worden aangetrokken om aan die behoeften tegemoet te komen. |
2. Deelnemers en plaatsen van de seminars/workshops en de openings- en sluitingsevenementen
Tenzij anders vermeld in de tekst van deze bijlage zal Saferworld potentiële deelnemers en locaties voor seminars en andere evenementen in het kader van het project voorstellen, die vervolgens worden goedgekeurd door de HV, in overleg met de bevoegde Raadsinstanties.
3. Gender
Saferworld zal het genderaspect integreren in strategieën en activiteiten die verband houden met de uitvoering van dit project, zodat vrouwen en mannen invloed uitoefenen op en deelnemen aan het project en evenveel baat hebben bij het project. Voor zover mogelijk zal Saferworld projectpartners aanmoedigen om seksegemengde delegaties voor te stellen om deel te nemen aan projectactiviteiten en ervoor te zorgen dat het gendereffect van illegale wapens en munitie wordt opgenomen in alle seminars en studiebezoeken.
4. Partners
Het is de bedoeling dat de belangrijkste projectpartners de China Arms Control and Disarmament Association en het Security Research and Information Centre (Kenia) zullen zijn.
5. Stuurcomité
Het stuurcomité voor dit project zal bestaan uit een vertegenwoordiger van de HV, van de Commissie en van Saferworld. Het Stuurcomité zal de uitvoering van dit besluit elk half jaar evalueren, ook met behulp van elektronische communicatiemiddelen.
6. Rapportage
Saferworld zal halfjaarlijks inhoudelijke rapporten indienen om de voortgang richting projectresultaten te evalueren. Saferworld zal ook jaarlijks, binnen 6 maanden na het einde van de uitvoeringsperiode, inhoudelijke en financiële rapporten en een eindrapport indienen.
7. Zichtbaarheid van de Unie en beschikbaarheid van bijstandsmateriaal
Materiaal dat in het kader van het project en de speciale website wordt geproduceerd, zal de zichtbaarheid van de Unie waarborgen, met name op basis van het logo en de grafische voorstelling van de handleiding voor communicatie en zichtbaarheid voor het externe optreden van de Europese Unie. De delegaties van de Unie moeten worden betrokken bij evenementen in derde landen om de politieke follow-up en zichtbaarheid te verbeteren.
(1) Besluit (GBVB) 2018/299 van de Raad van 26 februari 2018 ter bevordering van het Europees netwerk van onafhankelijke denktanks inzake non-proliferatie en ontwapening, ter ondersteuning van de uitvoering van een EU-strategie ter bestrijding van de verspreiding van massavernietigingswapens (PB L 56 van 28.2.2018, blz. 46).
(2) Besluit (GBVB) 2018/101 van de Raad van 22 januari 2018 betreffende het bevorderen van doeltreffende controle op de wapenuitvoer (PB L 17 van 23.1.2018, blz. 40).
(3) Besluit (GBVB) 2017/2283 van de Raad van 11 december 2017 ter ondersteuning van een mondiaal rapportagemechanisme inzake illegale handvuurwapens en lichte wapens en andere illegale conventionele wapens en illegale munitie om het risico van illegale handel te beperken (“iTrace III”) (PB L 328 van 12.12.2017, blz. 20).
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/44 |
UITVOERINGSBESLUIT (GBVB) 2019/1299 VAN DE RAAD
van 31 juli 2019
tot uitvoering van Besluit (GBVB) 2015/1333 betreffende beperkende maatregelen in het licht van de situatie in Libië
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de Europese Unie, en met name artikel 31, lid 2,
Gezien Besluit (GBVB) 2015/1333 van de Raad van 31 juli 2015 betreffende beperkende maatregelen in het licht van de situatie in Libië en tot intrekking van Besluit 2011/137/GBVB (1), en met name artikel 12, lid 2,
Gezien het voorstel van de hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid,
Overwegende hetgeen volgt:
|
(1) |
De Raad heeft op 31 juli 2015 Besluit (GBVB) 2015/1333 vastgesteld. |
|
(2) |
Overeenkomstig artikel 17, lid 2, van Besluit (GBVB) 2015/1333 heeft de Raad de lijsten van aangewezen personen en entiteiten in de bijlagen II en IV bij dat besluit opnieuw bezien. |
|
(3) |
De vermelding voor één persoon moet worden geschrapt uit bijlage II bij Besluit (GBVB) 2015/1333, en de vermeldingen voor twee personen moeten worden geschrapt uit bijlage IV bij dat besluit. |
|
(4) |
Besluit (GBVB) 2015/1333 moet dienovereenkomstig worden gewijzigd, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
De bijlagen II en IV bij Besluit (GBVB) 2015/1333 worden gewijzigd overeenkomstig de bijlage bij dit besluit
Artikel 2
Dit besluit treedt in werking op de dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Gedaan te Brussel, 31 juli 2019
Voor de Raad
De voorzitter
T. TUPPURAINEN
BIJLAGE
Besluit (GBVB) 2015/1333 wordt als volgt gewijzigd:
|
1) |
In bijlage II (Lijst van personen en entiteiten bedoeld in artikel 8, lid 2) wordt vermelding 1 (betreffende ABDUSSALAM, Abdussalam Mohammed) geschrapt van de lijst in deel A (Personen). |
|
2) |
In bijlage IV (Lijst van personen en entiteiten bedoeld in artikel 9, lid 2) worden vermeldingen 1 (betreffende ABDUSSALAM, Abdussalam Mohammed) en 14 (betreffende AL-BAGHDADI, Dr Abdulqader Mohammed) geschrapt van de lijst in deel A (Personen). |
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/46 |
UITVOERINGSBESLUIT (EU) 2019/1300 VAN DE COMMISSIE
van 26 juli 2019
betreffende het in de handel brengen van een genetisch gemodificeerde anjer (Dianthus caryophyllus L., lijn FLO-40685-2)
(Kennisgeving geschied onder nummer C(2019) 5496)
(Slechts de tekst in de Nederlandse taal is authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (1), en met name artikel 18, lid 1, eerste alinea,
Na raadpleging van de Europese Autoriteit voor voedselveiligheid,
Overwegende hetgeen volgt:
|
(1) |
Krachtens Richtlijn 2001/18/EG mag een product dat geheel of gedeeltelijk uit een genetisch gemodificeerd organisme of een combinatie van genetisch gemodificeerde organismen bestaat, alleen in de handel worden gebracht als de bevoegde instantie van de lidstaat die de kennisgeving voor het in de handel brengen van dat product heeft ontvangen, daarvoor schriftelijk toestemming heeft verleend. |
|
(2) |
Suntory Holdings Limited (Osaka, Japan) heeft in oktober 2013 bij de bevoegde instantie van Nederland een kennisgeving ingediend voor het in de handel brengen van een genetisch gemodificeerde anjer (Dianthus caryophyllus L., lijn FLO-40685-2). |
|
(3) |
De kennisgeving heeft betrekking op de invoer, de distributie en de verkoop in de detailhandel van snijbloemen van de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2. |
|
(4) |
Overeenkomstig artikel 14 van Richtlijn 2001/18/EG heeft de bevoegde instantie van Nederland een beoordelingsrapport opgesteld, waarin wordt geconcludeerd dat er geen redenen zijn om geen toestemming te geven voor het in de handel brengen van snijbloemen van de genetisch gemodificeerde anjer (Dianthus caryophyllus L., lijn FLO-40685-2) om als sierbloemen te worden gebruikt, mits aan bepaalde voorwaarden wordt voldaan. |
|
(5) |
Het beoordelingsrapport is ingediend bij de Commissie en bij de bevoegde instanties van de andere lidstaten, waarvan sommige bezwaren hebben ingediend tegen het in de handel brengen van het product. Eén lidstaat heeft haar bezwaren gehandhaafd. |
|
(6) |
In haar advies van 10 maart 2016 heeft de Europese Autoriteit voor voedselveiligheid (“de EFSA”) geconcludeerd dat er geen wetenschappelijke grond is om aan te nemen dat de invoer, de distributie en de verkoop in de detailhandel in de Unie van snijbloemen van de genetisch gemodificeerde anjer FLO-40685-2 als sierbloemen nadelige gevolgen zal hebben voor de gezondheid van de mens of het milieu (2). De EFSA was tevens van oordeel dat het door de houder van de toestemming ingediende monitoringplan aanvaardbaar was in het licht van het beoogde gebruik van de anjer FLO-40685-2. |
|
(7) |
Bij de analyse van het advies van de EFSA — waarbij rekening is gehouden met de volledige kennisgeving, het beoordelingsrapport van de bevoegde instantie van Nederland, de bezwaren van de lidstaten en de aanvullende informatie van de kennisgever naar aanleiding van de bezwaren van de lidstaten — zijn geen redenen naar voren gekomen om aan te nemen dat het in de handel brengen van snijbloemen van de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, nadelige gevolgen voor de gezondheid van de mens of het milieu zal hebben bij het voorgestelde gebruik als sierbloemen. |
|
(8) |
Met het oog op Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (3) en Verordening (EG) nr. 65/2004 van de Commissie (4) moet aan de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, een eenduidig identificatienummer worden toegekend. |
|
(9) |
In het licht van het advies van de EFSA moeten er voor het voorgenomen gebruik geen specifieke voorwaarden worden vastgesteld voor de behandeling of verpakking van het product en de bescherming van specifieke ecosystemen, milieus of geografische gebieden. |
|
(10) |
Op de etikettering van het product moet worden vermeld dat snijbloemen van de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, niet mogen worden gebruikt voor consumptie door mens of dier of voor de teelt. |
|
(11) |
In december 2016 is een krachtens bijlage III B.D.12 bij Richtlijn 2001/18/EG vereiste detectiemethode voor de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, geverifieerd en getest. |
|
(12) |
Het krachtens artikel 30, lid 1, van Richtlijn 2001/18/EG ingestelde comité heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Een uitvoeringshandeling werd nodig geacht en de voorzitter heeft de ontwerpuitvoeringshandeling voor verder beraad aan het Comité van beroep voorgelegd. Het Comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Toestemming
1. Door de bevoegde instantie van Nederland wordt schriftelijke toestemming verleend om de in artikel 2 gespecificeerde genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, waarvan kennisgeving is gedaan door Suntory Holdings Limited (Osaka, Japan) (referentie C/NL/13/02), in de handel te brengen.
2. De toestemming wordt schriftelijk verleend en vermeldt expliciet de in de artikelen 3 en 4 vastgestelde voorwaarden en het in artikel 2, lid 3, genoemde eenduidige identificatienummer.
3. De toestemming wordt beperkt tot het als product in de handel brengen van snijbloemen van de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2.
4. De toestemming geldt voor nakomelingen die zijn verkregen door vegetatieve reproductie van de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2.
5. De toestemming heeft een geldigheidsduur van tien jaar vanaf de datum waarop zij wordt verleend.
Artikel 2
Product
1. Het genetisch gemodificeerde organisme dat in de handel wordt gebracht, is een anjer (Dianthus caryophyllus L.) met een gewijzigde bloemkleur, afgeleid van een celcultuurlijn van Dianthus caryophyllus L. en gemodificeerd met Agrobacterium tumefaciens, stam AGL0, met behulp van de vector pCGP1991, waaruit lijn FLO-40685-2 is ontstaan.
De genetisch gemodificeerde anjer bevat de volgende DNA-sequenties in drie cassettes:
|
a) |
Cassette 1 Het dfr-petuniagen dat codeert voor dihydroflavonol-4-reductase (DFR), een sleutelenzym in de biosynthese van anthocyanen, met inbegrip van zijn eigen promotor en terminator. |
|
b) |
Cassette 2 De promotorsequentie van het leeuwenbekchalconsynthasegen, flavonoïd-3′5′-hydroxylase (f3′5′h) van Viola hortensis-cDNA dat codeert voor F3′5′H, een sleutelenzym in de biosynthese van anthocyanen, en de terminator van het D8-petuniagen dat codeert voor een putatief fosfolipide-transporteiwit. Deze twee cassettes zijn in het plantengenoom ingevoegd om de gewenste bloemkleur te verkrijgen. |
|
c) |
Cassette 3 De 35S-promotor van het bloemkoolmozaïekvirus, het niet-afgelezen 5′-uiteinde van het petuniagen dat codeert voor bindingseiwit van chlorofyl a/b en het van Nicotiana tabacum afgeleid gen SuRB (als) dat codeert voor een mutant acetolactaatsynthase (ALS), dat tolerantie voor sulfonylureum geeft, met inbegrip van zijn eigen terminator. Dit kenmerk is bij de selectie van transformaties als merker gebruikt. |
2. De genetisch gemodificeerde anjer bevat het insert of een deel ervan in vier loci:
|
— |
Locus 1: één kopie van het T-DNA die de drie cassettes bevat, en een onvolledige kopie van het T-DNA die alleen de f3′5′h-cassette met de rechter-T-DNA-grens bevat. De twee kopieën van het T-DNA worden gescheiden door een DNA-regio van het anjergenoom; |
|
— |
Locus 2: één insert dat de D8-terminator en de rechter-T-DNA-grens bevat; |
|
— |
Locus 3: één volledige en één onvolledige kopie van de f3′5′h-cassette, beide met D8-terminatorsequenties en staart-staartgeoriënteerde rechter-T-DNA-grenzen; |
|
— |
Locus 4: een onvolledige kopie van de als-cassette en de linker-T-DNA-grens. |
3. Het eenduidige identificatienummer van de genetisch gemodificeerde anjer is FLO-4Ø685-2.
Artikel 3
Voorwaarden voor het in de handel brengen
De genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, mag alleen in de handel worden gebracht als aan de volgende voorwaarden is voldaan:
|
a) |
de genetisch gemodificeerde anjer mag alleen als sierbloem worden gebruikt; |
|
b) |
de teelt van de genetisch gemodificeerde anjer is niet toegestaan; |
|
c) |
onverminderd de vertrouwelijkheidseisen van artikel 25 van Richtlijn 2001/18/EG is de methodologie voor de detectie en identificatie van de genetisch gemodificeerde anjer, met inbegrip van experimentele gegevens die de specificiteit van de methodologie aantonen, zoals gevalideerd door het referentielaboratorium van de Europese Unie, publiek beschikbaar op http://gmo-crl.jrc.ec.europa.eu/valid-2001-18.htm |
|
d) |
onverminderd de vertrouwelijkheidseisen van artikel 25 van Richtlijn 2001/18/EG stelt de houder van de toestemming op verzoek positieve en negatieve controlemonsters van het product — of het genetisch materiaal ervan — of referentiematerialen ter beschikking van de bevoegde instanties en inspectiediensten van de lidstaten en de controlelaboratoria van de Unie; |
|
e) |
op een etiket of — voor niet-voorverpakte producten — in een bij de genetisch gemodificeerde anjers gevoegd document worden de woorden “Dit product is een genetisch gemodificeerd organisme” of “Dit product is een genetisch gemodificeerde anjer”, en de woorden “niet voor consumptie door mens of dier of voor de teelt” vermeld. |
Artikel 4
Monitoring
1. Gedurende de geldigheidsduur van de toestemming ziet de houder van de toestemming erop toe dat het in de kennisgeving opgenomen monitoringplan — dat bestaat uit een algemeen toezichtsplan om na te gaan of de behandeling of het gebruik van de genetisch gemodificeerde anjer Dianthus caryophyllus L., lijn FLO-40685-2, nadelige gevolgen kan hebben voor de gezondheid van de mens of het milieu — wordt opgesteld en uitgevoerd.
Het monitoringplan is beschikbaar op [Link: op internet gepubliceerd plan].
2. De houder van de toestemming stelt de exploitanten en gebruikers rechtstreeks in kennis van de veiligheid en de algemene kenmerken van de genetisch gemodificeerde anjer en van de voorwaarden inzake monitoring, inclusief de beheersmaatregelen die bij accidentele voortplanting moeten worden genomen.
3. De houder van de toestemming dient bij de Commissie en de bevoegde instanties van de lidstaten jaarlijks een verslag over de resultaten van de monitoringactiviteiten in.
4. De houder van de toestemming kan aan de Commissie en de bevoegde instanties van de lidstaten het bewijs leveren dat:
|
a) |
de bestaande monitoringnetwerken, met inbegrip van de nationale botanische toezichtsnetwerken en gewasbeschermingsdiensten, zoals gespecificeerd in het in de kennisgeving opgenomen monitoringplan, de informatie verzamelen die relevant is voor de monitoring van de genetisch gemodificeerde anjer, en |
|
b) |
deze onder a) genoemde bestaande monitoringnetwerken hebben toegezegd die informatie vóór de in lid 3 vastgestelde datum voor de indiening van de monitoringverslagen bij de Commissie en de bevoegde instanties van de lidstaten, aan de houder van de toestemming beschikbaar te stellen. |
Artikel 5
Adressaat
Dit besluit is gericht tot het Koninkrijk der Nederlanden.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 106 van 17.4.2001, blz. 1.
(2) EFSA GMO Panel (EFSA Panel on Genetically Modified Organisms), 2016. Scientific opinion on a Part C notification (reference C/NL/13/02) from Suntory Holdings Limited for the import, distribution and retailing of carnation FLO-40685-2 cut flowers with modified petal colour for ornamental use. EFSA Journal 2016;14(4):4431, 18 blz.; doi: 10.2903/j.efsa.2016.4431.
(3) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(4) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/50 |
UITVOERINGSBESLUIT (EU) 2019/1301 VAN DE COMMISSIE
van 26 juli 2019
tot wijziging van Uitvoeringsbesluit 2013/327/EU met betrekking tot de verlenging van een vergunning voor het in de handel brengen van diervoeder dat geheel of gedeeltelijk bestaat uit genetisch gemodificeerd koolzaad Ms8, Rf3 en Ms8 × Rf3, overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5499)
(Slechts de tekst in de Duitse taal is authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 11, lid 3, en artikel 23, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Bij Uitvoeringsbesluit 2013/327/EU van de Commissie (2) is een vergunning verleend voor het in de handel brengen van levensmiddelen die geheel of gedeeltelijk bestaan uit genetisch gemodificeerd koolzaad Ms8, Rf3 en Ms8 × Rf3 en met dat genetisch gemodificeerde koolzaad geproduceerde levensmiddelen en diervoeders. |
|
(2) |
Daarvoor is bij Beschikking 2007/232/EG (3) van de Commissie een vergunning verleend voor het in de handel brengen van diervoeder dat geheel of gedeeltelijk bestaat uit genetisch gemodificeerde koolzaadproducten (Ms8, Rf3 en Ms8 × Rf3). Het toepassingsgebied van die vergunning omvatte ook producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerd koolzaad Ms8, Rf3 en Ms8 × Rf3, voor andere toepassingen dan voor levensmiddelen of diervoeders, met uitzondering van de teelt. |
|
(3) |
Op 20 mei 2016 heeft Bayer CropScience AG overeenkomstig de artikelen 11 en 23 van Verordening (EG) nr. 1829/2003 bij de Commissie een aanvraag ingediend tot verlenging van de vergunning voor het in de handel brengen van de producten die vallen onder Beschikking 2007/232/EG. |
|
(4) |
Op 28 november 2017 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 een gunstig advies (4) uitgebracht. Daarin is geconcludeerd dat de verlengingsaanvraag geen bewijs bevatte van nieuwe gevaren, gewijzigde blootstelling of wetenschappelijke onzekerheden die zouden leiden tot wijziging van de conclusies van de oorspronkelijke, in 2005 door EFSA goedgekeurde risicobeoordeling van Ms8, Rf3 en Ms8 × Rf3 (5). |
|
(5) |
De EFSA heeft in haar advies aandacht besteed aan alle specifieke vragen en bezorgdheden die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties, zoals bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(6) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij de beoogde toepassingen van de producten. |
|
(7) |
Rekening houdend met deze overwegingen, moet de vergunning voor het in de handel brengen van de producten die onder Beschikking 2007/232/EG vallen, worden verlengd. |
|
(8) |
Op 30 november 2017 heeft de aanvrager, Bayer CropScience AG, de Commissie gevraagd de vergunning voor de toepassingen van koolzaad Ms8, Rf3 en Ms8 × Rf3 die vallen onder de nieuwe verlengingsaanvraag en die voor toepassingen van de koolzaadproducten die vallen onder Uitvoeringsbesluit 2013/327/EU in één enkele vergunning samen te voegen. Per brief met dagtekening 5 december 2017 heeft de Commissie de aanvrager laten weten dat die samenvoeging zou plaatsvinden door het toepassingsgebied van Uitvoeringsbesluit 2013/327/EU uit te breiden tot de producten die onder de verlengingsaanvraag van 20 mei 2016 vallen. De aanvrager is er daarom van op de hoogte gebracht dat de samenvoeging tot gevolg zou hebben dat de producten die onder de verlengingsaanvraag vallen, aan de vergunningsvoorwaarden van Uitvoeringsbesluit 2013/327/EU zouden moeten voldoen. |
|
(9) |
De Commissie is van oordeel dat het verzoek van de aanvrager gerechtvaardigd is, en tot vereenvoudiging strekt. Daarom moet Uitvoeringsbesluit 2013/327/EU worden gewijzigd, door het toepassingsgebied uit te breiden tot de producten die momenteel onder Beschikking 2007/232/EG vallen. |
|
(10) |
Per brief met dagtekening 1 augustus 2018 heeft Bayer CropScience AG de Commissie gevraagd al zijn rechten en plichten voor alle vergunningen over te dragen aan BASF Agricultural Solutions Seed US LLC. Per brief met dagtekening 6 augustus 2018 heeft BASF SE namens BASF Agricultural Solutions Seed US LLC bevestigd akkoord te zijn met deze overdracht. Deze overdracht betreft Beschikking 2007/232/EG en Uitvoeringsbesluit 2013/327/EU. |
|
(11) |
Aan koolzaad Ms8, Rf3 en Ms8 × Rf3 is een eenduidig identificatienummer toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (6). Men moet dat eenduidig identificatienummer blijven gebruiken. |
|
(12) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (7). Om er echter voor te zorgen dat dergelijke producten binnen de grenzen van de door dit besluit verleende vergunning worden gebruikt, moet op het etiket van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde koolzaad Ms8, Rf3 en Ms8 × Rf3, met uitzondering van levensmiddelen, ook duidelijk worden aangegeven dat de producten in kwestie niet voor de teelt zijn bedoeld. |
|
(13) |
Het monitoringplan voor de milieueffecten zoals vastgesteld bij Uitvoeringsbesluit 2013/327/EU hoeft niet te worden gewijzigd, aangezien het in wezen identiek is aan het door de EFSA in het kader van de verlengingsaanvraag beoordeeld monitoringplan. |
|
(14) |
Alle relevante informatie over het verlenen van de vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(15) |
Beschikking 2007/232/EG moet worden ingetrokken. |
|
(16) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (8) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid via het uitwisselingscentrum voor bioveiligheid van dit besluit in kennis worden gesteld. |
|
(17) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Wijzigingen
1. Uitvoeringsbesluit 2013/327/EU wordt als volgt gewijzigd:
|
1) |
De titel wordt vervangen door: “Uitvoeringsbesluit 2013/327/EU van de Commissie van 25 juni 2013 tot verlening van een vergunning voor het in de handel brengen van levensmiddelen en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde koolzaad Ms8, Rf3 en Ms8 × Rf3, overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad”. |
|
2) |
Artikel 2 wordt vervangen door: “Artikel 2 Vergunningverlening Overeenkomstig de voorwaarden van dit besluit wordt voor de doeleinden van artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 een vergunning verleend voor de volgende producten:
|
|
3) |
Aan artikel 3 wordt een tweede lid toegevoegd: “De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de in artikel 2 bedoelde genetisch gemodificeerde koolzaad, met uitzondering van levensmiddelen en levensmiddeleningrediënten.”. |
|
4) |
Er wordt een nieuw artikel 3 bis toegevoegd: “Artikel 3 bis Detectiemethode Voor de detectie van koolzaad ACS-BNØØ5-8, ACS-BNØØ3-6 en ACS-BNØØ5-8 × ACS-BNØØ3-6 geldt de in punt d) van de bijlage vastgestelde methode.”. |
|
5) |
Artikel 6 wordt vervangen door: “Artikel 6 Vergunninghouder De houder van de vergunning is BASF Agricultural Solutions Seed US LLC, Verenigde Staten van Amerika, vertegenwoordigd door BASF SE, Duitsland.”. |
|
6) |
Artikel 8 wordt vervangen door: “Artikel 8 Adressaat Dit uitvoeringsbesluit is gericht tot BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Duitsland.”. |
2. De bijlage bij Uitvoeringsbesluit 2013/327/EU wordt als volgt gewijzigd:
|
1) |
Punt a) wordt vervangen door: “a) Aanvrager en vergunninghouder
vertegenwoordigd door BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Duitsland.”. |
|
2) |
Punt b) wordt vervangen door: “b) Benaming en specificatie van de producten
|
|
3) |
Aan punt c) wordt een nieuwe (tweede) alinea toegevoegd: “De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit in punt b) bedoelde genetisch gemodificeerde koolzaad, met uitzondering van levensmiddelen en levensmiddeleningrediënten.”. |
Artikel 2
Intrekking
Beschikking 2007/232/EG wordt ingetrokken.
Artikel 3
Adressaat
Dit uitvoeringsbesluit is gericht tot BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Duitsland.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Uitvoeringsbesluit 2013/327/EU van de Commissie van 25 juni 2013 tot verlening van een vergunning voor het in de handel brengen van levensmiddelen die geheel of gedeeltelijk bestaan uit genetisch gemodificeerd koolzaad Ms8, Rf3 en Ms8 × Rf3 of met die genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders, overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad (PB L 175 van 27.6.2013, blz. 57).
(3) Beschikking 2007/232/EG van de Commissie van 26 maart 2007 betreffende het in de handel brengen van koolzaadproducten (Brassica napus L., lijnen Ms8, Rf3 en Ms8 × Rf3), genetisch gemodificeerd met het oog op tolerantie voor het herbicide glufosinaat-ammonium, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 100 van 17.4.2007, blz. 20).
(4) Ggo-panel van de EFSA, 2017. Scientific opinion on the assessment of genetically modified oilseed rape MS8, RF3 and MS8 × RF3 for renewal of authorisation under regulation (EC) No 1829/2003 (application EFSA-GMO-RX-004). EFSA Journal 2017;15(11):5067.
(5) EFSA, 2005. Opinion of the Scientific Panel on Genetically Modified Organisms on a request from the Commission related to the application (Reference C/BE/96/01) for the placing on the market of glufosinate-tolerant hybrid oilseed rape Ms8 × Rf3, derived from genetically modified parental lines (Ms8, Rf3), for import and processing for feed and industrial uses, under Part C of Directive 2001/18/EC from Bayer CropScience. EFSA Journal 2005; 3(10):281, blz. 23.
(6) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(7) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(8) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/54 |
UITVOERINGSBESLUIT (EU) 2019/1302 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde katoen GHB614 × LLCotton25 × MON 15985 overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5501)
(Slechts de tekst in de Duitse taal is authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 11 februari 2011 heeft Bayer CropScience AG (de aanvrager) bij de bevoegde nationale instantie van Nederland en overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 een aanvraag ingediend voor het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerd katoen GHB614 × LLCotton25 × MON 15985 en de subcombinatie LLCotton25 × MON 15985 (hierna “de aanvraag” genoemd). De aanvraag betrof ook het in de handel brengen van genetisch gemodificeerd katoen GHB614 × LLCotton25 × MON 15985 en de subcombinatie LLCotton25 × MON 15985 in producten die er geheel of gedeeltelijk uit bestaan, voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt. |
|
(2) |
Per brief van 20 april 2011 werd de aanvrager meegedeeld dat de subcombinatie LLCotton25 × MON 15985 uit de aanvraag verwijderd moest worden om afzonderlijk te worden beoordeeld, vanwege de reproductieve eigenschappen van GHB614 × LLCotton25 × MON 15985. Per brief van 15 juni 2015 heeft de aanvrager een geactualiseerde versie van de aanvraag ingediend bij de Europese Autoriteit voor voedselveiligheid (EFSA), waarvan het toepassingsgebied was beperkt tot het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeder die geheel of gedeeltelijk bestaan uit of geproduceerd zijn met katoen GHB614 × LLCotton25 × MON 15985. |
|
(3) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag zowel gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling als de uit hoofde van de bijlagen III en IV bij die richtlijn vereiste informatie. De aanvraag omvatte eveneens een monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG. |
|
(4) |
Op 20 april 2018 heeft EFSA overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 een gunstig advies uitgebracht (3). De EFSA kwam tot de conclusie dat genetisch gemodificeerd katoen GHB614 × LLCotton25 × MON 15985 even veilig en voedzaam is als het niet genetisch gemodificeerde vergelijkingsmateriaal binnen het toepassingsgebied van de aanvraag. |
|
(5) |
De EFSA heeft in haar advies aandacht besteed aan alle specifieke vragen en bezorgdheden die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties, zoals bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(6) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij het beoogde gebruik van de producten. |
|
(7) |
Gezien het bovenstaande moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde katoen GHB614 × LLCotton25 × MON 15985. |
|
(8) |
Per brief met dagtekening 1 augustus 2018 heeft Bayer CropScience AG de Commissie gevraagd de rechten en plichten van Bayer CropScience AG met betrekking tot alle vergunningen en nog lopende aanvragen voor genetisch gemodificeerde producten over te dragen aan BASF Agricultural Solutions Seed US LLC. Per brief met dagtekening 6 augustus 2018 heeft BASF SE namens BASF Agricultural Solutions Seed US LLC bevestigd akkoord te zijn met deze overdracht. |
|
(9) |
Aan genetisch gemodificeerd katoen GHB614 × LLCotton25 × MON 15985 moet overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (4) een eenduidig identificatienummer worden toegekend. |
|
(10) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (5). Om er echter voor te zorgen dat dergelijke producten binnen de grenzen van de door dit besluit verleende vergunning worden gebruikt, moet op het etiket van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerd katoen GHB614 × LLCotton25 × MON 15985, met uitzondering van levensmiddelen, ook duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(11) |
De vergunninghouder moet elk jaar een verslag indienen over de uitvoering en de resultaten van de activiteiten in het monitoringplan voor de milieueffecten. Die resultaten moeten worden gepresenteerd overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (6). |
|
(12) |
Het advies van de EFSA rechtvaardigt niet het opleggen van specifieke voorwaarden of beperkingen voor het in de handel brengen en/of specifieke voorwaarden of beperkingen voor het gebruik en de behandeling, met inbegrip van voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van levensmiddelen en diervoeders, of de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, als bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(13) |
Alle relevante informatie over het verlenen van de vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(14) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (7) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(15) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Aan genetisch gemodificeerde katoen GHB614 × LLCotton25 × MON 15985, als nader gespecificeerd in punt b) van de bijlage bij dit besluit, wordt het eenduidige identificatienummer BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7 toegekend overeenkomstig Verordening (EG) nr. 65/2004.
Artikel 2
Vergunningverlening
Overeenkomstig de voorwaarden van dit besluit wordt voor de doeleinden van artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met katoen GHB614 × LLCotton25 × MON 15985; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met katoen GHB614 × LLCotton25 × MON 15985; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit katoen GHB614 × LLCotton25 × MON 15985, voor ander gebruik dan bedoeld onder a) en b) van dit artikel, met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de toepassing van de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de “naam van het organisme”“katoen”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de in artikel 1 bedoelde genetisch gemodificeerde katoen, met uitzondering van levensmiddelen en levensmiddeleningrediënten.
Artikel 4
Detectiemethode
Voor de detectie van de in artikel 1 bedoelde genetisch gemodificeerde katoen wordt de in punt d) van de bijlage vermelde methode gebruikt.
Artikel 5
Monitoringplan voor de milieueffecten
1. De vergunninghouder zorgt ervoor dat het in punt h) van de bijlage vermelde monitoringplan voor de milieueffecten wordt vastgesteld en uitgevoerd.
2. Overeenkomstig Beschikking 2009/770/EG dient de vergunninghouder elk jaar bij de Commissie een verslag in over de uitvoering en de resultaten van de activiteiten die in het monitoringplan zijn opgenomen.
Artikel 6
Communautair register
De informatie in de bijlage bij dit besluit wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De houder van de vergunning is BASF Agricultural Solutions Seed US LLC, Verenigde Staten van Amerika, vertegenwoordigd door BASF SE, Duitsland.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving.
Artikel 9
Adressaat
Dit uitvoeringsbesluit is gericht tot BASF SE, Carl-Bosch-Str. 38, 67063 Ludwigshafen, Duitsland.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2018. Scientific opinion on the assessment of genetically modified cotton GHB614 × LLCotton25 × MON 15985 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2011-94); EFSA Journal 2018;16(4):5213, 27 blz.; doi: 10.2903/j.efsa.2018.5213.
(4) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(5) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(6) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(7) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder:
|
Naam |
: |
BASF Agricultural Solutions Seed US LLC |
|
Adres |
: |
100 Park Avenue, Florham Park, New Jersey 07932, Verenigde Staten van Amerika |
Vertegenwoordigd door BASF SE, Carl-Bosch-Str. 38, 67063 Ludwigshafen, Duitsland.
b) Benaming en specificatie van de producten:
|
1. |
Levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met katoen GHB614 × LLCotton25 × MON 15985. |
|
2. |
Diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met katoen GHB614 × LLCotton25 × MON 15985. |
|
3. |
Producten die geheel of gedeeltelijk bestaan uit katoen GHB614 × LLCotton25 × MON 15985, voor andere toepassingen dan bedoeld in de punten 1 en 2, met uitzondering van de teelt. |
Het genetisch gemodificeerde katoen GHB614 × LLCotton25 × MON 15985, zoals beschreven in de aanvraag, brengt het 2mEPSPS-eiwit tot expressie dat tolerantie geeft voor glufosinaatbevattende herbiciden, het PAT-eiwit dat tolerantie geeft voor bepaalde op glufosinaat-ammonium gebaseerde herbiciden, en de Cry1Ac- en Cry1Ab2-eiwitten die bescherming bieden tegen bepaalde schadelijke lepidoptera. Bovendien werden het uidA-gen, dat codeert voor het GUS-eiwit, het nptII-gen, dat weerstand verleent tegen kanamycine en neomycine, en het aadA-gen, dat weerstand verleent tegen spectinomycine en streptomycine, bij het genetische modificatieproces als selectiemarkers gebruikt.
c) Etikettering:
|
1. |
Voor de toepassing van de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “katoen”. |
|
2. |
De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van de producten die geheel of gedeeltelijk bestaan uit de in punt e) gespecificeerde katoen GHB614 × LLCotton25 × MON 15985, met uitzondering van levensmiddelen en levensmiddeleningrediënten. |
d) Detectiemethode:
|
1. |
Voor de detectie van katoen GHB614 × LLCotton25 × MON 15985 gelden de kwantitatieve modificatiespecifieke PCR-methoden die zijn gevalideerd voor de genetisch gemodificeerde katoenlijnen BCS-GHØØ2-5, ACS-GHØØ1-3 en MON-15985-7. De detectiemethoden zijn gevalideerd op genomisch DNA dat is geëxtraheerd van bladeren van katoen BCS-GHØØ2-5, ACS-GHØØ1-3 en MON-15985-7. |
|
2. |
Gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3. |
referentiemateriaal: AOCS 1108-A5 (voor BCS-GHØØ2-5), AOCS 0306-E2 (voor ACS-GHØØ1-3) en AOCS 0804-D (MON-15985-7) zijn te vinden op de website van de American Oil Chemists' Society (AOCS) https://www.aocs.org/crm |
e) Eenduidig identificatienummer:
BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biodiversiteit gehechte Protocol van Cartagena inzake bioveiligheid:
[Uitwisselingscentrum voor bioveiligheid, Record ID number: wordt bij kennisgeving bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders].
g) Voorwaarden of beperkingen inzake het in de handel brengen, het gebruik of de behandeling van de producten:
Geen.
h) Monitoringplan voor de milieueffecten:
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders]
i) Voorschriften voor monitoring, na het in de handel brengen, van het gebruik van het levensmiddel voor menselijke consumptie:
Geen.
Opmerking: Het kan gebeuren dat de links naar documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders bij te werken.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/60 |
UITVOERINGSBESLUIT (EU) 2019/1303 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais 5307 (SYN-Ø53Ø7-1) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad inzake genetisch gemodificeerde levensmiddelen en diervoeders
(Kennisgeving geschied onder nummer C(2019) 5493)
(Slechts de teksten in de Nederlandse en de Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 7 april 2011 heeft Syngenta Crop Protection AG, via haar gelieerde onderneming Syngenta Crop Protection NV, bij de bevoegde nationale instantie van Duitsland en overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 een aanvraag ingediend voor het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais 5307 (hierna “de aanvraag” genoemd). De aanvraag betrof ook het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais 5307 voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt. |
|
(2) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag zowel gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling als de uit hoofde van de bijlagen III en IV bij die richtlijn vereiste informatie. De aanvraag omvatte eveneens een monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG. |
|
(3) |
Op 5 mei 2015 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 (3) een advies uitgebracht. De EFSA was niet in staat tot een algemene conclusie te komen over mais 5307 omdat het 28-daags toxiciteitsonderzoek dat werd verstrekt voor het eCry3.1Ab-eiwit, ontoereikend was. |
|
(4) |
Op 8 december 2016 heeft de aanvrager een nieuw 28-daags toxiciteitsonderzoek over het eCry3.1Ab-eiwit verstrekt. |
|
(5) |
Op 11 april 2018 heeft de EFSA een verklaring ter aanvulling van haar wetenschappelijk advies (4) gepubliceerd, waarin rekening is gehouden met het aanvullende toxiciteitsonderzoek. De EFSA heeft geconcludeerd dat maïs 5307, zoals beoordeeld in het oorspronkelijke advies en in het aanvullende toxiciteitsonderzoek, even veilig en voedzaam is als de conventionele tegenhanger ervan in het toepassingsgebied van de aanvraag. |
|
(6) |
De EFSA heeft in haar advies aandacht besteed aan alle vragen en bezorgdheden die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties, zoals bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(7) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansloot bij de beoogde toepassingen van de producten. |
|
(8) |
Rekening houdend met die conclusies, moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais 5307 voor de in de aanvraag vermelde toepassingen. |
|
(9) |
Aan de genetisch gemodificeerde mais 5307 moet een eenduidig identificatienummer worden toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (5). |
|
(10) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (6). Om er echter voor te zorgen dat dergelijke producten binnen de grenzen van de door dit besluit verleende vergunning worden gebruikt, moet op het etiket van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais 5307, met uitzondering van levensmiddelen, ook duidelijk worden vermeld dat de producten in kwestie niet voor de teelt zijn bedoeld. |
|
(11) |
Om rekening te houden met de uitvoering en de resultaten van de activiteiten die in het monitoringplan voor de milieueffecten zijn uiteengezet, moet de vergunninghouder jaarverslagen indienen, die zijn opgesteld overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (7). |
|
(12) |
Het advies van de EFSA rechtvaardigt niet het opleggen van specifieke voorwaarden of beperkingen voor het in de handel brengen, voor het gebruik en de behandeling, met inbegrip van voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van de levensmiddelen en diervoeders, of voor de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, als bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(13) |
Alle relevante informatie over het verlenen van de vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(14) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (8) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid via het uitwisselingscentrum voor bioveiligheid van dit besluit in kennis worden gesteld. |
|
(15) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Overeenkomstig Verordening (EG) nr. 65/2004 wordt aan de genetisch gemodificeerde mais (Zea mays L.) 5307, zoals gespecificeerd in de bijlage, onder b), bij dit besluit, het eenduidige identificatienummer SYN-Ø53Ø7-1 toegewezen.
Artikel 2
Vergunningverlening
Krachtens artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 wordt, overeenkomstig de voorwaarden van dit besluit, een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais SYN-Ø53Ø7-1; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais SYN-Ø53Ø7-1; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit mais SYN-Ø53Ø7-1, voor andere toepassingen dan bedoeld onder a) en b) van dit artikel, met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk uit mais SYN-Ø53Ø7-1 bestaan, met uitzondering van de in artikel 2, onder a), bedoelde producten.
Artikel 4
Detectiemethode
Voor de detectie van mais SYN-Ø53Ø7-1 geldt de in punt d) van de bijlage vastgestelde methode.
Artikel 5
Monitoring van de milieueffecten
1. De vergunninghouder zorgt ervoor dat het in punt h) van de bijlage vermelde monitoringplan voor de milieueffecten wordt vastgesteld en uitgevoerd.
2. Overeenkomstig Beschikking 2009/770/EG dient de vergunninghouder elk jaar bij de Commissie een verslag in over de uitvoering en de resultaten van de activiteiten die in het monitoringplan zijn opgenomen.
Artikel 6
Communautair register
De informatie in de bijlage bij dit besluit wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De vergunninghouder is Syngenta Crop Protection AG, Zwitserland, vertegenwoordigd door Syngenta Crop Protection NV, België.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar vanaf de datum van kennisgeving.
Artikel 9
Adressaat
Dit besluit is gericht aan Syngenta Crop Protection NV, Louizalaan 489, 1050 Brussel, België.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2015. Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG. EFSA Journal 2015;13(5):4083, 29 blz.; https://doi.org/10.2903/j.efsa.2015.4083
(4) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2018. Statement complementing the EFSA Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG taking into consideration an additional toxicological study. EFSA Journal 2018;16(4):5233, 9 blz.; https://doi.org/10.2903/j.efsa.2018.5233
(5) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(6) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(7) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(8) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder:
|
Naam |
: |
Syngenta Crop Protection AG |
|
Adres |
: |
Schwarzwaldallee 215, 4058 Bazel, Zwitserland |
Vertegenwoordigd door Syngenta Crop Protection NV, Louizalaan 489, 1050 Brussel, België.
b) Benaming en specificatie van de producten:
|
1. |
Levensmiddelen die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais SYN-Ø53Ø7-1 |
|
2. |
Diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais SYN-Ø53Ø7-1 |
|
3. |
Producten die geheel of gedeeltelijk bestaan uit mais SYN-Ø53Ø7-1, voor andere toepassingen dan bedoeld in de punten 1 en 2, met uitzondering van de teelt. |
De in de aanvraag beschreven genetisch gemodificeerde mais SYN-Ø53Ø7-1 brengt het eCry3.1Ab-eiwit tot expressie, dat weerstand biedt tegen bepaalde schadelijke schildvleugelige insecten, alsook het PMI-eiwit, dat als selectiemarker werd gebruikt.
c) Etikettering:
|
1. |
Voor de toepassing van de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”. |
|
2. |
De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk uit mais SYN-Ø53Ø7-1 bestaan, met uitzondering van de in artikel 2, onder a), bedoelde producten. |
d) Detectiemethode:
|
1. |
Modificatiespecifieke realtime kwantitatieve PCR-gebaseerde methode voor de detectie van de genetisch gemodificeerde mais SYN-Ø53Ø7-1 |
|
2. |
Gevalideerd door het bij Verordening (EG) nr. 1829/2003 aangewezen EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referentiemateriaal: AOCS 0411-C en AOCS 0411-D zijn verkrijgbaar bij de American Oil Chemists Society (AOCS) op https://www.aocs.org/crm |
e) Eenduidig identificatienummer:
SYN-Ø53Ø7-1
f) Informatie die vereist is krachtens bijlage II bij het Protocol van Cartagena inzake bioveiligheid bij het Verdrag inzake biodiversiteit:
[Uitwisselingscentrum voor bioveiligheid, Record ID: wordt bij kennisgeving bekendgemaakt in het communautaire register van genetisch gemodificeerde levensmiddelen en diervoeders].
g) Voorwaarden of beperkingen met betrekking tot het in de handel brengen, het gebruik en de behandeling van de producten:
Geen.
h) Monitoringplan voor de milieueffecten:
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het register van genetisch gemodificeerde levensmiddelen en diervoeders].
i) Voorschriften voor monitoring, na het in de handel brengen, van het gebruik van het levensmiddel voor menselijke consumptie:
Geen.
Opmerking: Het kan gebeuren dat de links naar de documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door middel van updates van het EU-register van genetisch gemodificeerde levensmiddelen en diervoeders.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/65 |
UITVOERINGSBESLUIT (EU) 2019/1304 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 4114 (DP-ØØ4114-3) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5491)
(Slechts de teksten in de Nederlandse en Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 27 november 2014 heeft Pioneer Overseas Corporation namens Pioneer Hi-Bred International Inc., Verenigde Staten, bij de bevoegde nationale instantie van Nederland overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 een aanvraag ingediend (hierna “de aanvraag” genoemd). De aanvraag betrof het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais 4114. De aanvraag betrof ook het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais 4114 voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt. |
|
(2) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling. De aanvraag omvatte tevens de uit hoofde van de bijlagen III en IV bij die richtlijn vereiste informatie en een monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij die richtlijn. |
|
(3) |
Op 24 mei 2018 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 (3) een gunstig advies uitgebracht. Zij heeft geconcludeerd dat de in de aanvraag beschreven genetisch gemodificeerde mais 4114 wat betreft de mogelijke gevolgen voor de gezondheid van mens en dier of het milieu even veilig is als het niet genetisch gemodificeerde vergelijkingsmateriaal en de geteste niet-genetisch gemodificeerde referentievariëteiten van mais. |
|
(4) |
De EFSA heeft in haar advies aandacht besteed aan alle vragen en bezorgdheden die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties, zoals bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(5) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij het beoogde gebruik van de producten. |
|
(6) |
Gezien het bovenstaande moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais 4114 voor de in de aanvraag vermelde toepassingen. |
|
(7) |
Aan de genetisch gemodificeerde mais 4114 moet een eenduidig identificatienummer worden toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (4). |
|
(8) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (5). Om er echter voor te zorgen dat dergelijke producten binnen de grenzen van de door dit besluit verleende vergunning worden gebruikt, moet op de etikettering van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais 4114, met uitzondering van levensmiddelen en levensmiddeleningrediënten, ook duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(9) |
Om verslag uit te brengen over de uitvoering en de resultaten van de in het monitoringplan voor de milieueffecten vermelde activiteiten moet de vergunninghouder jaarverslagen indienen, die worden gepresenteerd overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (6). |
|
(10) |
Het advies van de EFSA rechtvaardigt niet het opleggen van specifieke voorwaarden of beperkingen voor het in de handel brengen, het gebruik en de behandeling, inclusief voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van de levensmiddelen en diervoeders, of voor de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, als bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(11) |
Alle relevante informatie over het verlenen van de vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(12) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (7) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(13) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Overeenkomstig Verordening (EG) nr. 65/2004 wordt aan de genetisch gemodificeerde mais (Zea mays L.) 4114, zoals gespecificeerd in de bijlage, onder b), bij dit besluit, het eenduidige identificatienummer DP-ØØ4114-3 toegewezen.
Artikel 2
Verlenen van een vergunning
Overeenkomstig de voorwaarden van dit besluit wordt voor de doeleinden van artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 4114; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 4114; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde mais 4114 voor andere toepassingen dan bedoeld in de punten a) en b), met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde mais 4114, met uitzondering van levensmiddelen en levensmiddeleningrediënten.
Artikel 4
Detectiemethode
Voor de detectie van de genetisch gemodificeerde mais 4114 wordt de in de bijlage, onder d), vermelde methode gebruikt.
Artikel 5
Monitoringplan voor de milieueffecten
1. De vergunninghouder zorgt ervoor dat het in de bijlage, onder h), vermelde monitoringplan voor de milieueffecten wordt vastgesteld en uitgevoerd.
2. De vergunninghouder dient jaarlijks een verslag over de uitvoering en de resultaten van de in het monitoringplan opgenomen activiteiten bij de Commissie in overeenkomstig Beschikking 2009/770/EG.
Artikel 6
Communautair register
De informatie in de bijlage bij dit besluit wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De vergunninghouder is Pioneer Hi-Bred International, Inc., Verenigde Staten, vertegenwoordigd door Pioneer Overseas Corporation, België.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving.
Artikel 9
Adressaat
Dit besluit is gericht tot Pioneer Overseas Corporation, Kunstlaan 44, 1040 Brussel, België.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2018. Scientific Opinion on the assessment of genetically modified maize 4114 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014-123). EFSA Journal 2018; 16(5):5280, 25 blz. https://doi.org/10.2903/j.efsa.2018.5280
(4) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(5) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(6) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(7) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder
|
Naam |
: |
Pioneer Hi-Bred International, Inc. |
|
Adres |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, Verenigde Staten van Amerika |
Vertegenwoordigd door: Pioneer Overseas Corporation, Kunstlaan 44, 1040 Brussel, België.
b) Benaming en specificatie van de producten
|
1. |
Levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 4114. |
|
2. |
Diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais 4114. |
|
3. |
Producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais 4114 voor andere toepassingen dan bedoeld in de punten 1) en 2), met uitzondering van de teelt. |
De genetisch gemodificeerde mais 4114 brengt het Cry1F-eiwit (afgeknotte versie), het Cry34Ab1-eiwit en het Cry35Ab1-eiwit tot expressie, die bescherming bieden tegen specifieke schadelijke lepidoptera en schadelijke coleoptera, en het PAT-eiwit dat tolerantie geeft voor op glufosinaat-ammonium gebaseerde herbiciden.
c) Etikettering
|
1. |
Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”. |
|
2. |
De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk uit genetisch gemodificeerde mais 4114 bestaan, met uitzondering van de in deze bijlage, onder b), 1), bedoelde producten. |
d) Detectiemethode
|
1. |
Modificatiespecifieke realtime kwantitatieve PCR-gebaseerde methode voor de detectie van de genetisch gemodificeerde mais DP-ØØ4114-3. |
|
2. |
Gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referentiemateriaal: ERM®-BF439 is toegankelijk via het Gemeenschappelijk Centrum voor onderzoek (JRC) van de Europese Commissie op https://ec.europa.eu/jrc/en/reference-materials/catalogue/ |
e) Eenduidig identificatienummer
DP-ØØ4114-3.
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biodiversiteit gehechte Protocol van Cartagena inzake bioveiligheid
[Uitwisselingscentrum voor bioveiligheid, Record ID: wordt bij kennisgeving bekendgemaakt in het register van genetisch gemodificeerde levensmiddelen en diervoeders.]
g) Voorwaarden of beperkingen inzake het in de handel brengen, het gebruik of de behandeling van de producten
Geen.
h) Monitoringplan voor de milieueffecten
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het register van genetisch gemodificeerde levensmiddelen en diervoeders.]
i) Voorschriften voor monitoring na het in de handel brengen bij gebruik van het levensmiddel voor menselijke consumptie
Geen.
Opmerking: het kan gebeuren dat de links naar documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door het register van genetisch gemodificeerde levensmiddelen en diervoeders bij te werken.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/69 |
UITVOERINGSBESLUIT (EU) 2019/1305 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais Bt11 × MIR162 × 1507 × GA21 en de subcombinaties Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 en MIR162 × 1507, overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5502)
(Slechts de teksten in de Nederlandse en Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 10 augustus 2010 heeft Syngenta Crop Protection AG, via haar gelieerde onderneming Syngenta Crop Protection NV, bij de bevoegde nationale instantie van Duitsland en overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 een aanvraag ingediend voor het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais Bt11 × MIR162 × 1507 × GA21 (hierna “de aanvraag” genoemd). De aanvraag betrof ook het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais Bt11 × MIR162 × 1507 × GA21 voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt. |
|
(2) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag zowel gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling als de uit hoofde van de bijlagen III en IV bij die richtlijn vereiste informatie. De aanvraag omvatte eveneens een monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG. |
|
(3) |
Op 30 juli 2013 heeft Syngenta de aanvraag uitgebreid tot de tien subcombinaties van de afzonderlijke transformatiestappen van mais Bt11 × MIR162 × 1507 × GA21. |
|
(4) |
Op 31 maart 2016 heeft Syngenta de aanvraag bijgewerkt door de subcombinaties die reeds onder een andere aanvraag vielen, uit te sluiten: Bt11 × MIR162 × GA21, Bt11 × MIR162, Bt11 × GA21 en MIR162 × GA21, waarvoor een vergunning is verleend bij Uitvoeringsbesluit (EU) 2016/1685 van de Commissie (3), en de subcombinaties Bt11 × 1507 × GA21, Bt11 × 1507 en 1507 × GA21, waarvoor een vergunning is verleend bij Uitvoeringsbesluit (EU) 2017/1209 van de Commissie (4). Onder de aanvraag vallen dus de subcombinaties Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 en MIR162 × 1507. |
|
(5) |
Op 11 juli 2018 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 (5) een gunstig advies uitgebracht. De EFSA kwam tot de conclusie dat de genetisch gemodificeerde mais Bt11 × MIR162 × 1507 × GA21, zoals beschreven in de aanvraag, even veilig is als en uit voedingsoogpunt gelijkwaardig aan het niet genetisch gemodificeerde vergelijkingsmateriaal binnen de reikwijdte van de aanvraag. Wat betreft de drie subcombinaties die onder de aanvraag vallen, heeft de EFSA geconcludeerd dat zij geacht worden even veilig te zijn als de afzonderlijke transformatiestappen Bt11, MIR162, 1507 en GA21, de eerder beoordeelde subcombinaties en de in vier transformatiestappen gemodificeerde mais Bt11 × MIR162 × 1507 × GA21. |
|
(6) |
De EFSA heeft in haar advies aandacht besteed aan de vragen en bezorgdheden die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties, zoals bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(7) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij het beoogde gebruik van de producten. |
|
(8) |
Gezien het bovenstaande moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais Bt11 × MIR162 × 1507 × GA21 en de drie subcombinaties Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 en MIR162 × 1507 voor de in de aanvraag genoemde toepassingen. |
|
(9) |
Aan elk genetisch gemodificeerd organisme dat onder dit besluit valt, moet een eenduidig identificatienummer worden toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (6). |
|
(10) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (7). Om er echter voor te zorgen dat die producten binnen de grenzen van de door dit besluit verleende vergunning worden gebruikt, moet op de etikettering van die producten, met uitzondering van levensmiddelen, duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(11) |
Om verslag uit te brengen over de uitvoering en de resultaten van de in het monitoringplan voor de milieueffecten vermelde activiteiten moet de vergunninghouder jaarverslagen indienen, die worden gepresenteerd overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (8). |
|
(12) |
Het advies van de EFSA rechtvaardigt niet het opleggen van specifieke voorwaarden of beperkingen voor het in de handel brengen, het gebruik en de behandeling, inclusief voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van de levensmiddelen en diervoeders, of voor de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, als bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(13) |
Alle relevante informatie over het verlenen van de vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(14) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (9) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(15) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerde organismen en eenduidige identificatienummers
Overeenkomstig Verordening (EG) nr. 65/2004 worden aan de genetisch gemodificeerde mais, zoals gespecificeerd in de bijlage, onder b), bij dit besluit, de volgende eenduidige identificatienummers toegewezen:
|
a) |
het eenduidige identificatienummer SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9 voor de genetisch gemodificeerde mais (Zea mays L.) Bt11 × MIR162 × 1507 × GA21; |
|
b) |
het eenduidige identificatienummer SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 voor de genetisch gemodificeerde mais (Zea mays L.) Bt11 × MIR162 × 1507; |
|
c) |
het eenduidige identificatienummer SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9 voor de genetisch gemodificeerde mais (Zea mays L.) MIR162 × 1507 × GA21; |
|
d) |
het eenduidige identificatienummer SYN-IR162-4 × DAS-Ø15Ø7-1 voor de genetisch gemodificeerde mais (Zea mays L.) MIR162 × 1507. |
Artikel 2
Verlenen van een vergunning
Overeenkomstig de voorwaarden van dit besluit wordt voor de doeleinden van artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de in artikel 1 bedoelde genetisch gemodificeerde mais; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de in artikel 1 bedoelde genetisch gemodificeerde mais; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit de in artikel 1 bedoelde genetisch gemodificeerde mais voor andere toepassingen dan bedoeld in de punten a) en b), met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de in artikel 1 bedoelde genetisch gemodificeerde mais, met uitzondering van de in artikel 2, onder a), bedoelde producten.
Artikel 4
Detectiemethode
Voor de detectie van de in artikel 1 bedoelde genetisch gemodificeerde mais wordt de in de bijlage, onder d), vermelde methode gebruikt.
Artikel 5
Monitoringplan voor de milieueffecten
1. De vergunninghouder zorgt ervoor dat het in de bijlage, onder h), vermelde monitoringplan voor de milieueffecten wordt vastgesteld en uitgevoerd.
2. De vergunninghouder dient jaarlijks een verslag over de uitvoering en de resultaten van de in het monitoringplan opgenomen activiteiten bij de Commissie in overeenkomstig Beschikking 2009/770/EG.
Artikel 6
Communautair register
De informatie in de bijlage bij dit besluit wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De vergunninghouder is Syngenta Crop Protection AG, Zwitserland, vertegenwoordigd door Syngenta Crop Protection NV, België.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving.
Artikel 9
Adressaat
Dit besluit is gericht aan Syngenta Crop Protection NV/SA, Louizalaan 489, 1050 Brussel, België.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) Uitvoeringsbesluit (EU) 2016/1685 van de Commissie van 16 september 2016 tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais Bt11 × MIR162 × MIR604 × GA21, en genetisch gemodificeerde maissoorten die twee of drie van de transformatiestappen Bt11, MIR162, MIR604 en GA21 combineren, en tot intrekking van de Besluiten 2010/426/EU, 2011/892/EU, 2011/893/EU en 2011/894/EU (PB L 254 van 20.9.2016, blz. 22).
(4) Uitvoeringsbesluit (EU) 2017/1209 van de Commissie van 4 juli 2017 tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais Bt11 × 59122 × MIR604 × 1507 × GA21 en genetisch gemodificeerde maisrassen die twee, drie of vier van de transformatiestappen Bt11, 59122, MIR604, 1507 en GA21 combineren, overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad inzake genetisch gemodificeerde levensmiddelen en diervoeders (PB L 173 van 6.7.2017, blz. 28).
(5) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2018. Scientific Opinion on the assessment of genetically modified maize Bt11 × MIR162 × 1507 × GA21 and three subcombinations independently of their origin, for food and feed uses under Regulation (EC) No 1829/2003 (application EFSA-GMO-DE-2010-86). EFSA Journal 2018;16(7):5309.
(6) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(7) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(8) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(9) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder
|
Naam |
: |
Syngenta Crop Protection AG |
|
Adres |
: |
Schwarzwaldallee 215, CH-4058 Bazel, Zwitserland |
Vertegenwoordigd door Syngenta Crop Protection NV, Louizalaan 489, 1050 Brussel, België.
b) Benaming en specificatie van de producten
|
1) |
Levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais (Zea mays L.), zoals bedoeld onder e). |
|
2) |
Diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais (Zea mays L.), zoals bedoeld onder e). |
|
3) |
Producten die geheel of gedeeltelijk bestaan uit de onder e) bedoelde genetisch gemodificeerde mais voor andere toepassingen dan bedoeld in de punten 1) en 2), met uitzondering van de teelt. |
De genetisch gemodificeerde mais SYN-BTØ11-1 brengt het Cry1Ab-eiwit tot expressie, dat bescherming biedt tegen bepaalde schadelijke lepidoptera, alsook het PAT-eiwit dat tolerantie geeft voor op glufosinaat-ammonium gebaseerde herbiciden.
De genetisch gemodificeerde mais SYN-IR162-4 brengt het Vip3Aa20-eiwit tot expressie, dat bescherming biedt tegen bepaalde schadelijke lepidoptera, alsook het PMI-eiwit, dat als selectiemerker werd gebruikt.
De genetisch gemodificeerde mais DAS-Ø15Ø7-1 brengt het Cry1F-eiwit tot expressie, dat bescherming biedt tegen bepaalde schadelijke lepidoptera, alsook het PAT-eiwit dat tolerantie geeft voor op glufosinaat-ammonium gebaseerde herbiciden.
De genetisch gemodificeerde mais MON-ØØØ21-9 brengt het mEPSPS-eiwit tot expressie, dat tolerantie geeft voor op glyfosaat gebaseerde herbiciden.
c) Etikettering
|
1) |
Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”. |
|
2) |
De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk uit de onder e) gespecificeerde mais bestaan, met uitzondering van de in deze bijlage, onder b), 1), bedoelde producten. |
d) Detectiemethode
|
1) |
Voor de detectie van mais Bt11 × MIR162 × 1507 × GA21 gelden de kwantitatieve modificatiespecifieke PCR-methoden die zijn gevalideerd voor de genetisch gemodificeerde maislijnen SYN-BTØ11-1, SYN-IR162-4, DAS-Ø15Ø7-1 en MON-ØØØ21-9. |
|
2) |
Gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3) |
Referentiemateriaal: ERM®-BF412 (voor SYN-BTØ11-1) en ERM®-BF418 (voor DAS-Ø15Ø7-1) zijn toegankelijk via het Gemeenschappelijk Centrum voor onderzoek (JRC) van de Europese Commissie op https://ec.europa.eu/jrc/en/reference-materials/catalogue/ en AOCS 1208-A en AOCS 0407-A (voor SYN-IR162-4), AOCS 0407-A en AOCS 0407-B (voor MON-ØØØ21-9) zijn toegankelijk via de American Oil Chemists Society op https://www.aocs.org/crm#maize |
e) Eenduidige identificatienummers
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9;
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1;
SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9;
SYN-IR162-4 × DAS-Ø15Ø7-1.
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biodiversiteit gehechte Protocol van Cartagena inzake bioveiligheid
[Uitwisselingscentrum voor bioveiligheid, Record ID: wordt bij kennisgeving bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.]
g) Voorwaarden of beperkingen inzake het in de handel brengen, het gebruik of de behandeling van de producten
Geen.
h) Monitoringplan voor de milieueffecten
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.]
i) Voorschriften voor monitoring, na het in de handel brengen, van het gebruik van het levensmiddel voor menselijke consumptie
Geen.
Opmerking: Het kan gebeuren dat de links naar documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door bijwerking van het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/75 |
UITVOERINGSBESLUIT (EU) 2019/1306 VAN DE COMMISSIE
van 26 juli 2019
tot verlenging van de vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603 (DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5503)
(Slechts de teksten in de Nederlandse en Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 11, lid 3, en artikel 23, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Bij beschikking 2007/703/EG van de Commissie (2) is een vergunning verleend voor het in de handel brengen van levensmiddelen en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603 (hierna “mais 1507 × NK603” genoemd). Die vergunning omvat ook het in de handel brengen van andere producten dan levensmiddelen en diervoeders die geheel of gedeeltelijk bestaan uit mais 1507 × NK603, voor dezelfde gebruiksdoeleinden als andere mais, met uitzondering van de teelt. |
|
(2) |
Op 20 oktober 2016 hebben Pioneer Overseas Corporation — namens Pioneer Hi-Bred International, Inc. — en Dow AgroSciences Europe — namens Dow AgroSciences LLC — gezamenlijk bij de Commissie een aanvraag overeenkomstig de artikelen 11 en 23 van Verordening (EG) nr. 1829/2003 ingediend voor de verlenging van die vergunning. |
|
(3) |
Op 25 juli 2018 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 een gunstig advies uitgebracht (3). De EFSA is tot de conclusie gekomen dat de aanvraag tot verlenging geen gegevens bevat die wijzen op nieuwe gevaren, gewijzigde blootstelling of wetenschappelijke onzekerheden die zouden leiden tot een wijziging van de in 2006 door de EFSA geformuleerde conclusies van de oorspronkelijke risicobeoordeling van mais 1507 × NK603 (4) |
|
(4) |
De EFSA heeft in haar advies van 25 juli 2018 aandacht besteed aan alle vragen en punten van zorg die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties overeenkomstig artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(5) |
De EFSA heeft ook geconcludeerd dat het door de aanvragers ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij het beoogde gebruik van de producten. |
|
(6) |
Rekening houdend met die conclusies moet de vergunning voor het in de handel brengen van levensmiddelen en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais 1507 × NK603, en van producten die er geheel of gedeeltelijk uit bestaan, voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt, worden verlengd. |
|
(7) |
Bij brief van 13 september 2018 heeft Dow AgroSciences Europe de Commissie in het kader van de terugtrekking van het Verenigd Koninkrijk uit de Europese Unie verzocht Dow AgroSciences LLC, Verenigde Staten, in de Unie te laten vertegenwoordigen door Dow AgroSciences Distribution S.A.S., Frankrijk. Bij brief van 7 september 2018 heeft Dow AgroSciences Distribution S.A.S bevestigd hiermee in te stemmen. |
|
(8) |
Bij brief van 12 oktober 2018 heeft ook Dow AgroSciences LLC bevestigd ermee in te stemmen te worden vertegenwoordigd door Dow AgroSciences Distribution S.A.S. en verduidelijkt dat Mycogen Seeds een dochteronderneming is van Dow AgroSciences LLC. |
|
(9) |
Overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (5) is aan de genetisch gemodificeerde mais 1507 × NK603 een eenduidig identificatienummer toegekend in het kader van de oorspronkelijke verlening van een vergunning. Dat eenduidig identificatienummer moet verder worden gebruikt. |
|
(10) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (6). Om er echter voor te zorgen dat producten die geheel of gedeeltelijk bestaan uit mais 1507 × NK603 binnen de grenzen van de bij dit besluit verleende vergunning worden gebruikt, moet op het etiket van die producten — met uitzondering van levensmiddelen — duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(11) |
De vergunninghouders moeten gezamenlijk jaarverslagen indienen over de uitvoering en de resultaten van de in het monitoringplan vermelde activiteiten. Die resultaten moeten worden gepresenteerd overeenkomstig de voorschriften van Beschikking 2009/770/EG van de Commissie (7). |
|
(12) |
Het advies van de EFSA rechtvaardigt niet dat specifieke voorwaarden of beperkingen worden opgelegd voor het in de handel brengen, voor het gebruik en de behandeling — met inbegrip van voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van levensmiddelen en diervoeders — of voor de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, zoals bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(13) |
Alle relevante informatie over het verlenen van een vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(14) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (8) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(15) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Overeenkomstig Verordening (EG) nr. 65/2004 wordt aan de genetisch gemodificeerde mais (Zea mays L.) 1507 × NK603, zoals gespecificeerd in punt b) van de bijlage bij dit besluit, het eenduidige identificatienummer DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6 toegekend.
Artikel 2
Verlenging van de vergunning
Overeenkomstig de voorwaarden van dit besluit wordt de vergunning voor het in de handel brengen van de volgende producten verlengd:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde mais 1507 × NK603, voor andere toepassingen dan bedoeld in de punten a) en b) van dit artikel, met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde mais 1507 × NK603, met uitzondering van de in artikel 2, onder a), bedoelde producten.
Artikel 4
Detectiemethode
Voor de detectie van de genetisch gemodificeerde mais 1507 × NK603 wordt de in punt d) van de bijlage vermelde methode gebruikt.
Artikel 5
Monitoringplan voor de milieueffecten
1. De vergunninghouders zorgen ervoor dat het in punt h) van de bijlage vermelde monitoringplan voor de milieueffecten wordt opgesteld en uitgevoerd.
2. De vergunninghouders dienen gezamenlijk jaarverslagen over de uitvoering en de resultaten van de in het monitoringplan vermelde activiteiten bij de Commissie in overeenkomstig het formulier in Beschikking 2009/770/EG.
Artikel 6
Communautair register
De informatie in de bijlage bij dit besluit wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouders
1. De vergunninghouders zijn:
|
a) |
Pioneer Hi-Bred International, Inc., Verenigde Staten, vertegenwoordigd door Pioneer Overseas Corporation, België, en |
|
b) |
Dow AgroSciences LLC, Verenigde Staten, vertegenwoordigd door Dow AgroSciences Distribution S.A.S., Frankrijk. |
2. Beide vergunninghouders zijn verantwoordelijk voor het nakomen van de verplichtingen die bij dit besluit en bij Verordening (EG) nr. 1829/2003 aan vergunninghouders worden opgelegd.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving.
Artikel 9
Adressaten
Dit besluit is gericht tot:
|
a) |
Pioneer Overseas Corporation, Kunstlaan 44, 1040 Brussel, België, en |
|
b) |
Dow AgroSciences Distribution S.A.S., 6 rue Jean Pierre Timbaud, 78180 Montigny-le-Bretonneux, Frankrijk. |
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Beschikking 2007/703/EG van de Commissie van 24 oktober 2007 tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603 (DAS-Ø15Ø7-1xMON-ØØ6Ø3-6) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad (PB L 285 van 31.10.2007, blz. 47).
(3) EFSA GMO Panel 2018. Scientific Opinion on the assessment of genetically modified maize 1507 × NK603 for renewal of authorisation under Regulation (EC) No 1829/2003 (application EFSA-GMO-RX-008). EFSA Journal 2018;16(7): 5347.
(4) Opinion of the Scientific Panel on Genetically Modified Organisms on an application (Reference EFSA-GMO-UK-2004-05) for the placing on the market of insect-protected and glufosinate and glyphosate-tolerant genetically modified maize 1507 × NK603, for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Pioneer Hi-Bred and Mycogen Seeds. EFSA Journal 2006;4(5): 355.
(5) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(6) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(7) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(8) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvragers en vergunninghouders:
|
Naam |
: |
Pioneer Hi-Bred International, Inc. |
|
Adres |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, Verenigde Staten |
Vertegenwoordigd door: Pioneer Overseas Corporation, Kunstlaan 44, 1040 Brussel, België;
en
|
Naam |
: |
Dow AgroSciences LLC |
|
Adres |
: |
9330 Zionsville Road, Indianapolis, IN 46268-1054, Verenigde Staten |
Vertegenwoordigd door: Dow AgroSciences Distribution S.A.S., 6 rue Jean Pierre Timbaud, 78180 Montigny-le-Bretonneux, Frankrijk.
b) Benaming en specificatie van de producten:
|
1) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603; |
|
2) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde mais 1507 × NK603; |
|
3) |
producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde mais 1507 × NK603, voor andere toepassingen dan bedoeld in de punten 1) en 2), met uitzondering van de teelt. |
De genetisch gemodificeerde mais 1507 × NK603 brengt het cry1F-gen tot expressie, dat bescherming biedt tegen bepaalde schadelijke lepidoptera, het pat-gen, dat tolerantie geeft voor herbiciden op basis van glufosinaat-ammonium, en het cp4 epsps-gen, dat tolerantie geeft voor herbiciden op basis van glyfosaat.
c) Etikettering:
|
1) |
Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “mais”. |
|
2) |
De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde mais 1507 × NK603, met uitzondering van de in punt b), onder 1), van deze bijlage bedoelde producten. |
d) Detectiemethode:
|
1) |
Eventspecifieke real-time kwantitatieve PCR-gebaseerde methoden voor genetisch gemodificeerde mais DAS-Ø15Ø7-1 en mais MON-ØØ6Ø3-6, gevalideerd op mais DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6. |
|
2) |
Gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3) |
Referentiemateriaal: ERM®-BF418 (voor DAS-Ø15Ø7-1) en ERM®-BF415 (voor MON-ØØ6Ø3-6), toegankelijk via het Gemeenschappelijk Centrum voor onderzoek (GCO) van de Europese Commissie op https://ec.europa.eu/jrc/en/reference-materials/catalogue/ |
e) Eenduidig identificatienummer:
DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biodiversiteit gehechte Protocol van Cartagena inzake bioveiligheid:
[uitwisselingscentrum voor bioveiligheid, Record ID number: wordt bij kennisgeving bekendgemaakt in het register van genetisch gemodificeerde levensmiddelen en diervoeders].
g) Voorwaarden of beperkingen inzake het in de handel brengen, het gebruik of de behandeling van de producten:
Geen.
h) Monitoringplan voor de milieueffecten:
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (1).
[Link: plan bekendgemaakt in het register van genetisch gemodificeerde levensmiddelen en diervoeders]
i) Voorschriften voor monitoring na het in de handel brengen bij gebruik van het levensmiddel voor menselijke consumptie:
Geen.
Opmerking: Het kan gebeuren dat de links naar documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door het register van genetisch gemodificeerde levensmiddelen en diervoeders bij te werken.
(1) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/81 |
UITVOERINGSBESLUIT (EU) 2019/1307 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais MON 87403 (MON-874Ø3-1) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5481)
(Slechts de teksten in de Nederlandse en de Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 26 juni 2015 heeft Monsanto Europe nv namens Monsanto Company, Verenigde Staten van Amerika, bij de bevoegde nationale instantie van België en overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 een aanvraag ingediend voor het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais MON 87403 (“de aanvraag”). De aanvraag betrof ook het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais MON 87403 voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt. |
|
(2) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag zowel gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling als de uit hoofde van de bijlagen III en IV bij die richtlijn vereiste informatie. De aanvraag omvatte eveneens een monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG. |
|
(3) |
Op 26 april 2018 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 een gunstig advies uitgebracht (3). Zij heeft geconcludeerd dat in de aanvraag beschreven genetisch gemodificeerde mais MON 87403 wat betreft de mogelijke gevolgen voor de gezondheid van mens en dier of het milieu even veilig is als de conventionele tegenhanger ervan en de geteste niet-genetisch gemodificeerde referentievariëteiten van mais. |
|
(4) |
De EFSA heeft in haar advies aandacht besteed aan alle vragen en bezorgdheden die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties, zoals bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(5) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansloot bij het beoogde gebruik van de producten. |
|
(6) |
Gezien het bovenstaande moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais MON 87403 voor de in de aanvraag genoemde toepassingen. |
|
(7) |
Per brief met dagtekening 27 augustus 2018 heeft Monsanto Europe nv de Commissie ervan in kennis gesteld dat Monsanto Europe nv van wettelijke vorm is veranderd, en voortaan Bayer Agriculture bvba, België, heet. |
|
(8) |
Aan genetisch gemodificeerde mais MON 87403 moet een eenduidig identificatienummer worden toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (4). |
|
(9) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (5). Om er echter voor te zorgen dat dergelijke producten binnen de grenzen van de door dit besluit verleende vergunning worden gebruikt, moet op het etiket van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais MON 87403, met uitzondering van levensmiddelen, ook duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(10) |
Om verslag uit te brengen over de uitvoering en de resultaten van de in het monitoringplan voor de milieueffecten vermelde activiteiten moet de vergunninghouder jaarverslagen indienen, die worden gepresenteerd overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (6). |
|
(11) |
Het advies van de EFSA rechtvaardigt niet het opleggen van specifieke voorwaarden of beperkingen voor het in de handel brengen, het gebruik en de behandeling, met inbegrip van voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van levensmiddelen en diervoeders, of de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, als bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(12) |
Alle relevante informatie over het verlenen van de vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(13) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (7) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(14) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Aan de genetisch gemodificeerde mais (Zea mays L.) MON 87403, als nader gespecificeerd in punt b) van de bijlage bij dit besluit, wordt het eenduidige identificatienummer MON-874Ø3-1 toegekend, overeenkomstig Verordening (EG) nr. 65/2004.
Artikel 2
Vergunningverlening
Krachtens artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 wordt, overeenkomstig de voorwaarden van dit besluit, een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-874Ø3-1; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-874Ø3-1; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit mais MON-874Ø3-1 voor andere toepassingen dan bedoeld onder a) en b) van dit artikel, met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de “naam van het organisme”“mais”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk uit mais MON-874Ø3-1 bestaan, met uitzondering van de in artikel 2, onder a), bedoelde producten.
Artikel 4
Detectiemethode
Voor de detectie van mais MON-874Ø3-1 wordt de in punt d) van de bijlage vastgestelde methode gebruikt.
Artikel 5
Monitoringplan voor de milieueffecten
1. De vergunninghouder zorgt ervoor dat het in punt h) van de bijlage vermelde monitoringplan voor de milieueffecten wordt vastgesteld en uitgevoerd.
2. De vergunninghouder dient jaarlijks een verslag over de uitvoering van het monitoringplan en de resultaten van de monitoring bij de Commissie in overeenkomstig Beschikking 2009/770/EG.
Artikel 6
Communautair register
De informatie in de bijlage bij dit besluit wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De vergunninghouder is Monsanto Company, Verenigde Staten, vertegenwoordigd door Bayer Agriculture bvba, België.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving.
Artikel 9
Adressaat
Dit besluit is gericht tot Bayer Agriculture bvba, Scheldelaan 460, 2040 Antwerpen, België.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2018. Scientific Opinion on the assessment of genetically modified maize MON 87403 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-BE-2015-125). EFSA Journal 2018;16(3):5225, 28 pp. https://doi.org/10.2903/j.efsa.2018.5225
(4) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(5) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(6) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(7) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder
|
Naam |
: |
Monsanto Company |
|
Adres |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Verenigde Staten van Amerika |
Vertegenwoordigd door Bayer Agriculture bvba, Scheldelaan 460, 2040 Antwerpen, België.
b) Benaming en specificatie van de producten
|
1. |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-874Ø3-1; |
|
2. |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-874Ø3-1; |
|
3. |
producten die geheel of gedeeltelijk bestaan uit mais MON-874Ø3-1 voor andere toepassingen dan bedoeld in de punten 1) en 2), met uitzondering van de teelt. |
De genetisch gemodificeerde mais MON-874Ø3-1 is ontwikkeld om de biomassa van de aren vroeg in de reproductieve cyclus te verhogen via het tot uitdrukking brengen van het (door een gen van Arabidopsis thaliana gecodeerde) AtHB17Δ113-eiwit.
c) Etikettering
|
1. |
voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de “naam van het organisme”“mais”; |
|
2. |
de woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk uit mais MON-874Ø3-1 bestaan, met uitzondering van de in artikel 2, onder a), bedoelde producten. |
d) Detectiemethode
|
1. |
modificatiespecifieke realtime kwantitatieve PCR-gebaseerde methode voor de detectie van de genetisch gemodificeerde mais MON-874Ø3-1; |
|
2. |
gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium (gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx); |
|
3. |
referentiemateriaal: AOCS 0216-A is te vinden op de website van de American Oil Chemists' Society (AOCS) (http://www.aocs.org/crm). |
e) Eenduidig identificatienummer
MON-874Ø3-1
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid
[uitwisselingscentrum voor bioveiligheid, Record ID number: wordt bij kennisgeving bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders].
g) Voorwaarden of beperkingen inzake het in de handel brengen, het gebruik of de behandeling van de producten
Geen.
h) Monitoringplan voor de milieueffecten
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het register van genetisch gemodificeerde levensmiddelen en diervoeders]
i) Voorschriften voor monitoring na het in de handel brengen bij gebruik van het levensmiddel voor menselijke consumptie
Geen.
Opmerking: Het kan gebeuren dat de links naar documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door het register van genetisch gemodificeerde levensmiddelen en diervoeders bij te werken.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/85 |
UITVOERINGSBESLUIT (EU) 2019/1308 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais MON 87411 (MON-87411-9) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5487)
(Slechts de teksten in de Nederlandse en de Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 5 februari 2015 heeft Monsanto Europe N.V. namens Monsanto Company, Verenigde Staten van Amerika, overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 bij de bevoegde nationale instantie van Nederland een aanvraag ingediend voor het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON 87411 (“de aanvraag”). De aanvraag had ook betrekking op het in de handel brengen van producten die bestaan uit genetisch gemodificeerde mais MON 87411, voor andere toepassingen dan als levensmiddel of als diervoeder die ook voor andere maissoorten zijn toegelaten, met uitzondering van de teelt. |
|
(2) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag de gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling, alsmede de in de bijlagen III en IV bij die richtlijn omschreven gegevens. De aanvraag omvatte eveneens een monitoringplan voor de milieueffecten als vastgesteld in bijlage VII bij Richtlijn 2001/18/EG. |
|
(3) |
Op 2 juli 2018 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 (3) een gunstig advies uitgebracht. Zij heeft geconcludeerd dat in de aanvraag beschreven genetisch gemodificeerde mais MON 87411 wat betreft de mogelijke gevolgen voor de gezondheid van mens en dier en voor het milieu even veilig is als en uit voedingsoogpunt gelijkwaardig is met de conventionele tegenhanger ervan en de geteste niet genetisch gemodificeerde referentievariëteiten van mais. |
|
(4) |
De EFSA heeft in haar advies aandacht besteed aan alle kwesties en problemen die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties als bedoeld in artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(5) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij de beoogde toepassingen van de producten. |
|
(6) |
Rekening houdend met die conclusies, moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met genetisch gemodificeerde mais MON 87411 voor de in de aanvraag genoemde toepassingen. |
|
(7) |
Bij brief van 27 augustus 2018 heeft Monsanto Europe N.V. de Commissie ervan in kennis gesteld dat Monsanto Europe N.V. van rechtsvorm is veranderd en voortaan Bayer Agriculture BVBA, België, heet. |
|
(8) |
Aan genetisch gemodificeerde mais MON 87411 moet een eenduidig identificatienummer worden toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (4). |
|
(9) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (5). Om er echter voor te zorgen dat die producten binnen de grenzen van de bij dit besluit verleende vergunning worden gebruikt, moet op het etiket van producten die geheel of gedeeltelijk bestaan uit genetisch gemodificeerde mais MON 87411, met uitzondering van levensmiddelen, duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(10) |
Om verantwoording af te leggen over de uitvoering en de resultaten van de in het monitoringplan voor de milieueffecten vermelde activiteiten moet de vergunninghouder jaarverslagen indienen, die worden gepresenteerd overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (6). |
|
(11) |
Het advies van de EFSA rechtvaardigt niet het opleggen van specifieke voorwaarden of beperkingen voor het in de handel brengen, het gebruik en de behandeling, met inbegrip van voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van levensmiddelen en diervoeders, of de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, als bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(12) |
Alle relevante gegevens over het verlenen van de vergunning voor de producten moeten worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(13) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (7) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(14) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Aan genetisch gemodificeerde mais (Zea mays L.) MON 87411, als nader gespecificeerd in punt b) van de bijlage bij dit besluit, wordt het eenduidige identificatienummer MON-87411-9 toegekend, als bedoeld in Verordening (EG) nr. 65/2004.
Artikel 2
Vergunningverlening
Overeenkomstig de voorwaarden van dit besluit wordt voor de doeleinden van artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-87411-9; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-87411-9; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit mais MON-87411-9, voor andere toepassingen dan bedoeld onder a) en b), met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de toepassing van de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 luidt de “naam van het organisme”“mais”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit mais MON-87411-9, met uitzondering van de in artikel 2, onder a), bedoelde producten.
Artikel 4
Detectiemethode
Voor de detectie van mais MON-87411-9 wordt de in punt d) van de bijlage vastgestelde methode gebruikt.
Artikel 5
Monitoring van milieueffecten
1. De vergunninghouder zorgt ervoor dat het in punt h) van de bijlage vermelde monitoringplan voor de milieueffecten wordt vastgesteld en uitgevoerd.
2. Overeenkomstig Beschikking 2009/770/EG dient de vergunninghouder bij de Commissie elk jaar een verslag in over de uitvoering en de resultaten van de activiteiten die in het monitoringplan zijn opgenomen.
Artikel 6
Communautair register
De gegevens in de bijlage bij dit besluit worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De vergunninghouder is Monsanto Company, Verenigde Staten van Amerika, vertegenwoordigd door Bayer Agriculture BVBA, België.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving ervan.
Artikel 9
Adressaat
Dit besluit is gericht tot Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, België.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) Ggo-panel van de EFSA (Panel van de EFSA voor genetisch gemodificeerde organismen), 2018. Scientific opinion on the assessment of genetically modified maize MON 87411 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2015-124). EFSA Journal 2018; 16(6):5310, 29 blz. doi: 10.2903/j.efsa.2018.5310.
(4) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(5) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(6) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(7) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder
|
naam |
: |
Monsanto Company |
|
adres |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Verenigde Staten van Amerika. |
Vertegenwoordigd door Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, België.
b) Benaming en specificatie van de producten
|
1. |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-87411-9; |
|
2. |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met mais MON-87411-9; |
|
3. |
producten die geheel of gedeeltelijk bestaan uit mais MON-87411-9, voor andere toepassingen dan bedoeld onder 1) en 2), met uitzondering van de teelt. |
Genetisch gemodificeerde mais MON-87411-9 brengt het CP4 EPSPS-eiwit tot expressie, dat tolerantie geeft voor op glyfosaat gebaseerde herbiciden, alsmede het Cry3Bb1-eiwit en het DvSnf7-dsRNA, die resistentie verlenen tegen de maiswortelboorder (Diabrotica spp.).
c) Etikettering
|
1. |
voor de toepassing van de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 luidt de “naam van het organisme”“mais”; |
|
2. |
de woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit mais MON-87411-9, met uitzondering van de in punt b), onder 1), van deze bijlage bedoelde producten. |
d) Detectiemethode
|
1. |
modificatiespecifieke realtime kwantitatieve PCR-methode voor de detectie van genetisch gemodificeerde mais MON 87411; |
|
2. |
gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3. |
referentiemateriaal: AOCS 0215-B, toegankelijk via de American Oil Chemists' Society (AOCS) op https://www.aocs.org/crm |
e) Eenduidig identificatienummer
MON-87411-9
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid
[uitwisselingscentrum voor bioveiligheid, Record ID: wordt bij kennisgeving bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders].
g) Voorwaarden of beperkingen met betrekking tot het in de handel brengen, het gebruik of de behandeling van de producten
geen.
h) Monitoringplan voor de milieueffecten
monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders]
i) Voorschriften voor monitoring, na het in de handel brengen, van het gebruik van het levensmiddel voor menselijke consumptie
geen.
Opmerking: Het kan gebeuren dat de links naar de documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door bijwerking van het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/90 |
UITVOERINGSBESLUIT (EU) 2019/1309 VAN DE COMMISSIE
van 26 juli 2019
tot verlening van een vergunning voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON 87751 (MON-87751-7) overeenkomstig Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad
(Kennisgeving geschied onder nummer C(2019) 5489)
(Slechts de teksten in de Nederlandse en Franse taal zijn authentiek)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad van 22 september 2003 inzake genetisch gemodificeerde levensmiddelen en diervoeders (1), en met name artikel 7, lid 3, en artikel 19, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Op 26 september 2014 heeft Monsanto Europe SA/N.V. namens Monsanto Company, Verenigde Staten, bij de bevoegde nationale instantie van Nederland en overeenkomstig de artikelen 5 en 17 van Verordening (EG) nr. 1829/2003 een aanvraag ingediend voor het in de handel brengen van levensmiddelen, levensmiddeleningrediënten en diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON 87751 (hierna “de aanvraag” genoemd). De aanvraag betrof ook het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde soja MON 87751 voor andere toepassingen dan als levensmiddel of als diervoeder, met uitzondering van de teelt. |
|
(2) |
Overeenkomstig artikel 5, lid 5, en artikel 17, lid 5, van Verordening (EG) nr. 1829/2003 omvatte de aanvraag zowel gegevens en conclusies inzake de overeenkomstig de beginselen van bijlage II bij Richtlijn 2001/18/EG van het Europees Parlement en de Raad (2) uitgevoerde risicobeoordeling als de uit hoofde van de bijlagen III en IV bij die richtlijn vereiste informatie. De aanvraag omvatte eveneens een monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG. |
|
(3) |
Op 2 augustus 2018 heeft de Europese Autoriteit voor voedselveiligheid (EFSA) overeenkomstig de artikelen 6 en 18 van Verordening (EG) nr. 1829/2003 een gunstig advies uitgebracht (3). De EFSA is tot de conclusie gekomen dat — wat betreft de mogelijke gevolgen voor het milieu en de gezondheid van mens en dier — de in de aanvraag beschreven genetisch gemodificeerde soja MON 87751 even veilig is en dezelfde voedingswaarde heeft als de conventionele tegenhanger ervan en de geteste niet genetisch gemodificeerde referentievariëteiten van soja. |
|
(4) |
De EFSA heeft in haar advies aandacht besteed aan alle vragen en punten van zorg die de lidstaten aan de orde hebben gesteld in het kader van de raadpleging van de bevoegde nationale instanties overeenkomstig artikel 6, lid 4, en artikel 18, lid 4, van Verordening (EG) nr. 1829/2003. |
|
(5) |
De EFSA heeft ook geconcludeerd dat het door de aanvrager ingediende monitoringplan voor de milieueffecten, dat bestaat uit een algemeen toezichtsplan, aansluit bij het beoogde gebruik van de producten. |
|
(6) |
Rekening houdend met die conclusies moet een vergunning worden verleend voor het in de handel brengen van producten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON 87751, voor de in de aanvraag vermelde toepassingen. |
|
(7) |
Bij brief van 27 augustus 2018 heeft Monsanto Europe N.V. de Commissie meegedeeld dat Monsanto Europe N.V. van rechtsvorm is veranderd en voortaan Bayer Agriculture BVBA, België, heet. |
|
(8) |
Aan de genetisch gemodificeerde soja MON 87751 moet een eenduidig identificatienummer worden toegekend overeenkomstig Verordening (EG) nr. 65/2004 van de Commissie (4). |
|
(9) |
Op grond van het advies van de EFSA lijken voor de onder dit besluit vallende producten geen andere specifieke etiketteringsvoorschriften nodig te zijn dan die van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en die van artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad (5). Om er echter voor te zorgen dat die producten binnen de grenzen van de bij dit besluit verleende vergunning worden gebruikt, moet op het etiket van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde soja MON 87751 — met uitzondering van levensmiddelen — duidelijk worden vermeld dat zij niet voor de teelt zijn bedoeld. |
|
(10) |
Om verslag uit te brengen over de uitvoering en de resultaten van de in het monitoringplan voor de milieueffecten vermelde activiteiten moet de vergunninghouder jaarverslagen indienen overeenkomstig de voorschriften inzake standaardrapportageformulieren van Beschikking 2009/770/EG van de Commissie (6). |
|
(11) |
Het advies van de EFSA rechtvaardigt niet dat specifieke voorwaarden of beperkingen worden opgelegd voor het in de handel brengen, voor het gebruik en de behandeling — met inbegrip van voorschriften voor monitoring na het in de handel brengen betreffende de consumptie van levensmiddelen en diervoeders — of voor de bescherming van bepaalde ecosystemen/het milieu of geografische gebieden, zoals bedoeld in artikel 6, lid 5, onder e), en artikel 18, lid 5, onder e), van Verordening (EG) nr. 1829/2003. |
|
(12) |
Alle relevante informatie over het verlenen van een vergunning voor de producten moet worden opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders. |
|
(13) |
Krachtens artikel 9, lid 1, en artikel 15, lid 2, onder c), van Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad (7) moeten de partijen bij het aan het Verdrag inzake biologische diversiteit gehechte Protocol van Cartagena inzake bioveiligheid van dit besluit in kennis worden gesteld via het uitwisselingscentrum voor bioveiligheid. |
|
(14) |
Het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders heeft binnen de door zijn voorzitter vastgestelde termijn geen advies uitgebracht. Deze uitvoeringshandeling werd nodig geacht en de voorzitter heeft haar voor verder beraad aan het comité van beroep voorgelegd. Het comité van beroep heeft geen advies uitgebracht, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Genetisch gemodificeerd organisme en eenduidig identificatienummer
Overeenkomstig Verordening (EG) nr. 65/2004 wordt aan de genetisch gemodificeerde soja (Glycine max (L.) Merr.) MON 87751, zoals gespecificeerd in punt b) van de bijlage bij dit besluit, het eenduidige identificatienummer MON-87751-7 toegekend.
Artikel 2
Verlenen van een vergunning
Overeenkomstig de voorwaarden van dit besluit wordt voor de doeleinden van artikel 4, lid 2, en artikel 16, lid 2, van Verordening (EG) nr. 1829/2003 een vergunning verleend voor de volgende producten:
|
a) |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON-87751-7; |
|
b) |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON-87751-7; |
|
c) |
producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde soja MON-87751-7, voor andere toepassingen dan bedoeld in de punten a) en b), met uitzondering van de teelt. |
Artikel 3
Etikettering
1. Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “soja”.
2. De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde soja MON-87751-7, met uitzondering van de in artikel 2, onder a), bedoelde producten.
Artikel 4
Detectiemethode
Voor de detectie van de genetisch gemodificeerde soja MON-87751-7 wordt de in punt d) van de bijlage vermelde methode gebruikt.
Artikel 5
Monitoringplan voor de milieueffecten
1. De vergunninghouder zorgt ervoor dat het in punt h) van de bijlage vermelde monitoringplan voor de milieueffecten wordt opgesteld en uitgevoerd.
2. De vergunninghouder dient jaarverslagen over de uitvoering en de resultaten van de in het monitoringplan vermelde activiteiten bij de Commissie in overeenkomstig Beschikking 2009/770/EG.
Artikel 6
Communautair register
De informatie in de bijlage wordt opgenomen in het in artikel 28, lid 1, van Verordening (EG) nr. 1829/2003 bedoelde communautair register van genetisch gemodificeerde levensmiddelen en diervoeders.
Artikel 7
Vergunninghouder
De vergunninghouder is Monsanto Company, Verenigde Staten, vertegenwoordigd door Bayer Agriculture BVBA, België.
Artikel 8
Geldigheid
Dit besluit is van toepassing gedurende een periode van tien jaar met ingang van de datum van kennisgeving.
Artikel 9
Adressaat
Dit besluit is gericht tot Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, België.
Gedaan te Brussel, 26 juli 2019.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 18.10.2003, blz. 1.
(2) Richtlijn 2001/18/EG van het Europees Parlement en de Raad van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu en tot intrekking van Richtlijn 90/220/EEG van de Raad (PB L 106 van 17.4.2001, blz. 1).
(3) EFSA GMO Panel (EFSA Panel on genetically Modified Organisms), 2018. Scientific opinion on the assessment of genetically modified soybean MON 87751 for food and feed uses under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014—121). EFSA Journal 2018; 16(8):5346, 32 blz. doi: 10.2903/j.efsa.2018.5346.
(4) Verordening (EG) nr. 65/2004 van de Commissie van 14 januari 2004 tot vaststelling van een systeem voor de ontwikkeling en toekenning van eenduidige identificatienummers voor genetisch gemodificeerde organismen (PB L 10 van 16.1.2004, blz. 5).
(5) Verordening (EG) nr. 1830/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende de traceerbaarheid en etikettering van genetisch gemodificeerde organismen en de traceerbaarheid van met genetisch gemodificeerde organismen geproduceerde levensmiddelen en diervoeders en tot wijziging van Richtlijn 2001/18/EG (PB L 268 van 18.10.2003, blz. 24).
(6) Beschikking 2009/770/EG van de Commissie van 13 oktober 2009 tot vaststelling van standaardrapportageformulieren voor de presentatie van de resultaten van monitoring van de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu, als product of in producten en met het oog op het in de handel brengen, overeenkomstig Richtlijn 2001/18/EG van het Europees Parlement en de Raad (PB L 275 van 21.10.2009, blz. 9).
(7) Verordening (EG) nr. 1946/2003 van het Europees Parlement en de Raad van 15 juli 2003 betreffende de grensoverschrijdende verplaatsing van genetisch gemodificeerde organismen (PB L 287 van 5.11.2003, blz. 1).
BIJLAGE
a) Aanvrager en vergunninghouder
|
Naam |
: |
Monsanto Company |
|
Adres |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Verenigde Staten van Amerika |
Vertegenwoordigd door Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, België.
b) Benaming en specificatie van de producten
|
1. |
levensmiddelen en levensmiddeleningrediënten die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON-87751-7; |
|
2. |
diervoeders die geheel of gedeeltelijk bestaan uit of zijn geproduceerd met de genetisch gemodificeerde soja MON-87751-7; |
|
3. |
producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde soja MON-87751-7, voor andere toepassingen dan bedoeld in de punten 1) en 2), met uitzondering van de teelt. |
De genetisch gemodificeerde soja MON-87751-7 is ontwikkeld om bescherming te bieden tegen bepaalde schadelijke lepidoptera via de expressie van de cry1A.105- en cry2Ab2-genen.
c) Etikettering
|
1. |
Voor de etiketteringsvoorschriften van artikel 13, lid 1, en artikel 25, lid 2, van Verordening (EG) nr. 1829/2003 en artikel 4, lid 6, van Verordening (EG) nr. 1830/2003 is de naam van het organisme “soja”. |
|
2. |
De woorden “niet voor teeltdoeleinden” worden aangebracht op het etiket en in de begeleidende documenten van producten die geheel of gedeeltelijk bestaan uit de genetisch gemodificeerde soja MON-87751-7, met uitzondering van de in punt b), onder 1), van deze bijlage bedoelde producten. |
d) Detectiemethode
|
1. |
Modificatiespecifieke realtime kwantitatieve PCR-detectiemethoden voor de genetisch gemodificeerde soja MON-87751-7. |
|
2. |
Gevalideerd door het bij Verordening (EG) nr. 1829/2003 ingestelde EU-referentielaboratorium, gepubliceerd op http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3. |
Referentiemateriaal: AOCS 0215-A is toegankelijk via de American Oil Chemists' Society (AOCS) op https://www.aocs.org/crm |
e) Eenduidig identificatienummer
MON-87751-7
f) Informatie die vereist is krachtens bijlage II bij het aan het Verdrag inzake biodiversiteit gehechte Protocol van Cartagena inzake bioveiligheid
[uitwisselingscentrum voor bioveiligheid, Record ID number: wordt bij kennisgeving bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders].
g) Voorwaarden of beperkingen inzake het in de handel brengen, het gebruik of de behandeling van de producten
Geen.
h) Monitoringplan voor de milieueffecten
Monitoringplan voor de milieueffecten overeenkomstig bijlage VII bij Richtlijn 2001/18/EG.
[Link: plan bekendgemaakt in het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders]
i) Voorschriften voor monitoring na het in de handel brengen bij gebruik van het levensmiddel voor menselijke consumptie
Geen.
Opmerking: Het kan gebeuren dat de links naar de documenten na verloop van tijd gewijzigd moeten worden. Dergelijke wijzigingen worden bekendgemaakt door het communautair register van genetisch gemodificeerde levensmiddelen en diervoeders bij te werken.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/94 |
UITVOERINGSBESLUIT (EU) 2019/1310 VAN DE COMMISSIE
van 31 juli 2019
tot vaststelling van regels voor de werking van de Europese pool voor civiele bescherming en rescEU
(Kennisgeving geschied onder nummer C(2019) 5614)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Besluit nr. 1313/2013/EU van het Europees Parlement en de Raad van 17 december 2013 betreffende een Uniemechanisme voor civiele bescherming (1), en met name artikel 32, lid 1, onder g),
Overwegende hetgeen volgt:
|
(1) |
Met inachtneming van de primaire verantwoordelijkheid van de lidstaten voor de preventie, de paraatheid en de respons ten aanzien van natuurrampen en door de mens veroorzaakte rampen, bevordert het Uniemechanisme solidariteit en samenwerking tussen de lidstaten overeenkomstig respectievelijk artikel 3, lid 3, van het Verdrag betreffende de Europese Unie (VEU) en artikel 196 van het Verdrag betreffende de werking van de Europese Unie (VWEU). |
|
(2) |
Met de vaststelling van Besluit (EU) 2019/420 van het Europees Parlement en de Raad (2) werd het Uniemechanisme versterkt door de verhoging van de financiële steun van de Unie voor de Europese pool voor civiele bescherming en met de oprichting van rescEU. |
|
(3) |
Overeenkomstig artikel 21, lid 2, onder c), van Besluit nr. 1313/2013/EU moet de responscapaciteit die financiële steun van de Unie voor aanpassingskosten ontvangt, beschikbaar worden gesteld als onderdeel van de Europese pool voor civiele bescherming voor een minimumperiode die gekoppeld is aan de ontvangen financiering, en die varieert van 3 tot 10 jaar na de daadwerkelijke beschikbaarheidsdatum. De exacte beschikbaarheidstermijnen moeten worden gespecificeerd om de rechtszekerheid te waarborgen. |
|
(4) |
rescEU moet bijstand te verlenen in situaties van overmacht waarbij de algehele bestaande capaciteit op nationaal niveau en de door de lidstaten aan de Europese pool voor civiele bescherming toegezegde capaciteit tekortschieten om doeltreffend te reageren op rampen. Er moeten regels worden vastgesteld voor de oprichting, het beheer en het onderhoud van de rescEU-capaciteit om ervoor te zorgen dat rescEU op een doeltreffende wijze wordt uitgevoerd. |
|
(5) |
rescEU-capaciteit wordt beschikbaar gesteld voor responsoperaties in het kader van het Uniemechanisme. Naar aanleiding van een verzoek om bijstand via het Coördinatiecentrum voor respons in noodsituaties (ERCC) neemt de Commissie, in nauwe samenwerking met de verzoekende lidstaat en de lidstaat die de rescEU-capaciteit bezit, huurt of least, een besluit over de inzet van die capaciteit. Om een doeltreffend en transparant besluitvormingsproces te waarborgen, moeten criteria voor besluiten tot inzet en relevante operationele procedures worden vastgesteld. Voorts moeten criteria worden vastgesteld voor de besluitvorming over de inzet in geval van onverenigbare verzoeken om het gebruik van de rescEU-capaciteit. |
|
(6) |
rescEU-capaciteit kan voor nationale doeleinden worden gebruikt wanneer zij niet wordt gebruikt of nodig is voor responsoperaties in het kader van het Uniemechanisme. Om te garanderen dat rescEU capaciteit paraat en inzetbaar is in het kader van het Uniemechanisme binnen het tijdsbestek dat is vastgesteld op basis van de kwaliteitsvereisten voor elke type van rescEU capaciteit, moeten passende regels voor hun nationaal gebruik worden vastgesteld. |
|
(7) |
Wanneer rescEU capaciteit voor nationale doeleinden wordt gebruikt, moeten de lidstaten de Commissie hiervan in kennis stellen. Het meldingssysteem in geval van nationaal gebruik van rescEU capaciteit moet eenvoudig en doeltreffend zijn. |
|
(8) |
Met het oog op operationele efficiëntie moeten duidelijke regels worden vastgesteld inzake ontbinding en terugtrekking van rescEU-capaciteit. |
|
(9) |
Overeenkomstig artikel 12, lid 10, van Besluit nr. 1313/2013/EU kunnen lidstaten in specifieke gevallen weigeren personeel beschikbaar te stellen om rescEU-capaciteit buiten de Unie in te zetten. Er moeten regels worden vastgesteld voor die specifieke gevallen. |
|
(10) |
Bij de vaststelling van Uitvoeringsbesluit (EU) 2019/570 van de Commissie (3) werd de capaciteit voor de bestrijding van bosbranden vanuit de lucht gedefinieerd als rescEU-capaciteit. Om overeenkomstig artikel 21, lid 3, van Besluit nr. 1313/2013/EU financiële bijstand van de Unie te verlenen voor de ontwikkeling van dergelijke capaciteiten, moeten de totale geraamde kosten ervan worden vastgesteld. De totale geraamde kosten moeten worden berekend met inachtneming van de in bijlage I BIS bij Besluit nr. 1313/2013/EU vastgestelde categorieën van subsidiabele kosten. |
|
(11) |
Om de inzettermijnen te verkorten en de rechtszekerheid te verbeteren, moeten de voorwaarden voor het onderbrengen en exploiteren van rescEU-capaciteit worden verduidelijkt. Deze voorwaarden moeten de basis vormen voor operationele contracten tussen de Commissie en de lidstaten. |
|
(12) |
Om de nodige zichtbaarheid te geven aan de Unie wanneer rescEU-capaciteit wordt ingezet en om te zorgen voor uniforme voorwaarden voor de uitvoering van artikel 20 bis van Besluit nr. 1313/2013/EU, moeten in dit besluit regels voor passende zichtbaarheidsregelingen worden vastgesteld. |
|
(13) |
De rescEU-capaciteit moet worden geregistreerd, gecertificeerd en adequaat door de lidstaten worden onderhouden overeenkomstig de bestaande nationale en internationale regelgeving. Het certificeringsproces van het Uniemechanisme moet ook worden voltooid. |
|
(14) |
Met de inwerkingtreding op 21 maart 2019 van Besluit (EU) 2019/420 kan de Unie voortaan financiële bijstand verlenen voor de operationele kosten. Daarom moeten voor de lidstaten regels en procedures worden vastgesteld voor het verzoeken van dergelijke bijstand. |
|
(15) |
De in dit besluit vervatte maatregelen zijn in overeenstemming met het advies van het in artikel 33, lid 1, van Besluit nr. 1313/2013/EU bedoelde comité, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Onderwerp
Dit besluit stelt regels vast voor de tenuitvoerlegging van Besluit nr. 1313/2013/EU, met betrekking tot:
|
a) |
de inzet voor de Europese pool voor civiele bescherming van capaciteit die financiering ontvangt voor aanpassingskosten; |
|
b) |
criteria voor besluiten tot inzet van rescEU-capaciteit, ook in het geval van onverenigbare verzoeken; |
|
c) |
criteria voor besluiten inzake ontbinding en terugtrekking van rescEU-capaciteit; |
|
d) |
nationaal gebruik van rescEU-capaciteit; |
|
e) |
weigering personeel in te zetten buiten de Unie; |
|
f) |
de algemene inhoud van de operationele contracten; |
|
g) |
zichtbaarheidsvereisten voor het gebruik van rescEU-capaciteit; |
|
h) |
certificering en registratie van rescEU-capaciteit; |
|
i) |
totale geraamde kosten voor rescEU-capaciteit die wordt ingezet voor bestrijding van bosbranden vanuit de lucht; alsmede |
|
j) |
regelingen voor het aanvragen van financiële steun voor operationele kosten. |
Artikel 2
Inzet voor de Europese pool voor civiele bescherming van capaciteiten die financiering ontvangen voor aanpassingskosten
1. De lidstaten die financiële steun van de Unie ontvangen voor de aanpassing van de capaciteit overeenkomstig artikel 21, lid 2, onder c), van Besluit nr. 1313/2013/EU, verbinden zich ertoe dat deze capaciteit gedurende verschillende minimumperioden op basis van het totale bedrag van ontvangen financiering aan de Europese pool voor civiele bescherming wordt toegewezen.
De minimumperioden worden als volgt bepaald:
|
a) |
een minimumperiode van 3 jaar voor capaciteit waarvoor tot 300 000 EUR financiële steun van de Unie is ontvangen; |
|
b) |
een minimumperiode van 5 jaar voor capaciteit waarvoor een bedrag ten belope van 300 001 EUR tot 1 000 000 EUR financiële steun van de Unie is ontvangen; |
|
c) |
een minimumperiode van 7 jaar voor capaciteit waarvoor een bedrag ten belope van 1 000 001 EUR tot 2 000 000 EUR financiële steun van de Unie is ontvangen; |
|
d) |
een minimumperiode van 10 jaar voor capaciteit waarvoor meer dan 2 000 000 EUR financiële steun van de Unie is ontvangen; |
2. Indien de economische levensduur van een capaciteit korter is dan de in lid 1 bedoelde minimumperiode, wordt de minimumperiode bepaald door de lengte van de economische levensduur.
3. De Commissie kan via het ERCC ermee instemmen de in lid 1 bedoelde minimumperiode met betrekking tot een specifieke capaciteit te beëindigen indien dit door een lidstaat naar behoren wordt gemotiveerd.
Artikel 3
Criteria voor besluiten tot inzet van rescEU-capaciteit
1. Na ontvangst van een bijstandsverzoek beoordeelt het ERCC of de bestaande capaciteit die de lidstaten via het Uniemechanisme hebben aangeboden en de capaciteit die vooraf is toegewezen aan de Europese pool voor civiele bescherming, volstaan om een doeltreffende reactie op dat verzoek te waarborgen. Indien een doeltreffende reactie niet kan worden gegarandeerd, neemt de Commissie via het ERCC een besluit over de inzet van rescEU-capaciteit overeenkomstig de in artikel 12, lid 6, van Besluit nr. 1313/2013/EU vastgestelde procedure.
2. Bij het besluit om rescEU-capaciteit in te zetten, wordt rekening gehouden met de volgende specifieke criteria:
|
a) |
de operationele situatie in de lidstaten en potentiële rampenrisico's; |
|
b) |
de geschiktheid en toereikendheid van de rescEU-capaciteit om op de ramp te reageren; |
|
c) |
de geografische locatie van de rescEU-capaciteit, met inbegrip van de geraamde transporttijden naar het getroffen gebied; |
|
d) |
andere relevante criteria, met inbegrip van de voorwaarden voor de inzet van rescEU-capaciteit zoals vastgelegd in operationele contracten. |
3. Bij onverenigbare verzoeken om bijstand worden de volgende aanvullende criteria in aanmerking genomen bij een besluit over de inzet van rescEU-capaciteit:
|
a) |
de verwachte risico's voor mensenlevens; |
|
b) |
de verwachte risico's voor kritieke infrastructuur als bedoeld in artikel 2, onder a), van Richtlijn 2008/114/EG van de Raad (4), ongeacht of deze binnen of buiten de Unie is gevestigd; |
|
c) |
de verwachte gevolgen van de rampen, met inbegrip van de gevolgen voor het milieu; |
|
d) |
door het ERCC vastgestelde behoeften, alsmede eventuele bestaande inzetplannen; |
|
e) |
het potentiële risico van de verspreiding van rampen; |
|
f) |
de sociaal-economische gevolgen; |
|
g) |
inwerkingstelling van de solidariteitsclausule overeenkomstig artikel 222 van het Verdrag betreffende de werking van de Europese Unie; |
|
h) |
andere relevante operationele factoren. |
Artikel 4
Criteria voor besluiten inzake ontbinding en terugtrekking van rescEU-capaciteit
1. rescEU-capaciteit wordt ontbonden in de volgende gevallen:
|
a) |
na ontvangst van een voorlopige kennisgeving van afsluiting in Cecis; of |
|
b) |
wanneer een besluit tot terugtrekking overeenkomstig lid 2 wordt genomen. |
2. Een besluit om rescEU-capaciteit terug te trekken wordt door de Commissie genomen via het ERCC wanneer elders een grotere operationele behoefte is aan deze capaciteit of de behoeften ter plaatse het gebruik ervan niet langer rechtvaardigen. Het besluit wordt genomen in nauwe samenwerking met de lidstaat waar de rescEU-capaciteit is ondergebracht en de lidstaat/lidstaten die om bijstand verzoekt/verzoeken, alsook, in voorkomend geval, met derde landen of internationale organisaties.
3. Voor het nemen van het in lid 2 bedoelde besluit neemt de Commissie onder meer de in artikel 3, leden 2, en 3, genoemde criteria in aanmerking.
Artikel 5
Nationaal gebruik van rescEU-capaciteit
1. De lidstaten die rescEU-capaciteit voor nationale doeleinden gebruiken, zorgen voor:
|
a) |
de beschikbaarheid en de paraatheid voor het uitvoeren van operaties in het kader van het Uniemechanisme binnen de in de desbetreffende kwaliteitseisen vastgestelde termijn, tenzij anders overeengekomen met de Commissie; |
|
b) |
gelijke behandeling van de rescEU-capaciteit en andere nationale capaciteit met betrekking tot adequate voorzieningen op het vlak van onderhoud, opslag, verzekeringen, personeelsbezetting en andere relevante beheers- en onderhoudswerkzaamheden; |
|
c) |
snelle herstelling in geval van schade. |
2. De lidstaten stellen de Commissie via het ERCC in kennis van het nationale gebruik van rescEU-capaciteit en dienen na het gebruik ervan een verslag in.
3. Wanneer nationaal gebruik van rescEU-capaciteit gevolgen heeft voor de beschikbaarheid, als bedoeld in de eerste alinea, onder a), van dit artikel, verkrijgen de lidstaten voorafgaand aan de inzet van de capaciteit via het ERCC de toestemming van de Commissie.
De lidstaten zorgen ervoor dat de desbetreffende rescEU-capaciteit zo snel mogelijk beschikbaar is voor responsoperaties in het kader van het Uniemechanisme.
Artikel 6
Weigering personeel in te zetten buiten de Unie
1. Indien overeenkomstig artikel 12, lid 10, van Besluit nr. 1313/2013/EU een besluit is genomen om rescEU-capaciteit in te zetten buiten de Unie, kunnen de lidstaten weigeren hun personeel in te zetten in de volgende gevallen:
|
a) |
wanneer de diplomatieke betrekkingen tussen de lidstaat en het verzoekende derde land zijn verbroken; |
|
b) |
wanneer gewapende conflicten, de dreiging daarvan of andere even ernstige redenen ertoe zouden leiden dat de veiligheid en beveiliging van het personeel in gevaar zouden komen en de betrokken lidstaat niet aan zijn zorgplicht zou kunnen voldoen. |
2. De lidstaat die weigert zijn personeel in te zetten, stelt de Commissie hiervan onverwijld in kennis en verstrekt een met redenen omklede motivering.
Artikel 7
Algemene inhoud van operationele contracten
De in artikel 12, lid 5, van Besluit nr. 1313/2013/EU bedoelde operationele contracten dienen onder meer voor:
|
a) |
het specificeren van de aard van de entiteit waar de rescEU-capaciteit is ondergebracht; |
|
b) |
het specificeren van de locaties waar de rescEU-capaciteit is ondergebracht; |
|
c) |
het verstrekken van informatie over relevante logistiek en verzekering; |
|
d) |
het geven van een overzicht van het nationale besluitvormingsproces om de beschikbaarheid en paraatheid van rescEU-capaciteit voor operaties in het kader van het Uniemechanisme te waarborgen binnen de termijn die is vastgesteld in de desbetreffende kwaliteitsvereisten; |
|
e) |
het bijhouden van actuele informatie over het personeel, met inbegrip van de arbeidsvoorwaarden en -omstandigheden, verzekeringscontracten en opleiding, alsmede een beschrijving van de maatregelen die zijn genomen om de internationale invoering ervan te waarborgen; |
|
f) |
het voorzien in een onderhoudswerkplan; |
|
g) |
het vaststellen van specifieke rapportageverplichtingen; |
|
h) |
het vaststellen van zichtbaarheidsvereisten voor de Unie als bedoeld in artikel 20 bis van Besluit nr. 1313/2013/EU. |
Artikel 8
Zichtbaarheidsvereisten voor het gebruik van rescEU-capaciteit
Als rescEU-capaciteit wordt ingezet voor responsoperaties in het kader van het Uniemechanisme, wordt overeenkomstig artikel 20 bis van Besluit nr. 1313/2013/EU door de lidstaat waar de rescEU-capaciteit is ondergebracht en de lidstaat die om bijstand verzoekt, voorzien in passende zichtbaarheid van de Unie.
Artikel 9
Aansprakelijkheid en schadevergoeding
De lidstaten zien af van het instellen van een vordering tegen de Commissie voor schade als gevolg van bijstandsinterventies in het kader van het Uniemechanisme of voor gevolgen die voortvloeien uit het niet-inzetten, ontbinden of terugtrekken van rescEU-capaciteit die in het kader van het Uniemechanisme en dit besluit is verleend, tenzij bewezen is dat deze schade het gevolg is van fraude of ernstig wangedrag.
Artikel 10
Certificerings- en registratieregels
1. De lidstaten zorgen voor de certificering en registratie van rescEU-capaciteit overeenkomstig de toepasselijke nationale en internationale regels en voorschriften.
2. Wanneer de rescEU-capaciteit multifunctioneel is, worden de certificering en de registratie dienovereenkomstig voltooid.
3. De lidstaten certificeren rescEU-capaciteit in het kader van het certificeringsproces van het Uniemechanisme zo snel mogelijk en in overeenstemming met artikel 11, lid 4, van Besluit nr. 1313/2013/EU en hoofdstuk 5 van Uitvoeringsbesluit 2014/762/EU van de Commissie (5). rescEU-capaciteit waarvoor de voltooiing van het certificeringsproces van het Uniemechanisme lopende is, kan worden ingezet overeenkomstig artikel 3.
Artikel 11
Totale geraamde kosten voor rescEU-capaciteit voor de bestrijding van bosbranden vanuit de lucht
1. De kostencategorieën als bedoeld in de punten 1 tot en met 6 en punt 8 van bijlage I BIS bij Besluit nr. 1313/2013/EU worden in aanmerking genomen bij de berekening van de totale geraamde kosten van rescEU-capaciteit voor de bestrijding van bosbranden vanuit de lucht.
2. De kosten van de categorie kosten voor uitrusting zoals bedoeld in punt 1 van bijlage I BIS bij Besluit nr. 1313/2013/EU voor de capaciteit voor de bestrijding van bosbranden vanuit de lucht met vliegtuigen worden berekend op basis van de marktprijzen die gelden wanneer de capaciteit wordt verworven, gehuurd of geleased overeenkomstig artikel 12, lid 3, van Besluit nr.1313/2013/EU. Wanneer de lidstaten rescEU-capaciteit verwerven, huren of leasen, verstrekken zij de Commissie bewijsstukken van de daadwerkelijk geldende marktprijzen.
De kosten van de categorie kosten voor uitrusting zoals bedoeld in punt 1 van bijlage I BIS bij Besluit nr. 1313/2013/EU voor de capaciteit voor de bestrijding van bosbranden vanuit de lucht met helikopters worden berekend op basis van de marktprijzen die gelden wanneer de capaciteit wordt verworven, gehuurd of geleased overeenkomstig artikel 12, lid 3, van Besluit nr.1313/2013/EU. Wanneer de lidstaten rescEU-capaciteit verwerven, huren of leasen, verstrekken zij de Commissie bewijsstukken van de daadwerkelijk geldende marktprijzen.
3. De kosten van de kostencategorieën bedoeld in de punten 2 tot en met 6 en punt 8 van bijlage I BIS bij Besluit nr. 1313/2013/EU voor de bestrijding van bosbranden vanuit de lucht met vliegtuigen worden ten minste eenmaal berekend gedurende de periode van elk meerjarig financieel kader met ingang van de periode 2014-2020, rekening houdend met de informatie waarover de Commissie beschikt, met inbegrip van de inflatie en de kostenberekeningen die worden gemaakt ter financiering van nationale capaciteit overeenkomstig artikel 35 van Besluit nr. 1313/2013/EU. Deze kosten worden door de Commissie gebruikt voor het verstrekken van jaarlijkse financiële bijstand.
De kosten van de kostencategorieën bedoeld in de punten 2 tot en met 6 en punt 8 van bijlage I BIS bij Besluit nr. 1313/2013/EU voor de bestrijding van bosbranden vanuit de lucht met helikopters worden ten minste eenmaal berekend gedurende de periode van elk meerjarig financieel kader met ingang van de periode 2014-2020, rekening houdend met de informatie waarover de Commissie beschikt, met inbegrip van de inflatie en de kostenberekeningen die worden gemaakt ter financiering van nationale capaciteit overeenkomstig artikel 35 van Besluit nr. 1313/2013/EU. Deze kosten worden door de Commissie gebruikt voor het verstrekken van jaarlijkse financiële bijstand.
Artikel 12
Subsidiabele operationele kosten
1. De operationele kosten als bedoeld in artikel 23, lid 2, artikel 23, lid 4 ter, en artikel 23, lid 4 quater, van Besluit nr. 1313/2013/EU omvatten alle kosten van het exploiteren van een capaciteit tijdens een operatie die noodzakelijk zijn voor een operationeel doeltreffend optreden. Dergelijke kosten kunnen in voorkomend geval betrekking hebben op personeelskosten, internationaal en lokaal vervoer, logistiek, verbruiksgoederen en benodigdheden, onderhoud en andere kosten die nodig zijn om een doeltreffend gebruik van de capaciteit te waarborgen.
2. De in lid 1 bedoelde kosten komen niet in aanmerking voor financiering indien zij worden gedekt door gastlandsteun, op grond van artikel 39 van Uitvoeringsbesluit 2014/762/EU of overeenkomstig artikel 3, lid 2, van Uitvoeringsbesluit (EU) 2019/570, of wanneer zij worden gefinancierd via andere financiële instrumenten van de Unie.
3. De procedures voor het aanvragen van vervoerssteun als bedoeld in artikel 48, artikel 49, leden 1 en 3, artikel 51, artikel 53 en bijlage VIII van Uitvoeringsbesluit 2014/762/EU zijn van overeenkomstige toepassing op verzoeken om financiële steun voor operationele kosten totdat zij in voorkomend geval worden vervangen.
Artikel 13
Adressaten
Dit besluit is gericht tot de lidstaten.
Gedaan te Brussel, 31 juli 2019.
Voor de Commissie
Christos STYLIANIDES
Lid van de Commissie
(1) PB L 347 van 20.12.2013, blz. 924.
(2) Besluit (EU) 2019/420 van het Europees Parlement en de Raad van 13 maart 2019 tot wijziging van Besluit nr. 1313/2013/EU betreffende een Uniemechanisme voor civiele bescherming (PB L 77I van 20.3.2019, blz. 1).
(3) Uitvoeringsbesluit (EU) 2019/570 van de Commissie van 8 april 2019 tot vaststelling van regels voor de uitvoering van Besluit nr. 1313/2013/EU van het Europees Parlement en de Raad betreffende de rescEU-capaciteit en tot wijziging van Uitvoeringsbesluit 2014/762/EU van de Commissie (PB L 99 van 10.4.2019, blz. 41).
(4) Richtlijn 2008/114/EG van de Raad van 8 december 2008 inzake de identificatie van Europese kritieke infrastructuren, de aanmerking van infrastructuren als Europese kritieke infrastructuren en de beoordeling van de noodzaak de bescherming van dergelijke infrastructuren te verbeteren (PB L 345 van 23.12.2008, blz. 75).
(5) Uitvoeringsbesluit 2014/762/EU van de Commissie van 16 oktober 2014 tot vaststelling van uitvoeringsbepalingen van Besluit nr. 1313/2013/EU van het Europees Parlement en de Raad betreffende een Uniemechanisme voor civiele bescherming en tot intrekking van de Beschikkingen 2004/277/EG, Euratom en 2007/606/EG, Euratom van de Commissie (PB L 320 van 6.11.2014, blz. 1).
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/100 |
BESLUIT (EU) 2019/1311 VAN DE EUROPESE CENTRALE BANK
van 22 juli 2019
betreffende een derde reeks gerichte langerlopende herfinancieringstransacties (ECB/2019/21)
DE RAAD VAN BESTUUR VAN DE EUROPESE CENTRALE BANK,
Gezien het Verdrag betreffende de werking van de Europese Unie, en met name artikel 127, lid 2, het eerste streepje,
Gezien de statuten van het Europees Stelsel van centrale banken en van de Europese Centrale Bank, met name artikel 3.1, het eerste streepje, artikel 12.1, artikel 18.1, het tweede streepje en artikel 34.1, het tweede streepje,
Overwegende:
|
(1) |
Besluit ECB/2014/34 (1) voorziet in een reeks gerichte langerlopende herfinancieringstransacties (TLTRO's) die over een tweejarige periode van 2014 tot 2016 dienden te worden uitgevoerd (TLTROs-I) en Besluit (EU) 2016/810 van de Europese Centrale Bank (ECB/2016/10) (2) voorziet in een tweede reeks van TLTRO's die van juni 2016 tot en met maart 2017 dienden te worden uitgevoerd (TLTROs-II). |
|
(2) |
Op 7 maart 2019 heeft de Raad van bestuur ter uitoefening van haar mandaat besloten een nieuwe reeks van zeven gerichte langerlopende herfinancieringstransacties (TLTRO's-III) uit te voeren van september 2019 tot en met maart 2021, elk met een looptijd van twee jaar. De TLTRO's-III beogen gunstiger voorwaarden voor bankkredieten te behouden en accommoderend monetair beleid in lidstaten die de euro als munt hebben te ondersteunen. In aanmerking komende leningen omvatten in de context van deze maatregel de niet-financiële particuliere sector met uitzondering van leningen voor woningaankoop. In samenhang met andere vigerende niet-standaardmaatregelen beogen TLTRO's-III ertoe bij te dragen dat de inflatie op middellange termijn onder maar dicht bij 2 % komt te liggen. |
|
(3) |
Net als bij de eerste en tweede reeks TLTRO's is deelname aan TLTRO's-III als groep onder bepaalde voorwaarden mogelijk teneinde de deelname van instellingen te vergemakkelijken die om organisatorische redenen middels een groepsstructuur van het Eurosysteem lenen. Groepsdeelname geschiedt via één specifiek groepslid en vereist dat er aan de voorgeschreven voorwaarden is voldaan. Voorts moeten ter adressering van kwesties die verband houden met de intragroepliquiditeitsdistributie bij groepen die zijn gevormd op basis van nauwe banden tussen leden alle groepsleden formeel hun groepsdeelname schriftelijk bevestigen. Een TLTRO-groep die binnen het kader van TLTRO's uit hoofde van Besluit (EU) 2016/810 (ECB/2016/10) erkend werd, kan als een TLTRO-III-groep deelnemen in TLTRO's-III behoudens enige procedures aangaande inkennisstelling en erkenning. |
|
(4) |
Het globale bedrag dat uit hoofde van alle TLTRO's-III geleend kan worden dient te worden vastgesteld op basis van het uitstaande bedrag van in aanmerking komende leningen van een deelnemer aan de niet-financiële particuliere sector op 28 februari 2019, rekening houdend met de nog uitstaande bedragen die een TLTRO-III-deelnemer eerder leende uit hoofde van TLTRO's-II uit hoofde van Besluit (EU) 2016/810 (ECB/2016/10). Voorts kunnen in aanmerking komende leningen aan de niet-financiële particuliere sector die zelfgesecuritiseerd zijn (d.w.z. waar effecten op onderpand van activa die voortvloeien uit de securitisatie volledig behouden blijven) onder bepaalde voorwaarden ook worden opgenomen in de berekening van het leningvoume van de deelnemer. Dit zal de relatie tussen het leningvolume en de leningverstrekking aan de economie verbeteren. |
|
(5) |
Op elke TLTRO-III is een maximuminschrijvingsbedrag van toepassing. Het beperken van de grootte van de inschrijvingen beoogt een buitensporige concentratie van inschrijvingen in een paar transacties te voorkomen. |
|
(6) |
De op elke TLTRO-III toepasselijke rente wordt vastgesteld op basis van de leninghistoriek van de deelnemer in de periode van 1 april 2019 tot en met 31 maart 2021, zulks overeenkomstig de in dit besluit vastgelegde beginselen. |
|
(7) |
Elke TLTRO-III heeft een looptijd van twee jaren. Gezien deze kortere looptijd in vergelijking tot de eerste TLTRO's en TLTRO's-II, dienen deelnemers niet de mogelijkheid te hebben om de onder TLTRO's-III toegekende bedragen vrijwillig bedragen terug te betalen vóór hun vervaldag. |
|
(8) |
Voor instellingen die voornemens zijn deel te nemen aan TLTRO's-III gelden specifieke rapportagevoorschriften. De gerapporteerde gegevens worden aangewend: a) bij de vaststelling van het leningvolume, b) bij de berekening van de toepasselijke benchmark, c) bij de beoordeling van de uitvoering door deelnemers op grond van hun benchmarks, en d) voor overige analytische doeleinden, zoals vereist voor de uitvoering van Eurosysteemtaken. Voorts wordt overwogen dat de centrale banken van de lidstaten die de euro als munt hebben (hierna de “NCB's” genoemd) de ontvangen gerapporteerde gegevens binnen het Eurosysteem kunnen uitwisselen, voor zover en op het niveau dat noodzakelijk is voor de goede uitvoering van het TLTRO-III-kader, voor een analyse van de effectiviteit van het TLTRO-III-kader en voor overige analytische doeleinden van het Eurosysteem. Gerapporteerde gegevens mogen binnen het Eurosysteem ten behoeve van gegevensvalidatie gedeeld worden. |
|
(9) |
Opdat kredietinstellingen voldoende tijd hebben voor operationele voorbereidingen voor de eerste TLTRO-III, moet dit besluit onverwijld in werking treden, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Definities
Binnen het kader van dit besluit gelden de volgende definities:
1. “vorderingenoverschotbenchmark”: het bedrag van het in aanmerking komende vorderingenoverschot dat een deelnemer in de periode 1 april 2019 tot en met 31 maart 2021 moet overschrijden om in aanmerking te komen voor een rentevoet op de TLTRO-III kredietopname van die deelnemer die lager is dan de initieel toegepaste rentevoet en die wordt berekend overeenkomstig de beginselen en gedetailleerde voorschriften van artikel 4, respectievelijk bijlage I;
2. “uitstaandbedragbenchmark”: het totaal van de uitstaande in aanmerking komende leningen van een deelnemer op 31 maart 2019 en het vorderingenoverschotbenchmark van de deelnemer dat overeenkomstig de beginselen en gedetailleerde voorschriften van artikel 4, respectievelijk bijlage I berekend wordt;
3. “maximuminschrijvingsbedrag”: het maximumbedrag dat een deelnemer in alle TLTRO's-III kan lenen en dat wordt berekend overeenkomstig de beginselen en gedetailleerde voorschriften van artikel 4, respectievelijk bijlage I;
4. “leningvolume”: het maximumbedrag dat een deelnemer in alle TLTRO's-III kan lenen en dat wordt berekend overeenkomstig de beginselen en gedetailleerde voorschriften van artikel 4, respectievelijk bijlage I;
5. “kredietinstelling”: een kredietinstelling zoals bedoeld in artikel 2, punt 14, van Richtsnoer (EU) 2015/510 van de Europese Centrale Bank (ECB/2014/60) (3);
6. “afwijking van het de uitstaanbedragbenchmark”: de procentpunten waarmee de in aanmerking komende leningen van een deelnemer die zijn verstrekt in de periode van 1 april 2019 tot en met 31 maart 2021 zijn verhoogd of verlaagd met betrekking tot het uitstaandbenchmarkbedrag zoals berekend overeenkomstig de gedetailleerde voorschriften van artikel 4, respectievelijk bijlage I;
7. “in aanmerking komende leningen”: leningen aan niet-financiële vennootschappen en huishoudens (waaronder instellingen zonder winstoogmerk ten behoeve van huishoudens) die ingezeten zijn in de zin van in artikel 1, punt 4, van Verordening (EG) nr. 2533/98 van de Raad (4), in lidstaten die euro als munt hebben, met uitzondering van leningen aan huishoudens voor woningaankoop, zoals nader bepaald in bijlage II;
8. “in aanmerking komend vorderingenoverschot”: brutokredietverlening in de vorm van in aanmerking komende leningen na aftrek van aflossingen van uitstaande bedragen van in aanmerking komende leningen gedurende een specifieke periode, zoals nader bepaald in bijlage II;
9. “lege financiële instelling” (LFI): een lege financiële instelling zoals gedefinieerd in artikel 1, punt 1, van Verordening (EU) nr. 1075/2013 van de Europese Centrale Bank (ECB/2013/40) (5);
10. “eerste referentieperiode”: de periode van 1 april 2018 tot en met 31 maart 2019;
11. “LFI-code”: een unieke identificatiecode voor LFI in de lijst van LFI's voor die voor statistische doeleinden onderhouden en gepubliceerd wordt door de Europese Centrale Bank (ECB), zulks overeenkomstig artikel 3 van Verordening (EU) nr. 1075/2013 (ECB/2013/40);
12. “rentestimulansaanpassing”: de eventuele verlaging van de van toepassing zijnde rente op uit hoofde van TLTRO-III's geleende bedragen, uitgedrukt als een fractie van het gemiddelde verschil tussen de maximaal mogelijke rentevoet en de minimaal mogelijke rentevoet, zoals berekend overeenkomstig de gedetailleerde bepalingen van bijlage I;
13. “identificatiecode voor juridische entiteiten” (LEI): een aan de rechtspersoon overeenkomstig ISO 17442 toegewezen alfanumerieke referentiecode;
14. “monetaire financiële instelling” (MFI): een monetaire financiële instelling zoals bedoeld in artikel 1, punt a), van Verordening (EU) nr. 1071/2013 van de Europese Centrale Bank (ECB/2013/33) (6);
15. “MFI-code”: een unieke identificatiecode voor een MFI in de lijst van MFI's die voor statistische doeleinden onderhouden en gepubliceerd wordt door de Europese Centrale Bank (ECB), zulks overeenkomstig artikel 4 van Verordening (EU) nr. 1071/2013 (ECB/2013/33);
16. “uitstaande bedragen van in aanmerking komende leningen”: uitstaande in aanmerking komende leningen op de balans exclusief gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen, zoals nader bepaald in bijlage II;
17. “deelnemer”: een wederpartij die is toegelaten voor openmarkttransacties binnen het kader van het monetaire beleid van het Eurosysteem overeenkomstig Richtsnoer (EU) 2015/510 (ECB/2014/60), en die individueel of als groepslid in de hoedanigheid van leidende instelling inschrijft op TLTRO-III-tenders, en voor wie alle rechten en plichten gelden die samenhangen met zijn deelname aan de TLTRO-III-tenderprocedures;
18. “referentie-uitstaandbedrag”: de somvan uitstaande bedragen aan in aanmerking komende leningen en, ingeval van de uitoefening van de optie in artikel 6, lid 3, uitstaande bedragen van zelfgesecuritiseerde in aanmerking komende leningen op 28 februari 2019;
19. “betrokken NCB”: met betrekking tot een specifieke deelnemer, de NCB van de lidstaat waarin de deelnemer is gevestigd;
20. “tweede referentieperiode”: de periode van 1 april 2019 tot en met 31 maart 2021;
21. “securitisatie”: een transactie die a) een traditionele securitisatie is zoals gedefinieerd in artikel 2, punt 9, van Verordening (EU) 2017/2402 (7), en/of b) een securitisatie is als gedefinieerd in artikel 1, lid 2, van Verordening (EU) nr. 1075/2013 (ECB/2013/40) en die de overdracht van aan een LFI gesecuritiseerde leningen behelst;
22. “zelfgesecuritiseerde in aanmerking komende leningen”: in aanmerking komende door een deelnemer of een TLTRO-IIII groepslid geïnitieerde en gesecuritiseerde leningen, waarbij de effecten van onderpand op activa volgend uit de securitisatie 100 % behouden worden door die deelnemer of het TLTRO-III groepslid.
Artikel 2
De derde reeks gerichte langerlopende herfinancieringstransacties
1. Het Eurosysteem voert zeven TLTRO's-III uit overeenkomstig het op de ECB-website bekendgemaakte indicatieve TLTRO's-III-tijdschema.
2. Elke TLTRO-III vervalt zonder een mogelijkheid tot vrijwillige vroegtijdige aflossing twee jaar na de respectievelijke afwikkelingsdatum op een dag die samenvalt met de afwikkelingsdatum van een basisherfinancieringstransactie van het Eurosysteem, zulks overeenkomstig het op de ECB-website bekendgemaakte indicatieve TLTRO's-III-tijdschema.
3. TLTRO's-III:
|
a) |
zijn liquiditeitsverruimende wederinkooptransacties; |
|
b) |
worden door de NCB's gedecentraliseerd uitgevoerd; |
|
c) |
worden middels standaardtenders uitgevoerd, en |
|
d) |
worden als vasterentetenders uitgevoerd. |
4. De standaardvoorwaarden waaronder de NCB's bereid zijn krediettransacties uit te voeren gelden ten aanzien van alle TLTRO's-III, tenzij dit besluit anders bepaalt. Deze voorwaarden omvatten de procedures voor het uitvoeren van openmarkttransacties, de geschiktheidscriteria van wederpartijen en de beleenbaarheidscriteria voor onderpand voor krediettransacties van het Eurosysteem, alsmede de sancties voor de niet-naleving van wederpartijverplichtingen. Elke van deze voorwaarden wordt vastgelegd in de algemene en tijdelijke op herfinancieringstransacties van toepassing zijnde rechtskaders en worden verwerkt in de NCB-contracten en/of nationale wetgevende kaders.
5. Ingeval van een conflict tussen dit besluit en Richtsnoer (EU) 2015/510 (ECB/2014/60), of een andere ECB-rechtshandeling die het rechtskader vormt voor langerlopende herfinancieringstransacties en/of nationale maatregelen die dat rechtskader op nationaal niveau implementeren, prevaleert dit besluit.
Artikel 3
Deelname
1. Instellingen kunnen individueel deelnemen in TLTRO's-III indien zij toegelaten wederpartijen zijn voor openmarkttransacties binnen het kader van het monetaire beleid van het Eurosysteem.
2. Instellingen kunnen als groep deelnemen in TLTRO's-III door een TLTRO-groep te vormen. Deelname als een groep is van belang voor de berekening van het toepasselijke leningvolume en de benchmarks, zoals bedoeld in artikel 4 en de daarmee verbonden rapportageverplichtingen van artikel 6. Op deelname als groep zijn de volgende beperkingen van toepassing:
|
a) |
een instelling is slechts lid van één TLTRO-III-groep; |
|
b) |
een aan TLTRO's-III als groepslid deelnemende instelling mag niet individueel deelnemen; |
|
c) |
een als leidende instelling aangewezen instelling is het enige TLTRO-III-groepslid dat mag deelnemen in TLTRO-III-tenderprocedures, en |
|
d) |
de samenstelling en de leidende instelling van een TLTRO-III-groep blijven voor alle TLTRO's-III ongewijzigd, behoudens de leden 5 en 6 van dit artikel. |
3. Voor deelname aan TLTRO's-III middels een TLTRO-III-groep moet aan de volgende voorwaarden zijn voldaan.
|
a) |
Met ingang van de laatste dag van de maand voorafgaande aan de aanvraag bedoeld in punt d) van dit lid geldt voor ieder groepslid dat:
|
|
b) |
De groep wijst één groepslid aan als de leidende instelling voor de groep. De leidende instelling is een voor openmarkttransacties binnen het kader van het monetaire beleid van het Eurosysteem toegelaten wederpartij. |
|
c) |
Alle TLTRO-III-groepsleden zijn kredietinstellingen die zijn gevestigd in lidstaten die de euro als munt hebben en voldoen aan de criteria zoals bedoeld in artikel 55, onder a), b) en c), van Richtsnoer (EU) 2015/510 (ECB/2014/60). |
|
d) |
Behoudens punt e) dient de leidende instelling voor groepsdeelname bij haar NCB een aanvraag in overeenkomstig het op de ECB-website bekendgemaakte indicatieve TLTRO's-III-tijdschema. De aanvraag omvat:
|
|
e) |
Een TLTRO-II-groep die uit hoofde van Besluit ECB/2016/10 met het oog op TLTRO's-II werd erkend, kan als TLTRO-III-groep deelnemen in TLTRO's-III mits haar leidende instelling bij de betrokken NCB een schriftelijke mededeling daartoe indient overeenkomstig het op de ECB-website bekendgemaakte indicatieve TLTRO's-III-tijdschema. De schriftelijke mededeling omvat:
|
|
f) |
De leidende instelling verkrijgt van haar NCB de bevestiging dat de TLTRO-III-groep is erkend. Voorafgaand aan de afgifte van deze bevestiging kan de betrokken NCB de leidende instelling verzoeken elke aanvullende informatie te verstrekken die de NCB nodig acht om de potentiële TLTRO-III-groep te kunnen beoordelen. Bij de beoordeling van een groepsaanvraag houdt de betrokken NCB ook rekening met de beoordelingen van groepsleden door NCB's, zulks indien noodzakelijk, zoals verificatie van overeenkomstig punt d) of e) verstrekte documentatie, al naargelang het geval. |
Voor de toepassing van dit besluit komen onder geconsolideerd toezicht staande kredietinstellingen, inclusief bijkantoren van dezelfde kredietinstelling, ook voor erkenning als TLTRO-III-groep in aanmerking en wordt van hen verlangd dat zij mutatis mutandis aan de voorwaarden van dit artikel voldoen. Zulks faciliteert de vorming van TLTRO-III-groepen tussen dergelijke instellingen die deel uitmaken van dezelfde juridische entiteit. Ter bevestiging van de oprichting, dan wel van een gewijzigde samenstelling van een dergelijke TLTRO-III-groep, zijn lid 3, onder d), iv), en respectievelijk lid 6, onder b), ii), punt 5), van toepassing.
4. De betrokken NCB kan de aanvraag van de kandidaat-TLTRO-III-groep deels verwerpen indien één of meer instellingen die deel uitmaken van de aanvraag voor TLTRO-III-groepserkenning niet voldoen aan de voorwaarden van lid 3. In dat geval kunnen de verzoekende instellingen besluiten op te treden als TLTRO-III-groep in de samenstelling die beperkt is tot de groepsleden die voldoen aan de vereiste voorwaarden, of besluiten de aanvraag voor erkenning als TLTRO-III-groep in te trekken.
5. In uitzonderlijke gevallen waarin sprake is van objectieve redenen, kan de Raad van bestuur afwijken van de in lid 2 en 3 bedoelde voorwaarden.
6. Onverminderd lid 5 kan de samenstelling van een in overeenstemming met lid 3 erkende groep onder de volgende omstandigheden veranderen:
|
a) |
Een lid wordt van de deelname aan de TLTRO-III-groep uitgesloten indien het lid niet langer voldoet aan de vereisten van lid 3, onder a) of c). De NCB van het betrokken groepslid deelt de leidende instelling mee dat het groepslid niet aan die vereisten voldoet. In dergelijke gevallen stelt de betrokken leidende instelling de betrokken NCB in kennis van de gewijzigde status van haar groepslid. |
|
b) |
Indien met betrekking tot de TLTRO-III-groep na de laatste dag van de maand voorafgaande aan de aanvraag bedoeld in lid 3, onder d), aanvullende nauwe banden of aanvullende indirecte aanhouding van vereiste reserves bij het Eurosysteem tot stand komen, kan de samenstelling van de TLTRO-III-groep gewijzigd worden om de toevoeging van een nieuw lid weer te geven mits:
|
|
c) |
De TLTRO-III-groepsamenstelling kan veranderen als gevolg van een fusie, overname of splitsing, al naargelang het geval, mits voldaan is aan de voorwaarden in punt b), indien met betrekking tot de TLTRO-III-groep een fusie, overname of splitsing plaatsvindt waarbij TLTRO-III-groepsleden betrokken zijn, zulks na de laatste dag van de maand voorafgaande aan de in lid 3, onder d), bedoelde aanvraag en die operatie niet resulteert in een gewijzigde reeks van in aanmerking komende leningen. |
7. Indien de Raad van bestuur de gewijzigde TLTRO-III-groepssamenstelling overeenkomstig lid 5 heeft aanvaard, of indien de gewijzigde TLTRO-III-groepssamenstelling overeenkomstig lid 6 tot stand is gekomen, geldt het volgende, tenzij de Raad van bestuur anders beslist:
|
a) |
met betrekking tot de wijzigingen waarop lid 5, lid 6, onder b), of lid 6, onder c) van toepassing is, mag de leidende instelling deelnemen in een TLTRO-III--groep op basis van haar nieuwe TLTRO-III-groepsamenstelling nadat de leidende instelling een bevestiging heeft ontvangen dat de nieuwe TLTRO-III-groep is erkend, en |
|
b) |
een instelling die niet langer TLTRO-III-groepslid is, neemt noch individueel noch als lid van een andere TLTRO-III-groep deel aan andere TLTRO's-III, tenzij de instelling een nieuwe aanvraag tot deelname indient in overeenstemming met de leden 1, 3 of 6. |
8. Indien een leidende instelling niet langer een voor openmarkttransacties binnen het kader van het monetaire beleid van het Eurosysteem in aanmerking komende wederpartij is, wordt haar TLTRO-III-groep niet langer erkend en moet die leidende instelling alle uit hoofde van TLTRO's-III geleende bedragen aflossen.
Artikel 4
Leningvolume, maximuminschrijvingsbedrag en benchmarks
1. Het op een individuele deelnemer toepasselijke leningvolume wordt berekend op basis van de leninggegevens van het referentie-uitstaandbedrag van in aanmerking komende leningen van de individuele deelnemer. Het op een deelnemer in de hoedanigheid van leidende instelling van een TLTRO-III-groep toepasselijke leningvolume wordt berekend op basis van de geaggregeerde leninggegevens betreffende het referentie-uitstaandbedrag voor alle TLTRO-III-groepsleden.
2. Het leningvolume van elke deelnemer bedraagt 30 % van het referentie-uitstaandbedrag met aftrek van het eerder door die TLTRO-III-deelnemer geleende bedrag uit hoofde van TLTRO's-II uit hoofde van Besluit (EU) 2016/810 (ECB/2016/10) dat nog uitstaat op de afwikkelingsdatum van een TLTRO-III gezien de door de deelnemer overeenkomstig artikel 6 van Besluit ECB/2014/34 ingediende juridisch bindende kennisgeving voor verplichte vervroegde aflossing. De betrokken technische berekeningen zijn in bijlage I uiteengezet.
3. Indien een uit hoofde an Besluit ECB/2016/10 erkend lid van een TLTRO-groep ten behoeve van TLTO's-II geen lid van de respectieve TLTRO-III-groep wil zijn, wordt die kredietinstelling wat betreft de berekening van het TLTRO-III-leningvolume voor die kredietinstelling als een individuele deelnemer geacht uit hoofde van TLTRO's-II een bedrag geleend te hebben dat gelijk is aan het bedrag dat de leidende instelling van de TLRO-II-groep bij deze twee transacties geleend heeft, en dat nog steeds uitstaat op de afwikkelingsdatum van een TLTRO-III, vermenigvuldigd met het aandeel van in aanmerking komende leningen van het lid van die TLTRO-II-groep op 31 januari 2016. Ter berekening van het TLTRO-III-leningvolume van de leidende instelling wordt het laatstgenoemde bedrag afgetrokken van het bedrag dat de respectieve TLTRO-III groep wordt geacht geleend te hebben krachtens TLTRO's-II.
4. Het maximuminschrijvingsbedrag van elke deelnemer voor TLTRO-III is gelijk aan: i) het vaststellingsvolume verminderd met de bedragen die onder voorgaan TLTRO's-II zijn geleend, of (ii) een tiende van het totale referentie-uitstaandbedrag, als dat lager is. Dit bedrag wordt voor elke deelnemer beschouwd als een maximuminschrijvingsbedrag en de regels ten aanzien van inschrijvingen die het maximuminschrijvingsbedrag overschrijden, zoals bedoeld in artikel 36 van Richtsnoer (EU) 2015/510 (ECB/2014/60), zijn van toepassing. De betrokken technische berekeningen zijn in bijlage I uiteengezet.
5. De vorderingenoverschotbenchmark van een deelnemer wordt als volgt vastgesteld op basis van het in aanmerking komende vorderingenoverschot in de eerste referentieperiode:
|
a) |
voor deelnemers die in de eerste referentieperiode een positief in aanmerking komend vorderingenoverschot rapporteren, dan wel een vorderingenoverschot dat gelijk is aan nul, is de vorderingenoverschotbenchmark nul; |
|
b) |
voor deelnemers die in de eerste referentieperiode een negatief in aanmerking komend vorderingenoverschot rapporteren, is det vorderingenoverschotbenchmark gelijk aan het in aanmerking komend vorderingenoverschot voor de eerste referentieperiode. |
De betrokken technische berekeningen zijn uiteengezet in bijlage I. De vorderingenoverschotbenchmark voor deelnemers waaraan na 28 februari 2019 bankvergunningen zijn verstrekt, is gelijk aan nul, tenzij de Raad van bestuur in omstandigheden waarin het objectief gerechtvaardigd is, anders beslist.
6. Een uitstaandbedragbenchmark van een deelnemer wordt vastgesteld als de som van in de uitstaande bedragen voor in aanmerking komende leningen op 31 maart 2019 plus det vorderingenoverschotbenchmark. De betrokken technische berekeningen zijn in bijlage I uiteengezet.
Artikel 5
Rente
1. Behoudens lid 2 wordt de op uit hoofde van elk uit hoofde van TLTRO-III geleend bedrag toepasselijke rente bepaald op 10 basispunten boven de gemiddelde rente op de basisherfinancieringstransactierente voor de looptijd van de betrokken TLTRO-III.
2. De toepasselijke rente op de bedragen die deelnemers hebben geleend wier in aanmerking komende vorderingenoverschot in de tweede referentieperiode hun vorderingenoverschotbenchmark te boven gaat is lager dan de in lid 1 opgenomen rentevoet en kan zo laag zijn als 10 basispunten boven de gemiddelde depositorente die geldt voor de levensduur van de TLTRO-III, afhankelijk van de afwijking van de uitstaandbedragbenchmark. Gedetailleerde bepalingen en berekeningen zijn in bijlage I uiteengezet.
3. De afwijking van het uitstaandbedragbenchmark, de resulterende rentestimulansaanpassing en, indien van toepassing, en de definitieve rentevoeten worden overeenkomstig het op de ECB-website bekendgemaakte indicatieve tijdschema voor TLTRO's-III aan de deelnemers gecommuniceerd.
4. Rente moet achteraf betaald worden op de vervaldag van elke TLTRO-III.
5. Indien een NCB overeenkomstig haar contracten of reglementen haar ter beschikking staande verhaalsmogelijkheden uitoefent en een deelnemer daarom de uitstaande TLTRO-III-bedragen moet aflossen voordat de afwijking van de uitstaandbedragbenchmark en de eventuele resulterende rentestimulansaanpassing aan de deelnemer worden gecommuniceerd, wordt de op de door die deelnemer uit hoofde van elke TLTRO-III geleende bedragen toepasselijke rente bepaald op 10 basispunten boven de gemiddelde rente voor de basisherfinancieringstransactie voor de looptijd van de betrokken TLTRO-III tot de aflossingsdatum voor de NCB. Indien een dergelijke aflossing vereist is na de eventuele afwijking van de uitstaanbedragbenchmark en de resulterende rentestimulansanpassing aan de deelnemer is gecommuniceerd, wordt de toepasselijke rente op de de door die deelnemer uit hoofde van TLTRO-III geleende bedragen bepaald met inachtnemenig van de uitstaanbedragbenchmark.
Artikel 6
Rapportagevoorschriften
1. Elke deelnemer in TLTRO's-III verstrekt de betrokken NCB de gegevens die in de in bijlage II bedoelde verslagensjablonen zijn geïdentificeerd als volgt:
|
a) |
het referentie-uitstaandbedrag ten behoeve van het vaststellen van het leningsvolume en maximuminschrijvingsbedrag van de deelnemers van de deelnemer, alsmede gegevens die betrekking hebben op de eerste referentieperiode om de benchmarks van de deelnemer vast te stellen (hierna “het eerste verslag” genoemd), en |
|
b) |
Gegevens met betrekking tot de tweede referentieperiode voor het vaststellen van de toepasselijke rentevoeten (hierna “het tweede verslag” genoemd). |
2. De gegevens worden verstrek met inachtneming van het volgende:
|
a) |
het op de ECB-website bekendgemaakte indicatieve TLTRO-III-tijdschema; |
|
b) |
de in bijlage II vermelde richtsnoeren; |
|
c) |
de minimumnormen voor nauwkeurigheid en naleving van de concepten bedoeld in bijlage IV bij Verordening (EU) nr. 1071/2013 (ECB/2013/33). |
3. Deelnemers die voornemens zijn om zelfgesecuritiseerde in aanmerking komende leningen in de berekening van het leningsvolume oefenen deze optie uit door aanvullende posten op te nemen met betrekking tot de zelfgesecuritiseerde leningen, zoals ander bepaald in bijlage II, aangevuld met de beoordeling van de accountant van deze aanvullende posten met inachtneming van de volgende regels:
|
a) |
Deelnemers in de eerste of tweede TLTRO-III operatie kunnen deelnemen op basis van een eerste verslag waarin de aanvullende posten zijn weggelaten.Om evenwel zeker te stellen dat zelfgesecuritiseerde leningen worden opgenomen in de berekeningen van het leningvolume vanaf de tweede of derde operatie, worden de aanvullende posten en de respectieve beoordeling door de accountant ter beschikking gesteld aan de betrokken NCB vóór de uiterste termijn voor het eerste verslag voor elke van deze transacties zoals vermeld in het op de ECB-website bekendgemaakte indicatieve TLTRO-III tijdschema. |
|
b) |
Vóór de uiterste termijn zoals vermeld in het op de ECB-website bekendgemaakte indicatieve TLTRO-III tijdschema maken deelnemers die voor het eerste deelnemen in de derde of navolgende TLTRO-III transacties zowel het eerste verslag, met inbegrip van de aanvullende posten, als de respectieve beoordeling van de aanvullende posten door de accountant bekend. |
4. De termen die deelnemers in het door hen ingediende verslag gebruiken worden overeenkomstig de definities van die termen in Verordening (EU) nr. 1071/2013 (ECB/2013/33) geïnterpreteerd.
5. Een leidende instelling van een TLTRO-III-groep dient een verslag in met ten aanzien van alle TLTRO-III-groepsleden geaggregeerde data. De NCB van de leidende instelling, of een NCB van TLTRO-III-groepslid, kan bovendien in coördinatie met de NCB van de leidende instelling verlangen dat de leidende instelling gedesaggregeerde data voor elk individueel groepslid instuurt.
6. Elke deelnemer verzekert dat de kwaliteit van de uit hoofde van lid 1 tot en met lid 3 ingediende gegevens door een externe accountant zijn beoordeeld, de volgende regels inachtnemend:
|
a) |
de beoordeling van de accountant wordt ter beschikking gesteld aan de betrokken NCB binnen de uiterste termijn zoals vermeld in het op de ECB-website bekendgemaakte indicatieve tijdschema voor TLTRO's-III; |
|
b) |
de resultaten van de beoordeling van het tweede verslag door de accountant worden aan de betrokken NCB ter beschikking gesteld vóór de uiterste termijn zoals vermeld in het op ECB-website bekendgemaakte indicatieve tijdschema voor TLTRO's-III; |
|
c) |
de beoordelingen door de accountant concentreren zich op de in lid 2 en 4 vermelde vereisten. Met name dient de accountant:
Ingeval van groepsdeelname worden de resultaten van de beoordelingen door de accountant gedeeld met de NCB's van de overige TLTRO-III groepsleden. Op verzoek van de NCB van de deelnemer worden de gedetailleerde resultaten van de uit hoofde van dit lid uitgevoerde beoordelingen verstrekt aan die NCB en, ingeval van groepsdeelname, worden die gegevens vervolgens gedeeld met de NCB's van de groepsleden. |
|
d) |
de beoordelingen door de account omvat ten minste de volgende elementen:
|
Het Eurosysteem kan nadere richtsnoeren verstrekken over de wijze waarop de beoordeling door de accountant uitgevoerd moet worden, in welk geval de deelnemers verzekeren dat de accountants die richtsnoeren in hun beoordeling toepassen.
7. Na een wijziging van de TLTRO-III groepsamenstelling of een bedrijfsreorganisatie zoals een fusie, overname of opsplitsing (waaronder die resulterend uit afwikkeling of liquidatie van de deelnemer) die de reeks van in aanmerking komende leningen van de deelnemer raakt, wordt overeenkomstig de van de NCB van de deelnemer ontvangen aanwijzingen een herzien eerste verslag ingediend. De betrokken NCB beoordeelt de impact van de herziening en handelt dienovereenkomstig. Deze handeling kan de eis tot aflossing van de geleende bedragen zijn die het betrokken leningvolume te boven gaan, zulks rekening houdend met de gewijzigde TLTRO-III groepsamenstelling of de bedrijfsreorganisatie. De betrokken deelnemer, met inbegrip van een na de bedrijfsreorganisatie nieuw-opgerichte entiteit, verstrekt de door de betrokken NCB verlangde aanvullende informatie om de beoordeling van de impact van de herziening te ondersteunen.
8. In afwijking van lid 7 is herziening van het eerste verslag niet vereist, maar in plaats daarvan wordt de relevante impact op in aanmerking komende leningen geregistreerd als een aanpassing in het tweede verslag in de volgende gevallen:
|
(a) |
de reorganisatie van de onderneming betreft instellingen die vóór de reorganisatie van de onderneming onderworpen waren aan toezicht- of afwikkelingsmaatregelen en deze maatregelen, zoals bevestigd door de betrokken NCB, hun vermogen om gedurende ten minste de helft van de tweede referentieperiode leningen te verstrekken hebben belemmerd; |
|
(b) |
de reorganisatie van de onderneming betreft een acquisitie door een deelnemer die in de laatste 6 maanden voor de tweede referentieperiode werd voltooid, of |
|
(c) |
de betrokken NCB beoordeelt de impact van de wijziging in de groepssamenstelling of reorganisatie van de onderneming als geen herziend verslag vereisend. |
Voor de onder b) en c) genoemde gevallen mogen de deelnemers er nog steeds voor kiezen om het eerste rapport te herzien om reorganisaties van de ondernemingen in aanmerking te nemen.
9. De krachtens dit artikel door deelnemers verstrekte gegevens mogen door het Eurosysteem gebruikt worden voor de implementatie van het TLTRO-III-kader, alsook voor de analyse van de effectiviteit van het kader en voor overige analytische doeleinden van het Eurosysteem. Te dien einde kunnen NCB's die gegevens ontvangen op basis van dit artikel dergelijke gegevens uitwisselen binnen het Eurosysteem. Uit hoofde van dit artikel gerapporteerde gegevens mogen binnen het Eurosysteem voor doeleinden van gegevensvalidatie gedeeld worden.
Artikel 7
Niet-naleving van rapportagevoorschriften
1. Indien een deelnemer geen verslag indient of niet voldoet aan de auditvoorschriften, of indien fouten worden vastgesteld in de gerapporteerde gegevens, geldt het volgende:
|
(a) |
Indien een deelnemer het eerste verslag niet vóór het verstrijken van de uiterste termijn aan de betrokken NCB ter beschikking stelt, wordt zijn leningvolume teruggebracht tot nul. |
|
(b) |
Indien een deelnemer de resultaten van de beoordeling van het eerste verslag door de accountant niet vóór de uiterste termijn zoals vermeld in het op de ECB-website bekendgemaakte indicatieve TLTRO's-III-tijdschema aan de betrokken NCB ter beschikking stelt, zal de deelnemer alle uit hoofde van TLTRO-III geleende uitstaande bedragen aflossen op de afwikkelingsdatum van de eerstvolgende basis-herfinancieringstransactie tegen een rente van 10 basispunten boven het gemiddelde tarief van de basis-herfinancieringstransactie voor de looptijd van elke respectieve TLTRO-III. |
|
(c) |
Indien een deelnemer het tweede verslag niet binnen de desbetreffende uiterste termijn ter beschikking stelt aan de betrokken NCB, wordt de rente van 10 basispunten boven de gemiddelde rentevoet voor de basis-herfinancieringstransactie voor de looptijd van elke betrokken TLTRO-III toegepast op de door die deelnemer uit hoofde van alle TLTRO's-III geleende bedragen met een bijkomende dagelijkse boete van EUR 5000 totdat het tweede verslag is ingediend,looptijd tot een maximumbedrag van EUR 15 000. De boete wordt gecumuleerd en in rekening gebracht door de betrokken NCB na ontvangst van het tweede verslag of wanneer het maximumboetebedrag is bereikt als het tweede verslag tegen die termijn nog niet is ontvangen. |
|
(d) |
Indien een deelnemer de resultaten van de beoordeling door de accountant niet binnen de desbetreffende uiterste termijn ter beschikking stelt aan de betrokken NCB, wordt de rente van 10 basispunten boven de gemiddelde rente voor de basis-herfinancieringstransactie voor de looptijd van elke betrokken TLTRO-III toegepast op de door die deelnemers uit hoofde van de TLTRO's-III geleende bedragen. |
|
(e) |
Indien een deelnemer anderszins de verplichtingen in artikel 6, leden 6 en 7, niet nakomt, is de rente van 10 basispunten boven het gemiddelde tarief op de basis-herfinancieringstransactie voor de looptijd van elke betrokken TLTRO-III van toepassing op de door die deelnemer uit hoofde van TLTRO's-III geleende bedragen. |
|
(f) |
Indien een deelnemer, hetzij in verband met de in artikel 6, lid 6, bedoelde audit, dan wel anderszins in de ingediende verslagen foute gegevens vaststelt, waaronder onnauwkeurigheden of onvolledigheid, stelt de deelnemer de betrokken NCB daarvan zo spoedig mogelijk in kennis. Nadat de betrokken NCB over dergelijke fouten, onnauwkeurigheden of leemtes is ingelicht, of anderszins van dergelijke fouten, onnauwkeurigheden of leemtes kennis heeft verkregen: i) verstrekt de deelnemer zo spoedig mogelijk de door de betrokken NCB verlangde aanvullende informatie om de beoordeling van de impact van de betrokken fouten, onnauwkeurigheden of leemtes te ondersteunen, en ii) kan de betrokken NCB gepaste maatregelen nemen, waaronder een herberekening van de relevante waarden die op haar beurt impact heeft op toepasselijke rente op de door de deelnemer uit hoofde van TLTRO's-III geleende bedragen en het v van aflossing van de geleende bedragen die vanwege de fout, onnauwkeurigheid of leemte het leningvolume van de deelnemer te boven gaan. |
2. Lid 1 laat mogelijke sancties onverlet die uit hoofde van Besluit ECB/2010/10 (9) opgelegd kunnen worden ten aanzien van de in Verordening (EU) nr. 1071/2013 (ECB/2013/33) bedoelde rapportageverplichtingen.
Artikel 8
Inwerkingtreding
Dit besluit treedt op 3 augustus 2019 in werking.
Gedaan te Frankfurt am Main, 22 juli 2019.
De president van de ECB
Mario DRAGHI
(1) Besluit ECB/2014/34 van de Europese Centrale Bank van 29 juli 2014 betreffende met gerichte langerlopende herfinancieringstransacties verband houdende maatregelen (PB L 258 van 29.8.2014, blz. 11).
(2) Besluit ECB/2016/810 van de Europese Centrale Bank van 28 april 2016 betreffende een tweede reeks gerichte langerlopende herfinancieringstransacties (ECB/2016/10) (PB L 132 van 21.5.2016, blz. 107).
(3) Richtsnoer (EU) 2015/510 van de Europese Centrale Bank van 19 december 2014 betreffende de tenuitvoerlegging van het monetairbeleidskader van het Eurosysteem (ECB/2014/60) (PB L 91 van 2.4.2015, blz. 3).
(4) Verordening (EG) nr. 2533/98 van de Raad van 23 november 1998 met betrekking tot het verzamelen van statistische gegevens door de Europese Centrale Bank (PB L 318 van 27.11.1998, blz. 8).
(5) Verordening (EU) nr. 1075/2013 van de Europese Centrale Bank van 18 oktober 2013 houdende statistieken betreffende de activa en passiva van lege financiële instellingen die securitisatietransacties verrichten, (ECB/2013/40) (PB L 297 van 7.11.2013, blz. 107).
(6) Verordening (EU) nr. 1071/2013 van de Europese Centrale Bank van 24 september 2013 met betrekking tot de balans van de sector monetaire financiële instellingen (ECB/2013/33) (PB L 297 van 7.11.2013, blz. 1).
(7) Verordening (EU) 2017/2402 van het Europees Parlement en de Raad van 12 december 2017 tot vaststelling van een algemeen kader voor securitisatie en tot instelling van een specifiek kader voor eenvoudige, transparante en gestandaardiseerde securitisatie, en tot wijziging van de Richtlijnen 2009/65/EG, 2009/138/EG en 2011/61/EU en de Verordeningen (EG) nr. 1060/2009 en (EU) nr. 648/2012 (PB L 347 van 28.11.2017, blz. 35).
(8) Verordening (EG) nr. 1745/2003 van de Europese Centrale Bank van 12 september 2003 inzake de toepassing van reserveverplichtingen (ECB/2003/9) (PB L 250 van 2.10.2003, blz. 10).
(9) Besluit ECB/2010/10 van 19 augustus 2010 inzake niet-naleving van statistische rapportagevereisten (PB L 226 van 28.8.2010, blz. 48).
BIJLAGE 1
UITVOERING VAN DE DERDE REEKS VAN DOELGERICHTE LANGERLOPENDE HERFINANCIERINGSTRANSACTIES
1. Berekening van het leningvolume en het maximuminschrijvingsbedrag
Op deelnemers aan één van de derde reeks van gerichte langerlopende herfinancieringstransacties (TLTRO-III), hetzij individueel, hetzij als de leidende instelling van een TLTRO-III-groep, is het volgende leningvolume van toepassing. Het berekende leningvolume wordt afgerond tot het volgende veelvoud van 10 000 EUR.
Het op een individuele deelnemer aan de TLTRO's-III toepasselijke leningvolume wordt berekend op basis van het referentie-uitstaanbedrag dat het op 28 februari 2019 uitstaande bedrag van in aanmerking komende leningen en, na uitoefening van de optie in artikel 6, lid 3, zelfgesecuritiseerde in aanmerking komende leningen omvat. Het op een leidende instelling van een TLTRO-III-groep toepasselijke leningvolume wordt berekend op basis van het ten aanzien van alle TLTRO-III-groepsleden referentie-uitstaandbedrag.
Het leningvolume bedraagt 30 % van het voor de deelnemer (1) referentie-uitstaandbedrag min de door de deelnemer uit hoofde van Besluit (EU) 2016/810 (ECB/2016/10) (TLTRO's-II) geleende bedragen aan de gerichte langerlopende herfinancieringstransacties, die op de afwikkelingsdatum van de respectieve TLTRO-III nog uitstonden,, of bedraagt nul als een dergelijk bedrag negatief is, d.w.z.:
BAk = max(0,3 × ORFeb 2019 – OBk , 0) voor k = 1,…,7.
BAk is het leningvolume in TLTRO-II (waarbij k = 1,…,7), ORFeb 2019 is het referentie-uitstaandbedrag op 28 februari 2019 en OB k is het door de deelnemer in TLTRO's-II geleende en nog steeds uitstaande bedrag op de afwikkelingsdatum van de TLTRO-III k.
Het op elke deelnemer in elke TLTRO-III toepasselijke maximuminschrijvingsbedrag is: a) het leningvolume Bakk min de uit hoofde van vorige TLTRO's-III geleende bedragen, of b) een tiende van het het referentie-uitstaanbedrag als dat lager is. Ck ≥ 0 zijn de leningen van een deelnemer in TLTRO-III k, Ck ≤ BLk ,waarbij BLk is het maximuminschrijvingsbedrag voor deze deelnemer in transactie k dat als volgt gedefinieerd wordt:
BL 1 = min(BA 1, 0,1 × ORFeb 2019)
en

voor k = 2,…,7.
2. Benchmarkberekening
NLm is het in aanmerking komende vorderingenoverschot van een deelnemer in de kalendermaand m, berekend als de brutostroom van nieuwe in aanmerking komende leningen van de deelnemer in die maand min aflossingen van in aanmerking komende leningen, zoals gedefinieerd in bijlage II.
NLB staat voor het vorderingenoverschotbenchmark voor deze deelnemer. Dit wordt als volgt gedefinieerd:
NLB = min (NLApr 2018 + NLMay 2018 + … + NLMar 2019, 0)
Dit houdt in dat indien de deelnemer in de eerste referentieperiode een positief in aanmerking komend vorderingenoverschot heeft, of indien dat nul is, dan NLB = 0. Indien de deelnemer een negatief vorderingenoverschot heeft in de eerste referentieperiode, dan NLB = NLApr 2018 + NLMay 2018 + … + NLMar 2019.
OAB staat voor een uitstaandbedragbenchmark van de deelnemer. Dit wordt als volgt gedefinieerd:
OAB = max (OLMar 2019 + NLB,0),
waarbij OLMar 2019 het op eind maart 2019 uitstaande bedrag van in aanmering komende leningen is.
3. Rentevoetberekening
NSMar 2021 staat voor het bedrag verkregen door het in aanmerking komende vorderingenoverschot gedurende de periode 1 april 2019 tot en met 31 maart 2021 en het op 31 maart 2019 uitstaande bedrag dat berekend wordt als NSMar 2021 = OLMar 2019 + NLApr 2019 + … + NLMar 2021.
Nu staat EX voor de procentuele afwijking NSMar 2021 van de uitstaandbedragbenchmark, d.w.z.,

EX wordt uitgedrukt als een percentage tot 15 decimalen wordt afgerond. Indien OAB gelijk is aan nul, wordt EX geacht gelijk te zijn aan 2,5.
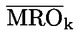 is de basisherfinancieringstransactierente (MRO- rentevoet) die geldt voor de looptijd van TLTRO-III k en die wordt uitgedrukt als een jaarlijkse percentage en
is de basisherfinancieringstransactierente (MRO- rentevoet) die geldt voor de looptijd van TLTRO-III k en die wordt uitgedrukt als een jaarlijkse percentage en  is het gemiddelde van de depositorente die geldt voor de looptijd van TLTRO-III k en uitgedrukt als een jaarlijkse percentage, d.w.z.:
is het gemiddelde van de depositorente die geldt voor de looptijd van TLTRO-III k en uitgedrukt als een jaarlijkse percentage, d.w.z.:

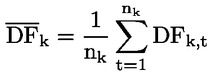
In bovenstaande vergelijkingen bakent nk (voor k=1,..7) het aantal dagen van de TLTRO-III k af, MROk,t bakent de op MRO van toepassing zijnde rentevoet op de t-de dag van de TLTRO-III k af, als deze MRO is uitgevoerd krachtens een vast tarief voor de volledige toewijzing, of MROk,t bakent de op de MRO van toepassing zijnde minimale inschrijvingsrente op de t-de-dag af van de TLTRO-III k, als deze MRO is uitgevoerd krachtens een variabele-rentetenderprocedure en uitgedrukt in een jaarlijks percentage. In de bovenstaande vergelijkingen bakent DFk,t de depositorentie af die geldt op de dag t-de-dag van TLTRO-III k, en wordt uitgedrukt als een jaarlijks percentage.
De rentestimulansaanpassing, gemeten als een fractie van de gemiddelde corridor tussen de maximaal mogelijke rentevoet (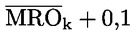 ) en de minimale rentevoet (
) en de minimale rentevoet ( ), bakent iri af; de op TLTRO-III k toepasselijke rentevoet, uitgedrukt als een jaarlijks percentage bakent rk
af; iri en rk
worden als volgt bepaald:
), bakent iri af; de op TLTRO-III k toepasselijke rentevoet, uitgedrukt als een jaarlijks percentage bakent rk
af; iri en rk
worden als volgt bepaald:
|
a) |
Indien een deelnemer zijn uitstaandbedragbenchmark van op 31 maart 2021 van in aanmerking komende leningen niet overschrijdt, dan wordt de rente op alle door de deelnemer uit hoofde van TLTRO's-III geleende bedragen bepaald op 10 basispunten boven de gemiddelde MRO-rentevoet voor de looptijd van de respectieve TLTRO-III, d.w.z. als EX ≤ 0, dan iri = 0 % en |
|
b) |
Indien een deelnemer zijn uitstaandbedragbenchmark van in aanmerking komende leningen met minstens 2,5 % overschrijdt op 31 maart 2021, dan wordt de toepasselijke rente op alle door de deelnemer uit hoofde van TLTRO's-III geleende bedragen bepaald op 10 basispunten boven de gemiddelde rente op de depositorente voor de looptijd van TLTRO-III, d.w.z. als EX ≥ 2,5, dan iri = 100 % en |
|
c) |
Indien een deelnemer zijn uitstaandbedragbenchmark van in aanmerking komende leningen met minder 2,5 % overschrijdt op 31 maart 2021, dan wordt de toepasselijke rentevoet op alle door de deelnemer uit hoofde van TLTRO's-III geleende bedragen lineair aangepast afhankelijk van het percentage waarmee de deelnemer zijn uitstaandbedragbenchmark van in aanmerking komende leningen overschrijdt, d.w.z. als 0 < EX < 2,5, dan |
De rentestimulansaanpassing (iri) wordt uitgedrukt in 15 decimalen.
De rentevoet (rk ) wordt uitgedrukt als een jaarlijks percentage, naar beneden afgerond tot op vier decimalen.
(1) Verwijzingen naar “een deelnemer” moeten opgevat worden als verwijzingen naar individuele deelnemers of TLTRO-III-groepen.
BIJLAGE II
DERDE REEKS VAN GERICHTE LANGERLOPENDE HERFINANCIERINGSTRANSACTIES — RICHTSNOEREN VOOR SAMENSTELLIING VAN DOOR DE RAPPORTAGESJABLONEN VEREISTE GEGEVENS
1. Inleiding (1)
Deze richtsnoeren bevatten instructies voor de samenstelling van de gegevensverslagen die TLTRO's-III-deelnemers overeenkomstig artikel 6 moeten indienen. De rapportageverplichtingen worden aan het einde van deze bijlage in rapportagesjablonen vastgelegd. Deze richtsnoeren zetten tevens de rapportageverplichtingen uiteen van aan de transacties deelnemende leidende instellingen van TLTRO-III-groepen.
Afdelingen 2 en 3 bevatten algemene informatie inzake de samenstelling en verzending van de gegevens en afdeling 4 zet de te rapporteren indicatoren uiteen.
2. Algemene informatie
De bij de berekening van de leningvolumes te gebruiken parameters betreffen leningen van monetaire financiële instellingen (MFI's) aan niet-financiële vennootschappen uit het eurogebied en MFI-leningen aan eurogebiedhuishoudens (2), met uitzondering van leningen voor woningaankoop, in alle valuta's. In overeenstemming met artikel 6 moeten twee gegevensverslagen worden ingediend: het eerste verslag omvat de gegevens van het referentie-uitstaandbedrag en gegevens met betrekking tot de eerste referentieperiode, en het tweede verslag omvat de gegevens met betrekking tot de tweede referentieperiode. Bedragen moeten apart worden gerapporteerd voor niet-financiële vennootschappen en voor huishoudens. Uitstaande bedragen van in aanmerking komende leningen worden aangepast vanwege gesecuritiseerde leningen of anderszins overgedragen, maar niet van de balans zverwijderde leningen, waarbij deelnemers evenwel de optie in artikel 6, lid 3 kunnen uitoefenen om zelfgesecuritiseerde in aanmerking komende leningen, ongeacht hun status op de balans, aan de berekening van het leningvolume toe te voegen. Gedetailleerde informatie is tevens vereist inzake relevante subcomponenten van deze posten, alsook inzake effecten die resulteren in aanpassingen van uitstaande bedragen van in aanmerking komende leningen, maar die geen verband houden met in aanmerking komend vorderingenoverschot (hierna “aanpassingen van uitstaande bedragen”), die tevens leningverkopen en -aankopen en overige leningoverdrachten afdekken.
Wat betreft het gebruik van de verzamelde informatie, zullen gegevens inzake het referentie-uitstaandbedrag worden gebruikt om het leningvolume vast te stellen. Daarnaast zullen gegevens inzake het in aanmerking komende vorderingenoverschot gedurende de eerste referentieperiode worden gebruikt voor de berekening van de vorderingenoverschotbenchmark en de uitstaandbedragbenchmark. Ondertussen zullen gegevens inzake het in aanmerking komende vorderingenoverschot gedurende de tweede referentieperiode worden gebruikt om kredietverleningontwikkelingen en bijgevolg de toepasselijke rentevoeten te beoordelen. Alle overige gebruikte indicatoren zijn noodzakelijk om de interne consistentie van de informatie en de informatieconsistentie met de binnen het Eurosysteem verzamelde statistische gegevens te verifiëren, alsook voor diepgaande monitoring van de TLTRO-III-programma-impact.
Het aan de voltooiing van de gegevensverslagen ten grondslag liggende algemene kader wordt gevormd door de rapportageverplichtingen van eurogebied-MFI's in de context van MFI-balanspoststatistieken (BSI), zoals bedoeld in de Verordening (EU) nr. 1071/2013 (ECB/2013/33). In het bijzonder wat betreft leningen schrijft artikel 8, lid 2, van Verordening (EU) nr. 1071/2013. (ECB/201333) voor dat zij “tegen de per maandultimo uitstaande hoofdsom gerapporteerd” worden. Afschrijvingen en afwaarderingen zoals bepaald door de betreffende relevante boekhoudpraktijken vallen niet onder dit bedrag. […] leningen worden niet gesaldeerd tegen enige activa of passiva. Als uitzondering op de in artikel 8, lid 2, vastgelegde regels die ook impliceren dat leningen inclusief voorzieningen gerapporteerd moeten worden, bepaalt artikel 8, lid 4, evenwel dat “NCB's kunnen rapportage van leningen waarvoor voorzieningen zijn getroffen, zonder deze voorzieningen toestaan, alsook de rapportage van overgenomen leningen tegen de ten tijde van de acquisitie overeengekomen prijs [d.w.z. de transactiewaarde], op voorwaarde dat alle ingezeten informatieplichtigen deze rapportagepraktijken toepassen”. Zelfgesecuritiseerde leningen mogen niet worden gerapporteerd na aftrek van voorzieningen indien deze van de balans worden verwijderd. De implicaties van deze afwijking van de algemene BSI-oriëntatie voor het samenstellen van de gegevensverslagen worden hierna in meer detail besproken.
Verordening (EU) nr. 1071/2013 (ECB/2013/33) moet ook als referentiedocument gebruikt worden voor wat betreft de bij het samenstellen van de gegevensverslagen te hanteren definities. Zie met name artikel 1 voor algemene definities, en delen 2 en 3 van bijlage II voor een definitie van de onder “leningen” te plaatsen categorieën van instrumenten, respectievelijk de sectoren van deelnemers. Het is van belang dat binnen het BSI-kader te ontvangen opgebouwde lopende rente op leningen op de balans opgenomen moet worden (d.w.z. op transactiebasis en niet wanneer de rente werkelijk ontvangen wordt, maar wordt uigesloten van de gegevens betreffende uitstaande bedragen van leningen. Gekapitaliseerde rente moet evenwel geregistreerd worden als deel van de uitstaande bedragen.
Enerzijds zijn vele van de te rapporteren gegevens reeds door MFI's overeenkomstig de vereisten van Verordening (EU) nr. 1071/2013 (ECB/2013/33) samengesteld, anderzijds moet enige aanvullende informatie samengesteld worden uit de deelnemers die inschrijven op TLTRO-III. Het methodologische kader voor BSI-statistieken, zoals vastgelegd in het Handboek betreffende MFI-balansstatistieken (3), verschaft alle veresite achtergrondinformatie voor de samenstelling van deze aanvullende gegevens;
3. Algemene rapportage-instructies
a) Rapportagesjablonenstructuur
De sjablonen bevatten een indicatie van de referentiedatums waaraan de gegevens refereren en groepeert de indicatoren in twee blokken: MFI-leningen aan niet-financiële vennootschappen in het eurogebied en MFI-leningen aan eurogebiedhuishoudens, met uitzondering van leningen voor woningaankoop. De in alle cellen geel gearceerde gegevens worden berekend uit de in andere cellen ingevoerde gegevens, zulks op basis van de verstrekte formules. De sjablonen omvatten ook validatieregels die de onderlinge consistentie van de gegevens verifiëren.
Er zijn twee verslagen in de TLTRO-III.
|
— |
In het eerste verslag moet het ingevulde gegevenssjabloon A inzake het referentie-uitstaandbedrag voor de berekening van het leningvolume en de maximiminschrijvingsbedragen worden opgenomen. Deelnemers die de optie in artikel 6, lid 3, uitoefenen moeten de aanvullende posten met betrekking tot zelfgesecuritiseerde in aanmerking komende leningen en de beoordeling van deze posten door de accountant verstrekken overeenkomstig artikel 6, lid 6, onder c). In het eerste verslag moet ook het ingevulde rapportagesjabloon B worden opgenomen voor de berekening van het vorderingenoverschot en benchmarks.voor de “eerste referentieperiode”, d.w.z. van 1 april 2018 tot 31 maart 2019 |
|
— |
In het tweede verslag moet het ingevulde rappotagesjabloon B worden opgenomen voor de “tweede referentieperiode”, d.w.z. an 1 april 2019 tot 31 maart 2021 voor de berekening van het vorderingenoverschot en de vergelijkingen tegen benchmarks waarop de toepasselijke rentevoeten zijn gebaseerd. |
In sjabloon B moeten indicatoren met betrekking tot uitstaande bedragen worden gerapporteerd aan het einde van de maand voorafgaand aan het begin van de rapportageperiode en aan het einde van de rapportageperiode; daarom moeten de op 31 maart 2018 en op 31 maart 2019 uitstaande bedragen voor de eerste referentieperiode worden gerapporteerd, en voor de tweede referentieperiode moeten de op 31 maart 2019 en op 31 maart 2021 uitstaande bedragen worden gerapporteerd. Op hun beurt moeten transactie- en aanpassingsgegevens alle relevante effecten bestrijken die zich tijdens de rapportageperiode voordoen.
b) Rapportage met betrekking tot TLTRO-III-groepen
Wat betreft de TLTRO's-III-groepsdeelname moeten normaliter gegevens geaggregeerd gerapporteerd worden. De nationale centrale banken van lidstaten die de euro als munt hebben (NCB's) kunnen evenwel informatie per individuele instelling verzamelen, indien dit passend wordt geacht.
c) Verzending van de gegevensverslagen
De voltooide gegevensverslagen moeten op aan de betrokken NCB gezonden worden overeenkomstig artikel 6 en het op de ECB-website bekendgemaakte indicatieve tijdschema voor TLTRO's-III, dat ook de in iedere verzending te bestrijken referentieperioden en de te hanteren gegevensreeksen voor de gegevenssamenstelling vermeldt.
d) Gegevenseenheid
Gegevens moet in een veelvoud van duizend euro gerapporteerd worden.
4. Definities
In deze afdeling worden de te rapporteren posten gedefinieerd; de nummering die in de rapportagesjablonen wordt gebruikt wordt tussen haakjes aangegeven.
a) Uitstaande bedragen van in aanmerking komende leningen (1 en 4)
De gegevens in deze cellen worden berekend op basis van de gerapporteerde cijfers met betrekking tot de volgende posten: “Uitstaande bedragen op de balans” (1.1 en 4.1), min “Uitstaande bedragen van gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen” (1.2 en 4.), plus “Uitstaande voorzieningen” (1.3 en 4.3). De laatste subterm is slechts relevant wanneer in weerwil van de algemene BSI-praktijk leningen min voorzieningen gerapporteerd worden.
De onderliggende voorzieningen van de uistaande bedragen van in aanmerking komende leningen zijn de volgende:
|
i) |
Uitstaande bedragen op de balans (1.1 en 4.1) Deze post omvat uitstaande bedragen van leningen die zijn verstrekt aan niet-financiële vennootschappen en huishoudens uit het eurogebied, met uitzondering van leningen voor woningaankoop. Opgebouwde rente, in tegenstelling tot gekapitaliseerde rente, is niet in de indicatoren opgenomen. Deze cellen zijn direct gekoppeld aan de vereisten van deel 2 van bijlage I bij Verordening (EU) nr. 1071/2013 (ECB/2013/33) (blok 2 van tabel 1 inzake maandstanden). Voor een meer gedetailleerde definitie van de in de gegevensverslagen op te nemen posten, zie deel 2 van bijlage II bij Verordening (EU) nr. 1071/2013 (ECB/2013/33) en afdeling 4.3 van het Handboek betreffende MFI-balansstatistieken. |
|
ii) |
Uitstaande bedragen van gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen (1.2 en 4.2). Deze post omvat uitstaande bedragen van gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen. Alle securitisatieactiviteiten moeten gerapporteerd worden, ongeacht de plaats van ingezetenschap van de lege financiële instellingen. Leningen in de vorm van kredietvorderingen die als onderpand zijn verstrekt aan het Eurosysteem voor krediettransacties binnen het kader van het monetaire beleid worden niet in deze post opgenomen. Deel 5 van bijlage I bij Verordening (EU) nr. 1071/2013 (ECB/2013/33) (blok 5.1 van tabel 5a betreffende maandgegevens) bestrijkt de vereiste informatie betreffende aan niet-financiële vennootschappen en huishoudens verstrekte gesecuritiseerde leningen die niet van de balans zijn verwijderd, maar vereist niet dat de laatste naar doel uitgesplitst worden. Bovendien worden uitstaande bedragen van leningen, die anderszins overgedragen zijn (d.w.z. niet middels securitisatie), maar niet van de balans verwijderd werden, niet door Verordening (EU) nr. 1071/2013 (ECB/2013/33) bestreken. Voor het samenstellen van de gegevensverslagen zijn dus aparte gegevensextracties uit de interne MFI-gegevensbestanden vereist. Voor aanvullende details van de in de gegevensverslagen op te nemen posten, zie deel 5 van bijlage I bij Verordening (EU) nr. 1071/2013 (ECB/2013/33) en afdeling 2.3 van het Handboek betreffende MFI-balansstatistieken. |
|
iii) |
Uitstaande voorzieningen (1.3 en 4.3) Deze gegevens zijn slechts van belang voor instellingen die in weerwil van de algemene BSI-praktijk leningen zonder voorzieningen rapporteren. Voor instellingen die als TLTRO-III-groep inschrijven is dit vereiste slechts van toepassing op instellingen in de groep die leningen zonder voorzieningen registreren. Deze post omvat individuele en collectieve voorzieningen voor bijzondere waardeverminderingen en verliezen op leningen (vóór de toepassing van afschrijvingen/afwaarderingen). De gegevens moeten betrekking hebben op uitstaande bedragen aan leningen op de balans (1.1 en 4.1), met uitzondering van “Uitstaande bedragen aan gescuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen” (1.2. en 4.2). Zoals vermeld in de derde alinea van punt 2, moeten leningen normaliter binnen het kader van BSI-statistieken gerapporteerd worden als uitstaande hoofdsom, met de daarmee overeenstemmende voorzieningen die zijn toegewezen aan “Kapitaal en reserves”. In dergelijke gevallen moet geen aparte informatie over voorzieningen gerapporteerd worden. Tegelijkertijd moet voor leningen die gerapporteerd worden zonder voorzieningen deze aanvullende informatie gerapporteerd worden om tussen MFI's volledig vergelijkbare gegevens te verzamelen. Indien het gebruikelijk is uitstaande bedragen van leningen zonder voorzieningen te rapporteren, kunnen NCB's de rapportage van deze informatie niet-verplicht maken. In dergelijke gevallen worden de berekeningen evenwel uit hoofde van het TLTRO-III-kader gebaseerd op bedragen van uitstaande leningen op de balans zonder voorzieningen (4). Voor aanvullende details, zie de verwijzing naar voorzieningen in de definitie van “Kapitaal en reserves” in deel 2 van bijlage II bij Verordening (EU) nr. 1071/2013 (ECB/2013/33). |
b) In aanmerking komend vorderingenoverschot (2)
Deze cellen registreren het vorderingenoverschot (transacties) dat gedurende de rapportageperiode verstrekt werd. De gegevens worden berekend op basis van de voor de subposten gerapporteerde cijfers, namelijk “brutokredietverlening” (2.1) minus “aflossingen” (2.2).
Gedurende de rapportageperiode overgesloten leningen moeten zowel als “aflossingen” gerapporteerd worden alsmede als “brutokredietverlening” ten tijde van de oversluiting. Aanpassingsgegevens moeten met de leningoversluiting verband houdende effecten omvatten.
Omgekeerde transacties gedurende de periode (d.w.z. gedurende de periode verstrekte en afgeloste leningen) moeten in beginsel zowel als “brutokredietverlening” gerapporteerd worden alsook als “aflossingen”. Biedende MFI's mogen deze transacties evenwel bij het samenstellen van het gegevensverslag uitsluiten, voor zover dat hun rapportagelast zou verlichten. In dat geval dienen zij de betrokken NCB te informeren en de gegevens inzake aanpassingen van de uitstaande bedragen en moeten de met deze repotransacties verband houdende effecten worden uitgesloten. Deze uitzondering geldt niet voor gedurende de periode verstrekte leningen die gesecuritiseerd of anderszins overgedragen zijn.
Schulden op kredietkaart, doorlopende leningen en rekening-courantkredieten moeten ook verantwoord worden. Aangaande deze instrumenten, saldomutaties vanwege gedurende de rapportageperioden opgenomen krediet of opgenomen bedragen moeten gebruikt worden als vervanger voor het vorderingenoverschot. Positieve bedragen moeten als “brutokredietverstrekking” (2.1) gerapporteerd worden, terwijl negatieve bedragen als “aflossingen” gerapporteerd (met +-teken) moeten worden (2.2).
|
i) |
Brutokredietverstrekking (2.1) Deze post omvat de stroom van nieuwe brutoleningen in de rapportageperiode, met uitzondering van leningovernames. Verleend krediet dat betrekking heeft op creditcardschulden, doorlopende leningen en rekening-courantkredieten moeten ook gerapporteerd worden, zoals hiervoor uitgelegd. Bedragen die gedurende de periode zijn toegevoegd aan door klanten verschuldigde bedragen, bijvoorbeeld, aan rentekapitalisatie (in tegenstelling tot opgebouwde rente) en vergoedingen moeten ook opgenomen worden. |
|
ii) |
Aflossingen (2.2) Deze post omvat de stroom van hoofdsomaflossingen gedurende de rapportageperiode, met uitzondering van aflossingen die verband houden met gesecuritiseerde of anderszins overgedragen leningen die niet van de balans verwijderd zijn. Aflossingen van schulden op kredietkaart, doorlopende leningen en rekening-courantkredieten moeten ook gerapporteerd worden, zoals hiervoor uitgelegd. Rentebetalingen van opgebouwde, maar nog niet gekapitaliseerde rente, leningoverdrachten en overige aanpassingen aan uitstaande bedragen (inclusief afschrijvingen en afwaarderingen) moeten niet gerapporteerd worden. Verordening (EU) nr. 1071/2013 (ECB/2013/33) schrijft voor dat omzettingen van schulden in aandelen worden behandeld als transacties. Ten behoeve van de samenstelling van de TLTRO-III-gegevensverslagen mogen voor de samenstelling van de gegevensverslagen waarbij door een deelnemer aan niet-financiële vennootschappen verstrekte leningen worden vervangen door aandelen die door die deelnemer in deze niet-financiële vennootschappen worden aangehouden, worden gerapporteerd als een herindeling en niet als een terugbetaling van de leningen, op voorwaarde dat het door de deelnemer aan de reële economie verschafte financieringsbedrag daardoor niet wordt verminderd, zoals bepaald door de desbetreffende NCB. De deelnemer verstrekt alle noodzakelijke informatie aan de NCB, zodat deze kan beslissen hoe de omzetting dient te worden behandeld. |
c) Aanpassingen in de uitstaande bedragen (3)
Deze cellen dienen voor het rapporteren van wijzigingen in uitstaande bedragen van in aanmerking komende leningen (verlagingen (–) en verhogingen (+)) die zich in de rapportageperiode voordoen en die geen verband houden met het vorderingenoverschot. Dergelijke wijzigingen vloeien voort uit transacties zoals securitisaties van leningen en overige overdrachten van leningen gedurende de rapportageperiode, en uit overige aanpassingen in verband met herwaarderingen ten gevolge van wisselkoerswijzigingen, afschrijvingen en waardeverminderingen en herindelingen van leningen.
De gegevens aangaande de aanpassingen van uitstaande bedragen worden berekend op basis van de cijfers die gerapporteerd worden in de subposten, namelijk “Verkoop en aankoop van leningen en overige overdrachten van leningen gedurende de rapportageperiode” (3.1) plus “Overige aanpassingen” (3.2).
|
i) |
Leningverkopen en -aankopen en overige leningoverdrachten gedurende de rapportageperiode (3.1)
|
|
ii) |
Overige aanpassingen (3.2) De volgende posten aangaandet overige aanpassingen moeten gerapporteerd worden voor uitstaande in aanmerking komende leningen op de balans, met uitzondering van gesecuritiseerde of anderszins overgedragen leningen die niet van de balans verwijderd worden.
|
d) Aanvullende bedragen met betrekking tot zelfgesecuritiseerde in aanmerking komende leningen (S.1)
Deelnemers die de in artikel 6, lid 3, opgenomen optie uitoefenen moeten ook de volgende aanvullende posten verstrekken aangaande de uitstaande bedragen van zelfgesecuritiseerde in aanmerking komende leningen in sjabloon A:
|
i) |
“Uitstaande bedragen van zelfgesecuritiseerde in aanmerking komende, maar niet van de balans verwijderde leningen” (S.1.1) Deze gegevens refereren aan leninngen die zelfgesecuritiseerd en opgenomen zijn in de bedragen die onder post 1.2 gerapporteerd worden |
|
ii) |
“Uitstaande bedragen van zelfgesecuritiseerde in aanmerking komende en van de balans verwijderde leningen (S.1.2) Deze gegevens refereren aan leningen die zelfgesecuritiseerd zijn en niet langer zijn opgenomen in de balans omdat ze daarvan verwijderd zijn. In zoverre de leningen nog steeds door de deelnemer worden afgelost zullen de rapportage-eisen van toepassing zijn op basis van Deel 5 van bijlage I bij Verordening (EU) Nr. 1071/2013 (blok 3.1 van tabellen 5a en 5b). |
|
iii) |
Uitstaande bedragen van voorzieningen met betrekking tot zelfgesecuritiseerde in aanmerking komende en niet van de balans verwijderde leningen (S.1.3) Deze gegevens refereren aan leningen die niet van de balans verwijderd zijn, d.w.z. die gerapporteerd worden onder S.1.1. Deze posten worden allen gerapporeerd in gevallen waarin, in tegenstelling tot de algemene BSI-praktijk, leningen worden gerapporteerd na aftrek van voorzieningen. In dat geval kunnen deelnemers evenwel besluiten om deze informatie niet te verstrekken, waardoor de betrokken bedragen niet worden opgenomen in de berekening van de uitstaande bedragen van in aanmerking komende leningen. |
TLTRO-III-rapportage
TLTRO-III rapportagesjabloon A
|
Rapportageperiode:28 februari 2019 |
|||||||||
|
|
|||||||||
|
Leningen aan niet-financiële vennootschappen en huishoudens, met uitzondering van leningen aan huishoudens voor woningaankoop (in duizend EUR) |
|||||||||
|
|
|||||||||
|
|
Belangrijkste aggregaten |
|
Leningen aan niet-financiële vennootschappen |
Leningen aan huishoudens (waarbij mede inbegrepen instellingen zonder winstoogmerk ten behoeve van huishoudens), met uitzondering van leningen voor woningaankoop |
|
|
|
||
|
|
|
|
|
|
|
|
post |
formule |
validatie |
|
|
1 |
Uitstaande bedragen van in aanmerking komende leningen (1 en 4) … |
|
0 |
0 |
1 |
1 = 1.1 – 1.2 (1.3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1 |
Aanvullende posten (met betrekking tot zelfgesecuritiseerde in aanmerking komende leningen) … |
|
0 |
0 |
S.1 |
S.1 = S.1.1 + S.1.2 (+S.1.3) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Onderliggende posten |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uitstaande bedragen van in aanmerking komende leningen op de balans |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1 |
Uitstaande bedragen op de balans … |
|
|
|
1.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2 |
Uitstaande bedragen van gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen … |
|
|
|
1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3 |
Uitstaande bedragen tegen leningen die gerapporteerd zijn in post 1.1, exclusief 1.2 (*1)… |
|
|
|
1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aanvullende posten (met betrekking tot zelfgesecuritiseerde in aanmerking komende leningen) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.1 |
Uitstaande bedragen van zelfgesecuritiseerde in aanmerking komende, maar niet van de balans verwijderde leningen … |
|
|
|
S.1.1 |
|
S.1.1 <= 1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.2 |
Uitstaande bedragen van zelfgesecuritiseerde in aanmerking komende en van de balans verwijderde leningen … |
|
|
|
S.1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.3 |
Uitstaande bedragen van voorzienigngen voor zelfgesecuritiseerde in aanmerking komende, maar niet van de balans verwijderde leningen (*1)… |
|
|
|
S.1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TLTRO-III-rapportagesjabloon B
|
Rapportageperiode:1 april 2018 tot en met 31 maart 2019 (eerse referentieperiode) / 1 april 2019 tot 31 maart 2021 (tweede referentieperiode) |
|||||||||
|
|
|||||||||
|
Leningen aan niet-financiële vennootschappen en huishoudens, met uitzondering van leningen aan huishoudens voor woningaankoop (in duizend EUR) |
|||||||||
|
|
|||||||||
|
|
Belangrijkste aggregaten |
|
Leningen aan niet-financiële vennootschappen |
Leningen aan huishoudens (waarbij mede inbegrepen instellingen zonder winstoogmerk ten behoeve van huishoudens), met uitzondering van leningen voor woningaankoop |
|
|
|
||
|
|
|
|
|
|
|
|
post |
formule |
validatie |
|
|
1 |
Uitstaande bedragen van in aanmerking komende leningen aan het einde van de maand voorafgaande aan het begin van de rapportageperiode … |
|
0 |
0 |
1 |
1 = 1.1 – 1.2 (+1.3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
In aanmerking komend vorderingenoverschot in de rapportageperiode … |
|
0 |
0 |
2 |
2 = 2.1 – 2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Aanpassingen in de uitstaande bedragen: verlagingen (–) en verhogingen (+) … |
|
0 |
0 |
3 |
3 = 3.1 + 3.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
Uitstaande bedragen van in aanmerking komende leningen aan het einde van de rapportageperiode … |
|
0 |
0 |
4 |
4 = 4.1 – 4.2 (+4.3) |
4 = 1 + 2 + 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Onderliggende posten |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uitstaande bedragen van in aanmerking komende leningen aan het einde van de maand voorafgaande aan het begin van de rapportageperiode |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1 |
Uitstaande bedragen op de balans … |
|
|
|
1.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2 |
Uitstaande bedragen van gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen … |
|
|
|
1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3 |
Uitstaande bedragen tegen leningen die gerapporteerd zijn in post 1.1, exclusief 1.2 (*2)… |
|
|
|
1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
In aanmerking komend vorderingenoverschot in de rapportageperiode |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.1 |
Brutokredietverstrekking … |
|
|
|
2.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2 |
Aflossingen … |
|
|
|
2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aanpassingen in de uitstaande bedragen: verlagingen (–) en verhogingen (+) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1 |
Leningverkopen en -aankopen en overige leningoverdrachten gedurende de rapportageperiode … |
|
0 |
0 |
3.1 |
3.1 = 3.1A + 3.1B + 3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1A |
Nettostromen van gesecuritiseerde leningen met een impact op leningstanden … |
|
|
|
3.1A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1B |
Nettostromen van anderszins overgedragen leningen met een impact op leningstanden … |
|
|
|
3.1B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1C |
Nettostromen van gesecuritiseerde of anderszins overgedragen leningen zonder impact op leningstanden … |
|
|
|
3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2 |
Overige aanpassingen … |
|
0 |
0 |
3.2 |
3.2 = 3.2A + 3.2B + 3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2A |
Herwaarderingen vanwege veranderingen in de wisselkoersen … |
|
|
|
3.2A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2B |
Afschrijvingen/afwaarderingen … |
|
|
|
3.2B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2C |
Herindelingen … |
|
|
|
3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uitstaande bedragen van in aanmerking komende leningen aan het einde van de rapportageperiode |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.1 |
Uitstaande bedragen op de balans … |
|
|
|
4.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.2 |
Uitstaande bedragen van gesecuritiseerde of anderszins overgedragen, maar niet van de balans verwijderde leningen … |
|
|
|
4.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.3 |
Uitstaande voorzieningen voor leningen die gerapporteerd zijn in post 4.1, exclusief 4.2 (*2)… |
|
|
|
4.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) Het conceptuele kader van de onderliggende rapportagevoorschriften verandert niet ten opzichte van het in de Besluiten ECB/2014/34 enn (EU) 2016/10 (ECB/2016/10) bedoelde kader, met uitzondering van de wijzigingen met betrekking tot het opnemen van zelfgesecuritiseerde leningen in de definitie van uitstaande bedragen van in aanmerking komende leningen.
(2) Voor het opstellen van de gegevensverslagen omvatten “huishoudens” instellingen zonder winstoogmerk ten behoeve van huishoudens.
(3) Zie het “Handboek betreffende MFI-balansstatistieken” ECB, april 2012, beschikbaar op de ECB-website onder www.ecb.europa.eu. Met name paragraaf 2.1.4, blz. 76 betreft statistische rapportage van leningen.
(4) Deze uitzondering heeft ook implicaties voor de gegevensrapportage betreffende afschrijvingen en afwaarderingen, zoals hierna uitgelegd.
(5) Deze tekenconventie die het tegengestelde zijn van Verordening (EU) nr. 1071/2013 (ECB/2013/33) strookt met het algemene vereiste aangaande aanpassingsgegevens, zoals hierboven uiteengezet — namelijk effecten die leiden tot stijgende of dalende uitstaande bedragen moeten respectievelijk met een +- of –-symbool gerapporteerd worden.
(6) Verordening (EU) nr. 1071/2013(ECB/2013/33) staat MFI's toe overgenomen leningen tegen hun transactiewaarde te rapporteren zolang dit een praktijk is die alle MFI's in het land toepassen. In dergelijke gevallen kunnen herwaarderingscomponenten ontstaan die onder post 3.2B gerapporteerd moeten worden.
(7) De referentiewisselkoers van de ECB moet gebruikt worden. Zie het persbericht van 8 juli 1998 betreffende het invoeren van gemeenschappelijke marktnormen, welk persbericht beschikbaar is op de ECB-website: http://www.ecb.europa.eu
(8) Dit vereiste wijkt af van de rapportagevereisten uit hoofde van Verordening (EU) nr. 1071/2013 (ECB/2013/33).
(9) Dit vereiste is hetzelfde als de uit hoofde van Verordening (EU) nr. 1071/2013 (ECB/2013/33) door MFI's te rapporteren informatie, welke MFI's leningen min voorzieningen registreren.
(*1) Slechts van toepassing indien leningen worden gerapporteerd zonder voorzieningen; zie de rapportage-instructies voor nadere details.
(*2) Slechts van toepassing indien leningen worden gerapporteerd na aftrek van voorzieningen; zie de rapportage-instructies voor nadere details.
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/123 |
BESLUIT (EU) 2019/1312 VAN DE EUROPESE CENTRALE BANK
van 22 juli 2019
tot wijziging van Besluit (EU) 2016/810 (ECB/2016/10) betreffende een tweede reeks gerichte langerlopende herfinancieringstransacties (ECB/2019/22)
DE RAAD VAN BESTUUR VAN DE EUROPESE CENTRALE BANK,
Gezien het Verdrag betreffende de werking van de Europese Unie, en met name artikel 127, lid 2, eerste streepje,
Gezien de statuten van het Europees Stelsel van centrale banken en van de Europese Centrale Bank, en met name artikel 3.1, eerste streepje, artikel 12.1, artikel 18.1, tweede streepje, en artikel 34.1, tweede streepje,
Gezien Richtsnoer (EU) 2015/510 van de Europese Centrale Bank van 19 december 2014 betreffende de tenuitvoerlegging van het monetairbeleidskader van het Eurosysteem (ECB/2014/60) (1),
Overwegende hetgeen volgt:
|
(1) |
Overeenkomstig artikel 1, lid 4, van Richtsnoer (EU) 2015/510 (ECB/2014/60) kan de Raad van bestuur te allen tijde besluiten tot aanpassing van hulpmiddelen, instrumenten, vereisten, criteria en procedures voor de implementatie van monetairbeleidstransacties van het Eurosysteem. |
|
(2) |
Op 28 april 2016 heeft de Raad van bestuur Besluit (EU) 2016/810 van de Europese Centrale Bank (ECB/2016/10) (2) vastgesteld ter uitvoering van haar prijsstabiliteitsmandaat en om de overdracht van het monetaire beleid te versterken door verdere stimulering van bankleningen aan de niet-financiële particuliere sector. Dit besluit voorziet in een tweede reeks van gerichte langerlopende herfinancieringstransacties (TLTRO's-II), die in de periode van juni 2016 tot maart 2017 worden uitgevoerd. |
|
(3) |
Op 7 maart 2019 heeft de Raad van bestuur besloten om een nieuwe serie van zeven langer lopende herfinancieringstransacties uit te voeren om gunstiger voorwaarden voor bankkredieten te behouden en accommoderend monetair beleid in lidstaten die de euro als munt hebben, te ondersteunen. De bepalingen met betrekking tot de TLTRO's-III worden in een apart besluit vastgesteld. |
|
(4) |
Teneinde de berekening van de maximuminschrijvingsbedragen voor de TLTRO's-III te faciliteren, en om rekening te houden met eventuele vrijwillige vervroegde aflossingen van uit hoofde van TLTRO's-II geleende bedragen, is het noodzakelijk om de kennisgevingsperiode voor een dergelijke vervroegde aflossing aan te passen. |
|
(5) |
Opdat kredietinstellingen over voldoende tijd beschikken voor de operationele voorbereidingen voor de eerste TLTRO-III, moet dit besluit onverwijld in werking treden. |
|
(6) |
Besluit (EU) 2016/810 (ECB/2016/10) moet derhalve dienovereenkomstig worden gewijzigd, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Wijzigingen
In artikel 6 van Besluit (EU) 2016/810 (ECB/2016/10) worden de leden 3 en 4 vervangen door:
“3. Om een beroep te kunnen doen op de vervroegde aflossingsprocedure, stelt een deelnemer de betrokken NCB uiterlijk twee weken voorafgaande aan de vervroegde aflossingsdatum ervan in kennis dat hij uit hoofde van de vervroegde aflossingsprocedure op de vervroegde aflossingsdatum vervroegd wil aflossen.
4. De in lid 3 bedoelde kennisgeving wordt twee weken voor de betrokken vervroegdeaflossingsdatum bindend voor de deelnemer. Indien de deelnemer het op de vervroegdeaflossingsdatum uit hoofde van de vervroegdeaflossingsprocedure verschuldigde bedrag niet of gedeeltelijk voldoet, kan zulks resulteren in de oplegging van een geldboete. De toepasselijke geldboete wordt overeenkomstig bijlage VII bij Richtsnoer (EU) 2015/510 (ECB/2014/60) berekend en komt overeen met de geldboete die wordt opgelegd indien niet wordt voldaan aan de verplichtingen om voldoende onderpand te verstrekken en het bedrag af te lossen dat de wederpartij aangaande transacties met wederinkoop voor monetairbeleidsdoeleinden is toegewezen. De oplegging van een geldboete geschiedt zonder afbreuk te doen aan het recht van de NCB om ingeval van wanbetaling de in artikel 166 van Richtsnoer (EU) 2015/510 (ECB/2014/60) vastgelegde verhaalsmogelijkheden uit te oefenen.”.
Artikel 2
Inwerkingtreding
Dit besluit treedt op 3 augustus 2019 in werking.
Gedaan te Frankfurt am Main, 22 juli 2019.
Namens de Raad van bestuur van de ECB
De president van de ECB
Mario DRAGHI
(1) Richtsnoer (EU) 2015/510 van de Europese Centrale Bank van 19 december 2014 betreffende de tenuitvoerlegging van het monetairbeleidskader van het Eurosysteem (ECB/2014/60) (richtsnoer algemene documentatie) (PB L 91 van 2.4.2015, blz. 3).
(2) Besluit ECB/2016/810 van de Europese Centrale Bank van 28 april 2016 betreffende een tweede reeks gerichte langerlopende herfinancieringstransacties (ECB/2016/10) (PB L 132 van 21.5.2016, blz. 107).
Rectificaties
|
2.8.2019 |
NL |
Publicatieblad van de Europese Unie |
L 204/125 |
Rectificatie van Verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen
( Publicatieblad van de Europese Unie L 152 van 16 juni 2009 )
Bladzijde 5, artikel 13, lid 1:
in plaats van:
“1. Het certificaat geldt vanaf het verstrijken van de wettelijke duur van het basisoctrooi, voor een duur die gelijk is aan de periode die is verstreken tussen de datum van de aanvraag voor het basisoctrooi en de datum van de eerste vergunning voor het in de handel brengen in de Gemeenschap, verminderd met een periode van vijf jaar.”,
lezen:
“1. Het certificaat wordt van kracht vanaf het verstrijken van de wettelijke duur van het basisoctrooi, voor een duur die gelijk is aan de periode die is verstreken tussen de datum van de aanvraag voor het basisoctrooi en de datum van de eerste vergunning voor het in de handel brengen in de Gemeenschap, verminderd met een periode van vijf jaar.”.
Bladzijde 5, artikel 13, lid 2:
in plaats van:
“2. Niettegenstaande het bepaalde in lid 1 kan de duur van het certificaat ten hoogste vijf jaar bedragen, gerekend vanaf de datum waarop het is ingegaan.”,
lezen:
“2. Niettegenstaande het bepaalde in lid 1 kan de duur van het certificaat ten hoogste vijf jaar bedragen, gerekend vanaf de datum waarop het van kracht wordt.”.