ISSN 1977-0758
Publicatieblad
van de Europese Unie
L 331

Uitgave in de Nederlandse taal
Wetgeving
57e jaargang
18 november 2014
|
ISSN 1977-0758 |
||
|
Publicatieblad van de Europese Unie |
L 331 |
|

|
||
|
Uitgave in de Nederlandse taal |
Wetgeving |
57e jaargang |
|
|
|
Rectificaties |
|
|
|
* |
||
|
|
* |
||
|
|
* |
||
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) Voor de EER relevante tekst |
|
NL |
Besluiten waarvan de titels mager zijn gedrukt, zijn besluiten van dagelijks beheer die in het kader van het landbouwbeleid zijn genomen en die in het algemeen een beperkte geldigheidsduur hebben. Besluiten waarvan de titels vet zijn gedrukt en die worden voorafgegaan door een sterretje, zijn alle andere besluiten. |
II Niet-wetgevingshandelingen
VERORDENINGEN
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/1 |
UITVOERINGSVERORDENING (EU) Nr. 1225/2014 VAN DE RAAD
van 17 november 2014
tot uitvoering van Verordening (EU) nr. 269/2014 betreffende beperkende maatregelen met betrekking tot acties die de territoriale integriteit, soevereiniteit en onafhankelijkheid van Oekraïne ondermijnen of bedreigen
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) nr. 269/2014 van de Raad van 17 maart 2014 betreffende beperkende maatregelen met betrekking tot acties die de territoriale integriteit, soevereiniteit en onafhankelijkheid van Oekraïne ondermijnen of bedreigen (1), en met name artikel 14, lid 1,
Overwegende hetgeen volgt:
|
(1) |
Op 17 maart 2014 heeft de Raad Verordening (EU) nr. 269/2014 vastgesteld. |
|
(2) |
De informatie betreffende één persoon die krachtens Verordening (EU) nr. 269/2014 is opgenomen in de lijst, moet worden gewijzigd. |
|
(3) |
Bijlage I bij Verordening (EU) nr. 269/2014 dient derhalve dienovereenkomstig te worden gewijzigd, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Bijlage I bij Verordening (EU) nr. 269/2014 wordt gewijzigd overeenkomstig de bijlage bij deze verordening.
Artikel 2
Deze verordening treedt in werking op de dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Raad
De voorzitter
F. MOGHERINI
(1) PB L 78 van 17.3.2014, blz. 6.
BIJLAGE
De vermelding voor de volgende persoon, als weergegeven in bijlage I bij Verordening (EU) nr. 269/2014, wordt vervangen door de onderstaande vermelding.
|
|
Naam |
Identificatiegegevens |
Motivering |
Datum van plaatsing op de lijst |
|
|
Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Geboren op 25.4.1946 in Almaty (voorheen bekend onder de naam Alma-Ata), Kazachstan |
Lid van de Raad van de Doema; voorzitter van de LDPR-partij. Hij heeft de inzet van Russische gewapende strijdkrachten in Oekraïne en de annexatie van de Krim actief ondersteund. Hij heeft actief gepleit voor de opdeling van Oekraïne. Namens de door hem voorgezeten LDPR-partij heeft hij een overeenkomst met de zogenoemde „Volksrepubliek Donetsk” ondertekend. |
12.9.2014 |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/3 |
VERORDENING (EU) Nr. 1226/2014 VAN DE COMMISSIE
van 17 november 2014
tot verlening van een vergunning voor een gezondheidsclaim voor levensmiddelen die over ziekterisicobeperking gaat
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1924/2006 van het Europees Parlement en de Raad van 20 december 2006 inzake voedings- en gezondheidsclaims voor levensmiddelen (1), en met name artikel 17, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Krachtens Verordening (EG) nr. 1924/2006 zijn gezondheidsclaims voor levensmiddelen verboden, tenzij de Commissie daarvoor overeenkomstig die verordening een vergunning heeft verleend en zij zijn opgenomen in een lijst van toegestane claims. |
|
(2) |
Verordening (EG) nr. 1924/2006 bepaalt tevens dat aanvragen voor een vergunning voor gezondheidsclaims door exploitanten van levensmiddelenbedrijven bij de bevoegde nationale autoriteit van een lidstaat kunnen worden ingediend. De bevoegde nationale autoriteit moet geldige aanvragen doorsturen naar de Europese Autoriteit voor voedselveiligheid (EFSA). |
|
(3) |
Na ontvangst van een aanvraag moet de EFSA de andere lidstaten en de Commissie daarvan onverwijld in kennis stellen en een advies over de desbetreffende gezondheidsclaim uitbrengen. |
|
(4) |
De Commissie moet bij haar besluit over de verlening van een vergunning voor gezondheidsclaims rekening houden met het advies van de EFSA. |
|
(5) |
Ingevolge een aanvraag van Lactalis B&C, die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim die betrekking had op „arm aan vet en arm aan smeerbare transvetten rijk aan onverzadigde en omega-3-vetzuren” en op de verlaging van LDL-cholesterolconcentraties (Vraag nr. EFSA-Q-2009-00458) (2). De door de aanvrager voorgestelde claim luidde als volgt: „Het vervangen van een vet rijk aan verzadigde of transvetzuren door een vet rijk aan onverzadigde vetzuren draagt bij aan de verlaging van LDL-cholesterol. LDL-cholesterol is een cardiovasculaire risicofactor.”. |
|
(6) |
Op grond van de overgelegde gegevens concludeerde de EFSA in haar op 25 mei 2011 door de Commissie en de lidstaten ontvangen advies dat een oorzakelijk verband was vastgesteld tussen de consumptie van mengsels van verzadigde vetzuren (VVZ's) in de voeding en de verhoging van de LDL-cholesterolconcentraties in het bloed, en dat het vervangen van een mengsel van VVZ's door cis-enkelvoudig onverzadigde vetzuren en/of cis-meervoudig onverzadigde vetzuren in voedsel of maaltijden op een gram-per-gram basis de LDL-cholesterolconcentraties verlaagt. Daarom moet een gezondheidsclaim waarin deze conclusie tot uiting komt, worden geacht te voldoen aan de vereisten van Verordening (EG) nr. 1924/2006 en in de EU-lijst van toegestane claims worden opgenomen. De klinische interventiestudie waarvoor de aanvrager de eigendomsrechten opeist, werd door de EFSA niet noodzakelijk geacht om tot haar conclusie te komen. Daarom wordt geoordeeld dat aan het vereiste van artikel 21, lid 1, onder c), van Verordening (EG) nr. 1924/2006 niet is voldaan en dat bijgevolg geen bescherming van door eigendomsrechten beschermde gegevens mag worden verleend. |
|
(7) |
De EFSA heeft in haar advies geconcludeerd dat, om van de claim te mogen worden voorzien, significante hoeveelheden verzadigde vetzuren moeten worden vervangen door enkelvoudige onverzadigde vetzuren en/of meervoudige onverzadigde vetzuren in voedsel of maaltijden op een gram-per-gram basis. Om te waarborgen dat een levensmiddel een significante hoeveelheid enkelvoudige onverzadigde vetzuren en/of meervoudige onverzadigde vetzuren bevat, is het bijgevolg aangewezen het gebruik van de claim tot oliën en vetten te beperken en dezelfde gebruiksvoorwaarden vast te stellen als voor de voedingsclaim „RIJK AAN ONVERZADIGDE VETTEN”, zoals opgenomen in de bijlage bij Verordening. (EG) nr. 1924/2006. |
|
(8) |
Artikel 16, lid 4, van Verordening (EG) nr. 1924/2006 bepaalt dat, indien een advies luidt dat voor de gezondheidsclaim een vergunning kan worden verleend, in dat advies bepaalde gegevens moeten worden opgenomen. Deze gegevens moeten derhalve in de bijlage bij deze verordening worden opgenomen voor de toegestane claim en moeten — naargelang het geval — de herziene formulering van de claim, specifieke gebruiksvoorwaarden voor de claim en — indien van toepassing — de voorwaarden voor of beperkingen van het gebruik van het levensmiddel en/of een aanvullende vermelding of waarschuwing omvatten, overeenkomstig de bepalingen van Verordening (EG) nr. 1924/2006 en het advies van de EFSA. |
|
(9) |
Een van de doelstellingen van Verordening (EG) nr. 1924/2006 is ervoor te zorgen dat gezondheidsclaims waarheidsgetrouw, duidelijk, betrouwbaar en voor de consument bruikbaar zijn, en dat daarmee rekening wordt gehouden bij de formulering en de presentatie van de claims. Als daarom de formulering van claims dezelfde betekenis voor consumenten heeft als die van een toegestane gezondheidsclaim, omdat deze hetzelfde verband aantonen tussen een levensmiddelencategorie, een levensmiddel of een van de bestanddelen daarvan en de gezondheid, moeten deze claims voldoen aan dezelfde gebruiksvoorwaarden als in de bijlage bij deze verordening vermeld zijn. |
|
(10) |
Bij het nemen van de in deze verordening vastgestelde maatregelen is rekening gehouden met de opmerkingen van de aanvragers en van het publiek die de Commissie overeenkomstig artikel 16, lid 6, van Verordening (EG) nr. 1924/2006 heeft ontvangen. |
|
(11) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
1. De in de bijlage bij deze verordening vermelde gezondheidsclaim mag overeenkomstig de in die bijlage beschreven voorwaarden worden gebruikt voor levensmiddelen die in de Unie in de handel worden gebracht.
2. De in lid 1 bedoelde gezondheidsclaim wordt opgenomen in de EU-lijst van toegestane claims, als bedoeld in artikel 14, lid 1, van Verordening (EG) nr. 1924/2006.
Artikel 2
Deze verordening treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 404 van 30.12.2006, blz. 9.
(2) EFSA Journal (2011); 9(5):2168.
BIJLAGE
Toegestane gezondheidsclaim
|
Aanvraag — Toepasselijke bepalingen van Verordening (EG) nr. 1924/2006 |
Aanvrager — Adres |
Nutriënt, stof, levensmiddel of levensmiddelencategorie |
Claim |
Voorwaarden voor het gebruik van de claim |
Voorwaarden voor en/of beperkingen van het gebruik van het levensmiddel en/of aanvullende vermelding of waarschuwing |
Referentie EFSA-advies |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking |
Lactalis B&C, ZA Les Placis, 35230 Bourgbarré, Frankrijk |
Enkelvoudig en/of meervoudig onverzadigde vetzuren |
Het is aangetoond dat het vervangen van verzadigde vetten in de voeding het bloedcholesterol verlaagt. Een hoog cholesterolgehalte is een risicofactor voor de ontwikkeling van coronaire hartziekten. |
De claim mag alleen worden gebruikt voor levensmiddelen met een hoog gehalte aan onverzadigde vetzuren, zoals bedoeld bij de claim RIJK AAN ONVERZADIGDE VETTEN, zoals vermeld in de bijlage bij Verordening (EG) nr. 1924/2006. |
De claim mag alleen worden gebruikt voor oliën en vetten. |
Q-2009-00458 |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/6 |
UITVOERINGSVERORDENING (EU) Nr. 1227/2014 VAN DE COMMISSIE
van 17 november 2014
tot vaststelling van een overeenkomstig Verordening (EG) nr. 73/2009 van de Raad op de rechtstreekse betalingen toe te passen aanpassingscoëfficiënt voor kalenderjaar 2014 en tot intrekking van Uitvoeringsverordening (EU) nr. 879/2014 van de Commissie
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) nr. 1306/2013 van het Europees Parlement en de Raad van 17 december 2013 inzake de financiering, het beheer en de monitoring van het gemeenschappelijk landbouwbeleid en tot intrekking van de Verordeningen (EEG) nr. 352/78, (EG) nr. 165/94, (EG) nr. 2799/98, (EG) nr. 814/2000, (EG) nr. 1290/2005 en (EG) nr. 485/2008 van de Raad (1), en met name artikel 26, lid 4,
Na raadpleging van het Comité voor de landbouwfondsen,
Overwegende hetgeen volgt:
|
(1) |
Op 21 maart 2014 is de Commissie met een voorstel voor een verordening van het Europees Parlement en de Raad gekomen dat betrekking heeft op de vaststelling van een overeenkomstig Verordening (EG) nr. 73/2009 van de Raad op de rechtstreekse betalingen toe te passen aanpassingscoëfficiënt voor kalenderjaar 2014 (2). Op 30 juni 2014 hadden het Europees Parlement en de Raad die aanpassingscoëfficiënt nog niet bepaald. Daarom heeft de Commissie, overeenkomstig artikel 26, lid 3, van Verordening (EG) nr. 1306/2013, de aanpassingscoëfficiënt vastgesteld bij Uitvoeringsverordening (EU) nr. 879/2014 van de Commissie (3). |
|
(2) |
Uit de ramingen voor de rechtstreekse betalingen en de marktuitgaven, zoals opgenomen in de door de Commissie opgestelde nota van wijzigingen nr. 1 bij de ontwerpbegroting 2015, is gebleken dat een aanpassing nodig is van het financiële-disciplineniveau waarmee in de ontwerpbegroting 2015 rekening was gehouden. Bij de opstelling van die nota van wijzigingen is een bedrag van 433 miljoen EUR aan financiële discipline verwerkt voor de in artikel 25 van Verordening (EU) nr. 1306/2013 bedoelde reserve voor crises in de landbouwsector. De Commissie moet de in Uitvoeringsverordening (EU) nr. 879/2014 vastgestelde aanpassingscoëfficiënt afstemmen op deze nieuwe informatie. |
|
(3) |
Landbouwers die een steunaanvraag voor rechtstreekse betalingen voor een bepaald kalenderjaar (N) indienen, ontvangen de betaling doorgaans binnen een vastgestelde betalingstermijn die in het begrotingsjaar (N + 1) valt. De lidstaten hebben echter de mogelijkheid om te eniger tijd en binnen bepaalde grenzen betalingen aan landbouwers te doen nadat deze betalingstermijn is verstreken. Dergelijke betalingen kunnen in een later begrotingsjaar vallen. Bij de toepassing van de financiële discipline voor een bepaald kalenderjaar dient de aanpassingscoëfficiënt niet te worden toegepast op betalingen in het kader van steunaanvragen die zijn ingediend in andere kalenderjaren dan dat waarvoor de financiële discipline geldt. Daarom moet met het oog op een gelijke behandeling van de landbouwers worden bepaald dat de aanpassingscoëfficiënt alleen wordt toegepast op betalingen in het kader van steunaanvragen die zijn ingediend in het kalenderjaar waarvoor de financiële discipline geldt, ongeacht het moment waarop de betaling aan de landbouwers wordt gedaan. |
|
(4) |
In artikel 8, lid 1, van Verordening (EU) nr. 1307/2013 van het Europees Parlement en de Raad (4) is bepaald dat de krachtens artikel 26 van Verordening (EU) nr. 1306/2013 vastgestelde aanpassingscoëfficiënt voor rechtstreekse betalingen alleen van toepassing is op rechtstreekse betalingen van meer dan 2 000 EUR die in het desbetreffende kalenderjaar aan een landbouwer worden toegekend. Voorts is in artikel 8, lid 2, van Verordening (EU) nr. 1307/2013 bepaald dat ingevolge de geleidelijke invoering van rechtstreekse betalingen de aanpassingscoëfficiënt pas vanaf 1 januari 2016 van toepassing is op Bulgarije en Roemenië en vanaf 1 januari 2022 op Kroatië. De bij deze verordening te bepalen aanpassingscoëfficiënt is dus niet van toepassing op betalingen aan landbouwers in deze lidstaten, |
|
(5) |
Om te garanderen dat de aangepaste aanpassingscoëfficiënt geldt met ingang van de datum waarop de betalingen aan de landbouwers overeenkomstig Verordening (EU) nr. 1306/2013 van start moeten gaan, dient deze verordening met ingang van 1 december 2014 van toepassing te zijn. |
|
(6) |
De aangepaste aanpassingscoëfficiënt moet worden gebruikt voor de berekening van alle betalingen die in het kader van een voor het kalenderjaar 2014 ingediende steunaanvraag aan een landbouwer moeten worden toegekend. Duidelijkheidshalve dient Uitvoeringsverordening (EU) nr. 879/2014 te worden ingetrokken, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
1. Met het oog op de toepassing van de in de artikelen 25 en 26 van Verordening (EU) nr. 1306/2013 bedoelde aanpassing en overeenkomstig artikel 8, lid 1, van Verordening (EU) nr. 1307/2013, worden de in artikel 2, punt d), van Verordening (EG) nr. 73/2009 van de Raad (5) gedefinieerde betalingen van meer dan 2 000 EUR die aan een landbouwer moeten worden toegekend in het kader van een voor kalenderjaar 2014 ingediende steunaanvraag, verlaagd met 1,302214 %.
2. De in lid 1 bedoelde verlaging geldt niet voor Bulgarije, Kroatië en Roemenië.
Artikel 2
Verordening (EU) nr. 879/2014 wordt ingetrokken.
Artikel 3
Deze verordening treedt in werking op de zevende dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Zij is van toepassing met ingang van 1 december 2014.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 347 van 20.12.2013, blz. 549.
(2) COM(2014) 175.
(3) Uitvoeringsverordening (EU) nr. 879/2014 van de Commissie van 12 augustus 2014 tot vaststelling van een overeenkomstig Verordening (EG) nr. 73/2009 van de Raad op de rechtstreekse betalingen toe te passen aanpassingscoëfficiënt voor kalenderjaar 2014 (PB L 240 van 13.8.2014, blz. 20).
(4) Verordening (EU) nr. 1307/2013 van het Europees Parlement en de Raad van 17 december 2013 tot vaststelling van voorschriften voor rechtstreekse betalingen aan landbouwers in het kader van de steunregelingen van het gemeenschappelijk landbouwbeleid en tot intrekking van Verordening (EG) nr. 637/2008 van de Raad en Verordening (EG) nr. 73/2009 van de Raad (PB L 347 van 20.12.2013, blz. 608).
(5) Verordening (EG) nr. 73/2009 van de Raad van 19 januari 2009 tot vaststelling van gemeenschappelijke voorschriften voor regelingen inzake rechtstreekse steunverlening aan landbouwers in het kader van het gemeenschappelijk landbouwbeleid en tot vaststelling van bepaalde steunregelingen voor landbouwers, tot wijziging van Verordeningen (EG) nr. 1290/2005, (EG) nr. 247/2006, (EG) nr. 378/2007 en tot intrekking van Verordening (EG) nr. 1782/2003 (PB L 30 van 31.1.2009, blz. 16).
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/8 |
VERORDENING (EU) Nr. 1228/2014 VAN DE COMMISSIE
van 17 november 2014
tot goedkeuring of weigering van bepaalde gezondheidsclaims voor levensmiddelen die over de ziekterisicobeperking gaan
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1924/2006 van het Europees Parlement en de Raad van 20 december 2006 inzake voedings- en gezondheidsclaims voor levensmiddelen (1), en met name artikel 17, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Krachtens Verordening (EG) nr. 1924/2006 zijn gezondheidsclaims voor levensmiddelen verboden, tenzij de Commissie daarvoor overeenkomstig die verordening een vergunning heeft verleend en zij zijn opgenomen in een lijst van toegestane claims. |
|
(2) |
Verordening (EG) nr. 1924/2006 bepaalt tevens dat aanvragen voor een vergunning voor een gezondheidsclaim door exploitanten van levensmiddelenbedrijven bij de nationale bevoegde autoriteit van een lidstaat kunnen worden ingediend. De nationale bevoegde autoriteit moet geldige aanvragen doorsturen naar de Europese Autoriteit voor voedselveiligheid, hierna „de EFSA” genoemd. |
|
(3) |
Na ontvangst van een aanvraag moet de EFSA de andere lidstaten en de Commissie daarvan onverwijld in kennis stellen en een advies over de desbetreffende gezondheidsclaim uitbrengen. |
|
(4) |
De Commissie moet bij haar besluit over de verlening van een vergunning voor gezondheidsclaims rekening houden met het advies van de EFSA. |
|
(5) |
Ingevolge een aanvraag van Abtei Pharma Vertriebs GmbH, die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot kauwtabletten die calcium en vitamine D3 bevatten en botverlies (Vraag nr. EFSA-Q-2008-721) (2). De door de aanvrager voorgestelde claim luidde als volgt: „Kauwtabletten met calcium en vitamine D verbeteren de botdichtheid bij vrouwen vanaf 50 jaar. Bijgevolg kunnen kauwtabletten het risico van breuken door osteoporose verminderen.” |
|
(6) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar op 7 augustus 2009 door de Commissie en de lidstaten ontvangen advies dat een oorzakelijk verband was vastgesteld tussen de consumptie van calcium, alleen of in combinatie met vitamine D, en de vermindering van het verlies van botmineraaldichtheid (BMD) bij vrouwen in de menopauze. De vermindering van het verlies van BMD kan bijdragen tot een vermindering van het risico van botbreuken. Daarom moeten twee gezondheidsclaims waarin deze conclusie tot uiting komt, worden geacht te voldoen aan de vereisten van Verordening (EG) nr. 1924/2006 en in de EU-lijst van toegestane claims worden opgenomen. De EFSA concludeerde echter dat de verstrekte informatie ontoereikend was om de voorwaarden voor het gebruik van de claims vast te stellen. Vervolgens richtte de Commissie zich opnieuw tot de EFSA om extra advies in te winnen zodat de risicomanagers passende gebruiksvoorwaarden voor deze gezondheidsclaims zouden kunnen vaststellen. De EFSA concludeerde in haar op 17 mei 2010 door de Commissie en de lidstaten ontvangen advies (Vraag nr. EFSA-Q-2009-00940) (3) dat dagelijks ten minste 1 200 mg calcium uit alle bronnen of ten minste 1 200 mg calcium en 800 I.E. (20 μg) vitamine D uit alle bronnen moet worden ingenomen om het geclaimde effect te verkrijgen. |
|
(7) |
Om te waarborgen dat, wanneer de gezondheidsclaim alleen over calcium wordt gemaakt, een levensmiddel een significante hoeveelheid calcium bevat, is het aangewezen gebruiksvoorwaarden vast te stellen waardoor de claim alleen mag worden gebruikt voor levensmiddelen die ten minste 400 mg calcium per gekwantificeerde portie bevatten. |
|
(8) |
Rekening houdend met de hoge inname vitamine D die nodig is om het geclaimde effect te verkrijgen (20 μg), wanneer de gezondheidsclaim over de combinatie van calcium en vitamine D wordt gemaakt, is het aangewezen het gebruik van de claim te beperken tot voedingssupplementen. Om te waarborgen dat een voedingssupplement een significante hoeveelheid calcium en vitamine D levert in het kader van deze claim, is het aangewezen gebruiksvoorwaarden vast te stellen waardoor de claim alleen mag worden gebruikt voor voedingssupplementen die ten minste 400 mg calcium en 15 μg vitamine D per dagelijkse hoeveelheid bevatten. |
|
(9) |
Ingevolge een aanvraag van DSM Nutritional Products Europe AG, die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van vitamine D en het risico op vallen voor mannen en vrouwen vanaf zestig jaar (Vraag nr. EFSA-Q-2010-01233) (4). De door de aanvrager voorgestelde claim luidde als volgt: „Vitamine D vermindert het risico van vallen. Vallen is een risicofactor voor breuken”. |
|
(10) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar op 30 september 2011 door de Commissie en de lidstaten ontvangen advies dat een oorzakelijk verband was vastgesteld tussen de consumptie van vitamine D en de vermindering van het risico van vallen, wat in positief verband wordt gebracht met houdingsinstabiliteit en spierzwakte. Het verminderen van het risico van vallen bij mannen en vrouwen vanaf zestig jaar is gunstig voor de gezondheid van de mens omdat zo ook het risico van botbreuken wordt verminderd. Daarom moet een gezondheidsclaim waarin deze conclusie tot uiting komt, worden geacht te voldoen aan de vereisten van Verordening (EG) nr. 1924/2006 en in de EU-lijst van toegestane claims worden opgenomen. |
|
(11) |
In haar advies concludeerde de EFSA ook dat 800 I.E. (20 μg) vitamine D uit alle bronnen dagelijks moet worden ingenomen om het geclaimde effect te verkrijgen. Rekening houdend met de hoge inname vitamine D die nodig is om het geclaimde effect te verkrijgen (20 μg), is het aangewezen het gebruik van de claim te beperken tot voedingssupplementen. Om te waarborgen dat een voedingssupplement een significante hoeveelheid calcium en vitamine D levert in het kader van deze claim, is het aangewezen gebruiksvoorwaarden vast te stellen waardoor de claim alleen mag worden gebruikt voor voedingssupplementen die ten minste 15 μg vitamine D per dagelijkse hoeveelheid bevatten. |
|
(12) |
Artikel 16, lid 4, van Verordening (EG) nr. 1924/2006 bepaalt dat, indien een advies luidt dat voor de gezondheidsclaim een vergunning kan worden verleend, in dat advies bepaalde gegevens moeten worden opgenomen. Deze gegevens dienen derhalve in bijlage I bij deze verordening te worden opgenomen voor de toegestane claims en dienen, al naargelang het geval, een herziene formulering van de claims, specifieke gebruiksvoorwaarden voor de claims en, indien van toepassing, de voorwaarden voor of beperkingen van het gebruik van het levensmiddel en/of een aanvullende vermelding of waarschuwing te omvatten, overeenkomstig de bepalingen van Verordening (EG) nr. 1924/2006 en de adviezen van de EFSA. |
|
(13) |
Een van de doelstellingen van Verordening (EG) nr. 1924/2006 is ervoor te zorgen dat gezondheidsclaims waarheidsgetrouw, duidelijk, betrouwbaar en voor de consument bruikbaar zijn, en dat daarmee rekening wordt gehouden bij de formulering en de presentatie van de claims. Als daarom de formulering van claims dezelfde betekenis voor consumenten heeft als die van een toegestane gezondheidsclaim, omdat deze hetzelfde verband aantonen tussen een levensmiddelencategorie, een levensmiddel of een van de bestanddelen daarvan en de gezondheid, moeten deze claims voldoen aan dezelfde gebruiksvoorwaarden als die welke in bijlage I bij deze verordening vermeld zijn. |
|
(14) |
Ingevolge een aanvraag van GP International Holding bv, die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot glucosaminehydrochloride en een verminderde mate van kraakbeendegeneratie (Vraag nr. EFSA-Q-2009-00412) (5). De door de aanvrager voorgestelde claim luidde als volgt: „Vertraagt/vermindert het afbraakproces van het kraakbeen in het spier- en skeletstelsel en vermindert bijgevolg het risico van osteoartritis”. |
|
(15) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar op 29 oktober 2009 door de Commissie en de lidstaten ontvangen advies dat geen oorzakelijk verband was vastgesteld tussen de consumptie van glucosaminehydrochloride en het beweerde effect. De claim mag bijgevolg niet worden toegestaan, aangezien hij niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006. |
|
(16) |
Ingevolge een aanvraag van de European Natural Soyfood Manufacturers Association (ENSA), de European Vegetable Protein Federation (EUVEPRO) en de Soya Protein Association (SPA) die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van geïsoleerde sojaproteïnen op de verlaging van de LDL-cholesterolconcentraties in het bloed (Vraag nr. EFSA-Q-2011-00784) (6). De door de aanvrager voorgestelde claim luidde als volgt: „Het is aangetoond dat proteïnerijke sojabooncomponenten het bloedcholesterol verlagen/verminderen; een verlaging van het bloedcholesterol kan het risico van (coronaire) hartziekten verminderen”. |
|
(17) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar op 2 februari 2012 door de Commissie en de lidstaten ontvangen advies dat geen oorzakelijk verband was vastgesteld tussen de consumptie van geïsoleerde sojaproteïnen (zoals omschreven door de aanvrager) en het beweerde effect. De claim mag bijgevolg niet worden toegestaan, aangezien hij niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006. |
|
(18) |
Ingevolge een aanvraag van Health Concern B.V, die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot een combinatie van plantensterolen en Cholesternorm®mix en de verlaging van de LDL- cholesterolconcentraties in het bloed (Vraag nr. EFSA-Q-2009-00237, EFSA-Q-2011-01114) (7). De door de aanvrager voorgestelde claim luidde als volgt: „Verlaagt actief het cholesterol”. |
|
(19) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar door de Commissie en de lidstaten op 17 juli 2012 ontvangen advies dat geen causaal verband was vastgesteld tussen de inname van de combinatie van plantensterolen en Cholesternorm®mix en het geclaimde effect onder de voorgestelde gebruiksvoorwaarden. De claim mag bijgevolg niet worden toegestaan, aangezien hij niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006. |
|
(20) |
Ingevolge een aanvraag van Minami Nutrition Health BVBA, die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van eicosapentaeenzuur (EPA) op een vermindering van het arachidonzuur (AA)/EPA-gehalte in het bloed bij kinderen met ADHD (Attention Deficit Hyperactivity Disorder) (Vraag nr. EFSA-Q-2012-00573) (8). De door de aanvrager voorgestelde claim luidde als volgt: „Het is aangetoond dat EPA het AA/EPA-gehalte in het bloed verlaagt. Een hoog AA/EPA-niveau is een risicofactor voor de ontwikkeling van aandachtsstoornissen bij kinderen met ADHD-achtige symptomen. Deze kinderen worden ook gekenmerkt door verminderde hyperactiviteit en/of naast elkaar bestaand oppositioneel gedrag”. |
|
(21) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar op 8 april 2013 door de Commissie en de lidstaten ontvangen advies dat de doelpopulatie een zieke populatie is (d.w.z. kinderen met ADHD) en dat het geclaimde effect verband houdt met de behandeling van een ziekte. |
|
(22) |
Verordening (EG) nr. 1924/2006 vormt een aanvulling op de algemene beginselen van Richtlijn 2000/13/EG van het Europees Parlement en de Raad van 20 maart 2000 betreffende de onderlinge aanpassing van de wetgeving der lidstaten inzake de etikettering en presentatie van levensmiddelen alsmede inzake de daarvoor gemaakte reclame (9). Artikel 2, lid 1, onder b), van Richtlijn 2000/13/EG bepaalt dat de etikettering geen eigenschappen aan levensmiddelen mag toeschrijven inzake het voorkomen, behandelen of genezen van een ziekte van de mens, of toespelingen mag maken op dergelijke eigenschappen. Bijgevolg mag de claim met betrekking tot de effecten van eicosapentaeenzuur (EPA) op een vermindering van het arachidonzuur AA/EPA-gehalte in het bloed van kinderen met ADHD niet worden toegestaan, aangezien het verboden is om een geneeskrachtige werking toe te schrijven aan levensmiddelen. |
|
(23) |
Ingevolge een aanvraag van McNeil Nutritionals en Raisio Nutrition Ltd die werd ingediend overeenkomstig artikel 14, lid 1, onder a), van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de consumptie van 2 g plantenstanolen (in plantenstanolesters) per dag als onderdeel van een dieet met een laag gehalte aan verzadigd vet en een dubbel zo grote afname van de LDL-cholesterolconcentraties in het bloed in vergelijking met de consumptie van een dieet dat alleen een laag gehalte aan verzadigd vet bevat (Vraag nr. EFSA-Q-2012-00915) (10). De door de aanvrager voorgestelde claim luidde als volgt: „Het consumeren van 2 g plantenstanolen (in plantenstanolesters) per dag als onderdeel van een dieet met een laag gehalte aan verzadigd vet resulteert in een dubbel zo grote afname van de LDL-cholesterolconcentraties in het bloed in vergelijking met het consumeren van een dieet dat alleen een laag gehalte aan verzadigd vet bevat. Een hoog cholesterolgehalte is een risicofactor voor de ontwikkeling van coronaire hartziekten”. |
|
(24) |
Op grond van de ingediende gegevens concludeerde de EFSA in haar op 8 april 2013 door de Commissie en de lidstaten ontvangen advies dat uit het bewijsmateriaal aangeleverd door de aanvrager niet kan worden afgeleid dat de consumptie van 2 g plantenstanolen (in plantenstanolesters) per dag als onderdeel van een dieet met een laag gehalte aan verzadigd vet resulteert in een dubbel zo grote afname van de LDL-cholesterolconcentraties in het bloed in vergelijking met het consumeren van een dieet dat alleen een laag gehalte aan verzadigd vet bevat. De claim mag bijgevolg niet worden toegestaan, aangezien hij niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006. |
|
(25) |
Bij het nemen van de in deze verordening vastgestelde maatregelen is rekening gehouden met de opmerkingen van de aanvragers en van het publiek die de Commissie overeenkomstig artikel 16, lid 6, van Verordening (EG) nr. 1924/2006 heeft ontvangen. |
|
(26) |
De toevoeging van stoffen aan of het gebruik van stoffen in levensmiddelen wordt geregeld bij specifieke EU- en nationale wetgeving, alsook de indeling van producten als levensmiddelen of geneesmiddelen. Besluiten over een gezondheidsclaim overeenkomstig Verordening (EG) nr. 1924/2006, zoals de opname in de lijst van toegestane claims, als bedoeld in artikel 14, lid 1, van die verordening, vormen niet een vergunning voor het in de handel brengen van de stof waarvoor de claim geldt, een besluit over de vraag of de stof in levensmiddelen kan worden gebruikt of een indeling van een bepaald product als een levensmiddel. |
|
(27) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
1. De in bijlage I bij deze verordening vermelde gezondheidsclaims mogen voor levensmiddelen op de markt van de Europese Unie worden gebruikt overeenkomstig de in die bijlage beschreven voorwaarden.
2. De in lid 1 bedoelde gezondheidsclaims worden opgenomen in de EU-lijst van toegestane claims, als bedoeld in artikel 14, lid 1, van Verordening (EG) nr. 1924/2006.
Artikel 2
De in bijlage II bij deze verordening vermelde gezondheidsclaims worden niet opgenomen in de EU-lijst van toegestane claims, als bedoeld in artikel 14, lid 1, van Verordening (EG) nr. 1924/2006.
Artikel 3
Deze verordening treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 404 van 30.12.2006, blz. 9.
(2) EFSA Journal (2009) 1180, blz. 1-13.
(3) EFSA Journal (2010);8(5):1609.
(4) EFSA Journal (2011);9(9):2382.
(5) EFSA Journal 2009;7(10):1358.
(6) EFSA Journal 2012;10(2):2555.
(7) EFSA Journal 2012;10(7):2810.
(8) EFSA Journal 2013;11(4):3161.
(9) PB L 109 van 6.5.2000, blz. 29.
(10) EFSA Journal 2013;11(4):3160.
BIJLAGE I
Toegestane gezondheidsclaims
|
Aanvraag — Toepasselijke bepalingen van Verordening (EG) nr. 1924/2006 |
Aanvrager — Adres |
Nutriënt, stof, levensmiddel of levensmiddelencategorie |
Claim |
Voorwaarden voor het gebruik van de claim |
Voorwaarden voor en/of beperkingen van het gebruik van het levensmiddel en/of aanvullende vermelding of waarschuwing |
Referentie EFSA-advies |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Duitsland. |
Calcium |
Calcium helpt het verlies van botmineralen bij vrouwen in de menopauze te verminderen. Een lage botmineraaldichtheid is een risicofactor voor botbreuken door osteoporose. |
De claim mag alleen worden gebruikt voor levensmiddelen die ten minste 400 mg calcium per gekwantificeerde portie bevatten. Aan de consument wordt de informatie verstrekt dat de claim specifiek is bedoeld voor vrouwen vanaf 50 jaar en dat het gunstige effect wordt verkregen bij een dagelijkse inname van ten minste 1 200 mg calcium uit alle bronnen. |
Bij levensmiddelen verrijkt met calcium mag de claim enkel worden gebruikt voor levensmiddelen die zich richten op vrouwen vanaf 50 jaar. |
Q-2008-721 Q-2009-00940 |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking. |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Duitsland. |
Calcium en vitamine D |
Calcium en vitamine D helpen het verlies van botmineralen bij vrouwen in de menopauze te verminderen. Een lage botmineraaldichtheid is een risicofactor voor botbreuken door osteoporose. |
De claim mag alleen worden gebruikt voor voedingssupplementen die ten minste 400 mg calcium en 15 μg vitamine D per dagelijkse portie bevatten. Aan de consument wordt de informatie verstrekt dat de claim specifiek is bedoeld voor vrouwen vanaf 50 jaar en dat het gunstige effect wordt verkregen bij een dagelijkse inname van ten minste 1 200 mg calcium en 20 μg vitamine D uit alle bronnen. |
Bij levensmiddelen verrijkt met calcium en vitamine D mag de claim enkel worden gebruikt voor levensmiddelen die zich richten op vrouwen vanaf 50 jaar. |
Q-2008-721 Q-2009-00940 |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisico-beperking. |
DSM Nutritional Products Europe AG, P.O. Box 2676, 4002 Basel, Zwitserland. |
Vitamine D |
Vitamine D helpt om de risico's van vallen te verminderen, in verband met houdingsinstabiliteit en spierzwakte. Vallen is een risicofactor voor botbreuken bij mannen en vrouwen vanaf 60 jaar. |
De claim mag alleen worden gebruikt voor voedingssupplementen die ten minste 15 μg vitamine D per dagelijkse portie bevatten. Aan de consument wordt de informatie verstrekt dat het gunstige effect wordt verkregen bij een dagelijkse inname van 20 μg vitamine D uit alle bronnen. |
Bij levensmiddelen verrijkt met vitamine D mag de claim enkel worden gebruikt voor levensmiddelen die zich richten op vrouwen vanaf 60 jaar. |
Q-2010-01233 |
BIJLAGE II
Afgewezen gezondheidsclaims
|
Aanvraag — Toepasselijke bepalingen van Verordening (EG) nr. 1924/2006 |
Nutriënt, stof, levensmiddel of levensmiddelencategorie |
Claim |
Referentie EFSA-advies |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking. |
Glucosaminehydrochloride |
Vertraagt/vermindert het afbraakproces van het kraakbeen in het spier- en skeletstelsel en vermindert bijgevolg het risico van osteoartritis. |
Q-2009-00412 |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking. |
Geïsoleerde sojaproteïnen |
Het is aangetoond dat proteïnerijke sojabooncomponenten het bloedcholesterol verlagen/verminderen; een verlaging van het bloedcholesterol kan het risico van (coronaire) hartziekten verminderen. |
Q-2011-00784 |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking. |
Plantesterolen in combinatie met Cholesternorm®mix |
Verlaagt actief het cholesterol. |
Q-2009-00237 Q-2011-01114 |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking. |
Eicosapentaeenzuur (EPA) |
Het is aangetoond dat EPA het AA/EPA-gehalte in het bloed verlaagt. Een hoog AA/EPA-niveau is een risicofactor voor de ontwikkeling van aandachtsstoornissen bij kinderen met ADHD-achtige symptomen. Deze kinderen worden ook gekenmerkt door mindere hyperactiviteit en/of naast elkaar bestaand oppositioneel gedrag. |
Q-2012-00573 |
|
Gezondheidsclaim overeenkomstig artikel 14, lid 1, onder a), inzake ziekterisicobeperking. |
Plantenstanolen (in plantenstanolesters) |
Het consumeren van 2 g plantenstanolen (in plantenstanolesters) per dag als onderdeel van een dieet met een laag gehalte aan verzadigd vet resulteert in een dubbel zo grote afname van de LDL cholesterolconcentraties in het bloed in vergelijking met het consumeren van een dieet dat alleen een laag gehalte aan verzadigd vet bevat. Een hoog cholesterolgehalte is een risicofactor voor de ontwikkeling van coronaire hartziekten. |
Q-2012-00915 |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/14 |
VERORDENING (EU) Nr. 1229/2014 VAN DE COMMISSIE
van 17 november 2014
tot weigering van een vergunning voor bepaalde gezondheidsclaims voor levensmiddelen die niet over ziekterisicobeperking en de ontwikkeling en de gezondheid van kinderen gaan
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1924/2006 van het Europees Parlement en de Raad van 20 december 2006 inzake voedings- en gezondheidsclaims voor levensmiddelen (1), en met name artikel 18, lid 5,
Overwegende hetgeen volgt:
|
(1) |
Krachtens Verordening (EG) nr. 1924/2006 zijn gezondheidsclaims voor levensmiddelen verboden, tenzij de Commissie daarvoor overeenkomstig die verordening een vergunning heeft verleend en zij zijn opgenomen in een lijst van toegestane claims. |
|
(2) |
In Verordening (EG) nr. 1924/2006 wordt eveneens bepaald dat aanvragen voor een vergunning voor een gezondheidsclaim door exploitanten van levensmiddelenbedrijven bij de bevoegde nationale autoriteit van een lidstaat kunnen worden ingediend. De nationale bevoegde autoriteit moet geldige aanvragen doorsturen naar de Europese Autoriteit voor voedselveiligheid (EFSA) voor een wetenschappelijke beoordeling en naar de Commissie en de lidstaten ter informatie. |
|
(3) |
De EFSA moet een advies uitbrengen over de desbetreffende gezondheidsclaim. |
|
(4) |
De Commissie moet bij haar besluit over de verlening van een vergunning voor gezondheidsclaims rekening houden met het advies van de EFSA. |
|
(5) |
Ingevolge een aanvraag van Italsur s.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van een combinatie van zwarte boerenkool, driekleurige snijbiet, tweekleurige spinazie en blauwe savooikool en de bescherming van bloedlipiden tegen oxidatieschade (vraag nr. EFSA-Q-2013-00574) (2). De door de aanvrager voorgestelde claim luidde als volgt: „draagt bij tot de bescherming van bloedlipiden tegen oxidatieschade”. |
|
(6) |
Op 30 oktober 2013 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van een combinatie van zwarte boerenkool, driekleurige snijbiet, tweekleurige spinazie en blauwe savooikool en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(7) |
Ingevolge een aanvraag van Italsur s.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van een combinatie van rode spinazie, groene spinazie, rode cichorei, groene cichorei, groene bladsnijbiet, rode bladsnijbiet, rode snijbiet, gele snijbiet en witte snijbiet en de bescherming van bloedlipiden tegen oxidatieschade (vraag nr. EFSA-Q-2013-00575) (3). De door de aanvrager voorgestelde claim luidde als volgt: „draagt bij tot de bescherming van bloedlipiden tegen oxidatieschade”. |
|
(8) |
Op 30 oktober 2013 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van een combinatie van rode spinazie, groene spinazie, rode cichorei, groene cichorei, groene bladsnijbiet, rode bladsnijbiet, rode snijbiet, gele snijbiet en witte snijbiet en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(9) |
Ingevolge een aanvraag van Italsur s.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van een combinatie van zwarte boerenkool, driekleurige snijbiet, tweekleurige spinazie en blauwe savooikool en de instandhouding van een normale concentratie LDL-cholesterol in het bloed (vraag nr. EFSA-Q-2013-00576) (4). De door de aanvrager voorgestelde claim luidde als volgt: „handhaaft een normale concentratie van cholesterol in het bloed”. |
|
(10) |
Op 30 oktober 2013 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van een combinatie van zwarte boerenkool, driekleurige snijbiet, tweekleurige spinazie en blauwe savooikool en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(11) |
Ingevolge een aanvraag van Italsur s.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van een combinatie van rode spinazie, groene spinazie, rode cichorei, groene cichorei, groene bladsnijbiet, rode bladsnijbiet, rode snijbiet, gele snijbiet en witte snijbiet en de instandhouding van een normale concentratie LDL-cholesterol in het bloed (vraag nr. EFSA-Q-2013-00579) (5). De door de aanvrager voorgestelde claim luidde als volgt: „handhaaft een normale concentratie van cholesterol in het bloed”. |
|
(12) |
Op 30 oktober 2013 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van een combinatie van rode spinazie, groene spinazie, rode cichorei, groene cichorei, groene bladsnijbiet, rode bladsnijbiet, rode snijbiet, gele snijbiet en witte snijbiet en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(13) |
Ingevolge een aanvraag van Omikron Italia S.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van een combinatie van diosmine, troxerutine en hesperidine en de instandhouding van een normale veneus-capillaire doorlaatbaarheid (vraag nr. EFSA-Q-2013-00353) (6). De door de aanvrager voorgestelde claim luidde als volgt: „het flavonoïdenmengsel van 300 mg diosmine, 300 mg troxerutine en 100 mg hesperidine levert een nuttige bijdrage tot de instandhouding van de fysiologische veneus-capillaire doorlaatbaarheid”. |
|
(14) |
Op 13 januari 2014 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van een combinatie van diosmine, troxerutine en hesperidine en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(15) |
Ingevolge een aanvraag van Omikron Italia S.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van een combinatie van diosmine, troxerutine and hesperidine en de instandhouding van een normale veneuze tonus (vraag nr. EFSA-Q-2013-00354) (7). De door de aanvrager voorgestelde claim luidde als volgt: „het flavonoïdenmengsel van 300 mg diosmine, 300 mg troxerutine en 100 mg hesperidine levert een nuttige bijdrage tot de instandhouding van de fysiologische veneuze tonus”. |
|
(16) |
Op 13 januari 2014 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van een combinatie van diosmine, troxerutine en hesperidine en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(17) |
Ingevolge een aanvraag van Italsur s.r.l. die werd ingediend overeenkomstig artikel 13, lid 5, van Verordening (EG) nr. 1924/2006, moest de EFSA een advies uitbrengen over een gezondheidsclaim met betrekking tot de effecten van de gerstesoep „Orzotto” en de bescherming van bloedlipiden tegen oxidatieschade (vraag nr. EFSA-Q-2013-00578) (8). De door de aanvrager voorgestelde claim luidde als volgt: „draagt bij tot de bescherming van bloedlipiden tegen oxidatieschade”. |
|
(18) |
Op 10 januari 2014 hebben de Commissie en de lidstaten het wetenschappelijke advies van de EFSA ontvangen, waarin op grond van de verstrekte gegevens werd geconcludeerd dat geen oorzakelijk verband was vastgesteld tussen de consumptie van de gerstesoep „Orzotto” en het geclaimde effect. Aangezien de claim niet voldoet aan de voorschriften van Verordening (EG) nr. 1924/2006, mag hij bijgevolg niet worden toegestaan. |
|
(19) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De in de bijlage bij deze verordening vermelde gezondheidsclaims worden niet opgenomen in de EU-lijst van toegestane claims als bedoeld in artikel 13, lid 3, van Verordening (EG) nr. 1924/2006.
Artikel 2
Deze verordening treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 404 van 30.12.2006, blz. 9.
(2) EFSA Journal 2013; 11(10):3413.
(3) EFSA Journal 2013; 11(10):3414.
(4) EFSA Journal 2013; 11(10):3415.
(5) EFSA Journal 2013; 11(10):3416.
(6) EFSA Journal 2014; 12(1):3511.
(7) EFSA Journal 2014; 12(1):3512.
(8) EFSA Journal 2014; 12(1):3519.
BIJLAGE
Afgewezen gezondheidsclaims
|
Aanvraag — Toepasselijke bepalingen van Verordening (EG) nr. 1924/2006 |
Nutriënt, stof, levensmiddel of levensmiddelencategorie |
Claim |
Referentie EFSA-advies |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Een combinatie van zwarte boerenkool, driekleurige snijbiet, tweekleurige spinazie en blauwe savooikool |
Draagt bij tot de bescherming van bloedlipiden tegen oxidatieschade |
Q-2013-00574 |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Een combinatie van rode spinazie, groene spinazie, rode cichorei, groene cichorei, groene bladsnijbiet, rode bladsnijbiet, rode snijbiet, gele snijbiet en witte snijbiet |
Draagt bij tot de bescherming van bloedlipiden tegen oxidatieschade |
Q-2013-00575 |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Een combinatie van zwarte boerenkool, driekleurige snijbiet, tweekleurige spinazie en blauwe savooikool |
Handhaaft een normale concentratie van cholesterol in het bloed |
Q-2013-00576 |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Een combinatie van rode spinazie, groene spinazie, rode cichorei, groene cichorei, groene bladsnijbiet, rode bladsnijbiet, rode snijbiet, gele snijbiet en witte snijbiet |
Handhaaft een normale concentratie van cholesterol in het bloed |
Q-2013-00579 |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Een combinatie van diosmine, troxerutine en hesperidine |
Het flavonoïdenmengsel van 300 mg diosmine, 300 mg troxerutine en 100 mg hesperidine levert een nuttige bijdrage tot de instandhouding van de fysiologische veneus-capillaire doorlaatbaarheid |
Q-2013-00353 |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Een combinatie van diosmine, troxerutine en hesperidine |
Het flavonoïdenmengsel van 300 mg diosmine, 300 mg troxerutine en 100 mg hesperidine levert een nuttige bijdrage tot de instandhouding van de fysiologische veneuze tonus |
Q-2013-00354 |
|
Gezondheidsclaim overeenkomstig artikel 13, lid 5, die is gebaseerd op nieuw wetenschappelijk bewijs en/of die een verzoek om bescherming van door eigendomsrechten beschermde gegevens inhoudt |
Gerstesoep „Orzotto” |
Draagt bij tot de bescherming van bloedlipiden tegen oxidatieschade |
Q-2013-00578 |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/18 |
UITVOERINGSVERORDENING (EU) Nr. 1230/2014 VAN DE COMMISSIE
van 17 november 2014
tot verlening van een vergunning voor koper bilysinaat als toevoegingsmiddel voor diervoeding voor alle diersoorten
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EG) nr. 1831/2003 van het Europees Parlement en de Raad van 22 september 2003 betreffende toevoegingsmiddelen voor diervoeding (1), en met name artikel 9, lid 2,
Overwegende hetgeen volgt:
|
(1) |
De verlening van vergunningen voor toevoegingsmiddelen voor diervoeding, met inbegrip van de vergunningsgronden en -procedures, is geregeld bij Verordening (EG) nr. 1831/2003. |
|
(2) |
Overeenkomstig artikel 7 van Verordening (EG) nr. 1831/2003 is een aanvraag voor de verlening van een vergunning voor koper bilysinaat ingediend. Bij die aanvraag waren de krachtens artikel 7, lid 3, van Verordening (EG) nr. 1831/2003 vereiste gegevens en documenten gevoegd. |
|
(3) |
Die aanvraag betreft de verlening van een vergunning voor koper bilysinaat als toevoegingsmiddel in de categorie „nutritionele toevoegingsmiddelen” voor alle diersoorten. |
|
(4) |
De Europese Autoriteit voor voedselveiligheid (EFSA) heeft in haar advies van 3 juli 2014 (2) geconcludeerd dat koper bilysinaat onder de voorgestelde gebruiksvoorwaarden geen ongunstige effecten voor de diergezondheid, de gezondheid van de mens of het milieu heeft en dat het als een effectieve bron van koper voor alle diersoorten kan worden beschouwd. Specifieke eisen voor toezicht na het in de handel brengen acht de EFSA niet nodig. De EFSA heeft ook het verslag over de analysemethode voor het toevoegingsmiddel voor diervoeding geverifieerd dat door het bij Verordening (EG) nr. 1831/2003 ingestelde referentielaboratorium was ingediend. |
|
(5) |
Uit de beoordeling van koper bilysinaat blijkt dat aan de in artikel 5 van Verordening (EG) nr. 1831/2003 vermelde voorwaarden voor de verlening van een vergunning is voldaan. Het gebruik van die stof zoals gespecifieerd in de bijlage bij deze verordening moet daarom worden toegestaan. |
|
(6) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor planten, dieren, levensmiddelen en diervoeders, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Voor de in de bijlage beschreven stof, die behoort tot de categorie „nutritionele toevoegingsmiddelen” en de functionele groep „verbindingen van sporenelementen”, wordt onder de in die bijlage vastgestelde voorwaarden een vergunning voor gebruik als toevoegingsmiddel voor diervoeder verleend.
Artikel 2
Deze verordening treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 268 van 18.10.2003, blz. 29.
(2) EFSA Journal 2014; 12(7):3796.
BIJLAGE
|
Identificatienummer van het toevoegingsmiddel |
Naam van de vergunninghouder |
Toevoegingsmiddel |
Samenstelling, chemische formule, beschrijving, analysemethode |
Diersoort of -categorie |
Maximumleeftijd |
Minimumgehalte |
Maximumgehalte |
Overige bepalingen |
Einde van de vergunnings-periode |
||||||||||||||||||||||||||||
|
Gehalte van het element (Cu) in mg/kg volledig diervoeder met een vochtgehalte van 12 % |
|||||||||||||||||||||||||||||||||||||
|
Categorie nutritionele toevoegingsmiddelen. Functionele groep: verbindingen van sporenelementen |
|||||||||||||||||||||||||||||||||||||
|
3b411 |
— |
Koper bilysinaat |
Karakterisering van het toevoegingsmiddel Poeder of korrels met een gehalte aan koper ≥ 14,5 % en lysine ≥ 84,0 %. Karakterisering van de werkzame stof Koperchelaat van L-lysine HCl Chemische formule: Cu(C6H13N2O2)2×2HCl CAS-nummer: 53383-24-7 Analysemethoden (1) Voor de kwantificatie van het gehalte aan lysine in het toevoegingsmiddel voor diervoeding:
Voor de kwantificatie van het totaalgehalte aan koper in het toevoegingsmiddel voor diervoeding en in voormengsels:
Voor de bepaling van het totaalgehalte aan koper in de voedermiddelen en mengvoeders:
|
Alle dier-soorten |
— |
— |
Runderen:
Schapen: 15 (totaal). Biggen tot twaalf weken: 170 (totaal). Schaaldieren: 50 (totaal). Andere dieren: 25 (totaal). |
|
8 december 2024 |
||||||||||||||||||||||||||||
(1) Nadere bijzonderheden over de analysemethoden zijn te vinden op het volgende adres van het referentielaboratorium: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/22 |
UITVOERINGSVERORDENING (EU) Nr. 1231/2014 VAN DE COMMISSIE
van 17 november 2014
tot vaststelling van de forfaitaire invoerwaarden voor de bepaling van de invoerprijs van bepaalde groenten en fruit
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Verordening (EU) nr. 1308/2013 van het Europees Parlement en de Raad van 17 december 2013 tot vaststelling van een gemeenschappelijke ordening van de markten voor landbouwproducten en tot intrekking van de Verordeningen (EEG) nr. 922/72, (EEG) nr. 234/79, (EG) nr. 1037/2001 en (EG) nr. 1234/2007 van de Raad (1),
Gezien Uitvoeringsverordening (EU) nr. 543/2011 van de Commissie van 7 juni 2011 tot vaststelling van nadere bepalingen voor de toepassing van Verordening (EG) nr. 1234/2007 van de Raad, wat de sectoren groenten en fruit en verwerkte groenten en fruit betreft (2), en met name artikel 136, lid 1,
Overwegende hetgeen volgt:
|
(1) |
Bij Uitvoeringsverordening (EU) nr. 543/2011 zijn, op grond van de resultaten van de multilaterale handelsbesprekingen van de Uruguayronde, de criteria vastgesteld aan de hand waarvan de Commissie voor de producten en de perioden die in bijlage XVI, deel A, bij die verordening zijn vermeld, de forfaitaire waarden bij invoer uit derde landen vaststelt. |
|
(2) |
De forfaitaire invoerwaarde wordt elke dag berekend overeenkomstig artikel 136, lid 1, van Uitvoeringsverordening (EU) nr. 543/2011, met inachtneming van de variabele gegevens voor die dag. Bijgevolg moet deze verordening in werking treden op de dag van de bekendmaking ervan in het Publicatieblad van de Europese Unie, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De in artikel 136 van Uitvoeringsverordening (EU) nr. 543/2011 bedoelde forfaitaire invoerwaarden worden vastgesteld in de bijlage bij de onderhavige verordening.
Artikel 2
Deze verordening treedt in werking op de dag van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 17 november 2014.
Voor de Commissie,
namens de voorzitter,
Jerzy PLEWA
Directeur-generaal Landbouw en Plattelandsontwikkeling
(1) PB L 347 van 20.12.2013, blz. 671.
(2) PB L 157 van 15.6.2011, blz. 1.
BIJLAGE
Forfaitaire invoerwaarden voor de bepaling van de invoerprijs van bepaalde groenten en fruit
|
(EUR/100 kg) |
||
|
GN-code |
Code derde landen (1) |
Forfaitaire invoerwaarde |
|
0702 00 00 |
AL |
94,9 |
|
MA |
77,1 |
|
|
MK |
78,8 |
|
|
ZZ |
83,6 |
|
|
0707 00 05 |
AL |
67,4 |
|
JO |
194,1 |
|
|
TR |
128,5 |
|
|
ZZ |
130,0 |
|
|
0709 93 10 |
AL |
65,0 |
|
MA |
52,3 |
|
|
TR |
125,4 |
|
|
ZZ |
80,9 |
|
|
0805 20 10 |
MA |
130,6 |
|
ZZ |
130,6 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
TR |
74,4 |
|
ZZ |
74,4 |
|
|
0805 50 10 |
TR |
78,7 |
|
ZZ |
78,7 |
|
|
0806 10 10 |
BR |
293,5 |
|
LB |
337,2 |
|
|
PE |
282,9 |
|
|
TR |
149,1 |
|
|
US |
303,0 |
|
|
ZZ |
273,1 |
|
|
0808 10 80 |
BR |
54,0 |
|
CA |
135,3 |
|
|
CL |
80,6 |
|
|
MD |
29,7 |
|
|
NZ |
144,2 |
|
|
US |
102,4 |
|
|
ZA |
108,6 |
|
|
ZZ |
93,5 |
|
|
0808 30 90 |
CN |
75,6 |
|
ZZ |
75,6 |
|
(1) Landennomenclatuur vastgesteld bij Verordening (EU) nr. 1106/2012 van de Commissie van 27 november 2012 tot uitvoering van Verordening (EG) nr. 471/2009 van het Europees Parlement en de Raad betreffende communautaire statistieken van de buitenlandse handel met derde landen, wat de bijwerking van de nomenclatuur van landen en gebieden betreft (PB L 328 van 28.11.2012, blz. 7). De code „ZZ” staat voor „overige oorsprong”.
BESLUITEN
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/24 |
BESLUIT 2014/800/GBVB VAN DE RAAD
van 17 november 2014
betreffende de lancering van de adviesmissie van de Europese Unie voor de hervorming van de civiele veiligheidssector in Oekraïne (EUAM Ukraine) en tot wijziging van Besluit 2014/486/GBVB
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de Europese Unie, en met name artikel 28, artikel 42, lid 4, en artikel 43, lid 2,
Gezien Besluit 2014/486/GBVB van de Raad van 22 juli 2014 betreffende de adviesmissie van de Europese Unie voor de hervorming van de civiele veiligheidssector in Oekraïne (EUAM Ukraine) (1), en met name artikel 4,
Gezien het voorstel van de hoge vertegenwoordiger van de Unie voor buitenlandse zaken en veiligheidsbeleid,
Overwegende hetgeen volgt:
|
(1) |
De Raad heeft op 22 juli 2014 Besluit 2014/486/GBVB vastgesteld. |
|
(2) |
Op 20 oktober 2014 heeft de Raad het operatieplan voor EUAM Ukraine goedgekeurd. |
|
(3) |
Op aanbeveling van de civiele operationele commandant, en nu EUAM Ukraine zijn initieel operationeel vermogen heeft bereikt, moet de missie op 1 december 2014 van start gaan. |
|
(4) |
In Besluit 2014/486/GBVB was sprake van een financieel referentiebedrag van 2 680 000 EUR voor de periode tot en met 30 november 2014. Voor de periode van 12 maanden die ingaat op 1 december 2014 moet een nieuw financieel referentiebedrag worden vastgesteld. Besluit 2014/486/GBVB dient daarom te worden gewijzigd. |
|
(5) |
EUAM Ukraine zal worden uitgevoerd in een mogelijk verslechterende situatie die de verwezenlijking van de doelstellingen van het externe optreden van de Unie, geformuleerd in artikel 21 van het Verdrag, kan hinderen, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
De adviesmissie van de Europese Unie voor de hervorming van de civiele veiligheidssector in Oekraïne (EUAM Ukraine) gaat op 1 december 2014 van start.
Artikel 2
De civiele operationele commandant voor EUAM Ukraine wordt hierbij met onmiddellijke ingang gemachtigd te beginnen met de uitvoering van de operatie.
Artikel 3
Artikel 14, lid 1, van Besluit 2014/486/GBVB van de Raad wordt vervangen door:
„1. Het financiële referentiebedrag ter dekking van de uitgaven in verband met EUAM Ukraine bedraagt tot en met 30 november 2014, 2 680 000 EUR. Het financiële referentiebedrag ter dekking van de uitgaven in verband met EUAM Ukraine voor de periode van 1 december 2014 tot en met 30 november 2015 beloopt 13 100 000 EUR. Het financiële referentiebedrag voor de daaropvolgende perioden wordt door de Raad vastgesteld.”
Artikel 4
Dit besluit treedt in werking op de datum waarop het wordt vastgesteld.
Gedaan te Brussel, 17 november 2014.
Voor de Raad
De voorzitter
F. MOGHERINI
(1) PB L 217 van 23.7.2014, blz. 42.
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/26 |
BESLUIT 2014/801/GBVB VAN DE RAAD
van 17 november 2014
tot wijziging van Besluit 2014/145/GBVB betreffende beperkende maatregelen met betrekking tot acties die de territoriale integriteit, soevereiniteit en onafhankelijkheid van Oekraïne ondermijnen of bedreigen
DE RAAD VAN DE EUROPESE UNIE,
Gezien het Verdrag betreffende de Europese Unie, en met name artikel 29,
Overwegende hetgeen volgt:
|
(1) |
Op 17 maart 2014 heeft de Raad Besluit 2014/145/GBVB (1) vastgesteld. |
|
(2) |
De informatie betreffende één persoon die krachtens Besluit 2014/145/GBVB is opgenomen in de lijst, moet worden gewijzigd. |
|
(3) |
De bijlage bij Besluit 2014/145/GBVB dient derhalve dienovereenkomstig te worden gewijzigd, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
De bijlage bij Besluit 2014/145/GBVB wordt gewijzigd overeenkomstig de bijlage bij dit besluit.
Artikel 2
Dit besluit treedt in werking op de dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Gedaan te Brussel, 17 november 2014.
Voor de Raad
De voorzitter
F. MOGHERINI
(1) Besluit 2014/145/GBVB van de Raad van 17 maart 2014 betreffende beperkende maatregelen met betrekking tot acties die de territoriale integriteit, soevereiniteit en onafhankelijkheid van Oekraïne ondermijnen of bedreigen (PB L 78 van 17.3.2014, blz. 16).
BIJLAGE
De vermelding voor de volgende persoon, als weergegeven in de bijlage bij Besluit 2014/145/GBVB, wordt vervangen door de onderstaande vermelding:
|
|
Naam |
Identificatiegegevens |
Motivering |
Datum van plaatsing op de lijst |
|
|
„Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Geboren op 25.4.1946 in Almaty (voorheen bekend onder de naam Alma-Ata), Kazachstan. |
Lid van de Raad van de Doema; voorzitter van de LDPR-partij. Hij heeft de inzet van Russische gewapende strijdkrachten in Oekraïne en de annexatie van de Krim actief ondersteund. Hij heeft actief gepleit voor de opdeling van Oekraïne. Namens de door hem voorgezeten LDPR-partij heeft hij een overeenkomst met de zogenoemde „Volksrepubliek Donetsk” ondertekend. |
12.9.2014” |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/28 |
UITVOERINGSBESLUIT VAN DE COMMISSIE
van 14 november 2014
tot wijziging van de Besluiten 2010/470/EU en 2010/472/EU met betrekking tot de veterinairrechtelijke voorschriften wat scrapie betreft voor de handel in en de invoer van embryo's van schapen en geiten in de Unie
(Kennisgeving geschied onder nummer C(2014) 8339)
(Voor de EER relevante tekst)
(2014/802/EU)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Richtlijn 92/65/EEG van de Raad van 13 juli 1992 tot vaststelling van de veterinairrechtelijke voorschriften voor het handelsverkeer en de invoer in de Gemeenschap van dieren, sperma, eicellen en embryo's waarvoor ten aanzien van de veterinairrechtelijke voorschriften geen specifieke communautaire regelgeving als bedoeld in bijlage A, onder I, bij Richtlijn 90/425/EEG (1) geldt, en met name artikel 11, lid 3, derde streepje, artikel 17, lid 2, onder b), artikel 18, lid 1, eerste streepje, en artikel 19, inleidende zin en onder b),
Overwegende hetgeen volgt:
|
(1) |
In bijlage IV, deel A, bij Besluit 2010/470/EU van de Commissie (2) is het model van gezondheidscertificaat vastgesteld voor de handel binnen de Unie van zendingen van na 31 augustus 2010 gewonnen of geproduceerde eicellen en embryo's van schapen en geiten. |
|
(2) |
In bijlage IV, deel 2, bij Besluit 2010/472/EU van de Commissie (3) is het model van gezondheidscertificaat vastgesteld voor de invoer van zendingen eicellen en embryo's van schapen en geiten in de Unie. |
|
(3) |
Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad (4) legt voorschriften vast inzake preventie, bestrijding en uitroeiing van overdraagbare spongiforme encefalopathieën (TSE's) bij runderen, schapen en geiten. Bijlage VIII, hoofdstuk A, bij die verordening bevat de voorwaarden voor de handel binnen de Unie in levende dieren, sperma en embryo's. Daarnaast zijn in bijlage IX bij die verordening de voorwaarden voor de invoer in de Unie van levende dieren, embryo's, eicellen en producten van dierlijke oorsprong uit derde landen vastgelegd. |
|
(4) |
In het licht van nieuwe wetenschappelijke gegevens is Verordening (EG) nr. 999/2001 gewijzigd bij Verordening (EU) nr. 630/2013 van de Commissie (5). De wijzigingen, die betrekking hebben op scrapie, zijn in Uitvoeringsbesluit 2013/470/EU van de Commissie (6) nader uitgewerkt in het in bijlage IV, deel A, bij Besluit 2010/470/EU vastgestelde model van gezondheidscertificaat voor de handel binnen de Unie in zendingen eicellen en embryo's van schapen en geiten en het in bijlage IV, deel 2, bij Besluit 2010/472/EU vastgestelde model van gezondheidscertificaat voor de invoer van zendingen eicellen en embryo's van schapen en geiten in de Unie, met een overgangstermijn tot en met 31 december 2014. |
|
(5) |
In overeenstemming met het op 24 januari 2013 uitgebrachte wetenschappelijk advies van de Europese Autoriteit voor voedselveiligheid (EFSA) over het risico op overdracht van klassieke scrapie via transplantatie van in vivo verkregen embryo's bij schapen, waarin zij concludeerde dat het risico dat klassieke scrapie wordt overgedragen door implantatie van homozygote of heterozygote ARR-schapenembryo's als verwaarloosbaar beschouwd mag worden, mits de aanbevelingen en procedures van de OIE met betrekking tot embryotransplantatie worden gevolgd, zijn de desbetreffende bepalingen van Verordening (EG) nr. 999/2001 gewijzigd bij Verordening (EU) nr. 1148/2014 van de Commissie (7). |
|
(6) |
Het in bijlage IV, deel A, bij Besluit 2010/470/EU vastgestelde model van gezondheidscertificaat voor de handel binnen de Unie in zendingen eicellen en embryo's van schapen en geiten en het in bijlage IV, deel 2, bij Besluit 2010/472/EU vastgestelde model van gezondheidscertificaat voor de invoer van zendingen eicellen en embryo's van schapen en geiten in de Unie moeten daarom worden gewijzigd om de voorschriften die zijn vastgelegd in Verordening (EG) nr. 999/2001, zoals gewijzigd bij Verordening (EU) nr. 1148/2014, hierin over te nemen. |
|
(7) |
Daarnaast moeten ter voorkoming van onduidelijkheden in het in bijlage IV, deel A, bij Besluit 2010/470/EU vastgestelde model van gezondheidscertificaat voor de handel binnen de Unie in zendingen eicellen en embryo's van schapen en geiten enkele verwijzingen naar Verordening (EG) nr. 999/2001 worden gewijzigd. |
|
(8) |
Bovendien is een preciezere formulering nodig voor het in bijlage IV, deel 2, bij Besluit 2010/472/EU vastgestelde model van gezondheidscertificaat voor de invoer van zendingen eicellen en embryo's van schapen en geiten in de Unie, om duidelijk te maken dat de testregelingen voor epizoötische hemorragische ziekte (EHD) betrekking hebben op vrouwelijke donorschapen en -geiten. |
|
(9) |
De Besluiten 2010/470/EU en 2010/472/EU moeten daarom dienovereenkomstig worden gewijzigd. |
|
(10) |
De in dit besluit vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Bijlage IV bij Besluit 2010/470/EU wordt gewijzigd overeenkomstig bijlage I bij dit besluit.
Artikel 2
Bijlage IV bij Besluit 2010/472/EU wordt gewijzigd overeenkomstig bijlage II bij dit besluit.
Artikel 3
Dit besluit is van toepassing met ingang van 1 januari 2015.
Artikel 4
Dit besluit is gericht tot de lidstaten.
Gedaan te Brussel, 14 november 2014.
Voor de Commissie
Vytenis ANDRIUKAITIS
Lid van de Commissie
(1) PB L 268 van 14.9.1992, blz. 54.
(2) Besluit 2010/470/EU van de Commissie van 26 augustus 2010 tot vaststelling van modellen van gezondheidscertificaten voor de handel binnen de Unie in sperma, eicellen en embryo's van paardachtigen, schapen en geiten en in eicellen en embryo's van varkens (PB L 228 van 31.8.2010, blz. 15).
(3) Besluit 2010/472/EU van de Commissie van 26 augustus 2010 inzake de invoer van sperma, eicellen en embryo's van schapen en geiten in de Unie (PB L 228 van 31.8.2010, blz. 74).
(4) Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad van 22 mei 2001 houdende vaststelling van voorschriften inzake preventie, bestrijding en uitroeiing van bepaalde overdraagbare spongiforme encefalopathieën (PB L 147 van 31.5.2001, blz. 1).
(5) Verordening (EU) nr. 630/2013 van de Commissie van 28 juni 2013 tot wijziging van de bijlagen bij Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad houdende vaststelling van voorschriften inzake preventie, bestrijding en uitroeiing van bepaalde overdraagbare spongiforme encefalopathieën (PB L 179 van 29.6.2013, blz. 60).
(6) Uitvoeringsbesluit 2013/470/EU van de Commissie van 20 september 2013 tot wijziging van de Besluiten 2010/470/EU en 2010/472/EU met betrekking tot de veterinairrechtelijke voorschriften wat scrapie betreft voor de handel in en de invoer van sperma, eicellen en embryo's van schapen en geiten in de Unie (PB L 252 van 24.9.2013, blz. 32).
(7) Verordening (EU) nr. 1148/2014 van de Commissie van 28 oktober 2014 tot wijziging van de bijlagen II, VII, VIII, IX en X bij Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad houdende vaststelling van voorschriften inzake preventie, bestrijding en uitroeiing van bepaalde overdraagbare spongiforme encefalopathieën (PB L 308 van 29.10.2014, blz. 66).
BIJLAGE I
In bijlage IV bij Besluit 2010/470/EU wordt deel A vervangen door:
„DEEL A
Model van gezondheidscertificaat IV A voor de handel binnen de Unie in zendingen eicellen en embryo's van schapen en geiten die na 31 augustus 2010 zijn gewonnen of geproduceerd overeenkomstig Richtlijn 92/65/EEG en worden verzonden door een erkend embryoteam/embryoproductieteam, dat de eicellen/embryo's heeft gewonnen/geproduceerd


 ”
”
BIJLAGE II
In bijlage IV bij Besluit 2010/472/EU wordt deel 2 vervangen door:
„DEEL 2
Model van gezondheidscertificaat voor de invoer van zendingen eicellen en embryo's van schapen en geiten

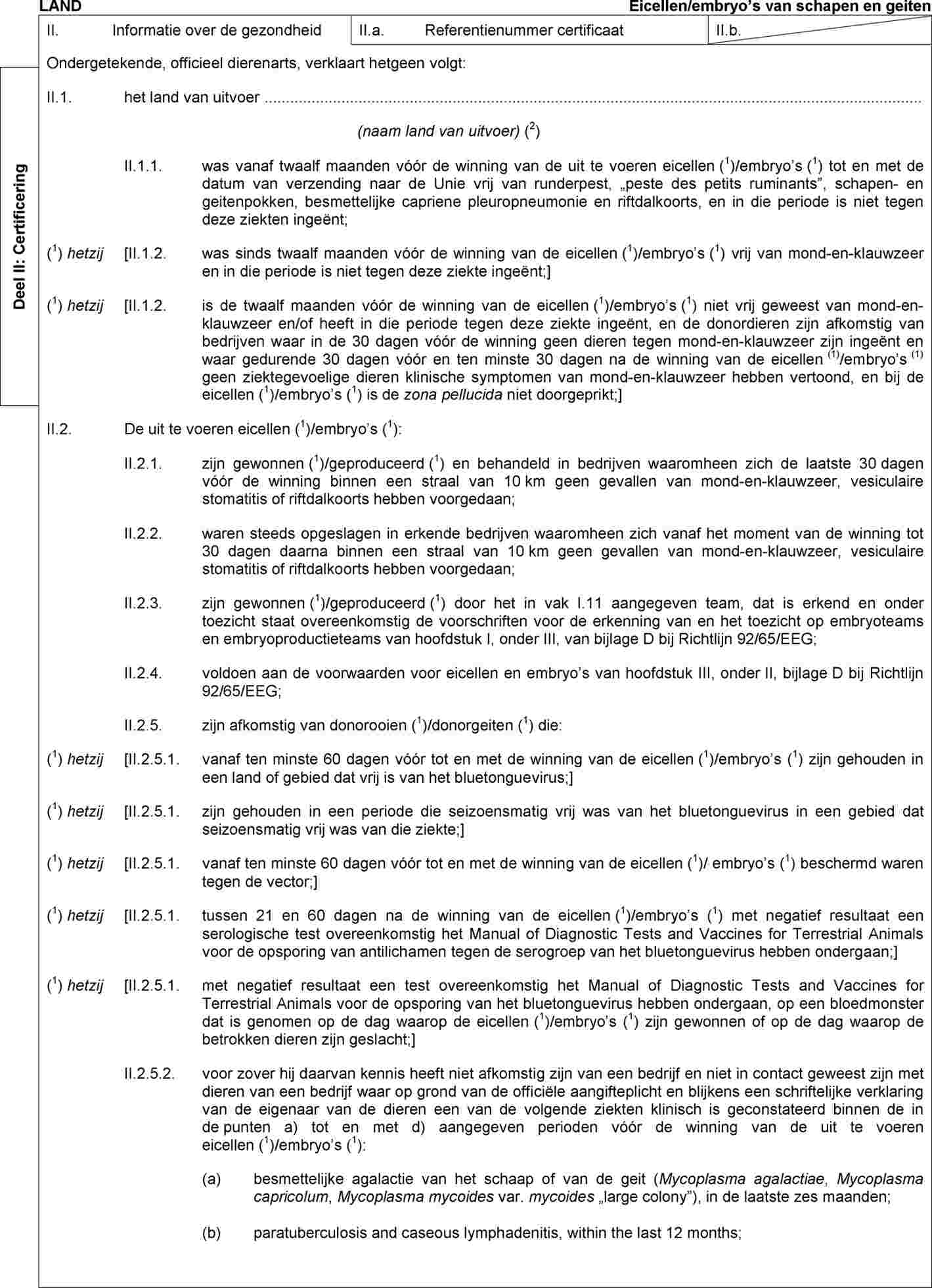


 ”
”
HANDELINGEN VAN BIJ INTERNATIONALE OVEREENKOMSTEN INGESTELDE ORGANEN
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/38 |
BESLUIT Nr. 1/2014 vAN HET GEMENGD COMITÉ EU-ZWITSERLAND
van 10 oktober 2014
tot vaststelling van de gevallen waarin de in artikel 3, lid 3, eerste alinea,van bijlage I bij de Overeenkomst tussen de Europese Gemeenschap en de Zwitserse Bondsstaat van 25 juni 2009 inzake de vereenvoudiging van de controles en formaliteiten bij het goederenvervoer en inzake douaneveiligheidsmaatregelen, bedoelde gegevens niet hoeven te worden medegedeeld
(2014/803/EU)
HET GEMENGD COMITÉ,
Gezien de Overeenkomst van 25 juni 2009 tussen de Europese Gemeenschap en de Zwitserse Bondsstaat inzake de vereenvoudiging van de controles en formaliteiten bij het goederenvervoer en inzake douaneveiligheidsmaatregelen („de overeenkomst”), en met name artikel 21, lid 3, en in samenhang met artikel 3, lid 3, tweede alinea van bijlage I,
Overwegende hetgeen volgt:
|
(1) |
De overeenkomst streeft ernaar de vereenvoudigde controles en formaliteiten bij de grensoverschrijding van goederen en het vlotte verloop van het handelsverkeer tussen de overeenkomstsluitende partijen te handhaven terwijl tegelijkertijd ook een hoog veiligheidsniveau in de toeleveringsketen wordt gegarandeerd. |
|
(2) |
De overeenkomstsluitende partijen hebben zich ertoe verbonden op hun respectieve grondgebied een gelijkwaardig veiligheidsniveau te handhaven door middel van maatregelen die gebaseerd zijn op de in de Europese Unie geldende wetgeving. |
|
(3) |
Wanneer voor een derde land bestemde goederen het douanegebied van een overeenkomstsluitende partij verlaten via het douanegebied van de andere overeenkomstsluitende partij, worden de veiligheidsgegevens in de summiere aangifte bij uitgang die is ingediend bij de bevoegde autoriteit van de eerstgenoemde overeenkomstsluitende partij, door deze autoriteit doorgegeven aan de bevoegde autoriteit van de laatstgenoemde overeenkomstsluitende partij. |
|
(4) |
Het Gemengd Comité kan de gevallen bepalen waarin deze gegevens niet hoeven te worden medegedeeld, mits het door deze overeenkomst gewaarborgde veiligheidsniveau niet in het gedrang wordt gebracht. |
|
(5) |
De lidstaten van de Europese Unie en de Zwitserse Bondsstaat zijn overeenkomstsluitende partijen bij het Verdrag van Chicago inzake de internationale burgerluchtvaart. Op grond van bijlage 17 bij dit Verdrag wordt alle vracht, alvorens in een luchtvaartuig te worden geladen, door de luchtvervoerders aan veiligheidscontroles onderworpen teneinde de internationale luchtvaart tegen wederrechtelijke daden te beschermen. |
|
(6) |
De Europese Gemeenschap en de Zwitserse Bondsstaat zijn gebonden door de op 21 juni 1999 gesloten overeenkomst inzake luchtvervoer die met name de veiligheid en de beveiliging van de luchtvaart regelt, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
Bij de uitvoer van goederen als bedoeld in artikel 3, lid 3, eerste alinea, van bijlage I bij de overeenkomst hoeven de gegevens niet te worden medegedeeld op voorwaarde dat:
|
a) |
de goederen worden aanvaard door een luchtvaartmaatschappij die deze buiten het douanegebied van de overeenkomstsluitende partijen vervoert; |
|
b) |
de uitgang van de goederen bij het douanekantoor van de tweede overeenkomstsluitende partij via de lucht gebeurt; |
|
c) |
een summiere aangifte bij uitgang of een douaneaangifte tot uitvoer die voldoet aan de eisen voor die summiere aangifte, is overgelegd aan het bevoegde douanekantoor voor de plaats waar de goederen worden uitgevoerd; |
|
d) |
wanneer de goederen aankomen bij het douanekantoor op de plaats van uitgang uit het douanegebied van de tweede overeenkomstsluitende partij, de vervoerder aan het douanekantoor in kwestie desgevraagd een kopie verstrekt van het Unie-uitvoergeleidedocument of een soortgelijk document, afgegeven door de Zwitserse douaneautoriteiten, dat de veiligheidsgegevens voor de uitgevoerde goederen bevat. |
Artikel 2
Dit besluit treedt in werking op de dag na die van de vaststelling ervan.
Gedaan te Vacallo, 10 oktober 2014.
Voor het EU-Zwitserland Gemengd Comité
De voorzitter
Michaela SCHÄRER-RICKENBACHER
Rectificaties
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/40 |
Rectificatie van Besluit 2014/252/EU van de Raad van 14 april 2014 betreffende de sluiting van de Overeenkomst tussen de Europese Unie en de Republiek Turkije inzake de overname van personen die zonder vergunning op het grondgebied verblijven
( Publicatieblad van de Europese Unie L 134 van 7 mei 2014 )
Bladzijde 1, overweging 3:
in plaats van:
|
„(3) |
Overeenkomstig de artikelen 1 en 2 van het Protocol betreffende de positie van het Verenigd Koninkrijk en Ierland ten aanzien van de ruimte van vrijheid, veiligheid en recht, dat aan het Verdrag betreffende de Europese Unie en het Verdrag betreffende de werking van de Europese Unie is gehecht, en onverminderd artikel 4 van genoemd protocol, neemt het Verenigd Koninkrijk niet deel aan de vaststelling van dit besluit, dat niet bindend is voor, noch van toepassing is in het Verenigd Koninkrijk.” |
te lezen:
|
„(3) |
Overeenkomstig artikel 3 van Protocol nr. 21 betreffende de positie van het Verenigd Koninkrijk en Ierland ten aanzien van de ruimte van vrijheid, veiligheid en recht, dat aan het Verdrag betreffende de Europese Unie en het Verdrag betreffende de werking van de Europese Unie is gehecht, heeft het Verenigd Koninkrijk bij brief van 21 september 2012 te kennen gegeven dat het aan de vaststelling en toepassing van dit besluit wenst deel te nemen.” |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/40 |
Rectificatie van Verordening (EG) nr. 552/2009 van de Commissie van 22 juni 2009 tot wijziging van bijlage XVII bij Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH)
( Publicatieblad van de Europese Unie L 164 van 26 juni 2009 )
Bladzijde 26, bijlage, punt 2, betreffende item 51, kolom 2, punt 2, van de tabel in bijlage XVII bij Verordening (EG) nr. 1907/2006:
in plaats van:
|
„2. |
Speelgoed en kinderverzorgingsartikelen die deze ftalaten bevatten in een concentratie van meer dan 0,1 gewichtsprocent mogen niet in de handel gebracht worden.” |
te lezen:
|
„2. |
Speelgoed en kinderverzorgingsartikelen die deze ftalaten bevatten in een concentratie van meer dan 0,1 gewichtsprocent van het weekgemaakte materiaal, mogen niet in de handel gebracht worden.” |
Bladzijde 26, bijlage, punt 2, betreffende item 52, kolom 2, punt 2, van de tabel in bijlage XVII bij Verordening (EG) nr. 1907/2006:
in plaats van:
|
„2. |
Speelgoed en kinderverzorgingsartikelen die deze ftalaten bevatten in een concentratie van meer dan 0,1 gewichtsprocent mogen niet in de handel gebracht worden.” |
te lezen:
|
„2. |
Dergelijk speelgoed en dergelijke kinderverzorgingsartikelen die deze ftalaten bevatten in een concentratie van meer dan 0,1 gewichtsprocent van het weekgemaakte materiaal, mogen niet in de handel gebracht worden.” |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/41 |
Rectificatie van Verordening (EU) nr. 1169/2011 van het Europees Parlement en de Raad van 25 oktober 2011 betreffende de verstrekking van voedselinformatie aan consumenten, tot wijziging van Verordeningen (EG) nr. 1924/2006 en (EG) nr. 1925/2006 van het Europees Parlement en de Raad tot intrekking van Richtlijn 87/250/EEG van de Commissie, Richtlijn 90/496/EEG van de Raad, Richtlijn 1999/10/EG van de Commissie, Richtlijn 2000/13/EG van het Europees Parlement en de Raad, Richtlijnen 2002/67/EG en 2008/5/EG van Commissie, en Verordening (EG) nr. 608/2004 van de Commissie
( Publicatieblad van de Europese Unie L 304 van 22 november 2011 )
Bladzijde 31, artikel 18, lid 3 (zoals gecorrigeerd bij rectificatie in PB L 247 van 13.9.2012, blz. 17):
in plaats van:
„3. Elk ingrediënt dat in de vorm van technisch vervaardigd nanomateriaal in een product is verwerkt, dient duidelijk in de lijst van ingrediënten te worden vermeld. De naam van het ingrediënt wordt gevolgd door het woord „nano” tussen haakjes.”
te lezen:
„3. Elk ingrediënt dat aanwezig is in de vorm van technisch vervaardigd nanomateriaal, dient duidelijk in de lijst van ingrediënten te worden vermeld. De naam van het ingrediënt wordt gevolgd door het woord „nano” tussen haakjes.”
Bladzijde 54, bijlage VII, deel C, tabel, eerste kolom, zevende rij:
in plaats van:
„Kleuren”
te lezen:
„Kleurstof”
Bladzijde 56, bijlage IX, punt 5, eerste alinea:
in plaats van:
|
„5. |
Wanneer een vast levensmiddel wordt aangeboden in een opgietvloeistof, wordt ook het netto-uitlekgewicht van dat levensmiddel vermeld. Van een geglansd levensmiddel wordt het gedeclareerde nettogewicht aangegeven exclusief het glazuur.” |
te lezen:
|
„5. |
Wanneer een vast levensmiddel wordt aangeboden in een opgietvloeistof, wordt ook het netto-uitlekgewicht van dat levensmiddel vermeld. Van een geglaceerd levensmiddel wordt het gedeclareerde nettogewicht aangegeven exclusief de glaceerlaag.” |
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/41 |
Rectificatie van Verordening (EU) nr. 655/2014 van het Europees Parlement en de Raad van 15 mei 2014 tot vaststelling van een procedure betreffende het Europees bevel tot conservatoir beslag op bankrekeningen om de grensoverschrijdende inning van schuldvorderingen in burgerlijke en handelszaken te vergemakkelijken
( Publicatieblad van de Europese Unie L 189 van 27 juni 2014 )
Bladzijde 82, artikel 28, lid 2, eerste zin:
in plaats van:
„2. Indien de schuldeiser in de lidstaat van herkomst woont, geschiedt de betekening of kennisgeving volgens het recht van die lidstaat. (…)”
te lezen:
„2. Indien de schuldenaar zijn woonplaats in de lidstaat van herkomst heeft, geschiedt de betekening of kennisgeving volgens het recht van die lidstaat. (…)”
|
18.11.2014 |
NL |
Publicatieblad van de Europese Unie |
L 331/42 |
Rectificatie van Uitvoeringsverordening (EU) nr. 1085/2014 van de Commissie van 15 oktober 2014 tot vaststelling van de forfaitaire invoerwaarden voor de bepaling van de invoerprijs van bepaalde groenten en fruit
( Publicatieblad van de Europese Unie L 298 van 16 oktober 2014 )
Bladzijde 11, in de bijlage komt de tabel als volgt te luiden:
|
(EUR/100 kg) |
||
|
GN-code |
Code derde landen (1) |
Forfaitaire invoerwaarde |
|
0702 00 00 |
AL |
64,0 |
|
MA |
122,4 |
|
|
MK |
60,9 |
|
|
ZZ |
82,4 |
|
|
0707 00 05 |
TR |
158,2 |
|
ZZ |
158,2 |
|
|
0709 93 10 |
TR |
142,8 |
|
ZZ |
142,8 |
|
|
0805 50 10 |
AR |
95,1 |
|
BR |
84,6 |
|
|
CL |
109,5 |
|
|
TR |
111,7 |
|
|
UY |
97,0 |
|
|
ZA |
101,1 |
|
|
ZZ |
99,8 |
|
|
0806 10 10 |
BR |
191,0 |
|
MK |
34,4 |
|
|
TR |
143,7 |
|
|
ZZ |
123,0 |
|
|
0808 10 80 |
BA |
49,5 |
|
BR |
53,2 |
|
|
CL |
89,4 |
|
|
NZ |
134,3 |
|
|
US |
192,1 |
|
|
ZA |
119,7 |
|
|
ZZ |
106,4 |
|
|
0808 30 90 |
CN |
75,7 |
|
TR |
116,3 |
|
|
ZA |
80,2 |
|
|
ZZ |
90,7 |
|
(1) Landennomenclatuur vastgesteld bij Verordening (EU) nr. 1106/2012 van de Commissie van 27 november 2012 tot uitvoering van Verordening (EG) nr. 471/2009 van het Europees Parlement en de Raad betreffende communautaire statistieken van de buitenlandse handel met derde landen, wat de bijwerking van de nomenclatuur van landen en gebieden betreft (PB L 328 van 28.11.2012, blz. 7). De code „ZZ” staat voor „overige oorsprong”.”