ISSN 1725-2598
doi:10.3000/17252598.L_2010.052.nld
Publicatieblad
van de Europese Unie
L 52

Uitgave in de Nederlandse taal
Wetgeving
53e jaargang
3 maart 2010
|
ISSN 1725-2598 doi:10.3000/17252598.L_2010.052.nld |
||
|
Publicatieblad van de Europese Unie |
L 52 |
|

|
||
|
Uitgave in de Nederlandse taal |
Wetgeving |
53e jaargang |
|
|
|
|
|
(1) Voor de EER relevante tekst |
|
NL |
Besluiten waarvan de titels mager zijn gedrukt, zijn besluiten van dagelijks beheer die in het kader van het landbouwbeleid zijn genomen en die in het algemeen een beperkte geldigheidsduur hebben. Besluiten waarvan de titels vet zijn gedrukt en die worden voorafgegaan door een sterretje, zijn alle andere besluiten. |
II Niet-wetgevingshandelingen
VERORDENINGEN
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/1 |
VERORDENING (EU) Nr. 175/2010 VAN DE COMMISSIE
van 2 maart 2010
ter uitvoering van Richtlijn 2006/88/EG van de Raad wat betreft maatregelen ter bestrijding van de verhoogde mortaliteit bij oesters van de soort Crassostrea gigas in samenhang met de detectie van het Ostreid herpesvirus 1 μvar (OsHV-1 μvar)
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Richtlijn 2006/88/EG van de Raad van 24 oktober 2006 betreffende veterinairrechtelijke voorschriften voor aquacultuurdieren en de producten daarvan en betreffende de preventie en bestrijding van bepaalde ziekten bij waterdieren (1), en met name op artikel 41, lid 3, en artikel 61, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Richtlijn 2006/88/EG stelt de veterinairrechtelijke voorschriften vast voor het in de handel brengen van aquacultuurdieren en producten daarvan. Bovendien stelt zij minimale preventiemaatregelen vast die bij een verdenking of uitbraak van bepaalde ziekten bij waterdieren moeten worden toegepast. |
|
(2) |
Artikel 41 van die richtlijn bepaalt dat de lidstaten passende maatregelen moeten nemen om een nieuwe ziekte onder controle te krijgen en om de verspreiding ervan te voorkomen. Indien zich een nieuwe ziekte voordoet, stelt de betrokken lidstaat de Commissie, de lidstaten en de EVA-lidstaten onverwijld hiervan in kennis, indien de bevindingen voor een andere lidstaat uit epizoötiologisch oogpunt van belang zijn. |
|
(3) |
Een verhoogde mortaliteit bij oesters van de soort Crassostrea gigas („Crassostrea gigas-oesters”) is tijdens het late voorjaar en de zomer van 2008 in verscheidene gebieden van Frankrijk en Ierland geconstateerd. Zij werd toegeschreven aan een combinatie van nadelige milieufactoren tezamen met de aanwezigheid van een bacterie van het geslacht Vibrio en de aanwezigheid van het Ostreid herpesvirus-1 (OsHV-1), inclusief een nieuw beschreven genotype van dat virus, genaamd OsHV-1 μvar. |
|
(4) |
De Franse autoriteiten hebben de Commissie, de lidstaten en de EVA-lidstaten in augustus 2008 in kennis gesteld van de situatie en de genomen maatregelen en de kwestie is in september 2008 voorgelegd aan het Permanent Comité voor de voedselketen en de diergezondheid. |
|
(5) |
In het voorjaar van 2009 is in Frankrijk, Ierland en de Kanaaleilanden opnieuw een aan dezelfde combinatie van factoren toegeschreven verhoogde mortaliteit geconstateerd. Hoewel de oorzaken van de sterfte nog onzeker blijven, duiden de in 2009 in Ierland en het Verenigd Koninkrijk uitgevoerde epizoötiologische onderzoeken erop dat OsHV-1 μvar een belangrijke rol bij de sterfte speelt. |
|
(6) |
De bevoegde autoriteiten van die lidstaten en van de Kanaaleilanden hebben de Commissie in kennis gesteld van de situatie en de genomen maatregelen en de kwestie is verscheidene keren voorgelegd aan het Permanent Comité voor de voedselketen en de diergezondheid. |
|
(7) |
De door de bevoegde autoriteiten in die lidstaten en de Kanaaleilanden genomen inperkingsmaatregelen ter bestrijding van de nieuwe ziekte waren hoofdzakelijk gebaseerd op de beperking van het verkeer van Crassostrea gigas-oesters buiten de door de verhoogde mortaliteit getroffen gebieden. |
|
(8) |
Gelet op het opnieuw uitbreken van de nieuwe ziekte in 2009 en de mogelijke herhaling daarvan en het risico van verdere verspreiding in het voorjaar en de zomer van 2010, en op grond van de opgedane ervaring, is het dienstig en nodig dat de reeds door de getroffen lidstaten genomen maatregelen worden uitgebreid. |
|
(9) |
Om te zorgen voor uniforme voorwaarden voor de uitvoering van de voorschriften van Richtlijn 2006/88/EG betreffende nieuwe ziekten en om ervoor te zorgen dat de genomen maatregelen voldoende bescherming bieden tegen een verdere verspreiding, zonder dat daarbij evenwel onnodige beperkingen op het verkeer van Crassostrea gigas-oesters worden opgelegd, is het nodig dat de maatregelen betreffende deze nieuwe ziekte op het niveau van de Europese Unie worden gecoördineerd. |
|
(10) |
Wanneer de bevoegde autoriteiten ervan in kennis worden gesteld dat een verhoogde mortaliteit bij Crassostrea gigas-oesters is geconstateerd, moeten monsters worden genomen en tests uitgevoerd om de aanwezigheid van OsHV-1 μvar op te sporen of uit te sluiten. |
|
(11) |
Wanneer de aanwezigheid van het virusgenotype OsHV-1 μvar is bevestigd, moeten door de lidstaten ziektebestrijdingsmaatregelen worden genomen, waaronder de instelling van een beperkingsgebied. Bij de bepaling van het beperkingsgebied moet rekening worden gehouden met bepaalde in deze verordening vastgestelde factoren. Die ziektebestrijdingsmaatregelen moeten duren totdat uit inspecties is gebleken dat de verhoogde mortaliteit niet meer bestaat. |
|
(12) |
Er moeten beperkingen op het verkeer van Crassostrea gigas-oesters buiten de beperkingsgebieden worden vastgesteld om het risico van verspreiding van de ziekte te verkleinen. Er moet echter worden voorzien in bepaalde afwijkingen ingeval het risico van verpreiding van de ziekte is verminderd. Die afwijkingen betreffen het verkeer van bepaalde Crassostrea gigas-oesters, bestemd voor kweek- en heruitzettingsgebieden in een ander beperkingsgebied of bestemd voor menselijke consumptie. Om te zorgen voor de traceerbaarheid van zendingen Crassostrea gigas-oesters, bestemd voor kweek- of heruitzettingsgebieden, moeten zij vergezeld gaan van een diergezondheidscertificaat. Bij de opstelling van het certificaat moet rekening worden gehouden met de toelichtingen in bijlage V bij Verordening (EG) nr. 1251/2008 van de Commissie van 12 december 2008 ter uitvoering van Richtlijn 2006/88/EG van de Raad wat betreft de voorwaarden en certificeringsvoorschriften voor het in de handel brengen en de invoer in de Gemeenschap van aquacultuurdieren en producten daarvan en tot vaststelling van een lijst van vectorsoorten (2). |
|
(13) |
Om verdere kennis op te doen over de status van deze nieuwe ziekte in de Unie en met name in de nog niet getroffen lidstaten en compartimenten daarvan en om te zorgen voor een vroegtijdige opsporing van de aanwezigheid van OsHV-1 μvar, kunnen de lidstaten programma's vaststellen met doelgerichte bemonstering en uitvoering van tests voor de vroegtijdige detectie van OsHV-1 μvar. Crassostrea gigas-oesters van oorsprong uit gebieden, onderworpen aan inperkingsmaatregelen in 2009 overeenkomstig nationale maatregelen of in 2010 overeenkomstig deze verordening, moeten aan bijkomende diergezondheidsvoorschriften voldoen als zij voor kweek- of heruitzettingsdoelstellingen worden binnengebracht in lidstaten of compartimenten waarvoor een dergelijk programma geldt, zolang OsHV-1 μvar in die lidstaat of dat compartiment niet wordt gedetecteerd. |
|
(14) |
Om ervoor te zorgen dat de in verschillende lidstaten in de context van programma's met doelgerichte bemonstering en uitvoering van tests voor de vroegtijdige detectie van OsHV-1 μvar verzamelde gegevens vergelijkbaar zijn, moeten bepaalde voorschriften in verband met de inhoud van dergelijke programma's worden vastgesteld. |
|
(15) |
De beschikbaarheid van precieze en actuele informatie over de situatie in verband met de detectie van OsHV-1 μvar in de lidstaten is een sleutelelement voor de effectieve bestrijding van de nieuwe ziekte. Daarom moeten de lidstaten de Commissie en de andere lidstaten onverwijld in kennis stellen van de eerste bevestigde aanwezigheid van het OsHV-1 μvar-virus op hun grondgebied in 2010. |
|
(16) |
Bovendien moet gebruik worden gemaakt van de informatiepagina's op internet, opgesteld overeenkomstig artikel 10 van Beschikking 2009/177/EG van de Commissie van 31 oktober 2008 houdende uitvoeringsbepalingen van Richtlijn 2006/88/EG van de Raad wat betreft bewakings- en uitroeiingsprogramma’s en de ziektevrije status van lidstaten, gebieden en compartimenten (3). |
|
(17) |
Om te zorgen voor de nodige transparantie en de tijdige toegang tot de relevante informatie over de nieuwe ziekte, moeten de lidstaten aan de Europese Commissie en de andere lidstaten informatie verstrekken over de beperkingsgebieden en de gebieden die eerder onderworpen waren aan inperkingsmaatregelen maar waar de afwezigheid van OsHV-1 μvar is aangetoond en programma's voor de vroegtijdige detectie van OsHV-1 μvar zijn opgesteld. |
|
(18) |
Aangezien er nog grote onzekerheid over de nieuwe ziekte bestaat, moeten de in deze verordening vastgestelde maatregelen van toepassing zijn tot eind december 2010. |
|
(19) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Definitie
Voor de uitvoering van deze verordening wordt onder OsHV-1 μvar verstaan: een genotype van het Ostreid-herpesvirus-1 (OsHV-1) dat wordt bepaald op grond van partiële-sequentiegegevens die een systematische deletie laten zien van 12 basisparen in ORF 4 van het genoom in vergelijking met OsHV-1 (GenBank # AY509253).
Artikel 2
Bemonstering, uitvoering van tests en instelling van beperkingsgebieden
1. Wanneer een verhoogde mortaliteit bij oesters van de soort Crassostrea gigas („Crassostrea gigas-oesters”) wordt geconstateerd, moet de bevoegde autoriteit:
|
a) |
monsters nemen overeenkomstig deel A van bijlage I; |
|
b) |
tests op de aanwezigheid van OsHV-1 μvar uitvoeren overeenkomstig de diagnosemethoden, vastgesteld in deel B van bijlage I. |
2. Wanneer de resultaten van de in lid 1, onder b), bedoelde tests wijzen op de aanwezigheid van OsHV-1 μvar, stelt de bevoegde autoriteit een beperkingsgebied in. Dat gebied wordt bepaald op grond van een voor elk geval afzonderlijke analyse, rekening houdend met de factoren die van invloed zijn op het risico van de verspreiding van de ziekte, vastgesteld in deel C van bijlage I.
3. De lidstaten stellen de Commissie en de andere lidstaten onverwijld in kennis van het eerste beperkingsgebied dat in 2010 op hun grondgebied is ingesteld.
Artikel 3
Voorschriften voor het in de handel brengen van Crassostrea gigas-oesters afkomstig uit een in lid 2 bedoeld beperkingsgebied
1. Crassostrea gigas-oesters afkomstig uit overeenkomstig artikel 2, lid 2, ingestelde beperkingsgebieden mogen niet uit dat gebied worden verplaatst.
2. In afwijking van lid 1 mogen zendingen Crassostrea gigas-oesters uit het beperkingsgebied worden gebracht, wanneer:
|
a) |
zij bestemd zijn voor een ander beperkingsgebied, ingesteld overeenkomstig artikel 2, lid 2; |
|
b) |
zij afkomstig zijn uit een deel van het beperkingsgebied, inclusief broederijen, dat niet door de verhoogde mortaliteit is getroffen en de zending is onderworpen aan:
|
|
c) |
zij vóór menselijke consumptie bestemd zijn voor verdere verwerking in zuiveringscentra, verzendcentra of verwerkingsinrichtingen die zijn uitgerust met een door de bevoegde autoriteit gevalideerd afvalwaterbehandelingssysteem dat:
|
|
d) |
zij bestemd zijn voor menselijke consumptie en daartoe zijn verpakt en geëtiketteerd overeenkomstig Verordening (EG) nr. 853/2004 van het Europees Parlement en de Raad (4), en:
|
|
e) |
de zendingen of producten daarvan bestemd zijn voor menselijke consumptie zonder verdere verwerking, mits zij zijn verpakt in detailverpakkingen die aan de bepalingen voor dergelijke verpakkingen van Verordening (EG) nr. 853/2004 voldoen. |
3. De zendingen, bedoeld in lid 2, onder a) en b), en bestemd voor kweek- of heruitzettingsgebieden, gaan vergezeld van een diergezondheidscertificaat, opgesteld overeenkomstig het model van bijlage II bij deze verordening en de toelichtingen in bijlage V bij Verordening (EG) nr. 1251/2008 van de Commissie.
Artikel 4
Opheffing van de in de artikelen 2 en 3 vastgestelde maatregelen
De bevoegde autoriteit kan de bestrijdingsmaatregelen in verband met de overeenkomstig artikel 2, lid 2, ingestelde beperkingsgebieden en de in artikel 3 vastgestelde beperkingen voor het in de handel brengen opheffen, nadat zij twee achtereenvolgende inspecties met een tussenpoos van 15 dagen heeft uitgevoerd, waaruit blijkt dat er geen verhoogde mortaliteit meer bestaat.
Artikel 5
Voorschriften voor het in de handel brengen van Crassostrea gigas-oesters afkomstig uit een compartiment waarvoor eerder bestrijdingsmaatregelen golden als gevolg van de verhoogde mortaliteit bij Crassostrea gigas-oesters in samenhang met OsHV-1 μvar
1. Crassostrea gigas-oesters die in de handel worden gebracht en afkomstig zijn uit een compartiment waarvoor in 2009 of 2010 inperkingsmaatregelen golden wegens de verhoogde mortaliteit bij Crassostrea gigas-oesters in samenhang met OsHV-1 μvar moeten:
|
a) |
vergezeld gaan van een diergezondheidscertificaat, opgesteld overeenkomstig het model van bijlage II bij deze verordening en de toelichtingen in bijlage V bij Verordening (EG) nr. 1251/2008, als de dieren:
|
|
b) |
afkomstig zijn uit een compartiment waar de afwezigheid van OsHV-1 μvar is aangetoond door bemonstering en uitvoering van tests overeenkomstig deel A van bijlage I, en |
|
c) |
voldoen aan de diergezondheidsvoorschriften die zijn vastgesteld in het modelcertificaat, bedoeld onder a). |
2. Een programma voor de vroegtijdige detectie van OsHV-1 μvar, als bedoeld in lid 1, onder a), punt i), moet aan de volgende eisen voldoen:
|
a) |
er moet een verklaring betreffende het programma bij het Permanent Comité voor de voedselketen en de diergezondheid worden ingediend; |
|
b) |
een dergelijke verklaring wordt opgesteld overeenkomstig punt 1, de punten 5.1, 5.2, 5.3, 5.5 en 5.9 en de punten 6 en 7 van het modelformulier in bijlage II bij Beschikking 2009/177/EG; |
|
c) |
het programma moet omvatten:
|
3. Lid 1 is van toepassing één week na de datum van de vergadering van het Permanent Comité voor de voedselketen en de diergezondheid waarop de verklaring betreffende het in lid 1, onder a), punt i), bedoelde programma is ingediend.
Artikel 6
Informatiepagina's op internet
1. De lidstaten stellen de Commissie en de andere lidstaten de volgende stukken ter beschikking:
|
a) |
een lijst van de beperkingsgebieden en de factoren waarmee rekening is gehouden bij de bepaling van die gebieden, inclusief een beschrijving van de geografische grenzen van het desbetreffende gebied, ingesteld overeenkomstig artikel 2, lid 2; |
|
b) |
een lijst van de compartimenten, inclusief een beschrijving van de geografische grenzen van het desbetreffende gebied:
|
|
c) |
verklaringen betreffende de programma′s, als bedoeld in artikel 5, lid 2, inclusief een beschrijving van de geografische grenzen van het desbetreffende gebied. |
2. De in lid 1 bedoelde informatie wordt bijgewerkt en ter beschikking gesteld via de informatiepagina's op internet, opgesteld overeenkomstig artikel 10 van Beschikking 2009/177/EG.
Artikel 7
Rapportage
Uiterlijk 1 oktober 2010 leggen de lidstaten aan de Commissie een verslag voor over de overeenkomstig artikel 5, lid 2, ingediende verklaringen betreffende de programma′s.
Het verslag wordt opgesteld overeenkomstig het modelformulier in bijlage VI bij Beschikking 2009/177/EG.
Artikel 8
Inwerkingtreding en toepassing
Deze verordening treedt in werking op de derde dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Zij is van toepassing van 15 maart 2010 tot en met 31 december 2010.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie
De voorzitter
José Manuel BARROSO
(1) PB L 328 van 24.11.2006, blz. 14.
(2) PB L 337 van 16.12.2008, blz. 41.
(3) PB L 63 van 7.3.2009, blz. 15.
(4) PB L 139 van 30.4.2004, blz. 55.
BIJLAGE I
DEEL A
Bemonstering
1. Bemonstering voor de uitvoering van artikel 2
De monsters, als bedoeld in artikel 2, bestaan uit ten minste 12 individuen van Crassostrea gigas-oesters. Bij de selectie van die dieren worden zwakke, openstaande of pas gestorven (niet in staat van ontbinding verkerende) individuen bemonsterd en zij worden verzameld uit het compartiment waar de sterfte is geconstateerd.
2. Monsterneming voor de uitvoering van artikel 3, lid 2, onder b), artikel 5, lid 1, onder b) en artikel 5, lid 2
|
a) |
De monsters voor de uitvoering van artikel 3, lid 2, onder b), bestaan uit:
Bij de selectie van die dieren moeten alle delen van de zending evenredig in het monster zijn vertegenwoordigd. Als zwakke, openstaande of pas gestorven (niet in staat van ontbinding verkerende) dieren aanwezig zijn, worden in de eerste plaats die dieren geselecteerd. |
|
b) |
De monsters voor de uitvoering van artikel 5, lid 2, bestaan uit ten minste 150 individuen van Crassostrea gigas per bemonsteringspunt. Alle bedrijven en kweekgebieden van weekdieren in de lidstaat of het compartiment waarop het programma betrekking heeft, worden bemonsterd. De monsters voor de uitvoering van artikel 5, lid 1, onder b), bestaan uit ten minste 150 individuen van Crassostrea gigas-oesters per compartiment. Bij de selectie van die dieren wordt rekening gehouden met de volgende criteria:
|
|
c) |
De in artikel 5, lid 2, bedoelde bemonstering wordt uitgevoerd in de periode van het jaar waarvan bekend is dat de prevalentie van OsHV-1 μvar dan in de lidstaat of het compartiment maximaal is. Wanneer dergelijke gegevens niet beschikbaar zijn, wordt de bemonstering uitgevoerd onmiddellijk na de periode waarin de watertemperatuur meer dan 16 °C bedraagt of op het tijdstip van het jaar wanneer de temperatuur normaliter haar jaarlijkse maximum bereikt. |
|
d) |
De in artikel 5, lid 1, onder b), bedoelde bemonstering wordt bij voorkeur uitgevoerd in de periode van het jaar, als beschreven in punt c). Als monsters buiten die periode van het jaar worden verzameld, moeten de bemonsterde oesters onder gelijkwaardige omstandigheden als beschreven in punt c) worden gehouden gedurende een passende periode voor de detectie van OsHV-1 μvar, voordat zij worden getest. |
DEEL B
Diagnosemethoden voor de detectie van OsHV-1 μvar
1. Toepassingsgebied
Deze procedure beschrijft een standaarddiagnosemethode voor de detectie en de identificatie van OsHV-1 μvar door middel van een polymerasekettingreactie (PCR). Zij maakt ook een onderscheid tussen OsHV-1 en OsHV-1 μvar mogelijk.
Om de reactieomstandigheden te optimaliseren en om de methode aan de apparatuur en de omstandigheden in hun eigen laboratorium aan te passen, mogen de laboratoria zo nodig wijzigingen in de in deze bijlage beschreven methode aanbrengen, mits een gelijke gevoeligheid en specificiteit kan worden aangetoond.
2. Definitie
OsHV-1 μvar wordt omschreven in artikel 1 van deze verordening.
3. Apparatuur en omgevingsomstandigheden
De voor de detectie en identificatie van OsHV-1 μvar door middel van PCR te gebruiken diagnosetest vereist de volgende uitrusting en omgevingsomstandigheden die klassiek voor PCR-tests worden gebruikt:
|
— |
Een gesloten zuurkast, uitgerust met een uv-producerend systeem om mogelijke verontreinigingen bij de bereiding van de PCR-mix uit te sluiten. |
|
— |
Twee volledige stellen pipetten (2 μl; 20 μl; 200 μl en 1 000 μl), het eerste voor DNA-extractie en het tweede voor de bereiding van de PCR-mix. |
|
— |
Drie verschillende pipetten: een pipet (2 μl) om de monsters in de PCR-mix te dispenseren, een pipet (20 μl) voor EB-bemonstering en een derde pipet (20 μl) om de PCR-producten op agarose gels te laden. |
|
— |
Filterpipettips (2 μl; 20 μl; 200 μl en 1 000 μl) voor DNA-extractie, bereiding van PCR-mix en monsterdispensing. |
|
— |
Pipettips (20 μl) voor het verzamelen van EB en het laden van amplificatieproducten op agarose gel. |
|
— |
Een PCR-apparaat voor de uitvoering van amplificaties. |
|
— |
Een horizontaal elektroforesesysteem voor de elektroforese van PCR-producten. |
|
— |
Een uv-tafel voor het observeren van de PCR-producten na agarose-gel-elektroforese. |
|
— |
Een systeem voor het verkrijgen van beelden van de gels. |
De uitvoerder van de test moet tijdens alle hieronder beschreven stappen een laboratoriumjas en handschoenen dragen. De laboratoriumjas en de handschoenen moeten bij voorkeur na elke belangrijke stap worden veranderd: DNA-extractie, bereiding van PCR-mix, monsterdispensing, amplificatie en gel-lading.
Er wordt aanbevolen om deze verschillende stappen in verschillende ruimten uit te voeren. Met name de amplificatie en de gel-lading/elektroforese moeten plaatsvinden in een andere ruimte dan die voor DNA-extractie, bereiding van PCR-mix en DNA-dispensing.
4. Procedure
4.1. Voorbereiding van het monster
Levende of pas gestorven (niet in staat van ontbinding verkerende) oesters, die vooraf kunnen worden ingevroren, worden verwerkt voor DNA-extractie.
De monsters worden op verschillende wijze verwerkt naargelang de grootte daarvan:
|
a) |
Voor larven worden pools van 50 mg van de hele dieren (inclusief de schelp), aangevuld met 200 μl gedistilleerd water, geplet en gecentrifugeerd bij 1 000 g gedurende 1 minuut. |
|
b) |
Voor zaad van 6 mm of kleiner worden pools van 300 mg van de hele dieren (inclusief de schelp), aangevuld met 1 200 μl gedistilleerd water, geplet en gecentrifugeerd bij 1 000 g gedurende 1 minuut. |
|
c) |
Voor zaad tussen 6 en 15 mm worden alle zachte weefsels van elk dier individueel geplet. |
|
d) |
Voor dieren groter dan 15 mm worden delen van de kieuwen en de mantel geïsoleerd. |
De DNA-extractie wordt uitgevoerd onder gebruikmaking van de QIAamp® DNA Mini Kit (QIAGEN) en volgens de instructies voor het weefseltestprotocol.
De verdere monsterbereiding wordt uitgevoerd in de onderstaande volgorde:
|
1. |
Doe 100 μl supernatant voor monsters, als bedoeld in de punten a) en b), of 10 tot 50 mg weefsels voor monsters, als bedoeld in de punten c) en d), in een 1,5 ml-microcentrifugebuis en voeg 180 μl ATL-buffer toe. |
|
2. |
Voeg 20 μl proteïnase K toe, vortex en incubeer bij 56 °C totdat het weefsel volledig is gelyseerd (één nacht). Vortex af en toe tijdens de incubatie om het monster te dispergeren. Centrifugeer korte tijd de 1,5 ml- microcentrifugebuis om de druppels van het deksel te verwijderen. |
|
3. |
Voeg 200 μl AL-buffer aan het monster toe, meng met pulse-vortexmixer gedurende 15 s en incubeer op 70 °C gedurende 10 minuten. Centrifugeer korte tijd de 1,5 ml-microcentrifugebuis om de druppels van het deksel te verwijderen. |
|
4. |
Voeg 200 μl ethanol (96-100 %) aan het monster toe en meng met pulse-vortexmixer gedurende 15 s. Centrifugeer korte tijd de 1,5 ml- microcentrifugebuis om de druppels van het deksel te verwijderen. |
|
5. |
Breng het mengsel van stap 4 zorgvuldig aan in de QIAamp Spin Column (in een 2 ml-verzamelbuis) zonder de rand nat te maken. Sluit het deksel en centrifugeer bij 10 000 omw./min. gedurende 1 min. Plaats de QIAamp Spin Column in een schone 2 ml-verzamelbuis (verstrekt in de kit) en gooi de buis met het filtraat weg. |
|
6. |
Open voorzichtig de QIAamp Spin Column en voeg 500 μl AW1-buffer toe zonder de rand nat te maken. Sluit het deksel en centrifugeer bij 10 000 omw./min. gedurende 1 min. Plaats de QIAamp Spin Column in een schone 2 ml-verzamelbuis (verstrekt in de kit) en gooi de verzamelbuis met het filtraat weg. |
|
7. |
Open voorzichtig de QIAamp Spin Column en voeg 500 μl AW2-buffer toe zonder de rand nat te maken. Sluit het deksel en centrifugeer op volle snelheid (14 000 omw./min.) gedurende 3 min. |
|
8. |
(Optioneel) Plaats de QIAamp Spin Column in een nieuwe 2 ml-verzamelbuis (niet verstrekt in de kit) en gooi de verzamelbuis met het filtraat weg. Centrifugeer op volle snelheid (14 000 omw./min.) gedurende 1 min. |
|
9. |
Plaats de QIAamp Spin Column in een schone 1,5 ml-microcentrifugebuis (niet verstrekt in de kit) en gooi de verzamelbuis met het filtraat weg. Open zorgvuldig de QIAamp Spin Column en voeg 100 μl gedistilleerd water toe. Incubeer 5 minuten bij kamertemperatuur en centrifugeer bij 10 000 omw./min. gedurende 1 min. |
|
10. |
Controleer de kwaliteit en de doeltreffendheid van de extractie (bijvoorbeeld door het meten van OD (260 nm) onder spectrofotometer of na elektroforese in agarose gel). |
|
11. |
Bereid een verdunning van uw monsters om een definitieve DNA-concentratie van 50-100 ng/μl te hebben. |
|
12. |
De DNA-oplossingen worden op 4 °C bewaard totdat de PCR-analyses worden uitgevoerd. |
Voor de DNA-extracties mogen andere in de handel verkrijgbare kits worden gebruikt, mits is aangetoond dat zij soortgelijke resultaten opleveren.
4.2. Polymerasekettingreactie (PCR)
4.2.1. Reagentia
|
— |
10 X-buffer (verstrekt met de Taq DNA-polymerase) |
|
— |
MgCl2 (verstrekt met de DNA-polymerase) (25 mM) |
|
— |
Taq DNA-polymerase (Goldstar, Eurogentec) 5 U/μl |
|
— |
dNTP (dATP, dCTP, dGTP, dTTT) Master Mix (20 mM) moet vóór gebruik 10 maal worden verdund (tot 2 mM) |
|
— |
d H2O (gedistilleerd H2O vrij van DNA en RNA) |
4.2.2. Primers
De volgende primers (1) moeten worden gebruikt:
|
|
CF (10 μM) |
|
|
CR (10 μM) |
4.2.3. PCR-mix
De PCR-mix voor elke buis is als volgt:
|
|
Volume per buis |
Definitieve concentratie |
|
Buffer (10 X) |
5 μl |
1X |
|
MgCl2 (25 mM) |
5 μl |
2,5 mM |
|
dNTP (2 mM) |
5 μl |
0,2 mM |
|
CF (10 μM) |
1 μl |
0,2 μM |
|
CR (10 μM) |
1 μl |
0,2 μM |
|
Taq polymérase (5 U/μl) |
0,5 μl |
2,5 U |
|
dH2O |
31,5 μl |
|
|
— |
49 μl van deze PCR-mix wordt in elke PCR-buis gedispenseerd |
|
— |
1 μl geëxtraheerd DNA (50-100 ng/μl) wordt aan elke buis toegevoegd |
4.2.4. Controles
Er zijn twee soorten controles:
|
— |
Negatieve controles bestaan uit dH2O (1 μl voor 49 μl PCR-mix). Zij zijn bedoeld om een potentiële reactieve verontreiniging of werkomgeving op te sporen. Een negatieve controle moet elke tien monsters of na elke batch monsters worden opgenomen. |
|
— |
Positieve controles bestaan uit plasmide-DNA dat de OsHV-1-doelgenoomregio CF-CR bevat. Zij zijn bedoeld om de doeltreffendheid van de PCR-reactie te controleren. Een positieve controle moet voor elke PCR-analyse worden opgenomen. Positieve controles zijn verkrijgbaar bij het communautaire referentielaboratorium. |
4.2.5. Amplificatie
Amplificatiecycli worden uitgevoerd in een PCR-apparaat (thermocycler).
|
— |
Initiële denaturatie: 2 min bij 94 °C |
|
— |
Amplificatie: 35 cycli (1 min bij 94 °C, 1 min bij 50 °C en 1 min bij 72 °C) |
|
— |
Eindelongatie: 5 min bij 72 °C |
4.3. Elektroforese
4.3.1. Reagentia
|
— |
50 X TAE (kan gebruiksklaar worden gekocht):
|
|
— |
Agarose gel 2,5 % in 1X TAE Ethidiumbromide (0,5 μg/ml) toegevoegd na koeling van de gel. |
|
— |
Laden blauwe kleurstof:
|
|
— |
Molecuulgewichtmerker: SmartLadder SF (Eurogentec): een gebruiksklare molecuulgewichtmerker met 9 banden met regelmatige afstanden van 100 tot 1 000 bp. |
4.3.2. Agarosegelbereiding
|
1. |
Weeg 2,5 g agarose, voeg 100 ml 1X TAE toe en verwarm totdat het mengsel is gesmolten. |
|
2. |
Na koeling van de oplossing wordt ethidiumbromide toegevoegd (5 μl voor 100 ml agarosegel) en de oplossing wordt uitgegoten in een specifieke mal, uitgerust met kammen (om kuiltjes te maken). |
|
3. |
Wanneer de gel is gepolymeriseerd, worden de kammen verwijderd en wordt de gel in een horizontaal elektroforesesysteem geplaatst dat voldoende 1X TAE bevat om de agarosegel te bedekken |
|
4. |
10 μl PCR-producten worden gemengd met 2 μl blauwe kleurstof (6X) en in de kuiltjes aangebracht |
|
5. |
Een gat wordt bestemd voor de molecuulgewichtmerker (5 μl) |
|
6. |
Er wordt een spanning van 50 tot 150 volt aangelegd gedurende 30 min tot 1 uur afhankelijk van de grootte en de dikte van de gel |
|
7. |
De gel wordt onder uv geobserveerd. |
4.4. Interpretatie
De aanwezigheid van OsHV-1 μVar in een monster blijkt uit de aanwezigheid van een band van de juiste grootte (157 bp in plaats van 173 bp voor OsHV-1) op een 2,5 % agarosegel, waarbij alle negatieve controles negatief en alle positieve controles positief zijn.
DEEL C
Bepaling van het beperkingsgebied
De volgende factoren die van invloed zijn op de risico's van de verspreiding van de ziekte, worden in aanmerking genomen bij de bepaling van het beperkingsgebied overeenkomstig artikel 2, lid 2:
|
a) |
aantal, percentage en verdeling van de weekdieren op het besmette bedrijf of kweekgebied van weekdieren; |
|
b) |
afstand en dichtheid van naburige bedrijven of kweekgebieden van weekdieren; |
|
c) |
nabijheid van verwerkingsinrichtingen, contactbedrijven of contactkweekgebieden van weekdieren; |
|
d) |
in de bedrijven of kweekgebieden van weekdieren aanwezige soorten; |
|
e) |
in de door de ziekte getroffen en de naburige bedrijven of kweekgebieden van weekdieren toegepaste kweekpraktijken, en |
|
f) |
hydrodynamische omstandigheden en andere uit epizoötiologisch oogpunt significante factoren. |
(1) Deze primers of beschrijvingen daarvan zijn verkrijgbaar bij het communautaire referentielaboratorium voor ziekten bij weekdieren (LGP-Ifremer, av de Mus de Loup, 17390 La Tremblade, France).
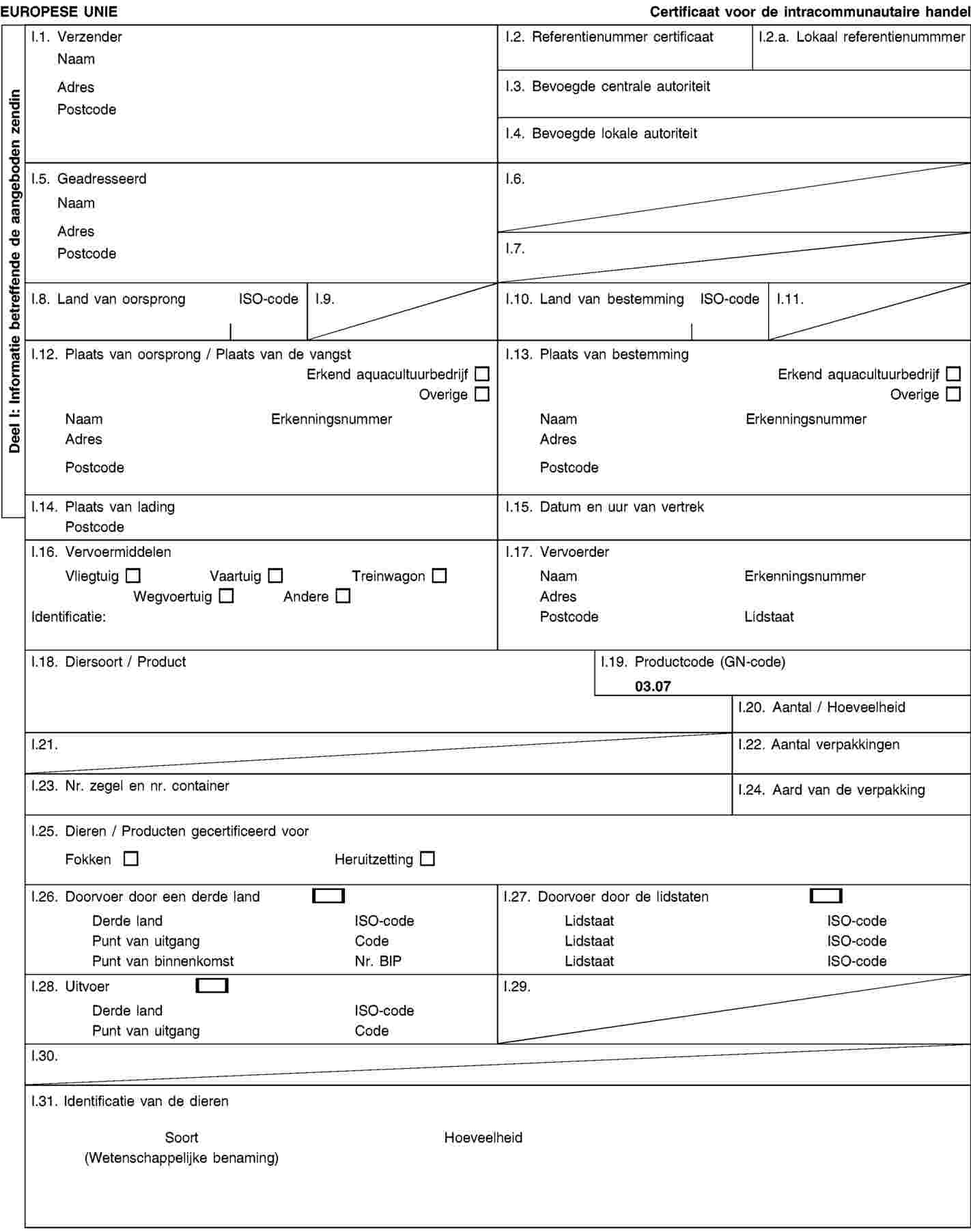
BIJLAGE II
Model van diergezondheidscertificaat voor het in de handel brengen van Crassostrea gigas-oesters, bestemd voor kweek- en heruitzettingsgebieden


|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/14 |
VERORDENING (EU) Nr. 176/2010 VAN DE COMMISSIE
van 2 maart 2010
tot wijziging van bijlage D bij Richtlijn 92/65/EEG van de Raad wat betreft spermacentra en spermaopslagcentra, embryoteams en embryoproductieteams, alsmede de voorschriften voor als donor fungerende paardachtigen, schapen en geiten en voor het hanteren van sperma, eicellen en embryo’s van die diersoorten
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Richtlijn 92/65/EEG van de Raad van 13 juli 1992 tot vaststelling van de veterinairrechtelijke voorschriften voor het handelsverkeer en de invoer in de Gemeenschap van dieren, sperma, eicellen en embryo’s waarvoor ten aanzien van de veterinairrechtelijke voorschriften geen specifieke communautaire regelgeving als bedoeld in bijlage A, onder I, van Richtlijn 90/425/EEG geldt (1), en met name op artikel 22, eerste alinea,
Overwegende hetgeen volgt:
|
(1) |
Richtlijn 92/65/EEG bevat de veterinairrechtelijke voorschriften voor het handelsverkeer en de invoer in de Europese Unie van dieren, sperma, eicellen en embryo’s waarvoor ten aanzien van de veterinairrechtelijke voorschriften geen specifieke wetgevingsbesluiten van de Europese Unie als bedoeld in die richtlijn gelden. |
|
(2) |
Die richtlijn bevat de voorschriften inzake de erkenning van en het toezicht op de stations en centra voor de winning van sperma van paardachtigen, schapen en geiten („spermacentra”). |
|
(3) |
Sommige spermacentra houden zich alleen bezig met de opslag van bij die dieren gewonnen sperma. Daarom moeten er afzonderlijke voorschriften komen voor de officiële erkenning van en het toezicht op dergelijke centra. |
|
(4) |
In Richtlijn 88/407/EEG van de Raad van 14 juni 1988 tot vaststelling van veterinairrechtelijke voorschriften van toepassing op het intracommunautaire handelsverkeer in sperma van runderen en de invoer daarvan (2) is het begrip spermaopslagcentrum gedefinieerd. Met het oog op de consistentie van de wetgeving van de Unie moeten de centra voor de opslag van sperma van de dieren waarop deze verordening betrekking heeft, overeenkomstig die definitie „spermaopslagcentra” worden genoemd. |
|
(5) |
Bovendien bevat Richtlijn 88/407/EEG voorschriften inzake de erkenning van en het toezicht op spermaopslagcentra voor runderen. Die voorschriften moeten als uitgangspunt worden beschouwd voor de voorschriften inzake de erkenning en het toezicht op spermaopslagcentra voor paardachtigen, schapen en geiten van deze verordening. De delen I en II van hoofdstuk I van bijlage D bij Richtlijn 92/65/EEG moeten dienovereenkomstig worden gewijzigd. |
|
(6) |
Richtlijn 92/65/EEG, zoals gewijzigd bij Richtlijn 2008/73/EG (3), bepaalt dat eicellen en embryo’s van schapen, geiten, paardachtigen en varkens gewonnen moeten zijn door een winningsteam, dan wel geproduceerd door een productieteam, dat is erkend door de bevoegde autoriteit van een lidstaat. |
|
(7) |
Daarom moeten in bijlage D bij Richtlijn 92/65/EEG de voorschriften voor de erkenning van die teams worden opgenomen. De Terrestrial Animal Health Code van de Werelddiergezondheidsorganisatie (OIE), achttiende editie, 2009 („de Terrestrial Code”) bevat de huidige technieken en de internationale normen voor de winning en behandeling van embryo’s. De hoofdstukken 4.7, 4.8 en 4.9 van de Terrestrial Code bevatten aanbevelingen voor de winning en behandeling van in vivo verkregen embryo’s, de winning en behandeling van in vitro geproduceerde embryo’s en de winning en behandeling van gemicromanipuleerde embryo’s. Met die aanbevelingen moet rekening worden gehouden in hoofdstuk III van bijlage D bij Richtlijn 92/65/EEG. De desbetreffende gedeelten moeten daarom dienovereenkomstig worden gewijzigd. |
|
(8) |
De International Embryo Transfer Society (IETS) is een internationale organisatie en een professioneel forum, bedoeld om onder andere de wetenschap van de embryoproductie te bevorderen en de standaardisatie van de procedures voor het hanteren en registreren van embryo’s op internationaal niveau te coördineren. De IETS werkt al een aantal jaren aan praktische protocollen op wetenschappelijke basis om de risico’s van de overdracht van ziekten door de transplantatie van embryo’s van donors naar ontvangers te vermijden. Die protocollen zijn grotendeels gebaseerd op de sanitaire methoden voor het hanteren van embryo’s zoals opgenomen in de derde editie van het handboek van de IETS, die in de Terrestrial Code nader zijn uitgewerkt. De door de IETS aanbevolen methoden voor het hanteren van embryo’s kunnen voor sommige ziekten in de plaats komen van traditionele preventiemaatregelen, zoals diagnostische tests bij donordieren, terwijl voor andere maatregelen de aanbevolen methoden alleen ter ondersteuning en aanvulling van die traditionele maatregelen gebruikt mogen worden. |
|
(9) |
Richtlijn 92/65/EEG bepaalt ook dat het sperma van als donor fungerende paardachtigen, schapen en geiten moet zijn gewonnen bij dieren die aan de voorschriften van hoofdstuk II van bijlage D bij die richtlijn voldoen. Die voorschriften moeten wat betreft donorhengsten, -rammen en -bokken worden herzien met inachtneming van de internationale normen in hoofdstuk 4.5 van de Terrestrial Code. De delen A en B van hoofdstuk II van bijlage D bij Richtlijn 92/65/EEG moeten dienovereenkomstig worden gewijzigd. |
|
(10) |
Bij de toepassing van deze verordening moet wat schapen en geiten betreft rekening worden gehouden met Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad van 22 mei 2001 houdende vaststelling van voorschriften inzake preventie, bestrijding en uitroeiing van bepaalde overdraagbare spongiforme encefalopathieën (4), Verordening (EG) nr. 546/2006 van de Commissie van 31 maart 2006 ter uitvoering van Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad wat betreft de nationale scrapiebestrijdingsprogramma’s en aanvullende garanties, tot afwijking van bepaalde voorschriften van Beschikking 2003/100/EG en tot intrekking van Verordening (EG) nr. 1874/2003 (5) en Verordening (EG) nr. 1266/2007 van de Commissie van 26 oktober 2007 tot vaststelling van uitvoeringsbepalingen voor Richtlijn 2000/75/EG van de Raad wat betreft bestrijding, monitoring, surveillance en beperkingen op de verplaatsingen van bepaalde dieren van vatbare soorten in verband met bluetongue (6). |
|
(11) |
Bij de toepassing van deze verordening moet wat betreft het gebruik van antibiotica in sperma of in de bij het winnen, invriezen en opslaan van embryo’s gebruikte media rekening worden gehouden met Richtlijn 2001/82/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor diergeneeskundig gebruik (7). |
|
(12) |
Bij de toepassing van deze verordening moet wat betreft donorzeugen rekening worden gehouden met Beschikking 2008/185/EG van de Commissie van 21 februari 2008 betreffende aanvullende garanties ten aanzien van de ziekte van Aujeszky voor het intracommunautaire handelsverkeer van varkens, en betreffende criteria voor de over deze ziekte te verstrekken gegevens (8). |
|
(13) |
Richtlijn 92/65/EEG bepaalt dat alleen sperma, eicellen en embryo’s die aan bepaalde voorwaarden voldoen, in het handelsverkeer mogen worden gebracht. Met name bepaalt die richtlijn dat hengsten die voor het winnen van sperma worden gebruikt, bepaalde tests moeten ondergaan, onder andere in verband met infectieuze anemie en besmettelijke baarmoederontsteking. Evenzo moeten vrouwelijke donordieren volgens Richtlijn 92/65/EEG aan bepaalde voorwaarden voldoen om voor het winnen van eicellen en embryo’s te mogen worden gebruikt. Vrouwelijke donordieren hoeven echter op dit moment nog geen tests op infectieuze anemie en besmettelijke baarmoederontsteking bij paarden te ondergaan. Aangezien er geen wetenschappelijke aanwijzingen voor zijn dat de risico’s als gevolg van de transplantatie van een bij een besmet donordier gewonnen embryo door een behandeling van embryo’s kan worden weggenomen, moeten in de veterinairrechtelijke voorschriften voor de handel in eicellen en embryo’s van paardachtigen ook tests op infectieuze anemie en besmettelijke baarmoederontsteking bij merries worden opgenomen. Hoofdstuk II, deel C, van bijlage D bij die richtlijn moet daarom dienovereenkomstig worden gewijzigd. |
|
(14) |
Bijlage D bij Richtlijn 92/65/EEG moet daarom dienovereenkomstig worden gewijzigd. |
|
(15) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Bijlage D bij Richtlijn 92/65/EEG wordt gewijzigd overeenkomstig de bijlage bij deze verordening.
Artikel 2
Deze verordening treedt in werking op de twintigste dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Zij is van toepassing met ingang van 1 september 2010.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie
De voorzitter
José Manuel BARROSO
(1) PB L 268 van 14.9.1992, blz. 54.
(2) PB L 194 van 22.7.1988, blz. 10.
(3) PB L 219 van 14.8.2008, blz. 40.
(4) PB L 147 van 31.5.2001, blz. 1.
(5) PB L 94 van 1.4.2006, blz. 28.
(6) PB L 283 van 27.10.2007, blz. 37.
(7) PB L 311 van 28.11.2001, blz. 1.
(8) PB L 59 van 4.3.2008, blz. 19.
BIJLAGE
Bijlage D bij Richtlijn 92/65/EEG wordt vervangen door:
„BIJLAGE D
HOOFDSTUK I
Voorschriften voor spermacentra, spermaopslagcentra, embryoteams en embryoproductieteams
I. Voorschriften voor de erkenning van spermacentra en spermaopslagcentra
1. Om te worden erkend en het in artikel 11, lid 4, bedoelde veterinaire registratienummer te verkrijgen moet een spermacentrum:
|
1.1. |
permanent onder toezicht staan van een door de bevoegde autoriteit aangewezen dierenarts van het centrum; |
|
1.2. |
de beschikking hebben over ten minste:
|
|
1.3. |
zo zijn gebouwd of geïsoleerd dat contact met vee buiten het centrum onmogelijk is; |
|
1.4. |
zo zijn gebouwd dat het gehele spermacentrum met uitzondering van de kantoorruimten en, wanneer het gaat om paardachtigen, van de bewegingsruimte, gemakkelijk kan worden gereinigd en ontsmet. |
2. Om te worden erkend moet elk spermaopslagcentrum:
|
a) |
als er niet uitsluitend sperma van één diersoort, dat is gewonnen in overeenkomstig deze richtlijn verkregen spermacentra, wordt opgeslagen, of als er overeenkomstig deze richtlijn embryo’s worden opgeslagen, aparte veterinaire registratienummers als bedoeld in artikel 11, lid 4, krijgen voor elke diersoort waarvan sperma op het centrum wordt opgeslagen; |
|
b) |
permanent onder toezicht staan van een door de bevoegde autoriteit aangewezen dierenarts van het centrum; |
|
c) |
beschikken over een opslagruimte voor sperma, met de nodige voorzieningen om het sperma en/of de embryo’s op te slaan, die zou gebouwd is dat die producten en de voorzieningen tegen ongunstige weersomstandigheden en milieu-invloeden worden beschermd; |
|
d) |
zo zijn gebouwd dat contact met vee of andere dieren buiten het centrum onmogelijk is; |
|
e) |
zo zijn gebouwd dat het gehele centrum met uitzondering van de kantoorruimten en, wanneer het gaat om paardachtigen, van de bewegingsruimte, gemakkelijk kan worden gereinigd en ontsmet; |
|
f) |
zo zijn gebouwd dat onbevoegden er geen toegang toe hebben. |
II. Voorschriften voor het toezicht op spermacentra en spermaopslagcentra
1. Op spermacentra moet:
|
1.1. |
zodanig toezicht worden uitgeoefend dat:
|
|
1.2. |
controle worden uitgeoefend zodat:
|
|
1.3. |
tijdens het fokseizoen ten minste eenmaal per jaar in het geval van seizoengebonden fokkerij en tweemaal per jaar in het geval van niet-seizoengebonden fokkerij door een officiële dierenarts een inspectie worden verricht waarbij, zo nodig op basis van de administratie, standaardwerkvoorschriften en interne audits, wordt nagegaan of nog steeds aan alle voorwaarden inzake erkenning, toezicht en controle wordt voldaan. |
2. Op spermaopslagcentra moet:
|
2.1. |
zodanig toezicht worden uitgeoefend dat:
|
|
2.2. |
worden gecontroleerd dat:
|
|
2.3. |
in afwijking van punt 2.2, onder a), de opslag van embryo’s in het erkende spermaopslagcentrum toegestaan is, mits zij aan de voorschriften van deze richtlijn voldoen en in afzonderlijke recipiënten worden opgeslagen; |
|
2.4. |
een officiële dierenarts ten minste tweemaal per kalenderjaar een inspectie houdt waarbij, zo nodig op basis van de administratie, standaardwerkvoorschriften en interne audits, wordt nagegaan of nog steeds aan alle voorwaarden inzake erkenning, toezicht en controle wordt voldaan. |
III. Voorschriften voor de erkenning van en het toezicht op embryoteams en embryoproductieteams
1. Om te kunnen worden erkend moet elk embryoteam aan de volgende eisen voldoen:
|
1.1. |
de winning, behandeling en opslag van embryo’s moet worden uitgevoerd door een teamdierenarts of onder diens verantwoordelijkheid door één of meer bevoegde technici die door de teamdierenarts zijn geschoold in hygiënemethoden en -technieken en in de technieken en beginselen van ziektebestrijding; |
|
1.2. |
de teamdierenarts is verantwoordelijk voor alle werkzaamheden van het team, waaronder:
|
|
1.3. |
het team staat onder algemeen toezicht van de officiële dierenarts, die ten minste elk kalenderjaar een inspectie houdt waarbij, zo nodig op basis van de administratie, standaardwerkvoorschriften en interne audits, wordt nagegaan of aan alle sanitaire voorschriften betreffende de verkrijging, behandeling en opslag van embryo’s en aan alle voorwaarden inzake erkenning en toezicht wordt voldaan; |
|
1.4. |
het team beschikt over een laboratorium met vaste vestigingsplaats of een mobiel laboratorium waar embryo’s onderzocht, behandeld en verpakt kunnen worden en dat ten minste bestaat uit een werkoppervlak, een optische of stereomicroscoop en zo nodig cryogene apparatuur; |
|
1.5. |
een laboratorium met vaste vestigingsplaats beschikt over:
|
|
1.6. |
een mobiel laboratorium:
|
|
1.7. |
de gebouwen en laboratoria zijn zodanig ontworpen en ingericht en de werkzaamheden van het team worden zodanig uitgevoerd dat kruisbesmetting van embryo’s wordt voorkomen; |
|
1.8. |
het team beschikt over een opslagvoorziening die
|
|
1.9. |
de bevoegde autoriteit mag de opslag van sperma in de in punt 1.8 bedoelde opslagruimten toestaan mits dat sperma:
|
2. Om te kunnen worden erkend moet elk embryoproductieteam tevens aan de volgende aanvullende eisen voldoen:
|
2.1. |
de leden van het team hebben de nodige scholing gekregen inzake ziektebestrijding en laboratoriumtechnieken, met name inzake de procedures voor het werken onder steriele omstandigheden; |
|
2.2. |
het team kan beschikken over een laboratorium met een vaste vestigingsplaats, dat:
|
|
2.3. |
wanneer eicellen en ander weefsel moeten worden gewonnen in een slachthuis, moet het team kunnen beschikken over de nodige apparatuur om de eierstokken en ander weefsel op een hygiënische en veilige manier te winnen en voor behandeling naar het laboratorium te vervoeren. |
HOOFDSTUK II
Voorschriften voor donordieren
I. Voorschriften voor donorhengsten
1. Voor het winnen van sperma mogen alleen hengsten worden gebruikt waarvan de dierenarts van het centrum heeft geconstateerd dat zij aan de volgende voorwaarden voldoen:
|
1.1. |
bij de toelating en op de dag van de spermawinning vertonen zij geen klinische symptomen van besmettelijke ziekten; |
|
1.2. |
zij zijn afkomstig van het grondgebied of, in geval van regionalisering, een deel van het grondgebied, van een lidstaat of een derde land, en van een bedrijf onder veterinair toezicht, waarbij het grondgebied of deel daarvan en het bedrijf voldoen aan de eisen van Richtlijn 90/426/EEG; |
|
1.3. |
de laatste 30 dagen vóór de spermawinning hebben zij verbleven in bedrijven waar in die periode geen enkele paardachtige klinische symptomen van equiene virusarteritis of besmettelijke baarmoederontsteking heeft vertoond; |
|
1.4. |
in de laatste 30 dagen vóór de eerste spermawinning en gedurende de winningsperiode worden zij niet voor natuurlijke dekking gebruikt; |
|
1.5. |
bij de dieren worden de volgende tests verricht, die worden uitgevoerd en gecertificeerd in een door de bevoegde autoriteit erkend laboratorium volgens het in punt 1.6 aangegeven programma:
|
|
1.6. |
zij hebben een van de volgende testprogramma’s ondergaan:
|
|
1.7. |
indien één of meer van de in punt 1.5 genoemde tests positief uitvallen, moet de donorhengst worden afgezonderd en mag het sinds de datum van de laatste negatieve test van die hengst verkregen sperma niet in de handel worden gebracht, behalve wanneer het gaat om equiene virusarteritis en het sperma van elk ejaculaat met negatief resultaat op equiene virusarteritis is getest. Sperma dat is verkregen van alle andere hengsten op het spermacentrum sinds de datum waarop het laatste monster is genomen dat een negatief resultaat gaf op een van de in punt 1.5 genoemde tests, wordt afzonderlijk opgeslagen en mag pas in de handel worden gebracht nadat de gezondheidsstatus van het spermacentrum is hersteld en het opgeslagen sperma het nodige officiële onderzoek heeft ondergaan om de aanwezigheid van verwekkers van de in punt 1.5 genoemde ziekten in het sperma uit te sluiten; |
|
1.8. |
sperma dat is verkregen van hengsten op een spermacentrum waarvoor een verbodsmaatregel geldt overeenkomstig artikel 4 of artikel 5 van Richtlijn 90/426/EEG wordt afzonderlijk opgeslagen en mag pas in de handel worden gebracht nadat de gezondheidsstatus van het spermacentrum overeenkomstig Richtlijn 90/426/EEG door de officiële dierenarts is hersteld en het opgeslagen sperma het nodige officiële onderzoek heeft ondergaan om de aanwezigheid van verwekkers van de in bijlage A bij Richtlijn 90/426/EEG genoemde ziekten in het sperma uit te sluiten. |
II. Voorschriften voor donorrammen en donorbokken
1. Voor alle rammen en bokken die tot een spermacentrum worden toegelaten, gelden de volgende eisen:
|
1.1. |
zij zijn gedurende ten minste 28 dagen in quarantaine gehouden in speciaal daartoe door de bevoegde autoriteit erkende voorzieningen, en alle daar aanwezige dieren hebben ten minste dezelfde gezondheidsstatus („quarantainevoorzieningen”); |
|
1.2. |
voordat zij de quarantainevoorzieningen worden binnengebracht, behoorden zij tot een officieel brucellosevrije schapen- of geitenhouderij overeenkomstig artikel 2 van Richtlijn 91/68/EEG en daarvóór zijn zij niet gehouden in een bedrijf met een lagere gezondheidsstatus ten aanzien van brucellose; |
|
1.3. |
zij komen van een bedrijf waar zij in de 60 dagen voorafgaande aan hun verblijf in quarantaine een serologische test op besmettelijke epididymitis (B. ovis) overeenkomstig bijlage D bij Richtlijn 91/68/EEG of een andere test met een gelijkwaardige gedocumenteerde gevoeligheid en specificiteit hebben ondergaan; |
|
1.4. |
zij hebben de volgende tests ondergaan, uitgevoerd op een bloedmonster dat binnen de 28 dagen vóór de aanvang van de in punt 1.1 bedoelde quarantaineperiode is genomen, waarbij alle testuitslagen negatief waren, afgezien van de onder c) ii) bedoelde test op border disease:
De bevoegde autoriteit mag toestaan dat voor de in dit punt bedoelde tests gebruik wordt gemaakt van monsters die zijn verkregen in de quarantainevoorzieningen. Indien die toestemming wordt verleend, mag de in punt 1.1 bedoelde quarantaineperiode niet aanvangen vóór de datum waarop de monsters zijn genomen. Indien één of meer van de in dit punt bedoelde tests positief blijken te zijn, wordt het dier in kwestie onmiddellijk uit de quarantainevoorzieningen verwijderd. Bij collectieve quarantaine mag de in punt 1.1 bedoelde quarantaineperiode voor de overige dieren pas aanvangen nadat het positief reagerende dier verwijderd is; |
|
1.5. |
zij hebben de volgende tests ondergaan, die zijn uitgevoerd op monsters die in de in punt 1.1 genoemde quarantaineperiode maar ten minste 21 dagen nadat zij de quarantainevoorzieningen zijn binnengebracht, zijn genomen, en waarvan de uitslagen negatief waren:
|
|
1.6. |
zij hebben de in punt 1.4, onder c) i) en ii), bedoelde tests op border disease ondergaan, die zijn uitgevoerd op bloedmonsters die in de in punt 1.1 genoemde quarantaineperiode maar ten minste 21 dagen nadat zij de quarantainevoorzieningen zijn binnengebracht, zijn genomen. Dieren (zowel seronegatief als seropositief) mogen alleen in het spermacentrum worden binnengebracht als geen seroconversie wordt geconstateerd bij de dieren die seronegatief zijn bevonden voor de datum waarop zij in de quarantainevoorzieningen werden binnengebracht. Als wel seroconversie wordt geconstateerd, moeten alle dieren die seronegatief blijven, in quarantaine worden gehouden totdat in de groep gedurende drie weken vanaf de datum waarop die seroconversie is opgetreden, geen verdere seroconversie meer is geconstateerd. Serologisch positieve dieren mogen het spermacentrum worden binnengebracht als de in punt 1.4, onder c) i), bedoelde test een negatief resultaat heeft opgeleverd. |
2. De dieren mogen slechts tot het spermacentrum worden toegelaten met de uitdrukkelijke toestemming van de dierenarts van het centrum. Er wordt een administratie bijgehouden van alle dieren die het spermacentrum binnenkomen en verlaten.
3. Dieren die in een spermacentrum worden toegelaten, mogen op de dag van toelating geen klinische ziektesymptomen vertonen.
Alle dieren moeten, onverminderd punt 4, afkomstig zijn uit quarantainevoorzieningen die op de dag van verzending van de dieren naar het spermacentrum aan de volgende voorwaarden voldoen:
|
a) |
binnen een straal van 10 km rond de quarantainevoorzieningen heeft zich sedert ten minste 30 dagen geen enkel geval van mond-en-klauwzeer voorgedaan; |
|
b) |
zij moeten sinds ten minste drie maanden vrij zijn van mond-en-klauwzeer en van brucellose; |
|
c) |
zij moeten sinds ten minste 30 dagen vrij zijn van ziekten waarvoor een aangifteplicht bestaat, zoals gedefinieerd in artikel 2, onder b), punt 6, van Richtlijn 91/68/EEG. |
4. Indien aan de in punt 3 omschreven voorwaarden is voldaan en indien de in punt 5 bedoelde routinetests in de twaalf maanden voorafgaande aan de overbrenging van de dieren zijn verricht, mogen dieren uit een erkend spermacentrum naar een ander spermacentrum met dezelfde gezondheidsstatus worden overgebracht zonder quarantaine en zonder tests, mits de dieren rechtstreeks worden overgebracht. Het betrokken dier mag niet direct of indirect in contact komen met evenhoevige dieren met een lagere gezondheidsstatus en de gebruikte transportmiddelen moeten vóór gebruik zijn ontsmet. Bij de overbrenging van een spermacentrum in een lidstaat naar een spermacentrum in een andere lidstaat moeten de bepalingen van Richtlijn 91/68/EEG in acht worden genomen.
5. Alle schapen en geiten die in een erkend spermacentrum verblijven, moeten ten minste één keer per kalenderjaar met negatief resultaat de onderstaande tests ondergaan:
|
a) |
voor brucellose (B. melitensis), een serologische test overeenkomstig bijlage C bij Richtlijn 91/68/EEG; |
|
b) |
voor besmettelijke epididymitis (B. ovis) een serologische test overeenkomstig bijlage D bij Richtlijn 91/68/EEG, of een andere test met gelijkwaardige gedocumenteerde gevoeligheid en specificiteit; |
|
c) |
voor border disease de in punt 1.4, onder c) ii), bedoelde antilichaamstest, die alleen wordt uitgevoerd op seronegatieve dieren. |
6. Alle in dit deel bedoelde tests worden uitgevoerd door een erkend laboratorium.
7. Indien één of meer van de in punt 5 bedoelde tests positief uitvallen, moet het betrokken dier worden afgezonderd en mag het sinds de datum van de laatste negatieve test gewonnen sperma niet in de handel worden gebracht.
Het in de eerste alinea bedoelde dier wordt uit het centrum verwijderd, behalve als het border disease betreft; in dat geval moet het dier een in punt 1.4, onder c) i), bedoelde test ondergaan, die een negatief resultaat moet opleveren.
Sperma dat is verkregen van alle andere dieren in het spermacentrum sinds de datum waarop het laatste monster is genomen dat een negatief resultaat gaf op een van de in punt 5 genoemde tests, wordt afzonderlijk opgeslagen en mag pas in de handel worden gebracht nadat de gezondheidsstatus van het spermacentrum is hersteld en het opgeslagen sperma het nodige officiële onderzoek heeft ondergaan om de aanwezigheid van verwekkers van de in punt 5 genoemde ziekten in het sperma uit te sluiten.
8. Sperma moet afkomstig zijn van dieren die:
|
a) |
geen klinische ziektesymptomen vertoonden op de dag waarop het sperma is gewonnen; |
|
b) |
gedurende de 12 maanden voorafgaand aan de datum van winning van het sperma:
|
|
c) |
wanneer het gaat om de winning van vers sperma, ten minste gedurende de laatste 30 dagen vóór de spermawinning zonder onderbreking in een erkend spermacentrum hebben verbleven; |
|
d) |
voldoen aan de eisen van de artikelen 4, 5 en 6 van Richtlijn 91/68/EEG; |
|
e) |
indien zij zijn gehouden op bedrijven als bedoeld in artikel 11, lid 2, eerste streepje, in de laatste 30 dagen vóór de spermawinning met negatief resultaat de volgende tests hebben ondergaan:
|
|
f) |
gedurende ten minste 30 dagen vóór de datum van de eerste spermawinning en tussen de datum van de eerste monsterneming als bedoeld in de punten 1.5 en 1.6 of onder e) en het eind van de winningsperiode niet voor natuurlijke dekking worden gebruikt. |
9. Sperma dat is verkregen van donorrammen of donorbokken op een spermacentrum of een bedrijf als bedoeld in artikel 11, lid 2, eerste streepje, waarvoor een verbodsmaatregel om veterinairrechtelijke redenen geldt overeenkomstig artikel 4 van Richtlijn 91/68/EEG, wordt afzonderlijk opgeslagen en mag pas in de handel worden gebracht nadat de gezondheidsstatus van het spermacentrum overeenkomstig Richtlijn 91/68/EEG door de officiële dierenarts is hersteld en het opgeslagen sperma het nodige officiële onderzoek heeft ondergaan om de aanwezigheid van verwekkers van de in bijlage B, onder I, bij Richtlijn 91/68/EEG genoemde ziekten in het sperma uit te sluiten.
HOOFDSTUK III
Eisen inzake sperma, eicellen en embryo’s
I. Voorschriften voor het winnen, behandelen, preserveren, opslaan en vervoeren van sperma
|
1.1. |
Indien, onverminderd Richtlijn 2001/82/EG van het Europees Parlement en de Raad (2), een antibioticum of mengsel van antibiotica wordt toegevoegd met een bactericide activiteit per ml sperma die ten minste gelijkwaardig is aan die van de volgende mengsels: gentamicine (250 μg), tylosine (50 μg), lincomycine-spectinomycine (150/300 μg); penicilline (500 IE), streptomycine (500 μg), lincomycine-spectinomycine (150/300 μg); of amikacine (75 μg), divekacine (25 μg), worden de namen van de toegevoegde antibiotica en de concentratie ervan vermeld op het in artikel 11, lid 2, vierde streepje, bedoelde gezondheidscertificaat. |
|
1.2. |
Alle instrumenten die bij het winnen, behandelen, preserveren en invriezen van sperma worden gebruikt, moeten vóór gebruik naar behoren worden ontsmet of gesteriliseerd, met uitzondering van instrumenten voor eenmalig gebruik. |
|
1.3. |
Bevroren sperma:
|
|
1.4. |
Voor de handel bestemd sperma:
|
II. Voorschriften voor eicellen en embryo’s
1. Winning en behandeling van in vivo verkregen embryo’s
In vivo verkregen embryo’s zijn het resultaat van bevruchting door kunstmatige inseminatie met sperma dat aan de eisen van deze richtlijn voldoet en worden gewonnen, behandeld en gepreserveerd met inachtneming van de volgende voorschriften:
|
1.1. |
de embryo’s worden gewonnen en behandeld door een erkend embryoteam, zonder in contact te komen met andere partijen embryo’s, die niet aan de bij deze richtlijn vastgestelde eisen voldoen; |
|
1.2. |
de embryo’s worden gewonnen op een plaats die gescheiden is van de andere delen van het gebouw of bedrijf waar het embryo wordt gewonnen, die goed is onderhouden en met zodanige materialen is gebouwd dat zij doeltreffend en gemakkelijk kan worden gereinigd en ontsmet; |
|
1.3. |
de embryo’s worden behandeld (onderzocht, gewassen, bewerkt en in steriele, geïdentificeerde rietjes, ampullen of andere verpakkingen gedaan) in een laboratorium met vaste vestigingsplaats of een mobiel laboratorium, waaromheen zich, voor zover het gevoelige soorten betreft, binnen een straal van 10 km sedert ten minste 30 dagen geen enkel geval van mond-en-klauwzeer heeft voorgedaan; |
|
1.4. |
alle apparatuur die wordt gebruikt voor het winnen, hanteren, wassen, invriezen en opslaan van embryo’s moet vóór gebruik gesteriliseerd of op adequate wijze gereinigd en ontsmet worden overeenkomstig het handboek van de IETS (3), of het moet apparatuur voor eenmalig gebruik zijn; |
|
1.5. |
biologische producten van dierlijke oorsprong die worden gebruikt in de media en oplossingen voor het winnen, behandelen, wassen en bewaren van embryo’s moeten vrij van pathogene micro-organismen zijn. De bij het winnen, invriezen en opslaan van embryo’s gebruikte media en oplossingen moeten volgens erkende methoden en in overeenstemming met het handboek van de IETS worden gesteriliseerd en op zodanige wijze worden gehanteerd dat zij steriel blijven. Aan de media voor het winnen, behandelen, wassen en opslaan van embryo’s mogen zo nodig antibiotica worden toegevoegd in overeenstemming met het handboek van de IETS; |
|
1.6. |
de cryogene middelen die voor het preserveren of opslaan van embryo’s worden gebruikt, mogen niet eerder voor andere producten van dierlijke oorsprong zijn gebruikt; |
|
1.7. |
alle voor embryo’s gebruikte rietjes, ampullen of andere verpakkingen moeten duidelijk geïdentificeerd worden met etiketten die in overeenstemming zijn met het gestandaardiseerde systeem volgens het handboek van de IETS; |
|
1.8. |
de embryo’s moeten worden gewassen overeenkomstig het handboek van de IETS en de zona pellucida moet vóór en onmiddellijk na het wassen intact zijn. De standaardwasprocedure moet worden aangevuld met wassingen met het enzym trypsine, in overeenstemming met het handboek van de IETS, wanneer bepaalde virussen moeten worden geïnactiveerd of verwijderd; |
|
1.9. |
embryo’s van verschillende donordieren mogen niet tezamen worden gewassen; |
|
1.10. |
de zona pellucida van elk embryo moet over de gehele oppervlakte onder een vergroting van ten minste 40 maal worden onderzocht en er moet worden gecertificeerd dat zij nog intact is en vrij van vreemde stoffen; |
|
1.11. |
embryo’s van een partij die bij het in punt 1.10 bedoelde onderzoek in orde zijn bevonden, worden in een steriel rietje, een steriele ampul of een andere steriele verpakking gedaan, die overeenkomstig punt 1.7 wordt gemerkt en onmiddellijk wordt verzegeld; |
|
1.12. |
elk embryo wordt in voorkomend geval zo spoedig mogelijk ingevroren en opgeslagen op een plaats die onder toezicht van de teamdierenarts staat; |
|
1.13. |
elk embryoteam moet geregeld monsters van niet-levensvatbare embryo’s of eicellen, spoelvloeistoffen of wasvloeistoffen die bij zijn werkzaamheden zijn verkregen, aan een officieel onderzoek op bacteriële en virale verontreiniging onderwerpen, in overeenstemming met het handboek van de IETS; |
|
1.14. |
elk embryoteam moet een administratie bijhouden met betrekking tot de winning van embryo’s, die gedurende twee jaar nadat de embryo’s zijn verhandeld of ingevoerd, wordt bewaard, en het volgende omvat:
|
2. Winning en bewerking van eicellen, eierstokken en andere weefsels voor de productie van embryo’s in vitro
De in de punten 1.1 tot en met 1.14 opgenomen voorschriften zijn van overeenkomstige toepassing op de winning en behandeling van eicellen, eierstokken en andere weefsels voor gebruik bij in-vitrofertilisatie en/of in-vitrokweek. Bovendien gelden daarvoor de volgende voorschriften:
|
2.1. |
de bevoegde autoriteit is bekend met het bedrijf of de bedrijven van oorsprong van de donordieren en is daarvoor bevoegd; |
|
2.2. |
wanneer eierstokken en andere weefsels in een slachthuis worden gewonnen, hetzij van afzonderlijke dieren hetzij van groepen donordieren („groepsgewijze winning”), moet dat slachthuis officieel erkend zijn overeenkomstig Verordening (EG) nr. 854/2004 van het Europees Parlement en de Raad van 29 april 2004 houdende vaststelling van specifieke voorschriften voor de organisatie van de officiële controles van voor menselijke consumptie bestemde producten van dierlijke oorsprong (4) en onder toezicht staan van een dierenarts die ervoor moet zorgen dat de ante- en postmortemkeuringen van potentiële donordieren worden uitgevoerd en moet verklaren dat zij vrij zijn van symptomen van de relevante besmettelijke ziekten die op dieren kunnen worden overgedragen. Rond het slachthuis heeft zich, voor zover het gevoelige soorten betreft, binnen een straal van 10 km sedert ten minste 30 dagen geen enkel geval van mond-en-klauwzeer voorgedaan; |
|
2.3. |
partijen eierstokken mogen het laboratorium voor behandeling pas worden binnengebracht nadat de postmortemkeuring van de donordieren heeft plaatsgevonden; |
|
2.4. |
de uitrusting voor het verwijderen en vervoeren van eierstokken en andere weefsels moet vóór gebruik gereinigd en ontsmet of gesteriliseerd worden en mag alleen voor die doeleinden worden gebruikt. |
3. Behandeling van in vitro verkregen embryo’s
De in de punten 1.1 tot en met 1.14 opgenomen voorschriften zijn van overeenkomstige toepassing op de behandeling van in vitro verkregen embryo’s. Bovendien gelden daarvoor de volgende voorschriften:
|
3.1. |
in vitro verkregen embryo’s worden verkregen door in-vitrofertilisatie met sperma dat aan de eisen van deze richtlijn voldoet; |
|
3.2. |
na afloop van de in-vitrokweekperiode maar voordat de embryo’s worden ingevroren, opgeslagen en vervoerd, worden zij gewassen en ondergaan zijn de in de punten 1.8, 1.10 en 1.11 genoemde behandelingen; |
|
3.3. |
embryo’s van verschillende donordieren, in geval van winning bij afzonderlijke dieren, of van verschillende groepsgewijze winningen, mogen niet tezamen worden gewassen; |
|
3.4. |
embryo’s van verschillende donordieren, in geval van winning bij afzonderlijke dieren, of van verschillende groepsgewijze winningen, mogen niet in hetzelfde rietje of dezelfde ampul of andere verpakking worden opgeslagen. |
4. Behandeling van gemicromanipuleerde embryo’s
Voordat een micromanipulatie wordt uitgevoerd waarbij de integriteit van de zona pellucida wordt aangetast, moeten alle embryo’s en eicellen worden gewonnen en behandeld overeenkomstig de in de punten 1, 2 en 3 opgenomen sanitaire voorschriften. Bovendien gelden de volgende voorschriften:
|
4.1. |
wanneer micromanipulatie van het embryo vereist is waarbij de zona pellucida wordt doorgeprikt, moet dit in geschikte laboratoriumvoorzieningen onder toezicht van een erkende teamdierenarts worden uitgevoerd; |
|
4.2. |
elk embryoteam houdt een administratie van zijn werkzaamheden bij overeenkomstig punt 1.14, waarin nadere gegevens worden opgenomen over de op de embryo’s uitgevoerde micromanipulatietechnieken waarbij de zona pellucida wordt doorgeprikt. Wanneer de embryo’s door in-vitrofertilisatie verkregen zijn, kan identificatie van de embryo’s plaatsvinden voor de partij als geheel, maar daarbij moeten de gegevens worden opgenomen over de datum waarop en de plaats waar de eierstokken en/of eicellen zijn gewonnen. Ook moet kunnen worden bepaald van welk bedrijf de donordieren afkomstig zijn. |
5. Opslag van embryo’s
|
5.1. |
Elk embryoteam en elk embryoproductieteam zorgt ervoor dat de embryo’s bij een geschikte temperatuur worden opgeslagen in opslagruimten als bedoeld in hoofdstuk I, deel III, punt 1.8. |
|
5.2. |
Bevroren embryo’s moeten vóór de verzending ten minste gedurende de laatste 30 dagen vanaf de datum van winning of productie worden opgeslagen onder goedgekeurde omstandigheden. |
6. Vervoer van embryo’s
|
6.1. |
Embryo’s die voor de handel bestemd zijn, moeten naar de lidstaat van bestemming worden vervoerd in recipiënten die vóór gebruik zijn gereinigd en ontsmet of gesteriliseerd, of voor eenmalig gebruik bestemd zijn, en die vóór verzending uit de erkende opslagruimte zijn verzegeld en genummerd. |
|
6.2. |
De rietjes, ampullen of andere verpakkingen moeten zodanig gemerkt zijn dat het nummer op de rietjes, ampullen of andere verpakkingen overeenkomt met het nummer op het in artikel 11, lid 3, derde streepje, bedoelde gezondheidscertificaat en met de recipiënt waarin zij worden opgeslagen en vervoerd. |
HOOFDSTUK IV
Eisen voor vrouwelijke donordieren
1. Voor het winnen van embryo’s of eicellen mogen alleen vrouwelijke donordieren worden gebruikt waarvoor de officiële dierenarts heeft vastgesteld dat zij en de bedrijven waarvan zij afkomstig zijn, voldoen aan de eisen van de richtlijnen inzake het handelsverkeer binnen de Unie in levende fok- en gebruiksdieren van de betrokken soort.
2. Naast de voorschriften van Richtlijn 64/432/EEG moeten donorzeugen, met uitzondering van in vivo verkregen embryo’s die een trypsinebehandeling hebben ondergaan, voldoen aan de overeenkomstig artikel 9 of artikel 10 van die richtlijn vastgesteld voorschriften met betrekking tot de ziekte van Aujeszky.
3. De bepalingen van Richtlijn 91/68/EEG zijn van toepassing op donorooien en donorgeiten.
4. Naast de voorschriften van Richtlijn 90/426/EEG geldt voor donormerries:
|
4.1. |
zij mogen gedurende ten minste 30 dagen vóór de eerste winning van eicellen of embryo’s en tussen de datum van de eerste monsterneming als bedoeld in de punten 4.2 en 4.3 en de datum van de winning van de eicellen en embryo’s niet natuurlijk zijn gedekt; |
|
4.2. |
zij moeten met negatief resultaat een agargel-immunodiffusietest (Cogginstest) of een Elisa voor het opsporen van infectieuze anemie bij paardachtigen ondergaan, uitgevoerd op bloedmonsters die voor het eerst in de laatste 30 dagen voor de datum van de eerste winning van eicellen of embryo’s en vervolgens tijdens de winningsperiode elke 90 dagen worden genomen; |
|
4.3. |
zij moeten een test op besmettelijke baarmoederontsteking bij paarden ondergaan door isolatie van Taylorella equigenitalis, uitgevoerd op monsters die gedurende twee opeenvolgende bronstperiode van de slijmvliesoppervlakken van de fossa clitoralis en de clitorale sinussen zijn genomen, alsmede een in een van de bronstperioden genomen kweekmonster van de endometriale cervix, waarbij alle tests na een kweek van 7 tot 14 dagen negatief moeten zijn.” |
(1) PB L 224 van 18.8.1990, blz. 62.
(2) PB L 311 van 28.11.2001, blz. 1.
(3) Manual of the International Embryo Transfer Society — A procedural guide and general information for the use of embryo transfer technology emphasising sanitary procedures, published by the International Embryo Transfer Society 1111 North Dunlap Avenue, Savoy, Illinois 61874 Verenigde Staten van Amerika (http://www.iets.org/).
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/28 |
VERORDENING (EU) Nr. 177/2010 VAN DE COMMISSIE
van 2 maart 2010
tot wijziging van Verordening (EEG) nr. 2454/93 houdende vaststelling van enkele bepalingen ter uitvoering van Verordening (EEG) nr. 2913/92 van de Raad tot vaststelling van het communautair douanewetboek
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Verordening (EEG) nr. 2913/92 van de Raad van 12 oktober 1992 tot vaststelling van het communautair douanewetboek (1), en met name op artikel 247,
Overwegende hetgeen volgt:
|
(1) |
Ter wille van de duidelijkheid is het wenselijk, de structuur te wijzigen van artikel 313 van Verordening (EEG) nr. 2454/93 van de Commissie (2) dat bepaalt in welke gevallen goederen worden geacht communautaire status te hebben. |
|
(2) |
Voor het instellen van de Europese maritieme ruimte zonder grenzen, zoals bedoeld in de mededeling en het actieplan van de Commissie betreffende de instelling van een Europese maritieme ruimte zonder grenzen (3), moeten de werkzaamheden van zowel de marktdeelnemers als van de douane worden vereenvoudigd met betrekking tot goederen die over zee worden vervoerd tussen havens die in het douanegebied van de Gemeenschap zijn gelegen. |
|
(3) |
In het bijzonder moet in een procedure worden voorzien voor het verlenen van vergunningen voor lijndiensten en voor de registratie van de vaartuigen die gebruikmaken van het elektronische informatie- en communicatiesysteem voor de afgifte van AEO-certificaten, zoals bedoeld in artikel 14 quinvicies van Verordening (EEG) nr. 2454/93. |
|
(4) |
Ter beperking van het gebruik van papieren documenten, dient de overlegging van een afdruk van het gegevensuitwisselingsmanifest bedoeld in artikel 324 sexies van Verordening (EEG) nr. 2454/93 niet te worden verlangd, wanneer de douaneautoriteiten toegang hebben tot het elektronische informatie- en communicatiesysteem dat dit manifest bevat. |
|
(5) |
Artikel 324 quater, lid 1, moet worden gewijzigd om hierin de juiste verwijzing in aan te brengen naar de bewaring van stempels. De onjuiste verwijzingen naar bijlage 37 quater bij Verordening (EEG) nr. 2454/93 die zijn opgenomen in de gegevens voor de aangifte douanevervoer in bijlage 37 bis bij die verordening, zoals gewijzigd bij Verordening (EG) nr. 1192/2008 (4), moeten worden gewijzigd. |
|
(6) |
Verordening (EEG) nr. 2454/93 moet derhalve dienovereenkomstig worden gewijzigd. |
|
(7) |
Ter bescherming van de legitieme verwachtingen van de marktdeelnemers moeten de vergunningen voor lijndiensten die zijn verleend vóór de toepassingsdatum van deze verordening worden aangemerkt als vergunningen die overeenkomstig deze verordening zijn afgegeven. Om ervoor te zorgen, dat alle vergunningen toegankelijk zijn in het zelfde elektronische systeem, moeten de eerdere vergunningen worden opgeslagen in het elektronische informatie- en communicatiesysteem voor de afgifte van AEO-certificaten. |
|
(8) |
De lidstaten en de douaneautoriteiten moet voldoende tijd worden gegeven om een volledig functioneel informatie- en communicatiesysteem op te zetten. |
|
(9) |
Daar de bepalingen betreffende de gegevens voor de aangifte douanevervoer in bijlage 37 bis bij Verordening (EEG) nr. 2454/93, zoals gewijzigd bij Verordening (EG) nr. 1192/2008, vanaf 1 juli 2008 van toepassing zijn, moeten de wijzigingen van die bepalingen eveneens vanaf die datum van toepassing zijn. |
|
(10) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Comité douanewetboek, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Verordening (EEG) nr. 2454/93 wordt als volgt gewijzigd:
|
1) |
Artikel 313 komt als volgt te luiden: „Artikel 313 1. Onverminderd artikel 180 van het wetboek en de in lid 2 van het onderhavige artikel genoemde uitzonderingen, worden alle goederen die zich in het douanegebied van de Gemeenschap bevinden geacht communautaire goederen te zijn, tenzij wordt vastgesteld dat zij de communautaire status niet hebben. 2. De volgende goederen worden niet geacht communautaire goederen te zijn, tenzij de communautaire status overeenkomstig de artikelen 314 tot en met 323 wordt aangetoond:
3. In afwijking van lid 2, onder a), worden de volgende goederen die in het douanegebied van de Gemeenschap zijn binnengebracht als communautaire goederen beschouwd, tenzij wordt vastgesteld dat zij de communautaire status niet hebben:
|
|
2) |
De artikelen 313 bis en 313 ter komen als volgt te luiden: „Artikel 313 bis Onder „lijndienst” wordt verstaan een dienst in het kader waarvan vaartuigen goederen vervoeren tussen uitsluitend in het douanegebied van de Gemeenschap gelegen havens. Deze vaartuigen mogen geen havens buiten het douanegebied van de Gemeenschap aandoen, noch een vrije zone van controletype I in de zin van artikel 799 in een zich in het douanegebied van de Gemeenschap gelegen haven. Artikel 313 ter 1. Een scheepvaartmaatschappij kan een vergunning worden verleend, een lijndienst te onderhouden na hiervoor een aanvraag te hebben ingediend bij de douaneautoriteiten van de lidstaat op het grondgebied waarvan die maatschappij is gevestigd of, bij het ontbreken daarvan, een regionaal kantoor heeft, mits aan de voorwaarden van dit artikel en van artikel 313 quater is voldaan. 2. Een vergunning wordt slechts aan scheepvaartmaatschappijen verleend die:
3. In de aanvraag voor een vergunning voor een lijndienst worden de lidstaten vermeld die bij die lijndienst zijn betrokken. De douaneautoriteiten van de lidstaat waarbij de aanvraag is ingediend (de vergunning verlenende douaneautoriteit) doet kennisgeving aan de douaneautoriteiten van de andere bij de lijndienst betrokken lidstaten (de betrokken douaneautoriteiten) door middel van het in artikel 14 quinvicies bedoelde elektronische informatie- en communicatiesysteem. Onverminderd lid 4, kunnen de betrokken douaneautoriteiten, binnen 45 dagen na ontvangst van deze kennisgeving, de aanvraag afwijzen, indien niet is voldaan aan de voorwaarde van lid 2, onder b), en de afwijzing mededelen door middel van het in artikel 14 quinvicies bedoelde elektronische informatie- en communicatiesysteem. De betrokken douaneautoriteit deelt de redenen van de afwijzing en de wettelijke bepalingen betreffende de gepleegde inbreuken mede. In dat geval geeft de vergunning verlenende douaneautoriteit de vergunning niet af en deelt zij de aanvrager, onder opgave van redenen, de afwijzing van de aanvraag mede. Indien geen antwoord of afwijzing van de betrokken douaneautoriteiten wordt ontvangen, geeft de vergunning verlenende douaneautoriteit, na te hebben onderzocht, of aan de vergunningvoorwaarden is voldaan, een vergunning af die door de andere bij de lijndienst betrokken lidstaten wordt aanvaard. Het in artikel 14 quinvicies bedoelde informatie- en communicatiesysteem wordt gebruikt voor de opslag van de vergunning en voor de mededeling aan de betrokken douaneautoriteiten dat de vergunning is verleend. 4. Wanneer de scheepvaartmaatschappij houder is van een AEO-certificaat als bedoeld in artikel 14 bis, lid 1, onder a) of c), wordt geacht te zijn voldaan aan de eisen van lid 2, onder a) en b), van het onderhavige artikel en de eisen bedoeld in lid 3 van het onderhavige artikel.”. |
|
3) |
De volgende artikelen 313 quater tot en met 313 septies worden ingevoegd: „Artikel 313 quarter 1. Nadat vergunning voor een lijndienst overeenkomstig artikel 313 ter is verleend, moet de betrokken scheepvaartmaatschappij deze gebruiken voor de vaartuigen die voor dat doel zijn geregistreerd. 2. De scheepvaartmaatschappij stelt de vergunning verlenende douaneautoriteit in kennis van alle omstandigheden die zich na het verlenen van de vergunning voordoen en die de voortzetting of de inhoud van de vergunning kunnen beïnvloeden. Wanneer een vergunning door de vergunning verlenende douaneautoriteit of op verzoek van de scheepvaartmaatschappij wordt ingetrokken, deelt de vergunning verlenende douaneautoriteit dit mede aan de betrokken douaneautoriteiten met behulp van het in artikel 14 quinvicies bedoelde elektronische informatie- en communicatiesysteem. 3. De in artikel 313 ter, lid 3, vastgestelde procedure is van toepassing wanneer de vergunning moet worden gewijzigd om deze van toepassing te doen zijn op lidstaten die niet waren genoemd in de oorspronkelijke of een vorige vergunning. Artikel 313 ter, lid 4, is van overeenkomstige toepassing. Artikel 313 quinquies 1. De scheepvaartmaatschappij die vergunning heeft voor het onderhouden van een lijndienst deelt de vergunning verlenende douaneautoriteit het volgende mede:
2. De overeenkomstig lid 1 meegedeelde inlichtingen worden door de vergunning verlenende douaneautoriteit binnen de temijn van een werkdag na de dag van ontvangst van de mededeling geregistreerd met behulp van het in artikel 14 quinvicies bedoelde elektronische informatie- en communicatiesysteem. Het systeem is toegankelijk voor de douaneautoriteiten die werkzaam zijn in binnen het douanegebied van de Gemeenschap gelegen havens. De registratie wordt van kracht op de eerste werkdag volgende op die van de registratie. Artikel 313 sexies Wanneer een voor een lijndienst geregistreerd vaartuig door toeval of overmacht wordt genoopt goederen op zee over te laden of een haven aan te doen die geen deel uitmaakt van de lijndienst, met inbegrip van havens buiten het douanegebied van de Gemeenschap of een vrije zone van controletype I in een haven in het douanegebied van de Gemeenschap, deelt de scheepvaartmaatschappij dit onverwijld mede aan de douaneautoriteiten van de volgende havens in de Gemeenschap die worden aangedaan, waaronder de havens die op de normale route van de lijndienst liggen. In deze havens geladen of geloste goederen worden niet geacht communautaire goederen te zjn. Artikel 313 septies 1. De douaneautoriteiten mogen van de scheepvaartmaatschappij verlangen, dat deze haar het bewijs levert dat de artikelen 313 ter tot en met 313 sexies zijn nagekomen. 2. Wanneer de douaneautoriteiten vaststellen, dat de scheepvaartmaatschappij de in lid 1 bedoelde bepalingen niet is nagekomen, deelt zij dit onverwijld aan alle bij de lijndienst betrokken douaneautoriteiten mede, met behulp van het in artikel 14 quinvicies bedoelde elektronische informatie- en communicatiesysteem, zodat deze autoriteiten de nodige maatregelen kunnen nemen.”. |
|
4) |
In artikel 324 quater, lid 1, komt de tweede alinea als volgt te luiden: „Punt 27 van bijlage 37 quinquies is van overeenkomstige toepassing.”. |
|
5) |
In artikel 324 sexies, lid 4, komen de punten c) en d) als volgt te luiden:
|
|
6) |
In bijlage 37 bis, titel II, punt B „Gegevens EDI-aangifte douanevervoer”, wordt gegevensgroep „COLLI” als volgt gewijzigd:
|
||||||||||||||||
Artikel 2
Vergunningen voor een lijndienst die zijn afgegeven vóór de in artikel 3, tweede alinea, van deze verordening genoemde toepassingsdatum worden geacht vergunningen te zijn die zijn afgegeven overeenkomstig Verordening (EEG) nr. 2454/93, zoals gewijzigd bij de onderhavige verordening.
De vergunning verlenende douaneautoriteit slaat deze vergunningen binnen een maand na de in artikel 3, tweede alinea, van deze verordening genoemde toepassingsdatum op in het in artikel 14 quinvicies van Verordening (EEG) nr. 2454/93 bedoelde informatie- en communicatiesysteem.
Artikel 3
Deze verordening treedt in werking op de zevende dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Artikel 1, punten 2) en 3), is van toepassing vanaf 1 januari 2012.
Artikel 1, punten 4) en 6), is van toepassing vanaf 1 juli 2008.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie
De voorzitter
José Manuel BARROSO
(1) PB L 302 van 19.10.1992, blz. 1.
(2) PB L 253 van 11.10.1993, blz. 1.
(3) COM(2009) 10 definitief.
(4) PB L 329 van 6.12.2008, blz. 1.
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/32 |
VERORDENING (EU) Nr. 178/2010 VAN DE COMMISSIE
van 2 maart 2010
tot wijziging van Verordening (EG) nr. 401/2006 wat betreft aardnoten (pinda’s), andere oliehoudende zaden, noten, abrikozenpitten, zoethout en plantaardige olie
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Verordening (EG) nr. 882/2004 van het Europees Parlement en de Raad van 29 april 2004 inzake officiële controles op de naleving van de wetgeving inzake diervoeders en levensmiddelen en de voorschriften inzake diergezondheid en dierenwelzijn (1), en met name op artikel 11, lid 4,
Overwegende hetgeen volgt:
|
(1) |
Verordening (EG) nr. 1881/2006 van de Commissie van 19 december 2006 tot vaststelling van maximumgehalten aan bepaalde verontreinigingen in levensmiddelen (2) stelt maximumgehalten voor bepaalde mycotoxinen in bepaalde levensmiddelen vast. |
|
(2) |
Bemonstering is zeer belangrijk om de gehalten aan mycotoxinen, die meestal zeer ongelijkmatig over de partij verdeeld zijn, op betrouwbare wijze te kunnen bepalen. Daarom moeten voor de bemonsteringswijze algemene criteria worden vastgesteld. |
|
(3) |
Verordening (EG) nr. 401/2006 van de Commissie van 23 februari 2006 tot vaststelling van bemonsteringswijzen en analysemethoden voor de officiële controle op het mycotoxinegehalte in levensmiddelen (3) stelt de criteria voor de bemonstering voor de controle op de mycotoxinegehalten vast. |
|
(4) |
Sommige bepalingen betreffende de bemonstering op aflatoxinen in bepaalde levensmiddelen moeten worden gewijzigd om rekening te houden met ontwikkelingen in de Codex Alimentarius en met recentelijk voor nieuwe categorieën levensmiddelen vastgestelde maximumgehalten aan mycotoxinen. |
|
(5) |
In de Codex Alimentarius is een nieuwe bemonsteringswijze vastgesteld voor aardnoten (pinda’s), amandelen, hazelnoten en pistaches die voor verdere verwerking bestemd zijn, en een nieuwe bemonsteringswijze voor consumptiegerede amandelen, hazelnoten en pistaches (4). |
|
(6) |
Om de handhaving van de maximumgehalten aan aflatoxinen te vergemakkelijken, is het passend de bemonsteringsvoorschriften van de Codex Alimentarius voor pinda’s, amandelen, hazelnoten en pistaches die voor verdere verwerking bestemd zijn, ook toe te passen op andere noten die voor verdere verwerking bestemd zijn, en de bemonsteringsvoorschriften van de Codex Alimentarius voor consumptiegerede amandelen, hazelnoten en pistaches ook toe te passen op andere consumptiegerede noten en aardnoten (pinda’s). De bemonsteringsprocedure voor noten moet ook op abrikozenpitten worden toegepast. Punt D van bijlage I bij Verordening (EG) nr. 401/2006 moet daarom dienovereenkomstig worden gewijzigd zodat het uitsluitend betrekking heeft op de bemonsteringsprocedure voor gedroogde vijgen, die ongewijzigd moet blijven; de nieuwe bemonsteringsprocedure voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten moet in een afzonderlijk punt van de bijlage worden ondergebracht. |
|
(7) |
Er zijn maximumgehalten vastgesteld voor aflatoxinen in andere oliehoudende zaden dan aardnoten (pinda’s) (5) en voor ochratoxine A in specerijen, zoethoutwortel en zoethoutextract (6). Het is passend te voorzien in specifieke bemonsteringsvoorschriften voor deze nieuwe categorieën levensmiddelen en waar nodig te verwijzen naar bestaande voorschriften. |
|
(8) |
De bemonstering van plantaardige oliën voor de controle op mycotoxinen heeft specifieke kenmerken en daarom moeten specifieke bemonsteringsvoorschriften worden vastgesteld. |
|
(9) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Bijlage I bij Verordening (EG) nr. 401/2006 wordt als volgt gewijzigd:
|
1) |
Punt D wordt vervangen door de tekst in bijlage I bij deze verordening. |
|
2) |
In punt E wordt de eerste zin vervangen door: „Deze bemonsteringswijze geldt voor de officiële controle op de maximumgehalten aan ochratoxine A, aflatoxine B1 en aflatoxinen totaal in specerijen.”. |
|
3) |
Punt G wordt vervangen door de tekst in bijlage II bij deze verordening. |
|
4) |
Er wordt een punt K, als opgenomen in bijlage III bij deze verordening, toegevoegd. |
Artikel 2
Deze verordening treedt in werking op de tiende dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Zij is van toepassing met ingang van de datum van inwerkingtreding.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie
De voorzitter
José Manuel BARROSO
(1) PB L 165 van 30.4.2004, blz. 1.
(2) PB L 364 van 20.12.2006, blz. 5.
(3) PB L 70 van 9.3.2006, blz. 12.
(4) Codex General Standard for Contaminants and toxins in foods (CODEX STAN 193-1995) http://www.codexalimentarius.net/download/standards/17/CXS_193e.pdf
(5) Verordening (EU) nr. 165/2010 van de Commissie van 26 februari 2010 tot wijziging van Verordening (EG) nr. 1881/2006 tot vaststelling van de maximumgehalten aan bepaalde verontreinigingen in levensmiddelen, wat betreft aflatoxinen (PB L 50 van 27.2.2010, blz. 8).
(6) Verordening (EU) nr. 105/2010 van de Commissie van 5 februari 2010 tot wijziging van Verordening (EG) nr. 1881/2006 tot vaststelling van de maximumgehalten aan bepaalde verontreinigingen in levensmiddelen, wat betreft ochratoxine A (PB L 35 van 6.2.2010, blz. 7).
BIJLAGE I
„D.1. Bemonsteringswijze voor gedroogde vijgen
Deze bemonsteringswijze geldt voor de officiële controle op de maximumgehalten aan aflatoxine B1 en aflatoxinen totaal in gedroogde vijgen.
D.1.1. Gewicht van het basismonster
Het basismonster weegt ongeveer 300 g, tenzij anders bepaald in dit punt D.1.
Bij partijen in detailverpakkingen hangt het gewicht van het basismonster af van het gewicht van de detailverpakking.
Indien de detailverpakking meer dan 300 g weegt, wordt een verzamelmonster van meer dan 30 kg samengesteld. Indien één detailverpakking veel meer dan 300 g weegt, wordt een basismonster van 300 g uit elke afzonderlijke detailverpakking genomen. Dit kan hetzij bij de bemonstering, hetzij in het laboratorium worden gedaan. Indien deze bemonsteringswijze onaanvaardbare economische schade aan de partij zou toebrengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast. Indien bijvoorbeeld een waardevol product in detailverpakkingen van 500 g of 1 kg wordt verkocht, mag het verzamelmonster worden verkregen door het samenvoegen van een kleiner aantal basismonsters dan aangegeven in de tabellen 1, 2 en 3, mits het verzamelmonster het vereiste gewicht heeft zoals aangegeven in de tabellen 1, 2 en 3.
Indien de detailverpakking iets minder dan 300 g weegt, wordt één detailverpakking als één basismonster beschouwd en wordt een verzamelmonster van minder dan 30 kg samengesteld. Indien de detailverpakking veel minder dan 300 g weegt, bestaat één basismonster uit twee of meer detailverpakkingen, zodat het de 300 g zo dicht mogelijk benadert.
D.1.2. Algemeen overzicht van de bemonsteringswijze voor gedroogde vijgen
Tabel 1
Verdeling van partijen in subpartijen naargelang van het product en het gewicht van de partij
|
Product |
Gewicht van de partij (ton) |
Gewicht van de subpartijen of aantal subpartijen |
Aantal basismonsters |
Gewicht van het verzamelmonster (kg) |
|
Gedroogde vijgen |
≥ 15 |
15-30 t |
100 |
30 |
|
< 15 |
— |
10-100 (1) |
≤ 30 |
D.1.3. Bemonsteringswijze voor gedroogde vijgen (partijen ≥ 15 t)
|
— |
Als de subpartijen fysiek van elkaar kunnen worden gescheiden, wordt elke partij in subpartijen verdeeld overeenkomstig tabel 1. Aangezien de partijen niet altijd een gewicht hebben dat een exact veelvoud is van het gewicht van de subpartijen, mag het gewicht van de subpartijen het aangegeven gewicht met maximaal 20 % overschrijden. |
|
— |
Elke subpartij wordt afzonderlijk bemonsterd. |
|
— |
Aantal basismonsters: 100. |
|
— |
Gewicht van het verzamelmonster: 30 kg. Dit door grof mengen verkregen monster wordt in drie gelijke laboratoriummonsters van 10 kg verdeeld vóór het wordt vermalen (het monster hoeft niet te worden verdeeld als het bestaat uit gedroogde vijgen die later worden gesorteerd of een andere fysische behandeling ondergaan en als de nodige apparatuur beschikbaar is om een monster van 30 kg te homogeniseren). |
|
— |
Elk laboratoriummonster van 10 kg wordt afzonderlijk fijngemalen en grondig gemengd, zodat het product volledig homogeen wordt, overeenkomstig bijlage II. |
|
— |
Indien de bovengenoemde bemonsteringswijze niet kan worden toegepast zonder onaanvaardbare economische schade aan de partij toe te brengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast, mits die zo representatief mogelijk is, nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. |
D.1.4. Bemonsteringswijze voor gedroogde vijgen (partijen < 15 t)
Er worden minimaal 10 en maximaal 100 basismonsters genomen, naargelang van het gewicht van de partij.
Aan de hand van onderstaande tabel 2 kan worden bepaald hoeveel basismonsters moeten worden genomen en hoe het verzamelmonster moet worden verdeeld.
Tabel 2
Aantal basismonsters naargelang van het gewicht van de partij en aantal onderverdelingen van het verzamelmonster
|
Gewicht van de partij (ton) |
Aantal basismonsters |
Gewicht van het verzamelmonster (kg) (in geval van detailverpakkingen kan het gewicht van het verzamelmonster variëren, zie punt D.1.1) |
Aantal laboratoriummonsters uit het verzamelmonster |
|
≤ 0,1 |
10 |
3 |
1 (geen verdeling) |
|
> 0,1 - ≤ 0,2 |
15 |
4,5 |
1 (geen verdeling) |
|
> 0,2 - ≤ 0,5 |
20 |
6 |
1 (geen verdeling) |
|
> 0,5 - ≤ 1,0 |
30 |
9 (- < 12 kg) |
1 (geen verdeling) |
|
> 1,0 - ≤ 2,0 |
40 |
12 |
2 |
|
> 2,0 - ≤ 5,0 |
60 |
18 (- < 24 kg) |
2 |
|
> 5,0 - ≤ 10,0 |
80 |
24 |
3 |
|
> 10,0 - ≤ 15,0 |
100 |
30 |
3 |
|
— |
Gewicht van het verzamelmonster: ≤ 30 kg. Dit door grof mengen verkregen monster wordt in twee of drie gelijke laboratoriummonsters van ≤ 10 kg verdeeld vóór het wordt vermalen (het monster hoeft niet te worden verdeeld als het bestaat uit gedroogde vijgen die later worden gesorteerd of een andere fysische behandeling ondergaan en als de nodige apparatuur beschikbaar is om een monster van 30 kg te homogeniseren). Indien het verzamelmonster minder dan 30 kg weegt, wordt het verzamelmonster als volgt in laboratoriummonsters verdeeld:
|
|
— |
Elk laboratoriummonster wordt afzonderlijk fijngemalen en grondig gemengd, zodat het product volledig homogeen wordt, overeenkomstig bijlage II. |
|
— |
Indien de bovengenoemde bemonsteringswijze niet kan worden toegepast zonder onaanvaardbare economische schade aan de partij toe te brengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast, mits die zo representatief mogelijk is, nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. |
D.1.5. Bemonsteringswijze voor afgeleide producten en samengestelde levensmiddelen
D.1.5.1.
|
— |
Aantal basismonsters: 100; bij partijen van minder dan 50 t worden 10 à 100 basismonsters genomen, naargelang van het gewicht van de partij (zie tabel 3). Tabel 3 Aantal basismonsters naargelang van het gewicht van de partij
|
|
— |
Het basismonster weegt ongeveer 100 g. Bij partijen in detailverpakkingen hangt het gewicht van het basismonster af van het gewicht van de detailverpakking. |
|
— |
Gewicht van het verzamelmonster = 1 à 10 kg, voldoende gemengd. |
D.1.5.2.
Bemonsteringswijze en aanvaarding zoals voor gedroogde vijgen (D.1.3 en D.1.4).
D.1.6. Bemonstering in de detailhandel
De bemonstering in de detailhandel wordt zo mogelijk verricht overeenkomstig de voorschriften in dit punt K.
Indien dit niet mogelijk is, mogen ander effectieve bemonsteringswijzen worden toegepast, mits het verzamelmonster voldoende representatief is voor de bemonsterde partij en de bemonsteringswijze nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. In ieder geval weegt het verzamelmonster ten minste 1 kg (2).
D.1.7. Specifieke bemonsteringswijze voor gedroogde vijgen en afgeleide producten die vacuümverpakt worden verkocht
D.1.7.1.
Van partijen groter dan of gelijk aan 15 t worden ten minste 50 basismonsters genomen, waarmee een verzamelmonster van 30 kg wordt samengesteld. Van partijen van minder dan 15 t wordt 50 % van het in tabel 2 aangegeven aantal basismonsters genomen, waarmee een verzamelmonster wordt samengesteld waarvan het gewicht in verhouding staat tot het gewicht van de bemonsterde partij (zie tabel 2).
D.1.7.2.
Van partijen groter dan of gelijk aan 50 t worden ten minste 25 basismonsters genomen, waarmee een verzamelmonster van 10 kg wordt samengesteld. Van partijen van minder dan 50 t wordt 25 % van het in tabel 3 aangegeven aantal basismonsters genomen, waarmee een verzamelmonster wordt samengesteld waarvan het gewicht in verhouding staat tot het gewicht van de bemonsterde partij (zie tabel 3).
D.1.8. Aanvaarding van een partij of een subpartij
Voor gedroogde vijgen die later worden gesorteerd of een andere fysische behandeling ondergaan:
|
— |
aanvaarding als het verzamelmonster of het gemiddelde van de laboratoriummonsters het maximumgehalte niet overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als het verzamelmonster of het gemiddelde van de laboratoriummonsters het maximumgehalte buiten redelijke twijfel overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
Voor gedroogde vijgen bestemd voor rechtstreekse menselijke consumptie:
|
— |
aanvaarding als geen van de laboratoriummonsters het maximumgehalte overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als één of meer van de laboratoriummonsters het maximumgehalte buiten redelijke twijfel overschrijden, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
Indien het verzamelmonster 12 kg of minder weegt:
|
— |
aanvaarding als het laboratoriummonster het maximumgehalte niet overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als het laboratoriummonster het maximumgehalte buiten redelijke twijfel overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
D.2. Bemonsteringswijze voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten
Deze bemonsteringswijze geldt voor de officiële controle op de maximumgehalten aan aflatoxine B1 en aflatoxinen totaal in aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten.
D.2.1. Gewicht van het basismonster
Het basismonster weegt ongeveer 200 g, tenzij anders bepaald in dit punt D.2.
Bij partijen in detailverpakkingen hangt het gewicht van het basismonster af van het gewicht van de detailverpakking.
Indien de detailverpakking meer dan 200 g weegt, wordt een verzamelmonster van meer dan 20 kg samengesteld. Indien één detailverpakking veel meer dan 200 g weegt, wordt een basismonster van 200 g uit elke afzonderlijke detailverpakking genomen. Dit kan hetzij bij de bemonstering, hetzij in het laboratorium worden gedaan. Indien deze bemonsteringswijze onaanvaardbare economische schade aan de partij zou toebrengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast. Indien bijvoorbeeld een waardevol product in detailverpakkingen van 500 g of 1 kg wordt verkocht, mag het verzamelmonster worden verkregen door het samenvoegen van een kleiner aantal basismonsters dan aangegeven in de tabellen 1, 2 en 3, mits het verzamelmonster het vereiste gewicht heeft zoals aangegeven in de tabellen 1, 2 en 3.
Indien de detailverpakking iets minder dan 200 g weegt, wordt één detailverpakking als één basismonster beschouwd en wordt een verzamelmonster van minder dan 20 kg samengesteld. Indien de detailverpakking veel minder dan 200 g weegt, bestaat één basismonster uit twee of meer detailverpakkingen, zodat het de 200 g zo dicht mogelijk benadert.
D.2.2. Algemeen overzicht van de bemonsteringswijze voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten
Tabel 1
Verdeling van partijen in subpartijen naargelang van het product en het gewicht van de partij
|
Product |
Gewicht van de partij (ton) |
Gewicht van de subpartijen of aantal subpartijen |
Aantal basismonsters |
Gewicht van het verzamelmonster (kg) |
|
Aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten |
≥ 500 |
100 t |
100 |
20 |
|
> 125 en < 500 |
5 subpartijen |
100 |
20 |
|
|
≥ 15 en ≤ 125 |
25 t |
100 |
20 |
|
|
< 15 |
— |
10-100 (3) |
≤ 20 |
D.2.3. Bemonsteringswijze voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten (partijen ≥ 15 t)
|
— |
Als de subpartijen fysiek van elkaar kunnen worden gescheiden, wordt elke partij in subpartijen verdeeld overeenkomstig tabel 1. Aangezien de partijen niet altijd een gewicht hebben dat een exact veelvoud is van het gewicht van de subpartijen, mag het gewicht van de subpartijen het aangegeven gewicht met maximaal 20 % overschrijden. |
|
— |
Elke subpartij wordt afzonderlijk bemonsterd. |
|
— |
Aantal basismonsters: 100. |
|
— |
Gewicht van het verzamelmonster: 20 kg. Dit door grof mengen verkregen monster wordt in twee gelijke laboratoriummonsters van 10 kg verdeeld vóór het wordt vermalen (het monster hoeft niet te worden verdeeld als het bestaat uit aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten of noten die later worden gesorteerd of een andere fysische behandeling ondergaan en als de nodige apparatuur beschikbaar is om een monster van 20 kg te homogeniseren). |
|
— |
Elk laboratoriummonster van 10 kg wordt afzonderlijk fijngemalen en grondig gemengd, zodat het product volledig homogeen wordt, overeenkomstig bijlage II. |
|
— |
Indien de bovengenoemde bemonsteringswijze niet kan worden toegepast zonder economische schade aan de partij toe te brengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast, mits die zo representatief mogelijk is, nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. |
D.2.4. Bemonsteringswijze voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten (partijen < 15 t)
Er worden minimaal 10 en maximaal 100 basismonsters genomen, naargelang van het gewicht van de partij.
Aan de hand van onderstaande tabel 2 kan worden bepaald hoeveel basismonsters moeten worden genomen en hoe het verzamelmonster moet worden verdeeld.
Tabel 2
Aantal basismonsters naargelang van het gewicht van de partij en aantal onderverdelingen van het verzamelmonster
|
Gewicht van de partij (ton) |
Aantal basismonsters |
Gewicht van het verzamelmonster (kg) (in geval van detailverpakkingen kan het gewicht van het verzamelmonster variëren, zie punt D.2.1) |
Aantal laboratoriummonsters uit het verzamelmonster |
|
≤ 0,1 |
10 |
2 |
1 (geen verdeling) |
|
> 0,1 - ≤ 0,2 |
15 |
3 |
1 (geen verdeling) |
|
> 0,2 - ≤ 0,5 |
20 |
4 |
1 (geen verdeling) |
|
> 0,5 - ≤ 1,0 |
30 |
6 |
1 (geen verdeling) |
|
> 1,0 - ≤ 2,0 |
40 |
8 (- < 12 kg) |
1 (geen verdeling) |
|
> 2,0 - ≤ 5,0 |
60 |
12 |
2 |
|
> 5,0 - ≤ 10,0 |
80 |
16 |
2 |
|
> 10,0 - ≤ 15,0 |
100 |
20 |
2 |
|
— |
Gewicht van het verzamelmonster: ≤ 20 kg. Dit door grof mengen verkregen monster wordt indien nodig in twee gelijke laboratoriummonsters van ≤ 10 kg verdeeld vóór het wordt vermalen (het monster hoeft niet te worden verdeeld als het bestaat uit aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten of noten die later worden gesorteerd of een andere fysische behandeling ondergaan en als de nodige apparatuur beschikbaar is om monsters van maximaal 20 kg te homogeniseren). Indien het verzamelmonster minder dan 20 kg weegt, wordt het verzamelmonster als volgt in laboratoriummonsters verdeeld:
|
|
— |
Elk laboratoriummonster wordt afzonderlijk fijngemalen en grondig gemengd, zodat het product volledig homogeen wordt, overeenkomstig bijlage II. |
|
— |
Indien de bovengenoemde bemonsteringswijze niet kan worden toegepast zonder onaanvaardbare economische schade aan de partij toe te brengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast, mits die zo representatief mogelijk is, nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. |
D.2.5. Bemonsteringswijze voor afgeleide producten, met uitzondering van plantaardige olie, en samengestelde levensmiddelen
D.2.5.1.
|
— |
Aantal basismonsters: 100; bij partijen van minder dan 50 t worden 10 à 100 basismonsters genomen, naargelang van het gewicht van de partij (zie tabel 3). Tabel 3 Aantal basismonsters naargelang van het gewicht van de partij
|
|
— |
Het basismonster weegt ongeveer 100 g. Bij partijen in detailverpakkingen hangt het gewicht van het basismonster af van het gewicht van de detailverpakking. |
|
— |
Gewicht van het verzamelmonster = 1 à 10 kg, voldoende gemengd. |
D.2.5.2.
Bemonsteringswijze en aanvaarding zoals voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten (D.2.3 en D.2.4).
D.2.6. Bemonstering in de detailhandel
De bemonstering in de detailhandel wordt zo mogelijk verricht overeenkomstig de voorschriften in dit punt K.
Indien dit niet mogelijk is, mogen ander effectieve bemonsteringswijzen worden toegepast, mits het verzamelmonster voldoende representatief is voor de bemonsterde partij en de bemonsteringswijze nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. In ieder geval weegt het verzamelmonster ten minste 1 kg (2).
D.2.7. Specifieke bemonsteringswijze voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten, noten en afgeleide producten die vacuümverpakt worden verkocht
D.2.7.1.
Van partijen groter dan of gelijk aan 15 t worden ten minste 50 basismonsters genomen, waarmee een verzamelmonster van 20 kg wordt samengesteld. Van partijen van minder dan 15 t wordt 50 % van het in tabel 2 aangegeven aantal basismonsters genomen, waarmee een verzamelmonster wordt samengesteld waarvan het gewicht in verhouding staat tot het gewicht van de bemonsterde partij (zie tabel 2).
D.2.7.2.
Van partijen groter dan of gelijk aan 15 t worden ten minste 25 basismonsters genomen, waarmee een verzamelmonster van 20 kg wordt samengesteld. Van partijen van minder dan 15 t wordt 25 % van het in tabel 2 aangegeven aantal basismonsters genomen, waarmee een verzamelmonster wordt samengesteld waarvan het gewicht in verhouding staat tot het gewicht van de bemonsterde partij (zie tabel 2).
D.2.7.3.
Van partijen groter dan of gelijk aan 50 t worden ten minste 25 basismonsters genomen, waarmee een verzamelmonster van 10 kg wordt samengesteld. Van partijen van minder dan 50 t wordt 25 % van het in tabel 3 aangegeven aantal basismonsters genomen, waarmee een verzamelmonster wordt samengesteld waarvan het gewicht in verhouding staat tot het gewicht van de bemonsterde partij (zie tabel 3).
D.2.8. Aanvaarding van een partij of een subpartij
Voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten die later worden gesorteerd of een andere fysische behandeling ondergaan:
|
— |
aanvaarding als het verzamelmonster of het gemiddelde van de laboratoriummonsters het maximumgehalte niet overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als het verzamelmonster of het gemiddelde van de laboratoriummonsters het maximumgehalte buiten redelijke twijfel overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
Voor aardnoten (pinda’s), andere oliehoudende zaden, abrikozenpitten en noten bestemd voor rechtstreekse menselijke consumptie:
|
— |
aanvaarding als geen van de laboratoriummonsters het maximumgehalte overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als één of beide laboratoriummonsters het maximumgehalte buiten redelijke twijfel overschrijden, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
Indien het verzamelmonster 12 kg of minder weegt:
|
— |
aanvaarding als het laboratoriummonster het maximumgehalte niet overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als het laboratoriummonster het maximumgehalte buiten redelijke twijfel overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
(1) Afhankelijk van het gewicht van de partij — zie tabel 2 in dit punt D.1.
(2) Indien het te bemonsteren deel zo klein is dat geen verzamelmonster van 1 kg kan worden verkregen, mag het verzamelmonster minder dan 1 kg wegen.”
(3) Afhankelijk van het gewicht van de partij — zie tabel 2 in dit punt D.2.
BIJLAGE II
„G. BEMONSTERINGSWIJZE VOOR KOFFIE, KOFFIEPRODUCTEN, ZOETHOUTWORTEL EN ZOETHOUTEXTRACT
Deze bemonsteringswijze geldt voor de officiële controle op de maximumgehalten aan ochratoxine A in gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract.
G.1. Gewicht van het basismonster
Het basismonster weegt ongeveer 100 g, tenzij anders bepaald in dit punt G.
Bij partijen in detailverpakkingen hangt het gewicht van het basismonster af van het gewicht van de detailverpakking.
Indien de detailverpakking meer dan 100 g weegt, wordt een verzamelmonster van meer dan 10 kg samengesteld. Indien één detailverpakking veel meer dan 100 g weegt, wordt een basismonster van 100 g uit elke afzonderlijke detailverpakking genomen. Dit kan hetzij bij de bemonstering, hetzij in het laboratorium worden gedaan. Indien deze bemonsteringswijze onaanvaardbare economische schade aan de partij zou toebrengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast. Indien bijvoorbeeld een waardevol product in detailverpakkingen van 500 g of 1 kg wordt verkocht, mag het verzamelmonster worden verkregen door het samenvoegen van een kleiner aantal basismonsters dan aangegeven in de tabellen 1 en 2, mits het verzamelmonster het vereiste gewicht heeft zoals aangegeven in de tabellen 1 en 2.
Indien de detailverpakking iets minder dan 100 g weegt, wordt één detailverpakking als één basismonster beschouwd en wordt een verzamelmonster van minder dan 10 kg samengesteld. Indien de detailverpakking veel minder dan 100 g weegt, bestaat één basismonster uit twee of meer detailverpakkingen, zodat het de 100 g zo dicht mogelijk benadert.
G.2. Algemeen overzicht van de bemonsteringswijze voor gebrande koffie, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract
Tabel 1
Verdeling van partijen in subpartijen naargelang van het product en het gewicht van de partij
|
Product |
Gewicht van de partij (ton) |
Gewicht van de subpartijen of aantal subpartijen |
Aantal basismonsters |
Gewicht van het verzamelmonster (kg) |
|
Gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract |
≥ 15 |
15-30 t |
100 |
10 |
|
< 15 |
— |
10-100 (1) |
1-10 |
G.3. Bemonsteringswijze voor gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract (partijen ≥ 15 t)
|
— |
Als de subpartijen fysiek van elkaar kunnen worden gescheiden, wordt elke partij in subpartijen verdeeld overeenkomstig tabel 1. Aangezien de partijen niet altijd een gewicht hebben dat een exact veelvoud is van het gewicht van de subpartijen, mag het gewicht van de subpartijen ten hoogste 20 % verschillen van het aangegeven gewicht. |
|
— |
Elke subpartij wordt afzonderlijk bemonsterd. |
|
— |
Aantal basismonsters: 100. |
|
— |
Gewicht van het verzamelmonster = 10 kg. |
|
— |
Indien de bovengenoemde bemonsteringswijze niet kan worden toegepast zonder onaanvaardbare economische schade aan de partij toe te brengen (wegens de vorm van de verpakking, de vervoermiddelen enz.), mag een alternatieve bemonsteringswijze worden toegepast, mits die zo representatief mogelijk is, nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. |
G.4. Bemonsteringswijze voor gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract (partijen < 15 t)
Van partijen gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract van minder dan 15 t worden, afhankelijk van het gewicht van de partij, 10 à 100 basismonsters genomen, waarmee een verzamelmonster van 1 à 10 kg wordt samengesteld.
Aan de hand van de onderstaande tabel kan worden bepaald hoeveel basismonsters moeten worden genomen.
Tabel 2
Aantal te nemen basismonsters naargelang van het gewicht van de partij gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract
|
Gewicht van de partij (ton) |
Aantal basismonsters |
Gewicht van het verzamelmonster (kg) |
|
≤ 0,1 |
10 |
1 |
|
> 0,1 - ≤ 0,2 |
15 |
1,5 |
|
> 0,2 - ≤ 0,5 |
20 |
2 |
|
> 0,5 - ≤ 1,0 |
30 |
3 |
|
> 1,0 - ≤ 2,0 |
40 |
4 |
|
> 2,0 - ≤ 5,0 |
60 |
6 |
|
> 5,0 - ≤ 10,0 |
80 |
8 |
|
> 10,0 - ≤ 15,0 |
100 |
10 |
G.5. Bemonsteringswijze voor gebrande koffiebonen, gemalen gebrande koffie, oploskoffie, zoethoutwortel en zoethoutextract die vacuümverpakt worden verkocht
Van partijen groter dan of gelijk aan 15 t worden ten minste 25 basismonsters genomen, waarmee een verzamelmonster van 10 kg wordt samengesteld. Van partijen van minder dan 15 t wordt 25 % van het in tabel 2 aangegeven aantal basismonsters genomen, waarmee een verzamelmonster wordt samengesteld waarvan het gewicht in verhouding staat tot het gewicht van de bemonsterde partij (zie tabel 2).
G.6. Bemonstering in de detailhandel
De bemonstering in de detailhandel wordt zo mogelijk verricht overeenkomstig de bemonsteringsvoorschriften in dit punt G.
Indien dit niet mogelijk is, mag een alternatieve bemonsteringswijze worden toegepast, mits het verzamelmonster voldoende representatief is voor de bemonsterde partij en de bemonsteringswijze nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. In ieder geval weegt het verzamelmonster ten minste 1 kg (2).
G.7. Aanvaarding van een partij of een subpartij
|
— |
aanvaarding als het laboratoriummonster het maximumgehalte niet overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als het laboratoriummonster het maximumgehalte buiten redelijke twijfel overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
(1) Afhankelijk van het gewicht van de partij — zie tabel 2 in dit punt G.
(2) Indien het te bemonsteren deel zo klein is dat geen verzamelmonster van 1 kg kan worden verkregen, mag het verzamelmonster minder dan 1 kg wegen.”
BIJLAGE III
„K. BEMONSTERINGSWIJZE VOOR PLANTAARDIGE OLIËN
Deze bemonsteringswijze geldt voor de officiële controle op de maximumgehalten voor mycotoxinen, met name aflatoxine B1, aflatoxinen totaal en zearalenon, in plantaardige oliën.
K.1. Bemonsteringswijze voor plantaardige oliën
|
— |
Het basismonster weegt ten minste ongeveer 100 g (ml) (afhankelijk van de aard van de zending, bv. onverpakte plantaardige olie, moeten ten minste drie basismonsters van ongeveer 350 ml worden genomen) en er wordt een verzamelmonster van ten minste 1 kg (liter) samengesteld. |
|
— |
Het minimumaantal basismonsters dat van de partij moet worden genomen, is in tabel 1 aangegeven. De partij moet voor zover mogelijk net vóór de bemonstering grondig worden gemengd, hetzij handmatig, hetzij mechanisch. In dit geval kan worden verondersteld dat de aflatoxine homogeen over de partij is verdeeld. Drie basismonsters van een partij zijn daarom voldoende om het verzamelmonster te vormen. Tabel 1 Minimumaantal van de partij te nemen basismonsters
Tabel 2 Verdeling van partijen in subpartijen naargelang van het gewicht van de partij
|
K.2. Bemonsteringswijze voor plantaardige oliën in de detailhandel
De bemonstering in de detailhandel wordt zo mogelijk verricht overeenkomstig de voorschriften in dit punt K.
Indien dit niet mogelijk is, mogen ander effectieve bemonsteringswijzen worden toegepast, mits het verzamelmonster voldoende representatief is voor de bemonsterde partij en de bemonsteringswijze nauwkeurig wordt beschreven en grondig wordt gedocumenteerd. In ieder geval weegt het verzamelmonster ten minste 1 kg (2).
K.3. Aanvaarding van een partij of een subpartij
|
— |
aanvaarding als het laboratoriummonster het maximumgehalte niet overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid; |
|
— |
weigering als het laboratoriummonster het maximumgehalte buiten redelijke twijfel overschrijdt, met inachtneming van de correctie voor terugvinding en de meetonzekerheid. |
(1) Als de subpartijen fysiek van elkaar kunnen worden gescheiden, worden grote onverpakte zendingen/partijen plantaardige olie in subpartijen verdeeld volgens tabel 2 van dit punt.
(2) Indien het te bemonsteren deel zo klein is dat geen verzamelmonster van 1 kg kan worden verkregen, mag het verzamelmonster minder dan 1 kg wegen.”
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/44 |
VERORDENING (EU) Nr. 179/2010 VAN DE COMMISSIE
van 2 maart 2010
tot vaststelling van de forfaitaire invoerwaarden voor de bepaling van de invoerprijs van bepaalde groenten en fruit
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Verordening (EG) nr. 1234/2007 van de Raad van 22 oktober 2007 houdende een gemeenschappelijke ordening van de landbouwmarkten en specifieke bepalingen voor een aantal landbouwproducten („integrale-GMO-verordening”) (1),
Gelet op Verordening (EG) nr. 1580/2007 van de Commissie van 21 december 2007 tot vaststelling van bepalingen voor de uitvoering van de Verordeningen (EG) nr. 2200/96, (EG) nr. 2201/96 en (EG) nr. 1182/2007 van de Raad in de sector groenten en fruit (2), en met name op artikel 138, lid 1,
Overwegende hetgeen volgt:
Bij Verordening (EG) nr. 1580/2007 zijn, op grond van de resultaten van de multilaterale handelsbesprekingen van de Uruguayronde, de criteria vastgesteld aan de hand waarvan de Commissie voor de producten en de perioden die in bijlage XV, deel A, bij die verordening zijn vermeld, de forfaitaire waarden bij invoer uit derde landen vaststelt,
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De in artikel 138 van Verordening (EG) nr. 1580/2007 bedoelde forfaitaire invoerwaarden worden vastgesteld in de bijlage bij de onderhavige verordening.
Artikel 2
Deze verordening treedt in werking op 3 maart 2010.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie, namens de voorzitter,
Jean-Luc DEMARTY
Directeur-generaal Landbouw en plattelandsontwikkeling
(1) PB L 299 van 16.11.2007, blz. 1.
(2) PB L 350 van 31.12.2007, blz. 1.
BIJLAGE
Forfaitaire invoerwaarden voor de bepaling van de invoerprijs van bepaalde groenten en fruit
|
(EUR/100 kg) |
||
|
GN-code |
Code derde landen (1) |
Forfaitaire invoerwaarde |
|
0702 00 00 |
JO |
67,6 |
|
MA |
113,6 |
|
|
TN |
130,0 |
|
|
TR |
116,9 |
|
|
ZZ |
107,0 |
|
|
0707 00 05 |
EG |
211,5 |
|
JO |
145,3 |
|
|
MK |
147,9 |
|
|
TR |
148,5 |
|
|
ZZ |
163,3 |
|
|
0709 90 70 |
MA |
132,4 |
|
TR |
89,4 |
|
|
ZZ |
110,9 |
|
|
0709 90 80 |
EG |
43,6 |
|
ZZ |
43,6 |
|
|
0805 10 20 |
CL |
52,4 |
|
EG |
45,1 |
|
|
IL |
56,5 |
|
|
MA |
46,5 |
|
|
TN |
46,6 |
|
|
TR |
58,8 |
|
|
ZZ |
51,0 |
|
|
0805 50 10 |
EG |
76,3 |
|
IL |
76,3 |
|
|
MA |
68,6 |
|
|
TR |
70,3 |
|
|
ZZ |
72,9 |
|
|
0808 10 80 |
CA |
76,4 |
|
CN |
70,6 |
|
|
MK |
24,7 |
|
|
US |
99,2 |
|
|
ZZ |
67,7 |
|
|
0808 20 50 |
AR |
78,5 |
|
CL |
200,0 |
|
|
CN |
54,8 |
|
|
US |
92,4 |
|
|
ZA |
91,9 |
|
|
ZZ |
103,5 |
|
(1) Landennomenclatuur vastgesteld bij Verordening (EG) nr. 1833/2006 van de Commissie (PB L 354 van 14.12.2006, blz. 19). De code „ZZ” staat voor „overige oorsprong”.
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/46 |
VERORDENING (EU) Nr. 180/2010 VAN DE COMMISSIE
van 2 maart 2010
tot wijziging van de bij Verordening (EG) nr. 877/2009 vastgestelde representatieve prijzen en aanvullende invoerrechten voor bepaalde producten uit de sector suiker voor het verkoopseizoen 2009/10
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Verordening (EG) nr. 1234/2007 van de Raad van 22 oktober 2007 houdende een gemeenschappelijke ordening van de landbouwmarkten en specifieke bepalingen voor een aantal landbouwproducten („Integrale-GMO-verordening”) (1),
Gelet op Verordening (EG) nr. 951/2006 van de Commissie van 30 juni 2006 houdende uitvoeringsbepalingen van Verordening (EG) nr. 318/2006 van de Raad wat betreft de handel met derde landen in de sector suiker (2), en met name op artikel 36, lid 2, tweede alinea, tweede zin,
Overwegende hetgeen volgt:
|
(1) |
De representatieve prijzen en aanvullende invoerrechten voor witte suiker, ruwe suiker en bepaalde stropen voor het verkoopseizoen 2009/10 zijn vastgesteld bij Verordening (EG) nr. 877/2009 van de Commissie (3). Deze prijzen en rechten zijn laatstelijk gewijzigd bij Verordening (EU) nr. 160/2010 van de Commissie (4). |
|
(2) |
Naar aanleiding van de gegevens waarover de Commissie momenteel beschikt, dienen deze bedragen overeenkomstig Verordening (EG) nr. 951/2006 te worden gewijzigd, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De bij Verordening (EG) nr. 951/2006 voor het verkoopseizoen 2009/10 vastgestelde representatieve prijzen en aanvullende invoerrechten voor de in artikel 36 van Verordening (EG) nr. 877/2009 bedoelde producten worden gewijzigd overeenkomstig de bijlage bij de onderhavige verordening.
Artikel 2
Deze verordening treedt in werking op 3 maart 2010.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie, namens de voorzitter,
Jean-Luc DEMARTY
Directeur-generaal Landbouw en plattelandsontwikkeling
(1) PB L 299 van 16.11.2007, blz. 1.
(2) PB L 178 van 1.7.2006, blz. 24.
(3) PB L 253 van 25.9.2009, blz. 3.
(4) PB L 49 van 26.2.2010, blz. 18.
BIJLAGE
Gewijzigde bedragen van de representatieve prijzen en aanvullende invoerrechten voor witte suiker, ruwe suiker en producten van GN-code 1702 90 95 die gelden met ingang van 3 maart 2010
|
(EUR) |
||
|
GN-code |
Representatieve prijs per 100 kg netto van het betrokken product |
Aanvullend recht per 100 kg netto van het betrokken product |
|
1701 11 10 (1) |
40,51 |
0,00 |
|
1701 11 90 (1) |
40,51 |
2,75 |
|
1701 12 10 (1) |
40,51 |
0,00 |
|
1701 12 90 (1) |
40,51 |
2,45 |
|
1701 91 00 (2) |
47,12 |
3,33 |
|
1701 99 10 (2) |
47,12 |
0,20 |
|
1701 99 90 (2) |
47,12 |
0,20 |
|
1702 90 95 (3) |
0,47 |
0,23 |
(1) Vaststelling voor de standaardkwaliteit als gedefinieerd in bijlage IV, punt III, van Verordening (EG) nr. 1234/2007.
(2) Vaststelling voor de standaardkwaliteit als gedefinieerd in bijlage IV, punt II, van Verordening (EG) nr. 1234/2007.
(3) Vaststelling per procent sacharose.
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/48 |
VERORDENING (EU) Nr. 181/2010 VAN DE COMMISSIE
van 2 maart 2010
betreffende de afgifte van certificaten voor de invoer van knoflook voor de deelperiode van 1 juni 2010 tot en met 31 augustus 2010
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Verordening (EG) nr. 1234/2007 van de Raad van 22 oktober 2007 houdende een gemeenschappelijke ordening van de landbouwmarkten en specifieke bepalingen voor een aantal landbouwproducten (integrale-GMO-verordening) (1),
Gelet op Verordening (EG) nr. 1301/2006 van de Commissie van 31 augustus 2006 houdende gemeenschappelijke voorschriften voor het beheer van door middel van een stelsel van invoercertificaten beheerde invoertariefcontingenten voor landbouwproducten (2), en met name op artikel 7, lid 2,
Overwegende hetgeen volgt:
|
(1) |
Bij Verordening (EG) nr. 341/2007 van de Commissie (3) is voorzien in de opening en vaststelling van de wijze van beheer van tariefcontingenten en de instelling van een stelsel van invoercertificaten en certificaten van oorsprong voor uit derde landen ingevoerde knoflook en bepaalde andere landbouwproducten. |
|
(2) |
De hoeveelheden waarvoor op grond van artikel 10, lid 1, van Verordening (EG) nr. 341/2007 door traditionele importeurs en door nieuwe importeurs A-certificaten zijn aangevraagd gedurende de eerste vijf werkdagen na de 15e dag van februari 2010, overtreffen de beschikbare hoeveelheden voor producten van oorsprong uit China en alle andere derde landen dan China. |
|
(3) |
Derhalve moet, overeenkomstig artikel 7, lid 2, van Verordening (EG) nr. 1301/2006, worden vastgesteld in welke mate de uiterlijk eind februari 2010 aan de Commissie toegezonden aanvragen van A-certificaten kunnen worden ingewilligd overeenkomstig artikel 12 van Verordening (EG) nr. 341/2007, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
Aanvragen voor A-invoercertificaten die op grond van artikel 10, lid 1, van Verordening (EG) nr. 341/2007 zijn ingediend gedurende de eerste vijf werkdagen na de 15e dag van februari 2010 en die aan de Commissie zijn toegezonden uiterlijk eind februari 2010, worden ingewilligd tot de in de bijlage bij de onderhavige verordening vermelde percentages van de gevraagde hoeveelheden.
Artikel 2
Deze verordening treedt in werking op de dag van haar bekendmaking in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie, namens de voorzitter,
Jean-Luc DEMARTY
Directeur-generaal Landbouw en plattelandsontwikkeling
(1) PB L 299 van 16.11.2007, blz. 1.
(2) PB L 238 van 1.9.2006, blz. 13.
(3) PB L 90 van 30.3.2007, blz. 12.
BIJLAGE
|
Oorsprong |
Volgnummer |
Toewijzingscoëfficiënt |
|||
|
Argentinië |
|||||
|
09.4104 |
X |
|||
|
09.4099 |
X |
|||
|
China |
|||||
|
09.4105 |
17,875957 % |
|||
|
09.4100 |
0,387100 % |
|||
|
Andere derde landen |
|||||
|
09.4106 |
100 % |
|||
|
09.4102 |
31,057336 % |
|||
|
|||||
BESLUITEN
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/50 |
BESLUIT VAN DE RAAD
van 25 februari 2010
tot oprichting van het Permanent Comité operationele samenwerking op het gebied van de binnenlandse veiligheid
(2010/131/EU)
DE RAAD VAN DE EUROPESE UNIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie, met name op artikel 240, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Conform artikel 71 van het Verdrag betreffende de werking van de Europese Unie dient binnen de Raad een permanent comité te worden opgericht om ervoor te zorgen dat binnen de Unie de operationele samenwerking op het gebied van de binnenlandse veiligheid wordt bevorderd en versterkt. |
|
(2) |
Derhalve moet een besluit worden aangenomen betreffende de oprichting en de taakstelling van dit comité, |
BESLUIT:
Artikel 1
Het Permanent Comité operationele samenwerking op het gebied van de binnenlandse veiligheid, (hierna „het Permanent Comité” genoemd), bedoeld in artikel 71 van het Verdrag, wordt hierbij in het kader van de Raad opgericht.
Artikel 2
Het Permanent Comité faciliteert, bevordert en versterkt de coördinatie van operationele acties van de autoriteiten van de lidstaten die voor binnenlandse veiligheid bevoegd zijn.
Artikel 3
1. Onverminderd de mandaten van de in artikel 5 genoemde organen faciliteert en waarborgt het Permanent Comité een doeltreffende operationele samenwerking en coördinatie uit hoofde van titel V van het derde deel van het Verdrag, met name op gebieden die door de politiële en douanesamenwerking worden bestreken of onder de bevoegdheid van de voor de controle en bescherming van de buitengrenzen verantwoordelijke autoriteiten vallen. In voorkomend geval bestrijkt zijn bevoegdheid ook de justitiële samenwerking in strafzaken die verband houden met de operationele samenwerking op het gebied van de binnenlandse veiligheid.
2. Tevens evalueert het Permanent Comité de algemene richting en doeltreffendheid van de operationele samenwerking; het wijst eventuele tekortkomingen of gebreken aan, en formuleert passende concrete aanbevelingen om die te verhelpen.
3. Het Permanent Comité verleent de Raad bijstand overeenkomstig de bepalingen van artikel 222 van het Verdrag.
Artikel 4
1. Het Permanent Comité wordt niet betrokken bij de uitvoering van operaties; zulks blijft de opdracht van de lidstaten.
2. Het Permanent Comité wordt niet betrokken bij het opstellen van wetgevingsbesluiten.
Artikel 5
1. Waar passend, worden vertegenwoordigers van Eurojust, Europol, het Europees Agentschap voor het beheer van de operationele samenwerking aan de buitengrenzen van de lidstaten van de Europese Unie (Frontex) en andere betrokken organen als waarnemers uitgenodigd voor de bijeenkomsten van het Permanent Comité.
2. Het Permanent Comité draagt bij tot de samenhang van het optreden van deze organen.
Artikel 6
1. Het Permanent Comité legt de Raad regelmatig een verslag over zijn activiteiten voor.
2. De Raad informeert het Europees Parlement en de nationale parlementen over de werkzaamheden van het Permanent Comité.
Artikel 7
Dit besluit treedt in werking op de dag waarop het wordt aangenomen.
Het wordt bekendgemaakt in het Publicatieblad van de Europese Unie.
Gedaan te Brussel, 25 februari 2010.
Voor de Raad
De voorzitter
A. PÉREZ RUBALCABA
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/51 |
BESLUIT VAN DE COMMISSIE
van 2 maart 2010
houdende de principiële erkenning dat de dossiers die zijn ingediend voor grondig onderzoek met het oog op de eventuele opneming van Trichoderma asperellum (stam T34) en isopyrazam in bijlage I bij Richtlijn 91/414/EEG van de Raad, volledig zijn
(Kennisgeving geschied onder nummer C(2010) 1099)
(Voor de EER relevante tekst)
(2010/132/EU)
DE EUROPESE COMMISSIE,
Gelet op het Verdrag betreffende de werking van de Europese Unie,
Gelet op Richtlijn 91/414/EEG van de Raad van 15 juli 1991 betreffende het op de markt brengen van gewasbeschermingsmiddelen (1), en met name op artikel 6, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Richtlijn 91/414/EEG voorziet in de opstelling van een communautaire lijst van werkzame stoffen die mogen worden gebruikt in gewasbeschermingsmiddelen. |
|
(2) |
Op 22 april 2009 heeft Biocontrol Technologies S.L. bij de autoriteiten van het Verenigd Koninkrijk een dossier ingediend met een aanvraag om de werkzame stof Trichoderma asperellum (stam T34) op te nemen in bijlage I bij Richtlijn 91/414/EEG. Voor isopyrazam is op 25 november 2008 door Syngenta Crop Protection AG bij de autoriteiten van het Verenigd Koninkrijk een dossier ingediend met een aanvraag om de werkzame stof op te nemen in bijlage I bij Richtlijn 91/414/EEG. |
|
(3) |
De autoriteiten van het Verenigd Koninkrijk hebben de Commissie meegedeeld dat de dossiers betreffende de werkzame stoffen op grond van een eerste onderzoek lijken te voldoen aan de in bijlage II bij Richtlijn 91/414/EEG vervatte voorschriften inzake gegevens en informatie. De ingediende dossiers blijken ten aanzien van één gewasbeschermingsmiddel dat de betreffende werkzame stof bevat, ook te voldoen aan de in bijlage III bij Richtlijn 91/414/EEG vervatte voorschriften inzake gegevens en informatie. Overeenkomstig artikel 6, lid 2, van Richtlijn 91/414/EEG hebben de aanvragers de dossiers aan de Commissie en de andere lidstaten toegezonden en heeft de Commissie deze dossiers aan het Permanent Comité voor de voedselketen en de diergezondheid voorgelegd. |
|
(4) |
Met dit besluit moet op het niveau van de Europese Unie officieel worden bevestigd dat de dossiers in beginsel voldoen aan de in bijlage II vastgestelde voorschriften inzake gegevens en informatie en, voor ten minste één gewasbeschermingsmiddel dat de desbetreffende werkzame stof bevat, aan de in bijlage III bij Richtlijn 91/414/EEG vastgestelde voorschriften. |
|
(5) |
De in dit besluit vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT HET VOLGENDE BESLUIT VASTGESTELD:
Artikel 1
De dossiers betreffende de in de bijlage bij dit besluit genoemde werkzame stoffen, die aan de Commissie en de lidstaten zijn voorgelegd met het oog op opneming van deze stoffen in bijlage I bij Richtlijn 91/414/EEG, voldoen in beginsel aan de in bijlage II bij die richtlijn vervatte voorschriften inzake gegevens en informatie.
Elk van de dossiers voldoet ten aanzien van één gewasbeschermingsmiddel dat de betrokken werkzame stof bevat, rekening houdend met het beoogde gebruik van dat middel, ook aan de in bijlage III bij die richtlijn vervatte voorschriften inzake gegevens en informatie.
Artikel 2
De als rapporteur aangewezen lidstaat bestudeert de in artikel 1 genoemde dossiers grondig en deelt de conclusies van de onderzoeken, vergezeld van eventuele aanbevelingen over het al dan niet opnemen van de in artikel 1 bedoelde werkzame stoffen in bijlage I bij Richtlijn 91/414/EEG en van eventuele aan die opneming te verbinden voorwaarden, zo spoedig mogelijk en uiterlijk één jaar na de bekendmaking van dit besluit in het Publicatieblad van de Europese Unie, aan de Commissie mee.
Artikel 3
Dit besluit is gericht tot de lidstaten.
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie
John DALLI
Lid van de Commissie
(1) PB L 230 van 19.8.1991, blz. 1.
BIJLAGE
ONDER DIT BESLUIT VALLENDE WERKZAME STOFFEN
|
Nr. |
Naam, CIPAC-identificatienummer |
Aanvrager |
Datum van de aanvraag |
Als rapporteur aangewezen lidstaat |
|
1 |
Trichoderma asperellum (stam T34) CIPAC-nr.: niet van toepassing |
Biocontrol Technologies S.L. |
22.4.2009 |
Verenigd Koninkrijk |
|
2 |
Isopyrazam CIPAC-nr.: syn-isomeer: 683777-13-1 anti-isomeer: 683777-14-2 |
Syngenta Crop Protection AG |
25.11.2008 |
Verenigd Koninkrijk |
AANBEVELINGEN
|
3.3.2010 |
NL |
Publicatieblad van de Europese Unie |
L 52/53 |
AANBEVELING VAN DE COMMISSIE
van 2 maart 2010
betreffende de voorkoming en beperking van verontreiniging van eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten met ethylcarbamaat en de controle op het ethylcarbamaatgehalte in die dranken
(Voor de EER relevante tekst)
(2010/133/EU)
DE EUROPESE COMMISSIE
Gelet op het Verdrag betreffende de werking van de Europese Unie, en met name op artikel 292,
Overwegende hetgeen volgt:
|
(1) |
Het Wetenschappelijk Panel voor contaminanten in de voedselketen van de Europese Autoriteit voor voedselveiligheid (EFSA) heeft op 20 september 2007 een wetenschappelijk advies over ethylcarbamaat en waterstofcyanide in voedingsmiddelen en dranken uitgebracht (1). In dat advies heeft het panel blootstellingsmarges voor ethylcarbamaat afgeleid bij verschillende consumptiescenario’s voor voedingsmiddelen en dranken. Op grond van die blootstellingsmarges is het panel tot de conclusie gekomen dat ethylcarbamaat in alcoholhoudende dranken een gezondheidsrisico inhoudt, met name in het geval van eau de vie van steenvruchten; daarom adviseert het panel maatregelen om het ethylcarbamaatgehalte in die dranken te beperken. Aangezien waterstofcyanide een belangrijke voorloper van ethylcarbamaat in eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten is, moeten die maatregelen volgens het panel vooral gericht zijn op waterstofcyanide en andere voorlopers van ethylcarbamaat, om te voorkomen dat deze stof tijdens de houdbaarheidsduur van de producten ontstaat. |
|
(2) |
In Verordening (EG) nr. 110/2008 van het Europees Parlement en de Raad van 15 januari 2008 betreffende de definitie, de aanduiding, de presentatie, de etikettering en de bescherming van geografische aanduidingen van gedistilleerde dranken en tot intrekking van Verordening (EEG) nr. 1576/89 van de Raad (2) zijn maximumgehalten voor waterstofcyanide („cyaanwaterstof”) in eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten vastgesteld. Volgens die verordening mogen eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten maximaal 7 g per hectoliter alcohol van 100 % vol (70 mg/l) bevatten. |
|
(3) |
Een gedragscode ter voorkoming en beperking van verontreiniging van eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten met ethylcarbamaat wordt als een geschikt instrument gezien om de aanbevelingen van de EFSA in praktijk te brengen. In deze gedragscode worden goede productiepraktijken aanbevolen waarvoor aangetoond is dat zij tot lagere ethylcarbamaatgehalten leiden. Een streefgehalte aan ethylcarbamaat van 1 mg/l in de drank zoals die gedronken wordt, is realistisch en haalbaar bij toepassing van goede productiepraktijken. |
|
(4) |
Het ethylcarbamaatgehalte in eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten moet gedurende drie jaar worden gecontroleerd en aan de hand van de resultaten van die controles moet het effect van de toepassing van deze gedragscode na drie jaar worden beoordeeld. Ook moet worden nagegaan of een maximumgehalte kan worden vastgesteld, |
HEEFT DE VOLGENDE AANBEVELING VASTGESTELD:
Aanbevolen wordt dat de lidstaten:
|
1. |
de nodige maatregelen nemen om ervoor te zorgen dat de in de bijlage opgenomen „Gedragscode ter voorkoming en beperking van verontreiniging van eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten met ethylcarbamaat” wordt toegepast door alle exploitanten die een rol spelen bij de productie, de verpakking, het vervoer, het voor handen hebben en de opslag van eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten; |
|
2. |
ervoor zorgen dat alle maatregelen worden genomen om tot een zo laag mogelijk ethylcarbamaatgehalte in eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten te komen, waarbij een streefdoel van 1 mg/l geldt; |
|
3. |
het ethylcarbamaatgehalte in eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten in de jaren 2010, 2011 en 2012 controleren om het effect van de in de bijlage opgenomen gedragscode te beoordelen; |
|
4. |
de jaarlijkse controlegegevens uiterlijk op 1 juni van het daaropvolgende jaar aan de EFSA sturen, waarbij de te verstrekken informatie en het formaat daarvan door de EFSA worden voorgeschreven; |
|
5. |
voor het controleprogramma de bemonsteringsmethoden volgen die zijn beschreven in deel B van de bijlage bij Verordening (EG) nr. 333/2007 van de Commissie van 28 maart 2007 tot vaststelling van bemonsteringswijzen en analysemethoden voor de officiële controle op de gehalten aan lood, cadmium, kwik, anorganisch tin, 3-MCPD en benzo(a)pyreen in levensmiddelen (3); |
|
6. |
de analyse op ethylcarbamaat uitvoeren overeenkomstig de criteria van de punten 1 en 2 van bijlage III bij Verordening (EG) nr. 882/2004 van het Europees Parlement en de Raad van 29 april 2004 inzake officiële controles op de naleving van de wetgeving inzake diervoeders en levensmiddelen en de voorschriften inzake diergezondheid en dierenwelzijn (4). |
Gedaan te Brussel, 2 maart 2010.
Voor de Commissie
John DALLI
Lid van de Commissie
(1) Opinion of the Scientific Panel on Contaminants in the Food chain on a request from the European Commission on ethyl carbamate and hydrocyanic acid in food and beverages, The EFSA Journal (2007) Journal number, 551, blz. 1. http://www.efsa.europa.eu/cs/BlobServer/Scientific_Opinion/Contam_ej551_ethyl_carbamate_en_rev.1,0.pdf?ssbinary = true
(2) PB L 39 van 13.2.2008, blz. 16.
(3) PB L 88 van 29.3.2007, blz. 29.
(4) PB L 165 van 3.4.2004, blz. 1.
BIJLAGE
Gedragscode ter voorkoming en beperking van verontreiniging van eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten met ethylcarbamaat
INLEIDING
|
1. |
Ethylcarbamaat is een stof die van nature voorkomt in gefermenteerde levensmiddelen en alcoholhoudende dranken, zoals brood, yoghurt, sojasaus, wijn, bier, en vooral in eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten, met name van kersen, pruimen, mirabellen en abrikozen. |
|
2. |
Ethylcarbamaat kan ontstaan uit diverse stoffen die vaak in voedingsmiddelen en dranken voorkomen, zoals waterstofcyanide (ook wel blauwzuur of cyaanwaterstof genoemd), ureum, citrulline en andere N-carbamylverbindingen. In de meeste gevallen is de uiteindelijke voorloperstof waarschijnlijk cyanaat, dat met ethanol reageert tot ethylcarbamaat. |
|
3. |
In gedistilleerde dranken van steenvruchten (eau de vie van steenvruchten en vruchtendraf-eau de vie van steenvruchten) kan ethylcarbamaat ontstaan uit cyanogene glycosiden die van nature in de pitten voorkomen. Bij het persen van de vruchten kunnen de pitten breken, waardoor cyanogene glycosiden met enzymen in de vruchtenbrij in aanraking kunnen komen. Daardoor worden de cyanogene glycosiden afgebroken tot waterstofcyanide of andere cyaniden. Waterstofcyanide kan ook uit hele pitten vrijkomen als de gegiste vruchtenbrij gedurende langere tijd wordt bewaard. Tijdens het distilleren kan het gehalte aan waterstofcyanide in alle fracties groter worden. Cyanide wordt onder invloed van licht geoxideerd tot cyanaat, dat met ethanol reageert tot ethylcarbamaat. Als deze reactie eenmaal op gang gekomen is, kan zij niet meer worden gestopt. |
|
4. |
Er zijn twee manieren om de concentratie ethylcarbamaat sterk te verminderen, namelijk het verlagen van de concentratie van de belangrijkste voorloperstoffen en het beperken van de vorming van cyanaat uit die stoffen. De belangrijkste factoren hierbij zijn de concentratie van de voorloperstoffen (bv. waterstofcyanide en andere cyaniden) en de opslagcondities, zoals de blootstelling aan licht en de temperatuur. |
|
5. |
Hoewel er tot op heden geen sterke correlatie is vastgesteld tussen het gehalte aan waterstofcyanide en dat aan ethylcarbamaat, is wel duidelijk dat onder bepaalde omstandigheden een hoge concentratie waterstofcyanide leidt tot een hoger ethylcarbamaatgehalte. Bij een gehalte aan waterstofcyanide gelijk aan of groter dan 1 mg/l in het uiteindelijke distillaat lijkt er meer ethylcarbamaat te worden gevormd (1), (2). |
|
6. |
In deel I wordt het productieproces beschreven. In deel II staan specifieke aanbevelingen op basis van goede productiepraktijken. |
I. BESCHRIJVING VAN HET PRODUCTIEPROCES
|
7. |
Het productieproces voor vruchten-eau de vie en vruchtendraf-eau de vie omvat het persen en vergisten van de hele vruchten, gevolgd door distillatie. De gebruikelijke processtappen zijn:
|
|
8. |
De voorloop komt bij het distilleren het eerst over. Deze fractie is gewoonlijk herkenbaar aan de geur (oplosmiddel, lak). De voorloop is doorgaans ongeschikt voor consumptie en moet worden weggedaan. |
|
9. |
De middelste distillatiefractie (het hart) bevat ethanol (ethylalcohol), de belangrijkste alcohol in alle sterke drank. Deze fractie, die de minste andere vluchtige bestanddelen dan ethanol en de zuiverste vruchtenaroma’s bevat, wordt altijd opgevangen. |
|
10. |
De naloop van de distillatie bestaat uit azijnzuur en foezelolie en heeft vaak een onaangename geur (azijn, planten). Deze fractie wordt ook weggedaan, maar kan opnieuw worden gedistilleerd omdat er altijd wat ethanol in achterblijft. |
II. AANBEVOLEN WERKWIJZE OP BASIS VAN GOEDE PRODUCTIEPRAKTIJKEN
Grondstoffen en bereiding van de vruchtenbrij
|
11. |
De grondstoffen en de bereiding van de vruchtenbrij moeten zodanig zijn dat vrijkomen van waterstofcyanide vermeden wordt. |
|
12. |
De steenvruchten moeten van hoge kwaliteit zijn, vrij van mechanische schade en microbiologisch bederf. |
|
13. |
De vruchten worden bij voorkeur ontpit. |
|
14. |
Als de vruchten niet ontpit zijn, moeten zij voorzichtig worden geperst om te voorkomen dat de pitten breken. |
Gisting
|
15. |
Aan de vruchtenbrij moeten voor alcoholproductie geselecteerde giststammen worden toegevoegd, zoals aangegeven in de gebruiksaanwijzing ervan. |
|
16. |
Bij het hanteren van de gegiste vruchtenbrij moeten hoge hygiënenormen in acht worden genomen en moet blootstelling aan licht zo veel mogelijk worden vermeden. De gegiste vruchtenbrij moet zo snel mogelijk worden gedistilleerd, omdat ook uit hele pitten waterstofcyanide kan vrijkomen als de vruchtenbrij langer wordt bewaard. |
Distillatieapparatuur
|
17. |
De distillatieapparatuur en het distillatieproces moeten zodanig zijn dat er geen waterstofcyanide in het distillaat terechtkomt. |
|
18. |
De distillatieapparatuur moet voorzien zijn van een automatische spoelinrichting en een koperkatalysator. De automatische spoelinrichting houdt de distilleerketel schoon en de koperkatalysator bindt het waterstofcyanide voordat het in het distillaat terechtkomt. |
|
19. |
Bij batchdistillatie is een automatische spoelinrichting niet nodig. De distillatieapparatuur moet dan steeds grondig worden gereinigd. |
|
20. |
In sommige gevallen, wanneer geen koperkatalysatoren of andere speciale cyanideafscheiders worden gebruikt, moet vóór de distillatie een koperverbinding aan de gegiste vruchtenbrij worden toegevoegd, om het waterstofcyanide te binden. Koperverbindingen zijn in speciaalzaken te koop en moeten nauwgezet volgens de gebruiksaanwijzing van de fabrikant worden gebruikt. |
Distillatieproces
|
21. |
Pitten die in de gegiste brij zijn achtergebleven, mogen niet in het distillatietoestel worden gepompt. |
|
22. |
De distillatie moet zodanig worden uitgevoerd dat de alcohol langzaam wordt afgedampt (bv. door met stoom te verwarmen en niet met een open vlam). |
|
23. |
De eerste fracties van het distillaat (de voorloop) moeten zorgvuldig worden afgescheiden. |
|
24. |
Vervolgens wordt de middenfractie (het hart) opgevangen en in het donker bewaard. Wanneer het alcoholgehalte in het opvangvat 50 % vol heeft bereikt, wordt overgeschakeld op het opvangen van de naloop, zodat eventueel gevormd ethylcarbamaat in die fractie wordt afgescheiden. |
|
25. |
De afgescheiden naloop, die mogelijk ethylcarbamaat bevat, moet worden opgevangen en in geval van herdistillatie afzonderlijk opnieuw worden gedistilleerd. |
Controle van het distillaat, de herdistillatie en de opslag
Waterstofcyanide
|
26. |
Het waterstofcyanidegehalte van de distillaten moet op gezette tijden worden nagegaan. Dit gehalte moet met geschikte tests worden bepaald, met behulp van sneltestkits voor waterstofcyanide of door een gespecialiseerd laboratorium. |
|
27. |
Als de concentratie waterstofcyanide in het distillaat meer dan 1 mg/l bedraagt, wordt herdistillatie met een katalysator of koperverbinding (zie de punten 18 en 20) aanbevolen, al naar het geval. |
|
28. |
In het ideale geval worden distillaten met een concentratie waterstofcyanide van bijna 1 mg/l ook geherdistilleerd of, als dat niet mogelijk is, opgeslagen in lichtdichte flessen of flessen in dozen, waarbij de opslagduur zo kort mogelijk moet zijn om te vermijden dat tijdens de opslag ethylcarbamaat wordt gevormd. |
Ethylcarbamaat
|
29. |
Het wordt aanbevolen om van distillaten waarin mogelijk al ethylcarbamaat gevormd is (bv. distillaten met onbekende productiewijze, hoger cyanidegehalte, blootstelling aan licht tijdens de opslag) het ethylcarbamaatgehalte te bepalen. Dit kan alleen door een gespecialiseerd laboratorium worden gedaan. |
|
30. |
Als blijkt dat de concentratie ethylcarbamaat in het distillaat groter is dan het streefgehalte van 1 mg/l, moet het distillaat eventueel worden geherdistilleerd. |
(1) Christoph, N., Bauer-Christoph C., Maßnahmen zur Reduzierung des Ethylcarbamatgehaltes bei der Herstellung von Steinobstbränden (I), Kleinbrennerei 1998; 11: 9-13.
(2) Christoph, N., Bauer-Christoph C., Maßnahmen zur Reduzierung des Ethylcarbamatgehaltes bei der Herstellung von Steinobstbränden (I), Kleinbrennerei 1999; 1: 5-13.