ISSN 1725-2598
Publicatieblad
van de Europese Unie
L 142

Uitgave in de Nederlandse taal
Wetgeving
51e jaargang
31 mei 2008
|
ISSN 1725-2598 |
||
|
Publicatieblad van de Europese Unie |
L 142 |
|

|
||
|
Uitgave in de Nederlandse taal |
Wetgeving |
51e jaargang |
|
Inhoud |
|
I Besluiten op grond van het EG- en het Euratom-Verdrag waarvan publicatie verplicht is |
Bladzijde |
|
|
|
VERORDENINGEN |
|
|
|
* |
Verordening (EG) nr. 440/2008 van de Commissie van 30 mei 2008 houdende vaststelling van testmethoden uit hoofde van Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH) ( 1 ) |
|
|
|
|
|
(1) Voor de EER relevante tekst |
|
NL |
Besluiten waarvan de titels mager zijn gedrukt, zijn besluiten van dagelijks beheer die in het kader van het landbouwbeleid zijn genomen en die in het algemeen een beperkte geldigheidsduur hebben. Besluiten waarvan de titels vet zijn gedrukt en die worden voorafgegaan door een sterretje, zijn alle andere besluiten. |
I Besluiten op grond van het EG- en het Euratom-Verdrag waarvan publicatie verplicht is
VERORDENINGEN
|
31.5.2008 |
NL |
Publicatieblad van de Europese Unie |
L 142/1 |
VERORDENING (EG) Nr. 440/2008 VAN DE COMMISSIE
van 30 mei 2008
houdende vaststelling van testmethoden uit hoofde van Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH)
(Voor de EER relevante tekst)
DE COMMISSIE VAN DE EUROPESE GEMEENSCHAPPEN,
Gelet op het Verdrag tot oprichting van de Europese Gemeenschap,
Gelet op Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad van 18 december 2006 inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH), tot oprichting van een Europees Agentschap voor chemische stoffen, houdende wijziging van Richtlijn 1999/45/EG en houdende intrekking van Verordening (EEG) nr. 793/93 van de Raad en Verordening (EG) nr. 1488/94 van de Commissie alsmede Richtlijn 76/769/EEG van de Raad en de Richtlijnen 91/155/EEG, 93/67/EEG, 93/105/EG en 2000/21/EG van de Commissie (1), en met name op artikel 13, lid 3,
Overwegende hetgeen volgt:
|
(1) |
Krachtens Verordening (EG) nr. 1907/2006 dienen op communautair niveau testmethoden te worden vastgesteld voor de beproeving van stoffen indien een dergelijke beproeving vereist is om informatie over de intrinsieke eigenschappen van die stoffen te verkrijgen. |
|
(2) |
In bijlage V van Richtlijn 67/548/EEG van de Raad van 27 juni 1967 betreffende de aanpassing van de wettelijke en bestuursrechtelijke bepalingen inzake de indeling, de verpakking en het kenmerken van gevaarlijke stoffen (2) zijn methoden vastgesteld voor de bepaling van de fysisch-chemische eigenschappen, de toxiciteit en de ecotoxiciteit van stoffen en preparaten. Bijlage V van Richtlijn 67/548/EEG is bij Richtlijn 2006/121/EG van het Europees Parlement en de Raad met ingang van 1 juni 2008 geschrapt. |
|
(3) |
De in bijlage V van Richtlijn 67/548/EEG vervatte testmethoden dienen in deze verordening te worden geïntegreerd. |
|
(4) |
Deze verordening sluit het gebruik van andere testmethoden niet uit, op voorwaarde dat het gebruik daarvan in overeenstemming is met artikel 13, lid 3, van Verordening (EG) nr. 1907/2006. |
|
(5) |
Bij de opzet van de testmethoden dient terdege rekening te worden gehouden met de beginselen van vervanging, vermindering en verfijning van het gebruik van dieren in procedures, met name wanneer passende gevalideerde methoden ter vervanging, vermindering of verfijning van dierproeven beschikbaar worden. |
|
(6) |
De bepalingen van deze verordening zijn in overeenstemming met het advies van het bij artikel 133 van Verordening (EG) nr. 1907/2006 ingestelde comité, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De in het kader van Verordening (EG) nr. 1907/2006 toe te passen testmethoden zijn opgenomen in de bijlage van deze verordening.
Artikel 2
De Commissie herbeziet indien nodig de in deze verordening vervatte testmethoden met het oog op de vervanging, de vermindering of de verfijning van proeven op gewervelde dieren.
Artikel 3
Alle verwijzingen naar bijlage V van Richtlijn 67/548/EEG worden gelezen als verwijzingen naar deze verordening.
Artikel 4
Deze verordening treedt in werking op de dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Zij is van toepassing met ingang van 1 juni 2008.
Gedaan te Brussel, 30 mei 2008.
Voor de Commissie
Stavros DIMAS
Lid van de Commissie
(1) PB L 396 van 30.12.2006, blz. 1; gerectificeerd in PB L 136 van 29.5.2007, blz. 3.
(2) PB 196 van 16.8.1967, blz. 1. Richtlijn laatstelijk gewijzigd bij Richtlijn 2006/121/EG van het Europees Parlement en de Raad (PB L 396 van 30.12.2006, blz. 849; gerectificeerd in PB L 136 van 29.5.2007, blz. 281) — verwijzing aan te passen na publicatie van de 30e AVT.
BIJLAGE
DEEL A: METHODEN VOOR DE BEPALING VAN DE FYSISCH-CHEMISCHE EIGENSCHAPPEN
INHOUD
|
A.1. |
SMELT-/VRIESTEMPERATUUR |
|
A.2. |
KOOKTEMPERATUUR |
|
A.3. |
RELATIEVE DICHTHEID |
|
A.4. |
DAMPSPANNING |
|
A.5. |
OPPERVLAKTESPANNING |
|
A.6. |
OPLOSBAARHEID IN WATER |
|
A.8. |
VERDELINGSCOËFFICIËNT |
|
A.9. |
VLAMPUNT |
|
A.10. |
ONTVLAMBAARHEID (VASTE STOFFEN) |
|
A.11. |
ONTVLAMBAARHEID (GASSEN) |
|
A.12. |
ONTVLAMBAARHEID (CONTACT MET WATER) |
|
A.13. |
PYROFORE EIGENSCHAPPEN VAN VASTE STOFFEN EN VLOEISTOFFEN |
|
A.14. |
EXPLOSIEGEVAAR |
|
A.15. |
ZELFONTBRANDINGSTEMPERATUUR (VLOEISTOFFEN EN GASSEN) |
|
A.16. |
RELATIEVE ZELFONTBRANDINGSTEMPERATUUR VAN VASTE STOFFEN |
|
A.17. |
OXIDERENDE EIGENSCHAPPEN (VASTE STOFFEN) |
|
A.18. |
AANTALGEMIDDELD MOLECUULGEWICHT EN MOLECUULGEWICHTSVERDELING VAN POLYMEREN |
|
A.19. |
GEHALTE VAN POLYMEREN AAN LAAGMOLECULAIRE BESTANDDELEN |
|
A.20. |
OPLOS/EXTRACTIEGEDRAG VAN POLYMEREN IN WATER |
|
A.21. |
OXIDERENDE EIGENSCHAPPEN (VLOEISTOFFEN) |
A.1. SMELT-/VRIESTEMPERATUUR
1. METHODE
De meeste van de beschreven methoden berusten op de testrichtlijnen van de OESO (1). De fundamentele principes worden besproken in de referenties (2) en (3).
1.1. INLEIDING
De hier beschreven methoden en toestellen dienen te worden toegepast voor de bepaling van de smelttemperatuur van stoffen, ongeacht de mate van zuiverheid ervan.
De keuze van de methode hangt af van de aard van de te onderzoeken stof. De beperkende factor zal dan ook worden bepaald door de vraag of de stof al dan niet gemakkelijk, moeilijk of helemaal niet kan worden verpulverd.
Voor sommige stoffen is de bepaling van de vries- of stoltemperatuur zinvoller; ook de normen voor deze bepaling werden in de methode opgenomen.
Indien, als gevolg van de specifieke eigenschappen van de stof, geen van de bovenstaande parameters eenvoudig kan worden gemeten, kan een vloeipunt geschikt zijn.
1.2. DEFINITIES EN EENHEDEN
Onder smelttemperatuur wordt verstaan de temperatuur, waarbij de faseovergang van vaste naar vloeibare toestand optreedt bij normale atmosferische druk; deze temperatuur komt in het ideale geval overeen met de vriestemperatuur.
Aangezien de faseovergang bij veel stoffen over een temperatuurbereik plaatsvindt, wordt deze vaak omschreven als het smelttraject.
Smelttemperatuur en -traject worden steeds uitgedrukt in K.
t = T - 273,15
|
t |
: |
Celsius-temperatuur, graden Celsius ( oC) |
|
T |
: |
thermodynamische temperatuur, Kelvin (K) |
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om van tijd tot tijd de werking van de methode te controleren en om vergelijkingen met resultaten van andere methoden mogelijk te maken.
In de referenties worden enige ijkstoffen genoemd (4).
1.4. PRINCIPE VAN DE TESTMETHODEN
De temperatuur (het temperatuurbereik), waarbij fase-overgang van vaste naar vloeibare of van vloeibare naar vaste toestand plaatsvindt, wordt bepaald. In de praktijk betekent dit dat een monster van de te onderzoeken stof bij atmosferische druk wordt verwarmd/gekoeld en dat de temperatuur in het begin- en het eindstadium van het smelt-/vriesproces wordt bepaald. Vijf onderzoekmethoden worden beschreven, namelijk: de capillaire methode, de methode met de verhitte plaat, de methode voor bepaling van de vriestemperatuur, thermische-analysemethoden, alsmede de bepaling van het vloeipunt (zoals ontwikkeld voor minerale oliën).
In sommige gevallen kan het gemakkelijker zijn de vriestemperatuur te bepalen in plaats van de smelttemperatuur.
1.4.1. Capillaire methode
1.4.1.1. Toestellen ter bepaling van de smelttemperatuur met behulp van een vloeistofbad
Een kleine hoeveelheid van de verpulverde stof wordt in een capillair gebracht en stevig aangedrukt. Het buisje wordt samen met een thermometer verwarmd, waarbij ervoor wordt gezorgd dat de temperatuurstijging tijdens het eigenlijke smeltproces minder dan circa 1 K/min bedraagt. De temperatuur in het begin- en eindstadium van het smeltproces wordt bepaald.
1.4.1.2. Toestellen ter bepaling van de smelttemperatuur met behulp van een metalen blok
Als omschreven in 1.4.1.1, met dit verschil dat het capillair en de thermometer in een verwarmd metalen blok zijn aangebracht en door openingen in het blok kunnen worden waargenomen.
1.4.1.3. Fotoceldetectie
Het monster in het capillair wordt automatisch verhit in een metalen cilinder. Een lichtbundel wordt, via openingen in de cilinder, door de stof heen op een nauwkeurig geijkte fotocel gericht. De optische eigenschappen van de meeste stoffen veranderen van ondoorschijnend naar doorschijnend bij het smelten. Zodra de lichtintensiteit die de fotocel bereikt toeneemt, zendt deze een stopsignaal naar de digitale meter die de temperatuur afleest van een thermometer met platinaweerstand in de verwarmingskamer. Deze methode leent zich niet voor toepassing op sommige sterk gekleurde stoffen.
1.4.2. Methode waarbij gebruik wordt gemaakt van een verhit oppervlak (hot stage)
1.4.2.1. De verhitte staaf volgens Kofler
De verhitte staaf volgens Kofler bestaat uit twee stukken metaal die een verschillend warmtegeleidingsvermogen bezitten en elektrisch worden verwarmd. De staaf is zo ontworpen dat de temperatuur nagenoeg lineair langs de lengte ervan varieert. De temperatuur van de verhitte staaf kan variëren van 283 K tot 573 K; de temperatuur wordt met een voor elke staaf afzonderlijk geijkt ruitertje (met wijzer) afgelezen. Om een smelttemperatuur te bepalen, wordt de stof in een dunne laag direct op het oppervlak van de verhitte staaf gebracht. Binnen enkele seconden ontstaat er een scherpe scheidingslijn tussen de vloeibare en de vaste fase. De wijzer wordt ingesteld op de scheidingslijn, waarna de temperatuur kan worden afgelezen.
1.4.2.2. Smeltpuntmicroscoop
Er bestaan verschillende verhitte platen voor microscopische smelttemperatuurbepaling waarbij met zeer kleine hoeveelheden materiaal kan worden gewerkt. Bij de meeste verhitte platen wordt de temperatuur gemeten met een gevoelig thermokoppel, maar bij sommige met een kwikthermometer. Een toestel voor microscopische bepaling van de smelttemperatuur met behulp van een verhitte plaat bestaat meestal uit een verwarmingskamer met een metalen plaat waarop het monster op een voorwerpglaasje wordt geplaatst, in het midden van de metalen plaat is een opening aangebracht zodat deze het licht van de microscoop doorlaat. Tijdens het gebruik wordt, om lucht uit de verwarmingskamer te weren, deze met een glazen plaat afgesloten.
De verwarming van het monster wordt ingesteld met een regelweerstand. Voor zeer nauwkeurige metingen bij optisch anisotrope stoffen kan gebruik worden gemaakt van gepolariseerd licht.
1.4.2.3. De meniscusmethode
Deze methode wordt speciaal toegepast voor polyamiden.
Bepaling van de temperatuur, waarbij de verplaatsing van een meniscus van siliconenolie die tussen een verhit oppervlak (hot stage) en een dekglas, geplaatst op het te onderzoeken polyamidemonster, is ingesloten, visueel wordt waargenomen.
1.4.3. Methode voor de bepaling van de vriestemperatuur
Het monster wordt in een speciaal proefbuisje in een toestel geplaatst voor de bepaling van de vriestemperatuur. Tijdens de afkoeling wordt het monster voortdurend zachtjes geroerd en de temperatuur wordt regelmatig afgelezen en geregistreerd. Zodra de temperatuur gedurende enkele aflezingen constant blijft, wordt deze temperatuur (na correctie voor afwijking van de thermometer) geregistreerd als de vriestemperatuur.
Onderkoeling moet worden voorkomen door een evenwicht te bewaren tussen de vaste en de vloeibare fase.
1.4.4. Thermische analyse
1.4.4.1. Differentiële thermische analyse (DTA)
Met deze techniek wordt het verschil in temperatuur geregistreerd tussen de te onderzoeken stof en een referentiestof als functie van de temperatuur, wanneer beide stoffen aan hetzelfde gecontroleerde temperatuurprogramma worden blootgesteld. Als het monster een faseovergang doormaakt met verandering van enthalpie, zal deze verandering aangetoond worden door een endotherme (smelten) of exotherme (bevriezen) afwijking van de basislijn van de temperatuurregistratie.
1.4.4.2. Differentiële scanningcalorimetrie (DSC)
Deze techniek registreert het verschil tussen de energieopname van de te onderzoeken stof en een referentiestof als functie van de temperatuur, wanneer beide stoffen aan hetzelfde gecontroleerde temperatuurprogramma worden onderworpen. Deze energie is de energie die nodig is om dezelfde temperatuur voor beide stoffen te bereiken. Als het monster een faseovergang doormaakt met verandering van enthalpie, zal deze verandering aangetoond worden door een endotherme (smelten) of exotherme (bevriezen) afwijking van de basislijn van de warmtestroomregistratie.
1.4.5. Vloeipunt
Deze methode werd ontwikkeld voor minerale oliën en is bruikbaar voor olieachtige stoffen met lage smelttemperaturen.
Na voorafgaande verwarming wordt het monster afgekoeld met een specifieke snelheid en telkens, iedere 3 K, onderzocht op vloeikarakteristieken. De laagste temperatuur waarbij nog beweging van de vloeistof wordt gezien, wordt genoteerd als het vloeipunt.
1.5. KWALITEITSCRITERIA
De toepasbaarheid en nauwkeurigheid van de verschillende methoden voor de bepaling van smelttemperaturen/smelttrajecten staat vermeld in de tabel.
TABEL: TOEPASBAARHEID VAN DE METHODEN
A. Capillaire methode
|
Meetmethode |
Stoffen die kunnen verpulveren |
Stoffen die niet vlot verpulveren |
Temperatuurbereik |
Geschatte nauwkeurigheid (1) |
Bestaande norm |
|
Smelttemperatuurtoestellen met vloeistofbad |
Ja |
Enkele |
273 tot 573 K |
±0,3 K |
JIS K 0064 |
|
Smelttemperatuurtoestellen met metalen blok |
Ja |
Enkele |
293 tot > 573 K |
±0,5 K |
ISO 1218 (E) |
|
Fotoceldetectie |
Ja |
Verscheidene met toepassing van hulpapparatuur |
253 tot 573 K |
±0,5 K |
|
B. Methode waarbij gebruik wordt gemaakt van een verhit oppervlak (hot stage) en methode voor de bepaling van de vriestemperatuur
|
Meetmethode |
Stoffen die kunnen verpulveren |
Stoffen die niet vlot verpulveren |
Temperatuurbereik |
Geschatte nauwkeurigheid (2) |
Bestaande norm |
|
Verhitte staaf volgens Kofler |
Ja |
Neen |
283 tot > 573 K |
±1,0 K |
ANSI/ASTM D 345176 |
|
Smeltpuntmicroscoop |
Ja |
Enkele |
273 tot > 573 K |
±0,5 K |
DIN 53736 |
|
Meniscusmethode |
Neen |
Specifiek voor polyamiden |
293 tot > 573 K |
±0,5 K |
ISO 1218 (E) |
|
Vriestemperatuurmethode |
Ja |
Ja |
223 tot 573 K |
±0,5 K |
zoals BS 4695 |
C. Thermische analyse
|
Meetmethode |
Stoffen die kunnen verpulveren |
Stoffen die niet vlot verpulveren |
Temperatuurbereik |
Geschatte nauwkeurigheid (3) |
Bestaande norm |
|
Differentiële thermische analyse |
Ja |
Ja |
173 tot 1 273 K |
tot 600 K ±0,5 K tot 1 273 K ±2,0 K |
ASTM E 537-76 |
|
Differentiële scanningcalorimetrie |
Ja |
Ja |
173 tot 1 273 K |
tot 600 K ±0,5 K tot 1 273 K ±2,0 K |
ASTM E 537-76 |
D. Vloeipunt
|
Meetmethode |
Stoffen die kunnen verpulveren |
Stoffen die niet vlot verpulveren |
Temperatuurbereik |
Geschatte nauwkeurigheid (4) |
Bestaande norm |
|
Vloeipunt |
Voor minerale oliën en olieachtige stoffen |
Voor minerale oliën en olieachtige stoffen |
223 tot 323 K. |
±3,0 K |
ASTM D 97-66 |
1.6. BESCHRIJVING VAN DE TESTMETHODEN
De aan te houden werkwijzen van bijna alle testmethoden staan beschreven in internationale en nationale normen (zie aanhangsel 1).
1.6.1. Methoden waarbij gebruik wordt gemaakt van een capillair
Bij een trage temperatuurstijging zullen verpulverde stoffen doorgaans volgens de in figuur 1 weergegeven stadia verlopen.
Figuur 1

Tijdens de smelttemperatuurbepaling wordt de temperatuur in het begin- en eindstadium van het smeltproces geregistreerd.
1.6.1.1. Toestellen ter bepaling van de smelttemperatuur met behulp van een vloeistofbad
In figuur 2 is een genormaliseerd glazen apparaat voor smelttemperatuurbepaling (JIS K 0064) afgebeeld. Alle specificaties zijn opgegeven in mm.
Figuur 2

Badvloeistof
Er moet een geschikte badvloeistof bepaald worden. De keuze van de vloeistof is afhankelijk van de smelttemperatuur van de te onderzoeken stof, bijvoorbeeld vloeibare paraffine voor stoffen met een smelttemperatuur van maximaal 473 K, siliconenolie voor stoffen met een smelttemperatuur van maximaal 573 K.
Voor stoffen met een smelttemperatuur hoger dan 523 K kan een mengsel, bestaande uit drie delen zwavelzuur en twee delen kaliumsulfaat (naar massa), worden gebruikt. Passende voorzorgsmaatregelen dienen te worden genomen wanneer een dergelijk mengsel wordt gebruikt.
Thermometer
Er mag alleen gebruik worden gemaakt van thermometers die aan de eisen in de volgende of daarmee overeenkomende normen voldoen:
ASTM E 1-71, DIN 12770, JIS K 8001.
Werkwijze
De droge stof wordt verpulverd in een mortier en in een aan één uiteinde dichtgesmolten capillair gebracht en wel zo dat het niveau van de vulling, nadat de stof stevig is aangedrukt, circa 3 mm bedraagt. Teneinde een gelijkvormig aangedrukt monster te verkrijgen, laat men het capillair vanaf een hoogte van circa 700 mm door een glazen buis verticaal op een horlogeglas vallen.
Het gevulde capillaire buisje wordt in een bad geplaatst en wel zo dat het midden van de kwikbol van de thermometer het capillair ter hoogte van het monster aanraakt. Doorgaans wordt het capillair in het toestel gebracht bij ongeveer 10 K beneden de smelttemperatuur.
De badvloeistof wordt zodanig verwarmd dat de temperatuurstijging circa 3 K/min bedraagt. De vloeistof moet worden geroerd. Bij ongeveer 10 K beneden de verwachte smelttemperatuur wordt de snelheid van de temperatuurstijging ingesteld op ten hoogste 1 K/min.
Berekening
De smelttemperatuur wordt als volgt berekend:
T = TD + 0,00016 (TD - TE) n
waarin:
|
T |
= |
de gecorrigeerde smelttemperatuur, uitgedrukt in K |
|
TD |
= |
de van thermometer D afgelezen temperatuur, in K |
|
TE |
= |
de van thermometer E afgelezen temperatuur, in K |
|
n |
= |
het aantal schaalverdelingen van het kwikdraad op het uitstekende gedeelte van thermometer D. |
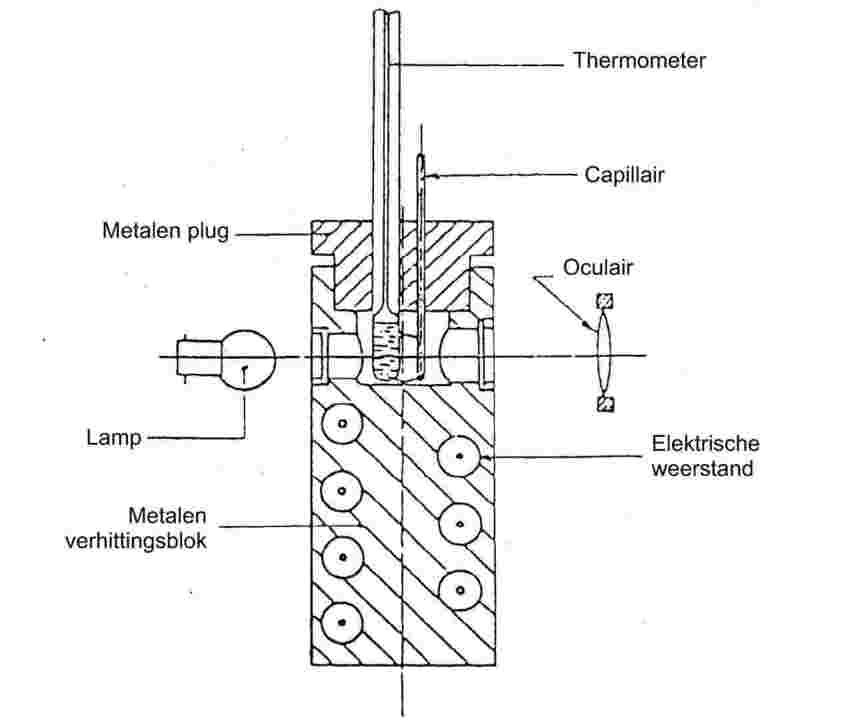
1.6.1.2. Toestellen ter bepaling van de smelttemperatuur met behulp van een metalen blok
Apparatuur
De apparatuur bestaat uit:
|
— |
een cilindervormig metalen blok, waarvan het bovenste gedeelte hol is en een kamer vormt (zie figuur 3); |
|
— |
een metalen stop met twee of meer openingen waarlangs buisjes in het metalen blok kunnen worden gebracht; |
|
— |
een verwarmingssysteem voor het metalen blok, bijvoorbeeld een in het blok ingesloten elektrische weerstand; |
|
— |
een regelbare weerstand voor de stroomtoevoer, indien van elektrische verwarming gebruik wordt gemaakt; |
|
— |
in de zijwanden van de kamer, in rechte hoeken ten opzichte van elkaar, vier vensters van hittebestendig glas; voor één van deze vensters is een oculair aangebracht, waardoor het capillair kan worden waargenomen, de overige drie vensters worden gebruikt voor de verlichting van de kamer en inhoud daarvan; |
|
— |
een aan één uiteinde gesloten capillair van hittebestendig glas (zie 1.6.1.1). |
Thermometer
Zie de in 1.6.1.1 genoemde normen. Thermo-elektrische meetinstrumenten van vergelijkbare nauwkeurigheid kunnen ook worden gebruikt.
Figuur 3
1.6.1.3. Fotoceldetectie
Apparatuur en werkwijze:
Het apparaat bestaat uit een metalen kamer met een geautomatiseerd verwarmingssysteem. Drie capillairen worden overeenkomstig 1.6.1.1 gevuld en in de oven geplaatst.
Er zijn verscheidene lineaire temperatuurstijgingen beschikbaar voor het ijken van het apparaat; de gewenste temperatuurstijging wordt elektrisch ingesteld met een van tevoren gekozen constante snelheid en heeft een lineair verloop. Recorders geven de werkelijke oventemperatuur en de temperatuur van de stof in het capillair aan.
1.6.2. Verwarmde oppervlakken (hot stages)
1.6.2.1. De verhitte staaf volgens Kofier
Zie aanhangsel.
1.6.2.2. Smeltpuntmicroscoop
Zie aanhangsel.
1.6.2.3. Meniscusmethode (polyamiden)
Zie aanhangsel.
De opwarmsnelheid bij temperaturen in de buurt van de smelttemperatuur moet minder zijn dan 1 K/min.
1.6.3. Methoden voor de vriestemperatuurbepaling
Zie aanhangsel.
1.6.4. Thermische analyse
1.6.4.1. Differentiële thermische analyse
Zie aanhangsel.
1.6.4.2. Differentiële scanningcalorimetrie
Zie aanhangsel.
1.6.5. Bepaling van het vloeipunt
Zie aanhangsel.
2. GEGEVENS
Soms is een thermometercorrectie noodzakelijk.
3. RAPPORTAGE
In het eindverslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
de gebruikte methode; |
|
— |
de nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen) en, indien van toepassing, voorafgaande zuivering; |
|
— |
een schatting van de nauwkeurigheid. |
Het gemiddelde van ten minste twee metingen die binnen de geschatte nauwkeurigheidsgrenzen (zie tabellen) vallen, wordt gerapporteerd als smelttemperatuur,
Als het temperatuurverschil tussen het beginpunt en het eindpunt van het smelten binnen de nauwkeurigheidsgrenzen van de methode valt, wordt de temperatuur van het eindstadium genomen als de smelttemperatuur; zo niet, dan moeten beide temperaturen worden gerapporteerd.
Als ontleding of sublimatie van de onderzochte stof optreedt voordat de smelttemperatuur is bereikt, dient de temperatuur waarbij dit effect optreedt, te worden gerapporteerd.
Alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof, dienen te worden gerapporteerd.
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 102 — Decision of the Council C(81) 30 Final. |
|
(2) |
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, vol. II, 803-834. |
|
(3) |
R. Weissberger ed.: Technique of organic chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I, Chapter VII. |
|
(4) |
IUPAC, Physicochemical Measurements: Catalogue of Reference Materials from National Laboratories, Pure and Applied Chemistry, 1976, Vol. 48, 505-515. |
Aanhangsel
Voor aanvullende technische gegevens kunnen de volgende normen als voorbeeld worden geraadpleegd.
1. Capillaire methoden
1.1. Smelttemperatuurtoestellen met een vloeistofbad
|
ASTM E 324-69 |
Standard test method for relative initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapillarverfahren |
|
JIS K 00-64 |
Testing methods for melting point of chemical products |
1.2. Smelttemperatuurtoestellen met een metalen blok
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics — polyamides — determination of „melting point” |
2. Hete oppervlakken
2.1. Verwarmde staaf volgens Kofler
|
ANSI/ASTM D 3451-76 |
Standard recommended practices for testing polymeric powder coatings |
2.2. Smeltpuntmicroscoop
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3. Meniscusmethode (polyamiden)
|
ISO 1218 (E) |
Plastics — polyamides — determination of „melting point” |
|
ANSI/ASTM D 2133-66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51-050 |
Résines de polyamides. Determination du „point de fusion”. Méthode du ménisque. |
3. Methoden voor vriestemperatuurbepaling
|
BS 4633 |
Method for the determination of crystallizing point |
|
BS 4695 |
Method for determination of melting point of petroleum wax (cooling curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de pétrole: détermination de la température de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsäuren |
|
NF T 60-114 |
Point de fusion des paraffines |
|
NF T 20-051 |
Méthode de détermination du point de cristallisation (point de congélation) |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Thermische analyse
4.1. Differentiële thermische analyse
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2. Differentiële scanningcalorimetrie
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Bepaling van het vloeipunt
|
NBN 52014 |
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d'écoulement limite — Monsterneming en ontleding van aardolieprodukten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils — Determination of pour point |
A.2. KOOKTEMPERATUUR
1. METHODE
De meeste van de beschreven methoden berusten op de testrichtlijn van de OESO (1). De fundamentele principes worden besproken in de referenties (2) en (3).
1.1. INLEIDING
De hier beschreven methoden en toestellen kunnen worden toegepast op vloeistoffen en op bij lage temperatuur smeltende stoffen, welke beneden de kooktemperatuur geen chemische reactie ondergaan (bijvoorbeeld: auto-oxidatie, omlegging, ontleding, enz.). De methoden zijn van toepassing op zuivere en onzuivere vloeistoffen.
De meeste aandacht wordt gegeven aan de fotoceldetectiemethode en thermische analysemethode, omdat hiermee zowel smelt- als kooktemperaturen kunnen worden bepaald. Bovendien kunnen deze metingen worden geautomatiseerd.
Het voordeel van de dynamische methode is, dat deze ook kan worden toegepast voor de bepaling van de dampspanning en dat het niet nodig is de kooktemperatuur te corrigeren tot normale druk (101,325 kPa) omdat de normale druk tijdens de meting kan worden ingesteld met behulp van een manostaat.
Opmerkingen:
De invloed van verontreinigingen op de bepaling van de kooktemperatuur is sterk afhankelijk van de aard van de verontreiniging. Indien in het monster vluchtige verontreinigingen aanwezig zijn, die de resultaten zouden kunnen beïnvloeden, kan de stof worden gezuiverd.
1.2. DEFINITIES EN EENHEDEN
De normale kooktemperatuur wordt gedefinieerd als de temperatuur waarbij de dampdruk van een vloeistof gelijk is aan 101,325 kPa.
Als de kooktemperatuur niet wordt gemeten bij normale atmosferische druk, kan de temperatuurafhankelijkheid van de dampdruk worden beschreven met de vergelijking van Clausius-Clapeyron:
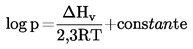
|
p |
= |
de dampspanning van de stof in pascal (Pa) |
|
ΔHv |
= |
de verdampingswarmte in J mol-1 |
|
R |
= |
de universele molaire gasconstante = 8,314 J mol-1 K-1 |
|
T |
= |
de thermodynamische temperatuur in K. |
Bij vermelding van de kooktemperatuur moet de druk tijdens de meting worden opgegeven.
Herleidingen
Druk (eenheid: kPa)
|
100 kPa |
= |
1 bar = 0,1 MPa („bar” is nog toegestaan, doch het gebruik hiervan wordt niet aanbevolen). |
|
133 Pa |
= |
1 mm Hg = 1 Torr (de eenheden mm Hg en Torr zijn niet meer toegestaan). |
|
1 atm |
= |
standaardatmosfeer = 101 325 Pa (de eenheid „atm” is niet toegestaan). |
Temperatuur (eenheid: K)
t = T - 273,15
|
t |
: |
Celsiustemperatuur, graden Celsius (oC) |
|
T |
: |
thermodynamische temperatuur, kelvin (K) |
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Referentiestoffen zijn in de eerste plaats bedoeld om zo nu en dan de werking van de methode te controleren en om vergelijking met de resultaten van andere methoden mogelijk te maken.
Een aantal ijkstoffen is te vinden in de methoden die zijn opgenomen in het aanhangsel.
1.4. PRINCIPE VAN DE TESTMETHODEN
Vijf methoden voor de bepaling van de kooktemperatuur (of kooktraject) berusten op de meting van de kooktemperatuur, twee andere op thermische analyse.
1.4.1. Bepaling met behulp van een ebullioscoop
De ebullioscoop is oorspronkelijk ontwikkeld voor de bepaling van het molecuulgewicht via de kooktemperatuurverhoging, doch leent zich ook voor nauwkeurige metingen van de kooktemperatuur. Een zeer eenvoudig toestel is beschreven in ASTM D 1120-72 (zie aanhangsel). De vloeistof wordt in dit toestel onder evenwichtscondities bij atmosferische druk verwarmd totdat zij kookt.
1.4.2. Dynamische methode
Bij deze methode meet men de condensatietemperatuur van de damp met behulp van een geschikte thermometer in de reflux tijdens het koken. De druk kan bij deze methode worden gevarieerd.
1.4.3. Destillatiemethode voor kooktemperatuur
Bij deze methode destilleert men de vloeistof en meet men de condensatietemperatuur van de damp, alsmede de hoeveelheid destillaat.
1.4.4. Methode volgens Siwoloboff
Bij deze methode verwarmt men het monster in een monsterbuisje, dat in een verwarmd vloeistofbad wordt gehouden. Een dichtgesmolten capillair met een luchtbel onderin wordt in het monsterbuisje gebracht.
1.4.5. Fotoceldetectie
Naar het beginsel volgens Siwoloboff worden de opstijgende bellen automatisch gemeten met een fotocel.
1.4.6. Differentiële thermische analyse
Met deze techniek wordt het verschil in temperatuur geregistreerd tussen de te onderzoeken stof en een referentiestof als functie van de temperatuur, wanneer beide stoffen aan hetzelfde gecontroleerde temperatuurprogramma worden blootgesteld. Als het monster een faseovergang doormaakt met verandering van enthalpie, zal deze verandering aangetoond worden door een endotherme afwijking (koken) van de basislijn van de temperatuurregistratie.
1.4.7. Differentiële scanningcalorimetrie
Deze techniek registreert het verschil tussen de energieopname van de te onderzoeken stof en een referentiestof als functie van de temperatuur, wanneer beide stoffen aan hetzelfde gecontroleerde temperatuurprogramma worden onderworpen. Deze energie is de energie die nodig is om dezelfde temperatuur voor beide stoffen te bereiken. Als het monster een faseovergang doormaakt met verandering van enthalpie zal deze verandering aangetoond worden door een endotherme afwijking (koken) van de basislijn van de warmtestroomregistratie.
1.5. KWALITEITSCRITERIA
De toepasbaarheid en nauwkeurigheid van de verschillende methoden voor de bepaling van de kooktemperatuur/kooktraject staan vermeld in tabel 1.
Tabel 1
Vergelijking van de methoden
|
Meetmethode |
Geschatte nauwkeurigheid |
Bestaande norm |
|
Ebullioscoop |
ASTM D 1120-72 (5) |
|
|
Dynamische methode |
±0,5 K (tot 600 K) (6) |
|
|
Destillatiemethode (kooktraject) |
±0,5 K (tot 600 K) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Volgens Siwoloboff |
± 2 K (tot 600 K) (6) |
|
|
Fotoceldetectie |
±0,3 K (bij 373 K) (6) |
|
|
Differentiële thermische analyse |
±0,5 K (tot 600 K) ±2,0 K (tot 1 273 K) |
ASTM E 537-76 |
|
Differentiële scanningcalorimetrie |
±0,5 K (tot 600 K) ±2,0 K (tot 1 273 K) |
ASTM E 537-76 |
1.6. BESCHRIJVING VAN DE METHODEN
De werkwijzen van een aantal testmethoden zijn beschreven in internationale en nationale normen (zie aanhangsel).
1.6.1. Ebullioscoop
Zie aanhangsel.
1.6.2. Dynamische methode
Zie testmethode A.4 voor de bepaling van de dampspanning.
De waargenomen kooktemperatuur bij een druk van 101,325 kPa wordt geregistreerd.
1.6.3. Destillatiemethode (kooktraject)
Zie aanhangsel.
1.6.4. Methode volgens Siwoloboff
Het monster wordt verwarmd in een smelttemperatuurtoestel in een monsterbuisje met een diameter van ongeveer 5 mm (figuur 1).
In figuur 1 staat een standaardapparaat voor de bepaling van de smelt- en kooktemperatuur (JIS K 0064) afgebeeld (glas, alle afmetingen in mm).
Figuur 1

Een capillair (kookcapillair) dat op ongeveer 1 cm boven het ondereind is dichtgesmolten, wordt in het monsterbuisje gebracht. Het monsterbuisje wordt met de te onderzoeken stof gevuld, totdat het dichtgesmolten deel van het capillair zich onder het vloeistofoppervlak bevindt. Het monsterbuisje met het kookcapillair wordt met een elastiekje aan de thermometer bevestigd of met een zijstuk vastgezet (zie figuur 2).
|
Figuur 2 Beginsel volgens Siwoloboff |
Figuur 3 Gewijzigd beginsel |
|
|
|
De badvloeistof wordt gekozen aan de hand van de kooktemperatuur. Bij temperaturen tot 573 K kan siliconenolie worden gebruikt. Vloeibare paraffine mag slechts worden gebruikt bij temperaturen tot 473 K. De verwarming van het vloeistofbad moet zo geregeld zijn, dat de temperatuur aanvankelijk 3 K/min stijgt. Het vloeistofbad moet worden geroerd. Bij ongeveer 10 K beneden de verwachte kooktemperatuur moet de verwarming zo worden ingesteld dat de temperatuur met minder dan 1 K/min stijgt. Zodra de kooktemperatuur wordt bereikt, beginnen er snel belletjes uit het kookcapillair te komen.
De kooktemperatuur wordt bereikt wanneer, bij tijdelijke afkoeling, de bellenvorming stopt en de vloeistof plotseling in het capillair omhoog komt. De bijbehorende stand van de thermometer is de kooktemperatuur van de te onderzoeken stof.
Bij het gewijzigd beginsel (figuur 3) wordt de kooktemperatuur bepaald in een smelttemperatuurcapillair. Deze wordt uitgetrokken tot een fijne punt van ongeveer 2 cm lengte, waarin een geringe hoeveelheid van het monster wordt opgezogen. Het open einde van de fijne punt wordt dicht gesmolten, zodat er zich onderin een kleine luchtbel bevindt (a). Bij verwarming in het smelttemperatuur toestel (b) zet de luchtbel uit. De kooktemperatuur komt overeen met de temperatuur waarbij de prop van de te onderzoeken stof op het niveau van het vloeistofoppervlak komt (c).
1.6.5. Fotoceldetectie
Het monster wordt verwarmd in een capillair in een verwarmd metaalblok.
Via geschikte openingen in het blok wordt een lichtbundel door de stof heen op een zorgvuldig geijkte fotocel gericht.
Terwijl de temperatuur van het monster oploopt, komen er luchtbellen uit het kookcapillair. Wanneer de kooktemperatuur wordt bereikt, neemt het aantal bellen flink toe. Hierbij verandert de intensiteit van het licht dat op de cel valt, waardoor het apparaat wordt stilgezet dat de temperatuur afleest van een thermometer met platina weerstand die in het blok is gemonteerd.
Deze methode is bijzonder nuttig omdat hiermee ook bepalingen mogelijk zijn beneden kamertemperatuur tot 253,15 K (– 20 oC) zonder enige veranderingen in de apparatuur. Het instrument moet alleen in een koelbad worden geplaatst.
1.6.6. Thermische analyse
1.6.6.1. Differentiële thermische analyse
Zie aanhangsel.
1.6.6.2. Differentiële scanningcalorimetrie
Zie aanhangsel.
2. GEGEVENS
Bij kleine afwijkingen van de normale druk (max. ± 5 kPa) worden de kooktemperaturen genormaliseerd tot Tn met behulp van de volgende numerieke vergelijking van Sidney Young:
Tn = T + (fT x Δ p)
waarin:
|
Δ p |
= |
(101,325 - p), [let op het teken] |
|
p |
= |
barometerstand in kPa, |
|
fT |
= |
tempo waarin de kooktemperatuur verandert met de druk in K/kPa, |
|
T |
= |
gemeten kooktemperatuur in K, |
|
Tn |
= |
kooktemperatuur gecorrigeerd tot normale druk in K. |
De temperatuurcorrectiefactoren fT en de vergelijkingen voor de benadering daarvan zijn opgenomen in de internationale en nationale normen die hierboven voor een groot aantal stoffen zijn genoemd.
Zo worden bijvoorbeeld in de methode DIN 53171 de volgende (bij benadering) correcties vermeld voor oplosmiddelen in verf (zie tabel 2).
Tabel 2:
Temperatuurcorrectiefactoren fT
|
Temperatuur T (K) |
Correctiefactor fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,44 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. RAPPORTAGE
In het eindverslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
de gebruikte methode; |
|
— |
een nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen) en, indien van toepassing, voorafgaande zuivering; |
|
— |
een schatting van de nauwkeurigheid. |
Het gemiddelde van ten minste twee metingen die binnen de geschatte nauwkeurigheidsgrenzen (zie tabel 1) vallen, wordt genoteerd als kooktemperatuur.
De gemeten kooktemperaturen en hun gemiddelde moeten worden opgegeven, alsmede de druk(ken), waarbij de metingen zijn uitgevoerd, in kPa. De druk dient bij voorkeur dicht bij de normale atmosferische druk te liggen.
Alle gegevens en opmerkingen, die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof, dienen te worden gerapporteerd.
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 103 — Decision of the Council C(81)30 Final. |
|
(2) |
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Burterworths, London, 1975, vol. II. |
|
(3) |
R. Weissberger ed.: Technique of organic chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol.I, Part I, Chapter VIII. |
Aanhangsel
Voor aanvullende technische gegevens kunnen de volgende normen als voorbeeld worden geraadpleegd:
1. Ebullioscoop
|
ASTM D 1120-72 |
Standard Test Method for Boiling Point of Engine Anti-freezes |
2. Destillatieprocess (kooktraject)
|
ISO/R 918 |
Test Method for Distillation (Disrillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Lösungsmittel für Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation: détermination du rendement et de l'intervalle de distillation |
3. Differentiële thermische analyse en differentiële scanningcalorimetrie
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse: Begriffe |
A.3. RELATIEVE DICHTHEID
1. METHODE
De beschreven methoden berusten op de testrichtlijn van de OESO (1). De fundamentele principes worden besproken in referentie (2).
1.1. INLEIDING
De hieronder beschreven methoden voor het bepalen van de relatieve dichtheid zijn van toepassing op vaste stoffen en op vloeistoffen, ongeacht de zuiverheid van deze stoffen. De verschillende methoden zijn vermeld in tabel 1.
1.2. DEFINITIES EN EENHEDEN
De relatieve dichtheid, D20/4, van vaste stoffen of vloeistoffen is de verhouding tussen de massa van een volume te onderzoeken stof bij 20 oC en de massa van hetzelfde volume water bij 4 oC. De relatieve dichtheid heeft geen dimensie.
De dichtheid, p, van een stof is het quotiënt van de massa m en het volume v van deze stof.
De dichtheid, p, wordt uitgedrukt in kg/m3 (SI-eenheden).
1.3. REFERENTIESTOFFEN (1) (3)
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om zo nu en dan de werking van de methode te controleren en om vergelijkingen met resultaten van andere methodes mogelijk te maken.
1.4. PRINCIPE VAN DE TESTMETHODEN
Er worden vier soorten methoden gebruikt.
1.4.1. Methoden gebaseerd op de opwaartse kracht
1.4.1.1. Areometer (hydrometer voor vloeistoffen)
Voldoende nauwkeurige en snelle dichtheidsbepalingen kunnen worden uitgevoerd met drijvende areometers; het gedeelte van de areometer dat in de vloeistof zakt, is bepalend voor de dichtheid van de vloeistof en kan van een schaalverdeling worden afgelezen.
1.4.1.2. Hydrostatische balans (voor vloeistoffen en vaste stoffen)
Het gewichtsverschil van een monster, gemeten in lucht en in een geschikte vloeistof (bijvoorbeeld water), kan worden gebruikt om de dichtheid ervan te bepalen.
Voor vaste stoffen geldt de gemeten dichtheid slechts voor het bewuste monster. Voor het bepalen van de dichtheid van vloeistoffen wordt een voorwerp met volume v eerst in lucht en vervolgens in de testvloeistof gewogen.
1.4.1.3. Methode met ondergedompeld voorwerp (voor vloeistoffen) (4)
Bij deze methode wordt de dichtheid van een vloeistof bepaald aan de hand van het verschil tussen de resultaten van een weging van de vloeistof voor en na het onderdompelen van een voorwerp met bekend volume in de te onderzoeken vloeistof.
1.4.2. Methoden met de pyknometer
Voor vaste stoffen en vloeistoffen kunnen pyknometers van uiteenlopende vorm en met bekend volume worden gebruikt. De dichtheid wordt berekend uit het verschil in gewicht tussen de volle en de lege pyknometer en het bekende volume daarvan.
1.4.3. Vergelijkingspyknometer met lucht (voor vaste stoffen)
De dichtheid van een vaste stof in willekeurige vorm kan bij kamertemperatuur worden gemeten met behulp van een gasvergelijkingspyknometer. Het volume van een stof wordt in lucht of in een inert gas gemeten in een cilinder waarvan het variabele volume gekalibreerd is. Voor de berekening van de dichtheid wordt na meting van het volume een massameting verricht.
1.4.4. Oscillerende dichtheidsmeter (5) (6) (7)
De dichtheid van een vloeistof kan worden gemeten met behulp van een oscillerende dichtheidsmeter. Een mechanische oscillator in de vorm van een U-buis wordt in trilling gebracht bij de resonantiefrequentie van de oscillator die afhankelijk is van zijn massa. Bij het inbrengen van een monster verandert de resonantiefrequentie van de oscillator. Het apparaat moet worden geijkt met twee vloeistoffen van bekende dichtheid. Deze ijkstoffen moeten bij voorkeur zo worden gekozen dat de dichtheden ervan zich aan de uiteinden van het meetbereik bevinden.
1.5. KWALITEITSCRITERIA
De toepasbaarheid van de verschillende methoden voor bepaling van de relatieve dichtheid staat vermeld in de tabel.
1.6. BESCHRIJVING VAN DE TESTMETHODEN
Normen, die als voorbeeld kunnen worden geraadpleegd voor aanvullende technische gegevens, zijn bijgevoegd in het aanhangsel.
De proeven moeten worden uitgevoerd bij 20 oC en ten minste in tweevoud.
2. GEGEVENS
Zie normen.
3. RAPPORTAGE
In het eindverslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
de gebruikte methode; |
|
— |
een nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen) en, indien van toepassing, voorafgaande zuivering. |
De relatieve dichtheid  dient te worden gerapporteerd zoals gedefinieerd onder 1.2, alsmede de fysische toestand van de onderzochte stof.
dient te worden gerapporteerd zoals gedefinieerd onder 1.2, alsmede de fysische toestand van de onderzochte stof.
Alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof, dienen te worden gerapporteerd.
Tabel
Toepasbaarheid van de methoden
|
Meetmethode |
Dichtheid |
Maximale dynamische viscositeit |
Bestaande norm |
|||
|
Vaste stof |
Vloeistof |
|||||
|
|
Ja |
5 Pa s |
ISO 387, ISO 649-2, NF T 20-050 |
||
|
|
|
|
|
||
|
Ja |
|
|
ISO 1183 (A) |
||
|
|
Ja |
5 Pa S |
ISO 901 en 758 |
||
|
|
Ja |
20 Pa s |
DIN 53217 |
||
|
|
|
|
ISO 3507 |
||
|
Ja |
|
|
ISO 1183 (B), NF T 20-053 |
||
|
|
Ja |
500 Pa s |
ISO 758 |
||
|
Ja |
|
|
DIN 55990 deel 3, DIN 53243 |
||
|
|
Ja |
5 Pa s |
|
||
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 109, Decision of the Council C(81) 30 final. |
|
(2) |
R. Weissberger ed., Technique of organic chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ., New York, 1959, vol. I, Part I. |
|
(3) |
IUPAC, Recommended reference materials for realisation of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, 508. |
|
(4) |
Wagenbreth, H., Die Tauchkugei zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm; 1979, Vol. 11, 427-430. |
|
(5) |
Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19, 297-302. |
|
(6) |
Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen — Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, 717-726. |
|
(7) |
Riemann, J., Der Einsatz der digitalen Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, 253-255. |
Aanhangsel
Voor aanvullende technische gegevens kunnen de volgende normen als voorbeeld worden geraadpleegd:
1. Methoden gebaseerd op de opwaartse kracht
1.1. Areometer
|
DIN 12790, ISO 387 |
Areometer; algemene aanwijzingen |
|
DIN 12791 |
Deel I: Dichtheidsareometers: constructie, instelling en gebruik Deel II: Dichtheidsareometers: genormaliseerde maten, benaming Deel III: Gebruik en test |
|
ISO 649-2 |
Laboratoriumglaswerk: Dichtheidsareometers voor algemeen gebruik |
|
NF T 20-050 |
Chemische producten voor industrieel gebruik — Bepaling van dichtheid van vloeistoffen — Areometermethode |
|
DIN 12793 |
Laboratoriumglaswerk: areometers voor bepaling van het meetbereik |
1.2. Hydrostatische balans
Voor vaste stoffen
|
ISO 1183 |
Methode A: Methoden voor het bepalen van de dichtheid en relatieve dichtheid van kunststoffen met uitzondering van schuimplastics |
|
NF T 20-049 |
Chemische producten voor industrieel gebruik — Bepaling van dichtheid van vaste stoffen uitgezonderd poeders en schuimproducten — Hydrostatische balansmethode |
|
ASTM D 792 |
Soortelijk gewicht en dichtheid van kunststoffen door verplaatsing |
|
DIN 53479 |
Proeven voor kunststoffen en elastomeren: bepaling van de dichtheid |
Voor vloeistoffen
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Proeven voor minerale oliën en verwante materialen: bepaling van de dichtheid |
|
ASTM D 941-55, ASTM D 1296-67 en ASTM D 1481-62 |
|
|
ASTM D 1298 |
Dichtheid, soortelijk gewicht of API-gewicht van ruwe aardolie en vloeibare aardolieproducten met de areometermethode |
|
BS 4714 |
Dichtheid, soortelijk gewicht of API-gewicht van ruwe aardolie en vloeibare aardolieproducten met de areometermethode |
1.3. Methode met ondergedompeld voorwerp
|
DIN 53217 |
Proeven voor verf, vernis en soortgelijke producten; dichtheidsbepaling met de methode met ondergedompeld voorwerp |
2. Pyknometermethoden
2.1. Voor vloeistoffen
|
ISO 3507 |
Pyknometers |
|
ISO 758 |
Vloeibare chemische producten; bepaling van de dichtheid bij 20 oC |
|
DIN 12797 |
Gay-Lussac pyknometer (voor niet-vluchtige vloeistoffen die niet al te visceus zijn) |
|
DIN 12798 |
Lipkin pyknometer (voor vloeistoffen met een kinematische viscositeit van minder dan 100.10-6 m2 s-1 bij 15 oC) |
|
DIN 12800 |
Sprengel pyknometer (voor vloeistoffen zoals in DIN 12798) |
|
DIN 12801 |
Reischauer pyknometer (voor vloeistoffen met een kinematische viscositeit van minder dan 100.10-6 m2 s -1 bij 20 oC, vooral ook toepasbaar op koolwaterstoffen en oplossingen in water, alsmede op vloeistoffen met een hogere dampdruk, ongeveer 1 bar bij 90 oC) |
|
DIN 12806 |
Hubbard pyknometer (voor alle soorten visceuze vloeistoffen met een niet al te hoge dampdruk, in het bijzonder voor verven, vernissen en bitumen) |
|
DIN 12807 |
Bingham pyknometer (voor vloeistoffen zoals in DIN 12801) |
|
DIN 12808 |
Jaulmes pyknometer (in het bijzonder voor mengsels van ethanol en water) |
|
DIN 12809 |
Pyknometer met ingeslepen thermometer en capillaire zijbuis (voor vloeistoffen die niet al te visceus zijn) |
|
DIN 53217 |
Proeven voor verven, vernissen en soortgelijke producten; bepaling van de dichtheid met behulp van een pyknometer |
|
DIN 51757 |
Punt 7: Proeven voor minerale oliën en verwante materialen; bepaling van de dichtheid |
|
ASTM D 297 |
Hoofdstuk 15: Rubberproducten — chemische analyse |
|
ASTM D 2111 |
Methode C: Organische halogeenverbindingen |
|
BS 4699 |
Methode voor het bepalen van soortelijk gewicht en dichtheid van aardolieproducten (met behulp van een bicapillaire pyknometer met schaalverdeling) |
|
BS 5903 |
Methode voor het bepalen van de relatieve dichtheid en dichtheid van aardolieproducten met behulp van een pyknometer met capillaire stop |
|
NF T 20-053 |
Chemische producten voor industrieel gebruik — Bepaling van dichtheid van vaste stoffen in poeders en vloeistoffen — Pyknometermethode |
2.2. Voor vaste stoffen
|
ISO 1183 |
Methode B: Methode voor het bepalen van de dichtheid en relatieve dichtheid van kunststoffen, met uitzondering van schuimplastics |
|
NF T 20-053 |
Chemische producten voor industrieel gebruik — Bepaling van dichtheid van vaste stoffen in poeder en vloeistoffen — Pyknometermethode |
|
DIN 19683 |
Bepaling van de bodemdichtheid |
3. Vergelijkingspyknometer met lucht
|
DIN 55990 |
Deel 3: Prüfung von Anstrichstoffen und ahnlichen Beschichrungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; chlorhaltige Polymere; Prüfung |
A.4. DAMPSPANNING
1. METHODE
De meeste van de beschreven methoden berusten op de testrichtlijn van de OESO (1). De fundamentele principes worden besproken in referenties (2) en (3).
1.1. INLEIDING
Voor het uitvoeren van deze test is het nuttig om van tevoren te beschikken over gegevens inzake de structuur, de smelttemperatuur en de kooktemperatuur van de stof.
Er bestaat geen meetmethode die voor alle mogelijke waarden van de dampspanning van toepassing is. Er worden daarom verschillende methoden aanbevolen voor het meten van de dampspanning van < 10-4 tot 105 Pa.
In de regel zal de dampspanning door verontreinigingen worden beïnvloed; de mate van beïnvloeding is sterk afhankelijk van de soort verontreiniging.
Indien er vluchtige verontreinigingen in het monster voorkomen, die het resultaat zouden kunnen beïnvloeden, kan het monster gezuiverd worden. Het kan tevens nuttig zijn om de dampdruk op te geven van technisch zuiver materiaal.
Bij sommige van de hier beschreven methoden gebruikt men apparaten met metalen onderdelen; bij het testen van corrosieve stoffen dient hiermee rekening gehouden te worden.
1.2. DEFINITIES EN EENHEDEN
De dampspanning van een stof wordt gedefinieerd als de druk van de damp van die stof bij verzadiging boven een vaste stof of vloeistof. Bij thermodynamisch evenwicht is de dampspanning van een zuivere stof alleen een functie van temperatuur.
De SI-eenheid van druk die moet worden gebruikt, is de pascal (Pa).
Enkele tot nu toe gebruikte eenheden en hun omrekeningsfactoren zijn:
|
1 torr (≡ 1 mm Hg) |
= 1,333 × 102 Pa |
|
1 atmosfeer |
= 1,013 × 105 Pa |
|
1 bar |
= 105 Pa. |
De SI-eenheid van temperatuur is de kelvin (K).
De universele molaire gasconstante R is 8,314 J mol-1 K-1.
De temperatuurafhankelijkheid van de dampdruk wordt beschreven met de vergelijking van Clausius-Clapeyron:

waarin:
|
p |
= |
de dampspanning van de stof in pascal (Pa) |
|
ΔHv |
= |
de verdampingswarmte in J mol-1 |
|
R |
= |
de universele molaire gasconstante in J mol-1 K-1 |
|
T |
= |
de thermodynamische temperatuur in K. |
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om zo nu en dan de werking van de methode te controleren en om vergelijkingen met resultaten van andere methoden mogelijk te maken.
1.4. PRINCIPE VAN DE TESTMETHODEN
Voor het bepalen van de dampspanning worden zeven methoden voorgesteld die in verschillende meetbereiken van de dampspanning kunnen worden toegepast. In elke methode wordt de dampspanning bepaald bij verschillende temperaturen. Binnen een beperkt temperatuurbereik is de logaritme van de dampspanning van een zuivere stof een lineaire functie van de reciproke waarde van de temperatuur.
1.4.1. Dynamische methode
In de dynamische methode wordt de kooktemperatuur bij een bepaalde druk gemeten.
Aanbevolen meetbereik:
van 103 Pa tot 105 Pa.
Deze methode wordt ook aanbevolen voor de bepaling van de normale kooktemperatuur en is voor dat doel bruikbaar tot 600 K.
1.4.2. Statische methode
In de statische methode wordt de dampspanning bij thermodynamisch evenwicht in een afgesloten systeem bepaald bij een bepaalde temperatuur. Deze methode is geschikt voor vaste stoffen en vloeistoffen bestaande uit een of meer componenten.
Aanbevolen meetbereik:
van 10 Pa tot 105 Pa.
Deze methode kan ook worden gebruikt in het bereik van 1 tot 10 Pa mits voorzichtigheid in acht wordt genomen.
1.4.3. Isoteniscoop
Deze genormaliseerde methode is ook een statische methode, maar is in het algemeen niet geschikt voor systemen met meerdere componenten. Meer gegevens zijn beschikbaar in ASTM-methode D-2879-86.
Aanbevolen meetbereik:
van 100 Pa tot 105 Pa.
1.4.4. Effusiemethode: Dampspanningsbalans
De hoeveelheid stof die een cel per tijdseenheid verlaat door een opening met bekende afmetingen, wordt bepaald onder vacuümomstandigheden, waarbij terugkeer van de stof naar de cel verwaarloosbaar is (bijvoorbeeld door meting van de kracht welke door een dampstroom op een gevoelige balans wordt uitgeoefend of door meting van de afname van het gewicht).
Aanbevolen meetbereik:
van 10-3 Pa tot 1 Pa.
1.4.5. Effusiemethode: Door middel van afname van gewicht of met dampval
Deze methode berust op een bepaling van de massa van de te onderzoeken stof die per tijdseenheid in de vorm van damp door een gekalibreerde micro-opening uit een Knudsencel (4) stroomt, in ultravacuümtoestand. De hoeveelheid uitgestroomde dampmassa kan verkregen worden door bepaling van de afname van de massa van de cel, of door condensatie van de damp bij lage temperatuur en bepaling van de hoeveelheid verdampte stof met behulp van chromatografische analyse. De dampspanning wordt berekend door toepassing van de Hertz-Knudsen-vergelijking.
Aanbevolen meetbereik:
van 10-3 Pa tot 1 Pa.
1.4.6. Gasverzadigingsmethode
Een stroom inert dragergas wordt over de stof geleid, zodat het gas verzadigd wordt met de damp van de stof. De hoeveelheid stof die door een bekende hoeveelheid dragergas is getransporteerd, kan gemeten worden door de damp in een geschikte val op te vangen, of door een in serie gekoppelde analytische techniek. Deze hoeveelheid wordt vervolgens gebruikt om de dampspanning bij een gegeven temperatuur te berekenen.
Aanbevolen meetbereik:
van 10-4 Pa tot 1 Pa.
Deze methode kan ook worden gebruikt in het bereik van 1 tot 10 Pa mits voorzichtigheid in acht wordt genomen.
1.4.7. Draaiende rotor
In de draaiende rotor bestaat het eigenlijke meetelement uit een in een magnetisch veld zwevend klein stalen kogeltje dat met hoge snelheid ronddraait. De gasdruk wordt afgeleid uit de drukafhankelijke snelheidsvermindering van het stalen kogeltje.
Aanbevolen meetbereik:
van 10-4 Pa tot 0,5 Pa.
1.5. KWALITEITSCRITERIA
De verschillende methoden voor het bepalen van de dampspanning worden in de tabel vergeleken op toepasbaarheid, herhaalbaarheid, reproduceerbaarheid, meetbereik en bestaande normalisatie.
Tabel
Kwaliteitscriteria
|
Meetmethode |
Stoffen |
Geschatte herhaalbaarheid (7) |
Geschatte reproduceerbaarheid (7) |
Aanbevolen bereik |
Bestaande norm |
|||
|
Vast |
Vloeibaar |
|||||||
|
Bij lage to smeltend |
Ja |
Tot 25 % |
Tot 25 % |
103 Pa tot 2 × 103 Pa |
— |
||
|
|
|
|
1-5 % |
1-5 % |
2 × 103 Pa tot 105 Pa |
— |
||
|
Ja |
Ja |
5-10 % |
5-10 % |
10 Pa to 105 Pa (8) |
NFT 20-048 (5) |
||
|
Ja |
Ja |
5-10 % |
5-10 % |
102 Pa tot 105 Pa |
ASTM-D 2879-86 |
||
|
Ja |
Ja |
5-20 % |
Tot 50 % |
10-3 Pa tot 1 Pa |
NFT 20-047(6) |
||
|
Ja |
Ja |
10-30 % |
— |
10-3 Pa tot 1 Pa |
— |
||
|
Ja |
Ja |
10-30 % |
Tot 50 % |
10-4 Pa tot 1 Pa (8) |
— |
||
|
Ja |
Ja |
10-20 % |
— |
10-4 Pa tot 0,5 Pa |
— |
||
1.6. BESCHRIJVING VAN DE TESTMETHODEN
1.6.1. Dynamische meting
1.6.1.1. Apparatuur
De meetapparatuur bestaat uit een kookvat met glazen of metalen koeler en voorzieningen voor het meten van temperatuur en het regelen en meten van druk. De meetapparatuur die in figuur 1 is afgebeeld, is van hittebestendig glas en bestaat uit vijf delen:
De grote, gedeeltelijk dubbelwandige buis bestaat uit een glazen slijpstuk, een koeler, een koelvat en een inlaatbuis.
De glazen cilinder met een Cottrell-pomp is gemonteerd in het kookgedeelte van de buis en heeft een ruw oppervlak van gebroken glas om „stoten” tijdens het kookproces te voorkomen.
De temperatuur wordt gemeten met behulp van een geschikte temperatuursensor (bijvoorbeeld een weerstandsthermometer of een thermokoppel), doorgevoerd in het apparaat tot op de plaats van het meetpunt (nr. 5, figuur 1) via een goed passende opening (bijvoorbeeld geslepen insteekverbinding).
De noodzakelijke aansluitingen met de apparatuur voor het regelen en meten van de druk worden gemaakt.
De bol, die als buffervolume werkt, is verbonden met de meetapparatuur door middel van een capillaire buis.
Het kookvat wordt verwarmd met een verwarmingselement (bijvoorbeeld een verwarmingspatroon) dat onderin de glazen apparatuur is aangebracht. De gewenste verwarmingsstroom wordt ingesteld en geregeld door middel van een thermokoppel.
Het vereiste vacuüm tussen 102 Pa en ongeveer 105 Pa wordt aangelegd met een vacuümpomp.
Voor het regelen van druk (meetbereik van ongeveer 102 Pa tot 105 Pa) en ventilatie wordt een passende kraan voor lucht of stikstoftoevoer gebruikt.
Voor het meten van de druk wordt een manometer gebruikt.
1.6.1.2. Meetprocedure
De dampspanning wordt gemeten door de kooktemperatuur van het monster bij verschillende ingestelde waarden van de druk tussen ongeveer 102 Pa en 105 Pa te bepalen. Als de temperatuur bij constante druk constant blijft, betekent dit dat de kooktemperatuur is bereikt. Schuimende stoffen kunnen met deze methode niet worden onderzocht.
De te onderzoeken stof wordt in een schoon en droog monstervat gebracht. Indien vaste stoffen niet als poeder beschikbaar zijn, kunnen er problemen ontstaan; deze kunnen echter worden opgelost door de koelwatermantel te verwarmen. Na het vullen wordt de apparatuur bij de flens gasdicht afgesloten en worden de stof en de apparatuur ontgast. Vervolgens wordt de laagst gewenste druk ingesteld en wordt het verwarmingssysteem aangezet. Tegelijkertijd wordt de temperatuurvoeler verbonden met een recorder.
Het evenwicht is bereikt, wanneer bij een constante druk een constante kooktemperatuur kan worden afgelezen. Wees voorzichtig om „stoten” tijdens het koken te voorkomen. Voorts moet volledige condensatie plaatsvinden op de koeler. Bij het bepalen van de dampspanning van bij lage temperatuur smeltende stoffen moet men voorkomen dat de condensor verstopt raakt.
Nadat dit evenwichtspunt is geregistreerd, wordt een hogere druk ingesteld. Dit proces wordt herhaald totdat een druk van 105 Pa is bereikt (ongeveer 5 tot 10 meetpunten in totaal). Ter controle moeten de evenwichtspunten nogmaals worden bepaald bij afnemende druk.
1.6.2. Statische methode
1.6.2.1. Apparatuur
De apparatuur omvat een vat voor het monster en een verwarmings- en koelsysteem om de monstertemperatuur in te stellen en te meten. De apparatuur bevat bovendien instrumenten om de druk in te stellen en te meten. Figuren 2a en 2b illustreren de basisbeginselen die hier van toepassing zijn.
De monsterruimte (figuur 2a) is aan één zijde afgesloten door een geschikte hoogvacuümkraan. Aan de andere zijde is een U-vormige buis bevestigd die een geschikte manometervloeistof bevat. Eén uiteinde van de U-vormige buis vertakt naar de vacuümpomp, de stikstofcilinder of de ventilatiekraan, en een manometer.
Een drukventiel met drukaanwijzing kan gebruikt worden in plaats van een U-buis (figuur 2b).
Om de stof op een ingestelde temperatuur te brengen, wordt de monsterruimte met de kraan en de U-vormige buis of drukventiel in een bad gebracht, dat op een constante temperatuur van ±0,2 K gehouden wordt. De temperatuur wordt aan de buitenkant van de monsterruimte of in het vat zelf gemeten.
Een vacuümpomp met een tegenstroomkoelbuis wordt gebruikt om het apparaat vacuüm te zuigen.
Bij methode 2a wordt de dampspanning van de stof indirect gemeten met een nulaanwijzer. Deze methode berust op het feit dat de dichtheid van de vloeistof in de U-buis verandert als de temperatuur sterk wisselt.
Voor de nulpuntsinstelling kunnen in de U-vormige buis, afhankelijk van het drukbereik en het chemisch gedrag van de stof, verschillende vloeistoffen worden gebruikt: siliconenoliën, ftalaten. De teststof mag niet merkbaar oplossen in of reageren met de vloeistof in de U-buis,
Voor de manometer kan kwik worden gebruikt in het bereik van normale luchtdrukken tot 102 Pa; siliconenvloeistoffen en ftalaten zijn geschikt voor drukken van 10 tot 102 Pa. De verwarmbare membraancapaciteitmanometers kunnen zelfs worden gebruikt bij drukken beneden 10-1 Pa. Er bestaan ook andere drukmeters die gebruikt kunnen worden tot 102 Pa.
1.6.2.2. Meetprocedure
Vóór de meting moeten alle onderdelen van de apparatuur in figuur 2 grondig gereinigd en gedroogd worden.
Vul voor methode 2a de U-buis met de gewenste vloeistof die moet zijn ontgast bij verhoogde temperatuur voordat tot aflezen wordt overgegaan.
De te onderzoeken stof wordt in het apparaat geplaatst waarna dit wordt gesloten en vervolgens de temperatuur voldoende wordt verlaagd voor ontgassing. De temperatuur moet laag genoeg zijn om te verzekeren dat alle lucht afgepompt is, maar mag — in geval van een meercomponentensysteem — de samenstelling van het materiaal niet veranderen. Indien gewenst kan een evenwichtstoestand sneller bereikt worden door te roeren.
Het monster kan onderkoeld worden met bijvoorbeeld vloeibare stikstof (opgelet: vermijd condensatie van lucht of pompvloeistof) of een mengsel van ethanol en droog ijs. Voor metingen bij lage temperatuur gebruikt men een bad met regelbare temperatuur, dat is aangesloten op een ultrastaat.
Met de kraan boven de monsterruimte in geopende stand wordt vervolgens de ingesloten lucht gedurende een aantal minuten uit de apparatuur gepompt. Daarna wordt de kraan gesloten en de temperatuur van het monster op het laagst gewenste niveau gebracht. Zo nodig moet de ontgassing verschillende keren herhaald worden.
Als het monster verhit wordt, stijgt de dampspanning. Dit verandert het evenwicht van de vloeistof in de U-buis. Om hiervoor te compenseren, wordt stikstof of lucht via de kraan in het apparaat binnengelaten tot de vloeistof in de drukmeter weer bij nul staat. De hiervoor vereiste druk kan afgelezen worden bij kamertemperatuur op een precisiemanometer. Deze druk komt overeen met de dampspanning van de te onderzoeken stof bij die specifieke meettemperatuur.
Methode 2b is gelijkaardig, maar de dampspanning wordt direct afgelezen.
De temperatuurafhankelijkheid van de dampspanning wordt bepaald met voldoende kleine temperatuurintervallen (ongeveer 5 tot 10 meetpunten in totaal) tot aan het gewenste maximum. Ter controle moeten de metingen bij lage temperaturen herhaald worden.
Als de waarden die verkregen worden bij de herhaalde metingen niet overeenkomen met de curve verkregen bij stijgende temperatuur, kan dit te wijten zijn aan een van de volgende factoren:
|
1. |
Het monster bevat nog altijd lucht (bijvoorbeeld stoffen met hoge viscositeit) of bij lage temperatuur kokende stoffen die vrijkomt/vrijkomen bij verwarming en verwijderd kan/kunnen worden door afpompen na verdere onderkoeling. |
|
2. |
De koeltemperatuur is niet laag genoeg. In dit geval wordt vloeibaar stikstof gebruikt als koelmiddel. Als 1 of 2 van toepassing is dienen de metingen herhaald te worden. |
|
3. |
De stof ondergaat een chemische reactie in het onderzochte temperatuurbereik (bijvoorbeeld afbraak, polymerisatie). |
1.6.3. Isoteniscoop
Zie referentie 7 voor een volledige beschrijving van deze methode. Het principe van het meetinstrument is afgebeeld in figuur 3. Evenals de statische methode, die is beschreven in 1.6.2, is de isoteniscoop geschikt voor onderzoek van vaste stoffen en vloeistoffen.
Voor vloeistoffen dient de stof zelf als vulvloeistof in de hulpmanometer. Een hoeveelheid vloeistof die voldoende is voor het vullen van de bol en de korte arm van het manometergedeelte, wordt in de isoteniscoop gebracht. De isoteniscoop wordt met het vacuümsysteem verbonden, leeggepompt en daarna gevuld met stikstof. Het leegmaken en doorspoelen van het systeem wordt tweemaal herhaald om de resterende zuurstof te verwijderen. De gevulde isoteniscoop wordt horizontaal gehouden zodat het monster zich in een dunne laag verspreidt over de bol en het manometergedeelte (U-deel). De druk in het systeem wordt gereduceerd tot 133 Pa en het monster wordt zachtjes verwarmd tot het juist kookt (verwijdering van opgeloste gefixeerde gassen). De isoteniscoop wordt dan zo gedraaid dat het monster terugloopt naar de bol en de korte arm van de manometer, zo dat beide volledig gevuld zijn met vloeistof. De druk wordt aangehouden zoals bij het ontgassen en de uitgetrokken punt van de monsterbol wordt verwarmd met een kleine vlam, totdat de damp die uit het monster vrijkomt voldoende expandeert om een deel van het monster uit het bovenste gedeelte van de bol en de manometerarm te verplaatsen naar het manometergedeelte van de isoteniscoop en zo een met damp gevulde, stikstofvrije ruimte te creëren.
Vervolgens wordt de isoteniscoop in een thermostatisch bad geplaatst, en de druk van de stikstof aangepast tot deze druk gelijk is aan de druk van het monster. Het drukevenwicht wordt aangeduid door het manometergedeelte van de isoteniscoop. Bij het evenwichtspunt is de dampspanning van de stikstof gelijk aan de dampspanning van de te onderzoeken stof.
Voor vaste stoffen worden de in 1.6.2.1 genoemde manometervloeistoffen gebruikt, afhankelijk van het druk- en temperatuurbereik. De ontgaste manometervloeistof wordt in de ronding van de lange arm van de isoteniscoop gebracht. Daarna wordt de te onderzoeken vaste stof in de bol gebracht en bij hogere temperatuur ontgast. Vervolgens wordt de isoteniscoop gekanteld zodat de manometervloeistof in de U-buis kan stromen. Het meten van de dampspanning als functie van de temperatuur vindt plaats volgens 1.6.2.
1.6.4. Effusiemethode: Dampspanningsbalans
1.6.4.1. Apparatuur
In de literatuur worden verschillende versies van het apparaat beschreven (1). Het hier beschreven apparaat illustreert de algemene basisprincipes (figuur 4). De belangrijkste onderdelen zijn afgebeeld in figuur 4; deze bestaan uit een hoogvacuüm roestvrijstalen of glazen houder, apparatuur om een vacuüm te creëren en te meten, alsmede ingebouwde onderdelen voor het meten van de dampspanning door middel van een balans. De volgende onderdelen zijn in het apparaat gemonteerd:
|
— |
Een verdampingsoven met een flens en een draaiende inlaat. De verdampingsoven is een cilindervormig vat, vervaardigd uit bijvoorbeeld koper of een chemisch inerte, thermische goed geleidende legering. Een glazen vat omgeven door een koperen wand kan ook gebruikt worden. De oven heeft een diameter van ongeveer 3 tot 5 cm en is 2 tot 5 cm hoog. Er zijn één tot drie openingen van verschillende grootte voor de dampstroom. De oven wordt verwarmd met behulp van of wel een verwarmingsplaat onder de oven, of wel een verwarmingsspiraal rond de buitenkant van de oven. Om te voorkomen dat de warmte zich verspreidt over de grondplaat wordt de verwarming verbonden met de grondplaat via een metalen stuk met lage thermische geleiding (nikkel-zilver- of chroom-nikkelstaal), bijvoorbeeld een nikkel-zilverbuis verbonden met de draaibare inlaat in het geval van een oven met verschillende openingen. Deze opstelling heeft als voordeel dat er een koperen staaf ingebracht kan worden. Zo kan er van buitenuit gekoeld worden met behulp van een koelbad. |
|
— |
Als het ovendeksel drie openingen van verschillende doorsnede heeft, welke 90o ten opzichte van elkaar zijn geplaatst, kunnen verschillende dampspanningen in het totale te meten bereik worden gemeten (openingen tussen ongeveer 0,30 en 4,50 mm doorsnede). Grote openingen dienen voor lage dampdrukken en vice versa. Door de oven te draaien kan de gewenste opening of een tussenstand voor de dampstroom (ovenopening — schild — balansschaal) worden ingesteld waardoor de molecuulstroom door de ovenopening op of naast de balansschaal wordt gericht. Om de temperatuur van de stof te meten, is een thermokoppel of weerstandsthermometer op een geschikte plaats gemonteerd. |
|
— |
Boven het schild hangt de balansschaal van een zeer gevoelige microbalans (zie verder). De balansschaal heeft een diameter van ongeveer 30 mm. Verguld aluminium is een geschikt materiaal. |
|
— |
De balansschaal wordt omgeven door een cilindervormige koelpot van messing of koper. Afhankelijk van het type heeft de balans een opening voor de balansarm en een schildopening voor de molecuulstroom, zodat totale condensatie van de damp op de balansschaal wordt verzekerd. De warmteafvoer naar buiten vindt plaats door een koperen staaf naar de koeling. Deze wordt door de grondplaat geleid en is daarvan thermisch geïsoleerd, bijvoorbeeld met een chroom-nikkelstalen buis. De staaf wordt onder de grondplaat in een dewarvat met vloeibare stikstof gedompeld of men laat vloeibare stikstof door de staaf stromen. De koelpot wordt zo op een temperatuur van ongeveer – 120 oC gehouden. De balansschaal wordt uitsluitend door straling gekoeld, voldoende voor het onderzochte drukbereik (koeling ongeveer een uur vóór het begin van de meting). |
|
— |
De balans wordt boven de koelpot geplaatst. Geschikte balansen zijn bijvoorbeeld een zeer gevoelige 2-armige elektronische microbalans (8) of een zeer gevoelig instrument met bewegende spiraal (zie OESO Test Guideline 104, uitgave 12.05.81). |
|
— |
De grondplaat bevat bovendien elektrische aansluitingen voor thermokoppels (of weerstandsthermometers) en verwarmingsspiralen. |
|
— |
In het vat wordt een vacuüm geproduceerd met behulp van een partiële vacuümpomp of een hoogvacuümpomp (vereist vacuüm van ongeveer 1 tot 2 × 10-3 Pa, verkregen na 2 uur pompen). De druk wordt geregeld met een geschikte ionisatiemanometer. |
1.6.4.2. Meetprocedure
Het vat wordt gevuld met de te onderzoeken stof en het deksel wordt gesloten. Het schild en de koelpot worden boven de oven geschoven. Het apparaat wordt gesloten en de vacuümpompen worden ingeschakeld. De einddruk vóór het begin van de meting is ongeveer 10-4 Pa. Vanaf 10-2 Pa wordt de koelpot aangezet.
Wanneer het benodigde vacuüm is bereikt, kan de ijkserie bij de laagst gewenste temperatuur worden gestart. De overeenkomstige opening in het deksel wordt ingesteld, de damp stroomt door het schild recht boven de opening en raakt de gekoelde balansschaal. De balansschaal moet groot genoeg zijn om te verzekeren dat hij wordt geraakt door de volledige dampstroom die door de opening in het schild geleid wordt. De impuls van de dampstroom werkt als kracht op de balansschaal en de moleculen condenseren op het gekoelde oppervlak.
De impuls en gelijktijdige condensatie veroorzaken een signaal op de recorder. Dit signaal kan op twee manieren worden beoordeeld:
|
1. |
Voor het hier beschreven apparaat wordt de dampspanning direct bepaald uit de impuls op de schaal (hiervoor hoeft de molecuulmassa niet bekend te zijn (2)). Er dient wel rekening gehouden te worden met geometrische factoren zoals de ovenopening en de hoek van de molecuulstroom bij het verwerken van de metingen. |
|
2. |
Tegelijkertijd kan de massa van het condensaat worden gemeten zodat de verdampingssnelheid hieruit kan worden berekend. De dampspanning kan ook worden berekend uit de verdampingssnelheid en de molecuulmassa door gebruik te maken van de vergelijking van Herz (2): |

waarin:
|
G |
= |
verdampingssnelheid (kg s-1 m-2) |
|
M |
= |
molaire massa (g mol-1) |
|
T |
= |
temperatuur (K) |
|
R |
= |
universele molaire gasconstante (J mol-1 K-1) |
|
p |
= |
dampspanning (Pa). |
Als het vereiste vacuüm is bereikt, wordt begonnen met de serie metingen bij de laagst gewenste meettemperatuur.
Voor verdere metingen wordt de temperatuur met kleine stappen verhoogd, totdat de hoogste gewenste temperatuur bereikt wordt. Vervolgens wordt het monster weer afgekoeld en eventueel wordt een tweede kromme van de dampspanning gemeten. Als de tweede reeks de resultaten van de eerste niet bevestigt, dan is het mogelijk dat de stof in het gemeten temperatuurbereik ontleedt.
1.6.5. Effusiemethode: Door middel van gewichtsafname
1.6.5.1. Apparatuur
Het uitstroomapparaat bestaat uit de volgende basisonderdelen:
|
— |
een tank die van een thermostaatregeling voorzien kan worden en waarin de effusiecellen zijn geplaatst; |
|
— |
een hoogvacuümpomp (bijvoorbeeld een diffusiepomp of een turbomoleculaire pomp) met vacuümmeter; |
|
— |
een val met gebruik van vloeibaar stikstof of droog ijs. |
In figuur 5 wordt een elektrisch verwarmde aluminium vacuümtank met 4 roestvrijstalen uitstroomcellen als voorbeeld afgebeeld. De roestvrijstalen folie van ongeveer 0,3 mm dikte heeft een uitstroomopening van 0,2 tot 1,0 mm doorsnede en is verbonden met de uitstroomcel via een van schroefdraad voorzien deksel.
1.6.5.2. Meetprocedure
De ijk- en teststoffen worden in elke uitstroomcel gebracht, het metalen diafragma met de opening wordt vastgeschroefd met behulp van het deksel, elke cel wordt gewogen met een nauwkeurigheid van 0,1 mg. De cel wordt in het van een thermostaat voorziene apparaat geplaatst, dat vervolgens wordt afgepompt tot beneden een tiende van de te verwachten druk. Met vaste tussenpozen van 5 tot 30 uur wordt lucht in het apparaat gelaten en de afname van de massa van de uitstroomcel wordt bepaald door een nieuwe weging.
Om zeker te zijn dat de resultaten niet beïnvloed worden door vluchtige verontreinigingen, wordt de cel opnieuw gewogen met vaste tussenpozen om te controleren of de verdampingssnelheid constant blijft over ten minste twee zulke perioden.
De dampspanning p in de uitstroomcel wordt gegeven door:

waarin:
|
p |
= |
dampspanning (Pa) |
|
m |
= |
massa van de stof die de cel verlaat tijdens tijd t (kg) |
|
t |
= |
tijd (s) |
|
A |
= |
oppervlakte van de opening (m2) |
|
K |
= |
correctiefactor |
|
R |
= |
universele gasconstante (J mol-1 K-1) |
|
T |
= |
temperatuur (K) |
|
M |
= |
molecuulmassa (kg mol-1). |
De correctiefactor K is afhankelijk van de verhouding van de lengte tot de straal van de cilindrische opening:
|
verhouding: |
0,1 |
0,2 |
0,6 |
1,0 |
2,0 |
|
K: |
0,952 |
0,909 |
0,771 |
0,672 |
0,514 |
De bovenstaande vergelijking kan ook geschreven worden als:

waarin 
Deze effusiecelconstante E kan bepaald worden met behulp van ijkstoffen (2,9) via de volgende vergelijking:
waarin:
|
p(r) |
= |
dampspanning van de ijkstof (Pa) |
|
M(r) |
= |
molecuulmassa van de ijkstof (kg mol-1). |
1.6.6. Gasverzadigingsmethode
1.6.6.1. Apparatuur
De apparatuur voor deze test bestaat uit de onderdelen zoals afgebeeld in figuur 6a en zoals hieronder beschreven (1).
Inert gas:
Het dragergas mag niet chemisch met de te onderzoeken stof reageren. Stikstof voldoet meestal, maar in een enkel geval kan een ander gas nodig zijn (10). Het gebruikte gas moet droog en schoon zijn (zie figuur 6a, onderdeel 4: relatieve vochtigheidsmeter).
Regeling van de gasstroom:
Voor het instellen van een constante gasstroom door de verzadigingskolom is een gasregelingssysteem nodig.
Dampvallen:
De keuze van het type dampval hangt af van de eigenschappen van het monster en de gekozen analysemethode. De damp moet kwantitatief worden opgevangen in een vorm waarin vervolgens analyse mogelijk is. Voor sommige stoffen zuilen dampvallen met een vloeistof zoals hexaan of ethyleenglycol geschikt zijn. Voor andere stoffen zijn vaste adsorbentia meer geschikt.
Als een alternatief voor dampvallen met daarop volgende analyse kunnen in serie gezette analytische technieken zoals chromatografie gebruikt worden om de hoeveelheid stof, die door een bekende hoeveelheid dragergas wordt verplaatst, te meten. Verder kan ook het massaverlies van het monster gemeten worden.
Warmtewisselaar:
Voor metingen bij verschillende temperaturen kan het noodzakelijk zijn om een warmtewisselaar in de opstelling aan te brengen.
Verzadigingskolom:
De te onderzoeken stof wordt, vanuit een oplossing, op een geschikte inerte drager gebracht. De aldus beladen drager wordt in een verzadigingskolom gebracht; de afmetingen van de kolom en de stroomsnelheid van het dragergas moeten een volledige verzadiging van het dragergas verzekeren. De verzadigingskolom moet zijn voorzien van een thermostaatregeling. Voor metingen boven kamertemperatuur moet het gedeelte tussen de verzadigingskolom en de dampvallen worden verwarmd om te voorkomen dat de te onderzoeken stof daar condenseert.
Om her verplaatsen van de stofmassa door diffusie te verminderen, kan een capillair achter de verzadigingskolom geplaatst worden (figuur 6b).
1.6.6.2. Meetprocedure
Bereiding van de verzadigingskolom:
Een oplossing van de te onderzoeken stof in een zeer vluchtig oplosmiddel wordt toegevoegd aan een geschikte hoeveelheid dragermateriaal. Er moet voldoende te onderzoeken stof worden toegevoegd om gedurende de gehele proef verzadiging te verzekeren. Het oplosmiddel wordt volledig afgedampt aan de lucht of in een roterende verdamper, waarna het grondig gemengde materiaal in de verzadigingskolom wordt gebracht. Nadat het monster op de gewenste temperatuur is gebracht, wordt droge stikstof door de apparatuur geleid.
Meting:
De dampvallen of in serie geplaatste detectors worden verbonden met de uitstroomleiding van de kolom en de tijd wordt geregistreerd. De stroomsnelheid wordt aan het begin en op gezette tijden gedurende het experiment gecontroleerd met behulp van een bellenteller (of continu met een massastroommeter).
De druk bij de uitgang van de verzadigingskolom moet worden gemeten:
|
a) |
ofwel door een manometer tussen de verzadigingskolom en de dampvallen te plaatsen (dit kan onbevredigend zijn vanwege de vergroting van de dode ruimte en het adsorberende oppervlak); |
|
b) |
ofwel door in een afzonderlijk experiment de drukvervallen over het gebruikte opvangsysteem te bepalen als functie van de stroomsnelheid (dit kan onbevredigend zijn bij gebruik van vloeistofvallen). |
De tijd die nodig is om de voor de verschillende analysemethoden vereiste hoeveelheid stof op te vangen, wordt bepaald aan de hand van inleidende proeven of schattingen. Als alternatief voor het opvangen van de stof voor verdere analyse kan een in serie gekoppelde kwantitatieve analytische techniek gebruikt worden (bijvoorbeeld chromatografie). Voordat de dampdruk bij een bepaalde temperatuur wordt berekend, moeten inleidende proeven worden uitgevoerd om de maximale stroomsnelheid te bepalen waarbij het dragergas volledig verzadigd zal worden met de damp van de te onderzoeken stof. Dit is het geval als het dragergas zo langzaam door de verzadiger wordt geleid, dat een nog geringere snelheid geen grotere berekende dampdruk geeft.
De te gebruiken analysemethode (bijvoorbeeld gaschromatografie of gravimetrie) hangt af van de aard van de te onderzoeken stof.
De hoeveelheid stof, die door een bekend volume dragergas wordt getransporteerd, wordt bepaald.
1.6.6.3. Berekening van de dampspanning
De dampspanning wordt berekend uit de dampdichtheid, W/V, met behulp van de vergelijking:

waarin
|
p |
= |
dampspanning (Pa) |
|
W |
= |
massa van de verdampte teststof (kg) |
|
V |
= |
volume verzadigd gas (m3) |
|
R |
= |
universele molaire gasconstante (J mol-1 K-1) |
|
T |
= |
temperatuur (K) |
|
M |
= |
molaire massa van de teststof (g mol-1) |
De gemeten volumes moeten worden gecorrigeerd voor druk- en temperatuurverschillen tussen de stroomsnelheidsmeter en de verzadigingskolom die met een thermostaat op constante temperatuur gehouden wordt Als de stroomsnelheidsmeter zich achter de dampval bevindt, kan het nodig zijn te corrigeren voor bestanddelen die uit de val verdampt zijn (1).
1.6.7. Draaiende rotor (8, 11, 13)
1.6.7.1. Apparatuur
De draaiende rotortechniek kan worden uitgevoerd met behulp van een draaiende-rotor-viscositeitsmeter zoals afgebeeld in figuur 8. Een schematische tekening van de experimentele opstelling wordt getoond in figuur 7.
De meetapparatuur bestaat meestal uit een meetkop met draaiende rotor, geplaatst in een van thermostaatregeling voorziene ruimte (geregeld op 0,1 oC). De monsterhouder wordt in een van een thermostaatregeling voorziene ruimte (geregeld op 0,01 oC) gebracht, en om condensatie te voorkomen, worden alle andere onderdelen van de opstelling op een hogere temperatuur gehouden. Een hoogvacuümpomp wordt aan het toestel verbonden door middel van hoogvacuümkranen.
De meetkop met draaiende rotor bestaat uit een stalen kogel (4 tot 5 mm doorsnede) in een buis. De kogel zweeft stabiel in een magnetisch veld, opgewekt met een combinatie van permanente magneten en controlespoelen.
De kogel wordt aan het draaien gebracht door rotatie van de velden. De rotatiesnelheid kan worden bepaald met meetspoelen, die de altijd aanwezige geringe zijdelingse magnetisatie van de kogel meten.
1.6.7.2. Meetprocedure
Als de kogel een bepaalde draaisnelheid v(o) (gewoonlijk ongeveer 400 toeren per seconde) heeft bereikt, wordt de energietoevoer gestopt waardoor een vertraging van de draaisnelheid optreedt, die het gevolg is van de gaswrijving.
De afname van de rotatiesnelheid wordt gemeten als functie van de tijd. Als de wrijving door de magnetische ophanging verwaarloosd kan worden ten opzichte van de wrijving van het gas, wordt de gasdruk p gegeven door:
![]()
waarin :
|
|
= |
gemiddelde snelheid van de gasmoleculen |
|
r |
= |
straal van de kogel |
|
ρ |
= |
soortelijke massa van de kogel |
|
σ |
= |
coëfficiënt van de overdracht van het tangentieel moment (o = 1 voor een ideaal boloppervlak van de kogel) |
|
t |
= |
tijd |
|
v(t) |
= |
rotatiesnelheid na tijd t |
|
v(o) |
= |
beginrotatiesnelheid. |
Deze vergelijking kan ook geschreven worden als:

waarin tn, tn-1 de tijd voorstelt die nodig is voor een gegeven aantal omwentelingen N. Deze tijdsintervallen tn en tn-1 volgen elkaar op waarbij tn > tn-1 .
De gemiddelde snelheid van het gasmolecuul  wordt gegeven door:
wordt gegeven door:

waarin:
|
T |
= |
temperatuur |
|
R |
= |
universele molaire gasconstante |
|
M |
= |
molaire massa. |
2. GEGEVENS
In elk van de voorafgaande methoden moet de dampspanning ten minste bij twee temperaturen worden bepaald. Bepaling van de dampspanning bij drie of meer temperaturen in het bereik van 0 tot 50 oC verdient de voorkeur, aangezien men dan kan controleren of de dampspanningskromme lineair is.
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
de gebruikte methode; |
|
— |
de nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen) en indien van toepassing, voorafgaande zuivering; |
|
— |
ten minste twee waarden voor de dampspanning en de bijbehorende temperaturen, bij voorkeur in het bereik van 0 tot 50 oC; |
|
— |
alle ruwe gegevens; |
|
— |
grafiek van log p tegen 1/T; |
|
— |
geschatte waarde van de dampspanning bij 20 of 25 oC. |
Indien een verandering (faseovergang, ontleding) in de onderzochte stof werd waargenomen, dient het testrapport in het bijzonder de volgende gegevens te bevatten:
|
— |
aard van de verandering; |
|
— |
temperatuur waarbij de verandering optreedt bij atmosferische druk; |
|
— |
dampspanning bij 10 oC respectievelijk 20 oC beneden de overgangstemperatuur en bij 10 o C respectievelijk 20 oC boven de overgangstemperatuur (tenzij het een overgang is van vaste fase naar gasfase). |
Alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof, dienen te worden gerapporteerd.
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 104. Decision of the Council C(81) 30 Final. |
|
(2) |
Ambrose, D., in B. Le Neindre, B. Vodar (Eds.): Experimental Thermodynamics, Butterworths, London, 1975, Vol. II. |
|
(3) |
R. Weissberger ed.: Technique of Organic Chemistry. Physical Methods of Organic Chemistry, 3rd ed., Chapter IX, Interscience Publ., New York, 1959, Vol. I, Part I. |
|
(4) |
Knudsen, M.: Ann. Phys. Lpz., 1909, Vol. 29, 1979; 1911, Vol. 34, 593. |
|
(5) |
NF T 20-047 AFNOR (Sept. 85). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10-1 to 10 PA5 — Static method. |
|
(6) |
NF T 20-048 AFNOR (Sept. 85). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10-3 to 1 Pa — Vapour pressure balance method. |
|
(7) |
ASTM D 2879-86, Standard test method for vapour pressure/temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
(8) |
G. Messer, P. Röhl, G. Grosse and W. Jitschin. J. Vac. Sci. Technol., (A), 1987, Vol. 5 (4), 2440. |
|
(9) |
Ambrose, D., Lawrenson, I. J., Sprake, C. H. S. J. Chem. Thermodynamics 1975, Vol. 7, 1173. |
|
(10) |
B. F. Rordorf. Thermochimica Acta, 1985, Vol. 85, 435. |
|
(11) |
G. Comsa, J. K. Fremerey and B. Lindenau. J. Vac. Sci. Technol., 1980, Vol. 17 (2), 642. |
|
(12) |
G. Reich. J. Vac. Sci. Technol., 1982, Vol. 20 (4), 1148. |
|
(13) |
J. K. Fremerey. J. Vac. Sci. Technol., (A), 1985, Vol. 3 (3), 1715. |
Aanhangsel 1
Schattingsmethode
INLEIDING
De berekende waarden van de dampspanning kunnen als volgt worden gebruikt:
|
— |
om te bepalen welke van de experimentele methoden geschikt is; |
|
— |
om een schatting of grenswaarde te verkrijgen, in geval de experimentele methode om technische redenen niet toegepast kan worden (ook als de dampspanning zeer laag is); |
|
— |
om die gevallen op te kunnen sporen, waar de experimentele meting kan worden weggelaten omdat de dampspanning waarschijnlijk < 10-5 Pa zal zijn bij omgevingstemperatuur. |
SCHATTINGSMETHODE
De dampspanning van vloeistoffen en vaste stoffen kan geschat worden met behulp van de gewijzigde Correlatie van Watson (a). Het enige benodigde gegeven is de normale kooktemperatuur. De methode is toepasbaar in het drukbereik van 105 Pa tot 10-5 Pa.
Uitgebreide informatie over deze methode wordt gegeven in het „Handbook of Chemical Property Estimation Methods” (b).
BEREKENINGSPROCEDURE
Volgens (b) wordt de dampspanning als volgt berekend:
waarin:
|
T |
= de bewuste temperatuur |
|
Tb |
= normale kooktemperatuur |
|
Pvp |
= dampspanning bij temperatuur T |
|
ΔHvb |
= verdampingswarmte |
|
ΔZb |
= samendrukbaarheidscoëfficiënt (geschat op 0,97) |
|
m |
= empirische factor afhankelijk van de fysische toestand bij de bewuste temperatuur. |
En verder

waarin KF een empirische factor is die verband houdt met de polariteit van de stof. De KF-factoren voor verschillende samengestelde stoffen worden gegeven in referentie (b).
Zeer vaak zijn gegevens beschikbaar over de kooktemperatuur bij gereduceerde druk. In deze gevallen wordt, volgens (b), de dampspanning als volgt berekend:

Hierbij is T1 het kookpunt bij de gereduceerde druk P1.
RAPPORT
Indien de schattingsmethode wordt gebruikt, dient het rapport een uitgebreide beschrijving van de berekening te bevatten.
LITERATUUR
|
(a) |
K. M. Watson, Ind. Eng. Chem., 1943, Vol. 35, 398. |
|
(b) |
W. J. Lyman, W. F. Reehl, D. H. Rosenblatt. Handbook of Chemical Property Estimation Methods, Mc Graw-Hill, 1982. |
Aanhangsel 2
Figuur 1
Apparaat voor bepaling van de dampspanningskromme volgens de dynamische methode

Figuur 2a
Apparaat voor bepaling van de dampspanningskromme volgens de statische methode (gebruikmakend van de U-buis manometer)

Figuur 2b
Apparaat voor bepaling van de dampspanningskromme volgens de statische methode (gebruikmakend van een drukaanwijzing)

Figuur 3
Isoteniscoop (referentie 7)

Figuur 4
Apparatuur voor bepaling van de dampspanningskromme met behulp van de dampspanningsbalansmethode

Figuur 5
Voorbeeld van een apparaat voor verdamping bij lage druk met behulp van de uitstroommethode, met een uitstroomcelvolume van 8 cm3

Figuur 6a
Voorbeeld van een gasstroomsysteem voor bepaling van de dampspanning volgens de gasverzadigingsmethode

Figuur 6b
Een voorbeeld van een systeem voor de bepaling van de dampspanning met de gasverzadigingsmethode, met een capillair geplaatst achter de verzadigingskamer

Figuur 7
Voorbeeld van experimentele opstelling voor de draaiende-rotormethode
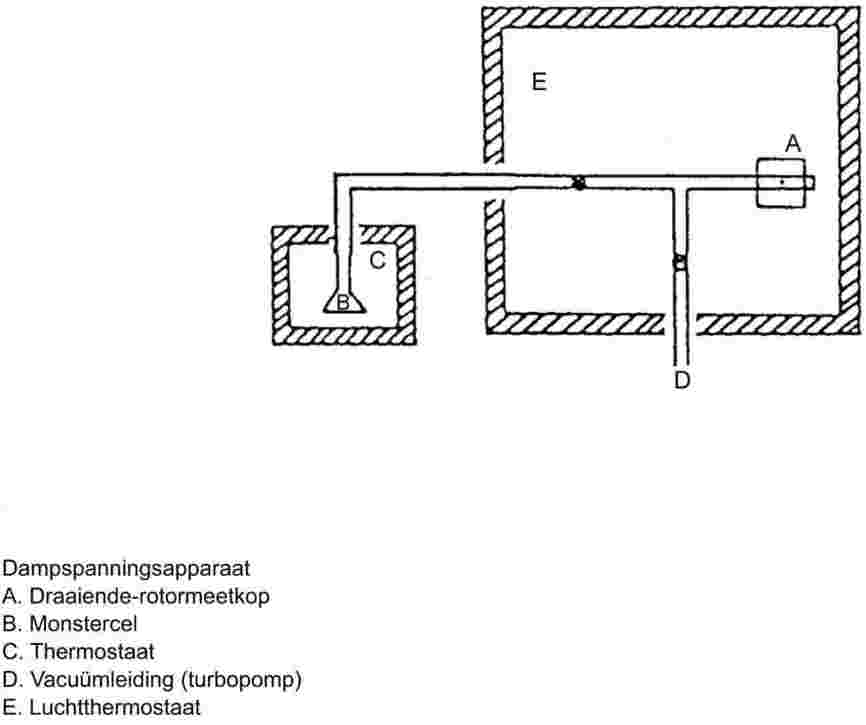
Figuur 8
Voorbeeld van een draaiende-rotormeetkop

A.5. OPPERVLAKTESPANNING
1. METHODE
De beschreven methoden berusten op de testrichtlijn van de OESO (1). De fundamentele principes worden besproken in referentie (2).
1.1. INLEIDING
De hier beschreven methoden zijn geschikt voor de bepaling van de oppervlaktespanning van waterige oplossingen.
Voor het uitvoeren van deze test is het nuttig om van tevoren te beschikken over gegevens inzake de oplosbaarheid in water, de structuur, de hydrolyseerbaarheid en de kritische concentraties voor de vorming van micellen.
De hieronder beschreven methoden zijn geschikt voor de meeste chemische stoffen, ongeacht de zuiverheid ervan.
Bepaling van de oppervlaktespanning met behulp van de ringspanningsmeter is alleen mogelijk voor waterige oplossingen met een dynamische viscositeit van minder dan ongeveer 200 mPa s.
1.2. DEFINITIES EN EENHEDEN
De vrije-oppervlakte-enthalpie per oppervlakte-eenheid heet de oppervlaktespanning.
De oppervlaktespanning wordt uitgedrukt in
N/m (SI-eenheid) of in m
N/m (SI-subeenheid).
1 N/m = 103 dyne/cm
1 mN/m = 1 dyne/cm in het verouderde cgs-systeem.
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om zo nu en dan de werking van de methode te controleren en om vergelijkingen met resultaten van andere methoden mogelijk te maken.
Een aantal referentiestoffen met zeer uiteenlopende oppervlaktespanningen staan vermeld in referenties (1) en (3).
1.4. PRINCIPE VAN DE TESTMETHODEN
De methoden berusten op de meting van de maximale kracht die verticaal moet worden uitgeoefend op een beugel of een ring die het oppervlak van de te onderzoeken vloeistof in een meetbak raakt, om deze beugel of ring van dit oppervlak te scheiden, of op een plaat waarvan een rand het oppervlak raakt, om de vloeistoflaag die zich heeft gevormd op te trekken.
Stoffen die oplosbaar zijn in water met een concentratie van ten minste 1 mg/l worden getest in waterige oplossingen bij één concentratie.
1.5. KWALITEITSCRITERIA
Deze methoden zijn nauwkeuriger dan waarschijnlijk voor milieubeoordelingsdoeleinden noodzakelijk is.
1.6. BESCHRIJVING VAN DE TESTMETHODEN
De stof wordt opgelost in gedestilleerd water. De concentratie van deze oplossing moet 90 % van die van een verzadigde oplossing in water bedragen. Indien deze concentratie de 1 g/l overschrijdt, wordt een oplossing van 1 g/l gebruikt voor de bepaling. Stoffen met een oplosbaarheid in water van minder dan 1 mg/l hoeven niet te worden onderzocht.
1.6.1. Plaatmethode
Zie ISO 304 en NF T 73-060 („Surface Active Agents — Determination of Surface Tension by Drawing up Liquid Films”).
1.6.2. Beugelmethode
Zie ISO 304 en NF T 73-060 („Surface Active Agents — Determination of Surface Tension by Drawing up Liquid Films”).
1.6.3. Ringmethode
Zie ISO 304 en NF T 73-060 („Surface Active Agents — Determination of Surface Tension by Drawing up Liquid Films”).
1.6.4. Geharmoniseerde ringmethode (OESO)
1.6.4.1. Apparatuur
In de handel verkrijgbare spanningsmeters kunnen voor deze metingen worden gebruikt. Zij bestaan uit:
|
— |
draaitafeltje; |
|
— |
systeem voor het meten van de kracht; |
|
— |
meetlichaam (ring); |
|
— |
meetvat. |
1.6.4.1.1.
Het draaitafeltje wordt gebruikt als draagvlak voor het meetvat met temperatuurregeling, waarin de te onderzoeken stof zich bevindt. Tezamen met het systeem voor het meten van de kracht is het draaitafeltje aan een rek gemonteerd.
1.6.4.1.2.
Het systeem voor het meten van de kracht (zie figuur) bevindt zich boven het draaitafeltje. De fout bij het meten van de kracht mag niet meer bedragen dan ± 10-6 N, hetgeen overeenkomt met een foutgrens van ±0,1 mg in een massameting. De meetschaal van de in de handel verkrijgbare tensiometers is meestal geijkt in mN/m zodat de oppervlaktespanning met een nauwkeurigheid van 0,1 mN/m rechtstreeks in mN/m kan worden afgelezen.
1.6.4.1.3.
De ring bestaat meestal uit een draad van platina-iridium met een dikte van ongeveer 0,4 mm en een gemiddelde omtrek van 60 mm. De ring wordt horizontaal opgehangen aan een metalen stift en een ophangsysteem om de verbinding met het krachtmeetsysteem tot stand te brengen (zie figuur).
Figuur
Meetlichaam
(alle maten in mm)

1.6.4.1.4.
Voor de te onderzoeken oplossing wordt een glazen meetvat met temperatuurregeling gebruikt. Het meetvat dient zo te zijn ontworpen dat tijdens de meting de temperatuur van de testvloeistof en de gasfase daarboven constant is en dat het monster niet kan verdampen. Ronde glazen bekers met een inwendige doorsnede van ten minste 45 mm zijn aanvaardbaar.
1.6.4.2. Voorbereiding van het apparaat
1.6.4.2.1.
Glazen vaten dienen zorgvuldig te worden schoongemaakt. Zo nodig moeten zij worden gespoeld met heet chroomzuur en vervolgens met stroperig fosforzuur (83 tot 98 gewichtsprocent H3PO4), dan grondig gespoeld met leidingwater, uitgewassen met tweemaal gedestilleerd water tot een neutrale pH, en vervolgens gedroogd of omgespoeld met een gedeelte van de te onderzoeken vloeistof.
De ring wordt eerst zorgvuldig in water gespoeld ten einde wateroplosbare stoffen te verwijderen, daarna kort in chroomzuur gedompeld, in tweemaal gedestilleerd water gewassen tot een neutrale pH is bereikt en ten slotte kort verhit boven een methanolvlam.
NB:
Verontreinigende stoffen zoals siliconen die niet in chroomzuur of fosforzuur oplossen, dienen met een geschikt organisch oplosmiddel te worden verwijderd.
1.6.4.2.2.
Bij de validering van het apparaat wordt het nulpunt gecontroleerd en zodanig ingesteld dat met de uitslag van de wijzer een nauwkeurige bepaling in mN/m mogelijk is.
Opstellen:
Het apparaat wordt, bijvoorbeeld met behulp van een waterpas aan de onderzijde van de tensiometer, horizontaal opgesteld; hiertoe wordt gebruik gemaakt van de schroeven aan de onderzijde van het apparaat.
Instelling van het nulpunt:
Na het aanbrengen van de ring aan het apparaat en alvorens deze in de vloeistof te dompelen wordt de wijzer van de tensiometer op nul gezet en wordt nagegaan of de ring evenwijdig aan het vloeistofoppervlak loopt. Hierbij kan het vloeistofoppervlak als spiegel worden gebruikt.
IJking:
Het ijken kan op twee manieren geschieden:
|
a) |
Met behulp van een massa; hierbij worden ruiters met een bekende massa van 0,1 tot 1,0 g op de ring aangebracht; de ijkfactor Фa, waarmee alle afgelezen waarden moeten worden vermenigvuldigd, wordt bepaald met behulp van de volgende vergelijking (1):
waarin:
|
|
b) |
Met behulp van water; hierbij wordt gebruik gemaakt van zuiver water met een oppervlaktespanning van bijvoorbeeld 72,3 mN/m bij 23 oC; deze procedure verloopt weliswaar vlotter dan die met de ruiters, maar houdt steeds het gevaar in dat de oppervlaktespanning van het water onjuist is door de aanwezigheid van sporen oppervlakteactieve stoffen. De ijkfactor, Фb, waarmee alle meetresultaten moeten worden vermenigvuldigd, wordt bepaald met behulp van de volgende vergelijking (2):
waarin:
|
1.6.4.3. Bereiding van de monsters
De te onderzoeken stoffen worden tot de gewenste concentraties in water opgelost; er mogen geen onoplosbare stoffen in het water voorkomen.
De oplossing moet op constante temperatuur worden gehouden (±0,5 oC). Aangezien de oppervlaktespanning van een oplossing in het meetvat met de tijd verandert, moeten er op verschillende tijdstippen metingen worden verricht en moet van de resultaten een kromme worden uitgezet waaruit het verloop van de oppervlaktespanning als functie van de tijd blijkt. Zodra geen verdere wijzigingen meer worden waargenomen, is er een evenwichtstoestand bereikt.
Stof en gasvormige verontreinigingen beïnvloeden het resultaat van de meting. De meting dient derhalve te worden verricht onder een scherm.
1.6.5. Testomstandigheden
De metingen dienen plaats te vinden bij ongeveer 20 oC en de temperatuur dient op ±0,5 oC na constant te zijn.
1.6.6. Uitvoering van de proef
De te meten oplossingen dienen in het zorgvuldig schoongemaakte meervat te worden overgebracht waarbij schuimvorming wordt vermeden; vervolgens wordt het meetvat op de tafel van het testapparaat geplaatst. Het tafelblad met het meetvat wordt omhoog gebracht tot de ring is gedompeld onder het oppervlak van de te onderzoeken oplossing. Vervolgens laat men het tafelblad geleidelijk en regelmatig (met een snelheid van ongeveer 0,5 cm/min) zakken om de ring van het oppervlak vrij te maken, tot de maximale kracht is bereikt. De vloeistoflaag die aan de ring hangt, mag de ring niet loslaten. Na de meting wordt de ring weer onder het oppervlak gedompeld en wordt de meting herhaald tot een constante waarde voor de oppervlaktespanning is bereikt. Bij iedere bepaling dient de tijd, die verlopen is sinds het overbrengen van de vloeistof naar het meetvat, te worden genoteerd. De meter wordt afgelezen op het moment van de maximale kracht die vereist is om de ring van het oppervlak van de vloeistof los te trekken.
2. GEGEVENS
Ter berekening van de oppervlaktespanning wordt de van het apparaat afgelezen waarde in mN/m eerst vermenigvuldigd met de ijkfactor Фa of Фb (afhankelijk van de toegepaste ijkprocedure). Dit leidt tot een waarde die slechts bij benadering juist is en daarom nog verder moet worden gecorrigeerd.
Harkins en Jordan (4) hebben langs empirische weg correctiefactoren bepaald voor oppervlaktespanningen die met de ringmethode zijn gemeten; deze correctiefactoren zijn afhankelijk van de afmetingen van de ring, de dichtheid van de vloeistof en de oppervlaktespanning.
Het is tamelijk omslachtig om de correctiefactor voor iedere meting afzonderlijk met behulp van de tabellen van Harkins en Jordan te bepalen voor de berekening van de oppervlaktespanning; daarom kan voor waterige oplossingen gebruik worden gemaakt van een vereenvoudigde procedure waarbij de gecorrigeerde waarden voor de oppervlaktespanning rechtstreeks uit de volgende tabel worden afgelezen (tussenliggende waarden worden via interpolatie verkregen).
Tabel
Correctie van de gemeten oppervlaktespanning
Uitsluitend voor waterige oplossingen, p ≈ 1 g/cm3
|
R |
= 9,55 mm (gemiddelde straal van de ring) |
|
r |
= 0,185 mm (straal van de draad van de ring) |
|
Gemeten waarde |
Gecorrigeerde waarde (mN/m) |
|
|
(IJking met massa (zie 1.6.4.2.2 (a)) |
IJking met water (zie 1.6.4.2.2 (b)) |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Deze tabel werd opgesteld aan de hand van de correctie volgens Harkins en Jordan en overeenkomstig de DIN-normen (DIN 53914) voor water en waterige oplossingen (met een dichtheid van p = 1 g/cm3) en voor in de handel verkrijgbare ringen met afmetingen R = 9,55 mm (gemiddelde straal van de ring) en r = 0,185 mm (straal van de draad van de ring). De tabel geeft de gecorrigeerde waarden voor oppervlaktespanningsmetingen die werden uitgevoerd na ijking met massa of met water.
Volgens een alternatieve methode zonder voorafgaande ijking kan de oppervlaktespanning als volgt worden berekend:
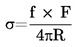
waarin:
|
F |
= |
de kracht die op de dynamometer wordt afgelezen bij het breken van de film |
|
R |
= |
de straal van de ring |
|
f |
= |
de correctiefactor (1). |
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFENEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
gebruikte testmethode; |
|
— |
gebruikt type water of oplossing; |
|
— |
nauwkeurige specificatie van de stoffen (beschrijving en verontreinigingen); |
|
— |
meetresultaten: afgelezen oppervlaktespanning waarbij zowel de afzonderlijke resultaten als het rekenkundig gemiddelde daarvan moet worden vermeld, alsmede het gecorrigeerde gemiddelde (waarbij rekening is gehouden met de correctiefactór voor het apparaat en de correctietabel); |
|
— |
concentratie van de oplossing; |
|
— |
temperatuur bij de meting; |
|
— |
ouderdom van de gebruikte oplossing, en met name de tijd tussen de bereiding en de meting van de oplossing; |
|
— |
beschrijving van de tijdafhankelijkheid van de oppervlaktespanning, na het overbrengen van de oplossing in het meetvat; |
|
— |
alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten, en met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de stof. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Met het oog op het feit dat gedestilleerd water een oppervlaktespanning heeft van 72,75 mN/m bij 20 oC, dienen stoffen met een oppervlaktespanning van minder dan 60 mN/m, zoals gemeten met deze methode, beschouwd te worden als oppervlakteactieve stoffen.
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 115 — Decision of the Council C(81) 30 Final. |
|
(2) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ. New York, 1959, Vol. I, Part I, Chapter XIV. |
|
(3) |
Pure Appl. Chem., 1976, Vol. 48, 511. |
|
(4) |
Harkins, W. D., Jordan, H. F., J. Amer. Chem. Soc, 1930, Vol. 52, 1751. |
A.6. OPLOSBAARHEID IN WATER
1. METHODE
De beschreven methoden berusten op de testrichtlijn van de OESO (1).
1.1. INLEIDING
Voor het uitvoeren van deze test is het nuttig om van tevoren te beschikken over gegevens inzake de structuurformule, de dampspanning, de dissociatieconstanten en de hydrolyse (als functie van de pH) van de stof.
Er bestaat niet één methode waarmee alle mogelijke waarden van de oplosbaarheid in water kunnen worden onderzocht.
De twee hieronder beschreven meetmethoden beslaan alle mogelijke waarden van de oplosbaarheid maar zijn niet van toepassing op vluchtige stoffen:
|
— |
de eerste methode wordt aangeduid als de „kolom-elutie”-methode en is van toepassing op chemisch zuivere stoffen met een geringe oplosbaarheid (< 10-2 g/l), welke stabiel zijn in water; |
|
— |
de tweede methode wordt aangeduid als de „methode met de kolf” en is van toepassing op chemisch zuivere stoffen met een hogere oplosbaarheid (> 10-2 g/l), welke stabiel zijn in water. |
De oplosbaarheid in water van de te onderzoeken stof kan aanzienlijk worden beïnvloed door de aanwezigheid van verontreinigingen.
1.2. DEFINITIES EN EENHEDEN
De oplosbaarheid van een stof in water wordt opgegeven als de massaconcentratie van de stof in een verzadigde oplossing in water bij een gegeven temperatuur. De oplosbaarheid in water wordt uitgedrukt in eenheden massa per volume oplossing. De SI-eenheid is kg/m3 (g/l kan ook worden gebruikt).
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om zo nu en dan de werking van de methode te controleren en om vergelijkingen met resultaten van andere methodes mogelijk te maken.
1.4. PRINCIPE VAN DE TESTMETHODEN
De hoeveelheid van het monster en de tijd die nodig zijn om de verzadigingswaarde te bereiken, moeten bij benadering worden bepaald in een eenvoudige inleidende test.
1.4.1. Kolom-elutie-methode
Deze methode is gebaseerd op de elutie van de te onderzoeken stof met water uit een microkolom welke is gevuld met een inert dragermateriaal zoals glasparels of zand, gedekt met een overmaat aan de te onderzoeken stof. De oplosbaarheid in water is bepaald zodra de massaconcentratie van het eluaat constant is. Dit blijkt uit een constante concentratiewaarde als functie van de tijd.
1.4.2. Methode met de kolf
Bij deze methode wordt de stof (vaste stoffen moeten worden fijngemaakt) opgelost in water bij een temperatuur die iets hoger is dan de testtemperatuur. Zodra verzadiging is bereikt wordt het mengsel afgekoeld en op de testtemperatuur gehouden, terwijl net zo lang wordt geroerd totdat er een evenwichtstoestand is bereikt. Als alternatief kan de meting rechtstreeks bij de testtemperatuur uitgevoerd worden, op voorwaarde dat men er, via geschikte monsternamen, zeker van is dat het verzadigingsevenwicht bereikt is. Vervolgens wordt de massaconcentratie van de stof in de waterige oplossing, welke geen onopgeloste deeltjes mag bevatten, bepaald aan de hand van een geschikte analysemethode.
1.5. KWALITEITSCRITERIA
1.5.1. Herhaalbaarheid
Voor de kolom-elutie-methode kan < 30 % haalbaar zijn; voor de methode met de kolf dient < 15 % in acht te worden genomen.
1.5.2. Gevoeligheid
Deze is afhankelijk van de analysemethode, maar het is mogelijk massaconcentraties te bepalen tot een waarde van 10-6 g/l.
1.6. BESCHRIJVING VAN DE TESTMETHODEN
1.6.1. Testomstandigheden
De test wordt bij voorkeur uitgevoerd bij 20 oC ±0,5 oC. Als wordt verwacht dat de oplosbaarheid temperatuurafhankelijk is (> 3 % per oC), dan wordt nog bij twee andere temperaturen gemeten, die ten minste 10 oC boven, respectievelijk 10 oC onder de eerste temperatuur liggen. In dit geval dient de temperatuurregeling op ±0,1 oC nauwkeurig te zijn. De gekozen temperatuur moet in alle betrokken delen van de apparatuur constant worden gehouden.
1.6.2. Inleidende test
In een maatcylinder van 10 ml, voorzien van een glazen stop, wordt gedestilleerd water op kamertemperatuur toegevoegd aan ongeveer 0,1 g monster (vaste stoffen moeten worden fijngemaakt). Toenemende volumes gedestilleerd water worden stapsgewijze toegevoegd, volgens onderstaande tabel.
|
0,1 g opgeloste stof in „x” ml water |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Oplosbaarheid bij benadering (g/l) |
> 1 000 |
1 000-200 |
200-100 |
100-50 |
50-10 |
10-1 |
< 1 |
Nadat de aangegeven hoeveelheid water is toegevoegd, wordt het mengsel telkens gedurende tien minuten hard geschud en vervolgens visueel onderzocht op eventuele onopgeloste delen van het monster. Als het monster of delen ervan onopgelost zijn nadat nog 10 ml water is toegevoegd, dient het experiment te worden herhaald in een maatcilinder van 100 ml met grotere volumes water. De tijd die nodig is om een stof op te lossen kan bij lagere waarden van de oplosbaarheid aanzienlijk langer zijn (minimaal 24 uur dient in acht te worden genomen). De benaderde waarde van de oplosbaarheid is in de tabel vermeld onder de hoeveelheid water waarin het monster geheel wordt opgelost. Als de stof nog steeds onoplosbaar blijkt moet meer dan 24 uur gewacht worden (maximaal 96 uur), of dient verdere verdunning plaats te vinden om te bepalen of de kolom-elutie-methode dan wel de methode met de kolf moet worden gebruikt.
1.6.3. Kolom-elutie-methode
1.6.3.1. Dragermateriaal, oplosmiddel en eluens
Het dragermateriaal voor de kolom-elutie-methode moet inert zijn. Bruikbare materialen zijn bijvoorbeeld glasparel en zand. Voor het aanbrengen van de te onderzoeken stof op het dragermateriaal dient gebruik te worden gemaakt van een geschikt vluchtig en analytisch zuiver oplosmiddel. Als eluens dient water, dat tweemaal gedestilleerd is in glas- of kwartsapparatuur, te worden gebruikt.
Opmerking:
Er mag geen gebruik worden gemaakt van water dat rechtstreeks uit een organische ionenwisselaar komt.
1.6.3.2. Laden van het dragermateriaal
Ongeveer 600 mg dragermateriaal wordt afgewogen en overgebracht in een rondbodemkolf van 50 ml.
Een afgewogen hoeveelheid van de te onderzoeken stof wordt opgelost in het gekozen oplosmiddel. De juiste hoeveelheid van deze oplossing wordt bij het dragermateriaal gevoegd. Het oplosmiddel moet, bijvoorbeeld in een roterende verdamper, volledig worden verdampt. Bij onvolledige verwijdering van het oplosmiddel kan het dragermateriaal, ten gevolge van verdelingseffecten aan het oppervlak, later niet worden verzadigd met water.
Het laden van het dragermateriaal kan aanleiding geven tot problemen (onjuiste resultaten) als de te onderzoeken stof wordt afgezet als olie of in een andere kristalvorm. Dit probleem moet experimenteel worden onderzocht en de bijzonderheden moeten worden gerapporteerd.
Het beladen dragermateriaal wordt gedurende ongeveer twee uur bevochtigd in ongeveer 5 ml water, waarna de suspensie wordt aangebracht op de microkolom. Anderzijds kan men ook het droge, beladen dragermateriaal direct in de met water gevulde microkolom brengen, en daarna ongeveer twee uur wachten totdat een evenwichtstoestand is ontstaan.
Testprocedure:
De stof kan op twee verschillende manieren van het dragermateriaal worden geëlueerd:
|
— |
recirculatiepomp (zie figuur 1); |
|
— |
voorraadfles (zie figuur 4). |
1.6.3.3. Kolom-elutie-methode met recirculatiepomp
Apparatuur
Een schema van het systeem is afgebeeld in figuur 1. In figuur 2 is een geschikte microkolom afgebeeld: elke maat is echter aanvaardbaar mits deze voldoet aan de criteria voor reproduceerbaarheid en gevoeligheid. De kolom moet aan de bovenzijde zijn voorzien van een reservoir voor ten minste vijf kolomvolumina water, en moet minimaal vijf monsters kunnen bevatten. Eventueel kunnen de afmetingen worden verminderd indien extra oplosmiddel wordt gebruikt ter vervanging van de eerste vijf kolomvolumina welke met verontreinigingen worden afgevoerd.
De kolom moet worden aangesloten op een recirculatiepomp waarmee een debiet van ongeveer 25 ml/uur kan worden ingesteld. De pomp wordt aangesloten door middel van polytetrafluorethyleen (PTFE) en/of glazen verbindingsstukken. De kolom en de pomp moeten zo worden opgesteld dat het mogelijk is om monsters te nemen van de uitstromende vloeistof en om het reservoir in evenwicht te houden met de atmosferische druk. Het kolommateriaal wordt ondersteund door een kleine (5 mm) prop glaswol waarmee ook deeltjes worden weggefilterd. Als recirculatiepomp kan bijvoorbeeld een peristaltische pomp of een membraanpomp worden gebruikt (er moet op worden toegezien dat aan de slangwand geen verontreiniging en/of adsorptie plaatsvindt).
Meetprocedure
De stroming door de kolom wordt op gang gebracht. Een debiet van ongeveer 25 ml/uur (dit komt overeen met ongeveer 10 kolomvolumina/uur voor de beschreven kolom) wordt aanbevolen. De eerste vijf kolomvolumina (minimaal) worden afgevoerd om wateroplosbare verontreinigingen te verwijderen. Vervolgens wordt de recirculatiepomp aan de onderzijde van de kolom aangesloten. De apparatuur blijft in werking totdat een evenwichtstoestand is bereikt; hiervoor geldt dat de concentraties in vijf opeenvolgende monsters niet meer dan ± 30 % mogen verschillen op aselecte wijze. Tussen de tijdstippen, waarop deze monsters worden genomen, moeten ten minste 10 kolomvolumina van het eluens passeren.
1.6.3.4. Kolom-elutie-methode met voorraadfles
Apparatuur (zie figuren 3 en 4)
Voorraadfles: voor aansluiting van de voorraadfles wordt gebruik gemaakt van een rond glazen slijpstuk en polytetrafluorethyleenslangen. Een debiet van ongeveer 25 ml/uur wordt aanbevolen. Er wordt een aantal opeenvolgende monsters van het eluaat genomen voor analyse volgens de gekozen methode.
Meetprocedure
In het middengebied van het eluaat, wanneer de concentraties constant zijn (± 30 %) in ten minste vijf opeenvolgende fracties, worden deze fracties gebruikt om de oplosbaarheid in water te bepalen.
In beide gevallen (circulatiepomp of voorraadfles) moet een tweede reeks metingen worden verricht waarbij het debiet de helft is van de aanvankelijke waarde. Als de resultaten van beide series metingen overeenstemmen, worden de testresultaten geaccepteerd. Als de oplosbaarheid bij het laagste debiet hoger blijkt, dan moet het halveren van het debiet worden voortgezet, totdat twee opeenvolgende series metingen dezelfde oplosbaarheid geven.
In beide gevallen (circulatiepomp of voorraadfles) moeten de monsters aan de hand van het Tyndall-effect (verstrooiing van licht) worden gecontroleerd op aanwezigheid van deeltjes in colloïdale toestand. De aanwezigheid van dergelijke deeltjes maakt de resultaten ongeldig, zodat de test moet worden herhaald nadat de filterwerking van de kolom is verbeterd.
De pH van elk monster moet worden geregistreerd. Er moet een tweede serie metingen worden uitgevoerd bij dezelfde temperatuur.
1.6.4. Methode met de kolf
1.6.4.1. Apparatuur
Voor de methode met de kolf is het volgende materiaal nodig:
|
— |
gangbaar laboratoriumglaswerk en -apparatuur; |
|
— |
een apparaat om de oplossingen in beweging te brengen bij constante temperatuur; |
|
— |
zo nodig voor emulsies een centrifuge (bij voorkeur met thermostaat); |
|
— |
apparatuur voor analytische bepaling. |
1.6.4.2. Meetprocedure
Aan de hand van de inleidende test wordt bepaald hoeveel materiaal nodig is om de gewenste hoeveelheid water te verzadigen. De benodigde hoeveelheid water hangt af van de analysemethode en van de oplosbaarheid. In drie van een glazen stop voorziene glazen vaten (bijvoorbeeld centrifugebuizen, kolven) wordt telkens ongeveer vijfmaal de aldus bepaalde hoeveelheid materiaal afgewogen. De gewenste hoeveelheid water wordt in elk vat gegoten, waarna de vaten goed worden afgesloten. De afgesloten vaten worden vervolgens bij een temperatuur van 30 oC in beweging gebracht. (Hiervoor wordt een schud- of roermachine gebruikt waarmee bij constante temperatuur kan worden gewerkt, bijvoorbeeld een magneetroerder in een waterbak met thermostaatregeling.) Na één dag wordt één van de vaten verwijderd, waarna onder af en toe roeren 24 uur wordt gewacht totdat bij de testtemperatuur een nieuwe evenwichtstoestand is ontstaan. Vervolgens wordt de inhoud van het vat gecentrifugeerd bij de testtemperatuur, waarna de concentratie van de teststof in de heldere waterige oplossing analytisch wordt bepaald. De beide andere kolven ondergaan dezelfde behandeling nadat zij gedurende twee respectievelijk drie dagen bij 30 oC zijn geëquilibreerd. Als de waarden voor de concentratie in ten minste de laatste twee vaten voldoen aan de vereiste reproduceerbaarheid, worden de testresultaten geaccepteerd. Als de resultaten van de vaten 1, 2 en 3 toenemende waarden geven, moet de hele test worden herhaald, waarbij langer wordt gewacht tot een evenwichtstoestand is ontstaan.
De meetprocedure kan ook worden uitgevoerd zonder voorverwarming bij 30 oC. Om de snelheid te kunnen schatten waarmee het verzadigingsevenwicht zich instelt, worden monsters genomen totdat blijkt dat verder roeren geen invloed meer heeft op de concentratie van de testoplossing.
De pH van elk monster moet worden geregistreerd.
1.6.5. Analyse
Hiervoor dient bij voorkeur een methode te worden toegepast waarmee verschillende stoffen kunnen worden onderscheiden, aangezien kleine hoeveelheden opgeloste verontreinigingen kunnen leiden tot grote fouten in de gemeten oplosbaarheid. Voorbeelden van zulke methoden zijn: gas- of vloeistofchromatografie, titratie, fotometrie, voltametrie.
2. GEGEVENS
2.1. KOLOM-ELUTIE-METHODE
Voor elke serie metingen moeten het gemiddelde en de standaardafwijking worden berekend van ten minste vijf opeenvolgende monsters, die op het verzadigingsniveau zijn genomen. De resultaten moeten worden opgegeven in eenheden massa per volume oplossing.
De gemiddelden van twee metingen met verschillend debiet moeten worden vergeleken en moeten een herhaalbaarheid beter dan 30 % hebben.
2.2. METHODE MET DE KOLF
Voor de drie kolven moeten de afzonderlijke resultaten worden vermeld en het gemiddelde van de als constant beschouwde resultaten (herhaalbaarheid beter dan 15 %) moet worden bepaald en opgegeven in eenheden massa per volume oplossing. Hiervoor kan het nodig zijn massa-eenheden om te rekenen naar volume-eenheden, waarbij rekening wordt gehouden met de dichtheid indien de oplosbaarheid zeer hoog is (> 100 g/l).
3. RAPPORTAGE
3.1. KOLOM-ELUTIE-METHODE
Het rapport dient zo mogelijk de volgende gegevens te bevatten:
|
— |
de resultaten van de inleidende test; |
|
— |
nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen); |
|
— |
de afzonderlijke concentraties, debieten en pH-waarden van elk monster; |
|
— |
het gemiddelde en de standaardafwijking van ten minste vijf monsters uit elke serie die zijn genomen op het verzadigingsniveau; |
|
— |
het gemiddelde van de twee opeenvolgende acceptabele series; |
|
— |
de temperatuur van het water tijdens het verzadigingsproces; |
|
— |
de toegepaste analysemethode; |
|
— |
de aard van het toegepaste dragermateriaal; |
|
— |
het laden van het dragermateriaal; |
|
— |
het gebruikte oplosmiddel; |
|
— |
elke gebleken chemische instabiliteit van de stof tijdens de test en de gebruikte methode; |
|
— |
alle gegevens en opmerkingen, die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof. |
3.2. METHODE MET DE KOLF
Het rapport dient zo mogelijk de volgende gegevens te bevatten:
|
— |
de resultaten van de inleidende test; |
|
— |
nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen); |
|
— |
de afzonderlijke analyses en het gemiddelde, indien meer dan één waarde werd bepaald, voor iedere kolf; |
|
— |
de pH van elk monster; |
|
— |
het gemiddelde van de waarden voor de verschillende kolven die onderling overeenstemden; |
|
— |
de testtemperatuur; |
|
— |
de toegepaste analysemethode; |
|
— |
elke gebleken chemische instabiliteit van de stof tijdens de test en de gebruikte methode; |
|
— |
alle gegevens en opmerkingen, die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof. |
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 105 — Decision of the Council C(81) 30 Final. |
|
(2) |
NF T 20-045 (AFNOR) (Sept. 85). Chemical products for industrial use — Determination of water solubility of solids and liquids with low solubility — Column elution method. |
|
(3) |
NF T 20-046 (AFNOR) (Sept. 85). Chemical products for industrial use — Determination of water solubility of solids and liquids with high solubility — Flask method. |
Aanhangsel
Figuur 1
Kolom-elutie-methode met recirculatiepomp

Figuur 2
Een voorbeeld van een microkolom
(alle afmetingen in mm)

Figuur 3
Een voorbeeld van een microkolom
(alle afmetingen in mm)

Figuur 4
Kolom-elutie-methode met voorraadfles

A.8. VERDELINGSCOËFFICIËNT
1. METHODE
De „schudfles”-methode berust op de testrichtlijn van de OESO (1).
1.1. INLEIDING
Voor het uitvoeren van deze test is het nuttig om van tevoren te beschikken over gegevens inzake de structuurformule, dissociatieconstante, oplosbaarheid in water, hydrolyse, oplosbaarheid in n-octanol en oppervlaktespanning van de stof.
Metingen van ioniseerbare stoffen dienen alleen te worden uitgevoerd met de niet-geïoniseerde vorm van de stof (vrij zuur of vrije base) verkregen met behulp van een geschikte buffer met een pH van minstens één pH-eenheid onder (vrij zuur) of boven (vrije base) de pK.
Deze testmethode omvat twee verschillende procedures: de schudflesmethode en de hogedrukvloeistofchromatografie (HPLC). De eerste methode is toepasbaar wanneer de log Pow-waarde (zie verder voor definities) in het bereik van - 2 tot 4 valt, de tweede methode in het bereik van 0 tot 6. Alvorens een van beide experimentele procedures uit te voeren, dient eerst een voorlopige schatting van de verdelingscoëfficiënt te worden gemaakt.
De schudflesmethode is alleen van toepassing op chemisch zuivere stoffen die oplosbaar zijn in water en n-octanol. De methode is niet van toepassing op oppervlakteactieve stoffen (waarvoor een berekende waarde of een raming, gebaseerd op de individuele oplosbaarheid in n-octanol en water, moet worden gerapporteerd).
De HPLC-methode is niet toepasbaar op sterke zuren en basen, metaalcomplexen en oppervlakte-actieve stoffen die met het eluent kunnen reageren. Voor deze stoffen dient een berekende waarde of een raming, gebaseerd op de individuele oplosbaarheid in n -octanol en water, te worden gerapporteerd.
De HPLC-methode is minder gevoelig voor de aanwezigheid van verontreinigingen in de teststof dan de schudflesmethode. Desondanks kunnen verontreinigingen soms de interpretatie van de resultaten bemoeilijken omdat moeilijk kan worden bepaald welke piek bij welke stof hoort. Voor mengsels die een band zonder resolutie geven, moeten de boven- en ondergrens van log P worden gerapporteerd.
1.2. DEFINITIES EN EENHEDEN
De verdelingscoëfficiënt (P) is gedefinieerd als de verhouding van de concentraties in evenwichtstoestand (Cj) van een opgeloste stof in een twee-fasensysteem bestaande uit twee niet-mengbare oplosmiddelen. Voor n-octanol en water:

De verdelingscoëfficiënt (P) is daarom het quotiënt van twee concentraties; gewoonlijk wordt deze waarde opgegeven als een logaritme met grondtal tien (log P).
1.3. REFERENTIESTOFFEN
Schudflesmethode
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om zo nu en dan de werking van de methode te controleren en om vergelijkingen met resultaten van andere methoden mogelijk te maken.
HPLC-methode
Om de gemeten HPLC-gegevens van een stof te kunnen correleren met de P-waarde, moet een ijklijn worden gemaakt van log P tegen de chromatografische gegevens, met behulp van minstens 6 referentiepunten. De gebruiker dient de geschikte referentiestoffen te kiezen. Zo mogelijk dient de Pow-waarde van minstens één referentiestof boven, en die van minstens één referentiestof onder de Pow van de teststof te liggen. Voor log P-waarden kleiner dan 4 kan bij de ijking worden uitgegaan van met de schudflesmethode verkregen gegevens. Voor log P-waarden groter dan 4 kan de ijking worden uitgevoerd met behulp van gevalideerde waarden uit de literatuur, op voorwaarde dat deze overeenkomen met de berekende waarden. Voor een grotere nauwkeurigheid verdient het de voorkeur om referentiestoffen te kiezen die qua structuur verwant zijn aan de te onderzoeken stof.
Er zijn uitgebreide lijsten beschikbaar met log Pow-waarden voor verschillende categorieën chemicaliën (2)(3). Als er geen gegevens over de verdelingscoëfficiēnt van structureel verwante stoffen beschikbaar zijn, mag een meer algemene ijking worden toegepast met andere ijkstoffen.
In aanhangsel 2 wordt een lijst van aanbevolen ijkstoffen en hun Pow-waarden gegeven.
1.4. PRINCIPE VAN DE TESTMETHODE
1.4.1. Schudflesmethode
Om een verdelingscoëfficiënt te kunnen bepalen, moet een evenwichtstoestand zijn bereikt tussen alle componenten van het systeem; de concentraties van de opgeloste stoffen moeten vervolgens in beide fasen worden bepaald. Uit de literatuur blijkt dat er voor dit probleem, dat wil zeggen het grondig mengen van beide fasen gevolgd door fasescheiding ten einde de evenwichtsconcentraties van de te onderzoeken stof te bepalen, verschillende technische oplossingen bestaan.
1.4.2. HPLC-methode
HPLC wordt uitgevoerd met analytische kolommen, gepakt met een in de handel verkrijgbare vaste fase, bestaande uit chemisch aan silica gebonden lange koolwaterstofketens (bijvoorbeeld C8, C18). Chemische stoffen die in deze kolommen geïnjecteerd worden, bewegen met verschillende snelheden door deze kolommen, wat een gevolg is van het verschil in verdeling tussen de mobiele fase en de stationaire koolwaterstoffase. Mengsels van stoffen worden geëlueerd in volgorde van waterafstotendheid, wateroplosbare stoffen het eerst en olieoplosbare stoffen het laatst, afhankelijk van hun koolwaterstof/water-verdelingscoëfficiënt. Op deze wijze kan de verhouding tussen de retentietijd in de (omgekeerde fase) kolom en de n-octanol/water-verdelingscoëfficiënt worden bepaald. De verdelingscoëfficiënt wordt afgeleid uit de capaciteitsfactor k, met de volgende formule:

waarin tR = retentietijd van de te onderzoeken stof, en t0 = gemiddelde tijd die een molecuul van het oplosmiddel nodig heeft om de kolom te passeren (dode tijd).
Kwantitatieve analysemethoden zijn niet vereist, alleen de elutietijd moet worden bepaald.
1.5. KWALITEITSCRITERIA
1.5.1. Herhaalbaarheid
Schudflesmethode
Om de nauwkeurigheid van de verdelingscoëfficiënt te garanderen moeten duplo-metingen worden verricht onder drie uiteenlopende testomstandigheden; hierbij kan zowel de hoeveelheid stof als de verhouding van de hoeveelheden oplosmiddel worden gevarieerd. De gevonden waarden van de verdelingscoëfficiënt moeten, uitgedrukt in gewone logaritmen, binnen een interval van ±0,3 log-eenheden vallen.
HPLC-methode
Om de betrouwbaarheid van de meting te vergroten moeten duplo-metingen worden verricht. De log P-waarden, afgeleid uit de individuele metingen, moeten binnen een bereik van ±0,1 log-eenheid liggen.
1.5.2. Gevoeligheid
Schudflesmethode
Het meetbereik van de methode wordt bepaald door de detectiegrens van de analysemethode. Deze moet voldoende laag zijn om log Pow-waarden in het bereik van – 2 tot 4 te kunnen bepalen (onder speciale voorwaarden kan dit bereik uitgebreid worden tot een log Pow van 5), wanneer de concentratie van de opgeloste stof in geen van beide fasen hoger is dan 0,01 mol per liter.
HPLC-methode
Met de HPLC-methode kunnen verdelingscoëfficiënten worden bepaald in het log Pow-bereik van 0 tot 6.
Normaal gezien kan de verdelingscoëfficiënt van een mengsel worden geschat tot op ± 1 log-eenheid van de schudfleswaarde. Voorbeelden van correlaties kunnen worden teruggevonden in de literatuur (4, 5, 6, 7, 8). Grotere nauwkeurigheid kan meestal worden bereikt met behulp van correlatiekrommen gebaseerd op referentiemengsels met verwante structuur (9).
1.5.3. Specificiteit
Schudflesmethode
De verdelingswet van Nernst geldt alleen voor verdunde oplossingen bij constante temperatuur, druk en pH. De wet geldt bovendien voor een zuivere stof die wordt verdeeld tussen twee zuivere oplosmiddelen. Indien in één of beide fasen tegelijkertijd verschillende opgeloste stoffen voorkomen, dan kan dit van invloed zijn op de resultaten.
Dissociatie of associatie van de opgeloste moleculen leidt tot afwijkingen van de verdelingswet van Nernst. Dergelijke afwijkingen blijken uit de concentratieafhankelijkheid van de verdelingscoëfficiënt.
Wegens het voorkomen van meervoudige evenwichtstoestanden mag deze test niet zonder correcties worden toegepast op ioniseerbare stoffen. Voor dergelijke stoffen dient het gebruik van bufferoplossingen in plaats van water te worden overwogen; de pH van de buffer dient ten minste 1 pH-eenheid te verschillen van de pKa van de stof en men dient rekening te houden met het belang van deze pH met betrekking tot het milieu.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Inleidende schatting van de verdelingscoëfficiënt
De verdelingscoëfficiënt wordt bij voorkeur geschat aan de hand van een berekeningsmethode (zie aanhangsel 1) of, indien van toepassing, op basis van de oplosbaarheidsverhouding van de te onderzoeken stof in de zuivere oplosmiddelen (10).
1.6.2. Schudflesmethode
1.6.2.1. Voorbereiding
n-Octanol: de verdelingscoëfficiënt moet worden bepaald met analytisch zuiver oplosmiddel.
Water: er moet gebruik worden gemaakt van gedestilleerd of dubbel gedestilleerd water uit apparatuur van glas of kwarts. Voor ioniseerbare verbindingen dienen zo nodig bufferoplossingen in plaats van water te worden gebruikt.
Opmerking:
Er mag geen gebruik worden gemaakt van water dat rechtstreeks uit een ionenwisselaar komt.
1.6.2.1.1.
Alvorens een verdelingscoëfficiënt te bepalen, worden de fasen van het oplosmiddelsysteem onderling verzadigd door uitschudden bij de temperatuur van het experiment. Hiertoe is het handig om gedurende 24 uur twee grote voorraadflessen met analytisch zeer zuiver n-octanol, respectievelijk water, waaraan voldoende water respectievelijk n-octanol is toegevoegd, mechanisch te schudden en daarna te laten staan totdat de fasen zich afscheiden en een verzadigingstoestand is ontstaan.
1.6.2.1.2.
Het twee-fasensysteem moet het testvat bijna vullen. Aldus wordt vervluchtiging van de vloeistof voorkomen. De volumeverhouding en de benodigde hoeveelheid van de te onderzoeken stof worden bepaald door:
|
— |
de inleidende bepaling van de verdelingscoëfficiënt (zie 1.6.1); |
|
— |
de minimale hoeveelheid van de te onderzoeken stof vereist voor de analyse; |
|
— |
de beperking van de maximale concentratie in beide fasen tot 0,01 mol/l. |
Er worden drie tests uitgevoerd: in de eerste test wordt gewerkt met de berekende volumeverhouding n-octanol/water; in de tweede test wordt deze verhouding gedeeld door twee, in de derde test wordt deze verhouding vermenigvuldigd met twee (bijvoorbeeld 1:1, 1:2, 2:1).
1.6.2.1.3.
Er wordt een voorraadoplossing bereid uit n-octanol voorverzadigd met water. De concentratie van deze voorraadoplossing moet nauwkeurig worden bepaald voor gebruik bij de bepaling van de verdelingscoëfficiënt. Deze oplossing moet onder stabiele omstandigheden bewaard worden.
1.6.2.2. Testomstandigheden
De testtemperatuur moet constant (± 1 oC) worden gehouden binnen een bereik van 20-25 oC.
1.6.2.3. Meetprocedure
1.6.2.3.1.
Voor de verschillende testomstandigheden moeten steeds twee testvaten worden gevuld met de vereiste, nauwkeurig bekende hoeveelheden van beide oplosmiddelen en de gewenste hoeveelheid voorraadoplossing.
Het volume van de n-octanol-fasen moet worden gemeten. De testvaten moeten in een schudmachine worden geplaatst of met de hand worden geschud. Aanbevolen wordt om, bij gebruik van een centrifugebuis, deze snel 180o te draaien om de transversale as, zodat de ingesloten lucht door de beide fasen omhoog beweegt. De ervaring heeft geleerd dat 50 van dergelijke bewegingen gewoonlijk voldoende zijn om het verdelingsevenwicht te bereiken. Om zeker te zijn wordt aangeraden om 100 bewegingen uit te voeren in 5 minuten.
1.6.2.3.2.
Indien noodzakelijk, moet het mengsel worden gecentrifugeerd om de fasen te scheiden. Dit moet worden gedaan in een laboratoriumcentrifuge bij kamertemperatuur; indien een centrifuge zonder temperatuurregeling wordt gebruikt, moeten de centrifugebuizen ten minste gedurende één uur op de testtemperatuur worden gehouden, zodat de evenwichtstoestand zich kan instellen voordat de analyse wordt uitgevoerd.
1.6.2.4. Analyse
Voor bepaling van de verdelingscoëfficiënt moet de concentratie van de te onderzoeken stof in beide fasen worden bepaald. Dit kan worden gedaan door onder de verschillende testomstandigheden uit alle buizen een monster van iedere fase te nemen en dit volgens de gekozen procedure te analyseren. De totale hoeveelheid van de te onderzoeken stof in beide fasen wordt berekend en vergeleken met de oorspronkelijke hoeveelheid toegevoegde stof.
Van de waterfase moet een monster worden genomen volgens een procedure waardoor zo min mogelijk sporen n-octanol worden meegenomen: voor de bemonstering van de waterfase kan een glazen injectiespuit met verwisselbare naald worden gebruikt. De injectiespuit moet van tevoren gedeeltelijk worden gevuld met lucht. De lucht moet zachtjes worden uitgedreven terwijl de naald door de n-octanol-fase wordt gestoken. De benodigde hoeveelheid van de waterfase wordt in de injectiespuit gezogen. De spuit wordt snel uit de oplossing gehaald, waarna de naald wordt losgemaakt. De inhoud van de injectiespuit kan nu worden gebruikt als monster van de waterfase. De concentratie in de twee afzonderlijke fasen dient bij voorkeur te worden bepaald met behulp van een analysemethode waarmee verschillende stoffen kunnen worden onderscheiden. Enkele voorbeelden van geschikte analysenmethoden zijn:
|
— |
fotometrische methoden; |
|
— |
gaschromatografie; |
|
— |
hogedrukvloeistofchromatografie (HPLC). |
1.6.3. HPLC-methode
1.6.3.1. Voorbereiding
Apparatuur
Benodigd is een vloeistofchromatograaf, uitgerust met een niet-pulserende pomp en een geschikte detectie-in-richting. Het gebruik van een injectieventiel met injectielussen wordt aangeraden. Aangezien de aanwezigheid van polaire groepen in de stationaire fase het juiste gedrag van de HPLC-kolom ernstig kan beïnvloeden, dient deze een zo klein mogelijk percentage polaire groepen te bevatten (11). Men kan gebruik maken van in de handel verkrijgbare, met microdeeltjes gevulde, omgekeerde fasepakkingen of van voorgepakte kolommen. Tussen het injectiesysteem en de analytische kolom kan een voorkolom worden geïnstalleerd.
Mobiele fase
Methanol en water, beide van HPLC-kwaliteit, worden gebruikt als elutiemiddel, dat voor gebruik wordt ontgast. Isokratische elutie dient te worden toegepast. Men moet methanol/water-verhoudingen met minimaal 25 % watergehalte gebruiken, normaliter neemt men een 3:1 (v/v) methanol/watermengsel om verbindingen met een log P van 6 binnen het uur te elueren, bij een stroomsnelheid van 1 ml/minuut. Voor verbindingen met een hoge log P kan het noodzakelijk zijn om de elutietijd te verkorten (evenals voor de referentiestoffen) door de polariteit van de mobiele fase of de kolomlengte te verminderen.
Stoffen met een zeer lage oplosbaarheid in n-octanol geven met de HPLC-methode veelal abnormaal lage log Pow-waarden; de pieken van dergelijke stoffen vallen soms samen met het oplosmiddelfront. Dit is waarschijnlijk te wijten aan het feit dat het verdelingsproces te traag verloopt om het evenwicht te bereiken binnen de tijdsduur die normaal voor een HPLC-scheiding nodig is. Het kan dan nuttig zijn om de stroomsnelheid en/of de methanol/water-verhouding te verlagen ten einde een betrouwbare waarde te verkrijgen.
Test- en referentiestoffen moeten in voldoende concentratie oplosbaar zijn in de mobiele fase om detectie mogelijk te maken. Alleen in uitzonderingsgevallen mogen additieven in het methanol/water-mengsel worden gebruikt, daar toevoegingen de eigenschappen van de kolom veranderen. Voor chromatogrammen met additieven is het verplicht een aparte kolom van hetzelfde type te gebruiken. Als methanol/water niet voldoet, mogen andere organisch-oplosmiddel/water-mengsels worden gebruikt, bijvoorbeeld ethanol/water of acetonitril/water.
De pH van het eluent is kritisch voor ioniseerbare stoffen. Hij moet in het juiste pH-bereik van de kolom liggen, gewoonlijk tussen 2 en 8. Bufferen wordt aangeraden. Voorzichtigheid dient in acht te worden genomen om neerslag van zout en achteruitgang van de kolom te voorkomen, hetgeen optreedt met sommige organische fase/buffer-mengsels. HPLC-metingen met stationaire fasen op basis van silica boven pH 8 worden afgeraden omdat het gebruik van een alkalische mobiele fase kan leiden rot een snelle achteruitgang van de kolomeigenschappen.
Opgeloste stoffen
De referentiestoffen dienen zo zuiver mogelijk te zijn. Verbindingen voor test- of ijkdoeleinden worden, indien mogelijk, opgelost in de mobiele fase.
Testomstandigheden
De temperatuur gedurende de metingen mag niet meer variëren dan ± 2 K.
1.6.3.2. Meting
Berekening van de dode tijd t0
De dode tijd t0 kan bepaald worden met of wel een homologe serie (bijvoorbeeld n-alkylmethylketonen) of wel organische stoffen die niet worden tegengehouden (bijvoorbeeld thioureum of formamide). Ter berekening van de dode tijd t0 met een homologe serie moet een set van ten minste 7 stoffen uit dezelfde serie worden geïnjecteerd en moeten de respectieve retentietijden worden bepaald. De ruwe retentietijden tr(nc + 1) worden uitgezet als functie van tr(nc), en het snijpunt a en de helling b van de regressievergelijking:
tr(nc + 1) = a + btr (nc)
worden bepaald (nc = aantal koolstofatomen). De dode tijd t0 wordt dan gegeven door:
t0 = a/(1 - b)
IJklijn
De volgende stap bestaat uit het construeren van een correlatiekromme van log k-waarden tegen log P voor geschikte referentiestoffen. In de praktijk wordt een set van 5 tot 10 standaard-referentiestoffen, met een log P-waarde rond het te verwachten bereik, tegelijkertijd geïnjecteerd en worden de retentietijden bepaald, bij voorkeur met een recorder/integrator die is verbonden met het detectiesysteem. De corresponderende logaritmen van de capaciteitsfactoren, log k, worden berekend en uitgezet als functie van log P, bepaald met de schudflesmethode. De ijking wordt uitgevoerd met regelmatige tussenpozen, minstens eenmaal per dag, zodat rekening kan worden gehouden met mogelijke veranderingen in het gedrag van de kolom.
Bepaling van de capaciteitsfactor van de te onderzoeken stof
De teststof wordt in een zo klein mogelijke hoeveelheid van de mobiele fase geïnjecteerd. De retentietijd wordt bepaald (in duplo), om zo de capaciteitsfactor k te kunnen berekenen. Uit de correlatiegrafiek van de ijkstoffen kan de verdelingscoëfficiënt van de teststof worden geïnterpoleerd. Voor zeer lage en zeer hoge verdelingscoëfficiënten is extrapolatie noodzakelijk. In deze gevallen dient men extra aandacht te besteden aan de betrouwbaarheidsgrenzen van de regressielijn.
2. GEGEVENS
Schudflesmethode
De betrouwbaarheid van de gevonden waarden voor P kan worden onderzocht door de gemiddelden van de duplo-bepalingen te vergelijken met het totale gemiddelde.
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen); |
|
— |
indien de methoden niet toepasbaar zijn (bijvoorbeeld oppervlakteactieve stoffen), dient een berekende waarde of een schatting gebaseerd op de individuele oplosbaarheid in n-octanol en water te worden opgegeven; |
|
— |
alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof. |
Voor de schudflesmethode:
|
— |
het resultaat van de inleidende schatting, indien van toepassing; |
|
— |
testtemperatuur; |
|
— |
gegevens over de analytische procedures voor bepaling van de concentraties; |
|
— |
tijd en snelheid van centrifugeren, indien van toepassing; |
|
— |
de gemeten concentraties in beide fasen voor elke bepaling (dit betekent dat in totaal 12 concentraties worden vermeld); |
|
— |
het gewicht van de onderzochte stof, het volume van elke fase in elk testvat en de berekende totale hoeveelheid van de onderzochte stof in elke fase bij evenwicht; |
|
— |
de berekende waarden van de verdelingscoëfficiënt (P) en het gemiddelde voor iedere groep testomstandigheden, evenals het gemiddelde van alle metingen; indien er aanwijzingen zijn dat de verdelingscoëfficiënt afhankelijk is van de concentratie, dient dit te worden vermeld in het testrapport; |
|
— |
de standaardafwijking van de afzonderlijke P-waarden ten opzichte van het gemiddelde; |
|
— |
de logaritme (grondtal 10) van de P-waarde gemiddeld over alle metingen; |
|
— |
de theoretisch berekende waarde van Pow, wanneer deze is bepaald of wanneer de gemeten waarde groter is dan 104; |
|
— |
pH van het gebruikte water en van de waterfase tijdens het experiment; |
|
— |
indien bufferoplossingen worden gebruikt, de redenen voor het gebruik van bufferoplossingen in plaats van water, samenstelling, concentratie en pH van de bufferoplossingen, pH van de waterige fase vóór en na het experiment. |
Voor de HPLC-methode:
|
— |
het resultaat van de inleidende schatting, indien van toepassing; |
|
— |
test- en referentiestoffen, en de zuiverheid; |
|
— |
testtemperatuur; |
|
— |
de pH waarbij de bepaling wordt uitgevoerd; |
|
— |
details van de analytische en de voorkolom, de mobiele fase en de detectiemethode; |
|
— |
retentiegegevens en log P-waarden uit de literatuur voor de bij de ijking gebruikte referentiestoffen; |
|
— |
details van de gevonden regressielijn (log k tegen log P); |
|
— |
gemiddelde retentiegegevens en de geïnterpoleerde log P-waarde voor de teststof; |
|
— |
beschrijving van de apparatuur en de werkomstandigheden; |
|
— |
elutieprofielen; |
|
— |
de hoeveelheden test- en referentiestoffen die in de kolom zijn gebracht; |
|
— |
dode tijd en hoe hij gemeten werd. |
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 107 — Decision of the Council C(81) 30 Final. |
|
(2) |
C. Hansch en A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(3) |
Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman; A.J. Leo, dir.) — Available from Pomona College Medicina! Chemistry Project, 1982, Pomona College, Claremont, California 91711. |
|
(4) |
L. Renberg, G. Sundström en K. Sundh-Nygärd, Chemosphere, 1980, vol. 80, 683. |
|
(5) |
H. Ellgehausen, C. D'Hondt en R. Fuerer, Pestic. Sci., 1981, vol. 12, 219. |
|
(6) |
B. McDuffie, Chemosphere, 1981, vol. 10, 73. |
|
(7) |
W.E. Hammers et al., J. Chromatogr., 1982, vol. 247, 1. |
|
(8) |
J.E. Haky en A.M. Young, J. Liq. Chromat., 1984, vol. 7, 675. |
|
(9) |
S. Fujisawa en E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, 787. |
|
(10) |
O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumspraxis (edited by E. Müller), Georg Thieme Verlag, Stuttgart (1958), Band I/1, 223-339. |
|
(11) |
R.F. Rekker en H.M. de Kort, Eur. J. Med. Chem., 1979, vol. 14, 479. |
|
(12) |
A. Leo, C. Hansch en D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, vol. 71, 525. |
|
(13) |
R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977. |
|
(14) |
NF T 20-043 (AFNOR) (Sept. 1985). Chemical products for industrial use — Determination of partition coefficient — Flask shaking method. |
|
(15) |
CV. Eadsforth en P. Moser, Chemosphere, 1983, vol. 12, 1 459. |
|
(16) |
A. Leo, C. Hansch en D. Elkins, Chem. Rev, 1971, vol. 71, 525. |
|
(17) |
C. Hansch, A. Leo, S.H. Unger, K.H. Kim, D. Nikaitani en E.J. Lien, J. Med. Chem., 1973, vol. 16, 1 207. |
|
(18) |
W.B. Neely, D.R. Branson en G.E. Blau, Environ. Sci. Technol., 1974, vol. 8, 1 113. |
|
(19) |
D.S. Brown en E.W. Flagg, J. Environ. Qual., 1981, vol. 10, 382. |
|
(20) |
J.K. Seydel en K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979. |
|
(21) |
R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984. |
|
(22) |
Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Basel, 1978. |
|
(23) |
N.S. Nirrlees, S.j. Noulton, C.T. Murphy en P.J. Taylor, j. Med. Chem., 1976, vol. 19, 615. |
Aanhangsel 1
Berekenings-/schattingsmethoden
INLEIDING
Een algemene inleiding tot berekeningsmethoden, gegevens en voorbeelden worden gegeven in het „Handbook of Chemical Property Estimation Methods” (a).
Berekende waarden voor Pow kunnen worden gebruikt:
|
— |
om te beslissen welke van de experimentele methoden het meest geschikt is (schudflesbereik: log Pow: – 2 tot 4, HPLC-bereik: log Pow: 0 tot 6); |
|
— |
om de geschikte testvoorwaarden te kunnen kiezen (bijvoorbeeld referentiestoffen voor de HPLC-methode, n-octanol/water-volumeverhoudingen voor de schudflesmethode); |
|
— |
ter controle voor het laboratorium zelf van eventuele fouten in het experiment; |
|
— |
om een Pow-schatting te leveren in die gevallen waar de experimentele methoden om technische redenen niet kunnen worden toegepast. |
SCHATTINGSMETHODE
Inleidende schatting van de verdelingscoëfficiënt
De waarde van de verdelingscoëfficiënt kan geschat worden met behulp van de oplosbaarheid van de teststof in zuivere oplosmiddelen. Hiervoor geldt:
![]()
BEREKENINGSMETHODEN
Principe van de berekeningsmethoden
Alle berekeningsmethoden zijn gebaseerd op de formele fragmentatie van het molecuul in geschikte substructuren, waarvoor betrouwbare log Pow-fragmentconstanten bekend zijn. De log Pow van het volledige molecuul wordt dan berekend als de som van de afzonderlijke waarden van de overeenkomstige fragmenten, plus de som van de correctietermen voor intramoleculaire wisselwerkingen.
Lijsten van fragmentconstanten en correctietermen zijn te vinden in de literatuur (b)(c)(d)(e). Sommige hiervan worden regelmatig bijgewerkt (b).
Kwaliteitscriteria
Over het algemeen vermindert de betrouwbaarheid van een berekeningsmethode met het toenemen van de complexiteit van de onderzochte stof. Voor eenvoudige moleculen met laag molecuulgewicht en slechts één of twee functionele groepen kan een afwijking van 0,1 tot 0,3 log Pow-eenheden worden verwacht tussen de resultaten van de verschillende fragmentatiemethoden en de gemeten waarde. Voor meer complexe moleculen kan de fout groter zijn. Dit is afhankelijk van de betrouwbaarheid en beschikbaarheid van fragmentconstanten, alsmede van het vermogen om intramoleculaire wisselwerkingen (bijvoorbeeld waterstofbruggen) te herkennen en het juiste gebruik van de correctietermen (minder problematisch met de computersoftware CLOGP-3) (b). In geval van ioniserende verbindingen is het belangrijk de lading of de mate van ionisatie juist in te schatten.
Berekeningsprocedures
Hansch π-methode
De oorspronkelijke hydrofobesubstitutieconstante π, geïntroduceerd door Fujita et al. (f), wordt gedefinieerd als:
πx = log Pow (PhX) - log Pow (PhH)
waarin Pow (PhX) de verdelingscoëfficiënt van een aromatisch derivaat is, en Pow (PhH) die van de oorspronkelijke verbinding,
(bijvoorbeeld πCI = log Pow (C6H5C1) - log Pow (C6H6) = 2,84 - 2,13 = 0,71).
Volgens zijn definitie is de Л-methode voornamelijk toepasbaar op aromatische substitutie. De Л-waarden van een groot aantal substitutiegroepen zijn in tabellen terug te vinden (b)(c)(d). Deze worden gebruikt voor de berekening van log Pow van aromatische moleculen of substructuren.
Rekker-Methode
Volgens Rekker (g) wordt de log Pow-waarde als volgt berekend:

waarin fi de moleculaire fragmentconstante voorstelt en ai de frequentie van het voorkomen ervan in het onderzochte molecuul. De correctietermen kunnen worden uitgedrukt als een integraal veelvoud van eén enkele constante cm (de zogenaamde „magische” constante). De fragmentconstanten fi en cm werden bepaald uit een lijst van 1 054 experimentele Pow waarden (825 stoffen) met behulp van meervoudige regressieanalyse (c)(h). De bepaling van de interactietermen wordt uitgevoerd volgens vaste regels beschreven in de literatuur (e)(h)(i).
Hansch-Leo-methode
Volgens Hansch en Leo (c) wordt de log Pow-waarde berekend uit:

waarin fi de moleculaire fragmentconstante voorstelt, Fj de correctietermen en ai en bj het overeenkomstige aantal keren dat ze voorkomen. Afgeleid uit experimentele Pow-waarden werd door „trial and error” een lijst gemaakt van atoom- en groepsfragmentwaarden evenals een lijst van correctietermen Fj (de zogenaamde „factoren”). De correctietermen zijn geclassificeerd in verschillende categorieën (a)(c). Omdat het vrij ingewikkeld en tijdrovend is rekening te houden met alle regels en correctietermen, werden softwarepakketten ontwikkeld (b).
Gecombineerde methode
De berekening van log Pow van complexe moleculen kan aanzienlijk verbeterd worden, indien het molecuul wordt opgesplitst in grotere substructuren waarvoor betrouwbare log Pow-waarden beschikbaar zijn, hetzij uit tabellen (b)(c) of uit eigen metingen. Zulke fragmenten (bijvoorbeeld heterocyclische structuren, antrachinon, azobenzeen) kunnen dan worden gecombineerd met de Л-waarden volgens Hansch of met de fragmentconstanten volgens Rekker of Leo.
Opmerkingen
|
i) |
De berekeningsmethoden kunnen slechts worden toegepast op gedeeltelijk of volledig geïoniseerde stoffen wanneer de mogelijkheid bestaat om de nodige correctiefactoren in de berekening te verwerken. |
|
ii) |
Als het bestaan van intramoleculaire waterstofbruggen kan worden aangenomen, moeten de overeenkomstige correctietermen (ongeveer +0,6 tot +1,0 log Pow-eenheden) bij het resultaat worden opgeteld (a). Aanwijzingen voor de aanwezigheid van waterstofbruggen kunnen worden verkregen uit ruimtelijke modellen of spectroscopische gegevens over het molecuul. |
|
iii) |
Als verschillende tautomere vormen mogelijk zijn, dient de meest waarschijnlijke vorm gebruikt te worden voor de berekening. |
|
iv) |
De herzieningen van lijsten met fragmentconstanten dienen zorgvuldig gevolgd te worden. |
Rapport
Bij het gebruik van berekenings-/schattingsmethoden dient het testrapport zo mogelijk de volgende gegevens te bevatten:
|
— |
beschrijving van de stof (mengsel, verontreinigingen, enz.); |
|
— |
aanwijzingen over mogelijke intramoleculaire waterstofbruggen, dissociatie, lading en alle andere ongewone effecten (bijvoorbeeld tautomerie); |
|
— |
beschrijving van de berekeningsmethode; |
|
— |
identificatie of leverancier van de database; |
|
— |
bijzonderheden in de keuze van de fragmenten; |
|
— |
uitgebreide documentatie van de berekening. |
LITERATUUR
|
(a) |
W.J. Lyman, W.F. Reehl en D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983. |
|
(b) |
Pomona College, Medicinal Chemistry Project. Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3). |
|
(c) |
C. Hansch en A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(d) |
A. Leo, C. Hansch en D. Elkins, Chem. Rev., 1971, vol. 71, 525. |
|
(e) |
R.F. Rekker en H.M. de Kort, Eur. J. Med. Chem. — Chim. Ther., 1979, vol. 14, 479. |
|
(f) |
T. Fujita, J. Iwasa en C. Hansch, J. Amer. Chem. Soc, 1964, vol. 86, 5175. |
|
(g) |
R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, vol. 1, Elsevier, New York, 1977. |
|
(h) |
C.V. Eadsforth en P. Moser, Chemosphere, 1983, vol. 12, 1459. |
|
(i) |
R.A. Scherrer, ACS — American Chemical Society, Washington D.C., 1984, Symposium Series 255, 225. |
Aanhangsel 2
Aanbevolen referentiestoffen voor de HPLC-methode
|
Nr. |
Referentiestof |
log Pow |
pKa |
|
1 |
2-Butanon |
0,3 |
|
|
2 |
4-Acetylpyridine |
0,5 |
|
|
3 |
Aniline |
0,9 |
|
|
4 |
Aceetanilide |
1,0 |
|
|
5 |
Benzylalcohol |
1,1 |
|
|
6 |
p-Methoxyfenol |
1,3 |
pKa = 10,26 |
|
7 |
Fenoxyazijnzuur |
1,4 |
pKa = 3,12 |
|
8 |
Fenol |
1,5 |
pKa = 9,92 |
|
9 |
2,4-Dinitrofenol |
1,5 |
pKa = 3,96 |
|
10 |
Benzonitril |
1,6 |
|
|
11 |
Fenylacetonitril |
1,6 |
|
|
12 |
4-Methylbenzylalcohol |
1,6 |
|
|
13 |
Acetofenon |
1,7 |
|
|
14 |
2-Nitrofenol |
1,8 |
pKa = 7,17 |
|
15 |
3-Nitrobenzoëzuur |
1,8 |
pKa = 3,47 |
|
16 |
4-Chlooraniline |
1,8 |
pKa = 4,15 |
|
17 |
Nirrobenzeen |
1,9 |
|
|
18 |
Cinnamylalcohol |
1,9 |
|
|
19 |
Benzoëzuur |
1,9 |
pKa = 4,19 |
|
20 |
p-Kresol |
1,9 |
pKa = 10,17 |
|
21 |
Kaneelzuur |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22 |
Anisool |
2,1 |
|
|
23 |
Methylbenzoaat |
2,1 |
|
|
24 |
Benzeen |
2,1 |
|
|
25 |
3-Methylbenzoëzuur |
2,4 |
pKa = 4,27 |
|
26 |
4-Chloorfenol |
2,4 |
pKa = 9,1 |
|
27 |
Trichloorethyleen |
2,4 |
|
|
28 |
Atrazine |
2,6 |
|
|
29 |
Ethylbenzoaat |
2,6 |
|
|
30 |
2,6-Dichloorbenzonitril |
2,6 |
|
|
31 |
3-Chloorbenzoëzuur |
2,7 |
pKa = 3,82 |
|
32 |
Tolueen |
2,7 |
|
|
33 |
1-Naftol |
2,7 |
pKa = 9,34 |
|
34 |
2,3-Dichlooraniline |
2,8 |
|
|
35 |
Chloorbenzeen |
2,8 |
|
|
36 |
Allylfenylether |
2,9 |
|
|
37 |
Broombenzeen |
3,0 |
|
|
38 |
Ethylbenzeen |
3,2 |
|
|
39 |
Benzofenon |
3,2 |
|
|
40 |
p-Fenylfenol |
3,2 |
pKa = 9,54 |
|
41 |
Thymol |
3,3 |
|
|
42 |
1,4-Dichloorbenzeen |
3,4 |
|
|
43 |
Difenylamine |
3,4 |
pKa = 0,79 |
|
44 |
Naftaleen |
3,6 |
|
|
45 |
Fenylbenzoaat |
3,6 |
|
|
46 |
Isopropylbenzeen |
3,7 |
|
|
47 |
2,4,6-Trichloorfenol |
3,7 |
pKa = 6 |
|
48 |
Bifenyl |
4,0 |
|
|
49 |
Benzylbenzoaat |
4,0 |
|
|
50 |
2,4-Dinitro-6-sec-butylfenol |
4,1 |
|
|
51 |
1,2,4-Trichloorbenzeen |
4,2 |
|
|
52 |
Dodecaancarbonzuur |
4,2 |
|
|
53 |
Difenylether |
4,2 |
|
|
54 |
n-Burylbenzeen |
4,5 |
|
|
55 |
Fenanthreen |
4,5 |
|
|
56 |
Fluorantheen |
4,7 |
|
|
57 |
Dibenzyl |
4,8 |
|
|
58 |
2,6-Difenylpyridine |
4,9 |
|
|
59 |
Trifenylamine |
5,7 |
|
|
60 |
DDT |
6,2 |
|
|
Andere referentiestoffen met lage log Pow |
|||
|
1 |
Nicotinezuur |
-0,07 |
|
A.9. VLAMPUNT
1. METHODE
1.1. INLEIDING
Alvorens de test uit te voeren is het nuttig te beschikken over oriënterende gegevens inzake de brandbaarheid van de stof. De testprocedure is van toepassing op vloeistoffen waarvan de dampen door een ontstekingsbron tot ontbranding kunnen worden gebracht. De hier beschreven testmethoden zijn alleen betrouwbaar indien de gemeten waarde van het vlampunt binnen een bereik ligt zoals in de afzonderlijke methoden is aangegeven.
Bij het selecteren van de te gebruiken methode dient rekening te worden gehouden met mogelijke chemische reacties tussen de teststof en het monstervat.
1.2. DEFINITIES EN EENHEDEN
Het vlampunt is de laagste temperatuur, gecorrigeerd tot een druk van 101,325 kPa, waarbij een vloeistof onder de beschreven omstandigheden zodanig verdampt, dat in het testvat een brandbaar mengsel van lucht en damp wordt gevormd.
Eenheden: oC
t = T - 273,15
(t in oC en T in K).
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Referentiestoffen zijn in de eerste plaats bedoeld om regelmatig de werking van de methode te controleren en om vergelijkingen met resultaten van andere methoden mogelijk te maken.
1.4. PRINCIPE VAN DE TESTMETHODE
De stof wordt in een testvat gebracht en verwarmd of gekoeld tot de testtemperatuur volgens de procedure beschreven bij de afzonderlijke testmethode. Ontstekingspogingen worden uitgevoerd om te zien of het monster al dan niet tot ontbranding kan worden gebracht bij de testtemperatuur.
1.5. KWALITEITSCRITERIA
1.5.1. Reproduceerbaarheid
De reproduceerbaarheid varieert met de gemeten waarde van het vlampunt en met de gebruikte testmethode; maximaal 2 oC.
1.5.2. Gevoeligheid
De gevoeligheid is afhankelijk van de gebruikte testmethode.
1.5.3. Toepasbaarheid
De toepasbaarheid van een aantal testmethoden blijft beperkt tot bepaalde vlampuntsbereiken en afhankelijk van stofeigenschappen (bijvoorbeeld hoge viscositeit).
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Voorbereidingen
Een monster van de te onderzoeken stof wordt in een testapparaat overeenkomstig 1.6.3.1, respectievelijk 1.6.3.2, gebracht.
Uit veiligheidsoverwegingen wordt aangeraden voor energetische of giftige stoffen een methode waarbij slechts een klein monstervolume (circa 2 cm3) nodig is, toe te passen.
1.6.2. Testomstandigheden
Het apparaat dient, voor zover de veiligheid dit toelaat, op een tochtvrije plaats te worden opgesteld.
1.6.3. Uitvoering van de test
1.6.3.1. Evenwichtsmethode
Zie ISO 1516, ISO 3680, ISO 1523 en ISO 3679.
1.6.3.2. Niet-evenwichtsmethode
Apparatuur van Abel:
Zie BS 2000-170, NF M 07-011 en NF T 66-009.
Apparatuur van Abel-Pensky:
Zie EN 57, DIN 51755, deel 1 (voor temperaturen van 5 tot 65 oC) DIN 51755, deel 2 (voor temperaturen lager dan 5 oC), NF M 07-036.
Apparatuur van Tag:
Zie ASTM D 56.
Apparatuur van Pensky-Martens:
Zie ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34 en NF M 07-019.
Opmerkingen:
Indien het vlampunt, bepaald volgens een van de niet-evenwichtsmethoden onder 1.6.3.2, de volgende waarden blijkt te hebben: 0 ± 2 oC, 21 ± 2 oC, 55 ± 2 oC, dient dit te worden bevestigd volgens een evenwichtsmethode met gebruik van dezelfde apparatuur.
Alleen de methoden waarmee de temperatuur van het vlampunt kan worden bepaald, komen in aanmerking voor gebruik ten behoeve van een kennisgeving.
Voor de bepaling van het vlampunt van visceuze vloeistoffen (verven, lijmen, e.d.) die oplosmiddelen bevatten, mag uitsluitend gebruik worden gemaakt van apparatuur en testmethoden die geschikt zijn voor bepaling van het vlampunt van visceuze vloeistoffen.
Zie ISO 3679, ISO 3680, ISO 1523 en DIN 53213, deel 1.
|
2. |
GEGEVENS |
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
nauwkeurige beschrijving van de stof (beschrijving en verontreinigingen); |
|
— |
de gebruikte testmethode alsmede eventuele wijzigingen; |
|
— |
de resultaten en alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten. |
4. LITERATUUR
Geen.
A.10. ONTVLAMBAARHEID (VASTE STOFFEN)
1. METHODE
1.1. INLEIDING
Alvorens de test uit te voeren is het nuttig te beschikken over oriënterende gegevens inzake potentieel explosieve eigenschappen van de stof.
Deze test dient alleen te worden toegepast op stoffen in poeder-, korrel- of pastavorm.
Alleen stoffen waarvan de brandsnelheid hoger is dan een bepaalde drempelwaarde, worden als licht ontvlambaar beschouwd. Daarom worden niet alle stoffen die kunnen worden ontstoken, maar alleen die stoffen die snel branden of waarvan het brandgedrag buitengewoon gevaarlijk is, inbegrepen.
Het is buitengewoon gevaarlijk indien een smeulproces zich voortplant door een metaalpoeder, vanwege de moeilijkheid om het vuur te doven. Daarom dienen metaalpoeders als licht ontvlambaar te worden beschouwd, als de smeulhaard zich binnen een zekere tijd door de gehele massa kan voortplanten.
1.2. DEFINITIES EN EENHEDEN
Brandtijd in seconden.
1.3. REFERENTIESTOFFEN
Niet gekozen.
1.4. PRINCIPE VAN DE TESTMETHODE
Van de stof wordt een ononderbroken rups of poederlijn met een lengte van ongeveer 250 mm gevormd waarop een oriënterende proef wordt uitgevoerd om te bepalen of, na ontsteken van het monster met behulp van een gasvlam, de vlam of het smeulproces zich voortplant. Als het vlamfront/smeulproces zich binnen een bepaalde tijdsduur over 200 mm van de sliert voortplant, dient een volledig testprogramma te worden uitgevoerd om de brandsnelheid vast te stellen.
1.5. KWALITEITSCRITERIA
Niet gegeven.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Oriënterende proef
Van de stof wordt een ononderbroken rups of poederlijn van ongeveer 250 mm lengte, 20 mm breedte en 10 mm hoogte gevormd op een onbrandbare, niet-poreuze en slecht warmtegeleidende grondplaat. Een hete vlam van een gasbrander (minimale diameter 5 mm) wordt gedurende maximaal 2 minuten bij één uiteinde van de rups gehouden totdat het poeder ontbrandt (5 minuten voor metaalpoeders of metaallegeringen). Men dient er op te letten of de ontbranding zich binnen 4 minuten (of 40 minuten bij metaalpoeders) voortplant over 200 mm van de poederrups. Indien de stof niet ontbrandt of indien de vlam of het smeulproces zich niet binnen 4 minuten (of 40 minuten bij metaalpoeders) voortplant over 200 mm poederrups dient de stof niet als licht ontvlambaar te worden beschouwd en behoeft geen verder onderzoek te worden uitgevoerd. Als het brandproces zich in minder dan 4 minuten, of minder dan 40 minuten bij metaalpoeders, voortplant over 200 mm van de poederrups dient de procedure zoals hieronder beschreven (punt 1.6.2. en volgende) te worden uitgevoerd.
1.6.2. Brandsnelheidstest
1.6.2.1. Voorbereidingen
Poeder of korrelvormige stoffen worden ingebracht (niet aandrukken) in een mal met een lengte van 250 mm en een driehoekige doorsnede met een inwendige hoogte van 10 mm en een inwendige breedte van 20 mm. Om de zijkanten te begrenzen zijn aan beide kanten van de mal in de lengterichting twee metalen platen gemonteerd die 2 mm uitsteken boven de rand van de driehoekige doorsnede (zie figuur). Vervolgens laat men de mal driemaal van een hoogte van 2 cm op een massief oppervlak vallen. Indien nodig wordt de mal bijgevuld. Vervolgens worden de zijplaten verwijderd en wordt de overtollige stof met een stevig blad weggeveegd. Een onbrandbare, niet-poreuze en slecht warmtegeleidende plaat wordt bovenop de mal gelegd, het apparaat wordt omgekeerd, waarna de mal wordt verwijderd.
Pastavormige stoffen worden op een onbrandbare, niet-poreuze en slecht warmtegeleidende plaat aangebracht in de vorm van een rups met een lengte van 250 mm en een doorsnede van ongeveer 1 cm2.
1.6.2.2. Testomstandigheden
Bij een vochtgevoelige stof dient de test zo snel als mogelijk na het verwijderen van de verpakking te worden uitgevoerd.
1.6.2.3. Uitvoering van de test
De rups wordt in een zuurkast geplaatst in een richting loodrecht op de richting van de trek.
De luchtsnelheid moet voldoende zijn om te verhinderen dat verbrandingsgassen naar de laboratoriumruimte ontsnappen; de luchtsnelheid mag gedurende de test niet veranderd worden. De apparatuur moet worden omgeven door een vochtscherm.
Met de hete vlam van een gasbrander (minimale diameter 5 mm) wordt de rups aan één kant ontstoken. Nadat de rups over een lengte van 80 mm heeft gebrand, wordt de brandsnelheid over de volgende 100 mm gemeten.
De test, waarbij steeds een schone koude plaat wordt gebruikt, wordt zesmaal uitgevoerd, tenzij eerder een positief resultaat wordt verkregen.
2. GEGEVENS
Voor de beoordeling zijn de brandduur in de oriënterende proef (1.6.1) en de kortste brandduur uit de hoogstens zes testen (1.6.2.3) van belang.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
een nauwkeurige specificatie van de stof (beschrijving en verontreinigingen); |
|
— |
een beschrijving van de fysische toestand en het vochtgehalte van de onderzochte stof; |
|
— |
de resultaten van de oriënterende test en, indien uitgevoerd, de brandsnelheidstest; |
|
— |
alle verdere opmerkingen die van belang zijn voor de interpretatie van de resultaten. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Poedervormige, korrelvormige of pastavormige stoffen worden als licht ontvlambaar beschouwd indien in één van de tests uitgevoerd volgens 1.6.2 de brandduur minder dan 45 seconden bedraagt. Poeders van metalen of metaallegeringen worden als licht ontvlambaar beschouwd, indien zij kunnen worden ontstoken en indien de vlam of reactiezone zich binnen 10 minuten over het gehele monster uitbreidt.
4. LITERATUUR
(1) NF T 20-042, (SEPT 85). Chemical products for industrial use. Determination of the flammability of solids.
Aanhangsel
Figuur
Mal en toebehoren om een rups van de te onderzoeken stof te vormen
(Afmetingen in mm)

A.11. ONTVLAMBAARHEID (GASSEN)
1. METHODE
1.1. INLEIDING
Met deze methode kan worden vastgesteld of mengsels van gassen en lucht bij kamertemperatuur (ongeveer 20 oC) en atmosferische druk brandbaar zijn, en zo ja, binnen welk concentratiebereik. Mengsels met toenemende concentraties van het te onderzoeken gas in lucht worden blootgesteld aan een elektrische vonk, waarna wordt vastgesteld of ontbranding plaatsvindt.
1.2. DEFINITIE EN EENHEDEN
De maat voor de brandbaarheid is het bereik van de concentratiewaarden tussen de onderste en bovenste ontploffingsgrens. De onder- en bovenexplosiegrenzen worden gevormd door de uiterste concentraties van het brandbare gas in lucht waarbij een vlam zich niet voortplant.
1.3. REFERENTIESTOF
Niet gegeven.
1.4. PRINCIPE VAN DE TESTMETHODE
De concentratie van het gas in de lucht wordt stap voor stap opgevoerd, waarbij het mengsel in iedere stap wordt blootgesteld aan een elektrische vonk.
1.5. KWALITEITSCRITERIA
Niet gegeven.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
Het testvat is een staande glazen cilinder met een inwendige diameter van minimaal 50 mm en een hoogte van minimaal 300 mm. De ontstekingselektroden bevinden zich op een onderlinge afstand van 3 tot 5 mm en worden 60 mm boven de cilinderbodem geplaatst. De cilinder is voorzien van een overdrukventiel. Het apparaat moet worden afgeschermd om schade bij een eventuele ontploffing te beperken.
Als ontstekingsbron wordt gebruik gemaakt van een staande inductievonk met een duur van 0,5 sec, opgewekt door een hoogspanningstransformator met een uitgangsspanning van 10 tot 15 kV (maximaal ingangsvermogen 300 W). Een voorbeeld van een geschikt apparaat wordt gegeven in referentie (2).
1.6.2. Testomstandigheden
De test moet worden uitgevoerd bij kamertemperatuur (ongeveer 20 oC).
1.6.3. Uitvoering van de test
Met behulp van doseerpompen wordt een bekende concentratie van het gas in lucht naar de glazen cilinder geleid. Het mengsel wordt blootgesteld aan een vonk en er wordt vastgesteld of er zich vanaf de ontstekingsbron al dan niet een vlam ontwikkelt die zich zelfstandig voortplant. De gasconcentratie wordt in stappen van 1 % vol opgevoerd, totdat ontbranding zoals boven bedoeld, plaatsvindt.
Als de chemische structuur van het gas erop wijst dat het niet ontvlambaar is en de samenstelling van het stoïchiometrische mengsel met lucht berekend kan worden, dienen alleen de mengsels in het bereik van 10 % beneden tot 10 % boven de stoïchiometrische samenstelling getest te worden in stappen van 1 %.
2. GEGEVENS
Het enige gegeven van belang voor bepaling van deze eigenschap is het optreden van een vlam die zich zelfstandig voortplant.
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
een nauwkeurige specificatie van de stof (beschrijving en verontreinigingen); |
|
— |
een beschrijving van de gebruikte apparatuur inclusief de afmetingen; |
|
— |
de temperatuur waarbij de test werd uitgevoerd; |
|
— |
de onderzochte concentraties en de verkregen resultaten; |
|
— |
het resultaat van de test: niet ontvlambaar of licht ontvlambaar gas. Indien geconcludeerd wordt dat het gas niet ontvlambaar is, moet het concentratiebereik waarover het gas in stappen van 1 % onderzocht werd, vermeld worden; |
|
— |
alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten. |
4. LITERATUUR
|
(1) |
NF T 20-041, (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases. |
|
(2) |
W. Berthold, D. Conrad, T. Grewer, H. Grosse-Wortmann, T. Redeker en H. Schacke. Entwicklung einer Standard-Apparatur zur Messung von Explosionsgrenzen. Chem.-Ing.-Tech., 1984, vol. 56, 2, blz. 126-127. |
A.12. ONTVLAMBAARHEID (CONTACT MET WATER)
1. METHODE
1.1. INLEIDING
Deze testmethode kan worden gebruikt om vast te stellen of de reactie van een stof met water of vochtige lucht leidt tot het vrijkomen van een gevaarlijke hoeveelheid van één of meer eventueel licht ontvlambare gassen.
De testmethode kan zowel op vaste als op vloeibare stoffen worden toegepast. Deze methode is niet van toepassing op stoffen die in aanraking met lucht spontaan ontbranden.
1.2. DEFINITIES EN EENHEDEN
Licht ontvlambaar: Stoffen die bij aanraking met water of vochtige lucht licht ontvlambare gassen produceren met een minimum ontwikkelingshoeveelheid van 1 liter per kg stof per uur.
1.3. PRINCIPE VAN DE TESTMETHODE
De stof wordt volgens de hieronder beschreven getrapte volgorde getest; als bij één van de stappen ontbranding optreedt, is verder onderzoek overbodig. Als bekend is dat de te onderzoeken stof niet heftig reageert met water kan worden verdergegaan met stap 4 (1.3.4).
1.3.1. Stap 1
De te onderzoeken stof wordt in een buis met gedistilleerd water op 20 oC gebracht en er wordt nagegaan of het vrijgekomen gas ontbrandt.
1.3.2. Stap 2
De te onderzoeken stof wordt gebracht op een filtreerpapier dat in een schotel met gedistilleerd water van 20 oC drijft, en er wordt nagegaan of het vrijkomende gas ontbrandt. Het filtreerpapier dient alleen om de stof op één plaats te houden, waardoor de kans op ontbranding toeneemt.
1.3.3. Stap 3
Van de te onderzoeken stof wordt een hoopje van ongeveer 2 cm hoog en 3 cm doorsnede gemaakt. Hierop worden een paar druppels water gebracht en er wordt nagegaan of het vrijkomende gas ontbrandt.
1.3.4. Stap 4
De te onderzoeken stof wordt met gedistilleerd water van 20 oC gemengd en de snelheid van gasontwikkeling wordt ieder uur gemeten gedurende een periode van 7 uur. Als de snelheid van de gasontwikkeling onregelmatig is of toeneemt tegen het eind van de periode van 7 uur, moet de duur van de meting tot maximaal 5 dagen worden verlengd. De test kan worden gestaakt zodra een snelheid hoger dan 1 liter/kg per uur wordt gemeten.
1.4. REFERENTIESTOF
Niet gegeven.
1.5. KWALITEITSCRITERIA
Niet gegeven.
1.6. BESCHRIJVING VAN DE METHODEN
1.6.1. Stap 1
1.6.1.1. Testomstandigheden
De proef wordt uitgevoerd bij kamertemperatuur (ongeveer 20 oC).
1.6.1.2. Uitvoering van de test
Een kleine hoeveelheid (ongeveer 2 mm doorsnede) van de te onderzoeken stof wordt in een bak met gedistilleerd water gebracht. Genoteerd wordt i) of er gas ontwijkt en ii) of het gas spontaan ontbrandt. Indien ontbranding van het gas plaatsvindt, is verder onderzoek van de stof niet nodig, omdat de stof dan als gevaarlijk wordt beschouwd.
1.6.2. Stap 2
1.6.2.1. Apparatuur
Een filtreerpapier laat men plat op het oppervlak van een hoeveelheid gedistilleerd water drijven in een geschikt vat, bijvoorbeeld een verdampingsschotel met een doorsnede van 100 mm.
1.6.2.2. Testomstandigheden
De proef wordt uitgevoerd bij kamertemperatuur (ongeveer 20 oC).
1.6.2.3. Uitvoering van de test
Een kleine hoeveelheid van de te onderzoeken stof (ongeveer 2 mm doorsnede) wordt midden op het filtreerpapier gebracht. Genoteerd wordt i) of er gas ontwijkt en ii) of het gas spontaan ontbrandt. Indien ontbranding van het gas plaatsvindt, is verder onderzoek van de stof niet nodig, omdat de stof dan als gevaarlijk wordt beschouwd.
1.6.3. Stap 3
1.6.3.1. Testomstandigheden
De proef wordt uitgevoerd bij kamertemperatuur (ongeveer 20 oC).
1.6.3.2. Uitvoering van de test
Van de te onderzoeken stof wordt een hoopje van ongeveer 2 cm hoogte en 3 cm doorsnede gemaakt met een kuiltje bovenin. In het kuiltje worden een paar druppels water gebracht en genoteerd wordt i) of er gas ontwijkt en ii) of het gas spontaan ontbrandt. Indien ontbranding van het gas plaatsvindt, is verder onderzoek van de stof niet nodig, omdat de stof dan als gevaarlijk wordt beschouwd.
1.6.4. Stap 4
1.6.4.1. Apparatuur
De apparatuur wordt opgesteld als in de figuur.
1.6.4.2. Testomstandigheden
Kijk of het vat van de te onderzoeken stof poeder bevat bestaande uit deeltjes van minder dan 500 μm diameter. Indien meer dan 1 gewichtsprocent van de stof poedervormig is of indien het monster brokkelig is, wordt de stof in zijn geheel vóór de test tot poeder gemalen; op deze manier wordt rekening gehouden met mogelijke verkleining van de deeltjesgrootte tijdens opslag en verwerking van de stof. In alle andere gevallen wordt de stof onderzocht zoals ze werd verkregen. De test moet worden uitgevoerd bij kamertemperatuur (ongeveer 20 oC) en atmosferische druk.
1.6.4.3. Uitvoering van de test
10 tot 20 ml water wordt in de druppeltrechter van het apparaat gebracht en 10 g van de te onderzoeken stof wordt afgewogen in de erlenmeyerkolf. Het volume van het vrijkomende gas kan op elke geschikte wijze worden gemeten. De kraan van de druppeltrechter wordt geopend zodat het water in de erlenmeyerkolf komt, en een chronometer gestart. De hoeveelheid vrijkomend gas wordt ieder uur gemeten gedurende een periode van 7 uur. Als tijdens deze periode het vrijkomen van gas onregelmatig verloopt, of als aan het eind van de periode de hoeveelheid vrijkomend gas toeneemt moeten de metingen voortgezet worden tot maximaal 5 dagen. Indien de gasontwikkelingssnelheid, tijdens de metingen, op welk ogenblik dan ook, meer dan 1 liter per kg stof en per uur bedraagt, kan het onderzoek gestaakt worden. De test moet in triplo worden uitgevoerd.
Indien de chemische identiteit van het gas niet bekend is, dient het te worden geanalyseerd. Indien het gas licht ontvlambare componenten bevat en niet bekend is of het totale mengsel licht ontvlambaar is, moet een mengsel van dezelfde samenstelling worden bereid en getest volgens methode A.11.
2. GEGEVENS
De onderzochte stof wordt als gevaarlijk beschouwd indien:
|
— |
spontane ontbranding plaatsvindt bij één van de stappen tijdens de testprocedure; of |
|
— |
een ontvlambaar gas vrijkomt met een grotere snelheid groter dan 1 liter per kg van de te onderzoeken stof per uur. |
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
een nauwkeurige specificatie van de stof (beschrijving en verontreinigingen); |
|
— |
gegevens over eventuele voorbehandeling van de onderzochte stof; |
|
— |
de resultaten van de tests (stappen 1, 2, 3 en 4); |
|
— |
de chemische identiteit van het vrijgekomen gas; |
|
— |
de snelheid waarmee het gas vrijkomt als stap 4 (1.6.4) wordt uitgevoerd; |
|
— |
alle verdere opmerkingen die van belang zijn voor interpretatie van de resultaten. |
4. LITERATUUR
|
(1) |
Recommendations on the Transport of Dangerous Goods, tests and criteria, 1990, United Nations, New York. |
|
(2) |
NF T 20-040, (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products. |
Aanhangsel
Figuur
Apparatuur

A.13. PYROFORE EIGENSCHAPPEN VAN VASTE STOFFEN EN VLOEISTOFFEN
1. METHODE
1.1. INLEIDING
De testprocedure is van toepassing op vaste en vloeibare stoffen, die spontaan kunnen ontbranden kort nadat ze bij kamertemperatuur (ongeveer 20 oC) in aanraking zijn gekomen met lucht.
Deze testprocedure is niet van toepassing op stoffen die bij kamertemperatuur eerst na uren- of dagenlange blootstelling aan lucht spontaan ontbranden of die op hogere temperatuur moeten worden gebracht om tot zelfontbranding te komen.
1.2. DEFINITIES EN EENHEDEN
Stoffen worden als pyrofoor beschouwd als ze ontbranden of verkoling veroorzaken onder de omstandigheden zoals beschreven onder 1.6.
Voor de zelfontvlambaarheid van vloeistoffen kan ook een test nodig zijn volgens methode A.15: Zelfontbrandingstemperatuur (vloeistoffen en gassen).
1.3. REFERENTIESTOFFEN
Niet gegeven.
1.4. PRINCIPE VAN DE TESTMETHODE
De stof, vast of vloeibaar, wordt op een inerte drager gebracht en gedurende 5 minuten bij omgevingstemperatuur in aanraking gebracht met lucht. Indien vloeistoffen niet ontbranden moeten ze geabsorbeerd worden op filterpapier en gedurende 5 minuten bij omgevingstemperatuur (ongeveer 20 oC) worden blootgesteld aan lucht. Als een vaste of vloeibare stof ontbrandt, of een vloeistof het filterpapier doet ontbranden of verkolen, wordt de stof beschouwd als pyrofoor.
1.5. KWALITEITSCRITERIA
Reproduceerbaarheid: gezien het belang met betrekking tot veiligheid is één enkel positief resultaat voldoende om de stof als pyrofoor te beschouwen.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
Een porseleinen bakje van ongeveer 10 cm doorsnede wordt bij kamertemperatuur (ongeveer 20 oC) tot een hoogte van ongeveer 5 mm gevuld met diatomeeënaarde.
Opmerking:
Diatomeeënaarde of een vergelijkbare en gangbare inerte stof wordt representatief geacht voor aarde waarmee gemorste stoffen in geval van een ongeluk in aanraking kunnen komen.
Droog filterpapier is vereist om vloeistoffen te onderzoeken die niet ontbranden na aanraking met lucht wanneer ze in aanraking zijn met een inerte drager.
1.6.2. Uitvoering van de test
a) Poedervormige vaste stoffen
1 tot 2 cm3 van de te onderzoeken, poedervormige stof wordt vanaf ongeveer 1 m hoogte op een niet-brandbaar oppervlak gestrooid; nagegaan wordt of de stof tijdens het vallen, of binnen 5 minuten na het neerkomen, ontbrandt.
De proef wordt 6 keer uitgevoerd tenzij ontbranding optreedt.
b) Vloeistoffen
Ongeveer 5 cm3 van de te onderzoeken vloeistof wordt in het porseleinen bakje gegoten en nagegaan wordt of de stof binnen 5 minuten ontbrandt.
Als geen ontbranding optreedt tijdens de zes proeven, voer dan de volgende tests uit:
Een hoeveelheid van 0,5 ml van de te onderzoeken stof wordt met behulp van een injectiespuit op een gekarteld filterpapiertje gebracht en er wordt nagegaan of ontbranding of verkoling van het filterpapier optreedt binnen vijf minuten nadat de vloeistof werd aangebracht. De test wordt driemaal uitgevoerd, tenzij ontbranding of verkoling optreedt.
2. GEGEVENS
2.1. BEWERKING VAN DE RESULTATEN
Het onderzoek mag worden gestaakt zodra een positief resultaat optreedt in één van de tests.
2.2. BEOORDELING
Indien de stof ontbrandt binnen vijf minuten na opbrengen op een inerte drager en blootstelling aan de lucht, of indien een vloeistof een filterpapiertje verkoolt of doet ontbranden binnen vijf minuten na opbrengen en blootstelling aan de lucht, wordt de stof beschouwd als zijnde pyrofoor.
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
een nauwkeurige specificatie van de stof (beschrijving en verontreinigingen); |
|
— |
de resultaten van de tests; |
|
— |
iedere bijkomende opmerking betreffende de interpretatie van de resultaten. |
4. LITERATUUR
|
(1) |
NF T 20-039, (SEPT 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids. |
|
(2) |
Recommendations on the Transport of Dangerous Goods, Tests and criteria, 1990, United Nations, New York. |
A.14. EXPLOSIEGEVAAR
1. METHODE
1.1. INLEIDING
De methode omvat een testschema om vast te stellen of een pasta explosiegevaar oplevert wanneer de stof aan een vlam (thermische gevoeligheid) of aan een schok of wrijving (mechanische gevoeligheid) wordt blootgesteld, alsmede of een vloeistof explosiegevaar oplevert wanneer de stof aan een vlam of aan een schok wordt blootgesteld.
De methode bestaat uit drie delen:
|
a) |
een test voor de thermische gevoeligheid (1); |
|
b) |
een test voor de mechanische gevoeligheid bij schokken (1); |
|
c) |
een test voor de mechanische gevoeligheid bij wrijving (1). |
De methode levert gegevens op waarmee de kans op ontstaan van een explosie door bepaalde veel voorkomende stimuli kan worden beoordeeld. De methode is niet bedoeld om vast te stellen of een stof onder om het even welke omstandigheden kan exploderen.
De methode is geschikt om te bepalen of een stof explosiegevaar oplevert (thermische en mechanische gevoeligheid) onder omstandigheden zoals beschreven in de richtlijn. De methode is gebaseerd op een aantal soorten apparaten die internationaal op grote schaal worden gebruikt (1) en die doorgaans zinvolle resultaten geven. Erkend wordt dat de methode geen definitief uitsluitsel geeft. Andere apparatuur dan beschreven, mag worden gebruikt op voorwaarde dat deze internationaal erkend is en dat de resultaten afdoende getoetst kunnen worden aan de resultaten met de beschreven apparatuur.
De proeven hoeven niet te worden uitgevoerd indien uit de beschikbare thermodynamische gegevens (vormingswarmte, ontledingswarmte) en/of afwezigheid van bepaalde reactieve groepen (2) in de structuurformule met afdoende zekerheid kan worden vastgesteld dat de stof niet snel kan ontleden onder productie van gassen of warmte (dat wil zeggen: het materiaal vertegenwoordigt geen enkel explosiegevaar). Een test op mechanische gevoeligheid voor wrijving is niet vereist voor vloeistoffen.
1.2. DEFINITIES EN EENHEDEN
Als explosief worden gedefinieerd: stoffen die door de werking van een vlam kunnen ontploffen of die gevoelig zijn voor schokken en wrijving in de beschreven apparatuur (of die mechanisch gevoeliger zijn dan 1,3-dinitrobenzeen in andere apparatuur).
1.3. REFERENTIESTOFFEN
Technisch, kristallijn 1,3-dinitrobenzeen gezeefd door 0,5 mm maaswijdte, voor de wrijvings- en schok-methode.
Perhydro-1,3,5-trinitro-1,3,5-triazine (RDX, hexogeen, cycloniet — CAS 121-82-4), geherkristalliseerd uit waterig cyclohexanon, nat gezeefd door een 250 μm zeef en op een 150 μm zeef en gedroogd bij 103 ± 2 oC (gedurende 4 uur) voor de tweede reeks wrijvings- en schoktests.
1.4. PRINCIPE VAN DE TESTMETHODE
Tot vaststelling van veilige omstandigheden voor het uitvoeren van de drie gevoeligheidstests zijn oriënterende proeven noodzakelijk.
1.4.1. Oriënterende proef (3)
Om veiligheidsredenen worden voor het uitvoeren van de gevoeligheidsbeproevingen zeer kleine monsters (ongeveer 10 mg) van de stof zonder afsluiting verwarmd in een gasvlam, blootgesteld aan schokken in een geschikt apparaat, en aan wrijving door middel van een hamer tegen een aambeeld of door middel van elk ander wrijvingstoestel. Het doel is vast te stellen of de stof zo gevoelig en explosiegevaarlijk is dat de voorgeschreven gevoeligheidstests, vooral die van thermische gevoeligheid, moeten worden uitgevoerd met speciale voorzorgen om aldus te voorkomen dat de onderzoeker gewond kan raken.
1.4.2. Thermische gevoeligheid
Bij deze methode wordt de stof verwarmd in een stalen buis, afgesloten door afsluitplaten met openingen van verschillende doorsnede, om vast te stellen of de stof bij thermische belasting en goed gedefinieerde opsluiting kan ontploffen.
1.4.3. Mechanische gevoeligheid (schok)
Bij deze methode wordt de stof aan een schok, veroorzaakt door een bepaalde massa vallend vanaf een bepaalde hoogte, onderworpen.
1.4.4. Mechanische gevoeligheid (wrijving)
Bij deze methode wordt de vaste stof of pasta onder bepaalde omstandigheden van belasting en relatieve beweging onderworpen aan wrijving russen standaardoppervlakken.
1.5. KWALITEITSCRITERIA
Niet gegeven.
1.6. BESCHRIJVING VAN DE TESTMETHODEN
1.6.1. Thermische gevoeligheid (werking van een vlam)
1.6.1.1. Apparatuur
Het apparaat bestaat uit een stalen buis, bestemd voor éénmalig gebruik, voorzien van een herbruikbare afsluitinrichting (figuur 1), die in een verwarmings- en beschermingstoestel wordt geplaatst. Elke buis is diep getrokken uit plaatstaal (zie aanhangsel) en heeft een inwendige doorsnede van 24 mm, een lengte van 75 mm en een wanddikte van 0,5 mm. Aan het open einde is de buis van een flens voorzien om afsluiting met de afsluitinrichting mogelijk te maken. De afsluitinrichting bestaat uit een drukbestendige ronde afsluitplaat met een gat in het midden, die met behulp van een tweedelige schroefverbinding (moer en kraag met schroefdraad) stevig op de buis wordt bevestigd. De moer en de kraag zijn gemaakt van chroommangaanstaal (zie aanhangsel) dat tot 800 oC vonkvrij is. De afsluitplaten zijn 6 mm dik en gemaakt van hittebestendig staal (zie aanhangsel), en zijn verkrijgbaar in een reeks verschillende openingsmaten.
1.6.1.2. Testomstandigheden
Normaal wordt de stof getest zoals hij verkregen werd, alhoewel het in sommige gevallen noodzakelijk kan zijn om de stof te testen na verpulvering, bijvoorbeeld indien hij geperst, gegoten of op andere wijze verdicht is.
Voor vaste stoffen wordt de hoeveelheid voor elke test te gebruiken materiaal bepaald met behulp van een twee-staps vulprocedure. Een gewogen buis wordt gevuld met 9 cm3 van de stof, waarna deze wordt aangedrukt met een kracht van 80 N verdeeld over de hele doorsnede van de buis. Om veiligheidsredenen of in gevallen waar de fysische vorm van het monster kan veranderen onder druk, mogen andere vulmethoden worden gebruikt; aandrukken is bijvoorbeeld niet geschikt als de stof zeer wrijvingsgevoelig is. Als de stof samendrukbaar is wordt meer materiaal bijgevoegd en aangeperst met 80 N totdat de buis gevuld is tot op 55 mm van de bovenkant. De massa van de stof die gebruikt wordt om de buis te vullen tot op het niveau van 55 mm wordt bepaald, vervolgens worden nog twee porties met deze massa, en elk aangedrukt met een kracht van 80 N, ingebracht. Daarna wordt het materiaal of wel bijgevuld of wel verwijderd en aangedrukt totdat de buis gevuld is tot op een hoogte van 15 mm van de bovenkant. Een tweede stap in de vulprocedure wordt uitgevoerd met een aangedrukte massa die een derde bedraagt van de totale hoeveelheid die in de eerste poging werd bepaald. Er worden nog twee van deze hoeveelheden toegevoegd en elk onder 80 N aangedrukt, waarna het niveau van de stof wordt aangepast tot op 15 mm van de bovenkant door materiaal naar behoefte toe te voegen of weg te halen. Voor elke beproeving wordt nu de hoeveelheid vaste stof gebruikt, die in de tweede vulprocedure is vastgesteld, waarbij het vullen wordt uitgevoerd met drie gelijke porties die achtereenvolgens worden samengeperst tot 9 cm3 met de daartoe benodigde kracht (het samenpersen kan worden vereenvoudigd met behulp van tussenringen).
Vloeistoffen en gels worden in de buis gebracht tot op een hoogte van 60 mm, waarbij zorg dient te worden gedragen dat bij het vullen met gel geen luchtbellen ontstaan. De buis wordt in de kraag geschoven, de juiste afsluitplaat wordt opgelegd en de moer wordt op de kraag geschroefd na het aanbrengen van een beetje smeermiddel op basis van molybdeendisulfide. Het is van essentieel belang te controleren dat er geen materiaal achterblijft tussen de moer, de plaat, en de schroefdraad.
De verwarming geschiedt met behulp van propaan uit een industriële cilinder voorzien van een drukregelaar (60 tot 70 mbar), dat via een meter door een verdeelstuk evenredig verdeeld wordt over vier branders (hetgeen visueel te controleren is aan de vlammen uit de branders). De branders worden rond de beproevingsruimte geplaatst zoals aangegeven in figuur 1. De vier branders hebben een gezamenlijk verbruik van ongeveer 3,2 liter propaan per minuut. Andere stookgassen of branders mogen gebruikt worden, maar de opwarmsnelheid moet verlopen zoals in figuur 3 aangegeven. Voor alle apparatuur dient de opwarmsnelheid periodiek gecontroleerd te worden met behulp van met diburylftalaat gevulde buizen zoals in figuur 3 is aangeduid.
1.6.1.3. Uitvoering van de proeven
Elke test wordt uitgevoerd totdat ofwel de buis gefragmenteerd is of de buis gedurende vijf minuten is verhit. Als de test resulteert in fragmentatie van de buis in drie of meer stukken, die soms nog aan elkaar zijn verbonden door smalle metaalstrookjes zoals geïllustreerd in figuur 2, wordt het resultaat beoordeeld als een opgetreden explosie. Een testresultaat, waarbij minder of geen fragmenten ontstaan, wordt beschouwd als niet explosief.
Een reeks van drie proeven met een afsluitplaat met een opening van 6,0 mm doorsnede wordt uitgevoerd en, als geen explosies optreden, een tweede reeks van drie proeven met een afsluitplaat met een opening van 2,0 mm. Indien een explosie plaatsvindt in een van de twee proefreeksen, kunnen verdere tests achterwege blijven.
1.6.1.4. Beoordeling
Het testresultaat wordt als positief beschouwd als er een explosie plaatsvindt in een van bovenstaande testreeksen.
1.6.2. Mechanische gevoeligheid (schok)
1.6.2.1. Apparatuur (figuur 4)
De belangrijkste onderdelen van een doorsnee valhamerapparaat zijn een gietstalen blok met voet, aambeeld, kolom, geleiders, valgewichten, een ontkoppelinrichting en een monsterhouder. Op het stalen blok van 230 mm lengte × 250 mm breedte × 200 mm hoogte met een gegoten voet van 450 mm lengte × 450 mm breedte × 60 mm hoogte, zit het stalen aambeeld van 100 mm doorsnede × 70 mm hoogte vastgeschroefd. Aan de achterkant van het stalen blok is de houder geschroefd waarin de kolom, bestaande uit een naadloze getrokken stalen buis, is bevestigd. Vier schroeven verankeren het apparaat aan een massief betonnen blok van 60 × 60 × 60 cm in een zodanige positie dat de geleiderbalken volkomen verticaal staan en het valgewicht vrij kan vallen. Gewichten van 5 en 10 kg massief staal kunnen worden gebruikt. Het slagoppervlak van de gewichten bestaat uit getemperd staal, HRC 60 tot 63, met een minimumdoorsnede van 25 mm.
Het te onderzoeken monster wordt gevat in een schokbeproevingsvat dat bestaat uit twee massieve, in het verlengde boven elkaar liggende stalen cilinders omhuld door een holle stalen geleidecilinder. De massief stalen cilinders hebben een doorsnede van 10 (-0,003; -0,005) mm en een hoogte van 10 mm, gepolijste oppervlakken, afgeronde zijvlakken (rondingsstraal 0,5 mm) en een hardheid van HRC 58 tot 65. De holle cilinder heeft een uitwendige diameter van 16 mm, een gepolijste binnenkant met een doorsnede van 10 (+0,005; +0,010) mm en een hoogte van 13 mm. Het beproevingsvat wordt vastgezet op een stalen tussenaambeeld (26 mm doorsnede en 26 mm hoogte) en wordt gecentreerd door een ring met perforaties via welke de explosiegassen kunnen worden afgevoerd.
1.6.2.2. Testomstandigheden
Het monstervolume dient 40 mm3 te bedragen of overeen te komen met het vulvolume in een alternatief apparaat. Vaste stoffen dienen in droge toestand te worden onderzocht en worden als volgt voorbewerkt:
|
a) |
poedervormige stoffen worden gezeefd (maaswijdte 0,5 mm); alles wat de zeef doorlaat, wordt voor de test gebruikt; |
|
b) |
samengeperste, gegoten of op andere wijze verdichte stoffen worden in stukken gebroken en gezeefd; de zeeffractie van 0,5 tot 1 mm doorsnede wordt gebruikt voor de test en dient representatief te zijn voor de oorspronkelijke stof. |
Stoffen die normaal gezien geleverd worden als pasta's zouden, in de mate van het mogelijke, moeten worden getest in droge staat of, in ieder geval, na het zoveel mogelijk verwijderd hebben van vloeistof. Vloeistoffen worden onderzocht met een spleet van 1 mm tussen de bovenste en de onderste stalen cilinder.
1.6.2.3. Uitvoering van de proeven
Een reeks van zes proeven wordt uitgevoerd waarbij men het gewicht van 10 kg van een hoogte van 0,40 m (40 J) laat vallen. Indien een explosie wordt verkregen in de reeks met 40 J moet een extra reeks van zes proeven worden uitgevoerd waarbij men 5 kg van 0,15 m (7,5 J) laat vallen. In andere apparaten wordt het monster vergeleken met de gekozen referentiestof via een vastgestelde procedure (bijvoorbeeld op-en-neer techniek, enz.).
1.6.2.4. Beoordeling
Het testresultaat wordt als positief beschouwd als ten minste éénmaal in een van de proeven een explosie (ontbranden en/of een knal staan hiermee gelijk) plaatsvindt met het beschreven slagapparaat of als het monster in een alternatieve slagproef gevoeliger is dan 1,3-dinitrobenzeen of RDX.
1.6.3. Mechanische gevoeligheid (wrijving)
1.6.3.1. Apparatuur (figuur 5)
Het wrijvingsapparaat bestaat uit een gietstalen grondplaat waarop het eigenlijke wrijvingstoestel gemonteerd is. Het wrijvingstoestel bestaat uit een vaste porseleinen pen en een bewegende porseleinen plaat. De porseleinen plaat zit vast in een slede welke tussen twee geleiders beweegt. De slede wordt via een aandrijfstang, een excentrische nok en een geschikt drijfwerk op zodanige wijze met een elektromotor verbonden, dat de porseleinen plaat slechts éénmaal onder de porseleinen pen heen en weer wordt bewogen over een afstand van 10 mm. De porseleinen pen kan belast worden met bijvoorbeeld 120 of 360 newton.
De vlakke porseleinen platen worden van wit technisch porselein (oppervlakteruwheid tussen 9 en 32 μm) gemaakt en zijn 25 mm lang, 25 mm breed en 5 mm hoog. De cylindrische porseleinen pen wordt eveneens van wit technisch porselein gemaakt, is 15 mm lang, heeft een doorsnede van 10 mm en bolvormige uiteinden met een rondingsstraal van 10 mm, en geruwd oppervlak.
1.6.3.2. Testomstandigheden
Het monstervolume dient 10 mm3 te bedragen of overeen te komen met het vulvolume in een alternatief apparaat.
Vaste stoffen dienen in droge toestand te worden onderzocht en worden als volgt voorbewerkt:
|
a) |
poedervormige stoffen worden gezeefd (maaswijdte 0,5 mm); alles wat de zeef doorlaat, wordt voor de test gebruikt; |
|
b) |
samengeperste, gegoten of op andere wijze verdichte stoffen worden in stukken gebroken en gezeefd; de zeeffractie kleiner dan 0,5 mm wordt gebruikt voor de test. |
Stoffen die gewoonlijk als pasta's geleverd zouden worden, moeten, in de mate van het mogelijke, in droge staat worden getest. Wanneer de stoffen niet in droge staat kunnen worden bereid, wordt de pasta (na het zoveel mogelijk verwijderen van vloeistof) getest als een 0,5 mm dikke, 2 mm brede en 10 mm lange plak, bereid met behulp van een mal.
1.6.3.3. Uitvoering van de proeven
De porseleinen pen wordt op het te onderzoeken monster geplaatst en de belasting wordt aangebracht. Tijdens de test moeten de groeven van de porseleinen plaat loodrecht op de bewegingsrichting liggen. Er moet goed op worden gelet dat de pen op het monster rust, dat voldoende van de te onderzoeken stof onder de pen ligt en dat de plaat op de juiste wijze onder de pen doorbeweegt. Voor pasta's wordt een 0,5 mm dikke mal met een gleuf van 2 bij 10 mm gebruikt om de pasta op de plaat aan te brengen. De porseleinen plaat moet in 0,44 seconden onder de porseleinen pen heen en weer bewegen over een afstand van 10 mm. De pen en elk gedeelte van het oppervlak mogen slechts voor één test worden gebruikt; de twee uiteinden van de pen kunnen dus dienen voor twee proeven en de twee oppervlakken van de plaat elk voor drie proeven.
Een reeks van zes proeven wordt uitgevoerd met 360 N belasting. Als een positief resultaat wordt verkregen tijdens deze zes proeven, moet een tweede reeks van zes proeven worden uitgevoerd met 120 N belasting. Bij gebruik van andere apparatuur wordt het monster vergeleken met de gekozen referentiestof via een vastgestelde procedure (bijvoorbeeld op-en-neer-techniek, enz.).
1.6.3.4. Beoordeling
Het testresultaat wordt als positief beschouwd als ten minste in één van de proeven een explosie (knetteren en/of een knal of ontbranden staan hiermee gelijk) plaatsvindt met het beschreven wrijvingsapparaat of als aan gelijkwaardige eisen voldaan wordt in andere wrijvingsapparatuur.
2. GEGEVENS
In beginsel wordt in de zin van deze richtlijn aan een stof of preparaat explosiegevaar toegeschreven indien een positief resultaat wordt verkregen in de thermische-, schok- of wrijvingsgevoeligheidstest.
3. RAPPORTAGE
3.1. TESTRAPPORT
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
de identiteit, samenstelling, zuiverheid, vochtgehalte, enz. van de onderzochte stof; |
|
— |
de fysische vorm van het monster, en of het al dan niet werd verpulverd, gebroken en/of gezeefd; |
|
— |
waarnemingen tijdens de thermische-gevoeligheidstests (bijvoorbeeld de monstermassa, aantal fragmenten, enz.); |
|
— |
waarnemingen tijdens de mechanische-gevoeligheidstests (bijvoorbeeld de vorming van grote hoeveelheden rook of complete ontleding zonder knal, vlammen, vonken, knallen, knetteren, enz.); |
|
— |
de resultaten van elke soort test; |
|
— |
indien afwijkende apparatuur is gebruikt, moet dit op wetenschappelijke gronden worden gerechtvaardigd; bovendien moet de correlatie tussen meetresultaten met de afwijkende apparatuur en de hierboven beschreven apparatuur bewezen worden; |
|
— |
eventueel nuttige opmerkingen, zoals verwijzing naar proeven met soortgelijke producten, die van belang kunnen zijn voor een correcte interpretatie van de resultaten; |
|
— |
alle aanvullende opmerkingen die van belang kunnen zijn voor een goede interpretatie van de resultaten. |
3.2. INTERPRETATIE EN BEOORDELING VAN DE RESULTATEN
In het testrapport moet worden vermeld welke resultaten als onjuist, afwijkend of niet-representatief worden beschouwd. Indien een van de resultaten moet worden verworpen, dient een toelichting én de resultaten van alle alternatieve of aanvullende proeven te worden gegeven. Indien een afwijkend resultaat niet kan worden verklaard, moet het worden aanvaard en gebruikt om de stof overeenkomstig in te delen.
4. LITERATUUR
|
(1) |
Recommendations on the Transport of Dangerous Goods, Tests and criteria, 1990, United Nations, New York. |
|
(2) |
Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750-60103-5, 1990. |
|
(3) |
Koenen, H., Ide, K.H., en Swart, K.H., Explosivstoffe, 1961, vol. 3, 6-13 en 30-42. |
|
(4) |
NF T 20-038 (Sept. 85). Chemical products for industrial use — Determination of explosive risk. |
Aanhangsel
Voorbeeld van materiaalspecificatie voor thermische-gevoeligheidstest (zie DIN 1623)
|
(1) |
Buis: Materiaalspecificatie nr. 1.0336.505 g |
|
(2) |
Afsluitplaat: Materiaalspecificatie nr. 1.4873 |
|
(3) |
Getapte kraag en moer: Materiaalspecificatie nr. 1.3817 |
Figuur 1
Apparatuur voor de thermische-gevoeligheidstest
(Alle afmetingen in mm)

Figuur 2
Thermische-gevoeligheidstest
(Voorbeelden van fragmentatie)

Figuur 3
IJking voor opwarmsnelheid in de thermische-gevoeligheidstest
Temperatuur/tijd-curve verkregen door verhitting van dibutylftalaat (27 cm3) in een gesloten (1,5 mm afsluitplaat) buis met behulp van een propaandebiet van circa 3,2 liter/minuut. De temperatuur wordt gemeten met een chromel/alumel thermokoppel, roestvrijstalen omhulsel van 1 mm doorsnede, in het midden van de buis geplaatst op 43 mm onder de rand. De opwarmsnelheid in het bereik van 135 oC tot 285 oC moet tussen 185 en 215 K/minuut liggen.
Figuur 4
Schokgevoeligheidstest
(Afmetingen in mm)
Figuur 4
Vervolg

Figuur 5
Wrijvingsgevoeligheidstest

A.15. ZELFONTBRANDINGSTEMPERATUUR (VLOEISTOFFEN EN GASSEN)
1. METHODE
1.1. INLEIDING
Explosieve stoffen en stoffen die spontaan ontbranden in aanraking met lucht bij kamertemperatuur moeten niet onderworpen worden aan dit onderzoek. De testprocedure is van toepassing op gassen, vloeistoffen en dampen die in aanwezigheid van lucht door een heet oppervlak tot ontbranding kunnen worden gebracht.
De temperatuur waarbij zelfontbranding optreedt, kan aanzienlijk worden verlaagd door de aanwezigheid van katalytische verontreinigingen, door het oppervlakmateriaal, of door een groter volume van het proefvat.
1.2. DEFINITIES EN EENHEDEN
De mate van zelfontbranding wordt uitgedrukt in de zelfontbrandingstemperatuur. De zelfontbrandingstemperatuur is de laagste temperatuur waarbij de te onderzoeken stof gemengd met lucht tot ontbranding komt onder omstandigheden zoals beschreven in deze testmethode.
1.3. REFERENTIESTOFFEN
De referentiestoffen worden beschreven in de normen (zie 1.6.3). Deze stoffen zijn in de eerste plaats bedoeld om de werking van de methode regelmatig te controleren en om vergelijking met resultaten van andere methoden mogelijk te maken.
1.4. PRINCIPE VAN DE TESTMETHODE
De methode bepaalt de laagste temperatuur van het binnenoppervlak van een vat, die leidt tot ontbranding van een in het vat geïnjecteerd(e) gas, damp, of vloeistof.
1.5. KWALITEITSCRITERIA
De reproduceerbaarheid is afhankelijk van het temperatuurgebied waarin de zelfontbranding optreedt, en van de gebruikte testmethode.
De gevoeligheid en specificiteit zijn afhankelijk van de gebruikte testmethode.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
De apparatuur wordt beschreven in de onder 1.6.3 genoemde methode.
1.6.2. Testomstandigheden
De te onderzoeken stof wordt onderzocht volgens de methode beschreven onder 1.6.3.
1.6.3. Uitvoering van de test
Zie: IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. GEGEVENS
Registreer de testtemperatuur, de atmosferische druk, de gebruikte hoeveelheid stof en de tijdsduur tot ontbranding.
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen); |
|
— |
de gebruikte hoeveelheid stof en de atmosferische druk; |
|
— |
de gebruikte apparatuur; |
|
— |
de resultaten van metingen (testtemperaturen, resultaten met betrekking tot ontbranding en bijbehorende tijdsduur); |
|
— |
alle verdere opmerkingen die van belang zijn voor interpretatie van de resultaten. |
4. LITERATUUR
Geen.
A.16. RELATIEVE ZELFONTBRANDINGSTEMPERATUUR VAN VASTE STOFFEN
1. METHODE
1.1. INLEIDING
Explosiegevaarlijke stoffen en stoffen die in contact met lucht bij kamertemperatuur spontaan ontbranden, moeten niet aan deze test worden onderworpen.
Deze test geeft oriënterende informatie over de zelfontbrandbaarheid van vaste stoffen bij verhoogde temperatuur.
Indien de warmte, die vrijkomt bij reactie van de stof met zuurstof of bij exotherme ontleding, niet snel genoeg aan de omgeving wordt afgegeven, vindt zelfopwarming en uiteindelijk zelfontbranding plaats. Zelfontbranding kan dus slechts optreden als de snelheid van de warmteproductie groter is dan die van het warmteverlies.
De testprocedure is bruikbaar als een oriënterende proef voor vaste stoffen. Omdat de ontsteking en verbranding van vaste stoffen ingewikkelde processen zijn, mag de volgens deze testmethode bepaalde zelfontbrandingstemperatuur alleen voor vergelijkingsdoeleinden worden gebruikt.
1.2. DEFINITIES EN EENHEDEN
De zelfontbrandingstemperatuur, die met deze methode verkregen wordt, is de laagste omgevingstemperatuur in oC waarbij een bepaald volume van een stof onder welbepaalde omstandigheden ontbrandt.
1.3. REFERENTIESTOFFEN
Niet gegeven.
1.4. PRINCIPE VAN DE TESTMETHODE
Een bepaald volume van de te onderzoeken stof wordt bij kamertemperatuur in een oven geplaatst; het temperatuurverloop in het midden van het monster wordt als functie van de tijd geregistreerd, terwijl de temperatuur van de oven met een snelheid van 0,5 oC/minuut wordt opgevoerd tot 400 oC of tot de smelttemperatuur indien deze lager is. Voor het doel van deze test wordt de temperatuur van de oven, waarbij de temperatuur van het monster door zelfopwarming 400 oC bereikt, de zelfontbrandingstemperatuur genoemd.
1.5. KWALITEITSCRITERIA
Niet gegeven.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
1.6.1.1. Oven
Een laboratoriumoven van ongeveer 2 liter, waarvan het temperatuurverloop lineair geregeld kan worden, en voorzien van natuurlijke luchtcirculatie en explosieontlasting. Teneinde eventueel explosiegevaar te vermijden, moet voorkomen worden dat ontledingsgassen in contact kunnen komen met de elektrische verwarmingselementen.
1.6.1.2. Gazen kubus
Een stuk roestvrij staalgaas met openingen van 0,045 mm moet worden uitgeknipt volgens het patroon van figuur 1. Het gaas wordt gevouwen en met draad vastgemaakt in de vorm van een kubus met open bovenkant.
1.6.1.3. Thermokoppels
Geschikte thermokoppels.
1.6.1.4. Recorder
Tweekanaalsrecorder, gecalibreerd van 0 tot 600 oC of hiermee overeenkomstige spanning.
1.6.2. Testomstandigheden
De stoffen worden getest zoals ontvangen.
1.6.3. Uitvoering van de test
De kubus wordt gevuld met de te onderzoeken stof waarbij onder zachtjes tikken zoveel stof toegevoegd wordt dat de kubus volledig gevuld is. Vervolgens wordt de kubus bij kamertemperatuur midden in de oven gehangen. Het ene thermokoppel wordt in het middelpunt van de kubus gebracht en het tweede tussen de kubus en de ovenwand om de oventemperatuur te registreren.
De temperaturen van de oven en van het monster worden continu geregistreerd terwijl de temperatuur van de oven met een snelheid van 0,5 oC/min wordt opgevoerd tot 400 oC of tot de smelttemperatuur indien deze lager is dan 400 oC.
Wanneer de stof reageert, zal het thermokoppel in het monster een scherpe temperatuursstijging boven de oventemperatuur te zien geven.
2. GEGEVENS
De oventemperatuur, waarbij de temperatuur van het monster door zelfopwarming 400 oC bereikt, is van belang voor de beoordeling (zie figuur 2).
3. RAPPORTAGE
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
een beschrijving van de onderzochte stof; |
|
— |
de meetresultaten inclusief de temperatuur/tijd-grafiek; |
|
— |
alle verdere opmerkingen die van belang zijn voor interpretatie van de resultaten. |
4. LITERATUUR
(1) NF T 20-036 (SEPT 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
Figuur 1
Patroon van de testkubus met ribben van 20 mm

Figuur 2
Karakteristieke temperatuur/tijd-curve

A.17. OXIDERENDE EIGENSCHAPPEN (VASTE STOFFEN)
1. METHODE
1.1. INLEIDING
Het is nuttig om, voordat deze test wordt uitgevoerd, te beschikken over gegevens over de mogelijke explosieve eigenschappen van de te onderzoeken stof.
Deze test is niet toepasbaar op vloeistoffen en gassen, explosieve of licht ontvlambare vaste stoffen of organische peroxiden.
Deze test hoeft niet uitgevoerd te worden als op grond van de structuurformule met afdoende zekerheid kan worden vastgesteld dat de stof niet exotherm kan reageren met een brandbare stof.
Teneinde vast te stellen of voor deze test speciale voorzorgsmaatregelen nodig zijn, moet een oriënterende proef worden uitgevoerd.
1.2. DEFINITIES EN EENHEDEN
Brandduur: de tijd in seconden die de reactiezone nodig heeft om zich langs een rups stof te verplaatsen, volgens de werkwijze van 1.6.
Brandsnelheid: de bijbehorende snelheid in mm/s.
Maximale brandsnelheid: de hoogste waarde van de brandsnelheden van mengsels die 10 tot 90 gewichtsprocent oxiderende stof bevatten.
1.3. REFERENTIESTOF
Als referentiestof voor de test en de oriënterende proef wordt bariumnitraat (analytisch zuiver) gebruikt.
Het referentiemengsel is het volgens 1.6 bereide mengsel van bariumnitraat en poedervormige cellulose, dat de grootst mogelijke brandsnelheid heeft (doorgaans een mengsel met 60 gewichtsprocent bariumnitraat).
1.4. PRINCIPE VAN DE TESTMETHODE
Met het oog op de veiligheid wordt een oriënterende proef uitgevoerd. Verdere onderzoeken zijn onnodig wanneer uit de oriënterende proef overduidelijk blijkt dat de te onderzoeken stof oxiderende eigenschappen heeft. In andere gevallen wordt de stof aan het volledige onderzoek onderworpen.
In het volledige onderzoek wordt de te onderzoeken stof in verschillende verhoudingen gemengd met een bepaalde brandbare stof. Van ieder mengsel wordt een rups gevormd en deze wordt aan één uiteinde aangestoken. De maximale brandsnelheid wordt bepaald en vergeleken met de maximale brandsnelheid van het referentiemengsel.
1.5. KWALITEITSCRITERIA
Indien nodig kunnen de stoffen op willekeurige wijze worden gemalen en gemengd, mits de maximale brandsnelheden uit de zes verschillende bepalingen niet meer dan 10 % verschillen van hun rekenkundige gemiddelde.
1.6. BESCHRIJVING VAN DE METHODE
1.6.1. Voorbereiding
1.6.1.1. Teststof
De deeltjesgrootte van het te onderzoeken monster wordt als volgt tot minder dan 0,125 mm verkleind: de stof wordt gezeefd en de overblijvende fractie gemalen; deze handelingen worden herhaald totdat de gehele portie door de zeef is gegaan.
Iedere methode voor malen en zeven kan worden gebruikt, zolang aan de kwaliteitscriteria is voldaan.
Vóór het bereiden van het mengsel wordt de stof eerst tot constant gewicht gedroogd bij 105 oC. Indien de ontledingstemperatuur van de te onderzoeken stof beneden 105 oC ligt, wordt de stof bij een lagere temperatuur gedroogd.
1.6.1.2. Brandbare stof
Poedervormige cellulose wordt gebruikt als brandbare stof. De cellulose moet het soort zijn dat wordt gebruikt bij dunne-laagchromatografie of kolomchromatografie. Een type waarbij meer dan 85 % van de vezels een lengte hebben tussen 0,020 en 0,075 mm is geschikt gebleken. Het cellulosepoeder wordt gezeefd door een zeef met openingen van 0,125 mm. Eén en dezelfde voorbewerkte batch cellulose wordt gebruikt gedurende de hele proef.
Vóór het bereiden van het mengsel wordt de poedervormige cellulose bij 105 oC tot constant gewicht gedroogd.
Indien in de oriënterende proef houtmeel wordt gebruikt, wordt het houtmeel van naaldhout gebruikt dat door een zeef met openingen van 1,6 mm valt; het gezeefde houtmeel wordt grondig gemengd en vervolgens vier uur bij 105 oC gedroogd in een laag van maximaal 25 mm dikte. Na afkoelen wordt het houtmeel in een luchtdicht vat dat zover mogelijk gevuld is, bewaard tot het ogenblik waarop het wordt gebruikt, zo mogelijk binnen 24 uur na het drogen.
1.6.1.3. Ontstekingsbron
Als ontstekingsbron dient de hete vlam van een gasbrander (minimale diameter 5 mm). Indien een andere ontstekingsbron wordt gebruikt (bijvoorbeeld bij proeven in een inerte atmosfeer), moeten beschrijving, redenen en geschiktheid worden gerapporteerd.
1.6.2. Uitvoering van de test
Opmerking:
In verband met mogelijk explosiegevaar moeten mengsels van oxiderende stoffen en cellulose of houtmeel met de nodige voorzichtigheid worden behandeld.
1.6.2.1. Oriënterende proef
Twee gewichtsdelen gedroogde stof worden grondig gemengd met één gewichtsdeel cellulose of houtmeel. Van het mengsel wordt, bijvoorbeeld met behulp van een glazen trechter waarvan de steel is dichtgestopt, zonder aandrukken een kegelvormig hoopje gemaakt met een basisdiameter van 3,5 cm en een hoogte van 2,5 cm.
Het hoopje wordt op een koude onbrandbare, niet poreuze en slecht warmtegeleidende grondplaat geplaatst. De oriënterende proef moet worden uitgevoerd in een zuurkast zoals beschreven in 1.6.2.2.
De ontstekingsbron wordt in contact gebracht met het hoopje stof. De heftigheid en de duur van de reactie worden geobserveerd en geregistreerd.
De stof kan worden aangemerkt als oxiderend als de reactie heftig verloopt.
Zodra het resultaat aanleiding geeft tot enige twijfel, dient de hieronder beschreven volledige test te worden uitgevoerd.
1.6.2.2. Volledig onderzoek
Er worden mengsels van de oxiderende stof en de brandbare stof gemaakt, waarbij het gehalte oxiderende stof in stappen van 10 gewichtsprocenten oploopt van 10 tot 90 gewichtsprocenten. In grensgevallen moeten tussenliggende mengverhoudingen worden bereid, zodat de maximale brandsnelheid nauwkeuriger kan worden bepaald.
Er wordt een rupsstof gevormd met behulp van een mal. Deze mal is van metaal, heeft een lengte van 250 mm en een driehoekige doorsnede met een hoogte van 10 mm en een basis van 20 mm. Aan weerszijden van de mal worden in de lengterichting twee metalen platen aangebracht die 2 mm boven de driehoekige doorsnede uitsteken (zie figuur). De mal wordt zonder aandrukken gevuld met een kleine overmaat van het mengsel. Na de mal eenmaal van een hoogte van 2 cm op een vast oppervlak te hebben laten vallen, wordt de overmaat mengsel met een schuingehouden blad weggeveegd. De zijstroken worden verwijderd en het overblijvende poeder wordt met een rol glad gestreken. Ten slotte wordt bovenop de mal een vuurvaste, niet poreuze en slecht warmtegeleidende plaat gelegd, het geheel wordt omgekeerd en de mal verwijderd.
De rups wordt in de zuurkast geplaatst in een richting loodrecht op de richting van de trek.
De luchtsnelheid moet voldoende zijn om te verhinderen dat verbrandingsgassen naar de laboratoriumruimte ontsnappen; de luchtsnelheid mag gedurende de test niet veranderd worden. De apparatuur moet worden omgeven door een tochtscherm.
In verband met de hygroscopische eigenschappen van cellulose en sommige te onderzoeken stoffen moet de test zo snel mogelijk worden uitgevoerd.
Eén uiteinde van de rups wordt aangestoken door aanraking met de vlam.
De brandduur wordt gemeten over een lengte van 200 mm, nadat de reactiezone reeds een beginafstand van 30 mm heeft afgelegd.
De test wordt uitgevoerd met de referentiestof en vervolgens ten minste éénmaal met elk mengsel uit de reeks van de te onderzoeken stof en cellulose.
Indien een maximale brandsnelheid wordt waargenomen die aanzienlijk hoger is dan de maximale brandsnelheid van het referentiemengsel, kan de test worden gestaakt; zo niet, dan moet de test vijfmaal worden herhaald met de drie mengsels die de hoogste brandsnelheid opleverden.
Indien men vermoedt dat het resultaat vals positief is, moet de test herhaald worden met een inerte stof met een zelfde deeltjesgrootte, zoals kiezelgoer, in plaats van cellulose. Ook kan het mengsel te onderzoeken stof/cellulose, dat de grootste verbrandingssnelheid heeft, opnieuw getest worden in een inerte atmosfeer (< 2 % v/v zuurstofgehalte).
2. GEGEVENS
Om veiligheidsredenen moet de hoogste brandsnelheid — en niet de gemiddelde waarde — worden beschouwd als kenmerk voor de oxiderende eigenschappen van de stof.
De hoogste waarde van de brandsnelheid binnen een serie van zes metingen voor één bepaald mengsel geldt voor de beoordeling.
Maak een grafiek waarin de hoogste waarde van de brandsnelheid van ieder mengsel wordt uitgezet tegen de concentratie van de oxiderende stof in ieder mengsel; bepaal uit deze grafiek de maximale brandsnelheid.
De zes waarden van de brandsnelheid, in een serie van zes metingen op het mengsel met de hoogste brandsnelheid, mogen niet meer dan 10 % afwijken van hun rekenkundig gemiddelde; anders moeten de gebruikte methoden voor malen en mengen verbeterd worden.
Vergelijk de verkregen maximale brandsnelheid met de maximale brandsnelheid van het referentiemengsel (zie 1.3).
Als tests worden uitgevoerd in een inerte atmosfeer, moet de maximale reactiesnelheid worden vergeleken met die van het referentiemengsel in een inerte atmosfeer.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
beschrijving, samenstelling, zuiverheid, vochtgehalte, enz. van de onderzochte stof; |
|
— |
eventuele voorbehandeling van de onderzochte stof (bijvoorbeeld malen, drogen enz.) |
|
— |
de in de onderzoeken gebruikte ontstekingsbron; |
|
— |
de resultaten van de metingen; |
|
— |
de wijze van reactie (bijvoorbeeld een „flashverbranding” aan het oppervlak of een verbranding door de gehele massa, eventuele informatie met betrekking tot de verbrandingsproducten enz.); |
|
— |
alle verdere opmerkingen die van belang zijn voor de interpretatie van de resultaten, inclusief een beschrijving van de heftigheid (vlammen, vonken, rook, smeulen, en dergelijke) en een schatting van de brandduur van de oriënterende proef, zowel voor de teststof als voor de referentiestof; |
|
— |
de resultaten van proeven met een inerte stof, indien van toepassing; |
|
— |
de resultaten van proeven in een inerte atmosfeer, indien van toepassing. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Een stof wordt aangemerkt als een oxiderende stof wanneer:
|
a) |
er in de oriënterende proef een heftige reactie optreedt; |
|
b) |
in de volledige test de maximale brandsnelheid van de onderzochte mengsels groter is dan of gelijk is aan de maximale brandsnelheid van het referentiemengsel van cellulose en bariumnitraat. |
Om vals positieve resultaten te vermijden, dient bij het verwerken van de resultaten ook rekening gehouden te worden met de resultaten verkregen bij het testen van stof gemengd met inert materiaal en/of in een inerte atmosfeer.
4. LITERATUUR
(1) NF T 20-035 (Sept. 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
Aanhangsel
Figuur
Mal en toebehoren voor de bereiding van de rups
(Afmetingen in mm)

A.18. AANTALGEMIDDELD MOLECUULGEWICHT EN MOLECUULGEWICHTSVERDELING VAN POLYMEREN
1. METHODE
Deze methode voor gelpermeatiechromatografie is overgenomen van TG 118 van de OESO (1996). Voor de fundamentele beginselen en nadere technische informatie wordt verwezen naar de referenties.
1.1. INLEIDING
Aangezien de eigenschappen van polymeren zo sterk uiteenlopen, is het onmogelijk een enkele methode te beschrijven waarin voor alle mogelijkheden en specifieke gevallen bij de scheiding van polymeren exact de omstandigheden voor scheiding en evaluatie worden aangegeven. Met name complexe polymeersystemen komen vaak niet in aanmerking voor gelpermeatiechromatografie (GPC). Wanneer GPC niet uitvoerbaar is, kan het molecuulgewicht met behulp van andere methoden worden bepaald (zie bijlage). In dat geval moet een gedetailleerde beschrijving van en een volledige motivering voor de gebruikte methode worden gegeven.
De hier beschreven methode is gebaseerd op de norm DIN 55672 (1). Deze norm bevat gedetailleerde informatie over de wijze waarop de experimenten moeten worden uitgevoerd en de gegevens moeten worden geëvalueerd. Wanneer veranderingen in de wijze van uitvoering nodig zijn, moet daarvoor een motivering worden gegeven. Ook andere normen kunnen worden gebruikt, mits de referenties volledig worden vermeld. In de beschreven methode worden voor de kalibratie polystyreenmonsters met een bekende polydispersiteit gebruikt en wijzigingen kunnen nodig zijn om de methode geschikt te maken voor bepaalde polymeren zoals in water oplosbare polymeren en vertakte polymeren met een lange keten.
1.2. DEFINITIES EN EENHEDEN
Het aantalgemiddeld molecuulgewicht (Mn) en het gewichtgemiddeld molecuulgewicht (Mw) worden bepaald met behulp van de volgende vergelijkingen:
|
|
|
waarbij
Hi = de hoogte van het detectorsignaal vanaf de basislijn bij het retentievolume Vi;
Mi = het molecuulgewicht van de polymeerfractie bij het retentievolume Vi;
N = het aantal meetpunten.
De verhouding Mw/Mn is de breedte van de molecuulgewichtsverdeling, die een maat is voor de dispersiteit van het systeem.
1.3. REFERENTIESTOFFEN
Aangezien GPC een relatieve methode is, moet het systeem worden gekalibreerd. Als standaard worden normaal gesproken fijn verdeelde lineair opgebouwde polystyreenmonsters gebruikt met bekende gemiddelde molecuulgewichten (Mn en Mw) en een bekende molecuulgewichtsverdeling. De kalibratiecurve kan alleen voor de bepaling van het molecuulgewicht van het onbekende monster worden gebruikt als de omstandigheden voor de scheiding van het monster en de standaards op identieke wijze zijn gekozen.
Een tijdens een bepaald experiment vastgesteld verband tussen het molecuulgewicht en het elutievolume is alleen onder de specifieke omstandigheden van dat experiment geldig. Daarbij gaat het vooral om de temperatuur, het oplosmiddel (of het oplosmiddelenmengsel), de omstandigheden tijdens chromatografie en de kolom of het kolomsysteem waarop de scheiding is uitgevoerd.
Een op deze manier bepaald molecuulgewicht van het monster is relatief en wordt beschreven als een „polystyreenequivalent molecuulgewicht”. Dit houdt in dat het molecuulgewicht afhankelijk van de structurele en chemische verschillen tussen het monster en de standaard in meer of mindere mate van de absolute waarde kan afwijken. Als een andere standaard wordt gebruikt, zoals polyethyleenglycol, polyethyleenoxide, polymethylmethacrylaat of polyacrylzuur, moet de reden daarvan worden vermeld.
1.4. PRINCIPE VAN DE TESTMETHODE
Zowel de molecuulgewichtsverdeling van het monster als het gemiddelde molecuulgewicht (Mn of Mw) kan met behulp van GPC worden bepaald. GPC is een speciaal soort vloeistofchromatografie waarbij het monster aan de hand van het hydrodynamische volume van de verschillende bestanddelen wordt gescheiden (2).
De scheiding voltrekt zich tijdens de passage van het monster door een kolom die met een poreus materiaal, meestal een organische gel, is gevuld. Kleine moleculen kunnen de poriën binnendringen, terwijl grote moleculen dit niet kunnen. Grote moleculen volgen dan ook een kortere weg en worden het eerste geëlueerd. Middelgrote moleculen kunnen sommige poriën binnendringen en worden later geëlueerd. De kleinste moleculen, waarvan de gemiddelde hydrodynamische straal kleiner is dan de poriën van de gel, kunnen alle poriën binnendringen. Deze worden het laatst geëlueerd.
In het ideale geval wordt de scheiding uitsluitend door de grootte van het molecuul bepaald, maar enige storing door absorptie-effecten is in de praktijk vrijwel niet te voorkomen. Een ongelijkmatige pakking van de kolom en dode ruimten kunnen de situatie nog ongunstiger maken (2).
Detectie gebeurt aan de hand van bijvoorbeeld de brekingsindex of uv-absorptie en levert een eenvoudige verdelingskromme op. Om echte waarden voor het molecuulgewicht aan de kromme te kunnen toekennen, moet de kolom echter worden gekalibreerd met behulp van polymeren met een bekend molecuulgewicht en liefst een in grote lijnen vergelijkbare structuur, bijvoorbeeld een aantal polystyreenstandaards. Meestal levert dit een gausscurve op, soms met een kleine staart aan de kant van de lage molecuulgewichten, waarbij op de verticale as de geëlueerde hoeveelheid in gewicht wordt uitgezet en op de horizontale as de logaritme van het molecuulgewicht.
1.5. KWALITEITSCRITERIA
De herhaalbaarheid (relatieve standaardafwijking) van het elutievolume moet beter zijn dan 0,3 %. Indien een chromatogram tijdafhankelijk wordt geëvalueerd en niet aan dit criterium voldoet, moet door correctie met behulp van een interne standaard de vereiste herhaalbaarheid van de analyse worden gewaarborgd (1). De polydispersiteit is afhankelijk van het molecuulgewicht van de standaard. Normale waarden voor polystyreenstandaards zijn:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
M p > 106 |
Mw/Mn < 1,20 |
(Mp is het molecuulgewicht van de standaard bij de top van de piek).
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Bereiding van de polystyreenstandaardoplossingen
De polystyreenstandaard wordt opgelost door deze zorgvuldig te mengen in de gekozen elutievloeistof. Bij de bereiding van de oplossingen moet rekening worden gehouden met de aanbevelingen van de fabrikant.
De concentratie van de standaardoplossingen wordt bepaald aan de hand van verschillende factoren, zoals het geïnjecteerde volume, de viscositeit van de oplossing en de gevoeligheid van de detector. Het maximale geïnjecteerde volume moet aan de lengte van de kolom worden aangepast om overlading te voorkomen. Voor een scheiding met behulp van GPC over een kolom van 30 cm × 7,8 mm wordt meestal een volume van 40 tot 100 μl geïnjecteerd. Grotere volumes zijn mogelijk, maar niet groter dan 250 μl. De optimale verhouding tussen het geïnjecteerde volume en de concentratie moet vóór de kalibratie van de kolom worden bepaald.
1.6.2. Bereiding van de monsteroplossing
In beginsel gelden voor de bereiding van de monsteroplossingen dezelfde eisen. Het monster wordt door zorgvuldig schudden opgelost in een geschikt oplosmiddel, bijvoorbeeld tetrahydrofuraan (THF). Het mag in geen geval met behulp van een ultrasoon bad worden opgelost. Indien nodig, wordt de monsteroplossing gezuiverd over een membraanfilter met een poriegrootte tussen 0,2 en 2 μm.
Indien de oplossing onopgeloste deeltjes bevat, moet dit in het eindverslag worden vermeld, aangezien deze door hoogmoleculaire bestanddelen kunnen ontstaan. Er moet aan adequate methode worden gebruikt om het gewichtspercentage van de onopgeloste deeltjes te bepalen. De oplossingen moeten binnen 24 uur worden gebruikt.
1.6.3. Apparatuur
|
— |
oplosmiddelreservoir |
|
— |
ontgasser (indien van toepassing) |
|
— |
pomp |
|
— |
pulsdemper (indien van toepassing) |
|
— |
injectiesysteem |
|
— |
chromatografiekolommen |
|
— |
detector |
|
— |
stromingsmeter (indien van toepassing) |
|
— |
gegevensrecorder/verwerker |
|
— |
afvalreservoir |
Er moet voor worden gezorgd dat het GPC-systeem niet met de gebruikte oplosmiddelen reageert (bijvoorbeeld door stalen capillairen te gebruiken voor THF-oplossingen).
1.6.4. Injectie- en oplosmiddeltoevoersysteem
Een bekend volume van de monsteroplossing wordt met behulp van een autosampler of manueel in een scherp begrensde zone op de kolom gebracht. Wanneer bij manueel opbrengen de plunjer van de injectiespuit te snel wordt ingedrukt of teruggetrokken, kan dit tot veranderingen in de waargenomen molecuulgewichtsverdeling leiden. Het oplosmiddeltoevoersysteem moet voorzover mogelijk pulsatievrij zijn en liefst een pulsdemper bevatten. De stroomsnelheid moet ongeveer 1 ml/min zijn.
1.6.5. Kolom
Afhankelijk van het monster wordt het polymeer gekarakteriseerd met behulp van één kolom of een aantal in serie gekoppelde kolommen. In de handel zijn verschillende poreuze pakkingsmaterialen met bekende eigenschappen (bijvoorbeeld poriegrootte en exclusiegrens) verkrijgbaar. De keuze van de gel en de lengte van de kolom wordt bepaald door zowel de eigenschappen van het monster (hydrodynamisch volume, molecuulgewichtsverdeling) als de specifieke omstandigheden voor de scheiding zoals oplosmiddel, temperatuur en stroomsnelheid (1)(2)(3).
1.6.6. Theoretische schotels
De voor de scheiding gebruikte kolom of combinatie van kolommen moet worden gekarakteriseerd met behulp van het aantal theoretische schotels. Daartoe moet, indien THF als elutievloeistof wordt gebruikt, een oplossing van ethylbenzeen of een andere geschikte apolaire stof op een kolom met een bekende lengte worden gebracht. Het aantal theoretische schotels wordt berekend met de volgende vergelijking:
|
|
of |
|
waarbij:
|
N |
= |
het aantal theoretische schotels; |
|
Vc |
= |
het elutievolume bij de top van de piek; |
|
W |
= |
de piekbreedte aan de basis; |
|
Wl/2 |
= |
de piekbreedte op halve hoogte. |
1.6.7. Scheidend vermogen
Naast het aantal theoretische schotels, een grootheid die bepalend is voor de bandbreedte, speelt ook het scheidend vermogen, dat wordt bepaald door de helling van de kalibratiecurve, een rol. Het scheidend vermogen van een kolom kan als volgt worden bepaald:

waarbij:
|
Ve, Mx |
= |
het elutievolume voor polystyreen met molecuulgewicht Mx; |
|
Ve,(10Mx) |
= |
het elutievolume voor polystyreen met een tien keer zo hoog molecuulgewicht. |
De resolutie van het systeem wordt meestal als volgt gedefinieerd:

waarbij:
|
Vel, Ve2 |
= |
het elutievolume van de twee polystyreenstandaards bij de top van de piek; |
|
Wl' W2 |
= |
die piekbreedte aan de basis; |
|
M1, M2 |
= |
het molecuulgewicht bij de top van de pieken (deze moeten een factor 10 van elkaar verschillen). |
De R-waarde voor het kolomsysteem moet groter zijn dan 1,7 (4).
1.6.8. Oplosmiddelen
Alle oplosmiddelen moeten zeer zuiver zijn (THF wordt gebruikt met een zuiverheid van 99,5 %). Het oplosmiddelreservoir (indien nodig onder inert gas) moet groot genoeg zijn voor de kalibratie van de kolom en de analyse van verschillende monsters. Het oplosmiddel moet worden ontgast voordat het via de pomp naar de kolom wordt getransporteerd.
1.6.9. Temperatuurbewaking
De temperatuur van de kritische interne onderdelen (injectieblok, kolommen, detector en leidingen) moet constant zijn en in overeenstemming zijn met het gekozen oplosmiddel.
1.6.10. Detector
De detector is bedoeld om de concentratie van het monster in het eluaat uit de kolom kwantitatief te registreren. Om een onnodige verbreding van de pieken te voorkomen, moet het volume van de meetcel van de detector zo klein mogelijk worden gehouden. Het volume mag niet groter zijn dan 10 μl, behalve voor lichtverstrooiings- en viscositeitsdetectoren. Meestal wordt voor de detectie differentiële refractometrie gebruikt. Indien dit in verband met de specifieke eigenschappen van het monster of de elutievloeistof nodig is, kunnen echter ook andere soorten detectors worden gebruikt, zoals UV/VIS, IR of viscositeitsdetectoren.
2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
Voor de gedetailleerde beoordelingscriteria en voor de eisen ten aanzien van het verzamelen en bewerken van de gegevens wordt verwezen naar de DIN-norm (1).
Voor elk monster moeten twee onafhankelijke experimenten worden uitgevoerd die los van elkaar moeten worden geanalyseerd.
Voor elke meting moet de waarde van Mn, MR, Mw/Mn en M worden vermeld. Daarbij moet expliciet worden vermeld dat de gemeten waarden relatief zijn en worden uitgedrukt in equivalent-molecuulgewicht van de gebruikte standaard.
Na de bepaling van de retentievolumes of de retentietijden (eventueel gecorrigeerd met behulp van een interne standaard) wordt de logaritmische waarde van M (waarbij M de top van de piek van de kalibratiestandaard is) tegen een van deze grootheden uitgezet. Per log-interval zijn minimaal twee kalibratiepunten nodig en voor de curve als geheel minimaal vijf meetpunten. Het geraamde molecuulgewicht van het monster moet tussen het eerste en het laatste meetpunt liggen. Voor de bepaling van het laagste molecuulgewicht van de kalibratiecurve wordt een oplossing van n-hexylbenzeen of een andere geschikte apolaire stof gebruikt. Het aantalgemiddelde en het gewichtgemiddelde molecuulgewicht worden meestal aan de hand van de bij punt 1.2 vermelde vergelijkingen met behulp van een computer bepaald. Wanneer de digitalisering met de hand gebeurt, kan ASTM D 3536-91 (3) worden geraadpleegd.
De verdelingskromme moet in de vorm van een tabel of als figuur (al dan niet cumulatieve frequentieverdeling tegen log M) worden verstrekt. Bij de grafische weergave moet één log-interval van het molecuulgewicht normaal gesproken ongeveer 4 cm breed zijn en moet de top van de piek ongeveer 8 cm hoog zijn. Bij een cumulatieve frequentieverdeling moet het verschil op de y-as tussen 0 en 100 % ongeveer 10 cm zijn.
2.2. TESTVERSLAG
Het testverslag moet de volgende informatie bevatten:
2.2.1. Onderzochte stof:
|
— |
beschikbare informatie over de onderzochte stof (identiteit, additieven, verontreinigingen); |
|
— |
beschrijving van de behandeling van het monster, opmerkingen, problemen. |
2.2.2. Apparatuur:
|
— |
elutievloeistofreservoir, inert gas, ontgassing van de elutievloeistof, samenstelling van de elutievloeistof, verontreinigingen; |
|
— |
pomp, pulsdemper, injectiesysteem; |
|
— |
scheidingskolommen (fabrikant, alle informatie over de kenmerken van de kolommen zoals poriegrootte en aard van het pakkingsmateriaal, aantal, lengte en volgorde van de gebruikte kolommen); |
|
— |
aantal theoretische schotels van de kolom (of de combinatie), scheidend vermogen (resolutie van het systeem); |
|
— |
informatie over de symmetrie van de pieken; |
|
— |
kolomtemperatuur, aard van de temperatuurregeling; |
|
— |
detector (meetprincipe, type, volume van de meetcel); |
|
— |
stromingsmeter, indien gebruikt (fabrikant, meetprincipe); |
|
— |
systeem voor gegevensregistratie en -verwerking (hardware en software). |
2.2.3. Kalibratie van het systeem:
|
— |
gedetailleerde beschrijving van de methode die wordt gebruikt om de kalibratiecurve samen te stellen; |
|
— |
informatie over de kwaliteitscriteria voor deze methode (bijvoorbeeld correlatiecoëfficiënt of som van de kwadraten). |
|
— |
informatie over alle extrapolaties, veronderstellingen en benaderingen tijdens de experimentele procedure en de beoordeling en verwerking van gegevens. |
|
— |
alle metingen die voor de samenstelling van de kalibratiecurve worden gebruik, moeten in een tabel worden opgenomen waarbij voor elk kalibratiepunt de volgende informatie moet worden vermeld:
|
2.2.4. Evaluatie:
|
— |
evaluatie op basis van tijd: methoden die worden gebruikt om de vereiste reproduceerbaarheid te waarborgen (correctiemethode, interne standaard enz.); |
|
— |
informatie over de keuze voor elutievolume of retentietijd als basis voor de evaluatie; |
|
— |
informatie over de grenzen van de evaluatie als een piek niet volledig wordt geanalyseerd; |
|
— |
beschrijving van afvlakmethoden indien deze zijn gebruikt; |
|
— |
procedures voor de bereiding en voorbehandeling van het monster; |
|
— |
eventuele aanwezigheid van onopgeloste deeltjes; |
|
— |
geïnjecteerd volume (μl) en concentratie daarin (mg/ml); |
|
— |
bespreking van effecten die tot afwijkingen van het ideale GPC-profiel leiden; |
|
— |
gedetailleerde beschrijving van alle wijzigingen in de testprocedures; |
|
— |
gedetailleerde informatie over de foutintervallen; |
|
— |
alle andere informatie en opmerkingen die relevant zijn voor de interpretatie van de resultaten. |
3. REFERENTIES
|
(1) |
DIN 55672 (1995). Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1. |
|
(2) |
Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Aanhangsel
Voorbeelden van andere methoden voor de bepaling van het aantalgemiddelde molecuulgewicht (Mn) van polymeren
Gelpermeatiechromatografie (GPC) geniet de voorkeur als methode voor de bepaling van Mn, vooral wanneer er verschillende standaards beschikbaar zijn waarvan de structuur vergelijkbaar is met die van het polymeer. Wanneer het gebruik van GPC praktische problemen oplevert of reeds wordt vermoed dat de stof niet aan een criterium voor Mn in de regelgeving zal voldoen (en dit vermoeden moet worden bevestigd), zijn echter andere methoden beschikbaar:
1. Gebruik van colligatieve eigenschappen
|
1.1. |
Ebullioscopie/Cryoscopie:
Hierbij wordt de kookpuntverhoging (ebullioscopie) of vriespuntverlaging (cryoscopie) van een oplosmiddel na toevoeging van het polymeer gemeten. Bij deze methode wordt gebruik gemaakt van het feit dat het effect van het opgeloste polymeer op het kookpunt/vriespunt van de vloeistof afhankelijk is van het molecuulgewicht van het polymeer (1)(2). Toepasbaarheid: Mn < 20 000. |
|
1.2. |
Dampspanningsverlaging:
Hierbij wordt de dampspanning van een gekozen referentievloeistof voor en na toevoeging van bekende hoeveelheden polymeer gemeten (1)(2). Toepasbaarheid: Mn < 20 000 (theoretisch; in de praktijk is de bruikbaarheid van deze methode beperkt). |
|
1.3. |
Membraan-osmometrie:
Berust op osmose, d.w.z. de natuurlijke neiging van moleculen van oplosmiddelen om zich via een semipermeabel membraan van een verdunde naar een geconcentreerde oplossing te verplaatsen om een evenwicht te bereiken. In dit geval bevat de verdunde oplossing geen polymeer en de geconcentreerde oplossing wel. Doordat het oplosmiddel door het membraan wordt getrokken, ontstaat een drukverschil dat afhankelijk is van de concentratie en het molecuulgewicht van het polymeer (1)(3)(4). Toepasbaarheid: 20 000 < Mn < 200 000. |
|
1.4. |
Dampfase-osmometrie:
Hierbij wordt de verdampingssnelheid van een zuivere oplosmiddelaërosol vergeleken met die van ten minste drie aerosolen die verschillende concentraties polymeer bevatten (1)(5)(6). Toepasbaarheid: Mn <20 000. |
2. Eindgroepanalyse
Om deze methode te kunnen gebruiken is kennis nodig omtrent zowel de algehele structuur van het polymeer als de aard van de eindgroepen die de ketens afsluiten (deze moeten met behulp van bijvoorbeeld NMR of titratie/derivatisering van de hoofdketen kunnen worden onderscheiden). Wanneer de concentratie van de eindgroepen in het polymeermolecuul wordt bepaald, kan op grond daarvan een waarde voor het molecuulgewicht worden afgeleid (7)(8)(9).
Toepasbaarheid: Mn tot 50 000 (met afnemende betrouwbaarheid).
Referenties
|
(1) |
Billmeyer, F.W. Jr., (1984). Textbook of Polymer Science, 3rd Edn, John Wiley, New York. |
|
(2) |
Glover, CA, (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I, P.E. Slade, Jr.ed., Marcel Dekker, New York. |
|
(3) |
ASTM D 3750-79, (1979). Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
Coll, H. (1989). Membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, pp. 25-52. |
|
(5) |
ASTM 3592-77, (1977). Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(6) |
Morris, C.E.M., (1989). Vapour Pressure Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., John Wiley and Sons. |
|
(7) |
Schröder, E., Muller, G., and Arndt, K-F., (1989). Polymer Characterisation, Carl Hanser Verlag, Munich. |
|
(8) |
Garmon, R.G., (1975). End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed. Marcel Dekker, New York. |
|
(9) |
Amiya, S., et al. (1990). Pure and Applied Chemistry, 62, 2139-2146. |
A.19. GEHALTE VAN POLYMEREN AAN LAAGMOLECULAIRE BESTANDDELEN
1. METHODE
Deze methode voor gelpermeatiechromatografie is overgenomen van TG 119 van de OESO (1996). Voor de fundamentele beginselen en nadere technische informatie wordt verwezen naar de referenties.
1.1. INLEIDING
Aangezien de eigenschappen van polymeren zo sterk uiteenlopen, is het onmogelijk een enkele methode te beschrijven waarin voor alle mogelijkheden en specifieke gevallen bij de scheiding van polymeren exact de omstandigheden voor scheiding en evaluatie worden aangegeven. Met name complexe polymeersystemen komen vaak niet in aanmerking voor gelpermeatiechromatografie (GPC). Wanneer GPC niet uitvoerbaar is, kan het molecuulgewicht met behulp van andere methoden worden bepaald (zie bijlage). In dat geval moet een gedetailleerde beschrijving van en een volledige motivering voor de gebruikte methode worden gegeven.
De hier beschreven methode is gebaseerd op de norm DIN 55672 (1). Deze norm bevat gedetailleerde informatie over de wijze waarop de experimenten moeten worden uitgevoerd en de gegevens moeten worden geëvalueerd. Wanneer veranderingen in de wijze van uitvoering nodig zijn, moet daarvoor een motivering worden gegeven. Ook andere normen kunnen worden gebruikt, mits de referenties volledig worden vermeld. In de beschreven methode worden voor de kalibratie polystyreenmonsters met een bekende polydispersiteit gebruikt en wijzigingen kunnen nodig zijn om de methode geschikt te maken voor bepaalde polymeren zoals in water oplosbare polymeren en vertakte polymeren met een lange keten.
1.2. DEFINITIES EN EENHEDEN
Een laag molecuulgewicht wordt hier willekeurig gedefinieerd als een molecuulgewicht beneden 1 000 dalton.
Het aantalgemiddelde molecuulgewicht (Mn) en het gewichtgemiddelde molecuulgewicht (Mw) worden bepaald met behulp van de volgende vergelijkingen:
|
|
|
waarbij:
|
Hi |
= |
de hoogte van het detectorsignaal vanaf de basislijn bij het retentievolume Vi; |
|
Mi |
= |
het molecuulgewicht van de polymeerfractie bij het retentievolume Vi; |
|
n |
= |
het aantal meetpunten. |
De verhouding Mw/Mn is de breedte van de molecuulgewichtsverdeling, die een maat is voor de dispersiteit van het systeem.
1.3. REFERENTIESTOFFEN
Aangezien GPC een relatieve methode is, moet het systeem worden gekalibreerd. Als standaard worden normaal gesproken fijn verdeelde lineair opgebouwde polystyreenmonsters gebruikt met bekende gemiddelde molecuulgewichten (Mn en Mw) en een bekende molecuulgewichtsverdeling. De kalibratiecurve kan alleen voor de bepaling van het molecuulgewicht van het onbekende monster worden gebruikt als de omstandigheden voor de scheiding van het monster en de standaards op identieke wijze zijn gekozen.
Een tijdens een bepaald experiment vastgesteld verband tussen het molecuulgewicht en het elutievolume is alleen onder de specifieke omstandigheden van dat experiment geldig. Daarbij gaat het vooral om de temperatuur, het oplosmiddel (of het oplosmiddelenmengsel), de omstandigheden tijdens chromatografie en de kolom of het kolomsysteem waarop de scheiding is uitgevoerd.
Een op deze manier bepaald molecuulgewicht van het monster is relatief en wordt beschreven als een „polystyreen-equivalent molecuulgewicht”. Dit houdt in dat het molecuulgewicht afhankelijk van de structurele en chemische verschillen tussen het monster en de standaard in meer of mindere mate van de absolute waarde kan afwijken. Als een andere standaard wordt gebruikt, zoals polyethyleenglycol, polyethyleenoxide, polymethylmethacrylaat of polyacrylzuur, moet de reden daarvan worden vermeld.
1.4. PRINCIPE VAN DE TESTMETHODE
Zowel de molecuulgewichtsverdeling van het monster als het gemiddelde molecuulgewicht (Mn of Mw) kan met behulp van GPC worden bepaald. GPC is een speciaal soort vloeistofchromatografie waarbij het monster aan de hand van het hydrodynamische volume van de verschillende bestanddelen wordt gescheiden (2).
De scheiding voltrekt zich tijdens de passage van het monster door een kolom die met een poreus materiaal, meestal een organische gel, is gevuld. Kleine moleculen kunnen de poriën binnendringen, terwijl grote moleculen dit niet kunnen. Grote moleculen volgen dan ook een kortere weg en worden het eerste geëlueerd. Middelgrote moleculen kunnen sommige poriën binnendringen en worden later geëlueerd. De kleinste moleculen, waarvan de gemiddelde hydrodynamische straal kleiner is dan de poriën van de gel, kunnen alle poriën binnendringen. Deze worden het laatst geëlueerd.
In het ideale geval wordt de scheiding uitsluitend door de grootte van het molecuul bepaald, maar enige storing door absorptie-effecten is in de praktijk vrijwel niet te voorkomen. Een ongelijkmatige pakking van de kolom en dode ruimten kunnen de situatie nog ongunstiger maken (2).
Detectie gebeurt aan de hand van bijvoorbeeld de brekingsindex of uv-absorptie en levert een eenvoudige verdelingskromme op. Om echte waarden voor het molecuulgewicht aan de kromme te kunnen toekennen, moet de kolom echter worden gekalibreerd met behulp van polymeren met een bekend molecuulgewicht en liefst een in grote lijnen vergelijkbare structuur, bijvoorbeeld een aantal polystyreenstandaards. Meestal levert dit een gausscurve op, soms met een kleine staart aan de kant van de lage molecuulgewichten, waarbij op de verticale as de geëlueerde hoeveelheid in gewicht wordt uitgezet en op de horizontale as de logaritme van het molecuulgewicht.
Het gehalte aan laagmoleculaire bestanddelen wordt uit deze kromme afgeleid. De kalibratie kan alleen nauwkeurig zijn als de respons van de laagmoleculaire bestanddelen per massa-eenheid equivalent is met die van het polymeer als geheel.
1.5. KWALITEITSCRITERIA
De herhaalbaarheid (relatieve standaardafwijking) van het elutievolume moet beter zijn dan 0,3 %. Indien een chromatogram tijdafhankelijk wordt geëvalueerd en niet aan dit criterium voldoet, moet door correctie met behulp van een interne standaard de vereiste herhaalbaarheid van de analyse worden gewaarborgd (1). De polydispersiteit is afhankelijk van het molecuulgewicht van de standaard. Normale waarden voor polystyreenstandaards zijn:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp is het molecuulewicht van de standaard bij de top van de piek.)
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Bereiding van de polystyreenstandaardoplossingen
De polystyreenstandaard wordt opgelost door deze zorgvuldig te mengen in de gekozen elutievloeistof. Bij de bereiding van de oplossingen moet rekening worden gehouden met de aanbevelingen van de fabrikant.
De concentratie van de standaardoplossingen wordt bepaald aan de hand van verschillende factoren, zoals het geïnjecteerde volume, de viscositeit van de oplossing en de gevoeligheid van de detector. Het maximale geïnjecteerde volume moet aan de lengte van de kolom worden aangepast om overlading te voorkomen. Voor een scheiding met behulp van GPC over een kolom van 30 cm × 7,8 mm wordt meestal een volume van 40 tot 100 μl geïnjecteerd. Grotere volumes zijn mogelijk, maar niet groter dan 250 μl. De optimale verhouding tussen het geïnjecteerde volume en de concentratie moet vóór de kalibratie van de kolom worden bepaald.
1.6.2. Bereiding van de monsteroplossing
In beginsel gelden voor de bereiding van de monsteroplossingen dezelfde eisen. Het monster wordt door zorgvuldig schudden opgelost in een geschikt oplosmiddel, bijvoorbeeld tetrahydrofuraan (THF). Het mag in geen geval met behulp van een ultrasoon bad worden opgelost. Indien nodig wordt de monsteroplossing gezuiverd over een membraanfilter met een poriegrootte tussen 0,2 en 2 μm.
Indien de oplossing onopgeloste deeltjes bevat, moet dit in het eindverslag worden vermeld aangezien deze door hoogmoleculaire bestanddelen kunnen ontstaan. Er moet een adequate methode worden gebruikt om het gewichtspercentage van de onopgeloste deeltjes te bepalen. De oplossingen moeten binnen 24 uur worden gebruikt.
1.6.3. Correctie voor het gehalte aan verontreinigingen en additieven
Meestal moet het gehalte aan bestanddelen met M < 1 000 worden gecorrigeerd voor de bijdrage van niet polymeerspecifieke componenten (zoals verontreinigingen en/of additieven), tenzij het gemeten gehalte al lager is dan 1 %. Dit gebeurt door een directe analyse van de polymeeroplossing of van het GPC-eluaat.
Wanneer het eluaat na de passage door de kolom te verdund is om nog te worden geanalyseerd, moet het worden geconcentreerd. Daarbij kan het nodig zijn het eluaat droog te dampen en vervolgens weer op te lossen. Het concentreren van het eluaat moet onder zodanige omstandigheden gebeuren dat wordt gewaarborgd dat er geen veranderingen in het eluaat optreden. De behandeling van het eluaat na GPC is afhankelijk van de analysemethode die voor de kwantitatieve bepaling wordt gebruikt.
1.6.4. Apparatuur
De GPC-apparatuur bestaat uit de volgende onderdelen:
|
— |
oplosmiddelreservoir |
|
— |
ontgasser (indien van toepassing) |
|
— |
pomp |
|
— |
pulsdemper (indien van toepassing) |
|
— |
injectiesysteem |
|
— |
chromatografiekolommen |
|
— |
detector |
|
— |
stromingsmeter (indien van toepassing) |
|
— |
gegevensrecorder/verwerker |
|
— |
afvalreservoir |
Er moet voor worden gezorgd dat het GPC-systeem niet met de gebruikte oplosmiddelen reageert (bijvoorbeeld door stalen capillairen te gebruiken voor THF-opIossingen).
1.6.5. Injectie- en oplosmiddeltoevoersysteem
Een bekend volume van de monsteroplossing wordt met behulp van een autosampler of manueel in een scherp begrensde zone op de kolom gebracht. Wanneer bij manueel opbrengen de plunjer van de injectiespuit te snel wordt ingedrukt of teruggetrokken, kan dit tot veranderingen in de waargenomen molecuulgewichtsverdeling leiden. Het oplosmiddeltoevoersysteem moet voor zover mogelijk pulsatievrij zijn en liefst een pulsdemper bevatten. De stroomsnelheid moet ongeveer 1 ml/min zijn.
1.6.6. Kolom
Afhankelijk van het monster wordt het polymeer gekarakteriseerd met behulp van één kolom of een aantal in serie gekoppelde kolommen. In de handel zijn verschillende poreuze pakkingsmaterialen met bekende eigenschappen (bijvoorbeeld poriegrootte en exclusiegrens) verkrijgbaar. De keuze van de gel en de lengte van de kolom wordt bepaald door zowel de eigenschappen van het monster (hydrodynamisch volume, molecuulgewichtsverdeling) als de specifieke omstandigheden voor de scheiding zoals oplosmiddel, temperatuur en stroomsnelheid (1)(2)(3).
1.6.7. Theoretische schotels
De voor de scheiding gebruikte kolom of combinatie van kolommen moet worden gekarakteriseerd met behulp van het aantal theoretische schotels. Daartoe moet, indien THF als elutievloeistof wordt gebruikt, een oplossing van ethylbenzeen of een andere geschikte apolaire stof op een kolom met een bekende lengte worden gebracht. Het aantal theoretische schotels wordt berekend met de volgende vergelijking:
|
|
of |
|
waarbij:
|
N |
= |
het aantal theoretische schotels; |
|
Ve |
= |
het elutievolume bij de top van de piek; |
|
W |
= |
de piekbreedte aan de basis; |
|
W1/2 |
= |
de piekbreedte op halve hoogte. |
1.6.8. Scheidend vermogen
Naast het aantal theoretische schotels, een grootheid die bepalend is voor de bandbreedte, speelt ook het scheidend vermogen, dat wordt bepaald door de helling van de kalibratiecurve, een rol. Het scheidend vermogen van een kolom kan als volgt worden bepaald:

waarbij:
|
Ve, Mr |
= |
het elutievolume voor polystyreen met molecuulgewicht Mx; |
|
Ve,(10.Mr) |
= |
het elutievolume voor polystyreen met een tien keer zo hoog molecuulgewicht. |
De resolutie van het systeem wordt meestal als volgt gedefinieerd:
waarbij:
|
Ve1, Ve2 |
= |
het elutievolume van de twee polystyreenstandaards bij de top van de piek; |
|
W1, W2 |
= |
de piekbreedte aan de basis; |
|
M1, M2 |
= |
het molecuulgewicht bij de top van de pieken (deze moeten een factor 10 van elkaar verschillen). |
De R-waarde voor het kolomsysteem moet groter zijn dan 1,7 (4).
1.6.9. Oplosmiddelen
Alle oplosmiddelen moeten zeer zuiver zijn (THF wordt gebruikt met een zuiverheid van 99,5 %). Het oplosmiddelreservoir (indien nodig onder inert gas) moet groot genoeg zijn voor de kalibratie van de kolom en de analyse van verschillende monsters. Het oplosmiddel moet worden ontgast voordat het via de pomp naar de kolom wordt getransporteerd.
1.6.10. Temperatuurbewaking
De temperatuur van de kritische interne onderdelen (injectieblok, kolommen, detector en leidingen) moet constant zijn en in overeenstemming zijn met het gekozen oplosmiddel.
1.6.11. Detector
De detector is bedoeld om de concentratie van het monster in het eluaat uit de kolom kwantitatief te registreren. Om een onnodige verbreding van de pieken te voorkomen, moet het volume van de meetcel van de detector zo klein mogelijk worden gehouden. Het volume mag niet groter zijn dan 10 μl, behalve voor lichtverstrooiings- en viscositeitsdetectoren. Meestal wordt voor de detectie differentiële refractometrie gebruikt. Indien dit in verband met de specifieke eigenschappen van het monster of de elutievloeistof nodig is, kunnen echter ook andere soorten detectors worden gebruikt, zoals UV/VIS, IR of viscositeitsdetectoren.
2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
Voor de gedetailleerde beoordelingscriteria en voor de eisen ten aanzien van het verzamelen en bewerken van de gegevens wordt verwezen naar de DIN-norm (1).
Voor elk monster moeten twee onafhankelijke experimenten worden uitgevoerd die los van elkaar moeten worden geanalyseerd. Het is van essentieel belang dat in alle gevallen onder dezelfde omstandigheden als de bepaling bij het monster ook een blancobepaling wordt uitgevoerd.
Er moet expliciet worden vermeld dat de gemeten waarden relatief zijn en worden uitgedrukt in equivalent-molecuulgewicht van de gebruikte standaard.
Na de bepaling van de retentievolumes of de retentietijden (eventueel gecorrigeerd met behulp van een interne standaard) wordt de logaritmische waarde van M (waarbij M de top van de piek van de kalibratiestandaard is) tegen een van deze grootheden uitgezet. Per log-interval zijn minimaal twee kalibratiepunten nodig en voor de curve als geheel minimaal vijf meetpunten. Het geraamde molecuulgewicht van het monster moet tussen het eerste en het laatste meetpunt liggen. Voor de bepaling van het laagste molecuulgewicht van de kalibratiecurve wordt een oplossing van n-hexylbenzeen of een andere geschikte apolaire stof gebruikt. Het gedeelte van de curve dat overeenkomt met molecuul-gewichten lager dan 1 000 wordt indien nodig gecorrigeerd voor verontreinigingen en additieven. De evaluatie van de elutiecurves gebeurt meestal met behulp van elektronische gegevensverwerking. Wanneer de digitalisering met de hand gebeurt, kan ASTM D 3536-91 (3) worden geraadpleegd.
Als er onoplosbaar polymeer op de kolom achterblijft, zal dit waarschijnlijk een hoger molecuulgewicht hebben dan de opgeloste fractie en als daar geen rekening mee wordt gehouden, zou het gehalte aan laagmoleculaire bestanddelen waarschijnlijk te hoog uitvallen. In de bijlage worden richtsnoeren gegeven om het gehalte aan laagmoleculaire bestanddelen te corrigeren voor de aanwezigheid van onoplosbaar polymeer.
De verdelingskromme moet in de vorm van een tabel of als figuur (al dan niet cumulatieve frequentieverdeling tegen log M) worden verstrekt. Bij de grafische weergave moet één log-interval van het molecuulgewicht normaal gesproken ongeveer 4 cm breed zijn en moet de top van de piek ongeveer 8 cm hoog zijn. Bij een cumulatieve frequentieverdeling moet het verschil op de y-as tussen 0 en 100 % ongeveer 10 cm zijn.
2.2. TESTVERSLAG
Het testverslag moet de volgende informatie bevatten:
2.2.1. Onderzochte stof:
|
— |
beschikbare informatie over de onderzochte stof (identiteit, additieven, verontreinigingen); |
|
— |
beschrijving van de behandeling van het monster, opmerkingen, problemen. |
2.2.2. Apparatuur:
|
— |
elutievloeistofreservoir, inert gas, ontgassing van de elutievloeistof, samenstelling van de elutievloeistof, verontreinigingen; |
|
— |
pomp, pulsdemper, injectiesysteem; |
|
— |
scheidingskolommen (fabrikant, alle informatie over de kenmerken van de kolommen zoals poriegrootte en aard van het pakkingsmateriaal, aantal, lengte en volgorde van de gebruikte kolommen); |
|
— |
aantal theoretische schotels van de kolom (of de combinatie), scheidend vermogen (resolutie van het systeem); |
|
— |
informatie over de symmetrie van de pieken; |
|
— |
kolomtemperatuur, aard van de temperatuurregeling; |
|
— |
detector (meetprincipe, type, volume van de meetcel); |
|
— |
stromingsmeter, indien gebruikt (fabrikant, meetprincipe); |
|
— |
systeem voor gegevensregistratie en -verwerking (hardware en software). |
2.2.3. Kalibratie van het systeem:
|
— |
gedetailleerde beschrijving van de methode die wordt gebruikt om de kalibratiecurve samen te stellen; |
|
— |
informatie over de kwaliteitscriteria voor deze methode (bijvoorbeeld correlatiecoëfficiënt of som van de kwadraten); |
|
— |
informatie over alle extrapolaties, veronderstellingen en benaderingen tijdens de experimentele procedure en de beoordeling en verwerking van gegevens; |
|
— |
alle metingen die voor de samenstelling van de kalibratiecurve worden gebruikt, moeten in een tabel worden opgenomen waarbij voor elk kalibratiepunt de volgende informatie moet worden vermeld:
|
2.2.4. Informatie over het gehalte aan laagmoleculaire bestanddelen:
|
— |
beschrijving van de bij de analyse gebruikte methoden en de wijze waarop de experimenten zijn uitgevoerd; |
|
— |
informatie over het gehalte aan laagmoleculaire bestanddelen (als gewichtspercentage van het totale monster); |
|
— |
informatie over het gehalte aan verontreinigingen, additieven en andere niet-polymeerbestanddelen (als gewichtspercentage van het totale monster). |
2.2.5. Evaluatie:
|
— |
evaluatie op basis van tijd: alle methoden die worden gebruikt om de vereiste reproduceerbaarheid te waarborgen (correctiemethode, interne standaard enz.); |
|
— |
informatie over de keuze voor elutievolume of retentietijd als basis voor de evaluatie; |
|
— |
informatie over de grenzen van de evaluatie als een piek niet volledig wordt geanalyseerd; |
|
— |
beschrijving van afvlakmethoden indien deze zijn gebruikt; |
|
— |
procedures voor de bereiding en voorbehandeling van het monster; |
|
— |
eventuele aanwezigheid van onopgeloste deeltjes; |
|
— |
geïnjecteerd volume (μl) en concentratie daarin (mg/ml); |
|
— |
bespreking van effecten die tot afwijkingen van het ideale GPC-profiel leiden; |
|
— |
gedetailleerde beschrijving van alle wijzigingen in de testprocedures; |
|
— |
gedetailleerde informatie over de foutintervallen; |
|
— |
alle andere informatie en opmerkingen die relevant zijn voor de interpretatie van de resultaten. |
3. REFERENTIES
|
(1) |
DIN 55672 (1995). Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1. |
|
(2) |
Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography — GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polysryrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Aanhangsel
Richtsnoeren om het gehalte aan laagmoleculaire bestanddelen te corrigeren voor de aanwezigheid van onoplosbaar polymeer
Wanneer een monster onoplosbaar polymeer bevat, gaat tijdens de GPC-analyse massa verloren. Het onoplosbare polymeer blijft irreversibel op de kolom of het monsterfilter achter, terwijl het oplosbare gedeelte van het monster door de kolom loopt. Wanneer de stijging van de brekingsindex (dn/dc) van het polymeer kan worden geschat of gemeten, kan de massa van de hoeveelheid monster die op de kolom verloren is gegaan, worden geschat. In dat geval wordt de correctie bepaald met behulp van een externe kalibratie met standaardmaterialen met een bekende concentratie en dn/dc om de respons van de refractometer te kalibreren. In het hier gegeven voorbeeld wordt een PMM-standaard (polymethylmethacrylaat) gebruikt.
Bij de externe kalibratie voor de analyse van acrylpolymeren wordt een PMM-standaard met een bekende concentratie in tetrahydrofuraan met behulp van GPC geanalyseerd en worden de resultaten gebruikt voor de bepaling van de refractometerconstante volgens de volgende vergelijking:
K = R/(C × V × dn/dc)
waarbij
|
K |
= |
de refractometerconstante (in microvoltseconde/ml); |
|
R |
= |
de respons van de PMM-standaard (in microvoltseconde); |
|
C |
= |
de concentratie van de PMM-standaard (in mg/ml); |
|
V |
= |
het geïnjecteerde volume (in ml); |
|
dn/dc |
= |
de stijging van de brekingsindex voor PMM in tetrahydrofuraan (in ml/mg). |
Normale waarden voor een PMM-standaard zijn:
|
R |
= |
2 937 891; |
|
C |
= |
1,07 mg/ml; |
|
V |
= |
0,1 ml; |
|
dn/dc |
= |
9 × 10-5 ml/mg. |
Met de aldus berekende waarde van K (3,05 × 1011) wordt vervolgens de theoretische respons van de detector berekend als het geïnjecteerde polymeer voor 100 % via de detector zou zijn geëlueerd.
A.20. OPLOS/EXTRACTIEGEDRAG VAN POLYMEREN IN WATER
1. METHODE
De hier beschreven methode is overgenomen van de herziene versie van TG 120 van de OESO (1997). Voor nadere technische informatie wordt verwezen naar referentie (1).
1.1. INLEIDING
Voor bepaalde polymeren (bijvoorbeeld emulsiepolymeren) moeten eerst voorbereidende werkzaamheden worden uitgevoerd voordat de hier beschreven methode kan worden toegepast. De methode kan niet worden gebruikt voor vloeibare polymeren en voor polymeren die onder de testomstandigheden met water reageren.
Wanneer de methode niet geschikt of niet bruikbaar is, kan het oplos/extractiegedrag met behulp van andere methoden worden onderzocht. In dat geval moet een gedetailleerde beschrijving van en een volledige motivering voor de gebruikte methode worden gegeven.
1.2. REFERENTIESTOFFEN
Geen.
1.3. PRINCIPE VAN DE TESTMETHODE
Het oplos/extractiegedrag van polymeren in waterig milieu wordt bepaald met behulp van de kolfmethode (zie methode A.6: Oplosbaarheid in water, methode met de kolf) waarin onderstaande wijzigingen worden aangebracht.
1.4. KWALITEITSCRITERIA
Geen.
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Apparatuur
Voor deze methode is de volgende apparatuur nodig:
|
— |
een vergruizer, bijvoorbeeld een maalapparaat, om deeltjes met een bekende grootte te vervaardigen; |
|
— |
een schudapparaat met regelbare temperatuur; |
|
— |
een membraanfiltersysteem; |
|
— |
adequate analyseapparatuur; |
|
— |
gestandaardiseerde zeven. |
1.5.2. Monstervoorbereiding
Een representatief monster moet eerst worden vergruisd tot deeltjes met een grootte van 0,125 tot 0,25 mm (gebruik hierbij geschikte zeven). Voor de stabiliteit van het monster of voor het maalprocedé kan koeling nodig zijn. Rubberachtige materialen kunnen bij de temperatuur van vloeibare stikstof worden vergruisd (1).
Als het niet mogelijk is een fractie met de vereiste deeltjesgrootte te verkrijgen, moet worden getracht de deeltjesgrootte zoveel mogelijk te verlagen en moet het resultaat in het verslag worden vermeld. Tevens moet in het verslag worden vermeld hoe het vergruisde monster voor de test is bewaard.
1.5.3. Procedure
In drie kolven met een glazenstop wordt telkens 10 g van de te onderzoeken stof afgewogen. Vervolgens wordt aan elke kolf 1 000 ml water toegevoegd. Indien het niet mogelijk blijkt met een hoeveelheid van 10 g polymeer te werken, moet de eerst hogere hoeveelheid worden gebruikt waarmee wel kan worden gewerkt en moet de hoeveelheid water dienovereenkomstig worden aangepast.
De kolven worden goed afgesloten en vervolgens bij 20 oC geschud. Hiervoor wordt een schuld- of roermachine gebruikt waarmee bij constante temperatuur kan worden gewerkt. Na 24 uur wordt de inhoud van elke kolf gecentrifugeerd of gefiltreerd en wordt de polymeerconcentratie in de heldere waterige fase met behulp van een geschikte analysemethode bepaald. Indien er geen geschikte analysemethoden voor de waterige fase beschikbaar zijn, kan de totale oplosbaarheid/extraheerbaarheid op basis van het drooggewicht van het residu op het filter of het gecentrifugeerde neerslag worden bepaald.
Meestal moet bij de kwantitatieve bepaling onderscheid worden gemaakt tussen de verontreinigingen en additieven enerzijds en het polymeer met een laag molecuulgewicht anderzijds. Bij een gravimetrische bepaling is het ook belangrijk dat er een blancobepaling zonder te onderzoeken stof wordt uitgevoerd om rekening te kunnen houden met residuen ten gevolge van de experimentele procedure.
Het oplos/extractiegedrag van polymeren in water bij 37 oC bij pH 2 en pH 9 kan op dezelfde wijze worden bepaald zoals beschreven voor de uitvoering van het experiment bij 20 oC. De pH kan worden aangepast door de toevoeging van geschikte bufferoplossingen of zuren of basen als zoutzuur, azijnzuur, natrium- of kahumhydroxide (p.a.) of NH3.
Afhankelijk van de gebruikte analysemethode moet de test een- of tweemaal worden uitgevoerd. Wanneer voldoende specifieke methoden beschikbaar zijn voor een directe analyse van de polymeercomponent in de waterige fase, moet één in het voorgaande beschreven test voldoende zijn. Wanneer dergelijke methoden echter niet beschikbaar zijn en het oplos/extractiegedrag van de polymeer uitsluitend wordt bepaald via een indirecte analyse waarbij alleen het totale gehalte aan organische koolstof (TOC) van het waterig extract wordt bepaald, moet de test tweemaal worden uitgevoerd. Deze tweede test moet ook in triplo gebeuren met polymeermonsters die tien keer zo klein zijn als bij de eerste test en dezelfde hoeveelheden water.
1.5.4. Analyse
1.5.4.1. Met één monsterhoeveelheid uitgevoerde test
Het is mogelijk dat er methoden beschikbaar zijn voor een directe analyse van de polymeercomponent in de waterige fase. Als dit niet het geval is, kan worden overwogen een indirecte analyse van opgeloste/geëxtraheerde polymeercomponenten uit te voeren, waarbij het totale gehalte aan oplosbaar materiaal wordt bepaald en wordt gecorrigeerd voor componenten die niet polymeerspecifiek zijn.
Een analyse van de totale hoeveelheid polymeer in de waterige fase is mogelijk:
met behulp van een voldoende gevoelige methode zoals:
|
— |
TOC met ontleding door persulfaat of dichromaat tot CO2, gevolgd door bepaling met behulp van IR of chemische analyse; |
|
— |
atoomabsorptiespectrometrie (AAS) of emissiespectrometrie met inductief gekoppeld plasma (ICP) voor polymeren die silicium of metaal bevatten; |
|
— |
Uv-absorptie of spectrofluorimetrie voor arylpolymeren, |
|
— |
LC/MS voor monsters met een laag molecuulgewicht; |
door vacuümverdampmg van het waterig extract en analyse van het droge residu met behulp van spectroscopie (bijvoorbeeld IR of uv) of AAS/ICP.
Als een analyse van de waterige fase als zodanig niet uitvoerbaar is, moet het waterige extract worden geëxtraheerd met een niet met water mengbaar organisch oplosmiddel, bijvoorbeeld een gechloreerde koolwaterstof. Vervolgens wordt het oplosmiddel verdampt en wordt het polymeergehalte van het residu volgens een van bovenstaande analysemethoden bepaald. Om de mate van oplossing/extractie van het polymeer zelf te bepalen, moeten componenten van dit residu waarvan wordt vastgesteld dat ze verontreinigingen of additieven zijn, in mindering worden gebracht.
Wanneer betrekkelijk grote hoeveelheden van dergelijke materialen aanwezig zijn, kan het nodig zijn het residu met behulp van bijvoorbeeld HPLC of GC te analyseren om onderscheid te maken tussen de verontreinigingen en het monomeer en van het monomeer afgeleide stoffen zodat het werkelijke gehalte aan laatstgenoemde stoffen kan worden bepaald.
In sommige gevallen kan het voldoende zijn het organische oplosmiddel te verdampen en het droge residu te wegen.
1.5.4.2. Met twee verschillende monsterhoeveelheden uitgevoerde test
Alle waterige extracten worden op TOC geanalyseerd.
Bij het niet-opgeloste/niet-geëxtraheerde deel van het monster wordt een gravimetrische bepaling uitgevoerd. Als na centrifugeren of filtreren van de inhoud van de kolf polymeerresten op de rand van de kolf zijn achtergebleven, moet de kolf met het filtraat worden gespoeld totdat alle zichtbare resten zijn verdwenen. Vervolgens wordt het filtraat opnieuw gecentrifugeerd of gefiltreerd. De op de filter of in de centrifugebuis achtergebleven residuen worden bij 40 oC onder vacuüm gedroogd tot constant gewicht en vervolgens gewogen.
2. GEGEVENS
2.1. MET ÉÉN MONSTERHOEVEELHEID UITGEVOERDE TEST
De aparte resultaten voor de drie kolven en de gemiddelde waarden moeten worden vermeld, uitgedrukt in massa-eenheden per volume oplossing (meestal mg/l) of massa-eenheden per massa polymeermonster (meestal mg/g). Daarnaast moet het gewichtsverlies van het monster worden vermeld (berekend als het gewicht van de opgeloste stof gedeeld door het gewicht van het oorspronkelijke monster). Bovendien moet de relatieve standaardafwijking worden berekend. Deze gegevens moeten worden vermeld voor de stof als geheel (polymeer + essentiële additieven enz.) en voor het zuivere polymeer (d.w.z. nadat de bijdrage van dergelijke additieven is afgetrokken).
2.2. MET TWEE VERSCHILLENDE MONSTERHOEVEELHEDEN UITGEVOERDE TEST
Voor elk waterig extract van de twee in triplo uitgevoerde experimenten dient de TOC-waarde te worden vermeld en daarnaast de gemiddelde waarde voor elk experiment. Deze gegevens dienen te worden uitgedrukt in massa-eenheden per volume oplossing (meestal mg C/l) en massa-eenheden per gewicht van het oorspronkelijke monster (meestal mgC/g).
Als er geen verschil is tussen de resultaten met de hoge en de lage monster/waterverhouding, kan dit erop wijzen dat alle extraheerbare componenten inderdaad zijn geëxtraheerd. In dat geval zou een directe analyse normaal gesproken niet nodig zijn.
Voor elk residu moet het gewicht worden vermeld en worden uitgedrukt als percentage van het oorspronkelijke gewicht van het monster. Per experiment dient het gemiddelde te worden berekend. Het percentage oplosbaar en extraheerbaar materiaal in het oorspronkelijke monster wordt berekend door het gevonden percentage van 100 % af te trekken.
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
3.1.1. Onderzochte stof:
|
— |
beschikbare informatie over de onderzochte stof (identiteit, additieven, verontreinigingen, gehalte aan laagmoleculaire bestanddelen). |
3.1.2. Testomstandigheden:
|
— |
beschrijving van de gevolgde procedures en de testomstandigheden; |
|
— |
beschrijving van de analyse- en detectiemethoden. |
3.1.3. Resultaten
|
— |
de oplosbaarheid/extraheerbaarheid in mg/l; aparte resultaten bij de verschillende oplossingen en gemiddelde waarden, gesplitst in polymeergehalte en verontreinigingen, additieven enz.; |
|
— |
oplosbaarheid/extraheerbaarheid in mg/g polymeer; |
|
— |
TOC-waarden van de waterige extracten, gewicht van de opgeloste stof en berekende percentages, indien gemeten; |
|
— |
de pH van elk monster; |
|
— |
informatie over de blancobepalingen; |
|
— |
indien nodig gegevens over de chemische instabiliteit van de onderzochte stof, zowel tijdens de testprocedure als tijdens de analyse; |
|
— |
alle informatie die voor de interpretatie van de resultaten van belang is. |
4. REFERENTIE
|
(1) |
DIN 53733 (1976), Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke. |
A.21. OXIDERENDE EIGENSCHAPPEN (VLOEISTOFFEN)
1. METHODE
1.1. INLEIDING
Deze testmethode is bedoeld om te meten in hoeverre een vloeistof de verbrandingssnelheid of verbrandingsintensiteit van een brandbare stof kan verhogen of met een brandbare stof een mengsel kan vormen dat spontaan ontbrandt wanneer beide stoffen grondig worden gemengd. De test is gebaseerd op de test voor oxiderende vloeistoffen van de VN (1) en is hieraan gelijkwaardig. Aangezien deze methode A.21 echter in de eerste plaats is bedoeld om te voldoen aan de vereisten van Verordening (EG) nr. 1907/2006, is slechts een vergelijking met één referentiestof vereist. Testen en vergelijken met bijkomende referentiestoffen kan nodig zijn wanneer het waarschijnlijk is dat de testresultaten voor andere doeleinden worden gebruikt (9).
Deze test hoeft niet te worden uitgevoerd wanneer op grond van de structuurformule met afdoende zekerheid kan worden vastgesteld dat de stof niet exotherm kan reageren met een brandbare stof.
Het is nuttig om, voordat deze test wordt uitgevoerd, te beschikken over gegevens over de mogelijke explosieve eigenschappen van de te onderzoeken stof.
Deze test is niet toepasbaar op vaste stoffen, gassen, explosieve of licht ontvlambare stoffen of organische peroxiden.
Deze test hoeft eventueel niet te worden uitgevoerd wanneer voor de te onderzoeken stof al resultaten beschikbaar zijn van de test voor oxiderende vloeistoffen van de VN (1).
1.2. DEFINITIES EN EEN HEDEN
Gemiddelde stijgtijd van de druk: het gemiddelde van de gemeten tijden waarin een mengsel tijdens de test een drukstijging veroorzaakt van 690 kPa tot 2 070 kPa boven de atmosferische druk.
1.3. REFERENTIESTOF
Als referentiestof wordt een waterige oplossing van 65 gewichtsprocent salpeterzuur (analytisch zuiver) gebruikt (10).
Wanneer de experimentator verwacht dat de testresultaten wellicht voor andere doeleinden worden gebruikt (9), kan het wenselijk zijn de test met bijkomende referentiestoffen uit te voeren (11).
1.4. PRINCIPE VAN DE TESTMETHODE
De testvloeistof wordt in een massaverhouding van 1:1 met cellulosevezel gemengd en in een drukvat gebracht. Indien tijdens het mengen of vullen spontane ontbranding optreedt, is verder testen niet nodig.
Indien geen spontane ontbranding optreedt, wordt de volledige test uitgevoerd. Het mengsel wordt in een drukvat verwarmd en de gemiddelde tijd waarin de druk stijgt van 690 kPa tot 2 070 kPa boven de atmosferische druk, wordt gemeten. Deze tijd wordt vergeleken met de gemiddelde stijgtijd voor de druk voor het 1:1-mengsel van de referentiestof(fen) en cellulose.
1.5. KWALITEITSCRITERIA
In een reeks van vijf proeven met dezelfde stof mag geen van de resultaten meer dan 30 % afwijken van het rekenkundige gemiddelde. Resultaten die meer dan 30 % van het gemiddelde afwijken, moeten worden verworpen, de meng- en vulprocedure moet worden verbeterd en de test moet worden herhaald.
1.6. BESCHRIJVING VAN DE METHODE
1.6.1. Voorbereiding
1.6.1.1. Brandbare stof
Als brandbare stof wordt droge cellulose met een vezellengte tussen 50 en 250 μm en een gemiddelde diameter van 25 μm gebruikt (12). Dit wordt gedurende 4 uur in een laag van ten hoogste 25 mm dik bij 105 oC gedroogd tot constant gewicht en in een exsiccator met droogmiddel bewaard totdat de vezel is afgekoeld en wordt gebruikt. Het watergehalte van de gedroogde cellulose moet minder zijn dan 0,5 % van de droge massa (13). Zo nodig dient de droogtijd te worden verlengd tot deze waarde is bereikt (13). Gedurende de hele test wordt een en dezelfde batch cellulose gebruikt (14).
1.6.1.2. Apparatuur
1.6.1.2.1.
Voor de test wordt gebruik gemaakt van een drukvat. Dit is een cilindrisch stalen drukvat met een lengte van 89 mm en een uitwendige diameter van 60 mm (zie figuur 1). De cilinder wordt zo bewerkt dat aan de buitenkant recht tegenover elkaar twee vlakke zijden ontstaan (waardoor de doorsnede van het vat wordt gereduceerd tot 50 mm) zodat de cilinder gemakkelijker kan worden gemanipuleerd wanneer de ontstekingsplug en ontluchtingsplug worden aangebracht. Het vat, dat een inwendige diameter van 20 mm heeft, wordt aan beide uiteinden tot een diepte van 19 mm opgeruimd en voorzien van een schroefdraad voor 1 „British Standard Pipe (BSP) of het metrische equivalent daarvan. Op 35 mm van een van de uiteinden wordt op 90o van de vlakke oppervlakken in het gebogen oppervlak van het vat een zijbuis geschroefd om de druk op te nemen. Daarvoor wordt een 12 mm diep gat geboord dat wordt voorzien van schroefdraad voor de ½” BSP (of metrisch equivalent) schroefdraad op het uiteinde van de zijbuis. Zo nodig wordt een inerte pakking aangebracht om een gasdichte verbinding te bekomen. De zijbuis steekt 55 mm buiten het drukvat uit en heeft een inwendige diameter van 6 mm. Het uiteinde van de zijbuis wordt opgeruimd en voorzien van een schroefdraad voor een membraanmanometer. Elk type manometer mag worden gebruikt, op voorwaarde dat de manometer bestand is tegen de hete gassen of ontledingsproducten en kan reageren op een drukstijging van 690-2 070 kPa in maximaal 5 ms.
Het uiteinde van het drukvat dat het verst verwijderd is van de zijbuis, wordt afgesloten met een ontstekingsplug met twee elektrodes, de ene geïsoleerd van de plug, de andere via de plug met de massa verbonden. Het andere uiteinde van het drukvat wordt afgesloten met een breekplaat (barstdruk ongeveer 2 200 kPa) die op zijn plaats wordt gehouden met een bevestigingsplug met een inwendige diameter van 20 mm. Zo nodig wordt voor de ontstekingsplug een inerte pakking gebruikt om een gasdichte verbinding te bekomen. Het drukvat wordt tijdens het gebruik in de juiste positie gehouden met een statief (figuur 2). Dit bestaat doorgaans uit een zachtstalen grondplaat van 235 mm × 184 mm × 6 mm en een 185 mm lange vierkante buis van 70 mm × 70 mm × 4 mm.
Van twee tegenover elkaar gelegen zijkanten van de vierkante buis wordt een deel verwijderd zodat een buis van 86 mm lengte overblijft die uitloopt in twee vlakke benen. De uiteinden van deze vlakke benen worden onder een hoek van 60o ten opzichte van de as van de buis afgekort en op de grondplaat gelast. Aan de bovenkant van de vierkante buis wordt in één zijkant een gleuf van 22 mm breed × 46 mm diep uitgefreesd, zodat de zijbuis in de gleuf valt wanneer het drukvat met de ontstekingsplug naar beneden in de vierkante buis wordt geplaatst. Op de onderste binnenzijde van de vierkante buis wordt een stuk staal van 30 mm breed en 6 mm dik gelast als afstandstuk. In de tegenoverliggende zijde worden twee 7 mm vleugelschroeven gedraaid om het drukvat stevig op zijn plaats te houden. Om het drukvat van onderen te steunen worden op de zijkanten die doorlopen naar de basis van het statief, twee stroken van 12 mm breed en 6 mm dik staal gelast.
1.6.1.2.2.
Het ontstekingssysteem bestaat uit een 25 cm lange Ni/Cr-draad met een diameter van 0,6 mm en een weerstand van 3,85 ohm/m. De draad wordt om een staaf met een diamater van 5 mm tot een spoel gewikkeld en met de elektrodes van de ontstekingsplug verbonden. De spoel moet een van de in figuur 3 afgebeelde configuraties hebben. De afstand tussen de bodem van het vat en de onderzijde van de ontstekingsspoel moet 20 mm bedragen. Wanneer de elektroden niet instelbaar zijn, moeten de einden van de ontstekingsdraad tussen de spoel en de bodem van het vat met een keramische mantel worden geïsoleerd. De draad wordt verhit met een voeding die een constante stroom van ten minste 10 A kan leveren.
1.6.2. Uitvoering van de test (15)
Het toestel wordt met manometer en verhittingssysteem, maar zonder de breekplaat, met de ontstekingsplug naar beneden neergezet. In een glazen beker worden met een glazen roerstaaf 2,5 g testvloeistof en 2,5 g gedroogde cellulose gemengd (16). Om veiligheidsredenen moet tijdens het mengen een veiligheidsschild tussen de experimentator en het mengsel zijn geplaatst. Indien het mengsel tot ontbranding komt tijdens het mengen of vullen, zijn geen verdere tests nodig. Het mengsel wordt in kleine hoeveelheden tegelijk in het drukvat gegoten, terwijl tegen het drukvat wordt geklopt om ervoor te zorgen dat het mengsel de ruimte rond de ontstekingsspoel vult en daarmee goed contact maakt. Het is belangrijk dat de spoel tijdens het vullen niet verbuigt, aangezien dit tot foutieve resultaten kan leiden (17). De breekplaat wordt op zijn plaats gebracht en de bevestigingsplug wordt stevig vastgeschroefd. Het gevulde drukvat wordt met de breekplaat naar boven in het statief geplaatst. De gehele opstelling moet zich in een geschikte gewapende afzuigkast of ontstekingskast bevinden. De voeding wordt aangesloten op de uitwendige aansluitingen van de ontstekingsplug. De stroomsterkte bedraagt 10 A. De tijd tussen het begin van het mengen en het inschakelen van de voeding mag niet langer zijn dan tien minuten.
Het signaal van de manometer wordt geregistreerd met een systeem waarmee het drukverloop kan worden geanalyseerd en continu kan worden geregistreerd (bijv. een transiëntrecorder gekoppeld aan een papierschrijver). Het mengsel wordt verwarmd tot de breekplaat breekt of totdat ten minste 60 seconden zijn verstreken. Als de breekplaat niet breekt, moet het mengsel afkoelen voordat het toestel voorzichtig wordt geopend, waarbij de nodige voorzorgen worden getroffen voor het geval een plotselinge drukstijging optreedt. Er worden vijf proeven uitgevoerd met de teststof en de referentiestof(fen). De tijd waarin de druk stijgt van 690 kPa tot 2 070 kPa boven de atmosferische druk, wordt genoteerd. Vervolgens wordt de gemiddelde stijgtijd van de druk berekend.
In sommige gevallen kunnen stoffen een (te hoge of te lage) drukstijging veroorzaken als gevolg van chemische reacties die niet relevant zijn voor de oxiderende eigenschappen van de stof. In die gevallen kan het nodig zijn de test te herhalen met een inerte stof, bijvoorbeeld diatomiet (kieselgoehr), in plaats van cellulose, om het karakter van de reactie te bepalen.
2. GEGEVENS
Stijgtijd voor de teststof en voor de referentiestof(fen). Stijgtijd voor de tests met een inerte stof, indien uitgevoerd.
2.1. VERWERKING VAN DE RESULTATEN
De gemiddelde stijgtijden van de druk voor de teststof en de referentiestof(fen) worden berekend.
De gemiddelde stijgtijd voor de tests met een inerte stof (indien uitgevoerd) wordt berekend.
Tabel 1 bevat enkele voorbeelden van resultaten
Tabel 1
Voorbeelden van resultaten (18)
|
Stof (19) |
Gemiddelde stijgtijd voor een 1:1 mengsel met cellulose (ms) |
|
Ammoniumdichromaat, verzadigde waterige oplossing |
20 800 |
|
Calciumnitraat, verzadigde waterige oplossing |
6 700 |
|
IJzer(III)nitraat, verzadigde waterige oplossing |
4 133 |
|
Lithiumperchloraat, verzadigde waterige oplossing |
1 686 |
|
Magnesiumperchloraat, verzadigde waterige oplossing |
777 |
|
Nikkelnitraat, verzadigde waterige oplossing |
6 250 |
|
Salpeterzuur, 65 % |
4 767 (20) |
|
Perchloorzuur, 50 % |
|
|
Perchloorzuur, 55 % |
59 |
|
Kaliumnitraat, 30 % waterige oplossing |
26 690 |
|
Zilvernitraat, verzadigde waterige oplossing |
|
|
Natriumchloraat, 40 % waterige oplossing |
2 555 (20) |
|
Natriumnitraat, 45 % waterige oplossing |
4 133 |
|
Inerte stof |
|
|
Water:cellulose |
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten de volgende gegevens worden opgenomen:
|
— |
identiteit, samenstelling, zuiverheid enz. van de teststof; |
|
— |
concentratie van de teststof; |
|
— |
procedure voor het drogen van de cellulose; |
|
— |
watergehalte van de gebruikte cellulose; |
|
— |
de meetresultaten; |
|
— |
eventuele resultaten van tests met een inerte stof; |
|
— |
berekende gemiddelde stijgtijden van de druk; |
|
— |
eventuele afwijkingen van deze methoden en redenen daarvoor; |
|
— |
alle verdere informatie of opmerkingen die van belang zijn voor de interpretatie van de resultaten. |
3.2. INTERPRETATIE VAN DE RESULTATEN (22)
De testresultaten worden beoordeeld op grond van:
|
a) |
de vraag of het mengsel van teststof en cellulose spontaan ontbrand; en |
|
b) |
een vergelijking van de gemiddelde stijgtijd voor de druk van 690 KPa naar 2 070 kPa met die voor de referentiestof(fen). |
Een vloeistof wordt aangemerkt als een oxiderende stof wanneer:
|
a) |
een mengsel in een 1:1 massaverhouding van de stof en cellulose spontaan ontbrand, of |
|
b) |
een mengsel in een massaverhouding van 1:1 van de stof en cellulose een gemiddelde stijgtijd oplevert kleiner dan of gelijk aan de gemiddelde stijgtijd van de druk van een mengsel in een 1:1 massaverhouding van een waterige oplossing van 65 gewichtsprocent salpeterzuur en cellulose. |
Om vals-positieve resultaten te vermijden, moet bij de interpretatie van de resultaten zo nodig ook rekening worden gehouden met resultaten verkregen bij het testen van de stof gemengd met inert materiaal.
4. REFERENTIES
|
(1) |
Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, page 342. Test O.2: Test for oxidizing liquids. |
Figuur 1
Drukvat

Figuur 2
Statief

Figuur 3
Ontstekingssysteem
Opmerking: Beide ontstekingssystemen kunnen worden gebruikt.
(1) Afhankelijk van het type instrument en de graad van zuiverheid van de stof.
(2) Afhankelijk van het type instrument en de graad van zuiverheid van de stof.
(3) Afhankelijk van het type instrument en de graad van zuiverheid van de stof.
(4) Afhankelijk van het type instrument en de graad van zuiverheid van de stof.
(5) Deze nauwkeurigheid geldt alleen voor eenvoudige toestellen zoals bijvoorbeeld beschreven in ASTM D 1120-72; de nauwkeurigheid kan worden verbeterd met meer verfijnde versies van de ebullioscoop.
(6) Deze nauwkeurigheid geldt alleen voor zuivere stoffen. Het gebruik in andere omstandigheden moet verantwoord worden.
(7) Afhankelijk van de zuiverheidsgraad.
(8) Deze methode kan ook gebruikt worden in het bereik van 1 tot 10 Pa mits voorzichtigheid in acht wordt genomen.
(9) Bijvoorbeeld in het kader van de vervoersvoorschriften van de VN.
(10) Het zuur moet vóór de test worden getitreerd om de concentratie ervan te bevestigen.
(11) In referentie 1 wordt bijvoorbeeld gebruikgemaakt van 50 gewichtprocent perchloorzuur en 40 gewichtprocent natriumchloraat.
(12) Bijvoorbeeld Whatman Column Chromatographic Cellulose Powder CF 11, catalogue no 4021 050.
(13) Bevestigd met (bijvoorbeeld) Karl-Fisher titratie.
(14) Een andere mogelijkheid om dit watergehalte te bereiken is (bijv.) verhitting bij 105 oC onder vacuüm gedurende 24 uur.
(15) Mengsels van oxiderende stoffen en cellulose kunnen explosief zijn en moeten met de nodige voorzichtigheid worden behandeld.
(16) In de praktijk kan dit worden gedaan door een grotere hoeveelheid testvloeistof en cellulose te mengen in een verhouding 1:1 en vervolgens 5 ±0,1 g van het mengsel in het drukvat te brengen. Het mengsel moet voor elke proef vers worden bereid.
(17) Met name moet contact tussen opeenvolgende wikkelingen van de spoel worden vermeden.
(18) Zie referentie (1) voor indeling volgens de vervoersvoorschriften van de VN.
(19) Verzadigde oplossingen worden bij 20 oC bereid.
(20) Gemiddelde waarde van vergelijkende interlaboratoriumproeven.
(21) Maximumdruk van 2 070 kPa niet bereikt.
(22) Zie referentie 1 voor de interpretatie van de resultaten onder de vervoersvoorschriften van de VN met verschillende referentiestoffen.
DEEL B: METHODEN VOOR DE BEPALING VAN DE TOXICITEIT EN ANDERE INVLOEDEN OP DE GEZONDHEID
INHOUD
ALGEMENE INLEIDING
|
B.1 bis. |
ACUTE ORALE TOXICITEIT: PROCEDURE MET VASTE DOSES |
|
B.1 ter. |
ACUTE ORALE TOXICITEIT: METHODE TER BEPALING VAN DE ACUTE-TOXICITEITSKLASSE |
|
B.2. |
ACUTE INHALATIETOXICITEIT |
|
B.3. |
ACUTE DERMALE TOXICITEIT |
|
B.4. |
ACUTE TOXICITEIT: HUIDIRRITATIE/CORROSIE |
|
B.5. |
ACUTE TOXICITEIT: OOGIRRITATIE/CORROSIE |
|
B.6. |
SENSIBILISATIE VAN DE HUID |
|
B.7. |
TOXICITEIT (ORAAL) BIJ HERHAALDE TOEDIENING (28 DAGEN) |
|
B.8. |
TOXICITEIT (INHALATIE) BIJ HERHAALDE TOEDIENING (28 DAGEN) |
|
B.9. |
TOXICITEIT (DERMAAL) BIJ HERHAALDE TOEDIENING (28 DAGEN) |
|
B.10. |
MUTAGENITEIT — IN VITRO TEST OP CHROMOSOOMAFWIJKINGEN IN ZOOGDIERCELLEN |
|
B.11. |
MUTAGENITEIT — IN VIVO TEST OP CHROMOSOOMAFWIJKINGEN IN BEENMERGCELLEN VAN ZOOGDIEREN |
|
B.12. |
MUTAGENITEIT — IN VIVO MICRONUCLEUSTEST BIJ ERYTROCYTEN VAN ZOOGDIEREN |
|
B.13/14. |
MUTAGENITEIT: TERUGMUTATIETEST MET BACTERIËN |
|
B.15. |
MUTAGENITEITSONDERZOEK EN SCREENING OP CARCINOGENESE: GENMUTATIE-SACCHAROMYCES CEREVISIAE |
|
B.16. |
MITOTISCHE RECOMBINATIE — SACCHAROMYCES CEREVISIAE |
|
B.17. |
MUTAGENITEIT — IN VITRO GENMUTATIETEST MET ZOOGDIERCELLEN |
|
B.18. |
DNA-BESCHADIGING EN -HERSTEL — DNA-HERSTELSYNTHESE — ZOOGDIERCELLEN IN VITRO |
|
B.19. |
ZUSTERCHROMATIDEN-UITWISSELINGSTEST IN VITRO |
|
B.20. |
GESLACHTSGEBONDEN RECESSIEVE LETALITEITSTEST MET DROSOPHILA MELANOGASTER |
|
B.21. |
ZOOGDIERENCELTRANSFORMATIETEST IN VITRO |
|
B.22. |
ONDERZOEK NAAR DOMINANTE LETALE MUTATIES BIJ KNAAGDIEREN |
|
B.23. |
TEST OP CHROMOSOOMAFWUKINGEN IN SPERMATOGONIA VAN ZOOGDIEREN |
|
B.24. |
VLEKKENTEST BIJ MUIZEN |
|
B.25. |
ERFELIJKE TRANSLOCATIES BIJ DE MUIS |
|
B.26. |
SUBCHRONISCHE ORALE TOXICITEITSTEST: TOXICITEITSONDERZOEK (ORAAL) OP KNAAGDIEREN BIJ HERHAALDE TOEDIENING (90 DAGEN) |
|
B.27. |
SUBCHRONISCHE ORALE TOXICITEITSTEST: TOXICITEITSONDERZOEK (ORAAL) OP DIEREN ANDERS DAN KNAAGDIEREN BIJ HERHAALDE TOEDIENING (90 DAGEN) |
|
B.28. |
SUBCHRONISCHE DERMALE TOXICITEITSTEST: 90 DAGEN-TEST MET HERHAALDE DERMALE TOEDIENING AAN KNAAGDIERSOORTEN |
|
B.29. |
SUBCHRONISCHE INHALATIETOXICITEITSTEST: 90 DAGEN-TEST MET HERHAALDE INHALATOIRE TOEDIENING AAN KNAAGDIERSOORTEN |
|
B.30. |
CHRONISCHE TOXICITEITSTEST |
|
B.31. |
ONDERZOEK NAAR PRENATALE ONTWIKKELINGSTOXICITEIT |
|
B.32. |
CARCINOGENITEITSONDERZOEK |
|
B.33. |
GECOMBINEERDE CHRONISCHE TOXICITEIT/CARCINOGENITEITSTEST |
|
B.34. |
REPRODUCTIETOXICITEITSONDERZOEK OVER ÉÉN GENERATIE |
|
B.35. |
REPRODUCTIETOXICITEITSONDERZOEK OVER TWEE GENERATIES |
|
B.36. |
TOXICOKINETIEK |
|
B.37. |
VERTRAAGDE NEUROTOXICITEIT VAN ORGANISCHE FOSFORVERBINDINGEN NA ACUTE BLOOTSTELLING |
|
B.38. |
VERTRAAGDE NEUROTOXICITEIT VAN ORGANISCHE FOSFORVERBINDINGEN BIJ HERHAALDE TOEDIENING (28 DAGEN) |
|
B.39. |
IN VIVO TEST OP DNA-HERSTELSYNTHESE IN LEVERCELLEN VAN ZOOGDIEREN |
|
B.40. |
IN VITRO HUIDCORROSIE: TEST OP BASIS VAN DE TRANSCUTANE ELEKTRISCHE WEERSTAND (TEW) |
|
B.40 BIS. |
IN VITRO HUIDCORROSIE: TEST MET HUMAAN HUIDMODEL |
|
B.41. |
IN VITRO 3T3 NRU FOTOTOXICITEITSTEST |
|
B.42. |
HUIDSENSIBILISATIE: LOKALE LYMFKLIERTEST |
|
B.43. |
NEUROTOXICITEITSONDERZOEK BIJ KNAAGDIEREN |
|
B.44. |
ABSORPTIE DOOR DE HUID: IN VIVO METHODE |
|
B.45. |
ABSORPTIE DOOR DE HUID: IN VITRO METHODE |
ALGEMENE INLEIDING
A. KARAKTERISERING VAN DE TESTSTOF
De samenstelling van de teststof, met inbegrip van de voornaamste verontreinigingen, en de relevante fysisch-chemische eigenschappen, waaronder de stabiliteit, moeten vóór de aanvang van ieder toxiciteitsonderzoek bekend zijn.
De fysisch-chemische eigenschappen van de teststof leveren belangrijke informatie over de keuze van de manier van toedienen, de opzet van ieder afzonderlijk onderzoek en het hanteren en bewaren van de teststof.
Alvorens het onderzoek wordt aangevat, moet een analytische methode voor de kwalitatieve en kwantitatieve bepaling van de teststof (zo mogelijk met inbegrip van de voornaamste verontreinigingen) in het toedieningsmedium en in het biologisch materiaal ontwikkeld worden.
Alle gegevens met betrekking tot de identificatie, de fysisch-chemische eigenschappen, de zuiverheid en het gedrag van de teststof moeten in het onderzoeksrapport worden opgenomen.
B. VERZORGING VAN DE DIEREN
Bij toxiciteitstests zijn een stringente bewaking van de levensomstandigheden en een goede verzorging van de dieren een eerste vereiste.
i) Huisvesting
De leefomstandigheden in de kamers of ruimten waar de proefdieren zijn ondergebracht, moeten geschikt zijn voor het soort proefdier. Voor ratten, muizen en cavia's is een kamertemperatuur van 22 oC ± 3 oC en een relatieve luchtvochtigheid van 30-70 % geschikt; voor konijnen moet de temperatuur 20 oC + 3 oC en de relatieve luchtvochtigheid 30-70 % bedragen.
Sommige experimentele technieken zijn bijzonder gevoelig voor temperatuureffecten; in dergelijke gevallen wordt in de beschrijving van de onderzoekmethode nader ingegaan op de correcte proefomstandigheden. Bij ieder onderzoek naar toxische effecten moeten de temperatuur en de vochtigheidsgraad worden gecontroleerd, opgetekend en in het eindverslag van de studie worden opgenomen.
Er moet gebruik worden gemaakt van kunstlicht met afwisselend twaalf uur licht — twaalf uur duisternis. Nadere gegevens over de verlichting moeten worden opgetekend en in het eindverslag worden opgenomen.
Tenzij anders bij de methode vermeld, worden de dieren hetzij afzonderlijk, hetzij in kleine groepen van hetzelfde geslacht gehuisvest In het laatste geval mogen per kooi niet meer dan vijf dieren worden gehuisvest.
Het is belangrijk om in verslagen over dierproeven steeds te vermelden welk soort kooien is gebruikt en hoeveel dieren tijdens de blootstelling aan de chemische stof en tijdens latere waarnemingsperioden in iedere kooi waren gehuisvest.
ii) Voeding
Bij de samenstelling van het voedsel moet worden voldaan aan alle eisen die de proefdiersoorten aan hun voeding stellen. Indien chemische stoffen via de voeding aan de dieren worden toegediend, kan de voedingswaarde door interactie tussen de stof en een bestanddeel van de voeding verminderd worden. Bij het interpreteren van de resultaten dient rekening te worden gehouden met de mogelijkheid van dergelijke reacties. Er kan gebruik worden gemaakt van gebruikelijk laboratoriumvoeder met een onbeperkte hoeveelheid drinkwater. De keuze van het voedsel kan mede worden bepaald door de noodzaak de teststof, wanneer die via het voedsel wordt toegediend, op een passende wijze daarmee te vermengen.
Onzuiverheden in de voeding waarvan bekend is dat ze de toxiciteit beïnvloeden, mogen niet in werkzame concentraties voorkomen.
C. ALTERNATIEVE TESTEN
De Europese Unie maakt zich sterk voor het ontwikkelen en valideren van alternatieve technieken die dezelfde hoeveelheid informatie opleveren als de huidige dierproeven, maar waarbij minder proefdieren worden gebruikt, die minder lijden veroorzaken of die het gebruik van dieren volledig overbodig maken.
Naarmate dergelijke methoden ter beschikking komen, moet het gebruik ervan waar mogelijk worden overwogen voor de risicobeoordeling en de daaruit voortvloeiende classificatie en etikettering ten aanzien van de intrinsieke risico's.
D. EVALUATIE EN INTERPRETATIE
Bij de evaluatie en interpretatie van de testresultaten moet rekening worden gehouden met de beperkingen ten aanzien van de mate waarin de resultaten van dierproeven en in-vitro tests kunnen worden geëxtrapoleerd naar de mens. Daarom kunnen aanwijzingen voor schadelijke effecten bij de mens, indien beschikbaar, gebruikt worden als bevestiging van de testresultaten.
E. LITERATUUR
De meeste van deze methoden zijn ontwikkeld binnen het kader van het OESO-programma inzake richtsnoeren voor het testen; zij moeten worden toegepast overeenkomstig de beginselen van „goede laboratoriumpraktijken”, om zoveel mogelijk te komen tot „onderlinge acceptatie van gegevens”.
Verdere informatie kan worden gevonden in de referenties die te vinden zijn in de OESO-richtsnoeren en in relevante literatuur die elders is gepubliceerd.
B.l bis. ACUTE ORALE TOXICITEIT: PROCEDURE MET VASTE DOSES
1. METHODE
Deze methode is gelijkwaardig aan TG 420 (2001) van de OESO.
1.1. INLEIDING
Bij klassieke methoden voor de bepaling van de acute toxiciteit wordt de dood van dieren als eindpunt gebruikt. In 1984 is door de British Toxicology Society een nieuwe aanpak voor acute toxiciteitstests voorgesteld op basis van de toediening van een reeks vaste doses (1). Deze aanpak gebruikt niet meer de dood van dieren als eindpunt, maar berust op de observatie van duidelijke toxiciteitsverschijnselen bij één van een reeks vaste doses. Na in-vivo valideringsonderzoek in het VK (2) en in internationaal verband (3) is deze procedure in 1992 als testmethode goedgekeurd. Vervolgens zijn de statistische eigenschappen van de procedure met vaste doses bij een reeks onderzoeken met behulp van mathematische modellen geëvalueerd (4)(5)(6). Met de combinatie van in-vivo-onderzoek en modellen is aangetoond dat de procedure reproduceerbaar is, minder dieren gebruikt en minder leed veroorzaakt dan de klassieke methoden en stoffen op een vergelijkbare wijze kan rangschikken als de andere testmethoden voor acute toxiciteit.
Richtsnoeren voor de keuze van de meest geschikte testmethode voor een bepaald doel worden gegeven in de leidraad voor tests op acute orale toxiciteit (7). Deze leidraad bevat ook aanvullende informatie over de uitvoering en interpretatie van testmethode B.l bis.
De methode heeft als beginsel dat bij het hoofdonderzoek slechts beperkt toxische doses worden gebruikt en dat de toediening van doses waarvan wordt verwacht dat ze dodelijk zijn, moet worden vermeden. Ook doses waarvan bekend is dat ze door een bijtende of sterk irriterende werking hevige pijn en leed veroorzaken, behoeven niet te worden toegediend. Stervende dieren of dieren die duidelijk pijn hebben of tekenen van hevig en voortdurend leed vertonen, worden op humane wijze gedood en worden bij de interpretatie van de testresultaten op dezelfde manier behandeld als dieren die tijdens de test gestorven zijn. Er is een aparte leidraad met criteria om te bepalen of stervende of hevig lijdende dieren moeten worden gedood en richtsnoeren om voorspelbare of ophanden zijnde sterfte te herkennen (8).
De methode levert informatie over de gevaarlijke eigenschappen op en maakt het mogelijk de stof te rangschikken en in te delen aan de hand van het „Globally Harmonised System” (GHS) voor de indeling van chemische stoffen die acute toxiciteit veroorzaken (9).
Het testlaboratorium moet vóór de uitvoering van het onderzoek alle beschikbare informatie over de teststof in overweging nemen. Hierbij gaat het om informatie als de identiteit en de chemische structuur van de stof, de fysisch-chemische eigenschappen, de resultaten van andere met de stof uitgevoerde toxiciteitstests in vivo of in vitro, toxicologische gegevens over qua structuur verwante stoffen en de voorgenomen toepassing(en) van de stof. Deze informatie is nodig om alle betrokkenen ervan te overtuigen dat de test relevant is voor de bescherming van de gezondheid van de mens en helpt tevens bij de keuze van een geschikte aanvangsdosis.
1.2. DEFINITIES
Acute orale toxiciteit: de schadelijke effecten die zich voordoen na orale toediening van één dosis van een stof of verschillende doses die binnen 24 uur worden toegediend.
Vertraagde sterfte: houdt in dat een dier niet binnen 48 uur sterft of stervende is maar later gedurende de observatieperiode van 14 dagen sterft.
Dosis: de toegediende hoeveelheid teststof. De dosis wordt uitgedrukt als gewicht van de teststof per gewichtseenheid van het proefdier (bijvoorbeeld mg/kg).
Manifeste toxiciteit: een algemene term die zodanige duidelijke toxiciteitsverschijnselen na de toediening van de teststof beschrijft (zie (3) voor voorbeelden), dat bij de eerstvolgende vaste dosis hevige pijn en blijvende verschijnselen van ernstig leed, stervende dieren (zie de leidraad voor humane eindpunten (8) voor criteria) of waarschijnlijke sterfte bij de meeste dieren kunnen worden verwacht.
GHS: het „Globally Harmonised Classification System” voor chemische stoffen en mengsels. Een samenwerkingsproject van de OESO (gezondheid van de mens en milieu), het Comité van deskundigen voor het vervoer van gevaarlijke goederen van de VN (fysisch-chemische eigenschappen) en de ILO (communicatie van gevaren) dat wordt gecoördineerd door het Gezamenlijk programma voor een verantwoord beheer van chemische stoffen (IOMC).
Ophanden zijnde sterfte: wanneer vóór het eerstvolgende geplande observatietijdstip een stervende toestand of sterfte wordt verwacht. Voorbeelden van indicaties voor deze toestand bij knaagdieren zijn convulsies, zijligging, liggende positie en tremors (zie de leidraad voor humane eindpunten (8) voor meer bijzonderheden).
LD 50 (mediaan van de letale dosis): een statistisch afgeleide enkelvoudige dosis van een stof waarvan kan worden verwacht dat 50 % van de dieren waaraan deze dosis oraal wordt toegediend, sterft. De LD 50 wordt uitgedrukt als gewicht van de teststof per gewichtseenheid van het proefdier (mg/kg).
Limietdosis: een dosis die bij tests als bovengrens wordt gehanteerd (2 000 of 5 000 mg/kg).
Stervende toestand: een toestand waarop de dood volgt of waarin overleven onmogelijk is, zelfs wanneer het dier wordt behandeld (zie de leidraad voor humane eindpunten (8) voor meer bijzonderheden).
Voorspelbare sterfte: een toestand met klinische verschijnselen die wijzen op sterfte op een bekend tijdstip in de toekomst vóór het geplande einde van het experiment, bijvoorbeeld wanneer het dier geen water of voer kan bereiken (zie de leidraad voor humane eindpunten (8) voor meer bijzonderheden).
1.3. PRINCIPE VAN DE TESTMETHODE
Groepen met dieren van hetzelfde geslacht krijgen stapsgewijs de vaste doses 5, 50, 300 en 2 000 mg/kg toegediend (bij wijze van uitzondering kan een extra vaste dosis van 5 000 mg/kg worden overwogen; zie punt 1.6.2). Op basis van een verkennende test wordt de aanvangsdosis gekozen, waarvan wordt verwacht dat er enige toxiciteitsverschijnselen optreden zonder dat er sprake is van ernstige toxische effecten of sterfte. Klinische verschijnselen en situaties die gepaard gaan met pijn, leed en ophanden zijnde sterfte, worden gedetailleerd in een aparte OESO-leidraad beschreven (8). Afhankelijk van het al dan niet optreden van toxiciteitsverschijnselen of sterfte kan er aan andere groepen dieren een hogere of lagere dosis worden toegediend. Deze procedure wordt gestaakt zodra de dosis wordt bepaald waarbij manifeste toxiciteit optreedt of ten hoogste één dier sterft, of wanneer blijkt dat er bij de hoogste dosis geen effecten worden geconstateerd of bij de laagste dosis dieren sterven.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Keuze van de diersoort
Bij voorkeur wordt de rat gebruikt, maar ook andere knaagdiersoorten kunnen worden gebruikt. Normaal gesproken worden vrouwtjes gebruikt (7), omdat uit literatuuronderzoek van klassieke LD50-tests blijkt dat er meestal weinig verschil in gevoeligheid tussen mannetjes en vrouwtjes is, maar wanneer er een verschil wordt geconstateerd, zijn vrouwtjes meestal iets gevoeliger (10). Als echter uit kennis omtrent de toxicologische of toxicokinetische eigenschappen van qua structuur verwante chemische stoffen blijkt dat mannetjes waarschijnlijk gevoeliger zullen zijn, moeten mannetjes worden gebruikt. Wanneer de test bij mannetjes wordt uitgevoerd, moet hiervoor een afdoende motivering worden gegeven. Er worden gezonde jonge volwassen dieren van gangbare laboratoriumstammen gebruikt.
De vrouwtjes mogen nog geen jongen hebben gehad en mogen niet drachtig zijn. Elk dier moet bij de eerste toediening 8 tot 12 weken oud zijn en het lichaamsgewicht mag niet meer dan ± 20 % afwijken van het gemiddelde gewicht van dieren waaraan al eerder een dosis is toegediend.
1.4.2. Huisvesting en voeding
De temperatuur in de proefdierruimte dient 22 oC (± 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater. De dieren mogen per dosis in groepen worden gehuisvest, maar het aantal dieren per kooi mag niet zo groot zijn dat een duidelijke observatie van elk dier wordt gestoord.
1.4.3. Voorbereiding van de dieren
De dieren worden aselect ingedeeld, gemerkt om elk dier afzonderlijk te kunnen identificeren en vóór het begin van de toediening gedurende minimaal 5 dagen in hun kooi gehouden om ze aan de omstandigheden in het laboratorium te laten wennen.
1.4.4. Bereiding van de dosis
In het algemeen worden alle doses van de teststof in het hele testbereik in een constant volume toegediend door de concentratie van de toegediende dosis te variëren. Wanneer echter een vloeibaar eindproduct of mengsel wordt getest, kan het voor de latere risicobeoordeling van die stof zinvoller zijn de teststof onverdund, d.w.z. met een constante concentratie, te gebruiken en sommige regelgevende instanties hebben dit verplicht gesteld. Het maximaal toe te dienen volume mag echter in geen geval worden overschreden. Het is afhankelijk van de grootte van het proefdier welk volume vloeistof in één keer kan worden toegediend. Bij knaagdieren mag het volume normaal gesproken niet groter zijn dan 1 ml/100 g lichaamsgewicht. Bij een waterige oplossing kan echter 2 ml/100 g lichaamsgewicht worden overwogen. Voor de formulering van de dosis wordt waar mogelijk het gebruik van een waterige oplossing/suspensie/emulsie aanbevolen, in volgorde van voorkeur gevolgd door een oplossing/suspensie/emulsie in olie (bijvoorbeeld maïsolie) en eventueel een oplossing in een ander medium. Wanneer een ander medium dan water wordt gebruikt, moeten de toxicologische kenmerken van het medium bekend zijn. De dosis moet kort vóór de toediening worden bereid, tenzij de stabiliteit van het preparaat gedurende de gebruiksperiode bekend is en is aangetoond dat deze aanvaardbaar is.
1.5. PROCEDURE
1.5.1. Toediening van de dosis
De teststof wordt in één dosis toegediend met een maagsonde of een geschikte katheter. In het uitzonderlijke geval dat één dosis niet mogelijk is, kan de dosis in kleinere porties worden verdeeld die in de loop van maximaal 24 uur worden toegediend.
De dieren moeten vóór de toediening vasten (ratten mogen bijvoorbeeld de nacht vóór de toediening geen voer maar wel water krijgen en muizen gedurende 3-4 uur). Na de vastperiode worden de dieren gewogen en wordt de teststof toegediend. Na de toediening van de stof kan men ratten nog eens 3-4 uur en muizen nog eens 1-2 uur laten vasten. Wanneer een dosis in de loop van de tijd in porties wordt toegediend, kan het afhankelijk van de lengte van de periode nodig zijn de dieren voer en water te geven.
1.5.2. Verkennende test
De verkennende test is bedoeld om de juiste aanvangsdosis voor het hoofdonderzoek te kunnen kiezen. De teststof wordt overeenkomstig het stroomschema in bijlage 1 achtereenvolgens telkens aan één dier toegediend. De verkennende test is afgelopen wanneer er een beslissing kan worden genomen over de aanvangsdosis voor het hoofdonderzoek (of als er bij de laagste vaste dosis een dier sterft).
Als aanvangsdosis voor de verkennende test wordt uit de vaste doses 5, 50, 300 en 2 000 mg/kg de dosis gekozen waarvan wordt verwacht dat er manifeste toxiciteit optreedt, waar mogelijk op basis van gegevens uit in-vitro- en in-vivo-onderzoek met dezelfde chemische stof en andere qua structuur verwante chemische stoffen. Wanneer deze informatie niet beschikbaar is, wordt 300 mg/kg als aanvangsdosis gebruikt.
Er wordt ten minste 24 uur gewacht voordat een dosis aan het volgende dier wordt toegediend. Alle dieren worden gedurende ten minste 14 dagen geobserveerd.
Bij wijze van uitzondering kan alleen met een motivering op basis van specifieke regelgevingsvereisten daarnaast het gebruik van een hogere vaste dosis van 5 000 mg/kg worden overwogen (zie bijlage 3). Met het oog op het welzijn van dieren zijn dierproeven in GHS-categorie 5 tot 2 000-5 000 mg/kg niet wenselijk en moeten deze alleen worden overwogen wanneer er een grote kans is dat de resultaten van die test van direct belang zijn voor de bescherming van de gezondheid van mensen of dieren of het milieu.
Wanneer een dier waaraan bij de verkennende test de laagste vaste dosis (5 mg/kg) is toegediend, sterft, is de normale procedure dat de test wordt afgesloten en de stof wordt ingedeeld in GHS-categorie 1 (zie bijlage 1). Als de indeling echter moet worden bevestigd, kan de volgende facultatieve aanvullende procedure worden uitgevoerd. De dosis van 5 mg/kg wordt aan een tweede dier toegediend. Als dit tweede dier sterft. is de indeling in GHS-categorie 1 bevestigd en wordt het onderzoek onmiddellijk beëindigd. Als het tweede dier blijft leven, wordt de dosis van 5 mg/kg aan ten hoogste nog eens drie dieren toegediend. Omdat er een hoog risico op sterfte zal zijn, moet de dosis met het oog op het welzijn van dieren achtereenvolgens aan telkens één dier worden toegediend. Vóór de toediening aan het volgende dier moet lang genoeg worden gewacht om vast te kunnen stellen dat het vorige dier waarschijnlijk zal blijven leven. Als er een tweede dier sterft, wordt de toediening onmiddellijk gestaakt en worden er geen dieren meer gebruikt. Een tweede dier dat sterft, levert (ongeacht het aantal dieren dat bij beëindiging is getest) het resultaat A op (2 of meer dode dieren), zodat de indelingsregel van bijlage 2 bij de vaste dosis van 5 mg/kg wordt gevolgd (categorie 1 als er 2 of meer dode dieren zijn en categorie 2 als er niet meer dan één dood dier is). Daarnaast geeft bijlage 4 een leidraad voor de indeling in het EU-systeem totdat het nieuwe GHS ingevoerd is.
1.5.3. Hoofdonderzoek
1.5.3.1. Aantal dieren en dosisniveaus
Het stroomschema in bijlage 2 geeft aan wat er na de test op het aanvangsniveau moet gebeuren. Er zijn drie mogelijkheden: de test wordt gestaakt en de desbetreffende gevaar-indelingscategorie wordt toegekend, de test wordt bij een hogere vaste dosis voortgezet of de test wordt bij een lagere vaste dosis voortgezet. Met het oog op de bescherming van dieren wordt een dosisniveau dat bij de verkennende test een dood dier opleverde, bij het hoofdonderzoek niet opnieuw getest (zie bijlage 2). De ervaring heeft geleerd dat het meest waarschijnlijke resultaat bij de aanvangsdosis is dat de stof kan worden ingedeeld en dat er geen verdere tests nodig zijn.
Normaal gesproken worden er voor elk dosisniveau in totaal vijf dieren van hetzelfde geslacht gebruikt, namelijk het dier dat deze dosis bij de verkennende test toegediend heeft gekregen en nog eens vier dieren (behalve wanneer bij wijze van uitzondering een dosisniveau van het hoofdonderzoek niet in de verkennende test was opgenomen).
Het tijdsverloop tussen de toediening op elk niveau wordt bepaald door de aanvang, de duur en de ernst van de toxiciteitsverschijnselen. Met de toediening van een volgende dosis wordt gewacht totdat men er zeker van is dat de eerder geteste dieren blijven leven. Indien nodig wordt een periode van drie of vier dagen tussen de toediening op elk dosisniveau aanbevolen om observatie van vertraagde toxiciteit mogelijk te maken. Dit interval kan indien gewenst worden aangepast, bijvoorbeeld bij een onduidelijke reactie.
Wanneer het gebruik van een hoogste vaste dosis van 5 000 mg/kg wordt overwogen, moet de procedure van bijlage 3 worden gevolgd (zie ook punt 1.6.2).
1.5.3.2. Limiettest
De limiettest wordt voornamelijk uitgevoerd wanneer er informatie is die erop wijst dat het testmateriaal waarschijnlijk niet toxisch is c.q. alleen toxisch is in hogere doses dan de limieten in de regelgeving. Informatie over de toxiciteit van het testmateriaal kan afkomstig zijn van kennis omtrent vergelijkbare geteste verbindingen of vergelijkbare geteste mengsels of producten, waarbij rekening wordt gehouden met de identiteit en het percentage van de bestanddelen waarvan bekend is dat ze in toxicologisch opzicht relevant zijn. Wanneer er weinig of geen informatie over de toxiciteit van het testmateriaal is of wordt verwacht dat het toxisch is, moet het hoofdonderzoek worden uitgevoerd.
De limiettest voor deze testmethode wordt volgens de normale procedure uitgevoerd met een verkennende test met een aanvangsdosis van 2 000 mg/kg (of in uitzonderingsgevallen 5 000 mg/kg), gevolgd door de toediening van deze dosis aan nog eens vier dieren.
1.6. OBSERVATIE
De dieren worden gedurende de eerste 30 minuten na de toediening ten minste éénmaal elk afzonderlijk geobserveerd, gedurende de eerste 24 uur periodiek met bijzondere aandacht voor de eerste vier uur en vervolgens dagelijks gedurende in totaal 14 dagen, behalve wanneer ze met het oog op het welzijn van dieren uit het onderzoek moeten worden genomen en op humane wijze moeten worden gedood of dood aangetroffen worden. De observatieduur is echter geen regel waarvan niet kan worden afgeweken. Deze moet worden bepaald aan de hand van de toxische reacties, het tijdstip waarop ze beginnen en de duur van de herstelperiode en kan dus worden verlengd indien dit nodig wordt geacht. Het is belangrijk op welk tijdstip de toxiciteitsverschijnselen verschijnen en verdwijnen, vooral als er een neiging is tot vertraagde toxiciteitsverschijnselen (11). Alle observaties worden systematisch geregistreerd en voor elk dier wordt een apart verslag bijgehouden.
Als de dieren toxiciteitsverschijnselen blijven vertonen, is aanvullende observatie nodig. Bij de observatie wordt gekeken naar veranderingen in de huid en de vacht, de ogen en de slijmvliezen, de ademhalingsorganen, de bloedsomloop, het autonome en centrale zenuwstelsel, de somatomotorische activiteit en het gedragspatroon. Er moet worden gelet op de observatie van tremors, convulsies, speekselafscheiding, diarree, lethargie, slaap en coma. Er moet rekening worden gehouden met de beginselen en criteria in de leidraad voor humane eindpunten (8). Dieren die stervend worden aangetroffen en dieren die hevige pijn hebben of blijvende tekenen van ernstig leed vertonen, worden op humane wijze gedood. Wanneer dieren op humane wijze worden gedood of dood worden aangetroffen, wordt zo nauwkeurig mogelijk geregistreerd op welk tijdstip ze zijn gestorven.
1.6.1. Lichaamsgewicht
Kort vóór de toediening van de teststof en vervolgens ten minste wekelijks wordt het gewicht van elk dier bepaald. De gewichtsverandering wordt berekend en geregistreerd. Aan het einde van de test worden de dieren die nog leven gewogen en vervolgens op humane wijze gedood.
1.6.2. Pathologie
Op alle proefdieren (ook degene die tijdens de test sterven of met het oog op het welzijn van dieren uit het onderzoek worden genomen) wordt macroscopische obductie uitgevoerd. Alle macroscopische pathologische veranderingen worden voor elk dier geregistreerd. Microscopisch onderzoek van organen die tekenen van macroscopische pathologische veranderingen vertonen bij dieren die 24 uur of langer na de toediening nog leven, kan ook worden overwogen aangezien dit nuttige informatie kan opleveren.
2. GEGEVENS
Er worden voor elk dier apart gegevens verstrekt. Daarnaast worden alle gegevens in tabelvorm samengevat met voor alle testgroepen vermelding van het gebruikte aantal dieren, het aantal dieren dat toxiciteitsverschijnselen vertoonde, het aantal dieren dat tijdens de test dood is aangetroffen of op humane wijze is gedood, het tijdstip waarop elk dier is gestorven, een beschrijving van de toxische effecten met het verloop en de omkeerbaarheid en de obductiebevindingen.
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag wordt indien van toepassing de volgende informatie opgenomen:
|
|
Teststof:
|
|
|
Medium (indien van toepassing):
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking en interpretatie van de resultaten. |
|
|
Conclusies. |
4 REFERENTIES
|
(1) |
British Toxicology Society Working Party on Toxicity (1984). Special report a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85-92. |
|
(2) |
Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 6, 279-291. |
|
(3) |
Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469-482 |
|
(4) |
Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324. |
|
(5) |
Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol. |
|
(6) |
Stallard, N., Whitehead, A. and Ridgeway, P. (2002) Statistical evaluation on the revised fixed dose procedure. Hum. Exp. Toxicol., 21, 183-196. |
|
(7) |
OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris. |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N. 19. |
|
(9) |
OECD (1998) Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF html|. |
|
(10) |
Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33,223-231. |
|
(11) |
Chan, P.K. and A.W. Hayes (1994). Chapter 16 Acute Toxicity and Eye Irritation. In Principles and Methods of Toxicology. 3 rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA. |
BIJLAGE 1:
STROOMSCHEMA VOOR DE VERKENNENDE TEST


BIJLAGE 2:
STROOMSCHEMA VOOR HET HOOFDONDERZOEK


BIJLAGE 3
CRITERIA VOOR DE INDELING VAN TESTSTOFFEN MET EEN VERWACHTE LD50, DIE HOGER LIGT DAN 2 000 MG/KG ZONDER DAT ER TESTS BEHOEVEN TE WORDEN UITGEVOERD
De criteria voor de gevarencategorie 5 zijn bedoeld om reststoffen te kunnen signaleren die een betrekkelijk geringe acute toxiciteit hebben maar onder bepaalde omstandigheden een gevaar voor kwetsbare bevolkingsgroepen kunnen opleveren. Van deze stoffen wordt verwacht dat ze een orale of dermale LD50 tussen 2 000 en 5 000 mg/kg hebben of een vergelijkbare toxiciteit voor andere routes. Deze teststoffen kunnen in de volgende gevallen in de gevarencategorie 2 000 mg/kg < LD50 < 5 000 mg/kg worden ingedeeld (categorie 5 in het GHS):
|
a) |
als ze via een van de testschema s van bijlage 2 op basis van de sterftecijfers in deze categorie terechtkomen; |
|
b) |
als er al betrouwbaar bewijsmateriaal beschikbaar is waaruit blijkt dat de LD50 binnen het interval van categorie 5 valt of als uit ander onderzoek bij dieren of toxische effecten bij de mens blijkt dat er sprake is van een risico voor de gezondheid van de mens van acute aard; |
|
c) |
via extrapolatie, raming of meting van gegevens als indeling in een gevaarlijkere categorie niet terecht is en
|
TESTEN BI J DOSES VAN MEER DAN 2 000 MG/KG
Bij wijze van uitzondering kan alleen met een motivering op basis van specifieke regelgevingsvereisten daarnaast het gebruik van een hogere vaste dosis van 5 000 mg/kg worden overwogen. Met het oog op het welzijn van dieren zijn dierproeven bij 5 000 mg/kg niet wenselijk en moeten deze alleen worden overwogen wanneer er een grote kans is dat de resultaten van die proeven van direct belang zijn voor de bescherming van de gezondheid van dieren of mensen (9).
Verkennende test
De beslissingsregels voor de sequentiële procedure van bijlage 1 worden uitgebreid met een dosis van 5 000 mg/kg. Dit betekent dat wanneer er bij een verkennende test een aanvangsdosis van 5 000 mg/kg wordt gebruikt die resultaat A (sterfte) oplevert, een tweede dier bij 2 000 mg/kg wordt getest; bij resultaat B of C (manifeste toxiciteit of geen toxiciteit) wordt 5 000 mg/kg als aanvangsdosis voor het hoofdonderzoek gekozen. Als een andere aanvangsdosis dan 5 000 mg/kg wordt gebruikt, wordt de test bij resultaat B of C met 2 000 mg/kg voortgezet met 5 000 mg/kg; wanneer vervolgens 5 000 mg/kg resultaat A oplevert, wordt 2 000 mg/kg als aanvangsdosis voor het hoofdonderzoek gekozen en bij resultaat B of C wordt 5 000 mg/kg als aanvangsdosis gekozen.
Hoofdonderzoek
De beslissingsregels voor de sequentiële procedure van bijlage 2 worden uitgebreid met een dosis van 5 000 mg/kg Dit betekent dat wanneer er bij het hoofdonderzoek een aanvangsdosis van 5 000 mg/kg wordt gebruikt die resultaat A (> 2 dode dieren) oplevert, een tweede groep bij 2 000 mg/kg wordt getest; bij resultaat B (manifeste toxiciteit en/of < 1 dood dier) of C (geen toxiciteit) wordt de stof niet volgens het GHS ingedeeld. Als een andere aanvangsdosis dan 5 000 mg/kg wordt gebruikt, wordt de test bij resultaat C met 2 000 mg/kg voortgezet met 5 000 mg/kg; wanneer vervolgens 5 000 mg/kg resultaat A oplevert, wordt de stof ingedeeld in categorie 5 van het GHS en bij resultaat B of C wordt de stof niet ingedeeld.
BIJLAGE 4:
TESTMETHODE B.l bis
Leidraad voor de indeling in het EU-systeem gedurende de overgangsperiode totdat het „Globally Harmonised Classification System” (GHS) volledig is ingevoerd (overgenomen uit referentie (8))


B.l ter. ACUTE ORALE TOXICITEIT: METHODE TER BEPALING VAN DE ACUTE-TOXICITEITSKLASSE
1. METHODE
Deze methode is gelijkwaardig aan TG 423 (2001) van de OESO.
1.1. INLEIDING
De in deze test beschreven methode ter bepaling van de acute-toxiciteitsklasse (1) is een stapsgewijze procedure waarbij voor iedere stap drie dieren van hetzelfde geslacht worden gebruikt. Afhankelijk van het aantal dode en/of stervende dieren kunnen er gemiddeld twee tot vier stappen nodig zijn om een uitspraak over de acute toxiciteit van de teststof te kunnen doen. Deze procedure is reproduceerbaar, gebruikt heel weinig dieren en kan stoffen op een vergelijkbare wijze rangschikken als de andere testmethoden voor acute toxiciteit. De methode ter bepaling van de acute-toxiciteitsklasse is gebaseerd op biometrische evaluaties (2)(3)(4)(5) met vaste doses, die ver genoeg uiteenliggen om een stof met het oog op de indeling en de bepaling van de gevaren te kunnen rangschikken. De in 1996 goedgekeurde methode is zowel op nationaal (6) als op internationaal (7) niveau uitgebreid in vivo gevalideerd in vergelijking met LD50-gegevens uit de literatuur.
Richtsnoeren voor de keuze van de meest geschikte testmethode voor een bepaald doel worden gegeven in de leidraad voor tests op acute orale toxiciteit (8). Deze leidraad bevat ook aanvullende informatie over de uitvoering en interpretatie van testmethode B.l ter.
Teststoffen behoeven niet te worden toegediend in doses waarvan bekend is dat ze door een bijtende of sterk irriterende werking hevige pijn en leed veroorzaken. Stervende dieren of dieren die duidelijk pijn hebben of tekenen van hevig en voortdurend leed vertonen, worden op humane wijze gedood en worden bij de interpretatie van de testresultaten op dezelfde manier behandeld als dieren die tijdens de test gestorven zijn. Er is een aparte leidraad met criteria om te bepalen of stervende of hevig lijdende dieren moeten worden gedood en richtsnoeren om voorspelbare of ophanden zijnde sterfte te herkennen (9).
Bij de methode worden vooraf bepaalde doses gebruikt en de resultaten maken het mogelijk de stof te rangschikken en in te delen aan de hand van het „Globally Harmonised System” voor de indeling van chemische stoften die acute toxiciteit veroorzaken (10).
De methode is in principe niet bedoeld om de berekening van een exacte LD50 mogelijk te maken, maar er kan wel een zeker blootstellingsinterval worden bepaald waar sterfte te verwachten valt, aangezien sterfte van een deel van de dieren het belangrijkste eindpunt van deze test blijft. Een LD50 kan met deze methode alleen worden bepaald wanneer ten minste twee doses een sterfte tussen 0 % en 100 % opleveren. Het gebruik van een aantal vooraf bepaalde doses, ongeacht de teststof, waarbij de indeling expliciet wordt gekoppeld aan het aantal dieren waarbij uiteenlopende toestanden worden geobserveerd, biedt betere mogelijkheden voor consistentie en herhaalbaarheid bij rapportage door verschillende laboratoria.
Het testlaboratorium moet vóór de uitvoering van het onderzoek alle beschikbare informatie over de teststof in overweging nemen. Hierbij gaat het om informatie als de identiteit en de chemische structuur van de stof, de fysisch-chemische eigenschappen, het resultaat van andere met de stof uitgevoerde toxiciteitstests in vivo of in vitro, toxicologische gegevens over de qua structuur verwante stoffen en de voorgenomen toepassing(en) van de stof. Deze informatie is nodig om alle betrokkenen ervan te overtuigen dat de test relevant is voor de bescherming van de gezondheid van de mens en helpt tevens bij de keuze van de geschiktste aanvangsdosis.
1.2. DEFINITIES
Acute orale toxiciteit: de schadelijke effecten die zich voordoen na orale toediening van een dosis van een stof of verschillende doses die binnen 24 uur worden toegediend.
Vertraagde sterfte: houdt in dat een dier niet binnen 48 uur sterft of stervende is maar later gedurende de observatieperiode van 14 dagen sterft.
Dosis: de toegediende hoeveelheid teststof. De dosis wordt uitgedrukt als gewicht van de teststof per gewichtseenheid van het proefdier (bijvoorbeeld mg/kg).
GHS: het „Globally Harmonised Classification System” voor chemische stoffen en mengsels. Een samenwerkingsproject van de OESO (gezondheid van de mens en milieu), het Comité van deskundigen voor het vervoer van gevaarlijke goederen van de VN (fysisch-chemische eigenschappen) en de ILO (communicatie van gevaren) dat wordt gecoördineerd door het Gezamenlijk programma voor een verantwoord beheer van chemische stoften (IOMC).
Ophanden zijnde sterfte: wanneer voor het eerstvolgende geplande observatietijdstip een stervende toestand of sterfte wordt verwacht. Voorbeelden van indicaties voor deze toestand bij knaagdieren zijn convulsies, zijligging, liggende positie en tremors (zie de leidraad voor humane eindpunten (9) voor meer bijzonderheden).
LD 50 (mediaan van de orale letale dosis): een statistisch afgeleide enkelvoudige dosis van een stof waarvan kan worden verwacht dat 50 % van de dieren waaraan deze dosis oraal wordt toegediend, sterft. De LD50 wordt uitgedrukt als gewicht van de teststof per gewichtseenheid van het proefdier (mg/kg).
Limietdosis: een dosis die bij tests als bovengrens wordt gehanteerd (2 000 of 5 000 mg/kg).
Stervende toestand: een toestand waarop de dood volgt of waarin overleven onmogelijk is, zelfs wanneer het dier wordt behandeld (zie de leidraad voor humane eindpunten (9) voor meer bijzonderheden).
Voorspelbare sterfte: een toestand met klinische verschijnselen die wijzen op sterfte op een bekend tijdstip in de toekomst voor het geplande einde van het experiment, bijvoorbeeld wanneer het dier geen water of voer kan bereiken (zie de leidraad voor humane eindpunten (9) voor meer bijzonderheden).
1.3. PRINCIPE VAN DE TEST
Het principe van de test is dat op basis van een stapsgewijze procedure, waarbij per stap een zo klein mogelijk aantal dieren wordt gebruikt, voldoende informatie over de acute toxiciteit van de teststof wordt verkregen om deze in te kunnen delen. Een van de vaste doses van de stof wordt oraal aan een groep proefdieren toegediend. De stof wordt stapsgewijs getest en bij elke stap worden drie dieren van hetzelfde geslacht (normaal gesproken vrouwtjes) gebruikt. Het resultaat van de stap (dieren die ten gevolge van de toediening van de stof sterven of niet) is bepalend voor de volgende stap, namelijk:
|
— |
de test kan worden gestaakt, |
|
— |
dezelfde dosis wordt aan nog eens drie dieren toegediend of |
|
— |
de eerstvolgende hogere of lagere dosis wordt aan drie andere dieren toegediend. |
Bijlage 1 bevat een gedetailleerde beschrijving van de testprocedure. Met deze methode kan een uitspraak worden gedaan over de indeling van de teststof in een van de toxiciteitsklassen die elk worden begrensd door vaste LD50 waarden.
1.4. BESCHRIJVING VAN DE METHODE
1.4.1. Keuze van de diersoort
Bij voorkeur wordt de rat gebruikt, maar ook andere knaagdiersoorten kunnen worden gebruikt Normaal gesproken worden vrouwtjes gebruikt (9), omdat uit literatuuronderzoek van klassieke LD50-tests blijkt dat er weliswaar meestal weinig verschil in gevoeligheid tussen mannetjes en vrouwtjes is, maar dat vrouwtjes meestal iets gevoeliger zijn wanneer er verschillen worden geconstateerd (11). Als echter uit kennis omtrent de toxicologische of toxicokinetische eigenschappen van qua structuur verwante chemische stoffen blijkt dat mannetjes waarschijnlijk gevoeliger zullen zijn, moeten mannetjes worden gebruikt. Wanneer de test bij mannetjes wordt uitgevoerd, moet hiervoor een afdoende motivering worden gegeven.
Er worden gezonde jonge volwassen dieren van gangbare laboratoriumstammen gebruikt. De vrouwtjes mogen nog geen jongen hebben gehad en mogen niet drachtig zijn. Elk dier moet bij de eerste toediening 8 tot 12 weken oud zijn en het lichaamsgewicht mag niet meer dan ± 20 % afwijken van het gemiddelde gewicht van dieren waaraan al eerder een dosis is toegediend.
1.4.2. Huisvesting en voeding
De temperatuur in de proefdierruimte dient 22 oC (± 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater. De dieren mogen per dosis in groepen worden gehuisvest, maar het aantal dieren per kooi mag niet zo groot zijn dat een duidelijke observatie van elk dier wordt gestoord.
1.4.3. Voorbereiding van de dieren
De dieren worden aselect ingedeeld, gemerkt om elk dier afzonderlijk te kunnen identificeren en voor de toediening gedurende minimaal 5 dagen in hun kooi gehouden om ze aan de omstandigheden in het laboratorium te laten wennen.
1.4.4. Bereiding van de dosis
In het algemeen worden alle doses van de teststof in het hele testbereik in een constant volume toegediend door de concentratie van de toegediende dosis te variëren. Wanneer echter een vloeibaar eindproduct of mengsel wordt getest, kan het voor de latere risicobeoordeling van die stof zinvoller zijn de teststof onverdund, d.w.z. met een constante concentratie, te gebruiken en sommige regelgevende instanties hebben dit verplicht gesteld. Het maximaal toe te dienen volume mag echter in geen geval worden overschreden. Het is afhankelijk van de grootte van het proefdier welk volume vloeistof in één keer kan worden toegediend. Bij knaagdieren mag het volume normaal gesproken niet groter zijn dan 1 ml/100 g lichaamsgewicht. Bij een waterige oplossing kan echter 2 ml/100 g lichaamsgewicht worden overwogen. Voor de formulering van de dosis wordt waar mogelijk het gebruik van een waterige oplossing/suspensie/emulsie aanbevolen, in volgorde van voorkeur gevolgd door een oplossing/suspensie/emulsie in olie (bijvoorbeeld maïsolie) en eventueel een oplossing in een ander medium. Wanneer een ander medium dan water wordt gebruikt, moeten de toxicologische kenmerken van het medium bekend zijn. De dosis moet kort voor de toediening worden bereid, tenzij de stabiliteit van het preparaat gedurende de gebruiksperiode bekend is en is aangetoond dat deze aanvaardbaar is.
1.5. PROCEDURE
1.5.1. Toediening van de dosis
De teststof wordt in een dosis toegediend met een maagsonde of een geschikte katheter In het uitzonderlijke geval dat een dosis niet mogelijk is, kan de dosis in kleinere porties worden verdeeld die in de loop van maximaal 24 uur worden toegediend.
De dieren moeten voor de toediening vasten (ratten mogen bijvoorbeeld de nacht voor de toediening geen voer maar wel water krijgen en muizen gedurende 3-4 uur). Na de vastpenode worden de dieren gewogen en wordt de teststof toegediend. Na de toediening van de stof kan men ratten nog eens 3-4 uur en muizen nog eens 1-2 uur laten vasten. Wanneer een dosis in de loop van de tijd in porties wordt toegediend, kan het afhankelijk van de lengte van de periode nodig zijn de dieren voer en water te geven.
1.5.2. Aantal dieren en hoogte van de doses
Voor elke stap worden er drie dieren gebruikt. Een van de vier vaste doses 5, 50, 300 en 2 000 mg/kg lichaamsgewicht wordt als aanvangsdosis gekozen. Als aanvangsdosis wordt de dosis gekozen waarbij naar alle waarschijnlijkheid enkele dieren zullen sterven. In de stroomschema's van bijlage 1 wordt de procedure beschreven die bij elk van de aanvangsdoses moet worden gevolgd. Daarnaast bevat bijlage 4 een leidraad voor de indeling in het EU systeem totdat het nieuwe GHS is ingevoerd.
Wanneer de beschikbare informatie erop wijst dat er bij de hoogste aanvangdosis (2 000 mg/kg lichaamsgewicht) waarschijnlijk geen dieren zullen sterven, moet er een limiettest worden uitgevoerd. Wanneer er geen informatie over een te testen stof is, wordt met het oog op het welzijn van dieren aanbevolen 300 mg/kg lichaamsgewicht als aanvangsdosis te gebruiken.
Het tijdsverloop tussen de toediening aan de verschillende groepen wordt bepaald door de aanvang, de duur en de ernst van de toxiciteitsverschijnselen. Met de toediening van een volgende dosis moet worden gewacht totdat men er zeker van is dat de eerder geteste dieren blijven leven.
Bij wijze van uitzondering kan alleen met een motivering op basis van specifieke regelgevingsvereisten daarnaast het gebruik van een hogere vaste dosis van 5 000 mg/kg lichaamsgewicht worden overwogen (zie bijlage 2). Met het oog op het welzijn van dieren zijn dierproeven in GHS categorie 5 (2 000-5 000 mg/kg) niet wenselijk en moeten deze alleen worden overwogen wanneer er een grote kans is dat de resultaten van die test van direct belang zijn voor de bescherming van de gezondheid van mens of dier of het milieu.
1.5.3. Limiettest
De limiettest wordt voornamelijk uitgevoerd wanneer er informatie is die erop wijst dat het testmateriaal waarschijnlijk niet toxisch is c.q. alleen toxisch is in hogere doses dan de limieten in de regelgeving. Informatie over de toxiciteit van het testmateriaal kan afkomstig zijn van kennis omtrent vergelijkbare geteste verbindingen of vergelijkbare geteste mengsels of producten, waarbij rekening wordt gehouden met de identiteit en het percentage van de bestanddelen waarvan bekend is dat ze in toxicologisch opzicht relevant zijn. Wanneer er weinig of geen informatie over de toxiciteit van het testmateriaal is of wordt verwacht dat het toxisch is, moet het hoofdonderzoek worden uitgevoerd.
Er kan een limiettest met een dosisniveau van 2 000 mg/kg worden uitgevoerd met zes dieren (drie dieren per stap). Bij wijze van uitzondering kan er een limiettest met een dosisniveau van 5 000 mg/kg worden uitgevoerd met drie dieren (zie bijlage 2). Als er dieren vanwege de toediening van de stof sterven, kan het nodig zijn de test bij de eerstvolgende lagere dosis voort te zetten.
1.6. OBSERVATIE
De dieren worden gedurende de eerste 30 minuten na de toediening ten minste eenmaal elk afzonderlijk geobserveerd, gedurende de eerste 24 uur periodiek met bijzondere aandacht voor de eerste vier uur en vervolgens dagelijks gedurende in totaal 14 dagen, behalve wanneer ze met het oog op het welzijn van dieren uit het onderzoek moeten worden genomen en op humane wijze moeten worden gedood of dood aangetroffen worden. De observatieduur is echter geen regel waarvan niet kan worden afgeweken. Deze moet worden bepaald aan de hand van de toxische reacties, het tijdstip waarop ze beginnen en de duur van de herstelperiode en kan dus worden verlengd indien dit nodig wordt geacht. Het is belangrijk op welk tijdstip de toxiciteitsverschijnselen verschijnen en verdwijnen, vooral als er een neiging is tot vertraagde toxiciteitsverschijnselen (12). Alle observaties worden systematisch geregistreerd en voor elk dier wordt een apart verslag bijgehouden.
Als de dieren toxiciteitsverschijnselen blijven vertonen, is aanvullende observatie nodig. Bij de observatie wordt gekeken naar veranderingen in de huid en de vacht, de ogen en de slijmvliezen, de ademhalingsorganen, de bloedsomloop, het autonome en centrale zenuwstelsel, de somatomotorische activiteit en het gedragspatroon. Er moet worden gelet op de observatie van tremors, convulsies, speekselafscheiding, diarree, lethargie, slaap en coma. Er moet rekening worden gehouden met de beginselen en criteria in de leidraad voor humane eindpunten (9). Dieren die stervend worden aangetroffen en dieren die hevige pijn hebben of blijvende tekenen van ernstig leed vertonen, worden op humane wijze gedood. Wanneer dieren op humane wijze worden gedood of dood worden aangetroffen, wordt zo nauwkeurig mogelijk geregistreerd op welk tijdstip ze zijn gestorven.
1.6.1. Lichaamsgewicht
Kort vóór de toediening van de teststof en vervolgens ten minste wekelijks wordt het gewicht van elk dier bepaald. De gewichtsverandering wordt berekend en geregistreerd. Aan het einde van de test worden de dieren die nog leven gewogen en op humane wijze gedood.
1.6.2. Pathologie
Op alle proefdieren (ook degene die tijdens de test sterven of met het oog op het welzijn van dieren uit het onderzoek worden genomen) wordt macroscopische obductie uitgevoerd. Alle macroscopische pathologische veranderingen worden voor elk dier geregistreerd. Microscopisch onderzoek van organen die tekenen van macroscopische pathologische veranderingen vertonen bij dieren die na 24 uur of langer nog leven, kan ook worden overwogen aangezien dit nuttige informatie kan opleveren.
2. GEGEVENS
Er worden voor elk dier apart gegevens verstrekt. Daarnaast worden alle gegevens in tabelvorm samengevat met voor alle testgroepen vermelding van het gebruikte aantal dieren, het aantal dieren dat toxiciteitsverschijnselen vertoonde, het aantal dieren dat tijdens de test dood is aangetroffen of op humane wijze is gedood, het tijdstip waarop elk dier is gestorven, een beschrijving van de toxische effecten met het verloop en de omkeerbaarheid en de obductiebevindingen.
3. RAPPORTACE
3.1. TESTVERSLAG
In het testverslag wordt indien van toepassing de volgende informatie opgenomen:
|
|
Teststof
|
|
|
Medium (indien van toepassing):
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking en interpretatie van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Roll R., Hofer-Bosse Th. and Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86. |
|
(2) |
Roll R., Riebschlager M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizitat von Chemikalien. Bundesgesundheitsblatt 32, 336-341. |
|
(3) |
Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute Toxic Class Method (Oral). Arch. Toxicol. 68, 559-610. |
|
(4) |
Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute Toxic Class Method (Oral). Arch. Toxicol. 69, 729-734. |
|
(5) |
Diener W., and Schlede E. (1999). Acute Toxicity Class Methods- Alterations to LD/LC50 Tests. ALTEX 16, 129-134. |
|
(6) |
Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute Toxic Class Method — An Alternative to the LD50, Test. Arch Toxicol 66, 455-470. |
|
(7) |
Schlede E, Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute Toxic Class Method (Oral). Arch. Toxicol. 69, 659-670. |
|
(8) |
OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris. |
|
(9) |
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Chemical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N. 19. |
|
(10) |
OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11. [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html]. |
|
(11) |
Lipnick R.L., Cotruvo, J.A., Hill R.N., Bruce R.D., Stitzel K.A., Walker A.P., Chu I., Goddard M., Segal L., Springer, J.A. and Myers R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223-231. |
|
(12) |
Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition A.W. Hayes, Editor. Raven Press, Ltd., New York, USA. |
BIJLAGE 1
PROCEDURE VOOR ELKE AANVANGSDOSIS
ALGEMENE OPMERKINGEN
In de stroomschema's in deze bijlage wordt voor elke aanvangsdosis de te volgen procedure geschetst:
|
— |
Bijlage 1 A: Aanvangsdosis 5 mg/kg lichaamsgewicht |
|
— |
Bijlage 1 B: Aanvangsdosis 50 mg/kg lichaamsgewicht |
|
— |
Bijlage 1 C: Aanvangsdosis 300 mg/kg lichaamsgewicht |
|
— |
Bijlage 1 D: Aanvangsdosis 2 000 mg/kg lichaamsgewicht |
De pijlen geven, afhankelijk van het aantal gestorven of op humane wijze gedode dieren, de te volgen procedure aan.
BIJLAGE 1 A
TESTPROCEDURE MET EEN AANVANGSDOSIS VAN 5 MG/KG LICHAAMSGEWICHT

BIJLAGE 1 B
TESTPROCEDURE MET EEN AANVANGSDOSIS VAN 50 MG/KG LICHAAMSGEWICHT

BIJLAGE 1 C
TESTROCEDURE MET EEN AANVANGSDOSIS VAN 300 MG/KG LICHAAMSGEWICHT
BIJLAGE 1 D
TESTPROCEDURE MET EEN AANVANGSDOSIS VAN 2 000 MG/KG LICHAAMSGEWICHT
BIJLAGE 2
CRITERIA VOOR DE INDELING VAN TESTSTOFFEN MET EEN VERWACHTE LD50, DIE HOGER LIGT DAN 2 000 MG/KG ZONDER DAT ER TESTS BEHOEVEN TE WORDEN UITGEVOERD
De criteria voor de gevarencategorie 5 zijn bedoeld om teststoffen te kunnen signaleren die een betrekkelijk geringe acute toxiciteit hebben, maar onder bepaalde omstandigheden een gevaar voor kwetsbare bevolkingsgroepen kunnen opleveren. Van deze stoffen wordt verwacht dat ze een orale of dermale LD50 tussen 2 000 en 5 000 mg/kg hebben of een vergelijkbare toxiciteit voor andere routes. Deze teststoffen moeten in de volgende gevallen in de gevarencategorie 2 000 mg/kg < LD50 < 5 000 mg/kg worden ingedeeld (categorie 5 in het GHS).
|
a) |
als ze via een van de testschema's van bijlage 1A-1D op basis van de sterftecijfers in deze categorie terechtkomen; |
|
b) |
als er al betrouwbaar bewijsmateriaal beschikbaar is waaruit blijkt dat de LD50 binnen het interval van categorie 5 valt of als uit ander onderzoek bij dieren of toxische effecten bij de mens blijkt dat er sprake is van een risico voor de gezondheid van de mens van acute aard; |
|
c) |
via extrapolatie, raming of meting van gegevens als indeling in een gevaarlijkere categorie niet terecht is en
|
TESTEN BIJ DOSES VAN MEER DAN 2 000 MG/KG
Met het oog op het welzijn van dieren zijn dierproeven in categorie 5 (5 000 mg/kg) niet wenselijk en moeten deze alleen worden overwogen wanneer er een grote kans is dat de resultaten van die test van direct belang zijn voor de bescherming van de gezondheid van mens of dier (10). Er dienen geen verdere tests bij hogere doses te worden uitgevoerd.
Wanneer testen met een dosis van 5 000 mg/kg nodig is, wordt er slechts één stap (d.w.z. drie dieren) uitgevoerd. Als het eerste dier na toediening sterft, gaat de toediening verder met 2 000 mg/kg volgens de stroomschema's van bijlage 1. Als het eerste dier blijft leven, wordt aan nog eens twee dieren 5 000 mg/kg toegediend. Als slechts één van de drie dieren sterft, wordt ervan uitgegaan dat de LD50 hoger is dan 5 000 mg/kg. Als beide dieren sterven, gaat de toediening verder met 2 000 mg/kg.
BIJLAGE 3
TESTMETHODE B.1 ter: Leidraad voor de indeling in het EU-systeem gedurende de overgangsperiode totdat het „Globally Harmonised Classification System” (GHS) volledig is ingevoerd (overgenomen uit referentie (8))
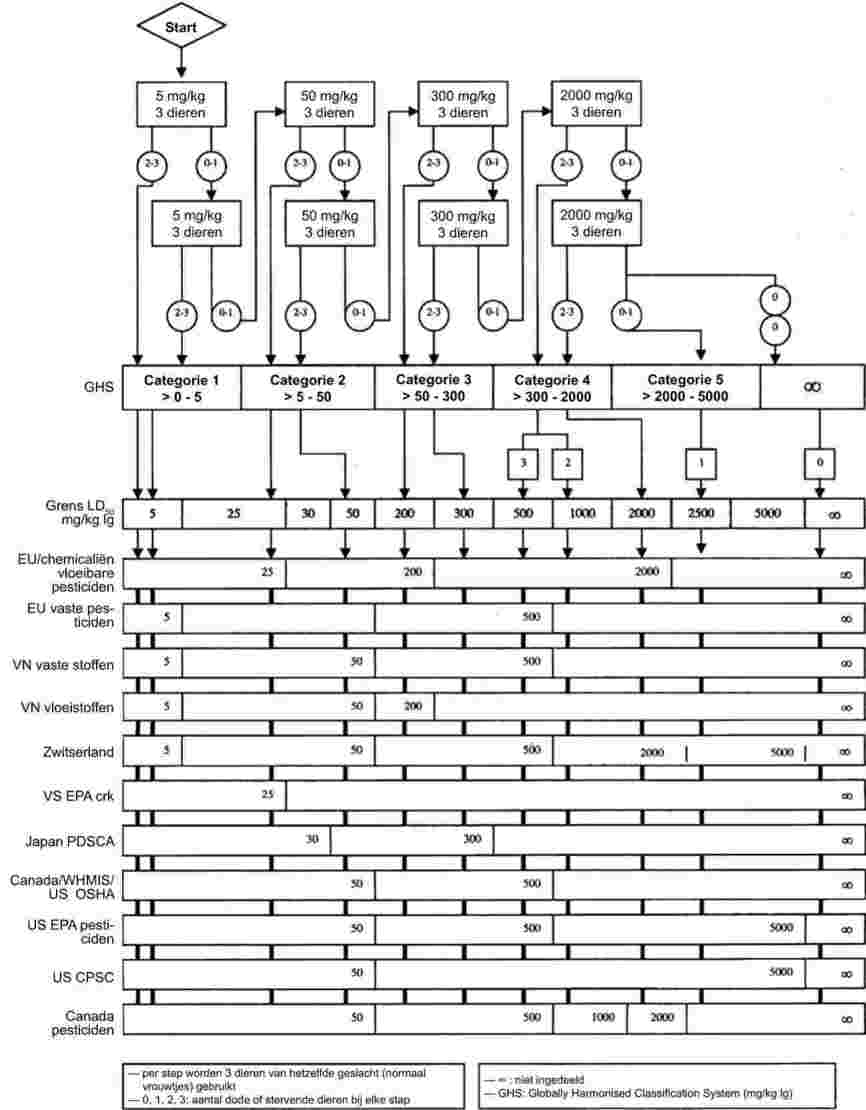

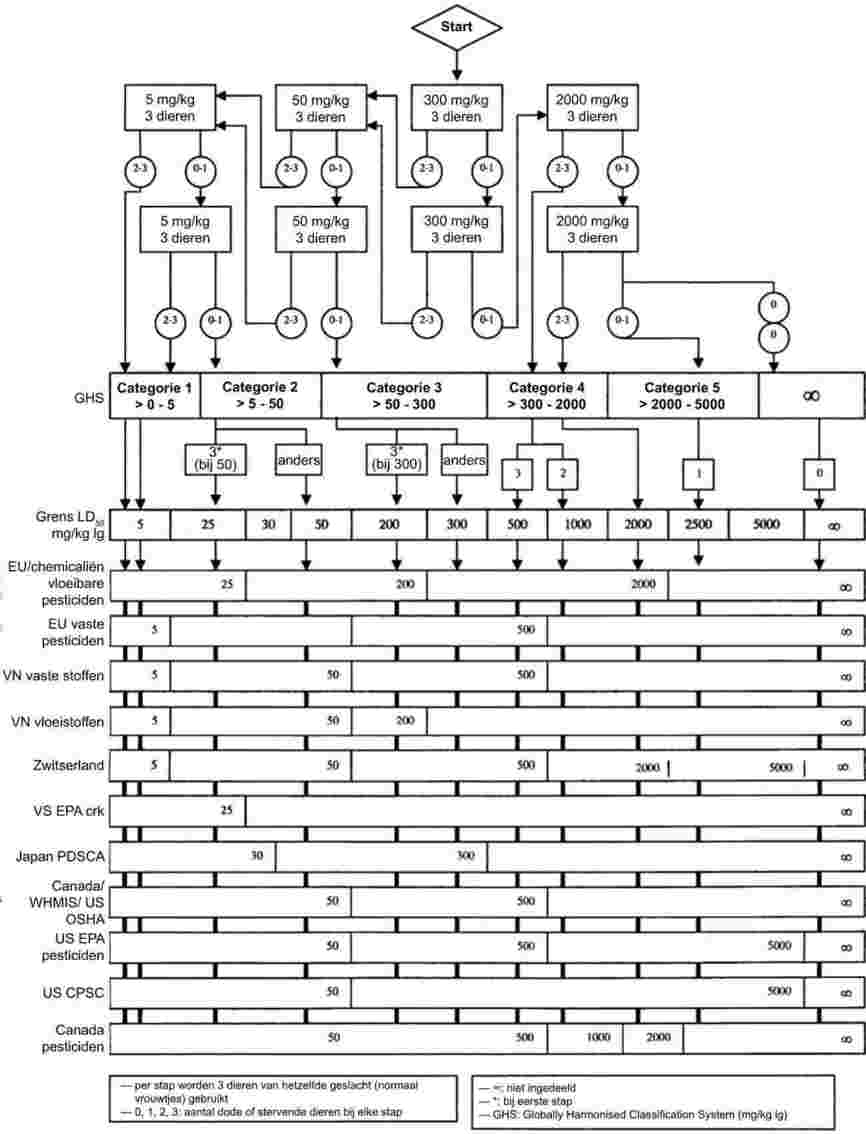

B.2. ACUTE INHALATIETOXICITEIT
1. METHODE
1.1. INLEIDING
Het is nuttig om over oriënterende informatie te beschikken ten aanzien van de deeltjesgrootte, de dampspanning, het smeltpunt, het kookpunt, het vlampunt en het ontploffingsgevaar (indien van toepassing) van de te onderzoeken stof.
Zie ook algemene inleiding deel B (punt A).
1.2. DEFINITIES
Zie algemene inleiding deel B (punt B).
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE TESTMETHODE
Verscheidene groepen proefdieren worden gedurende een vastgestelde periode aan geleidelijk stijgende concentraties van de teststof blootgesteld. Er wordt één concentratie per groep gebruikt. Vervolgens worden de symptomen en sterfte waargenomen. Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het einde van de studie leven, wordt necropsie verricht.
Dieren die hevige en aanhoudende tekenen van angst en pijn vertonen, zouden op humane wijze moeten worden gedood. Het doseren van teststoffen op een manier waarvan bekend is dat deze als gevolg van corrosieve of ernstig irriterende eigenschappen pijn en ongemak veroorzaakt, behoeft niet te worden uitgevoerd.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Voorbereidingen
Vóór het onderzoek worden de dieren ten minste 5 dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Gezonde jonge dieren worden op een willekeurige manier vóór de behandeling in het vereiste aantal groepen ingedeeld. Het is niet nodig de dieren aan een gesimuleerde blootstelling te onderwerpen, tenzij dit wenselijk is bij het type expositieapparatuur dat wordt gebruikt.
Vaste teststoffen moeten eventueel worden gemicroniseerd om deeltjes van geschikte grootte te verkrijgen.
Waar nodig wordt een passend medium aan de teststof toegevoegd, teneinde de juiste concentratie van de proefstof in de atmosfeer te bereiken, in dat geval moet ook een mediumcontrolegroep worden toegevoegd. Indien een medium of andere additieven worden gebruikt om de dosering te vergemakkelijken, moet bekend zijn dat deze geen toxische effecten veroorzaken. In voorkomend geval kunnen bestaande gegevens worden gebruikt.
1.6.2. Proefomstandigheden
1.6.2.1. Proefdieren
Tenzij er contra-indicaties bestaan, wordt de voorkeur gegeven aan ratten. De proef dient te worden uitgevoerd met een rattenstam die gewoonlijk in laboratoria wordt gebruikt. Per geslacht mag bij het begin van de studie het gewicht van de dieren die worden gebruikt, niet meer dan 20 % van het gemiddelde gewicht afwijken.
1.6.2.2. Aantal en geslacht
Voor ieder concentratieniveau moeten ten minste tien knaagdieren (vijf wijfjes en vijf mannetjes) worden gebruikt. De wijfjes moeten nullipaar zijn en mogen niet zwanger zijn.
Opmerking: In acute-toxiciteittesten met dieren van een hogere orde dan knaagdieren, dienen kleinere aantallen in overweging te worden genomen. De doses dienen zorgvuldig te worden gekozen, en alle moeite dient worden gedaan om matig toxische doses niet te boven te gaan. In dergelijke testen dient toediening van letale doses van de teststof te worden vermeden.
1.6.2.3. Blootstellingsconcentraties
Bij de proeven moeten voldoende (ten minste drie) expositieconcentraties worden gebruikt die zodanig onderling verschillen dat proefgroepen worden verkregen met duidelijke verschillen in toxische effecten en sterftecijfers. De gegevens moeten voldoende zijn om een concentratie/respons-curve te verkrijgen en om indien mogelijk, op aanvaardbare wijze een LC50 te bepalen
1.6.2.4. Limiettest
Als binnen een periode van 14 dagen geen sterfte wordt veroorzaakt door de expositie gedurende 4 uur van vijf mannelijke en vijf vrouwelijke proefdieren aan 20 mg/l in de vorm van een gas en aan 5 mg/l in de vorm van een vloeistofaerosol of van een stofaerosol, is het wellicht niet noodzakelijk verdere proeven te nemen.
1.6.2.5. Blootstellingstijd
De blootstellingstijd bedraagt 4 uur.
1.6.2.6. Apparatuur
De dieren worden aan de teststoffen blootgesteld met behulp van inhalatieapparatuur die zodanig gebouwd is dat kan worden gezorgd voor een dynamische luchtdoorstroming van ten minste 12 luchtverversingen per uur, een toereikend zuurstofgehalte en een gelijkmatige verdeling van de teststoffen in de atmosfeer. Als van een expositiekamer gebruik wordt gemaakt, moet deze op een zodanige wijze zijn ontworpen dat de dieren zo min mogelijk bij elkaar kunnen kruipen en zoveel mogelijk door inhalatie aan de teststof worden blootgesteld. Als algemene regel voor het verzekeren van een stabiele atmosfeer in de expositiekamer geldt, dat het totale „volume” van de proefdieren niet méér mag bedragen dan 5 % van het volume van de blootstellingskamer. Naar keuze kunnen de dieren oronasaal, alleen met hun kop of individueel met hun hele lijf aan de testlucht worden blootgesteld; de eerste twee methoden zullen ertoe bijdragen dat zo min mogelijk teststof via ander wegen in het lichaam wordt opgenomen.
1.6.2.7. Observatieperiode
De observatieperiode moet ten minste 14 dagen bedragen. Deze duur van de observatie moet echter niet als een streng vastgelegde periode worden beschouwd, maar moet door de toxische reacties, het tijdstip waarop deze voor het eerst worden waargenomen en de duur van het herstel worden bepaald; de observatieperiode kan dus indien noodzakelijk, worden verlengd. Van belang zijn het tijdstip waarop toxische verschijnselen voor het eerst zijn waargenomen, het tijdstip waarop zij weer verdwijnen en het tijdstip waarop de dood intreedt, in het bijzonder wanneer de kans bestaat op een uitgestelde dood.
1.6.3. Uitvoering
Kort vóór de blootstelling worden de dieren gewogen en vervolgens 4 uur lang aan de testconcentratie blootgesteld in het daarvoor bestemde apparaat; na evenwichtsinstelling van de concentratie in de blootstellingskamer. De evenwichtsinstelling mag niet veel tijd in beslag nemen. Tijdens de proef dient de temperatuur op 22 oC ± 3 oC te worden gehouden. In het ideale geval moet de relatieve vochtigheid tussen 30 % en 70 % worden gehouden, behalve waar dit niet goed uitvoerbaar is (bijvoorbeeld bij het testen van sommige aerosolen). Het onderhouden van een lichte onderdruk (≤ 5 mm water) voorkomt het weglekken van de teststof naar de omgeving. Gedurende de blootstelling worden de dieren voedsel en water onthouden. Om de testatmosfeer te genereren en concentratiemetingen uit te voeren dienen geschikte systemen gebruikt te worden. Het systeem moet de waarborg bieden dat de expositieomstandigheden bij de proef zo spoedig mogelijk stabiel zijn. De kamer moet zo ontworpen en bediend kunnen worden dat een homogene verdeling van de testatmosfeer binnen de kamer wordt gehandhaafd.
De volgende parameters moeten worden gemeten of gemonitord:
|
a) |
de luchtdoorstromingssnelheid (continu) (luchtdebiet); |
|
b) |
de feitelijke concentratie van de teststof in het ademhalingsgebied van de dieren, ten minste driemaal gemeten tijdens de blootstelling (sommige atmosferen, bijvoorbeeld aerosolen met hoge concentratie moeten eventueel vaker worden gecontroleerd). Tijdens de blootstelling mag de concentratie niet meer dan ± 15 % van het gemiddelde afwijken. Bij sommige aerosolen is het mogelijk dat de concentratie niet binnen deze grenzen gehouden kan worden; in dat geval kan een grotere afwijking worden aanvaard. Voor aerosolen moet zo dikwijls als noodzakelijk is (ten minste éénmaal per testgroep) een analyse worden uitgevoerd om de verdeling van de deeltjesgrootte te bepalen; |
|
c) |
de temperatuur en de vochtigheid, indien mogelijk continu. |
Tijdens en na de blootstelling worden waarnemingen gedaan die voor ieder individueel dier worden geregistreerd. Tijdens de eerste dag moeten frequent waarnemingen worden verricht. Ten minste één keer per werkdag moet een zorgvuldig klinisch onderzoek worden verricht, overige waarnemingen moeten iedere dag worden gedaan waarbij erop moet worden toegezien dat er zo weinig mogelijk dieren voor het onderzoek verloren gaan, bijvoorbeeld door necropsie of koeling van dood aangetroffen dieren en afzondering of opoffering van zwakke of stervende dieren.
Bij het observeren moet in ieder geval aandacht worden besteed aan veranderingen van huid, vacht, ogen, slijmvliezen, ademhalingsorganen, bloedsomloop, autonoom en centraal zenuwstelsel, somatomotorische activiteit en gedrag. Er moet bijzondere aandacht worden besteed aan de waarneming van het ademhalingsgedrag, tremoren, convulsies, speekselvloed, diarree, lethargie, slaap en coma. Het tijdstip waarop de dood intreedt, moet zo nauwkeurig mogelijk worden geregistreerd. Het gewicht van ieder dier wordt na de expositie éénmaal per week en bij de dood van de dieren bepaald.
Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het eind van de proefnemingen leven, wordt necropsie verricht, waarbij vooral aandacht wordt besteed aan veranderingen in het bovenste en onderste gedeelte van de ademhalingswegen. Alle macroscopisch waarneembare pathologische veranderingen worden geregistreerd. Als hiertoe aanleiding bestaat, worden weefselmonsters genomen voor histopathologisch onderzoek.
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: aantal dieren bij het begin van het onderzoek, tijdstip waarop de dood intreedt bij de individuele dieren, het aantal dieren dat andere toxiciteitsverschijnselen vertoont, een beschrijving van de toxische effecten en de bevindingen bij de necropsie. Veranderingen in het gewicht moeten worden berekend en geregistreerd indien de dieren langer dan een dag in leven blijven. Dieren die op humane wijze gedood worden omwille van angst en pijn in verband met de stofblootstelling worden geregistreerd als gestorven in verband met de stofblootstelling. Met behulp van een erkende methode wordt de LC50 bepaald. Bij de evaluatie van de gegevens moet ook aandacht worden besteed aan het eventuele verband dat bestaat tussen de blootstelling van de dieren aan de teststof en het aantal en de ernst van alle voorkomende afwijkingen, waaronder gedrags- en klinische afwijkingen, macroscopisch waarneembare beschadigingen, veranderingen in het lichaamsgewicht, sterfte en eventuele andere toxische effecten.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen
|
— |
diersoort, stam, herkomst, leefomstandigheden, voeding, enzovoort, |
|
— |
proefomstandigheden: beschrijving van de expositieapparatuur met inbegrip van ontwerp, type, afmetingen, luchtbron, systeem voor het genereren van aerosolen, methode van luchtconditionering en de wijze waarop de dieren tijdens de proeven in een blootstellingskamer zijn ondergebracht (als deze gebruikt is). Er moet een beschrijving worden gegeven van de apparatuur voor het meten van de temperatuur, de vochtigheid, de concentraties en de verdeling van de deeltjesgrootte van het aerosol. |
Gegevens betreffende de expositie:
Deze moeten tabellarisch worden gerangschikt en worden voorzien van gemiddelde waarden en een maat voor de variabiliteit (bijvoorbeeld standaardafwijking). Zij dienen, indien mogelijk, te omvatten:
|
a) |
de luchtdoorstromingssnelheid (luchtdebiet) door de inhalatieapparatuur; |
|
b) |
temperatuur en vochtigheid van de lucht; |
|
c) |
nominale concentraties (de totale hoeveelheid teststof die de inhalatieapparatuur wordt binnengeleid gedeeld door het luchtvolume); |
|
d) |
aard van het eventuele medium; |
|
e) |
feitelijke concentraties van de teststof in het ademhalingsgebied van de dieren; |
|
f) |
massa-mediaan van de aerodynamische diameter (MMAD) en de geometrische standaardafwijking (GSD); |
|
g) |
duur van de evenwichtsinstelling; |
|
h) |
duur van de expositie;
|
3.2. EVALUATIE EN INTERPRETATIE
Zie algemene inleiding deel B (punt D).
4. LITERATUUR
Zie algemene inleiding deel B (punt E).
B.3. ACUTE DERMALE TOXICITEIT
1. METHODE
1.1. INLEIDING
Zie algemene inleiding deel B (punt A).
1.2. DEFINITIES
Zie algemene inleiding deel B (punt B).
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE TESTMETHODE
De teststof wordt in geleidelijk stijgende doseringen op de huid van verscheidene groepen proefdieren aangebracht. Er wordt één dosis per groep gebruikt. Vervolgens worden de symptomen en sterfte waargenomen. Bij dieren die tijdens het onderzoek stenen en bij dieren die aan het eind van de proefnemingen leven, wordt necropsie verricht.
Dieren die hevige en aanhoudende tekenen van nood en pijn vertonen, moeten eventueel op humane wijze worden gedood. Het doseren van teststoffen op een manier waarvan bekend is dat deze als gevolg van bijtende of irriterende eigenschappen pijn en nood veroorzaakt, behoeft niet te worden uitgevoerd.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Voorbereidingen
Vóór het onderzoek worden de dieren in hun proefkooien ten minste 5 dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Gezonde, jong volwassen dieren worden op een willekeurige manier vóór de behandeling in groepen ingedeeld. Ongeveer 24 uur vóór de proef wordt het haar op het ruggedeelte van de romp van de proefdieren door knippen of scheren verwijderd, bij het knippen of scheren moet erop worden gelet dat de huid niet wordt bekrast, omdat daardoor de doorlaatbaarheid van de huid zou kunnen veranderen. Ten minste 10 % van de lichaamsoppervlakte moet voor het aanbrengen van de teststof worden onthaard. Bij een proef met vaste stoffen, die eventueel tot een poeder kunnen worden fijngemaakt, moet de teststof voldoende met water of, zo nodig, met een passend medium worden bevochtigd, zodat de stof goed in contact met de huid komt. Als van een medium gebruik wordt gemaakt, moet rekening worden gehouden met de invloed hiervan op de mate waarin de huid de teststof doorlaat. Vloeibare teststoffen worden in het algemeen onverdund gebruikt.
1.6.2. Proefomstandigheden
1.6.2.1. Proefdieren
Er kan gebruik worden gemaakt van volwassen ratten of konijnen. Ook andere diersoorten kunnen worden gebruikt, maar de noodzakelijkheid hiervan moet worden gerechtvaardigd. De proef dient te worden uitgevoerd met een stam die gewoonlijk in laboratoria wordt gebruikt. Per geslacht mag bij het begin van de studie het gewicht van de dieren die worden gebruikt, niet meer dan 20 % van het gemiddelde gewicht afwijken.
1.6.2.2. Aantal en geslacht
Voor ieder dosisniveau moeten ten minste 5 knaagdieren worden gebruikt. Zij dienen van hetzelfde geslacht te zijn. Indien wijfjes worden gebruikt, moeten deze nullipaar zijn en niet zwanger. Indien informatie beschikbaar is die aantoont dat eén van beide geslachten duidelijk gevoeliger is, dienen dieren van dit geslacht gebruikt te worden.
Opmerking: In onderzoeken naar acute toxiciteit met dieren van een hogere orde dan knaagdieren, dienen kleinere aantallen in overweging te worden genomen. De doses dienen zorgvuldig te worden uitgekozen, en alle moeite dient te worden gedaan om matig toxische doses niet te boven te gaan. In dergelijke testen dient toediening van letale doses van de teststof te worden vermeden.
1.6.2.3. Dosisniveaus
Bij de proeven moeten voldoende (ten minste drie) dosisniveaus worden toegepast die zodanig onderling verschillen dat proefgroepen worden verkregen met duidelijke verschillen in toxische effecten en sterftecijfers. Bij de vaststelling van de dosisniveaus moet rekening worden gehouden met alle mogelijke irriterende of corrosieve effecten. De gegevens moeten voldoende zijn om een dosis/respons-curve te maken en om, indien mogelijk, op aanvaardbare wijze een LD50 te bepalen.
1.6.2.4. Limiettest
Een limiettest met een dosis van ten minste 2 000 mg/kg lichaamsgewicht wordt uitgevoerd op een groep van 5 mannetjes en 5 wijfjes, met behulp van de hierboven beschreven testmethode. Indien sterfte wordt vastgesteld die met de teststof verband houdt, moet het uitvoeren van een volledig testprogramma overwogen worden.
1.6.2.5. Observatieperiode
De observatieperiode moet ten minste 14 dagen bedragen. Deze duur van de observatie moet echter niet als een streng vastgelegde periode beschouwd worden, maar moet door de toxische reacties, het tijdstip waarop deze voor het eerst worden waargenomen en de duur van het herstel worden bepaald, de observatieperiode kan dus, indien noodzakelijk, worden verlengd. Van belang zijn het tijdstip waarop intoxicatieverschijnselen voor het eerst zijn waargenomen en het tijdstip waarop zij weer verdwijnen, hun duur en het tijdstip waarop de dood intreedt, in het bijzonder wanneer de kans bestaat voor een vertraagde sterfte.
1.6.3. Uitvoering
Ieder dier moet individueel in een kooi worden gehuisvest. De teststof wordt gelijkmatig verdeeld over een oppervlak van ongeveer 10 % van de totale lichaamsoppervlakte. Bij zeer toxische stoffen mag het te behandelen oppervlak kleiner zijn, maar een zo groot mogelijke oppervlakte moet worden bedekt met een zo dun en zo gelijkmatig mogelijk aangebrachte laag.
De teststof moet gedurende de expositietijd van 24 uur door middel van poreus verbandgaas en niet-irriterend plakband in contact met de huid blijven. Het behandelde gedeelte van de huid moet op een geschikte wijze verder worden bedekt om het verbandgaas en de teststof op hun plaats te houden en om te verhinderen dat de dieren de teststof langs orale weg opnemen. Hulpmiddelen om de dieren te fixeren, kunnen worden gebruikt om te voorkomen dat de dieren de teststof via de mond opnemen, maar het wordt niet aangeraden de dieren volledig te immobiliseren.
Aan het eind van de expositieperiode wordt de resterende teststof — zo mogelijk met water — van de huid verwijderd of anders door middel van een andere geschikte reinigingstechniek.
De gedane waarnemingen moeten systematisch worden geregistreerd voor ieder individueel dier. Tijdens de eerste dag worden de dieren regelmatig geobserveerd. Ten minste één keer per werkdag moet een zorgvuldig klinisch onderzoek worden verricht. De andere waarnemingen moeten iedere dag worden verricht, waarbij erop moet worden toegezien dat er zo weinig mogelijk dieren voor het onderzoek verloren gaan, bijvoorbeeld door necropsie of koeling van dood aangetroffen dieren en door afzondering of opoffering van zwakke of stervende dieren.
Bij het observeren wordt aandacht besteed aan veranderingen van vacht, behandelde huid, ogen, slijmvliezen, ademhaling, bloedsomloop, autonoom en centraal zenuwstelsel, somatomotorische activiteit en gedrag. Er moet bijzondere aandacht worden besteed aan de waarneming van tremoren, speekselvloed, diarree, lethargie, slaap en coma. Het tijdstip waarop de dood intreedt moet zo nauwkeurig mogelijk worden geregistreerd. Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het einde van de proefnemingen leven, wordt necropsie verricht. Alle macroscopisch waarneembare pathologische veranderingen worden geregistreerd. Als hiertoe aanleiding bestaat, worden weefselmonsters genomen voor histopathologisch onderzoek.
Bepaling van de toxiciteit bij het andere geslacht
Na het voltooien van de studie voor het ene geslacht, moet ten minste een groep van 5 dieren van het andere geslacht worden blootgesteld aan de stof om te verzekeren dat dit geslacht niet duidelijk gevoeliger is voor de teststof. In bepaalde gevallen kunnen redenen bestaan voor het gebruik van minder dieren. Indien voldoende informatie beschikbaar is om aan te tonen dat dieren van het geteste geslacht duidelijk gevoeliger zijn, mag het testen van het andere geslacht achterwege worden gelaten.
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek, het tijdstip waarop de dood intreedt bij de individuele dieren, het aantal dieren dat andere intoxicatieverschijnselen vertoont, een beschrijving van de toxische effecten en de bevindingen bij de necropsie. Het gewicht van ieder individueel dier wordt bepaald kort voordat de teststof wordt aangebracht, en vervolgens één keer iedere week en ten slotte bij zijn dood; veranderingen in het gewicht worden berekend en geregistreerd, indien de dieren langer dan één dag in leven blijven. Dieren die op humane wijze gedood worden omwille van nood of ongemak en pijn in verband met de stof, worden geregistreerd als gestorven in verband met de stof. De LD50 moet door middel van een erkende methode worden bepaald.
Bij de evaluatie van de gegevens moet ook aandacht worden besteed aan het eventuele verband dat bestaat tussen de blootstelling van de dieren aan de teststof en het aantal en de ernst van alle voorkomende afwijkingen, waaronder gedrags- en klinische afwijkingen, macroscopisch waarneembare beschadigingen, veranderingen in het lichaamsgewicht, sterfte en eventuele andere toxicologische effecten.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voeding, enzovoort; |
|
— |
proefomstandigheden (met vermelding van de wijze waarop de huid is schoongemaakt en het soort verband: occlusief of niet occlusief); |
|
— |
dosisniveaus (met het eventuele medium en de concentraties); |
|
— |
het geslacht van de blootgestelde dieren; |
|
— |
tabellarische gegevens betreffende de effecten per geslacht en dosisniveau (dat wil zeggen het aantal dieren dat tijdens de proef stierf of gedood werd, het aantal dieren dat intoxicatieverschijnselen vertoont, het aantal blootgestelde dieren); |
|
— |
het tijdstip na de blootstelling waarop de dood intreedt, redenen en criteria voor het op humane wijze doden van dieren; |
|
— |
alle waarnemingen; |
|
— |
de LD50 van het geslacht dat het volledige onderzoek onderging, bepaald na 14 dagen (waarbij de berekeningsmethode dient te worden omschreven); |
|
— |
95 %-betrouwbaarheidsinterval voor de LD50 (waar dit gegeven kan worden); |
|
— |
dosis/sterfte-curve met helling (indien dit bij de gebruikte bepalingsmethode mogelijk is); |
|
— |
bevindingen bij de necropsie; |
|
— |
eventuele histopathologische bevindingen; |
|
— |
resultaten van de test die eventueel op het andere geslacht werd uitgevoerd; |
|
— |
bespreking van de resultaten (speciale aandacht dient besteed te worden aan het effect dat het op humane wijze doden van dieren tijdens de proeven zou kunnen hebben op de berekende LD50); |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie algemene inleiding deel B (punt D).
4. LITERATUUR
Zie algemene inleiding deel B (punt E).
B.4. ACUTE TOXICITEIT: HUIDIRRITTATIE/CORROSIE
1. METHODE
Deze methode is gelijkwaardig aan TG 404 (2002) van de OESO.
1.1. INLEIDING
Bij de samenstelling van deze bijgewerkte methode is bijzondere aandacht besteed aan mogelijke verbeteringen met het oog op het welzijn van de dieren en aan de evaluatie van alle bestaande informatie over de teststof om onnodige tests bij proefdieren te vermijden. In deze methode wordt de aanbeveling opgenomen de bestaande relevante gegevens op bewijskracht te analyseren, alvorens de beschreven in-vivo test op corrosie/irritatie van de stof wordt uitgevoerd. Wanneer er onvoldoende gegevens beschikbaar zijn, kunnen ze worden aangevuld door een sequentiële teststrategie te volgen (1). De aanbevolen teststrategie omvat de uitvoering van gevalideerde en erkende in-vitro tests en is als bijlage bij deze methode opgenomen. Bovendien wordt aanbevolen bij de voorlopige in-vivo test de drie testgaasjes waar mogelijk niet tegelijkertijd maar achtereenvolgens aan te brengen.
In het belang van zowel wetenschappelijke kwaliteit als het dierenwelzijn moeten er geen in-vivo tests worden uitgevoerd voordat alle beschikbare gegevens over de mogelijke huidcorrosie/irritatie door de stof zijn geëvalueerd op bewijskracht. Hierbij gaat het bijvoorbeeld om de resultaten van eerdere studies bij mensen en/of proefdieren, gegevens over corrosie/irritatie door een of meer qua structuur verwante stoffen of mengsels van dergelijke stoffen, gegevens waaruit blijkt dat de stof sterk zuur of sterk alkalisch is (2)(3), en resultaten van gevalideerde en erkende in-vitro- of ex-vivo tests (4)(5)(5a). Door een dergelijke analyse zijn er minder in-vivo tests nodig op huidcorrosie/irritatie door stoffen waarvoor al voldoende bewijsmateriaal bestaat uit andere onderzoeken met deze twee eindpunten.
Een aanbevolen sequentiële teststrategie, waarin de uitvoering van gevalideerde en erkende in-vitro- of ex-vivo tests op corrosie/irritatie is opgenomen, is als bijlage bij deze methode opgenomen. De strategie is ontwikkeld tijdens een OESO-workshop (6), met algemene stemmen door de deelnemers aanbevolen en als aanbevolen teststrategie opgenomen in het „Globally Harmonised System for the Classification of Chemical Substances” (GHS) (7). Hoewel deze sequentiële teststrategie geen integrerend onderdeel van testmethode B 4 is, wordt aanbevolen deze teststrategie te volgen alvorens in-vivo tests uit te voeren. Voor nieuwe stoffen is het de aanbevolen stapsgewijze testbenadering om wetenschappelijk verantwoorde gegevens over corrosie/irritatie door de stof te verkrijgen. Wanneer er voor bestaande stoften onvoldoende gegevens over de huidcorrosie/irritatie beschikbaar zijn, moet de strategie worden gebruikt om ontbrekende gegevens aan te vullen. Voor het gebruik van een andere teststrategie of -procedure of de beslissing om geen stapsgewijze testbenadering te volgen moet een motivering worden gegeven.
Als bij een bewijskrachtanalyse niet kan worden geconcludeerd of er sprake is van corrosie of irritatie, moet overeenkomstig de sequentiële teststrategie een in-vivo test worden overwogen (zie de bijlage).
1.2. DEFINITIES
Huidirritatie: het ontstaan van een omkeerbare beschadiging van de huid na het aanbrengen van een teststof gedurende maximaal 4 uur.
Huidcorrosie: het ontstaan van een onomkeerbare beschadiging van de huid, namelijk zichtbare necrose door de epidermis heen in de dermis, na het aanbrengen van een teststof gedurende maximaal 4 uur. Corrosie-reacties worden gekenmerkt door zweren, bloedingen, bloedkorsten en, tegen het eind van de observatieperiode van 14 dagen, ontkleuring door bleking van de huid, gebieden met volledige haaruitval en littekens. Voor de beoordeling van twijfelachtige letsels moet histopathologie worden overwogen.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof wordt in een dosis op de huid van een proefdier aangebracht; de onbehandelde huid van het proefdier wordt als controle gebruikt. De mate van irritatie/corrosie wordt op bepaalde tijdstippen afgelezen en ingeschaald en wordt nader beschreven om een volledige evaluatie van de effecten mogelijk te maken. De duur van de studie moet voldoende zijn om te kunnen beoordelen of de waargenomen effecten reversibel of irreversibel van aard zijn.
Dieren die gedurende een fase van de test voortdurend tekenen van ernstig ongerief en/of hevige pijn vertonen, moeten op humane wijze worden gedood en de stof dient dienovereenkomstig te worden beoordeeld. Voor criteria voor de beslissing om stervende en hevig lijdende dieren op humane wijze te doden wordt verwezen naar referentie (8).
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding van de in-vivo test
1.4.1.1. Keuze van de diersoort
Als proefdier wordt de voorkeur gegeven aan het albinokonijn en er worden gezonde jonge volwassen konijnen gebruikt. Wanneer er een andere soort wordt gebruikt, moet hiervoor een motivering worden gegeven.
1.4.1.2. Voorbereiding van de dieren
Ongeveer 24 uur voor de test wordt het haar op het ruggedeelte van de romp van de dieren door kort afknippen verwijderd. Er moet op worden gelet dat de huid niet wordt geschaafd. Alleen dieren met een gezonde en gave huid mogen worden gebruikt.
Sommige konijnenstammen hebben plekken met dichte haargroei, die in bepaalde perioden van het jaar meer op de voorgrond treden. De test mag niet op deze plekken met dichte haargroei worden uitgevoerd.
1.4.1.3. Huisvesting en voeding
De dieren worden in aparte kooien gehuisvest. De temperatuur in de proefdierruimte dient 20 oC (± 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater.
1.4.2. Testprocedure
1.4.2.1. Het aanbrengen van de teststof
De teststof wordt aangebracht op een klein huidoppervlak (ongeveer 6 cm2) en de plek wordt bedekt met een gaasje dat met behulp van niet-irriterend plakband op zijn plaats wordt gehouden. Wanneer de stof niet direct kan worden aangebracht (bijvoorbeeld bij vloeistoffen of bepaalde pasta's), wordt de teststof eerst op het gaasje aangebracht en wordt dit daarna op de huid bevestigd. Het gaasje moet gedurende de blootstellingsperiode door middel van een geschikt semi-occlusief verband in licht contact met de huid blijven. Als de teststof op het gaasje wordt aangebracht, moet dit zodanig op de huid worden bevestigd dat er een goed contact en een uniforme verdeling van de stof op de huid is. Er moet tevens voor worden gezorgd dat het gaasje voor het dier onbereikbaar is en dat inslikken of inademen van de teststof onmogelijk is.
Vloeibare stoffen worden in het algemeen onverdund gebruikt. Bij een proef met vaste stoffen (die indien nodig eventueel kunnen worden verpoederd) moet de teststof met een zo klein mogelijke hoeveelheid water (of indien nodig een ander geschikt medium) worden bevochtigd om voor een goed contact met de huid te zorgen. Wanneer een ander medium dan water wordt gebruikt, moet een eventuele invloed van het medium op de irritatie van de huid door de teststof minimaal zijn.
Aan het einde van de blootstellingsperiode, die normaal gesproken 4 uur bedraagt, moeten de resten van de teststof zo mogelijk met water of met een geschikt oplosmiddel worden verwijderd zonder de bestaande respons of de intacte epidermis te wijzigen.
1.4.2.2. Dosisniveau
Een dosis van 0,5 ml vloeistof of 0,5 g vaste stof of pasta wordt op het testgedeelte van de huid aangebracht.
1.4.2.3. Voorlopige test (in-vivo test op huidirritatie/corrosie met één dier)
Het is zeer wenselijk dat de in-vivo test in eerste instantie met één dier wordt uitgevoerd, vooral wanneer wordt vermoed dat de stof corrosie kan veroorzaken. Dit is in overeenstemming met de sequentiële teststrategie (zie bijlage 1).
Wanneer een stof op basis van een bewijskrachtanalyse als corrosief wordt beschouwd, zijn er geen verdere dierproeven nodig. Bij de meeste stoffen waarvan wordt vermoed dat ze corrosief zijn, zijn verdere in-vivo tests normaal gesproken niet nodig. Wanneer aanvullende gegevens nodig worden geacht omdat het bewijsmateriaal onvoldoende is, kunnen echter met de volgende aanpak beperkte dierproeven worden uitgevoerd. Bij het dier worden achtereenvolgens maximaal drie testgaasjes aangebracht. Het eerste gaasje wordt na drie minuten verwijderd. Als er geen ernstige huidreactie wordt waargenomen, wordt een tweede gaasje aangebracht dat na een uur wordt verwijderd. Als de waarnemingen in deze fase erop wijzen dat het niet onmenselijk is de blootstelling tot vier uur te verlengen, wordt een derde gaasje aangebracht, dat na vier uur wordt verwijderd, en wordt de reactie ingeschaald.
Als er na een van de drie achtereenvolgende blootstellingen een corrosiereactie wordt waargenomen, wordt de test onmiddellijk gestaakt. Als er na de verwijdering van het laatste gaasje geen corrosiereactie wordt waargenomen, wordt het dier gedurende 14 dagen geobserveerd tenzij er vóór die tijd al corrosie ontstaat.
Wanneer er niet wordt verwacht dat de teststof corrosie veroorzaakt maar deze wel irriterend kan zijn, wordt er één gaasje gedurende vier uur op één dier aangebracht.
1.4.2.4. Bevestigende test (in-vivo test op huidirritatie/corrosie met meer dieren)
Als er bij de voorlopige test geen corrosiereactie wordt waargenomen, moet de irritatie of negatieve reactie worden bevestigd met nog eens twee dieren die elk gedurende vier uur aan één gaasje worden blootgesteld. Als er bij de voorlopige test irritatie wordt waargenomen, kan de bevestigende test op sequentiële wijze worden uitgevoerd of door nog eens twee dieren tegelijkertijd bloot te stellen. Wanneer in een uitzonderlijk geval de voorlopige test niet wordt uitgevoerd, kunnen twee of drie dieren met één gaasje worden behandeld dat na vier uur wordt verwijderd. Wanneer er twee dieren worden gebruikt die beide dezelfde reactie vertonen, is verder testen niet nodig. Als de reactie verschilt, wordt ook het derde dier getest. Er kunnen extra dieren nodig zijn om duidelijkheid te krijgen omtrent moeilijk te interpreteren reacties.
1.4.2.5. Observatieperiode
De duur van de observatieperiode moet voldoende zijn om volledig te kunnen beoordelen of de waargenomen effecten reversibel zijn. Het experiment moet echter worden beëindigd zodra het dier voortdurend tekenen van hevige pijn of ernstig ongerief vertoont. Om te bepalen of de effecten reversibel zijn, moeten de dieren maximaal 14 dagen na de verwijdering van de gaasjes worden geobserveerd. Als al vóór het verstrijken van de 14 dagen wordt geconstateerd dat de effecten reversibel zijn, wordt het experiment op dat moment beëindigd.
1.4.2.6. Klinische observatie en inschaling van de huidreacties
Alle dieren worden op tekenen van erytheem en oedeem onderzocht en de respons wordt 60 minuten en vervolgens 24, 48 en 72 uur na de verwijdering van het gaasje ingeschaald. Bij de voorlopige test bij één dier wordt de huid ook onmiddellijk na de verwijdering van het gaasje onderzocht. De huidreactie wordt in een van de categorieën in de tabel ingeschaald en geregistreerd. Als er sprake is van een beschadiging van de huid die na 72 uur niet als irritatie of corrosie kan worden geïdentificeerd, kan het nodig zijn de observatie tot dag 14 voort te zetten om te bepalen of de effecten reversibel zijn. Naast de observatie van irritatie worden ook alle lokale toxische effecten, zoals ontvetting van de huid, en alle systemische schadelijke effecten (zoals effecten op klinische toxiciteitsverschijnselen en het lichaamsgewicht) volledig beschreven en geregistreerd. Om duidelijkheid te krijgen omtrent moeilijk te interpreteren reacties moet histopathologisch onderzoek worden overwogen.
De inschaling van huidreacties is per definitie subjectief. Om harmonisatie bij de inschaling van huidreacties te bevorderen en ter ondersteuning van de testlaboratoria en de personen die bij het uitvoeren en het interpreteren van de observatie betrokken zijn, moet het personeel dat de observatie uitvoert afdoende zijn opgeleid in het gebruikte scoresysteem (zie de tabel). Een geïllustreerde leidraad voor de inschaling van huidirritatie en ander letsel kan nuttig zijn (9). De inschaling van de huidreacties moet blind gebeuren.
2. GEGEVENS
2.1. VERMELDING VAN DE RESULTATEN
De resultaten van het onderzoek worden in het eindverslag in tabelvorm vermeld en hierin worden alle onder punt 3.1 vermelde gegevens opgenomen.
2.2. EVALUATIE VAN DE RESULTATEN
De scores voor de huidirritatie worden in samenhang met de aard en ernst van het letsel en de vraag of dit al dan niet reversibel is, beoordeeld. De individuele scores vormen geen absolute norm voor de irriterende eigenschappen van een materiaal, aangezien ook andere effecten van het testmateriaal worden beoordeeld. De individuele scores moeten veeleer als referentiewaarden worden beschouwd, die in combinatie met alle andere observaties tijdens het onderzoek moeten worden geëvalueerd.
Bij de beoordeling van de irritatiereactie moet rekening worden gehouden met de reversibiliteit van het huidletsel. Wanneer reacties als haaruitval (beperkt gebied), hyperkeratose, hyperplasie en schilfering tot het einde van de observatieperiode van 14 dagen blijven bestaan, moet de teststof als irriterend worden beschouwd.
3. RAPPORTACE
3.1. TESTVERSLAG
In het testverslag wordt de volgende informatie opgenomen:
|
|
Motivering voor in-vivo test: bewijskrachtanalyse van reeds bestaande testgegevens, zoals de resultaten van een sequentiële teststrategie:
|
|
|
Teststof:
|
|
|
Medium:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
4. REFERENTIES
|
(1) |
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995). The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410-429. |
|
(2) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26. |
|
(3) |
Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998). Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709-720. |
|
(4) |
ECETOC (1990) Monograph No. 15, „Skin Irritation”, European Chemical Industry, Ecology and Toxicology Centre, Brussels. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483-524. |
|
(5a) |
Testmethode B 40: Huidcorrosie. |
|
(6) |
OECD (1996). OECD Test Guidelines Programme: Final Report of the OECD Workshop onHarmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http.//www.oecd1.org/ehs/test/background.htm). |
|
(7) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm). |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 19 (http://www.oecd1.org/ehs/test/monos.htm). |
|
(9) |
EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990. [op verzoek verkrijgbaar bij het OESO secretariaat]. |
Tabel I:
INSCHALING VAN DE HUIDREACTIES
Vorming van erytheem en korsten
|
Geen erytheem |
0 |
|
Zeer licht erytheem (nauwelijks waarneembaar) |
1 |
|
Duidelijk gedefinieerd erytheem |
2 |
|
Matig tot ernstig erytheem |
3 |
|
Ernstig erytheem (diep rood) tot korstvorming waardoor de inschaling van erytheem onmogelijk is |
4 |
Maximale score 4
Vorming van oedeem
|
Geen oedeem |
0 |
|
Zeer licht oedeem (nauwelijks waarneembaar) |
1 |
|
Licht oedeem (de randen van het gebied zijn goed zichtbaar door duidelijke zwelling) |
2 |
|
Matig oedeem (ongeveer 1 mm zwelling) |
3 |
|
Ernstig oedeem (meer dan 1 mm zwelling tot buiten het blootstellingsgebied) |
4 |
Maximale score. 4
Om duidelijkheid te krijgen omtrent moeilijk te interpreteren reacties kan histopathologisch onderzoek worden uitgevoerd.
BIJLAGE
Een sequentiële teststrategie voor huidirritatie en -corrosie
ALGEMENE OVERWEGINGEN
In het belang van verantwoorde wetenschap en het welzijn van dieren is het belangrijk dat het onnodig gebruik van dieren wordt vermeden en dat tests waarvan hevige reacties bij dieren worden verwacht, tot een minimum worden beperkt. Alle informatie over een stof die relevant is voor de mogelijke huidirritatie/corrosie door die stof moet worden geëvalueerd voordat een in-vivotest wordt overwogen. Wellicht bestaat er al voldoende bewijsmateriaal om een teststof qua mogelijke huidirritatie of -corrosie in te delen zonder dat er tests bij proefdieren behoeven te worden uitgevoerd. Daarom zal het gebruik van een bewijskrachtanalyse en een sequentiële teststrategie de noodzaak van in-vivotests tot een minimum beperken, vooral als er van de stof hevige reacties worden verwacht.
Het gebruik van een bewijskrachtanalyse voor de evaluatie van bestaande informatie over huidirritatie en -corrosie door stoffen wordt aanbevolen om te bepalen of ander aanvullend onderzoek dan in-vivohuidonderzoek moet worden uitgevoerd om te helpen bij de bepaling van deze mogelijke effecten. Wanneer nader onderzoek nodig is, wordt aanbevolen de sequentiële teststrategie te gebruiken om de relevante experimentele gegevens te verkrijgen. Voor stoffen die nog niet zijn getest, moet de sequentiële teststrategie worden gebruikt om de gegevens te vergaren die nodig zijn om de mogelijke huidirritatie/corrosie te bepalen. De in deze bijlage beschreven teststrategie is tijdens een OESO-workshop (1) ontwikkeld en later bevestigd en opgenomen in het „Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances”, die de steun heeft gekregen van de 28e gezamenlijke vergadering van het Comité chemische stoffen en de Werkgroep chemische stoffen in november 1998 (2).
Hoewel deze sequentiële teststrategie geen integrerend onderdeel van testmethode B.4 is, vormt zij de aanbevolen aanpak voor de bepaling van de kenmerken qua huidirritatie/corrosie. Deze aanpak houdt zowel een optimale gedragscode als een ethische referentie voor in-vivotests op huidirritatie/corrosie in. De testmethode bevat een leidraad voor de uitvoering van de in-vivotest en geeft een overzicht van de factoren die vóór het begin van een dergelijke test in aanmerking moeten worden genomen. De strategie levert een benadering voor de evaluatie van bestaande gegevens over de eigenschappen van teststoffen inzake huidirritatie/corrosie en een trapsgewijze aanpak voor het vergaren van relevante gegevens over stoffen waarvoor nader onderzoek nodig is of waarvoor nog geen onderzoek is uitgevoerd. Ook wordt aanbevolen onder bepaalde omstandigheden gevalideerde en erkende in-vitro- of ex-vivotests op huidirritatie/corrosie uit te voeren.
BESCHRIJVING VAN DE EVALUATIE EN DE TESTSTRATEGIE
Alvorens te beginnen met tests als onderdeel van de sequentiële teststrategie (zie figuur), moet alle beschikbare informatie worden geëvalueerd om te bepalen of in-vivohuidonderzoek nodig is. Hoewel de evaluatie van individuele parameters (bijvoorbeeld een extreme pH) significante informatie kan opleveren, moet rekening worden gehouden met alle bestaande informatie. Alle relevante gegevens over de effecten van de betrokken stof of analoge verbindingen moeten bij het nemen van een beslissing over de bewijskracht worden geëvalueerd en er moet een motivering voor de beslissing worden gegeven. De nadruk moet in eerste instantie liggen op bestaande gegevens over de effecten van de stof bij mens en dier en vervolgens op de resultaten van in-vitro- of ex-vivotests. Waar mogelijk moet in-vivo-onderzoek aan corrosieve stoffen worden vermeden. Bij de teststrategie spelen de volgende factoren een rol:
Evaluatie van bestaande gegevens over de effecten bij mens en dier (stap 1). In de eerste plaats moet worden gekeken naar bestaande gegevens over de effecten bij de mens, zoals klinisch of bedrijfsgeneeskundig onderzoek en ziektegevallen, en/of gegevens van dierproeven, bijvoorbeeld van onderzoek naar huidtoxiciteit bij eenmalige of herhaalde blootstelling, omdat deze informatie opleveren die rechtstreeks verband houdt met huideffecten. Bij stoffen waarvan bekend is dat ze irritatie of corrosie veroorzaken en stoffen waarvoor duidelijk is aangetoond dat dit niet het geval is, behoeven geen in-vivotests te worden uitgevoerd.
Analyse van structuuractiviteit-relaties (SAR) (stap 2). Er moet worden gekeken naar de resultaten van tests met qua structuur verwante stoffen, indien deze beschikbaar zijn. Wanneer er voldoende gegevens beschikbaar zijn over de effecten van qua structuur verwante stoffen of mengsels van dergelijke stoffen bij mens en/of dier om te kunnen concluderen dat deze huidcorrosie/irritatie kunnen veroorzaken, mag worden aangenomen dat de te evalueren teststof tot dezelfde reacties zal leiden. In dat geval behoeft de stof wellicht niet te worden getest. Negatieve gegevens van onderzoek met qua structuur verwante stoffen of mengsels van dergelijke stoffen vormen in het kader van de sequentiële teststrategie niet een afdoende bewijs dat de stof geen corrosie of irritatie veroorzaakt. Voor de bepaling van de potentie voor zowel huidcorrosie als -irritatie moeten gevalideerde en erkende SAR-methoden worden gebruikt.
Fysisch-chemische eigenschappen en chemische reactiviteit (stap 3). Stoffen met een extreme pH van bijvoorbeeld < 2,0 en ≥ 11,5 kunnen hevige lokale effecten hebben. Als een stof op basis van een extreme pH als corrosief voor de huid wordt aangeduid, kan ook rekening worden gehouden met zijn zuur/alkalireserve (of buffercapaciteit) (3)(4). Als de buffercapaciteit erop wijst dat een stof wellicht niet corrosief voor de huid is, moeten er nadere tests worden uitgevoerd om dit te bevestigen, waarbij bij voorkeur een gevalideerde en erkende in-vitro- of ex-vivotest moet worden gebruikt (zie de stappen 5 en 6).
Huidtoxiciteit (slap 4). Als van een stof is aangetoond dat deze via de huid zeer toxisch is, is een in-vivo-onderzoek naar huidirritatie/corrosie wellicht niet uitvoerbaar, omdat de normaal gesproken gebruikte hoeveelheid teststof al groter kan zijn dan de zeer toxische dosis en derhalve tot gevolg kan hebben dat de dieren sterven of hevig lijden. Wanneer er al onderzoek naar de huidtoxiciteit bij albinokonijnen tot de limietdosis van 2 000 mg/kg lichaamsgewicht of meer is uitgevoerd en er geen huidirritatie of -corrosie is waargenomen, zijn verdere tests op huidirritatie/corrosie bovendien wellicht niet nodig. Bij de evaluatie van acute huidtoxiciteit bij eerder uitgevoerd onderzoek moet er op een aantal aspecten worden gelet. Zo kan de gerapporteerde informatie over huidletsel onvolledig zijn. De tests en observaties kunnen bij een andere soort dan het konijn zijn uitgevoerd en de gevoeligheid kan van soort tot soort sterk verschillen. Het is ook mogelijk dat de stof op de dieren is aangebracht in een vorm die niet geschikt is voor de beoordeling van huidirritatie/corrosie, bijvoorbeeld omdat de stof voor de test op huidtoxiciteit is verdund (5). Wanneer er echter goed opgezette en uitgevoerde onderzoeken op huidtoxiciteit bij konijnen zijn verricht, kunnen negatieve resultaten als voldoende bewijs worden beschouwd dat de stof geen corrosie of irritatie veroorzaakt.
Resultaten van in-vitro of ex-vivotests (stappen 5 en 6). Stoffen waarvan met een gevalideerde en erkende in-vitro of ex-vivotest (6)(7), die voor de beoordeling van deze specifieke effecten is opgezet, is aangetoond dat ze corrosieve of ernstig irriterende eigenschappen hebben, behoeven niet bij dieren te worden getest. Er kan worden aangenomen dat dergelijke stoffen in vivo vergelijkbare hevige effecten veroorzaken.
In-vivotest bij konijnen (stappen 7 en 8). Wanneer op grond van de bewijskracht wordt besloten over te gaan tot in-vivotests, dient eerst een voorlopige test met één dier te worden gedaan. Als de resultaten van deze test erop wijzen dat de stof corrosief voor de huid is, dienen er geen verdere tests te worden uitgevoerd. Als er bij de voorlopige test geen corrosief effect wordt waargenomen, moet de irritatiereactie of de negatieve respons worden bevestigd met ten hoogste nog eens twee dieren gedurende een blootstellingsperiode van vier uur. Als er bij de voorlopige test een irritatiereactie wordt waargenomen, kan de bevestigingstest sequentieel of door gelijktijdige blootstelling van de twee dieren worden uitgevoerd.
REFERENTIES
|
(1) |
OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996 (http://wwwl.oecd.org/ehs/tests/background.htm). |
|
(2) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://wwwl.oecd.org/ehs/Class/HCL6.htm). |
|
(3) |
Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, 709-720. |
|
(4) |
Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic In Vitro, 2 (1) pp 19-26. |
|
(5) |
Patil, S.M., Patrick, E., Maibach, H.I. (1996). Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, 411-436. |
|
(6) |
Testmethode B.40. |
|
(7) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483-524. |
Figuur
TEST- EN EVALUATIESTRATEGIE VOOR HUIDIRRITATIE/CORROSIE

B.5. ACUTE TOXICITEIT: OOGIRRITATIE/CORROSIE
1. METHODE
Deze methode is gelijkwaardig aan TG 405 (2002) van de OESO.
1.1. INLEIDING
Bij de samenstelling van deze bijgewerkte methode is bijzondere aandacht besteed aan mogelijke verbeteringen via de evaluatie van alle bestaande informatie over de teststof om onnodige tests bij proefdieren te vermijden en zodoende rekening te houden met de bezorgdheid omtrent het welzijn van dieren. In deze methode wordt de aanbeveling opgenomen de bestaande relevante gegevens op bewijskracht te analyseren (1), alvorens de beschreven in-vivotest op acute oogirritatie/corrosie wordt uitgevoerd. Wanneer er onvoldoende gegevens beschikbaar zijn, wordt aanbevolen deze aan te vullen door een sequentiële teststrategie te volgen (2)(3). De aanbevolen teststrategie omvat de uitvoering van gevalideerde en erkende in-vitrotests en is als bijlage bij de testmethode opgenomen. Bovendien wordt aanbevolen als prognose voor oogcorrosie een in-vivotest op huidirritatie/corrosie uit te voeren alvorens een in-vivo-oogtest te overwegen.
In het belang van zowel wetenschappelijke kwaliteit als het dierenwelzijn moeten er geen in-vivotests worden overwogen voordat alle beschikbare gegevens over de mogelijke oogcorrosie/irritatie door de stof zijn geëvalueerd op bewijskracht. Hierbij gaat het bijvoorbeeld om de resultaten van eerdere studies bij mensen en/of proefdieren, gegevens over corrosie/irritatie door een of meer qua structuur verwante stoffen of mengsels van dergelijke stoffen, gegevens waaruit blijkt dat de stof sterk zuur of sterk alkalisch is (4)(5), en resultaten van gevalideerde en erkende in-vitro- of ex-vivotests op huidcorrosie en -irritatie (6)(6a). De studies kunnen al vóór de bewijskrachtanalyse zijn uitgevoerd, maar dit kan ook naar aanleiding van deze analyse gebeuren.
Voor bepaalde stoffen kan uit een dergelijke analyse blijken dat er een in-vivo-onderzoek naar een mogelijke oogcorrosie/irritatie door de stof nodig is. In al deze gevallen verdient het de voorkeur, alvorens het gebruik van de in-vivo-oogtest te overwegen, eerst overeenkomstig testmethode B.4 (7) een onderzoek naar de in-vivohuideffecten van de stof uit te voeren en te beoordelen. Door toepassing van een bewijskrachtanalyse en de sequentiële teststrategie zal het minder vaak nodig zijn de in-vivotest op oogcorrosie/irritatie uit te voeren met stoffen waarvoor al voldoende bewijsmateriaal uit andere studies bestaat. Als met de sequentiële teststrategie niet kan worden bepaald of er sprake is van een mogelijke oogcorrosie of -irritatie, zelfs na de uitvoering van een in-vivo-onderzoek naar huidcorrosie en -irritatie, kan een in-vivotest op oogcorrosie/irritatie worden uitgevoerd.
Een aanbevolen sequentiële teststrategie, waarin de uitvoering van gevalideerde in-vitro- of ex-vivotests op corrosie/irritatie is opgenomen, is in de bijlage van deze testmethode opgenomen. De strategie is ontwikkeld tijdens een OESO-workshop (8), met algemene stemmen door de deelnemers aanbevolen en als aanbevolen teststrategie opgenomen in het „Globally Harmonised System for the Classification of Chemical Substances” (GHS) (9). Hoewel deze sequentiële teststrategie geen integrerend onderdeel van testmethode B.5 is, wordt aanbevolen deze teststrategie te volgen alvorens in-vivotests uit te voeren. Voor nieuwe stoffen is het de aanbevolen stapsgewijze testbenadering om wetenschappelijk verantwoorde gegevens over corrosie/irritatie door de stof te verkrijgen. Wanneer er voor bestaande stoffen onvoldoende gegevens over de huid- en oogcorrosie/irritatie beschikbaar zijn, moet de strategie worden gebruikt om ontbrekende gegevens aan te vullen. Voor het gebruik van een andere teststrategie of -procedure of de beslissing om geen stapsgewijze testbenadering te volgen moet een motivering worden gegeven.
1.2. DEFINITIES
Oogirritatie: het ontstaan van veranderingen in het oog na het aanbrengen van een teststof op het oppervlak aan de voorzijde van het oog, die binnen 21 dagen na het aanbrengen volledig reversibel zijn.
Oogcorrosie: het ontstaan van weefselbeschadiging in het oog of een ernstige fysieke zichtvermindering na het aanbrengen van een teststof op het oppervlak aan de voorzijde van het oog, die binnen 21 dagen na het aanbrengen niet volledig reversibel is.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof wordt in één dosis op een van de ogen van het proefdier aangebracht; het onbehandelde oog wordt als controle gebruikt. De mate van oogirritatie/corrosie wordt geëvalueerd door op bepaalde tijdstippen het letsel aan de conjunctiva, de cornea en de iris in te schalen. Ook andere effecten in het oog en schadelijke systemische effecten worden beschreven om een volledige evaluatie van de effecten mogelijk te maken. De duur van de studie moet voldoende zijn om te kunnen beoordelen of de effecten reversibel of irreversibel van aard zijn.
Dieren die gedurende een fase van de test voortdurend tekenen van ernstig ongerief en/of hevige pijn vertonen, moeten op humane wijze worden gedood en de stof dient dienovereenkomstig te worden beoordeeld. Voor criteria voor de beslissing om stervende en hevig lijdende dieren op humane wijze te doden wordt verwezen naar referentie (10).
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding van de in-vivotest
1.4.1.1. Keuze van de soort
Als proefdier wordt de voorkeur gegeven aan het albinokonijn en er worden gezonde jonge volwassen dieren gebruikt. Wanneer er een andere stam of soort wordt gebruikt, moet hiervoor een motivering worden gegeven.
1.4.1.2. Voorbereiding van de dieren
Beide ogen van ieder voorlopig voor de test geselecteerd proefdier worden binnen 24 uur vóór het begin van de test onderzocht. Dieren die aan oogirritatie, oogaandoeningen of een reeds bestaand cornealetsel lijden, mogen niet worden gebruikt.
1.4.1.3. Huisvesting en voeding
De dieren worden in aparte kooien gehuisvest. De temperatuur in de proefdierruimte dient voor konijnen 20 oC (+ 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater.
1.4.2. Testprocedure
1.4.2.1. Het aanbrengen van de teststof
De teststof wordt bij elk dier aangebracht in de conjunctivaalzak van één oog, waarbij het onderste ooglid voorzichtig van de oogbol wordt weggetrokken. Vervolgens worden de oogleden ongeveer één seconde zachtjes dichtgehouden om verlies van het materiaal te voorkomen. Het andere oog, dat niet behandeld wordt, fungeert als controle.
1.4.2.2. Irrigatie
De ogen van de proefdieren mogen gedurende ten minste 24 uur na het indruppelen van de teststof niet worden uitgewassen, tenzij het om een vaste stof gaat (zie punt 1.4.2.3.2) of wanneer er sprake is van onmiddellijke corrosieve of irriterende effecten. Na 24 uur mogen de ogen eventueel worden uitgewassen.
Het gebruik van een satellietgroep om de invloed van het uitwassen te onderzoeken wordt niet aanbevolen, tenzij dit wetenschappelijk verantwoord is. Als er een satellietgroep nodig is, dienen hiervoor twee konijnen te worden gebruikt. De wijze van uitwassen, waarbij het bijvoorbeeld gaat om het tijdstip, de samenstelling en temperatuur van de wasvloeistof, de duur, het volume en de stroomsnelheid, moet zorgvuldig worden vastgelegd.
1.4.2.3. Dosisniveau
1.4.2.3.1. Vloeibare teststoffen
Bij vloeibare reststoffen wordt een dosis van 0,1 ml gebruikt. Er mogen geen sproeipompjes worden gebruikt om de stof rechtstreeks in het oog te brengen. De vloeistof wordt na het sproeien opgevangen en vervolgens wordt 0,1 ml in het oog gedruppeld.
1.4.2.3.2. Vaste teststoffen
Bij het testen van vaste stoffen, pasta's en vaste deeltjes wordt een hoeveelheid met een volume van 0,1 ml of een gewicht van ten hoogste 100 mg gebruikt. Het testmateriaal wordt tot een fijn poeder vermalen. Alvorens het volume te meten wordt het vaste materiaal licht ingeklonken, bijvoorbeeld door tegen de houder te tikken. Als de vaste stof op het eerste observatietijdstip (1 uur na de behandeling) nog niet door fysiologische mechanismen uit het oog van het proefdier is verwijderd, kan het oog met fysiologisch zout of gedestilleerd water worden uitgewassen.
1.4.2.3.3. Aerosol-teststoffen
Aanbevolen wordt alle sproeivloeistoffen en aerosolen op te vangen voordat ze in het oog worden gedruppeld. Er wordt alleen een uitzondering gemaakt voor stoffen in spuitbussen onder druk, die niet kunnen worden opgevangen omdat ze verdampen. In deze gevallen wordt het oog opengehouden en wordt de teststof aan het oog toegediend door in één keer gedurende ongeveer één seconde vanaf een afstand van 10 cm recht voor het oog te spuiten. Deze afstand kan afhankelijk van de druk van de nevel en de inhoud worden aangepast. Er moet voor worden gezorgd dat het oog niet door de druk van de nevel wordt beschadigd. In bepaalde gevallen kan het nodig zijn na te gaan of een „mechanische” beschadiging van het oog door de druk van de nevel mogelijk is.
De dosis uit een spuitbus kan door een simulatie als volgt worden geraamd: de stof wordt door een opening die zo groot is als het oog van een konijn en recht voor het papier wordt gehouden, op een weegpapiertje gespoten. De gewichtstoename van het papier wordt gebruikt voor een benadering van de hoeveelheid die in het oog wordt gespoten. Bij vluchtige stoffen kan de dosis worden geraamd door een opvangbakje voor en na de verwijdering van het testmateriaal te wegen.
1.4.2.4. Voorlopige test (in-vivotest op oogirritatie/corrosie met één dier)
Zoals in de sequentiële teststrategie (zie bijlage 1) wordt gesteld, is het zeer wenselijk dat de in-vivotest in eerste instantie met één dier wordt uitgevoerd.
Als de resultaten van deze test erop wijzen dat de stof bij gebruik van de beschreven procedure corrosief of hevig irriterend is, dienen er geen verdere tests op oogirritatie te worden uitgevoerd.
1.4.2.5. Lokale anesthetica
Van geval tot geval kan worden bekeken of er lokale anesthetica moeten worden gebruikt. Als de bewijskrachtanalyse erop wijst dat de stof pijn kan veroorzaken of als uit de eerste tests blijkt dat er een pijnlijke reactie optreedt, kan vóór het indruppelen van de teststof een lokaal anestheticum worden toegediend. De aard, de concentratie en de dosis van het lokaal anestheticum moeten met zorg worden gekozen om ervoor te zorgen dat het gebruik niet leidt tot verschillen in de reactie op de teststof. Het controleoog moet op dezelfde wijze worden verdoofd.
1.4.2.6. Bevestigende test (in-vivotest op oogirritatie/corrosie met meer dieren)
Als er bij de voorlopige test geen corrosiereactie wordt waargenomen, moet de irritatie of negatieve reactie worden bevestigd met nog eens twee dieren. Als er bij de voorlopige test hevige irritatie wordt waargenomen, hetgeen wijst op een mogelijk hevig (irreversibel) effect bij de bevestigende test, wordt aanbevolen de bevestigende test op sequentiële wijze bij één dier tegelijk uit te voeren en de twee andere dieren niet tegelijkertijd bloot te stellen. Als er bij het tweede dier corrosieve of hevig irriterende effecten optreden, wordt de test niet voortgezet. Er kunnen extra dieren nodig zijn om een zwakke of matige irritatiereactie te bevestigen.
1.4.2.7. Observatieperiode
De duur van de observatieperiode moet voldoende zijn om de omvang en de reversibiliteit van de waargenomen effecten volledig te kunnen beoordelen. Het experiment moet echter worden beëindigd zodra het dier voortdurend tekenen van hevige pijn of ernstig ongerief vertoont (9). Om te bepalen of de effecten reversibel zijn, moeten de dieren normaal gesproken gedurende 21 dagen na de toediening van de teststof worden geobserveerd. Als al vóór het verstrijken van de 21 dagen wordt geconstateerd dat de effecten reversibel zijn, wordt het experiment op dat moment beëindigd.
1.4.2.7.1. Klinische observatie en inschaling van de oogreacties
De ogen worden 1, 24, 48 en 72 uur na het aanbrengen van de teststof onderzocht. De dieren worden niet langer dan nodig voor de test ingezet zodra er definitieve informatie is verkregen. Dieren die voortdurend tekenen van hevige pijn of ernstig ongerief vertonen, moeten op humane wijze worden gedood en de stof dient dienovereenkomstig te worden beoordeeld. Dieren die na de indruppeling de volgende oogletsels ontwikkelen, moeten op humane wijze worden gedood: perforatie van de cornea, significante ulceratie van de cornea en stafyloom; bloed in de voorste oogkamer; klasse 4 troebelheid van de cornea die gedurende 48 uur aanhoudt; afwezigheid van een lichtreflex (iris-reactie klasse 2) die gedurende 72 uur aanhoudt; ulceratie van de conjunctivae; necrose van de conjunctivae of het knipvlies: loslatend dood weefsel. De reden hiervoor is dat dergelijke letsels in het algemeen irreversibel zijn.
Wanneer de dieren geen oogletsel ontwikkelen, mag de test niet eerder dan drie dagen na de indruppeling worden beëindigd. Dieren met licht tot matig letsel moeten worden geobserveerd tot het letsel verdwijnt of gedurende 21 dagen; op dat tijdstip wordt de test dan afgesloten. Op dag 7, dag 14 en dag 21 worden de dieren geobserveerd om te bepalen wat de status van het letsel is en of het reversibel of irreversibel is.
Bij elk onderzoek wordt de score van de oogreactie (conjunctivae, cornea en iris) geregistreerd (zie tabel 1). Ook ander letsel in het oog (zoals pannus of verkleuring) en schadelijke systemische effecten worden gerapporteerd.
Het onderzoek van de respons kan worden vergemakkelijkt door het gebruik van een binoculaire loep, een handspleetlamp, een biomicroscoop of andere geschikte apparatuur. Na de registratie van de observaties na 24 uur kunnen de ogen nader worden onderzocht met behulp van fluoresceïne.
De inschaling van oogreacties is per definitie subjectief. Om harmonisatie bij de inschaling van oogreacties te bevorderen en ter ondersteuning van de testlaboratoria en de personen die bij het uitvoeren en het interpreteren van de observatie betrokken zijn, moet het personeel dat de observatie uitvoert afdoende zijn opgeleid in het gebruikte scoresysteem.
2. GEGEVENS
2.1. EVALUATIE VAN DE RESULTATEN
De scores voor de oogirritatie worden in samenhang met de aard en ernst van het letsel en de vraag of dit al dan niet reversibel is, beoordeeld. De individuele scores vormen geen absolute norm voor de irriterende eigenschappen van een materiaal, aangezien ook andere effecten van het restmateriaal worden beoordeeld. De individuele scores moeten veeleer als referentiewaarden worden beschouwd en zijn alleen zinvol wanneer ze worden ondersteund door een volledige beschrijving en evaluatie van alle observaties.
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag wordt de volgende informatie opgenomen:
|
|
Motivering voor in-vivotest: bewijskrachtanalyse van reeds bestaande testgegevens, zoals de resultaten van een sequentiële teststrategie:
|
|
|
Teststof:
|
|
|
Medium:
|
|
|
Proefdieren:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Een extrapolatie van de resultaten van het onderzoek naar oogirritatie bij proefdieren naar de mens heeft slechts een beperkte geldigheid. In veel gevallen is het albinokonijn gevoeliger voor stoffen die oogirritatie of -corrosie veroorzaken dan de mens.
Bij de interpretatie van de resultaten moet ervoor worden gezorgd dat irritatie ten gevolge van secundaire infectie wordt uitgesloten.
4. REFERENTIES
|
(1) |
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995). The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410-429. |
|
(2) |
de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C, Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N. (1997). Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, 159-164. |
|
(3) |
Worth A.P. and Fentem J.H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, 161-177. |
|
(4) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26. |
|
(5) |
Neun, D.J. (1993). Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231. |
|
(6) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483-524. |
|
(6a) |
Testmethode B.40: Huidcorrosie. |
|
(7) |
Testmethode B.4: Acute toxiciteit: huidirritatie/corrosie. |
|
(8) |
OECD (1996). OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
(9) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm). |
|
(10) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd.org/ehs/test/monos.htm). |
Tabel I:
INSCHALING VAN HET OOGLETSEL
Cornea
Troebelheid: dichtheidsgraad (wordt afgelezen in het gebied met de grootste dichtheid) (1)
|
Geen ulceratie of troebelheid |
0 |
|
Verspreide of diffuse troebele gebieden (meer dan een lichte vertroebeling van de normale glans); details van de iris duidelijk zichtbaar |
1 |
|
Gemakkelijk te onderscheiden doorschijnend gebied; details van de iris enigszins vervaagd |
2 |
|
Parelmoerachtig gebied; details van de iris niet zichtbaar; omvang van de pupil nauwelijks zichtbaar |
3 |
|
Troebele cornea; iris niet zichtbaar door de troebelheid |
4 |
Maximale score: 4
NOTEN
Iris
|
Normaal |
0 |
|
Duidelijk verdiepte rugae, congestie, zwelling, matige hyperemie rond de cornea of injectie; iris reageert op licht (een trage reactie wordt als een effect beschouwd) |
1 |
|
Bloeding, macroscopische destructie of geen reactie op licht |
2 |
Maximale score: 2
Conjunctivae
Roodheid (geldt voor palpebrale en bulbaire conjunctivae; niet voor cornea en iris)
|
Normaal |
0 |
|
Hyperemie in sommige bloedvaten (geïnjecteerd) |
1 |
|
Diffuse karmozijnrode kleur; individuele vaten niet gemakkelijk zichtbaar |
2 |
|
Diffuse dieprode kleur |
3 |
Maximale score: 3
Chemosis
Zwelling (geldt voor oogleden en/of knipvliezen)
|
Normaal |
0 |
|
Iets meer zwelling dan normaal |
1 |
|
Duidelijke zwelling met gedeeltelijk uitpuilende oogleden |
2 |
|
Zwelling met ongeveer half gesloten oogleden |
3 |
|
Zwelling met meer dan half gesloten oogleden |
4 |
Maximale score: 4
BIJLAGE
Een sequentiële teststrategie voor oogirritatie en -corrosie
ALGEMENE OVERWEGINGEN
In het belang van verantwoorde wetenschap en het welzijn van dieren is het belangrijk dat het onnodig gebruik van dieren wordt vermeden en dat tests waarvan hevige reacties bij dieren worden verwacht, tot een minimum worden beperkt. Alle informatie over een stof die relevant is voor de mogelijke oogirritatie/corrosie door die stof moet worden geëvalueerd voordat een in-vivotest wordt overwogen. Wellicht bestaat er al voldoende bewijsmateriaal om een teststof qua mogelijke oogirritatie of -corrosie in te delen zonder dat er tests bij proefdieren behoeven te worden uitgevoerd. Daarom zal het gebruik van een bewijskrachtanalyse en een sequentiële teststrategie de noodzaak van in-vivotests tot een minimum beperken, vooral als er van de stof hevige reacties worden verwacht.
Er wordt aanbevolen dat een bewijskrachtanalyse wordt gebruikt om bestaande informatie over oogirritatie en -corrosie door stoffen te evalueren en om te bepalen of ander aanvullend onderzoek dan in-vivo-oogonderzoek moet worden uitgevoerd om te helpen bij de bepaling van deze mogelijke effecten. Wanneer nader onderzoek nodig is, wordt aanbevolen de sequentiële teststrategie te gebruiken om de relevante experimentele gegevens te verkrijgen. Voor stoffen die nog niet zijn getest, moet de sequentiële teststrategie worden gebruikt om de gegevens te vergaren die nodig zijn om de oogcorrosie/irritatie te bepalen. De in deze bijlage beschreven teststrategie is tijdens een OESO-workshop (1) ontwikkeld. Later is zij bevestigd en opgenomen in het „Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances”, die de steun heeft gekregen van de 28e gezamenlijke vergadering van het Comité chemische stoffen en de Werkgroep chemische stoffen in november 1998 (2).
Hoewel deze teststrategie geen integrerend onderdeel van testmethode B.5 is, vormt zij de aanbevolen aanpak voor de bepaling van de eigenschappen qua oogirritatie/corrosie. Deze aanpak houdt zowel een optimale gedragscode als een ethische referentie voor in-vivotests op oogirritatie/corrosie in. De testmethode bevat een leidraad voor de uitvoering van de in-vivotest en geeft een overzicht van de factoren die vóór het overwegen van een dergelijke test in aanmerking moeten worden genomen. De sequentiële teststrategie levert een bewijskrachtbenadering voor de evaluatie van bestaande gegevens over de eigenschappen van stoffen inzake oogirritatie/corrosie en een trapsgewijze aanpak voor het vergaren van relevante gegevens over stoffen waarvoor nader onderzoek nodig is of waarvoor nog geen onderzoek is uitgevoerd. De strategie houdt in dat onder bepaalde omstandigheden eerst gevalideerde en erkende in-vitro of ex-vivotests en vervolgens testmethode B.4 op huidirritatie/corrosie worden uitgevoerd (3)(4).
BESCHRIJVING VAN DE STAPSGEWIJZE TESTSTRATEGIE
Alvorens te beginnen met tests als onderdeel van de sequentiële teststrategie (zie figuur), moet alle beschikbare informatie worden geëvalueerd om te bepalen of in-vivo-oogonderzoek nodig is. Hoewel de evaluatie van individuele parameters (bijvoorbeeld een extreme pH) significante informatie kan opleveren, moet alle bestaande informatie worden geëvalueerd. Alle relevante gegevens over de effecten van de betrokken stof en de qua structuur analoge verbindingen moeten bij het nemen van een beslissing over de bewijskracht worden geëvalueerd en er moet een motivering voor de beslissing worden gegeven. De nadruk moet in eerste instantie liggen op bestaande gegevens over de effecten van de stof bij mens en dier en vervolgens op de resultaten van in-vitro- of ex-vivotests. Waar mogelijk moet in-vivo-onderzoek aan corrosieve stoffen worden vermeden. Bij de teststrategie spelen de volgende factoren een rol:
Evaluatie van bestaande gegevens over de effecten bij mens en dier (stap 1). In de eerste plaats moet worden gekeken naar bestaande gegevens over de effecten bij de mens, zoals klinisch en bedrijfsgeneeskundig onderzoek en ziektegevallen, en/of gegevens van oogonderzoek bij proefdieren, omdat deze informatie opleveren die rechtstreeks verband houdt met oogeffecten. Vervolgens moeten de beschikbare gegevens van onderzoek bij mens en/of dier naar huidcorrosie/irritatie worden geëvalueerd. Stoffen waarvan bekend is dat ze corrosief of hevig irriterend voor het oog zijn, mogen niet in de ogen van dieren worden gedruppeld en dit geldt ook voor stoffen met corrosieve of irriterende effecten op de huid; deze stoffen moeten ook als corrosief en/of irriterend voor het oog worden beschouwd. Ook stoffen waarvoor bij eerder uitgevoerd oogonderzoek afdoende is aangetoond dat ze niet corrosief en niet irriterend zijn, dienen niet meer bij in-vivo-oogonderzoek te worden getest.
Analyse van structuuractiviteitrelaties (SAR) (stap 2). Er moet worden gekeken naar de resultaten van tests met qua structuur verwante chemische stoffen, indien deze beschikbaar zijn. Wanneer er voldoende gegevens beschikbaar zijn over de effecten van qua structuur verwante stoffen of mengsels van dergelijke stoffen bij mens en/of dier om te kunnen concluderen dat deze oogcorrosie/irritatie kunnen veroorzaken, mag worden aangenomen dat de teststof tot dezelfde reacties zal leiden. In dat geval behoeft de stof wellicht niet te worden getest. Negatieve gegevens van onderzoek met qua structuur verwante stoffen of mengsels van dergelijke stoffen vormen in het kader van de sequentiële teststrategie niet een afdoende bewijs dat de stof geen corrosie of irritatie veroorzaakt. Voor de bepaling van de potentie voor zowel huidcorrosie en -irritatie als oogcorrosie en -irritatie moeten gevalideerde en erkende SAR-methoden worden gebruikt.
Fysisch-chemische eigenschappen en chemische reactiviteit (stap 3). Stoffen met een extreme pH van bijvoorbeeld ≤ 2,0 of ≥ 11,5 kunnen hevige lokale effecten hebben. Als een stof op basis van een extreme pH als corrosief of irriterend voor het oog wordt aangeduid, kan ook rekening worden gehouden met zijn zuur/alkalireserve (buffercapaciteit) (5)(6). Als de buffercapaciteit erop wijst dat een stof wellicht niet corrosief voor het oog is, moeten er nadere tests worden uitgevoerd om dit te bevestigen, waarbij bij voorkeur een gevalideerde en erkende in-vitro- of ex-vivotest moet worden gebruikt (zie het gedeelte over de stappen 5 en 6).
Overweging van andere bestaande informatie (stap 4). In deze fase moet alle beschikbare informatie over systemische toxiciteit via de huid worden geëvalueerd. Ook de acute huidtoxiciteit van de teststof moet in de overwegingen worden betrokken. Als er is aangetoond dat de teststof via de huid zeer toxisch is, behoeft deze wellicht niet in het oog te worden getest. Hoewel er niet noodzakelijkerwijs een verband is tussen acute huidtoxiciteit en oogirritatie/corrosie, kan worden aangenomen dat een stof die via de huid zeer toxisch is, ook bij indruppelen in het oog hoge toxiciteit zal vertonen. Deze gegevens kunnen ook tussen de stappen 2 en 3 worden bezien.
Resultaten van in-vitro- of ex-vivotests (stappen 5 en 6). Stoffen waarvan met een in-vitro- of ex-vivotest (7)(8), die specifiek voor de beoordeling van oog- of huidcorrosie/irritatie is gevalideerd en erkend, is aangetoond dat ze corrosieve of hevig irriterende eigenschappen hebben, behoeven niet bij dieren te worden getest. Er kan worden aangenomen dat dergelijke stoffen in vivo vergelijkbare hevige effecten veroorzaken. Als er geen gevalideerde en erkende in-vitro/ex-vivotests beschikbaar zijn, worden de stappen 5 en 6 overgeslagen en wordt direct doorgegaan naar stap 7.
Evaluatie van in-vivohuidirritatie of -corrosie door de stof (stap 7). Wanneer er onvoldoende bewijsmateriaal bestaat voor de uitvoering van een doorslaggevende bewijskrachtanalyse van de mogelijke oogirritatie/corrosie door een stof op basis van gegevens uit bovengenoemde onderzoeken, moet eerst de mogelijke in-vivohuidirritatie/corrosie worden geëvalueerd met behulp van testmethode B.4 (4) en de bijbehorende bijlage (9). Als blijkt dat de stof huidcorrosie of hevige huidirritatie veroorzaakt, moet deze worden beschouwd als een stof die oogcorrosie veroorzaakt, tenzij er andere informatie is die tot een andere conclusie leidt. Dit betekent dat er dan geen in-vivotest op oogirritatie behoeft te worden uitgevoerd. Als de stof voor de huid niet corrosief of hevig irriterend is, moet er een in-vivotest op oogirritatie worden uitgevoerd.
In-vivotest bij konijnen (slappen 8 en 9). Een in-vivo-oogonderzoek dient te beginnen met een voorlopige test met één dier. Als de resultaten van deze test erop wijzen dat de stof hevig irriterend of corrosief voor de ogen is, dienen er geen verdere tests te worden uitgevoerd. Als er bij deze test geen corrosief of hevig irriterend effect wordt waargenomen, wordt er een bevestigende test met nog eens twee dieren uitgevoerd.
REFERENTIES
|
(1) |
OECD (1996). OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
(2) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm). |
|
(3) |
Worth, A.P. and Fentem J.H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161-177. |
|
(4) |
Testmethode B.4: Acute toxiciteit: huidirritatie/corrosie. |
|
(5) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26. |
|
(6) |
Neun, D.J. (1993). Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231. |
|
(7) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483-524. |
|
(8) |
Testmethode B.40: Huidcorrosie. |
|
(9) |
Bijlage van testmethode B.4: Een sequentiële teststrategie voor huidirritatie en -corrosie. |
Figuur
TEST- EN EVALUATIESTRATEGIE VOOR OOGIRRITATIE/CORROSIE


B.6. SENSIBILISATIE VAN DE HUID
1. METHODE
1.1. INLEIDING
Opmerkingen:
De gevoeligheid en het vermogen van een test om stoffen op te sporen met potentieel huidsensibiliserende eigenschappen bij de mens zijn belangrijk in een systeem voor de classificatie van toxische stoffen ten behoeve van de volksgezondheid.
Er bestaat géén universele testmethode waarmee alle stoffen die de menselijke huid kunnen sensibiliseren, adequaat kunnen worden geïdentificeerd en die voor alle stoffen toepasbaar is.
Bij de keuze van een test moet rekening worden gehouden met factoren zoals de fysische kenmerken van een stof, met inbegrip van het vermogen om de huid binnen te dringen.
Er zijn twee soorten tests ontwikkeld die gebruik maken van cavia's: het type waarbij een adjuvans wordt gebruikt en waarbij een verhoogde allergische reactie wordt opgewekt door het oplossen of suspenderen van de teststof in Freunds compleet adjuvans (FCA), en tests waarbij geen adjuvans wordt gebruikt.
Proeven met adjuvans voorspellen een eventueel huidsensibiliserend effect van een stof bij mensen wellicht nauwkeuriger dan methoden die geen gebruik maken van Freunds compleet adjuvans; zij verdienen dan ook de voorkeur.
De maximalisatietest met cavia's is een algemeen toegepaste test waarbij een adjuvans gebruikt wordt. Alhoewel verschillende andere methoden kunnen worden gebruikt om het huidsensibiliserend vermogen van een stof aan te tonen, wordt de maximalisatietest beschouwd als de adjuvanstechniek die de voorkeur heeft.
Voor veel soorten chemicaliën worden tests waarbij geen adjuvans wordt gebruikt (de Buehlertest heeft de voorkeur) als minder gevoelig beschouwd.
In bepaalde gevallen kunnen er goede redenen zijn om de Buehlertest te verkiezen, met lokale applicatie in plaats van intradermale injectie zoals in de maximalisatietest met cavia's. Voor het gebruik van de Buehlertest dient een wetenschappelijke motivering te worden gegeven.
De maximalisatietest met cavia's en de Buehlertest worden hier beschreven. Andere methoden mogen worden gebruikt op voorwaarde dat zij goed zijn gevalideerd en wetenschappelijk verantwoord zijn.
Indien een erkende screeningtest werd uitgevoerd en daarbij een positief resultaat werd geconstateerd, mag de teststof als een potentieel sensibiliserende stof worden aangemerkt en is het niet nodig ook nog een test met cavia's uit te voeren. Indien een dergelijke test evenwel tot een negatief resultaat heeft geleid, moet een caviatest worden uitgevoerd overeenkomstig de onder deze testmethode beschreven procedure.
Zie ook algemene inleiding deel B.
1.2. DEFINITIES
Huidsensibilisatie (allergische contactdermatitis): is een door een immuunrespons veroorzaakte huidreactie op een stof. Bij mensen kan de reactie de vorm aannemen van jeuk, erytheem, oedeem (waterzucht), pukkels, blaasjes, blaren of een combinatie hiervan. Bij andere soorten kunnen de reacties anders zijn en kan alleen erytheem of oedeem optreden.
Inductieblootstelling: een experimentele blootstelling van een proefdier aan een teststof met de bedoeling een hypersensitieve toestand te induceren.
Inductieperiode: een periode van ten minste een week na de inductieblootstelling, gedurende welke een hypersensitieve toestand ontwikkeld kan worden.
Provocatieblootstelling een experimentele blootstelling — na de inductieperiode — van een voorheen reeds blootgesteld proefdier aan een teststof, om vast te stellen of het dier een hypersensitieve reactie vertoont.
1.3. REFERENTIESTOFFEN
De gevoeligheid en de betrouwbaarheid van de gebruikte technieken moet iedere zes maanden worden vastgesteld door het gebruik van stoffen waarvan bekend is dat ze lichte tot matige huidsensibiliserende eigenschappen hebben.
Bij een goed uitgevoerde test kan een reactie van ten minste 30 % worden verwacht bij een adjuvanstest en van ten minste 15 % bij een niet-adjuvanstest, bij gebruikmaking van zwakke/middelsterke sensibilisatoren.
De volgende stoffen genieten de voorkeur:
|
CAS-nummer |
EINECS-nummer |
EINECS-naam |
Triviale naam |
|
101-86-0 |
202-983-3 |
α-hexylcinnamaldehyde |
α-hexylcinnamaldehyde |
|
149-30-4 |
205-736-8 |
benzothiazol-2-thiol (mercapto-benzothiazol) |
kaptax |
|
94-09-7 |
202-303-5 |
benzocaïne |
norcaïne |
Er kunnen omstandigheden zijn waarbij andere referentiestoffen, die aan bovenstaande eisen voldoen, kunnen worden gebruikt; dit moet wetenschappelijk verantwoord worden.
1.4. PRINCIPE VAN DE TESTMETHODE
De proefdieren worden eerst aan de teststof blootgesteld door een intradermale injectie en/of epidermale toepassing (inductieblootstelling). Na een rustperiode van 10 tot 14 dagen (inductieperiode), tijdens welke een immuunreactie op gang kan komen, worden de dieren blootgesteld aan een provocatiedosis. De omvang en intensiteit van de cutane reactie op de provocatieblootstelling bij de proefdieren wordt vergeleken met die van de controlegroep die een blanco behandeling ondergaat bij de industrie maar wél de provocatiedosis toegediend krijgt.
1.5. BESCHRIJVING VAN DE TESTMETHODEN
Als het nodig wordt geacht om de teststof te verwijderen, moet dit gebeuren met behulp van water of een ander geschikt oplosmiddel zonder dat de optredende reactie daardoor wordt beïnvloed of de opperhuid daardoor wordt geschonden.
1.5.1. Maximalisatietest met cavia's (GPMT)
1.5.1.1.
Gezonde jonge volwassen albinocavia's worden ten minste 5 dagen voor het begin van de test geacclimatiseerd aan de laboratoriumomstandigheden. Voor de test worden de dieren op aselecte wijze verdeeld over de behandelingsgroepen. Verwijdering van het haar gebeurt door middel van knippen, scheren of eventueel door chemische ontharing, afhankelijk van de gebruikte testmethode. Er dient op te worden gelet dat de huid niet beschadigd wordt. De dieren worden gewogen vóór het begin en aan het einde van de test.
1.5.1.2.
1.5.1.2.1. Proefdieren
Er wordt gebruik gemaakt van stammen albinocavia's die gewoonlijk in laboratoria worden gebruikt.
1.5.1.2.2. Aantal en geslacht
Er kan gebruik worden gemaakt van mannelijke en/of vrouwelijke dieren. Vrouwelijke dieren moeten nullipaar zijn en mogen niet zwanger zijn.
Minimaal 10 dieren worden gebruikt voor de behandelde groep en ten minste vijf voor de controlegroep. Als er minder dan 20 testcavia's en 10 controlecavia's worden gebruikt en het niet mogelijk is om vast te stellen of de teststof sensibiliserende eigenschappen heeft, wordt ten sterkste aangeraden om meer dieren te testen zodat een totaal van ten minste 20 testdieren en 10 controledieren wordt bereikt.
1.5.1.2.3. Dosisniveaus
De concentratie van de teststof die voor iedere inductie wordt gebruikt moet systemisch goed te verdragen zijn en gelijk zijn aan de hoogste concentratie die lichte tot matige huidirritatie veroorzaakt. De concentratie die voor de provocatieblootstelling wordt gebruikt moet de hoogste niet-irriterende dosis zijn. Indien noodzakelijk, kunnen de juiste concentraties worden vastgesteld aan de hand van een verkennende studie bij twee of drie proefdieren. Hierbij kan worden overwogen gebruik te maken van met FCA behandelde proefdieren.
1.5.1.3.
1.5.1.3.1. Inductie
Dag 0 — Testgroep
In de onthaarde schouderstreek worden drie paar injecties van 0,1 ml gegeven, zó dat van ieder paar er één aan elke zijde ligt:
Injectie 1: een 1:1-mengsel (volumeverhouding) van FCA en water of fysiologische zoutoplossing;
Injectie 2: de teststof in een geschikt vehiculum en in de geschikte concentratie;
Injectie 3: de teststof in de gekozen concentratie, opgelost in een l:l-mengsel (volumeverhouding) van FCA en water of fysiologische zoutoplossing.
Voor injectie 3 worden de in water oplosbare teststoffen in water opgelost vóór het mengen met FCA. In vet oplosbare of onoplosbare stoffen worden in FCA gesuspendeerd vóór het mengen met water. De uiteindelijke concentratie van de teststof moet gelijk zijn aan die welke voor injectie 2 wordt gebruikt.
De injecties 1 en 2 worden dicht bij elkaar en het dichtst bij het hoofd toegediend en injectie 3 aan de staartzijde van het testgebied.
Dag 0 — Controlegroep
Op dezelfde plaatsen als bij de proefdieren worden drie paar intradermale injecties van 0,1 ml toegediend:
Injectie 1: een 1:1-mengsel (volumeverhouding) van FCA en water of fysiologische zoutoplossing;
Injectie 2: het onverdunde vehiculum;
Injectie 3: een 50 %-formulering (gewicht/volume) van het vehiculum in een 1:1-mengsel (volumeverhouding) van FCA en water of fysiologische zoutoplossing.
Dag 5-7 — Testgroep en controlegroep
Als de te onderzoeken stof geen huidirritatie geeft wordt het testgebied ongeveer 24 uur vóór de plaatselijke inductiebehandeling na knippen en/of scheren behandeld met 0,5 ml van een 10 %-formulering van natriumlaurylsulfaat in vaseline om een plaatselijke irritatie op te wekken.
Dag 6-8 — Testgroep
Het testgebied wordt opnieuw onthaard. Een filtreerpapier (2 cm × 4 cm) wordt gedrenkt met de teststof in een geschikt vehiculum en door middel van een occlusief verband gedurende 48 uur op het testgebied aangebracht. De keuze van het vehiculum moet worden verantwoord. Vaste stoffen worden verpulverd en in een geschikt vehiculum opgenomen. Vloeistoffen kunnen, zo nodig, onverdund worden aangebracht.
Dag 6-8 — Controlegroep
Het testgebied wordt opnieuw onthaard. Op dezelfde wijze als bij de testgroep wordt alleen het vehiculum aangebracht en gedurende 48 uur met het testgebied in contact gehouden door een occlusief verband.
1.5.1.3.2. Provocatie
Dag 20-22 — Testgroep en controlegroep
Beide flanken van de dieren uit de testgroep en de controlegroep worden onthaard. Op één flank van de behandelde dieren wordt een gaasje of cupje met de teststof aangebracht en, waar nodig, een gaasje of cupje met alleen het vehiculum op de andere flank. Door middel van een occlusief verband wordt het gaasje gedurende 24 uur met de huid in contact gehouden.
1.5.1.3.3. Observatie en scoring; testgroep en controlegroep
|
— |
Ongeveer 21 uur nadat het gaasje is verwijderd, wordt het provocatiegebied gereinigd en zo nodig zorgvuldig geknipt en/of geschoren en onthaard. |
|
— |
Ongeveer 3 uur hierna (ongeveer 48 uur na het begin van de provocatie) wordt de reactie van de huid geobserveerd en geregistreerd volgens de in het aanhangsel vermelde scores. |
|
— |
Ongeveer 24 uur na deze waarneming wordt een tweede waarneming gedaan (72 uur na aanvang provocatie) en eveneens geregistreerd. |
Aangeraden wordt om de proefdieren en controledieren „blind” (d.w.z. zonder te weten of het test- of controledieren betreft) te scoren.
Als het nodig blijkt om opheldering te verkrijgen over de resultaten van de eerste provocatie kan na ongeveer een week een tweede provocatie (d.w.z. een herprovocatie) worden overwogen met, zo nodig, een nieuwe controlegroep. Herprovocatie kan ook plaatsvinden bij de oorspronkelijke controlegroep.
Alle reacties van de huid en alle ongewone bevindingen, waaronder ook systemische reacties, die het gevolg zijn van de inductie- en provocatieprocedures moeten worden geobserveerd en geregistreerd volgens de scoreschaal van Magnusson/Kligman (zie aanhangsel). Andere technieken zoals histopathologisch onderzoek of meting van de dikte van de huidplooi kunnen worden toegepast om klaarheid te verschaffen omtrent onduidelijke reacties.
1.5.2. Buehlertest
1.5.2.1.
Gezonde jonge volwassen albinocavia's worden ten minste 5 dagen voor het begin van de test geacclimatiseerd aan de laboratoriumomstandigheden. Voor de test worden de dieren op aselecte wijze verdeeld over de behandelingsgroepen. Verwijdering van het haar gebeurt door middel van knippen, scheren of eventueel door chemische ontharing, afhankelijk van de gebruikte testmethode. Er dient op te worden gelet dat de huid niet beschadigd wordt. De dieren worden gewogen vóór het begin en aan het eind van de test.
1.5.2.2.
1.5.2.2.1. Proefdieren
Er wordt gebruik gemaakt van stammen albinocavia's die gewoonlijk in laboratoria worden gebruikt.
1.5.2.2.2. Aantal en geslacht
Er kan gebruik worden gemaakt van mannelijke en/of vrouwelijke dieren. Vrouwelijke dieren moeten nullipaar zijn en mogen niet zwanger zijn.
Voor de behandelde groep worden minimaal 20 dieren gebruikt en voor de controlegroep ten minste 10.
1.5.2.2.3. Dosisniveaus
De concentratie van de teststof die voor iedere inductie wordt gebruikt moet de hoogste zijn die lichte maar geen excessieve huidirritatie geeft. De concentratie die voor de provocatieblootstelling wordt gebruikt moet de hoogste niet-irriterende dosis zijn. Indien noodzakelijk, kunnen de juiste concentraties worden vastgesteld aan de hand van een verkennende studie bij twee of drie proefdieren.
Als de teststoffen in water oplosbaar zijn verdient water of een verdunde, niet-irriterende oplossing van een surfactans de voorkeur als vehiculum. Bij andere teststoffen wordt de voorkeur gegeven aan 80 % alcohol/water bij de inductie en aan aceton bij de provocatie.
1.5.2.3.
5.5.2.3.1. Inductie
Dag 0 — Testgroep
Eén flank wordt onthaard. Het testgaasje moet doordrenkt zijn met de teststof in een geschikt vehiculum (de keuze van het vehiculum moet worden verantwoord; vloeibare teststoffen kunnen eventueel onverdund worden aangebracht).
Het testgaasje wordt op het testgebied aangebracht en daarmee gedurende 6 uur in contact gehouden door een occlusieve pleister of een cupje en een geschikt verband.
Het testgaasje moet afdekkend zijn. Er kan gebruik worden gemaakt van een rond of vierkant wattenschijfje met een oppervlakte van ongeveer 4-6 cm2. Om een goede afdekking te garanderen kan een passende voorziening worden gebruikt waardoor de bewegingsvrijheid van de dieren wordt beperkt. Bij gebruik van een zwachtel alléén kan herhaalde blootstelling nodig zijn.
Dag 0 — Controlegroep
Een flank wordt onthaard. Op dezelfde wijze als bij de testgroep wordt nu alleen het vehiculum aangebracht. Het testgaasje wordt op het testgebied aangebracht en daarmee gedurende 6 uur in contact gehouden door een occlusieve pleister of een cupje en een geschikt verband. Als kan worden aangetoond dat een blanco controlegroep niet nodig is, kunnen niet-behandelde dieren als controlegroep worden gebruikt.
Dag 6-8 en 13-15 — Testgroep en controlegroep
Hetzelfde testoppervlak van dezelfde flank ondergaat, na eventuele verwijdering van de beharing, op dag 6-8 en nogmaals op dag 13-15 dezelfde blootstelling als op dag 0.
1.5.2.3.2. Provocatie
Dag 27-29 — Testgroep en controlegroep
De onbehandelde flank van de test- en controledieren wordt onthaard. Een occlusieve pleister of een cupje met de juiste hoeveelheid teststof in de maximale niet-irriterende concentratie, wordt aangebracht op het achterste deel van de flank van de testdieren en van de controledieren.
Indien dit wenselijk is wordt op het voorste gedeelte van de onbehandelde flank van zowel de testdieren als de controledieren een occlusieve pleister of een cupje met alleen het vehiculum aangebracht. De pleisters of cupjes worden gedurende 6 uur op hun plaats gehouden door een geschikt verband.
1.5.2.3.3. Observatie en scoring
|
— |
Ongeveer 21 uur nadat de pleister is verwijderd wordt het provocatiegebied onthaard. |
|
— |
Ongeveer 3 uur hierna (ongeveer 30 uur na het begin van de provocatie) wordt de reactie van de huid geobserveerd en geregistreerd volgens de in het aanhangsel vermelde scores. |
|
— |
Ongeveer 24 uur na de 30-uurswaarneming wordt een tweede waarneming van de huidreacties gedaan (ongeveer 54 uur na aanvang van de provocatie) en worden de resultaten weer geregistreerd. |
Aangeraden wordt om de testdieren en controledieren „blind” (d.w.z. zonder te weten of het test-of controledieren betreft) te scoren.
Als het nodig blijkt om opheldering te verkrijgen over de resultaten van de eerste provocatie kan na ongeveer een week een tweede provocatie (d.w.z. een herprovocatie) overwogen worden met, zo nodig, een nieuwe controlegroep. Herprovocatie kan ook plaatsvinden bij de oorspronkelijke controlegroep.
Alle reacties van de huid en alle ongewone bevindingen, waaronder ook systemische reacties, die het gevolg zijn van de inductie- en provocatieprocedures moeten worden geobserveerd en geregistreerd volgens de schaal van Magnusson/Kligman (zie aanhangsel). Andere technieken zoals histopathologisch onderzoek of meting van de dikte van de huidplooi kunnen worden toegepast om klaarheid te verschaffen omtrent onduidelijke reacties.
2. GEGEVENS (GPMT EN BUEHLERTEST)
Alle gegevens moeten in tabelvorm worden samengevat, waarbij voor ieder dier de bij iedere controle waargenomen huidreacties worden vermeld.
3. RAPPORTAGE (GPMT EN BUEHLERTEST)
Wanneer vóór de proef met cavia's een screeningstest wordt uitgevoerd, moet een beschrijving van of verwijzing naar de test in kwestie (bijvoorbeeld de Local Lymph Node Assay (LI.NA) of de Mouse Ear Swelling Test (MEST)) worden gegeven en moeten bijzonderheden over de procedure worden verstrekt. Verder moeten de resultaten worden gerapporteerd die met de teststof en de referentiestof zijn verkregen.
Verslag van de proefnemingen (GPMT en Buehlertest)
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
|
Proefdieren:
|
|
|
Proefomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. LITERATUUR
Deze methode komt overeen met TG 406 van de OESO
Aanhangsel
TABEL
Magnusson/Kligman-scoreschaal voor de evaluatie van reacties op de provocatiepleister
0 = geen zichtbare verandering
1 = discontinu of vlekkerig erytheem
2 = matig en aaneengesloten erytheem
3 = ernstig erytheem met zwelling
B.7. TOXICITEIT (ORAAL) BIJ HERHAALDE TOEDIENING (28 DAGEN)
1. METHODE
1.1. INLEIDING
Zie algemene inleiding deel B.
1.2. DEFINITIES
Zie algemene inleiding deel B.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof wordt gedurende een periode van 28 dagen dagelijks oraal toegediend aan verschillende groepen proefdieren, in trapsgewijs stijgende doses. Er wordt één dosis per groep gebruikt. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks zorgvuldig geobserveerd om tekenen van toxiciteit te ontdekken. Bij dieren die tijdens het onderzoek sterven of worden afgemaakt, wordt een necropsie verricht. Dieren die aan het eind van het onderzoek nog in leven zijn worden afgemaakt en ook hierop wordt een necropsie verricht.
Bij deze methode ligt het accent meer op neurologische effecten als specifiek eindpunt. Benadrukt moet worden dat het noodzakelijk is de dieren zorgvuldig klinisch te observeren om zoveel mogelijk informatie te verzamelen. Deze methode moet het mogelijk maken potentieel neurotoxische chemicaliën te identificeren, die in dit opzicht nader verdienen te worden onderzocht. Voorts kan deze methode aanwijzingen geven over immunologische effecten en toxiciteit voor de voortplantingsorganen.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereidingen
Gezonde jonge volwassen dieren worden op aselecte wijze verdeeld over de controlegroep en de testgroepen. De kooien moeten op zodanige wijze worden opgesteld dat eventuele plaatseffecten geminimaliseerd worden. De dieren worden individueel geïdentificeerd en worden vóór het onderzoek ten minste 5 dagen in hun kooi gehouden ter acclimatisatie aan de laboratoriumomstandigheden.
De teststof wordt toegediend via een maagsonde of via de voeding of het drinkwater. De wijze van toedienen is afhankelijk van het doel van het onderzoek en de fysisch/chemische eigenschappen van de teststof.
Zo nodig moet de teststof worden opgelost of gesuspendeerd in een geschikt vehiculum. Het verdient aanbeveling om zo mogelijk een waterige oplossing of suspensie te gebruiken. Als dit niet mogelijk is kan voor een oplossing of suspensie in olie (bij voorbeeld maïsolie) of in laatste instantie voor een oplossing in een ander medium worden gekozen. Van andere media dan water moeten de toxicologische karakteristieken bekend zijn. De stabiliteit van de teststof in het vehiculum moet worden vastgesteld.
1.4.2. Proefomstandigheden
1.4.2.1. Proefdieren
De voorkeur wordt gegeven aan ratten, hoewel andere knaagdiersoorten kunnen worden gebruikt. Er dient gebruik te worden gemaakt van jonge gezonde volwassen dieren van rattenstammen die gewoonlijk in laboratoria worden gebruikt. De wijfjes moeten nullipaar zijn en mogen niet zwanger zijn. De toediening moet zo snel mogelijk na het verspenen beginnen en in ieder geval vóór de dieren negen weken oud zijn.
Bij het begin van de studie moet de gewichtsvariatie van de dieren minimaal zijn en mag het gewicht van ieder dier niet meer dan 20 % afwijken van het gemiddelde gewicht.
Als een proef met herhaalde orale toediening wordt uitgevoerd als inleiding op een studie van langere duur, moeten de dieren in beide studies bij voorkeur tot dezelfde stam behoren en dezelfde oorsprong hebben.
1.4.2.2. Aantal en geslacht
Op ieder dosisniveau moeten ten minste 10 dieren (5 mannetjes en 5 wijfjes) worden gebruikt. Indien het de bedoeling is sommige dieren tussentijds te doden, moet het aantal dieren worden verhoogd met het aantal dat volgens de proefopzet tussentijds zal worden gedood.
Daarnaast kan een satellietgroep van 10 dieren (5 per geslacht) gedurende 28 dagen worden behandeld met het hoge dosisniveau en vervolgens gedurende 14 dagen na de behandeling worden geobserveerd om na te gaan of de toxische effecten eventueel verdwijnen, voortduren of pas later tot uiting komen. Tevens wordt een satellietgroep van 10 controledieren (5 per geslacht) gebruikt.
1.4.2.3. Dosisniveaus
In het algemeen zijn drie testgroepen en een controlegroep vereist. Afgezien van de behandeling met de teststof moeten de dieren van de controlegroep op dezelfde wijze worden behandeld als de dieren in de testgroep Indien een vehiculum wordt gebruikt bij het toedienen van de teststof moet de controlegroep het grootste gebruikte volume van dat vehiculum toegediend krijgen.
Als uit andere gegevens kan worden geconcludeerd dat bij een dagelijkse dosis van 1 000 mg/kg lichaamsgewicht geen effecten worden verwacht, kan een limiettest worden uitgevoerd. Als er geen bruikbare gegevens beschikbaar zijn, kan een studie worden uitgevoerd om de orde van grootte van de te gebruiken doses te helpen bepalen.
De dosisniveaus moeten worden gekozen in het licht van de bestaande gegevens over toxiciteit en (toxico)kinetica van de teststof en verwante stoffen. Het hoogste dosisniveau moet zó gekozen worden dat toxische effecten optreden, maar geen sterfte of ernstig lijden. Verder moet een dalende reeks doses worden gekozen met het oog op het vaststellen van een eventuele dosis-responsrelatie en het niveau zonder schadelijk effect (NOAEL) op het laagste dosisniveau. Dosisniveaus die telkens een factor 2 à 4 verschillen zijn vaak optimaal. Toevoeging van een vierde testgroep is vaak te prefereren boven een zeer groot niveauverschil (bijvoorbeeld een factor 10 of meer) tussen de opvolgende doses.
Indien de stoffen via de voeding of het drinkwater worden toegediend is het van belang erop te letten dat de betrokken hoeveelheden teststof de normale voedings- of waterbalans niet verstoren. Als de teststof via de voeding wordt toegediend kan een vaste concentratie in de voeding (ppm) worden gebruikt óf een constant dosisniveau in termen van het lichaamsgewicht van het dier. Aangegeven moet worden welk alternatief is gebruikt. Bij gebruik van een maagsonde voor het toedienen van de teststof moet de dosis iedere dag op hetzelfde tijdstip worden gegeven en zo nodig worden aangepast om een constant dosisniveau per kg lichaamsgewicht te handhaven.
Als een studie met herhaalde toediening wordt gebruikt als voorloper van een studie op lange termijn moet bij beide studies soortgelijk voedsel worden verstrekt.
1.4.2.4. I.imiettest
Als volgens de hier beschreven procedures een proef wordt uitgevoerd met een dosisniveau van ten minste 1 000 mg/kg lichaamsgewicht per dag — of, in het geval van toediening via het voedsel of het drinkwater, het equivalente percentage in het voedsel of het water (berekend overeenkomstig het lichaamsgewicht) — en er geen waarneembare toxische effecten optreden, en deze ook niet kunnen worden verwacht op grond van gegevens betreffende stoffen met verwante structuur, is het niet noodzakelijk een volledige proef met drie dosisniveaus te doen. De limiettest is van toepassing tenzij het niveau waarop de mens kan worden blootgesteld, testen met een hogere dosis noodzakelijk maakt.
1.4.2.5. Observatieperiode
De dieren moeten 28 dagen worden geobserveerd. Dieren uit een satellietgroep die bestemd is voor vervolgwaarnemingen moeten daarna nog ten minste 14 dagen zonder behandeling worden geobserveerd om de persistentie van de toxische effecten c.q. het herstel alsmede het eventuele optreden van vertraagde toxiciteit te kunnen waarnemen.
1.4.3. Procedure
De dieren krijgen de teststof gedurende 28 dagen zeven maal per week toegediend. Indien de teststof vijf maal per week wordt toegediend moet dit worden verantwoord. Als de teststof wordt toegediend via een maagsonde, moet dit in één keer gebeuren onder gebruikmaking van een maagcatheter of een geschikte intubatiecanule. De maximale hoeveelheid vloeistof die per keer kan worden toegediend hangt af van de grootte van het dier. Het volume mag niet meer zijn dan 1 ml/100 g lichaamsgewicht, behalve als er een waterige oplossing wordt gebruikt, in welk geval 2 ml/100 g lichaamsgewicht is toegestaan. Met uitzondering van irriterende of bijtende stoffen, die gewoonlijk hevigere effecten veroorzaken bij hogere concentraties, moet de variabiliteit van het testvolume worden geminimaliseerd door aanpassing van de concentratie, zodat op alle dosisniveaus hetzelfde constante testvolume wordt gebruikt.
1.4.3.1. Algemene observaties
Algemene klinische waarnemingen moeten ten minste eenmaal per dag plaatsvinden, bij voorkeur steeds op hetzelfde tijdstip en met in achtneming van de piekperiode van de te verwachten effecten na toediening. De gezondheidstoestand van de dieren moet worden geregistreerd. De dieren moeten ten minste tweemaal per dag worden geobserveerd op ziekteverschijnselen en sterfte. Stervende dieren en dieren die in grote nood verkeren of hevige pijn lijden moeten worden verwijderd, op humane wijze afgemaakt en aan een necropsie onderworpen.
Alle dieren worden éénmaal voor het begin van de proef nauwkeurig klinisch onderzocht (om intra-individuele vergelijking mogelijk te maken) en vervolgens ten minste eenmaal per week. Dit onderzoek moet buiten de kooi op een vaste onderzoekplaats en bij voorkeur steeds op hetzelfde tijdstip uitgevoerd worden. De resultaten moeten zorgvuldig worden geregistreerd, waarbij bij voorkeur gebruik wordt gemaakt van scoringsystemen die expliciet door het testlaboratorium zijn vastgelegd. Er moet zoveel mogelijk worden gezorgd dat variaties in de proefomstandigheden minimaal zijn en dat de waarnemers niet weten welke behandeling een gegeven dier heeft ondergaan. Tekenen waarop moet worden gelet zijn onder meer (maar niet alleen): veranderingen in huid, vacht, ogen, slijmvliezen, optreden van af- en uitscheiding, en onwillekeurige reacties zoals traanvorming, rechtopstaan van het haar, verandering van de pupilgrootte of een ongewoon ademhalingspatroon. Veranderingen in gang, houding en respons op vasthouden en ook het uitvoeren van clonische of tonische bewegingen, stereotypen (bij voorbeeld excessief poetsgedrag, ronddraaien) of afwijkend gedrag (bijvoorbeeld zelfverminking, achteruitlopen) moeten worden geregistreerd.
Gedurende de vierde week van de blootstelling moet de sensorische reactiviteit op stimuli van verschillende aard (auditief, visueel en proprioceptief) worden bepaald en moet een bepaling van de grijpkracht en de motorische activiteit plaatsvinden. Nadere bijzonderheden omtrent de te volgen procedures zijn te vinden in de literatuur (zie algemene inleiding deel B).
Als de studie wordt verricht als voorstudie op een daaropvolgende subchronische (90-daagse) studie, kunnen functionele observaties in de vierde week achterwege worden gelaten. In dat geval moeten de functionele observaties in het bedoelde vervolgonderzoek plaatsvinden. Daar staat echter tegenover dat de beschikbaarheid van gegevens betreffende functionele prestaties uit de studie met herhaalde toediening, de keuze van de dosisniveaus voor de daaropvolgende subchronische studie ten goede kan komen.
Bij wijze van uitzondering kunnen functionele observaties ook achterwege blijven bij groepen die verder dermate sterke toxiciteitseffecten vertonen dat het testen van de functionele prestaties daardoor ernstig wordt gehinderd.
1.4.3.2. Lichaamsgewicht en voedel/waterconsumptie
Ieder dier moet ten minste eenmaal per week worden gewogen. De opgenomen hoeveelheid voedsel en water moet minstens eenmaal per week worden gemeten. Indien de teststof via het drinkwater wordt toegediend moet de waterconsumptie ook minstens eenmaal per week worden gemeten.
1.4.3.3. Hematologie
Aan het eind van de testperiode moeten de volgende onderzoeken worden verricht: bepaling van de hematocriet en de homoglobineconcentratie, erythrocytentelling, totale en differentiële leuko-cytentelling, plaatjestelling en bepaling van de stollingstijd en het stollingsvermogen.
De bloedmonsters worden genomen net vóór of tijdens het afmaken van de dieren; er dient te worden genoteerd uit welk lichaamsdeel. De monsters moeten onder de juiste omstandigheden worden bewaard.
1.4.3.4. Klinische biochemie
Om belangrijke toxische effecten op de weefsels en met name op de nieren en de lever te onderzoeken, moet klinisch-biochemisch onderzoek verricht worden op bloedmonsters van alle dieren, met uitzondering van de dieren die stervend zijn aangetroffen of die voortijdig zijn afgemaakt. Deze monsters moeten juist vóór het afmaken of als onderdeel van de procedure hiervoor worden genomen. Het verdient aanbeveling om de dieren vóór het bloedafnemen een nacht te laten vasten (2). Onderzoek van plasma en serum moet omvatten: natrium, kalium, glucose, totaal cholesterol, ureum, creatinine, totaal proteïne en albuminc, ten minste twee enzymen die een indicatie geven van hepatocellulaire effecten (zoals alanineaminotransferase, aspartaataminotransferase, alkalische fosfatase, gamma- glutamyltranspeptidase en sorbitoldehydrogenase). Bepaling van andere enzymen (van hepatische of andere oorsprong) en galzuren kan onder bepaalde omstandigheden nuttige informatie geven.
De volgende facultatieve urineanalysebepalingen kunnen tijdens de laatste week van het onderzoek worden uitgevoerd op basis van een volgens een vast tijdschema verlopende urinemonsterneming: aspect, hoeveelheid, osmolaliteit of dichtheid, pH, proteïnen, glucose en bloed/bloedcellen.
Verder moet een onderzoek naar serummarkers van algemene weefselschade overwogen worden. Andere onderzoeken die moeten worden uitgevoerd als van de teststof bekend is, of vermoed wordt, dat zij de desbetreffende metabolische profielen beïnvloedt, zijn: calcium, fosfaat, triglyce-riden (nuchterwaarde), specifieke hormonen, methemoglobine en cholesterinase. Deze moeten in het geval van teststoffen uit bepaalde klassen c.q. van geval tot geval worden geïndentificeerd.
In het algemeen is een flexibele aanpak noodzakelijk, afhankelijk van het soort proefdieren en het waargenomen en/of verwachte effect van een bepaalde stof.
Als bij gebrek aan referentiegegevens geen adequate vergelijkingsbasis voorhanden is, moet worden overwogen om hematologische en klinisch-biochemische variabelen te bepalen vóór met de toediening wordt begonnen.
1.4.3.5. Macroscopische necropsie
Alle proefdieren uit het onderzoek moeten worden onderworpen aan een volledige, gedetailleerde macroscopische necropsie, die onder meer een zorgvuldig onderzoek van het uitwendige oppervlak van het lichaam, alle lichaamsopeningen en de hersen-, borst- en buikholte en de organen daarin omvat. De lever, nieren, bijnieren, testes, bijballen, zwezerik, milt, hersenen en het hart van alle dieren moeten worden ontdaan van alle aanhangend weefsel en zo snel mogelijk na dissectie in natte toestand worden gewogen om uitdroging te voorkomen.
De volgende weefsels moeten worden geconserveerd in het fixeermiddel dat zowel voor het type weefsel als het voorgenomen histopathologische onderzoek het meest geschikt is: alle grotere laesies, hersenen (representatieve delen waaronder de grote en kleine hersenen en de brug van Varol), ruggenmerg, maag, dunne en dikke darm met plaques van Peyer, lever, nieren, bijnieren, milt, hart, zwezerik, schildklier, luchtpijp en longen (conserveren door opblazen met een fixatief en dan onderdompelen), geslachtsklieren, secundaire geslachtsorganen (bij voorbeeld uterus, prostaat), urineblaas, lymfeklieren (bij voorkeur een klier die in de route van de toediening gelegen is en één die daar ver van verwijderd is, om rekening te houden met systemische effecten), perifere zenuwen (grote heupzenuw of scheenbeenzenuw), bij voorkeur dicht bij de spier, en een coupe van het beenmerg (of, in plaats daarvan, een direct op een objectglaasje aangebracht stukje opgezogen beenmerg). De resultaten van het klinische onderzoek en van andere onderzoeken kunnen aanleiding zijn om nog andere weefsels te bestuderen. Ook moeten alle andere organen worden, geconserveerd die, voor zover bekend is van de eigenschappen van de teststof, waarschijnlijk als doelorgaan fungeren.
1.4.3.6. Histopathologisch onderzoek
Bij de dieren in de met de hoogste dosisniveau behandelde groep en bij de dieren in de controlegroep moet een volledig histopathologisch onderzoek worden verricht op de geconserveerde organen en weefsels. Als met de behandeling samenhangende veranderingen worden geconstateerd in de groep met de hoogste dosering, moet het onderzoek worden uitgebreid tot de dieren van alle andere doseringsgroepen.
Alle grotere laesies moeten worden onderzocht.
Indien gebruik wordt gemaakt van een satellietgroep moet ook daarbij histopathologisch onderzoek worden verricht op alle organen die in de behandelde groep effecten vertonen.
2. GEGEVENS
Er moeten individuele gegevens worden verstrekt. Verder moeten alle gegevens worden samengevat in tabellen die voor iedere proefgroep laten zien: het aantal dieren aan het begin van de test, het aantal dieren dat tijdens de test is gestorven of om ethische redenen is afgemaakt en het tijdstip waarop, het aantal dat verschijnselen van toxiciteit vertoonde, een beschrijving van de waargenomen toxiciteitsverschijnselen, waaronder het tijdstip van aanvang, de duur en ernst van de verschijnselen, het aantal dieren dat laesies vertoonde, het soort laesie en het percentage dieren dat elk soort laesie vertoonde.
Zo mogelijk moeten de numerieke resultaten met behulp van een geschikte en algemeen geaccepteerde statistische methode worden geëvalueerd. De gebruikte methoden moeten reeds bij het ontwerpen van de studie worden gekozen.
3. RAPPORTAGE
VERSLAG VAN HET ONDERZOEK
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
|
Proefdieren:
|
|
|
Proefomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. LITERATUUR
Deze methode komt overeen met TG 407 van de OESO.
B.8. TOXICITEIT (INHALATIE) BIJ HERHAALDE TOEDIENING (28 DAGEN)
1. METHODE
1.1. INLEIDING
Het is nuttig om over oriënterende informatie te beschikken ten aanzien van de deeltjesgrootteverdeling, de dampspanning, het smeltpunt, het kookpunt, het vlampunt en het ontploffingsgevaar (indien van toepassing) van de te onderzoeken stof.
Zie verder algemene inleiding deel B (punt A).
1.2. DEFINITIES
Zie algemene inleiding deel B (punt B).
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE TESTMETHODE
Verscheidene groepen proefdieren worden gedurende een periode van 28 dagen dagelijks een bepaalde tijd aan geleidelijk stijgende concentraties van de teststof blootgesteld. Er wordt een concentratie per groep gebruikt. Indien een medium wordt gebruikt om de juiste concentratie van de teststof in de atmosfeer te bereiken, moet een mediumcontrolegroep worden toegevoegd. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks geobserveerd om tekenen van toxiciteit te ontdekken. Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het eind van de proefnemingen leven, wordt necropsie verricht.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Voorbereidingen
Vóór het onderzoek worden de dieren ten minste 5 dagen onder gelijke huisvestings- en voedingsomstandigheden gehouden als gedurende de proef. Gezonde jonge dieren worden op willekeurige wijze voor het onderzoek in het vereiste aantal groepen ingedeeld. Waar nodig wordt een passend medium aan de teststof toegevoegd teneinde de juiste concentratie van de teststof in de atmosfeer te bereiken. Indien een medium of andere additieven worden gebruikt om de dosering te vergemakkelijken, moet bekend zijn dat deze geen toxische effecten veroorzaken. In voorkomend geval kunnen bestaande gegevens worden gebruikt.
1.6.2. Proefomstandigheden
1.6.2.1. Proefdieren
Tenzij er contra-indicaties zijn, wordt de voorkeur gegeven aan ratten. Er dient gebruik te worden gemaakt van jonge gezonde dieren van rattenstammen die gewoonlijk in laboratoria worden gebruikt.
Bij het begin van de studie mag het gewicht van de dieren die bij de test worden gebruikt niet meer dan ± 20 % van het betreffende gemiddelde gewicht afwijken.
1.6.2.2. Aantal en geslacht
Voor iedere testgroep moeten ten minste tien dieren (vijf wijfjes en vijf mannetjes) worden gebruikt. De wijfjes moeten nullipaar zijn en niet zwanger. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met het aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood. Daarnaast kan een satellietgroep van tien dieren (vijf per geslacht) gedurende 28 dagen worden behandeld met het hoogste concentratieniveau, waarna zij nog gedurende 14 dagen na de behandeling worden geobserveerd om na te gaan of de toxische effecten eventueel verdwijnen, voortduren of pas later tot uiting komen. Tevens wordt een satellietgroep van tien controledieren (vijf per geslacht) gebruikt.
1.6.2.3. Blootstellingsconcentraties
Ten minste drie concentraties met een controle of een mediumcontrole (overeenkomend met de concentratie van het medium bij het hoogste expositieniveau), indien een medium wordt gebruikt, zijn vereist. Afgezien van de toediening van de teststof moeten de dieren in de controlegroep op dezelfde wijze als de dieren in de testgroepen worden behandeld. De hoogste concentratie moet leiden tot toxische effecten, maar er mogen geen of weinig sterfgevallen voorkomen. Bij de laagste concentratie mogen geen tekenen van toxiciteit optreden. Indien het blootstellingsniveau van de mens kan worden geschat, moet de laagste concentratie deze overschrijden. In het ideale geval treden bij de middelste concentratie minimaal waarneembare toxische effecten op. Bij meer dan één tussenconcentratie moet het verschil tussen de concentraties zo groot zijn dat een gradatie in toxische effecten wordt verkregen. In de groep met de laagste concentratie, in de tussengroepen en in de controlegroepen mogen niet veel sterfgevallen voorkomen, omdat anders een zinvolle evaluatie van de resultaten niet mogelijk is.
1.6.2.4. Blootstellingstijd
De dagelijkse blootstellingstijd bedraagt 6 uur, maar een afwijkende duur kan in verband met specifieke vereisten nodig zijn.
1.6.2.5. Apparatuur
De dieren worden aan de teststoffen blootgesteld met behulp van inhalatieapparatuur die zodanig is gebouwd dat kan worden gezorgd voor een dynamische luchtdoorstroming van ten minste 12 luchtverversingen per uur, een toereikend zuurstofgehalte en een gelijkmatige verdeling van de teststof in de atmosfeer. Als van een expositiekamer gebruik wordt gemaakt, moet deze op zodanige wijze zijn ontworpen dat de dieren zo min mogelijk bij elkaar kunnen kruipen en zoveel mogelijk door inhalatie aan de teststof worden blootgesteld. Als algemene regel voor het verzekeren van een stabiele atmosfeer in de expositiekamer geldt dat het totale „volume” van de proefdieren niet méér mag bedragen dan 5 % van het volume van de blootstellingskamer. Naar keuze kunnen de dieren oronasaal, alleen met hun kop of individueel met hun hele lijf aan de testlucht worden blootgesteld; de eerste twee methoden zullen ertoe bijdragen dat zo min mogelijk teststof via andere wegen in het lichaam wordt opgenomen.
1.6.2.6. Observatieperiode
De proefdieren moeten tijdens de gehele periode van behandeling en herstel dagelijks op tekenen van toxiciteit worden onderzocht. Het tijdstip waarop de dood intreedt, het tijdstip waarop toxische verschijnselen voor het eerst zijn waargenomen en het tijdstip waarop zij weer verdwijnen, moeten worden genoteerd.
1.6.3. Uitvoering
De dieren worden gedurende een periode van 28 dagen, 5 tot 7 dagen per week aan de teststof blootgesteld. Dieren in satellietgroepen voor latere waarnemingen moeten nog 14 dagen zonder behandeling worden gehouden om herstel of voortduren van de toxische effecten te kunnen vaststellen. Tijdens de proefnemingen dient de temperatuur op 22 oC ± 3 oC te worden gehouden.
In het ideale geval moet de relatieve vochtigheid tussen 30 % en 70 % worden gehouden, behalve waar dit niet goed uitvoerbaar is (bijvoorbeeld bij het testen van sommige aerosolen). Het onderhouden van een lichte onderdruk (< 5 mm water) voorkomt het weglekken van de teststof naar de omgeving. Gedurende de blootstelling worden de dieren voedsel en water onthouden.
Er moet gebruik worden gemaakt van een dynamisch inhalatiesysteem met een geschikt systeem voor de analytische controle van de concentratie. Aanbevolen wordt in een verkennende proef vast te stellen welke blootstellingsconcentraties voor de proeven het meest geschikt zijn. De doorstromingssnelheid moet zodanig worden aangepast dat de condities in de expositiekamer homogeen zijn. Het systeem moet waarborgen dat de omstandigheden bij de proef zo spoedig mogelijk stabiel zijn.
De volgende parameters moeten worden gemeten of gemonitord:
|
a) |
de luchtdoorstromingssnelheid (luchtdebiet) (continu); |
|
b) |
de feitelijke concentratie van de teststof in het ademhalingsgebied. Tijdens de dagelijkse blootstelling mag de concentratie met niet méér dan ± 15 % van het gemiddelde afwijken. Bij sommige aerosolen is het mogelijk dat de concentratie niet binnen deze grenzen gehouden kan worden; in dat geval kan een grotere afwijking worden aanvaard. Tijdens de gehele duur van de studie moeten de dagelijkse concentraties zo constant mogelijk worden gehouden. Voor aerosolen moet ten minste éénmaal per week bij elke testgroep de deeltjesgrootteverdeling worden geanalyseerd; |
|
c) |
de temperatuur en de vochtigheid (continu, indien mogelijk); |
Tijdens en na de blootstelling worden waarnemingen gedaan die voor elk individueel dier systematisch worden geregistreerd. Alle dieren moeten dagelijks worden geobserveerd; tekenen van toxiciteit moeten worden genoteerd met het tijdstip waarop deze voor het eerst optreden en de mate en de duur ervan. Bij het observeren wordt in ieder geval aandacht besteed aan veranderingen van huid en vacht, ogen, slijmvliezen, ademhalingsorganen, bloedsomloop, autonoom en centraal zenuwstelsel, somatomotorische activiteit en gedrag. Wekelijks moeten de dieren worden gewogen. Het wordt eveneens aanbevolen het voerverbruik wekelijks te meten. De dieren moeten regelmatig worden geobserveerd, om te voorkomen dat ze voor de studie verloren gaan als gevolg van oorzaken als kannibalisme, autolyse van weefsels of omdat de dieren in verkeerde kooien zijn geplaatst. Na afloop van de onderzoekperiode wordt bij alle overlevende dieren in de behandelde groepen (afgezien van de dieren in de satellietgroep) necropsie verricht. Stervende dieren of dieren met hevige angst of pijn, moeten meteen na ontdekking worden verwijderd en op een humane manier worden gedood; bij hen wordt eveneens necropsie verricht.
Na afloop van de proeven moet bij alle dieren, met inbegrip van die uit de controlegroep, het volgende worden onderzocht:
|
i) |
hematologie, waarbij ten minste bepaling van hematocriet en hemoglobinegehalte, erythrocytentelling, totale en gedifferentieerde telling van de leucocyten en meting van stollingseigenschappen moeten worden uitgevoerd; |
|
ii) |
klinisch-biochemische bepalingen in het bloed waarbij ten minste één parameter van de leverfunctie en nierfunctie wordt bekeken: serum alanineaminotransferase (vroegere benaming: serum glutaminezuur-py-rodruivenzuur-transaminase (SGPT)), serum aspartaataminotransferase (vroegere benaming: serum glutaminezuur-oxaalazijnzuur-transaminase (SGOT)), ureum, albumine, bloedcreatinine, totaal bilirubine en totaal serumeiwit. |
Voor een goede toxicologische evaluatie kan het nodig zijn het onderzoek uit te breiden met: calcium, fosfor, chloride, natrium, kalium, glucosegehalte in nuchtere toestand, analyse van de lipiden, hormonen, zuur/base-evenwicht, methemoglobine en cholinesterase-activiteit.
Zo nodig kan verder klinisch-biochemisch onderzoek worden verricht om het onderzoek van de waargenomen effecten uit te breiden.
1.6.3.1. Macroscopische necropsie
Bij alle dieren in de studie moet een volledige macroscopische necropsie worden uitgevoerd. Zo spoedig mogelijk na sectie moeten ten minste lever, nieren, bijnieren, longen en testes nat worden gewogen om te voorkomen dat ze uitdrogen. Organen en weefsels (de ademhalingswegen, lever, nieren, milt, testes, bijnieren, hart en alle organen die macroscopisch waarneembare afwijkingen of veranderingen in omvang vertonen) moeten in een geschikt medium worden bewaard voor eventueel histopathologisch onderzoek. De longen moeten in hun geheel worden verwijderd, gewogen en behandeld worden met een geschikt fixatief om ervoor te zorgen dat de longstructuur intact blijft.
1.6.3.2. Histopathologisch onderzoek
Bij de dieren in de hoge concentratiegroep en bij de dieren in de controlegroep(en) moet histopathologisch onderzoek op de bewaarde organen en weefsels worden verricht. Organen en weefsels die bij het hoogste concentratieniveau door de teststof blijken te zijn beschadigd, moeten in alle groepen met een lagere dosering worden onderzocht. Bij het histopathologisch onderzoek van dieren in satellietgroepen moet speciaal worden gelet op organen en weefsels waar, bij de andere behandelde groepen, effecten blijken te zijn opgetreden.
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek en het aantal dieren waarbij ieder type beschadiging voorkomt.
Alle waargenomen resultaten moeten met behulp van een geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voeding, enzovoort; |
|
— |
proefomstandigheden: Beschrijving van de blootstellingsapparatuur met inbegrip van ontwerp, type, afmetingen, luchtbron, systeem voor het genereren van aerosolen, methode van luchtconditionering, behandeling van de afgevoerde lucht en de wijze waarop de dieren tijdens de proeven in een blootstellingskamer zijn ondergebracht als deze is gebruikt. Er moet een beschrijving worden gegeven van de apparatuur voor het meten van de temperatuur, de vochtigheid en, in voorkomend geval, de stabiliteit van de concentratie of de deeltjesgrootteverdeling van de aerosolen. Gegevens betreffende de blootstelling: Deze moeten tabellarisch worden gerangschikt en worden voorzien van gemiddelde waarden en een maat voor de variabiliteit (bijvoorbeeld standaardafwijking}. Zij dienen zo mogelijk te omvatten:
|
|
— |
gegevens over de toxische reactie per geslacht en concentratie; |
|
— |
tijdstip gedurende de studie waarop de dood intreedt, of aangeven of de dieren tot het einde van de proef in leven bleven; |
|
— |
beschrijving van toxische of andere effecten; hoogste niveau waarbij geen effect wordt waargenomen; |
|
— |
tijdstip waarop een abnormaal verschijnsel wordt waargenomen en het verloop hiervan; |
|
— |
gegevens over voedselconsumptie en lichaamsgewicht; |
|
— |
uitgevoerde hematologische proeven en alle resultaten; |
|
— |
uitgevoerde klinisch-biochemische proeven en alle resultaten; |
|
— |
bevindingen bij de necropsie; |
|
— |
een gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
waar mogelijk statistische behandeling van de resultaten; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie algemene inleiding deel B (punt D).
4. LITERATUUR
Zie algemene inleiding deel B (punt E).
B.9. TOXICITEIT (DERMAAL) BIJ HERHAALDE TOEDIENING (28 DAGEN)
1. METHODE
1.1. INLEIDING
Zie algemene inleiding deel B (punt A).
1.2. DEFINITIES
Zie algemene inleiding deel B (punt B).
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE TESTMETHODE
De teststof wordt gedurende een periode van 28 dagen dagelijks in geleidelijk stijgende doseringen op de huid van verscheidene groepen proefdieren aangebracht. Er wordt één dosis per groep gebruikt. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks geobserveerd om tekenen van toxiciteit te ontdekken. Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het eind van de proef leven, wordt necropsie verricht.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Voorbereidingen
Voor het onderzoek worden de dieren ten minste 5 dagen onder gelijke huisvestings- en voedingsomstandigheden gehouden als tijdens de proef voorkomen. Gezonde jonge dieren worden op willekeurige wijze voor de behandeling ingedeeld bij testgroepen en controlegroepen. Kort voor de proef wordt het haar op het ruggedeelte van de romp van de proefdieren geknipt; het haar kan ook worden geschoren, maar dit moet dan ongeveer 24 uur voor de proef worden gedaan. Gewoonlijk zal het dier ongeveer om de week opnieuw moeten worden geknipt of geschoren. Bij het knippen of scheren moet erop worden gelet dat de huid niet wordt bekrast. Ten minste 10 % van de lichaamsoppervlakte moet voor het aanbrengen van de teststof worden onthaard. Bij het bepalen van de oppervlakte die moet worden onthaard en de afmetingen van de aan te brengen bedekking moet rekening worden gehouden met het gewicht van het dier. Bij een proef met vaste stoffen, die eventueel tot poeder kunnen worden fijngemaakt, moet de teststof voldoende met water of, zo nodig, met een passend medium worden bevochtigd, zodat de stof goed in contact met de huid komt. Vloeibare teststoffen worden in het algemeen onverdund gebruikt. De teststof wordt gedurende 5 tot 7 dagen per week dagelijks aangebracht.
1.6.2. Proefomstandigheden
1.6.2.1. Proefdieren
Er kan gebruik worden gemaakt van volwassen ratten, konijnen of cavia's. Ook andere diersoorten kunnen worden gebruikt, maar de noodzaak hiervoor moet worden aangetoond.
Bij het begin van de studie mag het gewicht van de dieren die bij de test worden gebruikt niet meer dan ± 20 % van het gemiddelde gewicht afwijken.
1.6.2.2. Aantal en geslacht
Voor ieder dosisniveau moeten ten minste tien dieren (vijf wijfjes en vijf mannetjes) met een gezonde huid worden gebruikt. De wijfjes moeten nullipaar zijn en niet zwanger. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met het aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood. Daarnaast kan een satellietgroep van tien dieren (vijf per geslacht) gedurende 28 dagen worden behandeld met het hoge dosisniveau waarna zij nog gedurende 14 dagen na de behandeling worden geobserveerd om na te gaan of de toxische effecten eventueel verdwijnen, voortduren of pas later tot uiting komen. Tevens wordt een satellietgroep van tien controledieren (vijf per geslacht) gebruikt.
1.6.2.3. Dosisniveau
Ten minste drie dosisniveaus, met een controlegroep of een mediumcontrolegroep, indien een medium wordt gebruikt, zijn vereist. De expositieduur moet ten minste 6 uur per dag bedragen. De teststof moet iedere dag op ongeveer dezelfde tijd worden aangebracht; op vastgestelde tijden (iedere week of twee keer per week) is een correctie vereist om ervoor te zorgen dat het dosisniveau in verhouding tot het lichaamsgewicht van het dier constant blijft. Afgezien van de toediening van de teststof moeten de dieren in de controlegroep op dezelfde wijze als de dieren in de proefgroep worden behandeld. Indien een medium is gebruikt om het doseren te vergemakkelijken moet aan de mediumcontrolegroep op dezelfde wijze als aan de testgroep een dosis van het medium worden toegediend en deze dosis moet even groot zijn als die van de dieren in de groep met het hoogste dosisniveau. Het hoogste dosisniveau van de teststof moet leiden tot toxische effecten, maar er mogen geen of weinig sterfgevallen voorkomen. Bij het laagste dosisniveau mogen geen tekenen van toxiciteit optreden. Indien het blootstellingsniveau van de mens kan worden geschat, moet het laagste niveau deze overschrijden. In het ideale geval treden bij het middelste dosisniveau minimaal waarneembare toxische effecten op. Bij meer dan één tussendosis moet het verschil tussen de dosisniveaus zo groot zijn dat een gradatie in toxische effecten wordt verkregen. In de groep met de laagste dosis en in de tussengroepen, alsmede in de controlegroepen, mogen niet veel sterfgevallen voorkomen, omdat anders een zinvolle evaluatie van de resultaten niet mogelijk is.
Indien toediening van de teststof tot ernstige huidirritatie leidt, moeten de concentraties worden verlaagd, wat vermindering of ontbreken van andere toxische effecten bij het hoge dosisniveau tot gevolg kan hebben. Indien de huid ernstig is beschadigd, kan het zelfs noodzakelijk zijn de studie te beëindigen en een nieuwe studie met lagere concentraties te beginnen.
1.6.2.4. Limiettest
Indien bij een verkennende proef geen toxische effecten optreden bij een dosisniveau van 1 000 mg/kg, of een hoger niveau dat verband houdt met het niveau waaraan de mens, voor zover bekend, kan worden blootgesteld, is het wellicht niet noodzakelijk om verdere proeven te nemen.
1.6.2.5. Observatieperiode
De proefdieren moeten dagelijks worden onderzocht op tekenen van toxiciteit. Het tijdstip waarop de dood intreedt, het tijdstip waarop toxiciteitsverschijnselen voor het eerst zijn waargenomen en het tijdstip waarop zij weer verdwijnen, moeten worden opgetekend.
1.6.3. Uitvoering
De dieren moeten afzonderlijk in kooien worden gehuisvest. De dieren worden gedurende een periode van 28 dagen, zo mogelijk 7 dagen per week, met de teststof behandeld. Dieren in eventuele satellietgroepen voor latere waarnemingen moeten nog 14 dagen zonder behandeling worden gehouden om herstel of voortduren van de toxische effecten te kunnen vaststellen. De blootstellingstijd moet 6 uur per dag bedragen.
De teststof moet gelijkmatig worden aangebracht over een oppervlakte van ongeveer 10 % van de totale lichaamsoppervlakte. Bij zeer toxische stoffen kan de te bedekken oppervlakte kleiner zijn, maar een zo groot mogelijke oppervlakte moet worden bedekt met een zo dun en gelijkmatig mogelijk aangebrachte laag.
De teststof moet gedurende de blootstellingstijd door middel van poreus gaasverband en niet-irriterend plakband in contact met de huid worden gehouden. Het testgedeelte van de huid moet op geschikte wijze verder worden bedekt om het verbandgaas en de teststof op hun plaats te houden en om te verhinderen dat de dieren de teststof via de mond opnemen. Hulpmiddelen om de dieren te fixeren kunnen worden gebruikt om te voorkomen dat de dieren de teststof via de mond opnemen, maar het wordt niet aangeraden de dieren volledig te immobiliseren. Als alternatief kan een „beschermende halskraag” worden gebruikt.
Aan het einde van de blootstellingsperiode wordt de resterende teststof zo mogelijk met water van de huid verwijderd of anders door middel van een andere geschikte reinigingstechniek.
Alle dieren moeten dagelijks worden geobserveerd; tekenen van toxiciteit moeten worden genoteerd met inbegrip van het tijdstip waarop deze voor het eerst optraden en de mate en de duur ervan. Bij het observeren moet aandacht worden besteed aan veranderingen van de huid, de vacht, de ogen en de slijmvliezen, alsmede ademhalingsorganen, de bloedsomloop, het autonome en het centrale zenuwstelsel, de somatomotorische activiteit en het gedrag. Wekelijks moeten de dieren worden gewogen. Het is eveneens aanbevolen het voerverbruik wekelijks te meten. De dieren moeten regelmatig worden geobserveerd om te voorkomen dat ze voor de studie verloren gaan als gevolg van oorzaken als kannibalisme, autolyse van weefsels of omdat de dieren in verkeerde kooien zijn geplaatst. Na afloop van de onderzoekperiode wordt bij alle overlevende dieren in de behandelde groepen (afgezien van de dieren in de satellietgroep), necropsie verricht. Indien stervende dieren of dieren met hevige nood/ongemak of pijn worden aangetroffen, moeten deze worden verwijderd en op een humane manier worden gedood; bij hen wordt eveneens necropsie verricht.
Na afloop van de studie moeten bij alle dieren, met inbegrip van die uit de controlegroepen, de volgende onderzoekingen worden uitgevoerd:
|
1) |
Hematologie waarbij ten minste bepaling van hematocriet en hemoglobinegehalte, erythrocytentelling, totale en gedifferentieerde telling van de leucocyten en meting van stollingsvermogen. |
|
2) |
Klinisch-biochemische bepalingen in het bloed waarbij ten minste één parameter van de lever- en nierfunctie: serum alanineaminotransferase (vroegere benaming: serum glutaminezuur-pyrodruivenzuur-transaminase (SGPT)), serum aspartaataminotransferase (vroegere benaming: serum glutaminezuur-oxaalazijnzuur-transaminase (SGOT)), ureum, albumine, bloedcreatinine, totaal bilirubine en totaal serumeiwit. |
Voor een goede toxicologische evaluatie kan het nodig zijn het onderzoek uit te breiden met: calcium, fosfor chloride, natrium, kalium, glucosegehalte bij nuchtere toestand, analyse van de lipiden, hormonen, zuur/base-evenwicht, methemoglobine en cholinesterase-activiteit.
Zo nodig kan verder klinisch-biochemisch onderzoek worden verricht om het onderzoek van de waargenomen effecten uit te breiden.
1.6.4. Macroscopische necropsie
Bij alle dieren in de studie moet een volledige macroscopische necropsie worden uitgevoerd. Zo spoedig mogelijk na sectie moeten ten minste lever, nieren, bijnieren en testes nat worden gewogen om te voorkomen dat ze uitdrogen. Organen en weefsels (de normale en de behandelde huid, lever, nieren, milt, testes, bijnieren, hart en alle organen die macroscopisch waarneembare beschadigingen of veranderingen in omvang vertonen moeten in een geschikt medium worden bewaard voor eventueel later histopathologisch onderzoek.
1.6.5. Histopathologisch onderzoek
Bij de dieren in de groep die een hoge dosis heeft ontvangen en bij die in de controlegroep moet histopathologisch onderzoek op de bewaarde organen en weefsels worden verricht. Organen en weefsels die bij het hoogste doseringsniveau door de teststof blijken te zijn beschadigd, moeten in alle groepen met een lagere dosering worden onderzocht. Bij het histopathologisch onderzoek van de dieren in de satellietgroep moet speciaal worden gelet op de organen en weefsels waar, bij de andere behandelde groepen, effecten blijken te zijn opgetreden.
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek en het aantal dieren waarbij ieder type beschadiging voorkomt.
Alle waargenomen resultaten moeten met behulp van een geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, dieet, enzovoort; |
|
— |
proefomstandigheden (met inbegrip van het soort verband: occlusief of niet-occlusief); |
|
— |
dosisniveaus (met het eventueel medium) en concentraties; |
|
— |
waar mogelijk het hoogste dosisniveau waarbij geen effect optreedt; |
|
— |
gegevens over de toxische reactie naar geslacht en dosis; |
|
— |
tijdstip gedurende de studie waarop de dood intreedt, of aangeven of dieren tot het eind van de proef bleven leven; |
|
— |
toxische of andere effecten; |
|
— |
tijdstip waarop een abnormaal verschijnsel werd waargenomen en het verloop hiervan; |
|
— |
gegevens over voedsel en lichaamsgewicht; |
|
— |
uitgevoerde hematologische proeven en alle resultaten; |
|
— |
uitgevoerde klinisch-biochemische proeven en alle resultaten; |
|
— |
bevindingen bij de necropsie; |
|
— |
een gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
waar mogelijk statistische behandeling van de resultaten; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie algemene inleiding deel B (punt D).
4. LITERATUUR
Zie algemene inleiding deel B (punt E).
B.10. MUTAGENITEIT — IN-VITRO TEST OP CHROMOSOOMAFWIJKINGEN IN ZOOGDIERCELLEN
1. METHODE
Deze methode is overgenomen van TG 473 van de OESO: In-vitro test op chromosoomafwijkingen in zoogdiercellen (1997).
1.1. INLEIDING
De in-vitrotest op chromosoomafwijkingen is bedoeld om te bepalen welke stoffen structurele chromosoomafwijkingen bij gekweekte menselijke cellen veroorzaken (1)(2)(3). Er zijn twee soorten structurele afwijkingen: het chromosoomtype en het chromatidetype. De meeste chemische mutagenen veroorzaken afwijkingen van het chromatidetype, maar ook het chromosoomtype komt voor. Een toename van polyploïdie kan erop wijzen dat een chemische stof numerieke afwijkingen kan veroorzaken. Deze methode is echter niet opgezet om numerieke afwijkingen te meten en wordt normaal gesproken niet voor dat doel gebruikt. Chromosoommutaties en soortgelijke voorvallen veroorzaken veel genetische ziekten bij de mens en het lijkt er sterk op dat chromosoommutaties en soortgelijke voorvallen die veranderingen in oncogenen en tumorsuppressorgenen van somatische cellen veroorzaken, betrokken zijn bij de inductie van kanker bij de mens en bij proefdieren.
Bij de in-vitrotest op chromosoomafwijkingen kunnen culturen van permanente cellijnen, celstammen of primaire celculturen worden gebruikt. De gebruikte cellen worden geselecteerd op basis van het groeivermogen in een cultuur, de stabiliteit van het karyotype, het aantal chromosomen, de verscheidenheid van de chromosomen en de frequentie van spontane chromosoomafwijkingen.
Bij in vitro uitgevoerde tests moet er meestal een exogene metabole activeringsbron worden gebruikt. Dit metabole activeringssysteem kan de omstandigheden in een zoogdiercel in vivo niet volledig nabootsen. Er moet goed op worden gelet dat omstandigheden die kunnen leiden tot positieve resultaten die niet het gevolg zijn van intrinsieke mutageniteit maar door veranderingen in de pH of de osmolaliteit of een sterke cytotoxiciteit worden veroorzaakt, worden vermeden (4)(5).
Deze test wordt gebruikt voor de screening op mogelijke mutagenen en carcinogenen voor zoogdieren. Veel stoffen die positief op deze test reageren, zijn carcinogeen voor zoogdieren, maar er is geen absolute correlatie tussen deze test en carcinogeniteit. De correlatie is afhankelijk van de chemische klasse en het lijkt er steeds meer op dat er carcinogenen zijn die met deze test worden gesignaleerd omdat ze blijkbaar via andere mechanismen dan directe DNA-beschadiging werken.
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Afwijking van het chromatidetype: structurele chromosoombeschadiging waarbij breuken in individuele chromatiden ontstaan, eventueel gevolgd door recombinatie.
Afwijking van het chromosoomtype: structurele chromosoombeschadiging waarbij breuken in beide chromatiden op dezelfde plaats ontstaan, eventueel gevolgd door recombinatie.
Endoreduplicatie: een proces waarbij de kern na een S-fase met DNA-replicatie niet tot mitose overgaat, maar opnieuw een S-fase begint. Het resultaat is chromosomen met 4, 8, 16, ... chromatiden.
Hiaat: een achromatische beschadiging die kleiner is dan de breedte van één chromatide en waarbij de fout in de uitlijning van de chromatiden minimaal is.
Mitotische index: de verhouding tussen het aantal cellen in de metafase en het totale aantal cellen in een populatie: deze index geeft een indicatie van de snelheid waarmee deze populatie zich voortplant.
Numerieke afwijking: een verandering in het aantal chromosomen ten opzichte van het normale aantal dat kenmerkend is voor de gebruikte cellen.
Polyploïdie: het voorkomen van een ander veelvoud van het haploïde aantal chromosomen (n) dan het diploïde aantal (d.w.z. 3n, 4n, enz.).
Structurele afwijking: een verandering in de chromosoomstructuur die bij microscopisch onderzoek tijdens de metafase van de celdeling kan worden waargenomen in de vorm van deleties, fragmenten en intra- of interchromosomale uitwisselingen.
1.3. PRINCIPE VAN DE TESTMETHODE
Celculturen worden zowel met als zonder metabole activering aan de teststof blootgesteld. Op vooraf bepaalde tijdstippen na de blootstelling van de celculturen aan de teststof worden ze met een metafasestopper (bv. Colcemid® of colchicine) behandeld, geoogst en gekleurd en worden de cellen in de metafase microscopisch onderzocht op de aanwezigheid van chromosoomafwijkingen.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding
1.4.1.1. Cellen
Er kunnen verschillende soorten cellijnen, stammen of primaire celculturen worden gebruikt, waaronder ook menselijke cellen (bv. fibroblasten van Chinese hamsters of menselijke of van andere zoogdieren afkomstige perifere bloedlymfocyten).
1.4.1.2. Media en kweekomstandigheden
Er moet worden gezorgd voor geschikte kweekmedia en incubatieomstandigheden (kweekvat, CO2-concentratie, temperatuur en vochtigheid) voor de culturen. Permanente cellijnen en stammen moeten geregeld worden gecontroleerd om na te gaan of het modale aantal chromosomen stabiel is en er geen besmetting met mycoplasma heeft plaatsgevonden; indien dit laatste het geval is, mogen ze niet worden gebruikt. De normale tijd voor de celcyclus bij de gebruikte cellen en kweekomstandigheden moet bekend zijn.
1.4.1.3. Bereiding van de culturen
Permanente cellijnen en stammen: cellen uit stamculturen worden met een zodanige dichtheid in een kweekmedium geënt dat de kolonies voor het oogsten niet aaneengroeien, en bij 37 oC geïncubeerd.
Lymphocyten: met een stollingsremmer (bv. heparine) behandeld volledig bloed of geïsoleerde lymfocyten van gezonde proefpersonen worden toegevoegd aan het kweekmedium met een mitogeen (bv. fytohemagglutinine) en bij 37 oC geïncubeerd.
1.4.1.4. Metabole activering
De cellen dienen zowel met als zonder een geschikt metabool activeringssysteem aan de teststof te worden blootgesteld. Het meest gebruikte systeem is een post-mitochondriale fractie aangevuld met een cofactor (S9), verkregen uit de lever van knaagdieren die zijn behandeld met enzym-inducerende stoffen als Aroclor 1254 (6)(7)(8)(9) of een mengsel van fenobarbiton en ß-naftoflavon (10)(11)(12).
De post-mitochondriale fractie wordt meestal gebruikt bij een concentratie van 1-10 % (v/v) in het uiteindelijke medium. De omstandigheden voor het gebruik van een metabool activeringssysteem kunnen afhankelijk zijn van de aard van de geteste chemische verbinding. In sommige gevallen zal wellicht meer dan een concentratie van de post-mitochondriale fractie moeten worden gebruikt.
Een aantal ontwikkelingen, bijvoorbeeld de opbouw van genetisch aangepaste cellijnen waarin specifieke activeringsenzymen tot expressie komen, kan endogene activering mogelijk maken. Voor de keuze van de gebruikte cellijnen moet een wetenschappelijke verantwoording worden gegeven (bv. aan de hand van de relevantie van het cytochroom P450-isoenzym voor het metabolisme van de teststof).
1.4.1.5. Teststof/Bereiding
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de behandeling van de cellen worden verdund. Vloeibare teststoffen kunnen rechtstreeks aan het testsysteem worden toegediend en/of vóór de behandeling worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen van de teststof worden gebruikt.
1.4.2. Testomstandigheden
1.4.2.1. Oplosmiddel/Medium
Chemische reacties tussen het oplosmiddel/medium en de teststof moeten uitgesloten zijn en het oplosmiddel/medium moet verenigbaar zijn met het overleven van de cellen en de S9-activiteit. Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten gegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt. Wanneer stoffen worden getest die in water instabiel zijn, moeten de gebruikte organische oplosmiddelen watervrij zijn. Water kan door toevoeging van een moleculaire zeef worden verwijderd.
1.4.2.2. Blootstellingsconcentraties
Bij de bepaling van de hoogste concentratie moet onder andere rekening worden gehouden met de cytotoxiciteit, de oplosbaarheid in het testsysteem en veranderingen in de pH of de osmolaliteit.
De cytotoxiciteit moet met en zonder metabole activering in het hoofdexperiment worden bepaald aan de hand van adequate indicaties omtrent de integriteit en de groei van de cellen, zoals de mate van confluentie. het aantal levensvatbare cellen of de mitotische index. Het kan nuttig zijn vooraf een apart experiment uit te voeren om de cytotoxiciteit en de oplosbaarheid te bepalen.
Er moeten ten minste drie analyseerbare concentraties worden gebruikt. Wanneer er cytotoxiciteit optreedt, moeten deze concentraties een interval van de maximale tot geen of vrijwel geen toxiciteit bestrijken; dit betekent meestal dat de concentraties niet meer dan een factor 2 tot √10 uit elkaar mogen liggen. Bij het oogsten moet de hoogste concentratie een significante verlaging van de mate van confluentie, het aantal cellen of de mitotische index veroorzaken (voor alle parameters meer dan 50 %). De mitotische index is slechts een indirecte maat voor de cytotoxische/cytostatische effecten en is afhankelijk van het tijdstip na de behandeling. De mitotische index is echter aanvaardbaar voor culturen in suspensie, waarbij andere metingen van de toxiciteit omslachtig en onpraktisch kunnen zijn. Informatie over de kinetiek van de celcyclus, zoals de gemiddelde generatietijd (GGT), kan als aanvulling worden gebruikt. De GGT is echter een algeheel gemiddelde waaruit niet altijd blijkt of er achterblijvende deelpopulaties zijn en zelfs een geringe stijging van de GGT kan samengaan met een zeer aanzienlijke vertraging op het moment waarop de hoeveelheid afwijkingen maximaal is.
Bij stoffen met een betrekkelijk geringe cytotoxiciteit moet de maximale concentratie 5 μl/ml, 5 mg/ml of 0,01 M (de laagste van deze drie) zijn.
Bij betrekkelijk onoplosbare stoffen die bij lagere concentraties dan de oplosbaarheidsgrens niet toxisch zijn, moet de hoogste dosis een concentratie boven de oplosbaarheidsgrens in het uiteindelijke kweekmedium aan het eind van de behandelingsperiode zijn. In sommige gevallen (bv. wanneer de toxiciteit alleen optreedt bij hogere concentraties dan de oplosbaarheidsgrens, is het raadzaam bij meer dan één concentratie met zichtbaar neerslag te testen. Het kan nuttig zijn de oplosbaarheid aan het begin en het eind van de behandeling te bepalen, aangezien de oplosbaarheid tijdens de blootstelling in het testsysteem door de aanwezigheid van bijvoorbeeld cellen, S9 of serum kan veranderen. Onoplosbaarheid kan met het blote oog worden geconstateerd. Het neerslag mag niet storen bij het scoren.
1.4.2.3. Negatieve en positieve controles
Bij elk experiment moeten tegelijkertijd positieve en negatieve (oplosmiddel of medium) controles worden uitgevoerd, zowel met als zonder metabole activering. Wanneer metabole activering wordt gebruikt, moet de voor de positieve controle gebruikte chemische stof activering vereisen om een mutagene reactie te veroorzaken.
Voor de positieve controles moet een bekend klastogeen worden gebruikt, waarvan op het blootstellingsniveau een reproduceerbare en detecteerbare stijging ten opzichte van het achtergrondniveau kan worden verwacht om de gevoeligheid van het testsysteem aan te tonen.
De concentraties van de positieve controle moeten zodanig worden gekozen dat de effecten duidelijk zijn maar de gecodeerde objectglaasjes niet onmiddellijk als zodanig herkenbaar zijn. Als positieve controle kunnen bijvoorbeeld worden gebruikt:
|
Metabole activering |
Stof |
CAS-nr. |
Einecs-nr. |
|
Zonder exogene metabole activering |
Methylmethaansulfonaat |
66-27-3 |
200-625-0 |
|
Ethylmethaansulfonaat |
62-50-0 |
200-536-7 |
|
|
Ethylnitrosoureum |
759-73-9 |
212-072-2 |
|
|
Mitomycine C |
50-07-7 |
200-008-6 |
|
|
4-Nitrochinoline-N-oxide |
56-57-5 |
200-281-1 |
|
|
Met exogene metabole activering |
Benzo[a]pyreen |
50-32-8 |
200-028-5 |
|
Cyclofosfamide Cyclofosfamide monohydraat |
50-18-0 6055-19-2 |
200-015-4 |
Ook andere geschikte stoffen kunnen als positieve controle worden gebruikt. Waar mogelijk dient het gebruik van stoffen uit een verwante chemische klasse als positieve controle te worden overwogen.
Voor elk oogsttijdstip dienen negatieve controles in het experiment te worden opgenomen, waaraan uitsluitend het oplosmiddel of het medium wordt toegediend en die verder op dezelfde manier als de culturen met teststof worden behandeld. Daarnaast moeten er ook controles worden gebruikt waaraan niets wordt toegediend, tenzij in het verleden reeds is aangetoond dat het gekozen oplosmiddel geen schadelijke of mutagene effecten veroorzaakt.
1.4.3. Uitvoering
1.4.3.1. Behandeling met de teststof
Delende cellen worden zowel met als zonder metabool activeringssysteem met de teststof behandeld. De behandeling van lymfocyten moet ongeveer 48 uur na de mitogene stimulering beginnen.
|
1.4.3.2. |
Normaal gesproken moeten voor elke concentratie twee culturen worden gebruikt en voor culturen met negatieve/oplosmiddelcontrole wordt dit sterk aanbevolen. Wanneer aan de hand van gegevens uit het verleden kan worden aangetoond dat de verschillen tussen duploculturen minimaal zijn (13)(14), kan het gebruik van één cultuur voor elke concentratie aanvaardbaar zijn. Bij het testen van gassen of vluchtige stoffen moet een daarvoor geschikte methode worden gevolgd, bijvoorbeeld in een gesloten kweekvat (15)(16). |
1.4.3.3. Oogsttijdstippen
Bij het eerste experiment moeten de cellen zowel met als zonder metabole activering gedurende drie tot zes uur aan de teststof worden blootgesteld en wordt op een tijdstip dat overeenkomt met ongeveer 1,5-maal de normale lengte van een celcyclus na het begin van de behandeling bemonsterd (12). Als op deze wijze zowel met als zonder activering negatieve resultaten worden verkregen, wordt een nieuw experiment zonder activering uitgevoerd, waarbij de behandeling wordt voortgezet totdat op een tijdstip dat overeenkomt met ongeveer 1,5-maal de normale lengte van een celcyclus wordt bemonsterd. Voor sommige stoffen gaat de detectie beter bij een behandelings/bemonsteringstijd van meer dan 1,5-maal de lengte van de celcyclus. Negatieve resultaten met metabole activering moeten per geval worden bevestigd. Wanneer bevestiging van negatieve resultaten niet nodig wordt geacht, moet hiervoor een motivering worden gegeven.
1.4.3.4. Chromosoompreparaten
De celculturen worden meestal gedurende één tot drie uur vóór het oogsten behandeld met Colcemid® of colchicine. Elke celcultuur wordt afzonderlijk geoogst en behandeld voor het maken van chromosoompreparaten. Dit houdt in dat de cellen een hypotone behandeling krijgen, gevolgd door fixatie en kleuring.
1.4.3.5. Analyse
Alle objectglaasjes, ook die van de positieve en negatieve controles, worden vóór de microscopische analyse onafhankelijk gecodeerd. Aangezien bij de fixatie vaak een gedeelte van de metafasecellen breekt, waarbij chromosomen verloren gaan, moeten de gescoorde cellen voor alle celtypes het modale aantal ± 2 centromeren bevatten. Per concentratie en controle moeten minimaal 200 goed gespreide metafasen worden gescoord, indien van toepassing gelijkelijk verdeeld over de duplobepalingen. Wanneer een groot aantal afwijkingen wordt geconstateerd, kan dit aantal worden verlaagd.
Hoewel de test bedoeld is om structurele chromosoomafwijkingen op te sporen, is het belangrijk dat bij waarneming van polyploïdie en endoreduplicatie ook deze verschijnselen worden geregistreerd.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
Aangezien de cel bij dit experiment de eenheid is, moet het percentage cellen met één of meer structurele chromosoomafwijkingen worden bepaald. Er moet een overzicht worden gegeven van de verschillende soorten structurele chromosoomafwijkingen met de aantallen en de frequentie waarmee ze in de behandelde en controleculturen voorkomen. Hiaten worden apart geregistreerd en gerapporteerd, maar worden meestal niet in de totale frequentie van de afwijkingen opgenomen.
Gelijktijdige metingen van de cytotoxiciteit voor alle behandelde en negatieve controleculturen bij de hoofdexperimenten dienen ook te worden geregistreerd.
De gegevens moeten voor elke cultuur apart worden verstrekt. Daarnaast moet er een overzicht van alle gegevens in tabelvorm worden samengesteld.
Een duidelijk positieve reactie behoeft niet te worden bevestigd. Bij onduidelijke resultaten moet nader onderzoek worden gedaan, bij voorkeur onder gewijzigde experimentele omstandigheden. De noodzakelijke bevestiging van negatieve resultaten is al onder punt 1.4.3.3. besproken. Bij vervolgexperimenten dient wijziging van parameters te worden overwogen om de bepaling uit te breiden tot een breder scala van omstandigheden. Parameters die voor wijziging in aanmerking komen zijn bijvoorbeeld de concentratie-intervallen en de omstandigheden bij metabole activering.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Er zijn verschillende criteria om tot een positief resultaat te besluiten, zoals een concentratieafhankelijke of een reproduceerbare stijging van het aantal cellen met chromosoomafwijkingen. In eerste instantie moet naar de biologische relevantie van de resultaten worden gekeken. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt (3)(13). Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn.
Een stijging van het aantal polyploïde cellen kan erop wijzen dat de teststof in staat is mitotische processen te remmen en numerieke chromosoomafwijkingen te induceren. Een stijging van het aantal cellen met endoreduplicatie van chromosomen kan erop wijzen dat de teststof in staat is de voortgang van de celcyclus te remmen (17)(18).
Indien de resultaten voor een teststof niet aan bovenstaande criteria voldoen, wordt de stof in dit systeem als niet-mutageen beschouwd.
Hoewel de meeste experimenten duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststof in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt herhaald, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de in-vitrotest op chromosoomafwijkingen wijzen erop dat de teststof in gekweekte somatische zoogdiercellen structurele chromosoomafwijkingen induceert. Negatieve resultaten wijzen erop dat de stof onder de testomstandigheden in gekweekte somatische zoogdiercellen geen chromosoomafwijkingen induceert.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Cellen:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Evans, H.J. (1976). Cytological Methods for Detecting Chemical Mutagens. In: Chemical mutagens, Prin-ciples and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press. New York and Lon-don, pp. 1-29. |
|
(2) |
Ishidate, M.Jr. and Sofuni, T. (1985). The in Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture. In: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (Eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, pp. 427-432. |
|
(3) |
Galloway, S.M., Armstrong, M.J., Reuben, C Colman. S., Brown, B., Cannon, C, Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G.H., Resnick, M.A., Anderson, G. and Zeiger, E. (1978). Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals. Environs. Molec. Mutagen 10 (suppl.10), pp. 1-175. |
|
(4) |
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate. M.Jr., Brusick, D., Ashby, J. and Myhr. B.C. (1991). Genotoxicity under Extreme Culture Conditions. A report from)CPEMC Task Group 9. Mutation Res.. 257, pp. 147-204. |
|
(5) |
Morita. T., Nagaki, T.. Fukuda, I. and Okumura, K., (1992). Clastogenicity of low pH to Various Cultured Mammalian Cells. Mutation Res., 268, pp. 297-305. |
|
(6) |
Ames, B.N., McCann. J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31, pp. 347-364. |
|
(7) |
Maron, D.M. and Ames. B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, pp. 17 3-215. |
|
(8) |
Natarajan, A.T., Tates, A.D., van Buul, P.P.W., Meijers, M. and de Vogel, N. (1976). Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System In Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37, pp. 83-90. |
|
(9) |
Matsuoka, A., Hayashi, M and Ishidate, M. Jr. (1979). Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro. Mutation Res., 66, pp. 277-290. |
|
(10) |
Elliot, B.M., Combes, R.D., Elcombe. C.R., Gatehouse, D.G., Gibson, G.G., Mackay,].M. and Wolf, R.C. (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, pp. 175-177. |
|
(11) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds) In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, pp. 85-88. |
|
(12) |
Galloway, S.M., Aardema. M.J.. Ishidate, M.Jr., Ivett, J.L., Kirkland, DJ., Morita, T., Mosesso, P., Sofuni, T. (1994). Report from Working Group on In Vitro Tests for Chromosomal Aberrations. Mutation Res., 312, pp. 241-261. |
|
(13) |
Richardson, C, Williams, D.A., Allen, J.A., Amphlett, G., Chanter, D.O. and Phillips, B. (1989). Analysis of Data from In Vitro Cytogenetic Assays. In: Statistical Evaluation of Mutagenicity Test Data. Kirkland, D.J., (ed) Cambridge University Press, Cambridge, pp. 141-154. |
|
(14) |
Soper, K.A. and Galloway, S.M, (1994). Replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells. Mutation Res., 312, pp. 139-149. |
|
(15) |
Krahn. D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, pp. 91-103. |
|
(16) |
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels of Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis. 5, pp. 795-801. |
|
(17) |
Locke-Huhle. C. (1983). Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res., 119, pp. 403-413. |
|
(18) |
Huang, Y., Change, C. and Trosko. J.E. (1983). Aphidicolin-induced endoreduplication in Chinese hamster cells. Cancer Res., 43, pp. 1362-1364. |
B.11. MUTAGENITEIT — IN-VIVO TEST OP CHROMOSOOMAFWIJKINGEN IN BEENMERGCELLEN VAN ZOOGDIEREN
1. METHODE
Deze methode is overgenomen van TG 475 van de OESO: Test op chromosoomafwijkingen in beenmergcellen van zoogdieren (1997).
1.1. INLEIDING
De in-vivotest op chromosoomafwijkingen bij zoogdieren wordt gebruikt om te bepalen welke stoffen structurele chromosoomafwijkingen bij beenmergcellen van dieren, meestal knaagdieren, veroorzaken (1) (2) (3) (4). Er zijn twee soorten structurele afwijkingen: het chromosoomtype en het chromatidetype. Een toename van polyploïdie kan erop wijzen dat een chemische stof numerieke afwijkingen kan veroorzaken. De meeste chemische mutagenen veroorzaken afwijkingen van het chromatidetype, maar ook het chromosoomtype komt voor. Chromosoommutaties en soortgelijke voorvallen veroorzaken veel genetische ziekten bij de mens en het lijkt er sterk op dat chromosoommutaties en soortgelijke voorvallen die veranderingen in oncogenen en tumorsuppressorgenen veroorzaken, betrokken zijn bij de inductie van kanker bij de mens en bij proefdieren.
Voor deze test worden meestal knaagdieren gebruikt. Het doelweefsel is het beenmerg aangezien dit een sterk doorbloed weefsel is en een populatie snel delende cellen bevat die gemakkelijk kunnen worden geïsoleerd en verwerkt. De methode is niet geschikt voor andere diersoorten en doelweefsels.
Deze test op chromosoomafwijkingen is bijzonder geschikt om het gevaar van mutagene effecten te evalueren, aangezien rekening kan worden gehouden met factoren die samenhangen met het metabolisme in vivo, de farmacokinetiek en de DNA-herstelsynthese, hoewel deze aspecten van soort tot soort en van weefsel tot weefsel kunnen verschillen. Een in-vivotest is ook geschikt om een in vitro gesignaleerd mutageen effect nader te onderzoeken.
Als er aanwijzingen zijn dat de teststof of een reactieve metaboliet daarvan niet in het doelweefsel terechtkomt, is deze test niet geschikt.
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Afwijking van het chromatidetype: structurele chromosoombeschadiging waarbij breuken in individuele chromatiden ontstaan, eventueel gevolgd door recombinatie.
Afwijking van het chromosoomtype: structurele chromosoombeschadiging waarbij breuken in beide chromatiden op dezelfde plaats ontstaan, eventueel gevolgd door recombinatie.
Endoreduplicatie: een proces waarbij de kern na een S-fase met DNA-replicatie niet tot mitose overgaat, maar opnieuw een S-fase begint. Het resultaat is chromosomen met 4, 8, 16, ... chromatiden.
Hiaat: een achromatische beschadiging die kleiner is dan de breedte van één chromatide en waarbij de fout in de uitlijning van de chromatiden minimaal is.
Numerieke afwijking: een verandering in het aantal chromosomen ten opzichte van het normale aantal dat kenmerkend is voor de gebruikte cellen.
Polyploïdie: het voorkomen van een ander veelvoud van het haploïde aantal chromosomen (n) dan het diploïde aantal (d.w.z. 3n, 4n. enz.).
Structurele afwijking: een verandering in de chromosoomstructuur die bij microscopisch onderzoek tijdens de metafase van de celdeling kan worden waargenomen in de vorm van deleties, fragmenten en intra- of interchromosomale uitwisselingen.
1.3. PRINCIPE VAN DE TESTMETHODE
De dieren worden langs een geschikte weg aan de teststof blootgesteld en op geschikte tijdstippen na de behandeling gedood. Voordat de dieren worden gedood, worden ze behandeld met een metafasestopper (bv. colchicine of Colcemid®). Vervolgens worden chromosoompreparaten van de beenmergcellen gemaakt, die worden gekleurd; de cellen in de metafase worden geanalyseerd op chromosoomafwijkingen.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding
1.4.1.1. Keuze van de diersoort
Meestal worden ratten, muizen of Chinese hamsters gebruikt, maar in principe komt elke geschikte zoogdiersoort in aanmerking. Er dient gebruik te worden gemaakt van jonge gezonde volwassen dieren van in het laboratorium gangbare stammen. Bij het begin van de studie moet het gewichtsverschil tussen de dieren zo klein mogelijk zijn en mag dit maximaal ± 20 % van het gemiddelde gewicht van elk geslacht bedragen.
1.4.1.2. Huisvesting en voeding
De in de algemene inleiding van deel B genoemde algemene omstandigheden worden aangehouden, maar voor de luchtvochtigheid wordt gestreefd naar 50-60 %.
1.4.1.3. Voorbereiding van de dieren
Gezonde jonge volwassen dieren worden aselect ingedeeld in de behandelde en controlegroepen. De kooien moeten zodanig worden geplaatst dat mogelijke effecten daarvan tot een minimum worden beperkt. De dieren krijgen een unieke identificatie. Ze krijgen minimaal vijf dagen de tijd om in het laboratorium te acclimatiseren.
1.4.1.4. Bereiding van de doseringen
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de toediening aan de dieren worden verdund. Vloeibare teststoffen kunnen rechtstreeks worden toegediend of vóór de toediening worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen van de teststof worden gebruikt.
1.4.2. Testomstandigheden
1.4.2.1. Oplosmiddel/Medium
Het oplosmiddel/medium mag bij de gebruikte dosisniveaus geen toxische effecten veroorzaken en chemische reacties met de teststof moeten uitgesloten zijn. Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten gegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt.
1.4.2.2. Controles
Bij elk experiment moeten tegelijkertijd positieve en negatieve (oplosmiddel/medium) controles voor elk geslacht worden uitgevoerd. Afgezien van de behandeling met de teststof moeten de dieren in de controlegroepen op identieke wijze worden behandeld als de dieren in de andere groepen.
Voor de positieve controles moet een stof worden gebruikt die in vivo structurele afwijkingen veroorzaakt op een blootstellingsniveau waarbij een detecteerbare stijging ten opzichte van het achtergrondniveau kan worden verwacht. De doseringen van de positieve controles moeten zodanig worden gekozen dat de effecten duidelijk zijn maar de gecodeerde objectglaasjes niet onmiddellijk ais zodanig herkenbaar zijn. Het is aanvaardbaar de positieve controle langs een andere weg toe te dienen dan de teststof en slechts op één tijdstip te bemonsteren. Waar mogelijk kan het gebruik van stoffen uit een verwante chemische klasse als positieve controle worden overwogen. Als positieve controle kunnen bijvoorbeeld worden gebruikt:
|
Stof |
CAS-nr. |
Einecs-nr. |
|
Ethylmethaansulfonaat |
62-50-0 |
200-536-7 |
|
Ethylnitrosoureum |
759-73-9 |
212-072-2 |
|
Mitomycine C |
50-07-7 |
200-008-6 |
|
Cyclofosfamide Cyclofosfamide monohydraat |
50-18-0 605 5-19-2 |
200-015-4 |
|
Triethyleenmelamine |
51-18-3 |
200-083-5 |
Voor elk bemonsteringstijdstip dienen negatieve controles in het experiment te worden opgenomen, waaraan uitsluitend het oplosmiddel of het medium wordt toegediend en die verder op dezelfde manier als de andere groepen worden behandeld, tenzij uit in het verleden uitgevoerde controles aanvaardbare gegevens beschikbaar zijn over de spreiding over de dieren en de frequentie van cellen met chromosoomafwijkingen. Als voor de negatieve controles één bemonsteringstijdstip wordt gebruikt, kan hiervoor het beste het eerste bemonsteringstijdstip worden gekozen. Daarnaast moeten er ook onbehandelde controles worden gebruikt, tenzij in het verleden of in de literatuur reeds is aangetoond dat het gekozen oplosmiddel of medium geen schadelijke of mutagene effecten veroorzaakt.
1.5. UITVOERING
1.5.1. Aantal en geslacht van de dieren
Elke behandelde en controlegroep moet minimaal vijf analyseerbare dieren per geslacht bevatten. Als er bij de uitvoering van de studie gegevens uit studies bij dezelfde soort en met dezelfde blootstellingsweg beschikbaar zijn waaruit blijkt dat er geen significante verschillen in toxiciteit tussen de geslachten zijn, is het voldoende de test bij één geslacht uit te voeren. Wanneer de blootstelling aan een chemische stof bij de mens door het geslacht wordt bepaald, zoals bijvoorbeeld bij sommige geneesmiddelen het geval is, moet de test bij dieren van het desbetreffende geslacht worden uitgevoerd.
1.5.2. Behandelingsschema
De teststof wordt bij voorkeur in één dosis toegediend. De dosis kan eventueel worden gesplitst, waarbij de twee porties op dezelfde dag met een interval van niet meer dan enkele uren worden toegediend, om de toediening van een groot volume te vergemakkelijken. Voor een ander doseringsschema moet een wetenschappelijke motivering worden gegeven.
De monsters worden op twee aparte tijdstippen na de behandeling op één dag genomen. Voor knaagdieren ligt het eerste bemonsteringstijdstip op 1,5 maal de normale lengte van een celcyclus (deze cyclus duurt meestal 12 tot 18 uur) na de behandeling. Aangezien de voor de opname en het metabolisme van de teststof vereiste tijd en de effecten op de kinetiek van de celcyclus gevolgen kunnen hebben voor het optimale tijdstip om chromosoomafwijkingen te detecteren, verdient het aanbeveling 24 uur na het eerste bemonsteringstijdstip opnieuw te bemonsteren. Indien het doseringsschema meer dan één dag beslaat, moet één bemonsteringstijdstip op 1,5 maal de normale lengte van een celcyclus na de laatste toediening worden gebruikt.
Voordat de dieren worden gedood, worden ze intraperitoneaal geïnjecteerd met een adequate dosis metafasestopper (bv. Colcemid® of colchicine). De dieren worden na een adequate pauze bemonsterd. Voor muizen moet er ongeveer drie tot vijf uur worden gewacht en voor Chinese hamsters ongeveer vier tot vijf uur. De cellen worden uit het beenmerg gehaald en op chromosoomafwijkingen geanalyseerd.
1.5.3. Dosisniveaus
Als er een oriënterend onderzoek wordt uitgevoerd omdat er geen bruikbare gegevens over de dosering beschikbaar zijn, moet dit in hetzelfde laboratorium gebeuren met dezelfde soort, dezelfde stam, hetzelfde geslacht en hetzelfde behandelingsschema als bij het hoofdonderzoek (5). Als er sprake is van toxiciteit, worden er voor het eerste bemonsteringstijdstip drie dosisniveaus gebruikt. Deze dosisniveaus moeten een interval van de maximale tot geen of vrijwel geen toxiciteit bestrijken. Op het latere bemonsteringstijdstip behoeft alleen de hoogste dosis te worden gebruikt. De hoogste dosis wordt gedefinieerd als de dosis die zodanige toxiciteitsverschijnselen veroorzaakt dat er bij hogere doses met hetzelfde doseringsschema waarschijnlijk sterfte zal optreden. Stoften met een specifieke biologische activiteit bij lage niet-toxische doses (zoals hormonen en mitogenen) kunnen een uitzondering vormen op deze criteria om de dosering te bepalen en moeten per geval worden beoordeeld. De hoogste dosis kan ook worden gedefinieerd als een dosis die enigerlei aanwijzing van toxiciteit voor het beenmerg oplevert (bv. een daling van de mitotische index met meer dan 50 %).
1.5.4. Limiettest
Als een test met één dosis van minimaal 2 000 mg/kg lichaamsgewicht, in één keer of in twee porties op dezelfde dag toegediend, geen waarneembare toxische effecten veroorzaakt en op basis van gegevens over stoffen met een verwante structuur geen genotoxiciteit te verwachten valt, zal het wellicht niet nodig zijn een volledig onderzoek met drie dosisniveaus uit te voeren. Voor studies met een langere duur is de limietdosis 2 000mg/kg lichaamsgewicht/dag bij toediening gedurende maximaal 14 dagen en 1 000 mg/kg lichaamsgewicht/dag bij toediening gedurende meer dan 14 dagen. Op grond van gegevens omtrent de verwachte blootstelling van de mens kan het gebruik van een hoger dosisniveau bij de limiettest nodig worden geacht.
1.5.5. Toediening van de doses
De teststof wordt meestal met behulp van een maagsonde of een geschikte intubatiecanule of door intraperitoneale injectie toegediend. Ook andere toedieningswegen kunnen aanvaardbaar zijn, als daarvoor een motivering kan worden gegeven. Het maximale volume vloeistof dat in één keer met een sonde of injectie kan worden toegediend, is afhankelijk van de grootte van het proefdier. Het volume mag niet groter zijn dan 2ml/100g lichaamsgewicht. Voor het gebruik van grotere volumes moet een motivering worden gegeven. Behalve bij prikkelende of bijtende stoffen, die in hogere concentraties meestal hevigere effecten veroorzaken, moeten volumeverschillen tot een minimum worden beperkt door de concentratie aan te passen, zodat op alle dosisniveaus hetzelfde volume kan worden gebruikt.
1.5.6. Chromosoompreparaten
Onmiddellijk nadat het dier is gedood wordt beenmerg verwijderd, in een hypotone oplossing gebracht en gefixeerd. De cellen worden vervolgens op objectglaasjes uitgesmeerd en gekleurd.
1.5.7. Analyse
Als maat voor de cytotoxiciteit wordt in ten minste 1 000 cellen per dier voor alle behandelde dieren (ook de positieve controles) en onbehandelde dieren voor de negatieve controle de mitotische index bepaald.
Voor elk dier worden minimaal 100 cellen geanalyseerd. Wanneer een groot aantal afwijkingen wordt geconstateerd, kan dit aantal worden verlaagd. Alle objectglaasjes, ook die van de positieve en negatieve controles, worden vóór de microscopische analyse onafhankelijk gecodeerd. Aangezien bij de bereiding van de objectglaasjes vaak een gedeelte van de metafasecellen breekt, waarbij chromosomen verloren gaan, moeten de gescoorde cellen 2n ± 2 centromeren bevatten.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens moeten voor elk dier apart in tabelvorm worden verstrekt. De eenheid bij dit experiment is het dier. Voor elk dier moet het aantal gescoorde cellen, het aantal afwijkingen per cel en het percentage cellen met een of meer structurele chromosoomafwijkingen worden bepaald. Er moet een overzicht worden gegeven van de verschillende soorten structurele chromosoomafwijkingen met de aantallen en de frequentie waarmee ze in de behandelde en controlegroepen voorkomen. Hiaten worden apart geregistreerd en gerapporteerd maar meestal niet in de totale frequentie van de afwijkingen opgenomen. Als er geen aanwijzingen zijn voor verschillen in reactie tussen de geslachten, kunnen de gegevens van beide geslachten voor de statistische analyse worden gecombineerd.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Er zijn verschillende criteria om tot een positief resultaat te besluiten, zoals een dosisafhankelijke stijging van het relatieve aantal cellen met chromosoomafwijkingen of een duidelijke stijging van het aantal cellen met afwijkingen in één dosisgroep bij één bemonsteringstijd. In eerste instantie moet naar de biologische relevantie van de resultaten worden gekeken. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt (6). Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn. Bij onduidelijke resultaten moet nader onderzoek worden gedaan, bij voorkeur onder gewijzigde experimentele omstandigheden.
Een toename van polyploïdie kan erop wijzen dat de teststof in staat is numerieke chromosoomafwijkingen te induceren. Een toename van endoreduplicatie kan erop wijzen dat de teststof in staat is de voortgang van de celcyclus te remmen (7)(8).
Indien de resultaten voor een teststof niet aan bovenstaande criteria voldoen, wordt de stof bij deze test als niet-mutageen beschouwd.
Hoewel de meeste experimenten duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststof in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt uitgevoerd, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de in-vivotest op chromosoomafwijkingen wijzen erop dat een stof in het beenmerg van de geteste soort chromosoomafwijkingen induceert. Negatieve resultaten wijzen erop dat de stof onder de testomstandigheden in het beenmerg van de geteste soort geen chromosoomafwijkingen induceert.
De waarschijnlijkheid dat de teststof of de metabolieten daarvan in de grote bloedsomloop of specifiek het doelweefsel terechtkomen (systemische toxiciteit), dient te worden besproken.
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Adler, I.D. (1984). Cytogenetic Tests in Mammals. In: Mutagenicity Testing: a Practical Approach. S. Venitt and J.M. Parry (Eds). IRL Press, Oxford, Washington D.C., pp. 275-306. |
|
(2) |
Preston, R.J., Dean, B.J., Galloway, S., Holden, H., McFee, A.F. and Shelby, M. (1987). Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells. Mutation Res., 189, pp. 157-165. |
|
(3) |
Richold, M., Chandley, A., Ashby,)., Gatehouse, D.G., Bootman, J. and Henderson, L. (1990). In In Vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141. |
|
(4) |
Tice, R.R., Hayashi, M., MacGregor, J.T., Anderson, D., Blakey, D.H., Holden, H.E., Kirsch-Volders, M., Oleson Jr., F.B., Pacchierotti, F., Preston, R.J., Romagna, F., Simada, H., Sutou, S. and Vannier, B. (1994). Report from the Working Group on the in Vivo Mammalian Bone Marrow Chromosomal Aberration Test. Mutation Res., 312, pp. 305-312. |
|
(5) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe. J., Esdaile, DJ., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, pp. 31 3-319. |
|
(6) |
Lovell, D.P., Anderson, D., Albanese. R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In \'ivo Cytogenetic Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part. III. Statistical Evaluation of Mutagenicity Test Data. D.J. Kirkland, (Ed.) Cambridge University Press. Cambridge. pp. 184-232. |
|
(7) |
Locke-Huhle, C. (198 3). Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res. 119, pp. 403-413. |
|
(8) |
Huang, Y., Change, C. and Trosko, J.E. (1983). Aphidicolin-induced endoreduplication in Chinese hamster cells. Cancer Res.. 43, pp. 1362-1364. |
B.12. MUTAGENITEIT — IN-VIVO MICRONUCLEUSTEST BIJ ERYTROCYTEN VAN ZOOGDIEREN
1. METHODE
Deze methode is overgenomen van TG 474 van de OESO: Micronuleustest bij erytrocyten van zoogdieren (1997).
1.1. INLEIDING
De in-vivo micronuleustest bij zoogdieren wordt gebruikt om na te gaan of de teststof schade toebrengt aan de chromosomen of het mitotisch apparaat van erytroblasten door de analyse van erytrocyten die worden verkregen uit het beenmerg en/of de perifere bloedcellen van dieren, meestal knaagdieren.
De micronuleustest is bedoeld om stoften te signaleren die cytogenetische schade veroorzaken waarbij micro-nuclei ontstaan met achtergebleven chromosoomfragmenten of volledige chromosomen.
Wanneer een erytroblast uit het beenmerg zich ontwikkelt tot een polychromatische erytrocyt, wordt de hoofdkern uitgestoten: wanneer een micronucleus is ontstaan, kan deze in het overigens kernloze cytoplasma achterblijven. Omdat deze cellen geen hoofdkern bevatten, zijn de micronuclei gemakkelijker zichtbaar te maken. Een stijging van de frequentie waarmee bij behandelde dieren polychromatische erytrocyten met micronuclei worden aangetroffen, wijst op chromosoombeschadiging.
Voor deze test wordt meestal het beenmerg van knaagdieren gebruikt, aangezien in dit weefsel polychromatische erytrocyten worden gevormd. Het is ook aanvaardbaar het aantal onrijpe (polychromatische) erytrocyten met micronuclei in perifeer bloed te bepalen bij soorten waarvan is aangetoond dat de milt niet in staat is erytrocyten met micronuclei op te ruimen of dat de gevoeligheid om stoffen die structurele of numerieke chromosoomafwijkingen veroorzaken te detecteren afdoende is. Micronuclei kunnen aan de hand van een aantal criteria worden onderscheiden, bijvoorbeeld op grond van de aan- of afwezigheid van een kinetochoor-of centromeer-DNA in de micronuclei. Het belangrijkste eindpunt is de frequentie van onrijpe (polychromatische) erytrocyten met micronuclei. Het aantal rijpe (normochromatische) erytrocyten in het perifere bloed met micronuclei, bepaald bij een bekend aantal rijpe erytrocyten, kan ook als eindpunt van de bepaling worden gebruikt wanneer de dieren gedurende ten minste vier weken ononderbroken worden behandeld.
Deze in-vivo micronucleustest bij zoogdieren is bijzonder geschikt om het gevaar van mutagene effecten te evalueren, aangezien rekening kan worden gehouden met factoren die samenhangen met het metabolisme in vivo, de farmacokinetiek en de DNA-herstelsynthese, hoewel deze aspecten van soort tot soort, van weefsel tot weefsel en voor de verschillende genetische eindpunten kunnen verschillen. Een in-vivo bepaling is ook geschikt om een in vitro gesignaleerd mutageen effect nader te onderzoeken.
Als er aanwijzingen zijn dat de teststof of een reactieve metaboliet daarvan niet in het doelweefsel terechtkomt, is deze test niet geschikt.
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Centromeer (kinetochoor): het deel of de delen van een chromosoom waar tijdens de celdeling de spoeldraden aan vastzitten, zodat de verplaatsing van de dochterchromosomen naar de polen van de dochtercellen regelmatig kan verlopen.
Micronucleus: een kleine kern die buiten en naast de hoofdkern van cellen tijdens de telofase van de mitose (meiose) ontstaat door achtergebleven chromosoomfragmenten of volledige chromosomen.
Normochromatische erytrocyt: een rijpe erytrocyt zonder ribosomen die van onrijpe polychromatische erytrocyten kan worden onderscheiden door de selectieve kleuring van ribosomen.
Polychromatische erytrocyt: een onrijpe erytrocyt in een tussentijdse ontwikkelingsfase die nog ribosomen bevat en derhalve van rijpe normochromatische erytrocyten kan worden onderscheiden door de selectieve kleuring van ribosomen.
1.3. PRINCIPE VAN DE TESTMETHODE
De dieren worden langs een geschikte weg aan de teststof blootgesteld. Als beenmerg wordt gebruikt, worden de dieren op geschikte tijdstippen na de behandeling gedood, wordt het beenmerg verwijderd en worden er preparaten gemaakt die worden gekleurd (l)(2)(3)(4)(5)(6)(7). Wanneer perifeer bloed wordt gebruikt, wordt op geschikte tijdstippen na de behandeling bloed afgenomen en worden er uitstrijkpreparaten gemaakt die worden gekleurd (4)(8)(9)(10). Bij studies met perifeer bloed moet er zo weinig mogelijk tijd verstrijken tussen de laatste blootstelling en het oogsten van de cellen. De preparaten worden onderzocht op de aanwezigheid van micronuclei.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding
1.4.1.1. Keuze van de diersoort
Als beenmerg wordt gebruikt, worden muizen of ratten aanbevolen, maar in principe komt elke geschikte zoogdiersoort in aanmerking. Wanneer perifeer bloed wordt gebruikt, worden muizen aanbevolen. In principe komt elke geschikte zoogdiersoort echter in aanmerking, mits het een soort is waarvan de milt niet in staat is erytrocyten met micronuclei op te ruimen of een soort waarvan is aangetoond dat de gevoeligheid om stoffen die structurele of numerieke chromosoomafwijkingen veroorzaken te detecteren afdoende is. Er dient gebruik te worden gemaakt van jonge gezonde dieren van in het laboratorium gangbare stammen. Bij het begin van de studie moet het gewichtsverschil tussen de dieren zo klein mogelijk zijn en mag dit maximaal ± 20 % van het gemiddelde gewicht van elk geslacht bedragen.
1.4.1.2. Huisvesting en voeding
De in de algemene inleiding van deel B genoemde algemene omstandigheden worden aangehouden, maar voor de luchtvochtigheid wordt gestreefd naar 50-60 %.
1.4.1.3. Voorbereiding van de dieren
Gezonde jonge volwassen dieren worden aselect ingedeeld in de behandelde en controlegroepen. De dieren krijgen een unieke identificatie. Ze krijgen minimaal vijf dagen de tijd om in het laboratorium te acclimatiseren. De kooien moeten zodanig worden geplaatst dat mogelijke effecten daarvan tot een minimum worden beperkt.
1.4.1.4. Bereiding van de doseringen
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de toediening aan de dieren worden verdund. Vloeibare teststoffen kunnen rechtstreeks worden toegediend of vóór de toediening worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen van de teststof worden gebruikt.
1.4.2. Testomstandigheden
1.4.2.1. Oplosmiddel/Medium
Het oplosmiddel/medium mag bij de gebruikte dosisniveaus geen toxische effecten veroorzaken en chemische reacties met de teststof moeten uitgesloten zijn. Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten referentiegegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt.
1.4.2.2. Controles
Bij elk experiment moeten tegelijkertijd positieve en negatieve (oplosmiddel/medium) controles voor elk geslacht worden uitgevoerd. Afgezien van de behandeling met de teststof moeten de dieren in de controlegroepen op identieke wijze worden behandeld als de dieren in de andere groepen.
Voor de positieve controles moet een stof worden gebruikt die in-vivo micronuclei veroorzaakt op een blootstellingsniveau waarbij een detecteerbare stijging ten opzichte van het achtergrondniveau kan worden verwacht. De doseringen van de positieve controles moeten zodanig worden gekozen dat de effecten duidelijk zijn maar de gecodeerde objectglaasjes niet onmiddellijk als zodanig herkenbaar zijn. Het is aanvaardbaar de positieve controle langs een andere weg toe te dienen dan de teststof en slechts op één tijdstip te bemonsteren. Waar mogelijk kan bovendien het gebruik van stoffen uit een verwante chemische klasse als positieve controle worden overwogen. Als positieve controle kunnen bijvoorbeeld worden gebruikt:
|
Stof |
CAS-nr. |
Einecs-nr. |
|
Ethylmethaansulfonaat |
62-50-0 |
200-536-7 |
|
N-Ethyl-N-nitrosoureum |
759-73-9 |
212-072-2 |
|
Mitomycine C |
50-07-7 |
200-008-6 |
|
Cyclofosfamide Cyclofosfamide monohydraat |
50-18-0 60 5 5-19-2 |
200-015-4 |
|
Triethyleenmelamine |
51-18-3 |
200-083-5 |
Voor elk bemonsteringstijdstip dienen negatieve controles in het experiment te worden opgenomen, waaraan uitsluitend het oplosmiddel of het medium wordt toegediend en die verder op dezelfde manier als de andere groepen worden behandeld, tenzij uit in het verleden uitgevoerde controles aanvaardbare gegevens beschikbaar zijn over de spreiding over de dieren en de frequentie van cellen met micronuclei. Als voor de negatieve controles één bemonsteringstijdstip wordt gebruikt, kan hiervoor het beste het eerste bemonsteringstijdstip worden gekozen. Daarnaast moeten er ook onbehandelde controles worden gebruikt, tenzij in het verleden of in de literatuur reeds is aangetoond dat het gekozen oplosmiddel of medium geen schadelijke of mutagene effecten veroorzaakt.
Als perifeer bloed wordt gebruikt, kan een monster dat vóór de behandeling wordt genomen ook aanvaardbaar zijn als gelijktijdige negatieve controle, maar alleen wanneer het gaat om een korte studie met perifeer bloed (bv. één tot drie behandelingen) en het resultaat binnen het verwachte interval door de in het verleden uitgevoerde controle ligt.
1.5. UITVOERING
1.5.1. Aantal en geslacht van de dieren
Elke behandelde en controlegroep moet minimaal vijf analyseerbare dieren per geslacht bevatten (11). Als er bij de uitvoering van de studie gegevens uit studies bij dezelfde soort en met dezelfde blootstellingsweg beschikbaar zijn waaruit blijkt dat er geen significante verschillen in toxiciteit tussen de geslachten zijn, is het voldoende de test bij één geslacht uit te voeren. Wanneer de blootstelling aan een chemische stof bij de mens door het geslacht wordt bepaald, zoals bijvoorbeeld bij sommige geneesmiddelen het geval is, moet de test bij dieren van het desbetreffende geslacht worden uitgevoerd.
1.5.2. Behandelingsschema
Er kan geen standaardbehandelingsschema (d.w.z. één, twee of meer behandelingen met een interval van 24 uur) worden aanbevolen. De monsters van verlengde doseringsschema's zijn aanvaardbaar, mits een positief effect voor deze studie is aangetoond of, voor een negatieve studie, mits toxiciteit is aangetoond of de limietdosis is gebruikt, en de toediening tot het bemonsteringstijdstip is voortgezet. De dosis kan eventueel worden gesplitst, waarbij de twee porties op dezelfde dag met een interval van niet meer dan enkele uren worden toegediend, om de toediening van een groot volume te vergemakkelijken.
De test kan op twee manieren worden uitgevoerd:
|
a) |
De dieren worden eenmaal met de teststof behandeld. Beenmergmonsters worden ten minste tweemaal genomen, de eerste keer niet eerder dan 24 uur na de behandeling en de laatste keer uiterlijk 48 uur na de behandeling, met een afdoende interval tussen de monsters. Voor het gebruik van een bemonsteringstijdstip binnen 24 uur na de behandeling moet een motivering worden gegeven. Monsters van perifeer bloed worden ten minste tweemaal genomen, de eerste keer niet eerder dan 36 uur na de behandeling, met een afdoende interval na het eerste monster, en de laatste keer uiterlijk 72 uur na de behandeling. Wanneer op één bemonsteringstijdstip een positieve reactie wordt gesignaleerd, behoeven er geen verdere monsters meer te worden genomen. |
|
b) |
Als twee of meer dagelijkse behandelingen worden gebruikt (bv. twee of meer behandelingen met een interval van 24 uur), moet de bemonstering voor het beenmerg eenmaal gebeuren tussen 18 en 24 uur na de laatste behandeling en voor het perifere bloed eenmaal tussen 36 en 48 uur na de laatste behandeling (12). |
Indien dit nuttig is, kunnen daarnaast ook andere bemonsteringstijdstippen worden gebruikt.
1.5.3. Dosisniveaus
Als er een oriënterend onderzoek wordt uitgevoerd omdat er geen bruikbare gegevens over de dosering beschikbaar zijn, moet dit in hetzelfde laboratorium gebeuren met dezelfde soort, dezelfde stam, hetzelfde geslacht en hetzelfde behandelingsschema als bij het hoofdonderzoek (13). Als er sprake is van toxiciteit, worden er voor het eerste bemonsteringstijdstip drie dosisniveaus gebruikt. Deze dosisniveaus moeten een interval van de maximale tot geen of vrijwel geen toxiciteit bestrijken. Op het latere bemonsteringstijdstip behoeft alleen de hoogste dosis te worden gebruikt. De hoogste dosis wordt gedefinieerd als de dosis die zodanige toxiciteitsverschijnselen veroorzaakt dat er bij hogere doses met hetzelfde doseringsschema waarschijnlijk sterfte zal optreden. Stoffen met een specifieke biologische activiteit bij lage niet-toxische doses (zoals hormonen en mitogenen) kunnen een uitzondering vormen op deze criteria om de dosering te bepalen en moeten per geval worden beoordeeld. De hoogste dosis kan ook worden gedefinieerd als een dosis die enigerlei aanwijzing van toxiciteit voor het beenmerg oplevert (bv. een daling van de verhouding tussen het aantal onrijpe erytrocyten en het totale aantal erytrocyten in het beenmerg of het perifere bloed).
1.5.4. Limiettest
Als een test met één dosis van minimaal 2 000 mg/kg lichaamsgewicht, in één keer of in twee porties op dezelfde dag toegediend, geen waarneembare toxische effecten veroorzaakt en op basis van gegevens over stoffen met een verwante structuur geen genotoxiciteit te verwachten valt, zal het wellicht niet nodig zijn een volledig onderzoek met drie dosisniveaus uit te voeren. Voor studies met een langere duur is de limietdosis 2 000 mg/kg lichaamsgewicht/dag bij toediening gedurende maximaal 14 dagen en 1 000 mg/kg lichaamsgewicht/dag bij toediening gedurende meer dan 14 dagen. Op grond van gegevens omtrent de verwachte blootstelling van de mens kan het gebruik van een hoger dosisniveau bij de limiettest nodig worden geacht.
1.5.5. Toediening van de doses
De reststof wordt meestal met behulp van een maagsonde of een geschikte intubatiecanule of door intraperitoneale injectie toegediend. Ook andere toedieningswegen kunnen aanvaardbaar zijn, als daarvoor een motivering kan worden gegeven. Het maximale volume vloeistof dat in één keer met een sonde of injectie kan worden toegediend, is afhankelijk van de grootte van het proefdier. Het volume mag niet groter zijn dan 2 ml/100 g lichaamsgewicht. Voor het gebruik van grotere volumes moet een motivering worden gegeven. Behalve bij prikkelende of bijtende stoffen, die in hogere concentraties meestal heviger effecten veroorzaken, moeten volumeverschillen tot een minimum worden beperkt door de concentratie aan te passen, zodat op alle dosisniveaus hetzelfde volume kan worden gebruikt.
1.5.6. Beenmerg/bloedpreparaten
De beenmergcellen worden meestal volgens gangbare methoden uit het dijbeen of scheenbeen van pas gedode dieren verwijderd, geprepareerd en gekleurd. Perifeer bloed wordt uit de staartader of een ander geschikt bloedvat afgenomen. De bloedcellen worden onmiddellijk supravitaal gekleurd (8)(9)(10) of er wordt een uitstrijkpreparaat gemaakt dat vervolgens wordt gekleurd. Door het gebruik van een DNA-specifieke kleurstof (bv. acridine oranje (14) of Hoechst 33258 plus pyronine-Y (15)) kunnen sommige artefacten die zich bij het gebruik van niet voor DNA specifieke kleurstoffen kunnen voordoen, worden voorkomen. Dit neemt niet weg dat ook klassieke kleurstoffen (zoals Giemsa) kunnen worden gebruikt. Ook andere systemen (zoals cellulosekolommen om cellen die een kern bevatten te verwijderen (16)) kunnen worden gebruikt, mits is aangetoond dat deze methoden geschikt zijn voor micronucleuspreparaten in het laboratorium.
1.5.7. Analyse
Voor elk dier wordt de verhouding tussen het aantal onrijpe erytrocyten en het totale aantal (onrijpe + rijpe) erytrocyten bepaald door in totaal voor het beenmerg ten minste 200 erytrocyten en voor het perifere bloed ten minste 1 000 erytrocyten te tellen (17). Alle objectglaasjes, ook die van de negatieve en positieve controles, worden vóór de microscopische analyse onafhankelijk gecodeerd. Voor de bepaling van de frequentie waarmee onrijpe erytrocyten met micronuclei voorkomen, worden ten minste 2 000 rijpe erytrocyten per dier gescoord. Aanvullende informatie kan worden verkregen door rijpe erytrocyten op micronuclei te scoren. Bij de analyse van de objectglaasjes mag de verhouding tussen het aantal onrijpe erytrocyten en het totale aantal erytrocyten niet lager dan 20 % van de controlewaarde zijn. Wanneer de dieren onafgebroken gedurende ten minste vier weken zijn behandeld, kunnen ook ten minste 2 000 rijpe erytrocyten per dier op het voorkomen van micronuclei worden gescoord. Geautomatiseerde analysesystemen (beeldanalyse en celsuspensiedoorstroomcytometrie) zijn aanvaardbaar als alternatief voor handmatige beoordeling, indien ze afdoende zijn gemotiveerd en gevalideerd.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens moeten voor elke dier apart in tabelvorm worden verstrekt. De eenheid bij dit experiment is het dier. Voor elk onderzocht dier worden het aantal gescoorde onrijpe erytrocyten, het aantal onrijpe erytrocyten met micronuclei en het aantal onrijpe erytrocyten op het totale aantal apart vermeld. Wanneer de dieren onafgebroken gedurende ten minste vier weken zijn behandeld, moeten de gegevens over rijpe erytrocyten ook worden vermeld als deze zijn verzameld. Voor elk dier worden de verhouding tussen het aantal onrijpe erytrocyten en het totale aantal erytrocyten en, indien dit zinnig wordt geacht, het percentage van de erytrocyten met micronuclei vermeld. Als er geen aanwijzingen zijn voor verschillen in reactie tussen de geslachten, kunnen de gegevens van beide geslachten voor de statistische analyse worden gecombineerd.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Er zijn verschillende criteria om tot een positief resultaat te besluiten, zoals een dosisafhankelijke stijging van het aantal cellen met micronuclei of een duidelijke stijging van het aantal cellen met micronuclei in één dosis-groep bij één bemonsteringstijd. In eerste instantie moet naar de biologische relevantie van de resultaten worden gekeken. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt (18)(19). Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn. Bij onduidelijke resultaten moet nader onderzoek worden gedaan, bij voorkeur onder gewijzigde experimentele omstandigheden.
Indien de resultaten voor een teststof niet aan bovenstaande criteria voldoen, wordt de stof bij deze test als niet-mutageen beschouwd.
Hoewel de meeste experimenten duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststof in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt herhaald, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de micronucleustest wijzen erop dat de stof micronuclei induceert die ontstaan door chromosoombeschadigingen of beschadiging van het mitotisch apparaat in de erytroblasten van de geteste soort. Negatieve resultaten wijzen erop dat de stof onder de testomstandigheden geen micronuclei in de onrijpe erytrocyten van de geteste soort veroorzaakt.
De waarschijnlijkheid dat de teststof of de metabolieten daarvan in de grote bloedsomloop of specifiek het doelweefsel terechtkomen (systemische toxiciteit), dient te worden besproken.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Heddle, J.A. (1973). A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, pp. 187-190. |
|
(2) |
Schmid, W. (1975). The Micronucleus Test, Mutation Res., 31, pp. 9-15. |
|
(3) |
Heddle, J.A., Salamone, M.F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J.G. and Newell, G.W. (1983). The Induction of Micronuclei as a Measure of Genotoxicity. Mutation Res. 123, pp. 61-118. |
|
(4) |
Mavournin, K.H., Blakey, D.H., Cimino, M.C., Salamone, M.F. and Heddle, J.A. (1990). The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res.. 239, pp. 29-80. |
|
(5) |
MacGregor, J.T., Schlegel, R., Choy, W.N., and Wehr, C.M. (1983). Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice. In: „Developments in Science and Practice of Toxicology”, Hd. A.W. Hayes, R.C. Schnell and T.S. Miya, Elsevier, Amsterdam, pp. 555-558. |
|
(6) |
MacGregor, J.T., Heddle. J.A. Hite. M., Margolin, G.H.. Ramel, C, Salamone, M.F., Tice, R.R., and Wild, D. (1987). Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erytrocytes. Mutation Res. 189, pp. 103-122. |
|
(7) |
MacGregor, J.T., Wehr, CM., Henika, P.R., and Shelby, M.E. (1990). The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies. Fund. Appl. Toxicol. 14, pp. 513-522. |
|
(8) |
Hayashi, M., Morita, T.. Kodama. Y., Sofuni. T. and Ishidate, M. Jr. (1990). The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coates Slides. Mutation Res., 245, pp. 245-249. |
|
(9) |
The Collaborative Study Group for the Micronucleus Test (1992). Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridine Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS. MMS. Mutation Res., 278, pp. 83-98. |
|
(10) |
The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS. MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995). Protocol recommended for the short-term mouse peripheral blood micronucleus test. Mutagenesis, 10, pp. 153-159. |
|
(11) |
Hayashi, M., Tice, R.R., MacGregor, J.T., Anderson, D., Blackey, D.H., Kirsch-Volders, M., Oleson, Jr.F.B., Pacchierotti, F., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994). In Vivo Rodent Erythrocyte Micronucleus Assay. Mutation Res., 312, pp. 293-304. |
|
(12) |
Higashikuni, N. and Sutou, S. (1995). An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral blood micronucleus test. Mutagenesis, 10, pp. 313-319. |
|
(13) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Rochold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In vivo Mutagenicity Assays. Mutagenesis, 7, pp. 313-319. |
|
(14) |
Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983). An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test. Mutation Res., 120, pp. 241-247. |
|
(15) |
MacGregor, J.T., Wehr, C.M. and Langlois, R.G. (1983). A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y., Mutation Res., 120, pp. 269-275. |
|
(16) |
Romagna, F. and Staniforth, C.D. (1989). The automated bone marrow micronucleus test. Mutation Res.. 213, pp. 91-104. |
|
(17) |
Gollapudi, B. and McFadden, L.G. (1995). Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test. Mutation Res., 347, pp. 97-99. |
|
(18) |
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990). In Vivo Cytogenetics Assay. In: D.J. Kirkland (lid.) Basic Mutagenicity tests. UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I, revised. Cambridge University Press, Cambridge, New York. Port Chester, Melbourne, Sydney, pp. 115-141. |
|
(19) |
Lovell, D.P., Anderson. D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232. |
B.13/14. MUTAGENITEIT — TERUGMUTATIETEST MET BACTERIËN
1. METHODE
Deze methode is overgenomen van TG 471 van de OESO: Terugmutatietest met bacteriën (1997).
1.1. INLEIDING
Bij de terugmutatietest met bacteriën worden aminozuurafhankelijke stammen van Salmonella typhimurium en Eschenchia coli gebruikt voor de detectie van puntmutaties, waarbij vervanging, toevoeging of deletie van een of enkele DNA-basenparen optreedt (1)(2)(3). Deze terugmutatietest met bacteriën is gebaseerd op het beginsel dat mutaties worden gedetecteerd die ertoe leiden dat in de teststammen aanwezige mutaties en daarmee de functionele capaciteit van de bacteriën om een essentieel aminozuur te synthetiseren worden hersteld. Deze teruggemuteerde bacteriën worden zichtbaar doordat ze kunnen groeien zonder het aminozuur dat de ouderstam nodig heeft.
Puntmutaties veroorzaken veel genetische ziekten bij de mens en het lijkt er sterk op dat puntmutaties in oncogenen en tumorsuppressorgenen van somatische cellen betrokken zijn bij het ontstaan van tumoren bij de mens en bij proefdieren. De terugmutatietest met bacteriën is snel, goedkoop en betrekkelijk gemakkelijk uit te voeren. Veel van de teststammen hebben verschillende kenmerken waardoor ze gevoeliger zijn voor de detectie van mutaties, zoals reactieve DNA-sequenties op de terugmutatieplaatsen, een verhoogde permeabiliteit van de cel voor grote moleculen en de afwezigheid van DNA-herstelsystemen of de stimulering van fout-gevoelige DNA-herstelprocessen. De specificiteit van de teststammen kan enige nuttige informatie opleveren over de aard van de mutaties die door genotoxische stoffen worden geïnduceerd. Er zijn zeer veel gegevens beschikbaar over de resultaten van de terugmutatietest met bacteriën voor een grote verscheidenheid van structuren en er zijn betrouware mehtodologieën ontwikkeld voor het testen van chemische stoffen met uiteenlopende fysisch-chemische eigenschappen, waaronder ook vluchtige stoffen.
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Terugmutatietest bij Salmonella typhimurium of Escherichia coli: een test voor de detectie van mutaties in een aminozuurafhankelijke stam (respectievelijk histidine of tryptofaan), waarbij een stam ontstaat die onafhankelijk is van een externe aminozuurbron.
Mutageen met basenpaarvervanging: een stof die een wijziging van een base in het DNA veroorzaakt. Bij een terugmutatietest kan dit op de plaats van de oorspronkelijke mutatie of op een andere plaats in het bacteriële genoom gebeuren.
Mutageen met leesraamverschuiving: een stof die invoeging of deletie van een of meer basenparen in het DNA veroorzaakt, waardoor het leesraam in het RNA wijzigt.
1.3. TOELICHTING
Voor de terugmutatietest met bacteriën worden prokaryote cellen gebruikt, die in bijvoorbeeld opname, metabolisme, chromosoomstructuur en DNA-herstelprocessen van zoogdiercellen verschillen. Bij in vitro uitgevoerde tests moet er meestal een exogene metabole activeringsbron worden gebruikt. Dit metabole activeringssysteem kan de omstandigheden in een zoogdiercel in vivo niet volledig nabootsen. De test levert dan ook geen directe informatie op over de potentiële mutagene en carcinogene werking van een stof bij zoogdieren.
De terugmutatietest met bacteriën wordt meestal gebruikt als een eerste screening voor een genotoxische werking en met name de inductie van puntmutaties. Op basis van een groot aantal gegevens is gebleken dat veel stoffen die bij deze test positief reageren, ook bij andere tests een mutagene werking vertonen. Er zijn voorbeelden van mutagene stoffen die met deze test niet worden gesignaleerd; dit kan wellicht worden toegeschreven aan de specifieke aard van het gedetecteerde eindpunt, verschillen in metabole activering of verschillen in biologische beschikbaarheid. Anderzijds kunnen factoren die de gevoeligheid van de terugmutatietest met bacteriën bevorderen, leiden tot een te hoge inschatting van de mutagene werking.
De terugmutatietest met bacteriën zal wellicht niet geschikt zijn voor de beoordeling van bepaalde klassen chemische stoffen zoals sterk bactericide verbindingen (bv. bepaalde antibiotica) en stoffen waarvan vermoed wordt (of bekend is) dat ze specifiek het replicatiesysteem van zoogdiercellen storen (bv. bepaalde topoisomeraseremmers en bepaalde nucleosideanalogen). In deze gevallen zullen mutatietests met zoogdiercellen wellicht geschikter zijn.
Hoewel veel stoffen die positief op deze test reageren, ook carcinogeen voor zoogdieren zijn, is de correlatie niet absoluut. De correlatie is afhankelijk van de chemische klasse en er zijn carcinogenen die niet met deze test worden gesignaleerd omdat ze via andere niet-genotoxische mechanismen werken of via mechanismen die in bacteriecellen ontbreken.
1.4. PRINCIPE VAN DE TESTMETHODE
Suspensies van bacteriecellen worden zowel met als zonder een exogeen metabool activeringssysteem aan de teststof blootgesteld. Bij de methode met geïntegreerde voedingsbodem worden deze suspensies met een topagar vermengd en direct op minimaal medium uitgeplaat. Bij de preïncubatiemethode wordt het behandelde mengsel geïncubeerd en vervolgens met een topagar vermengd voordat het op minimaal medium wordt uitgeplaat. Bij beide technieken worden na twee of drie dagen incuberen de terugmutantkolonies geteld en wordt dit aantal vergeleken met het aantal spontane terugmutantkolonies op controleplaten met oplosmiddel.
Er zijn verschillende procedures voor de uitvoering van de terugmutatietest met bacteriën beschreven. Het meest gebruikt worden de methode met geïntegreerde voedingsbodem (1)(2)(3)(4), de preïncubatiemethode (2)(3)(5)(6)(7)(8), de fluctuatiemethode (9)(10) en de suspensiemethode (11). Ook wijzigingen voor het testen van gassen of dampen zijn beschreven (12).
De hier beschreven procedures gelden vooral voor de methode met geïntegreerde voedingsbodem en de preïncubatiemethode. Beide zijn aanvaarbaar voor de uitvoering van experimenten zowel met als zonder metabole activering. Bij sommige stoffen verloopt de detectie efficiënter met de preïncubatiemethode. Deze stoffen behoren tot chemische klassen als alifatische nitrosamines met een korte keten, divalente metalen, aldehyden, azokleurstoffen en diazoverbindingen, pyrollizidine-alkaloïden, allylverbindingen en nitroverbindingen (3). Tevens is het bekend dat bepaalde klassen mutagene verbindingen niet altijd met standaardprocedures als de methode met geïntegreerde voedingsbodem of de preïncubatiemethode worden gesignaleerd. Deze moeten als „speciale gevallen” worden beschouwd en voor de signalering daarvan wordt sterk aangeraden andere procedures te gebruiken. De volgende „speciale gevallen” kunnen worden genoemd (met voorbeelden van procedures die voor deze stoffen kunnen worden gebruikt): azokleurstoffen en diazoverbindingen (3)(5)(6)(13), gassen en vluchtige stoffen (12)(14)(15)(16) en glycosiden (17)(18). Voor een afwijking van de standaardprocedure moet een wetenschappelijke motivering worden gegeven.
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Voorbereiding
1.5.1.1. Bacteriën
Verse bacterieculturen worden gekweekt tot het laat-exponentiële of vroeg-stationaire groeistadium (ongeveer 109 cellen per ml). Culturen in de laat-stationaire fase mogen niet worden gebruikt. Het is van essentieel belang dat de bij het experiment gebruikte culturen een hoog gehalte aan levensvatbare bacteriën bevatten. De titer kan aan de hand van gegevens over groeicurves uit in het verleden uitgevoerde controles worden bepaald of door met behulp van een uitplaatexperiment het aantal levensvatbare cellen te bepalen.
De aanbevolen incubatietemperatuur is 37 oC.
Er moeten ten minste vijf bacteriestammen worden gebruikt. Daarbij moeten vier stammen van S. typhimurium zijn (TA 1535, TA 1537, TA 97a of TA 97; Ta 98: en TA 100) waarvan is aangetoond dat de resultaten betrouwbaar en in verschillende laboratoria reproduceerbaar zijn. Deze vier stammen van S. typhimunum hebben GC-basenparen op de primaire terugmutatieplaats en het is bekend dat bepaalde oxiderende mutagenen, cross-linkende stoffen en hydrazines daarmee niet altijd worden gesignaleerd. Voor deze stoffen kunnen de stammen WP2 van E. coli of TA 102 van S. typhimurium worden gebruikt (19), die een AT-basenpaar op de primaire terugmutatieplaats hebben. Als combinatie van stammen wordt derhalve aanbevolen:
|
— |
TA 1535 van S. typhimurium en |
|
— |
TA 1537 of TA 97 of TA 97a van S. typhimurium en |
|
— |
TA 98 van S. typhimurium en |
|
— |
TA 100 van S. typhimurium en |
|
— |
WP2 uvrA van E. coli of WP2 uvrA (pKM101) van E. coli of TA 102 van S. typhimurium. |
Om cross-linkende mutagenen te signaleren kan het de voorkeur verdienen TA 102 of een stam van E. coli die bedreven is in DNA-herstel (bv. WP2 (pKM101) van E. coli) te gebruiken.
Er moeten erkende procedures voor de bereiding van voorraadculturen, markercontrole en opslag worden gebruikt. Voor elk preparaat van de ingevroren voorraadcultuur moet de aminozuurafhankelijkheid voor de groei worden aangetoond (histidine voor stammen van S. typhimurium en tryptofaan voor stammen van E. coli). Ook ander fenotypekenmerken moeten worden gecontroleerd, namelijk: de aan- of afwezigheid van plasmiden met de R-factor, indien van toepassing (bv. resistentie tegen ampicilline bij de stammen TA 98, TA 100 en TA 97a of TA 97, WP2 uvrA en WP2 uvrA (pKM101) en resistentie tegen ampicilline en tetracycline bij stam TA 102); de aanwezigheid van karakteristieke mutaties (bv. de rfa-mutatie bij S. typhimurium door de gevoeligheid voor kristalviolet en de uvrA-mutatie bij E. coli of de uvrB-mutatie bij S. typhimurium door de gevoeligheid voor ultraviolet licht) (2)(3). Bij de stammen moeten ook spontane terugmutantkolonies voorkomen met een frequentie die ligt binnen het interval dat op grond van controlegegevens van het laboratorium uit het verleden kan worden verwacht en bij voorkeur binnen het interval dat in de literatuur wordt opgegeven.
1.5.1.2. Medium
Er wordt gebruikgemaakt van een geschikte minimale agar (bv. met minimaal medium E van Vogel-Bonner en glucose) en een topagar met histidine en bioline of tryptofaan om een aantal celdelingen mogelijk te maken (1)(2)(9).
1.5.1.3. Metabole activering
De bacteriën dienen zowel met als zonder een geschikt metabool activeringssysteem aan de teststof te worden blootgesteld. Het meest gebruikte systeem is een post-mitochondriale fractie aangevuld met een cofactor (S9), verkregen uit de lever van knaagdieren die zijn behandeld met enzym-inducerende stoffen als Aroclor 1254 (1)(2) of een combinatie van fenobarbiton en ß-naftoflavon (18)(20)(21). De post-mitochondriale fractie wordt meestal gebruikt bij een concentratie van 5 tot 30 % (v/v) in het S9-mengsel. De keuze en de omstandigheden voor het gebruik van een metabool activeringssysteem kunnen afhankelijk zijn van de aard van de geteste chemische verbinding. In sommige gevallen kan het nuttig zijn meer dan een concentratie van de post-mitochondriale fractie te gebruiken. Voor azokleurstoffen en diazoverbindingen kan wellicht beter een reductief metabool activeringssysteem worden gebruikt (6)(13).
1.5.1.4. Teststof/Bereiding
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de behandeling van de bacteriën worden verdund. Vloeibare teststoffen kunnen rechtstreeks aan het test-systeem worden toegediend en/of vóór behandeling worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen worden gebruikt.
Chemische reacties tussen het oplosmiddel/medium en de teststof moeten uitgesloten zijn en het oplosmiddel/medium moet verenigbaar zijn met het overleven van de bacteriën en de S9-activiteit (22). Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten gegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt. Wanneer stoffen worden getest die in water instabiel zijn, moeten de gebruikte organische oplosmiddelen watervrij zijn.
1.5.2. Testomstandigheden
1.5.2.1. Teststammen (zie punt 1.5.1.1)
1.5.2.2. Blootstellingsconcentraties
Bij de bepaling van de grootste te gebruiken hoeveelheid teststof moet onder andere rekening worden gehouden met de cytotoxiciteit en de oplosbaarheid in het uiteindelijke behandelingsmengsel.
Het kan nuttig zijn vooraf een apart experiment uit te voeren om de toxiciteit en de oplosbaarheid te bepalen. De cytotoxiciteit kan worden bepaald aan de hand van een daling in het aantal terugmutantkolonies, een opheldering of afname van de achtergrond of de mate waarin de behandelde culturen overleven. De cytotoxiciteit van een stof kan in aanwezigheid van een metabool activeringssysteem veranderen. De oplosbaarheid moet worden beoordeeld aan de hand van het met het blote oog zichtbare neerslaggedrag in het uiteindelijke mengsel onder de feitelijke testomstandigheden.
De aanbevolen maximale concentratie voor oplosbare niet-cytotoxische stoffen is 5 mg/plaat of 5 μl/plaat. Voor niet-cytotoxische stoffen die bij 5 mg/plaat of 5 μl/plaat niet oplosbaar zijn, moet een of meer van de geteste concentraties in het uiteindelijke behandelingsmengsel onoplosbaar zijn. Teststoffen die al bij lagere concentraties dan 5 mg/plaat of 5 μl/plaat cytotoxisch zijn, moeten tot een cytotoxische concentratie worden getest. Het neerslag mag niet storen bij het scoren.
Er moeten ten minste vijf analyseerbare concentraties van de teststof worden gebruikt met ongeveer een half log-interval (d.w.z. een factor √10) tussen de concentraties voor een eerste experiment. Kleinere intervallen kunnen nuttig zijn wanneer het verband tussen concentratie en respons wordt onderzocht. Hogere concentraties dan 5 mg/plaat of 5 μl/plaat kunnen worden overwogen bij de beoordeling van stoffen die significante hoeveelheden potentieel mutagene verontreinigingen bevatten.
1.5.2.3. Negatieve en positieve controles
Bij elke bepaling moeten tegelijkertijd stamspecifieke positieve en negatieve (oplosmiddel of medium) controles worden uitgevoerd, zowel met als zonder metabole activering. De concentraties van de positieve controle moeten zodanig worden gekozen dat voor elke bepaling wordt aangetoond dat deze correcte resultaten oplevert.
Voor bepalingen waarbij een metabool activeringssysteem wordt gebruikt, moet(en) de voor de positieve controle gebruikte referentiestof(fen) op basis van de aard van de gebruikte bacteriestam worden gekozen.
Voor bepalingen met metabole activering kunnen als positieve controle bijvoorbeeld worden gebruikt:
|
Stof |
Cas-nr |
Einecs-nr. |
|
9,10-dimethylanthraceen |
78l-43-l |
212-308-4 |
|
7,12-dimethylbenz[a]anthraceen |
57-97-6 |
200-359-5 |
|
Benzo[a]pyreen |
50-32-8 |
200-028-5 |
|
2-aminoantraceen |
613-13-8 |
210-330-9 |
|
Cyclofosfamide |
50-18-0 |
200-015-4 |
|
Cyclofosfamide monohydraat |
6055-19-2 |
|
Voor de methode met reductieve metabole activering kan als positieve controle worden gebruikt:
|
Stof |
CAS-nr. |
Einecs-nr. |
|
Kongo rood |
5 7 3-58-0 |
209-358-4 |
2-aminoantraceen mag niet als enige indicator voor de werkzaamheid van het S9-mengsel worden gebruikt. Als 2-aminoantraceen wordt gebruikt, moet elke charge S9 ook worden gekarakteriseerd met een mutageen waarvoor metabole activering met microsomale enzymen nodig is, zoals benzo[a]pyreen of dimethylbenzant-raceen.
Voor bepalingen zonder exogeen metabool activeringssysteem kunnen als stamspecifieke positieve controle bijvoorbeeld worden gebruikt:
|
Stof |
CAS-nr. |
Einecs-nr. |
Stam |
|
Natriumazide |
26628-22-S |
247-852-1 |
TA 1535 en TA 100 |
|
2-nitrofluoreen |
607-57-8 |
210-138-5 |
TA 98 |
|
9-aminoacridine |
90-45-9 |
201-995-6 |
TA 1537, TA 97 en TA 97a |
|
ICR 191 |
1 7070-4 5-0 |
241-129-4 |
TA 1537, TA 97 en TA 97a |
|
Cumeenhydroperoxide |
80-15-9 |
201-254-7 |
TA 102 |
|
Mitomycine C |
50-07-7 |
200-008-6 |
WP2 uvrA en TA 102 |
|
N-ethyl-N-nitro-N-nitrosoguanidine |
70-25-7 |
200-730-1 |
WP2, WP2 uvrA en WP2 uvrA(pKM101) |
|
4-nitroquinoline-1-oxide |
56-5 7-5 |
200-281-1 |
WP2, WP2 uvrA en WP2 uvrA(pKM101) |
|
Furylfuramide (AF2) |
3688-53-7 |
|
Stammen die plasmiden bevatten |
Ook andere geschikte stoffen kunnen als positieve controle worden gebruikt. Waar mogelijk dient het gebruik van stoffen uit een verwante chemische klasse als positieve controle te worden overwogen.
In het experiment dienen negatieve controles te worden opgenomen, waaraan uitsluitend het oplosmiddel of het medium zonder teststof wordt toegediend en die verder op dezelfde manier als de andere groepen worden behandeld. Daarnaast moeten er ook controles worden gebruikt waaraan niets wordt toegediend, tenzij in het verleden reeds is aangetoond dat het gekozen oplosmiddel geen schadelijke of mutagene effecten veroorzaakt.
1.5.3. Uitvoering
Voor de methode met geïntegreerde voedingsbodem (1)(2)(3)(4) zonder metabole activering wordt meestal 0,05 ml of 0,1 ml testoplossing, 0,1 ml verse bacteriecultuur (met ongeveer 108 levensvatbare cellen) en 0,5 ml steriele buffer gemengd met 2,0 ml topagar. Voor de bepaling met metabole activering wordt meestal 0,5 ml van het metabool activeringsmengsel met een afdoende hoeveelheid post-mitochondriale fractie (tussen 5 en 30 % (v/v) in het metabole activeringsmengsel) gemengd met de topagar (2,0 ml), de bacteriën en de test-stof/testoplossing. De inhoud van elke buis wordt gemengd en uitgegoten over het oppervlak van een minimale agarplaat. De topagar krijgt voor de incubatie de gelegenheid te stollen.
Voor de preïncubatiemethode (2)(3)(5)(6) wordt de teststof/testoplossing gepreïncubeerd met de teststam (met ongeveer 108 levensvatbare cellen) en steriele buffer of het metabole activeringssysteem (0,5 ml), meestal gedurende minimaal 20 minuten bij 30-37 oC, en vervolgens gemengd met de topagar en uitgegoten over het oppervlak van een minimale agarplaat. Meestal wordt 0,05 ml of 0,1 ml teststof/testoplossing, 0,1 ml bacteriën en 0,5 ml S9-mengsel of steriele buffer gemengd met 2,0 ml topagar. De buizen dienen gedurende de preïncubatie met behulp van een schudmachine te worden belucht.
Om een adequate raming van de spreiding te kunnen maken moeten voor elk dosisniveau drie platen worden gebruikt. Het gebruik van twee platen is aanvaardbaar wanneer daarvoor een wetenschappelijke motivering wordt gegeven. Wanneer nu en dan een plaat verloren gaat, maakt dit de bepaling niet noodzakelijkerwijs onbruikbaar.
Bij het testen van gassen of vluchtige stoffen moet een daarvoor geschikte methode worden gevolgd, bijvoorbeeld in een gesloten kweekvat (12)(14)(15)(16).
1.5.4. Incubatie
Alle platen voor een bepaling worden gedurende 48-72 uur bij 37 oC geïncubeerd. Na de incubatieperiode wordt het aantal terugmutantkolonies per plaat geteld.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens worden vermeld als het aantal terugmutantkolonies per plaat. Daarnaast moet ook het aantal terugmutantkolonies op de platen voor zowel negatieve (oplosmiddel en zonder behandeling, indien gebruikt) als positieve controle worden vermeld. Voor zowel de teststof als de positieve en negatieve (zonder behandeling en/of oplosmiddel) controle, moeten de tellingen per plaat, het gemiddelde aantal terugmutantkolonies per plaat en de standaardafwijking worden vermeld.
Een duidelijk positieve reactie behoeft niet te worden bevestigd. Bij onduidelijke resultaten moet nader onderzoek worden gedaan, bij voorkeur onder gewijzigde experimentele omstandigheden. Negatieve resultaten moeten per geval worden bevestigd. Wanneer een bevestiging van negatieve resultaten niet nodig wordt geacht, moet daarvoor een motivering worden gegeven. Bij vervolgexperimenten dient wijziging van parameters te worden overwogen om de bepaling uit te breiden tot een breder scala van omstandigheden. Parameters die voor wijziging in aanmerking komen zijn bijvoorbeeld de concentratie-intervallen, de wijze van behandeling (geïntegreerde voedingsbodem of preïncubatie in vloeistof) en de omstandigheden bij metabole activering.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Er zijn verschillende criteria om tot een positief resultaat te besluiten, zoals een concentratieafhankelijke stijging op het geteste interval en/of een reproduceerbare stijging bij een of meer concentraties van het aantal terugmutantkolonies per plaat bij ten minste één stam met of zonder metabool activeringssysteem (23). In eerste instantie moet naar de biologische relevantie van de resultaten worden gekeken. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt (24). Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn.
Indien de resultaten voor een teststof niet aan bovenstaande criteria voldoen, wordt de stof bij deze test als niet-mutageen beschouwd.
Hoewel de meeste experimenten duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststof in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt herhaald, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de terugmutatietest met bacteriën wijzen erop dat de teststof puntmutaties door basen-paarvervanging of leesraamverschuiving in het genoom van Salmonella typhimurium en/of Escherichia coli induceeert. Negatieve resultaten wijzen erop dat de stof onder de testomstandigheden bij de geteste soort niet mutageen is.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Stammen:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Ames, B.N., McCann, J. and Yamasaki E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, pp. 347-364. |
|
(2) |
Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, pp. 173-215. |
|
(3) |
Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C, Nohmi, T., Venitt, S. and Zeiger, E. (1994). Recommendations for the Performance of Bacterial Mutation Assays. Mutation Res., 312, pp. 217-233. |
|
(4) |
Kier, L.D., Brusick, D.J., Auletta, A.E., Von Halle, E.S., Brown, M.M., Simmon, V.F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T.K. and Ray, V. (1986). The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 168, pp. 69-240. |
|
(5) |
Yahagi, T., Degawa, M., Seino, Y.Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975). Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, 1, pp. 91-96. |
|
(6) |
Matsushima, M., Sugimura, T., Nagao. M., Yahagi, T., Shirai, A. and Sawamura, M. (1980). Factors Modulating Mutagenicity Microbial Tests. In: Short-term Test Systems for Detecting Carcinogens. Ed. Norpoth K.H. and Garner. R.C., Springer, Berlin-Heidelberg-New York. pp. 273-285. |
|
(7) |
Gatehouse, D.G., Rowland, I.R., Wilcox, P., Callender, R.D. and Foster, R. (1980). Bacterial Mutation Assays. In: Basic Mutagenicity Tests: UKEMS Part 1 Revised. Ed. D.J. Kirkland, Cambridge University Press, pp. 13-61. |
|
(8) |
Aeschacher, H.U., Wolleb, U. and Porchet, L. (1987). Liquid Preincubation Mutagenicity Test for Foods. J. Food Safety, 8, pp. 167-177. |
|
(9) |
Green, M.H.L., Muriel, W.J. and Bridges, B.A. (1976). Use of a simplified fluctuation test to detect low levels of mutagens. Mutation Res., 38, pp. 33-42. |
|
(10) |
Hubbard, S.A., Green, M.H.L., Gatehouse, D. and Bridges, J.W. (1984). The Fluctuation Test in Bacteria. In: Handbook of Mutagenicity Test Procedures. 2nd Edition. Ed. Kilbey, B.J., Legator, M, Nichols, W. and Ramel, C. Elsevier, Amsterdam-New York-Oxford, pp. 141-161. |
|
(11) |
Thompson, E.D. and Melampy, P.J. (1981). An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium. Environmental Mutagenesis, 3, pp. 453-465. |
|
(12) |
Araki, A., Noguchi, T., Kato, F. and Matsushima, T. (1994). lmproved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag. Mutation Res., 307, pp. 335-344. |
|
(13) |
Prival, M.J., Bell, S.J., Mitchell, V.D., Reipert, M.D. and Vaughan, V.L. (1984). Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay. Mutation Res., 136, pp. 33-47. |
|
(14) |
Zeiger. E., Anderson, B.E.. Haworth. S., Lawlor, T. and Mortelmans, K. (1992). Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals. Environ. Mol. Mutagen., 19, pp. 2-141. |
|
(15) |
Simmon, V., Kauhanen, K. and Tardiff, R.G. (1977). Mutagenic Activity of Chemicals Identified in Drinking Water. In Progress in Genetic Toxicology, D. Scott, B. Bridges and F. Sobels (Eds.) Elsevier, Amsterdam, pp. 249-258. |
|
(16) |
Hughes, T.J., Simmons, D.M., Monteith, I.G. and Claxton, L.D. (1987). Vaporization Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay. Environmental Mutagenesis, 9, pp. 421-441. |
|
(17) |
Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M. and Sugimura, T. (1979). Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium. Cancer Res., 39, pp. 3780-3782. |
|
(18) |
Tamura, G., Gold, C., Ferro-Luzzi, A. and Ames, B.N. (1980). Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora. Proc. Natl. Acad. Sci. USA, 77, pp. 4961-4965. |
|
(19) |
Wilcox, P., Naidoo, A., Wedd, D.J. and Gatehouse, D.G. (1990). Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains. Mutagenesis. 5, pp. 285-291. |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems. In: „In Vitro Metabolic Activation in Mutagenesis Testing”. Eds. F.J. de Serres et al. Elsevier, North Holland, pp. 85-88. |
|
(21) |
Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays. Mutagenesis, 7, (21) pp. 175-177. |
|
(22) |
Maron, D., Katzenellenbogen, J. and Ames, B.N. (1981). Compatibility of Organic Solvents with the Salmonella/Microsome Test. Mutation Res., 88. pp. 343-350. |
|
(23) |
Claxton, L.D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987). Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity. Mutation Res. 189, pp. 83-91. |
|
(24) |
Mahon, G.A.T., Green, M.H.L, Middleton, B., Mitchell, I., Robinson, W.D. and Tweats, D.J. (1989). Analysis of Data from Microbial Colony Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity testing. Part II. Statistical Evaluation of Mutagenicity Test Data. Ed. Kirkland, D.J., Cambridge University Press, pp. 28-65. |
B. 15. MUTAGENITEITSONDERZOEK EN SCREENING OP CARCINOGENESEGENMUTATIE — SACCHAROMYCES CEREVISIAE
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Er kunnen verschillende haploïde en diploïde stammen van de gist Saccharomyces cerevisiae worden gebruikt om de door chemische stoffen geïnduceerde genmutaties te meten, dit zowel met als zonder metabole activering.
Voorwaartse mutatiesystemen bij haploïde stammen zoals de meting van mutatie van rode mutanten met adeninebehoefte (ade-1, ade-2) naar witte mutanten met dubbele adeninebehoefte en selectieve systemen zoals de inductie van canavanine- en cycloheximideresistentie zijn gebruikt.
Het meest uitgebreid gevalideerde terugwaartse mutatiesysteem maakt gebruik van de haploïde stam XV 185-14C welke de oker nonsens mutaties ade 2-1, arg 4-17, lys 1-1 en trp 5-48 draagt die omkeerbaar zijn door basesubstitutiemutagenen die plaatsspecifieke mutaties of oker suppressor mutaties induceren. XV 185-14C heeft ook het his 1-7 kenmerk, een „missense” mutatie die hoofdzakelijk wordt gereverteerd door tweede-plaatsmutaties, en het hom 3-10 kenmerk, dat wordt gereverteerd door „frame shift”-mutagenen (verschuivingen in het leeskader).
Van de diploïde stammen van S.cerevisiae wordt alleen D7, die homozygoot is voor ilv 1-92, uitgebreid gebruikt.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
V oorbereidingen
De oplossingen van de teststof en van controle- of referentiestoffen dienen kort voor het uitvoeren van de test te worden bereid met behulp van een geschikt medium. Voor niet in water oplosbare organische stoffen moet een oplossing van niet meer dan 2 % v/v organische oplosmiddelen, zoals ethanol, aceton of dimethylsulfoxyde (DMSO) worden gebruikt. De eindconcentratie van het oplosmiddel dient de levensvatbaarheid en de groeikarakteristieken van de cel niet significant te beïnvloeden.
De cellen moeten met en zonder een geschikt exogeen metabool activeringssysteem aan de teststoffen worden blootgesteld.
Het meest gebruikte systeem is een met een cofactor aangevulde postmitochondriale fractie bereid uit levers van knaagdieren die met enzyminducerende agentia zijn voorbehandeld. Het gebruik van andere diersoorten, weefsels, postmitochondriale fracties of procedures kan ook geschikt zijn voor het verkrijgen van metabole activering.
Proefomstandigheden
De haploïde stam XV 185-14 C en de diploïde stam D7 zijn het meest gebruikt voor onderzoek naar genmutaties. Andere stammen kunnen eveneens geschikt zijn.
Er worden geschikte media gebruikt voor de bepaling van overleving en het aantal mutaties.
Positieve, onbehandelde en oplosmiddelencontroles moeten parallel worden uitgevoerd. Voor elk specifiek mutatie-eindpunt moeten geschikte positieve controlechemicaliën worden gebruikt.
Er zijn ten minste vijf behoorlijk gespreide concentraties van de teststof vereist. Voor toxische stoffen mag de hoogste geteste concentratie het overlevingspercentage niet tot minder dan 5 à 10 % verlagen. In water relatief onoplosbare stoffen dienen met behulp van geschikte methoden tot de uiterste oplosbaarheidsgrens te worden onderzocht. Voor volledig in water oplosbare niet-toxische stoffen dient de hoogste concentratie per geval te worden bepaald.
De platen worden gedurende vier tot zeven dagen bij 28 tot 30 oC in het donker geïncubeerd.
Er dienen subculturen te worden gebruikt met een spontane mutatiefrequentie binnen de normaal aanvaarde grenzen.
Voor de analyse van door genmutatie geproduceerde prototrofen en de levensvatbaarheid van de cellen moeten per concentratie ten minste drie replicaplaten worden gebruikt. Voor proefnemingen met kenmerken zoals hom 3-10 met een laag mutatieniveau moet het aantal gebruikte platen worden verhoogd, teneinde statistisch relevante gegevens te verkrijgen.
Uitvoering
S. cerevisiae-stammen worden gewoonlijk behandeld in een vloeistoftest met hetzij stationaire hetzij groeiende cellen. Het eerste experiment moet worden uitgevoerd met groeiende cellen. 1 — 5 × 107 cellen per ml worden gedurende maximaal achttien uur bij 28 tot 37 oC onder schudden aan de teststof blootgesteld; een passende hoeveelheid van een metabool activeringssysteem wordt tijdens de behandeling toegevoegd, waar dat van toepassing is. Na de behandeling worden de cellen gecentrifugeerd, uitgewassen en uitgezaaid op een geschikt cultuurmedium. Na incubatie worden op de platen overleving en de inductie van genmutaties bepaald. Indien het eerste experiment negatief is, moet een tweede experiment worden uitgevoerd met stationaire cellen. Als het eerste experiment positief is, dient dit in een passend, onafhankelijk experiment te worden bevestigd.
2. GEGEVENS
De gegevens moeten in tabellen worden samengevat met vermelding van het aantal getelde kolonies, het aantal mutanten, overlevings- en mutatiefrequenties. Alle resultaten moeten in een onafhankelijke proef worden bevestigd. De gegevens moeten met behulp van een geschikte statistische methode worden geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
gebruikte stam; |
|
— |
proefomstandigheden: stationaire fase of groeiende cellen, samenstelling van de media, incubatietemperatuur en -duur, metabool activeringssysteem; |
|
— |
behandelingsomstandigheden: blootstellingsniveaus, procedure en duur van de behandeling, behandelingstemperatuur, positieve en negatieve controles; |
|
— |
aantal getelde kolonies, aantal mutanten, overlevings- en mutatiefrequentie, dosis-responsverhouding (waar dat van toepassing is), statistische beoordeling van gegevens; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B. 16. MITOTISCHE RECOMBINATIE — SACCHAROMYCES CEREVISIAE
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Mitotische recombinatie bij Saccharomyces cerevisiae kan worden vastgesteld tussen genen (of meer algemeen tussen een gen en zijn centromeer) en binnen genen. Het eerste verschijnsel wordt mitotische overkruising genoemd en genereert reciproke producten terwijl het laatste verschijnsel meestal niet reciprook is en genconversie wordt genoemd. Overkruising kan over het algemeen worden vastgesteld door de productie van recessieve homozygote kolonies of sectoren in een heterozygote stam terwijl genconversie wordt vastgesteld door de productie van prototrofe revertanten in een auxotrofe heteroallele stam die twee verschillende defecte allelen van hetzelfde gen draagt. De voor het opsporen van mitotische genconversie meest gebruikte stammen zijn D4 (heteroalleel in ade 2 en trp 5), D7 (heteroalleel in trp 5), BZ34 (heteroalleel in arg 4) en JD1 (heteroalleel in his 4 en trp 5). Mitotische overkruising waarbij rode en roze homozygote sectoren worden geproduceerd, kan worden vastgesteld in D5 of D7 (waarin ook de mitotische genconversie en de terugwaartse mutatie in ilv 1-92 worden gemeten), aangezien beide stammen heteroalleel zijn voor complementerende allelen van ade2.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Oplossingen van de teststof en van controle- of referentiestoffen dienen kort voor het uitvoeren van de test te worden bereid met behulp van een geschikt medium. Voor niet in water oplosbare organische stoffen moet een oplossing van niet meer dan 2 % v/v organische oplosmiddelen, zoals ethanol, aceton en dimethylsulfoxyde (DMSO) worden gebruikt. De eindconcentratie van het oplosmiddel dient de levensvatbaarheid en de groeikarakteristieken van de cel niet significant te beïnvloeden.
De cellen moeten zowel met als zonder een geschikt exogeen metabool activeringssysteem aan de teststoffen worden blootgesteld. Het meest gebruikte systeem is een met cofactor aangevulde postmitochondriale fractie bereid uit de levers van knaagdieren die voorbehandeld zijn met enzyminducerende agentia. Het gebruik van andere diersoorten, weefsels, postmitochondriale fracties of procedures kan eveneens geschikt zijn voor het verkrijgen van metabole activering.
Proefomstandigheden
De meest gebruikte stammen zijn de diploïden D4, D5, D7 en JD1. Andere stammen kunnen ook gebruikt worden.
Er worden geschikte cultuurmedia gebruikt voor de bepaling van overleving en de mitotische recombinatiefrequentie.
Positieve, onbehandelde en oplosmiddelcontroles moeten parallel worden uitgevoerd. Voor elk specifiek recombinatie-eindpunt moeten geschikte positieve controlestoffen worden gebruikt.
Er zijn ten minste vijf behoorlijk gespreide concentraties van de teststof vereist. Factoren waarmee rekening moet worden gehouden zijn cytotoxiciteit en oplosbaarheid. De laagste concentratie mag geen effect hebben op de levensvatbaarheid van de cellen. Voor toxische chemicaliën mag de hoogste geteste concentratie het overlevingspercentage niet tot minder dan 5 a 10 % verlagen. In water relatief onoplosbare chemicaliën dienen met behulp van geschikte methoden tot de uiterste oplosbaarheidsgrens te worden onderzocht. Voor volledig in water oplosbare niet-toxische stoffen dient de hoogste concentratie per geval te worden bepaald.
De cellen kunnen, hetzij in de stationaire fase hetzij tijdens de groei, gedurende perioden van maximaal achttien uur aan de teststof worden blootgesteld. Bij lange behandelingstijden dienen de culturen evenwel microscopisch te worden gecontroleerd op spoorvorming, aangezien de proef daardoor zijn waarde verliest.
De platen worden in het donker gedurende vier tot zeven dagen bij 28 tot 30 oC geïncubeerd. Platen die worden gebruikt voor het opsporen van door mitotische overkruising geproduceerde rode en roze homozygote sectoren dienen voor het tellen nog een à twee dagen in een koelkast te worden bewaard (± 4 oC), teneinde de ontwikkeling van de geschikt gepigmenteerde kolonies te laten plaatsvinden.
Er moeten subculturen worden gebruikt met een spontane mitotische recombinatiefrequentie binnen de normaal aanvaarde grenzen.
Per concentratie moeten ten minste drie replicaplaten worden gebruikt voor de bepaling van het aantal door mitotische genconversie geproduceerde prototrofen en de levensvatbaarheid van de cellen. Indien het aantal door mitotische overkruising geproduceerde recessieve homozygoten wordt bepaald, dient het aantal platen te worden verhoogd, opdat een voldoende aantal kolonies kan worden onderzocht.
Uitvoering
S. cerevisiae-stammen worden gewoonlijk in een vloeistoftest behandeld en er worden hetzij stationaire hetzij groeiende cellen gebruikt. Het eerste experiment moet worden uitgevoerd met groeiende cellen. 1 — 5 × 107 cellen per ml worden gedurende maximaal achttien uur bij 28 tot 37 oC onder schudden aan de teststof blootgesteld; tijdens de behandeling wordt een passende hoeveelheid van een metabool activeringssysteem toegevoegd, waar dat van toepassing is.
Na de behandeling worden de cellen gecentrifugeerd, uitgewassen en uitgeplaat op een geschikt cultuurmedium. Na incubatie wordt op de platen de overleving en de inductie van mitotische recombinaties bepaald.
Indien het eerste experiment negatief is, moet een tweede experiment worden uitgevoerd met stationaire cellen. Als het eerste experiment positief is, dient dit in een passend, onafhankelijk experiment te worden bevestigd.
2. GEGEVENS
De gegevens moeten in tabellen worden samengevat met vermelding van het aantal getelde kolonies, het aantal recombinanten, overleving en recombinatiefrequentie.
Alle resultaten worden in een onafhankelijke proef bevestigd.
De gegevens moeten met behulp van een geschikte statistische methode worden geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
gebruikte stam; |
|
— |
proefomstandigheden: stationaire fase of groeiende cellen, samenstelling van de media, incubatietemperatuur en –duur, metabool activeringssysteem; |
|
— |
behandelingsomstandigheden: blootstellingsconcentratie, procedure en duur van de behandeling, behandelingstemperatuur, positieve en negatieve controles; |
|
— |
aantal getelde kolonies, aantal recombinanten, overleving en recombinatie-frequentie, dosis-responsverhouding (waar dat van toepassing is), statistische evaluatie van de gegevens; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.17. MUTAGENITEIT — IN-VITRO GENMUTATIETEST MET ZOOGDIERCELLEN
1. METHODE
Deze methode is overgenomen van TG 476 van de OESO: In-vitro genmutatietest met zoogdiercellen (1997).
1.1. INLEIDING
De in-vitro genmutatietest met zoogdiercellen kan worden gebruikt voor de detectie van genmutaties die door chemische stoffen zijn geïnduceerd. Geschikte cellijnen zijn bijvoorbeeld de L5178Y-muizenlymfoomcellen, de cellijnen CHO, CHO-AS52 en V79 van Chinese hamsters en de humane TK6-lymfoblastoïdcellen (1). Bij deze cellijnen zijn de meest gangbare genetische eindpunten: een mutatie bij thymidinekinase (TK), hypoxan-thineguanine-fosforibosyltransferase (HPRT) en transgeen xanthine-guanine-fosforibosyltransferase (XPRT). Bij de mutatietests met TK, HPRT en XPRT worden verschillende spectra van genetische gebeurtenissen gedetecteerd. Door de ligging van TK en XPRT op autosomen kunnen genetische gebeurtenissen worden gedetecteerd (bv. grote deleties) die niet op de HPRT-locus op X-chromosomen worden gesignaleerd (2)(3)(4)(5)(6).
Bij de in-vitro genmutatietest met zoogdiercellen kunnen culturen van permanente cellijnen of celstammen worden gebruikt. De gebruikte cellen worden geselecteerd op basis van het groeivermogen in een cultuur en de stabiliteit van de spontane mutatiefrequentie.
Bij in vitro uitgevoerde tests moet er meestal een exogene metabole activeringsbron worden gebruikt. Dit metabole activeringssysteem kan de omstandigheden in een zoogdiercel in vivo niet volledig nabootsen. Er moet goed op worden gelet dat omstandigheden die kunnen leiden tot positieve resultaten die niet het gevolg zijn van intrinsieke mutageniteit, worden vermeden. Positieve resultaten die niet het gevolg zijn van intrinsieke mutageniteit kunnen ontstaan door veranderingen in de pH of de osmolaliteit of een sterke cytotoxiciteit (7).
Deze test wordt gebruikt voor de screening op mogelijke mutagenen en carcinogenen voor zoogdieren. Veel stoffen die positief op deze test reageren, zijn carcinogeen voor zoogdieren, maar er is geen absolute correlatie tussen deze test en carcinogeniteit. De correlatie is afhankelijk van de chemische klasse en het lijkt er steeds meer op dat er carcinogenen zijn die niet met deze test worden gesignaleerd omdat ze blijkbaar via andere niet-genotoxische of in bacteriecellen afwezige mechanismen werken (6).
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Voorwaartse mutatie: een genmutatie van het oudertype naar de mutantvorm die leidt tot wijziging of verlies van de enzymactiviteit of de functie van het gecodeerde eiwit.
Mutageen met basenpaarvervanging: een stof die vervanging van een of meer basenparen in het DNA veroorzaakt.
Mutageen met leesraamverschuiving: een stof die invoeging of deletie van een of meer basenparen in het DNA-molecuul veroorzaakt.
Fenotypische expressietijd: de periode gedurende welke ongewijzigde genproducten uit pas gemuteerde cellen verdwijnen.
Mutantfrequentie: de verhouding tussen het aantal waargenomen mutantcellen en het aantal levensvatbare cellen.
Relatieve totale groei: de toename van het aantal cellen in de loop van de tijd in vergelijking met een controle-celpopulatie, berekend als het product van de suspensiegroei in vergelijking met de negatieve controle en de kloneringsefficiéntie in vergelijking met de negatieve controle.
Relatieve suspensiegroei: de toename van het aantal cellen tijdens de expressieperiode in vergelijking met de negatieve controle.
Levensvatbaarheid: de kloneringsefficiëntie van de behandelde cellen bij het uitplaten in selectieve omstandigheden na de expressieperiode.
Overleving: de kloneringsefficiëntie van de behandelde cellen bij het uitplaten aan het eind van de behandelingsperiode; de overleving wordt meestal uitgedrukt in vergelijking met de controlecelpopulatie.
1.3. PRINCIPE VAN DE TESTMETHODE
Cellen met een deficiëntie aan thymidinekinase (TK) door de mutatie TK+/- —> TK -/- zijn resistent voor de cytotoxische effecten van de pyrimidine-analoog trifluorthymidine (TFT). Cellen zonder deficiëntie aan thymidinekinase zijn gevoelig voor TFT, waardoor het celmetabolisme wordt geremd en er geen celdeling meer plaatsvindt. Dit betekent dat mutantcellen zich in aanwezigheid van TFT kunnen voortplanten en normale cellen, die thymidinekinase bevatten, niet. Analoog hieraan worden ook cellen met een deficiëntie aan HPRT of XPRT geselecteerd door resistentie voor 6-thioguanine (TG) of 8-azaguanine (AG). De eigenschappen van de teststof moeten zorgvuldig worden bekeken als een base-analoog of een met de selecterende stof verwante verbinding aan een van de genmutatietests met zoogdiercellen wordt onderworpen. Eventuele vermoedens omtrent selectieve toxiciteit van de teststof bij mutantcellen en gewone cellen moeten nader worden onderzocht. Bij het testen van chemische stoffen die verwant zijn met de selecterende stof moet worden bevestigd of het selectiesysteem en de selecterende stof bruikbaar zijn (8).
Cellen in een suspensie of een monolaagcultuur worden zowel met als zonder metabole activering gedurende een geschikte periode aan de teststof blootgesteld en overgeënt om de cytotoxiciteit te bepalen en fenotypische expressie mogelijk te maken alvorens de mutanten te selecteren (9)(10)(l l)(12)(13). De cytotoxiciteit wordt meestal bepaald door de relatieve kloneringsefficiëntie (overleving) of de relatieve totale groei van de culturen na de behandelingsperiode te meten. De behandelde culturen blijven een voldoende lange periode, kenmerkend voor elke locus en elk celtype, in groeimedium om een vrijwel optimale fenotypische expressie van de geïnduceerde mutaties mogelijk te maken. De mutantfrequentie wordt bepaald door bekende aantallen cellen te enten in medium met de selecterende stof voor de detectie van mutantcellen en in medium zonder de selecterende stof voor de bepaling van de kloneringsefficiëntie (levensvatbaarheid). Na een geschikte incubatietijd worden de kolonies geteld. De mutantfrequentie wordt bepaald aan de hand van het aantal mutantkolonies in het selectieve medium en het aantal kolonies in het niet-selectieve medium.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding
1.4.1.1. Cellen
Er kunnen verschillende soorten cellen voor deze test worden gebruikt, zoals subklonen van de cellijnen L5178Y, CHO, CHO-AS52, V79 of TK6. Van de bij deze test gebruikte cellen moet worden aangetoond dat ze gevoelig zijn voor chemische mutagenen en een hoge kloneringsefficiëntie en een stabiele spontane mutantfrequentie hebben. De cellen moeten op besmetting met mycoplasma worden gecontroleerd en mogen bij besmetting niet worden gebruikt.
De test moet zodanig worden opgezet dat deze een vooraf bepaalde gevoeligheid en onderscheidingsvermogen heeft. Het aantal cellen, culturen en concentraties van de teststof moet aan de hand van deze vooraf bepaalde parameters worden gekozen (14). Het minimale aantal levensvatbare cellen dat de behandeling overleeft en bij elke fase van de test wordt gebruikt, moet op basis van de spontane mutatiefrequentie worden gekozen. Een vuistregel is dat het gebruikte aantal cellen ten minste tien keer zo groot moet zijn als de inverse van de spontane mutatiefrequentie. Aanbevolen wordt echter ten minste 106 cellen te gebruiken. Er moeten afdoende gegevens uit het verleden over het gebruikte celsysteem beschikbaar zijn om aan te kunnen nemen dat de test consistente resultaten oplevert.
1.4.1.2. Media en kweekomstandigheden
Er moet worden gezorgd voor geschikte kweekmedia en incubatieomstandigheden (kweekvat), temperatuur, CO2-concentratie, en vochtigheid). De media moeten worden gekozen op basis van de bij de test gebruikte selectieve systemen en celtypes. Het is vooral belangrijk dat de kweekomstandigheden zodanig worden gekozen dat de celgroei tijdens de expressieperiode en het kolonievormend vermogen van zowel de mutantcellen als de gewone cellen optimaal zijn.
1.4.1.3. Bereiding van de culturen
Cellen uit stamculturen worden in een kweekmedium geënt en bij 37 oC geïncubeerd. Het is wellicht nodig reeds aanwezige mutantcellen uit de cultuur te verwijderen voordat deze voor de test wordt gebruikt.
1.4.1.4. Metabole activering
De cellen dienen zowel met als zonder een geschikt metabool activeringssysteem aan de teststof te worden blootgesteld. Het meest gebruikte systeem is een post-mitochondriale fractie aangevuld met een cofactor (S9), verkregen uit de lever van knaagdieren die zijn behandeld met enzym-inducerende stoffen als Aroclor 1254 (15)(16)(17)(18) of een combinatie van fenobarbiton en β-naftoflavon (19)(20).
De post-mitochondriale fractie wordt meestal gebruikt bij een concentratie van 1-10 % (v/v) in het uiteindelijke medium. De keuze en omstandigheden voor het gebruik van een metabool activeringssysteem kunnen afhankelijk zijn van de aard van de geteste chemische verbinding. In sommige gevallen zal wellicht meer dan een concentratie van de post-mitochondriale fractie moeten worden gebruikt.
Een aantal ontwikkelingen, bijvoorbeeld de opbouw van genetisch aangepaste cellijnen waarin specifieke activeringsenzymen tot expressie komen, kan endogene activering mogelijk maken. Voor de keuze van de gebruikte cellijnen moet een wetenschappelijke verantwoording worden gegeven (bv. aan de hand van de relevantie van het cytochroom P450-isoenzym vuur het metabolisme van de teststof).
1.4.1.5. Teststof/Bereiding
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de behandeling van de cellen worden verdund. Vloeibare teststoffen kunnen rechtstreeks aan het testsysteem worden toegediend en/of vóór de behandeling worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen van de teststof worden gebruikt.
1.4.2. Testomstandigheden
1.4.2.1. Oplosmiddel/Medium
Chemische reacties tussen het oplosmiddel/medium en de teststof moeten uitgesloten zijn en het oplosmiddel/medium moet verenigbaar zijn met het overleven van de cellen en de S9-activiteit. Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten gegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt. Wanneer stoffen worden getest die in water instabiel zijn, moeten de gebruikte organische oplosmiddelen watervrij zijn. Water kan door toevoeging van een moleculaire zeef worden verwijderd.
1.4.2.2. Blootstellingsconcentraties
Bij de bepaling van de hoogste concentratie moet onder andere rekening worden gehouden met de cytotoxiciteit, de oplosbaarheid in het testsysteem en veranderingen in de pH of de osmolaliteit.
De cytotoxiciteit moet met en zonder metabole activering in het hoofdexperiment worden bepaald aan de hand van adequate indicaties omtrent de integriteit en de groei van de cellen, zoals de relatieve kloneringsefficiëntie (overleving) of de relatieve totale groei. Het kan nuttig zijn vooraf een apart experiment uit te voeren om de cytotoxiciteit en de oplosbaarheid te bepalen.
Er moeten ten minste vier analyseerbare concentraties worden gebruikt. Wanneer er cytotoxiciteit optreedt, moeten deze concentraties een interval van de maximale tot geen of vrijwel geen toxiciteit bestrijken; dit betekent meestal dat de concentratieniveaus niet meer dan een factor 2 tot √10 uit elkaar mogen liggen. Als de maximale concentratie op cytotoxische eflecten is gebaseerd, moet de relatieve overleving (relatieve kloneringsefficiëntie) of de relatieve totale groei daarbij op ongeveer 10-20 % liggen (maar niet lager dan 10 %). Bij stoffen met een betrekkelijk geringe cytotoxiciteit moet de maximale concentratie 5 mg/ml, 5 μl/ml of 0,01 M (de laagste van deze drie) zijn.
Bij betrekkelijk onoplosbare stoffen moet de hoogste dosis bij of boven de oplosbaarheidsgrens onder de kweekomstandigheden liggen. De oplosbaarheidsgegevens moeten worden bepaald in het uiteindelijke behandelingsmedium waaraan de cellen worden blootgesteld. Het kan nuttig zijn de oplosbaarheid aan het begin en het eind van de behandeling te bepalen, aangezien de oplosbaarheid tijdens de blootstelling in het testsysteem door de aanwezigheid van bijvoorbeeld cellen. S9 of serum kan veranderen. Onoplosbaarheid kan met het blote oog worden geconstateerd. Het neerslag mag niet storen bij het scoren.
1.4.2.3. Controles
Bij elk experiment moeten tegelijkertijd positieve en negatieve (oplosmiddel of medium) controles worden uitgevoerd, zowel met als zonder metabole activering. Wanneer metabole activering wordt gebruikt, moet de voor de positieve controle gebruikte chemische stof activering vereisen om een mutagene reactie te veroorzaken.
Als positieve controle kunnen bijvoorbeeld worden gebruikt:
|
Metabole activering |
Locus |
Stof |
CAS-nr. |
Einecs-nr. |
|
Zonder exogene metabole activering |
HPRT |
Ethylmethaansulfonaat |
62-50-0 |
200-536-7 |
|
Ethylnitrosoureum |
759-73-9 |
212-072-2 |
||
|
TK (kleine en grote kolonies) |
Methylmethaansulfonaat |
66-27-3 |
200-625-0 |
|
|
XPRT |
Ethylmethaansulfonaat |
62-50-0 |
200-536-7 |
|
|
Ethylnitrosoureum |
759-73-9 |
212-072-2 |
||
|
Met exogene metabole activering |
HPRT |
3-Methylcholanthreen |
56-49-5 |
200-276-4 |
|
N-.Nitrosodimethylamine |
62-75-9 |
200-549-8 |
||
|
7,1 2-Dimethylbenzanthraceen |
57-97-6 |
200-359-5 |
||
|
TK (kleine en grote kolonies) |
Cyclofosfamide |
50-18-0 |
200-015-4 |
|
|
Cyclofosfamide monohydraat |
6055-19-2 |
|
||
|
Benzo[a]pyreen |
50-32-8 |
200-028-5 |
||
|
3-Methvlcholanthreen |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-Nitrosodimethylamine (voor hoge concentraties van S9) |
62-75-9 |
200-549-8 |
|
|
Benzo[a]pyreen |
50-32-8 |
200-028-5 |
Ook andere geschikte referentiestoffen kunnen als positieve controle worden gebruikt, bijvoorbeeld 5-broom-2'-deoxyuridine (CAS-nr. 59-14-3 en EINECS-nr. 200-415-9) als het laboratorium over referentiegegevens uit het verleden beschikt. Waar mogelijk dient het gebruik van stoffen uit een verwante chemische klasse als positieve controle te worden overwogen.
Er dienen negatieve controles in het experiment te worden opgenomen, waaraan uitsluitend het oplosmiddel of het medium wordt toegediend en die verder op dezelfde manier als de testgroepen worden behandeld. Daarnaast moeten er ook controles worden gebruikt waaraan niets wordt toegediend, tenzij in het verleden reeds is aangetoond dat het gekozen oplosmiddel geen schadelijke of mutagene effecten veroorzaakt.
1.4.3. Uitvoering
1.4.3.1. Behandeling met de teststof
Delende cellen worden zowel met als zonder metabole activering aan de teststof blootgesteld. De blootstelling moet gedurende een geschikte periode worden uitgevoerd (meestal is drie tot zes uur voldoende). De blootstelling kan een of meer celcycli beslaan.
Voor elke concentratie kan de bepaling met één behandelde cultuur of in duplo worden uitgevoerd. Wanneer één cultuur wordt gebruikt, moet het aantal concentraties worden verhoogd om ervoor te zorgen dat een afdoende aantal culturen kan worden geanalyseerd (d.w.z. ten minste acht analyseerbare concentraties). Voor de negatieve controle (oplosmiddel) moeten duploculturen worden gebruikt.
Bij het testen van gassen of vluchtige stoffen moet een daarvoor geschikte methode worden gevolgd, bijvoorbeeld in een gesloten kweekvat (21)(22).
1.4.3.2. Meting van de overleving, de levensvatbaarheid en de mutatiefrequentie
Aan het eind van de blootstellingsperiode worden de cellen gewassen en gekweekt om de overleving te bepalen en expressie van het mutantfenotype mogelijk te maken. Meestal wordt na de behandelingsperiode begonnen met de meting van de cytotoxiciteit door bepaling van de relatieve kloneringsefficiëntie (overleving) of de relatieve totale groei van de culturen.
Voor elke locus is er een bepaalde minimale tijd nodig om een vrijwel optimale fenotypische expressie van de geïnduceerde mutaties mogelijk te maken (voor HPRT en XPRT is ten minste zes tot acht dagen nodig en voor TK ten minste twee dagen). De cellen worden gekweekt in medium met en zonder de selecterende stof(fen) om respectievelijk het aantal mutanten en de kloneringsefficiëntie te bepalen. Aan het eind van de expressieperiode wordt een begin gemaakt met de meting van de levensvatbaarheid (gebruikt voor de berekening van de mutantfrequentie) door uitplating in het niet-selectieve medium.
Als de teststof positief reageert of de TK+/--test met L5178Y, moet bij ten minste een van de testculturen (de hoogste positieve concentratie) en bij de negatieve en positieve controles de grootte van de kolonies worden geïnventariseerd. Als de teststof negatief reageert op de TK+/--test met L5178Y, moet bij de negatieve en positieve controles de grootte van de kolonies worden geïnventariseerd. Als de TK+/--test met TK6 wordt gebruikt, kan de grootte van de kolonies ook worden geïnventariseerd.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
Er moeten gegevens worden verstrekt over de bepaling van de cytotoxiciteit en de levensvatbaarheid, het aantal kolonies en de mutantfrequentie bij de behandelde en de controleculturen. Als de teststof positief reageert op de TK+/--test met L5178Y, moeten de kolonies bij ten minste één concentratie van de teststof (de hoogste positieve concentratie) en bij de negatieve en positieve controles worden gescoord aan de hand van de criteria voor grote en kleine kolonies. Er is een gedetailleerde analyse gemaakt van de moleculaire en cytogenetische aard van zowel grote als kleine mutantkolonies (23)(24). Bij de TK+/--test worden de kolonies gescoord aan de hand van de criteria voor normale groei (grote kolonies) en langzame groei (kleine kolonies) (25). Mutantcellen die de omvangrijkste genetische beschadigingen hebben opgelopen, hebben een langere verdubbelingstijd en vormen derhalve kleine kolonies. De omvang van deze beschadiging varieert meestal van verlies van het hele gen tot karyotypisch zichtbare chromosoomafwijkingen. Er is een verband gelegd tussen mutanten met kleine kolonies en chemische stoffen die grootschalige chromosoomafwijkingen induceren (26). Minder ernstig aangetaste mutantcellen hebben een groeitempo dat vergelijkbaar is met de oudercellen en vormen grote kolonies.
De overleving (relatieve kloneringsefiiciëntie) of de relatieve totale groei moet worden vermeld. De mutantfrequentie moet worden uitgedrukt als de verhouding tussen het aantal mutantcellen en het aantal overlevende cellen.
De gegevens moeten voor elke cultuur apart worden verstrekt. Daarnaast moet er een overzicht van alle gegevens in tabelvorm worden samengesteld.
Een duidelijk positieve reactie behoeft niet te worden bevestigd. Bij onduidelijke resultaten moet nader onderzoek worden gedaan, bij voorkeur onder gewijzigde experimentele omstandigheden. Negatieve resultaten moeten per geval worden bevestigd. Wanneer een bevestiging van negatieve resultaten niet nodig wordt geacht, moet daarvoor een motivering worden gegeven. Bij vervolgexperimenten na onduidelijke of negatieve resultaten dient wijziging van parameters te worden overwogen om de bepaling uit te breiden tot een breder scala van omstandigheden. Parameters die voor wijziging in aanmerking komen zijn bijvoorbeeld de concentratie-intervallen en de omstandigheden bij metabole activering.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Er zijn verschillende criteria om tot een positief resultaat te besluiten, zoals een concentratieafhankelijke of een reproduceerbare stijging van de mutantfrequentie. In eerste instantie moet naar de biologische relevantie van de resultaten worden gekeken. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt. Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn.
Indien de resultaten voor een teststof niet aan bovenstaande criteria voldoen, wordt de stof in dit systeem als niet-mutageen beschouwd.
Hoewel de meeste studies duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststof in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt herhaald, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de in-vitro genmutatietest met zoogdiercellen wijzen erop dat de teststof in de gebruikte gekweekte zoogdiercellen oenmutaties induceert. Het duidelijkst is een positieve concentratieafhankelijke respons die reproduceerbaar is. Negatieve resultaten wijzen erop dat de stof onder de testomstandigheden in de gebruikte gekweekte zoogdiercellen geen genmutaties induceert.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Cellen:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Moore, M.M., DeMarini, D.M., DeSerres, F.J. and Tindall, K.R. (Eds.) (1987). Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York. |
|
(2) |
Chu, E.H.Y. and Mailing, H.V. (1968). Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro. Proc. Natl. Acad. Sci. USA, 61, pp. 1306-1312. |
|
(3) |
Liber, H.I. and Thilly, W.G. (1982). Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res., 94, pp. 467-485. |
|
(4) |
Moore, M.M., Harington-Brock, K., Doerr, C.L. and Dearfield, K.L. (1989). Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci, Mutagenesis, 4, pp. 394-403. |
|
(5) |
Aaron, C.S., and Stankowski, Jr.L.F. (1989). Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates Mutation Res., 223, pp. 121-128. |
|
(6) |
Aaron, C.S., Bolcsfoldi, G., Glatt, H.R., Moore, M., Nishi, Y., Stankowski, Jr.L.F., Theiss, J. and Thompson, E. (1994). Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, pp. 235-239. |
|
(7) |
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M., Brusick, D., Ashby, I. and Myhr. B.C. (1991). Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257, pp. 147-204. |
|
(8) |
Clive, D., McCuen, R., Spector, J.F.S., Piper, C. and Mavoumin. K. H. (1983), Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 115, pp. 225-251. |
|
(9) |
Li. A.P., Gupta, R.S., Heflich. R.H. and Wasson, J.S. (1988), A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 196, pp. 17-36. |
|
(10) |
Li, A.P., Carver, J.H., Choy, W.N.. Hsie. A.W., Gupta, R.S., Loveday, K.S., O'Neill, J.P., Riddle, J.C., Stankowski, L.F.Jr. and Yang, L.L. (1987). A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay. Mutation Res., 189, pp. 135-141. |
|
(11) |
Liber, H.L., Yandell, D.W. and Little, J.B. (1989). A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus. Mutation Res., 216, pp. 9-17. |
|
(12) |
Stankowski, L.F.Jr., Tindall, K.R., and Hsie, A.W. (1986). Quantitative and Molecular Analyses of Ethyl Methanosulphonate — and ICR 191 Induced Molecular Analyses of Ethyl Methanosulphonate — and ICR-191 Induced Mutation in AS52 Cells. Mutation Res., 160, pp. 133-147. |
|
(13) |
Turner, N.T., Baltson, A.G. and Clive, D. (1984). Procedures for the L5178Y/TK+/- — TK+/- Mouse Lymphoma Cell Mutagenicity Assay. In: Kilbey, B.J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers. New York, pp. 239-268. |
|
(14) |
Arlett, C.F., Smith, D.M., Clarke, G.M., Green, M.H.L., Cole, J., McGregor, D.B. and Asquith, J.C. (1989). Mammalian Cell Gene Mutation Assays. Based upon Colony Formation. In: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J., Ed., Cambridge University Press, pp. 66-101. |
|
(15) |
Abbondandolo. A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977). Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine. Mutation Res., 46, pp. 365-373. |
|
(16) |
Ames, B.N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicïty Test. Mutation Res., 31, pp. 347-364. |
|
(17) |
Clive, D., Johnson. K.O., Spector. J.H.S.. Batson A.G. and Brown M.M.M. (1979). Validation and Characterisation of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System. Mutat. Res., 59, pp. 61-108. |
|
(18) |
Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, pp. 173-215. |
|
(19) |
Elliott, B.M., Combes, R.D.. Elcombe, C.R., Gatehouse. D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Alternatives to Aroclor 1254-lnduced S9 in: In Vitro Genotoxicity Assays. Mutagenesis, 7, pp. 175-177. |
|
(20) |
Matsushima, T., Sawamura, M., Hara. K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: In Vitro Metabolic Activation in Mutagenesis Testing, de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot. R.M. (eds), Elsevier, North-Holland, pp. 85-88. |
|
(21) |
Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice. R.R., Costa. D.L., Schaich. K.M. (eds). Genotoxic Effects of Airborne Agents. New York. Plenum, pp. 91-103. |
|
(22) |
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5. pp. 79 5-801. |
|
(23) |
Applegate, M.L., Moore, M.M., Broder, C.B., Burrell, A. and Hozier, J.C. (1990). Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. Natl. Acad. Sci. USA, 87, pp. 51-55. |
|
(24) |
Moore, M.M., Clive, D., Hozier, J.C., Howard. B.E., Batson, A.G., Turner, N.T. and Sawyer, J. (1985). Analysis of Trifluorothymidine-Resistant (TFT1) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151, pp. 161-174. |
|
(25) |
Yandell, D.W., Dryja, T.P. and Little. J.B. (1990). Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells. Mutation Res., 229, pp. 89-102. |
|
(26) |
Moore, M.M. and Doerr. C.L. (1990). Comparison of Chromosome Aberration Frequency and Small-Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- — 3.7.2C Mouse Lymphoma Cells. Mutagenesis, 5, pp. 609-614. |
B.18. DNA-BESCHADIGING EN HERSTEL — DNA-HERSTELSYNTHESE — ZOOGDIERENCELLEN IN VITRO
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Het onderzoek naar DNA-herstelsynthese (Unscheduled DNA Synthesis, UDS) meet de DNA-herstelsynthese na excisie en verwijdering van een DNA-streng die de door chemische en fysische agentia geïnduceerde beschadiging bevat. De proef is gebaseerd op de opname van met tritium gemerkt thymidine (3H-TdR) in het DNA van zoogdierencellen die zich niet in de S-fase van de celcyclus bevinden. De opname van 3H-TdR kan worden bepaald met behulp van autoradiografie of van vloeistofscintillatietelling (liquid scintillation counting, LSC) van DNA uit behandelde cellen. Tenzij primaire rattenhepatocyten worden gebruikt, worden de zoogdierencellen in cultuur met en zonder een exogeen metabool activeringssysteem met de teststof behandeld. UDS kan eveneens in in-vivo-systemen worden gemeten.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Teststoffen en controle- of referentiestoffen moeten in groeimedium worden bereid of opgelost of gesuspendeerd in geschikte media en voor gebruik in de proef verder worden verdund in groeimedium. De uiteindelijke concentratie van het medium mag geen effect hebben op de levensvatbaarheid van de cel.
Primaire culturen van rattenhepatocyten, menselijke lymfocyten of permanente cellijnen (bijvoorbeeld menselijke diploïde fibroblasten) kunnen voor deze toets worden gebruikt.
De cellen moeten met en zonder geschikt metabool activeringssysteem aan de teststof worden blootgesteld.
Proefomstandigheden
Er zijn ten minste twee celculturen voor autoradiografie en zes (of minder als dit wetenschappelijk verantwoord is) celculturen voor LSC-UDS-metingen vereist voor elk punt in de proef.
Bij elke proef moeten parallelle positieve en negatieve (onbehandelde en/of medium) controles met en zonder metabole activering worden uitgevoerd.
Voorbeelden van positieve controles voor de proef met rattenhepatocyten zijn onder meer 7,12-dimethylbenzathraceen (7,12-DMBA) of 2-acetylaminofluoreen (2-AAF). Voor gevestigde cellijnen is 4-nitroquinoline-N-oxyde (4-NQO) een voorbeeld van een positieve controle voor autoradiografie en LSC-proeven, uitgevoerd zonder metabole activering; wanneer metabole activeringssystemen worden gebruikt is N-dimethylnitrosamine een positieve controleverbinding.
Er zijn meerdere concentraties van de teststof vereist die voldoende gespreid moeten zijn om de respons te bepalen. De hoogste concentratie moet een cytotoxisch effect veroorzaken. In water relatief onoplosbare stoffen dienen tot de uiterste oplosbaarheidsgrens te worden onderzocht. Voor volledig in water oplosbare niet-toxische stoffen dient de hoogste concentratie per geval te worden bepaald.
Om de culturen in stand te houden moeten geschikte groeimedia, CO2-concentraties, temperatuur en vochtigheidsgraad worden gebruikt. Permanente cellijnen moeten regelmatig worden gecontroleerd op Myco-plasma contaminatie.
Voor primaire hepatocytculturen wordt geen metabool activeringssysteem gebruikt. Permanente cellijnen en lymfocyten worden met en zonder geschikt metabool activeringssysteem aan de teststof blootgesteld.
Uitvoering
Permanente cellijnen worden uit stamculturen gegenereerd (bijvoorbeeld door trypsinebehandeling of door uitspoelen), met een geschikte dichtheid op kweekflessen uitgezaaid en geïncubeerd bij 37 oC.
Korte levende culturen rattenhepatocyten worden gekweekt door pas gedissocieerde hepatocyten in een geschikt medium te laten vasthechten aan de groeiende laag.
Menselijke lymfocytculturen worden met behulp van geschikte technieken gemaakt.
Primaire rattenhepatocyten
Pas geïsoleerde rattenhepatocyten worden gedurende een geschikte periode met de teststof behandeld in een medium dat 3H-TdR bevat. Na de behandelingsperiode wordt medium van de cellen verwijderd, de cellen worden gespoeld, gefixeerd en gedroogd. De glaasjes worden in een autoradiografische emulsie gedoopt, blootgesteld, ontwikkeld (als alternatief kan ook stripping film worden gebruikt), gekleurd en geteld.
Permanente cellijnen en lymfocyten
Autoradiografische methode: de celculturen worden voor een geschikte duur aan de teststof blootgesteld en daarna behandeld met 3H-TdR. De blootstellingstijd wordt bepaald door de aard van de stof, de activiteit van het metaboliseringssysteem en het soort cel. Om de UDS-piek op te sporen, moet het 3H-TdR hetzij samen met de teststof hetzij binnen enkele minuten na de blootstelling aan de teststof worden toegevoegd. De keuze tussen deze twee methoden is afhankelijk van een mogelijke interactie tussen teststof en 3H-TdR. Teneinde een onderscheid te maken tussen UDS en semiconservatieve DNA-repIicatie kan dit laatste verschijnsel worden geremd door toepassing van een arginine-deficiënt medium, laag serumgehalte of door hydroxyurea in het cultuurmedium.
LSC-metingen van UDS: vóór de behandeling met de teststof moet zoals hierboven beschreven worden voorkomen dat de cellen in de S-fase treden; nadien worden de cellen aan de teststof blootgesteld overeenkomstig de beschrijving voor autoradiografie. Na de incubatieperiode wordt het DNA uit de cellen gehaald en worden het totale DNA-gehalte en de 3H-TdR-opname bepaald.
Opgemerkt wordt dat bij gebruik van menselijke lymfocyten in de hierboven beschreven methoden de semiconservarieve DNA-replicatie niet moet worden onderdrukt in ongestimuleerde culturen.
Analyse
Voor de UDS-analyse van cellen in cultuur worden de S-fase kernen niet geteld. Per concentratie dienen ten minste 50 cellen te worden geteld. Voor de telling dienen de glaasjes te worden gecodeerd. Op elk glaasje moeten ver uiteenliggende, willekeurig gekozen velden worden geteld. De opgenomen hoeveelheid 3H-TdR in het cytoplasma moet worden bepaald door telling van drie gebieden ter grootte van een kern in het cytoplasma van elke getelde cel.
Voor de LSC-UDS-analyse moet van elke concentratie en van de controlepopulaties een passend aantal culturen worden gebruikt.
Alle resultaten moeten in een onafhankelijke proef worden bevestigd.
2. GEGEVENS
De gegevens moeten in tabellen worden samengevat.
2.1. AUTORADIOGRAFISCHE ANALYSE
De mate van 3H-TdR-opname in het cytoplasma en het aantal aangetroffen korrels op de celkern moeten afzonderlijk worden vermeld.
Gemiddelde, mediaan en modus kunnen worden gebruikt om de distributie van de 3H-TdR-opname in het cytoplasma en het aantal korrels per kern te beschrijven.
2.2. LSC-ANALYSE
Voor LSC-analyses moet de 3H-TdR-opname worden vermeld in dpm/μg DNA. Het gemiddeld aantal dpm/μg DNA met standaarddeviatie kan worden gebruikt om de distributie van de opname te beschrijven.
De gegevens moeten met behulp van een geschikte statistische methode worden geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
gebruikte cellen, dichtheid en passagegetal op het ogenblik van de behandeling, aantal celculturen; |
|
— |
toegepaste methode voor instandhouding van de celculturen met inbegrip van medium, temperatuur en CO2-concentratie; |
|
— |
teststof, medium, concentraties en verantwoording voor de in de test gebruikte concentraties; |
|
— |
gegevens over het metabole activeringssysteem; |
|
— |
behandelingsschema; |
|
— |
positieve en negatieve controles; |
|
— |
toegepaste autoradiografische techniek; |
|
— |
toegepaste methode om te voorkomen dat de cellen in de S-fase treden; |
|
— |
toegepaste methode voor DNA-extractie en bepaling van het totale DNA-gehalte in LSC-analyses; |
|
— |
indien mogelijk de dosis-responsverhouding; |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.19. ZUSTERCHROMATIDEN-UlTWISSELINGSTEST IN VITRO
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
De zusterchromatiden-uitwisselingstest (Sister Chromatid Exchange, SCE), is een kortdurende proef voor het opsporen van reciproke DNA-uitwisselingen tussen twee zusterchromatiden van een duplicerend chromosoom. SCE's zijn onderlinge uitwisselingen van DNA-replicatieproducten in ogenschijnlijk homologe loci. Vermoed wordt dat het uitwisselingsproces verband houdt met een DNA-breuk en -hereniging, ofschoon weinig bekend is over de moleculaire basis ervan. Om SCE's op te sporen moet een middel beschikbaar zijn om zusterchromatiden verschillend te merken. Dat kan gebeuren door gedurende twee celcycli broomdeoxyuridine (BrdU) in her chromosomaal DNA in te brengen.
In-vitro zoogdierencellen worden met en zonder een exogeen metabool activeringssysteem verkregen uit zoogdieren aan de teststof blootgesteld en gedurende twee replicatiecycli in een BrdU-bevattend medium gekweekt. Na behandeling met een „spindle”-remmer (bijvoorbeeld colchicine) om cellen in een metafaseachtig stadium van de mirose (c-metafase) te verzamelen, worden de cellen gewonnen en chromosoompreparaten gemaakt.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
1.6.1. Voorbereidingen
|
— |
Voor de test kunnen primaire culturen (menselijke lymfocyten) of gevestigde cellijnen (bij voorbeeld ovariumcellen van de Chinese hamster) worden gebruikt. De cellijnen moeten worden gecontroleerd op Mycoplasma-contaminatie. |
|
— |
Er moeten geschikte cultuurmedia en incubaneomstandigheden worden gebruikt (bijvoorbeeld temperatuur, cultuurflessen, CO2-gehalte en vochtigheidsgraad). |
|
— |
Vóór de behandeling van de cellen dienen de reststoffen te worden klaargemaakt in cultuurmedia of opgelost of gesuspendeerd in geschikte middelen. De uiteindelijke concentratie van een medium in het cultuursysteem mag geen significante invloed hebben op de levensvatbaarheid of de groeisnelheid van de cel en effecten op de SCE-frequentie moeten door middel van een oplosmiddel controle worden nagegaan. |
|
— |
De cellen moeten met en zonder exogeen metabool activeringssysteem bereid uit zoogdieren aan de reststoffen worden blootgesteld. Indien evenwel cellen met intrinsieke metabole activiteit worden gebruikt, moeten de aard en de omvang van de activiteit geschikt zijn voor de te onderzoeken chemische klasse. |
1.6.2. Proefomstandigheden
Voor elk punt in de proef moeten culturen ten minste in tweevoud worden gebruikt.
Positieve controles waarbij gebruik wordt gemaakt van een direct werkende stof en een stof die metabole activering vereist, moeten bij elke proefneming worden uitgevoerd: er dient eveneens een mediumcontrole te worden gebruikt.
Hierna volgen voorbeelden van stoffen die als positieve controle kunnen worden gebruikt:
|
— |
direct werkende stof:
|
|
— |
niet-rechtstreeks werkende stof:
|
Waar dar van toepassing is, kan ook een aanvullende positieve controle van dezelfde chemische klasse als de te onderzoeken stof worden meegenomen.
Er zijn ten minste drie behoorlijk gespreide concentraties van de teststof vereist. De hoogste concentratie moet een duidelijk toxisch effect veroorzaken en moet laag genoeg zijn om een goede celreplicatie te doen plaatsvinden. In water relatief onoplosbare stoffen dienen met behulp van geschikte methoden tot de uiterste oplosbaarheidsgrens te worden onderzocht. Voor volledig in water oplosbare niet-toxische stoffen dient de hoogste concentratie per geval te worden bepaald.
1.6.3. Uitvoering
Permanente cellijnen worden gegenereerd uit stamculturen (bijvoorbeeld door trypsinebehandeling of uitspoelen), met een geschikte dichtheid uitgezaaid in kweekflessen en geincubeerd bij 37 oC. Voor eenlagige culturen moet het aantal cellen per kweekfles worden aangepast zodat de culturen op het tijdstip van winning niet veel meer dan 50 % confluent zijn. Anderzijds kunnen cellen worden gebruikt in een suspensiecultuur. Culturen van menselijke lymfocyten worden met behulp van geschikte technieken opgezet uit gehepariniseerd bloed en bij 37 oC geïncubeerd.
Cellen in exponentiële groeifase worden voor een geschikte duur blootgesteld aan de teststof; in de meeste gevallen volstaan een tot twee uur maar in bepaalde gevallen mag de behandelingstijd worden verlengd tot maximaal twee complete celcycli. Cellen zonder toereikende intrinsieke metabole activiteit moeten met en zonder geschikt metabool activeringssysteem aan de teststof worden blootgesteld. Na de blootstellingsperiode worden de teststoffen van de cellen gewassen en worden de cellen gedurende twee replicatieronden in aanwezigheid van BrdU in cultuur gebracht. Een andere methode is de cellen gedurende de volledige cultuurtijd van twee celycli gelijktijdig bloot te stellen aan de teststof en aan BrdU.
Culturen van menselijke lymfocyten worden behandeld terwijl ze zich in een semisynchrone staat bevinden.
De cellen worden geanalyseerd in de tweede deling na de behandeling omdat het dan zeker is dat de gevoeligste fasen van de celcyclus aan de teststof zijn blootgesteld. Alle culturen waaraan BrdU is toegevoegd, moeten tot aan de winning van de cellen in het donker of in geschemerd licht van gloeilampen worden behandeld, teneinde de fotolyse van BrdU-bevattend DNA tot een minimum te beperken.
De celculturen worden een tot vier uren voor het winnen behandeld met een „spindle”-remmer (bijvoorbeeld colchicine). Elke cultuur wordt afzonderlijk gewonnen en bewerkt met het oog op het prepareren van chromosomen.
Chromosoompreparaten worden gemaakt met behulp van standaardcytogenetische technieken. De glaasjes kunnen met behulp van diverse technieken (bij voorbeeld fluorescentie plus Giemsa-methode) worden gekleurd om de SCE's aan te tonen.
Het aantal te analyseren cellen dient te zijn gebaseerd op de door controleproeven bepaalde spontane SCE-frequentie. Gewoonlijk worden ten minste 25 goed gespreide metafasen per cultuur geanalyseerd op SCE's. De glaasjes worden voor de analyse gecodeerd. Voor menselijke lymfocyten worden uitsluitend metafasen geanalyseerd die 46 centromeren bevatten. Voor gevestigde cellijnen worden uitsluitend metafasen geanalyseerd die ± 2 centromeren van het modale aantal bevatten. Er moet worden vermeld of een centromere verandering van kenmerk als SCE wordt beschouwd of niet. De resultaten moeten in een onafhankelijke proef worden bevestigd.
2. GEGEVENS
De gegevens moeten in tabellen worden samengevat. Voor alle behandelde en controleculturen moet het aantal SCE's in elke metafase en het aantal SCE's per chromosoom in elke metafase afzonderlijk worden vermeld.
De gegevens moeten met behulp van een geschikte statistische methode worden geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag van de proefneming moeten de volgende gegevens worden opgenomen:
|
— |
gebruikte cellen, methoden voor het in stand houden van de celculturen; |
|
— |
proefomstandigheden: samenstelling van cultuurmedia, CO2-concentratie, concentratie van de teststof, gebruikt oplosmiddel, incubatietemperatuur, behandelingstijd, toegepaste „spindle”-remmer, de concentratie ervan en de duur van de behandeling, gebruikte soort metabool activeringssysteem bereid uit zoogdieren, positieve en negatieve controles; |
|
— |
aantal celculturen per punt in de proef; |
|
— |
nadere gegevens omtrent de toegepaste techniek voor het prepareren van glaasjes; |
|
— |
aantal geanalyseerde metafasen (de gegevens dienen voor elke cultuur afzonderlijk te worden vermeld); |
|
— |
gemiddeld aantal SCE's per metafase en per chromosoom (de gegevens dienen voor elke cultuur afzonderlijk te worden vermeld); |
|
— |
criteria voor het tellen van SCE's; |
|
— |
verantwoording voor de gekozen dosis; |
|
— |
dosis-responsverhouding (indien mogelijk); |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.20. GESLACHTSGEBONDEN RECESSIEVE LETALITEITSTEST MET DROSOPH1LA MELANOGASTER
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Het onderzoek naar geslachtsgebonden recessieve letaliteit (Sex-linked recessive lethaltest, SLRL) waarbij Drosophila melanogaster wordt gebruikt, spoort mutaties, zowel puntsmutaties als kleine deleties, in de geslachtslijn van het insekt op. Deze test is een voorwaartse mutatietest waarmee kan worden gezocht naar mutaties in circa 800 loci op het X-chromosoom. Dat is circa 80 % van alle X-chromosoomloci. Het X-chromosoom vertegenwoordigt circa een vijfde van het gehele haploïde genoom.
Mutaties in het X-chromosoom van Drosophila melanogaster komen fenotypisch tot uiting bij mannetjes die drager zijn van het mutant gen. Indien de mutatie letaal is in de homozygote staat wordt dit afgeleid uit het ontbreken van een klasse mannelijke nakomelingen van de twee die normaal door een heterozygoot vrouwtje worden voortgebracht. Bij de SLRL-toets wordt van deze feiten gebruik gemaakt door middel van speciaal gemerkte en gerangschikte chromosomen.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Mannetjes van een goed gedefinieerd wild-type stamcultuur en vrouwtjes van de Muller-5 stamcultuur kunnen worden gebruikt. Andere goed gemerkte vrouwelijke stamculturen met meermaals geïnverteerde X-chromosomen kunnen eveneens worden gebruikt.
De teststoffen dienen in water te worden opgelost. In water onoplosbare stoffen kunnen in geschikte media worden opgelost of gesuspendeerd {bijvoorbeeld een mengsel van ethanol en Tween-60 of 80) en voor de toediening worden verdund in water of een zoutoplossing. Dimethylsulfoxyde (DMSO) moet als medium worden vermeden.
De proef moet worden opgezet met een vooraf bepaalde gevoeligheid en statistische kracht. De tijdens de desbetreffende controle waargenomen spontane mutatiefrequentie zal het aantal te analyseren behandelde chromosomen in sterke mate beïnvloeden.
Blootstelling kan oraal geschieden, door injectie of door blootstelling aan gassen of dampen. De teststof kan ook als voedsel worden toegediend in een suikeroplossing. Waar dat nodig is kunnen de stoffen worden opgelost in een 0,7 % natriumchlorideoplossing en in de thorax of abdomen worden geïnjecteerd.
Negatieve (medium) en positieve controles moeten worden meegenomen. Indien evenwel in het laboratorium geschikte controlegegevens uit het verleden beschikbaar zijn, behoeven geen parallelle controles te worden uitgevoerd.
Drie blootstellingsniveaus moeten worden gebruikt. Voor een voorbereidende beoordeling kan met een blootstellingsniveau van de teststof worden volstaan. Dat blootstellingsniveau is hetzij de hoogste getolereerde concentratie of de concentratie waarbij zich enige tekenen van toxiciteit voordoen. Voor niet-toxische stoffen dient een blootstelling tot maximale concentratie die uitvoerbaar is te worden gebruikt.
Wild-type mannetjes (drie tot vijf dagen oud) worden met teststof behandeld en individueel gepaard met een overmaat aan niet-gedekte vrouwtjes van de Muller-5 stamcultuur of van een andere goed gemerkte (met meervoudig geïnverteerde X-chromosomen) stamcultuur. Om de twee à drie dagen worden de vrouwtjes vervangen door andere niet-gedekte vrouwtjes, teneinde de volledige geslachtscelcyclus te bestrijken. Bij de nakomelingen van deze vrouwtjes worden letale effecten opgespoord die overeenstemmen met de effecten op rijp sperma, spermatiden in vroeg, midden of laat stadium, spermatocyten en spermatogonia op het ogenblik van de behandeling.
Heterozygote F1-vrouwtjes uit de hierboven beschreven kruising worden individueel gepaard (dat wil zeggen een vrouwtje per fles) met hun broertjes. In de F2-generatie wordt in elke cultuur de afwezigheid van wild-type mannetjes onderzocht. Indien een cultuur lijkt te zijn ontstaan uit een F1-vrouwtje dat een letaal kenmerk in het ouderlijk X-chromosoom draagt (dat wil zeggen er worden geen mannetjes met het behandelde chromosoom aangetroffen), dienen dochters van dat vrouwtje met hetzelfde genotype te worden onderzocht, teneinde na te gaan of de letaliteit in de volgende generatie wordt herhaald.
2. GEGEVENS
De gegevens moeten in tabellen worden samengevat met vermelding van het aantal geteste X-chromosomen, het aantal niet-vruchtbare mannetjes en het aantal letale chromosomen voor elke blootstellingsconcentratie en voor elke paringsperiode van elk mannetje. Per mannetje dient het aantal groepen van verschillende omvang te worden vermeld. De resultaten moeten in een afzonderlijke proef worden bevestigd.
De geslachtsgebonden recessieve letaliteitstest moet met behulp van geschikte statistische methoden worden geëvalueerd. Groeperingen van uit een mannetje ontstane recessief letalen moeten met behulp van een geschikte statistische methode worden behandeld en geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
stamcultuur: gebruikte Drosophilastammen, leeftijd van de insekten, aantal behandelde mannetjes, aantal steriele mannetjes, aantal gevormde F2-culturen, aantal F2-culturen zonder nakomelingen, aantal in elke geslachtscelfase aangetroffen chromosomen met een letaal kenmerk; |
|
— |
criteria voor de bepaling van de omvang van de behandelde groepen; |
|
— |
proefomstandigheden: gedetailleerde beschrijving van het behandelings- en bemonsteringsschema, blootstellingsniveaus, toxiciteitsgegevens, negatieve (oplosmiddel) en positieve controles (waar dat van toepassing is); |
|
— |
criteria voor het tellen van letale mutaties; |
|
— |
blootstelling/effectverhouding (indien mogelijk); |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.21. ZOOGDIERENCELTRANSFORMATIETEST IN VITRO
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Cultuursystemen van zoogdierencellen kunnen worden gebruikt voor het onderzoek van fenotypische veranderingen in vitro die worden geïnduceerd door chemische stoffen die betrokken zijn bij maligne transformaties in vivo. Algemeen gebruikte cellen zijn onder meer C3H10T½, 3T3, SHE, en Fischer-rat. De test is gebaseerd op wijzigingen in de celmorfologie, focusvorming of wijzigingen in de afhankelijkheid van de aanhechting in halfvast agar. Er bestaan andere, minder gebruikte systemen die andere fysiologische of morfologische wijzigingen in cellen ten gevolge van blootstelling aan carcinogene chemische stoffen opsporen. Van geen van de eindpunten van de in-vitro-proef staat vast dat er een mechanistische band is met kanker. Met enkele testsystemen kunnen tumorpromotoren worden opgespoord. Cytotoxiciteit kan worden bepaald door meting van het effect van de teststof op de kolonievorming (cloningsefficiëntie) of de groeisnelheid van de culturen. De cytotoxiciteitsbepaling kan worden gebruikt om vast te stellen dat blootstelling aan de teststof een toxisch effect heeft gehad, maar kan niet in alle testen worden gebruikt om de transformatiefrequentie te berekenen, aangezien voor sommige testen een langere incubatie en/of opnieuw uitplaten noodzakelijk kunnen zijn.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Een verscheidenheid aan cellijnen of primaire cellen is beschikbaar afhankelijk van de toegepaste transformatietest. De onderzoeker moet nagaan of de cellen voor de uit te voeren proef na blootstelling aan bekende carcinogenen de juiste fenotypische wijzigingen vertonen en dient ervoor te zorgen dat de validiteit en betrouwbaarheid van de in zijn laboratorium uitgevoerde test aangetoond en gedocumenteerd wordt.
De gebruikte media en proefomstandigheden dienen geschikt te zijn voor de uit te voeren transformatietesten.
De teststof mag in cultuurmedia worden bereid of voor de behandeling van de cellen worden opgelost of gesuspendeerd in geschikte middelen. De uiteindelijke concentratie van het (oplos)middel in het cultuursysteem mag de levensvatbaarheid van de cellen, de groeisnelheid of de mate van voorkomen van transformaties niet beïnvloeden.
De cellen dienen met en zonder geschikt metabool activeringssysteem aan de teststof te worden blootgesteld. Indien evenwel celsoorten worden gebruikt met een intrinsieke metabole activiteit, moet worden nagegaan of de aard van de activiteit geschikt is voor de onderzochte chemische klasse.
Proefomstandigheden
Voor elke proef moet een positieve controle worden uitgevoerd waarbij zowel een rechtstreeks werkende verbinding als een verbinding die metabole activering vereist, moeten worden meegenomen: er dient eveneens een negatieve (oplos)middelcontrole te worden gebruikt.
Hierna volgen voorbeelden van stoffen die als positieve controle kunnen worden gebruikt:
|
— |
Direct werkende stoffen:
|
|
— |
Verbindingen die metabole activering vereisen:
|
Wanneer dat van toepassing is, dient een aanvullende positieve controle van dezelfde chemische klasse als de teststof te worden uitgevoerd.
Meerdere concentraties van de teststof moeten worden gebruikt. Deze concentraties moeten een concentratieafhankelijk toxisch effect veroorzaken waarbij de hoogste concentratie een laag overlevingspeil geeft en de overleving in de laagste concentratie nagenoeg dezelfde is als die in de negatieve controle. In water relatief onoplosbare stoffen dienen met behulp van geschikte methoden tot de uiterste oplosbaarheidsgrens te worden onderzocht. Voor volledig in water oplosbare, niet-toxische stoffen dient de hoogste concentratie per geval te worden bepaald.
Uitvoering
De cellen moeten voldoende lang worden blootgesteld. De tijd is afhankelijk van het toegepaste testsysteem en bij langere blootstellingstijden kan het noodzakelijk zijn een nieuwe dosis toe te dienen en gelijktijdig het medium te veranderen (met indien noodzakelijk een vers metabool activeringsmengsel). Cellen met een ontoereikende intrinsieke metabole activiteit moeten met en zonder een geschikt metabool activeringssysteem aan de teststof worden blootgesteld. Na de blootstellingsperiode wordt de teststof van de cellen gewassen en worden de cellen op cultuurmedia gebracht onder omstandigheden die gunstig zijn om het verschijnen van getransformeerde fenotypes te controleren en wordt de mate van voorkomen van de transformaties bepaald. Alle resultaten worden in een onafhankelijke proef bevestigd.
2. GEGEVENS
De gegevens moeten in tabellen worden samengevat en kunnen naar gelang van de gebruikte toets in diverse vormen worden voorgesteld, bijvoorbeeld plaattellingen, positieve platen of aantal getransformeerde cellen. Wanneer dat van toepassing is, dient de overleving te worden uitgedrukt als een percentage van het controleniveau en de transformatiefrequentie als het aantal transformaties per aantal overlevenden. De gegevens moeten met behulp van een geschikte statistische methode worden geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag van de proef moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
gebruikt celtype, aantal celculturen, methode voor het in stand houden van celculturen; |
|
— |
proefomstandigheden: concentratie van de teststof, gebruikt (oplos)middel, incubatietemperatuur, incubatietijd, duur en frequentie van de behandeling, celdichtheid tijdens de behandeling, type van het gebruikte exogeen metabool activeringssysteem, positieve en negatieve controles, specificatie van het onderzochte fenotype, gebruikt selectief systeem (wanneer dat van toepassing is); verantwoording voor de keuze van de doses; |
|
— |
gebruikte methode voor het tellen van het aantal levensvatbare en getransformeerde cellen; |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.22. ONDERZOEK NAAR DOMINANTE LETALE MUTATIES BIJ KNAAGDIEREN
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Dominante letale effecten veroorzaken de dood van het embryo of van de foetus. De inductie van dominante letale mutaties door blootstelling aan een chemische stof wijst erop dat de stof het geslachtsweefsel van de proefdiersoort heeft aangetast. Algemeen wordt aangenomen dat dominante letale mutaties het gevolg zijn van beschadiging van de chromosomen (structurele en numerieke anomalieën). Als vrouwtjes worden behandeld, kan de dood van het embryo eveneens het gevolg zijn van toxische effecten.
In het algemeen worden mannetjes aan de teststof blootgesteld en met niet-behandelde, niet-gedekte vrouwtjes gepaard. De diverse geslachtscelstadia kunnen door middel van geregelde intervallen in de paring afzonderlijk worden onderzocht. De toename van het aantal dode implantaten per vrouwtje in de behandelde groep in vergelijking met het aantal dode implantaten per vrouwtje in de controlegroep geeft het verlies na implantatie weer. Het verlies voor implantatie kan worden geschat op grond van tellingen van de corpora lutea of door het totale aantal implantaten per vrouwtje in de behandelde en de controlegroep met elkaar te vergelijken. Het totale dominante letale effect is de som van het verlies voor en na de implantatie. De berekening van het totale dominante letale effect is gebaseerd op de vergelijking van de levende implantaten per vrouwtje in de testgroep met de levende implantaten per vrouwtje in de controlegroep. Een vermindering van het aantal implantaten op bepaalde tijdstippen kan het gevolg zijn van het doodgaan van cellen (bijvoorbeeld van spermatocyten en/of spermatogonia).
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Zo mogelijk moeten de teststoffen in een isotone zoutoplossing worden opgelost of gesuspendeerd. Niet in water oplosbare chemische stoffen kunnen in geschikte (oplos)middelen worden opgelost of gesuspendeerd. Het gebruikte (oplos)middel mag niet met de teststof interfereren en mag ook geen toxische effecten produceren. Er dienen verse bereidingen van de teststof te worden gebruikt.
Proefomstandigheden
De teststof moet in het algemeen slechts eenmaal worden toegediend. Op grond van toxicologische gegevens kan een schema met herhaalde behandelingen worden gebruikt. De normale toedieningswegen zijn orale intubatie of intraperitoneale injectie. Andere toedieningswegen kunnen eveneens geschikt zijn.
Ratten of muizen worden als proefdieren aanbevolen. Gezonde, geslachtelijk volledig rijpe dieren worden willekeurig ingedeeld in te behandelen groepen en controlegroepen.
Er dient een passend aantal behandelde mannetjes te worden gebruikt, rekening houdend met de spontane variatie van het te onderzoeken biologische kenmerk. Het gekozen aantal moet gebaseerd zijn op de van tevoren vastgestelde detectiegevoeligheid en significantie. Zo moet bijvoorbeeld bij een kenmerkende test het aantal mannetjes in elke dosisgroep voldoende zijn om per paringsinterval 30 à 50 drachtige vrouwtjes te hebben.
In het algemeen moet elk experiment parallelle positieve en negatieve (oplos)middelcontroles omvatten. Indien aanvaardbare positieve controleresultaten uit het recente verleden van in hetzelfde laboratorium verrichte experimenten beschikbaar zijn, kunnen deze worden gebruikt in plaats van een parallelle positieve controle. Positieve controlestoffen moeten in een voldoende lage dosis (bijvoorbeeld MMS, i.p., bij 10 mg/kg) worden gebruikt om de gevoeligheid van de test aan te tonen.
Normaliter moeten drie dosisniveaus worden gebruikt. De hoge dosis moet bij de behandelde dieren tekenen van toxiciteit of verminderde vruchtbaarheid teweegbrengen. In sommige gevallen kan met één enkele hoge dosis worden volstaan.
Niet-toxische stoffen moeten in doses van 5 g/kg bij één enkele toediening of in doses van 1 g/kg/dag bij herhaalde toediening worden getest.
Uitvoering
Er zijn diverse behandelingsschema's beschikbaar. Enkelvoudige toediening van de teststof is de meest toegepaste methode. Er kunnen ook andere behandelingsschema's worden gebruikt.
Na de behandeling laat men individuele mannetjes opeenvolgend na geschikte intervallen, met een of twee niet-behandelde, nog niet-gedekte vrouwtjes paren. De vrouwtjes moeten bij de mannetjes worden gelaten gedurende ten minste één volledige oestruscyclus of tot op het ogenblik dat de paring heeft plaatsgevonden, hetgeen wordt bepaald door de aanwezigheid van sperma in de vagina of door de aanwezigheid van een vaginale plug.
Het aantal paringen na de behandeling is afhankelijk van het behandelingsschema en moet groot genoeg zijn om alle geslachtscelstadia na de behandeling te kunnen onderzoeken.
De vrouwtjes worden in de tweede helft van de dracht gedood en de inhoud van de uterus wordt onderzocht om het aantal dode en levende implantaties te bepalen. Ook de eierstokken kunnen worden onderzocht om het aantal corpora lutea te bepalen.
2. GEGEVENS
De volgende gegevens moeten in tabellen worden weergegeven: aantal mannetjes, aantal drachtige vrouwtjes en aantal niet-drachtige vrouwtjes. De resultaten van elke paring, met inbegrip van de identiteit van elk mannetje en elk vrouwtje, moeten afzonderlijk worden gerapporteerd. Voor elk vrouwtje moet de week van de paring, het dosisniveau van het mannetje en de frequentie van levende en dode implantaten worden aangegeven.
De berekening van het totale dominante letale effect is gebaseerd op de vergelijking van de levende implantaten per vrouwtje in de testgroep met de levende implantaten per vrouwtje in de controlegroep. De verhouding tussen dode en levende implantaten bij de behandelde groep, vergeleken met dezelfde verhouding bij de controlegroep, wordt geanalyseerd om het verlies na implantatie na te gaan.
Als de gegevens van vroegtijdige en laattijdige sterften worden geregistreerd, moet dat uit de tabellen duidelijk blijken. Als het verlies vóór implantatie wordt geschat, moet dat worden gerapporteerd. Het verlies vóór implantatie kan worden berekend als een discrepantie tussen het aantal corpora lutea en het aantal implantaten of als een daling van het gemiddelde aantal implantaten per uterus in vergelijking met controleparingen.
De gegevens worden met behulp van geschikte statistische methoden geëvalueerd.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, leeftijd en gewicht van de gebruikte dieren, aantal dieren van elk geslacht in de experimentele en controlegroepen; |
|
— |
teststof, (oplos)middel, geteste dosisniveaus en verantwoording voor de selectie van de dosering, negatieve en positieve controles, gegevens over de toxiciteit; |
|
— |
expositiewijze en -duur; |
|
— |
paringsschema; |
|
— |
gebruikte methode om te bepalen dat de paring heeft plaatsgevonden; |
|
— |
tijdstip waarop de dieren worden gedood; |
|
— |
criteria voor de beoordeling van dominante letale mutaties; |
|
— |
dosis/responsverhouding (waar dat van toepassing is); |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.23. TEST OP CHROMOSOOMAFWIJKINGEN IN SPERMATOGONIA VAN ZOOGDIEREN
1. METHODE
Deze methode is overgenomen van TG 48 3 van de OESO: Test op chromosoomafwijkingen in spermatogonia van zoogdieren (1997).
1.1. INLEIDING
De in-vivotest op chromosoomafwijkingen in spermatogonia van zoogdieren wordt gebruikt om te bepalen welke stoffen structurele chromosoomafwijkingen in spermatogonia van zoogdieren veroorzaken (1)(2)(3)(4)(5). Er zijn twee soorten structurele afwijkingen: het chromosoomtype en het chromatidetype. De meeste chemische mutagenen veroorzaken afwijkingen van het chromatidetype, maar ook het chromosoomtype komt voor. Deze methode is niet bedoeld om numerieke afwijkingen te meten en wordt meestal niet voor dat doel gebruikt. Chromosoommutaties en soortgelijke voorvallen veroorzaken veel genetische ziekten bij de mens.
Bij deze test wordt gemeten wat er met de chromosomen van bepaalde kiemcellen (spermatogonia) gebeurt en op grond van het resultaat zullen wellicht voorspellingen kunnen worden gedaan over de inductie van erfelijke mutaties in kiemcellen.
Voor deze test worden meestal knaagdieren gebruikt. Het is een in vivo cytogenetische test waarbij chromosoomafwijkingen worden gedetecteerd die zich voordoen bij mitose van spermatogonia. De methode is niet geschikt voor andere doelweefsels.
Om afwijkingen van het chromatidetype in spermatogonia te detecteren, wordt de eerste mitose na de behandeling onderzocht, voordat deze beschadigingen bij latere celdelingen verloren gaan. Aanvullende informatie van behandelde spermatogoniastamcellen kan worden verkregen door de chromosomen bij de meiose te analyseren op afwijkingen van het chromosoomtype tijdens de diakinese-metafase I, wanneer de behandelde cellen spermatocyten worden.
Deze in-vivotest is bedoeld om na te gaan of mutagenen voor somatische cellen ook in kiemcellen mutageen zijn. Daarnaast is de test met spermatogonia geschikt om het gevaar van mutagene effecten te evalueren, aangezien rekening kan worden gehouden met factoren die samenhangen met het metabolisme in vivo, de farmacokinetiek en de DNA-herstelsynthese.
De testis bevat een aantal generaties spermalogonia met een uiteenlopende gevoeligheid voor chemische stoffen. De geconstateerde afwijkingen vertegenwoordigen dan ook een gecombineerde respons van de behandelde spermatogoniacelpopulaties, waarbij de in grotere aantallen voorkomende gedifferentieerde spermatogonia overheersen. Afhankelijk van hun plaats binnen de testis kunnen verschillende generaties spermatogonia vanwege de fysische en fysiologische barrière van de cellen van Sertoli en de bloed-testisbarrière al dan niet via de grote bloedsomloop bereikbaar zijn.
Als er aanwijzingen zijn dat de teststof of een reactieve metaboliet daarvan niet in het doelweefsel terechtkomt, is deze test niet geschikt.
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Afwijking van het chromatidetype: structurele chromosoombeschadiging waarbij breuken in individuele chromatiden ontstaan, eventueel gevolgd door recombinatie.
Afwijking van het chromosoomtype: structurele chromosoombeschadiging waarbij breuken in beide chromatiden op dezelfde plaats ontstaan, eventueel gevolgd door recombinatie.
Hiaat: een achromatische beschadiging die kleiner is dan de breedte van één chromatide en waarbij de fout in de uitlijning van de chromatiden minimaal is.
Numerieke afwijking: een verandering in het aantal chromosomen ten opzichte van het normale aantal dat kenmerkend is voor de gebruikte dieren.
Polyploïdie: het voorkomen van een ander veelvoud van het haploïde aantal chromosomen (n) dan het diploïde aantal (d.w.z. 3n, 4n, enz.).
Structurele afwijking: een verandering in de chromosoomstructuur die bij microscopisch onderzoek tijdens de metafase van de celdeling kan worden waargenomen in de vorm van deleties, fragmenten en intra- of interchromosomale uitwisselingen.
1.3. PRINCIPE VAN DE TESTMETHODE
De dieren worden langs een geschikte weg aan de teststof blootgesteld en op geschikte tijdstippen na de behandeling gedood. Voordat de dieren worden gedood, worden ze behandeld met een metafasestopper (bv. colchicine of ColcemidR). Vervolgens worden chromosoompreparaten van de kiemcellen gemaakt, die worden gekleurd; de cellen in de metafase worden geanalyseerd op chromosoomafwijkingen.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding
1.4.1.1. Keuze van de diersoort
Meestal worden mannetjes van Chinese hamsters of muizen gebruikt. Ook mannetjes van andere geschikte zoogdiersoorten komen echter in aanmerking. Er dient gebruik te worden gemaakt van jonge gezonde vowassen dieren van in het laboratorium gangbare stammen. Bij het begin van de studie moet het gewichtsver-schil tussen de dieren zo klein mogelijk zijn en mag dit maximaal ± 20 % van het gemiddelde gewicht bedragen.
1.4.1.2. Huisvesting en voeding
De in de algemene inleiding van deel B genoemde algemene omstandigheden worden aangehouden, maar voor de luchtvochtigheid wordt gestreeld naar 50-60 %.
1.4.1.3. Voorbereiding van de dieren.
Gezonde jonge volwassen mannetjes worden aselect ingedeeld in de behandelde en controlegroepen. De kooien moeten zodanig worden geplaatst dat mogelijke effecten daarvan tot een minimum worden beperkt. De dieren krijgen een unieke identificatie. Ze krijgen minimaal vijf dagen de tijd om in het laboratorium te acclimatiseren voordat de test begint.
1.4.1.4. Bereiding van de doseringen
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de toediening aan de dieren worden verdund. Vloeibare teststoffen kunnen rechtstreeks worden toegediend of vóór de toediening worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen van de teststof worden gebruikt.
1.4.2. Testomstandigheden
1.4.2.1. Oplosmiddel/Medium
Het oplosmiddel/medium mag bij de gebruikte dosisniveaus geen toxische effecten veroorzaken en chemische reacties met de teststof moeten uitgesloten zijn. Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten gegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt.
1.4.2.2. Controles
Bij elk experiment moeten tegelijkertijd positieve en negatieve (oplosmiddel/medium) controles worden uitgevoerd. Afgezien van de behandeling met de teststof moeten de dieren in de controlegroepen op identieke wijze worden behandeld als de dieren in de andere groepen.
Voor de positieve controles moet een stof worden gebruikt die in vivo structurele chromosoomafwijkingen in spermatogonia veroorzaakt bij toediening op een blootstellingsniveau waarbij een detecteerbare stijging ten opzichte van het achtergrondniveau kan worden verwacht.
De doseringen van de positieve controles moeten zodanig worden gekozen dat de effecten duidelijk zijn maar de gecodeerde objectglaasjes niet onmiddellijk als zodanig herkenbaar zijn. Het is aanvaardbaar de positieve controle langs een andere weg toe te dienen dan de teststof en slechts op één tijdstip te bemonsteren. Tevens kan waar mogelijk het gebruik van stoffen uit een verwante chemische klasse als positieve controle worden overwogen. Als positieve controle kunnen bijvoorbeeld worden gebruikt:
|
Stof |
CAS-nr. |
Einecs-nr. |
|
Cyclofosfamide Cyclofosfamide monohydraat |
50-18-0 6055-19-2 |
200-015-4 |
|
Cyclohexylamine |
108-91-8 |
203-629-0 |
|
Mitomycine C |
50-07-7 |
200-008-6 |
|
Acrylamide-monomeer |
79-06-1 |
201-173-7 |
|
Triethyleenmelamine |
51-18-3 |
200-083-5 |
Voor elk bemonsteringstijdstip dienen negatieve controles in het experiment te worden opgenomen, waaraan uitsluitend het oplosmiddel of het medium wordt toegediend en die verder op dezelfde manier als de andere groepen worden behandeld, tenzij uit in het verleden uitgevoerde controles aanvaardbare gegevens beschikbaar zijn over de spreiding over de dieren en de frequentie van cellen met chromosoomafwijkingen. Daarnaast moeten er ook onbehandelde controles worden gebruikt, tenzij in het verleden of in de literatuur reeds is aangetoond dat het gekozen oplosmiddel of medium geen schadelijke of mutagene effecten veroorzaakt.
1.5. UITVOERING
1.5.1. Aantal dieren
Elke behandelde en controlegroep moet minimaal vijf analyseerbare mannetjes bevatten.
1.5.2. Behandelingsschema
De teststof wordt bij voorkeur een of twee keer (d.w.z. als één of twee behandelingen) toegediend. De dosis kan eventueel worden gesplitst, waarbij de twee porties op dezelfde dag met een interval van niet meer dan enkele uren worden toegediend, om de toediening van een groot volume te vergemakkelijken. Voor een ander doseringsschema moet een wetenschappelijke motivering worden gegeven.
In de hoogste doseringsgroep worden twee bemonsteringstijdstippen na de behandeling gebruikt. Aangezien de kinetiek van de celcyclus door de teststof kan worden beïnvloed, wordt er één vroeg en één laat bemonsteringstijdstip gebruikt rond 24 en 48 uur na de behandeling. Voor andere doses dan de hoogste dosering moet een bemonsteringstijdstip op 24 uur of 1,5-maal de lengte van de celcyclus na de behandeling worden gekozen, tenzij bekend is dat een ander bemonsteringstijdstip geschikter is voor de detectie van effecten (6).
Daarnaast kunnen ook andere bemonsteringstijdstippen worden gebruikt. Een vroeger bemonsteringstijdstip zal bijvoorbeeld wellicht beter zijn bij stoffen die tot achterblijvende chromosomen kunnen leiden of S-onafhankelijke effecten kunnen hebben (1).
Per geval moet worden onderzocht of een schema voor herhaalde behandeling nodig is. Na herhaalde behandeling worden de dieren 24 uur (1,5-maal de lengte van de celcyclus) na de laatste behandeling gedood. Waar mogelijk kunnen aanvullende bemonsteringstijdstippen worden gebruikt.
Voordat de dieren worden gedood, worden ze intraperitoneaal geïnjecteerd met een adequate dosis metafase-stopper (bv. ColcemidR of colchicine). De dieren worden na een adequate wachttijd bemonsterd. Voor muizen moet er ongeveer drie tot vijf uur worden gewacht en voor Chinese hamsters ongeveer vier tot vijf uur.
1.5.3. Dosisniveaus
Als er een oriënterend onderzoek wordt uitgevoerd omdat er geen bruikbare gegevens over de dosering beschikbaar zijn, moet dit in hetzelfde laboratorium gebeuren met dezelfde soort, dezelfde stam en hetzelfde behandelingsschema als bij het hoofdonderzoek (7). Als er sprake is van toxiciteit, worden er voor het eerste bemonsteringstijdstip drie dosisniveaus gebruikt. Deze dosisniveaus moeten een interval van de maximale tot geen of vrijwel geen toxiciteit bestrijken. Op het latere bemonsteringstijdstip behoeft alleen de hoogste dosis te worden gebruikt. De hoogste dosis wordt gedefinieerd als de dosis die zodanige toxiciteitsverschijnselen veroorzaakt dat er bij hogere doses met hetzelfde doseringsschema waarschijnlijk sterfte zal optreden.
Stoffen met een specifieke biologische activiteit bij lage niet-toxische doses (zoals hormonen en mitogenen) kunnen een uitzondering vormen op deze criteria om de dosering te bepalen en moeten per geval worden beoordeeld. De hoogste dosis kan ook worden gedefinieerd als een dosis die enigerlei aanwijzing van toxiciteit voor de spermatogonia oplevert (bv. een daling van de verhouding tussen cellen in spermatogniamitose en eerste en tweede meiosemetafase: deze daling mag niet groter zijn dan 50 %).
1.5.4. Limiettest
Als een test met één dosis minimaal 2 000 mg/kg lichaamsgewicht/dag, in één keer of in twee porties op dezelfde dag toegediend, geen waarneembare toxische effecten veroorzaakt en op basis van gegevens over stoffen met een verwante structuur geen genotoxiciteit te verwachten valt, zal het wellicht niet nodig zijn een volledig onderzoek met drie dosisniveaus uit te voeren. Op grond van gegevens omtrent de verwachte blootstelling van de mens kan het gebruik van een hoger dosisniveau bij de limiettest nodig worden geacht.
1.5.5. Toediening van de doses
De teststof wordt meestal met behulp van een maagsonde of een geschikte intubatiecanule of door intraperi-toneale injectie toegediend. Ook andere toedieningswegen kunnen aanvaardbaar zijn, als daarvoor een motivering kan worden gegeven. Het maximale volume vloeistof dat in één keer met een sonde of injectie kan worden toegediend, is afhankelijk van de grootte van het proefdier. Het volume mag niet groter zijn dan 2 ml/100 g lichaamsgewicht. Voor het gebruik van grotere volumes moet een motivering worden gegeven. Behalve bij prikkelende of bijtende stoffen, die in hogere concentraties meestal heviger effecten veroorzaken, moeten volumeverschillen tot een minimum worden beperkt door de concentratie aan te passen, zodat op alle dosisniveaus hetzelfde volume kan worden gebruikt.
1.5.6. Chromosoompreparaten
Onmiddellijk nadat het dier is gedood worden suspensies gemaakt van cellen uit één testis of beide testes en worden deze in een hypotone oplossing gebracht en gefixeerd. De cellen worden vervolgens op objectglaasjes uitgesmeerd en gekleurd.
1.5.7. Analyse
Voor elk dier worden minimaal 100 goed gespreide metafases geanalyseerd (d.w.z. ten minste 500 metafases per groep). Wanneer een groot aantal afwijkingen wordt geconstateerd, kan dit aantal worden verlaagd. Alle objectglaasjes, ook die van de positieve en negatieve controles, worden vóór de microscopische analyse onafhankelijk gecodeerd. Aangezien bij de fixatieprocedures vaak een gedeelte van de metafasecellen breekt, waarbij chromosomen verloren gaan, moeten de gescoorde cellen 2n ± 2 centromeren bevatten.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens moeten voor elk dier in tabelvorm worden verstrekt. De eenheid bij dit experiment is het dier. Voor elk dier apart moet het aantal cellen met structurele chromosoomafwijkingen en het aantal chromosoomafwijkingen per cel worden bepaald. Er moet een overzicht worden gegeven van de verschillende soorten structurele chromosoomafwijkingen met de aantallen en de frequentie waarmee ze in de behandelde en controlegroepen voorkomen. Hiaten worden apart geregistreerd en gerapporteerd maar meestal niet in de totale frequentie van de afwijkingen opgenomen.
Als zowel mitose als meiose wordt geobserveerd, wordt als maat voor de cytotoxiciteit bij alle behandelde dieren en negatieve controles in een monster van in totaal 100 delende cellen per dier de verhouding tussen cellen in spermatogoniamitose en eerste en tweede meiosemetafase bepaald om een mogelijk cytotoxisch effect vast te stellen. Als alleen de mitose wordt geobserveerd, moet in ten minste 1 000 cellen voor elk dier de mitotische index worden bepaald.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Er zijn verschillende criteria om tot een positief resultaat te besluiten, zoals een dosisafhankelijke stijging van het relatieve aantal cellen met chromosoomafwijkingen of een duidelijke stijging van het aantal cellen met afwijkingen bij één dosis en één bemonsteringstijd. In eerste instantie moet naar de biologische relevantie van de resultaten worden gekeken. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt (8). Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn. Bij onduidelijke resultaten moet nader onderzoek worden gedaan, bij voorkeur onder gewijzigde experimentele omstandigheden.
Indien de resultaten voor een teststof niet aan bovenstaande criteria voldoen, wordt de stof bij deze test als niet-mutageen beschouwd.
Hoewel de meeste experimenten duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststof in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt herhaald, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de in-vivotest op chromosoomafwijkingen in spermatogonia wijzen erop dat de teststof in de kiemcellen van de geteste soort structurele chromosoomafwijkingen induceert. Negatieve resultaten wijzen erop dat de stof onder de testomstandigheden in de kiemcellen van de geteste soort geen chromosoomafwijkingen induceert.
De waarschijnlijkheid dat de teststof of de metabolieten daarvan in het doelweefsel terechtkomen, dient te worden besproken.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Adler, L.D., (1986). Clastogenic Potential in Mouse Spcrmatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications. In: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C., Lambert, B. and Magnusson, J. (eds) Liss, New York, pp. 477-484. |
|
(2) |
Adler, I.D., (1984). Cytogenetic tests in Mammals. In: Mutagenicity Testing: a Practical Approach. Ed. S. Venitt and J.M. Parry, IRL Press. Oxford, Washington DC. pp. 275-306. |
|
(3) |
Evans, E.P., Breckon, G. and Ford. C.E. (1964). An Air-drying Method for Meiotic Preparations from Mammalian Testes. Cytogenetics and Cell Genetics, 3. pp. 289-294. |
|
(4) |
Richold, M., Ashby, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990). In Vivo Cytogenetic Assays. In: D.J. Kirkland (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised, Cambridge University Press, Cambridge, New York, Port Chester. Melbourne, Sydney, pp. 115-141. |
|
(5) |
Yamamoto, K. and Kikuchi, Y. (1978). A New Method for Preparation of Mammalian Spermatogonial Chromosomes, Mutation Res. 52. pp. 207-209. |
|
(6) |
Adler, I.D., Shelby M.D., Bootman, J., Favor, J.. Generoso. W., Pacchierotti, F., Shibuya, T. and Tanaka N. (1994). International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests. Mutation Res., 312, pp. 313-318. |
|
(7) |
Fielder, R.J., Allen, J.A., Boobis. A.R., Botham, P.A.. Doe, J.. Esdaile. D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313-319. |
|
(8) |
Lovell, D.P., Anderson. D., Albanese, R., Amphlett. G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays. In: D.J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232. |
B.24. VLEKKENTEST BIJ MUIZEN
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Het betreft een in-vivo-test bij muizen waarbij zich ontwikkelende embryo's worden blootgesteld aan chemische stoffen. De cellen in de zich ontwikkelende embryo's waarop de test is gericht, zijn melanoblasten en de genen waarop de test is gericht, zijn die welke de pigmentering van de vachtharen regelen. De zich ontwikkelende embryo's zijn heterozygoot voor een aantal van deze vachtkleurgenen. Door een mutatie in of verlies van (door een verscheidenheid van genetische gebeurtenissen) het dominant alleel van een dergelijk gen in een melanoblast komt het recessief fenotype in de cellen van de afstammelingen tot uiting, waardoor een vlek met een andere kleur wordt gevormd in de vacht van de volgende generatie muizen. Het aantal nakomelingen met deze vlekken wordt geteld en de frequentie ervan vergeleken met het aantal nakomelingen van embryo's die uitsluitend met het oplosmiddel zijn behandeld. Het wordt verondersteld dat de vlekkentest somatische mutaties in foetale cellen detecteert.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Indien mogelijk worden de teststoffen opgelost of gesuspendeerd in een isotonische zoutoplossing. Niet in water oplosbare chemische stoffen worden opgelost of gesuspendeerd in geschikte (oplos)middelen. Het gebruikte (oplos)middel mag niet interfereren met de teststof en geen toxische effecten veroorzaken. Er dienen verse teststofpreparaten te worden gebruikt.
Muizen van de T-stam (nonagouti, a/a; chinchilla, pink eye, cchp/cchp; brown b/b; dilute, short ear, d se/d se, piebald spotting, s/s) worden gepaard hetzij met de HT-stam (palled, nonagouti, brachypodie, pa a bp/pa a bp; leaden fuzzy, 1n fz/ln fz; pearl pe/pe) of met C57 BL (nonagouti, a/a). Andere mogelijke kruisingen zoals tussen NMRI (nonagouti, a/a; albino, c/c) en DBA (nonagouti, a/a; brown b/b; dilute d/d) kunnen worden gebruikt op voorwaarde dat ze nonagouti-nakomelingen voortbrengen.
Er dient een voldoende aantal drachtige vrouwtjes te worden behandeld om voor elk gebruikt dosisniveau een geschikt aantal overlevende nakomelingen te verkrijgen. De omvang van het monster wordt bepaald door het aantal waargenomen vlekken bij de behandelde muizen en door de omvang van controlegegevens. Een negatief resultaat is alleen aanvaardbaar indien ten minste 300 nakomelingen van met de hoogste dosis behandelde vrouwtjes zijn geteld.
Er dienen parallelle controlegegevens van uitsluitend met het medium (negatieve controle) behandelde muizen beschikbaar te zijn. Controlegegevens uit het verleden van hetzelfde laboratorium kunnen bij elkaar worden genomen teneinde de gevoeligheid van de test te verhogen, op voorwaarde dat ze homogeen zijn. Indien geen mutageniteit van de teststof wordt ontdekt, dienen eveneens positieve controlegegevens beschikbaar te zijn die recent in hetzelfde laboratorium zijn verkregen na behandeling met een stof waarvan bekend is dat zij mutageen is in deze test.
De normale toedieningsweg is orale intubatie of intraperitoneale injectie van de drachtige vrouwtjes. In voorkomend geval kan de behandeling ook via inhalatie of andere toedieningswegen geschieden.
Ten minste twee dosisniveaus waarvan één tekenen van toxiciteit of een kleinere nestgrootte laat zien, worden gebruikt. Voor niet-toxische stoffen dient een blootstelling aan de hoogste dosis die is toe te passen te worden gebruikt.
Uitvoering
Normaliter wordt een enkele behandeling gegeven op dag acht, negen of tien van de dracht waarbij dag één de dag is waarop voor het eerst een vaginale plug wordt aangetroffen. Deze dagen stemmen overeen met 7,25, 8,25 en 9,25 dagen na conceptie. Tijdens deze dagen kunnen ook opeenvolgende behandelingen worden gegeven.
Drie à vier weken na de geboorte worden de nakomelingen gecodeerd en onderzocht op vlekken. Er dient een onderscheid te worden gemaakt tussen drie klassen van vlekken:
|
a) |
witte vlekken op minder dan vijf mm van de mid-ventrale lijn die waarschijnlijk worden veroorzaakt door celsterfte (WMVS), |
|
b) |
gele, agouti-achtige vlekken, in de buurt van mammae, genitalia, keel, oksels en nierstreek en op het midden van het voorhoofd waarvan verondersteld wordt dat zij worden veroorzaakt door misdifferentiatie (MDS), en |
|
c) |
willekeurig op de vacht verspreide gepigmenteerde en witte vlekken waarvan verondersteld wordt dat zij worden veroorzaakt door somatische mutaties (RS). |
Alle drie klassen moeten worden geteld maar alleen de laatste, RS, heeft een genetisch belang. Moeilijkheden met betrekking tot het onderscheid tussen MDS en RS kunnen worden opgelost door haarmonsters te onderzoeken met de fluorescentiemicroscoop.
Duidelijke macromorfologische abnormaliteiten bij de nakomelingen moeten worden vastgelegd.
2. GEGEVENS
De gegevens worden weergegeven als het totaal aantal getelde nakomelingen en het aantal met een of meer vermoedelijke somatische mutatievlekken. Gegevens van de behandelde en negatieve controlegroep worden met behulp van een geschikte statistische methode vergeleken. De gegevens worden ook per nest weergegeven.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag van de proef dienen de volgende gegevens te worden vermeld:
|
— |
de voor de kruising gebruikte stam; |
|
— |
aantal drachtige vrouwtjes in de experimentele en de controlegroep; |
|
— |
gemiddelde nestgrootte in de experimentele en controlegroepen bij de geboorte en bij het spenen; |
|
— |
dosisniveau(s) van de teststof; |
|
— |
gebruikt oplosmiddel; |
|
— |
dag van de dracht waarop de behandeling is gegeven; |
|
— |
toedieningsweg; |
|
— |
totaal aantal nakomelingen en het aantal met WMVS, MDS en RS in de experimentele en de controlegroepen; |
|
— |
macromorfologische abnormaliteiten; |
|
— |
dosis-responsverhouding van RS (waar dat van toepassing is); |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.25. ERFELIJKE TRANSLOCATIE BIJ DE MUIS
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIE
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Met de erfelijke translocatietest bij de muis worden structurele en numerieke wijzigingen in de geslachtscelchromosomen van zoogdieren gedetecteerd wanneer zij voorkomen in het nageslacht van de eerste generatie. De soorten chromosoomwijzigingen die gedetecteerd worden, zijn reciproke translocaties en indien het vrouwelijk nageslacht wordt meegerekend, verlies van het X-chromosoom. Dragers van translocaties en XO-vrouwtjes vertonen een verminderde vruchtbaarheid die wordt gebruikt voor de selectie van het F1-nageslacht met het oog op een cytogenetische analyse. Volledige steriliteit wordt veroorzaakt door bepaalde soorten translocaties (X-autosoom en c-t). Translocaties worden cytogenetisch vastgesteld in meiotische cellen in de diakinesemetafase I van mannelijke dieren, hetzij F1-mannetjes hetzij mannelijk nageslacht van F1-vrouwtjes. De XO-vrouwtjes zijn cytogenetisch bepaald door de aanwezigheid van slechts 39 chromosomen in beenmergmitoses.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereiding
De teststoffen worden opgelost in een isotonische zoutoplossing. Onoplosbare stoffen worden opgelost of gesuspendeerd in geschikte (oplos)middelen. Er dienen vers bereide oplossingen van de testverbinding te worden gebruikt. Indien een (oplos)middel wordt gebruikt om het toedienen te vergemakkelijken, mag deze niet interfereren met de teststof en geen toxische effecten veroorzaken.
De normale toedieningswegen zijn orale intubatie of intraperitoneale injectie. Ook andere toedieningswegen kunnen geschikt zijn.
Deze proef wordt verricht met muizen die gemakkelijk zijn te kweken en cytologisch te analyseren. Er is geen specifieke stam vereist. De gemiddelde nestgrootte bij de stam moet echter groter zijn dan acht en relatief constant.
Er worden gezonde geslachtsrijpe dieren gebruikt.
Het vereiste aantal dieren wordt bepaald door de spontane translocatiefrequentie en het voor een positief resultaat vereiste minimale inductieniveau.
De proef wordt gewoonlijk uitgevoerd door analyse van het mannelijke F1-nageslacht. Per dosisgroep dienen ten minste 500 mannelijke F1-nakomelingen te worden onderzocht. Indien ook vrouwelijke F1-nakomelingen bij het onderzoek worden betrokken, zijn 300 mannetjes en 300 vrouwtjes vereist.
Geschikte controlegegevens, afkomstig van parallelle en historische controles, dienen beschikbaar te zijn. Indien aanvaardbare positieve controlegegevens beschikbaar zijn van experimenten die recent in hetzelfde laboratorium zijn uitgevoerd, kunnen deze resultaten gebruikt worden in plaats van een parallelle positieve controle.
Een dosisniveau wordt getest, gewoonlijk de hoogste dosis waarbij een minimaal toxisch effect wordt veroorzaakt zonder dat het reproductiegedrag of de overleving wordt beïnvloed. Om de dosis-responsverhouding vast te stellen, zijn nog twee lagere doses vereist. Voor niet-toxische stoffen dient blootstelling aan de hoogste dosis die is toe te passen te worden gebruikt.
Uitvoering
Er zijn twee behandelingsschema's beschikbaar. Een enkele toediening van de teststof wordt het meest gebruikt. Ook kan de teststof zeven dagen per week gedurende 35 dagen worden toegediend. Het aantal paringen na de behandeling wordt bepaald door het behandelingsschema en dient voldoende groot te zijn om alle celstadia van de behandelde geslachtscellen te bemonsteren. Na de paringsperiode worden de vrouwtjes in afzonderlijke kooien ondergebracht. Bij de geboorte worden de datum, de nestgrootte en het geslacht van de nakomelingen geregistreerd. Alle mannelijke nakomelingen worden gespeend en de vrouwelijke nakomelingen worden niet gebruikt, tenzij ze worden meegenomen in de proef.
Een van de volgende twee methoden wordt gebruikt:
|
— |
vruchtbaarheidsonderzoek van het F1-nageslacht gevolgd door onderzoek van eventuele translocatiedragers door middel van een cytogenetische analyse. |
|
— |
Cytogenetische analyse van alle mannelijke F1-nakomelingen zonder voorafgaande selectie op basis van een vruchtbaarheidsonderzoek. |
|
a) |
Vruchtbaarheidsonderzoek Verminderde vruchtbaarheid van een F1-individu kan worden vastgesteld door observatie van de nestgrootte en/of analyse van de uterusinhoud van vrouwelijke dieren. Er dienen criteria te worden vastgelegd voor het bepalen van normale en verminderde vruchtbaarheid van de gebruikte muizenstam. Observatie van de nestgrootte: De te testen F1-mannetjes worden in afzonderlijke kooien geplaatst met vrouwtjes van dezelfde proef of van de kolonie. De kooien worden dagelijks gecontroleerd vanaf de achttiende dag na de paring. Bij de geboorte worden de nestgrootte en het geslacht van de F2-nakomelingen geregistreerd; hierna worden de nesten niet meer gebruikt. Indien vrouwelijke F1-nakomelingen worden onderzocht, worden de F2-nakomelingen uit kleine nesten voor verder onderzoek behouden. Vrouwelijke translocatiedragers worden opgespoord door cytogenetische analyse van een translocatie in een van de mannelijke nakomelingen. XO-vrouwtjes kunnen worden herkend door een verandering in de geslachtsverhouding van de nakomelingen van 1:1 naar 1:2 mannetjes/vrouwtjes. Bij een sequentiële methode worden normale F1-dieren niet verder onderzocht indien het eerste F2-nest een vooraf bepaalde normaalwaarde bereikt of overschrijdt; indien dit niet zo is, wordt een tweede of derde F2-nest onderzocht. F1-dieren die niet als normaal kunnen worden geclassificeerd na observatie van maximaal drie F2-nesten, worden hetzij verder onderzocht door analyse van de uterusinhoud van vrouwelijke dieren hetzij rechtstreeks onderworpen aan een cytogenetische analyse. Analyse van de uterusinhoud; De kleinere nestgrootte bij translocatiedragers is een gevolg van de dood van embryo's en dus wijst een hoog aantal dode implantaten op de aanwezigheid van een translocatie in het onderzochte dier. Men laat de te testen F1-mannetjes elk met twee tot drie vrouwtjes paren. De bevruchting kan worden vastgesteld door middel van een dagelijkse controle op vaginale plugs in de morgen. Veertien tot zestien dagen later worden de vrouwtjes gedood en wordt het aantal levende en dode implantaten in de uteri geregistreerd. |
|
b) |
Cytogenetische analyse Testespreparaten worden bereid door droging aan de lucht. Translocatiedragers worden opgespoord op grond van de aanwezigheid van multivalente configuraties tijdens de diakinesemetafase I in primaire spermatocyten. Indien ten minste twee cellen met multivalente associaties kunnen worden waargenomen, vormt dit een bewijs dat het onderzochte dier een translocatiedrager is. Indien voor het kweken geen selectie is gemaakt, worden alle F1-mannetjes cytogenetisch onderzocht. Per mannetje dienen ten minste 25 diakinesemetafasen I microscopisch te worden onderzocht. Voor F1-mannetjes met kleine testes en meiotische afbraak vóór de diakinese of voor F1-vrouwtjes waarbij XO wordt vermoed, is een onderzoek van de mitotische metafasen, de spermatogonia of het beenmerg noodzakelijk. De aanwezigheid van een ongewoon lang en/of kort chromosoom in tien afzonderlijke cellen is een bewijs voor een bepaalde mannelijke steriele translocatie (c-t type). Sommige mannelijke steriliteit veroorzakende X-autosoomtranslocaties kunnen uitsluitend aan de hand van analyse van de bandering van de mitotische chromosomen worden vastgesteld. De aanwezigheid van 39 chromosomen in alle tien mitoses geldt als bewijs voor een XO-toestand bij een vrouwtje. |
2. GEGEVENS
De gegevens worden in tabellarische vorm gepresenteerd.
Voor elke paringsinterval worden de gemiddelde nestgrootte en de geslachtsverhouding bij de geboorte en bij het spenen vermeld voor de paring van de ouders.
Voor vruchtbaarheidsonderzoek van F1-dieren worden de gemiddelde nestgrootten van alle normale paringen en de afzonderlijke nestgrootte voor F1-translocatiedragers gegeven. Voor de analyse van de uterusinhoud wordt het gemiddelde aantal levende en dode implantaten na normale paring en het individuele aantal levende en dode implantaten voor elke paring van F1-translocatiedragers vermeld.
Bij cytogenetische analyse van de diakinesemetafase I worden voor elke translocatiedrager het aantal soorten multivalente configuraties en het totaal aantal cellen genoteerd.
Voor steriele F1-dieren wordt het totaal aantal paringen en de duur van de paartijd vermeld. Het gewicht van de testes en gegevens van de cytogenetische analyse worden opgegeven.
Voor XO-vrouwtjes dienen de gemiddelde nestgrootte, geslachtsverhouding van F1-nakomelingen en resultaten van de cytogenetische analyse te worden vermeld.
Indien mogelijke F1-translocatiedragers vooraf geselecteerd zijn op basis van vruchtbaarheidsonderzoekingen, dienen de tabellen te vermelden hoeveel ervan bevestigde translocatieheterozygoten waren.
De gegevens van negatieve en positieve controleproeven worden op dezelfde manier voorgesteld.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
In het verslag van de proef moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
gebruikte stam, leeftijd van de dieren, gewicht van behandelde dieren; |
|
— |
aantal ouderdieren van elk geslacht in experimentele en controlegroepen; |
|
— |
proefomstandigheden, gedetailleerde beschrijving van de behandeling, dosisniveaus, oplosmiddelen, paringsschema; |
|
— |
aantal en geslacht van de nakomelingen per vrouwtje, aantal en geslacht van voor translocatieanalyse gekweekte nakomelingen; |
|
— |
tijdstip en criteria voor de translocatieanalyse; |
|
— |
aantal en nauwkeurige beschrijving van translocatiedragers, inclusief gegevens over het kweken en de uterusinhoud (wanneer dat van toepassing is); |
|
— |
cytogenetische methoden en resultaten van de microscopische analyse, bij voorkeur met foto's; |
|
— |
statistische evaluatie; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.26. SUBCHRONISCHE ORALE TOXICITEITSTEST TOXICITEITSONDERZOEK (ORAAL) OP KNAAGDIEREN BIJ HERHAALDE TOEDIENING (90 DAGEN)
1. METHODE
De methode die voor deze subchronische orale toxiciteitstest wordt gebruikt, is een kopie van de OECD TG 408 (1998).
1.1. INLEIDING
Bij de bepaling en evaluatie van de toxische eigenschappen van een chemische stof moet aan de hand van acute-toxiciteitstests of toxiciteitstests met herhaalde toediening (28 dagen) eerste informatie over de toxiciteit worden verkregen. Daarna kan de subchronische orale toxiciteit door middel van herhaalde toediening worden bepaald. Het onderzoek van 90 dagen levert informatie op over de mogelijke gevaren voor de gezondheid die kunnen voortvloeien uit herhaalde langdurige blootstelling vanaf de tijd na het spenen en de groeitijd tot aan de volgroeidheid. Het onderzoek zal informatie opleveren over de belangrijkste toxische effecten, er zullen organen die beschadigd kunnen worden en de mogelijkheid van accumulatie worden aangegeven, en er kan een inschatting worden gemaakt van een blootstellingsniveau zonder schadelijk effect, dat kan worden gebruikt bij de keuze van dosisniveaus voor chronische onderzoeken en voor de vaststelling van veiligheidscriteria voor de blootstelling van de mens.
De methode legt extra nadruk op de neurologische eindpunten en geeft een indicatie van de immunologische effecten en de effecten voor de voortplantingsorganen. Bovendien wordt benadrukt dat het van groot belang is de dieren klinisch zorgvuldig te observeren, om zoveel mogelijk informatie te verkrijgen. Met dit onderzoek moeten chemische stollen geïdentificeerd kunnen worden die neurotoxische of immunologische effecten kunnen hebben of die schadelijk voor de voortplantingsorganen kunnen zijn, waardoor verder diepteonderzoek gerechtvaardigd kan worden.
Zie ook algemene inleiding deel B.
1.2. DEFINITIES
Dosis: is de hoeveelheid teststof die wordt toegediend. De dosis wordt uitgedrukt in gewicht (g, mg) of in het gewicht van de teststof per gewichtseenheid proefdier (bv. mg/kg), of als constante voedingsconcentraties (ppm).
Dosering: is een algemene term die de dosis alsook de frequentie daarvan en de doseringsperiode omvat.
NOAEL: is de afkorting voor het niveau zonder waarneembaar schadelijk effect en is de hoogste dosis waarbij nog geen waarneembare toxiciteitsverschijnselen optreden.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof wordt gedurende een periode van 90 dagen dagelijks oraal toegediend aan verscheidene groepen proefdieren, in geleidelijk stijgende doses. Er wordt één dosis per groep gebruikt. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks geobserveerd om tekenen van toxiciteit te ontdekken. Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het eind van het onderzoek leven, wordt necropsie verricht.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding van de dieren
Voor het onderzoek worden gezonde dieren gebruikt die ten minste vijf dagen onder gelijke huisvestings- en voedingsomstandigheden zijn gehouden als tijdens de test en die niet eerder voor experimenten zijn gebruikt. De proefdieren worden op basis van kenmerken als soort, stam. oorsprong, geslacht, gewicht en/of leeftijd ingedeeld. De dieren worden willekeurig in de controle- en behandelingsgroepen ingedeeld. De kooien worden zodanig neergezet dat mogelijke effecten door de plaatsing daarvan tot een minimum worden beperkt. Elk dier krijgt een uniek identificatienummer.
1.4.2. Voorbereiding van de doses
De teststof kan via een maagsonde, met de voeding of met het drinkwater worden toegediend. De wijze van de orale toediening hangt af van het doel van het onderzoek en van de fysisch-chemische eigenschappen van het restmateriaal.
Waar nodig wordt de teststof in een geschikt medium opgelost of gesuspendeerd. Het verdient aanbeveling om in eerste instantie een oplossing/suspensie in water te overwegen. Als dit niet mogelijk is, kan een oplossing/emulsie in achtereenvolgens plantaardige olie (bv. maïsolie) of een ander medium worden overwogen. Van niet-waterige media moeten de toxische eigenschappen bekend zijn. De stabiliteit van de teststof tijdens de toediening moet worden vastgesteld.
1.4.3. Proefomstandigheden
1.4.3.1. Proefdieren
De voorkeur wordt gegeven aan ratten, maar er kunnen ook andere soorten knaagdieren worden gebruikt, bijvoorbeeld muizen. De proef dient te worden uitgevoerd met stammen van gezonde, jonge volgroeide dieren die gewoonlijk in laboratoria worden gebruikt. De wijfjes moeten nullipaar zijn en niet zwanger. De toediening moet zo snel mogelijk na het spenen beginnen maar in ieder geval voordat de dieren negen weken oud zijn. Per geslacht mag bij het begin van het onderzoek het gewicht van de dieren die worden gebruikt, niet meer dan ±20 % van het gemiddelde gewicht afwijken. Indien het onderzoek wordt uitgevoerd als voorstudie van een langdurig chronische-toxiciteitsonderzoek. moeten dieren van dezelfde stam en oorsprong voor beide onderzoeken worden gebruikt.
1.4.3.2. Aantal en geslacht
Voor ieder dosisniveau moeten ten minste 20 dieren (tien wijfjes en tien mannetjes) worden gebruikt. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal dieren worden verhoogd met het aantal dat tussentijds zal worden gedood. Op basis van de aanwezige kennis van de chemische stof of een stof die daar veel op lijkt, verdient het overweging een extra satellietgroep van tien dieren (vijf per geslacht) op te nemen in de controlegroep en in de groep met het hoogste dosisniveau, om na de behandeling te kunnen nagaan of er sprake is van reversibiliteit of persistentie van eventuele toxische effecten. De duur van deze nabehandelingsperiode moet worden vastgesteld in overeenstemming met de waargenomen effecten.
1.4.3.3. Dosisniveaus
Ten minste drie dosisniveaus en een bijbehorende controle zijn vereist, tenzij een limiettest wordt uitgevoerd (zie 1.4.3.4). De dosisniveaus kunnen gebaseerd zijn op de resultaten van onderzoeken met herhaalde toediening of van verkennende onderzoeken, en er moet rekening worden gehouden met bestaande toxicologische en toxicokinetische gegevens die voor de teststof of aanverwante materialen beschikbaar zijn. Indien er geen beperkingen vanwege de fysisch-chemische aard of de biologische effecten van de teststof zijn, moet het hoogste dosisniveau worden gekozen om toxiciteit te veroorzaken, maar niet de dood of ernstige pijn. Er moet een afnemende reeks dosisniveaus worden gekozen om elke doseringsgerelateerde respons en een niveau zonder schadelijk effect (NOAEL) op het laagste dosisniveau aan te tonen. Doorgaans zijn twee- tot viervoudige intervallen optimaal voor de instelling van de afnemende dosisniveaus, en de toevoeging van een vierde testgroep is vaak te verkiezen boven het gebruik van zeer grote intervallen (bv. meer dan een factor van 6 à 10) tussen twee doseringen.
De controlegroep moet een onbehandelde groep of een mediumcontrolegroep zijn, voorzover een medium wordt gebruikt voor de toediening van de teststof. Afgezien van de behandeling met de teststof moeten de dieren in de controlegroep op dezelfde wijze worden behandeld als die in de testgroep. Indien een medium wordt gebruikt, moet het medium aan de controlegroep in het voor de proef maximaal gebruikte volume worden toegediend. Indien een teststof wordt toegediend via de voeding en een geringere voedingsopname veroorzaakt, kan een paargevoede controlegroep nuttig zijn om onderscheid te maken tussen een vermindering vanwege de eetbaarheid of vanwege toxicologische veranderingen in het testmodel.
Er moet rekening worden gehouden met de navolgende eigenschappen van het medium en andere additieven, naargelang hetgeen van toepassing is: effecten op de absorptie, distributie, metabolisme of retentie van de teststof; effecten op de chemische eigenschappen van de teststof die de toxische karakteristieken daarvan kunnen veranderen; en effecten op het voedsel- of waterverbruik of de voedingsstatus van de dieren.
1.4.3.4. Limiettest
Indien een test bij een dosisniveau van ten minste 1 000 mg/kg lichaamsgewicht/dag en met gebruikmaking van de procedures die voor deze studie worden beschreven, een niveau zonder schadelijk effect oplevert en indien toxiciteit op grond van informatie over qua samenstelling aanverwante stoffen niet te verwachten is, hoeft wellicht niet het uitvoeren van een volledig onderzoek met gebruikmaking van drie doseringsniveaus overwogen te worden. De limiettest moet worden uitgevoerd tenzij het blootstellingsniveau van de mens duidt op de noodzaak een hoger dosisniveau te gebruiken.
1.5. PROCEDURE
1.5.1. Toediening van de doses
De dieren krijgen gedurende een periode van 90 dagen, 7 dagen per week, een dosis van de teststof toegediend. Voor elk ander doseringsinterval, bv. vijf dagen per week, moet een goede reden zijn. Indien de teststof via een maagsonde aan het dier wordt toegediend, moet dit in één enkele dosis gebeuren met gebruikmaking van een maagbuisje of een geschikte intubatiecanule. De maximale hoeveelheid vloeistof die in één keer kan worden toegediend, is afhankelijk van de grootte van het proefdier. Het maximale volume dat voor de proef wordt gebruikt, mag niet groter zijn dan 1 ml/100 g lichaamsgewicht, behalve bij oplossingen in water, waarvan het volume maximaal 2 ml/100 g lichaamsgewicht mag bedragen. Afgezien van irriterende of bijtende stoffen die normaliter bij hogere concentraties ergere effecten vertonen, moet de variabiliteit in het voor de proef gebruikte volume zo klein mogelijk worden gehouden door de concentratie zodanig aan te passen dat bij alle dosisniveaus een constant volume wordt gewaarborgd.
Wanneer stoffen met de voeding of het drinkwater worden toegediend, moet erop worden toegezien dat de hoeveelheden van de teststof niet interfereren met de normale voedings- of waterbalans. Indien de teststof met de voeding wordt toegediend, kan een constante voedingsconcentratie (ppm) of een constant dosisniveau als functie van het lichaamsgewicht van de dieren worden gebruikt; de gekozen methode moet worden gespecificeerd. Indien de stof via een maagsonde wordt toegediend, moeten de doses dagelijks op vaste tijdstippen worden gegeven. De doses moeten geregeld worden aangepast om een constant dosisniveau als functie van het lichaamsgewicht van het dier te verkrijgen. Indien een onderzoek gedurende een periode van 90 dagen wordt gebruikt als voorstudie van een langdurig chronisch toxiciteitsonderzoek, moet in beide onderzoeken dezelfde voeding worden gebruikt.
1.5.2. Waarnemingen
De observatieperiode moet ten minste 90 dagen duren. Dieren in satellietgroepen voor latere waarnemingen moeten nog gedurende een gepaste periode zonder behandeling worden gehouden om herstel of voortduren van de toxische effecten te kunnen vaststellen.
De proefdieren moeten ten minste eenmaal per dag worden geobserveerd, bij voorkeur op hetzelfde tijdstip, waarbij rekening moet worden gehouden met de piekperiode van verwachte effecten na de toediening van de dosis. De klinische conditie van de dieren moet geregistreerd worden. Ten minste tweemaal per dag, normaliter aan het begin en eind van elke dag, moeten alle dieren worden onderzocht op tekenen van ziekelijkheid of sterfte.
Ten minste eenmaal vóór de eerste blootstelling (om vergelijkingen op hetzelfde gebied te kunnen trekken) en eenmalig een week daarna moeten alle dieren aan een uitgebreid klinisch onderzoek worden onderworpen. De dieren moeten buiten hun kooi worden geobserveerd, bij voorkeur telkens in een standaardgebied en op hetzelfde tijdstip. De gegevens moeten zorgvuldig geregistreerd worden, bij voorkeur met behulp van scoringssystemen die door het proeflaboratorium expliciet zijn gedefinieerd. Er moet getracht worden verschillen in de observatiecondities tot een minimum te beperken. Er dient onder meer te worden gelet op veranderingen van huid en vacht, ogen en slijmvliezen, her voorkomen van secreties en excreties, en autonome activiteiten (bv. tranenvloed, pilo-erectie, pupilgrootte, abnormaal ademhalingspatroon). Ook veranderingen in de manier van lopen, de houding en de reactie op de behandeling alsmede de aanwezigheid van klonische of tonische bewegingen, stereotypen (bv. abnormaal poetsgedrag, blijven ronddraaien) of bizar gedrag (bv. zelfverminking, achteruit lopen) moeten geregistreerd worden (1).
Vóór de toediening van de teststof en na beëindiging van het onderzoek wordt een oftalmologisch onderzoek uitgevoerd, waarbij gebruik wordt gemaakt van een oftalmoscoop of een even geschikt apparaat. Dit onderzoek wordt bij voorkeur op alle dieren verricht, maar ten minste op die in de groepen met het hoge dosisniveau en in de controlegroepen. Wanneer oogafwijkingen worden vastgesteld, moeten alle dieren worden onderzocht.
Tegen het einde van de blootstellingsperiode maar in geen geval vóór de elfde week moeten onderzoeken naar de sensorische reacties op verschillende soorten stimuli (1) (bv. auditieve, visuele en proprioceptieve stimuli) (2), (3), (4), alsmede een bepaling van de grijpkracht (5) en van de motorische activiteit (6) worden verricht. Meer informatie over de procedures die kunnen worden gevolgd, is te vinden in de desbetreffende literatuur. Er kunnen evenwel ook andere dan de genoemde procedures worden toegepast.
De uitvoering van functionele waarnemingen tegen het eind van het onderzoek kan achterwege worden gelaten indien andere onderzoeken al gegevens over functionele waarnemingen hebben opgeleverd en uit de dagelijkse klinische waarnemingen geen functionele gebreken zijn gebleken.
In uitzonderingsgevallen kunnen functionele waarnemingen ook achterwege worden gelaten bij groepen die anders tekenen van toxiciteit vertonen in een mate die aanzienlijk zou interfereren met de uitvoering van de functionele test.
1.5.2.1. Lichaamsgewicht en voedsel-/waterverbruik
Alle dieren moeten ten minste eenmaal per week worden gewogen. Ook het voedselverbruik moet ten minste wekelijks worden gemeten. Indien de teststof met het drinkwater wordt toegediend, moet ook het waterverbruik ten minste wekelijks worden gemeten. Het meten van het waterverbruik kan ook worden overwogen bij voedsel- of maagsondeonderzoeken, gedurende welke de drinkactiviteit kan veranderen.
1.5.2.2. Hematologie en klinisch-biochemische bepalingen
Van een bepaalde plek moeten bloedmonsters worden genomen die, voorzover van toepassing, onder gepaste omstandigheden bewaard moeten worden. Aan het einde van de testperiode moeten de monsters worden genomen vlak vóór het doden van de dieren of als onderdeel van de dodingsprocedure.
Aan het einde van de testperiode en indien tussentijds bloedmonsters zijn genomen, moeten de volgende hematologische onderzoeken worden venijn: bepaling van het hematocriet en het hemoglobinegehalte, erythrocytentelling, totale en gedifferentieerde telling van de leukocyten, telling van de bloedplaatjes en meting van een maat voor het stollingsvermogen.
Klinisch-biochemische bepalingen die bedoeld zijn om wezenlijke toxische effecten in weefsels en met name effecten op de nier en lever te onderzoeken, moeten worden verricht op de bloedmonsters die van elk dier zijn genomen vlak vóór het doden daarvan of als onderdeel van de dodingsprocedure (afgezien van stervende en/of tussentijds gedode dieren). Op dezelfde wijze als bij de hematologische onderzoeken kunnen tussentijds bloedmonsters worden genomen ten behoeve van klinisch-biochemische tests. Het is aan te bevelen in de nacht voordat de bloedmonsters worden genomen de dieren voedsel te onthouden (3). Bepalingen in plasma of serum moeten het volgende omvatten: natrium, kalium, glucose, totaal cholesterol, ureum, bloedureum. stikstof, creatinine, totaal eiweit en albumine, en meer dan twee enzymen die symptomatisch zijn voor hepatocellulaire effecten (zoals alanineaminotransferase. aspartaataminotransferase, alkalinefosfatase, gammaglutamyl-transpeptidase en sorbitoldehydrogenase). Er kunnen ook metingen worden verricht van extra enzymen (van hepatische of andere oorsprong) en galzuren, die onder bepaalde omstandigheden nuttige informatie kunnen opleveren.
Als optie kunnen tijdens de laatste week van het onderzoek de volgende urineonderzoeken worden verricht, waarbij op regelmatige tijdstippen urinemonsters moeten worden genomen: uitzien, volume, osmolaliteit of relatieve dichtheid, pH, eiwit, glucose en bloed, bloedcellen.
Bovendien moet worden overwogen serummarkers van algemene weefselbeschadiging te onderzoeken. Andere bepalingen die uitgevoerd moeten worden wanneer de bekende eigenschappen van de teststof invloed hebben of kunnen hebben op de bijbehorende metabolische profielen: calcium, fosfor, triglyceriden bij nuchtere toestand, bepaalde hormonen, methemoglobine en cholinesterase-activiteit. Deze moeten voor chemische stoffen in bepaalde klassen of per geval geïdentificeerd worden.
Algemeen is een flexibele aanpak nodig, afhankelijk van de diersoorten en het waargenomen en/of verwachte effect van een bepaalde stol.
Wanneer historische basisgegevens ontoereikend zijn, moet worden overwogen of het noodzakelijk is vóór aanvang van de toediening hematologische en klinisch-biochemische variabelen te bepalen: het is algemeen niet aan te bevelen deze gegevens vóór de behandeling te genereren (7).
1.5.2.3. Macroscopische necropsie
Bij alle dieren in de studie moet een volledige macroscopische necropsie worden uitgevoerd, waaronder een zorgvuldig onderzoek van het huidoppervlak, alle lichaamsopeningen alsmede de schedelholte, de borstholte en de buikholte, en de inhoud daarvan. Lever, nieren, bijnieren, testes, epididymides, uterus, ovaria, thymus, milt, hersenen en het hart van alle dieren (afgezien van stervende en/of tussentijds gedode dieren) moeten zo nodig ontdaan worden van aanhechtend weefsel, en ze moeten zo spoedig mogelijk na de sectie nat worden gewogen om te voorkomen dat ze uitdrogen.
De volgende weefsels moeten in een medium worden bewaard dat zowel voor het type weefsel als voor het beoogde latere histopathologische onderzoek geschikt is: elk macroscopisch waarneembaar letsel, hersenen (alle relevante delen, waaronder cerebrum, cerebellum en merg/brug), ruggenmerg (op drie niveaus: cervicaal, middenthoracaal en lumbaal), hypofyse, schildklier, bijschildklier, thymus, slokdarm, speekselklieren, maag. dunne en dikke darmen (met inbegrip van de eilandjes van Peyer), lever, alvleesklier, nieren, bijnieren, milt, hart, luchtpijp en longen (behandeling door opblazen met een fixatief en vervolgens onderdompelen), aorta, geslachtsklieren, uterus, bijbehorende geslachtsorganen, borstklieren van wijfjes, prostaat, urineblaas, galblaas (muizen), lymfklieren (bij voorkeur één lymfklier op de toedieningsroute en één op een afstand van de toedieningsroute om systemische effecten op te vangen), perifere zenuw (grote beenzenuw of scheenbeen) bij voorkeur zeer dicht bij de spier, een beenmergsectie (en/of een vers beenmergaspiraat), huid en ogen (indien tijdens de oftalmologische onderzoeken veranderingen werden waargenomen). Uit de klinische en andere bevindingen kan de noodzaak blijken verder weefsel te onderzoeken. Ook organen waarvan op basis van de bekende eigenschappen van de teststof verondersteld wordt dat ze beschadigd kunnen worden, moeten worden bewaard.
1.5.2.4. Histopathologisch onderzoek
Bij alle dieren in de groep behandeld met het hoogste dosisniveau en bij de dieren in de controlegroep moet een volledig histopathologisch onderzoek worden verricht op de bewaarde organen en weefsels. Organen en weefsels die blijken te zijn beschadigd door de teststof op het hoogste dosisniveau, moeten in alle groepen met een lagere dosering worden onderzocht.
Alle macroscopisch waarneembare beschadigingen moeten onderzocht worden.
Bij het histopathologisch onderzoek van de dieren in de satellietgroepen moet speciaal worden gelet op die organen en weefsels waarin effecten blijken te zijn opgetreden bij de andere behandelde groepen.
2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
Er moeten individuele gegevens voor iedere testgroep worden verstrekt. Bovendien moeten alle gegevens worden samengevat in tabellen die voor iedere testgroep laten zien: het aantal dieren aan het begin van het onderzoek, het aantal dieren dat tijdens de test is gestorven of humaan moest worden gedood en het tijdstip waarop de dood bij de individuele dieren is ingetreden, het aantal dieren dat toxiciteitsverschijnselen vertoont, een beschrijving van de waargenomen toxische effecten, met inbegrip van het verloop in de tijd, de duur en de ernst van eventuele toxische effecten, het aantal dieren dat beschadigingen vertoont, de aard van de beschadigingen en het percentage dieren dat elk type beschadiging vertoont.
Voorzover van toepassing moeten alle waargenomen resultaten met behulp van een geschikte en algemeen erkende statistische methode worden geëvalueerd. De statistische methoden en de te analyseren gegevens moeten tijdens het ontwerp van het onderzoek worden gekozen.
2.2. VERSLAG VAN HET ONDERZOEK
In het verslag moeten de volgende gegevens worden opgenomen:
2.2.1. Teststof:
|
— |
fysieke aard, zuiverheid en fysico-chemische eigenschappen; |
|
— |
identificatiegegevens; |
|
— |
medium (waar van toepassing): rechtvaardiging van het gekozen medium wanneer dat geen water is. |
2.2.2. Diersoort:
|
— |
gebruikte diersoort en stam; |
|
— |
aantal, leeftijd en geslacht van de dieren; |
|
— |
herkomst, leefomstandigheden, voeding enz.; |
|
— |
gewicht van elk dier aan het begin van de proef. |
2.2.3. Proefomstandigheden:
|
— |
redenen voor de keuze van het dosisniveau; |
|
— |
details over de samenstelling van de teststof en voedselbereiding, gerealiseerde concentratie, stabiliteit en homogeniteit van het preparaat; |
|
— |
details over de toediening van de teststof; |
|
— |
toegepaste, werkelijke doses (mg/kg lichaamsgewicht/dag) en conversiefactor van de teststofconcentratie (ppm) in het voedsel/drinkwater naar de werkelijke dosis, voorzover van toepassing; |
|
— |
details over de kwaliteit van het voedsel en drinkwater. |
2.2.4. Resultaten:
|
— |
lichaamsgewicht en veranderingen in het lichaamsgewicht; |
|
— |
waar van toepassing voedselverbruik en waterverbruik; |
|
— |
gegevens over de toxische reacties naar geslacht en dosis, inclusief toxiciteitsverschijnselen; |
|
— |
aard, ernst en duur van de klinische waarnemingen (al dan niet reversibel); |
|
— |
uitgevoerd oftalmologisch onderzoek; |
|
— |
bepalingen van de activiteit van de zintuigen, de grijpkracht en de motorische activiteit (indien beschikbaar); |
|
— |
uitgevoerde hematologische onderzoeken en alle resultaten; |
|
— |
uitgevoerde klinisch-biochemische onderzoeken en alle resultaten; |
|
— |
lichaamsgewicht, orgaangewichten en verhoudingen lichaams-/orgaangewicht van gestorven dieren; |
|
— |
bevindingen bij de necropsie; |
|
— |
een gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
indien beschikbaar absorptiegegevens; |
|
— |
waar van toepassing statistische behandeling van de resultaten. |
Bespreking van de resultaten.
Conclusies.
3. REFERENTIES
|
(1) |
IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60. |
|
(2) |
Tupper, D. E., Wallace. R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40. pp. 999—1003. |
|
(3) |
Gad. S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology.). Toxicol. Environ. Health, 9, pp. 691—704. |
|
(4) |
Moser, V.C, Mc Daniel, K.M., Philips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol, 108, pp. 267—283. |
|
(5) |
Meyer O.A.., Tilson, H. A., Byrd, W.C., Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind-limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, pp. 233—236. |
|
(6) |
Crofton, K. M., Howard, J.L., Moser V. C. Gill, M.W., Reiter, L.W., Tilson, H.A., MacPhail, R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13. pp. 599—609. |
|
(7) |
Weingand, K., Brown, G., Hall, R. et al. (1996). „Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies”, Fundam. & Appl. Toxicol., 29. pp. 198—201. |
B.27. SUBCHRONISCHE ORALE TOXICITEITSTEST: TOXICITEITSONDERZOEK (ORAAL) OP DIEREN ANDERS DAN KNAAGDIEREN BIJ HERHAALDE TOEDIENING (90 DAGEN)
1. METHODE
De methode die voor deze subchronische orale toxiciteitstest wordt gebruikt, is een kopie van de OECD TG 409 (1998).
1.1. INLEIDING
Bij de bepaling en evaluatie van de toxische eigenschappen van een chemische stof moet aan de hand van acute-toxiciteitstests of toxiciteitstests met herhaalde toediening (28 dagen) eerst informatie over de toxiciteit worden verkregen. Daarna kan de subchronische orale toxiciteit door middel van herhaalde toediening worden bepaald. Het onderzoek van 90 dagen levert informatie op over de mogelijke gevaren voor de gezondheid die kunnen voortvloeien uit herhaalde blootstelling gedurende een periode van snelle groei tot aan de jonge volgroeidheid. Het onderzoek zal informatie opleveren over de belangrijkste toxische effecten, er zullen organen die beschadigd kunnen worden en de mogelijkheid van accumulatie worden aangegeven, en er kan een inschatting worden gemaakt van een blootstellingsniveau zonder schadelijk effect, dat kan worden gebruikt bij de keuze van dosisniveaus voor chronische onderzoeken en voor de vaststelling van veiligheidscriteria voor de blootstelling van de mens.
Met de testmethode kunnen negatieve effecten van blootstelling aan een chemische stof bij diersoorten anders dan knaagdieren worden geïdentificeerd. De test wordt uitsluitend gebruikt:
|
— |
indien uit effecten die in andere studies zijn vastgesteld, blijkt dat er behoefte is aan verduidelijking/karakterisering in een tweede diersoort anders dan knaagdieren; |
|
— |
indien uit toxicokinetische studies blijkt dar het gebruik van een specifieke diersoort anders dan knaagdieren de beste keuze als proefdier is, of |
|
— |
indien andere specifieke redenen het gebruik van diersoorten anders dan knaagdieren rechtvaardigen. |
Zie ook algemene inleiding deel B.
1.2. DEFINITIES
Dosis: is de hoeveelheid teststof die wordt toegediend. De dosis wordt uitgedrukt in gewicht (g, mg) of in het gewicht van de teststof per gewichtseenheid proefdier (bv. mg/kg), of als constante voedingsconcentraties (ppm).
Dosering: is een algemene term die de dosis alsook de frequentie daarvan en de doseringsperiode omvat.
NOAEL: is de afkorting voor het niveau zonder waarneembaar schadelijk effect en is de hoogste dosis waarbij nog geen waarneembare toxiciteitsverschijnselen optreden.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof wordt gedurende een periode van 90 dagen dagelijks oraal toegediend aan verscheidene groepen proefdieren, in geleidelijk stijgende doses. Er wordt één dosis per groep gebruikt. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks geobserveerd om tekenen van toxiciteit te ontdekken. Bij dieren die tijdens het onderzoek sterven en bij dieren die aan het eind van het onderzoek leven, wordt necropsie verricht.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Keuze van de diersoort
De meest gebruikte diersoort anders dan, knaagdieren is de hond, die van een bepaald ras moet zijn; de beagle wordt in dit verband vaak gebruikt. Ook andere diersoorten, bv. zwijnen en minivarkens, kunnen gebruikt worden. Primaten zijn niet aan te bevelen en voor het gebruik daarvan moeten goede redenen zijn. Er moeten jonge, gezonde dieren worden gebruikt. In het geval van honden moet met de toediening van de dosis bij voorkeur worden begonnen als de honden 4-6 maanden maar in geen geval meer dan 9 maanden oud zijn. Indien het onderzoek wordt uitgevoerd als voorstudie van een langdurig chronisch toxiciteitsonderzoek, moeten dieren van dezelfde soort/ras voor beide onderzoeken worden gebruikt.
1.4.2. Voorbereiding van de dieren
Voor het onderzoek worden gezonde, jonge dieren gebruikt die onder gelijke huisvestings- en voedingsomstandigheden zijn gehouden als tijdens de test en die niet eerder voor experimenten zijn gebruikt. De duur van de acclimatisering hangt af van de gekozen diersoort en de oorsprong daarvan. In dit verband gelden de volgende aanbevelingen: ten minste vijf dagen voor honden of voor dit doel speciaal gefokte varkens uit een eigen kolonie en ten minste twee weken als deze dieren van externe oorsprong zijn. De proefdieren worden op basis van kenmerken als soort, stam, oorsprong, geslacht, gewicht en/of leeftijd ingedeeld. De dieren worden willekeurig in de controle- en behandelingsgroepen ingedeeld. De kooien worden zodanig neergezet dat mogelijke effecten door de plaatsing daarvan tot een minimum worden beperkt. Elk dier krijgt een uniek identificatienummer.
1.4.3. Voorbereiding van de doses
De teststof kan met de voeding, met het drinkwater, via een maagsonde of in capsules worden toegediend. De wijze van de orale toediening hangt af van het doel van het onderzoek en van de fysisch-chemische eigenschappen van het testmateriaal.
Waar nodig wordt de teststof in een geschikt medium opgelost of gesuspendeerd. Het verdient aanbeveling om in eerste instantie een oplossing suspensie in water te overwegen. Als dit niet mogelijk is, kan een oplossing/emulsie in achtereenvolgens plantaardige olie (bv. maïsolie) of een ander medium worden overwogen. Van niet-waterige media moeten de toxische eigenschappen bekend zijn. De stabiliteit van de teststof tijdens de toediening moet worden vastgesteld.
1.5. PROCEDURE
1.5.1. Aantal en geslacht van de dieren
Voor ieder dosisniveau moeten ten minste acht dieren (vier wijfjes en vier mannetjes) worden gebruikt. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal dieren worden verhoogd met het aantal dat tussentijds zal worden gedood. Aan het einde van het onderzoek moeten voldoende dieren overblijven om een zinvolle evaluatie van de toxische effecten mogelijk te maken. Op basis van de aanwezige kennis van de chemische stof of een stof die daar veel op lijkt, verdient het overweging een extra satellietgroep van acht dieren (vier per geslacht) op te nemen in de controlegroep en in de groep met het hoogste dosisniveau, om na de behandeling te kunnen nagaan of er sprake is van reversibiliteit of persistentie van eventuele toxische effecten. De duur van deze nabehandelingsperiode moet worden vastgesteld in overeenstemming met de waargenomen effecten.
1.5.2. Dosisniveaus
Ten minste drie dosisniveaus en een bijbehorende controle zijn vereist, tenzij een limiettest wordt uitgevoerd (zie 1.5.3). De dosisniveaus kunnen gebaseerd zijn op de resultaten van onderzoeken met herhaalde toediening of van verkennende onderzoeken, en er moet rekening worden gehouden met bestaande toxicologische en toxicokinetische gegevens die voor de teststof of aanverwante materialen beschikbaar zijn. Indien er geen beperkingen vanwege de fvsisch-chemische aard of de biologische effecten van de teststof zijn, moet het hoogste dosisniveau worden gekozen om toxiciteit te veroorzaken, maar niet de dood of ernstige pijn. Er moet een afnemende reeks dosisniveaus worden gekozen om elke doseringsgerelateerde respons en een niveau zonder schadelijk effect (NOAEL) op het laagste dosisniveau aan te tonen. Doorgaans zijn twee- tot viervoudige intervallen optimaal voor de instelling van de afnemende dosisniveaus, en de toevoeging van een vierde testgroep is vaak te verkiezen boven het gebruik van zeer grote intervallen (bv. meer dan een factor van 6 à 10) tussen twee doseringen.
De controlegroep moet een onbehandelde groep of een mediumcontrolegroep zijn, voorzover een medium wordt gebruikt voor de toediening van de teststof. Afgezien van de behandeling met de teststof moeten de dieren in de controlegroep op dezelfde wijze worden behandeld als die in de testgroep. Indien een medium wordt gebruikt, moet het medium aan de controlegroep in het voor de proef maximaal gebruikte volume worden toegediend. Indien een teststof wordt toegediend via de voeding en een geringere voedingsopname veroorzaakt, kan een paargevoede controlegroep nuttig zijn om onderscheid te maken tussen een vermindering vanwege de eetbaarheid of vanwege toxicologische veranderingen in het testmodel.
Er moet rekening worden gehouden met de navolgende eigenschappen van het medium en andere additieven, naargelang hetgeen van toepassing is: effecten op de absorptie, distributie, metabolisme of retentie van de teststof; effecten op de chemische eigenschappen van de teststof die de toxische karakteristieken daarvan kunnen veranderen; en effecten op het voedsel- of waterverbruik of de voedingsstatus van de dieren.
1.5.3. Limiettest
Indien een test bij een dosisniveau van ten minste 1 000 mg/'kg lichaamsgewicht/dag en met gebruikmaking van de procedures die voor deze studie worden beschreven, een niveau zonder schadelijk effect oplevert en indien toxiciteit op grond van informatie over qua samenstelling aanverwante stoffen niet te verwachten is, hoeft wellicht niet het uitvoeren van een volledig onderzoek met gebruikmaking van drie doseringsniveaus overwogen te worden. De limiettest moet worden uitgevoerd tenzij het blootstellingsniveau van de mens duidt op de noodzaak een hoger dosisniveau te gebruiken.
1.5.4. Toediening van de doses
De dieren krijgen gedurende een periode van 90 dagen, zeven dagen per week, een dosis van de teststof toegediend. Voor elk ander doseringsinterval, bv. vijf dagen per week. moet een goede reden zijn. Indien de teststof via een maagsonde aan het dier wordt toegediend, moet dit in één enkele dosis gebeuren met gebruikmaking van een maagbuisje of een geschikte intubatiecanule. De maximale hoeveelheid vloeistof die in één keer kan worden toegediend, is afhankelijk van de grootte van het proefdier. Normaliter moet het volume zo laag mogelijk worden gehouden. Afgezien van irriterende of bijtende stoffen die normaliter bij hogere concentraties ergere effecten vertonen, moet de variabiliteit in het voor de proef gebruikte volume zo klein mogelijk worden gehouden door de concentratie zodanig aan te passen dat bij alle dosisniveaus een constant volume wordt gewaarborgd.
Wanneer stoffen met de voeding of het drinkwater worden toegediend, moet erop worden toegezien dat de hoeveelheden van de teststof niet interfereren met de normale voedings- of waterbalans. Indien de teststof met de voeding wordt toegediend, kan een constante voedingsconcentratie (ppm) of een constant dosisniveau als functie van het lichaamsgewicht van de dieren worden gebruikt; de gekozen methode moet worden gespecificeerd. Indien de stof via een maagsonde wordt toegediend, moeten de doses dagelijks op vaste tijdstippen worden gegeven. De doses moeten geregeld worden aangepast om een constant dosisniveau als functie van het lichaamsgewicht van het dier te verkrijgen. Indien een onderzoek gedurende een periode van 90 dagen wordt gebruikt als voorstudie van een langdurig chronisch toxiciteitsonderzoek, moet in beide onderzoeken dezelfde voeding worden gebruikt.
1.5.5. Waarnemingen
De observatieperiode moet ten minste 90 dagen duren. Dieren in satellietgroepen voor latere waarnemingen moeten nog gedurende een gepaste periode zonder behandeling worden gehouden om herstel of voortduren van de toxische effecten te kunnen vaststellen.
De proefdieren moeten ten minste eenmaal per dag worden geobserveerd, bij voorkeur op hetzelfde tijdstip, waarbij rekening moet worden gehouden met de piekperiode van verwachte effecten na de toediening van de dosis. De klinische conditie van de dieren moet geregistreerd worden. Ten minste tweemaal per dag, normaliter aan het begin en eind van elke dag moeten alle dieren worden onderzocht op tekenen van ziekelijkheid of sterfte.
Ten minste eenmaal vóór de eerste blootstelling (om vergelijkingen op hetzelfde gebied te kunnen trekken) en eenmalig een week daarna moeten alle dieren aan een uitgebreid klinisch onderzoek worden onderworpen. De dieren moeten buiten hun kooi worden geobserveerd, bij voorkeur telkens in een standaardgebied en op hetzelfde tijdstip. Er moet getracht worden verschillen in de observatiecondities tot een minimum te beperken. Alle waargenomen toxiciteitsverschijnselen moeten zorgvuldig worden geregistreerd, met inbegrip van het verloop in de tijd, de duur en de ernst ervan. Er dient onder meer te worden gelet op veranderingen van huid en vacht, ogen en slijmvliezen, het voorkomen van secreties en excreties, en autonome activiteiten (bv. tranenvloed, pilo-crectie, pupilgrootte, abnormaal ademhalingspatroon). Ook veranderingen in de manier van lopen, de houding en de reactie op de behandeling alsmede de aanwezigheid van klonische of tonische bewegingen, stereotypen (bv. abnormaal poetsgedrag. blijven ronddraaien) of bizar gedrag moeten geregistreerd worden.
Vóór de toediening van de teststof en na beëindiging van het onderzoek wordt een oftalmologisch onderzoek uitgevoerd, waarbij gebruik wordt gemaakt van een oftalmoscoop of een even geschikt apparaat. Dit onderzoek wordt bij voorkeur op alle dieren verricht, maar ten minste op die in de groepen met het hoge dosisniveau en in de controlegroepen. Wanneer oogafwijkingen worden vastgesteld, moeten alle dieren worden onderzocht.
1.5.5.1. Lichaamsgewicht en voedsel-/waterverbruik
Alle dieren moeten ten minste eenmaal per week worden gewogen. Ook het voedselverbruik moet ten minste wekelijks worden gemeten. Indien de teststof met het drinkwater wordt toegediend, moet ook het waterverbruik ten minste wekelijks worden gemeten. Het meten van het waterverbruik kan ook worden overwogen bij voedsel- of maagsondeonderzoeken, gedurende welke de drinkactiviteit kan veranderen.
1.5.5.2. Hematologie en klinisch-biochemische bepalingen
Van een bepaalde plek moeten bloedmonsters worden genomen die, voorzover van toepassing, onder gepaste omstandigheden bewaard moeten worden. Aan het einde van de testperiode moeten de monsters worden genomen vlak vóór het doden van de dieren of als onderdeel van de dodingsprocedure.
Aan het begin van de testperiode moeten de volgende hematologische onderzoeken worden verricht: bepaling van het hematocriet en het hemoglobinegehalte, erythrocytentelling, totale en gedifferentieerde telling van de leukocyten, telling van de bloedplaatjes en meting van een maat voor het stollingsvermogen, zoals prothrombinetijd of thromboplastinetijd. Deze onderzoeken moeten vervolgens om de maand of halverwege de testperiode en ten slotte aan het einde van de test worden herhaald.
Klinisch-biochemische bepalingen die bedoeld zijn om wezenlijke toxische effecten in weefsels en met name effecten op de nier en lever te onderzoeken, moeten worden verricht op bloedmonsters die van elk dier worden genomen aan het begin van de testperiode, om de maand of halverwege de test en ten slotte aan het einde van de testperiode. Tot de testgebieden die overwogen moeten worden, behoren elektrolytisch evenwicht, koolhydraatstofwisseling en de lever- en nierwerking. De keuze van specifieke tests wordt beïnvloed door waarnemingen van de werking van de teststof. Vóór het nemen van de bloedmonsters moet de dieren gedurende een voor die diersoort gepaste periode voedsel worden onthouden. Tot de aanbevolen onderzoeken behoren de meting van calcium, fosfor, chloride, natrium, kalium, glucose bij nuchtere toestand, alanineaminotransferase, aspartaataminotransferase, ornithinedecarboxylase, gammaglutamyltranspeptidase, ureumstikstof, albumine, bloedcreatinine, totaal bilirubine en totaal serumeiwit.
Ten minste aan het begin, vervolgens halverwege en ten slotte aan het einde van de studie moeten urine-onderzoeken worden verricht, waarbij de urinemonsters op regelmatige tijdstippen genomen moeten worden. Het volgende moet worden onderzocht: uitzien, volume, osmolaliteit of relatieve dichtheid, pH, eiwit, glucose en bloed/bloedcellen. Wanneer nodig kunnen hieraan nog parameters worden toegevoegd om het onderzoek van de waargenomen effecten te verlengen.
Bovendien moet worden overwogen markers van algemene weefselbeschadiging te onderzoeken. Andere bepalingen die nodig kunnen zijn voor een adequate toxicologische evaluatie zijn: analyse van lipiden, hormonen, het zuur-base-evenwicht. methemoglobine en cholinesteraseremming. Wanneer nodig kunnen hieraan nog klinisch-chemische parameters worden toegevoegd om het onderzoek van de waargenomen effecten te verlengen. Deze moeten voor chemische stoffen in bepaalde klassen of per geval geïdentificeerd worden.
Algemeen is een flexibele aanpak nodig afhankelijk van de diersoort en het waargenomen en/of verwachte effect van een bepaalde stof.
1.5.5.3. Macroscopische necropsie
Bij alle dieren in de studie moet een volledige macroscopische necropsie worden uitgevoerd, waaronder een zorgvuldig onderzoek van het huidoppervlak, alle lichaamsopeningen alsmede de schedelholte, de borstholte en de buikholte, en de inhoud daarvan. Lever, nieren, bijnieren, testes, epididymides. uterus, ovaria, thymus, milt, hersenen en het hart van alle dieren (afgezien van stervende en/of tussentijds gedode dieren) moeten zo nodig ontdaan worden van aanhechtend weefsel, en ze moeten zo spoedig mogelijk na de sectie nat worden gewogen om te voorkomen dat ze uitdrogen.
De volgende weefsels moeten in een medium worden bewaard dat zowel voor het type weefsel als voor het beoogde latere histopathologische onderzoek geschikt is: elk macroscopisch waarneembaar letsel, hersenen (alle relevante delen, waaronder cerebrum cerebellum en merg/brug), ruggenmerg (op drie niveaus: cervicaal, middenthoracaal en lumbaal), hypofyse. ogen, schildklier, bijschildklier, thymus, slokdarm, speekselklieren, maag, dunne en dikke darmen (met in begrip van de eilandjes van Peyer), lever, galblaas, alvleesklier, nieren, bijnieren, milt, hart, luchtpijp en longen, aorta, geslachtsklieren, uterus, bijbehorende geslachtsorganen, borstklieren van wijfjes, prostaat. urineblaas, lymfklieren (hij voorkeur één lymfklier op de toedieningsroute en één op een afstand van de toedieningsroute om systemische effecten op te vangen), perifere zenuw (grote beenzenuw of scheenbeen) bij voorkeur zeer dicht bij de spier, een beenmergsectie (en/of een vers beenmergaspiraat) en huid. Uit de klinische en andere bevindingen kan de noodzaak blijken verder weefsel te onderzoeken. Ook organen waarvan op basis van de bekende eigenschappen van de teststof verondersteld wordt dat ze beschadigd kunnen worden, moeten worden bewaard.
1.5.5.4. Histopathologisch onderzoek
Bij alle dieren in de groep behandeld met het hoogste dosisniveau en bij de dieren in de controlegroep moet een volledig histopathologisch onderzoek worden verricht op de bewaarde organen en weefsels. Organen en weefsels die blijken te zijn beschadigd door de teststof op het hoogste dosisniveau, moeten in alle groepen met een lagere dosering worden onderzocht.
Alle macroscopisch waarneembare beschadigingen moeten onderzocht worden.
Bij het histopathologisch onderzoek van de dieren in de satellietgroepen moet speciaal worden gelet op die organen en weefsels waarin effecten blijken te zijn opgetreden bij de andere behandelde groepen.
2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
Er moeten individuele gegevens voor iedere testgroep worden verstrekt. Bovendien moeten alle gegevens worden samengevat in tabellen die voor iedere testgroep laten zien: het aantal dieren aan het begin van het onderzoek, het aantal dieren dat tijdens de test is gestorven of humaan moest worden gedood en het tijdstip waarop de dood bij de individuele dieren is ingetreden, het aantal dieren dat toxiciteitsverschijnselen vertoont, een beschrijving van de waargenomen toxische effecten, met inbegrip van het verloop in de tijd, de duur en de ernst van eventuele toxische effecten, het aantal dieren dat beschadigingen vertoont, de aard van de beschadigingen en het percentage dieren dat elk type beschadiging vertoont.
Voorzover van toepassing moeten alle waargenomen resultaten met behulp van een geschikte en algemeen erkende statistische methode worden geëvalueerd. De statistische methoden en de te analyseren gegevens moeten tijdens het ontwerp van het onderzoek worden gekozen.
2.2. VERSLAG VAN HET ONDERZOEK
In het verslag moeten de volgende gegevens worden opgenomen:
2.2.1. Teststof:
|
— |
fysieke aard. zuiverheid en fysico-chemische eigenschappen; |
|
— |
identificatiegegevens; |
|
— |
medium (waar van toepassing): rechtvaardiging van het gekozen medium wanneer dat geen water is. |
2.2.2. Diersoort:
|
— |
gebruikte diersoort en stam; |
|
— |
aantal, leeftijd en geslacht van de dieren; |
|
— |
herkomst, leefomstandigheden, voeding enz.; |
|
— |
gewicht van elk dier aan het begin van de proef. |
2.2.3. Proefomstandigheden:
|
— |
redenen voor de keuze van het dosisniveau; |
|
— |
details over de samenstelling van de teststof en voedselbereiding, gerealiseerde concentratie, — stabiliteit en homogeniteit van het preparaat; |
|
— |
details over de toediening van de teststof; |
|
— |
toegepaste, werkelijke doses (mg/kg lichaamsgewicht/dag) en conversiefactor van de teststofconcentratie (ppm) in het voedsel/drinkwater naar de werkelijke dosis, voorzover van toepassing; |
|
— |
details over de kwaliteit van het voedsel en het drinkwater. |
2.2.4. Resultaten:
|
— |
lichaamsgewicht en veranderingen in het lichaamsgewicht; |
|
— |
waar van toepassing voedselverbruik en waterverbruik; |
|
— |
gegevens over de toxische reacties naar geslacht en dosis, inclusief toxiciteitsverschijnselen; |
|
— |
aard, ernst en duur van de klinische waarnemingen (al dan niet reversibel); |
|
— |
uitgevoerd oftalmologisch onderzoek; |
|
— |
uitgevoerde hematologische onderzoeken en alle resultaten; |
|
— |
uitgevoerde klinisch-biochemischc onderzoeken en alle resultaten; |
|
— |
lichaamsgewicht, orgaangewichten en verhoudingen lichaams-/orgaangewicht van gestorven dieren; |
|
— |
bevindingen bij de necropsie; |
|
— |
een gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
indien beschikbaar absorptiegegevens; |
|
— |
waar van toepassing statistische behandeling van de resultaten. |
Bespreking van de resultaten.
Conclusies.
B.28. SUBCHRONISCHE DERMALE TOXIClTEITSTEST 90 DAGEN-TEST MET HERHAALDE DERMALE TOEDIENING AAN KNAAGDIERSOORTEN
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
De teststof wordt gedurende een periode van 90 dagen dagelijks in geleidelijk stijgende doseringen bij verscheidene groepen proefdieren op de huid aangebracht. Er wordt een dosis per groep gebruikt. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks op tekenen van toxiciteit onderzocht. Op de dieren die tijdens het onderzoek sterven en die welke aan het eind van de proefnemingen nog in leven zijn, wordt necropsie verricht.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
1.6.1. Voorbereidingen
Voor het onderzoek worden de dieren ten minste vijf dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Voor her onderzoek worden gezonde, jonge dieren op willekeurige wijze in de te behandelen groepen en controlegroepen ingedeeld. Kort voor de proefneming wordt het haar op het ruggedeelte van de romp van de proefdieren geknipt. Het dier kan ook worden geschoren, maar dit moet dan ongeveer 24 uur voor de proef worden uitgevoerd. Gewoonlijk zal het dier ongeveer om de week opnieuw moeten worden geknipt of geschoren. Bij het knippen of scheren van de vacht moet erop worden geler dar de huid niet wordt beschadigd. Ten minste 10 % van de lichaamsoppervlakte moet voor de aanbrenging van de teststof worden onthaard. Bij het bepalen van de oppervlakte die moet worden onthaard, en de afmetingen van het verband moet rekening worden gehouden met her gewicht van het dier. Bij proefnemingen met vaste stoffen, die eventueel tot poeder kunnen worden fijngemalen, moer de teststof voldoende met water of, zo nodig, met een passend medium worden bevochtigd, zodat de stof goed in contact met de huid komt. Vloeibare teststoffen worden in het algemeen onverdund gebruikt. De teststof wordt gedurende vijf tot zeven dagen per week dagelijks aangebracht.
1.6.2. Proefomstandigheden
1.6.2.1.
Er kan gebruik worden gemaakt van volwassen ratten, konijnen of cavia's. Ook andere diersoorten kunnen worden gebruikt, maar de noodzaak hiervan moet worden aangetoond. Bij het begin van het onderzoek mag het gewicht van de dieren niet meer dan ± 20 % van het gemiddelde gewicht afwijken. Indien een studie naar de subchronische dermale toxiciteit wordt verricht ter voorbereiding op een chronisch onderzoek, dienen in beide studies dezelfde soort en stam te worden gebruikt.
1.6.2.2.
Voor ieder dosisniveau moeten ten minste twintig dieren (tien wijfjes en tien mannetjes) met een gezonde huid worden gebruikt. De vrouwtjes moeten nulliparae zijn en mogen niet drachtig zijn. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met het aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood. Daarnaast kan een satelliet groep van twintig dieren (tien per geslacht) gedurende 90 dagen met het hoge dosisniveau worden behandeld en nog gedurende 28 dagen na de behandeling worden geobserveerd om na te gaan of de toxische effecten eventueel verdwijnen, voortduren of vertraagd tot uiting komen.
1.6.2.3.
Er zijn ten minste drie dosisniveaus vereist, met een controle of een mediumcontrole indien een medium wordt gebruikt. De blootstellingsduur dient ten minste zes uur per dag te bedragen. De teststof moet iedere dag op dezelfde tijd worden toegediend; op gezette tijden (iedere week of om de veertien dagen) is een correctie vereist om ervoor te zorgen dat het dosisniveau in verhouding tot het lichaamsgewicht van het dier constant blijft. Afgezien van de toediening van de teststof, moeten de dieren in de controlegroep op dezelfde wijze worden behandeld als de dieren in de proefgroep. Indien ter vergemakkelijking van de dosering gebruik wordt gemaakt van een medium, moet aan de dieren in de mediumcontrolegroep de dosis op dezelfde wijze worden toegediend als aan de dieren in de behandelde groepen en moet deze dosis even groot zijn als die van de dieren in de groep met het hoogste dosisniveau. Het hoogste dosisniveau moet leiden tot toxische effecten, maar er mogen geen of weinig sterfgevallen voorkomen. Bij het laagste dosisniveau mogen geen tekenen van toxiciteit optreden. Wanneer er een bruikbare schatting van de menselijke blootstelling bestaat, moet het laagste niveau deze overschrijden. In het ideale geval treden bij het middelste dosisniveau nauwelijks waarneembare toxische effecten op. Bij meer dan één tussendosis moet het verschil tussen de dosisniveaus zo groot zijn dat een gradatie in toxische effecten wordt verkregen. In de groep met de geringe dosis en in de tussengroepen alsmede in de controlegroepen mogen niet veel sterfgevallen voorkomen, omdat anders een zinvolle evaluatie van de resultaten niet mogelijk is.
Indien toediening van de teststof tot ernstige huidirritatie leidt, moeten de concentraties worden verlaagd, wat vermindering of uitblijven van andere toxische effecten bij het hoge dosisniveau tot gevolg kan hebben. Indien de huid ernstig is beschadigd, kan het bovendien noodzakelijk zijn de studie te beëindigen en een nieuwe studie met lagere concentraties te beginnen.
1.6.3.
Indien bij een voorafgaand onderzoek bij een dosisniveau van 1 000 mg/kg of een hoger niveau, dat is gerelateerd aan het niveau waaraan de mens, voor zover bekend, kan worden blootgesteld, geen toxische effecten optreden, zijn verdere proeven wellicht niet noodzakelijk.
1.6.4
De proefdieren moeten dagelijks worden onderzocht op tekenen van toxiciteit. Het tijdstip waarop de dood intreedt, het tijdstip waarop de toxiciteitsverschijnselen zich voor het eerst voordoen, en het tijdstip waarop zij weer verdwijnen, moeten worden vastgelegd.
1.6.5.
De dieren moeten apart in kooien worden ondergebracht. De dieren worden in het ideale geval gedurende een periode van 90 dagen, zeven dagen per week, met de teststof behandeld.
Dieren in satellietgroepen voor latere waarnemingen moeten nog 28 dagen onbehandeld blijven om herstel of voortduren van de toxische effecten te kunnen vaststellen. De blootstellingsduur moet zes uur per dag bedragen.
De teststof moet gelijkmatig worden verdeeld over een oppervlakte van ongeveer 10 % van de totale lichaamsoppervlakte. Bij zeer toxische stoffen mag de te bedekken oppervlakte kleiner zijn, maar een zo groot mogelijke oppervlakte moet met een zo dun en gelijkmatig mogelijk aangebrachte laag worden bedekt.
De teststof moet voor de duur van de blootstelling door middel van poreus verbandgaas en niet-irriterend plakband in contact met de huid blijven. Dit gedeelte van de huid moet op een geschikte wijze nog verder worden bedekt om het verbandgaas en de teststof op hun plaats te houden en om te verhinderen dat de dieren de teststof oraal opnemen. Om dit te voorkomen kunnen hulpmiddelen worden gebruikt waarmee de dieren in hun bewegingsvrijheid worden belemmerd, maar het is niet aan te bevelen de bewegingsvrijheid van de dieren volledig te beperken,
Aan het eind van de blootstellingsperiode wordt de testerende teststof waar mogelijk met water van de huid verwijderd of anders door middel van een andere geschikte schoonmaakmethode.
Alle dieren moeten dagelijks worden gecontroleerd; tekenen van toxiciteit moeten samen met het tijdstip waarop deze voor het eerst zijn opgetreden, de mate en de duur ervan worden genoteerd. Bij het observeren van de dieren in de kooien moet aandacht worden besteed aan veranderingen in huid en vacht, ogen en slijmvliezen, ademhaling, bloedsomloop, autonoom en centraal zenuwstelsel, somatomotorische activiteit en gedrag. Het verbruik van voer moet wekelijks worden gemeten en de dieren moeten iedere week worden gewogen. De dieren moeten regelmatig worden geobserveerd om te voorkomen dat zij voor de studie verloren gaan als gevolg van oorzaken als kannibalisme, autolyse van weefsels of verkeerde huisvesting. Na afloop van de onderzoekperiode wordt op alle overlevende dieren van de behandelde groepen, afgezien van die in de satellietgroepen, necropsie verricht. Indien stervende dieren worden aangetroffen, moeten zij worden verwijderd; ook op hen wordt necropsie verricht.
Bij alle dieren, met inbegrip van die uit de controlegroep, worden gewoonlijk de volgende onderzoekingen verricht:
|
a) |
Voor de blootstelling aan de teststof en na afloop van het onderzoek dient bij voorkeur bij alle dieren, maar ten minste bij de groep met de hoge dosis en de controlegroep oogonderzoek met behulp van een oogspiegel of een ander voor dit doel geschikt instrument plaats te vinden. Indien er veranderingen in de ogen worden vastgesteld, moeten alle dieren worden onderzocht. |
|
b) |
Aan het einde van de onderzoekperiode vindt een hematologisch onderzoek plaats, dat onder meer omvat: bepaling van het hematocriet en het hemoglobinegehalte, telling van de erytrocyten, totaaltelling en gedifferentieerde telling van de leukocyten, alsmede meting van de stollingseigenschappen zoals stollingstijd, protrombinetijd en tromboplastinetijd, of telling van de bloedplaatjes. |
|
c) |
Aan het einde van de onderzoekperiode dienen klinische en biochemische bepalingen op het bloed te worden verricht. Voor alle studies in aanmerking komende testen zijn: elektrolytenbalans, koolhydraatstofwisseling, alsmede de lever- en nierfunctie. De selectie van specifieke testen is afhankelijk van de waarnemingen met betrekking tot het werkingsmechanisme van de stof. Het onderzoek is eventueel uit te breiden met metingen van: calcium, fosfor, chloride, natrium, kalium, nuchter glucosegehalte (met een aan de diersoort aangepaste periode van vasten), serumglutamaatpyruvaattransaminase (4), serumglutamaatoxaalacetaattransaminase (5), ornithinedecarboxylase, gammaglutamyltranspeptidase, ureumstikstof, albumine, bloedcreatinine, totaal bilirubine en totaal serumproteïne. Voor een goede toxicologische evaluatie kan de bepaling van de lipiden, hormonen, zuur/base-evenwicht, methemoglobine en cholinesterase-activiteit noodzakelijk zijn. Om het onderzoek van de waargenomen effecten uit te breiden kan zo nodig verder klinisch-biochemisch onderzoek worden verricht. |
|
d) |
Routinematig urineonderzoek is alleen vereist wanneer daartoe op grond van de verwachte of waargenomen toxiciteit een indicatie bestaat. |
In het geval van ontoereikende basisgegevens uit het verleden dient de bepaling van hematologische en klinisch-biochemische parameters voordat met de dosering wordt begonnen aandacht te krijgen.
Op alle dieren moet een volledige macroscopische necropsie worden verricht, waarbij het uitwendige lichaamsoppervlak, alle lichaamsopeningen, alsmede de schedel-, borst- en buikholte en hun inhoud worden onderzocht. De lever, nieren, bijnieren en testes moeten zo spoedig mogelijk na de sectie nat worden gewogen om uitdroging te voorkomen. De volgende organen en weefsels moeten in een geschikt medium worden bewaard voor eventueel later histopathologisch onderzoek: alle organen die met het blote oog zichtbare letsels vertonen, hersenen — inclusief delen van medulla/pons, cortex cerebelli en cortex cerebri, hypofyse, schildklier/bijschildklieren, thymusweefsel, (luchtpijp), longen, hart, aorta, speekselklieren, lever, milt, nieren, bijnieren, alvleesklier, geslachtsklieren, secundaire geslachtsorganen, galblaas (indien aanwezig), slokdarm, maag, duodenum, jejunum, ileum, blinde darm, colon, rectum, urineblaas, representatieve lymfklieren, (vrouwelijke borstklier), (dijbeenspieren), perifere zenuwen, (ogen), (borstbeen met beenmerg), (dijbeen — inclusief gewrichtsvlak), (ruggenmerg op drie plaatsen — cervicaal, mediothoracaal en lumbaal) en (traanklieren). (De tussen haakjes vermelde weefsels hoeven alleen te worden onderzocht als daarvoor aanwijzingen zijn vanwege toxicologische waarnemingen of als het orgaan is aangetast.)
|
a) |
Op de normale en behandelde huid en de organen en weefsels van alle dieren in de controlegroep en in de groep die de hoogste dosis heeft ontvangen, moet een volledig histopathologisch onderzoek worden verricht. |
|
b) |
Alle met het blote oog zichtbare letsels moeten worden onderzocht. |
|
c) |
De aangetaste organen dienen in dieren in andere dosisgroepen te worden onderzocht. |
|
d) |
Bij gebruikmaking van ratten dienen de longen van de dieren in de groep die een lage dosis heeft ontvangen en van die in de tussengroep histopathologisch te worden onderzocht op tekenen van infectie, aangezien op deze manier een goed beeld van de gezondheidstoestand van de dieren wordt verkregen. Verder routinematig histopathologisch onderzoek is bij de dieren in deze groepen niet vereist, maar moet steeds worden verricht op de organen die in de groep die een hoge dosis heeft ontvangen, letsels bleken te vertonen. |
|
e) |
Wordt van een satellietgroep gebruik gemaakt, dan moet histopathologisch onderzoek worden verricht op de weefsels en organen waar bij andere behandelde groepen effecten blijken te zijn opgetreden. |
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek, het aantal dieren dat letsels vertoont, de aard van de letsels en het percentage dieren waarbij ieder type letsel voorkomt. De resultaten moeten met behulp van een voor dit doel geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voer, enzovoort; |
|
— |
proefomstandigheden; |
|
— |
dosisniveaus (met het eventuele medium) en concentraties; |
|
— |
waar mogelijk, het dosisniveau waarop geen effect is waargenomen; |
|
— |
gegevens over de toxische reactie naar geslacht en dosis; |
|
— |
tijdstip gedurende de studie waarop de dood intreedt of aangeven of dieren tot het einde van de proef in leven bleven; |
|
— |
beschrijving van toxische of andere effecten; |
|
— |
tijdstip waarop een abnormaal verschijnsel werd waargenomen en verloop hiervan; |
|
— |
gegevens over voer en lichaamsgewicht; |
|
— |
oftalmologische bevindingen; |
|
— |
uitgevoerd hematologisch onderzoek en resultaten; |
|
— |
uitgevoerd klinisch-biochemisch onderzoek en resultaten (resultaten van het urineonderzoek inbegrepen); |
|
— |
bevindingen van de necropsie; |
|
— |
gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
waar toepasselijk, statistische verwerking van de resultaten; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.29. SUBCHRONISCHE INHALATIETOXICITEITSTEST: 90 DAGEN-TEST MET HERHAALDE INHALATOIRE TOEDIENING AAN KNAAG DIERSOORTEN
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Verscheidene groepen proefdieren warden gedurende een periode van 90 dagen dagelijks voor een bepaalde tijd aan geleidelijk stijgende concentraties van de teststof blootgesteld. Er wordt een concentratie per groep gebruikt. Indien een medium wordt gebruikt om de juiste concentratie van de teststof in de atmosfeer te bereiken, moet een mediumcontrolegroep worden gebruikt. Gedurende de periode dat de stof wordt toegediend, worden de dieren dagelijks op tekenen van toxiciteit onderzocht. Op de dieren die tijdens het onderzoek sterven en die welke aan het einde van de proefnemingen nog in leven zijn, wordt necropsie verricht.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
1.6.1.
Voor het onderzoek worden de dieren ten minste vijf dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Voor het onderzoek worden gezonde, jonge dieren op willekeurige wijze in de te behandelen en controlegroepen ingedeeld. Waar nodig wordt een passend medium aan de teststof toegevoegd, teneinde de juiste concentratie van de teststof in de atmosfeer te bereiken. Indien een medium of andere additieven worden gebruikt om de dosering te vergemakkelijken, moet daarvan bekend zijn dat zij geen toxische effecten veroorzaken. Eventueel kan gebruik worden gemaakt van bestaande gegevens.
1.6.2.
Tenzij er contra-indicaties zijn, wordt de voorkeur gegeven aan ratten. Er dient gebruik te worden gemaakt van stammen van jonge, gezonde dieren die gewoonlijk in laboratoria worden gebruikt. Bij het begin van het onderzoek mag het gewicht van de dieren die bij de proeven worden gebruikt, niet meer dan ± 20 % van het gemiddelde gewicht afwijken. Indien een studie naar de subchronische inhalatietoxiciteit wordt verricht ter voorbereiding op een langdurig onderzoek, dienen in beide studies dezelfde soort en stam te worden gebruikt.
Iedere testgroep moet uit ten minste twintig dieren (tien wijfjes en tien mannetjes) bestaan. De vrouwtjes moeten nulliparae zijn en mogen niet drachtig zijn. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met het aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood. Daarnaast kan een satellietgroep van twintig dieren (tien per geslacht) gedurende 90 dagen met het hoge concentratieniveau worden behandeld en nog gedurende 28 dagen na de behandeling worden geobserveerd om na te gaan of de toxische effecten eventueel verdwijnen, voortduren of vertraagd tot uiting komen.
Er zijn ten minste drie concentraties vereist, met een controle of een mediumcontrole (overeenkomend met de concentratie van het medium bij bet hoogste expositieniveau) indien een medium wordt gebruikt. Afgezien van de toediening van de teststof, moetende dieren in de controlegroep op dezelfde wijze worden behandeld als de dieren in (de behandelde groep. De hoogste concentratie moet leiden tot toxische effecten, maar er mogen geen of weinig sterfgevallen voorkomen. Bij de laagste concentratie mogen geen tekenen van toxiciteit optreden. Wanneer er een bruikbare schatting van de menselijke blootstelling bestaat, moet de laagste concentratie deze overschrijden. In het ideale geval treden bij de middelste concentratie nauwelijks waarneembare toxische effecten op. Bij meer dan één tussenconcentratie moet het verschil tussen de concentraties zo groot zijn dat een gradatie in toxische effecten wordt verkregen. In de groep met de geringe concentratie en in de tussenliggende groepen, alsmede in de controlegroepen mogen niet veel sterfgevallen voorkomen, omdat anders een zinvolle evaluatie van de resultaten niet mogelijk is.
De dagelijkse blootstellingsduur bedraagt zes uur nadat in de verschillende kamers de juiste concentratie is bereikt. De blootstellingsduur kan eventueel aan specifieke behoeften worden aangepast.
De dieren worden aan de teststof blootgesteld met behulp van inhalatieapparatuur die zodanig gebouwd moet zijn dat kan worden gezorgd voor een dynamische luchtdoorstroming van ten minste twaalf luchtverversingen per uur, een toereikend zuurstofgehalte en een gelijkmatige verdeling van de teststof in de atmosfeer. Als van een blootstellingskamer gebruik wordt gemaakt, moet deze op zodanige wijze zijn ontworpen dat de dieren elkaar zo min mogelijk verdringen en zoveel mogelijk door inhalatie aan de teststof worden blootgesteld. Als algemene regel voor het verzekeren van een stabiele atmosfeer in de expositiekamer geldt dat het totale „volume” van de proefdieren niet meer mag bedragen dan 5 % van het volume van de blootstellingskamer. Naar keuze kan de oronasale methode worden toegepast, de kop alleen worden blootgesteld of het gehele lichaam in een afzonderlijke ruimte worden blootgesteld; met de eerste twee methoden wordt bereikt dat zo min mogelijk van de teststof via andere wegen in het lichaam wordt opgenomen.
De proefdieren moeten tijdens de gehele periode van behandeling en herstel dagelijks op tekenen van toxiciteit worden onderzocht. Het tijdstip waarop de dood intreedt, het tijdstip waarop de toxiciteitsverschijnselen zich voor het eerst voordoen, en het tijdstip waarop zij weer verdwijnen, moeten worden vastgelegd.
1.6.3.
De dieren worden gedurende een periode van 90 dagen vijf tot zeven dagen per week aan de reststof blootgesteld. Dieren in satellietgroepen voor latere waarnemingen moeten nog 28 dagen onbehandeld blijven om herstel of voortduren van de toxische effecten te kunnen vaststellen. Tijdens de proefnemingen dient de temperatuur op 22 oC (± 3 oC) te worden gehouden. In het ideale geval moet de relatieve vochtigheid tussen 30 % en 70 % worden gehouden, behalve waar dit niet mogelijk is (bijvoorbeeld bij het testen van sommige aerosolen). Gedurende de blootstelling wordt de dieren voedsel en water onthouden.
Er moet gebruik worden gemaakt van een dynamisch inhalatiesysteem met een geschikt systeem voor de analytische controle van de concentratie. Aanbevolen wordt in een verkennende proef vast te stellen welke blootstellingsconcentraties voor de proeven het meest geschikt zijn. Het aantal luchtverversingen per uur moet worden aangepast, zodat in de gehele blootstellingskamer homogene omstandigheden heersen. Het systeem moet waarborgen dat de omstandigheden bij de proef zo spoedig mogelijk stabiel zijn.
De volgende parameters moeten worden gemeten of gecontroleerd:
|
a) |
Gedurende de hele proef het aantal luchtverversingen per uur. |
|
b) |
De feitelijke concentratie van de teststof in de ademhalingsruimte. Tijdens de dagelijkse blootstelling mag de concentratie met niet meer dan ± 15 % van het gemiddelde afwijken. Bij stof- en vloeistofaerosolen is het mogelijk dat de concentraties niet binnen de gestelde grenzen kunnen worden gehouden; in dat geval kan een grotere afwijking aanvaardbaar zijn. Tijdens de gehele duur van de studie moeten de dagelijkse concentraties zo constant mogelijk worden gehouden. Gedurende bet werken van de apparatuur voor het genereren van deeltjes moeten analyses worden uitgevoerd van de deeltjesgrootte, teneinde de stabiliteit van het aerosol vast te stellen. Tijdens de blootstelling moet zo dikwijls als dit noodzakelijk is een analyse worden uitgevoerd om de stabiliteitsconsistentie van de verdeling van de deeltjesgrootte te bepalen. |
|
c) |
Temperatuur en vochtigheid. |
|
d) |
Tijdens en na de blootstelling worden waarnemingen gedaan die voor elk dier afzonderlijk systematisch worden geregistreerd. Alle dieren moeten dagelijks worden geobserveerd; tekenen van toxiciteit moeten samen met het tijdstip waarop deze voor het eerst zijn opgetreden, de mate en de duur ervan worden vastgelegd. Bij het observeren van de dieren in de kooien wordi in ieder geval aandacht besteed aan veranderingen in huid en vacht, ogen, slijmvliezen, ademhaling, bloedsomloop, autonoom en centraal zenuwstelsel, somatomotorische activiteit en gedrag, Wekelijks moet het verbruik van voer worden gemeten en moeten de dieren worden gewogen. De dieren moeten regelmatig worden geobserveerd om te vermijden dat ze voor de studie verloren d) gaan als gevolg van oorzaken als kannibalisme, autolyse van weefsels of verkeerde huisvesting. Na afloop van de onderzoekperiode wordt op alle overlevende dieren van de behandelde groepen, afgezien van de dieren in de satellietgroep, necropsie verricht. Wanneer stervende dieren worden aangetroffen, moeten zij worden verwijderd; ook op hen wordt necropsie verricht. |
Bij alle dieren, met inbegrip van die uit de controlegroep, worden gewoonlijk de volgende onderzoekingen verricht:
|
a) |
Voor expositie aan de teststof en na afloop van het onderzoek dient bij voorkeur bij alle dieren, maar ten minste bij de groep met de hoge dosis en de controlegroep oogonderzoek met behulp van een oogspiegel of een ander voor dit doel geschikt instrument plaats te vinden. Indien er veranderingen in de ogen worden vastgesteld, moeten alle dieren worden onderzocht. |
|
b) |
Aan het einde van de onderzoekperiode vindt een hematologisch onderzoek plaats, dat onder meer omvat: bepaling van het hematocriet en het hemoglobinegehalte, telling van de erytrocyten, totaaltelling en gedifferentieerde telling van de leukocyten, alsmede meting van de stollingseigenschappen zoals stollingstijd, protrombinetijd en tromboplastinetijd, of telling van de bloedplaatjes. |
|
c) |
Aan het einde van de onderzoekperiode dienen klinische en biochemische bepalingen op het bloed te worden verricht. Voor alle studies in aanmerking komende testen zijn: elektrolytenbalans, koolhydraatstofwisseling, alsmede de lever- en nierfunctie. De selectie van specifieke testen is afhankelijk van de waarnemingen met betrekking tot het werkingsmechanisme van de stof. Het onderzoek is eventueel uit te breiden met metingen van: calcium, fosfor, chloride, natrium, kalium, nuchter glucosegehalte (met een aan de diersoort aangepaste periode van vasten), serumglutamaatpyruvaattransaminase (4), serumglutamaatoxaalacetaattransamina- se (5), ornithinedecarboxylase, gammaglutamyltranspeptidase, ureumstikstof, albumine, bloedcreatinine, totaal bilirubine en totaal serumproteïne. Voor een goede toxicologische evaluatie kan de bepaling van de lipiden, hormonen, zuur/base-evenwicht, methemoglobine en cholinesterase-activiteit noodzakelijk zijn. Om het onderzoek van de waargenomen effecten verder uit te breiden, kan zo nodig verder klinisch-biochemisch onderzoek worden verricht. |
|
d) |
Routinematig urineonderzoek is alleen vereist wanneer daartoe op grond van de verwachte of waargenomen toxiciteit een indicatie bestaat. |
In het geval van ontoereikende basisgegevens uit het verleden dient de bepaling van hematologische en klinisch-biochemische parameters voordat met de toediening wordt begonnen aandacht te krijgen.
Op alle dieren moet een volledige macroscopische necropsie worden verricht, waarbij het uitwendige lichaamsoppervlak, alle lichaamsopeningen, alsmede de schedel-, borst- en buikholte en hun inhoud worden onderzocht. De lever, nieren, bijnieren en testes moeten zo spoedig mogelijk na de sectie nat worden gewogen om uitdroging te voorkomen. De volgende organen en weefsels moeten in een geschikt medium worden bewaard voor eventueel later histopathologisch onderzoek: alle organen die met het blote oog zichtbare letsels vertonen, longen — die in hun geheel moeten worden verwijderd, gewogen en behandeld met een geschikt fixatief om ervoor te zorgen dat de longstructuur intact blijft {perfusie met een fixatief wordt als een doeltreffende methode beschouwd), weefsels van de nasopharynx, hersenen — inclusief delen van medulla/pons, cortex cerebelli en cortex cerebri, hypofyse, schildklier/bijschildklieren, thymusweefsel, luchtpijp, hart, aorta, speekselklieren, lever, milt, nieren, bijnieren, alvleesklier, geslachtsklieren, uterus, (secundaire geslachtsorganen), (huid), galblaas (indien aanwezig), slokdarm, maag, duodenum, jejunum, ileum, blinde darm, colon, rectum, urineblaas, representatieve lymfklie-ren, (vrouwelijke borstklier), (dijbeenspieren), perifere zenuwen, (ogen), borstbeen met beenmerg, (dijbeen — inclusief gewrichtsvlak), (ruggemerg op drie plaatsen — cervicaal, mediothoracaal en lumbaal) en (traanklieren). (De tussen haakjes vermelde weefsels hoeven alleen te worden onderzocht als daarvoor aanwijzingen zijn vanwege toxicologische waarnemingen of als het orgaan is aangetast.)
|
a) |
Op de ademhalingswegen en andere organen weefsels van alle dieren in de controlegroep en de groep die de hoogste dosis heeft ontvangen, moet een volledig histopathologisch onderzoek worden verricht. |
|
b) |
Alle met het blote oog zichtbare letsels moeten worden onderzocht. |
|
c) |
De aangetaste organen dienen in dieren in andere dosisgroepen te worden onderzocht. |
|
d) |
De longen van de dieren in de groep die een lage dosis heeft ontvangen, en van die in de tussengroep dienen ook histopathologisch te worden onderzocht, aangezien op deze manier een goed beeld van de gezondheidstoestand van de dieren wordt verkregen. Verder routinematig histopathologisch onderzoek is bij de dieren in deze groepen als vaste regel niet vereist, maar moet steeds worden verricht op de organen die in de groep die een hoge dosis heeft ontvangen, letsels bleken te vertonen. |
|
e) |
Wordt van een satellietgroep gebruik gemaakt dan moet histopathologisch onderzoek worden verricht op de weefsels en organen waar bij andere behandelde groepen effecten blijken te zijn opgetreden. |
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek, het aantal dieren dat letsels vertoont, de aard van de letsels en het percentage dieren waarbij ieder type letsel voorkomt. De resultaten moeten met behulp van een voor dit doel geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voer, enz.; |
|
— |
proefomstandigheden: Beschrijving van de blootstellingsapparatuur: met inbegrip van ontwerp, type, afmetingen, luchtbron, systeem voor het bereiden van stof- en vloeistofaerosolen, methoden voor het conditioneren van de lucht, behandeling van de afgewerkte lucht en wijze waarop de dieren tijdens de proeven in een blootstellingskamer zijn ondergebracht als deze wordt gebruikt. Er moet een beschrijving worden gegeven van de apparatuur voor het meten van de temperatuur, de vochtigheid en, in voorkomend geval, de stabiliteit van de concentratie en de deeltjesgrootte van de aerosolen. Gegevens betreffende de blootstelling: deze moeten in tabelvorm worden gerangschikt en worden voorzien van gemiddelde waarden en een maat voor de variabiliteit {bijvoorbeeld standaarddeviatie). Zij dienen te omvatten:
|
|
— |
gegevens over de toxische reactie naar geslacht en concentratie; |
|
— |
waar mogelijk het dosisniveau waarop geen effect is waargenomen; |
|
— |
tijdstip gedurende de studie waarop de dood intreedt of aangeven of dieren tot het einde van de proef in leven bleven; |
|
— |
beschrijving van toxische of andere effecten; niveau waarop de concentratie geen effect heeft; |
|
— |
tijdstip waarop een abnormaal verschijnsel werd waargenomen en verloop hiervan; |
|
— |
gegevens over voer en lichaamsgewicht; |
|
— |
oftalmologische bevindingen; |
|
— |
uitgevoerd hematologisch onderzoek en resultaten; |
|
— |
uitgevoerd klinisch-biochemisch onderzoek en resultaten (resultaten van het urineonderzoek inbegrepen); |
|
— |
bevindingen van de necropsie; |
|
— |
gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
waar toepasselijk, statistische verwerking van de resultaten; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.30. CHRONISCHE TOXICITEITSTEST
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
De teststof wordt normaal gesproken zeven dagen per week langs een geschikte weg aan verscheidene groepen proefdieren gedurende een groot deel van hun levensduur toegediend. Er wordt een dosis per groep gebruikt. Tijdens en na de blootstelling aan de reststof worden de proefdieren dagelijks op tekenen van toxiciteit onderzocht.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
1.6.1. Voorbereidingen
Voor het onderzoek worden de dieren ten minste vijf dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Voor het onderzoek worden gezonde, jonge dieren op willekeurige wijze in de te behandelen en controlegroepen ingedeeld.
1.6.2. Proefomstandigheden
Er wordt de voorkeur gegeven aan ratten.
Op grond van de resultaten van eerder uitgevoerd onderzoek mogen ook andere diersoorten (knaagdieren of niet-knaagdieren) worden gebruikt. Er dient gebruik te worden gemaakt van stammen van jonge, gezonde dieren die gewoonlijk in laboratoria worden gebruikt. Met de dosering dient zo spoedig mogelijk na het verspenen te worden begonnen.
Bij het begin van het onderzoek mag het gewicht van de dieren niet meer dan ± 20 % van het gemiddelde gewicht afwijken. Indien een studie naar de subchronische orale toxiciteit is uitgevoerd ter voorbereiding op een chronisch toxiciteitsonderzoek, dienen in beide studies dezelfde soort en stam te worden gebruikt.
Bij knaagdieren moeten voor ieder dosisniveau en de parallelle controlegroep ten minste 40 dieren (20 wijfjes en 20 mannetjes) worden gebruikt. De wijfjes moeten nulliparae zijn en mogen niet drachtig zijn. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met bet aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood.
In het geval van niet-knaagdieren kan worden volstaan met een kleiner aantal dieren, doch ten minste vier per geslacht per groep.
Naast de parallelle controlegroep dienen ten minste drie dosisniveaus te worden gebruikt. Het hoogste dosisniveau moet leiden tot duidelijke tekenen van toxiciteit, zonder dat het evenwel leidt tot overmatige sterfte onder de dieren.
Bij het laagste dosisniveau mogen geen tekenen van toxiciteit optreden.
De tussenliggende doses moeten worden gekozen in een gebied halverwege tussen de hoge en de lage dosis.
Bij de keuze van de dosisniveaus dient rekening te worden gehouden met de gegevens uit eerder uitgevoerd toxiciteitsonderzoek.
De frequentie van de blootstelling is normaliter dagelijks. Indien de teststof in het drinkwater wordt toegediend of met het voer wordt gemengd, dient dit steeds beschikbaar te zijn.
Er dient gebruik te worden gemaakt van een parallelle controlegroep die, afgezien van de blootstelling aan de teststof, in elk opzicht identiek is aan de behandelde groepen.
In speciale omstandigheden, zoals bij inhalatiestudies met aerosolen of bij het gebruik van een emulgator van niet-gekarakteriseerde biologische activiteit in orale studies, dient ook een negatieve controlegroep te worden gebruikt. De negatieve controlegroep wordt op dezelfde wijze behandeld als alle andere proefdieren, met dien verstande dat deze controlegroep niet aan de teststof of een medium moet worden blootgesteld.
Toediening geschiedt voornamelijk oraal of via inhalatie. De keuze van de toedieningsweg hangt af van de fysische en chemische eigenschappen van de teststof en de meest waarschijnlijke blootstellingsweg bij de mens.
Toediening via de huid levert aanzienlijke praktische problemen op. Chronische systemische toxiciteit die het resultaat is van opname via de huid, kan normaal gesproken worden afgeleid uit de resultaten van de orale test en de mate van absorptie via de huid, die kan worden afgeleid uit eerder uitgevoerd onderzoek naar de percutane toxiciteit.
Indien de teststof in het maagdarmkanaal wordt geresorbeerd, en de blootstelling van de mens onder meer langs orale weg plaatsvindt, verdient orale toediening de voorkeur, tenzij er contra-indicaties zijn. De dieren moeten de teststof toegediend krijgen in hun voer, opgelost in het drinkwater of in capsules. In het ideale geval dient de dosis zeven dagen per week dagelijks te worden toegediend, omdat bij dosering gedurende vijf dagen per week het dier zich in de tijd dat geen dosis wordt toegediend, eventueel herstelt of de toxiciteitsverschijnselen verdwijnen, waardoor de resultaten en de evaluatie daarvan kunnen worden beïnvloed. Voornamelijk uit praktische overwegingen echter wordt dosering gedurende vijf dagen per week aanvaardbaar geacht.
Aangezien bij inhalatiestudies de technische problemen ingewikkelder zijn dan bij andere toedieningswegen het geval is, volgen hieronder meer gedetailleerde aanwijzingen met betrekking tot deze wijze van toediening. In specifieke situaties vormt intratracheale instillatie wellicht een deugdelijk alternatief.
Bij chronische blootstellingen baseert men zich gewoonlijk op de verwachte praktijksituatie in de industrie, in welk geval de dieren vijf dagen per week gedurende zes uur na het bereiken van de juiste concentratie in de blootstellingskamer worden blootgesteld (onderbroken blootstelling), of op een mogelijke blootstelling in het milieu, in welk geval de dieren zeven dagen per week gedurende 22 tot 24 uur per dag worden blootgesteld (continue expositie), met ongeveer een uur voor het voederen van de dieren (iedere dag op dezelfde tijd) en het schoonmaken van de kamer.
In beide gevallen worden de dieren gewoonlijk blootgesteld aan een vaste concentratie van teststoffen. Een belangrijk verschil tussen onderbroken en continue expositie is dat er bij de eerste een periode van zeventien tot achttien uur is, waarin de dieren zich van de effecten van elke dagelijkse expositie kunnen herstellen; gedurende de weekeinden is deze herstelperiode nog langer.
De keuze tussen onderbroken of continue blootstelling hangt af van de doeleinden van het onderzoek en van de na te bootsen situatie bij de mens. Bepaalde technische moeilijkheden verdienen echter de aandacht. Zo kunnen bijvoorbeeld de voordelen van continue expositie voor het simuleren van de milieucondities wegvallen in verband met de noodzaak de dieren tijdens de blootstelling te eten en te drinken te geven, en de behoefte aan meer gecompliceerde (en betrouwbaardere) aerosol- en gasgeneratietechnieken en meettechnieken.
De dieren worden aan de teststoffen blootgesteld in inhalatiekamers die zodanig gebouwd moeten zijn dat kan worden gezorgd voor een dynamische luchtdoorstroming van ten minste twaalf luchtverversingen per uur, een toereikend zuurstofgehalte en een gelijkmatige verdeling van de teststof in de atmosfeer. De controle- en blootstellingskamers dienen qua structuur identiek te zijn, zodat, behalve waar het de blootstelling aan de teststoffen aangaat, in alle opzichten vergelijkbare blootstellingsomstandigheden gewaarborgd zijn. Binnen de kamer wordt over het algemeen een geringe onderdruk gehandhaafd om te voorkomen dat de teststof naar buiten lekt. De kamers dienen zodanig te zijn ontworpen dat de dieren elkaar zo min mogelijk verdringen. Als algemene regel voor het verzekeren van een stabiele atmosfeer in de blootstellingskamer geldt dat het totale volume van de proefdieren niet meer mag bedragen dan 5 % van het volume van de kamer.
De volgende parameters moeten worden gemeten of gecontroleerd:
|
i) |
Luchtdoorstroming: het aantal verversingen per uur in de kamer dient bij voorkeur continu te worden gemeten. |
|
ii) |
Tijdens de dagelijkse blootstelling mag de concentratie met niet meer dan ± 15 % van het gemiddelde afwijken. Tijdens de gehele duur van de studie moeten de dagelijkse concentraties zo constant mogelijk worden gehouden. |
|
iii) |
Temperatuur en vochtigheid: voor knaagdieren moet de temperatuur op 22 oC (± 2 oC) en de vochtigheid in de kamer op 30 tot 70 % worden gehouden, behalve wanneer water wordt gebruikt om de reststof in de atmosfeer van de expositiekamer te verstuiven. Beide waarden dienen bij voorkeur continu te worden gemeten. |
|
iv) |
Metingen van de deeltjesgrootte: wanneer de atmosfeer vloeibare of vaste aerosolen bevat, moet de verdeling van de deeltjesgrootte worden bepaald. De aerosoldeeltjes dienen een zodanige afmeting te hebben dar zij voor de gebruikte proefdieren in te ademen zijn. Monsters van de atmosfeer in de kamer dienen te worden genomen op ademhalingshoogte van de dieren. Her luchtmonster dient representatief te zijn voor de verdeling van de deeltjes waaraan de dieren zijn blootgesteld en dient, op gravimetrische basis, alle aerosoldeeltjes te bevatten, zelfs wanneer een groot gedeelte daarvan niet in te ademen is. Gedurende de werking van de apparatuur voor de verstuiving van de aerosoldeeltjes moeten regelmatig analyses worden uitgevoerd van de deeltjesgrootte, teneinde de stabiliteit van het aerosol na te gaan, en daarna tijdens de blootstelling zo vaak als nodig is om de stabiliteit van de verdeling van de deeltjesgrootte waaraan de dieren zijn blootgesteld, te bepalen. |
De toedieningsperiode dient ten minste twaalf maanden te bedragen.
1.6.3. Uitvoering
Ten minste éénmaal per dag dient een zorgvuldig klinisch onderzoek te worden verricht. Iedere dag moeten aanvullende waarnemingen worden gedaan, waarbij ervoor moet worden gezorgd dat er zo weinig mogelijk dieren voor het onderzoek verloren gaan, bijvoorbeeld door necropsie te verrichten op dood aangetroffen dieren of deze gekoeld te bewaren en afzondering of opoffering van zwakke of stervende dieren. Er moeten zorgvuldige waarnemingen worden gedaan, teneinde het optreden en ontwikkelen van alle toxische effecten te ontdekken en ervoor te zorgen dat er zo min mogelijk dieren verloren gaan als gevolg van ziekte, autolyse of kannibalisme.
Klinische tekenen, waaronder ook neurologische en oculaire veranderingen en sterfte, moeten voor alle dieren worden vastgesteld. Het tijdstip waarop de toxische verschijnselen, met inbegrip van verdachte tumoren, voor het eerst optreden, en de ontwikkeling ervan, dienen te worden vastgelegd.
Gedurende de eerste dertien weken van het onderzoek dient het lichaamsgewicht van elk dier afzonderlijk eenmaal per week te worden vastgelegd; daarna ten minste om de vier weken. Gedurende de eerste dertien weken van het onderzoek dient het verbruik van voer wekelijks te worden bepaald; daarna om de drie maanden, tenzij wijzigingen in de gezondheidstoestand of het lichaamsgewicht van het dier anders voorschrijven.
Een hematologish onderzoek (bijvoorbeeld hemoglobinegehalte, hematocriet, totaal aantal rode bloedlichaampjes, totaal aantal witte bloedlichaampjes, bloedplaatjes of andere metingen van de stollingseigenschappen) dient te worden verricht na drie maanden, zes maanden en vervolgens om de zes maanden en aan het einde van het onderzoek op bloedmonsters van alle niet-knaagdieren en van tien ratten per geslacht uit alle groepen. Indien mogelijk dienen deze monsters telkens afkomstig te zijn van dezelfde ratten. Bij niet-knaagdieren dient bovendien vóór de test een monster te worden genomen.
Indien op grond van klinische waarnemingen wordt vermoed dat de gezondheidstoestand van de dieren tijdens het onderzoek achteruitgaat, dient bij de betrokken dieren een differentiële telling van bloedcellen te worden uitgevoerd.
Een differentiële telling van bloedcellen wordt uitgevoerd op monsters afkomstig van de dieren in de hoogste dosisgroep en de controlegroep. Bij de daaropvolgende lagere groep(en) worden alleen differentiële tellingen van bloedcellen verricht als er tussen de hoogste groep en de controlegroepen een groot verschil bestaat of als daartoe op grond van het pathologisch onderzoek een indicatie wordt gegeven.
Van alle niet-knaagdieren en van tien ratten per geslacht uit alle groepen, indien mogelijk van dezelfde ratten en met dezelfde tussenpozen als bij het bloedonderzoek, moeten met het oog op een analyse urinemonsters worden genomen. In het geval van knaagdieren dienen bij de afzonderlijke dieren of op een samengevoegd monster per geslacht per groep de volgende bepalingen te worden verricht:
|
— |
uiterlijk: volume en dichtheid voor de afzonderlijke dieren; |
|
— |
eiwit, glucose, ketonen, occult bloed (semi-kwantitatief); en |
|
— |
microscopie van sediment (semi-kwantitatief). |
Ongeveer om de zes maanden en aan het einde van het onderzoek worden bloedmonsters voor klinisch-biochemische metingen genomen bij alle niet-knaagdieren en bij tien ratten per geslacht uit alle groepen, indien mogelijk steeds bij dezelfde ratten. Bij niet-knaagdieren dient bovendien voor het onderzoek een monster te worden genomen. Uit deze monsters wordt het plasma bereid, waarop de volgende bepalingen worden verricht:
|
— |
totaal eiwitgehalte; |
|
— |
albuminegehalte; |
|
— |
leverfunctietesten (zoals alkalische fosfataseactiviteit, glutamaatpyruvaattransaminase (4) activiteit en gluta-maatoxaalacetaattransaminase (5) activiteit), gammaglutamyltranspeptidase, ornithinedecarboxylase; |
|
— |
koolhydraatstofwisseling, zoals nuchter glucosegehalte van het bloed; |
|
— |
nierfunctietesten zoals ureumstikstof in het bloed. |
Op alle dieren, ook die welke tijdens het experiment stierven of gedood werden toen zij stervende waren, moet een volledig macroscopisch onderzoek worden verricht. Van alle dieren moeten, voordat zij gedood worden, bloedmonsters worden genomen voor differentiële tellingen van bloedcellen. Alle met het blote oog zichtbare letsels, tumoren of letsels waarvan wordt aangenomen dat het tumoren zijn, dienen te worden bewaard. Getracht moet worden om de macroscopische waarnemingen te correleren aan de microscopische bevindingen.
Alle organen en weefsels dienen voor microscopisch onderzoek te worden bewaard. Gewoonlijk zijn dat de volgende organen en weefsels: hersenen (6) (medulla/pons, cortex cerebelli, cortex cerebri), hypofyse, schildklier (met bijschildklieren), thymus, longen (met luchtpijp), hart, aorta, speekselklieren, lever (6), milt, nieren, bijnieren, slokdarm, maag, duodenum, jejunum, ileum, blinde darm, colon, rectum, uterus, urineblaas, lymfklieren, alvleesklier, geslachtsklieren (6), secundaire geslachtsorganen, vrouwelijke borstklier, huid, spieren, perifere zenuwen, ruggenmerg (cervicaal, thoracaal, lumbaal), borstbeen met beenmerg, dijbeen (met gewricht) en ogen. Vullen van de longen en urineblaas met een fixatief is de beste manier om deze weefsels te bewaren. Bij inhalatiestudies is het vullen van de longen van wezenlijk belang voor een goed histopathologisch onderzoek. Bij speciale studies zoals inhalatiestudies dient de gehele tractus respiratorius te worden onderzocht, inclusief neus, pharynx en larynx.
Indien nog ander klinisch onderzoek wordt verricht, dient de daaruit verkregen informatie vóór het microscopisch onderzoek beschikbaar te zijn, omdat dit voor de patholoog belangrijke aanwijzingen kan bevatten.
Alle zichtbare veranderingen, in het bijzonder tumoren en andere letsels in enig orgaan, dienen microscopisch te worden onderzocht. Daarnaast verdient het aanbeveling nog de volgende onderzoekingen te verrichten:
|
a) |
Microscopisch onderzoek van alle bewaarde organen en weefsels met een volledige beschrijving van alle geconstateerde letsels bij:
|
|
b) |
Organen en weefsels die afwijkingen vertonen die veroorzaakt (kunnen) zijn door de teststof, worden ook bij de lagere dosisgroepen onderzocht. |
|
c) |
Mocht uit het experiment blijken dat de normale levensduur van de dieren aanzienlijk wordt verkort of dat er effecten geïnduceerd worden die een toxische reactie zouden kunnen beïnvloeden, dan moet de eerstvolgende lagere dosisgroep worden onderzocht zoals hierboven beschreven. |
|
d) |
Voor een juiste beoordeling van de betekenis van de bij de blootgestelde dieren waargenomen veranderingen is bekendheid met het voorkomen van letsels die bij de gebruikte dierstam gewoonlijk voorkomen (onder dezelfde laboratoriumomstandigheden, dat wil zeggen controlegegevens uit het verleden) onontbeerlijk. |
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek, het aantal dieren dat letsels vertoont, en het percentage dieren waarbij ieder type letsel voorkomt. De resultaten moeten met behulp van een voor dit doel geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voer, enzovoort; |
|
— |
proefomstandigheden: Beschrijving van de blootstellingsapparatuur: Met inbegrip van ontwerp, type, afmetingen, luchtbron, systeem voor het bereiden van stof- en vloeistof-aerosolen, methode voor het conditioneren van de lucht, behandeling van de afgewerkte lucht en wijze waarop de dieren tijdens de proeven in een blootstellingskamer zijn ondergebracht als deze wordt gebruikt. Er moet een beschrijving worden gegeven van de apparatuur voor het meten van de temperatuur, de vochtigheid en, in voorkomend geval, de stabiliteit van de concentratie en de deeltjesgrootte van de aerosolen. Gegevens betreffende de blootstelling: Deze moeten in tabelvorm worden gerangschikt en voorzien worden van gemiddelde waarden en een maat voor de variabiliteit (bij voorbeeld standaarddeviatie). Ze dienen te omvatten:
|
|
— |
dosisniveaus (met het eventuele medium) en concentraties; |
|
— |
gegevens over de toxische reactie naar geslacht en dosis; |
|
— |
dosis- of concentratieniveau waarop geen effect is waargenomen; |
|
— |
tijdstip gedurende het onderzoek waarop de dood intreedt of aangeven of dieren tot het einde van de proef in leven bleven; |
|
— |
beschrijving van toxische of andere effecten; |
|
— |
tijdstip waarop een abnormaal verschijnsel werd waargenomen en verloop hiervan; |
|
— |
gegevens over voer en lichaamsgewicht; |
|
— |
oftalmologische bevindingen; |
|
— |
uitgevoerd hematologisch onderzoek en alle resultaten; |
|
— |
uitgevoerd klinisch-biochemisch onderzoek en alle resultaten (met inbegrip van resultaten van het urineonderzoek); |
|
— |
bevindingen van de necropsie; |
|
— |
gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
statistische verwerking van de resultaten, waar dat mogelijk is; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.31. ONDERZOEK NAAR DE PRENATALE ONTWIKKELINGSTOXICITEIT
1. METHODE
Deze methode is overgenomen van TG 414 (2001) van de OESO.
1.1. INLEIDING
Deze testmethode voor ontwikkelingstoxiciteit is bedoeld om algemene informatie te verschaffen over de effecten van prenatale blootstelling op het drachtige proefdier en het zich ontwikkelende organisme in utero; daarbij kunnen de effecten op het moederdier en het afsterven, structurele abnormaliteiten of afwijkende groei bij de foetus worden bepaald. Functionele gebreken zijn weliswaar een belangrijk aspect van ontwikkeling, maar zijn niet in deze testmethode opgenomen. Hierop kan worden getest door een apart onderzoek uit te voeren of door als uitbreiding van dit onderzoek de testmethode voor ontwikkelingsneurotoxiciteit uit te voeren. Voor informatie over het testen op functionele gebreken en andere postnatale effecten kan waar nodig de testmethode voor het reproductietoxiciteitsonderzoek over twee generaties en het onderzoek naar ontwikkelingsneurotoxiciteit worden geraadpleegd.
Specifieke aanpassingen van deze testmethode op basis van specifieke kennis omtrent bijvoorbeeld de fysisch-chemische of toxicologische eigenschappen van de teststof kunnen in bepaalde gevallen nodig zijn. Dergelijke aanpassingen zijn aanvaardbaar wanneer overtuigend wetenschappelijk bewijsmateriaal erop wijst dat de test door de aanpassing meer informatie oplevert. In zo'n geval dient het wetenschappelijk bewijsmateriaal zorgvuldig in het verslag te worden vermeld.
1.2. DEFINITIES
Ontwikkelingstoxicologie: de bestudering van schadelijke effecten op het zich ontwikkelende organisme die kunnen voortvloeien uit blootstelling vóór de bevruchting, tijdens de prenatale ontwikkeling of postnataal tot het tijdstip van geslachtelijke rijping. De belangrijkste uitingen van ontwikkelingstoxiciteit zijn: 1) dood van het organisme, 2) structurele abnormaliteiten, 3) afwijkende groei en 4) functionele gebreken. Ontwikkelingstoxicologie werd vroeger vaak teratologie genoemd.
Schadelijk effect: een aan de behandeling gerelateerde afwijking van de normale toestand die het vermogen van een organisme om te overleven, zich te reproduceren of zich aan de omgeving aan te passen vermindert. In het kader van de ontwikkelingstoxicologie in de ruimste zin vallen hier alle effecten onder die de normale ontwikkeling van de vrucht zowel voor als na de geboorte storen.
Afwijkende groei: een afwijking in het gewicht of de grootte van een of meer organen of het lichaam van een jong.
Afwijkingen (anomalieën): structurele afwijkingen in de ontwikkeling; hieronder vallen zowel misvormingen als variaties (28).
Misvorming/ernstige abnormaliteit: een structurele verandering die als schadelijk voor het dier wordt beschouwd (en ook dodelijk kan zijn) en meestal zelden voorkomt.
Variatie/lichte abnormaliteit: een structurele verandering die wordt geacht weinig of geen nadelige gevolgen voor het dier te hebben; deze kan van voorbijgaande aard zijn en betrekkelijk vaak in de controlepopulatie voorkomen.
Vrucht: alles wat in enige fase van de ontwikkeling vanaf de bevruchting tot de geboorte uit een bevruchte eicel ontstaat, met inbegrip van de extra-embryonale vliezen alsmede het embryo of de foetus.
Implantatie (innesteling): de hechting van de blastocyst aan de epitheelbekleding van de uterus, met inbegrip van de penetratie door het epitheel van de uterus en de inbedding in het endometrium.
Embryo: de vroege of ontwikkelingsfase van een organisme, meer in het bijzonder het ontwikkelingsproduct van de bevruchting van een eicel nadat de lange as verschenen is en totdat alle belangrijke structuren aanwezig zijn.
Embryotoxiciteit: schadelijke effecten op de normale structuur, ontwikkeling, groei en/of levensvatbaarheid van een embryo.
Foetus: het ongeboren jong in de post-embryonale periode.
Foetotoxiciteit: schadelijke effecten op de normale structuur, ontwikkeling, groei en/of levensvatbaarheid van een foetus.
Abortus: de voortijdige uitstoting uit de uterus van de producten van de conceptie: het embryo of een niet-levensvatbare foetus.
Resorptie: een vrucht die na de implantatie in de uterus sterft en wordt of is geresorbeerd.
Vroege resorptie: aanwijzingen voor implantatie zonder als zodanig te herkennen embryo/foetus.
Late resorptie: een dood embryo of een dode foetus met uiterlijke degeneratieve veranderingen.
NOAEL: afkorting voor „no-observed-adverse-effect level” (dosis zonder waargenomen schadelijke effecten): de hoogste dosis of het hoogste blootstellingsniveau waarbij geen aan de behandeling verbonden schadelijke effecten worden waargenomen.
1.3. REFERENTIESTOF
Geen.
1.4. PRINCIPE VAN DE TESTMETHODE
De teststof wordt aan drachtige dieren toegediend, normaal gesproken ten minste vanaf de implantatie tot één dag voor de dag waarop ze zullen worden gedood en deze dag dient zo dicht mogelijk bij de normale werpdatum te liggen zonder het risico te lopen dat er gegevens verloren gaan door een voortijdige worp. De testmethode is niet bedoeld om uitsluitend de organogenese-periode te onderzoeken (d.w.z. dag 5-15 bij knaagdieren en dag 6-18 bij het konijn), maar ook de effecten vanaf een eventuele pre-implantatie gedurende de gehele dracht tot de dag vóór de keizersnede. Kort voor de keizersnede worden de vrouwtjes gedood, wordt de inhoud van de uterus onderzocht en worden de foetussen onderzocht op van buitenaf zichtbare anomalieën en veranderingen in zachte weefsels en het skelet.
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Keuze van de diersoort
Er wordt aanbevolen de test bij de meest relevante soort uit te voeren en laboratoriumsoorten en -stammen te gebruiken die meestal bij tests op prenatale ontwikkelingstoxiciteit worden gebruikt. Van de knaagdiersoorten verdient de rat de voorkeur en van de niet-knaagdieren het konijn. Als een andere soort wordt gebruikt, dient hiervoor een motivering te worden gegeven.
1.5.2. Huisvesting en voeding
De temperatuur in de proefdierruimte dient voor knaagdieren 22 oC (+ 3 oC) en voor konijnen 18 oC (+ 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater.
De dekking gebeurt in daarvoor geschikte kooien. Dieren die gedekt zijn worden bij voorkeur apart gehuisvest, maar ook groepjes met kleine aantallen dieren zijn aanvaardbaar.
1.5.3. Voorbereiding van de dieren
Er worden gezonde dieren gebruikt die gedurende ten minste 5 dagen aan de omstandigheden in het laboratorium hebben kunnen wennen en waarop geen eerdere proeven zijn uitgevoerd. De kenmerken van de proefdieren qua soort, stam, herkomst, geslacht, gewicht en/of leeftijd worden vastgelegd. De dieren van alle testgroepen dienen zo veel mogelijk hetzelfde gewicht en dezelfde leeftijd te hebben. Op elk dosisniveau worden jonge volwassen vrouwtjes gebruikt die nog geen jongen hebben gehad. De vrouwtjes worden door mannetjes van dezelfde soort en stam gedekt en dekking door mannetjes met dezelfde ouders wordt vermeden. Voor knaagdieren is dag 0 van de dracht de dag waarop een vaginale prop en/of sperma wordt waargenomen. Voor konijnen is dag 0 meestal de dag van de coïtus of kunstmatige inseminatie als deze techniek wordt gebruikt. De kooien worden zodanig geplaatst dat mogelijke effecten door de plaatsing van de kooi tot een minimum worden beperkt. Elk dier krijgt een uniek identificatienummer. Vrouwtjes die gedekt zijn worden aselect ingedeeld in de controle- en behandelingsgroepen en als de vrouwtjes in groepjes gedekt zijn, worden de dieren in elk groepje gelijkelijk over de groepen verdeeld. Ook vrouwtjes die door hetzelfde mannetje bevrucht zijn, worden gelijkelijk over de groepen verdeeld.
1.6. UITVOERING
1.6.1. Aantal en geslacht van de dieren
Elke test- en controlegroep bevat een zodanig aantal vrouwtjes dat er bij obductie ongeveer 20 vrouwtjesdieren met implantatieplaatsen zijn. Groepen met minder dan 16 dieren met implantatieplaatsen zullen wellicht niet aan de eisen voldoen. Sterfte bij moederdieren maakt het onderzoek niet noodzakelijkerwijs onbruikbaar, mits deze niet hoger ligt dan ongeveer 10 %.
1.6.2. Bereiding van de doses
Als een medium of een ander additief wordt gebruikt om de toediening te vergemakkelijken, moet op de volgende kenmerken worden gelet: de effecten op de resorptie, de distributie, het metabolisme en de retentie of uitscheiding van de teststof, de effecten op de chemische eigenschappen van de teststof die de toxische kenmerken kunnen wijzigen en de effecten op het verbruik van voer of water of de voedingstoestand van de dieren. Het medium mag geen toxische effecten op de ontwikkeling of de voortplanting hebben.
1.6.3. Dosering
Normaal gesproken wordt de teststof dagelijks toegediend vanaf de implantatie (bv. dag 5 na de dekking) tot de dag vóór de geplande keizersnede. Als er voorbereidende onderzoeken beschikbaar zijn waaruit blijkt dat er geen grote kans is op verlies vóór implantatie, kan de behandeling worden uitgebreid tot de volledige drachtperiode vanaf de dekking tot één dag voor de dag waarop de dieren zullen worden gedood. Het is bekend dat een onjuiste behandeling of stress tijdens de dracht tot prenataal verlies kan leiden. Om prenataal verlies door niet aan de behandeling gerelateerde factoren te voorkomen worden onnodige manipulaties van drachtige dieren en stress door externe factoren zoals geluiden vermeden.
Er worden ten minste drie dosisniveaus en een gelijktijdige controlegroep gebruikt. Gezonde dieren worden aselect in de behandelde en controlegroepen ingedeeld. De dosisniveaus worden zodanig gekozen dat er sprake is van geleidelijk oplopende toxische effecten. Tenzij dit vanwege de fysisch/chemische aard of biologische kenmerken van de teststof onmogelijk is, wordt de hoogste dosis zodanig gekozen dat er enige ontwikkelingstoxiciteit en/of toxiciteit bij het moederdier wordt veroorzaakt (klinische verschijnselen of een afname van het lichaamsgewicht), maar geen sterfte of ernstig leed. Ten minste één lagere dosis moet minimale waarneembare toxische effecten veroorzaken. De laagste dosis mag geen verschijnselen van ontwikkelingstoxiciteit of toxiciteit bij het moederdier veroorzaken. Er wordt een dalende reeks dosisniveaus gekozen teneinde een dosisafhankelijke respons en de dosis zonder waargenomen schadelijke effecten (NOAEL) te bepalen. Intervallen van een factor twee of vier zijn vaak optimaal om de dalende dosisniveaus vast te stellen en het is vaak beter een vierde testgroep toe te voegen dan zeer grote intervallen (bv. meer dan een factor tien) tussen de doseringen te gebruiken. Hoewel het de bedoeling is een NOAEL bij het moederdier vast te stellen, kunnen ook onderzoeken waarbij een dergelijke dosis niet wordt bepaald aanvaardbaar zijn (1).
Bij de keuze van de dosisniveaus wordt rekening gehouden met eventueel bestaande gegevens over de toxiciteit en aanvullende informatie over het metabolisme en de toxicokinetiek van de teststof of verwante materialen. Deze informatie zal ook helpen aan te tonen dat het doseringsschema adequaat is.
Er wordt een gelijktijdige controlegroep gebruikt. Deze controlegroep krijgt een schijnbehandeling of, als bij de toediening van de teststof een medium wordt gebruikt, een behandeling met medium. Aan alle groepen wordt hetzelfde volume teststof of medium toegediend. De aanpak van de dieren in de controlegroep(en) is identiek aan die van de dieren in de testgroepen. Aan de mediumcontrolegroepen wordt de hoogste gebruikte mediumdosis toegediend (zoals in de laagste dosisgroep).
1.6.4. Limiettest
Als een test met één dosis van ten minste 1 000 mg/kg lichaamsgewicht/dag bij orale toediening volgens de voor dit onderzoek beschreven procedure geen waarneembare toxiciteit bij drachtige dieren of hun jongen veroorzaakt en op grond van bestaande gegevens (bv. over verwante verbindingen qua structuur en/of metabolisme) geen effect te verwachten valt, zal een volledig onderzoek met drie dosisniveaus wellicht niet nodig zijn. Het kan nodig zijn bij de limiettest op grond van de verwachte blootstelling van de mens een hogere orale dosis te gebruiken. Voor andere toedieningsvormen, zoals inhalatie of toediening op de huid, zal het maximaal haalbare blootstellingsniveau vaak worden bepaald en beperkt door de fysisch-chemische eigenschappen van de teststof (bij toediening op de huid mag bijvoorbeeld geen ernstige lokale toxiciteit optreden).
1.6.5. Toediening van de doses
De teststof of het medium wordt meestal oraal met een sonde toegediend. Als er een andere toedieningsweg wordt gebruikt, moet worden uitgelegd en gemotiveerd waarom deze gekozen is en kunnen er aanpassingen nodig zijn (2)(3)(4). De teststof wordt elke dag op ongeveer hetzelfde tijdstip toegediend.
De dosis voor een bepaald dier wordt normaal gesproken gebaseerd op de meest recente bepaling van het lichaamsgewicht. Bij de aanpassing van de dosis gedurende het laatste derde deel van de dracht moet echter zorgvuldigheid worden betracht. Voor de keuze van de dosis wordt gebruik gemaakt van bestaande gegevens om overmatige toxiciteit bij het moederdier te voorkomen. Als echter bij de behandelde moederdieren overmatige toxiciteit wordt geconstateerd, worden deze op humane wijze gedood. Als verschillende drachtige dieren tekenen van overmatige toxiciteit vertonen, moet worden overwogen de test bij deze dosisgroep tebeëindigen. Als de stof met een sonde wordt toegediend, wordt deze bij voorkeur met behulp van een maagsonde of een geschikte catheter in één dosis aan de dieren gegeven. Het maximale volume dat in één keer kan worden toegediend, is afhankelijk van de grootte van het dier. Het volume mag niet groter zijn dan 1 ml/100 g lichaamsgewicht, behalve wanneer het om een waterige oplossing gaat: in dat geval mag 2 ml/100 g lichaamsgewicht worden gebruikt. Wanneer maïsolie als medium wordt gebruikt, mag het volume niet groter zijn dan 0,4 ml/100 g lichaamsgewicht. Variaties in het toegediende volume worden tot een minimum beperkt door de concentratie aan te passen, zodat er voor alle dosisniveaus een constant volume wordt toegediend.
1.6.6. Observatie van de moederdieren
Ten minste eens per dag wordt er een klinische observatie uitgevoerd en vastgelegd, bij voorkeur elke dag op dezelfde tijd(en), waarbij rekening wordt gehouden met de periode na de toediening waarin de verwachte effecten maximaal zijn. De toestand van de dieren wordt geregistreerd, met inbegrip van dieren die gestorven of stervende zijn, relevante gedragsveranderingen en alle zichtbare tekenen van toxiciteit.
1.6.7. Lichaamsgewicht en voerconsumptie
De dieren worden op dag 0 van de dracht of uiterlijk op dag 3 van de dracht als door een externe fokker op een bekend tijdstip gedekte dieren worden geleverd, op de dag waarop de eerste dosis wordt toegediend, ten minste om de drie dagen gedurende de toedieningsperiode en op de dag waarop ze zullen worden gedood, gewogen.
De voerconsumptie wordt om de drie dagen geregistreerd en dit gebeurt op dezelfde dagen als waarop het lichaamsgewicht wordt bepaald.
1.6.8. Obductie
De vrouwtjes worden één dag voor de verwachte worp gedood. Vrouwtjes die vóór de dag waarop ze zullen worden gedood tekenen van abortus of voortijdige worp vertonen, worden gedood en aan een grondig macroscopisch onderzoek onderworpen.
Op het tijdstip waarop het moederdier wordt gedood of tijdens het onderzoek sterft, wordt het macroscopisch onderzocht op structurele abnormaliteiten of pathologische veranderingen. Om beïnvloeding tot een minimum te beperken worden de beoordeling van het moederdier tijdens de keizersnede en de latere analyse van de foetussen bij voorkeur uitgevoerd zonder de testgroep te kennen.
1.6.9. Onderzoek van de inhoud van de uterus
Onmiddellijk nadat het dier gedood is of zo spoedig mogelijk na sterfte wordt de uterus verwijderd en wordt nagegaan of de dieren drachtig zijn. Wanneer een dier niet drachtig lijkt, wordt de uterus nader onderzocht (bijvoorbeeld door kleuring met ammoniumsulfide voor knaagdieren en Salewski-kleuring of een andere geschikte methode voor konijnen) om dit te bevestigen (5).
De uterus van drachtige dieren wordt met de cervix gewogen. Bij drachtige dieren die tijdens het onderzoek dood zijn aangetroffen wordt het gewicht van de uterus niet bepaald.
Bij drachtige dieren wordt het aantal corpora lutea bepaald.
De inhoud van de uterus wordt onderzocht op het aantal dode embryo's of foetussen en levensvatbare foetussen. Om het relatieve tijdstip te bepalen waarop de vrucht gestorven is, wordt de mate van resorptie beschreven (zie punt 1.2),
1.6.10. Onderzoek van de foetussen
Van elke foetus worden het geslacht en het lichaamsgewicht bepaald.
Elke foetus wordt onderzocht op uitwendige afwijkingen (6).
De foetussen worden onderzocht op afwijkingen in het skelet en de zachte weefsels (zoals variaties en misvormingen of anomalieën) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23)(24). Indeling van afwijkingen in de foetus in categorieën verdient de voorkeur, maar is niet noodzakelijk. Wanneer indeling wel plaatsvindt, worden de criteria voor elke categorie duidelijk vermeld. Er wordt met name gelet op de voortplantingsorganen, die op tekenen van een afwijkende ontwikkeling worden onderzocht.
Bij knaagdieren wordt ongeveer de helft van elk nest behandeld en onderzocht met het oog op skeletafwijkingen. De andere helft wordt behandeld en onderzocht met het oog op afwijkingen in zachte weefsels, waarbij erkende of geschikte methoden voor seriesneden of zorgvuldige macroscopische ontleedtechnieken worden gebruikt.
Bij niet-knaagdieren zoals konijnen worden alle foetussen onderzocht op afwijkingen van zowel de zachte weefsels als het skelet. De lichamen van deze foetussen worden met behulp van zorgvuldige ontleedtechnieken beoordeeld op afwijkingen van de zachte weefsels, waarbij ook procedures kunnen worden gebruikt om de interne hartstructuur nader te beoordelen (25). Van de helft van de op deze wijze onderzochte foetussen wordt het hoofd verwijderd en behandeld met het oog op de beoordeling van de zachte weefsels (zoals de ogen, de hersenen, de neusgangen en de tong) met gangbare methoden voor seriesneden (26) of een even gevoelige methode. De lichamen van deze foetussen en de overige intacte foetussen worden met behulp van dezelfde methoden als voor knaagdieren zijn beschreven, behandeld en onderzocht met het oog op skeletafwijkingen.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens worden voor de moederdieren en hun jongen individueel gerapporteerd met een overzicht in tabelvorm, waarbij voor elke testgroep worden vermeld: het aantal dieren aan het begin van de test, het aantal dieren dat tijdens de test dood is aangetroffen of met het oog op een humane behandeling is gedood, het tijdstip van sterfte of humane doding, het aantal drachtige vrouwtjes, het aantal dieren met toxiciteitsverschijnselen, een beschrijving van de waargenomen toxiciteitsverschijnselen met vermelding van de aanvang, de duur en de ernst van de toxische effecten, de aard van de waarnemingen bij de embryo's/foetussen en alle relevante gegevens over de nesten.
De getalsmatige resultaten worden met een geschikte statistische methode geëvalueerd, waarbij het nest als de eenheid voor gegevensanalyse wordt gebruikt. Er wordt een algemeen aanvaarde statistische methode gebruikt; de statistische methoden worden bij de opzet van het onderzoek gekozen en gemotiveerd. Ook de gegevens over de dieren die niet overleven tot het tijdstip waarop ze zouden worden gedood, worden gerapporteerd. Deze gegevens kunnen in de groepsgemiddelden worden opgenomen als dit relevant is. De relevantie van de over deze dieren verkregen gegevens, en derhalve de opname in of uitsluiting van groepsgemiddelden, moet van geval tot geval worden beoordeeld en gemotiveerd.
2.2. EVALUATIE VAN DE RESULTATEN
De resultaten van het onderzoek naar de prenatale ontwikkelingstoxiciteit worden aan de hand van de waargenomen effecten beoordeeld. In deze evaluatie wordt de volgende informatie opgenomen:
|
— |
de testresultaten bij de moederdieren en de embryo's/foetussen, met inbegrip van een evaluatie van het verband of het ontbreken daarvan tussen de blootstelling van de dieren aan de teststof en het optreden en de ernst van alle bevindingen; |
|
— |
de criteria die zijn gehanteerd voor de indeling van externe afwijkingen en afwijkingen in de zachte weefsels en het skelet bij foetussen in categorieën, als deze indeling heeft plaatsgevonden; |
|
— |
eventueel controlegegevens uit het verleden om de interpretatie van de resultaten van het onderzoek te bevorderen; |
|
— |
de getallen die bij de berekening van alle percentages of indices zijn gebruikt; |
|
— |
een adequate statistische analyse van de resultaten van het onderzoek, indien van toepassing, waarbij voldoende informatie over de analysemethode wordt vermeld, zodat een onafhankelijke evaluator/statisticus de analyse kan beoordelen en reconstrueren. |
Wanneer bij een onderzoek wordt aangetoond dat er geen sprake is van toxische effecten, moet nader onderzoek worden overwogen om de resorptie en de biologische beschikbaarheid van de teststof vast te stellen.
2.3. INTERPRETATIE VAN DE RESULTATEN
Een onderzoek naar de prenatale ontwikkelingstoxiciteit levert informatie op over de effecten van herhaalde blootstelling aan een stof tijdens de dracht op de moederdieren en de ontwikkeling van hun jongen in de uterus. De resultaten van het onderzoek moeten in samenhang met de resultaten van het onderzoek naar subchronische en reproductietoxiciteit alsmede toxicokinetisch en ander onderzoek worden geïnterpreteerd. Aangezien de nadruk ligt op zowel de algemene toxiciteit voor de moederdieren als de ontwikkelingstoxiciteit, zal met de resultaten van het onderzoek tot op zekere hoogte onderscheid kunnen worden gemaakt tussen effecten op de ontwikkeling zonder algemene toxiciteit en effecten die zich alleen voordoen bij niveaus die ook voor het moederdier toxisch zijn (27).
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag wordt de volgende specifieke informatie opgenomen:
|
|
Teststof:
|
|
|
Medium (indien van toepassing):
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten: |
|
|
Gegevens over de toxische reacties bij de moederdieren per dosis, waaronder in elk geval maar niet uitsluitend:
|
|
|
Eindpunten voor ontwikkelingstoxiciteit per dosis voor nesten met implantaties, met inbegrip van:
|
|
|
Eindpunten voor ontwikkelingstoxiciteit per dosis voor nesten met levende foetussen, met inbegrip van:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Kavlock, R.J. et al. (1996). A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399-410. |
|
(2) |
Kimmel, C.A. and Francis, E.Z. (1990). Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386-398. |
|
(3) |
Wong, B.A., et al. (1997). Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; 1-8. |
|
(4) |
US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study. |
|
(5) |
Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterus der Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367. |
|
(6) |
Edwards, J.A. (1968). The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY. |
|
(7) |
Inouye, M. (1976). Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171-173. |
|
(8) |
Igarashi, E. et al. (1992) Frequency of Spontaneous Axial Skeletal Variations Detected by the Double Staining Technique for Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32; 381-391. |
|
(9) |
Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47: 229-242. |
|
(10) |
Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476. |
|
(11) |
Barrow, M.V. and Taylor, W.J. (1969). A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127; 291 -306. |
|
(12) |
Fritz, H. (1974). Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313-320. |
|
(13) |
Gibson, J.P. et al. (1966). Use of the Rabbit in Teratogenicity Studies. 'Toxicology and Applied Pharmacology 9; 398-408. |
|
(14) |
Kimmel, C.A. and Wilson, J.G. (1973). Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; 309-316. |
|
(15) |
Marr, M.C. et al. (1992). Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Matemal Exposure to Ethylene Glycol. Teratology 46; 169-181. |
|
(16) |
Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163-173. |
|
(17) |
Spark, C. and Dawson, A.B. (1928). The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411 -445. |
|
(18) |
Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Slain 'Technology 39; 61-63. |
|
(19) |
Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313-355. |
|
(20) |
Stuckhardt, J.L. and Poppe, S.M. (1984). Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4; 181-188. |
|
(21) |
Walker, D.G. and Wirtschafter, Z.T. (1957). The Genesis of the Rat Skeleton. Thomas, Springfield, IL. |
|
(22) |
Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp 251-277. |
|
(23) |
Wilson, J.G. and Fraser, F.C. (eds). (1977). Handbook of Teratology, Vol. 4. Plenum, NY. |
|
(24) |
Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vel. Acad. Sci. Hung. 28; 233-239. |
|
(25) |
Staples, R.E. (1974). Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37-38. |
|
(26) |
Van Julsingha, E.B. and C.G. Bennett (1977). A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126-144. |
|
(27) |
US Environmental Protection Agency (1991). Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56: 63798-63826. |
|
(28) |
Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249-292. |
B.32. CARCINOGENITEITSONDERZOEK
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
De teststof wordt normaal gesproken zeven dagen per week langs een geschikte weg aan verscheidene groepen proefdieren gedurende een groot deel van hun levensduur toegediend. Er wordt een dosis per groep gebruikt. Tijdens en na de blootstelling aan de reststof worden de proefdieren dagelijks op tekenen van toxiciteit onderzocht, met name op zich ontwikkelende tumoren.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voor het onderzoek worden de dieren ten minste vijf dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Voor het onderzoek worden gezonde, jonge dieren op willekeurige wijze in de te behandelen en controlegroepen ingedeeld.
1.6.1.
Er wordt de voorkeur gegeven aan ratten. Op grond van de resultaten van eerder uitgevoerd onderzoek mogen ook andere diersoorten (knaagdieren of niet-knaagdieren) worden gebruikt. Er dient gebruik te worden gemaakt van stammen van jonge, gezonde dieren die gewoonlijk in laboratoria worden gebruikt en met de dosering dient zo spoedig mogelijk na het spenen te worden begonnen.
Bij het begin van het onderzoek mag het gewicht van de dieren niet meer dan ± 20 % van het gemiddelde gewicht afwijken. Indien een studie naar de subchronische orale toxiciteit is uitgevoerd ter voorbereiding op een chronisch toxiciteitsonderzoek dienen in beide studies dezelfde soort en stam te worden gebruikt.
1.6.2.
Voor ieder dosisniveau en de parallelle controlegroep moeten ten minste 100 dieren (50 wijfjes en 50 mannetjes) worden gebruikt. De wijfjes moeten nulliparae zijn en mogen niet drachtig zijn. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met het aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood.
1.6.3.
Naast de parallelle controlegroep dienen ten minste drie dosisniveaus te worden gebruikt. Het hoogste dosisniveau moet leiden tot tekenen van minimale toxiciteit, zoals een lichte achteruitgang van de gewichtstoename (minder dan 10 %), zonder dat daardoor de normale levensduur als gevolg van andere effecten dan tumoren aanzienlijk wordt verkort.
Bij de laagste dosis mogen de normale groei, ontwikkeling en levensduur van het dier niet worden verstoord en mogen geen tekenen van toxiciteit optreden. In het algemeen dient deze dosis niet lager te zijn dan 10 % van de hoogste dosis.
De tussenliggende doses moeten worden gekozen in een gebied halverwege tussen de hoge en de lage dosis.
Bij de keuze van de dosisniveaus dient rekening te worden gehouden met de gegevens uit eerder uitgevoerd toxiciteitsonderzoek.
De frequentie van de blootstelling is normaliter dagelijks.
Indien de teststof in het drinkwater wordt toegediend of met het voer wordt gemengd, dient dit steeds beschikbaar te zijn.
1.6.4.
Er dient gebruik te worden gemaakt van een parallelle controlegroep die, afgezien van de blootstelling aan de teststof, in elk opzicht identiek is aan de behandelde groepen.
In speciale omstandigheden, zoals bij inhalatiestudies met aerosolen of bij gebruik van een emulgator met onbekende biologische activiteit via de orale weg, dient ook van een extra controlegroep gebruik te worden gemaakt, waarbij het medium wordt weggelaten.
1.6.5.
De drie belangrijkste toedieningswegen zijn de orale, de dermale en de inhalatieweg. De keuze van de toedieningsweg hangt af van de fysische en chemische eigenschappen van de teststof en de meest waarschijnlijke blootstellingsroute bij de mens.
1.6.5.1. Orale studies
Indien de teststof in het maagdarmkanaal wordt geresorbeerd en de blootstelling van de mens onder meer langs de orale weg geschiedt, verdient orale toediening de voorkeur, tenzij er contra-indicaties zijn. De dieren moeten de teststof toegediend krijgen in hun voedsel, opgelost in het drinkwater of in capsules.
In het ideale geval dient de dosis zeven dagen per week dagelijks te worden toegediend, omdat bij dosering gedurende vijf dagen per week het dier zich in de tijd dat geen dosis wordt toegediend eventueel herstelt of de toxiciteitsverschijnselen verdwijnen, waardoor de resultaten en de evaluatie daarvan kunnen worden beïnvloed. Voornamelijk uit praktische overwegingen echter wordt dosering gedurende vijf dagen per week aanvaardbaar geacht.
1.6.5.2. Dermale studies
Dermale blootstelling door het aanbrengen van de teststof op de huid kan worden gekozen om een belangrijke blootstellingsweg bij de mens te simuleren en als model voor de inductie van huidletsels.
1.6.5.3. Inhalatiestudies
Aangezien bij inhalatiestudies de technische problemen ingewikkelder zijn dan bij andere toedieningswegen het geval is, volgen hieronder meer gedetailleerde aanwijzingen met betrekking op deze wijze van toediening. In specifieke omstandigheden is intratracheale instillatie wellicht een deugdelijk alternatief.
Bij chronische blootstellingen baseert men zich gewoonlijk op de verwachte praktijksituatie in de industrie, in welk geval de dieren vijf dagen per week gedurende zes uur na het bereiken van de juiste concentratie in de blootstellingskamer worden blootgesteld (onderbroken blootstelling), of op een mogelijke blootstelling in het milieu, in welk geval de dieren zeven dagen per week gedurende 22 tot 24 uur per dag worden blootgesteld (continue blootstelling), met ongeveer een uur voor het voederen van de dieren (iedere dag op dezelfde tijd) en bet schoonmaken van de kamer. In beide gevallen worden de dieren doorgaans blootgesteld aan een vaste concentratie van teststoffen. Een belangrijk verschil tussen onderbroken en continue blootstelling is dat er bij de eerste een periode van zeventien tot achttien uur is waarin de dieren zich van de effecten van elke dagelijkse blootstelling kunnen herstellen; gedurende de weekeinden is deze herstelperiode nog langer.
De keuze tussen onderbroken of continue blootstelling hangt af van de doeleinden van het onderzoek en van de na te bootsen omstandigheden bij de mens. Bepaalde technische moeilijkheden verdienen echter de aandacht. Zo kunnen bijvoorbeeld de voordelen van continue blootstelling voor het nabootsen van de milieucondities wegvallen in verband met de noodzaak de dieren tijdens de blootstelling te eten en te drinken te geven, en de behoefte aan meer gecompliceerde en betrouwbare aerosol- en gasgeneratietechnieken en meettechnieken.
1.6.6.
De dieren worden aan de teststoffen blootgesteld in inhalatiekamers die zodanig gebouwd moeten zijn dat kan worden gezorgd voor een dynamische luchtdoorstroming van ten minste twaalf luchtverversingen per uur, een toereikend zuurstofgehalte en een gelijkmatige verdeling van de teststof in de atmosfeer. De controle- en blootstellingskamers moeten qua structuur identiek zijn, zodat, behalve waar het de blootstelling aan de teststoffen betreft, in alle opzichten vergelijkbare blootstellingsomstandigheden gewaarborgd zijn. Binnen de kamer wordt over het algemeen een geringe onderdruk gehandhaafd om te voorkomen dat de reststof naar buiten lekt. De blootstellingskamers moeten zodanig zijn ontworpen da: de dieren elkaar zo min mogelijk verdringen. Als algemene regel voor het verzekeren van een stabiele atmosfeer in de blootstellingskamer geldt dat het totale volume van de proefdieren niet meer mag bedragen dan 5 % van het volume van de kamer.
De volgende parameters moeten worden gemeten of gecontroleerd:
|
i) |
Luchtdoorstroming: het aantal luchtverversingen per uur in de kamer dient bij voorkeur continu te worden gemeten, |
|
ii) |
Tijdens de dagelijkse blootstelling mag de concentratie met niet meer dan ± 15 % van het gemiddelde afwijken. Tijdens de gehele duur van de studie moeten de dagelijkse concentraties zo constant mogelijk worden gehouden. |
|
iii) |
Temperatuur en vochtigheid; voor knaagdieren dient de temperatuur op 22 oC (± 2 oC) en de vochtigheid in de kamer op 30 tot 70 % te worden gehouden, behalve wanneer water wordt gebruikt om de reststof in de atmosfeer van de blootstellingskamer te verstuiven. Beide waarden dienen bij voorkeur continu te worden gemeten. |
|
iv) |
Metingen van de deeltjesgrootte: wanneer de atmosfeer vloeibare of vaste aerosolen bevat, dient de verdeling van de deeltjesgrootte te worden bepaald. De aerosoldeeltjes dienen een zodanige afmeting te hebben dat zij voor de gebruikte proefdieren in te ademen zijn. Monsters van de atmosfeer in de kamer dienen te worden genomen op ademhalingshoogte van de dieren. Het luchtmonster dient representatief te zijn voor de verdeling van de deeltjes waaraan de dieren zijn blootgesteld en dient, op gravimetrische basis, alle aerosoldeeltjes te bevatten, zelfs wanneer een groot gedeelte daarvan niet in te ademen is. Gedurende de werking van de apparatuur voor het verstuiven van deeltjes moeten regelmatig analyses worden uitgevoerd van de deeltjesgrootte, teneinde de stabiliteit van de aerosol na te gaan, en daarna tijdens de blootstelling zo vaak als nodig is om de stabiliteit van de verdeling van de deeltjesgrootte waaraan de dieren lijn blootgesteld te bepalen. |
1.6.7.
Een carcinogeniteitstest beslaat het grootste deel van de normale levensduur van de proefdieren. Bij muizen en hamsters dient het onderzoek na achttien maanden te worden beëindigd, bij ratten na 24 maanden; voor bepaalde dierstammen met een langere levensduur en/of een laag percentage spontane tumoren dient de studie te worden beëindigd na 24 maanden bij muizen en hamsters en na 30 maanden bij ratten. Een dergelijk uitgebreid onderzoek kan echter worden beëindigd wanneer het aantal overlevende dieren in de groep met de laagste dosis of in de controlegroep 25 % bedraagt. Indien blijkt dat de geslachten duidelijk verschillend reageren, dienen de geslachten afzonderlijk te worden beschouwd. Als alleen dieren in de groep met de hoogste dosis vroegtijdig sterven en dit duidelijk aan toxiciteit te wijten is, betekent dit niet dat het onderzoek moet worden beëindigd, mits de toxische verschijnselen bij de andere groepen geen problemen veroorzaken. Wil een negatief testresultaat aanvaardbaar zijn, dan mag niet meer dan 10 % van een groep voor het experiment verloren gaan als gevolg van autolyse, kannibalisme of huisvestingsproblemen, en moet bet percentage overlevende dieren in alle groepen na achttien maanden voor muizen en hamsters en na 24 maanden voor ratten ten minste 50 % bedragen.
1.6.8. Uitvoering
1.6.8.1.
De dieren moeten dagelijks in de kooien worden geobserveerd. Daarbij moet aandacht worden besteed aan veranderingen in huid en vacht, ogen en slijmvliezen, alsmede ademhaling, bloedsomloop, het autonome en centrale zenuwstelsel, somatomotorische activiteit en gedrag.
De dieren moeten regelmatig worden geobserveerd om te voorkomen dat zij voor de studie verloren gaan als gevolg van oorzaken als kannibalisme, autolyse van weefsels of het op verkeerde wijze in de kooien stoppen. Indien stervende dieren worden aangetroffen, moeten zij worden verwijderd; op hen wordt necropsie verricht.
Voor alle dieren dienen de klinische tekenen en sterfte te worden vastgelegd. Bijzondere aandacht moet worden besteed aan zich ontwikkelende tumoren; van elke met het blote oog zichtbare of voelbare tumor moeten het tijdstip waarop deze voor het eerst is opgetreden, de plaats, de afmetingen, het uiterlijk en het verloop worden opgetekend.
Gedurende de eerste dertien weken van het onderzoek dient het verbruik van voer (en water wanneer de teststof in het drinkwater wordt toegediend) wekelijks te worden gemeten; daarna ongeveer om de drie maanden, tenzij wijzigingen in de gezondheidstoestand of het lichaamsgewicht van het dier anders voorschrijven.
Gedurende de eerste dertien weken van het onderzoek dient het lichaamsgewicht voor elk dier afzonderlijk eens per week te worden vastgelegd; daarna ten minste om de vier weken.
1.6.8.2. Klinisch onderzoek
Als op grond van de observatie van de dieren in de kooien wordt vermoed dat de gezondheidstoestand van de dieren tijdens her onderzoek achteruit gaat, dient bij de betrokken dieren een differentiële telling van bloedcellen te worden uitgevoerd.
Na twaalf maanden, achttien maanden en voordat de dieren worden gedood, moet voor alle dieren een bloeduitstrijk worden gemaakt. Er wordt een differentiële telling van bloedcellen verricht op monsters afkomstig van de dieren in de groep met de hoogste dosis en de controlegroepen. Als het op grond van deze gegevens, met name die welke zijn verkregen vóór het doden van de dieren, of de gegevens van het pathologisch onderzoek nodig mocht blijken, moeten ook differentiële tellingen van bloedcellen worden verricht voor de eerstvolgende lagere dosisgroep(en).
Op alle dieren, ook die welke tijdens het onderzoek stierven of werden gedood toen zij stervende waren, dient een volledige macroscopische necropsie te worden verricht. Alle met het blote oog zichtbare tumoren of letsels waarvan wordt aangenomen dat het tumoren zijn, dienen te worden bewaard.
De volgende organen en weefsels dienen in een geschikt medium voor eventueel later histopathologisch onderzoek te worden bewaard: alle met het blote oog zichtbare letsels, hersenen (met inbegrip van delen van medulla/pons, cortex cerebelli en cortex cerebri), hypofyse, schildklier/bijschildklieren, thymusweefsel, luchtpijp en longen, hart, aorta, speekselklieren, lever, milt, nieren, bijnieren, alvleesklier, geslachtsklieren, uterus, secundaire geslachtsorganen, huid, slokdarm, maag, duodenum, jejunum, ileum, blinde darm, colon, rectum, urineblaas, representatieve lymfklieren, vrouwelijke borstklier, dijbeenspieren, perifere zenuwen, borstbeen met beenmerg, dijbeen (met inbegrip van gewrichtsvlak), ruggenmerg op drie plaatsen (cervicaal, mediothoracaal en lumbaal) en ogen.
Vullen van de longen en urineblaas met een fixatief is de beste manier om deze weefsels te bewaren. Bij inhalatiestudies is het vullen van de longen een eerste vereiste voor een goed histopathologisch onderzoek. Bij inhalatiestudies dient de gehele tractus respiratorius te worden bewaard, inclusief neusholte, pharynx en larynx,
|
a) |
Er dient een volledig histopathologisch onderzoek te worden verricht op de organen en weefsels van alle dieren die sterven of tijdens het onderzoek worden gedood en alle dieren in de controlegroep en de groep met de hoge dosis. |
|
b) |
Verder dienen alle met het blote oog zichtbare tumoren of letsels waarvan wordt vermoed dat het tumoren zijn, bij alle groepen histopathologisch te worden onderzocht. |
|
c) |
Indien er een aanzienlijk verschil bestaat in de incidentie van neoplastische letsels tussen de groep met de hoogste dosis en de controlegroep, dient een histopathologisch onderzoek te worden uitgevoerd op het bewuste orgaan of weefsel bij de andere dosisgroepen, |
|
d) |
Als het aantal overlevende dieren in de groep met de hoogste dosis aanmerkelijk kleiner is dan in de controlegroep, moet de eerstvolgende lagere dosisgroep volledig worden onderzocht. |
|
e) |
Indien bij de hoogste dosisgroep blijkt dat er toxische of andere effecten geïnduceerd werden die van invloed zouden kunnen zijn op de neoplastische respons, dient de eerstvolgende lagere dosisgroep volledig te worden onderzocht. |
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek, het aantal dieren waarbij tijdens het onderzoek tumoren zijn ontdekt, het tijdstip waarop deze zijn ontdekt, en het aantal dieren dat, na te zijn gedood, tumoren blijkt te hebben. De resultaten moeten met behulp van een voor dit doel geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voer, enzovoort; |
|
— |
proefomstandigheden:
|
|
— |
dosisniveaus (met het eventuele medium) en concentraties; |
|
— |
gegevens over de tumorincidentie naar geslacht, dosis en type tumor; |
|
— |
tijdstip gedurende het onderzoek waarop de dood intreedt of aangeven of dieren tot het eind van de proef in leven bleven; |
|
— |
gegevens over de toxische reactie naar geslacht en dosis; |
|
— |
beschrijving van toxische of andere effecten; |
|
— |
tijdstip waarop een abnormaal verschijnsel werd waargenomen en verloop hiervan; |
|
— |
gegevens over voedsel en lichaamsgewicht; |
|
— |
resultaten van hematologisch onderzoek; |
|
— |
bevindingen van de necropsie; |
|
— |
gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
statistische verwerking van de resultaten met een beschrijving van de gebruikte methoden; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.33. GECOMBINEERDE CHRONISCHE TOXICITEIT/CARCINOGENITEITSTEST
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
Doel van een gecombineerd onderzoek naar de chronische toxiciteit en carcinogeniteit is, na langdurige en herhaalde blootstelling de chronische en carcinogene effecten van een stof bij een zoogdiersoort te bepalen.
Hiertoe worden de voor het carcinogeniteitsonderzoek gebruikte groepen aangevuld met ten minste een te behandelen satellietgroep en een controlesatellietgroep. De voor de satellietgroep met de hoogste dosis gebruikte dosis mag hoger zijn dan die welke voor de hoge dosisgroep in het carcinogeniteitsonderzoek wordt gebruikt. De dieren in het carcinogeniteitsonderzoek worden op algemene toxiciteit en carcinogene reactie onderzocht. De dieren in de behandelde satellietgroep worden onderzocht op algemene toxiciteit.
De teststof wordt normaal gesproken gedurende zeven dagen per week langs een geschikte toedieningsweg aan verscheidene groepen proefdieren gedurende het grootste deel van hun levensduur toegediend. Er wordt een dosis per groep gebruikt. Tijdens en na blootstelling aan de teststof worden de proefdieren dagelijks op tekenen van toxiciteit en zich ontwikkelende tumoren onderzocht.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voor het onderzoek worden de dieren gedurende ten minste vijf dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Voor het onderzoek worden gezonde, jonge dieren op willekeurige wijze in te behandelen en controlegroepen ingedeeld,
1.6.1.
Er wordt de voorkeur gegeven aan ratten. Op grand van de resultaten van eerder uitgevoerd onderzoek mogen ook andere diersoorten (knaagdieren of niet-knaagdieren) worden gebruikt. Er dient gebruik te worden gemaakt van stammen van jonge, gezonde dieren die gewoonlijk in laboratoria worden gebruikt en met de dosering dient zo spoedig mogelijk na het verspenen te worden begonnen.
Bij het begin van het onderzoek mag het gewicht van de dieren niet meer dan ± 20 % van het gemiddelde gewicht afwijken, indien een studie naar de subchronische toxiciteit is uitgevoerd ter voorbereiding op een chronisch toxiciteitsonderzoek, dienen in beide studies dezelfde soort en stam te worden gebruikt.
1.6.2.
Er dient gebruik te worden gemaakt van beide geslachten. Voor ieder dosisniveau en de parallelle controlegroep moeten ten minste 100 dieren (50 wijfjes en 50 mannetjes) worden gebruikt. De wijfjes moeten nulliparae zijn en mogen niet drachtig zijn. Indien het de bedoeling is tussentijds dieren te doden, moet het aantal worden verhoogd met het aantal dieren dat volgens plan voor de voltooiing van de studie zal worden gedood.
De behandelde satellietgroep(en) voor de evaluatie van pathologische verschijnselen (behalve tumoren), moet(en) 20 dieren van elk geslacht omvatten, terwijl de satellietcontrolegroep tien dieren van elk geslacht dient te omvatten.
1.6.3.
Voor carcinogeniteitstesten dienen, naast de parallelle controlegroep, ten minste drie dosisniveaus te worden gebruikt. Het hoogste dosisniveau moet leiden tot tekenen van minimale toxiciteit, zoals een lichte achteruitgang van de gewichtstoename (minder dan 10 %), zonder dat daardoor de normale levensduur van het dier als gevolg van andere effecten dan tumoren aanzienlijk wordt bekort.
Bij de laagste dosis mogen de normale groei, ontwikkeling en levensduur van het dier niet worden verstoord en mogen geen tekenen van toxiciteit optreden. In het algemeen dient deze dosis niet lager te zijn dan 10 % van de hoogste dosis.
De tussenliggende doses moeten worden gekozen in een gebied halverwege tussen de hoge en de lage dosis.
Bij de keuze van de dosisniveaus dient rekening te worden gehouden met de gegevens uit eerder uitgevoerd toxiciteitsonderzoek.
Voor het onderzoek naar de chronische toxiciteit worden nog andere behandelde groepen en een controlesatellietgroep bij het onderzoek betrokken. De hoge dosis voor de dieren in de behandelde satellietgroep dient zo te worden gekozen dat er duidelijke tekenen van toxiciteit optreden.
De frequentie van de blootstelling is normaliter dagelijks.
Indien de teststof in het drinkwater wordt toegediend of met het voer wordt gemengd, dient dit steeds beschikbaar te zijn.
1.6.4.
Er dient gebruik te worden gemaakt van een parallelle controlegroep die, afgezien van de blootstelling aan de teststof, in elk opzicht identiek is aan de behandelde groepen.
In speciale omstandigheden, zoals bij inhalatiestudies met aerosolen of het gebruik van een emulgator met onbekende biologische activiteit via de orale weg, dient ook een aanvullende controlegroep te worden gebruikt die niet aan het medium wordt blootgesteld.
1.6.5.
De drie belangrijkste toedieningswegen zijn de orale, de dermale en de inhalatieweg. De keuze van de toedieningsweg hangt af van de fysische en chemische eigenschappen van de teststof en de meest waarschijnlijke blootstellingsroute bij de mens.
1.6.5.1. Orale studies
Indien de teststof in het maag-darmkanaal wordt geresorbeerd en de blootstelling van de mens onder meer langs de orale weg geschiedt, verdient orale toediening de voorkeur, tenzij er contra-indicaties zijn. De dieren moeten de teststof toegediend krijgen in hun voedsel, opgelost in het drinkwater of via capsules.
In het ideale geval dient de dosis zeven dagen per week dagelijks te worden toegediend, omdat bij dosering gedurende vijf dagen per week het dier zich in de tijd dat geen dosis wordt toegediend, eventueel herstelt of de toxiciteitsverschijnselen verdwijnen, waardoor de resultaten en de evaluatie daarvan kunnen worden beïnvloed. Voornamelijk uit praktische overwegingen echter wordt dosering gedurende vijf dagen per week aanvaardbaar geacht.
1.6.5.2. Dermale studies
Dermale blootstelling door het aanbrengen van de teststof op de huid kan worden gekozen om een belangrijke blootstellingsroute bij de mens na te bootsen en als model voor de inductie van huidletsels.
1.6.5.3. Inhalatiestudies
Aangezien bij inhalatiestudies de technische problemen ingewikkelder zijn dan bij andere toedieningswegen het geval is, volgen hieronder meer gedetailleerde aanwijzingen met betrekking tot deze wijze van toediening. Intratracheale instillatie is in specifieke omstandigheden wellicht een deugdelijk alternatief.
Bij chronische blootstellingen baseert men zich gewoonlijk op de verwachte praktijkomstandigheden in de industrie, in welk geval de dieren vijf dagen per week gedurende zes uur na het bereiken van de juiste concentratie in de blootstellingskamer worden blootgesteld (onderbroken blootstelling), of op een mogelijke expositie in het milieu, in welk geval de dieren zeven dagen per week gedurende 22 tot 24 uur per dag worden blootgesteld (continue blootstelling), met ongeveer een uur voor het voederen van de dieren (iedere dag op dezelfde tijd) en het schoonmaken van de kamers. In beide gevallen worden de dieren doorgaans blootgesteld aan een vaste concentratie van reststoffen. Een belangrijk verschil tussen onderbroken en continue blootstelling is dat er bij de eerste een periode van zeventien tot achttien uur is, waarin de dieren zich van de effecten van elke dagelijkse expositie kunnen herstellen; gedurende de weekeinden is deze herstelperiode nog langer.
De keuze tussen onderbroken of continue blootstelling hangt af van de doeleinden van het onderzoek en van de na te bootsen blootstellingsomstandigheden bij de mens, Bepaalde technische moeilijkheden verdienen echter de aandacht. Zo kunnen bijvoorbeeld de voordelen van continue blootstelling bij het nabootsen van de milieucondities wegvallen in verband met de noodzaak de dieren tijdens de blootstelling te eten en te drinken te geven, en de behoefte aan meer gecompliceerde en betrouwbare aerosol- en gasgeneratietechnieken en meettechnieken.
1.6.6.
De dieren worden aan de reststoffen blootgesteld in inhalatiekamers die zodanig gebouwd moeten zijn dat kan worden gezorgd voor een dynamische luchtdoorstroming van ten minste twaalf luchtverversingen per uur, een toereikend zuurstofgehalte en een gelijkmatige verdeling van de teststof in de atmosfeer. De controle- en blootstellingskamers moeten qua structuur identiek zijn, zodat, behalve waar het de blootstelling aan de reststoffen betreft, in alle opzichten vergelijkbare blootstellingsomstandigheden gewaarborgd zijn. Binnen in de kamer wordt over het algemeen een geringe onderdruk gehandhaafd om te voorkomen dat de teststof naar buiten lekt. De kamers dienen zodanig te zijn ontworpen dat de dieren elkaar zo min mogelijk verdringen. Als algemene regel voor het verzekeren van een stabiele atmosfeer in de blootstellingskamer geldt dat het totale volume van de proefdieren niet meer mag bedragen dan 5 % van het volume van de kamer.
De volgende parameters moeten worden gemeten of gecontroleerd:
|
i) |
Luchtdoorstroming: het aantal luchtverversingen per uur in de kamer dient bij voorkeur continu te worden gemeten. |
|
ii) |
Tijdens de dagelijkse blootstelling mag de concentratie met niet meer dan ± 15 % van het gemiddelde afwijken. Tijdens de gehele duur van de studie moeten de dagelijkse concentraties zo constant mogelijk worden gehouden. |
|
iii) |
Temperatuur en vochtigheid: voor knaagdieren dient de temperatuur op 22 oC (± 2 oC)en de vochtigheid in de kamer op 30 tot 70 % te worden gehouden, behalve wanneer water wordt gebruikt om de reststof in de atmosfeer van de blootstellingskamer te verstuiven. Beide waarden dienen bij voorkeur continu te worden gemeten. |
|
iv) |
Metingen van de deeltjesgrootte: wanneer de atmosfeer vloeibare of vaste aerosolen bevat, dient de verdeling van de deeltjesgrootte te worden bepaald. De aerosoldeeltjes dienen een zodanige afmeting te hebben dat zij voor de gebruikte proefdieren in te ademen zijn. Monsters van de atmosfeer dienen te worden genomen op ademhalingshoogte van de dieren. Het luchtmonster dient representatief te zijn voor de verdeling van de deeltjes waaraan de dieren zijn blootgesteld en dient, op gravimetrische basis, alle gesuspendeerde aerosoldeeltjes te bevatten, zelfs wanneer een groot gedeelte van de aerosoldeeltjes niet in te ademen is. Gedurende de werking van de apparatuur voor de verstuiving van deeltjes moeten regelmatig analyses worden uitgevoerd van de deeltjesgrootte, teneinde de stabiliteit van de aerosol na te gaan, en daarna tijdens de blootstelling zo vaak als nodig is om de stabiliteit van de verdeling van de deeltjesgrootte waaraan de dieren zijn blootgesteld, te bepalen. |
1.6.7.
Het gedeelte van het onderzoek dat betrekking heeft op de carcinogeniteit, beslaat het grootste deel van de normale levensduur van de proefdieren. Het onderzoek dient te worden beëindigd na achttien maanden voor muizen en hamsters en 24 maanden voor ratten; voor bepaalde dierstammen met een langere levensduur en/of een laag percentage spontane tumoren dient de studie te worden beëindigd na 24 maanden voor muizen en hamsters en na 30 maanden voor ratten. Een dergelijk uitgebreid onderzoek mag evenwel worden beëindigd wanneer het aantal overlevende dieren in de groep met de laagste dosis of in de controlegroep 25 % bedraagt. Indien blijkt dat de geslachten duidelijk verschillend reageren, dienen de geslachten afzonderlijk te worden beschouwd. Als alleen dieren in de groep met de hoogste dosis voortijdig sterven en dit duidelijk aan toxiciteit te wijten is, betekent dit niet dat de studie moet worden beëindigd, mits de toxische verschijnselen bij de andere groepen geen problemen opleveren. Wil een negatief testresultaat aanvaardbaar zijn, dan mag niet meer dan 10 % van een groep voor het experiment verloren gaan als gevolg van autolyse, kannibalisme of huisvestingsproblemen, en moet het percentage overlevende dieren in alle groepen na achttien maanden voor muizen en hamsters en na 24 maanden voor ratten ten minste 50 % bedragen.
De satellietgroepen van 20 behandelde dieren per geslacht en de tien controledieren per geslacht die worden gebruikt voor de chronische toxiciteitstests, dienen ten minste twaalf maanden te worden onderzocht. Deze dieren dienen te worden gedood met het oog op een beoordeling van de door de reststof veroorzaakte pathologie, waarbij geriatrische veranderingen geen rol mogen spelen.
1.6.8. Uitvoering
1.6.8.1.
De dieren moeten dagelijks in hun kooien worden geobserveerd, Daarbij dient aandacht te worden geschonken aan veranderingen in huid en vacht, ogen en slijmvliezen, alsmede ademhaling, bloedsomloop, het autonome en centrale zenuwstelsel, somatomotorische activiteit en gedrag.
Op gezette tijden dienen de dieren in de behandelde satellietgroep(en) klinisch te worden onderzocht.
De dieren moeten regelmatig worden geobserveerd om te voorkomen dat zij voor het onderzoek verloren gaan als gevolg van oorzaken als kannibalisme, autolyse van weefsels of het op verkeerde wijze in kooien stoppen. Indien stervende dieren worden aangetroffen, dienen deze te worden verwijderd; op hen wordt necropsie verricht.
Voor alle dieren moeten de klinische tekenen, inclusief neurologische en oculaire veranderingen, alsmede de sterfte worden vastgelegd. Bijzondere aandacht moet worden besteed aan zich ontwikkelende tumoren; het tijdstip waarop toxische verschijnselen voor het eerst optreden, en het verloop ervan dienen te worden opgetekend; van elke met het blote oog zichtbare of voelbare tumor moeten het tijdstip waarop deze voor het eerst is opgetreden, de plaats, de afmetingen, het uiterlijk en het verloop worden opgetekend.
Het verbruik van voer (en water wanneer de teststof in het drinkwater wordt toegediend) dient gedurende de eerste dertien weken van het onderzoek wekelijks te worden gemeten en vervolgens ongeveer om de drie maanden, tenzij wijzigingen in de gezondheidstoestand of het lichaamsgewicht van het dier anders voorschrijven.
Gedurende de eerste dertien weken van het onderzoek dient het lichaamsgewicht voor elk dier afzonderlijk eens per week te worden vastgelegd; daarna ten minste om de vier weken.
1.6.8.2. Klinisch onderzoek
Een hematologisch onderzoek (bijvoorbeeld hemoglobinegehalte, hematocriet, totaal aantal rode bloedlichaampjes, totaal aantal witte bloedlichaampjes, bloedplaatjes of andere metingen van de stollingseigenschappen) dient te worden verricht na drie maanden, zes maanden en vervolgens om de zes maanden en aan het eind van het onderzoek op bloedmonsters van tien ratten per geslacht uit alle groepen. Indien mogelijk dienen deze monsters telkens afkomstig te zijn van dezelfde ratten.
Indien op grond van de observatie van de dieren in de kooien wordt vermoed dat de gezondheidstoestand van de dieren tijdens het onderzoek achteruitgaat, dient bij de betrokken dieren een differentiële telling van bloedcellen te worden uitgevoerd. Een differentiële telling van bloedcellen wordt uitgevoerd op monsters afkomstig van de dieren in de hoogste dosisgroep en de controlegroep. Bij de daaropvolgende lagere groep(en) worden alleen differentiële tellingen van bloedcellen verricht als er tussen de hoogste groep en de controlegroepen een groot verschil bestaat of als daartoe op grond van het pathologisch onderzoek een indicatie wordt gegeven.
Er dienen urinemonsters te worden genomen van tien ratten per geslacht uit alle groepen, indien mogelijk met dezelfde tussenpozen als bij het bloedonderzoek hierboven. In het geval van knaagdieren dienen bij de afzonderlijke dieren of op een samengevoegd monster per geslacht per groep de volgende bepalingen te worden verricht:
|
— |
uiterlijk: volume en dichtheid voor de afzonderlijke dieren; |
|
— |
eiwit, glucose, ketonen, occult bloed (semi-kwantitatief); en |
|
— |
microscopie van sediment (semi-kwantitatief). |
Ongeveer om de zes maanden en aan het eind van het onderzoek worden bloedmonsters voor klinisch-biochemische metingen genomen bij alle niet-knaagdieren en bij tien ratten per geslacht uit alle groepen, indien mogelijk steeds bij dezelfde ratten. Bij niet-knaagdieren dient bovendien voor het onderzoek een monster te worden genomen. Uit deze monsters wordt het plasma bereid waarop de volgende bepalingen worden verricht;
|
— |
totaal eiwitgehalte; |
|
— |
albuminegehalte; |
|
— |
leverfunctietesten (zoals alkalische fosfataseactiviteit, glutamaatpyruvaattransaminase (4) activiteit en glutamaatoxaalacetaattransaminase (5) activiteit), gammagiutamyltranspeptidase, ornithinedecarboxylase; |
|
— |
koolhydraatstofwisseling, zoals nuchter glucosegehalte van het bloed; |
|
— |
nierfunctietesten zoals ureumstikstof in het bloed. |
Op alle dieren, ook die welke tijdens het experiment stierven of gedood werden toen zij stervende waren, moet een volledig macroscopisch onderzoek worden verricht. Van alle dieren moet, voordat zij gedood worden, een bloedmonster worden genomen voor differentiële tellingen van bloedcellen. Alle met het blote oog zichtbare tumoren of letsels waarvan wordt aangenomen dat het tumoren zijn, dienen te worden bewaard. Getracht moet worden om de macroscopische waarnemingen te correleren aan de microscopische bevindingen.
Alle organen en weefsels dienen voor microscopisch onderzoek te worden bewaard. Gewoonlijk zijn dat de organen en weefsels: hersenen (7) (medulla/pons, cortex cerebelli, cortex cerebri), hypofyse, schildklier (met bijschildklieren), thymus, longen (met luchtpijp), hart, aorta, speekselklieren, lever (7), milt, nieren (7), bijnieren (7), slokdarm, maag, duodenum, jejunum, ileum, blinde darm, colon, rectum, uterus, urineblaas, lymfklieren, alvleesklier, geslachtsklieren (7), secundaire geslachtsorganen, vrouwelijke borstklier, huid, spieren, perifere zenuwen, ruggenmerg (cervicaal, thoracaal, lumbaal), borstbeen met beenmerg, dijbeen (met gewricht) en ogen.
Vullen van de longen en urineblaas met een fixatief is de beste manier om deze weefsels te bewaren. Bij inhalatiestudies is het vullen van de longen van wezenlijk belang voor een goed histopathologisch onderzoek. Bij speciale studies zoals inhalatiestudies dient de gehele tractus respiratorius te worden onderzocht, met inbegrip van neus, pharynx en larynx.
Indien nog ander klinisch onderzoek wordt verricht, dient de daaruit verkregen informatie voor het microscopisch onderzoek beschikbaar te zijn, omdat dit voor de patholoog belangrijke aanwijzingen kan bevatten.
Voor het gedeelte van het onderzoek dat betrekking heeft op de chronische toxiciteit:
Alle bewaarde organen van alle dieren uit de satellietgroep met de hoge dosis en de controlegroep moeten uitvoerig worden onderzocht. Als in de satellietgroep met de hoogste dosis sprake is van pathologische verschijnselen die door de teststof worden veroorzaakt, moeten de aangetaste organen van alle andere dieren in alle andere behandelde satellietgroepen en die uit de behandelde groepen in het gedeelte van het onderzoek dat op de carcinogeniteit betrekking heeft, aan het eind van het onderzoek aan een volledig en uitvoerig histologisch onderzoek worden onderworpen.
Voor het gedeelte van het onderzoek dat betrekking heeft op de carcinogeniteit:
|
a) |
Er dient een volledig histopathologisch onderzoek te worden uitgevoerd op de organen en weefsels van alle dieren die tijdens het onderzoek sterven of worden gedood, en alle dieren uit de controlegroepen en de groep met de hoge dosis. |
|
b) |
Bij alle groepen moeten alle, in enig orgaan voorkomende, met het blote oog zichtbare tumoren of letsels waarvan wordt vermoed dat het tumoren zijn, worden onderzocht. |
|
c) |
Indien er tussen de hoge-dosisgroep en de controlegroepen een aanzienlijk verschil bestaat in de incidentie van neoplastische letsels, dient een histopathologisch onderzoek te worden verricht op het orgaan of weefsel in kwestie bij de andere dosisgroepen. |
|
d) |
Als het aantal overlevende dieren in de groep met de hoogste dosis aanmerkelijk kleiner is dan in de controlegroep, moet de eerstvolgende lagere dosisgroep volledig worden onderzocht. |
|
e) |
Indien bij de hoogste dosisgroep blijkt dat er toxische of andere effecten geïnduceerd worden die van invloed zouden kunnen zijn op de neoplastische respons, dan dient de eerstvolgende lagere dosisgroep volledig te worden onderzocht. |
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat: het aantal dieren bij het begin van het onderzoek, het aantal dieren waarbij tijdens het onderzoek tumoren of toxische effecten zijn ontdekt, het tijdstip waarop deze zijn ontdekt, en het aantal dieren waarbij, nadat deze zijn gedood, tumoren zijn aangetroffen. De resultaten moeten met behulp van een voor dit doel geschikte statistische methode worden geëvalueerd. Iedere erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voer, enzovoort; |
|
— |
proefomstandigheden:
|
|
— |
dosisniveaus (met het eventuele medium) en concentraties; |
|
— |
gegevens over de tumorincidentie naar geslacht, dosis en type tumor; |
|
— |
tijdstip gedurende het onderzoek waarop de dood intreedt of aangeven of dieren tot het eind van de proef in leven bleven (ook voor de satellietgroep); |
|
— |
gegevens over de toxische reactie naar geslacht en dosis; |
|
— |
beschrijving van toxische of andere effecten; |
|
— |
tijdstip waarop een abnormaal verschijnsel werd waargenomen en verloop hiervan; |
|
— |
oftalmologische bevindingen; |
|
— |
gegevens over voedsel en lichaamsgewicht; |
|
— |
resultaten van hematologisch onderzoek; |
|
— |
resultaten van klinisch-biochemisch onderzoek (resultaten van het urineonderzoek inbegrepen); |
|
— |
bevindingen van de necropsie; |
|
— |
gedetailleerde beschrijving van alle histopathologische bevindingen; |
|
— |
statistische verwerking van de resultaten met een beschrijving van de gebruikte methoden; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.34. REPRODUKTIETOXICITEITSONDERZOEK OVER ÉÉN GENERATIE
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
De teststof wordt in geleidelijk stijgende doseringen aan verscheidene groepen mannelijke en vrouwelijke dieren toegediend. Aan de mannetjes dient de teststof gedurende de groei en gedurende ten minste één volledige spermatogene cyclus (ongeveer 56 dagen bij de muis en 70 dagen bij de rat) toegediend te worden, teneinde eventuele, door de reststof veroorzaakte nadelige effecten op de spermatogenese aan het licht te brengen.
Aan de vrouwelijke ouderdieren (P-generatie) moet de reststof ten minste gedurende twee volledige oestruscycli worden toegediend, teneinde eventuele door de teststof veroorzaakte nadelige effecten op de oestrus aan het licht te brengen. Vervolgens laat men de dieren paren. Gedurende de paartijd wordt de teststof aan beide geslachten toegediend; daarna alleen aan de wijfjes gedurende de dracht en de zoogtijd. Bij toediening van de teststof via inhalatie zal de methode op een aantal punten moeten worden aangepast.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
1.6.1. Voorbereidingen
Voor het onderzoek worden gezonde, jonge dieren op willekeurige wijze in de te behandelen en controlegroepen ingedeeld. Voor het onderzoek worden de dieren ten minste vijf dagen onder dezelfde huisvestings- en voedingsomstandigheden gehouden als tijdens de proef. Aanbevolen wordt de teststof in het voedsel of drinkwater toe te dienen. Ook andere toedieningswegen komen in aanmerking. De teststof moet bij alle dieren voor de gehele duur van het experiment op dezelfde manier worden toegediend. Indien een medium of andere additieven worden gebruikt om de dosering re vergemakkelijken, moet ervan bekend zijn dat zij geen toxische effecten veroorzaken. Toediening geschiedt gedurende zeven dagen per week.
1.6.2.
Selectie van de soort
Er wordt de voorkeur gegeven aan ratten of muizen. Stammen met een lage vruchtbaarheid dienen niet te worden gebruikt. Er dient gebruik te worden gemaakt van gezonde dieren die nog niet eerder aan experimenten zijn onderworpen. Van de proefdieren dienen soort, stam, geslacht, gewicht en/of leeftijd bekend te zijn.
Voor een juiste beoordeling van de vruchtbaarheid dienen zowel de mannetjes als de wijfjes te worden onderzocht. Alle behandelde en controledieren dienen gespeend te zijn voordat met de dosering wordt begonnen.
Aantal en geslacht
Elke behandelde en controlegroep dient zoveel dieren te bevatten dat er steeds ongeveer 20 drachtige wijfjes zijn die op ongeveer hetzelfde tijdstip verwacht worden te werpen.
Dit om te komen tot voldoende drachten en nakomelingen om een zinvolle evaluatie te kunnen maken van de mogelijke effecten van de stof op de vruchtbaarheid, de dracht en het gedrag van de moeder bij de dieren van de oudergeneratie en het zogen, de groei en de ontwikkeling van de F1-generatie vanaf de conceptie tot aan de spening.
1.6.3.
Voer en water dienen ad libitum te worden verstrekt. Vlak voor de partus moeten de drachtige wijfjes apart in speciale hokken worden ondergebracht; eventueel kan nestmateriaal worden verstrekt.
1.6.3.1.
Er dienen ten minste drie dosisgroepen en een controlegroep te worden gebruikt. Indien bij de toediening van de teststof van een medium gebruik wordt gemaakt, dient dit aan de controlegroep in het hoogste gebruikte volume toegediend te worden. Indien een teststof leidt tot een verminderde voeropname of -absorptie, dan kan het noodzakelijk zijn een parallelle controlegroep te gebruiken. In het ideale gevat moet het hoogste dosisniveau bij de ouderdieren leiden tot toxische verschijnselen, maar niet tot sterfte, tenzij zulks op grond van de fysisch-chemische eigenschappen of de biologische effecten van de teststof onmogelijk is. In het ideale geval moeten de tussenliggende doses leiden rot minimale toxische effecten die aan de teststof zijn toe te schrijven, en mag de lage dosis niet tot enige waarneembare nadelige effecten bij de ouders of de nakomelingen leiden. Wanneer de teststof via een maagsonde of in capsules wordt toegediend, moet de aan elk dier toegediende dosis gebaseerd zijn op het lichaamsgewicht van het dier en wekelijks aan het gewijzigde lichaamsgewicht worden aangepast. Bij drachtige wijfjes kan de dosis desgewenst gebaseerd worden op het lichaamsgewicht op dag nul of dag zes van de dracht.
1.6.3.2.
Indien stoffen met een lage toxiciteit bij een dosisniveau van ten minste 1 000 mg/kg het voortplantingsvermogen op generlei wijze blijkt te zijn verstoord, zijn studies bij andere dosisniveaus wellicht niet noodzakelijk. Indien uit een voorafgaand onderzoek bij het hoge dosisniveau waarbij duidelijke tekenen van toxiciteit bij het moederdier voorkomen geen nadelige effecten op de vruchtbaarheid blijken, zijn studies bij andere dosisniveaus wellicht niet noodzakelijk.
1.6.3.3. Uitvoering van het onderzoek
Met de dagelijkse toediening van de teststof aan de mannelijke ouderdieren dient te worden begonnen wanneer deze vijf à negen weken oud zijn, nadat zij zijn gespeend en gedurende ten minste vijf dagen aan de proefomstandigheden zijn gewend. Bij ratten wordt de teststof gedurende tien weken vóór de paartijd toegediend (bij muizen gedurende acht weken). De mannetjes kunnen hetzij aan het einde van de paartijd worden gedood en onderzocht, hetzij op hun voer met de teststof in leven worden gehouden voor de eventuele voortbrenging van een tweede nest en dan enige tijd voor het eind van het onderzoek worden gedood en onderzocht. Bij vrouwelijke ouderdieren dient met de dosering na ten minste vijf dagen van gewenning aan de proefomstandigheden te worden begonnen en deze dient ten minste twee weken te hebben geduurd vóór de paring plaatsvindt. De dagelijkse toediening van de teststof aan de vrouwelijke ouderdieren dient te worden voortgezet gedurende de hele paringstijd van drie weken, de dracht en tot aan het spenen van de nakomelingen van de eerste generatie. Er dient aandacht te worden geschonken aan wijzigingen in het doseringsschema op grond van andere beschikbare informatie over de teststof, zoals inductie van het teststofmetabolisme of bioaccumulatie.
Bij studies naar de reproductietoxiciteit kan men hetzij één mannetje met één wijfje (1:1) of één mannetje met twee wijfjes (1:2) laten paren.
In het eerste geval (1:1) wordt één wijfje bij hetzelfde mannetje geplaatst totdat het drachtig is of er drie weken zijn verstreken. Elke ochtend worden de wijfjes onderzocht op de aanwezigheid van sperma of vaginale plugs. Dag nul van de dracht is de dag waarop een vaginale plug of sperma wordt aangetroffen, waarbij rekening wordt gehouden rnet de spermatogenese.
Bij de paartjes waarbij de paring mislukt, dient te worden nagegaan wat de oorzaak van deze kennelijke onvruchtbaarheid is.
Dit kan onder meer geschieden door de dieren nogmaals te laten paren, maar dan met vader- of moederdieren van bewezen vruchtbaarheid, door microscopisch onderzoek van de voortplantingsorganen en onderzoek van de oestruscyclus of de spermatogenese.
De dieren waaraan gedurende het vruchtbaarheidsonderzoek de teststof wordt toegediend, worden in de gelegenheid gesteld normaal te werpen en hun jongen tot de speentijd groot te brengen. De nestgrootte wordt hierbij niet gestandaardiseerd.
Als standaardisatie wel gebeurt, dan wordt voorgesteld als volgt tewerk te gaan. Tussen de eerste en de vierde dag na de geboorte kan de grootte van elk nest worden aangepast door het teveel aan jongen, via selectie, uil het nest te nemen om uiteindelijk vier mannetjes en vier wijfjes per nest over te houden.
Indien het aantal mannetjes of wijfjes niet voldoende is om er per nest vier van elk geslacht over te houden, kan worden volstaan met een gedeeltelijke aanpassing (bijvoorbeeld vijf mannetjes en drie wijfjes). Een en ander is niet van toepassing op nesten met minder dan acht jongen.
1.6.4.
Gedurende de hele onderzoekperiode wordt elk dier ten minste eenmaal per dag geobserveerd. Met de teststof samenhangende veranderingen in het gedrag, tekenen van een moeilijke of langdurige geboorte en alle tekenen van toxiciteit, inclusief sterfte, dienen te worden vastgelegd. Gedurende de tijd die aan de paring voorafgaat en de paartijd dient het verbruik van voer wekelijks te worden gemeten. Tijdens de dracht kan het verbruik van voer eventueel dagelijks worden gemeten. Na het werpen en tijdens de zoogtijd dient het verbruik van voer (en van water indien de teststof met het drinkwater wordt toegediend) te worden gemeten op dezelfde dag als de nesten worden gewogen. De mannelijke en vrouwelijke ouderdieren moeten worden gewogen op de eerste dag dat zij de teststof krijgen toegediend en daarna eenmaal per week. Deze waarnemingen moeten voor elk volwassen dier afzonderlijk worden vastgelegd.
De drachttijd dient te worden berekend vanaf dag nul van de dracht. Elke worp dient zo spoedig mogelijk na de geboorte te worden onderzocht, teneinde het aantal en geslacht van de jongen vast te stellen, alsmede het aantal dood- en levendgeboren jongen en de aanwezigheid van met het blote oog zichtbare afwijkingen.
Dode jongen en jongen die op de vierde dag worden gedood, dienen te worden bewaard en op eventuele afwijkingen te worden onderzocht. De levende jongen moeten worden geteld en de nesten moeten worden gewogen op de ochtend na de geboorte, op de vierde en de zevende dag en vervolgens wekelijks tot het eind van het onderzoek, wanneer de dieren afzonderlijk dienen te worden gewogen.
De bij de moederdieren en nakomelingen waargenomen lichamelijke of gedragsafwijkingen dienen te worden opgetekend.
1.6.5.
1.6.5.1.
Wanneer er ouderdieren tijdens het onderzoek worden gedood of sterven, dienen zij macroscopisch te worden onderzocht op eventuele structurele afwijkingen of pathologische veranderingen, waarbij speciaal aandacht moet worden geschonken aan de voortplantingsorganen. Dode of stervende jongen moeten op afwijkingen worden onderzocht.
1.6.5.2.
Van alle ouderdieren moeten de eierstokken, uterus, cervix, vagina, testes, epididymides, zaadblaasjes, prostaat, coagulans afscheidende klier, de hypofyse en aangetaste organen voor microscopisch onderzoek worden bewaard. In het geval dat deze organen nog niet bij andere onderzoeken, waarbij herhaalde doseringen zijn toegediend, zijn onderzocht, dienen zij microscopisch te worden onderzocht bij alle dieren uit de hoogste dosisgroep en de controlegroep en de dieren die tijdens het onderzoek sterven.
De organen die bij deze dieren afwijkingen vertonen, dienen vervolgens bij alle andere ouderdieren te worden onderzocht. In deze gevallen dienen alle weefsels die met het blote oog zichtbare pathologische veranderingen vertonen, microscopisch te worden onderzocht. Zoals hierboven reeds werd gesuggereerd, kunnen de voortplantingsorganen van dieren waarvan wordt vermoed dat zij onvruchtbaar zijn, aan een microscopisch onderzoek worden onderworpen.
2. GEGEVENS
De volgende gegevens moeten voor iedere proefgroep in tabellen worden samengevat; het aantal dieren bij het begin van het onderzoek, het aantal vruchtbare mannetjes, het aantal drachtige wijfjes, de aard van de veranderingen en het percentage dieren dat elk type verandering vertoont.
Indien mogelijk, moeten alle numerieke resultaten met behulp van een voor dit doel geschikte statistische methode worden geëvalueerd. Iedere algemeen erkende statistische methode kan hiervoor worden gebruikt.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMINGEN
In het verslag moeien, indien mogelijk, ook de volgende gegevens worden opgenomen:
|
— |
gebruikte diersoort/stam; |
|
— |
gegevens over de toxische reactie naar geslacht en dosis, met inbegrip van vruchtbaarheid, dracht en levensvatbaarheid; |
|
— |
tijdstip gedurende het onderzoek waarop de dood intreedt of aangeven of dieren tot de tijd waarop zij volgens plan zouden worden gedood of tot het einde van de proef in leven bleven; |
|
— |
tabel met het gewicht van elke worp, het gemiddelde gewicht van de jongen en het gewicht van elk jong afzonderlijk aan het eind van het onderzoek; |
|
— |
toxische of andere effecten op de reproductie, het nageslacht, postnatale groei, enzovoort; |
|
— |
dag waarop een abnormaal verschijnsel werd waargenomen en verloop hiervan; |
|
— |
gegevens over het lichaamsgewicht van de ouderdieren; |
|
— |
bevindingen van de necropsie; |
|
— |
gedetailleerde beschrijving van eventuele microscopische bevindingen; |
|
— |
statistische verwerking van de resultaten, waar dat van toepassing is; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
B.35. REPRODUCTIETOXICITEITSONDERZOEK OVER TWEE GENERATIES
1. METHODE
Deze methode is overgenomen van TG 416 (2001) van de OESO.
1.1. INLEIDING
Deze testmethode voor de reproductietoxiciteit over twee generaties is bedoeld om algemene informatie te verschaffen over de effecten van een teststof op de toestand en het functioneren van het mannelijke en vrouwelijke reproductiesysteem, met inbegrip van de functie van de geslachtsorganen, de oestruscyclus, het paargedrag, de bevruchting, de zwangerschap, de geboorte, de lactatie en het spenen, en de groei en ontwikkeling van de nakomelingen. De studie kan ook informatie verschaffen over de effecten van de teststof op de neonatale morbiditeit en mortaliteit en voorlopige gegevens over de prenatale en postnatale ontwikkelingstoxiciteit en kan als leidraad voor verdere tests fungeren. Deze testmethode is niet alleen bedoeld om de groei en ontwikkeling van de F1-generatie te bestuderen, maar ook om de toestand en het functioneren van het mannelijke en vrouwelijke reproductiesysteem daarvan en de groei en ontwikkeling van de F2-generatie te beoordelen. Om meer informatie te verkrijgen over de ontwikkelingstoxiciteit en functionele gebreken kunnen aanvullende tests in dit protocol worden opgenomen, waarbij eventueel de methoden voor ontwikkelingstoxiciteit en/of ontwikkelingsneurotoxiciteit kunnen worden geraadpleegd, of kunnen deze eindpunten bij aparte onderzoeken met de daartoe geschikte testmethoden worden bestudeerd.
1.2. PRINCIPE VAN DE TESTMETHODE
De teststof wordt in geleidelijk oplopende doseringen aan verschillende groepen mannetjes en vrouwtjes toegediend. De mannetjes van de P-generatie krijgen de teststof gedurende de groei en ten minste één volledige spermatogenese-cyclus toegediend (ongeveer 56 dagen bij de muis en 70 dagen bij de rat) om eventuele schadelijke effecten op de spermatogenese aan het licht te brengen. De effecten op het sperma worden aan de hand van een aantal spermaparameters (zoals de morfologie en beweeglijkheid van het sperma) en door weefselpreparatie en gedetailleerde histopathologie bepaald. Als er gegevens over de spermatogenese beschikbaar zijn uit een eerder uitgevoerd onderzoek met herhaalde toediening dat lang genoeg geduurd heeft, bv. een onderzoek van 90 dagen, behoeven de mannetjes van de P-generatie niet in de evaluatie te worden opgenomen. Wel wordt echter aanbevolen monsters of opgenomen digitale beelden van sperma van de P-generatie te bewaren om een latere evaluatie mogelijk te maken. De vrouwtjes van de P-generatie krijgen de teststof gedurende de groei en enkele volledige oestruscycli toegediend om eventuele schadelijke effecten van de teststof op de normale oestruscyclus te detecteren. De teststof wordt gedurende de dekperiode, gedurende de daaruit voortvloeiende dracht en tot en met het spenen van hun F1-jongen aan de ouderdieren (P-generatie) toegediend. Bij het spenen van de Fl-generatie wordt de toediening van de stof voortgezet bij de Fl-jongen, en wel gedurende hun groei tot volwassenheid, de dekking en de productie van een F2-generatie tot de F2-generatie wordt gespeend.
Alle dieren worden klinisch geobserveerd en pathologisch onderzocht op toxiciteitsverschijnselen, waarbij vooral wordt gelet op effecten op de toestand en het functioneren van het mannelijke en vrouwelijke reproductiesysteem en de groei en ontwikkeling van de jongen.
1.3. BESCHRIJVING VAN DE TESTMETHODE
1.3.1. Keuze van de diersoort
Voor de test worden bij voorkeur ratten gebruikt. Als er een andere soort wordt gebruikt, moet hiervoor een motivering worden gegeven en zullen er de nodige wijzigingen moeten worden aangebracht. Stammen met een lage vruchtbaarheid of waarvan bekend is dat er vaak ontwikkelingsstoornissen optreden, mogen niet worden gebruikt. Aan het begin van het onderzoek moeten de gewichtsverschillen tussen de dieren minimaal zijn en niet groter dan 20 % van het gemiddelde gewicht van elke sekse.
1.3.2. Huisvesting en voeding
De temperatuur in de proefdierruimte dient 22 oC (± 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. De verlichting dient met kunstlicht te gebeuren met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater. De keuze van het voer kan worden beïnvloed door de noodzaak om voor een afdoende vermenging van de teststof te zorgen wanneer die langs deze weg wordt toegediend.
De dieren kunnen elk apart of in kleine groepjes met hetzelfde geslacht worden ondergebracht. De dekking gebeurt in daarvoor geschikte kooien. Wanneer de dekking blijkt te hebben plaatsgevonden, worden de vrouwtjes apart gezet in werp- of drachthokken. Dieren die gedekt zijn kunnen ook in groepjes worden gehuisvest en één of twee dagen voor het werpen apart worden gezet. Dieren die gedekt zijn krijgen geschikt en gespecificeerd nestmateriaal wanneer ze gaan werpen.
1.3.3. Voorbereiding van de dieren
Er worden gezonde jonge dieren gebruikt die gedurende ten minste 5 dagen aan de omstandigheden in het laboratorium hebben kunnen wennen en waarop geen eerdere proeven zijn uitgevoerd. De kenmerken van de proefdieren qua soort, stam, herkomst, geslacht, gewicht en/of leeftijd worden vastgelegd. Alle broer/zus-verhoudingen tussen de dieren moeten bekend zijn, zodat dekking van zus door broer wordt vermeden. De dieren worden aselect ingedeeld in controlegroepen en behandelde groepen (waarbij geleding aan de hand van het lichaamsgewicht wordt aanbevolen). De kooien worden zodanig geplaatst dat mogelijke effecten door de plaatsing van de kooi tot een minimum worden beperkt. Elk dier krijgt een uniek identificatienummer. Bij de P-generatie gebeurt dit voordat de toediening begint. Bij de F1-generatie gebeurt dit bij het spenen voor de dieren die voor dekking worden geselecteerd. Voor alle geselecteerde F1-dieren wordt bijgehouden uit welk nest ze afkomstig zijn. Daarnaast wordt aanbevolen de jongen zo spoedig mogelijk na de geboorte een eigen identificatie te geven, wanneer wordt overwogen de jongen apart te wegen of functieproeven uit te voeren.
Wanneer met de toediening aan de ouderdieren (P-generatie) wordt gestart, dienen deze ongeveer 5-9 weken oud te zijn. De dieren van alle testgroepen dienen zo veel mogelijk hetzelfde gewicht en dezelfde leeftijd te hebben.
1.4. UITVOERING
1.4.1. Aantal en geslacht van de dieren
Elke test- en controlegroep dient een zodanig aantal dieren te bevatten dat er bij voorkeur ten minste 20 drachtige vrouwtjes op of vlak voor de werpdatum zijn. Bij stoffen die ongewenste aan de behandeling gerelateerde effecten veroorzaken (bv. steriliteit of te grote toxiciteit bij hoge doses), is dit soms onmogelijk. Het is de bedoeling dat er genoeg drachtige vrouwtjes zijn om een zinnige beoordeling mogelijk te maken van het vermogen van de stof om invloed te hebben op de vruchtbaarheid, de dracht en het gedrag van de moeder, het zogen, de groei en ontwikkeling van de F1-generatie vanaf de bevruchting tot aan de geslachtsrijpheid en de ontwikkeling van hun jongen (de F2-generatie) tot ze gespeend worden. Als het gewenste aantal drachtige dieren (d.w.z. 20) niet kan worden gehaald, betekent dit niet automatisch dat het onderzoek onbruikbaar is; dit moet van geval tot geval worden beoordeeld.
1.4.2. Bereiding van de doses
De teststof wordt bij voorkeur oraal (in het voer, in het drinkwater of met een sonde) toegediend, tenzij een andere toedieningsweg (b.v. dermaal of door inhalatie) geschikter wordt geacht.
Waar nodig wordt de teststof in een geschikt medium opgelost of gesuspendeerd. Aanbevolen wordt eerst te bezien of het mogelijk is een waterige oplossing/suspensie te gebruiken, als dit niet kan een oplossing/emulsie in olie (bv. maïsolie) te overwegen en daarna eventueel een ander medium. Wanneer een ander medium dan water wordt gebruikt, moeten de toxische kenmerken daarvan bekend zijn. De stabiliteit van de teststof in het medium moet worden bepaald.
1.4.3. Dosering
Er worden ten minste drie dosisniveaus en een gelijktijdige controlegroep gebruikt. Tenzij dit vanwege de fysisch/chemische aard of biologische kenmerken van de teststof onmogelijk is, moet de hoogste dosis zodanig worden gekozen dat er enige toxiciteit wordt veroorzaakt, maar geen sterfte of ernstig leed. Bij onverwachte sterfte zijn onderzoeken met een sterfte van minder dan ongeveer 10 % bij de ouderdieren (de P-generatie) normaal gesproken nog aanvaardbaar. Er wordt een dalende reeks dosisniveaus gekozen teneinde een dosisafhankelijk effect en de dosis zonder waargenomen schadelijke effecten (NOAEL) te bepalen. Intervallen van een factor twee of vier zijn vaak optimaal om de dalende dosisniveaus vast te stellen en het is vaak beter een vierde testgroep toe te voegen dan zeer grote intervallen (bv. meer dan een factor tien) tussen de doseringen te gebruiken. Bij toediening in het voer mag het dosisinterval niet meer dan een factor drie zijn. Bij de keuze van de dosisniveaus wordt rekening gehouden met bekende toxiciteitsgegevens, met name resultaten van onderzoek met herhaalde toediening. Ook met beschikbare gegevens over het metabolisme en de kinetiek van de teststof of verwante verbindingen dient rekening te worden gehouden. Bovendien zal met deze informatie ook makkelijker kunnen worden aangetoond dat het doseringsschema adequaat is.
De controlegroep wordt niet of, als bij de toediening van de teststof een medium wordt gebruikt, met medium behandeld. Afgezien van de toediening van de teststof is de behandeling van de dieren in de controlegroep identiek aan die van de dieren in de testgroepen. Als er een medium wordt gebruikt, wordt aan de controlegroep de hoogste gebruikte mediumdosis toegediend. Als een teststof in het voer wordt toegediend en leidt tot een lagere voeropname of voerbenutting, kan het gebruik van een paarsgewijs gevoerde controlegroep nodig worden geacht. In plaats van een gelijktijdige paarsgewijs gevoerde controlegroep kunnen ook gegevens worden gebruikt uit gecontroleerd onderzoek dat is opgezet om de effecten van een lagere voerconsumptie op reproductieparameters te bepalen.
Er moet aandacht worden geschonken aan de volgende kenmerken van het medium en andere additieven: effecten op de resorptie, de distributie, het metabolisme of de retentie van de teststof, effecten op de chemische eigenschappen van de teststof die de toxische kenmerken daarvan kunnen wijzigen en effecten op het voer- of watergebruik of de voedingstoestand van de dieren.
1.4.4. Limiettest
Als een onderzoek met orale toediening van één dosis van ten minste 1 000 mg/kg lichaamsgewicht/dag of, bij toediening in het voer of het drinkwater, een equivalent percentage in het voer of drinkwater volgens de voor dit onderzoek beschreven procedure geen waarneembare toxiciteit bij de ouderdieren of hun jongen veroorzaakt en op grond van gegevens over verwante verbindingen qua structuur en/of metabolisme geen toxiciteit te verwachten valt, zal een volledig onderzoek met verschillende dosisniveaus wellicht niet nodig zijn. De limiettest is bruikbaar, behalve wanneer vanwege de verwachte blootstelling van de mens een hogere orale dosis nodig wordt geacht. Voor andere toedieningsvormen, zoals inhalatie of toediening op de huid, zal het maximaal haalbare blootstellingsniveau vaak worden bepaald en beperkt door de fysisch-chemische eigenschappen van de teststof zoals de oplosbaarheid.
1.4.5. Toediening van de doses
De teststof wordt 7 dagen per week aan de dieren toegediend. Bij voorkeur wordt voor de orale toedieningsweg (in het voer, in het drinkwater of met een sonde) gekozen. Als er een andere toedieningsweg wordt gebruikt, moet er een motivering worden gegeven en kunnen er aanpassingen nodig zijn. De stof wordt aan alle dieren gedurende de vereiste proefperiode met dezelfde methode toegediend. Als de stof met een sonde wordt toegediend, moet dit met een maagsonde gebeuren. Het volume vloeistof dat in één keer wordt toegediend, mag niet groter zijn dan 1 ml/100 g lichaamsgewicht (voor maïsolie is het maximum 0,4 ml/100 g lichaamsgewicht), behalve wanneer het om een waterige oplossing gaat; in dat geval mag 2 ml/100 g lichaamsgewicht worden gebruikt. Behalve wanneer het om irriterende of bijtende stoffen gaat, waarbij meestal bij hogere concentraties heviger effecten optreden, worden variaties in het toegediende volume tot een minimum beperkt door de concentratie aan te passen, zodat er voor alle dosisniveaus een constant volume wordt toegediend. Bij sondetoediening krijgen de jongen de teststof meestal alleen indirect via de melk, totdat ze worden gespeend en directe toediening begint. Bij toediening in het voer of het drinkwater krijgen de jongen de teststof ook direct binnen wanneer ze in de laatste week van de lactatieperiode zelf beginnen te eten.
Wanneer stoffen via het voer of het drinkwater worden toegediend, is het belangrijk ervoor te zorgen dat de hoeveelheid teststof de normale voedings- of waterbalans niet stoort. Wanneer de teststof in het voer wordt toegediend, kan een constante voerconcentratie (in ppm) of een constante dosis in verhouding tot het lichaamsgewicht van het dier worden gebruikt. De gekozen methode dient te worden vermeld. Wanneer de stof met een sonde wordt toegediend, gebeurt dit elke dag op ongeveer hetzelfde tijdstip en wordt de dosis ten minste een keer per week aangepast om een constante dosis in verhouding tot het lichaamsgewicht te houden. Wanneer de met een sonde toegediende dosis op basis van het gewicht wordt aangepast, moet rekening worden gehouden met informatie over de placentaverdeling.
1.4.6. Testschema's
De dagelijkse toediening aan de ouderdieren (de mannetjes en vrouwtjes van de P-generatie) begint wanneer ze 5 tot 9 weken oud zijn. De dagelijkse toediening aan de mannetjes en vrouwtjes van de F1-generatie begint wanneer ze worden gespeend; er moet aan worden gedacht dat de directe blootstelling van de F1-jongen bij toediening van de teststof via het voer of het drinkwater al tijdens de lactatieperiode kan beginnen. Voor beide geslachten (P en F1) vindt de toediening ten minste 10 weken vóór de dekperiode plaats. Voor beide geslachten wordt de toediening gedurende de dekperiode van twee weken voortgezet. De mannetjes worden op humane wijze gedood en onderzocht wanneer ze niet meer nodig zijn voor de bepaling van de effecten op de reproductie. Bij de moederdieren (P-generatie) wordt de toediening gedurende de dracht en tot het spenen van de F1-jongen voortgezet. Op basis van de beschikbare informatie over de teststof, bijvoorbeeld over de toxiciteit, de metabolisme-inductie of de bioaccumulatie, moet worden overwogen of er wijzigingen in het toedieningsschema nodig zijn. De dosis voor een bepaald dier wordt normaal gesproken gebaseerd op de meest recente bepaling van het lichaamsgewicht. Bij de aanpassing van de dosis gedurende het laatste derde deel van de dracht moet echter zorgvuldigheid worden betracht.
De mannetjes en vrouwtjes van de P- en de F1-generatie worden behandeld tot ze worden gedood. Alle volwassen mannetjes en vrouwtjes van de P- en de F1-generatie worden op humane wijze gedood wanneer ze niet meer nodig zijn voor de bepaling van de effecten op de reproductie. De F1-jongen die niet voor dekking worden geselecteerd en alle F2-jongen worden na het spenen op humane wijze gedood.
1.4.7. De dekprocedure
1.4.7.1. Dekking bij de ouderdieren (P-generatie)
Voor elke dekking wordt één vrouwtje bij één mannetje van dezelfde dosisgroep gezet (1:1-dekking) totdat ze copuleren of er twee weken zijn verstreken. Elke dag worden de vrouwtjes onderzocht op de aanwezigheid van sperma of een vaginale prop. Als dag 0 van de dracht geldt de dag waarop een vaginale prop of sperma wordt gevonden. Wanneer de dekking geen succes heeft, kan worden overwogen de vrouwtjes opnieuw te laten dekken door mannetjes van dezelfde groep waarvan de vruchtbaarheid is aangetoond. In de gegevens wordt duidelijk vermeld welke dieren gepaard hebben. Dekking door een mannetje met dezelfde ouders wordt vermeden.
1.4.7.2. Dekking bij de F1-generatie
Voor de dekking van de F1-jongen worden uit elk nest bij het spenen ten minste één mannetje en één vrouwtje gekozen om te paren met andere jongen van hetzelfde dosisniveau maar een ander nest, hetgeen de F2-generatie oplevert. Wanneer er tussen de jongen uit één nest geen significante verschillen in lichaamsgewicht of uiterlijk worden waargenomen, worden de jongen aselect gekozen. Wanneer deze verschillen wel worden waargenomen, worden de beste vertegenwoordigers van elk nest gekozen. In de praktijk gebeurt dit het gemakkelijkst op basis van het lichaamsgewicht, maar het kan beter zijn om het op basis van het uiterlijk te doen. De dekking bij de F1-generatie gebeurt niet voordat ze volledig tot geslachtsrijpheid zijn gekomen.
Paren zonder jongen worden beoordeeld om te bepalen wat de oorzaak van de onvruchtbaarheid lijkt te zijn. Daartoe kan de gelegenheid worden gegeven voor paringen met andere mannetjes of vrouwtjes waarvan de vruchtbaarheid is aangetoond, kunnen de voortplantingsorganen microscopisch worden onderzocht en kan de oestruscyclus of de spermatogenese nader worden onderzocht.
1.4.7.3. Tweede dekking
In bepaalde gevallen, bijvoorbeeld bij aan de behandeling gerelateerde veranderingen in de nestgrootte of bij de waarneming van een twijfelachtig effect bij de eerste dekking, wordt aanbevolen de volwassen P- en F1-dieren opnieuw te laten paren om een tweede nest te krijgen. Daarbij wordt aanbevolen vrouwtjes of mannetjes die geen nest hebben gekregen te laten paren met dieren van het andere geslacht waarvan de vruchtbaarheid is aangetoond. Als in een van beide generaties een tweede nest nodig wordt geacht, laat men de dieren ongeveer een week na het spenen van het laatste nest opnieuw paren.
1.4.7.4. Nestgrootte
De dieren krijgen de gelegenheid hun jongen normaal te werpen en groot te brengen tot ze worden gespeend. Standaardisatie van de nestgrootte is facultatief. Wanneer standaardisatie gebeurt, moet de gebruikte methode gedetailleerd worden beschreven.
1.5 WAARNEMINGEN
1.5.1. Klinische observaties
Elke dag wordt een algemene klinische observatie uitgevoerd en bij sondetoediening wordt voor het tijdstip rekening gehouden met de periode na de toediening waarin maximale effecten worden verwacht. Gedragsveranderingen, tekenen dat het werpen moeilijk verloopt of langer duurt en alle toxiciteitsverschijnselen worden geregistreerd. Ten minste één maal per week wordt daarnaast een gedetailleerder onderzoek van elk dier uitgevoerd; dit kan gemakkelijk gebeuren wanneer het dier wordt gewogen. Tweemaal per dag en in het weekend eventueel éénmaal per dag wordt bij alle dieren naar ziekte of sterfte gekeken.
1.5.2. Lichaamsgewicht en voer/waterconsumptie van de ouderdieren
De ouderdieren (P- en F1-generatie) worden op de eerste dag van toediening en vervolgens ten minste één maal per week gewogen. De moederdieren (P- en F1-generatie) worden ten minste op de dagen 0, 7, 14 en 20 of 21 van de dracht gewogen en tijdens de lactatieperiode op de dagen waarop de nesten worden gewogen en op de dag waarop de dieren worden gedood. Deze observaties worden voor elk volwassen dier apart gerapporteerd. In de periode vóór de dekking en tijdens de dracht wordt de voerconsumptie ten minste wekelijks gemeten. Het watergebruik wordt ten minste wekelijks gemeten als de teststof in het water wordt toegediend.
1.5.3. De oestrus-cyclus
Bij de vrouwtjes van de P- en de F1-generatie worden de lengte en de normaliteit van de oestrus-cyclus geëvalueerd door vaginale uitstrijkjes vóór de dekking en facultatief tijdens de dekking totdat kan worden aangetoond dat de dekking heeft plaatsgevonden. Bij het verwijderen van cellen van de vagina/cervix moet ervoor worden gezorgd dat verstoring van de mucosa en daardoor schijnzwangerschap worden voorkomen (1).
1.5.4. Sperma-parameters
Van alle mannetjes van de P- en de F1-generatie wordt, wanneer ze worden gedood, het gewicht van de testis en de epididymis geregistreerd en wordt één exemplaar van elk orgaan bewaard voor histopathologisch onderzoek (zie de punten 1.5.7. en 1.5.8.1). Van een subgroep van ten minste tien mannetjes van elke groep P- en Fl-mannetjes worden de andere testis en epididymis gebruikt voor de telling van respectievelijk de homogenisatie-resistente spermatiden en de spermareserve in de staart van de epididymis. Bij deze zelfde subgroep wordt sperma uit de staart van de epididymis of het vas deferens verzameld om de beweeglijkheid en de morfologie van het sperma te beoordelen. Als er aan de behandeling gerelateerde effecten worden waargenomen of uit andere onderzoeken is gebleken dat effecten op de spermatogenese mogelijk zijn, wordt de beoordeling van het sperma bij alle mannetjes van elke dosisgroep uitgevoerd; in andere gevallen kan de telling worden beperkt tot de P- en F1-mannetjes uit de controlegroep en de groep met de hoogste dosis.
Het totale aantal homogenisatie-resistente spermatiden uit de testis en het sperma in de staart van de epididymis worden geteld (2)(3). De spermareserve in de staart kan worden afgeleid uit de concentratie en het volume van het sperma in de suspensie die voor de kwalitatieve beoordeling wordt gebruikt en het aantal spermatozoën dat later door het resterende staartweefsel fijn te malen en/of te homogeniseren wordt gevonden. De telling gebeurt direct na het doden van de dieren bij de gekozen subgroep van de mannetjes van alle dosisgroepen, tenzij er video- of digitale beelden worden gemaakt of tenzij de exemplaren worden ingevroren en later worden geanalyseerd. In deze gevallen kunnen de controlegroep en de groep met de hoogste dosis als eerste worden geanalyseerd. Als er geen aan de behandeling gerelateerde effecten (bv. effecten op het aantal spermatozoën, op de beweeglijkheid of op de morfologie) worden waargenomen, behoeven de andere dosisgroepen niet te worden geanalyseerd. Wanneer bij de groep met de hoogste dosis wel aan de behandeling gerelateerde effecten worden waargenomen, moeten de groepen met een lagere dosis ook worden beoordeeld.
De beweeglijkheid van sperma uit de epididymis (of het ductus deferens) wordt onmiddellijk na het doden beoordeeld of op video opgenomen. Het sperma wordt verwijderd, waarbij de beschadiging tot het minimum wordt beperkt, en met aanvaardbare methoden verdund voor de beweeglijkheidsanalyse (4). Het percentage spermatozoën in oplopende beweeglijkheidscategorieën wordt subjectief of objectief bepaald. Wanneer computergesteunde bewegingsanalyse wordt gebruikt (5)(6)(7)(8)(9)(10), worden de oplopende beweeglijkheidscategorieën bepaald door drempelwaarden voor de gemiddelde snelheid en rechtheid van het pad of een lineaire index die door de gebruiker worden bepaald. Als bij obductie de monsters op video worden opgenomen (11) of de beelden op een andere wijze worden vastgelegd, kan later een analyse van alleen de P- en F1-mannetjes van de controlegroep en de groep met de hoogste dosis worden uitgevoerd, tenzij er aan de behandeling gerelateerde effecten worden waargenomen; in dat geval moeten de groepen met een lagere dosis ook worden beoordeeld. Wanneer er geen video- of digitale beelden worden opgenomen, worden alle monsters in alle behandelingsgroepen bij de obductie geanalyseerd.
Er wordt een morfologische evaluatie van een spermamonster uit de epididymis (of het vas deferens) uitgevoerd. De spermatozoën (ten minste 200 per monster) worden als gefixeerde natte preparaten onderzocht (12) en als normaal of abnormaal ingedeeld. Morfologische abnormaliteiten van sperma zijn bijvoorbeeld versmelting, geïsoleerde koppen of misvormde koppen en/of staarten. De evaluatie wordt bij de geselecteerde subgroep mannetjes van alle dosisgroepen direct na het doden van de dieren of, wanneer er video- of digitale beelden worden opgenomen, op een later tijdstip uitgevoerd. Ook uitstrijkjes kunnen, wanneer ze gefixeerd zijn, later worden afgelezen. In deze gevallen kunnen de controlegroep en de groep met de hoogste dosis als eerste worden geanalyseerd. Als er geen aan de behandeling gerelateerde effecten (bv. effecten op de morfologie van het sperma ) worden waargenomen, behoeven de andere dosisgroepen niet te worden geanalyseerd. Wanneer bij de groep met de hoogste dosis wel aan de behandeling gerelateerde effecten worden waargenomen, moeten de groepen met een lagere dosis ook worden beoordeeld.
Als een van de bovengenoemde parameters voor de sperma-evaluatie al eerder als onderdeel van een onderzoek naar systemische toxiciteit van ten minste 90 dagen is onderzocht, behoeft deze bij het onderzoek over twee generaties niet noodzakelijkerwijs opnieuw te worden onderzocht. Wel wordt echter aanbevolen monsters of digitale beelden van het sperma van de P-generatie te bewaren om eventueel een latere evaluatie mogelijk te maken.
1.5.5. Jongen
Elk nest wordt zo spoedig mogelijk na het werpen (lactatiedag 0) onderzocht om het aantal en het geslacht van de jongen, de doodgeboren jongen en de levend geboren jongen en de aanwezigheid van macroscopische afwijkingen vast te stellen. Jongen die op dag 0 dood worden aangetroffen worden, als ze niet verweekt zijn, bij voorkeur onderzocht op mogelijke gebreken en de doodsoorzaak en geconserveerd. Levende jongen worden bij de geboorte (lactatiedag 0) of op dag 1 en vervolgens periodiek op weegdagen, zoals bijvoorbeeld de dagen 4, 7, 14 en 21 van de lactatie, geteld en apart gewogen. Bij de moederdieren of de jongen waargenomen lichamelijke of gedragsafwijkingen worden geregistreerd.
De lichamelijke ontwikkeling van de jongen wordt voornamelijk door de toename van het lichaamsgewicht geregistreerd. Andere lichamelijke parameters (zoals de oor- en oogopening, het doorkomen van tanden en de haargroei) kunnen aanvullende informatie opleveren, maar deze gegevens dienen bij voorkeur te worden beoordeeld in de context van gegevens over de geslachtelijke rijping (zoals leeftijd en lichaamsgewicht bij de opening van de vagina of de scheiding tussen eikel en voorhuid) (13). Functioneel onderzoek (bv. motorische activiteit, sensorische functie of reflex-ontogenie) bij de jongen van de F1-generatie voor en/of na het spenen, met name in verband met geslachtelijke rijping, wordt aanbevolen als dergelijk onderzoek niet in afzonderlijke studies is opgenomen. Bij gespeende jongen van de F1-generatie die voor dekking worden geselecteerd, wordt de leeftijd bij de opening van de vagina of de scheiding van de voorhuid bepaald. De anaal-genitale afstand wordt bij jongen van de F2-generatie op dag 0 na het werpen gemeten als dit in verband met wijzigingen in de verhouding mannetjes/vrouwtjes of het tijdstip van geslachtelijke rijping bij de F1-generatie wenselijk wordt geacht.
Functioneel onderzoek kan achterwege worden gelaten bij groepen met andere duidelijke tekenen van schadelijke effecten (zoals een significante daling van de gewichtstoename). Als functioneel onderzoek wordt uitgevoerd, moet dit niet gebeuren bij de jongen die voor dekking worden geselecteerd.
1.5.6. Macroscopische obductie
Alle ouderdieren (P- en F1-generatie), alle jongen met uiterlijke afwijkingen of klinische verschijnselen en één aselect gekozen jong/geslacht/nest van zowel de F1- als de F2-generatie worden, wanneer ze worden gedood of tijdens het onderzoek sterven, macroscopisch onderzocht op structurele afwijkingen of pathologische veranderingen. Daarbij wordt speciale aandacht besteed aan de organen van het reproductiesysteem. Jongen die op humane wijze zijn gedood omdat ze stervend waren en dode jongen (wanneer ze niet verweekt zijn) worden onderzocht op mogelijke gebreken en/of de doodsoorzaak en geconserveerd.
Bij alle vrouwtjes die voor het eerst een nest werpen wordt de uterus op een zodanige wijze onderzocht op de aanwezigheid van en het aantal implantatieplaatsen dat geen afbreuk wordt gedaan aan het histopathologische onderzoek.
1.5.7. Gewicht van de organen
Van alle ouderdieren van de P- en F1-generatie worden, wanneer ze worden gedood, het lichaamsgewicht en het gewicht van de volgende organen bepaald (organen die paarsgewijs voorkomen worden apart gewogen):
|
— |
de uterus en de eierstokken; |
|
— |
de testes en de epididymes (totaal en staart); |
|
— |
de prostaat; |
|
— |
de zaadblaasjes met de coagulatieklieren en hun vloeistof en de prostaat (als één geheel); |
|
— |
de hersenen, de lever, de nieren, de milt, de hypofyse, de schildklier, de bijnieren en bekende doelorganen. |
Bij de jongen van de F1- en de F2-generatie die voor obductie zijn geselecteerd, wordt het uiteindelijke lichaamsgewicht bepaald en van één aselect gekozen jong/geslacht/nest (zie punt 1.5.6) worden de volgende organen gewogen: hersenen, milt en thymus.
De resultaten van de macroscopische obductie en het wegen van de organen worden indien mogelijk beoordeeld in de context van waarnemingen bij andere onderzoeken met herhaalde toediening.
1.5.8. Histopathologie
1.5.8.1. Ouderdieren
De volgende organen en weefsels van de ouderdieren (P- en F1-generatie) of representatieve monsters daarvan worden in een geschikt medium gefixeerd en bewaard voor histopathologisch onderzoek:
|
— |
de vagina, de uterus met de cervix en de eierstokken (geconserveerd in een geschikt fixatief); |
|
— |
één testis (geconserveerd in Bouin's of een vergelijkbaar fixatief), één epididymis, de zaadblaasjes, de prostaat en de coagulatieklier; |
|
— |
eerder gespecificeerde doelorganen uit alle dieren van de P- en de F1-generatie die voor dekking zijn geselecteerd. |
Bij alle bovengenoemde geconserveerde organen en weefsels wordt voor alle P- en F1-dieren van de controlegroep en de groep met de hoogste dosis die voor dekking zijn geselecteerd, een volledig histopathologisch onderzoek uitgevoerd. Een onderzoek van de eierstokken van de P-dieren is facultatief. Organen waarin aan de behandeling gerelateerde wijzigingen worden aangetoond, worden ook in de groepen met een lagere dosis onderzocht om bij te dragen tot de bepaling van de NOAEL. Daarnaast worden de voortplantingsorganen van de dieren uit de groepen met een lagere dosis waarbij een verminderde vruchtbaarheid wordt vermoed, bijvoorbeeld degene die in gebreke zijn gebleven bij de dekking, de bevruchting of het werpen van gezonde jongen of waarvoor de periodiciteit van de oestrus of het aantal, de beweeglijkheid of de morfologie van de spermatozoën is aangetast, histopathologisch onderzocht. Alle macroscopische letsels zoals atrofie of tumoren worden onderzocht.
Er wordt uitgebreid histopathologisch onderzoek van de testis uitgevoerd (bv. met Bouin's fixatief, inbedding met paraffine en dwarscoupes met een dikte van 4-5 µm) om aan de behandeling gerelateerde effecten te signaleren, zoals achtergebleven spermatiden, ontbrekende kiemcellagen of -soorten, meerkernige reuzencellen of spermatogene cellen die in het lumen terechtkomen (14). Het onderzoek van de intacte epididymis omvat de kop, het lichaam en de staart en dit kan gebeuren door een lengtecoupe te onderzoeken. De epididymis wordt onderzocht op infiltratie van leukocyten, wijzigingen in het voorkomen van celtypen, afwijkende celtypen en fagocytose van spermatozoën. Voor het onderzoek van de mannelijke voortplantingsorganen kan kleuring met PAS en hematoxyline worden gebruikt.
De eierstok na de lactatieperiode moet primaire en groeiende follikels en de grote corpora lutea van de lactatie bevatten. Bij histopathologisch onderzoek moet een kwalitatieve depletie van de primaire follikelpopulatie worden waargenomen. Voor de F1-vrouwtjes wordt een kwantitatieve evaluatie van de primaire follikels uitgevoerd; het aantal dieren, de keuze van de coupe van de eierstok en de monstergrootte van de coupe moeten in statistisch opzicht adequaat zijn voor de gebruikte evaluatieprocedure. Bij het onderzoek wordt het aantal primaire follikels geteld en dit kan worden gecombineerd met het aantal kleine groeiende follikels om de behandelde en de controle-eierstokken te vergelijken (15)(16)(17)(18)(19).
1.5.8.2. Gespeende dieren
Macroscopisch abnormale weefsels en doelorganen van alle jongen met uitwendige afwijkingen of klinische verschijnselen en van het ene aselect gekozen jong/geslacht/nest uit zowel de F1- als de F2-generatie die niet voor dekking zijn geselecteerd, worden in een geschikt medium gefixeerd en bewaard voor histopathologisch onderzoek. Van de geconserveerde weefsels wordt een volledige histopathologische karakterisering uitgevoerd, waarbij de nadruk vooral ligt op de organen van het reproductiesysteem.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens worden individueel gerapporteerd met een overzicht in tabelvorm, waarbij voor elke testgroep en elke generatie worden vermeld: het aantal dieren aan het begin van de test, het aantal dieren dat tijdens de test dood is aangetroffen of met het oog op een humane behandeling is gedood, het tijdstip van sterfte of humane doding, het aantal vruchtbare dieren, het aantal drachtige vrouwtjes, het aantal dieren met toxiciteitsverschijnselen, een beschrijving van de waargenomen toxiciteitsverschijnselen met vermelding van de aanvang, de duur en de ernst van de toxische effecten, de aard van de waarnemingen bij de ouderdieren en de jongen, de aard van de histopathologische veranderingen en alle relevante gegevens over de nesten.
De getalsmatige resultaten worden met een geschikte algemeen aanvaarde statistische methode geëvalueerd; de statistische methoden worden bij de opzet van het onderzoek gekozen en gemotiveerd. Statistische dosis/respons-modellen kunnen nuttig zijn voor de analyse van de gegevens. In het verslag wordt voldoende informatie over de analysemethode en het gebruikte computerprogramma vermeld, zodat een onafhankelijke evaluator/statisticus de analyse kan beoordelen en reconstrueren.
2.2. EVALUATIE VAN DE RESULTATEN
De resultaten van dit reproductietoxiciteitsonderzoek over twee generaties worden aan de hand van de waargenomen effecten, zoals de resultaten van de obductie en microscopisch onderzoek, beoordeeld. De beoordeling omvat het verband, of het ontbreken daarvan, tussen de dosis van de teststof en de aanwezigheid of afwezigheid, de frequentie en de ernst van abnormaliteiten zoals macroscopisch letsel, gespecificeerde doelorganen, verminderde vruchtbaarheid, klinische abnormaliteiten, aantasting van de reproductie- en nestresultaten, veranderingen in het lichaamsgewicht, effecten op de mortaliteit en andere toxische effecten. Bij de beoordeling van de testresultaten wordt rekening gehouden met de fysisch-chemische eigenschappen van de teststof en, wanneer deze beschikbaar zijn, gegevens over de toxicokinetiek.
Een adequaat uitgevoerd reproductietoxiciteitsonderzoek levert een bevredigende raming van een dosis zonder effect op en een inzicht in schadelijke effecten op de reproductie, de geboorte, de lactatie en de postnatale ontwikkeling met inbegrip van de groei en de geslachtelijke ontwikkeling.
2.3. INTERPRETATIE VAN DE RESULTATEN
Een reproductietoxiciteitsonderzoek over twee generaties levert informatie op over de effecten van herhaalde blootstelling aan een stof gedurende alle fasen van de reproductiecyclus. Het onderzoek levert met name informatie op over de reproductieparameters en over de ontwikkeling, de groei, de rijping en het overleven van de jongen. De resultaten van het onderzoek moeten in samenhang met de resultaten van het onderzoek naar subchronische en prenatale ontwikkelingstoxiciteit alsmede toxicokinetisch en ander beschikbaar onderzoek worden geïnterpreteerd. De resultaten van dit onderzoek kunnen worden gebruikt bij de evaluatie van de noodzaak om een chemische stof nader te onderzoeken. De resultaten van het onderzoek kunnen in beperkte mate naar de mens worden geëxtrapoleerd. Ze kunnen het best worden gebruikt voor informatie over de doses zonder effect en de toelaatbare blootstelling van de mens (20)(21)(22)(23).
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag wordt de volgende informatie opgenomen:
|
|
Teststof:
|
|
|
Medium (indien van toepassing):
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies, met inbegrip van de NOAEL-waarden voor de effecten op de moederdieren en de jongen. |
4. REFERENTIES
|
(1) |
Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York. |
|
(2) |
Gray, L.E. et al. (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12:92-108. |
|
(3) |
Robb, G.W. et al. (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103-107. |
|
(4) |
Klinefelter, G.R. et al. (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5:39 44. |
|
(5) |
Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive'Toxicology 10(3):237-244. |
|
(6) |
Chapin, R.E. et al. (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6:267-273. |
|
(7) |
Klinefelter, G.R. et al. (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13:409-421. |
|
(8) |
Slott, V.L. et al. (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449-458. |
|
(9) |
Slott, V.L. and Perreault, S.D. (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thom Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida. pp. 319-333. |
|
(10) |
Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401-415. |
|
(11) |
Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330-337. |
|
(12) |
Linder, R.E. et al. (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491-505. |
|
(13) |
Korenbrot, C.C. et al. (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17:298303. |
|
(14) |
Russell, L.D. et al. (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida. |
|
(15) |
Heindel, J.J. and R.E. Chapin (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida. |
|
(16) |
Heindel, J.J. et al. (1989). Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421-426. |
|
(17) |
Manson, J.M. and Y.J. Kang (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York. |
|
(18) |
Smith, B.J. et al. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5:379-383. |
|
(19) |
Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and CA. Kimmel, (eds.), ILSI Press, Washington, DC. |
|
(20) |
Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and C.D. Klaassen (eds.), Pergamon, New York. |
|
(21) |
Zenick, H. and E.D. Clegg (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York. |
|
(22) |
Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York. |
|
(23) |
Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York. |
B.36. TOXICOKINETIEK
1. METHODE
1.1. INLEIDING
Zie Algemene inleiding — Deel B.
1.2. DEFINITIES
Zie Algemene inleiding — Deel B.
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE ONDERZOEKMETHODE
De teststof wordt langs een geschikte weg toegediend. Naar gelang van het doel van het onderzoek kan de stof in één enkele dosis of in, over een bepaalde periode herhaalde, doses aan een of meer groepen proefdieren worden toegediend. Daarna worden de teststof en/of metabolieten, afhankelijk van het soort onderzoek, bepaald in lichaamsvocht, weefsel en excreta.
Het onderzoek kan worden uitgevoerd met radioactief gemerkte of niet-gemerkte vormen van de teststof. Indien radioactiviteit wordt gebruikt, moet de radioactieve isotoop zodanig in de molecule van de stof zijn ingebouwd dat een maximum aantal gegevens over het metabolisme van de verbinding wordt verkregen.
1.5. KWALITEITSCRITERIA
Geen.
1.6. BESCHRIJVING VAN DE ONDERZOEKMETHODE
Voorbereidingen
Voor het onderzoek worden gezonde, jonge, volwassen dieren gedurende ten minste vijf dagen aan de laboratoriumomstandigheden gewend. Vóór het onderzoek worden de dieren op willekeurige wijze in de te behandelen groepen ingedeeld. In speciale omstandigheden kunnen zeer jonge, drachtige of van tevoren behandelde dieren worden gebruikt.
Proefomstandigheden
Proefdieren
Toxicokinetisch onderzoek kan op een of meer geschikte diersoorten worden uitgevoerd waarbij rekening moet worden gehouden met de soorten die zijn gebruikt of zullen worden gebruikt bij ander toxicologisch onderzoek van dezelfde teststof. Indien een knaagdier wordt gebruikt voor een test mag het gewicht niet meer dan ± 20 % van het gemiddelde gewicht afwijken.
Aantal en geslacht
Voor onderzoek naar de absorptie en de uitscheiding zijn ten minste vier dieren in elke dosisgroep vereist. Er hoeft geen voorkeur te worden gegeven aan een bepaald geslacht, maar in sommige omstandigheden kan het nodig zijn beide geslachten te onderzoeken. Indien zich verschillen in reacties voordoen afhankelijk van het geslacht moeten vier dieren van elk geslacht worden getest. In het geval van onderzoek met niet-knaagdieren kan worden volstaan met een kleiner aantal dieren. Indien de weefseldistributie wordt onderzocht, moet voor de grootte van de groep bij de aanvang van het onderzoek rekening worden gehouden met het aantal op elk tijdstip te doden dieren en het aantal te onderzoeken tijdstippen. Indien het metabolisme wordt onderzocht, wordt de grootte van de groep bepaald door hetgeen voor het onderzoek nodig is.
Voor studies waarbij met meervoudige doseringen wordt gewerkt of waarbij op meerdere tijdstippen wordt onderzocht, dient voor de grootte van de groep rekening te worden gehouden met het aantal tijdstippen en het aantal te doden dieren, waarbij het aantal evenwel niet kleiner mag zijn dan twee. De groep moet voldoende groot zijn om de opname, het plateau en de eliminatie (als dat van toepassing is) van de teststof en/of metabolieten op aanvaardbare wijze te karakteriseren.
Dosisniveaus
Indien één enkele dosis wordt toegediend zijn ten minste twee dosisniveaus vereist. Er dient een lage dosis te worden gebruikt waarbij geen toxische effecten worden waargenomen en een hoge dosis waarbij zich toxische effecten of veranderingen in de toxicokinetische parameters voordoen.
Indien herhaalde dosering wordt toegepast, zal de lage dosis meestal volstaan, maar in bepaalde omstandigheden kan eveneens een hoge dosis noodzakelijk zijn.
Toedieningsweg
Voor toxicokinetische studies moet dezelfde toedieningsweg worden gebruikt en waar dat van toepassing is hetzelfde medium als gebruikt wordt of zal worden gebruikt voor het andere toxiciteitsonderzoek. De teststof wordt gewoonlijk oraal toegediend met behulp van een maagsonde of in het voer, aangebracht op de huid of gedurende bepaalde perioden aan groepen testdieren toegediend door inhalatie. Intraveneuze toediening kan nuttig zijn om de relatieve opname via de andere wegen te bepalen. Bovendien kan kort na de intraveneuze toediening van een stof nuttige informatie worden verkregen over het distributiepatroon.
Er dient rekening te worden gehouden met mogelijke interferenties van het medium met de teststof. Ook dient aandacht te worden gegeven aan verschillen in opname tussen de toediening van de teststof met behulp van een maagsonde en in het voeren aan de noodzaak om de dosis nauwkeurig te bepalen, met name wanneer de teststof in het voer wordt toegediend.
Observatieperiode
Alle proefdieren moeten dagelijks worden geobserveerd. Tekenen van toxiciteit en andere relevante klinische verschijnselen moeten samen met het tijdstip waarop deze voor het eerst zijn opgetreden, de mate en de duur ervan worden genoteerd.
Uitvoering
Nadat de proefdieren zijn gewogen, wordt de teststof via een geschikte weg toegediend. Indien dat belangrijk wordt geacht, kunnen de dieren voor het toedienen van de teststof worden gevast.
Absorptie
De opnamesnelheid en de opgenomen hoeveelheid van de toegediende stof kunnen aan de hand van verschillende methoden worden beoordeeld, met en zonder referentiegroep (8), bijvoorbeeld:
|
— |
bepaling van de hoeveelheid teststof en/of metabolieten in excreta, zoals urine, gal, uitwerpselen, uitgeademde lucht en in het karkas resterende stof; |
|
— |
vergelijking van de biologische reactie (bijvoorbeeld acute toxiciteitsstudies) tussen de proefgroep en controle- en/of referentiegroepen; |
|
— |
vergelijking van de hoeveelheid via de nieren uitgescheiden stof en/of metabolieten in restgroep en referentiegroepen; |
|
— |
bepaling van de oppervlakte onder de plasmaconcentratie/tijdcurve van de teststof en/of metabolieten en vergelijking met gegevens van een referentiegroep. |
Distributie
Momenteel zijn twee methoden beschikbaar. Een ervan of beide kunnen worden gebruikt voor de analyse van distributiepatronen:
|
— |
met behulp van autoradiografie van het hele lichaam worden nuttige kwalitatieve gegevens verkregen, |
|
— |
het doden van dieren op verschillende tijdstippen na de blootstelling en het bepalen van de concentratie en de hoeveelheid teststof en/of metabolieten in weefsels en organen leveren kwantitatieve gegevens. |
Uitscheiding
Bij uitscheidingsstudies worden urine, uitwerpselen en uitgeademde lucht en, in bepaalde gevallen, gal verzameld. De hoeveelheid teststof en/of metabolieten in deze excreta dient op diverse tijdstippen na blootstelling te worden gemeten totdat circa 95 % van de toegediende dosis is uitgescheiden of gedurende zeven dagen, wat zich het eerst voordoet.
In speciale gevallen kan het nodig zijn rekening te houden met de uitscheiding van de teststof in de melk van zogende proefdieren.
Metabolisme
Ten einde de omvang en het patroon van het metabolisme van de teststof te bepalen, dienen de biologische monsters met behulp van geschikte technieken te worden geanalyseerd. Indien vragen uit voorafgaand toxicologisch onderzoek moeten worden opgelost, dient de moleculaire structuur van de metabolieten te worden gekarakteriseerd en moeten geschikte metabolismewegen worden voorgesteld. Het kan nuttig zijn onderzoek in vitro te verrichten om gegevens te verkrijgen over het metabolismepatroon.
Nadere gegevens over het verband tussen metabolisme en toxiciteit kunnen worden verkregen door biochemische studies, zoals het bepalen van effecten op de enzymesystemen die het metabolisme veroorzaken, uitputting van endogene niet-eiwit sulfhydrylverbindingen en de binding van de stof aan macromoleculen.
2. GEGEVENS
Naargelang van het soort onderzoek dienen de gegevens in tabellen te worden samengevat en zoveel mogelijk te worden ondersteund met grafische voorstellingen. Voor elke testgroep dienen, wanneer dat van toepassing is, de gemiddelde en statistische variatie van metingen met betrekking tot tijd, dosering, weefsels en organen te worden vermeld. De mate van absorptie, de hoeveelheid en de snelheid van uitscheiding moeten met geschikte methoden worden bepaald. Wanneer onderzoek naar het metabolisme wordt verricht, dient de moleculaire structuur van de geïdentificeerde metabolieten te worden opgegeven en moeten eventuele metabolismewegen worden voorgesteld.
3. RAPPORTAGE
3.1. VERSLAG VAN DE PROEFNEMING
Naar gelang van het soort onderzoek moeten, indien mogelijk, in het verslag de volgende gegevens worden opgenomen:
|
— |
diersoort, stam, herkomst, leefomstandigheden, voer, enzovoort; |
|
— |
kenmerken van de eventueel gebruikte gemerkte materialen; |
|
— |
gebruikte dosisniveaus en intervallen; |
|
— |
toedieningsweg(en) en eventueel gebruikt medium; |
|
— |
waargenomen toxische en andere effecten; |
|
— |
methoden voor het opsporen van de teststof en/of metabolieten in biologische monsters, met inbegrip van de uitgeademde lucht; |
|
— |
rangschikking van metingen in tabelvorm naar geslacht, dosis, regime, tijdstip, weefsels en organen; |
|
— |
gegevens over de mate van opname en uitscheiding in de tijd; |
|
— |
methoden voor de omschrijving en opsporing van metabolieten in biologische monsters; |
|
— |
methoden voor biologische metingen met betrekking tot het metabolisme; |
|
— |
voorgestelde wegen voor metabolisme; |
|
— |
bespreking van de resultaten; |
|
— |
interpretatie van de resultaten. |
3.2. EVALUATIE EN INTERPRETATIE
Zie Algemene inleiding — Deel B.
4. LITERATUUR
Zie Algemene inleiding — Deel B.
„B.37 VERTRAAGDE NEUROTOXICITEIT VAN ORGANISCHE FOSFORVERBIN-DINGEN NA ACUTE BLOOTSTELLING
1. METHODE
1.1. INLEIDING
Bij de bepaling en evaluatie van de toxische effecten van stoffen is het van belang rekening te houden met het vermogen van sommige soorten stoffen om specifieke typen neurotoxiciteit te veroorzaken die niet met andere toxiciteitstesten kunnen worden aangetoond. Bij sommige organische fosforverbindingen is waargenomen dat vertraagde neurotoxiciteit optreedt; deze stoffen moeten worden beschouwd als kandidaten voor evaluatie.
Door screening in vitro kan worden nagegaan welke stoffen vertraagde polyneuropathie kunnen veroorzaken; negatieve uitkomsten vormen echter geen bewijs dat de teststof niet neurotoxisch is.
Zie ook de algemene inleiding deel B.
1.2. DEFINITIES
Organische fosforverbindingen omvatten ongeladen organische esters, thioesters of anhydriden van organische fosforzuren, organische fosforzuren of organische fosforamidezuren of van verwante fosforthiozuren, fosforthiozurcn of fosforthioamidezuren, of andere stoffen die de vertraagde neurotoxiciteit kunnen veroorzaken die soms bij stoffen uit deze klasse wordt waargenomen.
Vertraagde neurotoxiciteit is een syndroom dat gepaard gaat met het langdurig vertraagde begin van ataxie, distale axonopathieén in het ruggemerg en perifere zenuwen en inhibitie en veroudering van NTE (neuropathy target esterase) in zenuwweefsel.
1.3. REFERENTIESTOFFEN
Een referentiestof kan worden getest met een positieve controlegroep om aan te tonen dat de respons van geteste diersoorten onder laboratoriumomstandigheden niet significant is veranderd.
Een voorbeeld van een vaak toegepaste neurotoxicum is tri-o-tolylfosfaat (CAS 78-30-8, EINECS 201-103-5, CAS-naam: fosforzuur, tris(2,methylfenyl)ester), ook bekend als tri-o-kresylfosfaat.
1.4. PRINCIPE VAN DE TESTMETHODE
De teststof wordt oraal in één enkele dosis toegediend aan hennen die, zo nodig, beschermd zijn tegen acute cholinerge effecten. De dieren worden gedurende 21 dagen geobserveerd op abnormaal gedrag, ataxie en verlammingsverschijnselen. Bij willekeurig geselecteerde hennen uit elke groep worden, gewoonlijk 24 en 48 uur na de toediening, biochemische bepalingen verricht, met name op inhibitie van NTE. Eenentwintig dagen na de toediening worden de resterende hennen gedood en wordt histopathologisch onderzoek verricht aan geselecteerd zenuwweefsel.
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Voorbereidingen
Gezonde jonge volwassen hennen die geen storende virusinfecties of medicatie hebben en die een normale gang vertonen worden aselect verdeeld over behandelde en controlegroepen en ten minste gedurende vijf dagen voor de aanvang van het onderzoek geacclimatiseerd aan de laborato-riumomstandigheden.
De kooien of verblijven moeten zó ruim zijn, dat de hennen vrij kunnen bewegen en dat de gang van de dieren makkelijk kan worden waargenomen.
Het toedienen van de teststof gebeurt gewoonlijk langs orale weg door middel van een maagsonde, gelatinecapsules of een vergelijkbare methode.Vloeistoffen kunnen onverdund of opgelost in een geschikt vehiculum zoals maïsolie worden toegediend. Vaste stoffen moeten waar mogelijk worden opgelost omdat grote hoeveelheden vaste stof in gelatinecapsules mogelijk niet helemaal worden geresorbeerd. Van een niet-waterig vehiculum dienen de toxische eigenschappen bekend te zijn. Als dit niet zo is moeten deze voor de aanvang van de proef worden bepaald.
1.5.2. Proefomstandigheden
1.5.2.1. Proefdieren
Het gebruik var jonge volwassen leghennen (Gallus gallus domesticus) van 8-12 maanden wordt aanbevolen. Er moet gebruik worden gemaakt van rassen en stammen van normale grootte en de hennen moeten zijn gefokt onder omstandigheden die vrij bewegen mogelijk maken.
1.5.2.2. Aantal en geslacht
Als aanvulling op de behandelde groep moet een controlegroep (vehiculum) en een positieve controlegroep worden gebruikt. De controlegroep (vehiculum) wordt op dezelfde wijze behandeld als de behandelde groep; alleen het toedienen van de teststof wordt achterwege gelaten.
Iedere groep vogels moet uit zoveel hennen beslaan dat er ten minste zes kunnen worden gedood voor biochemische bepalingen (telkens drie op twee tijdstippen) en zes de observatieperiode van 21 dagen kunnen overleven ten behoeve van pathologisch onderzoek.
Als positieve controle kan een gelijktijdig geobserveerde groep worden gebruikt of een groep uit een recent verricht onderzoek. De groep moet uit ten minste zes hennen bestaan die worden behandeld met een stof waarvan bekend is dat deze een vertraagd neurotoxische werking heeft. Drie hennen zijn bestemd voor biochemisch onderzoek en drie voor pathologisch onderzoek. Aangeraden wordt om gegevens uit eerdere onderzoeken periodiek aan te vullen. Als een essentieel onderdeel van de proef door het uitvoerend laboratorium wordt veranderd (bijvoorbeeld stam, voedsel, behuizing), motten nieuwe positieve controlegegevens worden ontwikkeld.
1.5.2.3. Dosisniveaus
Om het dosisniveau in het hoofdonderzoek vast te stellen moet een vooronderzoek worden verricht met een voldoende aantal hennen en dosis niveaugroepen. Er dient, om een juist dosisniveau voor de hoofdstudie te kunnen vaststellen, normaal gesproken enige mortaliteit op de treden in deze voorstudie. Om echter sterfte ten gevolge van acute cholinerge effecten te voorkomen, kan atropine of een ander preventief middel, waarvan bekend is dat het niet interfereert met vertraagde neurotoxische reacties, worden toegediend. Voor het vaststellen van de maximale niet-letale dosis van [eststoffen kan een aantal verschillende methoden worden gebruikt (zie methode B.1bis). Gegevens uit eerdere onderzoeken bij de hen of andere toxicologische gegevens kunnen ook nuttig zijn bij de keuze van de dosis.
Het dosisniveau van de teststof in de hoofdstudie moet zo hoog mogelijk liggen, rekening houdend met de resultaten van de voorstudie en de bovengrens van 2 000 mg/kg lichaamsgewicht. Als er tussentijdse mortaliteit optreedt mag dit er niet toe leiden dat er te weinig proefdieren overblijven voor biochemisch (6) en pathologisch (6) onderzoek na 21 dagen. Ter voorkoming van sterfte door acute cholinerge effecten kan atropine of een ander preventief middel worden toegediend waarvan bekend is dat het niet interfereert met vertraagde neuro-toxische reacties.
1.5.2.4. Limiettest
Als een test op een dosisniveau van ten minste 2 000 mg/kg lichaamsgewicht/dag bij gebruikmaking van de beschreven procedures voor dit onderzoek geen waarneembare toxische effecten geeft en als dit, door gegevens van proeven met structureel verwante stoffen, ook niet verwacht mag worden, kan een onderzoek waarbij van een hogere dosering gebruik wordt gemaakt achterwege blijven. De limiettest is van toepassing tenzij blootstelling bij mensen een hogere dosering noodzakelijk maakt.
1.5.3. Observatieperiode
De observatieperiode dient 21 dagen te zijn.
1.5.4. Procedure
Na toediening van een preventief middel om sterfte ten gevolge van acute cholinerge effecten te voorkomen, wordt de teststof in één enkele dosis toegediend.
Algemene observatie
Het observeren moet onmiddellijk na het toedienen beginnen. Alle hennen moeten gedurende de eerste twee dagen enkele malen per dag worden geobserveerd en daarna ten minste eenmaal per dag over een periode van 21 dagen of totdat de dieren worden gedood Alle tekenen van toxiciteit moeten worden geregistreerd, zoals tijdstip van aanvang, soort, ernst en duur van abnormaal gedrag Ataxie moet worden gemeten op een schaalverdeling met ten minste vier niveaus en er moe[ worden gelet op verlammingsverschijnselen. De hennen die zijn geselecteerd voor pathologie moeten ten minste tweemaal per week uit de kooi worden genomen voor een periode van gedwongen motorische activiteit, zoals het beklimmen van een ladder, om het observeren van minimale toxische effecten te vergemakkelijken. Stervende dieren en dieren die hevige stress of pijn vertonen moeten, zodra dit wordt opgemerkt, worden verwijderd, op humane wijze worden gedood en worden geobduceerd.
Lichaamsgewicht
Alle dieren worden vlak voor het toedienen van de teststof en daarna minstens éénmaal per week gewogen.
Biochemie
Zes hennen die willekeurig uit iedere behandelde en vehiculumcontrolegroep worden gekozen en drie hennen uit de positieve controlegroep (als die tegelijkertijd wordt onderzocht) moeten binnen een paar dagen na toediening worden gedood. De hersenen en het lumbale ruggemerg worden geprepareerd en onderzocht op NTE-remmende effecten. Verder kan het nuttig zijn om weefsel van de nervus ischiadicus voor hetzelfde doel te prepareren en te onderzoeken. Meestal worden van de controlegroep en alle behandelde groepen na 14 uur drie vogels gedood en na 48 uur nog eens drie, terwijl de drie hennen van de positieve controlegroep na 24 uur worden gedood. Als de waarneming van klinische verschijnselen van toxiciteit (vaak op grond van het begin van choli-nerge verschijnselen) er op duidt dat du toxische stol zeer langzaam wordt uitgescheiden, kan het aan te bevelen zijn om op twee tijdstippen tussen 24 uur en maximaal 72 uur na toediening weefsel van drie vogels te verzamelen.
Bepaling van acetylcholesterinase (AChE) kan ook bij deze monsters worden uitgevoerd als dat nodig lijkt. Er kan echter spontane reactivering van AChE in vivo optreden: dit kan leiden tot onderschatting van de remmende werking van de teststof op AChE.
Marcroscopische necropsie
Bij macroscopische necropsie van alle (volgens plan of omdat ze stervend waren) gedode dieren moet onder meer het uiterlijk van de hersenen en het ruggemerg worden onderzocht.
Histopathologisch onderzoek
Zenuwweefsel van dieren die de observatieperiode hebben overleefd en niet gebruikt zijn voor biochemisch onderzoek, moet microscopisch worden onderzocht- Het weefsel moet in situ worden gefixeerd door perfusietechnieken, Ondere andere moeten preparaten worden gemaakt van de kleine hersenen [ongeveer halverwege de lengte-as), het verlengde merg, het ruggemerg en perifere zenuwen. De preparaten van het ruggemerg moeten worden genomen uit het bovenste cervicaal segment, het midden van de thoracale regio en de Jumbo-sacrale regio. Ook moeten er preparaten van het distale deel van de nervus tibialis, de vertakkingen hiervan naar de musculus gastrocnemius en van de nervus ischiadicus worden genomen. De preparaten moeten worden gekleurd met de juiste voor myeline en axonen specifieke kleurstoffen.
2. GEGEVENS
Indien negatieve resultaten worden behaald met betrekking tot de parameters van deze methoden (biochemie, histopathologie en gedragsobservatie) is in het algemeen verder testen op vertraagde neurotoxiciteit niel nodig. Bij onduidelijke of dubbelzinnige resultaten voor deze parameters kan verdere evaluatie nodig zijn.
Er moeten individuele gegevens worden verstrekt. Verder moeten alle resultaten in tabelvorm worden gepresenteerd, waarbij voor iedere testgroep het aantal dieren bij aanvang moet worden vermeld, het aantal dieren dat laesies of gedrags- of biochemische effecten vertoont, het soort en de ernst van deze laesies of effecten en het percentage dieren dat een bepaalde laesie of een bepaald effect in een bepaalde mate vertoont
De bevindingen van dit onderzoek moeten worden geëvalueerd wal betreft het voorkomen, de ernst en de correlatie van gedrags-, biochemische en histopathologische effecten en ieder ander waargenomen effect bij de behandelde en de controlegroepen.
Numerieke resultaten moeten wordien geinterpreteerd met behulp van geschikte en algemeen geaccepteerde statistische methoden. De gebruikte statistische methoden moeten bij het ontwerp van het onderzoek worden gekozen.
3. RAPPORTAGE
VERSLAG VAN DE PROEFNEMINGEN
In het rapport moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
3.1. |
proefdieren:
|
|
3.2. |
Proefomstandigheden:
|
|
3.3. |
Resultaten: |
|
|
Bespreking van de resultaten. |
|
Conclusies. |
4. LITERATUUR
Deze methode komt overeen met TG 418 van de OESO.
B.38 VERTRAAGDE NEUROTOXICITEIT VAN ORGANISCHE FOSFORVERBINDINGEN BIJ HERHAALDE TOEDIENING (28 DAGEN)
1. METHODE
1.1. INLEIDING
Bij de bepaling en evaluatie van de toxische effecten van stoffen is het van belang rekening te houden met het vermogen van sommige soorten stoffen om specifieke typen neurotoxiciteit te veroorzaken die niet met andere toxiciteitstesten kunnen worden aangetoond Bij sommige organische fosforverbindingen is waargenomen dat vertraagde neurotoxiciteit optreedt, deze stoffen moeten worden beschouwd als kandidaten voor evaluatie.
Door screening in vitro kan worden nagegaan welke stoffen vertraagde polyneuropathie kunnen veroorzaken; negatieve uitkomsten vormen echter geen bewijs dat de teststof niet neurotoxisch is.
Deze 28-daagse test op vertraagde neurotoxiciteit geeft informatie over mogelijke gevaren voor de gezondheid die zich kunnen voordoen bij herhaalde blootstelling gedurende een beperkte tijd en over de relatie tussen dosis en respons. Tevens kan op grond van de test een schatting worden gemaakt van een dosis zonder waargenomen schadelijke effecten, hetgeen van nut kan zijn bij het vaststellen van veiligheidseisen bij blootstelling.
Zie ook de algemene inleiding deel B.
1.2. DEFINITIES
Organische fosforverbindingen omvatten ongeladen organische esters, thioesters of anhydriden van organische fosforzuren, organische fosforzuren of organische fosforamidezuren of van verwante fosforthiozuren, fosforthiozuren of fosforthioamidezuren, of andere stoffen die de vertraagde neurotoxiciteit kunnen veroorzaken die soms bij stoffen uit deze klasse wordt waargenomen.
Vertraagde neurotoxiciteit is een syndroom dat gepaard gaat met het langdurig vertraagde begin van ataxie, distale axonopathieen in het ruggemerg en perifere zenuwen en inhibitie en veroudering van NTE (neuropathy target esterase) in zenuwweefsel.
1.3. PRINCIPE VAN DE TESTMETHODE
Aan hennen wordt dagelijks, gedurende 28 dagen, oraal een dosis van de teststof toegediend. De dieren worden tot 14 dagen na de laatste dosis tenminste eenmaal per dag geobserveerd op abnormaal gedrag, ataxie en verlammingsverschijnselen. Bij willekeurig geselecteerde hennen uit elke groep worden, gewoonlijk 24 en 48 uur na de laatste toediening, biochemische bepalingen verricht, met name op inhibitie van NTE. Twee weken na de laatste dosis worden de resterende hennen gedood en wordt histopathologisch onderzoek verricht aan geselecteerd zenuwweefsel.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1 Voorbereidingen
Gezonde jonge volwassen hennen die geen storende virusinfecties of medicatie hebben en die een normale gang verronen worden aselect verdeeld over behandelde en controlegroepen en ten minste gedurende vijf dagen voor de aanvang van het onderzoek geacclimatiseerd aan de laborato-riumomstandigheden
De kooien of verblijven moeten zó ruim zijn. dat de hennen vrij kunnen bewegen en dat de gang van de dieren makkelijk kan warden waargenomen.
Het tot-dienen van de teststof moet iedere dag plaatsvinden, zeven dagen per week. bij voorkeur door middel van een maagsonde of gelatinecapsules. Vloeistoffen kunnen onverdund of opgelost in een geschikt vehiculum zoals maïsolie worden toegediend. Vaste stoffen moeten waar mogelijk worden opgelost omdat grote hoeveelheden vaste stof in gelatinecapsules mogelijk niet helemaal worden geresorbeerd. Van een niet-waterig vehiculum dienen de toxische eigenschappen bekend te zijn Als dit niet zo is moeten deze voor de aanvang van de proef worden bepaald.
1.4.2. Proefomstandigheden
Proefdieren
Het gebruik van jonge volwassen leghennen (Gallus gallus domesticus), 8-12 maanden oud, wordt aanbevolen. Er moet gebruik worden gemaakt van gangbare rassen en stammen van normale grootte en de hennen moeten zijn gefokt onder omstandigheden die vrij bewegen mogelijk maken.
Aantal en geslacht
In het algemeen moeten ten minste drie behandelde groepen en een controlegroep (vehiculum) worden gebruikt. De controlegroep (vehiculum) wordt op dezelfde wijze behandeld als de behandelde groep; alleen het toedienen van de testof wordt achterwege gelaten.
ledere groep vogels moet uit zoveel hennen bestaan dal er ten minste zes kunnen worden gedood voor biochemische bepalingen (telkens drie op twee tijdstippen) en zes de observatieperiode van 14 dagen na de behandeling kunnen overleven ten behoeve van pathologisch onderzoek.
Dosisniveaus
De keuze dosisniveaus moet worden gemaakt met inachtneming van de resultaten van een acute test op vertraagde neurotoxiciteit en alle andere beschikbare gegevens over toxiciteit of kinetica van de teststof Het hoogste dosisniveau moet gekozen worden met het doel toxische effecten te veroorzaken, bij voorkeur vertraagde neurotoxiciteit, zonder dat deze leiden tot sterfte of duidelijk lijden. Daarna moet een dalende reeks dosisniveaus gekozen worden om het verband tussen dosis en respons aan te tonen en bij het laagste niveau te komen tot een dosis zonder waargenomen schadelijke effecten.
Limiettest
Als een test op een dosisniveau van ten minste 1 000 mg/kg lichaamsgewicht/dag bij gebruikmaking van de beschreven procedures voor dit onderzoek geen waarneembare toxische effecten geeft en als dit, door gegevens van proeven met structureel verwante stoffen, ook niet verwacht mag worden, kan een onderzoek waarbij van een hogere dosering gebruik wordt gemaakt achterwege blijven. De limiettest is van toepassing tenzij de verwachte blootstelling bij mensen een hogere dosering noodzakelijk maakt.
Observatie periode
Alle dieren moeten ten minste eenmaal per dag worden geobserveerd gedurende de periode van blootstelling en 14 dagen daarna of totdat ze worden geobduceerd.
1.4.3. Procedure
De teststof wordt gedurende een periode van 28 dagen dagelijks (zeven dagen per week) aan de proefdieren toegediend.
Algemene observaties
Het observeren moet onmiddellijk na de eerste toediening beginnen. Alle hennen moeten gedurende de periode van 28 dagen waarop de stof wordt toegediend en gedurende 14 dagen daarna of totdat ze worden gedood, tenminste eenmaal per dag worden geobserveerd. Alle tekenen van toxiciteit moeten worden geregistreerd, zoals tijdstip van aanvang, soort, ernst en duur. Waarnemingen moeten onder meer, maar niet alleen, het observeren van abnormaal gedrag inhouden. Ataxie moet worden gemeten op een schaalverdeling met ten minste vier niveaus en er moet worden gelet op verlammingsverschijnselen. De hennen moeten ten minste tweemaal per week uit de kooi worden genomen voor ten periode van gedwongen motorische activiteit, zoals het beklimmen van een ladder, om het observeren van minimale toxische effecten te vergemakkelijken. Stervende dieten die hevige stress of pijn vertonen moeten, zodra dit wordt opgemerkt, worden verwijderd, op humane wijze worden gedood en worden geobduceerd.
Lichaamsgewicht
Alle dieren worden vlak voor het toedienen van de teststof en daarna minstens éénmaal per weck gewogen.
Biochemie
Zes hennen die willekeurig uit iedere behandelde en vehiculumcontrolegroep worden gekozen moeten binnen een paar dagen na toediening van de laatste dosis worden gedood. De hersenen en het lumbale ruggemerg worden geprepareerd en onderzocht op NTE-remmende effecten. Verder kan het nuttig zijn om weefsel van de nervus ischiadicus voor hetzelfde doel (NTE) te prepareren en te onderzoeken. Meestal worden van de controlegroep en alle behandelde groepen drie vogels 24 uur (en drie vogels 48 uur na de laatste dosis gedood Als gegevens van het acute onderzoek of andere (hij voorbeeld toxicokinetische) onderzoeken er op duiden dat het doden na de laatste dosis beter op een ander tijdstip kan gebeuren, dan moet dat tijdstip aangehouden worden en de motivering worden gedocumenteerd.
Bepaling van acetylcholesterinase (AChE) kan ook bij deze monsters worden uitgevoerd als dal nodig lijkt. Er kan echter spontane reactivering van AChE in vivo optreden; dit kan leiden tot onderschatting van de remmende werking van de teststof op AChE.
Macroscopische necropsie
Bij macroscopische necropsie van alle (volgens plan of omdat ze stervend waren) gedode dieren moet onder meer het uiterlijk van de hersenen en het ruggemerg worden onderzocht.
Histopathologisch onderzoek
Zenuwweefsel van dieren die de observatieperiode hebben overleefd en niet gebruikt zijn voor biochemisch onderzoek, moet microscopisch worden onderzocht. Het weefsel moet in situ worden gefixeerd door perfusietechnieken. Onder andere moeten preparaten worden gemaakt van de kleine hersenen (ongeveer halverwege de lengte-as), het verlengde merg, het ruggemerg en perifere zenuwen. De preparaten van tiet ruggemerg moeten worden genomen uit het bovenste cervicaal segment, het midden van de thoracale regio en de lumbo-sacrale regio. Ook motten er preparaten van het distale deel van de nervus tibialis, de vertakkingen hiervan naar de musculus gastrocnemius en van de nervus ischiadicus worden genomen. De preparaten moeten worden gekleurd met de juiste voor myeline en axonen specifieke kleurstoffen. In eerste instantie moet microscopisch onderzoek worden verricht op de geprepareerde weefsels van alle dieren uit de controlegroep en de groep met de hoogste dosis. Als er aanwijzingen zijn voor effecten in de groep met de hoogste dosering, moeten ook dieren uit de groepen met lagere doseringen worden onderzocht.
2. GEGEVENS
Indien negatieve resultaten worden behaald met betrekking tot de parameters van deze methode (biochemie, histopathologie en gedragsobservatie) is in het algemeen verder testen op vertraagde neurotoxiciteit niet nodig. Bij onduidelijke of dubbelzinnige resultaten voor deze parameters kan verdere evaluatie nodig zijn.
Er moeten individuele gegevens worden verstrekt- Verder moeten alle resultaten in tabelvorm worden gepresenteerd, waarbij voor iedere testgroep moeten worden vermeld het aantal dieren bij aanvang, het aantal dieren dat laesies of gedrags- of biochemische effecten vertoont, het soort en de ernst van deze laesies of effecten en het percentage dieren dat een bepaalde laesie of een bepaald effect in een bepaalde mate vertoont.
De bevindingen van dit onderzoek moeten worden geëvalueerd wat betreft het voorkomen, de ernst en de correlatie van gedrags-, biochemische en histopathologische effecten en ieder ander waargenomen effect bij de behandelde en de controlegroepen.
Numerieke resultaten moeten worden geïnterpreteerd met behulp van geschikte en algemeen geaccepteerde statistische methoden. De te gebruiken statistische methoden moeten bij het ontwerp van het onderzoek worden gekozen.
3. RAPPORTAGE
VERSLAG VAN DE PROEFNEMINGEN
In het rapport moeten, indien mogelijk, de volgende gegevens worden opgenomen:
|
3.1. |
Proefdieren:
|
|
3.2. |
Proefomstandigheden:
|
|
3.3. |
Resultaten:
|
|
Bespreking van de resultaten |
|
Conclusies. |
4. LITERATUUR
Deze methode komt overeen met TG 419 van de OESO.”
„B.39. IN-VIVO TEST OP DNA-HERSTELSYNTHESE IN LEVERCELLEN VAN ZOOGDIEREN
1. METHODE
Deze methode is overgenomen van TG 486 van de OESO: in-vivotest op DNA-herstelsynthese in levercellen van zoogdieren (1997).
1.1. INLEIDING
De in-vivo test op DNA-herstelsynthese (unscheduled DNA synthesis — UDS) in levercellen van zoogdieren wordt gebruikt om te bepalen welke stoften DNA-herstel in levercellen van behandelde dieren induceren (1)(2)(3)(4).
Deze in-vivotest maakt het mogelijk de genotoxische effecten van chemische stoffen in de lever te onderzoeken. Het gemeten eindpunt levert een indicatie op van de DNA-beschadiging en het herstel daarvan in lever-cellen. De lever is de plaats waar het metabolisme van geresorbeerde verbindingen zich meestal voor het grootste deel afspeelt en is derhalve een goede plaats om DNA-beschadiging in vivo te meten.
Als er aanwijzingen zijn dat de teststof niet in het doelweefsel terechtkomt, is deze test niet geschikt.
Het eindpunt van UDS wordt gemeten door bepaling van de opname van gelabelde nucleosiden in cellen waar geen geprogrammeerde DNA-synthese (in de S-fase) plaatsvindt. De meest gebruikte techniek is bepaling van de opname van met tritium gelabeld thymidine ('H-TdR) met behulp van autoradiografie. Bij een in vivo UDS-test wordt bij voorkeur gebruikgemaakt van de rattenlever. Ook andere weefsels dan de lever kunnen worden gebruikt, maar daarvoor is deze methode niet geschikt.
De detectie van een UDS-respons is afhankelijk van het aantal DNA-basen dat op de beschadigde plaats wordt verwijderd en vervangen. De UDS-test is dan ook bijzonder geschikt voor de detectie van stoffen die leiden tot vervanging van grote stukken van 20-30 basen („longpatch repair”). De gevoeligheid bij de detectie van „shortpatch repair”, waarbij één tot drie basen worden vervangen, is daarentegen veel lager. Bovendien kunnen mutagene effecten een gevolg zijn van niet of verkeerd herstelde of verkeerd gerepliceerde DNA-beschadi-gingen. De intensiteit van de UDS-respons levert geen indicatie op omtrent de betrouwbaarheid van het herstelproces. Daarnaast is het mogelijk dat een mutagene stot met DNA reageert, maar dat de DNA-beschadiging niet via een excisieherstelproces wordt gerepareerd. De UDS-test levert dus niet veel specifieke informatie over een mutagene werking op, maar dit wordt gecompenseerd door de potentiële gevoeligheid van dit eindpunt omdat het in het hele genoom wordt gemeten.
Zie ook de algemene inleiding van deel B.
1.2. DEFINITIES
Cel in herstel: een cel met een hogere nettokernkorreling (NKK) dan een vooraf bepaalde waarde, waarvoor het laboratorium dat de test uitvoert een motivering moet geven.
Nettokernkorreling: een kwantitatieve maat voor de UDS-activiteit van cellen bij een UDS-test met autoradiografie, berekend door het gemiddelde aantal cytoplasmakorrels in kern-equivalente cytoplasmagebieden (CK) af te trekken van het aantal kernkorrels (KK): NKK = NK — CK. De NKK wordt per cel apart berekend en vervolgens samengevoegd voor cellen in een cultuur, in parallelle culturen, enz.
DNA-herstelsynthese (unscheduled DNA synthesis — UDS): herstelsynthese van DNA na excisie en verwijdering van een stuk DNA dat gedeeltelijk beschadigd is door een chemische stof of een fysisch agens.
1.3. PRINCIPE VAN DE TESTMETHODE
De in vivo UDS-test in levercellen van zoogdieren levert een indicatie op van de herstelsynthese van DNA na excisie en verwijdering van een stuk DNA dat gedeeltelijk beschadigd is door een chemische stof of een fysisch agens. Meestal is de test gebaseerd op de inbouw van 3H-TdR in het DNA van levercellen met een geringe frequentie van cellen in de S-fase van de celcyclus. De opname van 3H-TdR wordt meestal bepaald met behulp van autoradiogralie. aangezien deze techniek niet zo gevoelig is voor storing door cellen in de S-fase als bijvoorbeeld vloeistofscintillatietelling.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereiding
1.4.1.1. Keuze van de diersoort
Meestal worden ratten gebruikt, maar in principe komt elke geschikte zoogdiersoort in aanmerking. Er dient gebruik te worden gemaakt van jonge gezonde volwassen dieren van in het laboratorium gangbare stammen. Bij het begin van de studie moet het gewichtsverschil tussen de dieren zo klein mogelijk zijn en mag dit maximaal ±20 % van het gemiddelde gewicht van eik geslacht bedragen.
1.4.1.2. Huisvesting en voeding
De in de algemene inleiding van deel B genoemde algemene omstandigheden worden aangehouden, maar voor de luchtvochtigheid wordt gestreefd naar 50-60 %.
1.4.1.3. Voorbereiding van de dieren
Gezonde jonge volwassen dieren worden aselect ingedeeld in de behandelde en controlegroepen. De kooien moeten zodanig worden geplaatst dat mogelijke effecten daarvan tot een minimum worden beperkt. De dieren krijgen een unieke identificatie en blijven voordat de test begint minimaal vijf dagen in hun kooi om in het laboratorium te acclimatiseren.
1.4.1.4. Teststof/Bereiding
Vaste teststoffen moeten in geschikte oplosmiddelen of media worden opgelost of gesuspendeerd en eventueel vóór de toediening aan de dieren worden verdund. Vloeibare teststoffen kunnen rechtstreeks worden toegediend of vóór de toediening worden verdund. Tenzij uit stabiliteitsgegevens blijkt dat opslag aanvaardbaar is, moeten verse bereidingen van de teststof worden gebruikt.
1.4.2. Testomstandigheden
1.4.2.1. Oplosmiddel/Medium
Het oplosmiddel/medium mag bij de gebruikte dosisniveaus geen toxische effecten veroorzaken en chemische reacties met de teststof moeten uitgesloten zijn. Als er andere dan gangbare oplosmiddelen/media worden gebruikt, moeten gegevens worden verstrekt waaruit blijkt dat ze geen problemen opleveren. Aanbevolen wordt waar mogelijk eerst te bezien of een waterig oplosmiddel/medium kan worden gebruikt.
1.4.2.2. Controles
In elk onafhankelijk uitgevoerd deel van het experiment moeten tegelijkertijd positieve en negatieve (oplosmiddel/medium) controles worden uitgevoerd. Afgezien van de behandeling met de teststof moeten de dieren in de controlegroepen op identieke wijze worden behandeld als de dieren in de andere groepen.
Voor de positieve controles moet een stof worden gebruikt waarvan bekend is dat deze tot UDS leidt op een blootstellingsniveau waarbij een detecteerbare stijging ten opzichte van het achtergrondniveau kan worden verwacht. Wanneer voor een positieve controle metabole activering nodig is, moet de dosering zodanig worden gekozen dat de respons gematigd is (4). De doseringen kunnen zodanig worden gekozen dat de effecten duidelijk zijn maar de gecodeerde objectglaasjes niet onmiddellijk als zodanig herkenbaar zijn. Als positieve controle kunnen bijvoorbeeld worden gebruikt:
|
Stof Bemonsteringstijdstip |
Stut |
CAS-nr |
Einecs-nr. |
|
Vroeg (2-4 uur) |
N'-Nitrosodimethylamine |
62-75-9 |
200-249-8 |
|
Laat (12-16 uur) |
N-Fluoreen-2-ylaceetamide (2-AAF) |
53-96-3 |
200-188-6 |
Ook andere geschikte stollen kunnen als positieve controle worden gebruikt. Het is aanvaardbaar de positieve controle langs een andere weg toe te dienen dan de teststof.
1.5. UITVOERING
1.5.1. Aantal en geslacht van de dieren
Er moet een afdoende aantal dieren worden gebruikt om rekening te houden met de natuurlijke biologische variatie in de respons op de test. Elke groep moet minimaal drie analyseerbare dieren bevatten. Wanneer er een significant basisbestand met gegevens uit het verleden is opgebouwd, zijn er voor de gelijktijdige negatieve en positieve controlegroepen slechts één o(twee dieren nodig.
Als er bij de uitvoering van de studie gegevens uit studies bij dezelfde soort en met dezelfde blootstellingsweg beschikbaar zijn waaruit blijkt dat er geen significante verschillen in toxiciteit tussen de geslachten zijn, is het voldoende de test bij één geslacht, bij voorkeur mannetjes, uit te voeren. Wanneer de blootstelling aan een chemische stof bij de mens door het geslacht wordt bepaald, zoals dit bijvoorbeeld bij sommige geneesmiddelen het geval is, moet de test bij dieren van het desbetreffende geslacht worden uitgevoerd.
1.5.2. Behandelingsschema
De teststof wordt in het algemeen in één behandeling toegediend.
1.5.3. Dosisniveaus
Normaal gesproken worden er ten minste twee dosisniveaus gebruikt. De hoogste dosis wordt gedefinieerd als de dosis die zodanige toxiciteitsverschijnselen veroorzaakt dat er bij hogere doses met hetzelfde doseringsschema waarschijnlijk sterfte zal optreden. In het algemeen wordt als laagste dosis 25-50 % van de hoogste dosis gebruikt.
Stoffen met een specifieke biologische activiteit bij lage niet-toxische doses (zoals hormonen en mitogenen) kunnen een uitzondering vormen op deze criteria om de dosering te bepalen en moeten per geval worden beoordeeld. Als er een oriënterend onderzoek wordt uitgevoerd omdat er geen bruikbare gegevens beschikbaar zijn, moet dit in hetzelfde laboratorium gebeuren met dezelfde soort, dezelfde stam, hetzelfde geslacht en hetzelfde behandelingsschema als bij het hoofdonderzoek.
De hoogste dosis kan ook worden gedefinieerd als een dosis die enigerlei aanwijzing van toxiciteit in de lever oplevert (bv. pyknotische kernen).
1.5.4. Limiettest
Als een test met één dosis van minimaal 2 000 mg/kg lichaamsgewicht, in één keer of in twee porties op dezelfde dag toegediend, geen waarneembare toxische effecten veroorzaakt en op basis van gegevens over stoffen met een verwante structuur geen genotoxiciteit te verwachten valt, zal het wellicht niet nodig zijn een volledig onderzoek uit te voeren. Op grond van gegevens omtrent de verwachte blootstelling van de mens kan het gebruik van een hoger dosisniveau, bij de limiettest nodig worden geacht.
1.5.5. Toediening van de doses
De teststof wordt meestal met behulp van een maagsonde of een geschikte intubatiecanule toegediend. Ook andere toedieningswegen kunnen aanvaardbaar zijn, als daarvoor een motivering kan worden gegeven. Intra-peritoneale toediening wordt echter niet aanbevolen, aangezien de lever dan rechtstreeks aan de teststof kan worden blootgesteld in plaats van via de bloedsomloop, tiet maximale volume vloeistof dat in één keer met een sonde of injectie kan worden toegediend, is afhankelijk van de grootte van het proefdier. Het volume mag niet groter zijn dan 2 ml/100 g lichaamsgewicht. Voor het gebruik van grotere volumes moet een motivering worden gegeven. Behalve bij prikkelende of bijtende stoffen, die in hogere concentraties meestal heviger effecten veroorzaken, moeten volumeverschillen tot een minimum worden beperkt door de concentratie aan te passen, zodat op alle dosisniveaus hetzelfde volume kan worden gebruikt.
1.5.6. Levercelpreparaten
Normaal gesproken worden twaalf tot 1» uur na de toediening van de teststof levercelpreparaten van de behandelde dieren gemaakt. Meestal is ook een eerder bemonsteringstijdstip (normaal gesproken twee tot vier uur na de behandeling! nodig, tenzij er op twaalf tot 16 uur een duidelijke positieve reactie is. Er kunnen echter ook andere bemonsteringstijdstippen worden gebruikt, wanneer daarvoor op basis van toxicokinetische gegevens een motivering kan worden gegeven.
Meestal worden kortetermijnculturen van zoogdierlevercellen gemaakt door de lever in situ met collagenase te perfuseren en de net losgemaakte levercellen zich te laten hechten aan een geschikt oppervlak. De levercellen van dieren uit de negatieve controlegroep moeten een levensvatbaarheid (5) van ten minste 50 % hebben
1.5.7. Bepaling van de UDS
Net geïsoleerde zoogdierlevercellen worden gedurende een geschikte periode, bijvoorbeeld drie tot acht uur, geïncubeerd met een medium dat meestal 3H-TdR bevat. Aan het eind van de incubatieperiode worden de cellen uit het medium verwijderd en kunnen ze vervolgens worden geïncubeerd met medium dat een overmaat ongelabeld thymidine bevat, om de niet ingebouwde radioactiviteit te verdrijven („cold chase”). De cellen worden vervolgens gespoeld, gefixeerd en gedroogd. Bij een langduriger incubatietijd zal de „cold chase” wellicht niet nodig zijn. De objectglaasjes worden in autoradiografischc emulsie gedoopt, in het donker belicht (bv. gekoeld gedurende zeven tot 14 dagen), ontwikkeld en gekleurd, waarna de belichte zilverkorrels worden geteld. Voor elk dier worden twee tot drie objectglaasjes geprepareerd.
1.5.8. Analyse
De geprepareerde objectglaasjes moeten voldoende cellen met een normale morfologie bevatten om een zinvolle bepaling van de UDS mogelijk te maken. De preparaten worden microscopisch onderzocht op tekenen van duidelijke cytotoxiciteit (bv. pyknose of een verlaagd gehalte aan het radioactieve isotoop).
De objectglaasjes worden vóór het tellen van de korrels gecodeerd. Normaal gesproken worden voor elk dier 100 cellen van ten minste twee objectglaasjes gescoord. Voor het scoren van minder dan 100 cellen per dier moet een motivering worden gegeven.
Kr worden geen korrels geteld bij cellen waarvan de kern in de S-fase is, maar het relatieve aantal cellen in de S-fase kan wel geregistreerd worden.
Met behulp van geschikte methoden wordt aan de hand van de neergeslagen zilverkorrels de hoeveelheid ingebouwd 3H-TdR in de kern en het cytoplasma van morfologisch normale cellen bepaald.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
De gegevens moeten voor elk objectglaasje en elk dier apart worden verstrekt. Daarnaast moet een overzicht van alle gegevens in tabelvorm worden gegeven. Voor elke cel, voor elk dier en voor elke dosis en tijd wordt de nettokernkorreling (NKK) berekend volgens de formule: NKK = NK — CK. Als het aantal „cellen in herstel” wordt geteld, moet een motivering worden gegeven voor de criteria voor de definitie van „cel in herstel” op basis van de resultaten bij in het verleden of tegelijkertijd uitgevoerde negatieve controles. De numerieke resultaten kunnen met behulp van statistische methoden worden geëvalueerd. Als statistische tests worden gebruikt, moeten deze vóór de uitvoering van het onderzoek worden gekozen en gemotiveerd.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Criteria voor een positieve/negatieve respons zijn bijvoorbeeld:
|
Positief |
i) |
NKK-waarden boven een vooraf bepaalde drempelwaarde die op basis van gegevens van het laboratorium uit het verleden wordt gemotiveerd; |
|
of |
ii) |
NKK-waarden die significant hoger zijn dan de gelijktijdige controle. |
|
Negatief |
i) |
NKK-waarden binnen/onder de controledrempelwaarde uit het verleden: |
|
of |
ii) |
NKK-waarden die niet significant hoger zijn dan de gelijktijdige controle. |
Er moet naar de biologische relevantie van de gegevens worden gekeken. Daarbij moet bijvoorbeeld rekening worden gehouden met parameters als de spreiding over dieren, het verband tussen dosis en respons en de cytotoxiciteit. Als hulpmiddel bij de evaluatie van de testresultaten kunnen statistische methoden worden gebruikt. Statistische significantie mag echter niet de enige bepalende factor voor een positieve reactie zijn.
Hoewel de meeste experimenten duidelijk positieve of negatieve resultaten zullen opleveren, zal een definitieve uitspraak over de effecten van de teststot in uitzonderingsgevallen onmogelijk zijn. De resultaten kunnen, hoe vaak het experiment ook wordt herhaald, onduidelijk of twijfelachtig blijven.
Positieve resultaten bij de UDS-test met levercellen van zoogdieren in vivo wijzen erop dat een teststof in vivo DNA-beschadigingen in levercellen van zoogdieren induceert, die in vitro door DNA-herstelsynthese kunnen worden gerepareerd. Negatieve resultaten wijzen erop dat de teststof onder de testomstandigheden geen DNA-beschadigingen induceert die met deze test kunnen worden gedetecteerd.
De waarschijnlijkheid dat de teststof in cc grote bloedsomloop of specifiek het doelweefsel terechtkomt (syste-mische toxiciteit), dient te worden besproken.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Oplosmiddel/Medium:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
(1) |
Ashby, j. Lefevre, P.A.., Burlinson, B. and Penman, M.G. (1985). An Assessment of the In Vivo Rat. Hepatocyte DNA Repair Assay, Mutation Res., 156, pp. 1-18. |
|
(2) |
Butterworth, B.E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis,). Probst, G. and Williams, G. (1987); A Protocol and Guide tor the In Vivo Rat Hepatocyte DNA-Repair Assay. Mutation Res., 189, pp. 123-133. |
|
(3) |
Kennelly, J.C., Waters, R., Ashby, J., Lefevre, P.A., Burlinson, IS., Benford, D.J., Dean, S.W. and Mitchell, I. de G. (1993), In Vivo Rat Liver UDS Assay. In: Kirkland D.J. and Fox M., (eds), Supplementary Muta- genicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part II revised. Cambridge University Press. Cambridge, New York, Port Chester, Mel- bourne, Sydney, pp. 5 2-77. |
|
(4) |
Madle, S., Dean. S.W., Andrae, U., Brambilla. G., Burlinson, B., Doolittle, D.J., Furihata, C, Hertner, T., McQueen, CA. and Mori, H. (199 3). Recommendations tor the Performance of UDS Tests In Vitro and In Vivo, Mutation Res., 312, pp. 26 3-285. |
|
(5) |
Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl. C. (1993), Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UD.Sj. Mutation Res., 291, pp. 21-27. |
|
(6) |
Mirsalis, J.C., Tyson, C.K. and Butterworth, B.E. (1982), Detection of Genotoxic Carcinogens in the in Vivo/In Vitro Hepatocyte DNA Repair Assay, Environ. Mutagen, 4, pp. 553-562.” |
B.40. IN VITRO -HUIDCORROSIE: TEST OP BASIS VAN DE TRANSCUTANE ELEKTRISCHE WEERSTAND (TEW)
1. METHODE
Deze testmethode komt overeen met OESO TG 430 (2004).
1.1. INLEIDING
Onder huidcorrosie wordt verstaan: het ontstaan van irreversibele weefselschade in de huid na het aanbrengen van een testmateriaal [zoals gedefinieerd in het GHS (Globally Harmonised System for Classification and Labelling of Chemicals, wereldwijd geharmoniseerd stelsel voor de indeling en etikettering van chemische stoffen] (1). Bij deze testmethode wordt de corrosiviteit bepaald volgens een procedure waarbij geen levende dieren worden gebruikt.
De bepaling van de huidcorrosiviteit ging meestal gepaard met het gebruik van proefdieren (2). Vanwege de pijn en het lijden van dieren waarvan bij deze procedure sprake was, is testmethode B.4 zodanig aangepast dat huidcorrosie met behulp van alternatieve in vitro-methoden kan worden bepaald, zodat pijn en lijden bij dieren kunnen worden vermeden.
Als eerste stap op weg naar de vaststelling van alternatieve tests die voor de bepaling van de huidcorrosiviteit met het oog op regelgeving kunnen worden gebruikt, zijn er prevalideringsstudies uitgevoerd (3). Daarna is een formele valideringsstudie van in vitro-methoden voor de bepaling van de huidcorrosie (4)(5) uitgevoerd (6)(7)(8). Het resultaat van deze studies en andere gepubliceerde literatuur hebben geleid tot de aanbeveling dat de volgende tests voor de bepaling van de in vivo-huidcorrosiviteit kunnen worden gebruikt (9)(10)(11): de test met het humane huidmodel (zie testmethode B.40 bis) en de test op basis van de transcutane elektrische weerstand (deze methode).
Op grond van een valideringsstudie en andere gepubliceerde studies is gerapporteerd dat met de bepaling op basis van de transcutane elektrische weerstand (TEW) bij rattenhuid (12)(13) een betrouwbaar onderscheid kan worden gemaakt tussen stoffen waarvan bekend is dat ze corrosief c.q. niet-corrosief voor de huid zijn (5)(9).
Met de in deze methode beschreven test kunnen corrosieve chemische stoffen en mengsels worden geïdentificeerd. Daarnaast kunnen ook niet-corrosieve stoffen en mengsels worden geïdentificeerd wanneer ter ondersteuning de bewijskracht wordt bepaald met behulp van andere bestaande informatie (b.v. pH, structuur/activiteitrelaties en gegevens over mens en/of dier) (1)(2)(11)(14). De test levert geen informatie over huidirritatie op en ook een onderverdeling van corrosieve stoffen zoals in het GHS (1) is niet mogelijk.
Voor een volledige beoordeling van lokale huideffecten na één blootstelling op de huid wordt aanbevolen de sequentiële teststrategie te volgen die als bijlage bij testmethode B.4 (2) is opgenomen en ook in het GHS (1) wordt beschreven. Deze teststrategie behelst de uitvoering van in vitro-tests op huidcorrosie (zoals in deze methode wordt beschreven) en huidirritatie voordat tests op levende dieren worden overwogen.
1.2. DEFINITIE
Huidcorrosie in vivo: het ontstaan van een irreversibele beschadiging van de huid, namelijk zichtbare necrose door de epidermis heen in de dermis, na het aanbrengen van een teststof gedurende ten hoogste vier uur. Corrosieve reacties worden gekenmerkt door zweren, bloedingen, bloederige korsten en aan het eind van de observatie na 14 dagen door verkleuring ten gevolge van het verbleken van de huid, stukken huidoppervlak die kaal geworden zijn en littekens. Om twijfelachtig letsel te evalueren moet histopathologie worden overwogen.
Transcutane elektrische weerstand (TEW): een maat voor de elektrische impedantie van de huid, uitgedrukt als elektrische weerstand in kiloOhm. Dit is een eenvoudige en krachtige methode om de barrièrefunctie te bepalen door de passage van ionen door de huid met behulp van een brug van Wheatstone te registreren.
1.3. REFERENTIESTOFFEN
Tabel 1:
Referentiestoffen
|
Naam |
EINECS-nr. |
CAS-nr. |
|
|
1,2-Diaminopropaan |
201-155-9 |
78-90-0 |
Sterk corrosief |
|
Acrylzuur |
201-177-9 |
79-10-7 |
Sterk corrosief |
|
2-tert. Butylfenol |
201-807-2 |
88-18-6 |
Corrosief |
|
Kaliumhydroxide (10 %) |
215-181-3 |
1310-58-3 |
Corrosief |
|
Zwavelzuur (10 %) |
231-639-5 |
7664-93-9 |
Corrosief |
|
Octaanzuur (caprylzuur) |
204-677-5 |
124-07-02 |
Corrosief |
|
4-Amino-1,2,4-triazool |
209-533-5 |
584-13-4 |
Niet corrosief |
|
Eugenol |
202-589-1 |
97-53-0 |
Niet corrosief |
|
Fenethylbromide |
203-130-8 |
103-63-9 |
Niet corrosief |
|
Tetrachloorethyleen |
204-825-9 |
27-18-4 |
Niet corrosief |
|
Isostearinezuur |
250-178-0 |
30399-84-9 |
Niet corrosief |
|
4-(Methylthio)benzaldeh yd |
222-365-7 |
3446-89-7 |
Niet corrosief |
De meeste vermelde chemische stoffen zijn afkomstig van de lijst van chemische stoffen die voor de internationale valideringsstudie van het ECVAM zijn gekozen (4). Ze zijn aan de hand van de volgende criteria gekozen:
|
i) |
een gelijk aantal corrosieve en niet-corrosieve stoffen; |
|
ii) |
in de handel verkrijgbare stoffen waarmee de meeste relevante chemische categorieën worden bestreken; |
|
iii) |
opneming van stoffen die sterk corrosief zijn en stoffen die minder corrosief zijn om onderscheid te kunnen maken op basis van de corrosiepotentie; |
|
iv) |
keuze van chemische stoffen die in een laboratorium kunnen worden gebruikt zonder andere ernstige gevaren op te leveren dan corrosiviteit. |
1.4. PRINCIPE VAN DE TESTMETHODE
Het testmateriaal wordt gedurende maximaal 24 uur aangebracht op het oppervlak van de epidermis van huidschijfjes in een testsysteem met twee compartimenten waarin de huidschijfjes als scheiding tussen de compartimenten fungeren. De huidschijfjes worden weggenomen uit de huid van op humane wijze gedode ratten met een leeftijd van 28-30 dagen. Corrosief materiaal wordt gekenmerkt doordat het een verlies van de normale intacte staat en barrièrefunctie van het stratum corneum kan veroorzaken, dat wordt gemeten als een daling van de TEW tot onder een drempelwaarde (12). Voor de TEW bij rattenhuid is een drempelwaarde van 5 kΩ gekozen op basis van uitgebreide gegevens voor een breed scala van chemische stoffen, waarbij de overgrote meerderheid van de waarden duidelijk boven (vaak > 10 kΩ) of duidelijk onder (vaak < 3 kΩ) deze waarde lag (12). In het algemeen verlagen materialen die bij dieren niet corrosief zijn maar wel irriterend of niet-irriterend, de TEW niet tot onder de drempelwaarde. Bovendien kan het gebruik van andere huidpreparaten of andere apparatuur deze drempelwaarde veranderen, zodat een verdere validering nodig is.
In de testprocedure wordt een kleurstofbindende stap opgenomen als bevestigende test voor positieve resultaten bij de TEW, onder andere voor waarden rond de 5 kΩ. Met de kleurstofbindende stap wordt bepaald of de toename van de permeabiliteit voor ionen door een fysieke vernietiging van het stratum corneum wordt veroorzaakt. Er is aangetoond dat met de TEW-methode met rattenhuid een prognose kan worden gegeven voor de in vivo-bepaling van de corrosiviteit bij het konijn volgens testmethode B.4 (2). Er dient te worden opgemerkt dat de in vivo-test bij het konijn ten aanzien van huidcorrosiviteit en huidirritatie zeer conservatief is in vergelijking met de test met een humane huidpatch (15).
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Dieren
Omdat de gevoeligheid van de huid van ratten voor chemische stoffen bij deze test al eerder is aangetoond (10), wordt de voorkeur gegeven aan deze species. De leeftijd (wanneer de huid wordt weggenomen) en de stam van de rat zijn heel belangrijk om ervoor te zorgen dat de haarfollikels in de rustfase verkeren voordat de volwassen haargroei begint.
Het haar op de rug en de flanken van jonge (ongeveer 22 dagen oude) mannetjes- of vrouwtjesratten (Wistar of een vergelijkbare stam) wordt met een kleine schaar zorgvuldig verwijderd. De dieren worden vervolgens gewassen door zorgvuldig te wrijven terwijl het geknipte gebied wordt ondergedompeld in een antibiotica-oplossing (die bijvoorbeeld streptomycine, penicilline, chlooramfenicol en amfotericine bevat in concentraties die werkzaam zijn voor het remmen van de groei van bacteriën). De dieren worden op de derde of vierde dag na de eerste keer wassen opnieuw met antibiotica gewassen en worden binnen drie dagen na de tweede keer wassen, wanneer het stratum corneum zich van de verwijdering van het haar hersteld heeft, gebruikt.
1.5.2. Het prepareren van de huidschijfjes
De dieren worden op humane wijze gedood wanneer ze 28-30 dagen oud zijn; deze leeftijd is van cruciaal belang. Vervolgens wordt de huid van de rug en de flanken van elk dier verwijderd en van overtollig onderhuids vet ontdaan door het voorzichtig van de huid los te trekken. Daarna worden er huidschijfjes verwijderd met een diameter van ongeveer 20 mm per stuk. De huid mag worden bewaard voordat de schijfjes worden gebruikt, wanneer wordt aangetoond dat de gegevens van de positieve en negatieve controles gelijkwaardig zijn aan die van verse huid.
Elk huidschijfje wordt over een van de uiteinden van een PTFE-buis (polytetrafluoretheen) gelegd, waarbij ervoor wordt gezorgd dat het oppervlak van de epidermis in contact met de buis is. Een rubber „O”-ring wordt strak over het uiteinde van de buis geschoven om de huid op zijn plaats te houden en het overtollige weefsel wordt weggeknipt. In figuur 2 worden de afmetingen van de buis en de „O”-ring aangegeven. Vervolgens wordt de rubber „O”-ring zorgvuldig met vaseline aan de PTFE-buis vastgekit. De buis wordt met een klemring vastgezet in een receptorcompartiment dat een MgSO4-oplossing (154 mM) bevat (figuur 1). Het huidschijfje moet volledig in de MgSO4-oplossing worden ondergedompeld. Van één rattenhuid kunnen wel 10-15 huidschijfjes worden gemaakt.
Voordat de test begint, wordt als kwaliteitsborgingsprocedure voor elke rattenhuid de elektrische weerstand van twee huidschijfjes gemeten. Als bij beide schijfjes een weerstand van meer dan 10 kΩ wordt gemeten, mogen de overige schijfjes voor de test worden gebruikt. Als de gemeten weerstand lager dan 10 kΩ is, mogen de overige schijfjes van die huid niet worden gebruikt.
1.5.3. Aanbrengen van de test- en controlestoffen
Voor elke studie moeten parallelle positieve en negatieve controles worden gebruikt om na te gaan of het experimentele model afdoende functioneert. Er moeten huidschijfjes van één dier worden gebruikt. Als positieve en negatieve controlestof worden respectievelijk 10 M zoutzuur en gedestilleerd water aanbevolen.
Vloeibare teststoffen (150 μl) worden gelijkmatig op het oppervlak van de epidermis in de buis aangebracht. Wanneer vast materiaal wordt getest, wordt een zodanige hoeveelheid van de vaste stof gelijkmatig op het schijfje aangebracht, dat het hele oppervlak van de epidermis bedekt is. Vervolgens wordt gedeïoniseerd water (150 μl) boven op de vaste stof toegevoegd en wordt de buis voorzichtig geschud. Om voor een maximaal contact met de huid te zorgen kan het nodig zijn dat vaste stoffen tot 30 oC worden verwarmd om de teststof te laten smelten of zachter te maken of worden fijngemalen om een korrelig materiaal of poeder te verkrijgen.
Voor elke test- en controlestof worden drie huidschijfjes gebruikt. De teststoffen worden gedurende 24 uur bij 20-23 oC aangebracht. De teststof wordt verwijderd door onder een straal leidingwater van maximaal 30 oC te wassen tot er geen materiaal meer kan worden verwijderd.
1.5.4. TEW-metingen
De impedantie van de huid wordt als TEW gemeten met een wisselstroommeetbrug van Wheatstone voor zwakstroom (13). Algemene specificaties van de brug zijn: bedrijfsspanning 1-3 Volt, een sinusvormige of rechthoekige wisselstroom van 50-1 000 Hz en ee n m eet ber eik va n t en min ste 0, 1-3 0 k Ω. Met de bi j d e v ali der ing sst udi e g ebr uik te mee tbr ug kon den in duc tan tie , c apa cit ant ie en wee rst and wo rde n g eme ten to t w aar den va n r esp ect iev eli jk 200 0 H , 2 000 μF en 2 M Ω, bij fr equ ent ies va n 1 00 Hz of 1 k Hz, me t s eri ële of pa ral lel le waa rde n. Voo r d e T EW- cor ros ivi tei tsb epa lin g w ord en de met ing en ger egi str eer d i n w eer sta nd bij ee n f req uen tie va n 1 00 Hz en met se rië le waa rde n. Alv ore ns de ele ktr isc he wee rst and te me ten wo rdt de op per vla kte spa nni ng van de hu id ver laa gd doo r z ove el 70 % e tha nol to e t e v oeg en dat de ep ide rmi s b ede kt is. Na en kel e s eco nde n w ord t d e e tha nol ui t d e b uis ve rwi jde rd en wor dt het we efs el geh ydr ate erd do or 3 m l M gSO 4-o plo ssi ng (15 4 m M) toe te vo ege n. De ele ktr ode n v an de mee tbr ug wor den aa n w eer szi jde n v an het hu ids chi jfj e g epl aat st om de wee rst and in kΩ /hu ids chi jfj e t e m ete n ( zie fi guu r 1 ). De afm eti nge n v an de ele ktr ode en de le ngt e v an het st uk ele ktr ode da t o nde r d e k rok odi lle nkl em uit kom t, zij n v erm eld in fi guu r 2 . D e k lem va n d e b inn ens te ele ktr ode ru st tij den s d e w eer sta nds met ing op de bo ven kan t v an de PTF E-b uis om er voo r t e z org en dat st eed s e en eve n l ang st uk van de el ekt rod e i n d e M gSO 4-o plo ssi ng ste ekt . D e b uit ens te ele ktr ode wo rdt zo dan ig in het re cep tor com par tim ent ge pla ats t d at dez e o p d e b ode m v an het co mpa rti men t r ust . D e a fst and tu sse n d e k lem rin g e n d e o nde rka nt van de PT FE- bui s w ord t c ons tan t g eho ude n ( zie fi guu r 2 ), aan gez ien de ze afs tan d d e g eme ten we ers tan d b eïn vlo edt . D it hou dt in dat de af sta nd tus sen de bi nne nst e e lek tro de en het hu ids chi jfj e c ons tan t e n m ini maa l m oet zi jn (1- 2 m m).
Als de gemeten weerstand hoger is dan 20 kΩ, kan dit worden veroorzaakt door de resten van de teststof waarmee het oppervlak van de epidermis van het huidschijfje bedekt is. Deze laag kan men verder trachten te verwijderen door bijvoorbeeld de PTFE-buis met de duim (met handschoen) dicht te houden en gedurende ongeveer 10 seconden te schudden. De MgSO4-oplossing wordt weggegooid en de weerstandsmeting wordt met verse MgSO4-oplossing herhaald.
De eigenschappen en afmetingen van de gebruikte testapparatuur en de testprocedure kunnen de gevonden TEW-waarden beïnvloeden. De drempelwaarde voor corrosie van 5 kΩ is bepaald op grond van gegevens die met de specifieke hier beschreven apparatuur en procedure zijn verkregen. Als de testomstandigheden worden gewijzigd of andere apparatuur wordt gebruikt, zullen de drempel- en controlewaarden dan ook wellicht verschillen. Daarom moeten de methodologie en de drempelwaarden voor de weerstand worden gekalibreerd door een aantal referentiestandaards te testen die worden gekozen uit de chemische stoffen die bij de valideringsstudie zijn gebruikt (4)(5) of uit vergelijkbare chemische categorieën als de chemische stoffen die worden bestudeerd. In tabel 1 is een verzameling geschikte referentiestoffen opgenomen.
1.5.5. Kleurstofbindingsmethoden
Blootstelling aan bepaalde niet-corrosieve materialen kan leiden tot een daling van de weerstand tot onder de drempelwaarde van 5 kΩ, waardoor ionen het stratum corneum kunnen passeren en de elektrische weerstand daalt (5). Neutrale organische stoffen en chemische stoffen met oppervlakteactieve eigenschappen (zoals detergenten, emulgatoren en andere surfactanten) kunnen huidlipiden verwijderen waardoor de permeabiliteit van de barrière voor ionen toeneemt. Dit betekent dat er, als de TEW-waarden van teststoffen lager zijn dan 5 kΩ of rond deze waarde liggen en er geen sprake is van visuele schade, een bepaling van de kleurstofpenetratie bij de controles en de behandelde weefsels dient te worden uitgevoerd om vast te stellen of de gemeten TEW-waarden het gevolg zijn van een toegenomen permeabiliteit van de huid of huidcorrosie (3)(5). Wanneer in het laatste geval het stratum corneum beschadigd is, penetreert de kleurstof sulforhodamine B snel na aanbrengen op het huidoppervlak en kleurt deze het weefsel daaronder. Deze specifieke kleurstof is stabiel voor een breed scala van chemische stoffen en wordt niet beïnvloed door onderstaande extractieprocedure.
1.5.5.1. Aanbrengen en verwijderen van de kleurstof sulforhodamine B
Na de TEW-bepaling wordt de magnesiumsulfaatoplossing uit de buis verwijderd en wordt de huid zorgvuldig onderzocht op zichtbare beschadiging. Als er geen zichtbare significante beschadiging is, wordt 150 μl van een 10 %-verdunning (g/v) van de kleurstof sulforhodamine B (Acid Red 52; C.I. 45100; EINECS-nummer 222-529-8; CAS-nummer 3520-42-1) in gedestilleerd water gedurende twee uur op het oppervlak van de epidermis van elk huidschijfje aangebracht. De huidschijfjes worden vervolgens gedurende ongeveer 10 seconden met leidingwater van ten hoogste kamertemperatuur gewassen om een eventuele overmaat of ongebonden kleurstof te verwijderen. Elk huidschijfje wordt voorzichtig van de PTFE-buis verwijderd en in een flesje (bv. een glazen scintillatieflesje van 20 ml) met gedeïoniseerd water (8 ml) gelegd. De flesjes worden gedurende 5 minuten zachtjes geschud om eventueel nog resterende ongebonden kleurstof te verwijderen. Daarna wordt deze wasprocedure herhaald en vervolgens worden de huidschijfjes in flesjes met 5 ml 30 % (g/v) natriumdodecylsulfaat (SDS) in gedestilleerd water gelegd en een nacht bij 60 oC geïncubeerd.
Na incubatie wordt elk huidschijfje verwijderd en weggegooid en wordt de resterende oplossing gedurende 8 minuten bij 21 oC gecentrifugeerd (relatieve centrifugale kracht ~ 175 × g). Vervolgens wordt 1 ml van het supernatans 1:5 (v/v) [d.w.z. 1 ml + 4 ml] verdund met 30 % (g/v) SDS in gedestilleerd water. De optische dichtheid (OD) van de oplossing wordt bij 565 nm gemeten.
1.5.5.2. Berekening van het kleurstofgehalte
Het gehalte aan de kleurstof sulforhodamine B per schijfje wordt berekend uit de OD-waarden (5) (de molaire extinctiecoëfficiënt van de kleurstof sulforhodamine B bij 565 nm = 8,7 × 104 en het molecuulgewicht = 580). Het gehalte aan de kleurstof wordt voor elk huidschijfje bepaald door een geschikte kalibratiecurve te gebruiken en vervolgens wordt voor de duplo's een gemiddeld kleurstofgehalte berekend.
2. GEGEVENS
De weerstand (in kΩ) en, indien van toepassing, het gemiddelde kleurstofgehalte (in Hg/schijfje) voor het testmateriaal en de positieve en negatieve controles worden in tabelvorm gerapporteerd (gegevens van de experimenten afzonderlijk en gemiddelden ± standaarddeviatie), met vermelding van gegevens voor duplobepalingen, herhaalde bepalingen, gemiddelden en de afzonderlijke waarden.
2.1. INTERPRETATIE VAN DE RESULTATEN
De gemiddelde TEW-resultaten worden geaccepteerd als de parallelle positieve en negatieve controlewaarden binnen het voor de methode in het testlaboratorium aanvaardbare bereik liggen. Het aanvaardbare weerstandsbereik voor de in het voorgaande beschreven methodologie en apparatuur wordt in onderstaande tabel vermeld:
|
Controle |
Stof |
Weerstandsbereik (kΩ) |
|
Positief |
10 M zoutzuur |
0,5-1,0 |
|
Negatief |
Gedestilleerd water |
10-25 |
De gemiddelde resultaten voor de kleurstofbinding worden geaccepteerd, mits de parallelle controlewaarden binnen het voor de methode aanvaardbare bereik liggen. Als aanvaardbaar bereik voor het kleurstofgehalte bij de controlestoffen voor de in het voorgaande beschreven methodologie en apparatuur wordt voorgesteld:
|
Controle |
Stof |
Bereik kleurstofgehalte (μg/schijf) |
|
Positief |
10 M zoutzuur |
40-100 |
|
Negatief |
Gedestilleerd water |
15-35 |
De teststof wordt als niet-corrosief voor de huid beschouwd:
|
i) |
als de gemiddelde TEW-waarde voor de teststof hoger dan 5 kΩ is of |
|
ii) |
als de gemiddelde TEW-waarde niet hoger dan 5 kΩ is en
|
De teststof wordt als corrosief voor de huid beschouwd:
|
i) |
als de gemiddelde TEW-waarde niet hoger dan 5 kΩ is en het huidschijfje duidelijk beschadigd is of |
|
ii) |
als de gemiddelde TEW-waarde niet hoger dan 5 kΩ is en
|
3. RAPPORTAGE
3.1. TESTRAPPORT
In het testrapport moet ten minste de volgende informatie worden opgenomen:
|
|
Test- en controlestoffen:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusie. |
4. REFERENTIES
|
1. |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
2. |
Testmethode B.4. Acute toxiciteit: Huidirritatie/corrosie. |
|
3. |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, DJ., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219-255. |
|
4. |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic, in Vitro 12, 471-482. |
|
5. |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhiitter, H.-G., and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic, in Vitro 12, 483-524. |
|
6. |
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62 pp. |
|
7. |
Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129-147. |
|
8. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf |
|
9. |
ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280. |
|
10. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.mehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
11. |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st-2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
12. |
Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test -modificationsand validation. Fd. Chem. Toxicol. 24, 507-512. |
|
13. |
Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic, in Vitro 6, 191-194. |
|
14. |
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709-720. |
|
15. |
Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845- 852. |
|
16. |
Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxic. in Vitro. 2, 7-17. |
Figuur 1:
Apparatuur voor de TEW-bepaling bij rattenhuid binnenste (dikke) elektrode

Figuur 2:
Afmetingen van de PTFE-buis (polytetrafluoretheen) en het receptorcompartiment en de gebruikte elektroden
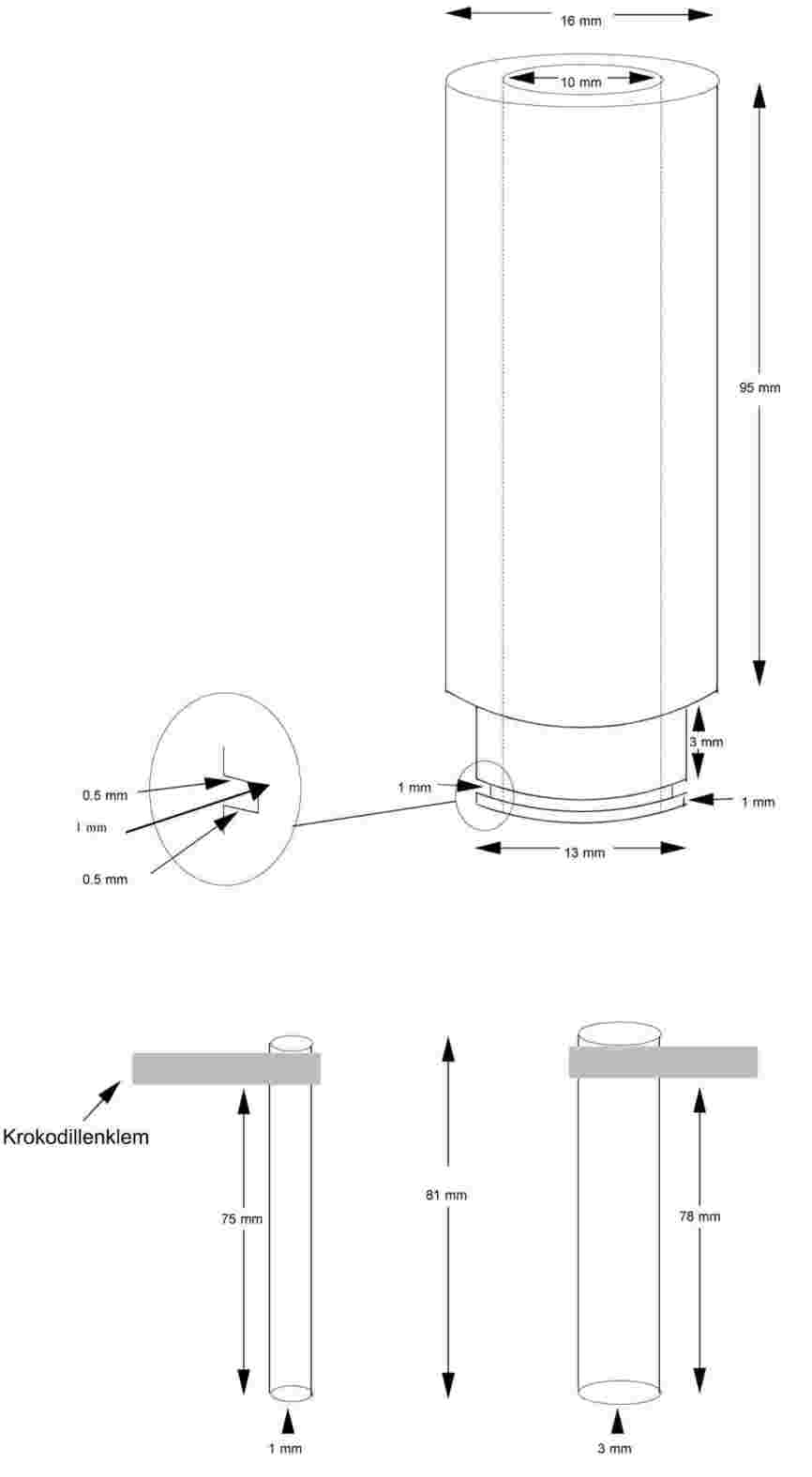
Kritische factoren van bovenstaande apparatuur:
|
— |
de binnendiameter van de PTFE-buis; |
|
— |
de lengte van de elektroden in vergelijking met de PTFE-buis en het receptorcompartiment, zodat de elektroden het huidschijfje niet raken en altijd een even lang stuk van de elektrode in contact met de MgSO4-oplossing is; |
|
— |
de hoeveelheid MgSO4-oplossing in het receptorcompartiment moet zodanig zijn dat het vloeistofniveau lager is dan in de PTFE-buis (zie figuur 1); |
|
— |
het huidschijfje moet stevig genoeg op de PTFE-buis worden bevestigd, zodat de elektrische weerstand een reële maat voor de eigenschappen van de huid is. |
B.40 BIS. IN-VITRO HUIDCORROSIE: TEST MET HUMAAN HUIDMODEL
1. METHODE
Deze testmethode komt overeen met OESO TG 431 (2004).
1.1. INLEIDING
Onder huidcorrosie wordt verstaan: het ontstaan van irreversibele weefselschade in de huid na het opbrengen van een testmateriaal (zoals gedefinieerd in het GHS (Globally Harmonised System for Classification and Labelling of Chemicals, wereldwijd geharmoniseerd stelsel voor de indeling en etikettering van chemische stoffen) (1). Bij deze testmethode behoeven voor de bepaling van de huidcorrosiviteit geen levende dieren of dierlijk weefsel te worden gebruikt.
De bepaling van de huidcorrosiviteit ging meestal gepaard met het gebruik van proefdieren (2). Vanwege de pijn en het lijden van dieren waarvan bij deze procedure sprake was, is testmethode B.4 zodanig aangepast dat huidcorrosie met behulp van alternatieve in-vitro methoden kan worden bepaald, zodat pijn en lijden bij dieren kunnen worden vermeden.
Als eerste stap op weg naar de vaststelling van alternatieve tests die voor de bepaling van de huidcorrosiviteit met het oog op regelgeving kunnen worden gebruikt, zijn er prevalideringsstudies uitgevoerd (3). Daarna is een formele valideringsstudie van in-vitro methoden voor de bepaling van de huidcorrosie (4)(5) uitgevoerd (6)(7)(8). Het resultaat van deze studies en andere gepubliceerde literatuur (9) hebben geleid tot de aanbeveling dat de volgende tests voor de bepaling van de in-vivo huidcorrosiviteit kunnen worden gebruikt (10)(11)(12)(13): de test met het humane huidmodel (deze methode) en de test op basis van de transcutane elektrische weerstand (zie testmethode B.40).
Op grond van valideringsstudies is gerapporteerd dat met tests waarbij humane huidmodellen worden gebruikt (3)(4)(5)(9), een betrouwbaar onderscheid kan worden gemaakt tussen stoffen waarvan bekend is dat ze corrosief c.q. niet-corrosief voor de huid zijn. Bovendien kan met het testprotocol wellicht ook een indicatief onderscheid worden gemaakt tussen stoffen met een meer of minder hevige corrosieve werking op de huid.
Met de in deze methode beschreven test kunnen corrosieve chemische stoffen en mengsels worden geïdentificeerd. Daarnaast kunnen ook niet-corrosieve stoffen en mengsels worden geïdentificeerd wanneer ter ondersteuning de bewijskracht wordt bepaald met behulp van andere bestaande informatie (bv. pH, structuur/activiteitrelaties en gegevens over mens en/of dier) (1)(2)(13)(14). Normaal gesproken levert de test niet voldoende informatie over huidirritatie op en is ook een onderverdeling van corrosieve stoffen zoals in het GHS (1) niet mogelijk.
Voor een volledige beoordeling van lokale huideffecten na één blootstelling op de huid wordt aanbevolen de sequentiële teststrategie te volgen die als bijlage bij testmethode B.4 (2) is opgenomen en ook in het GHS (1) wordt beschreven. Deze teststrategie behelst de uitvoering van in-vitrotests op huidcorrosie (zoals in deze methode wordt beschreven) en huidirritatie voordat tests op levende dieren worden overwogen.
1.2. DEFINITIES
Huidcorrosie in vivo: het ontstaan van een irreversibele beschadiging van de huid, namelijk zichtbare necrose door de epidermis heen in de dermis, na het opbrengen van een teststof gedurende ten hoogste vier uur. Corrosieve reacties worden gekenmerkt door zweren, bloedingen, bloederige korsten en aan het eind van de observatie na 14 dagen door verkleuring ten gevolge van het verbleken van de huid, stukken huidoppervlak die kaal geworden zijn en littekens. Om twijfelachtig letsel te evalueren moet histopathologie worden overwogen.
Levensvatbaarheid van cellen: een parameter waarmee de totale activiteit van een celpopulatie wordt gemeten (bv. het vermogen van cellulaire mitochondriale dehydrogenases om de vitale kleurstof MTT te reduceren) die, afhankelijk van het gemeten eindpunt en de opzet van de test, is gecorreleerd met het totale aantal en/of de vitaliteit van de cellen.
1.3. REFERENTIESTOFFEN
Tabel 1:
Referentiestoffen
|
Naam |
EINECS-nr. |
CAS-nr. |
|
|
1,2-Diaminopropaan |
201-155-9 |
78-90-0 |
Sterk corrosief |
|
Acrylzuur |
201-177-9 |
79-10-7 |
Sterk corrosief |
|
2-tert.-Butylfenol |
201-807-2 |
88-18-6 |
Corrosief |
|
Kaliumhydroxide (10 %) |
215-181-3 |
1310-58-3 |
Corrosief |
|
Zwavelzuur (10 %) |
231-639-5 |
7664-93-9 |
Corrosief |
|
Octaanzuur (caprylzuur) |
204-677-5 |
124-07-02 |
Corrosief |
|
4-Amino-1,2,4-triazool |
209-533-5 |
584-13-4 |
Niet-corrosief |
|
Eugenol |
202-589-1 |
97-53-0 |
Niet-corrosief |
|
Fenethylbromide |
203-130-8 |
103-63-9 |
Niet-corrosief |
|
Tetrachloorethyleen |
204-825-9 |
27-18-4 |
Niet-corrosief |
|
Isostearinezuur |
250-178-0 |
30399-84-9 |
Niet-corrosief |
|
4- (Methylthio)benzaldehyd |
222-365-7 |
3446-89-7 |
Niet-corrosief |
De meeste vermelde chemische stoffen zijn afkomstig van de lijst van chemische stoffen die voor de internationale valideringsstudie van het ECVAM zijn gekozen (4). Ze zijn aan de hand van de volgende criteria gekozen:
|
i) |
een gelijk aantal corrosieve en niet-corrosieve stoffen; |
|
ii) |
in de handel verkrijgbare stoffen waarmee de meeste relevante chemische categorieën worden bestreken; |
|
iii) |
opneming van stoffen die sterk corrosief zijn en stoffen die minder corrosief zijn om onderscheid te kunnen maken op basis van de corrosiepotentie; |
|
iv) |
keuze van chemische stoffen die in een laboratorium kunnen worden gebruikt zonder andere ernstige gevaren op te leveren dan corrosiviteit. |
1.4. PRINCIPE VAN DE TESTMETHODE
Het testmateriaal wordt plaatselijk aangebracht op een driedimensionaal humaan huidmodel, bestaande uit ten minste een gereconstrueerde epidermis met een functioneel stratum corneum. Corrosieve materialen worden geïdentificeerd doordat zij bij gespecificeerde blootstellingsperioden een daling van de levensvatbaarheid van de cellen [die bijvoorbeeld wordt bepaald door de reductie van MTT te meten (15)] tot onder gedefinieerde drempelwaarden kunnen veroorzaken. Het principe van de bepaling met het humane huidmodel is gebaseerd op de hypothese dat corrosieve chemische stoffen door diffusie of erosie het stratum corneum kunnen penetreren en cytotoxisch zijn voor de daaronder liggende cellagen.
1.4.1. Procedure
1.4.1.1. Humane huidmodellen
Humane huidmodellen kunnen op commerciële basis worden vervaardigd of verkregen (bv. de modellen EpiDerm™ en EPISKIN™) (16)(17)(18)(19) of in het testlaboratorium worden ontwikkeld of vervaardigd (20)(21). Voor het gebruik van menselijke huid gelden nationale en internationale ethische overwegingen en voorwaarden. Elk nieuw model moet worden gevalideerd (ten minste overeenkomstig de beschrijving onder 1.4.1.1.2). De voor deze test gebruikte humane huidmodellen moeten aan de volgende voorwaarden voldoen:
1.4.1.1.1.
Om het epitheel op te bouwen moeten humane keratocyten worden gebruikt. Er moeten verschillende lagen levende epitheelcellen aanwezig zijn onder een functioneel stratum corneum. Het huidmodel kan ook een laag met een stromale component hebben. Het stratum corneum moet uit verschillende lagen bestaan met het benodigde lipidenprofiel om te zorgen voor een functionele barrière die krachtig genoeg is om een snelle penetratie van cytotoxische markers tegen te gaan. De insluitingseigenschappen van het model moeten voorkomen dat materiaal om het stratum corneum heen in het levende weefsel terechtkomt. Als teststoffen om het stratum corneum heen kunnen komen, levert dit een slecht model voor blootstelling van de huid op. Het huidmodel mag niet verontreinigd zijn met bacteriën (met inbegrip van mycoplasma) of fungi.
1.4.1.1.2
De levensvatbaarheid wordt meestal gekwantificeerd met behulp van MTT of de andere metabool omgezette vitale kleurstoffen. In deze gevallen moet de optische dichtheid (OD) van de geëxtraheerde (opgeloste) kleurstof uit het negatieve controleweefsel ten minste 20 keer zo hoog zijn als de OD van het extractieoplosmiddel alleen [zie voor een overzicht (22)]. Het negatieve controleweefsel moet gedurende de volledige blootstellingsperiode van de test in cultuur stabiel zijn (een vergelijkbare gemeten levensvatbaarheid opleveren). Het stratum corneum moet krachtig genoeg zijn om de snelle penetratie van bepaalde cytotoxische markers (bv. 1 % Triton X-100) tegen te gaan. Deze eigenschap kan worden bepaald aan de hand van de blootstellingstijd die nodig is om de levensvatbaarheid van de cellen met 50 % te verlagen (ET50) (voor de modellen EpiDerm™ en EPISKIN™ is dit bv. > 2 uur). Er moet worden aangetoond dat het weefsel in de loop van de tijd en bij voorkeur van laboratorium tot laboratorium reproduceerbaar is. Bovendien moet daarmee een prognose kunnen worden gegeven van de corrosiepotentie van de referentiechemicaliën (zie tabel 1) wanneer deze volgens het gekozen testprotocol worden gebruikt.
1.4.1.2. Opbrengen van de teststof en de controlestoffen
Voor elke behandeling (blootstellingstijd), ook voor de controles, worden twee duploweefsels gebruikt. Voor vloeibaar materiaal moet er zo veel teststof worden opgebracht dat het huidoppervlak uniform bedekt is: er moet ten minste 25 μl/cm2 worden gebruikt. Voor vast materiaal moet er zo veel teststof worden opgebracht dat het huidoppervlak gelijkmatig bedekt is en dit moet vervolgens met gedeïoniseerd of gedestilleerd water worden bevochtigd om voor een goed contact met de huid te zorgen. Indien nodig moeten vaste stoffen tot een poeder worden vermalen voordat ze worden opgebracht. De wijze van opbrengen moet geschikt zijn voor de teststof (zie bijvoorbeeld referentie 5). Aan het eind van de blootstellingsperiode moet het testmateriaal zorgvuldig van het huidoppervlak worden gewassen met een geschikte buffer of 0,9 % NaCl.
Voor elke studie moeten parallelle positieve en negatieve controles worden gebruikt om na te gaan of het experimentele model afdoende functioneert. Als positieve controlestoffen worden ijsazijn of 8 N KOH aanbevolen. Als negatieve controles worden 0,9 % NaCl of water aanbevolen.
1.4.1.3. Meting van de levensvatbaarheid van de cellen
Voor de meting van de levensvatbaarheid van de cellen kunnen alleen kwantitatieve gevalideerde methoden worden gebruikt. Bovendien moet de meting van de levensvatbaarheid compatibel zijn met gebruik in een driedimensionaal weefselpreparaat. De meting van de levensvatbaarheid mag niet worden gestoord door niet-specifieke kleurstofbinding. Eiwitbindende kleurstoffen en kleurstoffen die geen metabole omzetting ondergaan (bijvoorbeeld neutraalrood), zijn derhalve niet geschikt. De meest gebruikte bepaling is de reductie van MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-difenyltetrazoliumbromide, thiazolylblauw: EINECS-nummer 206-069-5, CAS-nummer 298-93-1)], waarvan is aangetoond dat deze nauwkeurige en reproduceerbare resultaten oplevert (5), maar ook andere bepalingen kunnen worden gebruikt. Het huidmonster wordt gedurende 3 uur bij een geschikte incubatietemperatuur in een MTT-oplossing met een geschikte concentratie (bv. 0,3-1 mg/ml) gelegd. Er ontstaat een blauw formazanneerslag dat vervolgens wordt geëxtraheerd met een oplosmiddel (isopropanol) en de formazanconcentratie wordt gemeten door de OD bij een golflengte tussen 540 en 595 nm te bepalen.
De chemische effecten van het testmateriaal op de vitale kleurstof kunnen de effecten van het cellulaire metabolisme nabootsen, hetgeen tot een onjuiste bepaling van de levensvatbaarheid leidt. Er is aangetoond dat dit gebeurt wanneer dit testmateriaal niet volledig door wassen van de huid wordt verwijderd (9). Als het testmateriaal rechtstreekse effecten op de vitale kleurstof heeft, moeten er aanvullende controles worden gebruikt om storing van de meting van de levensvatbaarheid door de teststoffen te detecteren en daarvoor te corrigeren (9)(23).
2. GEGEVENS
Voor elk weefsel moeten de OD-waarden en de berekende procentuele levensvatbaarheid van de cellen voor het testmateriaal en de positieve en negatieve controles in tabelvorm worden gerapporteerd, met vermelding van gegevens over duplobepalingen, eventueel herhaalde bepalingen, gemiddelden en de afzonderlijke waarden.
2.1. INTERPRETATIE VAN DE RESULTATEN
De voor elk testmonster verkregen OD-waarden kunnen worden gebruikt voor de berekening van een procentuele levensvatbaarheid in vergelijking met de negatieve controle, die a priori op 100 % wordt gesteld. De drempelwaarde van de procentuele levensvatbaarheid van de cellen die als scheiding tussen corrosieve en niet-corrosieve testmaterialen (of tussen verschillende klassen van corrosiviteit) fungeert, of de statistische procedure die wordt gebruikt om de resultaten te evalueren en corrosieve materialen te identificeren, moet duidelijk worden gespecificeerd en gedocumenteerd en de juistheid daarvan moet worden aangetoond. In het algemeen worden deze drempelwaarden tijdens het optimaliseren van de test bepaald, tijdens de prevalideringsfase getest en bij een valideringsstudie bevestigd. De voorspelling van corrosiviteit bij het model EpiDerm™ is bijvoorbeeld (9):
De teststof wordt als corrosief voor de huid beschouwd:
|
i) |
als de levensvatbaarheid na 3 minuten blootstelling minder dan 50 % is of |
|
ii) |
als de levensvatbaarheid na 3 minuten blootstelling 50 % of hoger is en de levensvatbaarheid na 1 uur blootstelling minder dan 15 % is. |
De teststof wordt als niet-corrosief voor de huid beschouwd:
|
i) |
als de levensvatbaarheid na 3 minuten blootstelling 50 % of hoger is en de levensvatbaarheid na 1 uur blootstelling 15 % of hoger is. |
3. RAPPORTAGE
3.1. TESTRAPPORT
In het testrapport moet ten minste de volgende informatie worden opgenomen:
|
|
Test- en controlestof:
|
|
|
Een motivering voor het gebruikte huidmodel en protocol. |
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusie. |
4. REFERENTIES
|
1. |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
2. |
Testmethode B.4. Acute toxiciteit: Huidirritatie/corrosie. |
|
3. |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, DJ., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23,219— 255. |
|
4. |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In Vitro 12, 471-482. |
|
5. |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, 483-524. |
|
6. |
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp. |
|
7. |
Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129-147. |
|
8. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf. |
|
9. |
Liebsch, M., Traue, D., Barrabas, C, Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C, Kaufmann, T., Remmele, M. and Holzhütter, H.G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp.371-401. |
|
10. |
ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280. |
|
11. |
ECVAM (2000). ECVAM News & Views. ATLA 28, 365-67. |
|
12. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDerm™, EPISKTN™ (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
13. |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st-2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat |
|
14. |
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709-720. |
|
15 |
Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, 55-63. |
|
16. |
Cannon, CL., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In Vitro 8, 889-891. |
|
17. |
Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211- 225. |
|
18. |
Tinois E, Gaetani Q, Gayraud B, Dupont D, Rougier A, Pouradier DX (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133-140 |
|
19. |
Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post -transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310-319 |
|
20. |
Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163-171. |
|
21. |
Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747-756. |
|
22. |
Marshall, N.J., Goodwin, C.J., Holt, SJ. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69-84. |
|
23. |
Fentem, J.H., Briggs, D., Chesne', C, Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. In Vitro 15, 57-93. |
B.41. IN VITRO 3T3 NRU FOTOTOXICITEITSTEST
1. METHODE
Deze methode komt overeen met OESO TG 432 (2004).
1.1. INLEIDING
Fototoxiciteit wordt gedefinieerd als een toxische respons ten gevolge van een op het lichaam opgebrachte stof die wordt opgewekt of toeneemt (zichtbaar bij lagere doses) na een daaropvolgende blootstelling aan licht of die wordt geïnduceerd door bestraling van de huid na systemische toediening van een stof.
De in-vitro 3T3 NRU fototoxiciteitstest wordt gebruikt om na te gaan in hoeverre een teststof fototoxische effecten kan hebben, die na de blootstelling aan licht door de geëxciteerde chemische stof worden geïnduceerd. De test evalueert de fotocytotoxiciteit aan de hand van de relatieve verlaging van de levensvatbaarheid van cellen die in aanwezigheid van licht aan de chemische stof worden blootgesteld ten opzichte van blootstelling zonder licht. Stoffen die positief op deze test reageren, zullen in vivo na systemische toediening en distributie naar de huid of na lokale toediening waarschijnlijk fototoxisch zijn.
Van veel soorten chemische stoffen is gerapporteerd dat ze fototoxische effecten induceren (1)(2)(3)(4). Deze hebben als gemeenschappelijk kenmerk dat ze lichtenergie binnen het zonlichtspectrum kunnen absorberen. Volgens de eerste wet van de fotochemie (wet van Grotthaus-Draper) is voor een fotoreactie de absorptie van voldoende lichtquanta nodig. Voordat een biologische test wordt overwogen, moet dan ook een absorptiespectrum van de teststof in UV/zichtbaar licht worden bepaald volgens OESO-testrichtsnoer 101. Er is wel gesuggereerd dat het onwaarschijnlijk is dat een stof waarvan de molaire extinctie/absorptiecoëfficiënt lager is dan 10 liter × mol-1 × cm-1, fotoreactief is. Een dergelijke chemische stof hoeft wellicht niet volgens de in vitro 3T3 NRU fototoxiciteitstest of een andere biologische test op schadelijke fotochemische effecten te worden getest (1)(5). Zie ook bijlage 1.
De betrouwbaarheid en relevantie van de in-vitro 3T3 NRU fototoxiciteitstest is onlangs geëvalueerd (6)(7)(8)(9). Daarbij is aangetoond dat de in-vitro 3T3 NRU fototoxiciteitstest acute fototoxische effecten in vivo bij mens en dier voorspelt. De test is niet bedoeld om andere schadelijke effecten te voorspellen die zich door een gecombineerde werking van een chemische stof en licht kunnen voordoen, zoals fotogenotoxische, fotoallergische of fotocarcinogene effecten, en ook een bepaling van de fototoxische potentie is niet mogelijk. Bovendien is de test niet bedoeld voor de bestudering van indirecte mechanismen van fototoxiciteit, effecten van metabolieten van de teststof of effecten van mengsels.
Terwijl het gebruik van metaboliserende systemen een algemene voorwaarde is voor alle in-vitro tests voor de voorspelling van mogelijke genotoxische en carcinogene effecten, zijn er in het geval van de fototoxicologie tot op heden slechts enkele voorbeelden waarbij metabole omzetting nodig is om een chemische stof in vivo of in vitro als fototoxine te laten werken. Het wordt dan ook niet nodig of vanuit wetenschappelijk oogpunt wenselijk geacht om deze test met een metabool activerings systeem uit te voeren.
1.2. DEFINITIES
Bestralingssterke: de intensiteit van het ultraviolette (UV) of zichtbare licht dat op een oppervlak valt, uitgedrukt in W/m3 of mW/cm2.
Lichtdosis: de hoeveelheid (= intensiteit × tijd) ultraviolette (UV) of zichtbare straling die op een oppervlak valt, uitgedrukt in Joules (= W × s) per oppervlakte-eenheid, d.w.z. J/m3 of J/cm2.
UV-golflengtebanden: de door de CIE (Commission Internationale de L'Eclairage) aanbevolen indeling is: UVA (315-400 nm), UVB (280-315 nm) en UVC (100-280 nm). Er worden ook andere indelingen gehanteerd: de grens tussen UVB en UVA wordt vaak op 320 nm gelegd en UVA wordt soms onderverdeeld in UV-A1 en UV-A2, waarbij de grens op ongeveer 340 nm ligt.
Levensvatbaarheid van cellen: een parameter waarmee de totale activiteit van een celpopulatie wordt gemeten (bv. opname van de vitale kleurstof neutraalrood in cellulaire lysosomen) die, afhankelijk van het gemeten eindpunt en de opzet van de test, is gecorreleerd met het totale aantal en/of de vitaliteit van de cellen.
Relatieve levensvatbaarheid van cellen: de levensvatbaarheid van cellen, uitgedrukt in verhouding tot (negatieve) oplosmiddelcontrolecellen die de gehele testprocedure doorlopen hebben (+Irr of -Irr) maar niet met de teststof zijn behandeld.
PIF (foto-irritatiefactor): een factor die wordt verkregen door twee even effectieve cytotoxische concentraties (IC50) van de teststof te vergelijken die zijn verkregen zonder (-Irr) en met (+Irr) een niet-cytotoxische bestraling met UVA/zichtbaar licht.
IC50: de concentratie van de teststof waarbij de levensvatbaarheid van de cellen met 50 % daalt.
MPE (gemiddeld foto-effect): een parameter die wordt bepaald aan de hand van een mathematische analyse van de concentratie/responscurves die zijn verkregen zonder (-Irr) en met (+Irr) een niet-cytotoxische bestraling met UV A/zichtbaar licht.
Fototoxiciteit: een acute toxische respons die wordt opgewekt na de eerste blootstelling van de huid aan bepaalde chemische stoffen, gevolgd door de blootstelling aan licht, of op vergelijkbare wijze wordt geïnduceerd door bestraling van de huid na systemische toediening van een chemische stof.
1.3. PRINCIPE VAN DE TESTMETHODE
De in-vitro 3T3 NRU fototoxiciteitstest is gebaseerd op een vergelijking van de cytotoxiciteit van een chemische stof met en zonder blootstelling aan een niet-cytotoxische dosis gesimuleerd zonlicht. De cytotoxiciteit wordt in deze test uitgedrukt als een concentratieafhankelijke verlaging van de opname van de vitale kleurstof neutraalrood, die 24 uur na de behandeling met de teststof en de bestraling wordt gemeten (10). Neutraalrood is een zwakke kationische kleurstof die celmembranen gemakkelijk via andere processen dan diffusie penetreert en intracellulair in lysosomen accumuleert. Veranderingen in het oppervlak van het gevoelige lysosoom-membraan leiden tot kwetsbaarheid van de lysosomen en andere veranderingen die geleidelijk irreversibel worden. Dergelijke door xenobiotica veroorzaakte veranderingen leiden tot een daling van de opname en binding van neutraalrood. Het is derhalve mogelijk onderscheid te maken tussen levensvatbare, beschadigde en dode cellen en dat is de basis van deze test.
Balb/c 3T3 cellen worden gedurende 24 uur in cultuur gehouden zodat zich een monolaag vormt. Vervolgens worden voor elke teststof twee 96-wells-platen gedurende één uur gepreïncubeerd met 8 verschillende concentraties van de teststof. Daarna wordt een van de twee platen blootgesteld aan de hoogste niet-cytotoxische stralingsdosis, terwijl de andere plaat in het donker wordt bewaard. In beide platen wordt het behandelingsmedium vervolgens vervangen door cultuurmedium en na nog eens 24 uur incubatie wordt de levensvatbaarheid van de cellen bepaald aan de hand van de opname van neutraalrood. De levensvatbaarheid van de cellen wordt uitgedrukt als percentage van de levensvatbaarheid van onbehandelde oplosmiddelcontroles en wordt voor elke testconcentratie berekend. Om een uitspraak te doen over het fototoxische potentieel wordt de concentratie-afhankelijke respons met en zonder bestraling vergeleken, gewoonlijk op het niveau van de IC50, d.w.z. de concentratie die de levensvatbaarheid van de cellen in vergelijking met de onbehandelde controles met 50 % vermindert.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1. Voorbereidingen
1.4.1.1. Cellen
In de valideringsstudie is een permanente fibroblastcellijn van muizen — Balb/c 3T3, kloon 31 — van de American Type Culture Collection (ATCC), Manassas, VA (VS) of van de European Collection of Cell Cultures (ECACC), Salisbury, Wiltshire (VK) gebruikt en daarom wordt aanbevolen deze van een goed gekwalificeerde celbank te betrekken. Andere cellen of cellijnen kunnen met dezelfde testprocedure worden gebruikt als de cultuuromstandigheden aan de specifieke behoeften van de cellen worden aangepast, maar de gelijkwaardigheid moet worden aangetoond.
De cellen moeten periodiek worden gecontroleerd op de afwezigheid van mycoplasmabesmetting en mogen alleen worden gebruikt als deze niet wordt geconstateerd (11).
Het is belangrijk dat de UV-gevoeligheid van de cellen periodiek wordt gecontroleerd volgens de kwaliteitscontroleprocedure die in deze methode wordt beschreven. Aangezien de UVA-gevoeligheid van cellen met het aantal passages kan toenemen, moeten Balb/c 3T3 cellen met het laagst verkrijgbare aantal passages worden gebruikt, bij voorkeur lager dan 100 (zie punt 1.4.2.2.2 en bijlage 2).
1.4.1.2. Media en cultuuromstandigheden
Voor routinematige passage van de cellen en tijdens de testprocedure moeten geschikte cultuurmedia en incubatieomstandigheden worden gebruikt, voor Balb/c 3T3 cellen bijvoorbeeld DMEM (Dulbecco's Modified Eagle's Medium), aangevuld met 10 % serum van pasgeboren kalveren, 4 mM glutamine, penicilline (100 IE) en streptomycine (100 μg/ml), en incubatie onder vochtige omstandigheden bij 37 oC en 5-7,5 % CO2, afhankelijk van de buffer (zie punt 1.4.1.4, tweede alinea). Het is vooral belangrijk dat de celcultuuromstandigheden zo zijn dat de celcyclustijd binnen het normale gedocumenteerde bereik van de gebruikte cellen of cellijn ligt.
1.4.1.3. Prepareren van de culturen
Cellen uit ingevroren stamculturen worden met een geschikte dichtheid overgeënt in cultuurmedium en ten minste één maal in subcultuur gebracht voordat zij bij de in-vitro 3T3 NRU fototoxiciteitstest worden gebruikt.
Voor de fototoxiciteitstest gebruikte cellen worden overgeënt in cultuurmedium, waarbij de dichtheid zo is dat de culturen niet samenvloeien vóór het einde van de test, d.w.z. wanneer 48 uur na het overenten van de cellen de levensvatbaarheid van de cellen wordt bepaald. Voor Balb/c 3T3 cellen die worden gekweekt in 96-wells-platen, wordt bij het overenten een celdichtheid van 1 × 104 cellen per well aanbevolen
Voor elke teststof worden cellen op identieke wijze overgeënt op twee afzonderlijke 96-wells-platen die vervolgens parallel onder identieke cultuuromstandigheden de gehele testprocedure doorlopen, met uitzondering van de periode waarin een van de platen wordt bestraald (+Irr) en de andere in het donker wordt bewaard (-Irr).
1.4.1.4. Voorbereiding van de teststof
Teststoffen moeten vlak voor het gebruik vers worden bereid, tenzij er gegevens zijn waaruit blijkt dat ze tijdens opslag stabiel zijn. Aanbevolen wordt elke chemische bewerking en de eerste behandeling van de cellen onder zodanige lichtomstandigheden uit te voeren dat fotoactivering of afbraak van de teststof vóór de bestraling wordt voorkomen.
De teststoffen moeten worden opgelost in gebufferde zoutoplossingen, bijvoorbeeld Earl's Balanced Salt Solution (EBSS) of andere fysiologisch uitgebalanceerde bufferoplossingen, die vrij moeten zijn van eiwitcomponenten en licht absorberende componenten (bv. pH-indicatorkleurstoffen en vitaminen) om storing tijdens de bestraling te voorkomen. Aangezien de cellen tijdens de bestraling gedurende ongeveer 50 minuten buiten de CC2-incubator verblijven, moet er op worden gelet dat alkalisering wordt voorkomen. Als er zwakke buffers zoals EBSS worden gebruikt, kan dit gebeuren door de cellen bij 7,5 % CO2 te incuberen. Als de cellen bij slechts 5 % CO2 worden geïncubeerd, moet er een sterkere buffer worden gekozen.
Teststoffen met een beperkte oplosbaarheid in water moeten in een geschikt oplosmiddel worden opgelost. Als er een oplosmiddel wordt gebruikt, moet hiervan in alle culturen een constant volume aanwezig zijn, d.w.z. zowel in de negatieve (oplosmiddel)controles als in alle concentraties van de teststof, en mag het bij die concentratie niet cytotoxisch zijn. De concentraties van de teststof moeten zo worden gekozen dat neerslagen of troebele oplossingen worden voorkomen.
De aanbevolen oplosmiddelen zijn dimethylsulfoxide (DMSO) en ethanol (EtOH). Andere oplosmiddelen met een lage cytotoxiciteit kunnen in aanmerking komen. Voor het gebruik moeten alle oplosmiddelen worden onderzocht op specifieke eigenschappen, bijvoorbeeld reactie met de teststof, onderdrukking van het fototoxische effect, het vermogen om radicalen weg te vangen en/of chemische stabiliteit in het oplosmiddel.
Om het oplossen te bevorderen kan gebruik worden gemaakt van vortex-menging en/of sonificatie en/of verwarming tot geschikte temperaturen, tenzij dit nadelige gevolgen zou hebben voor de stabiliteit van de teststof.
1.4.1.5. Bestralingsomstandigheden
1.4.1.5.1.
De keuze van een geschikte lichtbron en filters is een cruciale factor bij fototoxiciteitstests. UVA en zichtbaar licht worden gewoonlijk geassocieerd met fototoxische reactie in vivo (3)(12), terwijl UVB in het algemeen minder relevant is maar sterk cytotoxisch is; de cytotoxiciteit neemt van 313 nm tot 280 nm met een factor 1 000 toe (13). Een van de criteria bij de keuze van een geschikte lichtbron is de eis dat de lichtbron golflengtes uitzendt die door de teststof worden geabsorbeerd (absorptiespectrum) en dat de lichtdosis (die binnen een redelijke blootstellingstijd haalbaar is) voldoende is om bekende fototoxische stoffen te detecteren. Bovendien mogen de gebruikte golflengtes en doses niet te veel schade aan het testsysteem toebrengen, bijvoorbeeld door de emissie van warmte (infraroodspectrum).
Simulatie van zonlicht met zonnesimulatoren wordt als de optimale kunstlichtbron beschouwd. De spectrale verdeling van de gefilterde zonnesimulator moet in de buurt liggen van die van daglicht, zoals vermeld in (14). In zonnesimulatoren worden xenonbooglampen en (gedoteerde) kwik-metaalhalidebooglampen gebruikt (15). Laatstgenoemde hebben het voordeel dat zij minder warmte afgeven en goedkoper zijn, maar de overeenstemming met zonlicht is minder volmaakt dan bij xenonbooglampen. Aangezien alle zonnesimulatoren significante hoeveelheden UVB uitstralen, moeten deze afdoende worden gefilterd om de sterk cytotoxische UVB-golflengtes te verzwakken. Omdat de kunststof materialen voor celculturen UV-stabilisatoren bevatten, moet het spectrum worden gemeten door hetzelfde type deksel van 96-wells-platen als bij de bepaling wordt gebruikt. Ongeacht de maatregelen die worden genomen om delen van het spectrum te verzwakken door filtering of onvermijdelijke filtereffecten van de apparatuur mag het spectrum dat onder deze filters wordt geregistreerd, niet afwijken van gestandaardiseerd daglicht (14). Een voorbeeld van de spectrale verdeling van de gefilterde zonnesimulator die bij de valideringsstudie van de in vitro 3T3 NRU fototoxiciteitstest is gebruikt, wordt vermeld in (8)(16). Zie ook figuur 1 van bijlage 2.
1.4.1.5.2.
De intensiteit van het licht (bestralingssterkte) moet periodiek vóór elke fototoxiciteitstest worden gecontroleerd met een geschikte breedband-UV-meter. De intensiteit moet worden gemeten door hetzelfde type deksel van 96-wells-platen als bij de bepaling wordt gebruikt. De UV-meter moet op de bron zijn gekalibreerd. De werking van de UV-meter moet worden gecontroleerd en daarvoor wordt het gebruik van een tweede referentie-UV-meter van hetzelfde type en met dezelfde kalibratie aanbevolen. In het ideale geval moet met grotere intervallen een spectroradiometer worden gebruikt om de spectrale bestralingssterkte van de gefilterde lichtbron te meten en de kalibratie van de breedband-UV-meter te controleren.
Er is vastgesteld dat een dosis van 5 J/cm2 (gemeten in het UVA-spectrum) niet cytotoxisch is voor Balb/c 3T3 cellen en voldoende sterk om chemische stoffen te exciteren en zo tot foto toxische reacties te leiden (6) (17); om in 50 minuten een bestralingsdosis van 5 J/cm2 te bereiken, werd de bestralingssterkte bijvoorbeeld afgesteld op 1,7 mW/cm2. Zie figuur 2 van bijlage 2. Als een andere cellijn of een andere lichtbron wordt gebruikt, kan het nodig zijn de bestralingsdosis te kalibreren, zodat de dosering zodanig kan worden gekozen dat deze niet schadelijk is voor de cellen maar wel voldoende om standaard-fototoxines te exciteren. De duur van de blootstelling aan het licht wordt als volgt berekend:
|
|
(1 J = 1 Wsec) |
1.4.2. Testomstandigheden
1.4.2.1. Concentraties van de teststof
Het bereik waarbinnen de concentraties van een met (+Irr) en zonder (-Irr) licht geteste stof moeten liggen, moet op correcte wijze worden bepaald in oriënterende experimenten. Het kan nuttig zijn eerst de aanvankelijke oplosbaarheid en de oplosbaarheid na 60 min (of een andere behandelingstijd, als daarvoor wordt gekozen) te bepalen, aangezien de oplosbaarheid in de loop van de tijd en tijdens de blootstelling kan veranderen. Om toxiciteit door onjuiste cultuuromstandigheden of door sterk zure of alkalische chemische stoffen te voorkomen, moet de pH van de celculturen met toegevoegde teststof tussen 6,5 en 7,8 liggen.
De hoogste concentratie van de teststof moet binnen fysiologische testomstandigheden vallen, hetgeen wil zeggen dat osmotische en pH-stress moeten worden vermeden. Afhankelijk van de teststof kan het nodig zijn rekening te houden met andere fysisch-chemische eigenschappen als factoren die de hoogste testconcentratie beperken. Bij betrekkelijk onoplosbare stoffen die bij concentraties tot het verzadigingspunt niet toxisch zijn, moet de hoogst haalbare concentratie worden getest. In het algemeen moet neerslaan van de teststof ongeacht de concentratie worden voorkomen. De maximale concentratie van een teststof mag niet hoger zijn dan 1 000 μg/ml; de osmolariteit mag niet hoger zijn dan 10 mmol/l. Er moet een meetkundige verdunningsreeks van 8 teststof-concentraties met een constante verdunningsfactor worden gebruikt (zie de tweede alinea van punt 2.1).
Als er informatie (uit een oriënterend experiment) is dat de teststof bij het experiment in het donker (-Irr) tot de hoogste concentratie niet cytotoxisch is, maar bij bestraling (+Irr) sterk cytotoxisch, kan het nodig zijn voor het (+Irr)-experiment een ander concentratiebereik te kiezen dan voor het (-Irr)-experiment om aan de eis van afdoende gegevenskwaliteit te voldoen.
1.4.2.2. Controles
1.4.2.2.1.
De cellen moeten periodiek (ongeveer elke vijfde passage) op gevoeligheid voor de lichtbron worden gecontroleerd door hun levensvatbaarheid na blootstelling aan oplopende bestralingsdoses te bepalen. Bij deze bepaling moeten verschillende bestralingsdoses worden gebruikt, waaronder doses die aanzienlijk hoger zijn dan voor de in-vitro 3T3 NRU fototoxiciteitstest worden gebruikt. Deze doses worden het gemakkelijkst kwantitatief bepaald door de UV-delen van de lichtbron te meten. De cellen worden overgeënt met de dichtheid die wordt gebruikt bij de in-vitro 3T3 NRU fototoxiciteitstest en de volgende dag bestraald. Vervolgens wordt één dag later door middel van de opname van neutraalrood de levensvatbaarheid van de cellen bepaald. Er moet worden aangetoond dat de resulterende hoogste niet-cytotoxische dosis (bijvoorbeeld bij de valideringsstudie 5 J/cm2 [UVA]) voldoende is om de referentiechemicaliën (tabel 1) op de juiste wijze in te delen.
1.4.2.2.2.
De test voldoet aan de kwaliteitscriteria als de bestraalde negatieve/oplosmiddelcontroles een levensvatbaarheid vertonen van ten minste 80 % van die van niet-bestraalde negatieve/oplosmiddelcontroles.
1.4.2.2.3.
Uit de absolute optische dichtheid (OD540 NRU) van het uit de oplosmiddelcontroles geëxtraheerde neutraalrood blijkt of de 1 × 104 cellen die per well zijn overgeënt tijdens de twee dagen van de test met een normale verdubbelingstijd zijn gegroeid. Een test voldoet aan de aanvaardbaarheidscriteria als de gemiddelde OD540 NRU van de onbehandelde controles ≥ 0,4 is (d.w.z. ongeveer twintig keer zo hoog als de achtergrondextinctie van het oplosmiddel).
1.4.2.2.4.
Parallel aan elke in vitro 3T3 NRU fototoxiciteitstest moet een chemische stof worden getest waarvan bekend is dat deze fototoxisch is. Chloorpromazine (CPZ) wordt aanbevolen. Voor CPZ dat wordt getest volgens het standaardprotocol in de in-vitro 3T3 NRU fototoxiciteitstest, zijn de volgende aanvaardbaarheidscriteria gedefinieerd: CPZ bestraald (+Irr): IC50 = 0,1 tot 2,0 μg/ml, CPZ niet-bestraald (-Irr): IC50 = 7,0 tot 90,0 Dg/ml. De foto-irritatiefactor (PIF) moet > 6 zijn. De resultaten van de positieve controle moeten in de loop der tijd worden gevolgd.
Ook andere fototoxische stoffen die met het oog op de chemische categorie of oplosbaarheidskenmerken van de onderzochte chemische stof geschikt zijn, kunnen in plaats van chloorpromazine als parallelle positieve controle worden gebruikt.
1.4.3. Testprocedure (6)(7)(8)(16)(17):
1.4.3.1. Eerste dag:
Breng in de buitenste wells van een 96-wells microtiterplaat voor weefselculturen 100 μl cultuurmedium (= blanco's). Breng in de overige wells 100 μl celsuspensie met 1 × 105 cellen/ml in cultuurmedium (= 1 × 104 cellen/well). Er worden twee platen gemaakt voor elke reeks teststofconcentraties en voor de positieve en oplosmiddelcontroles.
Incubeer de cellen gedurende 24 uur (zie punt 1.4.1.2) tot ze een half samenvloeiende monolaag vormen. Deze incubatieperiode is lang genoeg voor het herstel, de hechting en de exponentiële groei van de cellen.
1.4.3.2. Tweede dag:
Na incubatie wordt het cultuurmedium van de cellen gedecanteerd en worden ze zorgvuldig gewassen met 150 μl van de voor de incubatie gebruikte gebufferde oplossing. Voeg 100 μl buffer met de gewenste concentratie teststof of oplosmiddel (oplosmiddelcontrole) toe. Gebruik acht verschillende concentraties teststof. Incubeer de cellen met de teststof in het donker gedurende 60 minuten (zie punt 1.4.1.2 en punt 1.4.1.4, tweede alinea).
Van de twee voor elke reeks teststofconcentraties en de controles gemaakte platen wordt er één gekozen (meestal aselect) voor de bepaling van de cytotoxiciteit (-Irr) (d.w.z. de controleplaat) en één (de behandelde plaat) voor de bepaling van de fotocytotoxiciteit (+Irr).
Voor de +Irr-blootstelling worden de cellen gedurende 50 minuten bij kamertemperatuur door het deksel van de 96-wells-plaat bestraald met de hoogste stralingsdosis die niet cytotoxisch is (zie ook bijlage 2). De niet-bestraalde platen (-Irr) worden gedurende 50 minuten (= lichtblootstellingstijd) bij kamertemperatuur in een donkere kast bewaard.
Decanteer de testoplossing en was zorgvuldig tweemaal met 150 μl van de voor de incubatie gebruikte gebufferde oplossing zonder testmateriaal. Vervang de buffer door cultuurmedium en incubeer (zie punt 1.4.1.2) tot de volgende dag (18-22 uur).
1.4.3.3. Derde dag:
1.4.3.3.1.
De cellen worden met een fasecontrastmicroscoop onderzocht op groei, morfologie en integriteit van de monolaag. Veranderingen in de morfologie van de cellen en effecten op de celgroei worden geregistreerd.
1.4.3.3.2.
Was de cellen met 150 μl voorverwarmde buffer. Verwijder de wasvloeistof door voorzichtig te tikken. Voeg 100 μl van een oplossing van 50 μg/ml neutraalrood (NR) (3-amino-7-dimethylamino-2-methylfenazine hydrochloride, EINECS-nummer 209-035-8; CAS-nummer 553-24-2; C.I. 50040) in medium zonder serum (16) toe en incubeer gedurende 3 uur volgens de beschrijving onder punt 1.4.1.2. Na incubatie wordt het NR-medium verwijderd en worden de cellen gewassen met 150 μl buffer. Decanteer en verwijder de overmaat buffer door afvloeien of centrifugeren.
Voeg precies 150 μl NR-desorptieoplossing (vers bereid: 49 delen water + 50 delen ethanol + 1 deel azijnzuur) toe.
Schud de microtiterplaat gedurende 10 minuten zachtjes op een microtiterplaatschudder totdat het NR uit de cellen is geëxtraheerd en zich een homogene oplossing heeft gevormd.
Meet de optische dichtheid van het NR-extract bij 540 nm in een spectrofotometer, waarbij de blanco's als referentie worden gebruikt. Sla de gegevens in een geschikt elektronisch bestandsformaat op voor latere analyse.
2. GEGEVENS
2.1. KWALITEIT EN HOEVEELHEID VAN DE GEGEVENS
De testgegevens moeten een zinvolle analyse mogelijk maken van de met en zonder bestraling verkregen concentratie-afhankelijke respons en indien mogelijk de concentratie van de teststof waardoor de levensvatbaarheid van de cellen tot 50 % daalt (IC50). Als er cytotoxiciteit wordt geconstateerd, moeten zowel het concentratiebereik als de intervallen tussen de verschillende concentraties zo worden gekozen dat er een curve aan de experimentele gegevens kan worden gefit.
Zowel bij duidelijk positieve resultaten als bij duidelijk negatieve resultaten (zie punt 2.3, eerste alinea) zal het hoofdexperiment, voorafgegaan door een of meer oriënterende experimenten om het concentratiebereik te bepalen, wellicht volstaan.
Twijfelachtige resultaten, grensgevallen of onduidelijke resultaten moeten door verdere tests worden verduidelijkt (zie punt 2.4, tweede alinea). In deze gevallen moet een wijziging van de experimentele omstandigheden worden overwogen. Experimentele omstandigheden die voor wijziging in aanmerking komen, zijn bijvoorbeeld: het concentratiebereik of de intervallen, de preïncubatietijd en de bestralings/blootstellingstijd. Een kortere blootstellingstijd kan zinvol zijn voor chemische stoffen die in water instabiel zijn.
2.2. EVALUATIE VAN DE RESULTATEN
Om evaluatie van de gegevens mogelijk te maken kan een foto-irritatiefactor (PIF) of gemiddeld foto-effect worden berekend.
Voor de berekening van de mate van fotocytotoxiciteit (zie hieronder) moet de verzameling discrete concentratie/responswaarden worden benaderd met een passende continue concentratie/responscurve (model). Voor het fitten van de curve aan de gegevens wordt meestal een niet-lineaire regressiemethode gebruikt (18). Om de invloed van de variabiliteit van de gegevens op de gefitte curve te bepalen wordt een bootstrapprocedure aanbevolen.
Met behulp van de volgende formule wordt een foto-irritatiefactor (PIF) berekend:
![]()
Als een IC50 met of zonder licht niet kan worden berekend, kan er voor het testmateriaal geen PIF worden bepaald.

Het foto-effect PEC bij een concentratie C wordt gedefinieerd als het product van het responseffect REC en het dosiseffect DEC, d.w.z. PEC = REC × DEC. Het responseffect REC is het verschil tussen de waargenomen respons met en zonder licht, d.w.z. REC = Rc (-Irr) – Rc (+Irr). Het dosiseffect wordt als volgt berekend:

Het gemiddelde foto-effect (MPE) wordt gebaseerd op een vergelijking van de volledige concentratie/responscurves (19). Het wordt gedefinieerd als het gewogen gemiddelde van een representatieve verzameling foto-effectwaarden:
waarbij C* de equivalentieconcentratie is, d.w.z. de concentratie waarbij de +Irr-respons gelijk is aan de -Irr-respons bij concentratie C. Als C* niet kan worden bepaald omdat de responswaarden van de +Irr-curve systematisch hoger of lager zijn dan Rc(-Irr), wordt het dosiseffect gelijk aan 1 gesteld. De weegfactoren wi worden gegeven door de hoogste responswaarde, d.w.z. wi = MAX {Ri (+Irr), Ri (-Irr)}. Het concentratieraster Ci wordt zodanig gekozen dat in elk van de concentratieintervallen die worden bepaald door de bij het experiment gebruikte concentratiewaarden, hetzelfde aantal punten valt. De berekening van het MPE blijft beperkt tot de maximale concentratiewaarde waarbij ten minste een van de twee curves nog een responswaarde van ten minste 10 % vertegenwoordigt. Als deze maximale concentratie hoger is dan de hoogste concentratie die bij het +Irr-experiment is gebruikt, wordt het resterende gedeelte van de +Irr-curve op responswaarde „0” gesteld. Aan de hand van het antwoord op de vraag of de MPE-waarde al dan niet hoger is dan een op correcte wijze gekozen drempelwaarde (MPEC = 0,15), wordt de chemische stof al dan niet als fototoxisch ingedeeld.
Een softwarepakket voor de berekening van de PIF en het MPE is verkrijgbaar bij (20).
2.3. INTERPRETATIE VAN DE RESULTATEN
Op basis van de valideringsstudie (8) geldt voor een teststof met PIF < 2 of een MPE < 0,1 de prognose: „geen fototoxiciteit”. Bij een PIF > 2 en < 5 of een MPE > 0,1 en < 0,15 geldt de prognose: „waarschijnlijk fototoxiciteit”; en bij een PIF > 5 of een MPE > 0,15 geldt de prognose: „fototoxiciteit”.
Wanneer deze bepaling voor het eerst in een laboratorium wordt uitgevoerd, moeten de in tabel 1 vermelde referentiematerialen worden getest voordat teststoffen voor een bepaling van de fototoxiciteit worden getest. De PIF- of MPE-waarden moeten in de buurt van de in tabel 1 vermelde waarden liggen.
Tabel 1
|
Chemische naam |
EINECS-nr. |
CAS-nr. |
PIF |
MPE |
Absorptiepiek |
Oplosmidde (9) |
|
Amiodaron HCL |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,27-0,54 |
242 nm 300 nm (schouder) |
ethanol |
|
Chloorpromazine HCL |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33-0,63 |
309 nm |
ethanol |
|
Norfloxacin |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34-0,90 |
316 nm |
acetonitril |
|
Antraceen |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19-0,81 |
356 nm |
acetonitril |
|
Protoporfyrine IX, dinatrium |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54-0,74 |
402 nm |
ethanol |
|
L-Histidine |
|
[7006-35-1] |
geen PIF |
0,05-0,10 |
211 nm |
water |
|
Hexachlorofeen |
200-733-8 |
[70-30-4] |
1,1-1,7 |
0,00-0,05 |
299 nm 317 nm (schouder) |
ethanol |
|
Natriumlaurylsulfaat |
205-788-1 |
[151-21-3] |
1,0-1,9 |
0,00-0,05 |
geen absorptie |
water |
2.4. INTERPRETATIE VAN DE GEGEVENS
Als er alleen bij de hoogste testconcentratie fototoxische effecten worden waargenomen (met name voor in water oplosbare teststoffen), kunnen er aanvullende gegevens nodig zijn om de gevaren te bepalen. Hierbij kan het gaan om gegevens over de absorptie door de huid en accumulatie van de chemische stof in de huid en/of gegevens uit andere tests waarbij de chemische stof bijvoorbeeld in vitro is getest op dierlijke of menselijke huid of huidmodellen.
Als er geen toxiciteit wordt aangetoond (+Irr en -Irr) en als een slechte oplosbaarheid beperkingen oplegt aan de concentraties die kunnen worden getest, kan men zich afvragen of de teststof wel compatibel is met de bepaling en moet een bevestigende test worden overwogen, bijvoorbeeld met een ander model.
3. RAPPORTAGE
TESTRAPPORT
Het testrapport moet ten minste de volgende informatie bevatten:
|
|
Teststof:
|
|
|
Oplosmiddel:
|
|
|
Cellen:
|
|
|
Testomstandigheden (1); incubatie vóór en na behandeling:
|
|
|
Testomstandigheden (2); behandeling met de chemische stof:
|
|
|
Testomstandigheden (3); bestraling:
|
|
|
Testomstandigheden (4); neutraalrood-levensvatbaarheidstest:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
1. |
Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In Vitro 7: 95-102. |
|
2. |
Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In „Research Progress in Organic, Biological and Medicinal Chemistry” Vol. 3 part 1. North Holland Publishing Co. Amsterdam, p XI-XXXV. |
|
3. |
Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, 314-348. |
|
4. |
Spikes, J.D. (1989). Photosensitization. In „The science of Photobiology” Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p 79-110. |
|
5. |
OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No.7 „Guidance Document On Direct Phototransformation Of Chemicals In Water” Environment Directorate, OECD, Paris. |
|
6. |
Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793-796. |
|
7. |
Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7-8. |
|
8. |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305-327. |
|
9. |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31 th October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
10. |
Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119-124. |
|
11. |
Hay, R.J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225-237. |
|
12. |
Lambert L.A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In „Dermatotoxicology”, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p 515-530. |
|
13. |
Tyrrell R.M., Pidoux M (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825-1829. |
|
14. |
ISO 10977. (1993). Photography — Processed photographic colour films and paper prints — Methods for measuring image stability. |
|
15. |
Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No. 90, Vienna, 1993, ISBN 3900734275 |
|
16. |
ZEBET/ECVAM/COLIPA — Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs. |
|
17. |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679-708. |
|
18. |
Holzhütter, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127-138. |
|
19. |
Holzhütter, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445-462. |
|
20. |
http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_l_l_l_l, 00. html |
BIJLAGE 1
Rol van de 3T3 NRU fototoxiciteitstest in een sequentiële aanpak van het testen van de fototoxiciteit van chemische stoffen

BIJLAGE 2
Figuur 1
Spectrale verdeling van een gefilterde zonnesimulator

(zie punt 1.4.1.5, tweede alinea)
Figuur 1 geeft een voorbeeld van een aanvaardbare spectrale verdeling van de bestralingssterkte van een gefilterde zonnesimulator. Deze is afkomstig van de gedoteerde metaalhalide-bron die is gebruikt bij de valideringsstudie van de 3T3 NRU fototoxiciteitstest (6)(8)(17). In de figuur worden de effecten van twee verschillende filters en de extra filterende werking van het deksel van een 96-wells-celcultuurplaat aangegeven. Het H2-filter is alleen gebruikt bij testsystemen die een grotere hoeveelheid UVB kunnen verdragen (de huidmodeltest en de fotohemolysetest met rode bloedcellen). Bij de 3T3 NRU fototoxiciteitstest is het Hl-filter gebruikt. Uit de figuur blijkt dat de extra filterende werking van het deksel van de plaat vooral in het UVB-spectrum wordt waargenomen, maar nog genoeg UVB in het stralingsspectrum doorlaat voor de excitatie van chemische stoffen die een karakteristieke absorptie in het UVB-spectrum vertonen, zoals amiodaron (zie tabel 1).
Figuur 2
Bestralingsgevoeligheid van Balb/c 3T3-cellen (zoals gemeten in het UVA-spectrum)
Levensvatbaarheid van de cellen ( % opname van neutraal rood van onbestraalde controle)

bestralingstijd (minuten) (10 min = 1 joule UVA/cm2) (zie punt 1.4.1.5.2, tweede alinea, en de punten 1.4.2.2.1 en 1.4.2.2.2)
De gevoeligheid van Balb/c 3T3-cellen voor bestraling met de in de valideringsstudie van de 3T3 NRU fototoxiciteitstest gebruikte zonnesimulator, zoals gemeten in het UVA-spectrum. In de figuur zijn de resultaten weergegeven die in de pre-valideringsstudie in zeven verschillende laboratoria zijn verkregen (1). De twee curves met open symbolen zijn verkregen met oudere cellen (groot aantal passages), die door nieuwe celstammen moesten worden vervangen, terwijl de curves met dichte symbolen afkomstig zijn van cellen met een aanvaardbare bestralingstolerantie.
Uit deze gegevens is de hoogste niet-cytotoxische bestralingsdosis van 5 J/cm2 afgeleid (verticale stippellijn). Daarnaast geeft de horizontale stippellijn het in punt 1.4.2.2 vermelde maximaal aanvaardbare bestralingseffect aan.
B.42. HUIDSENSIBILISATIE: LOKALE LYMFKLIERTEST
1 METHODE
Deze methode is overgenomen van TG 429 (2002) van de OESO.
1.1 INLEIDING
De lokale lymfkliertest (LLKT) is afdoende gevalideerd en geaccepteerd om als nieuwe methode te kunnen worden ingevoerd (1)(2)(3). Dit is de tweede methode om de potentiële huidsensibilisatie door chemische stoffen bij dieren te bepalen. Bij de andere methode (B.6) worden cavia's gebruikt: de maximalisatietest en de Buehlertest (4).
De LLKT is een alternatief dat kan worden gebruikt om huidsensibilisatie door chemische stoffen te signaleren en om te bevestigen dat een chemische stof geen significant vermogen bezit om huidsensibilisatie te veroorzaken. Dit houdt niet noodzakelijkerwijs in dat de LLKT in alle gevallen in plaats van de proef met cavia's moet worden gebruikt, maar veeleer dat de test gelijkwaardig is en als alternatief kan worden gebruikt, waarbij positieve en negatieve resultaten niet langer behoeven te worden bevestigd.
De LLKT biedt ten aanzien van zowel de wetenschappelijke vooruitgang als het dierenwelzijn bepaalde voordelen. Hij bestudeert de inductiefase van huidsensibilisatie en levert kwantitatieve gegevens op die voor een dosis/responsbepaling kunnen worden gebruikt. Er zijn publicaties verschenen met de gegevens over de validatie van de LLKT en een overzicht van gerelateerd onderzoek (5)(6)(7)(8). Daarnaast moet worden opgemerkt dat de milde/gematigde sensibilisatoren, die worden aanbevolen als geschikte stoffen voor positieve controle bij tests met cavia's, ook geschikt zijn om bij de LLKT te worden gebruikt (6)(8)(9).
De LLKT is een in-vivo methode en leidt er derhalve niet toe dat er bij de bepaling van contactsensibilisatie geen dieren meer worden gebruikt. Het is echter wel mogelijk dat het aantal daarvoor gebruikte dieren wordt beperkt. Bovendien zorgt de LLKT voor een aanzienlijke verfijning van de manier waarop dieren voor het testen op contactsensibilisatie worden gebruikt. De LLKT is gebaseerd op het onderzoek van immunologische gebeurtenissen die tijdens de inductiefase van sensibilisatie door chemische stoffen worden gestimuleerd. In tegenstelling tot de proeven met cavia's behoeven bij de LLKT geen door provocatie geïnduceerde overgevoeligheidsreacties van de huid te worden opgewekt. Bovendien behoeft bij de LLKT geen adjuvans te worden gebruikt, hetgeen bij de maximalisatietest bij cavia's wel nodig is. Dit betekent dat het ongerief voor dieren bij de LLKT geringer is. Ondanks de voordelen van de LLKT ten opzichte van klassieke proeven met cavia's moet worden gesteld dat er bepaalde beperkingen zijn waardoor het gebruik van klassieke proeven met cavia's nodig kan zijn (zoals vals-negatieve resultaten bij de LLKT met bepaalde metalen of vals-positieve resultaten met bepaalde stoffen die de huid irriteren) (10).
Zie ook de algemene inleiding van deel B.
1.2 PRINCIPE VAN DE TESTMETHODE
Het beginsel dat aan de LLKT ten grondslag ligt, is dat sensibilisatoren induceren tot een primaire proliferatie van lymfocyten in de lymfklier die de afvoer verzorgt van de plaats waar de stof wordt aangebracht. Deze proliferatie is evenredig met de aangebrachte dosis (en de potentie van het allergeen) en biedt een eenvoudige mogelijkheid om een objectieve kwantitatieve meting van de sensibilisatie uit te voeren. De LLKT bepaalt deze proliferatie als een dosis/responsrelatie waarbij de proliferatie in de testgroepen wordt vergeleken met de proliferatie in met medium behandelde controlegroepen. De verhouding tussen de proliferatie bij behandelde groepen en bij de medium-controlegroepen wordt bepaald en deze z.g. stimuleringsindex moet minimaal drie zijn voordat een teststof nader kan worden beoordeeld als potentiële huidsensibilisator. De hier beschreven methoden zijn gebaseerd op het gebruik van radioactieve labeling voor de meting van celproliferatie. Er kunnen echter ook andere eindpunten voor de bepaling van de proliferatie worden gebruikt, mits daar een motivering en afdoende wetenschappelijke onderbouwing voor wordt gegeven met volledige referenties en een beschrijving van de methodologie.
1.3 BESCHRIJVING VAN DE TESTMETHODE
1.3.1 Voorbereiding
1.3.1.1 Huisvesting en voeding
De dieren worden in aparte kooien gehuisvest. De temperatuur in de proefdierruimte dient 22 oC (± 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater.
1.3.1.2 Voorbereiding van de dieren
De dieren worden aselect ingedeeld, gemerkt om elk dier afzonderlijk te kunnen identificeren (maar niet door enigerlei vorm van oormerking) en vóór het begin van de toediening gedurende minimaal 5 dagen in hun kooi gehouden om ze aan de omstandigheden in het laboratorium te laten wennen. Vóór het begin van de behandeling worden alle dieren onderzocht om vast te stellen dat ze geen waarneembaar huidletsel hebben.
1.3.2 Testomstandigheden
1.3.2.1 Proefdieren
Voor deze test worden bij voorkeur muizen gebruikt. Er worden jonge volwassen vrouwtjesmuizen van de CBA/Ca- of CBA/J-stam gebruikt, die nog geen jongen hebben gehad en niet drachtig zijn. Bij het begin van het onderzoek moeten de dieren 8-12 weken oud zijn; het gewichtsverschil tussen de dieren moet minimaal zijn en de afwijking mag niet groter zijn dan 20 % van het gemiddelde gewicht. Er mogen ook andere stammen of mannetjes worden gebruikt, wanneer er voldoende gegevens beschikbaar zijn om aan te tonen dat er geen significante stam- en/of geslachtsspecifieke verschillen in de LLKT-respons zijn.
1.3.2.2 Betrouwbaarheidscontrole
Er worden positieve controles gebruikt om aan te tonen dat de test goed is uitgevoerd en dat het laboratorium in staat is de test tot een goed einde te brengen. De positieve controle moet een positieve LLKT-respons opleveren bij een blootstellingsniveau waarbij in vergelijking met de negatieve controlegroep een stijging van de stimuleringsindex (SI) met > 3 wordt verwacht. De dosis van de positieve controle moet zodanig worden gekozen dat de inductie duidelijk maar niet buitensporig is. De stoffen hexylcinnamaldehyd (CAS-nr. 101-86-0, EINECS-nr. 202-983-3) en mercaptobenzothiazool (CAS-nr. 149-30-4, EINECS-nr. 205-736-8) verdienen de voorkeur. Onder bepaalde omstandigheden kunnen andere controlestoffen worden gebruikt die aan bovengenoemde criteria voldoen, mits een afdoende motivering wordt gegeven. Normaal gesproken zal er voor elke bepaling een positieve controlegroep nodig zijn, maar in bepaalde situaties kunnen testlaboratoria beschikken over historische gegevens van positieve controles waaruit blijkt dat er gedurende een periode van zes maanden of langer consequent sprake is van een bevredigende respons. In dergelijke gevallen kan worden volstaan met minder frequente tests met een positieve controle met een interval van ten hoogste zes maanden. Hoewel de stof voor de positieve controle moet worden getest in een medium waarvan bekend is dat het een consequente respons oplevert (zoals aceton of olijfolie), kan de regelgeving in bepaalde gevallen vereisen dat de tests ook in een ongebruikelijk medium (een klinisch/chemisch relevante formulering) worden uitgevoerd. In dat geval moet worden onderzocht of er mogelijkerwijs sprake is van een interactie tussen de positieve controle en dit ongebruikelijke medium.
1.3.2.3 Aantal dieren, dosisniveaus en keuze van het medium
Er worden minimaal vier dieren per dosisgroep gebruikt en ten minste drie concentraties van de teststof plus een negatieve controlegroep, die alleen met het medium voor de teststof wordt behandeld, en eventueel een positieve controlegroep. Wanneer de gegevens van elk dier afzonderlijk moeten worden verzameld, worden ten minste vijf dieren per dosisgroep gebruikt. Behalve dat de dieren in de controlegroepen niet met de teststof worden behandeld, worden ze verder op identieke wijze behandeld als de dieren in de behandelde groepen.
De keuze van de doses en het medium wordt gebaseerd op de aanbevelingen in referentie (1). De doses worden gekozen uit de concentratiereeks 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % enz. Bij de keuze van de drie opeenvolgende concentraties moet er rekening worden gehouden met bestaande gegevens over de acute toxiciteit en huidirritatie, wanneer die beschikbaar zijn, zodat bij de hoogste concentratie de blootstelling maximaal is zonder dat dit tot systemische toxiciteit en overmatige lokale huidirritatie leidt (2)(11).
Het medium wordt zodanig gekozen dat de testconcentraties en de oplosbaarheid maximaal zijn terwijl de oplossing/suspensie geschikt moet zijn om de teststof op te brengen. In volgorde van voorkeur worden aanbevolen: aceton/olijfolie (4:1 v/v), dimethylformamide, methylethylketon, propyleenglycol en dimethylsulfoxide (2)(10), maar ook een ander medium mag worden gebruikt als daarvoor een afdoende wetenschappelijke motivering wordt gegeven. In bepaalde gevallen kan het nodig zijn als extra controle een klinisch relevant oplosmiddel te gebruiken of de commerciële formulering waarin de teststof in de handel wordt gebracht. Er moet vooral voor worden gezorgd dat er hydrofiele bestanddelen worden opgenomen in een medium dat de huid vochtig maakt en niet onmiddellijk wegloopt. Een volledig waterig medium moet derhalve worden vermeden.
1.3.3 Testprocedure
1.3.3.1 Proefopzet
De proefopzet van de bepaling is als volgt:
|
|
Dag I: Van elk dier apart wordt het gewicht bepaald en vastgelegd. Vervolgens wordt 25 μl van de verdunning van de teststof, het medium zonder teststof of de positieve controle open aangebracht op het dorsum van elk oor. |
|
|
Dagen 2 en 3: Herhaal de aanbrengprocedure van dag 1. |
|
|
Dagen 4 en 5: Geen behandeling. |
|
|
Dag 6: Van elk dier wordt het gewicht vastgelegd. Injecteer bij de muizen van alle test- en controlegroepen 250 μl PBS (phosphate-buffered saline) die 20 μCi (7,4e + S Bq)3 H-methylthymidine bevat, in de staartader. Een andere mogelijkheid is injectie van 250 μl PBS die 2 μCi (7,4e + 7 Bq) 125I-jooddeoxyuridine en 10 o M fluordeoxyuridine bevat, bij alle muizen in de staartader. Vijf uur later worden de dieren gedood. De afvoerende auriculaire lymfklieren van elk oor worden uitgeprepareerd en voor elke groep gepoold in PBS (groepsgewijze aanpak); het is ook mogelijk voor elk dier apart de twee lymfklieren in PBS te poolen (individuele aanpak). Bijlage I van referentie 10 bevat gedetailleerde informatie en diagrammen voor de identificatie en het uitprepareren van de lymfklieren. |
1.3.3.2 Bereiding van de celsuspensies
Er wordt één celsuspensie gemaakt met lymfkliercellen van gepoolde groepen of van aparte dieren door het weefsel voorzichtig door een roestvrij stalen gaas met een maaswijdte van 200 μm te persen. De lymfkliercellen worden twee maal gewassen met een overmaat PBS en gedurende 18 uur met 5 % trichloorazijn/uur (TCA) neergeslagen bij 4 C (1). Het neerslag wordt geresuspendeerd in 1 ml TCA en voor H-telling overgebracht in scintillatie-telflesjes die 10 ml scintillatievloeistof bevatten, of direct overgebracht in gamma-telbuizen voor l25I-telling.
1.3.3.3 Bepaling van celproliferatie (opgenomen radioactiviteit)
De opname van H-methylthymidine wordt gemeten door (3-scintillatietelling als desintegraties per minuut (DPM). De opname van 125 I -jooddeoxyuridine wordt gemeten door125 I-telling en ook als DPM uitgedrukt. Afhankelijk van de gevolgde werkwijze wordt de opname uitgedrukt als DPM/behandelingsgroep (groepsgewijze aanpak) of DPM/dier (individuele aanpak).
1.3.3.4 Observatie
1.3.3.4.1
De dieren worden één keer per dag zorgvuldig geobserveerd op klinische verschijnselen van lokale toxiciteit op de plaats van aanbrengen of systemische toxiciteit. Alle observaties worden systematisch geregistreerd en van elk dier wordt een apart overzicht bijgehouden.
1.3.3.4.2
Zoals onder punt 1.3.3.1 is vermeld, wordt aan het begin van de test en wanneer de dieren volgens schema worden gedood, van elk dier het lichaamsgewicht bepaald.
1.3.4 Berekening van de resultaten
De resultaten worden uitgedrukt als de stimuleringsindex (SI). Bij de groepsgewijze aanpak wordt de SI berekend door de totale opname van radioactiviteit voor elke behandelde groep te delen door de totale opname van radioactiviteit voor de medium-controlegroep; dit levert een gemiddelde SI op. Bij de individuele aanpak wordt de SI berekend door de gemiddelde DPM/dier van elke groep behandeld met teststof en de positieve controlegroep, te delen door de gemiddelde DPM/dier voor de medium controlegroep. De gemiddelde SI voor de met medium behandelde controles is dan 1.
Wanneer voor de berekening van de SI de individuele aanpak wordt gevolgd, kan er een statistische analyse van de gegevens worden uitgevoerd. Bij het kiezen van een geschikte statistische analysemethode moet de onderzoeker zich bewust blijven van mogelijke verschillen in de variantie en andere soortgelijke problemen, die een gegevenstransformatie of een niet-parametrische statistische analyse noodzakelijk kunnen maken. Een geschikte aanpak voor de interpretatie van de gegevens is dat alle individuele gegevens van behandelde dieren en medium-controles worden geëvalueerd en dat daaruit, rekening houdend met de betrouwbaarheidsgrenzen, de best passende dosis/responscurve wordt afgeleid (8)(12)(13). De onderzoeker moet echter alert zijn op mogelijke „uitbijters” bij bepaalde dieren in een groep, waardoor het nodig kan zijn een andere maat voor de respons te gebruiken (bijvoorbeeld de mediaan in plaats van het gemiddelde) of de uitbijter te elimineren.
Wanneer er tot een positieve respons wordt besloten, moet de stimuleringsindex > 3 zijn en moet er rekening worden gehouden met de dosis/responsverhouding en eventueel de statistische significantie (3)(6)(8)(12)(14).
Als de verkregen resultaten onduidelijk zijn, moet er worden gekeken naar verschillende eigenschappen van de teststof, bijvoorbeeld of deze qua structuur verwant is met bekende huidsensibilisatoren, of de stof overmatige huidirritatie veroorzaakt en wat de aard van de waargenomen respons is. Deze en andere overwegingen worden elders gedetailleerd besproken (7).
2. GEGEVENS
De gegevens worden vermeld in een tabel met het gemiddelde en de afzonderlijke DPM-waarden en stimuleringindices voor elke dosisgroep (en tevens de medium-controlegroep).
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag wordt de volgende informatie opgenomen:
|
|
Teststof:
|
|
|
Medium:
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Betrouwbaarheidscontrole:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten:
|
4. REFERENTIES
|
1 |
Kimber, I. and Basketter, D.A. (1992). The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, 165-169. |
|
2 |
Kimber, 1, Derman, R.J., Scholes E.W, and Basketter, D.A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13-31. |
|
3 |
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E., Hastings, K.L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, 563-79. |
|
4 |
Testmethode B.6. |
|
5 |
Chamberlain, M. and Basketter, D.A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, 999-1002. |
|
6 |
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E (1996). The local lymph node assay- A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985-997. |
|
7. |
Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327-33. |
|
8 |
Van Och, F.M.M, Slob, W., De Jong, W.H., Vandebriel, R.J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146,49-59. |
|
9 |
Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, 281-4. |
|
10 |
National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov). |
|
11 |
Testmethode B.4. |
|
12 |
Basketter, D.A., Selbie, E., Scholes, E.W. Lees, D. Kimber, I. and Botham, P.A. (1993) Results with OECD recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63-67. |
|
13 |
Basketter D.A., Lea L.J., Dickens A., Briggs D., Pate I., Dearman R.J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19,261-266. |
|
14 |
Basketter DA, Blaikie L, Derman RJ, Kimber I, Ryan CA, Gerberick GF, Harvey P, Evans P, White IR and Rycroft RTG (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, 344-48. |
B.43. NEUROTOXICITEITSONDERZOEK BIJ KNAAGDIEREN
1 METHODE
Deze methode is gelijkwaardig aan TG 424 (1997) van de OESO.
Deze testmethode is bedoeld om de nodige informatie te krijgen om de mogelijke neurotoxiciteit van chemische stoffen bij volwassen dieren te bevestigen of nader te karakteriseren. Hij kan in combinatie met bestaande testmethoden voor onderzoek naar toxiciteit bij herhaalde toediening worden gebruikt of als zelfstandig onderzoek worden uitgevoerd. Raadpleging van de OESO-leidraad voor strategieën en methoden voor neurotoxiciteitsonderzoek (1) als ondersteuning bij de opzet van onderzoek op basis van deze testmethode wordt aanbevolen. Dit is vooral belangrijk wanneer wordt overwogen de voor het standaardgebruik van deze methode aanbevolen observaties en testprocedures te wijzigen. De leidraad is opgesteld om de keuze van andere testprocedures voor specifieke omstandigheden te vergemakkelijken.
Deze methode is niet geschikt voor de beoordeling van ontwikkelingsneurotoxiciteit.
1.1 INLEIDING
Bij de beoordeling en evaluatie van de toxische karakteristieken van chemische stoffen is het belangrijk de mogelijkheid van neurotoxische effecten te bezien. In de testmethode voor systemische toxiciteit bij herhaalde toediening zijn al observaties opgenomen om op mogelijke neurotoxiciteit te screenen. Deze testmethode kan worden gebruikt voor de opzet van een onderzoek om nadere informatie te verkrijgen over de neurotoxische effecten die bij het onderzoek naar systemische toxiciteit bij herhaalde toediening zijn gesignaleerd of om deze effecten te bevestigen. Ook zonder dat onderzoek naar systemische toxiciteit bij herhaalde toediening aanwijzingen voor een mogelijke neurotoxiciteit heeft opgeleverd, kunnen er voor sommige categorieën chemische stoffen echter aanwijzingen zijn dat ze beter met behulp van deze methode kunnen worden beoordeeld. Voorbeelden van dergelijke aanwijzingen zijn:
|
— |
waarneming van neurologische verschijnselen of neuropathologisch letsel bij ander toxiciteitsonderzoek dan onderzoek naar systemische toxiciteit bij herhaalde toediening of |
|
— |
een structurele verwantschap met stoffen waarvan bekend is dat ze neurotoxisch zijn of andere informatie die een verband met dergelijke stoffen legt. |
Daarnaast kan het gebruik van deze testmethode ook in andere gevallen nuttig zijn; zie voor nadere bijzonderheden (1).
Deze methode is zodanig opgezet dat hij op maat kan worden aangepast aan bepaalde behoeften om de specifieke histopathologische en gedragsmatige neurotoxiciteit van een chemische stof te bevestigen en voor een karakterisering en kwantificering van de neurotoxische reacties te zorgen.
In het verleden werd neurotoxiciteit gelijkgesteld met neuropathie met neuropathologisch letsel of neurologische stoornissen zoals een epileptische aanval, verlamming of tremor. Hoewel neuropathie een belangrijke uiting van neurotoxiciteit is, is het nu duidelijk dat er vele andere verschijnselen van toxiciteit voor het zenuwstelsel zijn (bv. het verlies van motorische coördinatie, sensorische afwijkingen en leer- en geheugenstoornissen) die bij een onderzoek naar neuropathie of ander onderzoek niet altijd naar voren komen.
Deze testmethode voor neurotoxiciteit is bedoeld om ernstige neuropathologische en neurogedragseffecten bij volwassen knaagdieren te detecteren. Gedragseffecten kunnen weliswaar ook zonder morfologische veranderingen nadelige gevolgen voor het organisme inhouden, maar niet alle gedragsveranderingen zijn specifiek voor het zenuwstelsel. Daarom moeten waargenomen veranderingen worden geëvalueerd in samenhang met gerelateerde histopathologische, hematologische of biochemische gegevens en gegevens over andere vormen van systemische toxiciteit. De in deze methode opgenomen tests met het oog op een karakterisering en kwantificering van de neurotoxische reacties omvatten specifieke histopathologische en gedragsprocedures die nader kunnen worden ondersteund met elektrofysiologisch en/of biochemisch onderzoek (1)(2)(3)(4).
Neurotoxica kunnen optreden via een aantal aangrijpingspunten binnen het zenuwstelsel en een scala van mechanismen. Aangezien er niet één pakket tests is waarmee de neurotoxische potentie van alle stoffen volledig kan worden beoordeeld, kan het nodig zijn andere in vivo of in vitro tests te gebruiken die specifiek zijn voor de waargenomen of verwachte soorten neurotoxiciteit.
Deze testmethode kan ook in combinatie met de richtsnoeren van de OESO-leidraad voor strategieën en methoden voor neurotoxiciteitsonderzoek (1) worden gebruikt om onderzoek op te zetten waarmee de dosis/respons-kwantificering nader kan worden gekarakteriseerd of de gevoeligheid kan worden verhoogd teneinde een betere bepaling van de dosis zonder waargenomen schadelijke effecten mogelijk te maken of bekende of vermoede gevaren van de chemische stof te staven. Er kan bijvoorbeeld onderzoek worden opgezet om de neurotoxische mechanismen te bepalen en te evalueren of om de gegevens aan te vullen die al beschikbaar zijn door het gebruik van basisprocedures voor neuropathologische en neurogedragsobservatie. Als gegevens die door het gebruik van de in deze methode aanbevolen standaardprocedures worden verkregen, al beschikbaar zijn en niet nodig worden geacht voor de interpretatie van de resultaten van het onderzoek, behoeven ze niet met dit onderzoek opnieuw te worden vergaard.
Dit onderzoek naar neurotoxiciteit levert, zelfstandig of in combinatie gebruikt, informatie op die:
|
— |
kan aangeven of het zenuwstelsel door de geteste chemische stof permanent of reversibel wordt aangetast; |
|
— |
kan bijdragen tot de karakterisering van de wijzigingen in het zenuwstelsel ten gevolge van de blootstelling aan de chemische stof en tot inzicht in het mechanisme daarvan; |
|
— |
het verband tussen dosis en respons en tussen tijd en respons kan bepalen teneinde een dosis zonder waargenomen schadelijke effecten te kunnen bepalen (die kan worden gebruikt om veiligheidscriteria voor de chemische stof vast testellen). |
Bij deze testmethode wordt de teststof oraal toegediend. Andere toedieningswegen (bv. dermaal of inhalatie) kunnen geschikter zijn en hiervoor kan het nodig zijn de aanbevolen procedures te wijzigen. De keuze van de toedieningsweg wordt bepaald door het blootstellingsprofiel bij de mens en de beschikbare toxicologische of kinetische informatie.
1.2 DEFINITIES
Schadelijk effect: een met de behandeling samenhangende afwijking van de normale situatie waardoor het organisme minder goed in staat is tot overleven, reproductie of aanpassing aan de omgeving.
Dosis: de toegediende hoeveelheid teststof. De dosis wordt uitgedrukt als gewicht (g, mg), als gewicht van de teststof per gewichtseenheid van het proefdier (bijvoorbeeld mg/kg) of als constante concentratie in het voer (ppm).
Dosering: een algemene term die de dosis en de frequentie en de duur van de toediening omvat.
Neurotoxiciteit: een schadelijke verandering in de structuur of de functie van het zenuwstelsel die een gevolg is van blootstelling aan een chemisch, biologisch of fysisch agens.
Neurotoxicum: een chemisch, biologisch of fysisch agens dat in staat is neurotoxiciteit te veroorzaken.
NOAEL: de afkorting van „no-observed-adverse effect level” (dosis zonder waargenomen schadelijke effecten), d.w.z. de hoogste dosis waarbij er geen met de behandeling samenhangende schadelijke gevolgen worden waargenomen.
1.3 PRINCIPE VAN DE TESTMETHODE
De teststof wordt in een aantal doses oraal toegediend aan verschillende groepen knaagdieren. Meestal is herhaalde toediening nodig gedurende 28 dagen of in de vorm van subchronisch (90 dagen) of chronisch (een jaar of langer) onderzoek. De in deze testmethode beschreven procedures kunnen ook worden gebruikt voor een onderzoek naar acute neurotoxiciteit. De dieren worden getest om afwijkend gedrag en/of neurologische afwijkingen te kunnen detecteren of karakteriseren. Gedurende elke observatieperiode wordt een scala van gedragsuitingen beoordeeld dat door neurotoxica kan worden beïnvloed. Aan het eind van de test wordt een deel van de dieren van elk geslacht van elke groep in situ geperfundeerd en worden er secties van de hersenen, het ruggenmerg en de perifere zenuwen geprepareerd en onderzocht.
Wanneer het onderzoek zelfstandig als screening voor neurotoxiciteit of voor de karakterisering van neurotoxische effecten wordt uitgevoerd, kunnen de dieren van elke groep die niet voor perfusie en vervolgens histopathologie worden gebruikt (zie tabel 1), voor specifieke neuropathologische, neurochemische, elektrofysiologische of neurogedragsprocedures worden gebruikt waarmee de gegevens kunnen worden aangevuld die worden verkregen uit het verplichte standaardonderzoek van deze methode (1). Deze aanvullende procedures kunnen bijzonder nuttig zijn wanneer empirische observaties of verwachte effecten wijzen op een specifiek type of aangrijpingspunt voor de neurotoxiciteit van een chemische stof. Anderzijds is het ook mogelijk de resterende dieren te gebruiken voor evaluaties zoals die zijn opgenomen in testmethoden voor onderzoek naar toxiciteit bij herhaalde toediening bij knaagdieren.
Wanneer de procedures van deze testmethode in combinatie met die van andere testmethoden worden gebruikt, is er een voldoende aantal dieren nodig om aan de observatievereisten voor beide onderzoeken te voldoen.
1.4 BESCHRIJVING VAN DE TESTMETHODE
1.4.1 Keuze van de diersoort
Bij voorkeur wordt de rat gebruikt, maar ook andere knaagdiersoorten kunnen worden gebruikt wanneer hiervoor een motivering wordt gegeven. Er worden gezonde jonge volwassen dieren van gangbare laboratoriumstammen gebruikt. De vrouwtjes mogen nog geen jongen hebben gehad en mogen niet drachtig zijn. De toediening begint zo spoedig mogelijk na het spenen, bij voorkeur uiterlijk wanneer de dieren zes weken oud zijn en in elk geval voordat de dieren negen weken oud zijn. Wanneer dit onderzoek met andere onderzoeken wordt gecombineerd, kan het echter nodig zijn deze leeftijdseis aan te passen. Aan het begin van het onderzoek mag het lichaamsgewicht van de dieren niet meer dan ± 20 % afwijken van het gemiddelde gewicht voor elk geslacht. Wanneer een onderzoek met herhaalde toediening van korte duur als voorbereiding op een langdurig onderzoek wordt uitgevoerd, moeten bij beide onderzoeken dieren van dezelfde stam en dezelfde herkomst worden gebruikt.
1.4.2 Huisvesting en voeding
De temperatuur in de proefdierruimte dient 22 oC (± 3 oC) te zijn. Hoewel de relatieve vochtigheid minimaal 30 % en bij voorkeur niet hoger dan 70 % (behalve bij het reinigen van de ruimte) dient te zijn, moet worden gestreefd naar 50-60 %. Verlichting gebeurt met kunstlicht met een ritme van 12 uur licht en 12 uur donker. Harde onregelmatige geluiden moeten tot een minimum worden beperkt. Als voeding mag het gewone laboratoriumvoer worden gebruikt met een onbeperkte hoeveelheid drinkwater. De keuze van het voer kan worden beïnvloed door de noodzaak om voor een afdoende mengbaarheid met de teststof te zorgen, wanneer de stof in het voer wordt toegediend. De dieren mogen apart of in kleine groepen met hetzelfde geslacht worden gehuisvest.
1.4.3 Voorbereiding van de dieren
De gezonde jonge dieren worden aselect ingedeeld in de behandelings- en controlegroepen. De kooien worden zodanig opgesteld dat mogelijke effecten door de plaatsing van de kooien tot een minimum worden beperkt. De dieren worden op unieke wijze gemerkt en vóór het begin van het onderzoek gedurende minimaal 5 dagen in hun kooi gehouden om ze aan de omstandigheden in het laboratorium te laten wennen.
1.4.4 Toedieningsweg en bereiding van de dosis
Deze testmethode behandelt specifiek de orale toediening van de teststof. De orale toediening kan met een maagsonde, in het voer, in het drinkwater of met capsules gebeuren. Ook andere toedieningswegen (bv. dermaal of inhalatie) kunnen worden gebruikt, maar hiervoor moeten de aanbevolen procedures wellicht worden gewijzigd. De keuze van de toedieningsweg wordt bepaald door het blootstellingsprofiel bij de mens en de beschikbare toxicologische of kinetische informatie. De motivering voor de keuze van de toedieningsweg en hieruit voortvloeiende wijzigingen in de procedures van deze testmethode moeten worden vermeld.
Waar nodig kan de teststof in een geschikt medium worden opgelost of gesuspendeerd. In eerste instantie wordt het gebruik van een waterige oplossing/suspensie aanbevolen, als tweede keuze een oplossing/suspensie in olie (bijvoorbeeld maïsolie) en uiteindelijk eventueel een oplossing/suspensie in een ander medium. De toxicologische kenmerken van het medium moeten bekend zijn. Daarnaast moet aandacht worden besteed aan de volgende kenmerken van het medium: effecten van het medium op de resorptie, de distributie, het metabolisme of de retentie van de teststof die wellicht gevolgen kunnen hebben voor de toxicologische kenmerken, en effecten op de consumptie van voer of water of de voedingsstatus van de dieren.
1.5 PROCEDURE
1.5.1 Aantal en geslacht van de dieren
Wanneer het onderzoek zelfstandig wordt uitgevoerd, moeten er in elke dosis- en controlegroep ten minste 20 dieren (10 vrouwtjes en 10 mannetjes) worden gebruikt voor de evaluatie van gedetailleerde klinische en functionele observaties. Van deze 10 vrouwtjes en 10 mannetjes moeten ten minste 5 vrouwtjes en 5 mannetjes aan het eind van het onderzoek in situ worden geperfundeerd en voor gedetailleerde neurohistopathologie worden gebruikt. Wanneer in een bepaalde dosisgroep slechts bij een beperkt aantal dieren verschijnselen van neurotoxische effecten worden geobserveerd, moet worden overwogen onder andere deze dieren voor perfusie te selecteren. Wanneer het onderzoek in combinatie met een onderzoek naar toxiciteit bij herhaalde toediening wordt uitgevoerd, moeten er voldoende dieren worden gebruikt om aan de doelstellingen van beide onderzoeken te voldoen. Tabel 1 bevat een overzicht van de minimale aantallen dieren per groep voor verschillende onderzoekcombinaties. Als het de bedoeling is tussentijds dieren te doden of bij bepaalde groepen na de behandeling te observeren of de toxische effecten reversibel zijn, blijven bestaan of vertraagd optreden of wanneer aanvullende observaties worden overwogen, moet het aantal dieren worden opgevoerd om ervoor te zorgen dat er voldoende dieren beschikbaar zijn voor observatie en histopathologie.
1.5.2 Behandelings- en controlegroepen
In het algemeen moeten er ten minste drie dosisgroepen en één controlegroep worden gebruikt, maar als er op grond van de beoordeling van andere gegevens bij herhaalde toediening van 1 000 mg/kg lichaamsgewicht/dag geen effecten worden verwacht, kan er een limiettest worden uitgevoerd. Als er geen geschikte gegevens beschikbaar zijn, kan er een verkennend onderzoek worden uitgevoerd om de te gebruiken doses te helpen bepalen. Afgezien van de toediening van de teststof worden de dieren in de controlegroep op identieke wijze behandeld als de dieren in de dosisgroepen. Als er bij de toediening van de teststof een medium wordt gebruikt, moet het hoogste gebruikte volume van het medium aan de controlegroep worden toegediend.
1.5.3 Betrouwbaarheidscontrole
Het laboratorium dat het onderzoek uitvoert, moet gegevens verstrekken waaruit blijkt dat het in staat is het onderzoek uit te voeren en wat de gevoeligheid van de gebruikte procedures is. Uit deze gegevens moet blijken dat het veranderingen in de verschillende voor observatie aanbevolen eindpunten, zoals autonome verschijnselen, sensorische reactiviteit, grijpkracht van de ledematen en motorische activiteit, kan detecteren en eventueel kwantificeren. Voor informatie over chemische stoffen die verschillende soorten neurotoxische reacties veroorzaken en als positieve controle kunnen worden gebruikt, wordt verwezen naar de referenties (2) tot en met (9). Als de procedures in grote lijnen gelijk blijven, kunnen gegevens uit het verleden worden gebruikt. Periodieke bijwerking van gegevens uit het verleden wordt aanbevolen. Wanneer de uitvoering van de test of de procedures door het laboratorium op een essentieel punt wordt gewijzigd, moet met nieuwe gegevens worden aangetoond dat de gevoeligheid van de procedures op peil blijft.
1.5.4 Keuze van de doses
Bij de keuze van de dosisniveaus wordt rekening gehouden met eerder waargenomen toxiciteit en kinetische gegevens die voor de teststof of verwante materialen beschikbaar zijn. De hoogste dosis wordt zodanig gekozen dat er neurotoxische effecten of duidelijke systemische toxische effecten optreden. Vervolgens wordt er een zodanige dalende reeks dosisniveaus gekozen dat er een verband tussen dosis en respons kan worden gelegd en er bij de laagste dosis geen schadelijke effecten worden waargenomen (NOAEU). In beginsel worden de dosisniveaus zodanig gekozen dat primaire toxische effecten op het zenuwstelsel kunnen worden onderscheiden van effecten die samenhangen met systemische toxiciteit. Twee of drie intervals is vaak optimaal en in plaats van een zeer groot interval tussen de doses (bv. meer dan een factor 10) verdient toevoeging van een vierde testgroep vaak de voorkeur. Wanneer er een redelijke raming van de blootstelling van de mens is, moet hier ook rekening mee worden gehouden.
1.5.5 Limiettest
Als een onderzoek met één dosis van ten minste 1 000 mg/kg lichaamsgewicht/dag volgens de beschreven procedures geen waarneembare neurotoxische effecten oplevert en als toxiciteit op grond van gegevens van qua structuur verwante verbindingen niet te verwachten valt, zal een volledig onderzoek met drie dosisniveaus wellicht niet nodig worden geacht. Op grond van de verwachte blootstelling van de mens kan het gebruik van een hogere orale dosis bij de limiettest nodig worden geacht. Bij andere toedieningswegen, bijvoorbeeld dermaal of inhalatie, wordt het maximaal haalbare blootstellingsniveau vaak bepaald door de fysisch-chemische eigenschappen van de teststof. Bij de uitvoering van een oraal acuut onderzoek moet de dosis voor een limiettest ten minste 2 000 mg/kg zijn.
1.5.6 Toediening van de dosis
De teststof wordt dagelijks, zeven dagen per week, gedurende ten minste 28 dagen aan de dieren toegediend; voor een toedieningsschema van vijf dagen per week of een kortere blootstellingsperiode moet een motivering worden gegeven. Wanneer de teststof met een sonde wordt toegediend, moet dit in één keer met een maagsonde of een geschikte katheter gebeuren. Het maximale volume van een vloeistof dat in één keer kan worden toegediend, is afhankelijk van de grootte van de proefdieren. Het volume mag niet groter zijn dan 1 ml/100 g lichaamsgewicht. Bij waterige oplossingen kan echter het gebruik van maximaal 2 ml/100 mg lichaamsgewicht worden overwogen. Behalve bij irriterende of bijtende stoffen, die normaal gesproken bij hogere concentraties hevigere effecten hebben, moeten volumeverschillen tot een minimum worden beperkt door de concentratie aan te passen, zodat er op alle dosisniveaus hetzelfde volume wordt toegediend.
Het is belangrijk dat er bij stoffen die via het voer of het drinkwater worden toegediend, voor wordt gezorgd dat de hoeveelheden teststof de normale voer- of waterbalans niet verstoren. Wanneer de teststof in het voer wordt toegediend, kan een constante concentratie in het voer (in ppm) of een constante dosis in verhouding tot het lichaamsgewicht van de dieren worden gebruikt; de gekozen methode moet worden gespecificeerd. Wanneer een stof met een sonde wordt toegediend, moet de dosis elke dag op een vergelijkbaar tijdstip worden toegediend en indien nodig worden aangepast om een constante dosis in verhouding tot het lichaamsgewicht van het dier te houden. Wanneer een onderzoek met herhaalde toediening als voorbereiding op een langdurig onderzoek wordt gebruikt, moet bij beide onderzoeken een vergelijkbare voeding worden gebruikt. Bij acuut onderzoek kan de dosis, als toediening in één keer niet mogelijk is, in kleinere porties worden verdeeld die in de loop van maximaal 24 uur worden toegediend.
1.6 OBSERVATIE
1.6.1 Frequentie van de observaties en tests
Bij onderzoek met herhaalde toediening bestrijkt de observatieperiode de toedieningsperiode. Bij acuut onderzoek vindt de observatie gedurende 14 dagen na de toediening plaats. Bij dieren in satellietgroepen die gedurende een periode na de behandeling zonder blootstelling worden gehouden, moeten de observaties ook deze periode bestrijken.
De frequentie van de observaties moet voldoende zijn voor een maximale kans op detectie van eventuele neurologische en/of gedragsafwijkingen. De observatie moet bij voorkeur elke dag op hetzelfde tijdstip plaatsvinden en hierbij moet rekening worden gehouden met de piekperiode voor de verwachte effecten na de toediening. Tabel 2 bevat een overzicht van de frequentie van de klinische observaties en functionele tests. Als kinetische of andere gegevens uit eerder onderzoek erop wijzen dat verschillende tijdstippen voor observaties, tests of periodes na observaties nodig zijn, moet er een ander schema worden opgesteld om zo veel mogelijk informatie te verkrijgen. Voor veranderingen in het schema moet een motivering worden gegeven.
1.6.1.1 Observatie van de algemene gezondheidstoestand en de mortaliteit/morbiditeit
Alle dieren worden ten minste één keer per dag zorgvuldig geobserveerd om hun gezondheidstoestand te beoordelen en ten minste twee keer per dag op morbiditeit en mortaliteit.
1.6.1.2 Gedetailleerde klinische observatie
Bij alle hiervoor geselecteerde dieren (zie tabel 1) wordt één keer vóór de eerste blootstelling (om vergelijking per dier mogelijk te maken) en daarna met verschillende tussenpozen afhankelijk van de duur van het onderzoek (zie tabel 2) een gedetailleerde klinische observatie uitgevoerd. Bij satellietherstelgroepen dienen aan het eind van de herstelperiode gedetailleerde klinische observaties te worden uitgevoerd. Gedetailleerde klinische observaties dienen buiten het eigen hok in een standaardloopruimte te gebeuren. Ze moeten zorgvuldig worden geregistreerd met behulp van scoresystemen met criteria of schalen voor elke meting bij de observatie. De gebruikte criteria of schalen moeten expliciet door het laboratorium worden gedefinieerd. Er moet worden getracht ervoor te zorgen dat de variaties in de testomstandigheden minimaal zijn (niet systematisch gerelateerd aan de behandeling) en dat de observaties worden uitgevoerd door geschoolde waarnemers die niet op de hoogte zijn van de gegeven behandeling.
Het verdient aanbeveling de observaties gestructureerd uit te voeren, waarbij voor elk dier op elk observatietijdstip systematisch goed gedefinieerde criteria worden gehanteerd (met inbegrip van een definitie van het „normale bereik”). Het „normale bereik” moet afdoende worden gedocumenteerd. Alle waargenomen verschijnselen moeten worden geregistreerd. Waar mogelijk moet ook de omvang van de waargenomen verschijnselen worden geregistreerd. Klinische observatie moet ten minste maar niet uitsluitend omvatten: veranderingen in huid, vacht, ogen en slijmvliezen, secretie en excretie van stoffen en autonome activiteit (bv. tranen, pilo-erectie, verandering in pupilgrootte, een ongebruikelijk ademhalingspatroon en/of ademen door de mond, ongebruikelijke urineer- of ontlastingsverschijnselen en verkleuring van de urine).
Ook ongebruikelijke reacties ten aanzien van de lichaamshouding, de mate van activiteit (bv. meer of minder exploratie van de standaardloopruimte) en de coördinatie van de bewegingen dienen te worden geregistreerd. Verandering in gang (bv. waggelen of ataxie), houding (bv. gebocheld) en reactiviteit op vastpakken, neerzetten of andere omgevingsprikkels, alsmede de aanwezigheid van klonische of tonische bewegingen, convulsies of tremors, stereotiep gedrag (bv. overmatige lichaamsverzorging, ongebruikelijke hoofdbewegingen, herhaaldelijk ronddraaien) of bizar gedrag (bv. bijten of overmatig likken, zelfverminking, achteruitlopen, stemgeluiden) of agressie moeten worden geregistreerd.
1.6.1.3 Functionele tests
Net als bij de gedetailleerde klinische observatie moeten ook de functionele tests bij alle hiervoor geselecteerde dieren (zie tabel 1) één keer vóór de eerste blootstelling en daarna geregeld worden uitgevoerd. Ook de frequentie van de functionele tests is afhankelijk van de duur van het onderzoek (zie tabel 2). Afgezien van de in tabel 2 vermelde observatieperioden moeten ook zo kort mogelijk voordat de dieren worden gedood, functionele observaties bij satellietherstelgroepen worden uitgevoerd. Bij de functionele tests moet worden gekeken naar de sensorische reactiviteit op verschillende soorten prikkels [bv. auditieve, visuele en proprioceptieve prikkels (5)(6)(7), een beoordeling van de grijpkracht van ledematen (8) en een beoordeling van de motorische activiteit (9). De motorische activiteit moet worden gemeten met een geautomatiseerd apparaat dat zowel een afname als een toename van de activiteit kan detecteren. Als er een ander gedefinieerd systeem wordt gebruikt, moet dit kwantitatief zijn en moeten de gevoeligheid en de betrouwbaarheid worden aangetoond. Elk apparaat moet worden getest om de betrouwbaarheid in de loop der tijd en de consistentie van apparaat tot apparaat te waarborgen. Voor een gedetailleerdere beschrijving van de te volgen procedures wordt verwezen naar de respectieve referenties. Als er geen gegevens zijn (bv. structuur/activiteit-relaties, epidemiologische gegevens of ander toxicologisch onderzoek) die aanwijzingen geven omtrent de mogelijke neurotoxische effecten, moet worden overwogen gespecialiseerdere tests op de sensorische en motorische functie of leren en geheugen uit te voeren om deze mogelijke effecten meer in detail te onderzoeken. Voor meer informatie over gespecialiseerdere tests en het gebruik daarvan wordt verwezen naar (1).
Bij wijze van uitzondering kunnen dieren die zodanige toxiciteitsverschijnselen vertonen dat deze de functionele test significant zouden storen, van deze test worden uitgesloten. Voor het uitsluiten van dieren van een functionele test moet een motivering worden gegeven.
1.6.2 Lichaamsgewicht en consumptie van voer en water
Bij onderzoek met een duur tot 90 dagen moeten alle dieren ten minste één keer per week worden gewogen en moet de voerconsumptie (de waterconsumptie als de teststof in het water wordt toegediend) ten minste wekelijks worden gemeten. Bij langdurig onderzoek moeten alle dieren de eerste 13 weken ten minste één keer per week worden gewogen en daarna ten minste één keer per vier weken. De eerste 13 weken wordt de voerconsumptie (de waterconsumptie als de teststof in het water wordt toegediend) ten minste wekelijks gemeten en daarna ongeveer één keer per drie maanden, tenzij met het oog op de gezondheidstoestand of de veranderingen in het lichaamsgewicht een ander ritme nodig is.
1.6.3 Oogheelkundig onderzoek
Bij een onderzoek dat langer dan 28 dagen duurt, moet vóór de toediening van de teststof en aan het einde van het onderzoek bij voorkeur bij alle dieren maar ten minste bij de dieren in de hoge dosis- en controlegroepen een oogheelkundig onderzoek worden uitgevoerd met een oftalmoscoop of een gelijkwaardig geschikt instrument. Als er veranderingen in de ogen worden waargenomen of als dit met het oog op klinische verschijnselen nodig is, moeten alle dieren worden onderzocht. Bij een langdurig onderzoek moet er ook na 13 weken een oogheelkundig onderzoek worden uitgevoerd. Het oogheelkundig onderzoek behoeft niet te worden uitgevoerd als deze gegevens al beschikbaar zijn uit ander onderzoek met een vergelijkbare duur en vergelijkbare dosisniveaus.
1.6.4 Hematologisch en klinisch-biochemisch onderzoek
Wanneer het onderzoek naar neurotoxiciteit in combinatie met een onderzoek naar systemische toxiciteit bij herhaalde toediening wordt uitgevoerd, moeten er hematologisch onderzoek en klinisch-biochemische bepalingen worden uitgevoerd zoals dit in de desbetreffende methode voor het onderzoek naar systemische toxiciteit is beschreven. De monsterneming moet zodanig gebeuren dat mogelijke neurogedragseffecten tot een minimum worden beperkt.
1.6.5 Histopathologie
Het neuropathologisch onderzoek moet worden opgezet als aanvulling op en uitbreiding van de observaties tijdens de in vivo fase van het onderzoek. Weefsels van ten minste 5 dieren/geslacht/groep (zie tabel 1 en volgende pragraaf) worden in situ gefixeerd met behulp van algemeen erkende perfusie- en fixatietechnieken (zie referentie 3, hoofdstuk 5, en referentie 4, hoofdstuk 50). Waarneembare macroscopische veranderingen worden geregistreerd. Wanneer het onderzoek zelfstandig als screening voor neurotoxiciteit of voor de karakterisering van neurotoxische effecten wordt uitgevoerd, kunnen de overige dieren worden gebruikt voor specifieke neurogedragsprocedures (10)(ll), neuropathologische procedures (10)(11)(12)(13), neurochemische procedures (1())(11)(14)(15) of elektrofysiologische procedures (1())(11)(16)(17) waarmee de hier beschreven procedures en onderzoeken kunnen worden aangevuld, of om meer dieren beschikbaar te hebben voor histopathologisch onderzoek. Deze aanvullende procedures zijn vooral nuttig wanneer empirische observaties of verwachte effecten wijzen op een specifiek type of aangrijpingspunt van de neurotoxiciteit (2)(3). Anderzijds is het ook mogelijk de resterende dieren te gebruiken voor standaardpathologisch onderzoek zoals dat in de testmethode voor onderzoek naar toxiciteit bij herhaalde toediening wordt beschreven.
Bij elk weefselspecimen in paraffine wordt een algemene kleurprocedure uitgevoerd, zoals hematoxyline en eosine (H&E), en wordt een microscopisch onderzoek uitgevoerd. Als er verschijnselen van perifere neuropathie worden waargenomen of vermoed, worden er monsters van perifeer zenuwweefsel in kunststof onderzocht. Klinische verschijnselen kunnen ook aanwijzingen opleveren voor andere onderzoekplaatsen of het gebruik van speciale kleurprocedures. Richtsnoeren voor andere plaatsen die kunnen worden onderzocht, zijn te vinden in (3)(4). Ook geschikte speciale kleurstoffen om specifieke soorten pathologische veranderingen aan te tonen, kunnen nuttig zijn (18).
Representatieve secties van het centrale en perifere zenuwstelsel worden histologisch onderzocht (zie referentie 3, hoofdstuk 5, en referentie 4, hoofdstuk 50). Normaal gesproken moeten onder andere de volgende gebieden worden onderzocht: de voorhersenen, het centrum van het cerebrum met een sectie door de hippocampus, de middenhersenen, het cerebellum, de pons, de medulla oblongata, het oog met oogzenuw en netvlies, het ruggenmerg bij de cervicale en lumbale verdikkingen, de ganglia van de dorsale wortel, de vezels van de dorsale en ventrale wortel, de proximale nervus ischiadicus, de proximale nervus tibialis (bij de knie) en de kuitspiervertakkingen van de nervus tibialis. Van het ruggenmerg en de perifere zenuwen moeten zowel dwarse of transversale als longitudinale secties worden gemaakt. Er moet worden gelet op het vaatstelsel van het zenuwstelsel. Tevens moet er een monster van een skeletspier, met name de kuitspier, worden onderzocht. Er moet bijzondere aandacht worden besteed aan plaatsen met een cellulaire en vezelstructuur en -patroon in het CZS en het PZS waarvan bekend is dat ze bijzonder gevoelig zijn voor neurotoxica.
Voor een leidraad voor neuropathologische veranderingen die vaak een gevolg zijn van blootstelling aan een toxische stof, wordt verwezen naar de referenties (3) en (4). Een stapsgewijs onderzoek van de weefselmonsters wordt aanbevolen, waarbij secties van de hoogste dosisgroep eerst worden vergeleken met die van de controlegroep. Als er in de monsters van deze groepen geen neuropathologische veranderingen worden waargenomen, is een verdere analyse niet nodig. Als er in de hoogste dosisgroep neuropathologische veranderingen worden waargenomen, worden er van elk van de mogelijk aangetaste weefsels van de tussengroepen en de laagste groep monsters genomen en sequentieel onderzocht.
Als er bij het kwalitatieve onderzoek bewijzen van neuropathologische veranderingen worden gevonden, moet er een tweede onderzoek worden uitgevoerd bij alle gebieden van het zenuwstelsel die deze veranderingen vertonen. Bij alle dosisgroepen worden er van elk van de mogelijkerwijs aangetaste gebieden secties gecodeerd en aselect zonder de code te kennen onderzocht. De frequentie en de ernst van elk letsel worden geregistreerd. Nadat van alle gebieden van alle dosisgroepen de score is bepaald, kan de code worden verbroken en kan er een statistische analyse worden uitgevoerd om het verband tussen dosis en respons te bepalen. Van elk letsel moeten er voorbeelden van uiteenlopende ernst worden beschreven.
De neuropathologische bevindingen moeten in de context van de gedragsobservaties en metingen alsmede andere gegevens uit eerder en tegelijkertijd uitgevoerd onderzoek naar de systemische toxiciteit van de teststof worden geëvalueerd.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
Er worden voor elk dier apart gegevens verstrekt. Daarnaast worden alle gegevens in tabelvorm samengevat met voor alle test- en controlegroepen vermelding van het aantal dieren aan het begin van het onderzoek, het aantal dieren dat tijdens het onderzoek dood is aangetroffen of op humane wijze is gedood met het tijdstip waarop ze zijn gestorven of gedood, het aantal dieren dat toxiciteitsverschijnselen vertoonde, een beschrijving van de waargenomen toxiciteitsverschijnselen, met inbegrip van de aanvang, de duur, de aard en de ernst van eventuele toxische effecten, en het aantal dieren met letsel, met vermelding van de aard en de ernst van het letsel of de letsels.
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
De resultaten van het onderzoek moeten worden geëvalueerd, waarbij wordt gekeken naar de incidentie, de ernst en de correlatie van neurogedragseffecten en neuropathologische effecten (en ook neurochemische en elektrofysiologische effecten als dit aanvullende onderzoek is uitgevoerd) en andere waargenomen schadelijke effecten. Waar mogelijk moeten getalsmatige resultaten met behulp van een geschikte en algemeen erkende statistische methode worden geëvalueerd. De statistische methoden moeten gedurende de opzet van het onderzoek worden gekozen.
3 RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Teststof:
|
|
|
Medium (indien van toepassing):
|
|
|
Proefdieren:
|
|
|
Testomstandigheden:
|
|
|
Observatie en testprocedures:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten:
|
|
|
Conclusies:
|
4. REFERENTIES
|
1. |
OECD Giudance Document on Neorutoxicity Testing Strategies and Test Methods. OECD, Paris, In Preparation. |
|
2. |
Test Guidline for a Developmental Neurotoxicitu Study, OECD Guidelines for the Testing of Chemicals. In preparation. |
|
3. |
World Health Organization (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals. |
|
4. |
Spencer, P.S. and Schaumburg, H.H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London. |
|
5. |
Tupper, D.E. and Wallace, R.B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, 999-1003. |
|
6. |
Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691-704. |
|
7. |
Moser, V.C., McDaniel, K.M. and Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, 267-283. |
|
8. |
Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., I, 233-236. |
|
9. |
Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599-609. |
|
10. |
Tilson, H.A., and Mitchell, C.L. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York. |
|
11. |
Chang, L.W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York. |
|
12. |
Broxup, B. (1991). Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., _10, 689-695. |
|
13. |
Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C. (1992). Comparison of Subchronic Neurotoxicity of 2- Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343-352. |
|
14. |
O'Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., H), 445-452. |
|
15. |
O'Callaghan J.P. and Miller, D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368-378. |
|
16. |
Fox. D.A., Lowndes, H.E. and Birkamper, G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, p 299-335. |
|
17. |
Johnson, B.L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/London, p. 726- 742. |
|
18. |
Bancroft, J.D. and Steven A. (1990). Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone. |
Table 1
Minimum numbers of animals needed per group when the neurotoxicity study is conducted separately or in combination whit studies
|
|
NEUROTOXICITY STUDY CONDUCTED AS: |
|||
|
Separate study |
Combined study with the 28-day study |
Combined study with the 90-day study |
Combined study with the chronic toxicity study |
|
|
Total number of animals per group |
10 males and 10 females |
10 males and 10 females |
15 males and 15 females |
25 males and 25 females |
|
Number of animals selected for functional testing including detailed clinical observations |
10 males and 10 females |
10 males and 10 females |
10 males and 10 females |
10 males and 10 females |
|
Number of animals selected per perfusion in situ and neurohistopathology |
5 males and 5 females |
5 males and 5 females |
5 males and 5 females |
5 males and 5 females |
|
Number of animals selected for repeated dose/subchronic/chronic toxicity observations, haematology, clinical biochemistry, histopathology, etc. as indicate in the respective Guidelines |
|
5 males and 5 females |
||
|
Supplemental observations, as appropriate |
5 males and 5 females |
|
|
|
Tabel 2
Frequentie van de klinische observatie en functionele tests
|
Aard van de observaties |
Duur van het onderzoek |
||||||||||||||||||||||||||
|
Acuut |
28 dagen |
90 dagen |
Chronisch |
||||||||||||||||||||||||
|
Bij alle dieren |
Algemene gezondheidstoestand |
dagelijks |
dagelijks |
dagelijks |
dagelijks |
||||||||||||||||||||||
|
Mortaliteit/morbiditeit |
Twee keer per dag |
Twee keer per dag |
Twee keer per dag |
Twee keer per dag |
|||||||||||||||||||||||
|
Bij dieren die voor de functionele observaties gekozen zijn |
Gedetailleerde klinische observaties |
|
|
|
|
||||||||||||||||||||||
|
Functionele tests |
|
|
|
|
|||||||||||||||||||||||
B.44. ABSORPTIE DOOR DE HUID: IN-VIVO METHODE
1. METHODE
Deze testmethode komt overeen met OESO TG 427 (2004).
1.1. INLEIDING
De blootstelling aan veel chemische stoffen gebeurt vooral via de huid, terwijl bij de meeste bij laboratoriumdieren uitgevoerde toxicologische onderzoeken de orale toedieningsroute wordt gebruikt. Het in deze methode beschreven in-vivo-onderzoek naar percutane absorptie biedt de koppeling die nodig is voor een extrapolatie vanuit oraal onderzoek bij de uitvoering van een veiligheidsbeoordeling na blootstelling via de huid.
Een stof moet een groot aantal cellagen van de huid passeren alvorens deze in de circulatie terecht kan komen. De snelheidsbepalende laag is voor de meeste stoffen het stratum corneum, dat bestaat uit dode cellen. De permeabiliteit van de huid is afhankelijk van zowel de lipofiliteit van de chemische stof en de dikte van de buitenste laag van de epidermis als andere factoren zoals het molecuulgewicht en de concentratie van de stof. In het algemeen is de permeabiliteit van de huid van ratten en konijnen groter dan die van de huid van de mens, terwijl de permeabiliteit van de huid van cavia's en apen meer lijkt op die van de huid van de mens.
De methoden om de percutane absorptie te meten kunnen in twee categorieën worden verdeeld: in vivo en in vitro. De in-vivo methode kan bij verschillende soorten laboratoriumdieren goede informatie over de absorptie door de huid opleveren. De ontwikkeling van in-vitro methoden is van een recenter datum. Daarbij wordt gebruik gemaakt van het transport over dierlijke of menselijke huid met een volledige of partiële dikte naar een vloeistofreservoir. De in-vitro methode wordt apart in een andere testmethode (1) beschreven. Als hulp bij het kiezen van de geschiktste methode in een bepaalde situatie wordt aanbevolen de richtsnoeren van de OESO voor de uitvoering van studies inzake absorptie door de huid (2) te raadplegen, aangezien hierin gedetailleerdere informatie wordt gegeven over de geschiktheid van zowel in-vivo methoden als in-vitro methoden.
De hier beschreven in-vivo methode maakt het mogelijk de penetratie van de teststof in het systemische compartiment via de huid te bepalen. De techniek is al vele jaren lang op grote schaal gebruikt (3)(4)(5)(6)(7). Hoewel in-vitro-onderzoek naar de percutane absorptie in veel gevallen geschikt kan zijn, kunnen er ook situaties zijn waarin alleen een in-vivo-onderzoek de benodigde gegevens kan opleveren.
De voordelen van de in-vivo methode zijn dat deze een fysiologisch en metabool intact systeem gebruikt, een ook in andere toxicologische onderzoeken veel gebruikte species gebruikt en voor gebruik met andere species kan worden aangepast. De nadelen zijn dat er levende dieren moeten worden gebruikt, dat er radioactief gelabeld materiaal nodig is om gemakkelijker betrouwbare resultaten te krijgen, dat er problemen zijn bij het bepalen van de vroege absorptiefase en dat er een verschil in permeabiliteit is tussen de species die de voorkeur heeft (de rat) en de menselijke huid. Dierlijke huid heeft in het algemeen een grotere permeabiliteit en kan daardoor tot een overschatting van de percutane absorptie bij de mens leiden (6)(8)(9). Bijtende/corrosieve stoffen mogen niet bij levende dieren worden getest.
1.2. DEFINITIES
Ongeabsorbeerde dosis: de hoeveelheid die na blootstelling van het huidoppervlak wordt afgespoeld en nog op de niet-occlusieve bedekking aanwezig is, met inbegrip van de hoeveelheid waarvan wordt aangetoond dat deze tijdens de blootstelling vanaf de huid is verdampt.
Geabsorbeerde dosis (in vivo): de hoeveelheid teststof die aanwezig is in de urine, de wasvloeistof van de kooi, de feces, de uitgeademde lucht (indien gemeten), het bloed, de weefsels (indien verzameld) en het resterende karkas na verwijdering van de huid op de opbrenglocatie.
Absorbeerbare dosis: de hoeveelheid die na het spoelen op of in de huid aanwezig is.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof, die bij voorkeur radioactief gelabeld is, wordt bij een of meer geschikte dosisniveaus in de vorm van een representatief gangbaar preparaat op de geschoren huid van dieren aangebracht. Het testpreparaat wordt gedurende een vaste periode in contact met de huid gelaten onder een geschikte afdekking (niet-occlusief, semi-occlusief of occlusief) teneinde inslikken van het testpreparaat te voorkomen. Aan het eind van de blootstellingstijd wordt de afdekking verwijderd en wordt de huid met een geschikt reinigingsmiddel gereinigd; de afdekking en het reinigingsmateriaal worden voor analyse bewaard en er wordt een nieuwe afdekking aangebracht. De dieren worden vóór, gedurende en na de blootstellingsperiode in individuele metabole kooien gehuisvest en de uitwerpselen en uitgeademde lucht worden gedurende deze perioden voor analyse verzameld. De uitgeademde lucht behoeft niet te worden opgevangen wanneer er voldoende informatie is waaruit blijkt dat er weinig of geen vluchtige radioactieve metabolieten worden gevormd. Voor elke studie worden normaal gesproken verscheidene groepen dieren gebruikt die aan het testpreparaat worden blootgesteld. Eén groep wordt aan het eind van de blootstellingsperiode gedood. Andere groepen worden met geprogrammeerde tussenpozen daarna gedood (2). Aan het eind van de bemonsteringstijd worden de resterende dieren gedood, wordt het bloed voor analyse verzameld, wordt de opbrenglocatie voor analyse verwijderd en wordt het karkas op eventueel niet-uitgescheiden materiaal geanalyseerd. De monsters worden op correcte wijze geanalyseerd en de mate van percutane absorptie wordt bepaald (6)(8)(9).
1.4. BESCHRIJVING VAN DE METHODE
1.4.1. Keuze van de diersoort
Meestal wordt de rat als species gebruikt, maar ook haarloze stammen en species waarvan de huidabsorptiesnelheid vergelijkbaarder is met die van de mens kunnen worden gebruikt (3)(6)(7)(8)(9). Er dienen jonge volwassen gezonde dieren van één geslacht (in principe mannetjes) van gangbare laboratoriumstammen te worden gebruikt. Aan het begin van de studie mag de gewichtsvariatie tussen de dieren niet groter zijn dan ± 20 % van het gemiddelde gewicht. Mannetjesratten van 200-250 g zijn bijvoorbeeld geschikt, vooral in de bovenste helft van dit interval.
1.4.2. Aantal en geslacht van de dieren
Voor elk testpreparaat en elke geprogrammeerde beëindigingstijd moet een groep van ten minste vier dieren van één geslacht worden gebruikt. Elke groep zal na een verschillende tijdsduur worden gedood, bijvoorbeeld aan het eind van de blootstellingsperiode (meestal 6 of 24 uur) en op tijdstippen daarna (bv. 48 en 72 uur). Als er gegevens beschikbaar zijn waaruit blijkt dat er aanzienlijke verschillen in huidtoxiciteit tussen mannetjes en vrouwtjes zijn, moet het gevoeligste geslacht worden gekozen. Als dergelijke gegevens niet beschikbaar zijn, kan elk van beide geslachten worden gebruikt.
1.4.3. Huisvesting en voeding
De temperatuur in de proefdierruimte moet 22 oC (± 3 oC) zijn. De relatieve luchtvochtigheid moet ten minste 30 % en (behalve tijdens het schoonmaken van de ruimte) bij voorkeur niet hoger dan 70 % zijn, maar er moet worden gestreefd naar 50-60 %. Er moet gebruik worden gemaakt van kunstlicht met een cyclus van 12 uur licht en 12 uur donker. Als voer mag gewoon laboratoriumvoer worden gebruikt en dit moet in ruime mate beschikbaar zijn met daarnaast een onbeperkte hoeveelheid drinkwater. Tijdens de studie en bij voorkeur ook tijdens het acclimatiseren worden de dieren individueel in metabole kooien gehuisvest. Aangezien de resultaten worden beïnvloed door het morsen van voer en water, moet de kans op dergelijke voorvallen tot een minimum worden beperkt.
1.4.4. Voorbereiding van de dieren
De dieren worden gemerkt om elk dier afzonderlijk te kunnen identificeren en gedurende ten minste vijf dagen vóór het begin van de studie in hun kooi gehouden, zodat ze aan de laboratoriumomstandigheden kunnen acclimatiseren.
Na de acclimatiseringsperiode en ongeveer 24 uur vóór de toediening wordt bij elk dier een stuk huid in de omgeving van de schouders en de rug geschoren. De permeabiliteit van beschadigde huid verschilt van die van intacte huid en er moet goed op worden gelet dat de huid niet wordt geschaafd. Na het scheren en ongeveer 24 uur voordat de teststof op de huid wordt aangebracht (zie punt 1.4.7), wordt het huidoppervlak met aceton schoongeveegd om talgvet te verwijderen. Nog eens met water en zeep wassen wordt niet aanbevolen, omdat zeepresten de absorptie van de teststof kunnen bevorderen. Het huidoppervlak moet groot genoeg zijn om een betrouwbare berekening van de geabsorbeerde hoeveelheid teststof per cm2 huid mogelijk te maken, bij voorkeur ten minste 10 cm2. Dit oppervlak is uitvoerbaar bij ratten met een lichaamsgewicht van 200-250 g. Na de voorbereiding worden de dieren in de metabole kooien teruggeplaatst.
1.4.5. Teststof
De teststof is de stof waarvan de penetratiekenmerken worden bestudeerd. De teststof moet bij voorkeur radioactief worden gelabeld.
1.4.6. Testpreparaat
Het preparaat van de teststof (bijvoorbeeld puur, verdund of geformuleerd materiaal met de teststof dat op de huid wordt aangebracht) moet hetzelfde zijn (of een realistisch surrogaat) als het preparaat waaraan mensen of andere potentiële doelsoorten kunnen worden blootgesteld. Voor een afwijking van het gangbare preparaat moet een motivering worden gegeven. Indien nodig wordt de teststof opgelost of gesuspendeerd in een geschikt medium. Voor een ander medium dan water moeten de absorptiekenmerken en de mogelijke interactie met de teststof bekend zijn.
1.4.7. Opbrengen op de huid
Er wordt een specifiek stuk van het huidoppervlak bepaald waar de teststof wordt opgebracht. Vervolgens wordt een bekende hoeveelheid testpreparaat gelijkmatig op deze plaats aangebracht. Deze hoeveelheid moet normaal gesproken representatief zijn voor de potentiële blootstelling van de mens, meestal 1-5 mg/cm2 huid voor een vaste stof en maximaal 10 μl/cm2 voor vloeistoffen. Voor andere hoeveelheden moet een motivering worden gegeven op basis van de verwachte gebruiksomstandigheden, de doelstellingen van de studie of de fysische kenmerken van het testpreparaat. Na opbrengen moet de behandelde locatie tegen verzorging door het dier zelf worden beschermd. Figuur 1 bevat een voorbeeld van een gangbaar instrument hiervoor. Meestal wordt de opbrenglocatie beschermd met een niet-occlusieve afdekking (bijvoorbeeld een permeabel nylon gaas). Bij oneindig opbrengen moet de opbrenglocatie echter occlusief worden afgedekt. Wanneer de recovery-efficiëntie van de teststof door verdamping van een half-vluchtige teststof in onaanvaardbare mate wordt verlaagd (zie ook de eerste alinea van punt 1.4.10), moet de verdampte stof worden opgevangen in een koolfilter waarmee het opbrenginstrument wordt afgedekt (zie figuur 1). Het is belangrijk dat een instrument de huid niet beschadigt en het testpreparaat niet absorbeert of daarmee reageert. De dieren worden in de individuele metabole kooien teruggeplaatst om de uitwerpselen te kunnen verzamelen.
1.4.8. Duur van de blootstelling en bemonstering
De blootstellingsduur is de tijdsduur tussen het opbrengen en verwijderen van het testpreparaat door de huid te wassen. Er moet op basis van de verwachte blootstellingsduur bij de mens een relevante blootstellingsduur worden gebruikt (meestal 6 of 24 uur). Na de blootstellingsperiode worden de dieren tot het geprogrammeerde tijdstip van doden in de metabole kooien gehouden. Gedurende de hele studie moet op periodieke tijdstippen worden geobserveerd of de dieren tekenen van toxiciteit/abnormale reacties vertonen. Aan het eind van de blootstellingsperiode wordt geobserveerd of de behandelde huid zichtbare tekenen van irritatie vertoont.
De metabole kooien moeten het mogelijk maken dat gedurende de hele studie de urine en de feces apart worden opgevangen. Ook moeten 14C-kooldioxide en vluchtige C-koolstofverbindingen kunnen worden opgevangen en deze moeten worden geanalyseerd wanneer ze in significante hoeveelheden worden geproduceerd (> 5 %). De urine, de feces en de opvangvloeistoffen (bijvoorbeeld 14C-kooldioxide en vluchtige 14C-koolstofverbindingen) moeten van elke groep op elk bemonsteringstijdstip apart worden verzameld. Als er voldoende informatie is waaruit blijkt dat er weinig of geen vluchtige radioactieve metabolieten worden gevormd, kunnen open kooien worden gebruikt.
De uitwerpselen worden gedurende de blootstellingsperiode, maximaal 24 uur na het eerste huidcontact, en vervolgens dagelijks tot het einde van het experiment verzameld. Drie intervallen voor de verzameling van de uitwerpselen zijn normaal gesproken voldoende, maar op grond van de beoogde toepassing van het testpreparaat of bestaande kinetische gegevens kunnen geschiktere of extra tijdstippen voor bestudering worden gekozen.
Aan het eind van de blootstellingsperiode wordt het beschermende instrument van elk dier verwijderd en apart bewaard om te worden geanalyseerd. De behandelde huid van alle dieren wordt ten minste drie keer gewassen met een reinigingsmiddel en bijvoorbeeld geschikte wattenproppen. Er moet voor worden gezorgd dat andere lichaamsdelen niet worden verontreinigd. Het reinigingsmiddel moet representatief zijn voor normale reinigingsmethoden, bijvoorbeeld een oplossing van zeep in water. Ten slotte moet de huid worden gedroogd. Alle wattenproppen en al het waswater moeten voor analyse worden bewaard. Er wordt een nieuwe afdekking aangebracht ter bescherming van de behandelde locatie van de dieren die behoren tot groepen die voor een later tijdstip bestemd zijn, voordat ze in hun eigen aparte kooien worden teruggeplaatst.
1.4.9. Slotprocedures
In elke groep worden de dieren op het geprogrammeerde tijdstip elk afzonderlijk gedood en wordt het bloed voor analyse opgevangen. Het beschermende instrument of de afdekking wordt voor analyse verwijderd. Bij elk dier wordt de huid van de opbrenglocatie en een vergelijkbaar oppervlak onbehandelde geschoren huid weggenomen om apart te worden geanalyseerd. De opbrenglocatie kan worden gefractioneerd om het stratum corneum te scheiden van de epidermis daaronder om meer informatie over de verdeling van de teststof te krijgen. De bepaling van deze verdeling gedurende een zekere periode na de blootstellingsperiode moet enige aanwijzingen opleveren over de lotgevallen van de teststof in het stratum corneum. Om het fractioneren van de huid (na het wassen van de huid aan het eind en het doden van het dier) te vergemakkelijken wordt elke beschermende afdekking verwijderd. De huid van de opbrenglocatie, met een ronde rand van de omringende huid daaromheen, wordt van de rat verwijderd en op een plaat geprikt. Op het huidoppervlak wordt met lichte druk een strook kleefband aangebracht en de kleefband wordt samen met een deel van het stratum corneum verwijderd. Vervolgens worden opnieuw stroken kleefband aangebracht totdat het kleefband niet meer aan het huidoppervlak blijft plakken, wanneer het stratum corneum volledig is verwijderd. Voor elk dier kunnen alle stroken kleefband in één houder worden verzameld en hieraan wordt een stof toegevoegd om het weefsel te verteren, waarin het stratum corneum wordt opgenomen. Potentiële doelorganen kunnen worden verwijderd om apart te worden geanalyseerd, voordat het resterende karkas op de daarin geabsorbeerde dosis wordt geanalyseerd. De karkassen van de dieren moeten apart worden bewaard voor analyse. Meestal zal een analyse van de totale inhoud volstaan. Doelorganen kunnen worden verwijderd om apart te worden geanalyseerd (indien andere studies daar aanleiding toe geven). De urine die op het geprogrammeerde tijdstip van doden nog in de blaas aanwezig is, moet aan de eerder verzamelde urine worden toegevoegd. Na het verzamelen van de uitwerpselen in de metabole kooien op het geprogrammeerde tijdstip van doden worden de kooien en de opvangbakken daarvan met een geschikt oplosmiddel gewassen. Ook andere mogelijk verontreinigde apparatuur wordt op dezelfde wijze geanalyseerd.
1.4.10. Analyse
In alle studies moet een afdoende recovery worden gehaald (daarbij moet worden gestreefd naar een gemiddelde van 100 ± 10 % van de radioactiviteit). Voor een recovery buiten dit interval moet een motivering worden gegeven. De hoeveelheid van de toegediende dosis in elk monster moet met geschikte gevalideerde procedures worden geanalyseerd.
In de statistische analyse moet een meting van de variantie van de duplo's voor elke opgebrachte hoeveelheid worden opgenomen.
2. GEGEVENS
Voor elk dier moeten op elk bemonsteringstijdstip voor de teststof en/of metabolieten de volgende metingen worden uitgevoerd. Naast de individuele gegevens moeten de voor elk bemonsteringstijdstip gegroepeerde gegevens als gemiddelden worden gerapporteerd.
|
— |
de hoeveelheid op de beschermende instrumenten; |
|
— |
de hoeveelheid die uit de huid kan worden verwijderd; |
|
— |
de hoeveelheid in/op de huid die niet van de huid kan worden gewassen; |
|
— |
de hoeveelheid in het bloedmonster; |
|
— |
de hoeveelheid in de uitwerpselen en de uitgeademde lucht (indien van toepassing); |
|
— |
de hoeveelheid die achterblijft in het karkas en in organen die voor aparte analyse zijn verwijderd. |
Aan de hand van de hoeveelheid teststof en/of metabolieten in de uitwerpselen, de uitgeademde lucht, het bloed en het karkas kan op elk tijdstip de totale geabsorbeerde hoeveelheid worden bepaald. Ook kan de hoeveelheid gedurende de blootstellingsduur geabsorbeerde teststof per cm2 aan de teststof blootgestelde huid worden berekend.
3. RAPPORTAGE
3.1. TESTRAPPORT
In het testrapport moeten de in het protocol vermelde voorschriften worden opgenomen, met inbegrip van een motivering voor het gebruikte testsysteem, en de volgende gegevens:
|
|
Teststof:
|
|
|
Testpreparaat:
|
|
|
Proefdier:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
1. |
Testmethode B.45. Absorptie door de huid: in vitro-methode. |
|
2. |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
3. |
ECETOC (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20. |
|
4. |
Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829-835. |
|
5. |
Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA. |
|
6. |
EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment. |
|
7. |
EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances. |
|
8. |
Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369-373. |
|
9. |
Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399-404. |
Figuur 1
Voorbeeld van een ontwerp voor een gangbaar instrument om de opbrenglocatie op de huid te bepalen en te beschermen bij in vivo-onderzoek van de percutane absorptie

B.45. ABSORPTIE DOOR DE HUID: IN-VITRO METHODE
1. METHODE
Deze testmethode komt overeen met OESO TG 428 (2004).
1.1. INLEIDING
Deze methode is ontworpen om informatie te verschaffen over de absorptie van een teststof die op weggenomen huid wordt aangebracht. De methode kan worden gecombineerd met de in-vivo methode voor absorptie door de huid (1) of afzonderlijk worden uitgevoerd. Als hulp bij het opzetten van studies op basis van deze methode wordt aanbevolen de richtsnoeren van de OESO voor de uitvoering van studies inzake absorptie door de huid (2) te raadplegen. Deze richtsnoeren zijn opgesteld om gemakkelijker geschikte in-vitro procedures voor specifieke omstandigheden te kunnen kiezen, zodat de betrouwbaarheid van resultaten die met deze methode worden verkregen, wordt gewaarborgd.
De methoden om de absorptie door de huid en de toediening via de huid te meten kunnen in twee categorieën worden verdeeld: in vivo en in vitro. In vivo-methoden voor absorptie door de huid zijn gangbaar en leveren farmacokinetische informatie bij een scala van diersoorten op. Een in-vivo methode wordt apart in een andere testmethode (1) beschreven. Ook in-vitro methoden worden al vele jaren gebruikt om de absorptie door de huid te meten. Hoewel er voor de in deze testmethode beschreven in-vitro methoden geen formeel valideringsonderzoek is uitgevoerd, waren deskundigen van de OESO het er in 1999 over eens dat er voldoende gegevens geëvalueerd waren om de in-vitro methode te ondersteunen (3). Nadere bijzonderheden ter motivering van deze ondersteuning, waaronder een significant aantal directe vergelijkingen van in vitro- en in-vivo methoden, worden in de richtsnoeren (2) vermeld. Er zijn verschillende monografieën waarin dit onderwerp wordt besproken en gedetailleerde achtergrondinformatie over het gebruik van een in-vitro methode wordt gegeven (4)(5)(6)(7)(8)(9)(10)(11)(12). In-vitro methoden meten de diffusie van chemische stoffen naar de huid en via de huid naar een vloeistofreservoir en kunnen niet-levende huid gebruiken om uitsluitend de diffusie te meten of verse metabool actieve huid om tegelijkertijd de diffusie en het metabolisme in de huid te meten. Dergelijke methoden worden specifiek gebruikt als screening om de toediening van chemische stoffen op en door de huid uit verschillende formuleringen te vergelijken en kunnen ook nuttige modellen bieden voor de evaluatie van de absorptie door de huid bij de mens.
De in-vitro methode is wellicht niet voor alle situaties en categorieën chemische stoffen bruikbaar. Het kan mogelijk zijn de in-vitro testmethode te gebruiken voor een eerste kwalitatieve evaluatie van de penetratie door de huid. In bepaalde gevallen zal het wellicht nodig zijn als vervolg hierop in-vivo gegevens te verzamelen. Voor een verdere uitwerking van situaties waarin de in-vitro methode geschikt is, wordt verwezen naar de richtsnoeren (2). Aanvullende gedetailleerde informatie om deze beslissing te ondersteunen is te vinden in (3).
Deze methode bevat algemene beginselen voor het meten van de absorptie door en de toediening via de huid van een teststof met behulp van verwijderde huid. Huid van vele zoogdiersoorten en ook van de mens kan worden gebruikt. De permeabiliteit van huid blijft na verwijdering uit het lichaam onveranderd, omdat de belangrijkste barrière voor diffusie het niet-levende stratum corneum is; actief transport van chemische stoffen door de huid is niet waargenomen. Er is aangetoond dat de huid in staat is bepaalde chemische stoffen tijdens de absorptie door de huid te metaboliseren (6), maar dit proces is niet snelheidsbeperkend ten aanzien van de feitelijk geabsorbeerde dosis, hoewel het de aard van het materiaal dat in de bloedsomloop terechtkomt wel kan beïnvloeden.
1.2. DEFINITIES
Ongeabsorbeerde dosis: de hoeveelheid die na blootstelling van het huidoppervlak wordt afgespoeld en nog op de niet-occlusieve bedekking aanwezig is, met inbegrip van de hoeveelheid waarvan wordt aangetoond dat deze tijdens de blootstelling vanaf de huid is verdampt.
Geabsorbeerde dosis (in vitro): massa teststof die binnen een gespecificeerd tijdsbestek in de receptorvloeistof of de systemische circulatie terechtkomt.
Absorbeerbare dosis (in vitro): de hoeveelheid die na het spoelen op of in de huid aanwezig is.
1.3. PRINCIPE VAN DE TESTMETHODE
De teststof, die radioactief gelabeld kan zijn, wordt aangebracht op het oppervlak van een huidmonster dat de twee compartimenten van een diffusiecel van elkaar scheidt. De chemische stof blijft gedurende een gespecificeerde tijd onder gespecificeerde omstandigheden op de huid aanwezig en wordt daarna met een geschikte reinigingsprocedure verwijderd. De receptorvloeistof wordt gedurende het experiment op bepaalde tijdstippen bemonsterd en geanalyseerd op de teststof en/of metabolieten.
Wanneer metabool actieve systemen worden gebruikt, kunnen met geschikte methoden metabolieten van de teststof worden geanalyseerd. Aan het eind van het experiment wordt, indien van toepassing, de distributie van de teststof en de metabolieten kwantitatief bepaald.
Onder geschikte omstandigheden, die in deze methode en de richtsnoeren (2) worden beschreven, wordt de absorptie van een teststof gedurende een bepaalde tijd gemeten door analyse van de receptorvloeistof en de behandelde huid. De hoeveelheid teststof die in de huid achterblijft, moet als geabsorbeerd worden beschouwd tenzij kan worden aangetoond dat de absorptie op grond van uitsluitend de waarden in de receptorvloeistof kan worden bepaald. Op grond van een analyse van de andere componenten (materiaal dat van de huid wordt gewassen of in de huidlagen achterblijft) kunnen nadere gegevens worden bepaald, bijvoorbeeld de totale verdeling van de teststof en de procentuele recovery.
Om de goede uitvoering en betrouwbaarheid van het testsysteem in het uitvoerende laboratorium aan te tonen moeten de resultaten voor relevante referentiechemicaliën beschikbaar zijn en in overeenstemming zijn met de gepubliceerde literatuur voor de gebruikte methode. Aan deze eis kan worden voldaan door tegelijk met de teststof een geschikte referentiestof (waarvan de lipofiliteit bij voorkeur vergelijkbaar is met die van de teststof) te testen of door adequate historische gegevens voor een aantal referentiestoffen met uiteenlopende lipofiliteit (bv. cafeïne, benzoëzuur en testosteron) te verstrekken.
1.4. BESCHRIJVING VAN DE TESTMETHODE
1.4.1 Diffusiecel
Een diffusiecel bestaat uit een donor- en een receptorcompartiment waartussen een stukje huid wordt geklemd (figuur 1 geeft een voorbeeld van een gangbaar ontwerp). De cel moet voor een goede afdichting rondom de huid zorgen en mogelijkheden bieden voor een gemakkelijke bemonstering en een goede menging van de receptorvloeistof die in contact staat met de onderkant van de huid, alsmede voor een goede regulering van de temperatuur van de cel en de inhoud daarvan. Zowel statische als doorstroom-diffusiecellen zijn aanvaardbaar. Normaal gesproken is er bij de blootstelling aan een eindige dosis van een testpreparaat geen sprake van occlusie van het donorcompartiment. Voor oneindige toepassingen en bepaalde scenario's voor eindige doses kan er echter wel occlusie van het donorcompartiment worden toegepast.
1.4.2 Receptorvloeistof
Het gebruik van een fysiologisch compatibele receptorvloeistof wordt aanbevolen, maar ook andere vloeistoffen mogen worden gebruikt, mits daarvoor een motivering wordt gegeven. De exacte samenstelling van de receptorvloeistof moet worden vermeld. Er moet worden aangetoond dat de teststof voldoende oplosbaar is in de receptorvloeistof, zodat deze geen belemmering voor absorptie vormt. Daarnaast mag de receptorvloeistof geen nadelige invloed op de intacte staat van de huid hebben. In een doorstroomsysteem mag de stroomsnelheid de diffusie van de teststof naar de receptorvloeistof niet belemmeren. In een systeem met een statische cel moet de vloeistof continu worden geroerd en periodiek worden bemonsterd. Als het metabolisme wordt onderzocht, moet de receptorvloeistof de levensvatbaarheid van de huid gedurende het hele experiment ondersteunen.
1.4.3 Huidpreparaten
Er kan huid van menselijke of dierlijke bronnen worden gebruikt. Voor het gebruik van menselijke huid gelden nationale en internationale ethische overwegingen en voorwaarden. Hoewel levende huid de voorkeur verdient, kan ook niet-levende huid worden gebruikt, mits kan worden aangetoond dat de huid intact is. Zowel epidermis-membranen (enzymatisch, met warmte of chemisch gescheiden) als huid met een partiële dikte (meestal 200-400 μm dik), verkregen met een dermatoom, kunnen worden gebruikt. Ook huid met een volledige dikte kan worden gebruikt, maar een al te dikke huid (d.w.z. ongeveer > 1 mm) moet worden vermeden, tenzij dit specifiek nodig is voor de bepaling van de teststof in de huidlagen. Voor de keuze van species, anatomische locatie en preparatietechniek moet een motivering worden gegeven. Er zijn aanvaardbare gegevens nodig van ten minste vier duplo's per testpreparaat.
1.4.4 Intacte staat van het huidpreparaat
Het is van cruciaal belang dat de huid op correcte wijze wordt geprepareerd. Een onjuiste behandeling kan leiden tot beschadiging van het stratum corneum en daarom moet de intacte staat van de geprepareerde huid worden gecontroleerd. Wanneer het huidmetabolisme wordt bestudeerd, moet de verse weggenomen huid zo spoedig mogelijk en onder omstandigheden waarvan bekend is dat ze metabole activiteit ondersteunen, worden gebruikt. Als algemene leidraad geldt dat verse weggenomen huid binnen 24 uur moet worden gebruikt, maar de aanvaardbare bewaartermijn kan afhangen van het bij de metabolisering betrokken enzymsysteem en de opslagtemperatuur (13). Wanneer de huidpreparaten vóór gebruik bewaard zijn, moet worden aangetoond dat de barrièrefunctie intact is gebleven.
1.4.5 Teststof
De teststof is de stof waarvan de penetratiekenmerken worden bestudeerd. De teststof moet bij voorkeur radioactief worden gelabeld.
1.4.6 Testpreparaat
Het preparaat van de teststof (bijvoorbeeld puur, verdund of geformuleerd materiaal met de teststof dat op de huid wordt aangebracht) moet hetzelfde zijn (of een realistisch surrogaat) als het preparaat waaraan mensen of andere potentiële doelsoorten kunnen worden blootgesteld. Voor een afwijking van het gangbare preparaat moet een motivering worden gegeven.
1.4.7 Concentraties en formuleringen van de teststof
Normaal gesproken wordt meer dan een concentratie van de teststof gebruikt, waarmee het bereik wordt bestreken van de concentraties waaraan de mens kan worden blootgesteld. Ook moet worden overwogen een aantal gangbare formuleringen te testen.
1.4.8 Opbrengen op de huid
Bij blootstelling van de mens aan chemische stoffen gaat het onder normale omstandigheden meestal om een eindige dosis. Daarom moet een zodanige hoeveelheid teststof worden opgebracht dat de blootstelling van de mens wordt nagebootst, normaal gesproken 1-5 mg/cm2 huid voor een vaste stof en maximaal 10 μl/cm2 voor vloeistoffen. Voor de hoeveelheid moet een motivering worden gegeven op basis van de verwachte gebruiksomstandigheden, de doelstellingen van de studie of de fysische kenmerken van het testpreparaat. De op de huid opgebrachte hoeveelheid kan bijvoorbeeld oneindig zijn wanneer er grote volumes per oppervlakte-eenheid worden opgebracht.
1.4.9 Temperatuur
De passieve diffusie van chemische stoffen (en derhalve ook de absorptie door de huid) wordt beïnvloed door de temperatuur. Het diffusiecompartiment en de huid moeten op een constante temperatuur rond de normale huidtemperatuur van 32 + 1 oC worden gehouden. Het ontwerp van de cel bepaalt op welke temperatuur het waterbad of het verwarmingsblok moet worden gehouden om ervoor te zorgen dat de temperatuur van het receptorcompartiment en de huid aan de fysiologische norm voldoet. De vochtigheid moet bij voorkeur tussen 30 % en 70 % liggen.
1.4.10 Duur van de blootstelling en bemonstering
De huid kan gedurende het hele experiment of een kortere tijd (bijvoorbeeld om een specifiek type blootstelling van de mens na te bootsen) aan het testpreparaat worden blootgesteld. De overmaat testpreparaat wordt met een geschikt reinigingsmiddel van de huid gewassen en de wasvloeistof wordt voor analyse opgevangen. De procedure om het testpreparaat te verwijderen is afhankelijk van de verwachte gebruiksomstandigheden en hiervoor moet een motivering worden gegeven. Normaal gesproken is een bemonsteringsperiode van 24 uur nodig om een afdoende karakterisering van het absorptieprofiel mogelijk te maken. Aangezien de toestand van de huid na 24 uur slechter kan worden, mag de bemonsteringstijd normaal gesproken niet langer zijn dan 24 uur. Voor teststoffen die snel in de huid penetreren zal dit wellicht niet nodig zijn, mar voor teststoffen die langzaam penetreren kan een langere periode nodig zijn. De bemonsteringsfrequentie van de receptorvloeistof moet zodanig zijn dat het absorptieprofiel van de teststof grafisch kan worden weergegeven.
1.4.11 Slotprocedures
Alle componenten van het testsysteem moeten worden geanalyseerd en de recovery moet worden bepaald. Deze omvat het donorcompartiment, het waswater van het huidoppervlak, het huidpreparaat en het receptorcompartiment met de receptorvloeistof. In sommige gevallen kan de huid worden gefractioneerd in blootgesteld huidoppervlak en huid onder de flens van de cel en in stratum corneum, epidermis en dermis, die dan apart kunnen worden geanalyseerd.
1.4.12 Analyse
In alle studies moet een afdoende recovery worden gehaald (daarbij moet worden gestreefd naar een gemiddelde van 100 ± 10 % van de radioactiviteit en voor afwijkingen moet een motivering worden gegeven). De hoeveelheid teststof in de receptorvloeistof, het huidpreparaat, het waswater van het huidoppervlak en het spoelwater van de apparatuur moet met behulp van een geschikte techniek worden geanalyseerd.
2. GEGEVENS
De analyse van de receptorvloeistof, de distributie van de teststof in het testsysteem en het absorptieprofiel in de loop van de tijd moeten worden gerapporteerd. Wanneer de blootstellingsvoorwaarden zodanig zijn dat er sprake is van een eindige dosis, moeten de van de huid gewassen hoeveelheid, de in en aan de huid gebonden hoeveelheid (en de hoeveelheid in de verschillende huidlagen, indien deze is geanalyseerd) en de hoeveelheid in de receptorvloeistof (snelheid en hoeveelheid of percentage van de opgebrachte hoeveelheid) worden berekend. De absorptie door de huid kan soms alleen met behulp van de gegevens over de receptorvloeistof worden uitgedrukt. Wanneer de teststof echter aan het eind van de studie nog in de huid aanwezig is, moet deze hoeveelheid wellicht worden meegerekend in de totale geabsorbeerde hoeveelheid (zie punt 66 van referentie (3)). Wanneer er sprake is van blootstellingsomstandigheden met een oneindige dosis, kunnen de gegevens de berekening van een permeabiliteitsconstante (Kp) mogelijk maken. In deze laatste situatie is het geabsorbeerde percentage niet relevant.
3. RAPPORTAGE
3.1. TESTRAPPORT
In het testrapport moeten de in het protocol vermelde voorschriften worden opgenomen, met inbegrip van een motivering voor het gebruikte testsysteem, en de volgende gegevens:
|
|
Teststof:
|
|
|
Testpreparaat:
|
|
|
Testomstandigheden:
|
|
|
Resultaten:
|
|
|
Bespreking van de resultaten. |
|
|
Conclusies. |
4. REFERENTIES
|
1. |
Testmethode B.44. Absorptie door de huid: in-vivo methode. |
|
2. |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
3. |
OECD (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris. |
|
4. |
Kemppainen BW and Reifenrath WG. (1990). Methods for skin absorption. CRC Press, Boca Raton. |
|
5. |
Bronaugh RL and Collier, SW (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pp. 237-241. |
|
6. |
Bronaugh RL and Maibach HL (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton. |
|
7. |
European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monograph No. 20, Percutaneous Absorption, ECETOC, Brussels. |
|
8. |
Diembeck W, Beek H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191-205. |
|
9. |
Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No. 65. |
|
10. |
Howes D, Guy R, Hadgraft J, Heylings JR et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10. |
|
11. |
Schaefer H and Redelmeier TE. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel. |
|
12. |
Roberts MS and Walters KA. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York. |
|
13. |
Jewell, C, Heylings, JR., Clowes, HM. And Williams, FM. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356-365. |
Figuur 1
Voorbeeld van een gangbaar ontwerp voor een statische diffusiecel voor in-vitro-onderzoek van de percutane absorptie

(1) Er moet worden aangegeven welk gebied van de cornea troebel is
(2) Voor een aantal bepalingen op serum en plasma, en met name voor de glucosebepaling, is een nacht vasten vóór de bloedafname wenselijk. De voornaamste reden is dat de toegenomen variabiliteit die onvermijdelijk het gevolg is van niet-vasten, subtiele effecten maskeert en de interpretatie bemoeilijkt. Daar staat tegenover dat een nacht vasten van invloed kan zijn op het algemene metabolisme van de dieren en dat dit in het bijzonder bij voedingstudies, de dagelijkse blootstelling aan de teststof verstoort. Als men de dieren een nacht laat vasten moeten de klinisch-biochemische bepalingen verricht worden na de functionele observaties in week 4 van de studie.
(3) Voor een aantal metingen serum en plasma, met name voor glucose, is het aan te bevelen de nacht ervoor de dieren voedsel te onthouden. De belangrijkste reden hiervoor is dat de verhoogde variabiliteit die onvermijdelijk voortvloeit uit het nuttigen van voedsel, ertoe zou leiden dat subtielere effecten verborgen en de interpretatie moeilijker zou worden. Aan de andere kant kan het 's nachts onthouden van voedsel echter interfereren met bet algemene metabolisme van de dieren en. met name in voedingsonderzoeken, de dagelijkse blootstelling aan de teststof verstoren. Indien ervoor wordt gekozen 's nachts voedsel te onthouden, moeten de klinisch-biochemische bepalingen worden uitgevoerd na de functionele waarnemingen van het onderzoek.
(4) Thans bekend als serumalanineaminotransferase.
(5) Thans bekend als serumaspartaataminotransferase.
(6) Deze organen, afkomstig van tien dieren per geslacht per groep voor knaagdieren en van alle niet-knaagdieren, alsmede de schildklier (met bijschildklieren) voor alle niet-knaagdieren, dienen te worden gewogen.
(7) Deze organen, afkomstig van tien dieren per geslacht per groep voor knaagdieren, dienen te worden gewogen.
(8) In deze methode is een referentiegroep een groep waarbij de teststof via een andere weg wordt toegediend waarbij zeker is dat de dosis volledig wordt geresorbeerd.
(9) Het voor het meten van de absorptie gebruikte oplosmiddel.
|
† |
Includes five animals selected for functional testing and detailed clinical observations as part of the neurotoxicity study |
DEEL C: METHODEN VOOR DE BEPALING VAN DE ECOTOXICITEIT
INHOUD
|
C.1. |
ACUTE TOXICITEIT VOOR VISSEN |
|
C.2. |
DAPHNIA Sp. — ACUTE IMMOBILISATIETEST |
|
C.3. |
GROEIREMMINGSTEST MET ALGEN |
|
C.4. |
BEPALING VAN DE „GEMAKKELIJKE” BIOLOGISCHE AFBREEKBAARHEID |
|
DEEL I. |
ALGEMENE BESCHOUWINGEN 30 |
|
DEEL II. |
DOC-AFVLAKKINGSTEST (Methode C.4-A) |
|
DEEL III. |
GEWIJZIGDE OESO-SCREENING TEST (Methode C.4-B) |
|
DEEL IV. |
KOOLDIOXYDE CO2-ONTWIKKELINGTEST (Methode C.4-C) |
|
DEEL V. |
MANOMETRISCHE RESPIROMETRIE TEST (Methode C.4-D) |
|
DEEL VI. |
GESLOTEN-FLESTEST (Methode C.4-E) |
|
DEEL VII. |
M.I.T.I.-TEST (Methode C.4-F) |
|
C.5. |
AFBRAAK — BIOCHEMISCH ZUURSTOFVERBRUIK |
|
C.6. |
AFBRAAK — CHEMISCH ZUURSTOFVERBRUIK |
|
C.7. |
AFBRAAK — NIET-BIOLOGISCHE AFBRAAK: HYDROLYSE IN AFHANKELIJKHEID VAN DE pH |
|
C.8. |
TOXICITEIT VOOR REGENWORMEN |
|
C.9. |
BIOLOGISCHE AFBRAAK — ZAHN-WELLENS TEST |
|
C.10. |
BIOLOGISCHE AFBRAAK — SIMULATIEPROEVEN ACTIEF SLIB |
|
C.11. |
BIOLOGISCHE AFBRAAK — ACTIEF SLIB: REMMING ADEMHALING |
|
C.12. |
BIOLOGISCHE AFBRAAK — GEWIJZIGDE SCAS-TEST |
|
C.13. |
BIOCONCENTRATIE: DOORSTROOMTEST MET VISSEN |
|
C.14. |
GROEITEST ONVOLWASSEN VISSEN |
|
C.15. |
VIS, KORTETERMIJN-TOXICITEITSTEST OP EMBRYONALE EN LARVESTADIA (SAC-FRY) |
|
C.16. |
HONINGBIJEN — ACUTE-TOXICITEITSTEST (ORAAL) |
|
C.17. |
HONINGBIJEN — ACUTE-TOXICITEITSTEST (CONTACT) |
|
C.l8. |
BEPALING VAN DE ADSORPTIE/DESORPTIE MET BEHULP VAN EEN BATCH-EVENWICHTSMETHODE |
|
C.19. |
RAMING VAN DE ADSORPTIECOËFFICIËNT (KOC) AAN DE BODEM EN AAN RIOOLSLIB MET BEHULP VAN HOGEDRUKVLOEISTOFCHROMATOGRAFIE(HPLC) |
|
C.20. |
DAPHNIA MAGNA VOORTPLANTINGSTEST |
|
C.21. |
MICRO-ORGANISMEN IN DE BODEM: BEPALING VAN DE OMZETTING VAN STIKSTOF |
|
C.22. |
MICRO-ORGANISMEN IN DE BODEM: BEPALING VAN DE OMZETTING VAN KOOLSTOF |
|
C.23. |
AEROBE EN ANAËROBE OMZETTING IN DE BODEM |
|
C.24. |
AEROBE EN ANAËROBE OMZETTING IN AQUATISCHE SEDIMENTSYSTEMEN |
C.1. ACUTE TOXICITEIT VOOR VISSEN
1. METHODE
1.1. INLEIDING
Het doel van deze test is het bepalen van de acute letale toxiciteit van een stof voor vissen in zoet water. Met het oog op de keuze van de testmethode (statisch, semi-statisch of doorstroming) die het meest geschikt is om concentraties van de teststof gedurende de testperiode voldoende constant te houden, is het wenselijk om, voor zover mogelijk, te beschikken over gegevens over de oplosbaarheid in water, dampspanning, chemische stabiliteit, dissociatieconstanten en biologische afbreekbaarheid van de teststof.
Zowel bij de voorbereiding van de test als bij de interpretatie van de resultaten moet rekening worden gehouden met aanvullende gegevens (bijvoorbeeld structuurformule, zuiverheidsgraad, aard en percentage van van belang zijnde verontreinigingen, aanwezigheid en hoeveelheden van additieven en de n-octanol/water-verdelingscoëfficiënt).
1.2. DEFINITIES EN EENHEDEN
Acute toxiciteit is het waarneembare schadelijke effect dat in een organisme wordt teweeggebracht binnen een korte tijd (dagen) van blootstelling aan een stof. In deze test wordt de acute toxiciteit uitgedrukt als de mediaan letale concentratie (LC50), dat wil zeggen de concentratie in water waardoor 50 % van een groep vissen in de proef wordt gedood binnen een continue blootstellingsperiode, die moet worden vermeld.
Alle concentraties van de teststof worden opgegeven in gewicht per volume (mg/l). Ze kunnen ook worden uitgedrukt als gewicht per gewicht (mg/kg–1).
1.3. REFERENTIESTOFFEN
Een referentiestof kan worden getest om aan te tonen dat de respons van geteste diersoorten onder laboratoriumomstandigheden niet in belangrijke mate is veranderd.
Voor deze test worden geen referentiestoffen gespecificeerd.
1.4. PRINCIPE VAN DE TESTMETHODE
Er kan een limiettest met 100 mg per liter worden uitgevoerd, om aan te tonen dat de LC50 groter is dan deze concentratie.
De vissen worden gedurende 96 uur blootgesteld aan de teststof die in een reeks concentraties aan het water is toegevoegd. De sterfte wordt ten minste elke 24 uur genoteerd en de concentraties waarbij 50 % van de vissen sterft (LC50) wordt indien mogelijk berekend voor elke waarnemingstijd.
1.5. KWALITEITSCRITERIA
De kwaliteitscriteria zijn zowel op de limiettest als op de volledige test van toepassing.
De sterfte in de controlegroepen mag aan het einde van de test niet hoger zijn dan 10 % (of één vis indien minder dan tien worden gebruikt).
Het zuurstofgehalte moet gedurende de gehele test meer dan 60 % van de verzadigingswaarde voor lucht zijn geweest.
De concentraties van de geteste stof dienen gedurende de gehele test binnen 80 % van de oorspronkelijke concentraties gehouden te worden.
Bij stoffen die gemakkelijk oplossen in het testmedium en stabiele oplossingen geven en bijvoorbeeld niet in belangrijke mate vervluchtigen of worden afgebroken, gehydrolyseerd of geadsorbeerd, mag de beginconcentratie als gelijk aan de nominale concentraties beschouwd worden. Evenwel dient aangetoond te worden dat de concentratie gedurende de gehele test gehandhaafd werden en dat aan de kwaliteitscriteria is voldaan.
Voor stoffen die:
|
i) |
moeilijk oplosbaar zijn in het testmedium of |
|
ii) |
in staat zijn stabiele emulsies of dispersies te vormen of |
|
iii) |
niet stabiel zijn in waterige oplossingen, |
dient de bij het begin van de proef in de oplossing (of, indien dit technisch onmogelijk is, in de waterkolom) gemeten concentratie als de beginconcentratie te worden beschouwd. De concentratie moet na een equilibratieperiode maar voordat de proefvissen worden ingebracht, worden bepaald.
In al deze gevallen dienen gedurende de test verdere metingen te worden uitgevoerd om de actuele blootstellingsconcentraties te bevestigen of om te bevestigen dat aan de kwaliteitscriteria is voldaan.
De pH mag niet meer dan 1 eenheid variëren.
1.6. BESCHRIJVING VAN DE TESTMETHODE
Er kunnen drie verschillende procedures worden toegepast:
Statische test:
Toxiciteitstest waarbij de te onderzoeken oplossing niet stroomt. (Oplossingen blijven ongewijzigd gedurende de test.)
Semi-statische test:
Test waarbij de oplossing niet stroomt, maar de testoplossing periodiek per bak wordt ververst na een langere periode (bijvoorbeeld 24 uur).
Doorstroomtest:
Toxiciteitstest waarin het water voortdurend wordt ververst in de testbakken waarbij de te onderzoeken stof wordt meegevoerd met het water teneinde het testmedium te verversen.
1.6.1. Reagentia
1.6.1.1. Oplossingen van de teststoffen
Stamoplossingen van de gewenste sterkte worden bereid door de stof op te lossen in gedeïoniseerd water of water volgens 1.6.1.2.
De gekozen testconcentraties worden bereid door verdunning van de stamoplossing. Indien hoge concentraties worden getest, kan de te onderzoeken stof rechtstreeks worden opgelost in het verdunningswater.
De stoffen moeten normaal gezien slechts worden getest tot aan de oplosbaarheidsgrens. Bij sommige stoffen (bijvoorbeeld stoffen met lage oplosbaarheid in water of een hoge POW, of stoffen die een stabiele dispersie vormen in plaats van een echte oplossing in water) is het aanvaardbaar een testconcentratie te onderzoeken boven de oplosbaarheidslimiet van de stof, om te verzekeren dat de maximaal oplosbare/stabiele concentratie werd bereikt. Het is echter belangrijk dat deze concentratie niet op andere wijze het testsysteem verstoort (bijvoorbeeld een vlies van de stof op het water waardoor de zuurstofvoorziening van het water verhinderd wordt).
Ultrasone dispersie, organische oplosmiddelen, emulgatoren of dispergeermiddelen kunnen worden gebruikt als hulpmiddel bij het bereiden van stamoplossingen van stoffen met een lage oplosbaarheid in water, of bij het dispergeren van deze stoffen in het testmedium. Indien dergelijke hulpstoffen worden gebruikt, moeten alle testconcentraties dezelfde hoeveelheid hulpstof bevatten en moeten extra controlevissen worden blootgesteld aan dezelfde concentratie van de hulpstof als die welke is gebruikt in de testreeks. De concentratie van dergelijke hulpstoffen dient zo laag mogelijk gehouden te worden en mag in géén geval groter zijn dan 100 mg per liter testmedium.
De test dient te worden uitgevoerd zonder correctie van de pH. Indien er aanwijzingen zijn voor een duidelijke verandering van de pH, wordt geadviseerd om de test te herhalen met gecorrigeerde pH en de resultaten te vermelden. In dat geval dient de pH-waarde van de stamoplossing te worden aangepast aan de pH-waarde van het verdunningswater, tenzij er speciale redenen zijn om dit niet te doen. Voor dit doel verdienen HCl en NaOH de voorkeur. Deze pH-correctie dient zodanig te geschieden dat de concentratie van de teststof in de stamoplossing niet in belangrijke mate wordt gewijzigd. Indien ten gevolge van de correctie een chemische reactie of fysische neerslagvorming van de teststof mocht optreden, dan dient dit te worden vermeld in het rapport.
1.6.1.2. Voorraad en verdunningswater
Leidingwater (waarin geen chloor, zware metalen of andere stoffen in mogelijk schadelijke concentraties mogen voorkomen), goede kwaliteit natuurlijk water of synthetisch water (zie aanhangsel 1) kunnen worden gebruikt. Water met een totale hardheid van 10 tot 250 mg per liter (als CaCO3) en met een pH van 6,0 tot 8,5 verdient de voorkeur.
1.6.2. Apparatuur
Alle apparatuur dient te zijn vervaardigd van chemisch inert materiaal:
|
— |
automatisch verdunningssysteem (voor doorstroomtest), |
|
— |
zuurstofmeter, |
|
— |
apparatuur voor de bepaling van de hardheid van water, |
|
— |
apparatuur voor de temperatuurbeheersing, |
|
— |
pH-meter. |
1.6.3. Testvissen
De vissen dienen gezond te zijn en vrij van elke waarneembare misvorming.
Het verdient aanbeveling de te gebruiken soorten te selecteren op basis van relevante praktische overwegingen, zoals goede beschikbaarheid gedurende het gehele jaar, goede houdbaarheid, geschiktheid voor testdoeleinden, relatieve gevoeligheid voor chemische stoffen, alsmede alle economische, biologische of ecologische factoren die van belang zijn. Tevens dient bij de keuze van de vissoort rekening gehouden te worden met de behoefte aan vergelijkbaarheid van de verkregen gegevens en met de bestaande internationale harmonisering (referentie 1).
Een lijst met voor de uitvoering van de onderhavige test aanbevolen vissoorten staat vermeld in aanhangsel 2; de zebravis en de regenboogforel hebben de voorkeur.
1.6.3.1. Het houden van voorraad
Testvissen dienen bij voorkeur afkomstig te zijn van één partij, met ongeveer dezelfde lengte en leeftijd. De vissen moeten ten minste 12 dagen onder de volgende omstandigheden worden bewaard:
Hoeveelheid vis per liter:
aangepast aan het systeem (recirculatie of doorstroming) en de vissoort;
Water:
zie 1.6.1.2;
Licht:
per dag een belichtingsperiode van 12 à 16 uur;
Zuurstofgehalte:
ten minste 80 % van de verzadigingswaarde voor lucht;
Voeren:
drie keer per week of dagelijks; dit wordt 24 uur voor het begin van de test stopgezet.
1.6.3.2. Sterfte
Na een gewenningsperiode van 48 uur wordt de sterfte geregistreerd, waarbij de volgende criteria worden gehanteerd:
|
— |
in 7 dagen meer dan 10 % van de populatie: de gehele partij wordt afgekeurd; |
|
— |
5 tot 10 % van de populatie: de periode van het in voorraad houden wordt met nog 7 dagen verlengd. Indien geen nieuwe sterfgevallen optreden, wordt de partij goedgekeurd. Anders dient deze te worden afgekeurd; |
|
— |
minder dan 5 % van de populatie: de partij wordt goedgekeurd. |
1.6.4. Aanpassing
Alle vissen moeten gedurende ten minste 7 dagen voor het gebruik worden blootgesteld aan water van de kwaliteit en de temperatuur zoals dat in de test zal worden gebruikt.
1.6.5. Testprocedure
Een definitieve test kan worden voorafgegaan door een test om het meetgebied vast te stellen. Deze verschaft gegevens over de voor de eigenlijke test te gebruiken reeks concentraties.
Naast de testreeks wordt een controlegroep zonder de teststof uitgevoerd en, indien van toepassing, ook een controlegroep met de hulpstof.
Afhankelijk van de fysische en chemische eigenschappen van de teststof kan gekozen worden voor een statische, semi-statische of doorstroomtest om aan de kwaliteitscriteria te voldoen.
Vissen worden als volgt aan de stof blootgesteld:
|
— |
tijdsduur: 96 uur; |
|
— |
aantal dieren: ten minste 7 per concentratie; |
|
— |
bakken: van een capaciteit die in overeenstemming is met de aanbevolen hoeveelheid vis per liter; |
|
— |
hoeveelheid vis per liter: een maximale bezettingsgraad van 1,0 g per liter voor statische en semi-statische tests wordt aanbevolen; voor doorstroomsystemen kan een grotere hoeveelheid vis per liter aanvaardbaar zijn; |
|
— |
testconcentratie: ten minste vijf concentraties die verschillen met een constante welke niet groter is dan 2,2 en die zo mogelijk het gebied met een sterfte van 0 % tot 100 % bestrijken; |
|
— |
water: zie 1.6.1.2; |
|
— |
licht: dagelijks een belichtingsperiode van 12 à 16 uur; |
|
— |
temperatuur: aangepast aan de soort (Aanhangsel 2); voor iedere afzonderlijke test moet de temperatuur evenwel constant blijven binnen ± 1 oC; |
|
— |
zuurstofgehalte: ten minste 60 % van de verzadigingswaarde voor lucht bij de gekozen temperatuur; |
|
— |
voeren: achterwege laten. |
De vissen worden gecontroleerd na de eerste 2 tot 4 uur en ten minste elke 24 uur. Vissen worden geacht dood te zijn indien aanraking van de staartwortel geen reactie teweeg brengt en geen ademhalingsbewegingen zichtbaar zijn. Dode vissen worden, zodra zij zijn opgemerkt, verwijderd en de sterfte wordt geregistreerd. Er wordt aantekening gemaakt van zichtbare afwijkingen (bijvoorbeeld evenwichtsverlies, veranderingen in zwemgedrag, ademhalingsfunctie, pigmentatie enzovoort).
De pH, zuurstofconcentratie en temperatuur moeten dagelijks worden gemeten.
Limiettest
Gebruikmakend van de procedure zoals beschreven in deze methode, kan een limiettest worden uitgevoerd met 100 mg per liter om aan te tonen dat de LC50 groter is dan deze concentratie.
Indien de aard van de stof zodanig is dat een concentratie van 100 mg per liter in het testwater niet bereikt kan worden, dient de proef te worden uitgevoerd met een concentratie die gelijk is aan de oplosbaarheid van de te onderzoeken stof (of de maximale concentratie die een stabiele dispersie vormt) in het gebruikte medium (zie ook punt 1.6.1.1).
De limiettest dient te worden uitgevoerd met 7 à 10 vissen en eenzelfde aantal in de controlegroepen. (De binomiale theorie schrijft voor dat als bij gebruik van 10 vissen geen sterfte optreedt, de LC50 met een betrouwbaarheid van 99,9 % groter is dan de in de limiettest gebruikte concentratie. Met 7, 8 of 9 vissen geeft de afwezigheid van sterfte een betrouwbaarheid van ten minste 99 % dat de LC50 groter is dan de gebruikte concentratie.)
Indien sterfte optreedt, dient een volledige test te worden uitgevoerd. Indien subletale effecten worden waargenomen, dienen deze te worden vermeld.
2. GEGEVENS EN EVALUATIE
Zet voor elke aanbevolen blootstellingsperiode op logaritmisch-waarschijnlijkheidspapier voor elk tijdstip waarop waarnemingen werden geregistreerd (24, 48, 72 en 96 uur) het sterftepercentage uit tegen de concentratie.
De LC50 en de betrouwbaarheidsintervallen (p = 0,05) dienen zo mogelijk voor iedere waarnemingsperiode geschat te worden met behulp van standaardprocedures; deze waarden moeten worden afgerond tot op één, of ten hoogste twee significante cijfers (voorbeelden voor afronding op twee cijfers: 170 voor 173,5; 0,13 voor 0,127; 1,2 voor 1,21).
In die gevallen waarin de helling van de concentratie/respons-percentage-kromme te steil is voor een berekening van de LC50-waarde, is een grafische schatting van deze waarde voldoende.
Indien twee opeenvolgende concentraties met een onderlinge verhouding van 2,2 slechts een sterfte van 0 respectievelijk 100 % geven, dan zijn deze waarden voldoende om aan te geven in welk gebied de LC50 ligt.
Indien blijkt dat de stabiliteit of homogeniteit van de teststof niet kan worden gehandhaafd, dient dit te worden vermeld en dient voorzichtigheid betracht te worden bij de interpretatie van de resultaten.
3. RAPPORTAGE
In het verslag moeten indien mogelijk de volgende gegevens worden opgenomen:
|
— |
gegevens over de testvis (wetenschappelijke naam; stam; leverancier; eventuele voorbehandeling; afmeting en aantal dat voor elke testconcentratie gebruikt is); |
|
— |
herkomst van het verdunningswater alsmede belangrijkste chemische kenmerken (pH, hardheid, temperatuur); |
|
— |
voor stoffen met een geringe oplosbaarheid in water, de methode voor de bereiding van de stam- en testoplossingen; |
|
— |
concentratie van eventuele hulpstoffen; |
|
— |
lijst van de gebruikte concentraties en alle beschikbare gegevens over de stabiliteit bij de concentraties van de teststof in de gebruikte oplossing; |
|
— |
als chemische analyses zijn uitgevoerd, dienen de toegepaste methoden en de verkregen resultaten te worden vermeld; |
|
— |
de resultaten van de limiettest, indien van toepassing; |
|
— |
redenen voor de keuze van de testprocedure alsmede verdere details (bijvoorbeeld statisch, semi-statisch, doseersnelheid, doorstroomsnelheid, of er belucht is, hoeveelheid vis per liter, enzovoort); |
|
— |
beschrijving van de testuitrusting; |
|
— |
lichtregime; |
|
— |
voor iedere 24 uur het zuurstofgehalte, de pH-waarde en de temperatuur van de testoplossingen; |
|
— |
gegevens om aan te tonen dat aan de kwaliteitscriteria is voldaan; |
|
— |
een tabel met de cumulatieve mortaliteit voor elke concentratie en voor de controlegroepen (en, zo nodig, voor de controlegroep met hulpstof) op elke aanbevolen waarnemingstijd; |
|
— |
grafiek van de concentratie/responspercentage-kromme aan het einde van de test; |
|
— |
zo mogelijk, de LC50-waarden op elk van de aanbevolen waarnemingstijden (met de 95 % betrouwbaarheidsgrenzen); |
|
— |
statistische procedures voor de bepaling van de LC50-waarden; |
|
— |
als een referentiestof wordt gebruikt moeten ook hiervan de resultaten worden vermeld; |
|
— |
hoogste testconcentratie die binnen de testperiode geen sterfte veroorzaakte; |
|
— |
laagste testconcentratie die binnen de testperiode 100 % sterfte veroorzaakte. |
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 Final and updates. |
|
(2) |
AFNOR — Determination of the acute toxicity of a substance to Brachydanio rerio — Static and Flow Through methods — NFT 90-303 June 1985. |
|
(3) |
AFNOR — Determination of the acute toxicity of a substance to Salmo gairdneri — Static and Flow Through methods — NFT 90-305 June 1985. |
|
(4) |
ISO 7346/1,/2 en/3 — Water Quality — Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan — Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method. |
|
(5) |
Eidgenössisches Departement des Innern, Schweiz: Richtlinien für Probenahme und Normung von Wasseruntersuchungsmethoden — Part II 1974. |
|
(6) |
DIN Testverfahren mit Wasserorganismen, 38 412 L(l) und L(15). |
|
(7) |
JIS K 0102, Acute toxicity test for fish. |
|
(8) |
NEN 6506 — Water — Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980. |
|
(9) |
Environmental Protection Agency, Methods for the Acute Toxicity Tests with Fish, Macroinvertebrates and Amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975. |
|
(10) |
Environmental Protection Agency, Environmental Monitoring and Support Laboratory, Office of Research and Development. EPA-600/4-78-012, January 1978. |
|
(11) |
Environmental Protection Agency: Toxic Substance Control, Part IV, 16 March 1979. |
|
(12) |
Standard Methods for the Examination of Water and Wastewater, 14th edition, APHA-AWWA-WPCF, 1975. |
|
(13) |
Commission of the European Communities.Inter-laboratory test programme concerning the study of the ecotoxicity of a chemical substance with respect to the fish. CEE Study D.8368, 22 March 1979. |
|
(14) |
Verfahrensvorschlag des Umweltbundesamtes rum akuten Fisch-Test. Rudolph, P. und Boje, R. Ökotoxikologie, Grundlagen für die Ökotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986. |
|
(15) |
Litchfield, J. T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm. Exp. Therap., 1949, vol. 96, 99. |
|
(16) |
Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978. |
|
(17) |
Sprague, J.B. Measurement of pollutant toxicity to fish. I Bioassay methods for acute toxicity. Water Res., 1969, vol. 3, 793-821. |
|
(18) |
Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res., 1970, vol. 4, 3-32. |
|
(19) |
Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials. ASTM STP 634, 1977, 65-84. |
|
(20) |
Stephan, C.E., Bush, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA. |
Aanhangsel 1
Synthetisch water
Voorbeeld van een geschikt verdunningswater
Alle chemicaliën moeten van pro-analyse kwaliteit zijn.
Het water moet gedistilleerd of gedeïoniseerd water van goede kwaliteit zijn met een geleidingsvermogen van minder dan 5 μScm-1.
Het toestel voor de distillatie van water mag geen koperen onderdelen bevatten.
Stamoplossingen
|
CaCl2. 2H20 (calciumchloridedihydraat) Oplossen in water en aanvullen met water tot 1 liter. |
11,76 g |
|
MgSO4.7H20 (magnesiumsulfaatheptahydraat) Oplossen in water en aanvullen met water tot 1 liter. |
4,93 g |
|
NaHCO3 (natriumwaterstofcarbonaat) Oplossen in water en aanvullen met water tot 1 liter. |
2,59 g |
|
KCl (kaliumchloride) Oplossen in water en aanvullen met water tot 1 liter. |
0,23 g |
Synthetisch verdunningswater
Meng 25 ml van elk van de vier stamoplossingen en vul met water aan tot 1 liter.
Belucht tot het zuurstofgehalte overeenkomt met de verzadigingswaarde voor lucht.
De pH moet 7,8 ± 0,2 bedragen.
De pH zo nodig bijstellen met NaOH (natriumhydroxide) of HCl (zoutzuur).
Het aldus verkregen verdunningswater wordt gedurende ongeveer 12 uur weggezet en behoeft niet verder te worden belucht.
De som van de Ca- en Mg-ionen in deze oplossing bedraagt 2,5 mmol per liter. De verhouding van de Ca- en Mg-ionen is 4:1 en die van de Na- en K-ionen 10:1. De totale alkaliteit van deze oplossing is 0,8 mmol per liter.
Eventuele afwijkingen van de bereidingswijze van het verdunningswater mogen niet leiden tot een andere samenstelling of andere eigenschappen van het water.
Aanhangsel 2
Voor tests aanbevolen vissoorten
|
Aanbevolen soort |
Aanbevolen testtemperatuur (°C) |
Aanbevolen totale lengte van het proefdier (cm) |
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamil-ton-Buchanan) Zebravis |
20-24 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafi-nesque) Modderkruiper |
20-24 |
5,0 ± 2,0 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus 1758) Gewone karper |
20-24 |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poeciliiae) Cyprinodonti-dae (Tomminck et Schlegel 1850) Japans rijstvisje |
20-24 |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) Guppy |
20-24 |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei, Centrarchidaej (Rafinesque Linnaeus 1758) Zonnebaars |
20-24 |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) Regenbogenforel |
12-17 |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758) Goudwinde |
20-24 |
6,0 ± 2,0 |
Herkomst
Bovengenoemde vissen laten zich gemakkelijk kweken en/of zijn het gehele jaar ruim verkrijgbaar. Zij kunnen worden geteeld en gekweekt in viskwekerijen of in het laboratorium onder omstandigheden waarbij ziektekiemen en parasieten onder controle gehouden worden, zodat de proefdieren gezond zijn en hun afkomst bekend is. Deze vissen zijn in veel delen van de wereld beschikbaar.
Aanhangsel 3
Voorbeeld van een concentratie / sterftepercentage — kromme
Voorbeeld van de bepaling van de LC50-waarde met logaritmisch-waarschijnlijkheidspapier

C.2. DAPHNIA Sp. — ACUTE IMMOBILISATIETEST
1. METHODE
Deze testmethode voor acute immobilisatie komt overeen met OESO TG 202 (2004).
1.1. INLEIDING
In deze methode wordt een test voor acute toxiciteit beschreven om de effecten van chemische stoffen op daphniden te bepalen. Er is zo veel mogelijk gebruik gemaakt van bestaande testmethoden (1)(2)(3).
1.2. DEFINITIES
In de context van deze methode worden de volgende definities gebruikt:
|
|
EC50: de concentratie waarbij wordt vastgesteld dat 50 % van de daphniden binnen een bepaalde blootstellingsperiode wordt geïmmobiliseerd. Als er een andere definitie wordt gebruikt, moet dit worden gerapporteerd en moet er een referentie worden vermeld. |
|
|
Immobilisatie: dieren die niet in staat zijn binnen 15 seconden na voorzichtig schudden van het testvat te zwemmen, worden geacht te zijn geïmmobiliseerd (zelfs als ze hun antennes nog kunnen bewegen). |
1.3. PRINCIPE VAN DE TESTMETHODE
Jonge daphniden, die aan het begin van de test nog geen 24 uur oud zijn, worden gedurende een periode van 48 uur aan een aantal concentraties van de teststof blootgesteld. De immobilisatie wordt na 24 uur en 48 uur geregistreerd en met controlewaarden vergeleken. De resultaten worden geanalyseerd om de EC50 na 48 uur te bepalen (zie de definitie in punt 1.2). Bepaling van de EC50 na 24 uur is facultatief.
1.4. INFORMATIE OVER DE TESTSTOF
De oplosbaarheid in water en de dampdruk van de teststof dienen bekend te zijn en er moet een betrouwbare analysemethode voor de kwantitatieve bepaling van de stof in de testoplossingen met een gerapporteerde recovery-capaciteit en bepalingsgrens beschikbaar zijn. Bruikbare informatie is bijvoorbeeld: de structuurformule, de zuiverheid van de stof, de stabiliteit in water of onder invloed van licht, de Pow en resultaten van een test op gemakkelijke biologische afbreekbaarheid (zie methode C.4).
NB: Richtsnoeren voor het testen van stoffen met zodanige fysisch-chemische eigenschappen dat dit problemen oplevert, zijn opgenomen in (4).
1.5. REFERENTIESTOFFEN
Er kan een EC50-test met een referentiestof worden uitgevoerd om te waarborgen dat de testomstandigheden betrouwbaar zijn. Voor dit doel worden toxische stoffen aanbevolen die in internationale ringtests (1)(5) zijn gebruikt (1). Bij voorkeur eens per maand en ten minste twee keer per jaar moeten er een of meer tests met een referentiestof worden uitgevoerd.
1.6. KWALITEITSCRITERIA
Voor een geldige test moet aan de volgende criteria worden voldaan:
|
— |
in de controlegroepen, met inbegrip van de controlegroep met het ontsluitingsmiddel, mag niet meer dan 10 % van de daphniden zijn geïmmobiliseerd; |
|
— |
de concentratie opgeloste zuurstof aan het eind van de test moet zowel in de controlegroepen als in de testgroepen ≥ 3 mg/l zijn. |
NB: Voor het eerste criterium mag niet meer dan 10 % van de controle-daphniden immobilisatie of andere verschijnselen van ziekte of stress vertonen, bijvoorbeeld verkleuring of ongebruikelijk gedrag zoals permanent verblijf aan het wateroppervlak.
1.7. BESCHRIJVING VAN DE TESTMETHODE
1.7.1. Apparatuur
Testvaten en andere apparatuur die in contact met de testoplossingen komt, moeten volledig van glas of een ander chemisch inert materiaal zijn gemaakt. Normaal gesproken worden glazen reageerbuizen of bekerglazen als testvat gebruikt; deze moeten vóór elk gebruik volgens standaardlaboratoriumprocedures worden gereinigd. De testvaten moeten losjes worden afgedekt om verlies van water door verdamping te beperken en om te voorkomen dat er stof in de oplossingen terechtkomt. Vluchtige stoffen moeten worden getest in volledig gevulde gesloten vaten die groot genoeg zijn om te voorkomen dat de zuurstofconcentratie een beperkende factor wordt of te sterk daalt (zie punt 1.6 en de eerste alinea van punt 1.8.3).
Daarnaast wordt (een deel van) de volgende apparatuur gebruikt: een zuurstofmeter (met micro-elektrode of andere geschikte instrumenten om de concentratie opgeloste zuurstof in monsters met een klein volume te meten), een pH-meter, geschikte apparatuur voor temperatuur-regulering, apparatuur voor de bepaling van de totale organische koolstofconcentratie (TOC), apparatuur voor de bepaling van het chemisch zuurstofverbruik (CZV), apparatuur voor de bepaling van de hardheid van water enz.
1.7.2. Testorganisme
Als testsoort wordt de voorkeur gegeven aan Daphnia magna Straus, maar voor deze test mogen ook andere geschikte Daphnia-soorten worden gebruikt (b.v. Daphnia pulex). Aan het begin van de test mogen de dieren nog geen 24 uur oud zijn en om de variabiliteit te beperken wordt sterk aanbevolen dat ze geen eerste nakomelingen zijn. Ze moeten afkomstig zijn van een gezonde stam (d.w.z. zonder tekenen van stress zoals hoge mortaliteit, aanwezigheid van mannelijke dieren en ephippia, vertraging bij het voortbrengen van het eerste broedsel, verkleurde dieren, enz.). Alle organismen die voor een bepaalde test worden gebruikt, moeten afkomstig zijn van culturen van dezelfde daphnidenstam. De stamdieren moeten onder vergelijkbare kweekomstandigheden (licht, temperatuur, medium) worden gehouden als tijdens de test worden gebruikt. Indien het tijdens de test te gebruiken daphniden-kweekmedium afwijkt van het medium voor de gangbare daphniden-cultuur, verdient het aanbeveling vóór de test een acclimatiseringsperiode in acht te nemen. Daartoe dienen broed-daphniden gedurende ten minste 48 uur vóór het begin van de test bij de testtemperatuur in verdunningswater te worden bewaard.
1.7.3. Medium- en verdunningswater
Natuurlijk water (oppervlakte- of grondwater), synthetisch water of ontchloord kraanwater zijn aanvaardbaar als medium- en verdunningswater, als de daphniden daarin gedurende het kweken, de acclimatisering en de test overleven zonder tekenen van stress te vertonen. Elk water dat voldoet aan de in bijlage 1 vermelde chemische kenmerken van aanvaardbaar verdunningswater, is geschikt om voor de test te worden gebruikt. Het moet gedurende de testperiode van constante kwaliteit te zijn. Synthetisch water kan worden vervaardigd door specifieke hoeveelheden reagentia aan gedeïoniseerd of gedestilleerd water toe te voegen. Voorbeelden van synthetisch water zijn te vinden in (1) en (6) en in bijlage 2. Er dient te worden opgemerkt dat media die bekende chelaatvormers bevatten, zoals de media M4 en M7 in bijlage 2, moeten worden vermeden voor teststoffen die metalen bevatten. De pH moet op het interval tussen 6 en 9 liggen. Een hardheid tussen 140 en 250 mg/l (als CaCO3) wordt aanbevolen voor Daphnia Magna, terwijl voor andere Daphnia-soorten ook een lagere hardheid geschikt kan zijn. Vóór het gebruik voor de test kan lucht door het verdunningswater worden geleid, zodat de concentratie opgeloste zuurstof het verzadigingspunt heeft bereikt.
Als natuurlijk water wordt gebruikt, moeten de kwaliteitsparameters ten minste twee keer per jaar worden gemeten of zodra het vermoeden bestaat dat deze kenmerken wellicht significant zijn veranderd (zie de vorige alinea en bijlage 1). Ook metingen van zware metalen (b.v. Cu, Pb, Zn, Hg, Cd en Ni) moeten worden uitgevoerd. Als ontchloord kraanwater wordt gebruikt, is een dagelijkse analyse op chloor wenselijk. Als het verdunningswater afkomstig is van een oppervlaktewater- of grondwaterbron, moeten de geleidbaarheid en de totale hoeveelheid organische koolstof (TOC) of het chemisch zuurstofverbruik (CZV) worden gemeten.
1.7.4. Testoplossingen
De testoplossingen met de gekozen concentraties worden meestal bereid door verdunning van een stamoplossing. Stamoplossingen moeten bij voorkeur worden bereid door de teststof in het verdunningswater op te lossen. Het gebruik van oplosmiddelen, emulgatoren of dispergeermiddelen moet zo veel mogelijk worden vermeden. In sommige gevallen kunnen dergelijke verbindingen echter nodig zijn om een stamoplossing te maken die geconcentreerd genoeg is. Richtsnoeren voor geschikte oplosmiddelen, emulgatoren en dispergeermiddelen zijn te vinden in (4). In elk geval mag de hoeveelheid teststof in de testoplossingen niet groter zijn dan de oplosbaarheidsgrens in het verdunningswater.
De test moet zonder aanpassing van de pH worden uitgevoerd. Als de pH niet op het interval 6-9 blijft, moet een tweede test worden uitgevoerd waarbij de pH van de stamoplossing wordt aangepast aan die van het verdunningswater vóór de toevoeging van de teststof. De aanpassing van de pH moet zodanig gebeuren dat de concentratie van de stamoplossing niet in significante mate verandert en dat dit niet leidt tot een chemische reactie of neerslaan van de teststof. HCl en NaOH verdienen de voorkeur.
1.8. PROCEDURE
1.8.1. Blootstellingsomstandigheden
1.8.1.1. Test-en controlegroepen
De testvaten worden gevuld met de juiste volumes verdunningswater en teststof-oplossingen. De volumeverhouding lucht/water in het testvat moet voor de test- en controlegroepen identiek zijn. Vervolgens worden de daphniden in de testvaten gebracht. Bij elke testconcentratie en voor de controlegroep moeten ten minste 20 dieren worden gebruikt, bij voorkeur verdeeld in vier groepen van elk vijf dieren. Per dier moet ten minste 2 ml testoplossing beschikbaar zijn (d.w.z. een volume van 10 ml voor vijf daphniden per testvat). De test kan worden uitgevoerd met semi-statische vervanging of een doorstroomsysteem wanneer de concentratie van de teststof niet stabiel is.
Naast de groepen met teststof moeten er één controlegroep met verdunningswater en indien van toepassing één controlegroep met het ontsluitingsmiddel in de test worden opgenomen.
1.8.1.2. Testconcentraties
Er kan een oriënterende test worden uitgevoerd om het concentratiebereik voor de definitieve test te bepalen, tenzij er informatie over de toxiciteit van de teststof beschikbaar is. Daartoe worden de daphniden blootgesteld aan een reeks concentraties van de teststof met een grote spreiding. Aan elke concentratie moeten gedurende 48 uur of korter vijf daphniden worden blootgesteld en er zijn geen duplo's nodig. De blootstellingsduur kan worden verkort (bv. 24 uur of minder) als er in kortere tijd gegevens kunnen worden verkregen die voor de oriënterende test volstaan.
Er moeten ten minste vijf testconcentraties worden gebruikt. Deze moeten een meetkundige reeks vormen met een rede die bij voorkeur niet hoger is dan 2,2. Als er minder dan vijf concentraties worden gebruikt, moet daarvoor een motivering worden gegeven. De hoogste geteste concentratie moet bij voorkeur leiden tot 100 % immobilisatie en de laagste geteste concentratie mag bij voorkeur geen waarneembaar effect veroorzaken.
1.8.1.3. Incubatieomstandigheden
De temperatuur moet binnen het interval tussen 18 oC en 22 oC liggen en moet voor elke afzonderlijke test binnen ± 1 oC stabiel zijn. Een cyclus met 16 uur licht en 8 uur donker wordt aanbevolen. Volledige duisternis is ook aanvaardbaar, vooral wanneer de teststof onder invloed van licht instabiel is.
De testvaten mogen tijdens de test niet worden belucht. De test wordt zonder aanpassing van de pH uitgevoerd. De daphniden mogen gedurende de test niet worden gevoerd.
1.8.1.4. Duur
De test duurt 48 uur.
1.8.2. Observaties
Elk testvat moet 24 en 48 uur na het begin van de test worden gecontroleerd op geïmmobiliseerde daphniden (zie punt 1.2 voor definities). Naast immobiliteit moet ook abnormaal gedrag of een afwijkend uiterlijk worden gerapporteerd.
1.8.3. Analytische bepalingen
Aan het begin en aan het eind van de test worden in de controlegroep(en) en bij de hoogste concentratie van de teststof de concentratie opgeloste zuurstof en de pH gemeten. De concentratie opgeloste zuurstof in de controlegroepen moet aan het geldigheidscriterium voldoen (zie punt 1.6). De pH mag binnen één test normaal gesproken niet meer dan 1,5 eenheid variëren. De temperatuur wordt meestal in controlevaten of in de lucht gemeten en moet bij voorkeur continu gedurende de test of ten minste aan het begin en het eind van de test worden geregistreerd.
De concentratie van de teststof moet ten minste bij de hoogste en laagste testconcentratie aan het begin en het eind van de test worden gemeten (4). Het verdient aanbeveling de resultaten op basis van de gemeten concentraties te bepalen. Als er echter gegevens beschikbaar zijn waaruit blijkt dat de concentratie van de teststof gedurende de hele test voldoende stabiel binnen ± 20 % van de nominale of gemeten beginconcentratie is gebleven, kunnen de resultaten op basis van de nominale of gemeten beginconcentraties worden bepaald.
1.9. LIMIETTEST
Er kan volgens de in deze methode beschreven procedures een limiettest worden uitgevoerd bij 100 mg teststof/l of (indien dit lager is) de oplosbaarheidsgrens in het testmedium om aan te tonen dat de EC50 hoger is dan deze concentratie. De limiettest moet met 20 daphniden (bij voorkeur verdeeld in vier groepen van vijf) en hetzelfde aantal in de controlegroep(en) worden uitgevoerd. Als er sprake is van immobilisatie, moet er een volledig onderzoek worden uitgevoerd. Elk geobserveerd abnormaal gedrag moet worden geregistreerd.
2. GEGEVENS
De gegevens moeten worden ingediend in de vorm van een tabel waarin voor elke behandelde en controlegroep wordt vermeld hoeveel van de gebruikte daphniden op elk observatietijdstip waren geïmmobiliseerd. Het percentage geïmmobiliseerde daphniden na 24 uur en 48 uur wordt uitgezet tegen de testconcentratie. De gegevens worden met geschikte statistische methoden (zoals probit-analyse) geanalyseerd om de helling van de curves en de EC50 met 95 %-betrouwbaarheidsgrenzen (p = 0,05) te berekenen (7) (8).
Wanneer de standaardmethodes voor de berekening van de EC50 niet bruikbaar zijn voor de verkregen gegevens, worden de hoogste concentratie die geen immobiliteit veroorzaakt en de laagste concentratie die 100 % immobiliteit veroorzaakt, als benadering voor de EC50 gebruikt (daarvoor wordt in dit geval het meetkundig gemiddelde van deze twee concentraties genomen).
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moet ten minste de volgende informatie worden opgenomen:
Teststof:
|
— |
fysische aard en relevante fysisch-chemische eigenschappen; |
|
— |
chemische identificatiegegevens, met inbegrip van de zuiverheid. |
Testsoort:
|
— |
bron en species van de Daphnia, de leverancier van de bron (indien bekend) en de gebruikte cultuuromstandigheden (met inbegrip van bron, aard en hoeveelheid van het voer en de voerfrequentie). |
Testomstandigheden:
|
— |
beschrijving van de testvaten: type, volume van de oplossing, aantal daphniden per testvat, aantal testvaten (duplo's) per concentratie; |
|
— |
methoden voor de bereiding van de stam- en testoplossingen, met inbegrip van eventueel gebruikte oplosmiddelen of dispergeermiddelen en gebruikte concentraties; |
|
— |
nadere bijzonderheden over het verdunningswater: bron en kwaliteitskenmerken van het water (pH, hardheid, verhouding Ca/Mg, verhouding Na/K, alkaliniteit, geleidbaarheid enz.); samenstelling van synthetisch water, indien gebruikt; |
|
— |
incubatieomstandigheden: temperatuur, lichtintensiteit en -periodiciteit, opgeloste zuurstof, pH enz. |
Resultaten:
|
— |
het aantal en het percentage daphniden in elke behandelde en controlegroep dat op elk observatietijdstip was geïmmobiliseerd of blijk gaf van schadelijke effecten (met inbegrip van abnormaal gedrag) en een beschrijving van de aard van de geobserveerde effecten; |
|
— |
de resultaten van de met een referentiestof uitgevoerde test en de datum waarop deze is uitgevoerd, indien beschikbaar; |
|
— |
de nominale testconcentraties en de resultaten van alle analyses om de concentratie van de teststof in de testvaten te bepalen; de recoverycapaciteit van de methode en de bepalingsgrens dienen ook te worden gerapporteerd; |
|
— |
alle tijdens de test uitgevoerde fysisch-chemische metingen van de temperatuur, de pH en de opgeloste zuurstof; |
|
— |
de EC50 na 48 uur voor immobilisatie met betrouwbaarheidsintervallen en grafieken van het model dat voor de berekening daarvan is gebruikt, de hellingen van de dosis/respons-curves en de standaardafwijking daarvan; de voor de bepaling van de EC50 gebruikte statistische procedures; (wanneer deze gegevens ook voor immobilisatie na 24 uur zijn gemeten, dienen deze ook te worden gerapporteerd) |
|
— |
een verklaring voor eventuele afwijkingen van de testmethode en een toelichting of deze afwijkingen gevolgen hebben gehad voor de resultaten van de test. |
4. REFERENTIES
|
(1) |
ISO 6341. (1996). Water quality — Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) — Acute toxicity test. Third edition, 1996. |
|
(2) |
EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines — Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids. |
|
(3) |
Environment Canada. (1996). Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada. |
|
(4) |
Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000. |
|
(5) |
Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia. |
|
(6) |
OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998. |
|
(7) |
Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 — American Society for Testing and Materials. Pp. 65-84. |
|
(8) |
Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK. |
Bijlage 1
ENKELE CHEMISCHE KENMERKEN VAN AANVAARDBAAR VERDUNNINGSWATER
|
Stof |
Concentratie |
|
Deeltjes |
< 20 mg/l |
|
Totale hoeveelheid organische koolstof |
< 2 mg/l |
|
Niet-geïoniseerde ammonium |
< 1 μg/l |
|
Chloorresiduen |
< 10 μg/l |
|
Totale hoeveelheid organofosfaat-bestrijdingsmiddelen |
< 50 ng/l |
|
Totale hoeveelheid organochloor-bestrijdingsmiddelen plus polychloorbifenylen |
< 50 ng/l |
|
Totale hoeveelheid organisch chloor |
< 25 ng/l |
Bijlage 2
VOORBEELDEN VAN GESCHIKT SYNTHETISCH TESTWATER
ISO-testwater (1)
|
Stamoplossingen (één stof) |
Voor de bereiding van synthetisch water worden de volgende volumes stamoplossingen toegevoegd aan 1 liter water (2) |
|
|
Stof |
Aan 1 liter water (2) toegevoegde hoeveelheid |
|
|
Calciumchloride CaCl2.2H2O |
11,76 g |
25 ml |
|
Magnesiumsulfaat MgSO4.7H2O |
4,93 g |
25 ml |
|
Natriumbicarbonaat NaHCO3 |
2,59 g |
25 ml |
|
Kaliumchloride KCl |
0,23 g |
25 ml |
Elendt-media M7 en M4
Acclimatisering aan Elendt-media M7 en M4
Sommige laboratoria hebben problemen ondervonden bij het rechtstreeks overbrengen van Daphnia in M4- en M7-media. Toch is er enig succes geboekt met geleidelijke acclimatisering, d.w.z. overgang van het eigen medium naar 30 % Elendt, vervolgens naar 60 % Elendt en tot slot naar 100 % Elendt. De vereiste acclimatiseringsperiode kan soms oplopen tot een hele maand.
Bereiding
Spoorelementen
Eerst worden afzonderlijke stamoplossingen (I) van individuele spoorelementen bereid in water met een geschikte zuiverheid, bijvoorbeeld gedeïoniseerd, gedestilleerd of gezuiverd door omgekeerde osmose. Uit deze verschillende stamoplossingen (I) wordt één tweede stamoplossing (II) bereid die alle spoorelementen bevat (gecombineerde oplossing):
|
Stamoplossing(en) I (één stof) |
Aan water toegevoegde hoeveelheid (mg/l) |
Concentratie (in vergelijking met medium M4) |
Voor de bereiding van de gecombineerde stamoplossing II wordt de volgende hoeveelheid stamoplossing I toegevoegd aan water (ml/l) |
|
|
M4 |
M7 |
|||
|
H3BO3 |
57 190 |
20 000-voudig |
1,0 |
0,25 |
|
MnCl2.4H2O |
7 210 |
20 000-voudig |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000-voudig |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000-voudig |
1,0 |
0,25 |
|
SrCl2.6H2O |
3 040 |
20 000-voudig |
1,0 |
0,25 |
|
NaBr |
320 |
20 000-voudig |
1,0 |
0,25 |
|
Na2MoO4.2H2 O |
1 230 |
20 000-voudig |
1,0 |
0,25 |
|
CuCl2.2H2O |
335 |
20 000-voudig |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000-voudig |
1,0 |
1,0 |
|
CoCl2.6H2O |
200 |
20 000-voudig |
1,0 |
1,0 |
|
KI |
65 |
20 000-voudig |
1,0 |
1,0 |
|
Na2Se03 |
43,8 |
20 000-voudig |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000-voudig |
1,0 |
1,0 |
|
Na2EDTA.2H2O |
5 000 |
2 000-voudig |
— |
— |
|
FeSO4.7H2O |
1 991 |
2 000-voudig |
— |
— |
|
Zowel de Na2EDTA- als de FeSO4-oplossing wordt apart bereid; vervolgens worden ze samengevoegd en onmiddellijk in een autoclaaf gesteriliseerd. |
||||
|
Dit levert op: |
||||
|
2 l Fe-EDTA-oplossing |
|
1 000-voudig |
20,0 |
5,0 |
M4- en M7-media
M4- en M7-media worden als volgt bereid met behulp van stamoplossing II, macronutriënten en vitamines:
|
|
Aan water toegevoegde hoeveelheid (mg/l) |
Concentratie (in vergelijking met medium M4) |
Voor de bereiding van het medium toegevoegde hoeveelheid stamoplossing II (ml/l) |
|
|
M4 |
M7 |
|||
|
Stamoplossing II (gecombineerde spoorelementen) |
|
20-voudig |
50 |
50 |
|
Stamoplossingen macronutriënten (één stof) |
|
|
|
|
|
CaCl2 2H2O |
293 800 |
1 000-voudig |
1,0 |
1,0 |
|
MgSO4 7H2O |
246 600 |
2 000-voudig |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000-voudig |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000-voudig |
1,0 |
1,0 |
|
Na2 Si03.9H2O |
50 000 |
5 000-voudig |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000-voudig |
0,1 |
0,1 |
|
KH2 PO4 |
1 430 |
10 000-voudig |
0,1 |
0,1 |
|
K2H PO4 |
1 840 |
10 000-voudig |
0,1 |
0,1 |
|
Gecombineer de stamoplossing met vitaminen |
— |
10 000-voudig |
0,1 |
0,1 |
|
De gecombineerde stamoplossing met vitaminen wordt bereid door de volgende drie vitaminen als volgt aan 1 liter water toe te voegen: |
||||
|
Thiaminehydrochloride |
750 |
10 000-voudig |
|
|
|
Cyanocobalamine (B12) |
10 |
10 000-voudig |
|
|
|
Biotine |
7,5 |
10 000-voudig |
|
|
De gecombineerde stamoplossing met vitaminen wordt in bevroren toestand in kleine porties bewaard. De vitaminen worden vlak vóór gebruik aan de media toegevoegd.
|
NB |
: |
Om het neerslaan van zouten bij de bereiding van de volledige media te voorkomen worden de porties van de stamoplossingen toegevoegd aan ongeveer 500-800 ml gedeïoniseerd water en daarna aangevuld tot 1 liter. |
|
NB |
: |
Zie voor de eerste publicatie over het M4-medium: Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33 |
C.3. GROEIREMMINGSTEST MET ALGEN
1. METHODE
1.1. INLEIDING
Het doel van deze test is het bepalen van de effecten van een stof op de groei van een eencellige groene algensoort. Met relatief korte onderzoeken (72 uur) kunnen de effecten op verschillende generaties bepaald worden. Deze methode kan worden aangepast voor het gebruik met verschillende eencellige algensoorten; dan dient evenwel een beschrijving van de gebruikte methode bij het testrapport gevoegd te worden.
Deze test is eenvoudig toe te passen op in water oplosbare stoffen die, onder de testomstandigheden, waarschijnlijk in oplossing blijven.
De methode kan gebruikt worden voor stoffen die de meting van de algengroei niet direct storen.
Alvorens met de test te beginnen is het wenselijk om, voor zover mogelijk, te beschikken over gegevens over de oplosbaarheid in water, dampspanning, chemische stabiliteit, dissociatieconstanten en biologische afbreekbaarheid van de stof.
Zowel bij de voorbereiding van de test als bij de interpretatie van de resultaten moet rekening worden gehouden met nadere gegevens (bijvoorbeeld structuurformule, zuiverheidsgraad, aard en percentage van belangrijke verontreinigingen, aanwezigheid en hoeveelheid van additieven en de n-octanol/water-verdelingscoëfficiënt).
1.2. DEFINITIES EN EENHEDEN
Celdichtheid: het aantal cellen per milliliter;
Groei: de toename van de celdichtheid gedurende de onderzoeksperiode;
Groeisnelheid: de toename van de celdichtheid per tijdseenheid;
EC50: in deze methode de concentratie van een teststof waarbij ten opzichte van de controle een 50 % vermindering van de groei (EbC50) of de groeisnelheid (ErC50) optreedt;
NOEC (no observed effect concentration, concentratie waarbij geen effect wordt waargenomen): in deze methode de hoogste geteste concentratie waarbij geen significante groeiremming wordt waargenomen ten opzichte van de controle.
Alle concentraties van de teststof worden opgegeven in gewicht per volume (mg/l). Ze kunnen ook worden uitgedrukt als gewicht per gewicht (mg.kg-1).
1.3. REFERENTIESTOFFEN
Een referentiestof kan worden getest om aan te tonen dat de gevoeligheid van de geteste soort onder de testomstandigheden in het laboratorium niet in belangrijke mate is veranderd.
Als een referentiestof wordt gebruikt, moeten de resultaten worden weergegeven in het testrapport. Kalium-dichromaat mag als referentiestof gebruikt worden, maar de kleur zou van invloed kunnen zijn op de kwaliteit en intensiteit van het voor de cellen beschikbare licht, alsmede op de spectrometrische bepalingen indien deze gebruikt worden. Kaliumdichromaat is gebruikt tijdens een internationale interlaboratoriumtest (zie referentie (3) en Aanhangsel 2).
1.4. PRINCIPE VAN DE TESTMETHODE
Er kan een limiettest met 100 mg per liter worden uitgevoerd om aan te tonen dat de EC50 hoger is dan deze concentratie.
Onder bepaalde omstandigheden worden exponentieel groeiende culturen van geselecteerde groene algen gedurende verschillende generaties blootgesteld aan verschillende concentraties van de teststof.
De testoplossingen worden geïncubeerd gedurende 72 uur en de celdichtheid wordt in iedere oplossing ten minste éénmaal per 24 uur gemeten. De remming van de groei wordt bepaald in verhouding tot een controlecultuur.
1.5. KWALITEITSCRITERIA
De kwaliteitscriteria zijn zowel op de limiettest als op de volle studie toepasselijk.
De celdichtheid in de controleculturen moet binnen drie dagen ten minste met een factor 16 zijn toegenomen.
De concentratie van de teststof dient gedurende de gehele test binnen 80 % van de oorspronkelijke concentratie gehouden te worden.
Bij stoffen die gemakkelijk oplossen in het testmedium en stabiele oplossingen vormen en bijvoorbeeld niet in belangrijke mate vervluchtigen of worden afgebroken, gehydrolyseerd of geadsorbeerd, mag de beginconcentratie als gelijk aan de nominale concentratie beschouwd worden. Evenwel dient aangetoond te worden dat de concentraties gedurende de gehele test gehandhaafd werden en dat aan de kwaliteitscriteria is voldaan.
Bij stoffen die:
|
i) |
slecht oplosbaar zijn in het testmedium of |
|
ii) |
in staat zijn stabiele emulsies of dispersies te vormen of |
|
iii) |
niet stabiel zijn in waterige oplossingen, |
dient de bij het begin van de proef gemeten concentratie als de beginconcentratie te worden beschouwd. De concentratie dient te worden bepaald na een periode van evenwichtsinstelling.
In al deze gevallen dienen gedurende de test verdere metingen te worden uitgevoerd om de actuele blootstellingsconcentraties te bevestigen of om te bevestigen dat aan de kwaliteitscriteria werd voldaan.
Zoals bekend kunnen significante hoeveelheden van de te onderzoeken stof tijdens de testperiode opgenomen in de biomassa van de algen. Om aan de bovengenoemde kwaliteitscriteria te voldoen dient daarom rekening gehouden te worden met zowel de hoeveelheid van de stof die is opgenomen in de algenbiomassa, als met de hoeveelheid stof in de oplossing (of, indien dit technisch onmogelijk is, gemeten in de waterkolom). Daar de bepaling van de concentratie van de stof in de biomassa van de algen aanzienlijke technische problemen kan stellen, kan aangetoond worden dat aan de kwaliteitscriteria is voldaan door de proef bij de hoogste concentratie uit te voeren, maar dan zonder algen, en de concentraties aan het begin en het einde van de proef in de oplossing (of, indien dit technisch onmogelijk is, in de waterkolom) te meten.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Reagentia
1.6.1.1. Oplossingen van de teststoffen
Stamoplossingen van de gewenste sterkte worden bereid door de stof op te lossen in gedeïoniseerd water of water volgens 1.6.1.2.
De gekozen testconcentraties worden bereid door geschikte hoeveelheden aan de algen-voorcultuur toe te voegen (zie Aanhangsel 1). Stoffen moeten normaal gezien enkel worden getest tot aan de oplosbaarheidsgrens. Bij sommige stoffen (bijvoorbeeld stoffen met lage oplosbaarheid in water of een hoge Pow, of stoffen die een stabiele dispersie vormen in plaats van een echte oplossing in water), is het aanvaardbaar een testconcentratie te onderzoeken boven de oplosbaarheidsgrens van de stof, om.te verzekeren dat de maximaal oplosbare/stabiele concentratie werd bereikt. Het is echter belangrijk dat deze concentratie niet op andere wijze het testsysteem verstoort (bijvoorbeeld een vlies van de stof op het water waardoor de zuurstofvoorziening van het water wordt verhinderd, enz.).
Ultrasone dispersie, organische oplosmiddelen, emulgatoren of dispergeermiddelen kunnen worden gebruikt als hulpmiddel bij het bereiden van stamoplossingen van stoffen met een lage oplosbaarheid in water of bij het dispergeren van deze stoffen in het testmedium. Indien dergelijke hulpstoffen worden gebruikt, moeten alle testconcentraties dezelfde hoeveelheid hulpstof bevatten en moeten extra controles worden blootgesteld aan dezelfde concentratie van de hulpstof als die welke is gebruikt in de testreeks. De concentratie van dergelijke hulpstoffen dient zo laag mogelijk gehouden te worden en mag in géén geval groter zijn dan 100 mg per liter testmedium.
De test dient te worden uitgevoerd zonder correctie van de pH. Indien er aanwijzingen zijn voor een duidelijke verandering van de pH, wordt aangeraden om de test te herhalen na correctie van de pH en de resultaten te vermelden. In dat geval dient de pH-waarde van de stamoplossing te worden aangepast aan de pH-waarde van het verdunningswater, tenzij er speciale redenen zijn om dit niet te doen. Voor dit doel verdienen HCl en NaOH de voorkeur. Deze pH-correctie dient zodanig te geschieden dat de concentratie van de teststof in de stamoplossing niet in belangrijke mate wordt gewijzigd. Indien tengevolge van de correctie een chemische reactie of fysische neerslagvorming van de teststof mocht optreden, dan dient dit te worden vermeld.
1.6.1.2. Testmedium
Het water dient gedistilleerd water van goede kwaliteit te zijn, of gedeïoniseerd water met een soortelijke geleiding van minder dan 5 μS.cm-1. Het toestel voor de distillatie van het water mag geen koperen onderdelen bevatten.
Het volgende medium wordt aangeraden.
Vier stamoplossingen worden bereid volgens de volgende tabel. De stamoplossingen worden gesteriliseerd met behulp van membraanfiltratie of een autoclaaf en opgeslagen in het donker bij 4 oC. Stamoplossing nr. 4 mag alleen met membraanfiltratie gesteriliseerd worden. Deze stamoplossingen worden verdund om de eindconcentraties van voedingsstoffen in de testoplossingen te bereiken.
|
Voedingsstoffen |
Concentratie in de stamoplossing |
Eindconcentratie in de testoplossing |
|
Stamoplossing 1: Macro-voedingsstoffen |
||
|
NH4Cl |
1,5 g/l |
15 mg/l |
|
MgCl2.6H2O |
1,2 g/l |
12 mg/l |
|
CaCl2.2H2O |
1,8 g/l |
18 mg/l |
|
MgSO4.7H2O |
1,5 g/l |
15 mg/l |
|
KH2PO4 |
0,16 g/l |
1,6 mg/l |
|
Stamoplossing 2: Fe-EDTA |
||
|
FeCl3.6H2O |
80 mg/l |
0,08 mg/l |
|
Na2EDTA.2H2O |
100 mg/l |
0,1 mg/l |
|
Stamoplossing 3: Spoorelementen |
||
|
H3BO3 |
185 mg/l |
0,185 mg/l |
|
MnCl2.4H2O |
415 mg/l |
0,415 mg/l |
|
ZnCl2 |
3 mg/l |
3 × 10-3 mg/l |
|
CoCl2.6H2O |
1,5 mg/l |
1,5 × 10-3 mg/l |
|
CuCl2.2H2O |
0,01 mg/l |
10-5 mg/l |
|
Na2MoO4.2H2O |
7 mg/l |
7 x 10-3 mg/l |
|
Stamoplossing 4:NaHCO3 |
||
|
NaHCO3 |
50 g/l |
50 mg/l |
De pH van het medium na bereiken van een evenwichtstoestand met lucht is ongeveer 8.
1.6.2. Apparatuur
|
— |
Gangbare laboratoriumuitrusting. |
|
— |
Testkolven met een geschikt volume (erlenmeyers van 250 ml zijn bijvoorbeeld geschikt indien het volume van de testoplossing 100 ml bedraagt). Alle testkolven dienen identiek te zijn wat betreft materiaal en dimensies. |
|
— |
Kweekapparaat: kast of kamer waarin de temperatuur binnen het bereik van 21 tot 25 oC, binnen ± 2 oC gehouden kan worden, en een continue uniforme verlichting in het spectraal bereik van 400 tot 700 nm. Indien de algen in de controleculturen de vereiste groeisnelheid hebben bereikt, mag aangenomen worden dat de groeivoorwaarden, inclusief de lichtintensiteit, voldoende waren. Het verdient aanbeveling op het gemiddelde niveau van de testoplossingen een lichtintensiteit tussen 60 en 120 μE.m-2.s-1 (35 tot 70 × 1018 fotonen.m-2.s-1) te gebruiken, gemeten in het bereik van 400 tot 700 nm met behulp van een geschikte receptor. Voor lichtmeters die geijkt zijn in lux is een gelijkwaardig bereik van 6 000 tot 10 000 lx aanvaardbaar. Deze lichtintensiteit kan verkregen worden met behulp van vier tot zeven 30 W TL-lampen van het universele witte type (kleurtemperatuur ongeveer 4 000 K) op 0,35 m afstand van de algencultuur. |
|
— |
Celdichtheidsmetingen moeten uitgevoerd worden met een rechtstreekse telling voor levende cellen, bijvoorbeeld een microscoop met telkamers. Andere methoden (fotometrie, rurbidimetrie ...) kunnen gebruikt worden indien zij voldoende gevoelig zijn en indien is aangetoond dat zij voldoende goed gecorreleerd zijn met de celdichtheid. |
1.6.3. Testorganismen
Het verdient aanbeveling om als groene algensoort een snelgroeiende soort te nemen dat geschikt is voor kweken en testen. De volgende soorten hebben de voorkeur:
|
— |
Selenastrum capricornutum, bijvoorbeeld ATCC 22662 of CCAP 278/4, |
|
— |
Scenedesmus subspicatus, bijvoorbeeld 86.81 SAG. |
Opmerking:
|
ATCC |
= |
American Type Culture Collection (V.S.) |
|
CCAP |
= |
Culture Centre of Algae and Protozoa (G.B.) |
|
SAG |
= |
Algencultuur-verzameling (Göttingen, B.R.D.) |
Indien andere soorten worden gebruikt, dient de stam te worden vermeld.
1.6.4. Testprocedure
Het concentratiebereik waarin het optreden van de effecten wordt verwacht, kan bepaald worden met behulp van proeven voor afbakening van het testbereik.
De twee meeteenheden voor groei (biomassa en groeisnelheid) kunnen resulteren in zeer uiteenlopende maten van groeiremming; beide dienen gebruikt te worden in de afbakeningsproef om er zeker van te zijn dat de meetkundige concentratiereeks een schatting van de EbC50 en de ErC50 mogelijk maakt.
Oorspronkelijke celdichtheid
Het verdient aanbeveling dat de celdichtheid in de testculturen voor Selenastrum capricornutum en Scenedesmus subspicatus in het begin ongeveer 104 cellen/ml bedraagt. Indien andere soorten worden gebruikt dient de biomassa vergelijkbaar te zijn.
Concentraties van de teststof
Ten minste vijf testconcentraties worden zo bereid dat ze een meetkundige reeks vormen, met een concentratieverhouding die niet groter is dan 2,2. De laagste geteste concentratie mag geen waarneembaar effect op de algengroei vertonen. De hoogste geteste concentratie dient de groei ten opzichte van de controle met ten minste 50 % te remmen en bij voorkeur de groei volledig te stoppen.
Duplo's en controles
Elke testconcentratie dient in triplo getest te worden. Drie controles zonder teststof dienen te worden uitgevoerd en indien van toepassing tevens drie controles met hulpstof. Indien gemotiveerd mag het testschema veranderd worden om het aantal concentraties op te voeren en het aantal duplo's per concentratie te verminderen.
Uitvoering van de test
Testculturen met de gewenste concentraties teststof en de gewenste hoeveelheid algen-inoculum worden bereid door toevoeging van hoeveelheden van de stamoplossing van de teststof aan de vereiste hoeveelheden preculturen van de algen (zie Aanhangsel 1).
De testkolven worden geschud en in het kweekapparaat geplaatst. De algen worden in suspensie gehouden door schudden, roeren of doorborrelen met lucht om aldus de gasuitwisseling te verbeteren en de pH-variatie in de testoplossing te verminderen. De culturen moeten op een temperatuur van 21 tot 25 oC worden gehouden, afgeregeld tot op ± 2 oC.
De celdichtheid in iedere kolf wordt ten minste 24, 48, en 72 uur na de start van de test bepaald. Gefilterd algen-medium met de juiste concentratie van de teststof wordt gebruikt als achtergrondbepaling, indien gebruik wordt gemaakt van andere methoden voor meting van de celdichtheid dan rechtstreekse telling.
De pH wordt aan het begin van de test en na 72 uur gemeten.
De pH van de controles mag tijdens de test niet meer dan 1,5 eenheid variëren.
Testen van vluchtige stoffen
Tot op heden bestaat er geen algemeen aanvaarde methode voor het testen van vluchtige stoffen. Indien van een stof bekend is dat ze neiging heeft tot verdampen, kunnen gesloten kolven met een vergrote vrije ruimte boven de vloeistof gebruikt worden. Er dient evenwel bij het berekenen van de vrije ruimte in de gesloten kolven rekening gehouden te worden met een mogelijk CO2-gebrek. Variaties op deze methode zijn voorgesteld (zie referentie (4)).
Getracht moet worden om de hoeveelheid stof te bepalen die in de oplossing blijft en aanbevolen wordt om extra voorzichtig te zijn bij het interpreteren van resultaten van tests met vluchtige chemicaliën met behulp van gesloten systemen.
Limiettest
Met de procedure beschreven in deze methode kan een limiettest worden uitgevoerd met 100 mg per liter om aan te tonen dat de EC50 hoger is dan deze concentratie.
Indien de aard van de stof zodanig is dat een concentratie van 100 mg per liter in het testwater niet bereikt kan worden, dient de proef te worden uitgevoerd bij een concentratie die gelijk is aan de oplosbaarheid van de te onderzoeken stof (of de maximale concentratie die een stabiele dispersie vormt) in het gebruikte medium (zie ook punt 1.6.1.1).
De limiettest dient ten minste in drievoud te worden uitgevoerd met hetzelfde aantal controles. De twee groeieenheden (biomassa en groeisnelheid) dienen bij de limiettest gebruikt te worden.
Indien in een limiettest een gemiddelde afname van de biomassa of de groeisnelheid ten opzichte van de controle van 25 % of meer wordt gevonden, dient een volledige studie te worden uitgevoerd.
2. GEGEVENS EN EVALUATIE
De in de testculturen en controles gemeten celdichtheid wordt in tabellen genoteerd met de concentraties van de teststof en de tijdstippen van de meting. De gemiddelde waarde van de celdichtheid voor iedere concentratie van de teststof en de controles wordt uitgezet als functie van de tijd (0-72 uur) om aldus groeikrommes te verkrijgen.
Om de concentratie/effect-verhouding te bepalen dienen de twee volgende benaderingen te worden gevolgd. Bepaalde stoffen kunnen de groei stimuleren bij lage concentraties. Alleen met gegevens die op een remming tussen 0 en 100 % wijzen, moet rekening gehouden worden.
2.1. VERGELIJKING VAN DE OPPERVLAKTEN ONDER DE GROEIKROMMES
De oppervlakte tussen de groeikrommes en de horizontale lijn N = NO kan berekend worden volgens de formule:
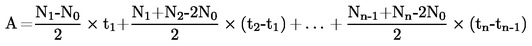
waarin
|
A |
= |
de oppervlakte, |
|
No |
= |
het aantal cellen/ml op tijd t0 (begin van de test), |
|
N1 |
= |
het gemeten aantal cellen/ml op tijd t1, |
|
N2 |
= |
het gemeten aantal cellen/ml op tijd tn, |
|
t1 |
= |
het tijdstip van de eerste meting na het begin van de test, |
|
tn |
= |
het tijdstip van de nde meting na het begin van de test, |
|
n |
= |
het aantal uitgevoerde metingen sinds het begin van de test. |
Het percentage celgroeiremming bij iedere teststofconcentratie (IA) wordt berekend volgens de formule:

waarin
|
Ac |
= |
de oppervlakte tussen de groeikromme voor de controle en de horizontale lijn N = No, |
|
At |
= |
de oppervlakte tussen de groeikromme bij concentratie t en de horizontale lijn N = No. |
|
IA |
= |
waarden worden uitgezet tegen de bijbehorende concentraties op semilogaritmisch papier of op semilogaritmisch waarschijnlijkheidspapier. Indien uitgezet op waarschijniijkheidspapier, dienen de punten op het oog, of met behulp van een berekende regressie te worden verbonden door een rechte lijn. |
De EC50 wordt geschat op grond van de regressielijn door de concentratie af te lezen die overeenkomt met 50 % remming (IA = 50 %). Om de met deze methode verkregen waarde ondubbelzinnig te onderscheiden, wordt voorgesteld om het symbool EbC50 te gebruiken. Het is van wezenlijk belang om de EbC50 aan te geven met de betrokken blootstellingsperiode, bijvoorbeeld EbC50 (0-72 uur).
2.2. VERGELIJKING VAN DE GROEISNELHEID
De gemiddelde specifieke groeisnelheid (μ) voor exponentieel groeiende culturen kan als volgt berekend worden:
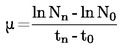
waarin t0 de tijd aan het begin van de test is.
De gemiddelde specifieke groeisnelheid kan anderszins worden afgeleid uit de helling van de regressielijn, verkregen door ln N uit te zetten tegen de tijd.
Het percentage remming van de specifieke groeisnelheid bij iedere teststofconcentratie (Iμt) wordt berekend volgens de formule:

waarin
|
μc |
= |
de gemiddelde specifieke groeisnelheid |
|
μt |
= |
de gemiddelde specifieke groeisnelheid voor de testconcentratie t |
De percentuele afname van de gemiddelde specifieke groeisnelheid bij iedere teststofconcentratie ten opzichte van de controlewaarde wordt uitgezet tegen de logaritme van de concentratie. De EC50 kan vervolgens afgelezen worden uit de verkregen grafiek. Om de met deze methode verkregen EC50-waarde ondubbelzinnig te onderscheiden, wordt voorgesteld om het symbool ErC50 te gebruiken. Het tijdstip van de meting dient te worden aangegeven; als de waarde bij de tijdstippen 0 en 72 uur behoort, wordt bijvoorbeeld het symbool als ErC50(0-72 uur) aangegeven.
Opmerking: De specifieke groeisnelheid is een logaritmische term, zodat kleine veranderingen in de groeisnelheid kunnen leiden tot grote veranderingen in de biomassa. De EbC- en ErC-waarden zijn daarom niet numeriek vergelijkbaar.
2.3. BEREKENING VAN DE NOEC
De concentratie waarbij geen effect wordt waargenomen (NOEC) wordt bepaald volgens een geschikte statistische procedure voor meervoudige monstervergelijking (bijvoorbeeld variantie-analyse en Dunnett-test), met behulp van de uit de triplo-tests verkregen afzonderlijke waarden van de oppervlakten onder de groeikrommes A (zie punt 2.1), of de specifieke groeisnelheden μ (zie 2.2).
3. RAPPORTAGE
In het verslag moeten indien mogelijk de volgende gegevens worden opgenomen:
|
— |
teststof: gegevens voor chemische identificatie; |
|
— |
gegevens over het testorganisme: oorsprong, laboratoriumcultuur, stamnummer, kweekmethode; |
|
— |
testomstandigheden:
|
|
— |
resultaten:
|
4. LITERATUUR
|
(1) |
OECD, Paris, 1981, Test Guideline 201. Decision of the Council C(81) 30 Final. |
|
(2) |
Umweltbundesamt, Berlijn, 1984, Verfahrensvorschlag „Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus”, in: Rudolph, P. und Boje, R. Ökötoxikologie, ecomed, Landsberg 1986. |
|
(3) |
ISO 8692 — Water Quality — Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. |
|
(4) |
S. Galassi en M. Vighi — Chemosphere, 1981, vol. 10, 1123-1126. |
Aanhangsel 1
Voorbeeld van een procedure voor het kweken van algen
Algemene observaties
Het doel van het kweken op basis van de volgende procedure is het verkrijgen van algenculturen voor toxiciteitstesten.
Geschikte methoden moeten gebruikt worden om te verzekeren dat de algenculturen niet besmet worden met bacteriën (ISO 4833). Axenische culturen zijn gewenst, maar eensoortige algenculturen zijn verplicht.
Alle behandelingen dienen te worden uitgevoerd onder steriele omstandigheden ter vermijding van besmetting met bacteriën of andere algen. Besmette culturen dienen te worden afgekeurd.
Procedure voor het verkrijgen van algenculturen
Bereiding van de voedingsstoffenoplossingen (media):
Het medium kan bereid worden door verdunnen van de geconcentreerde stamoplossingen van voedingsstoffen. Voor vast medium wordt 0,8 % agar toegevoegd. Het medium moet steriel zijn. Sterilisatie met een autoclaaf kan leiden tot verlies van NH3.
Stamculturen:
De stamculturen bestaan uit kleine algenculturen die regelmatig op vers medium worden overgezet om aldus als nieuw uitgangsmateriaal voor tests te dienen. Indien de culturen niet regelmatig worden gebruikt, worden zij uitgestreken in schuine agarbuizen. Deze worden ten minste éénmaal per twee maanden overgebracht op vers medium.
De stamculturen worden gekweekt in erlenmeyers met het geschikte medium (volume ongeveer 100 ml). Wanneer de algen geïncubeerd worden bij 20 oC met continue verlichting, is wekelijks overzetten vereist.
Gedurende het overzetten wordt een hoeveelheid „oud” medium met steriele pipetten zodanig overgebracht naar de kolf met het verse medium, dat de beginconcentratie van de snelgroeiende soort ongeveer 100 maal kleiner is dan in de oude cultuur.
De groeisnelheid kan bepaald worden uit de groeikromme. Indien bekend, is het mogelijk de dichtheid te schatten waarbij de cultuur moet worden overgezet naar het nieuwe medium. Dit dient te geschieden voordat de cultuur de afstervingsfase bereikt.
Voorcultuur:
De voorcultuur dient om een aantal algen te geven dat geschikt is voor inoculatie van de testculturen. De voorculturen worden geïncubeerd onder testomstandigheden en worden gebruikt terwijl zij nog exponentieel groeien, normaal gezien na een incubatieperiode van drie dagen. Wanneer de algenculturen misvormde of abnormale cellen bevatten, moeten ze worden afgekeurd.
Aanhangsel 2
In ISO 8692 („Water Quality — Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum”) worden de volgende resultaten vermeld voor een interlaboratoriumtest, uitgevoerd door 16 laboratoria, met kaliumdichromaat als teststof:
|
|
Bereik |
(mg/l) |
|
ErC50 (0-72 h) |
0,84 |
0,60 tot 1,03 |
|
EbC50(0-72h) |
0,53 |
0,20 tot 0,75 |
C.4. BEPALING VAN DE GEMAKKELIJKE BIOLOGISCHE AFBREEKBAARHEID
DEEL I. ALGEMENE BESCHOUWINGEN
1.1. INLEIDING
Voor het testen van de gemakkelijke biologische afbreekbaarheid van chemische stoffen in een aëroob watermedium worden zes testmethoden beschreven:
|
a) |
DOC (opgeloste organische koolstof) Afvlakkingstest (Methode C.4-A) |
|
b) |
Gewijzigde OESO-Screening test — Afvlakking DOC (Methode C.4-B) |
|
c) |
Kooldioxyde (CO2) Ontwikkelingstest (Gewijzigde Sturm-test) (Methode C.4-C) |
|
d) |
Manometrische respirometrie (Methode C.4-D) |
|
e) |
Gesloten-flestest (Methode C.4-E) |
|
f) |
MITI (Ministerie voor Internationale Handel en Industrie — Japan) (Methode C.4-F) |
In deel I van de methode worden zowel de algemene aanwijzingen als de op alle zes tests betrekking hebbende aanwijzingen gegeven. In de Delen II tot en met VII worden bijzonderheden over de afzonderlijke methoden vermeld. De bijlagen bevatten definities, formules en nadere toelichting.
Bij een vergelijkend onderzoek tussen laboratoria in OESO-verband in 1988 bleek dat de methoden overeenstemmende resultaten geven. Afhankelijk van de fysische kenmerken van de te onderzoeken stof kan echter de voorkeur naar de ene of de andere methode gaan.
1.2. KEUZE VAN DE GESCHIKTE METHODE
Voor een keuze van de meest in aanmerking komende methode is informatie over de oplosbaarheid, de dampdruk en de adsorptie-eigenschappen van de stof van wezenlijk belang. Voor het berekenen van theoretische waarden en/of het controleren van gemeten waarden voor parameters, bv. ThOD, ThCO2, DOC, TOC, COD (zie Bijlagen I en II) moet de scheikundige structuur of de brutoformule bekend zijn.
Teststoffen die tot ten minste 100 mg/l in water oplosbaar zijn kunnen met alle methoden worden bepaald, mits ze niet-vluchtig en niet-adsorberend zijn. Voor stoffen die slecht in water oplosbaar, vluchtig of adsorberend zijn, worden in Tabel 1 geschikte methoden aangegeven. De wijze waarop slecht in water oplosbare stoffen en vluchtige stoffen kunnen worden behandeld wordt beschreven in Bijlage III. Matig vluchtige stoffen kunnen worden onderzocht met behulp van de DOC-afvlakkingsmethode, indien er voldoende gasruimte in de proefvaten is (deze zouden goed afgesloten moeten worden). In dat geval dient een niet-biologische controle te worden toegepast voor het verdisconteren van een eventueel fysisch verlies.
Tabel 1
Bruikbaarheid van testmethoden
|
Test |
Analytische methode |
Geschiktheid voor de volgende stoffen: |
||
|
Slecht absorberend |
Vluchtig |
Oplosbaar |
||
|
DOC Afvlakking |
Opgeloste organische koolstof |
— |
— |
+/– |
|
Gew. OESO Afvlakking |
Opgeloste organische koolstof |
— |
— |
+/– |
|
Ontwikkeling CO2 |
Respirometrie: CO2-ontwikkeling |
+ |
— |
+ |
|
Manometrische respirometrie |
Manometrische respirometrie: zuurstofverbruik |
+ |
+/– |
+ |
|
Gesloten fles |
Respirometrie: opgeloste zuurstof |
+/- |
+ |
+ |
|
MITI |
Respirometrie: zuurstofverbruik |
+ |
+/- |
+ |
Informatie over de zuiverheid of de relatieve hoeveelheden van belangrijke componenten van het testmateriaal is nodig voor een interpretatie van de verkregen resultaten, vooral wanneer de uitkomsten gering of marginaal zijn.
Informatie over de giftigheid van de teststof voor bacteriën (Bijlage IV) kan zeer nuttig zijn voor het kiezen van de juiste testconcentraties en kan essentieel zijn voor een juiste interpretatie van een geringe waarde voor de biologische afbraak.
1.3. REFERENTIESTOFFEN
Voor een controle op de procedure worden referentiestoffen die aan de criteria voor gemakkelijke biologische afbreekbaarheid voldoen, onderzocht door een geschikte proefvolume referentiestof parallel met de gewone testuitvoeringen te behandelen.
Geschikte chemische stoffen zijn aniline (vers gedistilleerd), natriumacetaat en natriumbenzoaat. Deze referentiestoffen worden bij de onderhavige methoden alle afgebroken, zelfs wanneer niet bewust entmateriaal wordt toegevoegd.
Voorgesteld is een referentiestof te zoeken die wel gemakkelijk biologisch afbreekbaar is maar de toevoeging van een entmateriaal vereist. Daartoe is kaliumwaterstoftalaat voorgesteld, maar de geschiktheid moet nog worden aangetoond voordat deze stof als referentiestof aangenomen kan worden.
In de respirometrische testen kunnen stikstof bevattende verbindingen als gevolg van nitrificatie van invloed zijn op de opgenomen hoeveelheid zuurstof (zie Bijlagen II en V).
1.4. PRINCIPE VAN DE TESTMETHODEN
Een oplossing of suspensie van de teststof in een anorganisch medium wordt geënt en onder aërobe omstandigheden in het donker of in gedempt licht bebroed. De hoeveelheid DOC in de testoplossing die het gevolg is van het entmateriaal dient zo laag mogelijk te zijn in vergelijking met de hoeveelheid DOC tengevolge van de teststof.
Voor de endogene activiteit van het entmateriaal wordt een correctie aangebracht door middel van parallelle blanco proeven met entmateriaal maar zonder teststof, ofschoon de endogene activiteit van cellen in aanwezigheid van een teststof niet volledig overeenstemt met die van de endogene controle. De werking van de procedures wordt gecontroleerd door een parallelle test met een referentiestof uit te voeren.
In het algemeen wordt de afbraak gevolgd door de bepaling van parameters, zoals DOC, CO2-produktie en opgenomen zuurstof en worden op voldoende frequente tijdstippen metingen gedaan om het begin en het einde van de biologische afbraak vast te stellen. Bij automatische respirometers is de meting continu. Soms wordt de DOC gemeten naast een andere parameter, maar gewoonlijk wordt dit slechts bij het begin en bij de afloop van de test gedaan. Voor het bepalen van de primaire afbraak van de teststof en voor het bepalen van de concentratie van eventuele gevormde tussenproducten (verplicht bij de MITI-test) kan ook een specifieke chemische analyse worden uitgevoerd.
Gewoonlijk duurt de test 28 dagen. De proeven kunnen echter ook eerder dan na 28 dagen, en wel zodra de kromme voor de biologische afbraak gedurende ten minste 3 bepalingen een plateau vertoont, worden beëindigd. De proeven kunnen ook langer dan 28 dagen worden voortgezet, wanneer uit de kromme blijkt dat de biologische afbraak wel begonnen is, maar dat op dag 28 nog geen plateau is bereikt.
1.5. KWALITEITSCRITERIA
1.5.1. Reproduceerbaarheid
In verband met de aard van de biologische afbraak en van de als entmateriaal gebruikte gemengde bacteriepopulaties dienen bepalingen ten minste in tweevoud te worden uitgevoerd.
De ervaring leert in het algemeen dat hoe hoger de aanvankelijk aan het testmedium toegevoegde concentratie micro-organismen is, hoe geringer de afwijking tussen herhaalde bepalingen is. Uit ringtests is ook gebleken dat er tussen de resultaten van verschillende laboratoria grote verschillen kunnen zijn, maar gewoonlijk wordt met gemakkelijk biologische afbreekbare stoffen een goede overeenstemming verkregen.
1.5.2. Geldigheid van de test
Een test wordt geldig beschouwd indien het verschil tussen de uiterste waarden van de in de test meermalen uitgevoerde metingen van de verwijdering van teststof op het plateauniveau, aan het einde van de test of aan het einde van het venster van 10 dagen, minder is dan 20 % en indien het percentage afbraak van de referentiestof na 14 dagen het niveau voor gemakkelijke biologische afbreekbaarheid heeft bereikt. Indien aan een van deze voorwaarden niet is voldaan, dient de test te worden herhaald. Wegens de strengheid van de methoden behoeven lage waarden nog niet te betekenen dat de teststof onder milieu-omstandigheden niet biologisch afbreekbaar is, maar wel dat meer onderzoek nodig is om de biologische afbreekbaarheid vast te stellen.
Indien in een toxiciteitstest waarbij zowel de teststof als een referentiestof aanwezig is, in 14 dagen minder dan 35 % afbraak (gebaseerd op DOC) of minder dan 25 % afbraak (gebaseerd op ThOD of ThCO2) is opgetreden, kan worden aangenomen dat de teststoffen remmend werken (zie ook Bijlage IV). De testreeks dient dan te worden herhaald, zo mogelijk met een lagere concentratie teststof en/of een hogere concentratie entmateriaal, maar niet meer dan 30 mg vaste stof per liter.
1.6. ALGEMENE WERKWIJZEN EN BEREIDINGEN
Algemene omstandigheden die van toepassing zijn op de test zijn in Tabel 2 samengevat. Apparatuur en overige experimentele omstandigheden die op afzonderlijke tests betrekking hebben worden verderop in het hoofdstuk voor die test beschreven.
Tabel 2
Testomstandigheden
|
Test |
DOC Afvlakking |
CO2-ontwikkeling |
Manometrische respirometrie |
Gewijzigde OECD-test |
Gesloten fles |
MITI (I) |
|||||||||
|
Concentratie teststof als |
|
|
|
|
|
|
|||||||||
|
in mg/l |
|
|
100 |
|
2-10 |
100 |
|||||||||
|
mg DOC/1 |
10-40 |
10-20 |
10-40 |
|
|
|
|||||||||
|
mg ThOD/1 |
|
|
50-100 |
|
5-10 |
|
|||||||||
|
Concentratie entmateriaal (in cellen/l, bij benadering) |
≤ 30 mg/l SS of ≤ 100 ml effluent/l (107- 108) |
0,5 ml secundair effluent/l (105) |
≤ 5 ml effluent/l (104-106) |
30 mg/l SS (107-108) |
|||||||||||
|
Concentratie elementen in anorganisch medium (in mg/l): |
|
|
|
|
|
|
|||||||||
|
P |
116 |
11,6 |
29 |
||||||||||||
|
N |
1,3 |
0,13 |
1,3 |
||||||||||||
|
Na |
86 |
8,6 |
17,2 |
||||||||||||
|
K |
122 |
12,2 |
36,5 |
||||||||||||
|
Mg |
2,2 |
2,2 |
6,6 |
||||||||||||
|
Ca |
9,9 |
9,9 |
29,7 |
||||||||||||
|
Fe |
0,05-0,1 |
0,05-0,1 |
0,15 |
||||||||||||
|
pH |
7,4±0,2 |
bij voorkeur 7,0 |
|||||||||||||
|
Temperatuur |
22 ± 2 oC |
25 ± 1 oC |
|||||||||||||
|
|
|
|||||||||||||
1.6.1. Verdunningswater
Gedeïoniseerd of gedistilleerd water, dat vrij is van remmende concentraties giftige stoffen (bv. Cu++-ionen) wordt gebruikt. Het mag niet meer dan 10 % van de hoeveelheid organische koolstof die met het restmateriaal wordt geïntroduceerd bevatten. De grote zuiverheid van het testwater is nodig om hoge waarden van de blanco-proeven te vermijden. Besmetting kan het gevolg zijn van aanwezige verontreinigingen en ook van de ionenuitwisselende harsen en van de lysis van bacteriën en algen. Voor elke reeks tests dient slechts gebruik te worden gemaakt van een enkele voorraad water, die vooraf door middel van DOC-analyse is gecontroleerd. Zo'n controle is niet nodig voor de gesloten flestest, maar het zuurstofverbruik van het water moet laag blijven.
1.6.2. Voorraadoplossingen van anorganische componenten
Voor het bereiden van testoplossingen worden voorraadoplossingen met geschikte concentraties van anorganische componenten aangemaakt. Voor de methoden DOC-afvlakking, gewijzigde OESO-test, CO2-ontwikkeling, manometrische respirometrie en gesloten fles kunnen de onderstaande voorraadoplossingen worden gebruikt (met verschillende verdunningsfactoren).
De verdunningsfactoren en, voor de MITI-test, de specifieke bereiding van het anorganische medium, worden in de hoofdstukken van de afzonderlijke tests beschreven.
Voorraadoplossingen:
De onderstaande voorraadoplossingen worden bereid met gebruikmaking van reagentia van analytische kwaliteit.
|
a) |
Monokaliumdiwaterstoforthosfaat, KH2PO4 |
8,50 g |
|
Dikaliummonowaterstoforthofosfaat, K2HPO4 |
21,75 g |
|
|
Dinatriummonowaterstoforthofosfaat-dihydraat, Na2HPO4. 2 H2O |
33,40 g |
|
|
Ammoniumchloride, NH4Cl |
0,50 g |
|
|
Oplossen in water en tot 1 liter aanvullen. De pH van de oplossing moet 7,4 zijn. |
|
|
|
b) |
Calciumchloride, watervrij, CaCl2 of |
27,50 g |
|
Calciumchloride-dihydraat, CaCl2 . 2 H2O |
36,40 g |
|
|
In water oplossen en tot 1 liter aanvullen |
|
|
|
c) |
Magnesiumsulfaat-heptahydraat, MgSO4. 7 H2O |
22,50 g |
|
In water oplossen en tot 1 liter aanvullen |
|
|
|
d) |
IJzer(III)chloride-hexahydraat, FeCl3. 6 H2O |
0,25 g |
|
In water oplossen en tot 1 liter aanvullen |
|
Opmerking: Teneinde deze oplossing d) niet onmiddellijk voor gebruik te behoeven te bereiden, wordt één druppel geconcentreerde HCl of 0,4 g ethyleendiaminetetra-azijnzuur-dinatriumzout (EDTA) per liter toegevoegd.
1.6.3. Voorraadoplossingen van chemicaliën
Indien de oplosbaarheid meer dan 1 g/l bedraagt, wordt bijvoorbeeld 1-10 g, zoals toepasselijk is, aan teststof of referentiestof in gedeïoniseerd water opgelost en tot 1 liter aangevuld. In andere gevallen worden voorraadoplossingen in het anorganische medium bereid of wordt de stof rechtstreeks aan het anorganische medium toegevoegd. Voor het bewerken van minder goed oplosbare stoffen wordt verwezen naar Bijlage III, maar in de MITI-test (Methode C.4-F) dienen noch oplosmiddelen noch emulgatoren te worden gebruikt.
1.6.4. Entmateriaal
Het entmateriaal kan van diverse bronnen afkomstig zijn: actief slib, (chloorvrij) behandeld water, oppervlaktewater en grond of een mengsel daarvan. Indien bij de DOC-afvlakking, de CO2-ontwikkeling en de manometrische respirometrie actief slib wordt gebruikt, dient dit te worden onttrokken aan een behandelingsinstallatie of installatie op laboratoriumschaal die hoofdzakelijk huishoudelijk afvalwater verwerkt. Gebleken is dat entmateriaal van andere bronnen een grotere spreiding van resultaten geeft. Voor de gewijzigde OESO-test en de gesloten-flestest is een meer verdund entmateriaal zonder slibvlokken nodig en bij voorkeur wordt dan als bron een secundair effluent van een rioolwaterzuiveringsinstallatie of van een laboratoriuminstallatie met huishoudelijk afvalwater genomen. Voor de MITI-test is het entmateriaal afkomstig van een mengsel van bronnen. Het wordt in het hoofdstuk van die test beschreven.
1.6.4.1. Entmateriaal uit actief slib
Uit de beluchtingstank van een rioolwaterzuiveringsinstallatie of een laboratoriuminstallatie die hoofdzakelijk huishoudelijk afval verwerkt, wordt een vers monster actief slib verzameld. Grove deeltjes worden zo nodig door filtratie door een fijne zeef verwijderd; daarna wordt het slib aëroob gehouden.
In plaats daarvan kan na verwijdering van eventuele grove deeltjes worden bezonken of gecentrifugeerd (bv. 10 min bij 1 100 g). De bovenstaande vloeistof wordt weggeworpen. Het geconcentreerde slib kan in het mineraal medium gewassen worden; daarna wordt het in anorganisch medium gesuspendeerd tot een concentratie van 3-5 g gesuspendeerde vaste stof/l en belucht tot het tijdstip van gebruik.
Slib moet afkomstig zijn van een correct werkend zuiveringsstation. Als slib afkomstig is van een installatie met hoge omloopsnelheid, of geacht wordt remmers te bevatten, dient het te worden gewassen. Het opnieuw gesuspendeerde slib wordt na grondig mengen bezonken of gecentrifugeerd, de bovenstaande vloeistof wordt weggeworpen en het gewassen slib wordt in een volgend volume anorganisch medium opnieuw gesuspendeerd. Deze procedure wordt herhaald totdat het slib geacht wordt vrij te zijn van overmaat substraat of remmer.
Nadat het slib volledig opnieuw is gesuspendeerd, of bij niet-behandeld slib direct, wordt vlak voor gebruik een monster getrokken voor de bepaling van het droog gewicht aan gesuspendeerde vaste stoffen.
Een andere mogelijkheid is het homogeniseren van actief slib (3-5 g gesuspendeerde vaste stof per l). Het slib wordt 2 min bij matige snelheid in een mechanische menger behandeld. Het gemengde slib wordt gedurende 30 min of zoveel langer als nodig bezonken en de vloeistof wordt afgeschonken en gebruikt als entmateriaal in een hoeveelheid van 10 ml anorganisch medium.
1.6.4.2. Andere bronnen van entmateriaal
Dit kan worden betrokken van het secundaire effluent van een zuiveringsinstallatie of een laboratoriuminstallatie die hoofdzakelijk huishoudelijk afvalwater ontvangt. Er wordt een vers monster verzameld en dit wordt tijdens transport aëroob gehouden. Na 1 uur bezinken of filtreren door een grof filterpapier wordt het afgeschonken effluent of het filtraat aëroob gehouden zolang als nodig is. Tot 100 ml van dit soort entmateriaal per liter mineraal medium kan gebruikt worden.
Een verdere bron van entmateriaal is oppervlaktewater. In dit geval wordt een monster van een geschikt oppervlaktewater, bv. rivieren, plassen, verzameld en aëroob gehouden tot het nodig is. Zonodig wordt het entmateriaal door filtreren of centrifugeren geconcentreerd.
1.6.5. Preconditionering van entmateriaal
Entmateriaal kan op de proefomstandigheden worden gepreconditioneerd, maar mag niet vooraf aan de teststof worden aangepast. Preconditionering bestaat uit het beluchten van actief slib gedurende 5-7 dagen in anorganisch medium of secundaire effluent bij de testtemperatuur. Door preconditionering wordt de nauwkeurigheid van de testmethode soms verbeterd doordat de blancowaarden worden verlaagd. Het wordt niet nodig geacht het entmateriaal voor de MITI-test te preconditioneren.
1.6.6. Niet-biologische controles
Zonodig wordt gecontroleerd op mogelijke niet-biologische afbraak van de teststof door het bepalen van de verwijdering van DOC, de zuurstofopname of de kooldioxyde-ontwikkeling in steriele controles die geen entmateriaal bevatten. Het testmateriaal wordt gesteriliseerd door filtratie door een membraan (0,2-0,45 micrometer) of door toevoeging van een geschikte giftige stof met een geschikte concentratie. Indien gebruik gemaakt wordt van membraanfiltratie, moeten de monsters aseptisch verzameld worden, om de steriliteit ervan te behouden. De adsorptie van de teststof moet op voorhand uitgesloten worden. Is dit niet het geval, en is het entmateriaal uit actief slib afkomstig, moeten tests waarbij de biologische afbreekbaarheid als DOC-verwijdering bepaald wordt, een abiotische controle bevatten, die geënt en vergiftigd wordt.
1.6.7. Aantal kolven
Het aantal kolven in een doorsnee proef wordt in de betreffende hoofdstukken voor elke test beschreven.
Kolven van het volgende soort kunnen gebruikt worden:
|
— |
testsuspensie: met teststof en entmateriaal; |
|
— |
entmateriaalblanco: met entmateriaal alleen; |
|
— |
procedurecontrole: met referentiestof en entmateriaal; |
|
— |
abiotische steriele controle: met teststof — steriel (zie 1.6.6.); |
|
— |
adsorptiecontrole: met teststof, entmateriaal en steriliserend middel; |
|
— |
toxiciteitscontrole: met teststof, referentiestof en entmateriaal. |
Het is beslist nodig de bepalingen in de testsuspensie en entmateriaalblanco parallel uit te voeren. Het is raadzaam de bepalingen in de andere kolf parallel te volgen.
Dit is echter wellicht niet altijd mogelijk. Men dient zich er van te vergewissen dat er voldoende monsters worden genomen of afgelezen om een bepaling van het percentage verwijdering in het venster van 10 dagen mogelijk te maken.
1.7. GEGEVENS EN EVALUATIE
Bij de berekening van Dt, percentage afbraak, worden de gemiddelde waarden van duplometingen van de parameter zowel in de testvaten als van de entmateriaalblanco gebruikt. De formules daarvoor zijn vermeld in de onderstaande hoofdstukken die op de afzonderlijke tests betrekking hebben. Het verloop van de afbraak wordt grafisch weergegeven en het 10-dagenvenster wordt aangegeven. Het percentage verwijdering dat na afloop van het 10-dagenvenster is bereikt en de waarde van het plateau of, indien van toepassing, aan het eind van de test, worden berekend en gerapporteerd.
Bij de respirometrische tests kunnen stikstof bevattende verbindingen door nitrificatie van invloed zijn op de opgenomen hoeveelheid zuurstof (zie Bijlagen II en V).
1.7.1. Afbraak gemeten door middel van DOC-bepaling
Op elk tijdstip van monsterneming moet het percentage afbraak (Dt) voor de kolven met teststof apart, aan de hand van gemiddelden van in duplo gemeten DOC-waarden, berekend worden; het doel hiervan is, de validiteit van de test te bevestigen (zie 1.5.2). Het percentage afbraak wordt met de volgende formule berekend :

waarin:
|
Dt |
= |
% afbraak op tijdstip t, |
|
Co |
= |
gemiddelde beginconcentratie van DOC in het geënte kweekmedium dat de teststof bevat (mg DOC/1), |
|
Ct |
= |
gemiddelde concentratie DOC in het geënte kweekmedium dat de teststof bevat op tijdstip t (mg DOC/l), |
|
Cbo |
= |
gemiddelde beginconcentratie van DOC in het blanco geënte anorganische medium (mg DOC/1), |
|
Cbt |
= |
gemiddelde concentratie van DOC in het blanco geënte anorganische medium op tijdstip t (mg DOC/1). |
Alle concentraties worden experimenteel gemeten.
1.7.2. Afbraak gemeten door middel van specifieke analyse
Wanneer de specifieke analytische gegevens beschikbaar zijn, wordt de primaire biologische afbraak berekend:
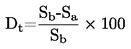
waarin:
|
Dt |
= |
% afbraak op tijdstip t, gewoonlijk 28 dagen, |
|
Sa |
= |
overblijvende hoeveelheid teststof in het entmedium aan het eind van de test (mg), |
|
Sb |
= |
overblijvende hoeveelheid teststof in de blanco test met water/medium waaraan alleen de teststof was toegevoegd (mg). |
1.7.3. Niet-biologische afbraak
Indien gebruik wordt gemaakt van een abiotische steriele controle, wordt het percentage niet-biologische afbraak berekend:

waarin:
|
Cs(o) |
= |
DOC concentratie in de steriele controle op dag 0 |
|
Cs(t) |
= |
DOC concentratie in de steriele controle op dag t |
1.8. RAPPORTAGE
Het testrapport bevat, voorzover mogelijk, de volgende gegevens:
|
— |
teststof en referentiestof en zuiverheid daarvan; |
|
— |
testomstandigheden; |
|
— |
entmateriaal: aard en plaats(en) van bemonstering, concentratie en eventuele preconditionering; |
|
— |
indien bekend, hoeveelheid en aard van industrieel afval dat in rioolwater aanwezig is; |
|
— |
testduur en testtemperatuur; |
|
— |
in geval van slecht oplosbare teststoffen, de uitgevoerde behandeling; |
|
— |
toegepaste testmethode; voor elke wijziging van de procedure dienen wetenschappelijke gronden en een toelichting te worden gegeven; |
|
— |
gegevensformulier; |
|
— |
alle eventueel waargenomen remmingsverschijnselen; |
|
— |
eventueel waargenomen niet-biologische afbraak; |
|
— |
specifieke analytisch-chemische gegevens, indien beschikbaar; |
|
— |
analytische gegevens over tussenproducten, indien beschikbaar; |
|
— |
de grafiek van het percentage afbraak tegen de tijd voor de teststof en de referentiestof; de aanloopfase, de afbraakfase, het 10-dagenvenster en de helling dienen duidelijk te zijn aangegeven (Bijlage I); indien de test aan de validiteitscriteria heeft voldaan, kan het gemiddelde van de percentages afbraak van de teststof bevattende kolven voor de grafiek gebruikt worden. |
|
— |
percentage verwijdering na het 10-dagenvenster, alsmede op het plateau of aan het eind van de test. |
DEEL II. DOC-AFVLAKKINGSTEST (Methode C.4-A)
II.1. PRINCIPE VAN DE METHODE
Een gemeten volume aan geënt anorganisch medium dat een bekende concentratie van de teststof (10-40 mg DOC/1) als de enige nominale bron van organische koolstof bevat wordt bij 22 ± 2 oC in het donker of in gedempt licht belucht.
De afbraak wordt door middel van DOC-analyse met regelmatige tussenpozen gedurende 28 dagen gevolgd. De mate van biologische afbraak wordt berekend doordat de concentratie aan verwijderde DOC (gecorrigeerd voor de DOC in de blanco-entmateriaalcontrole) als percentage van de aanvankelijk aanwezige concentratie wordt uitgedrukt. De mate van primaire biologische afbraak kan ook worden berekend uit een aanvullende chemische analyse die bij het begin en het eind van de incubatie wordt uitgevoerd.
II.2. BESCHRIJVING VAN DE METHODE
II.2.1. Apparatuur
|
a) |
Erlenmeyerkolven, bv. 250 ml tot 2 l, afhankelijk van het voor DOC-analyse benodigde volume; |
|
b) |
Schudmachine geschikt voor de erlenmeyers, hetzij met automatische temperatuurregeling, hetzij gebruikt in een kamer met constante temperatuur, en met een voldoende vermogen voor het in stand houden van aërobe omstandigheden in alle kolven; |
|
c) |
Filtratie-apparatuur met geschikte membranen; |
|
d) |
DOC-analyse-apparaat; |
|
e) |
Apparatuur voor het bepalen van opgeloste zuurstof; |
|
f) |
Centrifuge. |
II.2.2. Bereiding van anorganisch medium
Zie voor de bereiding van de voorraadoplossing 1.6.2.
10 ml oplossing a) wordt gemengd met 800 ml verdunningswater, daaraan wordt 1 ml van de oplossingen b) t/m d) toegevoegd en het geheel wordt met verdunningswater tot 1 l aangevuld.
II.2.3. Bereiding en preconditionering van entmateriaal
Het entmateriaal kan van diverse bronnen afkomstig zijn: actief slib, behandeld water, oppervlaktewater en grond of een mengsel daarvan.
Zie 1.6.4, 1.6.4.1, 1.6.4.2 en 1.6.5.
II.2.4. Bereiding van de proefoplossingen
Bij wijze van voorbeeld worden porties van 800 ml anorganisch medium in erlenmeyers van 2 liter gebracht en wordt in afzonderlijke kolven telkens een zodanig volume aan voorraadoplossingen van teststof en referentiestof gebracht dat een concentratie met een chemisch equivalent aan 10-40 mg DOC/l wordt verkregen. De pH wordt gecontroleerd en, zonodig, op 7,4 bijgesteld. De kolven worden geënt met actief slib of een andere bron van entmateriaal (zie 1.6.4) tot een uiteindelijke concentratie van niet meer dan 30 mg gesuspendeerde vaste stof per liter wordt verkregen. Tevens worden controles van entmateriaal in anorganisch medium, maar zonder test- of referentiestof, bereid.
Zo nodig wordt één kolf gebruikt om de eventuele remmende werking van een teststof te controleren door het enten van een oplossing die in het anorganische medium vergelijkbare concentraties van zowel de teststof als de referentiestof bevat.
Tevens wordt, indien nodig, een volgende steriele kolf ingericht voor de controle op de eventuele niet-biologische afbraak van de teststof door toepassing van een niet-geënte oplossing van de stof (zie 1.6.6).
Indien het vermoeden bestaat dat de teststof in belangrijke mate op glas, slib o.i.d. wordt geadsorbeerd, wordt bovendien in een voorafgaand onderzoek de waarschijnlijke mate van adsorptie en daarmee de geschiktheid van de test voor de desbetreffende stof bepaald (zie Tabel 1). Hiertoe wordt een kolf met de teststof, het entmateriaal en het steriliserend middel bereid.
In alle kolven wordt het volume met anorganisch medium tot 1 l aangevuld en na mengen wordt uit elke kolf een monster genomen ter bepaling van de beginconcentratie aan DOC (zie Bijlage II.4). De openingen van de kolven worden afgedekt, bij voorbeeld met aluminiumfolie, zodanig dat er een ongehinderde uitwisseling van lucht tussen de kolf en de omgevende atmosfeer kan plaatsvinden. Vervolgens worden de kolven op de schudmachine geplaatst en kan de test beginnen.
II.2.5. Aantal kolven in een doorsneeproef
Kolven 1 en 2: testsuspensie
Kolven 3 en 4: entmateriaalblanco
Kolf 5: procedurecontrole
bij voorkeur en zo nodig:
Kolf 6: abiotische steriele controle
Kolf 7: adsorptiecontrole
Kolf 8: toxiciteitscontrole
Zie ook I.6.7.
II.2.6. Uitvoering van de test
Gedurende de test worden met bepaalde tussenpozen de concentraties aan DOC in elke kolf in duplo bepaald, en wel zo vaak dat het begin van het 10-dagenvenster en het percentage verwijdering aan het eind van het 10-dagenvenster kunnen worden bepaald. Er wordt geen groter volume aan testsuspensie genomen dan voor elke bepaling nodig is.
Voordat een monster wordt genomen worden zo nodig verliezen door verdamping uit de kolven aangevuld door toevoeging van verdunningswater (1.6.1) in de vereiste hoeveelheid. Voordat een monster wordt onttrokken, wordt het kweekmedium grondig vermengd en wordt er zorg voor gedragen dat aan de wanden van de kolf hechtend materiaal wordt opgelost of gesuspendeerd.
Onmiddellijk nadat het monster is genomen wordt het met een membraan gefiltreerd of gecentrifugeerd (zie Bijlage II.4). De afgefiltreerde of gecentrifugeerde monsters worden op dezelfde dag geanalyseerd dan wel gedurende maximaal 48 uur bij 2-4 oC of langere tijd beneden - 18 oC bewaard.
II.3. GEGEVENS EN RAPPORTAGE
II.3.1. Verwerking van resultaten
Het percentage afbraak op tijdstip t wordt berekend zoals aangegeven bij 1.7.1 (DOC-bepaling) en, eventueel, bij 1.7.2 (specifieke analyse).
Alle resultaten worden op de daartoe bestemde gegevensformulieren ingevuld.
II.3.2. Geldigheid van de resultaten
Zie I.5.2.
II.3.3. Rapportage
Zie I.8.
II.4. GEGEVENSFORMULIER
Hieronder volgt een voorbeeld van een gegevensformulier.
DOC-AFVLAKKINGSTEST
|
1. |
LABORATORIUM |
|
2. |
DATUM AAN HET BEGIN VAN DE TEST |
3. TESTSTOF
Naam:
Concentratie voorraadoplossing: … mg/l als teststof
Beginconcentratie in het milieu, t0: …mg/l als teststof
4. ENTMATERIAAL
Herkomst:
Uitgevoerde behandeling:
Preconditionering, indien van toepassing:
Concentratie van gesuspendeerde vaste stof in reactiemengsel: mg/l
5. KOOLSTOFBEPALINGEN
Koolstofanalyse-apparaat:
|
|
Kolf nr. |
|
DOC na n dagen (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Teststof plus entmateriaal |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a, gem. Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b, gem. Cb(t) |
|
|
|
|
|
||
|
Blanco entmateriaal, zonder teststof |
3 |
c1 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
||
|
c, gem. Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d, gem. Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. EVALUATIE VAN VERKREGEN GEGEVENS
|
Kolf nr. |
|
% afbraak na n dagen |
||||
|
0 |
n1 |
n2 |
n3 |
n4 |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Gem. (3) |
|
0 |
|
|
|
|
Opmerking: soortgelijke formules kunnen worden gebruikt voor de referentiestof en toxiciteitscontroles.
7. NIET-BIOLOGISCHE CONTROLE (facultatief)
|
|
Tijd (dagen) |
|
|
0 |
t |
|
|
DOC.conc. (mg/l) in steriele controle |
Cs(o) |
Cs(t) |

8. SPECIFIEKE SCHEIKUNDIGE ANALYSE (facultatief)
|
|
resthoeveelheid teststof aan her einde van de test (mg/l) |
% primaire afbraak |
|
Steriele controle |
Sb |
|
|
Geënt testmedium |
Sa |
|
DEEL III. GEWIJZIGDE OESO-SCREENING TEST (Methode C.4-B)
III.1. PRINCIPE VAN DE METHODE
Een gemeten volume anorganisch medium dat een bekende concentratie teststof (10-40 mg DOC/1) als enige nominale bron van organische koolstof bevat wordt geënt met 0,5 ml effluent per liter medium. Het mengsel wordt in het donker of in gedempt licht bij 22 ± 2 oC belucht.
De afbraak wordt gedurende 28 dagen met regelmatige tussenpozen gevolgd door middel van DOC-analyse. De mate van biologische afbraak wordt berekend doordat de concentratie verwijderde DOC (gecorrigeerd voor de waarde in de blanco-entmateriaalcontrole) wordt uitgedrukt als percentage van de aanvankelijk aanwezige concentratie. De mate van primaire biologische afbraak kan ook worden berekend aan de hand van een aanvullende chemische analyse die aan het begin en aan het eind van de incubatie wordt uitgevoerd.
III.2. BESCHRIJVING VAN DE METHODE
III.2.1. Apparatuur
|
a) |
Erlenmeyerkolven, bv. 250 ml tot 2 l, afhankelijk van het voor DOC-analyse benodigde volume; |
|
b) |
Schudmachine — geschikt voor de erlenmeyers, hetzij met een automatische temperatuurregeling, hetzij gebruikt in een kamer met constante temperatuur, en met een zodanig vermogen dat in alle kolven aërobe omstandigheden kunnen worden gehandhaafd; |
|
c) |
Filtratie-apparatuur met geschikte membranen; |
|
d) |
DOC-analyse-apparaat; |
|
e) |
Apparatuur voor het bepalen van opgeloste zuurstof; |
|
f) |
Centrifuge. |
III.2.2. Bereiding van anorganisch medium
Zie voor de bereiding van de voorraadoplossing I.6.2.
10 ml van oplossing a) wordt gemengd met 800 ml verdunningswater, daaraan wordt 1 ml van de oplossingen b) t/m d) toegevoegd en het geheel wordt met verdunningswater tot 1 l aangevuld.
Bij deze methode wordt slechts 0,5 ml effluent/liter als entmateriaal gebruikt en daarom kan het nodig zijn het medium te versterken met spoorelementen en groeifactoren. Dit geschiedt door toevoeging van 1 ml van elk van de onderstaande oplossingen per liter uiteindelijk medium:
Spoorelementoplossing:
|
Mangaansulfaat-tetrahydraat, MnSO4. 4H2O |
39,9 mg |
|
Boorzuur, H3BO3 |
57,2 mg |
|
Zinksulfaat-heptahydraat, ZnSO4. 7H2O |
42,8 mg |
|
Ammoniumheptamolybdaat, (NH4)6Mo7O24 |
34,7 mg |
|
Fe-chelaat (FeCl3-ethyleendiaminetetraazijnzuur) |
100,0 mg |
|
Deze stoffen worden opgelost in verdunningswater en de oplossing wordt tot 1 000 ml met verdunningswater aangevuld. |
|
|
Vitamine-oplossing: |
|
|
Gistextract |
15,0 mg |
Het gistextract wordt opgelost in 100 ml verdunningswater De oplossing wordt gesteriliseerd door filtratie door een membraan van 0,2 micron of vers bereid.
III.2.3. Bereiding en preconditionering van entmateriaal
Het entmateriaal is afkomstig van het secundaire effluent van een zuiveringsinstallatie of een laboratoriuminstallatie die hoofdzakelijk huishoudelijk afvalwater ontvangt. Zie I.6.4.2 en I.6.5.
Hiervan wordt 0,5 ml per liter mineraal medium gebruikt.
III.2.4. Bereiding van de proefoplossingen
Bij wijze van voorbeeld worden porties van 800 ml anorganisch medium in erlenmeyers van 2 liter gebracht en wordt in de afzonderlijke kolven telkens een zodanig volume aan voorraadoplossingen van teststof en referentiestof toegevoegd dat een concentratie met een chemisch equivalent van 10-40 mg DOC/1 wordt verkregen. De pH-waarden worden gecontroleerd en, zonodig, op 7,4 bijgesteld. De kolven worden geënt met rioolwaterzuiveringseffluent in een hoeveelheid van 0,5 ml/liter (zie I.6.4.2). Tevens worden controles voor entmateriaal in het anorganische medium bereid zonder test- of referentiestof.
Zo nodig wordt één kolf gebruikt om de eventuele remmende werking van een teststof te controleren door het enten van een oplossing die in het anorganische medium vergelijkbare concentraties van zowel de teststof als de referentiestof bevat.
Tevens wordt, indien nodig, een volgende steriele kolf ingericht voor de controle op de eventuele niet-biologische afbraak van de teststof door toepassing van een niet-geënte oplossing van de stof (zie I.6.6).
Indien het vermoeden bestaat dat de teststof in belangrijke mate op glas, slib o.i.d. wordt geadsorbeerd, wordt bovendien in een voorafgaand onderzoek de waarschijnlijke mate van adsorptie en daarmee de geschiktheid van de test voor de desbetreffende stof bepaald (zie Tabel 1). Hiertoe wordt een kolf met de teststof, het entmateriaal en het steriliserend middel bereid.
In alle kolven wordt het volume met anorganisch medium tot 1 l aangevuld en na mengen wordt uit elke kolf een monster genomen ter bepaling van de beginconcentratie aan DOC (zie Bijlage II.4). De openingen van de kolven worden afgedekt, bijvoorbeeld met aluminiumfolie, zodanig dat er een ongehinderde uitwisseling van lucht tussen de kolf en de omgevende atmosfeer kan plaatsvinden. Vervolgens worden de kolven op de schudmachine geplaatst en kan de test beginnen.
III.2.5. Aantal kolven in een doorsneeproef
Kolven 1 en 2: testsuspensie
Kolven 3 en 4: entmateriaalblanco
Kolf 5: procedurecontrole
en bij voorkeur en zo nodig:
Kolf 6: abiotische steriele controle
Kolf 7: adsorptiecontrole
Kolf 8: toxiciteitscontrole
Zie ook I.6.7.
III.2.6. Uitvoering van de test
Gedurende de test worden met bepaalde tussenpozen de concentraties aan DOC in elke kolf in duplo bepaald, en wel zo vaak dat het begin van het 10-dagenvenster en het percentage verwijdering aan het eind van het 10-dagenvenster kunnen worden bepaald. Er wordt geen groter volume aan testsuspensie genomen dan voor elke bepaling nodig is.
Voordat een monster wordt genomen worden zo nodig verliezen door verdamping uit de kolven aangevuld door toevoeging van verdunningswater (I.6.1) in de vereiste hoeveelheid. Voordat een monster wordt onttrokken wordt het kweekmedium grondig vermengd en wordt er zorg voor gedragen dat aan de wanden van de kolf hechtend materiaal wordt opgelost of gesuspendeerd. Onmiddellijk nadat het monster is genomen wordt het met een membraan gefiltreerd of gecentrifugeerd (zie Bijlage II.4). De afgefiltreerde of gecentrifugeerde monsters worden op dezelfde dag geanalyseerd dan wel gedurende maximaal 48 uur bij 2-4 oC of langere tijd beneden - 18 oC bewaard.
III.3. GEGEVENS EN RAPPORTAGE
III.3.1. Verwerking van de resultaten
Het percentage afbraak op tijdstip t wordt berekend zoals aangegeven bij I.7.1 (DOC-bepaling) en, eventueel, bij I.7.2. (specifieke analyse).
Alle resultaten worden op de daartoe bestemde gegevensformulieren ingevuld.
III.3.2. Geldigheid van de resultaten
Zie I.5.2.
III.3.3. Rapportage
Zie I.8.
III.4. GEGEVENSFORMULIER
Hieronder wordt een voorbeeld van een gegevensformulier gegeven.
GEWIJZIGDE OESO-SCREENING TEST
|
1. |
LABORATORIUM |
|
2. |
DATUM AAN HET BEGIN VAN DE TEST |
3. TESTSTOF
Naam:
Concentratie voorraadoplossing: mg/l als teststof
Beginconcentratie in het milieu, t0: mg/l als teststof
4. ENTMATERIAAL
Herkomst:
Uitgevoerde behandeling:
Preconditionering, indien van toepassing:
Concentratie van gesuspendeerde vaste stof in reactiemengsel: mg/l
5. KOOLSTOFBEPALINGEN
Koolstofanalyse-apparaat:
|
|
Kolf nr. |
|
DOC na n dagen (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Teststof plus entmateriaal |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a, gem. Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b, gem. Cb(t) |
|
|
|
|
|
||
|
Blanco entmateriaal, zonder teststof |
3 |
c1 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
||
|
c, gem. Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d, gem. Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. EVALUATIE VAN VERKREGEN GEGEVENS
|
Kolf nr. |
|
% afbraak na n dagen |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Gem. (4) |
|
0 |
|
|
|
|
Opmerking: soortgelijke formules kunnen worden gebruikt voor de referentiestof en toxiciteitscontroles.
7. NIET-BIOLOGISCHE CONTROLE (facultatief)
|
|
Tijd (dagen) |
|
|
0 |
t |
|
|
DOC-conc. (mg/l) in steriele controle |
Cs(o) |
Cs(t) |

8. SPECIFIEKE SCHEIKUNDIGE ANALYSE (facultatief)
|
|
resthoeveelheid teststof aan her einde van de test (mg/l) |
% primaire afbraak |
|
Steriele controle |
Sb |
|
|
Geënt testmedium |
Sa |
|
DEEL IV. KOOLDIOXYDE CO2-ONTWIKKELINGTEST. (Methode C.4-C)
IV.1. PRINCIPE VAN DE METHODE
Een gemeten volume geënt anorganisch medium dat een bekende concentratie teststof (10-20 mg DOC of TOC/l) als enige nominale bron van organische koolstof bevat wordt belucht door doorleiden van kooldioxydevrije lucht met een geregelde snelheid, in het donker of in gedempt licht. De afbraak wordt gedurende 28 dagen gevolgd door bepaling van het geproduceerde kooldioxyde dat in barium- of natriumhydroxyde wordt afgevangen en door titratie van het resterende hydroxyde of als anorganische koolstof wordt gemeten. De hoeveelheid geproduceerd kooldioxyde uit de teststof (gecorrigeerd voor datgene dat afkomstig is van het blanco entmateriaal) wordt uitgedrukt als een percentage van ThCO2. De mate van biologische afbraak kan ook worden berekend aan de hand van een aanvullende DOC-analyse die aan het begin en aan het eind van de incubatie wordt uitgevoerd.
IV.2. BESCHRIJVING VAN DE METHODE
IV.2.1. Apparatuur
|
a) |
Kolven, inhoud 2-5 liter, elk voorzien van een beluchtingsbuis die tot onder in de kolf reikt en een uitgang; |
|
b) |
Magneetroerders, indien slecht oplosbare stoffen worden bepaald; |
|
c) |
Gas-absorptieflessen; |
|
d) |
Inrichting voor het regelen en meten van de luchtstroom; |
|
e) |
Apparatuur voor het uitwassen van kooldioxyde, voor het bereiden van lucht die vrij is van kooldioxyde; in plaats daarvan kan een mengsel van CO2-vrije zuurstof en CO2-vrije stikstof uit gascilinders in de juiste verhouding (20 % O2: 80 % N2) worden gebruikt; |
|
f) |
Inrichting voor het bepalen van kooldioxyde, hetzij titrimetrisch hetzij met behulp van een of ander analyse-apparaat voor anorganische koolstof; |
|
g) |
Inrichting voor membraanfiltratie (facultatief); |
|
h) |
DOC-analyse-apparaat (facultatief). |
IV.2.2. Bereiding van anorganisch medium
Zie voor de bereiding van de voorraadoplossingen, I.6.2.
10 ml van oplossing a) wordt gemengd met 800 ml verdunningswater, daaraan wordt 1 ml van de oplossingen b) t/m d) toegevoegd en het geheel wordt met verdunningswater tot 1 l aangevuld.
IV.2.3. Bereiding en preconditionering van entmateriaal
Het entmateriaal kan van diverse bronnen afkomstig zijn: actief slib, behandeld water, oppervlaktewater en grond of een mengsel daarvan.
Zie I.6.4,I.6.4.1, I.6.4.2 en I.6.5.
IV.2.4. Bereiding van de proefoplossingen
Bij wijze van voorbeeld geven de onderstaande volumes en gewichten de waarden aan voor 5-literkolven die 3 1 suspensie bevatten. Indien kleinere volumes worden gebruikt, worden de waarden dienovereenkomstig aangepast, maar er dient op te worden toegezien dat het gevormde kooldioxyde nauwkeurig kan worden gemeten.
In elke 5-literkolf wordt 2 400 ml anorganisch medium gebracht. Daaraan wordt een zodanig volume van het bereide actieve slib (zie I.6.4.1 en I.6.5) toegevoegd dat een concentratie aan gesuspendeerde deeltjes van niet meer dan 30 mg/l in het uiteindelijke 3 1 geënt mengsel wordt verkregen. In plaats daarvan kan eerst het bereide slib worden verdund tot een suspensie van 500-1 000 mg/l in het anorganische medium voordat een berekende hoeveelheid daarvan aan de 2 400 ml anorganisch medium in de 5-literkolf wordt toegevoegd om een concentratie van 30 mg/l in het uiteindelijke 3 1 proefvolume te verkrijgen. Dit gaat gepaard met een grotere nauwkeurigheid. Ook andere bronnen van entmateriaal kunnen worden gebruikt (zie I.6.4.2).
De geënte mengsels worden gedurende een nacht belucht met CO2-vrije lucht zodat kooldioxyde uit het systeem wordt verwijderd.
In telkens een aantal gelijke kolven worden afzonderlijk testmateriaal en referentiestof als gekende volumes voorraadoplossingen toegevoegd tot concentraties als gevolg van de toegevoegde stoffen van 10 tot 20 mg DOC of TOC/1; enkele kolven blijven zonder toevoeging van chemicaliën en dienen als controle op het entmateriaal. Slecht oplosbare teststoffen worden rechtstreeks in de kolven gebracht op basis van gewicht of volume of worden behandeld als beschreven in Bijlage III.
Zo nodig wordt één kolf gebruikt voor de controle op het eventuele remmende effect van de teststof waarbij zowel de teststof als de referentiestof in dezelfde concentraties als in de andere kolven worden toegevoegd.
Tevens wordt indien nodig een steriele kolf gebruikt voor de controle op de eventuele niet-biologische afbraak van de teststof, waarbij een niet-geënte oplossing van de stof wordt gebruikt (zie I.6.6). Steriliseren door toevoeging van een giftige stof met de geschikte concentratie.
Het volume van de suspensies wordt in alle kolven aangevuld tot 3 1 door toevoeging van anorganisch medium dat vooraf met CO2-vrije lucht is belucht. Eventueel kunnen monsters worden getrokken voor analyse van DOC (zie Bijlage II.4) en/of specifieke analyse. De absorptieflessen worden aangesloten op de luchtuitgangen van de kolven.
Indien bariumhydroxyde wordt gebruikt, worden drie absorptiekolven, die elk 100 ml 0,0125 M bariumhydroxyde-oplossing bevatten, in serie op elke 5-literkolf aangesloten. De oplossing moet vrij van neergeslagen sulfaat en carbonaat zijn en de concentratie moet vlak voor gebruik worden bepaald. Indien natriumhydroxyde wordt gebruikt, worden twee vallen aangesloten, waarbij de tweede dient als controle om aan te tonen dat alle kooldioxyde in de eerste is geabsorbeerd. Bruikbaar zijn absorptiekolven die zijn voorzien van sluitingen voor serumflessen. In elke kolf wordt 200 ml 0,05 M natriumhydroxyde gebracht, welke hoeveelheid voldoende is voor het absorberen van de totale hoeveelheid kooldioxyde die bij volledige afbraak van de teststof wordt ontwikkeld. De natriumhydroxyde-oplossing zal echter, zelfs indien deze vers is bereid, sporen carbonaten bevatten; dit wordt gecorrigeerd door aftrek van het carbonaat in de blanco.
IV.2.5. Aantal kolven in een doorsneeproef
Kolven 1 en 2: testsuspensie
Kolven 3 en 4: entmateriaalblanco
Kolf 5: procedurecontrole
en bij voorkeur en zo nodig:
Kolf 6: abiotische steriele controle
Kolf 7: toxiciteitscontrole
Zie ook I.6.7.
IV.2.6. Uitvoering van de test
De test wordt gestart doordat CO2-vrije lucht met een snelheid van 30-100 ml/min door de suspensies wordt geborreld. Van tijd tot tijd worden monsters van het kooldioxyde absorberende materiaal genomen voor analyse van het CO2-gehalte. Tijdens de eerste tien dagen verdient het aanbeveling elke tweede of derde dag analyses uit te voeren en vervolgens elke vijfde dag tot de 28stc dag zodat het 10-dagenvenster kan worden vastgesteld.
Op de 28ste dag worden (indien van toepassing) monsters getrokken voor DOC-analyse en/of specifieke analyse, wordt de pH van de suspensies gemeten en wordt aan elke kolf 1 ml geconcentreerd zoutzuur toegevoegd; de kolven worden gedurende een nacht belucht teneinde het in de testsuspensies aanwezige kooldioxyde te verdrijven. Op dag 29 wordt de laatste analyse van vrijgekomen kooldioxyde gemaakt.
Op de dagen van CO2-meting wordt de absorptiefles voor bariumhydroxyde die het dichtst bij de kolf staat, losgekoppeld en wordt de hydroxyde-oplossing getitreerd met 0,05 M HC1 met fenolftaleïne als indicator. De overige absorptieflessen worden een plaats dichter bij de kolf gebracht en er wordt een nieuwe absorptiefles met daarin 100 ml vers 0,0125 M bariumhydroxyde aan het eind van de reeks geplaatst. De titraties worden uitgevoerd wanneer dat nodig is, bijvoorbeeld wanneer in de eerste val een aanzienlijke hoeveelheid neerslag wordt waargenomen en voordat er in de tweede val een duidelijke neerslag is, of ten minste wekelijks. In het andere geval wordt, wanneer NaOH absorptiemiddel is, met een spuit een klein monster (afhankelijk van de kenmerken van de gebruikte koolstof-analysator) van de natriumhydroxyde-oplossing in de absorptiefles die het dichtst bij de kolf staat, getrokken. Het monster wordt in het IC-gedeelte van het koolstofanalyse-apparaat gespoten en rechtstreeks geanalyseerd op ontwikkelde kooldioxyde.
De inhoud van de tweede val wordt alleen aan het eind van de test geanalyseerd ter correctie van eventuele overdracht van kooldioxyde.
IV.3. GEGEVENS EN RAPPORTAGE
IV.3.1. Verwerking van de resultaten
De hoeveelheid in een absorptiefles afgevangen CO2 die wordt getitreerd komt overeen met:
mgCO2 = (100 × CB –0,5 × V × CA) × 44
waarin:
|
V |
= |
volume HCl dat is gebruikt voor het titreren van de 100 ml in de absorptiefles (ml), |
|
CB |
= |
concentratie bariumhydroxyde-oplossing (M), |
|
CA |
= |
concentratie zoutzuuroplossing (M), |
en, indien CB0,0125 M en CA0,05 M is, is de getitreerde hoeveelheid voor 100 ml bariumhydroxyde 50 ml en wordt het gewicht aan CO2 gegeven door:

In dit geval bedraagt dus de factor voor het herleiden van het getitreerde volume HCl tot geproduceerde mg CO21,1.
Het CO2-gewicht dat afkomstig is uit alleen het entmateriaal en dat wat afkomstig is van het entmateriaal plus de teststof worden berekend met de desbetreffende titratiewaarden en het verschil is het gewicht aan CO2 dat alleen door de teststof is geproduceerd.
Indien bijvoorbeeld het entmateriaal alleen een titratie van 48 ml en het entmateriaal plus teststof 45 ml geeft, dan geldt:
CO2 uit entmateriaal = 1,1 × (50-48) = 2,2 mg
CO2 uit entmateriaal plus teststof = 1,1 × (50-45) = 5,5 mg
en derhalve bedraagt het gewicht aan CO2 dat door teststof is produceerd 3,3 mg.
Het percentage biologische afbraak wordt berekend uit:
![]()
of,
![]()
waarbij 3,67 de omrekeningsfactor (44/12) van koolstof naar kooldioxyde is.
Het percentage afbraak na elk tijdsinterval wordt verkregen door optellen van het percentage van ThCO2-waarden dat voor elk van de dagen, tot het tijdstip waarop het is gemeten, is berekend.
Voor natriumhydroxyde-absorptieflessen wordt de hoeveelheid geproduceerd kooldioxyde berekend en uitgedrukt als IC (mg) door vermenigvuldiging van de concentratie IC in het absorptiemiddel met het volume van het absorptiemiddel.
Het percentage afbraak wordt berekend uit:
![]()
De verwijdering van DOC (indien van toepassing) wordt berekend zoals beschreven onder 1.7. Deze en alle andere resultaten worden op het beschikbare gegevensformulier vermeld.
IV.3.2. Geldigheid van de resultaten
Het IC-gehalte van de suspensie van teststof in het anorganische medium aan het begin van de test moet minder dan 5 % bedragen van de TC en de totale CO2-ontwikkeling in de entmateriaal-blanco aan het eind van de test mag doorgaans niet meer dan 40 mg/l medium bedragen. Indien waarden van meer dan 70 mg CO2/1 worden verkregen, dienen de gegevens en de proefopzet kritisch te worden onderzocht.
Zie ook I.5.2.
IV.3.3. Rapportage
Zie I.8.
IV.4. GEGEVENSFORMULIER
Hieronder volgt een voorbeeld van een gegevensformulier.
KOOLDIOXYDE (CO2) -ONTWIKKELINGTEST
|
1. |
LABORATORIUM |
|
2. |
DATUM AAN HET BEGIN VAN DE TEST |
3. TESTSTOF
Naam:
Concentratie voorraadoplossing: mg/l als teststof
Beginconcentratie in het milieu: mg/l als teststof
Totale C aan kolf toegevoegd: mg C
ThCO2: mg CO2
4. ENTMATERIAAL
Herkomst:
Uitgevoerde behandeling:
Preconditionering, indien van toepassing:
Concentratie van gesuspendeerde vaste stof in reactiemengsel: mg/l
|
5. |
KOOLDIOXYDEPRODUKTIE EN AFBREEKBAARHEID: |
Methode: Ba(OH)2/NaOH/andere
|
Tijd (dag) |
Gevormde CO2 test (mg) |
Gevormde CO2 blanco (mg) |
Gevormde CO2 cumulatief (mg) (test minus blanco gem.) |
% ThCO2
|
|||||
|
1 2 |
gem |
3 4 |
gem. |
1 |
2 |
1 |
2 |
gem. |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
n1 |
|
|
|
|
|
|
|
|
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
n3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
Opmerking: soortgelijke schema's kunnen worden gebruikt voor de referentiestof en voor toxiciteitscontroles.
6. KOOLSTOFANALYSE (facultatief)
Koolstofanalyse-apparaat:
|
Tijd (dag) |
Blanco mg/l |
Teststof mg/l |
|
0 |
Cb(o) |
Co |
|
28 (5) |
Cb(t) |
Ct |

7. NIET-BIOLOGISCHE AFBRAAK (facultatief)

DEEL V. MANOMETRISCHE RESPIROMETRIETEST (Methode C.4-D)
V.1. PRINCIPE VAN DE METHODE
Een gemeten volume geënt anorganisch medium dat een bekende concentratie teststof (100 mg/l teststof die ten minste 50-100 mg ThOD/l geeft) als enige nominale bron van organische koolstof bevat, wordt gedurende ten hoogste 28 dagen in een gesloten kolf bij een constante temperatuur (± 1 oC of minder) geroerd. Het gebruik aan zuurstof wordt bepaald hetzij door meten van hoeveelheid zuurstof (elektrolytisch geproduceerd) die nodig is om in de respirometerkolf een constant gasvolume te behouden, hetzij op grond van de verandering van het volume of van de druk (of een combinatie daarvan) in de apparatuur. Ontwikkelde kooldioxyde wordt geabsorbeerd in een oplossing van kaliumhydroxyde of een ander geschikt absorptiemiddel. De hoeveelheid door de teststof opgenomen zuurstof (gecorrigeerd voor opneming door de parallel behandelde blanco-entstof) wordt uitgedrukt als percentage ThOD of COD. Facultatief kan de primaire biologische afbraak worden berekend uit de aanvullende specifieke analyse die aan het begin en aan het einde van de incubatie wordt uitgevoerd, en de totale afbraak door DOC-analyse.
V.2. BESCHRIJVING VAN DE METHODE
V.2.1. Apparatuur
|
a) |
geschikte respirometer; |
|
b) |
temperatuurregeling, constant op ± 1 oC of beter; |
|
c) |
membraan-filtratie-inrichting (facultatief); |
|
d) |
koolstof analyse-apparaat (facultatief). |
V.2.2. Bereiding van anorganisch medium
Zie voor de bereiding van de voorraadoplossingen I.6.2.
10 ml van oplossing a) wordt gemengd met 800 ml verdunningswater, daaraan wordt 1 ml van de oplossingen b) t/m d) toegevoegd en het geheel wordt met verdunningswater tot 1 1 aangevuld.
V.2.3. Bereiding en preconditionering van entmateriaal
Het entmateriaal kan van diverse bronnen afkomstig zijn: actief slib, behandeld water, oppervlaktewater en grond of een mengsel daarvan.
Zie I.6.4., I.6.4.1., I.6.4.2. en I.6.5.
V.2.4. Bereiding van de proefoplossingen
Oplossingen van de teststof en referentiestof worden afzonderlijk in anorganisch medium, uitgaande van voorraadoplossingen, bereid in een hoeveelheid die doorgaans overeenkomt met een concentratie van 100 mg chemische stof/l (overeenkomend met ten minste 50-100 mg ThOD/1),
Het ThOD wordt berekend op basis van de vorming van ammoniumzouten, tenzij nitrificatie moet worden verwacht, in welk geval de berekening moeten worden gebaseerd op nitraatvorming (zie Bijlage II.2).
De pH-waarden worden bepaald en zonodig bijgesteld op 7,4±0,2.
Slecht oplosbare stoffen dienen pas in een later stadium te worden toegevoegd (zie hieronder).
Indien de giftigheid van de teststof moet worden bepaald, wordt nog een oplossing in anorganisch medium bereid welke zowel de teststof als de referentiestof in dezelfde concentraties als in de afzonderlijke oplossingen bevat.
Indien meting van de fysisch-chemische zuurstofopname nodig is, wordt een oplossing van de teststof die door toevoeging van een geschikte giftige stof gesteriliseerd is (zie I.6.6) in een hoeveelheid van gewoonlijk 100 mg ThOD/1 bereid.
Het benodigde volume van oplossingen van de teststof en de referentiestof wordt ten minste in duplo in kolven gebracht. In volgende kolven wordt alleen anorganisch medium gebracht (voor entstof controles) en, zo nodig, de gemengde oplossing van teststof en referentiestof en de steriele oplossing.
Indien de teststof slecht oplosbaar is wordt deze in dit stadium rechtstreeks toegevoegd op basis van gewicht of volume of wordt deze behandeld als beschreven in Bijlage III. Aan de compartimenten van het CO2-absorptie-apparaat worden kaliumhydroxyde, natronkalkpillen of een ander absorptiemiddel toegevoegd.
V.2.5. Aantal kolven in een doorsnee-proef
Kolven 1 en 2: testsuspensie
Kolven 3 en 4: entmateriaalblanco
Kolf 5: procedurecontrole
bij voorkeur en zo nodig:
Kolf 6: steriele controle
Kolf 7: toxiciteitscontrole
Zie I.6.7.
V.2.6. Uitvoering van de test
De kolven worden op de gewenste temperatuur gebracht en de daartoe bestemde kolven worden geënt met bereid actief slib of een andere bron van entmateriaal tot een concentratie aan gesuspendeerde vaste stof van niet meer dan 30 mg/l. De apparatuur wordt in gereedheid gebracht, de roerder wordt aangezet, het geheel wordt gecontroleerd op luchtdichtheid en de meting van de zuurstofopname wordt gestart. Gewoonlijk is dan geen verdere aandacht nodig behalve voor de nodige aflezingen en voor de dagelijkse controle op de juiste temperatuur en het juiste roeren.
De zuurstofopname wordt met behulp van de door de fabrikant van de apparatuur verstrekte methoden berekend uit de met regelmatige tussenpozen verrichte aflezingen. Aan het eind van de incubatie, gewoonlijk na 28 dagen, wordt de pH van de inhoud van de kolven gemeten, in het bijzonder indien de opgenomen hoeveelheid zuurstof lager is danwel hoger is dan ThODNH4 (voor stikstof bevattende verbindingen).
Indien nodig worden aan het begin en aan het eind monsters uit de respirometerkolven genomen voor analyse van DOC of specifieke chemische stof (zie Bijlage II.4). Bij monsterneming aan het begin dient er voor te worden gezorgd dat het volume van de in de kolf achterblijvende testsuspensie bekend is. Wanneer door een N-bevattende teststof zuurstof wordt opgenomen, wordt de toename van de concentratie nitriet en nitraat in 28 dagen bepaald en wordt de correctie voor de door nitrificatie verbruikte zuurstof berekend (Bijlage V).
V.3. GEGEVENS EN RAPPORTAGE
V.3.1. Verwerking van de resultaten
De opgenomen hoeveelheid zuurstof (mg) van de teststof na een bepaalde tijd (die is gecorrigeerd voor de blanco entstofcontrole na dezelfde tijd) wordt gedeeld door het gewicht van de onderzochte teststof. Dit geeft het BOD die is uitgedrukt als mg zuurstof/mg teststof, d.w.z.
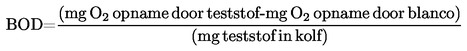
= mg O2 per mg teststof.
Het percentage biologische afbraak wordt berekend hetzij uit:

hetzij uit
![]()
Opgemerkt dient te worden dat deze twee methoden niet noodzakelijk dezelfde waarde geven; bij voorkeur wordt de eerstgenoemde methode gebruikt.
Voor teststoffen die stikstof bevatten wordt het geschikte ThOD (NH4 of NO3) gebruikt, afhankelijk van hetgeen bekend is of verwacht wordt omtrent het optreden van nitrificatie (Bijlage II.2). Indien nitrificatie optreedt maar niet volledig is, wordt uit de verandering in concentraties nitriet en nitraat een correctie berekend voor de door de nitrificatie verbruikte zuurstof (Bijlage V).
Wanneer facultatieve bepalingen van organische koolstof en/of specifieke chemische stof worden uitgevoerd, wordt het percentage afbraak berekend zoals beschreven is onder I.7.
Alle resultaten worden op de bijgevoegde gegevensformulieren vermeld.
V.3.2. Geldigheid van de resultaten
De hoeveelheid opgenomen zuurstof van de entmateriaalblanco bedraagt normaal 20-30 mg O2/l en mag in 28 dagen niet groter zijn dan 60 mg/l. Waarden hoger dan 60 mg/l nopen tot een kritisch onderzoek van de gegevens en de experimentele technieken. Indien de pH-waarde buiten het gebied 6-8,5 ligt en het zuurstofverbruik door de reststof minder dan 60 % bedraagt, dient de test te worden herhaald met een lagere concentratie teststof.
Zie ook I.5.2.
V.3.3. Rapportage
Zie I.8.
V.4. GEGEVENSFORMULIER
Hieronder volgt een voorbeeld van een gegevensformulier.
MANOMETRISCHE RESPIROMETRIETEST
|
1. |
LABORATORIUM |
|
2. |
DATUM AAN HET BEGIN VAN DE TEST |
3. TESTSTOF
Naam:
Concentratie voorraadoplossing: … mg/l
Beginconcentratie in het milieu, Co: … mg/l
Volume in de testkolf (V): … ml
ThOD stof/COD stof: … mg O2/mg (NH4, NO3)
4. ENTMATERIAAL
Herkomst:
Uitgevoerde behandeling:
Preconditionering, indien van toepassing:
Concentratie van gesuspendeerde vaste stof in reactiemengsel: mg/l
5. ZUURSTOFOPNAME: BIOLOGISCHE AFBREEKBAARHEID
|
|
Zeit (Tage) |
||||||||||||
|
0 |
|
7 |
|
14 |
|
|
21 |
|
|
28 |
|
||
|
O2 opname (mg) teststof |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a, gem. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 opname (mg) blanco |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b, gem. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gecorrigeerde BOD (mg) |
(a1 — bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
(a2 — bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOD per mg teststof |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% afbraak
|
D1 (a1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
D2 (a2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gem. (6) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V = volume medium in testkolf. |
|||||||||||||
N.B.: Soortgelijke schema's kunnen worden gebruikt voor de referentiestof en de toxiciteitscontroles.
6. CORRECTIE VOOR NITRIFICATIE (zie Bijlage V)
|
Dag |
0 |
28 |
Verschil |
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
— |
— |
|
7. KOOLSTOFANALYSE (facultatief)
Koolstofanalyseapparaat:
|
Tijd (dag) |
Blanco mg/l |
Teststof mg/1 |
|
0 |
(Cblo) |
(Co) |
|
28 (7) |
(Cblt) |
(Ct) |

8. SPECIFIEKE CHEMISCHE ANALYSE (facultatief)
|
Sb |
= |
concentratie in fysisch-chemische (steriele) controle na 28 dagen. |
|
Sa |
= |
concentratie in de geënte kolf na 28 dagen. |

9. NIET-BIOLOGISCHE AFBRAAK (facultatief)
|
a |
= |
zuurstofverbruik in steriele kolven na 28 dagen, (mg) |

(zie afdelingen 1 en 3)

DEEL VI. GESLOTEN-FLESTEST (Methode C.4-E)
VI.1. PRINCIPE VAN DE METHODE
De oplossing van de teststof in anorganisch medium, doorgaans met een concentratie van 2-5 mg/l, wordt geënt met een betrekkelijk gering aantal micro-organismen uit een gemengde populatie en wordt bij constante temperatuur in het donker in volledig gevulde, afgesloten flessen gehouden. De afbraak wordt gevolgd door analyse van opgeloste zuurstof gedurende 28 dagen. De door de teststof opgenomen hoeveelheid zuurstof, die wordt gecorrigeerd voor de opname door de parallel onderzochte blanco voor het entmateriaal, wordt uitgedrukt als percentage ThOD of COD.
VI.2. BESCHRIJVING VAN DE METHODE
VI.2.1. Apparatuur
|
a) |
BOD-flessen met glazen stoppen, bv. 250-350 ml; |
|
b) |
Waterbad of broedapparaat, voor het op constante temperatuur (± 1 oC of beter) houden van de flessen, met uitsluiting van licht; |
|
c) |
Grote glazen flessen (2-5 l) voor de bereiding van medium en voor het aanvullen van de BOD-flessen; |
|
d) |
Zuurstofelektrode en meter, of apparatuur en reagentia voor Winkler-titratie. |
VI.2.2. Bereiding van anorganisch medium
Zie voor de bereiding van de voorraadoplossing I.6.2.
1 (een) ml van oplossingen a) t/m d) wordt gemengd en het mengsel wordt met verdunningswater tot 11 aangevuld.
VI.2.3. Bereiding van het entmateriaal
Het entmateriaal is normaal afkomstig van het secundaire effluent van een zuiveringsinstallatie of een laboratoriuminstallatie die hoofdzakelijk huishoudelijk afvalwater ontvangt. Een alternatieve bron van entmateriaal is oppervlaktewater. Gewoonlijk wordt één druppel (0,05 ml) tot 5 ml filtraat per liter medium gebruikt; voorafgaandelijke proeven kunnen nodig zijn om het optimaal volume voor een gegeven effluent te bepalen (zie I.6.4.2 en I.6.5).
VI.2.4. Bereiding van de proefoplossingen
Anorganisch medium wordt gedurende ten minste 20 min krachtig belucht. Elke testreeks wordt met uit dezelfde voorraad afkomstig mineraal medium uitgevoerd. In het algemeen is het medium na 20 uur staan bij de testtemperatuur voor gebruik gereed. Ter controle wordt de concentratie opgeloste zuurstof bepaald; de waarde dient bij 20 oC ongeveer 9 mg/l te zijn. Alle overbreng- en aanvulhandelingen van het met lucht verzadigde medium dienen zonder bellen, bijvoorbeeld door gebruik van hevels, te worden uitgevoerd.
Voor de bepaling van de teststof en referentiestof in gelijktijdige proefseries worden parallelle groepen van BOD-flessen bereid. Een voldoende aantal BOD-flessen, waaronder entmateriaalblanco's worden gereed gemaakt zodat op de gewenste tijdstippen, bijvoorbeeld na 0, 7, 14, 21 en 28 dagen, ten minste duplo-metingen van het zuurstofgebruik kunnen worden gedaan. Om het 10-dagen venster met zekerheid te kunnen vaststellen kunnen meer flessen nodig zijn.
In grote flessen wordt volledig belucht anorganisch medium gebracht, zodanig dat de flessen voor ongeveer een derde gevuld zijn. Vervolgens wordt in afzonderlijke grote flessen zoveel van de voorraadoplossingen van de teststof en referentiestof gebracht dat de uiteindelijke concentratie van de stoffen niet meer dan ongeveer 10 mg/l is. Aan het blancocontrolemedium dat in een andere grote fles aanwezig is, wordt geen chemische stof toegevoegd.
Teneinde zekerheid te geven dat de activiteit van het entmateriaal niet beperkend is, mag de concentratie opgeloste zuurstof in de BOD-flessen niet lager dan 0,5 mg/l zijn. Dit beperkt de concentratie van de teststof tot ongeveer 2 mg/l. Van slecht afbreekbare teststoffen en van teststoffen met een lage ThOD kan echter 5-10 mg/l worden gebruikt. In sommige gevallen kan het raadzaam zijn twee parallelle reeksen van de teststof bij twee verschillende concentraties, bijvoorbeeld 2 en 5 mg/l uit te voeren. Als regel wordt de ThOD op grond van de vorming van ammoniumzouten berekend, maar indien verwacht wordt of bekend is dat nitrificatie optreedt, wordt de berekening uitgevoerd op basis van de vorming van nitraat (ThODNO3: zie Bijlage II.2). Indien nitrificatie evenwel niet volledig is of niet optreedt, wordt gecorrigeerd voor de veranderingen in concentratie nitriet en nitraat, zoals door analyse is vastgesteld (zie Bijlage V).
Indien de toxiciteit van de teststof moet worden onderzocht (bijvoorbeeld in het geval dat eerder een lage waarde voor de biologische afbreekbaarheid is gevonden) is een volgende reeks flessen nodig.
Een volgende grote fles wordt gevuld met belucht anorganisch medium (tot ongeveer een derde van het volume) plus teststof en referentiestof met uiteindelijke concentraties die als regel dezelfde zijn als die in de andere grote flessen.
De oplossingen in de grote flessen worden met secundair effluent (een druppel of ongeveer 0,05 ml, tot 5 ml/l) of met een andere bron, zoals rivierwater geënt (zie I.6.4.2). Tenslotte worden de oplossingen met belucht anorganisch medium tot het eindvolume aangevuld met behulp van een hevel die met het oog op een voldoende menging tot op de bodem van de fles reikt.
VI.2.5. Aantal kolven in een doorsneeproef
In een doorsneebepaling worden de volgende flessen gebruikt:
|
— |
ten minste 10 die teststof en entmateriaal bevatten (testsuspensie), |
|
— |
ten minste 10 met alleen entmateriaal (entmateriaalblanco), |
|
— |
ten minste 10 met referentiestof en entmateriaal (procedurecontrole), |
|
— |
en, zonodig 6 flessen met teststof, referentiestof en entmateriaal (toxiciteitscontrole). Om zekerheid te geven dat het 10-dagen venster kan worden vastgesteld zal ongeveer het dubbele aantal flessen nodig zijn. |
VI.2.6. Uitvoering van de test
Elke bereide oplossing wordt met behulp van een hevel uit het onderste kwart (niet de bodem) van de desbetreffende grote fles onmiddellijk in de bijbehorende groep BOD-flessen overgebracht, zodat alle BOD-flessen volledig gevuld zijn. Er wordt zachtjes op de kolven geklopt om eventuele luchtbellen te verwijderen. De flessen van het tijdstip nul worden onmiddellijk op opgeloste zuurstof onderzocht met behulp van de Winkler-methode of met elektrodemethoden. De inhoud van de flessen kan met het oog op latere analyse via de Winkler-methode worden bewaard door toevoeging van mangaan(II)sulfaat en natriumhydroxyde (het eerste Winkler-reagens). De zorgvuldig afgesloten flessen die de zuurstof als bruin gehydrateerd mangaan(III)oxyde gefixeerd bevatten, worden gedurende niet langer dan 24 uur bij 10-20 oC in het donker bewaard, voordat de overige stappen van de Winkler-methode worden uitgevoerd. De overige herhalingsflessen worden afgesloten zodanig dat er geen luchtbellen worden opgesloten en worden in het donker bij 20 oC geïncubeerd. Elke reeks moet vergezeld gaan van een volledige parallelreeks voor de bepaling van het geënte blanco-medium. Voor analyse van opgelost zuurstof op gezette tijden (ten minste wekelijks) gedurende de bebroeding van 28 dagen wordt van elke reeks ten minste één duplofles genomen.
Wekelijkse monsterneming is voldoende voor de bepaling van het percentage verwijdering in een 14-dagenvenster, terwijl een bemonstering om de 3-4 dagen het vaststellen van een 10-dagenvenster mogelijk maakt, waarbij ongeveer tweemaal zoveel flessen nodig zijn.
Voor stikstof bevattende teststoffen moeten correcties voor de door eventueel optredende nitrificatie veroorzaakte zuurstofopname worden uitgevoerd. Hiertoe wordt de methode met de O2-elektrode toegepast voor de bepaling van de concentratie opgeloste zuurstof, waarna uit de BOD-fles een monster wordt genomen voor analyse van nitriet en nitraat. Uit de toename van de concentratie nitriet en nitraat wordt de gebruikte hoeveelheid zuurstof berekend (zie Bijlage V).
VI.3. GEGEVENS EN RAPPORTAGE
VI.3.1. Verwerking van de resultaten
Allereerst wordt het BOD dat na elk tijdstip is opgetreden berekend door aftrekken van de zuurstofafname (mg O2/l) van de entmateriaal-blanco van de afname als gevolg van de teststof. Deze gecorrigeerde afname wordt gedeeld door de concentratie (mg/l) van de teststof waarbij het specifieke BOD als mg zuurstof per mg teststof wordt verkregen. Het percentage biologische afbreekbaarheid wordt berekend door het specifieke BOD door het specifieke ThOD (dat is berekend volgens Bijlage II.2) of COD (door analyse bepaald, zie Bijlage II.3) te delen, dus:

= mg O2 per mg teststof.
![]()
ofwel
![]()
Opgemerkt dient te worden dat deze twee methoden niet dezelfde uitkomst behoeven te geven; het gebruik van de eerste methode heeft de voorkeur.
Voor teststoffen die stikstof bevatten wordt het geschikte ThOD (NH4 of NO3) gebruikt, afhankelijk van hetgeen bekend is of verwacht wordt omtrent het optreden van nitrificatie (Bijlage II.2). Indien nitrificatie optreedt maar niet volledig is, wordt uit de verandering in concentraties nitriet en nitraat een correctie berekend voor de door nitrificatie verbruikte zuurstof (zie Bijlage V).
VI.3.2. Geldigheid van de resultaten
De afname van de hoeveelheid zuurstof in de entmateriaal-blanco mag na 28 dagen niet meer dan 1,5 mg opgeloste zuurstof/l bedragen. Bij hogere waarden dan deze moeten de experimentele technieken worden doorgelicht. De restconcentratie zuurstof in de testflessen mag nooit minder dan 0,5 mg/l worden. Dergelijke lage zuurstofconcentraties zijn slechts geldig, indien met de methode waarmee opgeloste zuurstof wordt bepaald dergelijke concentraties nauwkeurig kunnen worden gemeten.
Zie ook I.5.2.
VI.3.3. Rapportage
Zie I.8.
VI.4. GEGEVENSFORMULIER
Hieronder volgt een voorbeeld van een gegevensformulier
GESLOTEN-FLESTEST
|
1. |
LABORATORIUM |
|
2. |
DATUM AAN HET BEGIN VAN DE TEST |
3. TESTSTOF
Naam:
Concentratie voorraadoplossing: … mg/l
Beginconcentratie in de fles: … mg/l
ThOD/COD: … mg O2/mg teststof
4. ENTMATERIAAL
Herkomst:
Uitgevoerde behandeling:
Preconditionering, indien van toepassing:
Concentratie in reactiemengsel: ml/l
5. DO-BEPALING
Methode: Winkler/elektrode
Analyses kolven
|
Duur van incubatie (d) |
DO (mg/l) |
|||||
|
0 |
n1 |
n2 |
|
|||
|
Blanco (zonder stof) |
1 |
C1 |
|
|
|
|
|
2 |
C2 |
|
|
|
|
|
|
Gem. |
|
|
|
|
|
|
|
Teststof |
1 |
a1 |
|
|
|
|
|
|
2 |
a2 |
|
|
|
|
|
Gem. |
|
|
|
|
|
|
N.B.: Soortgelijke schema's kunnen worden gebruikt voor de referentie-stof en de toxiciteitscontroles.
6. CORRECTIE VOOR NITRIFICATIE (zie Bijlage V)
|
Duur van incubatie (d) |
0 |
n1 |
n2 |
n3 |
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
7. DO-AFNAME: % AFBRAAK
|
|
Afname na n dagen (mg/l) |
|||
|
n1 |
n2 |
n3 |
|
|
|
FLES 1: (mto - mtx) - (mbo - mbx) |
|
|
|
|
|
FLES 2: (mto - mtx) - (mbo - mbx) |
|
|
|
|
|
FLES 1:
|
|
|
|
|
|
FLES 2:
|
|
|
|
|
| % D gem. (8) =
|
|
|
|
|
|
mto |
= |
waarde in de testkolf op tijdstip 0 |
|
mtX |
= |
waarde in de testkolf op tijdstip x |
|
mbo |
= |
gem. blanco waarde op tijdstip 0 |
|
mbx |
= |
gem. blanco waarde op tijdstip x |
Ook de correctie voor nitrificatie uit iii + vi in afdeling 6 dient te worden toegepast.
8. BLANCO DO — AFNAME
Zuurstofverbruik door blanco: (mbo — mb28) mg/l. Dit verbruik is van belang voor de geldigheid van de test. Het dient minder dan 1,5 mg/l te zijn.
DEEL VII. M.I.T.I.-TEST (Methode C.4-F)
VII.1. PRINCIPE VAN DE METHODE
De zuurstofopname door een geroerde oplossing of suspensie van de teststof in een anorganisch medium dat met speciaal gekweekte, niet-aangepaste micro-organismen is geënt, wordt automatisch gedurende 28 dagen bij 25 ± 1 oC in een verduisterde, afgesloten respirometer automatisch gemeten. Het vrijkomende kooldioxyde wordt door natronkalk geabsorbeerd. De biologische afbreekbaarheid wordt uitgedrukt als het percentage zuurstofopname (gecorrigeerd voor opname door de blanco) van de theoretische opname (ThOD). Het percentage primaire biologische afbreekbaarheid wordt ook berekend uit een aanvullende specifieke chemische analyse die aan het begin en aan het eind van de incubatie wordt uitgevoerd en verder, naar keuze, door middel van DOC-analyse.
VII.2. BESCHRIJVING VAN DE METHODE
VII.2.1. Apparatuur
|
a) |
Automatische elektrolytische BOD-meter of respirometer, doorgaans uitgerust met 6 flessen, met elk 300 ml en voorzien van kommetjes die het absorptiemiddel voor CO2 bevatten; |
|
b) |
Kamer met constante temperatuur en/of waterbad van 25 oC ± 1 oC of beter; |
|
c) |
Membraanfiltratie-eenheid (facultatief); |
|
d) |
Koolstof-analysator (facultatief). |
VII.2.2. Bereiding van anorganisch medium
De volgende voorraadoplossingen worden uitgaande van reagentia van analytische kwaliteit en water (I.6.1) bereid:
|
a) |
Monokaliumdiwaterstoforthofosfaat, KH2PO4 |
8,50 g |
|
Dikaliummonowaterstoforthofosfaat, K2HPO4 |
21,75 g |
|
|
Dinatriummonowaterstoforthofosfaat-dodecahydraat Na2HPO412 H2O |
44,60 g |
|
|
Ammoniumchloride, NH4Cl |
1,70 g |
|
|
Deze stoffen worden in water opgelost en de oplossingwordt tot 1 liter aangevuld. |
|
|
|
De pH-waarde van de oplossing dient 7,2 te zijn. |
|
|
|
b) |
Magnesiumsulfaat-heptahydraat, MgSO47 H2O |
22,50 g |
|
wordt in water opgelost en tot 1 liter aangevuld. |
|
|
|
c) |
Calciumchloride, watervrij, CaCl2 |
27,50 g |
|
wordt in water opgelost en tot 1 liter aangevuld |
|
|
|
d) |
IJzer(III)chloride-hexahydraat, FeCl3. 6 H2O |
0,25 g |
|
wordt in water opgelost en tot 1 liter aangevuld |
|
Van elke oplossing a), b), c) en d) wordt 3 ml genomen en er wordt tot 1 liter aangevuld.
VII.2.3. Bereiding van entmateriaal
Verse monsters worden verzameld op niet minder dan 10 locaties, voornamelijk in gebieden waar uiteenlopende chemicaliën worden gebruikt en geloosd. Van plaatsen zoals rioolwaterzuiveringsinstallaties, behandelingsinstallaties voor industrieel afvalwater, rivieren, plassen en zeeën worden monsters van 1 liter slib, oppervlaktebodem, water e.d. verzameld en grondig dooreen gemengd. Na verwijdering van drijvend materiaal en bezinking wordt de bovenstaande vloeistof met nutriumhydroxyde of fosforzuur op pH 7 ± 1 gebracht.
Van de gefiltreerde bovenstaande vloeistof wordt een voldoende volume genomen voor het vullen van een actief-slibtank van het vul-en-loop-type en de vloeistof wordt ongeveer 23,5 uur belucht. Dertig minuten na beëindigen van de beluchting wordt ongeveer eenderde van het gehele volume van de bovenstaande vloeistof verwijderd en wordt een gelijk volume van een oplossing (pH 7) die telkens 0,1 % glucose, pepton en monokaliumorthofosfaat bevat aan het bezonken materiaal toegevoegd waarna de beluchting wordt hervat. Deze procedure wordt eenmaal per dag herhaald. De slibeenheid dient volgens een verantwoorde praktijk te worden gebruikt: effluenten moeten helder zijn, de temperatuur bedraagt 25 ± 2 oC , de pH 7 ± 1, slib bezinkt goed, er is voldoende beluchting om het mengsel te allen tijde aëroob te houden, er zijn protozoën aanwezig en de activiteit van het slib wordt ten minste elke drie maanden ten opzichte van een referentiestof getest. Het slib wordt niet eerder als entmateriaal gebruikt dan na een werking van ten minste één maand, maar ook niet meer dan na vier maanden. Daarna wordt op gezette tijden, elke drie maanden, een monster van ten minste 10 locaties genomen.
Teneinde vers en oud slib op dezelfde activiteit te houden wordt de gefiltreerde bovenstaande vloeistof van een in gebruik zijnd actief slib gemengd met een gelijk volume van de gefiltreerde bovenstaande vloeistof van een vers uit tien bronnen verzameld mengsel en wordt de verenigde vloeistof als boven gekweekt. 18-24 uur nadat de eenheid is gevoed wordt slib als entmateriaal genomen.
VII.2.4. Bereiding van de proefoplossingen
De volgende zes kolven worden bereid:
Nr. 1: teststof in verdunningswater, 100 mg/l
Nr. 2, 3 en 4: teststof in anorganisch medium, 100 mg/l
Nr. 5: referentiestof (bv. aniline) in anorganisch medium, 100 mg/l
Nr. 6: alleen anorganisch medium
Slecht oplosbare teststoffen worden rechtstreeks op basis van gewicht of volume toegevoegd of behandeld als beschreven in Bijlage III, met dien verstande dat er geen oplosmiddelen of emulgeermiddelen worden gebruikt. In alle kolven wordt in daarvoor bestemde kommetjes absorptiemiddel voor CO2 gebracht. De pH in de kolven nrs. 2, 3 en 4 wordt op 7,0 ingesteld.
VII.2.5. Uitvoering van de test
De kolven nrs. 2, 3 en 4 (testsuspensies), nr. 5 (activiteitscontrole) en nr. 6 (entmateriaal-blanco) worden geënt met een klein volume entmateriaal tot een concentratie van 30 mg/l gesuspendeerde vaste stof. Aan de kolf 1, die dient als niet-biologische controle, wordt geen entmateriaal toegevoegd. De apparatuur wordt gemonteerd, de luchtdichtheid wordt gecontroleerd, de roerders worden aangezet en de meting van de zuurstofopname in het donker wordt begonnen. De temperatuur, de roerder en het coulometrische registratieapparaat voor zuurstofopname worden dagelijks gecontroleerd en eventuele kleurverandering van de inhoud van de kolven wordt genoteerd. De opgenomen hoeveelheid zuurstof voor de zes kolven wordt rechtstreeks, met een geschikte methode afgelezen, bv. van het zespuntspapierregistratieapparaat, waaruit een BOD-kromme voortkomt. Aan het eind van de incubatie, gewoonlijk 28 dagen, wordt de pH van de inhoud van de kolven gemeten en worden de concentraties van de resterende teststof en van eventueel tussenproduct en, in geval van wateroplosbare teststof, de concentratie DOC bepaald (Bijlage II.4). In geval van vluchtige stoffen wordt bijzondere zorgvuldigheid betracht. Indien nitrificatie wordt verwacht, worden zo mogelijk de nitraat- en nitrietconcentratie bepaald.
VII.3. GEGEVENS EN RAPPORTAGE
VII.3.1. Verwerking van de resultaten
De door de teststof na een gegeven tijdsduur opgenomen hoeveelheid zuurstof (mg), die is gecorrigeerd voor de door de blancocontrole van het entmateriaal in dezelfde tijd opgenomen hoeveelheid, wordt gedeeld door het gewicht van de gebruikte teststof. Dit geeft het BOD, uitgedrukt als mg zuurstof/mg teststof, d.w.z.:

= mg O2/mg teststof
Het percentage biologische afbraak wordt dan verkregen uit:
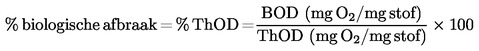
Voor mengsels wordt het ThOD berekend uit elementairanalyse, net als voor een eenvoudige verbinding. Al naar gelang nitrificatie afwezig dan wel volledig is (Bijlage II.2) wordt het bijbehorende ThOD (ThODNH4 of ThODNO3) gebruikt. Indien echter nitrificatie optreedt maar niet volledig is, wordt een correctie aangebracht voor de door nitrificatie verbruikte hoeveelheid zuurstof die is berekend uit de veranderingen in concentraties nitriet en nitraat (Bijlage V).
Het percentage primaire biologische afbraak wordt berekend uit het verlies aan specifieke (moeder)stof (zie I.7.2).
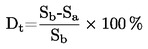
Indien er in kolf nr. 1, waar fysisch-chemische verwijdering wordt gemeten, een verlies aan teststof is geweest, wordt dit gerapporteerd en wordt de concentratie teststof (Sb) na 28 dagen in deze kolf gebruikt voor het berekenen van het percentage biologische afbraak.
Wanneer bepalingen van de DOC worden uitgevoerd (naar keuze), wordt het percentage uiteindelijke biologische afbraak berekend uit:

zoals beschreven onder punt I.7.1. Als er verlies aan DOC in kolf nr. 1, waarin fysisch-chemische verwijdering wordt gemeten, is geweest, wordt de DOC-concentratie in deze kolf gebruikt voor het berekenen van het percentage biologische afbraak.
Alle resultaten worden op de bijgaande gegevensformulieren geregistreerd.
VII.3.2. Geldigheid van de resultaten
De zuurstofopname door de entmateriaal-blanco bedraagt normaal 20-30 mg O2/l en mag over 28 dagen niet meer zijn dan 60 mg/l. Hogere waarden dan 60 mg/l betekenen dat de gegevens en experimentele technieken moeten worden getoetst. Indien de pH-waarde buiten het gebied van een 6-8,5 ligt en het zuurstofverbruik door de teststof minder dan 60 % bedraagt, dient de test met een lagere concentratie teststof te worden herhaald.
Zie ook I.5.2.
Indien het percentage afbraak van aniline dat is berekend uit het zuurstofgebruik na 7 dagen niet meer dan 40 % en na 14 dagen niet meer dan 65 % bedraagt, wordt de test als ongeldig beschouwd.
VII.3.3. Rapportage
Zie I.8.
VII.4. GEGEVENSFORMULIER
Hieronder volgt een voorbeeld van een gegevensformulier
MITI (I) TEST
|
1. |
LABORATORIUM |
|
2. |
DATUM AAN HET BEGIN VAN DE TEST |
3. TESTSTOF
Naam:
Concentratie voorraadoplossing: mg/l als teststof
Beginconcentratie in het milieu, Co: mg/l als teststof
Volume reactiemengsel, V: ml
ThOD: ... mg O2/l
4. ENTMATERIAAL
Verzamelingsplaatsen van slib:
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
Concentratie gesuspendeerde vaste stof in actief slib na acclimatisering met synthetisch rioolwater = ... mg/l
Volume actief slib per liter eindmedium = ...ml
Concentratie slib in eindmedium = ... mg/l
5. ZUURSTOFOPNAME: BIOLOGISCHE AFBREEKBAARHEID
Gebruikt type respirometer:
|
|
Tijd (dagen) |
||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
O2 opname (mg) teststof |
a1 |
|
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a3 |
|
|
|
|
|
||
|
O2 opname (mg) blanco |
b |
|
|
|
|
|
|
|
Gecorrigeerde O2 opname (mg) |
(a1 - b) (a2 - b) (a3 - b) |
|
|
|
|
|
|
|
BOD per mg teststof |
|
Kolf 1 |
|
|
|
|
|
|
Kolf 2 |
|
|
|
|
|
||
|
Kolf 3 |
|
|
|
|
|
||
|
% afbraak
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
||
|
3 |
|
|
|
|
|
||
|
Gem. (9) |
|
|
|
|
|
||
N.B.: Soortgelijke schema's kunnen worden gebruikt voor de referentiestof en de toxiciteitscontroles.
6. KOOLSTOFANALYSE (facultatief)
Koolstofanalyseapparaat:
|
Kolf |
DOC |
% DOC verwijd. |
Gemiddelde |
|||
|
Gemeten |
Gecorrig |
|||||
|
Water + teststof |
a |
|
|
|
— |
— |
|
Slib + teststof |
b1 |
|
bl-c |
|
|
|
|
Slib + teststof |
b2 |
|
b2-c |
|
|
|
|
Slib + teststof |
b3 |
|
b3-c |
|
|
|
|
Blancocontrole |
c |
|
— |
|
— |
— |

7. GEGEVENS UIT DE SPECIFIEKE CHEMISCHE ANALYSE
|
|
Resthoeveelheid teststof bij einde test |
% afbraak |
|
blancotest met water |
Sb |
|
|
geënt medium |
Sa1 |
|
|
Sa2 |
|
|
|
Sa3 |
|

Berekend wordt het % afbraak, respectievelijk voor kolven a1, a2 en a3.
8. OPMERKING
De kromme van het BOD tegen de tijd wordt, indien beschikbaar, bijgevoegd.
Bijlage I
AFKORTINGEN EN DEFINITIES
|
DO |
: |
Opgeloste zuurstof (mg/l) is de concentratie zuurstof die is opgelost in een waterig medium. |
|
BOD |
: |
(BZV), biochemisch zuurstofverbruik (g) is de hoeveelheid zuurstof die door micro-organismen wordt verbruikt bij het metaboliseren van een testverbinding; wordt ook uitgedrukt als g zuurstofopname per g testverbinding (zie methode C.5). |
|
COD |
: |
(CZV), chemisch zuurstofverbruik (g) is de hoeveelheid zuurstof die tijdens oxydatie van een tesrverbinding met warm, zuur dichromaat wordt verbruikt; het biedt een maat van de aanwezige hoeveelheid oxydeerbaar materiaal; wordt ook uitgedrukt als g zuurstof verbruikt per g testverbinding (zie methode C.6). |
|
DOC |
: |
Opgeloste organische koolstof is de organische koolstof die in de oplossing aanwezig is of die of door een filter van 0,45 micrometer gaat of na centrifugeren bij 40 000 m.s-2 (±4 000 g) gedurende 15 min in de vloeistof blijft. |
|
ThOD |
: |
Theoretisch zuurstofverbruik (mg) is de totale hoeveelheid zuurstof die nodig is om een chemische stof volledig te oxyderen; het wordt berekend op basis van de molecuulformule (zie Bijlage II.2) en wordt ook uitgedrukt als mg zuurstof die nodig is per mg testverbinding. |
|
ThCO2 |
: |
Theoretische hoeveelheid kooldioxyde (mg) is de hoeveelheid kooldioxyde die volgens berekening uit het bekende of gemeten koolstofgehalte van de testverbinding wordt geproduceerd, wanneer deze volledig wordt gemineraliseerd; wordt ook uitgedrukt als mg kooldioxyde ontwikkeld per mg testverbinding. |
|
TOC |
: |
Totale organische koolstof van een monster is de som van de hoeveelheid organische koolstof in oplossing en in suspensie. |
|
IC |
: |
Anorganische koolstof. |
|
TC |
: |
Totale koolstof is de som van de in een monster aanwezige organische en anorganische koolstof. |
Primaire biologische afbraak:
is de wijziging in de chemische structuur van een stof als gevolg van een biologisch proces, hetgeen leidt tot verlies van een bepaalde eigenschap van de stof.
Uiteindelijke biologische afbraak (aëroob):
is de mate van afbraak die wordt verkregen wanneer de testverbinding volledig door micro-organismen wordt omgezet tot kooldioxyde, water, anorganische zouten en nieuwe microbiële celbestanddelen (biomassa).
Gemakkelijk biologisch afbreekbaar:
een arbitraire indeling van chemische stoffen die bepaalde schiftingsproeven op uiteindelijke biologische afbreekbaarheid hebben doorstaan; deze proeven zijn zo streng dat geacht wordt dat dergelijke verbindingen in aquatisch milieu onder aërobe omstandigheden snel en volledig biologisch worden afgebroken.
Inherent biologisch afbreekbaar:
een indeling van chemische stoffen waarvoor welke erkende proef op biologische afbreekbaarheid dat ook een ondubbelzinnig bewijs van biologische afbraak (primair of uiteindelijk) levert.
Behandelbaarheid:
is de geschiktheid van verbindingen tot verwijdering gedurende biologische afvalwaterbehandeling zonder nadelige invloed op de normale werking van de behandelingsprocessen. In het algemeen zijn gemakkelijk biologische afbreekbare verbindingen behandelbaar, maar geldt dat niet voor alle inherent biologisch afbreekbare verbindingen. Niet-biologische processen kunnen ook optreden.
Aanlooptijd
is de duur vanaf de enting in een afvlakkingstest, totdat het percentage afbraak tot ten minste 10 % is gestegen. De aanlooptijd is vaak sterk variabel en slecht reproduceerbaar.
Afbraaktijd
is de tijd van het eind van de aanlooptijd tot het tijdstip dat 90 % van de maximale afbraak is bereikt.
10-dagenvenster
is de periode van 10 dagen onmiddellijk na het bereiken van 10 % afbraak.
Bijlage II
BEREKENING EN BEPALING VAN GESCHIKTE TOTAAL PARAMETERS
Afhankelijk van de gekozen methode zijn bepaalde totaalparameters nodig. In dit gedeelte wordt de herleiding van deze waarden beschreven. Het gebruik van deze parameters wordt bij de afzonderlijke methoden beschreven.
1. Koolstofgehalte
Het koolstofgehalte wordt berekend uit de bekende elementaire samenstelling of bepaald aan de hand van elementair analyse van de teststof.
2. Theoretisch zuurstofverbruik (ThOD)
Het theoretische zuurstofverbruik (ThOD) kan worden berekend indien de elementaire samenstelling bekend is of door elementair analyse is bepaald. Voor de verbinding met samenstelling:
CcHhClclNnNanaOoPpSs
is dit zonder nitrificatie,
 mg/mg
mg/mg
of net nitrificatie,
 mg/mg
mg/mg
3. Chemisch zuurstofverbruik (COD)
Het chemisch zuurstofverbruik (COD) wordt bepaald volgens methode C.6.
4. Opgeloste organische koolstof (DOC)
Opgeloste organische koolstof (DOC) is per definitie de organische koolstof van een chemische stof of een mengsel in water dat door een filter van 0,45 micrometer gaat.
Uit de testvaten worden monsters getrokken en deze worden onmiddellijk met een geschikt membraanfilter in het filtreerapparaat gefiltreerd. De eerste 20 ml (bij gebruik van kleine filters kan deze hoeveelheid worden verminderd) van het filtraat wordt verwijderd. Hoeveelheden van 10-20 ml, of minder in geval van injectie (volume afhankelijk van de voor de koolstof analysator benodigde hoeveelheid), worden apart gehouden voor koolstofanalyse. De DOC-concentratie wordt bepaald met behulp van een analyseapparaat voor organische koolstof, waarmee een koolstofconcentratie die overeenkomt met of kleiner is dan 10 % van de oorspronkelijke, in de test gebruikte DOC-concentratie nauwkeurig kan worden gemeten.
Gefiltreerde monsters die niet op dezelfde werkdag kunnen worden geanalyseerd kunnen worden bewaard, gedurende 48 uur in een koelkast bij 2-4 oC, of gedurende langere tijden beneden –18 oC.
Opmerkingen:
Membraanfilters zijn met het oog op hydrofilisering vaak geïmpregneerd met oppervlakteactieve stoffen. Een dergelijk filter kan derhalve enkele mg oplosbare organische koolstof bevatten die kunnen storen bij de bepalingen van de biologische afbreekbaarheid. Oppervlakteactieve stoffen en andere oplosbare organische verbindingen worden uit de filters verwijderd doordat deze driemaal telkens een uur in gedeïoniseerd water worden uitgekookt. De filters kunnen dan gedurende een week in water worden bewaard. Indien er eenmalige filterpatronen worden gebruikt, moet elke partij worden gecontroleerd op het niet-afgeven van oplosbare organische koolstof.
Afhankelijk van het type membraanfilter kan de teststof door adsorptie worden vastgehouden. Het kan daarom raadzaam zijn na te gaan dat de teststof niet door het filter wordt vastgehouden.
Centrifugeren bij 40 000 m.sec-2 (4 000 g) gedurende 15 min kan worden toegepast in plaats van filtratie, voor het onderscheid tussen TOC en DOC. Bij een beginconcentratie van < 10 mg DOC/l is in deze methode niet betrouwbaar, omdat dan niet alle bacteriën worden verwijderd of koolstof als deel van het bacteriële plasma opnieuw in oplossing gaat.
LITERATUUR
|
— |
Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, p. 65. |
|
— |
Wagner, R., Von Wasser, 1976, Vol 46, 139. |
|
— |
DIN-Entwurf 38 409 Teil 41 — Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngroβen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuβ Wasserwesen (NAW) in DIN Deutsches Institut für Normung e.V. |
|
— |
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol 13 (1), 169. |
Bijlage III
BEOORDELING VAN DE BIOLOGISCHE AFBREEKBAARHEID VAN SLECHT OPLOSBARE STOFFEN
Bij tests op de biologische afbreekbaarheid van slecht oplosbare stoffen dient aan de volgende aspecten bijzondere aandacht te worden geschonken.
Terwijl homogene vloeistoffen zelden bemonsteringsproblemen opleveren, verdient het aanbeveling dat vaste stoffen op geschikte wijze worden gehomogeniseerd opdat fouten als gevolg van het niet-homogeen zijn worden voorkomen. Bijzondere nauwkeurigheid moet worden betracht wanneer representatieve monsters van een aantal milligrammen uit mengsels van chemicaliën of stoffen met grote hoeveelheden verontreinigingen nodig zijn.
Tijdens de tests kunnen uiteenlopende vormen van dooreenmenging worden toegepast. Er moet op worden gelet dat er slechts voldoende wordt geroerd om de stof gedispergeerd te houden, en dat er geen oververhitting, overmatige schuimvorming of overmatige afschuifkrachten optreden.
Er kan een emulgator worden gebruikt die een stabiele dispersie van de stof geeft. Deze dient niet giftig te zijn voor bacteriën en mag niet biologisch worden afgebroken of onder de testomstandigheden schuimvorming veroorzaken.
Dezelfde criteria zijn zowel op oplosmiddelen als op de emulgatoren van toepassing.
Het gebruik van vaste dragers wordt voor vaste teststoffen niet aanbevolen, maar zij kunnen wel geschikt zijn voor olieachtige stoffen.
Wanneer hulpstoffen zoals emulgatoren, oplosmiddelen en dragers worden gebruikt, dient een blancoproef waarin de hulpstof aanwezig is te worden uitgevoerd.
De drie respirometrische tests CO2, BOD en MITI kunnen alle worden gebruikt voor het bestuderen van de biologische afbreekbaarheid van slecht oplosbare verbindingen.
LITERATUUR
|
— |
de Morsier, A. et al. Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, Vol 16, 833. |
|
— |
Gerike, P. The biodegradability testing of poorly water soluble compounds, Chemosphere, 1984, Vol 13, 169. |
Bijlage IV
BEOORDELING VAN DE BIOLOGISCHE AFBREEKBAARHEID VAN STOFFEN DIE VAN GIFTIGHEID VOOR HET ENTMATERIAAL WORDEN VERDACHT
Wanneer een chemische stof wordt onderworpen aan onderzoek op gemakkelijke biologische afbreekbaarheid en niet biologisch afbreekbaar blijkt te zijn, wordt de volgende procedure aanbevolen indien onderscheid tussen remming en inertheid wordt gewenst (Reynolds et al., 1987).
Voor de toxiciteitsproef en de biologische afbraakproef moet hetzelfde of een soortgelijk entmateriaal worden gebruikt.
Voor het bepalen van de toxiciteit van chemicaliën die in tests op de gemakkelijke biologische afbreekbaarheid worden onderzocht komt de toepassing van de remming van de slibademhalingssnelheid (test op de remming van de ademhaling van actief slib — Richtlijn 87/302/EEG), BOD en/of groeiremming of een combinatie daarvan in aanmerking.
Indien remming als gevolg van giftigheid moet worden voorkomen, kan het aanbeveling verdienen dat de concentraties teststof die in het onderzoek op de gemakkelijke biologische afbreekbaarheid worden gebruikt minder dan 1/10 van de EC50-waarden (of minder dan de EC20-waarden) die zijn verkregen bij de toxiciteitstest bedragen. Verbindingen met een EC50-waarde van meer dan 300 mg/l hebben waarschijnlijk geen toxische effecten bij het onderzoek op gemakkelijke biologische afbreekbaarheid.
EC50-waarden van minder dan 20 mg/l geven waarschijnlijk wel ernstige problemen bij het navolgende onderzoek. Er dienen dan lage testconcentraties te worden toegepast en gebruik dient dan te worden gemaakt van de strenge en gevoelige gesloten-flesproef of van met 14C gemerkt materiaal. Anderzijds kunnen met een geacclimatiseerd entmateriaal hogere concentraties teststof worden gebruikt. In het laatste geval gaat echter het specifieke criterium van de test op de gemakkelijke biologische afbreekbaarheid verloren.
LITERATUUR
Reynolds, L. et al. Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, Vol 16, 2259.
Bijlage V
CORRECTIE VAN ZUURSTOFOPNAME VOOR HET OPTREDEN VAN NITRIFICATIE
Fouten die het gevolg zijn van het niet in aanmerking nemen van nitrificatie bij de bepaling door middel van de zuurstofopname van de biologische afbreekbaarheid van teststoffen die geen stikstof bevatten zijn zeer gering (niet meer dan 5 %), zelfs indien oxydatie van de ammonium-N in het medium ongeregeld voorkomt tussen test- en blancovaten. Bij teststoffen die stikstof bevatten kunnen echter aanzienlijke fouten ontstaan.
Indien nitrificatie is opgetreden maar niet volledig is, kan de waargenomen zuurstofopname door het reactiemengsel worden gecorrigeerd voor de hoeveelheid zuurstof die is gebruikt voor het oxyderen van ammonium tot nitriet en nitraat, indien de veranderingen in de concentratie tijdens incubatie van nitriet en nitraat worden bepaald met inachtneming van de volgende vergelijkingen:
|
2 NH4Cl + 3 O2 = 2 HNO2 + 2 HCl + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Totaal: |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Uit vergelijking (1) volgt dat de zuurstofopname door 28 g stikstof in ammoniumchloride (NH4Cl) die wordt geoxydeerd tot nitriet 96 g bedraagt, d.w.z. een factor van 3,43 (96/28). Op dezelfde wijze volgt uit vergelijking (3) dat de zuurstofopname door 28 g stikstof bij oxydatie tot nitraat 128 g bedraagt, d.w.z. een factor 4,57 (128/28).
Aangezien de reacties na elkaar verlopen, en worden bewerkstelligd door afzonderlijke en verschillende bacteriesoorten, is het mogelijk dat de concentratie nitriet toeneemt of afneemt, in het laatste geval zal een overeenkomstige concentratie nitraat worden gevormd. De bij de vorming van nitraat verbruikte hoeveelheid zuurstof bedraagt dus 4,57 maal.de toename van de nitraatconcentratie, terwijl de hoeveelheid zuurstof die samenhangt met de vorming van nitriet 3,43 maal de toename van de nitrietconcentratie is of bij afname van de concentratie het zuurstofverlies -3,43 is maal de afname in de concentratie.
Dus:
|
O2 verbruikt bij nitraatvorming = 4,57 × toename N-nitraatconcentratie |
(4) |
|
en |
|
|
O2 verbruikt bij nitrietvorming = 3,43 × toename N-nitrietconcentratie |
(5) |
|
en |
|
|
O2 verloren bij verdwijning nitriet = -3,43 × afname N-nitrietconcentratie |
(6) |
|
zodat |
|
|
O2-opname als gevolg van nitrificatie = ±3,43 × wijziging in N-nitrietconcentratie + 4,57 × toename N-nitraatconcentratie |
(7) |
|
en dus |
|
|
O2-opname als gevolg van C-oxydatie = totaal waargenomen opname — opname als gevolg van nitrificatie |
(8) |
Anderzijds kan, indien alleen totaal geoxydeerde N wordt bepaald, de zuurstofopname als gevolg van nitrificatie in eerste benadering worden gesteld op 4,57 × toename van geoxydeerde N.
De correctiewaarde voor zuurstofverbruik als gevolg van C-oxydatie wordt vervolgens vergeleken met ThODNH4, zoals berekend in Bijlage II.
C.5. AFBRAAK — BIOCHEMISCH ZUURSTOFVERBRUIK
1. METHODE
1.1. INLEIDING
Het doel van de proef is de meting van het biochemisch zuurstofverbruik (BZV) van vaste of vloeibare organische stoffen.
De gegevens die in deze test zijn verwerkt, hebben betrekking op in water oplosbare verbindingen; vluchtige verbindingen en verbindingen die slechts in geringe mate in water oplosbaar zijn, kunnen echter in principe ook worden getest.
De methode is alleen van toepassing op die organische teststoffen die bij de in de test gebruikte concentratie niet remmend werken op bacteriën. Als de teststof niet oplosbaar is bij de te onderzoeken concentratie, kunnen speciale maatregelen zoals de toepassing van ultrasone dispersie nodig zijn om de teststof goed te dispergeren.
Gegevens over de toxiciteit van de stof kunnen van nut zijn bij de interpretatie van lage gevonden waarden en bij de keuze van geschikte concentraties.
1.2. DEFINITIES EN EENHEDEN
Het BZV is gedefinieerd als de massa opgeloste zuurstof die onder voorgeschreven omstandigheden nodig is voor de biochemische oxydatie van een bepaald volume van een oplossing van de stof.
De resultaten worden weergegeven als g BZV per g geteste stof.
1.3. REFERENTIESTOFFEN
Het gebruik van referentiestoffen om de activiteit van het inoculum te controleren, is wenselijk.
1.4. PRINCIPE VAN DE TESTMETHODE
Een van tevoren bepaalde hoeveelheid van de stof wordt opgelost of gedispergeerd in een geschikt, goed belucht medium, geënt met micro-organismen en bij een constante vastgestelde omgevingstemperatuur in het donker geïncubeerd.
Het BZV wordt bepaald door het verschil in de hoeveelheid opgeloste zuurstof bij het begin en bij het einde van de test. De testduur mag niet minder dan 5 dagen en niet meer dan 28 dagen bedragen.
Parallel wordt een blanco proef uitgevoerd zonder teststof.
1.5. KWALITEITSCRITERIA
De bepaling van het BZV geldt niet zonder meer als bepaling van de biologische afbreekbaarheid van de stof. Deze test is alleen te beschouwen als oriënterende proef.
1.6. BESCHRIJVING VAN DE TESTMETHODE
Eerst wordt een oplossing of dispersie van de stof bereid om een BZV-concentratie te verkrijgen die verenigbaar is met de gebruikte methode. Vervolgens wordt het BZV bepaald volgens een geschikte nationaal of internationaal genormaliseerde methode.
2. GEGEVENS EN EVALUATIE
Het BZV van de oplossing wordt berekend volgens de gekozen genormaliseerde methode en herleid naar gram BZV per gram teststof.
3. RAPPORTAGE
De gebruikte methode moet worden vermeld.
Het biochemisch zuurstofverbruik moet het gemiddelde zijn van ten minste drie geldige metingen.
Alle informatie en opmerkingen die van belang kunnen zijn voor de interpretatie van de resultaten moeten worden vermeld, vooral wat betreft verontreinigingen, fysische toestand, toxische effecten en de oorspronkelijke samenstelling van de stof welke van invloed zouden kunnen zijn op de resultaten.
Indien een stof is toegevoegd om de biologische nitrificatie te remmen, moet dit worden vermeld.
4. LITERATUUR
Lijst van genormaliseerde methoden, bij voorbeeld:
|
|
NF T 90-103: Determination of the biochemical oxygen demand. |
|
|
NBN 407: Biochemical oxygen demand. |
|
|
NEN 3235 5.4: Bepaling van het biochemisch zuurstofverbruik (BZV). |
|
|
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London. |
|
|
ISO 5815: Determination of biochemical oxygen demand after n days. |
C.6. AFBRAAK — CHEMISCH ZUURSTOFVERBRUIK
1. METHODE
1.1. INLEIDING
Het doel van de methode is de meting van het chemisch zuurstofverbruik (CZV) van vaste en vloeibare organische stoffen onder vaste laboratoriumomstandigheden op een genormaliseerde manier, die identiek is voor alle organische stoffen.
Informatie betreffende de formule van de stof is nuttig voor de uitvoering van deze test en de interpretatie van de resultaten (bijvoorbeeld halogeenzouten, ijzer(II)zouten van organische verbindingen, organochloorverbindingen).
1.2. DEFINITIES EN EENHEDEN
Het chemisch zuurstofverbruik is een maat voor de oxydeerbaarheid van een stof, uitgedrukt als de door de stof onder vaste laboratoriumomstandigheden verbruikte equivalente hoeveelheid zuurstof van een oxyderend reagens.
Het resultaat wordt uitgedrukt in gram CZV per gram geteste stof.
1.3. REFERENTIESTOFFEN
Het is niet altijd nodig om bij het onderzoek van een nieuwe stof referentiestoffen te gebruiken. Deze zijn in de eerste plaats bedoeld om zo nu en dan de methode te ijken en om de resultaten te kunnen vergelijken als een andere methode wordt gebruikt.
1.4. PRINCIPE VAN DE TESTMETHODE
Een bekende in water opgeloste of gedispergeerde hoeveelheid van de stof wordt geoxydeerd met kaliumdichromaat in sterk zwavelzuur met zilversulfaat als katalysator; deze laat men gedurende 2 uur „refluxen”. Het resterende dichromaat wordt bepaald door titratie met gestandaardiseerd ijzer(II) ammoniumsulfaat.
Bij chloorhoudende stoffen wordt kwik(II)sulfaat (10) toegevoegd om de storing door chloride te verminderen.
1.5. KWALITEITSCRITERIA
Aangezien de bepaling identiek is voor alle organische stoffen, is de CZV-waarde een „oxydeerbaarheidsindicator” en wordt als zodanig gebruikt als een practische methode om de hoeveelheid organische stof te meten.
Deze test kan worden gestoord door chloride; ook kan de CZV-bepaling worden gestoord door anorganische reducerende of oxyderende agentia.
Enkele cyclische verbindingen en vele vluchtige stoffen (bijvoorbeeld lagere vetzuren) worden niet volledig geoxydeerd in deze test.
1.6. BESCHRIJVING VAN DE TESTMETHODE
Allereerst wordt een oplossing of dispersie van de stof bereid met een CZV tussen 250 en 600 mg/l.
„Opmerkingen”:
Van slecht oplosbare en niet-dispergeerbare stoffen kan een hoeveelheid fijn verpulverde stof of een hoeveelheid vloeistof worden afgewogen die overeenkomt met ongeveer 5 mg CZV. Dit wordt met water in de opstelling voor het experiment gebracht.
Het CZV wordt vaak, en speciaal bij moeilijk oplosbare stoffen, beter bepaald met een variant van de methode, bij voorbeeld in een gesloten systeem met drukregulator (H. Kelkenberg, 1975). Met deze wijziging kunnen stoffen die met de conventionele methode slechts moeizaam bepaald kunnen worden — bij voorbeeld azijnzuur — vaak met succes worden gemeten. Ook deze methode faalt echter met pyridine. Indien de kaliumdichromaatconcentratie, zoals beschreven in referentie (1) wordt verhoogd tot 0,25 N (0,0416 M), kan het directe afwegen van 5 tot 10 mg stof vereenvoudigd worden, hetgeen essentieel is voor de CZV-bepaling van slecht in water oplosbare stoffen (referentie (2)).
Anders wordt vervolgens het CZV bepaald aan de hand van een geschikte nationaal of internationaal genormaliseerde methode.
2. GEGEVENS EN EVALUATIE
Het CZV van de inhoud van het testvat wordt berekend aan de hand van de gekozen genormaliseerde methode en omgerekend tot gram CZV per gram geteste stof.
3. RAPPORTAGE
De gehanteerde referentiemethode moet worden vermeld.
Het chemisch zuurstofverbruik moet een gemiddelde van ten minste drie metingen zijn. Alle informatie en opmerkingen die van belang zijn voor de inrerpretatie van de resultaten moeten worden vermeld, met name wat betreft verontreinigingen, fysische toestand en de oorspronkelijke samenstelling van de stof (indien bekend) die van invloed kunnen zijn op de resultaten.
Het gebruik van kwik(II)sulfaat om de storing door chloride te verminderen, moet worden vermeld.
4. LITERATUUR
|
(1) |
Kelkenberg, H., Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146, |
|
(2) |
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169. Enkele gestandaardiseerde methoden:
|
C.7. AFBRAAK — NIET-BIOLOGISCHE AFBRAAK: Hydrolyse in AFHANKELIJKHEID VAN DE pH
1. METHODE
Deze testmethode komt overeen met OESO TG 111 (2004).
1.1. INLEIDING
Chemische stoffen kunnen bijvoorbeeld rechtstreeks, door overwaaien bij het spuiten, door afspoeling, door drainage, door afvalverwijdering, in industrieel, huishoudelijk of agrarisch afvalwater of door depositie uit de lucht in oppervlaktewateren terechtkomen en in die wateren via chemische (bijvoorbeeld hydrolyse of oxidatie), fotochemische en/of microbiologische processen worden omgezet. In deze testmethode wordt een laboratoriumprocedure beschreven voor de bepaling van de niet-biologische hydrolytische omzetting van chemische stoffen in aquatische systemen bij pH-waarden die normaal gesproken in het milieu worden aangetroffen (pH 4-9), die op bestaande richtsnoeren is gebaseerd (1)(2)(3)(4)(5)(6)(7).
De experimenten worden uitgevoerd ter bepaling van i) de hydrolysesnelheid van de teststof in afhankelijkheid van de pH en ii) de identiteit of aard en vormings- en afbraaksnelheid van de hydrolyseproducten waaraan organismen kunnen worden blootgesteld. Dit onderzoek kan nodig zijn voor chemische stoffen die rechtstreeks in het water terechtkomen of die wellicht via de andere bovengenoemde routes in het milieu terecht kunnen komen.
1.2. DEFINITIES EN EENHEDEN
Zie bijlage 2.
1.3. TOEPASBAARHEID VAN DE METHODE
De methode kan in het algemeen worden gebruikt voor (al dan niet gelabelde) chemische stoffen waarvoor een analysemethode met een afdoende nauwkeurigheid en gevoeligheid beschikbaar is. Enigszins vluchtige en niet-vluchtige verbindingen met een afdoende oplosbaarheid in water kunnen worden getest. De test mag niet worden gebruikt voor chemische stoffen die vanuit water zeer vluchtig zijn (bv. fumigatiemiddelen of organische oplosmiddelen) die daardoor onder de experimentele omstandigheden tijdens deze test niet in oplossing kunnen worden gehouden. De test kan moeilijk uitvoerbaar zijn voor stoffen met een minimale oplosbaarheid in water (8).
1.4. PRINCIPE VAN DE TESTMETHODE
De teststof wordt toegevoegd aan steriele bufferoplossingen in water met verschillende pH-waarden (pH 4, 7 en 9), die vervolgens in het donker onder gecontroleerde laboratoriumomstandigheden (bij constante temperatuur) worden geïncubeerd. Op geschikte tijdstippen worden de bufferoplossingen geanalyseerd op de teststof en op hydrolyseproducten. Voor een (bijvoorbeeld met 14C) gelabelde teststof kan er gemakkelijker een massabalans worden bepaald.
Deze testmethode heeft een gefaseerde aanpak die in bijlage 1 wordt vermeld en verklaard. Elke fase wordt geïnitieerd door de resultaten van de fase daarvoor.
1.5. INFORMATIE OVER DE TESTSTOF
Voor de meting van de hydrolysesnelheid kan een al dan niet gelabelde teststof worden gebruikt. In het algemeen wordt voor de bestudering van de hydrolyseroute en de bepaling van de massabalans de voorkeur gegeven aan gelabeld materiaal; in bijzondere gevallen zal labeling echter wellicht niet absoluut noodzakelijk zijn. Labeling met 14C wordt aanbevolen, maar ook het gebruik van andere isotopen zoals 13C, 15N of 3H kan nuttig zijn. Het label moet zo veel mogelijk in het meest stabiele gedeelte of de meest stabiele gedeelten van het molecuul worden aangebracht. Als de teststof bijvoorbeeld één ring bevat, is labeling aan deze ring vereist; als de teststof twee of meer ringen bevat, kan er apart onderzoek nodig zijn om te beoordelen wat er met elke gelabelde ring gebeurt en om bruikbare informatie over de vorming van hydrolyseproducten te krijgen. De zuiverheid van de teststof moet ten minste 95 % zijn.
Vóór de uitvoering van een hydrolysetest moet de volgende informatie over de teststof beschikbaar zijn:
|
a) |
de oplosbaarheid in water [testmethode A.6]; |
|
b) |
de oplosbaarheid in organische oplosmiddelen; |
|
c) |
de dampspanning [testmethode A.4] en/of de constante van de wet van Henry; |
|
d) |
de verdelingscoëfficiënt n-octanol/water [testmethode A.8]; |
|
e) |
de dissociatieconstante (pKa) [OESO-richtsnoer 112] (9); |
|
f) |
eventueel de directe en indirecte fotochemische omzettingssnelheid in water. |
Er moeten analysemethoden beschikbaar zijn voor de kwantitatieve bepaling van de teststof en indien van toepassing voor de kwalitatieve en kwantitatieve bepaling van de hydrolyseproducten in waterige oplossing (zie ook punt 1.7.2).
1.6. REFERENTIESTOFFEN
Waar mogelijk moeten referentiestoffen worden gebruikt voor de kwalitatieve en kwantitatieve bepaling van de hydrolyseproducten met behulp van spectroscopische en chromatografische methoden of andere voldoende gevoelige methoden.
1.7. KWALITEITSCRITERIA
1.7.1. Recovery
Door onmiddellijk na de toevoeging van de teststof de bufferoplossingen of de extracten daarvan ten minste in duplo te analyseren wordt een eerste indicatie verkregen van de herhaalbaarheid van de analysemethode en de uniformiteit van de procedure voor het toevoegen van de teststof. In latere fasen van de experimenten wordt de recovery bepaald aan de hand van de respectieve massabalansen (wanneer gelabeld materiaal wordt gebruikt). Voor gelabelde en ongelabelde stoffen moet de recovery tussen 90 % en 110 % liggen (7). Wanneer het bereiken van dit interval technische problemen oplevert, is een recovery van 70 % voor ongelabelde chemische stoffen aanvaardbaar, maar moet er wel een motivering worden gegeven.
1.7.2. Herhaalbaarheid en gevoeligheid van de analysemethode
De herhaalbaarheid van de analysemethode(n) voor de kwantitatieve bepaling van de teststof en de hydrolyseproducten op latere tijdstippen kan worden gecontroleerd door dezelfde bufferoplossingen (of de extracten daarvan) in duplo te analyseren, nadat er voldoende hoeveelheden hydrolyseproducten zijn gevormd voor een kwantitatieve bepaling.
De analysemethode moet gevoelig genoeg zijn om concentraties van de teststof tot 10 % of minder van de aanvankelijke concentratie kwantitatief te bepalen. Indien van toepassing, moeten de analysemethoden ook gevoelig genoeg zijn om een hydrolyseproduct dat (op enig tijdstip gedurende de test) overeenkomt met 10 % of meer van de toegevoegde hoeveelheid teststof, tot 25 % of minder van de piekconcentratie kwantitatief te bepalen.
1.7.3. Betrouwbaarheidsintervallen voor kinetische gegevens over de hydrolyse
Voor alle regressiecoëfficiënten, snelheidsconstanten, halveringstijden en andere kinetische parameters (bijvoorbeeld de DT50) moeten de betrouwbaarheidsintervallen worden berekend en vermeld.
1.8. BESCHRIJVING VAN DE TESTMETHODE
1.8.1. Uitrusting en apparatuur
Het onderzoek moet in glazen houders (bijvoorbeeld reageerbuizen of flesjes) in het donker en indien nodig in steriele omstandigheden worden uitgevoerd, tenzij informatie vooraf (zoals de verdelingscoëfficiënt n-octanol/water) erop wijst dat de teststof zich aan glas kan hechten. In dat geval moet wellicht worden overwogen een ander materiaal (zoals Teflon) te gebruiken. Hechting aan glas kan wellicht ook met behulp van een of meer van de volgende methoden worden beperkt:
|
— |
bepaling van de massa van de aan het reactievat gesorbeerde teststof en hydrolyseproducten; |
|
— |
gebruik van een ultrasoon bad; |
|
— |
al het glaswerk op elk bemonsteringstijdstip met oplosmiddel spoelen; |
|
— |
gebruik van geformuleerde producten; |
|
— |
een grotere hoeveelheid co-oplosmiddel gebruiken om de teststof aan het systeem toe te voegen; als er een co-oplosmiddel wordt gebruikt, mag dit geen hydrolyse van de teststof veroorzaken. |
Normaal gesproken zijn er waterbadschudapparaten met temperatuurregulering of incubators met thermostaatregulering voor de incubatie van de verschillende testoplossingen nodig.
Verder is er standaard-laboratoriumapparatuur nodig, zoals met name:
|
— |
een pH-meter; |
|
— |
analyse-apparatuur zoals GC-, HPLC- en TLC-apparatuur, met inbegrip van de nodige detectiesystemen voor de analyse van al dan niet radioactief gelabelde stoffen of de inverse isotoopverdunningsmethode; |
|
— |
instrumenten voor kwalitatieve analyse (MS, GC-MS, HPLC-MS, NMR enz.); |
|
— |
een vloeistofscintillatieteller; |
|
— |
scheitrechters voor vloeistof/vloeistof-extractie; |
|
— |
instrumenten voor de concentratie van oplossingen en extracten (bijvoorbeeld een rotatie verdamper); |
|
— |
een instrument voor temperatuur-regulering (bijvoorbeeld een waterbad). |
Als chemicaliën worden onder andere gebruikt:
|
— |
organische oplosmiddelen, p.a., zoals hexaan en dichloormethaan; |
|
— |
scintillatievloeistof; |
|
— |
bufferoplossingen (zie punt 1.8.3 voor nadere bijzonderheden). |
Al het glaswerk, water (p.a.) en bufferoplossingen die bij de hydrolysetests worden gebruikt, moeten worden gesteriliseerd.
1.8.2. Toevoeging van de teststof
De teststof moet als waterige oplossing aan de verschillende bufferoplossingen (zie bijlage 3) worden toegevoegd. Als dit nodig is om de teststof goed op te kunnen lossen, mogen kleine hoeveelheden met water mengbare oplosmiddelen (zoals acetonitril, aceton of ethanol) voor de toevoeging en verdeling van de teststof worden gebruikt, maar deze hoeveelheden mogen normaal gesproken niet groter zijn dan 1 % (v/v). Wanneer een hogere concentratie oplosmiddelen wordt overwogen (bijvoorbeeld bij een slecht oplosbare teststof), kan dit alleen worden toegestaan wanneer kan worden aangetoond dat het oplosmiddel geen effect heeft op de hydrolyse van de teststof.
Het gebruik van geformuleerde producten wordt normaal gesproken afgeraden, aangezien niet kan worden uitgesloten dat de bestanddelen van de formulering het hydrolyseproces kunnen beïnvloeden. Voor slecht in water oplosbare teststoffen of voor stoffen die zich aan glas hechten (zie punt 1.8.1), kan het gebruik van geformuleerd materiaal echter een geschikt alternatief zijn.
Er moet één concentratie van de teststof worden gebruikt; deze mag niet hoger zijn dan 0,01 M of de helft van de verzadigingsconcentratie (zie bijlage 1).
1.8.3. Bufferoplossingen
De hydrolysetest moet bij de pH-waarden 4, 7 en 9 worden uitgevoerd. Daartoe moeten er met behulp van p.a. chemicaliën en water bufferoplossingen worden bereid. In bijlage 3 worden enkele geschikte buffersystemen beschreven. Er dient te worden opgemerkt dat het gebruikte buffersysteem de hydrolysesnelheid kan beïnvloeden en wanneer dit wordt geconstateerd, moet er een ander buffersysteem worden gebruikt (11).
De pH van elke bufferoplossing moet met een gekalibreerde pH-meter tot op ten minste 0,1 nauwkeurig bij de juiste temperatuur worden gecontroleerd.
1.8.4. Testomstandigheden
1.8.4.1. Temperatuur
De hydrolyse-experimenten moeten bij constante temperatuur worden uitgevoerd. Met het oog op extrapolatie is het belangrijk de temperatuur tot op ten minste ±0,5 oC nauwkeurig te houden.
Als het hydrolysegedrag van de teststof onbekend is, wordt er een oriënterende test (fase 1) bij een temperatuur van 50 oC uitgevoerd. Kinetische tests in latere fasen moeten bij ten minste drie temperaturen worden uitgevoerd (met inbegrip van de test bij 50 oC), tenzij bij de test van fase 1 is vastgesteld dat de teststof ongevoelig voor hydrolyse is. Als temperatuurinterval wordt 10-70 oC aanbevolen (waarvan bij voorkeur ten minste één temperatuur beneden 25 oC wordt gebruikt); de rapportagetemperatuur (25 oC) en de meeste temperaturen die men in de praktijk tegenkomt, liggen binnen dit interval.
1.8.4.2. Licht en zuurstof
Alle hydrolysetests moeten worden uitgevoerd met een geschikte methode om fotolyse-effecten te voorkomen. Alle nodige maatregelen moeten worden genomen om zuurstof uit te sluiten (bijvoorbeeld door vóór het bereiden van de oplossing gedurende 5 minuten helium, stikstof of argon door te leiden).
1.8.4.3. Duur van de test
De oriënterende test wordt gedurende 5 dagen uitgevoerd, terwijl de tests van de latere fasen gedurende 30 dagen worden uitgevoerd of, indien dit vóór die tijd het geval is, totdat 90 % van de teststof is gehydrolyseerd.
1.8.5. Uitvoering van de test
1.8.5.1. Oriënterende test (fase 1)
De oriënterende test wordt uitgevoerd bij 50 ± 0,5 oC en pH 4,0, 7,0 and 9,0. Als er na vijf dagen minder dan 10 % hydrolyse wordt waargenomen (t0,5 (25oC) > 1 jaar), wordt de teststof als ongevoelig voor hydrolyse beschouwd en behoeven er normaal gesproken geen aanvullende tests te worden uitgevoerd. Als bekend is dat de teststof bij in het milieu relevante temperaturen instabiel is (12), behoeft de oriënterende test niet te worden uitgevoerd. De analysemethode moet nauwkeurig en gevoelig genoeg zijn om een daling van de aanvankelijke concentratie met 10 % te detecteren.
1.8.5.2. Hydrolyse van instabiele stoffen (fase 2)
De latere (geavanceerde) test moet worden uitgevoerd bij de pH-waarden waarbij is geconstateerd dat de teststof instabiel is, zoals gedefinieerd in bovenstaande oriënterende test. De gebufferde oplossingen van de teststof wordt met een thermostaat op de geselecteerde temperaturen gehouden. Om te testen of de reactie zich als eerste orde gedraagt, wordt elke reactie-oplossing geanalyseerd met intervallen die ten minste zes gespreide datapunten opleveren die normaal gesproken tussen 10 % en 90 % hydrolyse van de teststof liggen. Er wordt steeds meer dan een testmonster genomen (ten minste twee monsters in afzonderlijke reactievaten) en de inhoud wordt op elk van de ten minste zes bemonsteringstijdstippen geanalyseerd (hetgeen ten minste twaalf duplodatapunten oplevert). Het gebruik van één monster waaruit op elk bemonsteringstijdstip steeds aparte hoeveelheden van de testoplossing worden genomen, wordt onjuist geacht aangezien daarbij geen analyse van de variabiliteit van de gegevens mogelijk is en er problemen kunnen ontstaan met verontreiniging van de testoplossing. Aan het eind van de test van de tweede fase (d.w.z. bij 90 % hydrolyse of na 30 dagen) moeten tests ter bevestiging van de steriliteit worden uitgevoerd. Als er echter geen afbraak (d.w.z. omzetting) wordt waargenomen, wordt een test op steriliteit niet nodig geacht.
1.8.5.3. Identificatie van de hydrolyseproducten (fase 3)
Alle belangrijke hydrolyseproducten en ten minste degene die overeenkomen met > 10 % van de toegevoegde hoeveelheid teststof, moeten met geschikte analysemethoden worden geïdentificeerd.
1.8.5.4. Facultatieve tests
Bij een voor hydrolyse gevoelige teststof kunnen aanvullende tests bij andere pH-waarden dan 4, 7 en 9 nodig zijn. Voor fysiologische doeleinden kan bijvoorbeeld een test in een zuurder milieu (bijvoorbeeld pH 1,2) nodig zijn, waarbij één fysiologisch relevante temperatuur (37 oC) wordt gebruikt.
2. GEGEVENS
De hoeveelheden teststof en eventueel hydrolyseproducten moeten voor elk bemonsteringstijdstip en voor elke pH en temperatuur als percentage van de aanvankelijke concentratie teststof en, indien van toepassing, in mg/l worden vermeld. Daarnaast moet er, als er een gelabelde teststof is gebruikt, een massabalans in percentages van de aanvankelijke concentratie teststof worden vermeld.
Er dient een grafische weergave van de logaritmisch omgezette gegevens van de concentraties van de teststof, uitgezet tegen de tijd, te worden gerapporteerd. Alle belangrijke hydrolyseproducten en ten minste degene die overeenkomen met ≥10 % van de toegevoegde hoeveelheid teststof, moeten worden geïdentificeerd en hun logaritmisch omgezette concentraties moeten op dezelfde wijze als voor de oorspronkelijke stof worden uitgezet om de vormings- en afbraaksnelheid aan te geven.
2.1. BEHANDELING VAN DE RESULTATEN
Met behulp van de benodigde kinetische modelberekeningen moeten nauwkeurigere bepalingen van halveringstijden of DT50-waarden worden verkregen. De halveringstijden en/of DT50-waarden (met inbegrip van de betrouwbaarheidsgrenzen) moeten samen met een beschrijving van het gebruikte model, de orde van de kinetiek en de correlatiecoëfficiënt (r2) voor elke pH en temperatuur worden gerapporteerd. Indien van toepassing moeten de berekeningen ook op de hydrolyseproducten worden toegepast.
Wanneer het snelheidsonderzoek bij verschillende temperaturen wordt uitgevoerd, moeten de hydrolysesnelheidsconstantes van pseudo eerste orde (kobs) als functie van de temperatuur worden beschreven. De berekening moet worden gebaseerd op zowel de scheiding van kobs in snelheidsconstanten voor zuur-gekatalyseerde, neutrale en base-gekatalyseerde hydrolyse (respectievelijk kH, kneutral en kOH) en de Arrhenius-vergelijking:

Hierbij zijn Ai en Bi regressieconstanten van respectievelijk intercept en helling van de optimaal passende lijnen die afkomstig zijn van de lineaire regressie van ln ki tegen de reciproque waarde van de absolute temperatuur in Kelvin (T). Via de Arrhenius-relaties voor zuur-gekatalyseerde, neutrale en base-gekatalyseerde hydrolyse kunnen snelheidsconstanten voor pseudo eerste orde en derhalve halveringstijden worden berekend voor andere temperaturen, waarbij een directe experimentele bepaling van een snelheidsconstante niet uitvoerbaar is (10).
2.2. EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
De meeste hydrolysereacties hebben een pseudo eerste orde reactiesnelheid, zodat de halveringstijd onafhankelijk van de concentratie is (zie vergelijking 4 in bijlage 2). Dit houdt in dat het meestal mogelijk is bij 10-2 tot 10-3 M in het laboratorium bepaalde resultaten toe te passen op milieuomstandigheden (≤ 10-6 M) (10). Mabey en Mill hebben voor uiteenlopende chemische stoffen verschillende voorbeelden gerapporteerd van een goede overeenstemming tussen de in zuiver en natuurlijk water gemeten hydrolysesnelheden (11), mits zowel de pH als de temperatuur was gemeten.
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moet ten minste de volgende informatie worden opgenomen:
Teststof:
|
— |
de triviale naam, de chemische naam, het CAS-nummer, de structuurformule (met vermelding van de plaats van het label als radioactief gelabeld materiaal wordt gebruikt) en relevante fysisch-chemische eigenschappen (zie punt 1.5); |
|
— |
de zuiverheid (verontreinigingen) van de teststof; |
|
— |
de radiochemische zuiverheid van een gelabelde stof en de molaire activiteit (indien van toepassing). |
|
— |
Bufferoplossingen: |
|
— |
datum van en gegevens over de bereiding; |
|
— |
gebruikte buffers en gebruikt water; |
|
— |
molariteit en pH van de bufferoplossingen. |
Testomstandigheden:
|
— |
data waarop het onderzoek is uitgevoerd; |
|
— |
toegevoegde hoeveelheid teststof; |
|
— |
methode en oplosmiddelen (type en hoeveelheid) voor de toevoeging van de teststof; |
|
— |
geïncubeerd volume van de gebufferde teststofoplossingen; |
|
— |
beschrijving van het gebruikte incubatiesysteem; |
|
— |
pH en temperatuur tijdens het onderzoek; |
|
— |
bemonsteringstijdstippen; |
|
— |
extractiemethode(s); |
|
— |
methoden voor de kwalitatieve en kwantitatieve bepaling van de teststof en de hydrolyseproducten in de bufferoplossingen; |
|
— |
aantal duplo-bepalingen. |
Resultaten:
|
— |
de herhaalbaarheid en gevoeligheid van de gebruikte analysemethoden; |
|
— |
de recovery (in punt 1.7.1 wordt vermeld welke percentages voor een geldig onderzoek gehaald moeten worden); |
|
— |
duplo-gegevens en gemiddelden in de vorm van een tabel; |
|
— |
de massabalans gedurende en aan het eind van het onderzoek (wanneer een gelabelde teststof wordt gebruikt); |
|
— |
de resultaten van de oriënterende test; |
|
— |
een bespreking en interpretatie van de resultaten; |
|
— |
alle oorspronkelijke gegevens en figuren. |
De volgende informatie is alleen vereist wanneer de hydrolysesnelheid wordt bepaald:
|
— |
figuren waarin voor de teststof en eventueel de hydrolyseproducten bij elke pH en temperatuur de concentraties tegen de tijd worden uitgezet; |
|
— |
tabellen met de resultaten van de Arrhenius-vergelijking voor 20 oC/25 oC, met pH, snelheidsconstante [h-1 of dag-1], halveringstijd of DT50, temperaturen [ oC] met betrouwbaarheidsgrenzen en correlatiecoëfficiënten (r2) of vergelijkbare informatie; |
|
— |
voorgestelde hydrolyseroutes. |
4. REFERENTIES
|
(1) |
OECD (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, adopted 12 May 1981. |
|
(2) |
US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 EC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(3) |
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada. |
|
(4) |
Europese Unie (EU) (1995). Richtlijn 95/36/EG van de Commissie tot wijziging van Richtlijn 91/414/EEG van de Raad betreffende het op de markt brengen van gewasbeschermingsmiddelen. Bijlage II: Gedrag en lotgevallen in het milieu. |
|
(5) |
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(6) |
BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980). |
|
(7) |
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
(8) |
OECD (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23. |
|
(9) |
OECD (1993). Guidelines for the Testing of Chemicals. Paris. OECD (1994 — 2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(10) |
Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993). |
|
(11) |
Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383-415. |
Bijlage 1
Gefaseerd testschema voor hydrolyse

Bijlage 2
Definities en eenheden
In alle gevallen moeten eenheden van het Internationale Eenhedenstelsel (SI-eenheden) worden gebruikt.
Teststof: een stof, hetzij de oorspronkelijke verbinding, hetzij relevante omzettingsproducten.
Omzettingsproducten: alle stoffen die bij biotische en abiotische omzettingsreacties van de teststof ontstaan.
Hydrolyseproducten: alle stoffen die bij hydrolytische omzettingsreacties van de teststof ontstaan.
Hydrolyse: een reactie van een teststof RX met water, met als nettoresultaat de uitwisseling van de groep X met OH in het reactiecentrum:
|
RX + HOH → ROH + HX |
[1] |
Afhankelijk van de snelheidsbepalende stap wordt de snelheid waarmee de concentratie van RX bij dit vereenvoudigde proces afneemt, gegeven door:
|
snelheid = k [H2O] [RX] |
tweede orde reactie |
|
of |
|
|
snelheid = k [RX] |
eerste orde reactie |
Omdat water in vergelijking met de teststof in grote overmaat aanwezig is, wordt dit reactietype meestal beschreven als pseudo eerste orde reactie waarin de waargenomen snelheidsconstante wordt gegeven door:
|
kobs = k [H2O] |
[2] |
en kan worden bepaald volgens de vergelijking (13)
|
|
[3] |
waarbij
t= tijd
en Co en Ct= concentraties van RX op de tijdstippen 0 en t.
Deze constante heeft als dimensie (tijd)-1 en de halveringstijd van de reactie (tijd die nodig is om 50 % van RX te laten reageren) wordt gegeven door:
|
|
[4] |
Halveringstijd (t0,5): de tijd die nodig is voor hydrolyse van 50 % van een hoeveelheid teststof, wanneer de omzetting kan worden beschreven door kinetiek van de eerste orde; deze is onafhankelijk van de aanvankelijke concentratie.
DT50 (Disappearance Time 50): de tijd waarin de aanvankelijke concentratie van de teststof met 50 % daalt; deze verschilt van de halveringstijd t0,5 wanneer de reactie niet volgens kinetiek van de eerste orde verloopt.
Bepaling van k bij een andere temperatuur
Wanneer de reactieconstante voor twee temperaturen bekend is, kan deze met behulp van de Arrhenius-vergelijking voor andere temperaturen worden berekend:
![]() of
of 
Wanneer ln k wordt uitgezet tegen 1/T, levert dit een rechte lijn op met helling -E/R.
Hierbij is:
|
k |
= |
snelheidsconstante, gemeten bij verschillende temperaturen; |
|
E |
= |
activeringsenergie [kJ/mol]; |
|
T |
= |
absolute temperatuur [K]; |
|
R |
= |
gasconstante [8,314 J/mol.K]. |
De activeringsenergie wordt berekend met behulp van regressieanalyse of de volgende vergelijking:

waarbij T2 > T1.
Bijlage 3
Buffersystemen
A. CLARK EN LUBS:
Buffermengsels van CLARK en LUBS (14)
|
Samenstelling |
pH |
|
0,2 N HCl +0,2 N KCl bij 20 oC |
|
|
47,5 ml HCl + 25 ml KC1 verdunnen tot 100 ml |
1,0 |
|
32,25 ml HC1 + 25 ml KC1 verdunnen tot 100 ml |
1,2 |
|
20,75 ml HC1 + 25 ml KC1 verdunnen tot 100 ml |
1,4 |
|
13,15 ml HC1 + 25 ml KC1 verdunnen tot 100 ml |
1,6 |
|
8,3 ml HC1 + 25 ml KC1 verdunnen tot 100 ml |
1,8 |
|
5,3 ml HC1 + 25 ml KC1 verdunnen tot 100 ml |
2,0 |
|
3,35 ml HC1 + 25 ml KC1 verdunnen tot 100 ml |
2,2 |
|
0,1 M kaliumbiftalaat +0,1 N HC1 bij 20 oC |
|
|
46,70 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
2,2 |
|
39,60 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
2,4 |
|
32,95 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
2,6 |
|
26,42 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
2,8 |
|
20,32 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
3,0 |
|
14,70 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
3,2 |
|
9,90 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
3,4 |
|
5,97 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
3,6 |
|
2,63 ml 0,1 N HC1 + 50 ml biftalaat tot 100 ml |
3,8 |
|
0,1 M kaliumbiftalaat +0,1 N NaOH bij 20 oC |
|
|
0,40 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
4,0 |
|
3,70 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
4,2 |
|
7,50 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
4,4 |
|
12,15 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
4,6 |
|
17,70 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
4,8 |
|
23,85 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
5,0 |
|
29,95 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
5,2 |
|
35,45 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
5,4 |
|
39,85 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
5,6 |
|
43,00 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
5,8 |
|
45,45 ml 0,1 N NaOH + 50 ml biftalaat tot 100 ml |
6,0 |
Buffermengsels van CLARK en LUBS (vervolg)
|
0,1 M monokaliumfosfaat +0,1 N NaOH bij 20 oC |
|
|
5,70 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
6,0 |
|
8,60 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
6,2 |
|
12,60 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
6,4 |
|
17,80 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
6,6 |
|
23,45 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
6,8 |
|
29,63 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
7,0 |
|
35,00 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
7,2 |
|
39,50 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
7,4 |
|
42,80 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
7,6 |
|
45,20 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
7,8 |
|
46,80 ml 0,1 N NaOH + 50 ml fosfaat tot 100 ml |
8,0 |
|
0,1 M H3BO3 in 0,1 M KC1 +0,1 N NaOH bij 20 oC |
|
|
2,61 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
7,8 |
|
3,97 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
8,0 |
|
5,90 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
8,2 |
|
8,50 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
8,4 |
|
12,00 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
8,6 |
|
16,30 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
8,8 |
|
21,30 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
9,0 |
|
26,70 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
9,2 |
|
32,00 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
9,4 |
|
36,85 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
9,6 |
|
40,80 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
9,8 |
|
43,90 ml 0,1 N NaOH + 50 ml boorzuur tot 100 ml |
10,0 |
B. KOLTHOFF EN VLEESCHHOUWER:
Citraatbuffers van KOLTHOFF en VLEESCHHOUWER
|
Samenstelling |
pH |
|
0,1 M monokaliumcitraat en 0,1 N HC1 bij 18 oC (15) |
|
|
49,7 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
2,2 |
|
43,4 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
2,4 |
|
36,8 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
2,6 |
|
30,2 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
2,8 |
|
23,6 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
3,0 |
|
17,2 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
3,2 |
|
10,7 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
3,4 |
|
4,2 ml 0,1 N HC1 + 50 ml citraat tot 100 ml |
3,6 |
|
0,1 M monokaliumcitraat en 0,1 N NaOH bij 18 oC (15) |
|
|
2,0 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
3,8 |
|
9,0 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
4,0 |
|
16,3 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
4,2 |
|
23,7 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
4,4 |
|
31,5 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
4,6 |
|
39,2 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
4,8 |
|
46,7 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
5,0 |
|
54,2 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
5,2 |
|
61,0 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
5,4 |
|
68,0 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
5,6 |
|
74,4 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
5,8 |
|
81,2 ml 0,1 N NaOH + 50 ml citraat tot 100 ml |
6,0 |
C. SÖRENSEN:
Boraatmengsels van SÖRENSEN
|
Samenstelling |
Sörensen 18 oC |
Walbum, pH bij |
|||
|
ml borax |
ml HCl/NaOH |
10 oC |
40 oC |
70 oC |
|
|
0,05 M borax +0,1 N HC1 |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
0,05 M borax +0,1 N NaOH |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
Fosfaatmengsels van SÖRENSEN
|
Samenstelling |
pH |
|
0,0667 M monokaliumfosfaat +0,0667 M dinatriumfosfaat bij 20 oC |
|
|
99,2 ml KH2PO4+0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml KH2PO4+1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml KH2PO4+2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml KH2PO4+4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml KH2PO4+7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml KH2PO4+11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml KH2PO4+17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml KH2PO4+24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml KH2PO4+34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml KH2PO4+46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml KH2PO4+58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml KH2PO4+70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml KH2PO4+80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml KH2PO4+87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml KH2PO4+92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml KH2PO4+96,3 ml Na2HPO4 |
8,0 |
C.8. TOXICITEIT VOOR REGENWORMEN
TEST MET KUNSTMATIGE GROND
1. METHODE
1.1. INLEIDING
In deze laboratoriumtests wordt de te onderzoeken stof toegevoegd aan kunstmatige grond waarin gedurende veertien dagen regenwormen worden geplaatst. Na deze veertien dagen (en naar keuze ook al na zeven dagen) wordt het letale effect van de stof op de regenwormen onderzocht. Met deze test kan betrekkelijk snel een indruk worden verkregen van het effect van chemicaliën op regenwormen bij opname via de huid en via het voedsel.
1.2. DEFINITIE EN EENHEID
LC50: De geschatte concentratie van een stof die de dood van 50 % van de proefdieren gedurende de testperiode tot gevolg heeft.
1.3. REFERENTIESTOF
Op gezette tijden wordt een referentiestof getoetst om aan te tonen dat de gevoeligheid van het testsysteem niet wezenlijk is veranderd.
Als referentiestof wordt aanbevolen chlooraceetamide van analytische kwaliteit.
1.4. PRINCIPE VAN DE TEST
Grond is een variabel medium en daarom wordt voor deze proef een nauwkeurig gedefinieerde kunstmatige leemgrond gebruikt. Volwassen regenwormen van de soort Eisenia foetida (zie de opmerking in het aanhangsel) worden gehouden in deze kunstmatige grond, die is behandeld met verschillende concentraties van de te onderzoeken stof. De kunstgrond wordt na veertien dagen (en naar keuze ook na zeven dagen) vanaf het begin van de proef op een schaal uitgespreid en het aantal overlevende regenwormen bij elke concentratie wordt geteld.
1.5. KWALITEITSNORMEN
De opzet is zodanig dat de test ten aanzien van het testsubstraat en het organisme zo reproduceerbaar mogelijk is. Indien de sterfte in de controles aan het eind van de proef hoger is dan 10 %, is de test ongeldig.
1.6. BESCHRIJVING VAN DE METHODE
1.6.1. Materiaal
1.6.1.1.
Als basistestsubstraat wordt goed gedefinieerde kunstmatige grond gebruikt.
|
a) |
Basissubstraat (percentages aangegeven in droog gewicht)
|
|
b) |
Testsubstraat Het testsubstraat bevat het basissubstraat, de teststof en gedeïoniseerd water. Het vochtgehalte bedraagt 25 tot 42 % van het drooggewicht van het basissubstraat. Het vochtgehalte van het substraat wordt bepaald door een monster bij 105 oC tot constant gewicht te drogen. De kunstmatige grond moet zover nat worden gemaakt dat er net geen water op blijft staan. Er moet zorgvuldig worden gemengd, zodat een gelijkmatige verdeling van de te onderzoeken stof over het substraat wordt verkregen. Aangegeven moet worden op welke wijze de te onderzoeken stof door het substraat is gemengd. |
|
c) |
Controlesubstraat Het controlesubstraat bevat het basissubstraat en water. Indien een hulpstof is gebruikt, moet een extra controle worden gedaan met daarin dezelfde hoeveelheid van de hulpstof. |
1.6.1.2.
Er wordt gebruik gemaakt van glazen potten met een inhoud van ongeveer 1 liter (afgesloten met plastic deksels, schotels of plastic folie met luchtgaten), die worden gevuld met een hoeveelheid nat test- of controlesubstraat die overeenkomt met 500 g droog substraat.
1.6.2. Testomstandigheden
De potten worden geplaatst in klimaatkamers bij een temperatuur van 20 ± 2 oC onder continu licht. De lichtintensiteit dient 400 tot 800 lux te bedragen.
De testduur bedraagt veertien dagen maar de sterfte kan indien gewenst ook at na zeven dagen worden bepaald.
1.6.3. Werkwijze
De concentraties van de te onderzoeken stof worden uitgedrukt als gewicht van de stof per drooggewicht basissubstraat (mg/kg).
Het concentratiegebied dat leidt tot een sterfte tussen 0 tot 100 % kan worden bepaald in een oriënterende toets met behulp waarvan de reeks concentraties voor de definitieve test kan worden vastgesteld.
In de oriënterende toets wordt de te onderzoeken stof getest bij de volgende concentraties: 1 000, 100, 10, 1 en 0,1 mg stof per kg testsubstraat (drooggewicht).
Als er een volledige definitieve toets wordt uitgevoerd, kan voor de oriënterende toets worden volstaan met uitvoering in enkelvoud, dat wil zeggen met één pot per concentratie en één voor de controle zonder de te onderzoeken stof, elk met tien wormen.
De resultaten van de oriënterende toets worden gebruikt voor het kiezen van ten minste vijf concentraties in een meetkundige reeks die juist het gebied tussen 0 en 100 % sterfte bestrijken en onderling met een constante factor van ten hoogste 1,8 verschillen.
Door middel van de toets met deze reeks concentraties moeten de LC50-waarde en de bijbehorende betrouwbaarheidsgrenzen zo nauwkeurig mogelijk kunnen worden geschat.
In de definitieve toets worden ten minste vier potten per concentratie en vier controles zonder de te onderzoeken stof, elk met tien wormen, onderzocht. De resultaten van deze parallelle toetsen worden gegeven als een gemiddelde met een standaarddeviatie.
Wanneer twee opeenvolgende concentraties, met een onderlinge verhouding van 1,8 slechts respectievelijk 0 en 100 % sterfte geven, zijn deze twee waarden voldoende om het gebied aan te geven waarbinnen de LC50 ligt.
Het testsubstraat wordt zoveel mogelijk bereid zonder andere hulpstoffen dan water. Vlak voor het begin van de test wordt een oplossing, emulsie of dispersie van de te onderzoeken stof in gedeïoniseerd water of een ander oplosmiddel met het basissubstraat gemengd of daarover gelijkmatig verdeeld met een fijne chroma to grafische of soortgelijke sproeier.
Indien de te onderzoeken stof onoplosbaar is in water, kan deze worden opgelost in een zo klein mogelijk volume van een geschikt organisch oplosmiddel (bijvoorbeeld hexaan, aceton of chloroform).
Alleen gemakkelijk verdampende oplosmiddelen mogen worden gebruikt voor het oplossen, dispergeren of emulgeren van de te onderzoeken stof. Het testsubstraat wordt voor het gebruik geventileerd. De hoeveelheid verdampt water wordt daarna weer aangevuld.
De controle moet van elke hulpstof dezelfde hoeveelheid bevatten. Indien de te onderzoeken stof niet oplosbaar, dispergeerbaar of emulgeerbaar is in organische oplosmiddelen, wordt 10 g van een mengsel van fijn gemalen kwartszand en een hoeveelheid van de te onderzoeken stof die nodig is voor de behandeling van 500 g droog gewicht aan kunstmatige grond gemengd met 490 g droog gewicht aan basissubstraat.
Voor elke testportie wordt een hoeveelheid nat testsubstraat die overeenkomt met 500 g droog gewicht in een glazen pot gebracht en worden tien regenwormen, die 24 uur in een soortgelijk nat basissubstraat zijn geconditioneerd en voor gebruik snel zijn gewassen en met filtreerpapier van overtollig water zijn ontdaan, bovenop het testsubstraat geplaatst.
De potten worden afgedekt met geperforeerde plastic deksels, schalen of folie om uitdrogen van het substraat te voorkomen en worden vervolgens veertien dagen onder de testomstandigheden gehouden.
De bepalingen worden gedaan veertien dagen (en eventueel zeven dagen) na het begin van de test. Het substraat wordt uitgespreid op een plaat van glas of roestvrij staal. De regenwormen worden onderzocht en het aantal overlevende wormen wordt bepaald. Regenwormen worden als dood aangemerkt indien zij niet reageren op een zachte mechanische prikkel op de kop.
Indien onderzoek na zeven dagen plaatsvindt, wordt het substraat terug in de pot gedaan en worden de overlevende regenwormen weer bovenop het testsubstraat geplaatst.
1.6.4. Testorganismen
De testorganismen zijn volwassen Eisenia foetida (zie opmerking in de bijlage), ten minste twee maanden oud met clitellum, nat gewicht 300-600 mg (voor kweekmethode zie aanhangsel).
2. GEGEVENS
2.1. VERWERKING VAN DE RESULTATEN
De concentraties van de onderzochte stof worden vermeld-in samenhang met de bijbehorende percentages dode regen wormen.
Wanneer de gegevens zich daartoe lenen, worden de LC50-waarde en de betrouwbaarheidsgrenzen (p = 0,05) bepaald volgens standaardmethoden (Litchfield en Wilcoxon, 1949 of gelijkwaardige methode). De LC50 wordt weergegeven in mg te onderzoeken stof per kg testsubstraat (droog gewicht).
Indien de helling van de concentratiecurve te steil ïs voor de berekening van de LC50, is een grafische schatting van deze waarde voldoende.
Wanneer twee opeenvolgende concentraties met een onderlinge verhouding van 1,8 slechts respectievelijk 0 % en 100 % sterfte geven, zijn deze waarden voldoende voor het aangeven van het gebied waarbinnen de LC50 ligt.
3. VERSLAGGEVING
3.1. TESTRAPPORT
Het testrapport moet, indien mogelijk, bevatten:
|
— |
een verklaring dat de test is uitgevoerd overeenkomstig de bovenvermelde kwaliteitsnormen; |
|
— |
uitgevoerde toetsen (oriënterende toets en/of definitieve toets); |
|
— |
nauwkeurige beschrijving van de testomstandigheden of verklaring dat de test is uitgevoerd overeenkomstig deze methode; alle afwijkingen worden vermeld; |
|
— |
nauwkeurige beschrijving van de wijze waarop de te onderzoeken stof door het basissubstraat is gemengd; |
|
— |
gegevens over de testorganismen (soort, leeftijd, gemiddeld gewicht en variatie in gewicht, houd- en kweekomstandigheden, leverancier); |
|
— |
gebruikte methode voor de bepaling van de LC50; |
|
— |
testresultaten met inbegrip van alle gebruikte gegevens; |
|
— |
beschrijving van waargenomen symptomen of wijzigingen in het gedrag van de testorganismen; |
|
— |
sterfte in de controleproeven; |
|
— |
LC50 of hoogste geteste concentratie zonder sterfte dan wel laagste geteste concentratie met een sterfte van 100 %, veertien dagen (en eventueel zeven dagen) na de start van de test; |
|
— |
grafiek van de concentratie-responscurve; |
|
— |
resultaten verkregen met de referentiestof, in samenhang met de onderhavige test dan wel uit eerdere kwaliteitsborging. |
4. REFERENTIES
|
(1) |
OESO, Parijs, 1981, Testrichtlijn 207, Besluit C(81) 30 def. van de Raad. |
|
(2) |
Edwards, C. A., en Lofty, J. R., 1977, Biology of Earthworms, Chapman and Hall, London, 331 blz. |
|
(3) |
Bouche, M. B., 1972, Lombriciens de France, Écologie et Systématique, Institut National de la Recherche Agronomique, 671 blz. |
|
(4) |
Litchfield, J. T., en Wilcoxon, F., A simplified method of evaluating dose-effect experiments, Journal of Pharmacology and Experimental Therapeutics 96, 1949, blz. 99. |
|
(5) |
Commission of the European Communities, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983. |
|
(6) |
Umweltbundesamt/Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag „Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden”, in: Rudolph/Boje: ökotoxikologie, ecomed, Landsberg, 1986. |
Aanhangsel
Kweken en houden van de wormen vóór de test
Voor het kweken worden 30 tot 50 volwassen wormen in een kweekbak met vers substraat gebracht en na veertien dagen daaruit verwijderd. Deze dieren kunnen worden gebruikt voor verder kweken. De uit de cocons gekomen regenwormen worden voor het onderzoek gebruikt wanneer ze volwassen zijn (onder de voorgeschreven omstandigheden na twee tot drie maanden).
Houd- en kweekomstandigheden
|
Klimaatkamer |
: |
temperatuur 20 ± 2 oC, zo mogelijk met continu licht (intensiteit 400 — 800 lux). |
|
Kweekbakken |
: |
geschikte ondiepe bakken met een inhoud van 10 tot 20 l. |
|
Substraat |
: |
Eisenia foetida kan worden gekweekt in verschillende dierlijke uitwerpselen. Aanbevolen als kweekmedium wordt een mengsel van 50 volumeprocent turf en 50 % koemest of paardemest. Het medium moet een pH hebben van 6 tot 7 (bij te stellen met calciumcarbonaat) en een lage-ionengeleiding (lager dan 6 mmho's of 0,5 % zoutconcentratie). Het substraat dient vochtig maar niet te nat te zijn. Naast de aangegeven methode kunnen ook andere procedures die goede resultaten geven worden gebruikt. |
Opmerking: Eisenia foetida bestaat in twee ondersoorten die door sommige taxonomen als soorten worden aangemerkt (Bouche, 1972). Deze zijn morfologisch overeenkomstig, maar de ene, Eisenia foetida foetida, heeft kenmerkende dwarse strepen of banden op de segmenten terwijl de andere, Eisenia foetida andrei, deze niet heeft en een onregelmatige roodachtige kleur heeft. Zo mogelijk dient Eisenia foetida andrei te worden gebruikt. Andere soorten kunnen worden gebruikt indien de benodigde methodiek beschikbaar is.
C.9. BIOLOGISCHE AFBRAAK
ZAHN-WELLENS TEST
1. METHODE
1.1. INLEIDING
Het doel van deze methode is de bepaling van de uiteindelijke biologische afbreekbaarheid van in water oplosbare, niet-vluchtige organische stoffen, wanneer deze in een statische proef aan betrekkelijk hoge concentraties micro-organismen worden onderworpen.
Aan de gesuspendeerde vaste stoffen kan fysisch-chemische adsorptie plaatsvinden en hiermee moet bij het interpreteren van de resultaten rekening worden gehouden (zie 3.2).
De te onderzoeken stoffen worden gebruikt in concentraties, die overeenkomen met DOC-waarden tussen 50 en 400 mg/liter of COD-waarden tussen 100 en 1 000 mg/liter (DOC = opgeloste organische koolstof; COD = chemisch zuurstofverbruik). Deze betrekkelijk hoge concentraties hebben het voordeel dat ze analytisch betrouwbaar zijn, Verbindingen met toxische eigenschappen kunnen het afbraakproces vertragen of verhinderen.
In deze methode wordt door middel van meting van de concentratie opgeloste organische koolstof of het chemisch zuurstofverbruik de uiteindelijke biologische afbraak van de teststof bepaald.
Het gelijktijdig toepassen van een specifieke analytische methode biedt de mogelijkheid de primaire biologische afbraak van de stof (verdwijning van de oorspronkelijke chemische structuur) te bepalen.
Deze methode is alleen toepasbaar op die organische stoffen die bij de in de test gebruikte concentratie:
|
— |
onder de testomstandigheden in water oplosbaar zijn, |
|
— |
onder de testomstandigheden een verwaarloosbare dampspanning hebben, |
|
— |
geen remmende werking op bacteriën hebben, |
|
— |
slechts in beperkte mate worden geadsorbeerd aan de testapparatuur, |
|
— |
niet door schuimvorming uit de testoplossing verdwijnen. |
Gegevens over de onderlinge verhoudingen van de belangrijkste componenten van het testmateriaal kunnen van nut zijn bij het interpreteren van de resultaten, vooral wanneer deze laag of marginaal zijn.
Gegevens aangaande de toxiciteit van de stof ten opzichte van micro-organismen zijn gewenst voor de interpretatie van lage resultaten en voor de keuze van de geschikte testconcentraties.
1.2. DEFINITIES EN EENHEDEN
De aan het eind van de proef verkregen mate van afbraak wordt opgegeven als de „biologische afbreekbaarheid in de Zahn-Wellens test”:

waarin:
|
DT |
= |
biologische afbraak ( %) op tijd T, |
|
CA |
= |
DOC- of COD-waarden in het testmengsel, zoals gemeten drie uur na het begin van de test (mg/l) (DOC = opgeloste organische koolstof, COD = chemisch zuurstofverbruik), |
|
CT |
= |
DOC- of COD-waarden in het testmengsel op het tijdstip van monsterneming (mg/L), |
|
CB |
= |
DOC- of COD-waarden van de blanco op het tijdstip van monsterneming (mg/l), |
|
CBA |
= |
DOC- of COD-waarden van de blanco, zoals gemeten drie uur na het begin van de test (mg/l). |
De mate van afbraak wordt op het dichtstbijzijnde hele procent afgerond.
Het percentage afbraak wordt bepaald als zijnde het percentage DOC- of COD-verwijdering van de onderzochte stof.
Het verschil tussen de waarde gemeten na drie uur en de berekende of bij voorkeur gemeten oorspronkelijke waarde kan nuttige informatie verschaffen over de verwijdering van de stof (zie 3.2: Interpretatie van de resultaten).
1.3. REFERENTIESTOFFEN
Bij het onderzoeken van nieuwe stoffen kunnen referentiestoffen soms van nut zijn; er kunnen echter nog geen specifieke referentiestoffen worden aanbevolen.
1.4. PRINCIPE VAN DE TESTMETHODE
In een glazen vat van 1 tot 4 liter inhoud, uitgerust met een roertoestel en een beluchtingsapparaat, worden actief slib, minerale voedingsstoffen en het testmateriaal als enige koolstofbron in water bij elkaar gebracht. Het mengsel wordt gedurende hooguit 28 dagen onder diffuus licht of in een donkere ruimte bij 20 tot 25 oC geroerd en belucht. Het verloop van het afbraakproces wordt gevolgd door het dagelijks of op andere geschikte gezette tijden bepalen van de DOC- of COD-waarden in de gefiltreerde oplossing. De verhouding tussen de verdwenen hoeveelheid DOC (of COD) bij elke meettijd en de hoeveelheid drie uur na het begin wordt uitgedrukt als het percentage biologische afbraak en dient voor het bepalen van de mate van afbraak op dat tijdstip.
Het resultaat wordt uitgezet tegen de tijd en geeft aldus de kromme van de biologische afbraak.
Wanneer een specifieke analytische methode wordt toegepast, kunnen de veranderingen in de concentratie van de uitgangsmolecule als gevolg van de biologische afbraak worden gemeten (primaire biologische afbreekbaarheid).
1.5. KWALITEITSCRITERIA
De reproduceerbaarheid van deze test is in een ringtest voldoende gebleken.
De gevoeligheid van de methode wordt grotendeels bepaald door de veranderlijkheid van de blanco en, in mindere mate, door de nauwkeurigheid van de bepaling van opgeloste organische koolstof en van de concentratie von de testverbinding in de vloeistof.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Preparaten
1.6.1.1.
Water: drinkwater met een organisch-koolstofgehalte kleiner dan 5 mg/1. De totale concentratie van calcium- en magnesiumionen te zamen mag 2,7 mmol/1 niet overschrijden; zonodig moet met gedeïoniseerd of gedestilleerd water worden verdund.
|
Zwavelzuur, analytisch reagens (AR): |
50 g/l |
|
Natriumhydroxideoplossing AR: |
40 g/l |
|
Minerale nutriëntoplossingen: hiervoor wordt in 1 liter gedeïoniseerd water opgelost: |
|
|
ammoniumchloride, NH4Cl, AR: |
38,5 g |
|
natriumdiwaterstoffosfaat, NaH2PO4 2 H2O, AR: |
33,4 g |
|
kaliumdiwaterstoffosfaat, KH2PO4, AR: |
8,5 g |
|
di-kaliumwaterstoffosfaat, K2HPO4, AR: |
21,75 g |
Dit mengsel dient tegelijkertijd als voedingsstof maar ook als bufferaplossing.
1.6.1.2.
Glazen vaten met inhoud van 1 tot 4 liter (bij voorbeeld cilindervormige recipiënten).
Roerapparaat met glazen of metalen roerblad op een geschikte schacht. (De roerder moet 5 tot 10 cm boven de bodem van het vat ronddraaien.) Een magneetroerder met een roerstaaf van 7 tot 10 cm kan eveneens gebruikt worden.
Glazen buis met een inwendige diameter van 2 tot 4 mm voor het inleiden van lucht. De opening van de buis moet zich ongeveer 1 cm boven de bodem van het vat bevinden.
Centrifuge (ongeveer 3 550 g).
pH-meter.
Apparaat voor het meten van de opgeloste zuurstof.
Papieren filters.
Membraanfiltreerapparaat.
Membraanfilters, mazen van 0,45 μm. Membraanfilters zijn geschikt als vaststaat dat zij geen koolstof afgeven en bij het filtreren de stof niet absorberen.
Analyseapparatuur voor het bepalen van het organisch koolstofgehalte en het chemisch zuurstofverbruik.
1.6.1.3.
Actief slib uit een biologische zuiveringsinstallatie wordt gewassen door (herhaald) centrifugeren of bezinken in het water dat gebruikt wordt voor de test (zie boven).
Het actief slib moet de juiste kenmerken hebben. Dergelijk slib kan worden betrokken van een goed werkende waterzuiveringsinstallatie. Om zoveel mogelijk verschillende soorten en stammen van bacteriën te verkrijgen kan het de voorkeur verdienen inocula van verschillende bronnen (bij voorbeeld verschillende zuiveringsinstallaties, bodemextracten, rivierwater en dergelijke) te mengen. Het mengsel moet dan worden behandeld als hierboven beschreven.
Voor het controleren van de activiteit van het actief slib, zie 1.6.2, onder „Functionele controle”.
1.6.1.4.
In het testvat worden gebracht: 500 ml testwater, 2,5 ml/l minerale nutriëntoplossing en een hoeveelheid actief slib die overeenkomt met 0,2-1,0 g/l droge stof in het uiteindelijke mengsel. Hieraan wordt een voldoende hoeveelheid van een voorraadoplossing van de te onderzoeken stof toegevoegd, zodanig dat Het DOC-gehalte in het uiteindelijke mengsel 50-400 mg/l bedraagt. De overeenkomstige COD-waarden zijn 100-1 000 mg/l. Het volume wordt met testwater op een totaal van 1 tot 4 liter gebracht. De keuze van het volume wordt bepaald door het aantal monsters voor de DOC- of COD-bepaling en door de voor de analytische procedure benodigde volumes.
Doorgaans wordt een volume van 2 liter als voldoende beschouwd. Er wordt ten minste één blanco controlevat bereid dat parallel met elke testreeks wordt behandeld; het bevat alleen actief slib en minerale nutriëntoplossing, aangevuld met testwater tot hetzelfde totale volume als in de testvaten.
1.6.2. Uitvoering van de test
De testvaten worden geroerd met magneetroerders of schroefbladen onder gedempt licht of in het donker bij 20 tot 25 oC. Beluchting vindt plaats door middel van perslucht die met een wattenfilter en eventueel een wasfles wordt gereinigd. Er dient voor gezorgd te worden dat het slib niet bezinkt en de zuurstofconcentratie niet beneden de 2 mg/l daalt.
De pH-waarde wordt op gezette tijden (bij voorbeeld dagelijks) gemeten en zonodig bijgesteld tot pH 7 à 8.
Verliezen ten gevolge van verdamping worden vlak voor de monsterneming aangevuld met gedeïoniseerd of gedestilleerd water in de vereiste hoeveelheden. Een goede methode bestaat erin, het vloeistofniveau voor het begin van de proef aan te duiden op het vat. Na elke monsterneming worden, bij uitgeschakelde beluchting en beroering, nieuwe aanduidingen aangebracht. De eerste monsters worden steeds drie uur na het begin van de test genomen, teneinde adsorptie van testmateriaal aan het actief slib te kunnen ontdekken.
De verwijdering van het testmateriaal wordt gevolgd aan de hand van DOC- of COD-bepalingen, welke dagelijks of op andere gezette tijden worden uitgevoerd. De monsters uit het testvat en de blanco's worden gefiltreerd door een zorgvuldig gewassen papieren filter. De eerste 5 ml filtraat van de testoplossing worden niet gebruikt. Moeilijk filtreerbaar slib kan worden afgescheiden door voorafgaand centrifugeren gedurende tien minuten. DOC- en COD-bepalingen worden ten minste in duplo uitgevoerd. De test duurt maximaal 28 dagen.
Opmerking: Monsters die troebel blijven, worden gefiltreerd door membraanfilters. De membraanfilters mogen geen organisch materiaal afgeven of adsorberen.
Parallel met elke testreeks wordt een vat met een bekende stof onderzocht teneinde de functionele capaciteit van het actieve slib te controleren. Diëthyleenglycol is voor dit doel bruikbaar gebleken.
Indien de analyses met betrekkelijk korte intervallen worden uitgevoerd (bij voorbeeld dagelijks), komt het adaptatiefenomeen duidelijk tot uiting in de afbraakkromme (zie figuur 2). Om deze reden wordt de test niet vlak voor het weekeinde gestart.
Indien adaptatie in de laatste dagen van de test optreedt, kan de test worden verlengd tot de afbraak is beëindigd.
Opmerking: Indien een grondiger kennis van het gedrag van het geadapteerde slib nodig is, wordt hetzelfde actief slib nogmaals met hetzelfde testmateriaal in contact gebracht volgens de volgende procedure:
De roermotor en het beluchtingsapparaat worden uitgeschakeld en men laat het actief slib bezinken. De bovendrijvende vloeistof wordt verwijderd, het volume wordt met water op 2 liter gebracht, vervolgens wordt er vijftien minuten geroerd, waarna men het slib weer laat bezinken. Nadat de bovendrijvende vloeistof weer is verwijderd, wordt het resterende slib gebruikt om de test met hetzelfde materiaal volgens 1.6.1.4 en 1.6.2 te herhalen. Het actief slib kan ook door centrifugeren in plaats van door bezinken worden afgezonderd.
Het geadapteerde slib kan met vers slib worden gemengd tot een totale hoeveelheid van 0,2-1 g droog gewicht per liter.
Doorgaans worden de monsters gefiltreerd door een grondig gewassen papieren filter (voor het wassen wordt gedeïoniseerd water gebruikt).
Monsters die troebel blijven, worden door membraanfilters gefiltreerd (0,45 μm).
De DOC-concentratie in de filtraten van het monster (eerste 5 ml worden niet gebruikt) wordt, in duplo, bepaald met behulp van het DOC-instrument. Als analyse van de filtraten op dezelfde dag niet mogelijk is, worden deze tot de volgende dag in de koelkast bewaard. Langer bewaren wordt niet aanbevolen.
De COD-concentratie in de nitraten van het monster wordt bepaald met een COD-analyseapparaat volgens de procedure beschreven in referentie (2).
2. RESULTATEN
De DOC-en COD-concentraties in de monsters worden ten minste in duplo bepaald volgens 1.6.2. Het percentage afbraak op tijdstip T wordt berekend volgens de bij 1.2 gegeven formule (met definities).
De mate van afbraak wordt naar het dichtstbijzijnde geheel percent afgerond. De mate van afbraak die aan het eind van de test is verkregen, wordt opgegeven als de „biologische afbreekbaarheid in de Zahn-Wellens test”.
Opmerking: Indien volledige afbraak bereikt wordt voor het einde van de testduur en dit resultaat door een tweede analyse op de volgende dag wordt bevestigd, kan de test worden beëindigd.
3. VERSLAG
3.1. TESTVERSLAG
Het testrapport moet, indien mogelijk, bevatten:
|
— |
de beginconcentratie van de teststof, |
|
— |
alle andere gegevens en experimentele resultaten betreffende de onderzochte stof, de referentiestof, indien gebruikt, en de blanco, |
|
— |
de concentratie na drie uur, |
|
— |
de biologische afbraakkromme met een toelichting, |
|
— |
datum en plaats van monsterneming van het inoculum, adaptatietoestand, gebruikte concentratie, enz., |
|
— |
wetenschappelijke verantwoording voor eventuele wijzigingen in de testprocedure. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Geleidelijke verwijdering van DOC of COD in de loop van dagen of weken betekent dat de teststof biologisch wordt afgebroken.
Fysisch-chemische adsorptie kan echter in sommige gevallen een rol spelen en dit wordt aangetoond door een gehele of gedeeltelijke verwijdering van de teststof gedurende de eerste drie uur en door het onverwacht klem blijven van het verschil tussen de resultaten bekomen met de controlevloeistof en de bovendrijvende vloeistof.
Als er onderscheid moet worden gemaakt tussen de biologische afbraak (of gedeeltelijke biologische afbraak) en adsorptie, zijn aanvullende proeven nodig.
Dit kan op een aantal manieren geschieden, waarvan de meest geschikte erin bestaat de bovendrijvende vloeistof als inoculum te gebruiken in een test van het basisniveau (bij voorkeur een respirometrische test).
Stoffen die in deze test een grote mate van niet door adsorptie veroorzaakte verwijdering van DOC (COD) te zien geven, dienen te worden beschouwd als potentieel biologisch afbreekbaar. Een gedeeltelijke, niet door adsorptie veroorzaakte verwijdering duidt erop dat de stof ten minste in enige mate biologisch afbreekbaar is. Een geringe of ontbrekende verwijdering van DOC (COD) kan het gevolg zijn van remming van micro-organismen door de teststof en dit kan ook aan het licht komen door lysis en verlies van slib, hetgeen leidt tot troebele bovendrijvende vloeistoffen. In een dergelijk geval moet de test worden herhaald met een lagere concentratie van teststof.
Door toepassing van een voor een verbinding specifieke analytische methode of van een met I4C gemerkte teststof kan een grotere gevoeligheid worden bereikt. Bij onderzoek van een 14C-verbinding vormt het terugvinden van 14CO2 de bevestiging dat biologische afbraak heeft plaatsgevonden.
Wanneer resultaten worden uitgedrukt in termen van primaire biologische afbraak dient er, zo mogelijk, een verklaring gegeven te worden over de wijziging van de chemische structuur die leidt tot een vermindering van de respons van de oorspronkelijke teststof.
De validatie van de analytische methode moet opgegeven worden te zamen met de respons die gevonden werd met het blanco-testmedium.
4. REFERENTIES
|
(1) |
OESO, Parijs, 1981, Testrichtlijn 302 B, Besluit C(81) 30 def. van de Raad. |
|
(2) |
Bijlage V, C.9 Degradatie: Chemisch zuurstofverbruik, Richtlijn 84/449/EEG van de Commissie, Publicatieblad van de Europese Gemeenschappen nr. L 25 van 19.9.1984. |
Aanhangsel
VOORBEELD VAN EEN VERSLAG
|
Organische verbinding: |
4-Ethoxybenzoczuur |
|
Theoretische testconcentratie: |
600 mg/l |
|
Theoretische DOC: |
390 mg/l |
|
Entmateriaal: |
Waterzuiveringsinstallatie van … |
|
Concentratie: |
1 g droge stof per liter |
|
Adaptatietoestand: |
niet geadapteerd |
|
Analyse: |
DOC-bepaling |
|
Monstervolume: |
3 ml |
|
Controlestof: |
Diëthyleenglycol |
|
Toxiciteit van de verbinding: |
Geen toxische effecten beneden 1 000 mg/l Gebruikte test: fermentatie/buizentest |
|
Testtijd |
Controlestof |
Teststof |
|||||
|
Blanco DOC (16) mg/l |
DOC (16) mg/l |
Netto DOC mg/l |
Afbraak % |
DOC (16) mg/l |
Netto DOC mg/l |
Afbraak % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3, uur |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
l dag |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 dagen |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 dagen |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 dagen |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 dagen |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 dagen |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 dagen |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 dagen |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
Figuur 1
Voorbeelden van krommen van de biologische afbraak

Figuur 2
Voorbeelden van adaptatie van slib

C.10. BIOLOGISCHE AFBRAAK
SIMULATIEPROEVEN ACTIEF SLIB
1. METHODE
1.1. INLEIDING
1.1.1. Algemene opmerkingen
De methode is uitsluitend van toepassing op die organische stoffen die bij de in de test gebruikte concentratie:
|
— |
oplosbaar zijn in water in de mate die nodig is voor de bereiding van de testoplossingen, |
|
— |
onder de testomstandigheden een te verwaarlozen dampdruk hebben, |
|
— |
niet remmend werken op bacteriën. |
Gegevens over de mate waarin de belangrijke componenten van het restmateriaal zich tot elkaar verhouden, zijn van nut bij de interpretatie van de verkregen resultaten, vooral wanneer de testwaarden laag of marginaal zijn.
Informatie over de giftigheid van de stof voor micro-organismen is gewenst voor de interpretatie van lage testwaarden en, bij de keuze van de juiste testconcentraties.
1.1.2. Bepaling van de uiteindelijke biologische afbreekbaarheid (DOC/COD-analyse)
Het doel van deze methode is de uiteindelijke biologische afbreekbaarheid te bepalen door het meten van de afbraaksnelheid van de stof en eventuele metabolieten daarvan in een actief-slibmodelinstallatie bij een concentratie die overeenkomt met meer dan 12 mg DOC/l (of ongeveer 40 mg COD/l). De ideale concentratie ligt rond 20 mg DOC/l. (DOC = opgeloste organische koolstof; COD — CZV = chemisch zuurstofverbruik.)
Het organisch koolstofgehalte (of het chemisch zuurstofverbruik) van het restmateriaal moet bepaald worden.
1.1.3. Bepaling van de primaire biologische afbreekbaarheid (specifieke analyse)
Het doel van deze methode is de primaire biologische afbreekbaarheid van een stof te bepalen in een actief-slibmodelinstallatie bij een concentratie van ongeveer 20 mg/l volgens een bepaalde analytische methode (een hogere of een lagere concentratie is mogelijk indien de analytische methode en de eventuele toxiciteit dat toelaten). Hiermee kan de primaire biologische afbreekbaarheid van de stof (verdwijning van de oorspronkelijke chemische structuur) worden bepaald.
Doel van deze methode is niet het bepalen van de mineralisatie van de onderzochte stof.
Voor de bepaling van de onderzochte stof moet een goede analytische methode beschikbaar zijn.
1.2. DEFINITIES EN EENHEDEN
1.2.1. DOC/COD-analyse
De mate van verdwijning van de stof wordt gegeven door:
|
|
[1 a)] |
waarin:
|
DR |
= |
mate van verdwijning in procent DOG (of COD) binnen de gegeven gemiddelde verblijftijd ten opzichte van het testmateriaal, |
|
T |
= |
concentratie van het testmateriaal in de toevoerstroom in mg DOC/l (of COD/l), |
|
E |
= |
DOC- of COD-concentratie in de afvoerstroom (effluent) van de testeenheid in mg DOC/l (of COD/l), |
|
EO |
= |
DOC- of COD-concentratie in de afvoerstroom van de blancoeenheid in mg DOC/l (of COD/l). |
De afbraak wordt opgegeven als percentage DOC- of COD-verwijdering binnen de gegeven verblijftijd ten opzichte van het testmateriaal.
1.2.2. Specifieke analyse
Het percentage verdwijning van de onderzochte stof uit de waterfase (Rw) binnen de gegeven verblijftijd wordt gegeven door:
|
|
[1 b)] |
waarin:
|
C1 |
= |
concentratie van de stof in de toevoerstroom van de testeenheid (mg stof/1, bepaald met specifieke analyse), |
|
CO |
= |
concentratie van de stof in de afvoerstroom van de testeenheid (mg- stof/l, bepaald met specifieke analyse). |
1.3. REFERENTIESTOFFEN
Bij het onderzoek van een nieuwe stof kan het gebruik van referentiestoffen in sommige gevallen nuttig zijn; specifieke referentiestoffen kunnen echter nog niet worden aanbevolen.
1.4. PRINCIPE VAN DE TESTMETHODEN
Voor de bepaling van de uiteindelijke biologische afbreekbaarheid worden twee proefeenheden met actief slib (van OESO-bevestigende test of poreuze potten) tegelijkertijd in werking gesteld. De teststof wordt aan het influent (kunstmatig of huishoudelijk afvalwater) van een van de twee eenheden toegevoegd terwijl de andere alleen afvalwater ontvangt. Voor de bepaling van de primaire biologische afbreekbaarheid met specifieke analyse van het influent en effluent wordt slechts één eenheid gebruikt.
De DOC- of COD-concentraties van het effluent worden gemeten; ook kunnen de concentraties van de stof zelf en afbreekproducten bepaald worden met specifieke analysemethoden.
De DOC van de uitgangsstof wordt niet gemeten maar eenvoudig opgegeven.
Wanneer DOC- of COD-metingen worden verricht, wordt verondersteld dat het verschil in gemiddelde concentraties tussen de effluenten van de test en van de controle het gevolg is van niet-afgebroken uitgangsstof.
Wanneer specifieke analyses worden uitgevoerd, kan de verandering in de concentratie van de oorspronkelijke verbinding worden gemeten (primaire biologische afbreekbaarheid).
De eenheden kunnen eventueel werken volgens de „coupled units mode” via wederzijdse enting.
1.5. KWALITEITSNORMEN
De aanvangsconcentratie van de stof is afhankelijk van het type toegepaste analyse en de beperkingen daarvan.
1.6. BESCHRIJVING VAN DE METHODE
1.6.1. Voorbereiding
1.6.1.1.
Er zijn twee eenheden van hetzelfde type nodig, behalve wanneer specifieke analyses worden verricht. Twee soorten installaties kunnen worden gebruikt:
OESO-bevestigende test
De apparatuur (aanhangsel 1) bestaat uit een voorraadvat (A) voor kunstmatig afvalwater, een doseerpomp (B), een beluchtingsvat (C), een nabezinkvat (D), een persluchtpomp (E) voor het recirculeren van actief slib en een vergaarbak (F) voor het opvangen van behandeld afvalwater.
De vaten (A) en (F) zijn van glas of geschikte kunststof met een inhoud van ten minste 24 liter. Pomp (B) zorgt voor een constante toevoer van kunstmatig afvalwater naar het beluchtingsvat; elk geschikt systeem mag worden gebruikt, mits de toevoerstroom en de concentratie worden gehandhaafd, Bij normaal gebruik is de hoogte van het nabezinkvat (D) zo ingesteld dat het beluchtingsvat 3 liter gemengde vloeistof bevat. Een plaatje van gesinterd glas voor de beluchting (beluchter) (G) hangt in vat (C) op het laagste punt van de binnenste kegel van dit vat. De hoeveelheid via de beluchtingsinrichting ingeblazen lucht wordt gemeten met een stroommeter.
De persluchtpomp (E) wordt zo ingesteld dat het actief slib voortdurend en gelijkmatig uit het nabezinkvat naar beluchtingsvat (C) wordt teruggevoerd.
„Poreuze pot”
De „poreuze pot” wordt vervaardigd van vellen poreus polyethyleen (2 mm dik, maximale poriegrootte 95 μm), waarvan cilinders van 14 cm doorsnede worden gemaakt met een conisch uiteinde van 45o (figuren 1 en 2 van aanhangsel 2). De poreuze pot is ingesloten in een ondoordringbaar vat van geschikte kunststof van 15 cm doorsnede met een uitgang op 17,2 cm hoogte op het cilindrische gedeelte, die het volume (3 liter) in de pot bepaalt. Een vaste draagring van geschikte kunststof rondom de bovenkant van het binnenvat zorgt ervoor dat er tussen het binnenvat en het buitenvat een ruimte is van 0,5 cm breedte voor het afvalwater.
De poreuze potten kunnen worden opgehangen in het midden van een thermostatisch geregeld waterbad. Er is luchttoevoer naar de bodem van het binnenvat waarop geschikte beluchters zijn gemonteerd.
De vaten (A) en (E) zijn van glas of geschikte kunststof met een inhoud van ten minste 24 liter. Pomp (B) zorgt voor een constante toevoer van kunstmatig rioolwater naar het beluchtingsvaf, elk geschikt systeem is bruikbaar, mits de invoerstroom en de concentratie zijn verzekerd.
Er moeten enige poreuze binnenpotten in reserve worden gehouden ter vervanging van potten die tijdens het gebruik verstopt raken; verstopte potten worden gereinigd door ze 24 uur in een hypochlorietoplossing te dompelen en vervolgens grondig met leidingwater te spoelen.
1.6.1.2.
De membraanfiltratieapparatuur en membraanfilters hebben een poriegrootte van 0,45 μm. Membraanfilters zijn geschikt indien vaststaat dat zij geen koolstof afgeven en de stof tijdens de filtratie niet absorberen.
1.6.1.3.
Er kan gebruik gemaakt worden van geschikt kunstmatig afvalwater of van huishoudelijk afvalwater,
Voorbeeld van een kunstmatige toevoer
Per liter leidingwater worden opgelost:
|
Pepton: |
160 mg, |
|
Vleesextract: |
10 mg, |
|
Ureum: |
30 mg, |
|
NaCl: |
7 mg, |
|
CaCl2 — 2H2O: |
4 mg, |
|
MgSo4. 7H2O: |
2 mg, |
|
K2HPO4: |
28 mg. |
Huishoudelijk afvalwater
Dit wordt dagelijks opnieuw verzameld uit de overloop van de primaire bezinkingsvijver van een zuiveringsinstallatie voor voornamelijk huishoudelijk afvalwater.
1.6.1.4.
Een oplossing van de teststof (bijvoorbeeld 1 %) wordt bereid, teneinde aan de testeenheid te worden toegevoegd. De concentratie van het materiaal wordt bepaald, zodat het juiste volume bekend is dat aan het afvalwater of rechtstreeks aan de eenheid via een tweede pomp moet worden toegevoegd, teneinde de vereiste testconcentratie te verkrijgen.
1.6.1.5.
Opmerking: Bij gebruik van huishoudelijk afvalwater heeft het geen zin entmateriaal met lage bacterieconcentratie te gebruiken, actief slib kan echter wel worden gebruikt.
Verschillende entmaterialen kunnen worden gebruikt.
Drie voorbeelden:
|
a) |
Entmateriaal uit secondaire effluent Het entmateriaal wordt genomen van een secondaire effluent van goede kwaliteit uit een zuiveringsinstallatie voor voornamelijk huishoudelijk afvalwater. Het monster afvoerwater wordt tussen de bemonstering en het gebruik onder aerobe omstandigheden gehouden. Voor de bereiding van het entmateriaal wordt het monster door een grof filter geleid, waarbij de eerste 200 ml wordt weggeworpen. Het filtraat wordt tot aan het gebruik aeroob gehouden. Het entmateriaal moet op de dag van de monstername worden gebruikt. Voor het enten is ten minste 3 ml nodig. |
|
b) |
Samengesteld entmateriaal Entmateriaal uit secondaire effluent Zie beschrijving hierboven. Entmateriaal uit bodem 100 g tuingrond (vruchtbaar, niet steriel) wordt gesuspendeerd in 1 000 ml chloorvrij drinkwater. (Grond met een extreem gehalte aan klei, zand of humus is niet geschikt.) Na roeren laat men de suspensie 30 minuten bezinken. De bovenstaande vloeistof wordt door een grof papierfilter gehaald, waarbij de eerste 200 ml wordt weggeworpen. Het filtraat wordt direct daarna tot aan het gebruik belucht. Het entmateriaal wordt op de dag van bereiding, gebruikt. Entmateriaal uit oppervlaktewater Ook wordt nog een deel van het entmateriaal genomen uit mesosaproob oppervlaktewater. Het monster wordt door een grof papierfilter geleid, waarbij de eerste 200 ml wordt weggeworpen. Het filtraat wordt aeroob gehouden tot aan het gebruik. Het entmateriaal wordt gebruikt op de dag van de monstername. Gelijke volumes van de drie verschillende entmonsters worden bijeengebracht en grondig gemengd. Het uiteindelijke entmateriaal wordt van dit mengsel genomen. Voor het enten wordt ten minste 3 ml gebruikt |
|
c) |
Entmateriaal uit actief slib Als entmateriaal kan ook een hoeveelheid (niet meer dan 3 liter) actief slib (gehalte aan gesuspendeerde vaste stof maximaal 2,5 g/l) worden genomen uit de beluchtingstank van een zuiveringsinstallatie voor voornamelijk huishoudelijk afvalwater. |
1.6.2. Werkwijze
De test wordt uitgevoerd bij kamertemperatuur, dat wil zeggen tussen 18 en 25 oC.
Indien gewenst kan de test ook bij lagere temperatuur (minimaal 10 oC) worden uitgevoerd; indien de stof dan wordt afgebroken, is verder onderzoek doorgaans niet nodig. Indien de stof bij die temperatuur echter niet wordt afgebroken, moet de test worden uitgevoerd bij een constante temperatuur tussen 18 en 25 oC.
1.6.2.1.
De groei/stabilisatieperiode van het slib is de tijd gedurende welke de concentratie gesuspendeerd actief slib en de activiteit van de testeenheden toenemen tot een stationaire toestand bereikt wordt onder de heersende omstandigheden.
De aanloopperiode is de periode tussen het tijdstip waarop de toevoeging van teststof begint en het tijdstip waarop de verwijdering daarvan een plateau (betrekkelijk constante waarde) bereikt. Deze periode dient niet langer dan zes weken te zijn.
De beoordelingsperiode is een tijdvak van drie weken vanaf het tijdstip dat de verwijdering van de teststof een betrekkelijk constante, doorgaans hoge waarde bereikt. Voor stoffen die in de eerste zes weken weinig of geen afbraak vertonen, worden de daaropvolgende drie weken genomen als beoordelingsperiode.
Als eerste stap worden de voor één test benodigde eenheden gevuld met het toevoerwater gemengde entmateriaal.
De beluchter (en persluchtpomp (E) bij gebruik van de eenheden van de OESO-bevestigende test) en doseerinrichting (B) worden vervolgens in werking gesteld.
Door het beluchtingsvat (C) wordt toevoerwater zonder teststof geleid met een snelheid van hetzij 1 liter per uur hetzij 0,5 liter per uur; dit geeft een gemiddelde verblijftijd van drie respectievelijk zes uur.
De beluchting wordt zodanig geregeld dat de inhoud van het vat (C) constant in suspensie blijft en het gehalte opgeloste zuurstof ten minste 2 mg/l bedraagt.
Schuimvorming wordt met gepaste middelen tegengegaan, Antischuimmiddelen die het actief slib remmen, mogen niet worden gebruikt.
Het slib, dat zich langs de bovenste rand van het beluchtingsvat (C) en (bij testeenheden van de OESO-bevestigende test) onder in het nabezinkvat (D) en in de omloop heeft verzameld, wordt ten minste eenmaal per dag door roeren of op andere wijze naar de gemengde suspensie teruggebracht.
Wanneer het slib niet bezinkt, kan de dichtheid ervan worden verhoogd door 2 ml 5 % ijzer(III)-chlorideoplossing toe te voegen en dit zo nodig te herhalen.
Het effluent wordt gedurende 20 tot 24 uur in vat (E respectievelijk F) opgevangen en na grondig mengen wordt er een monster genomen. Vat E of F wordt daarna grondig gereinigd.
Om de efficiëntie van het proces te volgen en zo nodig bij te sturen, worden het chemisch zuurstofverbruik of het gehalte opgeloste organische koolstof (DOC) van het filtraat van het opgevangen effluent en dat van het gefiltreerde influent ten minste tweemaal per week gemeten (filtratie geschiedt met een membraan met een poriegrootte van 0,45 μm waarbij het eerste filtraat, van ongeveer 20 ml wordt weggeworpen).
De afname van COD of DOC moet zich stabiliseren wanneer een min of meer regelmatige dagelijkse afbraak is bereikt.
Het gehalte aan droge stof van het actief slib in het beluchtingsvat wordt ten minste tweemaal per week bepaald (in g/l). De eenheden kunnen op twee manieren in werking worden gehouden: in het ene geval wordt het gehalte droge stof in het actief slib tweemaal per week bepaald en, wanneer dit boven 2,5 g/l komt, wordt de overmaat actief slib afgevoerd; in het andere geval wordt dagelijks 500 ml van de gemengde vloeistof afgevoerd, zodat een gemiddelde verblijftijd voor het slib van zes dagen ontstaat.
Wanneer de gemeten en geschatte parameters (efficiëntie van het proces (in COD- of DOC-verwijdering), slibconcentratie, bezinkingsneiging van het slib, troebelheid van het effluent en dergelijke) van de twee eenheden voldoende constant zijn geworden, kan de teststof in de toevoerstroom van een van de twee eenheden, overeenkomstig 1.6.2.2 worden toegevoegd.
Als alternatief kan de teststof worden toegevoegd bij het begin van de slibgroeiperiode (1.6.2.1), in het bijzonder wanneer slib als entmateriaal wordt toegevoegd.
1.6.2.2.
De bedrijfscondities van de aanloopperiode worden gehandhaafd en er wordt voldoende voorraadoplossing (ongeveer 1 %) van de teststof aan de toevoer van de testeenheid toegevoegd zodat de gewenste concentratie teststof (ongeveer 10-20 mg DOC/l of 40 mg COD/l) in het afvalwater wordt verkregen. Dit kan worden bereikt door de oplossing dagelijks in het afvalwater te mengen of door een afzonderlijk pompsysteem. Deze concentratie kan geleidelijk worden bereikt. Indien de teststof geen vergiftiging van het actief slib teweeg brengt, kunnen ook hogere concentraties worden onderzocht.
De blancoeenheid wordt uitsluitend met toevoerwater gevoed zonder toegevoegde stoffen. Voor analyse worden geschikte volumes effluent genomen en door membraanfilters (0,45 μm) geleid, waarbij het eerste filtraat van ongeveer 20 ml worde weggeworpen.
De gefiltreerde monsters moeten op dezelfde dag worden geanalyseerd of anders op een geschikte wijze worden geconserveerd, bijvoorbeeld door aan elke tien ml filtraat 0,05 ml 1 % kwik(II)chlorideoplossing toe te voegen of door gekoeld (2-4 oC tot 24 uur, –18 oC indien langer) te bewaren.
De aanlooptijd waarin de teststof wordt toegevoegd dient niet langer te zijn dan zes weken en de beoordelingsperiode niet korter dan drie weken, zodat ongeveer 14 tot 20 bepalingen beschikbaar zijn voor de berekening van het eindresultaat.
Gekoppelde eenheden
De koppeling van de eenheden komt tot stand door eenmaal per dag 1,5 liter actief-slibsuspensie uit de beluchtingsvaten met actief slib tussen de twee eenheden uit te wisselen. Indien het testmateriaal sterk absorberend is, wordt slechts 1,5 liter van de bovenstaande vloeistof uit de bezinkingsvaten opgenomen en in het actief-slibvat van de andere eenheid gegoten.
1.6.2.3.
Om het gedrag van de stof te volgen, kunnen twee soorten analyse worden uitgevoerd:
DOC en COD
De DOC-concentraties worden in duplo bepaald met de koolstofanalysator en/of de COD-waarden worden bepaald overeenkomstig referentie (2).
Specifieke analyse
De concentraties van de onderzochte stoffen worden bepaald met een geschikte analytische methode. Zo mogelijk wordt ook een specifieke bepaling van de stof geabsorbeerd op slib uitgevoerd.
2. GEGEVENS
2.1. GEKOPPELDE EENHEDEN
Wanneer de methode van gekoppelde eenheden wordt gevolgd, worden de dagelijkse verdwijningspercentages berekend volgens 1.2.1.
Deze dagelijkse verdwijningspercentages worden gecorrigeerd tot DRc voor de materiaaloverdracht als gevolg van de overentingsprocedure met behulp van vergelijking [2] voor een verblijftijd van drie uur en vergelijking [3] voor een verblijftijd van zes uur:
|
|
[2] |
|
|
[3] |
Het gemiddelde van de DRc-waarden wordt, evenals de standaardafwijking, berekend met vergelijking (4):
|
|
[4] |
waarin:
|
SDRC |
= |
standaardafwijking van de reeks DRc-waarden, |
|
|
= |
gemiddelde DRc-waardc, |
|
n |
= |
aantal bepalingen. |
Uitschieters van de DRc-reeks worden geëlimineerd vanaf het 95 % waarschijnlijkheidsniveau volgens een geschikte statistische methode, bijvoorbeeld Nalimov (6). Vervolgens worden het gemiddelde en de standaardafwijking van de DRc-waarden zonder uitschieters opnieuw berekend.
Het eindresultaat wordt vervolgens berekend met vergelijking [5]:
|
|
[5] |
waarin:
|
tn-1 ; α |
= |
tabelwaarde van t voor n paar waarden van E en EO en statistische betrouwbaarheid P (P = 1 - α), waarbij P wordt gesteld op 95 % (1). |
Het resultaat wordt opgegeven als gemiddelde met tolerantiegrenzen bij het 95 % waarschijnlijkheidsniveau met opgave van de bijbehorende standaardafwijking en het aantal gegevens uit de DRc-reeks zonder uitschieters en het aantal uitschieters, bijvoorbeeld:
|
DRc |
= |
98,6±2,3 % DOC-verwijdering, |
|
s |
= |
4,65 % DOC,-verwijdering, |
|
n |
= |
18, |
|
x |
= |
aantal uitschieters. |
2.2. NIET-GEKOPPELDE EENHEDEN
De werking van de eenheden kan als volgt worden gecontroleerd:

Deze dagelijkse verwijderingsgraad kan grafisch worden uitgezet, waardoor bepaalde tendensen, bijvoorbeeld in verband met de acclimatisering, naar voren komen.
2.2.1. Gebruik van COD/DOC-bepalingen
Het dagelijkse verdwijningspercentage DR wordt berekend volgens 1.2.1.
Het gemiddelde van de DR-waarden en de standaardafwijking worden berekend overeenkomstig:
|
|
[6] |
waarin:
|
SDR |
= |
standaardafwijking van de reeks DRi-waarden, |
|
|
= |
gemiddelde van DRi |
|
n |
= |
aantal bepalingen. |
Uitschieters van de reeks DR-waarden worden geëlimineerd vanaf het 95 % waarschijnlijkheidsniveau volgens een geschikte statistische methode, bijvoorbeeld Nalimov (6). Vervolgens worden het gemiddelde en de standaardafwijking van de DR-waarden zonder uitschieters opnieuw berekend.
Daarna wordt het eindresultaat berekend met vergelijking [7]
|
|
[7] |
waarin:
|
tn-1;α |
= |
tabelwaarde van t voor n paar waarden van E en EO en statistische betrouwbaarheid P (P = 1 - α), waarbij P wordt gesteld op 95 % (1). |
Het resultaat wordt opgegeven als het gemiddelde met tolerantiegrenzen bij 95 % waarschijnlijkheidsniveau, de bijbehorende standaardafwijking en het aantal gegevens van de reeks DR-waarden ronder uitschieters en het aantal uitschieters, bijvoorbeeld:
|
DR |
= |
(98,6±2,3 %) DOC-verwijdering, |
|
s |
= |
4,65 % DOC-verwijdering, |
|
n |
= |
18, |
|
x |
= |
aantal uitschieters. |
2.2.2. Gebruik van specifieke analyse
Het percentage verwijdering van de teststof uit de waterfase (Rw) wordt berekend volgens 1.2.2.
3. VERSLAGGEVING
3.1. TESTRAPPORT
Het testrapport moet, indien mogelijk, bevatten:
|
— |
het in aanhangsel 3 weergegeven formulier waaruit de bedrijfsomstandigheden voor de test blijken; |
|
— |
de gekozen apparatuur (OESO-bevestigende test of poreuze pot); |
|
— |
de gekozen wijze van uitvoering: al dan niet gekoppelde eenheden; |
|
— |
soort afvalwater: kunstmatig of huishoudelijk; indien huishoudelijk afvalwater, datum en plaats van bemonstering; |
|
— |
entmateriaal, met datum en plaats van bemonstering; |
|
— |
een verklaring met de beschrijving van de analysemethode indien specifieke analyses zijn uitgevoerd; |
|
— |
grafiek van het percentage COD- of DOC-verwijdering als functie van de tijd, inclusief aanloopperiode en beoordelingsperiode; |
|
— |
analytisch terugvindpercentage van de teststof als COD of DOC in de voorraadoplossing; |
|
— |
indien specifieke analyses werden uitgevoerd, de grafiek van het percentage verwijdering van de onderzochte stof uit de waterfase als functie van de tijd (aanloop- en beoordelingsperiode); |
|
— |
de gemiddelde verwijdering van DOC, COD of van teststof en standaardafwijking, berekend uit de resultaten van de beoordelingsperiode, dat wil zeggen wanneer er een constante verwijdering van restmateriaal is dan wel de installatie stationair werkt; |
|
— |
grafiek van de concentratie actief slib als functie van de tijd; |
|
— |
opmerkingen over het actief slib (verwijdering van overmaat slib, sterke toename, ijzerchloride, enz.) |
|
— |
in de test gebruikte concentratie van de stof; |
|
— |
alle resultaten van de analyse van het slib; |
|
— |
alle informatie en experimentele resultaten over de teststof en, indien gebruikt, de referentiestof; |
|
— |
wetenschappelijke verantwoording van eventuele wijzigingen in de procedure. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Een geringe verwijdering van de teststof uit de waterfase kan het gevolg zijn van remming van micro-organismen door de teststof. Dit kan ook blijken uit de ontbinding en het verlies van slib, met als gevolg een troebele vloeistof en uit een afname van de efficiëntie van de COD- of DOC-verwijdering van de proefinstallatie.
Fysisch-chemische adsorptie kan ook een rol spelen. Verschillen tussen de biologische aantasting van de verbinding en de fysisch-chemische adsorptie kan blijken door analyse van het slib na een geschikte desorptie.
Indien onderscheid moet worden gemaakt tussen biologische afbraak (of gedeeltelijke biologische afbraak) en adsorptie, zijn verdere proeven nodig.
Hiervoor bestaat een aantal mogelijkheden, maar de meest ondubbelzinnige is het gebruik van de bovenstaande vloeistof als entmateriaal in een basistest (bij voorkeur respirometrische test).
Indien hoge percentages DOC- of COD-verwijdering worden waargenomen, is dit het gevolg van biologische afbraak, terwijl bij geringe verwijdering de biologische afbraak niet te onderscheiden is van verwijdering. Indien bijvoorbeeld een oplosbare verbinding een hoge adsorptieconstante van 98 % blijkt te hebben en per dag 10 % overmaat slib wordt afgevoerd, is een verwijdering tot 40 % mogelijk; bij een afvoer van 30 % overmaat slib per dag kan verwijdering als gevolg van adsorptie aan en verwijdering met overmaat slib oplopen tot 65 % (4),
Wanneer specifieke analyses worden uitgevoerd, moet gelet worden op het verband tussen de structuur van de stof en de gebruikte specifieke analyse; In dit geval kan het waargenomen verschijnsel niet worden uitgelegd als mineralisering van de stof.
4. REFERENTIES
|
(1) |
OESO, Parijs, 1981, Testrichtlijn 303 A, Besluit C(81) 30 def. van de Raad. |
|
(2) |
Bijlage V, C 9 Degradatie: Chemisch zuurstofverbruik, Richtlijn 84/449/EEG van de Commissie, Publicatieblad van de Europese Gemeenschappen L 251 van 19.9.1984. |
|
(3) |
Painter, H. A., en King, E. F,, Porous-Pot method for assessing biodegradability, Technical Report TR70, juni 1978, Water Research Centre, UK. |
|
(4) |
Wierich, P.,en Gerike, P.,The Fate of Soluble Recalcitrant, and Adsorbing Compounds in Activated Sludge Plants, Ecotoxicology and Environmental Safety, Vol. 5, no. 2, juni 1981, blz. 161 en 171. |
|
(5) |
Richtlijnen 82/242/EEG en 82/243/EEG ( Publicatieblad van de Europese Gemeenschappen L 109 van 22.4.1982) tot wijziging van de Richtlijnen 73/404/EEG en 73/405/EEG: Biologische afbreekbaarheid van detergenten ( Publicatieblad van de Europese Gemeenschappen L 347 van 17.12.1973). |
|
(6) |
Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreißertests, insbesondere bei Ringversuchen zur Überprüfung analytisch-chemischer Untersuchungsmethoden, Fesenius-Zeitschrift für Analytische Chemie 303 (1980), blz. 406. |
Aanhangsel 1
Figuur 1

Figuur 2

Aanhangsel 2
Figuur 1
Apparatuur voor bepaling biologische afbreekbaarheid

Figuur 2
Maten van poreus beluchtingsvat van 3 liter

Aanhangsel 3
Bedrijfsomstandigheden voor de simulatieproef actief slib
Kruis aan in elke groep
Apparatuur
|
OESO-bevestigende test |
|
|
Poreuze pot |
|
Werkwijze
|
Enkele eenheid |
|
|
Gekoppelde eenheden |
|
|
Niet-gekoppelde eenheden |
|
Overenting
|
Geen |
|
|
Actief slib |
|
|
Supernatans |
|
Gemiddelde verblijftijd
|
Drie uur |
|
|
Zes uur |
|
Basisnutriënt
|
Huishoudelijk afvalwater |
|
|
Kunstmatig afvalwater |
|
Entmateriaal
|
Secondaire effluent |
|
|
Samengesteld |
|
|
Actief slib |
|
Toevoeging teststof
|
Vanaf het begin |
|
|
Stapsgewijze toename |
|
|
Nadat slib is gevormd |
|
Analyse
|
Specifiek |
|
|
COD |
|
|
DOC |
|
C.11. BIOLOGISCHE AFBRAAK
ACTIEF SLIB: REMMING ADEMHALING
1. METHODE
1.1. INLEIDING
In de hier beschreven methode wordt de invloed van een teststof op micro-organismen bepaald doordat de ademhalingssnelheid onder gedefinieerde omstandigheden wordt gemeten in aanwezigheid van verschillende concentraties van de teststof.
Deze methode is een snelle test, waarmee stoffen die de werking van aerobe microbiële zuiveringsinstallaties kunnen schaden, kunnen worden geïdentificeerd. Ook dient de test om een aanwijzing te krijgen van niet-remmende concentraties van stoffen waarvan de biologische afbreekbaarheid moet worden onderzocht.
De definitieve test kan worden voorafgegaan door een oriënterende proef. Deze levert informatie op over het concentratiegebied dat in de definitieve test dient te worden onderzocht.
De test bevat verder twee controles zonder reststof, welke respectievelijk aan het begin en aan het eind van de test worden ingezet. Bovendien wordt elke partij actief slib met behulp van een referentiestof gecontroleerd.
Deze methode verloopt het gemakkelijkst met stoffen die door de goede oplosbaarheid in water in de geringe vluchtigheid waarschijnlijk in het water blijven.
Voor stoffen met beperkte oplosbaarheid in het testmedium is het niet altijd mogelijk de EC50 te bepalen.
Resultaten gebaseerd op zuurstofopname kunnen tot onjuiste conclusies leiden, indien de teststof de neiging heeft de oxidatieve fosforylering te ontkoppelen.
Voor de uitvoering van de test is de volgende informatie over de teststof van nut:
|
— |
oplosbaarheid in water, |
|
— |
dampdruk, |
|
— |
structuurformule, |
|
— |
zuiverheid. |
Aanbeveling
Actief slib kan potentieel ziekteverwekkende organismen bevatten en dient daarom met voorzichtigheid te worden behandeld.
1.2. DEFINITIES EN EENHEDEN
Onder ademhalingssnelheid wordt verstaan het zuurstofverbruik van actief slib van micro-organismen in afvalwater. Dit wordt doorgaans uitgedrukt in mg O2 per mg actief slib (droge stof) per uur.
Voor de berekening van het remmende effect van een bepaalde concentratie van de teststof wordt de ademhalingssnelheid uitgedrukt als percentage van het gemiddelde van de ademhalingssnelheden van de twee controles:
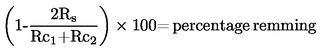
waarin:
|
R6 |
= |
ademhalingssnelheid bij de geteste concentratie van de teststof, |
|
RC1 |
= |
ademhalingssnelheid van de eerste controle, |
|
RC2 |
= |
ademhalingssnelheid van de tweede controle. |
De EC50 in deze methode is de concentratie van de teststof waarbij de ademhalingssnelheid 50 % bedraagt van die in de controle onder de in deze methode beschreven omstandigheden.
1.3. REFERENTIESTOFFEN
Aanbevolen wordt 3,5-dichloorfenol, dat een bekende remmer van de ademhaling is, te gebruiken als referentiestof en hiervan de EC50 te testen ter controle van de gevoeligheid van het slib.
1.4. PRINCIPE VAN DE TESTMETHODE
De ademhalingssnelheid van actief slib waaraan een standaardhoeveelheid kunstmatig afvalwater wordt toegevoegd, wordt gemeten na een contacttijd van 30 minuten of drie uur of beide. Ook wordt de ademhalingssnelheid van hetzelfde actief slib gemeten in aanwezigheid van verschillende concentraties van de teststof onder overigens identieke omstandigheden. De remmende werking van de teststof bij een bepaalde concentratie wordt weergegeven als percentage van de gemiddelde ademhalingssnelheden van twee controles. Een EC50-waarde wordt berekend op grond van bepalingen bij verschillende concentraties.
1.5. KWALITEITSNORMEN
De testresultaten zijn geldig indien:
|
— |
de ademhalingssnelheden van de twee controles onderling minder dan 15 % verschillen; |
|
— |
de EC50 (30 minuten en/of drie uur) van 3,5-dichloorfenol 5 tot 30 mg/l bedraagt. |
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Reagentid
1.6.1.1.
De benodigde oplossingen van de teststof worden bij de aanvang van het onderzoek vers uit een voorraadoplossing bereid. Voor de voorraadoplossing kan, indien de onderstaande aanbevolen werkwijze wordt gevolgd, een concentratie van 0,5 g/l worden aangehouden.
1.6.1.2.
Een oplossing van 3,5-dichloorfenol kan bijvoorbeeld worden bereid door 0,5 g 3,5-dichloorfenol op te lossen in 10 ml 1M NaOH, dan tot ongeveer 30 ml met gedestilleerd water te verdunnen, vervolgens onder roeren 0,5 M H2SO4 toe te voegen tot er een neerslag begint te ontstaan — hiervoor zal ongeveer 8 ml 0,5 M H2SO4 nodig zijn — en ten slotte het mengsel met gedistilleerd water tot 1 liter te verdunnen. De pH moet dan liggen tussen 7 en 8.
1.6.1.3.
Kunstmatig afvalwater wordt bereid door de volgende hoeveelheden stoffen op te lossen in 1 liter water:
|
— |
16 g pepton, |
|
— |
11 g vleesextract, |
|
— |
3 g ureum, |
|
— |
0,7 g NaCl, |
|
— |
0,4 g CaCl2,.2H2O, |
|
— |
0,2 g MgSO4.7H2O, |
|
— |
2,8 g K2HPO4. |
Opmerking 1: Dit kunstmatige afvalwater is 100 maal zo geconcentreerd als hetgeen is beschreven in het technisch rapport van de OESO „Proposed method for the determination of the biodegradability of surfactants used in synthetic detergents” van 11 juni 1976. Bovendien is er dikaliumwaterstoffosfaat toegevoegd.
Opmerking 2: Indien het kunstmatige afvalwater niet onmiddellijk wordt gebruikt, moet het in het donker bij 0 tot 4 oC bewaard worden gedurende maximaal één week, zodanig dat verandering in samenstelling vermeden wordt. Het kunstmatige afvalwater kan eventueel gesteriliseerd worden voor opslag of de pepton en het vleesextract kunnen kort voor de uitvoering van de test toegevoegd worden. Vóór het gebruik moet de oplossing goed worden gemengd en de pH worden bijgesteld.
1.6.2. Apparatuur
Meetapparaat: De precieze maten zijn niet van wezenlijk belang. Er moet echter geen vrije ruimte bovenin zijn en de elektrode moet goed zijn ingeklemd in de hals van het meetvat.
Benodigde apparatuur:
|
— |
meetapparaat (zie figuur 1), |
|
— |
beluchtingstoestel, |
|
— |
pH-elektrode en meetapparatuur, |
|
— |
O2-elektrode. |
1.6.3. Bereiding van het entmateriaal
Als microbieel entmateriaal voor de test wordt doorgaans actief slib uit een zuiveringsinstallatie gebruikt die hoofdzakelijk huishoudelijk afvalwater behandelt.
Indien nodig kunnen de grotere deeltjes door bezinking, gedurende bijvoorbeeld vijftien minuten, en door decanteren van de bovenlaag met fijnere deeltjes voor het gebruik afgescheiden worden. Een alternatieve methode is het gedurende enkele seconden homogeniseren van het slib met behulp van een mixer.
Wanneer er reden is te veronderstellen dat er toxische componenten aanwezig zijn, moet het slib gewassen worden met leidingwater of een isotone oplossing. Na centrifugeren wordt het supernatant gedecanteerd (deze procedure moet drie keer herhaald worden).
Een klein gedeelte van het slib wordt gewogen en gedroogd. Aan de hand van dit resultaat kan de hoeveelheid nat slib berekend worden die in water gesuspendeerd dient te worden teneinde een actief slib te verkrijgen met een droge-stofgehalte tussen 2 en 4 g/l. Dit niveau correspondeert met een concentratie tussen 0,8 en 1,6 g/l in het testmedium, wanneer de hieronder aanbevolen procedure wordt gevolgd.
Indien het slib niet kan worden gebruikt op de dag dat het is verzameld, wordt aan elke liter actief slib die op bovenstaande wijze is bereid, 50 ml kunstmatig afvalwater per liter slib toegevoegd; dit mengsel wordt dan 's nachts belucht bij 20 ± 2 oC. Ook gedurende de dag wordt dit belucht. Voor gebruik wordt de pH gecontroleerd en indien nodig tussen 6 en 8 gebracht. Het gehalte aan gesuspendeerde vaste stof wordt bepaald als beschreven in de voorgaande alinea.
Indien dezelfde partij slib nodig is voor proeven op opeenvolgende dagen (ten hoogste vier dagen) wordt aan het eind van elke werkdag steeds 50 ml kunstmatig afvalwater toegevoegd.
1.6.4. Uitvoering van de test
|
Duur/contacttijd: |
30 minuten en/of drie uur, gedurende welke tijd wordt belucht. |
|
Water: |
Drinkwater (zo nodig chloorvrij gemaakt). |
|
Luchttoevoer: |
Schone lucht, vrij van olie. Stroomsnelheid 0,5 tot 1 liter/minuut. |
|
Meetapparaat: |
Platbodemkolf, bijvoorbeeld een BOD-kolf (zie figuur 1). |
|
Zuurstofmeter: |
Een geschikte zuurstofelektrode met een recorder. |
|
Voedingsoplossing: |
Kunstmatig afvalwater (zie boven). |
|
Teststof: |
De testoplossing wordt vers bereid bij de aanvang van de test. |
|
Referentiestof: |
bijvoorbeeld 3,5-dichloorfenol (ten minste drie concentraties). |
|
Controle: |
Geënt monster zonder teststof. |
|
Temperatuur: |
20 ± 2 oC. |
Voor zowel de teststof als de referentiestof kan voor de drie uur contactperiode de volgende werkwijze worden gevolgd:
Er worden verschillende vaten (bijvoorbeeld bekerglazen van 1 1) gebruikt.
Er worden ten minste vijf concentraties gebruikt die onderling steeds met dezelfde factor (bij voorkeur kleiner dan 3,2) verschillen.
Op tijdstip „0” wordt 16 ml kunstmatig afvalwater aangevuld met water tot 300 ml. Hieraan wordt 200 ml microbieel entmateriaal toegevoegd en het totale mengsel (500 ml) wordt in het eerste vat gegoten (eerste controle C1).
De testvaten moeten continu belucht worden om er zeker van te zijn dat het gehalte aan opgelost O2 niet lager wordt dan 2,5 mg/l en dat vlak voor de meting van de ademhalingssnelheid de O2-concentratie ten minste 6,5 mg/l bedraagt.
Op tijdstip „vijftien minuten” (vijftien minuten is een willekeurige maar geschikte tijd) wordt bovenstaande procedure herhaald, behalve dat eerst aan de 16 ml kunstmatig afvalwater 100 ml voorraadoplossing van de teststof wordt toegevoegd voordat met water tot 300 ml en daarna met microbieel entmateriaal tot 500 ml wordt aangevuld. Dit mengsel wordt dan in een tweede vat gegoten en als boven belucht. Dit proces wordt met tussenpozen van vijftien minuten herhaald met verschillende volumes van de voorraadoplossing van de teststof, zodat een reeks vaten ontstaat met verschillende concentraties van de teststof. Ten slotte wordt een tweede controle bereid (C2).
Na drie uur wordt de pH gemeten, wordt een goed homogeen monster van de inhoud van het eerste vat in het meetapparaat gegoten en wordt de ademhalingssnelheid gedurende maximaal tien minuten gemeten.
Deze bepaling wordt om de vijftien minuten herhaald met steeds een volgend vat, zodanig dat de contacttijd per vat drie uur is.
Met elke partij microbieel entmateriaal wordt de referentiestof op dezelfde wijze getest.
Wanneer er metingen na 30 minuten contact nodig zijn, moet een andere procedure worden gekozen (bijvoorbeeld meer dan één zuurstofmeter).
Indien meting van het chemisch zuurstofverbruik nodig is, worden nog meer vaten bereid met teststof, kunstmatig afvalwater en water, maar zonder actief slib. Het zuurstofverbruik wordt gemeten en geregistreerd na een beluchtingstijd van 30 minuten en/of drie uur (contacttijd).
2. GEGEVENS EN UITWERKING
De ademhalingssnelheid wordt berekend uit de recorderuitslag in mg O2/l tussen ongeveer 6,5 mg O2/l en 2,5 mg O2/l of over een periode van tien minuten indien de ademhalingssnelheid laag is. Het gedeelte van de ademhalingscurve waarover de ademhalingssnelheid wordt gemeten moet rechtlijnig zijn.
Indien de ademhalingssnelheden van de twee controles niet binnen 15 % van elkaar liggen of de EC50 (30 minuten en/of drie uur) van de referentiestof niet in het aanvaardbare gebied (5 tof 30 mg/l voor 3,5-dichloorfenol) ligt, is de test niet geldig en moet deze worden herhaald.
Het percentage remming wordt bij elke testconcentratie berekend (zie 1.2). Het percentage remming wordt uitgezet tegen de concentratie op log-normaal- of log-waarschijnlijkheidspapier en daaruit wordt de EC50-waarde herleid.
De 95 % betrouwbaarheidsgrenzen voor de EC50-waarden kunnen volgens standaardprocedures worden bepaald.
3. VERSLAGGEVING
3.1. TESTRAPPORT
Het testrapport moet, indien mogelijk, bevatten:
|
— |
teststof: scheikundige gegevens ter identificatie; |
|
— |
testsysteem: herkomst, concentratie en eventuele voorbehandeling van het actief slib; |
|
— |
testomstandigheden:
|
|
— |
resultaten:
|
3.2. INTERPRETATIE VAN DE GEGEVENS
De EC50-waarde dient te worden beschouwd als niet meer dan een aanwijzing voor de waarschijnlijke toxiciteit van de teststof, hetzij voor de afvalwaterbehandeling met actief slib, hetzij voor micro-organismen in afvalwater, omdat de in het milieu optredende ingewikkelde interacties in een laboratoriumproef niet voldoende kunnen worden nagebootst. Bovendien kunnen teststoffen die mogelijk remmend werken op de ammonia-oxydatie eveneens atypische inhibitiecurven opleveren. Dergelijke curven dient men met gepaste terughoudendheid te interpreteren.
4. REFERENTIES
|
(1) |
International Standard ISO 8192-1986. |
|
(2) |
Broecker, B., en Zahn, R., Water Research 11, 1977, blz. 165. |
|
(3) |
Brown, D., Hitz, H. R., en Schaefer, L., Chemosphere 10, 1981, blz. 245. |
|
(4) |
ETAD (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, also described by: |
|
(5) |
Robra, B., Wasser/Abwasser 117, 1976, blz. 80. |
|
(6) |
Schefer, W., Textilveredlung 6, 1977, blz. 247. |
|
(7) |
OESO, Parijs, 1981, Testrichtlijn 209, Besluit C(81) 30 def. van de Raad. |
C.12. BIOLOGISCHE AFBRAAK
GEWIJZIGDE SCAS-TEST
1. METHODE
1.1. INLEIDING
Doel van de methode is te bepalen in hoeverre in water oplosbare, niet-vluchtige organische verbindingen uiteindelijk biologisch afbreekbaar zijn, wanneer zij gedurende lange tijd worden blootgesteld aan relatief hoge concentraties micro-organismen. De micro-organismen worden gedurende deze tijd in leven gehouden door dagelijkse toevoeging van voorbezonken rioolwater. (Voor gebruik tijdens het weekend kan het rioolwater bij 4 oC worden bewaard. Tevens kan het synthetisch rioolwater van de OESO-bevestigende test worden gebruikt.)
Er kan fysisch-chemische adsorptie aan de gesuspendeerde deeltjes plaatsvinden; hiermee moet bij de interpretatie van de resultaten rekening worden gehouden (zie 3.2).
Vanwege de lange verblijftijd van de vloeibare fase (36 uur) en de tussentijdse toevoeging van nutriënten worden bij de test niet de omstandigheden in een rioolwaterzuiveringsinstallatie gesimuleerd. De resultaten met verschillende verbindingen wijzen erop dat de potentiële biologische afbraak bij de test hoog is.
De testomstandigheden zijn zeer gunstig voor de selectie en/of adaptatie van micro-organismen die de te testen verbinding kunnen afbreken. (De procedure kan ook worden gebruikt voor het verkrijgen van geadapteerde inocula voor andere tests).
Bij deze methode wordt de uiteindelijke biologische afbreekbaarheid van de te testen verbindingen beoordeeld door meting van de concentratie opgelost organisch koolstof (Concentration Dissolved Organic Carbon = DOC concentration). Het verdient de voorkeur de DOC-concentratie na aanzuren en zuiveren te bepalen en niet als het verschil van Ctotaal — Canorg.
Wanneer tegelijkertijd een specifieke analysemethode wordt gebruikt, kan tevens worden nagegaan in hoeverre primaire afbraak van de verbinding plaatsvindt (verdwijning van de oorspronkelijke chemische structuur).
De methode kan alleen worden toegepast bij die organische verbindingen die bij de in de test gebruikte concentratie:
|
— |
in water oplosbaar zijn (ten minste 20 mg opgelost organisch koolstof per liter), |
|
— |
een verwaarloosbare dampspanning hebben, |
|
— |
niet remmend werken op bacteriën, |
|
— |
binnen het testsysteem niet in belangrijke mate worden geadsorbeerd, |
|
— |
niet door schuimvorming uit de oplossing verdwijnen. |
Het gehalte aan organisch koolstof van het testmateriaal moet worden bepaald.
Gegevens over de onderlinge verhoudingen van de belangrijkste bestanddelen van het testmateriaal zijn nuttig voor de interpretatie van de verkregen resultaten, met name als de gevonden waarden laag of zeer laag zijn.
Gegevens over de toxiciteit van de stof voor micro-organismen kunnen nuttig zijn voor de interpretatie van lage waarden en voor de keuze van geschikte testconcentraties.
1.2. DEFINITIES EN EENHEDEN
|
CT |
= |
concentratie van de testverbinding uitgedrukt in organisch koolstof, zoals deze aan het begin van de beluchtingsperiode in het bezonken rioolwater aanwezig is of daaraan wordt toegevoegd (mg/l), |
|
Ct |
= |
concentratie opgelost organisch koolstof in het supernatans van het testmengsel aan het eind van de beluchtingsperiode (mg/l), |
|
Cc |
= |
concentratie opgelost organisch koolstof in het supernatans van het controlemengsel aan het eind van de beluchtingsperiode (mg/l). |
Bij deze methode wordt biologische afbraak gedefinieerd als het verdwijnen van organisch koolstof. De biologische afbraak kan worden uitgedrukt als:
|
1. |
De verdwenen hoeveelheid als percentage van de per dag toegevoegde hoeveelheid verbinding (Dda):
|
|
2. |
De verdwenen hoeveelheid als percentage van de aan het begin van elke dag aanwezige hoeveelheid verbinding
de indexen i en (i + 1) verwijzen naar de dag van meting. Vergelijking 2 a) wordt aanbevolen wanneer de DOC-concentratie in het effluent van dag tot dag verschilt, terwijl vergelijking 2 b) kan worden gebruikt wanneer de DOC-concentratie in het effluent van dag tot dag relatief constant blijft. |
1.3. REFERENTIEVERBINDINGEN
In sommige gevallen kan bij het onderzoek van een nieuwe verbinding het gebruik van referentieverbindingen nuttig zijn; hier worden echter geen specifieke referentieverbindingen aanbevolen.
Er worden gegevens verschaft over een aantal verbindingen waarvoor een ringonderzoek is uitgevoerd (zie aanhangsel 1), voornamelijk om de methode zo nu en dan te kunnen ijken en om bij gebruik van een andere methode de resultaten te kunnen vergelijken.
1.4. PRINCIPE VAN DE TESTMETHODE
Actief slib uit een rioolwaterzuiveringsinstallatie wordt in een semi-continue actief-slibinstallatie (SCAS) gebracht. De te testen verbinding en voorbezonken rioolwater, worden toegevoegd en het mengsel wordt gedurende 23 uur belucht. Vervolgens wordt de beluchting gestopt, laat men het slib bezinken en wordt het supernatans verwijderd.
Het in de beluchtingskamer achtergebleven slib wordt vervolgens vermengd met een nieuwe hoeveelheid van de te testen verbinding en rioolwater en de cyclus wordt herhaald.
De biologische afbraak wordt gemeten door bepaling van de hoeveelheid opgelost organisch koolstof in het supernatans. Deze waarde wordt vergeleken met de waarde die wordt verkregen voor het supernatans van controleslib, waaraan alleen voorbezonken rioolwater is toegevoegd.
Wanneer een specifieke analysemethode wordt gebruikt, kunnen ook veranderingen in de concentratie van de uitgangsstof ten gevolge van biologische afbraak worden gemeten (primaire biologische afbreekbaarheid).
1.5. KWALITEITSCRITERIA
De reproduceerbaarheid van deze methode, gebaseerd op het verdwijnen van opgelost organisch koolstof, is nog niet aangetoond. (Wanneer rekening wordt gehouden met primaire biologische afbraak, worden zeer nauwkeurige gegevens verkregen voor materiaal dat in hoge mate afbreekbaar is.)
De gevoeligheid van de methode wordt grotendeels bepaald door de variatie in de blancobepaling en in mindere mate door de nauwkeurigheid van de bepaling van opgelost organisch koolstof en de concentratie van de te testen verbinding in de vloeistof aan het begin van elke cyclus.
1.6. BESCHRIJVING VAN DE TESTPROCEDURE
1.6.1. Voorbereidingen
Voor elke te testen verbinding en voor de blancobepalingen moet een voldoende aantal schone beluchtingskamers (de oorspronkelijke SCAS-testopstelling van 1,5 1 kan tevens worden gebruikt) worden opgesteld, voorzien van luchtinlaatbuizen (figuur 1). De perslucht voor de testopstelling wordt gefiltreerd door een grof filter met watten, mag geen organisch koolstof bevatten en moet vooraf worden verzadigd met water om verliezen door verdamping zoveel mogelijk te voorkomen.
Uit een actief-slibinstallatie, waar voornamelijk huishoudelijk afvalwater wordt gereinigd, wordt een monster actief-slibsuspensie genomen, dat 1 tot 4 g gesuspendeerde stoffen/l bevat. Voor elke beluchtingskamer is ongeveer 150 ml van de gemengde vloeistof nodig.
Er worden voorraadoplossingen van de te testen verbinding in gedistilleerd water gemaakt; onder normale omstandigheden is een concentratie van 400 mg/l berekend als organisch koolstof nodig, zodat de concentratie van de te testen verbinding, als er geen biologische afbraak optreedt, aan het begin van elke beluchtingscyclus 20 mg koolstof/l is.
Hogere concentraties zijn mogelijk als de toxiciteit voor micro-organismen dit toelaat.
De concentratie organisch koolstof in de voorraadoplossingen wordt gemeten.
1.6.2. Testomstandigheden
De test dient te worden uitgevoerd bij 20 tot 25 oC.
Er wordt een hoge concentratie aerobe micro-organismen gebruikt (1 tot 4 % gesuspendeerd materiaal per liter) en de effectieve verblijfstijd is 36 uur. Het koolstofhoudend materiaal in het rioolwater wordt in hoge mate geoxideerd, onder normale omstandigheden binnen acht uur na het begin van elke beluchtingscyclus. Daarna is de ademhaling in het slib gedurende de rest van de beluchtingsperiode endogeen; gedurende deze periode is de te testen verbinding het enige beschikbare substraat, tenzij ook deze snel wordt gemetaboliseerd. Deze kenmerken, alsmede het feit dat het testmengsel bij gebruik van huishoudelijk afvalwater als medium elke dag opnieuw wordt geënt, leveren zeer gunstige omstandigheden op voor zowel adaptatie als een hoge mate van biologische afbraak.
1.6.3. Uitvoering van de test
Uit een actief-slibinstallatie voor in hoofdzaak huishoudelijk afvalwater of een laboratoriuminstallatie wordt een gemengd vloeistofmonster genomen en tot gebruik in het laboratorium aeroob bewaard. Elke beluchtingskamer (ook die voor de blancobepaling) wordt gevuld met 150 ml van de gemengde vloeistof (wanneer de oorspronkelijke SCAS-testapparatuur wordt gebruikt, moeten de genoemde volumes met 10 worden vermenigvuldigd) en de beluchting wordt gestart. Na 23 uur wordt de beluchting gestopt en laat men het slib gedurende 45 minuten bezinken. De kraan wordt opengedraaid en uit elke beluchtingskamer tapt men 100 ml van het supernatans af. Vlak voor gebruik wordt een hoeveelheid voorbezonken rioolwater genomen; 100 ml daarvan wordt toegevoegd aan het in elke beluchtingskamer achtergebleven slib. De beluchting wordt opnieuw gestart. In deze fase wordt geen testmateriaal toegevoegd; elke dag wordt uitsluitend huishoudelijk afvalwater in de beluchtingskamer gebracht, tot er na bezinken een helder supernatans wordt verkregen. Dit duurt meestal maximaal twee weken; de hoeveelheid opgelost organisch koolstof in het supernatans aan het eind van elke beluchtingscyclus benadert dan een constante waarde.
Aan het eind van deze periode wordt het bezonken slib uit de verschillende kamers gemengd en wordt in elke kamer 50 ml van dit gemengde slib gebracht.
In het testvat voor de blanco-bepaling worden 95 ml voorbezonken rioolwater en 5 ml water gebracht. In de overige testvaten wordt 95 ml voorbezonken rioolwater en 5 ml van de voorraadoplossing (400 mg/l) van de te testen verbinding gebracht. De beluchting wordt opnieuw gestart en 23 uur later stopgezet. Vervolgens laat men het slib 45 minuten bezinken; het supernatans wordt afgetapt en de hoeveelheid opgeloste organische koolstof wordt bepaald.
Deze vul- en aftapprocedure wordt gedurende de hele test elke dag herhaald.
Het is wellicht nodig vóór het bezinken de wanden van de kamers schoon te maken, om te voorkomen dat zich hierop boven het vloeistofniveau vaste deeltjes gaan afzetten. Om onderlinge verontreiniging te voorkomen wordt voor elke kamer een afzonderlijke schraper of borstel gebruikt.
De hoeveelheid opgelost organisch koolstof in het supernatans wordt bij voorkeur elke dag bepaald, hoewel het toelaatbaar is de analyse minder vaak uit te voeren. Vóór analyse wordt de vloeistof gefiltreerd door gewassen membraanfilters van 0,45 μm of gecentrifugeerd. Membraanfilters kunnen worden gebruikt, als vaststaat dat deze tijdens de filtratie geen koolstof afgeven en ook de testverbinding niet adsorberen. De temperatuur van het monster mag in de centrifuge niet hoger zijn dan 40 oC.
Er zijn geen vaste regels voor de tijdsduur van de test voor verbindingen die niet of nauwelijks biologisch worden afgebroken, maar de ervaring leert dat deze in het algemeen minimaal 12 weken en maximaal 26 weken moet zijn.
2. GEGEVENS EN EVALUATIE
De hoeveelheid opgelost organisch koolstof in het supernatans bij de testbepalingen en de blancobepalingen worden tegen de tijd uitgezet.
Naarmate de biologische afbraak ten einde loopt, zullen de waarden voor de testbepalingen in de buurt komen te liggen van de blancowaarden. Wanneer het verschil tussen de twee waarden bij drie opeenvolgende metingen constant blijft, worden er nog zoveel metingen uitgevoerd dat statistische behandeling van de gegevens mogelijk is en wordt het percentage van de te testen verbinding dat biologisch wordt afgebroken berekend (Dda of Dssd, zie 1.2).
3. RAPPORTAGE
3.1. TESTRAPPORT
Het testrapport moet, indien mogelijk, bevatten:
|
— |
alle gegevens over de aard van het rioolwater en de gebruikte proefopstelling en de resultaten van de bepalingen met de te testen verbinding en met de eventueel gebruikte referentieverbinding en de resultaten van de blancobepalingen, |
|
— |
de temperatuur, |
|
— |
de afbraakcurve met een beschrijving en de berekeningswijze (zie 1.2), |
|
— |
datum en plaats van monsterneming van het actief slib en het rioolwater en gegevens over adaptatie daarvan, concentratie, enz., |
|
— |
wetenschappelijke motivering voor veranderingen in de testprocedure, |
|
— |
handtekening en datum. |
3.2. INTERPRETATIE VAN DE RESULTATEN
Aangezien de via deze methode te testen verbinding niet gemakkelijk biologisch afbreekbaar zal zijn, zal een verlaging van de DOC-concentratie uitsluitend ten gevolge van biologische afbraak onder normale omstandigheden geleidelijk plaatsvinden in de loop van dagen of weken, behalve in gevallen waar een plotselinge adaptatie optreedt, hetgeen blijkt uit een abrupte concentratieverlaging na enkele weken.
Fysisch-chemische adsorptie kan echter soms een belangrijke rol spelen; in dat geval verdwijnt het toegevoegde DOC reeds in het begin volledig of gedeeltelijk. Wat er vervolgens gebeurt, is afhankelijk van factoren als de mate van adsorptie en de concentratie van gesuspendeerde deeltjes in het afgetapte effluent. Meestal is het verschil in DOC-concentratie in het supernatans tussen de blancobepaling en de testbepaling aanvankelijk gering en neemt dit geleidelijk toe tot een nieuwe waarde die gedurende de rest van het experiment constant blijft, tenzij adaptatie optreedt.
Om onderscheid te kunnen maken tussen biologische afbraak (of gedeeltelijke biologische afbraak) en adsorptie moeten andere tests worden uitgevoerd. Dit kan op een aantal manieren gebeuren, maar het meest ondubbelzinnig is het supernatans of het slib als inoculum te gebruiken bij een elementair (bij voorkeur respirometrisch) experiment.
Testverbindingen, waarbij in dit experiment een grote verlaging van de DOC-concentratie optreedt, welke verlaging niet wordt veroorzaakt door adsorptie, moeten worden beschouwd als eventueel biologisch afbreekbaar. Een gedeeltelijke, niet door adsorptie veroorzaakte verlaging wijst erop dat de verbinding althans enigermate biologisch wordt afgebroken.
Een geringe of in het geheel geen verlaging van de DOC-concentratie kan worden veroorzaakt door inhibitie van de micro-organismen door de te testen verbinding; dit kan ook blijken uit afbraak en verlies van slib, waarbij een troebel supernatans ontstaat. In dit geval moet de test worden herhaald met een lagere concentratie van de te testen verbinding.
Door het gebruik van specifieke analysemethoden of van met 14C gelabelde testverbindingen kan een grotere gevoeligheid worden bereikt. In het geval van 14C-testverbindingen wordt de biologische afbraak aangetoond door het ontstaan van 14C02.
Wanneer er bij de resultaten ook gegevens worden vermeld over primaire biologische afbraak, moet, indien mogelijk, worden verklaard door welke verandering in de chemische structuur een geringere hoeveelheid van de oorspronkelijke testverbinding wordt aangetroffen.
De bruikbaarheid van de analysemethode moet worden aangetoond en de resultaten van de blancobepaling moeten worden vermeld.
4. REFERENTIES
|
(1) |
OESO, Parijs, 1981, Testrichtlijn 302 A, Besluit C{81) 30 def. van de Raad. |
Aanhangsel 1
SCAS-test: voorbeeld van resultaten
|
Chemische stof |
Ct (mg/l) |
Ct — Cc (mg/l) |
Percentage biodegradatie, Dda |
Testduur (dagen) |
|
4-acetyl aminobenzeen sulfonaat |
17,2 |
2,0 |
85 |
40 |
|
Tetrapropyleenbenzeen sulfonaat |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenol |
16,9 |
0,8 |
95,3 |
40 |
|
Diëthyleenglycol |
16,5 |
0,2 |
98,8 |
40 |
|
Aniline |
16,9 |
1,7 |
95,9 |
40 |
|
Cyclopentaan tetracarboxylaat |
17,9 |
3,2 |
81,1 |
120 |
Aanhangsel 2
Voorbeeld van testopstelling
Figure 1

C.13. BIOCONCENTRATIE: DOORSTROOMTEST MET VISSEN
1. METHODE
Deze methode voor het meten van de bioconcentratie stemt overeen met OESO-methode TG 305 (1996).
1.1. INLEIDING
Deze methode betreft een procedure voor de bepaling van het bioconcentratiegedrag van stoffen in vissen in een „flow-through”-situatie (doorstromend water). Hoewel een doorstroomtest veruit te verkiezen is, mag eventueel ook in semistatische omstandigheden worden gewerkt voorzover aan de validiteitscriteria wordt voldaan.
De beschrijving van de methode omvat alle bijzonderheden die nodig zijn om de test te kunnen uitvoeren; er blijft voldoende ruimte om de proefopzet aan te passen aan de omstandigheden in het betrokken laboratorium en de specifieke karakteristieken van de teststof. De methode is bij uitstek geschikt voor stabiele organische verbindingen met een log Pow-waarde tussen 1,5 en 6,0 (1), maar mag niettemin ook worden toegepast op superlipofiele stoffen (met een log Pow > 6,0). De voorlopige (a priori) schatting van de bioconcentratiefactor („BCF” of ook wel „KB”) zal voor dergelijke superlipofiele stoffen meestal hoger zijn dan de met behulp van laboratoriumexperimenten bepaalde bioconcentratiefactor in de stationaire situatie (BCFSS). Een preliminaire schatting van de bioconcentratiefactor van organische stoffen met een log Pow-waarde die 9,0 of minder bedraagt, kan worden verkregen door toepassing van de vergelijking van Bintein et al. (2). De parameters die het bioconcentratiegedrag karakteriseren, omvatten de opnamesnelheidsconstante (k1), de depuratiesnelheidsconstante (k2) en de BCFSS.
Het gebruik van radioactief gemerkte teststoffen kan de analyse van de water- en vismonsters vergemakkelijken en laat ook toe te bepalen of het noodzakelijk is eventuele afbraakstoffen te identificeren en te kwantificeren. Indien de totale hoeveelheid radioactieve residu's wordt gemeten (bijvoorbeeld door verbranding of weefselsolubilisatie), heeft de gemeten BCF betrekking op de oorspronkelijke verbinding, de eventueel achterblijvende metabolieten daarvan en de geassimileerde koolstof. BCF-waarden die worden bepaald op basis van de totale hoeveelheid radioactieve residu's zijn derhalve niet zonder meer vergelijkbaar met BCF-waarden die worden verkregen door een specifieke chemische bepaling van (uitsluitend) de oorspronkelijke verbinding.
In studies met radioactieve merkers kan eventueel door toepassing van zuiveringstechnieken de BCF-waarde voor de oorspronkelijke verbinding worden bepaald; desgewenst kunnen de belangrijkste metabolieten worden gekarakteriseerd. Ook kan door analyse en identificatie van de residuen in de weefsels een studie van het metabolisme van de vissen met een bioconcentratieonderzoek worden gecombineerd.
1.2. DEFINITIES EN EENHEDEN
Bioconcentratie/bioaccumulatie is de toename van de concentratie van de teststof in of op een organisme (of bepaalde weefsels daarvan) ten opzichte van de concentratie van die stof in het omringende medium.
De bioconcentratiefactor (BCF of KB) op enig moment van de opnamefase van deze accumulatietest, is de verhouding van de concentratie van de teststof in of op de vis of bepaalde weefsels daarvan (Cf in μg/g (ppm)) en de concentratie van die stof in het omringende medium (Cw in μg/ml (ppm)).
De bioconcentratiefactor in stationaire situatie (BCFSS of KB) ondergaat gedurende langere tijd geen significante wijzigingen als de concentratie van de teststof in het omringende medium constant blijft.
Een plateau (stationaire toestand) wordt bereikt wanneer in een grafiek van de concentratie van de teststof in de vissen (Cf) als functie van de tijd de curve evenwijdig gaat lopen met de tijdas en drie opeenvolgende bepalingen van Cf op monsters die met tussenpozen van ten minste twee dagen worden genomen, niet meer dan 20 % van elkaar verschillen en er bovendien geen significant verschil bestaat tussen de waarden verkregen op de drie bemonsteringstijdstippen. Wanneer de analyse op samengevoegde monsters wordt uitgevoerd, zijn ten minste vier opeenvolgende bepalingen vereist. Voor teststoffen die langzaam worden opgenomen, verdient het de voorkeur om intervallen van zeven dagen te gebruiken.
Een bioconcentratiefactor die rechtstreeks uit de snelheidsconstanten (k1/k2) wordt berekend, wordt kinetische bioconcentratiefactor (BCFk) genoemd.
De octanol-water-partitiecoëfficiënt (Pow of Kow) is de verhouding van de oplosbaarheid van een stof in n-octanol en in water bij evenwicht (methode A.8). De logaritme van Pow is een indicator van de neiging tot bioconcentratie van een chemische stof in aquatische organismen.
De blootstellings- of opnamefase is de periode gedurende welke de vissen aan de teststof worden blootgesteld.
De opnamesnelheidsconstante (k1) is het cijfer dat aangeeft hoe snel de concentratie van de teststof in of op de proefdieren (of bepaalde weefsels daarvan) toeneemt wanneer de vissen aan die stof worden blootgesteld (k1 wordt uitgedrukt in dag-1).
De op de blootstellingsfase volgende depuratiefase (eliminatiefase) is de periode die begint op het moment dat de proefdieren van een medium dat de teststof bevat, worden overgebracht naar een medium dat die stof niet bevat, en gedurende welke de depuratie (of netto eliminatie) van de teststof uit de vis (of bepaalde weefsels daarvan) wordt bestudeerd.
De depuratie- (of eliminatie-)snelheidsconstante (k2) is het cijfer dat aangeeft hoe snel de concentratie van de teststof in het proefdier (of bepaalde weefsels daarvan) afneemt nadat de vis is overgebracht van een medium dat de teststof bevat naar een medium dat die stof niet bevat (k2 wordt uitgedrukt in dag-1).
1.3. PRINCIPE VAN DE TESTMETHODE
De test omvat twee fasen: de blootstellingsfase (opnamefase) en de daaropvolgende depuratiefase. Gedurende de opnamefase worden afzonderlijke groepen vissen van dezelfde soort blootgesteld aan ten minste twee concentraties van de teststof. Met de overbrenging van de vissen naar een medium dat de teststof niet bevat, wordt de depuratiefase ingeluid. Een depuratiefase is altijd noodzakelijk, tenzij er zich tijdens de blootstellingsfase nauwelijks enige opname van de stof heeft voorgedaan (d.w.z. als de BCF minder dan 10 bedraagt). De concentratie van de teststof in of op de vissen (of bepaalde weefsels daarvan) wordt systematisch gedocumenteerd gedurende de beide fasen van de test. Naast de groepen vissen die aan de twee testconcentraties worden blootgesteld, wordt ook een controlegroep vissen gehouden onder — afgezien van de afwezigheid van de teststof — identieke omstandigheden. Op die manier kunnen de schadelijke effecten die eventueel in de bioconcentratietest worden waargenomen, worden gerelateerd aan waarnemingen op een passende controlegroep en kan een „nuleffectbepaling” van de concentraties van de teststof worden uitgevoerd.
De opnamefase duurt 28 dagen tenzij wordt aangetoond dat de evenwichtstoestand eerder wordt bereikt. Een raming van de duur van de opnamefase en de tijd die nodig is om de stationaire toestand (dynamisch evenwicht) te bereiken, kan worden verkregen met behulp van de vergelijking in aanhangsel 3. Vervolgens wordt de depuratiefase aangevat: de vissen worden overgebracht naar een nieuwe, schone bak die hetzelfde medium, maar zonder de teststof, bevat. Zo mogelijk wordt de bioconcentratiefactor op twee manieren berekend: als bioconcentratiefactor in stationaire situatie (BCFSS), d.w.z. als de verhouding van de concentratie in de vissen (Cf) en in het water (Cw) bij kennelijk dynamisch evenwicht, en als kinetische bioconcentratiefactor (BCFk), d.w.z. als de verhouding van de snelheidsconstanten k1 (opname) en k2), uitgaande van een eersteordekinetiek. Als duidelijk is dat het proces niet door een eersteordekinetiek kan worden beschreven, moet een complexer model worden gebruikt (zie aanhangsel 5).
Indien na 28 dagen nog geen stationaire toestand (dynamisch evenwicht) is bereikt, dient de opnamefase te worden verlengd met 60 dagen, tenzij de stationaire toestand eerder wordt bereikt; dan wordt de depuratiefase aangevat.
De opnamesnelheidsconstante, de depuratie- (eliminatie-)snelheidsconstante (of -constanten, indien een complexer model vereist is), de bioconcentratiefactor en, zo mogelijk, een betrouwbaarheidsinterval voor elk van deze parameters worden berekend aan de hand van het model dat de gemeten concentraties van de teststof in de vissen en het water het beste beschrijft.
De BCF wordt berekend aan de hand van het totale versgewicht van de vis. Voor bepaalde doeleinden mogen evenwel ook specifieke weefsels of organen (bijvoorbeeld spieren, lever) worden gebruikt als de vissen groot genoeg zijn of als zij kunnen worden opgedeeld in een eetbaar („filet”) en een niet-eetbaar („ingewanden”) gedeelte. Aangezien er voor veel organische stoffen een duidelijk verband bestaat tussen neiging tot bioconcentratie en lipofilie, bestaat er een overeenkomstig verband tussen het vetgehalte van de in de proeven gebruikte vissen en de waargenomen bioconcentratie van die stoffen. Om deze bron van variatie in de testresultaten voor stoffen met een goede oplosbaarheid in vetten (d.w.z. met log Pow >3) te verkleinen, dient de mate van bioconcentratie niet alleen te worden berekend op basis van de totale lichaamsmassa maar ook op basis van de vetfractie.
Het vetgehalte dient, voorzover mogelijk, te worden bepaald op hetzelfde biologisch materiaal waarop ook de concentratie van de teststof wordt bepaald.
1.4. GEGEVENS BETREFFENDE DE TESTSTOF
Alvorens met de bioconcentratietest wordt begonnen, moeten de volgende gegevens over de teststof bekend zijn:
|
— |
oplosbaarheid in water; |
|
— |
octanol-water-partitiecoëfficiënt (deze wordt met Pow of ook wel met Kow aangegeven en wordt bepaald met de HPLC-methode overeenkomstig A.8); |
|
— |
hydrolyse; |
|
— |
fotochemische omzetting in water onder invloed van natuurlijk of gesimuleerd zonlicht alsmede in de belichtingsomstandigheden waaronder ook de bioconcentratietest zal worden uitgevoerd (3); |
|
— |
oppervlaktespanning (namelijk voor stoffen waarbij log Pow niet kan worden bepaald); |
|
— |
dampspanning; |
|
— |
biologische afbreekbaarheid (voorzover relevant). |
Eveneens vereist zijn gegevens over de toxiciteit van de teststof voor de in de test gebruikte vissoort, bij voorkeur in de vorm van de asymptotische (tijdonafhankelijke) LC50 Er dient een passende analytische methode, met bekende nauwkeurigheid, precisie en gevoeligheid, voor de kwantitatieve bepaling van de teststof in de testoplossingen en in het biologisch materiaal beschikbaar te zijn, evenals een protocol voor de toebereiding en de opslag van de monsters. De analytische aantoonbaarheidsgrens van de teststof, zowel in water als in visweefsel, dient eveneens bekend te zijn. Wanneer een met 14C gemerkte teststof wordt gebruikt, moet bekend zijn welk percentage van de radioactiviteit met onzuiverheden is geassocieerd.
1.5. GELDIGHEID VAN DE TEST
Voor een valide test moet aan de volgende voorwaarden worden voldaan:
|
— |
de temperatuurschommelingen dienen kleiner te zijn dan ± 2 oC; |
|
— |
de concentratie van de opgeloste zuurstof mag nooit minder bedragen dan 60 % van het verzadigingsniveau; |
|
— |
de concentratie van de teststof in de bakken is gedurende de opnamefase nooit meer dan 20 % hoger of lager dan het gemiddelde van de gemeten waarden; |
|
— |
de sterfte en de incidentie van andere ongunstige factoren (ziekte) dienen aan het einde van de test zowel in de behandelde groep als in de controlegroep minder dan 10 % te bedragen; indien de test gedurende verscheidene weken of maanden wordt voortgezet, mogen de sterfte en de incidentie van andere ongunstige factoren in elk van beide groepen vissen niet meer bedragen dan 5 % per maand en 30 % in het totaal. |
1.6. REFERENTIESTOFFEN
Het gebruik van referentiestoffen waarvan het bioconcentratiegedrag bekend is, kan in sommige gevallen nuttig zijn om de experimentele procedure te toetsen. Vooralsnog kunnen evenwel geen specifieke stoffen worden aanbevolen.
1.7. BESCHRIJVING VAN DE TESTMETHODE
1.7.1. Apparatuur
Voor alle onderdelen van de installatie moet het gebruik van materialen die oplossen of sorberen, waardoor stoffen in het water worden vrijgegeven of waardoor enig ander schadelijk effect op de vissen kan worden veroorzaakt, zoveel mogelijk worden vermeden. Er kunnen normale, uit een chemisch inert materiaal vervaardigde rechthoekige of cilindervormige bakken worden gebruikt die voldoende ruimte bieden, gegeven de beoogde populatiedichtheid (aantal vissen per liter water). Het gebruik van slangen uit zacht plastic moet zoveel mogelijk worden vermeden. Bij voorkeur dienen verbindingsbuizen van teflon ®, roestvrij staal en/of glas te worden gebruikt. De ervaring wijst uit dat het voor stoffen met een hoge adsorptiecoëfficiënt, zoals synthetische pyretroïden, noodzakelijk kan zijn gesilaniseerd glas te gebruiken. In een dergelijk geval moet de apparatuur na gebruik worden verwijderd (geen hergebruik).
1.7.2. Water
Voor de test wordt normaliter water van natuurlijke oorsprong gebruikt dat wordt verkregen uit een niet-verontreinigde bron van uniforme kwaliteit. Het voor de verdunningen gebruikte water moet zodanig zijn dat de gekozen vissoort daarin gedurende de acclimatisatie en de looptijd van de test kan overleven zonder dat de specimens een abnormaal aspect of gedrag gaan vertonen. In het ideale geval wordt aangetoond dat de gekozen vissoort in het verdunningswater kan overleven, groeien en zich voortplanten (bijvoorbeeld in een laboratoriumkweek of in een toxiciteitstest die de hele levenscyclus omvat). Van het water moeten ten minste de pH, de hardheid, het totaalgehalte aan vaste stof en het totaalgehalte aan organische koolstof worden bepaald, alsmede, zo mogelijk, het ammonium- en nitrietgehalte en de alkaliniteit en, voor mariene soorten, het zoutgehalte. De parameters die belangrijk zijn voor het optimale welzijn van de vissen zijn genoegzaam bekend; niettemin worden in aanhangsel 1 aanbevelingen gedaan wat betreft de maximumconcentratie van een aantal stoffen in het voor de tests gebruikte zoet en zeewater.
Het water dient gedurende de test een constante kwaliteit te vertonen. De pH-waarde dient in het interval 6,0-8,5 te liggen en mag bovendien in de loop van de test met niet meer dan ±0,5 pH-eenheden schommelen. Om te garanderen dat het verdunningswater de testresultaten niet noemenswaardig beïnvloedt (bijvoorbeeld door complexatie van de teststof) en geen ongunstige invloed heeft op de conditie van de vissen, moeten regelmatig monsters worden genomen en geanalyseerd. Zware metalen (bijvoorbeeld Cu, Pb, Zn, Hg, Cd, Ni), de belangrijkste anionen en kationen (bijvoorbeeld Ca, Mg, Na, K, Cl, SO4), bestrijdingsmiddelen (bijvoorbeeld totaalgehalte aan organofosforpesticiden en totaalgehalte aan organochloorpesticiden) en het totaalgehalte aan organische koolstof en zwevende deeltjes moeten bijvoorbeeld om de drie maanden worden bepaald als van het verdunningswater bekend is dat het een relatief constante kwaliteit heeft. Indien is aangetoond dat de waterkwaliteit op een schaal van ten minste één jaar constant blijft, zijn minder frequente bepalingen en langere intervallen (bijvoorbeeld zes maanden) toelaatbaar.
Het natuurlijke gehalte aan zwevende deeltjes en het totaalgehalte aan organische koolstof (TOC) van het verdunningswater dienen zo laag mogelijk te zijn om te vermijden dat de teststof aan het organisch materiaal adsorbeert waardoor de biologische beschikbaarheid ervan zou afnemen (4). De maximale toelaatbare concentraties bedragen 5 mg/l voor deeltjes (droge stof, achterblijvend op een 0,45 μm filter) en 2 mg/l voor het totaal aan organische koolstof (zie aanhangsel 1). Desnoods moet het water vóór gebruik worden gefilterd. De bijdrage van de proefdieren zelf (excrementen) en van de voedselresiduen aan de hoeveelheid organische koolstof in het water dient zo klein mogelijk te worden gehouden. Gedurende de hele duur van de test mag het gehalte aan organische koolstof in de proefbakken, afgezien van de koolstof in de teststof zelf en, in voorkomend geval, het agens dat de oplosbaarheid daarvan dient te verhogen, niet meer bedragen dan 10 mg/l (± 20 %).
1.7.3. Testoplossingen
Er wordt een stockoplossing met een passende concentratie van de teststof klaargemaakt. De stockoplossing wordt bij voorkeur bereid door eenvoudig mengen en schudden van de teststof in het verdunningswater. Het gebruik van oplosmiddelen of dispergeermiddelen (oplosbaarheidsbevorderende agentia) verdient geen aanbeveling; niettemin kan dit in bepaalde gevallen nodig zijn om een stockoplossing van een passende concentratie te verkrijgen. Als oplosmiddelen mogen ethanol, methanol, ethyleenglycol-monomethylether, ethyleenglycol-dimethylether, demithylformamide en triëthyleenglycol worden gebruikt. Als dispergeermiddelen mogen Cremophor RH40, Tween 80, 0,01 % methylcellulose en HCO-40 worden gebruikt. Wanneer biologisch gemakkelijk afbreekbare stoffen worden gebruikt, moet in het bijzonder worden gewaakt voor problemen die zich als gevolg van bacteriegroei in het doorstroomsysteem kunnen voordoen. De teststof mag radioactief worden gemerkt en dient de hoogste zuiverheidsgraad (bij voorkeur meer dan 98 %) te bezitten.
Voor doorstroomtests is een systeem vereist dat de stockoplossing van de teststof continu verdeelt en verdunt en ervoor zorgt dat in de bakken met de proefdieren de gewenste testconcentratie wordt gehandhaafd (bijvoorbeeld doseerpomp, mechanisme voor evenredige verdunning, saturatorsysteem). Een verversingssnelheid van ten minste vijf bakvolumes per dag voor iedere proefbak is wenselijk. Het gebruik van een doorstroomsysteem is verkieslijk, maar als dit niet mogelijk is (bijvoorbeeld omdat de gebruikte proefdieren daarvan schade ondervinden) mag een semistatisch systeem worden gebruikt op voorwaarde dat aan de validiteitscriteria wordt voldaan. De stroomsnelheid van de stockoplossingen en het verdunningswater moet 48 uur vóór het begin van de rest en vervolgens (gedurende de test) ten minste eenmaal per dag worden gecontroleerd. Deze controle omvat eveneens de bepaling van de stroomsnelheid door iedere proefbak afzonderlijk: er moet op worden toegezien dat de verschillen, zowel per bak als tussen de bakken onderling, niet meer dan 20 % bedragen.
1.7.4. Keuze van de vissoort
Belangrijke criteria bij de keuze van de soort zijn dat zij gemakkelijk verkrijgbaar is, dat exemplaren van de geschikte grootte beschikbaar zijn en dat de soort op een bevredigende manier in het laboratorium kan worden gehouden. Andere keuzecriteria zijn het recreatieve, commerciële of ecologische belang van de soort alsmede haar relatieve gevoeligheid, het succes waarmee zij in het verleden is gebruikt enz.
In aanhangsel 2 wordt een aantal aanbevolen soorten opgesomd. Ook ander soorten mogen worden gebruikt, maar in dat geval kan het nodig zijn de testprocedure aan te passen om geschikte proefomstandigheden te creëren. In dit geval moeten de reden waarom de soort werd gekozen en de bijzonderheden van de proefopzet worden gerapporteerd.
1.7.5. Leefomstandigheden van de vissen
Laat het visbestand gedurende ten minste twee weken acclimatiseren in water dat de temperatuur heeft waarbij de test zal worden uitgevoerd; verschaf continu voldoende voedsel van hetzelfde type als datgene dat bij de test zal worden gebruikt.
Na een aanpassingsperiode van 48 uur wordt de sterfte geregistreerd en worden de volgende criteria toegepast:
|
— |
sterfte groter dan 10 % van de populatie in zeven dagen: de hele partij wordt afgekeurd; |
|
— |
de sterfte bedraagt 5 tot 10 % van de populatie in zeven dagen: verdere acclimatisatie gedurende zeven dagen; |
|
— |
de sterfte bedraagt minder dan 5 % van de populatie in zeven dagen: de partij wordt geaccepteerd, maar achteraf alsnog afgekeurd indien gedurende de volgende periode van zeven dagen meer dan 5 % sterfte optreedt. |
Zie erop toe dat de voor de test gebruikte vissen geen zichtbare ziektetekenen of abnormaliteiten vertonen. Verwijder alle zieke vissen. De vissen mogen niet tegen ziekten worden behandeld gedurende de test of gedurende de twee weken die daaraan voorafgaan.
1.8. UITVOERING VAN DE TEST
1.8.1. Verkennende test
Het verdient aanbeveling een verkennende proef uit te voeren om de proefomstandigheden bij de definitieve test (bijvoorbeeld teststofconcentraties, duur van de opname- en de depuratiefase) te optimaliseren.
1.8.2. Blootstellingsomstandigheden
1.8.2.1.
De duur van de opnamefase kan worden geschat op basis van bestaande praktijkervaring (bijvoorbeeld gegevens uit een eerdere studie of kennis van de accumulatiesnelheid van een verwante chemische stof) of op basis van bepaalde empirische relaties, stoelend op gegevens betreffende de oplosbaarheid in water of de octanol-water-partitiecoëfficiënt van de teststof (zie aanhangsel 3).
De opnamefase dient 28 dagen te duren, tenzij kan worden aangetoond dat reeds eerder een evenwicht wordt bereikt. Indien de stationaire toestand (dynamisch evenwicht) na 28 dagen nog niet is bereikt, moet de opnamefase met 60 dagen worden verlengd, tenzij de stationaire toestand eerder wordt bereikt; gedurende de hele voortzetting van de opnamefase worden ook de metingen voortgezet.
1.8.2.2.
Een tijd die half zo lang is als de opnamefase is meestal voldoende voor een adequate reductie (bijvoorbeeld met 95 %) van de lichaamsconcentratie van de teststof (zie aanhangsel 3 voor een verklaring van deze raming). Indien de tijd die nodig is voor een vermindering met 95 % in de praktijk te lang is (bijvoorbeeld indien de depuratiefase dan meer dan twee keer zo lang als de normale duur van de opnamefase, dus meer dan 56 dagen, zou duren) mag een kortere periode worden gebruikt (bijvoorbeeld tot de concentratie van de teststof minder dan 10 % van de concentratie in de stationaire toestand bedraagt). Voor stoffen met een ingewikkelder opname- en depuratiepatroon dan kan worden beschreven met een ééncompartimentmodel dat een eersteordekinetiek vertoont, moet evenwel toch in een langere depuratiefase worden voorzien met het oog op de bepaling van de eliminatiesnelheidsconstanten. De duur van de depuratiefase kan in voorkomend geval overigens mee worden beperkt door de tijd dat de concentratie van de teststof in de vissen boven de analytische aantoonbaarheids-grens blijft.
1.8.2.3.
Kies het aantal vissen per testconcentratie zo dat bij iedere bemonstering ten minste vier vissen per monster beschikbaar zijn. Indien een groter statistisch onderscheidingsvermogen is vereist, dienen meer vissen per monster te worden gebruikt.
Als volwassen vissen worden gebruikt, moet worden gerapporteerd of mannelijke of vrouwelijke exemplaren, dan wel beide, werden gebruikt. In dit laatste geval moet voor het begin van de blootstelling worden aangetoond dat er tussen beide geslachten qua vetgehalte geen significant verschil bestaat. Het kan noodzakelijk zijn alle mannelijke en alle vrouwelijke exemplaren samen te voegen.
Voor elke test moeten vissen met een min of meer uniform lichaamsgewicht worden gebruikt: het gewicht van de kleinste vis mag niet minder bedragen dan twee derde van dat van de grootste. Alle vissen moeten tot dezelfde jaarklasse behoren en dezelfde oorsprong hebben. Aangezien het gewicht en de leeftijd van een vis soms een significant effect op de BCF lijken te hebben (1), moeten deze gegevens nauwkeurig worden geregistreerd. Het verdient aanbeveling vóór de test een steekproef uit het vissenbestand te wegen om een schatting van het gemiddelde gewicht te verkrijgen.
1.8.2.4.
Gebruik een grote water/visverhouding om de vermindering van Cw door de introductie van de vissen bij het begin van de test zo klein mogelijk te houden en een afname van het gehalte aan opgeloste zuurstof te vermijden. Van belang is ook dat de dichtheid van de vissen op de biologische kenmerken van de gekozen soort wordt afgestemd. De aanbevolen dichtheid bedraagt normaliter 0,1-1,0 gram vis (versgewicht) per liter water per dag. Een grotere dichtheid is toelaatbaar als wordt aangetoond dat de schommelingen van de concentratie van de teststof de ± 20 %-grenzen niet overschrijden en het gehalte aan opgeloste zuurstof nooit minder bedraagt dan 60 % van het verzadigingspunt.
Bij de keuze van de geschikte vissendichtheid dient rekening te worden gehouden met de normale biotoop van de betrokken vissoort. Zo kunnen demersale vissen bij eenzelfde watervolume in het aquarium een grotere bodemoppervlakte verlangen dan pelagische soorten.
1.8.2.5.
Gedurende de acclimatisatie- en de testperiode wordt de vissen geschikt voer met een bekend vet- en totaal eiwitgehalte verstrekt in een voldoende hoeveelheid om ze gezond te houden en hun lichaamsgewicht op peil te houden. De vissen krijgen gedurende de acclimatisatie- en de testperiode dagelijks ongeveer 1 à 2 % van hun lichaamsgewicht te eten; bij een dergelijk regime blijft het vetgehalte bij de meeste vissoorten min of meer constant gedurende de test. De hoeveelheid voer moet bijvoorbeeld eens per week worden herberekend teneinde het lichaamsgewicht en het vetgehalte constant te houden. Voor die berekening kan het gewicht van de in iedere testbak overblijvende vissen worden geschat aan de hand van het gewicht van de vissen in de laatste uit die testbak getrokken steekproef. Het gewicht van de achterblijvende vissen zelf wordt niet bepaald.
Niet opgegeten voer en uitwerpselen worden dagelijks, korte tijd (30 minuten tot 1 uur) na de voedering, met behulp van een hevel uit de testbakken verwijderd. Die bakken worden in de loop van de test zo schoon mogelijk gehouden om de concentratie van organische stoffen zo laag mogelijk te houden, aangezien de aanwezigheid van organische koolstof de biologische beschikbaarheid van de teststof negatief kan beïnvloeden (1).
Aangezien vele visvoeders uit vismeel worden vervaardigd, moet het voeder op de aanwezigheid van de teststof worden onderzocht. Het verdient ook aanbeveling het voeder op de aanwezigheid van bestrijdingsmiddelen en zware metalen te onderzoeken.
1.8.2.6.
De belichtingsperiode beloopt meestal 12 à 16 uur en de temperatuur (±2 oC) dient geschikt te zijn voor de gebruikte vissoort (zie aanhangsel 2). Het type belichting en de karakteristieken daarvan dienen bekend te zijn. Er dient rekening te worden gehouden met de mogelijkheid dat de teststof bij de gebruikte belichting fotochemisch in andere stoffen wordt omgezet. Door een passende belichting moet worden vermeden dat de vissen aan onnatuurlijke fotochemische omzettingsproducten worden blootgesteld. In bepaalde gevallen kan het nodig zijn de UV-straling met een golflengte van minder dan 290 nm weg te filteren.
1.8.2.7.
Er worden vissen blootgesteld aan ten minste twee concentraties van de teststof in doorstromend water. Normaliter wordt de hoogste concentratie van teststof zo gekozen dat zij ongeveer 1 % bedraagt van de acute asymptotische LC50 en ten minste tien keer zo hoog is als de aantoonbaarheidsgrens van de stof in water voor de gebruikte analysemethode.
De hoogste testconcentratie kan ook worden bepaald door de acute 96h-LC50 te delen door een passende omzettingscoëfficiënt (de verhouding tussen de acuut letale en de chronisch letale concentratie, die voor diverse chemische stoffen kan variëren tussen ongeveer 3 en 100). Kies zo mogelijk de andere concentratie(s) zo dat zij een factor tien van elkaar verschillen. Indien dit in het licht van de andere criteria („1 % van LC50” en „boven de analytische aantoonbaarheidsgrens”) niet mogelijk is, kan een kleinere meetkundige reden worden gekozen of kan het gebruik van een met 14C gemerkte teststof worden overwogen. Gebruik geen concentraties die hoger zijn dan die van de verzadigde oplossing.
Wanneer een oplosbaarheidsbevorderend agens wordt gebruikt, mag de concentratie daarvan niet meer bedragen dan 0,1 ml per liter en dient deze dezelfde te zijn in alle testbakken. De bijdrage van agens en teststof samen aan het totale organischekoolstofgehalte in het water in de testbakken moet bekend zijn. Het gebruik van dergelijke agentia moet hoe dan ook tot elke prijs worden vermeden.
1.8.2.8.
Naast de experimentele reeksen dient een controlegroep te worden behandeld met het verdunningswater of, in voorkomend geval, met dat water en het oplosbaarheidsbevorderend agens, voorzover vaststaat dat dat agens geen effect heeft op de vissen. Zoniet zijn beide controlebehandelingen noodzakelijk.
1.8.3. Frequentie van de metingen van de waterkwaliteit
In de loop van de test moeten het gehalte aan opgeloste zuurstof, TOC, pH en temperatuur in alle bakken worden gemeten. De totale hardheid en, voorzover relevant, het zoutgehalte moeten worden gemeten in de bakken met de controlegroepen en in een bak met de hoogste teststofconcentratie. De zuurstofconcentratie en, voorzover relevant, het zoutgehalte moeten ten minste drie keer worden gemeten tijdens de opnamefase — aan het begin, omstreeks het midden en aan het einde van die fase — en vervolgens om de week gedurende de depuratiefase. De TOC moet worden bepaald bij het begin van de opnamefase (24 uur en 48 uur vóór de vissen in de bakken worden geïntroduceerd) en vervolgens ten minste wekelijks, zowel gedurende de opname- als gedurende de depuratiefase. De temperatuur moet dagelijks worden gemeten, de pH aan het begin en aan het einde van elke periode en de hardheid eenmaal in de loop van de test. Het is wenselijk de temperatuur in ten minste één bak continu te registreren.
1.8.4. Bemonstering en analyse van de vissen en het water
1.8.4.1.
Met het oog op de bepaling van de teststofconcentratie wordt het water in de testbakken bemonsterd vóór de vissen worden geïntroduceerd en voorts zowel gedurende de opname- als gedurende de depuratiefase. Het water moet ten minste even vaak als en tegelijk met de vissen worden bemonsterd, en wel vóór de voedering. Gedurende de opnamefase wordt de concentratie van de teststof bepaald om te controleren of aan de validiteitscriteria wordt voldaan.
De vissen worden ten minste vijfmaal in de loop van de opnamefase en ten minste viermaal in de loop van de depuratiefase bemonsterd. Omdat het in bepaalde gevallen moeilijk is op basis van dit aantal monsters een voldoende precieze schatting van de BCF-waarde te berekenen, met name wanneer er aanwijzingen bestaan dat een andere dan een simpele eersteordedepuratiekinetiek wordt gevolgd, is het raadzaam gedurende beide periodes een hogere bemonsteringsfrequentie aan te houden (zie aanhangsel 4). De extra monsters worden bewaard en worden slechts geanalyseerd indien de resultaten van de eerste reeks analyses niet blijken te volstaan om de BCF met de gewenste precisie te berekenen.
Aanhangsel 4 bevat een voorbeeld van een goed bemonsteringsschema. Uitgaande van andere hypothetische Pow-waarden ter bepaling van de blootstellingstijd die nodig is voor 95 % opname, kunnen probleemloos andere bemonsteringsschema's worden doorgerekend.
De bemonstering wordt tijdens de opnamefase voortgezet. Die fase duurt 28 dagen, tenzij zich eerder een stationaire toestand instelt. Indien na 28 dagen nog geen stationaire toestand is bereikt, wordt de bemonstering gedurende 60 dagen voortgezet tenzij zich eerder een stationaire toestand instelt. Voor de start van de depuratiefase worden de vissen naar schone bakken overgebracht.
1.8.4.2.
De te analyseren watermonsters worden bijvoorbeeld verkregen door afheveling uit het midden van de testbak met behulp van een slang uit inert materiaal. Aangezien kennelijk noch filtratie, noch centrifugatie in alle omstandigheden een volledige scheiding van de biologisch beschikbare en de biologisch niet-beschikbare fractie van de teststof garanderen (met name niet voor superlipofiele stoffen, d.w.z. stoffen met een log Pok > 5) (1) (5), dienen deze bewerkingen niet op de monsters te worden toegepast.
In plaats daarvan moeten maatregelen worden getroffen om de bakken zo schoon mogelijk te houden en moet het TOC-gehalte zowel gedurende de opnamefase als gedurende de depuratiefase bestendig worden gecontroleerd.
Bij iedere bemonstering wordt een adequaat aantal vissen (meestal ten minste vier) uit de testbakken verwijderd, kortstondig met water gespoeld, door afbetten „gedroogd”, onverwijld op de meest geschikte en humane manier gedood en gewogen.
Het verdient de voorkeur de vissen en het water onmiddellijk na de monsterneming te analyseren om afbraakprocessen en andere verliezen te vermijden. Bovendien kunnen op deze wijze naargelang de test vordert een benaderde opname- en depuratiesnelheid worden berekend. Indien de analyse meteen wordt uitgevoerd, wordt ook vermeden dat te veel tijd voorbijgaat alvorens het bereiken van het plateau wordt geconstateerd.
Indien de analyse niet onmiddellijk wordt uitgevoerd, worden de monsters in geschikte omstandigheden opgeslagen. In dit geval moeten, vooraleer de studie wordt aangevat, gegevens worden vergaard over de geschikte wijze van bewaring voor de teststof in kwestie — bijvoorbeeld diepvriezen of bewaren bij 4 oC, duur van de opslag, wijze van extractie enz.
1.8.4.3.
Aangezien de nauwkeurigheid, de precisie en de gevoeligheid van de analysemethode ten aanzien van de teststof bepalend zijn voor de kwaliteit van de hele procedure, moet experimenteel worden gecontroleerd of de precisie en de reproduceerbaarheid van de chemische analyse alsmede de terugvinding van de teststof in de water- en vismonsters bevredigend zijn voor de gekozen methode. Vergewis u eveneens van het feit dat geen teststof aantoonbaar is in het verdunningswater.
Zo nodig worden bij de test gemeten Cw— en Cf-waarden gecorrigeerd aan de hand van de terugvinding en de nuleffectmetingen bij de controlegroep(en). De vis- en watermonsters worden consequent behandeld op zodanige wijze dat contaminatie en verliezen (bijvoorbeeld als gevolg aan adsorptie aan de bemonsteringsapparatuur) zoveel mogelijk wordt vermeden.
1.8.4.4.
Indien in de test radioactief gemerkt materiaal wordt gebruikt, kan hetzij de totale hoeveelheid radioactiviteit (d.w.z. in de oorspronkelijke stof én de metabolieten daarvan) worden gedoseerd, hetzij een zuivering worden uitgevoerd waardoor de oorspronkelijke stof afzonderlijk kan worden geanalyseerd. Ook kunnen de belangrijkste metabolieten worden gekarakteriseerd wanneer de stationaire toestand is bereikt c.q. aan het einde van de opnamefase (al naar gelang van wat zich het eerst voordoet). Indien de BCF, gemeten op basis van de totale hoeveelheid radioactief gemerkte residuen, > 1 000 % is, is het raadzaam — en voor bepaalde categorieën chemische stoffen zoals bestrijdingsmiddelen ten stelligste aan te bevelen — de afbraakproducten die in de stationaire toestand > 10 % van de totale hoeveelheid residuen in het visweefsel vertegenwoordigen, te identificeren en te kwantificeren. Indien de afbraakproducten die 10 % of meer van de totale hoeveelheid radioactief gemerkte residuen in het visweefsel vertegenwoordigen, worden geïdentificeerd en gekwantificeerd, verdient het aanbeveling de afbraakproducten in de geanalyseerde watermonsters op dezelfde wijze uit te splitsen.
De concentratie van de teststof dient normaliter voor iedere gewogen vis afzonderlijk te worden bepaald. Als zulks niet mogelijk is, mogen de gelijktijdig genomen vismonsters worden samengevoegd, maar een dergelijke samenvoeging houdt restricties in voor de statistische procedures die op de gegevens kunnen worden toegepast. Indien het belangrijk is dat een specifieke statistische procedure kan worden toegepast of een bepaald statistisch onderscheidingsvermogen wordt gehaald, moet de test, rekening houdend met die samenvoegingsprocedure en dat onderscheidingsvermogen, met een adequaat aantal proefdieren worden uitgevoerd (6) (7).
De BCF moet worden berekend in relatie tot het totale versgewicht en, voor zeer lipofiele stoffen, ook in relatie tot de vetfractie. Het vetgehalte van de vissen wordt zo mogelijk bij iedere bemonstering bepaald. Voor de bepaling van het vetgehalte moeten passende methoden worden gebruikt (zie de referenties 8 en 2 van aanhangsel 3). De chloroform/methanol-extractietechniek kan als standaardmethode worden aanbevolen (9). De verschillende methoden geven verschillende resultaten (10). Derhalve is het van belang dat bijzonderheden over de gebruikte methode worden verstrekt. De bepaling van het vet moet, als het kan, worden uitgevoerd op hetzelfde extract als datgene dat voor de bepaling van de teststof wordt gebruikt — de vetten moeten immers meestal toch worden verwijderd alvorens het extract chromatografisch kan worden geanalyseerd. Het vetgehalte van de vissen (in mg per kg versgewicht) behoort aan het einde van het experiment niet meer dan 25 % meer of minder te bedragen dan bij het begin. Het drogestofgehalte van het weefsel (in %) moet ook worden gerapporteerd met het oog op een mogelijke omrekening van het vetgehalte in termen van vers- respectievelijk drooggewicht.
2. GEGEVENS
2.1. VERWERKING VAN DE RESULTATEN
De opnamecurve van de teststof wordt verkregen door de concentratie in/op de vissen (of bepaalde weefsels daarvan) in de opnamefase uit te zetten tegen de tijd in een lineair coördinatenstelsel. Als de curve een plateau bereikt, d.w.z. asymptotisch evenwijdig gaat lopen met de tijdas, wordt BCFSS berekend als:
![]()
Als geen stationaire situatie wordt bereikt, kan niettemin BCFSS met een voor de risico-evaluatie afdoende precisie worden berekend uit een benaderde „stationaire toestand” bij 80 % (1,6/k2) of 95 % (3,0/k2) van de evenwichtswaarde.
De kinetische concentratiefactor BCFk wordt berekend als de verhouding k1/k2 van de twee eersteordesnelheidsconstanten. De depuratiesnelheidsconstante (k2 wordt meestal bepaald op de depuratiecurve, dit is de grafiek van de afname van de teststofconcentratie in de vissen in de loop van de tijd. De opnamesnelheidsconstante (k1) wordt dan berekend uit k2 en een waarde voor Cf die wordt gehaald uit de opnamecurve (zie ook aanhangsel 5). Het verdient de voorkeur KCFk en de snelheidsconstanten k1 en k2 te berekenen met behulp van een gecomputeriseerde niet-lineaire parameterschattingstechniek (11). Is dit onmogelijk, dan kunnen k1 en k2 grafisch worden bepaald. Indien de depuratiecurve duidelijk geen eersteordekinetiek vertoont, moeten complexere modellen worden gebruikt (zie de referenties in aanhangsel 3) en moet het advies van een biostatisticus worden ingewonnen.
2.2. INTERPRETATIE VAN DE RESULTATEN
De resultaten moeten met de nodige omzichtigheid worden geïnterpreteerd als de gemeten concentraties van de teststofoplossingen in de buurt liggen van de analytische aantoonbaarheidsgrens.
Bioconcentratiegegevens van goede kwaliteit resulteren in scherp afgetekende opname- en eliminatiecurven. Het verschil tussen de waarden voor de opname- respectievelijk de depuratieconstante als bepaald voor de twee testconcentraties behoort niet meer te bedragen dan 20 %. Indien tussen de gemeten waarden van de opname c.q. de depuratiesnelheidsconstante voor de twee gebruikte testconcentraties een significant verschil bestaat, moet dit worden genoteerd en moeten mogelijk verklaringen worden gesuggereerd. Bij goed opgezette studies is het betrouwbaarheidsinterval voor de BCF in het algemeen niet veel ruimer dan (puntschatting) ± 20 %.
3. RAPPORTAGE
In het verslag over de test moeten de volgende gegevens worden opgenomen:
3.1. TESTSTOF:
|
— |
voorkomen en, indien relevant, fysisch-chemische eigenschappen; |
|
— |
chemische karakteristieken (eventueel met inbegrip van het organischekoolstofgehalte); |
|
— |
indien radioactief gemerkt materiaal wordt gebruikt, de precieze positie van het radioactieve atoom (de radioactieve atomen) en het percentage van de radioactiviteit dat met onzuiverheden is geassocieerd. |
3.2. PROEFDIERSOORT:
|
— |
wetenschappelijke naam, stam, oorsprong, eventuele voorafgaande behandeling, acclimatisatie, leeftijd, grootte-interval enz. |
3.3. PROEFOMSTANDIGHEDEN:
|
— |
gebruikte testprocedure (bijvoorbeeld doorstroomsysteem of semistatisch systeem); |
|
— |
aard en kenmerken van de gebruikte verlichting en lichtregime (L:D); |
|
— |
proefopzet (bijvoorbeeld aantal en grootte van de testbakken, verversingssnelheid van het water, aantal replicaties, aantal vissen per replicatie, aantal testconcentraties, duur van de opname- en de depuratiefase, frequentie van de bemonstering van vissen en water); |
|
— |
wijze waarop de stockoplossingen worden bereid en vervangingsfrequentie (indien een oplosbaarheidsbevorderend agens wordt gebruikt, moeten de aard, de concentratie en de bijdrage daarvan tot het organischekoolstofgehalte van het water in de testbakken worden vermeld); |
|
— |
de nominale testconcentraties, de gemiddelden en standaardafwijkingen van de desbetreffende in de testbakken gemeten waarden en de methode waarmee zij zijn bepaald; |
|
— |
de oorsprong van het verdunningswater, een beschrijving van de eventuele voorafgaande behandeling daarvan, de resultaten van eventuele proeven betreffende het vermogen van de proefdieren om in dat water te overleven en de kenmerken van dat water: pH, hardheid, temperatuur, gehalte aan opgeloste zuurstof, residueel chloorgehalte (indien bepaald), totale hoeveelheid organische koolstof (TOC) en zwevende deeltjes, zoutgehalte van het proefmedium (voorzover relevant), alsmede de resultaten van eventuele andere bepalingen; |
|
— |
waterkwaliteit in de testbakken, pH, hardheid, TOC, temperatuur en gehalte aan opgeloste zuurstof; |
|
— |
nadere gegevens over het voer (bijvoorbeeld aard, herkomst, samenstelling — zo mogelijk ten minste het vet- en het eiwitgehalte —, voederfrequentie en -hoeveelheid); |
|
— |
gegevens over de behandeling van de vis- en watermonsters, met inbegrip van bijzonderheden over de voorbereiding, de opslag, de extractie en de procedures (met inbegrip van de precisie daarvan) voor de analytische bepaling van de teststof en, in voorkomend geval, het vetgehalte. |
3.4. RESULTATEN:
|
— |
resultaten van eventuele voorbereidende experimenten; |
|
— |
sterfte van de vissen in de controlegroep(en) en de vissen in iedere proefbak, alsmede eventuele waarnemingen van abnormaal gedrag; |
|
— |
het vetgehalte van de vissen (indien dit ter gelegenheid van de bemonstering werd bepaald); |
|
— |
grafieken van het verloop van de opname (inclusief het bereiken van de stationaire toestand) en de depuratie van de teststof door de vissen (met een weergave van alle meetwaarden); |
|
— |
Cf en Cw (met standaardafwijking en, desgewenst, bereik) voor ieder bemonsteringstijdstip. Cf wordt uitgedrukt in μg per gram versgewicht (ppm) van het lichaam als geheel of van bepaalde weefsels, bijvoorbeeld het vetweefsel, en Cw in μg per ml (ppm). De Cw-waarden voor de controlegroepen en de nuleffectmetingen dienen eveneens te worden gerapporteerd; |
|
— |
de bioconcentratiefactor in stationaire situatie (BCFSS) en/of de kinetische bioconcentratiefactor (BCFk) alsmede, in voorkomend geval, de 95 %-betrouwbaarheidsgrenzen voor de opname- en de depuratie-(eliminatie-)snelheidsconstante, alle berekend in relatie tot het totale lichaamsgewicht c.q. de totale vetfractie (in voorkomend geval) van het dier of van nader omschreven weefsels. Voor iedere beproefde concentratie van de teststof moeten de gemiddelden, betrouwbaarheidsintervallen en standaardafwijkingen (voorzover bekend) worden gerapporteerd. Geef aan welke gegevensverwerkings- en rekenmethoden werden gebruikt; |
|
— |
indien radioactief gemerkt materiaal werd gebruikt en voorzover daartoe aanleiding bestaat: gegevens over de eventuele accumulatie van metabolieten; |
|
— |
alle ongewone verschijnselen die zich in de loop van de test hebben voorgedaan, alle afwijkingen van voornoemde procedures en alle andere relevante gegevens. |
Aangezien metingen die resulteren in de conclusie „niet aantoonbaar bij de gegeven aantoonbaar-heidsgrens” onbruikbaar zijn voor het berekenen van de snelheidsconstanten, moet door aanpassingen van de proefopzet in het licht van de gegevens van voorbereidende experimenten dat type uitkomst zoveel mogelijk worden vermeden.
4. REFERENTIES
|
(1) |
Connell D.W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, pp. 117-156. |
|
(2) |
Bintein S., Devillers J. and Karcher W. (1993). Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, 29-390. |
|
(3) |
OECD, Paris (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testine and Assessment of Chemicals. No 3. |
|
(4) |
Kristensen P. (1991). Bioconcentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark. |
|
(5) |
US EPA 822-R-94-002 (1994). Great Lake Water Quality Initiative Technical Support Doc. for the Procedure to Determine Bioaccumulation Factors. July 1994. |
|
(6) |
US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher's Lane, Rockville, MD 20852, July 1975. |
|
(7) |
US EPA (1974). Section 5, A(l). Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711. |
|
(8) |
Compaan H. (1980) in „The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation”, Ch. 2.3, Part II. Government Publishing Office, The Hague, The Netherlands. |
|
(9) |
Gardner et al. (1995). Limn. & Oceanogr. 30, 1099-1105. |
|
(10) |
Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Chem. 10, pp. 1431-1436. |
|
(11) |
CEC. Bioconcentration of chemical substances in fish: the flow-through method-Ring Test Programme, 1984-1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm. |
|
(12) |
ASTM E-1022-84 (Reapproved 1988). Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs. |
Aanhangsel 1
Chemische karakteristieken van aanvaardbaar verdunningswater
|
|
Stof |
Drempelconcentratie |
|
1 |
Deeltjes |
5 mg/l |
|
2 |
Totaal organische koolstof |
2 mg/l |
|
3 |
Niet-geïoniseerde ammoniak |
1 μg/l |
|
4 |
Residueel chloor |
10 μg/l |
|
5 |
Totaal organofosforpesticiden |
50 ng/l |
|
6 |
Totaal organochloorpesticiden plus polychloorbifenylen |
50 ng/1 |
|
7 |
Totaal organische chloorverbindingen |
25 ng/1 |
|
8 |
Aluminium |
1 μg/1 |
|
9 |
Arseen |
1 μg/l |
|
10 |
Chroom |
1 μg/l |
|
11 |
Kobalt |
1 ng/1 |
|
12 |
Koper |
1 ug/1 |
|
13 |
IJzer |
1 μg/l |
|
14 |
Lood |
1 μg/l |
|
15 |
Nikkel |
1 μg/l |
|
16 |
Zink |
1 μg/l |
|
17 |
Cadmium |
100 ng/1 |
|
18 |
Kwik |
100 ng/1 |
|
19 |
Zilver |
100 ng/1 |
Aanhangsel 2
Voor de tests geschikte vissoorten
|
|
Aanbevolen soort |
Aanbevolen temperatuurbereik ( oC) |
Aanbevolen grootteklasse (totale lichaamslengte in cm) |
|
1 |
Danio rerio (17) (Teleostei, Cyprinidae) (Hamilton-Buchanan) Zebravis |
20-25 |
3,0±0,5 |
|
2 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) „Fathead minnow” |
20-25 |
5,0±2,0 |
|
3 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Karper |
20-25 |
5,0±3,0 |
|
4 |
Oryzias latipes (Teleostei, Poeciliidae) (Temminck and Schlegel) Japans rijstvisje |
20-25 |
4,0±1,0 |
|
5 |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters) Guppy |
20-25 |
3,0±1,0 |
|
6 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) „Bluegill” — Zonnebaars |
20-25 |
5,0±2,0 |
|
7 |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) Regenboogforel |
13-17 |
8,0±4,0 |
|
8 |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) Driedoornige stekelbaars |
18-20 |
3,0±1,0 |
In diverse landen zijn ook verschillende estuanene en mariene soorten gebruikt, bijvoorbeeld
|
Leiostomus xanthurus |
(Puntombervis) |
|
Cyprinodon variegatus |
(Edelsteentandkarper) |
|
Menidia beryllina |
(„Silverside”) |
|
Cymatogaster aggregata |
(„Shiner perch”) |
|
Parophrys vetulus |
(„English sole”) |
|
Leptocottus armatus |
(„Staghorn sculpin”) |
|
Gasteroteus aculeatus |
(Driedoornige stekelbaars) |
|
Dicentrarcus labrax |
(Zeebaars) |
|
Alburnus alburnus |
(Alver) |
Herkomst
De in de tabel genoemde zoetwatervissen zijn gemakkelijk te kweken en/of het hele jaar door vlot verkrijgbaar, de beschikbaarheid van de mariene en estuariene soorten verschilt van land tot land. De genoemde soorten kunnen in viskwekerijen of in het laboratorium vrij van ziekten en parasieten worden opgekweekt en tot voortplanting gebracht, zodat voor de test gezonde dieren van bekende afstamming kunnen worden gebruikt. Dergelijke vissen zijn in vele delen van de wereld verkrijgbaar.
Aanhangsel 3
Voorspelling van de duur van de opname- en de depuratiefase
1. Voorspelling van de duur van de opnamefase
Alvorens de test wordt uitgevoerd, kan een schatting van k2 en derhalve van de tijd die nodig is om de stationaire toestand te bereiken, worden verkregen uit het empirische verband dat is aangetoond tussen k2 en de n-octanol-water-partitiecoëfficiënt (Pow) en tussen k2 en de oplosbaarheid in water(s).
Een schatting van k2 (dag-1) kan bijvoorbeeld worden verkregen uit het volgende empirische verband (1):
|
log10 k2 = -0,414 log10(Pow) + 1,47 (r2 = 0,95) |
(vergelijking 1) |
Voor andere verbanden, zie referentie (2).
Indien de waarde van de partitiecoëfficiënt (Pow) niet bekend is, kan een schatting worden verkregen (3) uit de oplosbaarheid van de stof in water (S), aan, de hand van:
|
log10 (Pow) = 0,862 log10(s) + 0,710 (r2 = 0,994) |
(vergelijking 2) |
waarin
s = oplosbaarheid (mol/l): (n = 36).
Deze verbanden zijn alleen geldig voor stoffen waarvoor de waarde van log Pow ligt tussen 2 en 6,5 (4).
De tijd die nodig is om een bepaald percentage van de stationaire concentratie te bereiken, kan worden geraamd met behulp van de schatting van k2 en de algemene vergelijking die de opname- en depuratiekinetiek beschrijft (eerstordekinetiek):

of, indien C constant is:
|
|
(vergelijking 3) |
Bij het naderen van de stationaire toestand (t → ∞), kan vergelijking 3 worden vereenvoudigd (5) (6) tot:
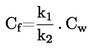 of Cf/Cw = k1/k2
= BCF
of Cf/Cw = k1/k2
= BCF
De grootheid (k1/k2) . Cw is dan een benadering van de concentratie van de stof in de vissen in de stationaire toestand (Cf, s).
Vergelijking 3 kan dan worden herschreven als:
|
|
(vergelijking 4) |
Door toepassing van de vergelijking 4 kan de tijd worden geschat die nodig is om een bepaald percentage van de stationaire concentratie te bereiken voorzover een voorlopige schatting van k2 op basis van vergelijking 1 of vergelijking 2 beschikbaar is.
Als vuistregel geldt dat de optimale duur van de opnamefase voor het verkrijgen van statistisch aanvaardbare gegevens wat betreft BCFk overeenstemt met de tijd die nodig is opdat de concentratie van de teststof in de vissen, uitgezet tegen de niet-getransformeerde tijd, ten minste het middelpunt 1,6/k2 bereikt, oftewel 80 % van de stationaire concentratie, maar niet meer dan 3,0/k2 of 95 % van de stationaire concentratie (7).
De tijd die nodig is om 80 % van de stationaire concentratie te bereiken, bedraagt (vergelijking 4):
|
|
(vergelijking 5) |
Op dezelfde wijze kan worden berekend dat 95 % van de stationaire concentratie wordt bereikt na:
|
|
(vergelijking 6) |
Bijvoorbeeld bedraagt de duur van de opnamefase (top) voor een teststof met log Pow = 4 bij benadering (op basis van de vergelijkingen 1, 5 en 6):
|
log10k2 = -0,414.(4) + 1,47 |
k2 = 0,652 d-1 |
top = t80 = 1,6/0,652, d.w.z. 2,45 d (59 h)
of top = t95 = 3,0/0,652, d.w.z. 4,60 d (110 h)
Op analoge wijze kan voor een teststof waarvoor s = 10-5 mol/l log(s) = -5,0) de duur van de opnamefase met behulp van de vergelijkingen 1, 2, 5 en 6 als volgt worden berekend:
log10 (Pow) = 0,862 . (-5,0) + 0,710 = 5,02
log10 K2 = 0,414 . (5,02) + 1,47
k2 = 0,246 d -1
top = t80 = 1,6/0,246, d.w.z. 6,5 d (156 h)
of top = t95 = 3,0/0,246, d.w.z. 12,2 d (293 h)
Als alternatief kan de uitdrukking
teq = 6,54 × 103 Pow + 55,31 h
worden gebruikt om de tijd te berekenen die nodig is voor het daadwerkelijk bereiken van de stationaire situatie (4).
2. Voorspelling van de duur van de depuratiefase
Een schatting van de tijd die nodig is om de lichaamsconcentratie van een stof tot een bepaald percentage van de aanvankelijke concentratie terug te brengen, kan eveneens worden verkregen aan de hand van de algemene vergelijking van de opname- en depuratiekinetiek (eersteordekinetiek) (1) (8).
Voor de depuratiefase wordt Cw gelijkgesteld aan 0. De vergelijking wordt dan gereduceerd tot
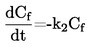 of
of 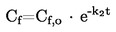
waarin Cf.o de concentratie is bij het begin van depuratiefase. 50 % depuratie wordt verkregen na t50, die als volgt wordt berekend:
 of
of 
Zo ook wordt 95 % depuratie bereikt na

Als de opnamefase wordt afgesloten wanneer 80 % van de stationaire concentratie is bereikt (1,6/k2) en de depuratiefase wanneer de eliminatie 95 % beloopt (3,0/k2), bedraagt de duur van de depuratiefase ongeveer het dubbele van de duur van de opnamefase.
Het is belangrijk hierbij op te merken dat al deze schattingen gebaseerd zijn op de onderstelling dat het opname- en het depuratieproces kunnen worden beschreven door een eersteordekinetiek. Als duidelijk is dat een eersteordekinetiek niet van toepassing is, dienen complexere modellen te worden gebruikt (zie bijvoorbeeld referentie (1)).
Referenties (ad aanhangsel 3)
|
(1) |
Spacie A. and Hamelink J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, pp 309-320. |
|
(2) |
Kristensen P. (1991). Bioconcentration is fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute. |
|
(3) |
Chiou C.T. and Schmedding D.W. (1982). Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), pp. 4-10. |
|
(4) |
Hawker D.W. and Connell D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), pp 701-707. |
|
(5) |
Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975). Transactions of the American Fisheries Society, 104 (4), pp 785-792. |
|
(6) |
Ernst W. (1985). Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4, pp. 243-255. SCOPE, 1985, John Wiley & Sons Ltd, N.Y. |
|
(7) |
Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977). Guidelines for the optimal design of experiments to estimate parameters in first order kenetic models, Can. J. Chem. Eng. 55, pp 614-622. |
|
(8) |
Könemann H. and Van Leeuwen K. (1980). Toxicokinetics in fish: Accumulation and elimination of six chlorobenzenes by Guppies. Chemosphere, 9, pp 3-19. |
Aanhangsel 4
Theoretisch voorbeeld van een bemonsteringsschema voor een bioconcentratietest met een stofwaarvoor log Pow = 4
|
Bemonstering vissen |
Bemonsteringsschema |
Aantal watermonsters |
Aantal vissen per monster |
||||
|
Minimale bemonstering: tijdstip (in dagen) |
Extra monsternemingen |
||||||
|
Opnamefase |
-1 0 |
|
2 (18) 2 |
Introductie van 45-80 vissen |
|||
|
1e |
0,3 |
0,4 |
2 (2) |
4 (4) |
|||
|
2e |
0,6 |
0,9 |
2 (2) |
4 (4) |
|||
|
3e |
1,2 |
1,7 |
2 (2) |
4 (4) |
|||
|
4e |
2,4 |
3,3 |
2 (2) |
4 (4) |
|||
|
5e |
4,7 |
|
2 |
6 |
|||
|
Depuratiefase |
|
|
|
Vissen overbrengen naar water zonder de teststof |
|||
|
6e |
5,0 |
5,3 |
|
4 (4) |
|||
|
7e |
5,9 |
7,0 |
|
4 (4) |
|||
|
8e |
9,3 |
11,2 |
|
4 (4) |
|||
|
9e |
14,0 |
17,5 |
|
6 (4) |
|||
|
De cijfers tussen haakjes zijn de aantallen extra monsters (van het water en de vissen) die worden genomen ingeval voor een aanvullende bemonstering werd geopteerd.
|
|||||||
Aanhangsel 5
Keuze van een model
Er is van uitgegaan dat de meeste bioconcentratieprocessen op een „acceptabele” manier worden beschreven door een simpel twee-compartiment/twee-parametermodel, wat zich vertaalt in een lineair verband wanneer de concentratie van de stof in de vissen tijdens de depuratiefase op semi-logaritmisch papier tegen de tijd wordt uitgezet. Wanneer de trend in de desbetreffende gegevens niet door een rechte kan worden beschreven, dient een complexer model te worden gebruikt. Zie daarvoor bijvoorbeeld de publicatie van Spacie en Hamelink (referentie 1 in aanhangsel 3).
Grafische methode voor de bepaling van de depuratie-(eliminatie-)snelheidsconstante k2
Zet de concentratie van de teststof in ieder vismonster op semi-logaritmisch papier uit tegen het bemonsteringstijdstip. De richtingscoëfficiënt van de trendlijn is k2.


Houd er rekening mee dat afwijkingen van een lineair verband tussen log Cf en t een aanwijzing kunnen vormen voor een complex depuratiepatroon dat niet door een eersteordekinetiek kan worden beschreven. Om depuratiepatronen door te rekenen die niet door een eersteordekinetiek worden gekenmerkt, kunnen eveneens grafische methoden worden gebruikt.
Grafische methode voor de bepaling van de opnamesnelheidsconstante k1
Als k2 bekend is, kan k1 als volgt worden berekend:
|
|
(vergelijking 1) |
De waarde van Cf wordt afgelezen op de helft van de hoogte van de geëffende opnamecurve die wordt verkregen wanneer de concentratie van de stof in de vissen (op logaritmische schaal) wordt uitgezet tegen die tijd (op lineaire schaal).
Computermethode voor de berekening van de opname- en de depuratie-(eliminatie-)snelheidsconstante
Voor de berekening van de bioconcentratiefactor en de snelheidsconstanten k1 en k2 verdient het de voorkeur gebruik te maken van gecomputeriseerde niet-lineaire parameterschattingstechnieken. Deze programma's berekenen een waarde voor k1 en k2 op basis van de aan de tijd gerelateerde concentratiegegevens en het model:
|
|
(vergelijking 2) |
|
|
(vergelijking 3) |
waarin tc = het moment waarop de opnamefase wordt afgebroken.
Met deze techniek wordt ook een schatting van de standaardafwijking van k1 en k2 verkregen.
Aangezien k2 in de meeste gevallen met een vrij grote precisie uit de depuratiecurve kan worden geschat, en aangezien er tussen de parameters k2 en k2 een sterke correlatie bestaat als zij gelijktijdig worden geschat, kan het wenselijk zijn eerst, en uitsluitend aan de hand van de depuratiegegevens, k2 te berekenen en vervolgens k1 uit de opnamegegevens te schatten door middel van niet-lineaire regressie.
C.14. GROEITEST ONVOLWASSEN VISSEN
1. METHODE
Deze groei-toxiciteitstest is overgenomen van OESO TG 215 (2000).
1.1. INLEIDING
Het doel van deze test is het beoordelen van de effecten van een langdurige blootstelling aan chemische stoffen op de groei van onvolwassen vissen. De test is gebaseerd op een methode, die binnen de Europese Unie is ontwikkeld en getest met de rondzendproef (1) (3), voor het beoordelen van de effecten van chemische stoffen op de groei van onvolwassen regenboogforel (Oncorynchus mykiss) in een doorstroomprocedure. Voor deze test mogen ook andere goed gedocumenteerde vissoorten worden gebruikt. In het verleden zijn bijvoorbeeld al eens groeitests uitgevoerd met zebravissen (Danio rerio) (19) (2) (4) (5) en rijstvissen (medaka, Oryzias latipes) (6) (7) (8).
Zie ook Algemene inleiding, deel C.
1.2. DEFINITIES
Lowest observed effect concentration (LOEC): de laagste geteste concentratie van een teststof waarbij de stof een significant effect (p < 0,05) heeft vergeleken met de controlegroep. Alle testconcentraties boven de LOEC moeten een schadelijk effect hebben dat gelijk is aan of groter is dan de LOEC.
No observed effect concentration (NOEC): de testconcentratie direct onder de LOEC.
ECX: bij deze testmethode wordt de concentratie van de teststof die x % variatie in de groeisnelheid van de vissen veroorzaakt vergeleken met de controlegroepen.
Densiteit: het natte gewicht van de vissen per volume water.
Bezettingsgraad: het aantal vissen per volume water.
Specifieke groeisnelheid van de afzonderlijke vissen: de groeisnelheid van één afzonderlijke vis met als uitgangspunt het begingewicht.
Gemiddelde specifieke groeisnelheid per bak: de gemiddelde groeisnelheid van een bakpopulatie bij een bepaalde concentratie.
Pseudo-specifieke groeisnelheid: de afzonderlijke groeisnelheid van de vissen vergeleken met het gemiddelde begingewicht van de bakpopulatie.
1.3. PRINCIPE VAN DE TESTMETHODE
Onvolwassen vissen in exponentiële groeifasen worden, nadat ze zijn gewogen, in testkamers geplaatst en blootgesteld aan een reeks subletale concentraties van de teststof die is opgelost in water. Hierbij moet bij voorkeur de doorstroomprocedure worden gebruikt. Als dit niet mogelijk is, moet een geschikte semistatische procedure (statisch-verversing) worden gebruikt. De test duurt 28 dagen. De vissen worden dagelijks gevoerd. Het voedselrantsoen is afhankelijk van het begingewicht van de vissen en kan indien gewenst na 14 dagen opnieuw worden berekend. Na afloop van de test worden de vissen opnieuw gewogen. De effecten op de groeisnelheid worden geanalyseerd met een regressiemodel, zodat kan worden geraamd welke concentratie x % variatie in de groeisnelheid kan veroorzaken, d.w.z. ECX (bijvoorbeeld EC10, EC2 of EC30). De gegevens kunnen ook worden vergeleken met de controlewaarden, zodat de LOEC en NOEC kunnen worden bepaald.
1.4. GEGEVENS OVER DE TESTSTOF
Resultaten van een acute toxiciteitstest (zie methode C.1), bij voorkeur met dezelfde vissoort als in deze test is gebruikt, moeten beschikbaar zijn. Dit betekent dat de oplosbaarheid in water en de dampspanning van de teststof bekend moeten zijn en dat er een betrouwbare analysemethode, met een bekende en gerapporteerde nauwkeurigheid en detectiegrens, beschikbaar is voor de kwantitatieve bepaling van de stof in de testoplossingen.
Nuttige gegevens over de teststof zijn de structuurformule, de zuiverheid van de stof, de stabiliteit van de stof in water en licht, pKa, Pow en de resultaten van een onderzoek naar de mate van gemakkelijke biologische afbreekbaarheid (zie methode C.4).
1.5. GELDIGHEID VAN DE TEST
De test is alleen geldig als aan de onderstaande voorwaarden wordt voldaan:
|
— |
het sterftecijfer in de controlegroep(en) mag aan het eind van de test niet hoger zijn dan 10 %; |
|
— |
het gemiddelde gewicht van vissen in de controlegroep(en) moet zodanig zijn toegenomen dat de minimumvariatie in groeisnelheid die als significant wordt beschouwd, kan worden gedetecteerd. Een rondzendproef (3) heeft aangetoond dat bij regenboogforel het gemiddelde gewicht van vissen in de controlegroepen binnen 28 dagen met minimaal de helft (d.w.z. 50 %) van hun gemiddelde begingewicht moet zijn toegenomen. Bijvoorbeeld: begingewicht 1 g/vis (= 100 %), eindgewicht na 28 dagen: ≥ 1,5 g/vis (≥ 150 %); |
|
— |
het gehalte aan opgeloste zuurstof moet gedurende de gehele test minimaal 60 % van de verzadigingswaarde van lucht zijn geweest; |
|
— |
het verschil in watertemperatuur tussen de testkamers mag op geen enkel moment van de test groter zijn dan ± 1 oC. Tevens mag de watertemperatuur niet meer dan 2 oC hoger of lager zijn dan het temperatuurbereik dat voor de vissoort wordt gespecificeerd (aanhangsel 1). |
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
Standaardlaboratoriumapparatuur, met name:
|
a) |
zuurstof- en pH-meters; |
|
b) |
apparatuur voor het bepalen van de hardheid en alkaliteit van water; |
|
c) |
geschikte apparatuur voor de temperatuurregeling en bij voorkeur ook voor continue bewaking; |
|
d) |
bakken van chemisch inert materiaal met een inhoud die geschikt is voor de aanbevolen densiteit en bezettingsgraad (zie punt 1.8.5 en aanhangsel 1); |
|
e) |
weegschaal met een toereikende nauwkeurigheid (d.w.z. nauwkeurig tot op ±0,5 %). |
1.6.2. Water
Water waarin de gekozen testsoort langdurig kan overleven en groeien is geschikt als testwater. Gedurende de test moet de waterkwaliteit constant zijn. De pH-waarde moet binnen een bereik van 6,5 en 8,5 blijven, maar tijdens een test mag deze niet meer dan ±0,5 pH-eenheden schommelen. De aanbevolen hardheid is 140 mg/l (CaCO3) of hoger. Om ervoor te zorgen dat het verdunningswater de testresultaten niet noemenswaardig beïnvloedt (bijvoorbeeld door complexvorming met de teststof), moeten regelmatig monsters worden genomen en geanalyseerd. Zware metalen (bijvoorbeeld Cu, Pb, Zn, Hg, Cd en Ni), de belangrijkste anionen en kationen (bijvoorbeeld Ca, Mg, Na, K, Cl en SO4), bestrijdingsmiddelen (bijvoorbeeld totaalgehalte aan organofosfor-pes-ticiden en totaalgehalte aan organochloor-pesticiden) en het totaalgehalte aan organische koolstof en zwevende deeltjes moeten bijvoorbeeld om de drie maanden worden bepaald als van het verdunningswater bekend is dat het een relatief constante kwaliteit heeft. Indien is aangetoond dat de waterkwaliteit gedurende ten minste één jaar constant blijft, zijn minder frequente bepalingen en langere intervallen (bijvoorbeeld zes maanden) toelaatbaar. In aanhangsel 2 worden enkele chemische kenmerken van geschikt verdunningswater genoemd.
1.6.3. Testoplossingen
De testoplossingen met de gekozen concentraties worden bereid door verdunning van een stamoplossing.
De stamoplossing wordt bij voorkeur bereid door eenvoudig mengen en schudden van de teststof in het verdunningswater met mechanische middelen (bijvoorbeeld door te roeren of met ultrasone trillingen). Voor het maken van een stamoplossing van een passende concentratie kunnen verzadigingskolommen (oplosbaarheidskolommen) worden gebruikt.
Het gebruik van oplosmiddelen of dispergeermiddelen (ontsluitingsmiddelen) kan in bepaalde gevallen nodig zijn om een stamoplossing van een passende concentratie te verkrijgen. Voorbeelden van passende oplosmiddelen zijn aceton, ethanol, methanol, dimethylsulfoxide, dimethylformamide en triethyleenglycol. Voorbeelden van passende dispergeermiddelen zijn Cremophor RH40, Tween 80, 0,01 % methylcellulose en HCO-40. Als gemakkelijk biologisch afbreekbare agentia (bijvoorbeeld aceton) en/of zeer vluchtige stoffen worden gebruikt, moet worden gewaakt voor problemen die zich als gevolg van bacteriegroei in de doorstroomtests kunnen voordoen. Indien wordt gebruikgemaakt van een ontsluitingsmiddel, mag dit geen grote invloed hebben op de groei en geen zichtbaar negatief effect hebben op de onvolwassen vissen, hetgeen blijkt uit de controlegroep met uitsluitend oplosmiddel.
Voor doorstroomtests is een systeem vereist dat de stamoplossing van de teststof continu verdeelt en verdunt en ervoor zorgt dat de testkamers de juiste testconcentratie krijgen toegediend (bijvoorbeeld met een doseerpomp, mechanisme voor evenredige verdunning of saturatorsysteem). De stroomsnelheid van de stamoplossingen en het verdunningswater moet regelmatig, bij voorkeur dagelijks, worden gecontroleerd en mag gedurende de gehele test hooguit 10 % afwijken. Met een rondzendproef (3) is aangetoond dat, bij regenboogforel, een verversingsfrequentie tijdens de test van 6 liter/g vis per dag acceptabel is (zie punt 1.8.2.2).
Bij semistatische (verversings)tests hangt de verversingsfrequentie af van de stabiliteit van de teststof, maar dagelijks verversen van water wordt aanbevolen. Als uit eerdere stabiliteitstests (zie punt 1.4) blijkt dat de concentratie van de teststof gedurende de verversingsperiode niet stabiel blijft (d.w.z. buiten 80-120 % van de nominale concentratie valt of onder 80 % van de gemeten oorspronkelijke concentratie), moet worden overwogen om over te gaan op een doorstroomtest.
1.6.4. Keuze van de vissoort
Voor deze test wordt de regenboogforel (Oncorhynchus mykiss) aanbevolen omdat hiermee met de rondzendproef de meeste ervaring is opgedaan (1) (2). Andere goed gedocumenteerde vissoorten mogen ook worden gebruikt, maar de testprocedure moet wellicht worden aangepast teneinde passende testomstandigheden te creëren. In het verleden is bijvoorbeeld ook ervaring opgedaan met zebravissen (Danio rerio) (3) (4) en rijstvissen (medaka, Oryzias latipes) (5) (6) (7). Als er wordt gekozen voor een andere vissoort, moet worden aangegeven waarom er voor deze soort is gekozen en tevens worden gerapporteerd welke experimentele methode wordt toegepast.
1.6.5. Leefomstandigheden van de vis
De testvissen worden geselecteerd uit een populatie van één stam, bij voorkeur van hetzelfde broedsel, dat bij het begin van de test minimaal twee weken oud is en in leven gehouden is onder omstandigheden die qua waterkwaliteit en verlichting overeenkomen met die tijdens de test. Voor de gehele duur van hun verblijf en van de test moeten ze per dag een rantsoen van minimaal 2 % en bij voorkeur 4 % van hun lichaamsgewicht toegediend krijgen.
Na een gewenningsperiode van 48 uur wordt het sterftecijfer geregistreerd en worden de volgende criteria toegepast:
|
— |
sterftecijfer van meer dan 10 % van de populatie binnen zeven dagen: de gehele partij afkeuren; |
|
— |
sterftecijfer tussen 5 % en 10 % van de populatie: zeven dagen extra voor de aanpassing; als het sterftecijfer gedurende deze zeven dagen hoger dan 5 % is, de gehele partij afkeuren; |
|
— |
sterftecijfer van minder dan 5 % van de populatie binnen zeven dagen: de gehele partij accepteren. |
De vissen mogen in de twee weken voorafgaande aan de test of tijdens de test niet worden behandeld voor ziekten.
1.7. TESTOPZET
De „testopzet” heeft betrekking op het aantal testconcentraties en de factor waarmee ze van elkaar verschillen, het aantal bakken per concentratieniveau en het aantal vissen per bak. Idealiter moet bij de keuze van de testopzet rekening worden gehouden met:
|
a) |
het doel van het onderzoek; |
|
b) |
de methode van statistische analyse die wordt toegepast; |
|
c) |
de beschikbaarheid en kosten van experimentele middelen. |
De omschrijving van het doel van het onderzoek moet, indien mogelijk, de statistische power specificeren waarbij een bepaald verschil (bijvoorbeeld in groeisnelheid) moet worden gedetecteerd, of de nauwkeurigheid specificeren waarmee de ECx (bijvoorbeeld met x = 10, 20 of 30, en bij voorkeur niet minder dan 10) moet worden geraamd. Zonder deze gegevens kan geen goede omschrijving worden gegeven van de omvang van het onderzoek.
Het is belangrijk om te onderkennen dat een opzet die optimaal is (optimaal gebruik van de middelen) voor toepassing bij één methode voor statistische analyse, niet per definitie ook optimaal is voor een andere. De aanbevolen opzet voor de raming van een LOEC/NOEC is daardoor niet dezelfde als de opzet die wordt aanbevolen voor regressieanalyse.
In de meeste gevallen verdient regressieanalyse de voorkeur boven de variantieanalyse. De redenen daarvoor worden uiteengezet door Stephan en Rogers (9). Als er echter geen geschikt regressiemodel wordt gevonden (r2 < 0,9), moet NOEC/LOEC worden gebruikt.
1.7.1. Opzet voor regressieanalyse
De belangrijke overwegingen bij het opzetten van een test die door middel van regressie wordt geanalyseerd, zijn:
|
a) |
de effectconcentratie (bijvoorbeeld EC10,20,30) en het concentratiebereik waarbinnen het effect van de teststof van belang is, moeten altijd begrepen zijn onder de concentraties die in de test worden gebruikt. De nauwkeurigheid waarmee de effectconcentraties kunnen worden geraamd, is optimaal wanneer de effectconcentratie zich in het midden bevindt van het bereik van geteste concentraties. Een voorbereidende test voor het vaststellen van het bereik kan nuttig zijn bij het selecteren van de juiste testconcentraties; |
|
b) |
teneinde een goed statistisch model te verkrijgen, moet de test minimaal één bak met een controlegroep omvatten en vijf extra bakken met verschillende concentraties. Wanneer gebruik wordt gemaakt van een ontsluitingsmiddel, moet er naast de testreeks een controlegroep worden behandeld met de hoogste testconcentratie ontsluitingsmiddel (zie punt 1.8.3 en 1.8.4); |
|
c) |
er mag worden gebruikgemaakt van een geschikte geometrische reeks of logaritmische reeks (10) (zie aanhangsel 3). De verdeling van de testconcentraties moet bij voorkeur logaritmisch zijn; |
|
d) |
als er meer dan zes bakken beschikbaar zijn, moeten de extra bakken worden gebruikt als replicaatbakken of worden verdeeld over de reeks concentraties om zodoende een kleiner verschil tussen de niveaus te creëren. Beide mogelijkheden zijn even goed. |
1.7.2. Opzet voor de raming van een NOEC/LOEC met behulp van ANOVA (variantieanalyse)
Het is wenselijk om voor elke concentratie een replicaatbak te hebben. De statistische analyse moet op bakniveau worden uitgevoerd (11). Zonder replicaatbakken kan, behalve met de variabiliteit die verband houdt met de afzonderlijke vissen, geen rekening worden gehouden met de variabiliteit tussen de bakken. Bij eerdere onderzoeken is echter gebleken (12) dat de variabiliteit tussen de bakken in een dergelijke test erg klein is vergeleken met de variabiliteit in de bakken (d.w.z. tussen de vissen). Als relatief aanvaardbaar alternatief kan de statistische analyse daarom op het niveau van de afzonderlijke vissen worden uitgevoerd.
Normaliter worden er minimaal vijf testconcentraties in een geometrische reeks met een factor van bij voorkeur ten hoogste 3,2 gebruikt.
Wanneer tests worden uitgevoerd met replicaatbakken, moet het aantal replicaatbakken voor controlegroepen en dus het aantal vissen over het algemeen het dubbele zijn van het aantal in elk van de testconcentraties, die van gelijke omvang moeten zijn (13)(14)(15). Als er geen replicaatbakken zijn, moet het aantal vissen in de controlegroep gelijk zijn aan dat in elke testconcentratie.
Als de ANOVA wordt gebaseerd op bakken in plaats van afzonderlijke vissen (wat zou betekenen dat elke vis afzonderlijk moet worden gemerkt of dat moet worden gebruikgemaakt van pseudospecifieke groeisnelheden (zie punt 2.1.2)), moeten er voldoende replicaatbakken aanwezig zijn om de standaardafwijking van „bakken met concentraties” te kunnen bepalen. Dit betekent dat de niveaus van fouttolerantie in de variantieanalyse minimaal 5 moeten zijn (11). Als er alleen replicaten worden gemaakt van de controlegroepen, bestaat het risico dat de foutvariabiliteit onzuiver is. Deze kan dan namelijk toenemen met de gemiddelde waarde van de groeisnelheid in kwestie. Omdat de groeisnelheid waarschijnlijk zal afnemen naarmate de concentratie hoger wordt, is het mogelijk dat de variabiliteit wordt overschat.
1.8. PROCEDURE
1.8.1. Selectie en weging van de testvissen
Het is belangrijk om de variatie in het gewicht van de vissen aan het begin van de test zoveel mogelijk te beperken. In aanhangsel 1 worden geschikte gewichtbereiken aangegeven voor de verschillende vissoorten die worden aanbevolen voor deze test. Voor de gehele partij vissen die in deze test wordt gebruikt, geldt dat het bereik van het afzonderlijke gewicht van de vissen aan het begin van de test idealiter binnen ± 10 %, maar maximaal binnen 25 %, van het rekenkundig gemiddelde blijft. Het verdient aanbeveling om voorafgaande aan de test een steekproef te nemen om het gemiddelde gewicht te bepalen.
De stampopulatie mag vanaf 24 uur voor het begin van de test niet worden gevoerd. De vissen moeten vervolgens willekeurig worden geselecteerd. De vissen krijgen een verdovingsmiddel toegediend (bijvoorbeeld een oplossing in water van 100 mg/l tricaïne-methaansulfonaat (MS 222) geneutraliseerd met twee delen natrium-bicarbonaat per deel MS 222) en worden afzonderlijk in natte toestand gewogen (drooggedept) zoals beschreven in aanhangsel 1. De vissen met een gewicht binnen het juiste bereik, moeten worden behouden en vervolgens willekeurig over de testbakken worden verdeeld. Het totale natte gewicht van alle vissen in een bak moet worden geregistreerd. Het gebruik van verdovingsmiddelen en het behandelen van de vissen (inclusief droogdeppen en wegen) kan stress en verwondingen veroorzaken bij de onvolwassen dieren, met name bij kleine soorten. Onvolwassen vissen moeten daarom uiterst voorzichtig worden behandeld om stress en verwondingen bij deze dieren te voorkomen.
Op dag 28 van de test worden de vissen opnieuw gewogen (zie punt 1.8.6). Als het echter noodzakelijk wordt geacht het rantsoen opnieuw te berekenen, mogen de vissen ook op dag 14 van de test opnieuw worden gewogen (zie punt 1.8.2.3). Er zijn ook andere methoden, zoals de fotografische methode, voor het vaststellen van veranderingen in de visgrootte aan de hand waarvan de rantsoenen kunnen worden aangepast.
1.8.2. Blootstellingsomstandigheden
1.8.2.1. Duur
De test duurt ≥ 28 dagen.
1.8.2.2. Densiteit en bezettingsgraad
Het is belangrijk dat de densiteit en bezettingsgraad worden afgestemd op de gebruikte vissoort (zie aanhangsel 1). Als de bezettingsgraad te hoog is, zullen de vissen gestrest raken en daardoor minder hard groeien of zelfs ziek worden. Als de bezettingsgraad te laag is, kan territoriumgedrag ontstaan, dat de groei eveneens kan beïnvloeden. In elk geval moet de densiteit zo laag zijn dat het gehalte aan opgeloste zuurstof van minimaal 60 % van de luchtverzadigingswaarde zonder beluchting in stand kan worden gehouden. Een rondzendproef (3) heeft aangetoond dat bij regenboogforel een densiteit van 16 vissen van 3-5 g in een volume van 40 liter acceptabel is. De aanbevolen waterverversingsfrequentie tijdens de test is 6 liter/g vis per dag.
1.8.2.3. Voeding
De vissen moeten geschikt voedsel toegediend krijgen (aanhangsel 1) in zodanige hoeveelheden dat een acceptabele groeisnelheid wordt bereikt. Bacteriegroei en troebelheid van het water moeten zoveel mogelijk worden voorkomen. Bij regenboogforel wordt waarschijnlijk aan deze voorwaarden voldaan als zij een rantsoen van 4 % van hun lichaamsgewicht per dag krijgen (3) (16) (17) (18). Het dagelijkse rantsoen kan worden verdeeld over twee gelijke porties met een tussenpoos van minimaal 5 uur. Het rantsoen is gebaseerd op het totale gewicht van de vissen in een testbak aan het begin van de test. Als de vissen op dag 14 opnieuw worden gewogen, moet het rantsoen opnieuw worden berekend. De vissen mogen vanaf 24 uur voordat ze worden gewogen, geen voedsel krijgen.
Niet gegeten voedsel en fecaal materiaal moeten dagelijks uit de testbakken worden verwijderd door de bodem van de bakken zorgvuldig schoon te maken met een zuiger.
1.8.2.4. Licht en temperatuur
De fotoperiode en watertemperatuur moeten worden afgestemd op de gekozen vissoort (aanhangsel 1).
1.8.3. Testconcentraties
Normaliter zijn er vijf concentraties van de teststof nodig, ongeacht de testopzet (zie punt 1.7.2). Eerder opgedane kennis over de toxiciteit van de teststof (bijvoorbeeld n.a.v. een acute test en/of onderzoeken voor het vaststellen van het bereik) helpt bij het kiezen van de juiste testconcentraties. Als minder dan vijf concentraties worden gebruikt, moet hiervoor een geldige reden worden gegeven. De hoogste geteste concentratie mag de oplosbaarheidsgrens van de teststof in water niet overschrijden.
Als een ontsluitingsmiddel wordt gebruikt bij het maken van stamoplossingen, mag de uiteindelijke concentratie hiervan niet groter zijn dan 0,1 ml/l en moet de concentratie bij voorkeur in alle bakken gelijk zijn (zie punt 1.6.3). Het gebruik van deze middelen moet echter te allen tijde zoveel mogelijk worden vermeden.
1.8.4. Controlegroepen
Het aantal controlegroepen dat wordt behandeld met verdunningswater hangt af van de testopzet (zie punten 1.7-1.7.2). Als er een ontsluitingsmiddel wordt gebruikt, moet er een aantal controlegroepen met water waaraan een ontsluitingsmiddel is toegevoegd, worden opgenomen in de test. Dit aantal moet gelijk zijn aan het aantal controlegroepen dat wordt behandeld met verdunningswater.
1.8.5. Frequentie van de analytische bepalingen en metingen
Tijdens de test worden de concentraties van de teststoffen regelmatig gemeten (zie hieronder).
Bij doorstroomtests moet de stroomsnelheid van het verdunningswater en de toxische stamoplossing regelmatig worden gecontroleerd, bij voorkeur dagelijks, en mag deze gedurende de gehele test hooguit 10 % afwijken. Als wordt verwacht dat de concentratie van de teststof binnen ± 20 % van de nominale waarden blijft (d.w.z. binnen het interval van 80-120 %; zie punt 1.6.2 en 1.6.3), is het raadzaam om in elk geval de hoogste en laagste testconcentraties te analyseren. Doe dit aan het begin van de test en daarna eens per week. Bij tests waarbij niet wordt verwacht dat de concentratie van de teststof binnen ± 20 % van de nominale concentratie blijft (op basis van stabiliteitsgegevens van de teststof), moeten alle testconcentraties worden geanalyseerd. Hierbij moet dezelfde procedure worden gevolgd als hierboven.
Bij semistatische (verversings)tests waarbij wordt verwacht dat de concentratie van de teststof binnen ± 20 % van de nominale waarden blijft, is het raadzaam om in elk geval de hoogste en laagste testconcentraties te analyseren. Doe dit vlak na het bereiden van de oplossing en vlak vóór het verversen, bij het begin van de test en vervolgens eens per week. Bij tests waarbij niet wordt verwacht dat de concentratie van de teststof binnen ± 20 % van de nominale concentratie blijft, moeten alle testconcentraties worden geanalyseerd volgens dezelfde procedure als voor de stabielere stoffen.
Het is wenselijk de resultaten te baseren op gemeten concentraties. Als echter kan worden aangetoond dat de concentratie van de teststof in de oplossing gedurende de gehele test binnen ± 20 % van de nominale of de gemeten oorspronkelijke concentratie is gebleven, mogen de resultaten worden gebaseerd op de nominale of gemeten waarden.
Monsters moeten mogelijk worden gefilterd (bijvoorbeeld met een 0,45 μm poriëngrootte) of gecentrifugeerd. Centrifugatie verdient de voorkeur. Als het testmateriaal echter niet aan filters adsorbeert, is filtratie mogelijk een geschikt alternatief.
In de loop van de test moet het gehalte aan opgeloste zuurstof, de pH en de temperatuur in alle testbakken worden gemeten. De totale hardheid, alkaliteit en (voorzover relevant) het zoutgehalte moeten worden gemeten in de bakken met de controlegroepen en in één bak met de hoogste concentratie teststof. Het zuurstofgehalte en (voorzover relevant) het zoutgehalte moeten tijdens de test ten minste drie keer worden gemeten (aan het begin, omstreeks het midden en aan het eind). Bij semistatische tests is het raadzaam het opgeloste zuurstofgehalte vaker te meten, bij voorkeur voor en na elke waterverversing of minimaal één keer per week. De pH moet bij semistatische (verversings)tests voor en na elke waterverversing worden gemeten en bij doorstroomtests minimaal één keer per week. De hardheid en alkaliteit moeten per test eenmaal worden gemeten. De temperatuur moet bij voorkeur in ten minste één testbak continu worden gecontroleerd.
1.8.6. Waarnemingen
Gewicht: aan het eind van de test moet van alle overlevende vissen het natte gewicht (drooggedept) worden gewogen, hetzij per testbak of afzonderlijk. Het gezamenlijk wegen van alle vissen in een testbak verdient de voorkeur boven het afzonderlijk wegen van de vissen waarbij elke vis eerst moet worden gemerkt. Wanneer elke vis apart wordt gewogen om de specifieke groeisnelheid van de afzonderlijke vissen te kunnen bepalen, mag de toegepaste merkmethode geen stress veroorzaken bij de vissen (alternatieven voor koudmerken kunnen wenselijk zijn, bijvoorbeeld het gebruik van een fijne, gekleurde vislijn).
De vissen moeten gedurende de test dagelijks worden onderzocht. Als er een externe afwijking (zoals bloedingen of ontkleuring) of afwijkend gedrag wordt geconstateerd, moet dit worden genoteerd. Ook de sterfte moet worden geregistreerd en de dode vissen moeten zo snel mogelijk worden verwijderd. Dode vissen worden niet vervangen. Als de aanbevolen densiteit en bezettingsgraad worden aangehouden, wordt namelijk voorkomen dat veranderingen in het aantal vissen per bak de groei beïnvloeden. Het rantsoen moet echter wel worden aangepast.
2. GEGEVENS EN RAPPORTAGE
2.1. BEWERKING VAN DE RESULTATEN
Het is wenselijk om bij de opzet en analyse van de test een statisticus te betrekken omdat de methode een aanzienlijke variatie in de opzet van het experiment toelaat, bijvoorbeeld in het aantal testkamers, het aantal testconcentraties, het aantal vissen, enz. Gezien de beschikbare opties in de opzet van de test, worden hier geen richtlijnen voor de statistische procedures gegeven.
Als het sterftecijfer in een testbak hoger is dan 10 %, mag voor deze bak geen groeisnelheid worden berekend. Wel moet worden gerapporteerd wat het sterftecijfer per testconcentratie is.
Het belangrijkste concept van deze test is het bepalen van de specifieke groeisnelheid r tussen tijdstip t1 en tijdstip t2, ongeacht de methode die wordt toegepast om de gegevens te analyseren. Deze snelheid kan op verschillende manieren worden gedefinieerd, afhankelijk van het feit of de vissen afzonderlijk gemarkeerd zijn dan wel of er een bakgemiddelde vereist is.



waarbij
|
r1 |
= |
specifieke groeisnelheid van een afzonderlijke vis |
|
r2 |
= |
gemiddelde specifieke groeisnelheid per bak |
|
r3 |
= |
pseudo-specifieke groeisnelheid |
|
W1,W2 |
= |
gewicht van een bepaalde vis op het tijdstip t1 respectievelijk t2 |
|
loge W1 |
= |
logaritme van het gewicht van een afzonderlijke vis aan het begin van de onderzoeksperiode |
|
loge w2 |
= |
logaritme van het gewicht van een afzonderlijke vis aan het eind van de onderzoeksperiode |
|
logeW1 |
= |
gemiddelde van de logaritmen van de waarden W1 voor de vissen in de bak aan het begin van de onderzoeksperiode |
|
logeW2 |
= |
gemiddelde van de logaritmen van de waarden w2 voor de vissen in de bak aan het eind van de onderzoeksperiode |
|
t1, t2 |
= |
tijd (dag) bij het begin en eind van de onderzoeksperiode |
r1, r2, r3 kunnen voor de periode van dag 0-28 worden berekend en, indien van toepassing (d.w.z. als op dag 14 metingen zijn uitgevoerd), voor de periode van dag 0-14 en dag 14-28.
2.1.1. Analyse van de resultaten met de regressiemethode (concentratie-reactie-model)
Met deze analysemethode wordt een nuttig rekenkundig verband gelegd tussen de specifieke groeisnelheid en de concentratie, waardoor het mogelijk is de „ECX” te ramen, d.w.z. elke willekeurige EC-waarde. Deze analysemethode maakt de berekening van r voor afzonderlijke vissen (r1) overbodig. In plaats daarvan kan de analyse worden gebaseerd op de gemiddelde waarde van r per bak (r2). De voorkeur gaat uit naar de laatste methode, mede omdat deze geschikter is voor kleine vissoorten.
De gemiddelde specifieke groeisnelheden per bak (r2) moeten grafisch worden uitgezet tegen de concentratie, zodat de concentratie-reactie-relatie tot uitdrukking komt.
Voor het uitdrukken van de relatie tussen r2 en de concentratie moet een geschikt model worden gekozen. De keuze moet worden beargumenteerd.
Als elke bak een oneven aantal vissen bevat, moet de passingsprocedure, hetzij eenvoudig of niet-lineair, worden gewogen zodat rekening wordt gehouden met de oneven aantallen.
Met behulp van de passingsmethode voor het model moet een raming gemaakt kunnen worden van bijvoorbeeld de EC20 en van de bijbehorende dispersie (hetzij standaardafwijking of betrouwbaarheidsinterval). De grafiek van het gepaste model moet worden weergegeven in relatie tot de gegevens zodat de mate waarin het model past, zichtbaar wordt (8) (18) (19) (20).
2.1.2. Analyse van de resultaten voor de raming van de LOEC
Als bij de test gebruik is gemaakt van replicaatbakken voor alle concentratieniveaus, kan de LOEC worden geraamd aan de hand van een variantieanalyse (ANOVA) van de gemiddelde specifieke groeisnelheid per bak (zie punt 2.1), gevolgd door een geschikte methode (bijvoorbeeld de test van Dunnet of Williams (12) (13) (14) (21)) voor het vergelijken van de gemiddelde r voor elke concentratie met de gemiddelde r van de controlegroepen om de laagste concentratie vast te stellen waarbij dit verschil bij een waarschijnlijkheidsgrens van 0,05 significant is. Als niet wordt voldaan aan de vereiste voorwaarden voor parametermethoden — niet-normale verdeling (bijvoorbeeld de test van Shapiro-Wilk) of heterogene variantie (test van Barlett) — moet worden overwogen om de gegevens te transformeren om varianties te homogeniseren alvorens de ANOVA of een gewogen ANOVA uit te voeren.
Als bij de test niet voor elke concentratie een replicaatbak is gebruikt, zal een ANOVA gebaseerd op bakken ongevoelig of zelfs onmogelijk zijn. In dat geval kan er als tussenoplossing voor worden gekozen de ANOVA te baseren op de pseudo-specifieke groeisnelheid r3 van afzonderlijke vissen.
De gemiddelde r3 voor elke testconcentratie kan vervolgens worden vergeleken met de gemiddelde r3 van de controlegroepen. Vervolgens kan de LOEC op dezelfde manier worden vastgesteld als hierboven is beschreven. Het is belangrijk dat wordt onderkend dat deze methode geen rekening houdt met, of bescherming biedt tegen, variabiliteit tussen de bakken, behalve die welke wordt veroorzaakt door de variabiliteit tussen de afzonderlijke vissen. Bij eerdere onderzoeken is echter gebleken (9) dat de variabiliteit tussen de bakken erg klein is vergeleken met de variabiliteit in de bakken (d.w.z. tussen de vissen onderling). Als de vissen niet afzonderlijk worden geanalyseerd, moet de methode voor het vaststellen van de uitbijter worden vermeld samen met de reden waarom deze methode wordt gebruikt.
2.2. INTERPRETATIE VAN DE RESULTATEN
De resultaten moeten met de nodige omzichtigheid worden geïnterpreteerd als de gemeten toxische concentraties in de testoplossingen in de buurt liggen van de detectiegrens van de analysemethode, of, bij semistatische tests, als de concentratie van de teststof afneemt in de periode na het bereiden van de oplossing en vóór het verversen.
2.3. TESTRAPPORT
In het testrapport moeten de volgende gegevens worden opgenomen:
2.3.1. Teststof:
|
— |
fysiek voorkomen en relevante fysisch-chemische kenmerken, |
|
— |
chemische identificatiegegevens, voorzover relevant met inbegrip van de zuiverheid en de analysemethode voor het bepalen van de teststof. |
2.3.2. Diersoort:
|
— |
wetenschappelijke naam, eventueel |
|
— |
stam, grootte, leverancier, eventuele voorbehandelingen, enz. |
2.3.3. Testomstandigheden:
|
— |
toegepaste testprocedure (bijvoorbeeld semistatisch/verversing, doorstroom, densiteit, bezettingsgraad, enz.), |
|
— |
testopzet (bijvoorbeeld het aantal testbakken, testconcentraties en replicaten, en het aantal vissen per bak, |
|
— |
wijze waarop de stamoplossingen werden bereid en verversingsfrequentie (indien een ontsluitingsmiddel is gebruikt, moet de concentratie daarvan worden vermeld), |
|
— |
de nominale testconcentraties, de gemiddelden van de in de testbakken gemeten waarden en de standaardafwijkingen, de methode waarmee zij zijn bepaald, en gegevens waaruit blijkt dat de resultaten van de metingen betrekking hebben op de concentraties van de teststof in de oplossing, |
|
— |
kenmerken van het verdunningswater: pH, hardheid, alkaliteit, temperatuur, gehalte aan opgeloste zuurstof, residueel chloorgehalte (indien gemeten), totale hoeveelheid organische koolstof, zwevende deeltjes, zoutgehalte van het testmedium (indien gemeten), alsmede de resultaten van eventuele andere metingen, |
|
— |
waterkwaliteit in de testbakken: pH, hardheid, temperatuur en gehalte aan opgeloste zuurstof, |
|
— |
gedetailleerde gegevens over de voeding (bijvoorbeeld het type voedsel, de leverancier, het rantsoen en de frequentie). |
2.3.4. Resultaten:
|
— |
gegevens waaruit blijkt dat de controlegroepen voldeden aan het validiteitscriterium voor overleving, en gegevens over de sterfte bij de verschillende testconcentraties, |
|
— |
toegepaste technieken voor statistische analyse, statistieken gebaseerd op replicaten of vissen, verwerking van de gegevens en beweegredenen voor het gebruik van deze technieken, |
|
— |
tabelgegevens over het afzonderlijke gewicht en het gemiddelde gewicht van de vissen op dag 0, 14 (indien gemeten) en 28, waarden met betrekking tot de gemiddelde of pseudo-specifieke groeisnelheid (afhankelijk van wat van toepassing is) per bak voor de periode van dag 0-28 of eventueel dag 0-14 en 14-28, |
|
— |
resultaten van de statistische analyse (d.w.z. regressieanalyse of ANOVA), bij voorkeur in grafische en tabelvorm weergegeven en de LOEC (p = 0,05) en NOEC of ECx met, indien mogelijk, de bijbehorende standaardafwijkingen, |
|
— |
gevallen van abnormale reacties bij de vissen en zichtbare effecten die werden veroorzaakt door de test stof. |
3. REFERENTIES
|
(1) |
Solbe J. F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No PRD 1388-M/2. |
|
(2) |
Ashley S., Mallett M.J. and Grandy N.J., (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M. |
|
(3) |
Crossland N.O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, pp. 1855-1870. |
|
(4) |
Nagel R. Bresh H., Caspers N., Hansen P. D., Market M., Munk R., Scholz N. and Höfte B. B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ, Safety, 21, pp, 157-164. |
|
(5) |
Yamamoto, Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish, Tokio, Japan. |
|
(6) |
Holcombe, G. W,, Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R, D, (1995). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes). Arch, Environ. Conta. Toxicol. 28, pp. 287-297. |
|
(7) |
Benoit, D. A., Holcombe, G, W, and Spehar, R, L, (1991). Guidelines for conducting early life toxicity tests with Japanese medaka [Oryzias latipes). Ecological Research Series EPA-600/3-91-063. US Environmental Protection Agency, Duluth, Minnesota. |
|
(8) |
Stephan C.E. and Rogers J.W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R. C. Bahner and D. J. Hansen, eds., American Society for Testing and Materials, Philadelphia, pp. 328-338. |
|
(9) |
Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmon). Conservation and Protection, Ontario, Report EPS l/RM/28, 81 pp. |
|
(10) |
Cox D.R. (1958). Planning of experiments. Wiley Edt. |
|
(11) |
Pack S., (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991. |
|
(12) |
Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(13) |
Dunnett C.W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491. |
|
(14) |
Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117. |
|
(15) |
Johnston, W.L., Atkinson, J.L., Glanville N.T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, pp. 123-133. |
|
(16) |
Quinton, J.C. and Blake, R.W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynfhus mykiss. Journal of Fish Biology, 37, pp. 33-41, |
|
(17) |
Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. 288 pp. |
|
(18) |
Bruce, R.D. and Versteeg D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, pp. 1485-1494. |
|
(19) |
DeGraeve, G.M., Cooney, J.M., Pollock, T.L., Reichenbach, J.H., Dean, Marcus, M.D. and Mclntyre, D.O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. Report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo Alto, CA. |
|
(20) |
Norbert-King T.J. (1988). An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minnesota, Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988, 12 pp. |
|
(21) |
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, pp. 510-531. |
Aanhangsel 1
AANBEVOLEN VISSOORTEN VOOR DE TEST EN GESCHIKTE TESTOMSTANDIGHEDEN
|
Vissoort |
Aanbevolen bereik van de testtemperatuur (oC) |
Fotoperiode (uren) |
Aanbevolen bereik voor begingewicht van de vissen (g) |
Aanbevolen meetnauwkeurigheid |
Densiteit (g/l) |
Bezettingsgraad (per liter) |
Voedsel |
Testduur (dagen) |
|
Aanbevolen vissoorten: |
|
|
|
|
|
|
|
|
|
Oncorhynchus mykiss Regenboogforel |
12,5-16,0 |
12-16 |
1-5 |
tot op 100 mg |
1,2-2,0 |
4 |
Droog merkvoer van zalmachtig broedsel |
≥ 28 |
|
Andere goed gedocumenteerde vissoorten: |
|
|
|
|
|
|
|
|
|
Danio rerio Zebravis |
21-25 |
12-16 |
0,050-0,100 |
tot op 1 mg |
0,2-1,0 |
5-10 |
Levend voedsel (Brachionus Artemia) |
≥ 28 |
|
Oryzias latipes Rijstvis (Medaka) |
21-25 |
12-16 |
0,050-0,100 |
tot op 1 mg |
0,2-1,0 |
5-20 |
Levend voedsel (Brachionus Artemia) |
≥ 28 |
Aanhangsel 2
ENKELE CHEMISCHE KENMERKEN VAN GESCHIKT VERDUNNINGSWATER
|
Stof |
Concentraties |
|
Vaste deeltjes |
< 20 mg/l |
|
Totaalgehalte aan organische koolstof |
< 2 mg/l |
|
Niet-geïoniseerde ammonia |
< 1 μg/l |
|
Restchloorgehalte |
< 10 μg/1 |
|
Totaalgehalte aan organofosfor-pesticiden |
< 50 ng/l |
|
Totaalgehalte aan organochloor-pesticiden en polychloorbifenylen |
< 50 ng/l |
|
Totaalgehalte aan organisch chloor |
< 25 ng/l |
Aanhangsel 3
Logaritmische reeks concentraties die geschikt zijn voor de toxiciteitstest (9)
|
Kolom (aantal concentraties tussen 100 en 10 of tussen 10 en 1) (20) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
|
|
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
|
|
|
|
1,6 |
3,2 |
5,2 |
7,5 |
|
|
|
|
1,0 |
2,2 |
3,7 |
5,6 |
|
|
|
|
|
1,5 |
2,7 |
4,2 |
|
|
|
|
|
1,0 |
1,9 |
3,2 |
|
|
|
|
|
|
1,4 |
2,4 |
|
|
|
|
|
|
1,0 |
1,8 |
|
|
|
|
|
|
|
1,3 |
|
|
|
|
|
|
|
1,0 |
C.15. VIS, KORTETERMIJN-TOXICITEITSTEST OP EMBRYONALE EN LARVESTADIA (SAC-FRY)
1. METHODE
Deze kortetermijn-toxiciteitstest is overgenomen van OESO TG 212 (1998).
1.1. INLEIDING
Deze kortetermijn-toxiciteitstest op de embryonale en larvestadia van de vis is een kortetermijntest waaraan de levensstadia vanaf het pasbevruchte ei tot en met de larvetijd worden blootgesteld. Tijdens de test wordt er geen voedsel toegediend. De test moet daarom worden beëindigd terwijl de larve zich nog voedt aan de dooierzak.
Het doel van de test is het bepalen van letale en, tot op zekere hoogte, subletale effecten van chemicaliën op de specifieke stadia van de geteste diersoort. De test kan nuttige informatie bieden omdat deze a) een brug kan vormen tussen letale en subletale tests, b) kan dienen als screeningtest voor een volledige test over de eerste levensfase of voor een chronische-toxiciteitstest en c) kan worden gebruikt voor het testen van vissoorten waarbij de normale technieken die worden gebruikt niet voldoende geavanceerd zijn voor het testen van de overgangsperiode van endogene tot exogene voeding.
Het is belangrijk om te weten dat alleen tests die alle stadia van de levenscyclus van een vis omvatten een betrouwbare schatting kunnen geven van de chronische toxiciteit van chemicaliën bij vissen. Tevens moet men zich realiseren dat een test die niet alle stadia omvat minder gevoelig is en dat daarmee ook de chronische toxiciteit kan worden onderschat. Daarom wordt verwacht dat de embryo- en larvetest minder gevoelig is dan een volledige test over de eerste levensfase, met name ten opzichte van zeer lipofiele chemicaliën (log Pow > 4) en chemicaliën met een bepaalde toxische werking. Kleinere verschillen in de gevoeligheid tussen de twee tests zijn echter te verwachten bij chemicaliën met een niet-specifieke, narcotische werking (1).
Vóór de publicatie van deze test is de meeste ervaring met deze embryo- en larvetest opgedaan met de zoetwatervis Danio rerio Hamilton-Buchanan (Teleostei, Cyprinidae — algemene naam: zebravis). Meer gedetailleerde informatie over het uitvoeren van tests met deze vissoort is te vinden in aanhangsel 1. Het gebruik van andere vissoorten waarmee ook ervaring is opgedaan, is echter ook toegestaan (tabel 1A en 1B).
1.2. DEFINITIES
Lowest Observed Effect Concentration (LOEC): de laagste geteste concentratie van een teststof waarbij de stof een significant effect (p < 0,05) heeft vergeleken met de controlegroep. Alle testconcentraties boven de LOEC moeten een schadelijk effect hebben dat gelijk is aan of groter is dan de LOEC.
No Observed Effect Concentration (NOEC): de testconcentratie direct onder de LOEC.
1.3. PRINCIPE VAN DE TEST
De embryonale en larvestadia van de vis worden blootgesteld aan een reeks concentraties van de in water opgeloste teststof. Binnen het protocol kan men kiezen tussen een semi-statische procedure en een doorstroomprocedure. De keuze hangt af van het type teststof. De test begint met het plaatsen van de bevruchte eitjes in de testkamers en eindigt vlak voordat de dooierzak van welke larve dan ook in een van de testkamers volledig is verbruikt of voordat er sterfte optreedt door verhongering in de controlegroep. Vervolgens worden de letale of subletale effecten vastgesteld en vergeleken met de controlewaarden zodat de LOEC en NOEC kunnen worden vastgesteld. De effecten kunnen ook worden geanalyseerd met een regressiemodel, zodat kan worden ingeschat wat de concentratie is die een gegeven procentueel effect kan opleveren (d.w.z. LC/ECX, waarbij x een bepaald % effect is).
1.4. GEGEVENS OVER DE TESTSTOF
Resultaten van een acute toxiciteitstest (zie methode C.1), bij voorkeur met dezelfde vissoort als in deze test is gebruikt, moeten beschikbaar zijn. De resultaten kunnen van pas komen bij het selecteren van de juiste reeks testconcentraties in de test die betrekking heeft op de eerste levensfase. De oplosbaarheid in water (inclusief de oplosbaarheid in testwater) en de dampspanning van de teststof moeten bekend zijn. Er moet een betrouwbare, analytische methode, met een bekende en gerapporteerde nauwkeurigheid en detectiegrens, beschikbaar zijn voor de kwantitatieve bepaling van de stof in de testoplossingen.
De gegevens over de teststof die nuttig zijn bij het bepalen van de testomstandigheden zijn de structuurformule, de zuiverheid van de stof, de stabiliteit van de stof in licht, de stabiliteit onder de testcondities, pKa, Pow en de resultaten van een onderzoek naar de mate van gemakkelijke biologische afbreekbaarheid (zie methode C.4).
1.5. GELDIGHEID VAN DE TEST
Een test is alleen geldig als aan de onderstaande voorwaarden wordt voldaan:
|
— |
het totale percentage bevruchte eitjes in de controlegroep en eventueel in de bakken met alleen het oplosmiddel dat de test overleeft, moet groter of gelijk zijn aan de minimale percentages in aanhangsel 2 en 3, |
|
— |
het gehalte aan opgeloste zuurstof moet gedurende de gehele test tussen 60 % en 100 % van de verzadigingswaarde van lucht liggen, |
|
— |
het verschil in watertemperatuur tussen de testkamers en tussen de opeenvolgende dagen mag op geen enkel moment van de test groter zijn dan ±1,5 oC. Tevens mag de watertemperatuur niet hoger of lager zijn dan het temperatuurbereik dat voor de vissoort wordt gespecificeerd (aanhangsel 2 en 3). |
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Testkamers
Voor de test mogen glazen bakken en bakken van ander chemisch inert materiaal worden gebruikt. De grootte van de bakken moet geschikt zijn voor de beoogde densiteit (zie punt 1.7.1.2). Het is aan te bevelen de testkamers willekeurig in het testgebied te plaatsen. Als er systematische effecten in het laboratorium optreden die kunnen worden beheerst door het gebruik van blokken, verdient een willekeurig blokontwerp waarbij in elk blok alle behandelingen plaatsvinden de voorkeur boven een compleet willekeurig ontwerp. Als er wordt gebruikgemaakt van blokken, moet hier bij de gegevensanalyse rekening mee worden gehouden. De testkamers moeten worden beschermd tegen ongewenste invloeden van buitenaf.
1.6.2. Keuze van de vissoort
In tabel 1A staan de aanbevolen vissoorten. Dit sluit het gebruik van andere vissoorten niet uit (voorbeelden in tabel 1B), maar de testprocedure moet wellicht worden aangepast teneinde passende testomstandigheden te creëren. Als er wordt gekozen voor een andere vissoort, moet worden aangegeven waarom er voor deze soort is gekozen en tevens worden gerapporteerd welke experimentele methode wordt toegepast.
1.6.3. Leefomstandigheden van de broedvis
Meer informatie over de relatief beste leefomstandigheden voor de broedvissen vindt u in OESO TG 210 (21) en in de referenties (2)(3)(4)(5)(6).
1.6.4. Omgaan met embryo's en larven
Embryo's en larven kunnen binnen de hoofdbak worden onderverdeeld in kleinere bakken die zijn voorzien van gaaswanden waardoor de testoplossing vrij door de hoofdbak kan stromen. Een niet-turbulente stroming in deze kleine bakken kan worden verkregen door deze aan een arm te hangen die ze op en neer beweegt en tegelijkertijd de organismen onder water houdt. Ook kan worden gebruikgemaakt van een sifonspoelsysteem. Bevruchte eitjes van zalmachtigen kunnen op een rek of gaas worden gelegd met gaten die zo groot zijn dat de larven, nadat ze zijn uitgekomen, er doorheen kunnen vallen. In semi-statische tests waarbij de organismen dagelijks moeten worden overgeplaatst, kan bij het verwijderen van embryo's en larven het best gebruik worden gemaakt van pasteurpipetten (zie paragraaf 1.6.6).
Indien er eihouders, roosters of gaaswerken zijn gebruikt om de eitjes in de hoofdbak op hun plaats te houden, moeten deze worden verwijderd zodra de larven uitkomen (21). Stukken gaas die voorkomen dat vissen ontsnappen, mogen niet worden verwijderd. Als larven moeten worden overgeplaatst, mogen ze niet worden blootgesteld aan lucht en mogen er geen netten worden gebruikt om de vissen uit de eihouders te halen (deze waarschuwing is mogelijk niet van toepassing op sommige minder fragiele vissoorten, zoals de karper). Het moment van overplaatsing is afhankelijk van de vissoort. Soms is overplaatsing niet nodig. Voor de semistatische techniek mogen bekers of lage bakjes worden gebruikt. Indien nodig worden de bekers vlak boven de bodem voorzien van een stukje gaas. Als het volume van deze bakjes voldoet aan de densiteitvereisten (zie 1.7.1.2), is het overplaatsen van de embryo's of larven mogelijk niet nodig.
1.6.5. Water
Water dat voldoet aan de chemische kenmerken van geschikt verdunningswater zoals vermeld in aanhangsel 4 en waarin de gekozen vissoort minstens zo goed kan overleven als in het water dat wordt beschreven in de aanhangsels 2 en 3, is geschikt als testwater. Gedurende de testperiode moet de waterkwaliteit constant zijn. De pH-waarde mag niet meer dan ±0,5 pH-eenheden schommelen. Om ervoor te zorgen dat het verdunningswater de testresultaten niet noemenswaardig beïnvloedt (bijvoorbeeld door complexvorming met de teststof) en geen ongunstige invloed heeft op de conditie van de broedvissen, moeten regelmatig monsters worden genomen en geanalyseerd. Zware metalen (bijvoorbeeld Cu, Pb, Zn, Hg, Cd en Ni), de belangrijkste anionen en kationen (bijvoorbeeld Ca, Mg, Na, K, Cl en SO4), bestrijdingsmiddelen (bijvoorbeeld totaalgehalte aan organo-fosfor-pesticiden en totaalgehalte aan organochloor-pesticiden) en het totaalgehalte aan organische koolstof en zwevende deeltjes moeten bijvoorbeeld om de drie maanden worden bepaald als van het verdunningswater bekend is dat het een relatief constante kwaliteit heeft. Indien is aangetoond dat de waterkwaliteit gedurende ten minste één jaar constant blijft, zijn minder frequente bepalingen en langere intervallen (bijvoorbeeld zes maanden) toelaatbaar.
1.6.6. Testoplossingen
De testoplossingen met de gekozen concentraties worden bereid door verdunning van een stamoplossing.
De stamoplossing wordt bij voorkeur bereid door eenvoudig mengen en schudden van de teststof in het verdunningswater met mechanische middelen (bijvoorbeeld door te roeren of met ultrasone trillingen). Voor het maken van een stamoplossing van een passende concentratie kunnen verzadigingskolommen (oplosbaarheidskolommen) worden gebruikt. Het gebruik van oplosmiddelen of dispergeermiddelen (ontsluitingsmiddelen) verdient geen aanbeveling; niettemin kan dit in bepaalde gevallen nodig zijn om een stamoplossing van een passende concentratie te verkrijgen. Voorbeelden van passende oplosmiddelen zijn ethanol, methanol, dimethyl-formamide en triethyleenglycol. Voorbeelden van passende dispergeermiddelen zijn Cremophor RH40, Tween 80, 0,01 % methylcellulose en HCO-40. Als gemakkelijk biologisch afbreekbare agentia (bijvoorbeeld aceton) en/of zeer vluchtige stoffen worden gebruikt, moet worden gewaakt voor problemen die zich als gevolg van bacteriegroei in de doorstroomtests kunnen voordoen. Indien wordt gebruikgemaakt van een ontsluitingsmiddel, mag dit geen grote invloed hebben op de overlevingskansen en geen zichtbaar negatief effect hebben op de vroege levensstadia, hetgeen blijkt uit de controle met uitsluitend oplosmiddel. Het gebruik van deze stoffen moet echter te allen tijde zoveel mogelijk worden vermeden.
Voor de semistatische techniek kunnen twee verschillende verversingsprocedures worden toegepast; i) er worden nieuwe testoplossingen bereid in schone bakken en levende eitjes en larven worden in een kleine hoeveelheid oude oplossing voorzichtig naar de nieuwe schone bakken overgeplaatst waarbij blootstelling aan lucht moet worden vermeden, of ii) de organismen blijven in de bakken terwijl een deel van het testwater (minimaal driekwart) wordt ververst. De verversingsfrequentie hangt af van de stabiliteit van de teststof, maar dagelijks verversen van water wordt aanbevolen. Als uit eerdere stabiliteitstests (zie punt 1.4) blijkt dat de concentratie van de teststof gedurende de verversingsperiode niet stabiel blijft (d.w.z. buiten 80-120 % van de nominale concentratie valt of onder 80 % van de gemeten oorspronkelijke concentratie), moet worden overwogen om over te gaan op een doorstroomtest. In elk geval moet erop worden toegezien dat de larven tijdens de verversingsprocedure geen stress ondervinden.
Voor doorstroomtests is een systeem vereist dat de stamoplossing van de teststof continu verdeelt en verdunt en ervoor zorgt dat de testkamers de juiste testconcentratie krijgen toegediend (bijvoorbeeld met een doseerpomp, mechanisme voor evenredige verdunning of saturatorsysteem). De stroomsnelheid van de stamoplossingen en het verdunningswater moet regelmatig, bij voorkeur dagelijks, worden gecontroleerd en mag gedurende de gehele test hooguit 10 % afwijken. Een stroomsnelheid die overeenkomt met ten minste vijf testkamervolumes per 24 uur is wenselijk (2).
1.7. PROCEDURE
Voor informatie over de resultaten van de toxiciteitstest met visembryo's en -larven kunt u de bestaande literatuur raadplegen. De literatuurlijst van deze tekst bevat enkele voorbeelden (7) (8) (9).
1.7.1. Blootstellingsomstandigheden
1.7.1.1. Duur
De test moet bij voorkeur worden gestart binnen 30 minuten na de bevruchting van de eitjes. De embryo's worden in de testoplossing geplaatst vóór, of zo snel mogelijk na, het begin van het blastodiscus-stadium en altijd vóór het begin van het gastrulastadium. Als de eitjes afkomstig zijn van een commerciële leverancier, is het niet altijd mogelijk de test direct na de bevruchting te starten. Omdat de gevoeligheid van de test sterk kan worden beïnvloed door het uitstellen van de start, moet de test binnen 8 uur na de bevruchting worden gestart. Omdat de larven gedurende de periode van blootstelling niet worden gevoederd, moet de test worden beëindigd voordat een van de larven, ongeacht in welke testkamer, de dooierzak volledig heeft verbruikt of voordat er sterfte door verhongering optreedt binnen de controlegroep. De duur hangt af van de vissoort die wordt gebruikt. In aanhangsel 2 en 3 wordt voor een aantal vissoorten de aanbevolen testduur biologisch vermeld.
1.7.1.2. Densiteit
Het aantal bevruchte eitjes aan het begin van de test moet toereikend zijn om te kunnen voldoen aan de statistische vereisten. De eitjes moeten willekeurig worden verdeeld over de verschillende behandelingen. Daarbij moeten minimaal 30 bevruchte eitjes, gelijk of zo gelijk mogelijk (bij bepaalde vissoorten is het namelijk moeilijk om een gelijk aantal per groep te verkrijgen) over ten minste drie replicaattestkamers verdeeld, per concentratie worden gebruikt. De densiteit (biomassa per volume testoplossing) moet zo laag zijn dat het gehalte aan opgeloste zuurstof van minimaal 60 % van de luchtverzadigingswaarde zonder beluchting in stand kan worden gehouden. Bij doorstroomtests wordt een densiteit van maximaal 0,5 g/l per 24 uur en maximaal 5 g/l oplossing op een willekeurig moment (2) aanbevolen.
1.7.1.3. Licht en temperatuur
De fotoperiode en testwatertemperatuur moeten worden afgestemd op de gekozen vissoort (aanhangsel 2 en 3). Gebruik voor het controleren van de temperatuur desgewenst een extra testbak.
1.7.2. Testconcentraties
Normaliter zijn er vijf concentraties van de teststof nodig die een constante factor van maximaal 3,2 van elkaar verschillen. Bij het selecteren van de reeks concentraties moet rekening worden gehouden met de curve van LC50 tegen blootstellingsperiode tijdens het acute toxiciteitsonderzoek. In bepaalde situaties mogen minder dan vijf concentraties worden gebruikt, bijvoorbeeld bij een limiettest, en kan het interval tussen de concentraties worden verkort. Als er minder dan vijf concentraties worden gebruikt, moet hiervoor een geldige reden worden gegeven. Er mogen geen concentraties van de stof worden gebruikt die hoger zijn dan de LC50 over 96 uur of, indien dit lager is, 100 mg/l. Tevens mogen stoffen niet boven hun oplosbaarheidsgrens in het testwater worden getest.
Als een ontsluitingsmiddel wordt gebruikt bij het maken van testoplossingen (zie punt 1.6.6), mag de uiteindelijke concentratie hiervan in de testbakken niet groter zijn dan 0,1 ml/l en moet de concentratie in alle bakken gelijk zijn.
1.7.3. Controles
Naast de testreeks moet er een controlegroep worden behandeld met alleen het verdunningswater (eventueel met replicaat) en, indien van toepassing, een controlegreep met water waaraan het ontsluitingsmiddel is toegevoegd (eventueel met replicaat).
1.7.4. Frequentie van de analytische bepalingen en metingen
Tijdens de test worden de concentraties van de teststoffen regelmatig gemeten.
In semistatische tests waarbij wordt verwacht dat de concentratie van de teststof binnen ± 20 % van de nominale concentratie blijft (d.w.z. binnen het interval van 80-120 %; zie punt 1.4 en 1.6.6), is het raadzaam om in elk geval de hoogste en laagste testconcentraties te analyseren. Doe dit vlak na het bereiden van de oplossing en vlak vóór het verversen, en ten minste drie keer, verspreid over de test (d.w.z. dat monsters van dezelfde oplossing moeten worden geanalyseerd — vlak na het bereiden van de oplossing en vlak vóór het verversen).
Bij tests waarbij niet wordt verwacht dat de concentratie van de teststof binnen ± 20 % van de nominale concentratie blijft (op basis van stabiliteitsgegevens van de stof), moeten alle testconcentraties worden geanalyseerd. Doe dit vlak na het bereiden en vlak vóór het verversen en volgens dezelfde procedure als hierboven (d.w.z. ten minste drie keer, verspreid over de test). Deze bepaling van de concentratie van de teststof vóór het verversen van de oplossing hoeft voor elke testconcentratie slechts bij de oplossing van één replicaatbak te gebeuren. Het interval tussen deze metingen mag niet meer dan zeven dagen bedragen. Het is wenselijk de resultaten te baseren op gemeten concentraties. Als echter kan worden aangetoond dat de concentratie van de teststof in de oplossing gedurende de gehele test binnen ± 20 % van de nominale of de gemeten oorspronkelijke concentratie is gebleven, mogen de resultaten worden gebaseerd op de nominale of gemeten oorspronkelijke waarden.
Bij doorstroomtests is een soortgelijke procedure als hierboven van toepassing (maar de meting van „oude” oplossingen is niet van toepassing). Als de testduur echter langer is dan zeven dagen, is het mogelijk verstandig het aantal monsternemingen tijdens de eerste week te verhogen (bijvoorbeeld drie meetreeksen), zodat men zeker weet dat de testconcentraties stabiel blijven.
Monsters moeten mogelijk worden gecentrifugeerd of gefilterd (bijvoorbeeld met een 0,45 μm poriëngrootte). Omdat echter kennelijk noch centrifugatie noch filtratie een volledige scheiding van de biologisch beschikbare en de biologisch niet-beschikbare fractie van de teststof garandeert, kunnen deze behandelingen wellicht niet altijd op de monsters worden toegepast.
In de loop van de test moet het gehalte aan opgeloste zuurstof, de pH en de temperatuur in alle testbakken worden gemeten. De totale hardheid en (voorzover relevant) het zoutgehalte moeten worden gemeten in de bakken met de controlegroepen en in één bak met de hoogste concentratie teststof. Het zuurstofgehalte en (voorzover relevant) het zoutgehalte moeten tijdens de test ten minste drie keer worden gemeten (aan het begin, omstreeks het midden en aan het eind). Bij semi-statische tests is het raadzaam het opgeloste zuurstofgehalte vaker te meten, bij voorkeur voor en na elke waterverversing of minimaal één keer per week. De pH moet bij semistatische tests voor en na elke waterverversing worden gemeten en bij doorstroomtests minimaal één keer per week. De hardheid moet gedurende de test eenmaal worden gemeten. De temperatuur moet dagelijks worden gemeten en bij voorkeur in één testbak continu worden gecontroleerd.
1.7.5. Waarnemingen
1.7.5.1. Stadium van embryonale ontwikkeling
Het embryonale stadium (d.w.z. het gastrulastadium) bij het begin van de blootstelling aan de teststof moet zo nauwkeurig mogelijk worden vastgesteld. Hiervoor kan een representatief monster van eitjes worden gebruikt die afdoende zijn gefixeerd en geklaard. Voor een beschrijving en afbeeldingen van de embryonale stadia kan ook de literatuur worden geraadpleegd (2) (5) (10) (11).
1.7.5.2. Uitkomen en overleven
Minimaal één keer per dag moet uitkomen en overleven worden geobserveerd en de aantallen geregistreerd. Het is mogelijk wenselijk om aan het begin van de test vaker te kijken (bijvoorbeeld elke 30 minuten gedurende de eerste drie uur), omdat in sommige gevallen de overlevingstijden relevanter zijn dan het aantal dode diertjes (bijvoorbeeld als er sprake is van acute toxische effecten). Dode embryo's en larven moeten direct nadat ze worden opgemerkt, worden verwijderd, omdat ze snel kunnen ontbinden. Het verwijderen van dode organismen moet zeer voorzichtig gebeuren om aanstoten en beschadigen van naastgelegen eitjes/larven te voorkomen. Deze zijn namelijk uitermate fragiel en gevoelig. De criteria voor „dood” variëren per stadium:
|
— |
eitjes: met name in de eerste stadia duidelijk minder doorzichtig en een verandering van kleur als gevolg van coagulatie en/of precipitatie van proteïne, hetgeen resulteert in een wit ondoorschijnend uiterlijk; |
|
— |
embryo's: geen embryonale beweging en/of geen hartslag en/of ontkleuring en afname van doorzichtigheid bij soorten die als embryo gewoonlijk doorzichtig zijn; |
|
— |
larven: onbeweeglijkheid en/of geen ademhaling en/of geen hartslag en/of witte ondoorschijnende kleur van het centrale zenuwstelsel en/of geen reactie op een mechanische prikkel. |
1.7.5.3. Afwijkend uiterlijk
Het aantal larven met een afwijkende lichaamsvorm en/of pigmentatie en de fase van het verbruik van de dooierzak moeten regelmatig, afhankelijk van de duur van de test en de aard van de afwijking, worden gerapporteerd. Embryo's en larven met een afwijking kunnen van nature voorkomen en bij sommige vissoorten kan het aantal oplopen tot enkele procenten van de controlegroep(en). Dieren met een afwijking mogen alleen uit de testbakken worden verwijderd als ze dood zijn.
1.7.5.4. Afwijkend gedrag
Afwijkingen, zoals hyperventilatie, ongecoördineerd zwemmen en atypische onbeweeglijkheid, moeten regelmatig, afhankelijk van de duur van de test, worden gerapporteerd. Hoewel het moeilijk is deze effecten te kwantificeren, kunnen ze (indien waargenomen) helpen bij de interpretatie van de sterftecijfers doordat ze informatie geven over de toxische werking van de teststof.
1.7.5.5. Lengte
Het is wenselijk om aan het eind van de test de lengte van elk organisme te meten. Hierbij kunnen de standaardlengte, de vorklengte en de totale lengte worden gemeten. Als er echter vinrot in de staart of vinerosie is opgetreden, moet de standaardlengte worden gemeten. Over het algemeen moet de variatiecoëfficiënt voor de lengte van replicaatorganismen in de controlegroepen van een goed uitgevoerde test ≤ 20 % zijn.
1.7.5.6. Gewicht
Aan het eind van de test kan van elk organisme het gewicht worden gemeten; het droge gewicht (24 uur bij 60 oC) heeft de voorkeur boven het natte gewicht (drooggedept). Over het algemeen moet de variatiecoëfficiënt voor het gewicht van replicaatorganismen in de controlegroepen van een goed uitgevoerde test ≤ 20 % zijn.
Deze waarnemingen resulteren in de volgende gegevens die alle voor een deel kunnen worden gebruikt voor een statistische analyse:
|
— |
cumulatieve sterfte, |
|
— |
aantal gezonde larven aan het eind van de test, |
|
— |
tijd van begin uitkomen eitjes tot eind uitkomen eitjes (d.w.z. 90 % van de eitjes in elke replicaatbak), |
|
— |
aantal larven dat per dag uitkomt, |
|
— |
lengte (en gewicht) van overlevende organismen aan eind van de test, |
|
— |
aantal larven dat misvormd is of een afwijking vertoont. |
|
— |
aantal larven dat afwijkend gedrag vertoont. |
2. GEGEVENS EN RAPPORTAGE
2.1. BEWERKING VAN DE RESULTATEN
Het is wenselijk om bij de opzet en analyse van de test een statisticus te betrekken omdat de methode een aanzienlijke variatie in de opzet van het experiment toelaat, bijvoorbeeld in het aantal testkamers, het aantal testconcentraties, het oorspronkelijk aantal bevruchte eitjes en de gemeten parameters. Gezien de beschikbare opties in de opzet van de test, worden hier geen richtlijnen voor de statistische procedures gegeven.
Als de LOEC/NOEC wordt bepaald, moet de variatie binnen elke set replicaatbakken worden geanalyseerd met behulp van ANOVA (variantie-analyse) of kruistabellen. Bij het maken van een meervoudige vergelijking tussen de resultaten van de afzonderlijke concentraties en de resultaten van de controlegroepen, komt de methode van Dunnett mogelijk goed van pas (12) (13). Er zijn ook andere bruikbare methoden beschikbaar (14) (15). De omvang van het effect dat met ANOVA of een andere methode kan worden wordt vastgesteld, (d.w.z. het onderscheidingsvermogen van de test) moet worden berekend en gerapporteerd. Overigens zijn niet alle waarnemingen die worden vermeld in punt 1.7.5.6 geschikt voor statistische analyse met ANOVA. De cumulatieve sterfte en het aantal gezonde larven aan het eind van de test kunnen bijvoorbeeld worden geanalyseerd met probitmethoden.
Als de LC/ECx wordt bepaald, moet er een geschikte curve (of meerdere curven), zoals de logistische curve, worden bepaald voor de gegevens met behulp van een statistische methode, zoals de kleinste kwadratenmethode of de niet-lineaire kleinste kwadratenmethode. De curven moeten worden geparametriseerd zodat LC/ECx en de standaardafwijking direct kunnen worden bepaald. Hierdoor wordt het berekenen van de betrouwbaarheidsgrenzen van de LC/ECx een stuk eenvoudiger. Tenzij er goede redenen zijn om andere betrouwbaarheidsniveaus te hanteren, moet een betrouwbaarheid van 95 % aan beide zijden worden aangehouden. De passingsprocedure moet bij voorkeur een middel bieden waarmee de significantie van de mate waarin de curve niet past, kan worden berekend. Voor het maken van de curven kunnen grafische methoden worden gebruikt. Regressieanalyse is geschikt voor alle waarnemingen in punt 1.7.5.6.
2.2. INTERPRETATIE VAN DE RESULTATEN
De resultaten moeten met de nodige omzichtigheid worden geïnterpreteerd als de gemeten toxische concentraties in de testoplossingen in de buurt liggen van de detectie van de analysemethode. De resultaten voor concentraties die de oplosbaarheidsgrens van de teststof in water overschrijden, moeten ook voorzichtig worden geïnterpreteerd.
2.3. TESTRAPPORT
In het testrapport moeten de volgende gegevens worden opgenomen:
2.3.1. Teststof:
|
— |
fysiek voorkomen en relevante fysisch-chemische kenmerken, |
|
— |
chemische identificatiegegevens, voorzover relevant met inbegrip van de zuiverheid en de analysemethode voor het bepalen van de hoeveelheid van de teststof. |
2.3.2. Diersoort:
|
— |
wetenschappelijke naam, stam, aantal moedervissen (d.w.z. het aantal vrouwtjes dat werd gebruikt voor het produceren van het benodigde aantal eitjes in de test), herkomst en de methode waarop de bevruchte eitjes werden verzameld en vervolgens werden behandeld. |
2.3.3. Testomstandigheden
|
— |
toegepaste testprocedure (bijvoorbeeld semi-statische test of doorstroomtest, tijdsduur vanaf bevruchting tot start van de test, densiteit, enz.), |
|
— |
fotoperiode(n), |
|
— |
testopzet (bijvoorbeeld het aantal testkamers en replicaten, het aantal embryo's per replicaat), |
|
— |
wijze waarop de stamoplossingen werden bereid en verversingsfrequentie (indien een ontsluitingsmiddel is gebruikt, moeten de aard en de concentratie daarvan worden vermeld), |
|
— |
de nominale testconcentraties, de in de testbakken gemeten waarden met gemiddelden en standaardafwijkingen en de methode waarmee zij zijn bepaald, en, indien de teststof bij een lagere concentratie dan in de testsituatie oplosbaar is in water, moet worden aangetoond dat de metingen betrekking hebben op de concentraties van de stof in de testoplossing, |
|
— |
kenmerken van het verdunningswater; pH, hardheid, temperatuur, gehalte aan opgeloste zuurstof, residueel chloorgehalte (indien gemeten), totale hoeveelheid organische koolstof (TOC), zwevende deeltjes, zoutgehalte van het testmedium (indien gemeten), alsmede de resultaten van eventuele andere metingen, |
|
— |
waterkwaliteit in de testbakken: pH, hardheid, temperatuur en gehalte aan opgeloste zuurstof. |
2.3.4. Resultaten:
|
— |
resultaten van eventuele voorbereidende onderzoeken naar de stabiliteit van de teststof, |
|
— |
gegevens waaruit blijkt dat de totale overleving in de controlegroepen voldeed aan de aanvaardbaarheidsnorm voor het gebruikte proefdier (aanhangsel 2 en 3), |
|
— |
gegevens over de sterfte/overleving tijdens de embryonale en larvestadia en de totale sterfte/overleving, |
|
— |
aantal dagen waarbinnen de eitjes zijn uitgekomen en aantal uitgekomen eitjes, |
|
— |
gegevens over lengte (en gewicht), |
|
— |
gevallen en beschrijving van morfologische afwijkingen (indien aanwezig), |
|
— |
gevallen en beschrijving van effecten op het gedrag (indien aanwezig), |
|
— |
statistische analyse en verwerking van de gegevens, |
|
— |
bij tests die zijn geanalyseerd met ANOVA, de LOEC bij p = 0,05 en de NOEC voor elke reactie die is vastgesteld, met inbegrip van een beschrijving van de statistische procedures die zijn gebruikt en een indicatie van de omvang van het waar te nemen effect, |
|
— |
bij tests die zijn geanalyseerd met regressietechnieken, de LC/ECX en betrouwbaarheidsintervallen, en een grafiek van het aangepaste model dat werd gebruikt voor de berekening, |
|
— |
beweegredenen voor eventuele afwijkingen van deze testmethode. |
3. REFERENTIES
|
(1) |
Kristensen P. (1990). Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 pp. June 1990. |
|
(2) |
ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 pp. |
|
(3) |
Brauhn J.L. and Schoettger R.A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota. |
|
(4) |
Brungs W.A. and Jones B.R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures. p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota. |
|
(5) |
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, pp. 121-173. |
|
(6) |
Legault R. (1958). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, pp. 328-330. |
|
(7) |
Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, pp. 61-71. |
|
(8) |
Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, pp. 807-821. |
|
(9) |
Van Leeuwen C.J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, pp. 129-145. |
|
(10) |
Kirchen R.V. and W.R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company. |
|
(11) |
Kirchen R.V. and W.R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 pp. |
|
(12) |
Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, pp. 1096-1121. |
|
(13) |
Dunnett C.W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491. |
|
(14) |
Mc Clave J.T., Sullivan J.H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia. |
|
(15) |
Van Leeuwen C.J., Adema D.M.M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, pp. 321-334. |
|
(16) |
Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, 81 pp. |
|
(17) |
Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, pp. 126-134. |
|
(18) |
Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology — an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: pp. 231-236. |
|
(19) |
Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, pp. 19-28. |
|
(20) |
US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth. |
|
(21) |
US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth. |
|
(22) |
De Graeve G.M., Cooney J.D., McIntyre D.O., Poccocic T.L, Reichenbach N.G., Dean J.H. and Marcus M.D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, pp. 1189-1203. |
|
(23) |
Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish. |
|
(24) |
Balon E.K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 pp. |
|
(25) |
Blaxter J.H.S. (1988). Pattern and variety in development, in: W.S. Hoar and D.J. Randall eds., Fish Physiology, Vol. XIA, Academie press, pp. 1-58. |
Tabel 1A
Aanbevolen vissoorten voor de test
|
Zoetwatervissen |
|
Oncorhynchus mykiss Regenboogforel (9) (16) |
|
Danio rerio Zebravis (7) (17) (18) |
|
Cyprinus caprio Karper (8) (19) |
|
Oryzias latipes Japanse rijstvis/Medaka (20) (21) |
|
Pimephales promelas „Fathead minnow” (8) (22) |
Tabel 1B
Voorbeelden van andere goed gedocumenteerde vissoorten die al eens zijn gebruikt
|
Zoetwatervissen |
Zoutwatervissen |
|
Carassius auratus Goudvis (8) |
Menidia peninsulae „Tidewater silverside” (23) (24) (25) |
|
Lepomis macrochirus Zonnebaars (8) |
Clupea harengus Haring (24) (25) |
|
Gadus morhua Kabeljauw (24) (25) |
|
|
Cyprinodon variegatus Edelsteen tandkarper (23) (24) (25) |
Aanhangsel 1
RICHTLIJNEN BIJ HET UITVOEREN VAN EEN TOXICITEITSTEST MET EMBRYO'S EN LARVEN (SAC-FRY) VAN DE ZEBRAVIS (BRACHYDANIO RERIO)
INLEIDING
De zebravis komt oorspronkelijk voor in de snelstromende rivieren in het gebied van de kust van Coromandel in India. De vis wordt vaak gebruikt in aquaria en behoort tot de karperachtigen. Voor informatie over het kweken en verzorgen van zebravissen kunnen de standaardnaslagwerken over tropische vissen worden geraadpleegd. De biologie van de vis en zijn gebruik in visserijonderzoek is bestudeerd door Laale (1).
De vis wordt zelden langer dan 45 mm. De romp is cilindrisch en heeft 7-9 donkerblauwe, horizontale, zilverachtige strepen. Deze strepen lopen tot aan de anale en staartvinnen. De rug is olijfgroen. De mannetjes zijn dunner dan de vrouwtjes. De vrouwtjes zijn zilveriger en hebben een opgezwollen buik, met name vlak voor het kuitschieten.
De volwassen vissen zijn bestand tegen grote schommelingen in de temperatuur, pH en hardheid. Om de vissen echter gezond te houden, zodat de eitjes die worden geproduceerd van goede kwaliteit zijn, moeten optimale omstandigheden worden gecreëerd.
Bij het kuitschieten wordt het vrouwtje door het mannetje achtervolgd en aangestoten. Zodra de eitjes worden uitgestoten, worden ze bevrucht. De eitjes, die doorzichtig en niet-klevend zijn, vallen op de bodem, waar ze soms door de ouders worden opgegeten. Het kuitschieten wordt beïnvloed door licht. Als er 's ochtends voldoende licht is, vindt het kuitschieten gewoonlijk in de eerste uren na zonsopgang plaats.
Een vrouwtje kan met tussenpozen van een week wel honderden eitjes per keer produceren.
LEEFOMSTANDIGHEDEN VAN DE OUDERVISSEN, REPRODUCTIE EN VROEGE LEVENSSTADIA
Selecteer een geschikt aantal gezonde vissen en plaats deze ten minste twee weken voor het geplande kuitschieten in het juiste water (zie aanhangsel 4). De vissen moeten zich minimaal eenmaal hebben voortgeplant voordat ze de eitjes produceren die voor de test worden gebruikt. De dichtheid van de vissen mag in deze periode niet groter zijn dan 1 gram vis per liter. Als het water regelmatig wordt ververst of er wordt gebruikgemaakt van zuiveringssystemen, is het mogelijk de dichtheid te verhogen. In de bakken moet een temperatuur van 25 ± 2 oC worden gehandhaafd. De vissen moeten gevarieerd voedsel krijgen, bijvoorbeeld geschikt commercieel verkrijgbaar droogvoer, pas uitgekomen arthemia, chironomiden, daphnia en enchytreeën.
Hieronder worden twee procedures beschreven. In het verleden hebben deze geleid tot een groep gezonde bevruchte eitjes, die groot genoeg was om er een test mee uit te voeren.
|
i) |
Acht vrouwtjes en zestien mannetjes worden in een aquarium met 50 liter verdunningswater geplaatst. Ze worden afgeschermd van direct licht en minimaal 48 uur zo min mogelijk gestoord. Op de middag vóór de dag dat de test van start gaat, wordt onderin het aquarium een kuitbak geplaatst. Deze bestaat uit een frame (plexiglas of ander geschikt materiaal) van 5-7 cm hoog met een grof net van 2-5 mm bovenin en een fijn net van 10-30 μg onderin. Aan het grove net van het frame wordt een aantal „kuitbomen” bevestigd. Deze zijn gemaakt van uit nylon touw dat is losgedraaid. Nadat de vissen 12 uur in het donker hebben doorgebracht, wordt er een zwak licht aangedaan waarna het kuitschieten op gang komt. Twee tot vier uur na het kuitschieten, wordt de kuitbak verwijderd en worden de eitjes verzameld. De kuitbak zorgt ervoor dat de vissen de eitjes niet kunnen opeten en dat de eitjes gemakkelijk kunnen worden verzameld. De groep vissen moet zich al minimaal eenmaal hebben voortgeplant voordat de eitjes worden geproduceerd die voor de test worden gebruikt. |
|
ii) |
Vijf tot tien vrouwtjes- en mannetjesvissen worden minimaal twee weken voor het geplande kuitschieten in aparte bakken ondergebracht. Na 5-10 dagen zijn de buikjes van de vrouwtjes opgezwollen en zijn hun genitale papillen zichtbaar. Bij mannetjesvissen ontbreken deze. Het kuitschieten vindt plaats in een speciaal aquarium dat onderin is voorzien van een gaaswerk (zie boven). Het aquarium wordt tot 5-10 cm boven dit gaaswerk gevuld met verdunningswater. Op de dag voordat het kuitschieten moet plaatsvinden, worden er één vrouwtje en twee mannetjes in geplaatst. De watertemperatuur wordt geleidelijk verhoogd totdat het water één graad warmer is dan de acclimatiseringstemperatuur. Het licht wordt gedoofd en het aquarium moet vervolgens zoveel mogelijk met rust worden gelaten. 's Ochtends wordt er een zwak licht aangedaan waarna het kuitschieten op gang komt. Na 2-4 uur worden de vissen verwijderd en de eitjes verzameld. Als er meer eitjes nodig zijn dan het aantal dat één vrouwtje kan produceren, kunnen er meerdere aquaria tegelijk worden gebruikt. Als vóór de test wordt vastgelegd wat de voortplantingsresultaten van de afzonderlijk vrouwtjes zijn (aantal eitjes en kwaliteit), kunnen de vrouwtjes die het hoogst scoren, worden gebruikt voor het kuitschieten. |
De eitjes moeten in glazen zuigbuisjes (inwendige diameter minimaal 4 mm) met een flexibele ballon worden overgeplaatst naar de testbakken. De hoeveelheid water waarin de eitjes worden vervoerd moet zo klein mogelijk zijn. De eitjes zijn zwaarder dan water en zakken uit het buisje. Zorg ervoor dat de eitjes (en larven) niet in contact komen met lucht. Om er zeker van te zijn dat er zich in de eerste ontwikkelingsstadia geen onregelmatigheden voordoen, moet er een microscopisch onderzoek worden verricht op een monster (of meerdere monsters) van de eitjes. De eitjes mogen niet worden gedesinfecteerd.
Het sterftecijfer onder de eitjes is het hoogst binnen 24 uur na de bevruchting. In deze periode is een sterfte van 5-40 % niet uitzonderlijk. Eitjes sterven af door een mislukte bevruchting of door stoornissen in de ontwikkeling. De kwaliteit van de eitjes lijkt afhankelijk te zijn van de vrouwtjesvis die ze heeft geproduceerd. Sommige vrouwtjes produceren namelijk altijd eitjes van een goede kwaliteit en andere nooit. Ook het ontwikkelingstempo en de snelheid waarmee de eitjes uitkomen, verschillen per groep eitjes. De eitjes die met succes zijn bevrucht en de larven hebben hoge overlevingskansen, gewoonlijk 90 % of hoger. Bij 25 oC komen de eitjes 3-5 dagen na de bevruchting uit. De dooierzak is ongeveer 13 dagen na de bevruchting volledig verbruikt.
De ontwikkeling van het embryo is goed beschreven door Hisaoka en Battle (2). Doordat de eitjes en de uitgekomen larven doorzichtig zijn, kan de ontwikkeling van de vis worden gevolgd en kunnen misvormingen worden waargenomen. Ongeveer 4 uur na kuitschieten, kunnen de niet-bevruchte eitjes worden onderscheiden van de bevruchte eitjes (3). Om dit te kunnen zien, worden de eitjes en larven in een kleine testbak geplaatst en bestudeerd onder een microscoop.
De testomstandigheden voor de vroege levensstadia worden genoemd in aanhangsel 2. De optimale waarden voor de pH en de hardheid van het verdunningswater zijn respectievelijk 7,8 en 250 mg CaCO3/l.
BEREKENINGEN EN STATISTIEKEN
Hiervoor wordt een tweefasige aanpak aanbevolen. Eerst worden de gegevens over sterfte, abnormale ontwikkeling en de duur van het uitkomen van de eitjes statistisch geanalyseerd. Vervolgens wordt in concentraties waarbij geen negatieve effecten op een van deze parameters werd geconstateerd, de lengte van de visjes statistisch bepaald. Deze aanpak wordt aanbevolen omdat de stof selectief kleinere visjes kan doden, de duur van het uitkomen kan vertragen en zware misvormingen kan veroorzaken, waardoor de lengtemetingen een vertekend beeld kunnen geven. Bovendien wordt er per behandeling ongeveer hetzelfde aantal vissen gemeten en kan zodoende de betrouwbaarheid van de teststatistieken worden gegarandeerd.
BEPALEN VAN LC50 EN EC50
Het percentage overlevende eitjes en larven wordt berekend en gecorrigeerd voor de sterfte in de controlegroepen volgens de formule van Abbott (4):
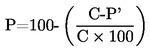
waarbij
|
P |
= |
gecorrigeerd % overleving |
|
P' |
= |
% overleving waargenomen bij testconcentratie |
|
C |
= |
% overleving in controlegroep |
Indien mogelijk wordt aan het eind van de test met een passende methode de LC50 bepaald.
Als het wenselijk is ook de morfologische afwijkingen in de statistische EC50 op te nemen, kan hiervoor Stephan (5) worden geraadpleegd.
VASTSTELLEN VAN DE LOEC EN NOEC
Eén doel van een embryo- en larvetest is de testgroepen te vergelijken met de controlegroep, d.w.z. het bepalen van de LOEC. Hiertoe moeten verschillende vergelijkingsprocedures worden toegepast (6) (7) (8) (9) (10).
REFERENTIES
|
(1) |
Laale H.W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, pp. 121-173. |
|
(2) |
Hisaoka K.K. and Battle H.I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 pp. |
|
(3) |
Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, pp. 173-181. |
|
(4) |
Finney D.J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, pp. 1-333. |
|
(5) |
Stephan C.E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, pp. 69-81. |
|
(6) |
Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(7) |
Dunnett C.W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491. |
|
(8) |
Williams D.A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, pp. 103-117. |
|
(9) |
Williams D.A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, pp. 519-531. |
|
(10) |
Sokal R.R. and Rohlf F.J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco. |
Aanhangsel 2
TESTOMSTANDIGHEDEN, DUUR EN OVERLEVINGSCRITERIA VOOR AANBEVOLEN VISSOORTEN
|
Vissoort |
Temperatuur (oC) |
Zoutgehalte (0/00) |
Fotoperiode (in uren) |
Duur van de stadia (in dagen) |
Normale duur van test |
Overleving binnen controlegroep (minimum %) |
||
|
Embryo |
Larve |
Uitkomen eitjes |
Na uitkomen eitjes |
|||||
|
ZOETWATER |
||||||||
|
Brachydanio rerio Zebravis |
25 ± 1 |
— |
12-16 |
3-5 |
8-10 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 5 dagen na het uitkomen van de eitjes (8-10 dagen) |
80 |
90 |
|
Oncorhynchus mykiss Regenboogforel |
10 ± 1 (22) 12 ± 1 (23) |
— |
0 (24) |
30-35 |
25-30 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 20 dagen na het uitkomen van de eitjes (50-55 dagen) |
66 |
70 |
|
Cyprinus carpio Karper |
21-25 |
— |
12-16 |
5 |
> 4 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 4 dagen na het uitkomen van de eitjes (8-9 dagen) |
80 |
75 |
|
Oryzias latipes Japanse rijstvis/Medaka |
24 ± 1 (22) 23 ± 1 (23) |
— |
12-16 |
8-11 |
4-8 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 5 dagen na het uitkomen van de eitjes (13-16 dagen) |
80 |
80 |
|
Pimephales promelas Fathead minnow |
25 + 2 |
— |
16 |
4-5 |
5 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 4 dagen na het uitkomen van de eitjes (8-9 dagen) |
60 |
70 |
Aanhangsel 3
Testomstandigheden, duur en overlevingscriteria voor andere goed gedocumenteerde vissoorten
|
Vissoort |
Temperatuur (oC) |
Zoutgehalte (0/00) |
Fotoperiode (in uren) |
Duur van de stadia (in dagen) |
Normale duur van embryo en larvetest |
Overleving binnen controlegroep (minimum %) |
||
|
|
|
|
|
Embryo |
Larve |
Uitkomen eitjes |
Na uitkomen eitjes |
|
|
ZOETWATER |
||||||||
|
Carassius auratus Goudvis |
24 ± 1 |
— |
— |
3-4 |
> 4 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 4 dagen na het uitkomen van de eitjes (7 dagen) |
— |
80 |
|
Leopomis macrochirus Zonnebaars |
21 ± 1 |
— |
16 |
3 |
> 4 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 4 dagen na het uitkomen van de eitjes (7 dagen) |
— |
75 |
|
ZOUTWATER |
||||||||
|
Menidia peninsulae Tidewater silverside |
22-25 |
15-22 |
12 |
1,5 |
10 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 5 dagen na het uitkomen van de eitjes (6-7 dagen) |
80 |
60 |
|
Clupea harengus Haring |
10 ± 1 |
8-15 |
12 |
20-25 |
3-5 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 3 dagen na het uitkomen van de eitjes (23-27 dagen) |
60 |
80 |
|
Gadus morhua Kabeljauw |
5 ± 1 |
5-30 |
12 |
14-16 |
3-5 |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 3 dagen na het uitkomen van de eitjes (18 dagen) |
60 |
80 |
|
Cyprinodon variegatus Edelsteentandkarper |
25 ± 1 |
15-30 |
12 |
— |
— |
Zo snel mogelijk na de bevruchting (vroeg gastrula-stadium) tot 4/7 dagen na het uitkomen van de eitjes (28 dagen) |
> 75 |
80 |
Aanhangsel 4
ENKELE CHEMISCHE KENMERKEN VAN GESCHIKT VERDUNNINGSWATER
|
Stof |
Concentratie |
|
Vaste deeltjes |
< 20 mg/l |
|
Totaalgehalte aan organische koolstof |
< 2 mg/l |
|
Niet-geïoniseerde ammonia |
< 1 μg/l |
|
Restchloorgehalte |
< 10 μg/1 |
|
Totaalgehalte aan organofosfor-pesticiden |
< 50 ng/l |
|
Totaalgehalte aan organochloor-pesticiden en polychloorbifenylen |
< 50 ng/l |
|
Totaalgehalte aan organisch chloor |
< 25 ng/l |
C.16. HONINGBIJEN — ACUTE-TOXICITEITSTEST (ORAAL)
1. METHODE
De methode die voor deze acute-toxiciteitstest wordt gebruikt, is een kopie van de OECD TG 213 (1998).
1.1. INLEIDING
Deze toxiciteitstest is een laboratoriummethode die bedoeld is voor de bepaling van de acute orale toxiciteit van gewasbeschermingsproducten en andere chemische stoffen voor volgroeide werkbijen.
Bij de vaststelling en evaluatie van de toxische eigenschappen van stoffen kan het nodig zijn de acute orale toxiciteit in honingbijen te bepalen, bv. wanneer het waarschijnlijk is dat bijen aan een bepaalde chemische stof worden blootgesteld. Het onderzoek naar de acute orale toxiciteit wordt uitgevoerd om de inherente toxiciteit van pesticiden en andere chemische stoffen voor bijen te bepalen. De resultaten van deze test moeten gebruikt worden om te bepalen of verdere evaluatie nodig is. Deze methode kan met name worden gebruikt bij stapsgewijze programma's om de gevaren van pesticiden voor bijen te evalueren, waarbij in de loop van het onderzoek wordt overgegaan van toxiciteitstests in laboratoria naar semiveld- en veldexperimenten (1). Pesticiden kunnen worden getest als actieve stof (a.s.) of als kant-en-klare producten.
Er moet een toxische standaard worden gebruikt om de gevoeligheid van bijen en de nauwkeurigheid van de testprocedure te verifiëren.
1.2. DEFINITIES
Acute orale toxiciteit: omvat de schadelijke effecten die binnen een maximale periode van 96 uur na de orale toediening van een enkelvoudige dosis van de teststof optreden.
Dosis: is de hoeveelheid toegediende teststof. De dosis wordt uitgedrukt in het gewicht (μg) van de teststof per proefdier (μg/bij). De werkelijke dosis voor elke bij kan niet worden berekend, omdat de bijen gezamenlijk worden gevoerd, maar een schatting van de gemiddelde dosis is wel mogelijk (totaal verbruikte teststof/aantal proefbijen in één korf).
LD50 (mediaan letale dosis) oraal: is een statistisch vastgestelde enkelvoudige dosis van een stof, waarvan kan worden verwacht dat bij 50 % van de dieren die de dosis oraal hebben ontvangen, de dood intreedt. De LD50-waarde wordt uitgedrukt in μg teststof per bij. Bij pesticiden kan de teststof een actieve stof (a.s.) of een kant-en-klaar product zijn dat een of meer actieve stoffen bevat.
Sterfte: een dier wordt als dood geregistreerd als het volledig immobiel is.
1.3. PRINCIPE VAN DE TESTMETHODE
Volgroeide werkbijen (Apis mellifera) worden blootgesteld aan een aantal doses van de teststof gedispergeerd in een sacharoseoplossing. Vervolgens wordt aan de bijen hetzelfde voer toegediend, zonder de teststof. Gedurende ten minste 48 uur wordt de sterfte dagelijks geregistreerd en vergeleken met de controlewaarden. Indien het sterftepercentage tussen 24 uur en 48 uur stijgt, terwijl de sterfte in de controlegroep op een aanvaardbaar niveau blijft, d.w.z. < 10 % , is het gepast de duur van de test tot maximaal 96 uur te verlengen. De resultaten worden geanalyseerd om de LD50 bij 24 uur en 48 uur te berekenen en, wanneer het onderzoek wordt verlengd, bij 72 uur en 96 uur.
1.4. VALIDITEIT VAN DE TEST
Een test is uitsluitend onder de volgende voorwaarden geldig:
|
— |
aan het einde van de test mag de gemiddelde sterfte voor het totale aantal bijen in de controlegroepen niet meer dan 10 % bedragen; |
|
— |
de LD50 van de toxische standaard ligt binnen het gespecificeerde bereik. |
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Verzameling van de bijen
Voor de test worden jonge, volgroeide werkbijen van hetzelfde ras gebruikt, d.w.z. bijen met dezelfde leeftijd, voedingsstatus enz. De bijen moeten afkomstig zijn van voldoende gevoede, gezonde, zoveel mogelijk ziektevrije en van een goede koningin voorziene volken met een bekende geschiedenis en fysiologische status. Ze kunnen op de ochtend van het gebruik of de avond vóór de test worden gevangen en tot de volgende dag onder dezelfde omstandigheden als tijdens de proef worden gehouden. Bijen uit korven zonder broedsel zijn geschikt. Het is af te raden bijen vroeg in de lente of laat in de herfst te vangen, omdat ze in die periode een andere fysiologie hebben. Wanneer proeven vroeg in de lente of laat in de herfst uitgevoerd moeten worden, kunnen de bijen in een incubator worden gehouden en gedurende één week met „bijenbrood” (stuifmeel dat uit de honingraat is verzameld) en een sacharoseoplossing worden grootgebracht. Bijen die met chemische stoffen zijn behandeld, bv. met antibiotica of antivarroaproducten, mogen gedurende vier weken na beëindiging van de laatste behandeling niet voor toxiciteitstests worden gebruikt.
1.5.2. Huisvestings- en voedingsomstandigheden
De gebruikte korven moeten gemakkelijk te reinigen en goed geventileerd zijn. Elk geschikt materiaal kan worden gebruikt, bv. roestvrij staal, gaas, kunststof of wegwerphout. Groepen van tien bijen per korf verdienen de voorkeur. De grootte van de korven moet geschikt zijn voor het aantal bijen, d.w.z. ze moeten voldoende ruimte bieden.
De bijen moeten in een laboratoriumruimte onder donkere omstandigheden en bij een temperatuur van 25 ± 2 oC worden gehouden. De relatieve vochtigheid, normaliter ca. 50-70 %, moet gedurende de test geregistreerd worden. Alle handelingen, waaronder behandeling en waarnemingen, kunnen bij (dag)licht worden verricht. Als voedsel wordt een sacharoseoplossing in water met een eindconcentratie van 500 g/l (50 % g/v) gebruikt. Na de toediening van de testdoses moet ad libitum voedsel worden verstrekt. Het voedselsysteem moet registratie van het voedselverbruik voor elke korf mogelijk maken (zie 1.6.3.1). Er kan een glazen buis (ca. 50 mm lang en 10 mm breed met aan het open uiteinde een versmalling van de diameter tot 2 mm) worden gebruikt.
1.5.3. Voorbereiding van de bijen
De verzamelde bijen worden willekeurig in de testkorven ingedeeld, die op hun beurt willekeurig in de laboratoriumruimte worden geplaatst.
De bijen mag maximaal 2 uur vóór aanvang van de proef voedsel worden onthouden. Het wordt aanbevolen de bijen vóór de behandeling voedsel te onthouden, zodat alle bijen qua darminhoud aan het begin van de proef aan elkaar gelijk zijn. Stervende bijen moeten voor aanvang van de proef worden vervangen door gezonde exemplaren.
1.5.4. Voorbereiding van de doses
Wanneer de teststof met water kan worden gemengd, kan deze direct in een 50 % sacharoseoplossing worden gedispergeerd. Bij technische producten en stoffen met een geringe oplosbaarheid in water kunnen media zoals organische oplosmiddelen, emulgators of dispergeermiddelen die een laag toxisch effect op bijen hebben (bv. aceton, dimethylformamide, dimethylsulfoxide), worden gebruikt. De concentratie van het medium is afhankelijk van de oplosbaarheid van de teststof en moet gelijk zijn voor alle onderzochte concentraties. Een mediumconcentratie van 1 % is algemeen geschikt en mag niet worden overschreden.
Er moeten geschikte controleoplossingen worden voorbereid, d.w.z. oplossingen waarbij een oplos- of dispergeermiddel wordt gebruikt om de teststof oplosbaar te maken. Er moeten twee aparte controlegroepen worden gebruikt: een oplossing in water en een sacharoseoplossing waarbij het oplosmiddel/de drager de bij de dosering van de oplossing gebruikte concentratie heeft.
1.6. PROCEDURE
1.6.1. Test- en controlegroepen
Het aantal geteste doses en replicaties moet voldoen aan de statistische vereisten voor de bepaling van de LD50 met de 95 % betrouwbaarheidsgrenzen. Normaliter zijn voor de test vijf doses nodig in een geometrische reeks, met een factor van ten hoogste 2,2, die alle waarden voor de LD50 omvatten. Toch moeten de verdunningsfactor en het aantal concentraties voor dosering worden bepaald ten opzichte van de helling van de toxiciteitscurve (dosis/sterfte-curve), waarbij rekening moet worden gehouden met de statistische methode die voor de analyse van de resultaten is gekozen. Aan de hand van een verkennende proef kunnen de juiste concentraties voor de dosering worden gekozen.
Een dosis van elke testconcentratie wordt toegediend aan minimaal drie gelijke testgroepen, elk bestaande uit tien bijen. Naast de testgroep moeten ten minste drie controlegroepen, elk bestaande uit tien bijen, worden gebruikt. Ook bij de gebruikte oplosmiddelen/dragers moet gebruik worden gemaakt van controlegroepen (zie 1.5.4).
1.6.2. Toxische standaard
Bij de testreeks moet een toxische standaard worden toegepast. Er moeten ten minste drie doses worden gekozen om de verwachte LD50-waarde te dekken. Voor elke testdosis worden ten minste drie gelijke korven met elk tien bijen gebruikt. Als toxische standaard kan het best dimethoaat worden gebruikt, waarvan de geregistreerde orale LD50-24 uur tussen 0,10 en 0,35 μg a.s./bij ligt (2). Andere toxische standaarden zijn echter ook aanvaardbaar, voorzover voldoende gegevens verstrekt kunnen worden om de verwachte dosisrespons te kunnen verifiëren (bv. parathion).
1.6.3. Blootstelling
1.6.3.1. Toediening van de doses
Aan elke testgroep bijen moet een dosis van 100-200 μl van een 50 % sacharoseoplossing in water worden toegediend met de juiste concentratie van de teststof. Bij producten met een geringe oplosbaarheid, lage toxiciteit of lage concentratie in de samenstelling moeten grotere hoeveelheden worden gebruikt, omdat in de sacharoseoplossing hogere verhoudingen gebruikt moeten worden. Er moet worden bijgehouden hoeveel behandeld voedsel elke groep verbruikt. Zodra het voedsel is verbruikt (meestal binnen 3-4 uur), moet de voedselhouder uit de korf worden verwijderd en vervangen worden door een houder met uitsluitend de sacharoseoplossing. De sacharoseoplossingen worden dan ad libitum verstrekt. Voor sommige mengsels, bij hogere concentraties, kan een weigering van de testdosis ertoe leiden dat weinig of geen voedsel wordt verbruikt. Na uiterlijk 6 uur moet het niet-verbruikte behandelde voedsel worden vervangen door uitsluitend de sacharoseoplossing. De verbruikte hoeveelheid behandeld voedsel wordt bepaald (bv. meting van volume/gewicht van het resterende behandelde voedsel).
1.6.3.2. Duur
De proef duurt bij voorkeur 48 uur, te beginnen nadat de testoplossing is vervangen door uitsluitend de sacharoseoplossing. Indien de sterfte na de eerste 24 uur met meer dan 10 % blijft stijgen, moet de proef tot maximaal 96 uur worden verlengd, mits de sterfte in de controlegroep niet meer dan 10 % bedraagt.
1.6.4. Waarnemingen
De sterfte wordt 4 uur na aanvang van de test en vervolgens na 24 uur en 48 uur (d.w.z. na de toediening van de dosis) geregistreerd. Wanneer de observatieperiode moet worden verlengd, moeten om de 24 uur, tot een maximum van 96 uur, verdere bepalingen worden uitgevoerd, mits de sterfte in de controlegroep niet hoger is dan 10 %.
De verbruikte hoeveelheid voedsel per groep moet worden geschat. Een vergelijking van de verbruikte hoeveelheden behandeld en onbehandeld voedsel binnen de genoemde 6 uur kan informatie opleveren over de smakelijkheid van het behandelde voedsel.
Alle abnormale gedragseffecten die in de proefperiode worden waargenomen, moeten geregistreerd worden.
1.6.5. limiettest
In sommige gevallen (bv. wanneer verwacht wordt dat een bepaalde teststof een lage toxiciteit heeft) kan een limiettest worden uitgevoerd met 100 μg a.s./bij, om aan te tonen dat de LD50 hoger is dan deze waarde. Dezelfde procedure moet worden toegepast, inclusief drie gelijke testgroepen, voor de testdosis, de relevante controlegroepen, de bepaling van de verbruikte hoeveelheid behandeld voedsel en het gebruik van de toxische standaard. Indien sterfte optreedt, dient een volledige studie te worden uitgevoerd. Indien subletale effecten worden waargenomen (zie 1.6.4), dienen deze te worden vermeld.
2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
De gegevens moeten worden samengevat in tabellen die voor iedere behandelingsgroep alsmede voor de controlegroep en de groep met de toxische standaard laten zien: het aantal gebruikte bijen, de sterfte op elk observatietijdstip en het aantal bijen dat abnormaal gedrag vertoont. De sterftecijfers worden met geschikte statistische methoden geanalyseerd (bv. probitmethode, voortschrijdend gemiddelde, binomiale waarschijnlijkheid) (3) (4). Maak dosis/respons-curven op elk aanbevolen observatietijdstip en bereken de hellingen van de curven en de mediaan letale dosis (LD50) met de 95 %-betrouwbaarheidsgrenzen. Correcties voor de sterfte in de controlegroep zijn mogelijk met de correctie van Abbott (4) (5). Wanneer het behandelde voedsel niet volledig wordt verbruikt, moet per groep worden bepaald welke dosis van de teststof is verbruikt. De LD50 wordt uitgedrukt in μg teststof per bij.
2.2. VERSLAG VAN HET ONDERZOEK
In het verslag moeten de volgende gegevens worden opgenomen:
2.2.1. Teststof:
|
— |
fysieke aard en relevante fysisch-chemische eigenschappen (bv. stabiliteit in water, dampspanning), |
|
— |
chemische identificatiegegevens, waaronder structuurformule, zuiverheid (d.w.z. voor pesticiden de identiteit en concentratie van de actieve stof(fen)). |
2.2.2. Diersoort:
|
— |
wetenschappelijke naam, stam, bij benadering de leeftijd (in weken), verzamelingsmethode, gegevens over de verzameling, |
|
— |
informatie over de volken die gebruikt zijn voor de verzameling van de testbijen, inclusief gezondheid, ziekten bij volgroeide bijen, voorbehandeling enz. |
2.2.3. Proefomstandigheden:
|
— |
temperatuur en relatieve vochtigheid van de laboratoriumruimte, |
|
— |
huisvestingsomstandigheden, inclusief soort, grootte en materiaal van de korven, |
|
— |
methoden voor de bereiding van de stam- en testoplossingen (wanneer gebruikt moet zowel het oplosmiddel als de concentratie daarvan worden vermeld), |
|
— |
proefopzet, bv. aantal en gebruikte testconcentraties, aantal controlegroepen; voor elke testconcentratie en controlegroep het aantal gelijke korven en het aantal bijen per korf, |
|
— |
datum van de proef. |
2.2.4. Resultaten:
|
— |
wanneer uitgevoerd de resultaten van een verkennend onderzoek, |
|
— |
ruwe gegevens: sterfte bij elke geteste dosis op elk observatietijdstip, |
|
— |
grafiek van de dosis/respons-curven aan het einde van de test, |
|
— |
LD50-waarden met de 95 %-betrouwbaarheidsgrenzen, op elk van de aanbevolen observatietijdstippen, voor de teststof en de toxische standaard, |
|
— |
statistische methoden die gebruikt zijn voor de bepaling van de LD50, |
|
— |
sterfte in de controlegroepen, |
|
— |
andere waargenomen of gemeten biologische effecten, bv. abnormaal gedrag van de bijen (inclusief weigering van de testdosis), hoeveelheid verbruikt voedsel in behandelde en onbehandelde groepen, |
|
— |
elke afwijking van de hier beschreven testmethoden alsook elke andere relevante informatie. |
3. REFERENTIES
|
(1) |
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products — Honeybees. EPPO Bulletin, Vol. 23, N.1, pp. 151-165. March 1993. |
|
(2) |
Gough, H.J., McIndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, pp. 119-125. |
|
(3) |
Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113. |
|
(4) |
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(5) |
Abbott, W.S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, pp. 265-267. |
C.17. HONINGBIJEN — ACUTE-TOXICITEITSTEST (CONTACT)
1. METHODE
De methode die voor deze acute-toxiciteitstest wordt gebruikt, is een kopie van de OECD TG 214 (1998).
1.1. INLEIDING
Deze toxiciteitstest is een laboratoriummethode die bedoeld is voor de bepaling van de acute contacttoxiciteit van gewasbeschermingsproducten en andere chemische stoffen voor volgroeide werkbijen.
Bij de vaststelling en evaluatie van de toxische eigenschappen van stoffen kan het nodig zijn de acute contacttoxiciteit in honingbijen te bepalen, bv. wanneer het waarschijnlijk is dat bijen aan een bepaalde chemische stof worden blootgesteld. Het onderzoek naar de acute contacttoxiciteit wordt uitgevoerd om de inherente toxiciteit van pesticiden en andere chemische stoffen voor bijen te bepalen. De resultaten van deze test moeten gebruikt worden om te bepalen of verdere evaluatie nodig is. Deze methode kan met name worden gebruikt bij stapsgewijze programma's om de gevaren van pesticiden voor bijen te evalueren, waarbij in de loop van het onderzoek wordt overgegaan van toxiciteitstests in laboratoria naar semiveld- en veldexperimenten (1). Pesticiden kunnen worden getest als actieve stof (a.s.) of als kant-en-klare producten.
Er moet een toxische standaard worden gebruikt om de gevoeligheid van bijen en de nauwkeurigheid van de testprocedure te verifiëren.
1.2. DEFINITIES
Acute contacttoxiciteit: omvat de schadelijke effecten die binnen een maximale periode van 96 uur na de lokale toediening van een enkelvoudige dosis van de teststof optreden.
Dosis: is de hoeveelheid toegediende teststof. De dosis wordt uitgedrukt in het gewicht (μg) van de teststof per proefdier (μg/bij).
LD 50 (mediaan letale dosis) contact: is een statistisch vastgestelde enkelvoudige dosis van een stof, waarvan kan worden verwacht dat bij 50 % van de dieren die de dosis door contact hebben ontvangen, de dood intreedt. De LD50-waarde wordt uitgedrukt in μg teststof per bij. Bij pesticiden kan de teststof een actieve stof (a.s.) of een kant-en-klaar product zijn dat een of meer actieve stoffen bevat.
Sterfte: een dier wordt als dood geregistreerd als het volledig immobiel is.
1.3. PRINCIPE VAN DE TESTMETHODE
Volgroeide werkbijen (Apis mellifera) worden blootgesteld aan een aantal doses van de teststof opgelost in een geschikte drager, door rechtstreekse toediening aan de thorax (druppeltjes). De test duurt 48 uur. Indien het sterftepercentage tussen 24 uur en 48 uur stijgt, terwijl de sterfte in de controlegroep op een aanvaardbaar niveau blijft, d.w.z. < 10 %, is het gepast de duur van de test tot maximaal 96 uur te verlengen. De sterfte wordt dagelijks geregistreerd en met de controlewaarden vergeleken. De resultaten worden geanalyseerd om de LD50 bij 24 uur en 48 uur te berekenen en, wanneer de studie wordt verlengd, bij 72 uur en 96 uur.
1.4. VALIDITEIT VAN DE TEST
Een test is uitsluitend onder de volgende voorwaarden geldig:
|
— |
aan het einde van de test mag de gemiddelde sterfte voor het totale aantal bijen in de controlegroepen niet meer dan 10 % bedragen: |
|
— |
de LD50 van de toxische standaard ligt binnen het gespecificeerde bereik. |
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Verzameling van de bijen
Voor de test worden jonge, volgroeide werkbijen gebruikt, d.w.z. bijen met dezelfde leeftijd, voedingsstatus, stam enz. De bijen moeten afkomstig zijn van voldoende gevoede, gezonde, zoveel mogelijk ziektevrije en van een goede koningin voorziene volken met een bekende geschiedenis en fysiologische status. Ze kunnen op de ochtend van het gebruik of de avond voor de test worden gevangen en tot de volgende dag onder dezelfde omstandigheden als tijdens de proef worden gehouden. Bijen uit korven zonder broedsel zijn geschikt. Het is af te raden bijen vroeg in de lente of laat in de herfst te vangen, omdat ze in die periode een andere fysiologie hebben. Wanneer proeven vroeg in de lente of laat in de herfst uitgevoerd moeten worden, kunnen de bijen in een incubator worden gehouden en gedurende één week met „bijenbrood” (stuifmeel dat uit de honingraat is verzameld) en een sacharoseoplossing worden grootgebracht. Bijen die met chemische stoffen zijn behandeld, bv. met antibiotica of antivarroaproducten, mogen gedurende vier weken na beëindiging van de laatste behandeling niet voor toxiciteitstests worden gebruikt.
1.5.2. Huisvestings- en voedingsomstandigheden
De gebruikte korven moeten gemakkelijk te reinigen en goed geventileerd zijn. Elk geschikt materiaal kan worden gebruikt, bv. roestvrij staal, gaas, kunststof of wegwerphout. De grootte van de korven moet geschikt zijn voor het aantal bijen, d.w.z. ze moeten voldoende ruimte bieden. Groepen van tien bijen per korf verdienen de voorkeur.
De bijen moeten in een laboratoriumruimte onder donkere omstandigheden en bij een temperatuur van 25 ± 2 oC. worden gehouden. De relatieve vochtigheid, normaliter ca. 50-70 %, moet gedurende de test geregistreerd worden. Alle handelingen, waaronder behandeling en waarnemingen, kunnen bij (dag)licht worden verricht. Als voedsel wordt een sacharoseoplossing in water met een eindconcentratie van 500 g/l 50 % g/v) gebruikt, dat gedurende de testperiode met behulp van een voedselhouder ad libitum wordt verstrekt. Er kan een glazen buis (ca. 50 mm lang en 10 mm breed met aan het open uiteinde een versmalling van de diameter tot 2 mm) worden gebruikt.
1.5.3. Voorbereiding van de bijen
Voor de toediening van de teststof kunnen de verzamelde bijen met kooldioxide of stikstof worden verdoofd. De hoeveelheid gebruikt anesteticum en de blootstellingsduur moeten zo gering mogelijk zijn. Stervende bijen moeten voor aanvang van de proef worden vervangen door gezonde exemplaren.
1.5.4. Voorbereiding van de doses
De teststof moet als oplossing in een drager worden toegediend, d.w.z. een organisch oplosmiddel of een oplossing in water met een bevochtigingsmiddel. Als organisch oplosmiddel verdient aceton de voorkeur, maar er kunnen ook andere organische oplosmiddelen met een lage toxiciteit voor bijen worden gebruikt (bv. dimethylformamide, dimethylsulfoxide). Voor kant-en-klare producten die in water gedispergeerd zijn en voor hoogpolaire organische stoffen die niet oplosbaar zijn in dragers van organische oplosmiddelen, kunnen oplossingen wellicht gemakkelijker worden toegediend wanneer ze worden voorbereid in een zwakke oplossing van een in de handel verkrijgbaar bevochtigingsmiddel (bv. Agral, Cittowett, Lubrol, Triton, Tween).
Er moeten geschikte controleoplossingen worden voorbereid, d.w.z. waarbij een oplos- of dispergeermiddel wordt gebruikt om de teststof oplosbaar te maken. Er worden twee aparte controlegroepen gebruikt, één behandeld met water en één behandeld met het oplos-/dispergeermiddel.
1.6. PROCEDURE
1.6.1. Test- en controlegroepen
Het aantal geteste doses en replicaties moet voldoen aan de statistische vereisten voor de bepaling van de LD50 met de 95- % betrouwbaarheidsgrenzen. Normaliter zijn voor de test vijf doses nodig in een geometrische reeks, met een factor van ten hoogste 2,2, die alle waarden voor de LD50 omvatten. Toch moet het aantal doses worden bepaald ten opzichte van de helling van de toxiciteitscurve (dosis/sterfte-curve), waarbij rekening moet worden gehouden met de statistische methode die voor de analyse van de resultaten is gekozen. Aan de hand van een verkennende proef kunnen de juiste doses worden gekozen.
Een dosis van elke testconcentratie wordt toegediend aan minimaal drie gelijke restgroepen, elk bestaande uit tien bijen.
Naast de testgroep moeten ten minste drie controlegroepen, elk bestaande uit tien bijen, worden gebruikt. Indien een organisch oplosmiddel of een bevochtigingsmiddel wordt gebruikt, moeten drie extra controlegroepen van elk tien bijen voor het oplos- of bevochtigingsmiddel worden opgenomen.
1.6.2. Toxische standaard
Bij de testreeks moet een toxische standaard worden toegepast. Er moeten ten minste drie doses worden gekozen om de verwachte LD50-waarde te dekken. Voor elke testdosis worden ten minste drie gelijke korven met elk tien bijen gebruikt. Ais toxische standaard kan het best dimethoaat worden gebruikt, waarvan de geregistreerde orale LD50-24 uur tussen 0,10 en 0,30 μg a.s./bij ligt (2). Andere toxische standaarden zijn echter ook aanvaardbaar, voorzover voldoende gegevens verstrekt kunnen worden om de verwachte dosisrespons te kunnen verifiëren (bv. parathior).
1.6.3. Blootstelling
1.6.3.1. Toediening van de doses
De verdoofde bijen worden individueel met de teststof behandeld (lokale toediening). De bijen worden willekeurig in de verschillende testdosis- en controlegroepen ingedeeld. Met een microapplicator wordt 1 μl van een oplossing met de teststof en de juiste concentratie in de dorsale zijde van de thorax van elke bij ingebracht. Ook andere volumes mogen gebruikt worden, maar moeten gerechtvaardigd worden. Na de toediening van de oplossing worden de bijen in de testkorven ingedeeld en voorzien van sacharoseoplossingen.
1.6.3.2. Duur
De proef duurt bij voorkeur 48 uur. Indien de sterfte in de periode van 24 uur tot 48 uur meer dan 10 % stijgt, moet de proef tot maximaal 96 uur worden verlengd, mits de sterfte in de controlegroep niet meer dan 10 % bedraagt.
1.6.4. Waarnemingen
De sterfte wordt 4 uur na de toediening van de dosis en vervolgens na 24 uur en 48 uur geregistreerd. Wanneer de observatieperiode moet worden verlengd, moeten om de 24 uur, tot een maximum van 96 uur, verdere bepalingen worden uitgevoerd, mits de sterfte in de controlegroep niet hoger is dan 10 %.
Alle abnormale gedragseffecten die in de proefperiode worden waargenomen, moeten geregistreerd worden.
1.6.5. Limiettest
In sommige gevallen (bv. wanneer verwacht wordt dat een bepaalde teststof een lage toxiciteit heeft) kan een limiettest worden uitgevoerd met 100 μg a.s./bij, om aan te tonen dat de LD50 hoger is dan deze waarde. Dezelfde procedure moet worden toegepast, inclusief drie gelijke testgroepen, voor de testdosis, de relevante controlegroepen, de bepaling van de verbruikte hoeveelheid behandeld voedsel en het gebruik van de toxische standaard. Indien sterfte optreedt, dient een volledige studie te worden uitgevoerd. Indien subletale effecten worden waargenomen (zie 1.6.4), dienen deze te worden vermeld.
2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
De gegevens moeten worden samengevat in tabellen die voor iedere behandelingsgroep alsmede voor de controlegroep en de groep met de toxische standaard laten zien: het aantal gebruikte bijen, de sterfte op elk observatietijdstip en het aantal bijen dat abnormaal gedrag vertoont. De sterftecijfers worden met geschikte statistische methoden geanalyseerd (bv. probitmethode, voortschrijdend gemiddelde, binomiale waarschijnlijkheid) (3) (4). Maak dosis/respons-curven op elk aanbevolen observatietijdstip (d.w.z. 24 uur, 48 uur en, wanneer van toepassing, 72 uur en 96 uur) en bereken de hellingen van de curven en de mediaan letale dosis (LD50) met de 95 %-betrouwbaarheidsgrenzen. Correcties voor de sterfte in de controlegroep zijn mogelijk met de correctie van Abbott (4) (5). De LD50 wordt uitgedrukt in μg teststof per bij.
2.2. VERSLAG VAN HET ONDERZOEK
In het verslag moeten de volgende gegevens worden opgenomen:
2.2.1. Teststof:
|
— |
fysieke aard en fysisch-chemische eigenschappen (bv. stabiliteit in water, dampspanning), |
|
— |
chemische identificatiegegevens, waaronder structuurformule, zuiverheid (d.w.z. voor pesticiden de identiteit en concentratie van de actieve stoffen)). |
2.2.2. Diersoort:
|
— |
wetenschappelijke naam. stam, bij benadering de leeftijd dn weken), verzamelingsmethode, gegevens over de verzameling. |
|
— |
informatie over tic volken die gebruikt zijn voor de verzameling van de testbijen, inclusief gezondheid, ziekten bij volgroeide bijen, voorbehandeling enz. |
2.2.3. Proefomstandigheden:
|
— |
temperatuur en relatieve vochtigheid van de laboratoriumruimte, |
|
— |
huisvestingsomstandigheden, inclusief soort, grootte en materiaal van de korven, |
|
— |
methoden voor de toediening van de teststof, bv. gebruikte drager, gebruikt volume van de testoplossing en het gebruikte anesteticum, |
|
— |
proefopzet, bv. aantal en gebruikte testdoses, aantal controlegroepen; voor elke testdosis en controlegroep het aantal gelijke korven en het aantal bijen per korf, |
|
— |
datum van de proef. |
2.2.4. Resultaten:
|
— |
wanneer uitgevoerd de resultaten van een verkennend onderzoek, |
|
— |
ruwe gegevens: sterfte bij elke geteste concentratie op elk observatietijdstip, |
|
— |
grafiek van de dosis/respons-curven aan het einde van de test, |
|
— |
LD50-waarden, met de 95 %-betrouwbaarheidsgrenzen, op elk van de aanbevolen observatietijdstippen, voor de teststof en de toxische standaard, |
|
— |
statistische methoden die gebruikt zijn voor de bepaling van de LD50, |
|
— |
sterfte in de controlegroepen. |
|
— |
andere waargenomen of gemeten biologische effecten en elke abnormale respons van de bijen, |
|
— |
elke afwijking van de hier beschreven testmethoden alsook elke andere relevante informatie. |
3. REFERENTIES
|
(1) |
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products — Honeybees. EPPO bulletin, Vol. 23, N.1, pp. 151-165. March 1993. |
|
(2) |
Gough, H. J., Mclndoe, E. C., Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, pp. 119-125. |
|
(3) |
Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113. |
|
(4) |
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(5) |
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, pp. 265-267. |
C.18. BEPALING VAN DE ADSORPTIE/DESORPTIE MET BEHULP VAN EEN BATCH-EVENWICHTSMETHODE
1. METHODE
Deze methode is overgenomen van TG 106 van de OESO: bepaling van de adsorptie/desorptie met behulp van een batch-evenwichtsmethode (2000).
1.1. INLEIDING
In de methode is rekening gehouden met een rondzendproef en een workshop voor bodemselectie voor de ontwikkeling van een adsorptietest (1) (2) (3) (4) en met bestaande richtsnoeren op nationaal niveau (5) (6) (7) (8) (9) (10) (11).
Adsorptie/desorptieonderzoek is nuttig om essentiële informatie te verkrijgen over de mobiliteit van chemische stoffen en hun verdeling in de compartimenten bodem, water en lucht van de biosfeer (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). De informatie kan worden gebruikt bij de prognose of raming van bijvoorbeeld de beschikbaarheid van een stof voor afbraak (22) (23), omzetting en opname door organismen (24); uitloging door het bodemprofiel (16) (18) (19) (21) (25) (26) (27) (28); vluchtigheid vanuit de bodem (21) (29) (30); afspoeling van het landoppervlak naar natuurlijke wateren (18) (31) (32). Adsorptiegegevens kunnen worden gebruikt voor vergelijkende en modelberekeningen (19) (33) (34) (35).
De verdeling van een chemische stof tussen bodem- en waterfase is een complex proces dat wordt bepaald door verschillende factoren: de chemische aard van de stof (12) (36) (37) (38) (39) (40), de kenmerken van de bodem (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49) en klimaatfactoren zoals regenval, temperatuur, zonlicht en wind. De talloze verschijnselen en mechanismen die een rol spelen bij de adsorptie van een stof door de bodem kunnen dan ook niet volledig worden opgenomen in een eenvoudig laboratoriummodel zoals de hier beschreven methode. Ook al is deze methode een benadering waarin niet alle mogelijkheden in het milieu worden bestreken, toch levert zij voldoende informatie op over de relevantie van de adsorptie van een stof vanuit milieuoogpunt.
Zie ook de algemene inleiding.
1.2. TOEPASSINGSGEBIED
Met deze methode wordt getracht een raming van het adsorptie/desorptiegedrag van een stof ten opzichte van de bodem te bepalen. Het is de bedoeling een sorptiewaarde te verkrijgen die kan worden gebruikt om een prognose te doen omtrent de verdeling onder een scala van milieuomstandigheden; daartoe wordt de adsorp-tiecoëfficiënt bij evenwicht voor een chemische stof bij verschillende bodemtypes bepaald als functie van de bodemkenmerken (gehalte aan organische koolstof, kleigehalte en bodemtextuur, pH enz.). Er moeten verschillende bodemtypes worden gebruikt om de interactie van een bepaalde stof met in de natuur voorkomende bodemtypes zo breed mogelijk te kunnen bestrijken.
Bij deze methode wordt onder adsorptie het bindingsproces van chemische stoffen aan het bodemoppervlak verstaan; er wordt geen onderscheid gemaakt tussen verschillende adsorptieprocessen (fysische en chemische adsorptie) en bijvoorbeeld oppervlak-gekatalyseerde afbraak, bulkadsorptie of chemische reacties. Er wordt geen rekening gehouden met de adsorptie aan colloïddeeltjes (diameter < 0,2 μm) die uit het bodemmonster ontstaan.
Als belangrijkste bodemparameters voor de adsorptie worden beschouwd: het gehalte aan organische koolstof (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48); het gehalte aan klei en de bodemtextuur (3) (4) (41) (42) (43) (44) (45) (46) (47) (48) en de pH voor ioniseerbare verbindingen (3) (4) (42). Ook de effectieve capaciteit voor kationuitwisseling, het gehalte aan amorf ijzer en aluminiumoxides, met name voor vulkanische en tropische bodemtypes (4) en het specifieke oppervlak (49) kunnen een rol spelen.
De test is bedoeld om de adsorptie van een chemische stof aan verschillende bodemtypes met een uiteenlopend gehalte aan organische koolstof, kleigehalte en bodemtextuur en pH te bepalen en bestaat uit drie fasen:
|
Fase 1: |
Voorbereidend onderzoek voor de bepaling van:
|
|
Fase 2: |
Screening: de adsorptie wordt bij vijf verschillende bodemtypes onderzocht aan de hand van de adsorptiekinetiek bij één concentratie en de bepaling van de verdelingscoëfficiënt Kd en Koc. |
|
Fase 3: |
Bepaling van de adsorptie-isothermen volgens Freundlich om na te gaan wat de invloed van de concentratie op de mate van adsorptie aan de bodem is. Onderzoek van de desorptie aan de hand van de desorptiekinetiek/desorptie-isothermen volgens Freundlich (zie aanhangsel). |
1.3. DEFINITIES EN EENHEDEN
|
Symbool |
Definitie |
Eenheid |
|
|
adsorptiepercentage op het tijdstip ti |
% |
|
Aeq |
adsorptiepercentage bij het adsorptie-evenwicht |
% |
|
|
massa van de aan het bodemmonster geadsorbeerde teststof op het tijdstip ti |
μg |
|
|
massa van de aan het bodemmonster geadsorbeerde teststof gedurende het tijdsinterval Δti |
μg |
|
|
aan het bodemmonster geadsorbeerde massa teststof bij het adsorptie-evenwicht |
μg |
|
m0 |
massa van de teststof in de proefbuis aan het begin van de adsorptietest |
μg |
|
|
massa van de teststof, gemeten in een monster (
|
μg |
|
|
massa van de teststof in de oplossing bij het adsorptie-evenwicht |
μg |
|
msoil |
hoeveelheid van het bodemmonster, uitgedrukt in droge massa |
g |
|
Cst |
massaconcentratie van de stockoplossing van de stof |
μg cm-3 |
|
Co |
massaconcentratie van de testoplossing in contact met het bodemmonster op het tijdstip t = 0 |
μg cm-3 |
|
|
massaconcentratie van de stof in de waterfase op het tijdstip ti waarop de analyse wordt uitgevoerd |
μg cm-3 |
|
|
gehalte aan de aan het bodemmonster geadsorbeerde stof bij het adsorptie-evenwicht |
μg g-1 |
|
|
massaconcentratie van de stof in de waterfase bij het adsorptie-even-wicht |
μg cm-3 |
|
Vo |
volume van de waterfase die tijdens de adsorptietest in contact met het bodemmonster is, op het tijdstip t = 0 |
cm3 |
|
|
volume van het monster waarin de teststof wordt bepaald |
cm3 |
|
Kd |
verdelingscoefficiënt voor adsorptie |
cm3 g-1 |
|
Koc |
genormaliseerde adsorptiecoëfiiciënt voor organische koolstof |
cm3g-1 |
|
Kom |
genormaliseerde verdelingscoëfficiënt voor organisch materiaal |
cm3 g-1 |
|
|
adsorptiecoëfficiënt volgens Freundlich |
μg 1-1/n (cm3) 1/n g-1 |
|
1/n |
Freundlich-exponent |
|
|
|
desorptiepercentage op het tijdstip ti |
% |
|
|
desorptiepercentage gedurende het tijdsinterval Δti |
% |
|
Kdes |
schijnbare desorptiecoëfficiënt |
cm3 g-1 |
|
|
desorptiecoëfficiënt volgens Freundlich |
μg 1-1/n (cm3) 1/n g-1 |
|
|
massa van de uit het bodemmonster gedesorbeerde teststof op het tijdstip ti |
μg |
|
|
massa van de uit het bodemmonster gedesorbeerde teststof gedurende het tijdsinterval Δti |
μg |
|
|
! analytisch bepaalde massa van de stof in de waterfase bij het desorptie-evenwicht |
μg |
|
|
totale massa van de gedesorbeerde teststof bij het desorptie-evenwicht |
μg |
|
|
massa van de stof die na het tijdsinterval Δti aan het bodemmonster geadsorbeerd blijft |
μg |
|
|
massa van de stof die door onvolledige vervanging van het volume overblijft van het adsorptie-evenwicht |
μg |
|
|
gehalte aan de stof die bij het desorptie-evenwicht aan het bodemmonster geadsorbeerd blijft |
μg g-1 |
|
|
massaconcentratie van de teststof in de waterfase bij het desorptie-evenwicht |
μg cm-3 |
|
vT |
totaalvolume van de waterfase die tijdens het volgens de seriële methode uitgevoerde desorptiekinetiek-experiment in contact met het bodemmonster is |
cm3 |
|
Vr |
volume van het supernatans dat na het bereiken van het adsorptie-evenwicht uit de buis verwijderd is en is vervangen door een gelijk volume CaCl2-oplossing (0,01 M) |
cm3 |
|
|
volume van het monster dat op het tijdstip ti tijdens het volgens de seriële methode uitgevoerde desorptiekinetiek-experiment voor analysedoeleinden wordt genomen |
cm3 |
|
|
volume van de oplossing die bij het desorptiekinetiek-experiment (parallelle methode) voor de bepaling van de teststof uit buis (i) is genomen |
cm3 |
|
|
volume van de oplossing die voor de bepaling van de teststof bij het desorptie-evenwicht uit de buis is genomen |
cm3 |
|
MB |
massabalans |
% |
|
mE |
totale massa van de teststof die in twee stappen uit het bodemmonster en de wanden van de proefbuis is geëxtraheerd |
μg |
|
Vrec |
volume van het supernatans dat na het adsorptie-evenwicht wordt verwijderd |
cm3 |
|
Pow |
verdelingscoëfficiënt octanol/water |
|
|
pKa |
dissociatieconstante |
|
|
Sw |
oplosbaarheid in water |
g l-1 |
1.4. PRINCIPE VAN DE TESTMETHODE
Bekende volumes van oplossingen van de teststof, al dan niet radioactief gelabeld, met een bekende concentratie in 0,01 M CaCl2 worden toegevoegd aan bodemmonsters met een bekend drooggewicht die vooraf zijn geëquilibreerd in 0,01 M CaCl2. Het mengsel wordt gedurende een geschikte tijd geschud. De bodemsuspensie wordt vervolgens door centrifugeren en desgewenst filtreren gescheiden en de waterfase wordt geanalyseerd. De hoeveelheid aan het bodemmonster geadsorbeerde teststof wordt berekend als het verschil tussen de hoeveelheid aanvankelijk in de oplossing aanwezige teststof en de hoeveelheid die aan het eind van het experiment is overgebleven (indirecte methode).
Het is ook mogelijk de hoeveelheid geadsorbeerde teststof rechtstreeks door bodemanalyse te bepalen (directe methode). Deze procedure, waarbij de bodemfractie stapsgewijs wordt geëxtraheerd met een geschikt oplosmiddel, wordt aanbevolen voor gevallen waarin het verschil in de concentratie van de stof in de oplossing niet nauwkeurig kan worden bepaald. Voorbeelden van dergelijke gevallen zijn: adsorptie van de teststof aan de wanden van het proefvat, instabiliteit van de teststof binnen de tijdschaal van het experiment, een geringe adsorptie die slechts kleine concentratieveranderingen in de oplossing veroorzaakt en een sterke adsorptie die leidt tot een zo lage concentratie dat deze niet nauwkeurig kan worden bepaald. Als een radioactief gelabelde stof wordt gebruikt, kan in plaats van bodemextractie worden gekozen voor bodemanalyse door verbranding en vloeistofscintillatietelling. Vloeistofscintillatietelling is echter een aspecifieke techniek waarbij geen onderscheid kan worden gemaakt tussen de oorspronkelijke stof en omzettingsproducten; deze techniek mag dan ook alleen worden gebruikt als de teststof gedurende het hele onderzoek stabiel is.
1.5. INFORMATIE OVER DE TESTSTOF
De gebruikte reagentia moeten chemisch zuiver (p.a.) zijn. Aanbevolen wordt ongelabelde teststoffen met een bekende samenstelling en bij voorkeur een zuiverheid van minimaal 95 % of radioactief gelabelde teststoffen met een bekende samenstelling en radioactieve zuiverheid te gebruiken. Wanneer tracers met een korte halveringstijd worden gebruikt, moet een vervalcorrectie worden uitgevoerd.
Voordat een adsorptie/desorptietest wordt uitgevoerd, moet de volgende informatie over de teststof beschikbaar zijn:
|
a) |
de oplosbaarheid in water (A.6.): |
|
b) |
de dampspanning (A.4.) en/of de constante van de wet van Henry; |
|
c) |
de niet-biologische afbraak: hydrolyse in afhankelijkheid van de pH (C.7.); |
|
d) |
de verdelingscoëfficiënt (A.8.); |
|
e) |
de „gemakkelijke” biologische afbreekbaarheid (C.4) of de aerobe en anaerobe omzetting in de bodem; |
|
f) |
de pKa van ioniseerbare stoffen; |
|
g) |
de directe fotolyse in water (d.w.z. het UV/Vis-absorptiespectrum in water, kwantumopbrengst) en de fotodegradatie op de bodem. |
1.6. TOEPASBAARHEID VAN DE TEST
De test kan worden gebruikt voor chemische stoffen waarvoor een analysemethode met een afdoende nauwkeurigheid beschikbaar is. Een belangrijke parameter die de betrouwbaarheid van de resultaten kan beïnvloeden, met name wanneer de indirecte methode wordt gebruikt, is de stabiliteit van de teststof binnen de tijdschaal van de test. Een eerste vereiste is dan ook dat de stabiliteit tijdens een voorbereidend onderzoek wordt gecontroleerd; als er binnen de tijdschaal van de test een omzetting wordt waargenomen, wordt aanbevolen bij het hoofdonderzoek zowel de bodem- als de waterfase te analyseren.
Bij de uitvoering van deze test kunnen er problemen ontstaan met stoffen die slecht oplosbaar zijn in water (Sw < 10-4 g l-1) en met stoffen met een hoge lading, aangezien de concentratie in de waterfase in dat geval niet met een voldoende nauwkeurigheid analytisch kan worden bepaald. In deze gevallen moeten er aanvullende maatregelen worden genomen. In de desbetreffende hoofdstukken van deze beschrijving wordt aangegeven hoe deze problemen kunnen worden aangepakt.
Bij het testen van vluchtige stoffen moet ervoor worden gezorgd dat verliezen tijdens de behandeling worden voorkomen.
1.7. BESCHRIJVING VAN DE METHODE
1.7.1. Apparatuur en reagentia
Standaardlaboratoriumapparatuur, met name:
|
a) |
buizen of potten voor de uitvoering var. de experimenten. Het is belangrijk dat deze buizen of potten
|
|
b) |
schudapparaat: overhead-schudder of gelijkwaardige apparatuur: het schudapparaat moet het bodemmonster tijdens het schudden in suspensie houden; |
|
c) |
centrifuge: bij voorkeur met hoge snelheid, bijvoorbeeld > 3 000 g, instelbare temperatuur, in staat om deeltjes met een diameter van meer dan 0,2 μm uit een waterige oplossing neer te slaan. De houders moeten tijdens het schudden en centrifugeren worden afgesloten om damp- en waterverlies te voorkomen; om adsorptie aan de dop tot een minimum te beperken moeten gedeactiveerde doppen worden gebruikt, zoals schroefdoppen met teflonbekleding; |
|
d) |
facultatief: filtreerapparatuur; steriele wegwerpfilters met een porositeit van 0,2 μm. Bij de keuze van het filtermateriaal moet goed worden opgelet, zodat verliezen van de teststof aan dit materiaal worden voorkomen; voor slecht oplosbare teststoffen wordt organisch filtermateriaal afgeraden; |
|
e) |
analyse-instrumentarium dat geschikt is om de concentratie van de teststof te meten; |
|
f) |
laboratoriumoven die kan worden ingesteld op een temperatuur van 103 oC tot 110 oC. |
1.7.2. Karakterisering en selectie van de bodem
De bodem moet worden gekarakteriseerd aan de hand van drie parameters die worden geacht grotendeels bepalend voor de adsorptiecapaciteit te zijn: gehalte aan organische koolstof, kleigehalte en bodemtextuur en pH. Zoals reeds is vermeld (zie „Toepassingsgebied”), kunnen ook andere fysisch-chemische eigenschappen van de bodem invloed hebben op de adsorptie/desorptie van een bepaalde stof en daarmee moet in die gevallen rekening worden gehouden.
De voor de karakterisering van de bodem gebruikte methoden zijn heel belangrijk en kunnen een significante invloed op de resultaten hebben. Daarom wordt aanbevolen de pH van de bodem in een 0,01 M CaCl2-oplossing (de oplossing die bij de adsorptie/desorptietest wordt gebruikt) volgens de desbetreffende ISO-methode (ISO 10390-1) te bepalen. Tevens wordt aanbevolen de andere relevante bodemeigenschappen volgens de standaardmethoden (ISO-handboek voor bodemanalyse) te bepalen; in dat geval kunnen de sorptiegegevens op basis van algeheel gestandaardiseerde bodemparameters worden geanalyseerd. In de referenties (50-52) worden enige richtsnoeren gegeven voor bestaande standaardmethoden voor bodemanalyse en -karakterisering. Voor de kalibratie van bodemtestmethoden wordt het gebruik van referentiebodem aanbevolen.
Tabel 1 bevat richtsnoeren voor de selectie van bodemtypes voor adsorptie/desorptie-experimenten. De zeven vermelde bodemtypes bestrijken het scala dat in gematigde geografische zones voorkomt. Voor ioniseerbare teststoffen moeten de geselecteerde bodemtypes een breed pH-bereik beslaan om de adsorptie van de stof in geïoniseerde en niet-geïoniseerde vorm te kunnen bepalen. Onder punt 1.9 „Uitvoering van de test”, worden richtsnoeren gegeven voor het aantal verschillende bodemtypes dat in de verschillende fasen van de test moet worden gebruikt.
Als de voorkeur wordt gegeven aan andere bodemtypes, moeten deze aan de hand van dezelfde parameters worden gekarakteriseerd en moet de spreiding van de eigenschappen vergelijkbaar zijn met die van tabel 1, ook al voldoen ze niet exact aan de criteria.
Tabel 1
Richtsnoeren voor de selectie van bodemmonsters voor adsorptie/desorptie
|
Bodemtype |
pH-bereik (in 0,01 M CaCl2) |
Organisch koolstofgehalte ( %) |
Kleigehalte (%) |
Bodemtextuur (25) |
|
1 |
4,5-5,5 |
1,0-2,0 |
65-80 |
klei |
|
2 |
> 7,5 |
3,5-5,0 |
20-40 |
kleileem |
|
3 |
5,5-7,0 |
1,5-3,0 |
15-25 |
siltleem |
|
4 |
4,0-5,5 |
3,0-4,0 |
15-30 |
leem |
|
5 |
< 4,0-6,0 (26) |
< 10-15 (26) |
lemig zand |
|
|
6 |
> 7,0 |
40-65 |
kleileem/klei |
|
|
— |
< 4,5 |
> 10 |
< 10 |
zand/lemig zand |
1.7.3. Monsterneming en opslag van bodemmonsters
1.7.3.1. Monsterneming
Er worden geen specifieke technieken of gereedschappen voor monsterneming aanbevolen; de monsternemingstechniek is afhankelijk van het doel van het onderzoek (53) (54) (55) (56) (57) (58).
Er moet rekening worden gehouden met de volgende overwegingen:
|
a) |
er moet gedetailleerde achtergrondinformatie over de veldlocatie zijn; daarbij gaat het bijvoorbeeld om de ligging, de vegetatie, behandelingen met pesticiden en/of kunstmest, biologische toevoegingen of onopzettelijke verontreiniging. De aanbevelingen van de ISO-norm voor bodembemonstering (ISO 10381-6) moeten bij de beschrijving van de bemonsteringslocatie in acht worden genomen; |
|
b) |
de bemonsteringslocatie moet worden gespecificeerd met UTM (Universele Transversale Mercatorprojectie/European Horizontal Datum) of geografische coördinaten; daardoor kan een bepaalde bodem in de toekomst opnieuw worden bemonsterd of kan een betere specificatie van de bodem worden gegeven binnen de uiteenlopende classificatiesystemen die in de verschillende landen worden gebruikt. Tevens mogen monsters alleen in een A-horizont tot maximaal 20 cm diep worden genomen. Met name bij bodemtype nr. 7 moet een Oh-horizont, als deze in de bodem aanwezig is, in het monster worden opgenomen. |
De houders waarin en de temperatuur waarbij de bodemmonsters worden vervoerd, moeten zodanig zijn dat significante wijzigingen in de aanvankelijke bodemeigenschappen uitgesloten zijn.
1.7.3.2. Opslag
Het gebruik van verse bodemmonsters verdient de voorkeur. Alleen als dit niet mogelijk is, moeten de monsters bij kamertemperatuur en luchtdroog worden bewaard. Er is geen aanbevolen houdbaarheidstermijn, maar monsters die meer dan drie jaar zijn bewaard moeten vóór gebruik opnieuw worden geanalyseerd op hun gehalte aan organische koolstof. pH en capaciteit voor kationuitwisseling.
1.7.3.3. Behandeling en voorbereiding van bodemmonsters voor de test
De bodemmonsters worden bij kamertemperatuur (bij voorkeur 20-25 oC) aan de lucht gedroogd. Bij het losmaken moet zo weinig mogelijk kracht worden gebruikt om de oorspronkelijke textuur van de bodem zo veel mogelijk intact te houden. De monsters worden gezeefd tot een deeltjesgrootte ≤ 2 mm; bij het zeven moeten de aanbevelingen van de ISO-norm voor bodembemonstering (ISO 10381-6) worden opgevolgd. Een zorgvuldige homogenisering wordt aanbevolen, aangezien de reproduceerbaarheid van de resultaten daardoor wordt bevorderd. Het vochtgehalte van de bodem wordt bij drie monsters bepaald door verhitting op 105 oC tot constant gewicht (ongeveer 12 uur). Bij alle berekeningen wordt onder de massa van het bodemmonster het drooggewicht verstaan, d.w.z. de voor het vochtgehalte gecorrigeerde massa.
1.7.4. Voorbereiding van de teststof voor de toevoeging aan de bodemmonsters
De teststof wordt opgelost in 0,01 M CaCl2 in gedestilleerd of gedeïoniseerd water; de CaCl2-oplossing wordt als waterfase gebruikt om het centrifugeren te vergemakkelijken en de kationuitwisseling tot een minimum te beperken. De concentratie van de stockoplossing moet bij voorkeur drie ordes van grootte hoger zijn dan de detectiegrens van de gebruikte analysemethode. Deze drempel vormt een waarborg voor nauwkeurige metingen bij de hier gevolgde methode; daarnaast moet de concentratie van de stockoplossing lager zijn dan de oplosbaarheid van de teststof in water.
De stockoplossing moet bij voorkeur vlak voor de toevoeging aan het bodemmonster worden bereid en moet afgesloten in het donker bij 4 oC worden bewaard. De houdbaarheidstermijn is afhankelijk van de stabiliteit van de teststof en de concentratie in de oplossing.
Alleen bij slecht oplosbare stoffen (Sw < l0-4 g l-1) kan, als het moeilijk is de teststof op te lossen, een solubilisator nodig zijn. Deze solubilisator: a) moet mengbaar zijn met water, zoals methanol of acetonitril; b) mag niet in een hogere concentratie dan 1 % van het totale volume van de stockoplossing aanwezig zijn en de concentratie in de oplossing van de teststof die met het bodemmonster in contact komt moet lager zijn (bij voorkeur lager dan 0,1 %); en c) mag geen oppervlakteactieve stof zijn en geen solvolysereactie met de teststof aangaan. Het gebruik van een solubilisator moet bij de rapportage van de gegevens worden vermeld en gemotiveerd.
Slecht oplosbare stollen kunnen ook door „spiking” aan het testsysteem worden toegevoegd: de teststof wordt opgelost in een organisch oplosmiddel en een hoeveelheid daarvan wordt toegevoegd aan het systeem met het bodemmonster en de 0,01 M CaCl2-eplossing in gedestilleerd of gedeïoniseerd water. Het gehalte van de waterfase aan organisch oplosmiddel moet zo laag mogelijk worden gehouden, normaal gesproken maximaal 0,1 %. „Spiking” uit een organisch oplosmiddel kan als nadeel hebben dat de reproduceerbaarheid qua volume slecht is. Dit betekent dat er sprake is van een extra fout aangezien de concentratie van de teststof en het co-oplosmiddel niet bij alle tests gelijk is.
1.8. VOORWAARDEN WAARAAN DE UITVOERING VAN DE ADSORPTIE/DESORPTIETEST MOET VOLDOEN
1.8.1. De analysemethode
De belangrijkste parameters die de nauwkeurigheid van de sorptiemetingen kunnen beïnvloeden zijn: de nauwkeurigheid van de analysemethode voor zowel de opgeloste als de geadsorbeerde fase, de stabiliteit en zuiverheid van de teststof, het bereiken van het sorptie-evenwicht, de omvang van de concentratieverandering in de oplossing, de verhouding bodemmonster/oplossing en de veranderingen in de bodemstructuur tijdens de instelling van het evenwicht (35) (59-62). Aanhangsel 2 bevat enkele voorbeelden die relevant zijn voor de nauwkeurigheid.
De betrouwbaarheid van de gebruikte analysemethode moet worden gecontroleerd op het concentratiebereik dat bij de test wordt verwacht. Het staat de experimentator volledig vrij een geschikte methode te ontwikkelen waarvan de nauwkeurigheid, de precisie, de reproduceerbaarheid, de detectiegrenzen en de recovery aan de eisen voldoen. In het volgende experiment worden richtsnoeren voor de uitvoering van een dergelijke test gegeven.
Een geschikt volume 0,01 M CaCl2 bijvoorbeeld 100 cm3, wordt gedurende 4 uur geschud met een hoeveelheid, bijvoorbeeld 20 g, van een sterk adsorberend bodemtype, d.w.z. met een hoog gehalte aan organische koolstof en klei; het gebruikte gewicht en volume kan aan de behoefte worden aangepast, maar een verhouding bodemmonster/oplossing van 1:5 is een goed uitgangspunt. Het mengsel wordt gecentrifugeerd en de waterfase kan worden gefiltreerd. Aan deze fase wordt een bekend volume van de stockoplossing met de teststof toegevoegd om te zorgen dat de nominale concentratie binnen het bereik ligt dat bij de test wordt verwacht. Om de aard van de oplossing zo weinig mogelijk te veranderen mag dit volume niet groter zijn dan 10 % van het uiteindelijke volume van de waterfase. De oplossing wordt geanalyseerd.
Om artefacten in de analysemethode en matrixeffecten van de bodem op te sporen moet één blancobepaling met bodemmonster + CaCl2-oplossing (zonder teststof) worden uitgevoerd.
Voor sorptiemetingen kunnen bijvoorbeeld de volgende analysemethoden worden gebruikt: gaschromatografie (GLC), hogedrukvloeistofchromatografie (HPLC), spectrometrie (bv. GC/massaspectrometrie of HPLC/massaspectrometrie) en vloeistofscintillatietelling (voor radioactief gelabelde stoffen). Onafhankelijk van de gebruikte analysemethode wordt deze geschikt geacht als de recovery tussen 90 % en 110 % van de nominale waarde ligt. Om detectie en evaluatie na de faseverdeling mogelijk te maken moeten de detectiegrenzen van de analysemethode ten minste twee ordes van grootte onder de nominale concentratie liggen.
De kenmerken en detectiegrenzen van de beschikbare analysemethode voor het adsorptieonderzoek spelen een belangrijke rol bij de bepaling van de testomstandigheden en de hele praktische uitvoering van de test. In de hier gegeven beschrijving wordt een algemene route vermeld en worden aanbevelingen en richtsnoeren gegeven voor andere oplossingen wanneer de analysemethode en de omstandigheden in het laboratorium beperkingen opleggen.
1.8.2. De keuze van een optimale verhouding bodemmonster/oplossing
De keuze van een geschikte verhouding bodemmonster/oplossing voor het sorptieonderzoek wordt bepaald door de verdelingscoëfficiënt Kd en de gewenste relatieve adsorptie. De verandering van de concentratie van de stof in de oplossing bepaalt de statistische nauwkeurigheid van de meting op basis van de vorm van de adsorptievergelijking en de beperkingen van de analysemethode bij de bepaling van de concentratie van de stof. Daarom is het meestal verstandig een aantal vaste verhoudingen te kiezen waarbij de adsorptie hoger is dan 20 % en liefst hoger dan 50 % (62). terwijl erop moet worden gelet dat de concentratie van de teststof in de waterfase hoog genoeg blijft om nauwkeurig te kunnen worden gemeten. Dit is vooral belangrijk bij hoge adsorptiepercentages.
Een geschikte manier om de juiste verhouding bodemmonster/waterfase te kiezen is op basis van een raming van de Kd-waarde door voorbereidend onderzoek of erkende schattingstechnieken (zie aanhangsel 3). Vervolgens kan een geschikte verhouding worden gekozen op basis van een grafiek waarin de verhouding bodemmonster/oplossing bij vaste adsorptiepercentages is uitgezet tegen de Kd (zie figuur 1). In deze grafiek wordt uitgegaan van een lineaire adsorptievergeliiking (28). Het verband wordt verkregen door vergelijking 4 voor de Kd te herschikken tot vergelijking 1:
|
|
(1) |
of in de logaritmische vorm, uitgaande van R = msoil/V0 en Aeq %/100 = :
:
|
|
(2) |

Figuur 1 geeft een overzicht van de vereiste verhouding bodemmonster/oplossing als functie van Kd bij verschillende adsorptiepercentages. Zo wordt bij een verhouding 1:5 en een Kd van 20 ongeveer 80 % van de teststof geadsorbeerd. Om bij dezelfde Kd een adsorptie van 50 % te krijgen moet een verhouding van 1:25 worden gebruikt. Als de geschikte verhouding bodemmonster/oplossing op deze manier wordt gekozen, geeft dit de nodige flexibiliteit om aan de experimentele behoeften te voldoen.
De gevallen waarin de chemische stof sterk of nauwelijks wordt geadsorbeerd, leveren meer problemen op. Bij een geringe adsorptie wordt een verhouding bodemmonster/oplossing van 1:1 aanbevolen, hoewel bij sommige zeer organische bodemtypes een lagere verhouding nodig kan zijn om een suspensie te verkrijgen. Bij de meting van kleine veranderingen in de concentratie in de oplossing moet zorgvuldig naar de analysemethode worden gekeken om te voorkomen dat de adsorptiemeting onnauwkeurig wordt. Anderzijds kan bij een zeer hoge verdelingscoëfficiënt Kd de verhouding bodemmonster/oplossing worden opgevoerd tot wel 1:100 om ervoor te zorgen dat er een significante hoeveelheid van de stof in de oplossing achterblijft. Er moet echter voor een goede menging worden gezorgd en het systeem moet voldoende tijd krijgen voor de instelling van het evenwicht. Een andere aanpak is schatting van de Kd-waarde met behulp van ramingstechnieken op basis van bijvoorbeeld de Pow-waarde (zie aanhangsel 3). Dit kan met name nuttig zijn bij slecht geadsorbeerde/polaire stoffen met een Pow < 20 en lipofiele/sterk geadsorbeerde stoffen met een Pow > 104.
1.9. UITVOERING VAN DE TEST
1.9.1. Testomstandigheden
Alle experimenten worden uitgevoerd bij kamertemperatuur en indien mogelijk bij een constante temperatuur tussen 20 oC en 25 oC.
Bij het centrifugeren moeten de omstandigheden zodanig zijn dat deeltjes groter dan 0,2 μm uit de oplossing kunnen worden verwijderd. Dit zijn de kleinste deeltjes die als vaste deeltjes worden beschouwd; beneden deze grenswaarde vallen ze in de categorie colloïddeeltjes. Aanhangsel 4 bevat richtsnoeren om de centrifugeeromstandigheden te bepalen.
Als het centrifugeren niet zodanig kan gebeuren dat de verwijdering van grotere deeltjes dan 0,2 μm wordt gewaarborgd, moet een combinatie van centrifugeren en filtreren met filters van 0,2 μm worden gebruikt. Deze filters moeten van een geschikt inert materiaal zijn vervaardigd om verliezen van de teststof daaraan te voorkomen. In elk geval moet worden aangetoond dat er bij het filtreren geen teststof verloren gaat.
1.9.2. Fase 1: Voorbereidend onderzoek
Het doel van de uitvoering van een voorbereidend onderzoek is al in het hoofdstuk „Toepassingsgebied” beschreven. In onderstaande beschrijving worden richtsnoeren gegeven voor de wijze waarop een dergelijk experiment kan worden opgezet.
1.9.2.1. Selectie van de optimale verhouding bodemmonster/oplossing
Er worden twee bodemtypes en drie verhoudingen bodemmonster/oplossing gebruikt (zes experimenten). Eén bodemtype heeft een hoog gehalte aan organische koolstof en een laag kleigehalte en het andere een laag gehalte aan organische koolstof en een hoog kleigehalte. De volgende verhoudingen worden aangeraden:
|
— |
50 g bodemmonster en 50 cm3 oplossing van de teststof in water (verhouding 1:1), |
|
— |
10 g bodemmonster en 50 cm3 oplossing van de teststof in water (verhouding 1:5), |
|
— |
2 g bodemmonster en 50 cm5 oplossing van de teststof in water (verhouding 1:25). |
De minimale hoeveelheid bodemmonster waarmee het experiment kan worden uitgevoerd, is afhankelijk van de mogelijkheden van het laboratorium en de gebruikte analysemethode. Om betrouwbare resultaten te krijgen wordt echter aangeraden minimaal 1 g en bij voorkeur 2 g te gebruiken.
Eén controlemonster met uitsluitend de teststof in 0,01 M CaCl2-oplossing (zonder bodemmonster) wordt aan exact dezelfde behandeling onderworpen als de testsystemen om de stabiliteit van de teststof in de CaCl2-op-lossing en de mogelijke adsorptie aan de wanden van het proefvat te controleren.
Voor elk bodemtype wordt één blancobepaling met dezelfde hoeveelheid bodemmonster en een totaalvolume van 50 cm30,01 M CaCl2-oplossing (zonder teststof) op dezelfde wijze behandeld. Deze bepaling fungeert als achtergrond tijdens de analyse om storende stoffen of verontreinigde bodem te kunnen signaleren.
Alle experimenten, ook de controle- en blancobepalingen, moeten minimaal in duplo worden uitgevoerd. Het totale aantal monsters dat voor het onderzoek nodig is kan aan de hand van de gevolgde methode worden bepaald.
In het algemeen worden voor het voorbereidend onderzoek en het hoofdonderzoek dezelfde methoden gebruikt. Uitzonderingen op deze regel worden waar nodig vermeld.
De aan de lucht gedroogde bodemmonsters worden geëquilibreerd door de nacht vóór de dag van het experiment (gedurende 12 uur) te schudden met een minimaal volume van 45 cm30,01 M CaCl2-oplossing. Vervolgens wordt een bepaald volume van de stockoplossing met de teststof toegevoegd om het uiteindelijke volume op 50 cm3 te brengen. Dit toegevoegde volume stockoplossing: a) mag niet groter zijn dan 10 % van het uiteindelijke volume van de waterfase van 50 cm3 om de aard van de oplossing vóór equilibreren zo weinig mogelijk te veranderen en b) moet bij voorkeur leiden tot een beginconcentratie van de teststof in contact met het bodemmonster (Co) die ten minste twee ordes van grootte hoger ligt dan de detectiegrens van de analysemethode: deze drempelwaarde waarborgt dat er ook bij een hoge adsorptie (> 90 %) nauwkeurige metingen kunnen worden uitgevoerd en dat later de adsorptie-isothermen kunnen worden bepaald. Tevens wordt indien mogelijk een lagere beginconcentratie van de stof (Co) dan de helft van de oplosbaarheidsgrens aanbevolen.
De concentratie van de stockoplossing (Cst) kan analoog aan het volgende voorbeeld worden berekend. Uitgaande van een detectiegrens van 0,01 μg cm-3 van 90 % en een adsorptie van 90 % moet de beginconcentratie van de teststof in contact met het bodemmonster bij voorkeur 1 μg cm-3 zijn (twee ordes van grootte hoger dan de detectiegrens). Wanneer het maximale aanbevolen volume van de stockoplossing wordt toegevoegd, d.w.z. 5 cm3 aan 45 cm3 geëquilibreerde 0,01 M CaCl2-oplossing (=10 % van de stockoplossing t.o.v. het totaalvolume van de waterfase van 50 cm3), moet de concentratie van de stockoplossing 10 μg cm-3 zijn: dit is drie ordes van grootte hoger dan de detectiegrens van de analysemethode.
De pH van de waterfase moet voor en na het contact met het bodemmonster worden gemeten, aangezien deze een belangrijke rol bij het hele adsorptieproces speelt, met name bij ioniseerbare stoffen.
Het mengsel wordt geschud totdat het adsorptie-evenwicht zich heeft ingesteld. De daarvoor benodigde tijd varieert sterk, afhankelijk van de stof en het bodemmonster: meestal volstaat een periode van 24 uur (77). Aanbevolen wordt tijdens het voorbereidend onderzoek gedurende een schudperiode van 48 uur achtereenvolgens verschillende monsters te nemen (bv. na 4, 8, 24 en 48 uur). De analysetijdstippen moeten echter gelet op het werkschema in het laboratorium flexibel worden gehanteerd.
Er zijn twee mogelijkheden voor de analyse van de teststof in de waterige oplossing: a) de parallelle methode en b) de seriële methode. Met nadruk moet worden gesteld dat de parallelle methode weliswaar experimenteel omslachtiger is, maar dat de mathematische behandeling van de resultaten eenvoudiger is (zie aanhangsel 5). De keuze van de gevolgde methode wordt echter aan de experimentator overgelaten, die rekening moet houden met de beschikbare laboratoriumfaciliteiten en middelen.
|
a) |
Parallelle methode: per tijdsinterval waarvoor de adsorptiekinetiek wordt onderzocht, wordt een mengsel met dezelfde verhouding bodemmonster/oplossing bereid. Na bijvoorbeeld 4 uur wordt de waterfase na centrifugeren en desgewenst filtreren zo volledig mogelijk uit de eerste buis verwijderd en vervolgens gemeten; na bijvoorbeeld 8 uur gebeurt dit voor de tweede buis, na 24 uur voor de derde buis enz. |
|
b) |
Seriële methode: voor elke verhouding bodemmonster/oplossing wordt slechts één mengsel in duplo bereid. Op vooraf bepaalde tijdstippen wordt het mengsel gecentrifugeerd om de fasen te scheiden. In een kleine hoeveelheid van de waterfase wordt de teststof onmiddellijk geanalyseerd; vervolgens gaat het experiment verder met het oorspronkelijke mengsel. Als na het centrifugeren wordt gefiltreerd, moet filtratie van kleine hoeveelheden waterige oplossing in het laboratorium mogelijk zijn. Om te zorgen dat de verhouding bodemmonster/oplossing niet significant verandert en de voor adsorptie beschikbare hoeveelheid oplossing tijdens de test niet afneemt, wordt aanbevolen in totaal niet meer dan 1 % van het totale volume van de oplossing voor de analyses te gebruiken. |
Het adsorptiepercentage  wordt op elk tijdstip ti berekend op basis van de nominale beginconcentratie en de gemeten concentratie op het bemonsteringstijdstip ti en gecorrigeerd voor de waarde van de blanco-bepaling. De
wordt op elk tijdstip ti berekend op basis van de nominale beginconcentratie en de gemeten concentratie op het bemonsteringstijdstip ti en gecorrigeerd voor de waarde van de blanco-bepaling. De  . wordt uitgezet tegen de tijd (zie figuur 1 in aanhangsel 5) om te bepalen wanneer het evenwicht wordt bereikt (29). Tevens wordt de Kd-waarde bij evenwicht berekend. Op basis van deze Kd-waarde worden geschikte verhoudingen bodemmonster/oplossing uit figuur 1 gekozen, zodat het adsorptiepercentage hoger dan 20 % en bij voorkeur hoger dan 50 % is (61). Alle vergelijkingen en beginselen voor het tekenen van de curve worden vermeld in het hoofdstuk over gegevens en rapportage en in aanhangsel 5.
. wordt uitgezet tegen de tijd (zie figuur 1 in aanhangsel 5) om te bepalen wanneer het evenwicht wordt bereikt (29). Tevens wordt de Kd-waarde bij evenwicht berekend. Op basis van deze Kd-waarde worden geschikte verhoudingen bodemmonster/oplossing uit figuur 1 gekozen, zodat het adsorptiepercentage hoger dan 20 % en bij voorkeur hoger dan 50 % is (61). Alle vergelijkingen en beginselen voor het tekenen van de curve worden vermeld in het hoofdstuk over gegevens en rapportage en in aanhangsel 5.
1.9.2.2. Bepaling van de equilibratietijd voor adsorptie en de bij evenwicht geadsorbeerde hoeveelheid teststof
Zoals reeds is vermeld, kan aan de hand van curves waarin  of
of  tegen de tijd wordt uitgezet, worden bepaald wanneer het adsorptie-evenwicht zich heeft ingesteld en hoeveel teststof bij evenwicht is geadsorbeerd. De figuren 1 en 2 in aanhangsel 5 zijn voorbeelden van dergelijke curves. De equilibratietijd is de tijd die het systeem nodig heeft om stationair te worden.
tegen de tijd wordt uitgezet, worden bepaald wanneer het adsorptie-evenwicht zich heeft ingesteld en hoeveel teststof bij evenwicht is geadsorbeerd. De figuren 1 en 2 in aanhangsel 5 zijn voorbeelden van dergelijke curves. De equilibratietijd is de tijd die het systeem nodig heeft om stationair te worden.
Indien bij een bepaald bodemmonster de curve niet horizontaal gaat lopen maar blijft stijgen, kan dit worden veroorzaakt door complicerende factoren zoals biologische afbraak of trage diffusie. Biologische afbraak kan worden aangetoond door het experiment te herhalen met een gesteriliseerd bodemmonster. Als zich ook in dat geval geen evenwicht instelt, moet er worden gezocht naar andere verschijnselen die zich in dat specifieke geval kunnen voordoen; dit kan gebeuren door de experimentele omstandigheden (temperatuur, schudtijd, verhouding bodemmonster/oplossing) te wijzigen. De experimentator moet zelf bepalen of het zinvol is de testprocedure verder uit te voeren, ook al zal zich wellicht geen evenwicht instellen.
1.9.2.3. Adsorptie aan het oppervlak van hei proefvat en stabiliteit van de teststof
Enige informatie over de adsorptie van de teststof aan het oppervlak van de proefvaten en over de stabiliteit van de stof kan uit een analyse van de controlemonsters worden afgeleid. Als er meer stof verdwijnt dan de standaardafwijking van de analysemethode, kan er sprake zijn van niet-biologische afbraak en/of adsorptie aan het oppervlak van het proefvat. Deze verschijnselen kunnen van elkaar worden onderscheiden door de wanden van het proefvat grondig te wassen met een bekend volume van een geschikt oplosmiddel en de wasvloeistof op de teststof te analyseren. Als er geen adsorptie aan het oppervlak van het proefvat wordt waargenomen, wijst het verdwijnen van de teststof op niet-biologische afbraak. Als er wel adsorptie wordt geconstateerd, moeten er proefvaten van een ander materiaal worden gebruikt. De bij dit experiment verkregen gegevens over de adsorptie aan het oppervlak van de proefvaten kunnen echter niet rechtstreeks naar het experiment met bodemmonster/oplossing worden geëxtrapoleerd, aangezien deze adsorptie door de aanwezigheid van het bodemmonster wordt beïnvloed.
Aanvullende informatie over de stabiliteit van de teststof kan worden verkregen door de bepaling van de massabalans van de teststof in de loop van de tijd. Dit betekent dat de waterfase, bodemextracten en de wanden van het proefvat op de teststof worden geanalyseerd. Het verschil tussen de toegevoegde massa en de som van de hoeveelheden die in de waterfase en bodemextracten en aan de wanden van het proefvat worden teruggevonden, is gelijk aan de afgebroken en; of verdampte en/of niet-geëxtraheerde hoeveelheid. Om een massabalans te kunnen bepalen moet net adsorptie-evenwicht zich binnen de periode waarin het experiment wordt uitgevoerd, hebber, ingesteld.
De massabalans wordt bepaald voor beide bodemtypes en één verhouding bodemmonster/oplossing per bodemtype waarbij de depletie bij evenwicht hoger is dar, 20 % en bij voorkeur hoger dan 50 %. Wanneer het experiment om de verhouding te bepalen wordt afgerond met de analyse van het laatste monster van de waterfase na 48 uur, worden de fasen door centrifugeren en desgewenst filtreren gescheiden. De waterfase wordt zo volledig mogelijk verwijderd en aan de bodemfase wordt een geschikt oplosmiddel (een extractiecoëfficiënt van minimaal 95 %) toegevoegd om de reststof te extraheren. Aanbevolen wordt deze extractie ten minste twee maal na elkaar uit te voeren. De hoeveelheid teststof in het bodem- en het proefvatextract wordt gemeten en de massabalans wordt bepaald (zie vergelijking 10 in het hoofdstuk Gegevens en rapportage). Als de massabalans lager is dan 90 %, wordt de reststof geacht binnen de tijdschaal van de test instabiel te zijn. Het onderzoek kan dan wel worden voortgezet, mits echter rekening wordt gehouden met de instabiliteit van de teststof; in dit geval wordt: aanbevolen in het hoofdonderzoek beide fasen te analyseren.
1.9.2.4. Fase 2: Adsorptiekinetiek hij één concentratie van de teststof
Er worden vijf bodemtypes gebruikt, die uit tabel 1 worden gekozen. Indien mogelijk verdient het aanbeveling enkele of alle bodemtypes uit het voorbereidende onderzoek te gebruiken, omdat in dat geval fase 2 voor deze bodemtypes niet behoeft te worden herhaald.
Op basis van de resultaten van het voorbereidend onderzoek worden de equilibratietijd, de verhouding bodemmonster/oplossing, het gewicht van het bodemmonster, het volume van de waterfase in contact met het bodemmonster en de concentratie van de teststof in de oplossing gekozen. Analyse moet bij voorkeur gebeuren na ongeveer 2, 4, 6, 8 (indien mogelijk ook 10} en 24 uur contacttijd; de schudtijd kan tot maximaal 48 uur worden verlengd, wanneer is gebleken dat een stof een langere equilibratietijd vergt. De analysetijdstippen kunnen echter met enige flexibiliteit worden bepaald.
Elk experiment (één bodemmonster en één oplossing) wordt ten minste in duplo uitgevoerd om de spreiding van de resultaten te kunnen bepalen. In elk experiment wordt één blancobepaling opgenomen. Daarbij worden dezelfde massa bodemmonster en hetzelfde volume 0,01 M CaCl2-oplossing (zonder teststof) als bij het experiment gebruikt. Een controlemonster met alleen de teststof in 0,01 M Ca Cl2-op lossing (zonder bodemmonster) wordt aan dezelfde behandeling onderworpen om onverwachte afwijkingen te kunnen constateren.
Het adsorptiepercentage wordt op elk tijdstip (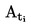 ) en/of over elk tijdsinterval (
) en/of over elk tijdsinterval ( ) berekend (al naar behoefte) en tegen de tijd uitgezet. Tevens worden de verdelingscoëfficiënt Kd bij evenwicht en de genormaliseerde adsorptiecoëfficiënt voor organische koolstof Kor. (voor apolaire organische stoffen) berekend.
) berekend (al naar behoefte) en tegen de tijd uitgezet. Tevens worden de verdelingscoëfficiënt Kd bij evenwicht en de genormaliseerde adsorptiecoëfficiënt voor organische koolstof Kor. (voor apolaire organische stoffen) berekend.
Resultaten van de bepaling van de adsorptiekinetiek
De lineaire Kd-waarde is meestal een nauwkeurige beschrijving van het sorptiegedrag in de bodem (35)(78) en geeft de inherente mobiliteit van chemische stoffen in de bodem aan. Zo worden chemische stoffen met een Kd ≤ 1 cm3 g-1 in het algemeen als mobiel beschouwd. Ook op basis van de Koc-waarden is een indelingssysteem voor de mobiliteit opgezet door MacCall et al. (16). Daarnaast zijn er indelingssytemen voor de uitloging op basis van een verband tussen Koc en DT-50 (30) (32) (79).
Op basis van ten foutenanalyse (61) is geconcludeerd dat Kd-waarden lager dan 0,3 cm3 g-1 niet nauwkeurig kunnen worden bepaald aan de hand van een afname van de concentratie in de waterfase, zelfs als de (met het oog op de nauwkeurigheid) gunstigste verhouding bodemmonster/oplossing, d.w.z. 1:1 wordt gebruikt. In dit geval wordt een analyse van beide fasen, zowel bodem als oplossing, aanbevolen.
Gelet op bovenstaande opmerkingen wordt aanbevolen het onderzoek naar het adsorptiegedrag van een chemische stof in de bodem en zijn potentiële mobiliteit uit te breiden met een bepaling van de adsorptie-isothermen volgens Freundlich, wanneer een nauwkeurige bepaling van Kd met het hier beschreven experimentele protocol mogelijk is. Een nauwkeurige bepaling is mogelijk als vermenigvuldiging van Kd met de verhouding bodemmonster/oplossing een getal groter dan 0,3 opleven wanneer de daling van de concentratie in de waterfase wordt gemeten (indirecte methode) of een getal groter dan 0,1 wanneer beide fasen worden geanalyseerd (directe methode) (61).
1.9.2.5. Fase 3: Adsorptie-isothermen en desorptiekinetiek/desorptie-isothermen
1.9.2.5.1.
Er worden vijf concentraties van de teststof gebruikt, die bij voorkeur twee ordes van grootte beslaan: bij de keuze van deze concentraties moet rekening worden gehouden met de oplosbaarheid in water en de resulterende evenwichtsconcentraties in de waterfase. Per bodemmonster moet in het hele onderzoek dezelfde verhouding bodem/oplossing worden gebruikt. De adsorptietest wordt volgens bovenstaande methode uitgevoerd, met als enige verschil dat de waterfase slechts éénmaal wordt geanalyseerd op het tijdstip waarop het evenwicht zich heeft ingesteld zoals bepaald tijdens fase 2. De evenwichtsconcentraties in de oplossing worden bepaald en de geadsorbeerde hoeveelheid wordt aan de hand van de afname van de hoeveelheid teststof in de oplossing berekend of met de directe methode bepaald. De geadsorbeerde massa teststof per massaeenheid bodemmonster wordt uitgezet tegen de evenwichtsconcentratie van de teststof (zie het hoofdstuk Gegevens en rapportage).
Resultaten van de bepaling van de adsorptie-isotherm
Van de tot op heden gesuggereerde mathematische modellen voor de adsorptie wordt voor de beschrijving van het adsorptieproces meestal de Freundlich-isotherm gebruikt. Gedetailleerdere informatie over de interpretatie en relevantie van adsorptiemodellen is te vinden in de referenties (41) (45) (80) (83) (82).
NB: Er dient te worden opgemerkt dat een vergelijking van de waarde van KF (adsorptiecoëffïciënt volgens Freundlich) voor verschillende stoffen alleen mogelijk is als deze K1-waarden in dezelfde eenheden worden uitgedrukt (83).
1.9.2.5.2.
Dit experiment is bedoeld om na te gaan of een chemische stof reversibel of irreversibel aan de bodem wordt geadsorbeerd. Deze informatie is belangrijk, aangezien het desorptieproces ook bij het gedrag van een stof in de praktijksituatie een belangrijke rol speelt. Bovendien kunnen desorptiegegevens goed worden gebruikt bij computermodellen voor uitloging en de simulering van de afspoeling van opgeloste stoffen. Als een desorptie-onderzoek gewenst wordt, wordt aanbevolen de hier beschreven methode te volgen voor elk systeem waarvoor een nauwkeurige bepaling van Kd bij de reeds beschreven methode ter bepaling van de adsorptiekinetiek mogelijk was.
Net als voor de bepaling van de adsorptiekinetiek zijn er twee mogelijkheden voor de uitvoering van het desorptiekinetiekexperiment: a) de parallelle methode en b) de seriële methode. De keuze van de gevolgde methode wordt aan de experimentator overgelaten, die rekening moet houden met de beschikbare laboratoriumfaciliteiten en middelen.
|
a) |
Parallelle methode: voor elk bodemmonster waarvoor het desorptieonderzoek wordt uitgevoerd, wordt per tijdsinterval waarvoor de desorptiekinetiek wordt onderzocht, een mengsel met dezelfde verhouding bodemmonster/oplossing bereid. Bij voorkeur dienen dezelfde tijdsintervallen als bij het adsorptiekinetiekexperiment te worden gebruikt; het totale tijdsinterval kan echter waar nodig worden verlengd om te zorgen dat het desorptie-evenwicht zich kan instellen. Voor elk experiment (één bodemmonster, één oplossing) wordt één blancobepaling uitgevoerd met dezelfde hoeveelheid bodemmonster en 0,01 M CaCl2-oplossing (zonder teststof) als bij bet experiment. Een controlemonster met de teststof in 0,01 M CaCl2-oplossing (zonder bodemmonster) wordt aan dezelfde behandeling onderworpen. Alle mengsels van bodemmonster met oplossing worden geschud totdat het adsorptie-evenwicht (zoals bepaald tijdens fase 2) zich instelt. Vervolgens worden de fasen door centrifugeren gescheiden en wordt de waterfase zo volledig mogelijk verwijderd. De verwijderde oplossing wordt vervangen door een gelijk volume 0,01 M CaCl2-oplossing zonder teststof en het nieuwe mengsel wordt opnieuw geschud. De waterfase van de eerste buis wordt na bijvoorbeeld 2 uur zo volledig mogelijk verwijderd en gemeten, van de tweede buis na 4 uur, van de derde buis na 6 uur, enz., totdat het desorptie-evenwicht wordt bereikt. |
|
b) |
Seriële methode: na het adsorptiekinetiekexperiment wordt het mengsel gecentrifugeerd en wordt de waterfase zo volledig mogelijk verwijderd. De verwijderde oplossing wordt vervangen door een gelijk volume 0,01 M CaCl2- oplossing zonder teststof. Het nieuwe mengsel wordt geschud totdat het desorptie-evenwicht zich heeft ingesteld. Tijdens deze periode wordt het mengsel op vooraf bepaalde tijdstippen gecentrifugeerd om de fasen te scheiden. In een kleine hoeveelheid van de waterfase wordt de teststof onmiddellijk geanalyseerd: vervolgens gaat het experiment verder met het oorspronkelijke mengsel. Het volume van elk monster voor de analyse mag niet groter zijn dan 1 % van het totale volume. Om te zorgen dat de verhouding bodemmonster/oplossing niet verandert, wordt het mengsel aangevuld met hetzelfde volume verse 0,01 M CaCl2-oplossing en vervolgens wordt het schudden hervat tot het volgende analysetijdstip. |
Het desorptiepercentage wordt op elk tijdstip (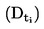 ) over elk tijdsinterval (
) over elk tijdsinterval ( ) berekend (al naar behoefte) en tegen de tijd uitgezet. Tevens wordt de desorptiecoëfficiënt Kdes bij evenwicht berekend. Alle benodigde vergelijkingen zijn vermeld in het hoofdstuk Gegevens en rapportage en aanhangsel 5.
) berekend (al naar behoefte) en tegen de tijd uitgezet. Tevens wordt de desorptiecoëfficiënt Kdes bij evenwicht berekend. Alle benodigde vergelijkingen zijn vermeld in het hoofdstuk Gegevens en rapportage en aanhangsel 5.
Resultaten van het desorptiekinetiekietiekexperiment
Door het desorptiepercentage 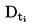 en het adsorptiepercentage
en het adsorptiepercentage  in één figuur tegen de tijd uit te zetten, kan de omkeerbaarheid van het adsorptieproces worden bepaald. Als het desorptie-evenwicht zich binnen uiterlijk tweemaal de equilibratietijd voor de adsorptie instelt en in totaal meer dan 95 % van de geadsorbeerde hoeveelheid wordt gedesorbeerd, wordt de adsorptie als reversibel beschouwd.
in één figuur tegen de tijd uit te zetten, kan de omkeerbaarheid van het adsorptieproces worden bepaald. Als het desorptie-evenwicht zich binnen uiterlijk tweemaal de equilibratietijd voor de adsorptie instelt en in totaal meer dan 95 % van de geadsorbeerde hoeveelheid wordt gedesorbeerd, wordt de adsorptie als reversibel beschouwd.
1.9.2.5.3.
Desorptie-isothermen volgens Freundlich worden bepaald voor de bodemmonsters waarvoor ook de adsorptie-isothermen zijn bepaald. De uitvoering van het experiment gebeurt net als bij de bepaling van de desorptiekinetiek met als enige verschil dat de waterfase slechts éénmaal, bij het desorptie-evenwicht, wordt geanalyseerd. De gedesorbeerde hoeveelheid reststof wordt berekend. De hoeveelheid teststof die bij het desorptie-evenwicht aan het bodemmonster geadsorbeerd blijft, wordt uitgezet tegen de evenwichtsconcentratie van de teststof in de oplossing (zie het hoofdstuk Gegevens en rapportage en aanhangsel 5).
2. GEGEVENS EN RAPPORTAGE
De analysegegevens worden in de vorm van tabellen weergegeven (zie aanhangsel 6). De afzonderlijke metingen er de berekende gemiddelden worden vermeld. De adsorptie-isothermen worden grafisch weergegeven. De berekeningen worden volgens onderstaande voorschriften uitgevoerd.
In dit verband wordt ervan uitgegaan dat 1 cm3 waterige oplossing 1 g weegt. De verhouding bodemmonster/oplossing kan in eenheden g/g of g/vol met hetzelfde getal worden weergegeven.
2.1. ADSORPTIE
De adsorptie ( ) wordt gedefinieerd als het percentage van de aan het begin van de test aanwezige stof dat onder de testomstandigheden aan het bodemmonster wordt geadsorbeerd. Als de teststof stabiel is en niet in significante mate aan de wanden van het vat wordt geadsorbeerd, wordt
) wordt gedefinieerd als het percentage van de aan het begin van de test aanwezige stof dat onder de testomstandigheden aan het bodemmonster wordt geadsorbeerd. Als de teststof stabiel is en niet in significante mate aan de wanden van het vat wordt geadsorbeerd, wordt  op elk tijdstip ti, als volgt berekend:
op elk tijdstip ti, als volgt berekend:
|
|
(3) |
Hierbij is:
|
|
= |
adsorptiepercentage op het tijdstip ti ( %); |
|
|
= |
massa van de op het tijdstip ti aan bet bodemmonster geadsorbeerde teststof (μg); |
|
m0 |
= |
massa van de teststof in de proefbuis aan het begin van de test (μg). |
Aanhangsel 5 bevat gedetailleerde informatie over de wijze waarop het adsorptiepercentage  , voor de parallelle en seriële methode wordt berekend.
, voor de parallelle en seriële methode wordt berekend.
De verdelingscoëfficiënt Kd is de verhouding tussen het gehalte van de bodemfase aan de slof en de massaconcentratie van de stof in de waterige oplossing onder de testomstandigheden nadat het adsorptie-evenwicht is bereikt.
|
|
(4) |
Hierbij is:
|
|
= |
gehalte aan de geadsorbeerde stof in het bodemmonster bij het adsorptie-evenwicht (μg g-1) |
|
|
= |
massaconcentratie van de stof in de waterfase bij adsorptie-evenwicht (μg cm-3). Deze concentratie wordt door analyse bepaald waarbij rekening wordt gehouden met het resultaat van de blancobepaling |
|
|
= |
bij adsorptie-evenwicht aan het bodemmonster geadsorbeerde massa teststof (μg) |
|
|
= |
massa van de stof in de oplossing bij adsorptie-evenwicht (μg) |
|
msoil |
= |
hoeveelheid van het bodemmonster, uitgedrukt in droge massa (g); |
|
V0 |
= |
volume van de waterfase die aan het begin van de test in contact met het bodemmonster is (cm-3). |
Het verband tussen Aeq en Kd is:
|
|
(5) |
Hierbij is:
|
Aeq |
= |
adsorptiepercentage bij adsorptie-evenwicht in %. |
De genormaliseerde adsorptiecoëfficiënt voor organische koolstof Koc geeft het verband aan tussen de verdelingscoëfficiënt Kd en het gehalte van het bodemmonster aan organische koolstof:
|
|
(6) |
Hierbij is:
|
% OC |
= |
percentage organische koolstof in het bodemmonster (g g-1). |
Koc is een coëfficiënt die vooral kenmerkend is voor de verdeling van apolaire organische stoffen over de organische koolstof in de bodem of het sediment en water. De adsorptie van deze stoffen is gecorreleerd aan het gehalte van de sorberende vaste stof aan organisch materiaal (7); Koc is derhalve afhankelijk van de specifieke kenmerken van de humusfracties die door verschillen in onder andere herkomst en ontstaanswijze aanzienlijke verschillen in sorptiecapaciteit vertonen.
2.1.1. Adsorptie-isothermen
De vergelijking voor de adsorptie-isothermen volgens Freundlich geeft het verband aan tussen de geadsorbeerde hoeveelheid teststof en de concentratie van de teststof in oplossing bij evenwicht (vergelijking 8).
De gegevens worden behandeld als onder „Adsorptie” en voor elke proefbuis wordt het gehalte aan de aan het bodemmonster geadsorbeerde teststof na de adsorptietest  , elders aangegeven als x/m) berekend. Aangenomen wordt dat het evenwicht zich heeft ingesteld en dat
, elders aangegeven als x/m) berekend. Aangenomen wordt dat het evenwicht zich heeft ingesteld en dat  de waarde bij evenwicht vertegenwoordigt:
de waarde bij evenwicht vertegenwoordigt:
|
|
(7) |
De adsorptievergelijking volgens Freundlich is:
|
|
(8) |
of in de lineaire vorm:
|
|
(9) |
Hierbij is:
|
|
= |
de adsorptiecoëfficiënt volgens Freundlich; de dimensie is uitsluitend cm3 g-1 als l/n = 1; in alle andere gevallen wordt de helling 1/n geïntroduceerd in de dimensie van |
|
n |
= |
de regressieconstante; 1/n ligt meestal tussen 0,7 en 1,0 hetgeen aangeeft dat de sorptiegegevens vaak enigszins niet-lineair zijn. |
De vergelijkingen 8 en 9 worden uitgezet en de waarden van 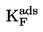 en 1/n worden berekend door regressieanalyse met behulp van vergelijking 9. De correlatiecoëfficiënt r2 van de log-vergelijking wordt ook berekend. Figuur 2 bevat een voorbeeld van dergelijke curves.
en 1/n worden berekend door regressieanalyse met behulp van vergelijking 9. De correlatiecoëfficiënt r2 van de log-vergelijking wordt ook berekend. Figuur 2 bevat een voorbeeld van dergelijke curves.
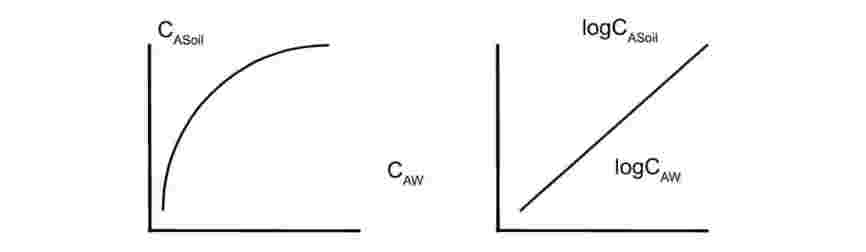
2.1.2. Massabalans
De massabalans (MB) wordt gedefinieerd als het percentage van een stof dat na een adsorptietest door analyse wordt teruggevonden in vergelijking met de nominale hoeveelheid stof aan het begin van de test.
De behandeling van de gegevens verschilt voor oplosmiddelen die al dan niet volledig mengbaar zijn met water. Voor met water mengbare oplosmiddelen kan de onder „Desorptie” beschreven behandeling van de gegevens worden gebruikt om de door oplosmiddelextractie teruggevonden hoeveelheid stof te bepalen. Als het oplosmiddel minder goed mengbaar is met water, moet de teruggevonden hoeveelheid apart worden bepaald.
De massabalans MB voor de adsorptie wordt als volgt berekend (aangenomen wordt dat de term (mE) overeenkomt met de totale hoeveelheid teststof die met een organisch oplosmiddel uit het bodemmonster en de wanden van het proefvat wordt geëxtraheerd):
|
|
(10) |
Hierbij is:
|
MB |
= |
massabalans ( %); |
|
mE |
= |
totale hoeveelheid teststof die in twee stappen uit het bodemmonster en de wanden van het proefvat wordt geëxtraheerd (μg); |
|
Co |
= |
massaconcentratie van de testoplossing in contact met het bodemmonster op het tijdstip t = 0 (μg cm-3): |
|
Vrec |
= |
volume van het supernatans dat na het adsorptie-evenwicht wordt verwijderd (cm-3), |
2.2. DESORPTIE
De desorptie (D) wordt gedefinieerd als het percentage van de teststof dat onder de testomstandigheden wordt gedesorbeerd in vergelijking met de hoeveelheid stof die daarvoor was geadsorbeerd:
|
|
(11) |
Hierbij is:
|
|
= |
desorptiepercentage op het tijdstip ti ( %); |
|
|
= |
massa van de uit het bodemmonster gedesorbeerde teststof op het tijdstip ti (μg); |
|
|
= |
massa van de bij adsorptie-evenwicht aan het bodemmonster geadsorbeerde teststof (μg). |
Aanhangsel 5 bevat gedetailleerde informatie over de wijze waarop het desorptiepercentage  voor de parallelle en de seriële methode wordt berekend.
voor de parallelle en de seriële methode wordt berekend.
De schijnbare desorptiecoëfficiënt (Kdes) is de verhouding tussen het resterende gehalte van de bodemfase aan de stof en de massaconcentratie van de gedesorbeerde stof in de waterige oplossing onder de testomstandigheden nadat het desorptie-evenwicht is bereikt:
|
|
(12) |
Hierbij is:
|
Kdes |
= |
desorptiecoëfficiënt (cm3 g-1) |
|
|
= |
totale massa van de bij dessorptie-evenwicht uit het bodemmonster gedesorbeerde teststof (μg); |
|
VT |
= |
totaalvolume van de waterfase die tijdens de desorptiekinetiektest in contact met het bodemmonster is (cm-3) |
In aanhangsel 5 worden in het hoofdstuk „Desorptie” richtsnoeren gegeven voor de berekening van  .
.
Opmerking
Als de adsorptietest volgens de parallelle methode werd uitgevoerd, wordt het volume VT in vergelijking 12 gelijkgesteld aan Vo.
2.2.1. Desorptie-isothermen
De vergelijking voor de desorptie-isothermen volgens Freundlich geeft het verband aan tussen de hoeveelheid teststof die aan het bodemmonster geadsorbeerd blijft en de concentratie van de teststof in oplossing bij het desorptie-evenwicht (vergelijking 16).
Voor elke proefbuis wordt de hoeveelheid teststof die bij het desorptie-evenwicht aan het bodemmonster geadsorbeerd blijft, als volgt berekend:
|
|
(13) |
 wordt gedefinieerd als:
wordt gedefinieerd als:
|
|
(14) |
Hierbij is:
|
|
= |
gehalte aan de teststof dat bij het desorptie-evenwicht aan het bodemmonster geadsorbeerd blijft (μg g-1): |
|
|
= |
analytisch bepaalde massa van de stof in de waterfase bij desorptie-evenwicht (μg); |
|
|
= |
massa van de stof die door onvolledige vervanging van het volume overblijft van het adsorptie- evenwicht (μg); |
|
|
= |
massa van de stof in de oplossing bij het adsorptie-evenwicht (μg); |
|
|
(15) |
|
|
= |
volume van de oplossing dat voor de bepaling van de teststof bij het desorptie-evenwicht uit de buis is genomen (cm3); |
|
VR |
= |
volume van het supernatans dat na het bereiken van het adsorptie-evenwicht uit de buis is verwijderd en is vervangen door een gelijk volume 0,01 M CaCl2-oplossing (cm3); |
De desorptievergelijking volgens Freundlich is:
|
|
(16) |
of in de lineaire vorm:
|
|
(17) |
Hierbij is:
|
|
= |
de desorptiecoëfficiënt volgens Freundlich; |
|
n |
= |
de regressieconstante; |
|
|
= |
de massaconcentratie van de stof in de waterfase bij desorptie-evenwicht (μg cm-1). |
De vergelijkingen 16 en 17 kunnen worden uitgezet en en  en 1/n worden berekend door regressie-analyse met behulp van vergelijking 17.
en 1/n worden berekend door regressie-analyse met behulp van vergelijking 17.
Opmerking
Als de adsorptie- of desorptie-exponent volgens Freundlich (1/n) gelijk is aan 1, is de adsorptie- of desorptie-coëfficiënt volgens Freundlich  respectievelijk
respectievelijk  ) gelijk aan de adsorptie- of desorptie-evenwichtsconstante (Kd respectievelijk Kdes en is de curve van Cs tegen Caq lineair. Als de exponent niet gelijk is aan 1, is de curve van Cs tegen Caq niet lineair en varieert de adsorptie- en desorptieconstante over de isotherm.
) gelijk aan de adsorptie- of desorptie-evenwichtsconstante (Kd respectievelijk Kdes en is de curve van Cs tegen Caq lineair. Als de exponent niet gelijk is aan 1, is de curve van Cs tegen Caq niet lineair en varieert de adsorptie- en desorptieconstante over de isotherm.
2.2.2. Testverslag
In het testverslag moet de volgende informatie worden opgenomen:
|
— |
Volledige identificatie van de gebruikte bodemmonsters met vermelding van: |
|
— |
geografische gegevens van de locatie (lengte en breedte), |
|
— |
datum van monsterneming, |
|
— |
gebruikspatroon (landbouw, bosbouw, enz.), |
|
— |
diepte van monsterneming, |
|
— |
zand/silt/kleigehalte, |
|
— |
pH-waarden (in 0,01 M CaCl2), |
|
— |
gehalte aan organische koolstof, |
|
— |
gehalte aan organisch materiaal, |
|
— |
stikstofgehalte, |
|
— |
C/N-verhouding, |
|
— |
kationuitwisselingscapaciteit (mmol/kg), |
|
— |
alle informatie over het verzamelen en de opslag van bodemmonsters, |
|
— |
indien van toepassing, alle relevante informatie voor de interpretatie van de adsorptie/desorptie van de teststof, |
|
— |
referentie van de methoden die voor de bepaling van de verschillende parameters zijn gebruikt; |
|
— |
informatie over de teststof, indien van toepassing; |
|
— |
temperatuur van de experimenten; |
|
— |
omstandigheden bij het centrifugeren; |
|
— |
analysemethode die voor de bepaling van de teststof is gebruikt; |
|
— |
motivering voor een eventueel gebruik van een solubilisator bij de bereiding van de stockoplossing van de teststof; |
|
— |
verklaring voor correcties bij de berekeningen, indien van toepassing; |
|
— |
gegevens aan de hand van het formulier daarvoor (aanhangsel 6) en grafische afbeeldingen; |
|
— |
alle informatie en opmerkingen die nuttig kunnen zijn voor de interpretatie van de testresultaten. |
3. REFERENTIES
|
(1) |
Kukowski H. and Brümmer G.. (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02 045, Part II. |
|
(2) |
Franzle O., Kuhnt G. and Vetter L. (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02 045, Part I. |
|
(3) |
Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No l.94.60. Joint Research Centre. European Commission, ISPRA, December 1994. |
|
(4) |
OECD Test Guidelines Programme. Final Report of the OECD Workshop on Selection of Soils/Sediments. Beligirate. Italy. 18-20 january 1995 (June 1995). |
|
(5) |
US Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1. Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540 09-88-096. Date: l 1988. |
|
(6) |
US Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines. Series 83 5-rate. Transport and Transformation Test Guidelines, OPPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048. April 1996. |
|
(7) |
ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments. |
|
(8) |
Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987. |
|
(9) |
Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air. |
|
(10) |
Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment. |
|
(11) |
BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany. |
|
(12) |
Calvet R., (1989), ’Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils’, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review). |
|
(13) |
Calvet R., (1980), ’Adsorption-Desorption Phenomena’ in Interactions between herbicides and the soil. (R. J. Hance ed.), Academic Press, London, pp. 83-122. |
|
(14) |
Hasset J.)., and Banwart W.L., (1989), ’The sorption of nonpolar organics by soils and sediments’ in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, pp. 31-44. |
|
(15) |
van Genuchten M.Th., Davidson J.M., and Wierenga P.J., (1974), ’An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media’. Soil Sci. Soc. Am. Proc, Vol. 38(1), pp. 29-35. |
|
(16) |
McCall P.J., Laskowski D.A., Swann R.L, and Dishburger H.J., (1981), ’Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis’, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC. |
|
(17) |
Lambert S. M., Porter P. E., and Schieferrstein R.H., (1965), ’Movement and sorption of chemicals applied to the soil’. Weeds, 13, pp. IS5-190. |
|
(18) |
Rhodes R.C, Belasco I.J., and Pease H.L., (1970) ’Determination of mobility and adsorption of agrochemicals in soils’. J.Agric.Food Chem., 18, pp. 524-528. |
|
(19) |
Russell M. H., (199 5), ’Recommended approaches to assess pesticide mobility in soil’ in Environmental Behavior of Agrochemicals (ed. T. R. Roberts and P. C. Kearney). John Wiley & Sons Ltd. |
|
(20) |
Esser H. O., Hemingway R.J., Klein W, Sharp D.B., Vonk J.W. and Holland P.T., (1988), ’Recommended approach to the evaluation of the environmental behavior of pesticides’, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, pp. 901-932. |
|
(21) |
Guth J.A., Burkhard N., and D.O. Eberle, (1976), ’Experimental models for studying the persistence of pesticides in soils’. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp. 137-157, BCPC, Surrey, UK. |
|
(22) |
Furminge C. G. L., and O.sgerbybv J. M., (1967), ’Persistence of herbicides in soil’. J. Sci. Fd Agric, 18, pp. 269-273. |
|
(23) |
Burkhard N., and Guth J. A.. (1981), ’Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-l,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption’. Pestic. Sci. 12, pp. 45-52. |
|
(24) |
Guth J. A., Gerber H. R., and Schlaepfer T., (1977). ’Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides’. Proc. Br. Crop Prot. Conf., 3, pp. 961-971. |
|
(25) |
Osgerby J. M., (1973). ’Process affecting herbicide action in soil’. Pestic. Sci., 4, pp. 247-258. |
|
(26) |
Guth J. A., (1972), ’Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden’. Schr. Reihe Ver. Wass.-Boden-Lufthyg. Berlin-Dahlem. Heft 37. pp. 143-154. |
|
(27) |
Hamaker I.W. (1975). ’The interpretation of soil leaching experiments’, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed.), pp. 13 5-172, Plenum Press, NY. |
|
(28) |
Helling C.S. (1971). ’Pesticide mobility in soils’. Soil Soc. Soc. Amer. Proc., 35, pp. 732-210. |
|
(29) |
Hamaker I. W. (1972). ’Diffusion and volatilization’ in Organic chemicals in the soil environment (C.A.I. Goring and J. W. Hamaker eds). Vol. l. pp. 49-143. |
|
(30) |
Burkhard N. and Guth J. A., (1981), ’Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system’. Pestic. Sci. 12, pp. 37-44. |
|
(31) |
Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G., (1984), ’Potential pesticide contamination of groundwater from agricultural uses’, in Treatment and Disposal of Pesticide Wastes, pp. 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(32) |
Gustafson D.I., (1989), ’Groundwater ubiquity score: a simple method for assessing pesticide leachability’. J. Environ. Toxic. Chem., 8(4), pp. 339-357. |
|
(33) |
Leistra M., and Dekkers W.A., (1976). ’Computed effects of adsorption kinetics on pesticide movementin soils’. J. of Soil Sci., 28, pp. 340-3 50. |
|
(34) |
Bromilov R.H., and Leistra M., (1980), ’Measured and simulated behavior of aldicarb and its oxidation products in fallow soils’. Pest. Sci., 11. pp. 389-395. |
|
(35) |
Green R.E., and Karickoff S.W., (1990), ’Sorption estimates for modeling’, in Pesticides in the Soil Environment: Process, Impacts and Modeling fed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, pp. 80-101. |
|
(36) |
Lambert S.M., (1967), ’Functional relationship between sorption in soil and chemical structure’. J. Agri. Food Chem., 15, pp. 572-576. |
|
(37) |
Hance R.J., (1969), ’An empirical relationship between chemical structure and the sorption of some herbicides by soils’. J. Agri. Food Chem., 17, pp. 667-668. |
|
(38) |
Briggs G.G. (1969), ’Molecular structure of herbicides and their sorption by soils’. Nature, 223, 1288. |
|
(39) |
Briggs G.G. (1981). ’Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor’. J. Agric. Food Chem., 29, pp. 1050-1059. |
|
(40) |
Sabljic A., (1984), ’Predictions of the nature and strength of soil sorption of organic polutance by molecular topology’. J. Agric. Food Chem., 32, pp. 243-246. |
|
(41) |
Bailey G.W., and White J.L., (1970), ’Factors influencing the adsorption, desorption, and movement of pesticides in soil’. Residue Rev., 32, pp. 29-92. |
|
(42) |
Bailey G.W., J.L. White and Y. Rothberg., (1968), ’Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate’. Soil Sci. Soc. Amer. Proc. 32: pp. 222-234. |
|
(43) |
Karickhoff S.W., (1981), ’Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils’. Chemosphere 10, pp. 833-846. |
|
(44) |
Paya-Perez A., Riaz M. and Larsen B., (1989), ’Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners’. Environ. Toxicol. Safety 21, pp. 1-17. |
|
(45) |
Hamaker J.W., and Thompson J.M., (1972). ’Adsorption in organic chemicals' in Organic Chemicals in the Soil Environment (Goring C.A.I, and Hamaker J.W.. eds), Vol 1 and II, Marcel Dekker, Inc., New York, NY, 1972. pp. 49-143.’ |
|
(46) |
Deli J., and Warren G F., 19 71, ’Adsorption, desorption and leaching of diphenamid in soils’. Weed Sci. 19: pp. 67-69. |
|
(47) |
Chu-Huang Wu. Buehring N., Davinson J. M. and Santelmann, (1975), ’Napropamide Adsorption, desorption and Movement in soils’. Weed Science, Vol. 23, pp. 454-457. |
|
(48) |
Haues M.H.B., Stacey M., and Thompson I.M. (1968), ’Adsorption of s-triazine herbicides by soil organic preparations’ in isotopes and Radiation in Soil Organic Studies, p.75, International. Atomic Energy Agency, Vienna. |
|
(49) |
Pionke H.B., and Deangelis R.J. (l980), ’Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase’, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19. Vol. III: Supporting Documentation, USDA Conservation Research report. |
|
(50) |
ISO Standard Compendium Environment: Soil Quality — General aspects: chemical and physical methods of analysis biological methods of analysis. First Edition (1994). |
|
(51) |
Scheffer F., and Schachtsschabel, Lekrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition. |
|
(52) |
Black, Evans D.D., White J, L., Ensminger L.E. and Clark F.E., eds. ’Methods of Soil Analysis’, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982. |
|
(53) |
ISO/DIS 10381-1 Soil Quality — Sampling — Pan 1: Guidance on the design of sampling programmes. |
|
(54) |
ISO/DIS 10381-2 Soil Quality — Sampling — Pan 2: Guidance on sampling techniques. |
|
(55) |
ISO/DIS 10381-3 Soil Quality — Sampling — Part 3: Guidance on safety of sampling. |
|
(56) |
ISO/DIS 10381-4 Soil Quality — Sampling — Part 4: Guidance on the investigation of natural and cultivated soils. |
|
(57) |
ISO/DIS 10381-5 Soil Quality — Sampling — Part 5: Guidance on the investigation of soil contamination of urban and industrial sites. |
|
(58) |
ISO 10381-6, 1993: Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(59) |
Green R.E., and Yamane V.K., (1970), ’Precision in pesticide adsorption measurements’. Soil Sci. Am. Proc, 34, pp. 3 5 3-3 54. |
|
(60) |
Grover R., and Hance R.J. (1970), ’Effect of ratio of soil to water on adsorption of linuron and atrazine’. Soil Sci., pp. 109-138. |
|
(61) |
Boesten, J.J.T.I., ’Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system’. Pest. Sci. 1990. 30, pp. 31-41. |
|
(62) |
Boesten, J.J.T.I. ’Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106’. Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26-29 April 1994. |
|
(63) |
Bastide J., Cantier J.M., et Coste C., (1980), ’Comportement de substances herbicides dans le sol en fonction de leur structure chimique’. Weed Res. 21, pp. 227-231. |
|
(64) |
Brown D.S., and Flagg E.W., (1981), ’Empirical prediction of organic pollutants sorption in natural sediments’. J. Environ.Qual., 10(3), pp. 382-386. |
|
(65) |
Chiou C.T., Porter P.E., and Schmedding D.W., (1983), ’Partition equilibria of non-ionic organic compounds between soil organic matter and water’. Environ. Sci. Technol., 17(4), pp. 227-231. |
|
(66) |
Gerstl Z., and Mingelgrin U. (1984),’Sorption of organic substances by soils and sediments’. J. Environm. Sci. Health, B19 (3), pp. 297-312. |
|
(67) |
Vowles P.D., and Mantoura R.F.C, (1987), ’Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons’. Chemosphere, 16(1), pp. 109-116. |
|
(68) |
Lyman W.J., Reehl W.F.and Rosenblatt D.H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC. |
|
(69) |
Keniga E.E. and Goring C.A.I. (1980). ’Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota’ in Aquatic Toxicology (eds J.G. Eaton, et al.), pp.78-115, ASTM STP 707. Philadelphia. |
|
(70) |
Chiou C.T., Peters L.J. and Freed Y. H., (1979), ’A physical concept of soil-water equilibria for non-ionic organic compounds’. Science, Vol. 206, pp. 831-832. |
|
(71) |
Hassett J.J., Banwart W.I., Wood S.G. and Means J.C. (1981), ’Sorption of/-Naphtol: implications concerning the limits of hydrorophobic .sorption’. Soil Sci. Soc. Am.). 45, pp. 38-42. |
|
(72) |
Karickhoff S. W., (1981), ’Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils’. Chemosphere, Vol. 10iS), pp. 833-846. |
|
(73) |
Moreale A., van Bladel R. (1981). ’Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité-reactivité’. Revue de l'Agric, 34-14). pp. 319-322. |
|
(74) |
Müller M., Kördel W. (1996). ’Comparison of screening methods for the determination/estimation of adsorption coefficients on soil’. Chemosphere, 32(12). pp. 2493-2504. |
|
(75) |
Kördel W., Kotthoff G.. Müller M. (1995). ’HPLC — screening method for the determination of the adsorption coefricien: on soil — results of a ring test’. Chemosphere 30 (7), pp. 1373-1384. |
|
(76) |
Kördel W., Stutte J., Kotthoff G. (1993), ’HPLC — screening method for the determination of the adsorption coefficient on soil — comparison of different stationary phases’. Chemosphere 27 (12), pp. 2341-2352. |
|
(77) |
Hance, R.J., (1967), ’The Speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides’. Weed Research. Vol. 7, pp. 29-36. |
|
(78) |
Koskinen W.O and Harper S.S., (1990), ’The retention processes: mechanisms’ in Pesticides in the Soil Environment: Processes, impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin. |
|
(79) |
Cohen S.Z., Creeger S.M., Carsei R.F., and Enfield C.G. (1984), ’Potential pesticide contamination of groundwater from agricultural uses’, in Treatment and Disposal of Pesticide Wastes, pp.297-325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(80) |
Giles C.H., (1970). ’Interpretation and use of sorption isotherms’ in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, pp. 14-32. |
|
(81) |
Giles, C. H.; McEwan J.H.; Nakhwa, S.N. and Smith, D. (1960), ’Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils’. J. Chem. Soc, pp. 3973-93. |
|
(82) |
Calvet R., Tercé M., and Arvien J.C. (1980), ’Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de 1'adsorption’. Ann. Agron. 31: pp. 239-251. |
|
(83) |
Bedbur E., (1996), ’Anomalies in the Freundlich equation’, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, UK. |
|
(84) |
Guth, J.A., (1985), ’Adsorption/desorption’, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK. |
|
(85) |
Soil Texture Classification (US and 1AO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:505 (1962). |
Aanhangsel 1
Testschema

Aanhangsel 2
INVLOED VAN DE NAUWKEURIGHEID VAN DE ANALYSEMETHODE EN DE CONCENTRATIEVERANDERING OP DE NAUWKEURIGHEID VAN DE ADSORPTIERESULTATEN
Uit onderstaande tabel (84) blijkt duidelijk dat wanneer het verschil tussen de aanvankelijke massa (m0 =110 μg) en de evenwichtsmassa m (eq) = 100 μg) van de teststof in de oplossing heel klein is, een fout van 5 % in de meting van de evenwichtsconcentratie leidt tot een fout van 50 % bij de berekening van het gehalte aan de stof dat aan het bodemmonster is geadsorbeerd (
(eq) = 100 μg) van de teststof in de oplossing heel klein is, een fout van 5 % in de meting van de evenwichtsconcentratie leidt tot een fout van 50 % bij de berekening van het gehalte aan de stof dat aan het bodemmonster is geadsorbeerd ( ) en van 52,4 % bij de berekening van Kd.
) en van 52,4 % bij de berekening van Kd.
|
Hoeveelheid bodemmonster: |
msoil |
= 10 g |
|
Volume van de oplossing: |
Vo |
= 100 cm3 |
|
|
FOR-L_2008142NL.01044401.notes.0187.xml.jpg (μg) |
FOR-L_2008142NL.01044401.notes.0188.xml.jpg (μg cm-3) |
R |
FOR-L_2008142NL.01044401.notes.0189.xml.jpg (μg) |
FOR-L_2008142NL.01044401.notes.0190.xml.jpg (μg-1) |
R‡ |
Kd* |
R‡ |
|
|
VOOR A = 9 % |
|||||||
|
m0 = 110 μg of C0=1,100 μg/cm3 |
100 |
1,000 |
Ware waarde |
10 |
1,00 |
Ware waarde |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
|
VOOR A = 55 % |
|||||||
|
m0= 110 μg of C0=1,100 μg/cm3 |
50,0 |
0,500 |
Ware waarde |
60,0 |
6,00 |
Ware waarde |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,5 50 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
|
VOOR A = 99 % |
|||||||
|
m0 = 110 μg of C0=1,100 μg/cm3 |
1,100 |
0,011 |
Ware waarde |
108,9 |
10,89 |
Ware waarde |
990 |
|
|
1,111 |
0,0111 |
1 % |
108,88 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 % |
899 |
9,2 % |
|
|
|
= |
|
|
|
= |
waarin: massa van de teststof in de bodemfase bij evenwicht (μg) |
|
|
= |
massa van de teststof in, de waterfase bij evenwicht (μg) |
|
|
= |
gehalte van de bodemfase aan de teststof bij evenwicht (μg g-1; |
|
|
= |
massaconcentratie van de teststot in de waterfase bij evenwicht μg (cm-3; |
|
R |
= |
analysefout in de bepaling van |
|
R‡ |
= |
fout in berekening ten gevolge van de analysefout R. |
Aanhangsel 3
SCHATTINGSTECHNIEKEN VOOR Kd
|
1. |
Schattingstechnieken maken een prognose van Kd mogelijk op basis van een correlatie met bijvoorbeeld Pow -waarden (12) (39) (63-68), gegevens over de oplosbaarheid in water (12) (19) (21) (39) (68-73), of polariteitsgegevens die door HPLC bij omgekeerde fase zijn verkregen (74-76). Koc of Kom wordt berekend met behulp van de vergelijkingen in de tabellen 1 en 2 en vervolgens wordt Kd berekend uit de vergelijkingen:
|
|
2. |
Deze correlaties zijn gebaseerd op twee uitgangspunten: (1.) de adsorptie van een stof wordt vooral bepaald door het organisch materiaal in de bodem en (2.) de interacties daarbij zijn voornamelijk niet-polair. Dit betekent dat deze correlaties: (1) niet of slechts tot op zekere hoogte gelden voor polaire stoffen en (2.) niet kunnen worden gebruikt wanneer het gehalte van de bodem aan organisch materiaal zeer laag is (12). Bovendien is de correlatie tussen Pow en de adsorptie wel bevredigend gebleken (19), maar kan dit niet worden gezegd voor het verband tussen de oplosbaarheid in water en de adsorptie (19) (21); tot op heden zijn de resultaten van de studies zeer tegenstrijdig. |
|
3. |
In de tabellen 1 en 2 worden enkele voorbeelden gegeven van de correlatie tussen de adsorptiecoëfficiënt en respectievelijk de verdelingscoëfficiënt octanol/water en de oplosbaarheid in water. Tabel 1 Voorbeelden van de correlatie tussen de adsorptiecoëfficiënt en de verdelingscoëfficiënt octanol/water; zie voor andere voorbeelden (12) en (68)
Tabel 2 Voorbeelden van de correlatie tussen de adsorptiecoëfficiënt en de oplosbaarheid in water; zie voor andere voorbeelden (68) en (69).
|
Aanhangsel 4
BEREKENINGEN VOOR DE BEPALING VAN DE CENTRIFUGEEROMSTANDIGHEDEN
|
1. |
Voor de centrifugeertijd geldt, uitgaande van ronde deeltjes, de volgende formule:
Ter vereenvoudiging worden alle parameters in niet-Sl-eenheden (g, cm) beschreven. Hierbij is:
Om een volledige scheiding te waarborgen moet in het algemeen het dubbele van de berekende tijd worden gebruikt. |
|
2. |
Vergelijking (1) kan verder worden vereenvoudigd als we ervan uitgaan dat de viscositeit (η) en de dichtheid (ρaq) van de oplossing gelijk zijn aan de viscositeit en de dichtheid van water bij 25 oC, d.w.z. η = 8,95 x 10-3 g s-1 cm-1 en ρaq = 1,0 g.cm-3. In dat geval geldt voor de centrifugeertijd:
|
|
3. |
Uit vergelijking (2) blijkt dat voor een scheiding van deeltjes met een specifieke grootte (in ons geval een straal van 0,1 μm) twee parameters belangrijk zijn bij de bepaling van de centrifugeeromstandigheden (tijd en snelheid): 1. de dichtheid van het bodemmonster en 2. de hoogte van het mengsel in de centrifugebuis (Rb-Rt), d.w.z. de afstand die een bodemdeeltje van het vloeistofoppervlak van de oplossing naar de bodem van de buis moet afleggen; bij een vast volume wordt de hoogte van het mengsel in de buis uiteraard bepaald door het kwadraat van de straal van de buis. |
|
4. |
Figuur 1 geeft het verband tussen centrifugeertijd (t) en -snelheid (rpm) bij uiteenlopende bodemdichtheid (ρs) (figuur la) en uiteenlopende hoogte van het mengsel in de centrifugebuis (figuur 1b). Uit figuur la blijkt duidelijk wat de invloed van de bodemdichtheid is: bij een gangbare centrifugeersnelheid van 3 000 rpm is de centrifugeertijd ongeveer 240 minuten bij een bodemdichtheid van 1,2 g cm3 en slechts 50 minuten bij 2,0 g cm3. Figuur lb levert voor een gangbare centrifugeersnelheid van 3 000 rpm ongeveer 50 minuten op bij een hoogte van het mengsel van 10 cm en slechts zeven minuten bij een hoogte van 1 cm. Het is echter belangrijk dat er een optimaal compromis wordt gevonden tussen zo kort mogelijk centrifugeren en optimaal gebruiksgemak bij de scheiding van de fasen na het centrifugeren. |
|
5. |
Bovendien moet bij de bepaling van de experimentele omstandigheden bij het scheiden van bodemfase en oplossing worden bedacht dat er een derde „pseudofase” kan ontstaan: colloïden. Deze deeltjes met een grootte van minder dan 0,2 μm kunnen een belangrijke rol spelen bij het hele adsorptiemechanisme van een stof in een bodemsuspensie. Wanneer wordt gecentrifugeerd zoals hierboven is beschreven, blijven de colloïden in de waterfase en worden ze tegelijk met de waterfase geanalyseerd. Dit betekent dat de informatie over het effect van deze deeltjes verloren gaat. Als het laboratorium beschikt over ultracentrifuges of ultrafiltratiefaciliteiten, kan de adsorptie/desorptie van een stof in de bodem diepgaander worden onderzocht en kan ook informatie worden verkregen over de adsorptie van de stof aan colloïden. In dit geval moet ultracentrifugatie bij 60 000 rpm of ultrafiltratie met een porositeit van 100 000 Dalton worden gebruikt voor een scheiding van de drie fasen bodem, colloïden en oplossing. Het testprotocol moet ook dienovereenkomstig worden gewijzigd, zodat de analyse van de stof bij alle drie fasen wordt uitgevoerd. |

Aanhangsel 5
BEREKENING VAN DE ADSORPTIE A ( %) EN DESORPTIE D ( %)
Het tijdschema voor de procedure is:

Voor alle berekeningen wordt ervan uitgegaan dat de teststof stabiel is en niet in significante mate aan de wanden van het proefvat wordt geadsorbeerd.
ADSORPTIE A (%)
a) Parallelle methode
Het adsorptiepercentage wordt voor elke proefbuis (i) op elk tijdstip ti berekend volgens de vergelijking:
|
|
De factoren in deze vergelijking worden als volgt berekend:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
Hierbij is:
|
|
= |
adsorptiepercentage ( %) op het tijdstip ti |
|
|
= |
massa van de aan het bodemmonster geadsorbeerde teststof op het tijdstip ti waarop de analyse wordt uitgevoerd (μg) |
|
m0 |
= |
massa van de teststof in de proefbuis aan het begin van de test (μg) |
|
Co |
= |
massaconcentratie van de testoplossing in contact met het bodemmonster op het tijdstip t = 0 (μg cm-3) |
|
|
= |
massaconcentratie van de stof in de waterfase op het tijdstip ti waarop de analyse wordt uitgevoerd (μg cm-3): deze concentratie wordt door analyse bepaald, rekening houdend met de resultaten van de blancobepaling |
|
VO |
= |
volume van de testoplossing in contact met het bodemmonster op het tijdstip t = 0 (cm3). |
Het adsorptiepercentage  of
of  wordt uitgezet tegen de tijd en vervolgens wordt het tijdstip bepaald waarop het sorptie-evenwicht zich heeft ingesteldt de figuren 1 en 2 bevatten voorbeelden van dergelijke curves.
wordt uitgezet tegen de tijd en vervolgens wordt het tijdstip bepaald waarop het sorptie-evenwicht zich heeft ingesteldt de figuren 1 en 2 bevatten voorbeelden van dergelijke curves.
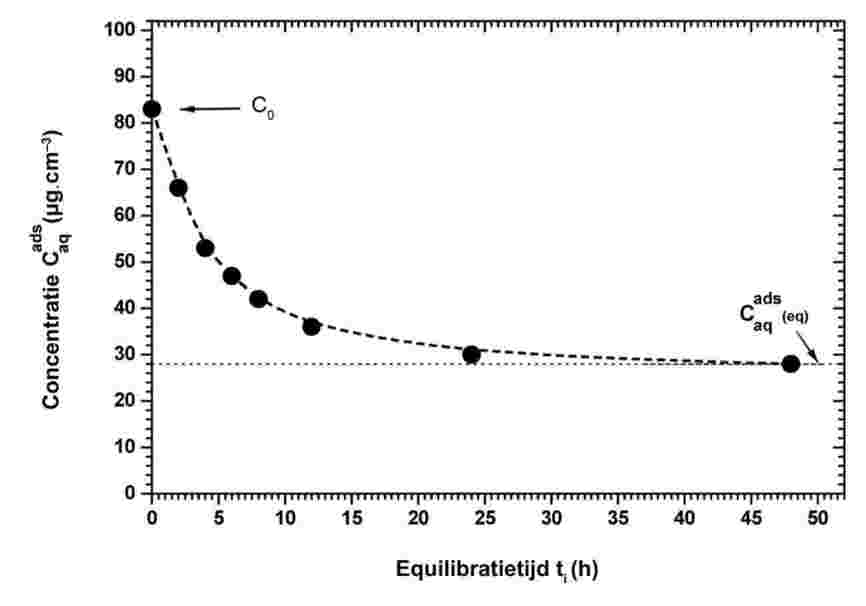
b) Seriële methode
In de volgende vergelijkingen wordt er rekening mee gehouden dat de adsorptieprocedure wordt uitgevoerd door meting van de teststof in kleine porties van de waterfase na specifieke tijdsintervallen.
|
— |
De hoeveelheid van de stof die gedurende elk tijdsinterval aan het bodemmonster wordt geadsorbeerd, wordt als volgt berekend:
|
|
— |
Het adsorptiepercentage over elk tijdsinterval (
terwijl het adsorptiepercentage op het tijdstip ti (
Het adsorptiepercentage |
|
— |
Op het evenwichtstijdstip teq:
|
De hier gebruikte parameters worden gedefinieerd als:
|
|
= |
massa van de aan het bodemmonster geadsorbeerde teststof gedurende de tijdsintervallen Δt1, Δt2 … Δtn (μg) |
|
|
= |
massa van de stof, gemeten in een monster op het tijdstip |
|
|
= |
massa van de aan het bodemmonster geadsorbeerde teststof bij het adsorptie-evenwicht f(μg) |
|
|
= |
massa van de stof in de oplossing bij het adsorptie-evenwicht (μg) |
|
|
= |
volume van het monster waarin de teststof wordt bepaald (cm3) |
|
|
= |
adsorptiepercentage dat overeenkomt met een tijdsinterval Ati ( %) |
|
|
= |
adsorptiepercentage bij het adsorptie-evenwicht ( %). |
DESORPTIE D ( %)
Als het tijdstip t0 waarop het desorptie-experiment begint, wordt het moment beschouwd waarop het maximale volume van de oplossing met teststof (nadat het adsorptie-evenwicht zich heeft ingesteld) wordt verwijderd en vervangen door een gelijk volume 0,01 M CaCl2-oplossing.
a) Parallelle methode
Op een tijdstip ti wordt de massa van de teststof gemeten in de waterfase die uit buis i is verwijderd ( ) en wordt de gedesorbeerde massa berekend met behulp van de vergelijking:
) en wordt de gedesorbeerde massa berekend met behulp van de vergelijking:
|
|
(13) |
Bij het desorptie-evenwicht is ti = teq en derhalve  =
= 
De massa van de gedurende een tijdsinterval (Δti) gedesorbeerde teststof is:
|
|
(14) |
Het desorptiepercentage wordt berekend:
op een tijdstip ti met de vergelijking:
|
|
(15) |
en gedurende een tijdsinterval (Δti) met de vergelijking:
|
|
(16) |
Hierbij is:
|
|
= |
desorptiepercentage op een tijdstip ti (%) |
|
|
= |
desorptiepercentage over een tijdsinterval Δti (%) |
|
|
= |
massa van de op een tijdstip ti gedesorbeerde teststof (μg) |
|
|
= |
massa van de gedurende een tijdsinterval Δti gedesorbeerde teststof (μg) |
|
|
= |
analytisch bepaalde massa van de teststof in een op een tijdstip t; voor analyse genomen volume-oplossing (μg). |
|
|
= |
massa van de teststof die door onvolledige vervanging van het volume overblijft van het adsorp-tie-evenwicht (μg). |
|
|
(17) |
|
|
= |
massa van de teststof in de oplossing bij het adsorptie-evenwicht (μg) |
|
VR |
= |
volume van het supematans dat na het bereiken van het adsorptie-evenwicht uit de buis verwijderd is en is vervangen door een gelijk volume 0,01 M CaCl2-oplossing (cm3) |
|
|
= |
volume van de oplossing die bij het desorptiekinetiek-experiment voor de bepaling van de teststof uit buis (i) is genomen (cm3) |
Het desorptiepercentage 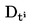 of
of  (afhankelijk van de eisen van de studie) wordt uitgezet tegen de tijd en vervolgens wordt het tijdstip bepaald waarop het desorptie-evenwicht zich heeft ingesteld.
(afhankelijk van de eisen van de studie) wordt uitgezet tegen de tijd en vervolgens wordt het tijdstip bepaald waarop het desorptie-evenwicht zich heeft ingesteld.
b) Seriële methode
In de volgende vergelijkingen wordt er rekening mee gehouden dat de adsorptieprocedure is uitgevoerd door meting van de teststof in kleine porties ( ) van de waterfase (de seriële methode in punt 1.9: „Uitvoering van de test”). Aangenomen wordt dat a) het na het adsorptiekinetiek-experiment uit de buis verwijderde supernatans is vervangen door een gelijk volume 0,01 M CaCl2-oplossing (VR) en b) het totale volume van de waterfase in contact met het bodemmonster (VT) gedurende het desorptiekinetiek-experiment constant blijft en wordt gegeven door de vergelijking:
) van de waterfase (de seriële methode in punt 1.9: „Uitvoering van de test”). Aangenomen wordt dat a) het na het adsorptiekinetiek-experiment uit de buis verwijderde supernatans is vervangen door een gelijk volume 0,01 M CaCl2-oplossing (VR) en b) het totale volume van de waterfase in contact met het bodemmonster (VT) gedurende het desorptiekinetiek-experiment constant blijft en wordt gegeven door de vergelijking:
|
|
(18) |
Op een tijdstip ti:
|
— |
De massa van de teststof in een kleine hoeveelheid oplossing (
|
|
— |
Bij het desorptie-evenwicht is ti = teq en derhalve |
|
— |
Het desorptie-percentage
|
Over een tijdsinterval (Δti):
Over elk tijdsinterval wordt de hoeveelheid gedesorbeerde stof als volgt berekend:
|
— |
voor het eerste tijdsinterval Δt1 = t1-to
|
|
— |
voor het tweede tijdsinterval Δt2 = t2-t1
|
|
— |
voor het ne tijdsinterval Δtn = tn-tn-1
|
Ten slotte wordt het desorptiepercentage over elk tijdsinterval  berekend met behulp van de vergelijking:
berekend met behulp van de vergelijking:
|
|
(24) |
terwijl het desorptiepercentage op het tijdstip ti ( ) wordt berekend met de vergelijking:
) wordt berekend met de vergelijking:
|
|
(25) |
De hier gebruikte parameters worden gedefinieerd als:
|
|
= |
massa van de teststof die aan het bodemmonster blijft geadsorbeerd na de tijdsintervallen Δt1, Δt2, ..., Δtn (μg) |
||
|
|
= |
massa van de teststof die wordt gedesorbeerd gedurende de tijdsintervallen At,, Δt2, ..., Δtn (μg) |
||
|
|
= |
massa van de teststof die in een hoeveelheid oplossing ( |
||
|
VT |
= |
totaalvolume van de waterfase die tijdens het volgens de seriële methode uitgevoerde desorptiekinetiek-experiment in contact met het bodemmonster is (cm3) |
||
|
|
= |
massa van de teststof die door onvolledige vervanging van het volume overblijft van het adsorptie-evenwicht (μg)
|
||
|
VR |
= |
volume van het supernatans dat na het bereiken van het adsorptie-evenwicht uit de buis verwijderd is en is vervangen door een gelijk volume 0,01 M CaCl2-oplossing (cm3) |
||
|
|
= |
volume van het monster dat tijdens het volgens de seriële methode uitgevoerde desorptiekinetiek-experiment voor analysedoeleinden uit buis (i) wordt genomen (cm3).
|
Aanhangsel 6
ADSORPTIE/DESORPTIE IN DE BODEM: RAPPORTAGEFORMULIEREN
Geteste stof:
Getest bodemmonster:
Gehalte van het bodemmonster aan droge massa (105 oC, 12 uur): … %
Temperatuur … oC
Geschiktheid van de analysemethode
|
Gewicht bodemmonster |
g |
|
|
Droge massa in bodemmonster |
g |
|
|
Volume CaCl2-oplossing |
cm3 |
|
|
Nominale concentratie eindoplossing |
μg cm-3 |
|
|
Concentratie eindoplossing bij analyse |
μg cm-3 |
|
Principe van de gebruikte analysemethode:
Kalibratie van de analysemethode:
Geteste stof:
Getest bodemmonster:
Gehalte van het bodemmonster aan droge massa (105 oC, 12 uur): … %
Temperatuur … oC
|
Gevolgde analysemethodologie |
Indirect |
|
Parallel |
|
Serieel |
|
|
|
Direct |
|
|
|
|
|
Adsorptietest: testmonsters
|
|
Symbool |
Eenheid |
Equilibratietijd |
Equilibratietijd |
Equilibratietijd |
Equilibratietjjd |
||||
|
Buis nr. |
|
|
|
|
|
|
|
|
|
|
|
Gewicht bodemmonster |
— |
g |
|
|
|
|
|
|
|
|
|
Droge massa bodemmonster |
msoil |
g |
|
|
|
|
|
|
|
|
|
Volume water in afgewogen bodemmonster (berekend) |
Vws |
cm3 |
|
|
|
|
|
|
|
|
|
Volume 0,01 M CaCl2-oplossing voor equilibratie bodemmonster |
|
cm3 |
|
|
|
|
|
|
|
|
|
Volume stockoplossing |
|
cm3 |
|
|
|
|
|
|
|
|
|
Totaal volume waterfase in contact met bodemmonster |
VO |
cm3 |
|
|
|
|
|
|
|
|
|
Beginconcentratie testoplossing |
C0 |
μg cm-3 |
|
|
|
|
|
|
|
|
|
Massa teststof aan begin van de test |
m0 |
μg |
|
|
|
|
|
|
|
|
|
Na schudden en centrifugeren |
||||||||||
|
INDIRECTE METHODE |
||||||||||
|
Parallelle methode |
||||||||||
|
Concentratie teststof in waterfase na correctie blanco |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Seriële methode |
||||||||||
|
Gemeten massa teststof in het analysemonster VVa A |
|
μg |
|
|
|
|
|
|
|
|
|
DIRECTE METHODE |
||||||||||
|
Massa aan het bodemmonster geadsorbeerde teststof |
|
μg |
|
|
|
|
|
|
|
|
|
Berekening van de adsorptie |
||||||||||
|
Adsorptie |
|
% |
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
|
Gemiddelde |
|
|
|
|
|
|
||||
|
Adsorptie |
Kd |
cm3 g-1 |
|
|
|
|
|
|
|
|
|
Gemiddelde |
|
|
|
|
|
|
||||
|
Adsorptie |
Koc |
cm3 g-1 |
|
|
|
|
|
|
|
|
|
Gemiddelde |
|
|
|
|
|
|
||||
Geteste stof:
Getest bodemmonster:
Gehalte van het bodemmonster aan droge massa (105 oC, 12 uur):… %
Temperatuur:… oC
Adsorptietest: blanco- en controlebepalingen
|
|
Symbool |
Eenheid |
Blanco |
Blanco |
Controle |
|||
|
Buis nr. |
|
|
|
|
|
|
|
|
|
Gewicht bodemmonster |
|
g |
|
|
|
|
0 |
0 |
|
Volume water in afgewogen bodemmonster (berekend) |
|
cm3 |
|
|
|
|
— |
— |
|
Toegevoegd volume 0,01 M CaCl2-oplossing |
|
cm3 |
|
|
|
|
|
|
|
Toegevoegd volume stockoplossing met teststof |
|
cm3 |
0 |
0 |
|
|
|
|
|
Totaal volume waterfase (berekend) |
|
cm3 |
|
|
|
|
— |
— |
|
Beginconcentratie van de teststof in de waterfase |
|
μg cm-3 |
|
|
|
|
|
|
|
Na schudden en centrifugeren |
||||||||
|
Concentratie in waterfase |
|
μg cm-3 |
|
|
|
|
|
|
NB: Indien nodig kolommen toevoegen.
Geteste stof:
Getest bodemmonster:
Gehalte van het bodemmonster aan droge massa (105 oC, 1 2 uur): … %
Temperatuur: … oC
Massabalans
|
|
Symbool |
Eenheid |
|
|
|
|
|
Buis nr. |
|
|
|
|
|
|
|
Gewicht bodemmonster |
— |
g |
|
|
|
|
|
Droge massa bodemmonster |
msoil |
g |
|
|
|
|
|
Volume water in afgewogen bodemmonster (berekend) |
Vws |
ml |
|
|
|
|
|
Volume 0,01 M CaCl2-oplossing voor equili-bratie bodemmonster |
|
ml |
|
|
|
|
|
Volume stockoplossing |
|
cm3 |
|
|
|
|
|
Totaal volume waterfase in contact met bodemmonster |
V0 |
cm3 |
|
|
|
|
|
Beginconcentratie testoplossing |
C0 |
μg cm-3 |
|
|
|
|
|
Equilibratietijd |
— |
uur |
|
|
|
|
|
Na schudden en centrifugeren |
||||||
|
Concentratie teststof in waterfase bij adsorptie-evenwicht na correctie blanco |
|
μg cm-3 |
|
|
|
|
|
Equilibratietijd |
teq |
uur |
|
|
|
|
|
Eerste verdunning met oplosmiddel |
||||||
|
Volume verwijderde waterfase |
Vrec |
cm3 |
|
|
|
|
|
Volume toegevoegd oplosmiddel |
ΔV |
cm3 |
|
|
|
|
|
Eerste extractie met oplosmiddel |
||||||
|
Signaal geanalyseerd in oplosmiddel |
SE1 |
var. |
|
|
|
|
|
Concentratie teststof in oplosmiddel |
CE1 |
μg cm-3 |
|
|
|
|
|
Massa van uit bodemmonster en wanden proefvat geëxtraheerde teststof |
mE1 |
μg |
|
|
|
|
|
Tweede verdunning met oplosmiddel |
||||||
|
Volume verwijderd oplosmiddel |
ΔVs |
cm3 |
|
|
|
|
|
Volume toegevoegd oplosmiddel |
ΔV' |
cm3 |
|
|
|
|
|
Tweede extractie met oplosmiddel |
||||||
|
Signaal geanalyseerd in oplosmiddel |
SE2 |
var. |
|
|
|
|
|
Concentratie teststof in oplosmiddel |
CE2 |
μg cm-3 |
|
|
|
|
|
Massa van uit bodemmonster en wanden proefvat geëxtraheerde teststof |
mE2 |
μg |
|
|
|
|
|
Totale massa in twee stappen geëxtraheerde teststof |
mE |
μg |
|
|
|
|
|
Massabalans |
MB |
% |
|
|
|
|
Geteste stof:
Getest bodemmonster:
Gehalte van het bodemmonster aan droge massa (105 oC, 12 uur): %
Temperatuur: oC
Adsorptie-isothermen
|
|
Symbool |
Eenheid |
|
|
|
|
|
|
|
|
|
Buis nr. |
|
|
|
|
|
|
|
|
|
|
|
Gewicht bodemmonster |
— |
g |
|
|
|
|
|
|
|
|
|
Droge massa bodemmonster |
E |
g |
|
|
|
|
|
|
|
|
|
Volume water in afgewogen bodemmonster (berekend) |
Vws |
cm3 |
|
|
|
|
|
|
|
|
|
Volume 0,01 Μ CaCl2-oplossing voor equilibratie bodemmonster |
|
cm3 |
|
|
|
|
|
|
|
|
|
Volume toegevoegde stockoplossing |
|
cm3 |
|
|
|
|
|
|
|
|
|
Totaal volume waterfase in contact met bodemmonster (berekend) |
V0 |
cm3 |
|
|
|
|
|
|
|
|
|
Concentratie oplossing |
C0 |
μg cm-3 |
|
|
|
|
|
|
|
|
|
Equilibratietijd |
— |
uur |
|
|
|
|
|
|
|
|
|
Na schudden en centrifugeren |
||||||||||
|
Concentratie teststof in waterfase na correctie blanco |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Temperatuur |
|
oC |
|
|
|
|
|
|
|
|
|
Massa geadsorbeerde teststof per eenheid bodemmonster |
|
μg g-1 |
|
|
|
|
|
|
|
|
Regressie-analyse:
Waarde van: KF ads:
Waarde van l/n:
Regressiecoëfficiënt r2:
Geteste stof:
Getest bodemmonster:
Gehalte van het bodemmonster aan droge massa (105 oC, 12 uur): … %
Temperatuur: … oC
|
Gevolgde analysemethodologie: |
Indirect |
|
Parallel |
|
Serieel |
|
Desorptietest
|
|
Symbool |
Eenheid |
Tijdsinterval |
Tijdsinterval |
Tijdsinterval |
Tijdsinterval |
|
|
Buis nr. uit adsorptiestap |
|
|
|
|
|
|
|
|
Massa aan het bodemmonster geadsorbeerde stof bij adsorptie-evenwicht |
|
μg |
|
|
|
|
|
|
Verwijderd volume waterfase, vervangen door 0,01 Μ CaCl2 |
VR |
cm3 |
|
|
|
|
|
|
Totaal volume waterfase in contact met bodem |
PM |
Vo |
cm3 |
|
|
|
|
|
SM |
VT |
cm3 |
|
|
|
|
|
|
Massa stof die door onvolledige vervanging van het volume overblijft van het adsorptie-evenwicht |
|
μg |
|
|
|
|
|
|
Desorptiekinetiek |
|||||||
|
Gemeten massa van de op het tijdstip tj uit het bodemmonster gedesorbeerde stof |
|
μg |
|
|
|
|
|
|
Volume van de oplossing die voor de meting van de teststof uit buis (i) is genomen |
PM |
Vr i |
cm3 |
|
|
|
|
|
SM |
va D |
cm3 |
|
|
|
|
|
|
Massa van de op het tijdstip ti uit het bodemmonster gedesorbeerde teststof (berekend) |
|
μg |
|
|
|
|
|
|
Massa van de gedurende het tijdsinterval Δti uit het bodemmonster gedesorbeerde teststof (berekend) |
|
μg |
|
|
|
|
|
|
Desorptiepercentage |
|||||||
|
Desorptie op het tijdstip ti |
Dti |
% |
|
|
|
|
|
|
Desorptie gedurende het tijdsinterval Δti |
|
% |
|
|
|
|
|
|
Schijnbare desorptiecoëfficiënt |
Kdes |
|
|
|
|
|
|
PM: Parallelle methode
SM: Seriële methode
C.19. RAMING VAN DE ADSORPTIECOËFFICIËNT (Koc) AAN DE BODEM EN AAN RIOOLSLIB MET BEHULP VAN HOGEDRUKVLOEISTOFCHROMATOGRAFIE (HPLC)
1. METHODE
Deze methode is overgenomen van OESO TG 121 (2001).
1.1. INLEIDING
Het sorptiegedrag van stoffen ten opzichte van de bodem en van rioolslib kan worden beschreven aan de hand van parameters die langs experimentele weg worden bepaald met behulp van testmethode C.18. Een belangrijke parameter is de adsorptiecoëfficiënt, die wordt gedefinieerd als de verhouding tussen de concentratie van de stof in de bodem/het rioolslib en de concentratie van de stof in de waterfase bij het adsorptie-evenwicht. De genormaliseerde adsorptiecoëfficiënt voor het organische-koolstofgehalte van de bodem Koc is een bruikbare indicator van de bindingscapaciteit van een chemische stof aan organisch bodemmateriaal en rioolslib en maakt vergelijkingen mogelijk tussen verschillende chemische stoffen. Deze parameter kan worden geraamd door middel van correlaties met de oplosbaarheid in water en de verdelingscoëfficiënt n-octanol/water (1) (2) (3) (4) (5) (6) (7).
Bij de in deze test beschreven onderzoeksmethode wordt gebruikgemaakt van HPLC voor de raming van de adsorptiecoëfficiënt Koc aan de bodem en aan rioolslib (8). De ramingen zijn betrouwbaarder dan die op basis van KSAR-berekeningen (9). Aangezien deze onderzoeksmethode gebaseerd is op ramingen, kan zij de bij testmethode C.18 gebruikte batch-evenwichtsexperimenten niet volledig vervangen. Toch kan de geraamde Koc van nut zijn bij de keuze van geschikte testparameters voor adsorptie-/desorptieonderzoeken volgens testmethode C.18 door de berekening van Kd (verdelingscoëfficiënt) of Kf (adsorptiecoëfficiënt volgens Freundlich) volgens vergelijking 3 (zie punt 1.2).
1.2. DEFINITIES
Kd: De verdelingscoëfficiënt wordt gedefinieerd als de verhouding van evenwichtsconcentraties C van een opgeloste teststof in een tweefasensysteem dat bestaat uit een sorptiemiddel (bodem of rioolslib) en een waterfase; deze coëfficiënt is een waarde zonder dimensies wanneer de concentraties in beide fasen worden uitgedrukt in gewicht/gewicht. Indien de concentratie in de waterfase wordt uitgedrukt in gewicht/volume, zijn de eenheden ml.g-1. Kd kan variëren naar gelang van de sorptiemiddeleigenschappen en concentratieafhankelijk zijn.
|
|
(1) |
Hierbij is:
|
Csoil |
= |
concentratie van de teststof in de bodem bij evenwicht (μg . gM) |
|
Csludge |
= |
concentratie van de teststof in slib bij evenwicht (μg . g-1) |
|
Caq |
= |
concentratie van de teststof in de waterfase bij evenwicht (μg . g-1, μg . ml-1). |
Kf: De adsorptiecoëfficiënt volgens Freundlich wordt gedefinieerd als de concentratie van de teststof in de bodem of in rioolslib (x/m) wanneer de evenwichtsconcentratie Caq in de waterfase gelijk is aan één; de eenheden zijn μg . g-1 sorptiemiddel. De waarde kan variëren naar gelang van de sorptiemiddeleigenschappen.
|
|
(2) |
Hierbij is:
|
x/m |
= |
hoeveelheid testof x (μg) die is geadsorbeerd aan de hoeveelheid sorptiemiddel m (g) bij evenwicht |
|
l/n |
= |
helling van de adsorptie-isotherm volgens Freundlich |
|
Caq |
= |
concentratie van de teststof in de waterfase bij evenwicht (μg . ml-1) |
Bij
Koc: De verdelingscoëfficiënt (Kd) of adsorptiecoëfficiënt volgens Freundlich (Kf) genormaliseerd voor het organische-koolstofgehalte (foc) van een sorptiemiddel; deze coëfficiënt is met name voor niet-geïoniseerde chemische stoffen een tamelijk nauwkeurige indicator voor de mate van adsorptie van een stof aan het sorptiemiddel en maakt vergelijkingen mogelijk tussen verschillende chemische stoffen. Afhankelijk van de dimensies van Kd en Kf kan Koc dimensieloos zijn of de eenheden ml . g-1 of μg . g-1 organisch materiaal hebben.
|
|
(3) |
Het verband tussen Koc en Kd is niet altijd lineair; Koc-waarden kunnen dan ook verschillen van bodemtype tot bodemtype, hoewel zij nauwelijks uiteenlopen vergeleken met Kd-of Kf-waarden.
De adsorptiecoëfficiënt (Koc) wordt afgeleid uit de capaciteitsfactor (k') aan de hand van een ijkcurve van log k' versus log Koc van de geselecteerde referentieverbindingen.
|
|
(4) |
Hierbij is:
|
tR |
= |
HPLC-retentietijd van test- en referentiestof (minuten) |
|
t0 |
= |
dode tijd HPLC (minuten) (zie punt 1.8.2). |
Pow: De verdelingscoëfficiënt octanol/water wordt gedefinieerd als de verhouding van de concentraties van opgeloste stof in n-octanol en water; dit is een dimensieloze waarde
|
|
(5) |
1.3. REFERENTIESTOFFEN
Voordat de methode wordt gebruikt, moeten de structuurformule, de zuiverheid en de dissociatieconstante (indien van toepassing) bekend zijn. Gegevens over de oplosbaarheid in water en organische oplosmiddelen, de verdelingscoëfficiënt octanol/water en de hvdrolysekenmerken zijn nuttig.
Om de gemeten HPLC-retentiegegevens van een teststof te correleren aan de adsorptiecoëfficiënt Koc van die stof, moet een ijkgrafiek van log Koc versus log k' worden getekend. Er moet gebruik worden gemaakt van minimaal zes referentiepunten, waarvan ten minste één boven en ten minste één onder de verwachte teststofwaarde dient te liggen. De methode zal veel nauwkeuriger zijn als er referentiestoffen worden gebruikt die qua structuur verwant zijn aan de teststof. Indien dergelijke gegevens niet beschikbaar zijn, dient de gebruiker zelf geschikte ijkstoffen te kiezen. In dat geval moet een meer algemene reeks van qua structuur heterogene stoffen worden gekozen. Voor rioolslib zijn toegestane stoffen en Koc-waarden opgenomen in tabel 1, voor de bodem in tabel 3 (zie aanhangsel). De eventuele keuze van andere ijkstoffen moet worden onderbouwd.
1.4. PRINCIPE VAN DE TESTMETHODE
Er wordt gebruikgemaakt van analvtische HPLC-kolommen die zijn gevuld met een in de handel verkrijgbare vaste cyaanpropvifase die lipofiele en polaire bestanddelen bevat. Verder wordt een op een silicamatrix gebaseerde gematigd polaire stationaire fase gebruikt:
|
— 0 — Si |
— CH2 — CH2 — CH2 |
— CN |
|
Silica |
Arolaire spacer |
Polair bestanddeel |
Het principe van de testmethode is hetzelfde als dat van testmethode A.8 (verdelingscoëfficiënt, HPLC-methode). Op het moment dat de teststof samen met de mobiele fase door de kolom stroomt, gaat die stof een interactie aan met de stationaire fase. De teststof wordt vertraagd als gevolg van de verdeling tussen mobiele en stationaire fasen. De tweeledige samenstelling van de stationaire fase — polaire en apolaire locaties — maakt dezelfde soort interactie tussen polaire en apolaire groepen van een molecuul mogelijk als bij organisch materiaal in bodem- of rioolslibmatrices. Op basis hiervan kan er een verband worden gelegd tussen de retentietijd in de kolom en de adsorptiecoëfficiënt aan organisch materiaal.
Met name bij polaire stoffen heeft de pH een belangrijke invloed op het sorptiegedrag. Bij landbouwgrond en reservoirs van rioolwaterzuiveringsinstallaties schommelt de pH gewoonlijk tussen 5,5 en 7,5. Voor ioniseerbare stoffen moeten er twee tests worden verricht met zowel geïoniseerde als niet-geioniseerde vormen in geschikte bufferoplossingen, doch alleen in gevallen waarin ten minste 10 % van de testverbinding uiteen zal vallen binnen pH 5,5 tot 7,5.
Aangezien de evaluatie uitsluitend plaatsvindt op basis van het verband tussen de retentie in de HPLC-kolom en de adsorptiecoëfficiënt, is er geen kwantitatieve analysemethode nodig en behoeft slechts de retentietijd te worden bepaald. Indien er een geschikte reeks referentiestoffen beschikbaar is en de methode benut wordt onder standaard experimentele omstandigheden, vormt die methode een snelle en efficiënte manier om de adsorptiecoëfficiënt Koc te ramen.
1.5. TOEPASBAARHEID VAN DE TEST
De HPLC-methode kan worden gebruikt voor chemische stoffen (al dan niet gelabeld) waarvoor een geschikt detectiesysteem (bijv. spectrofotometer, radioactiviteitsdctector) beschikbaar is en die voldoende stabiel zijn gedurende het experiment. De methode kan zeer bruikbaar zijn voor chemische stoffen die moeilijk op een andere manier experimenteel te onderzoeken zijn (zoals vluchtige stoffen; stoffen die niet in water oplosbaar zijn in een concentratie die analyseerbaar is; stoffen met een sterke affiniteit tot het oppervlak van incubatie-systemen). De methode kan worden gebruikt voor mengsels die niet-opgeloste elutiebanden opleveren. In dat geval moeten de onder- en bovengrenzen van de log Koc-waarden van de verbindingen van het testmengsel worden vermeld.
Hoewel onzuiverheden soms problemen kunnen opleveren voor de interpretatie van HPLC-resultaten, zijn zij van ondergeschikt belang zolang de teststof duidelijk langs analytische weg kan worden geïdentificeerd en van de onzuiverheden kan worden gescheiden.
De methode is geldig verklaard voor de stoffen die zijn opgenomen in tabel 1 van het aanhangsel en is tevens gebruikt voor een aantal andere chemische stoffen, die behoren tot de volgende chemische categorieën:
|
— |
aromatische aminen (bijv. trifluralin, 4-chlooraniline, 3,5-dinitroaniline, 4-methylaniline, N-methylaniline, 1-naftylamine); |
|
— |
aromatische carbonzure esters (bijv. benzoëzure methylester, 3,5-dinitrobenzoëzure ethylester); |
|
— |
aromatische koolwaterstoften (bijv. tolueen, xyleen, ethylbenzeen, nitrobenzeen); |
|
— |
aryloxyfenoxypropionzure esters (bijv. diclofop-methyl, fenoxaprop-ethyl, fenoxaprop-P-ethyl); |
|
— |
schimmelwerende middelen, benzimidazol en imidazol (bijv. carbendazim, fuberidazol, triazoxide); |
|
— |
carbonzure amiden (bv. 2-chloorbenzamide. N.N-dimethylbenzamide, 3,5-dinitrobenzamide, N-methyl-benzamide, 2-nitrobenzamide. 3-nitrobenzamide); |
|
— |
chloorkoolwaterstoffen (bv. endosulfan, DDT, hexachloorbenzeen, quintozeen, 1,2,3-trichloorbenzeen); |
|
— |
organofosfor-insecticiden (bv. azinfos-methyl, disulfoton, fenamifos, isofenfos, pyrazofos, sulprofos, triazofos); |
|
— |
fenolen (bijv. fenol. 2-nitrofenol. 4-nitrofenol. pentachloorfenol. 2,4,6-trichloorfenol, 1-naftol); |
|
— |
fenylureumderivaten (bv. isoproturon monolinuron, pencycuron); |
|
— |
igmentkleurstoffen (bv. Acid Yellow 219, Basic Blue 41, Direct Red 81); |
|
— |
polyaromatische koolwaterstoffen (bv. acenafteen, naftaleen); |
|
— |
1,3,5-triazine-herbiciden (bv. prometryn, propazin, simazin, terbutryn); |
|
— |
triazoolderivaten (bv. tebuconazol, triadimefon, triadimenol, triapentenol). |
De methode kan niet worden gebruikt voor stoffen die met het eluent of de stationaire fase reageren, en ook niet voor stoffen die een specifieke interactie aangaan met anorganische bestanddelen (bv. vorming van clustercomplexen met kleimineralen). Het is mogelijk dat de methode niet werkt bij oppervlakteactieve stoffen, anorganische verbindingen en matige of sterke organische zuren en basen. Er kunnen log Koc-waarden van 1,5 tot 5,0 worden bepaald. Ioniseerbare stoffen moeten worden gemeten met behulp van een gebufferde mobiele fase, waarbij er wel op moet worden gelet dat precipitatie van bufferbestanddelen of van de teststof wordt voorkomen.
1.6. KWALITEITSCRITERIA
1.6.1. Nauwkeurigheid
Normaliter kan de adsorptiecoëfficiënt van een teststof worden geraamd tot binnen ±0,5 log eenheid van de waarde die is bepaald met behulp van de batch-evenwichtsmethode (zie tabel 1 van het aanhangsel). Een hogere nauwkeurigheid is haalbaar als de gebruikte referentiestoffen qua structuur verwant zijn aan de teststof.
1.6.2. Herhaalbaarheid
De bepalingen moeten ten minste in duplo worden uitgevoerd. De uit afzonderlijke metingen afgeleide waarden van log KOC moeten binnen een bereik van 0,25 log eenheid vallen.
1.6.3. Reproduceerbaarheid
De ervaring die tot nu toe met de methode is opgedaan, ondersteunt de geldigheid ervan. Uit een onderzoek naar de HPLC-methode, waarbij gebruik werd gemaakt van 48 stoffen (merendeels pesticiden) waarvoor betrouwbare gegevens over Koc in de bodem beschikbaar waren, kwam een correlatiecoëfficiënt van R = 0,95 naar voren (10) (11).
Er is een vergelijkingstest onder elf laboratoria gehouden ter verbetering en validatie van de methode (12). De resultaten zijn vermeld in tabel 2 van het aanhangsel
1.7. BESCHRIJVING VAN DE TESTMETHODE
1.7.1. Voorbereidende raming van de adsorptiecoëfficiënt
Daar de verdelingscoëfficiënt octanol/water Pow (= Kow) en, in zekere mate, de oplosbaarheid in water met name bij niet-geïoniseerde stoffen kunnen worden gebruikt als indicatoren van de mate van adsorptie, kunnen zij tevens worden benut voor voorbereidende bereikbepaling. Er is een aantal bruikbare correlaties gepubliceerd voor verschillende groepen chemische stoffen (1) (2) (3) (4) (5) (6) (7).
1.7.2. Apparatuur
Vereist is een vloeistofchromatograaf met een pulsloze pomp en een geschikt detectieapparaat. Het gebruik van een injectieklep met inicctielus wordt aanbevolen. Er moet gebruik worden gemaakt van in de handel verkrijgbare chemisch gebonden cyaanpropylharsen op silicabasis (bv. Hypersil en Zorbax CN). Er mag een voorkolom van hetzelfde materiaal tussen het injectiesysteem en de analysekolom worden geplaatst. Kolommen van verschillende leveranciers kunnen aanzienlijk uiteenlopen qua scheidingsefficiëntie. Als richtsnoer moeten de volgende capaciteitsfactoren k' worden gehaald: log k' > 0,0 voor log KOK = 3,0 en log k' > 0,4 voor log Koc = 2,0 bij gebruik van methanol water 55/45 % als mobiele fase.
1.7.3. Mobiele fasen
Van de diverse geteste mobile rasen worden de twee volgende aanbevolen:
|
— |
methanol/water (55/45 % v/v); |
|
— |
methanol/0,01 M citraatbuffer pH 6,0 (55/45 % v/v). |
Er wordt gebruikgemaakt van een combinatie van methanol van HPLC-kwaliteit met gedestilleerd water of citraatbuffer voor de bereiding van het uitspoeloplosmiddel. Het mengsel wordt vóór gebruik ontgast. Er moet isocratische elutie worden toegepast. Als methanol/water-mengsels niet geschikt zijn kunnen ook andere organisch-oplosmiddel/water-mengsels worden uitgeprobeerd, zoals ethanol/water- of acetonitril/water-mengsels. Voor ioniseerbare verbindingen wordt het gebruik van een bufferoplossing aanbevolen om de pH te stabiliseren. Zoutprecipitatie en achteruitgang van de kolom, verschijnselen die zich kunnen voordoen bij sommige organische fase/buffer-mengsels, moeten worden voorkomen.
Er mogen geen additieven zoals ionenpaarreagentia worden gebruikt, omdat die van invloed kunnen zijn op de sorptie-eigenschappen van de stationaire fase. Dergelijke veranderingen van de stationaire fase kunnen onomkeerbaar zijn. Daarom moeten experimenten waarbij additieven worden gebruikt, uitgevoerd worden op gescheiden kolommen.
1.7.4. Oplossingen
De test- en referentiestoffen moeten worden opgelost in de mobiele fase.
1.8. UITVOERING VAN DE TEST
1.8.1. Testomstandigheden
De temperatuur tijdens de metingen moet worden geregistreerd. Temperatuurregeling van het kolomcompartiment wordt sterk aanbevolen teneinde constante omstandigheden te garanderen tijdens het ijken en ramen en het meten van de teststof.
1.8.2. Bepaling van de dode tijd t0
Voor deze bepaling kunnen twee methoden worden gebruikt (zie ook punt 1.2).
1.8.2.1. Bepaling van de dode tijd t0 door middel van een homologe reeks
Gebleken is dat deze procedure betrouwbare en gestandaardiseerde to-waarden oplevert. Zie voor nadere bijzonderheden testmethode A.8, Verdelingscoëfficiënt (n-octanol/water), HPLC-methode.
1.8.2.2. Bepaling van de dode tijd t0 door middel van inerte stoffen waarvan geen retentie door de kolom plaatsvindt
Deze techniek is gebaseerd op de injectie van oplossingen van formamide, ureum of natriumnitraat. De metingen moeten ten minste in duplo worden verricht.
1.8.3. Bepaling van de retentietijden tR
De referentiestoffen moeten worden gekozen zoals beschreven in punt 1.3. Ze mogen als gemengde standaard worden geïnjecteerd om hun retentietijden te bepalen, mits aangetoond is dat de retentietijd van elke referentiestandaard niet wordt beïnvloed door de aanwezigheid van de andere referentiestandaarden. Er dient regelmatig en in ieder geval tweemaal per dag te worden geijkt teneinde rekening te kunnen houden met onvoorziene veranderingen in de prestaties van de kolom. Het verdient de voorkeur de ijkinjecties uit te voeren vóór en na de injecties van de testsrof om er zeker van te zijn dat de retentietijden niet zijn gewijzigd. De teststoffen worden afzonderlijk in zo klein mogelijke hoeveelheden geïnjecteerd (om overlading van de kolom te voorkomen) en de retentietijden ervan u-orden bepaald.
Om het vertrouwen in de meting te vergroten moeten de bepalingen ten minste in duplo worden verricht. De uit afzonderlijke metingen afgeleide waarden van log Koc moeten binnen een bereik van 0,25 log eenheid vallen.
1.8.4. Evaluatie
Uit de dode tijd t0 en de retentietijden tR van de gekozen referentiestoffen worden de capaciteitsfactoren k' berekend volgens vergelijking 4 (zie punt 1.2). Daarna worden de log k'-gegevens van de referentiestoffen uitgezet tegen hun in de labellen 1 en 3 van het aanhangsel vermelde log Koc-waarden die zijn verkregen bij batch-evenwichtsexperimenten. Aan de hand van deze curve wordt vervolgens de log k'-waarde van een teststof gebruikt om de log Koc -waarde van die stofte bepalen. Als uit de actuele resultaten blijkt dat de log Koc van de teststof buiten het ijkbereik valt moet de test worden herhaald met andere, geschiktere referentiestoffen.
2. GEGEVENS EN RAPPORTAGE
In het rapport moeten de volgende gegevens worden opgenomen:
|
— |
identiteit van test- en referentiestoffen en hun zuiverheid, alsmede pKa-waarden voorzover relevant; |
|
— |
beschrijving van apparatuur en bedrijfsomstandigheden, bv. type en maat van analysekolom en voorkolom, detectieapparaat, mobiele fase (verhouding tussen bestanddelen en pH), temperatuurbereik tijdens de metingen; |
|
— |
dode tijd en methode die wordt gebruikt voor de bepaling daarvan; |
|
— |
in de kolom gebrachte hoeveelheden test- en referentiestoffen; |
|
— |
retentietijden van referentieverbindingen die voor ijkdoeleinden worden gebruikt; |
|
— |
nadere gegevens over de aangebrachte regressielijn (log k' vs. log Koc) en een grafiek van die lijn; |
|
— |
gemiddelde retentiegegevens en geraamde log Koc-waarde van de testverbinding; |
|
— |
chromatogrammen. |
3. REFERENTIES
|
(1) |
W.J. Lyman, W.F. Reehl, D.H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, Chap. 4, McGraw-Hill, New York. |
|
(2) |
J. Hodson, N.A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, 1 67. |
|
(3) |
G.G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, pp. 1050-1039. |
|
(4) |
C.T. Chiou, P.E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, pp. 227-231. |
|
(5) |
Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment.]. Environm. Sci, Health, B19, pp. 297-312. |
|
(6) |
C.T. Chiou, L.J. Peters, V.H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, pp. S31-832. |
|
(7) |
S.W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, pp. 833-846. |
|
(8) |
W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), pp. 121-128. |
|
(9) |
M. Mueller, W. Kordel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), pp. 2493-2504. |
|
(10) |
W. Kördel. J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), pp. 2341-2352. |
|
(11) |
B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, pp. 28 5-304. |
|
(12) |
W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient or, soil-results of a ring test. Chemosphere, 30(7), pp. 1373-1384. |
Aanhangsel
Tabel 1
Vergelijking van Koc-waarden voor bodem en rioolslib en volgens de HPLC-screeningmethode (32) (33) berekende waarden
|
Stof |
CAS-nr. |
Log Ko; rioolslib |
Log Koc HPLC |
Δ |
Log Koc bodem |
Log Koc HPLC |
Δ |
|
Atrazin |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linuron |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fenthion |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monuron |
1 50-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantreen |
S5-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Benzoëzure fenylester |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Benzamide |
5 5-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-nitrobenzamide |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Aceetanilide |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Aniline |
6 2-5 3-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-dichlooraniline |
9 5-S2-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
Tabel 2
Resultaten van een vergelijkende laboratoriumtest (elf laboratoria) verricht ter verbetering en validatie van de HPLC-methode (34)
|
Stof |
CAS-nr. |
Log Koc |
Koc |
Log Koc |
|
(OESO 106) |
(HPLC-methode) |
|||
|
Atrazin |
1912-24-9 |
1,81 |
78 ± 16 |
1,89 |
|
Monuron |
150-68-5 |
1,99 |
100 ± 8 |
2,00 |
|
Triapentenol |
77608-88-3 |
2,37 |
292 ± 58 |
2,47 |
|
Linuron |
3 30-55-2 |
2,59 |
465 ± 62 |
2,67 |
|
Fenthion |
5 5-38-9 |
3,31 |
2062 ± 648 |
3,31 |
Tabel 3
Aanbevolen referentiestoffen voor de HPLC-screeningmethode op basis van bodemadsorptiegegevens
|
Referentiestof |
CAS-nr. |
Gemiddelde log Kow -waarden van batchevenwicht |
Aantal Koc-gegevens |
Log S.D. |
Bron |
|
Aceetanilide |
103-S4-4 |
1,25 |
4 |
0,48 |
|
|
Fenol |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-Nitrobenzamide |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N, N-dimethylbenzamide |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-Methylbenzamide |
619-5 5-6 |
1,78 |
3 |
1,76 |
|
|
Methylbenzoaat |
93-58-3 |
1,80 |
4 |
1,08 |
|
|
Atrazin |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
Isoproturon |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3-Nitrobenzamide |
64 5-09-0 |
1,95 |
3 |
1,31 |
|
|
Aniline |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-Dinitrobenzamide |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Carbendazim |
10605-21-7 |
2,35 |
3 |
1,37 |
|
|
Triadimenol |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triazoxide |
72459-58-6 |
2,44 |
3 |
1,66 |
|
|
Triazofos |
2401 7-47-S |
2,55 |
3 |
1,78 |
|
|
Linuron |
3 30-5 5-2 |
2,59 |
3 |
1,97 |
|
|
Naftaleen |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endosulfan-diol |
2157-19-9 |
3,02 |
5 |
2,29 |
|
|
Methiocarb |
2032-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
63405-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3-Trichloorbenzeen |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
γ-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Fenthion |
5 5-38-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red 81 |
2610-1 1-9 |
3,43 |
4 |
2,68 |
|
|
Pyrazofos |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
α-Endosulfan |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Diclofop-methyl |
51338-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantreen |
85-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (mix) |
26850-47-5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
C.20. DAPHNIA MAGNA VOORTPLANTINGSTEST
1. METHODE
Deze methode voor het testen van de voortplantingstoxiciteit neemt OESO TG 211 (1998) integraal over.
1.1. INLEIDING
Het doel van de test is in de eerste plaats het beoordelen van het effect van chemicaliën op het voortplan-tingsresultaat van Daphnia magna.
1.2. DEFINITIES EN EENHEDEN
Moederdieren: de vrouwelijke Daphnia die aanwezig zijn bij aanvang van de test en voorwerp zijn van de studie naar het voortplantingsresultaat.
Nakomelingen: de jonge Daphnia die tijdens de test worden voortgebracht door de moederdieren.
Lowest Observed Effect Concentration (LOEC) (concentratie waarbij het laagste effect wordt waargenomen): de laagste testconcentratie van de stof waarbij een effect is waargenomen dat statistisch significant is voor de voortplanting en de mortaliteit van moederdieren (bij p < 0,05) in vergelijking met de controle, binnen een aangegeven blootstellingsperiode. Alle testconcentraties boven de LOEC moeten echter een schadelijk effect hebben dat gelijk is aan of groter dan de effecten die worden waargenomen bij de LOEC. Indien niet aan deze beide voorwaarden kan worden voldaan, moet uitgebreid worden toegelicht hoe de LOEC (en daarmee de NOEC) is geselecteerd.
No Observed Effect Concentration (NOEC) (concentratie waarbij geen effect wordt waargenomen): de testconcentratie direct onder de LOEC, die in vergelijking met de controle geen statistisch significant effect heeft (p < 0,05) binnen een aangegeven blootstellingsperiode.
EC X : de concentratie van de in water opgeloste teststof die resulteert in een x %-vermindering van de voortplanting van Daphnia magna binnen een aangegeven blootstellingsperiode.
Intrinsieke groeisnelheid: een maat voor de groei van de populatie waarbij wordt uitgegaan van het voortplantingsresultaat en de leeftijdspecifieke mortaliteit (20) (21) (22). Bij stabiele populaties is die snelheid nul. Bij toenemende populaties is zij positief en bij afnemende populaties negatief. De laatstgenoemde populaties zijn uiteraard niet levensvatbaar en zullen uiteindelijk uitsterven.
Detectiegrens: de laagste concentratie die wel kan worden gedetecteerd doch niet gekwantificeerd.
Bepalingsgrens: de laagste concentratie die kwantitatief meetbaar is.
Mortaliteit: een dier wordt geregistreerd als gestorven als het immobiel is, d.w.z. als het niet tot zwemmen in staat is of als er geen beweging van aanhangsels of het postabdomen wordt waargenomen binnen 15 seconden na zachtjes bewegen van het testvat. (Gebruik van een andere definitie moet met bronvermelding worden vermeld.)
1.3. PRINCIPE VAN DE TESTMETHODE
Jonge vrouwelijke Daphnia (de moederdieren), die bij aanvang van de test nog geen 24 uur oud zijn, worden blootgesteld aan de teststof die aan het water is toegevoegd in een aantal uiteenlopende concentraties. De test-duur is 21 dagen. Aan het eind van de test wordt het totale aantal voortgebrachte levende nakomelingen per moederdier dat aan het eind van de test nog in leven is, geteld. Dit houdt in dat nakomelingen die zijn voortgebracht door volwassen dieren die tijdens de test sterven, niet worden meegeteld. Het voortplantingsresultaat van de moederdieren kan ook op andere manieren worden uitgedrukt (bijvoorbeeld in het aantal levende nakomelingen dat per dag en per dier is voortgebracht vanaf de eerste dag dat er nakomelingen werden waargenomen), maar die moeten dan wel worden vermeld naast het totale aantal nakomelingen dat per moederdier dat nog in leven was aan het eind van de test, werd voortgebracht. Het voortplantingsresultaat van de aan de teststof blootgestelde dieren wordt vergeleken met dat van de controlegroep(en) teneinde de Lowest Observed Effect Concentration (LOEC) en daarmee ook de No Observed Effect Concentration (NOEC) te bepalen. Daarnaast vindt waar mogelijk data-analyse plaats met behulp van een regressiemodel om de concentratie te schatten die zou leiden tot een x %-vermindering van het voortplantingsresultaat (d.w.z. EC50, EC20 of EC10).
Het aantal overlevende moederdieren en de tijd die nodig was voor het voortbrengen van het eerste broedsel, moeten eveneens worden vermeld. Ook andere stofgerelateerde effecten op parameters als groei (bijvoorbeeld lengte) en mogelijke intrinsieke groeisnelheid kunnen voorwerp van onderzoek zijn.
1.4. GEGEVENS OVER DE TESTSTOF
Er moeten resultaten van een met Daphnia magna verrichte acutetoxiciteitstest (zie methode C.2, deel I) beschikbaar zijn. Deze kunnen bruikbaar zijn bij de selectie van een geschikt aantal uiteenlopende testconcen-traties voor de voortplantingstests. De oplosbaarheid in water en de dampspanning van de teststof moeten bekend zijn; tevens moet er een betrouwbare analysemethode beschikbaar zijn voor de kwantificering van de stof in de testoplossingen met vermelding van de herstelcapaciteit en de bepalingsgrens.
Voorbeelden van gegevens over de teststof die bruikbaar kunnen zijn bij de vaststelling van de testvoorwaar-den zijn de structuurformule, de zuiverheidsgraad van de stof, de stabiliteit bij licht, de stabiliteit onder de testvoorwaarden, pKa, Pow en resultaten van de test betreffende gemakkelijke biologische afbreekbaarheid (zie methode C.4).
1.5. GELDIGHEID VAN DE TEST
Wil de test geldig zijn, dan moet in de controlegroep(en) aan de volgende prestatiecriteria worden voldaan:
|
— |
de mortaliteit van de moederdieren (vrouwelijke Daphnia) mag aan het eind van de test niet hoger zijn dan 20 %; |
|
— |
het gemiddelde aantal levende nakomelingen dat is voortgebracht per moederdier dat aan het eind van de test nog in leven is, is ≥ 60. |
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
Testvaten en andere apparaten die in aanraking komen met de testoplossingen, mogen alleen uit glas of een ander chemisch inert materiaal bestaan. Normaal gesproken zijn de testvaten glazen bekers.
Daarnaast zijn alle of sommige van de volgende apparaten vereist:
|
— |
zuurstofmeter (met micro-elektrode of andere geschikte voorzieningen voor de meting van opgeloste zuurstof in monsters met een klein volume); |
|
— |
adequate apparatuur voor de temperatuurbeheersing; |
|
— |
pH-meter; |
|
— |
uitrusting voor de bepaling van de hardheid van water; |
|
— |
uitrusting voor de bepaling van de totale organische koolstofconcentratie (TOC) van water of uitrusting voor de bepaling van het chemisch zuurstofverbruik (COD); |
|
— |
adequate apparatuur voor de regeling van het lichtregime en de meting van de lichtintensiteit. |
1.6.2. Testorganisme
De testsoort is Daphnia magna Strauss. Andere Daphnia-soorten zijn eveneens toegestaan, mits ze aan de toepasselijke geldigheidscriteria voldoen (het geldigheidscriterium met betrekking tot het voortplantingsresultaat bij de controlegroepen moet relevant zijn voor de Daphnia-soort). Indien andere Daphnia-soorten worden gebruikt, moeten die duidelijk worden vermeld en dient dat gebruik te worden onderbouwd.
De kloon moet bij voorkeur zijn geïdentificeerd door middel van bepaling van het genotype. Uit onderzoek (1) is gebleken dat de voortplantingsprestatie van kloon A (die afkomstig is van IRCHA in Frankrijk) (3) consequent voldoet aan het geldigheidscriterium van een gemiddelde van ≥ 60 nakomelingen per overlevend moederdier indien gekweekt onder de in deze methode beschreven voorwaarden. Desalniettemin zijn andere klonen aanvaard mits de Daphnia-cultuur aantoonbaar voldoet aan de geldigheidscriteria voor een test.
Bij aanvang van de test mogen de dieren nog geen 24 uur oud zijn; ze mogen geen eerste nakomelingen zijn. Ze moeten afkomstig zijn van een gezonde stam (d.w.z. geen tekenen van stress vertonen, zoals hoge mortaliteit, aanwezigheid van mannelijke dieren en ephippia, vertraging in het voortbrengen van het eerste broedsel, verkleurde dieren, enz. De stamdieren moeten onder soortgelijke kweekomstandigheden (licht, temperatuur, medium, voeding en aantal dieren per eenheid worden gehouden als die welke van toepassing zijn tijdens de test. Indien het tijdens de test te gebruiken Daphnia-kweekmedium afwijkt van het medium voor de gangbare Daphnia-cultuur, verdient het aanbeveling een aan de test voorafgaande acclimatiseringsperiode van normaliter circa drie weken (d.w.z. één generatie aan te houden om stress bij de moederdieren te voorkomen.
1.6.3. Testmedium
Het verdient aanbeveling om bij deze test gebruik te maken van een volledig beschreven medium. Op die manier kan het gebruik van additieven vermeden worden (zoals zeewier, grondextract, enz.), die moeilijk te typeren zijn, en kan er beter gestandaardiseerd worden tussen laboratoria. De media Elendt M4 (4) en M7 (zie aanhangsel 1) zijn hiertoe geschikt gebleken. Desalniettemin zijn andere media (bijvoorbeeld (5) en (6)) aanvaardbaar mits de prestaties van de Daphnia-cultuur aantoonbaar voldoen aan de geldigheidscriteria voor de test.
Indien gebruik wordt gemaakt van media met niet-beschreven additieven, moeten die additieven niet alleen duidelijk worden gespecificeerd, maar moeten er ook gegevens in het testrapport worden opgenomen over de samenstelling, in het bijzonder met betrekking tot het koolstofgehalte, aangezien dit een bijdrage kan leveren aan de voeding. Het verdient aanbeveling de totale organische koolstof (TOC) en/of het chemisch zuurstofverbruik (COD) van het stampreparaat van het organische additief te bepalen en een schatting te maken van de resulterende bijdrage aan TOC/COD in het testmedium. De TOC-niveaus in het medium (d.w.z. vóór toevoeging van de algen) zijn bij voorkeur lager dan 2 mg/l (7).
In geval van teststoffen met metalen moet worden onderkend dat de eigenschappen van het testmedium (bijvoorbeeld hardheid, chelaatvormend vermogen) van invloed kunnen zijn op de toxiciteit van de teststof. Een volledig beschreven medium is dan ook wenselijk. Op dit moment zijn er echter slechts twee volledig beschreven media waarvan bekend is dat ze geschikt zijn voor langetermijnkweek van Daphnia magna: Elendt M4 en M7. Beide media bevatten de chelaatvormer EDTA. Uit werkzaamheden is naar voren gekomen (2) dat de „klaarblijkelijke toxiciteit” van cadmium in de regel lager is wanneer de voortplantingstest wordt uitgevoerd in M4- en M7-media dan bij uitvoering in media die geen EDTA bevatten. M4 en M7 worden derhalve niet aanbevolen voor metaalhoudende teststoffen, terwijl ook het gebruik van andere media die bekende chelaatvor-mers bevatten, vermeden dient te worden. Het kan raadzaam zijn om voor metaalhoudende stoffen een ander medium te gebruiken, zoals volgens ASTM geregenereerd hard schoon water (7), dat geen EDTA bevat, met toevoeging van zeewierextract (8). Deze combinatie van volgens ASTM geregenereerd hard schoon water en zeewierextract is ook geschikt voor langetermijnkweek en het testen van Daphnia magna (2), hoewel die combinatie nog altijd een licht chelaatvormende werking heeft vanwege de organische component in het toegevoegde zeewierextract.
Bij aanvang en tijdens de test moet de concentratie opgeloste zuurstof boven 3 mg/l liggen. De pH moet liggen tussen 6-9 en normaliter mag er geen variatie van meer dan 1,5 eenheid optreden bij welke test dan ook. Een hardheid van meer dan 140 mg/l (als CaCO3) wordt aanbevolen. Uit tests op dit niveau en de hierboven beschreven tests is naar voren gekomen dat de voortplantingsprestatie voldoet aan de geldigheidscriteria (9) (10).
1.6.4. Testoplossingen
Testoplossingen van de gekozen concentraties worden in de regel bereid middels verdunning van een stam-oplossing. Stamoplossingen moeten bij voorkeur worden bereid door oplossing van de stof in het testmedium.
In sommige gevallen kan het gebruik van organische oplosmiddelen of dispergeermiddelen nodig zijn om een voldoende geconcentreerde stamoplossing te maken, maar het gebruik van dergelijke middelen moet waar mogelijk worden voorkomen. Voorbeelden van geschikte oplosmiddelen zijn aceton, ethanol, methanol, dime-thylformamide en triëthyleenglycol. Voorbeelden van geschikte dispergeermiddelen zijn Cremophor RH40, methylcellulose 0,01 % en HCO-40. De teststof in de testoplossingen mag in geen geval de grens van de oplosbaarheid in het testmedium overschrijden.
Oplosmiddelen worden gebruikt voor de productie van een stamoplossing die nauwkeurig in water kan worden gedoseerd. Bij de aanbevolen oplosmiddelconcentratie in het uiteindelijke testmedium (d.w.z. ≤ 0,1 ml/l) zijn bovengenoemde oplosmiddelen niet toxisch en leiden ze niet tot een hogere oplosbaarheid in water van een stof.
Dispergeermiddelen kunnen een goed hulpmiddel zijn bij een nauwkeurige dosering en dispersie. Bij de aanbevolen concentratie in het uiteindelijke testmedium (≤ 0,1 ml/l) zijn bovengenoemde dispergeermiddelen niet toxisch en leiden ze niet tot een hogere oplosbaarheid in water van een stof.
1.7. TESTOPZET
De behandelingen moeten alle plaatsvinden in een speciaal voor de desbetreffende behandeling bestemd testvat en de testvaten moeten daarna op willekeurige wijze worden behandeld. Het nalaten hiervan kan een vertekend beeld geven dat uitgelegd zou kunnen worden als een concentratie-effect. In het bijzonder moet hierbij gedacht worden aan de mogelijkheid dat, wanneer met experimentele units wordt omgegaan in volgorde van behandeling of concentratie, bepaalde met tijd verband houdende effecten, zoals vermoeidheid bij de uitvoerder van het experiment of andere fouten, kunnen leiden tot het vaststellen van grotere effecten bij de hogere concentraties. Bovendien zou overwogen moeten worden de test af te breken als de testresultaten beïnvloed kunnen worden door een conditie waarvan reeds sprake was bij aanvang van de test of door een omgevingsconditie, zoals de plaats in het laboratorium.
1.8. PROCEDURE
1.8.1. Blootstellingsomstandigheden
1.8.1.1. Duur
De test duurt 21 dagen.
1.8.1.2. Kwantiteit
De moederdieren worden afzonderlijk, d.w.z. één per testvat, in de vaten ondergebracht met 50-100 ml medium in elk vat.
Soms kunnen grotere volumes nodig zijn om te voldoen aan de eisen van de analytische procedure die wordt gebruikt voor de bepaling van de teststofconcentratie, hoewel het bundelen van replicatieonderzoeken voor chemische analyse ook is toegestaan. Bij gebruik van volumes van meer dan 100 ml dient de hoeveelheid voer die aan de Daphnia wordt gegeven, eventueel te worden verhoogd om ervoor te zorgen dat er voldoende voer aanwezig is en dat wordt voldaan aan de geldigheidscriteria. Bij doorstroomtests mag om technische redenen voor een andere opzet worden gekozen (bijvoorbeeld vier groepen van tien dieren in een groter test-volume), mits eventuele wijzigingen in de testopzet in het testrapport worden vermeld.
1.8.1.3. Aantal dieren
Bij semistatische tests ten minste tien dieren afzonderlijk gehouden bij elke testconcentratie en ten minste tien dieren afzonderlijk gehouden in de controlereeks.
Wat doorstroomtests betreft is gebleken dat een aantal van 40, in vier groepen van tien verdeelde dieren bij elke testconcentratie geschikt is (1). Een kleiner aantal testorganismen is toegestaan; een minimum van 20 dieren per concentratie verdeeld over twee of meer replicatieonderzoeken met een gelijk aantal dieren (bijvoorbeeld vier replicatieonderzoeken met elk vijf watervlooien) wordt aanbevolen. Opgemerkt dient te worden dat het bij tests waar dieren in groepen worden gehouden, niet mogelijk is het voortplantingsresultaat uit te drukken in het totale aantal levende nakomelingen per moederdier dat aan het eind van de test nog in leven is, als er moederdieren sterven. In die gevallen moet dat resultaat worden uitgedrukt in het „totale aantal levende nakomelingen per moederdier dat bij aanvang van de test aanwezig was”.
1.8.1.4. Voeding
Bij semistatische tests moet er bij voorkeur dagelijks worden gevoerd, doch in ieder geval driemaal per week (d.w.z. naargelang van de verandering van medium). Indien hiervan wordt afgeweken (bijvoorbeeld bij doorstroomtests), moet dat in het testrapport worden vermeld.
Tijdens de test moet de voeding van de moederdieren bij voorkeur bestaan uit levende algencellen of ten minste een van de volgende bestanddelen: Chlorella sp., Selenastrum capricornutum (tegenwoordig Pseudokirch-neriella subcapitata (11)) en Scenedesmus subspicatus. Uitgangspunt bij de voeding moet de aan elk moederdier toegediende hoeveelheid organische koolstof (C) zijn. Uit onderzoek (12) is gebleken dat een hoeveelheid van 0,1 à 0,2 mg C/Daphnia/dag voor Daphnia magna voldoende is om een zodanig aantal nakomelingen te krijgen dat wordt voldaan aan de geldigheidscriteria voor de test. De voeding kan worden gegeven in een gelijkmatige, over de gehele testperiode uitgesmeerde hoeveelheid of desgewenst in een lagere hoeveelheid bij aanvang van de test, die daarna wordt opgevoerd teneinde rekening te houden met de groei van de moederdieren. Ook in dat geval moet de hoeveelheid echter altijd binnen de aanbevolen hoeveelheid van 0,1-0,2 mg C/Daphnia/dag blijven.
Indien er gebruik moet worden gemaakt van alternatieve middelen, zoals algencelaantal of lichtabsorptie, om aan de vereiste hoeveelheid voeding te komen (d.w.z. gemakshalve, aangezien de meting van het koolstofgehalte tijdrovend is), moet elk laboratorium zijn eigen nomografie opstellen waarin het alternatieve middel wordt gerelateerd aan het koolstofgehalte van de algencultuur (zie aanhangsel 2 voor suggesties inzake het opstellen van een nomografie). Nomografieën moeten ten minste eenmaal per jaar worden gecontroleerd, doch vaker als de algencultuuromstandigheden zijn gewijzigd. Gebleken is dat lichtabsorptie een beter alternatief voor het koolstofgehalte is dan het celaantal (13).
Er dient een geconcentreerde algensuspensie te worden toegediend aan de Daphnia om de hoeveelheid algen-kweekmedium die in de testvaten wordt overgebracht, zoveel mogelijk te beperken. De algen kunnen worden geconcentreerd door middel van centrifugeren, gevolgd door hersuspensie in gedistilleerd water, gedeïoniseerd water of Daphnia-kweekmedium.
1.8.1.5. Licht
16 uren licht met een intensiteit van ten hoogste 15-20 μE . m-2 . s-1.
1.8.1.6. Temperatuur
De temperatuur van de testmedia moet liggen tussen 18-22 oC. Waar mogelijk moet de temperatuur echter bij geen enkele test met meer dan 2 oC variëren binnen dit bereik (bijvoorbeeld 18-20, 19-21 of 20-22 oC). Voor de controle van de temperatuur kan het dienstig zijn een extra testvat te gebruiken.
1.8.1.7. Beluchting
De testvaten mogen niet worden belucht tijdens de test.
1.8.2. Testconcentratie
Normaliter moeten er ten minste vijf testconcentraties worden bereid in een meetkundige reeks met een scheidingsfactor die bij voorkeur niet hoger is dan 3.2, en moet voor elke testconcentratie het juiste aantal replica-tieonderzoeken worden uitgevoerd (zie punt 1.8.1.3). Het eventuele gebruik van minder dan vijf concentraties moet worden beargumenteerd. Stoffen mogen niet worden getest boven de grens van hun oplosbaarheid in het testmedium.
Bij de vaststelling van het concentratiebereik moet aandacht worden geschonken aan het volgende:
|
i) |
Als het de bedoeling is de LOEC/NOEC vast te stellen, moet de laagste testconcentratie zo laag zijn dat de vruchtbaarheid bij die concentratie niet significant lager is dan die van de controlegroep. Als dat niet het geval is, moet de test worden herhaald met een lagere laagste concentratie. |
|
ii) |
Als het de bedoeling is de LOEC/NOEC vast te stellen, moet de hoogste testconcentratie zo hoog zijn dat de vruchtbaarheid bij die concentratie significant lager is dan die van de controlegroep. Als dat niet het geval is, moet de test worden herhaald met een hogere hoogste concentratie. |
|
iii) |
Indien een schatting wordt gemaakt van de ECX betreffende effecten op de voortplanting, is het raadzaam om een dusdanig aantal concentraties te gebruiken dat de ECX met voldoende zekerheid kan worden bepaald. Indien een schatting wordt gemaakt van de EC50 betreffende effecten op de voortplanting, is het raadzaam dat de hoogste testconcentratie groter is dan deze EC50. Als niet op deze wijze te werk wordt gegaan zal — hoewel de EC50 nog steeds geschat kan worden — het betrouwbaarheidsinterval van de EC50 erg breed worden, en is wellicht ook niet goed te beoordelen of het model wel voldoet. |
|
iv) |
Het testconcentratiebereik moet bij voorkeur geen concentraties omvatten die statistisch gezien een significant effect hebben op overleving van volwassen dieren, aangezien de aard van de test daarmee zou veranderen van een eenvoudige voortplantingstest in een gecombineerde voortplantings- en mortaliteitstest, die een veel complexere statistische analyse vergt. |
Voorafgaande kennis over de toxiciteit van de teststof (bijvoorbeeld op basis van een acute test en/of op verdeling gerichte studies) kan een goed hulpmiddel zijn bij de selectie van de juiste testconcentraties.
Indien een oplosmiddel of dispergeermiddel wordt gebruikt bij de bereiding van testoplossingen (zie punt 1.6.4), mag de uiteindelijke concentratie in de testvaten niet hoger zijn dan 0,1 ml/l en moet die bovendien in alle testvaten dezelfde zijn.
1.8.3. Controles
Ter aanvulling op de testreeks moet of één testmediumcontrolereeks en, indien relevant, één controlereeks met het oplosmiddel of het dispergeermiddel worden uitgevoerd. Indien gebruikt moet de oplosmiddel- of dis-pergeermiddelconcentratie dezelfde zijn als in de vaten met de teststof. Het juiste aantal replicatieonderzoeken moet worden verricht (zie punt 1.8.1.3).
Bij een goed uitgevoerde test moet de coëfficiënt van de variatie rond het gemiddelde aantal levende nakomelingen per moederdier in de controlegroep(en) in de regel ≤ 25 % zijn; dit moet worden vermeld voor elke testopzet waarbij gebruik wordt gemaakt van afzonderlijk gehouden dieren.
1.8.4. Verversing van het testmedium
De frequentie waarmee het medium wordt ververst, hangt af van de stabiliteit van de teststof, maar moet ten minste driemaal per week zijn. Indien, uit voorafgaande stabiliteitstests (zie punt 1.4) blijkt dat de teststofconcentratie niet stabiel is (d.w.z. buiten het bereik van 80-120 % van de nominale concentratie of dalend tot onder 80 % van de gemeten beginconcentratie) gedurende de maximale verversingsperiode (d.w.z. drie dagen), moet worden overwogen het medium vaker te verversen of gebruik te maken van een doorstroomtest.
Wanneer het medium wordt ververst in semistatische tests, wordt een tweede reeks testvaten bereid waarin de moederdieren worden overgebracht door middel van bijvoorbeeld een glazen pipet met een geschikte diameter. De hoeveelheid met de Daphnia overgebracht medium moet zo klein mogelijk zijn.
1.8.5. Observaties
De resultaten van de observaties gedurende de test moeten worden vermeld op informatiebladen (zie de voorbeelden in de aanhangsels 3 en 4). Indien er nog andere metingen gedaan moeten worden (zie de punten 1.3 en 1.8.8), zijn er mogelijk meer observaties nodig.
1.8.6. Nakomelingen
De door elk moederdier voortgebrachte nakomelingen moeten bij voorkeur dagelijks worden verwijderd en geteld vanaf het moment dat het eerste broedsel verschijnt, teneinde te voorkomen dat ze voer opeten dat voor de volwassen dieren is bestemd. Hoewel in het kader van deze methode alleen het aantal levende nakomelingen moet worden geteld, moet ook de aanwezigheid van niet-uitgekomen eitjes of dode nakomelingen worden vermeld.
1.8.7. Mortaliteit
De mortaliteit onder de moederdieren moet bij voorkeur dagelijks worden geregistreerd en ten minste op dezelfde tijdstippen als de telling van de nakomelingen.
1.8.8. Andere parameters
Hoewel deze methode voornamelijk bedoeld is voor de beoordeling van de effecten op de voortplanting, kunnen er mogelijk ook andere effecten in zodanige mate worden gekwantificeerd dat statistische analyse mogelijk is. Groeimetingen zijn zeer wenselijk aangezien zij informatie verschaffen over mogelijke subletale effecten, welke gegevens soms bruikbaarder zijn dan voortplantingsmetingen alleen; de meting van de lengte van de moederdieren (d.w.z. de lichaamslengte met uitzondering van het anale uiteinde) aan het eind van de test wordt aanbevolen. Andere te meten of te berekenen parameters zijn de tijd die nodig is om het eerste broedsel (en de daaropvolgende broedsels) voort te brengen, aantal en omvang van de nakomelingen per dier, aantal niet-uitgekomen eitjes, aanwezigheid van mannelijke dieren of ephippia en de intrinsieke groeisnelheid van de populatie.
1.8.9. Frequentie van analytische bepalingen en metingen
De zuurstofconcentratie, temperatuur, hardheid en pH-waarden moeten ten minste eenmaal per week worden gemeten, in verse en oude media, in de controle(s) en in de hoogste teststofconcentratie.
Tijdens de test worden de concentraties van de teststof regelmatig bepaald.
Bij semistatische tests waarbij de concentratie van de teststof naar verwachting binnen ± 20 % van de nominale waarde zal blijven (d.w.z. binnen het bereik van 80-120 %, zie de punten 1.4 en 1.8.4), verdient het aanbeveling de hoogste en laagste testconcentraties in ieder geval te analyseren bij de verse bereiding ervan alsmede eenmaal bij verversing in de eerste week van de test (d.w.z. analyses moeten worden verricht op een monster van een en dezelfde oplossing — bij verse bereiding en bij verversing). Daarna moeten deze bepalingen in ieder geval wekelijks worden herhaald.
Bij tests waarbij de concentratie van de teststof naar verwachting niet binnen ± 20 % van de nominale waarde zal blijven, moeten alle testconcentraties zowel bij de verse bereiding als bij verversing worden geanalyseerd. Bij tests echter waarbij de gemeten beginconcentratie van de teststof weliswaar niet binnen ± 20 % van de nominale waarde ligt. maar wel naar tevredenheid kan worden aangetoond dat de beginconcentraties herhaalbaar en stabiel zijn (d.w.z. binnen het bereik van 80-120 % van de beginconcentraties), kunnen de chemische bepalingen in de weken 2 en 3 van de test worden beperkt tot de hoogste en laagste testconcentraties. In alle gevallen hoeft de bepaling van teststofconcentraties vóór de verversing slechts op één replicatieonderzoekvat bij elke testconcentratie te worden uitgevoerd.
Bij doorstroomtests is een gelijksoortige monstermethode van toepassing als bij semistatische tests (met dien verstande dat de meting van oplossingen hier niet van toepassing is). Desalniettemin kan het raadzaam zijn meer monsters te nemen in de eerste week (bijvoorbeeld via drie reeksen metingen) om te bewerkstelligen dat de testconcentraties stabiel blijven. Bij dit soort testen moet de doorstromingssnelheid van het oplosmiddel en de teststof dagelijks worden gecontroleerd.
Als er voldoende aanwijzingen zijn dat de concentratie van de te testen stof gedurende de gehele test en naar tevredenheid binnen ± 20 % van de nominale of gemeten beginconcentratie is gebleven, mogen de resultaten worden gebaseerd op nominale of gemeten beginwaarden. Indien de afwijking van de nominale of gemeten beginconcentratie groter is dan ± 20 %, moeten de resultaten worden uitgedrukt in tijdgewogen gemiddelde (zie aanhangsel 5).
2. GEGEVENS EN RAPPORTAGE
2.1. VERWERKING VAN DE RESULTATEN
Het doel van de test is het bepalen van het effect van de teststof op het totale aantal levende nakomelingen per moederdier dat aan het eind van de test nog in leven is. Het totale aantal nakomelingen per moederdier moet per testvat worden berekend (d.w.z. via replicatieonderzoek). Als bij een replicatieonderzoek het moederdier sterft tijdens de test of als het blijkt te gaan om een mannelijk dier, wordt dat replicatieonderzoek niet meegenomen in de analyse. De analyse zal in dat geval worden gebaseerd op een lager aantal replicatieonderzoeken.
Voor de schatting van de LOEC — en daarmee de NOEC — met betrekking tot de effecten van de chemische stof op het voortplantingsresultaat moet het gemiddelde voortplantingsresultaat van alle replicatieonderzoeken bij elke concentratie en de gebundelde reststandaardafwijking worden berekend aan de hand van variantie-analyse (ANOVA). Vervolgens moet per concentratie het gemiddelde worden vergeleken met het controlegemiddelde aan de hand van een geschikte meervoudigevergelijkingsmethode. Geschikt zijn de Dunnett- of Williams-test (14) (15) (16) (17). Gecontroleerd moet worden of de binnen de ANOVA gehanteerde aanname betreffende de variantiehomogeniteit standhoudt. Dit kan beter langs grafische weg worden gedaan dan middels een formele significantietest (18); een Bartlett-test is een geschikt alternatief. Als de aanname geen stand houdt moet transformatie van gegevens worden overwogen om de varianties vóór de ANOVA te homogeniseren of om een gewogen ANOVA uit te voeren. De omvang van het met behulp van ANOVA waarneembare effect (d.w.z. het geringste significante verschil) moet worden berekend en vermeld.
Voor de schatting van de concentratie die zou leiden tot een achteruitgang met 50 % van het voortplantingsresultaat (d.w.z. de EC50), moet voor de gegevens een geschikte kromme — bijvoorbeeld een logistieke kromme — worden uitgezet met behulp van een statistische methode zoals die van de kleinste kwadraten. De parameters van de kromme kunnen zo worden gekozen dat de EC50 en de standaardafwijking daarvan direct kunnen worden geschat, waarmee de berekening van de betrouwbaarheidsgrenzen betreffende de EC50 aanzienlijk kan worden vergemakkelijkt. Tenzij er goede redenen zijn om de voorkeur te geven aan verschillende betrouwbaarheidsniveaus, moeten tweezijdig 95 % betrouwbaarheidsgrenzen worden vermeld. De procedure moet bij voorkeur voorzien in een methode voor de beoordeling van de significantie van het gebrek aan „fit”. Dit kan langs grafische weg geschieden, of door middel van verdeling van de restsom van de kwadraten in „gebrek aan fit” en „zuivere afwijkingscomponenten” en uitvoering van een significantietest inzake dat „gebrek aan fit”. Aangezien behandelingen die leiden tot een hoge vruchtbaarheid waarschijnlijk een grotere variante in het aantal voortgebrachte nakomelingen hebben dan behandelingen die leiden tot een lage vruchtbaarheid, moet weging van de vastgestelde waarden om de verschillende varianties in de verschillende behandelingsgroepen tot uitdrukking te brengen, in overweging worden genomen (zie voor achtergrondinformatie referentie 18).
Bij de analyse van de gegevens van de eindringtest (2) is een logistieke kromme uitgezet aan de hand van het volgende model, waarbij moet worden aangetekend dat ook andere geschikte modellen gebruikt mogen worden:

waarin:
|
Y |
= |
het totale aantal nakomelingen per moederdier dat aan het eind van de test nog in leven was (berekend per vat); |
|
x |
= |
de stofconcentratie; |
|
c |
= |
het verwachte aantal nakomelingen wanneer x = 0; |
|
x0 |
= |
de EC50 in de populatie; |
|
b |
= |
de hellingsparameter. |
In de meeste situaties zal dit model naar alle waarschijnlijkheid voldoen, maar er zijn ook tests waar dat niet opgaat. De geldigheid van het hierboven voorgestelde model moet worden gecontroleerd. In sommige gevallen kan een hormesismodel waarin lage concentraties sterkere effecten sorteren, uitkomst bieden (19).
Ook concentraties betreffende andere effecten zoals de EC10 of EC20 kunnen worden geschat, zij het dat het wellicht beter is andere parameters voor het model te kiezen dan die welke worden gebruikt bij de schatting van de EC50.
2.2. TESTRAPPORT
Het testrapport moet het volgende omvatten:
2.2.1. Teststof
|
— |
Fysische kenmerken en relevante fysisch-chemische eigenschappen. |
|
— |
Chemische identificatiegegevens, waaronder de zuiverheid. |
2.2.2. Testsoort
|
— |
De kloon (ongeacht of die genetisch getypeerd is), leverancier of bron (voor zover bekend) en de toegepaste cultuuromstandigheden. Als gebruik wordt gemaakt van een andere soort dan Daphnia magna, moet dit worden gerapporteerd en beargumenteerd. |
2.2.3. Testomstandigheden
|
— |
Toegepaste testprocedure (bijvoorbeeld semistatisch of doorstroom, volume, hoeveelheid Daphnia per liter). |
|
— |
Fotoperiode en lichtintensiteit. |
|
— |
Testopzet (bijvoorbeeld aantal replicatieonderzoeken, aantal moederdieren per replicatieonderzoek). |
|
— |
Bijzonderheden over het gebruikte kweekmedium. |
|
— |
Voor zover gebruikt, toevoegingen van organisch materiaal, met inbegrip van de samenstelling, bron. bereidingsmethode, TOC/COD van stamoplossingen, schatting van de resulterende TOC/COD in het test- medium. |
|
— |
Gedetailleerde informatie over voeding, waaronder de hoeveelheid (in mg C/Daphnia/dag) en het schema (bijvoorbeeld soort voer, met inbegrip van de specifieke naam (soort) wat de algen betreft en, voor zover bekend, de stam en de kweekomstandigheden). |
|
— |
Bereidingsmethode van stamoplossingen en frequentie van de verversing (indien gebruikt, moeten het oplosmiddel en het dispergeermiddel alsmede de concentratie ervan worden vermeld). |
2.2.4. Resultaten
|
— |
Resultaten van eventuele voorafgaande studies naar de stabiliteit van de teststof. |
|
— |
De nominale testconcentraties en de resultaten van alle analyses ter bepaling van de concentratie van de teststof in de testvaten (zie voorbeeld informatiebladen in aanhangsel 4); de herstelcapaciteit van de methode en de bepalingsgrens moeten ook worden gerapporteerd. |
|
— |
Waterkwaliteit in de testvaten (d.w.z. pH, temperatuur en opgeloste-zuurstofconcentratie, en TOC en/of COD en hardheid waar van toepassing) (zie voorbeeld informatieblad in aanhangsel 3). |
|
— |
De volledige gegevens over de levende nakomelingen per moederdier (zie voorbeeld informatieblad in aanhangsel 3). |
|
— |
Sterftecijfer onder de moederdieren en de dag (en) waarop de sterfte plaatsvond (zie voorbeeld informatie blad in aanhangsel 3). |
|
— |
De variatiecoëfficiënt van de vruchtbaarheid in de controlegroep (gebaseerd op het totale aantal levende nakomelingen per moederdier dat aan het eind van de test nog in leven was). |
|
— |
Grafische voorstelling van het totale aantal levende nakomelingen per moederdier (voor elk replicatieonderzoek) dat nog in leven was aan het eind van de test afgezet tegen de concentratie van de teststof. |
|
— |
De Lowest Observed Effect Concentration (LOEC) voor de voortplanting, inclusief een beschrijving van de toegepaste statistische procedures en een indicatie van de omvang van het effect dat zou kunnen worden waargenomen, alsmede de No Observed Effect Concentration (NOEC) voor de voortplanting; waar van toepassing moet ook de LOEC/NOEC betreffende de moraliteit van de moederdieren worden vermeld. |
|
— |
Voor zover van toepassing, de ECX betreffende de voortplanting en betrouwbaarheidsintervallen en een grafiek van het het voor de berekening daarvan gehanteerde model de helling van de dosis-responscurve en de standaardafwijking daarvan. |
|
— |
Andere waargenomen biologische effecten of metingen: vermelding van eventuele andere biologische effecten die werden waargenomen of gemeten (bijvoorbeeld groei van moederdieren), met inbegrip van eventuele passende onderbouwing. |
|
— |
Een toelichting op eventuele afwijkingen van de testmethode. |
3. REFERENTIES
|
(1) |
OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 maart 1993. |
|
(2) |
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997. |
|
(3) |
Baird D.J., Barber J., Bradley M.C., Soares A.M.V.M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, blz. 257-265. |
|
(4) |
Elendt B.P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, blz. 25-33. |
|
(5) |
EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio. |
|
(6) |
Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, blz. 775-782. |
|
(7) |
ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. 20 blz. |
|
(8) |
Baird D.J., Soares A.M.V.M., Girling A., Barber J., Bradley M.C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H. Løkke, H. Tyle & F. Bro-Rasmussen. Eds.), blz. 144-148. |
|
(9) |
Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, blz. 1-8. |
|
(10) |
Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), blz. 185-196. |
|
(11) |
Korshikov (1990). Pseudohrchnericlla subcapitata Hindak, F-1990. Biologice Prace, 36, 209. |
|
(12) |
Sims I.R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, blz. 2053-2058. |
|
(13) |
Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, blz. 459-466. |
|
(14) |
Dunnett C.W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, blz. 1096-1121. |
|
(15) |
Dunnett C.W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, blz. 482-491. |
|
(16) |
Williams D. A. (1971). A test lor differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, blz. 103-117. |
|
(17) |
Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, blz. 510-531. |
|
(18) |
Draper N.R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y. |
|
(19) |
Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, blz. 93-96. |
|
(20) |
Wilson E.O. and Bossen, W. H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers. |
|
(21) |
Poole R.W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York. blz. 532. |
|
(22) |
Meyer J. S., Ingersoll C. G., McDonald L.L. and Bovce M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, blz. 1156-1166. |
Aanhangsel 1
BEREIDING VAN VOLLEDIG BESCHREVEN MEDIA ELENDT M7 EN M4
Acclimatisering aan Elendt M7- en Elendt M4-media
Sommige laboratoria hebben problemen ondervonden bij het rechtstreeks overbrengen van Daphnia in M4- (1) en M7-media. Toch is er enig succes geboekt met geleidelijke acclimatisering, d.w.z. overgang van het eigen medium naar 30 % Elendt, vervolgens naar 60 % Elendt en tot slot naar 100 % Elendt. Soms is een acclimatiseringsperiode van een volle maand nodig.
BEREIDING
Spoorelementen
Afzonderlijke stamoplossingen (I) van individuele spoorelementen worden eerst bereid in water met een geschikte zuiverheid, d.w.z. gedeïoniseerd, gedistilleerd of omgekeerde osmose. Uit deze verschillende stamoplossingen (I) wordt een enkelvoudige stamoplossing (II) bereid, die alle spoorelementen bevat (gecombineerde oplossing), te weten:
|
Stamoplossingen I (enkelvoudige stof) |
Aan water toegevoegde hoeveelheid (mg/l) |
Concentratie (in relatie tot medium M4) (-voudig) |
Ter bereiding van de gecombineerde stamoplossing II de volgende hoeveelheid stamoplossing I aan water toevoegen (ml/l) |
|
|
M 4 |
M 7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 * 4 H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 * 6 H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 * 2 H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 * 2 H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 * 6 H2O |
200 |
20 000 |
1,0 |
1,0 |
|
Kl |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2EDTA * 2 H2O |
5 000 |
2 000 – |
— |
— |
|
FeSO4 * 7 H2O |
1 991 |
2 000 |
— |
— |
|
Zowel de Na2EDTA- als de FeSO4-oplossingen worden enkelvoudig bereid, samengebracht en onmiddellijk met een autoclaaf gesteriliseerd. Hiermee wordt verkregen: |
||||
|
21 Fe-EDTA-oplossing |
|
1 000 |
20,0 |
5,0 |
M4- en M7-media
M4- en M7-media worden als volgt bereid met behulp van stamoplossing II, macronutriënten en vitamines:
|
|
Aan water toegevoegde hoeveelheid (mg/l) |
Concentratie (in relatie tot medium M4) (-voudig) |
Toegevoegde hoeveelheid stamoplossing ter bereiding van medium (ml/l) |
|||||
|
M 4 |
M 7 |
|||||||
|
Stamoplossing II gecombineerde spoorelementen |
|
20 |
50 |
50 |
||||
|
Macronutriëntstamoplossingen |
||||||||
|
CaCl2 * 2 H2O |
293 800 |
1 000 |
1,0 |
1,0 |
||||
|
MgSO4 * 7 H2O |
246 600 |
2 000 |
0,5 |
0,5 |
||||
|
KC1 |
58 000 |
10 000 |
0,1 |
0,1 |
||||
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
||||
|
Na2SiO3 * 9 H2O |
50 000 |
5 000 |
0,2 |
0,2 |
||||
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
||||
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
||||
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
||||
|
Gecombineerde vitaminestamoplossing |
— |
10 000 |
0,1 |
0,1 |
||||
|
De gecombineerde vitaminestamoplossing wordt bereid door toevoeging van de 3 vitamines aan 1 liter water, zoals hieronder weergegeven: |
||||||||
|
Thiaminehydrochloride |
750 |
10 000 |
— |
— |
||||
|
Cyanocobalamine (B12) |
10 |
10 000 |
— |
— |
||||
|
Biotine |
7,5 |
10 000 |
— |
— |
||||
|
De gecombineerde vitaminestamoplossing wordt in bevroren toestand bewaard in kleine fracties. De vitamines worden kort vóór gebruik aan de media toegevoegd.
|
||||||||
Aanhangsel 2
TOTALE ORGANISCHE KOOLSTOF (TOC) ANALYSE EN OPSTELLING VAN EEN NOMOGRAFIE VOOR TOC-GEHALTE VAN ALGENVOEDING
Normaal gesproken wordt het koolstofgehalte van de algenvoeding niet rechtstreeks gemeten, maar afgeleid uit correlaties (d.w.z. nomografieën) met alternatieve middelen zoals algencelaantal of lichtabsorptie.
De TOC moet worden gemeten via hogetemperatuuroxidatie en niet met methoden op basis van uv of persulfaat. (Zie: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Hol-born, Londen WC1V 6HB.)
Voor het opstellen van nomografieën moeten algen middels centrifugeren worden gescheiden van het groeimedium, gevolgd door hersuspensie in gedistilleerd water. De surrogaatparameter en de TOC-concentratie moet in elk monster driemaal worden gemeten. Blanco's van gedistilleerd water moeten worden geanalyseerd; de TOC-concentratie moet worden afgeleid uit die van het algenmonster.
De nomografie moet lineair zijn over het vereiste koolstofconcentratiebereik. Voorbeelden zijn hieronder weergegeven.
NB: Deze grafieken mogen niet worden gebruikt voor conversiedoeleinden; het is van wezenlijk belang dat laboratoria hun eigen nomografieën opstellen.



Aanhangsel 3
VOORBEELD INFORMATIEBLAD VOOR REGISTRATIE VAN MEDIUMVERVERSING, FYSISCH-CHEMISCHE CONTROLEGEGEVENS, VOEDING, DAPHNIA-VOORTPLANTING EN MORTALITEIT VOLWASSEN DIEREN
|
Experiment nr: |
Begin gegevens: |
Kloon: |
Medium: |
Type voeding: |
Teststof: |
Nominale concentratie: |
||||||||||||||||||
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
Renov. medio (mar-car) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nieuw |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oud |
|
|
|
O2 mg/l (38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nieuw |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oud |
|
|
|
Temp ( oC) (38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nieuw |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oud |
|
|
|
Voeding gegeven |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aantal levende nakomelingen (39) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal |
|
Vat 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal |
|
|
Cumulatieve mortaliteit volwassen dieren (40) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aanhangsel 4
VOORBEELD INFORMATIEBLAD VOOR REGISTRATIE VAN RESULTATEN CHEMISCHE ANALYSE
a) Gemeten concentraties
|
Nominale concentratie |
Monster week 1 |
Monster week 2 |
Monster week 3 |
|||
|
Vers |
Oud |
Vers |
Oud |
Vers |
Oud |
|
|
|
|
|
|
|
|
|
b) Gemeten concentraties als percentage van nominale concentratie
|
Nominale concentratie |
Monster week 1 |
Monster week 2 |
Monster week 3 |
|||
|
Vers |
Oud |
Vers |
Oud |
Vers |
Oud |
|
|
|
|
|
|
|
|
|
Aanhangsel 5
BEREKENING TIJDGEWOGEN GEMIDDELDE
Tijdgewogen gemiddelde
Daar de concentratie van de teststof in de periode tussen de mediumverversingen kan afnemen, moet goed worden bekeken welke concentratie moet worden gekozen als representatief voor het concentratiebereik dat wordt ondergaan door de Daphnia-moederdieren. Deze keuze moet gebaseerd zijn op biologische én statistische overwegingen. Als bijvoorbeeld wordt aangenomen dat de voortplanting vóór alles wordt beïnvloed door de piekconcentratie, moet de maximumconcentratie worden gebruikt. Wanneer men er daarentegen van uitgaat dat het geaccumuleerde of langeretermijn-effect van de toxische stof belangrijker is, is een gemiddelde concentratie relevanter. In dat geval is de tijdgewogen gemiddelde concentratie geschikt, aangezien daarbij rekening wordt gehouden met de variatie van de momentane concentratie over een bepaalde tijdsperiode.
Figuur 1:
Voorbeeld van tijdgewogen gemiddelde

Figuur 1 laat een voorbeeld zien van een (vereenvoudigde) test over zeven dagen met mediumverversing op dag 0, 2 en 4.
|
|
De dunne zigzaglijn geeft de concentratie op enig tijdstip weer. Als vooronderstelling geldt dat de concentratie daalt volgens een exponentieel achteruitgangsproces. |
|
|
De zes vierkantjes geven de waargenomen concentraties weer zoals gemeten aan het begin en het einde van elke verversingsperiode. |
|
|
De dikke, ononderbroken lijn geeft het tijdgewogen gemiddelde weer. |
Het tijdgewogen gemiddelde wordt zo berekend dat het oppervlak onder dat gemiddelde gelijk is aan het oppervlak onder de concentratiekromme. Zie onderstaande tabel 1 voor de berekening van dit voorbeeld.
Tabel 1:
Berekening van het tijdgewogen gemiddelde
|
Verversing nr. |
Dagen |
Conc0 |
Concl |
Ln(Conc0) |
Ln(Concl) |
Oppervlak |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Totaal dagen: 7 |
Totaal oppervlak |
50,091 |
||||
|
Tijdgewogen gemiddelde |
7,156 |
|||||
|
Dagen: het aantal dagen in de verversingsperiode. Conc0: de gemeten concentratie aan het begin van elke verversingsperiode. Conc1: de gemeten concentratie aan het einde van elke verversingsperiode. Ln(Conc0): de natuurlijke logaritme van Conc0. Ln(Conc1): de natuurlijke logaritme van Conc1. Oppervlak: het oppervlak onder de exponentiele kromme voor elke verversingsperiode. Het wordt berekend aan de hand van de volgende formule:
|
||||||
Het „Tijdgewogen gemiddelde” is het „Totaal oppervlak” gedeeld door het „Totaal dagen”.
Voor de toepasbaarheid op de Daphnia-voortplantingstest zou de tabel uiteraard moeten worden uitgebreid en betrekking moeten hebben op een periode van 21 dagen.
Het is duidelijk dat niet bevestigd kan worden dat het achteruitgangsproces inderdaad exponentieel is als de waarnemingen alleen plaatsvinden aan het begin en einde van elke verversingsperiode. Een andere kromme zou resulteren in een andere berekening van het „Oppervlak”. Hoe dan ook, het is alleszins plausibel uit te gaan van een exponentieel achteruitgangsproces en de weergegeven kromme is waarschijnlijk het beste alternatief bij gebrek aan andere gegevens.
Toch is de nodige voorzichtigheid geboden als geen enkele stof wordt aangetroffen bij de chemische analyse aan het eind van de verversingsperiode. Als niet ingeschat kan worden hoe snel de stof uit de oplossing verdwenen is, kan er ook geen realistisch oppervlak onder de kromme worden vastgesteld, en dus ook geen aannemelijk tijdgewogen gemiddelde.
C.21. MICRO-ORGANISMEN IN DE BODEM: BEPALING VAN DE OMZETTING VAN STIKSTOF
1. METHODE
Deze methode is overgenomen van TG 216 (2000) van de OESO.
1.1. INLEIDING
In deze testmethode wordt een laboratoriumtest beschreven om te onderzoeken welke effecten chemische stoffen na één blootstelling op lange termijn hebben op de omzetting van stikstof door micro-organismen in de bodem. De test is in eerste instantie gebaseerd op aanbevelingen van de Organisatie voor de bescherming van planten in Europa en het Middellandse Zeegebied (1). Er is echter ook rekening gehouden met andere richtsnoeren, bijvoorbeeld van de Biologische Bundesanstalt in Duitsland (2), het Environmental Protection Agency in de VS (3) de SETAC (4) en de Internationale Organisatie voor Normalisatie (5). Tijdens een workshop van de OESO over de selectie van bodem/sediment in Belgirate in Italië in 1995 (6) is overeenstemming bereikt over het aantal en de aard van de in deze test te gebruiken bodemmonsters. De aanbevelingen voor het verzamelen, behandelen en bewaren van de bodemmonsters zijn gebaseerd op ISO-richtsnoeren (7) en aanbevelingen van de workshop in Belgirate. Bij de beoordeling en evaluatie van toxische kenmerken van teststoffen kan het nodig zijn de effecten op de microbiële activiteit van de bodem te bepalen, bijvoorbeeld wanneer er gegevens over de potentiële neveneffecten van gewasbeschermingsmiddelen op de microflora van de bodem nodig zijn of wanneer wordt verwacht dat de micro-organismen in de bodem aan andere chemische stoffen dan gewasbeschermingsmiddelen worden blootgesteld. De bepaling van de omzetting van stikstof wordt uitgevoerd om de effecten van deze chemische stoffen op de microflora van de bodem te bepalen. Als er landbouwchemicaliën (b.v. gewasbeschermingsmiddelen, kunstmest of bosbouwchemicaliën) worden getest, worden zowel de bepaling van de omzetting van stikstof als de bepaling van de omzetting van koolstof uitgevoerd. Als er andere stoffen dan landbouwchemicaliën worden getest, volstaat de bepaling van de omzetting van stikstof. Als de EC50 bij de bepaling van de omzetting van stikstof voor dergelijke stoffen echter binnen het bereik valt van de waarde die voor in de handel verkrijgbare nitrificatieremmers (zoals nitrapyrin) wordt gevonden, kan een bepaling van de omzetting van koolstof worden uitgevoerd om nadere informatie te verkrijgen.
De bodem bestaat uit levende en niet-levende componenten die complexe en heterogene mengsels kunnen vormen. Micro-organismen spelen een belangrijke rol bij de afbraak en omzetting van organisch materiaal in vruchtbare bodem en veel soorten dragen bij tot verschillende aspecten van de vruchtbaarheid van de bodem. Een verstoring van deze biochemische processen op lange termijn kan mogelijkerwijs de cycli van nutriënten verstoren en verandering brengen in de vruchtbaarheid van de bodem. Omzetting van koolstof en stikstof vindt in elke vruchtbare bodem plaats. Hoewel de voor deze processen verantwoordelijke microbiële levensgemeenschappen van bodem tot bodem verschillen, zijn de omzettingsroutes in grote lijnen gelijk.
De hier beschreven testmethode is bedoeld om te detecteren welke schadelijke effecten een stof op lange termijn op het omzettingsproces van stikstof in een aërobe bodem aan het oppervlak kan hebben. Met de testmethode kunnen ook de effecten van stoffen op de omzetting van koolstof door de microflora in de bodem worden bepaald. De vorming van nitraat vindt plaats na het verbreken van de koolstof/stikstof-binding. Als er in de behandelde en de controlebodem een even hoge nitraatproductie wordt gemeten, is het daarom zeer waarschijnlijk dat de belangrijkste afbraakroutes voor koolstof intact zijn en functioneren. Het voor de test gekozen substraat (verpoederd luzememeel) heeft een gunstige koolstof/stikstof-verhouding (meestal tussen 12/1 en 16/1). Daardoor is er tijdens de test een geringer koolstoftekort en kunnen microbiële levensgemeenschappen, als ze door een chemische stof worden aangetast, zich binnen 100 dagen weer herstellen.
Deze testmethode is ontwikkeld uit tests die in eerste instantie bedoeld waren voor stoffen waarvoor kan worden geraamd welke hoeveelheid de bodem bereikt. Dit geldt bijvoorbeeld voor gewasbeschermingsmiddelen die in bekende hoeveelheden op het veld worden gebracht. Voor landbouwchemicaliën is het voldoende twee doses te testen die relevant zijn voor de opgebrachte hoeveelheid die wordt verwacht of geraamd. Landbouwchemicaliën kunnen als werkzame stof of als geformuleerd product worden getest. De test kan echter ook voor andere stoffen worden gebruikt. Door zowel de op de bodem gebrachte hoeveelheid teststof als de manier waarop de gegevens worden geëvalueerd, te veranderen, kan de test ook worden gebruikt voor chemische stoffen waarvoor niet bekend is hoeveel er naar verwachting in de bodem terecht zal komen. Daarom worden voor andere stoffen dan landbouwchemicaliën de effecten van een reeks concentraties op de omzetting van stikstof bepaald. De gegevens uit deze tests worden gebruikt om een dosis/respons-curve samen te stellen en ECx-waarden te berekenen, waarbij x het procentuele effect aangeeft.
1.2. DEFINITIES
Omzetting van stikstof: de uiteindelijke afbraak van stikstofhoudend organisch materiaal door micro-organismen via ammonificatie en nitrificatie tot het anorganische eindproduct nitraat.
EC x (effectieve concentratie): de concentratie van de teststof in de bodem die leidt tot een remming van de omzetting van stikstof in nitraat met x procent.
EC 50 (mediaan van de effectieve concentratie): de concentratie van de teststof in de bodem die leidt tot een remming van de omzetting van stikstof in nitraat met 50 procent (50 %).
1.3. REFERENTIESTOFFEN
Geen.
1.4. PRINCIPE VAN DE TESTMETHODE
Gezeefde bodem wordt verbeterd met verpoederd plantenmeel en hetzij behandeld met de teststof, hetzij niet behandeld (controle). Als er landbouwchemicaliën worden getest, wordt aanbevolen minimaal twee concentraties te testen die moeten worden gekozen op grond van de hoogste concentratie die op het veld wordt verwacht. Na 0, 7, 14 en 28 dagen incubatie worden monsters van de behandelde en de controlebodem geëxtraheerd met een geschikt oplosmiddel en wordt de hoeveelheid nitraat in de extracten bepaald. De nitraatvorming in de behandelde monsters wordt vergeleken met de controlemonsters en de procentuele afwijking van de behandelde ten opzichte van de controlemonsters wordt berekend. Alle tests duren ten minste 28 dagen. Als op dag 28 het verschil tussen de behandelde en de controlebodem 25 % of groter is, worden de metingen voortgezet tot maximaal 100 dagen. Als er andere stoffen dan landbouwchemicaliën worden getest, wordt de teststof in een reeks concentraties aan de bodemmonsters toegevoegd en wordt na 28 dagen incubatie de hoeveelheid nitraat in de behandelde en de controlemonsters bepaald. De resultaten van tests met verschillende concentraties worden aan regressieanalyse onderworpen en de ECx-waarden (d.w.z. de EC50, de EC25 en/of de EC10) worden berekend. Zie ook de definities.
1.5. GELDIGHEID VAN DE TEST
Bij landbouwchemicaliën wordt de evaluatie van de testresultaten gebaseerd op betrekkelijk kleine verschillen (gemiddeld ± 25 %) tussen de nitraatconcentratie in de behandelde en de controlemonsters en grote verschillen in de controles kunnen dan ook tot onjuiste resultaten leiden. Het verschil tussen replicaat-controlemonsters moet derhalve kleiner zijn dan ± 15 %.
1.6. BESCHRIJVING VAN DE TESTMETHODE
1.6.1. Apparatuur
Er worden testbakken van chemisch inert materiaal gebruikt. Het volume moet geschikt zijn voor de procedure die voor de incubatie van de bodem wordt gebruikt, d.w.z. incubatie in één keer of als een reeks afzonderlijke bodemmonsters (zie punt 1.7.1.2). Het waterverlies moet tot een minimum worden beperkt maar gasuitwisseling moet tijdens de test mogelijk zijn (de testbakken kunnen bijvoorbeeld met geperforeerde polyetheenfolie worden afgedekt). Wanneer vluchtige stoffen worden getest, moeten er afsluitbare gasdichte bakken worden gebruikt. Deze moeten zo groot zijn dat het bodemmonster ongeveer een kwart van hun volume beslaat.
Er wordt standaardlaboratoriumapparatuur gebruikt, waaronder:
|
— |
een schudapparaat: een mechanische schudmachine of gelijkwaardige apparatuur; |
|
— |
een centrifuge (3 000 g) of filtreerapparaat (met nitraatvrij filtreerpapier); |
|
— |
een instrument voor nitraatanalyse met een afdoende gevoeligheid en reproduceerbaarheid. |
1.6.2. Selectie en aantal bodemsoorten
Er wordt één bodemsoort gebruikt. De aanbevolen kenmerken van de bodem zijn:
|
— |
zandgehalte: minimaal 50 % en maximaal 75 %; |
|
— |
pH: 5,5-7,5; |
|
— |
organisch koolstofgehalte: 0,5-1,5 %; |
|
— |
de microbiële biomassa moet worden gemeten (8)(9) en het koolstofgehalte daarvan moet minimaal 1 % van het totale organische koolstofgehalte van de bodem zijn. |
In de meeste gevallen levert een bodem met deze kenmerken de ongunstigste situatie op, aangezien de adsorptie van de teststof minimaal is en de beschikbaarheid voor de flora maximaal. Een test met andere bodemsoorten is dan ook meestal niet nodig. In bepaalde gevallen, bijvoorbeeld wanneer de teststof naar verwachting vooral bij bepaalde bodemsoorten zoals zure bosgrond zal worden gebruikt of bij elektrostatisch geladen chemische stoffen, kan het echter nodig zijn nog een andere bodemsoort te gebruiken.
1.6.3. Verzameling en opslag van de bodemmonsters
1.6.3.1. Verzameling
Er moet gedetailleerde informatie beschikbaar zijn over de geschiedenis van de locatie waar de testbodem wordt verzameld, zoals de exacte ligging, de vegetatie, de data van behandelingen met gewasbeschermingsmiddelen, behandelingen met organische en anorganische mest, toevoegingen van biologisch materiaal en onopzettelijke verontreinigingen. De voor de verzameling van de bodem gekozen locatie moet op lange termijn kunnen worden gebruikt. Permanente weidegrond en velden met eenjarige graangewassen (behalve maïs) of dicht ingezaaide groenbemestingsgewassen zijn geschikt. De gekozen monsternemingsplaats mag gedurende ten minste één jaar vóór de monsterneming niet met gewasbeschermingsmiddelen zijn behandeld. Ook mag er gedurende ten minste zes maanden geen organische mest zijn opgebracht. Het gebruik van anorganische mest is alleen aanvaardbaar wanneer dit in overeenstemming met de eisen van het gewas is en er mogen gedurende ten minste drie maanden na de opbrenging van de mest geen monsters worden genomen. Het gebruik van grond die is behandeld met meststoffen waarvan bekend is dat ze biocide-effecten hebben (b.v. calciumcyaanamide) moet worden vermeden.
Gedurende of vlak na lange perioden (meer dan 30 dagen) van droogte of doordrenking van de bodem mogen er geen monsters worden genomen. Bij een omgeploegde bodem moeten de monsters van een diepte van 0 tot 20 cm worden genomen. Bij grasland (weidegrond) of andere bodemsoorten waar gedurende lange perioden (ten minste één teeltseizoen) niet geploegd wordt, kan de maximale monsterdiepte iets groter dan 20 cm (b.v. maximaal 25 cm) zijn.
De bakken waarin en de temperatuur waarbij de bodemmonsters worden vervoerd, moeten zodanig zijn dat de oorspronkelijke eigenschappen van de bodem niet significant veranderen.
1.6.3.2. Opslag
Het gebruik van grond die net van het veld komt, verdient de voorkeur. Als opslag in het laboratorium niet kan worden vermeden, kan de grond gedurende maximaal drie maanden in het donker bij 4±2 oC worden bewaard. Tijdens de opslag van grond moet er voor aërobe omstandigheden worden gezorgd. Als de grond wordt verzameld in gebieden waar deze gedurende ten minste drie maanden per jaar bevriest, is opslag gedurende zes maanden bij - 18 oC tot - 22 oC mogelijk. Vóór elk experiment wordt de microbiële biomassa van opgeslagen grond gemeten; het koolstofgehalte van de biomassa moet minimaal 1 % van het totale organische koolstofgehalte van de bodem zijn (zie punt 1.6.2).
1.6.4. Behandeling en voorbereiding van de grond voor de test
1.6.4.1. Pre-incubatie
Als de grond opgeslagen was (zie punt 1.6.3.2), wordt pre-incubatie gedurende 2 tot 28 dagen aanbevolen. De temperatuur en het vochtgehalte van de bodem tijdens de pre-incubatie moeten vergelijkbaar zijn met die tijdens de test (zie de punten 1.6.4.2 en 1.7.1.3).
1.6.4.2. Fysisch-chemische kenmerken
De grond wordt met de hand ontdaan van grote voorwerpen (stenen, delen van planten enz.) en zonder overmatig drogen vochtig gezeefd tot een deeltjesgrootte van maximaal 2 mm. Het vochtgehalte van het bodemmonster moet met gedestilleerd of gedeïoniseerd water worden aangepast tot 40-60 % van het maximale watergehalte.
1.6.4.3. Verbetering met organisch substraat
De bodem wordt verbeterd met een geschikt organisch substraat, zoals verpoederd luzerne/grasmeel (hoofdbestanddeel Medicago sativa) met een C/N-verhouding tussen 12/1 en 16/1. De aanbevolen luzerne/bodem-verhouding is 5 gram luzerne per kg bodem (drooggewicht).
1.6.5. Voorbehandeling van de teststof voordat deze op de bodem wordt gebracht
De teststof wordt normaal gesproken met behulp van een draagstof opgebracht. Dit kan water zijn (voor in water oplosbare stoffen) of een inerte vaste stof zoals fijn kwartszand (deeltjesgrootte 0,1-0,5 mm). Andere vloeibare draagstoffen dan water (b.v. organische oplosmiddelen zoals aceton of chloroform) moeten worden vermeden omdat deze de microflora kunnen aantasten. Als zand als draagstof wordt gebruikt, kan deze worden gecoat met de in een geschikt oplosmiddel opgeloste of gesuspendeerde teststof. In dat geval moet het oplosmiddel vóór het mengen met de bodem door verdamping worden verwijderd. Voor een optimale verdeling van de teststof in de bodem wordt een verhouding van 10 g zand per kg grond (drooggewicht) aanbevolen. De controlemonsters worden behandeld met uitsluitend een even grote hoeveelheid water en/of kwartszand.
Bij het testen van vluchtige stoffen moeten verliezen tijdens de behandeling zoveel mogelijk worden voorkomen en moet er naar een homogene verdeling in de bodem worden gestreefd (de teststof kan bijvoorbeeld op verschillende plaatsen in de bodem worden geïnjecteerd).
1.6.6. Testconcentraties
Als er landbouwchemicaliën worden getest, moeten er ten minste twee concentraties worden gebruikt. De laagste concentratie moet ten minste overeenkomen met de maximale hoeveelheid die naar verwachting in de praktijk in de bodem terecht zal komen, terwijl de hoogste concentratie een veelvoud van de laagste concentratie moet zijn. Bij de berekening van de concentratie van de aan de bodem toegevoegde teststof wordt uitgegaan van een uniforme vermenging in de bodem tot een diepte van 5 cm en een dichtheid van de droge grond van 1,5. Voor landbouwchemicaliën die rechtstreeks op de bodem worden gebracht en voor chemische stoffen waarvoor de hoeveelheid die op de bodem terechtkomt voorspelbaar is, worden als testconcentratie de maximale PEC (predicted environmental concentration) en het vijfvoud van deze concentratie aanbevolen. Stoffen die naar verwachting meer dan één keer per seizoen op de bodem worden gebracht, moeten worden getest bij concentraties die worden berekend door de PEC te vermenigvuldigen met het aantal keren dat dit naar verwachting maximaal gebeurt. De hoogste geteste concentratie mag echter niet hoger zijn dan tien keer de maximale per keer opgebrachte hoeveelheid. Als andere stoffen dan landbouwchemicaliën worden getest, wordt een meetkundige reeks van ten minste vijf concentraties gebruikt. De geteste concentraties moeten het interval bestrijken dat voor de bepaling van de ECx-waarden nodig is.
1.7. UITVOERING VAN DE TEST
1.7.1. Blootstellingsomstandigheden
1.7.1.1. Behandeling en controle
Als er landbouwchemicaliën worden getest, wordt de grond in drie even zware porties verdeeld. Twee porties worden gemengd met de draagstof die de teststof bevat en de andere portie met de draagstof zonder teststof (controle). Voor zowel de behandelde als de controlegrond wordt minimaal een bepaling in triplo aanbevolen. Als er andere stoffen dan landbouwchemicaliën worden getest, wordt de grond in zes even zware porties verdeeld. Vijf porties worden gemengd met de draagstof die de teststof bevat en de andere portie met de draagstof zonder teststof. Voor zowel de behandelde als de controlegrond wordt een bepaling in triplo aanbevolen. Er moet worden gezorgd voor een homogene verdeling van de teststof in de behandelde bodemmonsters. Bij het mengen moeten comprimering en kluitvorming van de grond worden voorkomen.
1.7.1.2. Incubatie van de bodemmonsters
Incubatie van de bodemmonsters kan op twee manieren gebeuren: als één monster voor elke behandelde en onbehandelde bodem of als een reeks aparte even grote submonsters voor elke behandelde en onbehandelde bodem. Wanneer vluchtige stoffen worden getest, mag de test echter uitsluitend met een reeks aparte submonsters worden uitgevoerd. Wanneer de grond als één monster wordt geïncubeerd, worden grote hoeveelheden van elke behandelde en onbehandelde bodem geïncubeerd en worden tijdens de test waar nodig submonsters voor analyse genomen. De hoeveelheid die aanvankelijk voor elke behandelde en onbehandelde bodem wordt geïncubeerd, is afhankelijk van de grootte van de submonsters, het aantal replicaatbepalingen dat voor de analyse wordt gebruikt en het verwachte maximale aantal monsternemingstijdstippen. Grond die als één monster wordt geïncubeerd, moet vóór het nemen van submonsters grondig worden gemengd. Wanneer de bodem als een reeks aparte bodemmonsters wordt geïncubeerd, wordt elke portie behandelde en onbehandelde grond in het vereiste aantal submonsters verdeeld, die worden gebruikt wanneer ze nodig zijn. Wanneer bij een experiment meer dan twee monstememingstijdstippen kunnen worden verwacht, moeten er voldoende submonsters voor alle replicaatbepalingen en alle monsternemingstijdstippen worden gemaakt. Ten minste drie replicaatmonsters van de testbodem worden onder aërobe omstandigheden geïncubeerd (zie punt 1.7.1.1). Tijdens alle tests moeten er geschikte bakken worden gebruikt met voldoende ruimte boven de grond om te voorkomen dat er anaërobe omstandigheden ontstaan. Wanneer er vluchtige stoffen worden getest, mag de test uitsluitend met een reeks aparte submonsters worden uitgevoerd.
1.7.1.3. Testomstandigheden en duur van de test
De test wordt in het donker bij kamertemperatuur (20±2 oC) uitgevoerd. Het vochtgehalte van de bodemmonsters moet gedurende de test op 40-60 % van het maximale watergehalte van de bodem worden gehouden (zie punt 1.6.4.2) met een bereik van ±5 %. Indien nodig kan gedestilleerd of gedeïoniseerd water worden toegevoegd.
De minimale duur van een test is 28 dagen. Als er landbouwchemicaliën worden getest, wordt de nitraatvorming in behandelde en controlemonsters vergeleken. Als op dag 28 het verschil groter dan 25 % is, wordt de test voortgezet tot het verschil 25 % of minder is maar maximaal gedurende 100 dagen. Voor andere stoffen dan landbouwchemicaliën wordt de test na 28 dagen beëindigd. Op dag 28 wordt de hoeveelheid nitraat in de behandelde en de controlemonsters bepaald en worden de ECx-waarden berekend.
1.7.2. Monsterneming en analyse van de grond
1.7.2.1. Schema voor de monsterneming
Als er landbouwchemicaliën worden getest, worden de bodemmonsters op de dagen 0, 7, 14 en 28 op nitraat geanalyseerd. Als er een langere test nodig is, wordt na dag 28 om de 14 dagen een analyse uitgevoerd.
Als er andere stoffen dan landbouwchemicaliën worden getest, worden er ten minste vijf testconcentraties gebruikt en worden de bodemmonsters aan het begin (dag 0) en aan het eind van de blootstellingsperiode (dag 28) op nitraat geanalyseerd. Als dit nodig wordt geacht, kan er bijvoorbeeld op dag 7 een tussentijdse meting worden gedaan. De op dag 28 verkregen gegevens worden gebruikt om de ECx-waarde voor de chemische stof te bepalen. Als dat gewenst is, kunnen de gegevens van de controlemonsters op dag 0 worden gebruikt om de oorspronkelijke hoeveelheid nitraat in de bodem te bepalen.
1.7.2.2. Analyse van de bodemmonsters
Op elk monsternemingstijdstip wordt in elk replicaatmonster (behandeld en controle) de gevormde hoeveelheid nitraat bepaald. Het nitraat wordt uit de bodem geëxtraheerd door de monsters met een geschikte extractievloeistof, bijvoorbeeld een 0,1 M kaliumchlorideoplossing, te schudden. Een hoeveelheid van 5 ml KCl-oplossing per gram grond (drooggewicht) wordt aanbevolen. Om de extractie te optimaliseren, mogen de bakken met grond en extractievloeistof ten hoogste halfvol zijn. De mengsels worden gedurende 60 minuten bij 150 rpm geschud. De mengsels worden gecentrifugeerd of gefiltreerd en de vloeistoffase wordt op nitraat geanalyseerd. Deeltjesvrije vloeibare extracten kunnen vóór analyse maximaal zes maanden bij - 20±5 oC worden bewaard.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
Als de test met landbouwchemicaliën wordt uitgevoerd, wordt de gevormde hoeveelheid nitraat in elk replicaat-bodemmonster geregistreerd en worden de gemiddelde waarden van alle replicaatbepalingen in tabelvorm vermeld. De omzetting van stikstof wordt met adequate en algemeen erkende statistische methoden (b.v. een F-test, niveau met 5 % significantie) bepaald. De gevormde hoeveelheid nitraat wordt uitgedrukt in mg nitraat/kg drooggewicht bodem/dag. De nitraatvorming bij elke behandelde bodem wordt vergeleken met de controle en de procentuele afwijking van de controle wordt berekend.
Als de test met andere stoffen dan landbouwchemicaliën wordt uitgevoerd, wordt de gevormde hoeveelheid nitraat in elk replicaat-bodemmonster bepaald en wordt er een dosis/respons-curve samengesteld om de ECX-waarden te bepalen. De hoeveelheid nitraat (in mg nitraat/kg drooggewicht bodem) die na 28 dagen in de behandelde monsters wordt gevonden, wordt vergeleken met de controle. Uit deze gegevens wordt de procentuele remming voor elke testconcentratie berekend. Deze percentages worden uitgezet tegen de concentratie en met behulp van statistische procedures worden de ECx-waarden berekend. Met behulp van standaardprocedures worden ook de betrouwbaarheidsgrenzen (p = 0,95) voor de berekende ECX bepaald (10)(ll)(12).
Teststoffen die grote hoeveelheden stikstof bevatten, kunnen bijdragen tot de tijdens de test gevormde hoeveelheid nitraat. Als deze stoffen bij een hoge concentratie worden getest (b.v. stoffen waarvan wordt aangenomen dat ze herhaaldelijk worden opgebracht), moeten er afdoende controles in de test worden opgenomen (d.w.z. bodem met teststof maar zonder plantenmeel). Bij de berekening van de ECX moet dan rekening worden gehouden met de gegevens van deze controles.
2.2. INTERPRETATIE VAN DE RESULTATEN
Wanneer de resultaten van tests met landbouwchemicaliën worden geëvalueerd en het verschil in de nitraatvorming tussen de laagste concentratie (d.w.z. de maximale verwachte concentratie) en de controle op enig monsternemingstijdstip na dag 28 niet groter dan 25 % is, kan worden geconcludeerd dat het product op lange termijn geen invloed op de omzetting van stikstof in de bodem heeft. Wanneer de resultaten van tests met andere stoffen dan landbouwchemicaliën worden geëvalueerd, worden de EC50, de EC25 en/of de EC10 gebruikt.
3. RAPPORTAGE
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Een volledige specificatie van de gebruikte bodem met vermelding van o.a.:
|
|
|
De teststof:
|
|
|
Het substraat:
|
|
|
De testomstandigheden:
|
|
|
De resultaten:
|
4. REFERENTIES
|
(1) |
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990). |
|
(3) |
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987. |
|
(4) |
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels. |
|
(5) |
ISO/DIS 14238 (1995). Soil Quality — Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee 1SO/TC 190/SC 4: Soil Quality — Biological Methods. |
|
(6) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995. |
|
(7) |
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(8) |
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. |
|
(9) |
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation-extraction method. |
|
(10) |
Litchfield, J.T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113. |
|
(11) |
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(12) |
Finney, D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK. |
C.22. MICRO-ORGANISMEN IN DE BODEM: BEPALING VAN DE OMZETTING VAN KOOLSTOF
1. METHODE
Deze methode is overgenomen van TG 217 (2000) van de OESO.
1.1 INLEIDING
In deze testmethode wordt een laboratoriumtest beschreven om te onderzoeken welke effecten gewasbeschermingsmiddelen en wellicht andere chemische stoffen na één blootstelling op lange termijn kunnen hebben op de omzetting van koolstof door micro-organismen in de bodem. De test is in eerste instantie gebaseerd op aanbevelingen van de Organisatie voor de bescherming van planten in Europa en het Middellandse-Zeegebied (1). Er is echter ook rekening gehouden met andere richtsnoeren, bijvoorbeeld van de Biologische Bundesanstalt in Duitsland (2), het Environmental Protection Agency in de VS (3) en de SET AC (4). Tijdens een workshop van de OESO over de selectie van bodem/sediment in Belgirate in Italië in 1995 (5) is overeenstemming bereikt over het aantal en de aard van de in deze test te gebruiken bodemmonsters. De aanbevelingen voor het verzamelen, behandelen en bewaren van de bodemmonsters zijn gebaseerd op ISO-richtsnoeren (6) en aanbevelingen van de workshop in Belgirate.
Bij de beoordeling en evaluatie van toxische kenmerken van teststoffen kan het nodig zijn de effecten op de microbiële activiteit van de bodem te bepalen, bijvoorbeeld wanneer er gegevens over de potentiële neveneffecten van gewasbeschermingsmiddelen op de microflora van de bodem nodig zijn of wanneer wordt verwacht dat de micro-organismen in de bodem aan andere chemische stoffen dan gewasbeschermingsmiddelen worden blootgesteld. De bepaling van de omzetting van koolstof wordt uitgevoerd om de effecten van deze chemische stoffen op de microflora van de bodem te bepalen. Als er landbouwchemicaliën (b.v. gewasbeschermingsmiddelen, kunstmest of bosbouwchemicaliën) worden getest, worden zowel de bepaling van de omzetting van koolstof als de bepaling van de omzetting van stikstof uitgevoerd. Als er andere stoffen dan landbouwchemicaliën worden getest, volstaat de bepaling van de omzetting van stikstof. Als de EC50 bij de bepaling van de omzetting van stikstof voor dergelijke stoffen echter binnen het bereik valt van de waarde die voor in de handel verkrijgbare nitrificatieremmers (zoals nitrapyrin) wordt gevonden, kan een bepaling van de omzetting van koolstof worden uitgevoerd om nadere informatie te verkrijgen.
De bodem bestaat uit levende en niet-levende componenten die complexe en heterogene mengsels kunnen vormen. Micro-organismen spelen een belangrijke rol bij de afbraak en omzetting van organisch materiaal in vruchtbare bodem en veel soorten dragen bij tot verschillende aspecten van de vruchtbaarheid van de bodem. Een verstoring van deze biochemische processen op lange termijn kan mogelijkerwijs de cycli van nutriënten verstoren en verandering brengen in de vruchtbaarheid van de bodem. Omzetting van koolstof en stikstof vindt in elke vruchtbare bodem plaats. Hoewel de voor deze processen verantwoordelijke microbiële levensgemeenschappen van bodem tot bodem verschillen, zijn de omzettingsroutes in grote lijnen gelijk.
Deze testmethode is bedoeld om te detecteren welke schadelijke effecten een stof op lange termijn op het omzettingsproces van koolstof in aërobe bodem aan het oppervlak kan hebben. De test is gevoelig voor veranderingen in de grootte en activiteit van de microbiële levensgemeenschappen die verantwoordelijk zijn voor de omzetting van koolstof, aangezien deze gemeenschappen daarbij zowel chemische stress als een koolstoftekort ondervinden. Er wordt een zandige bodem met weinig organisch materiaal gebruikt. Deze bodem wordt met de teststof behandeld en geïncubeerd onder omstandigheden die een snel microbieel metabolisme mogelijk maken. Onder deze omstandigheden raken de bronnen van gemakkelijk beschikbare koolstof in de bodem snel uitgeput. Dit leidt tot een koolstoftekort waardoor microbiële cellen enerzijds afsterven en anderzijds aangezet worden tot latentie en/of sporenvorming. Als de test meer dan 28 dagen duurt, kan de som van deze reacties in controles (onbehandelde bodem) worden gemeten als een geleidelijk verlies van metabool actieve microbiële biomassa (7). Als de biomassa in bodem met koolstof-stress onder de testomstandigheden door de aanwezigheid van een chemische stof wordt aangetast, komt deze wellicht niet op hetzelfde niveau terug als in de controles. Dit betekent dat een verstoring door de teststof, ongeacht op welk moment tijdens de test dit gebeurt, vaak tot het einde van de test aanhoudt.
Deze testmethode is ontwikkeld uit tests die in eerste instantie bedoeld waren voor stoffen waarvoor kan worden geraamd welke hoeveelheid de bodem bereikt. Dit geldt bijvoorbeeld voor gewasbeschermingsmiddelen die in bekende hoeveelheden op het veld worden gebracht. Voor landbouwchemicaliën is het voldoende twee doses te testen die relevant zijn voor de opgebrachte hoeveelheid die wordt verwacht of geraamd. Landbouwchemicaliën kunnen als werkzame stof of als geformuleerd product worden getest. Het gebruik van de test blijft echter niet beperkt tot stoffen met een voorspelbare milieuconcentratie. Door zowel de op de bodem gebrachte hoeveelheid teststof als de manier waarop de gegevens worden geëvalueerd, te veranderen, kan de test ook worden gebruikt voor chemische stoffen waarvoor niet bekend is hoeveel er naar verwachting in de bodem terecht zal komen. Daarom worden voor andere stoffen dan landbouwchemicaliën de effecten van een reeks concentraties op de omzetting van koolstof bepaald. De gegevens uit deze tests worden gebruikt om een dosis/respons-curve samen te stellen en ECx-waarden te berekenen, waarbij x het procentuele effect aangeeft.
1.2 DEFINITIES
Omzetting van koolstof: de afbraak van organisch materiaal door micro-organismen tot het anorganische eindproduct kooldioxide.
EC x (effectieve concentratie): de concentratie van de teststof in de bodem die leidt tot een remming van de omzetting van koolstof in kooldioxide met x procent.
EC50 (mediaan van de effectieve concentratie): de concentratie van de teststof in de bodem die leidt tot een remming van de omzetting van koolstof in kooldioxide met 50 procent.
1.3 REFERENTIESTOFFEN
Geen.
1.4 PRINCIPE VAN DE TESTMETHODE
Gezeefde bodem wordt hetzij behandeld met de teststof, hetzij niet behandeld (controle). Als er landbouwchemicaliën worden getest, wordt aanbevolen minimaal twee concentraties te testen die moeten worden gekozen op grond van de hoogste concentratie die op het veld wordt verwacht. Na 0, 7, 14 en 28 dagen incubatie worden monsters van de behandelde en de controlebodem met glucose gemengd en wordt de door glucose geïnduceerde ademhaling gedurende twaalf uur gemeten. De ademhaling wordt uitgedrukt in vrijgekomen kooldioxide (in mg kooldioxide/kg droge bodem/uur) of verbruikte zuurstof (in mg zuurstof/kg bodem/uur). De gemiddelde ademhaling in de behandelde bodemmonsters wordt vergeleken met de controlemonsters en de procentuele afwijking van de behandelde ten opzichte van de controlemonsters wordt berekend. Alle tests duren ten minste 28 dagen. Als op dag 28 het verschil tussen de behandelde en de controlebodem 25 % of groter is, worden de metingen om de veertien dagen voortgezet tot maximaal 100 dagen. Als er andere stoffen dan landbouwchemicaliën worden getest, wordt de teststof in een reeks concentraties aan de bodemmonsters toegevoegd en wordt na 28 dagen de door glucose geïnduceerde ademhaling (d.w.z. de gemiddelde hoeveelheid gevormd kooldioxide of verbruikte zuurstof). De resultaten van tests met een reeks concentraties worden aan regressieanalyse onderworpen en de ECx-waarden (d.w.z. de EC50, de EC25 en/of de EC10) worden berekend. Zie ook de definities.
1.5 GELDIGHEID VAN DE TEST
Bij landbouwchemicaliën wordt de evaluatie van de testresultaten gebaseerd op betrekkelijk kleine verschillen (gemiddeld ± 25 %) tussen het vrijgekomen kooldioxide of de verbruikte zuurstof in (of door) de behandelde en de controlemonsters en grote verschillen in de controles kunnen dan ook tot onjuiste resultaten leiden. Het verschil tussen replicaat-controlemonsters moet derhalve kleiner zijn dan ± 15 %.
1.6 BESCHRIJVING VAN DE TESTMETHODE
1.6.1 Apparatuur
Er worden testbakken van chemisch inert materiaal gebruikt. Het volume moet geschikt zijn voor de procedure die voor de incubatie van de bodem wordt gebruikt, d.w.z. incubatie in één keer of als een reeks afzonderlijke bodemmonsters (zie punt 1.7.1.2). Het waterverlies moet tot een minimum worden beperkt maar gasuitwisseling moet tijdens de test mogelijk zijn (de testbakken kunnen bijvoorbeeld met geperforeerde polyetheenfolie worden afgedekt). Wanneer vluchtige stoffen worden getest, moeten er afsluitbare gasdichte bakken worden gebruikt. Deze moeten zo groot zijn dat het bodemmonster ongeveer een kwart van hun volume beslaat.
Voor de bepaling van de door glucose geïnduceerde ademhaling zijn incubatiesystemen en instrumenten voor de meting van het gevormde kooldioxide of de verbruikte zuurstof nodig. Voor voorbeelden van dergelijke systemen en instrumenten wordt naar de literatuur verwezen (8) (9) (10) (11).
1.6.2 Selectie en aantal bodemsoorten
Er wordt één bodemsoort gebruikt. De aanbevolen kenmerken van de bodem zijn:
|
— |
zandgehalte: minimaal 50 % en maximaal 75 %; |
|
— |
pH: 5,5-7,5; |
|
— |
organisch koolstofgehalte: 0,5-1,5 %; |
|
— |
de microbiële biomassa moet worden gemeten (12)(13) en het koolstofgehalte daarvan moet minimaal 1 % van het totale organische koolstofgehalte van de bodem zijn. |
In de meeste gevallen levert een bodem met deze kenmerken de ongunstigste situatie op, aangezien de adsorptie van de teststof tot een minimum wordt beperkt en de beschikbaarheid van de stof voor de flora maximaal is. Een test met andere bodemsoorten is dan ook meestal niet nodig. In bepaalde gevallen, bijvoorbeeld wanneer de teststof naar verwachting vooral bij bepaalde bodemsoorten zoals zure bosgrond zal worden gebruikt of bij elektrostatisch geladen chemische stoffen, kan het echter nodig zijn een andere bodemsoort te gebruiken.
1.6.3 Verzameling en opslag van de bodemmonsters
1.6.3.1 Verzameling
Er moet gedetailleerde informatie beschikbaar zijn over de geschiedenis van de locatie waar de testbodem wordt verzameld, zoals de exacte ligging, de vegetatie, de data van behandelingen met gewasbeschermingsmiddelen, behandelingen met organische en anorganische mest, toevoegingen van biologisch materiaal en onopzettelijke verontreinigingen. De voor de verzameling van de bodem gekozen locatie moet op lange termijn kunnen worden gebruikt. Permanente weidegrond en velden met eenjarige graangewassen (behalve maïs) of dicht ingezaaide groenbemestingsgewassen zijn geschikt. De gekozen monstememingsplaats mag gedurende ten minste één jaar vóór de monsterneming niet met gewasbeschermingsmiddelen zijn behandeld. Ook mag er gedurende ten minste zes maanden geen organische mest zijn opgebracht. Het gebruik van anorganische mest is alleen aanvaardbaar wanneer dit in overeenstemming met de eisen van het gewas is en er mogen gedurende ten minste drie maanden na de opbrenging van de mest geen monsters worden genomen. Het gebruik van grond die is behandeld met meststoffen waarvan bekend is dat ze biocide-effecten hebben (b.v. calciumcyaanamide) moet worden vermeden.
Gedurende of vlak na lange perioden (meer dan 30 dagen) van droogte of doordrenking van de bodem mogen er geen monsters worden genomen. Bij een omgeploegde bodem moeten de monsters van een diepte van 0 tot 20 cm worden genomen. Bij grasland (weidegrond) of andere bodemsoorten waar gedurende lange perioden (ten minste één teeltseizoen) niet geploegd wordt, kan de maximale monsterdiepte iets groter dan 20 cm (b.v. maximaal 25 cm) zijn. De bakken waarin en de temperatuur waarbij de bodemmonsters worden vervoerd, moeten zodanig zijn dat de oorspronkelijke eigenschappen van de bodem niet significant veranderen.
1.63.2 Opslag
Het gebruik van grond die net van het veld komt, verdient de voorkeur. Als opslag in het laboratorium niet kan worden vermeden, kan de grond gedurende maximaal drie maanden in het donker bij 4 ± 2 oC worden bewaard. Tijdens de opslag van grond moet er voor aërobe omstandigheden worden gezorgd. Als de grond wordt verzameld in gebieden waar deze gedurende ten minste drie maanden per jaar bevriest, is opslag gedurende zes maanden bij - 18 oC mogelijk. Vóór elk experiment wordt de microbiële biomassa van opgeslagen grond gemeten; het koolstofgehalte van de biomassa moet minimaal 1 % van het totale organische koolstofgehalte van de bodem zijn (zie punt 1.6.2).
1.6.4 Behandeling en voorbereiding van de grond voor de test
1.6.4.1 Pre-incubatie
Als de grond opgeslagen was (zie de punten 1.6.4.2 en 1.7.1.3), wordt pre-incubatie gedurende 2 tot 28 dagen aanbevolen. De temperatuur en het vochtgehalte van de bodem tijdens de pre-incubatie moeten vergelijkbaar zijn met die tijdens de test (zie de punten 1.6.4.2 en 1.7.1.3).
1.6.4.2 Fysisch-chemische kenmerken
De grond wordt met de hand ontdaan van grote voorwerpen (stenen, delen van planten enz.) en zonder overmatig drogen vochtig gezeefd tot een deeltjesgrootte van maximaal 2 mm. Het vochtgehalte van het bodemmonster moet met gedestilleerd of gedeïoniseerd water worden aangepast tot 40-60 % van het maximale watergehalte.
1.6.5 Voorbehandeling van de teststof voordat deze op de bodem wordt gebracht
De teststof wordt normaal gesproken met behulp van een draagstof opgebracht. Dit kan water zijn (voor in water oplosbare stoffen) of een inerte vaste stof zoals fijn kwartszand (deeltjesgrootte 0,1-0,5 mm). Andere vloeibare draagstoffen dan water (b.v. organische oplosmiddelen zoals aceton of chloroform) moeten worden vermeden omdat deze de microflora kunnen aantasten. Als zand als draagstof wordt gebruikt, kan deze worden gecoat met de in een geschikt oplosmiddel opgeloste of gesuspendeerde teststof. In dat geval moet het oplosmiddel vóór het mengen met de bodem door verdamping worden verwijderd. Voor een optimale verdeling van de teststof in de bodem wordt een verhouding van 10 g zand per kg grond (drooggewicht) aanbevolen. De controlemonsters worden behandeld met uitsluitend dezelfde hoeveelheid water en/of kwartszand.
Bij het testen van vluchtige stoffen moeten verliezen tijdens de behandeling worden voorkomen en moet er naar een homogene verdeling in de bodem worden gestreefd (de teststof kan bijvoorbeeld op verschillende plaatsen in de bodem worden geïnjecteerd).
1.6.6 Testconcentraties
Als er gewasbeschermingsmiddelen of andere chemische stoffen met een voorspelbare milieuconcentratie worden getest, moeten er ten minste twee concentraties worden gebruikt. De laagste concentratie moet ten minste overeenkomen met de maximale hoeveelheid die naar verwachting in de praktijk in de bodem terecht zal komen, terwijl de hoogste concentratie een veelvoud van de laagste concentratie moet zijn. Bij de berekening van de concentratie van de aan de bodem toegevoegde teststof wordt uitgegaan van een uniforme vermenging in de bodem tot een diepte van 5 cm en een dichtheid van de droge grond van 1,5. Voor landbouwchemicaliën die rechtstreeks op de bodem worden gebracht en voor chemische stoffen waarvoor de hoeveelheid die in de bodem terechtkomt voorspelbaar is, worden als testconcentratie de voorspelbare milieuconcentratie (PEC — predictable environmental concentration) en het vijfvoud van deze concentratie aanbevolen. Stoffen die naar verwachting meer dan een keer per seizoen op de bodem worden gebracht, moeten worden getest bij concentraties die worden berekend door de PEC te vermenigvuldigen met het aantal keren dat dit naar verwachting maximaal gebeurt. De hoogste geteste concentratie mag echter niet hoger zijn dan tien keer de maximale per keer opgebrachte hoeveelheid.
Als andere stoffen dan landbouwchemicaliën worden getest, wordt een meetkundige reeks van ten minste vijf concentraties gebruikt. De geteste concentraties moeten het interval bestrijken dat voor de bepaling van de ECx-waarden nodig is.
1.7 UITVOERING VAN DE TEST
1.7.1 Hlootstellingsomstandigheden
1.7.1.1 Behandeling en controle
Als er landbouwchemicaliën worden getest, wordt de grond in drie even zware porties verdeeld. Twee porties worden gemengd met de draagstof die de teststof bevat en de andere portie met de draagstof zonder teststof (controle). Voor zowel de behandelde als de controlegrond wordt minimaal een bepaling in triplo aanbevolen. Als er andere stoffen dan landbouwchemicaliën worden getest, wordt de grond in zes even zware porties verdeeld. Vijf porties worden gemengd met de draagstof die de teststof bevat en de andere portie met de draagstof zonder teststof. Voor zowel de behandelde als de controlegrond wordt een bepaling in triplo aanbevolen. Er moet worden gezorgd voor een homogene verdeling van de teststof in de behandelde bodemmonsters. Bij het mengen moeten comprimering en kluitvorming van de grond worden voorkomen.
1.7.1.2 Incubatie van de bodemmonsters
Incubatie van de bodemmonsters kan op twee manieren gebeuren: als één monster voor elke behandelde en onbehandelde bodem of als een reeks aparte even grote submonsters voor elke behandelde en onbehandelde bodem. Wanneer vluchtige stoffen worden getest, mag de test echter uitsluitend met een reeks aparte submonsters worden uitgevoerd. Wanneer de grond als één monster wordt geïncubeerd, worden grote hoeveelheden van elke behandelde en onbehandelde bodem geïncubeerd en worden tijdens de test waar nodig submonsters voor analyse genomen. De hoeveelheid die aanvankelijk voor elke behandelde en onbehandelde bodem wordt geïncubeerd, is afhankelijk van de grootte van de submonsters, het aantal replicaatbepalingen dat voor de analyse wordt gebruikt en het verwachte maximale aantal monsternemingstijdstippen. Grond die als één monster wordt geïncubeerd, moet vóór het nemen van submonsters grondig worden gemengd. Wanneer de bodem als een reeks aparte bodemmonsters wordt geïncubeerd, wordt elke portie behandelde en onbehandelde grond in het vereiste aantal submonsters verdeeld, die worden gebruikt wanneer ze nodig zijn. Wanneer bij een experiment meer dan twee monstememingstijdstippen kunnen worden verwacht, moeten er voldoende submonsters voor alle replicaatbepalingen en alle monsternemingstijdstippen worden gemaakt. Ten minste drie replicaatmonsters van de testbodem worden onder aërobe omstandigheden geïncubeerd (zie punt 1.7.1.1). Tijdens alle tests moeten er geschikte bakken worden gebruikt met voldoende ruimte boven de grond om te voorkomen dat er anaërobe omstandigheden ontstaan. Wanneer er vluchtige stoffen worden getest, mag de test uitsluitend met een reeks aparte submonsters worden uitgevoerd.
1.7.1.3 Testomstandigheden en duur van de test
De test wordt in het donker bij kamertemperatuur (20 ± 2 oC) uitgevoerd. Het vochtgehalte van de bodemmonsters moet gedurende de test op 40-60 % van het maximale watergehalte van de bodem worden gehouden (zie punt 1.6.4.2) met een bereik van ± 5 %. Indien nodig kan gedestilleerd of gedeïoniseerd water worden toegevoegd.
De minimale duur van een test is 28 dagen. Als er landbouwchemicaliën worden getest, worden de hoeveelheden vrijgekomen kooldioxide of verbruikte zuurstof in de behandelde en de controlemonsters vergeleken. Als op dag 28 het verschil groter dan 25 % is, wordt de test voortgezet tot het verschil 25 % of minder is maar maximaal gedurende 100 dagen. Als er andere stoffen dan landbouwchemicaliën worden getest, wordt de test na 28 dagen beëindigd. Op dag 28 worden de hoeveelheden vrijgekomen kooldioxide of verbruikte zuurstof in de behandelde en de controlemonsters bepaald en worden de ECx-waarden berekend.
1.7.2 Monsterneming en analyse van de grond
1.7.2.1 Schema voor de monsterneming
Als er landbouwchemicaliën worden getest, wordt de door glucose geïnduceerde ademhaling van de bodemmonsters op de dagen 0, 7, 14 en 28 bepaald. Als er een langere test nodig is, wordt na dag 28 om de 14 dagen een analyse uitgevoerd.
Als er andere stoffen dan landbouwchemicaliën worden getest, worden er ten minste vijf testconcentraties gebruikt en wordt de door glucose geïnduceerde ademhaling van de bodemmonsters aan het begin (dag 0) en aan het eind van de blootstellingsperiode (dag 28) bepaald. Als dit nodig wordt geacht, kan er bijvoorbeeld op dag 7 een tussentijdse meting worden gedaan. De op dag 28 verkregen gegevens worden gebruikt om de ECx-waarde voor de chemische stof te bepalen. Als dat gewenst is, kunnen de gegevens van de controlemonsters op dag 0 worden gebruikt om de oorspronkelijke hoeveelheid metabool actieve microbiële biomassa in de bodem te bepalen (12).
1.7.2.2 Meling van de door glucose geïnduceerde ademhaling
Op elk monsternemingstijdstip wordt in elk replicaatmonster (behandeld en controle) de door glucose geïnduceerde ademhaling bepaald. De bodemmonsters worden gemengd met een zodanige hoeveelheid glucose dat er onmiddellijk een maximale ademhalingsreactie optreedt. De hoeveelheid glucose die bij een bepaalde bodem nodig is om een maximale ademhalingsreactie te veroorzaken, kan bij een vooronderzoek met een reeks glucoseconcentraties worden bepaald (14). Voor een zandige bodem met 0,5-1,5 % organische koolstof is 2 000 tot 4 000 mg glucose per kg drooggewicht bodem echter meestal voldoende. De glucose kan met schoon kwartszand (10 g zand/kg drooggewicht bodem) tot poeder worden vermalen en homogeen met de bodem worden vermengd.
De met glucose verrijkte bodemmonsters worden geïncubeerd in geschikte apparatuur om de ademhaling continu, om het uur of om de twee uur bij 20 ± 2 oC te meten (zie punt 1.6.1). Het vrijgekomen kooldioxide of de verbruikte zuurstof wordt gedurende twaalf uur gemeten en de metingen dienen zo spoedig mogelijk te beginnen, d.w.z. binnen 1 tot 2 uur na de toevoeging van de glucose. De totale hoeveelheid gedurende de twaalf uur vrijgekomen kooldioxide of verbruikte zuurstof wordt gemeten en de gemiddelde ademhaling wordt bepaald.
2. GEGEVENS
2.1 BEHANDELING VAN DE RESULTATEN
Als er landbouwchemicaliën worden getest, wordt de hoeveelheid vrijgekomen kooldioxide of verbruikte zuurstof in elk replicaat-bodemmonster geregistreerd en worden de gemiddelde waarden van alle replicaatbepalingen in tabelvorm vermeld. De resultaten worden met adequate en algemeen erkende statistische methoden (b.v. een F-test, niveau met 5 % significantie) geëvalueerd. De door glucose geïnduceerde ademhaling wordt uitgedrukt in mg kooldioxide/kg drooggewicht bodem/uur of mg zuurstof/kg drooggewicht bodem/uur. De gemiddelde vorming van kooldioxide of het gemiddelde verbruik van zuurstof bij elke behandelde bodem wordt vergeleken met de controle en de procentuele afwijking van de controle wordt berekend.
Als de test met andere stoffen dan landbouwchemicaliën wordt uitgevoerd, wordt de hoeveelheid vrijgekomen kooldioxide of verbruikte zuurstof in elk replicaat-bodemmonster bepaald en wordt er een dosis/respons-curve samengesteld om de ECx-waarden te bepalen. De door glucose geïnduceerde ademhaling (d.w.z. mg kooldioxide/kg drooggewicht bodem/uur of mg zuurstof/kg drooggewicht bodem/uur) die na 28 dagen in de behandelde monsters wordt bepaald, wordt vergeleken met de controle. Uit deze gegevens wordt de procentuele remming voor elke testconcentratie berekend. Deze percentages worden uitgezet tegen de concentratie en met behulp van statistische procedures worden de ECx-waarden berekend. Met behulp van standaardprocedures worden ook de betrouwbaarheidsgrenzen (p = 0,95) voor de berekende ECx bepaald (15)(16)(17).
2.2 INTERPRETATIE VAN DE RESULTATEN
Wanneer de resultaten van tests met landbouwchemicaliën worden geëvalueerd en het verschil in de ademhaling tussen de laagste concentratie (d.w.z. de maximale verwachte concentratie) en de controle op enig monsternemingstijdstip na dag 28 niet groter dan 25 % is, kan worden geconcludeerd dat het product op lange termijn geen invloed op de omzetting van koolstof in de bodem heeft. Wanneer de resultaten van tests met andere stoffen dan landbouwchemicaliën worden geëvalueerd, worden de EC50, de EC25 en/of de EC10 gebruikt.
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Een volledige specificatie van de gebruikte bodem met vermelding van o.a.:
|
|
|
De teststof:
|
|
|
De testomstandigheden:
|
|
|
De resultaten:
|
4. REFERENTIES
|
(1) |
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990). |
|
(3) |
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987. |
|
(4) |
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels. |
|
(5) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995. |
|
(6) |
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(7) |
Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in „Pesticide Effects on Soil Microflora”. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45-60. |
|
(8) |
Anderson, J.P.E. (1982). Soil Respiration, in „Methods of Soil Analysis — Part 2: Chemical and Microbiological Properties”. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831-871. |
|
(9) |
ISO 11266-1. (1993). Soil Quality — Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions. |
|
(10) |
ISO 14239 (1997E). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions. |
|
(11) |
Heinemeye, r O., Insam, H., Kaiser, E.A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81. |
|
(12) |
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. |
|
(13) |
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation- extraction method. |
|
(14) |
Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113-120. |
|
(15) |
Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113. |
|
(16) |
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(17) |
Finney D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK. |
C.23. AEROBE EN ANAEROBE OMZETTING IN DE BODEM
1. METHODE
Deze methode is overgenomen van TG 307 (2002) van de OESO.
1.1 INLEIDING
Deze testmethode is gebaseerd op bestaande richtsnoeren (1)(2)(3)(4)(5)(6)(7)(8)(9). De hier beschreven methode is bedoeld om de aërobe en anaërobe omzetting van chemische stoffen in de bodem te evalueren. De experimenten zijn bedoeld om te bepalen i) wat de omzettingssnelheid van de teststof is en ii) wat de aard en de vormings- en afbraaksnelheid is van omzettingsproducten waaraan planten en bodemorganismen kunnen worden blootgesteld. Dergelijke onderzoeken zijn nodig voor chemische stoffen die rechtstreeks op de bodem worden gebracht of waarvan het aannemelijk is dat ze in het bodemmilieu terecht zullen komen. De resultaten van dit laboratoriumonderzoek kunnen ook worden gebruikt voor de ontwikkeling van monsternemings- en analyseprotocollen voor verwant veldonderzoek.
Aëroob en anaëroob onderzoek met één bodemtype is meestal voldoende voor de evaluatie van omzettingsroutes (8)(10)(ll). De omzettingssnelheid moet daarnaast in ten minste drie bodemtypes worden bepaald (8)(10).
In Belgirate (Italië) is in 1995 een OESO-workshop over bodem- en sedimentselectie gehouden (10), waar met name overeenstemming is bereikt over het aantal bodemtypes dat voor deze test moet worden gebruikt. De geteste bodemtypes moeten representatief zijn voor de milieusituatie op de plaats waar de stoffen worden gebruikt of vrijkomen. Zo moeten chemische stoffen die in een subtropisch of tropisch klimaat vrijkomen, met Ferrasols of Nitosols (FAO-systeem) worden getest. De workshop heeft op basis van de ISO-richtsnoeren (15) ook aanbevelingen gedaan voor het verzamelen, behandelen en bewaren van bodemmonsters. Het gebruik van paddy(rijst)-bodem komt in deze methode ook aan de orde.
1.2 DEFINITIES
Teststof: een stof, hetzij de oorspronkelijke verbinding, hetzij relevante omzettingsproducten.
Omzettingsproducten: alle stoffen die ontstaan bij biotische of abiotische omzettingsreacties van de teststof, met inbegrip van CO2 en producten in gebonden residuen.
Gebonden residuen: verbindingen in de bodem, in planten of in dieren die na extractie in de vorm van de oorspronkelijke verbinding of de metabolieten/omzettingsproducten daarvan in de matrix achterblijven. De extractiemethode mag de verbindingen zelf of de structuur van de matrix niet significant wijzigen. De aard van de binding kan gedeeltelijk worden opgehelderd door extractiemethoden die de matrix wijzigen of door verfijnde analysetechnieken. Tot op heden zijn op deze manier bijvoorbeeld covalente, ionische en sorptiebindingen en insluitingen gesignaleerd. In het algemeen heeft de vorming van gebonden residuen tot gevolg dat de biologische toegankelijkheid en de biologische beschikbaarheid significant afnemen (12) [gewijzigd overgenomen uit IUPAC 1984 (13)].
Aërobe omzetting: reacties die in aanwezigheid van moleculaire zuurstof verlopen (14).
Anaërobe omzetting: reacties die bij uitsluiting van moleculaire zuurstof verlopen (14).
Bodem: een mengsel van anorganische en organische chemische bestanddelen, in het laatste geval bestaande uit verbindingen met een hoog koolstof- en stikstofgehalte en een hoog molecuulgewicht, dat kleine (meestal micro-)organismen bevat. Bodem kan in twee toestanden worden verwerkt:
|
(a) |
onverstoord, zoals in de loop der tijd ontwikkeld, met kenmerkende lagen van verschillende bodemtypes; |
|
(b) |
verstoord, zoals meestal aangetroffen in bouwland of wanneer bij deze test gebruikte monsters door graven worden genomen (14). |
Mineralisatie: de volledige afbraak van een organische verbinding tot CO2 en H2O onder aërobe omstandigheden en CH4, CO2 en H2O onder anaërobe omstandigheden. In de context van de/e testmethode betekent mineralisatie, wanneer met 14C gelabelde verbindingen worden gebruikt, een volledige afbraak waarbij een gelabeld koolstofatoom wordt geoxideerd en een equivalente hoeveelheid 14CO2 vrijkomt (14).
Halveringstijd (t0,5): de tijd die nodig is om 50 % van een hoeveelheid teststof om te zetten, wanneer de omzetting kan worden beschreven door kinetiek van de eerste orde; deze is onafhankelijk van de concentratie.
DT50 (Disappearance Time 50): de tijd waarin de concentratie van de teststof met 50 % daalt; deze verschilt van de halveringstijd t0,5 wanneer de omzetting niet volgens kinetiek van de eerste orde plaatsvindt.
DT75 (Disappearance Time 75): de tijd waarin de concentratie van de teststof met 75 % daalt.
DT90 (Disappearance Time 90): de tijd waarin de concentratie van de teststof met 90 % daalt.
1.3 REFERENT1ESTOFFEN
Voor de karakterisering en/of identificatie van omzettingsproducten met behulp van spectroscopische en chromatografische methoden moeten reterentiestoffen worden gebruikt.
1.4 TOEPASBAARHEID VAN DE TEST
De methode kan worden gebruikt voor alle chemische stoffen (al dan niet radioactief gelabeld) waarvoor een analysemethode met een afdoende nauwkeurigheid en gevoeligheid beschikbaar is. Enigszins vluchtige, niet-vluchtige, in water oplosbare en niet in water oplosbare stoffen kunnen worden getest. De test mag niet worden gebruikt voor chemische stoffen met een grote vluchtigheid vanuit de bodem (b.v. fumigatiemiddelen of organische oplosmiddelen) die onder de experimentele omstandigheden tijdens deze test uit de bodem verdwijnen.
1.5 INFORMATIE OVER DE TESTSTOF
Voor de meting van de omzettingssnelheid kan een al dan niet gelabelde teststof worden gebruikt. Voor de bestudering van de omzettingsroute en voor de bepaling van een massabalans is gelabeld materiaal nodig. Labeling met 14C wordt aanbevolen, maar ook het gebruik van andere isotopen zoals 13C, 15N, 3H of 32P kan nuttig zijn. Het label moet zo veel mogelijk in het meest stabiele gedeelte van het molecuul worden aangebracht (41). De zuiverheid van de teststof moet ten minste 95 % zijn.
Vóór de uitvoering van een test om de aërobe en anaërobe omzetting in de bodem te bepalen moet de volgende informatie over de teststof beschikbaar zijn:
|
(a) |
de oplosbaarheid in water (methode A.6); |
|
(b) |
de oplosbaarheid in organische oplosmiddelen; |
|
(c) |
de dampspanning (methode A.4) en de constante van de wet van Henry; |
|
(d) |
de verdelingscoëfficiënt n-octanol/water (methode A.8); |
|
(e) |
de chemische stabiliteit in het donker (hydrolyse) (methode C.7); |
|
(f) |
de pKa als een molecuul protonering of deprotonering kan ondergaan [OESO-richtsnoer 112] (16). |
Ook informatie over de toxiciteit van de teststof voor micro-organismen in de bodem kan nuttig zijn [testmethoden C.21 en C.22] (16).
Er moeten analysemethoden (met inbegrip van methoden voor extractie en clean-up) beschikbaar zijn voor de kwalitatieve en kwantitatieve bepaling van de teststof en de omzettingsproducten daarvan.
1.6 PRINCIPE VAN DE TESTMETHODE
De bodemmonsters worden met de teststof behandeld en worden onder gecontroleerde laboratoriumomstandigheden (bij constante temperatuur en met een constant vochtgehalte van de bodem) in het donker geïncubeerd in kolven van het biometer-type of in doorstroomsystemen. Nadat voldoende tijd is verstreken, worden de bodemmonsters geëxtraheerd en op de oorspronkelijke stof en de omzettingsproducten daarvan geanalyseerd. Ook vluchtige producten worden met geschikte absorptie-apparatuur opgevangen om te worden geanalyseerd. Door met 14C gelabeld materiaal te gebruiken kunnen de verschillende mineralisatiesnelheden worden gemeten door het ontstane 14CO2 weg te vangen en kan de massabalans, met inbegrip van de vorming van aan de bodem gebonden residuen, worden bepaald.
1.7 KWALITEITSCRITERIA
1.7.1 Recovery
Door onmiddellijk na de toevoeging van de teststof bodemmonsters ten minste in duplo te extraheren en te analyseren wordt een eerste indicatie verkregen van de herhaalbaarheid van de analysemethode en de uniformiteit van de procedure voor het opbrengen van de teststof. In latere fasen van de experimenten wordt de recovery bepaald aan de hand van de respectieve massabalansen. Voor gelabelde stoffen moet de recovery tussen 90 % en 110 % liggen (8) en voor ongelabelde stoffen tussen 70 % en 110 % (3).
1.7.2 Herhaalbaarheid en gevoeligheid van de analysemethode
De herhaalbaarheid van de analysemethode (exclusief de efficiëntie van de extractie in het begin) voor de kwantitatieve bepaling van de teststof en de omzettingsproducten kan worden gecontroleerd door één extract van een bodemmonster, dat lang genoeg is geïncubeerd voor de vorming van om/ettingsproducten, in duplo te analyseren.
De aantoonbaarheidsgrens van de analysemethode voor de teststof en voor de omzettingsproducten mag niet hoger zijn dan 0,01 mg.kg-1 bodem (als teststof) of, indien dit lager is, 1 % van de opgebrachte dosis. De bepaalbaarheidsgrens moet ook worden gespecificeerd.
1.7.3 Nauwkeurigheid van de omzettingsgegevens
Een regressieanalyse van de concentratie van de teststof als functie van de tijd levert de vereiste informatie op over de betrouwbaarheid van de omzettingscurve en maakt het mogelijk de betrouwbaarheidsgrenzen te berekenen voor de halveringstijd (bij kinetiek van de pseudo-eerste orde) of de DT50 en, indien van toepassing, de DT75 en de DT90.
1.8 BESCHRIJVING VAN DE TESTMETHODE
1.8.1 Apparatuur en chemicaliën
Incubatiesystemen bestaan in de vorm van statische gesloten systemen of geschikte doorstroomsystemen (7)(17). In de figuren 1 en 2 worden voorbeelden gegeven van respectievelijk een geschikt doorstroomapparaat voor bodemincubatie en een kolf van het biometer-type. Beiden soorten incubatiesystemen hebben hun voordelen en beperkingen (7)(17).
Er is standaard-laboratoriumapparatuur nodig, met name:
|
— |
analyse-instrumenten voor bijvoorbeeld GLC, HPLC en TLC, met inbegrip van de nodige detectiesystemen voor de analyse van al dan niet radioactief gelabelde stoffen, of voor de inverse isotoopverdunningsmethode; |
|
— |
instrumenten voor identificatie (b.v. MS, GC-MS, HPLC-MS of NMR); |
|
— |
een vloeistofscintillatieteller; |
|
— |
een oxidator voor de verbranding van radioactief materiaal; |
|
— |
een centrifuge; |
|
— |
extractieapparatuur (b.v. centrifugebuizen voor koude extractie en een Soxhlet-apparaat voor continue extractie met reflux); |
|
— |
instrumenten voor de concentratie van oplossingen en extracten (b.v. een rotatieverdamper); |
|
— |
een waterbad; |
|
— |
een mechanisch mengapparaat (b.v. een kneedmachine of een roermotor). |
De volgende chemicaliën worden onder andere gebruikt:
|
— |
NaOH p.a., 2 mol.dm-3, of een andere geschikte base (b.v. KOH of ethanolamine); |
|
— |
H2SO4 p.a., 0,05 mol.dm-3; |
|
— |
ethyleenglycol p.a.; |
|
— |
vast absorptiemateriaal zoals natronkalk en polyurethaanproppen: |
|
— |
organische oplosmiddelen p.a., zoals aceton of methanol; |
|
— |
scintillatievloeistof. |
1.8.2 Het opbrengen van de teststof
Om de teststof aan de bodem toe te voegen en daarin te verdelen kan deze worden opgelost in water (gedeïoniseerd of gedestilleerd) of indien nodig in minimale hoeveelheden aceton of andere organische oplosmiddelen (6) waarin de teststof voldoende oplosbaar en stabiel is. Het gekozen oplosmiddel mag in de gebruikte hoeveelheid echter geen significante invloed op de microbiële activiteit van de bodem hebben (zie de punten 1.5 en 1.9.2-1.9.3). Het gebruik van oplosmiddelen die de microbiële activiteit remmen, zoals chloroform, dichloormethaan en andere gehalogeneerde oplosmiddelen, moet worden vermeden.
De teststof kan ook als vaste stof worden toegevoegd, bijvoorbeeld gemengd met kwartszand (6) of een klein submonster van de testbodem dat aan de lucht gedroogd en gesteriliseerd is. Als de teststof met behulp van een oplosmiddel wordt toegevoegd, moet het oplosmiddel eerst verdampen voordat het submonster met de teststof aan het oorspronkelijke niet-steriele bodemmonster wordt toegevoegd.
Bij algemene chemische stoffen, die voornamelijk via zuiveringsslib/gebruik in de landbouw in de bodem terechtkomen, moet de teststof eerst aan het slib worden toegevoegd, dat dan vervolgens in het bodemmonster wordt gebracht (zie de punten 1.9.2 en 1.9.3).
Het gebruik van geformuleerde producten wordt in de regel niet aanbevolen. Bijvoorbeeld bij slecht oplosbare teststoffen kan het gebruik van geformuleerd materiaal echter een geschikt alternatief zijn.
1.8.3 Bodem
1.8.3.1 Selectie van de bodem
Om de omzettingsroute te bepalen kan een representatief bodemtype worden gebruikt: zandig leem, siltig leem, leem of lemig zand [volgens de FAO- en USDA-indeling (18)] met een pH van 5,5-8,0, een organisch koolstofgehalte van 0,5-2,5 % en een microbiële biomassa van ten minste 1 % van het totale organische koolstofgehalte wordt aanbevolen (10).
Voor het onderzoek naar de omzettingssnelheid moeten ten minste drie aanvullende bodemtypes worden gebruikt die een scala van relevante bodemtypes vormen. Het organisch koolstofgehalte, de pH, het kleigehalte en de microbiële biomassa van de bodemtypes moeten uiteenlopen (10).
Van alle bodemtypes moeten in elk geval de textuur ( % zand, % silt en % klei) [volgens de FAO- en USDA-indeling (18)|, de pH, de kation-uitwisselingscapaciteit, het organisch koolstofgehalte, de dichtheid van de droge grond, de waterretentie-kenmerken (42) en de microbiële biomassa (uitsluitend voor aëroob onderzoek) worden bepaald. Aanvullende informatie over de eigenschappen van de bodem kan nuttig zijn bij de interpretatie van de resultaten. Voor de bepaling van de bodemkenmerken kunnen de in de referenties (19)(20)(21)(22)(23) aanbevolen methoden worden gebruikt. De microbiële biomassa dient met de SIR-methode (substraat-geïnduceerde ademhaling) (25)(26) of met andere methoden (20) te worden bepaald.
1.8.3.2 Verzameling, behandeling en opslag van de bodemmonsters
Er moet gedetailleerde informatie beschikbaar zijn over de geschiedenis van de locatie waar de testbodem wordt verzameld, zoals de exacte ligging, de vegetatie, behandelingen met chemische stoffen, behandelingen met organische en anorganische mest, toevoegingen van biologisch materiaal of andere verontreinigingen. Als de bodem in de loop van de voorgaande vier jaar met de teststof of structureel analoge verbindingen daarvan is behandeld, mag deze niet voor het omzettingsonderzoek worden gebruikt (10)(15).
De grond moet vers van het veld (van de A-horizont of de toplaag van 20 cm) worden verzameld met een bodemwatergehalte dat zeven gemakkelijker maakt. Voor andere bodem dan paddy-velden moet monsterneming niet gedurende of vlak na lange perioden (>30 dagen) van droogte, vorst of overstroming gebeuren (14). De monsters moeten zodanig worden vervoerd dat veranderingen in het bodemwatergehalte tot een minimum worden beperkt, en zo veel mogelijk in het donker worden bewaard op een plaats waar er lucht bij kan komen. Een losjes dichtgeknoopte polyetheen zak is hier in het algemeen geschikt voor.
De grond moet zo spoedig mogelijk na monsterneming worden verwerkt. Vegetatie, groot formaat bodemfauna en stenen moeten worden verwijderd voordat de grond door een zeef van 2 mm wordt gezeefd om kleine stenen en resten van planten en dieren te verwijderen. Voordat de grond wordt gezeefd, mag deze niet te veel worden gedroogd en platgedrukt (15).
Wanneer het in de winter moeilijk is om in het veld monsters te nemen (bevroren bodem of een laag sneeuw), kunnen deze worden genomen van een partij grond die in een kas, bedekt door vegetatie (bijvoorbeeld gras of een gras/klaver-mengsel), wordt bewaard. Er is een duidelijke voorkeur voor onderzoek met vers van het veld gehaalde grond, maar als de verzamelde en bewerkte grond vóór het begin van het onderzoek moet worden opgeslagen, moeten de omstandigheden adequaat zijn en mag dit slechts een beperkte tijd gebeuren (4 ± 2 oC gedurende maximaal drie maanden) om de microbiële activiteit op peil te houden (43). Voor gedetailleerde instructies voor de verzameling, behandeling en opslag van grond die voor biotransformatie-experimenten moet worden gebruikt, wordt verwezen naar (8)(10)(15)(26)(27).
Voordat de bewerkte grond voor de test wordt gebruikt, wordt deze gepre-incubeerd om ontkieming en de verwijdering van zaden mogelijk te maken en om het evenwicht van het microbiële metabolisme na de overgang van de monsternemings- en opslagomstandigheden naar de incubatie-omstandigheden te herstellen. Een pre-incubatieperiode van 2 tot 28 dagen met bij benadering de temperatuur en de vochtomstandigheden van de echte test volstaat in het algemeen (15). De opslag en de pre-incubatie mogen samen niet langer dan drie maanden duren.
1.9 UITVOERING VAN DE TEST
1.9.1 Testomstandigheden
1.9.1.1 Testtemperatuur
Gedurende de hele testperiode moet de grond in het donker worden geïncubeerd bij een constante temperatuur die representatief is voor de klimaatomstandigheden waar de teststof zal worden gebruikt of zal vrijkomen. Voor alle teststoffen die in een gematigd klimaat in de bodem terecht kunnen komen, wordt een temperatuur van 20 ± 2 oC aanbevolen. De temperatuur moet worden gemonitord.
Voor chemische stoffen die in een kouder klimaat worden gebruikt of vrijkomen (bijvoorbeeld in noordelijke landen of in de herfst of de winter), moeten daarnaast ook bodemmonsters bij een lagere temperatuur (bijvoorbeeld 10 ± 2 oC) worden geïncubeerd.
1.9.1.2 Vochtgehalte
Voor omzettingsproeven onder aërobe omstandigheden moet het vochtgehalte van de bodem (44) op een pF tussen 2,0 en 2,5 worden gebracht en gehouden (3). Het vochtgehalte van de bodem wordt uitgedrukt als massa water per massa droge grond en moet periodiek worden gecontroleerd (bijvoorbeeld om de twee weken) door de incubatiekolven te wegen en waterverliezen moeten worden gecompenseerd door water toe te voegen (bij voorkeur steriel gefilterd kraanwater). Er moet op worden gelet dat bij het toevoegen van vocht (eventuele) verliezen van de teststof en/of omzettingsproducten door vervluchtiging en/of afbraak onder invloed van licht worden voorkomen of tot een minimum worden beperkt.
Voor omzettingsproeven onder anaërobe of paddy-omstandigheden wordt de grond onder water gezet om deze met water te verzadigen.
1.9.1.3 Aërobe incubatie-omstandigheden
In de doorstroomsystemen worden de omstandigheden aëroob gehouden door periodiek met bevochtigde lucht te spoelen of daar continu mee te ventileren. In de biometerkolven vindt de uitwisseling van lucht door diffusie plaats.
1.9.1.4 Steriele aërobe omstandigheden
Om informatie te krijgen over de relevantie van de abiotische omzetting van een teststof kunnen bodemmonsters worden gesteriliseerd (zie de referenties 16 en 29 voor sterilisatiemethoden), behandeld met steriele teststof (bijvoorbeeld door de oplossing via een steriele filter toe te voegen) en belucht met bevochtigde steriele lucht zoals beschreven onder punt 1.9.1.3. Voor paddy-bodem moeten grond en water worden gesteriliseerd en moet de incubatie volgens punt 1.9.1.6 worden uitgevoerd.
1.9.1.5 Anaërobe incubatie-omslandigheden
Om anaërobe omstandigheden te krijgen en te houden wordt de met de teststof behandelde grond gedurende 30 dagen of, indien dit korter is, één halveringstijd of DT50, onder aërobe omstandigheden geïncubeerd en vervolgens met water doordrenkt (waterlaag van 1-3 cm) en wordt het incubatiesysteem met een inert gas (bijvoorbeeld stikstof of argon) doorgespoeld (45). Het testsysteem moet mogelijkheden bieden voor de meting van bijvoorbeeld de pH, de zuurstofconcentratie en de redoxpotentiaal en apparatuur bevatten voor het wegvangen van vluchtige producten. Het systeem van het biometer-type moet gesloten zijn om te voorkomen dat door diffusie lucht binnendringt.
1.9.1.6 Paddy-incubatieomstandigheden
Om de omzetting in paddy-rijstbodem te onderzoeken wordt de bodem onder water gezet met een waterlaag van ongeveer 1-5 cm en wordt de teststof aan de waterfase toegevoegd (9). Een bodemdiepte van ten minste 5 cm wordt aanbevolen. Het systeem wordt net als onder aërobe omstandigheden met lucht geventileerd. De pH, de zuurstofconcentratie en de redoxpotentiaal van de waterlaag worden gemonitord en gerapporteerd. Voordat de omzettingsproef wordt begonnen, is een pre-incubatieperiode van minimaal twee weken nodig (zie punt 1.8.3.2).
1.9.1.7 Duur van de test
Het onderzoek naar snelheid en route mag normaal gesproken niet langer duren dan 120 dagen (46) (3)(6)(8), omdat daarna in een kunstmatig laboratoriumsysteem, dat van natuurlijke aanvulling afgesloten is, in de loop der tijd een daling van de microbiële activiteit van de bodem kan worden verwacht. Wanneer dit nodig is om de afbraak van de teststof en de vorming en afbraak van belangrijke omzettingsproducten te karakteriseren, kan het onderzoek gedurende langere tijd (bijvoorbeeld 6 of 12 maanden) worden voortgezet (8). Voor langere incubatieperioden moet in het testverslag een motivering worden gegeven en in dat geval moet gedurende en aan het eind van deze perioden de biomassa worden gemeten.
1.9.2 Uitvoering van de test
In elke incubatiekolf (zie de figuren 1 en 2 in bijlage 3) wordt ongeveer 50 tot 200 g grond (drooggewicht) gebracht, die volgens een van de onder punt 1.8.2 beschreven methoden met de teststof wordt behandeld. Wanneer er voor de toevoeging van de teststof organische oplosmiddelen worden gebruikt, moeten deze door verdamping uit de grond worden verwijderd. Vervolgens wordt de grond met een spatel en/of door de kolf te schudden grondig gemengd. Als het onderzoek onder paddy-omstandigheden wordt uitgevoerd, worden de grond en het water na de toevoeging van de teststof grondig gemengd. Kleine porties (bijvoorbeeld 1 g) van de behandelde grond worden op de teststof geanalyseerd om te controleren of deze uniform verdeeld is. Alternatieve methoden komen later aan de orde.
De toegevoegde hoeveelheid moet overeenkomen met de grootste hoeveelheid van een gewasbeschermingsmiddel die in de gebruiksaanwijzing voor opbrenging wordt aanbevolen en een uniforme vermenging tot een adequate diepte op het veld (bijvoorbeeld de bovenste laag van 10 cm van de bodem (47). Voor chemische stoffen die bijvoorbeeld op het blad of zonder vermenging op de bodem worden opgebracht, moet bij de berekening van de hoeveelheid die aan elke kolf moet worden toegevoegd, worden uitgegaan van een diepte van 2,5 cm. Voor chemische stoffen die met de grond worden vermengd, is de adequate diepte de in de gebruiksaanwijzing vermelde vermengingsdiepte. Voor algemene chemische stoffen wordt de opgebrachte hoeveelheid bepaald op basis van de meest relevante aanvoerroute; als bijvoorbeeld zuiveringsslib de belangrijkste route voor de toevoer naar de bodem is, moet de chemische stof aan het slib worden toegevoegd in een concentratie die overeenkomt met de verwachte concentratie in het slib en moet de hoeveelheid aan de grond toegevoegd slib overeenkomen met de normale hoeveelheid op landbouwgrond gebruikt slib. Als deze concentratie niet hoog genoeg is om belangrijke omzettingsproducten te bepalen, kan incubatie van aparte bodemmonsters met grotere hoeveelheden nuttig zijn, maar te grote hoeveelheden die de microbiële functies van de bodem beïnvloeden, moeten worden vermeden (zie de punten 1.5 en 1.8.2).
Ook kan een grotere hoeveelheid (d.w.z. 1 tot 2 kg) grond met de teststof worden behandeld, zorgvuldig in een geschikt mengapparaat worden gemengd en vervolgens in kleine porties van 50 tot 200 g in de incubatiekolven worden overgebracht (bijvoorbeeld met behulp van monsterverdelers). Kleine porties (bijvoorbeeld 1 g) van de behandelde grond worden op de teststof geanalyseerd om te controleren of deze uniform verdeeld is. Een dergelijk procedure verdient de voorkeur aangezien daarmee een uniformere verdeling van de teststof in de bodem mogelijk is.
Ook onbehandelde bodemmonsters worden onder dezelfde (aërobe) omstandigheden als de met de teststof behandelde monsters geïncubeerd. Deze monsters worden gebruikt voor de meting van de biomassa gedurende en aan het eind van het onderzoek.
Wanneer de teststof voor de toevoeging aan de bodem in een of meer organische oplosmiddelen wordt opgelost, worden met de/elfde hoeveelheid oplosmiddel(en) behandelde bodemmonsters worden onder dezelfde (aërobe) omstandigheden als de met de teststof behandelde monsters geïncubeerd. Deze monsters worden gebruikt voor de meting van de biomassa aan het begin, gedurende en aan het eind van het onderzoek om na te gaan welke effecten de organische oplosmiddelen op de microbiële biomassa hebben.
De kolven met de behandelde bodemmonsters worden aan het in figuur 1 beschreven doorstroomsysteem bevestigd of met de in figuur 2 afgebeelde absorptiekolom afgesloten (zie bijlage 3).
1.9.3 Monsterneming en meting
Op geschikte tijdstippen worden incubatiekolven in duplo verwijderd en worden de bodemmonsters met geschikte oplosmiddelen met een verschillende polariteit geëxtraheerd en op de teststof en/of omzettingsproducten geanalyseerd. In een goed opgezet onderzoek zijn er voldoende kolven om op elk monsternemingstijdstip twee kolven te kunnen gebruiken. Ook de absorptieoplossingen of het vaste absorptiemateriaal worden op verschillende tijdstippen (gedurende de eerste maand om de 7 dagen en daarna om de 17 dagen) gedurende en aan het eind van de incubatie van elk bodemmonster verwijderd en op vluchtige producten geanalyseerd. Naast een bodemmonster dat direct na de toevoeging wordt genomen (dag 0), worden nog ten minste 5 andere monstememingspunten gekozen. De tijdstippen worden zodanig gekozen dat het verloop van de afbraak van de teststof en van de vorming en afbraak van de omzettingsproducten kan worden bepaald (bijvoorbeeld na 0, 1, 3 en 7 dagen, na 2 en 3 weken, na 1, 2 en 3 maanden enz.).
Wanneer een met C gelabelde teststof wordt gebruikt, wordt de niet-extraheerbare radioactiviteit door verbranding kwantitatief bepaald en wordt er voor elk monsternemingstijdstip een massabalans bepaald.
Bij anaërobe en paddy-incubatie worden de bodem- en de waterfase gezamenlijk op de teststof en de omzettingsproducten geanalyseerd of vóór extractie en analyse door filtratie of centrifugeren gescheiden.
1.9.4 Facultatieve tests
Aërobe niet-steriele proeven bij andere temperaturen en vochtgehaltes van de bodem kunnen nuttig zijn om de invloed van de temperatuur en het vochtgehalte van de bodem op de omzettingssnelheid van een teststof en/of de omzettingsproducten daarvan in de bodem te bepalen.
Met behulp van bijvoorbeeld superkritische vloeistofextractie kan worden getracht de niet-extraheerbare radioactiviteit nader te karakteriseren.
2. GEGEVENS
2.1 BEHANDELING VAN DE RESULTATEN
Voor elk monsternemingstijdstip wordt de hoeveelheid teststof, omzettingsproducten, vluchtige stoffen (uitsluitend in %) en niet-extraheerbaar materiaal als percentage van de oorspronkelijk toegevoegde concentratie en eventueel als mg.kg-1 bodem (op basis van het drooggewicht) vermeld. Voor elk monsternemingstijdstip dient er een massabalans te worden gegeven als percentage van de oorspronkelijk toegevoegde concentratie. Door in een grafiek de concentratie van de teststof uit te zetten tegen de tijd kan de halveringstijd of de DT50 worden bepaald. Belangrijke omzettingsproducten moeten worden geïdentificeerd en ook hun concentratie moet tegen de tijd worden uitgezet om hun vormings- en afbraaksnelheid aan te geven. Een belangrijk omzettingsproduct is een product dat op enig moment tijdens het onderzoek in een grotere hoeveelheid dan 10 % van de toegevoegde dosis aanwezig is.
De weggevangen vluchtige producten geven een indicatie van het vervluchtigingsvermogen van een teststof en de omzettingsproducten daarvan vanuit de bodem.
Er moet een nauwkeuriger bepaling van de halveringstijd of de DT50 en eventueel de DT75 en de DT90 worden verkregen door de nodige kinetische modelberekeningen uit te voeren. Naast de halveringstijd en de DT50 wordt er ook een beschrijving van het gebruikte model gegeven met vermelding van de orde van de kinetiek en de determinatiecoëfficiënt (r). Kinetiek van de eerste orde krijgt de voorkeur, tenzij r < 0,7. Eventueel moeten de berekeningen ook worden toegepast op de belangrijke omzettingsproducten. Voorbeelden van geschikte modellen worden beschreven in de referenties 31 tot en met 35.
Wanneer onderzoek bij verschillende temperaturen wordt uitgevoerd, wordt de omzettingssnelheid binnen het experimentele temperatuurtraject als functie van de temperatuur beschreven met behulp van de vergelijking van Arrhenius:
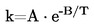 of
of  .
.
waarbij ln A en B regressiecontanten zijn van respectievelijk het intercept en de helling van een best passende rechte die voortkomt uit een lineaire regressie van ln k tegen l/T, k de snelheidsconstantie bij temperatuur T is en T de temperatuur in Kelvin is. Er moet goed worden gelet op het beperkte temperatuurtraject waarop de vergelijking van Arrhenius geldig is wanneer de omzetting door de microbiële activiteit wordt bepaald.
2.2 EVALUATIE EN INTERPRETATIE VAN DE RESULTATEN
Hoewel het onderzoek in een kunstmatig laboratoriumsysteem wordt uitgevoerd, kan aan de hand van de resultaten een raming worden gemaakt van de omzettingssnelheid van de teststof en de vormings- en afbraaksnelheid van de omzettingsproducten onder veldomstandigheden (36)(37).
Een onderzoek naar de omzettingsroute van een teststof levert informatie op over de manier waarop de structuur van de gebruikte stof in de bodem onder invloed van chemische en microbiële reacties verandert.
3. RAPPORTACE
TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
De teststof:
|
|
|
Referentiestoffen:
|
|
|
De gebruikte bodem:
|
|
|
De testomstandigheden:
|
|
|
De resultaten:
|
4. REFERENTIES
|
(1) |
US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(2) |
Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada. |
|
(3) |
Europese Union (EU) (1995). Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex 11, Part A and Annex III, Part A: Fate and Behaviour in the Environment. |
|
(4) |
Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(5) |
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden — Abbau, Umwandlung und Metabolismus. |
|
(6) |
ISO/DIS 11266-1 (1994). Soil Quality -Guidance on laboratory tests for biodegradation of organic chemicals in soil — Part 1: Aerobic conditions. |
|
(7) |
ISO 14239 (1997). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions. |
|
(8) |
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
(9) |
MAFF — Japan 2000 — Draft Guidelines for transformation studies of pesticides in soil — Aerobic metabolism study in soil under paddy field conditions (flooded). |
|
(10) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995. |
|
(11) |
Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157. |
|
(12) |
DFG: Pesticide Bound Residues in Soil. Wiley — VCH (1998). |
|
(13) |
T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984) |
|
(14) |
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981) |
|
(15) |
ISO 10381-6 (1993). Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(16) |
Annex V to Dir. 67/548/EEC |
|
(17) |
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114. |
|
(18) |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962). |
|
(19) |
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition. |
|
(20) |
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition. |
|
(21) |
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition. |
|
(22) |
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main. |
|
(23) |
Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart. |
|
(24) |
Anderson, J.P.E., Domsch, K.H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, 215-221. |
|
(25) |
ISO 14240-1 and 2 (1997). Soil Quality — Determination of soil microbial biomass — Part 1: Substrate- induced respiration method. Part 2: fumigation-extraction method. |
|
(26) |
Anderson, J.P.E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45-60. |
|
(27) |
Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and bio- transformation of pesticides in aqueous environment. Proceedings of the 16’ Symposium on Environmental Science of Pesticide, 105-120. |
|
(28) |
Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59-63 (SETAC-Europe). |
|
(29) |
Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68-69 (SETAC-Europe). |
|
(30) |
Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, 197-200. |
|
(31) |
Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146. |
|
(32) |
Hamaker, J.W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181-199. |
|
(33) |
Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. In „Environmental Dynamics of Pesticides”. R. Haque and V.H. Freed, Eds., 135- 172. |
|
(34) |
Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz — Nachrichten Bayer 39, 188-204. |
|
(35) |
Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz — Nachrichten Bayer 33, 47-60. |
|
(36) |
Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, 1032-1041. |
|
(37) |
Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 83-122. |
Bijlage 1
WATERDRUK, VELDCAPACITEIT (VC) EN WATERHOUDEND VERMOGEN (WHV) (48)
|
Hoogte van de waterkolom [cm| |
pF (49) |
bar (50) |
Opmerkingen |
|
107 |
7 |
104 |
Droge bodem |
|
1,6.104 |
4,2 |
16 |
Verwelkingspunt |
|
104 |
4 |
10 |
|
|
103 |
3 |
1 |
|
|
6.102 |
2,8 |
0,6 |
|
|
3,3.102 |
2,5 |
0,33 (51) |
Bereik van de veldcapaciteit (52) |
|
102 |
2 |
0,1 |
|
|
60 |
1,8 |
0,06 |
|
|
33 |
1,5 |
0,033 |
|
|
10 |
1 |
0,01 |
WHV (bij benadering) |
|
1 |
0 |
0,001 |
Met water verzadigde bodem |
De waterdruk wordt als hoogte van de waterkolom in cm of in bar gemeten. Vanwege het grote bereik van de zuigspanning wordt eenvoudigheidshalve de pF-waarde gebruikt, de logaritme van de hoogte van de waterkolom in cm.
De veldcapacileil wordt gedefinieerd als de hoeveelheid water die door een natuurlijke bodem twee dagen na een langdurige regenperiode of afdoende irrigatie tegen de zwaartekracht in kan worden vastgehouden. Deze grootheid wordt in situ op het veld in onverstoorde grond bepaald. De meting is dus niet van toepassing op laboratorium-bodemmonsters die wel verstoord zijn. De in verstoorde grond bepaalde VC-waarde kan een sterke systematische variatie vertonen.
Het waterhoudend vermogen (WHV) wordt in het laboratorium met verstoorde en onverstoorde grond bepaald door een bodemkolom via capillair transport met water te verzadigen. Het WHV is vooral voor verstoorde grond nuttig en kan wel 30 % hoger liggen dan de veldcapaciteit (1). Het WHV is experimenteel ook gemakkelijker te bepalen dan een betrouwbare VC-waarde.
Noten
Bijlage 2
VOCHTGEHALTE VAN DE BODEM (in g water per 100 g droge grond) VAN VERSCHILLENDE BODEMSOORTEN UIT VERSCHILLENDE LANDEN
|
|
|
Vochtgehalte van de bodem bij |
||
|
Bodemtype |
Land |
|||
|
|
|
WHV (53) |
pF= 1,8 |
pF = 2,5 |
|
Zand |
Duitsland |
28,7 |
8,8 |
3,9 |
|
Lemig zand |
Duitsland |
50,4 |
17,9 |
12,1 |
|
Lemig zand |
Zwitserland |
44,0 |
35,3 |
9,2 |
|
Siltig leem |
Zwitserland |
72,8 |
56,6 |
28,4 |
|
Kleileem |
Brazilië |
69,7 |
38,4 |
27,3 |
|
Kleileem |
Japan |
74,4 |
57,8 |
31,4 |
|
Zandig leem |
Japan |
82,4 |
59,2 |
36,0 |
|
Siltig leem |
VS |
47,2 |
33,2 |
18,8 |
|
Zandig leem |
VS |
40,4 |
25,2 |
13,3 |
Bijlage 3
Figuur 1
Voorbeeld van een doorstroomapparaat voor de bestudering van de omzetting van chemische stoffen in de bodem (54) (55)

Figuur 2
Voorbeeld van een kolf van het biometer-type voor de bestudering van de omzetting van chemische stoffen in de bodem (56)
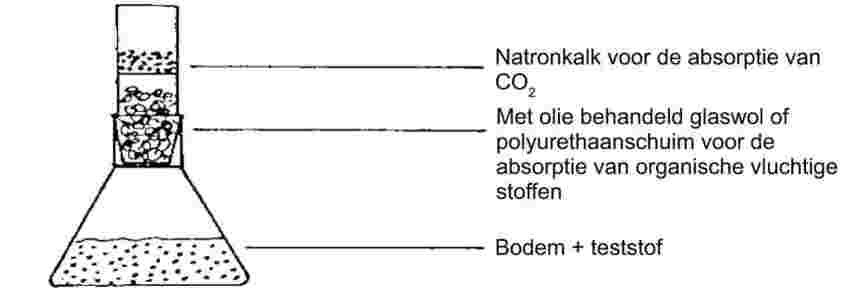
C.24. AËROBE EN ANAËROBE OMZETTING IN AQUA TISCHE SEDIMENTSYSTEMEN
1. METHODE
Deze methode is overgenomen van TG 308 (2002) van de OESO.
1.1 INLEIDING
Chemische stoffen kunnen bijvoorbeeld rechtstreeks, door overwaaien bij het spuiten, door afspoeling, door drainage, door afvalverwijdering, in industrieel, huishoudelijk of agrarisch afvalwater of door depositie uit de lucht in ondiepe of diepe oppervlaktewateren terechtkomen. In deze testmethode wordt een laboratoriumprocedure beschreven voor de bepaling van de aërobe en anaërobe omzetting van organische stoffen in aquatische sedimentsystemen. De methode is gebaseerd op bestaande richtsnoeren (1)(2)(3)(4)(5)(6). In Belgirate (Italië) is in 1995 een OESO-workshop over bodem- en sedimentselectie gehouden (7), waar met name overeenstemming is bereikt over het aantal sedimenttypes dat voor de/e test moet worden gebruikt. De workshop heeft op basis van de ISO-richtsnoeren (8) ook aanbevelingen gedaan voor het verzamelen, behandelen en bewaren van sedimentmonsters. Dergelijke onderzoeken zijn nodig voor chemische stoffen die direct aan water worden toegevoegd of waarvan het aannemelijk is dat ze via bovengenoemde routes in het aquatisch milieu terecht zullen komen.
De omstandigheden in natuurlijke aquatische sedimentsystemen zijn in de bovenstaande waterfase vaak aëroob. De bovenste laag van het sediment kan aëroob of anaëroob zijn, terwijl het diepere sediment meestal anaëroob is. Om al deze mogelijkheden te omvatten worden in dit document zowel aërobe als anaërobe tests beschreven. Bij de aërobe test wordt een aërobe waterkolom boven een aërobe sedimentlaag met daaronder een anaërobe gradiënt gesimuleerd. Bij de anaërobe test wordt een volledig anaëroob water/sedimentsysteem gesimuleerd. Als de omstandigheden erop wijzen dat er significant van deze aanbevelingen moet worden afgeweken, bijvoorbeeld door een intacte sedimentkern te gebruiken of sediment dat aan de teststof blootgesteld kan zijn, zijn daarvoor andere methoden beschikbaar (9).
1.2 DEFINITIES
In alle gevallen moeten eenheden van het Internationale Eenhedenstelsel (SI) worden gebruikt.
Teststof: een stof, hetzij de oorspronkelijke verbinding, hetzij relevante omzettingsproducten.
Omzettingsproducten: alle stoffen die ontstaan bij biotische en abiotische omzettingsreacties van de teststof, met inbegrip van CO2 en gebonden residuen.
Gebonden residuen: verbindingen in de bodem, in planten of in dieren die na extractie in de vorm van de oorspronkelijke verbinding of de metabolieten daarvan in de matrix achterblijven. De extractiemethode mag de verbindingen zelf of de structuur van de matrix niet significant wijzigen. De aard van de binding kan gedeeltelijk worden opgehelderd door extractiemethoden die de matrix wijzigen of door verfijnde analysetechnieken. Tot op heden zijn op deze manier bijvoorbeeld covalente, ionische en sorptiebindingen en insluitingen gesignaleerd. In het algemeen heeft de vorming van gebonden residuen tot gevolg dat de biologische toegankelijkheid en de biologische beschikbaarheid significant afnemen (10) [gewijzigd overgenomen uit IUPAC 1984 (11)].
Aërobe omzetting (oxiderend): reacties die in aanwezigheid van moleculaire zuurstof verlopen (12).
Anaërobe omzetting (reducerend): reacties die bij uitsluiting van moleculaire zuurstof verlopen (12).
Natuurlijk water: oppervlaktewater dat uit bijvoorbeeld een meer of een rivier wordt verkregen.
Sediment: een mengsel van anorganische en organische chemische bestanddelen, in het laatste geval bestaande uit verbindingen met een hoog koolstof- en stikstofgehalte en een hoog molecuulgewicht. Het wordt afgezet door natuurlijk water en vormt een grensvlak met dat water.
Mineralisatie: de volledige afbraak van een organische verbinding tot CO2 en H2O onder aërobe omstandigheden en CH4, CO2 en H2O onder anaërobe omstandigheden. In de context van de/e testmethode betekent mineralisatie, wanneer radioactief gelabelde verbindingen worden gebruikt, een volledige afbraak van een molecuul waarbij een gelabeld koolstofatoom volledig wordt geoxideerd of gereduceerd en een equivalente hoeveelheid respectievelijk CO2 of CH4 vrijkomt.
Halveringstijd (t 0,5): de tijd die nodig is om 50 % van een hoeveelheid teststof om te zetten, wanneer de omzetting kan worden beschreven door kinetiek van de eerste orde; deze is onafhankelijk van de aanvankelijke concentratie.
DT 50 (Disappearance Time 50): de tijd waarin de aanvankelijke concentratie van de teststof met 50 % daalt.
DT 75 (Disappearance Time 75): de tijd waarin de aanvankelijke concentratie van de teststof met 75 % daalt.
DT 90 (Disappearance Time 90): de tijd waarin de aanvankelijke concentratie van de teststof met 90 % daalt.
1.3 REFERENTIESTOFFEN
Voor de kwalitatieve en kwantitatieve bepaling van omzettingsproducten met behulp van spectroscopische en chromatografische methoden moeten referentiestoffen worden gebruikt.
1.4 INFORMATIE OVER DE TESTSTOF
Voor de meting van de omzettingssnelheid kan een al dan niet met een isotoop gelabelde teststof worden gebruikt, hoewel de voorkeur wordt gegeven aan gelabeld materiaal. Voor de bestudering van de omzettingsroute en voor de bepaling van een massabalans is gelabeld materiaal nodig. Labeling met C wordt aanbevolen, maar ook het gebruik van andere isotopen zoals 13C, 15N, 3H of 32P kan nuttig zijn. Het label moet zo veel mogelijk in het meest stabiele gedeelte van het molecuul worden aangebracht (57). De chemische en/of radiochemische zuiverheid van de teststof moet ten minste 95 % zijn.
Vóór de uitvoering van een test moet de volgende informatie over de teststof beschikbaar zijn:
|
(a) |
de oplosbaarheid in water (methode A.6); |
|
(b) |
de oplosbaarheid in organische oplosmiddelen; |
|
(c) |
de dampspanning (methode A.4) en de constante van de wet van Henry; |
|
(d) |
de verdelingscoëfficiënt n-octanol/water (methode A.8); |
|
(e) |
de adsorptiecoëfficiënt (Kd, Kf of Koc) (Methode C.18); |
|
(f) |
de hydrolyse (methode C.7); |
|
(g) |
de dissociatieconstante (pKa) [OESO-richtsnoer 112] (13); |
|
(h) |
de chemische structuur van de teststof en eventueel de plaats van het (de) isotopenlabel(s). |
NB: De temperatuur waarbij deze metingen zijn uitgevoerd, moet worden gerapporteerd.
Ook informatie over de toxiciteit van de teststof voor micro-organismen, over de gemakkelijke en/of intrinsieke biologische atbreekbaarheid en over de aërobe en anaërobe omzetting in de bodem kan nuttig zijn.
Er moeten analysemethoden (met inbegrip van methoden voor extractie en clean-up) beschikbaar zijn voor de kwalitatieve en kwantitatieve bepaling van de teststof en de omzettingsproducten daarvan in water en in sediment (zie punt 1.7.2).
1.5 PRINCIPE VAN DE TESTMETHODE
Bij deze testmethode worden een aëroob en een anaëroob aquatisch sedimentsysteem gebruikt (zie bijlage 1) dat het mogelijk maakt:
|
(i) |
de omzettingssnelheid van de teststof in een water/sedimentsysteem te meten; |
|
(ii) |
de omzettingssnelheid van de teststof in het sediment te meten; |
|
(iii) |
de mineralisatiesnelheid van de teststof en/of de omzettingsproducten daarvan te meten (wanneer een met C gelabelde teststof wordt gebruikt); |
|
(iv) |
de omzettingsproducten in de water- en de sedimentfase kwalitatief en kwantitatief te bepalen en een massabalans op te stellen (wanneer een gelabelde teststof wordt gebruikt); |
|
(v) |
de verdeling van de teststof en de omzettingsproducten daarvan over de twee fasen gedurende een incubatieperiode in het donker (om bijvoorbeeld algenbloei te voorkomen) bij constante temperatuur te meten. Wanneer dit met het oog op de gegevens verantwoord is, worden de halveringstijd, de DT50, de DT75 en de DT90 bepaald, maar deze mogen niet veel verder dan de duur van het experiment worden geëxtrapoleerd (zie punt 1.2) |
Voor zowel de aërobe als de anaërobe test moeten ten minste twee sedimenten met het bijbehorende water worden gebruikt (7). Er kunnen echter gevallen zijn waarin er meer dan twee aquatische sedimenten moeten worden gebruikt, bijvoorbeeld wanneer het gaat om een chemische stof die zowel in zoet water als in het mariene milieu kan voorkomen.
1.6 TOEPASBAARHEID VAN DE TEST
De methode kan in het algemeen worden gebruikt voor alle chemische stoffen (al dan niet gelabeld) waarvoor een analysemethode met een afdoende nauwkeurigheid en gevoeligheid beschikbaar is. Enigszins vluchtige, niet-vluchtige, in water oplosbare en slecht in water oplosbare stoffen kunnen worden getest. De test mag niet worden gebruikt voor chemische stoffen met een grote vluchtigheid vanuit water (b.v. fumigatiemiddelen of organische oplosmiddelen) die daardoor onder de experimentele omstandigheden tijdens deze test uit het water en/of het sediment verdwijnen.
De methode is tot op heden toegepast op het onderzoek van de omzetting van chemische stoffen in zoet water en sedimenten daarvan, maar kan in beginsel ook voor estuariene/mariene systemen worden gebruikt. Zij is niet geschikt voor een simulatie van de omstandigheden in stromend water (zoals rivieren) of in open zee.
1.7 KWALITEITSCRITERIA
1.7.1 Recovery
Door onmiddellijk na de toevoeging van de teststof water- en sedimentmonsters ten minste in duplo te extraheren en te analyseren wordt een eerste indicatie verkregen van de herhaalbaarheid van de analysemethode en de uniformiteit van de procedure voor het toevoegen van de teststof. In latere fasen van de experimenten wordt de recovery bepaald aan de hand van de respectieve massabalansen (wanneer gelabeld materiaal wordt gebruikt). Voor gelabelde stoffen moet de recovery tussen 90 % en 110 % liggen (6) en voor ongelabelde stoffen tussen 70 % en 110 %.
1.7.2 Herhaalbaarheid en gevoeligheid van de analysemethode
De herhaalbaarheid van de analysemethode (exclusief de efficiëntie van de extractie in het begin) voor de kwantitatieve bepaling van de teststof en de omzettingsproducten kan worden gecontroleerd door één extract van een water- of sedimentmonster, dat lang genoeg is geïncubeerd voor de vorming van omzettingsproducten, in duplo te analyseren.
De aantoonbaarheidsgrens van de analysemethode voor de teststof en voor de omzettingsproducten mag niet hoger zijn dan 0,01 mg.kg-1 water of sediment (als teststof) of, indien dit lager is, 1 % van de aanvankelijk aan een testsysteem toegevoegde hoeveelheid. De bepaalbaarheidsgrens moet ook worden gespecificeerd.
1.7.3 Nauwkeurigheid van de omzettingsgegevens
Een regressieanalyse van de concentratie van de teststof als functie van de tijd levert de vereiste informatie op over de nauwkeurigheid van de omzettingscurve en maakt het mogelijk de betrouwbaarheidsgrenzen te berekenen voor de halveringstijd (bij kinetiek van de pseudo-eerste orde) of de DT50 en eventueel de DT75 en de DT90.
1.8 BESCHRIJVING VAN DE METHODE
1.8.1 Testsysteem en apparatuur
Het onderzoek moet in glazen houders (bijvoorbeeld flessen of centrifugebuizen) worden uitgevoerd, tenzij informatie vooraf (zoals de verdelingscoëfficiënt n-octanol/water of sorptiegegevens) erop wijst dat de teststof zich aan glas kan hechten; in dat geval moet wellicht worden overwogen een ander materiaal (zoals Teflon) te gebruiken. Wanneer bekend is dat de teststof zich aan glas hecht, kan dit probleem met behulp van een of meer van de volgende methoden worden beperkt:
|
— |
de massa van de aan het glas gesorbeerde teststof en omzettingsproducten bepalen; |
|
— |
al het glaswerk aan het eind van de test met oplosmiddel spoelen: |
|
— |
geformuleerde producten gebruiken (zie ook punt 1.9.2); |
|
— |
een grotere hoeveelheid co-oplosmiddel gebruiken om de teststof aan het systeem toe te voegen; als een co-oplosmiddel wordt gebruikt, mag dit geen solvolyse van de teststof veroorzaken. |
In de bijlagen 2 en 3 worden voorbeelden gegeven van karakteristieke testapparaten, namelijk respectievelijk een doorstroomsysteem en een systeem van het biometer-type (14). In referentie (15) worden andere geschikte incubatiesystemen beschreven. De experimentele apparatuur moet de uitwisseling van lucht of stikstof en het wegvangen van vluchtige producten mogelijk maken. De afmetingen van de apparatuur moeten zodanig zijn dat aan de eisen van de test wordt voldaan (zie punt 1.9.1). Ventilatie kan gebeuren door zachtjes doorborrelen of door lucht of stikstof over het wateroppervlak te leiden. In het laatste geval kan het nuttig zijn het water van boven zachtjes te roeren om de zuurstof of stikstof beter in het water te verdelen. Er mag geen CO2-vrije lucht worden gebruikt omdat daardoor de pH van het water kan stijgen. Verstoring van het sediment is in elk geval onwenselijk en moet zo veel mogelijk worden voorkomen. Enigszins vluchtige chemische stoffen moeten in een systeem van het biometer-type bij licht roeren van het wateroppervlak worden getest. Er kunnen ook gesloten systemen met lucht of stikstof boven de vloeistof en interne flacons voor het wegvangen van vluchtige producten worden gebruikt (16). Bij de aërobe test is een periodieke verversing van het gas boven de vloeistof nodig om het zuurstofverbruik door de biomassa te compenseren.
Voor het wegvangen van vluchtige omzettingsproducten kunnen bijvoorbeeld worden gebruikt: kaliumhydroxide- of natriumhydroxide-oplossingen van 1 mol.dm-3 voor kooldioxide (58) en ethyleenglycol, ethanolamine of 2 % paraffine in xyleen voor organische verbindingen. Vluchtige stoffen die onder anaërobe omstandigheden ontstaan, zoals methaan, kunnen bijvoorbeeld met een moleculaire zeef worden opgevangen. Deze vluchtige stoffen kunnen bijvoorbeeld tot CO2 worden verbrand door het gas bij een temperatuur van 900 oC door een met CuO gevulde kwartsbuis te leiden en het gevormde CO2 in een alkalische absorptieoplossing weg te vangen (17).
Er is laboratoriumapparatuur voor de chemische analyse van de teststof en de omzettingsproducten nodig (gaschromatografie (GLC), hogedrukvloeistofchromatografie (HPLC), dunnelaagchromatografie (TLC), massaspectroscopie (MS), gaschromatograt'ie-massaspectrometrie (GC/MS), vloeistofchromatografie-massaspectrometrie (LC/MS), kernspinresonantie (NMR) enz.) met inbegrip van detectiesystemen voor al dan niet radioactief gelabelde chemische stoffen. Wanneer radioactief gelabeld materiaal wordt gebruikt, zijn ook een vloeistofscintillatieteller en een verbrandingsoxidator (voor de verbranding van sedimentmonsters vóór de analyse van de radioactiviteit) nodig.
Daarnaast zijn eventueel ook andere standaard-laboratoriumapparatuur voor fysisch-chemische en biologische bepalingen (zie tabel 1 onder punt 1.8.2.2), glaswerk, chemicaliën en reagentia nodig.
1.8.2 Selectie van aquatische sedimenten en aantal sedimenten
De monstememingsplaatsen moeten aan de hand van het doel van de test in een bepaalde situatie worden gekozen. Bij de keuze van de monstememingsplaatsen moet rekening worden gehouden met stoffen die wellicht in het verleden door landbouw, industrie of huishoudens in het stroomgebied en het water stroomopwaarts terecht zijn gekomen. Als het sediment in de loop van de voorgaande vier jaar met de teststof of structureel analoge verbindingen is verontreinigd, mag het niet worden gebruikt.
1.8.2.1 Selectie van het sediment
Voor het aërobe onderzoek worden normaal gesproken twee sedimenten gebruikt (7). Het organische koolstofgehalte en de textuur van de gekozen sedimenten moeten verschillen. Eén sediment moet een hoog organisch koolstofgehalte (2,5-7,5 %) en een fijne textuur hebben en het andere sediment een laag organisch koolstofgehalte (0,5-2,5 %) en een grove textuur. Het verschil in organisch koolstofgehalte moet normaal gesproken ten minste 2 % zijn. Een „fijne textuur” wordt gedefinieerd als een gehalte aan [klei + silt] (59) van > 50 % en een „grove textuur” wordt gedefinieerd als een gehalte aan [klei + silt] van < 50 %. Het verschil in gehalte aan [klei + silt 1 voor de twee sedimenten moet normaal gesproken ten minste 20 % zijn. Wanneer een chemische stof ook in het zeewater terecht kan komen, moet ten minste een van de water/sedimentsystemen van mariene herkomst zijn.
Voor het strikt anaërobe onderzoek moeten monsters van twee sedimenten (met het bijbehorende water) uit de anaërobe zones van oppervlaktewateren worden genomen (7). Zowel het sediment als de waterfase moeten voorzichtig worden behandeld en vervoerd zodat er geen zuurstof bij kan komen.
Ook andere parameters kunnen belangrijk zijn bij de keuze van sedimenten en moeten van geval tot geval worden bezien. Zo zal het pH-bereik van sedimenten belangrijk zijn wanneer chemische stoffen worden getest waarvan de omzetting en/of sorptie pH-afhankelijk kunnen zijn. Een pH-afhankelijkheid van sorptie kan gevolgen hebben voor de pKa van de teststof.
1.8.2.2 Karakterisering van de water/sedimentmonsters
In onderstaande tabel wordt een overzicht gegeven van de sleutelparameters die voor zowel water als sediment moeten worden gemeten en gerapporteerd (met vermelding van de gebruikte methode) en de fase van de test waarin deze parameters moeten worden bepaald. Ter informatie: methoden voor de bepaling van deze parameters worden vermeld in de referenties (18)(19)(20)(21).
Daarnaast kan het van geval tot geval nodig zijn andere parameters te meten en te rapporteren (bijvoorbeeld voor zoet water: deeltjes, alkaliniteit, hardheid, geleidingsvermogen en NO3/PO4 (verhouding en elk apart); voor sedimenten: kation-uitwisselingscapaciteit, waterhoudend vermogen, carbonaat en stikstof en fosfor totaal; voor mariene systemen: zoutgehalte). Een analyse van sedimenten en water op nitraat, sulfaat, biologisch beschikbaar ijzer en wellicht andere elektronenacceptoren kan ook nuttig zijn bij de beoordeling van redox-omstandigheden, vooral wanneer het gaat om anaërobe omzetting.
Meting van parameters voor de karakterisering van water/sedimentmonsters (7)(22)(23)
|
Parameter |
Fase van de testprocedure |
|||||
|
Monster neming |
Nabewerking |
Begin acclimatisering |
Begin test |
Gedurende test |
Einde test |
|
|
Water |
||||||
|
Herkomst/bron |
X |
|
|
|
|
|
|
Temperatuur |
X |
|
|
|
|
|
|
pH |
X |
|
X |
X |
X |
X |
|
TOC |
|
|
X |
X |
|
X |
|
O2-concentratie* |
X |
|
X |
X |
X |
X |
|
Redoxpotentiaal* |
|
|
X |
X |
X |
X |
|
Sediment |
||||||
|
Herkomst/bron |
X |
|
|
|
|
|
|
Laagdiepte |
X |
|
|
|
|
|
|
pH |
|
X |
X |
X |
X |
X |
|
Deeltjesgrootte-verdeling |
|
X |
|
|
|
|
|
TOC |
|
X |
X |
X |
|
X |
|
Microbiële biomassa (60) |
|
X |
|
X |
|
X |
|
Redoxpotentiaal (61) |
Observatie (kleur/geur) |
|
X |
X |
X |
X |
1.8.3 Verzameling, behandeling en opslag
1.8.3.1 Verzameling
Voor de monsterneming van sediment moeten de ontwerprichtsnoeren van de ISO voor de monsterneming van bodemsediment (8) worden gevolgd. Sedimentmonsters worden genomen van de hele bovenste sedimentlaag van 5 tot 10 cm. Het bijbehorende water moet op dezelfde plaats en op hetzelfde tijdstip als het sediment worden verzameld. Voor het anaërobe onderzoek moet het monster van het sediment en het bijbehorende water worden genomen en vervoerd zonder dat er zuurstof bij kan komen (28) (zie punt 1.8.2.1). In de literatuur worden enkele monsternemingsapparaten beschreven (8)(23).
1.8.3.2 Behandeling
Het sediment wordt door filtratie van het water gescheiden en het sediment wordt met behulp van extra water van de locatie, dat vervolgens wordt weggegooid, nat gezeefd over een zeef van 2 mm. Vervolgens worden bekende hoeveelheden sediment en water in de gewenste verhouding (zie punt 1.9.1) in incubatiekolven gemengd en voorbehandeld voor de acclimatiseringsperiode (zie punt 1.8.4). Voor het anaërobe onderzoek moeten alle bewerkingen worden uitgevoerd zonder dat er zuurstof bij kan komen (29)(30)(31)(32)(33).
1.8.3.3 Opslag
Het gebruik van verse monsters sediment en water wordt ten zeerste aanbevolen, maar als opslag nodig is, moeten sediment en water volgens bovenstaande beschrijving worden gezeefd en samen in een laag water (6-10 cm) in het donker bij 4 ± 2 oC (62) gedurende maximaal 4 weken worden opgeslagen (7)(8)(23). Monsters die voor aëroob onderzoek worden gebruikt, moeten zodanig worden bewaard dat er gemakkelijk lucht bij kan komen (bijvoorbeeld in open bakken), terwijl monsters voor anaëroob onderzoek zodanig moeten worden bewaard dat er geen zuurstof bij kan komen. Bevriezing van sediment en water en uitdroging van het sediment tijdens het vervoer en de opslag moeten worden voorkomen.
1.8.4 Voorbehandeling van de sediment/watermonsters voor de test
Voordat de teststof wordt toegevoegd, wordt elk sediment/watermonster geacclimatiseerd. Daartoe worden de monsters onder precies dezelfde omstandigheden als die van de incubatie tijdens de test in het incubatieapparaat gebracht dat bij de test zal worden gebruikt (zie punt 1.9.1). De acclimatiseringsperiode is de tijd die het systeem nodig heeft om redelijk stabiel te worden, zoals dit tot uiting komt in de pH, de zuurstofconcentratie in het water, de redoxpotentiaal van het sediment en het water en de macroscopische scheiding van de fasen. De acclimatiseringsperiode duurt normaal gesproken een tot twee weken en mag niet meer dan vier weken duren. De resultaten van de tijdens deze periode uitgevoerde bepalingen moeten worden gerapporteerd.
1.9 UITVOERING VAN DE TEST
1.9.1 Testomstandigheden
De test wordt in het incubatieapparaat (zie punt 1.8.1) uitgevoerd met een volumeverhouding water/sediment tussen 3:1 en 4:1 en een sedimentlaag van 2,5 cm (±0,5 cm). Een minimum hoeveelheid van 50 g sediment (droog gewicht) per incubatie tijdens wordt.
De test wordt in het donker bij een constante temperatuur tussen 10 oC en 30 oC uitgevoerd. Een temperatuur van 20 ± 2 oC is geschikt. Daarnaast kan waar nodig, afhankelijk van de informatie die de test moet opleveren, van geval tot geval ook een lagere temperatuur (bijvoorbeeld 10 oC) worden overwogen. De incubatietemperatuur worden gemonitord en gerapporteerd.
1.9.2 Behandeling en toevoeging van de teststof
Er wordt één concentratie van de teststof gebruikt. Voor gewasbeschermingsmiddelen die rechtstreeks in wateren worden gebracht, moet de op de etikettering vermelde maximale dosering als de maximaal toe te dienen hoeveelheid worden gebruikt (63), berekend op basis van het oppervlak van het water in de houder. In alle andere gevallen wordt de te gebruiken concentratie afgeleid van de geraamde emissie in het milieu. Er moet voor worden gezorgd dat de concentratie van de teststof voldoende is om de omzettingsroute en de vorming en afbraak van de omzettingsproducten te kunnen karakteriseren. Het kan nodig zijn hogere doses te gebruiken (bijvoorbeeld een factor 10 hoger), wanneer de concentraties van de teststof aan het begin van de test dicht bij de aantoonbaarheidsgrens liggen en/of wanneer belangrijke omzettingsproducten niet gemakkelijk kunnen worden aangetoond wanneer hun concentratie 10 % van de oorspronkelijk gebruikte hoeveelheid teststof bedraagt. Als er echter hogere testconcentraties worden gebruikt, mogen deze geen significante schadelijke effecten hebben op de microbiële activiteit van het water/sedimentsysteem. Om voor een constante concentratie van de teststof in houders met verschillende afmetingen te zorgen, kan het nodig zijn de hoeveelheid toe te voegen materiaal aan te passen op basis van de verhouding tussen de diepte van de waterkolom in de houder en de waterdiepte in het veld (er wordt uitgegaan van een diepte van 100 cm, maar ook een andere diepte kan worden gebruikt). Voor een voorbeeld van een dergelijke berekening wordt verwezen naar bijlage 4.
In het ideale geval wordt de teststof als waterige oplossing aan de waterfase van het testsysteem toegevoegd. Als dit onvermijdelijk is, mogen kleine hoeveelheden met water mengbare oplosmiddelen (zoals aceton of ethanol) voor de toevoeging en verdeling van de teststof worden gebruikt, maar deze hoeveelheden mogen niet groter zijn dan 1 % (v/v) en geen schadelijke effecten op de microbiële activiteit van het testsysteem hebben. De bereiding van de waterige oplossing van de teststof moet voorzichtig gebeuren — het gebruik van een generatorkolom of menging vooraf kan nodig zijn om voor een volledige homogeniteit te zorgen. Na de toevoeging van de waterige oplossing aan het testsysteem wordt aanbevolen de waterfase voorzichtig te mengen, waarbij het sediment zo min mogelijk wordt verstoord.
Het gebruik van geformuleerde producten wordt normaal gesproken afgeraden, aangezien de bestanddelen van de formulering de verdeling van de teststof en/of de omzettingsproducten over de water- en sedimentfase kunnen beïnvloeden. Voor slecht in water oplosbare stoffen kan het gebruik van geformuleerd materiaal echter een geschikt alternatief zijn.
Het aantal incubatiehouders is afhankelijk van het aantal monsternemingstijdstippen (zie punt 1.9.3). Er moeten zo veel testsystemen beschikbaar zijn dat er op elk monsternemingstijdstip twee systemen uit de proef kunnen worden genomen. Wanneer er controle-opstellingen voor elk aquatisch sedimentsysteem worden gebruikt, mogen deze niet met de teststof worden behandeld. De controle-opstellingen kunnen worden gebruikt om aan het eind van het onderzoek de microbiële biomassa van het sediment en de totale hoeveelheid organische koolstof in het water en het sediment te bepalen. Twee controle-opstellingen (d.w.z. één voor elk aquatisch sediment) kunnen worden gebruikt voor de monitoring van de vereiste parameters in het sediment en het water gedurende de acclimatiseringsperiode (zie de tabel onder punt 1.8.2.2). Wanneer de teststof met behulp van een oplosmiddel wordt toegevoegd, zijn twee extra controle-opstellingen nodig om de schadelijke effecten daarvan op de microbiële activiteit van het testsysteem te meten.
1.9.3 Duur van de test en monsterneming
Het experiment mag normaal gesproken niet langer duren dan 100 dagen (6) en moet worden voortgezet totdat de afbraakroute en het verdelingspatroon sediment/water vaststaan of 90 % van de teststof door omzetting en/of vervluchtiging is verdwenen. Er moeten ten minste zes monsternemingstijdstippen zijn (inclusief het beginpunt) en een facultatief vooronderzoek (zie punt 1.9.4) kan worden gebruikt om een adequaat monsternemingsschema vast te stellen en de duur van de test te bepalen, tenzij er uit eerder onderzoek voldoende gegevens over de teststof beschikbaar zijn. Voor hydrofobe teststoffen kunnen extra monsternemingspunten tijdens de beginfase van het onderzoek nodig zijn om de snelheid van de verdeling over de sediment- en de waterfase te bepalen.
Op geschikte monsternemingstijdstippen worden hele incubatiehouders (in duplo) voor analyse uit de test genomen. Het sediment en het bovenstaande water worden apart geanalyseerd (64). Hert bovenstaande water wordt voorzichtig verwijderd, waarbij het sediment zo min mogelijk wordt verstoord. Bij de extractie en karakterisering van de teststof en de omzettingsproducten worden adequate analyseprocedures gevolgd. Er moet op worden gelet dat ook materiaal dat aan de incubatiehouder of aan de verbindingsbuizen voor het wegvangen van vluchtige stoffen is geadsorbeerd, wordt verwijderd.
1.9.4 Facultatief vooronderzoek
Als de duur en het monsternemingsschema niet aan de hand van ander relevant onderzoek aan de teststof kunnen worden bepaald, kan een facultatief vooronderzoek nuttig zijn, dat onder dezelfde testomstandigheden wordt uitgevoerd als het definitieve onderzoek. Als er een vooronderzoek wordt uitgevoerd, moeten de relevante experimentele omstandigheden en resultaten daarvan kort worden gerapporteerd.
1.9.5 Metingen en analyse
Voor elk monsternemingstijdstip wordt de concentratie van de teststof en de omzettingsproducten in het water en het sediment gemeten en gerapporteerd (als concentratie en als percentage van de toegevoegde hoeveelheid). In het algemeen moeten omzettingsproducten die op enig monsternemingstijdstip in grotere hoeveelheden dan 10 % van de toegevoegde radioactiviteit in het hele water/sedimentsysteem worden bepaald, worden geïdentificeerd tenzij er een redelijke motivering is om dit niet te doen. Ook voor omzettingsproducten waarvan de concentratie gedurende het onderzoek voortdurend stijgt, moet identificatie worden overwogen, zelfs als hun concentratie niet hoger wordt dan bovengenoemde grenswaarde, aangezien dit op persistentie kan wijzen. Deze aspecten moeten van geval tot geval worden bekeken en in het verslag moet een motivering van de conclusies worden opgenomen.
Voor elk monsternemingstijdstip worden ook de resultaten van systemen voor het wegvangen van gassen en vluchtige stoffen (CO2 en bijvoorbeeld vluchtige organische verbindingen) gerapporteerd. Ook de mineralisatiesnelheden worden gerapporteerd. Voor elk monsternemingstijdstip worden de niet-extraheerbare (gebonden) residuen in sediment gerapporteerd.
2. GEGEVENS
2.1 BEHANDELING VAN DE RESULTATEN
Voor elk monsternemingstijdstip wordt de totale massabalans of de recovery (zie punt 1.7.1) van de toegevoegde radioactiviteit berekend. De resultaten worden als percentage van de toegevoegde radioactiviteit gerapporteerd. De verdeling van de radioactiviteit tussen water en sediment wordt voor elk monsternemingstijdstip als concentratie en als percentage gerapporteerd.
De halveringstijd, de DT50 en eventueel de DT75 en de DT90 van de teststof worden samen met hun betrouwbaarheidsgrenzen (zie punt 1.7.3) berekend. Informatie over de snelheid waarmee de teststof uit het water en het sediment verdwijnt, kan met behulp van geschikte evaluatiehulpmiddelen worden verkregen. Deze kunnen variëren van het gebruik van kinetiek van de pseudo-eerste orde en empirische technieken voor de bepaling van de optimale curve waarbij grafische of numerieke oplossingen worden toegepast, tot complexere evaluaties met behulp van bijvoorbeeld modellen met een of meer compartimenten. Voor nadere bijzonderheden wordt verwezen naar de desbetreffende gepubliceerde literatuur (35)(36)(37).
Alle benaderingen hebben hun sterke en zwakke punten en lopen qua complexiteit sterk uiteen. Wanneer wordt uitgegaan van kinetiek van de eerste orde, worden de afbraak- en distributieprocessen wellicht te zeer vereenvoudigd, maar wanneer dit mogelijk is levert dit een parameter op (de snelheidsconstante of halveringstijd) die gemakkelijk te begrijpen is en bruikbaar is voor simulatiemodellen en de berekening van geraamde milieuconcentraties. Empirische benaderingen of lineaire transformaties kunnen leiden tot curves die beter bij de gegevens aansluiten en maken derhalve een betere bepaling van de halveringstijd, de DT50 en eventueel de DT75 en de DT90 mogelijk. Het nut van de afgeleide constanten is echter beperkt. Compartimentmodellen kunnen een aantal nuttige constanten voor een risicobeoordeling opleveren, die de afbraaksnelheid in verschillende compartimenten en de verdeling van de chemische stof beschrijven. Ze moeten ook worden gebruikt voor de bepaling van de snelheidsconstanten voor de vorming en afbraak van belangrijke omzettingsproducten. In alle gevallen moet er een motivering voor de keuze van de methode worden gegeven en moet degene die het experiment uitvoert grafisch en/of statistisch aantonen hoe goed de curve en de gegevens bij elkaar aansluiten.
3. RAPPORTAGE
3.1 TESTVERSLAG
In het testverslag moet de volgende informatie worden opgenomen:
|
|
De teststof:
|
|
|
Referentiestoffen:
|
|
|
Voor de test gebruikte sedimenten en wateren:
|
|
|
De testomstandigheden:
|
|
|
De resultaten:
|
4. REFERENTIES
|
(1) |
BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany. |
|
(2) |
Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands. |
|
(3) |
MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United Kingdom. |
|
(4) |
Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) — Anaerobic and aerobic. Canada, pp 35-37. |
|
(5) |
US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism. |
|
(6) |
SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels. |
|
(7) |
OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995. |
|
(8) |
ISO/DIS 5667-12. (1994). Water quality — Sampling — Part 12: Guidance on sampling of bottom sediments. |
|
(9) |
US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080. |
|
(10) |
DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998). |
|
(11) |
T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984). |
|
(12) |
OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981). |
|
(13) |
OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(14) |
Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC — Pests and Diseases, 3B-4, 149-158. |
|
(15) |
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons. |
|
(16) |
Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, 631-637. |
|
(17) |
Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, 661-667. |
|
(18) |
Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison. |
|
(19) |
APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C. |
|
(20) |
Rowell, D.L. (1994). Soil Science Methods and Applications. Longman. |
|
(21) |
Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038-1039. |
|
(22) |
SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop „A Meeting of Experts on Guidelines for Static Field Mesocosms Tests”, 3-4 July 1991. |
|
(23) |
SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach. |
|
(24) |
Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858-2868. |
|
(25) |
Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol., 329-338. |
|
(26) |
Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197-203. |
|
(27) |
ISO-14240-2. (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation- extraction method. |
|
(28) |
Beelen, P. van and F. van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13-21. |
|
(29) |
Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850-857. |
|
(30) |
Birch, R.R., Biver, C, Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. |
|
(31) |
Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499-1509. |
|
(32) |
Nuck, B.A. and Federle, T.W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, 3597-3603. |
|
(33) |
US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090. |
|
(34) |
Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961-968. |
|
(35) |
Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues 11. Pflanzenschutz — Nachrichten Bayer, 39, 187-203. |
|
(36) |
Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues 1. Pflanzenschutz — Nachrichten Bayer, 33, 47-60. |
|
(37) |
Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference — Pest and Diseases, pp 1349-1354. |
Bijlage 1
RICHTSNOEREN VOOR HET AËROBE EN HET ANAËROBE TESTSYSTEEM
Het aërobe testsysteem
Het in deze testmethode beschreven aërobe testsysteem bestaat uit een aërobe waterlaag (met een zuurstofconcentratie die normaal tussen 7 en 10 mg.l-1 ligt) en een sedimentlaag die aan het oppervlak aëroob en onder het oppervlak anaëroob is (met een gemiddelde redoxpotentiaal (Eh) in het anaërobe gedeelte van het sediment die normaal tussen - 80 en - 190 mV ligt). In elke incubatie-opstelling wordt vochtige lucht over het wateroppervlak geleid om voor voldoende zuurstof in de ruimte boven het water te zorgen.
Het anaërobe testsysteem
Voor het anaërobe testsysteem is de testprocedure in grote lijnen gelijk aan de voor het aërobe systeem geschetste procedure, behalve dat in elke incubatie-opstelling vochtige stikstof over het wateroppervlak wordt geleid om voor voldoende stikstof in de ruimte boven het water te zorgen. Het sediment en het water worden als anaëroob beschouwd zodra de redoxpotentiaal (Eh) lager dan - 100 mV is.
Bij de anaërobe test wordt voor de bepaling van de mineralisatie ook het vrijgekomen kooldioxide en methaan gemeten.
Bijlage 2
VOORBEELD VAN EEN DOORSTROOMOPSTELLING

Bijlage 3
VOORBEELD VAN EEN BIOMETERAPPARAAT

Bijlage 4
VOORBEELD VOOR DE BEREKENING VAN DE HOEVEELHEID TESTSTOF DIE AAN EEN TESTHOUDER WORDT TOEGEVOEGD
|
Inwendige diameter van de cylinder: |
= 8 cm |
|
Diepte waterkolom zonder sediment: |
= 12 cm |
|
Oppervlak waterspiegel: 3,142 × 42 |
= 50,3 cm2 |
|
Toe te voegen hoeveelheid: 500 g teststof/ha komt overeen met 5 ug/cm2 |
|
|
Totaal in μg: 5 × 50,3 |
= 251,5 μg |
|
Aanpassing van de hoeveelheid op basis van een diepte van 100 cm: 12 x 251,5 ÷ 100 |
= 30,18 μg |
|
Volume van de waterkolom: 50,3 × 12 |
= 603 ml |
|
Concentratie in water: 30,18 ÷ 603 |
= 0,050 μg/ml of 50 μg/l |
(1) De resultaten van deze ringtests en een technisch corrigendum van ISO 6341 leveren voor kaliumdichromaat (K2Cr2O7) een EC50 na 24 uur tussen 0,6 en 1,7 mg/l op.
(2) Water met een geschikte zuiverheid, bijvoorbeeld gedeïoniseerd, gedestilleerd of gezuiverd door omgekeerde osmose, met een geleidbaarheid die bij voorkeur niet hoger is dan 10 μS.cm-1.
(3) Indien D1 en D2 te veel van elkaar verschillen, moet het gemiddelde niet berekend worden.
(4) Indien D1 en D2 te veel van elkaar verschillen, moet het gemiddelde niet berekend worden.
(5) of aan het eind van de incubatie
(6) Indien D1 en D2 te veel van elkaar verschillen, moet het gemiddelde niet berekend worden.
(7) of aan het eind van de incubatie
(8) Indien D1 en D2 te veel van elkaar verschillen, moet het gemiddelde niet berekend worden.
(9) Indien D1 en D2 te veel van elkaar verschillen, moet het gemiddelde niet berekend worden.
(10) Na gebruik dienen oplossingendie kwikzouten bevatten te worden nabehandeld om verspreiding van kwik in het milieu te voorkomen.
(11) Mabey and Mill bevelen het gebruik van boraat- of acetaat- in plaats van fosfaatbuffers aan (11).
(12) Deze informatie kan uit andere bronnen afkomstig zijn, zoals gegevens over de hydrolyse van qua structuur vergelijkbare verbindingen uit de literatuur of uit andere oriënterende semi-kwantitatieve tests met de teststof tijdens een eerdere ontwikkelingsfase.
(13) Als uitzetting van de logaritmisch omgezette gegevens tegen de tijd geen lineaire functie oplevert (die overeenkomt met een eerste orde reactiesnelheid), kan vergelijking [3] niet worden gebruikt om de hydrolyse-snelheidsconstante van de teststof te bepalen.
(14) De in deze tabellen gerapporteerde pH-waarden zijn uit de potentiaalmetingen berekend met behulp van de standaardvergelijkingen van Sörensen (1909). De corresponderende pH-waarden zijn 0,04 eenheden hoger dan de waarden in de tabel.
(15) Voeg een klein kristal thymol of een vergelijkbare stof toe om de groei van schimmels te voorkomen.
(16) Gemiddelde waarden van bepalingen in triplo.
(17) Meyer A., Orti G. (1993), Proc. Royal Society of London, Series B., Vol. 252, p. 231
(18) Bemonster het water nadat ten minste reeds drie bakvolumes zijn doorgestroomd.
De cijfers tussen haakjes zijn de aantallen extra monsters (van het water en de vissen) die worden genomen ingeval voor een aanvullende bemonstering werd geopteerd.
|
NB |
: |
De preliminaire, aan de test voorafgaande schatting van k. op basis van log Pow = 4,0 bedraagt 0,652 dag-1. De totale duur van het experiment wordt gelijkgesteld aan 3 × top = 3 × 4,6 dagen, d.w.z. 14 dagen. Voor de schatting van Pow, zie aanhangsel 3. |
(19) Meyer, A., Bierman, C.H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio Rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, 231-236.
(20) Uit de kolom kan een reeks van vijf (of meer) opeenvolgende concentraties worden gekozen. De klassemiddenwaarden tussen de concentraties in kolom (x) worden verkregen uit kolom (2x + 1). De waarden in de tabel staan voor concentraties uitgedrukt in percentage per volume of in gewicht (mg/l of μg/1). De waarden kunnen waar nodig worden vermenigvuldigd met of gedeeld door elke tiende macht. Kolom 1 kan worden gebruikt als er veel onduidelijkheid bestaat over het toxiciteitsniveau.
(21) OECD, Paris, 1992, Test Guideline 210, Fish, Early-life Stage Toxicity Test.
(22) Voor embryo's.
(23) Voor larven.
(24) Duisternis voor embryo's en larven tot een week nadat de eitjes zijn uitgekomen, behalve wanneer ze worden geïnspecteerd. Daarna zwak licht tot het eind van de test.
(25) Volgens het systeem van de FAO en de VS (85).
(26) De waarde van deze variabelen moet bij voorkeur binnen het vermeide bereik vallen. Als het echter moeilijk is geschikt bodemmateriaal te vinden, is ook een waarde beneden het vermelde minimum aanvaardbaar.
(27) Bodem met minder dan 0,3 % organische koolstof kan de correlatie tussen het gehalte aan organisch materiaal en de adsorptie verstoren. Het verdient dan ook aanbeveling bodem met minimaal 0,3 % organische koolstof te gebruiken.
(29) Curves waarin de concentratie van de teststof wordt uitgezet tegen de tijd, kunnen ook worden gebruikt om te bepalen wanneer het evenwicht 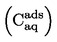 wordt bereikt (zie figuur 2 in aanhangsel 5).
wordt bereikt (zie figuur 2 in aanhangsel 5).
(30) DT-50 tijd waarin 50 1/2 van de teststof wordt afgebroken.
(31) Deze vergelijkingen gelden voor zowel de directe als de indirecte methode. Alle andere vergelijkingen gelden alleen voor de indirecte methode.
(32) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), blz. 121-1 28.
(33) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), blz. 107-119.
(34) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test, Chemosphere. 30(7) -blz. 1373-1384.
(35) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No. 106 01 044 (1994).
(36) B.V. Oepen. W. Kördel, W. Klein. (1991) . Chemoshere 22. blz. 285-304.
(37) Door de bedrijfstak verstrekte gegevens.
(38) Aangeven welk vat voor het experiment werd gebruikt.
(39) Niet-uitgekomen eitjes aangeven als „AB” in het desbetreffend vakje
(40) Eventuele mortaliteit van volwassen dieren aangeven als „M” in het desbetreffend vakje.
(41) Als de teststof bijvoorbeeld één ring bevat, moet deze ring worden gelabeld; als de teststof twee of meer ringen bevat, kan er apart onderzoek nodig zijn om te bekijken wat er met elke gelabelde ring gebeurt en om bruikbare informatie over de vorming van omzettingsproducten te verkrijgen.
(42) De waterretentiekenmerken van een bodemtype kunnen worden gemeten als de veldcapaciteit, het waterhoudend vermogen of de waterspanning (pF). Zie bijlage I voor een uitleg. In het testverslag moet worden vermeld of de waterretentiekenmerken en de dichtheid van de droge grond in onverstoorde of verstoorde (bewerkte) veldmonsters zijn bepaald.
(43) Recente onderzoekresultaten wijzen erop dat ook grond uit gematigde zones zonder een significant verlies van microbiële activiteit gedurende meer dan drie maanden bij - 20 oC kan worden bewaard (28)(29).
(44) De grond mag niet te nat en niet te droog zijn om een afdoende beluchting en voeding van de microflora in de bodem te waarborgen. Als vochtgehalte voor een optimale microbiële groei wordt een waterhoudend vermogen (WHV) van 40-60 % en een waterspanning van 0,1-0,33 bar aanbevolen (6). Dit laatste interval komt overeen met een pF van 2,0-2,5. In bijlage 2 wordt voor verschillende bodemtypes het karakteristieke vochtgehalte vermeld.
(45) Aan het bodemoppervlak en zelfs daaronder heersen meestal aërobe omstandigheden, zoals is gebleken uit een onderzoekproject in opdracht van de EU [K. Takagi et al. (1992): Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17-21 augustus 1992, Sigtuna, Zweden|. Anaërobe omstandigheden komen slechts sporadisch voor wanneer de bodem na zware regenval doordrenkt is of wanneer in rijstvelden paddy-omstandigheden heersen.
(46) Aëroob onderzoek kan al lang vóór de 120 dagen worden beëindigd, mits de uiteindelijke omzettingsroute en de uiteindelijke mineralisatie op dat moment duidelijk bereikt zijn. Beëindiging van de test is mogelijk na 120 dagen of wanneer ten minste 90 % van de teststof is omgezet, maar alleen als ten minste 5 % CO2 is gevormd.
(47) De aanvankelijke concentratie op basis van het oppervlak wordt als volgt berekend:

|
Cbodem |
= |
aanvankelijke concentratie in de bodem [mg-kg-1]. |
|
A |
= |
opgebrachte hoeveelheid [kg.ha-1]; 1 = dikte van de bodemlaag [m]; d = dichtheid van de droge bodem [kg.m-3]. |
Als vuistregel geldt dat een opgebrachte hoeveelheid van 1 kg.ha-1 tot een bodemconcentratie van ongeveer 1 mg.kg-1 in een laag van 10 cm leidt (uitgaande van een dichtheid van de droge bodem van 1 g cm-3).
(48) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(49) pF = log hoogte waterkolom in cm.
(50) 1 bar= 105Pa.
(51) Komt overeen met een watergehalte van ongeveer 10 % in zand, 35 % in leem en 45 % in klei.
(52) De veldcapaciteit is niet constant maar varieert van bodemtype tot bodemtype tussen pF 1,5 en 2,5.
(53) Waterhoudend vermogen
(54) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.),
(55) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
(56) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146.
(57) Als de teststof bijvoorbeeld één ring bevat, moet deze ring worden gelabeld; als de teststof twee of meer ringen bevat, kan er apart onderzoek nodig zijn om te bekijken wat er met elke gelabelde ring gebeurt en om bruikbare informatie over de vorming van omzettingsproducten te verkrijgen.
(58) Aangezien deze alkalische absorptie-oplossingen ook kooldioxide uit de ventilatielucht absorberen en kooldioxide die bij aërobe experimenten door ademhaling ontstaat, moeten ze geregeld worden ververst om verzadiging en zodoende verlies van hun absorptievermogen te voorkomen.
(59) [Klei + silt] is de minerale fractie van het sediment met een deeltjesgrootte < 50 urn.
(60) De methode met de microbiële ademhalingssnelheid (26), de fumigatiemethode (27) of de telplaatmethode (bijvoorbeeld bacteriën, actinomyceten, fungi en totaal aantal kolonies) voor aëroob onderzoek en de vormingssnelheid van methaan voor anaëroob onderzoek.
(61) Uit recent onderzoek is gebleken dat metingen van de zuurstofconcentratie van water en van redoxpotentialengeen mechanistische of voorspellende waarde hebben voor de groei en ontwikkeling van microbiële populaties in oppervlaktewateren (24)(25). De bepaling van het biochemische zuurstofverbruik (BZV, bij de monsterneming en aan het begin en aan het einde van de test) en van de concentratie van de micro/macronutriënten Ca, Mg en Mn (aan het begin en aan het einde van de test) in water en de meting van de totale hoeveelheid N en P in sedimenten (bij de monsterneming en aan het einde van de test) zijn wellicht betere instrumenten voor de interpretatie en evaluatie van de aërobe biotransformatiesnelheid en -route.
(62) Uit recent onderzoek is gebleken dat opslag bij 4 oC tot een afname van het organisch koolstofgehalte van het sediment kan leiden, hetgeen mogelijkerwijs tot gevolg kan hebben dat de microbiële activiteit afneemt (34).
(63) Een test met een tweede concentratie kan nuttig zijn voor chemische stoffen die langs verschillende routes in het oppervlaktewater terechtkomen en waarbij dit tot significant verschillende concentraties leidt, zolang de laagste concentratie met een afdoende nauwkeurigheid kan worden geanalyseerd.
(64) Wanneer een snelle heroxidatie van anaërobe omzettingsproducten aannemelijk is, moeten ook bij de monsterneming en analyse anaërobe omstandigheden worden gehandhaafd.