|
24.8.2009
|
NL
|
Publicatieblad van de Europese Unie
|
L 220/1
|
VERORDENING (EG) Nr. 761/2009 VAN DE COMMISSIE
van 23 juli 2009
tot wijziging, in verband met de aanpassing ervan aan de technische vooruitgang, van Verordening (EG) nr. 440/2008 van de Commissie houdende vaststelling van testmethoden uit hoofde van Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH)
(Voor de EER relevante tekst)
DE COMMISSIE VAN DE EUROPESE GEMEENSCHAPPEN,
Gelet op het Verdrag tot oprichting van de Europese Gemeenschap,
Gelet op Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad van 18 december 2006 inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH), tot oprichting van een Europees Agentschap voor chemische stoffen, houdende wijziging van Richtlijn 1999/45/EG en houdende intrekking van Verordening (EEG) nr. 793/93 van de Raad en Verordening (EG) nr. 1488/94 van de Commissie alsmede Richtlijn 76/769/EEG van de Raad en de Richtlijnen 91/155/EEG, 93/67/EEG, 93/105/EG en 2000/21/EG van de Commissie (1), en met name op artikel 13, lid 3,
Overwegende hetgeen volgt:
|
(1)
|
Verordening (EG) nr. 440/2008 van de Commissie (2) bevat de testmethoden voor de bepaling van de fysisch-chemische eigenschappen, de toxiciteit en de ecotoxiciteit van stoffen, die worden toegepast voor de uitvoering van Verordening (EG) nr. 1907/2006.
|
|
(2)
|
Verordening (EG) nr. 440/2008 dient te worden bijgewerkt teneinde daarin wijzigingen in bepaalde testmethoden en verscheidene nieuwe, door de OESO goedgekeurde testmethoden op te nemen. De belanghebbenden zijn over dit voorstel geraadpleegd. De wijzigingen behelzen de aanpassing van de desbetreffende methoden aan de wetenschappelijke en technische vooruitgang.
|
|
(3)
|
De bepalingen inzake dampspanning moeten worden herzien om daar de nieuwe effusiemethode in op te nemen.
|
|
(4)
|
Het is noodzakelijk een nieuwe methode voor de meting van de naar de lengte gewogen meetkundig gemiddelde diameter van vezels toe te voegen.
|
|
(5)
|
Er dient met prioriteit een nieuwe in-vitrotestmethode voor huidirritatie in Verordening (EG) nr. 440/2008 te worden opgenomen teneinde overeenkomstig Richtlijn 86/609/EEG van de Raad van 24 november 1986 inzake de onderlinge aanpassing van de wettelijke en bestuursrechtelijke bepalingen van de lidstaten betreffende de bescherming van dieren die voor experimentele en andere wetenschappelijke doeleinden worden gebruikt (3), tot een verlaging van het aantal proefdieren te komen. Hoewel een ontwerp voor een in-vitrotestmethode voor huidirritatie nog bij de OESO in behandeling is, dient methode B.46 in dit uitzonderlijke geval in deze verordening te worden opgenomen. Methode B.46 dient zo spoedig te worden geactualiseerd, zodra er binnen de OESO overeenstemming is bereikt of nadere informatie die een dergelijke herziening rechtvaardigt, beschikbaar komt.
|
|
(6)
|
De bepalingen betreffende de groeiremmingstest met algen moeten worden herzien om er meer soorten in op te nemen en aan te sluiten bij de eisen inzake de risico-evaluatie en de indeling van chemische stoffen.
|
|
(7)
|
Er dient een nieuwe methode voor de meting van de aerobe mineralisatie in oppervlaktewater te worden toegevoegd, in de vorm van een simulatietest voor de biologische afbreekbaarheid, en een nieuwe methode voor de beoordeling van de toxiciteit bij het genus Lemna door middel van een groeiremmingstest.
|
|
(8)
|
Verordening (EG) nr. 440/2008 moet dan ook dienovereenkomstig worden gewijzigd.
|
|
(9)
|
De bepalingen van deze verordening zijn in overeenstemming met het advies van het bij artikel 133 van Verordening (EG) nr. 1907/2006 ingestelde comité,
|
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De bijlage van Verordening (EG) nr. 440/2008 wordt als volgt gewijzigd:
|
1)
|
Deel A wordt als volgt gewijzigd:
|
a)
|
hoofdstuk A.4 wordt vervangen door hoofdstuk A.4 in bijlage I van deze verordening;
|
|
b)
|
hoofdstuk A.22 in bijlage II van deze verordening wordt toegevoegd.
|
|
|
2)
|
Deel B wordt als volgt gewijzigd:
hoofdstuk B.46 in bijlage III van deze verordening wordt toegevoegd.
|
|
3)
|
Deel C wordt als volgt gewijzigd:
|
a)
|
hoofdstuk C.3 wordt vervangen door hoofdstuk C.3 in bijlage IV van deze verordening;
|
|
b)
|
de hoofdstukken C.25 en C.26 in de bijlagen V en VI van deze verordening worden toegevoegd.
|
|
Artikel 2
Deze verordening treedt in werking op de derde dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 23 juli 2009.
Voor de Commissie
Stavros DIMAS
Lid van de Commissie
(1) PB L 396 van 30.12.2006, blz. 1.
(2) PB L 142 van 31.5.2008, blz. 1.
(3) PB L 358 van 18.12.1986, blz. 1.
BIJLAGE I
1. METHODE
Deze methode is gelijkwaardig aan OESO TG 104 (2004).
1.1. INLEIDING
Deze herziene versie van methode A.4 (1) bevat een aanvullende meetmethode, Effusiemethode: isotherme thermogravimetrie, ontwikkeld voor stoffen met zeer lage spanningen (tot 10–10 Pa). Gezien de behoefte aan meetmethoden, met name voor het bepalen van de dampspanning van stoffen met lage dampspanning, zijn de overige meetmethoden van deze methode herzien met betrekking tot andere toepassingsbereiken.
Bij thermodynamisch evenwicht is de dampspanning van een zuivere stof alleen een functie van de temperatuur. De fundamentele principes worden besproken in de referenties (2) en (3).
Er bestaat geen meetmethode die voor alle mogelijke waarden van de dampspanning, van minder dan 10–10 tot 105 Pa, van toepassing is. Deze methode omvat acht meetmethoden voor de dampspanning, die toepasbaar zijn voor verschillende dampspanningsbereiken. Tabel 1 biedt een vergelijking van de toepasbaarheid en het meetbereik van de verschillende methoden. De meetmethoden kunnen alleen worden toegepast voor verbindingen die niet ontleden onder de testomstandigheden. In gevallen waarin de experimentele methoden om technische redenen niet kunnen worden toegepast kan de dampspanning ook worden geschat. Een aanbevolen schattingsmethode wordt beschreven in het aanhangsel.
1.2. DEFINITIES EN EENHEDEN
De dampspanning van een stof wordt gedefinieerd als de verzadigingsdruk boven een vaste stof of vloeistof.
Voor de druk dient de SI-eenheid, de pascal (Pa), te worden gebruikt. Andere eenheden die in het verleden zijn gebruikt worden hieronder weergegeven, samen met hun herleidingsfactoren:
|
1 Torr
|
=
|
1 mm Hg
|
=
|
1,333 × 102 Pa
|
|
1 atmosfeer
|
=
|
1,013 × 105 Pa
|
|
|
|
1 bar
|
=
|
105 Pa
|
|
|
De SI-eenheid van temperatuur is de kelvin (K). De formule voor het herleiden van graden Celsius naar Kelvin is:
T = t + 273,15
Hierin is T de Kelvintemperatuur ofwel de thermodynamische temperatuur en t de Celsiustemperatuur.
Tabel 1
|
Meetmethode
|
Vaste stoffen
|
Vloeistoffen
|
Geschatte herhaalbaarheid
|
Geschatte reproduceerbaarheid
|
Aanbevolen bereik
|
|
Dynamische methode
|
Laag smeltpunt
|
Ja
|
tot 25 %
1-5 %
|
tot 25 %
1-5 %
|
103 Pa tot 2x103 Pa
2 × 103 Pa tot 105 Pa
|
|
Statische methode
|
Ja
|
Ja
|
5-10 %
|
5-10 %
|
10 Pa – 105 Pa
10–2 Pa tot 105 Pa (1)
|
|
Isoteniscoopmethode
|
Ja
|
Ja
|
5-10 %
|
5-10 %
|
102 Pa tot 105 Pa
|
|
Effusiemethode: dampspanningsbalans
|
Ja
|
Ja
|
5-20 %
|
tot 50 %
|
10–3 tot– 1 Pa
|
|
Effusiemethode: Knudsencel
|
Ja
|
Ja
|
10-30 %
|
—
|
10–10 tot 1 P
|
|
Effusiemethode: isotherme thermogravimetrie
|
Ja
|
Ja
|
5-30 %
|
tot 50 %
|
10–10 tot 1 Pa
|
|
Gasverzadigingsmethode
|
Ja
|
Ja
|
10-30 %
|
tot 50 %
|
10–10 tot 103 Pa
|
|
Draaienderotormethode
|
Ja
|
Ja
|
10-20 %
|
—
|
10–4 tot 0,5 Pa
|
1.3. PRINCIPE VAN DE TEST
Over het algemeen wordt de dampspanning bepaald bij verschillende temperaturen. Binnen een beperkt temperatuurbereik is de logaritme van de dampspanning van een zuivere stof omgekeerd evenredig met de thermodynamische temperatuur, volgens de vereenvoudigde vergelijking van Clausius-Clapeyron:

waarin:
|
p
|
=
|
de dampspanning van de stof in pascal (Pa)
|
|
ΔHv
|
=
|
de verdampingswarmte in J mol–1
|
|
R
|
=
|
de universele molaire gasconstante, 8,314 J mol–1 K–1
|
|
T
|
=
|
de thermodynamische temperatuur in K
|
1.4. REFERENTIESTOFFEN
Het is niet nodig om referentiestoffen te gebruiken. Deze stoffen zijn in de eerste plaats bedoeld om van tijd tot tijd de werking van een methode te controleren en om vergelijkingen tussen resultaten van verschillende methoden mogelijk te maken.
1.5. BESCHRIJVING VAN DE METHODE
1.5.1. Dynamische methode (methode van Cottrell)
1.5.1.1. Principe
De dampspanning wordt bepaald door het meten van de kooktemperatuur van een stof bij verschillende ingestelde waarden van de druk tussen ongeveer 103 Pa en 105 Pa. Deze methode wordt ook aanbevolen voor het bepalen van de kooktemperatuur. Voor dat doel is de methode bruikbaar tot 600 K. De kooktemperatuur van vloeistoffen op een diepte van 3 tot 4 centimeter is ongeveer 0,1 °C hoger dan aan de oppervlakte, vanwege de hydrostatische druk van de vloeistofkolom. In de methode van Cottrell (4) wordt de thermometer in de damp boven de oppervlakte van de vloeistof geplaatst en wordt de kokende vloeistof voortdurend over de kwikbol van de thermometer geleid. De kwikbol wordt bedekt door een dunne vloeistoflaag die in evenwicht is met de damp bij atmosferische druk. Zo geeft de thermometer de echte kooktemperatuur aan, zonder meetfouten door oververhitting of hydrostatische druk. De oorspronkelijk door Cottrell gebruikte pomp is weergegeven in figuur 1. Buis A bevat de kokende vloeistof. Een platina draad B, die in de bodem is bevestigd, bevordert gelijkmatig koken. De zijbuis C leidt naar een condensor en de mantel D zorgt ervoor dat het koude condensaat niet bij de thermometer E kan komen. Als de vloeistof in A kookt, worden de in de trechter opgevangen bellen en vloeistof via de twee armen van de pomp F over de kwikbol van de thermometer geleid.
|
Figuur 1

|
Figuur 2

|
Cottrell-pomp (4)
|
F:
|
Verwarmingselement (ca. 150 W)
|
1.5.1.2. Apparatuur
In figuur 2 is een zeer nauwkeurig meetapparaat weergegeven, dat werkt volgens het Cottrell-principe. Het bestaat uit een buis met een kookgedeelte aan de benedenzijde, een koeler in het midden, en een uitgang en een flens aan de bovenzijde. De Cottrell-pomp wordt in het kookgedeelte geplaatst, dat wordt verwarmd door middel van een elektrisch verwarmingspatroon. De temperatuur wordt gemeten via een mantelthermokoppel of een weerstandsthermometer die bij de flens aan de bovenzijde naar binnen steekt. De uitgang wordt verbonden aan het drukregelingssysteem, dat bestaat uit een vacuümpomp, een buffervolume, een manostaat voor het inlaten van stikstof om de druk te regelen, en een manometer.
1.5.1.3. Werkwijze
De stof wordt in het kookgedeelte gebracht. Indien vaste stoffen niet als poeder beschikbaar zijn, kunnen er problemen ontstaan, maar deze kunnen soms worden opgelost door de koelwatermantel te verwarmen. De apparatuur wordt bij de flens afgesloten en de stof wordt ontgast.
Vervolgens wordt de laagst gewenste druk ingesteld en wordt het verwarmingssysteem aangezet. Tegelijkertijd wordt de temperatuurvoeler verbonden met een recorder.
Het evenwicht is bereikt, wanneer bij een constante druk een constante kooktemperatuur kan worden afgelezen. Wees voorzichtig om „stoten” tijdens het koken te voorkomen. Voorts moet volledige condensatie plaatsvinden op de koeler. Bij het bepalen van de dampspanning van bij lage temperatuur smeltende stoffen moet men voorkomen dat de condensor verstopt raakt.
Nadat dit evenwichtspunt is geregistreerd, wordt een hogere druk ingesteld. Dit proces wordt herhaald totdat een druk van 105 Pa is bereikt (ongeveer 5 tot 10 meetpunten in totaal). Ter controle moeten de evenwichtspunten nogmaals worden bepaald bij afnemende druk.
1.5.2. Statische methode
1.5.2.1. Principe
In de statische methode (5) wordt de dampspanning bij thermodynamisch evenwicht bepaald bij een ingestelde temperatuur. Deze methode is geschikt voor stoffen en vloeistoffen die uit meerdere componenten bestaan en vaste stoffen in het bereik van 10–1 tot 105 Pa en eveneens, mits behoedzaam uitgevoerd, in het bereik van 1 tot 10 Pa.
1.5.2.2. Apparatuur
De opstelling bestaat uit een thermostatisch bad (met een nauwkeurigheid van ±0,2 K), een vat voor het monster dat verbonden is aan de vacuümleiding, een manometer en een drukregelingssysteem. De monsterruimte (figuur 3a) is verbonden aan de vacuümleiding via een kraan en een hulpmanometer (een U-buis met een geschikte manometervloeistof) die dient voor de nulpuntsinstelling. Afhankelijk van het drukbereik en het chemisch gedrag van de teststof zijn kwik, siliconenoliën en ftalaten geschikte manometervloeistoffen. Het gebruik van kwik dient echter om milieuredenen waar mogelijk te worden vermeden. De teststof mag niet merkbaar oplossen in of reageren met de vloeistof in de U-buis (figuur 3b). Voor de manometer kan kwik worden gebruikt in het bereik van normale drukken tot 102 Pa; siliconenvloeistoffen en ftalaten zijn geschikt voor drukken van 10 tot 102 Pa. Er bestaan ook andere drukmeters die gebruikt kunnen worden tot 102 Pa, en verwarmbare membraancapaciteitmanometers kunnen zelfs worden gebruikt bij drukken beneden 10–1 Pa. De temperatuur wordt aan de buitenkant van de monsterruimte of in het vat zelf gemeten.
1.5.2.3. Werkwijze
Vul bij gebruikmaking van de in figuur 3a beschreven opstelling de U-buis met de gewenste vloeistof, die moet zijn ontgast bij hogere temperatuur voordat tot aflezen wordt overgegaan. De teststof wordt in de opstelling gebracht en bij lagere temperatuur ontgast. In het geval van een meercomponentensysteem moet de temperatuur laag genoeg zijn om te verzekeren dat de samenstelling van het materiaal niet verandert. Een evenwichtstoestand kan sneller worden bereikt door te roeren. Het monster kan onderkoeld worden met vloeibare stikstof of droog ijs, waarbij condensatie van lucht of pompvloeistof moet worden vermeden. Met de kraan boven de monsterruimte in geopende stand wordt vervolgens de ingesloten lucht gedurende een aantal minuten uit de apparatuur gepompt. Zo nodig moet de ontgassing verschillende keren herhaald worden.
|
Figuur 3a
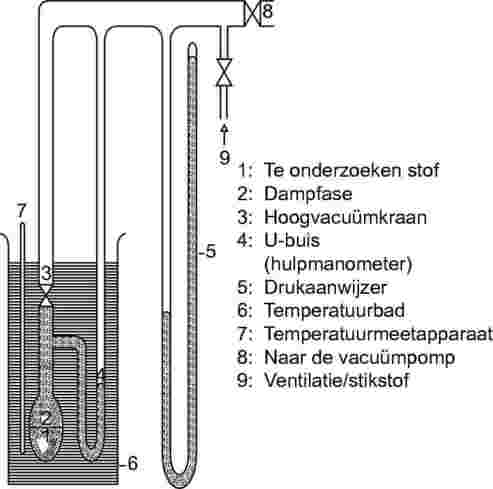
|
Figuur 3b

|
Als het monster verhit wordt met de kraan gesloten, stijgt de dampspanning. Dit verandert het evenwicht van de vloeistof in de U-buis. Om hiervoor te compenseren, wordt stikstof of lucht via de kraan in het toestel binnengelaten tot de vloeistof in de drukmeter weer bij nul staat. De hiervoor vereiste druk kan afgelezen worden bij kamertemperatuur op een manometer of op een instrument met hogere precisie. Deze druk komt overeen met de dampspanning van de stof bij die meettemperatuur. Bij gebruikmaking van de in figuur 3b weergegeven opstelling wordt de dampspanning direct afgelezen.
De dampspanning wordt bepaald met voldoende kleine temperatuurintervallen (ongeveer 5 tot 10 meetpunten in totaal) tot aan de gewenste maximumtemperatuur.
Ter controle moeten de metingen bij lage temperaturen herhaald worden. Als de waarden die verkregen worden bij de herhaalde metingen niet overeenkomen met de grafiek die is verkregen bij stijgende temperatuur, kan dit te wijten zijn aan een van de volgende situaties:
|
i)
|
Het monster bevat nog altijd lucht (bijvoorbeeld stoffen met hoge viscositeit) of bij lage temperatuur kokende stoffen die vrijkomt/vrijkomen bij verwarming;
|
|
ii)
|
De stof ondergaat een chemische reactie in het onderzochte temperatuurbereik (bijvoorbeeld afbraak, polymerisatie).
|
1.5.3. Isoteniscoopmethode
1.5.3.1. Principe
De isoteniscoop (6) is gebaseerd op het principe van de statische methode. Bij deze methode wordt een monster in een bol gebracht die op constante temperatuur wordt gehouden en die wordt verbonden met een manometer en een vacuümpomp. Verontreinigingen die vluchtiger zijn dan de te onderzoeken stof worden verwijderd door te ontgassen bij gereduceerde druk. De dampspanning van het monster bij de ingestelde temperatuur wordt in evenwicht gebracht met een bekende druk van een inert gas. De isoteniscoop is ontwikkeld om de dampspanning van bepaalde vloeibare koolwaterstoffen te meten, maar is eveneens geschikt voor onderzoek van vaste stoffen. Over het algemeen is de methode niet geschikt voor meercomponentensystemen. Bij monsters die niet-vluchtige verontreinigingen bevatten vertonen de resultaten slechts geringe meetfouten. Het aanbevolen meetbereik is 102 tot 105 Pa.
1.5.3.2. Apparatuur
Een voorbeeld van een meetinstrument is afgebeeld in figuur 4. Zie ASTM D 2879-86 (6) voor een volledige beschrijving.
1.5.3.3. Werkwijze
Voor vloeistoffen dient de stof zelf als vulvloeistof in de hulpmanometer. Een hoeveelheid vloeistof die voldoende is voor het vullen van de bol en de korte arm van de manometer, wordt in de isoteniscoop gebracht. De isoteniscoop wordt met het vacuümsysteem verbonden, leeggepompt en daarna gevuld met stikstof. Het leegmaken en doorspoelen van het systeem wordt tweemaal herhaald om de resterende zuurstof te verwijderen. De gevulde isoteniscoop wordt horizontaal gehouden zodat het monster zich in een dunne laag verspreidt over de monsterbol en de manometer. De druk in het systeem wordt gereduceerd tot 133 Pa en het monster wordt zachtjes verwarmd tot het juist kookt (verwijdering van opgeloste gassen). De isoteniscoop wordt dan zo gedraaid dat het monster terugloopt naar de bol en het de korte arm van de manometer vult. De druk wordt op 133 Pa gehouden. De uitgetrokken punt van de monsterbol wordt verwarmd met een kleine vlam, totdat de damp die uit het monster vrijkomt voldoende expandeert om een deel van het monster uit het bovenste gedeelte van de bol en de manometerarm te verplaatsen naar het manometergedeelte van de isoteniscoop en zo een met damp gevulde, stikstofvrije ruimte te creëren. Vervolgens wordt de isoteniscoop in een thermostatisch bad geplaatst, en de druk van de stikstof aangepast tot deze druk gelijk is aan de druk van het monster. Bij het evenwichtspunt is de dampspanning van de stikstof gelijk aan de dampspanning van de stof.
Figuur 4
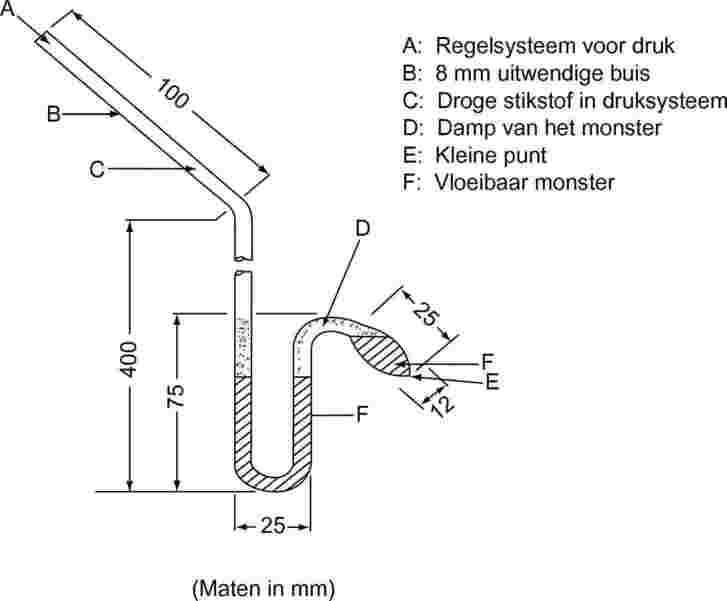
Voor vaste stoffen worden manometervloeistoffen zoals siliconenoliën of ftalaten gebruikt, afhankelijk van het druk- en temperatuurbereik. De ontgaste manometervloeistof wordt in de ronding van de lange arm van de isoteniscoop gebracht. Daarna wordt de te onderzoeken vaste stof in de bol gebracht en bij hogere temperatuur ontgast. Vervolgens wordt de isoteniscoop gekanteld zodat de manometervloeistof in de U-buis kan stromen.
1.5.4. Effusiemethode: dampspanningsbalans (7)
1.5.4.1. Principe
Een monster van een teststof wordt verwarmd in een kleine oven en in een vacuüm stolp gebracht. De oven wordt afgesloten met een deksel met kleine openingen van bekende diameter. De damp van de stof die door een van de openingen ontsnapt, wordt naar de balansschaal van een zeer gevoelige balans geleid, die ook is omgeven door een vacuüm stolp. In sommige ontwerpen wordt de balansschaal omgeven door een koelpot voor warmteafvoer naar buiten door middel van thermische geleiding en wordt deze door straling gekoeld zodat de ontsnappende damp erop condenseert. De impuls van de dampstroom werkt als kracht op de balansschaal. De dampspanning kan op twee manieren worden afgeleid: rechtstreeks uit de kracht op de balansschaal en tevens uit de verdampingssnelheid met behulp van de Hertz-Knudsen-vergelijking (2):
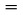
waarin:
|
G
|
=
|
verdampingssnelheid (kg s–1 m–2)
|
|
M
|
=
|
molaire massa (g mol–1)
|
|
T
|
=
|
temperatuur (K)
|
|
R
|
=
|
universele gasconstante (J mol–1 K–1)
|
|
p
|
=
|
dampspanning (Pa)
|
Het aanbevolen meetbereik is 10–3 tot 1 Pa.
1.5.4.2. Apparatuur
Het algemene principe van de opstelling is weergegeven in figuur 5.
Figuur 5

|
A:
|
Grondplaat
|
F:
|
Koelpot en koelstaaf
|
|
B:
|
Instrument met bewegende spiraal
|
G:
|
Verdampingsoven
|
|
C:
|
Stolp
|
H:
|
Dewarvat met vloeibare stikstof
|
|
D:
|
Balans met balansschaal
|
I:
|
Temperatuurmeting van het monster
|
|
E:
|
Vacuüm meetinstrument
|
J:
|
Teststof
|
1.5.5. Effusiemethode: Knudsencel
1.5.5.1. Principe
Deze methode berust op de schatting van de massa van de hoeveelheid teststof die per tijdseenheid in de vorm van damp door een gekalibreerde micro-opening uit een Knudsencel (8) stroomt, in ultravacuüm toestand. De uitgestroomde dampmassa kan verkregen worden door bepaling van de afname van de massa van de cel of door condensatie van de damp bij lage temperatuur en bepaling van de hoeveelheid verdampte stof met behulp van chromatografie. De dampspanning wordt berekend door toepassing van de Hertz-Knudsen-vergelijking (zie paragraaf 1.5.4.1) met correctiefactoren die afhankelijk zijn van de parameters van de apparatuur (9). Het aanbevolen meetbereik is 10–10 tot 1 Pa (10)(11)(12)(13)(14).
1.5.5.2. Apparatuur
Het algemene principe van de opstelling is weergegeven in figuur 6.
Figuur 6

|
1:
|
Verbinding naar vacuüm
|
7:
|
Deksel met schroefdraad
|
|
2:
|
Uitsparingen voor platina weerstandsthermometer of temperatuurmeting en -regeling
|
8:
|
Vleugelmoeren
|
|
3: t
|
Deksel voor vacuümva
|
9:
|
Bouten
|
|
4:
|
O-ring
|
10:
|
Roestvrijstalen uitstroomcel
|
|
5:
|
Aluminium vacuümvat
|
11:
|
Verwarmingspatroon
|
|
6:
|
Onderdeel voor het plaatsen en verwijderen van de cellen
|
|
|
1.5.6. Effusiemethode: isotherme thermogravimetrie
1.5.6.1. Principe
Deze methode berust op bepaling van de verhoogde verdampingssnelheden voor de teststof bij hogere temperaturen en omgevingsdruk door middel van thermogravimetrie (10)(15)(16)(17)(18)(19)(20). De verdampingssnelheden vT worden verkregen door de gekozen verbinding bloot te stellen aan een atmosfeer van langzaam stromend inert gas en bij bekende isotherme temperaturen T in Kelvin de gewichtsafname gedurende geschikte tijdsperioden te meten. De dampspanningen pT worden berekend uit de vT-waarden met behulp van het lineaire verband tussen de logaritme van de dampspanning en de logaritme van de verdampingssnelheid. Indien nodig kan worden geëxtrapoleerd tot temperaturen van 20 en 25 °C door log pT uit te zetten tegen 1/T. Deze methode is geschikt voor stoffen met dampspanningen tot 10–10 Pa (10–12 mbar) en met een zuiverheid die zo dicht mogelijk de 100 % benadert, teneinde een verkeerde interpretatie van de gemeten gewichtsafname te vermijden.
1.5.6.2. Apparatuur
Het algemene principe van de proefopstelling is weergegeven in figuur 7.
Figuur 7
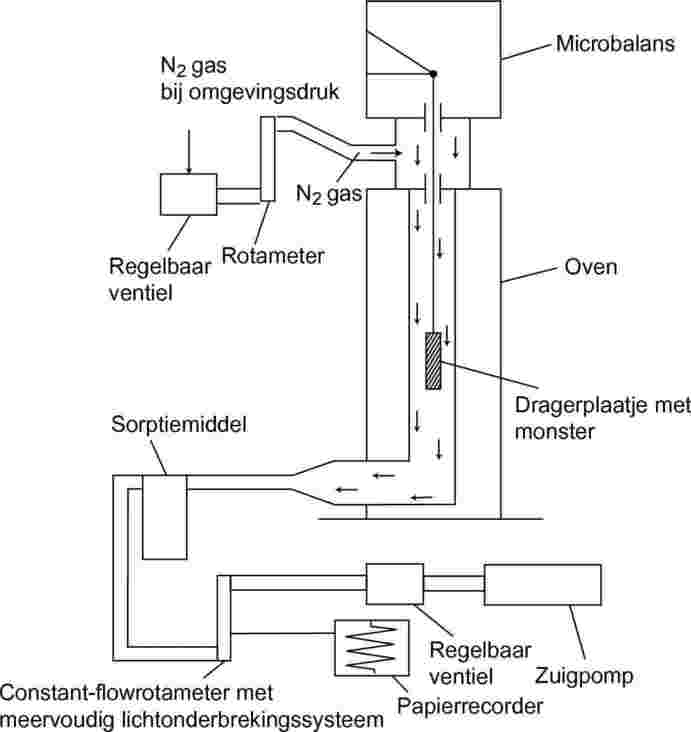
De verdampte teststofmoleculen worden meegevoerd in een stroom van droog stikstofgas. Deze strijkt langs het dragerplaatje, dat aan een microbalans in een thermostatisch geregelde ruimte hangt. Na het verlaten van deze ruimte wordt de gasstroom gezuiverd door een sorptiemiddel.
1.5.6.3. Werkwijze
De teststof wordt als homogene laag op het oppervlak van een geruwd glasplaatje aangebracht. Bij vaste stoffen wordt het plaatje gelijkmatig bevochtigd met een oplossing van de stof in een geschikt oplosmiddel en in een inerte atmosfeer gedroogd. Voor de meting wordt het dragerplaatje in een thermogravimetrisch analyseapparaat gehangen, waarna continu de gewichtsafname als functie van de tijd wordt gemeten.
De verdampingssnelheid vT bij een bepaalde temperatuur wordt berekend uit de gewichtsafname Δm van het dragerplaatje met behulp van de vergelijking
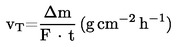
waarin F staat voor de oppervlakte van de teststoflaag, gewoonlijk de oppervlakte van het dragerplaatje, en t de tijd is waarin de massa met Δm afneemt.
De dampspanning pT wordt berekend op basis van het verband met de verdampingssnelheid vT:
Log pT = C + D log vT
waarin C en D constanten zijn die specifiek zijn voor de gebruikte proefopstelling en die afhangen van de diameter van de meetruimte en de stroomsnelheid van het stikstofgas. Deze constanten moeten eenmalig worden bepaald door een reeks verbindingen met bekende dampspanningen te meten en log pT uit te zetten tegen log vT (11)(21)(22).
Het verband tussen de dampspanning pT en de kelvintemperatuur T wordt gegeven door
Log pT = A + B 1/T
waarin A en B constanten zijn die worden verkregen door log pT uit te zetten tegen 1/T. Met behulp van deze vergelijking kan door extrapolatie de dampspanning voor iedere andere temperatuur worden verkregen.
1.5.7. Gasverzadigingsmethode (23)
1.5.7.1. Principe
Inert gas wordt bij kamertemperatuur en met een bekende stroomsnelheid door of over een monster van de teststof geleid. De stroomsnelheid moet laag genoeg zijn om de noodzakelijke verzadiging in de gasfase te verzekeren. De getransporteerde stof wordt opgevangen, over het algemeen met behulp van een sorptiemiddel, en aan kwantitatieve analyse onderworpen. Als een alternatief voor dampvallen met daarop volgende analyse kunnen in serie gezette analytische technieken zoals chromatografie worden gebruikt om de hoeveelheid getransporteerde stof te meten. De dampspanning wordt berekend met de aanname dat wordt voldaan aan de ideale gaswet en dat de totale druk van een gasmengsel gelijk is aan de som van de drukken van de componenten van het gasmengsel. De partiële druk van de teststof, met andere woorden de dampspanning, wordt berekend uit het bekende totale gasvolume en het gewicht van het getransporteerde materiaal.
De gasverzadigingsmethode is geschikt voor vaste en vloeibare stoffen en kan worden gebruikt voor dampspanningen tot 10–10 Pa (10)(11)(12)(13)(14). De methode is het betrouwbaarst voor dampspanningen beneden 103 Pa. Boven 103 Pa levert de methode over het algemeen een te hoge waarde voor de dampspanning op, waarschijnlijk als gevolg van aerosolvorming. Aangezien de metingen van de dampspanningen bij kamertemperatuur worden uitgevoerd hoeven de data niet te worden geëxtrapoleerd vanaf hoge temperaturen en wordt extrapolatie vanaf hoge temperaturen, dikwijls aanleiding tot ernstige meetfouten, vermeden.
1.5.7.2. Apparatuur
De methode vereist het gebruik van een thermostatisch geregeld vat. In de opzet in figuur 8 is een vat weergegeven met drie houders voor vaste monsters en drie houders voor vloeibare monsters, zodat zowel voor een vast als voor een vloeibaar monster een analyse in drievoud kan worden uitgevoerd. De temperatuur wordt constant gehouden ±0,5 °C of beter.
Figuur 8

Als dragergas wordt over het algemeen stikstof gebruikt, maar in een enkel geval kan een ander gas nodig zijn (24). Het dragergas moet droog zijn. De gasstroom wordt in 6 stromen gesplitst, geregeld met naaldventielen (opening ongeveer 0,79 mm), en stroomt het vat in door koperen buizen met een binnendiameter van 3,8 mm. Als zich een temperatuurevenwicht heeft ingesteld stroomt het gas door het monster en de sorptieval, waarna het het vat verlaat.
Vaste monsters worden geladen in glazen buisjes met een binnendiameter van 5 mm, met propjes glaswol aan weerszijden (zie figuur 9). In figuur 10 is een houder voor vloeibare monsters weergegeven en een sorptiesysteem. De best reproduceerbare methode om de dampspanning van vloeistoffen te meten is door de vloeistof aan te brengen op glasparels of op een inert sorptiemiddel als silica, en hiermee de houder te beladen. Als alternatief kan men het dragergas door een grof glasfrit leiden en het door een kolom van vloeibare teststof laten borrelen.
|
Figuur 9
|
Figuur 10

|
Het sorptiesysteem bevat een voor- en een nafilter. Bij heel lage dampspanningen worden slechts kleine hoeveelheden stof door het sorptiemiddel opgevangen en kan adsorptie aan de glaswol en de glazen buizen tussen monster en sorptiemiddel een aanzienlijk probleem vormen.
Met vast CO2 gekoelde dampvallen vormen een andere efficiënte manier om het verdampte materiaal te verzamelen. Ze geven geen tegendruk op de verzadigingskolom en bovendien laat het opgevangen materiaal zich gemakkelijk kwantitatief analyseren.
1.5.7.3. Werkwijze
De stroomsnelheid van het uitstromende dragergas wordt gemeten bij kamertemperatuur. De stroomsnelheid wordt gedurende het experiment regelmatig gecontroleerd om zeker te zijn van de nauwkeurigheid van de waarde voor het totale volume van het dragergas. Continue controle met een massastroommeter verdient de voorkeur. Verzadiging van de gasfase kan aanzienlijke contacttijden vergen en dus vrij lage gasstroomsnelheden (25).
Aan het einde van het experiment worden het voor- en het nafilter van het sorptiesysteem apart geanalyseerd. De verbinding op elk filter wordt gedesorbeerd door toevoeging van een oplosmiddel. De resulterende oplossingen worden aan kwantitatieve analyse onderworpen om de massa te bepalen die van elk filter is gedesorbeerd. De keuze van de analysemethode (alsmede de keuzen van het sorptiemiddel en het desorberende oplosmiddel) hangt af van de aard van de teststof. De desorptie-efficiëntie wordt bepaald door een bekende hoeveelheid van de monsterstof op het sorptiemiddel aan te brengen, desorptie uit te voeren en te analyseren hoeveel is teruggewonnen. Het is van belang dat de desorptie-efficiëntie wordt gecontroleerd op of nabij de monsterconcentratie onder testomstandigheden.
Om er zeker van te zijn dat het dragergas verzadigd is met de teststof worden drie verschillende gasstroomsnelheden gebruikt. Als de berekende dampspanning niet verandert afhankelijk van de stroomsnelheid wordt aangenomen dat het gas is verzadigd.
De dampspanning wordt berekend met behulp van de vergelijking:
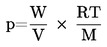
waarin:
|
p
|
=
|
dampspanning (Pa)
|
|
W
|
=
|
massa van de verdampte teststof (g)
|
|
V
|
=
|
volume verzadigd gas (m3)
|
|
R
|
=
|
universele molaire gasconstante (J mol–1 K–1)
|
|
T
|
=
|
temperatuur (K)
|
|
M
|
=
|
molaire massa van de teststof (g mol–1).
|
De gemeten volumes moeten worden gecorrigeerd voor druk- en temperatuurverschillen tussen de stroomsnelheidsmeter en de verzadigingskolom.
1.5.8. Draaienderotormethode
1.5.8.1. Principe
Bij deze methode wordt gebruikgemaakt van een draaienderotorviscositeitsmeter, met als meetelement een kleine stalen kogel die zweeft in een magnetisch veld en die aan het draaien wordt gebracht door rotatie van de velden (26)(27)(28). De draaisnelheid kan worden bepaald met meetspoelen. Als de kogel een bepaalde draaisnelheid (gewoonlijk ongeveer 400 toeren per seconde) heeft bereikt, wordt de energietoevoer gestopt waardoor een vertraging van de draaisnelheid optreedt, die het gevolg is van de gaswrijving. De afname van de rotatiesnelheid wordt gemeten als functie van de tijd. De dampspanning wordt afgeleid uit de drukafhankelijke snelheidsafname van de stalen kogel. Het aanbevolen meetbereik is 10–4 tot 0,5 Pa.
1.5.8.2. Apparatuur
Een schematische tekening van de proefopstelling is afgebeeld in figuur 11. De meetkop wordt geplaatst in een van thermostaatregeling voorziene ruimte (geregeld op 0,1 °C). De monsterhouder wordt in een aparte van een thermostaatregeling voorziene ruimte (eveneens geregeld op 0,1 °C) gebracht. Om condensatie te voorkomen, worden alle andere onderdelen van de opstelling op een hogere temperatuur gehouden. Het hele toestel wordt verbonden aan een hoogvacuümsysteem.
Figuur 11

2. GEGEVENS EN RAPPORTAGE
2.1. GEGEVENS
In elk van de voorafgaande methoden moet de dampspanning ten minste bij twee temperaturen worden bepaald. Bepaling van de dampspanning bij drie of meer temperaturen in het bereik van 0 tot 50 °C verdient de voorkeur, aangezien men dan kan controleren of de dampspanningskromme lineair is. Bij de effusiemethode (Knudsencel en isotherme thermogravimetrie) en de gasverzadigingsmethode, wordt een temperatuurbereik voor de meting van 120 tot 150 °C aanbevolen in plaats van 0 tot 50 °C.
2.2. TESTVERSLAG
In het verslag moeten de volgende gegevens worden opgenomen:
|
—
|
de nauwkeurige specificatie van de te onderzoeken stof (beschrijving en verontreinigingen) en indien van toepassing, voorafgaande zuivering;
|
|
—
|
het vereiste minimumaantal van twee waarden voor de dampspanning en de bijbehorende temperaturen — bij voorkeur drie of meer — in het bereik van 0 tot 50 °C (of 120 tot 150 °C);
|
|
—
|
ten minste één van de temperaturen dient 25 °C of lager te zijn, indien technisch mogelijk volgens de gekozen methode;
|
|
—
|
grafiek van log p tegen 1/T;
|
|
—
|
geschatte waarde van de dampspanning bij 20 of 25 °C.
|
Indien een verandering (faseovergang, ontleding) wordt waargenomen, dienen de volgende gegevens te worden opgenomen:
|
—
|
aard van de verandering;
|
|
—
|
temperatuur waarbij de verandering optreedt bij atmosferische druk;
|
|
—
|
dampspanning bij 10 °C respectievelijk 20 °C beneden de overgangstemperatuur en bij 10 °C respectievelijk 20 °C boven deze temperatuur (tenzij het een overgang is van vaste fase naar gasfase).
|
Alle gegevens en opmerkingen die van belang zijn voor de interpretatie van de resultaten, met name gegevens met betrekking tot verontreinigingen en de fysische toestand van de onderzochte stof, dienen te worden gerapporteerd.
3. LITERATUUR
|
(1)
|
Publicatieblad van de Europese Unie L 383 A, 26-47 (1992).
|
|
(2)
|
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., en Vodar, B., Eds., Butterworths, London.
|
|
(3)
|
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York.
|
|
(4)
|
Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York.
|
|
(5)
|
NF T 20-048 AFNOR (September 1985). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa — Static method.
|
|
(6)
|
ASTM D 2879-86, Standard test method for vapour pressure — temperature relationship and initial decomposition temperature of liquids by isoteniscope.
|
|
(7)
|
NF T 20-047 AFNOR (September 1985). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa — Vapour pressure balance method.
|
|
(8)
|
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593.
|
|
(9)
|
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173.
|
|
(10)
|
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521-532.
|
|
(11)
|
Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000)
|
|
(12)
|
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22-28
|
|
(13)
|
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269-278.
|
|
(14)
|
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117-122.
|
|
(15)
|
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137-147.
|
|
(16)
|
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393-400.
|
|
(17)
|
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161-168.
|
|
(18)
|
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27-31.
|
|
(19)
|
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300-310.
|
|
(20)
|
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512-20.
|
|
(21)
|
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range -25 °C to 150 °C.
|
|
(22)
|
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002)
|
|
(23)
|
40 CFR, 796. (1993). pp 148-153, Office of the Federal Register, Washington DC
|
|
(24)
|
Rordorf B.F. (1985). Thermochimica Acta 85, 435.
|
|
(25)
|
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375.
|
|
(26)
|
Messer G., Röhl, P., Grosse G., en Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440.
|
|
(27)
|
Comsa G., Fremerey J.K., en Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642.
|
|
(28)
|
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715.
|
(1) Bij gebruik van een capacitieve manometer.
Aanhangsel
Schattingsmethode
INLEIDING
De berekende waarden van de dampspanning kunnen als volgt worden gebruikt:
|
—
|
om te bepalen welke van de experimentele methoden geschikt is;
|
|
—
|
om een schatting of grenswaarde te verkrijgen, ingeval de experimentele methode om technische redenen niet toegepast kan worden.
|
SCHATTINGSMETHODE
De dampspanning van vloeistoffen en vaste stoffen kan worden geschat met behulp van de gewijzigde Correlatie van Watson (a). Het enige benodigde gegeven is de normale kooktemperatuur. De methode is toepasbaar in het drukbereik van 105 tot 10–5 Pa.
Uitgebreide informatie over deze methode wordt gegeven in het „Handbook of Chemical Property Estimation Methods” (b). Zie ook OECD Environmental Monograph No.67 (c).
BEREKENINGSMETHODE
De dampspanning wordt als volgt berekend:

waarin:
|
T
|
=
|
betreffende temperatuur
|
|
Tb
|
=
|
normaal kookpunt
|
|
Pvp
|
=
|
dampspanning bij temperatuur T
|
|
ΔHvb
|
=
|
verdampingswarmte
|
|
ΔZb
|
=
|
compressibiliteitscoëfficiënt (geschat op 0,97)
|
|
m
|
=
|
empirische factor afhankelijk van de fysische toestand bij de betreffende temperatuur
|
Voorts:

waarin KF een empirische factor is waarin de polariteit van de stof tot uitdrukking komt. KF-waarden voor verscheidene typen verbindingen worden opgesomd in referentie (b).
Dikwijls zijn gegevens beschikbaar waarin een kookpunt bij verlaagde druk wordt gegeven. In dergelijke gevallen wordt de dampspanning als volgt berekend:

waarin T1 staat voor het kookpunt bij de verlaagde druk P1.
VERSLAG
Bij gebruik van de schattingsmethode dient de berekening uitvoerig in het verslag te worden gedocumenteerd.
LITERATUUR
|
(a)
|
Watson, K.M. (1943). Ind. Eng. Chem, 35, 398.
|
|
(b)
|
Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill.
|
|
(c)
|
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993).
|
BIJLAGE II
|
A.22.
|
NAAR LENGTE GEWOGEN MEETKUNDIG GEMIDDELDE VAN DE DIAMETER VAN VEZELS
|
1. METHODE
1.1. INLEIDING
In deze methode wordt een procedure beschreven voor de bepaling van het naar lengte gewogen meetkundig gemiddelde van de diameter (Length Weighted Geometric Mean Diameter — LWGMD) van in bulk geproduceerde synthetische anorganische vezels (Man Made Mineral Fibres — MMMF). Aangezien er een waarschijnlijkheid van 95 % is dat de LWGMD van de populatie tussen de 95 %-betrouwbaarheidsniveaus (LWGMD ± twee keer de standaardfout) van het monster ligt, zal als testwaarde de onderste 95 %-betrouwbaarheidsgrens van het monster worden gerapporteerd (d.w.z. LWGMD minus twee keer de standaardfout). De methode is gebaseerd op een bijwerking (juni 1994) van een ontwerp-bedrijfsprocedure van de HSE, die is overeengekomen tijdens een bijeenkomst van de ECFIA en de HSE in Chester op 26 september 1993 en voor en op basis van een tweede interlaboratoriumproef is ontwikkeld (1, 2). Deze meetmethode kan worden gebruikt voor de karakterisering van de vezeldiameter van bulkstoffen of producten die MMMF bevatten, zoals refractaire keramische vezels (RKV), synthetische glasvezels (Man Made Vitreous Fibres — MMVF) of kristallijne en polykristallijne vezels.
Weging naar lengte is een methode om te compenseren voor het effect op de diameterdistributie ten gevolge van het breken van lange vezels bij de bemonstering of behandeling van het materiaal. Voor de meting van de grootteverdeling van MMMF-diameters worden meetkundige statistische methoden (meetkundig gemiddelde) gebruikt, omdat deze diameters meestal een grootteverdeling hebben die een lognormaalverdeling benadert.
Meting van de lengte èn de diameter is zowel saai als tijdrovend, maar als alleen de vezels worden gemeten die een oneindig dunne lijn in een REM-gezichtsveld raken, is de waarschijnlijkheid dat een bepaalde vezel wordt geselecteerd evenredig met de lengte daarvan. Aangezien daarmee de lengte in de berekening van de weging naar lengte wordt verdisconteerd, behoeft alleen nog de diameter te worden gemeten en kan de LWGMD-2SE volgens de beschrijving worden berekend.
1.2. DEFINITIES
Deeltje: Een object met een lengte/breedte-verhouding van minder dan 3:1.
Vezel: Een object met een lengte/breedte-verhouding (aspectverhouding) van ten minste 3:1.
1.3. TOEPASSINGSGEBIED EN BEPERKINGEN
De methode is bedoeld voor diameterdistributies met een mediane diameter van 0,5 μm tot 6 μm. Grotere diameters kunnen met een lagere REM-vergrotingsfactor worden gemeten, maar de methode krijgt steeds meer beperkingen voor kleinere vezels en als de mediane diameter kleiner is dan 0,5 μm, wordt een TEM-meting (transmissie-elektronenmicroscoop) aanbevolen.
1.4. PRINCIPE VAN DE TESTMETHODE
Uit de vezelmat of uit losse bulkvezels wordt een aantal representatieve boormonsters genomen. De lengte van de bulkvezels wordt met behulp van een vergruisprocedure verkleind en een representatief deelmonster wordt gedispergeerd in water. Er worden meetmonsters geëxtraheerd, gefiltreerd over een polycarbonaatfilter met een poriegrootte van 0,2 μm en geprepareerd voor onderzoek met een rasterelektronenmicroscoop (REM). De vezeldiameters worden gemeten bij een vergrotingsfactor van 10 000 × of meer (1) met behulp van een steekproefname langs een lijn om een zuivere raming van de mediane diameter te krijgen. Het onderste 95 %-betrouwbaarheidsinterval (op basis van een eenzijdige toets) wordt berekend om een raming te krijgen van de laagste waarde van het meetkundig gemiddelde van de vezeldiameter van het materiaal.
1.5. BESCHRIJVING VAN DE TESTMETHODE
1.5.1. Veiligheids/voorzorgmaatregelen
De blootstelling van personen aan vezels in de lucht moet tot een minimum worden beperkt en voor het hanteren van de droge vezels moet een zuurkast of een handschoenenkast worden gebruikt. Om de effectiviteit van de beperkende maatregelen te bepalen moet periodiek monitoring van de blootstelling van personen worden uitgevoerd. Bij het hanteren van MMMF moeten wegwerphandschoenen worden gebruikt om huidirritatie te beperken en kruisbesmetting te voorkomen.
1.5.2. Apparatuur
|
—
|
Pers en matrijzen (voor 10 MPa).
|
|
—
|
Polycarbonaatfilter met capillaire poriën met een poriegrootte van 0,2 μm (diameter 25 mm).
|
|
—
|
Cellulose-ester membraanfilter met een poriegrootte van 5 μm dat als secundair filter kan worden gebruikt.
|
|
—
|
Glazen filtreerapparaat (of wegwerp-filtratiesystemen) voor filters met een diameter van 25 mm (bv. glazen microanalysekit van Millipore, typenr. XX10 025 00).
|
|
—
|
Vers gedestilleerd water dat is gefiltreerd over een filter met een poriegrootte van 0,2 μm om micro-organismen te verwijderen.
|
|
—
|
Sputter coater met een goud- of goud/palladiumtarget.
|
|
—
|
Rasterelektronenmicroscoop met een resolutie tot 10 nm en een vergrotingsfactor van 10 000 ×.
|
|
—
|
Diversen: spatels, scalpelmesje type 24, pincet, REM-buisjes, koolstoflijm of koolstofkleefband, zilverpasta.
|
|
—
|
Ultrasone sonde of ultrasoon bad (tafelmodel).
|
|
—
|
Monsterboor of kurkboor om boormonsters van een MMMF-mat te nemen.
|
1.5.3. Testprocedure
1.5.3.1. Monstername
Voor matten en platen wordt een 25 mm monsterboor of kurkboor gebruikt om monsters van de doorsnede te nemen. Deze moeten gelijkmatig gespreid over de breedte van een klein stuk van de mat worden genomen of, als een langer stuk van de mat beschikbaar is, uit aselect gekozen plaatsen. Dezelfde apparatuur kan worden gebruikt om aselecte monsters uit losse vezels te nemen. Indien mogelijk moeten er zes monsters worden genomen om de ruimtelijke variatie in het bulkmateriaal te verdisconteren.
De zes boormonsters worden in een matrijs met een diameter van 50 mm bij 10 Mpa verbrijzeld. Het materiaal wordt met een spatel gemengd en opnieuw aan 10 Mpa blootgesteld. Vervolgens wordt het materiaal uit de matrijs verwijderd en in een gesloten glazen fles bewaard.
1.5.3.2. Monstervoorbereiding
Indien nodig kan organisch bindmiddel worden verwijderd door de vezels gedurende ongeveer één uur bij 450 °C in een oven te leggen.
Verdeel het monster in vieren door een kegelvormig hoopje te maken en dit in vieren te verdelen („cone and quarter”-techniek) (dit moet in een zuurkast gebeuren).
Voeg met een spatel een kleine hoeveelheid (< 0,5 g) monster toe aan 100 ml vers gedestilleerd water dat over een membraanfilter van 0,2 μm is gefiltreerd (ook andere bronnen van ultrazuiver water mogen worden gebruikt, als is aangetoond dat deze aan de eisen voldoen). Dispergeer grondig met een ultrasone sonde die bij een vermogen van 100 W zodanig is ingesteld dat cavitatie optreedt (als er geen sonde beschikbaar is, wordt de volgende methode gebruikt: gedurende 30 seconden herhaaldelijk schudden en omkeren; gedurende vijf minuten ultrasoneren in een tafelmodel ultrasoon bad; vervolgens nog eens gedurende 30 seconden herhaaldelijk schudden en omkeren).
Onmiddellijk na het dispergeren van de vezels wordt met een pipet met brede opening (inhoud 2-5 ml) een aantal analysemonsters genomen (bv. drie monsters van 3, 6 en 10 ml).
Elk analysemonster wordt onder vacuüm gefiltreerd over een polycarbonaatfilter van 0,2 μm op een secundair MEC-filter met een poriegrootte van 5 μm, waarbij een glazen filterkroes van 25 mm met een cilindrisch reservoir wordt gebruikt. In de filterkroes wordt ongeveer 5 ml gefiltreerd gedestilleerd water gebracht en het analysemonster wordt langzaam in het water gepipetteerd, waarbij de pipetpunt onder de meniscus wordt gehouden. De pipet en het reservoir moeten na het pipetteren grondig worden gespoeld, aangezien dunne vezels de neiging hebben aan het oppervlak te blijven.
Verwijder het filter voorzichtig, maak het los van het secundaire filter en leg het in een houder om te laten drogen.
Snij met een type 24 scalpelmes met een schokkende beweging een kwart of halve filterschijf met het filterresidu af. Plak de doorsnede met een stukje koolstofkleefband of koolstoflijm zorgvuldig op een REM-stub. Op ten minste drie plaatsen wordt zilverpasta aangebracht om het elektrisch contact aan de randen van het filter en de stub te verbeteren. Als de lijm/zilverpasta droog is, wordt met een sputter coater ongeveer 50 nm goud of goud/palladium op het oppervlak van het neerslag aangebracht.
1.5.3.3. REM: kalibratie en uitvoering
1.5.3.3.1. Kalibratie
De kalibratie van de REM moet ten minste één keer per week worden gecontroleerd (liefst één keer per dag) met een gecertificeerd kalibratierooster. De kalibratie moet aan de hand van een gecertificeerde standaard worden gecontroleerd en als de gemeten waarde (REM) niet binnen ±2 % van de gecertificeerde waarde ligt, moet de REM-kalibratie worden aangepast en opnieuw worden gecontroleerd.
De REM moet met een reële monstermatrix bij een vergrotingsfactor van 2 000 × in staat zijn tot een resolutie van ten minste een minimale zichtbare diameter van 0,2 µm.
1.5.3.3.2. Uitvoering
De REM moet worden gebruikt met een vergrotingsfactor van 10 000 × (2) onder omstandigheden die een goede resolutie met een aanvaardbaar beeld geven bij een lage aftastsnelheid van bijvoorbeeld 5 seconden per opname. Hoewel de operationele vereisten van verschillende REM’s kunnen uiteenlopen, wordt bij materialen met een betrekkelijk laag atoomgewicht in het algemeen de beste zichtbaarheid en resolutie verkregen bij gebruik van een versnellingsspanning van 5-10 keV met een kleine stipafmeting en een korte werkafstand. Aangezien er een lineair traject wordt afgelegd, moet er een helling van 0° worden gebruikt om opnieuw scherpstellen tot een minimum te beperken of als de REM een eucentrische objecttafel heeft, moet de eucentrische werkafstand worden gebruikt. Er kan een lagere vergrotingsfactor worden gebruikt als het materiaal geen kleine vezels (kleine diameter) bevat en de vezeldiameter groot is (> 5 μm).
1.5.3.4. Groottebepaling
1.5.3.4.1. Onderzoek bij lage vergrotingsfactor om het monster te evalueren
In eerste instantie wordt het monster bij een lage vergrotingsfactor onderzocht om na te gaan of grote vezels aan elkaar klitten en om de dichtheid van de vezels te bepalen. Als er te veel klitten zijn, wordt aanbevolen een nieuw monster te maken.
Met het oog op de statistische nauwkeurigheid moet er een minimaal aantal vezels worden gemeten en een hoge vezeldichtheid zal wellicht wenselijk lijken, aangezien het bestuderen van lege velden tijdrovend is en niet tot de analyse bijdraagt. Als het filter echter te veel materiaal bevat, wordt het moeilijk alle meetbare vezels te meten en omdat kleine vezels achter grotere vezels verborgen kunnen liggen, worden deze dan wellicht gemist.
Bij een vezeldichtheid van meer dan 150 vezels per millimeter van het lineaire traject kan een systematische fout tot een te hoge LWGMD leiden. Anderzijds leidt een lage vezelconcentratie tot een langere analysetijd en het is vaak kosteneffectief om een monster te maken met een vezeldichtheid die dichter bij het optimum ligt in plaats van tellingen te blijven uitvoeren bij filters met een lage concentratie. Een optimale vezeldichtheid moet gemiddeld ongeveer één of twee telbare vezels per gezichtsveld bij een vergrotingsfactor 5 000 opleveren. De optimale dichtheid is echter wel afhankelijk van de grootte (diameter) van de vezels, dus de experimentator moet zijn kennis en ervaring gebruiken om te beoordelen of de vezeldichtheid in de buurt van de optimale dichtheid ligt of niet.
1.5.3.4.2. Weging van de vezeldiameters naar lengte
Alleen de vezels die een op het scherm van de REM getrokken (oneindig) dunne lijn raken (of kruisen), worden geteld. Daartoe wordt over het centrum van het scherm een horizontale (of verticale) lijn getrokken.
Er kan ook één punt in het centrum van het scherm worden aangebracht, waarna een continue scan in één richting over het filter wordt gestart. Van elke vezel met een aspectverhouding van meer dan 3:1 die dit punt raakt of kruist, wordt de diameter gemeten en geregistreerd.
1.5.3.4.3. Groottebepaling van de vezels
Aanbevolen wordt ten minste 300 vezels te meten. Elke vezel wordt slechts eenmaal gemeten op het snijpunt met de lijn of het punt op het scherm (of vlakbij het snijpunt als de randen van de vezels niet goed te zien zijn). Als er vezels met een niet-uniforme doorsnede worden aangetroffen, wordt er een meting gebruikt van de gemiddelde diameter van de vezel. Bij de bepaling van de rand en het meten van de kortste afstand tussen de randen van de vezel moet zorgvuldig worden gewerkt. De groottebepaling kan on-line gebeuren of off-line met opgeslagen beelden of foto’s. Halfautomatische beeldmeetsystemen die de gegevens direct downloaden naar een spreadsheet worden aanbevolen, aangezien ze tijd besparen en fouten bij het overschrijven elimineren en de berekeningen kunnen worden geautomatiseerd.
Voor lange vezels moet bij een lage vergrotingsfactor worden gecontroleerd of de uiteinden niet naar het gezichtsveld van de meting terugkrullen, zodat vaststaat dat deze vezels slechts één keer worden gemeten.
2. GEGEVENS
2.1. BEHANDELING VAN DE RESULTATEN
Vezeldiameters hebben meestal geen normaalverdeling. Door een log-transformatie uit te voeren kan er echter een verdeling worden verkregen die de normaalverdeling benadert.
Bereken het rekenkundig gemiddelde (gemiddelde lnD) en de standaarddeviatie (SDlnD) van de natuurlijke logaritmen (lnD) van de n vezeldiameters (D):
|

|
(1)
|
|

|
(2)
|
Om de standaardfout (SElnD) te krijgen wordt de standaarddeviatie gedeeld door de vierkantswortel van het aantal metingen:
|

|
(3)
|
Van het gemiddelde wordt twee keer de standaardfout afgetrokken en van deze waarde (gemiddelde minus twee keer de standaardfout) wordt de e-macht berekend; dit levert het meetkundig gemiddelde minus twee keer de standaardfout van het meetkundig gemiddelde:
|

|
(4)
|
3. RAPPORTAGE
TESTVERSLAG
In het testverslag moet ten minste de volgende informatie worden opgenomen:
|
—
|
de waarde van LWGMD-2SE;
|
|
—
|
eventuele afwijkingen van de procedure, met name degene die gevolgen kunnen hebben voor de precisie of de nauwkeurigheid van de resultaten, met een afdoende motivering.
|
4. REFERENTIES
|
1.
|
B. Tylee SOP MF 240. Health and Safety Executive. February 1999.
|
|
2.
|
G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994.
|
(1) Deze vergrotingsfactor is geschikt voor vezels van 3 µm; voor vezels van 6 µm zal een vergrotingsfactor van 5 000 × wellicht geschikter zijn.
(2) Zie voor vezels van 3 µm de vorige voetnoot.
BIJLAGE III
|
B.46.
|
IN VITRO HUIDIRRITATIE: TEST MET GERECONSTRUEERD HUMAAN EPIDERMISMODEL
|
1. METHODE
1.1. INLEIDING
Onder huidirritatie wordt verstaan: het ontstaan van reversibele beschadiging van de huid na het aanbrengen van een teststof gedurende maximaal 4 uur (zoals gedefinieerd in het wereldwijd geharmoniseerd systeem voor de indeling en etikettering van chemische stoffen (Globally Harmonized System of classification and labelling of chemicals) van de Verenigde Naties (GHS)) (1). Deze testmethode behelst een in-vitroprocedure die binnen een teststrategie een opzichzelfstaande vervangende test vormt. De procedure kan, afhankelijk van informatieverplichtingen, gebruikt worden om de irritatie van de huid door stoffen te bepalen, in een benadering met meervoudige bewijsvoering („weight of evidence” benadering) (2).
De bepaling van huidirritatie ging meestal gepaard met het gebruik van proefdieren (zie methode B.4) (3). De betekenis van methode B.4 voor dierenwelzijn ligt in de mogelijkheid om huidcorrosie/-irritatie vast te stellen door toepassing van een sequentiële teststrategie waarbij gevalideerde in-vitro- en ex-vivomethoden worden gebruikt, zodat pijn en lijden van dieren wordt vermeden. Er zijn op dit moment drie gevalideerde in-vitrotestmethoden of richtsnoeren voor het testen, B.40, B.40bis en TG 435 (4, 5, 6), die bruikbaar zijn voor het deel van de sequentiële teststrategie van B.4 dat betrekking heeft op corrosie.
Deze testmethode is gebaseerd op gereconstrueerde humane epidermismodellen, die door hun globale samenstelling (het gebruik van humane epidermale keratinocyten als bron van cellen, en de kenmerkende weefsel- en celstructuur) in biochemisch en fysiologisch opzicht sterke overeenkomst vertonen met de bovenste delen van de humane huid, d.w.z. de epidermis. Volgens de procedure van deze testmethode kunnen de gevaarseigenschappen van irriterende stoffen van GHS-categorie 2 geïdentificeerd worden. De testmethode omvat ook een reeks prestatienormen voor de beoordeling van soortgelijke en gewijzigde testmethoden met gereconstrueerde humane epidermis (7).
Voor twee in-vitrotestmethoden, die commercieel verkrijgbaar zijn als EpiSkinTM en EpiDermTM, waarin gereconstrueerde humane epidermis als modelsysteem wordt gebruikt, zijn prevaliderings-, optimaliserings- en valideringsstudies uitgevoerd (8, 9, 10, 11, 12, 13, 14, 15, 16, 17). Deze referenties zijn gebaseerd op R 38. Bepaalde herberekeningsaspecten ten behoeve van het GHS worden in referentie 25 besproken. Methoden waarvan de prestaties overeenkomen met die van EpiSkinTM (gevalideerde referentiemethode 1), worden aanbevolen als een opzichzelfstaande test ter vervanging van de in-vivotest bij konijnen om irriterende stoffen van GHS-categorie 2 te classificeren. Methoden waarvan de prestaties overeenkomen met die van EpiDermTM (gevalideerde referentiemethode 2), worden uitsluitend aanbevolen als screeningstest of als onderdeel van een sequentiële teststrategie in een „weight of evidence”-benadering voor het classificeren van irriterende stoffen van GHS-categorie 2. Voordat een voorgestelde in-vitrohuidirritatietest met gereconstrueerde humane epidermis voor regelgevingsdoeleinden kan worden gebruikt, moeten de betrouwbaarheid, relevantie (nauwkeurigheid) en beperkingen met het oog op het voorgestelde gebruik worden bepaald, om te verzekeren dat deze kwaliteiten vergelijkbaar zijn met die van gevalideerde referentiemethode 1, overeenkomstig de in deze testmethode beschreven prestatienormen (aanhangsel).
Twee andere in-vitrotestmethoden met gereconstrueerde humane epidermis zijn gevalideerd overeenkomstig de normen die in deze testmethode zijn opgenomen, en de resultaten die met deze testen zijn verkregen komen overeen met die van gevalideerde referentiemethode 1 (18) Dit zijn de gemodificeerde EpiDermTM-testmethode (gemodificeerde referentiemethode 2) en de SkinEthic RHETM-testmethode („me too”-methode 1).
1.2. DEFINITIES
De volgende definities zijn voor deze testmethode relevant:
Nauwkeurigheid: De mate van overeenstemming tussen resultaten verkregen met de testmethode en erkende referentiewaarden. Het is een maat voor de prestaties van de testmethode en één aspect van relevantie. Deze term en de term „concordantie”, waaronder het percentage correcte uitkomsten van een testmethode wordt verstaan, worden vaak door elkaar gebruikt..
Batchcontrolestof: Benchmarkstof die een gematigde weefselrespons, gemeten als de levensvatbaarheid van de cellen, teweegbrengt.
Levensvatbaarheid van de cellen: Parameter waarmee de totale activiteit van een celpopulatie wordt weergegeven, bijvoorbeeld als het vermogen van cellulaire mitochondriale dehydrogenasen om de vitale kleurstof MTT (3-[4,5-dimethylthiazool-2-yl]-2,5-difenyltetrazoliumbromide) te reduceren. Deze parameter is, afhankelijk van het gemeten eindpunt en de opzet van de test, gecorreleerd met het totale aantal levende cellen en/of de vitaliteit van de cellen.
ET50
: De blootstellingstijd die nodig is om de levensvatbaarheid van de cellen met 50 % te doen dalen bij aanbrenging van de markerstof in een bepaalde, vaste concentratie, zie ook IC50.
Percentage fout-negatieve uitslagen: Het percentage van alle positieve stoffen dat door een testmethode onterecht als negatief wordt geïdentificeerd. Het is één indicator van de prestaties van de testmethode.
Percentage fout-positieve uitslagen: Het percentage van alle negatieve (niet-actieve) stoffen dat onterecht als positief wordt geïdentificeerd. Het is één indicator van de prestaties van de testmethode.
Oneindige dosis: Hoeveelheid op de huid aangebrachte teststof die groter is dan de hoeveelheid die nodig is om het huidoppervlak volledig en gelijkmatig te bedekken.
GHS (Globally Harmonized System of classification and labelling of chemicals): Een systeem dat criteria vastlegt voor de indeling van stoffen en mengsels op basis van gevaarseigenschappen, overeenkomstig gestandaardiseerde soorten en niveaus van gevaren van fysisch-chemische aard en gevaren voor de gezondheid en het milieu, en dat de desbetreffende voorlichtingselementen bepaalt, zoals pictogrammen, signaalwoorden, gevarenaanduidingen, voorzorgsmaatregelen en veiligheidsinformatiebladen, waarmee informatie over de schadelijke effecten van de stoffen kenbaar wordt gemaakt met de bedoeling mensen (waaronder werkgevers, werknemers, transporteurs, consumenten en medewerkers van spoeddiensten) en het milieu te beschermen (1), en dat in de EU wordt uitgevoerd in Verordening (EG) nr. 1272/2008.
IC50
: De concentratie waarin een markerstof de levensvatbaarheid van de weefsels met 50 % doet dalen (IC50) na een vaste blootstellingstijd, zie ook ET50.
Prestatienormen: Normen, gebaseerd op een gevalideerde referentiemethode, die de basis vormen voor de beoordeling van de vergelijkbaarheid van een voorgestelde, in mechanistisch en functioneel opzicht gelijksoortige testmethode. Hieronder begrepen zijn: I) essentiële componenten van de testmethode; II) een minimumlijst van referentiestoffen die zijn gekozen uit de stoffen die zijn gebruikt om de aanvaardbare prestaties van de gevalideerde referentiemethode aan te tonen; en III) de nauwkeurigheids- en betrouwbaarheidsniveaus die door de voorgestelde testmethode moeten worden gehaald wanneer ze worden beoordeeld aan de hand van de minimumlijst van referentiestoffen; deze waarden zijn gebaseerd op de waarden die voor de gevalideerde referentiemethode zijn verkregen.
Betrouwbaarheid: Indicator van de mate waarin een testmethode, uitgevoerd volgens een vast protocol, op reproduceerbare wijze binnen één laboratorium en tussen verschillende laboratoria verspreid over de tijd kan worden uitgevoerd. De betrouwbaarheid wordt bepaald door berekening van intra- en interlaboratoriumreproduceerbaarheid.
Gevoeligheid: Het percentage van alle positieve/actieve stoffen dat door middel van de test correct wordt ingedeeld. De gevoeligheid is een maat voor de nauwkeurigheid van een testmethode die categoriale resultaten oplevert, en is een belangrijke factor bij de beoordeling van de relevantie van een testmethode.
Specificiteit: Het percentage van alle negatieve/niet-actieve stoffen dat door middel van de test correct wordt ingedeeld. De specificiteit is een maat voor de nauwkeurigheid van een testmethode die categoriale resultaten oplevert, en is een belangrijke factor bij de beoordeling van de relevantie van een testmethode.
Huidirritatie: Het ontstaan van reversibele beschadiging van de huid na het aanbrengen van een teststof gedurende maximaal 4 uur. Huidirritatie is een lokaal optredende, niet-immunogene reactie die zich kort na stimulatie voordoet (24). Het voornaamste kenmerk is dat het een reversibel proces is waarbij ontstekingsreacties en de meeste klinische symptomen van ontstekinggerelateerde irritatie (erytheem, oedeem, jeuk en pijn) optreden.
1.3. MOGELIJKHEDEN EN BEPERKINGEN
Een beperking van de testen met gereconstrueerde humane epidermis die onder deze testmethode vallen, is dat stoffen daarmee uitsluitend kunnen worden ingedeeld als huidirriterende stoffen van VN-GHS-categorie 2. Aangezien het met deze testen niet mogelijk is om stoffen in de optionele VN-GHS-categorie 3 in te delen, worden alle overige stoffen niet geclassificeerd (geen categorie). Afhankelijk van de eisen op het gebied van regelgeving en eventuele toekomstige toevoeging van nieuwe eindpunten, verbeteringen of de ontwikkeling van nieuwe „me too”-tests, kan het nodig zijn deze testmethode te herzien.
Deze testmethode is geëigend voor de identificatie van de gevaarseigenschappen van irriterende stoffen die uit één component bestaan (19), maar geeft geen adequate informatie over huidcorrosie. Gassen en aerosolen kunnen niet getest worden en mengsels zijn tot nu toe nog niet in een valideringsstudie beoordeeld.
1.4. PRINCIPE VAN DE TEST
De teststof wordt plaatselijk aangebracht op een driedimensionaal humaan epidermismodel, dat is opgebouwd uit normale epidermale keratinocyten van humane oorsprong, die zijn gekweekt tot een meerlaags, sterk gedifferentieerd model van de humane epidermis. Het model bestaat uit een georganiseerd stratum basale, stratum spinosum en stratum granulosum, en een meerlagig stratum corneum met intercellulaire lamellaire lipidenlagen waarvan de verdeling in het weefsel analoog is aan de patronen die in vivo worden gezien.
Het principe van de bepaling met het gereconstrueerde humane epidermismodel berust op de hypothese dat irriterende stoffen door diffusie het stratum corneum kunnen penetreren en cytotoxisch zijn voor de onderliggende cellagen. De levensvatbaarheid van de cellen wordt bepaald door meting van de omzetting door dehydrogenase van de vitale kleurstof MTT (3-[4,5-dimethylthiazool-2-yl]-2,5-difenyltetrazoliumbromide, thiazolylblauw; EINECS-nummer 206-069-5, CAS-nummer 298-93-1) in een blauw formazanzout, dat op kwantitatieve wijze wordt gemeten nadat het uit het weefsel is geëxtraheerd (20). Irriterende stoffen worden geïdentificeerd op grond van hun vermogen om een de levensvatbaarheid van de cellen te verminderen tot onder gedefinieerde drempelwaarden (d.w.z. ≤ 50 %, voor irriterende stoffen van VN-GHS-categorie 2). Stoffen waarbij de levensvatbaarheid van de cellen boven de gedefinieerde drempelwaarde blijft, worden niet geclassificeerd (d.w.z. > 50 %, geen categorie).
De testsystemen op basis van gereconstrueerde humane epidermis kunnen gebruikt worden om vaste stoffen, vloeistoffen, halfvaste stoffen en wassen te testen. Vloeistoffen mogen waterig of niet-waterig zijn; vaste stoffen mogen al dan niet in water oplosbaar zijn. Indien mogelijk moeten vaste stoffen in de vorm van een fijn poeder worden getest. Aangezien voor de validering van de testsystemen met een gereconstrueerd humaan epidermismodel 58 zorgvuldig gekozen stoffen zijn gebruikt, die een breed spectrum van chemische klassen vertegenwoordigen, kan verwacht worden dat de methoden algemeen bruikbaar zullen zijn voor stoffen van uiteenlopende chemische klassen (16). In de validering zijn 13 irriterende stoffen van GHS-categorie 2 opgenomen. Er dient te worden opgemerkt dat niet-bijtende zuren, basen, zouten en andere anorganische stoffen niet in de validering zijn opgenomen en dat sommige bekende categorieën irriterende organische stoffen, zoals hydroperoxiden, fenolen en oppervlakteactieve stoffen, niet of slechts tot op zekere hoogte zijn opgenomen.
1.5. AANTONING VAN BEKWAAMHEID
Laboratoria kunnen het wenselijk achten om, voordat zij een onder deze testmethode vallende gevalideerde methode routinematig gaan gebruiken, eerst hun technische bekwaamheid te toetsen met de tien stoffen die in tabel 1 worden aanbevolen. Bij deze testmethode wordt de optionele VN-GHS-categorie 3 als geen categorie beschouwd. Voordat, onder deze testmethode, nieuwe soortgelijke (me-too)-methoden die in structureel en functioneel opzicht vergelijkbaar zijn met gevalideerde referentiemethoden, of gewijzigde versies van gevalideerde methoden, voor regelgevingsdoeleinden kunnen worden ingezet, moet aan de hand van de prestatienormen die in het aanhangsel van deze testmethode zijn beschreven, worden aangetoond dat hun betrouwbaarheid en nauwkeurigheid vergelijkbaar zijn met die van de gevalideerde referentiemethoden.
Tabel 1.
Stoffen voor bekwaamheidstoetsing, een subgroep van de in het aanhangsel opgenomen lijst van referentiestoffen
|
Stof
|
CAS-nummer
|
In vivo score
|
Fysische toestand
|
GHS-categorie
|
|
Naftaleenazijnzuur
|
86-87-3
|
0
|
s
|
geen cat.
|
|
Isopropanol
|
67-63-0
|
0,3
|
l
|
geen cat.
|
|
Methylstearaat
|
112-61-8
|
1
|
s
|
geen cat.
|
|
Heptylbutyraat
|
5870-93-9
|
1,7
|
l
|
optionele cat. 3
|
|
Hexylsalicylaat
|
6259-76-3
|
2
|
l
|
optionele cat. 3
|
|
Cyclamenaldehyde
|
103-95-7
|
2,3
|
l
|
cat. 2
|
|
1-Broomhexaan
|
111-25-1
|
2,7
|
l
|
cat. 2
|
|
Butylmethacrylaat
|
97-88-1
|
3
|
l
|
cat. 2
|
|
1-Methyl-3-fenyl-1-piperazine
|
5271-27-2
|
3,3
|
s
|
cat. 2
|
|
Heptanal
|
111-71-7
|
4
|
l
|
cat. 2
|
1.6. BESCHRIJVING VAN DE METHODE
Hieronder volgt een beschrijving van de componenten en procedures van een test met een gereconstrueerd humaan epidermismodel voor het bepalen van huidirritatie. Een gereconstrueerd humaan epidermismodel kan worden vervaardigd, bereid, of commercieel worden verkregen (bv. EpiSkin™, EpiDerm™ en SkinEthic RHE™). Protocollen van de standaardtestmethoden EpiSkin™, EpiDerm™ en SkinEthic RHE™ zijn beschikbaar op [http://ecvam.jrc.ec.europa.eu] (21, 22, 23). De tests moeten als volgt worden uitgevoerd:
1.6.1. Componenten van het gereconstrueerde humane epidermismodel
1.6.1.1. Algemene modelvoorwaarden
Om het epitheel op te bouwen moeten normale humane keratinocyten worden gebruikt. Er moeten meerdere lagen levende epitheelcellen (stratum basale, stratum spinosum, stratum granulosum) aanwezig zijn onder een functioneel stratum corneum. Het stratum corneum moet uit meerdere lagen bestaan en het vereiste lipidenprofiel hebben, zodat een sterke en functionele barrière wordt gevormd waar cytotoxische markerstoffen, bv. natriumdodecylsulfaat (SDS) of Triton X-100, niet snel doorheen kunnen dringen. De barrièrefunctie kan beoordeeld worden door de concentratie te bepalen waarin een markerstof de levensvatbaarheid van het weefsel met 50 % doet dalen (IC50) na een vaste blootstellingstijd, of door de blootstellingstijd te bepalen die nodig is om de levensvatbaarheid van de cellen met 50 % te doen dalen (ET50) bij aanbrenging van de markerstof in een bepaalde, vaste concentratie. De omsluitingseigenschappen van het model moeten voorkomen dat materiaal om het stratum corneum heen het levende weefsel kan bereiken. Dat zou een slecht model voor huidblootstelling opleveren. Het huidmodel mag niet verontreinigd zijn met bacteriën, virussen, mycoplasma of fungi.
1.6.1.2. Functionele modelvoorwaarden
1.6.1.2.1. Levensvatbaarheid
De levensvatbaarheid wordt bij voorkeur gekwantificeerd door middel van de MTT-test (20). De optische dichtheid (OD) van de (opgeloste) kleurstof die wordt geëxtraheerd uit het weefsel dat met de negatieve controlestof (NC) is behandeld, dient ten minste 20 keer zo hoog te zijn als de OD van het extractieoplosmiddel alleen. Ook moet worden aangetoond dat het met NC behandelde weefsel stabiel is in kweek (constante levensvatbaarheidswaarden geeft) voor de duur van de blootstelling.
1.6.1.2.2. Barrièrefunctie
Het stratum corneum met de daarin aanwezige lipiden dient sterk genoeg te zijn om snelle penetratie van cytotoxische markerstoffen, bv. SDS of Triton X-100, te weerstaan, wat wordt beoordeeld aan de hand van de IC50 of ET50.
1.6.1.2.3. Morfologie
Histologisch onderzoek van de gereconstrueerde huid/epidermis moet door gekwalificeerde medewerkers worden uitgevoerd, die kunnen beoordelen of de structuur van het weefsel op die van humane huid/epidermis lijkt (onder meer een meerlagig stratum corneum).
1.6.1.2.4. Reproduceerbaarheid
De resultaten van de methode waarbij een bepaald model wordt gebruikt moeten reproduceerbaar zijn in de tijd, wat bij voorkeur door middel van een geschikte batchcontrolestof (benchmarkstof) wordt vastgesteld (zie aanhangsel).
1.6.1.2.5. Kwaliteitscontroles (QC) van het model
Elke weefselbatch van het epidermale model moet voldoen aan bepaalde criteria voor productievrijgave, waarvan de criteria voor levensvatbaarheid (paragraaf 1.6.1.2.1) en barrièrefunctie (paragraaf 1.6.1.2.2) het belangrijkst zijn. Door de leverancier van het huidmodel (of de onderzoeker als het model in het laboratorium zelf is ontwikkeld) moet een aanvaardbaarheidsbereik (boven- en ondergrens) worden vastgesteld voor de IC50 of de ET50. De barrière-eigenschappen van het weefsel moeten na ontvangst door het laboratorium worden gecontroleerd. Een betrouwbare voorspelling van irritatie-effecten kan uitsluitend worden gedaan op grond van resultaten verkregen met deugdelijk weefsel. Bij wijze van voorbeeld zijn hieronder de aanvaardbaarheidsbereiken voor de gevalideerde referentiemethoden gegeven.
Tabel 2.
Voorbeelden van QC-criteria voor batchvrijgave
|
|
Ondergrens aanvaardbaarheid
|
Gemiddelde van aanvaardbaarheidsbereik
|
Bovengrens aanvaardbaarheid
|
|
Gevalideerde referentiemethode 1 (SDS-behandeling van 18 uur)
|
IC50 = 1,0 mg/ml
|
IC50 = 2,32 mg/ml
|
IC50 = 3,0 mg/ml
|
|
Gevalideerde referentiemethode 2 (1 % Triton X-100)
|
ET50 = 4,8 h
|
ET50 = 6,7 h
|
ET50 = 8,7 h
|
1.6.1.3. Het aanbrengen van de test- en controlestoffen
Voor elke behandeling, ook voor de controles, moet een voldoende aantal weefselmonsters worden gebruikt (ten minste drie per experiment). Voor zowel vloeibare als vaste stoffen geldt dat er zo veel teststof moet worden opgebracht dat het huidoppervlak gelijkmatig bedekt is, d.w.z. ten minste 25 μl/cm2 of 25 mg/cm2, maar er mag geen oneindige dosis (zie 1.2, definities) worden gebruikt. In het geval van vaste stoffen moet het epidermisoppervlak voor aanbrenging worden bevochtigd met gedeïoniseerd of gedestilleerd water, om voor een goed contact met de huid te zorgen. Indien mogelijk moeten vaste stoffen in de vorm van een fijn poeder worden getest. Aan het eind van de blootstellingsperiode moet de teststof zorgvuldig met waterige buffer of 0,9 % NaCl van het huidoppervlak worden gewassen. Afhankelijk van het gereconstrueerde humane epidermismodel dat wordt gebruikt, varieert de blootstellingsperiode van 15 tot 60 minuten, en de incubatietemperatuur van 20 tot 37 °C. Voor details, zie de SOP’s (Standard Operating Procedures) voor de drie methoden (21, 22, 23).
In elke studie moeten negatieve controles (NC) en positieve controles (PC) worden gebruikt om aan te tonen dat de levensvatbaarheid (NC), de barrièrefunctie en de resulterende gevoeligheid (PC) van de weefsels binnen een gedefinieerd historisch aanvaardbaarheidsbereik liggen. Als PC-stof wordt een waterige SDS-oplossing van 5 % aanbevolen. Als NC-stoffen zijn water of met fosfaat gebufferde fysiologische zoutoplossing (PBS) geschikt.
1.6.1.4. Metingen van de levensvatbaarheid van de cellen
Het belangrijkste aspect van de testprocedure is dat de levensvatbaarheid niet onmiddellijk na de blootstelling aan de teststoffen wordt gemeten, maar pas nadat de behandelde en gewassen weefsels voldoende lang zijn geïncubeerd in vers medium. Gedurende deze periode kan het weefsel herstellen van zwak irriterende effecten en vertonen zich duidelijke cytotoxische effecten. In de optimaliseringsfase van de test (9, 10, 11, 12, 13) is gebleken dat een na-incubatie van 42 uur optimaal is, en deze tijd is dan ook aangehouden bij de validering van de referentietestmethoden.
De MTT-omzettingstest is een gevalideerde kwantitatieve methode, en de aangewezen methode voor het meten van de levensvatbaarheid van de cellen. De test werkt goed met geconstrueerd driedimensionaal weefsel. Het huidmonster wordt 3 uur in een MTT-oplossing met een geschikte concentratie (bv. 0,3-1 mg/ml) gelegd. Het neergeslagen blauwe formazanproduct wordt vervolgens met een oplosmiddel (bv. isopropanol, aangezuurde isopropanol) uit het weefsel geëxtraheerd, en de formazanconcentratie wordt bepaald door de OD te meten bij 570 nm, bij een bandbreedte van maximaal ongeveer 30 nm.
De optische eigenschappen van de teststof of chemische effecten van de teststof op het MTT kunnen de test storen en tot een foutieve bepaling van de levensvatbaarheid leiden (omdat de teststof de kleurproductie kan voorkomen of omkeren, of juist veroorzaken). Dit kan gebeuren als een bepaalde teststof niet volledig van de huid wordt verwijderd door wassen, of als de stof in de epidermis penetreert. Als de teststof rechtstreekse effecten op het MTT heeft, zelf gekleurd is, of tijdens de weefselbehandeling gekleurd raakt, moeten er aanvullende controles worden uitgevoerd om storing van de levensvatbaarheidsmeting door de teststof te detecteren en daarvoor te corrigeren. Voor een gedetailleerde beschrijving van hoe rechtstreekse MTT-reductie kan worden getest, zie het testprotocol bij de gevalideerde referentiemethoden (21, 22, 23). Niet-specifieke kleur (NSC) veroorzaakt door deze storende effecten mag niet meer zijn dan 30 % van NC (met het oog op correcties). Als NSC > 30 %, wordt de teststof als incompatibel met de test beschouwd.
1.6.1.5. Aanvaardbaarheidscriteria voor de test
Bij elke test met deugdelijke weefselbatches (zie paragraaf 1.6.1.2.5) geeft de OD die men meet voor met NC behandelde weefsels, per definitie de kwaliteit weer van de weefsels die het hele proces van verzending en ontvangst, evenals alle stappen uit het irritatietestprotocol hebben doorgemaakt. De OD-waarden van controles mogen niet onder historisch vastgestelde ondergrenzen komen. Evenzo komt de gevoeligheid die de weefsels nog bezitten en het vermogen van de weefsels om op een irriterende stof te reageren onder de specifieke omstandigheden van elke test, tot uitdrukking in metingen met weefsels die met PC, bv. 5 % waterige SDS-oplossing, zijn behandeld (de levensvatbaarheid is bijvoorbeeld ≤ 40 % voor gevalideerde referentiemethode 1, en ≤ 20 % voor gevalideerde referentiemethode 2). Er moeten bijbehorende en geschikte grenzen voor de toegestane variabiliteit tussen weefselmonsters worden gedefinieerd (bijvoorbeeld: als standaarddeviaties worden gebruikt moeten die ≤ 18 % zijn).
2. GEGEVENS
2.1. GEGEVENS
Voor elke behandeling moeten de gegevens die voor elk individueel testmonster zijn verkregen (bv. OD-waarden en de berekende procentuele levensvatbaarheid van de cellen voor elke teststof, inclusief de classificatie) in tabelvorm worden gerapporteerd, met vermelding van gegevens van eventuele herhaalde experimenten. Daarnaast moeten voor elke bepaling gemiddelden ± standaarddeviatie worden vermeld. Waargenomen interacties met het MTT-reagens en gekleurde teststoffen moeten voor alle geteste stoffen worden gemeld.
2.2. INTERPRETATIE VAN DE RESULTATEN
De OD-waarde die voor elk testmonster wordt verkregen kan gebruikt worden voor het berekenen van de procentuele levensvatbaarheid in vergelijking met NC, die op 100 % wordt gesteld. De drempelwaarde van de procentuele levensvatbaarheid van de cellen die als scheiding tussen irriterende en niet-geclassificeerde teststoffen fungeert, en de statistische procedure(s) die worden gebruikt om de resultaten te evalueren en irriterende stoffen te identificeren, moeten duidelijk worden gespecificeerd en gedocumenteerd, en de juistheid daarvan moet worden aangetoond. De voor de gevalideerde referentiemethoden geldende drempelwaarden voor de voorspelling van irritatie zijn hieronder gegeven:
De teststof wordt beschouwd als irriterend voor de huid overeenkomstig VN-GHS-categorie 2:
|
i)
|
als de levensvatbaarheid van het weefsel na blootstelling en na-incubatie minder is dan of gelijk is aan (≤) 50 %.
|
De teststof wordt beschouwd als behorend tot geen categorie:
|
ii)
|
als de levensvatbaarheid van het weefsel na blootstelling en na-incubatie meer dan (>) 50 % is.
|
3. RAPPORTAGE
3.1. TESTRAPPORT
Het testrapport moet de volgende informatie bevatten:
Test- en controlestoffen:
|
—
|
de chemische naam of namen, zoals de IUPAC- of CAS-naam, en het CAS-nummer, indien dit bekend is;
|
|
—
|
de zuiverheid en de samenstelling van de stof (in gewichtsprocent(en));
|
|
—
|
de fysisch-chemische eigenschappen die voor de uitvoering van het onderzoek relevant zijn (bv. fysische toestand, stabiliteit en vluchtigheid, pH, oplosbaarheid in water indien bekend);
|
|
—
|
de behandeling van de test-/controlestoffen voorafgaand aan de test, indien van toepassing (bv. verwarmen, fijnmalen);
|
|
—
|
de bewaaromstandigheden.
|
Motivering voor het gebruikte huidmodel en protocol.
Testomstandigheden:
|
—
|
het gebruikte celsysteem;
|
|
—
|
kalibratie-informatie voor de meetapparatuur (bijvoorbeeld een spectrofotometer), en de bandbreedte die voor het meten van de levensvatbaarheid van de cellen is gebruikt;
|
|
—
|
volledige ondersteunende informatie over het specifieke gebruikte huidmodel, met inbegrip van de deugdelijkheid daarvan. Hieronder moet ten minste informatie zijn over:
|
iv)
|
de reproduceerbaarheid en voorspelbaarheid,
|
|
v)
|
kwaliteitscontroles (QC) van het model;
|
|
|
—
|
gedetailleerde informatie over de gebruikte testprocedure;
|
|
—
|
de gebruikte testdoses, duur van de blootstelling en de na-incubatie;
|
|
—
|
een beschrijving van eventuele modificaties van de testprocedure;
|
|
—
|
verwijzingen naar historische gegevens over het model. Deze moeten ten minste omvatten:
|
i)
|
de aanvaardbaarheid van de QC-gegevens met verwijzing naar historische batchgegevens,
|
|
ii)
|
de aanvaardbaarheid van de waarden voor de positieve en negatieve controles met verwijzing naar gemiddelde waarden en bereiken van negatieve en positieve controles;
|
|
|
—
|
een beschrijving van de gebruikte evaluatiecriteria inclusief een motivering van de geselecteerde drempelwaarde(n) voor het voorspellingsmodel.
|
Resultaten:
|
—
|
een tabel met de gegevens voor de individuele testmonsters;
|
|
—
|
een beschrijving van andere waargenomen effecten.
|
Bespreking van de resultaten.
Conclusies.
4. REFERENTIES
|
1.
|
Verenigde Naties (VN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), tweede herziene uitgave, VN, New York en Genève, 2007. Beschikbaar op: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html.
|
|
2.
|
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Beschikbaar op: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649.
|
|
3.
|
Test Method B.4. Acute toxicity; dermal irritation/corrosion.
|
|
4.
|
Test Method B.40. In vitro skin corrosion: transcutaneous electrical resistance test (TER).
|
|
5.
|
Test Method B.40 bis. In vitro skin corrosion: Human skin model test.
|
|
6.
|
OECD (2006). Test Guideline 435. OECD guideline for the testing of chemicals. In vitro membrane barrier test method. Opgesteld op 19 juli 2006. Beschikbaar op: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html.
|
|
7.
|
ECVAM (2009) Performance standards for applying human skin models to in vitro skin irritation. Beschikbaar onder Download Study Documents, op: http://ecvam.jrc.ec.europa.eu.
|
|
8.
|
Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. en Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the management team. Toxicology in Vitro 15, 57-93.
|
|
9.
|
Portes, P., Grandidier, M.H., Cohen, C. en Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765-770.
|
|
10.
|
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. en Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107-114.
|
|
11.
|
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. en Spielmann H. (2005). The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests — an assessment of the performance of the optimised test. ATLA 33, 351-367.
|
|
12.
|
Cotovio, J., Grandidier, M.-H., Portes, P., Roguet, R. en Rubinsteen, G. (2005). The in vitro acute skin irritation of chemicals: optimisation of the EPISKIN prediction model within the framework of the ECVAM validation process. ATLA 33, 329-249.
|
|
13.
|
Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. en Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30, 109-129.
|
|
14.
|
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. en Zuang, V. (2007). The ECVAM international validation study on in vitro tests for acute skin irritation: Report on the validity of the EPISKIN and EpiDerm assays and on the skin integrity function test. ATLA 35, 559-601.
|
|
15.
|
Hoffmann, S. (2006). ECVAM skin irritation validation study phase II: Analysis of the primary endpoint MTT and the secondary endpoint IL1-α. 135 blz. + bijlagen. Beschikbaar onder Download Study Documents, op: http://ecvam.jrc.ec.europa.eu.
|
|
16.
|
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. en Zuang. V (2007). ECVAM international validation study on in vitro tests for acute skin irritation: Selection of test chemicals. ATLA 35, 603-619.
|
|
17.
|
J. Cotovio, M.-H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy — results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351-358.
|
|
18.
|
ESAC-verklaring betreffende geüpdatete EpiDerm-test en soortgelijke SkinEthic-test, 5 november 2008.
|
|
19.
|
EC (2006). Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad van 18 december 2006 inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH), tot oprichting van een Europees Agentschap voor chemische stoffen, houdende wijziging van Richtlijn 1999/45/EG en houdende intrekking van Verordening (EEG) nr. 793/93 van de Raad en Verordening (EG) nr. 1488/94 van de Commissie alsmede Richtlijn 76/769/EEG van de Raad en de Richtlijnen 91/155/EEG, 93/67/EEG, 93/105/EG, en 2000/21/EG van de Commissie.
Official Journal of the European Union L396/1 van 30.12.2006. OPOCE, Luxemburg.
|
|
20.
|
Mosman, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63.
|
|
21.
|
EpiSkin™ SOP, versie 1.6 (januari 2005). Validation of the EpiSkin Skin Irritation Test — 42 hours assay for the prediction of acute skin irritation of chemicals. Beschikbaar onder Download Study Documents, op: http://ecvam.jrc.ec.europa.eu.
|
|
22.
|
EpiDerm™ SOP, versie 5.0 (oktober 2004). Draft Standard Operating Procedure. In vitro Skin Irritation Test: human skin model. Model: EpiDermTM- 200. Beschikbaar onder Download Study Documents, op: http://ecvam.jrc.ec.europa.eu.
|
|
23.
|
SkinEthic RHETM SOP. Komt beschikbaar onder Download Study Documents, op: http://ecvam.jrc.ec.europa.eu.
|
|
24.
|
Harvell, J.D., Lamminstausta, K, Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis, Mc Graw-Hill, New York, blz. 7-18
|
|
25.
|
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, 13 november 2008.
|
Aanhangsel
Beoordeling van de prestatiekenmerken van voorgestelde in vitro gereconstrueerde humane epidermismodellen voor huidirritatie
INLEIDING
Voorgestelde procedures die onder deze testmethode vallen moeten geëvalueerd worden aan de hand van stoffen die het volledige bereik van Draize-irritatiescores bestrijken, om de betrouwbaarheid en nauwkeurigheid van de procedures vast te stellen. Evaluatie van deze voorgestelde procedures met de 20 aanbevolen referentiestoffen (tabel 2) moet betrouwbaarheids- en nauwkeurigheidswaarden opleveren die vergelijkbaar zijn met die van gevalideerde referentiemethode 1 (tabel 3) (1). De normen voor nauwkeurigheid en betrouwbaarheid waaraan moet worden voldaan, zijn hieronder vermeld onder II en III. De groep referentiestoffen omvat niet-geclassificeerde en geclassificeerde (VN-GHS-categorie 2) stoffen, die relevante chemische klassen vertegenwoordigen, zodat de betrouwbaarheid en prestaties (gevoeligheid, specificiteit, percentages fout-negatieve uitslagen, fout-positieve uitslagen en nauwkeurigheid) van de voorgestelde testmethode vergeleken kunnen worden met die van gevalideerde referentiemethode 1. Zowel de betrouwbaarheid van de testmethode als het vermogen om irriterende stoffen van VN-GHS-categorie 2 correct te identificeren, moeten worden bepaald voordat de methode kan worden gebruikt voor het testen van nieuwe stoffen.
PRESTATIENORMEN
De prestatienormen omvatten de volgende drie elementen: I) essentiële componenten van de testmethode, II) referentiestoffen en III) gespecificeerde nauwkeurigheids- en betrouwbaarheidswaarden (2). Deze prestatienormen zijn gebaseerd op de prestatienormen gedefinieerd na voltooiing van het huidirritatievalideringsonderzoek van het Europees Centrum voor de validering van alternatieve methoden (ECVAM) (3).
I) Essentiële componenten van de testmethode
Algemene modelvoorwaarden
Om het epitheel op te bouwen moeten normale humane keratinocyten worden gebruikt. Er moeten meerdere lagen levende epitheelcellen (stratum basale, stratum spinosum, stratum granulosum) aanwezig zijn onder een functioneel stratum corneum. Het stratum corneum moet uit verschillende lagen bestaan en het vereiste lipidenprofiel hebben, zodat een sterke en functionele barrière wordt gevormd waar cytotoxische markerstoffen, bv. SDS of Triton X-100, niet snel doorheen kunnen dringen. De barrièrefunctie kan beoordeeld worden door de concentratie te bepalen waarin een markerstof de levensvatbaarheid van het weefsel met 50 % doet dalen (IC50) na een vaste blootstellingstijd, of door de blootstellingstijd te bepalen die nodig is om de levensvatbaarheid van de cellen met 50 % te doen dalen (ET50) bij aanbrenging van de markerstof in een bepaalde, vaste concentratie. De omsluitingseigenschappen van het model moeten voorkomen dat materiaal om het stratum corneum heen het levende weefsel kan bereiken. Dat zou een slecht model voor huidblootstelling opleveren. Het huidmodel mag niet verontreinigd zijn met bacteriën, virussen, mycoplasma of fungi.
Functionele modelvoorwaarden
Levensvatbaarheid
De levensvatbaarheid wordt bij voorkeur gekwantificeerd door middel van de MTT-test (4). De OD van de (opgeloste) kleurstof die uit het met NC behandelde weefsel wordt geëxtraheerd, moet ten minste 20 keer zo hoog zijn als de OD van het extractieoplosmiddel alleen. Ook moet worden aangetoond dat het met NC behandelde weefsel stabiel is in kweek (constante levensvatbaarheidswaarden geeft) voor de duur van de blootstelling.
Barrièrefunctie
Het stratum corneum met de daarin aanwezige lipiden dient sterk genoeg te zijn om snelle penetratie van cytotoxische markerstoffen, bv. SDS of Triton X-100, te weerstaan, wat wordt beoordeeld aan de hand van de IC50 of ET50.
Morfologie
Histologisch onderzoek van de gereconstrueerde huid/epidermis moet door gekwalificeerde medewerkers worden uitgevoerd die kunnen beoordelen of de structuur van het weefsel op die van humane huid/epidermis lijkt (onder meer een meerlagig stratum corneum).
Reproduceerbaarheid
De resultaten van de methode met een specifiek model moeten reproduceerbaar zijn in de tijd, en dit wordt bij voorkeur vastgesteld door middel van een geschikte batchcontrolestof (benchmarkstof) (zie definities onder punt 1.2).
Kwaliteitscontroles (QC) van het model
Elke weefselbatch van het gebruikte epidermale model moet voldoen aan bepaalde criteria voor productievrijgave, waarvan de criteria voor levensvatbaarheid en barrièrefunctie het belangrijkst zijn. Door de leverancier van het huidmodel (of de onderzoeker als het model in het laboratorium zelf is ontwikkeld) moet een aanvaardbaarheidsbereik (boven- en ondergrens) worden vastgesteld voor de IC50 of de ET50. De barrière-eigenschappen van het weefsel moeten na ontvangst door het laboratorium worden gecontroleerd. Een betrouwbare voorspelling van irritatie-effecten kan uitsluitend worden gedaan op grond van resultaten verkregen met deugdelijk weefsel. Bij wijze van voorbeeld zijn hieronder de aanvaardbaarheidsbereiken voor de gevalideerde referentiemethoden gegeven.
Tabel 1.
Voorbeelden van QC-criteria voor batchvrijgave
|
|
Ondergrens aanvaardbaarheid
|
Gemiddelde van aanvaardbaarheidsbereik
|
Bovengrens aanvaardbaarheid
|
|
Gevalideerde referentiemethode 1 (SDS-behandeling van 18 uur)
|
IC50 = 1,0 mg/ml
|
IC50 = 2,32 mg/ml
|
IC50 = 3,0 mg/ml
|
|
Gevalideerde referentiemethode 2 (1 % Triton X-100)
|
ET50 = 4,8 h
|
ET50 = 6,7 h
|
ET50 = 8,7 h
|
II) Referentiestoffen
Referentiestoffen worden gebruikt om na te gaan of de betrouwbaarheid en nauwkeurigheid van een voorgestelde nieuwe testmethode met in vitro gereconstrueerde humane epidermis, die in structureel en functioneel opzicht voldoende gelijkenis vertoont met gevalideerde referentiemethoden, of licht gewijzigd is ten opzichte van een gevalideerde referentiemethode, zich laten vergelijken met de overeenkomstige kwaliteiten van gevalideerde referentiemethode 1 (1). Onder de 20 referentiestoffen die in tabel 2 zijn vermeld bevinden zich zowel stoffen van VN-GHS-categorie 2, als stoffen die verschillende relevante chemische klassen vertegenwoordigen. Deze lijst van stoffen bestaat uit: 10 stoffen van VN-GHS-categorie 2, 3 stoffen van optionele VN-GHS-categorie 3, en 7 niet-ingedeelde stoffen. Bij deze testmethode wordt de optionele categorie 3 als geen categorie beschouwd. Deze referentiestoffen vormen het minimum aan stoffen dat gebruikt moet worden voor de evaluatie van de nauwkeurigheid en betrouwbaarheid van een huidirritatietestmethode met gereconstrueerde humane epidermis. Wanneer een stof uit de lijst niet beschikbaar is, kan een andere stof waarvoor voldoende in-vivoreferentiegegevens beschikbaar zijn, worden gebruikt Indien gewenst kan de minimumlijst van referentiestoffen worden uitgebreid met stoffen die andere chemische klassen vertegenwoordigen en waarvoor voldoende in-vivoreferentiegegevens beschikbaar zijn, om de nauwkeurigheid van de voorgestelde testmethode nader te evalueren.
Tabel 2.
Referentiestoffen voor de bepaling van de nauwkeurigheids- en betrouwbaarheidswaarden van huidirritatiemodellen met gereconstrueerde humane epidermis
|
Stof (1)
|
CAS-nr.
|
EINECS-nr.
|
Fysische toestand
|
In vivo score
|
GHS in vitro cat.
|
GHS in vivo cat.
|
|
1-broom-4-chloorbutaan
|
6940-78-9
|
230-089-3
|
l
|
0
|
cat. 2
|
geen cat.
|
|
diethylftalaat
|
84-66-2
|
201-550-6
|
l
|
0
|
geen cat.
|
geen cat.
|
|
naftaleenazijnzuur
|
86-87-3
|
201-705-8
|
s
|
0
|
geen cat.
|
geen cat.
|
|
allylfenoxyacetaat
|
7493-74-5
|
231-335-2
|
l
|
0,3
|
geen cat.
|
geen cat.
|
|
Isopropanol
|
67-63-0
|
200-661-7
|
l
|
0,3
|
geen cat.
|
geen cat.
|
|
4-methylthiobenzaldehyde
|
3446-89-7
|
222-365-7
|
l
|
1
|
cat. 2
|
geen cat.
|
|
methylstearaat
|
112-61-8
|
203-990-4
|
s
|
1
|
geen cat.
|
geen cat.
|
|
heptylbutyraat
|
5870-93-9
|
227-526-5
|
l
|
1,7
|
geen cat.
|
optionele cat. 3
|
|
hexylsalicylaat
|
6259-76-3
|
228-408-6
|
l
|
2
|
geen cat.
|
optionele cat. 3
|
|
tri-isobutylfosfaat
|
126-71-6
|
204-798-3
|
l
|
2
|
cat. 2
|
optionele cat. 3
|
|
1-decanol
|
112-30-1
|
203-956-9
|
l
|
2,3
|
cat. 2
|
cat. 2
|
|
cyclamenaldehyde
|
103-95-7
|
203-161-7
|
l
|
2,3
|
cat. 2
|
cat. 2
|
|
1-broomhexaan
|
111-25-1
|
203-850-2
|
l
|
2,7
|
cat. 2
|
cat. 2
|
|
2-chloormethyl-3,5-dimethyl-4-methoxypyridinehydrochloride
|
86604-75-3
|
434-680-9
|
s
|
2,7
|
cat. 2
|
cat. 2
|
|
a-terpineol
|
98-55-5
|
202-680-6
|
l
|
2,7
|
cat. 2
|
cat. 2
|
|
di-n-propyldisulfide
|
629-19-6
|
211-079-8
|
l
|
3
|
geen cat.
|
cat. 2
|
|
butylmethacrylaat
|
97-88-1
|
202-615-1
|
l
|
3
|
cat. 2
|
cat. 2
|
|
benzeenthiol, 5-(1,1-dimethylethyl)-2-methyl
|
7340-90-1
|
438-520-9
|
l
|
3,3
|
cat. 2
|
cat. 2
|
|
1-methyl-3-fenyl-1-piperazine
|
5271-27-2
|
431-180-2
|
s
|
3,3
|
cat. 2
|
cat. 2
|
|
Heptanal
|
111-71-7
|
203-898-4
|
l
|
4
|
cat. 2
|
cat. 2
|
De lijst van stoffen in tabel 2 is zodanig samengesteld dat zij een representatieve afspiegeling vormt van de groep van 58 stoffen die in het internationale huidirritatievalideringsonderzoek van het ECVAM zijn gebruikt. De stoffen van tabel 2 zijn aan de hand van de volgende criteria gekozen:
|
—
|
de stoffen zijn commercieel verkrijgbaar
|
|
—
|
ze bestrijken het volledige bereik van Draize-irritatiescores (van niet-irriterend tot sterk irriterend)
|
|
—
|
de chemische structuur van de stoffen is goed omschreven
|
|
—
|
de stoffen zijn representatief voor de in het ECVAM-valideringsonderzoek bepaalde reproduceerbaarheid en voorspellingskracht van de gevalideerde methode
|
|
—
|
de stoffen zijn representatief voor de chemische functionaliteit die in het valideringsproces is gebruikt
|
|
—
|
de stoffen kennen geen extreem toxisch profiel (bv. carcinogeen of toxisch voor het voortplantingssysteem) en er zijn ook geen buitensporige verwijderingskosten aan verbonden.
|
III) Gedefinieerde nauwkeurigheids- en betrouwbaarheidswaarden
De prestaties (gevoeligheid, specificiteit, percentage fout-negatieve uitslagen, percentage fout-positieve uitslagen en nauwkeurigheid) van de voorgestelde testmethode moeten vergelijkbaar zijn met die van gevalideerde referentiemethode 1 (tabel 3), dat wil zeggen dat de gevoeligheid ten minste (≥) 80 % moet zijn, de specificiteit ten minste (≥) 70 %, en de nauwkeurigheid ten minste (≥) 75 %. De berekening van de prestaties moet gebaseerd zijn op alle classificaties die voor de 20 stoffen in de verschillende deelnemende laboratoria zijn verkregen. In elk laboratorium dient de classificatie van elke stof plaats te vinden op basis van de gemiddelde levensvatbaarheid over de uitgevoerde experimenten (minimaal drie geldige experimenten).
Tabel 3
Prestaties van gevalideerde referentiemethode 1 (2)
|
Test-methode
|
Aantal stoffen
|
Gevoeligheid
|
Specificiteit
|
Percentage fout-negatief
|
Percentage fout-positief
|
Nauwkeurigheid
|
|
Gevalideerde referentiemethode 1 (3)
|
58
|
87,2 % (4)
|
71,1 % (5)
|
12,8 %
|
29,9 %
|
74,7 %
|
|
Gevalideerde referentiemethode 1 (3)
|
20
|
90 %
|
73,3 %
|
10 %
|
26,7 %
|
81,7 %
|
De betrouwbaarheid van de voorgestelde testmethode moet vergelijkbaar zijn met die van de gevalideerde referentiemethoden.
Reproduceerbaarheid binnen een laboratorium
Bepaling van de intralaboratoriumvariabiliteit zou een concordantie van ten minste (≥) 90 % te zien moeten geven tussen de classificaties van de 20 referentiestoffen (categorie 2/geen categorie), die in verschillende, onafhankelijke experimenten binnen één laboratorium tot stand zijn gekomen.
Reproduceerbaarheid tussen laboratoria
Het is niet nodig om een bepaling van interlaboratoriumreproduceerbaarheid uit te voeren als de voorgestelde testmethode in slechts een laboratorium zal worden gebruikt. Voor methoden waarvan het de bedoeling is dat zij tussen laboratoria worden overgedragen, moet de concordantie tussen classificaties van de 20 referentiestoffen (categorie 2/geen categorie) die tot stand zijn gekomen in verschillende, onafhankelijke experimenten in bij voorkeur minimaal drie laboratoria, ten minste (≥) 80 % zijn.
REFERENTIES
|
1.
|
Spielmann, H., mailto:Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., mailto:Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. en Zuang, V. (2007). The ECVAM international validation study on in vitro tests for acute skin irritation: Report on the validity of the EPISKIN and EpiDerm assays and on the skin integrity function test. ATLA 35, 559-601.
|
|
2.
|
OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Parijs.
|
|
3.
|
ECVAM (2007) Performance standards for applying human skin models to in vitro skin irritation. Beschikbaar onder Download Study Documents, op http://ecvam.jrc.ec.europa.eu. Bereikbaar op 27.10.2008.
|
|
4.
|
Mosman, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63.
|
|
5.
|
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. en Zuang. V (2007). ECVAM international validation study on in vitro tests for acute skin irritation: Selection of test chemicals. ATLA 35, 603-619.
|
(1) De 20 referentiestoffen vormen een representatieve selectie uit de 58 stoffen die oorspronkelijk zijn gebruikt voor de validering van referentiemethode 1 (EpiSkin™). Een volledige lijst van teststoffen en de criteria volgens welke zij worden gekozen is beschikbaar (5).
(2) Tabel 3 geeft de prestaties van gevalideerde referentiemethode 1, die betrekking hebben op het vermogen van deze methode om irriterende stoffen (VN-GHS-categorie 2) en niet-geclassificeerde stoffen (geen categorie met inbegrip van optionele categorie 3) correct te identificeren, voor respectievelijk de 58 en 20 referentiestoffen (tabel 2).
(3) EpiSkin™
(4) Gebaseerd op 13 irriterende stoffen van GHS-categorie 2.
(5) Gebaseerd op 45 irriterende stoffen van GHS-categorie 3 of stoffen zonder GHS-categorie.
BIJLAGE IV
|
C.3.
|
ZOETWATERALGEN EN CYANOBACTERIËN: GROEIREMMINGSTEST
|
1. METHODE
Deze methode komt overeen met OESO TG 201 (2006) (1).
1.1. INLEIDING
Testmethoden worden periodiek in het licht van de wetenschappelijke vorderingen getoetst en geactualiseerd. Testmethode C.3 moest worden herzien om er andere soorten in op te nemen en om te voldoen aan de eisen inzake vaststelling van de gevaren en indeling van chemische stoffen. De herziening is uitgevoerd op basis van uitgebreide praktische ervaring, vorderingen van de wetenschap op het gebied van toxiciteitsonderzoek bij algen en uitgebreid gebruik in het kader van regelgeving sinds de oorspronkelijke vaststelling.
1.2. DEFINITIES
In de context van deze methode worden de volgende definities en afkortingen gebruikt:
Biomassa: het drooggewicht van het levende materiaal in een populatie per volume-eenheid, bv. mg algen/liter testoplossing. Meestal wordt „biomassa” als massa gedefinieerd, maar in de context van deze test wordt de eenheid massa per volume gebruikt. Bovendien wordt de biomassa bij deze test meestal gemeten in vervangende eenheden, zoals aantal cellen of fluorescentie, en ook deze eenheden kunnen bij gebruik van de term „biomassa” worden bedoeld.
ECx
: de concentratie van de in het testmedium opgeloste teststof die binnen een bepaalde blootstellingsperiode (die expliciet moet worden vermeld als deze afwijkt van de volledige of normale duur van de test) leidt tot een afname van de groei van het testorganisme met x% (bv. 50 %). Om ondubbelzinnig aan te geven of een EC-waarde gebaseerd is op de groeisnelheid of de opbrengst, worden respectievelijk de symbolen „EsC” en „EoC” gebruikt.
Groeimedium: het volledige synthetische cultuurmedium waarin de algen gedurende de blootstelling aan de teststof groeien. De teststof wordt normaal gesproken in het medium opgelost.
Groeisnelheid (gemiddelde specifieke groeisnelheid): de logaritmische toename van de biomassa gedurende de blootstellingsperiode.
LOEC (Lowest Observed Effect Concentration): de laagste geteste concentratie waarbij wordt waargenomen dat de stof binnen een bepaalde blootstellingstijd in vergelijking met de controle tot een statistisch significante afname van de groei (p < 0,05) leidt. Alle testconcentraties boven de LOEC moeten echter een schadelijk effect hebben dat ten minste gelijk is aan het bij de LOEC waargenomen effect. Wanneer niet aan deze twee voorwaarden kan worden voldaan, moet een volledige toelichting worden gegeven op de wijze waarop de LOEC (en dus de NOEC) is bepaald.
NOEC (No Observed Effect Concentration): de testconcentratie die direct onder de LOEC ligt.
Opbrengst: de waarde van een meetvariabele aan het eind van de blootstellingstijd, verminderd met de waarde van de meetvariabele aan het begin van de blootstellingstijd, waarmee de toename van de biomassa gedurende de test wordt uitgedrukt.
Responsvariabele: een variabele voor de bepaling van de toxiciteit, met uiteenlopende berekeningsmethoden afgeleid van de gemeten parameters voor de biomassa. Voor deze testmethode worden de responsvariabelen groeisnelheid en opbrengst afgeleid van de direct gemeten biomassa of een van de vermelde vervangende eenheden.
Specifieke groeisnelheid: een responsvariabele die wordt gedefinieerd als het quotiënt van het verschil tussen de natuurlijke logaritmen van een observatie-parameter (in deze testmethode de biomassa) en de betrokken tijdsduur.
Variatiecoëfficiënt: een dimensieloze maat voor de variabiliteit van een parameter, gedefinieerd als het quotiënt van standaardafwijking en gemiddelde. Dit quotiënt kan ook als percentage worden uitgedrukt. De gemiddelde variatiecoëfficiënt van de gemiddelde specifieke groeisnelheid in controle-duplo's moet als volgt worden berekend:
|
1.
|
bereken de procentuele variatiecoëfficiënt van de gemiddelde specifieke groeisnelheid uit de dagelijkse/partiële groeisnelheid in de verschillende duplo's;
|
|
2.
|
bereken de gemiddelde waarde van alle onder punt 1 berekende waarden; dit levert de gemiddelde variatiecoëfficiënt van de dagelijkse/partiële specifieke groeisnelheid in controle-duplo's.
|
1.3. TOEPASBAARHEID VAN DE TEST
Deze testmethode kan het gemakkelijkst worden toegepast op stoffen die oplosbaar zijn in water en waarvan kan worden verwacht dat ze onder de testomstandigheden in oplossing blijven. Voor het testen van stoffen die vluchtig zijn, sterk adsorberen, gekleurd zijn, slecht oplosbaar zijn in water of nadelige gevolgen kunnen hebben voor de beschikbaarheid van nutriënten of mineralen in het testmedium, kan het nodig zijn de beschreven procedure op bepaalde punten aan te passen (bv. een gesloten systeem of conditionering van de testvaten). In de referenties (2), (3) en (4) wordt een leidraad gegeven voor enkele geschikte aanpassingen.
1.4. PRINCIPE VAN DE TEST
Met deze test wordt getracht de effecten van een stof op de groei van zoetwater-microalgen en/of cyanobacteriën te bepalen. Exponentieel groeiende testorganismen worden gedurende normaal gesproken 72 uur in batchculturen aan de teststof blootgesteld. Ondanks de betrekkelijk korte duur van de test kunnen de effecten over verschillende generaties worden bepaald.
De respons van het systeem is de afname van de groei in een reeks algenculturen (testeenheden) die aan verschillende concentraties van een teststof worden blootgesteld. De respons wordt bepaald als functie van de blootstellingsconcentratie in vergelijking met de gemiddelde groei van een duploreeks van niet-blootgestelde controleculturen. Met het oog op een volledige expressie van de respons van het systeem op toxische effecten (optimale gevoeligheid) krijgen de culturen de gelegenheid om met voldoende nutriënten en continu licht onbeperkt exponentieel te groeien gedurende een periode die lang genoeg is om de afname van de specifieke groeisnelheid te kunnen meten.
De groei en de remming van de groei worden kwantitatief bepaald door de biomassa van de algen als functie van de tijd te meten. De biomassa van de algen wordt gedefinieerd als het drooggewicht per volume-eenheid, bv. mg algen/liter testoplossing. Het drooggewicht is echter moeilijk te bepalen en daarom worden vaak vervangende parameters gebruikt. Telling van de cellen is de meest gangbare van deze parameters. Andere mogelijkheden zijn celvolume, fluorescentie, optische dichtheid enz. Er moeten omrekeningsfactoren bekend zijn tussen de gemeten vervangende parameter en de biomassa.
Het eindpunt van de test is groeiremming, uitgedrukt als de logaritmische toename van de biomassa (gemiddelde specifieke groeisnelheid) gedurende de blootstellingsperiode. Op basis van de gemiddelde specifieke groeisnelheden die in een reeks testoplossingen worden geregistreerd, wordt de concentratie bepaald die een specifiek percentage remming van de groeisnelheid (bv. 50 %) veroorzaakt; deze wordt uitgedrukt als de EsCx (bv. EsC50).
Voor de toepassing van deze methode binnen het EU-regelgevingskader moet de berekening van de resultaten om de onder punt 2.2 beschreven redenen worden gebaseerd op een gemiddelde specifieke groeisnelheid. Bij deze testmethode wordt ook de opbrengst als responsvariabele gebruikt; deze kan in bepaalde landen nodig zijn om aan specifieke voorschriften in de regelgeving te voldoen. Deze wordt gedefinieerd als de biomassa aan het eind van de blootstellingsperiode verminderd met de biomassa aan het begin van de blootstellingsperiode. Op basis van de opbrengst die in een reeks testoplossingen wordt geregistreerd, wordt de concentratie bepaald die een specifiek percentage afname van de opbrengst (bv. 50 %) veroorzaakt; deze wordt uitgedrukt als de EoCx (bv. EoC50).
Daarnaast kunnen langs statistische weg de laagste concentratie met waargenomen effecten (LOEC) en de concentratie zonder waargenomen effecten (NOEC) worden bepaald.
1.5. INFORMATIE OVER DE TESTSTOF
De informatie over de teststof, die nuttig kan zijn om de testomstandigheden te bepalen, omvat bijvoorbeeld de structuurformule, de zuiverheid, de stabiliteit in licht, de stabiliteit onder de testomstandigheden, de absorptie van licht, de pKa en de resultaten van onderzoek naar de omzetting van de stof, waaronder de biologische afbreekbaarheid in water.
De oplosbaarheid in water, de verdelingscoëfficiënt octanol/water (Pow) en de dampspanning van de teststof moeten bekend zijn en er moet een gevalideerde methode beschikbaar zijn voor de kwantitatieve bepaling van de stof in de testoplossingen met een gerapporteerde recovery en detectiegrens.
1.6. REFERENTIESTOF
Er kunnen een of meer referentiestoffen worden getest, zoals 3,5-dichloorfenol dat bij de internationale rondzendproef is gebruikt (4), om de testprocedure te controleren. Kaliumdichromaat kan ook als referentiestof voor groene algen worden gebruikt. Het is wenselijk ten minste twee keer per jaar een referentiestof te testen.
1.7. GELDIGHEID VAN DE TEST
Voor een geldige test moet aan de volgende criteria worden voldaan:
|
—
|
De biomassa in de controleculturen moet binnen de testperiode van 72 uur exponentieel met ten minste een factor 16 zijn toegenomen. Dit komt overeen met een specifieke groeisnelheid van 0,92 dag–1. Voor de meest gebruikte soorten is de groeisnelheid meestal aanzienlijk hoger (zie aanhangsel 1). Wanneer soorten worden gebruikt die trager groeien dan de in aanhangsel 1 vermelde soorten, wordt wellicht niet aan dit criterium voldaan. In dat geval moet de testperiode worden verlengd, zodat in de controleculturen een groei met ten minste een factor 16 wordt verkregen, terwijl de groei gedurende de hele testperiode exponentieel moet zijn. De testperiode kan worden ingekort, maar moet ten minste 48 uur zijn, om gedurende de test een exponentiële groei te houden, zolang de vermenigvuldigingsfactor minimaal 16 is.
|
|
—
|
De gemiddelde variatiecoëfficiënt voor partiële specifieke groeisnelheden (voor tests van 72 uur dagen 0-1, 1-2 en 2-3) in de controleculturen (zie punt 1.2 onder „variatiecoëfficiënt”) mag niet hoger zijn dan 35 %. Zie de tweede alinea van punt 2.2.1 voor de berekening van de partiële specifieke groeisnelheid. Dit criterium geldt voor de gemiddelde waarde van variatiecoëfficiënten die voor duplo-controleculturen worden berekend.
|
|
—
|
De variatiecoëfficiënt van gemiddelde specifieke groeisnelheden gedurende de hele testperiode in duplo-controleculturen mag bij tests met Pseudokirchneriella subcapitata en Desmodesmus
subspicatus niet hoger zijn dan 7 %. Voor andere minder vaak gebruikte soorten mag deze waarde niet hoger zijn dan 10 %.
|
1.8. BESCHRIJVING VAN DE METHODE
1.8.1. Apparatuur
De testvaten en andere apparatuur die in aanraking komt met de testoplossingen, moeten volledig van glas of een ander chemisch inert materiaal gemaakt zijn. Alle voorwerpen moeten grondig worden gewassen om ervoor te zorgen dat er geen organische of anorganische verontreinigingen zijn die invloed kunnen hebben op de groei van de algen of de samenstelling van de testoplossingen.
Als testvat zullen normaal gesproken glazen kolven worden gebruikt die zo groot zijn dat het volume van de cultuur groot genoeg is voor metingen tijdens de test en een afdoende massaoverdracht van CO2 uit de lucht mogelijk is (zie de tweede alinea van punt 1.8.9). Let op dat het volume van de vloeistof groot genoeg moet zijn voor de analyses (zie de vijfde alinea van punt 1.8.11).
Daarnaast zal (een deel van) de volgende apparatuur nodig zijn:
|
—
|
Kweekapparatuur: aanbevolen wordt een kast of kamer waarin de gekozen incubatietemperatuur tot op ±2 °C nauwkeurig kan worden gehouden.
|
|
—
|
Instrumenten voor lichtmeting: er moet rekening mee worden gehouden dat de meetmethode voor de lichtintensiteit en met name de aard van de receptor (collector) de gemeten waarde beïnvloedt. De metingen moeten bij voorkeur worden uitgevoerd met een sferische (4π)-receptor (die reageert op direct en gereflecteerd licht uit alle hoeken boven en onder het meetvlak) of een 2π-receptor (die reageert op licht uit alle hoeken boven het meetvlak).
|
|
—
|
Apparatuur om de biomassa van de algen te bepalen. De meest gebruikte vervangende parameter voor de biomassa van de algen is telling van de cellen en dit kan gebeuren met een elektronische deeltjesteller, een microscoop met een telkamer of een flow-cytometer. Andere vervangende biomassa-parameters kunnen worden gemeten met een flow-cytometer, een fluorimeter, een spectrofotometer of een colorimeter. Er moet een omrekeningsfactor worden berekend voor het verband tussen celtelling en drooggewicht. Om bij gebruik van een spectrofotometer bij lage biomassa-concentraties bruikbare metingen uit te kunnen voeren kan het nodig zijn cuvetten te gebruiken met een optische weglengte van ten minste 4 cm.
|
1.8.2. Testorganismen
Er kunnen verschillende soorten los groeiende microalgen en cyanobacteriën worden gebruikt. Van de in aanhangsel 1 vermelde stammen is aangetoond dat ze geschikt zijn voor de in deze testmethode beschreven testprocedure.
Als andere soorten worden gebruikt, moeten de stam en/of de herkomst worden vermeld. Er moet worden bevestigd dat de gekozen algen onder de gebruikte omstandigheden gedurende de hele testperiode exponentieel kunnen blijven groeien.
1.8.3. Groeimedium
Er worden twee groeimedia aanbevolen: het OESO-medium en het AAP-medium. De samenstelling van deze media wordt in aanhangsel 2 vermeld. Let op dat de aanvankelijke pH-waarde en de buffercapaciteit (die de pH-stijging reguleert) voor deze media verschillen. Dit betekent dat de resultaten van de tests afhankelijk van het gebruikte medium kunnen verschillen, vooral wanneer ionogene stoffen worden getest.
In bepaalde gevallen kan het nodig zijn de groeimedia te wijzigen, bijvoorbeeld wanneer metalen en chelaatvormers worden getest of wanneer bij andere pH-waarden wordt getest. Wanneer een gewijzigd medium wordt gebruikt, moet dit gedetailleerd worden beschreven en moet een motivering worden gegeven (3)(4).
1.8.4. Aanvankelijke biomassa-concentratie
De aanvankelijke hoeveelheid biomassa moet in alle testculturen even groot zijn en klein genoeg om zonder risico op een tekort aan nutriënten exponentiële groei in de hele incubatieperiode mogelijk te maken. De aanvankelijke hoeveelheid biomassa mag niet groter zijn dan 0,5 mg/l als drooggewicht. De volgende aanvankelijke celconcentraties worden aanbevolen:
|
Pseudokirchneriella subcapitata:
|
5 × 103-104
|
cellen/ml
|
|
Desmodesmus subspicatus
|
2-5 × 103
|
cellen/ml
|
|
Navicula pelliculosa
|
104
|
cellen/ml
|
|
Anabaena flos-aquae
|
104
|
cellen/ml
|
|
Synechococcus leopoliensis
|
5 × 104-105
|
cellen/ml
|
1.8.5. Concentraties van de teststof
Op basis van de resultaten van een oriënterende test kan het concentratiebereik worden bepaald waar effecten te verwachten zijn. Voor de definitieve tests moeten ten minste vijf concentraties worden gekozen die een meetkundige reeks vormen met een rede van ten hoogste 3,2. Voor teststoffen met een vlakke concentratie/responscurve moet wellicht een hogere rede worden gekozen. De concentratiereeks moet bij voorkeur het interval bestrijken waar 5-75 % remming van de groeisnelheid optreedt.
1.8.6. Duplo's en controles
Elke testconcentratie moet in triplo worden getest. Als bepaling van de NOEC niet nodig is, mag het aantal concentraties worden verhoogd en het aantal duplo's per concentratie worden verlaagd. De controlebepaling moet ten minste in triplo worden uitgevoerd en het aantal controles moet liefst twee keer zo groot zijn als het aantal duplo's dat voor elke testconcentratie wordt gebruikt.
Voor de analyse van de teststof-concentraties kan een aparte reeks testoplossingen worden bereid (zie de vierde en de zesde alinea van punt 1.8.11).
Wanneer een oplosmiddel wordt gebruikt om de teststof in oplossing te brengen, moeten in de testopzet extra controles worden opgenomen met dezelfde concentratie oplosmiddel als in de testculturen.
1.8.7. Bereiding van de entcultuur
Om de algen aan de testomstandigheden te laten wennen en ervoor te zorgen dat ze in de exponentiële groeifase zijn wanneer ze voor het beënten van de testoplossingen worden gebruikt, wordt 2-4 dagen vóór het begin van de tests een entcultuur in het testmedium gemaakt. De hoeveelheid biomassa van de algen moet zo groot zijn dat exponentiële groei in de entcultuur tot het begin van de test mogelijk is. De entcultuur moet onder dezelfde omstandigheden worden geïncubeerd als de testculturen. Meet de toename van de biomassa in de entcultuur om na te gaan of de groei onder de kweekomstandigheden binnen het normale bereik voor de teststam ligt. In aanhangsel 3 wordt een voorbeeld van de procedure voor het kweken van algen beschreven. Om synchrone celdelingen tijdens de test te voorkomen van een tweede voortplantingsstap van de entcultuur nodig zijn.
1.8.8. Bereiding van de testoplossingen
Alle testoplossingen moeten dezelfde concentratie groeimedium en dezelfde aanvankelijke hoeveelheid biomassa algen bevatten. De testoplossingen met de gekozen concentraties worden meestal bereid door een stamoplossing van de teststof met groeimedium en entcultuur te mengen. Stamoplossingen worden normaal gesproken bereid door de stof in testmedium op te lossen.
Om slecht in water oplosbare stoffen in het testmedium op te nemen kunnen oplosmiddelen zoals aceton, t-butylalcohol en dimethylformamide als drager worden gebruikt (2)(3). De oplosmiddelconcentratie mag niet hoger zijn dan 100 µl/l en alle culturen (met inbegrip van de controles) in de testreeks moet dezelfde concentratie oplosmiddel worden toegevoegd.
1.8.9. Incubatie
De testvaten worden afgesloten met een lucht doorlatende stop. Ze worden geschud en in het kweekapparaat gezet. Tijdens de tests moeten de algen in suspensie worden gehouden en moet de overdracht van CO2 worden vergemakkelijkt. Daartoe moet voortdurend worden geschud of geroerd. De culturen moeten op een temperatuur tussen 21 °C en 24 °C worden gehouden, gereguleerd tot op ±2 °C nauwkeurig. Voor andere soorten dan in aanhangsel 1 worden vermeld, bijvoorbeeld tropische soorten, zijn hogere temperaturen wellicht geschikt, mits aan de geldigheidscriteria kan worden voldaan. Er wordt aanbevolen de kolven een willekeurige plaats te geven en hun plaats in de incubator elke dag te veranderen.
De pH van het controlemedium mag gedurende de test niet meer dan 1,5 eenheden stijgen. Voor metalen en verbindingen die bij een pH in de buurt van de pH tijdens de test gedeeltelijk ioniseren, kan het nodig zijn de pH-verschuiving te beperken om reproduceerbare en goed gedefinieerde resultaten te verkrijgen. Een verschuiving van minder dan 0,5 pH-eenheid is technisch haalbaar en kan worden bereikt door te zorgen voor een afdoende massaoverdracht van CO2 vanuit de omgevingslucht naar de testoplossing, bijvoorbeeld door de schudsnelheid op te voeren. Het is ook mogelijk de behoefte aan CO2 te verminderen door de aanvankelijke hoeveelheid biomassa of de duur van de test te verlagen.
Het oppervlak waar de culturen worden geïncubeerd, moet continu worden verlicht met uniform fluorescerend licht, bijvoorbeeld van het type „cool white” of „daglicht”. De lichtvereisten zijn niet voor alle stammen algen en cyanobacteriën gelijk. De lichtintensiteit moet zodanig worden gekozen dat deze geschikt is voor het gebruikte testorganisme. Voor de aanbevolen soorten groene algen moet de lichtintensiteit ter hoogte van de testoplossingen binnen het bereik 60-120 µE·m–2·s–1 liggen, wanneer deze met een geschikte receptor wordt gemeten binnen het voor fotosynthese effectieve golflengtebereik van 400-700 nm. Sommige soorten, met name Anabaena flos-aquae, groeien goed bij een lage lichtintensiteit en kunnen bij een hoge intensiteit worden beschadigd. Voor deze soorten moet een gemiddelde lichtintensiteit binnen het bereik 40-60 µE·m–2·s–1 worden gekozen. (Voor lichtmeetinstrumenten die in lux gekalibreerd zijn, komt een bereik van 4 440-8 880 lux voor „cool white” licht ongeveer overeen met de aanbevolen lichtintensiteit 60-120 µE·m–2·s–1). De lichtintensiteit mag niet meer dan ±15 % afwijken van de over het incubatieoppervlak gemiddelde lichtintensiteit.
1.8.10. Duur van de test
De test duurt normaal gesproken 72 uur. De duur van de tests mag echter ook korter of langer zijn, mits aan alle geldigheidscriteria van punt 1.7 kan worden voldaan.
1.8.11. Metingen en analyses
De biomassa van de algen wordt in elke kolf gedurende de testperiode ten minste één keer per dag bepaald. Als de metingen worden uitgevoerd bij kleine volumes die met een pipet uit de testoplossing worden gehaald, mogen deze niet worden vervangen.
Meting van de biomassa gebeurt door handmatige celtelling met een microscoop of met een elektronische deeltjesteller (door telling van cellen en/of biovolume). Ook andere technieken kunnen worden gebruikt, zoals flow-cytometrie, in vitro of in vivo chlorofyl-fluorescentie (6)(7) of optische dichtheid, mits voor de hoeveelheden die bij de test worden gevonden een bevredigende correlatie met de biomassa kan worden aangetoond.
De pH van de oplossingen wordt aan het begin en aan het eind van de test gemeten.
Mits een analyseprocedure voor de bepaling van de teststof op het gebruikte concentratiebereik beschikbaar is, moeten de testoplossingen worden geanalyseerd om de aanvankelijke concentratie en het behoud van de concentratie bij de blootstelling tijdens de test te controleren.
Wanneer het waarschijnlijk is dat de blootstellingsconcentraties gedurende de test minder dan 20 % van de nominale waarden zullen afwijken, kan een analyse van de concentratie van de teststof aan het begin en het eind van de test bij een lage en een hoge testconcentratie en een concentratie rond de verwachte EC50 voldoende zijn. Wanneer het onwaarschijnlijk is dat de concentraties binnen 80-120 % van de nominale waarde blijven, wordt een analyse van alle testconcentraties aan het begin en het eind van de test aanbevolen. Bij vluchtige, instabiele of sterk adsorberende teststoffen wordt daarnaast aanbevolen gedurende de blootstellingsperiode om de 24 uur een monster te analyseren om beter te kunnen bepalen hoeveel teststof verloren gaat. Voor deze stoffen zullen er extra duplo's nodig zijn. In alle gevallen behoeft de concentratie van de teststof slechts bij één duplo van elke testconcentratie te worden bepaald (of bij de gecombineerde inhoud van de duplo-testvaten).
De specifiek voor de analyse van de blootstellingsconcentraties gedurende de test bereide testmedia moeten net zo worden behandeld als die welke voor de test worden gebruikt, d.w.z. ze moeten met algen worden beënt en onder identieke omstandigheden worden geïncubeerd. Als de concentratie van de opgeloste teststof moet worden bepaald, kan het nodig zijn de algen van het medium te scheiden. De scheiding moet bij voorkeur gebeuren door centrifugeren met een laag toerental dat voldoende is om de algen te laten bezinken.
Als kan worden aangetoond dat de concentratie van de geteste stof de gehele test op afdoende wijze binnen ±20 % van de nominale of gemeten aanvankelijke concentratie is gebleven, kan de analyse van de resultaten op basis van de nominale of gemeten aanvankelijke waarden worden uitgevoerd. Als de afwijking van de nominale of gemeten aanvankelijke concentratie groter is dan ±20 %, moet de analyse van de resultaten worden uitgevoerd op basis van het meetkundige gemiddelde van de concentratie gedurende de blootstelling of op basis van modellen waarmee de afname van de concentratie van de teststof wordt beschreven (3)(8).
De groeiremmingstest met algen is een dynamischer testsysteem dan de meeste andere tests op aquatische toxiciteit op korte termijn. Dit betekent dat de feitelijke blootstellingsconcentraties moeilijk te bepalen kunnen zijn, vooral voor adsorberende stoffen die bij lage concentraties worden getest. In die gevallen betekent het verdwijnen van de stof uit de oplossing door adsorptie aan de toenemende biomassa van de algen niet dat deze uit het testsysteem verloren gaat. Wanneer het resultaat van de test wordt geanalyseerd, moet worden gecontroleerd of een daling van de concentratie van de teststof in de loop van de test gevolgd wordt door een daling van de groeiremming. Als dit het geval is, kan worden overwogen een geschikt model te gebruiken om de daling van de concentratie van de teststof te beschrijven (8). Als dit niet het geval is, zal het wellicht correct zijn om de analyse van de resultaten op basis van de aanvankelijke (nominale of gemeten) concentraties uit te voeren.
1.8.12. Andere observaties
Er moet een microscopische observatie worden uitgevoerd om na te gaan of de entcultuur een normaal en gezond uiterlijk heeft en om een eventueel abnormaal uiterlijk van de algen (wellicht veroorzaakt door de blootstelling aan de teststof) aan het eind van de test te detecteren.
1.8.13. Limiettest
Onder bepaalde omstandigheden, bijvoorbeeld wanneer een oriënterende test erop wijst dat de teststof bij concentraties tot 100 mg·l–1 of tot de oplosbaarheidsgrens in het testmedium (als deze lager ligt) geen toxische effecten heeft, kan een limiettest worden uitgevoerd, waarbij de respons in een controlegroep en één dosisgroep (100 mg·l–1 of een concentratie die gelijk is aan de oplosbaarheidsgrens) wordt vergeleken. Er wordt sterk aanbevolen dit te ondersteunen met een analyse van de blootstellingsconcentratie. Alle in het voorgaande beschreven testomstandigheden en geldigheidscriteria zijn ook van toepassing bij een limiettest, behalve de bepaling dat het aantal behandelde duplo's ten minste zes moet zijn. De responsvariabelen in de controlegroep en de dosisgroep kunnen worden geanalyseerd met behulp van een statistische toets om gemiddelden te vergelijken, bijvoorbeeld een t-toets van Student. Als de variantie in de twee groepen niet gelijk is, moet er een aangepaste t-toets voor ongelijke varianties worden uitgevoerd.
1.8.14. Wijziging voor sterk gekleurde stoffen
De bestraling (lichtintensiteit) moet in het hoogste segment van het in deze testmethode voorgeschreven bereik liggen: 120µE m-2 s-1 of hoger.
Het lichtpad moet worden verkort door het volume van de testoplossingen te verlagen (in het interval 5-25 ml).
Er moet voldoende worden geschud (bijvoorbeeld matig schudden) om een hoge blootstellingsfrequentie van de algen aan hoge bestraling aan het oppervlak van de cultuur te verkrijgen.
2. GEGEVENS
2.1. UITZETTING VAN DE GROEICURVES
De biomassa in de testvaten kan worden uitgedrukt in eenheden van de voor de meting gebruikte vervangende parameter (bv. aantal cellen of fluorescentie).
Maak een tabel met de bepaalde biomassa-concentratie in de testculturen en de controles en daarnaast de concentraties teststof en de meettijdstippen met een resolutie van ten minste hele uren om zo de groeicurves uit te kunnen zetten. Bij deze eerste stap kan zowel een logaritmische schaal als een lineaire schaal nuttig zijn, maar een logaritmische schaal is verplicht en levert meestal een betere presentatie op van de variaties in het groeipatroon gedurende de testperiode. Wanneer de exponentiële groei met een logaritmische schaal wordt uitgezet, levert dit een rechte lijn op met als helling de specifieke groeisnelheid.
Ga met behulp van de curves na of de controleculturen gedurende de hele test met de verwachte snelheid exponentieel groeien. Kijk met een kritisch oog naar alle datapunten en de vorm van de grafieken en controleer de ruwe gegevens en procedures op mogelijke fouten. Controleer vooral punten waarvan de afwijking op een systematische fout lijkt. Als duidelijk is dat er sprake is van fouten in de procedures en/of deze zeer waarschijnlijk zijn, moet het desbetreffende punt als uitbijter worden beschouwd en niet in de verdere statistische analyses worden opgenomen. (Een algenconcentratie van nul in een van de twee of drie duplo's kan erop wijzen dat het testvat niet correct beënt is of niet goed schoongemaakt was.) In het verslag moet duidelijk worden vermeld om welke redenen een bepaald punt als uitbijter is beschouwd. Alleen (zeldzame) fouten in de procedures worden als reden geaccepteerd en dit geldt niet voor alleen een slechte precisie. Statistische procedures om te bepalen wat een uitbijter is, zijn voor een probleem van dit type maar beperkt bruikbaar en kunnen niet als vervanging voor een deskundig oordeel worden gebruikt. Uitbijters (als zodanig gemarkeerd) moeten bij voorkeur niet worden verwijderd uit later weergegeven grafieken of tabellen met gegevens.
2.2. RESPONSVARIABELEN
De test is bedoeld om de effecten van de teststof op de groei van algen te bepalen. In deze testmethode worden twee responsvariabelen beschreven, aangezien de lidstaten niet alle dezelfde voorkeuren en behoeften qua regelgeving hebben. De testresultaten zijn alleen in alle lidstaten aanvaardbaar als de effecten met beide onderstaande responsvariabelen a) en b) worden bepaald:
|
a)
|
de gemiddelde specifieke groeisnelheid: deze responsvariabele wordt berekend op basis van de logaritmische toename van de biomassa gedurende de testperiode, uitgedrukt per dag;
|
|
b)
|
de opbrengst: dit is de biomassa aan het eind van de test verminderd met de biomassa aan het begin.
|
Voor de toepassing van deze methode binnen het EU-regelgevingskader moet de berekening van de resultaten om de hier beschreven redenen worden gebaseerd op een gemiddelde specifieke groeisnelheid. Er moet worden opgemerkt dat de met behulp van deze twee responsvariabelen berekende waarden voor de toxiciteit niet vergelijkbaar zijn en bij gebruik van de resultaten van de test moet met dit verschil rekening worden gehouden. Vanwege de mathematische grondslagen van de respectieve benaderingen zullen de ECx-waarden op basis van de gemiddelde specifieke groeisnelheid (EsCx) in het algemeen hoger zijn dan de resultaten op basis van de opbrengst (EoCx) als de testomstandigheden van deze testmethode worden aangehouden. Dit moet niet worden geïnterpreteerd als een verschil in gevoeligheid tussen de twee responsvariabelen, maar alleen als een mathematisch verschil tussen de waarden. Het begrip gemiddelde specifieke groeisnelheid is gebaseerd op het algemene exponentiële groeipatroon van algen in niet-beperkte culturen, waarbij de toxiciteit wordt bepaald op basis van de effecten op de groeisnelheid, zonder dat deze afhankelijk is van het absolute niveau van de specifieke groeisnelheid van de controle, van de helling van de concentratie/responscurve of van de duur van de test. De resultaten op basis van de responsvariabele opbrengst zijn daarentegen afhankelijk van al deze andere variabelen. De EoCx is afhankelijk van de specifieke groeisnelheid van de bij elke test gebruikte algensoort en van de maximale specifieke groeisnelheid die van soort tot soort en zelfs van stam tot stam kan verschillen. Deze responsvariabele moet niet worden gebruikt voor een vergelijking tussen algensoorten of zelfs verschillende stammen qua gevoeligheid voor toxische stoffen. De wetenschap geeft weliswaar de voorkeur aan het gebruik van de gemiddelde specifieke groeisnelheid om de toxiciteit te bepalen, maar in deze testmethode wordt ook de bepaling van de toxiciteit op basis van de opbrengst opgenomen om te voldoen aan de vereisten in de huidige regelgeving in bepaalde landen.
2.2.1. Gemiddelde groeisnelheid
De gemiddelde specifieke groeisnelheid voor een bepaalde periode wordt voor elk testvat (controle of behandeld) met de volgende vergelijking berekend als de logaritmische toename van de biomassa:
 (dag–1)
(dag–1)
Hierbij is:
|
µ
i-j
|
de gemiddelde specifieke groeisnelheid van tijdstip i tot tijdstip j;
|
|
X
i
|
de biomassa op tijdstip i;
|
|
X
j
|
de biomassa op tijdstip j.
|
Voor elke dosisgroep en controlegroep wordt een gemiddelde waarde voor de groeisnelheid berekend en een waarde voor de variantie.
Bereken de gemiddelde specifieke groeisnelheid over de hele duur van de test (normaal gesproken dagen 0-3) met de nominaal geënte biomassa als startwaarde en niet een gemeten startwaarde, omdat op deze manier meestal een grotere precisie wordt bereikt. Als de voor de meting van de biomassa gebruikte apparatuur een voldoende precieze bepaling van de geringe biomassa in het inoculum mogelijk maakt (bv. een flow-cytometer), kan de gemeten aanvankelijke concentratie biomassa worden gebruikt. Bepaal tevens de partiële groeisnelheid, berekend als de specifieke groeisnelheden voor elke dag gedurende de test (dagen 0-1, 1-2 en 2-3) en ga na of de controle-groeisnelheid constant blijft (zie de geldigheidscriteria onder punt 1.7). Wanneer de specifieke groeisnelheid op dag 1 significant lager is dan de totale gemiddelde specifieke groeisnelheid, wijst dit op een lag-fase. Een lag-fase kan in controleculturen worden beperkt en vrijwel geëlimineerd door een juiste vermeerdering van de voorcultuur, maar een lag-fase bij behandelde culturen kan wijzen op herstel na aanvankelijke toxische stress of een verminderde blootstelling door verlies van de teststof (bv. door sorptie aan de algen-biomassa) na de aanvankelijke blootstelling. Dit betekent dat de partiële groeisnelheid kan worden bepaald om de effecten van de teststof gedurende de blootstellingsperiode te evalueren. Aanzienlijke verschillen tussen de partiële groeisnelheid en de gemiddelde groeisnelheid wijzen erop dat de groei niet voortdurend exponentieel is en dat de groeicurves grondig moeten worden bestudeerd.
De procentuele remming van de groeisnelheid wordt voor elke behandelde duplo berekend met de volgende vergelijking:

Hierbij is:
|
%Is
|
procentuele remming van de gemiddelde specifieke groeisnelheid;
|
|
µC
|
gemiddelde waarde van de gemiddelde specifieke groeisnelheid (µ) in de controlegroep;
|
|
µD
|
gemiddelde specifieke groeisnelheid in de dosisgroep.
|
Wanneer oplosmiddelen worden gebruikt om de teststof in oplossing te brengen, moeten bij de berekening van de procentuele remming niet de controles zonder oplosmiddel maar de oplosmiddelcontroles worden gebruikt.
2.2.2. Opbrengst
De opbrengst wordt voor elk testvat van de dosis- en controlegroepen berekend als de biomassa aan het eind van de test verminderd met de biomassa aan het begin. Voor elke testconcentratie en controle wordt een gemiddelde waarde voor de opbrengst berekend en een waarde voor de variantie. De procentuele remming van de opbrengst (%Io) kan voor elke behandelde duplo als volgt worden berekend:

Hierbij is:
|
% Io
|
procentuele remming van de opbrengst;
|
|
OC
|
gemiddelde waarde van de opbrengst in de controlegroep;
|
|
OD
|
waarde voor de opbrengst in de dosisgroep.
|
2.3. UITZETTING VAN DE CONCENTRATIE/RESPONSCURVE
De procentuele remming wordt uitgezet tegen de logaritme van de concentratie van de teststof en de curve wordt zorgvuldig bestudeerd, waarbij elk punt dat in de eerste fase als uitbijter is beschouwd, niet wordt gebruikt. Trek op het oog of met behulp van computer-interpolatie een vloeiende lijn door de punten om een eerste indruk te krijgen van het verband tussen concentratie en respons en gebruik daarna een gedetailleerdere methode, bij voorkeur een gecomputeriseerde statistische methode. Afhankelijk van het beoogde gebruik van de gegevens, de kwaliteit (precisie) van de gegevens en de hoeveelheid gegevens alsmede de beschikbaarheid van instrumenten voor gegevensanalyse kan worden besloten (soms volledig terecht) de gegevensanalyse in deze fase te beëindigen en de kerncijfers EC50 en EC10 (en/of EC20) simpelweg uit de op het oog getrokken curve af te lezen (zie ook de onderstaande tekst over stimulerende effecten). Geldige redenen om niet gebruik te maken van een statistische methode kunnen bijvoorbeeld zijn:
|
—
|
de gegevens zijn niet geschikt voor gecomputeriseerde methoden om betrouwbaarder resultaten te verkrijgen dan op grond van een deskundig oordeel mogelijk is — in dergelijke situaties is het mogelijk dat sommige computerprogramma's zelfs geen betrouwbare oplossing opleveren (iteraties die wellicht niet convergeren enz.);
|
|
—
|
een respons waarbij de groei wordt gestimuleerd, kan met de beschikbare computerprogramma's niet afdoende worden verwerkt (zie hieronder).
|
2.4. STATISTISCHE PROCEDURES
Het is de bedoeling met behulp van regressieanalyse een kwantitatief verband tussen concentratie en respons te verkrijgen. Het is mogelijk een gewogen lineaire regressie te gebruiken nadat op de responsgegevens een linearisering-transformatie is uitgevoerd, bijvoorbeeld naar probit-, logit- of Weibull-eenheden (9), maar de voorkeur wordt gegeven aan niet-lineaire regressieprocedures, die beter omgaan met onvermijdelijke onregelmatigheden in gegevens en afwijkingen van regelmatige distributies. In de buurt van het nulpunt of totale remming kunnen dergelijke onregelmatigheden door de transformatie worden uitvergroot en kunnen ze de analyse storen (9). Er moet worden opgemerkt dat standaardmethoden voor analyses met behulp van probit-, logit- of Weibull-transformaties bedoeld zijn voor gebruik bij een binaire respons (bv. sterfte of overleven) en moeten worden aangepast om voor groei- of biomassa-data te kunnen worden gebruikt. Specifieke procedures voor de bepaling van ECx-waarden uit continue gegevens zijn te vinden in (10), (11) en (12). Het gebruik van niet-lineaire regressieanalyse wordt in aanhangsel 4 nader beschreven.
Voor elke te analyseren responsvariabele wordt het verband tussen concentratie en respons gebruikt voor de berekening van puntschattingen van ECx-waarden. Waar mogelijk moeten voor elke schatting de 95 %-betrouwbaarheidsgrenzen worden bepaald. De kwaliteit van de fitting van de responsgegevens op het regressiemodel moet grafisch of statistisch worden bepaald. De regressieanalyse moet met de individuele duplo-respons worden uitgevoerd en niet met gemiddelden van dosisgroepen. Als niet-lineaire fitting van de curve echter moeilijk is of niet lukt vanwege een te grote spreiding in de gegevens, kan het probleem worden omzeild door de regressie uit te voeren op groepsgemiddelden om zo op praktische wijze de invloed van vermoedelijke uitbijters te beperken. Wanneer deze mogelijkheid wordt gebruikt, moet dit in het testverslag worden vermeld als een afwijking van de normale procedure, omdat fitting van de curve met individuele duplo's geen goede resultaten opleverde.
Als de beschikbare regressiemodellen/methoden niet geschikt zijn voor de gegevens, kunnen de EC50 en de betrouwbaarheidsgrenzen ook worden bepaald met behulp van lineaire interpolatie met bootstrapping (13).
Voor de bepaling van de LOEC en daaruit de NOEC en voor de effecten van de teststof op de groeisnelheid moeten de gemiddelden van de dosisgroepen worden vergeleken met behulp van variantieanalyse-technieken (ANOVA). Het gemiddelde voor elke concentratie moet dan worden vergeleken met het gemiddelde van de controlegroep met behulp van een geschikte methode voor meervoudige vergelijking of trendtoets. Hiervoor kan de Dunnett- of Williams-toets geschikt zijn (14)(15)(16)(17)(18). Er moet worden bepaald of de ANOVA-aanname van homogeniteit van variantie opgaat. Deze bepaling kan grafisch worden uitgevoerd of met een formele toets (18). Hiervoor kan de Levene- of Bartlett-toets worden gebruikt. Wanneer de aanname van homogeniteit van variantie niet opgaat, kan dit soms worden gecorrigeerd door logaritmische transformatie van de gegevens. Als de heterogeniteit van variantie extreem is en niet door transformatie kan worden gecorrigeerd, moet een analyse met methoden als de stap-omlaag-trendtoets van Jonckheere worden overwogen. Aanvullende richtsnoeren voor de bepaling van de NOEC zijn te vinden in (12).
Recente wetenschappelijke ontwikkelingen hebben geleid tot een aanbeveling om het begrip NOEC niet langer te gebruiken en te vervangen door op regressie gebaseerde puntschattingen van ECx. Voor deze algentest is geen geschikte waarde voor x vastgesteld. Een interval van 10 tot 20 % lijkt geschikt (afhankelijk van de gekozen responsvariabele) en bij voorkeur moeten zowel de EC10 als de EC20 worden gerapporteerd.
2.5. GROEISTIMULERING
Soms wordt bij lage concentraties groeistimulering (negatieve remming) waargenomen. Dit kan een gevolg zijn van hormese („toxische stimulering”) of van de toevoeging van stimulerende groeifactoren met het testmateriaal aan het gebruikte minimale medium. De toevoeging van anorganische nutriënten zou geen directe effecten mogen hebben, omdat het testmedium gedurende de hele test een overschot aan nutriënten zou moeten bevatten. Stimulering bij lage dosis kan bij EC50-berekeningen meestal worden genegeerd, tenzij deze stimulering extreem is. Als de stimulering extreem is of als een ECx-waarde voor een lage x moet worden berekend, kunnen echter speciale procedures nodig zijn. Schrapping van een respons met stimulering uit de gegevensanalyse moet indien mogelijk worden vermeden en als de beschikbare software voor fitting van de curve een lichte stimulering niet accepteert, kan lineaire interpolatie met bootstrapping worden gebruikt. Als de stimulering extreem is, kan gebruik van een hormese-model worden overwogen (19).
2.6. NIET-TOXISCHE GROEIREMMING
Wanneer het testmateriaal licht absorbeert, kan dit tot een verlaging van de groeisnelheid leiden omdat schaduwwerking de beschikbare hoeveelheid licht vermindert. Dergelijke fysische effecten moeten door aanpassing van de testomstandigheden van toxische effecten worden gescheiden en apart worden gerapporteerd. Een leidraad hiervoor is te vinden in (2) en (3).
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moeten de volgende gegevens worden opgenomen:
Teststof:
|
—
|
fysische aard en relevante fysisch-chemische eigenschappen, waaronder de oplosbaarheidsgrens in water;
|
|
—
|
chemische identificatiegegevens, waaronder de zuiverheid.
|
Geteste soort:
|
—
|
stam, leverancier of herkomst en gebruikte cultuuromstandigheden.
|
Testomstandigheden:
|
—
|
begindatum en duur van de test;
|
|
—
|
beschrijving van de testopzet: testvaten, cultuurvolumes, dichtheid van de biomassa aan het begin van de test;
|
|
—
|
samenstelling van het medium;
|
|
—
|
testconcentraties en duplo's (bv. aantal duplo's, aantal testconcentraties en rede van de gebruikte meetkundige reeks);
|
|
—
|
beschrijving van de bereiding van testoplossingen, met vermelding van het gebruik van oplosmiddelen enz.;
|
|
—
|
intensiteit en eigenschappen van het licht (bron, homogeniteit);
|
|
—
|
geteste concentraties: de nominale testconcentraties en eventuele resultaten van analyses om de concentratie van de teststof in de testvaten te bepalen. De recovery van de methode en de bepalingsgrens in de testmatrix moeten worden gerapporteerd;
|
|
—
|
alle afwijkingen van deze testmethode;
|
|
—
|
de methode voor de bepaling van de biomassa en bewijsmateriaal voor de correlatie tussen de gemeten parameter en het drooggewicht.
|
Resultaten:
|
—
|
de pH aan het begin en het eind van de test voor alle dosisgroepen;
|
|
—
|
de biomassa voor elke kolf bij elk meetpunt en de methode voor het meten van de biomassa;
|
|
—
|
de groeicurves (biomassa uitgezet tegen de tijd);
|
|
—
|
de berekende responsvariabelen voor elke behandelde duplo met het gemiddelde en de variatiecoëfficiënt voor de duplo's;
|
|
—
|
een grafische weergave van het verband tussen concentratie en effect;
|
|
—
|
de bepaalde toxiciteit voor responsvariabelen, zoals EC50, EC10 en EC20, en de bijbehorende betrouwbaarheidsintervallen. De LOEC en de NOEC, indien deze zijn berekend, en de voor de bepaling daarvan gebruikte statistische methoden;
|
|
—
|
als ANOVA is gebruikt, de grootte van het effect dat kan worden gedetecteerd (bv. het minst significante verschil);
|
|
—
|
een eventuele stimulering van de groei, als deze bij een behandeling is geconstateerd;
|
|
—
|
andere waargenomen effecten, zoals morfologische veranderingen van de algen;
|
|
—
|
bespreking van de resultaten, met inbegrip van een eventuele beïnvloeding van de resultaten van de test die een gevolg is van afwijkingen van deze testmethode.
|
4. LITERATUUR
|
(1)
|
OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test
|
|
(2)
|
ISO 1998: Water quality — Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442
|
|
(3)
|
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23.
|
|
(4)
|
ISO 1998: Water quality — Sampling — Part 16: General Guidance for Biotesting. ISO 5667-16.
|
|
(5)
|
ISO 1993: Water quality — Algal growth inhibition test. ISO 8692
|
|
(6)
|
Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525-2531.
|
|
(7)
|
Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp.919-925
|
|
(8)
|
Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073-2079.
|
|
(9)
|
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
|
|
(10)
|
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
|
|
(11)
|
Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485-1494.
|
|
(12)
|
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
|
|
(13)
|
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN.
|
|
(14)
|
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096-1121
|
|
(15)
|
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482-491.
|
|
(16)
|
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117.
|
|
(17)
|
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510-531.
|
|
(18)
|
Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
|
|
(19)
|
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
|
Aanhangsel 1
Stammen waarvan is aangetoond dat ze geschikt zijn voor de test
Groene algen
|
—
|
Pseudokirchneriella subcapitata, (voorheen bekend als Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
|
|
—
|
Desmodesmus subspicatus (voorheen bekend als Scenedesmus subspicatus) 86.81 SAG
|
Diatomeeën
|
—
|
Navicula pelliculosa, UTEX 664
|
Cyanobacteriën
|
—
|
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
|
|
—
|
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
|
Bronnen van stammen
De aanbevolen stammen zijn in culturen met één algensoort verkrijgbaar bij de volgende collecties (in alfabetische volgorde):
|
|
|
ATCC: American Type Culture Collection
|
|
10801 University Boulevard
|
|
Manassas, Virginia 20110-2209
|
|
USA
|
|
|
|
|
CCAP, Culture Collection of Algae and Protozoa
|
|
Institute of Freshwater Ecology,
|
|
Windermere Laboratory
|
|
Far Sawrey, Amblerside
|
|
Cumbria
|
|
LA22 0LP
|
|
UK
|
|
|
|
|
Sammlung von Algenkulturen
|
|
Albrecht-von-Haller-Institut
|
|
Universität Göttingen
|
|
Nikolausberger Weg 18
|
|
37073 Göttingen
|
|
GERMANY
|
|
|
|
|
UTEX Culture Collection of Algae
|
|
Section of Molecular, Cellular and Developmental Biology
|
|
School of Biological Sciences
|
|
the University of Texas at Austin
|
|
Austin, Texas 78712
|
|
USA
|
|
Uiterlijk en kenmerken van de aanbevolen soorten
|
|
P. subcapitata
|
D. subspicatus
|
N. pelliculosa
|
A. flos-aquae
|
S. leopoliensis
|
|
Uiterlijk
|
Gekromde, gedraaide losse cellen
|
Ovale, meestal losse cellen
|
Staafjes
|
Ketens van ovale cellen
|
Staafjes
|
|
Grootte (L × W) in µm
|
8-14 × 2-3
|
7-15 × 3-12
|
7,1 × 3,7
|
4,5 × 3
|
6 × 1
|
|
Celvolume (µm3/cel)
|
40-60 (1)
|
60-80 (1)
|
40-50 (1)
|
30-40 (1)
|
2,5 (2)
|
|
Drooggewicht cel (mg/cel)
|
2-3 × 10–8
|
3-4 × 10–8
|
3-4 × 10–8
|
1-2 × 10–8
|
2-3 × 10–9
|
|
Groeisnelheid (3) (dag–1)
|
1,5-1,7
|
1,2-1,5
|
1,4
|
1,1-1,4
|
2,0-2,4
|
Specifieke aanbevelingen voor het kweken en behandelen van de voor de test aanbevolen soorten
Pseudokirchneriella subcapitata en Desmodesmus subspicatus
Deze groene algen zijn in het algemeen gemakkelijk in verschillende cultuurmedia te bewaren. Bij de cultuurcollecties is informatie verkrijgbaar over geschikte media. De cellen zijn normaal gesproken solitair en de celdichtheid kan gemakkelijk worden gemeten met behulp van een elektronische deeltjesteller of een microscoop.
Anabaena flos-aquae
Voor het bewaren van een stamcultuur kunnen verschillende groeimedia worden gebruikt. Het is vooral belangrijk te voorkomen dat de groei in de log-fase voorbij is voordat de batchcultuur wordt overgezet, omdat herstel op dit punt moeilijk is.
Anabaena flos-aquae ontwikkelt klonten met geneste ketens van cellen. De omvang van deze klonten is afhankelijk van de cultuuromstandigheden. Het kan nodig zijn deze klonten in stukken te breken wanneer voor de bepaling van biomassa telling met een microscoop of een elektronische deeltjesteller wordt gebruikt.
Ultrasoonbehandeling van submonsters kan worden gebruikt om ketens in stukken te breken teneinde de variabiliteit bij het tellen te verminderen. Als deze behandeling langer duurt dan nodig is om de ketens in stukken te breken, kunnen de cellen uiteenvallen. De intensiteit en de duur van de behandeling moeten voor elke dosisgroep identiek zijn.
Tel genoeg velden op de hemocytometer (ten minste 400 cellen) om de variabiliteit te compenseren. Dit zal de betrouwbaarheid van bepaling van de dichtheid met een microscoop verhogen.
Voor de bepaling van het totale celvolume van Anabaena kan, nadat de celketens door voorzichtig ultrasoon behandelen in stukken zijn gebroken, een elektronische deeltjesteller worden gebruikt. De ultrasoon-energie moet worden aangepast om uiteenvallen van de cellen te voorkomen.
Gebruik een vortex-mixer of soortgelijke geschikte methoden om ervoor te zorgen dat de voor het beënten van de testvaten gebruikte algensuspensie goed gemengd en homogeen is.
De testvaten worden op een schudtafel (draaiend of heen-en-weer-gaand) met ongeveer 150 bewegingen per minuut geplaatst. Ook periodiek schudden kan worden gebruikt om de neiging van Anabaena om samen te klonteren tegen te gaan. Als er klonten ontstaan, moet erop worden gelet dat de monsters voor de meting van de biomassa representatief zijn. Krachtig schudden vóór de bemonstering kan nodig zijn om klonten met algen uiteen te laten vallen.
Synechococcus leopoliensis
Voor het bewaren van een stamcultuur kunnen verschillende groeimedia worden gebruikt. Bij de cultuurcollecties is informatie verkrijgbaar over geschikte media.
Synechococcus leopoliensis groeit als solitaire staafvormige cellen. De cellen zijn heel klein en dit compliceert het gebruik van een microscoop voor celtellingen om de biomassa te meten. Elektronische deeltjestellers die geschikt zijn voor het tellen van deeltjes vanaf een grootte van ongeveer 1 μm, zijn nuttig. Ook in vitro fluorimetrische bepaling is bruikbaar.
Navicula pelliculosa
Voor het bewaren van een stamcultuur kunnen verschillende groeimedia worden gebruikt. Bij de cultuurcollecties is informatie verkrijgbaar over geschikte media. Let op dat het medium silicaat moet bevatten.
Navicula pelliculosa kan onder bepaalde groeiomstandigheden klonten vormen. Door de vorming van lipiden hebben de algencellen soms de neiging zich in de oppervlaktelaag op te hopen. Onder deze omstandigheden moeten er bij het nemen van submonsters voor de bepaling van de biomassa speciale maatregelen worden genomen om representatieve monsters te krijgen. Krachtig schudden, bijvoorbeeld met een vortex-mixer, kan nodig zijn.
(1) Gemeten met elektronische deeltjesteller.
(2) Berekend op grond van grootte.
(3) Meest frequent waargenomen groeisnelheid in OESO-medium bij een lichtintensiteit van ongeveer 70 µE·m–2·s–1 en 21 °C.
Aanhangsel 2
Groeimedia
Een van de volgende twee groeimedia kan worden gebruikt:
OESO-medium: oorspronkelijk medium van OESO TG 201, tevens overeenkomstig ISO 8692
US. EPA-medium AAP, tevens overeenkomstig ASTM.
Bij de bereiding van deze media moeten p.a. reagentia en gedeïoniseerd water worden gebruikt.
Samenstelling van het AAP-medium (US. EPA) en het OESO-medium van TG 201
|
Component
|
EPA
|
OESO
|
|
|
mg/l
|
mM
|
mg/l
|
mM
|
|
NaHCO3
|
15,0
|
0,179
|
50,0
|
0,595
|
|
NaNO3
|
25,5
|
0,300
|
|
|
|
NH4Cl
|
|
|
15,0
|
0,280
|
|
MgCl2·6(H2O)
|
12,16
|
0,0598
|
12,0
|
0,0590
|
|
CaCl2·2(H2O)
|
4,41
|
0,0300
|
18,0
|
0,122
|
|
MgSO4·7(H2O)
|
14,6
|
0,0592
|
15,0
|
0,0609
|
|
K2HPO4
|
1,044
|
0,00599
|
|
|
|
KH2PO4
|
|
|
1,60
|
0,00919
|
|
FeCl3·6(H2O)
|
0,160
|
0,000591
|
0,0640
|
0,000237
|
|
Na2EDTA·2(H2O)
|
0,300
|
0,000806
|
0,100
|
0,000269 (1)
|
|
H3BO3
|
0,186
|
0,00300
|
0,185
|
0,00299
|
|
MnCl2·4(H2O)
|
0,415
|
0,00201
|
0,415
|
0,00210
|
|
ZnCl2
|
0,00327
|
0,000024
|
0,00300
|
0,0000220
|
|
CoCl2·6(H2O)
|
0,00143
|
0,000006
|
0,00150
|
0,00000630
|
|
Na2MoO4·2(H2O)
|
0,00726
|
0,000030
|
0,00700
|
0,0000289
|
|
CuCl2.2(H2O)
|
0,000012
|
0,00000007
|
0,00001
|
0,00000006
|
|
pH
|
7,5
|
8,1
|
In de test met het diatomee Navicula pelliculosa moeten beide media worden aangevuld met Na2SiO3·9H20 tot een concentratie van 1,4 mg Si/l.
De pH van het medium wordt verkregen bij evenwicht tussen het carbonaatsysteem van het medium en de partiële druk van CO2 in de lucht. Een bruikbare relatie tussen de pH bij 25 °C en de molaire bicarbonaat-concentratie is:
pHeq = 11,30 + log [HCO3]
Bij 15 mg/l NaHCO3 is pHeq = 7,5 (US. EPA-medium) en bij 50 mg/l NaHCO3 is pHeq = 8,1 (OESO-medium).
Samenstelling in elementen van de testmedia
|
Element
|
EPA
|
OESO
|
|
|
mg/l
|
mg/l
|
|
C
|
2,144
|
7,148
|
|
N
|
4,202
|
3,927
|
|
P
|
0,186
|
0,285
|
|
K
|
0,469
|
0,459
|
|
Na
|
11,044
|
13,704
|
|
Ca
|
1,202
|
4,905
|
|
Mg
|
2,909
|
2,913
|
|
Fe
|
0,033
|
0,017
|
|
Mn
|
0,115
|
0,115
|
Bereiding van het OESO-medium
|
Nutriënt
|
Concentratie in de stamoplossing
|
|
Stamoplossing 1: macronutriënten
|
|
NH4Cl
MgCl2·6H2O
CaCl2·2H2O
MgSO4·7H2O
KH2PO4
|
1,5 g·l–1
1,2 g·l–1
1,8 g·l–1
1,5 g·l–1
0,16 g·l–1
|
|
Stamoplossing 2: ijzer
|
|
FeCl3·6H2O
Na2EDTA·2H2O
|
64 mg·l–1
100 mg·l–1
|
|
Stamoplossing 3: spoorelementen
|
|
H3BO3
MnCl2·4H2O
ZnCl2
CoCl2·6H2O
CuCl2·2H2O
Na2MoO4·2H2O
|
185 mg·l–1
415 mg·l–1
3 mg·l–1
1,5 mg·l–1
0,01 mg·l–1
7 mg·l–1
|
|
Stamoplossing 4: bicarbonaat
|
|
NaHCO3
|
50 g·l–1
|
|
Na2SiO3·9H20
|
|
Steriliseer de stamoplossingen door membraanfiltratie (gemiddelde poriediameter 0,2 µm) of in de autoclaaf (120 °C, 15 min). Bewaar de oplossingen in het donker bij 4 °C.
Stamoplossingen 2 en 4 mogen niet in de autoclaaf worden gesteriliseerd, maar alleen door membraanfiltratie.
Bereid een groeimedium door toevoeging van de benodigde volumes van stamoplossingen 1-4 aan water:
Voeg aan 500 ml gesteriliseerd water toe:
Vul met gesteriliseerd water aan tot 1 000 ml.
Laat het medium lang genoeg staan om het evenwicht met CO2 in de lucht zich te laten instellen, indien nodig door enkele uren steriele gefilterde lucht door te leiden.
Bereiding van het AAP-medium
|
A1.1.
|
Voeg 1 ml van elke stamoplossing in A1.2.1–A1.2.7 toe aan ongeveer 900 ml gedeïoniseerd of gedestilleerd water en vul aan tot 1 liter.
|
|
A1.2.
|
De macronutriënt-stamoplossingen worden bereid door de volgende reagentia op te lossen in 500 ml gedeïoniseerd of gedestilleerd water. De reagentia A1.2.1, A1.2.2, A1.2.3 en A1.2.4 kunnen in één stamoplossing worden gecombineerd.
|
|
A1.2.1.
|
NaNO3
– 12,750 g.
|
|
A1.2.2.
|
MgCl2
·6H2O – 6,082 g.
|
|
A1.2.3.
|
CaCl2
·2H2O – 2,205 g.
|
|
A1.2.4.
|
Micronutriënt-stamoplossing — (zie A1.3).
|
|
A1.2.5.
|
MgSO4·7H2O – 7,350 g.
|
|
A1.2.6.
|
K2HPO4
– 0,522 g.
|
|
A1.2.7.
|
NaHCO3
– 7,500 g.
|
|
A1.2.8.
|
Na2SiO3·9H2O — Zie opmerking A1.1.
Opmerking A1.1: Alleen voor diatomeeën-testsoorten gebruiken. Kan rechtstreeks worden toegevoegd (202,4 mg) of als stamoplossing tot een uiteindelijke concentratie van 20 mg Si/l in het medium.
|
|
A1.3.
|
De micronutriënt-stamoplossing wordt bereid door de volgende reagentia op te lossen in 500 ml gedeïoniseerd of gedestilleerd water:
|
|
A1.3.1.
|
H3BO3
– 92,760 mg.
|
|
A1.3.2.
|
MnCl2·4H2O – 207,690 mg.
|
|
A1.3.3.
|
ZnCl2
– 1,635 mg.
|
|
A1.3.4.
|
FeCl3·6H2O – 79,880 mg.
|
|
A1.3.5.
|
CoCl2·6H2O – 0,714 mg.
|
|
A1.3.6.
|
Na2MoO4·2H2O – 3,630 mg.
|
|
A1.3.7.
|
CuCl2·2H2O – 0,006 mg.
|
|
A1.3.8.
|
Na2EDTA·2H2O – 150,000 mg.
[dinatrium(ethyleendinitrilo)tetraacetaat].
|
|
A1.3.9.
|
Na2SeO4·5H2O – 0,005 mg — Zie opmerking A1.2.
Opmerking A1.2: Alleen in medium voor stamculturen van diatomeeënsoorten gebruiken
|
|
A1.4.
|
Breng de pH op 7,5 ± 0,1 met 0,1 N of 1,0 N NaOH of HCl.
|
|
A1.5.
|
Filtreer de media in een steriele fles over een 0,22 μm membraanfilter (als een deeltjesteller wordt gebruikt) of een 0,45 μm membraanfilter (als er geen deeltjesteller wordt gebruikt).
|
|
A1.6.
|
Bewaar het medium in het donker bij ongeveer 4 °C tot het wordt gebruikt.
|
(1) De molaire verhouding EDTA/ijzer is iets hoger dan 1. Dit voorkomt dat ijzer neerslaat en beperkt tevens chelaatvorming van ionen van zware metalen tot een minimum.
Aanhangsel 3
Voorbeeld van een procedure voor het kweken van algen
Algemene opmerkingen
Het doel van het kweken op basis van de volgende procedure is het verkrijgen van algenculturen voor toxiciteitstesten.
Er moeten geschikte methoden worden gebruikt om ervoor te zorgen dat de algenculturen niet met bacteriën worden besmet. Axenische culturen zijn wenselijk, maar er moeten culturen met één algensoort worden gemaakt en gebruikt.
Alle handelingen dienen onder steriele omstandigheden te worden uitgevoerd om besmetting met bacteriën of andere algen te voorkomen.
Apparatuur en materialen
Zie in de testmethode onder „Apparatuur”.
Procedures voor het verkrijgen van algenculturen
Bereiding van de nutriëntoplossingen (media):
Alle nutriëntzouten van het medium worden bereid als geconcentreerde stamoplossing en koel en in het donker bewaard. Deze oplossingen worden door filtratie of in een autoclaaf gesteriliseerd.
Het medium wordt bereid door de juiste hoeveelheid stamoplossing aan steriel gedestilleerd water toe te voegen, waarbij moet worden opgelet dat besmetting wordt voorkomen. Voor vast medium wordt 0,8 % agar toegevoegd.
Stamcultuur:
Stamculturen zijn kleine algenculturen die regelmatig op vers medium worden overgezet om zo als nieuw uitgangsmateriaal voor tests te dienen. Als de culturen niet regelmatig worden gebruikt, worden zij uitgestreken in schuine agarbuizen. Deze worden ten minste éénmaal per twee maanden overgezet op vers medium.
De stamculturen worden gekweekt in erlenmeyers met het geschikte medium (volume ongeveer 100 ml). Wanneer de algen bij 20 °C met continue verlichting worden geïncubeerd, is wekelijks overzetten vereist.
Bij het overzetten wordt een hoeveelheid „oude” cultuur met steriele pipetten zodanig overgebracht naar een kolf met vers medium dat de beginconcentratie van de snel groeiende soort ongeveer 100 maal kleiner is dan in de oude cultuur.
De groeisnelheid van een soort kan uit de groeicurve worden bepaald. Indien deze bekend is, is het mogelijk de dichtheid te schatten waarbij de cultuur naar nieuw medium moet worden overgezet. Dit moet gebeuren voordat de cultuur in de afstervingsfase komt.
Voorcultuur:
De voorcultuur is bedoeld om een aantal algen te krijgen dat geschikt is voor het beënten van de testculturen. De voorcultuur wordt geïncubeerd onder de testomstandigheden en wordt gebruikt terwijl deze nog exponentieel groeit, normaal gesproken na een incubatieperiode van 2 tot 4 dagen. Wanneer de algenculturen misvormde of abnormale cellen bevatten, moeten ze worden afgekeurd.
Aanhangsel 4
Gegevensanalyse door niet-lineaire regressie
Algemene overwegingen
De respons bij tests met algen en andere groeitests met micro-organismen (groei van biomassa) is van nature een continue of metrische variabele — een processnelheid als de groeisnelheid wordt gebruikt en de integraal over tijd als voor de hoeveelheid biomassa wordt gekozen. Beide worden vergeleken met de corresponderende gemiddelde respons van niet-blootgestelde controles waar de respons voor de gebruikte omstandigheden maximaal is, waarbij licht en temperatuur in de algentest de primaire bepalende factoren zijn. Het systeem is gedistribueerd of homogeen en de biomassa kan als een continuüm worden beschouwd zonder naar individuele cellen te kijken. De variantieverdeling van het type respons voor een dergelijk systeem houdt uitsluitend verband met experimentele factoren (meestal beschreven als lognormale of normale foutverdeling). Bij een karakteristieke binaire bioassay-respons wordt de tolerantie (meestal binomiaal verdeeld) van individuele organismen daarentegen vaak als de belangrijkste variantie-component beschouwd. In dit geval is de controlerespons nul of het achtergrondniveau.
In de ongecompliceerde situatie neemt de genormaliseerde of relatieve respons r monotoon af van 1 (geen remming) tot 0 (100 % remming). Hierbij dient te worden opgemerkt dat elke respons een bijbehorende fout heeft en dat een schijnbare negatieve remming uitsluitend ten gevolge van een toevalsfout kan worden berekend.
Regressieanalyse
Modellen
Een regressieanalyse is gericht op een kwantitatieve beschrijving van de concentratie/responscurve in de vorm van een mathematische regressiefunctie Y = f (C) of in de meeste gevallen F (Z) waarbij Z = log C. Met de inverse C = f–1 (Y) kunnen ECx-waarden, zoals de EC50, de EC10 en de EC20, en hun 95 %-betrouwbaarheidsgrenzen worden berekend. Van verschillende eenvoudige mathematische functionele vormen is gebleken dat ze met succes kunnen worden gebruikt voor de beschrijving van het verband tussen concentratie en respons bij groeiremmingstests met algen. Hierbij gaat het bijvoorbeeld om de logistische vergelijking, de asymmetrische Weibull-vergelijking en de lognormale verdelingsfunctie; dit zijn allemaal sigmoïde curves die asymptotisch tot 1 naderen voor C → 0 en tot 0 voor C → ∞.
Het gebruik van continue drempelfunctiemodellen (bv. het model van Kooijman voor remming van de populatiegroei, Kooijman et al., 1996) is recent voorgesteld als alternatief voor asymptotische modellen. Dit model gaat uit van het ontbreken van effecten bij concentraties beneden een bepaald drempelwaarde, EC0+, die wordt bepaald door extrapolatie van de concentratie/responscurve tot de concentratie-as met behulp van een eenvoudige continue functie die in het beginpunt niet differentieerbaar is.
Er moet worden opgemerkt dat de analyse een eenvoudige minimumbepaling van residuele kwadratensommen kan zijn (uitgaande van constante variantie) of van gewogen kwadratensommen als heterogeniteit van de variantie wordt gecompenseerd.
Procedure
De procedure kan als volgt worden geschetst: kies een geschikte functionele vergelijking Y = f (C) en fit deze met behulp van niet-lineaire regressie op de gegevens. Gebruik bij voorkeur de metingen van elke kolf afzonderlijk en niet de gemiddelden van de duplo's om zo veel mogelijk informatie uit de gegevens te kunnen halen. Anderzijds heeft de praktijk geleerd dat als de variantie hoog is, de gemiddelde waarden van de duplo's wellicht een robuustere mathematische bepaling opleveren, die minder wordt beïnvloed door toevallige fouten in de gegevens, dan wanneer elk datapunt afzonderlijk wordt gebruikt.
Teken de gefitte curve en de gemeten gegevens en kijk of de fitting van de curve geschikt is. Analyse van de residuen kan hiervoor een zeer geschikt instrument zijn. Als het gekozen functionele verband om de concentratie/responscurve te fitten niet de hele curve beschrijft of een bepaald essentieel deel niet goed beschrijft, zoals de respons bij lage concentraties, moet in plaats van een symmetrische een andere optie voor fitting van de curve worden gekozen, bijvoorbeeld een asymmetrische curve zoals de Weibull-functie. Negatieve remming kan problemen opleveren bij bijvoorbeeld de lognormale verdelingsfunctie en ook in dat geval is een andere regressiefunctie nodig. Er wordt niet aanbevolen aan dergelijke negatieve waarden de waarde 0 of een kleine positieve waarde toe te kennen, omdat dit de foutverdeling verstoort. Het kan nuttig zijn een aparte fitting van de curve voor bepaalde delen van de curve te maken, bijvoorbeeld het deel met een geringe remming voor de bepaling van EClage x-waarden. Bereken uit de gefitte vergelijking — door „inverse bepaling”, C = f–1 (Y) — karakteristieke puntramingen ECx en rapporteer minimaal de EC50 en een of twee EClage x-waarden. De praktijk heeft geleerd dat de precisie van de algentest normaal gesproken een redelijk nauwkeurige bepaling bij 10 % remming mogelijk maakt als de datapunten volstaan, tenzij stimulering bij lage concentraties als storende factor optreedt. De precisie van een EC20-waarde is vaak aanzienlijk beter dan die van een EC10, omdat de EC20 meestal op het ongeveer lineaire deel van de centrale concentratie/responscurve ligt. Soms kan de EC10 vanwege groeistimulering moeilijk te interpreteren zijn. Dit betekent dat de EC10 weliswaar normaal gesproken met een afdoende nauwkeurigheid te bepalen is, maar dat toch wordt aanbevolen altijd ook de EC20 te rapporteren.
Wegingsfactoren
De toevallige variantie is in het algemeen niet constant en heeft meestal een evenredige component, zodat het de voorkeur verdient standaard een gewogen regressie uit te voeren. Meestal wordt aangenomen dat de wegingsfactoren voor een dergelijke analyse omgekeerd evenredig zijn met de variantie:
Wi = 1/Var(ri)
Veel regressieprogramma's bieden de mogelijkheid om een gewogen regressieanalyse uit te voeren, waarbij de wegingsfactoren in een tabel worden opgenomen. Wegingsfactoren moeten liefst worden genormaliseerd door ze met n/Σ wi te vermenigvuldigen (n is het aantal datapunten), zodat de som gelijk aan 1 is.
Normalisering van de respons
Normalisering met de gemiddelde controlerespons levert bepaalde principeproblemen op en leidt tot een nogal gecompliceerde variantiestructuur. Door de respons te delen door de gemiddelde controlerespons om de procentuele remming te berekenen wordt een extra fout geïntroduceerd, die wordt veroorzaakt door de fout in het controlegemiddelde. Tenzij deze fout te verwaarlozen is, moeten de wegingsfactoren in de regressie en betrouwbaarheidsgrenzen worden gecorrigeerd voor de covariantie met de controle (17). Er moet worden opgemerkt dat een hoge precisie bij de bepaalde gemiddelde controlerespons belangrijk is om de algehele variantie voor de relatieve respons tot een minimum te beperken.
Deze variantie is (subscript i verwijst naar concentratie i en subscript 0 naar de controles):
Yi = Relatieve respons = ri/r0 = 1 — I = f (Ci)
met variantie:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
Aangezien
(∂ Yi/ ∂ ri) = 1/r0 and (∂ Yi / ∂ r0) = ri/r0
2
wordt met een normale datadistributie en mi en m0 duplo's:
Var(ri) = σ2/mi
de totale variantie van de relatieve respons Yi:
Var(Yi) = σ2/(r0
2 mi) + ri
2·σ2/r0
4 m0
De fout in het controlegemiddelde is omgekeerd evenredig met de vierkantswortel van het gemiddelde aantal controleduplo's en soms kan het gerechtvaardigd zijn om historische gegevens mee te nemen en zo de fout sterk te verlagen. Het is ook mogelijk de gegevens niet te normaliseren en de absolute respons, inclusief de controlerespons, te fitten maar de controlerespons als extra parameter te introduceren voor de fitting met niet-lineaire regressie. Bij een gebruikelijke regressievergelijking met twee parameters moeten met deze methode drie parameters worden gefit, zodat er meer datapunten nodig zijn dan bij niet-lineaire regressie met gegevens die met een vooraf bepaalde controlerespons worden genormaliseerd.
Inverse betrouwbaarheidsintervallen
De berekening van betrouwbaarheidsintervallen voor niet-lineaire regressie met behulp van inverse bepaling is vrij gecompliceerd en meestal niet als standaardoptie beschikbaar in normale statistische computerprogrammapakketten. Benaderde betrouwbaarheidsgrenzen kunnen worden verkregen met behulp van standaardprogramma's voor niet-lineaire regressie met herparametrisering (Bruce en Versteeg, 1992), hetgeen inhoudt dat de mathematische vergelijking moet worden herschreven met de gewenste puntbepalingen, bijvoorbeeld de EC10 en de EC50 als de te bepalen parameters. (Neem als functie I = f (α, β, concentratie) en gebruik de definitierelaties f (α, β, EC10) = 0,1 en f (α, β, EC50) = 0,5 om f (α, β, concentratie) te vervangen door een gelijkwaardige functie g (EC10, EC50, concentratie).
Een directere berekening (Andersen et al, 1998) wordt uitgevoerd door de oorspronkelijke vergelijking te houden en een Taylor-expansie rond het gemiddelde van ri en r0 te gebruiken.
De laatste tijd zijn „bootstrap-methoden” populair geworden. Deze methoden gebruiken de gemeten gegevens en een door een aselecte getallengenerator bepaalde frequent herhaalde steekproeftrekking voor de bepaling van een empirische variantieverdeling.
Literatuur
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625-1632.
Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485-1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405-420.
BIJLAGE V
|
C.25.
|
AEROBE MINERALISATIE IN OPPERVLAKTEWATER — SIMULATIETEST VOOR BIOLOGISCHE AFBRAAK
|
1. METHODE
Deze methode is gelijkwaardig aan OESO TG 309 (2004) (1)
1.1. INLEIDING
Deze test is bedoeld om de tijdsduur te meten voor de biologische afbraak van een teststof in lage concentratie in aeroob natuurlijk water en de waarnemingen te kwantificeren in de vorm van kinetische snelheidsweergaven. De simulatietest is een laboratorium-schudkolfstest om de snelheden te bepalen voor de aerobe biologische afbraak van organische stoffen in monsters van natuurlijk oppervlaktewater (zoet, brak of zout). De test is gebaseerd op ISO/DIS 14592-1 (2) en bevat ook elementen van de testmethoden C.23 en C.24 (3)(4). Eventueel kan bij lange testduren een semicontinue in plaats van een ladingsgewijze procedure worden gevolgd, teneinde achteruitgang van de testmicrokosmos te vermijden. Het doel van de simulatietest is in de eerste plaats het bepalen van de mineralisatie van de teststof in oppervlaktewater, en mineralisatie vormt de basis voor de weergave van de afbraakkinetiek. Een optioneel tweede doel van de test is het verkrijgen van gegevens over de primaire afbraak en de vorming van belangrijke omzettingsproducten. Het aantonen van de omzettingsproducten en zo mogelijk het bepalen van de concentraties daarvan is met name van belang voor stoffen die zeer langzaam gemineraliseerd worden (bv. bij halveringstijden van de totale resthoeveelheid 14C van meer dan 60 dagen). Vanwege analysegrenzen moeten voor het aantonen en bepalen van belangrijke omzettingsproducten normaal gesproken hogere concentraties van de teststof (bv. > 100 μg/l) worden gebruikt.
Een lage concentratie in deze test betekent een concentratie (bv. minder dan 1 μg/l tot 100 μg/l) die laag genoeg is om zeker te zijn dat de biologische afbraakkinetiek die uit de test komt overeenkomt met de verwachte kinetiek in het milieu. Vergeleken met de totale hoeveelheid biologisch afbreekbare koolstofsubstraten in het voor de test gebruikte water, zal de in lage concentratie aanwezige teststof optreden als secundair substraat. Dit betekent een verwachte biologische afbraakkinetiek van de eerste orde („non-growth” kinetiek) en een mogelijke afbraak van de teststof door „cometabolisme”. Eerste-ordekinetiek houdt in dat de afbraaksnelheid (mg/l/dag) evenredig is met de gaandeweg afnemende substraatconcentratie. Bij echte eerste-ordekinetiek is de specifieke afbraaksnelheidsconstante k onafhankelijk van de tijd en de concentratie. Dat wil zeggen: k verandert niet merkbaar in de loop van een experiment en evenmin met de concentratieverhoging tussen de experimenten. De specifieke afbraaksnelheidsconstante is per definitie gelijk aan de relatieve concentratieverandering per tijdseenheid: k = (1/C) · (dC/dt). Hoewel onder de voorgeschreven omstandigheden normaal gesproken eerste-ordekinetiek te verwachten valt, kunnen er bepaalde situaties zijn waarin een andere kinetiek moet worden toegepast. Afwijkingen van eerste-ordekinetiek kunnen bijvoorbeeld worden waargenomen als overdrachtsverschijnselen zoals de diffusiesnelheid, in plaats van de biologische reactiesnelheid, de beperkende factor zijn voor de biologische afbraaksnelheid. De gegevens kunnen echter zo goed als altijd worden beschreven door pseudo-eerste-ordekinetiek met een concentratie-afhankelijke snelheidsconstante.
Voorafgaand aan de test dient informatie beschikbaar te zijn over de biologische afbreekbaarheid van de teststof bij hogere concentraties (bv. uit standaard screeningtests) en over de niet-biologische afbreekbaarheid, omzettingsproducten en relevante fysisch-chemische eigenschappen, zodat deze kunnen worden gebruikt bij het opzetten van het experiment en het interpreteren van de resultaten. Met behulp van met 14C gemerkte teststoffen en de bepaling van de faseverdeling van 14C aan het einde van de test kan de totale biologische afbreekbaarheid worden bepaald. Bij gebruik van een ongemerkte teststof kan de totale biologische afbreekbaarheid alleen worden geschat indien een hogere concentratie is getest en alle belangrijke omzettingsproducten bekend zijn.
1.2. DEFINITIES
Primaire biologische afbraak: De structurele verandering (omzetting) van een chemische verbinding door micro-organismen die leidt tot het verlies van chemische identiteit.
Functionele biologische afbraak: De structurele verandering (omzetting) van een chemische verbinding door micro-organismen die leidt tot het verlies van een bepaalde eigenschap.
Totale aerobe biologische afbraak: De afbraak van een chemische verbinding door micro-organismen, in aanwezigheid van zuurstof, tot kooldioxide, water en anorganische zouten van alle andere aanwezige elementen (mineralisatie) en de productie van nieuwe biomassa en organische microbiële biosyntheseproducten.
Mineralisatie: De afbraak van een chemische verbinding of organisch materiaal door micro-organismen, in aanwezigheid van zuurstof, tot kooldioxide, water en anorganische zouten van alle andere aanwezige elementen.
Aanlooptijd: De tijdsduur vanaf de aanvang van de test, totdat adaptatie van de afbrekende micro-organismen heeft plaatsgevonden en de biologische afbraak van een chemische verbinding of organisch materiaal tot een detecteerbaar niveau is gestegen (bv. 10 % van de theoretische maximale afbraak, of lager, afhankelijk van de gevoeligheid van de meettechniek).
Maximale biologische afbraak: Het percentage biologische afbraak van een chemische verbinding of organisch materiaal in een test waarboven geen verdere biologische afbraak plaatsvindt tijdens de test.
Primair substraat: Een verzameling natuurlijke koolstof- en energiebronnen die zorgen voor de groei en de instandhouding van de microbiële biomassa.
Secundair substraat: Een substraatcomponent die in een dermate lage concentratie aanwezig is dat de afbraak ervan slechts verwaarloosbare hoeveelheden koolstof en energie levert aan de werkzame micro-organismen in verhouding tot de hoeveelheden koolstof en energie die worden geleverd door de belangrijkste substraatcomponenten (het primaire substraat).
Afbraaksnelheidsconstante: Een eerste-orde of pseudo-eerste-orde kinetische snelheidsconstante, k (d–1), die de snelheid van het afbraakproces weergeeft. Voor een ladingsgewijs experiment wordt k geschat aan de hand van het begindeel van de afbraakcurve die wordt verkregen na afloop van de aanlooptijd.
Halveringstijd, t1/2 (d): Term die wordt gebruikt om de snelheid van een eerste-ordereactie aan te geven. Het is het tijdsinterval dat overeenkomt met een afname van de concentratie met een factor 2. Het verband tussen de halveringstijd en de afbraaksnelheidsconstante wordt gegeven door de vergelijking t1/2 = ln2/k.
Disappearance Time 50, DT50 (d): Term die wordt gebruikt om de uitkomst van biologische-afbraaktests te kwantificeren. De DT50 is het tijdsinterval, met inbegrip van de aanlooptijd, dat nodig is om een afbraak van 50 procent te bereiken.
Aantoonbaarheidsgrens en bepaalbaarheidsgrens: De aantoonbaarheidsgrens is de laagste concentratie van een stof waarbij de identiteit van de stof nog kan worden onderscheiden van analytische artefacten. De bepaalbaarheidsgrens is de laagste concentratie van een stof waarbij de concentratie nog met aanvaardbare nauwkeurigheid kan worden bepaald.
Opgeloste organische koolstof (DOC): Dat deel van de organische koolstof in een watermonster dat niet door een bepaalde fasescheiding kan worden verwijderd (bv. centrifugering bij 40 000 ms–2 gedurende 15 min of membraanfiltratie met membranen met een poriediameter van 0,2 μm-0,45 μm).
Totale organische 14C-activiteit (TOA): De totale 14C-activiteit die is toe te schrijven aan organische koolstof.
Opgeloste organische 14C-activiteit (DOA): De totale 14C-activiteit die is toe te schrijven aan de opgeloste organische koolstof.
Deeltjesvormige organische 14C-activiteit (POA): De totale 14C-activiteit die is toe te schrijven aan organische koolstofdeeltjes.
1.3. TOEPASBAARHEID VAN DE TEST
Deze simulatietest is toepasbaar op niet-vluchtige of licht vluchtige organische stoffen, in lage concentraties. Bij gebruik van niet-luchtdichte kolven (bv. afgesloten met watten), kunnen stoffen met een constante van de wet van Henry van minder dan ongeveer 1 Pa·m3/mol (zo’n 10–5 atm·m3/mol) worden beschouwd als in de praktijk niet-vluchtig. Bij gebruik van afgesloten kolven met gasruimte is het mogelijk om licht vluchtige stoffen te testen (met een constante van de wet van Henry < 100 Pa·m3/mol of < 10–3 atm·m3/mol) zonder dat er verliezen optreden uit het testsysteem. Als niet de juiste voorzorgsmaatregelen worden genomen kan verlies van met 14C gemerkte stoffen optreden wanneer de CO2 wordt verwijderd. In dergelijke situaties kan het noodzakelijk zijn de CO2 weg te vangen in een extern CO2-absorbtiesysteem (voor directe 14CO2-bepaling; zie aanhangsel 3). Voor de bepaling van de biologische afbraakkinetiek moeten de teststofconcentraties lager zijn dan de oplosbaarheid van de teststof in water. Er zij evenwel gewezen dat de literatuurwaarden voor de oplosbaarheid in water aanzienlijk hoger kunnen zijn dan de oplosbaarheid van de teststof in natuurlijk water. Eventueel kan de oplosbaarheid van bijzonder slecht in water oplosbare teststoffen worden vastgesteld met gebruik van het te testen natuurlijke water.
De methode kan worden gebruikt voor het simuleren van de biologische afbraak in oppervlaktewater dat vrij is van grove deeltjes („pelagische test”) of in troebel oppervlaktewater dat bv. afkomstig kan zijn van een water/sediment-grensvlak („gesuspendeerd-sedimenttest”).
1.4. PRINCIPE VAN DE TEST
De test wordt ladingsgewijs uitgevoerd door de teststof te incuberen met hetzij alleen oppervlaktewater („pelagische test”) of oppervlaktewater dat is aangevuld met 0,01 g drooggewicht/l gesuspendeerde vaste stof/sediment („gesuspendeerd-sedimenttest”) ter simulatie van een waterlichaam met gesuspendeerde vaste stof of geresuspendeerd sediment. De concentratie gesuspendeerde vaste stof/sediment in de lagere regionen van dit interval is kenmerkend voor het meeste oppervlaktewater. De testkolven worden in het donker, bij omgevingstemperatuur, onder aerobe omstandigheden en onder roeren geïncubeerd. Om de afbraakkinetiek te bepalen moeten ten minste twee verschillende teststofconcentraties worden gebruikt, die met een factor 5 tot 10 van elkaar verschillen en het verwachte concentratiebereik in het milieu vertegenwoordigen. De maximale teststofconcentratie mag niet boven 100 µg/l liggen, maar maximale testconcentraties van 10 µg/l of lager verdienen de voorkeur, opdat de biologische afbraak volgens eerste-ordekinetiek verloopt. De laagste concentratie mag niet hoger zijn dan 10 µg/Al, maar laagste testconcentraties van 1-2 μg/l of lager verdienen de voorkeur. Normaal gesproken kan een adequate analyse van zulke lage concentraties worden bereikt met behulp van in de handel verkrijgbare met 14C gemerkte stoffen. Vanwege analytische grenzen is het dikwijls onmogelijk de teststofconcentratie met de vereiste nauwkeurigheid te meten indien met een teststof concentratie ≤ 100 µg/l wordt gewerkt (zie de tweede alinea van paragraaf 1.7.2). Hogere teststofconcentraties (> 100 µg/l en soms > 1 mg/l) kunnen worden gebruikt voor het aantonen en bepalen van belangrijke omzettingsproducten of als een specifieke analysemethode met een lage aantoonbaarheidsgrens niet beschikbaar is. Als getest wordt met hoge teststofconcentraties, kan het zijn dat de resultaten niet kunnen worden gebruikt voor het schatten van de eerste-orde afbraakconstante en halveringstijd, daar de afbraak waarschijnlijk niet volgens eerste-ordekinetiek verloopt.
De afbraak wordt gevolgd met gewenste tijdsintervallen, door hetzij de resthoeveelheid 14C te meten, hetzij de restconcentratie van de teststof, bij gebruik van een specifieke chemische analyse. Door het meest stabiele deel van het molecuul te merken met 14C kan de totale mineralisatie worden bepaald, terwijl door een minder stabiel deel van het molecuul met 14C te merken, en door specifieke analyse te gebruiken, enkel de primaire biologische afbraak kan worden bepaald. Het meest stabiele deel bevat echter niet noodzakelijkerwijs het relevante functionele gedeelte van het molecuul (het gedeelte dat in verband gebracht kan worden met een specifieke eigenschap zoals toxiciteit, bioaccumulatie, etc.). Als dit het geval is kan het wenselijk zijn een teststof te gebruiken die met 14C gemerkt is in het functionele deel, teneinde de eliminatie van de specifieke eigenschap te volgen.
1.5. INFORMATIE OVER DE TESTSTOF
In deze test kunnen zowel radioactief gemerkte teststoffen als ongemerkte teststoffen worden gebruikt. 14C-merking wordt aanbevolen en normaal gesproken moet het meest stabiele deel/moeten de meest stabiele delen van het molecuul worden gemerkt (zie ook paragraaf 1.4). Voor stoffen die meer dan een aromatische ring bevatten worden bij voorkeur in elke ring een of meerdere koolstofatomen met 14C gemerkt. Bovendien moeten bij voorkeur aan weerszijden van gemakkelijk afbreekbare bindingen een of meer koolstofatomen met 14C worden gemerkt. De chemische en/of radiochemische zuiverheid van de teststof moet > 95 % zijn. De specifieke activiteit bij radioactief gemerkte stoffen is bij voorkeur ongeveer 50 μCi/mg (1,85 MBq) of meer, ten behoeve van de 14C-metingen in tests met lage beginconcentraties. Over de teststof moeten de volgende gegevens beschikbaar zijn:
|
—
|
de oplosbaarheid in water [Methode A.6];
|
|
—
|
de oplosbaarheid in organisch(e) oplosmiddel(en) (voor stoffen die met een oplosmiddel worden toegevoegd of met een lage oplosbaarheid in water);
|
|
—
|
de dissociatieconstante (pKa) als de stof onderhevig is aan protonering of deprotonering [OECD TG 112] (5);
|
|
—
|
de dampspanning [Methode A.4] en de constante van de wet van Henry;
|
|
—
|
de chemische stabiliteit in water en in het donker (hydrolyse) [Methode C.7].
|
Bij het testen van slecht in water oplosbare stoffen in zeewater kan het ook nuttig zijn om de uitzoutingsconstante (of „constante van Setsjenov”) Ks te weten, die wordt gedefinieerd als log (S/S’) = Ks Cm, waarin S en S’ staan voor de oplosbaarheid van de stof in respectievelijk zoet water en zout water, en Cm voor de molaire zoutconcentratie.
Als de test wordt uitgevoerd als „gesuspendeerd-sedimenttest” moeten de volgende gegevens beschikbaar zijn:
|
—
|
de verdelingscoëfficiënt n-octanol/water [Methode A.8];
|
|
—
|
de adsorptiecoëfficiënt [Methode C.18];
|
Andere gegevens die van pas kunnen komen zijn o.a.:
|
—
|
de concentratie in het milieu, indien bekend of geschat;
|
|
—
|
de toxiciteit van de teststof voor micro-organismen [Methode C.11];
|
|
—
|
de „gemakkelijke” en/of inherente biologische afbreekbaarheid [Methoden C.4 A-F, C.12, C.9, OECD TG 302 (5)];
|
|
—
|
de aerobe en anaerobe biologische afbreekbaarheid in de bodem en de omzetting in aquatische sedimentsystemen [Methoden C.23, C.24].
|
1.6. REFERENTIESTOF
Als referentiestof moet een stof worden gebruikt die normaal gesproken onder aerobe omstandigheden gemakkelijk wordt afgebroken (bv. aniline of natriumbenzoaat). Het verwachte tijdsinterval voor de afbraak van aniline en natriumbenzoaat is over het algemeen minder dan 2 weken. Met de referentiestoffen kan men zich ervan vergewissen dat de microbiële activiteit van het testwater zich binnen bepaalde grenzen bevindt, d.w.z. dat het water een actieve microbiële populatie bevat.
1.7. KWALITEITSCRITERIA
1.7.1. Recovery
Onmiddellijk na de toevoeging van de teststof moet de aanvankelijke testconcentratie worden gecontroleerd door meting van de 14C-activiteit of door chemische analysemethoden in geval van ongemerkte stoffen, en dit dient ten minste in duplo te gebeuren. Dit verschaft informatie over de toepasbaarheid en de herhaalbaarheid van de analysemethode en over de homogeniteit van de teststofverdeling. Normaal gesproken wordt in de verdere analysen van gegevens de gemeten aanvankelijke 14C-activiteit of teststofconcentratie gebruikt in plaats van de nominale concentratie, aangezien verliezen door sorptie of doseringsfouten daarmee worden opgevangen. Bij een met 14C gemerkte teststof wordt de recovery aan het einde van het experiment gegeven door de massabalans (zie de laatste alinea van paragraaf 1.8.9.4). Idealiter moet de massabalans voor radioactief gemerkte stoffen tussen 90 % en 110 % liggen, terwijl de nauwkeurigheid van de analyse een aanvankelijke recovery tussen 70 % en 110 % moet opleveren voor ongemerkte teststoffen. Deze bereiken moeten worden opgevat als streefcijfers en moeten niet worden gebruikt als criteria voor de aanvaardbaarheid van de test. Eventueel kan de nauwkeurigheid van de analyse worden bepaald voor de teststof bij een lagere concentratie dan de beginconcentratie en voor belangrijke omzettingsproducten.
1.7.2. Herhaalbaarheid en gevoeligheid van de analysemethode
De herhaalbaarheid van de analysemethode (inclusief de efficiëntie van de extractie in het begin) voor de kwantitatieve bepaling van de teststof, en indien van toepassing de omzettingsproducten, moet worden gecontroleerd aan de hand van een analyse in vijfvoud van individuele extracties van het wateroppervlak.
De aantoonbaarheidsgrens van de analysemethode voor de teststof en voor de omzettingsproducten moet mogelijkerwijs zodanig zijn dat ten minste 1 % van de aanvankelijk aan het testsysteem toegevoegde hoeveelheid kan worden aangetoond. De bepaalbaarheidsgrens mag niet hoger zijn dan 10 % van de toegevoegde concentratie. Omwille van de chemische analyse van veel organische stoffen en hun omzettingsproducten is het dikwijls noodzakelijk dat de teststof in een betrekkelijk hoge concentratie wordt toegevoegd, d.w.z. > 100 μg/l.
1.8. BESCHRIJVING VAN DE TESTMETHODE
1.8.1. Apparatuur
De test kan worden uitgevoerd in conische of cilindervormige kolven met de vereiste inhoud (bv. 0,5 of 1,0 liter), die worden afgesloten met een siliconen of rubberen stop, of in CO2-dichte serumflessen (bv. met butylrubberen septum). Een andere optie is de test uit te voeren met behulp van meerdere kolven en bij elk monsterinterval een hele kolf te nemen, ten minste in tweevoud (zie de laatste alinea van paragraaf 1.8.9.1). Voor niet-vluchtige, ongemerkte teststoffen is gasdichte afsluiting niet nodig; een losse prop watten ter voorkoming van verontreiniging vanuit de lucht is afdoende (zie tweede alinea van paragraaf 1.8.9.1). Licht vluchtige stoffen moeten worden getest in een biometersysteem, waarbij het wateroppervlak zachtjes wordt geroerd. Om bacteriële verontreiniging uit te sluiten, kunnen de vaten eventueel worden gesteriliseerd door ze voor gebruik te verhitten of te autoclaveren. Daarnaast wordt de volgende standaard-laboratoriumapparatuur gebruikt:
|
—
|
een schudtafel of magneetroerders om de testkolven voortdurend in beweging te houden;
|
|
—
|
een troebelheidsmeter voor nephelometrische troebelheidsmetingen;
|
|
—
|
een oven of magnetronoven voor drooggewichtbepalingen;
|
|
—
|
membraanfiltratieapparaat;
|
|
—
|
autoclaaf of oven voor hittesterilisatie van het glaswerk;
|
|
—
|
voorzieningen om met 14C gemerkte stoffen te werken;
|
|
—
|
apparatuur om de 14C-activiteit te bepalen in CO2-absorptieoplossingen en indien nodig in sedimentmonsters;
|
|
—
|
analyseapparatuur voor de bepaling van de teststof (en referentiestoffen), bij gebruik van specifieke chemische analyse (bv. gaschromatografie of hogedrukvloeistofchromatografie).
|
1.8.2. Stockoplossingen van de teststof
Voor de bereiding van de stockoplossingen van de teststof en de referentiestoffen wordt gedeïoniseerd water gebruikt (zie de eerste alinea van paragraaf 1.8.7). Het gedeïoniseerde water mag geen stoffen bevatten die toxisch zijn voor micro-organismen, en de hoeveelheid opgeloste organische koolstof (DOC) mag niet hoger zijn dan 1 mg/l (6).
1.8.3. Verzameling en vervoer van het oppervlaktewater
De monsternemingsplaats voor het verzamelen van het oppervlaktewater moet in iedere gegeven situatie worden uitgekozen in overeenstemming met het doel van de test. Bij het kiezen van monsternemingsplaatsen moet rekening gehouden worden met stoffen die wellicht in het verleden vanuit de landbouw, industrie of huishoudens op die plaats zijn terechtgekomen. Als bekend is dat een aquatisch milieu in de voorgaande vier jaar verontreinigd is met de teststof of structureel analoge verbindingen, moet het niet worden gebruikt voor het verzamelen van testwater, tenzij men juist onderzoek wil doen naar de afbraaksnelheden op eerder blootgestelde locaties. De pH en de temperatuur van het water moeten op de monsternemingsplaats worden gemeten. Bovendien moeten de monsternemingsdiepte en het uiterlijk van het watermonster (bv. de kleur en de troebelheid) worden opgeschreven (zie paragraaf 3). Om aerobe omstandigheden aan te tonen moet de zuurstofconcentratie en/of de redoxpotentiaal in het water en in de bovenste sedimentlaag worden gemeten, tenzij dit vanzelf spreekt op grond van het uiterlijk en ervaringen met de plaats uit het verleden. Het oppervlaktewater moet worden vervoerd in een grondig gereinigde bak. Tijdens het vervoer mag de temperatuur van het monster de testtemperatuur niet significant overschrijden. Indien het vervoer langer duurt dan 2 tot 3 uur wordt aanbevolen het monster te koelen tot 4 °C. Het watermonster mag niet worden bevroren.
1.8.4. Opslag en behandeling van het oppervlaktewater
De test moet bij voorkeur binnen één dag na de monsterneming worden gestart. Als opslag van het water nodig is moet de opslagperiode zoveel mogelijk worden beperkt en in geen geval meer dan 4 weken duren. Het watermonster moet tot gebruik op 4 °C worden gehouden met beluchting. Voor gebruik moeten de grove deeltjes worden verwijderd, bv. door filtratie met een nylonfilter met een maaswijdte van ca. 100 μm, met een grof papierfilter, of door bezinking.
1.8.5. Behandeling van water aangevuld met sediment (optioneel)
Voor de gesuspendeerd-sedimenttest wordt sediment uit de bovenste sedimentlaag toegevoegd aan de kolven met natuurlijk water (dat is gefilterd ter verwijdering van grove deeltjes, zoals beschreven in paragraaf 1.8.4), zodat een suspensie wordt verkregen; de concentratie van gesuspendeerde vaste stof moet tussen 0,01 en 1 g/l liggen. Dit oppervlaktesediment moet afkomstig zijn van dezelfde monsternemingsplaats als het watermonster. Afhankelijk van het specifieke aquatische milieu kan het oppervlaktesediment gekenmerkt worden door een hoog organisch koolstofgehalte (2,5-7,5 %) en een fijne textuur of door een laag organisch koolstofgehalte (0,5-2,5 %) en een grove textuur (3). Het oppervlaktesediment moet als volgt worden behandeld: steek meerdere sedimentkernen met behulp van een buisje van doorzichtig plastic, verwijder onmiddellijk na de monsterneming de bovenste aerobe lagen (van het oppervlak tot een diepte van maximaal 5 mm) en voeg de sedimentkernen samen. Het resulterende sedimentmonster moet worden vervoerd in een bak met een grote luchtruimte om het sediment onder aerobe omstandigheden te houden (als het vervoer langer duurt dan 2-3 uur moet gekoeld worden tot 4 °C). Het sedimentmonster moet in het testwater worden gesuspendeerd in een verhouding van 1:10 en op 4 °C worden gehouden met beluchting tot gebruik. Als opslag van het sediment nodig is moet de opslagperiode zoveel mogelijk worden beperkt en in geen geval meer dan 4 weken duren.
1.8.6. Semicontinue procedure (optioneel)
Bij een lange aanlooptijd voordat een significante afbraak van de teststof kan worden gemeten kan een langdurige incubatie (van meerdere maanden) noodzakelijk zijn. Indien dit bekend is van eerdere testen met een bepaalde stof, kan de test worden gestart door middel van een semicontinue procedure, waarbij een deel van het testwater of de testsuspensie periodiek kan worden vernieuwd (zie aanhangsel 2). Een tweede mogelijkheid is dat de normale ladingsgewijze test kan worden veranderd in een semicontinue test, indien er gedurende een testperiode van ongeveer 60 dagen met de ladingsgewijze procedure geen afbraak van de teststof is bereikt (zie de tweede alinea van paragraaf 1.8.8.3).
1.8.7. Toevoeging van de teststof (of referentiestof)
Van stoffen met een hoge oplosbaarheid in water (> 1 mg/l) en een lage vluchtigheid (constante van de wet van Henry < 1 Pa·m3/mol of < 10–5 atm·m3/mol) kan een stockoplossing worden bereid in gedeïsoniseerd water (zie paragraaf 1.8.2); het vereiste volume van de stockoplossing wordt aan de testvaten toegevoegd om de gewenste concentratie te bereiken. Het volume aan toegevoegde stockoplossing moet tot een praktisch minimum worden beperkt (< 10 % van het uiteindelijke vloeistofvolume, indien mogelijk). Een andere procedure is om de teststof in een groter volume testwater op te lossen, dat kan worden beschouwd als alternatief voor het gebruik van organische oplosmiddelen.
Indien noodzakelijk kunnen stockoplossingen van niet-vluchtige stoffen met een lage oplosbaarheid in water worden bereid met behulp van een vluchtig organisch oplosmiddel, maar de aan het testsysteem toegevoegde hoeveelheid oplosmiddel mag niet hoger zijn dan 1 % v/v en mag geen nadelige effecten hebben op de microbiële activiteit. Het oplosmiddel mag de stabiliteit van de teststof in water niet beïnvloeden. Het oplosmiddel moet tot een uiterst kleine hoeveelheid worden beperkt, zodat het de DOC-concentratie van het testwater of de testsuspensie niet significant verhoogt. Dit moet worden gecontroleerd door middel van een stofspecifieke analyse of, indien mogelijk, een DOC-analyse (6). Gezorgd moet worden dat de overgebrachte hoeveelheid oplosmiddel tot het strikt noodzakelijke wordt beperkt, en dat de hoeveelheid teststof in het uiteindelijke volume testwater kan oplossen. Andere technieken om de teststof aan de testvaten toe te voegen kunnen worden gebruikt zoals beschreven in (7) en (8). Wanneer voor de toevoeging van de teststof een organisch oplosmiddel wordt gebruikt, dient een oplosmiddelcontrolegroep met testwater zonder toevoegingen en testwater met toegevoegde referentiestof op gelijke wijze te worden behandeld als de actieve testvaten waaraan teststof in oplosmiddel is toegevoegd. Het doel van deze oplosmiddelcontrolegroep is om mogelijke negatieve effecten van het oplosmiddel op de microbiële populatie te onderzoeken aan de hand van de afbraak van de referentiestof.
1.8.8. Testomstandigheden
1.8.8.1. Testtemperatuur
De incubatie dient in het donker plaats te vinden (bij voorkeur) of in diffuus licht, en bij gecontroleerde temperatuur (± 2 °C), hetzij de temperatuur in het veld, hetzij een standaardtemperatuur van 20-25 °C. De temperatuur in het veld kan de daadwerkelijke monstertemperatuur zijn op het monsternemingstijdstip of de gemiddelde temperatuur op de monsternemingsplaats.
1.8.8.2. Schudden/roeren
Om de deeltjes en micro-organismen in suspensie te houden moet continu worden geschud of geroerd. Dit bevordert eveneens de zuurstofoverdracht uit de luchtruimte naar de vloeistof voor een adequate handhaving van de aerobe omstandigheden. Plaats de kolven op een schudtafel (schudsnelheid ongeveer 100 omwentelingen/min) of gebruik magneetroerders. Het schudden/roeren moet continu zijn, maar niet harder dan noodzakelijk om de suspensie homogeen te houden.
1.8.8.3. Testduur
De test mag normaal gesproken niet langer duren dan 60 dagen, tenzij de semicontinue procedure met periodieke vernieuwing van de testoplossing wordt toegepast (zie paragraaf 1.8.6 en aanhangsel 2). De testduur voor de ladingsgewijze test kan echter worden verlengd tot maximaal 90 dagen, indien de afbraak van de teststof binnen de eerste 60 dagen is begonnen. De afbraak wordt met geschikte tijdsintervallen gemonitord door bepaling van de resterende 14C-activiteit of van de 14CO2-ontwikkeling (zie paragraaf 1.8.9.4), en/of door chemische analyse (paragraaf 1.8.9.5). De incubatietijd moet lang genoeg zijn om het afbraakproces te kunnen berekenen. De mate van afbraak moet bij voorkeur de 50 % overschrijden, en voor langzaam afbreekbare stoffen moet de mate van afbraak afdoende zijn (normaal gesproken groter dan 20 % afbraak) om het schatten van een kinetische afbraaksnelheidsconstante mogelijk te maken.
Op gezette tijden moeten de pH en de zuurstofconcentratie in het testsysteem worden gemeten, tenzij eerdere ervaringen met soortgelijke tests met water- en sedimentmonsters van dezelfde monsternemingsplaats dergelijke metingen overbodig maken. Onder sommige omstandigheden kan de metabolisering van primaire substraten bij veel hogere concentraties in het water of het sediment mogelijk leiden tot een zodanige CO2-ontwikkeling en zuurstofdepletie dat de experimentele omstandigheden gedurende de test significant worden gewijzigd.
1.8.9. Procedure
1.8.9.1. Bereiding van de kolven voor de pelagische test
Vul de testkolven met een geschikt volume van het testwater, ten hoogste ongeveer een derde van het kolfvolume en ten minste zo’n 100 ml. Bij gebruik van meerdere kolven (zodat bij iedere monsterneming een hele kolf kan worden genomen) is het geschikte testwatervolume eveneens zo’n 100 ml, aangezien kleine monstervolumes invloed kunnen hebben op de lengte van de aanlooptijd. De teststof wordt toegevoegd vanuit een stockoplossing, zoals beschreven in de paragrafen 1.8.2 en 1.8.7. Voor de bepaling van de afbraakkinetiek en de berekening van de afbraaksnelheidsconstante moeten ten minste twee verschillende teststofconcentraties worden gebruikt die een factor 5 tot 10 van elkaar verschillen. Beide gekozen concentraties moeten lager zijn dan 100 µg/l en bij voorkeur in het bereik liggen van < 1-10 µg/l.
Sluit de kolven af met lucht- en CO2-dichte stoppen of deksels. Voor niet–14C-gemerkte niet-vluchtige testverbindingen zijn losse propjes watten ter voorkoming van verontreiniging vanuit de lucht afdoende (zie paragraaf 1.8.1), mits van alle belangrijke afbraakproducten bekend is dat ze niet vluchtig zijn en bij gebruik van indirecte CO2-bepaling (zie aanhangsel 3).
Incubeer de kolven bij de gekozen temperatuur (zie paragraaf 1.8.8.1). Monsters voor chemische analyse en 14C-metingen moeten worden genomen bij het begin van de test (d.w.z. voordat de afbraak begint; zie paragraaf 1.7.1) en vervolgens met geschikte tijdsintervallen in de loop van de test. De monsterneming kan worden uitgevoerd door submonsters af te nemen (bv. aliquots van 5 ml) uit elke replicaat-kolf, of bij elke monsterneming een hele kolf te nemen. De mineralisatie van de teststof kan zowel indirect als direct worden bepaald (zie aanhangsel 3). Over het algemeen zijn gedurende de afbraakfase (d.w.z. na de aanlooptijd) minimaal vijf monsternemingen vereist voor een betrouwbare schatting van de snelheidsconstante, tenzij voor snel afbreekbare stoffen kan worden verantwoord dat drie monsternemingen voldoende zijn. Omdat bij stoffen die minder snel worden afgebroken gemakkelijk meer metingen kunnen worden gedaan tijdens de afbraakfase moeten meer meetpunten worden gebruikt voor de schatting van k. Vanwege de uiteenlopende biologische afbraaksnelheden kan geen vast tijdsschema worden gegeven voor de monsterneming; bij langzame afbraak wordt evenwel aanbevolen om eens per week een monster te nemen. Als de teststof snel wordt afgebroken moet gedurende de eerste drie dagen eens per dag een monster worden genomen en daarna eens in de twee of drie dagen. Onder bepaalde omstandigheden, zoals bij zeer snel gehydrolyseerde stoffen, kan het nodig zijn om met intervallen van uren te bemonsteren. Aanbevolen wordt om voorafgaand aan de test een verkennende test uit te voeren om de geschikte monsternemingsintervallen te bepalen. Als er monsters beschikbaar moeten zijn voor verdere specifieke analyse, is het aan te bevelen meerdere monsters te nemen en de te analyseren monsters na afloop van het experiment uit te kiezen volgens een „achterwaartse” strategie, d.w.z. de laatste monsters worden als eerste geanalyseerd (zie de tweede alinea van paragraaf 1.8.9.5 voor advies over de stabiliteit van monsters tijdens opslag).
1.8.9.2. Aantal kolven en monsters
Gebruik voldoende testkolven om te kunnen beschikken over:
|
—
|
testkolven; ten minste twee kolven voor elke teststofconcentratie (maar bij voorkeur minimaal drie) of meerdere testkolven voor iedere concentratie, als bij elke monsterneming een hele kolf wordt genomen (symbool: FT);
|
|
—
|
testkolven voor de berekening van de massabalans; ten minste twee kolven voor iedere testconcentratie (symbool: FM);
|
|
—
|
blancocontrole, zonder teststof; ten minste één blanco testkolf met alleen testwater (symbool: FB);
|
|
—
|
referentiecontrole; twee kolven met referentiestof (bv. aniline of natriumbenzoaat, concentratie: 10 µg/l) (symbool:FC). De referentiecontrole is bedoeld ter bevestiging van een minimum aan microbiële activiteit. Indien gewenst kan een radioactief gemerkte referentiestof worden gebruikt, ook wanneer de afbraak van de teststof wordt gemonitord met behulp van chemische analyse;
|
|
—
|
steriele controle; een of twee kolven met gesteriliseerd testwater voor het onderzoeken of er mogelijk niet-biologische afbraak of ander niet-biologisch verlies van teststof plaatsvindt (symbool: FS). De biologische activiteit kan worden gestopt door het testwater te autoclaveren (20 min bij 121 °C), of door een giftige stof toe te voegen (bv. natriumazide (NaN3) in een concentratie van 10-20 g/l, kwikchloride (HgCl2) in een concentratie van 100 mg/l of formaline in een concentratie van 100 mg/l), of door bestraling met gammastraling. Bij gebruik van HgCl2 moet dit worden weggegooid als toxisch afval. Voor water waaraan een grote hoeveelheid sediment is toegevoegd, is het niet gemakkelijk steriele omstandigheden te bereiken; in dat geval wordt aanbevolen meermaals te autoclaveren (bv. driemaal). Houd er rekening mee dat de sorptie-eigenschappen van het sediment kunnen veranderen als gevolg van het autoclaveren;
|
|
—
|
oplosmiddelcontroles, met testwater en testwater met referentiestof; twee kolven worden behandeld met dezelfde hoeveelheid oplosmiddel en volgens dezelfde procedure als voor de toevoeging van de teststof. Het doel hiervan is om, door de afbraak van de referentiestof te bepalen, na te gaan of het oplosmiddel een nadelige invloed heeft.
|
Bij het ontwerpen van de test moet de onderzoeker rekening houden met het relatieve belang van hogere experimentele replicatie ten opzichte van een groter aantal monsternemingtijdstippen. Het exacte aantal benodigde kolven zal afhangen van de methode die wordt gebruikt voor het meten van de afbraak (zie de derde alinea van paragraaf 1.8.9.1; paragraaf 1.8.9.4 en aanhangsel 3).
Uit iedere testkolf moeten op elk monsternemingstijdstip twee submonsters worden genomen (bv. aliquots van 5 ml). Als meerdere kolven worden gebruikt om hele kolven te kunnen nemen, moeten hiervoor op elk monsternemingstijdstip ten minste twee kolven worden bestemd (zie eerste alinea van paragraaf 1.8.9.1).
1.8.9.3. Bereiding van de kolven voor de gesuspendeerd-sedimenttest [optioneel]
Voeg de noodzakelijke volumes testwater en, indien nodig, sediment toe aan de testvaten (zie paragraaf 1.8.5). De bereiding van de vaten voor de gesuspendeerd-sedimenttest is hetzelfde als bij de pelagische test (zie de paragrafen 1.8.9.1 en 1.8.9.2). Gebruik bij voorkeur serumflessen of gelijkvormige kolven. Plaats de afgesloten kolven horizontaal op een schudtafel. Uiteraard moeten open kolven voor niet–14C-gemerkte, niet-vluchtige stoffen rechtop worden geplaatst; in dit geval wordt magnetisch roeren met behulp van glas-gecoate roerstaafjes aanbevolen. Indien nodig kunnen de kolven worden belucht om daadwerkelijk aerobe omstandigheden te handhaven.
1.8.9.4. Radiochemische bepalingen
De 14CO2-ontwikkeling kan indirect en direct worden gemeten (zie aanhangsel 3). Voor de indirecte 14CO2-bepaling wordt gekeken naar het verschil tussen de aanvankelijke 14C-activiteit in het testwater of de testsuspensie en de totale restactiviteit op het monsternemingstijdstip, zoals die wordt gemeten na het aanzuren van het monster tot pH 2-3 en het verwijderen van de CO2. Op die manier wordt de anorganische koolstof verwijderd en is de gemeten restactiviteit afkomstig van organisch materiaal. Indirecte 14CO2-bepaling moet niet worden gebruikt als tijdens de omzetting van de teststof belangrijke vluchtige omzettingsproducten worden gevormd (zie aanhangsel 3). Indien mogelijk moet de 14CO2-ontwikkeling direct worden gemeten (zie aanhangsel 3), op elk monsternemingstijdstip in ten minste één testkolf; met deze werkwijze kan zowel de massabalans als het biologisch afbraakproces worden gecontroleerd, maar zij is alleen toepasbaar bij tests die worden uitgevoerd met afgesloten kolven.
Als de 14CO2-ontwikkeling direct wordt gemeten tijdens de test, moeten hiervoor aan het begin van de test meer kolven worden klaargemaakt. Directe 14CO2-bepaling wordt aanbevolen als tijdens de omzetting van de teststof belangrijke vluchtige omzettingsproducten worden gevormd. Bij elk meetpunt worden de aanvullende testkolven aangezuurd tot pH 2-3 en wordt 14CO2 opgevangen in een intern of extern absorbens (zie aanhangsel 3).
Eventueel kunnen de concentraties van de met 14C gemerkte teststof en van de belangrijke omzettingsproducten worden bepaald met behulp van radiochromatografie (dunnelaagchromatografie, RAD-TLC) of HPLC met radiochemische detectie.
Eventueel kan de faseverdeling van de resterende radioactiviteit (zie aanhangsel 1), de resterende referentiestof en de omzettingsproducten worden bepaald.
Aan het einde van de test moet de massabalans worden bepaald aan de hand van directe 14CO2-meting, met behulp van aparte testkolven waaruit in de loop van de test geen monsters zijn genomen (zie aanhangsel 3).
1.8.9.5. Specifieke chemische analyse
Indien een gevoelige analysemethode beschikbaar is, kan de biologische afbraak worden bepaald door het meten van de totale restconcentratie van de teststof, in plaats van het gebruik van radioactieve merking. Bij gebruik van een radioactief gemerkte teststof (om de totale mineralisatie te meten) kunnen specifieke chemische analysemethoden parallel hieraan worden uitgevoerd om nuttige aanvullende informatie te verkrijgen en om de procedure te controleren. Specifieke chemische analysemethoden kunnen ook worden gebruikt om de bij de afbraak van de teststof gevormde omzettingsproducten te meten. Dit word aanbevolen voor gemineraliseerde stoffen met halveringstijden van meer dan 60 dagen. De concentraties van de teststof en de omzettingsproducten moeten op elk monsternemingstijdstip worden gemeten en gerapporteerd (als concentratie en als percentage van de toegevoegde hoeveelheid). Over het algemeen moeten bij elk monsternemingstijdstip de omzettingsproducten worden geïdentificeerd die in een concentratie ≥ 10 % van de toegevoegde concentratie worden gedetecteerd. Ook voor omzettingsproducten waarvan de concentraties tijdens het onderzoek voortdurend toenemen moet identificatie worden overwogen, zelfs als de concentraties ervan de hierboven gegeven grens niet bereiken, aangezien dit kan wijzen op persistentie. Ook het analyseren van omzettingsproducten in steriele controlekolven verdient te worden overwogen, als snelle niet-biologische omzetting van de teststof (bv. hydrolyse) mogelijk wordt geacht. Of het nodig is omzettingsproducten te kwantificeren en te identificeren moet van geval tot geval worden overwogen en moet worden verantwoord in het verslag. Extractietechnieken met organische oplosmiddelen moeten worden toegepast in overeenstemming met de aanwijzingen die in de desbetreffende analyseprocedures worden gegeven.
Indien de analyse binnen 24 uur wordt uitgevoerd (hetgeen de voorkeur verdient) moeten alle monsters bij 2 tot 4 °C luchtdicht worden opgeslagen. Voor langere opslag moeten de monsters worden bevroren onder –18 °C of chemisch worden geconserveerd. Aanzuring is af te raden als methode om monster te conserveren, daar aangezuurde monsters instabiel kunnen zijn. Indien de monsters niet binnen 24 uur worden geanalyseerd en langduriger worden bewaard, moet een onderzoek worden uitgevoerd naar de stabiliteit bij opslag, om de stabiliteit van de betreffende verbindingen bij opslag onder –18 °C of onder geconserveerde omstandigheden aan te tonen. Indien de analysemethode extractie met oplosmiddelen of vaste-fase-extractie (SPE) omvat, moet de extractie onmiddellijk na de monsterneming of na gekoelde opslag van het monster gedurende maximaal 24 uur worden uitgevoerd.
Afhankelijk van de gevoeligheid van de analysemethode kunnen grotere monstervolumes dan in paragraaf 1.8.1 aangegeven nodig zijn. De test kan gemakkelijk worden uitgevoerd met testvolumes van een liter in kolven van 2-3 liter, waardoor het mogelijk wordt monsters te nemen van ca. 100 ml.
2. GEGEVENS EN RAPPORTAGE
2.1. BEHANDELING VAN DE GEGEVENS
2.1.1. Grafiek van de gegevens
Rond de monsternemingstijdstippen af op een geheel aantal uren (tenzij de stof in een tijdspanne van minuten een substantiële afbraak ondergaat) maar niet op een geheel aantal dagen. Zet de geschatte restactiviteit van de teststof (voor met 14C gemerkte stoffen) of de restconcentratie (voor ongemerkte stoffen) uit tegen de tijd in zowel een lineaire grafiek als in een semilogaritmische grafiek (zie de figuren 1a en 1b). Vergelijk, als afbraak heeft plaatsgevonden, de resultaten van de FT-kolven met die van de FS-kolven. Als de gemiddelde resultaten van de kolven met teststof (FT) en de steriele kolven (FS) minder dan 10 % van elkaar verschillen, kan worden aangenomen dat de waargenomen afbraak hoofdzakelijk niet-biologisch is. Als de afbraak in de FS-kolven lager is, kunnen de cijfers worden gebruikt om de resultaten van de FT-kolven te corrigeren (door aftrekking) om de mate van biologische afbraak te schatten. Wanneer optionele analysen van de omzettingsproducten zijn uitgevoerd, moeten naast een grafiek van de afbraak van de teststof grafieken van de vorming en afbraak van die omzettingsproducten worden geleverd.
Schat de aanloopfase tL uit de afbraakcurve (de semilogaritmische grafiek) door het lineaire gedeelte te extrapoleren tot nul afbraak of anders door de tijd te bepalen tot ongeveer 10 % afbraak (zie de figuren 1a en 1b). Schat aan de hand van de semilogaritmische grafiek de eerste-orde snelheidsconstante k, en de bijbehorende standaarddeviatie door lineaire regressie van de natuurlijke logaritme van de resterende 14C-activiteit/teststofconcentratie tegen de tijd. Met name bij 14C-metingen moeten alleen gegevens worden gebruikt vanuit het eerste lineaire gedeelte van de grafiek na afloop van de aanlooptijd, en verdient het de voorkeur te kiezen voor weinig gegevens die representatief zijn boven veel gegevens met een grotere onzekerheid. Onder onzekerheid vallen hierbij de fouten die inherent zijn aan het aanbevolen directe gebruik van de meetwaarden voor de resterende 14C-activiteit (zie hieronder). Indien de afbraak een tweefasig patroon volgt, kan het soms relevant zijn om twee verschillende waarden voor de snelheidsconstante te berekenen. Hiertoe worden twee verschillende fasen van de afbraakcurve gedefinieerd. De snelheidsconstante k en de halveringstijd t½ = ln2/k moeten voor iedere replicaat-kolf apart worden berekend, wanneer submonsters uit dezelfde kolf worden genomen, dan wel berekend op grond van gemiddelde waarden, wanneer op ieder monsternemingstijdstip hele kolven worden genomen (zie de laatste alinea van paragraaf 1.8.9.2). Bij gebruik van de eerstgenoemde werkwijze moeten zowel de snelheidsconstante en de halveringstijd voor iedere replicaat-kolf apart worden gerapporteerd als de gemiddelde waarden met standaardfout. Indien hoge teststofconcentraties zijn gebruikt kan het zijn dat de afbraakcurve aanzienlijk afwijkt van een rechte lijn (semilogaritmische grafiek) en dat eerste-ordekinetiek niet van toepassing is. Het vaststellen van een halveringstijd heeft dan ook geen betekenis. Voor een beperkt gegevensbereik kan echter pseudo-eerste-ordekinetiek worden toegepast, waarmee de Disappearance Time 50 (DT50; de tijd die nodig is voor 50 % afbraak) kan worden geschat. Er moet evenwel rekening mee worden gehouden dat de DT50 slechts een beschrijving geeft van een bepaalde reeks gegevens en niet kan worden gebruikt voor het voorspellen van het afbraakverloop buiten dat gegevensbereik. Analysehulpmiddelen om de statistische berekeningen en het fitten van de curven te vergemakkelijken zijn algemeen beschikbaar en het gebruik van dergelijke programmatuur wordt aanbevolen.
Als specifieke chemische analysen worden uitgevoerd moeten de snelheidsconstanten en halveringstijden voor de primaire afbraak op dezelfde wijze worden geschat als hierboven beschreven voor de totale mineralisatie. Indien de primaire afbraak het beperkende proces is, is het soms mogelijk meetpunten uit het gehele afbraakverloop te gebruiken, aangezien de metingen direct zijn, in tegenstelling tot de metingen van de 14C-activiteit.
Bij gebruik van met 14C gemerkte stoffen moet in ieder geval aan het einde van de test een massabalans worden opgesteld, uitgedrukt als percentage van de toegevoegde beginconcentratie.
2.1.2. Restactiviteit
Wanneer het met 14C gemerkte gedeelte van een organische stof biologisch wordt afgebroken wordt het grootste deel van de 14C omgezet in 14CO2, terwijl een ander deel gebruikt wordt voor groei van de biomassa en/of synthese van extracellulaire metabolieten. Bij totale biologische afbraak van een stof wordt dus niet 100 % van de koolstof uit die stof omgezet in 14CO2. De 14C die in biosyntheseproducten wordt ingebouwd komt vervolgens langzaam vrij in de vorm van 14CO2 als gevolg van „secundaire mineralisatie”. Daardoor zullen grafieken van de resterende organische 14C-activiteit (gemeten na het wegvangen van de CO2) of de geproduceerde 14CO2 tegen de tijd „tailing” vertonen na voltooiing van de afbraak. Dit bemoeilijkt de kinetische interpretatie van de gegevens en daarom kan normaal gesproken alleen het begindeel van de curve (na het einde van de aanlooptijd tot aan het bereiken van ongeveer 50 % afbraak) worden gebruikt voor het schatten van de afbraaksnelheidsconstante. Als de teststof is afgebroken is de totale resterende organische 14C-activiteit altijd hoger dan de 14C-activiteit van de overgebleven intacte teststof. Als de afbraak van de teststof volgens een eerste-ordereactie verloopt en een constante fractie α wordt gemineraliseerd tot CO2, zal het begin van de helling van de 14C-verdwijningscurve (de totale hoeveelheid 14C tegen de tijd) een factor α maal de helling van de overeenkomstige curve voor de teststofconcentratie zijn (of, om precies te zijn, het met 14C gemerkte gedeelte van de teststof). Wanneer de metingen van de totale organische 14C-activiteit ongecorrigeerd worden gebruikt, zal de berekende afbraaksnelheidsconstante dan ook een voorzichtige schatting zijn. Procedures om de teststofconcentraties te schatten aan de hand van de gemeten radiochemische activiteiten op basis van uiteenlopende vereenvoudigende aannamen zijn beschreven in referenties (2), (9), (10) en (11). Dergelijke procedures zijn heel eenvoudig toe te passen voor gemakkelijk afbreekbare stoffen.
2.2. INTERPRETATIE VAN DE RESULTATEN
Als de gevonden k onafhankelijk is van de toegevoegde concentratie (d.w.z. als de berekende k ongeveer gelijk is bij verschillende teststofconcentraties) mag worden aangenomen dat de eerste-orde snelheidsconstante representatief is voor de gebruikte testomstandigheden, te weten de teststof, het watermonster en de testtemperatuur. In hoeverre generalisatie of extrapolatie van de resultaten tot andere systemen geoorloofd is moet op basis van deskundigheid worden beoordeeld. Bij gebruik van een hoge teststofconcentratie, waardoor de afbraak niet volgens eerste-ordekinetiek verloopt, kunnen de gegevens niet worden gebruikt voor een rechtstreekse schatting van een eerste-orde snelheidsconstante of bijbehorende halveringstijd. De gegevens uit een test met een hoge teststofconcentratie kunnen echter nog altijd bruikbaar zijn voor het schatten van de totale mineralisatie en/of het aantonen en bepalen van omzettingsproducten.
Indien de snelheden van andere verliesprocessen dan biologische afbraak (bv. hydrolyse of vervluchtiging) bekend zijn kunnen deze worden afgetrokken van de netto in de test waargenomen verliessnelheid voor een ruwe schatting van de biologische afbraaksnelheid. Gegevens over hydrolyse kunnen bijvoorbeeld worden verkregen uit de steriele controle of uit een parallelle test met hogere teststofconcentratie.
Indirecte of directe 14CO2-bepaling (paragraaf 1.8.9.4 en aanhangsel 3) is alleen te gebruiken om te meten in welke mate de teststof wordt gemineraliseerd tot CO2. Voor het analyseren van de concentraties van de met 14C gemerkte teststof en de vorming van belangrijke omzettingsproducten kan radiochromatografie (RAD-TLC) of HPLC worden gebruikt (zie de derde alinea van paragraaf 1.8.9.4). Om een directe schatting van de halveringstijd mogelijk te maken mogen er geen belangrijke omzettingsproducten (gedefinieerd als ≥ 10 % van de toegevoegde hoeveelheid teststof) aanwezig zijn. Indien belangrijke omzettingsproducten volgens deze definitie aanwezig zijn is een gedetailleerde evaluatie van de gegevens vereist, in de vorm van bijvoorbeeld herhaalde uitvoering van de test en/of identificatie van de omzettingsproducten (zie de eerste alinea van paragraaf 1.8.9.5), tenzij de levensloop van de omzettingsproducten voldoende kan worden beoordeeld op basis van ervaring (bv. informatie over de afbraakroute). Als het aandeel van de teststof dat wordt omgezet in CO2 varieert (met een grote afhankelijkheid van de concentratie van de teststof of andere beschikbare substraten, de testomstandigheden en de microbiële kolonie), is deze test niet geschikt voor een rechtstreekse schatting van de totale biologische afbraak, zoals in een DOC-afnametest; de uitkomst is echter van gelijke orde als van een respirometrische test. De mineralisatiegraad zal dus minder zijn dan of gelijk aan het minimale niveau van totale biologische afbraak. Voor een completer beeld van de totale biologische afbraak (mineralisatie en opname in biomassa) moet aan het einde van de test de faseverdeling van de 14C worden geanalyseerd (zie aanhangsel 1). De 14C in de deeltjesfase zal bestaan uit de 14C die is opgenomen in de bacteriële biomassa en de 14C die aan organische deeltjes is gesorbeerd.
2.3. VALIDITEIT VAN DE TEST
Indien de referentiestof niet binnen het verwachte tijdsinterval wordt afgebroken (voor aniline en natriumbenzoaat normaal gesproken binnen twee weken), moet de validiteit van de test worden betwijfeld en nader worden onderzocht, of anders moet de test worden herhaald met een nieuw watermonster. In een ISO ringtest van de methoden, waaraan zeven laboratoria op verschillende plaatsen in Europa hebben meegedaan, werden geadapteerde afbraaksnelheidsconstanten voor aniline gevonden van 0,3 tot 1,7 d–1 met een gemiddelde van 0,8 d–1 bij 20 oC en een standaardfout van ±0,4 d–1 (t½ = 0,9 dagen). De aanlooptijd was over het algemeen 1 tot 7 dagen. Van de onderzochte watermonsters werd een bacteriële biomassa gerapporteerd van 103-104 kolonievormende eenheden (kve) per ml. De afbraaksnelheden in voedselrijke Midden-Europese watermonsters waren groter dan in oligotrofe Noord-Europese watermonsters, hetgeen mogelijk toe te schrijven is aan het verschil in trofische status of voorgaande blootstelling aan chemicaliën.
De totale recovery (massabalans) aan het einde van het experiment moet voor radioactief gemerkte stoffen tussen 90 % en 110 % liggen, terwijl voor ongemerkte teststoffen de aanvankelijke recovery aan het begin van het experiment tussen 70 % en 110 % moet liggen. De aangegeven bereiken moeten evenwel worden opgevat als streefcijfers en moeten niet worden gebruikt als criteria voor de aanvaardbaarheid van de test.
3. TESTVERSLAG
Het type onderzoek — pelagische of gesuspendeerd-sedimenttest — moet duidelijk worden aangegeven in het testverslag, waarin eveneens ten minste de volgende gegevens moeten worden opgenomen:
Teststof en referentiestoffen:
|
—
|
triviale namen, chemische namen (IUPAC-namen en/of CAS-namen), CAS-nummers, structuurformules (waarin de plaats van de 14C wordt aangegeven bij gebruik van een radioactief gemerkte stof) en relevante fysisch-chemische eigenschappen van de teststof en de referentiestoffen (zie de paragrafen 1.5 en 1.6);
|
|
—
|
chemische namen, CAS-nummers, structuurformules (waarin de plaats van de 14C wordt aangegeven bij gebruik van een radioactief gemerkte stof) en relevante fysisch-chemische eigenschappen van stoffen die zijn gebruikt als standaarden voor het aantonen en bepalen van omzettingsproducten;
|
|
—
|
de zuiverheid (verontreinigingen) van de teststof;
|
|
—
|
de zuiverheid van het label van gemerkte chemicaliën en molaire activiteit (indien van toepassing).
|
Oppervlaktewater:
Van het watermonster moeten ten minste de volgende gegevens worden vermeld:
|
—
|
de locatie en beschrijving van de monsternemingsplaats inclusief, indien mogelijk, vervuilingsgeschiedenis;
|
|
—
|
de datum en de tijd waarop het monster is verzameld;
|
|
—
|
het gehalte aan voedingsstoffen (totale N, ammonium, nitriet, nitraat, totale P, opgelost orthofosfaat);
|
|
—
|
de monsternemingsdiepte;
|
|
—
|
het uiterlijk van het watermonster (bv. kleur en troebelheid);
|
|
—
|
DOC-gehalte en TOC-gehalte;
|
|
—
|
de temperatuur en de pH op de plaats en het tijdstip van de monsterneming;
|
|
—
|
de zuurstofconcentratie of de redoxpotentiaal (alleen verplicht als aerobe omstandigheden niet vanzelfsprekend zijn);
|
|
—
|
de saliniteit of de conductiviteit (in geval van zeewater of brak water);
|
|
—
|
gesuspendeerde vaste stoffen (in geval van een troebel monster);
|
|
—
|
eventueel overige relevante informatie over de monsternemingsplaats op het tijdstip van monsterneming (bv. actuele en historische gegevens over de stroomsnelheid van rivieren of zeestromingen, belangrijke lozingen in de nabijheid en het soort lozingen, weersomstandigheden voorafgaand aan de monsterneming);
|
en optioneel:
|
—
|
microbiële biomassa (bv. directe telling met acridine oranje of kolonievormende eenheden);
|
|
—
|
chlorofyl-a-gehalte als specifieke schatting voor de algenbiomassa.
|
Indien de gesuspendeerd-sedimenttest is uitgevoerd moeten bovendien de volgende gegevens over het sediment worden vermeld:
|
—
|
de diepte waarop het sediment is verzameld;
|
|
—
|
het uiterlijk van het sediment (zoals gekleurd, modderig, siltig of zandig);
|
|
—
|
de textuur (bv. percentage grof zand, fijn zand, silt en klei);
|
|
—
|
het drooggewicht in g/l van de gesuspendeerde vaste stoffen, TOC-concentratie of gloeiverlies als maat voor het gehalte aan organisch materiaal;
|
|
—
|
de zuurstofconcentratie of de redoxpotentiaal (alleen verplicht als aerobe omstandigheden niet vanzelfsprekend zijn).
|
Testomstandigheden:
|
—
|
de tijdsduur tussen monsterneming en het gebruik van het monster in de laboratoriumtest, wijzen van bewaren van het monster, voorbewerking van het monster, uitvoeringsdata van de studies;
|
|
—
|
de hoeveelheid toegevoegde teststof, testconcentratie en referentiestof;
|
|
—
|
de methode van toevoegen van de teststof en eventueel gebruik van oplosmiddelen;
|
|
—
|
het gebruikte volume oppervlaktewater en sediment (indien gebruikt) en het volume dat bij elk interval werd onttrokken voor analyse;
|
|
—
|
een beschrijving van het gebruikte testsysteem.
|
Indien niet in het donker is gewerkt: gegevens over de omstandigheden van het „diffuse licht”;
|
—
|
gegevens over de gebruikte methode(n) voor het opzetten van de steriele controles (bv. de temperatuur, de tijd en het aantal autoclaveringen);
|
|
—
|
de incubatietemperatuur;
|
|
—
|
gegevens over de analysetechnieken en de gebruikte methode(n) voor de radiochemische metingen, de massabalanscontrole en de metingen van de faseverdeling (indien uitgevoerd).
|
|
—
|
het aantal replicatie-bepalingen.
|
Resultaten:
|
—
|
de recovery (zie paragraaf 1.7.1);
|
|
—
|
de herhaalbaarheid en de gevoeligheid van de gebruikte analysemethoden, inclusief de detectiegrens en de bepaalbaarheidsgrens (zie paragraaf 1.7.2);
|
|
—
|
alle onbewerkte gegevens (inclusief monsternemingstijdstippen) en berekende waarden in tabelvorm, en de afbraakcurven; vermeld voor elke testconcentratie en voor elke replicaat-kolf de lineaire correlatiecoëfficiënt voor de helling van de logaritmische grafiek en een eerste-orde of pseudo-eerste-orde snelheidsconstante (indien mogelijk), en de bijbehorende halveringstijd (of de halfwaardetijd, t50);
|
|
—
|
vermeld relevante waarden als gemiddelden van de waarnemingen in de individuele replicatie-bepalingen, bv. de lengte van de aanlooptijd, de afbraaksnelheidsconstante en de bijbehorende halveringstijd (of t50);
|
|
—
|
kenmerk het systeem als geadapteerd of niet-geadapteerd op grond van het uiterlijk van de afbraakcurve en de mogelijke invloed van de testconcentratie;
|
|
—
|
de resultaten van de eindcontrole van de massabalans en de resultaten van faseverdelingsmetingen (indien uitgevoerd);
|
|
—
|
de fractie gemineraliseerde 14C en, bij gebruik van specifieke analysen, de totale primaire afbraak;
|
|
—
|
de identificatie, de molaire concentratie en het percentage van de onderzochte en belangrijke omzettingsproducten (zie eerste alinea van paragraaf 1.8.9.5), indien van toepassing;
|
|
—
|
een voorgestelde omzettingsroute, indien van toepassing;
|
|
—
|
een bespreking van de resultaten.
|
4. LITERATUUR
|
1.
|
OECD TG 309 (2004) Aerobic Mineralisation in surface water — Simulation Biodegradation Test.
|
|
2.
|
ISO/DIS 14592-1 (1999) Water quality — Evaluation of the aerobic biodegradability of organic compounds at low concentrations — Part 1: Shake flask batch test with surface water or surface water/sediment suspensions.
|
|
3.
|
Testmethode C.23. Aerobe en anaerobe omzetting in aquatische sedimentsystemen.
|
|
4.
|
Testmethode C.24. Aerobe en anaerobe omzetting in de bodem.
|
|
5.
|
OESO (1993). Guidelines for the Testing of Chemicals. OECD, Paris.
|
|
6.
|
ISO 8245 (1999). Water quality — Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
|
|
7.
|
ISO 10634 (1995). Water quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
8.
|
OESO ontwerp (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 (to be published summer 2000).
|
|
9.
|
Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394-401.
|
|
10.
|
Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274-283.
|
|
11.
|
ISO/CD 14592-1 (1999). Ring test report: Water Quality — Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 — report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions.
|
Aanhangsel 1
Faseverdeling van 14C
Ter controle van de procedure dienen de routinemetingen van de resterende organische 14C-activiteit (TOA) worden aangevuld met massabalansmetingen door middel van een directe bepaling van de 14CO2-ontwikkeling na opvanging van het CO2 met een adsorbens (zie aanhangsel 3). Een positieve 14CO2-vorming is op zichzelf direct bewijs voor biologische afbraak, daar deze niet optreedt bij niet-biologische afbraak of andere verliesmechanismen, zoals vervluchtiging en sorptie. Door meting van de verdeling van de TOA tussen de opgeloste fase (de opgeloste organische 14C-activiteit, DOA) en de deeltjesfase (deeltjesvormige organische 14C-activiteit, POA), na scheiding van de deeltjes door middel van membraanfiltratie of centrifugatie, kan aanvullende informatie worden verkregen om het biologische afbraakgedrag verder te karakteriseren. De POA bestaat uit teststof die is gesorbeerd door de microbiële biomassa en aan andere deeltjes, naast de van teststof afkomstige koolstof die is gebruikt voor de synthese van nieuw celmateriaal en op die manier is opgenomen in de deeltjesvormige biomassafractie. De vorming van opgelost met 14C gemerkt organisch materiaal kan worden geschat als de DOA aan het einde van het biologische afbraakproces (wanneer de curve van de afbraak tegen de tijd een plateau vertoont).
Schat de faseverdeling van de resterende 14C in geselecteerde monsters door deze te filteren met een 0,22 μm of 0,45 μm membraanfilter van een materiaal waaraan geen significante adsorptie van teststof optreedt (te denken valt aan polycarbonaatfilters). Als de sorptie van de teststof aan het filter te groot is om te verwaarlozen (hetgeen voorafgaand aan het experiment dient te worden gecontroleerd) kan in plaats van filtratie centrifugatie bij hoge snelheid (2 000 g; 10 min.) worden gebruikt.
Met het filtraat of centrifugaat kan worden verdergegaan met de in aanhangsel 3 beschreven procedure voor ongefilterde monsters. Los de membraanfilters op in een geschikte scintillatievloeistof en voer een telling uit volgens de gebruikelijke procedure, normaal gesproken met alleen dovingscorrectie aan de hand van de externe-standaard-kanaal-verhouding, of gebruik een oxidiser. Bij gebruik van centrifugatie: resuspendeer de pellet van de deeltjesfractie in 1-2 ml gedistilleerd water en breng dit over in een scintillatieflesje. Was vervolgens tweemaal met 1 ml gedistilleerd water en breng dit over in het scintillatieflesje. Indien nodig kan de suspensie voor de vloeistofscintillatietelling in een gel worden opgenomen.
Aanhangsel 2
Semicontinue procedure
Voor voldoende afbraak van persistente stoffen kan langdurige incubatie nodig zijn, tot meerdere maanden. Normaal gesproken moet de test niet langer duren dan 60 dagen, tenzij de eigenschappen van het oorspronkelijke watermonster worden bewaard door de testsuspensie te verversen. De testduur kan evenwel worden verlengd tot maximaal 90 dagen zonder verversing van de testsuspensie, indien de afbraak van de teststof binnen de eerste 60 dagen is begonnen.
Gedurende langdurige incubatie kan de diversiteit van de microbiële kolonie afnemen als gevolg van uiteenlopende verliesprocessen en als gevolg van de mogelijke depletie van het watermonster van essentiële voedingsstoffen en primaire koolstofsubstraten. Voor een adequate bepaling van de afbraaksnelheid van stoffen die langzaam worden afgebroken wordt dan ook aanbevolen een semicontinue test te gebruiken. De test moet volgens een semicontinue procedure worden gestart als op basis van eerdere ervaring wordt verwacht dat een incubatietijd van drie maanden nodig is om 20 % afbraak van de teststof te bereiken. Ook kan de normale ladingsgewijze test worden omgezet in een semicontinue test als gedurende ca. 60 testdagen volgens de ladingsgewijze procedure nog geen afbraak van de teststof is bereikt. Wanneer een aanzienlijke mate van afbraak is vastgesteld (bv. > 20 %) kan de semicontinue procedure worden gestopt en kan de test worden voortgezet als ladingsgewijs experiment.
In de semicontinue test wordt om de week ongeveer een derde van het volume van de testsuspensie vervangen door vers verzameld water met toegevoegde teststof in de beginconcentratie. Evenzo wordt sediment in de beginconcentratie (tussen 0,01 and 1 g/l) aan het vervangende water toegevoegd in geval van de optionele gesuspendeerd-sedimenttest. Indien de test wordt uitgevoerd met gesuspendeerd vast sediment is het van belang dat het systeem ook gedurende de verversing van het water volledig in suspensie blijft, en dat de verblijftijd voor vaste stoffen en water gelijk is. Zo niet, dan kan de beoogde overeenkomstigheid met een homogeen aquatisch systeem zonder vastliggende fasen verloren gaan. Daarom verdient het bij gebruik van de semicontinue procedure de voorkeur dat een beginconcentratie van gesuspendeerd sediment wordt gekozen in het lagere bereik van het opgegeven interval.
De voorgeschreven toevoeging van de teststof betekent dat door de gedeeltelijke verversing van de testsuspensie de beginconcentratie van de teststof niet wordt overschreden en dat de adaptatie die dikwijls wordt waargenomen bij hoge teststofconcentraties wordt vermeden. Doordat de procedure zowel zorgt voor hernieuwde enting als voor compensatie voor de depletie van voedingsstoffen en primaire substraten, wordt de oorspronkelijke microbiële diversiteit hersteld en kan de testduur in principe tot in het oneindige worden verlengd. Bij gebruik van de semicontinue procedure is het van belang op te merken dat de overgebleven teststofconcentratie moet worden gecorrigeerd voor de bij iedere verversingsprocedure toegevoegde en afgenomen hoeveelheden teststof. Voor verbindingen met weinig sorptie kunnen de totale en de opgeloste teststofconcentratie door elkaar worden gebruikt. Onder de omschreven omstandigheden (0,1-1 g vaste stof/l) is de sorptie te verwaarlozen (< 5 %) voor stoffen met een log Kow < 3 (geldig voor neutrale, lipofiele verbindingen). Dit wordt aanschouwelijk gemaakt in het volgende rekenvoorbeeld. Een vastestofgehalte van 0,1 g/l komt grofweg overeen met 10 mg koolstof per liter (koolstoffractie, fC = 0,01). Aannemende dat:
log Kow (van de teststof) = 3
Koc = 0,42 × Kow
Verdelingscoëfficiënt, Kd = fC × Koc
dan is opgeloste fractie van de totale concentratie (C-water (Cw)/C-totaal (Ct):
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999
Aanhangsel 3
Bepaling van 14CO2
Indirecte 14CO2-bepaling
Voor routinemetingen is de indirecte methode normaal gesproken de minst tijdrovende en meest nauwkeurige methode, als de teststof niet vluchtig is en niet wordt omgezet in vluchtige omzettingsproducten. Breng ongefilterde monsters van bv. 5 ml over in scintillatieflesjes. Een geschikte beginactiviteit in de monsters is 5 000 dpm-10 000 dpm (80-170 Bq) en de minimale beginactiviteit is zo'n 1 000 dpm. De CO2 moet worden verwijderd na aanzuring tot pH 2-3 met 1-2 druppels geconcentreerd H3PO4 of HCl, door gedurende ½-1 uur lucht door te leiden, dan wel door de kolven gedurende 1-2 uur heftig te schudden (bv. op een microtiterplaatschudder) of een nacht lang zachter te schudden. De efficiëntie van de CO2-verwijderingsprocedure moet worden gecontroleerd (door het doorleiden van lucht of het schudden te verlengen). Voeg vervolgens een geschikte scintillatievloeistof voor het tellen van waterige monsters toe, homogeniseer het monster met een rotatiemixer en bepaal de radioactiviteit aan de hand van vloeistofscintillatietelling, met aftrekking van de achtergrondactiviteit in de blancokolven (FB). Tenzij het testwater sterk gekleurd is of een hoge concentratie deeltjes bevat, zal de doving van de monsters normaal gesproken gelijk zijn en is dovingscorrectie met behulp van een externe standaard voldoende. Bij sterk gekleurd testwater kan dovingscorrectie door toevoeging van een interne standaard nodig zijn. Als de deeltjesconcentratie hoog is, kan het zijn dat het niet mogelijk is een homogene oplossing of gel te verkrijgen, of dat de doving te zeer varieert. In dat geval kan de hieronder beschreven telmethode voor testsuspensies worden gebruikt. Als de test wordt uitgevoerd als gesuspendeerd-sedimenttest zou de 14CO2-meting indirect kunnen worden uitgevoerd door een homogeen monster van 10 ml te nemen van het testwater/de testsuspensie en de fasen te scheiden door centrifugatie bij een geschikte snelheid (bv. bij 40 000 m/s2 gedurende 15 min). De waterige fase dient dan te worden behandeld als hierboven beschreven. De 14C-activiteit in de deeltjesfase (POA) moet worden bepaald door het sediment te resuspenderen in een klein volume gedistilleerd water, dit over te brengen in scintillatieflesjes, en scintillatievloeistof toe te voegen om een gel te vormen (voor dit doel zijn speciale scintillatievloeistoffen verkrijgbaar). Afhankelijk van de aard van de deeltjes (bv. het gehalte aan organisch materiaal) kan het mogelijk zijn het monster gedurende de nacht te solubiliseren en vervolgens te homogeniseren met een rotatiemixer alvorens de scintillatievloeistof toe te voegen. De POA kan ook worden bepaald door bij overmaat zuurstof te verbranden met behulp van een oxidiser. Bij het tellen moeten altijd interne standaarden worden doorgemeten en kan het nodig zijn dovingscorrecties uit te voeren door de interne standaard aan ieder afzonderlijk monster toe te voegen.
Directe 14CO2-bepaling
Bij directe 14CO2-meting moeten aan het begin van de test meer kolven worden klaargemaakt. Bij ieder meetpunt moeten testkolven worden aangezuurd tot pH 2-3 en moet de 14CO2 worden opgevangen in een intern (aangebracht in elke testkolf aan het begin van de test) of extern absorbens. Als adsorptiemedium kunnen alkali (bv. een 1 M NaOH-oplossing, of een NaOH-pil), ethanolamine dan wel afgeleiden van ethanolamine, of in de handel verkrijgbare adsorptiesystemen worden gebruikt. Voor de directe meting van het 14CO2, moeten de kolven worden afgesloten, bv. met een butylrubberen septum.
Figuur 1a
Voorbeeld van een metrische gegevensgrafiek (de restactiviteit tegen de tijd)
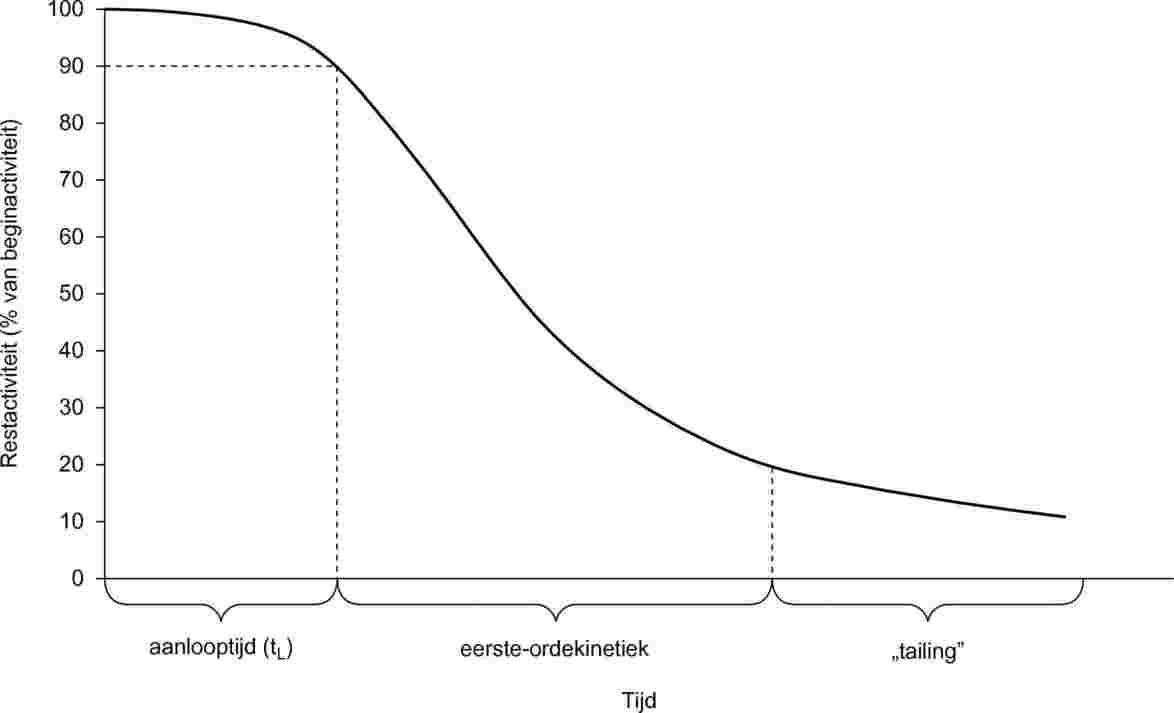
Figuur 1b
Voorbeeld van een logaritmische gegevensgrafiek (de ln van de restactiviteit tegen de tijd).

BIJLAGE VI
|
C.26.
|
LEMNA SP.: GROEIREMMINGSTEST
|
1. METHODE
Deze methode komt overeen met OESO TG 221 (2006) (1). De EU-instanties zijn het er algemeen over eens dat de Lemna-test voor sterk gekleurde stoffen een geschikt alternatief is voor een test met algen (2)(3).
1.1. INLEIDING
Deze testmethode is bedoeld om de toxiciteit van stoffen te bepalen voor zoetwaterplanten van het geslacht Lemna (eendenkroos). De methode is gebaseerd op bestaande richtsnoeren(4)(5)(6)(7)(8)(9), maar met een aantal wijzigingen op deze methoden in verband met recent onderzoek en adviezen over bepaalde cruciale aspecten. De voorgestelde methode is door middel van een internationale rondzendproef gevalideerd (10).
In deze testmethode worden toxiciteitstests beschreven met Lemna
gibba en Lemna minor, die beide uitgebreid zijn bestudeerd en waarvoor bovengenoemde normen zijn verschenen. De taxonomie van Lemna spp. is lastig en wordt gecompliceerd doordat er een breed scala van fenotypen bestaat. Hoewel er bij Lemna sprake kan zijn van genetische variabiliteit bij de respons op toxische stoffen, zijn er momenteel onvoldoende gegevens over deze bron van variabiliteit om het gebruik van een specifieke kloon voor deze testmethode aan te kunnen bevelen. Er dient te worden opgemerkt dat de test niet axenisch wordt uitgevoerd, maar dat er in bepaalde fasen van de testprocedure maatregelen worden genomen om besmetting door andere organismen tot een minimum te beperken.
Tests met verversing (semistatisch en doorstroom) en zonder verversing (statisch) van de testoplossing worden gedetailleerd beschreven. Afhankelijk van de doelstellingen van de test en de voorschriften in de regelgeving wordt aanbevolen het gebruik van semistatische en doorstroommethoden te overwegen, bijvoorbeeld voor stoffen die ten gevolge van verdamping, afbraak onder invloed van licht, neerslaan of biologische afbraak snel uit de oplossing verdwijnen. Zie (11) voor een nadere leidraad.
1.2. DEFINITIES
In de context van deze testmethode worden de volgende definities en afkortingen gebruikt:
Biomassa: het drooggewicht van het levende materiaal in een populatie. Bij deze test worden meestal vervangende eenheden voor biomassa gemeten, zoals aantal schijfjes of schijfoppervlak, en ook deze eenheden kunnen bij gebruik van de term „biomassa” worden bedoeld.
Chlorose: gele verkleuring van schijfweefsel.
Doorstroomtest: een test waarbij de testoplossing continu wordt ververst.
ECx
: de concentratie van de in het testmedium opgeloste teststof die binnen een bepaalde blootstellingsperiode (die expliciet moet worden vermeld als deze afwijkt van de volledige of normale duur van de test) leidt tot een afname van de groei van Lemna met × % (bv. 50 %). Om ondubbelzinnig aan te geven of een EC-waarde gebaseerd is op de groeisnelheid of de opbrengst, worden de symbolen „EsC” voor de groeisnelheid en „EoC” voor de opbrengst gebruikt, gevolgd door de gebruikte meetvariabele, bv. EsC (aantal schijfjes).
Fenotype: de waarneembare kenmerken van een organisme die door de interactie van de genen met het milieu worden bepaald.
Gebocheldheid: schijfjes die er gebocheld of gezwollen uitzien.
Groei: een toename van de meetvariabele, bv. aantal schijfjes, drooggewicht, natgewicht of schijfoppervlak, gedurende de testperiode.
Groeisnelheid (gemiddelde specifieke groeisnelheid): de logaritmische toename van de biomassa gedurende de blootstellingsperiode.
Kloon: een organisme of cel, door ongeslachtelijke voortplanting ontstaan uit één individu. Individuen uit één kloon zijn derhalve genetisch identiek.
Kolonie: een combinatie van aan elkaar vastzittende moeder- en dochterschijfjes (meestal 2 tot 4). Soms ook plant genoemd.
LOEC (Lowest Observed Effect Concentration): de laagste geteste concentratie waarbij wordt waargenomen dat de stof binnen een bepaalde blootstellingstijd in vergelijking met de controle tot een statistisch significante afname van de groei (p < 0,05) leidt. Alle testconcentraties boven de LOEC moeten echter een schadelijk effect hebben dat ten minste gelijk is aan het bij de LOEC waargenomen effect. Wanneer niet aan deze twee voorwaarden kan worden voldaan, moet een volledige toelichting worden gegeven op de wijze waarop de LOEC (en dus de NOEC) is bepaald.
Meetvariabelen: een type variabelen dat wordt gemeten voor de uitdrukking van het eindpunt van de test met behulp van een of meer verschillende responsvariabelen. Bij deze methode zijn aantal schijfjes, schijfoppervlak, versgewicht en drooggewicht meetvariabelen.
Monocultuur: een cultuur met één plantensoort.
Necrose: sterfte van schijfjesweefsel (dat daardoor wit of met water doordrenkt wordt).
NOEC (No Observed Effect Concentration): de testconcentratie die direct onder de LOEC ligt.
Opbrengst: de waarde van een meetvariabele om de biomassa uit te drukken aan het eind van de blootstellingstijd, verminderd met de waarde van de meetvariabele aan het begin van de blootstellingstijd.
Responsvariabele: een variabele voor de bepaling van de toxiciteit, met uiteenlopende berekeningsmethoden afgeleid van de gemeten variabelen voor de beschrijving van de biomassa. Voor deze testmethode worden de responsvariabelen groeisnelheid en opbrengst afgeleid van meetvariabelen zoals aantal schijfjes, schijfoppervlak, versgewicht of drooggewicht.
Schijfje: een individuele „bladachtige” structuur van een eendenkroosplant. Het is de kleinste eenheid, d.w.z. een individu dat zich kan voortplanten.
Semistatische (verversing) test: een test waarbij de testoplossing op specifieke tijdstippen gedurende de test periodiek wordt ververst.
Statische test: een testmethode waarbij de testoplossing gedurende de test niet wordt ververst.
Testeindpunt: de algemene factor waarvan het de bedoeling is dat deze door de teststof in vergelijking met de controle zal veranderen. Het eindpunt van deze testmethode is groeiremming, die kan worden uitgedrukt door verschillende responsvariabelen die op een of meer meetvariabelen gebaseerd zijn.
Testmedium: het volledige synthetische groeimedium waarin de testplanten gedurende de blootstelling aan de teststof groeien. De teststof wordt normaal gesproken in het testmedium opgelost.
1.3. PRINCIPE VAN DE TEST
Exponentieel groeiende plantenculturen van het geslacht Lemna krijgen de gelegenheid om gedurende zeven dagen in verschillende concentraties van de teststof als monocultuur te groeien. Het doel van de test is om op basis van bepalingen van gekozen meetvariabelen de effecten van de stof op de vegetatieve groei gedurende deze periode kwantitatief te bepalen. De primaire meetvariabele is het aantal schijfjes. Daarnaast wordt ten minste één andere meetvariabele gemeten (totaaloppervlak van de schijfjes, drooggewicht of versgewicht), aangezien sommige stoffen andere meetvariabelen veel sterker kunnen beïnvloeden dan het aantal schijfjes. Om de effecten van de stof kwantitatief te bepalen wordt de groei in de testoplossingen vergeleken met de groei van de controles en wordt de concentratie bepaald die een specifiek percentage remming van de groeisnelheid (bv. 50 %) veroorzaakt; deze wordt uitgedrukt als de ECx (bv. EC50).
Het testeindpunt is groeiremming, uitgedrukt als de logaritmische toename van de meetvariabele (gemiddelde specifieke groeisnelheid) gedurende de blootstellingsperiode. Op basis van de gemiddelde specifieke groeisnelheden die in een reeks testoplossingen worden geregistreerd, wordt de concentratie bepaald die een specifiek percentage remming van de groeisnelheid (bv. 50 %) veroorzaakt; deze wordt uitgedrukt als de EsCx (bv. EsC50).
Bij deze testmethode wordt ook de opbrengst als responsvariabele gebruikt; deze kan in bepaalde landen nodig zijn om aan specifieke voorschriften in de regelgeving te voldoen. Deze wordt gedefinieerd als de meetvariabelen aan het eind van de blootstellingsperiode verminderd met de meetvariabelen aan het begin van de blootstellingsperiode. Op basis van de opbrengst die in een reeks testoplossingen wordt geregistreerd, wordt de concentratie bepaald die een specifiek percentage afname van de opbrengst (bv. 50 %) veroorzaakt; deze wordt uitgedrukt als de EoCx (bv. EoC50).
Daarnaast kunnen langs statistische weg de laagste concentratie met waargenomen effecten (LOEC) en de concentratie zonder waargenomen effecten (NOEC) worden bepaald.
1.4. INFORMATIE OVER DE TESTSTOF
Er moet een analysemethode beschikbaar zijn met een afdoende gevoeligheid voor de kwantitatieve bepaling van de stof in het testmedium.
De informatie over de teststof, die nuttig kan zijn om de testomstandigheden te bepalen, omvat bijvoorbeeld de structuurformule, de zuiverheid, de oplosbaarheid in water, de stabiliteit in water en licht, de pKa, de Kow, de dampspanning en de biologische afbreekbaarheid. De oplosbaarheid in water en de dampspanning kunnen worden gebruikt om de constante van de Wet van Henry te berekenen die aangeeft of significante verliezen van de teststof gedurende de testperiode te verwachten zijn. Mede op grond hiervan kan worden bepaald of er specifieke maatregelen moeten worden genomen om dergelijke verliezen te beperken. Wanneer de informatie over de oplosbaarheid en stabiliteit van de teststof onzeker is, wordt aanbevolen deze onder de testomstandigheden te bepalen, d.w.z. in het groeimedium, bij de temperatuur en met het belichtingsschema zoals die bij de test worden gebruikt.
Wanneer regulering van de pH van het testmedium van bijzonder belang is, bijvoorbeeld bij het testen van metalen of stoffen die instabiel voor hydrolyse zijn, wordt aanbevolen een buffer aan het groeimedium toe te voegen (zie de eerste alinea van punt 1.7.4). Nadere richtsnoeren voor het testen van stoffen met zodanige fysisch-chemische eigenschappen dat ze moeilijk te testen zijn, zijn te vinden in (11).
1.5. REFERENTIESTOF
Er kunnen een of meer referentiestoffen worden getest, zoals 3,5-dichloorfenol dat bij de internationale rondzendproef is gebruikt (10), om de testprocedure te controleren. Het is raadzaam ten minste twee keer per jaar of, wanneer de test met een vrij lage frequentie wordt uitgevoerd, tegelijk met de bepaling van de toxiciteit van een teststof een referentiestof te testen.
1.6. GELDIGHEID VAN DE TEST
Voor een geldige test moet de verdubbelingstijd van het aantal schijfjes bij de controlegroep minder dan 2,5 dagen (60 uur) zijn, hetgeen overeenkomt met ongeveer een zevenvoudige toename in zeven dagen en een gemiddelde specifieke groeisnelheid van 0,275 d–1. Wanneer de in deze testmethode beschreven media en testomstandigheden worden gebruikt, kan dit criterium met een statische testopzet worden gehaald (8). Ook bij een semistatische en een doorstroomtest zal dit criterium naar verwachting kunnen worden gehaald. In punt 2.1 wordt de berekening van de verdubbelingstijd beschreven.
1.7. BESCHRIJVING VAN DE METHODE
1.7.1. Apparatuur
Alle apparatuur die in aanraking komt met de testmedia, moet van glas of een ander chemisch inert materiaal gemaakt zijn. Glaswerk dat voor de culturen en de test wordt gebruikt, moet worden ontdaan van chemische verontreinigingen die in het medium terecht kunnen komen en moet steriel zijn. De testvaten moeten zo breed zijn dat de schijfjes van de verschillende kolonies in de controlevaten kunnen groeien zonder dat ze elkaar aan het eind van de test overlappen. De wortels mogen de bodem van de testvaten raken, maar een minimale diepte van 20 mm en een minimaal volume van 100 ml in elk testvat wordt aanbevolen. De keuze van de testvaten is geen kritische factor zolang aan deze eisen wordt voldaan. Van zowel bekerglazen (van glas) als kristalliseerschalen of glazen petrischalen met geschikte afmetingen is gebleken dat ze geschikt zijn. De testvaten moeten worden afgedekt om verdamping en onopzettelijke verontreiniging tot een minimum te beperken, waarbij echter wel de nodige uitwisseling van lucht mogelijk moet zijn. Bij het kiezen van geschikte testvaten en met name deksels moet erop worden gelet dat ze geen schaduwwerking of veranderingen in de spectrale kenmerken van licht veroorzaken.
De culturen en de testvaten mogen niet samen worden bewaard. Hiervoor kan het best worden gezorgd door aparte klimaatkasten, incubators of klimaatkamers te gebruiken. De verlichting en de temperatuur moeten kunnen worden gereguleerd en moeten constant worden gehouden (zie punt 1.7.8).
1.7.2. Testorganisme
Als organisme wordt voor deze test Lemna gibba of Lemna minor gebruikt. Aanhangsel 1 bevat een korte beschrijving van soorten eendenkroos die voor toxiciteitstests zijn gebruikt. Het plantenmateriaal kan van een cultuurcollectie of een ander laboratorium worden betrokken of uit het veld worden gehaald. Als de planten uit het veld worden gehaald, moeten ze ten minste gedurende acht weken vóór gebruik in hetzelfde medium in cultuur worden gehouden als voor de test wordt gebruikt. Op de plaatsen die voor het verzamelen van de beginculturen worden gebruikt, mogen er geen zichtbare bronnen van verontreiniging zijn. Als ze van een ander laboratorium of van een cultuurcollectie worden betrokken, moeten ze op dezelfde manier gedurende minimaal drie weken in cultuur worden gehouden. De herkomst van het plantenmateriaal en de voor de test gebruikte soort en kloon (indien bekend) moeten altijd worden gerapporteerd.
Er moeten monoculturen worden gebruikt, die zichtbaar vrij zijn van verontreiniging door andere organismen zoals algen en protozoën. Gezonde planten van L. minor bestaan uit kolonies met twee tot vijf schijfjes, terwijl gezonde kolonies van L. gibba maximaal zeven schijfjes kunnen bevatten.
De kwaliteit en uniformiteit van de voor de test gebruikte planten zullen een significante invloed hebben op het resultaat van de test en de planten moeten dan ook met zorg worden gekozen. Er moeten jonge, snel groeiende planten worden gebruikt zonder zichtbare beschadigingen en zonder verkleuring (chlorose). Wanneer een cultuur veel kolonies met ten minste twee schijfjes bevat, wijst dit op een goede kwaliteit. Een groot aantal losse schijfjes wijst op milieustress, bv. een nutriënt als beperkende factor, en plantenmateriaal van dergelijke culturen mag niet voor de test worden gebruikt.
1.7.3. Culturen
Om de onderhoudfrequentie van culturen te beperken (bv. wanneer er gedurende enige tijd geen Lemna-tests gepland zijn), kunnen de culturen onder beperkte verlichting en bij verlaagde temperatuur (4-10 °C) worden bewaard. Aanhangsel 2 bevat een gedetailleerde beschrijving van deze werkwijze. Wanneer er duidelijke tekenen van verontreiniging door algen of andere organismen zijn, moet er bij een submonster van Lemna-schijfjes oppervlaktesterilisatie worden uitgevoerd, waarna het naar vers medium wordt overgezet (zie aanhangsel 2). In dit geval moet de resterende verontreinigde cultuur worden afgekeurd.
Ten minste zeven dagen vóór de test worden voldoende kolonies aseptisch overgezet naar vers steriel medium en gedurende 7-10 dagen onder de testomstandigheden gekweekt.
1.7.4. Testmedium
Voor Lemna minor en Lemna gibba worden onderstaande media aanbevolen. Er moet zorgvuldig worden overwogen of er een pH-buffer in het testmedium moet worden opgenomen (MOPS (4-morfolinepropaansulfonzuur, CAS-nr. 1132-61-2, EINECS-nr. 214-478-5) in medium voor L. minor en NaHCO3 in medium voor L. gibba) wanneer het vermoeden bestaat dat deze met de teststof zou kunnen reageren en de toxische effecten zou kunnen beïnvloeden. Steinberg-medium (12) is ook aanvaardbaar, zo lang aan de geldigheidscriteria wordt voldaan.
Voor het kweken van en testen met L. minor wordt een gewijzigde versie van het Lemna-groeimedium van het Zweedse instituut voor normalisatie (SIS) aanbevolen. In aanhangsel 3 wordt de samenstelling van dit medium vermeld.
Het in aanhangsel 3 beschreven groeimedium 20X-AAP wordt aanbevolen voor het kweken van en testen met L. gibba.
Het ook in aanhangsel 3 beschreven Steinberg-medium is ook geschikt voor L. minor, maar kan ook voor L. gibba worden gebruikt, zo lang aan de geldigheidscriteria wordt voldaan.
1.7.5. Testoplossingen
De testoplossingen worden meestal bereid door een stamoplossing te verdunnen. Stamoplossingen van de teststof worden meestal bereid door de stoffen in groeimedium op te lossen.
De hoogste geteste concentratie van de teststof mag normaal gesproken niet hoger liggen dan de oplosbaarheid in water van de stof onder de testomstandigheden. Er moet echter worden opgemerkt dat Lemna spp. op het oppervlak drijft en kan worden blootgesteld aan stoffen die zich aan het grensvlak tussen water en lucht ophopen (bijvoorbeeld stoffen die slecht oplosbaar zijn in water, hydrofobe stoffen of oppervlakteactieve stoffen). In dergelijke situaties zullen de planten aan ander materiaal worden blootgesteld dan in de oplossing aanwezig is en kunnen de testconcentraties afhankelijk van de kenmerken van de teststof hoger liggen dan de oplosbaarheid in water. Voor slecht in water oplosbare teststoffen kan het nodig zijn om met behulp van een organisch oplosmiddel of dispergeermiddel een geconcentreerde stamoplossing of dispersie van de stof te maken om de toevoeging van nauwkeurige hoeveelheden van de teststof aan het testmedium te vergemakkelijken en bij het dispergeren en oplossen daarvan te helpen. Al het mogelijke moet worden gedaan om gebruik van dergelijke materialen te vermijden. Het gebruik van oplosmiddelen of dispergeermiddelen als hulpstof mag niet tot fytotoxiciteit leiden. Vaak gebruikte oplosmiddelen die bij concentraties tot 100 μl·l–1 geen fytotoxiciteit veroorzaken, zijn bijvoorbeeld aceton en dimethylformamide. Als een oplosmiddel of dispergeermiddel wordt gebruikt, moet de uiteindelijke concentratie daarvan worden gerapporteerd en tot een minimum worden beperkt (≤ 100 μl·l–1) en moeten alle test- en controleoplossingen dezelfde concentratie oplosmiddel of dispergeermiddel bevatten. Zie (11) voor nadere richtsnoeren voor het gebruik van dispergeermiddelen.
1.7.6. Dosis- en controlegroepen
Wanneer er vooraf iets bekend is over de toxiciteit van de teststof voor Lemna, bijvoorbeeld uit een oriënterende test, kan dit nuttig zijn bij het kiezen van geschikte testconcentraties. Bij de definitieve toxiciteitstest moeten er normaal gesproken ten minste vijf testconcentraties worden gebruikt die een meetkundige reeks vormen. De rede van de reeks mag bij voorkeur niet hoger zijn dan 3,2 maar bij een vlakke concentratie/responscurve mag een hogere waarde worden gebruikt. Als er minder dan vijf concentraties worden gebruikt, moet er een motivering worden gegeven. Bij elke testconcentratie moeten er ten minste drie duplo's worden gebruikt.
Bij de bepaling van het bereik van de testconcentraties (voor een oriënterende en/of de definitieve toxiciteitstest) moet rekening worden gehouden met de volgende overwegingen:
|
—
|
Als er een ECx wordt bepaald, moet de ECx-waarde binnen het bereik van de testconcentraties vallen om een adequaat betrouwbaarheidsniveau te waarborgen. Als bijvoorbeeld de EC50 wordt bepaald, moet de hoogste testconcentratie hoger zijn dan de EC50. Als de EC50 buiten het bereik van de testconcentraties ligt, zullen de bijbehorende betrouwbaarheidsintervallen groot zijn en zal een correcte bepaling van de statistische fit van het model wellicht niet mogelijk zijn.
|
|
—
|
Als het de bedoeling is de LOEC/NOEC te bepalen, moet de laagste testconcentratie zo laag zijn dat de groei niet significant lager is dan die van de controle. Bovendien moet de hoogste testconcentratie dan zo hoog zijn dat de groei significant lager is dan die van de controle. Als dit niet het geval is, moet de test met een ander concentratiebereik worden herhaald (tenzij de hoogste concentratie samenvalt met de oplosbaarheidsgrens of de maximaal vereiste grensconcentratie, bijvoorbeeld 100 mg·l–1).
|
In elke test moeten controles worden opgenomen waarbij het medium, het aantal schijfjes en kolonies, de milieuomstandigheden en de procedures identiek zijn aan die van de testvaten, maar zonder de teststof. Als er een oplosmiddel of dispergeermiddel als hulpstof wordt gebruikt, moet er een extra controle worden opgenomen waaraan het oplosmiddel/dispergeermiddel in dezelfde concentratie wordt toegevoegd als in de vaten met de teststof. Het aantal controleduplo's (en, indien van toepassing, oplosmiddelduplo's) moet ten minste gelijk zijn aan en liefst twee keer zo groot zijn als het aantal vaten dat voor elke testconcentratie wordt gebruikt.
Als de NOEC niet behoeft te worden bepaald, kan de testopzet zodanig worden aangepast dat het aantal concentraties wordt opgevoerd en het aantal duplo's per concentratie wordt verlaagd. Er moeten echter minimaal drie controleduplo's worden gebruikt.
1.7.7. Blootstelling
Uit 2 tot 4 zichtbare schijfjes bestaande kolonies worden vanuit de entcultuur onder aseptische omstandigheden op aselecte wijze overgezet naar de testvaten. Elk testvat moet in totaal 9 tot 12 schijfjes bevatten. Het aantal schijfjes en kolonies moet in elk testvat hetzelfde zijn. Uit de met deze methode opgedane ervaring en de gegevens van de rondzendproef is gebleken dat drie duplo's per dosisgroep, waarbij elke duplo aanvankelijk 9 tot 12 schijfjes bevat, voldoende is om verschillen in groei tussen de dosisgroepen te detecteren van ongeveer 4 % tot 7 % remming (bij berekening van de groeisnelheid) of 10 % tot 15 % remming (bij berekening van de opbrengst) (10).
Wat de locatie van de testvaten in de incubator betreft, moet een aselecte opzet worden gehanteerd om de invloed van plaatselijke verschillen in lichtintensiteit of temperatuur zo veel mogelijk te beperken. Een blokopzet of aselecte verplaatsing van de vaten bij het doen van observaties (of frequenter verplaatsen) is ook vereist.
Als uit een oriënterende stabiliteitstest is gebleken dat de concentratie van de teststof in de loop van de test (7 dagen) niet op peil blijft (d.w.z. de gemeten concentratie daalt tot minder dan 80 % van de gemeten aanvankelijke concentratie), wordt een semistatische testopzet aanbevolen. In dit geval moeten de kolonies ten minste twee keer in de loop van de test (bijvoorbeeld op dag 3 en op dag 5) aan vers bereide test- en controleoplossingen worden blootgesteld. De frequentie van blootstelling aan vers medium is afhankelijk van de stabiliteit van de teststof; bij zeer instabiele of vluchtige stoffen kan een hogere frequentie nodig zijn om de concentratie vrijwel constant te houden. In sommige gevallen kan een doorstroomprocedure nodig zijn (11)(13).
Blootstelling door aanbrengen op het blad (spuiten) komt in deze testmethode niet aan de orde; zie hiervoor (14).
1.7.8. Incubatieomstandigheden
Er moet continue warme of koele witte fluorescerende belichting worden gebruikt om te zorgen voor een lichtintensiteit binnen het bereik 85-135 μE·m–2·s–1, wanneer deze wordt gemeten binnen het voor fotosynthese effectieve golflengtebereik (400-700 nm) op punten op dezelfde afstand van de lichtbron als de Lemna-schijfjes (dit komt overeen met 6 500-10 000 lux). De lichtintensiteit mag niet meer dan ± 15 % afwijken van de over het testoppervlak gemiddelde lichtintensiteit. De methode waarmee het licht wordt gedetecteerd en gemeten, met name het type sensor, zal de gemeten waarde beïnvloeden. De voorkeur wordt gegeven aan sferische sensoren (die reageren op licht uit alle hoeken boven en onder het meetvlak) en „cosinus”-sensoren (die reageren op licht uit alle hoeken boven het meetvlak) in plaats van unidirectionele sensoren, aangezien deze een hogere uitslag geven voor een meerpuntslichtbron van het hier beschreven type.
De temperatuur in de testvaten moet 24 ± 2 °C zijn. De pH van het controlemedium mag gedurende de test niet meer dan 1,5 eenheden stijgen. Een afwijking van meer dan 1,5 eenheden maakt de test echter niet ongeldig wanneer kan worden aangetoond dat aan de geldigheidscriteria wordt voldaan. In speciale gevallen, bijvoorbeeld wanneer instabiele stoffen of metalen worden getest, moet extra zorg aan de pH-verschuiving worden besteed. Zie (11) voor nadere richtsnoeren.
1.7.9. Duur
De test wordt 7 dagen na het overzetten van de planten naar de testvaten beëindigd.
1.7.10. Metingen en analyses
Aan het begin van de test wordt het aantal schijfjes in de testvaten geteld en geregistreerd, waarbij ervoor moet worden gezorgd dat overlappende maar apart zichtbare schijfjes worden meegeteld. Het aantal schijfjes (normaal of abnormaal) moet aan het begin van de test, ten minste één keer per drie dagen gedurende de blootstellingsperiode (d.w.z. ten minste twee keer gedurende de periode van 7 dagen) en aan het eind van de test worden bepaald. Veranderingen in de ontwikkeling van de plant (bijvoorbeeld qua grootte van de schijfjes, uiterlijk, verschijnselen van necrose, chlorose of gebocheldheid, uit elkaar vallen of verlies van drijfvermogen van kolonies, lengte en uiterlijk van de wortels) moeten worden geregistreerd. Ook significante kenmerken van het testmedium (bijvoorbeeld aanwezigheid van onopgelost materiaal of algengroei in het testvat) moeten worden geregistreerd.
Naast de bepalingen van het aantal schijfjes gedurende de test moeten ook de effecten van de teststof op een (of meer) van de volgende meetvariabelen worden bepaald:
|
i)
|
totaaloppervlak van de schijfjes,
|
Het voordeel van het totaaloppervlak van de schijfjes is dat het voor elk testvat en controlevat aan het begin, gedurende en aan het eind van de test kan worden bepaald. Het droog- of versgewicht moet aan het begin van de test worden bepaald bij een monster van de entcultuur dat representatief is voor wat er wordt gebruikt om de test te starten, en aan het eind van de test bij het plantenmateriaal van elk testvat en controlevat. Als het oppervlak van de schijfjes niet wordt gemeten, krijgt het drooggewicht de voorkeur boven het versgewicht.
Het totaaloppervlak van de schijfjes, het drooggewicht en het versgewicht kunnen als volgt worden bepaald:
|
i)
|
Totaaloppervlak van de schijfjes: het totaaloppervlak van de schijfjes van alle kolonies kan door beeldanalyse worden bepaald. Met een videocamera kan een silhouet van het testvat en de planten worden opgenomen (bijvoorbeeld door het vat op een lichtbak te zetten) en dit beeld kan worden gedigitaliseerd. Door kalibratie met vlakke vormen met een bekend oppervlak kan vervolgens het totaaloppervlak van de schijfjes in een testvat worden bepaald. Er moet op worden gelet dat storing door de rand van het testvat wordt voorkomen. Een andere methode, die echter bewerkelijker is, is een foto van de testvaten en planten te maken, het resulterende silhouet van de kolonies uit te knippen en het oppervlak te bepalen met een bladoppervlak-analysator of millimeterpapier. Ook andere technieken (bv. de papiergewicht-verhouding tussen het silhouet van het kolonieoppervlak en een oppervlakte-eenheid) kunnen bruikbaar zijn.
|
|
ii)
|
Drooggewicht: Uit elk testvat worden alle kolonies verzameld en afgespoeld met gedestilleerd of gedeïoniseerd water. Ze worden afgevloeid om het aanhangend water te verwijderen en vervolgens bij 60 °C gedroogd tot constant gewicht. Ook wortelfragmenten moeten mee worden bepaald. Het drooggewicht moet worden uitgedrukt met een precisie van ten minste 0,1 mg.
|
|
iii)
|
Versgewicht: Alle kolonies worden overgebracht naar vooraf gewogen buizen van polystyreen (of een ander inert materiaal) met kleine (1 mm) gaten in de ronde bodem. De buizen worden vervolgens gedurende tien minuten bij kamertemperatuur gecentrifugeerd bij 3 000 rpm. De buizen, die de nu gedroogde kolonies bevatten, worden opnieuw gewogen en het versgewicht wordt berekend door het resultaat van het gewicht van de lege buis af te trekken.
|
1.7.10.1. Frequentie van de metingen en analyses
Als een statische testopzet wordt gebruikt, moet de pH van elke dosisgroep aan het begin en het eind van de test worden gemeten. Als een semistatische testopzet wordt gebruikt, moet de pH vóór elke verversing in elke batch „verse” testoplossing en ook in de corresponderende „gebruikte” oplossingen worden gemeten.
De lichtintensiteit moet in de klimaatkast, incubator of klimaatkamer worden gemeten op punten op dezelfde afstand van de lichtbron als de Lemna-schijfjes. De metingen moeten ten minste eenmaal gedurende de test worden uitgevoerd. De temperatuur van het medium moet ten minste eenmaal per dag worden gemeten in een speciaal vat dat onder dezelfde omstandigheden in de klimaatkast, incubator of klimaatkamer wordt bewaard.
De concentraties van de teststof worden op geschikte tijdstippen gedurende de test bepaald. Bij statische tests moeten de concentraties minimaal aan het begin en aan het eind van de test worden bepaald.
Bij semistatische tests moeten, wanneer de concentratie van de teststof naar verwachting niet binnen ± 20 % van de nominale concentratie zal blijven, alle vers bereide testoplossingen en dezelfde oplossingen bij elke verversing (zie de derde alinea van punt 1.7.7) worden geanalyseerd. Wanneer de gemeten aanvankelijke concentratie van de teststof niet binnen ± 20 % van de nominale concentratie ligt, maar afdoende kan worden aangetoond dat de aanvankelijke concentraties herhaalbaar en stabiel zijn (d.w.z. binnen het bereik van 80-120 % van de aanvankelijke concentratie liggen), behoeven de chemische bepalingen echter alleen bij de hoogste en laagste testconcentratie te worden uitgevoerd. In alle gevallen behoeft de concentratie van de teststof vóór verversing slechts bij één duplo van elke testconcentratie te worden bepaald (of bij de gecombineerde inhoud van de duplo-testvaten).
Als een doorstroomtest wordt gebruikt, kan een vergelijkbaar bemonsteringsschema worden gebruikt als voor semistatische tests is beschreven, met een analyse aan het begin, halverwege en aan het eind van de test, maar in dit geval is een meting van de „gebruikte” oplossingen niet relevant. Bij een dergelijke test moet de stroomsnelheid van het verdunningsmiddel en de teststof of de stamoplossing van de teststof dagelijks worden gecontroleerd.
Als kan worden aangetoond dat de concentratie van de geteste stof de gehele test op afdoende wijze binnen ± 20 % van de nominale of gemeten aanvankelijke concentratie is gebleven, kan de analyse van de resultaten op basis van de nominale of gemeten aanvankelijke waarden worden uitgevoerd. Als de afwijking van de nominale of gemeten aanvankelijke concentratie groter is dan ± 20 %, moet de analyse van de resultaten worden uitgevoerd op basis van het meetkundige gemiddelde van de concentratie gedurende de blootstelling of op basis van modellen waarmee de afname van de concentratie van de teststof wordt beschreven (11).
1.7.11. Limiettest
Onder bepaalde omstandigheden, bijvoorbeeld wanneer een oriënterende test erop wijst dat de teststof bij concentraties tot 100 mg·l–1 of tot de oplosbaarheidsgrens in het testmedium (als deze lager ligt) geen toxische effecten heeft, kan een limiettest worden uitgevoerd, waarbij de respons in een controlegroep en één dosisgroep (100 mg·l–1 of een concentratie die gelijk is aan de oplosbaarheidsgrens) wordt vergeleken. Er wordt sterk aanbevolen dit te ondersteunen met een analyse van de blootstellingsconcentratie. Alle in het voorgaande beschreven testomstandigheden en geldigheidscriteria zijn ook van toepassing bij een limiettest, behalve het aantal duplo's in de controlegroep, dat moet worden verdubbeld. De groei in de controlegroep en de dosisgroep kan worden geanalyseerd met behulp van een statistische toets om gemiddelden te vergelijken, bijvoorbeeld een t-toets van Student.
2. GEGEVENS EN RAPPORTAGE
2.1. VERDUBBELINGSTIJD
Om de verdubbelingstijd (Td) van het aantal schijfjes te bepalen en na te gaan of dit geldigheidscriterium door de test wordt gehaald (zie punt 1.6), wordt op de gegevens van de controlevaten de volgende formule toegepast:
Td = ln 2/μ
Hierbij is μ de gemiddelde specifieke groeisnelheid, bepaald volgens de beschrijving in de eerste en tweede alinea van punt 2.2.1.
2.2. RESPONSVARIABELEN
De test is bedoeld om de effecten van de teststof op de vegetatieve groei van Lemna te bepalen. In deze testmethode worden twee responsvariabelen beschreven, aangezien de lidstaten niet alle dezelfde voorkeuren en behoeften qua regelgeving hebben. De testresultaten zijn alleen in alle lidstaten aanvaardbaar als de effecten met beide onderstaande responsvariabelen a) en b) worden bepaald:
|
a)
|
de gemiddelde specifieke groeisnelheid: deze responsvariabele wordt berekend op basis van de logaritmische verandering in het aantal schijfjes en daarnaast op basis van de logaritmische verandering in een andere meetparameter (totaaloppervlak van de schijfjes, drooggewicht of versgewicht) in de loop van de tijd (uitgedrukt per dag) in de controlegroep en elke dosisgroep. Dit wordt soms de relatieve groeisnelheid genoemd (15).
|
|
b)
|
de opbrengst: deze responsvariabele wordt berekend op basis van de verandering in het aantal schijfjes en daarnaast op basis van de verandering in een andere meetparameter (totaaloppervlak van de schijfjes, drooggewicht of versgewicht) in de controlegroep en elke dosisgroep tot het eind van de test.
|
Er moet worden opgemerkt dat de met behulp van deze twee responsvariabelen berekende waarden voor de toxiciteit niet vergelijkbaar zijn en bij gebruik van de resultaten van de test moet met dit verschil rekening worden gehouden. Vanwege de mathematische grondslagen van de respectieve benaderingen zullen de ECx-waarden op basis van de gemiddelde specifieke groeisnelheid (EsCx) in het algemeen hoger zijn dan de resultaten op basis van de opbrengst (EoCx) als de testomstandigheden van deze testmethode worden aangehouden. Dit moet niet worden geïnterpreteerd als een verschil in gevoeligheid tussen de twee responsvariabelen, maar alleen als een mathematisch verschil tussen de waarden. Het begrip gemiddelde specifieke groeisnelheid is gebaseerd op het algemene exponentiële groeipatroon van eendenkroos in niet-beperkte culturen, waarbij de toxiciteit wordt bepaald op basis van de effecten op de groeisnelheid, zonder dat deze afhankelijk is van het absolute niveau van de specifieke groeisnelheid van de controle, van de helling van de concentratie/responscurve of van de duur van de test. De resultaten op basis van de responsvariabele opbrengst zijn daarentegen afhankelijk van al deze andere variabelen. De EoCx is afhankelijk van de specifieke groeisnelheid van de bij elke test gebruikte eendenkroossoort en van de maximale specifieke groeisnelheid die van soort tot soort en zelfs van kloon tot kloon kan verschillen. Deze responsvariabele moet niet worden gebruikt voor een vergelijking tussen eendenkroossoorten of zelfs verschillende klonen qua gevoeligheid voor toxische stoffen. De wetenschap geeft weliswaar de voorkeur aan het gebruik van de gemiddelde specifieke groeisnelheid om de toxiciteit te bepalen, maar in deze testmethode wordt ook de bepaling van de toxiciteit op basis van de opbrengst opgenomen om te voldoen aan de vereisten in de huidige regelgeving in bepaalde landen.
De toxiciteit moet worden bepaald op basis van het aantal schijfjes en daarnaast één andere meetvariabele (totaaloppervlak van de schijfjes, drooggewicht of versgewicht), omdat sommige stoffen wellicht veel meer invloed hebben op andere meetvariabelen dan het aantal schijfjes. Dit effect zou niet worden gedetecteerd als alleen het aantal schijfjes wordt berekend.
Er wordt een tabel gemaakt met het aantal schijfjes en een andere geregistreerde meetvariabele, d.w.z. het totaaloppervlak van de schijfjes, het drooggewicht of het versgewicht, alsmede de concentraties van de teststof op elk meettijdstip. Bij de latere gegevensanalyse, bijvoorbeeld om de LOEC, de NOEC of de ECx te bepalen, moet worden uitgegaan van de waarden voor de afzonderlijke duplo's en niet van de berekende gemiddelden voor elke dosisgroep.
2.2.1. Gemiddelde specifieke groeisnelheid
De gemiddelde specifieke groeisnelheid voor een bepaalde periode wordt voor elke test- of controlevat met de volgende vergelijking berekend als de logaritmische toename van de groeivariabelen – het aantal schijfjes en één andere meetvariabele (totaaloppervlak van de schijfjes, drooggewicht of versgewicht):

Hierbij is:
|
—
|
µ
i-j
|
de gemiddelde specifieke groeisnelheid van tijdstip i tot tijdstip j;
|
|
—
|
N
i
|
de meetvariabele in het test- of controlevat op tijdstip i;
|
|
—
|
N
j
|
de meetvariabele in het test- of controlevat op tijdstip j;
|
|
—
|
t
|
de periode van tijdstip i tot tijdstip j.
|
Voor elke dosisgroep en controlegroep wordt een gemiddelde waarde voor de groeisnelheid berekend en een waarde voor de variantie.
De gemiddelde specifieke groeisnelheid moet voor de volledige testperiode worden berekend (tijdstip „i” in bovenstaande formule is het begin van de test en tijdstip „j” is het einde van de test). Voor elke testconcentratie en controle wordt een gemiddelde waarde voor de gemiddelde specifieke groeisnelheid berekend en een waarde voor de variantie. Daarnaast moet de partiële groeisnelheid worden bepaald om effecten van de teststof gedurende de blootstellingsperiode te evalueren (bijvoorbeeld door inspectie van de log-getransformeerde groeicurves). Aanzienlijke verschillen tussen de partiële groeisnelheid en de gemiddelde groeisnelheid wijzen erop dat de groei niet voortdurend exponentieel is en dat de groeicurves grondig moeten worden bestudeerd. In dit geval zou het een behoedzame aanpak zijn om de specifieke groeisnelheden van behandelde culturen gedurende de periode van maximale remming te vergelijken met die van controles gedurende dezelfde periode.
De procentuele remming van de groeisnelheid (Is) kan dan voor elke testconcentratie (dosisgroep) worden berekend met de volgende formule:

Hierbij is:
|
—
|
%Is
|
procentuele remming van de gemiddelde specifieke groeisnelheid;
|
|
—
|
µC
|
gemiddelde waarde van µ in de controlegroep;
|
|
—
|
µD
|
gemiddelde waarde van µ in de dosisgroep.
|
2.2.2. Opbrengst
De effecten op de opbrengst worden bepaald op basis van twee meetvariabelen, het aantal schijfjes en één andere meetvariabele (totaaloppervlak van de schijfjes, drooggewicht of versgewicht) in elk testvat aan het begin en het eind van de test. Voor het drooggewicht of het versgewicht wordt de biomassa aan het begin bepaald op basis van een monster met schijfjes dat wordt genomen van dezelfde batch die voor het beënten van de testvaten wordt gebruikt (zie de tweede alinea van punt 1.7.3). Voor elke testconcentratie en controle wordt een gemiddelde waarde voor de opbrengst berekend en een waarde voor de variantie. De gemiddelde procentuele remming van de opbrengst (%Io) kan voor elke dosisgroep als volgt worden berekend:

Hierbij is:
|
—
|
%Io
|
procentuele remming van de opbrengst;
|
|
—
|
bC
|
biomassa aan het eind minus biomassa aan het begin in de controlegroep;
|
|
—
|
bD
|
biomassa aan het eind minus biomassa aan het begin in de dosisgroep.
|
2.2.3. Uitzetting van de concentratie/responscurves
Uitzetting van de gemiddelde procentuele remming van de responsvariabele (Is of Io, berekend volgens de laatste alinea van punt 2.2.1 of punt 2.2.2) tegen de logaritme van de concentratie van de teststof levert concentratie/responscurves op.
2.2.4. Bepaling van de ECx
De ECx (bv. EC50) moet worden bepaald op basis van zowel de gemiddelde specifieke groeisnelheid (EsCx) als de opbrengst (EoCx), in beide gevallen op basis van het aantal schijfjes en één andere meetvariabele (totaaloppervlak van de schijfjes, drooggewicht of versgewicht). De reden hiervoor is dat sommige teststoffen het aantal schijfjes anders beïnvloeden dan andere meetvariabelen. De gewenste toxiciteitsparameters zijn derhalve vier ECx-waarden voor elk berekend remmingsniveau x: EsCx (aantal schijfjes), EsCx (totaaloppervlak schijfjes, drooggewicht of versgewicht), EoCx (aantal schijfjes) en EoCx (totaaloppervlak schijfjes, drooggewicht of versgewicht).
2.3. STATISTISCHE PROCEDURES
Het is de bedoeling met behulp van regressieanalyse een kwantitatief verband tussen concentratie en respons te verkrijgen. Het is mogelijk een gewogen lineaire regressie te gebruiken nadat op de responsgegevens een linearisering-transformatie is uitgevoerd, bijvoorbeeld naar probit-, logit- of Weibull-eenheden (16), maar de voorkeur wordt gegeven aan niet-lineaire regressieprocedures, die beter omgaan met onvermijdelijke onregelmatigheden in gegevens en afwijkingen van regelmatige distributies. In de buurt van het nulpunt of totale remming kunnen dergelijke onregelmatigheden door de transformatie worden uitvergroot en kunnen ze de analyse storen (16). Er moet worden opgemerkt dat standaardmethoden voor analyses met behulp van probit-, logit- of Weibull-transformaties bedoeld zijn voor gebruik bij een binaire respons (bv. sterfte of overleven) en moeten worden aangepast om voor groeisnelheid- of opbrengst-data te kunnen worden gebruikt. Specifieke procedures voor de bepaling van ECx-waarden uit continue gegevens zijn te vinden in (17), (18) en (19).
Voor elke te analyseren responsvariabele wordt het verband tussen concentratie en respons gebruikt voor de berekening van puntschattingen van ECx-waarden. Waar mogelijk moeten voor elke schatting de 95 %-betrouwbaarheidsgrenzen worden bepaald. De kwaliteit van de fitting van de responsgegevens op het regressiemodel moet grafisch of statistisch worden bepaald. De regressieanalyse moet met de individuele duplo-respons worden uitgevoerd en niet met gemiddelden van dosisgroepen.
Als de beschikbare regressiemodellen/methoden niet geschikt zijn voor de gegevens, kunnen de EC50 en de betrouwbaarheidsgrenzen ook worden bepaald met behulp van lineaire interpolatie met bootstrapping (20).
Voor de bepaling van de LOEC en daaruit de NOEC moeten de gemiddelden van de dosisgroepen worden vergeleken met behulp van variantieanalyse-technieken (ANOVA). Het gemiddelde voor elke concentratie moet dan worden vergeleken met het gemiddelde van de controlegroep met behulp van een geschikte methode voor meervoudige vergelijking of trendtoets. Hiervoor kan de Dunnett- of Williams-toets geschikt zijn (21)(22)(23)(24). Er moet worden bepaald of de ANOVA-aanname van homogeniteit van variantie opgaat. Deze bepaling kan grafisch worden uitgevoerd of met een formele toets (25). Hiervoor kan de Levene- of Bartlett-toets worden gebruikt. Wanneer de aanname van homogeniteit van variantie niet opgaat, kan dit soms worden gecorrigeerd door logaritmische transformatie van de gegevens. Als de heterogeniteit van variantie extreem is en niet door transformatie kan worden gecorrigeerd, moet een analyse met methoden als de stap-omlaag-trendtoets van Jonckheere worden overwogen. Aanvullende richtsnoeren voor de bepaling van de NOEC zijn te vinden in (19).
Recente wetenschappelijke ontwikkelingen hebben geleid tot een aanbeveling om het begrip NOEC niet langer te gebruiken en te vervangen door op regressie gebaseerde puntschattingen van ECx. Voor deze Lemna-test is geen geschikte waarde voor x vastgesteld. Een interval van 10 tot 20 % lijkt echter geschikt (afhankelijk van de gekozen responsvariabele) en bij voorkeur moeten zowel de EC10 als de EC20 worden gerapporteerd.
3. RAPPORTAGE
3.1. TESTVERSLAG
In het testverslag moeten de volgende gegevens worden opgenomen:
Teststof:
|
—
|
fysische aard en fysisch-chemische eigenschappen, waaronder de oplosbaarheidsgrens in water;
|
|
—
|
chemische identificatiegegevens (bv. het CAS-nr.), waaronder de zuiverheid.
|
Geteste soort:
|
—
|
wetenschappelijke naam, kloon (indien bekend) en herkomst.
|
Testomstandigheden:
|
—
|
gebruikte testprocedure (statisch, semistatisch of doorstroom);
|
|
—
|
begindatum en duur van de test;
|
|
—
|
beschrijving van de testopzet: testvaten en deksels, volume van de oplossingen, aantal kolonies en schijfjes per testvat aan het begin van de test;
|
|
—
|
testconcentraties (nominaal en gemeten, indien van toepassing) en aantal duplo's per concentratie;
|
|
—
|
wijze van bereiding van de stam- en testoplossingen, met vermelding van het gebruik van eventuele oplosmiddelen of dispergeermiddelen;
|
|
—
|
temperatuur tijdens de test;
|
|
—
|
lichtbron, lichtintensiteit en -homogeniteit;
|
|
—
|
pH-waarden van de test- en controleoplossingen;
|
|
—
|
concentraties van de teststof en de analysemethode met relevante kwaliteitsborgingsgegevens (valideringsstudies, standaarddeviaties of betrouwbaarheidsgrenzen van analyses);
|
|
—
|
methoden voor de bepaling van het aantal schijfjes en andere meetvariabelen (drooggewicht, versgewicht of oppervlak schijfjes);
|
|
—
|
alle afwijkingen van deze testmethode.
|
Resultaten:
|
—
|
de ruwe gegevens: het aantal schijfjes en andere meetvariabelen in elk test- en controlevat bij elke observatie en elk analysetijdstip;
|
|
—
|
de gemiddelden en standaarddeviaties voor elke meetvariabele;
|
|
—
|
de groeicurves voor elke concentratie (aanbevolen met log-getransformeerde meetvariabele; zie tweede alinea van punt 2.2.1);
|
|
—
|
de verdubbelingstijd/groeisnelheid in de controle op basis van het aantal schijfjes;
|
|
—
|
de berekende responsvariabelen voor elke behandelde duplo met het gemiddelde en de variatiecoëfficiënt voor de duplo's;
|
|
—
|
een grafische weergave van het verband tussen concentratie en effect;
|
|
—
|
de bepaalde toxische eindpunten voor responsvariabelen, zoals EC50, EC10 en EC20, en de bijbehorende betrouwbaarheidsintervallen. De LOEC en/of de NOEC, indien deze zijn berekend, en de voor de bepaling daarvan gebruikte statistische methoden;
|
|
—
|
als ANOVA is gebruikt, de grootte van het effect dat kan worden gedetecteerd (bv. het minst significante verschil);
|
|
—
|
een eventuele stimulering van de groei, als deze bij een behandeling is geconstateerd;
|
|
—
|
eventuele visuele verschijnselen van fytotoxiciteit en observaties van de testoplossingen;
|
|
—
|
bespreking van de resultaten, met inbegrip van een eventuele beïnvloeding van de resultaten van de test die een gevolg is van afwijkingen van deze testmethode.
|
4. LITERATUUR
|
(1)
|
OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test.
|
|
(2)
|
Het gebruik van Lemna-studies voor gekleurde stoffen wordt gedetailleerd besproken in hoofdstuk 13.5.3 van de „EU Manual of Decisions” van juli 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals
|
|
(3)
|
Guidance on information requirements and chemical safety assessment — Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, available at
http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A
|
|
(4)
|
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (Reapproved 1998). pp. 733-742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
|
|
(5)
|
USEPA — United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8pp.
|
|
(6)
|
AFNOR — Association Française de Normalisation. (1996). XP T 90-337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
|
|
(7)
|
SSI — Swedish Standards Institute. (1995). Water quality — Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
|
|
(8)
|
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37-120 pp
|
|
(9)
|
Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145.
|
|
(10)
|
Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc — Environment Agency.
|
|
(11)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23.
|
|
(12)
|
ISO DIS 20079. Water Quality — Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) — Duckweed Growth Inhibition Test.
|
|
(13)
|
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory — Duluth, Minnesota 55804. US EPA Report No. EPA-600/3-77 108. September 1977.
|
|
(14)
|
Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353-359.
|
|
(15)
|
Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481-483.
|
|
(16)
|
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
|
|
(17)
|
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
|
|
(18)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485-1494.
|
|
(19)
|
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
|
|
(20)
|
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN.
|
|
(21)
|
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096-1121.
|
|
(22)
|
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
|
|
(23)
|
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(24)
|
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(25)
|
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
|
Aanhangsel 1
Beschrijving van Lemna spp.
De meestal als „eendenkroos” aangeduide waterplant, Lemna spp., behoort tot de familie Lemnaceae, die een aantal wereldwijd voorkomende soorten in vier geslachten heeft. Hun uiterlijk en taxonomie is uitgebreid beschreven (1)(2). Lemna gibba en L. minor zijn soorten die representatief zijn voor gematigde zones en worden vaak voor toxiciteitstests gebruikt. Beide soorten hebben een drijvende of in het water ondergedompelde bladachtige stengel (schijfje) en uit het midden van de onderkant van elk schijfje steekt een heel dunne wortel. Lemna spp. heeft zelden bloemen en de reproductie verloopt ongeslachtelijk door het maken van nieuwe schijfjes (3). De jongere planten zijn meestal bleker dan de oudere, hebben kortere wortels en bestaan uit twee of drie schijfjes die niet even groot zijn. Doordat Lemna klein is, een eenvoudige structuur heeft, zich ongeslachtelijk voortplant en een korte generatietijd heeft, zijn planten van dit geslacht heel geschikt voor laboratoriumproeven (4)(5).
Omdat de gevoeligheid waarschijnlijk van soort tot soort verschilt, mag de gevoeligheid alleen binnen één soort worden vergeleken.
Voorbeelden van Lemna-soorten die voor tests zijn gebruikt: soortenreferentie
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935-941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90-337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality — Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (Reapproved 1998). pp. 733-742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959-1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87-96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481-483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102-2111.
Bronnen van Lemna-soorten
|
University of Toronto Culture Collection of Algae and Cyanobacteria
|
|
Department of Botany, University of Toronto
|
|
Toronto, Ontario, CANADA, M5S 3 B2
|
|
Tel: +1-416-978-3641
|
|
Fax: +1-416-978-5878
|
|
e-mail: jacreman@botany.utoronto.ca
|
|
http://www.botany.utoronto.ca/utcc
|
|
North Carolina State University
|
|
Forestry Dept
|
|
Duckweed Culture Collection
|
|
Campus Box 8002
|
|
Raleigh, NC 27695-8002
|
|
UNITED STATES
|
|
Tel 001 (919) 515-7572
|
|
astomp@unity.ncsu.edu
|
|
Institute of Applied Environmental Research (ITM) Stockholm University
|
|
106 91 Stockholm
|
|
SWEDEN
|
|
Tel: +46 8 674 7240
|
|
Fax +46 8 674 7636
|
|
Federal Environmental Agency (UBA)
|
|
FG III 3.4
|
|
Schichauweg 58
|
|
12307 Berlin
|
|
GERMANY
|
|
e-mail: lemna@uba.de
|
|
http://www.umweltbundesamt.de/contact.htm
|
Literatuur
|
(1)
|
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221-287.
|
|
(2)
|
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland.
|
|
(3)
|
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82-991150-0-0. The Agricultural Research Council of Norway, University of Oslo.
|
|
(4)
|
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1-14.
|
|
(5)
|
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7-22.
|
Aanhangsel 2
Bewaring van stamculturen
Stamculturen kunnen bij lage temperatuur (4-10 °C) geruime tijd worden bewaard zonder opnieuw te hoeven worden opgezet Voor Lemna kan hetzelfde groeimedium worden gebruikt als voor de test, maar voor stamculturen kan een ander nutriëntrijk medium worden gebruikt.
Periodiek wordt een aantal jonge, lichtgroene planten met een aseptische techniek overgezet naar nieuwe kweekvaten met vers medium. Onder de hier voorgestelde koele omstandigheden kan er drie maanden worden gewacht voordat er een nieuwe subcultuur wordt gemaakt.
Er moeten chemisch zuivere (met zuur gewassen) en steriele glazen kweekvaten worden gebruikt en aseptische behandelingstechnieken worden toegepast. Bij verontreiniging van de stamcultuur, bijvoorbeeld met algen of schimmels, moeten er maatregelen worden genomen om de verontreinigende organismen te verwijderen. Bij algen en de meeste andere verontreinigende organismen kan dit gebeuren door oppervlaktesterilisatie. Er wordt een monster van het verontreinigde plantenmateriaal genomen en de wortels worden afgeknipt. Het materiaal wordt vervolgens krachtig geschud in schoon water en vervolgens gedurende 30 seconden tot 5 minuten ondergedompeld in 0,5 % (v/v) natriumhypochloriet-oplossing. Het plantenmateriaal wordt vervolgens afgespoeld met steriel water en in een aantal porties overgebracht in kweekvaten met vers groeimedium. Veel schijfjes zullen door deze behandeling afsterven, vooral als er een lange blootstellingstijd wordt gebruikt, maar meestal zullen sommige van de overlevende schijfjes vrij van verontreiniging zijn. Deze kunnen dan worden gebruikt om nieuwe culturen te beënten.
Aanhangsel 3
Media
Voor L. minor en L. gibba worden verschillende groeimedia aanbevolen. Voor L. minor wordt een gewijzigde versie van een medium van het SIS (Zweeds instituut voor normalisatie) aanbevolen, terwijl voor L. gibba het medium 20X-AAP wordt aanbevolen. Voor beide media wordt de samenstelling hieronder vermeld. Bij de bereiding van deze media moeten p.a. reagentia en gedeïoniseerd water worden gebruikt.
Groeimedium voor Lemna van het SIS
|
—
|
De stamoplossingen I-V worden in de autoclaaf (15 minuten bij 120 °C) of door membraanfiltratie (poriediameter ongeveer 0,2 µm) gesteriliseerd.
|
|
—
|
Stamoplossing VI (en facultatief VII) worden alleen door membraanfiltratie gesteriliseerd; deze mogen niet in de autoclaaf worden behandeld.
|
|
—
|
Steriele stamoplossingen moeten koel en in het donker worden bewaard. De stamoplossingen I-V moeten binnen zes maanden worden gebruikt, terwijl stamoplossing VI (en facultatief VII) ten hoogste één maand kunnen worden bewaard.
|
Stamoplossing nr.
|
Stof
|
Concentratie in stamoplossing (g·l–1)
|
Concentratie in bereid medium (mg·l–1)
|
Bereid medium
|
|
Element
|
Concentratie (mg·l–1)
|
|
I
|
NaNO3
KH2PO4
|
8,50
1,34
|
85
13,4
|
Na; N
K; P
|
32; 14
6,0; 2,4
|
|
II
|
MgSO4 · 7H2O
|
15
|
75
|
Mg; S
|
7,4; 9,8
|
|
III
|
CaCl2 · 2H2O
|
7,2
|
36
|
Ca; Cl
|
9,8; 17,5
|
|
IV
|
Na2CO3
|
4,0
|
20
|
C
|
2,3
|
|
V
|
H3BO3
MnCl2 · 4H2O
Na2MoO4 · 2H2O
ZnSO4 · 7H2O
CuSO4 · 5H2O
Co(NO3)2 · 6H2O
|
1,0
0,20
0,010
0,050
0,0050
0,010
|
1,00
0,20
0,010
0,050
0,0050
0,010
|
B
Mn
Mo
Zn
Cu
Co
|
0,17
0,056
0,0040
0,011
0,0013
0,0020
|
|
VI
|
FeCl3 · 6H2O
Na2-EDTA·2H2O
|
0,17
0,28
|
0,84
1,4
|
Fe
—
|
0,17
—
|
|
VII
|
MOPS (buffer)
|
490
|
490
|
—
|
—
|
|
|
—
|
Voor de bereiding van één liter SIS-medium wordt aan 900 ml gedeïoniseerd water toegevoegd:
|
—
|
1 ml stamoplossing VII (facultatief)
|
NB: Stamoplossing VII (MOPS-buffer) kan voor bepaalde teststoffen nodig zijn (zie de laatste alinea van punt 1.4).
|
|
—
|
De pH wordt met 0,1 M of 1 M HCl of NaOH op 6,5 ± 0,2 gebracht en het volume wordt met gedeïoniseerd water aangevuld tot 1 liter.
|
Groeimedium 20X-AAP
De stamoplossingen worden bereid in steriel gedestilleerd of gedeïoniseerd water.
De steriele stamoplossingen moeten koel en in het donker worden bewaard. Onder deze omstandigheden kunnen de stamoplossingen ten minste 6-8 weken worden bewaard.
Voor het medium 20X-AAP worden vijf nutriënt-stamoplossingen gemaakt (A1, A2, A3, B en C), waarbij p.a. reagentia worden gebruikt. Voor de bereiding van het groeimedium wordt 20 ml van elke nutriënt-stamoplossing toegevoegd aan ongeveer 850 ml gedeïoniseerd water. De pH wordt met 0,1 M of 1 M HCl of NaOH op 7,5 ± 0,1 gebracht en het volume wordt met gedeïoniseerd water aangevuld tot 1 liter. Vervolgens wordt het medium over een (ongeveer) 0,2 μm membraanfilter in een steriele fles gefiltreerd.
Het groeimedium voor de test moet 1-2 dagen vóór gebruik worden bereid, zodat de pH kan stabiliseren. De pH van het groeimedium moet vóór gebruik worden gecontroleerd en indien nodig met 0,1 M of 1 M HCl of NaOH worden aangepast, zoals hierboven is beschreven.
|
Stamoplossing nr.
|
Stof
|
Concentratie in stamoplossing (g·l–1) (1)
|
Concentratie in bereid medium (mg·l–1) (1)
|
Bereid medium
|
|
Element
|
Concentratie (mg·l–1) (1)
|
|
A1
|
NaNO3
MgCl2·6H2O
CaCl2·2H2O
|
26
12
4,4
|
510
240
90
|
Na; N
Mg
Ca
|
190; 84
58,08
24,04
|
|
A2
|
MgSO4·7H2O
|
15
|
290
|
S
|
38,22
|
|
A3
|
K2HPO4·3H2O
|
1,4
|
30
|
K; P
|
9,4;3,7
|
|
B
|
H3BO3
MnCl2·4H2O
FeCl3·6H2O
Na2EDTA·2H2O
ZnCl2
CoCl2·6H2O
Na2MoO4·2H2O
CuCl2·2H2O
|
0,19
0,42
0,16
0,30
3,3 mg·l–1
1,4 mg·l–1
7,3 mg·l–1
0,012 mg·l–1
|
3,7
8,3
3,2
6,0
66 μg·l–1
29 μg·l–1
145 μg·l–1
0,24 μg·l–1
|
B
Mn
Fe
—
Zn
Co
Mo
Cu
|
0,65
2,3
0,66
—
31 μg·l–1
7,1 μg·l–1
58 μg·l–1
0,080 μg·l–1
|
|
C
|
NaHCO3
|
15
|
300
|
Na; C
|
220; 43
|
NB: De theoretisch juiste uiteindelijke bicarbonaat-concentratie (waarbij de pH niet significant hoeft te worden aangepast) is 15 mg/l en niet 300 mg/l. In het verleden, en ook bij de rondzendproef voor deze test, is het medium 20X-AAP echter altijd gebruikt met 300 mg/l. bicarbonaat (I. Sims, P. Whitehouse and R. Lacey. (1999): The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc — Environment Agency).
STEINBERG-medium (volgens ISO 20079)
Concentraties en stamoplossingen
|
—
|
Het gewijzigde Steinberg-medium wordt in ISO 20079 alleen voor Lemna minor gebruikt (aangezien daar alleen Lemna minor wordt toegestaan), maar uit tests is gebleken dat ook met Lemna gibba goede resultaten te verkrijgen zijn.
|
|
—
|
Bij de bereiding van het medium moeten p.a. reagentia en gedeïoniseerd water worden gebruikt.
|
|
—
|
Het nutriëntmedium wordt bereid uit stamoplossingen of het 10-voudig geconcentreerde medium, dat een maximale concentratie van het medium mogelijk maakt zonder dat er een neerslag ontstaat.
|
Tabel 1:
pH-gestabiliseerd STEINBERG-medium (gewijzigd volgens Altenburger)
|
Stof
|
Nutriëntmedium
|
|
Macro-elementen
|
mol.gewicht
|
mg/l
|
mmol/l
|
|
KNO3
|
101,12
|
350,00
|
3,46
|
|
Ca(NO3)2 · 4H2O
|
236,15
|
295,00
|
1,25
|
|
KH2PO4
|
136,09
|
90,00
|
0,66
|
|
K2HPO4
|
174,18
|
12,60
|
0,072
|
|
MgSO4 · 7H2O
|
246,37
|
100,00
|
0,41
|
|
Micro-elementen
|
mol.gewicht
|
µg/l
|
µmol/l
|
|
H3BO3
|
61,83
|
120,00
|
1,94
|
|
ZnSO4 · 7H2O
|
287,43
|
180,00
|
0,63
|
|
Na2MoO4 · 2H2O
|
241,92
|
44,00
|
0,18
|
|
MnCl2 · 4H2O
|
197,84
|
180,00
|
0,91
|
|
FeCl3 · 6H2O
|
270,21
|
760,00
|
2,81
|
|
Dinatrium-EDTA, dihydraat
|
372,24
|
1 500,00
|
4,03
|
Tabel 2:
Stamoplossingen (macro-elementen)
|
1.
|
Macro-elementen (50-voudig geconcentreerd)
|
|
g/l
|
|
Stamoplossing 1:
|
|
KNO3
|
17,50
|
|
KH2PO4
|
4,5
|
|
K2HPO4
|
0,63
|
|
Stamoplossing 2:
|
|
MgSO4 · 7H2O
|
5,00
|
|
Stamoplossing 3:
|
|
Ca(NO3)2 · 4H2O
|
14,75
|
Tabel 3:
Stamoplossingen (micro-elementen)
|
2.
|
Micro-elementen (1 000-voudig geconcentreerd)
|
|
mg/l
|
|
Stamoplossing 4:
|
|
H3BO3
|
120,0
|
|
Stamoplossing 5:
|
|
ZnSO4 · 7H2O
|
180,0
|
|
Stamoplossing 6:
|
|
Na2MoO4 · 2H2O
|
44,0
|
|
Stamoplossing 7:
|
|
MnCl2 · 4H2O
|
180,0
|
|
Stamoplossing 8:
|
|
FeCl3 · 6H2O
|
760,00
|
|
Dinatrium-EDTA, dihydraat
|
1 500,00
|
|
—
|
De stamoplossingen 2 en 3 en (apart) 4 tot en met 7 kunnen worden gecombineerd (rekening houdend met de vereiste concentraties).
|
|
—
|
Om de stamoplossingen langer te kunnen bewaren kunnen ze 20 minuten bij 121 °C in een autoclaaf worden behandeld of steriel worden gefiltreerd (0,2 µm). Voor stamoplossing 8 wordt steriele filtratie (0,2 µm) sterk aanbevolen.
|
Bereiding van het (gewijzigde) STEINBERG-medium in de uiteindelijke concentratie
|
—
|
Voeg 20 ml van de stamoplossingen 1, 2 en 3 (zie tabel 2) toe aan ongeveer 900 ml gedeïoniseerd water om neerslaan te voorkomen.
|
|
—
|
Voeg 1,0 ml van de stamoplossingen 4, 5, 6, 7 en 8 toe (zie tabel 3).
|
|
—
|
De pH moet nu 5,5 ± 0,2 zijn (eventueel aanpassen met een minimaal volume verdund NaOH of HCl).
|
|
—
|
Vul met water aan tot 1 000 ml.
|
|
—
|
Als de stamoplossingen gesteriliseerd waren en geschikt water is gebruikt, is verdere sterilisatie niet nodig. Als de sterilisatie met het uiteindelijke medium wordt uitgevoerd, moet stamoplossing 8 na de behandeling in de autoclaaf (20 minuten bij 121 °C) worden toegevoegd.
|
Bereiding van het 10-voudig geconcentreerde (gewijzigde) STEINBERG-medium om tijdelijk te bewaren
|
—
|
Voeg 20 ml van de stamoplossingen 1, 2 en 3 (zie tabel 2) toe aan ongeveer 30 ml gedeïoniseerd water om neerslaan te voorkomen.
|
|
—
|
Voeg 1,0 ml van de stamoplossingen 4, 5, 6, 7 en 8 toe (zie tabel 3). Vul met water aan tot 100 ml.
|
|
—
|
Als de stamoplossingen gesteriliseerd waren en geschikt water is gebruikt, is verdere sterilisatie niet nodig. Als de sterilisatie met het uiteindelijke medium wordt uitgevoerd, moet stamoplossing 8 na de behandeling in de autoclaaf (20 minuten bij 121 °C) worden toegevoegd.
|
|
—
|
De pH van het medium (uiteindelijke concentratie) moet 5,5 ± 0,2 zijn.
|
(1) Tenzij anders vermeld.


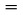



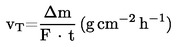

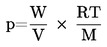













 (dag
(dag





