|
26.2.2009
|
NL
|
Publicatieblad van de Europese Unie
|
L 54/1
|
VERORDENING (EG) Nr. 152/2009 VAN DE COMMISSIE
van 27 januari 2009
tot vaststelling van de bemonsterings- en analysemethoden voor de officiële controle van diervoeders
(Voor de EER relevante tekst)
DE COMMISSIE VAN DE EUROPESE GEMEENSCHAPPEN,
Gelet op het Verdrag tot oprichting van de Europese Gemeenschap,
Gelet op Verordening (EG) nr. 882/2004 van het Europees Parlement en de Raad van 29 april 2004 inzake officiële controles op de naleving van de wetgeving inzake diervoeders en levensmiddelen en de voorschriften inzake diergezondheid en dierenwelzijn (1), en met name op artikel 11, lid 4, onder a), b) en c),
Overwegende hetgeen volgt:
|
(1)
|
De volgende besluiten, die zijn vastgesteld ter uitvoering van Richtlijn 70/373/EEG, zijn overeenkomstig artikel 61, lid 2, van Verordening (EG) nr. 882/2004 nog van kracht:
|
—
|
Eerste Richtlijn 71/250/EEG van de Commissie van 15 juni 1971 betreffende de vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van veevoeders (2);
|
|
—
|
Tweede Richtlijn 71/393/EEG van de Commissie van 18 november 1971 betreffende de vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van veevoeders (3);
|
|
—
|
Derde Richtlijn 72/199/EEG van de Commissie van 27 april 1972 betreffende de vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van veevoeders (4);
|
|
—
|
Vierde Richtlijn 73/46/EEG van de Commissie van 5 december 1972 houdende vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van veevoeders (5);
|
|
—
|
Eerste Richtlijn 76/371/EEG van de Commissie van 1 maart 1976 houdende vaststelling van gemeenschappelijke bemonsteringsmethoden voor de officiële controle van diervoeders (6);
|
|
—
|
Zevende Richtlijn 76/372/EEG van de Commissie van 1 maart 1976 houdende vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van diervoeders (7);
|
|
—
|
Achtste Richtlijn 78/633/EEG van de Commissie van 15 juni 1978 houdende vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van diervoeders (8);
|
|
—
|
Negende Richtlijn 81/715/EEG van de Commissie van 31 juli 1981 houdende vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van diervoeders (9);
|
|
—
|
Tiende Richtlijn 84/425/EEG van de Commissie van 25 juli 1984 houdende vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van diervoeders (10);
|
|
—
|
Richtlijn 86/174/EEG van de Commissie van 9 april 1986 tot vaststelling van de methode voor de berekening van de energiewaarde van mengvoeders voor pluimvee (11);
|
|
—
|
Elfde Richtlijn 93/70/EEG van de Commissie van 28 juli 1993 tot vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van diervoeders (12);
|
|
—
|
Twaalfde Richtlijn 93/117/EG van de Commissie van 17 december 1993 tot vaststelling van gemeenschappelijke analysemethoden voor de officiële controle van diervoeders (13);
|
|
—
|
Richtlijn 98/64/EG van de Commissie van 3 september 1998 tot vaststelling van communautaire analysemethoden voor de bepaling van aminozuren, ruwvet en olaquindox in diervoeders en houdende wijziging van Richtlijn 71/393/EEG (14);
|
|
—
|
Richtlijn 1999/27/EG van de Commissie van 20 april 1999 tot vaststelling van communautaire analysemethoden voor de bepaling van amprolium, diclazuril en carbadox in dierenvoeders, houdende wijziging van de Richtlijnen 71/250/EEG en 73/46/EEG en houdende intrekking van Richtlijn 74/203/EEG (15);
|
|
—
|
Richtlijn 1999/76/EG van de Commissie van 23 juli 1999 tot vaststelling van gemeenschappelijke analysemethoden voor de bepaling van het gehalte aan lasalocide-natrium van diervoeders (16);
|
|
—
|
Richtlijn 2000/45/EG van de Commissie van 6 juli 2000 tot vaststelling van communautaire analysemethoden voor de bepaling van vitamine A, vitamine E en tryptofaan in diervoeders (17);
|
|
—
|
Richtlijn 2002/70/EG van de Commissie van 26 juli 2002 tot vaststelling van voorschriften voor de gehaltebepaling van dioxinen en dioxineachtige pcb’s in diervoeders (18);
|
|
—
|
Richtlijn 2003/126/EG van de Commissie van 23 december 2003 inzake de analysemethoden voor de bepaling van bestanddelen van dierlijke oorsprong in het kader van de officiële controle van diervoeders (19).
|
|
|
(2)
|
Aangezien Richtlijn 70/373/EEG door Verordening (EG) nr. 882/2004 is vervangen, moeten de uitvoeringsbesluiten van die richtlijn door één verordening worden vervangen. Tegelijkertijd moeten de methoden worden aangepast aan de ontwikkeling van wetenschap en techniek. Methoden die niet meer aan het beoogde doel beantwoorden, moeten worden geschrapt. Het is de bedoeling de bemonsteringsvoorschriften te zijner tijd aan te passen aan recente ontwikkelingen in de wijze waarop diervoeders geproduceerd, opgeslagen, vervoerd en in de handel gebracht worden, maar vooralsnog moeten de huidige bemonsteringsvoorschriften van kracht blijven.
|
|
(3)
|
De Richtlijnen 71/250/EEG, 71/393/EEG, 72/199/EEG, 73/46/EEG, 76/371/EEG, 76/372/EEG, 78/633/EEG, 81/715/EEG, 84/425/EEG, 86/174/EEG, 93/70/EEG, 93/117/EG, 98/64/EG, 1999/27/EG, 1999/76/EG, 2000/45/EG, 2002/70/EG en 2003/126/EG moeten derhalve worden ingetrokken.
|
|
(4)
|
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid,
|
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De bemonstering voor de officiële controle van diervoeders in verband met de bepaling van de bestanddelen, toevoegingsmiddelen en ongewenste stoffen, met uitzondering van bestrijdingsmiddelenresiduen en micro-organismen, geschiedt volgens de in bijlage I beschreven methoden.
Artikel 2
Voor de voorbereiding van de monsters voor de analyse en de weergave van de resultaten worden de in bijlage II beschreven methoden gebruikt.
Artikel 3
De analyse voor de officiële controle van diervoeders wordt uitgevoerd met de methoden die worden beschreven in bijlage III (analysemethoden ter controle van de samenstelling van voedermiddelen en mengvoeders), bijlage IV (analysemethoden ter controle van het gehalte aan toegelaten toevoegingsmiddelen in diervoeders), bijlage V (analysemethoden voor de controle op ongewenste stoffen in diervoeders) en bijlage VI (analysemethoden voor de bepaling van bestanddelen van dierlijke oorsprong in het kader van de officiële controle van diervoeders).
Artikel 4
De energiewaarde van mengvoeders voor pluimvee wordt berekend overeenkomstig bijlage VII.
Artikel 5
De in bijlage VIII beschreven analysemethoden voor de controle op de illegale aanwezigheid van niet meer toegelaten toevoegingsmiddelen in diervoeders worden ter bevestiging gebruikt.
Artikel 6
De Richtlijnen 71/250/EEG, 71/393/EEG, 72/199/EEG, 73/46/EEG, 76/371/EEG, 76/372/EEG, 78/633/EEG, 81/715/EEG, 84/425/EEG, 86/174/EEG, 93/70/EEG, 93/117/EG, 98/64/EG, 1999/27/EG, 1999/76/EG, 2000/45/EG, 2002/70/EG en 2003/126/EG worden ingetrokken.
Verwijzingen naar de ingetrokken richtlijnen gelden als verwijzingen naar deze verordening en worden gelezen volgens de concordantietabel in bijlage IX.
Artikel 7
Deze verordening treedt in werking op de twintigste dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Zij is van toepassing met ingang van 26 augustus 2009.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 27 januari 2009.
Voor de Commissie
Androulla VASSILIOU
Lid van de Commissie
(1) PB L 165 van 30.4.2004, blz. 1; gerectificeerd in PB L 191 van 28.5.2004, blz. 1.
(2) PB L 155 van 12.7.1971, blz. 13.
(3) PB L 279 van 20.12.1971, blz. 7.
(4) PB L 123 van 29.5.1972, blz. 6.
(5) PB L 83 van 30.3.1973, blz. 21.
(6) PB L 102 van 15.4.1976, blz. 1.
(7) PB L 102 van 15.4.1976, blz. 8.
(8) PB L 206 van 29.7.1978, blz. 43.
(9) PB L 257 van 10.9.1981, blz. 38.
(10) PB L 238 van 6.9.1984, blz. 34.
(11) PB L 130 van 16.5.1986, blz. 53.
(12) PB L 234 van 17.9.1993, blz. 17.
(13) PB L 329 van 30.12.1993, blz. 54.
(14) PB L 257 van 19.9.1998, blz. 14.
(15) PB L 118 van 6.5.1999, blz. 36.
(16) PB L 207 van 6.8.1999, blz. 13.
(17) PB L 174 van 13.7.2000, blz. 32.
(18) PB L 209 van 6.8.2002, blz. 15.
(19) PB L 339 van 24.12.2003, blz. 78.
BIJLAGE I
BEMONSTERINGSMETHODEN
1. DOEL EN TOEPASSINGSGEBIED
De monsters voor de officiële controle van diervoeders worden genomen volgens de hierna beschreven methoden. De aldus verkregen monsters worden representatief geacht voor de bemonsterde partijen.
2. BEMONSTERAARS
De monsters worden genomen door personen die daartoe door de lidstaten zijn gemachtigd.
3. DEFINITIES
Partij: hoeveelheid van een product die een eenheid vormt, en waarvan aangenomen wordt dat zij uniforme kenmerken bezit.
Basismonster: een hoeveelheid die op een bepaald punt uit de partij is genomen.
Verzamelmonster: het geheel van basismonsters van dezelfde partij.
Deelmonster: een gedeelte dat representatief is voor het verzamelmonster en dat wordt verkregen door verkleinen van dat monster.
Eindmonster: een gedeelte van het deelmonster of van het gehomogeniseerde verzamelmonster.
4. APPARATUUR
|
4.1.
|
De bemonsteringsapparatuur moet zijn vervaardigd uit materiaal dat de te bemonsteren producten niet verontreinigt. Deze apparatuur kan door de lidstaten worden goedgekeurd.
|
4.2. Aanbevolen apparatuur voor de bemonstering van vaste diervoeders
4.2.1. Handmatige bemonstering
|
4.2.1.1.
|
Schop met platte bodem en verticale randen
|
|
4.2.1.2.
|
Boor met lange gleuf of met een in vakken ingedeelde gleuf. De afmetingen van de boor moeten zijn aangepast aan de kenmerken van de partij (diepte van de verpakking, afmetingen van de zak enz.) en aan de grootte van de deeltjes waaruit het diervoeder is samengesteld.
|
4.2.2. Mechanische bemonstering
Voor de bemonstering van diervoeders die in beweging zijn, mag gebruik worden gemaakt van goedgekeurde mechanische apparaten.
4.2.3. Monsterverdeler
Voor het nemen van basismonsters, alsmede voor de bereiding van deelmonsters en van eindmonsters, mag gebruik worden gemaakt van apparaten waarmee het monster in ongeveer gelijke delen kan worden verdeeld.
5. KWANTITATIEVE VEREISTEN
|
5.A.
|
Voor de controle van stoffen of producten die gelijkmatig in het diervoeder verdeeld zijn
|
|
5.A.1.
|
Partij
De grootte van de partij moet zodanig zijn dat ieder deel van deze partij kan worden bemonsterd.
|
|
5.A.2.
|
Basismonsters
|
|
5.A.2.1.
|
Onverpakte diervoeders:
|
Minimumaantal basismonsters:
|
|
5.A.2.1.1.
|
partijen van niet meer dan 2,5 ton
|
zeven
|
|
5.A.2.1.2.
|
partijen van meer dan 2,5 ton
|
√ 20 maal het aantal ton waaruit de partij is samengesteld (1), tot maximaal 40 basismonsters
|
|
5.A.2.2.
|
Verpakte diervoeders:
|
Minimumaantal te bemonsteren verpakkingen (2):
|
|
5.A.2.2.1.
|
Verpakkingen met een inhoud van meer dan 1 kg:
|
|
5.A.2.2.1.1.
|
partijen samengesteld uit 1-4 verpakkingen
|
alle verpakkingen
|
|
5.A.2.2.1.2.
|
partijen samengesteld uit 5-16 verpakkingen
|
vier
|
|
5.A.2.2.1.3.
|
partijen samengesteld uit meer dan 16 verpakkingen
|
√ het aantal verpakkingen waaruit de partij is samengesteld (1), tot maximaal 20 verpakkingen
|
|
5.A.2.2.2.
|
Verpakkingen met een inhoud van niet meer dan 1 kg
|
vier
|
|
5.A.2.3.
|
Vloeibare of halfvloeibare diervoeders:
|
Minimumaantal te bemonsteren verpakkingen (2):
|
|
5.A.2.3.1.
|
Recipiënten met een inhoud van meer dan 1 liter:
|
|
5.A.2.3.1.1.
|
partijen samengesteld uit 1-4 recipiënten
|
alle recipiënten
|
|
5.A.2.3.1.2.
|
partijen samengesteld uit 5-16 recipiënten
|
vier
|
|
5.A.2.3.1.3.
|
partijen samengesteld uit meer dan 16 recipiënten
|
√ het aantal recipiënten waaruit de partij is samengesteld (1), tot maximaal 20 recipiënten
|
|
5.A.2.3.2.
|
Recipiënten met een inhoud van niet meer dan 1 liter
|
vier
|
|
5.A.2.4.
|
Voederblokken en likstenen
|
Minimumaantal te bemonsteren blokken of likstenen (2):
één blok of liksteen per partij van 25 eenheden, tot maximaal vier blokken of likstenen.
|
|
5.A.3.
|
Verzamelmonster
Per partij is één verzamelmonster vereist. De totale massa van de basismonsters die samen het verzamelmonster vormen, mag niet lager zijn dan de hierna vermelde hoeveelheden:
|
|
5.A.3.1.
|
Onverpakte diervoeders
|
4 kg
|
|
5.A.3.2.
|
Verpakte diervoeders:
|
|
|
5.A.3.2.1.
|
verpakkingen met een inhoud van meer dan 1 kg
|
4 kg
|
|
5.A.3.2.2.
|
verpakkingen met een inhoud van niet meer dan 1 kg
|
massa van de inhoud van vier oorspronkelijke verpakkingen
|
|
5.A.3.3.
|
Vloeibare of halfvloeibare diervoeders:
|
|
|
5.A.3.3.1.
|
recipiënten met een inhoud van meer dan 1 liter
|
4 liter
|
|
5.A.3.3.2.
|
recipiënten met een inhoud van niet meer dan 1 liter
|
volume van de inhoud van vier oorspronkelijke recipiënten
|
|
5.A.3.4.
|
Voederblokken en likstenen:
|
|
5.A.3.4.1.
|
met een massa van meer dan 1 kg per stuk
|
4 kg
|
|
5.A.3.4.2.
|
met een massa van niet meer dan 1 kg per stuk
|
massa van vier oorspronkelijke blokken of likstenen
|
|
5.A.4.
|
Eindmonsters
Na eventuele verkleining worden uit het verzamelmonster eindmonsters verkregen. Er moet ten minste één eindmonster worden geanalyseerd. Het voor de analyse bestemde eindmonster omvat minimaal:
|
|
|
vaste diervoeders
|
500 g
|
|
|
vloeibare of halfvloeibare diervoeders
|
500 ml
|
|
5.B.
|
Voor de controle van ongewenste stoffen of producten die waarschijnlijk niet gelijkmatig in het diervoeder verdeeld zijn, zoals aflatoxinen, moederkoren, ricinus en crotalaria in voedermiddelen (3)
|
|
5.B.1.
|
Partij: zie 5.A.1.
|
|
5.B.2.
|
Basismonsters
|
|
5.B.2.1.
|
Onverpakte diervoeders: zie 5.A.2.1.
|
|
5.B.2.2.
|
Verpakte diervoeders:
|
Minimumaantal te bemonsteren verpakkingen:
|
|
5.B.2.2.1.
|
partijen samengesteld uit 1-4 verpakkingen
|
alle verpakkingen
|
|
5.B.2.2.2.
|
partijen samengesteld uit 5-16 verpakkingen
|
vier
|
|
5.B.2.2.3.
|
partijen samengesteld uit meer dan 16 verpakkingen
|
√ het aantal verpakkingen waaruit de partij is samengesteld (1), tot maximaal 40 verpakkingen
|
|
5.B.3.
|
Verzamelmonsters
Het aantal verzamelmonsters hangt af van de grootte van de partij. Het minimumaantal verzamelmonsters per partij staat hieronder vermeld. De totale massa van de basismonsters die samen een verzamelmonster vormen, mag niet kleiner zijn dan 4 kg.
|
|
5.B.3.1.
|
Onverpakte diervoeders
|
|
|
|
Massa van de partij in ton:
|
Minimumaantal verzamelmonsters per partij:
|
|
|
niet meer dan 1
|
1
|
|
|
meer dan 1 en niet meer dan 10
|
2
|
|
|
meer dan 10 en niet meer dan 40
|
3
|
|
|
meer dan 40
|
4
|
|
5.B.3.2.
|
Verpakte diervoeders
|
|
|
|
Aantal verpakkingen waaruit de partij is samengesteld:
|
Minimumaantal verzamelmonsters per partij:
|
|
|
1 tot en met 16
|
1
|
|
|
17 tot en met 200
|
2
|
|
|
201 tot en met 800
|
3
|
|
|
meer dan 800
|
4
|
|
5.B.4.
|
Eindmonsters
Na verkleining worden uit het verzamelmonster eindmonsters verkregen. Er moet ten minste één eindmonster per verzamelmonster worden geanalyseerd. De massa van het voor de analyse bestemde monster mag niet minder bedragen dan 500 g.
|
6. INSTRUCTIES BETREFFENDE DE BEMONSTERING, DE BEREIDING EN DE VERPAKKING VAN DE MONSTERS
6.1. Algemeen
De monsters moeten zo snel mogelijk worden genomen en bereid, met inachtneming van de voorzorgsmaatregelen die vereist zijn om verandering of verontreiniging van het product te voorkomen. De bemonsteringsapparatuur alsmede de oppervlakken en recipiënten die bestemd zijn voor de monsters moeten schoon en droog zijn.
6.2. Basismonsters
6.2.A. Voor de controle van stoffen of producten die gelijkmatig in het diervoeder verdeeld zijn
De basismonsters moeten op willekeurige wijze uit de gehele partij worden genomen. De massa of het volume daarvan moet ongeveer gelijk zijn.
6.2.A.1. Onverpakte diervoeders
De partij wordt op denkbeeldige wijze in een aantal ongeveer gelijke delen verdeeld. Op willekeurige wijze wordt een aantal delen gekozen overeenkomstig het aantal onder 5.A.2 vermelde basismonsters en er wordt minstens één monster uit elk van deze delen genomen.
Eventueel kunnen de monsters worden getrokken wanneer de partij in beweging wordt gebracht (laden of lossen).
6.2.A.2. Verpakte diervoeders
Nadat het vereiste aantal te bemonsteren verpakkingen genomen is, zoals in 5.A.2 is aangegeven, wordt uit de inhoud van elke verpakking met een boor of een schop een gedeelte genomen. Eventueel worden de monsters genomen nadat de verpakkingen afzonderlijk zijn geledigd. In elk verzamelmonster worden klonters zo nodig fijngemaakt en weer aan het monster toegevoegd.
6.2.A.3. Vloeibare of halfvloeibare homogene of homogeniseerbare diervoeders
Nadat het vereiste aantal te bemonsteren recipiënten gekozen is, zoals in 5.A.2 is aangegeven, wordt uit elke recipiënt een monster genomen nadat zo nodig de inhoud ervan gehomogeniseerd is.
De basismonsters kunnen eventueel worden genomen bij het aftappen van het product.
6.2.A.4. Vloeibare of halfvloeibare, niet-homogeniseerbare diervoeders
Nadat het vereiste aantal te bemonsteren recipiënten genomen is, zoals in 5.A.2 is aangegeven, worden op verschillende niveaus monsters genomen.
De monsters mogen ook worden genomen bij het aftappen van het product, na de eerste fracties ervan te hebben verwijderd.
In beide gevallen mag het totale volume van de monsters niet minder dan 10 liter bedragen.
6.2.A.5. Voederblokken en likstenen
Nadat het vereiste aantal te bemonsteren blokken of likstenen genomen is, zoals in 5.A.2 is aangegeven, wordt een gedeelte van elk blok of elke liksteen genomen.
6.2.B. Voor de controle van ongewenste stoffen of producten die waarschijnlijk niet gelijkmatig in het diervoeder verdeeld zijn, zoals aflatoxinen, moederkoren, ricinus en crotalaria in voedermiddelen
De partij wordt op denkbeeldige wijze in een aantal ongeveer gelijke delen verdeeld overeenkomstig het aantal in 5.B.3 vermelde verzamelmonsters. Wanneer dit aantal meer dan één bedraagt, wordt het totaal aantal in 5.B.2 voorgeschreven basismonsters op ongeveer gelijke wijze over de verschillende delen verdeeld. Vervolgens worden ongeveer gelijke hoeveelheden genomen (4), zodanig dat de totale massa van de monsters van elk deel niet minder bedraagt dan de minimumhoeveelheid van 4 kg die vereist is voor elk verzamelmonster. De basismonsters afkomstig van verschillende delen mogen niet worden samengevoegd.
6.3. Bereiding van de verzamelmonsters
6.3.A. Voor de controle van stoffen of producten die gelijkmatig in het diervoeder zijn verdeeld
De ondermonsters worden samengevoegd zodat één verzamelmonster wordt verkregen.
6.3.B. Voor de controle van ongewenste stoffen of producten die waarschijnlijk niet gelijkmatig in het diervoeder verdeeld zijn, zoals aflatoxinen, moederkoren, ricinus en crotalaria in voedermiddelen
De van elk gedeelte van de partij afkomstige basismonsters worden samengevoegd en het in 5.B.3 voorgeschreven aantal verzamelmonsters wordt gevormd, waarbij ervoor moet worden gezorgd dat de herkomst van elk verzamelmonster wordt vermeld.
6.4. Bereiding van de eindmonsters
Elk verzamelmonster wordt zorgvuldig gemengd zodat een homogeen monster wordt verkregen (5). Zo nodig wordt het verzamelmonster eerst tot ten minste 2 kg of 2 liter (deelmonster) verkleind met een mechanische of automatische monsterverdeler of door kwarteren.
Vervolgens worden minstens drie laboratoriummonsters met ongeveer dezelfde massa of hetzelfde volume bereid, die aan de in 5.A.4 of 5.B.4 vermelde kwantitatieve eisen beantwoorden. Elk monster moet in een daartoe geschikte recipiënt worden overgebracht. Alle nodige voorzorgen moeten worden genomen om elke wijziging in de samenstelling van het monster of elke verontreiniging of verandering die tijdens het vervoer of de opslag kan plaatsvinden, te voorkomen.
6.5. Verpakking van de eindmonsters
De recipiënten of verpakkingen worden zodanig verzegeld en geëtiketteerd (het etiket moet deel uitmaken van het zegel) dat het onmogelijk is deze te openen zonder het zegel te beschadigen.
7. BEMONSTERINGSRAPPORT
Voor elke monsterneming wordt een bemonsteringsrapport opgesteld aan de hand waarvan de bemonsterde partij op ondubbelzinnige wijze kan worden geïdentificeerd.
8. BESTEMMING VAN DE MONSTERS
Voor elk verzamelmonster wordt ten minste één eindmonster zo spoedig mogelijk naar het met de analyse belaste laboratorium gezonden, tezamen met de voor de analist noodzakelijke gegevens.
(1) Indien de uitkomst een gebroken getal is, moet dit getal op het eerstvolgende hogere gehele getal worden afgerond.
(2) Voor verpakkingen of recipiënten met een inhoud van niet meer dan 1 kg of 1 liter en voor blokken of likstenen met een massa van niet meer dan 1 kg per stuk, bestaat het basismonster uit de inhoud van één oorspronkelijke verpakking of recipiënt, dan wel één blok of liksteen.
(3) De onder 5.A beschreven methoden worden gebruikt voor de controle op aflatoxinen, moederkoren, ricinus en crotalaria in volledige en aanvullende diervoeders.
(4) Voor verpakte diervoeders wordt uit de inhoud van elke verpakking met behulp van een boor of schop een gedeelte genomen, zo nodig nadat de verpakkingen elk afzonderlijk zijn geleegd.
(5) In elk verzamelmonster worden klonters zo nodig fijngemaakt en weer aan het monster toegevoegd.
BIJLAGE II
ALGEMENE BEPALINGEN BETREFFENDE ANALYSEMETHODEN VOOR DIERVOEDERS
A. VOORBEREIDING VAN MONSTERS VOOR DE ANALYSE
1. Doel
De hieronder beschreven werkwijzen hebben betrekking op het voor de analyse gereedmaken van de naar de controlelaboratoria gezonden eindmonsters nadat de bemonstering overeenkomstig bijlage I heeft plaatsgevonden.
Deze monsters worden zodanig voorbereid dat de voor de uitvoering van de analysemethoden afgewogen hoeveelheden homogeen zijn en representatief voor de eindmonsters.
2. Voorzorgsmaatregelen
De voor de monstervoorbereiding te volgen werkwijze hangt af van de analysemethode. Het is dus van groot belang dat de gevolgde werkwijze geschikt is voor de gebruikte analysemethode.
Alle noodzakelijke bewerkingen moeten zodanig worden uitgevoerd dat verontreiniging van het monster en verandering in de samenstelling ervan zo veel mogelijk worden vermeden.
Het malen, mengen en zeven moet zo snel mogelijk gebeuren onder zo gering mogelijke blootstelling van het monster aan lucht en licht. Vermijd het gebruik van maaltoestellen die het monster aanmerkelijk kunnen verwarmen.
Voor diervoeders die bijzonder gevoelig zijn voor warmte wordt malen met de hand aanbevolen. Ook moet er voor gewaakt worden dat het maaltoestel zelf niet de oorzaak van verontreiniging met sporenelementen vormt.
Als de monstervoorbereiding niet kan worden uitgevoerd zonder dat het vochtgehalte van het monster daardoor sterk verandert, moet het vochtgehalte vóór en na de voorbereiding worden bepaald volgens de methode van deel A van bijlage III.
3. Werkwijze
Verdeel het monster in geschikte deelmonsters voor analyse- en referentiedoeleinden door middel van geschikte monsterverdelingsmethoden, zoals met een schep verdelen, statisch spleetverdelen of roterend verdelen. Kwarteren wordt niet aanbevolen omdat dit tot grote fouten in de deelmonsters kan leiden. Bewaar het referentiemonster in een geschikt schoon en droog vat, dat voorzien is van een luchtdichte stop, en bereid deelmonsters voor de analyse van ten minste 100 g zoals hieronder beschreven.
3.1. Diervoeders die als zodanig gemalen kunnen worden
Zeef, tenzij in de analysemethode anders is aangegeven, het hele monster door een zeef met mazen van 1 mm (overeenkomstig ISO-aanbeveling R565), zo nodig na malen. Maal niet te fijn.
Meng het gezeefde monster en doe het in een geschikt schoon en droog vat, dat voorzien is van een luchtdichte stop. Meng nogmaals, vlak voor de hoeveelheid voor analyse wordt afgewogen.
3.2. Diervoeders die na drogen gemalen kunnen worden
Droog het monster, tenzij in de analysemethoden anders is aangegeven, zo ver dat het vochtgehalte tot 8-12 % is teruggebracht, overeenkomstig de voordroogmethode zoals beschreven in punt 4.3 van de in bijlage III, deel A, opgenomen vochtbepalingsmethode. Ga dan verder te werk als in paragraaf 3.1.
3.3. Vloeibare of halfvloeibare diervoeders
Verzamel het monster is een geschikt schoon en droog vat, dat voorzien is van een luchtdichte stop. Meng het grondig, vlak voor de hoeveelheid voor analyse wordt afgewogen.
3.4. Andere diervoeders
Monsters die niet volgens een van de bovenstaande methoden kunnen worden bereid, moeten worden behandeld volgens een andere werkwijze, die zodanig is dat in ieder geval de voor de analyse afgewogen hoeveelheden homogeen zijn en representatief voor de eindmonsters.
4. Bewaren van monsters
Bewaar de monsters bij een temperatuur die hun samenstelling niet zal beïnvloeden. Monsters die bestemd zijn voor de analyse van vitaminen of producten die bijzonder gevoelig zijn voor licht moeten worden bewaard in bruine glazen vaten.
B. BEPALINGEN BETREFFENDE IN DE ANALYSEMETHODEN GEBRUIKTE REAGENTIA EN APPARATUUR
|
1.
|
Tenzij in de analysemethoden anders is aangegeven, moeten alle voor de analyse gebruikte reagentia analytisch zuiver zijn (p.a.). Bij het bepalen van sporenelementen moet de zuiverheid van de reagentia gecontroleerd worden door een blancoproef. Afhankelijk van de verkregen uitkomst kan verdergaande zuivering van de reagentia nodig zijn.
|
|
2.
|
Elke in de analysemethoden genoemde handeling waar het gaat om bereiding van oplossingen, verdunning, spoelen of wassen, zonder dat de aard van het gebruikte oplosmiddel is aangegeven, houdt in dat water moet worden gebruikt. Als algemene regel geldt dat water moet zijn gedemineraliseerd of gedestilleerd. In bepaalde gevallen, die in de analysemethoden nader worden aangegeven, moet het een speciale zuiveringsbehandeling hebben ondergaan.
|
|
3.
|
Van de standaardapparatuur die normaal in de controlelaboratoria aanwezig is, worden alleen speciale instrumenten en toestellen of apparatuur waaraan bijzondere eisen zijn gesteld in de analysemethoden vermeld. Deze moeten schoon zijn, vooral wanneer het gaat om de bepaling van kleine hoeveelheden stof.
|
C. TOEPASSING VAN ANALYSEMETHODEN EN WEERGAVE VAN DE RESULTATEN
1. Extractieprocedure
In verscheidene methoden wordt een specifieke extractieprocedure genoemd. In de regel mogen ook andere extractieprocedures worden gebruikt, mits bewezen is dat de gevolgde procedure voor de geanalyseerde matrix hetzelfde extractierendement heeft als de in de methode genoemde procedure.
2. Clean-upprocedure
In verscheidene methoden wordt een specifieke clean-upprocedure genoemd. In de regel mogen ook andere clean-upprocedures worden gebruikt, mits bewezen is dat de gevolgde procedure voor de geanalyseerde matrix dezelfde analyseresultaten geeft als de in de methode genoemde procedure.
3. Vermelding van de gebruikte analysemethode
In het algemeen wordt voor de bepaling van elke stof in diervoeders één analysemethode vastgesteld. Wanneer er meer methoden zijn opgegeven, moet de door het controlelaboratorium gebruikte methode in het analyserapport worden aangegeven.
4. Aantal bepalingen
Het in het analyserapport vermelde resultaat is de gemiddelde waarde uit ten minste twee, op aparte porties van het monster uitgevoerde bepalingen, met voldoende herhaalbaarheid.
Als echter bij de analyse op ongewenste stoffen het resultaat van de eerste bepaling significant (> 50 %) onder de te controleren specificatie ligt, zijn verdere bepalingen niet nodig, mits adequate kwaliteitszorgprocedures zijn gevolgd.
Als bij de controle van het opgegeven gehalte van een stof of ingrediënt de uitslag van de eerste bepaling het opgegeven gehalte bevestigt, d.w.z. de uitslag ligt binnen de tolerantiegrenzen voor het opgegeven gehalte, zijn verdere bepalingen niet nodig, mits adequate kwaliteitszorgprocedures zijn gevolgd.
In sommige gevallen zijn deze tolerantiegrenzen in wetgeving vastgelegd, bijvoorbeeld in Richtlijn 79/373/EEG van de Raad (1).
5. Weergave van het analyseresultaat
Het analyseresultaat moet worden opgegeven op de in de analysemethode vastgelegde wijze, met een passend aantal significante cijfers en waarbij zo nodig rekening wordt gehouden met het vochtgehalte van het eindmonster voor de behandeling.
6. Meetonzekerheid en terugvindingspercentage bij de analyse van ongewenste stoffen
Voor ongewenste stoffen in de zin van Richtlijn 2002/32/EG, met inbegrip van dioxinen en dioxineachtige pcb's, wordt een product dat bedoeld is voor het voederen van dieren als niet in overeenstemming met het vastgestelde maximumgehalte beschouwd als het resultaat van de analyse dat maximumgehalte overschrijdt, met inachtneming van de uitgebreide meetonzekerheid en de correctie voor terugvinding. Aan de hand van de gemeten concentratie, gecorrigeerd voor terugvinding en na aftrek van de uitgebreide meetonzekerheid, wordt nagegaan of aan het maximumgehalte wordt voldaan. Deze werkwijze geldt alleen als de meetonzekerheid en de correctie voor terugvinding voor de gebruikte analysemethode kunnen worden bepaald (dus bijvoorbeeld niet voor microscopisch onderzoek).
Het analyseresultaat wordt als volgt weergegeven (voor zover de meetonzekerheid en het terugvindingspercentage voor de gebruikte analysemethode kunnen worden bepaald):
|
a)
|
gecorrigeerd voor de terugvinding, waarbij het terugvindingspercentage moet worden vermeld. De correctie voor terugvinding is niet nodig bij terugvindingspercentages tussen 90 en 110 %;
|
|
b)
|
als „x ± U”, waarbij x het analyseresultaat is en U de uitgebreide meetonzekerheid, met een dekkingsfactor 2, zodat een betrouwbaarheidsniveau van ongeveer 95 % wordt verkregen.
|
Als het analyseresultaat echter significant (> 50 %) onder de te controleren specificatie ligt, mag het analyseresultaat zonder correctie voor terugvinding worden opgegeven en mag de vermelding van het terugvindingspercentage en de meetonzekerheid achterwege blijven, mits adequate kwaliteitszorgprocedures zijn gevolgd en de analyse alleen tot doel heeft na te gaan of aan de wettelijke bepalingen is voldaan.
(1) PB L 86 van 6.4.1979, blz. 30.
BIJLAGE III
ANALYSEMETHODEN TER CONTROLE VAN DE SAMENSTELLING VAN VOEDERMIDDELEN EN MENGVOEDERS
A. BEPALING VAN VOCHT
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vocht in diervoeders. Er wordt op gewezen dat in het geval van diervoeders die vluchtige stoffen, zoals organische zuren, bevatten bij de bepaling van het vochtgehalte ook een aanzienlijke hoeveelheid vluchtige stoffen wordt gemeten.
Dit voorschrift heeft geen betrekking op de analyse van melkproducten als voedermiddelen, van minerale stoffen en mengsels die overwegend uit mineralen bestaan, van dierlijke en plantaardige vetten en van oliehoudende zaden en vruchten.
2. Beginsel
Het monster wordt gedroogd onder bepaalde omstandigheden, die afhankelijk zijn van de aard van het diervoeder. Het massaverlies wordt door weging bepaald. Vaste diervoeders met een hoog vochtgehalte moeten eerst worden voorgedroogd.
3. Apparatuur
|
3.1.
|
Molen van een materiaal dat geen vocht absorbeert, die gemakkelijk te reinigen is en waarmee snel en gelijkmatig kan worden gemalen zonder noemenswaardig warmte op te wekken, die zo goed mogelijk kan worden afgesloten van de buitenlucht en voldoet aan de eisen genoemd onder 4.1.1 en 4.1.2 (bv. microkruisslagmolens, micromolens met waterkoeling, demonteerbare kogelmolens, langzaam lopende kogelmolens en molens met getande schijven).
|
|
3.2.
|
Analytische balans, nauwkeurigheid 1 mg.
|
|
3.3.
|
Droogschalen van roestbestendig metaal of van glas voorzien van een luchtdicht afsluitend deksel en met een zodanig nuttig oppervlak dat het monster kan worden uitgespreid tot ongeveer 0,3 g/cm2.
|
|
3.4.
|
Elektrische droogstoof met thermostaat (± 2 oC), waarmee de temperatuur snel kan worden geregeld en die goed ventileert (1).
|
|
3.5.
|
Elektrische vacuümdroogstoof met oliepomp, voorzien van een inrichting voor toevoer van gedroogde, warme lucht of voorzien van een droogmiddel (bv. calciumoxide).
|
|
3.6.
|
Exsiccator met dikke, geperforeerde plaat van metaal of porselein en met een effectief droogmiddel.
|
4. Werkwijze
|
NB
|
:
|
De in dit hoofdstuk beschreven handelingen moeten direct na het openen van de verpakking van de monsters worden uitgevoerd. De analyses moeten ten minste in duplo worden uitgevoerd.
|
4.1. Voorbereiding
4.1.1. Diervoeders met uitzondering van de onder 4.1.2 en 4.1.3 genoemde
Neem ten minste 50 g van het monster. Maak dit, zo nodig, op passende wijze fijn, zodanig dat veranderingen in het vochtgehalte worden voorkomen (zie 6).
4.1.2. Granen en grutten
Neem ten minste 50 g van het monster. Maal dit tot deeltjes van zodanige grootte dat ten minste 50 % ervan door een zeef van 0,5 mm gaat en dat niet meer dan 10 % blijft liggen op een zeef met ronde mazen van 1 mm.
4.1.3. Vloeibare of brijachtige diervoeders; diervoeders die in hoofdzaak bestaan uit vet
Neem ongeveer 25 g monster, tot op 10 mg nauwkeurig gewogen, voeg een passende hoeveelheid watervrij zand toe, tot op 10 mg nauwkeurig gewogen, en meng tot een homogeen product is verkregen.
4.2. Drogen
4.2.1. Diervoeders met uitzondering van de onder 4.2.2 en 4.2.3 genoemde
Weeg een droogschaal (3.3) met deksel tot op 1 mg nauwkeurig. Breng ongeveer 5 g van het monster, tot op 1 mg nauwkeurig gewogen, in de getarreerde droogschaal en spreid gelijkmatig uit. Plaats de droogschaal zonder deksel in een vooraf op 103 oC gebrachte droogstoof. Om te voorkomen dat de temperatuur te veel daalt, dient de droogschaal zo snel mogelijk in de droogstoof gebracht te worden. Laat gedurende 4 uur drogen, gerekend vanaf het tijdstip dat de stoof weer op een temperatuur van 103 oC is. Sluit na het openen van de stoof de droogschaal met het deksel, neem hem uit de stoof, laat gedurende 30-45 minuten afkoelen in de exsiccator (3.6) en weeg tot op 1 mg nauwkeurig.
Monsters die in hoofdzaak bestaan uit vet, worden nog eens gedurende 30 minuten bij 103 oC in de stoof gedroogd. Het verschil tussen de resultaten van beide wegingen mag niet meer bedragen dan 0,1 % vocht.
4.2.2. Graan, meel, grutten en gries
Weeg een droogschaal (3.3) met deksel tot op 0,5 mg nauwkeurig. Breng ongeveer 5 g van het fijngemaakte monster, tot op 1 mg nauwkeurig gewogen, in de getarreerde droogschaal en spreid gelijkmatig uit. Plaats de droogschaal zonder deksel in een vooraf op 130 oC gebrachte droogstoof. Om te voorkomen dat de temperatuur te veel daalt, dient de droogschaal zo snel mogelijk in de droogstoof gebracht te worden. Laat gedurende 2 uur drogen, gerekend vanaf het tijdstip dat de stoof weer op een temperatuur van 130 oC is. Sluit na het openen van de stoof de droogschaal met het deksel, neem hem uit de stoof, laat gedurende 30-45 minuten afkoelen in de exsiccator (3.6) en weeg tot op 1 mg nauwkeurig.
|
4.2.3.
|
Mengvoeders met een gehalte aan sacharose of lactose van meer dan 4 %: voedermiddelen als johannesbrood, gehydrolyseerde graanproducten, moutkiemen, suikerbietensnijdsels, visperssap en suikersap, en mengvoeders met meer dan 25 % minerale zouten met kristalwater.
Weeg een droogschaal (3.3) met deksel tot op 0,5 mg nauwkeurig. Breng ongeveer 5 g van het monster, tot op 1 mg nauwkeurig gewogen, in de getarreerde droogschaal en spreid gelijkmatig uit. Plaats de droogschaal zonder deksel in de vooraf op 80-85 oC gebrachte vacuümdroogstoof (3.5). Om te voorkomen dat de temperatuur te veel daalt, dient de droogschaal zo snel mogelijk in de droogstoof gebracht te worden.
Stel de druk in op 10 cm kwik en droog het monster gedurende 4 uur bij deze druk, hetzij onder toevoer van droge, warme lucht, hetzij met behulp van een droogmiddel (ongeveer 300 g voor 20 monsters). In het laatste geval wordt bij het bereiken van de voorgeschreven druk de verbinding met de vacuümpomp verbroken. Reken de droogtijd vanaf het tijdstip dat de droogstoof weer op een temperatuur van 80-85 oC is. Laat na het beëindigen van de droogtijd de druk in de stoof voorzichtig weer komen op die van de buitenlucht. Sluit na het openen van de vacuümdroogstoof de droogschaal met het deksel, neem hem uit de stoof, laat gedurende 30-45 minuten afkoelen in de exsiccator (3.6) en weeg vervolgens tot op 1 mg nauwkeurig. Droog nogmaals gedurende 30 minuten onder vacuüm in de stoof bij 80-85 oC en weeg opnieuw. Het verschil tussen de resultaten van beide wegingen mag niet meer bedragen dan 0,1 % vocht.
|
4.3. Voordrogen
4.3.1. Diervoeders met uitzondering van de onder 4.3.2 genoemde
Vaste diervoeders met een hoog gehalte aan vocht, die moeilijk fijn te maken zijn, worden als volgt voorgedroogd:
Breng 50 g van het ongemalen monster (geperste diervoeders of diervoeders in brokken zo nodig grof breken), tot op 10 mg nauwkeurig gewogen, in een geschikte recipiënt (bv. een schaal van aluminium van 20 bij 12 cm met een rand van 0,5 cm). Droog in een stoof bij een temperatuur van 60-70 oC, totdat het vochtgehalte is teruggebracht tot een waarde tussen 8 % en 12 %. Neem de recipiënt uit de droogstoof en laat onafgedekt gedurende 1 uur afkoelen in het laboratorium; weeg vervolgens tot op 10 mg nauwkeurig. Maak het monster onmiddellijk daarna fijn als beschreven onder 4.1.1 en droog, al naargelang de aard van het monster, als beschreven onder 4.2.1 of 4.2.3.
4.3.2. Granen
Granen met een vochtgehalte van meer dan 17 % moeten als volgt worden voorgedroogd:
Breng 50 g van het ongemalen graan, tot op 10 mg nauwkeurig gewogen, in een geschikte recipiënt (bv. een schaal van aluminium van 20 bij 12 cm met een rand van 0,5 cm). Droog in een stoof gedurende 5-7 minuten bij een temperatuur van 130 oC. Neem de recipiënt uit de droogstoof en laat onafgedekt gedurende 2 uur afkoelen in het laboratorium; weeg vervolgens tot op 10 mg nauwkeurig. Maak onmiddellijk daarna fijn als beschreven onder 4.1.2 en droog als beschreven onder 4.2.2.
5. Berekening van de resultaten
Het vochtgehalte van het monster in procent (X) wordt weergegeven door de volgende formules:
5.1. Drogen zonder voordrogen
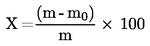
waarbij:
|
m
|
=
|
oorspronkelijke massa van het monster (in g);
|
|
m0
|
=
|
massa van het gedroogde monster (in g).
|
5.2. Drogen zonder voordrogen

waarbij:
|
m
|
=
|
oorspronkelijke massa van het monster (in g);
|
|
m1
|
=
|
massa van het monster na voordrogen (in g);
|
|
m2
|
=
|
massa van het monster na fijnmaken (in g);
|
|
m0
|
=
|
massa van het gedroogde monster (in g).
|
5.3. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 0,2 % absoluut.
6. Waarneming
Indien het monster fijngemaakt moet worden en dit een verandering van het vochtgehalte van het product ten gevolge heeft, dienen de analyseresultaten die betrekking hebben op de bestanddelen van het diervoeder, omgerekend te worden naar het vochtgehalte van het oorspronkelijke monster.
B. BEPALING VAN VOCHT IN DIERLIJKE EN PLANTAARDIGE VETTEN EN OLIËN
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vocht, water en andere vluchtige stoffen in dierlijke en plantaardige vetten en oliën.
2. Beginsel
Het monster wordt bij 103 oC gedroogd tot constante massa (het massaverlies tussen twee opeenvolgende wegingen mag niet meer dan 1 mg zijn). Het massaverlies wordt door weging bepaald.
3. Apparatuur
|
3.1.
|
Schaal met vlakke bodem, van corrosiebestendig materiaal, diameter 8-9 cm, hoogte circa 3 cm.
|
|
3.2.
|
Thermometer met een versterkt reservoir en een expansieruimte, gekalibreerd van ongeveer 80 oC tot ten minste 110 oC, lengte circa 10 cm.
|
|
3.3.
|
Zandbad of elektrische verwarmingsplaat.
|
|
3.4.
|
Exsiccator met een effectief droogmiddel.
|
4. Werkwijze
Breng ongeveer 20 g van het gehomogeniseerde monster, tot op 1 mg nauwkeurig gewogen, in de droge, getarreerde schaal (3.1) met de thermometer (3.2). Verhit onder voortdurend roeren met de thermometer op het zandbad of op de verwarmingsplaat (3.3) zodanig dat na ongeveer 7 minuten een temperatuur van 90 oC bereikt wordt.
Verminder de toevoer van warmte overeenkomstig de frequentie waarmee gasbellen van de bodem van de schaal opstijgen. De temperatuur mag niet hoger komen dan 105 oC. Roer onder voortdurend schrapen over de bodem van de schaal tot de belvorming ophoudt.
Verwarm nog enkele malen tot 103 ± 2 oC om er zeker van te zijn dat al het vocht uitgedreven wordt; laat tussen twee opeenvolgende verhittingen afkoelen tot 93 oC. Laat vervolgens in de exsiccator (3.4) afkoelen tot kamertemperatuur en weeg. Herhaal deze procedure totdat het massaverlies tussen twee opeenvolgende wegingen niet meer bedraagt dan 2 mg.
|
NB
|
:
|
Een massatoename van het monster na herhaalde verwarming duidt op oxidatie van het vet. Gebruik in dat geval bij de berekening het resultaat van de weging die vlak voor de massatoename gedaan werd.
|
5. Berekening van de resultaten
Het vochtgehalte van het monster in procent (X) volgt uit de volgende formule:

waarbij:
|
m
|
=
|
massa van het analysemonster (in g);
|
|
m1
|
=
|
massa van de schaal met inhoud voor verhitting (in g);
|
|
m2
|
=
|
massa van de schaal met inhoud na verhitting (in g);
|
Resultaten beneden 0,05 % moeten aangegeven worden als „minder dan 0,05 %”.
Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 0,05 % absoluut.
C. BEPALING VAN HET GEHALTE AAN RUW EIWIT
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan ruw eiwit in diervoeders aan de hand van het stikstofgehalte, bepaald volgens de kjeldahlmethode.
2. Beginsel
Het monster wordt ontsloten met zwavelzuur in aanwezigheid van een katalysator. De zure oplossing wordt met een oplossing van natriumhydroxide basisch gemaakt. De ammoniak wordt afgedestilleerd en opgevangen in een bekende hoeveelheid zwavelzuur, waarvan de overmaat met een standaardoplossing natriumhydroxide wordt getitreerd.
Ook kan de vrijgekomen ammoniak in een overmaat boorzuur worden geleid, waarna met zoutzuur of zwavelzuur wordt getitreerd.
3. Reagentia
|
3.2.
|
Katalysator: koper(II)oxide (CuO) of koper(II)sulfaat-pentahydraat (CuSO4·5H2O).
|
|
3.4.
|
Zwavelzuur, ρ
20 = 1,84 g/ml.
|
|
3.5.
|
Zwavelzuur, gesteld, c(H2SO4) = 0,25 mol/l.
|
|
3.6.
|
Zwavelzuur, gesteld, c(H2SO4) = 0,10 mol/l.
|
|
3.7.
|
Zwavelzuur, gesteld, c(H2SO4) = 0,05 mol/l.
|
|
3.8.
|
Methylroodindicator: los 300 mg methylrood op in 100 ml ethanol, σ = 95-96 % (V/V).
|
|
3.9.
|
Natriumhydroxideoplossing (mag technisch zuiver zijn), β = 40 g/100 ml (m/V: 40 %).
|
|
3.10.
|
Natriumhydroxide, gestelde oplossing, c(NaOH) = 0,25 mol/l.
|
|
3.11.
|
Natriumhydroxide, gestelde oplossing, c(NaOH) = 0,10 mol/l.
|
|
3.12.
|
Puimsteenkorrels, met zoutzuur gewassen en gegloeid.
|
|
3.13.
|
Aceetanilide (smeltpunt 114 oC, N-gehalte 10,36 %).
|
|
3.14.
|
Sacharose (vrij van stikstof).
|
|
3.16.
|
Methylroodindicatoroplossing: los 100 mg methylrood op in 100 ml ethanol of methanol.
|
|
3.17.
|
Broomkresolgroenoplossing: los 100 mg broomkresolgroen op in 100 ml ethanol of methanol.
|
|
3.18.
|
Boorzuuroplossing (10-40 g/l, afhankelijk van de gebruikte apparatuur).
Bij colorimetrische eindpuntsbepaling moeten de methylrood- en broomkresolgroenindicator aan de boorzuuroplossingen worden toegevoegd. Bij de bereiding van 1 liter boorzuur wordt, voordat het volume wordt aangevuld, 7 ml methylroodindicatoroplossing (3.16) en 10 ml broomkresolgroenoplossing (3.17) toegevoegd.
De pH van de boorzuuroplossing kan afhankelijk van het gebruikte water van keer tot keer verschillen. Vaak moet een kleine hoeveelheid base worden toegevoegd om een positieve blanco te verkrijgen.
|
NB
|
:
|
Toevoeging van 3-4 ml NaOH (3.11) aan 1 liter boorzuuroplossing van 10 g/l geeft doorgaans goede resultaten. Bewaar de oplossing bij kamertemperatuur in het donker en afgeschermd tegen bronnen van ammoniakdamp.
|
|
|
3.19.
|
Zoutzuur, gesteld, c(HCl) = 0,10 mol/l.
|
NB:
|
Andere gestelde oplossingen (3.5, 3.6, 3.7, 3.10, 3.11 en 3.19) mogen worden gebruikt, mits hiervoor in de berekeningen wordt gecorrigeerd. De concentraties moeten altijd tot op vier decimalen worden uitgedrukt.
|
|
4. Apparatuur
Apparatuur, geschikt voor het uitvoeren van ontsluiting, destillatie en titratie volgens Kjeldahl.
5. Werkwijze
5.1. Ontsluiting
Weeg 1 g van het monster tot op 0,001 g nauwkeurig af en breng dit in de recipiënt van de ontsluitingsapparatuur. Voeg hieraan toe 15 g kaliumsulfaat (3.1), een geschikte hoeveelheid katalysator (3.2) (0,3-0,4 g koper(II)oxide of 0,9-1,2 g koper(II)sulfaat-pentahydraat), 25 ml zwavelzuur (3.4) en zo nodig een paar puimsteenkorrels (3.12); meng het geheel.
Verwarm de recipiënt eerst zacht, zo nodig onder af en toe zwenken, totdat de massa is verkoold en het schuim is verdwenen; verhit vervolgens krachtiger tot de vloeistof regelmatig kookt. Er is voldoende verhit wanneer het kokende zuur tegen de wand van de recipiënt condenseert. Zorg ervoor dat de wand niet oververhit raakt en dat er geen organische stof aan de wand gaat vastzitten.
Kook nog twee uur nadat de oplossing helder en lichtgroen geworden is; laat vervolgens afkoelen.
5.2. Destillatie
Voeg genoeg water toe om de sulfaten volledig op te lossen. Laat afkoelen; voeg zo nodig enkele zinkkorrels (3.3) toe. Volg de procedure van punt 5.2.1 of 5.2.2.
5.2.1. Destillatie met opvang in zwavelzuur
Breng in de opvangkolf van de destillatieapparatuur een nauwkeurig afgemeten hoeveelheid van 25 ml zwavelzuur (3.5 of 3.7), afhankelijk van het verwachte stikstofgehalte. Voeg enkele druppels methylroodindicator (3.8) toe.
Verbind de ontsluitingsrecipiënt met de koeler van het destillatieapparaat en zorg ervoor dat het uiteinde van de koelbuis zich ten minste 1 cm onder het vloeistofoppervlak in de opvangkolf bevindt (zie opmerking 8.3). Giet langzaam 100 ml natriumhydroxideoplossing (3.9) in de ontsluitingsrecipiënt, zonder ammoniakverlies (zie opmerking 8.1). Verwarm de recipiënt totdat alle ammoniak overgedestilleerd is.
5.2.2. Destillatie met opvang in boorzuur
Volg de hierna beschreven procedure als het ammoniakgehalte van het destillaat met de hand bepaald wordt. Volg de gebruiksaanwijzing van de destillatieapparatuur als deze volledig geautomatiseerd is, inclusief bepaling van het ammoniakgehalte van het destillaat.
Plaats een opvangkolf met 25-30 ml boorzuuroplossing (3.18) aan het uiteinde van de koeler, zodanig dat het uiteinde zich onder het vloeistofoppervlak van de oplossing met overmaat boorzuur bevindt. Stel het destillatieapparaat in op een afgifte van 50 ml natriumhydroxideoplossing (3.9). Stel het destillatieapparaat in werking volgens de gebruiksaanwijzing en destilleer de door het toevoegen van de natriumhydroxideoplossing vrijkomende ammoniak af. Vang het destillaat op in de boorzuuroplossing. De hoeveelheid destillaat (duur van de stoomdestillatie) hangt af van de hoeveelheid stikstof in het monster. Volg de gebruiksaanwijzing.
|
NB
|
:
|
Bij een halfautomatisch destillatieapparaat verlopen de toevoeging van overmaat natriumhydroxide en de stoomdestillatie automatisch.
|
5.3. Titratie
Volg de procedure van punt 5.3.1 of 5.3.2.
5.3.1. Zwavelzuur
Titreer de overmaat zwavelzuur in de opvangkolf terug met natriumhydroxideoplossing (3.10 of 3.11, afhankelijk van de concentratie van het gebruikte zwavelzuur), totdat het eindpunt is bereikt.
5.3.2. Boorzuur
Titreer de inhoud van de opvangkolf met een buret met het gestelde zoutzuur (3.19) of zwavelzuur (3.6) en lees af hoeveel titrant gebruikt is.
Bij colorimetrische eindpuntsbepaling is het eindpunt bij het eerste spoor van roze kleur in de vloeistof. Lees de buret met een nauwkeurigheid van 0,05 ml af. Een magneetroerder met verlichting of een fotometrische detector kan helpen bij de bepaling van het eindpunt.
Bij gebruik van een stoomdestillatieapparaat met automatische titratie gebeurt dit automatisch.
Volg de gebruiksaanwijzing voor het gebruikte destillatieapparaat (al dan niet met titrator).
|
NB
|
:
|
Bij gebruik van een automatisch titratiesysteem begint de titratie onmiddellijk na de destillatie en wordt de 1 %-boorzuuroplossing (3.18) gebruikt.
Bij een volledig automatisch destillatieapparaat kan de automatische titratie van de ammoniak ook worden uitgevoerd met eindpuntsbepaling met een potentiometrisch pH-systeem.
In dat geval wordt een automatische titrator met pH-meter gebruikt. De pH-meter moet door middel van gangbare ijkmethoden naar behoren geijkt zijn in het pH-gebied tussen 4 en 7.
Het eindpunt van de titratie, het steilste punt in de titratiecurve (buigpunt) ligt bij pH 4,6.
|
5.4. Blancobepaling
Om te bevestigen dat de reagentia vrij van stikstof zijn, wordt een blancobepaling (ontsluiting, destillatie en titratie) uitgevoerd met 1 g sacharose (3.14) in plaats van het monster.
6. Berekening van de resultaten
De berekeningen worden uitgevoerd zoals aangegeven in punt 6.1 of 6.2.
6.1. Berekening voor titratie als beschreven in punt 5.3.1
Het gehalte aan ruw eiwit, uitgedrukt als massapercentage, wordt berekend met de volgende formule:

waarbij:
|
V0
|
=
|
het volume (in ml) NaOH (3.10 of 3.11) dat in de blancobepaling is gebruikt;
|
|
V1
|
=
|
het volume (in ml) NaOH (3.10 of 3.11) dat in de titratie van het monster is gebruikt;
|
|
c
|
=
|
de concentratie (in mol/l) natriumhydroxide (3.10 of 3.11);
|
|
m
|
=
|
de massa (in g) van het monster.
|
6.2. Berekening voor titratie als beschreven in punt 5.3.2
6.2.1. Titratie met zoutzuur
Het gehalte aan ruw eiwit, uitgedrukt als massapercentage, wordt berekend met de volgende formule:

waarbij:
|
m
|
=
|
de massa (in g) van het monster;
|
|
c
|
=
|
de concentratie (in mol/l) van het gestelde zoutzuur (3.19);
|
|
V0
|
=
|
het volume (in ml) zoutzuur dat in de blancobepaling is gebruikt;
|
|
V1
|
=
|
het volume (in ml) zoutzuur dat in de monsterbepaling is gebruikt.
|
6.2.2. Titratie met zwavelzuur
Het gehalte aan ruw eiwit, uitgedrukt als massapercentage, wordt berekend met de volgende formule:

waarbij:
|
m
|
=
|
de massa (in g) van het analysemonster;
|
|
c
|
=
|
de concentratie (in mol/l) van het gestelde zwavelzuur (3.6);
|
|
V0
|
=
|
het volume (in ml) zwavelzuur (3.6) dat voor de blancobepaling is gebruikt;
|
|
V1
|
=
|
het volume (in ml) zwavelzuur (3.6) dat voor de monsterbepaling is gebruikt.
|
7. Verificatie van de methode
7.1. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
0,2 % absoluut voor ruweiwitgehalten van minder dan 20 %,
|
|
—
|
1,0 % van het hoogste resultaat voor ruweiwitgehalten van 20 % tot 40 %,
|
|
—
|
0,4 % absoluut voor ruweiwitgehalten van meer dan 40 %.
|
7.2. Nauwkeurigheid
Voer de bepaling (ontsluiting, destillatie en titratie) uit op 1,5-2,0 g aceetanilide (3.13) in aanwezigheid van 1 g sacharose (3.14); 1 g aceetanilide verbruikt 14,80 ml zwavelzuur (3.5). Er moet ten minste 99 % worden teruggevonden.
8. Opmerkingen
|
8.1.
|
De apparatuur kan tot het manuele, halfautomatische of automatische type behoren. Indien de ontsluitingsvloeistof tussen ontsluiting en destillatie overgebracht moet worden, mag er geen verlies optreden. Indien de recipiënt van de destillatieapparatuur niet voorzien is van een druppeltrechter, moet de natriumhydroxideoplossing langzaam langs de wand toegevoegd worden, onmiddellijk voordat de recipiënt met de koeler wordt verbonden.
|
|
8.2.
|
Herhaal de bepaling met een grotere hoeveelheid zwavelzuur (3.4) dan hierboven vermeld, wanneer het materiaal tijdens het ontsluiten vast wordt.
|
|
8.3.
|
Voor producten met een laag stikstofgehalte kan het volume zwavelzuur (3.7) dat in de opvangkolf wordt gebracht zo nodig worden verminderd tot 10 of 15 ml en met water tot 25 ml worden aangevuld.
|
|
8.4.
|
Voor routineanalyse mogen andere analysemethoden worden gebruikt om het ruweiwitgehalte te bepalen, maar de in dit deel C beschreven kjeldahlmethode is de referentiemethode. Voor elke matrix afzonderlijk moet worden aangetoond dat met de alternatieve methode (bv. Dumas) dezelfde resultaten worden verkregen als met de referentiemethode. Aangezien de met de alternatieve methode verkregen resultaten ook na verificatie van de gelijkwaardigheid van beide methoden enigszins kunnen afwijken van de met de referentiemethode verkregen resultaten, moet in het analyseverslag worden vermeld welke methode voor de bepaling van het ruweiwitgehalte gebruikt is.
|
D. BEPALING VAN UREUM
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan ureum in diervoeders.
2. Beginsel
Het monster wordt onder toevoeging van een klaringsmiddel in water gesuspendeerd. De suspensie wordt gefiltreerd. In het filtraat wordt na toevoegen van 4-dimethylaminobenzaldehyd (4-DMAB) het gehalte aan ureum bepaald door meting van de extinctie bij een golflengte van 420 mm.
3. Reagentia
|
3.1.
|
4-Dimethylaminobenzaldehydoplossing: los 1,6 g 4-DMAB op in 100 ml ethanol 96 % en voeg 10 ml zoutzuur (ρ20 = 1,19 g/ml) toe. Het reagens is slechts twee weken houdbaar.
|
|
3.2.
|
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
|
|
3.3.
|
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)6·3H2O, op in water. Vul met water aan tot 100 ml.
|
|
3.4.
|
Actieve kool die geen ureum adsorbeert (controleer dit).
|
|
3.5.
|
Ureum, oplossing van 0,1 % (m/V).
|
4. Apparatuur
|
4.1.
|
Roteerapparaat met ongeveer 35-40 omwentelingen per minuut.
|
|
4.2.
|
Reageerbuizen: 160 × 16 mm, met geslepen stop.
|
5. Werkwijze
5.1. Analyse van het monster
Breng 2 g van het monster, tot op 1 mg nauwkeurig gewogen, en 1 g actieve kool (3.4) in een maatkolf van 500 ml. Voeg 400 ml water en 5 ml Carrez I-oplossing (3.2) toe, meng gedurende ongeveer 30 seconden en voeg 5 ml Carrez II-oplossing (3.3) toe. Laat gedurende 30 minuten mengen in het roteerapparaat. Vul vervolgens met water aan tot de streep, schud en filtreer.
Pipetteer van het heldere en kleurloze filtraat 5 ml in een reageerbuis met geslepen stop, voeg 5 ml 4-DMAB-oplossing (3.1) toe en meng. Plaats de buis in een waterbad op 20 oC (± 4 oC). Meet na 15 minuten met de spectrofotometer de extinctie van de monsteroplossing bij 420 nm. Vergelijk het resultaat met de blanco-oplossing van de reagentia.
5.2. IJkgrafiek
Breng in maatkolven van 100 ml resp. 1, 2, 4, 5 en 10 ml ureumoplossing (3.5), vul aan tot de streep met water (en meng). Pipetteer van elk van deze oplossingen 5 ml af, voeg hieraan telkens 5 ml 4-DMAB-oplossing (3.1) toe en meng. Meet de extinctie tegen een oplossing die 5 ml 4-DMAB en 5 ml water, vrij van ureum, bevat, zoals hierboven aangegeven. Stel een ijkgrafiek op.
6. Berekening van de resultaten
Bepaal aan de hand van de ijkgrafiek de hoeveelheid ureum in het monster.
Druk het resultaat uit als percentage van het monster.
7. Opmerkingen
|
7.1.
|
Indien het gehalte aan ureum meer bedraagt dan 3 % wordt het monster teruggebracht tot 1 g, of het filtraat zodanig verdund dat in 500 ml niet meer dan 50 mg ureum aanwezig is.
|
|
7.2.
|
Bij lage gehalten aan ureum moet meer analysemateriaal afgewogen worden, zo lang een helder en kleurloos filtraat wordt verkregen.
|
|
7.3.
|
Indien het monster eenvoudige stikstofverbindingen bevat, zoals aminozuren, wordt de extinctie bij 435 nm gemeten.
|
E. BEPALING VAN VLUCHTIGE STIKSTOFHOUDENDE BASEN
I. DOOR MICRODIFFUSIE
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vluchtige stikstofhoudende basen, uitgedrukt als ammoniak, in diervoeders.
2. Beginsel
Het monster wordt met water geëxtraheerd, de oplossing geklaard en gefiltreerd. De vluchtige stikstofhoudende basen worden met een kaliumcarbonaatoplossing door microdiffusie uitgedreven, in een boorzuuroplossing opgevangen en met zwavelzuur getitreerd.
3. Reagentia
|
3.1.
|
Trichloorazijnzuur, oplossing van 20 % (m/V).
|
|
3.2.
|
Indicator: los 33 mg broomkresolgroen en 65 mg methylrood op in 100 ml ethanol 95-96 % (V/V).
|
|
3.3.
|
Boorzuuroplossing: los 10 g boorzuur op in 200 ml ethanol 95-96 % (V/V) en 700 ml water in een maatkolf van 1 liter. Voeg 10 ml indicator (3.2) toe. Meng en neutraliseer de oplossing zo nodig met natriumhydroxideoplossing tot zwak rood. 1 ml van deze oplossing kan maximaal 300 μg NH3 binden.
|
|
3.4.
|
Verzadigde oplossing van kaliumcarbonaat: los 100 g kaliumcarbonaat op in 100 ml kokend water. Laat afkoelen en filtreer.
|
|
3.5.
|
Zwavelzuur 0,01 mol/l.
|
4. Apparatuur
|
4.1.
|
Roteerapparaat met ongeveer 35-40 omwentelingen per minuut.
|
|
4.2.
|
Conwayschalen (zie figuur) van glas of kunststof.
|
|
4.3.
|
Microburet, verdeeld tot in 1/100 ml.
|
5. Werkwijze
Breng 10 g van het monster, tot op 1 mg nauwkeurig gewogen, met 100 ml water in een maatkolf van 200 ml en laat gedurende 30 minuten roteren. Voeg 50 ml trichloorazijnzuuroplossing (3.1) toe, vul aan tot de streep met water, schud krachtig en filtreer door een vouwfilter.
Pipetteer in het midden van de conwayschaal 1 ml boorzuuroplossing (3.3) en in de buitenring 1 ml filtraat van het monster. Sluit de schaal gedeeltelijk met het ingevette deksel. Breng dan snel in de buitenring 1 ml verzadigde kaliumcarbonaatoplossing (3.4) en sluit de schaal luchtdicht af. Manipuleer vervolgens voorzichtig met de schaal zodanig, dat de beide oplossingen in de buitenring gemengd worden. Laat dan ten minste gedurende 4 uur staan bij kamertemperatuur of gedurende 1 uur bij 40 oC.
Titreer vervolgens de vluchtige basen in de boorzuuroplossing met zwavelzuur (3.5) met behulp van een microburet (4.3).
Verricht op gelijke wijze een blancobepaling zonder analysemateriaal.
6. Berekening van de resultaten
1 ml H2SO40,01 mol/l komt overeen met 0,34 mg ammoniak.
Druk het resultaat uit als percentage van het monster.
Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
10 % relatief bij gehalten aan ammoniak van minder dan 1,0 %;
|
|
—
|
0,1 % absoluut bij gehalten aan ammoniak van 1,0 % of meer.
|
7. Opmerking
Indien het gehalte aan ammoniak in het monster meer bedraagt dan 0,6 % wordt het oorspronkelijke filtraat verdund.

II. DOOR DESTILLATIE
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vluchtige stikstofhoudende basen, uitgedrukt als ammoniak, in vismelen die vrijwel geen ureum bevatten. De methode is alleen toepasbaar indien het gehalte aan ammoniak minder bedraagt dan 0,25 %.
2. Beginsel
Het monster wordt met water geëxtraheerd, de oplossing geklaard en gefiltreerd. Na toevoegen van magnesiumoxide worden de vluchtige stikstofhoudende basen bij kooktemperatuur uitgedreven en opgevangen in een bekende hoeveelheid zwavelzuur. De overmaat zuur wordt teruggetitreerd met natriumhydroxideoplossing.
3. Reagentia
|
3.1.
|
Trichloorazijnzuur, oplossing van 20 % (m/V).
|
|
3.3.
|
Antischuimemulsie (bv. siliconen).
|
|
3.4.
|
Zwavelzuur 0,05 mol/l.
|
|
3.5.
|
Natriumhydroxideoplossing 0,1 mol/l.
|
|
3.6.
|
Methylroodoplossing 0,3 % in ethanol 95-96 % (V/V).
|
4. Apparatuur
|
4.1.
|
Roteerapparaat met ongeveer 35-40 omwentelingen per minuut.
|
|
4.2.
|
Destillatieapparatuur volgens Kjeldahl.
|
5. Werkwijze
Breng 10 g van het monster, tot op 1 mg nauwkeurig gewogen, met 100 ml water in een maatkolf van 200 ml en laat gedurende 30 minuten roteren. Voeg 50 ml trichloorazijnzuuroplossing (3.1) toe, vul aan tot de streep met water, schud krachtig en filtreer door een vouwfilter.
Breng van het heldere filtraat een bepaalde hoeveelheid — afhankelijk van het te verwachten gehalte aan vluchtige stikstofhoudende basen (in het algemeen 100 ml) — in de destillatiekolf. Verdun tot 200 ml en voeg 2 g magnesiumoxide (3.2) en enkele druppels antischuimemulsie (3.3) toe. De oplossing moet basisch reageren t.o.v. lakmoespapier; indien dit niet het geval is, moet meer magnesiumoxide (3.2) toegevoegd worden. Volg de in punt 5.2 of 5.3 beschreven methode voor het bepalen van het ruweiwitgehalte (deel C van deze bijlage).
Verricht op gelijke wijze een blancobepaling zonder analysemateriaal.
6. Berekening van de resultaten
1 ml H2SO40,05 mol/l komt overeen met 1,7 mg ammoniak.
Druk het resultaat uit als percentage van het monster.
Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 10 % relatief.
F. BEPALING VAN AMINOZUREN (MET UITZONDERING VAN TRYPTOFAAN)
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van de vrije (synthetische en natuurlijke) aminozuren en de totale hoeveelheid (vrije en in peptiden gebonden) aminozuren in diervoeders, waarbij gebruik wordt gemaakt van een aminozuuranalysator. De methode kan worden gebruikt voor bepaling van de volgende aminozuren: cysteïne/cystine, methionine, lysine, threonine, alanine, arginine, asparaginezuur, glutaminezuur, glycine, histidine, isoleucine, leucine, fenylalanine, proline, serine, tyrosine en valine.
Deze methode maakt geen onderscheid tussen het aminozuur zelf en de zouten ervan, en kan niet differentiëren tussen de D- en L-vorm van aminozuren. De methode kan niet worden gebruikt voor de bepaling van tryptofaan of van hydroxyanalogen van aminozuren.
2. Beginsel
2.1. Vrije aminozuren
De vrije aminozuren worden met verdund zoutzuur geëxtraheerd. Stikstofhoudende macromoleculen die meekomen bij de extractie worden geprecipiteerd met sulfosalicylzuur en door filtratie verwijderd. De pH van de gefiltreerde oplossing wordt op 2,20 gebracht. De aminozuren worden gescheiden door ionenwisselingschromatografie, en na reactie met ninhydrine bepaald door fotometrische detectie bij 570 nm.
2.2. Totaal aminozuurgehalte
De gekozen werkwijze is afhankelijk van de te onderzoeken aminozuren. Cysteïne/cystine en methionine moeten vóór hydrolyse tot resp. cysteïnezuur en methioninesulfon worden geoxideerd. Tyrosine moet worden bepaald in hydrolysaten van niet-geoxideerde monsters. Alle andere aminozuren die in punt 1 zijn genoemd kunnen zowel in geoxideerde als in niet-geoxideerde monsters worden bepaald.
De oxidatie wordt uitgevoerd bij 0 oC met een mengsel van permierenzuur en fenol. Overmaat oxidatiemiddel wordt ontleed met dinatriumdisulfiet. Het geoxideerde of niet-geoxideerde monster wordt gedurende 23 uur gehydrolyseerd met zoutzuur (3.20). De pH van het hydrolysaat wordt op 2,20 gebracht. De aminozuren worden door ionenwisselingschromatografie van elkaar gescheiden en worden bepaald door reactie met ninhydrine gevolgd door fotometrische detectie bij 570 nm (440 nm voor proline).
3. Reagentia
Er moet dubbel gedestilleerd water of water van vergelijkbare kwaliteit worden gebruikt (geleidbaarheid < 10 μS).
|
3.1.
|
Waterstofperoxide, w = 30 % (m/m).
|
|
3.2.
|
Mierenzuur, w = 98-100 % (m/m).
|
|
3.6.
|
5-Sulfosalicylzuur-dihydraat.
|
|
3.7.
|
Zoutzuur, d = 1,18 g/ml (ongeveer).
|
|
3.8.
|
Trinatriumcitraat-dihydraat.
|
|
3.9.
|
2,2′-Thiodiethanol (thiodiglycol).
|
|
3.12.
|
Petroleumether, kooktraject 40-60 oC.
|
|
3.13.
|
Norleucine, of een andere verbinding die kan dienen als interne standaard.
|
|
3.14.
|
Stikstofgas (< 10 ppm zuurstof).
|
|
3.16.1.
|
Standaardverbindingen als genoemd in punt 1. Zuivere verbindingen, zonder kristalwater. Vóór gebruik gedurende een week drogen in vacuüm boven P2O5 of H2SO4.
|
|
3.16.3.
|
Methioninesulfon.
|
|
3.17.
|
Natriumhydroxideoplossing, c = 7,5 mol/l:
Los 300 g NaOH (3.5) op in water en vul aan tot 1 liter.
|
|
3.18.
|
Natriumhydroxideoplossing, c = 1 mol/l:
Los 40 g NaOH (3.5) op in water en vul aan tot 1 liter.
|
|
3.19.
|
Mierenzuur-fenoloplossing:
Meng 889 g mierenzuur (3.2) met 111 g water en voeg 4,73 g fenol (3.3) toe.
|
|
3.20.
|
Hydrolysemengsel, c = 6 mol HCl/l met 1 g fenol/l:
Voeg 1 g fenol (3.3) toe aan 492 ml HCl (3.7) en vul aan met water tot 1 liter.
|
|
3.21.
|
Extractiemengsel, c = 0,1 mol HCl/l met 2 % thiodiglycol: neem 8,2 ml HCl (3.7), meng met circa 900 ml water, voeg 20 ml thiodiglycol (3.9) toe en vul aan met water tot 1 liter (meng 3.7 en 3.9 niet direct).
|
|
3.22.
|
5-Sulfosalicylzuuroplossing, β = 6 %:
Los 60 g 5-sulfosalicylzuur (3.6) op in water en vul aan met water tot 1 liter.
|
|
3.23.
|
Oxidatiemengsel (permierenzuur-fenol):
Meng in een klein bekerglas 0,5 ml waterstofperoxide (3.1) met 4,5 ml mierenzuur-fenoloplossing (3.19). Incubeer gedurende 1 uur bij 20-30 oC zodat er permierenzuur wordt gevormd, en koel vervolgens in een ijsbad met smeltend ijs (15 minuten) voordat de vloeistof aan het monster wordt toegevoegd.
Voorzichtig: vermijd aanraking met de huid en draag beschermende kleding.
|
|
3.24.
|
Citraatbuffer, c = 0,2 mol Na+/l, pH 2,20:
Los 19,61 g natriumcitraat (3.8), 5 ml thiodiglycol (3.9), 1 g fenol (3.3) en 16,50 ml HCl (3.7) op in ongeveer 800 ml water. Breng de pH op 2,20. Vul aan met water tot 1 liter.
|
|
3.25.
|
Elutiebuffers, bereid overeenkomstig de voorschriften voor de gebruikte analysator (4.9).
|
|
3.26.
|
Ninhydrinereagens, bereid overeenkomstig de voorschriften voor de gebruikte analysator (4.9).
|
|
3.27.
|
Standaardaminozuuroplossingen. Deze oplossingen moeten worden bewaard bij een temperatuur van minder dan 5 oC.
|
|
3.27.1.
|
Stamoplossing van aminozuren (3.16.1).
c = 2,5 μmol/ml van elk aminozuur in zoutzuur.
Commercieel verkrijgbaar.
|
|
3.27.2.
|
Stamoplossing van cysteïnezuur en methioninesulfon, c = 1,25 μmol/ml.
Los 0,2115 g cysteïnezuur (3.16.2) en 0,2265 g methioninesulfon (3.16.3) op in citraatbuffer (3.24) in een maatkolf van 1 liter, en vul aan tot de streep met citraatbuffer. Bewaar, niet langer dan twaalf maanden, bij een temperatuur van minder dan 5 oC. Deze oplossing wordt niet gebruikt wanneer de stamoplossing (3.27.1) cysteïnezuur en methioninesulfon bevat.
|
|
3.27.3.
|
Stamoplossing van de interne standaard, bv. norleucine, c = 20 μmol/ml.
Los 0,6560 g norleucine (3.13) op in citraatbuffer (3.24) in een maatkolf van 250 ml en vul aan tot de streep met citraatbuffer. Bewaar, niet langer dan zes maanden, bij een temperatuur van minder dan 5 oC.
|
|
3.27.4.
|
Standaardaminozuurijkoplossing voor gebruik bij hydrolysaten, c = 5 nmol/50 μl cysteïnezuur en methioninesulfon, en c = 10 nmol/50 μl van de andere aminozuren. Los 2,2 g natriumchloride (3.10) op in een 100 ml bekerglas met 30 ml citraatbuffer (3.24). Voeg 4,00 ml stamoplossing van aminozuren (3.27.1) toe, 4,00 ml stamoplossing van cysteïnezuur en methioninesulfon (3.27.2), en — indien van toepassing — 0,50 ml stamoplossing van de interne standaard (3.27.3). Breng de pH met natriumhydroxideoplossing (3.18) op 2,20.
Breng kwantitatief over in een maatkolf van 50 ml, vul aan tot de streep met citraatbuffer (3.24) en meng.
Bewaar, niet langer dan drie maanden, bij een temperatuur van minder dan 5 oC.
Zie ook de opmerkingen in punt 9.1.
|
|
3.27.5.
|
Standaardaminozuurijkoplossing voor gebruik bij hydrolysaten, bereid volgens punt 5.3.3.1, en voor gebruik bij extracten (5.2). De ijkoplossing wordt bereid als beschreven in 3.27.4, met weglating van natriumchloride.
Bewaar, niet langer dan drie maanden, bij een temperatuur van minder dan 5 oC.
|
4. Apparatuur
|
4.1.
|
Rondbodemkolf, 100 of 250 ml, met terugvloeikoeler.
|
|
4.2.
|
Fles van borosilicaatglas, 100 ml, met schroefdop voorzien van rubber/teflon inlay (bv. Duran, Schott) voor gebruik in de oven.
|
|
4.3.
|
Oven met geforceerde ventilatie en temperatuurregulering, nauwkeuriger dan ± 2 oC.
|
|
4.4.
|
pH-meter (in drie decimalen afleesbaar).
|
|
4.5.
|
Membraanfilter, 0,22 μm.
|
|
4.8.
|
Schudapparaat of magneetroerder.
|
|
4.9.
|
Aminozuuranalysator of HPLC-apparatuur met ionenwisselingskolom, onderdeel voor de ninhydrinereactie, nakolomsderivatisering en fotometrische detector.
De kolom wordt gevuld met gesulfoneerd polystyreenhars waarop aminozuren van elkaar en van ander ninhydrinepositief materiaal worden gescheiden. Het debiet van buffer en ninhydrine wordt gereguleerd door pompen met een nauwkeurigheid van ±0,5 %, zowel tijdens de standaardijking als tijdens de analyse van het monster.
Bij sommige aminozuuranalysatoren kunnen hydrolysemethoden worden gebruikt waarbij het hydrolysaat een natriumconcentratie heeft van c = 0,8 mol/l, terwijl ook al het uit de oxidatiestap overgebleven mierenzuur nog aanwezig is. Andere analysatoren geven geen goede scheiding van bepaalde aminozuren in hydrolysaten met een overmaat mierenzuur en/of een hoge natriumconcentratie. In zulke gevallen wordt het volume zuur gereduceerd door verdamping tot ongeveer 5 ml na hydrolyse en vóór instelling van de juiste pH. De verdamping gebeurt onder vacuüm bij ten hoogste 40 oC.
|
5. Werkwijze
5.1. Monstervoorbereiding
Het monster wordt gemalen tot de deeltjes een zeef met een maaswijdte van 0,5 mm passeren. Monsters met een hoog vochtgehalte moeten voor het malen eerst worden gevriesdroogd, of aan de lucht gedroogd bij ten hoogste 50 oC. Monsters met een hoog vetgehalte moeten voor het malen worden geëxtraheerd met petroleumether (3.12).
5.2. Bepaling van vrije aminozuren in diervoeders en voormengsels
Weeg een geschikte hoeveelheid (1-5 g) van het voorbewerkte monster (5.1) op 0,2 mg nauwkeurig af in een erlenmeyer en voeg 100,0 ml extractiemengsel (3.21) toe. Schud of roer het mengsel gedurende 60 minuten in een schudapparaat of met een magneetroerder (4.8). Laat het neerslag bezinken en pipetteer 10,0 ml van de bovenstaande vloeistof in een bekerglas van 100 ml.
Voeg onder aanhoudend roeren 5,0 ml sulfosalicylzuuroplossing (3.22) toe, en roer nog 5 minuten door op de magneetroerder. Filtreer of centrifugeer de bovenstaande vloeistof om eventueel aanwezig neerslag te verwijderen. Breng 10,0 ml van de verkregen oplossing in een bekerglas van 100 ml op pH 2,20 met natriumhydroxideoplossing (3.18), spoel de oplossing met citraatbuffer (3.24) in een maatkolf van geschikt volume, en vul aan tot de streep met bufferoplossing (3.24).
Voeg, als er een interne standaard wordt gebruikt, 1,00 ml interne standaard (3.27.3) toe per 100 ml eindoplossing en vul aan tot de streep met bufferoplossing (3.24).
Ga verder met de chromatografiestap volgens 5.4.
Als chromatografie van de extracten niet dezelfde dag mogelijk is, moeten zij worden bewaard bij een temperatuur van minder dan 5 oC.
5.3. Bepaling van de totale hoeveelheid aminozuren
5.3.1. Oxidatie
Weeg een 0,1-1 g van het voorbewerkte monster (5.1) tot op 0,2 mg nauwkeurig af in:
|
—
|
een rondbodemkolf van 100 ml (4.1) in geval van open hydrolyse (5.3.2.3), of
|
|
—
|
een rondbodemkolf van 250 ml (4.1) als een lage natriumconcentratie vereist wordt (5.3.3.1), of
|
|
—
|
een fles van 100 ml met schroefdop (4.2) voor gesloten hydrolyse (5.3.2.4).
|
De ingewogen hoeveelheid monster moet een stikstofgehalte van ongeveer 10 mg hebben en mag niet meer dan 100 mg vocht bevatten.
Breng de kolf/fles in een ijsbad met smeltend ijs op 0 oC, voeg 5 ml oxidatiemengsel (3.23) toe en meng met een gebogen glazen spatel. Sluit de kolf/fles met de spatel erin af met luchtdichte folie en zet het ijsbad met het gesloten vat gedurende 16 uur in een koelkast bij 0 oC. Neem de kolf/fles na 16 uur uit de koelkast en ontleed de overmaat oxidatiereagens door 0,84 g dinatriumdisulfiet (3.4) toe te voegen.
Ga verder met 5.3.2.1.
5.3.2. Hydrolyse
5.3.2.1.
Hydrolyse van geoxideerde monsters
Voeg aan het volgens 5.3.1 geoxideerde monster 25 ml hydrolysemengsel (3.20) toe, waarbij zorgvuldig alle sporen van het mengsel van de wand van het vat en van de spatel worden gespoeld.
Ga, afhankelijk van de gebruikte hydrolyseprocedure, verder met 5.3.2.3 of 5.3.2.4.
5.3.2.2.
Hydrolyse van niet-geoxideerde monsters
Weeg 0,1-1 g van het voorbewerkte monster (5.1) tot op 0,2 mg nauwkeurig af in een rondbodemkolf van 100 ml of 250 ml (4.1) of in een fles met schroefdop van 100 ml (4.2). De ingewogen hoeveelheid monster moet een stikstofgehalte van ongeveer 10 mg hebben. Voeg voorzichtig 25 ml hydrolysemengsel (3.20) toe en meng met het monster. Ga verder met punt 5.3.2.3 of punt 5.3.2.4.
5.3.2.3.
Open hydrolyse
Doe drie glasparels bij het mengsel (bereid volgens 5.3.2.1 of 5.3.2.2) en kook gedurende 23 uur in een kolf voorzien van een terugvloeikoeler. Spoel, na beëindiging van de hydrolyse, de koeler schoon met 5 ml citraatbuffer (3.24). Neem de koeler van de kolf en plaats de kolf in een ijsbad.
Ga verder met 5.3.3.
5.3.2.4.
Gesloten hydrolyse
Zet de fles met het volgens 5.3.2.1 of 5.3.2.2 bereide mengsel in een oven (4.3) bij 110 oC. Laat gedurende het eerste uur de schroefdop los op de fles staan, om te voorkomen dat zich druk opbouwt als gevolg van gasvorming en om explosies te voorkomen. Sluit de fles niet af met de dop. Draai de dop na een uur op de fles en laat deze gedurende 23 uur in de oven (4.3) staan. Neem de fles uit de oven als de hydrolyse is voltooid, draai de dop voorzichtig van de fles en zet deze in een bad met smeltend ijs. Laat afkoelen.
Breng, afhankelijk van de manier waarop de pH wordt ingesteld (5.3.3), de inhoud van de fles met behulp van citraatbuffer (3.24) kwantitatief over in een bekerglas of rondbodemkolf van 250 ml.
Ga verder met 5.3.3.
5.3.3. Aanpassen van de pH
Ga verder met aanpassing van de pH volgens 5.3.3.1 of 5.3.3.2, afhankelijk van de natriumtolerantie van de aminozuuranalysator (4.9).
5.3.3.1.
Chromatografiesystemen (4.9) die een lage natriumconcentratie vereisen
Bij aminozuuranalysatoren die een lage natriumconcentratie vereisen (en waarbij het volume zuur wordt ingedampt) wordt aanbevolen een stamoplossing van de interne standaard (3.27.3) te gebruiken.
Voeg in dit geval vóór het indampen 2,00 ml van de stamoplossing van de interne standaard (3.27.3) toe aan het hydrolysaat.
Voeg twee druppels octaan-1-ol (3.15) toe aan het hydrolysaat, verkregen volgens 5.3.2.3 of 5.3.2.4.
Breng met een rotatieverdamper (4.7) onder vacuüm bij 40 oC het volume terug tot 5-10 ml. Wordt het eindvolume per ongeluk kleiner dan 5 ml, dan moet het hydrolysaat worden weggegooid en de analyse opnieuw worden ingezet.
Breng de pH op 2,20 met natriumhydroxideoplossing (3.18) en ga verder met 5.3.4.
5.3.3.2.
Alle andere aminozuuranalysatoren (4.9)
Neem het volgens 5.3.2.3 of 5.3.2.4 verkregen hydrolysaat en neutraliseer het ten dele door voorzichtig, onder roeren, 17 ml natriumhydroxideoplossing (3.17) toe te voegen; let op dat de temperatuur niet hoger wordt dan 40 oC.
Breng de pH op 2,20 bij kamertemperatuur met natriumhydroxideoplossing (3.17) en daarna natriumhydroxideoplossing (3.18). Ga verder met 5.3.4.
5.3.4. Monsteroplossing voor chromatografie
Breng het op pH gebrachte hydrolysaat (5.3.3.1 of 5.3.3.2) met citraatbuffer (3.24) kwantitatief over in een 200 ml maatkolf en vul aan tot de streep met buffer (3.24).
Als er nog geen interne standaard is gebruikt, voeg dan nu 2,00 ml interne standaard (3.27.3) toe en vul aan tot de streep met citraatbuffer (3.24). Meng goed.
Ga verder met de chromatografiestap (5.4).
Als chromatografie van de monsteroplossingen niet dezelfde dag mogelijk is, moeten zij worden bewaard bij een temperatuur van minder dan 5 oC.
5.4. Chromatografie
Laat het extract (5.2) of hydrolysaat (5.3.4) voor de chromatografische bepaling op kamertemperatuur komen. Schud het mengsel en filtreer een geschikte hoeveelheid door een 0,22 μm membraanfilter (4.5). De resulterende heldere oplossing wordt gebruikt voor ionenwisselingschromatografie met behulp van een aminozuuranalysator (4.9).
Injectie kan met de hand worden gedaan of automatisch. Het is van belang dat steeds dezelfde hoeveelheid oplossing ±0,5 % op de kolom wordt gebracht voor analyse van standaarden en monsters — tenzij er een interne standaard wordt gebruikt — en dat de verhouding natrium/aminozuur in standaard- en monsteroplossingen onderling zo veel mogelijk overeenkomen.
Hoe vaak er ijkbepalingen nodig zijn is afhankelijk van de stabiliteit van het ninhydrinereagens en van het analytische systeem in het algemeen. Standaarden en monsters worden zodanig met citraatbuffer (3.24) verdund dat de standaard een piekoppervlakte levert die 30-200 % bedraagt van de piekoppervlakte van het monster.
Er zal een zekere variabiliteit zitten in de chromatografie van aminozuren, afhankelijk van het type analysator en de gebruikte soort hars. Het systeem waarvoor wordt gekozen moet de aminozuren van elkaar en van andere ninhydrinepositieve stoffen kunnen scheiden. Binnen het bepalingsbereik moet het chromatografiesysteem een lineaire respons geven op veranderingen in de hoeveelheid aminozuren die op de kolom worden gebracht.
Er moeten bij de chromatografische analyse van een equimolaire oplossing van de te bepalen aminozuren dal/piekratio’s worden verkregen die overeenkomen met de hieronder genoemde. Deze equimolaire oplossing moet ten minste 30 % bevatten van de maximale hoeveelheid van elk aminozuur die met het aminozuuranalysesysteem (4.9) nog nauwkeurig kan worden bepaald.
Voor scheiding van threonine en serine mag de dal/piekratio voor de kleinste piek van de twee overlappende aminozuren op het chromatogram niet meer bedragen dan 2:10. (Als alleen cysteïne/cystine, methionine, threonine en lysine worden bepaald, wordt de nauwkeurigheid van de bepaling ongunstig beïnvloed door onvoldoende scheiding van aangrenzende pieken.) Voor alle andere aminozuren moet de scheiding beter zijn dan 1:10.
Het systeem moet lysine van „lysineartefacten” en van ornithine kunnen scheiden.
6. Berekening van de resultaten
De piekoppervlakte van monster en standaard wordt voor elk aminozuur afzonderlijk bepaald en het gehalte (X), uitgedrukt als g aminozuur per kg monster, wordt berekend.

Vermenigvuldig bij gebruik van een interne standaard met: 
|
A
|
=
|
piekoppervlakte van hydrolysaat of extract;
|
|
B
|
=
|
piekoppervlakte van standaardijkoplossing;
|
|
C
|
=
|
piekoppervlakte van interne standaard in hydrolysaat of extract;
|
|
D
|
=
|
piekoppervlakte van interne standaard, standaardijkoplossing;
|
|
M
|
=
|
molecuulgewicht van het te bepalen aminozuur;
|
|
c
|
=
|
concentratie standaard in μmol/ml;
|
|
m
|
=
|
massa monster (g) (gecorrigeerd tot oorspronkelijke massa indien gedroogd of ontvet);
|
|
V
|
=
|
ml totaal hydrolysaat (5.3.4) of ml berekend totaal verdunningsvolume van het extract (6.1).
|
Cystine en cysteïne worden in hydrolysaten van geoxideerde monsters beide bepaald als cysteïnezuur, maar berekend als cystine (C6H12N2O4S2, M = 240,30 g/mol) door een molecuulgewicht van 120,15 (= 0,5 × 240,30 g/mol) te nemen.
Methionine wordt in hydrolysaten van geoxideerd monster bepaald als methioninesulfon, maar berekend als methionine met gebruikmaking van het molecuulgewicht van methionine: 149,21 g/mol.
Toegevoegd vrij methionine wordt na extractie bepaald als methionine; voor de berekening wordt hetzelfde molecuulgewicht gebruikt.
|
6.1.
|
Het totale verdunningsvolume van extracten (F) voor de bepaling van vrije aminozuren (5.2) wordt als volgt berekend:

|
V
|
=
|
eindvolume van het extract.
|
|
7. Evaluatie van de methode
De methode is in 1990 getest in een internationaal ringonderzoek, waarvoor vier soorten diervoeders zijn gebruikt (mengvoer voor varkens, slachtkuikenvoer, eiwitconcentraat, voormengsel). De waarden, na eliminatie van uitschieters, van gemiddelde en standaardafwijking worden gegeven in de hierna volgende tabellen:
Gemiddelden in g/kg
|
Referentiemateriaal
|
Aminozuur
|
|
Threonine
|
Cysteïne/cystine
|
Methionine
|
Lysine
|
|
Varkensmengvoer
|
6,94
n = 15
|
3,01
n = 17
|
3,27
n = 17
|
9,55
n = 13
|
|
Slachtkuikenvoer
|
9,31
n = 16
|
3,92
n = 18
|
5,08
n = 18
|
13,93
n = 16
|
|
Eiwitconcentraat
|
22,32
n = 16
|
5,06
n = 17
|
12,01
n = 17
|
47,74
n = 15
|
|
Voormengsel
|
58,42
n = 16
|
—
|
90,21
n = 16
|
98,03
n = 16
|
|
n
|
=
|
aantal deelnemende laboratoria.
|
|
7.1. Herhaalbaarheid
De herhaalbaarheid, uitgedrukt als intralaboratoriumstandaardafwijking, van bovengenoemd ringonderzoek wordt weergegeven in onderstaande tabellen:
Intralaboratoriumstandaardafwijking (Sr) in g/kg
|
Referentiemateriaal
|
Aminozuur
|
|
Threonine
|
Cysteïne/cystine
|
Methionine
|
Lysine
|
|
Varkensmengvoer
|
0,13
n = 15
|
0,10
n = 17
|
0,11
n = 17
|
0,26
n = 13
|
|
Slachtkuikenvoer
|
0,20
n = 16
|
0,11
n = 18
|
0,16
n = 18
|
0,28
n = 16
|
|
Eiwitconcentraat
|
0,48
n = 16
|
0,13
n = 17
|
0,27
n = 17
|
0,99
n = 15
|
|
Voormengsel
|
1,30
n = 16
|
—
|
2,19
n = 16
|
2,06
n = 16
|
|
n
|
=
|
aantal deelnemende laboratoria.
|
|
Variatiecoëfficiënt (%) van de intralaboratoriumstandaardafwijking (Sr)
|
Referentiemateriaal
|
Aminozuur
|
|
Threonine
|
Cysteïne/cystine
|
Methionine
|
Lysine
|
|
Varkensmengvoer
|
1,9
n = 15
|
3,3
n = 17
|
3,4
n = 17
|
2,8
n = 13
|
|
Slachtkuikenvoer
|
2,1
n = 16
|
2,8
n = 18
|
3,1
n = 18
|
2,1
n = 16
|
|
Eiwitconcentraat
|
2,7
n = 16
|
2,6
n = 17
|
2,2
n = 17
|
2,4
n = 15
|
|
Voormengsel
|
2,2
n = 16
|
—
|
2,4
n = 16
|
2,1
n = 16
|
|
n
|
=
|
aantal deelnemende laboratoria.
|
|
7.2. Reproduceerbaarheid
De waarden van de interlaboratoriumstandaardafwijking, verkregen in bovengenoemd ringonderzoek worden weergegeven in onderstaande tabel:
Interlaboratoriumstandaardafwijking (SR) in g/kg
|
Referentiemateriaal
|
Aminozuur
|
|
Threonine
|
Cysteïne/cystine
|
Methionine
|
Lysine
|
|
Varkensmengvoer
|
0,28
n = 15
|
0,30
n = 17
|
0,23
n = 17
|
0,30
n = 13
|
|
Slachtkuikenvoer
|
0,48
n = 16
|
0,34
n = 18
|
0,55
n = 18
|
0,75
n = 16
|
|
Eiwitconcentraat
|
0,85
n = 16
|
0,62
n = 17
|
1,57
n = 17
|
1,24
n = 15
|
|
Voormengsel
|
2,49
n = 16
|
—
|
6,20
n = 16
|
6,62
n = 16
|
|
n
|
=
|
aantal deelnemende laboratoria.
|
|
Variatiecoëfficiënt (%) van de interlaboratoriumstandaardafwijking (SR)
|
Referentiemateriaal
|
Aminozuur
|
|
Threonine
|
Cysteïne/cystine
|
Methionine
|
Lysine
|
|
Varkensmengvoer
|
4,1
n = 15
|
9,9
n = 17
|
7,0
n = 17
|
3,2
n = 13
|
|
Slachtkuikenvoer
|
5,2
n = 16
|
8,8
n = 18
|
10,9
n = 18
|
5,4
n = 16
|
|
Eiwitconcentraat
|
3,8
n = 16
|
12,3
n = 17
|
13,0
n = 17
|
3,0
n = 15
|
|
Voormengsel
|
4,3
n = 16
|
—
|
6,9
n = 16
|
6,7
n = 16
|
|
n
|
=
|
aantal deelnemende laboratoria.
|
|
8. Gebruik van referentiematerialen
Of de methode op de juiste manier is toegepast dient te worden geverifieerd door herhaalde bepaling van gecertificeerde referentiematerialen, voor zover beschikbaar. Aanbevolen wordt de ijking uit te voeren met gecertificeerde aminozuurijkoplossingen.
9. Opmerkingen
|
9.1.
|
In verband met verschillen tussen aminozuuranalysatoren moeten de uiteindelijke concentraties van de ijkoplossingen van standaardaminozuren (3.27.4 en 3.27.5) en van het hydrolysaat (5.3.4) als richtsnoer worden beschouwd.
Het lineaire meetbereik van het apparaat moet voor alle aminozuren worden gecontroleerd.
De standaardoplossing wordt zodanig verdund met citraatbuffer dat pieken in het midden van het bereik worden verkregen.
|
|
9.2.
|
Indien HPLC-apparatuur wordt gebruikt voor de analyse van de hydrolysaten moeten de proefomstandigheden worden geoptimaliseerd overeenkomstig de aanbevelingen van de leverancier.
|
|
9.3.
|
Bij toepassing van de methode op diervoeders die meer dan 1 % chloride bevatten (krachtvoer, minerale voeders, aanvullende diervoeders) is het mogelijk dat voor methionine een te lage waarde wordt gemeten en is een speciale behandeling vereist.
|
G. BEPALING VAN TRYPTOFAAN
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van de totale hoeveelheid tryptofaan en de hoeveelheid vrij tryptofaan in diervoeders. Zij maakt geen onderscheid tussen de D- en de L-vorm.
2. Beginsel
Voor de bepaling van de totale hoeveelheid tryptofaan wordt het monster onder basische condities gehydrolyseerd met een verzadigde bariumhydroxideoplossing en gedurende 20 uur tot 110 oC verhit. Na de hydrolyse wordt er een interne standaard toegevoegd.
Voor de bepaling van de hoeveelheid vrij tryptofaan wordt het monster onder licht zure condities geëxtraheerd in aanwezigheid van een interne standaard.
Het tryptofaan en de interne standaard in het hydrolysaat of extract worden bepaald door HPLC met fluorescentiedetectie.
3. Reagentia
|
3.1.
|
Er dient dubbel gedestilleerd water of water van gelijkwaardige kwaliteit te worden gebruikt (conductiviteit < 10 μS/cm).
|
|
3.2.
|
Standaardstof: tryptofaan (zuiverheid/gehalte ≥ 99 %), gedroogd onder vacuüm boven difosforpentaoxide.
|
|
3.3.
|
Interne standaard: α-methyltryptofaan (zuiverheid/gehalte ≥ 99 %), gedroogd onder vacuüm boven difosforpentaoxide.
|
|
3.4.
|
Bariumhydroxide-octahydraat (er dient op te worden toegezien dat Ba(OH)2·8H2O niet langdurig aan lucht wordt blootgesteld om de vorming van BaCO3 te voorkomen; dit zou de bepaling kunnen storen) (zie opmerking 9.3).
|
|
3.6.
|
Orthofosforzuur, w = 85 % (m/m).
|
|
3.7.
|
Zoutzuur, ρ20 = 1,19 g/ml.
|
|
3.8.
|
Methanol, HPLC-kwaliteit of gelijkwaardig.
|
|
3.9.
|
Petroleumether, kooktraject 40-60 oC.
|
|
3.10.
|
Natriumhydroxideoplossing, c = 1 mol/l:
Los 40,0 g NaOH (3.5) op in water en vul met water aan tot 1 liter (3.1).
|
|
3.11.
|
Zoutzuur, c = 6 mol/l:
Neem 492 ml HCl (3.7) en vul met water aan tot 1 liter.
|
|
3.12.
|
Zoutzuur, c = 1 mol/l:
Neem 82 ml HCl (3.7) en vul met water aan tot 1 liter.
|
|
3.13.
|
Zoutzuur, c = 0,1 mol/l:
Neem 8,2 ml HCl (3.7) en vul met water aan tot 1 liter.
|
|
3.14.
|
Orthofosforzuur, c = 0,5 mol/l:
Neem 34 ml orthofosforzuur (3.6) en vul met water (3.1) aan tot 1 liter.
|
|
3.15.
|
Geconcentreerde tryptofaanoplossing (3.2), c = 2,50 μmol/ml:
Los 0,2553 g tryptofaan (3.2) in een maatkolf van 500 ml op in zoutzuur (3.13) en vul aan tot de streep met zoutzuur (3.13). Gedurende maximaal vier weken houdbaar bij -18 oC.
|
|
3.16.
|
Geconcentreerde internestandaardoplossing, c = 2,50 μmol/ml:
Los 0,2728 g α-methyltryptofaan (3.3) in een maatkolf van 500 ml op in zoutzuur (3.13) en vul aan tot de streep met zoutzuur (3.13). Gedurende maximaal vier weken houdbaar bij -18 oC.
|
|
3.17.
|
IJkstandaardoplossing van tryptofaan en interne standaard:
Neem 2,00 ml geconcentreerde tryptofaanoplossing (3.15) en 2,00 ml geconcentreerde internestandaardoplossing (α-methyltryptofaan) (3.16). Verdun met water (3.1) en methanol (3.8) tot ongeveer hetzelfde volume en ongeveer dezelfde methanolconcentratie (10-30 %) als het eindhydrolysaat.
Deze oplossing moet vóór gebruik vers worden bereid.
Bescherm tijdens de bereiding tegen direct zonlicht.
|
|
3.19.
|
1,1,1-Trichloor-2-methylpropaan-2-ol
|
|
3.20.
|
Ethanolamine, m > 98 % (m/m).
|
|
3.21.
|
Oplossing van 1 g 1,1,1-trichloor-2-methylpropaan-2-ol (3.19) in 100 ml methanol (3.8).
|
|
3.22.
|
Mobiele fase voor HPLC: 3,00 g azijnzuur (3.18) + 900 ml water (3.1) +50,0 ml oplossing (3.21) van 1,1,1-trichloor-2-methylpropaan-2-ol (3.19) in methanol (3.8) (1 g/100 ml). Breng de pH met ethanolamine (3.20) op 5,00. Vul aan met water tot 1 000 ml (3.1).
|
4. Apparatuur
|
4.1.
|
HPLC-apparatuur met een spectrofluorimetrische detector.
|
|
4.2.
|
HPLC-kolom: 125 mm × 4 mm, C18, vulling van 3 μm, of een gelijkwaardige kolom.
|
|
4.4.
|
Polypropyleenkolf, inhoud 125 ml, met brede hals en schroefdop.
|
|
4.5.
|
Membraanfilter, 0,45 μm.
|
|
4.6.
|
Autoclaaf 110 (± 2) oC, 1,4 (±0,1) bar.
|
|
4.7.
|
Schudapparaat of magneetroerder.
|
5. Werkwijze
5.1. Monstervoorbewerking
Het monster wordt gemalen tot de deeltjes een zeef met een maaswijdte van 0,5 mm passeren. Monsters met een hoog vochtgehalte moeten voor het malen eerst worden gevriesdroogd, of aan de lucht gedroogd bij ten hoogste 50 oC. Monsters met een hoog vetgehalte dienen voorafgaand aan het malen te worden geëxtraheerd met petroleumether (3.9).
5.2. Bepaling van de hoeveelheid vrij tryptofaan (extract)
Weeg een geschikte hoeveelheid (1-5 g) van het voorbewerkte monster (5.1) tot op 1 mg nauwkeurig af in een erlenmeyer. Voeg 100,0 ml zoutzuur (3.13) en 5,00 ml geconcentreerde internestandaardoplossing (3.16) toe. Schud of meng gedurende 60 minuten met behulp van een schudapparaat of een magneetroerder (4.7). Laat het bezinksel neerslaan en pipetteer 10,0 ml van de bovenstaande oplossing in een bekerglas. Voeg 5 ml orthofosforzuur (3.14) toe. Breng de pH met natriumhydroxide (3.10) op 3. Voeg voldoende methanol (3.8) toe om een methanolconcentratie tussen 10 en 30 % in het eindvolume te verkrijgen. Breng over in een maatkolf met een geschikt volume en verdun met water tot een volume dat is vereist voor de chromatografie (bij benadering hetzelfde volume als de ijkstandaardoplossing (3.17)).
Filtreer een paar ml van de oplossing door een membraanfilter van 0,45 μm (4.5) vóór injectie in de HPLC-kolom. Ga verder met de chromatografiestap volgens 5.4.
Bescherm de standaardoplossing en extracten tegen direct zonlicht. Als het niet mogelijk is de extracten dezelfde dag te analyseren, kunnen ze gedurende maximaal drie dagen bij 5 oC worden bewaard.
5.3. Bepaling van de totale hoeveelheid tryptofaan (hydrolysaat)
Weeg 0,1-1 g van het voorbewerkte monster (5.1) tot op 0,2 mg nauwkeurig af in de polypropyleenmaatkolf (4.4). De ingewogen hoeveelheid monster moet een stikstofgehalte hebben van ongeveer 10 mg. Voeg 8,4 g bariumhydroxide-octahydraat (3.4) en 10 ml water toe. Meng in een vortexmenger (4.8) of magneetroerder (4.7). Laat de magneet met tefloncoating in het mengsel zitten. Spoel de wanden van het vat af met 4 ml water. Plaats de schroefdop erop en sluit de maatkolf losjes. Breng over in een autoclaaf (4.6) met kokend water en laat het geheel 30-60 minuten stomen. Sluit de autoclaaf en autoclaveer gedurende 20 uur bij 110 (± 2) oC.
Breng de temperatuur terug tot iets onder 100 oC alvorens de autoclaaf te openen. Voeg 30 ml water op kamertemperatuur aan het warme mengsel toe om uitkristalliseren van Ba(OH)2·8H2O tegen te gaan. Schud of roer voorzichtig. Voeg 2,00 ml geconcentreerde internestandaardoplossing (α-methyltryptofaan) (3.16) toe. Laat de vaten gedurende 15 minuten in een water/ijsbad afkoelen.
Voeg 5 ml orthofosforzuur (3.14) toe. Laat het vat in het koelbad, neutraliseer al roerend met zoutzuur (3.11) en breng de pH met zoutzuur (3.12) op 3,0. Voeg voldoende methanol toe om een methanolconcentratie tussen 10 en 30 % in het eindvolume te verkrijgen. Breng over in een maatkolf met een geschikt volume en verdun met water tot het volume dat voor de chromatografie vereist is (bv. 100 ml). Toevoeging van methanol mag geen neerslag veroorzaken.
Filtreer een paar ml van de oplossing door een membraanfilter van 0,45 μm (4.5) vóór injectie in de HPLC-kolom. Ga verder met de chromatografiestap volgens 5.4.
Bescherm de standaardoplossing en de hydrolysaten tegen direct zonlicht. Als het niet mogelijk is de hydrolysaten dezelfde dag te analyseren, kunnen ze gedurende maximaal drie dagen bij 5 oC worden bewaard.
5.4. HPLC-bepaling
De volgende condities voor isocratische elutie worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen (zie ook de opmerkingen in punt 9.1 en 9.2):
|
HPLC-kolom (4.2):
|
125 mm × 4 mm, C18, vulling van 3 μm, of gelijkwaardig;
|
|
kolomtemperatuur:
|
kamertemperatuur;
|
|
mobiele fase (3,22):
|
3,00 g azijnzuur (3.18) + 900 ml water (3.1) +50,0 ml oplossing (3.21) van 1,1,1-trichloor-2-methylpropaan-2-ol (3.19) in methanol (3.8) (1 g/100 ml). Breng de pH op 5,00 met ethanolamine (3.20). Vul aan tot 1 000 ml met water (3.1);
|
|
elutiesnelheid:
|
1 ml/min;
|
|
benodigde tijd:
|
ongeveer 34 minuten;
|
|
detectiegolflengte:
|
excitatie: 280 nm, emissie: 356 nm;
|
|
injectievolume
|
20 μl.
|
6. Berekening van de resultaten
De hoeveelheid tryptofaan (X) in g per 100 g monster wordt berekend met de volgende formule:

|
A
|
=
|
piekoppervlakte van interne standaard, ijkstandaardoplossing (3.17);
|
|
B
|
=
|
piekoppervlakte van tryptofaan, extract (5.2) of hydrolysaat (5.3);
|
|
V1
|
=
|
volume in ml (2 ml) van geconcentreerde tryptofaanoplossing (3.15), toegevoegd aan de ijkoplossing (3.17);
|
|
c
|
=
|
concentratie in μmol/ml (= 2,50) van geconcentreerde tryptofaanoplossing (3.15), toegevoegd aan de ijkoplossing (3.17);
|
|
V2
|
=
|
volume in ml van geconcentreerde internestandaardoplossing (3.16), toegevoegd bij de extractie (5.2) (= 5,00 ml) of aan het hydrolysaat (5.3) (= 2,00 ml);
|
|
C
|
=
|
piekoppervlakte van interne standaard, extract (5.2) of hydrolysaat (5.3);
|
|
D
|
=
|
piekoppervlakte van tryptofaan, ijkstandaardoplossing (3.17);
|
|
V3
|
=
|
volume in ml (= 2,00 ml) van geconcentreerde internestandaardoplossing (3.16) toegevoegd aan de ijkstandaardoplossing (3.17);
|
|
m
|
=
|
massa van het analysemonster in g (gecorrigeerd tot de oorspronkelijke massa indien gedroogd en/of ontvet);
|
|
M
|
=
|
molecuulgewicht van tryptofaan (= 204,23 g/mol).
|
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer dan 10 % van het hoogste resultaat bedragen.
8. Resultaten van een ringonderzoek
In EG-verband is een ringonderzoek verricht (de vierde vergelijkende studie) waarbij drie monsters werden geanalyseerd door maximaal twaalf laboratoria om de hydrolysemethode te certificeren. De analyses werden voor elk monster vijfmaal uitgevoerd. De resultaten staan in de volgende tabel:
|
|
monster 1
varkensvoer
|
monster 2
varkensvoer met toegevoegd L-tryptofaan
|
monster 3
varkenskrachtvoer
|
|
L
|
12
|
12
|
12
|
|
n
|
50
|
55
|
50
|
|
Gemiddelde [g/kg]
|
2,42
|
3,40
|
4,22
|
|
Sr [g/kg]
|
0,05
|
0,05
|
0,08
|
|
r [g/kg]
|
0,14
|
0,14
|
0,22
|
|
CVr [ %]
|
1,9
|
1,6
|
1,9
|
|
SR [g/kg]
|
0,15
|
0,20
|
0,09
|
|
R [g/kg]
|
0,42
|
0,56
|
0,25
|
|
CVR [ %]
|
6,3
|
6,0
|
2,2
|
|
L
|
=
|
aantal laboratoria die resultaten hebben ingestuurd;
|
|
n
|
=
|
aantal afzonderlijke resultaten, na eliminatie van uitschieters (m.b.v. Cochran- en Dixon-toets);
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
r
|
=
|
herhaalbaarheid;
|
|
R
|
=
|
reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid, in %;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid, in %.
|
Bij een ander ringonderzoek in EG-verband (de derde vergelijkende studie) werden twee monsters geanalyseerd door maximaal 13 laboratoria om de methode voor extractie van vrij tryptofaan te certificeren. De analyses werden voor elk monster vijfmaal uitgevoerd. De resultaten staan in de volgende tabel:
|
|
monster 4
mengsel van tarwe en soja
|
monster 5
mengsel van tarwe en soja (= monster 4) met toegevoegd tryptofaan (0,457 g/kg)
|
|
L
|
12
|
12
|
|
n
|
55
|
60
|
|
Gemiddelde [g/kg]
|
0,391
|
0,931
|
|
Sr [g/kg]
|
0,005
|
0,012
|
|
r [g/kg]
|
0,014
|
0,034
|
|
CVr [ %]
|
1,34
|
1,34
|
|
SR [g/kg]
|
0,018
|
0,048
|
|
R [g/kg]
|
0,050
|
0,134
|
|
CVR [ %]
|
4,71
|
5,11
|
|
L
|
=
|
aantal laboratoria die resultaten hebben ingestuurd;
|
|
n
|
=
|
aantal afzonderlijke resultaten, na eliminatie van uitschieters (m.b.v. Cochran- en Dixon-toets);
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
r
|
=
|
herhaalbaarheid;
|
|
R
|
=
|
reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid, in %;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid, in %.
|
Bij een ander ringonderzoek in EG-verband werden vier monsters geanalyseerd door maximaal zeven laboratoria met als doel een tryptofaancertificatie voor hydrolyse. De resultaten staan in onderstaande tabel. De analyses werden voor elk monster vijfmaal uitgevoerd.
|
|
monster 1
varkensmengvoer
(CRM 117)
|
monster 2
vismeel met laag vetgehalte
(CRM 118)
|
monster 3
sojameel
(CRM 119)
|
monster 4
mageremelkpoeder
(CRM 120)
|
|
L
|
7
|
7
|
7
|
7
|
|
n
|
25
|
30
|
30
|
30
|
|
Gemiddelde [g/kg]
|
2,064
|
8,801
|
6,882
|
5,236
|
|
Sr [g/kg]
|
0,021
|
0,101
|
0,089
|
0,040
|
|
r [g/kg]
|
0,059
|
0,283
|
0,249
|
0,112
|
|
CVr [ %]
|
1,04
|
1,15
|
1,30
|
0,76
|
|
SR [g/kg]
|
0,031
|
0,413
|
0,283
|
0,221
|
|
R [g/kg]
|
0,087
|
1,156
|
0,792
|
0,619
|
|
CVR [ %]
|
1,48
|
4,69
|
4,11
|
4,22
|
|
L
|
=
|
aantal laboratoria die resultaten hebben ingestuurd;
|
|
n
|
=
|
aantal afzonderlijke resultaten, na eliminatie van uitschieters (m.b.v. Cochran- en Dixon-toets);
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
r
|
=
|
herhaalbaarheid;
|
|
R
|
=
|
reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid, in %;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid, in %.
|
9. Opmerkingen
|
9.1.
|
Onder de volgende speciale chromatografische condities kan een betere scheiding tussen tryptofaan en α-methyltryptofaan worden verkregen.
Isocratische elutie met gradiëntreiniging van de kolom:
|
HPLC-kolom:
|
125 mm × 4 mm, C18, vulling van 5 μm, of een gelijkwaardige kolom;
|
|
kolomtemperatuur:
|
32 oC;
|
|
mobiele fase:
|
A: 0,01 mol/l KH2PO4/methanol, 95+5 (V+V);
B: methanol;
|
|
gradiëntprogramma:
|
0 min
|
100 % A
|
0 % B;
|
|
|
15 min
|
100 % A
|
0 % B;
|
|
|
17 min
|
60 % A
|
40 % B;
|
|
|
19 min
|
60 % A
|
40 % B;
|
|
|
21 min
|
100 % A
|
0 % B;
|
|
|
33 min
|
100 % A
|
0 % B;
|
|
elutiesnelheid:
|
1,2 ml/minuut;
|
|
benodigde tijd:
|
ongeveer 33 minuten.
|
|
|
9.2.
|
De chromatografie varieert afhankelijk van het type HPLC en kolomvullingsmateriaal. Met het gekozen systeem moet een basislijnscheiding tussen tryptofaan en de interne standaard tot stand gebracht kunnen worden. Verder is het van belang dat afbraakproducten goed van tryptofaan en de interne standaard worden gescheiden. Er moeten hydrolysaten zonder interne standaard worden gebruikt om de basislijn onder de interne standaard te controleren op verontreinigingen. Het is van belang dat de uitvoeringstijd lang genoeg is voor de elutie van alle afbraakproducten, daar anders traag eluerende pieken de volgende chromatografische bepalingen kunnen storen.
Binnen het bepalingsgebied moet het chromatografiesysteem een lineaire respons geven. De lineaire respons moet worden gemeten bij een constante (de normale) concentratie van de interne standaard en bij verschillende tryptofaanconcentraties. Het is van belang dat de piekgrootte zowel voor tryptofaan als voor de interne standaard binnen het lineaire gebied van het HPLC/fluorescentiesysteem ligt. Als de piek van tryptofaan en/of de interne standaard te klein of te groot is, dient de analyse te worden herhaald met een andere monstergrootte en/of een gewijzigd eindvolume.
|
|
9.3.
|
Bariumhydroxide
De oplosbaarheid van bariumhydroxide neemt mettertijd steeds verder af. Dit resulteert in een troebele oplossing voor de HPLC-bepaling, die lage waarden voor tryptofaan kan opleveren.
|
H. BEPALING VAN RUW VET
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methoden voor de bepaling van het gehalte aan ruw vet in diervoeder. Zij heeft geen betrekking op de analyse van oliehoudende zaden en vruchten.
Naargelang van de aard en samenstelling van het diervoeder en de reden van de analyse moet één van de twee hieronder beschreven methoden worden gevolgd.
1.1. Methode A — rechtstreeks extraheerbaar ruw vet
Deze methode geldt voor voedermiddelen van plantaardige oorsprong, met uitzondering van die waarvoor methode B kan worden toegepast.
1.2. Methode B — totaal ruw vet
Deze methode geldt voor voedermiddelen van dierlijke oorsprong en voor alle mengvoeders. Zij moet worden gebruikt voor alle diervoeders waaruit het ruwe vet niet volledig kan worden geëxtraheerd zonder voorafgaande hydrolyse; dit geldt bijvoorbeeld voor glutenproducten, gist, aardappeleiwitten en producten die behandelingen als extrusie, vervlokking en verhitting ondergaan.
1.3. Interpretatie van de resultaten
In alle gevallen waarin met methode B als uitkomst een hoger percentage wordt geconstateerd dan met methode A, wordt de uitkomst van methode B als de juiste waarde beschouwd.
2. Beginsel
2.1. Methode A
Het ruwe vet wordt geëxtraheerd met petroleumether. Het oplosmiddel wordt afgedestilleerd en het residu gedroogd en gewogen.
2.2. Methode B
Het monster wordt bij verhoogde temperatuur met zoutzuur behandeld. Het mengsel wordt afgekoeld en gefiltreerd. Het residu wordt gewassen en gedroogd en verder volgens methode A geanalyseerd.
3. Reagentia
|
3.1.
|
Petroleumether, kooktraject: 40-60 oC. Het broomgetal moet kleiner dan 1 zijn en het verdampingsresidu kleiner dan 2 mg/100 ml.
|
|
3.2.
|
Natriumsulfaat, watervrij.
|
|
3.3.
|
Zoutzuur, c = 3 mol/l.
|
|
3.4.
|
Filtermateriaal, bijvoorbeeld kiezelgoer, Hyflo-supercel.
|
4. Apparatuur
|
4.1.
|
Extractieapparaat. Indien het apparaat werkt met een hevel (Soxhlet) moet de refluxsnelheid zodanig zijn dat ongeveer tien cyclussen per uur worden doorlopen; bij apparaten zonder hevel moet de refluxsnelheid ongeveer 10 ml per minuut zijn.
|
|
4.2.
|
Extractiehulzen die geen in petroleumether oplosbaar materiaal bevatten en een aan de eisen van 4.1 aangepaste porositeit hebben.
|
|
4.3.
|
Droogstoof, hetzij een vacuümstoof ingesteld op 75 oC ± 3 oC of een oven met luchtcirculatie ingesteld op 100 oC ± 3 oC.
|
5. Werkwijze
5.1. Methode A (zie punt 8.1)
Weeg 5 g van het monster tot op 1 mg nauwkeurig af, breng dit in een extractiehuls (4.2) en dek het af met ontvette watten.
Breng de huls in een extractieapparaat (4.1) en extraheer gedurende 6 uur met petroleumether (3.1). Vang het extract op in een van enkele stukjes puimsteen voorzien, gedroogd en getarreerd kolfje (2).
Destilleer het oplosmiddel af en droog het residu vervolgens gedurende 1,5 uur in de droogstoof (4.3). Laat afkoelen in een exsiccator en weeg. Droog nogmaals gedurende 30 minuten om zeker te zijn dat de massa van het vet constant is (het massaverlies tussen de twee wegingen mag niet meer bedragen dan 1 mg).
5.2. Methode B
Weeg 2,5 g van het monster tot op 1 mg nauwkeurig af (8.2), breng het in een bekerglas van 400 ml of een erlenmeyer van 300 ml en voeg 100 ml zoutzuur (3.3) en enkele stukjes puimsteen toe. Bedek het bekerglas met een horlogeglas of sluit de erlenmeyer aan op een terugvloeikoeler. Breng het mengsel op een kleine vlam of op een kookplaat net aan de kook en laat het gedurende 1 uur zachtjes koken. Draag er zorg voor dat de stof niet aan de wand gaat vastzitten.
Koel af en voeg zoveel filtermateriaal (3.4) toe dat bij het filtreren geen vetverlies optreedt. Filtreer door nat, vetvrij dubbel filtreerpapier. Was het residu met koud water totdat het waswater neutraal is. Controleer of het filtraat vet bevat. Indien in het filtraat vet aanwezig is, moet het monster vóór de hydrolyse geëxtraheerd worden met petroleumether, volgens methode A.
Breng het dubbelfilter met residu op een horlogeglas en droog het gedurende 1,5 uur in een droogstoof (4.3) op 100 oC ± 3 oC.
Breng het dubbelfilter met gedroogd residu in een extractiehuls (4.2) en dek het af met ontvette watten. Breng de huls in een extractieapparaat (4.1) en handel verder als beschreven in punt 5.1, tweede en derde alinea.
6. Weergave van de resultaten
Druk de massa van het residu uit als percentage van het monster.
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
0,2 % in absolute waarde, voor ruwvetgehalten lager dan 5 %;
|
|
—
|
4,0 % van het hoogste resultaat voor ruwvetgehalten tussen 5 en 10 %;
|
|
—
|
0,4 % in absolute waarde, voor ruwvetgehalten boven 10 %.
|
8. Opmerkingen
|
8.1.
|
Producten met een hoog vetgehalte, die moeilijk fijn te maken zijn, of waarvan moeilijk een homogeen analysemonster kan worden getrokken, worden als volgt behandeld.
Weeg 20 g van het monster op 1 mg nauwkeurig af en meng dit met 10 g of meer watervrij natriumsulfaat (3.2). Extraheer het mengsel met petroleumether (3.1) zoals beschreven in punt 5.1. Breng het volume van het extract met petroleumether (3.1) op 500 ml en meng. Breng 50 ml van deze oplossing in een van enkele stukjes puimsteen voorziene, gedroogde en getarreerde kolf. Destilleer het oplosmiddel af, droog het residu en handel verder als beschreven in punt 5.1, laatste alinea.
Verwijder het oplosmiddel uit het extractieresidu in de huls en maak het residu dan fijn tot een deeltjesgrootte van 1 mm. Breng het residu weer in de huls (geen natriumsulfaat toevoegen) en handel verder als beschreven in punt 5.1, tweede en derde alinea.
Bereken het vetgehalte als percentage van het monster met de volgende formule:
(10m1 + m2) × 5
waarbij:
|
m1
|
=
|
massa in g van het residu na de eerste extractie (aliquot deel van het extract);
|
|
m2
|
=
|
massa in g van het residu na de tweede extractie.
|
|
|
8.2.
|
Bij vetarme producten kan van 5 g analysemateriaal worden uitgegaan.
|
|
8.3.
|
Bij voeder voor gezelschapsdieren dat een hoog vochtgehalte heeft, kan het nodig zijn om vóór hydrolyse en extractie via methode B watervrij natriumsulfaat toe te voegen.
|
|
8.4.
|
Wat punt 5.2 betreft kan het doeltreffender zijn om warm in plaats van koud water te gebruiken om het residu, na filtrering, te wassen.
|
|
8.5.
|
Het kan nodig zijn sommige diervoeders langer dan anderhalf uur te drogen. Te veel drogen moet evenwel worden voorkomen aangezien dit tot lage resultaten kan leiden. Er mag gebruik worden gemaakt van een microgolfoven.
|
|
8.6.
|
Als het ruwvetgehalte hoger is dan 15 % verdient het aanbeveling om het monster vóór hydrolyse via methode A en vervolgens nogmaals via methode B te extraheren. Dit hangt tot op zekere hoogte af van de aard van het diervoeder en de aard van het ruwe vet in het voeder.
|
I. BEPALING VAN RUWE CELSTOF
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan in zuur en basisch milieu onoplosbare, vetvrije organische bestanddelen in diervoeders, standaard aangeduid als ruwe celstof.
2. Beginsel
Het monster wordt, zo nodig na ontvetten, achtereenvolgens behandeld met kokende oplossingen van zwavelzuur en kaliumhydroxide van bepaalde concentraties. Het residu wordt afgefiltreerd op een filter van gesinterd glas, gewassen, gedroogd, gewogen en bij een temperatuur van 475 tot 500 oC gegloeid. Het massaverlies als gevolg van het gloeien is een maat voor het gehalte aan ruwe celstof in het testmonster.
3. Reagentia
|
3.1.
|
Zwavelzuur, c = 0,13 mol/l.
|
|
3.2.
|
Antischuimmiddel (bv. n-octanol).
|
|
3.3.
|
Filtreerhulpmiddel (Celite 545 of gelijkwaardig), gedurende vier uur bij 500 oC verhit (8.6).
|
|
3.5.
|
Petroleumether, kooktraject: 40-60 oC.
|
|
3.6.
|
Zoutzuur, c = 0,5 mol/l.
|
|
3.7.
|
Kaliumhydroxideoplossing, c = 0,23 mol/l.
|
4. Apparatuur
|
4.1.
|
Verwarmingstoestel voor ontsluiting met zwavelzuur en kaliumhydroxideoplossing, voorzien van een houder voor de filterkroes (4.2), een afvoerbuis met kraan voor de vloeistofafvoer en de vacuümaansluiting, eventueel met perslucht. Het toestel moet vóór gebruik dagelijks 5 minuten met kokend water worden voorverwarmd.
|
|
4.2.
|
Glasfilterkroes met filter van gesinterd glas met poriën van 40-90 μm. Voor het eerste gebruik wordt de filterkroes enkele minuten op 500 oC verhit en afgekoeld (8.6).
|
|
4.3.
|
Kookcilinder met een inhoud van ten minste 270 ml met terugvloeikoeler.
|
|
4.4.
|
Droogstoof met thermostaat.
|
|
4.5.
|
Moffeloven met thermostaat.
|
|
4.6.
|
Extractietoestel, voorzien van een houder voor de filterkroes (4.2) en een afvoerbuis met kraan voor de vacuümaansluiting en de vloeistofafvoer.
|
|
4.7.
|
Verbindingsringen voor de aansluiting tussen het verwarmingstoestel (4.1), de filterkroes (4.2) en de kookcilinder (4.3) en voor de aansluiting tussen het extractietoestel (4.6) en de filterkroes.
|
5. Werkwijze
Weeg 1 g van het bereide monster tot op 1 mg nauwkeurig af, breng het in de filterkroes (4.2) (zie opmerkingen onder 8.1, 8.2 en 8.3) en voeg 1 g filtreerhulpmiddel (3.3) toe.
Sluit het verwarmingstoestel (4.1) en de filterkroes (4.2) op elkaar aan en verbind vervolgens de kookcilinder (4.3) met de filterkroes. Breng in de kookcilinder met de filterkroes 150 ml tot het kookpunt verhit zwavelzuur (3.1) en voeg zo nodig enkele druppels antischuimmiddel (3.2) toe.
Breng de vloeistof in 5 ± 2 minuten aan de kook en kook krachtig gedurende precies 30 minuten.
Open de kraan van de afvoerbuis (4.1) en filtreer het zwavelzuur onder vacuüm door de filterkroes. Was het residu op het filter driemaal met telkens 30 ml kokend water. Na elke wasstap dient het residu te worden drooggezogen.
Sluit de kraan van de afvoerbuis en breng in de kookcilinder met filterkroes 150 ml tot het kookpunt verhitte kaliumhydroxideoplossing (3.7) en enkele druppels antischuimmiddel (3.2). Breng de vloeistof in 5 ± 2 minuten aan de kook en kook krachtig gedurende precies 30 minuten. Filtreer en was het residu op dezelfde wijze als na de behandeling met zwavelzuur.
Zuig het residu na de laatste wasbehandeling droog en sluit de filterkroes met inhoud aan op het extractietoestel (4.6). Was het residu onder vacuüm driemaal met telkens 25 ml aceton (3.4). Na elke wasstap dient het residu te worden drooggezogen.
Droog de filterkroes in de droogstoof bij 130 oC tot constante massa. Koel de kroes na elke droging in de exsiccator af en weeg snel. Plaats de filterkroes vervolgens in een moffeloven en veras de inhoud ten minste 30 minuten bij 475-500 oC tot constante massa (het massaverlies tussen twee opeenvolgende wegingen mag niet meer dan 2 mg zijn).
Koel de filterkroes na elke verassing eerst af in de moffeloven en vervolgens in de exsiccator en weeg daarna.
Verricht op gelijke wijze een blancobepaling zonder monster. Het massaverlies als gevolg van het verassen mag niet meer dan 4 mg bedragen.
6. Berekening van de resultaten
Bereken het gehalte aan ruwe celstof als percentage van het monster met de volgende formule:

waarbij:
|
m
|
=
|
massa van het analysemonster, in g;
|
|
m0
|
=
|
massaverlies na verassen bij de bepaling met het analysemonster, in g;
|
|
m1
|
=
|
massaverlies na verassen bij de blancobepaling, in g.
|
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
0,6 % absoluut bij gehalten aan ruwe celstof van minder dan 10 %;
|
|
—
|
6 % van het hoogste resultaat, bij gehalten aan ruwe celstof van 10 % of meer.
|
8. Opmerkingen
|
8.1.
|
Diervoeders die meer dan 10 % ruw vet bevatten, moeten voorafgaande aan de bepaling worden ontvet met petroleumether (3.5). Sluit de filterkroes (4.2) met het ingewogen monster aan op het extractietoestel (4.6) en was onder vacuüm driemaal met telkens 30 ml petroleumether. Zuig het monster droog, sluit de filterkroes aan op het verwarmingstoestel (4.1) en voer de bepaling uit zoals beschreven in punt 5.
|
|
8.2.
|
Diervoeders die niet direct met petroleumether (3.5) extraheerbare vetten bevatten, moeten zoals aangegeven in punt 8.1 worden ontvet en vervolgens na opkoken met zwavelzuur nogmaals worden ontvet. Sluit na opkoken met zwavelzuur en daaropvolgend wassen de filterkroes met inhoud aan op het extractietoestel (4.6) en was driemaal met telkens 30 ml aceton, gevolgd door driemaal wassen met telkens 30 ml petroleumether. Zuig het filter droog onder vacuüm en vervolg de bepaling zoals beschreven bij punt 5, te beginnen met de behandeling met kaliumhydroxideoplossing.
|
|
8.3.
|
Diervoeders die meer dan 5 % carbonaat, uitgedrukt als calciumcarbonaat, bevatten, worden als volgt behandeld. Sluit de filterkroes (4.2) met het ingewogen monster aan op het verwarmingstoestel (4.1). Was het monster driemaal met 30 ml zoutzuur (3.6). Wacht na elke toevoeging van zoutzuur ongeveer een minuut voordat het monster wordt afgefiltreerd. Was eenmaal met 30 ml water en voer de bepaling verder uit zoals beschreven bij punt 5.
|
|
8.4.
|
Indien voor meervoudige bepalingen uitgeruste apparatuur wordt gebruikt (met een aantal aan hetzelfde verwarmingstoestel aangesloten filterkroezen), mogen in dezelfde reeks geen twee bepalingen van hetzelfde monster uitgevoerd worden.
|
|
8.5.
|
Wanneer de zure of basische oplossingen na opkoken moeilijk te filtreren zijn, moet perslucht door de afvoerbuis van het verwarmingstoestel worden geblazen, waarna het filtreren wordt voortgezet.
|
|
8.6.
|
Met het oog op de levensduur van de glasfilterkroezen mag de verassingstemperatuur niet hoger dan 500 oC zijn. Bij het verhitten en afkoelen moeten temperatuurschokken worden vermeden.
|
J. BEPALING VAN SUIKERS
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan reducerende suikers en aan suikers totaal na inversie, uitgedrukt als glucose of eventueel, na vermenigvuldigen met de factor 0,95, als sacharose. De methode is toepasbaar voor mengvoeders. Voor andere diervoeders dienen bijzondere werkwijzen in acht te worden genomen. Het gehalte aan lactose moet eventueel afzonderlijk bepaald worden en bij de berekening moet met dat resultaat rekening gehouden worden.
2. Beginsel
De suikers worden in verdunde ethanol opgelost; de oplossing wordt met Carrez I- en Carrez II-oplossing geklaard. Na het afdampen van de ethanol worden — voor en na inversie — de bepalingen uitgevoerd volgens de methode Luff-Schoorl.
3. Reagentia
|
3.1.
|
Ethanol 40 % (V/V), d = 0,948 g/ml bij 20 oC, geneutraliseerd ten opzichte van fenolftaleïne.
|
|
3.2.
|
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
|
|
3.3.
|
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)6·3H2O, op in water. Vul met water aan tot 100 ml.
|
|
3.4.
|
Methyloranje, oplossing van 0,1 % (m/V).
|
|
3.7.
|
Natriumhydroxideoplossing 0,1 mol/l.
|
|
3.8.
|
Luff-Schoorl-reagens:
Voeg, onder voorzichtig omzwenken, de citroenzuuroplossing (3.8.2) bij de natriumcarbonaatoplossing (3.8.3). Voeg daarna toe de kopersulfaatoplossing (3.8.1) en vul aan met water tot 1 liter. Laat een nacht staan en filtreer.
Controleer de concentraties in het aldus verkregen reagens (Cu 0,05 mol/l, Na2CO3 1 mol/l), zie punt 5.4, laatste alinea. De pH van de oplossing moet ongeveer 9,4 zijn.
|
|
3.8.1.
|
Kopersulfaatoplossing: los 25 g kopersulfaat, CuSO4·5H2O, vrij van ijzer, op in 100 ml water.
|
|
3.8.2.
|
Citroenzuuroplossing: los 50 g citroenzuur, C6H8O7·H2O, op in 50 ml water.
|
|
3.8.3.
|
Natriumcarbonaatoplossing: los 143,8 g watervrij natriumcarbonaat op in ongeveer 300 ml warm water. Laat afkoelen.
|
|
3.9.
|
Natriumthiosulfaatoplossing 0,1 mol/l.
|
|
3.10.
|
Zetmeeloplossing: voeg aan 1 liter kokend water een suspensie van 5 g oplosbaar zetmeel in 30 ml water toe en houd 3 minuten aan de kook; laat vervolgens afkoelen en voeg eventueel 10 mg kwik(II)jodide toe als conserveermiddel.
|
|
3.11.
|
Zwavelzuur 3 mol/l.
|
|
3.12.
|
Kaliumjodideoplossing 30 % (m/V).
|
|
3.13.
|
Puimsteenkorrels, met zoutzuur uitgekookt, met water gewassen en gedroogd.
|
|
3.14.
|
3-Methylbutaan-l-ol.
|
4. Apparatuur
Roteerapparaat met ongeveer 35-40 omwentelingen per minuut.
5. Werkwijze
5.1. Extractie van het monster
Breng 2,5 g van het monster, tot op 1 mg nauwkeurig gewogen, in een maatkolf van 250 ml. Voeg 200 ml ethanol (3.1) toe en laat de kolf gedurende 1 uur roteren. Voeg 5 ml Carrez I-oplossing (3.2) toe en schud gedurende ongeveer 30 seconden. Voeg vervolgens 5 ml Carrez II-oplossing (3.3) toe en schud gedurende 1 minuut. Vul aan tot de streep met ethanol (3.1), meng en filtreer. Neem 200 ml van het filtraat en damp in tot op ongeveer de helft van het volume, teneinde het grootste gedeelte van de ethanol te verwijderen. Breng het restant kwantitatief met heet water over in een maatkolf van 200 ml, koel af, vul aan tot de streep met water, meng en filtreer zo nodig. Gebruik deze oplossing voor de bepaling van reducerende suikers en voor de bepaling van suikers totaal na inversie.
5.2. Bepaling van reducerende suikers
Pipetteer een hoeveelheid van ten hoogste 25 ml van de oplossing af, die minder dan 60 mg reducerende suikers, uitgedrukt als glucose, bevat. Vul zo nodig met gedestilleerd water aan tot 25 ml en bepaal het gehalte aan reducerende suikers volgens Luff-Schoorl. Druk het resultaat uit als percentage glucose.
5.3. Bepaling van totaal suikers na inversie
Pipetteer 50 ml van de oplossing in een maatkolf van 100 ml; voeg enkele druppels methyloranje (3.4) toe en voeg vervolgens, voorzichtig en onder voortdurend omzwenken, zoutzuur (3.5) toe totdat een duidelijke omslag naar rood verkregen is. Voeg dan 15 ml zoutzuur (3.6) toe en plaats de kolf gedurende 30 minuten in een bad met flink kokend water. Koel snel af tot ongeveer 20 oC en voeg 15 ml natriumhydroxideoplossing (3.7) toe. Vul aan met water tot 100 ml en meng goed. Pipetteer een hoeveelheid van ten hoogste 25 ml, die minder dan 60 mg reducerende suikers, uitgedrukt als glucose, bevat. Vul zo nodig met gedestilleerd water aan tot 25 ml en bepaal het gehalte aan reducerende suikers volgens Luff-Schoorl. Druk het resultaat uit als percentage glucose, of eventueel sacharose door vermenigvuldigen met de factor 0,95.
5.4. Titratie volgens Luff-Schoorl
Pipetteer 25 ml Luff-Schoorl-reagens (3.8) in een erlenmeyer van 300 ml en voeg vervolgens precies 25 ml van de geklaarde suikeroplossing toe. Verhit na toevoeging van twee puimsteenkorrels (3.13) onder omzwenken uit de hand boven een vrije vlam van matige hoogte, zodanig dat de vloeistof in ongeveer 2 minuten kookt. Plaats daarna de erlenmeyer onmiddellijk op een draadgaas met een asbestplaat met een opening van ongeveer 6 cm diameter; steek van te voren onder het draadgaas een vlam aan en regel deze zodanig dat alleen de bodem van de erlenmeyer verwarmd wordt. Verbind de erlenmeyer met een terugvloeikoeler. Laat vanaf dit moment precies 10 minuten koken, koel dan onmiddellijk af in koud water en titreer na 5 minuten als volgt.
Voeg aan de vloeistof 10 ml kaliumjodideoplossing (3.12) toe en onmiddellijk daarna voorzichtig (wegens het sterke schuimen) 25 ml zwavelzuur (3.11). Titreer dan met natriumthiosulfaatoplossing (3.9) tot roomgeel, voeg de zetmeeloplossing (3.10) als indicator toe en voltooi de titratie.
Verricht eenzelfde titratie in een mengsel van precies 25 ml Luff-Schoorl-reagens (3.8) en 25 ml water na toevoeging van 10 ml kaliumjodideoplossing (3.12) en 25 ml zwavelzuur (3.11), maar nu zonder verwarmen.
6. Berekening van de resultaten
Bepaal aan de hand van de onderstaande tabel de hoeveelheid glucose in mg die overeenkomt met het verschil van de beide titratie-uitkomsten, uitgedrukt in ml natriumthiosulfaatoplossing 0,1 mol/l. Druk het resultaat uit als percentage van het monster.
7. Bijzondere werkwijzen
|
7.1.
|
Weeg bij diervoeders met een hoog gehalte aan melasse en bij andere diervoeders die weinig homogeen zijn 20 g af in een maatkolf van 1 liter; voeg 500 ml water toe en laat gedurende 1 uur roteren. Klaar daarna met telkens de viervoudige hoeveelheden Carrez I- en II-oplossing (3.2) en (3.3), zoals onder 5.1 beschreven. Vul dan aan tot de streep met ethanol 80 % (V/V).
Meng en filtreer. Verwijder de ethanol zoals onder 5.1 beschreven. Indien er geen gedextrineerd zetmeel aanwezig is, wordt met gedestilleerd water aangevuld.
|
|
7.2.
|
Weeg van melasse en van voedermiddelen die een hoog gehalte aan suikers, maar praktisch geen zetmeel bevatten (johannesbrood, suikerbietensnijdsels enz.) 5 g in een maatkolf van 250 ml; voeg 200 ml gedestilleerd water toe en laat gedurende 1 uur, of langer indien nodig, roteren. Klaar met Carrez I- en II-oplossing (3.2) en (3.3), zoals onder 5.1 beschreven. Vul aan tot de streep met koud water, meng en filtreer. Handel voor de bepaling van suikers totaal als bij 5.3.
|
8. Opmerkingen
|
8.1.
|
Om schuimvorming te voorkomen verdient het aanbeveling vóór het verwarmen met het reagens volgens Luff-Schoorl ongeveer 1 ml 3-methylbutaan-1-ol (3.1) toe te voegen (ongeacht het volume).
|
|
8.2.
|
Het verschil tussen het percentage suikers totaal na inversie, uitgedrukt als glucose, en het percentage reducerende suikers, uitgedrukt als glucose, geeft — na vermenigvuldiging met 0,95 — het percentage sacharose.
|
|
8.3.
|
Het gehalte aan reducerende suikers exclusief lactose kan op twee manieren worden bepaald:
|
|
8.3.1.
|
Voor een benaderende berekening wordt het gehalte aan lactose — gevonden bij een afzonderlijke bepaling — vermenigvuldigd met 0,675 en van het gehalte aan reducerende suikers afgetrokken.
|
|
8.3.2.
|
Voor een nauwkeurige berekening van de reducerende suikers exclusief lactose is het echter noodzakelijk dat bij de beide bepalingen uiteindelijk dezelfde hoeveelheid analysemateriaal in bewerking genomen wordt. Een van de bepalingen wordt uitgevoerd in een deel van de oplossing verkregen in 5.1, de andere bepaling in een deel van de oplossing verkregen bij de bepaling van lactose volgens de desbetreffende methode (na vergisting van andere suikers en klaring).
In beide gevallen wordt het suikergehalte bepaald volgens Luff-Schoorl en berekend als mg glucose. Deze waarden worden van elkaar afgetrokken en het verschil wordt uitgedrukt als percentage van het monster.
Voorbeeld:
De beide afgepipetteerde hoeveelheden komen bij elke bepaling overeen met 250 mg analysemateriaal.
In het eerste geval wordt 17 ml natriumthiosulfaatoplossing 0,1 mol/l verbruikt, overeenkomend met 44,2 mg glucose; in het tweede geval 11 ml, overeenkomend met 27,6 mg glucose.
Het verschil bedraagt dus 16,6 mg glucose.
Het gehalte aan reducerende suikers, exclusief lactose, berekend als glucose, bedraagt dan:
|
Tabel van de waarden voor 25 ml Luff-Schoorl-reagens
ml Na2S2O30,1 mol/l, verwarmd gedurende 2 minuten, aan de kook gedurende 10 minuten
|
Na2S2O3
0,1 mol/liter
|
Glucose, fructose, invertsuikers
C6H12O6
|
Lactose
C12H22O11
|
Maltose
C12H22O11
|
Na2S2O3
0,1 mol/l
|
|
ml
|
mg
|
verschil
|
mg
|
verschil
|
mg
|
verschil
|
ml
|
|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
|
2,4
4,8
7,2
9,7
12,2
14,7
17,2
19,8
22,4
25,0
27,6
30,3
33,0
35,7
38,5
41,3
44,2
47,1
50,0
53,0
56,0
59,1
62,2
|
2,4
2,4
2,5
2,5
2,5
2,5
2,6
2,6
2,6
2,6
2,7
2,7
2,7
2,8
2,8
2,9
2,9
2,9
3,0
3,0
3,1
3,1
|
3,6
7,3
11,0
14,7
18,4
22,1
25,8
29,5
33,2
37,0
40,8
44,6
48,4
52,2
56,0
59,9
63,8
67,7
71,7
75,7
79,8
83,9
88,0
|
3,7
3,7
3,7
3,7
3,7
3,7
3,7
3,7
3,8
3,8
3,8
3,8
3,8
3,8
3,9
3,9
3,9
4,0
4,0
4,1
4,1
4,1
|
3,9
7,8
11,7
15,6
19,6
23,5
27,5
31,5
35,5
39,5
43,5
47,5
51,6
55,7
59,8
63,9
68,0
72,2
76,5
80,9
85,4
90,0
94,6
|
3,9
3,9
3,9
4,0
3,9
4,0
4,0
4,0
4,0
4,0
4,0
4,1
4,1
4,1
4,1
4,1
4,2
4,3
4,4
4,5
4,6
4,6
|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
|
K. BEPALING VAN LACTOSE
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan lactose in diervoeders die meer dan 0,5 % lactose bevatten.
2. Beginsel
De suikers worden in water opgelost. De oplossing wordt vergist met Saccharomyces cerevisiae, waarbij de lactose niet wordt afgebroken. Na klaren en filtreren wordt in het filtraat het gehalte aan lactose bepaald volgens Luff-Schoorl.
3. Reagentia
|
3.1.
|
Suspensie van Saccharomyces cerevisiae: suspendeer 25 g verse gist in 100 ml water. In de koelkast bewaren: ten hoogste een week houdbaar.
|
|
3.2.
|
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
|
|
3.3.
|
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)6·3H2O, op in water. Vul met water aan tot 100 ml.
|
|
3.4.
|
Luff-Schoorl-reagens:
Voeg, onder voorzichtig omzwenken, de citroenzuuroplossing (3.4.2) bij de natriumcarbonaatoplossing (3.4.3). Voeg daarna de kopersulfaatoplossing (3.4.1) toe en vul aan met water tot 1 liter. Laat een nacht staan en filtreer. Controleer de concentraties in het aldus verkregen reagens (Cu 0,05 mol/l, Na2CO3 1 mol/l). De pH van de oplossing moet ongeveer 9,4 zijn.
|
|
3.4.1.
|
Kopersulfaatoplossing: los 25 g kopersulfaat, CuSO4·5H2O, vrij van ijzer, op in 100 ml water.
|
|
3.4.2.
|
Citroenzuuroplossing: los 50 g citroenzuur, C6H8O7·H2O, op in 50 ml water.
|
|
3.4.3.
|
Natriumcarbonaatoplossing: los 143,8 g watervrij natriumcarbonaat op in ongeveer 300 ml warm water. Laat afkoelen.
|
|
3.5.
|
Puimsteenkorrels, met zoutzuur uitgekookt, met water gewassen en gedroogd.
|
|
3.6.
|
Kaliumjodideoplossing 30 % (m/V).
|
|
3.8.
|
Natriumthiosulfaatoplossing 0,1 mol/l.
|
|
3.9.
|
Zetmeeloplossing: voeg aan 1 liter kokend water een suspensie van 5 g oplosbaar zetmeel in 30 ml water toe en houd 3 minuten aan de kook; koel vervolgens af en voeg eventueel 10 mg kwik(II)jodide toe als conserveermiddel.
|
4. Apparatuur
Waterbad met thermostaat, ingesteld op 38-40 oC.
5. Werkwijze
Breng 1 g van het monster, tot op 1 mg nauwkeurig gewogen, in een maatkolf van 100 ml. Voeg 25-30 ml water toe. Plaats de kolf gedurende 30 minuten in een kokendwaterbad. Koel dan af tot ongeveer 35 oC, voeg 5 ml gistsuspensie (3.1) toe en meng. Plaats de kolf gedurende 2 uur in een waterbad van 38-40 oC. Koel vervolgens af tot ongeveer 20 oC.
Voeg daarna 2,5 ml Carrez I-oplossing (3.2) toe en schud gedurende 30 seconden; voeg dan 2,5 ml Carrez II-oplossing (3.3) toe en schud weer gedurende 30 seconden. Vul nu aan met water tot 100 ml, meng en filtreer. Pipetteer van het filtraat een hoeveelheid van ten hoogste 25 ml, die bij voorkeur 40-80 mg lactose bevat, in een erlenmeyer van 300 ml; vul zo nodig aan met water tot 25 ml.
Verricht op dezelfde wijze een blancobepaling met 5 ml gistsuspensie (3.1). Bepaal het gehalte aan lactose volgens Luff-Schoorl als volgt: voeg precies 25 ml Luff-Schoorl-reagens (3.4) toe. Verhit na toevoeging van twee puimsteenkorrels (3.5) onder omzwenken uit de hand boven een vrije vlam van matige hoogte, zodanig dat de vloeistof in ongeveer 2 minuten kookt. Plaats daarna de erlenmeyer onmiddellijk op een draadgaas met een asbestplaat met een opening van ongeveer 6 cm diameter; steek van te voren onder het draadgaas een vlam aan en regel deze zodanig dat alleen de bodem van de erlenmeyer verwarmd wordt. Verbind de erlenmeyer met een terugvloeikoeler. Laat vanaf dit moment precies 10 minuten koken, koel dan onmiddellijk af in koud water en titreer na 5 minuten als volgt.
Voeg aan de vloeistof 10 ml kaliumjodideoplossing (3.6) toe en onmiddellijk daarna voorzichtig (wegens het sterke schuimen) 25 ml zwavelzuur (3.7). Titreer dan met natriumthiosulfaatoplossing (3.8) tot roomgeel, voeg de zetmeeloplossing (3.9) als indicator toe en voltooi de titratie.
Verricht eenzelfde titratie in een mengsel van precies 25 ml Luff-Schoorl-reagens (3.4) en 25 ml water na toevoeging van 10 ml kaliumjodideoplossing (3.6) en 25 ml zwavelzuur (3.7), maar nu zonder verwarmen.
6. Berekening van de resultaten
Bepaal aan de hand van de onderstaande tabel de hoeveelheid lactose in mg die overeenkomt met het verschil van de beide titratie-uitkomsten, uitgedrukt in ml natriumthiosulfaatoplossing 0,1 mol/l.
Druk het resultaat (watervrije lactose) uit als percentage van het monster.
7. Opmerking
Voeg, indien het gehalte aan vergistbare suikers hoger is dan 40 %, meer dan 5 ml gistsuspensie (3.1) toe.
Tabel van de waarden voor 25 ml Luff-Schoorl-reagens
ml Na2S2O30,1 mol/l, verwarmd gedurende 2 minuten, aan de kook gedurende 10 minuten
|
Na2S2O3
0,1 mol/l
|
Glucose, fructose, invertsuikers
C6H12O6
|
Lactose
C12H22O11
|
Maltose
C12H22O11
|
Na2S2O3
0,1 mol/l
|
|
ml
|
mg
|
verschil
|
mg
|
verschil
|
mg
|
verschil
|
ml
|
|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
|
2,4
4,8
7,2
9,7
12,2
14,7
17,2
19,8
22,4
25,0
27,6
30,3
33,0
35,7
38,5
41,3
44,2
47,1
50,0
53,0
56,0
59,1
62,2
|
2,4
2,4
2,5
2,5
2,5
2,5
2,6
2,6
2,6
2,6
2,7
2,7
2,7
2,8
2,8
2,9
2,9
2,9
3,0
3,0
3,1
3,1
|
3,6
7,3
11,0
14,7
18,4
22,1
25,8
29,5
33,2
37,0
40,8
44,6
48,4
52,2
56,0
59,9
63,8
67,7
71,7
75,7
79,8
83,9
88,0
|
3,7
3,7
3,7
3,7
3,7
3,7
3,7
3,7
3,8
3,8
3,8
3,8
3,8
3,8
3,9
3,9
3,9
4,0
4,0
4,1
4,1
4,1
|
3,9
7,8
11,7
15,6
19,6
23,5
27,5
31,5
35,5
39,5
43,5
47,5
51,6
55,7
59,8
63,9
68,0
72,2
76,5
80,9
85,4
90,0
94,6
|
3,9
3,9
3,9
4,0
3,9
4,0
4,0
4,0
4,0
4,0
4,0
4,1
4,1
4,1
4,1
4,1
4,2
4,3
4,4
4,5
4,6
4,6
|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
|
L. BEPALING VAN ZETMEEL
POLARIMETRISCHE METHODE
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan zetmeel en hoogmoleculaire afbraakproducten van zetmeel in diervoeders om na te gaan of die in overeenstemming zijn met de vermelde energiewaarde (bepalingen in bijlage VII) en Richtlijn 96/25/EG van de Raad (3).
2. Beginsel
De bepaling bestaat uit twee onderdelen. Het eerste deel omvat de behandeling van het monster met verdund zoutzuur. Na klaren en filtreren wordt de optische draaiing van de oplossing polarimetrisch bepaald.
Het tweede deel omvat de extractie van het monster met ethanol 40 %. Na aanzuren van het filtraat met zoutzuur, klaren en filtreren wordt de optische draaiing gemeten zoals bij het eerste deel.
Het verschil tussen de twee metingen, vermenigvuldigd met een bekende factor geeft het zetmeelgehalte van het monster.
3. Reagentia
|
3.1.
|
Zoutzuur, 25 % (m/m), d = 1,126 g/ml.
|
|
3.2.
|
Zoutzuur, 1,13 % (m/V).
De sterkte moet worden gecontroleerd door titratie met natriumhydroxideoplossing 0,1 mol/l ten opzichte van de indicator methylrood 0,1 % (m/V) in ethanol 94 % (V/V). Om 10 ml te neutraliseren is 30,94 ml NaOH 0,1 mol/l nodig.
|
|
3.3.
|
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
|
|
3.4.
|
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)6·3H2O, op in water. Vul met water aan tot 100 ml.
|
|
3.5.
|
Ethanol 40 % (V/V), d = 0,948 g/ml bij 20 oC.
|
4. Apparatuur
|
4.1.
|
Erlenmeyer van 250 ml met normaalslijpstuk en terugvloeikoeler.
|
|
4.2.
|
Polarimeter of sacharimeter.
|
5. Werkwijze
5.1. Monstervoorbewerking
Maak het monster zo fijn dat het door een zeef met ronde mazen van 0,5 mm diameter gaat.
5.2. Bepaling van de totale optische draaiing (P of S) (zie opmerking 7.1)
Weeg 2,5 g van het monster tot op 1 mg nauwkeurig af in een maatkolf van 100 ml. Voeg 25 ml zoutzuur (3.2) toe, schud de kolf totdat het monster goed gesuspendeerd is en voeg nogmaals 25 ml zoutzuur (3.2) toe. Plaats de kolf in een kokendwaterbad en schud gedurende de eerste 3 minuten krachtig en regelmatig om klontvorming te voorkomen. De hoeveelheid water in het bad moet groot genoeg zijn om aan de kook te blijven wanneer de kolf erin wordt geplaatst. De kolf mag tijdens het schudden niet uit het water worden gehaald. Neem na precies 15 minuten de kolf uit het bad, voeg 30 ml koud water toe en laat onmiddellijk afkoelen tot 20 oC.
Voeg 5 ml Carrez I-oplossing (3.3) toe en schud gedurende ongeveer 30 seconden. Voeg vervolgens 5 ml Carrez II-oplossing (3.4) toe en schud nogmaals gedurende ongeveer 30 seconden. Vul aan tot de streep met water, meng en filtreer. Als het filtraat niet volledig helder is (wat zelden voorkomt), herhaal dan de bepaling met grotere hoeveelheden Carrez I- en II-oplossing, bijvoorbeeld 10 ml.
Meet vervolgens de optische draaiing van de oplossing in een buis van 200 mm met de polarimeter of de sacharimeter.
5.3. Bepaling van de optische draaiing (P' of S') van de in ethanol 40 % oplosbare stoffen
Weeg 5 g van het monster tot op 1 mg nauwkeurig af in een maatkolf van 100 ml en voeg ongeveer 80 ml ethanol (3.5) toe (zie opmerking 7.2). Laat de kolf gedurende 1 uur staan bij kamertemperatuur; schud de oplossing gedurende die tijd zesmaal krachtig, zodat het monster goed met de ethanol wordt vermengd. Vul vervolgens aan tot de streep met ethanol (3.5), meng en filtreer.
Pipetteer 50 ml van het filtraat (= 2,5 g monster) in een erlenmeyer van 250 ml, voeg 2,1 ml zoutzuur (3.1) toe en schud krachtig. Verbind de erlenmeyer met een terugvloeikoeler en plaats hem in een kokendwaterbad. Neem na precies 15 minuten de erlenmeyer uit het bad, breng de inhoud ervan over in een maatkolf van 100 ml, spoel na met een kleine hoeveelheid koud water en laat afkoelen tot 20 oC.
Klaar vervolgens met Carrez I- en II-oplossing (3.3) en (3.4), vul aan tot de streep met water, meng, filtreer en meet de optische draaiing als aangegeven onder 5.2, tweede en derde alinea.
6. Berekening van de resultaten
Het zetmeelgehalte van het monster (in %) wordt als volgt berekend:
6.1. Meting met de polarimeter
|
P
|
=
|
totale optische draaiing in booggraden;
|
|
P'
|
=
|
optische draaiing in booggraden van de in ethanol 40 % oplosbare stoffen;
|
|

|
=
|
specifieke optische draaiing van zuiver zetmeel. De waarden die standaard voor deze factor worden gebruikt zijn:
|
+ 185,9o:
|
rijstzetmeel
|
|
+ 185,7o:
|
aardappelzetmeel
|
|
+ 184,6o:
|
maiszetmeel
|
|
+ 182,7o:
|
tarwezetmeel
|
|
+ 181,5o:
|
gerstzetmeel
|
|
+ 181,3o:
|
haverzetmeel
|
|
+ 184,0o:
|
ander zetmeelsoorten en zetmeelmengsels in mengvoeders.
|
|
6.2. Metingen met de sacharimeter
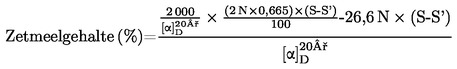
|
S
|
=
|
totale optische draaiing in sacharimetrische graden;
|
|
S'
|
=
|
optische draaiing in sacharimetrische graden van de in ethanol 40 % oplosbare stoffen;
|
|
N
|
=
|
massa in g van de hoeveelheid sacharose die in 100 ml water bij meting met een buis van 200 mm een optische draaiing van 100 sacharimetrische graden geeft:
16,29 g voor Franse sacharimeters,
26,00 g voor Duitse sacharimeters,
20,00 g voor gemengde sacharimeters.
|
|

|
=
|
specifieke optische draaiing van zuiver zetmeel (zie 6.1).
|
6.3. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 0,4 absoluut bij zetmeelgehalten van minder dan 40 %, en 1 % relatief bij zetmeelgehalten van 40 % of meer.
7. Opmerkingen
|
7.1.
|
Als het monster meer dan 6 % carbonaten bevat, berekend als calciumcarbonaat, moeten deze voor de bepaling van de totale optische draaiing worden ontleed door een behandeling met precies de daarvoor benodigde hoeveelheid verdund zwavelzuur.
|
|
7.2.
|
Producten met een hoog gehalte aan lactose, zoals weipoeder, mageremelkpoeder enz., worden na het toevoegen van de 80 ml ethanol (3.5) als volgt behandeld. Verbind de erlenmeyer met een terugvloeikoeler en plaats hem gedurende 30 minuten in een waterbad van 50 oC. Laat vervolgens afkoelen en handel verder als beschreven onder 5.3.
|
|
7.3.
|
Voor de hierna vermelde voedermiddelen is bekend dat zij, als ze in aanzienlijke hoeveelheden in diervoeders voorkomen, de bepaling van het zetmeelgehalte via de polarimetrische methode kunnen storen, zodat foutieve resultaten kunnen worden verkregen:
|
—
|
producten van (suiker)bieten, zoals (suiker)bietenpulp, (suiker)bietenmelasse, (suiker)bietenpulp-gemelasseerd, (suiker)biet-vinasse, (biet)suiker;
|
|
—
|
lijnzaad; lijnzaadschilfers; lijnzaadschroot;
|
|
—
|
kool- en raapzaad; kool- en raapzaadschilfers; kool- en raapzaadschroot; kool- en raapzaadschillen;
|
|
—
|
zonnebloemzaad; zonnebloemzaadschroot; zonnebloemzaadschroot van gedeeltelijk ontdopt zaad;
|
|
—
|
kokosschilfers; kokosschroot;
|
|
—
|
producten met een hoog gehalte aan inuline (bv. topinamboerchips en -meel);
|
|
M. BEPALING VAN RUWE AS
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan ruwe as in diervoeders.
2. Beginsel
De stof wordt gegloeid bij een temperatuur van 550 oC, waarna het residu wordt gewogen.
3. Reagentia
Ammoniumnitraatoplossing 20 % (m/V).
4. Apparatuur
|
4.1.
|
Elektrische verwarmingsplaat.
|
|
4.2.
|
Elektrische moffeloven met thermostaat.
|
|
4.3.
|
Verassingsschalen van kwarts, porselein of platina, rechthoekig (ca. 60 × 40 × 25 mm) of rond (diameter 60-75 mm, hoogte 20-40 mm).
|
5. Werkwijze
Weeg ongeveer 5 g van het monster (2,5 g in geval van stoffen die neiging hebben tot opzwellen) tot op 1 mg nauwkeurig af in een tevoren op 550 oC gegloeide en na afkoeling gewogen verassingsschaal. Verhit de schaal op de elektrische verwarmingsplaat langzamerhand totdat het analysemateriaal verkoold is. Volg daarna de werkwijze zoals beschreven in 5.1 of 5.2.
|
5.1.
|
Plaats de schaal in de op 550 oC ingestelde, geijkte moffeloven. Verhit zo lang, totdat een witte, lichtgrijze of roodachtige as verkregen is, die duidelijk vrij is van kooldeeltjes. Plaats de schaal daarna in een exsiccator en weeg direct nadat de schaal is afgekoeld.
|
|
5.2.
|
Plaats de schaal in de op 550 oC ingestelde, geijkte moffeloven. Gloei gedurende 3 uur. Plaats de schaal daarna in een exsiccator en weeg direct nadat de schaal is afgekoeld. Gloei nogmaals gedurende 30 minuten om zeker te zijn dat de massa van de as constant is (het massaverlies tussen de twee wegingen mag niet meer bedragen dan 1 mg).
|
6. Berekening van de resultaten
Bereken de massa van het residu door de massa van de lege schaal af te trekken.
Druk het resultaat uit als percentage van het monster.
7. Opmerkingen
|
7.1.
|
Bij stoffen die moeilijk te verassen zijn, worden na ten minste 3 uur gloeien aan de afgekoelde ruwe as enkele druppels ammoniumnitraatoplossing 20 % of water toegevoegd (echter voorzichtig om verstuiven en vastbakken van de stof te vermijden). Na drogen in een droogstoof wordt opnieuw gegloeid. Herhaal zo nodig deze bewerking totdat een volledige verassing is verkregen.
|
|
7.2.
|
Stoffen die ook na behandeling als beschreven onder 7.1 niet volledig verast zijn, worden als volgt behandeld. Na 3 uur gloeien wordt de as met heet gedestilleerd water opgenomen en door een klein asvrij filter afgefiltreerd. Filter en residu worden vervolgens in de gebruikte asschaal teruggebracht en opnieuw gegloeid. Nadat de schaal is afgekoeld wordt het filtraat in dezelfde schaal gebracht, ingedampt tot droog, gegloeid en gewogen.
|
|
7.3.
|
Van oliën en vetten wordt een hoeveelheid van 25 g nauwkeurig afgewogen in een voor deze hoeveelheid passende schaal. Vervolgens wordt de stof verkoold door het analysemateriaal met een reep asvrij filtreerpapier in brand te steken. Na het verkolen wordt het residu met een juist voldoende hoeveelheid water bevochtigd. Vervolgens wordt gedroogd en verder behandeld als beschreven in punt 5.
|
N. BEPALING VAN IN ZOUTZUUR ONOPLOSBARE AS
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van in zoutzuur onoplosbare, minerale bestanddelen van diervoeders. Afhankelijk van de aard van het monster zijn twee werkwijzen vastgesteld.
|
1.1.
|
Werkwijze A: toepasbaar voor organische voedermiddelen en voor de meeste mengvoeders.
|
|
1.2.
|
Werkwijze B: toepasbaar voor mineralen en mineralenmengsels, alsmede voor mengvoeders waarvan het gehalte aan in zoutzuur onoplosbare as, bepaald volgens werkwijze A, meer bedraagt dan 1 %.
|
2. Beginsel
|
2.1.
|
Werkwijze A: het monster wordt verast, de as behandeld met kokend zoutzuur en het onoplosbare residu wordt afgefiltreerd en gewogen.
|
|
2.2.
|
Werkwijze B: het monster wordt met zoutzuur behandeld. De oplossing wordt afgefiltreerd, het residu wordt verast en de as wordt dan verder behandeld zoals onder werkwijze A beschreven.
|
3. Reagentia
|
3.2.
|
Trichloorazijnzuuroplossing 20 % (m/V).
|
|
3.3.
|
Trichloorazijnzuuroplossing 1 % (m/V).
|
4. Apparatuur
|
4.1.
|
Elektrische verwarmingsplaat.
|
|
4.2.
|
Elektrische moffeloven met thermostaat.
|
|
4.3.
|
Verassingsschalen van kwarts, porselein of platina, rechthoekig (ca. 60 × 40 × 25 mm) of rond (diameter 60-75 mm, hoogte 20-40 mm).
|
5. Werkwijze
5.1. Werkwijze A
Veras het analysemateriaal op dezelfde manier als bij de bepaling van ruwe as beschreven is. Men kan ook de bij de ruwe asbepaling verkregen as gebruiken.
Breng de as met 75 ml zoutzuur (3.1) over in een bekerglas van 250-400 ml. Breng de vloeistof voorzichtig tot koken en houdt daarna gedurende 15 minuten juist aan de kook. Filtreer de hete oplossing door een asvrij papieren filter en was het residu met heet water uit tot zuurvrij. Droog het filter met residu en veras bij een temperatuur van tenminste 550 oC en ten hoogste 700 oC in een getarreerde verassingsschaal. Laat afkoelen in een exsiccator en weeg.
5.2. Werkwijze B
Weeg 5 g van het monster tot op 1 mg nauwkeurig af in een bekerglas van 250-400 ml. Voeg achtereenvolgens 25 ml water en 25 ml zoutzuur (3.1) toe, zwenk om en laat staan totdat de gasontwikkeling is opgehouden. Voeg dan nog 50 ml zoutzuur (3.1) toe. Wacht nogmaals tot een eventuele gasontwikkeling praktisch tot stilstand is gekomen. Verwarm het bekerglas daarna in een kokendwaterbad gedurende 30 minuten of zoveel langer als nodig is om eventueel aanwezig zetmeel volledig te hydrolyseren. Filtreer de hete oplossing over een asvrij filter en was het filter uit met ongeveer 50 ml heet water (zie opmerking 7). Plaats het filter met residu in een verassingsschaaltje, droog en veras bij tenminste 550 oC en ten hoogste 700 oC. Breng de as met 75 ml zoutzuur (3.1) over in een bekerglas van 250-400 ml, en handel verder als beschreven onder 5.1, tweede alinea.
6. Berekening van de resultaten
Bereken de massa van het residu door de massa van de lege schaal af te trekken. Druk het resultaat uit als percentage van het monster.
7. Opmerking
Als bij het filtreren moeilijkheden worden ondervonden, wordt de bepaling opnieuw gedaan, maar wordt in plaats van 50 ml zoutzuur (3.1) 50 ml trichloorazijnzuuroplossing 20 % (3.2) toegevoegd en wordt het filter met hete trichloorazijnzuuroplossing 1 % (3.3) uitgewassen.
O. BEPALING VAN CARBONATEN
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van carbonaten, standaard uitgedrukt als calciumcarbonaat, in de meeste diervoeders.
In bepaalde gevallen (bv. ijzercarbonaat) moet een bijzondere methode worden gevolgd.
2. Beginsel
Carbonaten worden met zoutzuur ontleed. Het vrijgekomen koolstofdioxide wordt opgevangen in een gekalibreerde buis. Dit volume wordt vergeleken met het volume dat onder gelijke omstandigheden vrijkomt uit een bekende hoeveelheid calciumcarbonaat.
3. Reagentia
|
3.1.
|
Zoutzuur, d = 1,10 g/ml.
|
|
3.3.
|
Zwavelzuur, circa 0,05 mol/l, gekleurd met methylrood.
|
4. Apparatuur
Toestel volgens Scheibler-Dietrich (zie tekening) of gelijkwaardige apparatuur.
5. Werkwijze
Weeg, afhankelijk van het gehalte aan carbonaten van het monster, een hoeveelheid analysemateriaal af zoals hieronder aangegeven:
|
—
|
0,5 g voor producten met een gehalte aan carbonaten, uitgedrukt als calciumcarbonaat, van 50 tot 100 %;
|
|
—
|
1 g voor producten met een gehalte aan carbonaten, uitgedrukt als calciumcarbonaat, van 40 tot 50 %;
|
|
—
|
2-3 g voor andere producten.
|
Breng het afgewogen analysemateriaal in het daartoe bestemde vat (4) van het toestel, waarin zich een buisje van onbreekbaar materiaal bevindt dat 10 ml zoutzuur (3.1) bevat, en verbind dit vat met het toestel. Draai de driewegkraan (5) zo dat de buis (1) met de buitenlucht in verbinding staat. Stel met de beweegbare buis (2), die met gekleurd zwavelzuur (3.3) gevuld en met de gekalibreerde buis (1) verbonden is, het niveau van de vloeistof in op het nulpunt. Draai de kraan (5) zodanig dat buis (1) met buis (3) verbonden is en controleer dan het nulpunt.
Breng vervolgens het zoutzuur (3.1) langzaam bij het analysemateriaal door het vat (4) schuin te houden. Houd de druk gelijk door buis (2) te laten zakken. Beweeg het vat (4) zo lang op en neer tot de koolstofdioxideontwikkeling geheel is afgelopen.
Herstel de druk door de vloeistof in de buizen (1) en (2) op gelijk niveau te brengen, wacht enige minuten tot het volume constant blijft en lees daarna af.
Verricht een controleproef met 0,5 g calciumcarbonaat (3.2) onder dezelfde omstandigheden.
6. Berekening van de resultaten
Bereken het gehalte aan carbonaten, uitgedrukt als calciumcarbonaat, als percentage van het monster met de volgende formule:

waarbij:
|
X
|
=
|
massapercentage carbonaten in het monster, uitgedrukt als calciumcarbonaat;
|
|
V
|
=
|
ml CO2, vrijgekomen uit het monster;
|
|
V1
|
=
|
ml CO2, vrijgekomen uit 0,5 g CaCO3;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Opmerkingen
|
7.1.
|
Wanneer de afgewogen hoeveelheid monster meer dan 2 g bedraagt, wordt tevoren 15 ml gedestilleerd water in het vat (4) gebracht en wordt de inhoud voor het begin van de proef gemengd. Gebruik dan dezelfde hoeveelheid water bij de vergelijkingsproef.
|
|
7.2.
|
Als een apparaat wordt gebruikt waarvan het volume van dat van Scheibler-Dietrich afwijkt, moeten de af te wegen hoeveelheid monster, de hoeveelheid controlemateriaal en de berekening worden aangepast.

|
P. BEPALING VAN TOTAAL FOSFOR
FOTOMETRISCHE METHODE
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan totaal fosfor in diervoeders. De methode is bijzonder geschikt voor de analyse van diervoeders met een laag gehalte aan fosfor. In bepaalde gevallen (producten die rijk zijn aan fosfor) kan een gravimetrische methode worden toegepast.
2. Beginsel
Het monster wordt ontsloten, hetzij langs droge weg (organische diervoeders), hetzij langs natte weg (minerale stoffen en vloeibare diervoeders), en in zure oplossing gebracht. De oplossing wordt behandeld met vanadaat-molybdaatreagens. De extinctie van de gevormde geelgekleurde oplossing bij 430 nm wordt gemeten met een spectrofotometer.
3. Reagentia
|
3.2.
|
Zoutzuur, ρ20 = 1,10 g/ml (ongeveer 6 mol/l).
|
|
3.3.
|
Salpeterzuur, ρ20 = 1,045 g/ml.
|
|
3.4.
|
Salpeterzuur, ρ20 = 1,38-1,42 g/ml.
|
|
3.5.
|
Zwavelzuur, ρ20 = 1,84 g/ml.
|
|
3.6.
|
Vanadaat-molybdaatreagens: meng in een maatkolf van 1 liter 200 ml ammoniumheptamolybdaatoplossing (3.6.1), 200 ml ammoniummonovanadaatoplossing (3.6.2) en 134 ml salpeterzuur (3.4). Vul aan tot de streep met water.
|
|
3.6.1.
|
Ammoniumheptamolybdaatoplossing: los 100 g ammoniumheptamolybdaat, (NH4)6Mo7O24·4H2O, op in warm water. Voeg 10 ml ammonia (d = 0,91 g/ml) toe en vul aan met water tot 1 liter.
|
|
3.6.2.
|
Ammoniumheptamolybdaatoplossing: los 2,35 g ammoniummonovanadaat, NH4VO3, op in 400 ml warm water. Voeg langzaam, onder voortdurend roeren, 20 ml verdund salpeterzuur (7 ml HNO3 (3.4) + 13 ml H2O) toe en vul aan met water tot 1 liter.
|
|
3.7.
|
Fosforstandaardoplossing 1 mg/ml: los 4,387 g kaliumdiwaterstoffosfaat, KH2PO4, op in water en vul aan met water tot 1 liter.
|
4. Apparatuur
|
4.1.
|
Verassingschalen van kwarts, porselein of platina.
|
|
4.2.
|
Elektrische moffeloven met thermostaat, ingesteld op 550 oC.
|
|
4.3.
|
Kjeldahlkolf van 250 ml.
|
|
4.4.
|
Maatkolven en pipetten.
|
|
4.6.
|
Reageerbuizen, diameter ca. 16 mm, met normaalslijpstuk 14,5; inhoud 25-30 ml.
|
5. Werkwijze
5.1. Bereiding van de oplossing
Bereid de oplossing als beschreven onder 5.1.1 of 5.1.2, afhankelijk van de aard van het monster.
5.1.1. Algemene werkwijze
Breng 1 g of meer van het monster, tot op 1 mg nauwkeurig gewogen, in een kjeldahlkolf. Voeg 20 ml zwavelzuur (3.5) toe en zwenk om, teneinde het analysemateriaal goed met het zuur te bevochtigen en vastzitten aan de wand van de kolf te voorkomen. Verwarm de kolf en laat gedurende 10 minuten koken. Laat even afkoelen, voeg 2 ml salpeterzuur (3.4) toe en verwarm zacht. Laat weer even afkoelen, voeg opnieuw een weinig salpeterzuur (3.4) toe en breng weer aan de kook. Herhaal deze bewerkingen totdat de oplossing kleurloos is. Laat hierna afkoelen, voeg een weinig water toe, giet de vloeistof in een maatkolf van 500 ml en spoel de kjeldahlkolf met heet water uit. Laat afkoelen, vul aan tot de streep met water, meng en filtreer.
5.1.2. Werkwijze voor monsters die organische stoffen bevatten, maar geen calcium- of magnesiumdiwaterstoffosfaat
Weeg ongeveer 2,5 g monster tot op 1 mg nauwkeurig af in een verassingsschaal en meng door en door met 1 g calciumcarbonaat (3.1). Veras in de moffeloven bij 550 oC totdat een witte of grijze as verkregen is (een kleine hoeveelheid koolstof stoort niet). Breng de as in een bekerglas van 250 ml, voeg 20 ml water toe en voeg vervolgens zoutzuur (3.2) toe tot het bruisen ophoudt. Voeg dan nog 10 ml zoutzuur (3.2) toe. Plaats het bekerglas op een zandbad en damp in tot droog om het kiezelzuur onoplosbaar te maken. Neem het residu op in 10 ml salpeterzuur (3.3) en laat gedurende 5 minuten koken op het zandbad of de verwarmingsplaat, zonder dat tot droog ingedampt wordt. Giet de vloeistof in een maatkolf van 500 ml en spoel het bekerglas meermalen met heet water uit. Laat afkoelen, vul aan tot de streep met water, meng en filtreer.
5.2. Ontwikkelen van de kleur en meten van de extinctie
Verdun een aliquot van het volgens 5.1.1 of 5.1.2 verkregen filtraat zo dat een fosforconcentratie verkregen wordt van ten hoogste 40 μg/ml. Pipetteer 10 ml van deze oplossing in een reageerbuis (4.6), voeg 10 ml vanadaat-molybdaatreagens (3.6) toe en meng. Laat gedurende ten minste 10 minuten staan bij 20 oC. Meet dan met een spectrofotometer de extinctie bij 430 nm tegen een mengsel van 10 ml vanadaat-molybdaatreagens (3.6) en 10 ml water.
5.3. IJkgrafiek
Bereid van de standaardoplossing (3.7) oplossingen die respectievelijk 5, 10, 20, 30 en 40 μg fosfor per ml bevatten. Voeg aan 10 ml van elk van deze oplossingen 10 ml vanadaat-molybdaatreagens (3.6) toe en meng. Laat gedurende ten minste 10 minuten staan bij 20 oC. Meet dan de extincties zoals beschreven in 5.2. Stel een ijkgrafiek op, waarbij op de abscis de hoeveelheden fosfor en op de ordinaat de daarbij behorende extinctiewaarden worden uitgezet. Het verloop van de ijkgrafiek is lineair voor fosforconcentraties tussen 0 en 40 μg fosfor per ml.
6. Berekening van de resultaten
Bepaal aan de hand van de ijkgrafiek het gehalte aan fosfor in het analysemonster.
Druk het resultaat uit als percentage van het monster.
Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
3 % relatief ten opzichte van het hoogste resultaat bij gehalten van minder dan 5 % fosfor;
|
|
—
|
0,15 % absoluut bij gehalten van 5 % of meer.
|
Q. BEPALING VAN CHLOOR VAN CHLORIDEN
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van chloor van in water oplosbare chloriden, standaard uitgedrukt als natriumchloride. Het is toepasbaar voor alle diervoeders.
2. Beginsel
Chloriden worden in water opgelost. Indien het analysemateriaal organische stoffen bevat, wordt een klaring toegepast. De oplossing wordt met salpeterzuur zwak aangezuurd en chloriden worden met een zilvernitraatoplossing als zilverchloride neergeslagen. De overmaat zilvernitraat wordt volgens de volhardmethode teruggetitreerd met ammoniumthiocyanaatoplossing.
3. Reagentia
|
3.1.
|
Ammoniumthiocyanaatoplossing 0,1 mol/l.
|
|
3.2.
|
Zilvernitraatoplossing 0,1 mol/l.
|
|
3.3.
|
Verzadigde oplossing van ammoniumijzer(III)sulfaat, (NH4)Fe(SO4)2.
|
|
3.4.
|
Salpeterzuur, d = 1,38 g/ml.
|
|
3.7.
|
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
|
|
3.8.
|
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)6·3H2O, op in water. Vul met water aan tot 100 ml.
|
|
3.9.
|
Actieve kool, vrij van chloriden en geen chloriden absorberend.
|
4. Apparatuur
Roteerapparaat met ongeveer 35-40 omwentelingen per minuut.
5. Werkwijze
5.1. Bereiding van de oplossing
Bereid al naar de aard van het monster, een oplossing als onder 5.1.1, 5.1.2 of 5.1.3 beschreven.
Verricht tegelijkertijd een blancobepaling zonder analysemateriaal.
5.1.1. Monsters die geen organische stoffen bevatten
Weeg ten hoogste 10 g analysemateriaal, waarin niet meer dan 3 g chloor als chloriden aanwezig is, tot op 1 mg nauwkeurig af in een maatkolf van 500 ml met 400 ml water van omstreeks 20 oC. Laat gedurende 30 minuten roteren, vul aan tot de streep met water, meng en filtreer.
5.1.2. Monsters die organische stoffen bevatten, met uitzondering van producten vermeld onder 5.1.3
Weeg ongeveer 5 g van het analysemateriaal tot op 1 mg nauwkeurig af in een maatkolf van 500 ml. Voeg 1 g actieve kool (3.9) toe en daarna 400 ml water van omstreeks 20 oC en 5 ml Carrez I-oplossing (3.7), zwenk gedurende 30 seconden om en voeg dan 5 ml Carrez II-oplossing (3.8) toe. Laat gedurende 30 minuten roteren, vul aan tot de streep met water, meng en filtreer.
5.1.3. Bakkerijafvalproducten, lijnkoeken en lijnmeel, producten met veel lijnmeel en andere producten met een hoog gehalte aan slijmstoffen of colloïdale stoffen (bv. gedextrineerd zetmeel)
Bereid de oplossing als beschreven onder 5.1.2, maar filtreer niet af. Laat vervolgens bezinken (zo nodig wordt gecentrifugeerd). Pipetteer 100 ml van de bovenstaande vloeistof in een maatkolf van 200 ml. Voeg aceton (3.6) toe, meng, vul aan tot de streep met aceton, meng en filtreer.
5.2. Titratie
Pipetteer 25-100 ml van het filtraat (afhankelijk van het te verwachten gehalte aan chloor), verkregen volgens 5.1.1, 5.1.2 of 5.1.3, in een erlenmeyer. De afgepipetteerde hoeveelheid mag niet meer dan 150 mg chloor (Cl) bevatten. Verdun zo nodig met water tot ten minste 50 ml. Voeg vervolgens 5 ml salpeterzuur (3.4), 20 ml verzadigde ammoniumijzer(III)sulfaatoplossing (3.3) en twee druppels ammoniumthiocyanaatoplossing (3.1) uit een tot op het nulpunt gevulde buret toe. Voeg daarna uit een buret zilvernitraatoplossing (3.2) toe, totdat een overmaat van 5 ml aanwezig is. Voeg dan 5 ml diethylether (3.5) toe en schud krachtig om het neerslag te doen samenklonteren. Titreer de overmaat zilvernitraat met ammoniumthiocyanaatoplossing (3.1) totdat een roodbruine kleur ontstaat, die ten minste één minuut blijft.
6. Berekening van de resultaten
Bereken de hoeveelheid chloor (X), uitgedrukt als percentage natriumchloride, met de volgende formule:

waarbij:
|
V1
|
=
|
ml toegevoegde zilvernitraatoplossing 0,1 mol/l;
|
|
V2
|
=
|
ml ammoniumthiocyanaatoplossing 0,1 mol/l verbruikt bij de titratie;
|
|
m
|
=
|
massa van het analysemonster.
|
Indien een blancoproef een verbruik aan zilvernitraatoplossing 0,1 mol/l oplevert, wordt deze waarde van het volume (V1 - V2) afgetrokken.
7. Opmerkingen
|
7.1.
|
De titratie kan ook potentiometrisch uitgevoerd worden.
|
|
7.2.
|
Producten met een zeer hoog gehalte aan vet dienen tevoren met diethylether of petroleumether ontvet te worden.
|
|
7.3.
|
Bij vismelen kan de titratie volgens Mohr uitgevoerd worden.
|
(1) Voor het drogen van granen, meel, grutten en gries moet de oven een zodanige warmtecapaciteit hebben dat, indien zij is voorverwarmd op 131 oC, deze temperatuur na het inzetten van het maximale aantal monsters weer binnen 45 minuten wordt bereikt. De ventilatie moet zodanig zijn dat wanneer het maximale aantal monsters zachte tarwe gedurende twee uur wordt gedroogd, de resultaten minder dan 0,15 % verschillen van de resultaten na vier uur drogen.
(2) Neem, indien het vet later kwalitatief moet worden onderzocht, glasparels in plaats van stukjes puimsteen.
(3) PB L 125 van 23.5.1996, blz. 35.
BIJLAGE IV
ANALYSEMETHODEN TER CONTROLE VAN HET GEHALTE AAN TOEGELATEN TOEVOEGINGSMIDDELEN IN DIERVOEDERS
A. BEPALING VAN VITAMINE A
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van vitamine A (retinol) in diervoeders en voormengsels. Onder vitamine A worden begrepen all-trans-retinylalcohol en de cis-isomeren daarvan die met deze methode worden bepaald. Het gehalte aan vitamine A wordt uitgedrukt in Internationale Eenheden (IE) per kg. 1 IE komt overeen met de activiteit van 0,300 μg all-trans-vitamine A-alcohol of 0,344 μg all-trans-vitamine A-acetaat of 0,550 μg all-trans-vitamine A-palmitaat.
De bepaalbaarheidsgrens is 2 000 IE vitamine A/kg.
2. Beginsel
Het monster wordt gehydrolyseerd met een ethanolische kaliumhydroxideoplossing waarna de vitamine A wordt geëxtraheerd met petroleumether. Het oplosmiddel wordt verwijderd door verdamping en het residu wordt opgelost in methanol en zo nodig verdund tot de gewenste concentratie. Het gehalte aan vitamine A wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (RP-HPLC) met uv- of fluorescentiedetectie. De chromatografische parameters worden zodanig gekozen dat er geen scheiding optreedt tussen de all-trans-vitamine A-alcohol en de cis-isomeren ervan.
3. Reagentia
|
3.2.
|
Petroleumether, kooktraject 40-60 oC.
|
|
3.4.
|
Kaliumhydroxideoplossing, c = 50 g/100 ml.
|
|
3.5.
|
Natriumascorbaatoplossing, c = 10 g/100 ml (zie opmerking 7.7).
|
|
3.6.
|
Natriumsulfide, Na2S· xH2O (x = 7-9).
|
|
3.6.1.
|
Natriumsulfideoplossing, c = 0,5 mol/l in glycerol, β = 120 g/l (voor x = 9) (zie opmerking 7.8).
|
|
3.7.
|
Fenolftaleïneoplossing, c = 2 g/100 ml in ethanol (3.1).
|
|
3.9.
|
Mobiele fase voor HPLC: mengsel van methanol (3,3) en water, bv. 980 + 20 (V + V). De exacte verhouding wordt bepaald door de eigenschappen van de gebruikte kolom.
|
|
3.10.
|
Stikstof, zuurstofvrij.
|
|
3.11.
|
All-trans-Vitamine A-acetaat, extra zuiver, met gecertificeerde activiteit, bv. 2,80 × 106 IE/g.
|
|
3.11.1.
|
Stamoplossing van all-trans-vitamine A-acetaat: weeg 50 mg vitamine A-acetaat (3.11) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in propaan-2-ol (3.8) en vul aan tot de streep met hetzelfde oplosmiddel. De nominale concentratie van deze oplossing is 1 400 IE vitamine A per ml. Het exacte gehalte dient te worden bepaald volgens 5.6.3.1.
|
|
3.12.
|
All-trans-Vitamine A-palmitaat, extra zuiver, met gecertificeerde activiteit, bv. 1,80 × 106 IE/g.
|
|
3.12.1.
|
Stamoplossing van all-trans-vitamine A-palmitaat: weeg 80 mg vitamine A-palmitaat (3.12) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in propaan-2-ol (3.8) en vul aan tot de streep met hetzelfde oplosmiddel. De nominale concentratie van deze oplossing is 1 400 IE vitamine A per ml. Het exacte gehalte dient te worden bepaald volgens 5.6.3.2.
|
|
3.13.
|
2,6-Di-tert-butyl-4-methylfenol (BHT) (zie opmerking 7.5).
|
4. Apparatus
|
4.2.1.
|
Platbodemkolven of erlenmeyers, 500 ml, met slijpstuk.
|
|
4.2.2.
|
Maatkolven met geslepen stop en een smalle hals, 10, 25, 100 en 500 ml.
|
|
4.2.3.
|
Scheitrechters, 1 000 ml, met geslepen stop.
|
|
4.2.4.
|
Peervormige kolven, 250 ml, met slijpstuk.
|
|
4.3.
|
Allihn-condensor, huislengte 300 mm, met slijpstuk en adapter voor gasaanvoerleiding.
|
|
4.4.
|
Papieren vouwfilter voor fasescheiding, diameter 185 mm (bv. Schleicher & Schuell 597 HY 1/2).
|
|
4.5.
|
HPLC-apparatuur met injectiesysteem:
|
|
4.5.1.
|
HPLC-kolom, 250 mm × 4 mm, C18, vulling van 5 of 10 μm, of een gelijkwaardige kolom (prestatiecriterium: slechts één piek voor alle retinolisomeren onder de HPLC-condities).
|
|
4.5.2.
|
Uv- of fluorescentiedetector met variabele golflengte.
|
|
4.6.
|
Spectrofotometer met kwartscuvetten van 10 mm.
|
|
4.7.
|
Waterbad met magneetroerder.
|
|
4.8.
|
Extractieapparatuur (zie figuur 1) bestaande uit:
|
|
4.8.1.
|
Glazen cilinder met een inhoud van 1 liter, voorzien van een slijpstuk en een geslepen stop.
|
|
4.8.2.
|
Opzet met slijpstuk, voorzien van een zijarm en een verstelbare buis door het midden. De verstelbare buis moet een U-vormig benedenuiteinde hebben en een uitstroomopening aan het andere uiteinde, zodat de bovenste vloeistoflaag in de cilinder kan overlopen naar een scheitrechter.
|
5. Werkwijze
|
NB
|
:
|
Vitamine A is gevoelig voor (uv-)licht en oxidatie. Alle bewerkingen moeten plaatsvinden buiten de invloed van licht (met bruin glaswerk of glaswerk dat is beschermd met aluminiumfolie) en zuurstof (spoelen met stikstof). Tijdens de extractie dient de lucht boven de vloeistof te worden vervangen door stikstof (voorkom overdruk door de stop af en toe even los te maken).
|
5.1. Monstervoorbewerking
Maal het monster zo fijn dat het een zeef met mazen van 1 mm kan passeren, en zorg dat er geen warmte vrijkomt. Het malen dient onmiddellijk voorafgaand aan het wegen en verzepen te geschieden, daar er anders vitamine A-verliezen kunnen optreden.
5.2. Verzeping
Weeg, afhankelijk van het vitamine A-gehalte, tussen 2 en 25 g van het monster tot op 1 mg nauwkeurig af in een platbodemkolf of erlenmeyer van 500 ml (4.2.1). Voeg achtereenvolgens al roerend 130 ml ethanol (3.1), ongeveer 100 mg BHT (3.13), 2 ml natriumascorbaatoplossing (3.5) en 2 ml natriumsulfideoplossing (3.6) toe. Sluit een condensor (4.3) aan op de kolf en dompel de kolf in een waterbad met magneetroerder (4.7). Breng het mengsel aan de kook en laat het 5 minuten refluxen. Voeg daarna 25 ml kaliumhydroxideoplossing (3.4) toe via de condensor (4.3) en laat het mengsel nog eens 25 minuten refluxen, al roerend onder een trage stikstofstroom. Spoel vervolgens de condensor met circa 20 ml water en laat de inhoud van de kolf afkoelen tot kamertemperatuur.
5.3. Extractie
Giet de verzepingsoplossing al spoelend met in totaal 250 ml water kwantitatief over in een scheitrechter van 1 000 ml (4.2.3) of in de extractieapparatuur (4.8). Spoel de verzepingsmaatkolf achtereenvolgens met 25 ml ethanol (3.1) en 100 ml petroleumether (3.2) en giet het uitspoelsel over in de scheitrechter of de extractieapparatuur. De verhouding van water en ethanol in de gecombineerde oplossingen dient ongeveer 2:1 te zijn. Schud het mengsel krachtig gedurende 2 minuten en laat het daarna 2 minuten staan om het te laten bezinken.
5.3.1. Extractie met een scheitrechter (4.2.3)
Breng na scheiding van de lagen (zie opmerking 7.3) de petroleumether over in een andere scheitrechter (4.2.3). Herhaal deze extractie tweemaal met 100 ml petroleumether (3.2) en tweemaal met 50 ml petroleumether (3.2).
Was de gecombineerde extracten tweemaal in de scheitrechter onder voorzichtig omzwenken (om emulsievorming tegen te gaan) met hoeveelheden van 100 ml water en vervolgens onder herhaaldelijk schudden met telkens nieuwe hoeveelheden van 100 ml water, totdat het water kleurloos blijft bij toevoeging van fenolftaleïneoplossing (3.7) (viermaal wassen is gewoonlijk voldoende). Filtreer het gewassen extract door een droog vouwfilter voor fasescheiding (4.4) in een maatkolf van 500 ml (4.2.2) om eventueel aanhangend water te verwijderen. Spoel de scheitrechter en het filter met 50 ml petroleumether (3.2), vul aan tot de streep met petroleumether (3.2) en meng goed.
5.3.2. Extractie met extractieapparatuur (4.8)
Vervang na scheiding van de lagen (zie opmerking 7.3) de stop van de glazen cilinder (4.8.1) door de opzet (4.8.2) en plaats het U-vormige benedenuiteinde van de verstelbare buis zodanig dat het zich juist boven het niveau van het scheidingsvlak bevindt. Breng, onder toepassing van druk uit een stikstofleiding op de zijarm, de bovenste laag petroleumether over in een scheitrechter van 1 000 ml (4.2.3). Voeg 100 ml petroleumether (3.2) toe aan de glazen cilinder, doe de stop erop en schud goed. Wacht tot de lagen gescheiden zijn en breng de bovenste laag over in de scheitrechter zoals beschreven. Herhaal de extractieprocedure nog eens met 100 ml petroleumether (3.2), daarna nog tweemaal met telkens 50 ml petroleumether (3.2) en breng de petroleumetherlagen over in de scheitrechter.
Was de gecombineerde petroleumetherextracten zoals beschreven in 5.3.1 en ga verder te werk zoals daar beschreven.
5.4. Bereiding van de monsteroplossing voor HPLC
Pipetteer een aliquot van het petroleumetherextract (uit 5.3.1 of 5.3.2) in een peervormige maatkolf van 250 ml (4.2.4). Damp het oplosmiddel in tot bijna droog met de rotatieverdamper (4.1) bij verminderde druk en een badtemperatuur van maximaal 40 oC. Herstel de atmosferische druk door toevoer van stikstof (3.10) en neem de kolf uit de rotatieverdamper. Verwijder het resterende oplosmiddel met een stikstofstroom (3.10) en neem het residu onmiddellijk op in een bekend volume (10-100 ml) methanol (3.3) (de concentratie vitamine A moet tussen 5 en 30 IE/ml liggen).
5.5. HPLC-bepaling
Vitamine A wordt afgescheiden in een C18 reversed-phase kolom (4.5.1) en de concentratie wordt gemeten door middel van een uv-detector (325 nm) of fluorescentiedetector (excitatie: 325 nm, emissie: 475 nm) (4.5.2).
Injecteer een aliquot (bv. 20 μl) van de oplossing in methanol die is verkregen in 5.4 en elueer met de mobiele fase (3.9). Bereken de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van dezelfde monsteroplossing en de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van de ijkoplossingen (5.6.2).
HPLC-condities
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen:
|
HPLC-kolom (4.5.1):
|
250 mm × 4 mm, C18, vulling van 5 of 10 μm, of een gelijkwaardige kolom;
|
|
mobiele fase (3,9):
|
mengsel van methanol (3.3) en water, bv. 980 + 20 (V + V);
|
|
elutiesnelheid:
|
1-2 ml/min;
|
|
detector (4.5.2):
|
uv-detector (325 nm) of fluorescentiedetector
(excitatie: 325 nm, emissie: 475 nm).
|
5.6. IJking
5.6.1. Bereiding van de standaard-werkoplossingen
Pipetteer 20 ml van de vitamine A-acetaat-stamoplossing (3.11.1) of 20 ml van de vitamine A-palmitaat-stamoplossing (3.12.1) in een platbodemkolf of erlenmeyer van 500 ml (4.2.1) en hydrolyseer zoals beschreven onder 5.2, echter zonder toevoeging van BHT. Extraheer vervolgens met petroleumether (3.2) volgens 5.3 en vul tot 500 ml aan met petroleumether (3.2). Damp 100 ml van dit extract met de rotatieverdamper (zie 5.4) in tot het bijna droog is, verwijder het resterende oplosmiddel met een stikstofstroom (3.10) en neem het residu op in 10,0 ml methanol (3.3). De nominale concentratie van deze oplossing is 560 IE vitamine A per ml. Het exacte gehalte dient te worden bepaald volgens 5.6.3.3. De standaard-werkoplossing moet vóór gebruik vers worden bereid.
Pipetteer 2,0 ml van deze standaard-werkoplossing in een maatkolf van 20 ml, vul aan tot de streep met methanol (3.3) en meng. De nominale concentratie van deze verdunde standaard-werkoplossing is 56 IE vitamine A per ml.
5.6.2. Bereiding van de ijkoplossingen en tekenen van de ijkgrafiek
Breng 1,0, 2,0, 5,0 en 10,0 ml van de verdunde standaard-werkoplossing over in een reeks maatkolven van 20 ml, vul aan tot de streep met methanol (3.3) en meng. De nominale concentraties van deze oplossingen zijn 2,8, 5,6, 14,0 en 28,0 IE vitamine A per ml.
Injecteer diverse malen 20 μl van iedere ijkoplossing en bepaal de gemiddelde piekhoogten (-oppervlakten). Maak met de gemiddelde piekhoogten (-oppervlakten) een ijkgrafiek, rekening houdend met de resultaten van de uv-controle (5.6.3.3).
5.6.3. Uv-standaardisatie van de standaardoplossingen
5.6.3.1.
Vitamine A-acetaat-stamoplossing
Pipetteer 2,0 ml van de vitamine A-acetaat-stamoplossing (3.11.1) in een maatkolf van 50 ml (4.2.2) en vul aan tot de streep met propaan-2-ol (3.8). De nominale concentratie van deze oplossing is 56 IE vitamine A per ml. Pipetteer 3,0 ml van deze verdunde vitamine A-acetaatoplossing in een maatkolf van 25 ml en vul aan tot de streep met propaan-2-ol (3.8). De nominale concentratie van deze oplossing is 6,72 IE vitamine A per ml. Neem met de spectrofotometer (4.6) het uv-spectrum van deze oplossing tussen 300 nm en 400 nm op tegen propaan-2-ol (3.8). Het extinctiemaximum moet tussen 325 nm en 327 nm liggen.
Berekening van het vitamine A-gehalte:
IE vitamine A/ml = E326 × 19,0
(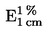 voor vitamine A-acetaat = 1 530 bij 326 nm in propaan-2-ol)
voor vitamine A-acetaat = 1 530 bij 326 nm in propaan-2-ol)
5.6.3.2.
Vitamine A-palmitaat-stamoplossing
Pipetteer 2,0 ml van de vitamine A-palmitaat-stamoplossing (3.12.1) in een maatkolf van 50 ml (4.2.2) en vul aan tot de streep met propaan-2-ol (3.8). De nominale concentratie van deze oplossing is 56 IE vitamine A per ml. Pipetteer 3,0 ml van deze verdunde vitamine A-palmitaatoplossing in een maatkolf van 25 ml en vul aan tot de streep met propaan-2-ol (3.8). De nominale concentratie van deze oplossing is 6,72 IE vitamine A per ml. Neem met de spectrofotometer (4.6) het uv-spectrum van deze oplossing tussen 300 nm en 400 nm op tegen propaan-2-ol (3.8). Het extinctiemaximum moet tussen 325 nm en 327 nm liggen.
Berekening van het vitamine A-gehalte:
IE vitamine A/ml = E326 × 19,0
( voor vitamine A-palmitaat = 957 bij 326 nm in propaan-2-ol)
voor vitamine A-palmitaat = 957 bij 326 nm in propaan-2-ol)
5.6.3.3.
Vitamine A-standaard-werkoplossing
Pipetteer 3,0 ml van de onverdunde vitamine A-standaard-werkoplossing die is bereid volgens 5.6.1 in een maatkolf van 50 ml (4.2.2) en vul aan tot de streep met propaan-2-ol (3.8). Pipetteer 5,0 ml van deze oplossing in een maatkolf van 25 ml en vul aan tot de streep met propaan-2-ol (3.8). De nominale concentratie van deze oplossing is 6,72 IE vitamine A per ml. Neem met de spectrofotometer (4.6) het uv-spectrum van deze oplossing tussen 300 nm en 400 nm op tegen propaan-2-ol (3.8). Het extinctiemaximum moet tussen 325 nm en 327 nm liggen.
Berekening van het vitamine A-gehalte:
IE vitamine A/ml = E325 × 18,3
( voor vitamine A-alcohol = 1 821 bij 325 nm in propaan-2-ol)
voor vitamine A-alcohol = 1 821 bij 325 nm in propaan-2-ol)
6. Berekening van de resultaten
Bepaal de concentratie van de monsteroplossing in IE/ml uit de gemiddelde hoogte (oppervlakte) van de vitamine A-pieken van de monsteroplossing aan de hand van de ijkgrafiek (5.6.2).
Het vitamine A-gehalte w in IE/kg van het monster wordt verkregen met de volgende formule:
 [UI/kg]
[UI/kg]
waarbij:
|
c
|
=
|
vitamine A-concentratie van de monsteroplossing (5.4) in IE/ml;
|
|
V1
|
=
|
volume van de monsteroplossing (5.4) in ml;
|
|
V2
|
=
|
volume van het in 5.4 genomen aliquot in ml;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Opmerkingen
|
7.1.
|
Voor monsters met een lage vitamine A-concentratie kan het zinvol zijn de petroleumetherextracten van twee verzepingsfracties (gewogen hoeveelheid: 25 g) voor de HPLC-bepaling te combineren tot één monsteroplossing.
|
|
7.2.
|
Het voor de analyse ingewogen monster mag niet meer dan 2 g vet bevatten.
|
|
7.3.
|
Als er geen fasescheiding optreedt, voeg dan circa 10 ml ethanol (3.1) toe om de emulsie te breken.
|
|
7.4.
|
Met levertraan en andere zuivere vetten dient de verzepingstijd te worden verlengd tot 45-60 minuten.
|
|
7.5.
|
In plaats van BHT mag ook hydrochinon worden gebruikt.
|
|
7.6.
|
Met een normalefasekolom kunnen de retinolisomeren van elkaar worden gescheiden. In dat geval moeten bij de berekeningen de piekhoogten (-oppervlakten) van alle cis- en trans-isomeren bij elkaar worden opgeteld.
|
|
7.7.
|
In plaats van natriumascorbaatoplossing mag ook ongeveer 150 mg ascorbinezuur worden gebruikt.
|
|
7.8.
|
In plaats van natriumsulfideoplossing mag ook ongeveer 50 mg EDTA worden gebruikt.
|
|
7.9.
|
Bij de analyse van vitamine A in melkvervangers moet op het volgende worden gelet:
|
—
|
bij de verzeping (5.2): als gevolg van de hoeveelheid vet in het monster is mogelijk een grotere hoeveelheid kaliumhydroxideoplossing (3.4) nodig;
|
|
—
|
bij de extractie (5.3): in verband met de aanwezigheid van emulsies kan het nodig zijn de verhouding water/ethanol van 2:1 te wijzigen.
|
Om na te gaan of de gebruikte analysemethode in deze specifieke matrix (melkvervanger) betrouwbare resultaten geeft, moet een analyseportie worden gebruikt om de terugvinding te bepalen. Als het terugvindingspercentage kleiner dan 80 % is, moet het analyseresultaat voor terugvinding gecorrigeerd worden.
|
8. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer dan 15 % van het hoogste resultaat bedragen.
9. Resultaten van een ringonderzoek
(1)
|
|
Voormengsel
|
Voeder met voormengsel
|
Mineraalconcentraat
|
Eiwitvoeder
|
Biggenvoeder
|
|
L
|
13
|
12
|
13
|
12
|
13
|
|
n
|
48
|
45
|
47
|
46
|
49
|
|
gemiddelde [IE/kg]
|
17,02 × 106
|
1,21 × 106
|
537 100
|
151 800
|
18 070
|
|
Sr [IE/kg]
|
0,51 × 106
|
0,039 × 106
|
22 080
|
12 280
|
682
|
|
r [IE/kg]
|
1,43 × 106
|
0,109 × 106
|
61 824
|
34 384
|
1 910
|
|
CVr [ %]
|
3,0
|
3,5
|
4,1
|
8,1
|
3,8
|
|
SR [IE/kg]
|
1,36 × 106
|
0,069 × 106
|
46 300
|
23 060
|
3 614
|
|
R [IE/kg]
|
3,81 × 106
|
0,193 × 106
|
129 640
|
64 568
|
10 119
|
|
CVR [ %]
|
8,0
|
6,2
|
8,6
|
15
|
20
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
r
|
=
|
herhaalbaarheid;
|
|
R
|
=
|
reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid.
|

B. BEPALING VAN VITAMINE E
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van vitamine E in diervoeders en voormengsels. Het gehalte aan vitamine E wordt uitgedrukt in mg DL-α-tocoferolacetaat per kg. 1 mg DL-α-tocoferolacetaat komt overeen met 0,91 mg DL-α-tocoferol (vitamine E).
De bepaalbaarheidsgrens is 2 mg vitamine E/kg. Deze bepaalbaarheidsgrens kan alleen worden gehaald met een fluorescentiedetector. Met een uv-detector is de bepaalbaarheidsgrens 10 mg/kg.
2. Beginsel
Het monster wordt gehydrolyseerd met een ethanolische kaliumhydroxideoplossing en de vitamine E wordt geëxtraheerd met petroleumether. Het oplosmiddel wordt verwijderd door verdamping en het residu wordt opgelost in methanol en, indien noodzakelijk, verdund tot de gewenste concentratie. Het gehalte aan vitamine E wordt bepaald door reversed-phase hogedrukvloeistofchromatografie (RP-HPLC) met fluorescentie- of uv-detectie.
3. Reagentia
|
3.2.
|
Petroleumether, kooktraject 40-60 oC.
|
|
3.4.
|
Kaliumhydroxideoplossing, c = 50 g/100 ml.
|
|
3.5.
|
Natriumascorbaatoplossing, c = 10 g/100 ml (zie opmerking 7.7).
|
|
3.6.
|
Natriumsulfide, Na2S·xH2O (x = 7-9).
|
|
3.6.1.
|
Natriumsulfideoplossing, c = 0,5 mol/l in glycerol, β = 120 g/l (voor x = 9) (zie opmerking 7.8).
|
|
3.7.
|
Fenolftaleïneoplossing, c = 2 g/100 ml in ethanol (3.1).
|
|
3.8.
|
Mobiele fase voor HPLC: mengsel van methanol (3.3) en water, bv. 980 + 20 (V + V). De exacte verhouding wordt bepaald door de eigenschappen van de gebruikte kolom.
|
|
3.9.
|
Stikstof, zuurstofvrij.
|
|
3.10.
|
DL-α-tocoferolacetaat, extra zuiver, met gecertificeerde activiteit.
|
|
3.10.1.
|
Stamoplossing van DL-α-tocoferolacetaat: weeg 100 mg DL-α-tocoferolacetaat (3.10) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in ethanol (3.1) en vul aan tot de streep met hetzelfde oplosmiddel. 1 ml van deze oplossing bevat 1 mg DL-α-tocoferolacetaat. (uv-controle: zie 5.6.1.3; stabilisatie: zie opmerking 7.4).
|
|
3.11.
|
DL-α-tocoferol, extra zuiver, met gecertificeerde activiteit.
|
|
3.11.1.
|
Stamoplossing van DL-α-tocoferol: weeg 100 mg DL-α-tocoferol (3.11) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in ethanol (3.1) en vul aan tot de streep met hetzelfde oplosmiddel. 1 ml van deze oplossing bevat 1 mg DL-α-tocoferol. (uv-controle: zie 5.6.2.3; stabilisatie: zie opmerking 7.4).
|
|
3.12.
|
2,6-Di-tert-butyl-4-methylfenol (BHT) (zie opmerking 7.5).
|
4. Apparatuur
|
4.2.1.
|
Platbodemkolven of erlenmeyers, 500 ml, met slijpstuk.
|
|
4.2.2.
|
Maatkolven met geslepen stop en een smalle hals, 10, 25, 100 en 500 ml.
|
|
4.2.3.
|
Scheitrechters, 1 000 ml, met geslepen stop.
|
|
4.2.4.
|
Peervormige kolven, 250 ml, met slijpstuk.
|
|
4.3.
|
Allihn-condensor, huislengte 300 mm, met slijpstuk en adapter voor gasaanvoerleiding.
|
|
4.4.
|
Papieren vouwfilter voor fasescheiding, diameter 185 mm (bv. Schleicher & Schuell 597 HY 1/2).
|
|
4.5.
|
HPLC-apparatuur met injectiesysteem:
|
|
4.5.1.
|
HPLC-kolom, 250 mm × 4 mm, C18, vulling van 5 of 10 μm of een gelijkwaardige kolom.
|
|
4.5.2.
|
Fluorescentie- of uv-detector met variabele golflengte.
|
|
4.6.
|
Spectrofotometer met kwartscuvetten van 10 mm.
|
|
4.7.
|
Waterbad met magneetroerder.
|
|
4.8.
|
Extractieapparatuur (zie figuur 1) bestaande uit:
|
|
4.8.1.
|
Glazen cilinder met een inhoud van 1 liter, voorzien van een slijpstuk en een geslepen stop.
|
|
4.8.2.
|
Opzet met slijpstuk, voorzien van een zijarm en een verstelbare buis door het midden. De verstelbare buis moet een U-vormig benedenuiteinde hebben en een uitstroomopening aan het andere uiteinde, zodat de bovenste vloeistoflaag in de cilinder kan overlopen naar een scheitrechter.
|
5. Werkwijze
|
NB
|
:
|
Vitamine E is gevoelig voor (uv-)licht en oxidatie. Alle bewerkingen moeten plaatsvinden buiten de invloed van licht (met bruin glaswerk of glaswerk dat is beschermd met aluminiumfolie) en zuurstof (spoelen met stikstof). Tijdens de extractie dient de lucht boven de vloeistof te worden vervangen door stikstof (voorkom overdruk door de stop af en toe even los te maken).
|
5.1. Monstervoorbewerking
Maal het monster zo fijn dat het een zeef met mazen van 1 mm kan passeren, en zorg dat er geen warmte vrijkomt. Het malen dient onmiddellijk voorafgaand aan het wegen en verzepen te geschieden, daar er anders vitamine E-verliezen kunnen optreden.
5.2. Verzeping
Weeg, afhankelijk van het vitamine E-gehalte, tussen 2 en 25 g van het monster tot op 0,01 g nauwkeurig af in een kolf of erlenmeyer van 500 ml (4.2.1). Voeg daar achtereenvolgens al roerend 130 ml ethanol (3.1), ongeveer 100 mg BHT (3.12), 2 ml natriumascorbaatoplossing (3.5) en 2 ml natriumsulfideoplossing (3.6) aan toe. Sluit een condensor (4.3) aan op de kolf en dompel de kolf in een waterbad met magneetroerder (4.7). Breng het mengsel aan de kook en laat het 5 minuten refluxen. Voeg daarna 25 ml kaliumhydroxideoplossing (3.4) toe via de condensor (4.3) en laat het mengsel nog eens 25 minuten refluxen, al roerend onder een trage stikstofstroom. Spoel vervolgens de condensor met circa 20 ml water en laat de inhoud van de kolf afkoelen tot kamertemperatuur.
5.3. Extractie
Giet de verzepingsoplossing al spoelend met in totaal 250 ml water kwantitatief over in een scheitrechter van 1 000 ml (4.2.3) of in de extractieapparatuur (4.8). Spoel de verzepingsmaatkolf achtereenvolgens met 25 ml ethanol (3.1) en 100 ml petroleumether (3.2) en giet het uitspoelsel over in de scheitrechter of de extractieapparatuur. De verhouding van water en ethanol in de gecombineerde oplossingen dient ongeveer 2:1 te zijn. Schud het mengsel krachtig gedurende 2 minuten en laat het daarna 2 minuten staan om het te laten bezinken.
5.3.1. Extractie met een scheitrechter (4.2.3)
Breng na scheiding van de lagen (zie opmerking 7.3) de petroleumether over in een andere scheitrechter (4.2.3). Herhaal deze extractie tweemaal met 100 ml petroleumether (3.2) en tweemaal met 50 ml petroleumether (3.2).
Was de gecombineerde extracten tweemaal in de scheitrechter onder voorzichtig omzwenken (om emulsievorming tegen te gaan) met hoeveelheden van 100 ml water en vervolgens onder herhaaldelijk schudden met telkens nieuwe hoeveelheden van 100 ml water, totdat het water kleurloos blijft bij toevoeging van fenolftaleïneoplossing (3.7) (viermaal wassen is gewoonlijk voldoende). Filtreer het gewassen extract door een droog vouwfilter voor fasescheiding (4.4) in een maatkolf van 500 ml (4.2.2) om eventueel aanhangend water te verwijderen. Spoel de scheitrechter en het filter met 50 ml petroleumether (3.2), vul aan tot de streep met petroleumether (3.2) en meng goed.
5.3.2. Extractie met extractieapparatuur (4.8)
Vervang na scheiding van de lagen (zie opmerking 7.3) de stop van de glazen cilinder (4.8.1) door de opzet (4.8.2) en plaats het U-vormige benedenuiteinde van de verstelbare buis zodanig dat het zich juist boven het niveau van het scheidingsvlak bevindt. Breng, onder toepassing van druk uit een stikstofleiding op de zijarm, de bovenste laag petroleumether over in een scheitrechter van 1 000 ml (4.2.3). Voeg 100 ml petroleumether (3.2) toe aan de glazen cilinder, doe de stop erop en schud goed. Wacht tot de lagen gescheiden zijn en breng de bovenste laag over in de scheitrechter zoals beschreven. Herhaal de extractieprocedure nog eens met 100 ml petroleumether (3.2), daarna nog tweemaal met telkens 50 ml petroleumether (3.2) en breng de petroleumetherlagen over in de scheitrechter.
Was de gecombineerde petroleumetherextracten zoals beschreven in 5.3.1 en ga verder te werk zoals daar beschreven.
5.4. Bereiding van de monsteroplossing voor HPLC
Pipetteer een aliquot van het petroleumetherextract (uit 5.3.1 of 5.3.2) in een peervormige kolf van 250 ml (4.2.4). Damp het oplosmiddel in tot bijna droog met de rotatieverdamper (4.1) bij verminderde druk en een badtemperatuur van maximaal 40 oC. Herstel de atmosferische druk door toevoer van stikstof (3.9) en neem de kolf uit de rotatieverdamper. Verwijder het resterende oplosmiddel met een stikstofstroom (3.9) en neem het residu onmiddellijk op in een bekend volume (10-100 ml) methanol (3.3) (de concentratie DL-α-tocoferol moet tussen 5 en 30 μg/ml liggen).
5.5. HPLC-bepaling
Vitamine E wordt afgescheiden in een C18 reversed-phase kolom (4.5.1) en de concentratie wordt gemeten door middel van een fluorescentiedetector (excitatie: 295 nm, emissie: 330 nm) of een uv-detector (292 nm) (4.5.2).
Injecteer een aliquot (bv. 20 μl) van de oplossing in methanol die is verkregen in 5.4 en elueer met de mobiele fase (3.8). Bereken de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van dezelfde monsteroplossing en de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van de ijkoplossingen (5.6.2).
HPLC-condities
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen:
|
HPLC-kolom (4.5.1):
|
250 mm × 4 mm, C18, vulling van 5 of 10 μm, of een gelijkwaardige kolom;
|
|
mobiele fase (3,8):
|
mengsel van methanol (3.3) en water, bv. 980 + 20 (V + V);
|
|
elutiesnelheid:
|
1-2 ml/minuut;
|
|
detector (4.5.2):
|
fluorescentiedetector
(excitatie: 295 nm/emissie: 330 nm) of uv-detector (292 nm).
|
5.6. IJking (DL-α-tocoferolacetaat of DL-α-tocoferol)
5.6.1. DL-α-tocoferolacetaat-standaard
5.6.1.1.
Bereiding van de standaard-werkoplossing
Pipetteer 25 ml van de DL-α-tocoferolacetaat-stamoplossing (3.10.1) in een platbodemkolf of erlenmeyer van 500 ml (4.2.1) en hydrolyseer zoals beschreven onder 5.2. Extraheer vervolgens met petroleumether (3.2) volgens 5.3 en vul aan tot 500 ml met petroleumether. Damp 25 ml van dit extract in tot het bijna droog is met de rotatieverdamper (zie 5.4), verwijder het resterende oplosmiddel met een stikstofstroom (3.9) en neem het residu op in 25,0 ml methanol (3.3). De nominale concentratie van deze oplossing is 45,5 μg DL-α-tocoferol per ml, wat overeenkomt met 50 μg DL-α-tocoferolacetaat per ml. De standaard-werkoplossing moet vóór gebruik vers worden bereid.
5.6.1.2.
Bereiding van de ijkoplossingen en tekenen van de ijkgrafiek
Breng 1,0, 2,0, 4,0 en 10,0 ml van de standaard-werkoplossing over in een reeks maatkolven van 20 ml, vul aan tot de streep met methanol (3.3) en meng. De nominale concentraties van deze oplossingen zijn 2,5, 5,0, 10,0 en 25,0 μg/ml DL-α-tocoferolacetaat, d.w.z. 2,28, 4,55, 9,10 en 22,8 μg/ml DL-α-tocoferol.
Injecteer diverse malen 20 μl van iedere ijkoplossing en bepaal de gemiddelde piekhoogten (-oppervlakten). Maak met deze gemiddelde piekhoogten (-oppervlakten) een ijkgrafiek.
5.6.1.3.
Uv-standaardisatie van de DL-α-tocoferolacetaat-stamoplossing (3.10.1)
Verdun 5,0 ml van de DL-α-tocoferolacetaat-stamoplossing (3.10.1) tot 25,0 ml met ethanol en neem met de spectrofotometer (4.6) het uv-spectrum van deze oplossing tussen 250 nm en 320 nm op tegen ethanol (3.1).
Het absorptiemaximum moet bij 284 nm liggen:
 = 43,6 bij 284 nm in ethanol.
= 43,6 bij 284 nm in ethanol.
Bij deze verdunning moet een extinctiewaarde van 0,84 tot 0,88 worden verkregen.
5.6.2. DL-α-tocoferolacetaat-standaard
5.6.2.1.
Bereiding van de standaard-werkoplossing
Pipetteer 2 ml van de DL-α-tocoferol-stamoplossing (3.11.1) in een maatkolf van 50 ml, los op in methanol (3.3) en vul aan tot de streep met methanol. De nominale concentratie van deze oplossing is 40 μg DL-α-tocoferol per ml, wat overeenkomt met 44,0 g DL-α-tocoferolacetaat per ml. De standaard-werkoplossing moet vóór gebruik vers worden bereid.
5.6.2.2.
Bereiding van de ijkoplossingen en tekenen van de ijkgrafiek
Breng 1,0, 2,0, 4,0 en 10,0 ml van de standaard-werkoplossing over in een reeks maatkolven van 20 ml, vul aan tot de streep met methanol (3.3) en meng. De nominale concentraties van deze oplossingen zijn 2,0, 4,0, 8,0 en 20,0 μg/ml DL-α-tocoferol, d.w.z. 2,20, 4,40, 8,79 en 22,0 μg/ml DL-α-tocoferol.
Injecteer diverse malen 20 μl van iedere ijkoplossing en bepaal de gemiddelde piekhoogten (-oppervlakten). Maak met deze gemiddelde piekhoogten (-oppervlakten) een ijkgrafiek.
5.6.2.3.
Uv-standaardisatie van de DL-α-tocoferol-stamoplossing (3.11.1)
Verdun 2,0 ml van de DL-α-tocoferol-stamoplossing (3.11.1) tot 25,0 ml met ethanol en neem met de spectrofotometer (4.6) het uv-spectrum van deze oplossing tussen 250 nm en 320 nm op tegen ethanol (3.1).
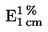 = 75,8 bij 292 nm in ethanol.
= 75,8 bij 292 nm in ethanol.
Bij deze verdunning moet een extinctiewaarde van 0,6 worden verkregen.
6. Berekening van de resultaten
Bepaal de concentratie van de monsteroplossing in μg/ml uit de gemiddelde hoogte (oppervlakte) van de vitamine E-pieken van de monsteroplossing (berekend als α-tocoferolacetaat) aan de hand van de ijkgrafiek (5.6.1.2 of 5.6.2.2).
Het vitamine E-gehalte w in mg/kg van het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
c
|
=
|
vitamine E-concentratie (als α-tocoferolacetaat) van de monsteroplossing (5.4) in μg/ml;
|
|
V1
|
=
|
volume van de monsteroplossing (5.4) in ml ;
|
|
V2
|
=
|
volume van het in 5.4 genomen aliquot in ml;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Opmerkingen
|
7.1.
|
Voor monsters met een lage vitamine E-concentratie kan het zinvol zijn de petroleumetherextracten van twee verzepingsfracties (gewogen hoeveelheid: 25 g) voor de HPLC-bepaling te combineren tot één monsteroplossing.
|
|
7.2.
|
Het voor de analyse ingewogen monster mag niet meer dan 2 g vet bevatten.
|
|
7.3.
|
Als er geen fasescheiding optreedt, voeg dan circa 10 ml ethanol (3.1) toe om de emulsie te breken.
|
|
7.4.
|
Voeg na de spectrofotometrische meting van de oplossing van DL-α-tocoferolacetaat respectievelijk DL-α-tocoferol volgens 5.6.1.3 of 5.6.2.3 circa 10 mg BHT (3.12) aan de oplossing (3.10.1 of 3.10.2) toe en bewaar de oplossing in een koelkast (maximale houdbaarheid: vier weken).
|
|
7.5.
|
In plaats van BHT mag ook hydrochinon worden gebruikt.
|
|
7.6.
|
Met een normalefasekolom kunnen α-, β-, γ- en δ-tocoferol van elkaar worden gescheiden.
|
|
7.7.
|
In plaats van natriumascorbaatoplossing mag ook circa 150 mg ascorbinezuur worden gebruikt.
|
|
7.8.
|
In plaats van natriumsulfideoplossing mag ook circa 50 mg EDTA worden gebruikt.
|
|
7.9.
|
Vitamine E-acetaat hydrolyseert in basisch milieu zeer snel en is daarom erg gevoelig voor oxidatie, met name in aanwezigheid van sporenelementen als ijzer of koper. Dat betekent dat bij de bepaling van vitamine E in voormengsels met een concentratie van meer dan 5 000 mg/kg afbraak van vitamine E kan optreden. Daarom wordt ter bevestiging een HPLC-methode met enzymatische afbraak van de vitamine E-formulering zonder verzeping aanbevolen.
|
8. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer dan 15 % van het hoogste resultaat bedragen.
9. Resultaten van een ringonderzoek
(2)
|
|
Voormengsel
|
Voeder met voormengsel
|
Mineraalconcentraat
|
Eiwitvoeder
|
Biggenvoeder
|
|
L
|
12
|
12
|
12
|
12
|
12
|
|
n
|
48
|
48
|
48
|
48
|
48
|
|
gemiddelde [mg/kg]
|
17 380
|
1 187
|
926
|
315
|
61,3
|
|
Sr [mg/kg]
|
384
|
45,3
|
25,2
|
13,0
|
2,3
|
|
r [mg/kg]
|
1 075
|
126,8
|
70,6
|
36,4
|
6,4
|
|
CVr [ %]
|
2,2
|
3,8
|
2,7
|
4,1
|
3,8
|
|
SR mg/kg]
|
80
|
65,0
|
55,5
|
18,9
|
7,8
|
|
R [mg/kg]
|
2 324
|
182,0
|
155,4
|
52,9
|
21,8
|
|
CVR [ %]
|
4,8
|
5,5
|
6,0
|
6,0
|
12,7
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
r
|
=
|
herhaalbaarheid;
|
|
R
|
=
|
reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid.
|

C. BEPALING VAN DE SPORENELEMENTEN IJZER, KOPER, MANGAAN EN ZINK
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van de sporenlementen ijzer, koper, mangaan en zink in diervoeders. De bepaalbaarheidsgrenzen zijn:
2. Beginsel
Het monster wordt, na destructie van eventueel aanwezig organisch materiaal, in zoutzuur opgelost. De elementen ijzer, koper, mangaan en zink worden na verdunning bepaald door middel van atoomabsorptiespectometrie.
3. Reagentia
Inleiding
Voor de bereiding van reagentia en analyseoplossingen moet water worden genomen waarin de te bepalen kationen niet voorkomen; dit kan worden bereid door het water tweemaal te destilleren in een destilleerapparaat van borosilicaatglas of kwarts, dan wel door het tweemaal te zuiveren met behulp van ionenwisselaars.
De reagentia moeten ten minste van analysekwaliteit zijn. De afwezigheid van het te bepalen element moet worden gecontroleerd door een blancobepaling. Zo nodig moeten de reagentia nog verder worden gezuiverd.
In plaats van de hieronder beschreven standaardoplossingen kunnen in de handel verkrijgbare standaardoplossingen worden gebruikt, waarvan de zuiverheid gegarandeerd en voor gebruik gecontroleerd is.
|
3.1.
|
Zoutzuur (d = 1,19 g/ml).
|
|
3.3.
|
Zoutzuur (0,5 mol/l).
|
|
3.4.
|
Waterstoffluorideoplossing, 38-40 % (V/V), met een ijzergehalte van minder dan 1 mg/l en een indamprest (uitgedrukt als sulfaat) van minder dan 10 mg/l.
|
|
3.5.
|
Zwavelzuur (d = 1,84 g/ml).
|
|
3.6.
|
Waterstofperoxide (ongeveer 100 volumedelen zuurstof (30 % m/m)).
|
|
3.7.
|
Standaardijzeroplossing (1 000 μg Fe/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing: los 1 g ijzerdraad op in 200 ml zoutzuur 6 mol/l (3.2), voeg 16 ml waterstofperoxide (3.6) toe en vul aan met water tot 1 liter.
|
|
3.7.1.
|
Verdunde standaardijzeroplossing (100 μg Fe/ml), bereid door één deel standaardoplossing (3.7) met negen delen water te verdunnen.
|
|
3.8.
|
Standaardkoperoplossing (1 000 μg Cu/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing:
|
—
|
los 1 g koperpoeder op in 25 ml zoutzuur 6 mol/l (3.2), voeg 5 ml waterstofperoxide (3.6) toe en vul aan met water tot 1 liter.
|
|
|
3.8.1.
|
Verdunde standaardkoperoplossing (10 μg Cu/ml), bereid door één deel standaardoplossing (3.8) met negen delen water te verdunnen en één deel van de aldus bereide oplossing wederom met negen delen water te verdunnen.
|
|
3.9.
|
Standaardmangaanoplossing (1 000 μg Mn/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing:
|
—
|
los 1 g mangaanpoeder op in 25 ml zoutzuur 6 mol/l (3.2) en vul aan met water tot 1 liter.
|
|
|
3.9.1.
|
Verdunde standaardmangaanoplossing (10 μg Mn/ml), bereid door één deel standaardoplossing (3.9) met negen delen water te verdunnen en één deel van de aldus bereide oplossing wederom met negen delen water te verdunnen.
|
|
3.10.
|
Standaardzinkoplossing (1 000 μg Zn/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing:
|
—
|
los 1 g zinkband of bladzink op in 25 ml zoutzuur 6 mol/l (3.2) en vul aan met water tot 1 liter.
|
|
|
3.10.1.
|
Verdunde standaardzinkoplossing (10 μg Zn/ml), bereid door één deel standaardoplossing (3.10) met negen delen water te verdunnen en één deel van de aldus bereide oplossing wederom met negen delen water te verdunnen.
|
|
3.11.
|
Lanthaanchlorideoplossing: los 12 g lanthaanoxide op in 150 ml water, voeg 100 ml zoutzuur 6 mol/l (3.2) toe en vul aan met water tot 1 liter.
|
4. Apparatuur
|
4.1.
|
Moffeloven met temperatuurregelaar en bij voorkeur een pyrometer.
|
|
4.2.
|
Glaswerk van resistent borosilicaat. Aanbevolen wordt materiaal te nemen dat uitsluitend voor de bepaling van sporenelementen wordt gebruikt.
|
|
4.3.
|
Atoomabsorptiespectrofotometer die qua gevoeligheid en nauwkeurigheid in het betreffende meetgebied voldoet aan de eisen die in verband met de methode worden gesteld.
|
5. Werkwijze
(3)
5.1. Monsters met organisch materiaal
5.1.1. Verassen en bereiden van de oplossing voor de analyse
(4)
|
5.1.1.1.
|
Weeg 5-10 g monster tot op 0,2 mg nauwkeurig af in een schaal van kwarts of platina (zie opmerking onder b)), droog in de droogstoof bij 105 oC en plaats de schaal in de koude moffeloven (4.1). Sluit de oven (zie opmerking c)) en breng de temperatuur in ongeveer 90 minuten geleidelijk op 450-475 oC. Handhaaf deze temperatuur gedurende 4-16 uur (bijvoorbeeld ’s nachts) zodat het koolstofhoudende materiaal verdwijnt; open vervolgens de moffeloven en laat afkoelen (zie opmerking d)).
Bevochtig de inhoud van de schaal met water en breng deze over in een bekerglas van 250 ml. Spoel de schaal uit met in totaal ongeveer 5 ml zoutzuur (3.1) en voeg dit langzaam en voorzichtig toe aan de inhoud van het bekerglas (de reactie kan hevig zijn doordat er CO2 ontstaat). Voeg onder roeren druppelsgewijs meer zoutzuur (3.1) toe tot het bruisen ophoudt. Damp in tot droog onder nu en dan roeren met een glazen staaf.
Voeg vervolgens bij het residu 15 ml zoutzuur 6 mol/l (3.2) toe en daarna ongeveer 120 ml water. Roer met de glazen roerstaaf en laat deze in het bekerglas staan; dek het bekerglas af met een horlogeglas. Breng de inhoud zachtjes aan de kook en houd aan de kook tot er geen as meer zichtbaar in de oplossing gaat. Filtreer over asvrij filtreerpapier en vang het filtraat op in een maatkolf van 250 ml. Spoel het bekerglas en het filtreerpapier uit met 5 ml heet zoutzuur 6 mol/l (3.2) en tweemaal met kokend water. Vul aan tot de streep met water (de zoutzuurconcentratie is dan ongeveer 0,5 mol/l).
|
|
5.1.1.2.
|
Als het residu op het filtreerpapier zwart is (koolstof) breng het dan opnieuw in de moffeloven en veras weer bij 450-475 oC. Deze verassing, die slechts enkele uren duurt (ongeveer 3-5 uur), is voltooid zodra de as er wit of bijna wit uitziet. Neem het residu op met ongeveer 2 ml zoutzuur (3.1), damp in tot droog en voeg 5 ml zoutzuur 6 mol/l (3.2) toe. Verwarm de oplossing en filtreer deze in de maatkolf; vul aan tot de streep met water (de zoutzuurconcentratie is dan ongeveer 0,5 mol/l).
Opmerkingen:
|
a)
|
Bij de bepaling van sporenelementen moet men bedacht zijn op het gevaar van contaminatie, vooral door zink, koper en ijzer. Daarom mogen deze metalen niet voorkomen in het materiaal dat voor de bereiding van de monsters wordt gebruikt.
Ter beperking van het algemene contaminatierisico moet worden gewerkt in een stofvrije atmosfeer met uiterst schone apparatuur en zorgvuldig gewassen glaswerk. Vooral de zinkbepaling is gevoelig voor verschillende soorten contaminatie, bv. door glaswerk, reagentia, stof enz.
|
|
b)
|
De massa van het te verassen monster wordt berekend aan de hand van het te verwachten gehalte aan sporenelementen in het diervoeder, rekening houdend met de gevoeligheid van de te gebruiken spectrofotometer. Bij sommige diervoeders met een zeer laag gehalte aan sporenelementen kan het wellicht noodzakelijk zijn te beginnen met 10-20 g analysemateriaal en de uiteindelijke oplossing aan te vullen tot slechts 100 ml.
|
|
c)
|
Het verassen moet worden uitgevoerd in een gesloten moffeloven zonder lucht- of zuurstoftoevoer.
|
|
d)
|
De op de pyrometer afgelezen temperatuur mag niet meer bedragen dan 475 oC.
|
|
5.1.2. Spectrofotometrische bepaling
5.1.2.1.
Bereiding van de ijkoplossingen
Bereid voor ieder te bepalen element op basis van de verdunde standaardoplossingen 3.7.1, 3.8.1, 3.9.1 en 3.10.1 een reeks ijkoplossingen, elk met een zoutzuurconcentratie van ongeveer 0,5 mol/l en (bij ijzer, mangaan en zink) een gehalte aan lanthaanchloride dat overeenkomt met 0,1 % La (m/V).
De gekozen gehaltes aan sporenelementen moeten binnen het gevoeligheidsbereik van de te gebruiken spectrofotometer liggen. In de onderstaande tabellen zijn bij wijze van voorbeeld de samenstellingen opgegeven van typische reeksen ijkoplossingen; naargelang van het type en de gevoeligheid van de gebruikte spectrofotometer kan het echter noodzakelijk zijn andere concentraties te kiezen.
IJzer
|
μg Fe/ml
|
0
|
0,5
|
1
|
2
|
3
|
4
|
5
|
|
ml verdunde standaardoplossing (3.7.1) (1 ml = 100 μg Fe)
|
0
|
0,5
|
1
|
2
|
3
|
4
|
5
|
|
ml HCl (3.2)
|
7
|
7
|
7
|
7
|
7
|
7
|
7
|
|
+ 10 ml lanthaanchlorideoplossing (3.11), met water aanvullen tot 100 ml
|
Koper
|
μg Cu/ml
|
0
|
0,1
|
0,2
|
0,4
|
0,6
|
0,8
|
1,0
|
|
ml verdunde standaardoplossing (3.8.1) (1 ml = 10 μg Cu)
|
0
|
1
|
2
|
4
|
6
|
8
|
10
|
|
ml HCl (3.2)
|
8
|
8
|
8
|
8
|
8
|
8
|
8
|
Mangaan
|
μg Mn/ml
|
0
|
0,1
|
0,2
|
0,4
|
0,6
|
0,8
|
1,0
|
|
ml verdunde standaardoplossing (3.9.1) (1 ml = 10 μg Mn)
|
0
|
1
|
2
|
4
|
6
|
8
|
10
|
|
ml HCl (3.2)
|
7
|
7
|
7
|
7
|
7
|
7
|
7
|
|
+ 10 ml lanthaanchlorideoplossing (3.11), met water aanvullen tot 100 ml
|
Zink
|
μg Zn/ml
|
0
|
0,05
|
0,1
|
0,2
|
0,4
|
0,6
|
0,8
|
|
ml verdunde standaardoplossing (3.10.1) (1 ml = 10 μg Zn)
|
0
|
0,5
|
1
|
2
|
4
|
6
|
8
|
|
ml HCl (3.2)
|
7
|
7
|
7
|
7
|
7
|
7
|
7
|
|
+ 10 ml lanthaanchlorideoplossing (3.11), met water aanvullen tot 100 ml
|
5.1.2.2.
Bereiding van de oplossingen voor de analyse
Voor de bepaling van koper kan de volgens 5.1.1 bereide oplossing in de regel rechtstreeks worden gebruikt. Indien het noodzakelijk is om het gehalte binnen de reeks van de ijkoplossingen te brengen, kan een aliquot van die oplossing worden gepipetteerd in een maatkolf van 100 ml die daarna tot de streep wordt aangevuld met zoutzuur 0,5 mol/l (3.3).
Voor de bepaling van ijzer, mangaan en zink wordt een aliquot van de volgens 5.1.1 bereide oplossing gepipetteerd in een maatkolf van 100 ml, waarna 10 ml lanthaanchorideoplossing (3.11) wordt toegevoegd en tot de streep wordt aangevuld met zoutzuur 0,5 mol/l (3.3) (zie ook de opmerking onder 8).
5.1.2.3.
Blancobepaling
Bij de blancobepaling moet de volledige werkwijze worden toegepast, maar dan zonder monstermateriaal. De ijkoplossing „0” mag niet als blanco worden gebruikt.
5.1.2.4.
Meting van de atoomabsorptie
Meet de atoomabsorptie van de ijkoplossingen en van de te analyseren oplossing met een oxiderende lucht-acetyleenvlam bij de volgende golflengten:
Voer iedere meting viermaal uit.
5.2. Minerale diervoeders
Indien het monster geen organisch materiaal bevat, is verassing vooraf overbodig. Handel dan als beschreven in 5.1.1.1, te beginnen met de tweede alinea. Indampen met waterstoffluorideoplossing kan worden overgeslagen.
6. Berekening van de resultaten
Bereken het gehalte aan sporenelementen in de te analyseren oplossing aan de hand van een ijkgrafiek. Druk de resultaten uit in mg sporenelement per kg monster (ppm).
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
5 mg/kg absoluut, voor gehaltes aan het betrokken sporenelement van maximaal 50 mg/kg;
|
|
—
|
10 % van het hoogste resultaat, voor gehaltes aan het betrokken sporenelement van 50 tot en met 100 mg/kg;
|
|
—
|
10 mg/kg absoluut, voor gehaltes aan het betrokken sporenelement van 100 tot en met 200 mg/kg;
|
|
—
|
5 % van het hoogste resultaat, voor gehaltes aan het betrokken sporenelement van meer dan 200 mg/kg.
|
8. Opmerking
De aanwezigheid van grote hoeveelheden fosfaten kan de bepaling van ijzer, mangaan en zink storen. Die storing kan worden weggenomen door toevoeging van lanthaanchlorideoplossing (3.11). Indien echter de massaverhouding (Ca + Mg)/P groter dan 2 is, kan de toevoeging van lanthaanchlorideoplossing (3.11) aan de te analyseren oplossing en de ijkoplossingen achterwege blijven.
D. BEPALING VAN HALOFUGINON
DL-trans-7-broom-6-chloor-3-[3-(3-hydroxy-2-piperidyl)acetonyl]chinazoline-4(3H)-on-hydrobromide
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan halofuginon in diervoeders. De bepaalbaarheidsgrens is 1 mg/kg.
2. Beginsel
Na behandeling met heet water wordt halofuginon als vrije base in ethylacetaat geëxtraheerd en vervolgens als hydrochloride in zure waterige oplossing geëxtraheerd. Het extract wordt gezuiverd door middel van ionenwisselingschromatografie. Het gehalte aan halofuginon wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.1.
|
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
|
|
3.2.
|
Amberlite XAD-2 hars.
|
|
3.6.
|
Standaardstof halofuginon (DL-trans-7-broom-6-chloor-3-[3-hydroxy-2-piperidyl)acetonyl]chinazoline-4(3H)-on-hydrobromide, E 764).
|
|
3.6.1.
|
Stamoplossing van halofuginon, 100 μg/ml
Weeg 50 mg halofuginon (3.6) tot op 0,1 mg nauwkeurig af in een maatkolf van 500 ml, los op in ammoniumacetaatbuffer (3.18), vul aan tot de streep met bufferoplossing en meng. Deze oplossing is bij 5 oC in het donker drie weken houdbaar.
|
|
3.6.2.
|
IJkoplossingen
Breng in een reeks maatkolven van 100 ml respectievelijk 1,0, 2,0, 3,0, 4,0 en 6,0 ml stamoplossing (3.6.1). Vul aan tot de streep met mobiele fase (3.21) en meng. Deze oplossingen hebben een concentratie van respectievelijk 1,0, 2,0, 3,0, 4,0 en 6,0 μg/ml halofuginon. Deze oplossingen moeten voor gebruik vers worden bereid.
|
|
3.7.
|
Zoutzuur, ρ20 = 1,16 g/ml (ongeveer).
|
|
3.13.
|
EDTA (ethyleendiaminetetraazijnzuur, dinatriumzout).
|
|
3.14.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
|
3.15.
|
Natriumcarbonaatoplossing, c = 10 g/100 ml.
|
|
3.16.
|
Met natriumchloride verzadigde natriumcarbonaatoplossing, c = 5 g/100 ml.
Los 50 g natriumcarbonaat (3.11) op in water, vul aan tot 1 liter en voeg natriumchloride (3.12) toe tot de oplossing verzadigd is.
|
|
3.17.
|
Verdund zoutzuur, ongeveer 0,1 mol/l.
Vul 10 ml zoutzuur (3.7) aan met water tot 1 liter.
|
|
3.18.
|
Ammoniumacetaatbuffer, ongeveer 0,25 mol/l.
Los 19,3 g ammoniumacetaat (3.3) en 30 ml ijsazijn (3.5) op in water (3.14) en vul aan tot 1 liter.
|
|
3.19.
|
Bereiding Amberlite XAD-2 hars.
Was een geschikte hoeveelheid Amberlite (3.2) met water tot alle chloride-ionen zijn verwijderd, zoals vastgesteld met een zilvernitraatproef (3.20) op het waswater. Was de hars daarna met 50 ml methanol (3.8), doe de methanol weg en bewaar de hars onder verse methanol.
|
|
3.20.
|
Zilvernitraatoplossing, ongeveer 0,1 mol/l.
Los 0,17 g zilvernitraat (3.9) op in 10 ml water.
|
|
3.21.
|
HPLC-mobiele fase
Meng 500 ml acetonitril (3.1) met 300 ml ammoniumacetaatbuffer (3.18) en 1 200 ml water (3.14). Breng de pH met azijnzuur (3.5) op 4,3. Filtreer door een filter van 0,22 μm (4.8) en ontgas de oplossing (bv. door 10 minuten ultrasoonbehandeling). De oplossing is in afgesloten toestand in het donker één maand houdbaar.
|
4. Apparatuur
|
4.4.
|
HPLC-apparatuur met uv-detector met variabele golflengte of diode-arraydetector.
|
|
4.4.1.
|
HPLC-kolom, 300 mm × 4 mm, C18, vulling van 10 μm of een gelijkwaardige kolom.
|
|
4.5.
|
Glazen kolom (300 mm × 10 mm) voorzien van een gesinterd-glasfilter en een kraan.
|
|
4.6.
|
Glasvezelfiters, diameter 150 mm.
|
|
4.7.
|
Membraanfilter, 0,45 μm.
|
|
4.8.
|
Membraanfilter, 0,22 μm.
|
5. Werkwijze
|
NB
|
:
|
Halofuginon als vrije base is in basisch milieu en in ethylacetaat niet stabiel. Het mag niet langer dan 30 minuten in ethylacetaat blijven.
|
5.1. Algemeen
|
5.1.1.
|
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen halofuginon of storende stoffen aanwezig zijn.
|
|
5.1.2.
|
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid halofuginon is toegevoegd als aanwezig in het monster. Voor een gehalte van 3 mg/kg wordt 300 μl stamoplossing (3.6.1) aan 10 g blanco diervoeder toegevoegd. Vervolgens wordt gemengd en 10 minuten gewacht alvorens de extractiestap (5.2) uit te voeren.
|
NB
|
:
|
Voor de toepassing van deze methode moet het blanco diervoeder van vergelijkbare soort zijn als het monster en mag hierin bij analyse geen halofuginon aantoonbaar zijn.
|
|
5.2. Extractie
Weeg 10 g van het voorbewerkte monster tot op 0,1 g nauwkeurig af in een centrifugebuis van 200 ml, voeg 0,5 g natriumascorbaat (3.10), 0,5 g EDTA (3.13) en 20 ml water toe en meng. Plaats de buis gedurende 5 minuten in een waterbad van 80 oC. Voeg na afkoelen tot kamertemperatuur 20 ml natriumcarbonaatoplossing (3.15) toe en meng. Voeg direct daarna 100 ml ethylacetaat (3.4) toe en schud 15 seconden krachtig met de hand. Plaats de buis daarna, met niet geheel afgesloten stop, 3 minuten in een ultrasoonbad (4.1). Centrifugeer 2 minuten en decanteer daarna het ethylacetaat door een glasvezelfilter (4.6) in een scheitrechter van 500 ml. Herhaal de extractie van het monster met een tweede portie van 100 ml ethylacetaat. Was de verzamelde extracten 1 minuut met 50 ml met natriumchloride verzadigde natriumcarbonaatoplossing (3.16) en doe de waterlaag weg.
Extraheer de organische laag 1 minuut met 50 ml zoutzuur (3.17). Breng de onderstaande waterige fase over in een scheitrechter van 250 ml. Extraheer de organische laag 1,5 minuut lang met nog eens 50 ml zoutzuur en voeg dit bij het eerste extract. Was de verzamelde zuurextracten door ongeveer 10 seconden omzwenken met 10 ml ethylacetaat (3.4).
Breng de waterige fase kwantitatief over in een rondbodemkolf van 250 ml en doe de organische fase weg. Damp met een rotatieverdamper (4.2) al het overblijvende ethylacetaat uit de oplossing af. De temperatuur van het waterbad mag niet hoger dan 40 oC zijn. Bij een verminderde druk van circa 25 mbar is al het ethylacetaat bij 38 oC in 5 minuten verwijderd.
5.3. Clean-up
5.3.1. Voorbereiding van de Amberlite-kolom
Voor elk monsterextract wordt een XAD-2-kolom gemaakt. Breng 10 g bereide Amberlite (3.19) met methanol (3.8) in een glazen kolom (4.5). Doe een propje glaswol bovenop het harsbed. Laat de methanol uit de kolom lopen en was de hars met 100 ml water, waarbij het vloeistofniveau boven het harsbed moet blijven. Laat de kolom voor gebruik 10 minuten equilibreren. Zorg ervoor dat de kolom nooit droog komt te staan.
5.3.2. Clean-up van monsterextract
Breng het extract (5.2) kwantitatief over op de bovenkant van de voorbereide Amberlite-kolom (5.3.1) en elueer de kolom; doe het eluaat weg. De elutiesnelheid mag niet meer dan 20 ml/minuut bedragen. Spoel de rondbodemkolf met 20 ml zoutzuur (3.17) en gebruik de spoelvloeistof om de harskolom te spoelen. Blaas eventuele resten zuur door met een stroom lucht. Doe de spoelvloeistof weg. Breng 100 ml methanol (3.8) op de kolom, laat 5-10 ml elueren en vang het eluaat op in een rondbodemkolf van 250 ml. Laat de rest van de methanol 10 minuten met de hars equilibreren, vervolg de elutie met een snelheid van niet meer dan 20 ml/minuut en vang het eluaat op in dezelfde rondbodemkolf. Damp de methanol af met de rotatieverdamper (4.2), waarbij de temperatuur van het waterbad niet boven 40 oC mag komen. Breng het residu met de mobiele fase (3.21) kwantitatief over in een maatkolf van 10 ml. Vul aan tot de streep met mobiele fase en meng. Een deel wordt door een membraanfilter (4.7) gefiltreerd. Gebruik deze oplossing voor de HPLC-bepaling (5.4).
5.4. HPLC-bepaling
5.4.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen:
HPLC-kolom (4.4.1);
mobiele fase voor HPLC (3.21);
elutiesnelheid: 1,5-2 ml/minuut;
detectiegolflengte: 243 nm;
injectievolume: 40-100 μl.
Controleer de stabiliteit van het chromatografiesysteem door enige malen de ijkoplossing (3.6.2) met 3,0 μg/ml te injecteren totdat constante piekhoogten (-oppervlakten) en retentietijden worden verkregen.
5.4.2. IJkgrafiek
Injecteer elke ijkoplossing (3.6.2) enkele malen en meet voor elke concentratie de piekhoogten (-oppervlakten). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.4.3. Monsteroplossing
Injecteer het monsterextract (5.3.2) enige malen, waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt, en bepaal de gemiddelde piekhoogte (-oppervlakte) van de halofuginonpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (-oppervlakte) van de halofuginonpieken van de monsteroplossing op basis van de ijkgrafiek (5.4.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan halofuginon w (mg/kg) wordt verkregen met de volgende formule:
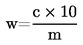
waarbij:
|
c
|
=
|
concentratie halofuginon van de monsteroplossing in μg/ml;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract en de ijkoplossing (3.6.2) met 6,0 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract een geschikte hoeveelheid van een ijkoplossing (3.6.2) toe. De toegevoegde hoeveelheid halofuginon moet ongeveer gelijk zijn aan de geschatte hoeveelheid halofuginon in het monsterextract.
Alleen de hoogte van de halofuginonpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale hoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm;
|
|
b)
|
tussen 225 en 300 nm mogen de spectra van het monster en de standaard, opgenomen op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de twee spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
|
|
c)
|
tussen 225 en 300 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag bij halofuginongehalten tot maximaal 3 mg/kg niet meer dan 0,5 mg/kg bedragen.
7.3. Terugvinding
Voor het blancomonster met toevoeging moet het terugvindingspercentage ten minste 80 % bedragen.
8. Resultaten van een ringonderzoek
In een ringonderzoek (5) werden drie monsters door acht laboratoria onderzocht.
Resultaten
|
|
monster A
(blanco)
bij ontvangst
|
monster B (meel)
|
monster C (pellets)
|
|
|
|
bij ontvangst
|
na twee maanden
|
bij ontvangst
|
na twee maanden
|
|
gemiddelde [mg/kg]
|
NA
|
2,80
|
2,42
|
2,89
|
2,45
|
|
SR [mg/kg]
|
—
|
0,45
|
0,43
|
0,40
|
0,42
|
|
CVR [ %]
|
—
|
16
|
18
|
14
|
17
|
|
tv. [ %]
|
|
86
|
74
|
88
|
75
|
|
NA
|
=
|
niet aantoonbaar;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid ( %)
|
|
tv.
|
=
|
terugvinding ( %)
|
E. BEPALING VAN ROBENIDINE
1,3-bis[(4-chloorbenzylideen)amino]guanidine-hydrochloride
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan robenidine in diervoeders. De bepaalbaarheidsgrens is 5 mg/kg.
2. Beginsel
Het monster wordt met aangezuurde methanol geëxtraheerd. Het extract wordt gedroogd en een gedeelte ervan wordt opgezuiverd over een aluminiumoxidekolom. Robenidine wordt met methanol uit de kolom geëlueerd, geconcentreerd en tot een geschikt volume aangevuld met mobiele fase. Het gehalte aan robenidine wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.2.
|
Aangezuurde methanol.
Breng 4,0 ml zoutzuur (ρ
20 = 1,18 g/ml) over in een maatkolf van 500 ml, vul aan tot de streep met methanol (3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
|
|
3.3.
|
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
|
|
3.4.
|
Moleculaire zeef.
Korrels van type 3A, 8-12 mesh (korrels van 1,6-2,5 mm, kristallijn aluminosilicaat, poriediameter 0,3 mm)
|
|
3.5.
|
Aluminiumoxide, zuur, activiteitsklasse I voor kolomchromatografie.
Breng 100 g aluminiumoxide over in een geschikte kolf en voeg 2,0 ml water toe. Sluit de kolf af met een stop en schud de kolf ongeveer 20 minuten. In een goed afgesloten kolf bewaren.
|
|
3.6.
|
Kaliumdiwaterstoffosfaatoplossing, c = 0,025 mol/l.
Los 3,40 g kaliumdiwaterstoffosfaat op in water (HPLC-kwaliteit of gelijkwaardig) in een maatkolf van 1 000 ml, vul aan tot de streep met water en meng.
|
|
3.7.
|
Dinatriumwaterstoffosfaatoplossing, c = 0,025 mol/l.
Los 3,55 g watervrij dinatriumwaterstoffosfaat (of 4,45 g dihydraat of 8,95 g dodecahydraat ervan) op in water (HPLC-kwaliteit of gelijkwaardig) in een maatkolf van 1 liter, vul aan tot de streep met water en meng.
|
|
3.8.
|
Mobiele fase voor HPLC.
Meng de volgende reagentia met elkaar:
|
|
650 ml acetonitril (3.3),
|
|
|
250 ml water (HPLC-kwaliteit of gelijkwaardig),
|
|
|
50 ml kaliumdiwaterstoffosfaatoplossing (3.6),
|
|
|
50 ml dinatriumwaterstoffosfaatoplossing (3.7).
|
Filtreer over een filter van 0,22 μm (4.6) en ontgas de oplossing (bv. door 10 minuten ultrasoonbehandeling).
|
|
3.9.
|
Standaardstof.
Zuiver robenidine: 1,3-bis[(4-chloorbenzylideen)amino]guanidine-hydrochloride.
|
|
3.9.1.
|
Stamoplossing van robenidine: 300 μg/ml
Weeg 30 mg standaardstof robenidine (3.9) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml, los dit op in aangezuurde methanol (3.2), vul aan tot de streep en meng. Wikkel de kolf in aluminiumfolie en bewaar deze in het donker.
|
|
3.9.2.
|
Werkoplossing van robenidine: 12 μg/ml
Breng 10,0 ml stamoplossing (3.9.1) over in een maatkolf van 250 ml, vul aan tot de streep met de mobiele fase (3.8) en meng. Wikkel de kolf in aluminiumfolie en bewaar deze in het donker.
|
|
3.9.3.
|
IJkoplossingen
Breng in een reeks maatkolven van 50 ml respectievelijk 5,0, 10,0, 15,0, 20,0 en 25,0 ml werkoplossing (3.9.2). Vul aan tot de streep met mobiele fase (3.8) en meng. Deze oplossingen komen overeen met respectievelijk 1,2, 2,4, 3,6, 4,8 en 6,0 μg/ml robenidine. Deze oplossingen moeten voor gebruik vers worden bereid.
|
|
3.10.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
4. Apparatuur
|
4.1.
|
Glazen kolom.
Gemaakt van bruin glas, voorzien van een kraan en een reservoir van ongeveer 150 ml inhoud; inwendige diameter 10-15 mm, lengte 250 mm.
|
|
4.2.
|
Mechanisch schudapparaat of magneetroerder.
|
|
4.4.
|
HPLC-apparatuur met uv-detector met variabele golflengte of diode-arraydetector; bereik 250-400 nm.
|
|
4.4.1.
|
HPLC-kolom: 300 mm × 4 mm, C18, vulling van 10 μm, of gelijkwaardig.
|
|
4.5.
|
Glasvezelfiltreerpapier (Whatman GF/A, of gelijkwaardig).
|
|
4.6.
|
Membraanfilter, 0,22 μm.
|
|
4.7.
|
Membraanfilter, 0,45 μm.
|
5. Werkwijze
|
NB
|
:
|
Robenidine is lichtgevoelig. Bij alle bewerkingen moet bruin glaswerk worden gebruikt.
|
5.1. Algemeen
|
5.1.1.
|
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen robenidine of storende stoffen aanwezig zijn.
|
|
5.1.2.
|
De terugvinding moet bepaald worden door middel van analyse van het blanco diervoeder (5.1.1) waaraan een vergelijkbare hoeveelheid robenidine is toegevoegd als aanwezig in het monster. Pipetteer voor een gehalte van 60 mg/kg 3,0 ml stamoplossing (3.9.1) in een erlenmeyer van 250 ml. Damp de oplossing in een stroom stikstof in tot ongeveer 0,5 ml. Voeg 15 g blanco diervoeder toe, meng en wacht 10 minuten, alvorens de extractiestap (5.2) uit te voeren.
|
NB
|
:
|
Voor de toepassing van deze methode moet het blanco diervoeder van vergelijkbare soort te zijn als het monster en mag hierin bij analyse geen robenidine aantoonbaar zijn.
|
|
5.2. Extractie
Weeg ongeveer 15 g van het voorbereide monster tot op 0,01 g nauwkeurig af. Breng het over in een erlenmeyer van 250 ml en voeg 100,0 ml aangezuurde methanol (3.2) toe; sluit de kolf af en schud 1 uur met het schudapparaat (4.2). Filtreer de oplossing door een glasvezelfilter (4.5) en vang het hele filtraat op in een erlenmeyer van 150 ml. Voeg 7,5 g moleculaire zeef (3.4) toe, sluit de kolf af met een stop en schud 5 minuten. Filtreer onmiddellijk door een glasvezelfilter. Bewaar deze oplossing voor de clean-up (5.3).
5.3. Clean-up
5.3.1. Bereiding van de aluminiumoxidekolom
Doe een propje glaswol onder in een glazen kolom (4.1) en druk dit met een glazen staaf aan. Weeg 11,0 g bereid aluminiumoxide (3.5) af en breng dit over in de kolom. Het aluminiumoxide moet zo weinig mogelijk aan de atmosfeer worden blootgesteld. Tik zachtjes onderaan tegen de gevulde kolom zodat het aluminiumoxide zich zet.
5.3.2. Clean-up van het monster
Pipetteer 5,0 ml van het volgens 5.2 bereide monsterextract op de kolom. Houd de punt van de pipet dicht tegen de kolomwand en laat de oplossing door het aluminiumoxide absorberen. Elueer het robenidine met 100 ml methanol (3.1) met een elutiesnelheid van 2-3 ml/min en vang het eluaat op in een rondbodemkolf van 250 ml. Damp de methanoloplossing droog met de rotatieverdamper (4.3) onder verminderde druk bij 40 oC. Neem het residu op in 3-4 ml mobiele fase (3.8) en breng de oplossing kwantitatief over in een maatkolf van 10 ml. Spoel de rondbodemkolf na met enkele porties van 1-2 ml mobiele fase en breng deze spoelvloeistof in de maatkolf over. Vul aan tot de streep met dezelfde vloeistof en meng. Een deel wordt door een membraanfilter van 0,45 μm (4.7) gefiltreerd. Gebruik deze oplossing voor de HPLC-bepaling (5.4).
5.4. HPLC-bepaling
5.4.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
HPLC-kolom (4.4.1);
mobiele fase voor HPLC (3.8);
elutiesnelheid: 1,5-2 ml/minuut;
detectiegolflengte 317 nm;
injectievolume: 20-50 μl.
Controleer de stabiliteit van het chromatografiesysteem door enige malen de ijkoplossing (3.9.3) met 3,6 μg/ml te injecteren totdat constante piekhoogten (-oppervlakten) en retentietijden worden verkregen.
5.4.2. IJkgrafiek
Injecteer elke ijkoplossing (3.9.3) enkele malen en meet voor elke concentratie de piekhoogten (-oppervlakten). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.4.3. Monsteroplossing
Injecteer het monsterextract (5.3.2) enige malen waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt; bepaal de gemiddelde piekhoogte (oppervlakte) van de robenidinepieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de robenidinepieken van de monsteroplossing aan de hand van de ijkgrafiek (5.4.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan robenidine w (mg/kg) in het monster wordt verkregen met de volgende formule:
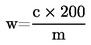
waarbij:
|
c
|
=
|
concentratie robenidine van de monsteroplossing in μg/ml;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract en de ijkoplossing (3.9.3) met 6 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract een geschikte hoeveelheid van een ijkoplossing (3.9.3) toe. De toegevoegde hoeveelheid robenidine moet ongeveer gelijk zijn aan de geschatte hoeveelheid robenidine in het monsterextract.
Alleen de hoogte van de robenidinepiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale hoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm;
|
|
b)
|
tussen 250 en 400 nm mogen de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de twee spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
|
|
c)
|
tussen 250 en 400 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag bij robenidinegehalten van meer dan 15 mg/kg niet meer dan 10 % van het hoogste resultaat bedragen.
7.3. Terugvinding
Voor het blancomonster met toevoeging moet het terugvindingspercentage ten minste 85 % bedragen.
8. Resultaten van een ringonderzoek
In EG-verband is een ringonderzoek georganiseerd waarin vier monsters pluimveevoer en konijnenvoer, als voedermeel of in pelletvorm, door twaalf laboratoria werden onderzocht. Op elk monster werden duploanalyses uitgevoerd. De resultaten zijn hieronder vermeld.
|
|
Pluimvee
|
Konijnen
|
|
|
meel
|
pellets
|
meel
|
pellets
|
|
gemiddelde [mg/kg]
|
27,00
|
27,99
|
43,6
|
40,1
|
|
Sr [mg/kg]
|
1,46
|
1,26
|
1,44
|
1,66
|
|
CVr [ %]
|
5,4
|
4,5
|
3,3
|
4,1
|
|
SR [mg/kg]
|
4,36
|
3,36
|
4,61
|
3,91
|
|
CVR [ %]
|
16,1
|
12,0
|
10,6
|
9,7
|
|
Terugvinding [ %]
|
90,0
|
93,3
|
87,2
|
80,2
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid, in %;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid, in %.
|
F. BEPALING VAN DICLAZURIL
2,6-Dichloor-α-(4-chloorfenyl)-4-[4,5-dihydro-3,5-dioxo-1,2,4-triazine-2(3H)-yl]benzeenacetonitril
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van diclazuril in diervoeders en voormengsels. De aantoonbaarheidsgrens is 0,1 mg/kg, de bepaalbaarheidsgrens 0,5 mg/kg.
2. Beginsel
Na toevoeging van een interne standaard wordt het monster geëxtraheerd met aangezuurde methanol. In het geval van diervoeders wordt een aliquot van het extract opgezuiverd met een C18-vastefasekolom. Diclazuril wordt uit de kolom geëlueerd met een mengsel van aangezuurde methanol en water. Na indamping wordt het residu opgelost in DMF/water. In het geval van voormengsels wordt het extract ingedampt en wordt het residu opgelost in DMF/water. Het gehalte aan diclazuril wordt bepaald door middel van ternaire gradiënt reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.1.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
|
3.3.
|
Tetrabutylammoniumwaterstofsulfaat (TBHS).
|
|
3.4.
|
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
|
|
3.5.
|
Methanol, HPLC-kwaliteit of gelijkwaardig.
|
|
3.6.
|
N,N-dimethylformamide (DMF).
|
|
3.7.
|
Zoutzuur, ρ20 = 1,19 g/ml.
|
|
3.8.
|
Standaardstof: diclazuril II-24: 2,6-dichloor-α-(4-chloorfenyl)-4-[4,5-dihydro-3,5-dioxo-1,2,4-triazine-2(3H)-yl]benzeenacetonitril van gegarandeerde zuiverheid, E 771.
|
|
3.8.1.
|
Stamoplossing van diclazuril, 500 μg/ml
Weeg 25 mg standaardstof diclazuril (3.8) tot op 0,1 mg nauwkeurig af in een maatkolf van 50 ml. Los op in DMF (3.6), vul aan tot de streep met DMF (3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.8.2.
|
Standaardoplossing diclazuril, 50 μg/ml
Breng 5,00 ml van de stamoplossing (3.8.1) over in een maatkolf van 50 ml, vul aan tot de streep met DMF (3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.9.
|
Interne standaard: 2,6-dichloor-α-(4-chloorfenyl)-4-(4,5-dihydro-3,5-dioxo-1,2,4-triazine-2(3H)-yl)-α-methylbenzeenacetonitril.
|
|
3.9.1.
|
Stamoplossing interne standaard, 500 μg/ml.
Weeg 25 mg interne standaard (3.9) tot op 0,1 mg nauwkeurig af in een maatkolf van 50 ml. Los op in DMF (3.6) en meng. Vul aan tot de streep met DMF (3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.9.2.
|
Internestandaardoplossing, 50 μg/ml.
Breng 5,00 ml van de stamoplossing van de interne standaard (3.9.1) over in een maatkolf van 50 ml, vul aan tot de streep met DMF (3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.9.3.
|
Internestandaardoplossing voor voormengsels, p/1 000 mg/ml.
(p = nominaal gehalte aan diclazuril in het voormengsel in mg/kg).
Weeg 0,1 mg p/10 mg van de interne standaard tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml, los op in DMF (3.6) in een ultrasoonbad (4.6), vul aan tot de streep met DMF en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.10.
|
IJkoplossing, 2 μg/ml.
Pipetteer 2,00 ml standaardoplossing diclazuril (3.8.2) en 2,00 ml internestandaardoplossing (3.9.2) in een maatkolf van 50 ml. Voeg 16 ml DMF (3.6) toe, vul aan tot de streep met water en meng. Deze oplossing moet vóór gebruik vers worden bereid.
|
|
3.11.
|
C18-vastefasekolom, bv. Bond Elut, volume: 1 cc, massa van de vaste fase: 100 mg.
|
|
3.12.
|
Extractievloeistof: aangezuurde methanol.
Pipetteer 5,0 ml zoutzuur (3.7) in 1 000 ml methanol (3.5) en meng.
|
|
3.13.
|
Mobiele fase voor HPLC:
|
|
3.13.1.
|
Eluens A: ammoniumacetaat-tetrabutylammoniumwaterstofsulfaatoplossing.
Los 5 g ammoniumacetaat (3.2) en 3,4 g TBHS (3.3) op in 1 000 ml water (3.1) en meng.
|
|
3.13.2.
|
Eluens B: acetonitril (3.4).
|
|
3.13.3.
|
Eluens C: methanol (3.5).
|
4. Apparatuur
|
4.1.
|
Mechanisch schudapparaat.
|
|
4.2.
|
Apparatuur voor ternaire-gradiënt-HPLC.
|
|
4.2.1.
|
HPLC-kolom, Hypersil ODS, vulling van 3 μm, 100 mm × 4,6 mm, of een gelijkwaardige kolom.
|
|
4.2.2.
|
Uv-detector met variabele golflengte of diode-arraydetector.
|
|
4.4.
|
Membraanfilter, 0,45 μm.
|
5. Werkwijze
5.1. Algemeen
5.1.1. Blanco diervoeder
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen diclazuril of storende stoffen aanwezig zijn. De blanco dient van vergelijkbare soort te zijn als het monster en hierin mogen geen diclazuril of storende stoffen aantoonbaar zijn.
5.1.2. Bepaling van de terugvinding
Het terugvindingspercentage dient te worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid diclazuril is toegevoegd als aanwezig in het monster. Voeg voor een gehalte van 1 mg/kg 0,1 ml stamoplossing (3.8.1) toe aan 50 g van een blanco, meng zorgvuldig, laat gedurende 10 minuten staan en meng vervolgens nog enige malen alvorens de extractiestap (5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort als het monster niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een vergelijkbare hoeveelheid diclazuril toegevoegd als aanwezig in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen diclazuril is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Diervoeders
Weeg ongeveer 50 g monster tot op 0,01 g nauwkeurig af. Breng dit over in een erlenmeyer van 500 ml, voeg 1,00 ml internestandaardoplossing (3.9.2) en 200 ml extractievloeistof (3.12) toe en sluit de erlenmeyer af. Schud het mengsel op het schudapparaat (4.1) gedurende één nacht. Laat het mengsel 10 minuten staan om het te laten bezinken. Breng 20 ml van de bovenstaande vloeistof over in een geschikte glazen recipiënt en verdun met 20 ml water. Breng deze oplossing over in een kolom (3.11) en zorg dat de oplossing de kolom passeert door het aanleggen van een vacuüm (4.5). Was de voorkolom met 25 ml van een mengsel van de extractievloeistof (3.12) en water, 65 + 35 (V + V). Doe de opgevangen fracties weg en elueer de verbindingen met 25 ml van een mengsel van extractievloeistof (3.12) en water, 80 + 20 (V + V). Damp deze fractie in met een rotatieverdamper (4.3) bij 60 oC, totdat de fractie juist droog is. Los het residu op in 1,0 ml DMF (3.6), voeg 1,5 ml water (3.1) toe en meng. Filtreer door een membraanfilter (4.4). Vervolg met de HPLC-bepaling (5.3).
5.2.2. Voormengsels
Weeg ongeveer 1 g monster tot op 0,001 g nauwkeurig af. Breng dit over in een erlenmeyer van 500 ml, voeg 1,00 ml internestandaardoplossing (3.9.3) en 200 ml extractievloeistof (3.12) toe en sluit de erlenmeyer af. Schud het mengsel op het schudapparaat (4.1) gedurende één nacht. Laat het mengsel 10 minuten staan om het te laten bezinken. Breng een aliquot van 10 000/p ml (p = nominaal gehalte van diclazuril in het voormengsel in mg/kg) van de bovenstaande vloeistof over in een rondbodemkolf van geschikte maat. Damp de vloeistof met de rotatieverdamper (4.3) onder verminderde druk en bij 60 oC in, totdat het residu juist droog is geworden. Neem het residu op in 10,0 ml DMF (3.6), voeg 15,0 ml water (3.1) toe en meng. Vervolg met de HPLC-bepaling (5.3).
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
|
HPLC-kolom (4.2.1):
|
100 mm × 4,6 mm, Hypersil ODS, 3 μm vulling, of een gelijkwaardige kolom;
|
|
|
mobiele fase:
|
eluens A (3.13.1):
|
waterige oplossing van ammoniumacetaat en tetrabutylammoniumwaterstofsulfaat;
|
|
|
eluens B (3.13.2):
|
acetonitril;
|
|
|
eluens C (3.13.3):
|
methanol;
|
|
elutiemethode:
|
|
—
|
begincondities: A + B + C = 60 + 20 + 20 (V + V + V);
|
|
—
|
schakel na 10 minuten elutie over op gradiëntelutie naar: A + B + C = 45 + 20 + 35 (V + V + V);
|
spoel met B gedurende 10 minuten;
|
|
elutiesnelheid:
|
1,5-2 ml/minuut;
|
|
|
injectievolume:
|
20 μl;
|
|
|
detectiegolflengte:
|
280 nm.
|
|
Controleer de stabiliteit van het HPLC-systeem door enige malen de ijkoplossing (3.10) van 2 μg/ml te injecteren, totdat constante piekhoogten en retentietijden worden verkregen.
5.3.2. IJkoplossing
Injecteer enige malen 20 μl ijkoplossing (3.10) en bepaal de gemiddelde hoogte (oppervlakte) van de diclazurilpiek en de piek van de interne standaard.
5.3.3. Monsteroplossing
Injecteer enige malen 20 μl monsteroplossing (5.2.1 of 5.2.2) en bepaal de gemiddelde hoogte (oppervlakte) van de diclazurilpiek en de piek van de interne standaard.
6. Berekening van de resultaten
6.1. Diervoeders
Het gehalte aan diclazuril w (mg/kg) in het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
hd,s
|
=
|
piekhoogte (-oppervlakte) van diclazuril in de monsteroplossing (5.2.1);
|
|
hi,s
|
=
|
piekhoogte (-oppervlakte) van de interne standaard in de monsteroplossing (5.2.1);
|
|
hd,c
|
=
|
piekhoogte (-oppervlakte) van diclazuril in de ijkoplossing (3.10);
|
|
hi,c
|
=
|
piekhoogte (-oppervlakte) van de interne standaard in de ijkoplossing (3.10);
|
|
cd,c
|
=
|
diclazurilconcentratie in de ijkoplossing in μg/ml (3.10);
|
|
m
|
=
|
massa van het analysemonster in g;
|
|
V
|
=
|
volume van het monsterextract volgens 5.2.1 (d.w.z. 2,5 ml).
|
6.2. Voormengsels
Het gehalte aan diclazuril w (mg/kg) in het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
hd,c
|
=
|
piekhoogte (-oppervlakte) van diclazuril in de ijkoplossing (3.10);
|
|
hi,c
|
=
|
piekhoogte (-oppervlakte) van de interne standaard in de ijkoplossing (3.10);
|
|
hd,s
|
=
|
piekhoogte (-oppervlakte) van diclazuril in de monsteroplossing (5.2.2);
|
|
hi,s
|
=
|
piekhoogte (-oppervlakte) van de interne standaard in de monsteroplossing (5.2.2);
|
|
cd,c
|
=
|
diclazurilconcentratie in de ijkoplossing in μg/ml (3.10);
|
|
m
|
=
|
massa van het analysemonster in g;
|
|
V
|
=
|
volume van het monsterextract volgens 5.2.2 (d.w.z. 25 ml);
|
|
p
|
=
|
nominaal gehalte aan diclazuril in het voormengsel in mg/kg.
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract (5.2.1 of 5.2.2) en de ijkoplossing (3.10) worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (5.2.1 of 5.2.2) een geschikte hoeveelheid van een ijkoplossing (3.10) toe. De toegevoegde hoeveelheid diclazuril moet ongeveer gelijk zijn aan de geschatte hoeveelheid diclazuril in het monsterextract.
Alleen de hoogte van de diclazurilpiek en die van de piek van de interne standaard mogen naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm.
|
|
b)
|
tussen 230 en 320 nm mogen de spectra van het monster en de standaard, opgenomen op de top van de chromatografische piek voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt.
|
|
c)
|
tussen 230 en 320 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
30 % van het hoogste resultaat bij diclazurilgehalten tussen 0,5 mg/kg en 2,5 mg/kg;
|
|
—
|
0,75 mg/kg bij diclazurilgehalten tussen 2,5 mg/kg en 5 mg/kg;
|
|
—
|
15 % van het hoogste resultaat bij diclazurilgehalten van meer dan 5 mg/kg.
|
7.3. Terugvinding
Voor het (blanco)monster met toevoeging dient het terugvindingspercentage ten minste 80 % te bedragen.
8. Resultaten van een ringonderzoek
Er is een ringonderzoek georganiseerd waarbij vijf monsters door elf laboratoria zijn onderzocht. Deze monsters bestonden uit twee voormengsels; het ene werd gemengd met een organische matrix (O 100) en het andere met een anorganische matrix (A 100). Het theoretische gehalte is 100 mg diclazuril per kg. De drie mengvoeders voor pluimvee waren afkomstig van drie verschillende producenten (NL) (L1/Z1/K1). Het theoretische gehalte is 1 mg diclazuril per kg. De laboratoria waren gevraagd elk monster eenmaal of in duplo te analyseren. (Voor meer details over dit ringonderzoek zie „Journal of AOAC International”, Volume 77, nr. 6, 1994, blz. 1 359-1 361). De resultaten staan in de volgende tabel.
|
|
monster 1
A 100
|
monster 2
O 100
|
monster 3
L1
|
monster 4
Z1
|
monster 5
K1
|
|
L
|
11
|
11
|
11
|
11
|
6
|
|
n
|
19
|
18
|
19
|
19
|
12
|
|
Gemiddelde
|
100,8
|
103,5
|
0,89
|
1,15
|
0,89
|
|
Sr (mg/kg)
|
5,88
|
7,64
|
0,15
|
0,02
|
0,03
|
|
CVr ( %)
|
5,83
|
7,38
|
17,32
|
1,92
|
3,34
|
|
SR (mg/kg)
|
7,59
|
7,64
|
0,17
|
0,11
|
0,12
|
|
CVR ( %)
|
7,53
|
7,38
|
18,61
|
9,67
|
13,65
|
|
nominaal gehalte (mg/kg)
|
100
|
100
|
1
|
1
|
1
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid.
|
9. Opmerkingen
Eerder moet zijn aangetoond dat de diclazurilrespons lineair is in het gebied van de gemeten concentraties.
G. BEPALING VAN HET GEHALTE AAN LASALOCIDE-NATRIUM
Natriumzout van een door Streptomyces lasaliensis geproduceerd polyethermonocarbonzuur
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van lasolacide-natrium in diervoeders en voormengsels. De aantoonbaarheidsgrens is 5 mg/kg, de bepaalbaarheidsgrens 10 mg/kg.
2. Beginsel
Lasalocide-natrium wordt uit het monster geëxtraheerd met aangezuurde methanol, en het gehalte wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met spectrofluorimetrische detectie.
3. Reagentia
|
3.1.
|
Kaliumdiwaterstoffosfaat (KH2PO4).
|
|
3.2.
|
Fosforzuur, w = 85 % (m/m).
|
|
3.3.
|
Verdund fosforzuur, c = 20 %.
Verdun 23,5 ml fosforzuur (3.2) met water tot 100 ml.
|
|
3.4.
|
6-Methyl-2-heptylamine (1,5-dimethylhexylamine), w = 99 % (m/m).
|
|
3.5.
|
Methanol, HPLC-kwaliteit of gelijkwaardig.
|
|
3.6.
|
Zoutzuur, d = 1,19 g/ml.
|
|
3.7.
|
Fosfaatbuffer, c = 0,01 mol/l.
Los 1,36 g KH2PO4 (3.1) op in 500 ml water (3.11), voeg 3,5 ml fosforzuur (3.2) en 10,0 ml 6-methyl-2-heptylamine (3.4) toe. Breng de pH op 4,0 met verdund fosforzuur (3.3) en verdun tot 1 000 ml met water (3.11).
|
|
3.8.
|
Aangezuurde methanol.
Breng 5,0 ml zoutzuur (3.6) over in een maatkolf van 1 000 ml, vul aan tot de streep met methanol (3.5) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
|
|
3.9.
|
Mobiele fase voor HPLC, fosfaatbuffer-methanol, 5 + 95 (V + V).
Meng 5 ml fosfaatbuffer (3.7) met 95 ml methanol (3.5).
|
|
3.10.
|
Lasalocide-natrium standaardstof van gegarandeerde zuiverheid, C34H53O8Na (natriumzout van een door Streptomyces lasaliensis geproduceerd polyethermonocarbonzuur), E 763.
|
|
3.10.1.
|
Stamoplossing van lasalocide-natrium, 500 μg/ml
Weeg 50 mg lasalocide-natrium (3.10) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml en los op in aangezuurde methanol (3.8), vul aan tot de streep met hetzelfde oplosmiddel en meng. Deze oplossing moet vóór gebruik vers worden bereid.
|
|
3.10.2.
|
Werkoplossing van lasalocide-natrium, 50 μg/ml
Pipetteer 10,0 ml van de stamoplossing (3.10.1) in een maatkolf van 100 ml, vul aan tot de streep met aangezuurde methanol (3.8) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
|
|
3.10.3.
|
IJkoplossingen
Breng 1,0, 2,0, 4,0, 5,0 en 10,0 ml werkoplossing (3.10.2) in een reeks maatkolven van 50 ml. Vul aan tot de streep met aangezuurde methanol (3.8) en meng. Deze oplossingen komen overeen met respectievelijk 1,0, 2,0, 4,0, 5,0 en 10,0 μg lasalocide-natrium per ml. Deze oplossingen moeten vóór gebruik vers worden bereid.
|
|
3.11.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
4. Apparatuur
|
4.1.
|
Ultrasoonbad (of schudmachine in een waterbad) met temperatuurregeling.
|
|
4.2.
|
Membraanfilter, 0,45 μm.
|
|
4.3.
|
HPLC-apparatuur met injectiesysteem, geschikt voor injectiehoeveelheden van 20 μl.
|
|
4.3.1.
|
HPLC-kolom, 125 mm × 4 mm, reversed-phase C18, vulling van 5 μm, of een gelijkwaardige kolom.
|
|
4.3.2.
|
Spectrofluorimeter met variabele excitatie- en emissiegolflengte.
|
5. Werkwijze
5.1. Algemeen
5.1.1. Blanco diervoeder
Voor de bepaling van de terugvinding (5.1.2) moet een blanco voedermonster worden geanalyseerd om te controleren of er geen lasalocide-natrium of storende stoffen aanwezig zijn. Het blanco voedermonster moet van een vergelijkbare soort zijn als het monster en hierin mogen geen lasalocide-natrium of storende stoffen aantoonbaar zijn.
5.1.2. Bepaling van de terugvinding
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder waaraan een hoeveelheid lasalocide-natrium is toegevoegd die vergelijkbaar is met die in het monster. Breng voor een gehalte van 100 mg/kg 10,0 ml van de stamoplossing (3.10.1) over in een erlenmeyer van 250 ml en damp de oplossing in tot ongeveer 0,5 ml. Voeg 50 g blanco toe, meng zorgvuldig, laat gedurende 10 minuten staan en meng vervolgens nog enige malen opnieuw alvorens de extractiestap (5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een hoeveelheid lasalocide-natrium toegevoegd die vergelijkbaar is met die in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen lasalocide-natrium is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Diervoeders
Weeg 5-10 g van het monster tot op 0,01 g nauwkeurig af in een afsluitbare erlenmeyer van 250 ml. Voeg met een pipet 100,0 ml aangezuurde methanol (3.8) toe. Sluit niet volledig af en zwenk de erlenmeyer om te dispergeren. Plaats de erlenmeyer gedurende 20 minuten in het ultrasoonbad (4.1) bij ongeveer 40 oC, haal hem eruit en koel af tot kamertemperatuur. Laat ongeveer 1 uur staan totdat het gesuspendeerde materiaal is neergeslagen, filtreer vervolgens een aliquot door een membraanfilter van 0,45 μm (4.2) in een daartoe geschikt monsterflesje. Vervolg met de HPLC-bepaling (5.3).
5.2.2. Voormengsels
Weeg 2 g van het niet-gemalen voormengsel tot op 0,001 g nauwkeurig af in een maatkolf van 250 ml. Voeg 100,0 ml aangezuurde methanol (3.8) toe en zwenk de maatkolf om te dispergeren. Plaats de kolf met inhoud gedurende 20 minuten in het ultrasoonbad (4.1) bij ongeveer 40 oC, haal hem eruit en koel af tot kamertemperatuur. Verdun door aangezuurde methanol (3.8) toe te voegen tot de streep en meng grondig. Laat ongeveer 1 uur staan totdat het gesuspendeerde materiaal is neergeslagen, filtreer vervolgens een aliquot door een membraanfilter van 0,45 μm (4.2). Verdun een zodanige hoeveelheid van het heldere filtraat met aangezuurde methanol (3.8) dat een oplossing met ongeveer 4 μg/ml lasalocide-natrium wordt verkregen. Vervolg met de HPLC-bepaling (5.3).
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
|
HPLC-kolom (4.3.1):
|
125 mm × 4 mm, reversed-phase C18, 5 μm vulling, of een gelijkwaardige kolom;
|
|
mobiele fase (3,9):
|
mengsel van fosfaatbuffer (3.7) en methanol (3.5), 5 + 95 (V + V);
|
|
elutiesnelheid:
|
1,2 ml/minuut;
|
|
detectiegolflengte:
|
|
|
excitatie:
|
310 nm;
|
|
emissie
|
419 nm;
|
|
injectievolume:
|
20 μl.
|
Controleer de stabiliteit van het HPLC-systeem door enige malen de ijkoplossing (3.10.3) van 4,0 μg/ml te injecteren, totdat constante piekhoogten (of -oppervlakten) en retentietijden worden verkregen.
5.3.2. IJkgrafiek
Injecteer elke ijkoplossing (3.10.3) enkele malen en meet voor elke concentratie de gemiddelde piekhoogte (-oppervlakte). Maak een ijkgrafiek met de gemiddelde piekhoogten (-oppervlakten) als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.3.3. Monsteroplossing
Injecteer de in 5.2.1 en 5.2.2 verkregen monsterextracten enige malen, waarbij hetzelfde injectievolume als voor de ijkoplossingen wordt gebruikt, en bepaal de gemiddelde piekhoogten (-oppervlakten) van de lasalocide-natriumpieken.
6. Berekening van de resultaten
Bereken uit de gemiddelde piekhoogte (-oppervlakte) die door injectie van de monsteroplossing (5.3.3) is verkregen, het gehalte aan lasalocide-natrium (μg/ml) aan de hand van de ijkgrafiek.
6.1. Diervoeders
Het gehalte aan lasalocide-natrium w (mg/kg) in het monster wordt verkregen met de volgende formule:
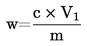 [mg/kg]
[mg/kg]
waarbij:
|
c
|
=
|
het gehalte lasalocide-natrium van de monsteroplossing (5.2.1) in μg/ml;
|
|
V1
|
=
|
volume van het monsterextract volgens 5.2.1 in ml (d.w.z. 100);
|
|
m
|
=
|
massa van het analysemonster in g.
|
6.2. Voormengsels
Het gehalte aan lasalocide-natrium w (mg/kg) in het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
c
|
=
|
het gehalte lasalocide-natrium van de monsteroplossing (5.2.2) in μg/ml;
|
|
V2
|
=
|
volume van het monsterextract volgens 5.2.2 in ml (d.w.z. 250);
|
|
f
|
=
|
verdunningsfactor volgens 5.2.2;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Validatie van de resultaten
7.1. Identiteit
Op spectrofluorimetrische detectie gebaseerde methoden zijn minder aan storing onderhevig dan die waarbij uv-detectie wordt toegepast. De identiteit van de geanalyseerde stof kan worden vastgesteld door cochromatografie.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (5.2.1 of 5.2.2) een juiste hoeveelheid van een ijkoplossing (3.10.3) toe. De hoeveelheid toegevoegd lasalocide-natrium moet ongeveer even groot zijn als de in het monsterextract gevonden hoeveelheid. Alleen de hoogte van de lasalocide-natriumpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % liggen van de breedte van het monster waaraan geen lasalocide-natrium is toegevoegd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
15 % van het hoogste resultaat bij een gehalte aan lasalocide-natrium tussen 30 mg/kg en 100 mg/kg;
|
|
—
|
15 mg/kg bij een gehalte aan lasalocide-natrium tussen 100 mg/kg en 200 mg/kg;
|
|
—
|
7,5 % van het hoogste resultaat bij een gehalte aan lasalocide-natrium van meer dan 200 mg/kg.
|
7.3. Terugvinding
Voor het (blanco) voedermonster met toevoeging moet het terugvindingspercentage ten minste 80 % bedragen. Voor het voormengselmonster met toevoeging moet het terugvindingspercentage ten minste 90 % bedragen.
8. Resultaten van een ringonderzoek
Er heeft een ringonderzoek (6) plaatsgevonden waarbij twee voormengsels (monster 1 en 2) en vijf soorten voeder (monster 3 tot en met 7) door twaalf laboratoria zijn onderzocht. Op elk monster werden duploanalyses uitgevoerd. De resultaten staan in de volgende tabel:
|
|
monster 1
voormengsel voor kippen
|
monster 2
voormengsel voor kalkoenen
|
monster 3
pellets voor kalkoenen
|
monster 4
voederbrokjes voor kippen
|
monster 5
voeder voor kalkoenen
|
monster 6
voeder voor kippen A
|
monster 7
voeder voor kippen B
|
|
L
|
12
|
12
|
12
|
12
|
12
|
12
|
12
|
|
n
|
23
|
23
|
23
|
23
|
23
|
23
|
23
|
|
gemiddelde [mg/kg]
|
5 050
|
16 200
|
76,5
|
78,4
|
92,9
|
48,3
|
32,6
|
|
Sr [mg/kg]
|
107
|
408
|
1,71
|
2,23
|
2,27
|
1,93
|
1,75
|
|
CVr [ %]
|
2,12
|
2,52
|
2,24
|
2,84
|
2,44
|
4,00
|
5,37
|
|
SR [mg/kg]
|
286
|
883
|
3,85
|
7,32
|
5,29
|
3,47
|
3,49
|
|
CVR [ %]
|
5,66
|
5,45
|
5,03
|
9,34
|
5,69
|
7,18
|
10,70
|
|
nominaal gehalte [mg/kg]
|
5 000 (7)
|
16 000 (7)
|
80 (7)
|
105 (7)
|
120 (7)
|
50 (8)
|
35 (8)
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid, in %;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid, in %.
|
(1) Uitgevoerd door de Werkgroep diervoeders van het Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
(2) Uitgevoerd door de Werkgroep diervoeders van het Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
(3) Er mogen andere ontsluitingsmethoden worden gebruikt, mits is aangetoond dat die vergelijkbare resultaten opleveren (bv. microgolfontsluiting onder hoge druk).
(4) Groenvoer (vers of gedroogd) bevat soms grote hoeveelheden plantaardig kiezelzuur dat moet worden verwijderd omdat het sporenelementen kan vasthouden. Bij monsters van dergelijke diervoeders moet derhalve de volgende gewijzigde procedure worden toegepast. Ga te werk als in 5.1.1.1 tot en met de filtratie. Was het filtreerpapier met het onoplosbare residu tweemaal uit met kokend water en breng het in een kwarts- of platinaschaal. Veras in de moffeloven (4.1) bij een temperatuur lager dan 550 oC tot alle koolstofhoudend materiaal is verdwenen. Voeg na afkoelen enkele druppels water toe en daarna 10-15 ml waterstoffluorideoplossing (3.4). Damp in tot droog bij ongeveer 150 oC. Indien het residu nog steeds enig kiezelzuur bevat, los het dan opnieuw op in enkele ml waterstoffluorideoplossing (3.4) en damp in tot droog. Voeg 5 druppels zwavelzuur (3.5) toe en verwarm tot er geen witte damp meer ontstaat. Voeg vervolgens 5 ml zoutzuur 6 mol/l (3.2) en ongeveer 30 ml water toe, verwarm en filtreer de oplossing in een maatkolf van 250 ml; koel af en vul aan tot de streep met water (de zoutzuurconcentratie is dan ongeveer 0,5 mol/l). Handel verder als beschreven in 5.1.2.
(5) The Analyst 108, 1983, blz. 1 252-1 256.
(6) Analyst, 1995, 120, 2175-2180.
(7) Door de fabrikant opgegeven gehalte.
(8) In het laboratorium bereid voeder.
BIJLAGE V
ANALYSEMETHODEN VOOR DE CONTROLE OP ONGEWENSTE STOFFEN IN DIERVOEDERS
A. BEPALING VAN VRIJ EN TOTAAL GOSSYPOL
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vrij gossypol, totaal gossypol en aan gossypol chemisch nauw verwante stoffen in katoenzaad, katoenzaadmeel en katoenzaadkoeken en in mengvoeders die deze voedermiddelen bevatten, indien het gehalte aan vrij gossypol, totaal gossypol en aan gossypol chemisch nauw verwante stoffen hoger is dan 20 mg/kg.
2. Beginsel
Gossypol wordt geëxtraheerd in aanwezigheid van 3-aminopropaan-1-ol, hetzij met een mengsel van propaan-2-ol en hexaan voor het bepalen van vrij gossypol, hetzij met dimethylformamide voor het bepalen van totaal gossypol. Het gossypol wordt met aniline omgezet in gossypoldianiline, waarvan de extinctie gemeten wordt bij 440 nm.
3. Reagentia
|
3.1.
|
Propaan-2-ol-hexaanmengsel: meng 60 volumedelen propaan-2-ol met 40 volumedelen n-hexaan.
|
|
3.2.
|
Oplosmiddel A: breng in een maatkolf van 1 liter ongeveer 500 ml propaan-2-ol-hexaanmengsel (3.1), 2 ml 3-aminopropaan-1-ol, 8 ml ijsazijn en 50 ml water. Vul aan tot de streep met propaan-2-ol-hexaanmengsel (3.1). Dit reagens is een week houdbaar.
|
|
3.3.
|
Oplosmiddel B: pipetteer 2 ml 3-aminopropaan-1-ol en 10 ml ijsazijn in een maatkolf van 100 ml. Koel af tot kamertemperatuur en vul aan tot de streep met N, N-dimethylformamide. Dit reagens is een week houdbaar.
|
|
3.4.
|
Aniline: Als de extinctie bij een blancobepaling meer bedraagt dan 0,022, moet de aniline worden gedestilleerd over zinkpoeder, waarbij 10 % voorloop en 10 % naloop worden verwijderd. Dit reagens is enige maanden houdbaar in een gesloten bruine fles, bewaard in een koelkast.
|
|
3.5.
|
Gossypolstandaardoplossing A: Breng 27,9 mg gossypolacetaat in een maatkolf van 250 ml. Los op in oplosmiddel A (3.2) en vul hiermee aan tot de streep. Pipetteer 50 ml van deze oplossing in een maatkolf van 250 ml en vul aan tot de streep met oplosmiddel A. Deze oplossing bevat 0,02 mg/ml gossypol. Laat de oplossing vóór gebruik 1 uur staan bij kamertemperatuur.
|
|
3.6.
|
Gossypolstandaardoplossing B: breng 27,9 mg gossypolacetaat in een maatkolf van 50 ml, los op in oplosmiddel B (3.3) en vul hiermee aan tot de streep. Deze oplossing bevat 0,5 mg/ml gossypol.
De gossypolstandaardoplossingen A en B zijn — in het donker bewaard — 24 uur houdbaar.
|
4. Apparatuur
|
4.1.
|
Roteerapparaat ongeveer 35 omwentelingen per minuut.
|
5. Werkwijze
5.1. Analysemonster
De af te wegen hoeveelheid analysemateriaal hangt af van het te verwachten gehalte aan gossypol. Het verdient de voorkeur te werken met een kleine hoeveelheid analysemateriaal en met een relatief groot aliquot van het filtraat, om een voldoende hoeveelheid gossypol te verkrijgen voor een nauwkeurige fotometrische meting. Voor het bepalen van vrij gossypol in katoenzaad, katoenzaadmeel en katoenzaadkoeken mag de massa van het analysemonster niet meer bedragen dan 1 g; van mengvoeders kan tot 5 g worden afgewogen. In het algemeen kan een aliquot van 10 ml van het filtraat worden afgepipetteerd; het moet 50-100 μg gossypol bevatten. Voor het bepalen van totaal gossypol kan de af te wegen hoeveelheid analysemateriaal variëren van 0,5 tot 5 g, zodanig dat in een aliquot van 2 ml van het filtraat 40 tot 200 μg gossypol aanwezig is.
De analyse moet worden uitgevoerd bij een omgevingstemperatuur van omstreeks 20 oC.
5.2. Bepaling van vrij gossypol
Breng het afgewogen analysemonster in een kolf van 250 ml met slijpstuk, waarvan de bodem bedekt is met glaskralen. Pipetteer hierin 50 ml oplosmiddel A (3.2), sluit de kolf en laat gedurende 1 uur roteren. Filtreer door een droogfilter en vang het filtraat op in een kleine kolf met slijpstuk. Bedek tijdens het filtreren de trechter met een horlogeglas.
Pipetteer gelijke aliquots van het filtraat, die 50 tot 100 mg gossypol bevatten, in twee maatkolven van 25 ml (A en B). Vul eventueel het volume aan tot 10 ml met oplosmiddel A (3.2). Vul vervolgens de inhoud van maatkolf (A) aan tot 25 ml met propaan-2-ol-hexaanmengsel (3.1). Deze oplossing dient als referentieoplossing voor de monsteroplossing.
Pipetteer vervolgens in twee andere maatkolven van 25 ml (C en D) 10 ml oplosmiddel A (3.2). Vul vervolgens de inhoud van maatkolf (C) aan tot 25 ml met propaan-2-ol-hexaanmengsel (3.1). Deze oplossing dient als referentieoplossing voor de blanco-oplossing.
Voeg aan de maatkolven (D) en (B) 2 ml aniline (3.4) toe. Verwarm gedurende 30 minuten in een kokendwaterbad voor het ontwikkelen van de kleuring. Koel af tot kamertemperatuur, vul aan tot de streep met propaan-2-ol-hexaanmengsel (3.1), meng en laat gedurende 1 uur staan.
Meet met de spectrofotometer de extinctie van de blanco-oplossing D bij 440 nm in een glascuvet van 1 cm ten opzichte van de referentieoplossing C. Meet vervolgens evenzo de extinctie van de monsteroplossing B ten opzichte van de referentieoplossing A.
Trek de extinctie van de blanco-oplossing af van die van de monsteroplossing (= gecorrigeerde extinctie). Bereken uit de aldus verkregen waarde het gehalte aan vrij gossypol als beschreven onder 6.
5.3. Bepaling van totaal gossypol
Breng een hoeveelheid analysemateriaal die 1-5 mg gossypol bevat, in een maatkolf van 50 ml en voeg 10 ml oplosmiddel B (3.3) toe. Bereid tevens een blanco-oplossing door 10 ml oplosmiddel B (3.3) in een tweede maatkolf van 50 ml te brengen. Verwarm beide kolven gedurende 30 minuten in een kokendwaterbad. Koel af tot kamertemperatuur en vul de inhoud van beide maatkolven aan tot de streep met propaan-2-ol-hexaanmengsel (3.1). Laat na mengen gedurende 10-15 minuten staan en filtreer dan af in kolfjes met slijpstuk.
Pipetteer 2 ml van het filtraat van het monster in twee maatkolven van 25 ml en 2 ml van het filtraat van de blanco in twee andere maatkolven van 25 ml. Vul van elke serie één maatkolf aan tot 25 ml met propaan-2-ol-hexaanmengsel (3.1). Deze oplossingen dienen als referentieoplossingen.
Voeg aan de twee andere maatkolven 2 ml aniline (3.4) toe. Verwarm gedurende 30 minuten in een kokendwaterbad voor het ontwikkelen van de kleuring. Koel af tot kamertemperatuur, vul aan tot de streep met propaan-2-ol-hexaanmengsel (3.1), meng en laat 1 uur staan.
Meet de extincties als beschreven onder 5.2 voor vrij gossypol. Bereken uit de aldus verkregen waarde het gehalte aan totaal gossypol als beschreven onder 6.
6. Berekening van de resultaten
De resultaten kunnen op basis van de specifieke extinctie (6.1) of aan de hand van een ijkgrafiek (6.2) worden berekend.
6.1. Op basis van de specifieke extinctie
Onder de beschreven omstandigheden bedraagt de specifieke extinctie voor:
|
vrij gossypol:
|
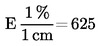
|
|
totaal gossypol:
|

|
Het gehalte aan vrij of totaal gossypol van het monster wordt verkregen met de volgende formule:
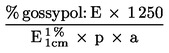
waarbij:
|
E
|
=
|
gecorrigeerde extinctie, als bepaald volgens 5.2;
|
|
p
|
=
|
massa van het analysemonster in g;
|
|
a
|
=
|
aliquot van het filtraat in ml.
|
6.2. Met een ijkgrafiek
6.2.1. Vrij gossypol
Neem twee series van telkens vijf maatkolven van 25 ml. Pipetteer in beide series respectievelijk 2,0, 4,0, 6,0, 8,0 en 10,0 ml gossypolstandaardoplossing A (3.5). Vul elke kolf aan tot 10 ml met oplosmiddel A (3.2). Voeg aan elke serie nog een maatkolf van 25 ml toe die alleen 10 ml oplosmiddel A (3.2) bevat (blancobepaling).
Vul de kolven van de eerste serie (met inbegrip van de kolf voor de blancobepaling) aan tot 25 ml met propaan-2-ol-hexaanmengsel (3.1) (referentieserie).
Voeg 2 ml aniline (3.4) toe aan elke kolf van de tweede serie (met inbegrip van de kolf voor de blancobepaling). Verwarm gedurende 30 minuten in een kokendwaterbad voor het ontwikkelen van de kleuring. Koel af tot kamertemperatuur, vul aan tot de streep met propaan-2-ol-hexaanmengsel (3.1), meng en laat gedurende 1 uur staan (standaardserie).
Bepaal de extinctie van elke oplossing van de standaardserie ten opzichte van de referentieserie, zoals beschreven in 5.2. Stel een ijkgrafiek op, waarbij op de abscis de hoeveelheden gossypol (in μg) en op de ordinaat de daarbij behorende extinctiewaarden worden uitgezet.
6.2.2. Totaal gossypol
Neem zes maatkolven van 50 ml. Breng in de eerste 10 ml oplosmiddel B (3.3) en in de andere respectievelijk 2,0, 4,0, 6,0, 8,0 en 10,0 ml of gossypolstandaardoplossing B (3.6). Vul elke kolf aan tot 10 ml met oplosmiddel B (3.3). Verwarm gedurende 30 minuten in een kokendwaterbad. Koel af tot kamertemperatuur, vul aan tot de streep met propaan-2-ol-hexaanmengsel (3.1) en meng.
Pipetteer van deze oplossingen telkens 2,0 ml in twee series van zes maatkolven van 25 ml. Vul de maatkolven van de eerste serie aan tot 25 ml met propaan-2-ol-hexaanmengsel (3.1) (referentieserie).
Voeg aan de maatkolven van de tweede serie telkens 2 ml aniline (3.4) toe. Verwarm gedurende 30 minuten in een kokendwaterbad. Koel af tot kamertemperatuur, vul aan tot de streep met propaan-2-ol-hexaanmengsel (3.1), meng en laat gedurende 1 uur staan (standaardserie).
Bepaal de extinctie van elke oplossing van de standaardserie ten opzichte van de referentieserie, zoals beschreven in 5.2. Stel een ijkgrafiek op, waarbij op de abscis de hoeveelheden gossypol (in μg) en op de ordinaat de daarbij behorende extinctiewaarden worden uitgezet.
6.3. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
15 % van het hoogste resultaat bij gossypolgehalten van minder dan 500 ppm,
|
|
—
|
75 ppm absoluut voor gossypolgehalten van 500 tot en met 750 ppm,
|
|
—
|
10 % van de hoogste waarde voor gossypolgehalten van meer dan 750 ppm.
|
B. BEPALING VAN HET GEHALTE AAN DIOXINEN (PCDD/PCDF) EN DIOXINEACHTIGE PBC's
I. BEMONSTERINGSWIJZE EN INTERPRETATIE VAN DE ANALYSERESULTATEN
1. Doel en toepassingsgebied
De monsters voor de officiële controle op het gehalte aan dioxinen (polychloordibenzo-p-dioxinen (PCDD's) en polychloordibenzofuranen (PCDF's)) en dioxineachtige polychloorbifenylen (pcb's) (1) in diervoeders worden genomen overeenkomstig bijlage I. De in punt 5.A van die bijlage beschreven kwantitatieve voorschriften voor de controle van stoffen of producten die gelijkmatig over het diervoeder verdeeld zijn, moeten worden gevolgd. De op die manier verkregen verzamelmonsters worden representatief geacht voor de partijen of subpartijen waarvan zij zijn genomen. Op basis van de gehalten die in de laboratoriummonsters worden geconstateerd, wordt bepaald of de partijen voldoen aan de maximumgehalten zoals vastgesteld bij Richtlijn 2002/32/EG van het Europees Parlement en de Raad (2).
2. Overeenstemming van de partij of subpartij met de eisen
De partij wordt aanvaard als het resultaat van één analyse het desbetreffende maximumgehalte zoals vastgelegd in Richtlijn 2002/32/EG niet overschrijdt, rekening houdend met de meetonzekerheid.
De partij is niet in overeenstemming met het in Richtlijn 2002/32/EG vastgelegde maximumgehalte als de door een duplobepaling (3) bevestigde bovengrens (4) van het analyseresultaat buiten redelijke twijfel groter is dan dat maximumgehalte, rekening houdend met de meetonzekerheid.
De meetonzekerheid wordt volgens een van de volgende methoden verdisconteerd:
|
—
|
door de uitgebreide onzekerheid te berekenen met een dekkingsfactor 2, wat een betrouwbaarheidsniveau van ongeveer 95 % oplevert. Een partij of subpartij voldoet niet aan de voorschriften als de gemeten waarde minus de onzekerheid boven het maximumgehalte ligt. Bij een afzonderlijke bepaling van dioxinen en dioxineachtige pcb's moet de som van de geschatte uitgebreide onzekerheid van de afzonderlijke analyseresultaten van dioxinen en dioxineachtige pcb's worden gebruikt voor de som van dioxinen en dioxineachtige pcb's.
|
|
—
|
door de beslissingsgrens (CCα) te bepalen overeenkomstig Beschikking 2002/657/EG van de Commissie (5) (punt 3.1.2.5. van de bijlage — stoffen waarvoor een toelaatbaar gehalte is vastgesteld). Een partij voldoet niet aan de eisen als de gemeten waarde gelijk aan of groter dan de CCα is.
|
Deze interpretatievoorschriften gelden voor het analyseresultaat van het monster voor officiële controledoeleinden. Dit doet geen afbreuk aan het recht van de lidstaten om nationale voorschriften voor de analyse van monsters voor verhaals- en arbitragedoeleinden te hanteren.
II. MONSTERVOORBEREIDING EN VOORSCHRIFTEN VOOR DE ANALYSEMETHODEN DIE WORDEN GEBRUIKT VOOR DE OFFICIËLE CONTROLE OP HET GEHALTE AAN DIOXINEN (PCDD's/PCDF's) EN DIOXINEACHTIGE PCB's
1. Doel en toepassingsgebied
Deze voorschriften gelden voor de analyse van voedermiddelen en diervoeders ter bepaling van het gehalte aan dioxinen (polychloordibenzo-p-dioxinen (PCDD's) en polychloordibenzofuranen (PCDF's)) en dioxineachtige polychloorbifenylen (pcb's).
De aanwezigheid van dioxinen in diervoeders kan worden nagegaan aan de hand van een screeningsmethode waarmee monsters met een gehalte aan dioxinen en dioxineachtige pcb's dat minder dan 25 % onder het betrokken concentratieniveau ligt of dat overschrijdt, worden uitgeselecteerd. De dioxineconcentratie in deze uitgeselecteerde monsters moet worden bepaald of bevestigd met een bevestigingsmethode.
Screeningsmethoden zijn methoden die worden gebruikt om de aanwezigheid van dioxinen en dioxineachtige pcb's op het betrokken concentratieniveau vast te stellen. Met deze methoden kunnen in korte tijd veel monsters worden verwerkt en ze worden gebruikt om uit grote aantallen monsters die monsters te selecteren die mogelijk positief reageren. Zij zijn er specifiek op gericht fout-negatieve resultaten te vermijden.
Bevestigingsmethoden zijn methoden die volledige of aanvullende informatie leveren voor de ondubbelzinnige identificatie en bepaling van dioxinen en dioxineachtige pcb's op het betrokken concentratieniveau.
2. Achtergrond
Aangezien milieumonsters en biologische monsters (met inbegrip van monsters van voedermiddelen en diervoeders) in de regel complexe mengsels van verschillende dioxinecongeneren bevatten, is het begrip toxische-equivalentiefactoren (TEF's) ontwikkeld om de risicobeoordeling te vergemakkelijken. Deze TEF's zijn vastgesteld om de concentraties van mengsels van 2,3,7,8-gesubstitueerde PCDD's en PCDF's, en een aantal non-ortho- en mono-ortho-chloorgesubstitueerde pcb's die dioxineachtige activiteit bezitten, uit te drukken in toxische equivalenten (TEQ's) 2,3,7,8-TCDD. De concentraties van de verschillende stoffen in een monster worden elk met de bijbehorende TEF vermenigvuldigd en vervolgens bij elkaar opgeteld ter verkrijging van de totale concentratie aan dioxineachtige verbindingen, uitgedrukt in TEQ's.
Uitsluitend met het oog op de toepassing van deze verordening is de aanvaarde specifieke bepaalbaarheidsgrens van een afzonderlijke congeneer gelijk aan de concentratie van een analyt in een monsterextract die voor de twee te meten ionen een instrumentele respons geeft met een signaal-ruisverhouding van 3:1 voor het zwakste signaal waarbij voldaan wordt aan de basiseisen zoals retentietijd en isotopenverhouding overeenkomstig de bepalingsmethode die wordt beschreven in EPA method 1613 revision B.
3. Kwaliteitsborgingvoorschriften voor de monstervoorbereiding
Voor de voorbereiding van de analysemonsters moeten de algemene voorschriften van bijlage II worden gevolgd.
Daarnaast moet aan de volgende voorschriften worden voldaan:
|
—
|
De monsters moeten worden bewaard en vervoerd in recipiënten van glas, aluminium, polypropyleen of polyethyleen. Sporen papierstof moeten van de monsterrecipiënt verwijderd worden. Het glaswerk moet worden gespoeld met oplosmiddelen die van tevoren op de aanwezigheid van dioxinen zijn gecontroleerd.
|
|
—
|
Er moet een blancobepaling worden verricht door de gehele analyseprocedure met weglating van het monster uit te voeren.
|
|
—
|
Er moet een voldoende grote hoeveelheid monster worden geëxtraheerd om aan de eisen inzake gevoeligheid te voldoen.
|
4. Voorschriften voor de laboratoria
|
—
|
De laboratoria moeten de prestaties aantonen van een methode in de buurt van het betrokken concentratieniveau, bv. 0,5 maal, 1 maal en 2 maal het betrokken concentratieniveau, met een aanvaardbare variatiecoëfficiënt voor herhaalde analyse. Zie voor de bijzonderheden met betrekking tot de acceptatiecriteria punt 5.
|
|
—
|
De bepaalbaarheidsgrens voor een bevestigingsmethode dient ongeveer een vijfde van het betrokken concentratieniveau te zijn, zodat om en nabij het betrokken concentratieniveau aanvaardbare variatiecoëfficiënten worden verkregen.
|
|
—
|
Bij wijze van interne kwaliteitsborging moeten voortdurend blancobepalingen en bepalingen op verrijkte monsters of controlemonsters (bij voorkeur gecertificeerde referentiematerialen, indien beschikbaar) worden uitgevoerd.
|
|
—
|
Het met goed gevolg deelnemen aan interlaboratoriumonderzoeken ter bepaling van de geschiktheid van laboratoria is de beste manier om de bekwaamheid tot het uitvoeren van specifieke analyses aan te tonen. Succesvolle deelname aan interlaboratoriumonderzoeken voor bv. bodem- of afvalwatermonsters bewijst echter nog niet noodzakelijk dat een laboratorium ook monsters van levensmiddelen en diervoeders, waarin de verontreinigingsconcentraties lager zijn, kan analyseren. Daarom is het verplicht om steeds deel te nemen aan interlaboratoriumonderzoeken voor de gehaltebepaling van dioxinen en dioxineachtige pcb's in de betrokken matrices (levensmiddelen en diervoeders).
|
|
—
|
De laboratoria moeten door een erkende instantie die werkt volgens ISO-handleiding 58 geaccrediteerd zijn om te garanderen dat zij kwaliteitsborging op hun analyses toepassen. De laboratoria moeten geaccrediteerd zijn overeenkomstig de norm ISO/IEC/17025.
|
5. Voorschriften voor de analysemethode voor dioxinen en dioxineachtige pcb's
Basisvoorschriften voor de acceptatie van analysemethoden
|
—
|
Hoge gevoeligheid en lage aantoonbaarheidsgrenzen. Voor PCDD's en PCDF's moeten de aantoonbaarheidsgrenzen in het picogram TEQ-gebied (10-12 g) liggen in verband met de extreme toxiciteit van sommige van deze verbindingen. Het is bekend dat pcb's in hogere concentraties voorkomen dan PCDD's en PCDF's. Voor de meeste pcb-congeneren is een gevoeligheid in het nanogramgebied (10-9 g) al voldoende. Voor de bepaling van de sterker toxische dioxineachtige pcb-congeneren (met name non-ortho-gesubstitueerde congeneren) moet echter dezelfde gevoeligheid worden gehaald als voor PCDD's en PCDF's.
|
|
—
|
Hoge selectiviteit (specificiteit). PCDD's, PCDF's en dioxineachtige pcb's moeten kunnen worden onderscheiden van tal van andere stoffen die ook worden geëxtraheerd en de bepaling kunnen storen, en die aanwezig zijn in concentraties die enkele orden van grootte hoger kunnen liggen dan de concentraties van de te bepalen analyten. Bij gaschromatografie-massaspectrometriemethoden (GC/MS) moet onderscheid kunnen worden gemaakt tussen de verschillende congeneren, bv. tussen toxische congeneren (zoals de zeventien 2,3,7,8-gesubstitueerde PCDD's en PCDF's en dioxineachtige pcb's) en andere congeneren. Met bioassays kunnen de TEQ-waarden selectief als de som van PCDD's, PCDF's en dioxineachtige pcb's worden bepaald.
|
|
—
|
Grote nauwkeurigheid (juistheid en precisie). De bepaling moet een valide en betrouwbare schatting van de werkelijke concentratie in een monster opleveren. Grote nauwkeurigheid (nauwkeurigheid van de meting: de mate van overeenstemming tussen het meetresultaat en de werkelijke of toegekende waarde van de te meten grootheid) is vereist om afwijzing van een analyse-uitkomst van een monster op grond van de geringe betrouwbaarheid van de raming van de TEQ's te voorkomen. De nauwkeurigheid wordt uitgedrukt als juistheid (verschil tussen de gemiddelde waarde die is gemeten voor een analyt in een gecertificeerd referentiemateriaal en zijn gecertificeerde waarde, uitgedrukt als percentage van deze laatste waarde) en precisie (RSDR: de relatieve standaardafwijking, berekend op basis van resultaten die onder reproduceerbaarheidsomstandigheden zijn verkregen).
|
Tot de screeningsmethoden behoren bioassays en GC/MS-methoden; als bevestigingsmethoden worden hogeresolutiegaschromatografie/hogeresolutiemassaspectrometriemethoden (HRGC/HRMS) gebruikt.
Bij de totale TEQ-waarde moet aan de volgende criteria voldaan worden:
|
|
Screeningsmethoden
|
Bevestigingsmethoden
|
|
Percentage fout-negatieve uitslagen
|
< 1 %
|
|
|
Juistheid
|
|
- 20 % tot + 20 %
|
|
Precisie RSDR
|
< 30 %
|
< 15 %
|
6. Specifieke voorschriften voor screenings- en bevestigingsmethoden (GC/MS)
|
—
|
Aan het begin van de analyseprocedure, bijvoorbeeld vóór de extractie, moeten 13C-gelabelde 2,3,7,8-chloorgesubstitueerde interne PCDD/F-standaarden en 13C-gelabelde interne dioxineachtige pcb-standaarden worden toegevoegd om de analysemethode te valideren. Er moet ten minste één congeneer voor elk van de tetra- tot octagechloreerde homologe groepen voor PCDD/F's en ten minste één congeneer voor elk van de homologe groepen voor dioxineachtige pcb's worden toegevoegd (een andere mogelijkheid is het toevoegen van ten minste één congeneer voor elke voor de bepaling van PCDD/F's en dioxineachtige pcb's gebruikte functie voor meting van massaspectrometrisch geselecteerde ionen). Er is een duidelijke voorkeur, zeker in het geval van bevestigingsmethoden, voor het gebruik van alle zeventien 13C-gelabelde 2,3,7,8-gesubstitueerde interne PCDD/F-standaarden en alle twaalf 13C-gelabelde interne dioxineachtige PCB-standaarden.
|
|
—
|
De relatieve responsfactoren moeten ook worden bepaald voor congeneren waarvoor geen 13C-gelabeld analogon is toegevoegd onder gebruikmaking van geschikte ijkoplossingen.
|
|
—
|
In geval van diervoeders van plantaardige oorsprong en diervoeders van dierlijke oorsprong die minder dan 10 % vet bevatten, moeten de interne standaarden vóór de extractie worden toegevoegd. Bij diervoeders van dierlijke oorsprong die meer dan 10 % vet bevatten, kunnen de interne standaarden hetzij vóór de extractie worden toegevoegd, hetzij na de vetextractie. Er moet een geschikte validatie van de extractie-efficiëntie worden uitgevoerd, afhankelijk van het stadium waarin interne standaarden worden geïntroduceerd en van de vraag of de resultaten op product- of vetbasis worden weergegeven.
|
|
—
|
Voordat de GC/MS-analyse wordt uitgevoerd, moeten een of twee standaarden (surrogaten) worden toegevoegd ter bepaling van de terugvinding.
|
|
—
|
Bepaling van de terugvinding is noodzakelijk. Voor bevestigingsmethoden moet de terugvinding van de verschillende interne standaarden tussen 60 en 120 % liggen. Lagere of hogere terugvindingspercentages voor bepaalde congeneren, met name voor sommige hepta- en octagechloreerde dibenzodioxinen en dibenzofuranen, kunnen worden geaccepteerd mits hun bijdrage tot de TEQ-waarde niet meer dan 10 % van de totale TEQ-waarde (gebaseerd op de som van PCDD/F's en dioxineachtige pcb's) bedraagt. Voor screeningsmethoden moet de terugvinding tussen de 30 en 140 % liggen.
|
|
—
|
De dioxinen moeten met geschikte chromatografische technieken worden gescheiden van storende chloorverbindingen zoals niet-dioxineachtige pcb's en gechloreerde difenylethers (bij voorkeur met behulp van een florisil-, aluminiumoxide- en/of koolstofkolom).
|
|
—
|
De gaschromatografische scheiding van de isomeren moet voldoende zijn (< 25 % piek-piek tussen 1,2,3,4,7,8-HxCDF en 1,2,3,6,7,8-HxCDF).
|
|
—
|
De bepaling dient te gebeuren volgens EPA Method 1613 revision B: „Tetra-through octa-chlorinated dioxins and furans by isotope dilution HRGC/HRMS” of een methode met gelijkwaardige prestatiecriteria.
|
|
—
|
Het verschil tussen de boven- en de ondergrens mag niet meer dan 20 % bedragen voor diervoeders met een dioxineverontreiniging in de buurt van of boven het maximumniveau. Voor diervoeders waarvan het gehalte aan verontreinigingen ver boven het maximumgehalte ligt, mag het verschil tussen 25 en 40 % liggen.
|
7. Screeningsmethoden
7.1. Inleiding
Er kunnen verschillende benaderingen worden gevolgd voor de screeningsmethode: een echte screening en een kwantitatieve benadering.
Screening
De respons van de monsters wordt vergeleken met die van een referentiemonster op het betrokken concentratieniveau. Monsters die een kleinere respons vertonen dan het referentiemonster worden als negatief aangemerkt, monsters met een grotere respons als verdacht positief. Eisen:
|
—
|
In elke testreeks moeten een blanco en een of meer referentiemonsters worden meegenomen, die op hetzelfde moment onder identieke omstandigheden worden geëxtraheerd en onderzocht. Het referentiemonster moet een duidelijk verhoogde respons te zien geven in vergelijking met een blanco.
|
|
—
|
Er moeten extra referentiemonsters met een concentratie van 0,5 maal en 2 maal het betrokken concentratieniveau worden onderzocht om aan te tonen dat de test in het voor de controle van het betrokken concentratieniveau relevante concentratiebereik voldoet.
|
|
—
|
Bij het onderzoeken van andere matrices moet nagegaan worden of de referentiemonsters geschikt zijn, bij voorkeur door monsters te onderzoeken waarvan met HRGC/HRMS is aangetoond dat zij een TEQ-waarde van ongeveer die dat van het referentiemonster hebben, dan wel een tot die concentratie verrijkt blancomonster.
|
|
—
|
Aangezien er bij bioassays geen interne standaarden kunnen worden gebruikt, zijn herhaalbaarheidstests van groot belang om gegevens te verkrijgen over de standaardafwijking binnen één testreeks. De variatiecoëfficiënt moet kleiner dan 30 % zijn.
|
|
—
|
Voor bioassays moeten de doelverbindingen, de mogelijke storingen en de maximaal toelaatbare blancowaarden worden vastgesteld.
|
Kwantitatieve benadering
Voor de kwantitatieve benadering zijn standaardverdunningsreeksen, clean-up en bepaling in duplo of triplo, alsmede blanco- en terugvindingsbepalingen nodig. Het resultaat kan worden uitgedrukt als TEQ, waarbij wordt aangenomen dat de verbindingen die het signaal geven aan het TEQ-principe voldoen. Dit kan worden gedaan door met TCDD (of een standaardmengsel dioxinen/furanen/dioxineachtige pcb's) een ijkgrafiek te maken om het TEQ-gehalte in het extract en dus in het monster te berekenen. Dit wordt vervolgens gecorrigeerd voor het TEQ-gehalte dat voor een blancomonster is berekend (om te corrigeren voor onzuiverheden afkomstig van de gebruikte oplosmiddelen en chemicaliën) en de terugvinding (berekend uit het TEQ-gehalte in een kwaliteitscontrolemonster met een concentratie omstreeks het betrokken concentratieniveau). Het schijnbare verlies in de terugvinding kan ten dele te wijten zijn aan matrixeffecten en/of verschillen tussen de TEF-waarden in de bioassays en de officiële TEF-waarden die door de Wereldgezondheidsorganisatie zijn vastgesteld.
7.2. Voorschriften voor screeningsmethoden
|
—
|
Voor screening kunnen GC/MS-methoden en bioassays worden gebruikt. Voor GC/MS-methoden moeten de in punt 6 beschreven voorschriften worden gebruikt. Voor bioassays op basis van cellen zijn specifieke voorschriften vastgelegd in punt 7.3 en voor bioassays op basis van kits in punt 7.4.
|
|
—
|
Er moet informatie beschikbaar zijn over het aantal fout-positieve en fout-negatieve uitslagen in een groot aantal monsters onder en boven het maximumniveau of actieniveau in vergelijking met het TEQ-gehalte dat met een bevestigingsmethode is bepaald. Het werkelijke percentage fout-negatieve uitslagen moet kleiner dan 1 % zijn. Het percentage fout-positieve monsters moet zo klein zijn dat gebruik als screeningstest zinvol is.
|
|
—
|
Positieve resultaten moeten altijd door middel van een bevestigingsmethode (HRGC/HRMS) bevestigd worden. Daarnaast moeten monsters uit een groot TEQ-bereik worden bevestigd met HRGC/HRMS (ongeveer 2-10 % van de negatieve monsters). Er moet informatie over de overeenstemming tussen de bioassay- en HRGC/HRMS-resultaten worden verstrekt.
|
7.3. Specifieke voorschriften voor bioassays op basis van cellen
|
—
|
Bij het uitvoeren van een bioassay is voor elke testrun een reeks referentieconcentraties van TCDD of een dioxine/furanenmengsel vereist (volledige dosis-responscurve met R2 > 0,95). Voor screeningsdoeleinden kan echter ook een gedetailleerdere curve voor het lageconcentratiebereik worden gebruikt voor het analyseren van monsters met een laag gehalte.
|
|
—
|
Voor het resultaat van de bioassay over een constant tijdsinterval moet een TCDD-referentieconcentratie (ongeveer driemaal de bepaalbaarheidsgrens) op een kwaliteitscontroleformulier worden gebruikt. Een andere mogelijkheid is de relatieve respons van een referentiemonster ten opzichte van de TCDD-ijkgrafiek, aangezien de respons van de cellen van tal van factoren kan afhangen.
|
|
—
|
Voor elk soort referentiemateriaal moeten kwaliteitscontrolekaarten worden bijgehouden en gecontroleerd om na te gaan of het resultaat in overeenstemming is met de aangegeven richtsnoeren.
|
|
—
|
Met name voor kwantitatieve berekeningen moet de inductie van de gebruikte monsterverdunning in het lineaire gebied van de ijkgrafiek liggen. Monsters die boven het lineaire gebied van de ijkgrafiek liggen, moeten worden verdund en opnieuw worden gemeten. Aanbevolen wordt om telkens ten minste drie verdunningen te meten.
|
|
—
|
De standaardafwijking mag voor een triplobepaling bij elke monsterverdunning niet meer zijn dan 15 % en bij drie onafhankelijke experimenten niet meer dan 30 %.
|
|
—
|
De aantoonbaarheidsgrens kan worden gesteld op driemaal de standaardafwijking van de oplosmiddelblanco of het achtergrondniveau. Een andere mogelijkheid is hiervoor de concentratie te nemen die in de ijkgrafiek van de testdag overeenkomt met een respons die boven de achtergrond ligt (een inductie van vijfmaal de respons van de oplosmiddelblanco). De bepaalbaarheidsgrens kan worden gesteld op vijf- tot zesmaal de standaardafwijking van de oplosmiddelblanco of het achtergrondniveau; ook kan hiervoor de concentratie worden genomen die in de ijkgrafiek van de testdag overeenkomt met een respons die duidelijk boven de achtergrond ligt (een inductie van tienmaal de respons van de oplosmiddelblanco).
|
7.4. Specifieke voorschriften voor bioassays op basis van kits
|
—
|
Er dient voor te worden gezorgd dat de bioassays op basis van kits gevoelig en betrouwbaar genoeg zijn om te worden gebruikt bij diervoeders.
|
|
—
|
De aanwijzingen van de fabrikant voor de monstervoorbereiding en de analyses moeten worden opgevolgd.
|
|
—
|
Testkits waarvan de houdbaarheidsdatum is verstreken, mogen niet worden gebruikt.
|
|
—
|
Materiaal of componenten die bedoeld zijn voor andere kits, mogen niet worden gebruikt.
|
|
—
|
De testkits moeten worden opgeslagen binnen het aangegeven temperatuurbereik en worden gebruikt bij de aangegeven gebruikstemperatuur.
|
|
—
|
De aantoonbaarheidsgrens voor een immunoassay wordt bepaald als de som van het gemiddelde en driemaal de standaardafwijking, verkregen uit tien blancoanalyses, gedeeld door de helling van de lineaire regressievergelijking.
|
|
—
|
In het laboratorium moeten proeven worden uitgevoerd op referentiestandaarden om na te gaan of de respons van de standaard in de test in een aanvaardbaar bereik ligt.
|
8. Weergave van de resultaten
Voor zover de gebruikte analyseprocedure dit toelaat, moeten de analyseresultaten de concentraties van de afzonderlijke PCDD/F- en pcb-congeneren omvatten en worden gerapporteerd als „ondergrens”, „bovengrens” en „middelwaarde” teneinde voldoende details te verstrekken om de resultaten al naar de gestelde eisen te kunnen interpreteren.
Het verslag moet ook het vetgehalte van het monster en de voor vetextractie gehanteerde methode vermelden.
De terugvindingspercentages van de verschillende interne standaarden moeten worden aangegeven ingeval de terugvindingspercentage buiten het in punt 6 aangegeven bereik liggen, wanneer het maximumniveau wordt overschreden en in de overige gevallen op verzoek.
Daar de meetonzekerheid bij de beslissing of het monster aan de eisen voldoet, in aanmerking moet worden genomen, moet deze parameter ook worden aangegeven. Derhalve dienen de analyseresultaten te worden vermeld als „x ± U”, waarbij x het analyseresultaat is en U de uitgebreide meetonzekerheid, met een dekkingsfactor 2, zodat een betrouwbaarheidsniveau van ongeveer 95 % wordt verkregen. Bij een afzonderlijke bepaling van dioxinen en dioxineachtige pcb's moet de som van de geschatte uitgebreide onzekerheid van de afzonderlijke analyseresultaten van dioxinen en dioxineachtige pcb's worden gebruikt voor de som van dioxinen en dioxineachtige pcb's.
Als de meetonzekerheid door de toepassing van CCα (zie punt I.2) in aanmerking wordt genomen, dient deze parameter te worden aangegeven.
(1) Tabel van toxische-equivalentiefactoren (TEF's) voor dioxinen, furanen en dioxineachtige pcb's:
|
Congeneer
|
TEF-waarde
|
Congeneer
|
TEF-waarde
|
|
Dibenzo-p-dioxinen („PCDD's”)
|
|
„Dioxineachtige” pcb's:
|
|
|
2,3,7,8-TCDD
|
1
|
|
|
|
1,2,3,7,8-PeCDD
|
1
|
Non-ortho-pcb's
|
|
|
1,2,3,4,7,8-HxCDD
|
0,1
|
PCB 77
|
0,0001
|
|
1,2,3,6,7,8-HxCDD
|
0,1
|
PCB 81
|
0,0001
|
|
1,2,3,7,8,9-HxCDD
|
0,1
|
PCB 126
|
0,1
|
|
1,2,3,4,6,7,8-HpCDD
|
0,01
|
PCB 169
|
0,01
|
|
OCDD
|
0,0001
|
Mono-ortho-pcb's
|
|
|
|
|
PCB 105
|
0,0001
|
|
Dibenzofuranen („PCDFs”)
|
|
PCB 114
|
0,0005
|
|
2,3,7,8-TCDF
|
0,1
|
PCB 118
|
0,0001
|
|
1,2,3,7,8-PeCDF
|
0,05
|
PCB 123
|
0,0001
|
|
2,3,4,7,8-PeCDF
|
0,5
|
PCB 156
|
0,0005
|
|
1,2,3,4,7,8-HxCDF
|
0,1
|
PCB 157
|
0,0005
|
|
1,2,3,6,7,8-HxCDF
|
0,1
|
PCB 167
|
0,00001
|
|
1,2,3,7,8,9-HxCDF
|
0,1
|
PCB 189
|
0,0001
|
|
2,3,4,6,7,8-HxCDF
|
0,1
|
|
|
|
1,2,3,4,6,7,8-HpCDF
|
0,01
|
|
|
|
1,2,3,4,7,8,9-HpCDF
|
0,01
|
|
|
|
OCDF
|
0,0001
|
|
|
|
Gebruikte afkortingen: „T” = tetra; „Pe” = penta; „Hx” = hexa; „Hp” = hepta; „O” = octa; „CDD” = chloordibenzo-p-dioxine; „CDF” = chloordibenzofuran; „CB” = chloorbifenyl.
|
(2) PB L 140 van 30.5.2002, blz. 10.
(3) De duplobepaling is noodzakelijk om de mogelijkheid van interne kruisverontreiniging of een onbedoelde verwisseling van monsters uit te sluiten. De eerste bepaling, waarbij de meetonzekerheid in aanmerking wordt genomen, wordt gebruikt voor de controle op de naleving.
Indien de analyse wordt gedaan in verband met een incident met dioxineverontreiniging, kan de bevestiging door middel van de duplobepaling komen te vervallen als de voor de analyse geselecteerde monsters via traceerbaarheid terug te voeren zijn op dat incident.
(4) Om de bovengrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer aan de TEQ (toxisch equivalent) gelijkgesteld aan de bepaalbaarheidsgrens. Om de ondergrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer aan de TEQ gelijkgesteld aan nul.
Om de middelwaarde te berekenen wordt de bijdrage van elke niet-bepaalde congeneer aan de TEQ gelijkgesteld aan de helft van de bepaalbaarheidsgrens.
(5) PB L 221 van 17.8.2002, blz. 8.
BIJLAGE VI
ANALYSEMETHODEN VOOR DE BEPALING VAN BESTANDDELEN VAN DIERLIJKE OORSPRONG IN HET KADER VAN DE OFFICIËLE CONTROLE OP DIERVOEDERS
Voorschriften voor de microscopische detectie en identificatie van, en de schatting van het gehalte aan, bestanddelen van dierlijke oorsprong in diervoeders
1. Doel en toepassingsgebied
Deze voorschriften worden gebruikt voor het opsporen van bestanddelen van dierlijke oorsprong (gedefinieerd als producten verkregen door verwerking van karkassen en delen van karkassen van zoogdieren, pluimvee en vis) in diervoeders aan de hand van microscopisch onderzoek in het kader van het gecoördineerde inspectieprogramma op het gebied van diervoeding krachtens Verordening (EG) nr. 882/2004 van het Europees Parlement en de Raad (1). Op voorwaarde dat de methoden van deze bijlage voor alle officiële tests worden gebruikt, kan ook een tweede test worden uitgevoerd met afwijkende of alternatieve methoden, om de opsporing van bepaalde soorten dierlijke bestanddelen te verbeteren of de herkomst van de dierlijke bestanddelen nader te bepalen. Ook kan een afwijkend protocol worden gebruikt bij het onderzoek van bepaalde specifieke dierlijke bestanddelen zoals plasma of bot in talg (zie ook punt 9), mits die analyses worden uitgevoerd naast de in het gecoördineerde inspectieprogramma voorgeschreven analyses.
2. Gevoeligheid
Afhankelijk van de aard van de bestanddelen van dierlijke oorsprong kunnen zeer geringe hoeveelheden (minder dan 0,1 %) in diervoeders worden aangetoond.
3. Beginsel
Voor de identificatie wordt een representatief monster gebruikt, dat is genomen overeenkomstig bijlage I en op adequate wijze is voorbereid. Het navolgende protocol is geschikt voor diervoeders met een laag vochtgehalte. Diervoeders met een hoger vochtgehalte dan 14 % worden vóór behandeling gedroogd (gecondenseerd). Voor bepaalde diervoeders of voedermiddelen (bv. vetten, oliën) is een speciale behandeling nodig (zie punt 9). De bestanddelen van dierlijke oorsprong worden geïdentificeerd op basis van typische microscopisch identificeerbare kenmerken (spierweefsel en andere vleesdeeltjes, kraakbeen, beenderen, hoorn, haar, bloed, veren, eierschalen, visgraten, schubben). Identificatie vindt plaats aan de hand van zowel de zeeffracties (punt 6.1) als het geconcentreerde sediment (punt 6.2) van het monster.
4. Reagentia
4.1. Inbedmedia
|
4.1.1.
|
Chloraalhydraat (60 % in water, m/V).
|
|
4.1.2.
|
Loog (NaOH 2,5 % m/V of KOH 2,5 % m/V) voor de zeeffracties.
|
|
4.1.3.
|
Paraffineolie of glycerol (viscositeit 68-81) voor microscopische waarneming in het sediment.
|
4.2. Wasvloeistoffen
4.3. Sedimentatievloeistof
|
4.3.1.
|
Tetrachloorethyleen (d = 1,62).
|
4.4. Kleurstoffen
|
4.4.1.
|
Jood-kaliumjodideoplossing (los 2 g kaliumjodide op in 100 ml water en voeg onder geregeld schudden 1 g jood toe).
|
|
4.4.2.
|
Alizarinerood (verdun 2,5 ml zoutzuur 1 M in 100 ml water en voeg hieraan 200 mg alizarinerood toe).
|
|
4.4.3.
|
Cystinereagens (2 g loodacetaat, 10 g NaOH/100 ml H2O).
|
|
4.4.4.
|
Jood-kaliumjodideoplossing (opgelost in ethanol 70 %).
|
4.5. Bleekmiddel
|
4.5.1
|
Natriumhypochlorietoplossing, in handelskwaliteit (9,6 % actief chloor).
|
5. Uitrusting
|
5.1.
|
Analytische balans (nauwkeurigheid 0,01 g, voor het geconcentreerde sediment 0,001 g).
|
|
5.2.
|
Verkleiningsapparatuur (maalmolen of vijzel, met name voor voeder dat bij de analyse meer dan 15 % vet bevat).
|
|
5.3.
|
Zeefstel, voorzien van zeefgaas met vierkante mazen van maximaal 0,50 mm maaswijdte.
|
|
5.4.
|
Scheitrechter of imhoffglas.
|
|
5.5.
|
Stereomicroscoop (vergroting minimaal 40×).
|
|
5.6.
|
Samengestelde microscoop (vergroting minimaal 400×), doorvallend licht of gepolariseerd licht.
|
|
5.7.
|
Gebruikelijk laboratoriumglaswerk.
Alle uitrusting moet grondig gereinigd zijn. Scheitrechters en glaswerk moeten in een reinigingsmachine gereinigd worden. De zeven moeten met een hardharige borstel gereinigd worden.
|
6. Werkwijze
Voeder in pellets kan voorgezeefd worden als beide fracties afzonderlijk geanalyseerd worden.
Ga uit van ten minste 50 g monster (zo nodig na zorgvuldig malen met geschikte verkleiningsapparatuur (5.2) om een juiste structuur te krijgen). Neem van het gemalen materiaal twee representatieve porties, een voor de zeeffracties (minimaal 5 g) (6.1) en een voor het geconcentreerde sediment (minimaal 5 g) (6.2). Met het oog op de identificatie kan gebruikgemaakt worden van kleurstoffen (6.3).
Om de aard van de dierlijke eiwitten en de herkomst van de deeltjes aan te geven kan gebruikgemaakt worden van een beslissingsondersteunend systeem zoals ARIES en van referentiemonsters.
6.1. Identificatie van de bestanddelen van dierlijke oorsprong in de zeeffracties
Zeef ten minste 5 g van het monster met het zeefstel (5.3) in twee fracties.
De zeeffractie(s) met de grove deeltjes (of een representatief deel daarvan) wordt/worden als dunne laag op een geschikte drager aangebracht en wordt/worden onder de stereomicroscoop (punt 5.5) bij diverse vergrotingen onderzocht op bestanddelen van dierlijke oorsprong.
Met de zeeffractie(s) met de fijne deeltjes worden preparaten gemaakt die onder de samengestelde microscoop (punt 5.6) bij diverse vergrotingen worden onderzocht op bestanddelen van dierlijke oorsprong.
6.2. Identificatie van de bestanddelen van dierlijke oorsprong in het geconcentreerde sediment
Breng ten minste 5 g monster (tot op 0,01 g nauwkeurig afgewogen) in een scheitrechter of imhoffglas en voeg ten minste 50 ml tetrachloorethyleen (punt 4.3.1) toe. Schud of roer het mengsel een aantal malen.
|
—
|
Laat bij gebruik van een gesloten scheitrechter het mengsel enige tijd (ten minste 3 minuten) staan en scheid vervolgens het sediment af. Herhaal het schudden en laat het sediment daarna ten minste 3 minuten staan. Scheid het sediment nogmaals af.
|
|
—
|
Laat bij gebruik van een open imhoffglas het mengsel ten minste 5 minuten staan en scheid vervolgens het sediment af.
|
Het volledige sediment wordt gedroogd en vervolgens gewogen (tot op 0,001 g nauwkeurig). Wegen is alleen nodig wanneer een schatting vereist is. Wanneer het sediment veel grove deeltjes bevat, kan het met een zeefstel (punt 5.3) in twee fracties worden verdeeld. Het droge sediment wordt onder de stereomicroscoop (punt 5.5) en de samengestelde microscoop (punt 5.6) onderzocht op botbestanddelen.
6.3. Gebruik van inbedmedia en kleurstoffen
De microscopische identificatie van de bestanddelen van dierlijke oorsprong kan worden vergemakkelijkt door gebruik te maken van speciale inbedmedia en kleurstoffen.
Chloraalhydraat (4.1.1): wanneer zorgvuldig wordt verhit, kunnen celstructuren duidelijker worden waargenomen omdat de zetmeelkorrels geleren en ongewenste celinhoud wordt verwijderd.
Loog (4.1.2): natriumhydroxide of kaliumhydroxide heldert het materiaal van het voeder op, waardoor het opsporen van spierweefsel, haar en andere keratinestructuren gemakkelijker wordt.
Paraffineolie en glycerol (4.1.3): botbestanddelen worden gemakkelijk geïdentificeerd in dit inbedmedium aangezien de meeste holten met lucht gevuld blijven en worden gezien als zwarte gaten van 5-15 μm.
Jood-kaliumjodideoplossing (4.4.1): wordt gebruikt voor het aantonen van zetmeel (blauwpaarse kleur) en eiwit (geeloranje kleur). De oplossingen kunnen zo nodig worden verdund.
Alizarineroodoplossing (4.4.2): rode/roze kleuring van beenderen, graten en schubben. Voordat het sediment wordt gedroogd (zie punt 6.2) wordt het volledige sediment overgebracht in een glazen reageerbuis en tweemaal met ongeveer 5 ml alcohol (4.2.1) gespoeld (beide keren vortexen, ongeveer een minuut laten bezinken en het oplosmiddel afschenken). Vóór gebruik van de kleurstof wordt het sediment gebleekt door toevoeging van ten minste 1 ml natriumhypochlorietoplossing (4.5.1). Laat gedurende 10 minuten reageren. Vul de reageerbuis met water, laat het sediment 2-3 minuten bezinken en schenk het water en de gesuspendeerde deeltjes af. Spoel het sediment vervolgens tweemaal met ongeveer 10 ml water (beide keren vortexen, laten bezinken en het water afschenken). Voeg 2-10 druppels alizarineroodoplossing toe, afhankelijk van de hoeveelheid residu. Schud het mengsel en laat enkele seconden reageren. Spoel het gekleurde sediment vervolgens tweemaal met ongeveer 5 ml alcohol (4.2.1) en daarna eenmaal met aceton (4.2.2) (telkens vortexen, ongeveer een minuut laten bezinken en het oplosmiddel afschenken). Hierna kan het sediment worden gedroogd.
Cystinereagens (4.4.3): wanneer zorgvuldig wordt verhit, worden de cystine-bevattende bestanddelen (haar, veren enz.) zwartbruin.
6.4. Onderzoek van diervoeders die vismeel kunnen bevatten
Ten minste één preparaat van de fijne zeeffractie en van de fijne fractie van het sediment wordt onder de samengestelde microscoop onderzocht (punten 6.1 en 6.2).
Wanneer vismeel volgens het etiket een van de ingrediënten is of in het eerste onderzoek wordt vermoed of geconstateerd dat vismeel aanwezig is, worden ten minste nog twee preparaten van de fijne zeeffractie van het oorspronkelijke monster alsmede de volledige sedimentfractie onderzocht.
7. Berekening en evaluatie
De lidstaten zorgen ervoor dat de in dit punt beschreven procedures worden gevolgd bij de officiële analyse met het oog op de schatting van het gehalte aan (en niet slechts de aanwezigheid van) dierlijke bestanddelen.
De berekening kan alleen worden gemaakt indien de bestanddelen van dierlijke oorsprong botfragmenten bevatten.
Botfragmenten van warmbloedige landdieren (d.w.z. zoogdieren en vogels) kunnen van de verschillende soorten visgraten in het microscopisch preparaat worden onderscheiden aan de hand van de typische lacunen. Het gehalte aan bestanddelen van dierlijke oorsprong in het monster wordt geschat met inachtneming van:
|
—
|
het geschatte aandeel (massapercentage) botfragmenten in het geconcentreerde sediment en
|
|
—
|
het aandeel (massapercentage) bot in de bestanddelen van dierlijke oorsprong.
|
De schatting moet gebaseerd zijn op ten minste drie preparaten (indien mogelijk) en ten minste vijf velden per preparaat. Bij mengvoeders bevat het geconcentreerde sediment normaliter niet alleen botfragmenten van landdieren en visgraatfragmenten, maar ook andere deeltjes met een hoge soortelijke massa, bijvoorbeeld mineralen, zand, verhoute plantendeeltjes en dergelijke.
7.1. Geschatte waarde van het percentage botfragmenten
% botfragmenten van landdieren = (S × c)/W
% fragmenten van visgraten en schubben = (S × d)/W
|
(S =
|
massa van het sediment (mg), c = correctiefactor (%) voor het geschatte aandeel botbestanddelen van landdieren in het sediment, d = correctiefactor (%) voor het geschatte aandeel fragmenten van visgraten en schubben in het sediment, W = massa van het voor de sedimentatie gebruikte monstermateriaal (mg)).
|
7.2. Geschatte waarde van de bestanddelen van dierlijke oorsprong
Het aandeel bot in dierlijke producten kan aanzienlijk variëren. (Het percentage bot in beendermeel ligt in de orde van 50-60 %, in vleesmeel in de orde van 20-30 %; in vismeel varieert het gehalte aan graten en schubben naargelang van de soort en de oorsprong van het vismeel, maar normaal ligt het in de orde van 10-20 %).
Indien de aard van het in het monster aanwezige diermeel bekend is, kan het gehalte worden geschat:
Geschat gehalte aan bestanddelen afkomstig van landdieren (%) = (S × c)/(W × f) × 100
Geschat gehalte aan bestanddelen afkomstig van vis (%) = (S × d)/(W × f) × 100
|
(S =
|
massa van het sediment (mg), c = correctiefactor (%) voor het geschatte aandeel botbestanddelen van landdieren in het sediment, d = correctiefactor (%) voor het geschatte aandeel fragmenten van visgraten en schubben in het sediment, f = correctiefactor voor het aandeel bot in de bestanddelen van dierlijke oorsprong in het onderzochte monster, W = massa van het voor de sedimentatie gebruikte monstermateriaal (mg)).
|
8. Weergave van het resultaat van het onderzoek
Er moet ten minste informatie worden verstrekt over de aanwezigheid van bestanddelen afkomstig van landdieren en van vismeel. De verschillende gevallen worden als volgt gerapporteerd:
|
8.1.
|
Wat betreft de aanwezigheid van bestanddelen afkomstig van landdieren:
|
—
|
voor zover microscopisch kan worden waargenomen, bevat het onderzochte monster geen bestanddelen afkomstig van landdieren;
of
|
|
—
|
voor zover microscopisch kan worden waargenomen, bevat het onderzochte monster bestanddelen afkomstig van landdieren;
|
|
|
8.2.
|
en, wat betreft de aanwezigheid van vismeel:
|
—
|
voor zover microscopisch kan worden waargenomen, bevat het onderzochte monster geen bestanddelen afkomstig van vissen;
of
|
|
—
|
voor zover microscopisch kan worden waargenomen, bevat het onderzochte monster bestanddelen afkomstig van vissen.
|
Wanneer bestanddelen afkomstig van vissen of landdieren worden aangetroffen, kan bij de uitslag van het onderzoek zo nodig ook een schatting worden gegeven van de hoeveelheid aangetroffen bestanddelen (x %, < 0,1 %, 0,1-0,5 %, 0,5-5 % of > 5 %) en kunnen het soort landdier, zo mogelijk, en de geïdentificeerde dierlijke bestanddelen (spierweefsel, kraakbeen, beenderen, hoorn, haar, bloed, veren, eierschalen, visgraten, schubben) worden vermeld.
Ingeval een schatting van de hoeveelheid dierlijke ingrediënten wordt gegeven, moet de gehanteerde correctiefactor f worden vermeld.
Indien botbestanddelen van landdieren worden geïdentificeerd, bevat het rapport bovendien de volgende zin:
„De mogelijkheid dat de bovengenoemde bestanddelen afkomstig zijn van zoogdieren kan niet worden uitgesloten.”.
Deze zin is niet vereist indien voor de botfragmenten van landdieren is aangegeven of zij van pluimvee of van zoogdieren afkomstig zijn.
|
9. Facultatief protocol voor de analyse van vetten en oliën
Het volgende protocol kan voor de analyse van vetten en oliën worden gebruikt:
|
—
|
Verwarm vast vet, bijvoorbeeld in een microgolfoven, tot het gesmolten is.
|
|
—
|
Pipetteer 40 ml vet van het onderste gedeelte van het monster in een centrifugebuis.
|
|
—
|
Centrifugeer gedurende 10 minuten bij 4 000 omwentelingen per minuut.
|
|
—
|
Als het vet na het centrifugeren gestold is, verwarm het dan nogmaals in een oven tot het gesmolten is. Centrifugeer nogmaals gedurende 5 minuten bij 4 000 omwentelingen per minuut.
|
|
—
|
Breng de helft van de gedecanteerde verontreinigingen met een lepel of spatel over in een petrischaaltje of op een objectglaasje voor microscopische identificatie van eventuele dierlijke bestanddelen (vleesdeeltjes, veren, botfragmenten enz.). Als inbedmedium voor microscopie wordt paraffineolie of glycerol aanbevolen.
|
|
—
|
De resterende verontreinigingen worden gebruikt voor sedimentatie zoals beschreven in punt 6.2.
|
(1) PB L 165 van 30.4.2004, blz. 1; gerectificeerd in PB L 191 van 28.5.2004, blz. 1.
BIJLAGE VII
METHODE VOOR DE BEREKENING VAN DE ENERGIEWAARDE VAN MENGVOEDERS VOOR PLUIMVEE
1. Berekeningswijze en opgave van de energiewaarde
De energiewaarde van mengvoeders voor pluimvee wordt berekend volgens de volgende formule, op basis van de percentages van bepaalde analytische bestanddelen van het voeder. Deze waarde wordt uitgedrukt in megajoule (MJ) metaboliseerbare energie (ME), gecorrigeerd voor stikstof, per kilogram mengvoeder:
MJ/kg ME = 0,1551 × % ruw eiwit +0,3431 × % ruw vet +0,1669 × % zetmeel +0,1301 × % suikers totaal (uitgedrukt als sacharose).
2. Toleranties voor de opgegeven waarden
Indien bij de officiële controles een verschil wordt vastgesteld tussen het resultaat van de controle en de opgegeven energiewaarde, dus een hogere of lagere energiewaarde van het voeder, wordt een tolerantie van ten minste 0,4 MJ/kg ME toegestaan.
3. Weergave van de resultaten
Het uit formule verkregen resultaat wordt tot op één decimaal nauwkeurig opgegeven.
4. Bemonsterings- en analysemethoden
De bemonstering van het mengvoeder en de bepaling van de in de berekeningsmethode aangegeven analytische bestanddelen gebeurt volgens de communautaire bemonsterings- en analysemethoden die gelden voor de officiële controle van diervoeders.
De volgende methoden moeten worden toegepast:
|
—
|
voor de bepaling van het ruwvetgehalte: werkwijze B voor de bepaling van ruw vet, beschreven in bijlage III, deel H.
|
|
—
|
voor de bepaling van het zetmeelgehalte: de polarimetrische methode, beschreven in bijlage III, deel L.
|
BIJLAGE VIII
ANALYSEMETHODEN VOOR DE CONTROLE OP DE ILLEGALE AANWEZIGHEID VAN NIET MEER TOEGELATEN TOEVOEGINGSMIDDELEN IN DIERVOEDERS
NB:Voor de opsporing van de illegale aanwezigheid van niet meer toegelaten toevoegingsmiddelen in diervoeders mogen analysemethoden gebruikt worden die gevoeliger zijn dan de in deze bijlage beschreven methoden.De in deze bijlage beschreven methoden moeten ter bevestiging worden gebruikt.
A. BEPALING VAN METHYLBENZOQUAAT
7-benzyloxy-6-butyl-3-methoxycarbonyl-4-chinolon
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan methylbenzoquaat in diervoeders. De bepaalbaarheidsgrens is 1 mg/kg.
2. Beginsel
Methylbenzoquaat wordt uit het monster geëxtraheerd met een oplossing van methaansulfonzuur in methanol. Het extract wordt gezuiverd met dichloormethaan, door middel van ionenwisselingschromatografie en daarna nogmaals met dichloormethaan. Het gehalte aan methylbenzoquaat wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.2.
|
Methanol, HPLC-kwaliteit of gelijkwaardig.
|
|
3.3.
|
Mobiele fase voor HPLC.
Mengsel van methanol (3.2) en water (HPLC-kwaliteit) 75 + 25 (V + V).
Filtreer door een filter van 0,22 μm (4.5) en ontgas de oplossing (bv. door 10 minuten ultrasoonbehandeling).
|
|
3.4.
|
Verdund methaansulfonzuur, c = 2 %.
Verdun 20,0 ml methaansulfonzuur met methanol (3.2) tot 1 000 ml.
|
|
3.5.
|
Verdund zoutzuur, c = 10 %.
Verdun 100 ml zoutzuur (ρ20 = 1,18 g/ml) met water tot 1 000 ml.
|
|
3.6.
|
Kationenwisselingshars Amberlite CG-120 (Na), 100-200 mesh.
De hars wordt vóór gebruik voorbehandeld. Suspendeer 100 g hars in 500 ml zoutzuur (3.5) en breng het mengsel op een kookplaat onder voortdurend roeren aan de kook. Laat het mengsel afkoelen en decanteer het zuur. Filtreer de rest onder vacuüm door filtreerpapier. Was de hars tweemaal met telkens 500 ml water en vervolgens met 250 ml methanol (3.2). Spoel de hars met nog eens 250 ml methanol (3.2) en droog de filterkoek door overleiden van lucht. Bewaar de gedroogde hars in een afgesloten fles.
|
|
3.7.
|
Standaardstof: zuiver methylbenzoquaat (7-benzyloxy-6-butyl-3-methoxycarbonyl-4-chinolon)
|
|
3.7.1.
|
Methylbenzoquaat-stamoplossing, 500 μg/ml
Weeg 50 mg standaardstof (3.7) tot op 0,1 mg nauwkeurig af, los dit in een maatkolf van 100 ml op in verdund methaansulfonzuur (3.4), vul aan tot de streep en meng.
|
|
3.7.2.
|
Methylbenzoquaat-werkoplossing, 50 μg/ml
Breng 5,0 ml methylbenzoquaat-stamoplossing (3.7.1) over in een maatkolf van 50 ml, vul aan tot de streep met methanol (3.2) en meng.
|
|
3.7.3.
|
IJkoplossingen
Breng in een reeks maatkolven van 25 ml respectievelijk 1,0, 2,0, 3,0, 4,0 en 5,0 ml methylbenzoquaat-werkoplossing (3.7.2). Vul aan tot de streep met mobiele fase (3.3) en meng. Deze oplossingen hebben concentraties van respectievelijk 2,0, 4,0, 6,0, 8,0 en 10,0 μg/ml methylbenzoquaat. Deze oplossingen moeten vóór gebruik vers worden bereid.
|
4. Apparatuur
|
4.3.
|
Glazen kolom (250 mm × 15 mm), voorzien van een kraan en een reservoir van ongeveer 200 ml inhoud.
|
|
4.4.
|
HPLC-apparatuur met uv-detector met variabele golflengte of diode-arraydetector.
|
|
4.4.1.
|
HPLC-kolom: 300 mm × 4 mm, C18, vulling van 10 μm, of een gelijkwaardige kolom.
|
|
4.5.
|
Membraanfilter, 0,22 μm.
|
|
4.6.
|
Membraanfilter, 0,45 μm.
|
5. Werkwijze
5.1. Algemeen
|
5.1.1.
|
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen methylbenzoquaat of storende stoffen aanwezig zijn.
|
|
5.1.2.
|
De terugvinding moet bepaald worden door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid methylbenzoquaat is toegevoegd als aanwezig in het monster. Voeg voor een gehalte van 15 mg/kg aan 20 g blanco diervoeder 600 μl stamoplossing (3.7.1) toe, meng en wacht 10 minuten alvorens de extractiestap (5.2) uit te voeren.
Voor de toepassing van deze methode moet het blanco diervoeder van vergelijkbare soort te zijn als het monster en mag hierin bij analyse geen methylbenzoquaat aantoonbaar zijn.
|
5.2. Extractie
Weeg ongeveer 20 g van het voorbewerkte monster tot op 0,01 g nauwkeurig af en breng het over in een erlenmeyer van 250 ml. Voeg 100,0 ml verdund methaansulfonzuur (3.4) toe en schud 30 minuten (4.1). Filtreer de oplossing door filtreerpapier en bewaar het filtraat voor de vloeistof-vloeistofverdelingsstap (5.3).
5.3. Vloeistof-vloeistofverdeling
Breng 25,0 ml van het bij 5.2 verkregen filtraat over in een scheitrechter van 500 ml die 100 ml zoutzuur (3.5) bevat. Voeg 100 ml dichloormethaan (3.1) in de scheitrechter toe en schud 1 minuut. Wacht tot de fasen gescheiden zijn en laat de onderste laag (dichloormethaan) in een rondbodemkolf van 500 ml lopen. Herhaal de extractie van de waterfase met nog twee porties dichloormethaan van 40 ml en voeg de extracten bij het eerste extract in de rondbodemkolf. Damp het dichloormethaanextract droog met de rotatieverdamper (4.2) bij 40 oC onder verminderde druk. Neem het residu op in 20-25 ml methanol (3.2), sluit de kolf af met een stop en bewaar het gehele extract voor ionenwisselingschromatografie (5.4).
5.4. Ionenwisselingschromatografie
5.4.1. Bereiding van de kationenwisselingskolom
Doe een propje glaswol onder in een glazen kolom (4.3). Maak een suspensie van 5,0 g van de behandelde kationenwisselingshars (3.6) met 50 ml zoutzuur (3.5), giet de suspensie in de glazen kolom en laat de hars bezinken. Laat de overmaat zuur tot net boven het oppervlak van de hars weglopen en spoel de kolom met water tot het afgetapte water met lakmoes neutraal reageert. Breng 50 ml methanol (3.2) op de kolom en laat deze doorlopen tot het oppervlak van de hars.
5.4.2. Kolomchromatografie
Breng het bij 5.3 verkregen extract met een pipet voorzichtig op de kolom. Spoel de rondbodemkolf met twee porties van 5-10 ml methanol (3.2) en breng de spoelvloeistof ook telkens op de kolom. Laat het extract tot het oppervlak van de hars doorlopen en spoel de kolom met 50 ml methanol (3.2), zodanig dat de elutiesnelheid niet meer dan 5 ml/minuut bedraagt. Doe de doorgelopen vloeistof weg. Elueer het methylbenzoquaat met 150 ml verdund methaansulfonzuur (3.4) van de kolom en vang het eluaat op in een erlenmeyer van 250 ml.
5.5. Vloeistof-vloeistofverdeling
Breng het bij 5.4.2 verkregen eluaat over in een scheitrechter van 1 liter. Spoel de erlenmeyer met 5-10 ml methanol (3.2) en voeg de spoelvloeistof toe aan de inhoud van de scheitrechter. Voeg 300 ml zoutzuur (3.5) en 130 ml dichloormethaan (3.1) toe. Schud 1 minuut en wacht tot de fasen gescheiden zijn. Laat de onderste laag (dichloormethaan) in een rondbodemkolf van 500 ml lopen. Herhaal de extractie van de waterfase met nog twee porties van 70 ml dichloormethaan en voeg deze extracten bij het eerste extract in de rondbodemkolf.
Damp het dichloormethaanextract droog met de rotatieverdamper (4.2) bij 40 oC onder verminderde druk. Neem het residu in de kolf op in ongeveer 5 ml methanol (3.2) en breng deze oplossing kwantitatief over in een maatkolf van 10 ml. Spoel de rondbodemkolf na met nog twee porties van 1-2 ml methanol en breng deze in de maatkolf over. Vul aan tot de streep met methanol en meng. Een aliquot wordt door een membraanfilter (4.6) gefiltreerd. Gebruik deze gefiltreerde oplossing voor de HPLC-bepaling (5.6).
5.6. HPLC-bepaling
5.6.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen.
|
—
|
mobiele fase voor HPLC: methanol-watermengsel (3.3);
|
|
—
|
elutiesnelheid: 1-1,5 ml/minuut;
|
|
—
|
detectiegolflengte: 265 nm;
|
|
—
|
injectievolume: 20-50 μl.
|
Controleer de stabiliteit van het chromatografiesysteem door enige malen de ijkoplossing (3.7.2) met 4 μg/ml te injecteren totdat constante piekhoogten (-oppervlakten) en retentietijden worden verkregen.
5.6.2. IJkgrafiek
Injecteer elke ijkoplossing (3.7.3) enkele malen en meet voor elke concentratie de piekhoogten (-oppervlakten). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.6.3. Monsteroplossing
Injecteer het monsterextract (5.5) enige malen waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt; bepaal de gemiddelde piekhoogte (-oppervlakte) van de methylbenzoquaatpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de methylbenzoquaatpieken van de monsteroplossing aan de hand van de ijkgrafiek (5.6.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan methylbenzoquaat w (mg/kg) van het monster wordt verkregen met de volgende formule:

waarbij:
|
c
|
=
|
concentratie methylbenzoquaat van de monsteroplossing in μg/ml;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract en de ijkoplossing (3.7.3) met 10 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract een geschikte hoeveelheid van de methylbenzoquaat-werkoplossing (3.7.2) toe. De toegevoegde hoeveelheid methylbenzoquaat moet ongeveer gelijk zijn aan de geschatte hoeveelheid methylbenzoquaat in het monsterextract.
Alleen de hoogte van de methylbenzoquaatpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale hoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm;
|
|
b)
|
tussen 220 en 350 nm mogen de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de twee spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
|
|
c)
|
tussen 220 en 350 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 10 % van het hoogste resultaat voor gehalten aan methylbenzoquaat tussen 4 en 20 mg/kg.
7.3. Terugvinding
Voor het blancomonster met toevoeging moet het terugvindingspercentage ten minste 90 % bedragen.
8. Resultaten van een ringonderzoek
Vijf monsters werden door tien laboratoria onderzocht. Op elk monster werden duploanalyses uitgevoerd.
|
|
Blanco
|
Meel 1
|
Pellets 1
|
Meel 2
|
Pellets 2
|
|
gemiddelde [mg/kg]
|
NA
|
4,50
|
4,50
|
8,90
|
8,70
|
|
Sr [mg/kg]
|
—
|
0,30
|
0,20
|
0,60
|
0,50
|
|
CVr [ %]
|
—
|
6,70
|
4,40
|
6,70
|
5,70
|
|
SR [mg/kg]
|
—
|
0,40
|
0,50
|
0,90
|
1,00
|
|
CVR [ %]
|
—
|
8,90
|
11,10
|
10,10
|
11,50
|
|
terugvinding [ %]
|
—
|
92,00
|
93,00
|
92,00
|
89,00
|
|
NA
|
=
|
niet aantoonbaar;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid, in %;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid, in %.
|
B. BEPALING VAN OLAQUINDOX
2-[N
-2′-(hydroxyethyl
)carbamoyl]-3-
methylchinoxaline-N
1
,N
4
-dioxide
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan olaquindox in diervoeders. De bepaalbaarheidsgrens is 5 mg/kg.
2. Beginsel
Het monster wordt geëxtraheerd met een mengsel van methanol en water. Het gehalte aan olaquindox wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.2.
|
Methanol, HPLC-kwaliteit of gelijkwaardig.
|
|
3.3.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
|
3.4.
|
Mobiele fase voor HPLC.
Een mengsel van water (3.3) en methanol (3.2), 900 + 100 (V + V).
|
|
3.5.
|
Standaardstof: zuiver olaquindox 2-[N-2′-(hydroxyethyl)carbamoyl]-3-methylchinoxaline-N
1,N
4-dioxide, E 851.
|
|
3.5.1.
|
Olaquindox-stamoplossing, 250 μg/ml
Weeg 50 mg olaquindox (3.5) tot op 0,1 mg nauwkeurig af in een maatkolf van 200 ml en voeg ongeveer 190 ml water toe. Plaats de kolf gedurende 20 minuten in een ultrasoonbad (4.1). Koel de oplossing na de ultrasoonbehandeling af tot kamertemperatuur, vul aan tot de streep met water en meng. Wikkel de kolf in aluminiumfolie en bewaar de kolf in een koelkast. De oplossing is zo één maand houdbaar.
|
|
3.5.2.
|
Olaquindox-werkoplossing olaquindox, 25 μg/ml
Breng 10,0 ml van de stamoplossing (3.5.1) over in een maatkolf van 100 ml, vul aan tot de streep met mobiele fase (3.4) en meng. Wikkel de kolf in aluminiumfolie en bewaar de kolf in een koelkast. Deze oplossing moet dagelijks vers worden bereid.
|
|
3.5.3.
|
IJkoplossingen
Breng in een reeks maatkolven van 50 ml respectievelijk 1,0, 2,0, 5,0, 10,0, 15,0 en 20,0 ml werkoplossing (3.5.2). Vul aan tot de streep met mobiele fase (3.4) en meng. Wikkel de kolf in aluminiumfolie. Deze oplossingen komen overeen met respectievelijk 0,5, 1,0, 2,5, 5,0, 7,5 en 10,0 μg olaquindox per ml.
Deze oplossingen moeten iedere dag vers worden bereid.
|
4. Apparatuur
|
4.2.
|
Mechanisch schudapparaat.
|
|
4.3.
|
HPLC-apparatuur met uv-detector met variabele golflengte of diode-arraydetector.
|
|
4.3.1.
|
HPLC-kolom, 250 mm × 4 mm, C18, vulling van 10 μm of een gelijkwaardige kolom.
|
|
4.4.
|
Membraanfilter, 0,45 μm.
|
5. Werkwijze
|
NB:
|
Olaquindox is lichtgevoelig. Alle bewerkingen moeten bij gedempt licht of in bruin glaswerk plaatsvinden.
|
5.1. Algemeen
|
5.1.1.
|
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen olaquindox of storende stoffen aanwezig zijn.
|
|
5.1.2.
|
De terugvinding dient te worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid olaquindox is toegevoegd als aanwezig in het monster. Breng voor een gehalte van 50 mg/kg 10,0 ml stamoplossing (3.5.1) in een erlenmeyer van 250 ml en damp in tot een volume van 0,5 ml. Voeg 50 g blanco diervoeder toe, meng zorgvuldig, laat gedurende 10 minuten staan en meng vervolgens nog enige malen, alvorens de extractiestap (5.2) uit te voeren.
|
NB:
|
Voor de toepassing van deze methode moet het blanco diervoeder van vergelijkbare soort zijn als het monster en mag hierin geen olaquindox aantoonbaar zijn.
|
|
5.2. Extractie
Weeg ongeveer 50 g monster tot op 0,01 g nauwkeurig af. Breng het over in een erlenmeyer van 1 000 ml, voeg 100 ml methanol (3.1) toe en plaats de erlenmeyer 5 minuten in een ultrasoonbad (4.1). Voeg 410 ml water toe en laat nog 15 minuten in het ultrasoonbad staan. Haal de erlenmeyer uit het ultrasoonbad, plaats hem 30 minuten op het schudapparaat (4.2) en filtreer door een vouwfilter. Breng 10,0 ml filtraat in een maatkolf van 20 ml, vul aan tot de streep met water en meng. Een deel wordt door een membraanfilter (4.4) gefiltreerd (zie punt 9. Opmerking). Voer de HPLC-bepaling (5.3) uit.
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
|
HPLC-kolom (4.3.1)
|
|
|
mobiele fase (3.4):
|
mengsel van water (3.3) en methanol (3.2), 900 + 100 (V + V);
|
|
elutiesnelheid:
|
1,5-2 ml/minuut;
|
|
detectiegolflengte:
|
380 nm;
|
|
injectievolume:
|
20-100 μl.
|
Controleer de stabiliteit van het chromatografische systeem door enige malen de ijkoplossing (3.5.3) van 2,5 μg/ml te injecteren totdat constante piekhoogten en retentietijden worden verkregen.
5.3.2. IJkgrafiek
Injecteer elke ijkoplossing (3.5.3) enkele malen en meet voor elke concentratie de gemiddelde piekhoogte (-oppervlakte). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.3.3. Monsteroplossing
Injecteer het monsterextract (5.2) enige malen waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt en bepaal de gemiddelde piekhoogte (-oppervlakte) van de olaquindoxpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de olaquindoxpieken van de monsteroplossing op basis van de ijkgrafiek (5.3.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan olaquindox w in mg/kg in het monster wordt verkregen met de volgende formule:

waarbij:
|
c
|
=
|
concentratie olaquindox van de monsteroplossing (5.2) in μg/ml;
|
|
m
|
=
|
massa van het analysemonster in g (5.2).
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract (5.2) en de ijkoplossing met 5,0 μg/ml (3.5.3) worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (5.2) een geschikte hoeveelheid van een ijkoplossing (3.5.3) toe. De toegevoegde hoeveelheid olaquindox moet ongeveer gelijk zijn aan de geschatte hoeveelheid olaquindox in het monsterextract.
Alleen de hoogte van de olaquindoxpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, opgenomen op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm;
|
|
b)
|
tussen 220 en 400 nm mogen de spectra van het monster en de standaard, opgenomen op de top van de chromatografische piek voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
|
|
c)
|
tussen 220 en 400 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag bij olaquindoxgehalten tussen 10 en 200 mg/kg niet meer dan 15 % van het hoogste resultaat bedragen.
7.3. Terugvinding
Voor het blancomonster met toevoeging moet het terugvindingspercentage ten minste 90 % bedragen.
8. Resultaten van een ringonderzoek
In EG-verband is een ringonderzoek georganiseerd waarbij vier monsters biggenvoer, waaronder één blanco, door 13 laboratoria zijn onderzocht. De resultaten worden hieronder vermeld:
|
|
monster 1
|
monster 2
|
monster 3
|
monster 4
|
|
L
|
13
|
10
|
11
|
11
|
|
n
|
40
|
40
|
44
|
44
|
|
gemiddelde [mg/kg]
|
—
|
14,6
|
48,0
|
95,4
|
|
Sr [mg/kg]
|
—
|
0,82
|
2,05
|
6,36
|
|
SR [mg/kg]
|
—
|
1,62
|
4,28
|
8,42
|
|
CVr [ %]
|
—
|
5,6
|
4,3
|
6,7
|
|
CVR [ %]
|
—
|
11,1
|
8,9
|
8,8
|
|
nominaal gehalte
|
|
|
|
|
|
[mg/kg]
|
—
|
15
|
50
|
100
|
|
terugvinding in %
|
—
|
97,3
|
96,0
|
95,4
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid.
|
9. Opmerking
Hoewel de methode niet is gevalideerd voor diervoeders met meer dan 100 mg/kg olaquindox, zouden bevredigende resultaten bereikt kunnen worden door minder af te wegen en/of het extract (5.2) te verdunnen om een concentratie binnen het bereik van de ijkgrafiek (5.3.2) te krijgen.
C. BEPALING VAN AMPROLIUM
1-[(4-Amino-2-propylpyrimidine-5-yl)methyl]-2-methylpyridiniumchloride-hydrochloride
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van amprolium in diervoeders en voormengsels. De aantoonbaarheidsgrens is 1 mg/kg en de bepaalbaarheidsgrens 5 mg/kg.
2. Beginsel
Het monster wordt geëxtraheerd met een mengsel van methanol en water. Na verdunning met de mobiele fase en membraanfiltratie wordt het gehalte aan amprolium bepaald met kationenwisselings-hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.2.
|
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
|
|
3.3.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
|
3.4.
|
Natriumdiwaterstoffosfaatoplossing, c = 0,1 mol/l.
Los 13,80 g natriumdiwaterstoffosfaat-monohydraat in een maatkolf van 1 000 ml op in water (3.3), vul aan tot de streep met water (3.3) en meng.
|
|
3.5.
|
Natriumperchloraatoplossing, c = 1,6 mol/l.
Los 224,74 g natriumperchloraat-monohydraat in een maatkolf van 1 000 ml op in water (3.3), vul aan tot de streep met water (3.3) en meng.
|
|
3.6.
|
Mobiele fase voor HPLC (zie opmerking 9.1).
Een mengsel van acetonitril (3.2), natriumdiwaterstoffosfaatoplossing (3.4) en natriumperchloraatoplossing (3.5), 450 + 450 + 100 (V + V + V). Filtreer de oplossing vóór gebruik door een 0,22 μm membraanfilter (4.3) en ontgas de oplossing (bv. in het ultrasoonbad (4.4) gedurende ten minste 15 minuten).
|
|
3.7.
|
Standaardstof: zuiver amprolium, 1-[(4-amino-2-propylpyrimidine-5-yl)methyl]-2-methylpyridiniumchloride-hydrochloride, E 750 (zie opmerking 9.2).
|
|
3.7.1.
|
Amprolium-stamoplossing, 500 μg/ml
Weeg 50 mg amprolium (3.7) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in 80 ml methanol (3.1) door de kolf gedurende 10 minuten in een ultrasoonbad (4.4) te plaatsen. Koel de oplossing na de ultrasoonbehandeling af tot kamertemperatuur, vul aan tot de streep met water en meng. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.7.2.
|
Amprolium-werkoplossing, 50 μg/ml
Pipetteer 5,0 ml van de stamoplossing (3.7.1) in een maatkolf van 50 ml, vul aan tot de streep met extractievloeistof (3.8) en meng. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.7.3.
|
IJkoplossingen
Pipetteer in een reeks maatkolven van 50 ml respectievelijk 0,5, 1,0 en 2,0 ml werkoplossing (3.7.2). Vul aan tot de streep met mobiele fase (3.6) en meng. Deze oplossingen komen overeen met respectievelijk 0,5, 1,0 en 2,0 μg amprolium per ml. Deze oplossingen moeten vóór gebruik vers worden bereid.
|
|
3.8.
|
Extractievloeistof.
Een mengsel van methanol (3.1) en water, 2 + 1 (V + V).
|
4. Apparatuur
|
4.1.
|
HPLC-apparatuur met injectiesysteem, geschikt voor injectiehoeveelheden van 100 μl.
|
|
4.1.1.
|
HPLC-kolom, 125 mm × 4 mm, cation exchange Nucleosil 10 SA, vulling van 5 of 10 μm, of een gelijkwaardige kolom.
|
|
4.1.2.
|
uv-detector met variabele golflengte of diode-arraydetector.
|
|
4.2.
|
Membraanfilter, PTFE-materiaal, 0,45 μm.
|
|
4.3.
|
Membraanfilter, 0,22 μm.
|
|
4.5.
|
Mechanisch schudapparaat of magneetroerder.
|
5. Werkwijze
5.1. Algemeen
5.1.1. Blanco diervoeder
Voor de bepaling van het terugvindingspercentage (5.1.2) moet een blanco diervoeder worden geanalyseerd om te controleren of er geen amprolium of storende stoffen aanwezig zijn. Het blanco diervoeder moet van vergelijkbare soort zijn als het monster en hierin mogen geen amprolium of storende stoffen aantoonbaar zijn.
5.1.2 Bepaling van de terugvinding
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid amprolium is toegevoegd als aanwezig in het monster. Pipetteer voor een gehalte van 100 mg/kg 10,0 ml stamoplossing (3.7.1) in een erlenmeyer van 250 ml en damp dit in tot een volume van ongeveer 0,5 ml. Voeg 50 g blanco diervoeder toe, meng zorgvuldig, laat 10 minuten staan en meng vervolgens nog enige malen alvorens de extractiestap (5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een vergelijkbare hoeveelheid amprolium toegevoegd als aanwezig in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen amprolium is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Voormengsels (gehalte aan amprolium < 1 %) en diervoeders
Weeg afhankelijk van het gehalte aan amprolium 5-40 g monster tot op 0,01 g nauwkeurig af in een erlenmeyer van 500 ml en voeg 200 ml extractievloeistof (3.8) toe. Plaats de erlenmeyer gedurende 15 minuten in een ultrasoonbad (4.4). Haal de erlenmeyer uit het ultrasoonbad, en plaats hem gedurende 1 uur op het schudapparaat of de magneetroerder (4.5). Verdun een aliquot van het extract met mobiele fase (3.6) tot een amproliumconcentratie van 0,5-2 μg/ml en meng (zie opmerking 9.3). Filtreer 5-10 ml van deze verdunde oplossing door een membraanfilter (4.2). Vervolg met de HPLC-bepaling (5.3).
5.2.2. Voormengsels (gehalte aan amprolium ≥ 1 %)
Weeg 1-4 g monster, afhankelijk van het gehalte aan amprolium, tot op 0,001 g nauwkeurig af in een erlenmeyer van 500 ml en voeg 200 ml extractievloeistof (3.8) toe. Plaats de erlenmeyer gedurende 15 minuten in een ultrasoonbad (4.4). Haal de erlenmeyer uit het ultrasoonbad, en plaats hem gedurende 1 uur op het schudapparaat of de magneetroerder (4.5). Verdun een aliquot van het extract met mobiele fase (3.6) tot een amproliumconcentratie van 0,5-2 μg/ml en meng (zie opmerking 9.3). Filtreer 5-10 ml van deze verdunde oplossing door een membraanfilter (4.2). Vervolg met de HPLC-bepaling (5.3).
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
|
HPLC
|
|
|
kolom (4.1.1):
|
125 mm × 4 mm, cation exchange Nucleosil 10 SA, 5 of 10 μm vulling, of gelijkwaardig;
|
|
mobiele fase (3.6):
|
mengsel van acetonitril (3.2), natriumdiwaterstoffosfaatoplossing (3.4) en natriumperchloraatoplossing (3.5), 450 + 450 + 100 (V + V + V);
|
|
elutiesnelheid:
|
0,7-1 ml/minuut;
|
|
detectiegolflengte:
|
264 nm;
|
|
injectievolume:
|
100 μl.
|
Controleer de stabiliteit van het chromatografische systeem door enige malen de ijkoplossing (3.7.3) van 1,0 μg/ml te injecteren totdat constante piekhoogten en retentietijden worden verkregen.
5.3.2. IJkgrafiek
Injecteer elke ijkoplossing (3.7.3) enkele malen en meet voor elke concentratie de gemiddelde piekhoogte (-oppervlakte). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.3.3. Monsteroplossing
Injecteer het monsterextract (5.2) enige malen waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt en bepaal de gemiddelde piekhoogte (-oppervlakte) van de amproliumpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de amproliumpieken van de monsteroplossing aan de hand van de ijkgrafiek (5.3.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan amprolium w in mg/kg in het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
V
|
=
|
volume van de extractievloeistof (3.8) in ml volgens 5.2 (d.w.z. 200 ml);
|
|
c
|
=
|
amproliumconcentratie van de monsteroplossing (5.2) in μg/ml;
|
|
f
|
=
|
verdunningsfactor volgens 5.2;
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract (5.2) en de ijkoplossing (3.7.3) met 2,0 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (5.2) een geschikte hoeveelheid van een ijkoplossing (3.7.3) toe. De toegevoegde hoeveelheid amprolium moet ongeveer gelijk zijn aan de geschatte hoeveelheid amprolium in het monsterextract.
Alleen de hoogte van de amproliumpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm;
|
|
b)
|
tussen 210 en 320 nm mogen de spectra van het monster en de standaard, opgenomen op de top van de chromatografische piek voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
|
|
c)
|
tussen 210 en 320 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
|
—
|
15 % van het hoogste resultaat bij amproliumgehalten tussen 25 en 500 mg/kg;
|
|
—
|
75 mg/kg bedragen bij amproliumgehalten tussen 500 en 1 000 mg/kg;
|
|
—
|
7,5 % van het hoogste resultaat bij amproliumgehalten van meer dan 1 000 mg/kg.
|
7.3. Terugvinding
Voor het (blanco)monster met toevoeging moet het terugvindingspercentage ten minste 90 % bedragen.
8. Resultaten van een ringonderzoek
Er is een ringonderzoek uitgevoerd waarbij drie soorten pluimveevoer (monsters 1 t/m 3), een mineraal diervoeder (monster 4) en een voormengsel (monster 5) zijn onderzocht. De resultaten staan in de volgende tabel.
|
|
monster 1 (blanco diervoeder)
|
monster 2
|
monster 3
|
monster 4
|
monster 5
|
|
L
|
14
|
14
|
14
|
14
|
15
|
|
n
|
56
|
56
|
56
|
56
|
60
|
|
gemiddelde [mg/kg]
|
—
|
45,5
|
188
|
5 129
|
25 140
|
|
Sr [mg/kg]
|
—
|
2,26
|
3,57
|
178
|
550
|
|
CVr [ %]
|
—
|
4,95
|
1,90
|
3,46
|
2,20
|
|
SR [mg/kg]
|
—
|
2,95
|
11,8
|
266
|
760
|
|
CVR [ %]
|
—
|
6,47
|
6,27
|
5,19
|
3,00
|
|
nominaal gehalte [mg/kg]
|
—
|
50
|
200
|
5 000
|
25 000
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid.
|
9. Opmerkingen
|
9.1.
|
Als het monster thiamine bevat, verschijnt de thiaminepiek in het chromatogram net iets vóór de amproliumpiek. Bij toepassing van deze methode moeten amprolium en thiamine worden gescheiden. Als amprolium en thiamine niet worden gescheiden door de bij deze methode gebruikte kolom (4.1.1), vervang dan ten hoogste 50 % van de acetonitrilfractie van de mobiele fase (3.6) door methanol.
|
|
9.2.
|
Volgens de Britse Farmacopee vertoont het spectrum van een amproliumoplossing (c = 0,02 mol/l) in zoutzuur (c = 0,1 mol/l) maxima bij 246 nm en 262 nm. De extinctie bij 246 nm moet 0,84 bedragen en bij 262 nm 0,80.
|
|
9.3.
|
Het extract moet altijd worden verdund met de mobiele fase, omdat de retentietijd van de amproliumpiek anders aanzienlijk kan verschuiven door veranderingen in ionensterkte.
|
D. BEPALING VAN CARBADOX
Methyl-3-(2-chinoxalinylmethyleen)carbazaat-N
1
,N
4
-dioxide
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van carbadox in diervoeders en voormengsels. De aantoonbaarheidsgrens is 1 mg/kg en de bepaalbaarheidsgrens 5 mg/kg.
2. Beginsel
Het monster wordt geëquilibreerd met water en geëxtraheerd met een mengsel van methanol en acetonitril. In het geval van diervoeders wordt een aliquot van het gefiltreerde extract gezuiverd met een aluminiumoxidekolom. In het geval van voormengsels en preparaten wordt een aliquot van het gefiltreerde extract tot een geschikte concentratie verdund met water, methanol en acetonitril. Het gehalte aan carbadox wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
|
3.2.
|
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
|
|
3.3.
|
Azijnzuur, w = 100 %.
|
|
3.4.
|
Aluminiumoxide: neutraal, activiteitsklasse I.
|
|
3.5.
|
Methanol-acetonitril 1 + 1 (V + V).
Meng 500 ml methanol (3.1) met 500 ml acetonitril (3.2).
|
|
3.6.
|
Azijnzuur, σ = 10 %.
Verdun 10 ml azijnzuur (3.3) met water tot 100 ml.
|
|
3.8.
|
Water, HPLC-kwaliteit of gelijkwaardig.
|
|
3.9.
|
Acetaatbuffer, c = 0,01 mol/l, pH = 6,0.
Los 0,82 g natriumacetaat (3.7) op in 700 ml water (3.8) en breng de pH op 6,0 met azijnzuur (3.6). Breng de oplossing over in een maatkolf van 1 000 ml, vul aan tot de streep met water (3.8) en meng.
|
|
3.10.
|
Mobiele fase voor HPLC.
Meng 825 ml acetaatbuffer (3.9) met 175 ml acetonitril (3.2).
Filtreer door een filter van 0,22 μm (4.5) en ontgas de oplossing (bv. door 10 minuten ultrasoonbehandeling).
|
|
3.11.
|
Standaardstof.
Zuiver carbadox: methyl-3-(2-chinoxalinylmethyleen)carbazaat-N1,N4-dioxide, E 850.
|
|
3.11.1.
|
Carbadox-stamoplossing, 100 μg/ml (zie NB in punt 5 „Werkwijze”)
Weeg 25 mg standaardstof carbadox (3.11) tot op 0,1 mg nauwkeurig af in een maatkolf van 250 ml. Los dit op in het methanol-acetonitrilmengsel (3.5) door middel van ultrasoonbehandeling (4.7). Koel de oplossing na de ultrasoonbehandeling af tot kamertemperatuur, vul aan tot de streep met methanol-acetonitrilmengsel (3.5) en meng. Wikkel de kolf in aluminiumfolie of gebruik bruin glaswerk en bewaar in een koelkast. Bij een temperatuur van ten hoogste 4 oC is de oplossing gedurende één maand stabiel.
|
|
3.11.2.
|
IJkoplossingen
Pipetteer in een reeks van maatkolven van 100 ml respectievelijk 2,0, 5,0, 10,0 en 20,0 ml van de stamoplossing (3.11.1). Voeg 30 ml water toe, vul aan tot de streep met methanol-acetonitrilmengsel (3.5) en meng. Wikkel de kolven in aluminiumfolie. Deze oplossingen komen overeen met respectievelijk 2,0, 5,0, 10,0 en 20,0 μg carbadox per ml.
IJkoplossingen moeten vóór gebruik vers worden bereid.
|
NB:
|
Voor de bepaling van carbadox in diervoeders die minder dan 10 mg/kg bevatten, moeten ijkoplossingen met een concentratie lager dan 2,0 μg/ml worden bereid.
|
|
|
3.12.
|
Een mengsel van water en methanol-acetonitrilmengsel (3.5), 300 + 700 (V + V).
Meng 300 ml water met 700 ml van het methanol-acetonitrilmengsel (3.5).
|
4. Apparatuur
|
4.1.
|
Schudapparaat of magneetroerder.
|
|
4.2.
|
Glasvezelfiltreerpapier (Whatman GF/A, of gelijkwaardig).
|
|
4.3.
|
Glazen kolom (lengte 300-400 mm, binnendiameter ca. 10 mm) met een fritje van gesinterd glas en een aftapkraan.
|
NB:
|
Een glazen kolom met een kraantje of een glazen kolom met een taps toelopend uiteinde mag ook worden gebruikt; daarbij wordt het benedenuiteinde afgesloten met een propje glaswol.
|
|
|
4.4.
|
HPLC-apparatuur met injectiesysteem, geschikt voor injectiehoeveelheden van 20 μl.
|
|
4.4.1.
|
HPLC-kolom: 300 mm × 4 mm, C18, vulling van 10 μm, of gelijkwaardig.
|
|
4.4.2.
|
Uv-detector met variabele golflengte of diode-arraydetector met een meetbereik van 225 nm tot 400 nm.
|
|
4.5.
|
Membraanfilter, 0,22 μm.
|
|
4.6.
|
Membraanfilter, 0,45 μm.
|
5. Werkwijze
|
NB:
|
Carbadox is lichtgevoelig. Alle bewerkingen moeten bij gedempt licht plaatsvinden of in bruin glaswerk of glaswerk gewikkeld in aluminiumfolie.
|
5.1. Algemeen
5.1.1. Blanco diervoeder
Voor de uitvoering van het terugvindingspercentage (5.1.2) moet een blanco diervoeder worden geanalyseerd om te controleren of er geen carbadox of storende stoffen aanwezig zijn. Het blanco diervoeder moet van vergelijkbare soort te zijn als het monster en hierin mogen geen carbadox of storende stoffen aantoonbaar zijn.
5.1.2. Bepaling van de terugvinding
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder (5.1.1) waaraan een vergelijkbare hoeveelheid carbadox is toegevoegd als aanwezig in het monster. Pipetteer voor een gehalte van 50 mg/kg 5,0 ml stamoplossing (3.11.1) in een erlenmeyer van 200 ml. Damp de oplossing in een stroom stikstof in tot ongeveer 0,5 ml. Voeg 10 g blanco diervoeder toe, meng en wacht 10 minuten, alvorens de extractiestap (5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een vergelijkbare hoeveelheid carbadox toegevoegd als aanwezig in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen carbadox is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Diervoeders
Weeg 10 g monster tot op 0,01 g nauwkeurig af in een erlenmeyer van 200 ml. Voeg 15,0 ml water toe, meng en equilibreer gedurende 5 minuten. Voeg 35,0 ml van het methanol-acetonitrilmengsel (3.5) toe, sluit de erlenmeyer af en plaats hem gedurende 30 minuten op het schudapparaat of de magneetroerder (4.1). Filtreer de oplossing door glasvezelfiltreerpapier (4.2). Bewaar deze oplossing voor de clean-up (5.3).
5.2.2. Voormengsels (0,1-2,0 %)
Weeg 1 g niet-gemalen monster tot op 0,001 g nauwkeurig af in een erlenmeyer van 200 ml. Voeg 15,0 ml water toe, meng en equilibreer gedurende 5 minuten. Voeg 35,0 ml van het methanol-acetonitrilmengsel (3.5) toe, sluit de erlenmeyer af en plaats hem gedurende 30 minuten op het schudapparaat of de magneetroerder (4.1). Filtreer de oplossing door glasvezelfiltreerpapier (4.2).
Pipetteer een aliquot van het filtraat in een maatkolf van 50 ml. Voeg 15,0 ml water toe, vul aan tot de streep met methanol-acetonitrilmengsel (3.5) en meng. De carbadoxconcentratie van de eindoplossing dient ongeveer 10 μg/ml te bedragen. Filtreer een aliquot door een 0,45 μm filter (4.6).
Vervolg met de HPLC-bepaling (5.4).
5.2.3. Preparaten (> 2 %)
Weeg 0,2 g niet-gemalen monster tot op 0,001 g nauwkeurig af in een erlenmeyer van 250 ml. Voeg 45,0 ml water toe, meng en equilibreer gedurende 5 minuten. Voeg 105,0 ml van het methanol-acetonitrilmengsel (3.5) toe, sluit de erlenmeyer af en homogeniseer. Onderwerp het monster gedurende 15 minuten aan een ultrasoonbehandeling (4.7) en schud of roer het vervolgens gedurende 15 minuten (4.1). Filtreer de oplossing door glasvezelfiltreerpapier (4.2).
Verdun een aliquot van het filtraat met het mengsel van water en methanol-acetonitril (3.12) tot een carbadox-eindconcentratie van 10-15 μg/ml (voor een 10 %-preparaat is de verdunningsfactor 10). Filtreer een aliquot door een 0,45 μm filter (4.6).
Vervolg met de HPLC-bepaling (5.4).
5.3. Clean-up
5.3.1. Bereiding van de aluminiumoxidekolom
Weeg 4 g aluminiumoxide (3.4) af en breng dit over in de glazen kolom (4.3).
5.3.2. Clean-up van het monster
Breng 15 ml gefiltreerd extract (5.2.1) in de aluminiumoxidekolom en doe de eerste 2 ml eluaat weg. Vang de volgende 5 ml op en filtreer een aliquot door een 0,45 μm filter (4.6).
Vervolg met de HPLC-bepaling (5.4).
5.4. HPLC-bepaling
5.4.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
|
HPLC-
|
|
|
kolom (4.4.1):
|
300 mm × 4 mm, C18, vulling van 10 μm, of een gelijkwaardige kolom;
|
|
mobiele fase (3.10):
|
mengsel van acetaatbuffer (3.9) en acetonitril (3.2), 825 + 175 (V + V);
|
|
elutiesnelheid:
|
1,5-2 ml/minuut;
|
|
detectiegolflengte:
|
365 nm;
|
|
injectievolume:
|
20 μl.
|
Controleer de stabiliteit van het HPLC-systeem door enige malen de ijkoplossing (3.11.2) van 5,0 μg/ml te injecteren, totdat constante piekhoogten (-oppervlakten) en retentietijden worden verkregen.
5.4.2. IJkgrafiek
Injecteer elke ijkoplossing (3.11.2) enkele malen en meet voor elke concentratie de piekhoogte (-oppervlakte). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.4.3. Monsteroplossing
Injecteer het monsterextract [(5.3.2) voor diervoeders, (5.2.2) voor voormengsels en (5.2.3) voor preparaten] enige malen en bepaal de gemiddelde piekhoogte (-oppervlakte) van de carbadoxpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de carbadoxpieken van de monsteroplossing aan de hand van de ijkgrafiek (5.4.2) de carbadoxconcentratie van de monsteroplossing in μg/ml.
6.1. Diervoeders
Het gehalte aan carbadox w (mg/kg) in het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
c
|
=
|
carbadoxconcentratie van de monsteroplossing (5.3.2) in μg/ml;
|
|
V1
|
=
|
extractievolume in ml (d.w.z. 50);
|
|
m
|
=
|
massa van het analysemonster in g.
|
6.2. Voormengsels en preparaten
Het gehalte aan carbadox w (mg/kg) in het monster wordt verkregen met de volgende formule:
 [mg/kg]
[mg/kg]
waarbij:
|
c
|
=
|
carbadoxconcentratie van de monsteroplossing (5.2.2 of 5.2.3) in μg/ml;
|
|
V2
|
=
|
extractievolume in ml (d.w.z. 50 voor voormengsels, 150 voor preparaten);
|
|
f
|
=
|
verdunningsfactor volgens 5.2.2 (voormengsels) of 5.2.3 (preparaten);
|
|
m
|
=
|
massa van het analysemonster in g.
|
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode-arraydetector, waarbij de spectra van het monsterextract en de ijkoplossing (3.11.2) met 10,0 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract een geschikte hoeveelheid van een ijkoplossing (3.11.2) toe. De toegevoegde hoeveelheid carbadox moet ongeveer gelijk zijn aan de geschatte hoeveelheid carbadox in het monsterextract.
Alleen de hoogte van de carbadoxpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale hoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diode-arraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
|
a)
|
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diode-arraydetectie is deze marge meestal ± 2 nm;
|
|
b)
|
tussen 225 en 400 nm mogen de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de twee spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
|
|
c)
|
tussen 225 en 400 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10-100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
|
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag bij carbadoxgehalten van 10 mg/kg en hoger niet meer dan 15 % van het hoogste resultaat bedragen.
7.3. Terugvinding
Voor het (blanco)monster met toevoeging moet het terugvindingspercentage ten minste 90 % bedragen.
8. Resultaten van een ringonderzoek
Er is een ringonderzoek uitgevoerd waarbij zes diervoeders, vier voormengsels en drie preparaten door acht laboratoria zijn onderzocht. Op elk monster werden duploanalyses uitgevoerd. (Voor meer details over het ringonderzoek, zie Journal of the AOAC, Volume 71, 1988, blz. 484-490). De resultaten (exclusief uitschieters) worden hieronder vermeld.
Tabel 1
Resultaten van het ringonderzoek voor diervoeders
|
|
monster 1
|
monster 2
|
monster 3
|
monster 4
|
monster 5
|
monster 6
|
|
L
|
8
|
8
|
8
|
8
|
8
|
8
|
|
n
|
15
|
14
|
15
|
15
|
15
|
15
|
|
gemiddelde (mg/kg)
|
50,0
|
47,6
|
48,2
|
49,7
|
46,9
|
49,7
|
|
Sr (mg/kg)
|
2,90
|
2,69
|
1,38
|
1,55
|
1,52
|
2,12
|
|
CVr ( %)
|
5,8
|
5,6
|
2,9
|
3,1
|
3,2
|
4,3
|
|
SR (mg/kg)
|
3,92
|
4,13
|
2,23
|
2,58
|
2,26
|
2,44
|
|
CVR ( %)
|
7,8
|
8,7
|
4,6
|
5,2
|
4,8
|
4,9
|
|
nominaal gehalte (mg/kg)
|
50,0
|
50,0
|
50,0
|
50,0
|
50,0
|
50,0
|
Tabel 2
Resultaten van het ringonderzoek voor voormengsels en preparaten
|
|
voormengsels
|
preparaten
|
|
A
|
B
|
C
|
D
|
A
|
B
|
C
|
|
L
|
7
|
7
|
7
|
7
|
8
|
8
|
8
|
|
n
|
14
|
14
|
14
|
14
|
16
|
16
|
16
|
|
gemiddelde (g/kg)
|
8,89
|
9,29
|
9,21
|
8,76
|
94,6
|
98,1
|
104
|
|
Sr (g/kg)
|
0,37
|
0,28
|
0,28
|
0,44
|
4,1
|
5,1
|
7,7
|
|
CVr ( %)
|
4,2
|
3,0
|
3,0
|
5,0
|
4,3
|
5,2
|
7,4
|
|
SR (g/kg)
|
0,37
|
0,28
|
0,40
|
0,55
|
5,4
|
6,4
|
7,7
|
|
CVR ( %)
|
4,2
|
3,0
|
4,3
|
6,3
|
5,7
|
6,5
|
7,4
|
|
nominaal gehalte (mg/kg)
|
10,0
|
10,0
|
10,0
|
10,0
|
100
|
100
|
100
|
|
L
|
=
|
aantal laboratoria;
|
|
n
|
=
|
aantal bepalingen;
|
|
Sr
|
=
|
standaardafwijking van de herhaalbaarheid;
|
|
CVr
|
=
|
variatiecoëfficiënt van de herhaalbaarheid;
|
|
SR
|
=
|
standaardafwijking van de reproduceerbaarheid;
|
|
CVR
|
=
|
variatiecoëfficiënt van de reproduceerbaarheid.
|
BIJLAGE IX
CONCORDANTIETABELLEN ALS BEDOELD IN ARTIKEL 6
1. Richtlijn 71/250/EEG
|
Richtlijn 71/250/EEG
|
Deze verordening
|
|
Artikel 1, eerste alinea
|
Artikel 3
|
|
Artikel 1, tweede alinea
|
Artikel 2
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage, deel 1
|
Bijlage II
|
|
Bijlage, deel 2
|
—
|
|
Bijlage, deel 3
|
—
|
|
Bijlage, deel 4
|
Bijlage III, deel O
|
|
Bijlage, deel 5
|
Bijlage III, deel M
|
|
Bijlage, deel 6
|
Bijlage III, deel N
|
|
Bijlage, deel 7
|
Bijlage III, deel Q
|
|
Bijlage, deel 9
|
Bijlage III, deel K
|
|
Bijlage, deel 10
|
—
|
|
Bijlage, deel 11
|
—
|
|
Bijlage, deel 12
|
Bijlage III, deel J
|
|
Bijlage, deel 14
|
Bijlage III, deel D
|
|
Bijlage, deel 16
|
—
|
2. Richtlijn 71/393/EEG
|
Richtlijn 71/393/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage, deel I
|
Bijlage III, deel A
|
|
Bijlage, deel II
|
Bijlage III, deel E
|
|
Bijlage, deel III
|
Bijlage III, deel P
|
|
Bijlage, deel IV
|
Bijlage III, deel H
|
3. Richtlijn 72/199/EEG
|
Richtlijn 72/199/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Bijlage I, deel 1
|
Bijlage III, deel L
|
|
Bijlage I, deel 2
|
Bijlage III, deel C
|
|
Bijlage I, deel 3
|
—
|
|
Bijlage I, deel 4
|
—
|
|
Bijlage I, deel 5
|
Bijlage V, deel A
|
|
Bijlage II
|
—
|
4. Richtlijn 73/46/EEG
|
Richtlijn 73/46/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Bijlage I, deel 1
|
Bijlage III, deel B
|
|
Bijlage I, deel 2
|
—
|
|
Bijlage I, deel 3
|
Bijlage III, deel I
|
5. Richtlijn 76/371/EEG
|
Richtlijn 76/371/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 1
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage
|
Bijlage I
|
6. Richtlijn 76/372/EEG
|
Richtlijn 76/372/EEG
|
Deze verordening
|
|
Artikel 1
|
—
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage
|
—
|
7. Richtlijn 78/633/EEG
|
Richtlijn 78/633/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage, deel 1
|
—
|
|
Bijlage, deel 2
|
—
|
|
Bijlage, deel 3
|
Bijlage IV, deel C
|
8. Richtlijn 81/715/EEG
|
Richtlijn 81/715/EEG
|
Deze verordening
|
|
Artikel 1
|
—
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage
|
—
|
9. Richtlijn 84/425/EEG
|
Richtlijn 84/425/EEG
|
Deze verordening
|
|
Artikel 1
|
—
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage
|
—
|
10. Richtlijn 86/174/EEG
|
Richtlijn 86/174/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 4
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage
|
Bijlage VII
|
11. Richtlijn 93/70/EEG
|
Richtlijn 93/70/EEG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage
|
Bijlage IV, deel D
|
12. Richtlijn 93/117/EG
|
Richtlijn 93/117/EG
|
Deze verordening
|
|
Artikel 1
|
Artikelen 3 en 5
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Bijlage, deel 1
|
Bijlage IV, deel E
|
|
Bijlage, deel 2
|
Bijlage VIII, deel A
|
13. Richtlijn 98/64/EG
|
Richtlijn 98/64/EG
|
Deze verordening
|
|
Artikel 1
|
Artikelen 3 en 5
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Bijlage, deel A
|
Bijlage III, deel F
|
|
Bijlage, deel C
|
Bijlage VIII, deel B
|
14. Richtlijn 1999/27/EG
|
Richtlijn 1999/27/EG
|
Deze verordening
|
|
Artikel 1
|
Artikelen 3 en 5
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Artikel 5
|
—
|
|
Artikel 6
|
—
|
|
Artikel 7
|
—
|
|
Bijlage, deel A
|
Bijlage VIII, deel C
|
|
Bijlage, deel B
|
Bijlage IV, deel F
|
|
Bijlage, deel C
|
Bijlage VIII, deel D
|
15. Richtlijn 1999/76/EG
|
Richtlijn 1999/76/EG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Bijlage
|
Bijlage IV, deel G
|
16. Richtlijn 2000/45/EG
|
Richtlijn 2000/45/EG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Bijlage, deel A
|
Bijlage IV, deel A
|
|
Bijlage, deel B
|
Bijlage IV, deel B
|
|
Bijlage, deel C
|
Bijlage III, deel G
|
17. Richtlijn 2002/70/EG
|
Richtlijn 2002/70/EG
|
Deze verordening
|
|
Artikel 1
|
Artikel 1
|
|
Artikel 2
|
Artikelen 2 en 3
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Artikel 5
|
—
|
|
Bijlage I
|
Bijlage I en bijlage V, deel B, punt I
|
|
Bijlage II
|
Bijlage II en bijlage V, deel B, punt II
|
18. Richtlijn 2003/126/EG
|
Richtlijn 2003/126/EG
|
Deze verordening
|
|
Artikel 1
|
Artikel 3
|
|
Artikel 2
|
—
|
|
Artikel 3
|
—
|
|
Artikel 4
|
—
|
|
Artikel 5
|
—
|
|
Artikel 6
|
—
|
|
Bijlage
|
Bijlage VI
|
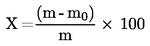










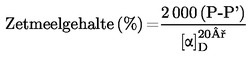
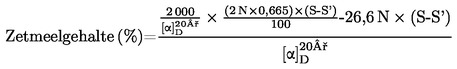


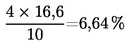



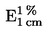 voor vitamine A-acetaat = 1 530 bij 326 nm in propaan-2-ol)
voor vitamine A-acetaat = 1 530 bij 326 nm in propaan-2-ol) voor vitamine A-palmitaat = 957 bij 326 nm in propaan-2-ol)
voor vitamine A-palmitaat = 957 bij 326 nm in propaan-2-ol) voor vitamine A-alcohol = 1 821 bij 325 nm in propaan-2-ol)
voor vitamine A-alcohol = 1 821 bij 325 nm in propaan-2-ol) [UI/kg]
[UI/kg]
 = 43,6 bij 284 nm in ethanol.
= 43,6 bij 284 nm in ethanol.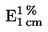 = 75,8 bij 292 nm in ethanol.
= 75,8 bij 292 nm in ethanol. [mg/kg]
[mg/kg]
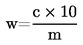
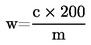
 [mg/kg]
[mg/kg] [mg/kg]
[mg/kg]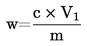 [mg/kg]
[mg/kg] [mg/kg]
[mg/kg]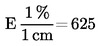

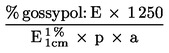


 [mg/kg]
[mg/kg] [mg/kg]
[mg/kg] [mg/kg]
[mg/kg]