EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02006D0168-20130801
Commission Decision of 4 January 2006 establishing the animal health and veterinary certification requirements for imports into the Community of bovine embryos and repealing Decision 2005/217/EC (notified under document number C(2005) 5796) (Text with EEA relevance) (2006/168/EC)
Consolidated text: Beschikking van de Commissie van 4 januari 2006 tot vaststelling van de veterinairrechtelijke voorschriften en de voorschriften inzake veterinaire certificering voor de invoer van runderembryo's in de Gemeenschap en tot intrekking van Beschikking 2005/217/EG (Kennisgeving geschied onder nummer C(2005) 5796) (Voor de EER relevante tekst) (2006/168/EG)
Beschikking van de Commissie van 4 januari 2006 tot vaststelling van de veterinairrechtelijke voorschriften en de voorschriften inzake veterinaire certificering voor de invoer van runderembryo's in de Gemeenschap en tot intrekking van Beschikking 2005/217/EG (Kennisgeving geschied onder nummer C(2005) 5796) (Voor de EER relevante tekst) (2006/168/EG)
2006D0168 — NL — 01.08.2013 — 004.001
Dit document vormt slechts een documentatiehulpmiddel en verschijnt buiten de verantwoordelijkheid van de instellingen
|
BESCHIKKING VAN DE COMMISSIE van 4 januari 2006 tot vaststelling van de veterinairrechtelijke voorschriften en de voorschriften inzake veterinaire certificering voor de invoer van runderembryo's in de Gemeenschap en tot intrekking van Beschikking 2005/217/EG (Kennisgeving geschied onder nummer C(2005) 5796) (Voor de EER relevante tekst) (PB L 057, 28.2.2006, p.19) |
Gewijzigd bij:
|
|
|
Publicatieblad |
||
|
No |
page |
date |
||
|
VERORDENING (EG) Nr. 1792/2006 VAN DE COMMISSIE van 23 oktober 2006 |
L 362 |
1 |
20.12.2006 |
|
|
L 315 |
22 |
2.12.2009 |
||
|
L 194 |
12 |
21.7.2012 |
||
|
VERORDENING (EU) Nr. 519/2013 VAN DE COMMISSIE van 21 februari 2013 |
L 158 |
74 |
10.6.2013 |
|
|
L 172 |
32 |
25.6.2013 |
||
Gerectificeerd bij:
BESCHIKKING VAN DE COMMISSIE
van 4 januari 2006
tot vaststelling van de veterinairrechtelijke voorschriften en de voorschriften inzake veterinaire certificering voor de invoer van runderembryo's in de Gemeenschap en tot intrekking van Beschikking 2005/217/EG
(Kennisgeving geschied onder nummer C(2005) 5796)
(Voor de EER relevante tekst)
(2006/168/EG)
DE COMMISSIE VAN DE EUROPESE GEMEENSCHAPPEN,
Gelet op het Verdrag tot oprichting van de Europese Gemeenschap,
Gelet op Richtlijn 89/556/EEG van de Raad van 25 september 1989 tot vaststelling van veterinairrechtelijke voorschriften voor het intracommunautaire handelsverkeer in embryo's van als huisdier gehouden runderen en de invoer daarvan uit derde landen ( 1 ), en met name op artikel 7, lid 1, en op artikel 9, lid 1, eerste alinea, onder b),
Overwegende hetgeen volgt:|
(1) |
In Richtlijn 89/556/EEG worden de veterinairrechtelijke voorwaarden vastgesteld die van toepassing zijn op het intracommunautaire handelsverkeer in verse en diepgevroren embryo's van als huisdier gehouden runderen en de invoer daarvan uit derde landen. |
|
(2) |
Die richtlijn bepaalt onder meer dat runderembryo's niet van de ene naar de andere lidstaat mogen worden verzonden, tenzij de bevruchting ervan door middel van kunstmatige inseminatie of in-vitrofertilisatie is geschied, met sperma van een donorstier uit een door de bevoegde autoriteit voor de winning, behandeling en opslag van sperma erkend spermacentrum of met sperma dat overeenkomstig Richtlijn 88/407/EEG van de Raad van 14 juni 1988 tot vaststelling van de veterinairrechtelijke voorschriften van toepassing op het intracommunautaire handelsverkeer in sperma van runderen en de invoer daarvan ( 2 ) is ingevoerd. |
|
(3) |
In Beschikking 92/452/EEG van de Commissie van 30 juli 1992 houdende vaststelling van lijsten van embryoteams en embryoproductieteams die in derde landen zijn erkend met het oog op de uitvoer van runderembryo's naar de Gemeenschap ( 3 ) is bepaald dat de lidstaten de invoer van runderembryo's uit derde landen alleen toestaan als die embryo's zijn verzameld, behandeld, met inbegrip van in-vitrofertilisatie, en opgeslagen door embryoteams die in de lijsten in die beschikking worden vermeld. |
|
(4) |
Naar aanleiding van handelsproblemen als gevolg van bij Beschikking 92/471/EEG van de Commissie ( 4 ), ingevoerde nieuwe, strengere voorschriften inzake voor bevruchting gebruikt rundersperma heeft de Commissie Beschikking 2005/217/EG van 9 maart 2005 tot vaststelling van de veterinairrechtelijke voorschriften en de voorschriften inzake veterinaire certificering voor de invoer van runderembryo’s in de Gemeenschap ( 5 ) goedgekeurd. |
|
(5) |
Beschikking 2005/217/EG voorziet in een overgangsperiode die afloopt op 31 december 2006 voor de invoer van runderembryo's die zijn verzameld of geproduceerd vóór 1 januari 2006 en waarvan de bevruchting is geschied met sperma dat niet volledig aan Richtlijn 88/407/EEG voldoet, mits deze embryo's worden gebruikt voor implantatie bij vrouwelijke runderen in de lidstaat van bestemming en niet in het intracommunautaire handelsverkeer worden gebracht. |
|
(6) |
De International Embryo Transfer Society (IETS) acht de kans op overdracht van bepaalde besmettelijke ziekten via embryo’s op ontvangers of hun nakomelingen te verwaarlozen, mits de embryo’s tussen de verzameling en het transport op de juiste wijze worden behandeld. De Werelddiergezondheidsorganisatie (OIE) neemt ten aanzien van in vivo verkegen embryo's hetzelfde standpunt in. Niettemin moeten in het belang van de diergezondheid hogerop passende voorzorgsmaatregelen genomen worden ten aanzien van het voor de bevruchting gebruikte sperma, met name ten aanzien van in vitro ontwikkelde embryo's. |
|
(7) |
De communautaire voorschriften voor de invoer van door natuurlijke bevruchting (in vivo) verkregen en door middel van in-vitrofertilisatie geproduceerde runderembryo’s moeten daarom, met name ten aanzien van het voor de bevruchting gebruikte sperma, worden aangepast. |
|
(8) |
In het licht van de door de IETS uitgevoerde risicoanalyse en in overeenstemming met de aanbevelingen van de OIE dienen de voorwaarden voor de invoer van in vivo verkregen runderembryo's te worden vereenvoudigd, terwijl voor de invoer van in vitro geproduceerde embryo's strengere veterinairrechtelijke voorschriften gehandhaafd dienen te blijven, met bijzondere beperkingen voor gevallen waarin de zona pellucida tijdens het proces beschadigd is. |
|
(9) |
Ter wille van de duidelijkheid van de Gemeenschapswetgeving moet Beschikking 2005/217/EG worden ingetrokken en door deze beschikking worden vervangen. |
|
(10) |
Om de marktdeelnemers echter in staat te stellen zich aan de nieuwe bepalingen van deze beschikking aan te passen is het wenselijk om in een overgangsregeling te voorzien, waarbij vóór 1 januari 2006 verzamelde of geproduceerde embryo's van als huisdier gehouden runderen overeenkomstig de voorschriften van bijlage V bij deze beschikking onder bepaalde voorwaarden in de Gemeenschap mogen worden ingevoerd. |
|
(11) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE BESCHIKKING GEGEVEN:
Artikel 1
Algemene voorwaarden voor de invoer van embryo’s
De lidstaten voeren uitsluitend runderembryo’s (hierna „embryo’s” genoemd) in die in de in bijlage I bij deze beschikking genoemde derde landen zijn verzameld of geproduceerd door overeenkomstig artikel 8 van Richtlijn 89/556/EEG erkende embryoteams en embryoproductieteams..
Artikel 2
Invoer van in vivo verkregen embryo's
De lidstaten staan de invoer toe van embryo’s die het resultaat zijn van bevruchting in vivo en die voldoen aan de veterinairrechtelijke voorschriften in het model van het veterinair certificaat in bijlage II.
Artikel 3
Invoer van in vitro geproduceerde embryo's
1. De lidstaten staan de invoer toe van embryo’s die door middel van in-vitrofertilisatie geproduceerd zijn met sperma dat met Richtlijn 88/407/EG in overeenstemming is en die voldoen aan de veterinairrechtelijke voorschriften in het model van het veterinair certificaat in bijlage III bij deze beschikking.
2. De lidstaten staan de invoer toe van embryo’s die door middel van in-vitrofertilisatie geproduceerd zijn met sperma dat in bijlage I bij Beschikking 2004/639/EG ( 6 ) van de Commissie vermelde derde landen in erkende spermacentra is geproduceerd of in spermaopslagcentra is opgeslagen en die voldoen aan de veterinairrechtelijke voorschriften in het model van het veterinair certificaat in bijlage IV bij deze beschikking, mits die embryo's:
a) niet in het intracommunautaire handelsverkeer worden gebracht; en
b) uitsluitend worden gebruikt voor implantatie bij vrouwelijke runderen in de in het veterinaire certificaat aangegeven lidstaat van bestemming.
Artikel 4
Overgangsmaatregelen
In afwijking van de artikelen 2 en 3 staan de lidstaten tot en met 31 december 2006 de invoer uit de in bijlage I genoemde derde landen toe van embryo’s die voldoen aan:
a) de veterinairrechtelijke voorschriften in het model van het veterinair certificaat in bijlage V, en
b) de volgende voorwaarden:
i) zij zijn vóór 1 januari 2006 verzameld of geproduceerd;
ii) zij worden alleen gebruikt voor implantatie bij vrouwelijke runderen in de op het veterinair certificaat vermelde lidstaat van bestemming;
iii) zij mogen niet in het intracommunautaire handelsverkeer worden gebracht;
iv) zijn gaan vergezeld van voornoemd certificaat, dat vóór 1 januari 2007 naar behoren is ingevuld.
Artikel 5
Intrekking
Beschikking 2005/217/EG wordt ingetrokken.
Artikel 6
Toepasbaarheid
Deze beschikking is van toepassing met ingang van 1 januari 2006.
Artikel 7
Adressaten
Deze beschikking is gericht tot de lidstaten.
BIJLAGE I
|
ISO-code |
Derde land |
Toepasselijk veterinair certificaat |
||
|
AR |
Argentinië |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
AU |
Australië |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
CA |
Canada |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
CH |
Zwitserland (1) |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
▼M4 ————— |
||||
|
IL |
Israël |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
MK |
voormalige Joegoslavische Republiek Macedonië (2) |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
NZ |
Nieuw-Zeeland (3) |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
US |
Verenigde Staten van Amerika |
BIJLAGE II |
BIJLAGE III |
BIJLAGE IV |
|
(1) De voor invoer uit Zwitserland te gebruiken certificaten voor in vivo verkregen en in vitro geproduceerde embryo’s zijn opgenomen in bijlage C bij Richtlijn 89/556/EEG, met de aanpassingen zoals beschreven in bijlage 11, aanhangsel 2, hoofdstuk VI, deel B, punt 2, bij de Overeenkomst tussen de Europese Gemeenschap en de Zwitserse Bondsstaat inzake de handel in landbouwproducten, goedgekeurd bij Besluit 2002/309/EG, Euratom van de Raad en, wat betreft de overeenkomst inzake Wetenschappelijke en Technologische samenwerking, van de Commissie van 4 april 2002 betreffende de sluiting van zeven overeenkomsten met de Zwitserse Bondsstaat. (2) Voorlopige code die geen gevolgen heeft voor de definitieve benaming die aan het land wordt gegeven na afloop van de onderhandelingen die momenteel in het kader van de Verenigde Naties worden gevoerd. (3) Het voor invoer uit Nieuw-Zeeland te gebruiken certificaat voor in vivo verkregen embryo’s is opgenomen in bijlage IV bij Beschikking 2003/56/EG van de Commissie van 24 januari 2003 tot vaststelling van gezondheidscertificaten voor de invoer van levende dieren en dierlijke producten uit Nieuw-Zeeland (alleen voor de in Nieuw-Zeeland verzamelde embryo’s). Het is vastgesteld overeenkomstig de Overeenkomst tussen de Europese Gemeenschap en Nieuw-Zeeland inzake sanitaire maatregelen voor de handel in levende dieren en dierlijke producten, goedgekeurd bij Besluit 97/132/EG van de Raad. |
||||
BIJLAGE II
Model van veterinair certificaat voor de invoer van in vivo verkregen embryo’s van als huisdier gehouden runderen die overeenkomstig richtlijn 89/556/EEG van de Raad zijn verzameld
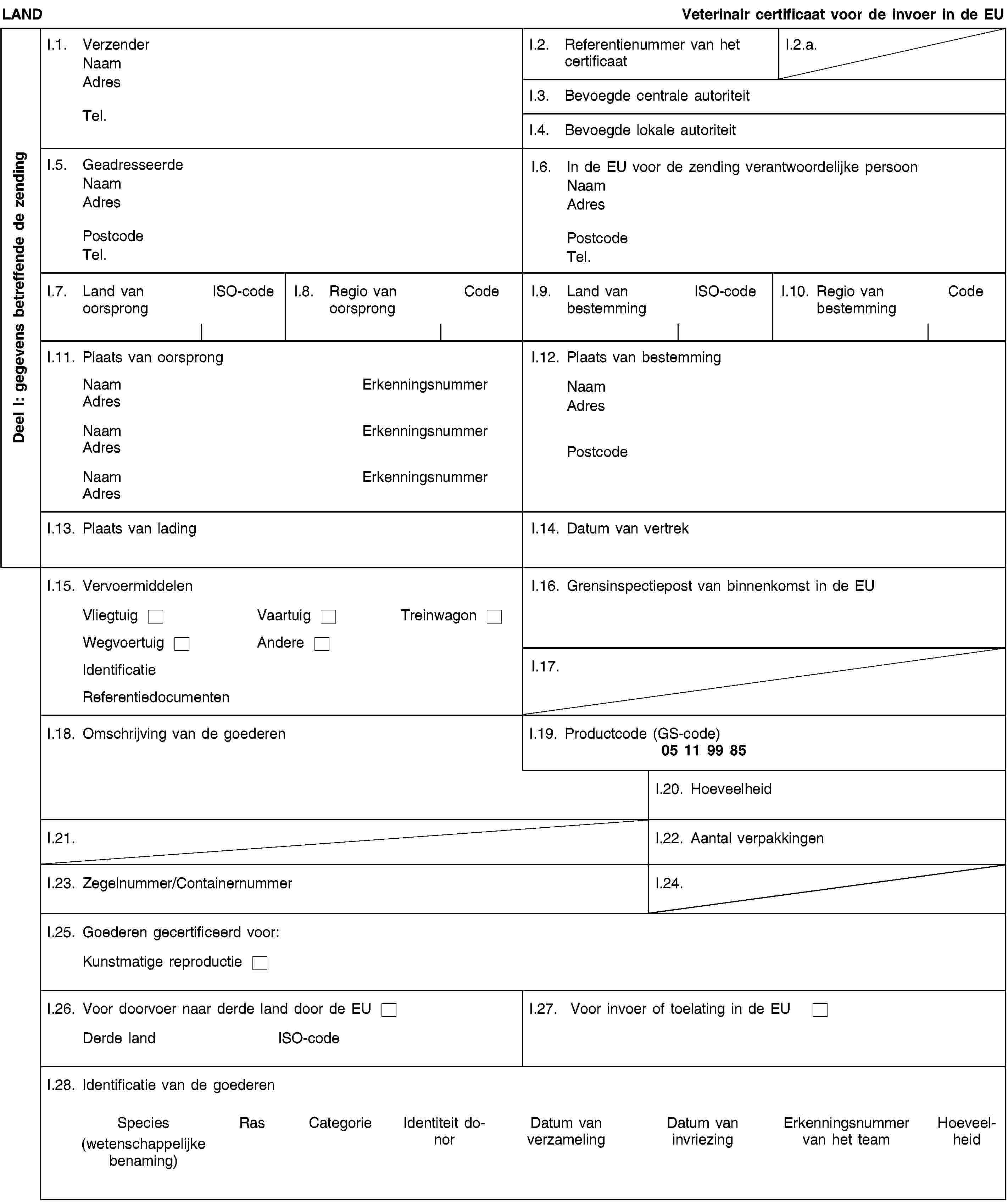
 hetzij [II.1.1.2. in de twaalf maanden voor de verzameling niet vrij was van mond-en-klauwzeer of nodulaire dermatose of in deze periode inentingen tegen deze ziekten heeft uitgevoerd, en:bij de embryo’s de zona pellucida niet is doorgeprikt;de embryo’s onmiddellijk na het verzamelen ten minste 30 dagen lang onder goedgekeurde voorwaarden zijn opgeslagen;de vrouwelijke donordieren afkomstig zijn van bedrijven waar in de 30 dagen voor het verzamelen geen dieren tegen mond-en-klauwzeer of nodulaire dermatose zijn ingeënt en waar gedurende 30 dagen voor en ten minste 30 dagen na de verzameling van de embryo’s ziektegevoelige dieren geen klinische symptomen van mond-en-klauwzeer of nodulaire dermatose hebben vertoond.]II.1.2. werden verzameld door het embryoteam (3), dat:erkend is overeenkomstig hoofdstuk I van bijlage A bij Richtlijn 89/556/EEG;dat de embryo’s heeft verzameld, behandeld, opgeslagen en vervoerd overeenkomstig hoofdstuk II van bijlage A bij Richtlijn 89/556/EEG;dten minste tweemaal per jaar wordt gecontroleerd door een officiële dierenarts.II.1.3. werden verzameld en behandeld in bedrijven waaromheen in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, epizoötische hemorragische ziekte, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose is voorgekomen in de 30 dagen voor het verzamelen van de embryo’s en tot de dag van verzending naar de Unie als het verse embryo’s betreft, of in de 30 dagen na de verzameling als het embryo’s betreft die overeenkomstig punt II.1.1.2 minstens 30 dagen moeten worden opgeslagen.II.1.4. vanaf het tijdstip van verzameling tot 30 dagen daarna (of, in het geval van verse embryo’s, tot de datum van verzending naar de Unie) waren opgeslagen in bedrijven waaromheen zich in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose heeft voorgedaan.II.1.5. werden verzameld van vrouwelijke donordieren die:II.1.5.1. in de 30 dagen voor het verzamelen verbleven in bedrijven waaromheen in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, bluetongue, epizoötische hemorragische ziekte, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose is voorgekomen;II.1.5.2. op de dag van de verzameling volledig vrij waren van klinische ziektesymptomen;II.1.5.3. in de zes maanden voor het verzamelen van de embryo’s op het grondgebied van het exporterende land hebben verbleven in maximaal twee beslagen:die volgens officiële vaststellingen in die periode tuberculosevrij waren;die volgens officiële vaststellingen in die periode brucellosevrij waren;die vrij waren van enzoötische runderleukose of waarin de laatste drie jaar geen klinische symptomen van enzoötische runderleukose zijn geconstateerd;waarin de laatste twaalf maanden bij geen enkel dier klinische symptomen van infectieuze boviene rinotracheïtis/infectieuze pustuleuze vulvovaginitis zijn geconstateerd.II.1.6. Twerden bevrucht door middel van kunstmatige inseminatie met sperma afkomstig van spermacentra of spermaopslagcentra die door de bevoegde autoriteit van een in bijlage I bij Uitvoeringsbesluit 2011/630/EU (4) vermeld derde land of een deel daarvan of door de bevoegde autoriteit van een lidstaat erkend zijn voor de verzameling, behandeling en/of opslag van sperma.](./../../../resource.html?uri=celex:02006D0168-20130801.NLD.xhtml.L_2013172NL.01003501.tif.jpg)

BIJLAGE III
Model van veterinair certificaat voor de invoer van in vitro geproduceerde embryo’s van als huisdier gehouden runderen, bevrucht met sperma dat voldoet aan richtlijn 88/407/EEG van de Raad
 hetzij [II.1.1.2. in de twaalf maanden voor de productie niet vrij was van mond-en-klauwzeer of nodulaire dermatose of in deze periode inentingen tegen deze ziekten heeft uitgevoerd, en:bij de productie van de embryo’s de zona pellucida niet is doorgeprikt;de embryo’s onmiddellijk na de productie ten minste 30 dagen lang onder goedgekeurde voorwaarden zijn opgeslagen;de vrouwelijke donordieren afkomstig zijn van bedrijven waar in de 30 dagen voor het verzamelen geen dieren tegen mond-en-klauwzeer of nodulaire dermatose zijn ingeënt en waar gedurende 30 dagen voor en ten minste 30 dagen na de verzameling van de oöcyten van ziektegevoelige dieren geen klinische symptomen van mond-en-klauwzeer of nodulaire dermatose hebben vertoond.]II.1.2. werden geproduceerd door het embryoproductieteam (3) dat:erkend is overeenkomstig hoofdstuk I van bijlage A bij Richtlijn 89/556/EEG;de embryo’s heeft geproduceerd, behandeld, opgeslagen en vervoerd overeenkomstig hoofdstuk II van bijlage A bij Richtlijn 89/556/EEG;ten minste tweemaal per jaar wordt gecontroleerd door een officiële dierenarts.II.2. de oöcyten die werden gebruikt bij de productie van de voor uitvoer bestemde embryo’s, werden verzameld in bedrijven waaromheen in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, epizoötische hemorragische ziekte, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose is voorgekomen in de 30 dagen voor het verzamelen van de embryo’s en tot de dag van verzending naar de Unie als het verse embryo’s betreft, of in de 30 dagen na de verzameling als het embryo’s betreft die overeenkomstig punt II.1.1.2 minstens 30 dagen moeten worden opgeslagen.II.3. vanaf het tijdstip van verzameling van de oöcyten tot 30 dagen daarna (of, in het geval van verse embryo’s, tot de datum van verzending) de voor uitvoer bestemde embryo’s opgeslagen waren in bedrijven waaromheen zich in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose heeft voorgedaan.II.4. de donordieren van de bij de productie van voor uitvoer bestemde embryo’s gebruikte oöcyten:II.4.1. in de 30 dagen voor het verzamelen van de oöcyten verbleven in bedrijven waaromheen in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, bluetongue, epizoötische hemorragische ziekte, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose is voorgekomen;II.4.2. op de dag van de verzameling volledig vrij waren van klinische ziektesymptomen;II.4.3. in de zes maanden voor het verzamelen van de embryo’s op het grondgebied van het exporterende land hebben verbleven in maximaal twee beslagen:die volgens officiële vaststellingen in die periode tuberculosevrij waren;die volgens officiële vaststellingen in die periode brucellosevrij waren;die vrij waren van enzoötische runderleukose of waarin de laatste drie jaar geen klinische symptomen van enzoötische runderleukose zijn geconstateerd;waarin de laatste twaalf maanden bij geen enkel dier klinische symptomen van infectieuze boviene rinotracheïtis/infectieuze pustuleuze vulvovaginitis zijn geconstateerd;(1) hetzij [II.4.4. vanaf ten minste 60 dagen voor tot en met de verzameling van de oöcyten zijn gehouden in een land of gebied dat vrij is van het bluetonguevirus,]](./../../../resource.html?uri=celex:02006D0168-20130801.NLD.xhtml.L_2013172NL.01003801.tif.jpg)
 hetzij [II.4.4. tussen 21 en 60 dagen na de verzameling met negatief resultaat een serologische test overeenkomstig het Manual of Diagnostic Tests and Vaccines for Terrestrial Animals van de OIE voor de opsporing van antilichamen tegen de bluetonguevirusgroep hebben ondergaan en de embryo’s ten minste 30 dagen zijn opgeslagen,](1) hetzij [II.4.4. umet negatief resultaat een test overeenkomstig het Manual of Diagnostic Tests and Vaccines for Terrestrial Animals van de OIE hebben ondergaan voor de opsporing van een ziekteverwekker op een bloedmonster dat op de datum van verzameling of de datum van slachting is genomen. In dat laatste geval zijn de embryo’s geproduceerd zonder dat de zona pellucida is doorgeprikt.]II.5. de uit te voeren embryo’s werden bevrucht door middel van in-vitrofertilisatie met sperma afkomstig van spermacentra of spermaopslagcentra (4):(1) hetzij [II.5.1. die zijn erkend overeenkomstig artikel 5, lid 1, van Richtlijn 88/407/EEG en gevestigd in een lidstaat van de Europese Unie, en het sperma voldoet aan de voorschriften in Richtlijn 88/407/EEG,](1) hetzij [II.5.1. die zijn erkend overeenkomstig artikel 9, lid 1, van Richtlijn 88/407/EEG en gevestigd in een derde land of een deel daarvan dat is opgenomen in de lijst in bijlage I bij Uitvoeringsbesluit 2011/630/EU, en het sperma voldoet aan de voorschriften in bijlage II, deel 1, afdeling A, bij dat besluit.]OpmerkingenDeel I:Vak I.6: in de EU voor de zending verantwoordelijke persoon: dit vak hoeft alleen te worden ingevuld als het een certificaat voor doorvoer is.Vak I.11: plaats van oorsprong het embryoproductieteam vanwaar de embryo’s naar de Unie zijn verzonden en dat overeenkomstig artikel 8, lid 2, van Richtlijn 89/556/EEG is opgenomen in de lijst op de volgende website van de Commissie: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htmVak I.22: aantal verpakkingen komt overeen met het aantal containers.Vak I.23: identificatie van container en zegelnummer moet worden vermeld.Vak I.26: invullen als het om doorvoer, respectievelijk invoer gaat.Vak I.27: invullen als het om doorvoer, respectievelijk invoer gaat.Vak I.28: soort: „Bos taurus”, „Bison bison” of „Bubalus bubalis” aangeven, naargelang van het geval;categorie: „in vitro geproduceerde embryo’s” aangeven;identiteit moederdier de officiële identificatie van het dier;identiteit vaderdier de officiële identificatie van het dier;datum van invriezing vermelden als: dd.mm.jjjj;erkenningsnummer van het team: shet embryoproductieteam dat de embryo’s heeft geproduceerd, behandeld en opgeslagen en dat overeenkomstig artikel 8, lid 2, van Richtlijn 89/556/EEG is opgenomen in de lijst op de volgende website van de Commissie: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htmDeel II:(1) Doorhalen wat niet van toepassing is.(2) Alleen derde landen die zijn opgenomen in bijlage I bij Beschikking 2006/168/EG.(3) Alleen embryoproductieteams die overeenkomstig artikel 8, lid 2, van Richtlijn 89/556/EEG zijn opgenomen in de lijst op de volgende website van de Commissie: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm(4) Alleen spermacentra die overeenkomstig artikel 5, lid 2, en artikel 9, lid 2, van Richtlijn 88/407/EEG zijn opgenomen in de lijst op de volgende websites van de Commissie:http://ec.europa.eu/food/animal/approved_establishments/establishments_vet_field_en.htm;http://ec.europa.eu/food/animal/semen_ova/bovine/index_en.htmDe kleur van de handtekening en van het stempel moet verschillen van die van de gedrukte tekst.](./../../../resource.html?uri=celex:02006D0168-20130801.NLD.xhtml.L_2013172NL.01003901.tif.jpg)

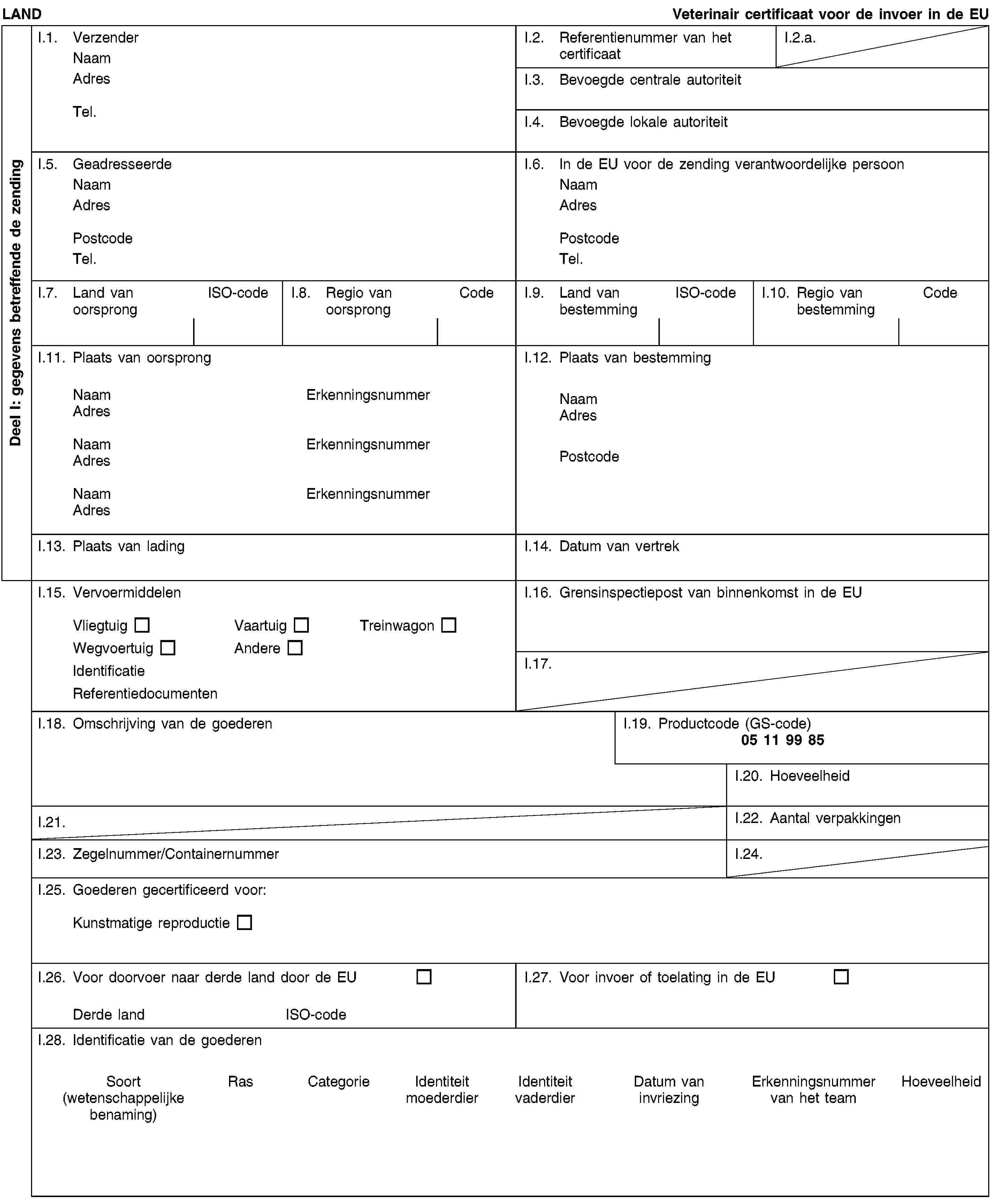
BIJLAGE IV
Model van veterinair certificaat voor de invoer van in vitro geproduceerde embryo’s van als huisdier gehouden runderen, bevrucht met sperma afkomstig van door de bevoegde autoriteit van het exporterende land erkende spermacentra of spermaopslagcentra

 hetzij [II.1.1.2. in de twaalf maanden voor de productie niet vrij was van mond-en-klauwzeer of nodulaire dermatose of in deze periode inentingen tegen deze ziekten heeft uitgevoerd, en:bij de productie van de embryo’s de zona pellucida niet is doorgeprikt;,de embryo’s onmiddellijk na de productie ten minste 30 dagen lang onder goedgekeurde voorwaarden zijn opgeslagen;de vrouwelijke donordieren afkomstig zijn van bedrijven waar in de 30 dagen voor het verzamelen geen dieren tegen mond-en-klauwzeer of nodulaire dermatose zijn ingeënt en waar gedurende 30 dagen voor en ten minste 30 dagen na de verzameling van de oöcyten van ziektegevoelige dieren geen klinische symptomen van mond-en-klauwzeer of nodulaire dermatose hebben vertoond.]II.1.2. werden geproduceerd door het embryoproductieteam (3) dat:erkend is overeenkomstig hoofdstuk I van bijlage A bij Richtlijn 89/556/EEG;de embryo’s heeft geproduceerd, behandeld, opgeslagen en vervoerd overeenkomstig hoofdstuk II van bijlage A bij Richtlijn 89/556/EEG;ten minste tweemaal per jaar wordt gecontroleerd door een officiële dierenarts.II.2. de oöcyten die werden gebruikt bij de productie van de voor uitvoer bestemde embryo’s werden verzameld in bedrijven waaromheen in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, epizoötische hemorragische ziekte, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose is voorgekomen in de 30 dagen voor het verzamelen van de embryo’s en tot de dag van verzending naar de Unie als het verse embryo’s betreft, of in de 30 dagen na de verzameling als het embryo’s betreft die overeenkomstig punt II.2.2 minstens 30 dagen moeten worden opgeslagen.II.3. vanaf het tijdstip van verzameling van de oöcyten tot 30 dagen daarna (of, in het geval van verse embryo’s, tot de datum van verzending) de voor uitvoer bestemde embryo’s opgeslagen waren in bedrijven waaromheen zich in een gebied met een straal van minstens 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose heeft voorgedaan.II.4. de donordieren van de bij de productie van voor uitvoer bestemde embryo’s gebruikte oöcyten:II.4.1. in de 30 dagen voor het verzamelen van de oöcyten verbleven in bedrijven waaromheen in een gebied met een straal van 10 km volgens officiële vaststellingen geen enkel geval van mond-en-klauwzeer, bluetongue, epizoötische hemorragische ziekte, vesiculeuze stomatitis, riftdalkoorts, besmettelijke boviene pleuropneumonie of nodulaire dermatose is voorgekomen;II.4.2. op de dag van de verzameling volledig vrij waren van klinische ziektesymptomen;II.4.3. in de zes maanden voor het verzamelen van de embryo’s op het grondgebied van het exporterende land hebben verbleven in maximaal twee beslagen:die volgens officiële vaststellingen in die periode tuberculosevrij waren;die volgens officiële vaststellingen in die periode brucellosevrij waren;die vrij waren van enzoötische runderleukose of waarin de laatste drie jaar geen klinische symptomen van enzoötische runderleukose zijn geconstateerd;waarin de laatste twaalf maanden bij geen enkel dier klinische symptomen van infectieuze boviene rinotracheïtis/infectieuze pustuleuze vulvovaginitis zijn geconstateerd;(1) hetzij [II.4.4. vanaf ten minste 60 dagen voor tot en met de verzameling van de oöcyten zijn gehouden in een land of gebied dat vrij is van het bluetonguevirus,]](./../../../resource.html?uri=celex:02006D0168-20130801.NLD.xhtml.L_2013172NL.01004201.tif.jpg)
 hetzij [II.4.4. tussen 21 en 60 dagen na de verzameling met negatief resultaat een serologische test overeenkomstig het Manual of Diagnostic Tests and Vaccines for Terrestrial Animals van de OIE voor de opsporing van antilichamen tegen de bluetonguevirusgroep hebben ondergaan en de embryo’s ten minste 30 dagen zijn opgeslagen,](1) hetzij [II.4.4. met negatief resultaat een test overeenkomstig het Manual of Diagnostic Tests and Vaccines for Terrestrial Animals van de OIE hebben ondergaan voor de opsporing van een ziekteverwekker op een bloedmonster dat op de datum van verzameling of de datum van slachting is genomen. In dat laatste geval zijn de embryo’s geproduceerd zonder dat de zona pellucida is doorgeprikt.]II.5. de uit te voeren embryo’s werden bevrucht door middel van in-vitrofertilisatie met sperma afkomstig van spermacentra of spermaopslagcentra die door de bevoegde autoriteit van een in bijlage I bij Uitvoeringsbesluit 2011/630/EG (4) vermeld derde land of een deel daarvan of door de bevoegde autoriteit van een lidstaat erkend zijn voor de verzameling, behandeling en/of opslag van sperma.OpmerkingenOvereenkomstig artikel 3, onder a), van Richtlijn 89/556/EEG zijn de runderembryo’s die in vitro zijn geproduceerd met sperma uit door het exporterende land erkende spermacentra, en zijn ingevoerd onder de in dit certificaat vastgestelde voorwaarden, uitgesloten van de handel binnen de Unie.Deel I:Vak I.6: in de EU voor de zending verantwoordelijke persoon: dit vak hoeft alleen te worden ingevuld als het een certificaat voor doorvoer is.Vak I.11: plaats van oorsprong: het embryoproductieteam vanwaar de embryo’s naar de Unie zijn verzonden en dat overeenkomstig artikel 8, lid 2, van Richtlijn 89/556/EEG is opgenomen in de lijst op de volgende website van de Commissie:http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htmVak I.22: aantal verpakkingen: komt overeen met het aantal containers.Vak I.23: identificatie van container en zegelnummer moet worden vermeld.Vak I.26: invullen als het om doorvoer, respectievelijk invoer gaat;Vak I.27: invullen als het om doorvoer, respectievelijk invoer gaat;Vak I.28: soort: select amongst „Bos taurus”, „Bison bison” of „Bubalus bubalis” aangeven, naargelang van het geval;categorie: „in vitro geproduceerde embryo’s” aangeven;identiteit moederdier: de officiële identificatie van het dier;identiteit vaderdier: de officiële identificatie van het dier;datum van invriezing vermelden als: dd.mm.jjjj;erkenningsnummer van het team: het embryoproductieteam dat de embryo’s heeft geproduceerd, behandeld en opgeslagen; en dat overeenkomstig artikel 8, lid 2, van Richtlijn 89/556/EEG is opgenomen in de lijst op de volgende website van de Commissie: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htmDeel II:(1) Doorhalen wat niet van toepassing is.(2) Alleen derde landen die zijn opgenomen in bijlage I bij Beschikking 2006/168/EG.(3) Alleen embryoproductieteams die overeenkomstig artikel 8, lid 2, van Richtlijn 89/556/EEG zijn opgenomen in de lijst op de volgende website van de Commissie: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm(4) Alleen derde landen die zijn opgenomen in bijlage I bij Uitvoeringsbesluit 2011/630/EU.De kleur van de handtekening en van het stempel moet verschillen van die van de gedrukte tekst.](./../../../resource.html?uri=celex:02006D0168-20130801.NLD.xhtml.L_2013172NL.01004301.tif.jpg)

BIJLAGE V
VETERINAIR CERTIFICAAT VOOR INVOER BESTEMDE EMBRYO'S VAN ALS HUISDIER GEHOUDEN RUNDEREN DIE ZIJN VERZAMELD OF GEPRODUCEERD VOOR 1 JANUARI 2006



( 1 ) PB L 302 van 19.10.1989, blz. 1. Richtlijn laatstelijk gewijzigd bij Verordening (EG) nr. 806/2003 (PB L 122 van 16.5.2003, blz. 1).
( 2 ) PB L 194 van 22.7.1988, blz. 10. Richtlijn laatstelijk gewijzigd bij Beschikking 2004/101/EG van de Commissie (PB L 30 van 4.2.2004, blz. 15).
( 3 ) PB L 250 van 29.8.1992, blz. 40. Beschikking laatstelijk gewijzigd bij Beschikking 2005/774/EG (PB L 291 van 5.11.2005, blz. 46).
( 4 ) PB L 270 van 15.9.1992, blz. 27. Beschikking laatstelijk gewijzigd bij Beschikking 2004/786/EG (PB L 346 van 23.11.2004, blz. 32).
( 5 ) PB L 69 van 16.3.2005, blz. 41.
( 6 ) PB L 292 van 15.9.2004, blz. 21.


