|
(6)
|
pievieno turpmāk norādīto C.31 līdz C.46 nodaļu: “C.31. SAUSZEMES AUGU TESTS: DĪGSTU UZDĪGŠANAS UN DĪGSTU AUGŠANAS TESTS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 208 (2006. gads). Testēšanas metodes tiek regulāri pārskatītas, ņemot vērā zinātnes attīstību un piemērojamību izmantošanai regulējumā. Šī atjauninātā testa metode ir izstrādāta, lai novērtētu ķīmisko vielu iespējamo ietekmi uz dīgstu uzdīgšanu un augšanu. Tā neattiecas uz hronisku ietekmi vai ietekmi uz vairošanos (t. i., sēklu un ziedu veidošanos, augļu nobriešanu). Lai nodrošinātu, ka tiek izmantotas atbilstošas testēšanas metodes (piemēram, testējot metālus/metāla savienojumus, jāņem vērā pH un saistīto pretēji lādēto jonu ietekme), jāņem vērā ekspozīcijas apstākļi un testējamās ķīmiskās vielas īpašības (1). Šī testa metode neattiecas uz augiem, kas pakļauti ķīmisko vielu izgarojumiem. Testa metode ir piemērojama vispārēju ķīmisko vielu, biocīdu un kultūraugu aizsardzības līdzekļu (ko dēvē arī par augu aizsardzības līdzekļiem vai pesticīdiem) testēšanai. Tā ir izstrādāta, pamatojoties uz esošām metodēm (2)(3)(4)(5)(6)(7). Tika ņemtas vērā arī citas atsauces, kas attiecas uz augu testēšanu (8)(9)(10). Izmantotās definīcijas ir dotas 1. papildinājumā.
|
TESTA PRINCIPS
|
2.
|
Testā izvērtē ietekmi uz augstāko augu dīgstu uzdīgšanu un agrīnu augšanu pēc ekspozīcijas testējamai ķīmiskajai vielai augsnē (vai citā piemērotā augsnes matricā). Sēklas novieto saskarē ar augsni, kas apstrādāta ar testējamo ķīmisko vielu, un ietekmi parasti novērtē 14 līdz 21 dienu pēc tam, kad kontrolgrupā uzdīgst 50 % dīgstu. Izmērāmais mērķis ir vizuāls dīgstu uzdīgšanas novērtējums, asnu saussvars (alternatīvi – asnu svaigsvars) un atsevišķos gadījumos asnu garuma novērtējums, kā arī redzamas kaitīgas ietekmes uz dažādām auga daļām novērtējums. Šos mērījumus un novērojumus salīdzina ar neapstrādātu kontrolgrupas augu rezultātiem.
|
|
3.
|
Atkarībā no prognozējamā ekspozīcijas ceļa testējamā ķīmiskā viela ir jāiestrādā augsnē (vai, iespējams, mākslīgā augsnes matricā) vai ar to jāapstrādā augsnes virskārta, kas pienācīgi atspoguļo iespējamo ķīmiskās vielas ekspozīcijas ceļu. Iestrādi augsnē veic, apstrādājot tādu augsni, kas ņemta ārpus rizosfēras. Pēc augsnes apstrādes to pārvieto uz podiņiem, tad attiecīgo augu sugu sēklas iesētj augsnē. Virsmas apstrādi veic jau podiņos ievietotai augsnei, kurā sēklas jau ir iesētas. Testa vienības (kontrolgrupas un apstrādātas augsnes ar sēklām) pēc tam novieto atbilstošos apstākļos, lai veicinātu dīgšanu/augšanu.
|
|
4.
|
Atkarībā no pētījuma mērķa testu var veikt, lai noteiktu devas un atbildreakcijas līkni vai kā robežtestu vienai koncentrācijai/rādītājam. Ja vienas koncentrācijas/rādītāja testa rezultāti pārsniedz noteiktu toksiskuma līmeni (piemēram, novēro ietekmi, kas lielāka par x %), veic diapazona noteikšanas testu, lai noteiktu augšējo un apakšējo toksicitātes robežu, pēc tam veicot vairākus koncentrācijas/ rādītāja testus, lai izveidotu devas un atbildreakcijas līkni. Jāizmanto piemērota statistiskā analīze, lai noskaidrotu iedarbīgo koncentrāciju ECx vai iedarbīgo apstrādes rādītāju ERx (piemēram, EC25, ER25, EC50, ER50) attiecībā uz visjutīgāko interesējošo parametru vai parametriem. Tāpat arī šajā testā var aprēķināt nenovērojamās ietekmes koncentrāciju (NOEC) un zemāko novērojamās ietekmes koncentrāciju (LOEC).
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
5.
|
Turpmāk minētā informācija ir noderīga ķīmiskās vielas paredzamā ekspozīcijas ceļa identifikācijai un testa izstrādāšanai: struktūrformula, tīrības pakāpe, šķīdība ūdenī, šķīdība organiskos šķīdinātājos, 1-oktanola/ūdens sadalījuma koeficients, augsnes sorbcijas spēja, tvaika spiediens, ķīmiskā stabilitāte ūdenī un gaismā un bioloģiskās noārdīšanās spēja.
|
TESTA DERĪGUMS
|
6.
|
Lai testu varētu uzskatīt par derīgu, kontrolgrupām jāatbilst šādiem testa kritērijiem:
|
—
|
dīgstu uzdīgšana ir vismaz 70 %;
|
|
—
|
dīgstiem nav redzama fitotoksiska ietekme (piemēram, hloroze, nekroze, vīte, lapu un stublāja deformācijas), un augi uzrāda tikai konkrētās sugas augšanas un morfoloģijas parastās variācijas;
|
|
—
|
pētījuma laikā vidējais izdīgušo kontrolgrupas dīgstu izdzīvošanas rādītājs ir vismaz 90 %;
|
|
—
|
konkrētās sugas vidiskie apstākļi ir identiski, un barotne satur vienādu daudzumu augsnes matricas, augšanas veicināšanas barotnes vai tā paša avota substrāta.
|
|
ĶĪMISKĀ STANDARTVIELA
|
7.
|
Ķīmisko standartvielu var regulāri testēt, lai pārliecinātos, ka testa veiktspēja un konkrēto testa augu atbildreakcija, kā arī testa apstākļi laika gaitā nav būtiski mainījušies. Alternatīvi kontrolgrupās veiktus vēsturiskos biomasas vai augšanas mērījumus var izmantot, lai novērtētu testa sistēmas veiktspēju konkrētā laboratorijā, un tos var izmantot par laboratorijas iekšējās kvalitātes kontroles pasākumiem.
|
TESTĒŠANAS METODES APRAKSTS
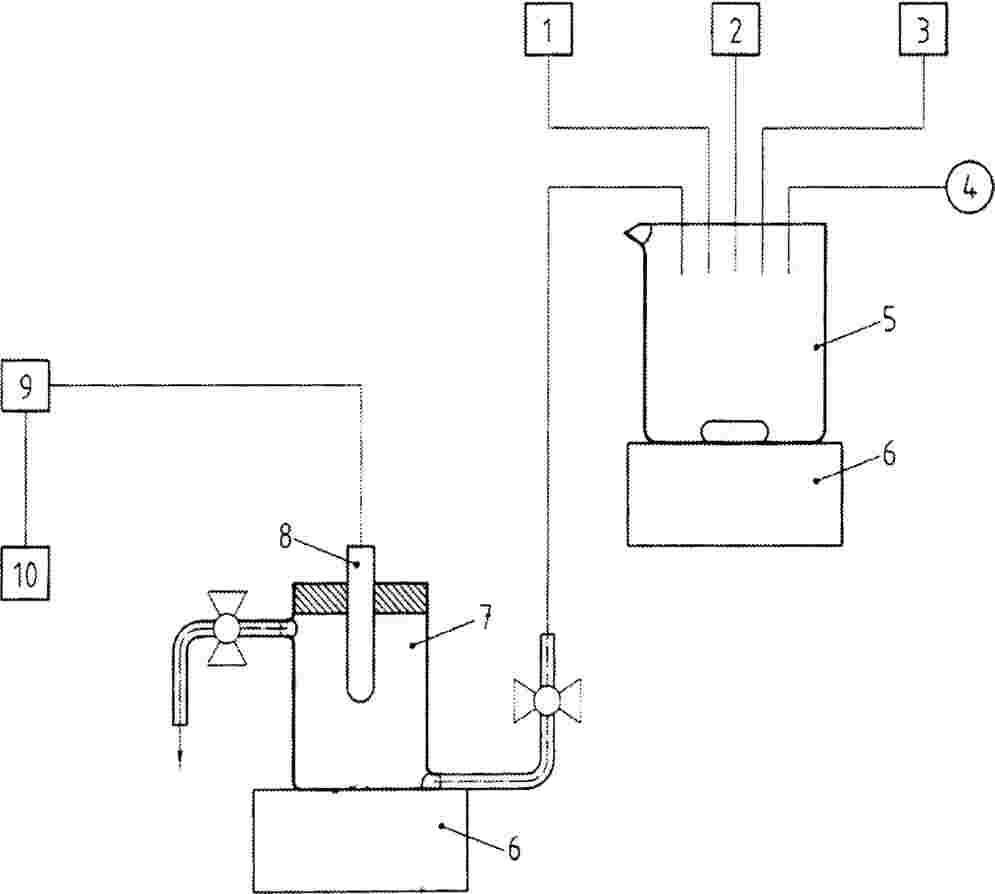
Dabiska augsne – mākslīgs substrāts
|
8.
|
Augus var audzēt podos, izmantojot smilšainu smilšmālu, smilšmālainu smilti vai smilšainu, mālainu smilšmālu, kas satur līdz 1,5 procentiem organiskā oglekļa (aptuveni 3 procenti organisko vielu). Var izmantot arī komerciālo stādu augsni vai sintētisko augsnes maisījumu, kas satur līdz 1,5 procentus organiskā oglekļa. Mālainas augsnes nevajadzētu lietot, ja ir zināms, ka testējamajai ķīmiskajai viela ir augsta māltiece. Lauka augsne jāizsijā līdz 2 mm daļiņu lielumam, lai to homogenizētu un atdalītu rupjās daļiņas. Pārskatā jāiekļauj informācija par gatavās augsnes veidu un tekstūru, organiskā oglekļa %, pH līmeni un sāls saturu, kā arī elektrovadītspēju. Augsne ir jāklasificē atbilstoši standarta klasifikācijas shēmai (11). Augsni var pasterizēt vai karsēt, lai samazinātu augsnes patogēnu ietekmi.
|
|
9.
|
Dabiska augsne var sarežģīt rezultātu interpretēšanu un mainīgo fizikālķīmisko īpašību un mikroorganismu populāciju dēļ palielināt mainīgumu. Šie mainīgie savukārt ietekmē mitrumnoturspēju, ķīmisko vielu saistīšanas spēju, aerāciju un barības vielu un mikroelementu saturu. Papildus šo fizisko faktoru atšķirībām būs arī ķīmisko īpašību atšķirības, piemēram, atšķirīgs pH līmenis un redokspotenciāls, kas var ietekmēt testējamās ķīmiskās vielas bioloģisko pieejamību (12)(13)(14).
|
|
10.
|
Mākslīgos substrātus parasti neizmanto augu aizsardzības līdzekļu testēšanai, taču tie var būt noderīgi vispārēju ķīmisku vielu testēšanai vai gadījumos, kad ir nepieciešams samazināt dabisko augšņu mainīgumu un palielināt testa rezultātu salīdzināmību. Izmantojamajiem substrātiem ir jāsastāv no inertiem materiāliem, lai mazinātu mijiedarbību ar testējamo ķīmisko vielu, ar šķīdinātāja nesēju vai abiem. Skābē mazgātas kvarca smiltis, minerālvate un stikla pērlītes (piemēram, 0,35–0,85 mm diametrā) ir atzītas par piemērotu inertu materiālu, kas minimāli absorbē testējamo ķīmisko vielu (15), nodrošinot, ka ķīmiskā viela būs maksimāli pieejama dīgstiem caur saknēm. Nepiemēroti substrāti ir vermikulīts, perlīts vai citi materiāli ar augstu absorbcijas spēju. Jānodrošina uzturvielas augu augšanai, lai nodrošinātu, ka augi netiek pakļauti stresam barības vielu trūkuma dēļ, un, ja iespējams, tas ir jānovērtē, veicot ķīmiskās analīzes vai vizuāli novērtējot kontrolgrupas augus.
|
Kritēriji testa sugu atlasei
|
11.
|
Sugu atlasei jābūt saprātīgi plašai, piemēram, attiecībā uz to taksonomisko daudzveidību augu valstī, to izplatību, pieejamību, konkrētai sugai raksturīgo dzīves ciklu un dabisko areālu, lai iegūtu plašu atbildreakciju klāstu (8)(10)(16)(17)(18)(19)(20). Izvēloties iespējamās testa sugas, jāņem vērā turpmāk norādītie rādītāji:
|
—
|
suga ir vienādas sēklas, kas ir viegli pieejamas no uzticamā standarta sēklu avotā vai avotiem un kam raksturīga konsekventa, uzticama un vienmērīga dīgšana, kā arī vienāda dīgstu augšana;
|
|
—
|
augs ir piemērots testēšanai laboratorijā, un ar to var iegūt ticamus un reproducējamus rezultātus vienā un vairākās testēšanas iekārtās;
|
|
—
|
testēšanā iekļautās sugas augu jutīgumam jāsaskan ar to augu atbildreakcijām, kas atrodami vidē un eksponēti ķīmiskajai vielai;
|
|
—
|
tie jau iepriekš zināmā mērā izmantoti toksicitātes testos, un to izmantošana, piemēram, herbicīdu biotestos, smago metālu skrīningā, sāļuma vai minerālvielu stresa testos vai allelopātijas pētījumos norāda uz to jutīgumu pret daudziem dažādiem faktoriem;
|
|
—
|
tie ir piemēroti šajā testa metodē izmantotajiem augšanas apstākļiem;
|
|
—
|
tie atbilst testa derīguma kritērijiem.
|
Dažas no vēsturiski testos visvairāk izmantotajām sugām ir uzskaitītas 2. pielikumā, un potenciālās sugas, kas nav kultūraugi, ir 3. papildinājumā.
|
|
12.
|
Testā iekļauto sugu skaits ir atkarīgs no attiecīgajām normatīvajām prasībām, tāpēc tas šajā testa metodē nav norādīts.
|
Testējamās ķīmiskās vielas ievadīšana
|
13.
|
Ķīmiskā viela ir jāpievieno piemērotam nesējam (piemēram, ūdenim, acetonam, etilspirtam, polietilēnglikolam, akāciju sveķiem (gumiarābikam), smiltij). Var testēt arī maisījumus (preparātus vai preparātu maisījumus), kas satur aktīvās vielas un dažādas palīgvielas.
|
Iestrāde augsnē/mākslīgā substrātā
|
14.
|
Ķīmiskās vielas, kas ir ūdenī šķīstošas vai suspendētas ūdenī, var pievienot ūdenim, un pēc tam šķīdumu sajauc ar augsni, izmantojot atbilstošas maisīšanas ierīces. Šī veida testēšana var būt lietderīga, ja ekspozīcija ķīmiskajai vielai notiek caur augsni vai augsnes porūdeni un ja pastāv bažas par uzņemšanu ar saknēm. Pievienojot testējamo ķīmisko vielu, nedrīkst pārsniegt augsnes ūdensnoturspēju. Pievienotā ūdens tilpumam ir jābūt vienādam visās testa koncentrācijās, bet tas jāierobežo, lai novērstu augsnes salipšanu.
|
|
15.
|
Ķīmiskās vielas ar vāju šķīdību ūdenī izšķīdina piemērotā gaistošā šķīdinātājā (piemēram, acetons, etanols) un sajauc ar smiltīm. Šķīdinātāju pēc tam no smiltīm var atdalīt, izmantojot gaisa plūsmu, vienlaikus nepārtraukti maisot smiltis. Apstrādātās smiltis sajauc ar eksperimentālo augsni. Izveido otro kontrolparaugu, kurā pievieno tikai smiltis un šķīdinātāju. Visiem testa apstrādes paraugiem un otrajam kontrolparaugam pievieno vienādu daudzumu smilšu, kas sajauktas ar šķīdinātāju, kurš pēc tam atdalīts. Cietu, nešķīstošu testējamo ķīmisko vielu gadījumā sauso augsni un ķīmisko vielu sajauc piemērotā maisīšanas ierīcē. Pēc tam augsni ieliek podos un nekavējoties iesēj sēklas.
|
|
16.
|
Ja augsnes vietā izmanto mākslīgo substrātu, ķīmiskās vielas, kas šķīst ūdenī, var izšķīdināt barības vielu šķīdumā tieši pirms testa sākuma. Ķīmiskās vielas, kas nešķīst ūdenī, bet kuras var suspendēt ūdenī, izmantojot šķīdinātāja nesējvielu, būtu jāpievieno barības vielu šķīdumam kopā ar nesējvielu. Ūdenī nešķīstošas ķīmiskās vielas, kurām nav pieejama netoksiska ūdenī šķīstoša nesējviela, jāizšķīdina piemērotā gaistošā šķīdinātājā. Šķīdumu sajauc ar smiltīm vai stikla pērlītēm, kas novietotas rotācijas vakuumierīcē, un iztvaicē, atstājot uz smiltīm vai lodītēm viendabīgu ķīmiskās vielas pārklājumu. Nosvērta pērlīšu daļa jāekstrahē ar to pašu organisko šķīdinātāju un ķīmiski jātestē, pirms tiek piepildīti stādīšanas konteineri.
|
Virsas apstrāde
|
17.
|
Attiecībā uz kultūraugu aizsardzības līdzekļiem apstrādei ar testējamo ķīmisko vielu bieži izmanto augsnes virsas apsmidzināšanu ar testa šķīdumu. Visām iekārtām, ko izmanto testu veikšanai, tostarp iekārtām, ko izmanto testējamās ķīmiskas vielas sagatavošanai un administrēšanai, jābūt tā konstruētām un ar tādu jaudu, lai testus ar šo ierīci varētu veikt pareizi un tie nodrošinātu reproducējamu pārklājumu. Visa augsnes virsa jānoklāj vienmērīgi. Būtu jāizvairās no situācijas, kad ķīmiskā vielu tiek adsorbēta vai reaģē ar aprīkojumu (piemēram, plastmasas caurulēm un lipofilajām ķīmiskajām vielām vai tērauda daļām un elementiem). Testējamo ķīmisko vielu izsmidzina uz augsnes virsas, imitējot tipisku uzklāšanu ar izsmidzinātāju. Kopumā izsmidzināšanas apjomam jābūt atbilstošiem parastā lauksaimniecības praksē izmantotajam un apjoms (ūdens daudzums utt.) ir jāietver pārskatā. Jāizvēlas tāds sprauslu veids, kas nodrošina vienmērīgu augsnes virsas noklāšanu. Ja tiek izmantoti šķīdinātāji un nesējvielas, jāizveido otra kontrolaugu kopa, kas saņem tikai šķīdinātāju/nesējvielu. Tas nav jādara, ja augu aizsardzības līdzekļus testē kā preparātus.
|
Testējamās ķīmiskās vielas koncentrācijas/rādītāja verifikācija
|
18.
|
Apstrādes koncentrācijas/rādītāji jāapstiprina, veicot attiecīgu analītisko verifikāciju. Šķīstošām vielām visas testa koncentrācijas/rādītājus var verificēt un apstiprināt, analizējot augstāko testā izmantoto šķīduma koncentrāciju, dokumentējot turpmāko atšķaidīšanu un izmantojot kalibrētas vielas uzklāšanas iekārtas (piemēram, kalibrēti analītiskie stikla trauki, smidzinātāja iekārtas kalibrēšana). Nešķīstošām ķīmiskajām vielām sastāvdaļu materiāla verifikācija jānodrošina ar augsnei pievienotās testējamās ķīmiskās vielas nosvēršanu. Ja nepieciešams uzrādīt homogenitāti, var būt nepieciešams veikt augsnes analīzes.
|
PROCEDŪRA
Testēšanas plāns
|
19.
|
Vienas sugas sēklas tiek iesētas podos. Podos iesēto augu sēklu skaits ir atkarīgs no augu sugas, poda izmēra un testa ilguma. Jānodrošina tāds augu skaits podā, lai būtu atbilstoši augšanas apstākļi un podi testa veikšanas laikā nebūtu pārblīvēti. Maksimālais augu blīvums ir aptuveni 3–10 sēklas uz 100 cm2, atkarībā no sēklu izmēra. Piemēram, ieteicams viens vai divi kukurūzas, sojas pupiņu, tomātu, gurķu vai cukurbiešu augi 15 cm traukā, trīs rapša vai zirņu augi 15 cm traukā un 5 līdz 10 sīpolu, kviešu, vai citu sīku sēklu 15 cm traukā. Sēklu skaitam un replikātu podu (replikāts saskaņā ar definīciju ir pods, tāpēc augi vienā podā neveido replikātu) skaitam jābūt pietiekamam optimālai statistiskai analīzei (21). Jāievēro, ka mainīgums būs lielāks tām testa sugām, kurām izmanto mazāku skaitu lielu sēklu vienā podā (replikātā), salīdzinot ar testa sugām, kurām katrā podā iespējams izmantot lielāku skaitu sīku sēklu. Stādot vienādu skaitu sēklu katrā podā, šo mainību var samazināt līdz minimumam.
|
|
20.
|
Kontrolgrupas izmanto, lai nodrošinātu, ka novērotā ietekme ir saistīta tikai ar ekspozīciju testējamai ķīmiskajai vielai vai attiecināma uz to. Atbilstošajai kontrolgrupai ir visos aspektos jābūt identiskai testa grupai, izņemot to, ka tā netiek eksponēta testējamai ķīmiskajai vielai. Attiecīgajā testā visiem testa augiem, tostarp kontrolgrupai, vajadzētu būt no viena avota. Lai novērstu neobjektivitāti, testa un kontrolgrupas podi jāizraugās pēc nejaušības principa.
|
|
21.
|
Būtu jāizvairās izmantot sēklas, kas pārklātas ar insekticīdu vai fungicīdu (t. i., “apstrādātas” sēklas). Tomēr dažas regulējošās iestādes atļauj noteiktu ārpussistēmas saskares fungicīdu (piemēram, kaptāna, tirama) lietošanu (22). Ja ir bažas par patogēniem sēklās, sēklas uz neilgu laiku var iemērkt vājā 5 % hipohlorīta šķīdumā, pēc tam kārtīgi noskalot tekošā ūdenī un izžāvēt. Nav atļauta nekāda korektīva apstrāde ar citu augu aizsardzības līdzekli.
|
Testa apstākļi
|
22.
|
Testa apstākļi būtu jātuvina tiem apstākļiem, kas nepieciešami normālai testa sugu un varietāšu augšanai (4. papildinājumā ir norādīti testa apstākļu piemēri). Arī dīgstošie augi jātur atbilstoši labai dārzkopības praksei kontrolētas vides kamerās, augšanas kamerās vai siltumnīcās. Izmantojot augšanas iekārtas, šāda prakse parasti ietver kontroli un šādu datu pietiekami biežu (piemēram, ik dienas) reģistrāciju: temperatūra, mitrums, oglekļa dioksīda koncentrācija, gaisma (intensitāte, viļņu garums, fotosintēzes aktivitātei atbilstošā spektra daļa) un gaismas periodu, laistīšanas līdzekļi utt., lai nodrošinātu labu augšanu, ko novērtē ar izraudzītās sugas kontrolaugiem. Siltumnīcā temperatūru kontrolē, izmantojot ventilēšanas, apkures un/vai dzesēšanas sistēmas. Turpmāk norādīti apstākļi, kas ieteicami testēšanai siltumnīcās:
|
—
|
temperatūra: 22 °C ± 10 °C;
|
|
—
|
fotoperiods: gaisma vismaz 16 stundas;
|
|
—
|
gaismas intensitāte: 350 ± 50 μE/m2/s. Ja gaismas intensitāte nokrītas zem 200 μE/m2/s, viļņu garuma 400–700 nm, var būt nepieciešama papildu apgaismošana, izņemot noteiktām sugām, kuru prasības pēc gaismas ir zemākas.
|
Pētījuma laikā jāmonitorē un pārskatā jāiekļauj informācija par vides apstākļiem. Augi audzējami neporainos plastmasas vai glazētos podos ar paplāti vai paliktni zem tiem. Laiku pa laikam podi ir jāpārvieto, lai līdz minimumam samazinātu mainību augu augšanā (audzēšanas iekārtu testēšanas apstākļu atšķirību dēļ). Podiem ir jābūt pietiekami lieliem, lai nodrošinātu normālu augšanu.
|
|
23.
|
Augsnes barības vielas var papildināt, cik nepieciešams, lai uzturētu labu dzīvotspēju. Par papildu barības vielu nepieciešamību un padeves laiku var spriest, novērojot kontrolaugus. Testa konteineros ieteicama laistīšana no apakšas (piemēram, izmantojot stikla šķiedras daktis). Tomēr sākotnēji var izmantot laistīšanu no augšas, lai stimulētu sēklu dīgšanu; paraugos, kur veikta augsnes virsas apstrāde, tas atvieglos ķīmiskās vielas virzību augsnē.
|
|
24.
|
Konkrētajiem augšanas apstākļiem ir jābūt piemērotiem testa sugām un testējamajām ķīmiskajām vielām. Kontrolaugi un apstrādātie augi ir jāglabā vienādos vides apstākļos, tomēr būtu jāveic piemēroti pasākumi, lai novērstu šķērsekspozīciju (piemēram, gaistošām ķīmiskajām vielām) starp dažādiem apstrādes testējamās ķīmiskās vielas paraugiem un kontrolgrupām.
|
Vienas koncentrācijas/rādītāja testēšana
|
25.
|
Lai noteiktu ķīmiskās vielas koncentrāciju/rādītāju, ar kuru veikt vienas koncentrācijas/rādītāja (provocēšanas/robežas) testu, ir jāņem vērā vairāki faktori. Vispārējām ķīmiskām vielām tie ietver arī vielas fizikālķīmiskās īpašības. Attiecībā uz augu aizsardzības līdzekļiem jāņem vērā testējamās ķīmiskās vielas fizikālķīmiskās īpašības un izmantošanas modelis, testējamās ķīmiskās vielas maksimālā koncentrācija vai lietojuma deva, lietošanas reižu skaits vienā sezonā un/vai noturība. Lai noteiktu, vai vispārējai ķīmiskai vielai piemīt fitotoksiskas īpašības, to var būt lietderīgi pārbaudīt testā maksimālajā līmenī – 1 000 mg/kg sausas augsnes.
|
Diapazona noteikšanas tests
|
26.
|
Ja nepieciešams, diapazona noteikšanas testu var veikt, lai gūtu norādījumus par koncentrācijām/rādītājiem, kas jātestē galīgajā devas un atbildreakcijas pētījumā. Diapazona noteikšanas testā testa koncentrācijām/rādītājiem jābūt ar plašiem intervāliem (piemēram, 0,1, 1,0, 10, 100 un 1 000 mg/kg sausas augsnes). Augu aizsardzības līdzekļu koncentrācijas/rādītāji varētu būt balstīti uz ieteicamo vai maksimālo koncentrāciju vai lietošanas rādītāju, piemēram, 1/100, 1/10, 1/1 no ieteicamās/maksimālās koncentrācijas vai lietošanas rādītāja.
|
Vairāku koncentrāciju/daudzumu testēšana
|
27.
|
Vairāku koncentrāciju/rādītāju testa mērķis ir noteikt devas un atbildreakcijas sakarību un noteikt ECx vai ERx vērtību uzdīgšanai, biomasai un/vai redzamajai ietekmei, salīdzinot ar kontrolgrupām, kuras nav eksponētas vielai, saskaņā ar pārvaldes iestāžu prasībām.
|
|
28.
|
Koncentrāciju vai rādītāju skaitam un intervāliem būtu jābūt pietiekamiem, lai varētu iegūt uzticamu devas un atbildreakcijas sakarību un regresijas vienādojumu, kā arī aplēst ECx vai ERx vērtības. Izraudzītajām koncentrācijām/rādītājiem būtu jāietver nosakāmās ECx vai ERx vērtības. Piemēram, ja ir nepieciešama EC50 vērtība, būtu vēlams veikt testēšanu pie rādītājiem, kas rada 20 līdz 80 % ietekmi. Lai to sasniegtu, ieteicamais testa koncentrāciju/rādītāju skaits ir vismaz pieci ģeometriskā progresijā un neapstrādātā kontrole intervālos ar kvocientu, kas nepārsniedz trīs. Katrā apstrādes grupā un kontrolgrupā ir jābūt vismaz četriem replikātiem un kopā vismaz 20 sēklām. Tādiem augiem, kam ir zema dīgtspēja vai mainīgi augšanas paradumi, var būt nepieciešams izmantot vairāk replikātu, lai uzlabotu testa statistisko jaudu. Ja tiek izmantots lielāks skaits testa koncentrāciju/rādītāju, replikātu skaitu var samazināt. Ja ir jānosaka NOEC, var būt nepieciešams izveidot vairāk replikātu, lai panāktu vēlamo statistisko jaudu (23).
|
Novērojumi
|
29.
|
Novērošanas periodā, proti, 14 līdz 21 dienu pēc tam, kad ir izdīguši 50 % no kontrolgrupas augiem (arī šķīdinātāja kontrolgrupas augiem, ja tāda ir), augus novēro bieži (vismaz reizi nedēļā, bet, ja iespējams, ik dienas) attiecībā uz to uzdīgšanu un redzamo fitotoksiskumu un mirstību. Testa beigās reģistrē izdzīvojušo augu uzdīgšanas un biomasas procentuālos mērījumus, kā arī redzamo kaitīgo ietekmi uz dažādām auga daļām. Tas ietver uzdīgušo dīgstu izskata anomālijas, kavētu augšanu, hlorozi, krāsas zaudēšanu, mirstību un ietekmi uz augu attīstību. Galīgo biomasu var izmērīt, izmantojot izdzīvojušo augu galīgo vidējo sauso dzinumu svaru, ievācot dzinumus pie augsnes virskārtas un tos žāvējot līdz nemainīgam svaram 60 °C temperatūrā. Galīgo biomasu var mērīt, arī izmantojot svaigu dzinumu svaru. Ja to prasa pārvaldes iestādes, beigupunkts var būt arī dzinumu garums. Būtu jāizmanto vienota vizuālo bojājumu uzskaites sistēma, lai novērtētu toksicitātes atbildreakcijas. Piemēri kvalitatīvā un kvantitatīvā vizuālā novērtējuma veikšanai ir doti atsaucēs (23)(24).
|
DATI UN PĀRSKATU SAGATAVOŠANA
Statistiskā analīze
Vienas koncentrācijas/rādītāja tests
|
30.
|
Dati par katru augu sugu ir jāanalizē, izmantojot piemērotu statistisko metodi (21). Jāreģistrē testa koncentrācijas/rādītāja ietekmes līmenis vai arī attiecīgās ietekmes nesasniegšana pie testa koncentrācijas/rādītāja (piemēram, < x % ietekme, novērota pie y koncentrācijas vai rādītāja)
|
Vairāku koncentrāciju/rādītāju tests
|
31.
|
Devas un atbildreakcijas sakarību nosaka regresijas vienādojuma izteiksmē. Var izmantot dažādus modeļus, piemēram, ECx vai ERx noteikšanai (piemēram, EC25, ER25, EC50, ER50) un tā uzdīgšanas ticamības robežām var būt piemēroti binārie dati, logita, probita, Veibula, Spīrmena–Kerbera saīsinātā metode. Dīgstu augšanu (svars un garums) kā nepārtrauktus ECx vai ERx beigupunktus un to ticamības robežas var aprēķināt, izmantojot atbilstošu regresijas analīzi (piemēram, Brūsa–Ferštēga (Bruce-Versteeg) nelineārās regresijas analīzi (25)). Kad vien iespējams, visjutīgākajām sugām R2 ir jābūt 0,7 vai augstākam un izmantotajām testa koncentrācijām/rādītājiem jāietver 20 % līdz 80 % ietekmes. Ja jānosaka NOEC, būtu jādod priekšroka jaudīgu statistisko testu izmantošanai un tie būtu jāizvēlas, balstoties uz datu sadalījumu (21)(26).
|
Testēšanas pārskats
|
32.
|
Testēšanas pārskatā jāparāda pētījumu rezultāti, kā arī sīks testa apstākļu apraksts, detalizēta rezultātu apspriešana, datu analīze un analīzes rezultātā izdarītie secinājumi. Jāsniedz arī pārskats tabulas veidā un rezultātu kopsavilkums. Pārskatā iekļauj turpmāk norādītos elementus.
|
|
Testējamā ķīmiskā viela:
|
—
|
ķīmiskās vielas identifikācijas dati, attiecīgās testējamās ķīmiskās vielas īpašības (piemēram, log Pow, šķīdība ūdenī, tvaika spiediens un informācija par vielas apriti vidē un mijiedarbību ar to, kā arī uzvedība, ja informācija ir pieejama);
|
|
—
|
informācija par testa šķīduma pagatavošanu un testa koncentrāciju verifikāciju, kā norādīts 18. punktā.
|
|
|
|
Testa suga:
|
—
|
informācija par testa organismu: suga/varietāte, augu dzimtas, zinātniskie un vispārpieņemtie nosaukumi, pēc iespējas sīkāka informācija par sēklu avotu un vēsturi (t. i., piegādātāja nosaukums, dīgtspēja procentos, sēklu lieluma klase, grupas vai partijas numurs, sēklu ievākšanas gads vai augšanas sezona, dīgtspējas novērtējuma datums), dzīvotspēja utt.;
|
|
—
|
testēto viendīgļlapju un divdīgļlapju sugu skaits;
|
|
—
|
sugu izraudzīšanās pamatojums;
|
|
—
|
sēklu uzglabāšanas, apstrādes un uzturēšanas apraksts.
|
|
|
|
Testa apstākļi:
|
—
|
testēšanas iekārta (piemēram, augšanas kamera, fitotrons vai siltumnīca);
|
|
—
|
testēšanas sistēmas apraksts (piemēram, podu izmēri, podu materiāli un augsnes daudzums);
|
|
—
|
augsnes apraksts (augsnes tekstūra vai tips: augsnes daļiņu sadalījums un klasifikācija, fizikālķīmiskās īpašības, tostarp organisko vielu %, organiskā oglekļa % un pH);
|
|
—
|
augsnes/substrāta (piemēram, augsnes, mākslīgās augsnes, smiltšu un citu) sagatavošana pirms testa;
|
|
—
|
barotnes apraksts, ja tādu izmanto;
|
|
—
|
testējamās ķīmiskās vielas lietojums: lietošanas metodes apraksts, aprīkojuma apraksts, ekspozīcijas rādītāji un apjomi, tostarp ķīmiskā verifikācija, kalibrēšanas metodes apraksts un lietošanas laika vides apstākļu apraksts;
|
|
—
|
augšanas apstākļi: gaismas intensitāte (piemēram, PAR, fotosintēzes aktivitātei atbilstošā spektra daļa), fotoperiods, maksimālā/minimālā temperatūra, laistīšanas grafiks un metode, mēslošana;
|
|
—
|
sēklu skaits podā, augu skaits uz devu, replikātu (podu) skaits uz ekspozīcijas rādītāju;
|
|
—
|
kontrolparaugu veids un skaits (negatīvi un/vai pozitīvi kontrolparaugi, arī šķīdinātāja kontrolparaugs, ja tādu izmanto);
|
|
|
|
Rezultāti:
|
—
|
tabula par katra replikāta, testa koncentrācijas/rādītāja un sugas beigupunktiem;
|
|
—
|
uzdīgušo dīgstu skaits un procentuālais salīdzinājums ar kontrolparaugiem;
|
|
—
|
biomasas mērījumi (dzinumu saussvars vai svaigsvars) procentos no kontrolparaugiem;
|
|
—
|
augu dzinumu garums procentos no kontrolparaugiem, ja to mēra;
|
|
—
|
testējamās ķīmiskās vielas iedarbībā radušos redzamo bojājumu procentuālā vērtība un kvalitatīvs un kvantitatīvs redzamo bojājumu apraksts (hloroze, nektroze, vīte, lapu un stublāju deformācija, kā arī nenovērota ietekme), salīdzinot ar kontrolgrupas augiem;
|
|
—
|
izmantotās vērtējuma skalas apraksts, ar kuru novērtē redzamos bojājumus, ja tiek sniegts vizuāls vērtējums;
|
|
—
|
viena rādītāja pētījumiem pārskatā jāiekļauj bojājumi procentos;
|
|
—
|
ECx vai ERx (piemēram, EC50, ER50, EC25, ER25) vērtības un ar tām saistītās ticamības robežas. Ja ir veikta regresijas analīze, norāda regresijas vienādojuma standartkļūdu un individuālo parametru novērtējuma standartkļūdu (piemēram, virziena koeficients, krustpunkts);
|
|
—
|
NOEC (un LOEC) vērtība, ja tā aprēķināta;
|
|
—
|
statistisko procedūru un izmantoto pieņēmumu apraksts;
|
|
—
|
šo datu un testētās sugas devas un atbildreakcijas sakarības grafisks attēlojums.
|
|
Ziņo par atkāpēm no testa procedūrām, kas aprakstītas šajā testa metodē, un jebkuriem neraksturīgiem notikumiem testa laikā.
|
LITERATŪRA
|
(1)
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
International Organisation of Standards. (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards. (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Ind. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
(19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OECD (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Šā pielikuma C33. nodaļa “Slieku vairošanās tests (Eisenia fetida/Eisenia andrei)”.
|
1. papildinājums
Definīcijas
|
|
Aktīvā sastāvdaļa (AS) (vai aktīvā viela (AV)) ir viela, ar ko paredzēts nodrošināt īpašu bioloģisko ietekmi (piemēram, insektu kontroli, augu slimību kontroli, nezāļu kontroli apstrādes zonā); to dēvē arī par tehniskās tīrības pakāpes aktīvo sastāvdaļu, aktīvo vielu.
|
|
|
Ķīmiskā viela ir viela vai to maisījums.
|
|
|
Kultūraugu aizsardzības līdzekļi
(CPP)
vai augu aizsardzības produkti
(PPP)
, vai pesticīdi ir tādas vielas ar noteiktu bioloģisko aktivitāti, ko ar nolūku lieto kultūraugu aizsargāšanai pret kaitēkļiem (piemēram, sēnīšu slimībām, kukaiņiem un konkurējošiem augiem).
|
|
|
ECx. X % ietekmes koncentrācija vai ERx. x % ietekmes rādītājs ir koncentrācija vai rādītājs, kas mērītajā testa beigupunktā rada nelabvēlīgas x % izmaiņas salīdzinājumā ar kontrolgrupu (piemēram, par 25 % vai 50 % samazina dīgstu uzdīgšanu, dzinumu svaru, galīgo augu skaitu vai palielina vizuālos bojājumus, kas attiecīgi atbilstu EC25/ER25 vai EC50/ER50).
|
|
|
Uzdīgšana ir koleoptila vai dīgļlapas parādīšanās virs augsnes virsas.
|
|
|
Preparāts ir komerciāls produkts, kas satur aktīvo vielu (aktīvo sastāvdaļu), pazīstams arī kā galapreparāts (8) vai tipisks galapatēriņa produkts (TEP).
|
|
|
Zemākā novērojamās ietekmes koncentrācija
(LOEC)
ir zemākā testējamās ķīmiskās vielas koncentrācija, pie kuras novērota ietekme. Šajā testā koncentrācijai, kas atbilst LOEC, attiecīgajā ekspozīcijas periodā, salīdzinot ar kontrolgrupu, ir statistiski nozīmīga ietekme (p < 0,05) un tā ir augstāka par NOEC vērtību.
|
|
|
Nemērķa augi ir augi, kas neatrodas mērķaugu zonā. Attiecībā uz kultūraugu aizsardzības līdzekļiem tas parasti attiecas uz augiem ārpus apstrādes zonas.
|
|
|
Nenovērojamās ietekmes koncentrācija
(NOEC)
ir testējamās ķīmiskās vielas koncentrācija, pie kuras nav novērota nekāda ietekme. Šajā testā koncentrācijai, kas atbilst NOEC, attiecīgajā ekspozīcijas periodā, salīdzinot ar kontrolgrupu, nav statistiski nozīmīgas ietekmes (p < 0,05).
|
|
|
Fitotoksiskums: kaitīgās novirzes (saskaņā ar mērījumiem un vizuālo novērtējumu) no normāla augu izskata un augšanas konkrētas ķīmiskās vielas ietekmē.
|
|
|
Replikāts ir eksperimenta vienība, kas reprezentē kontrolgrupu un/vai apstrādes grupu. Šajos pētījumos audzēšanas pods pēc definīcijas ir replikāts.
|
|
|
Vizuāls novērtējums: vizuālo bojājumu novērtējums, kura pamatā ir auga stāves, augtspēja, anomāliju, hlorozes, nekrozes un vispārējā izskata novērojumi, ko salīdzina ar kontrolgrupu.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai to maisījums, kuru testē, izmantojot šo testēšanas metodi.
|
2. papildinājums
To augu sugu saraksts, kas vēsturiski izmantoti testēšanā
|
Dzimta
|
Suga
|
Vispārpieņemtie nosaukumi
|
|
DIVDĪGĻLAPJI (DICOTYLEDONAE)
|
|
Čemurziežu
|
Daucus carota
|
Savvaļas burkāns
|
|
Kurvjziežu
|
Helianthus annuus
|
Vasaras saulgrieze
|
|
Kurvjziežu
|
Lactuca sativa
|
Dārza salāti
|
|
Krustziežu
|
Sinapis alba
|
Baltā sinepe
|
|
Krustziežu
|
Brassica campestris var. chinensis
|
Ķīnas kāposts
|
|
Krustziežu
|
Brassica napus
|
Rapsis
|
|
Krustziežu
|
Brassica oleracea var. capitata
|
Galviņkāposts
|
|
Krustziežu
|
Brassica rapa
|
Ripsis
|
|
Krustziežu
|
Lepidium sativum
|
Dārza cietķērsa
|
|
Krustziežu
|
Raphanus sativus
|
Rutks (redīss)
|
|
Balandu
|
Beta vulgaris
|
Biete
|
|
Ķirbju
|
Cucumis sativus
|
Lauka gurķis
|
|
Tauriņziežu
|
Glycine max (G. soja)
|
Soja
|
|
Tauriņziežu
|
Phaseolus aureus
|
Zeltainā pupiņa
|
|
Tauriņziežu
|
Phaseolus vulgaris
|
Parastā pupiņa
|
|
Tauriņziežu
|
Pisum sativum
|
Sējas zirnis
|
|
Tauriņziežu
|
Trigonella foenum-graecum
|
Grieķu trigonella
|
|
Tauriņziežu
|
Lotus corniculatus
|
Ragainais vanagnadziņš
|
|
Tauriņziežu
|
Trifolium pratense
|
Pļavas āboliņš
|
|
Tauriņziežu
|
Vicia sativa
|
Sējas vīķis
|
|
Linu
|
Linum usitatissimum
|
Sējas lins
|
|
Sūreņu
|
Fagopyrum esculentum
|
Sējas griķis
|
|
Nakteņu
|
Solanum lycopersicon
|
Parastais tomāts
|
|
VIENDĪGĻLAPJI (MONOCOTYLEDONAE)
|
|
Liliju
|
Allium cepa
|
Dārza sīpols
|
|
Graudzāļu
|
Avena sativa
|
Sējas auza
|
|
Graudzāļu
|
Hordeum vulgare
|
Parastais miezis
|
|
Graudzāļu
|
Lolium perenne
|
Daudzgadīgā airene
|
|
Graudzāļu
|
Oryza sativa
|
Sējas rīss
|
|
Graudzāļu
|
Secale cereale
|
Sējas rudzi
|
|
Graudzāļu
|
Sorghum bicolor
|
Parastais sorgo
|
|
Graudzāļu
|
Triticum aestivum
|
Parastais kviesis
|
|
Graudzāļu
|
Zea mays
|
Parastā kukurūza
|
3. papildinājums
Potenciālais saraksts sugām, kas nav kultūraugi
ESAO potenciālās sugas augu toksicitātes testiem
Piezīme: turpmākajā tabulā ir sniegta informācija par 52 sugām, kas nav kultūraugi (katram ierakstam iekavās ir sniegtas atsauces). Uzdīgšanas rādītāji ir aizgūti no publicētās literatūras, un tie ir paredzēti tikai kā vispārēja norāde. Individuālā pieredze var atšķirties atkarībā no sēklu izcelsmes un citiem faktoriem.
|
DZIMTA, sugas botāniskais nosaukums
(vispārpieņemtais nosaukums latviešu valodā)
|
Dzīves ilgums (9) un dzīvotne
|
Sēklas svars
(mg)
|
Dīgšanas vai augšanas fotoperiods (10)
|
Augšanas dziļums
(mm) (11)
|
Dīgšanas ilgums
(dienas) (12)
|
Īpaša apstrāde (13)
|
Toksicitātes tests (14)
|
Sēklu piegādātāji (15)
|
Citas atsauces (16)
|
|
APIACEAE
Torilis japónica
(Japānas sārtburkšķis)
|
А, В traucējumu skartas platības, dzīvžogi, ganības (16, 19)
|
1,7–1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
aukstā stratifikācija (7, 14, 18, 19), var būt nepieciešama nobriešana (19), dīgšanu inhibē tumsa (1, 19), nav īpašu apstrādes nosacījumu (5)
|
PĒC (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(ilgziedu mārpuķīte)
|
Ρ
pļavas, aramlauki, velēnas platības (16, 19)
|
0,09–0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
apstarošana neietekmē dīgšanu (18, 19), nav īpašu apstrādes nosacījumu (4, 14)
|
PĒC (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(zilā rudzupuķe)
|
A
lauki, ceļmalas, klajas dzīvotnes (16)
|
4,1–4,9 (4, 14)
|
L = D (14)
|
0–3 (2, 4, 14)
|
14–21 (100 %) (14)
|
nav īpašu apstrādes nosacījumu (2, 4)
|
PĒC (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(melnā zilgalvīte)
|
Ρ
lauki, ceļmalas, klajas dzīvotnes (16, 19)
|
2,4–2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
var būt nepieciešama nobriešana (18, 19), dīgšanu imhibē tumsa (19), nav īpašu apstrādes nosacījumu (5, 14, 26)
|
PĒC (5, 22, 26)
|
A
|
|
|
Inula helenium
(helēniju ālante)
|
Ρ
mitrāji, traucējumu skartas vietas
(16)
|
1–1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
nav īpašu apstrādes nosacījumu (4)
|
PĒC (4)
|
A, F
|
|
|
Leontodon hispidus
(matainā vēlpiene)
|
Ρ
lauki, ceļmalas, traucējumu skartas platības (16, 19)
|
0,85 -1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
dīgšanu kavē tumsa (17, 18, 19) nav īpašu apstrādes nosacījumu (5, 23)
|
PĒC (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(pūkainā saulcerīte)
|
Β, Ρ traucējumu skartas vietas
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
nav īpašu apstrādes nosacījumu
(4, 14, 33)
|
PĒC (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(Kanādas zeltgalvīte)
|
Ρ
ganības, klajas dzīvotnes (16)
|
0,06–0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14–21
(11)
|
sajaukt ar smiltīm vienādās proporcijās un mērcēt 500 vienībās glutaraldehīdā uz miljonu vienību šķīdinātāja 24 stundas (11), nav īpašu apstrādes nosacījumu (4)
|
PĒC (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(Pensilvānijas smaildadzis)
|
A
lauki, klajas dzīvotnes (16)
|
25–61 (14, 29)
|
|
0(1)
5(29)
|
|
dīgšanu var inhibēt tumsa (1), mērcēt siltā ūdenī 12 stundas (29)
|
PIRMS un PĒC (31)
|
A
|
|
|
Xanthium spinosum
(dzeloņainais smaildadzis)
|
A
klajas dzīvotnes (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
skarifikācija (14), nav īpašu apstrādes nosacījumu (6)
|
PIRMS un PĒC (6)
|
A
|
|
|
Xanthium strumarium
(dziedzerainais smaildadzis)
|
A
lauki, klajas dzīvotnes (16)
|
67,4 (14)
|
L = D (14)
|
10–20 (6, 21)
|
|
nav īpašu apstrādes nosacījumu
(6, 14, 21)
|
PIRMS un PĒC (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(pļavas ķērsa)
|
Ρ
lauki, ceļmalas, velēnas platības (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
dīgšanu inhibē tumsa (18, 19), nav īpašu apstrādes nosacījumu (5, 14, 22)
|
PĒC (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(pļavas spulgnaglene)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
var būt nepieciešama nobriešana (18), nav īpašu apstrādes nosacījumu (5, 14, 15, 22–26)
|
PĒC (5, 15, 22–26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(baltā balanda)
|
A
laukmales, traucējumu skartas platības (16, 19)
|
0,7–1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
apstrāde atšķiras atkarībā no sēklu krāsas (19), sausumā ir miera periods (19), dīgšanu inhibē tumsa (1, 18, 19), aukstā stratifikācija (18), nav īpašu apstrādes nosacījumu (14, 34)
|
PIRMS un PĒC (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(divšķautņu asinszāle)
|
Ρ
lauki, aramzeme, klajas dzīvotnes (16, 19)
|
0,1 –0,23
(14, 19)
|
L= D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
dīgšanu inhibē tumsa (1, 18, 19),
nav īpašu apstrādes nosacījumu (5, 14, 15, 25, 27)
|
PĒC
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(īvjlapu ipomeja)
|
A
ceļmalas, klajas dzīvotnes, labības lauki (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10–20
(6, 10, 21)
|
4 (100 %)
(10)
|
apstarošana neietekmē dīgšanu (1),
nav īpašu apstrādes nosacījumu (6, 21)
|
PIRMS un PĒC
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(apaļais dižmeldrs)
|
Ρ
aramzeme, ganības, ceļmalas (16, 30)
|
0,2
(14)
|
L= D
(14)
|
0 (1)
10–20 (6, 10)
|
12 (91 %)
(10)
|
dīgšanu inhibē tumsa (1),
nav īpašu apstrādes nosacījumu (6, 10, 14)
|
PIRMS un PĒC
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(ragainais vanagnadziņš)
|
Ρ
zālainas platības, ceļmalas, klajas dzīvotnes (16, 19)
|
1–1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikācija (14, 19),
apstarošana neietekmē dīgšanu (18, 19), nav īpašu apstrādes nosacījumu (23, 25)
|
PĒC
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(platlapu kasija, platlapu senna)
|
A
mitri meži (16)
|
23–28
(9)
|
L = D (14)
L > D (9)
|
10–20
(6,9)
|
|
mērcēt sēklas ūdenī 24 stundas (9),
skarifikācija (14), sēklu dzīvotspēja atšķiras atkarībā no krāsas (1), nav īpašu apstrādes nosacījumu (6)
|
PĒC
(6,9)
|
A
|
|
|
Sesbania exaltata
(kaņepju sebānija)
|
A
aluviāla augsne (16)
|
11–13
(9, 14)
|
L > D (9)
|
10–20
(9, 21)
|
|
mērcēt sēklas ūdenī 24 stundas (9),
apstarošana neietekmē dīgšanu (1), nav īpašu apstrādes nosacījumu (21)
|
PIRMS un PĒC
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(pļavas āboliņš)
|
Ρ
lauki, ceļmalas, aramzeme (16, 19)
|
1,4–1,7
(14, 19)
|
L= D (14)
|
|
1 (50 %)
(19)
|
skarifikācija (14, 18),
var būt nepieciešama nobriešana (19), apstarošana neietekmē dīgšanu (1, 19), nav īpašu apstrādes nosacījumu (5)
|
PĒC
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(sirds mātere)
|
Ρ
klajumi (16)
|
0,75–1,0
(4, 14)
|
L= D (14)
|
0
(4)
|
|
nav īpašu apstrādes nosacījumu
(4, 14)
|
PĒC
(4)
|
F
|
|
|
Mentha spicata
(krūzmētra)
|
Ρ
mitrāji (16)
|
2,21
(4)
|
|
0
(4)
|
|
nav īpašu apstrādes nosacījumu
(4)
|
PĒC
(4)
|
F
|
|
|
Nepeta cataria
(īstā kaķumētra)
|
Ρ
traucējumu skartas platības (16)
|
0,54
(4, 14)
|
L= D (14)
|
0
(4)
|
|
nav īpašu apstrādes nosacījumu
(2, 4, 14)
|
PĒC
(2,4)
|
F
|
|
|
Prunella vulgaris
(parastā brūngalvīte)
|
Ρ
aramlauki, zālainas platības, traucējumu skartas vietas (16, 19)
|
0,58–1,2
(4, 14, 19)
|
L= D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
dīgšanu inhibē tumsa (18, 19),
lielākas sēklas dīgst labāk (1), nav īpašu apstrādes nosacījumu (4, 14, 22)
|
PĒC
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(ārstniecības pātaine)
|
Ρ
pļavas, laukmales (19)
|
14–18
(14, 19)
|
L= D (14)
|
|
7 (50 %)
(19)
|
nav īpašu apstrādes nosacījumu
(5, 14, 22)
|
PĒC
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(Teofrasta virvene)
|
A
lauki, klajas dzīvotnes (16)
|
8.8
(14)
|
L= D (14)
|
10–20
(6, 10, 21)
|
4 (84 %)
(10)
|
skarifikācija (14),
nav īpašu apstrādes nosacījumu (5, 10, 21)
|
PIRMS un PĒC
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(dzeloņainā alteja)
|
A
lauki, ceļmalas (16)
|
3,8
(14)
|
L= D (14)
|
10–20
(6, 21)
|
|
skarifikācija (14),
apstarošana neietekmē dīgšanu (1), nav īpašu apstrādes nosacījumu (6, 21)
|
PIRMS un PĒC
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(zīda magone)
|
A
lauki, aramzeme, traucējumu skartas vietas (16, 19)
|
0,1–0,3
(4, 14, 19, 29)
|
L= D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
aukstā stratifikācija un skarifikācija (1, 19, 32),
nav īpašu apstrādes nosacījumu (4, 14, 29)
|
PĒC
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis,
(parastā smilga)
|
zālieni, ganības (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
dīgšanu inhibē tumsa (1, 17–19), nav īpašu apstrādes nosacījumu (10)
|
PĒC (10)
|
A, E
|
|
|
Alopecurus myosuroides
(peļastīšu lapsaste)
|
A
lauki, klajas dzīvotnes (16)
|
0,9–1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
skarifikācija (14), apstrādāt ar 101 mg/L KNO3 (14), siltā stratifikācija (1), dīgšanu inhibē tumsa (1), nav īpašu apstrādes nosacījumu (34)
|
PIRMS un PĒC
(28, 34)
|
A
|
32
|
|
Avena fatua
(vēja auza)
|
A
apstrādājamas platības, klajumi (16)
|
7–37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10–20 (6, 10)
|
3 (70 %) (18)
|
skarifikācija (7, 32), dīgšanu inhibē tumsa (1)
aukstā stratifikācija (1, 18), nav īpašu apstrādes nosacījumu (6, 10, 14)
|
PIRMS un PĒC (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(īstā jumtauza)
|
A
lauki, ceļmalas, aramzeme (16)
|
0,45–2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
nobriešanas periods (1, 7, 32), dīgšanu inhibē gaisma (1), nav īpašu apstrādes nosacījumu (14)
|
PIRMS un PĒC (28, 31)
|
A
|
|
|
Cynosurus cristatus
(parastā sekstaine)
|
P
lauki, ceļmalas, klajumi (16, 19)
|
0,5–0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
apstarošana neietekmē dīgšanu (19), nav īpašu apstrādes nosacījumu (14, 29)
|
PĒC (5)
|
A
|
|
|
Digitaria sanguinalis
(asinssarkanā pasāre)
|
A
lauki, velēnas platības, klajumi (16)
|
0,52–0,6 (14, 30)
|
L = D (14)
|
10–20 (21)
|
7 (75 %)
14 (94 %) (7)
|
skarifikācija, aukstā stratifikācija un nobriešana (1, 7, 14, 32), apstrādāt ar 101 mg/L KNO3 (14), dīgšanu inhibē tumsa (1), nav īpašu apstrādes nosacījumu (21)
|
PIRMS un PĒC (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(parastā gaiļsāre)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10–20 (7, 21)
|
|
skarifikācija (7, 32), apstarošana neietekmē dīgšanu (1), nav īpašu apstrādes nosacījumu (3, 14, 21)
|
PIRMS un PĒC (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(Kanādas savvaļas rudzi)
|
P
upmalas, traucējumu skartas vietas (16)
|
4–5 (14, 30)
|
L = D (11)
|
1
(11)
|
14–28
(11)
|
nav īpašu apstrādes nosacījumu
(2, 11)
|
PĒC (2)
|
C, D, E
|
|
|
Festuca pratensis
(pļavas auzene)
|
P
lauki, mitrāji (16, 19)
|
1,53–2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
nav īpašu apstrādes nosacījumu
(10, 19)
|
PĒC (10)
|
A
|
7
|
|
Hordeum pusillum
(pundurmiezis)
|
A
ganības, ceļmalas, klajumi (16)
|
3,28 (14)
|
|
|
|
siltā stratifikācija (1), apstarošana neietekmē dīgšanu (1)
|
PIRMS (31)
|
|
7
|
|
Phieum pratense
(pļavas timotiņš)
|
P
ganības, aramlauki, traucējumu skartas vietas (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0–10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
dīgšanu inhibē tumsa (19), apstarošana neietekmē dīgšanu (17), nav īpašu apstrādes nosacījumu (10, 14, 17, 19)
|
PĒC (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(dārza vējgriķis)
|
A
klajumi, ceļmalas (16)
|
5–8 (4, 14, 29)
|
L = D (20)
|
0–2 (4, 29)
|
|
aukstā stratifikācija 4–8 nedēļas (1, 2, 4, 20, 29), apstarošana neietekmē dīgšanu (1)
|
PIRMS un PĒC 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(skābeņlapu sūrene)
|
A
mitra augsne (16)
|
1,8–2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
apstarošana neietekmē dīgšanu (1), dīgšanu inhibē tumsa (18), aukstā stratifikācija (1), nav īpašu apstrādes nosacījumu (5)
|
PIRMS un PĒC (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(Pensilvānijas sūrene)
|
A
lauki, klajumi (16)
|
3,6–7 (14, 29)
|
|
2 (29)
|
|
aukstā stratifikācija 4 nedēļas 0–5 °C temperatūrā (1, 29), dīgšanu inhibē tumsa (1)
|
PIRMS (31)
|
A, E
|
|
|
Polygonum persicaria
(blusu sūrene)
|
A
traucējumu skartas platības, aramzeme (16, 19)
|
2,1 –2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
skarifikācija, aukstā stratifikācija, apstrāde ar glutaraldehīdu (14), aukstā stratifikācija, nobriešana (17–19), dīgšanu inhibē tumsa (19), nav īpašu apstrādes nosacījumu (13)
|
PĒC (13)
|
A
|
32
|
|
Rumex crispus
(cirtainā skābene)
|
P
aramlauki, ceļmalas, klajumi (16, 19)
|
1,3–1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
dīgšanu inhibē tumsa (18, 19), var būt nepieciešama nobriešana (18), nav īpašu apstrādes nosacījumu (4, 14, 33)
|
PĒC (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(tīruma pavirza)
|
A
aramlauki, klajumi, traucējumu skartas vietas (16, 19)
|
0,4–0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
aukstā stratifikācija, apstrāde ar glutaraldehīdu (1,14, 18, 19, 32), dīgšanai nepieciešama gaisma (1), nav īpašu apstrādes nosacījumu (2, 4)
|
PĒC (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(kodīgā gundega)
|
Ρ
aramlauki, ceļmalas, klajumi (16, 19)
|
1,5–2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41–56 (19, 29)
|
nav īpašu apstrādes nosacījumu
(5, 14, 22, 24–26)
|
PĒC (5, 22, 24–26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(pilsētas bitene)
|
Ρ
dzīvžogi, mitrāji
(16, 19)
|
0,8–1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
dīgšanu inhibē tumsa (18, 19), siltā stratifikācija (1), nav īpašu apstrādes nosacījumu (5, 14, 22, 25, 26)
|
PĒC (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(ķeraiņu madara)
|
A
aramlauki, mitrāji, traucējumu skartas vietas (16, 19)
|
7–9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
aukstā stratifikācija (1, 18, 19), apstarošana neietekmē dīgšanu (18, 19), gaisma inhibē dīgšanu (1), nav īpašu apstrādes nosacījumu (6, 14)
|
PIRMS un PĒC (6, 28)
|
A
|
32
|
|
Galium mollugo
(mīkstā madara)
|
Ρ
dzīvžogu vaļņi, klajumi (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
nav īpašu apstrādes nosacījumu
(5, 14, 22, 24, 26, 29)
|
PĒC (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(sarkanā uzpirkstīte)
|
Β, Ρ dzīvžogi, klajumi (16, 19)
|
0,1–0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
dīgšanu inhibē tumsa (1, 17–19), nav īpašu apstrādes nosacījumu (4, 22–26)
|
PĒC (4, 22–26)
|
D, G, F
|
|
|
Veronica persica
(Persijas veronika)
|
A
aramlauki, klajumi, traucējumu skartas vietas (16, 19)
|
0,5–0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3(19)
5 (96 %) (18)
|
dīgšanu inhibē tumsa (18, 19), aukstā stratifikācija (18), nav īpašu apstrādes nosacījumu (14)
|
PIRMS un PĒC (28)
|
A
|
32
|
Sēklu piegādātāji
|
Piegādātāja ID
|
Informācija par piegādātāju
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344–4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586–3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431–7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873–3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O.
Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274–7333
|
|
www.thompson-morgan.com
|
|
ATSAUCES
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 – 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. pp. 151 – 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC – Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
4. papildinājums
Noteiktām kultūraugu sugām piemērotu augšanas apstākļu piemēri
Ir noskaidrots, ka turpmāk minētie apstākļi ir piemēroti 10 kultūraugu sugām un tos var izmantot kā orientierus arī testiem augšanas kamerās, kuros izmanto dažas citas sugas:
|
|
oglekļa dioksīda koncentrācija: 350 ± 50 daļiņas uz miljonu;
|
|
|
relatīvais gaisa mitrums: 70 ± 5 % gaišajos periodos 90 ± 5 % tumšajos periodos;
|
|
|
temperatūra: 25 ± 3 °C dienā, 20 ± 3 °C naktī;
|
|
|
fotoperiods: 16 stundas gaismā/8 stundas tumsā, pieņemot, ka vidējais viļņu garums ir no 400 līdz 700 nm;
|
|
|
gaismas spilgtums – 350 ± 50 μE/m2/s, mērot lapotnes augšā.
|
Kultūraugu sugas:
|
—
|
parastais tomāts (Solanum lycopersicon);
|
|
—
|
lauka gurķis (Cucumis sativus);
|
|
—
|
dārza salāti (Lactuca sativa);
|
|
—
|
galviņkāposts (Brassica oleracea var. capitata);
|
|
—
|
savvaļas burkāns (Daucus carota);
|
|
—
|
sējas auza (Avena sativa);
|
|
—
|
daudzgadīgā airene (Lolium perenne);
|
|
—
|
parastā kukurūza (Zea mays);
|
|
—
|
dārza sīpols (Allium cepa).
|
C.32. SĪKSLIEKU VAIROŠANĀS TESTS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 220 (2004. gads). Tā ir izveidota, lai izvērtētu ķīmisko vielu ietekmi uz sīkslieku Enchytraeus albidus (Henle, 1873) vairošanos augsnē. Tā galvenokārt balstīta uz metodi, ko izstrādāja Vācijas Federatīvā vides pārvalde (1) un kas ir pārbaudīta starplaboratoriju salīdzinošajā testēšanā (2). Tika apsvērtas arī citas testēšanas metodes, ar kurām testēt ķīmisko vielu toksicitāti sīksliekām (Enchytraeidae) un sliekām (3)(4)(5)(6)(7)(8).
|
SĀKOTNĒJIE APSVĒRUMI
|
2.
|
Augsnē mītošie sīkslieku (Enchytraeus) ģints posmtārpi ir ekoloģiski piemērotas sugas ekotoksikoloģiskajai testēšanai. Lai gan sīksliekas bieži vien ir sastopamas augsnēs, kur mīt sliekas, ir arī tiesa, ka tās bieži lielā daudzumā sastopamas augsnēs, kur slieku nav. Sīksliekas var izmantot laboratorijas testos, kā arī lauka un jauktajos pētījumos. No praktiskā viedokļa daudzas sīkslieku sugas ir viegli kopt un audzēt, un to vairošanās laiks ir ievērojami īsāks nekā sliekām. Tādēļ vairošanās testa ilgums sīkslieku gadījumā ir tikai 4–6 nedēļas, turpretī Kalifornijas sarkano hibrīdslieku (Eisenia fetida) gadījumā tas ir astoņas nedēļas.
|
|
3.
|
Pamatinformāciju par sīkslieku ekoloģiju un ekotoksikoloģiju zemes vidē var atrast (9)(10)(11)(12).
|
TESTĒŠANAS PRINCIPS
|
4.
|
Pieaugušas sīksliekas pakļauj virknei testējamās ķīmiskās vielas koncentrāciju, kas tiek iejaukta mākslīgā augsnē. Testu var iedalīt divos posmos: a) diapazona noteikšanas tests, ja nav pieejama pietiekama informācija; tajā mirstība ir galvenais beigupunkts, ko izvērtē pēc divu nedēļu ekspozīcijas, un b) galīgais vairošanās tests, kurā izvērtē kopējo jauno īpatņu un izdzīvojušo vecāku skaitu. Galīgā testa ilgums ir sešas nedēļas. Pēc pirmajām trīs nedēļām pieaugušos tārpus aizvāc un reģistrē morfoloģiskās izmaiņas. Pēc nākamajām trīs nedēļām saskaita no vecāku producētajiem kokoniem izšķīlušos pēcnācējus. Testējamai ķīmiskajai vielai eksponēto dzīvnieku vairošanās rādītājs tiek salīdzināts ar kontrolgrupu vairošanās rādītāju, lai noteiktu i) nenovērojamās ietekmes koncentrāciju (NOEC) un/vai ii) ECx (piemēram, EC10, EC50), ar regresijas modeli aplēšot koncentrāciju, kas izraisītu vairošanās rādītāja samazināšanos par x %. Testējamām koncentrācijām būtu jāaptver ECx (piemēram, EC10, EC50), lai ECx tiktu interpolēts, nevis ekstrapolēts.
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
5.
|
Vēlams zināt testējamās ķīmiskās vielas šķīdību ūdenī (log Kow), augsnes ūdens sadalījuma koeficientu (piemēram, šā pielikuma C.18 vai C.19. nodaļā) un tvaika spiedienu. Ir vēlama papildu informācija par testējamās ķīmiskās vielas apriti augsnē, piemēram, fotolīzes un hidrolīzes rādītāju.
|
|
6.
|
Šo testa metodi var izmantot ūdenī šķīstošām un nešķīstošām ķīmiskajām vielām. Tomēr attiecīgi atšķirsies arī testējamās ķīmiskās vielas lietošanas veids. Šī testēšanas metode nav izmantojama nedz gaistošām ķīmiskajām vielām, t. i., ķīmiskajām vielām, kurām Henrija konstante vai gaisa/ūdens sadalījuma koeficients ir lielāks nekā viens, nedz arī ķīmiskajām vielām, kuru tvaika spiediens pārsniedz 0,0133 Pa 25 °C temperatūrā.
|
TESTA DERĪGUMS
|
7.
|
Lai tests būtu derīgs, kontrolparaugos tam jāatbilst šādiem izpildes kritērijiem:
|
—
|
pieaugušo indivīdu mirstība nedrīkst pārsniegt 20 % diapazona noteikšanas testa beigās un pēc pirmajām trīs vairošanās testa nedēļām;
|
|
—
|
pieņemot, ka testa sākumā uz vienu trauku tika izmantoti 10 pieaugušie indivīdi, testa beigās uz vienu trauku jābūt izšķīlušamies vidēji vismaz 25 jaunajiem īpatņiem;
|
|
—
|
vidējā jauno īpatņu skaita variācijas koeficients nedrīkst pārsniegt 50 % vairošanās testa beigās.
|
Ja tests neatbilst iepriekš minētajiem derīguma kritērijiem, tas jāizbeidz, ja vien nav pamatot testa turpināšanu. Pamatojums būtu jāiekļauj testēšanas pārskatā.
|
ĶĪMISKĀ STANDARTVIELA
|
8.
|
Ķīmiskā standartviela ir vai nu jātestē regulāros intervālos, vai, iespējams, jāiekļauj katrā testā, lai pārliecinātos, ka testējamo organismu reakcija laika gaitā nav būtiski mainījusies. Piemērota ķīmiskā standartviela ir karbendazīms, kam ir pierādīta ietekme uz sīkslieku izdzīvošanu un vairošanos (13)(14), vai arī var izmantot citas ķīmiskās vielas ar labi izpētītiem toksicitātes datiem. Starplaboratoriju salīdzinošajā testēšanā izmantoja karbendazīma preparātu, kas pazīstams ar komercnosaukumu Derosal™, ko piegādā AgrEvo Company (Frankfurte, Vācija) un kas satur 360 g /l (32,18 %) aktīvās vielas (2). Starplaboratoriju salīdzinošajā testēšanā noteiktā vairošanās EC50 bija diapazonā 1,2 ± 0,8 mg aktīvās vielas (AV)/kg sausmasas (2). Ja testa sērijā iekļauj pozitīvu toksisko standartu, izmanto vienu koncentrāciju un replikātu skaitam jābūt tādam pašam kā kontrolgrupas paraugu skaitam. Karbendazīma gadījumā ir ieteicamā testējamā koncentrācija ir 1,2 mg AV/kg sausmasas (karbendazīmu testējot kā šķidru preparātu).
|
TESTA APRAKSTS
Aparatūra
|
9.
|
Testēšanas traukiem jābūt izgatavotiem no stikla vai cita ķīmiski inerta materiāla. Piemērotas ir stikla burkas (piemēram, ar tilpumu 0,20–0,25 litri un diametru ≈ 6 cm). Traukiem jābūt ar caurspīdīgiem vākiem (piemēram, no stikla vai polietilēna), kas ir izveidoti tā, lai samazinātu ūdens iztvaikošanu, vienlaikus atļaujot gāzu apmaiņu starp augsni un atmosfēru. Vākiem jābūt caurspīdīgiem, lai gaisma varētu izkļūt cauri.
|
|
10.
|
Nepieciešams laboratorijas standartaprīkojums, jo īpaši:
|
—
|
piemēroti, precīzi svari;
|
|
—
|
piemērota temperatūras kontroles ierīce,
|
|
—
|
piemērota mitruma kontroles ierīce (nav vajadzīga, ja ekspozīcijas traukiem ir vāki);
|
|
—
|
inkubators vai maza telpa ar gaisa kondicionētāju;
|
|
—
|
pincetes, āķi vai cilpas;
|
|
Mākslīgās augsnes sagatavošana
|
11.
|
Šajā testā (5)(7) izmanto mākslīgo augsni ar šādu sastāvu (pamatojoties uz saussvariem, kas žāvēti līdz konstantam svaram 105 °C temperatūrā):
|
—
|
10 % gaisā žāvētas un smalki samaltas sfagnu kūdras (ir pieņemams daļiņu izmērs 2 ± 1 mm); pirms to izmanto testā, ieteicams pārbaudīt, vai augsne, kas sagatavota ar svaigu kūdras paraugu, ir piemērota tārpu audzēšanai;
|
|
—
|
20 % kaolīna mālu (kaolinīta saturam vēlams būt virs 30 %);
|
|
—
|
apmēram 0,3 līdz 1,0 % kalcija karbonāta (CaCO3, pulverizēta, analītiskās tīrības pakāpes), lai iegūtu pH 6,0 ± 0,5; pievienojamā kalcija karbonāta daudzums galvenokārt atkarīgs no kūdras kvalitātes/veida;
|
|
—
|
apmēram 70 % gaisā žāvētu kvarca smilšu (atkarībā no nepieciešamā CaCO3 daudzuma), lielākoties smalku smilšu, kas vairāk nekā par 50 % sastāv no daļiņām ar izmēru 50 līdz 200 mikroni.
|
Pirms izmantot augsni galīgajā testā, ir ieteicams pierādīt mākslīgās augsnes piemērotību tārpu audzēšanai un testa derīguma kritēriju izpildei. Ir īpaši ieteicams veikt šādu pārbaudi, lai pārliecinātos, ka testa izpilde nav traucēta, ja organiskā oglekļa saturs mākslīgajā augsnē ir samazināts, piemēram, samazinot kūdras saturu līdz 4–5 % un attiecīgi palielinot smilšu saturu. Šādi samazinot organiskā oglekļa saturu, var samazināties testējamās ķīmiskās vielas iespēja adsorbēties augsnē (organiskajā ogleklī) un palielināties testējamās ķīmiskās vielas pieejamība tārpiem. Ir pierādīts, ka Enchytraeus albidus var atbilst vairošanās derīguma kritērijiem, ja tās testē lauka augsnēs ar zemāku organiskā oglekļa saturu, nekā minēts iepriekš (piemēram, 2,7 %) (15), un ir gūta pieredze – lai gan ierobežota – ka to var panākt arī ar mākslīgu augsni, kas satur 5 % kūdras.
Piezīme: izmantojot dabisko augsni papildu (piemēram, augstāka līmeņa) testēšanā, arī ir jāpierāda augsnes piemērotība un testa derīguma kritēriju izpilde.
|
|
12.
|
Augsnes sausās sastāvdaļas rūpīgi samaisa (piemēram, liela izmēra laboratorijas maisītājā). Tas jādara vismaz vienu nedēļu pirms testa sākšanas. Samaisītā augsne divas dienas jāuzglabā, lai līdzsvarotu/stabilizētu skābumu. pH noteikšanā izmanto augsnes un 1 M kālija hlorīda (KCl) vai 0,01 M kalcija hlorīda (CaCl2) šķīduma maisījumu attiecībā 1:5 (sk. (16) un 3. papildinājumu). Ja augsnes skābums pārsniedz vajadzīgo diapazonu (sk. 11. punktu), to var pielāgot, pievienojot atbilstošu daudzumu CaCO3. Ja augsne ir pārāk sārmaina, to var koriģēt, pievienojot vairāk maisījuma, kas minēts 11. punktā, bet izlaižot CaCO3.
|
|
13.
|
Mākslīgās augsnes maksimālo ūdensnoturspēju (WHC) nosaka saskaņā ar 2. papildinājumā aprakstītajām procedūrām. Vienu vai divas dienas pirms testa sākšanas sauso mākslīgo augsni iepriekš samitrina, pievienojot pietiekami daudz dejonizēta ūdens, lai iegūtu apmēram pusi galīgā ūdens satura, kas ir 40 līdz 60 % maksimālās ūdensnoturspējas. Testa sākumā iepriekš samitrinātā augsne tiek sadalīta daļās atbilstoši testējamo koncentrāciju (un attiecīgā gadījumā ķīmiskās standartvielas) un kontrolgrupas paraugu skaitam. Mitruma saturu pielāgo 40–60 % maksimālās WHC, pievienojot testējamās ķīmiskās vielas šķīdumu un/vai destilētu vai dejonizētu ūdeni (sk. 19.–21. punktu). Mitruma saturu nosaka testa sākumā un beigās (izžāvējot līdz konstantam svaram 105 °C temperatūrā), un tam jābūt tārpu izdzīvošanai optimālajā intervālā. Augsnes mitruma saturu var aptuveni pārbaudīt, maigi saspiežot augsni rokās; ja mitruma saturs ir atbilstošs, starp pirkstiem jāparādās sīkiem ūdens pilieniem.
|
Testējamo dzīvnieku izvēle un sagatavošana
|
14.
|
Ieteicamās testēšanas sugas ir Enchytraeus albidus (Henle, 1837), Enchytraeidae dzimtas pārstāve (Oligochaeta kārta, Annelida tips). Enchytraeus albidus ir viena no lielākajām sīkslieku sugām – ir reģistrēti īpatņi garumā līdz 35 mm (17)(18). E. albidus ir izplatīta visā pasaulē un ir sastopama jūras, saldūdens un sauszemes vidēs, galvenokārt trūdošā organiskajā materiālā (jūraszālēs, kompostā) un reti pļavās (9). Tās lielā ekoloģiskā tolerance un dažas morfoloģiskās variācijas var liecināt par to, ka pastāv dažādas rases.
|
|
15.
|
E. albidus ir komerciāli pieejama kā zivju barība. Ir jāpārbauda, vai kultūra nav kontaminēta ar citu kultūru, parasti ar mazākām sugām (1) (19). Ja rodas kontaminācija, visi tārpi ir jānomazgā ar ūdeni Petri platē. Tad ir jāizvēlas pieauguši E. albidus īpatņi (izmantojot stereomikroskopu), lai aizsāktu jaunu kultūru, bet pārējos tārpus nelieto. E. albidus var viegli audzēt plašā klāstā dažādu organisko materiālu (sk. 4. papildinājumu). E. albidus dzīves cikls ir īss, jo briedums tiek sasniegts laikā no 33. (18 °C) līdz 74. dienai (12 °C) (1). Testēšanai var tikt izmantotas tikai tās kultūras, kas laboratorijā vismaz piecas nedēļas (vienu paaudzi) uzglabātas bez problēmām.
|
|
16.
|
Arī citas sīkslieku (Enchytraeus) ģints sugas ir piemērotas, piemēram, E. buchholzi (Vejdovsky, 1879) vai E. crypticus (Westheide & Graefe, 1992) (sk. 5. papildinājumu). Ja izmanto citas sīkslieku sugas, tās ir skaidri jāidentificē un pārskatā jāsniedz pamatojums, kādēļ izraudzīta šī suga.
|
|
17.
|
Testos izmantojamie dzīvnieki ir pieauguši tārpi. Tiem jābūt oliņām (baltiem plankumiem) jostiņas rajonā un jābūt aptuveni vienāda izmēra (apmēram 1 cm gariem). Pavairošanas kultūras sinhronizācija nav nepieciešama.
|
|
18.
|
Ja sīksliekas neaudzē viena un tā paša veida augsnē un apstākļos (ieskaitot barošanas apstākļus), ko izmantos galīgajā testā, tās vismaz 24 stundas līdz 3 dienas jāaklimatizē. Pieaugušo indivīdu skaits, kas ir lielāks nekā nepieciešams testa veikšanai, sākumā jāaklimatizē, lai būtu iespēja noraidīt bojātus vai citādi nepiemērotus īpatņus. Aklimatizācijas perioda beigās testam izvēlas tikai tārpus, kuriem ir oliņas un kuri neizrāda uzvedības anomālijas (piemēram, nemēģina izkļūt no augsnes). Tārpus uzmanīgi izvāc ar juveliera pinceti, āķiem vai cilpām un novieto uz Petri plates ar nelielu daudzumu svaiga ūdens. Šim nolūkam vislabāk izmantot rekonstituētu svaigu ūdeni atbilstoši šā pielikuma C.20. nodaļai (Daphnia magna vairošanās tests), jo dejonizēts, demineralizēts vai krāna ūdens var būt tārpiem kaitīgs. Tārpus pārbauda ar stereomikroskopu un nelieto tos, kuriem nav oliņu. Rūpīgi aizvāc visas ērces vai lēcastes, kas varētu būt inficējušas kultūras. Veselīgos tārpus, ko neizmanto testā, novieto atpakaļ izejkultūrā.
|
Testējamo koncentrāciju sagatavošana
Ūdenī šķīstoša testējamā ķīmiskā viela
|
19.
|
Pagatavo testējamās ķīmiskās vielas šķīdumu dejonizētā ūdenī daudzumā, kas ir pietiekams visiem vienas testējamās koncentrācijas replikātiem. Ieteicams izmantot atbilstošu ūdens daudzumu, lai panāktu nepieciešamo mitruma saturu, t. i., 40–60 % maksimālās ūdensnoturspējas WHC (sk. 13. punktu). Katru testējamās ķīmiskās vielas šķīdumu pirms iemaisīšanas testēšanas traukā rūpīgi sajauc ar vienu paraugu iepriekš samitrinātas augsnes.
|
Ūdenī nešķīstoša testējamā ķīmiskā viela
|
20.
|
Ja ķīmiskā viela nešķīst ūdenī, bet šķīst organiskajos šķīdinātājos, testējamo ķīmisko vielu var izšķīdināt mazākajā iespējamā piemērotas nesējvielas (piemēram, acetona) tilpumā. Jāizmanto tikai gaistoši šķīdinātāji. Nesējvielu izsmidzina vai iejauc nelielā daudzumā (piemēram, 2,5 g) smalku kvarca smilšu. No nesējvielas atbrīvojas, to vienu stundu iztvaicējot velkmes skapī. Šo kvarca smilšu un testējamās ķīmiskās vielas maisījumu pievieno iepriekš samitrinātajai augsnei un rūpīgi samaisa ar atbilstošu daudzumu dejonizēta ūdens, lai iegūtu nepieciešamo mitruma saturu. Galīgo maisījumu sadala pa testēšanas traukiem.
|
|
21.
|
Ja ķīmiskā viela vāji šķīst ūdenī un organiskajos šķīdinātājos, 2,5 g smalki samaltu kvarca smilšu uz katru testēšanas trauku samaisa ar tādu testējamās ķīmiskās vielas daudzumu, ar kuru var iegūt vēlamo testēšanas koncentrāciju. Šo kvarca smilšu un testējamās ķīmiskās vielas maisījumu pievieno iepriekš samitrinātajai augsnei un rūpīgi samaisa ar atbilstošu daudzumu dejonizēta ūdens, lai iegūtu nepieciešamo mitruma saturu. Galīgo maisījumu sadala pa testēšanas traukiem. Procedūru atkārto katrai testējamajai koncentrācijai un sagatavo arī atbilstošus kontrolparaugus.
|
|
22.
|
Parasti ķīmiskās vielas netestē koncentrācijās, kas pārsniedz 1 000 mg/kg augsnes sausmasas. Tomēr testēšana augstākās koncentrācijās var būt nepieciešama sakaņā ar konkrēta testa mērķiem.
|
TESTĒŠANAS NORISE
Testa grupas un kontrolgrupas
|
23.
|
Katras testējamās koncentrācijas gadījumā testēšanas traukā ievieto testējamās augsnes daudzumu, kas atbilst 20 g saussvara (sk. 19.–21. punktu). Sagatavo arī kontrolgrupas paraugus bez testējamās ķīmiskās vielas. Katram traukam pievieno barību atbilstoši 29. punktā aprakstītajai procedūrai. Katram testēšanas traukam pēc nejaušības principa iedala desmit tārpus. Tārpus rūpīgi pārvieto uz katru trauku un novieto uz augsnes virsas, izmantojot, piemēram, juveliera pinceti, āķus vai cilpas. Testējamo koncentrāciju un kontrolgrupas replikātu skaits ir atkarīgs no izmantotā testēšanas plāna (sk. 34. punktu). Testēšanas traukus pēc nejaušības principa izvieto testēšanas inkubatorā, un ik nedēļu tos pēc nejaušības principa pārkārto.
|
|
24.
|
Ja testējamās ķīmiskās vielas ievadīšanai izmanto nesējvielu, papildus testa sērijai ir jāsagatavo viena kontrolsērija ar kvarca smiltīm, kas apsmidzinātas vai sajauktas ar šo šķīdinātāju. Šķīdinātāja vai disperģētājvielas koncentrācijai jābūt tādai pašai, kādu izmanto testēšanas traukos ar testējamo ķīmisko vielu. Ja ķīmiskā viela jāievada saskaņā ar 21. punktā aprakstītajām procedūrām, ir jānodrošina kontrolsērija ar papildu kvarca smilšu daudzumu (2,5 g uz trauku).
|
Testēšanas apstākļi
|
25.
|
Testēšanas temperatūra ir 20 ± 2 °C. Lai atturētu tārpus no līšanas ārā no augsnes, testu veic kontrolētos gaismas un tumsas ciklos (vēlams – 16 stundas gaismas un 8 stundas tumsas) pie 400 līdz 800 luksu apgaismojuma testēšanas trauku rajonā.
|
|
26.
|
Lai pārbaudītu augsnes mitrumu, traukus testēšanas sākumā un turpmāk reizi nedēļā nosver. Svara zudumu kompensē, pievienojot atbilstošu daudzumu dejonizēta ūdens. Jāpiebilst, ka ūdens zudumu var samazināt, uzturot augstu gaisa mitrumu (>80 %) testēšanas inkubatorā.
|
|
27.
|
Mitruma saturs un pH jāmēra gan diapazona noteikšanas, gan galīgā testa sākumā un beigās. Mērījumi jāveic kontrolgrupas un apstrādātajos (visu koncentrāciju) augsnes paraugos, kas sagatavoti un uzturēti tādā pašā veidā kā testa kultūras, bet nesatur tārpus. Barība šiem augsnes paraugiem būtu jāpievieno tikai testēšanas sākumā, lai veicinātu mikrobu aktivitāti. Pievienotās barības daudzumam jābūt tādam pašam kā testējamajām kultūrām pievienotajam. Testēšanas laikā šiem traukiem nav nepieciešams pievienot papildu barību.
|
Barošana
|
28.
|
Var izmantot barību, kas spēj uzturēt sīkslieku populāciju. Ir konstatēts, ka piemērots barības materiāls ir auzu pārslas – vēlams, iepriekš autoklavētas, lai izvairītos no mikrobioloģiskās kontaminācijas (piemērota ir arī karsēšana).
|
|
29.
|
Pirms tārpu ievietošanas katrā traukā vispirms augsnē iemaisa barību (50 mg samaltu auzu pārslu). Turpmāk barību pievieno ik nedēļu līdz 21. dienai. 28. dienā barošanu neveic, jo pieaugušie indivīdi šajā posmā ir aizvākti, bet jaunajiem tārpiem turpmāk ir vajadzīgs salīdzinoši maz papildu barības. Testēšanas laikā barošana nozīmē 25 mg samaltu auzu pārslu uz trauku, ko rūpīgi uzber uz augsnes virskārtas, lai izvairītos no tārpu savainošanas. Lai samazinātu sēnīšu augšanu, auzu pārslas būtu jāaprok augsnē, apsedzot ar nelielu daudzumu augsnes. Ja barība netiek apēsta, būtu jāsamazina barības porcija.
|
Diapazona noteikšanas testa plāns
|
30.
|
Kad nepieciešams, diapazona noteikšanas testu veic, piemēram, ar piecām testējamās ķīmiskās vielas koncentrācijām – 0,1, 1,0, 10, 100 un 1 000 mg/kg (augsnes saussvara). Viens replikāts katrai apstrādei un kontrolgrupai ir pietiekami.
|
|
31.
|
Diapazona noteikšanas testa ilgums ir divas nedēļas. Testa beigās izvērtē tārpu mirstību. Tārpu reģistrē kā beigtu, ja tas nereaģē uz mehānisko kairinājumu priekšējā galā. Papildu informācija par mirstību var noderēt, arī izlemjot par koncentrāciju intervālu galīgajam testam. Tādēļ vajadzētu reģistrēt arī izmaiņas pieaugušo uzvedībā (piemēram, nespēju ierakties augsnē; gulēšanu nekustīgā stāvoklī pret testēšanas trauka stikla sienu) un morfoloģijā (piemēram, atvērtu brūču klātbūtni), kā arī jauno īpatņu klātbūtni. Pēdējo rādītāju var noteikt ar 6. papildinājumā aprakstīto iekrāsošanas metodi.
|
|
32.
|
LC50 var aptuveni noteikt, aprēķinot mirstības datu ģeometrisko vidējo. Nosakot koncentrāciju intervālu galīgajam testam, pieņem, ka ietekme uz vairošanos ir līdz pat 10 reizes zemāka nekā LC50. Tomēr tā ir empīriska sakarība, katrā konkrētā gadījumā tā var atšķirties. Papildu novērojumi diapazona noteikšanas testā, piemēram, jauno īpatņu klātbūtne, var palīdzēt precizēt testējamās ķīmiskās vielas koncentrāciju intervālu, ko izmantot galīgajā testā.
|
|
33.
|
Lai pareizi noteiktu LC50, ieteicams veikt testu, izmantojot vismaz četrus katras testējamās ķīmiskās vielas koncentrācijas replikātus un adekvātu skaitu koncentrāciju, lai pie minētajām koncentrācijām iegūtu vismaz četras atbildreakcijas vidējās vērtības, kuru starpība būs statistiski nozīmīga. Attiecīgos gadījumos izmanto arī līdzīgu skaitu kontrolgrupu koncentrāciju un replikātu.
|
Galīgā vairošanās testa plāns
|
34.
|
Pamatojoties uz starplaboratoriju salīdzinošās testēšanas rekomendācijām (2), var piedāvāt trīs testa plānus.
|
—
|
NOEC noteikšanai būtu testē vismaz piecas koncentrācijas ģeometriskā progresijā. Katrai testējamajai koncentrācijai ieteicami četri replikāti, kā arī vēl astoņi kontrolreplikāti. Katrai nākamajai koncentrācijai būtu jābūt ne vairāk kā 1,8 reizes lielākai nekā iepriekšējai.
|
|
—
|
ECx (piemēram, EC10, EC50), noteikšanai būtu jātestē vismaz piecas koncentrācijas, un tām būtu jāaptver ECx, lai ECx varētu interpolēt, nevis ekstrapolēt. Katrai testējamajai koncentrācijai ieteicami vismaz četri replikāti, kā arī vēl četri kontrolreplikāti. Kvocients var atšķirties, t. i., būt mazāks vai vienāds ar 1,8 paredzamajā ietekmes diapazonā un lielāks nekā 1,8 augstākām vai zemākām koncentrācijām.
|
|
—
|
Kombinēta pieeja ļauj noteikt gan NOEC, gan ECx. Būtu jāizmanto astoņas apstrādes koncentrācijas ģeometriskā progresijā. Katrai apstrādei ieteicami četri replikāti, kā arī vēl astoņi kontrolreplikāti. Katrai nākamajai koncentrācijai būtu jābūt ne vairāk kā 1,8 reizes lielākai nekā iepriekšējai.
|
|
|
35.
|
Jāizmanto desmit pieauguši tārpi uz testēšanas trauku (sk. 23. punktu). Barību testēšanas traukam pievieno testēšanas sākumā un turpmāk reizi nedēļā (sk. 29. punktu) līdz 21. dienai ieskaitot. 21. dienā augsnes paraugus rūpīgi pārmeklē ar rokām, novēro un saskaita dzīvos pieaugušos tārpus un pieraksta izmaiņas uzvedībā (piemēram, nespēja ierakties augsnē; nekustīga gulēšana pret testēšanas trauka stikla sienu) un morfoloģijā (piemēram, atvērtas brūces). Tad visi pieaugušie tārpi tiek aizvākti no testēšanas traukiem un testēšanas augsnes. Testēšanas augsni, kas satur producētos kokonus, inkubē trīs papildu nedēļas tajos pašos testēšanas apstākļos, izņemot to, ka barošana notiek tikai 35. dienā (t. i., 25 mg samaltu auzu pārslu uz trauku).
|
|
36.
|
Pēc trīs nedēļām saskaita jaunos izšķīlušos tārpus. Ieteicamā metode balstās uz iekrāsošanu ar bengāļu sarkano (sk. 6. papildinājumu), lai gan piemērotas ir arī citas mitrās (bet ne karstās) ekstrakcijas un flotācijas tehnikas sk. 6. papildinājumu) (4)(10)(11)(20). Iekrāsošana ar bengāļu sarkano ir ieteicama tāpēc, ka suspendēto māla daļiņu radītās duļķes var traucēt augsnes substrāta mitrajai ekstrakcijai.
|
Robežtests
|
37.
|
Ja diapazona noteikšanas testā pie augstākās koncentrācijas (t. i., 1 000 mg/kg) nenovēro nekādu ietekmi, vairošanās testu var veikt kā robežtestu, izmantojot 1 000 mg/kg, lai pierādītu, ka vairošanās NOEC ir lielāka nekā šī vērtība.
|
Testa kopsavilkums un grafiks
|
38.
|
Testēšanas posmus var rezumēt šādi:
|
Laiks
|
Diapazona noteikšanas tests
|
Galīgais tests
|
|
– 7. diena vai agrāk
|
|
—
|
Sagatavojiet mākslīgo augsni (sauso sastāvdaļu samaisīšana)
|
|
|
—
|
Sagatavojiet mākslīgo augsni (sauso sastāvdaļu samaisīšana)
|
|
|
– 5. diena
|
|
—
|
Pārbaudiet mākslīgās augsnes pH
|
|
—
|
Izmēriet augsnes maksimālo WHC
|
|
|
—
|
Pārbaudiet mākslīgās augsnes pH
|
|
—
|
Izmēriet augsnes maksimālo WHC
|
|
|
– 5. līdz – 3. diena
|
|
—
|
Sašķirojiet tārpus aklimatizācijai
|
|
|
—
|
Sašķirojiet tārpus aklimatizācijai
|
|
|
– 3. līdz 0. diena
|
|
—
|
Aklimatizējiet tārpus vismaz 24 stundas
|
|
|
—
|
Aklimatizējiet tārpus vismaz 24 stundas
|
|
|
– 1. diena
|
|
—
|
Iepriekš samitriniet mākslīgo augsni un sadaliet pa partijām
|
|
|
—
|
Iepriekš samitriniet mākslīgo augsni un sadaliet pa partijām
|
|
|
0. diena
|
|
—
|
Sagatavojiet izejšķīdumus
|
|
—
|
Ievadiet testējamo ķīmisko vielu
|
|
—
|
Iesveriet testa substrātu testēšanas traukos
|
|
—
|
Izmēriet augsnes pH un mitruma saturu
|
|
|
—
|
Sagatavojiet izejšķīdumus
|
|
—
|
Pievienojiet Ievadiet ķīmisko vielu
|
|
—
|
Iesveriet testa substrātu testēšanas traukos
|
|
—
|
Izmēriet augsnes pH un mitruma saturu
|
|
|
7. diena
|
|
—
|
Pārbaudiet augsnes mitruma saturu
|
|
|
—
|
Pārbaudiet augsnes mitruma saturu
|
|
|
14. diena
|
|
—
|
Nosakiet pieaugušo īpatņu mirstību
|
|
—
|
Aplēsiet jauno īpatņu skaitu
|
|
—
|
Izmēriet augsnes pH un mitruma saturu
|
|
|
—
|
Pārbaudiet augsnes mitruma saturu
|
|
|
21. diena
|
|
|
—
|
Novērojiet pieaugušo īpatņu uzvedību
|
|
—
|
Aizvāciet pieaugušos īpatņus
|
|
—
|
Nosakiet pieaugušo īpatņu mirstību
|
|
—
|
Pārbaudiet augsnes mitruma saturu
|
|
|
28. diena
|
|
|
—
|
Pārbaudiet augsnes mitruma saturu
|
|
|
35. diena
|
|
|
—
|
Pārbaudiet augsnes mitruma saturu
|
|
|
42. diena
|
|
|
—
|
Saskaitiet jaunos tārpus
|
|
—
|
Izmēriet augsnes pH un mitruma saturu
|
|
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
39.
|
Lai gan 7. papildinājumā ir sniegts īss apskats, šai testēšanas metodei nav galīgu statistisku norādījumu par testa rezultātu analizēšanu.
|
|
40.
|
Diapazona noteikšanas testā galvenais beigupunkts ir mirstība. Vajadzētu reģistrēt arī izmaiņas pieaugušo īpatņu uzvedībā (piemēram, nespēju ierakties augsnē, gulēšanu nekustīgā stāvoklī pret testēšanas trauka stikla sienu) un morfoloģijā (piemēram, atvērtas brūces), kā arī jauno īpatņu klātbūtni. Lai noteiktu LC50, parasti būtu jālieto probita analīze (21) vai logistiskā regresija. Tomēr gadījumos, kad šī analīzes metode nav piemērota (piemēram, ja ir pieejamas mazāk nekā trīs daļēji nāvējošas koncentrācijas), var izmantot alternatīvas metodes. Šīs metodes var būt slīdošie vidējie (22), saīsinātā Spīrmena–Kerbera metode [Spearman-Karber method] (23) vai vienkārša interpolācija (piemēram, LC0 un LC100 ģeometriskais vidējais, ko aprēķina, izvelkot kvadrātsakni no LC0 un LC100 reizinājuma).
|
|
41.
|
Galīgajā testā beigupunkts ir vaislība (t. i., radušos jauno īpatņu skaits). Tomēr, tāpat kā diapazona noteikšanas testā, galīgajā pārskatā ir jāiekļauj arī visas kaitējuma pazīmes. Statistiskajai analīzei jāaprēķina vairošanās aritmētiskais vidējais un standartnovirze katrai apstrādes un kontroles grupai.
|
|
42.
|
Ja ir veikta dispersijas analīze, standartnovirzi (s) un brīvības pakāpes (df) var aizstāt ar summārās dispersijas aplēsi, kas iegūta attiecīgi no ANOVA un tās brīvības pakāpēm, ar nosacījumu, ka dispersija nav atkarīga no koncentrācijas. Šajā gadījumā izmantojiet atsevišķās kontroles un apstrādes dispersijas. Šīs vērtības parasti aprēķina ar komerciālu statistikas programmu, par replikātiem izmantojot katra trauka rezultātus. Ja negatīvo un šķīdinātāja kontroļu datu apkopošana šķiet saprātīgāka nekā testēšana, salīdzinot ar vienu no tām, tās būtu jātestē, lai pārliecinātos, ka tās nav būtiski atšķirīgas (piemērotus testus sk. 45. punktā un 7. papildinājumā).
|
|
43.
|
Papildu statistiskā testēšana un slēdziens ir atkarīgs no tā, vai replikātu vērtības atbilst normālsadalījumam un to dispersija ir homogēna.
|
NOEC noteikšana
|
44.
|
Priekšroka ir jaudīgu testu lietošanai. Būtu jāizmanto informācija, piemēram, no iepriekšējās pieredzes ar starplaboratoriju salīdzinošo testēšanu vai citiem vēsturiskiem datiem, par to, vai dati ir aptuveni normāli sadalīti. Būtiskāka ir dispersijas homogenitāte (homoskedastiskums). Pieredze liecina, ka nereti dispersija palielinās, palielinoties vidējām vērtībām. Tādos gadījumos homoskedastiskumu var panākt ar datu transformāciju. Tomēr šādai transformācijai būtu jābalstās uz pieredzi ar vēsturiskiem datiem, nevis pētāmajiem datiem. Homogēnu datu gadījumā būtu jāveic vairāki t-testi, piemēram, Viljamsa tests (Williams' test) (α = 0,05, vienpusējais) (24)(25) vai dažos gadījumos – Daneta tests (Dunnett's test) (26)(27). Jānorāda, ka nevienlīdzīgas replikācijas gadījumā, tabulas t vērtības jāizlabo atbilstoši Daneta un Viljamsa ieteikumiem. Reizēm atbildreakcijas nepalielinās/nesamazinās regulāri, jo ir plaša variācija. Tādā gadījumā – ja ir izteikta novirze no monotonitātes – piemērotāks ir Daneta tests. Ja ir novirzes no homoskedastiskuma, var būt pamatoti uzmanīgāk izmeklēt iespējamo ietekmi uz dispersijām, lai varētu izlemt, vai t-testus var izmantot bez būtiskiem jaudas zudumiem (28). Alternatīvi var izmantot multiplu U-testu, piemēram, Bonferoni U-testu (Bonferroni U-test) saskaņā ar Holmu (29), vai, ja šie dati ir heteroskedastiski, bet citādi ir atbilst pamatā esošai monotonai devas atbildreakcijai, citu neparametrisku testu, piemēram, Džonkhīra–Terpstras testu (Jonckheere-Terpstra) (30)(31) vai Šērlija testu (Shirley test) (32)(33); kopumā tie būtu vēlamāki nekā nelīdzvērtīgās dispersijas t-testi (sk. arī shēmu 7. papildinājumā).
|
|
45.
|
Ja ir veikts robežtests un izpildās parametriskās testēšanas procedūras priekšnosacījumi (normālsadalījums, homogenitāte), var izmantot pāru Stjūdenta t-testu (Student t-test), ja ne – Manna–Vitnija U-testa procedūru (Mann-Whitney U-test) (29).
|
ECx noteikšana
|
46.
|
Lai aprēķinātu ECx vērtību, lineārās vai nelineārās regresijas analīzē izmanto katras apstrādes vidējās vērtības pēc tam, kad ir iegūta atbilstoša devas–atbildreakcijas funkcija. Attiecībā uz tārpu augšanu kā nepārtrauktu atbildreakciju ECx vērtības var aplēst, izmantojot piemērotu regresijas analīzi (35). Kā piemērotas funkcijas bināriem datiem (mirstībai/izdzīvošanai un pēcnācēju skaitam) minamas normālā sigmoīda, logistiskā vai Veibula (Weibull) funkcija, kas satur divus līdz četrus parametrus, no kuriem daži var modelēt arī hormētiskas atbildreakcijas. Ja devas–atbildreakcijas funkcija piemeklēta ar lineāras regresijas analīzi, ar regresijas analīzi būtu jākonstatē būtisks r2 (determinācijas koeficients) un/vai virziena koeficients, pirms nosaka ECx,, regresijas analīzē atrastajā vienādojumā ievietojot vērtību, kas atbilst x % kontroles vidējā. 95 % ticamības intervālu aprēķina pēc Fīlera (Fieller) (citēts Finneja (Finney) darbā (21)) vai citām modernām, atbilstošām metodēm.
|
|
47.
|
Alternatīvi atbildreakciju modelē kā modeļa parametra procentuālo daļu vai proporciju, kas tiek interpretēta kā kontroles vidējā reakcija. Tādos gadījumos normālo (logistisko, Veibula) sigmoīdo līkni bieži vien viegli pielāgot rezultātiem, izmantojot probita regresijas procedūru (21). Tādos gadījumos svēršanas funkcija jāpielāgo metriskām atbildreakcijām, kā norādījis Kristensens (Christensen) (36). Savukārt tad, ja ir novērota hormēze, probita analīze būtu jāaizstāj ar četru parametru logistisko vai Veibula funkciju, kas pielāgota ar nelineāras regresijas procedūru (36). Ja datiem nevar piemeklēt piemērotu devas–atbildreakcijas funkciju, ECx un tās ticamības intervālu aprēķināšanai var izmantot alternatīvas metodes, piemēram, slīdošos vidējos pēc Tompsona (Thompson) (22) un saīsināto Spīrmena–Kerbera metodi (23).
|
TESTĒŠANAS PĀRSKATS
|
48.
|
Testēšanas pārskatā jāiekļauj turpmāk norādītā informācija.
|
|
Testējamā ķīmiskā viela:
|
—
|
fizikālais veids un attiecīgās fizikālķīmiskās īpašības (piemēram, šķīdība ūdenī, tvaika spiediens);
|
|
—
|
testējamās ķīmiskās vielas ķīmiskais nosaukums IUPAC nomenklatūrā, CAS numurs, partija, sērija, struktūrformula un tīrība;
|
|
—
|
parauga derīguma termiņš.
|
|
|
|
Testējamās sugas:
|
—
|
izmantotie testa dzīvnieki: suga, zinātniskais nosaukums, organismu izcelsme un audzēšanas apstākļi.
|
|
|
|
Testēšanas apstākļi:
|
—
|
mākslīgās augsnes sastāvdaļas un sagatavošana;
|
|
—
|
testējamās ķīmiskās vielas ievadīšanas metode;
|
|
—
|
testēšanas apstākļu apraksts, tostarp temperatūras, mitruma satura, pH u. c. raksturojums;
|
|
—
|
eksperimenta plāna un procedūru pilnīgs apraksts.
|
|
|
|
Testa rezultāti:
|
—
|
pieaugušo tārpu mirstība pēc divām nedēļām un jauno īpatņu skaits diapazona noteikšanas testa beigās;
|
|
—
|
pieaugušo tārpu mirstība pēc trīs nedēļu ekspozīcijas un pilnīgi dati par jaunajiem īpatņiem galīgā testa beigās;
|
|
—
|
visi novērotie testa organismu fiziskie vai patoloģiskie simptomi un uzvedības izmaiņas;
|
|
—
|
vairošanās LC50, NOEC un/vai ECx (piemēram, EC50, EC10), ja kāds no šiem rādītājiem ir piemērojams, norādot ticamības intervālus un piemeklētā modeļa grafiku, kas izmantots tā aprēķināšanai, visa rezultātu interpretācijai noderīgā informācija un novērojumi.
|
|
Jāziņo par atkāpēm no procedūrām, kas aprakstītas šajā testēšanas metodē, un visiem neraksturīgiem notikumiem testēšanas laikā.
|
LITERATŪRA
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
(3)
|
Westheide, W. and Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Šā pielikuma C.8. nodaļa “Slieku akūtas toksicitātes tests”.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(8)
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. and Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
1. papildinājums
DEFINĪCIJAS
Šajā testēšanas metodē ir izmantotas turpmāk sniegtās definīcijas.
|
|
Ķīmiskā viela ir viela vai to maisījums.
|
|
|
ECx
(ietekmes koncentrācija, pie kuras ietekme ir x %) ir koncentrācija, kas konkrētā ekspozīcijas periodā uz testa organismiem atstāj x % ietekmi salīdzinājumā ar kontrolgrupu. Šajā testā ietekmes koncentrācijas izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LC0
(neletālā koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kas noteiktā laika periodā nenonāvē nevienu no tai eksponētajiem testa organismiem. Šajā testā LC0 izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LC50
(medianālā letālā koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kas noteiktā laika periodā nonāvē 50 % no tai eksponētajiem testa organismiem. Šajā testā LC50 izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LC100
(pilnīgi letālā koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kas noteiktā laika periodā nonāvē 100 % no tai eksponētajiem testa organismiem. Šajā testā LC100 izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LOEC
(zemākā novērojamās ietekmes koncentrācija) ir zemākā testējamās ķīmiskās vielas koncentrācija ar statistiski nozīmīgu ietekmi (p < 0,05). Šajā testā LOEC izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību. Visām koncentrācijām, kas ir lielākas nekā LOEC, normāli vajadzētu būt ietekmei, kas statistiski atšķiras no kontrolgrupas rādītāja. Jebkādas atkāpes no iepriekš minētā, nosakot LOEC, jāpamato testēšanas pārskatā.
|
|
|
NOEC
(nenovērojamās ietekmes koncentrācija) ir testējamās ķīmiskās vielas augstākā koncentrācija, kas ir tieši zem LOEC un kurai nav novērojamas ietekmes. Šajā testā NOEC atbilstošajai koncentrācijai konkrētā ekspozīcijas periodā nav statistiski nozīmīgas ietekmes (p < 0,05) salīdzinājumā ar kontrolgrupu.
|
|
|
Vairošanās ātrums ir vidējais izšķīlušos jauno tārpu skaits uz pieaugušo skaitu testēšanas laikā.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai to maisījums, kuru testē, izmantojot šo testēšanas metodi.
|
2. papildinājums
Maksimālās ūdensnoturspējas noteikšana
Mākslīgās augsnes ūdensnoturspējas noteikšana
Turpmākā metode ir atzīta par pieņemamu. Tā ir aprakstīta ISO DIS 11268-2 C pielikumā.
Ievāciet noteiktu daudzumu (piemēram, 5 g) testējamās augsnes substrāta ar piemērotu ierīci (gliemežcauruli u. c.). Nosedziet caurules apakšu ar filtrpapīra gabalu un pēc uzpildīšanas ar ūdeni novietojiet to uz statīva ūdens vannā. Caurule pakāpeniski jāiegremdē, līdz ūdens līmenis pārsniedz augsnes virsējo līmeni. Tad tā jāatstāj ūdenī apmēram uz trīs stundām. Tā kā nav iespējams iegūt visu ūdeni, kas uzsūcies augsnes kapilāros, augsnes paraugam būtu divas stundas jāļauj notecēt, novietojot cauruli uz ļoti slapju smalki samaltu kvarca smilšu dobītes noslēgtā traukā (lai novērstu izžūšanu). Tad paraugs jānosver un jāizžāvē līdz konstantai masai 105 °C. Ūdensnoturspēju (WHC) var aprēķināt šādi:
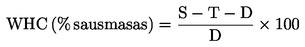
kur:
|
S
|
=
|
ūdens piesātinātais substrāts + caurules masa + filtrpapīra masa
|
|
T
|
=
|
tara (caurules masa + filtrpapīra masa)
|
|
D
|
=
|
substrāta sausmasa
|
ATSAUCES:
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
3. papildinājums
Augsnes PH noteikšana
Turpmākā metode augsnes pH noteikšanai balstās uz aprakstu ISO 10390 (“Augsnes kvalitāte – pH noteikšana”).
Noteiktu augsnes daudzumu vismaz 12 stundas žāvē istabas temperatūrā. Tad vismaz 5 gramus augsnes suspendē piecreiz lielākā tilpumā vai nu 1 M analītiskās tīrības pakāpes kālija hlorīda (KCl), vai 0,01 M analītiskās tīrības pakāpes kalcija hlorīda (CaCl2) šķīduma. Tad suspensiju kārtīgi krata piecas minūtes. Pēc kratīšanas suspensijai ļauj nosēsties vismaz 2 stundas, bet ne ilgāk kā 24 stundas. Tad izmēra šķidrās fāzes pH ar pH mērītāju, kas pirms katra mērījuma kalibrēts, izmantojot atbilstošu buferšķīdumu sēriju (piemēram, pH 4,0 un 7,0).
ATSAUCES:
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
4. papildinājums
Enchytraeus sugu kultivēšanas apstākļi
Enchytraeus albidus (kā arī citas sīkslieku (Enchytraeus) ģints sugas) var kultivēt lielās plastmasas kastēs (piemēram, 30 × 60 × 10 cm), kas aizpildītas ar mākslīgās augsnes un nekontaminētas dabiskas dārza augsnes maisījumu attiecībā 1:1. Jāizvairās no komposta materiāla izmantošanas, jo tas var saturēt toksiskas ķīmiskās vielas, piemēram, smagos metālus. Pirms izmantošanas augsne jāatbrīvo no faunas (piemēram, sasaldējot). Var izmantot arī substrātu tikai no mākslīgās augsnes, bet vairošanās ātrums var būt zemāks nekā tas, ko var panākt ar jauktas augsnes substrātu. Kultivēšanai izmantojamā substrāta pH jābūt 6,0 ± 0,5.
Kultūru glabā tumsā 15 līdz 20 °C ± 2 °C temperatūrā. Jāizvairās no temperatūras, kas ir augstāka nekā 23 °C. Jārūpējas, lai augsne būtu mitra, bet ne slapja. Par pareizu augsnes mitruma saturu liecina mazu ūdens lāsīšu parādīšanās starp pirkstiem, maigi saspiežot augsni. Jāizvairās no bezskābekļa apstākļu rašanās, nodrošinot to, ka kultūras konteineru vāki nodrošina adekvātu gāzu apmaiņu ar atmosfēru. Augsne katru nedēļu ir rūpīgi jāuzirdina, lai veicinātu apskābekļošanu.
Tārpus var barot ar auzu pārslām. Auzas jāglabā noslēgtos traukos un jāautoklavē vai jāuzkarsē pirms izmantošanas, lai izvairītos no miltu ērču (piemēram, Glyzyphagus sugas, Astigmata, Acarina) vai plēsīgu ērču (piemēram, Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina) invāzijas. Pēc termiskas apstrādes barība ir jāsamaļ, lai to var viegli uzkaisīt uz augsnes virskārtas. Laiku pa laikam auzu pārslas var papildināt ar vitamīniem, pienu vai mencu aknu eļļu. Citi piemēroti barības avoti ir pārtikas raugs un zivju barība TetraMin.
Barošana notiek apmēram divas reizes nedēļā. Atbilstošs daudzums auzu pārslu tiek uzkaisīts augsnes virskārtai vai arī rūpīgi iemaisīts substrātā augsnes uzirdināšanas laikā, lai veicinātu apskābekļošanu. Absolūtais dodamās barības daudzums ir atkarīgs no tārpu skaita substrātā. Barības daudzums būtu jāpalielina, ja tā visa tiek apēsta dienas laikā pēc uzkaisīšanas. Pretējā gadījumā, ja barība joprojām palikusi virskārtā, kad pienācis otrās barošanas laiks (pēc nedēļas), tās daudzums ir jāsamazina. Barība, kas kontaminēta ar sēnīšu kolonijām, jāaizvāc un jāaizstāj. Pēc trīs mēnešiem tārpi jāpārliek svaigi sagatavotā substrātā.
Kultivēšanas apstākļi uzskatāmi par apmierinošiem, ja tārpi: a) nemēģina atstāt augsnes substrātu, b) ātri pārvietojas cauri augsnei, c) ir ar spīdīgu ārējo virsmu bez pielipušām augsnes daļiņām, d) ir vairāk vai mazāk bālgani, e) kultūrās ir atrodami dažādos vecumos un f) nepārtraukti vairojas.
5. papildinājums
Testa norise ar citām sīkslieku ģints (Enchytraeus) sugām
Sugu izvēle
Var izmantot ne tikai E. albidus, bet arī citas sīkslieku sugas, taču tad attiecīgi ir jāpielāgo testa procedūra un derīguma kritēriji. Tā kā daudzas sīkslieku sugas ir viegli pieejamas un ir viegli uzturamas laboratorijā, vissvarīgākais kritērijs, kas mudina izvēlēties citu sugu, nevis E. albidus, ir ekoloģiskais nozīmīgums un papildus – salīdzināms jutīgums. Sugas maiņai var būt arī formāli iemesli. Piemēram, valstīs, kurās E. albidus nav sastopama un to nevar importēt (piemēram, karantīnas ierobežojumu dēļ), vajadzēs izmantot citas sīkslieku sugas.
Piemērotu alternatīvu sugu piemēri
|
—
|
Enchytraeus crypticus (Westheide & Graefe, 1992). Pēdējos gados šo sugu bieži izmanto ekotoksikoloģiskajos pētījumos, jo tās pārstāvjus ir vienkārši audzēt un testēt. Tomēr tā ir sīka un to ir sarežģītāk izmantot nekā E. albidus (jo īpaši posmos pirms iekrāsošanas metodes izmantošanas). Nav drošu liecību, ka E. crypticus eksistē laukā – tā ir aprakstīta tikai pēc slieku kultūrām. Tāpēc tās ekoloģiskās prasības nav zināmas.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky, 1879). Šis vārds, iespējams, apzīmē cieši radniecīgu sugu grupu, ko morfoloģiski ir grūti atšķirt. Tās izmantošana testēšanā nav ieteicama, iekams var noteikt testā izmantojamo īpatņu sugu. E. buchholzi parasti ir sastopamas pļavās un traucējumu skartās vietās, piemēram, ceļmalās.
|
|
—
|
Enchytraeus luxuriosus. Šī suga sākotnēji bija pazīstama kā E. minutus, bet nesen tikusi aprakstīta (1). To atklāja U. Grēfe (U. Graefe, Hamburga) pļavā netālu no Sanktpēterordingas (St. Peter-Ording, Šlēsviga-Holšteina, Vācija). E. luxuriosus ir apmēram divreiz mazākas par E. albidus, bet lielākas nekā citu šeit aprakstīto sugu pārstāvji; tā varētu būt laba E. albidus alternatīva.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen, 1963). Līdz šim ziņojumi par šo sugu bijuši no Vācijas un Spānijas minerālaugsnēm, kur tā ir izplatīta, bet parasti ne īpaši lielās populācijās. Salīdzinājumā ar citām šīs ģints sīkajām sugām to ir salīdzinoši viegli identificēt. Nekas nav zināms par tās uzvedību laboratorijas testos vai tās jutīgumu pret ķīmiskajām vielām. Tomēr ir atklāts, ka tās ir viegli kultivēt (E. Belotti, personīgā saziņā).
|
Audzēšanas apstākļi
Visas iepriekš minētās sīkslieku ģints (Enchytraeus) sugas var kultivēt tajos pašos substrātos, ko izmanto E. albidus. Tā kā šo sugu pārstāvji ir mazāki, kultūras trauki var būt mazāki un, lai gan var izmantot to pašu barību, jākoriģē porciju lielums. Šo sugu dzīves cikls ir īsāks nekā E. albidus, un barošana jāveic biežāk.
Testēšanas apstākļi
Testēšanas apstākļi kopumā ir tādi paši kā E. albidus, izņemot to, ka:
|
—
|
testēšanas trauka izmērs var būt mazāks (bet tas nav obligāti);
|
|
—
|
vairošanās testa ilgums var būt īsāks (bet tas nav obligāti), t. i., četras nedēļas sešu vietā; tomēr diapazona noteikšanas testa ilgumu nevajadzētu mainīt;
|
|
—
|
ņemot vērā jauno tārpu nelielo izmēru, lai skaitīt būtu vieglāk, ļoti ieteicams izmantot iekrāsošanas metodi;
|
|
—
|
derīguma kritērijs, kas attiecas uz “jauno īpatņu skaitu katrā testēšanas traukā kontrolesgrupā” būtu jānomaina uz “50”.
|
ATSAUCES
|
(1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
6. papildinājums
Ekstrakcijas tehniku detalizēts apraksts
Iekrāsošana ar bengāļu sarkano
Šo metodi, ko sākotnēji izstrādāja limnoloģijā (1), pirmoreiz izmantošanai jauno sīkslieku skaitīšanai Enchytraeidae vairošanās testā ierosināja V. de Koens (W. de Coen) (Ģentes Universitāte, Beļģija). Neatkarīgi no viņa modificētu versiju (bengāļu sarkanā un formaldehīda, nevis etilspirta maisījums) izstrādāja Nīderlandes Nacionālais sabiedrības un vides veselības institūts Bilthovenā (RIVM Bilthoven) (2)(3).
Galīgā testa beigās (t. i., pēc sešām nedēļām) augsni no testēšanas traukiem pārliek seklā konteinerā. Šim nolūkam noder Bellaplasta trauks vai gaismas baseins ar rievotu apakšdaļu – pēdējais tāpēc, ka rievas ierobežo tārpu pārvietošanos novērošanas lauka ietvaros. Jaunos īpatņus fiksē ar etilspirtu (apmēram 5 ml uz replikātu). Tad traukus uzpilda ar ūdeni līdz 1–2 cm slānim. Pievieno dažus pilienus (200 līdz 300 μl) bengāļu sarkanā (1 % etilspirta šķīdums) (alternatīvi: 0,5 % eozīna) un abas sastāvdaļas rūpīgi samaisa. Pēc 12 stundām tārpiem būtu jāiekrāsojas sarkanīgā krāsā un būtu jābūt viegli saskaitāmiem, jo tie gulēs uz substrāta virskārtas. Alternatīvi substrāta/spirta maisījumu pirms tārpu skaitīšanas var izskalot caur sietu (acu izmērs: 0,250 mm). Izmantojot šo procedūru, kaolinīts, kūdra un daļa smilšu izskalosies un būs vieglāk saskatīt un saskaitīt sārti iekrāsotos tārpus. Skaitīšanu atvieglo arī izgaismotu lēcu (lēcu izmērs: vismaz 100 × 75 mm; palielinājums: 2–3×) izmantošana.
Iekrāsošanas tehnika samazina skaitīšanas laiku līdz dažām minūtēm uz trauku un – orientējoši –vienam cilvēkam vajadzētu spēt novērtēt visus viena testa traukus ne ilgāk kā divās dienās.
Mitrā ekstrakcija
Mitrā ekstrakcija būtu jāsāk uzreiz pēc testa beigām. Augsni no katra trauka ievieto uz plastmasas sietos ar apmēram 1 mm acīm. Tad sietus iekar plastmasas bļodās tā, lai tie nepieskartos apakšdaļai. Bļodas rūpīgi uzpilda ar ūdeni, līdz paraugi sietos ir pilnībā iegrimuši ūdenī. Lai nodrošinātu vairāk nekā 90 % klātesošo tārpu atgūšanas rādītāju, būtu jāizmanto trīs dienu ekstrakcijas periods 20 ± 2 °C temperatūrā. Ekstrakcijas perioda beigās sietus aizvāc un ūdeni (izņemot nelielu daudzumu) lēnām nolej, uzmanoties neizliet sedimentus bļodu apakšdaļā. Tad plastmasas bļodas viegli sakrata, lai suspendētu nogulsnes virsējā ūdenī. Ūdeni pārlej Petri platē un pēc tam, kad augsnes daļiņas ir nosēdušās, sīksliekas var identificēt, aizvākt un saskaitīt ar stereomikroskopu un fleksiblu tērauda pinceti.
Flotācija
R. Kupermans (R. Kuperman) piezīmē aprakstījis uz flotāciju balstītu metodi (4). Pēc testēšanas trauka satura fiksācijas ar etilspirtu augsni applūdina ar Ludox (AM-30 koloidālais silīcijs, 30 masas % suspensija ūdenī) līdz 10–15 mm virs augsnes virskārtas. Pēc augsnes un flotācijas līdzekļa rūpīgas maisīšanas 2–3 minūtes var viegli saskaitīt jaunos tārpus, kas peld pa virsu.
ATSAUCES
|
(1)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. and Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
7. papildinājums
Statistiskās datu novērtēšanas (NOEC noteikšanas) pārskats
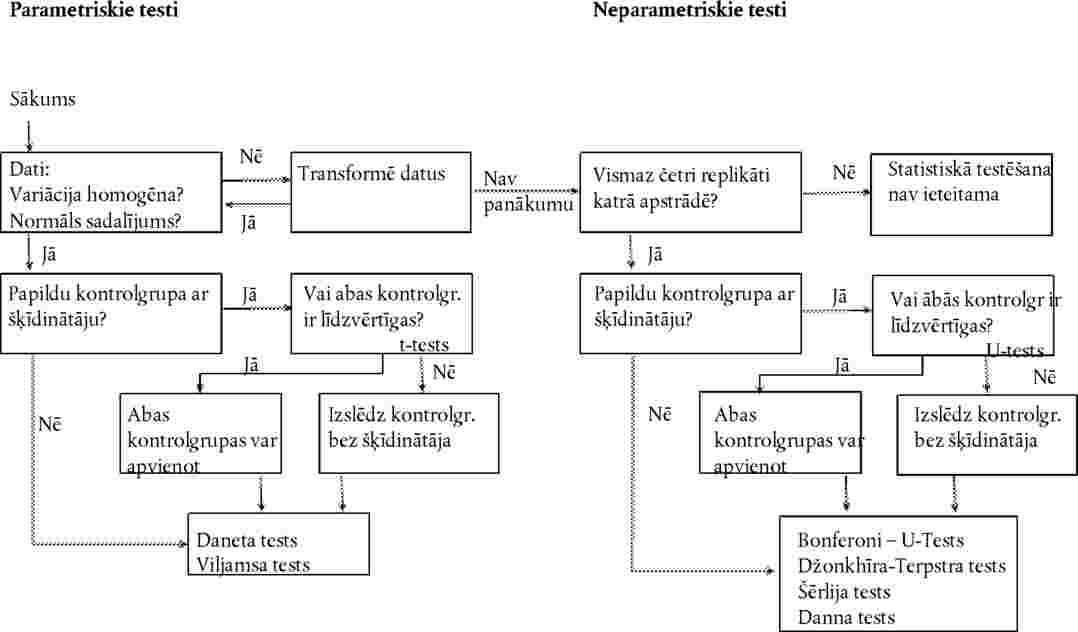
C.33. SLIEKU VAIROŠANĀS TESTS (EISENIA FETIDA / EISENIA ANDREI)
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 222 (2004. gads). Tā ir izveidota, lai novērtētu augsnē esošo ķīmisko vielu ietekmi uz Kalifornijas sarkano hibrīdslieku (Eisenia fetida) (Savigny, 1826) vai mēslu slieku (Eisenia andrei) (Andre, 1963) vairošanās rādītāju (un citiem subletāliem beigupunktiem) (1)(2). Tests ir pārbaudīts starplaboratoriju salīdzinošajā testēšanā (3). Pastāv slieku akūtās toksicitātes testēšanas metode (4). Ir publicētas vairākas citas starptautiskas un nacionālas vadlīnijas par slieku akūtās un hroniskās toksicitātes testiem (5)(6)(7)(8).
|
|
2.
|
Kalifornijas sarkano hibrīdslieku (Eisenia fetida) / mēslu slieku (Eisenia andrei) uzskata par augsnes faunas un konkrēti slieku pārstāvēm. Pamatinformācija par slieku ekoloģiju un to izmantošanu ekotoksikoloģiskajos pētījumos ir pieejama (7)(9)(10)(11)(12).
|
TESTĒŠANAS PRINCIPS
|
3.
|
Pieaugušie tārpi tiek pakļauti virknei testējamās ķīmiskās vielas koncentrāciju, kas ir vai nu iejaukta augsnē, vai (pesticīdu gadījumā) ievadīta augsnē vai uzsmidzināta augsnei, izmantojot paņēmienus, kas atbilst ķīmiskās vielas lietošanas veidam. Metodes lietojums ir specifisks testa nolūkam. Testējamo koncentrāciju diapazonu izvēlas, lai iezīmētu tās, kas astoņu nedēļu laikā varētu atstāt gan subletālu, gan letālu ietekmi. Pieaugušo tārpu mirstību un ietekmi uz augšanu nosaka četras nedēļas pēc ekspozīcijas. Tad pieaugušie indivīdi tiek aizvākti no augsnes un ietekmi uz vairošanos novērtē pēc vēl četrām nedēļām, saskaitot augsnē klātesošos slieku pēcnācējus. Testējamās ķīmiskās vielas ekspozīcijai pakļauto tārpu vairošanās rādītāju salīdzina ar kontrolgrupas rādītāju(-iem), lai noteiktu i) nenovērojamās ietekmes koncentrāciju (NOEC) un/vai ii) ECx (piemēram, EC10, EC50), lietojot regresijas modeli, lai aplēstu koncentrāciju, kas izraisītu vairošanās rādītāja samazināšanos par x %. Testējamām koncentrācijam ir jāaptver ECx (piemēram, EC10, EC50), lai ECx iegūtu interpolējot, nevis ekstrapolējot (sk. definīcijas 1. papildinājumā).
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
4.
|
Lai palīdzētu atbilstošu testēšanas procedūru izveidei, jābūt pieejamai šādai informācijai par testējamo ķīmisko vielu:
|
—
|
un informācija par apriti vidē un mijiedarbību ar to, ja tā ir iespējama (piemēram, fotolīzes un hidrolīzes rādītājs, ja tas ir būtiski lietošanas veidiem).
|
|
|
5.
|
Šī testēšanas metode ir izmantojama visām ķīmiskajām vielām neatkarīgi no to šķīdības ūdenī. Šī testēšanas metode nav piemērojama nedz gaistošām ķīmiskajām vielām, t. i., ķīmiskajām vielām, kurām Henrija konstante vai gaisa/ūdens sadalījuma koeficients ir lielāks nekā viens, nedz arī ķīmiskajām vielām, kuru tvaika spiediens pārsniedz 0,0133 Pa 25 °C temperatūrā.
|
|
6.
|
Šajā testēšanas metodē netiek ņemtā vērā iespējamā testējamās ķīmiskās vielas degradācija testēšanas laikā. Līdz ar to nevar pieņemt, ka ekspozīcijas koncentrācijas visu testēšanas laiku saglabāsies sākotnējā līmenī. Tādā gadījumā ir ieteicama testējamās ķīmiskās vielas ķīmiskā analīze testēšanas sākumā un beigās.
|
ĶĪMISKĀ STANDARTVIELA
|
7.
|
Jānosaka ķīmiskās standartvielas NOEC un ECx, lai pārliecinātos, ka laboratorijas testa apstākļi ir piemēroti un ka testa organismu reakcija laika gaitā statistiski nemainās. Ieteicams ķīmisko standartvielu testēt vismaz reizi gadā vai arī, ja testēšana notiek retāk, veikt to paralēli ar testējamās ķīmiskās vielas toksicitātes noteikšanu. Karbendazīms vai benomils ir piemērotas ķīmiskās standartvielas, kuru ietekme uz vairošanos ir pierādīta (3). Būtisks efekts būtu jānovēro starp a) 1 un 5 mg aktīvās vielas (AV) uz kg sausās masas un b) 250–500 g/ha jeb 25–50 mg/m2. Ja testu virknē iekļauj pozitīvu toksisko standartu, izmanto vienu koncentrāciju, un replikātu skaitam jābūt tādam pašam kā kontrolgrupas replikātu skaitam.
|
TESTA DERĪGUMS
|
8.
|
Lai testa rezultāts būtu uzskatāms par derīgu, kontrolgrupas replikātos ir jābūt izpildītiem šādiem kritērijiem:
|
—
|
katrā replikātā (ar 10 pieaugušajiem) testēšanas beigās jābūt izšķīlušamies ≥ 30 jaunajiem īpatņiem;
|
|
—
|
vairošanās variācijas koeficientam jābūt ≤ 30 %
|
|
—
|
pieaugušo īpatņu mirstībai sākotnējās četrās testēšanas nedēļās jābūt ≤ 10 %.
|
Ja tests neatbilst iepriekš minētajiem derīguma kritērijiem, tas jāpārtrauc, ja vien nav iespējams sniegt pamatojumu testa turpināšanai. Pamatojums jāiekļauj pārskatā.
|
TESTA APRAKSTS
Aparatūra
|
9.
|
Jāizmanto testēšanas konteineri no stikla vai cita ķīmiski inerta materiāla ar tilpumu apmēram viens vai divi litri. Konteineru šķērsgriezuma laukumam jābūt apmēram 200 cm2, lai substrātā tiktu nodrošināts mitrums apmēram 5–6 cm dziļumā, kad tiek pievienoti 500–600 g substrāta sausmasas. Konteinera vāka konstrukcijai būtu jāļauj notikt gāzu apmaiņai starp substrātu un atmosfēru un jānodrošina gaismas piekļuve (piemēram, perforēts, caurspīdīgs vāks), vienlaikus neļaujot tārpiem izkļūt. Ja substrāta daudzums ir ievērojami lielāks nekā 500 līdz 600 g uz testēšanas konteineru, tārpu skaits būtu proporcionāli jāpalielina.
|
|
10.
|
Nepieciešams laboratorijas standartaprīkojums, jo īpaši:
|
—
|
pH mērītājs un fotometrs;
|
|
—
|
piemēroti, precīzi svari;
|
|
—
|
piemērota temperatūras kontroles ierīce,
|
|
—
|
piemērota mitruma kontroles ierīce (nav nepieciešama, ja ekspozīcijas traukiem ir vāki);
|
|
—
|
inkubators vai maza telpa ar gaisa kondicionētāju;
|
|
—
|
pincetes, āķi vai cilpas;
|
|
Mākslīgās augsnes sagatavošana
|
11.
|
Šajā testā (5)(7) izmanto mākslīgo augsni ar šādu sastāvu (pamatojoties uz saussvariem, žāvējot līdz konstantam svaram 105 °C temperatūrā):
|
—
|
10 % sfagnu kūdras (tik tuvu pH 5,5 līdz 6,0, cik vien iespējams, bez redzamām augu atliekām, smalki samaltas, izžāvētas līdz izmērītam mitruma saturam);
|
|
—
|
20 % kaolīna mālu (vēlamais kaolinīta saturs – virs 30 %);
|
|
—
|
0,3 līdz 1,0 % kalcija karbonāta (CaCO3, pulverizēta, analītiskās tīrības pakāpes), lai iegūtu sākotnējo pH 6,0 ± 0,5;
|
|
—
|
70 % gaisžāvētu kvarca smilšu (atkarībā no nepieciešamā CaCO3 daudzuma), lielākoties smalku smilšu, kas vairāk nekā par 50 % sastāv no daļiņām ar izmēru 50 līdz 200 mikroni.
|
1. piezīme. Nepieciešamais CaCO3 daudzums būs atkarīgs no augsnes substrāta sastāvdaļām, tostarp barības, un tas būtu jānosaka ar augsnes apakšparaugu mērījumiem uzreiz pirms testēšanas. pH mēra jauktā paraugā 1 M kālija hlorīda (KCl) vai 0,01 M kalcija hlorīda (CaCl2) šķīdumā (13).
2. piezīme. Mākslīgās augsnes organiskā oglekļa saturu var samazināt, piemēram, samazinot kūdras saturu līdz 4–5 % un attiecīgi palielinot smilšu saturu. Šādi samazinot organiskā oglekļa saturu, var samazināties iespējamība, ka testējamā ķīmiskā viela adsorbēsiesaugsnē (organiskajā ogleklī) un palielināties testējamās ķīmiskās vielas pieejamība tārpiem. Ir pierādīts, ka tests ar Kalifornijas sarkano hibrīdslieku var izpildīt vairošanās derīguma kritērijus, ja tās testē lauka augsnē ar zemāku organiskā oglekļa saturu, nekā minēts iepriekš (piemēram, 2,7 %) (14), kā arī ir gūta pieredze, ka to var panākt arī ar mākslīgu augsni, kura satur 5 % kūdras. Tāpēc nav nepieciešams pirms šādas augsnes izmantošanas galīgajā testā pierādīt mākslīgās augsnes atbilstību, jo var pieļaut, ka tests atbilst derīguma kritērijiem, ja vien kūdras saturs nav samazināts vairāk, nekā iepriekš norādīts.
3. piezīme. Izmantojot dabisko augsni papildu (piemēram, augstāka līmeņa) testēšanā, arī ir jāpierāda augsnes piemērotība un testa derīguma kritēriju izpilde.
|
|
12.
|
Augsnes sausās sastāvdaļas rūpīgi samaisa (piemēram, liela izmēra laboratorijas maisītājā) labi vēdinātā vietā. Pirms testa sākšanas sauso mākslīgo augsni samitrina, pievienojot pietiekami daudz dejonizēta ūdens, lai iegūtu apmēram pusi galīgā ūdens satura, kas ir 40 līdz 60 % maksimālās ūdensnoturspējas (atbilst 50 ± 10 % mitruma sausmasā). Tā iegūst substrātu bez stāvoša ūdens vai brīva ūdens, kad to saspiež plaukstā. Mākslīgās augsnes maksimālo ūdensnoturspēju (WHC) nosaka saskaņā ar 2. papildinājumā, ISO 11274 (15) vai līdzvērtīgā ES standartā aprakstītajām procedūrām.
|
|
13.
|
Ja testējamo ķīmisko vielu uzklāj uz augsnes virskārtas vai iejauc augsnē bez ūdens, galīgo ūdens daudzumu var iejaukt mākslīgajā augsnē tās sagatavošanas laikā. Ja testējamā ķīmiskā viela tiek iejaukta augsnē kopā ar nelielu daudzumu ūdens, papildu ūdeni var pievienot kopā ar testējamo ķīmisko vielu (sk. 19. punktu).
|
|
14.
|
Augsnes mitruma saturu nosaka testēšanas sākumā un beigās saskaņā ar ISO 11465 (16) vai līdzvērtīgu ES standartu, bet augsnes pH – saskaņā ar 3. papildinājumu vai ISO 10390 (13), vai līdzvērtīgu ES standartu. Šie mērījumi būtu jāveic augsnes kontrolparaugā un katrā testējamās koncentrācijas augsnes paraugā. Augsnes pH nedrīkst pielāgot, ja tiek testētas skābas vai bāziskas ķīmiskās vielas. Mitruma saturs jāmonitorē visu testēšanas laiku, periodiski nosverot konteinerus (sk. 26. un 30. punktu).
|
Testa dzīvnieku izvēle un sagatavošana
|
15.
|
Testēšanā izmanto Kalifornijas sarkano hibrīdslieku (Eisenia fetida) vai mēslu slieku (Eisenia andrei) (1)(2). Lai sāktu testēšanu, ir vajadzīgi pieauguši tārpi vecumā no diviem mēnešiem līdz vienam gadam un ar jostiņu. Tārpi būtu jāizvēlas no sinhronizētas kultūras ar relatīvi homogēnu vecuma struktūru (4. papildinājums). Testa grupas īpatņu vecumam nevajadzētu atšķirties vairāk kā par četrām nedēļām.
|
|
16.
|
Izvēlētie tārpi vismaz vienu dienu jāaklimatizē tāda tipa mākslīgās augsnes substrātā, ko paredzēts izmantot testēšanā. Šā perioda laikā tārpi jābaro ar to pašu barību, ko izmantos testēšanā (sk. 31. līdz 33. punktu).
|
|
17.
|
Grupas pa 10 tārpiem būtu atsevišķi jānosver un pēc nejaušības principa jāsadala pa testēšanas konteineriem testēšanas sākumā. Pirms nosvēršanas tārpi ir jānomazgā (ar dejonizētu ūdeni) un liekais ūdens ir jāaizvāc, īsu brīdi paturot tārpus uz filtrpapīra. Atsevišķo tārpu mitrajam svaram vajadzētu būt no 250 līdz 600 mg.
|
Testējamo koncentrāciju sagatavošana
|
18.
|
Var izmantot divas testējamās ķīmiskās vielas ievadīšanas metodes: testējamās ķīmiskās vielas iejaukšanu augsnē (sk. 19.–21. punktu) vai uzklāšanu uz augsnes virskārtas (sk. 22.–24. punktu). Piemērotas metodes izvēle ir atkarīga no testa nolūka. Parasti ir ieteicama testējamās ķīmiskās vielas iejaukšana augsnē. Tomēr var būt nepieciešams lietot ievadīšanas procedūras, kas atbilst parastajai lauksaimniecības praksei (piemēram, šķidrā preparāta izsmidzināšana vai īpašu pesticīdu preparātu izmantošana, piemēram, granulas vai sēklu kodinātāji). Šķīdinātāji, ko izmanto, lai augsni būtu vieglāk apstrādāt ar ķīmiskajām vielām, būtu jāizvēlas, pamatojoties uz to zemo toksicitāti attiecībā uz sliekām, un testēšanas plānā jāiekļauj atbilstoša šķīdinātāja kontrole (sk. 27. punktu).
|
Testējamās ķīmiskās vielas iejaukšana augsnē
Ūdenī šķīstoša testējamā ķīmiskā viela
|
19.
|
Tieši pirms testēšanas sākšanas pagatavo testējamās ķīmiskās vielas šķīdumu dejonizēta ūdens daudzumā, kas ir pietiekams visiem vienas testējamās koncentrācijas replikātiem. Lai atvieglotu testējamā šķīduma sagatavošanu, var būt nepieciešams palīgšķīdinātājs. Ir lietderīgi sagatavot šķīdumu tādā daudzumā, kāds nepieciešams, lai sasniegtu galīgo mitruma saturu (40 līdz 60 % maksimālās ūdensnoturspējas). Šķīdumu rūpīgi sajauc ar augsnes substrātu pirms ievadīšanas testēšanas konteinerā.
|
Ūdenī nešķīstoša testējamā ķīmiskā viela
|
20.
|
Testējamo ķīmisko vielu izšķīdina nelielā daudzumā piemērota organiskā šķīdinātāja (piemēram, acetona) un tad uzsmidzina uz nelielā daudzuma smalku kvarca smilšu vai tajās iejauc. Tad šķīdinātāju iztvaicē, vismaz dažas minūtes turot trauku velkmes skapī. Apstrādātās smiltis rūpīgi iejauc iepriekš samitrinātajā mākslīgajā augsnē. Pēc tam, lai sasniegtu galīgo mitruma saturu – 40 līdz 60 % maksimālās ūdensnoturspējas –, pievieno un iejauc dejonizētu ūdeni (nepieciešamajā daudzumā). Tad augsne ir gatava ievietošanai testēšanas konteineros (traukos). Jāuzmanās no tā, vai šķīdinātāji nav sliekām toksiski.
|
Ūdenī un organiskajos šķīdinātājos nešķīstoša testējamā ķīmiskā viela
|
21.
|
Pagatavo maisījumus no 10 g smalki samaltu rūpniecisko kvarca smilšu un testējamās ķīmiskās vielas daudzumā, kas nepieciešams testējamās koncentrācijas sasniegšanai augsnē. Pēc tam maisījumu rūpīgi iejauc iepriekš samitrinātajā mākslīgajā augsnē. Pēc tam, lai sasniegtu galīgo mitruma saturu – 40 līdz 60 % maksimālās ūdensnoturspējas –, pievieno un iejauc dejonizētu ūdeni (nepieciešamajā daudzumā). Tad augsne ir gatava ievietošanai testēšanas konteineros.
|
Testējamās ķīmiskās vielas uzklāšana augsnes virskārtai
|
22.
|
Augsni apstrādā pēc tam, kad ir pievienoti tārpi. Vispirms testēšanas konteinerus piepilda ar samitrināto augsnes substrātu un nosvērtos tārpus novieto uz virskārtas. Veselīgi tārpi parasti uzreiz ierokas substrātā, un attiecīgi visus uz virskārtas palikušos pēc 15 minūtēm uzskata par bojātiem un aizstāj. Ja tārpus aizstāj, jaunpievienotie un aizstātie ir jānosver, lai būtu zināms eksponētās tārpu grupas kopējais dzīvsvars un tārpus saturošā konteinera kopsvars sākumā.
|
|
23.
|
Ievada testējamo ķīmisko vielu. To nedrīkst pievienot augsnei pirmo pusstundu pēc tārpu ievietošanas (vai ja tārpi atrodas augsnes virskārtā), lai izvairītos no tiešas ekspozīcijas, testējamai ķīmiskajai vielai nonākot saskarē ar ādu. Ja testējamā ķīmiskā viela ir pesticīds, var būt piemēroti to uzsmidzināt uz augsnes virskārtas. Testējamā ķīmiskā viela būtu jāuzklāj uz augsnes virskārtas tik vienmērīgi, cik vien iespējams, izmantojot piemērotu laboratorijas mēroga izsmidzināšanas ierīci, lai simulētu aerosola izsmidzināšanu laukā. Pirms ievadīšanas būtu jānoņem testēšanas konteinera vāks un jāaizstāj ar ieliktni, kas pasargātu konteinera sānu sienas no aerosola. Ieliktni var pagatavot no testēšanas trauka ar noņemtu pamatni. Ievadīšanai būtu jānotiek 20 ± 2 °C temperatūrā un – dažādiem ūdensšķīdumiem, emulsijām vai dispersijām – ar ūdens izsmidzināšanas apjomu no 600 līdz 800 μl/m2. Apjoms būtu jāpārbauda ar piemērotu kalibrācijas paņēmienu. Īpaši preparāti, piemēram, granulas vai sēklu kodinātājs, būtu jāuzklāj veidā, kas atbilst lauksaimnieciskajam lietojumam.
|
|
24.
|
Testēšanas konteineri jāatstāj atvērti vienu stundu, lai ļautu iztvaikot visiem gaistošajiem šķīdinātājiem, ko izmanto testējamās ķīmiskās vielas ievadīšanā. Jārūpējas, lai šajā laikā no testēšanas trauka neizkļūtu neviens tārps.
|
PROCEDŪRA
Testa grupas un kontrolgrupas
|
25.
|
Ieteicamā proporcija ir 10 sliekas uz 500–600 g mākslīgās augsnes sausmasas (t. i., 50–60 g augsnes uz tārpu). Ja izmanto lielāku augsnes daudzumu, kā tas var būt, ja testē pesticīdus, kurus ievada īpašos veidos, piemēam, kā sēklu kodinātāju, proporcija 50–60 g augsnes uz tārpu jāsaglabā, palielinot tārpu skaitu. Katram kontrolgrupas un apstrādes konteineram sagatavo desmit tārpus. Tārpus noskalo ar ūdeni, noslauka un tad uz īsu brīdi novieto uz absorbējoša papīra, lai ļautu liekajam ūdenim notecēt.
|
|
26.
|
Lai izvairītos no sistemātiskām kļūdām tārpu sadalē pa testēšanas konteineriem, testējamās populācijas homogenitāte būtu jānosaka, atsevišķi nosverot 20 tārpus, kas pēc nejaušības principa atlasīti no populācijas, no kuras ņem testējamos tārpus. Kad ir nodrošināta homogenitāte, tārpu partijas jāizvēlas, jānosver un jāsadala pa testēšanas konteineriem, izmantojot randomizācijas procedūru. Pēc testējamo tārpu pievienošanas jāizmēra katra testēšanas konteinera svars, lai nodrošinātu to, ka ir zināms sākotnējais svars, ko var izmantot par atskaites punktu augsnes mitruma satura monitoringam visu testa laiku, kā aprakstīts 30. punktā. Tad testēšanas konteinerus aizver, kā aprakstīts 9. punktā, un ievieto testēšanas kamerā.
|
|
27.
|
Katrai testējamās ķīmiskās vielas ievadīšanas metodei, kas aprakstīta 18. līdz 24. punktā, sagatavo piemērotus kontrolparaugus. Sagatavojot kontrolparaugus, ievēro attiecīgās aprakstītās procedūras, izņemot to, ka nepievieno testējamo ķīmisko vielu. Tas nozīmē, ka attiecīgos gadījumos organiskos šķīdinātājus, kvarca smiltis un citas nesējvielas pievieno kontrolgrupas paraugiem tādās pašās koncentrācijās/daudzumos kā apstrādes paraugos. Ja testējamās ķīmiskās vielas pievienošanai izmanto šķīdinātāju vai citu nesējvielu, jāsagatavo arī papildu kontrolparaugs bez nesējvielas vai testējamās ķīmiskās vielas un jānotestē, lai pārliecinātos, ka nesējvielai nav ietekmes uz rezultātu.
|
Testēšanas apstākļi
|
28.
|
Testēšanas temperatūra ir 20 ± 2 °C. Testu veickontrolētos gaismas un tumsas ciklos (vēlams, 16 stundas gaismas un astoņas stundas tumsas) pie 400 līdz 800 luksu apgaismojuma testēšanas konteineru zonā.
|
|
29.
|
Testēšanas laikā testēšanas konteinerus nevēdina, taču testēšanas trauku vāku dizainam būtu jānodrošina gāzu apmaiņas iespēja, vienlaikus ierobežojot mitruma iztvaikošanu (sk. 9. punktu).
|
|
30.
|
Augsnes substrāta ūdens saturu testēšanas konteineros uztur visā testēšanas laikā, periodiski pārsverot testēšanas konteinerus (bez to vākiem). Zudumus pēc vajadzības kompensē ar dejonizētu ūdeni. Ūdens saturam nevajadzētu par vairāk nekā 10 % atšķirties no sākotnējā.
|
Barošana
|
31.
|
Jebkāda barība ar pierādītu kvalitāti, kas piemērota vismaz tārpu svara uzturēšanai testēšanas laikā, ir uzskatāma par pieņemamu. Pieredze liecina, ka piemērota barība ir auzu milti, govju vai zirgu mēsli. Būtu jāpārbauda, vai govis vai zirgi, no kuriem mēsli iegūti, nav saņēmuši medikamentus vai ārstēšanu ar ķīmiskajām vielām, piemēram, augšanas stimulantiem, attārpošanas vai līdzīgiem veterinārajiem produktiem, kas varētu nevēlami ietekmēt tārpus testēšanas laikā. Ir ieteicams ievākt govju mēslus pašiem, jo pieredze liecina, ka komerciāli pieejamie govju mēsli, ko izmanto dārza mēslošanā, var negatīvi ietekmēt tārpus. Mēsli pirms lietošanas jāizžāvē gaisā, smalki jāsamaļ un jāpasterizē.
|
|
32.
|
Katra svaigā barības partija pirms izmantošanas testā jāiebaro netestējamajai tārpu kultūrai, lai pārliecinātos, ka tā ir piemērotas kvalitātes. Augšanai un kokonu ražošanai nevajadzētu samazināties salīdzinājumā ar tārpiem, kas turēti substrātā, kurš nesatur svaigu barības porciju (apstākļi atbilstoši testēšanas metodes C.8 aprakstam (4)).
|
|
33.
|
Barību pirmoreiz pievieno vienu dienu pēc tārpu ievietošanas un testējamās ķīmiskās vielas ievadīšanas augsnē. Katrā konteinerā augsnes virskārtai pārkaisa apmēram 5 g barības, ko samitrina ar dejonizētu ūdeni (apmēram 5 līdz 6 ml uz konteineru). Turpmāk barību pievieno reizi nedēļā četru nedēļu testēšanas periodā. Ja barība netiek apēsta, porcija būtu jāsamazina, lai izvairītos no sēnīšu augšanas vai pelējuma. Pieaugušos indivīdus no augsnes aizvāc 28. testēšanas dienā. Katram testēšanas konteineram pievieno papildu 5 g barības. Atlikušajās četrās testēšanas nedēļās papildu barošanas vairs nenotiek.
|
Testēšanas koncentrāciju izvēle
|
34.
|
Atbilstošas testējamās ķīmiskās vielas koncentrācijas izvēlē vajadzētu noderēt iepriekšējām zināšanām par testējamās ķīmiskās vielas toksicitāti, piemēram, no akūtās toksicitātes testa (4) un/vai diapazona noteikšanas testiem. Kad nepieciešams, veic diapazona noteikšanas testu, piemēram, ar piecām testējamajām koncentrācijām – 0,1, 1,0, 10, 100 un 1 000 mg/kg (augsnes sausmasas). Katrai apstrādei un kontrolgrupai pietiek ar vienu paraugu. Diapazona noteikšanas testa ilgums ir divas nedēļas, un mirstību novērtē testa beigās.
|
Eksperimentālais plāns
|
35.
|
Tā kā testam nevar noteikt tikai vienu summāro statistisko lielumu, šī testēšanas metode paredz iespēju noteikt NOEC un EXx. Visticamāk, pārskatāmā nākotnē regulatīvās iestādes pieprasīs noteikt NOEC. Iespējams, drīzumā sāks plašāk izmantot EXx, kas izriet no statistiskiem un ekoloģiskiem apsvērumiem. Tāpēc, pamatojoties uz starplaboratoriju salīdzinošās testēšanas rekomendācijām par sīkslieku vairošanās testa metodi (17), tiek piedāvāti trīs plāni.
|
|
36.
|
Nosakot koncentrāciju diapazonu, būtu jāpatur prātā šādi apsvērumi.
|
—
|
NOEC noteikšanai būtu jānotestē vismaz piecas/divpadsmit koncentrācijas ģeometriskā progresijā. Katrai testējamajai koncentrācijai ieteicami četri replikāti, kā arī vēl astoņi kontrolreplikāti. Katrai nākamajai koncentrācijai būtu jābūt ne vairāk kā 2,0 reizes lielākai nekā iepriekšējai.
|
|
—
|
ECx (piemēram, EC10, EC50) noteikšanai ir ieteicams izmantot adekvātu skaitu koncentrāciju, lai pie minētajām koncentrācijām iegūtu vismaz četras atbildreakcijas vidējās vērtības, kuru starpība būs statistiski nozīmīga. Katrai testējamajai koncentrācijai ieteicami vismaz divi replikāti, kā arī vēl seši kontrolreplikāti. Kvocients var atšķirties, t. i., tas var būt mazāks par vai vienāds ar 1,8 paredzamajā ietekmes diapazonā un lielāks nekā 1,8 augstākām vai zemākām koncentrācijām.
|
|
—
|
Kombinēta pieeja ļauj noteikt gan NOEC, gan ECx. Būtu jāizmanto astoņas apstrādes koncentrācijas ģeometriskā progresijā. Katrai apstrādei ieteicami četri replikāti, kā arī vēl astoņi kontrolreplikāti. Katrai nākamajai koncentrācijai būtu jābūt ne vairāk kā 1,8 reizes lielākai nekā iepriekšējai.
|
|
Testēšanas ilgums un mērījumi
|
37.
|
28. dienā novēro un saskaita pieaugušos tārpus. Reģistrē arī jebkādu neparastu uzvedību (piemēram, nespēju ierakties augsnē; nekustīgu gulēšanu) un morfoloģiskas izmaiņas (piemēram, atvērtas brūces). Tad visus pieaugušos tārpus izņem no testēšanas traukiem, saskaita un nosver. Tārpus saturošās augsnes pārnešana uz tīru paplāti pirms novērtēšanas var atvieglot pieaugušo īpatņu meklēšanu. Pirms nosvēršanas tārpi, kas izņemti no augsnes, ir jānomazgā (ar dejonizētu ūdeni) un liekais ūdens ir jāaizvāc, īsu brīdi paturot tārpus uz filtrpapīra. Visi tārpi, kas šajā laikā netiek atrasti, ir reģistrējami kā miruši, jo tiek pieņemts, ka šādi tārpi ir nomiruši un sadalījušies pirms novērtēšanas.
|
|
38.
|
Ja augsne ir bijusi aizvākta no konteineriem, tā ir jānovieto atpakaļ (bez pieaugušajiem tārpiem, bet ar tajā izveidotajiem kokoniem). Tad augsni papildu četras nedēļas inkubē tajos pašos testēšanas apstākļos, izņemot to, ka barošana notiek tikai vienreiz šīs testa fāzes sākumā (sk. 33. punktu).
|
|
39.
|
Otrā 4 nedēļu perioda beigās nosaka jauno, no kokoniem izšķīlušos īpatņu un kokonu skaitu testējamajā augsnē, izmantojot procedūras, kas aprakstītas 5. papildinājumā. Testēšanas perioda laikā jāreģistrē arī visas tārpiem nodarīta kaitējuma vai bojājumu pazīmes.
|
Robežtests
|
40.
|
Ja diapazona noteikšanas testā pie augstākās koncentrācijas (t. i., 1 000 mg/kg) nenovēro nekādu ietekmi, vairošanās testu veic kā robežtestu, izmantojot 1 000 mg/kg testa koncentrāciju. Robežtests sniegs iespēju pierādīt, ka vairošanās NOEC ir lielāka nekā robežkoncentrācija, vienlaikus līdz minimumam samazinot testā izmantojamo tārpu skaitu. Gan apstrādātajai augsnei, gan kontrolgrupai vajadzīgi astoņi replikāti.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
41.
|
Lai gan 6. papildinājumā ir sniegts pārskats, šai testēšanas metodei nav galīgu statistisku norādījumu par testa rezultātu analizēšanu.
|
|
42.
|
Viens beigupunkts ir mirstība. Vajadzētu reģistrēt arī izmaiņas pieaugušo īpatņu uzvedībā (piemēram, nespēju ierakties augsnē, gulēšanu nekustīgā stāvoklī pret testēšanas trauka stikla sienu) un morfoloģijā (piemēram, atvērtas brūces), kā arī jauno īpatņu klātbūtni. Lai noteiktu LC50, parasti būtu jālieto probita analīze (18) vai logistiskā regresija. Tomēr gadījumos, kad šī analīzes metode nav piemērota (piemēram, ja ir pieejamas mazāk nekā trīs daļēji nāvējošas koncentrācijas), var izmantot alternatīvas metodes. Šīs metodes var būt slīdošie vidējie (19), saīsinātā Spīrmena–Kerbera metode (20) vai vienkārša interpolācija (piemēram, LC0 un LC100 ģeometriskais vidējais, ko aprēķina, izvelkot kvadrātsakni no LC0 un LC100 reizinājuma).
|
|
43.
|
Otrs beigupunkts ir vaislība (t. i., radušos/izšķīlušos jauno īpatņu skaits). Tomēr, tāpat kā diapazona noteikšanas testā, galīgajā pārskatā ir jāiekļauj arī visas kaitējuma pazīmes. Statistiskajai analīzei vajag aprēķināt vairošanās aritmētisko vidējo
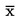
un standartnovirzi katrai apstrādes un kontroles grupai. |
|
44.
|
Ja ir veikta dispersijas analīze, standartnovirzi (s) un brīvības pakāpes (df) var aizstāt ar summārās dispersijas aplēsi, kas iegūta attiecīgi no ANOVA un tās brīvības pakāpēm, ar nosacījumu, ka dispersija nav atkarīga no koncentrācijas. Šajā gadījumā izmantojiet atsevišķās kontroles un apstrādes dispersijas. Šīs vērtības parasti aprēķina ar komerciālu statistikas programmu, par replikātiem izmantojot katra trauka rezultātus. Ja negatīvo un šķīdinātāja kontroļu datu apkopošana šķiet saprātīgāka nekā testēšana, salīdzinot ar vienu no tām, tās būtu jātestē, lai pārliecinātos, ka tās nav būtiski atšķirīgas (piemērotus testus sk. 47. punktā un 6. papildinājumā).
|
|
45.
|
Papildu statistiskā testēšana un slēdziens ir atkarīgs no tā, vai replikātu vērtības atbilst normālsadalījumam un to dispersija ir homogēna.
|
NOEC noteikšana
|
46.
|
Priekšroka ir jaudīgu testu lietošanai. Būtu jāizmanto informācija, piemēram, no iepriekšējās pieredzes ar starplaboratoriju salīdzinošo testēšanu vai citiem vēsturiskiem datiem, par to, vai dati ir aptuveni normāli sadalīti. Būtiskāka ir dispersijas homogenitāte (homoskedastiskums). Pieredze liecina, ka nereti dispersija palielinās, palielinoties vidējām vērtībām. Tādos gadījumos homoskedastiskumu var panākt ar datu transformāciju. Tomēr šādai transformācijai būtu jābalstās uz pieredzi ar vēsturiskiem datiem, nevis pētāmajiem datiem. Homogēnu datu gadījumā būtu jāveic vairāki t-testi, piemēram, Viljamsa tests (Williams' test) (α = 0,05, vienpusējais) (21)(22) vai dažos gadījumos – Daneta tests (Dunnett's test) (23)(24). Jānorāda, ka nevienlīdzīgas replikācijas gadījumā, tabulas t vērtības jāizlabo atbilstoši Daneta un Viljamsa ieteikumiem. Reizēm atbildreakcijas nepalielinās/nesamazinās regulāri, jo ir plaša variācija. Tādā gadījumā – ja ir izteikta novirze no monotonitātes – piemērotāks ir Daneta tests. Ja ir novirzes no homoskedastiskuma, var būt pamatoti uzmanīgāk izmeklēt iespējamo ietekmi uz dispersijām, lai varētu izlemt, vai t-testus var izmantot bez būtiskiem jaudas zudumiem (25). Alternatīvi var izmantot multiplu U-testu, piemēram, Bonferoni U-testu (Bonferroni U-test) saskaņā ar Holmu (26), vai, ja šie dati ir heteroskedastiski, bet citādi ir atbilst pamatā esošai monotonai devas atbildreakcijai, citu neparametrisku testu, piemēram, Džonkhīra–Terpstras testu (Jonckheere-Terpstra) (27)(28) vai Šērlija testu (29)(30); kopumā tie būtu vēlamāki nekā nelīdzvērtīgās dispersijas t-testi (sk. arī shēmu 6. papildinājumā).
|
|
47.
|
Ja ir veikts robežtests un izpildās parametriskās testēšanas procedūras priekšnosacījumi (normālsadalījums, homogenitāte), var izmantot pāru Stjūdenta t-testu, ja ne – Manna–Vitnija U-testa procedūru (31).
|
ECx noteikšana
|
48.
|
Lai aprēķinātu ECx vērtību, lineārās vai nelineārās regresijas analīzē izmanto katras apstrādes vidējie rādītāji pēc tam, kad ir iegūta atbilstoša devas–atbildreakcijas funkcija. Attiecībā uz tārpu augšanu kā nepārtrauktu reakciju ECx vērtības var aplēst, izmantojot piemērotu regresijas analīzi (32). Kā piemērotas funkcijas bināriem datiem (mirstībai/izdzīvotībai un pēcnācēju skaitam) minamas normālā sigmoīda, logistiskā vai Veibula funkcija, kas satur divus līdz četrus parametrus, no kuriem daži var modelēt arī hormētiskas atbildreakcijas. Ja devas–atbildreakcijas funkcija piemeklēta ar lineāras regresijas analīzi, ar regresijas analīzi būtu jākonstatē būtisks r2 (determinācijas koeficients) un/vai virziena koeficients, pirms nosaka ECx, regresijas analīzē atrastajā vienādojumā ievietojot vērtību, kas atbilst x % kontroles vidējā. 95 % ticamības intervālu aprēķina pēc Fīlera (Fieller) (citēts Finneja (Finney) darbā (18)) vai citām modernām, atbilstošām metodēm.
|
|
49.
|
Alternatīvi atbildreakciju modelē kā modeļa parametra procentuālo daļu vai proporciju, kas tiek interpretēta kā kontroles vidējā reakcija. Tādos gadījumos normālo (logistisko, Veibula) sigmoīdo līkni bieži vien viegli pielāgot rezultātiem, izmantojot probita regresijas procedūru (18). Tādos gadījumos svēršanas funkcija jāpielāgo metriskām atbildreakcijām, kā norādījis Kristensens (Christensen) (33). Savukārt tad, ja ir novērota hormēze, probita analīze būtu jāaizstāj ar četru parametru logistisko vai Veibula funkciju, kas pielāgota ar nelineāras regresijas procedūru (34). Ja datiem nevar piemeklēt piemērotu devas–atbildreakcijas funkciju, ECx un tās ticamības intervālu aprēķināšanai var izmantot alternatīvas metodes, piemēram, slīdošos vidējos pēc Tompsona (Thompson) (19) un saīsināto Spīrmena–Kerbera metodi (20).
|
TESTĒŠANAS PĀRSKATS
|
50.
|
Testēšanas pārskatā jāiekļauj turpmāk norādītā informācija.
|
|
Testējamā ķīmiskā viela:
|
—
|
testējamās ķīmiskās vielas, tās partijas, sērijas, CAS numura un tīrības pilnīgs apraksts;
|
|
—
|
testējamās ķīmiskās vielas īpašības (piemēram, log Kow
, šķīdība ūdenī, tvaika spiediens, Henrija konstante (H) un informācija par tās apriti).
|
|
|
|
Testa organismi:
|
—
|
izmantotie testa dzīvnieki: suga, zinātniskais nosaukums, organismu izcelsme un audzēšanas apstākļi;
|
|
—
|
testējamo dzīvnieku vecums, lieluma (masas) diapazons.
|
|
|
|
Testēšanas apstākļi:
|
—
|
detalizēta informācija par testējamās augsnes sagatavošanu;
|
|
—
|
augsnes maksimālā ūdensnoturspēja;
|
|
—
|
testējamās ķīmiskās vielas ievadīšanai augsnē izmantotā paņēmiena apraksts;
|
|
—
|
testējamās ķīmiskās vielas ievadīšanai izmantoto ķīmisko palīgvielu apraksts;
|
|
—
|
attiecīgā gadījumā – detalizēta informācija par izsmidzināšanas aprīkojuma kalibrāciju;
|
|
—
|
eksperimenta plāna un procedūras apraksts;
|
|
—
|
testēšanas konteineru izmērs un testa augsnes tilpums;
|
|
—
|
testēšanas apstākļi: gaismas intensitāte, gaismas un tumsas ciklu ilgums, temperatūra;
|
|
—
|
barošanas režīma apraksts; testā izmantotās barības veids un daudzums; barošanas datumi;
|
|
—
|
augsnes pH un ūdens saturs testēšanas sākumā un beigās.
|
|
|
|
Testa rezultāti:
|
—
|
pieaugušo indivīdu mirstība ( %) katrā testēšanas konteinerā pirmo 4 testēšanas nedēļu beigās;
|
|
—
|
pieaugušo indivīdu kopējā masa testa sākumā katrā testēšanas konteinerā;
|
|
—
|
dzīvo pieaugušo indivīdu ķermeņa svara izmaiņas ( % sākotnējā svara) katrā testēšanas konteinerā pēc pirmajās četrām testēšanas nedēļām;
|
|
—
|
katrā testēšanas konteinerā izšķīlušos jauno īpatņu skaits testēšanas beigās;
|
|
—
|
acīmredzamu vai patoloģisku simptomu vai uzkrītošu uzvedības izmaiņu apraksts;
|
|
—
|
rezultāti, kas iegūti ar ķīmisko standartvielu;
|
|
—
|
vairošanās LC50, NOEC un/vai ECx (piemēram, EC50, EC10), ja kāds no šiem rādītājiem ir piemērojams, norādot ticamības intervālus un piemeklētā modeļa grafiku, kas izmantots tā aplēšanai, visa rezultātu interpretācijai noderīgā informācija un novērojumi;
|
|
—
|
devas un atbildreakcijas sakarības diagramma;
|
|
—
|
katra testēšanas konteinera rezultāti.
|
|
Jāziņo par atkāpēm no procedūrām, kas aprakstītas šajā testēšanas metodē, un visiem neraksturīgiem notikumiem testēšanas laikā.
|
LITERATŪRA
|
(1)
|
Jaenicke, J. (1982). 'Eisenia foetida' is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N. and J. Stenerson (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 – 282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
(4)
|
Šā pielikuma C.8. nodaļa “Slieku akūtas toksicitātes tests”.
|
|
(5)
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., and L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. and J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
(13)
|
(ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
(16)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
(17)
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
1. papildinājums
DEFINĪCIJAS
Šai testēšanas metodei piemērojamas šādas definīcijas.
|
|
Ķīmiskā viela ir viela vai to maisījums.
|
|
|
ECx
(ietekmes koncentrācija, pie kuras ietekme ir x %) ir koncentrācija, kas konkrētā ekspozīcijas periodā uz testa organismiem atstāj x % ietekmi salīdzinājumā ar kontrolgrupu. Piemēram, EC50 ir aplēstā koncentrācija, kas noteiktā ekspozīcijas periodā atstāj ietekmi uz testa beigupunktu 50 procentos no eksponētās populācijas. Šajā testā ietekmes koncentrācijas izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību vai kā testējamās ķīmiskās vielas masu uz augsnes laukuma vienību.
|
|
|
LC0
(neletālā koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kas noteiktā laika periodā nenonāvē nevienu no tai eksponētajiem testa organismiem. Šajā testā LC0 izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LC50
(medianālā letālā koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kas noteiktā laika periodā nonāvē 50 % no tai eksponētajiem testa organismiem. Šajā testā LC50 izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LC100
(pilnīgi letālā koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kas noteiktā laika periodā nonāvē 100 % no tai eksponētajiem testa organismiem. Šajā testā LC100 izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību.
|
|
|
LOEC
(zemākā novērojamās ietekmes koncentrācija) ir zemākā testējamās vielas koncentrācija ar statistiski nozīmīgu ietekmi (p < 0,05). Šajā testā LOEC izsaka kā testējamās ķīmiskās vielas masas un augsnes sausmasas attiecību vai kā testējamās ķīmiskās vielas masas daudzums uz augsnes laukuma vienību. Visām koncentrācijām, kas ir lielākas nekā LOEC, normāli vajadzētu būt ietekmei, kas statistiski atšķiras no kontrolgrupas rādītāja. Jebkādas novirzes no iepriekš minētā jāpamato testēšanas pārskatā.
|
|
|
NOEC
(nenovērojamās ietekmes koncentrācija) ir testējamās ķīmiskās vielas augstākā koncentrācija, kas ir tieši zem LOEC un kurai nav novērojamas ietekmes. Šajā testā NOEC atbilstošajai koncentrācijai attiecīgajā ekspozīcijas periodā nav statistiski nozīmīgas ietekmes (p < 0,05) salīdzinājumā ar kontrolgrupu.
|
|
|
Vairošanās ātrums: vairošanās ātrums ir vidējais izšķīlušos jauno tārpu skaits uz pieaugušo skaitu testēšanas laikā.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai to maisījums, kuru testē, izmantojot šo testēšanas metodi.
|
2. papildinājums
Augsnes maksimālās ūdensnoturspējas noteikšana
Šī metode ir atzīta par piemērotu augsnes maksimālās ūdensnoturspējas noteikšanai. Tā ir aprakstīta ISO DIS 11268-2 C pielikumā (1).
Ievāciet noteiktu daudzumu (piemēram, 5 g) testējamās augsnes substrāta ar piemērotu parauga paņemšanas ierīci (gliemežcauruli u. c.). Nosedziet caurules apakšu ar filtrpapīra gabalu, uzpildiet ar ūdeni un tad novietojiet to uz statīva ūdens vannā. Caurule pakāpeniski jāiegremdē, līdz ūdens līmenis pārsniedz augsnes virsējo līmeni. Tad tā jāatstāj ūdenī apmēram uz trīs stundām. Tā kā nav iespējams iegūt visu ūdeni, kas uzsūcies augsnes kapilāros, augsnes paraugam būtu divas stundas jāļauj notecēt, novietojot cauruli uz ļoti slapju smalki samaltu kvarca smilšu dobītes nosegtā traukā (lai novērstu izžūšanu). Tad paraugs būtu jānosver un jāizžāvē līdz konstantai masai 105 °C temperatūrā. Ūdensnoturspēju (WHC) var aprēķināt šādi:
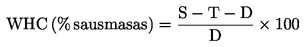
kur:
|
S
|
=
|
ūdens piesātinātais substrāts + caurules masa + filtrpapīra masa
|
|
T
|
=
|
tara (caurules masa + filtrpapīra masa)
|
|
D
|
=
|
substrāta sausā masa
|
ATSAUCES
|
(1)
|
ISO (International Organization for Standardisation) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
3. papildinājums
Augsnes PH noteikšana
Turpmākā metode augsnes pH noteikšanai balstās uz aprakstu ISO DIS 10390 (“Augsnes kvalitāte – pH noteikšana” (1)).
Noteiktu augsnes daudzumu vismaz 12 stundas žāvē istabas temperatūrā. Tad vismaz 5 gramus augsnes suspendē piecreiz lielākā tilpumā vai nu 1 M analītiskās tīrības pakāpes kālija hlorīda (KCl), vai 0,01 M analītiskās tīrības pakāpes kalcija hlorīda (CaCl2) šķīduma. Tad suspensiju kārtīgi krata piecas minūtes. Pēc kratīšanas suspensijai ļauj nosēsties vismaz 2 stundas, bet ne ilgāk kā 24 stundas. Tad izmēra šķidrās fāzes pH ar pH mērītāju, kas pirms katra mērījuma kalibrēts, izmantojot atbilstošu buferšķīdumu sēriju (piemēram, pH 4,0 un 7,0).
ATSAUCES
|
(1)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
4. papildinājums
Kalifornijas sarkanās hibrīdsliekas (Eisenia fetida)/mēslu sliekas (Eisenia andrei) kultivēšana
Audzēšanu vēlams veikt klimatiskajā skapī 20 °C ± 2 °C. Šādā temperatūrā pie pietiekama barības nodrošinājuma tārpi sasniegs briedumu apmēram 2 līdz 3 mēnešu laikā.
Abas sugas var audzēt daudzu dažādu dzīvnieku mēslos. Ieteicamā audzēšanas vide ir zirgu vai liellopu mēslu un kūdras maisījums attiecībā 50:50. Jāpārbauda, vai govis vai zirgi, no kuriem iegūti mēsli, nav saņēmuši medikamentus vai tikuši ārstēti ar ķīmiskām vielām, piemēram, augšanas stimulantiem, attārpotājiem vai līdzīgiem veterinārām zālēm, kas testēšanas laikā tārpus varētu nevēlami ietekmēt. Ir ieteicams pašiem ievākt govju mēslus no “bioloģiskiem” avotiem, jo pieredze liecina, ka komerciāli pieejamie mēsli, ko izmanto dārza mēslošanā, tārpus var ietekmēt negatīvi. Iegūtā substrāta pH vērtībai jābūt aptuveni 6–7 (koriģē ar kalcija karbonātu), tā jonu vadītspējai jābūt zemai (mazāk nekā 6 mS/cm vai sāls koncentrācija mazāk nekā 0,5 %) un tas nedrīkst būt pārmērīgi piesārņots ar amonjaku vai dzīvnieku urīnu. Substrātam jābūt mitram, bet ne pārāk slapjam. Piemērotas ir vairošanās kastes ar 10 līdz 50 litru tilpumu.
Lai iegūtu standartvecuma un standartlieluma (masas) tārpus, kultivēšanu ieteicams sākt ar kokoniem. Kad kultūra izaudzēta, to uztur, pieaugušos tārpus ievietojot vairošanās kastē ar svaigu substrātu uz 14 līdz 28 dienām, lai nodrošinātu kokonu veidošanos. Tad pieaugušos indivīdus aizvāc, un jaunos īpatņus, kas izšķīlušies no kokoniem, izmanto par pamatu nākamajai kultūrai. Tārpus pastāvīgi baro ar dzīvnieku mēsliem un laiku pa laikam pārvieto svaigā substrātā. Pieredze liecina, ka piemērota barība ir gaisā žāvēti, smalki samalti govju vai zirgu mēsli vai auzu milti. Jāpārbauda, vai govis vai zirgi, no kuriem iegūti mēsli, nav saņēmuši medikamentozu ārstēšanu ar ķīmiskām vielām, piemēram, augšanas stimulantiem, kas varētu nevēlami ietekmēt tārpus ilgstošas kultivēšanas laikā. Tārpus, kas izšķīlušies no kokoniem, testēšanā izmanto, kad tie ir 2 līdz 12 mēnešus veci un uzskatāmi par pieaugušiem.
Tārpus var uzskatīt par veseliem, ja tie pārvietojas pa substrātu, nemēģina to atstāt un pastāvīgi vairojas. Par substrāta izsīkšanu liecina tārpu ļoti lēna pārvietošanās un dzeltens pakaļējais gals. Tādā gadījumā ieteicams pievienot svaigu substrātu un/vai samazināt tārpu biezību.
5. papildinājums
NO KOKONIEM IZŠĶĪLUŠOS JAUNO TĀRPU SKAITĪŠANAS PAŅĒMIENI
Tārpu šķirošana ar rokām no augsnes substrāta prasa ļoti daudz laika. Tāpēc iesaka divas alternatīvas metodes.
|
a)
|
Testēšanas konteinerus ievieto ūdens vannā, kur sākotnēji temperatūra ir 40 °C, bet vēlāk to paaugstina līdz 60 °C. Pēc apmēram 20 minūtēm jaunajiem tārpiem jāparādās augsnes virspusē, no kurienes tos var viegli paņemt un saskaitīt.
|
|
b)
|
Testēšanas augsni var izskalot caur sietu, izmantojot metodi, ko izstrādājis van Gestels (van Gestel) kopā ar kolēģiem, (1) pieņemot, ka kūdra un mēsli vai augsnei pievienotie auzu milti tikuši smalki samalti. Vienu virs otra novieto divus sietus (acu izmērs – 0,5 mm; sietu diametrs – 30 cm). Testēšanas konteinera saturu ar spēcīgu krāna ūdens strūklu izskalo caur sietiem, jaunos tārpus un kokonus pārsvarā atstājot augšējā sietā. Ir svarīgi piebilst, ka šīs procedūras laikā visa augšējā sieta virsma jāuztur slapja, lai jaunie tārpi peldētu ūdens slānī un nevarētu izkļūt caur sieta porām. Vislabākos rezultātus var panākt, izmantojot dušas uzgali.
|
Kad viss augsnes substrāts ir izskalots caur sietu, jaunos īpatņus un kokonus no augšējā sieta var ieskalot bļodā. Tad bļodas saturu atstāj nostāvēties, lai tukšie kokoni peldētu pa ūdens virsu, bet pilnie kokoni un jaunie tārpi nogrimtu apakšdaļā. Stāvošo ūdeni tad var noliet un jaunos tārpus un kūniņas pārnest uz Petri plati ar nedaudz ūdens. Tārpus izvākt skaitīšanai var ar adatu vai pinceti.
Pieredze liecina, ka jauno tārpu ekstrakcijai labāk piemērota ir a) metode, jo jaunie tārpi var izkļūt pat caur 0,5 mm sīkiem caurumiņiem.
Vienmēr jānosaka, cik efektīva ir metode, ko izmanto, lai tārpus (un kokonus, ja iespējams) izvāktu no augsnes substrāta. Ja jaunos īpatņus šķiro ar rokām, ieteicams šo procedūru visiem paraugiem veikt divreiz.
ATSAUCES
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
6. papildinājums
Pārskats par datu statistisku novērtēšanu (NOEC noteikšana)
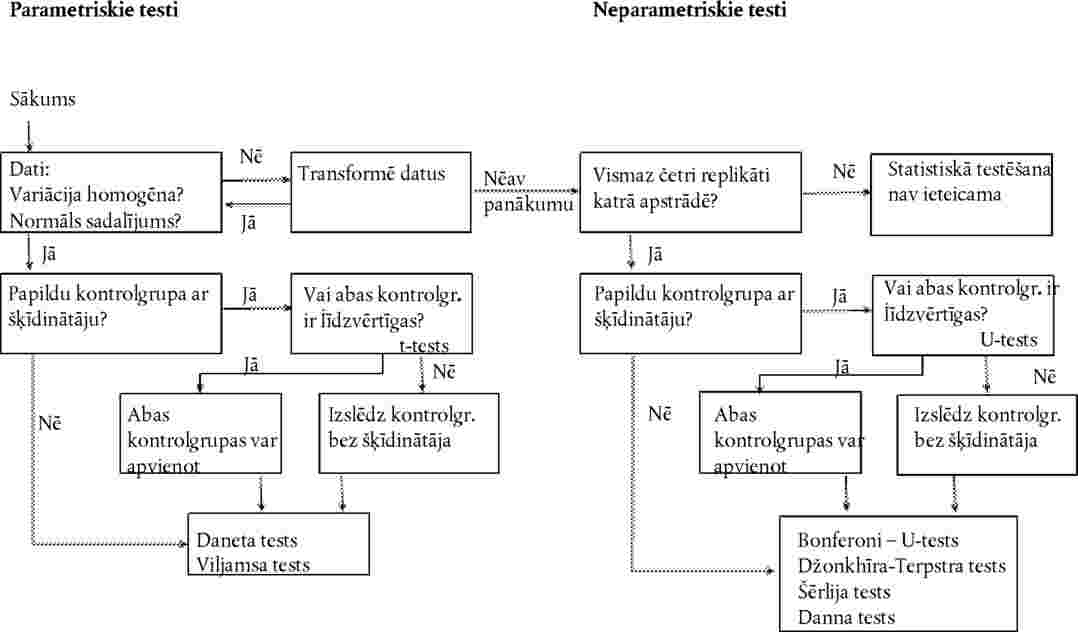
C.34. ANAEROBO BAKTĒRIJU AKTIVITĀTES INHIBĒŠANĀS NOTEIKŠANA PĒC TĀ, KĀ SAMAZINĀS GĀZES IZDALĪŠANĀS NO ANAEROBI BIONOĀRDOŠĀM (NOTEKŪDEŅU) DŪŅĀM
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 224 (2007. gads). Ķīmiskās vielas, kas nonāk ūdensvidē, iet cauri gan anaerobām, gan aerobām zonām, kur tās var noārdīties un/vai inhibēt baktēriju aktivitāti; dažos gadījumos tās anaerobās zonās var netraucēti saglabāties gadu desmitiem vai ilgāk. Notekūdeņu apstrādē pirmais posms – primārā nosēšanās – virspusējā šķidrumā ir aerobs un apakšā esošajās dūņās – anaerobs. Tam seko otrais posms, kurā aerobā zona ir aktīvo dūņu aerācijas baseinā, savukārt anaerobā zona – sekundārās nostādināšanas tvertnes apakšā esošās dūņās. Abos posmos dūņas parasti pakļauj anaerobai apstrādei, kurā rodas metāns un oglekļa dioksīds, ko parasti izmanto, lai ražotu elektrību. Plašākā vidē ķīmiskās vielas, kas nonāk līču, estuāru un jūras sedimentos, visticamāk, nenoteiktu laiku paliks šajās anaerobajās zonās, ja vien tās nav bionoārdāmas. Šajās zonās vislielākajā daudzumā nonāks ķīmiskās vielas ar attiecīgām fizikālām īpašībām, piemēram, nelielu šķīdību ūdenī, augstu adsorbēšanos uz suspendētām cietvielu daļiņām, kā arī nespēju tikt bioloģiski aerobi noārdītām.
|
|
2.
|
Lai gan vēlams, lai vidē nonākošas ķīmiskās vielas būtu bionoārdāmas gan aerobos, gan anaerobos apstākļos, ir būtiski, lai ne pirmajos, ne otrajos šādas ķīmiskās vielas neinhibētu mikroorganismu darbību. Apvienotajā Karalistē ir bijuši vairāki gadījumi, kur metāna ražošana pilnīgi inhibējusies, un to izraisījis, piemēram, rūpnieciskajos notekūdeņos esošais pentahlorfenols, kura dēļ inhibējušās dūņas ar ļoti augstām izmaksām nācies no bioreaktoriem transportēt uz “drošām” vietām un tās aizstāt ar veselīgām bionoārdošām dūņām no tuvējiem kompleksiem. Taču daudzos gadījumos mazāk smagus bioreaktoru traucējumus izraisījušas vairākas citas ķīmiskās vielas, arī alifātiskie halogēnūdeņraži (ķīmiskā tīrīšana) un deterģenti, kuri būtiski mazinājuši bioreaktoru efektivitāti.
|
|
3.
|
Tikai viena testēšanas metode, C.11 (1), kas saistīta ar bakteriālās aktivitātes inhibēšanos (aktīvo dūņu respirācija), dod iespēju novērtēt, kā testējamās ķīmiskās vielas ietekmē skābekļa uzņemšanas ātrumu substrāta klātbūtnē. Metodi plaši izmanto, lai agrīni noteiktu ķīmisko vielu iespējamo kaitīgo ietekmi uz notekūdeņu aerobo apstrādi, kā arī lai noteiktu testējamās ķīmiskās vielas neinhibējošās koncentrācijas, ko izmantot dažādajos bionoārdāmības testos. Ar testēšanas metodi C.43 (2) var tikai ierobežoti noteikt testējamās ķīmiskās vielas toksicitāti attiecībā uz to, cik gāzes producē anaerobās dūņas, kas atšķaidītas līdz vienai desmitdaļai no to normālās cietvielu daļiņu koncentrācijas, lai nodrošinātu nepieciešamo precizitāti procentuālās bionoārdīšanās novērtēšanā. Tā kā atšķaidītas dūņas var būt jutīgākas pret inhibējošām ķīmiskajām vielām, ISO grupa nolēma izstrādāt metodi, kurā izmanto neatšķaidītas dūņas. Tika pārbaudīti vismaz trīs testi (no Dānijas, Vācijas un Apvienotās Karalistes) un beigās tika sagatavoti divi ISO standarti – viens, ISO 13 641-1 (3), attiecībā uz neatšķaidītām dūņām un otrs, ISO 13 641-2 (4), attiecībā uz simtkārtīgi atšķaidītām dūņām – lai reprezentētu sašķidrinātas dūņas un sedimentus ar mazskaitlīgām baktēriju populācijām. Abas metodes tika pārbaudītas starplaboratoriju salīdzinošajā testēšanā (5); 1. daļa tika apstiprināta kā pieņemams standarts, bet 2. daļa izraisīja domstarpības. Apvienotās Karalistes zinātnieki uzskatīja, ka metode vēl jāpēta, jo liela daļa dalībnieku ziņoja, ka gāze veidojas nedaudz vai vispār neveidojas, daļēji tāpēc, ka gāzestelpas procents optimālai jutībai bija pārāk liels (75 %).
|
|
4.
|
Senākā pētījumā Apvienotajā Karalistē (6)(7) aprakstīta manometriska metode, kurā 500 ml kolbās izmantoja neatšķaidītas bionoārdošas dūņas, kā arī neapstrādātas notekūdeņu dūņas – par substrātu; sistēma bija neērta un neapstrādātās dūņas smakoja. Vēlāk Vilsons (Wilson) ar kolēģiem sekmīgi lietoja kompaktāku un ērtāku Šeltona un Tiedjē (Shelton, Tiedje) (8) aparātu, ko izstrādāja Batersbijs (Battersby) un Vilsons (9). Kavahara (Kawahara) ar kolēģiem (11) laboratorijā sekmīgi sagatavoja vairākas standartizētas dūņas izmantošanai anaerobiskās bionoārdāmības un inhibēšanās testos ar vairākām ķīmiskajām vielām. Tika aizstāts arī substrāts, neapstrādātu dūņu vietā testu veicot ar simtkārtīgi atšķaidītām anaerobajām dūņām vai ar sašķidrinātām dūņām, sedimentiem u. tml., kam ir zema bakteriālā aktivitāte.
|
|
5.
|
Šī metode var sniegt informāciju, kas var noderēt, lai paredzētu iespējamo testējamās ķīmiskās vielas ietekmi uz gāzes producēšanos anaerobajos bioreaktoros. Tomēr tikai ilgāka testēšana, kas precīzāk simulē darbojošos bioreaktorus, var parādīt, vai mikroorganismi testējamajai ķīmiskajai vielai var adaptēties, vai arī ķīmiskās vielas, visticamāk, adsorbēsies un, dūņās adsorbējušās, toksiskas koncentrācijas sasniegs ilgākā laika periodā, nekā pieļauj šis tests.
|
TESTĒŠANAS PRINCIPS
|
6.
|
Alikvotas daļas no anaerobi bionoārdošu dūņu (kopējā cietvielu daļiņu koncentrācija: 20 līdz 40 g/l) un noārdāma substrāta šķīduma maisījuma noslēgtos traukos atsevišķi un vienlaikus ar vairākām testējamās ķīmiskās vielas koncentrācijām inkubē līdz trim dienām. Kad pudelēs palielinājies spiediens (Pa), izmēra, kāds daudzums gāzes (metāna un oglekļa dioksīda) radies. Gāzes rašanās procentuālo inhibēšanos, ko izraisījusi testējamā ķīmiskā viela dažādās koncentrācijās, aprēķina pēc daudzumiem, kas radušies attiecīgajās testēšanas un kontroles pudelēs. EC50 un citas iedarbīgās koncentrācijas aprēķina pēc diagrammām, kur norādīta inhibēšanās procentuālā atkarība no testējamās ķīmiskās vielas koncentrācijas, vai biežāk pēc logaritmiskās sakarības.
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
7.
|
Testējamā ķīmiskā viela jāizmanto tīrākajā pieejamajā formā, jo dažu testējamo ķīmisko vielu, piemēram, hlorfenolu, piemaisījumi var būt daudz toksiskāki nekā pati testējamā ķīmiskā viela. Tomēr jāapsver, vai ķīmiskās vielas nav jātestē tādā formā, kādā tās ražo vai dara komerciāli pieejamas. Parasti nav ieteicams izmantot gatavus līdzekļus, tomēr attiecībā mazšķīstošām testējamām ķīmiskajām vielām to izmantošana var būt lietderīga. Pieejamām jābūt šādām testējamās ķīmiskās vielas īpašībām: šķīdība ūdenī un dažos organiskajos šķīdinātājos, tvaika spiediens, adsorbcijas koeficients, hidrolīze un bionoārdāmība anaerobiskos apstākļos.
|
METODES PIEMĒROTĪBA
|
8.
|
Tests ir piemērojams ķīmiskajām vielām, kas šķīst vai nešķīst ūdenī, tostarp gaistošām ķīmiskajām vielām. Tomēr ar ūdenī mazšķīstošiem (sk. atsauci (12)) un viegli gaistošiem materiāliem jāstrādā īpaši uzmanīgi. Turklāt var izmantot arī inokulātus no citām anaerobām vidēm, piemēram, dūņām, papildinātām augsnēm un sedimentiem. Anaerobas baktēriju sistēmas, kas jau iepriekš bijušas eksponētas toksiskām ķīmiskām vielām, var pielāgot tam, lai tās saglabātu aktivitāti ksenobiotisku ķīmisko vielu klātbūtnē. No pielāgotām baktēriju sistēmām iegūti inokulāti var uzrādīt augstāku toleranci pret testējamām ķīmiskajām vielām salīdzinājumā ar inokulātu, kas iegūts no nepielāgotām sistēmām.
|
ĶĪMISKĀ STANDARTVIELA
|
9.
|
Lai pārbaudītu procedūru, testē ķīmisko standartvielu, parastajā testa gaitā paralēli iekārtojot piemērotus traukus; ir pierādīts, ka anaerobo gāzes producēšanos, skābekļa patēriņu aktīvajās dūņās un citas bioķīmiskās reakcijas pastāvīgi inhibē 3,5-dihlorfenols. Divas citas ķīmiskās vielas, konkrētāk – metilēna bis-tiocianāts un pentahlorfenols – ir uzrādījušas, ka metāna producēšanos inhibē vēl vairāk nekā 3,5-dihlorfenols, taču ar tām iegūtie rezultāti nav validēti. Pentahlorfenols nav ieteicams, jo tīrā formā tas nav viegli pieejams.
|
REZULTĀTU REPRODUCĒjamība
|
10.
|
Laboratorijās, kas piedalījās starptautiskajā starplaboratoriju salīdzinošajā testēšanā (5), 3,5-dihlorfenola un 2-brometāna sulfonskābes EC50 vērtību reproducējamība bija tikai mērena. (Pirmajai intervāls bija no 32 mg/l līdz 502 mg/l un otrajai – 220–2 190 mg/l.)
|
Laboratoriju skaits
|
Kā mg/l
|
Kā mg/g dūņu
|
|
Vidējā vērtība
|
Standartnovirze
|
Variācijas koeficients (%)
|
Vidējā vērtība
|
Standartnovirze
|
Variācijas koeficients (%)
|
|
|
3, 5-dihlorfenols
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-brometāna sulfonskābe
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
EC50 dati no starplaboratoriju salīdzinošās testēšanas – neatšķaidītas dūņas
|
11.
|
Augstais variācijas koeficients laboratoriju vidū lielā mērā atspoguļo dūņu mikroorganismu jutīguma atšķirības, ko radījusi iepriekšēja eksponētība vai neeksponētība testējamai ķīmiskajai vielai vai tai ķīmiski radniecīgām vielām. Precizitāte, ar kādu, pamatojoties uz dūņu koncentrāciju, tika noteikta EC50 vērtība, tikai nedaudz pārsniedza “tilpuma” vērtību (mg/l). Trīs laboratorijas, kas ziņoja par savu 3,5-dihlorfenola EC50 vērtību precizitāti, uzrādīja daudz zemākus variācijas koeficientus (attiecīgi 22,9 un 18 % EC50 mg/g) nekā visu desmit laboratoriju vidējās vērtības. Atsevišķās vidējās vērtības trijām laboratorijām bija attiecīgi 3,1, 3,2 un 2,8 mg/g. Zemākais pieņemamais variācijas koeficients laboratoriju vidū salīdzinājumā ar daudz augstākajiem starplaboratoriju vērtību koeficientiem (attiecīgi 9–22 % salīdzinājumā ar 92 %) norāda, ka atsevišķu dūņu īpašības būtiski atšķiras.
|
METODES APRAKSTS
Aprīkojums
|
12.
|
Nepieciešams laboratorijas standarta aprīkojums un turpmāk norādītais:
|
a)
|
inkubators – dzirksteļdrošs un kontrolēts 35 °C ± 2 °C temperatūrā;
|
|
b)
|
spiedienizturīgi stikla testēšanas trauki ar piemērotu nominālo tilpumu (17), katrs ar gāznecaurlaidīgu apvalkotu blīvi, kas spēj izturēt apmēram 2 bārus jeb 2 × 105 Pa (apvalkošanai izmantojiet, piemēram, PTFE = politetrafluoretēnu). Ir ieteicamas stikla seruma pudeles ar nominālo tilpumu 125 ml un faktisko tilpumu ap 160 ml, noslēgtas ar seruma blīvēm (18) un aizlocītiem alumīnija gredzeniem; bet var lietot pudeles ar kopējo tilpumu no 0,1 līdz 1 litram;
|
|
c)
|
precīzs manometrs (19) un pierīkota adata;
kopējā gāzes producēšanās (metāns kopā ar oglekļa dioksīdu), mērīta ar manometru, kas pielāgots tā, lai mērītu radušos gāzi un laistu to cauri. Piemērots instruments ir, piemēram, precīzs manuāls manometrs, kas savienots ar šļirces adatu; lieko spiedienu atbrīvo trīsvirzienu gāznecaurlaidīgs vārsts (1. papildinājums). Spiediena sensora caurules un vārsta iekšējo tilpumu ir nepieciešams uzturēt tik zemu, cik vien iespējams, lai aprīkojuma tilpuma neievērošanas dēļ ieviesušās kļūdas būtu nebūtiskas.
|
|
d)
|
izolēti konteineri bionoārdošo dūņu transportēšanai;
|
|
e)
|
trīsvirzienu spiediena vārstii
|
|
f)
|
siets ar 1 mm kvadrātveida acīm;
|
|
g)
|
rezervuārs bionoārdošajām dūņām; 5 litru tilpuma stikla vai ļoti blīva polietilēna pudele, kas aprīkota ar maisītāju un ierīcēm, kuri nodrošina slāpekļa gāzes (sk. 13. punktu) plūšanu caur brīvo tilpumu;
|
|
h)
|
membrānu filtri (0,2 μm) substrāta sterilizēšanai;
|
|
i)
|
mikrošļirces, ar kurām veido gāznecaurlaidīgu savienojumu starp spiediena sensoru (sk. 12. punkta c) apakšpunktu) un pudeļu brīvo tilpumu (sk. 12. punkta b) apakšpunktu), kā arī pudelēs ievada nešķīstošus, šķidrus testēšanas materiālus;
|
|
j)
|
bokss ar cimdiem– nav obligāts, bet ieteicams, ar viegli pozitīvu slāpekļa spiedienu.
|
|
Reaģenti
|
13.
|
Visā testēšanā jāizmanto analītiski tīri reaģenti. Visā testēšanā jāizmanto augstas tīrības pakāpes slāpekļa gāze ar skābekļa piejaukumu mazāk nekā 5 μl/l.
|
Ūdens
|
14.
|
Ja kādā posmā ir nepieciešama atšķaidīšana, izmanto dejonizētu, iepriekš atgaisotu ūdeni. Šo ūdeni analītiski kontrolēt nav vajadzīgs, bet pārliecinieties, ka dejonizācijas aparātu regulāri pārbauda. Izmanto dejonizētu ūdeni arī izejšķīdumu pagatavošanai. Pirms anaerobiskā inokulāta pievienošanas jebkuram šķīdumam vai testējamā materiāla atšķaidīšanas pārliecinieties, ka tas nesatur skābekli. To var izdarīt, cauri atšķaidīšanas ūdenim (vai cauri atšķaidījumiem) vienu stundu pirms inokulāta pievienošanas laižot slāpekļa gāzi vai atšķaidīšanas ūdeni uzsildot līdz vārīšanās punktam un bezskābekļa atmosfērā atvēsinot līdz istabas temperatūrai.
|
Bionoārdītās dūņas
|
15.
|
Bioreaktora notekūdeņu attīrīšanas stacijā vai no laboratorijas bioreaktora, kas pārstrādā galvenokārt sadzīves notekūdeņus, ievāc aktīvas bionoārdošas dūņas. Praktisku informāciju par dūņām no laboratorijas bioreaktora var atrast avotos (11). Ja ir paredzēts izmantot pielāgotu inokulātu, var apsvērt, vai neizmantot bionoārdošas dūņas no rūpniecisko notekūdeņu attīrīšanas stacijas. Dūņu savākšanai izmanto pudeles ar platu kakliņu, kas izgatavotas no augsta blīvuma polietilēna vai līdzīgiem materiāliem, kuri var izplesties. Paraugu pudeles uzpilda līdz līmenim 1 cm zem pudeles augšas, cieši tās noslēdz, vēlams, ar drošības ventili (sk. 12. punkta e) apakšpunktu), un ievieto izolētos konteineros (12. punkta d) apakšpunkts), lai samazinātu temperatūras šoku līdz brīdim, kad tās ievieto inkubatorā, kurā uztur 35 °C ± 2 °C temperatūru. Atverot pudeles, uzmanīgi paver plombu vai ar trīsvirzienu spiediena atbrīvošanas vārstu (12. punkta e) apakšpunkts) panāk, ka atbrīvo lieko spiedienu. Dūņas vēlams izmantot dažās pirmajās stundās pēc savākšanas, pretējā gadījumā tās zem slāpekļa brīvajā tilpumā 35 °C ± 2 °C temperatūrā var glabāt līdz trim dienām, šādi aktivitātei zūdot tikai nedaudz.
Brīdinājums. Bionoārdošas dūņas rada uzliesmojošas gāzes, kas ir ugunsnedrošas un sprādzienbīstamas; tās satur arī potenciāli patogēnus mikroorganismus, tāpēc darbā ar dūņām ievēro attiecīgus piesardzības pasākumus. Drošības apsvērumu dēļ dūņu ievākšanai neizmanto stikla traukus.
|
Inokulāts
|
16.
|
Neilgi pirms izmantošanas dūņas uzmanīgi samaisa un caur sietu ar 1 mm2 acīm (12. punkta f) apakšpunkts) ielaiž piemērotā pudelē (12. punkta g) apakšpunkts), caur tās brīvo tilpumu laižot slāpekli. Paglabā paraugu kopējo sauso cietvielu daļiņu koncentrācijas mērīšanai (sk., piemēram, ISO 11 923 (13) vai līdzvērtīgu ES standartu). Ieteicams izmantot neatšķaidītas dūņas. Cietvielu daļiņu koncentrācija parasti ir no 2 līdz 4 % (svars/tilpums). Pārbauda dūņu pH vērtību un, ja nepieciešams, to koriģē līdz 7 ± 0,5.
|
Testēšanas substrāts
|
17.
|
Dejonizētā ūdenī izšķīdina 10 g buljona ar barības vielām (piemēram, Oxoid), 10 g rauga ekstrakta un 10 g D-glikozes un iegūto šķīdumu atšķaida līdz 100 ml. Sterilizē ar filtrēšanu caur 0,2 μm membrānas filtru (12. punkta h) apakšpunkts) un izmanto uzreiz vai uzglabā 4 °C temperatūrā ne ilgāk kā vienu dienu.
|
Testējamā ķīmiskā viela
|
18.
|
Katrai ūdenī šķīstošai testējamajai ķīmiskajai vielai sagatavo atsevišķu izejšķīdumu, kas satur, piemēram, 10 g/l ķīmiskās vielas bezskābekļa ūdens atšķaidījumā (14. punkts). Ar attiecīgiem šo izejšķīdumu tilpumiem sagatavo reakcijas maisījumus ar pakāpeniskas secības koncentrācijām. Alternatīvi ar katru izejšķīdumu sagatavo atšķaidījumu rindu tā, lai testēšanas pudelēs attiecībā uz katru nepieciešamo beigu koncentrāciju būtu pievienojams vienāds tilpums. Ja nepieciešams, izejšķīdumu pH pielāgo līdz 7 ± 0,2.
|
|
19.
|
Attiecībā uz testējamām ķīmiskajām vielām, kas pietiekami nešķīst ūdenī, sk. ISO 10 634 (12) vai līdzvērtīgu ES standartu. Ja nepieciešams organisks šķīdinātājs, neizmantojiet tādus šķīdinātājus kā hloroforms vai oglekļa tetrahlorīds, kas, kā zināms, ir spēcīgi metāna producēšanās inhibitori. Attiecīgas koncentrācijas gaistošā šķīdinātājā, piemēram, acetonā vai dietilēterī, sagatavo ūdenī nešķīstošas ķīmiskās vielas šķīdumu. Tukšajās testēšanas pudelēs vajadzīgajos tilpumos pievieno šķīdinātāja šķīdumu (sk. 12. punkta b) apakšpunktu) un pirms dūņu pievienošanas ļauj šķīdinātājam iztvaikot. Citu apstrāžu gadījumā izmanto ISO 10 634 (12) vai līdzvērtīgu ES standartu, taču ņem vērā, ka jebkādas emulsiju gatavošanā izmantotas virsmaktīvas vielas var inhibēt anaerobo gāzes producēšanos. Ja uzskata, ka organisko šķīdinātāju un emulgantu klātbūtne var radīt artefaktus, testējamo ķīmisko vielu kā pulveri vai šķidrumu var pievienot tieši testējamajam maisījumam. Gaistošas ķīmiskās vielas vai ūdenī nešķīstošas šķidras testējamās ķīmiskās vielas var ar mikrošļircēm injicēt jau uzsētajās seruma pudelēs (sk. 12. punkta i) apakšpunktu).
|
|
20.
|
Testējamo ķīmisko vielu pudelēs pievieno tā, lai izveidotu ģeometrisku koncentrāciju rindu, piemēram, 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l un 15,6 mg/l. Ja no datiem par līdzīgām ķīmiskajām vielām nav zināms toksicitātes intervāls, vispirms veic diapazona noteikšanas provizorisko testu ar 1 000 mg/l, 100 mg/l un 10 mg/l koncentrācijām, lai noskaidrotu attiecīgo intervālu.
|
Ķīmiskā standartviela
|
21.
|
Sagatavo 3,5-dihlorfenola šķīdumu ūdenī (10 g/l), cietajai vielai pakāpeniski pievienojot minimālo daudzumu nātrija hidroksīda šķīduma (5 mol/l) un to kratot, līdz tā pilnībā izšķīdusi. Tad vajadzīgajā tilpumā pievieno bezskābekļa atšķaidīšanas ūdeni (14. punkts); šķīšanu var veicināt apstrāde ar ultraskaņu. Var izmantot citas ķīmiskās standartvielas, ja ar tām vismaz trīs testos ar dažādiem inokulātiem (dažādi avoti vai dažādi savākšanas laiki) ir iegūts EC50 vidējais diapazons.
|
TRAUCĒJUMI/KĻŪDAS
|
22.
|
Domājams, ka dažas dūņu sastāvdaļas ar potenciālajiem inhibitoriem var reaģēt, padarot tos mikroorganismiem nepieejamus, tādējādi inhibēšanos mazinot vai pilnīgi novēršot. Turklāt, ja dūņas jau satur ķīmisko vielu ar inhibējošu iedarbību, šīs ķīmiskās vielas testēšanā tiks iegūti kļūdaini rezultāti. Bez šīm iespējamībām ir vairāki zināmi faktori, kas var novest pie aplamiem rezultātiem. Tie ir norādīti 3. papildinājumā kopā ar metodēm, kas dos iespēju kļūdas novērst vai vismaz samazināt.
|
TESTA PROCEDŪRA
|
23.
|
Nepieciešamo paraugu skaits ir atkarīgs no tā, cik liela precizitātes pakāpe attiecībā uz inhibēšanās rādītājiem vajadzīga. Ja pudeļu plombas testēšanas laikā ir pietiekami gāznecaurlaidīgas, pietiks tikai ar vienu testēšanas pudeļu sēriju (vismaz trīs eksemplāros) visās nepieciešamajās koncentrācijās. Līdzīgā kārtā sagatavo vienu pudeļu sēriju ar ķīmisko standartvielu un vienu kontrolkomplektu. Tomēr, ja pudeļu plombas iztur tikai vienu vai dažus dūrienus, katram intervālam (t), par kuru jāiegūst rezultāti, sagatavo testēšanas pudeļu sēriju (piemēram, trīs eksemplāros) visās testējamās ķīmiskās vielas koncentrācijās. Līdzīgā kārtā sagatavo “t” pudeļu sērijas ķīmiskajai standartvielai un kontrolēm.
|
|
24.
|
Ir ieteicams izmantot boksu ar cimdiem (12. j) punkts). Vismaz 30 minūtes pirms testēšanas sākšanas caur boksu ar cimdiem, kurā ir viss nepieciešamais aprīkojums, palaiž slāpekļa gāzes plūsmu. Gādājiet, ka laikā, kad notiek darbs ar pudelēm un to noslēgšana, dūņu temperatūra ir 35 °C ± 2 °C robežās.
|
Priekštestēšana
|
25.
|
Ja dūņu aktivitāte nav zināma, ieteicams veikt priekštestēšanu. Sagatavo kontrolparaugus ar cietvielu daļiņu koncentrāciju, piemēram, 10 g/l, 20 g/l un 40 g/l) un substrātu, bet bez testējamajām ķīmiskajām vielām. Izmanto arī dažādus reakcijas maisījuma tilpumus, lai iegūtu trīs vai četras dažādas brīvā tilpuma un šķidruma slāņa tilpuma attiecības. Pēc iegūtajiem datiem par dažādos laika intervālos producētās gāzes tilpumu [izraugās] vispiemērotākos apstākļus, kas ļauj veikt divus mērījums dienā, iegūt nozīmīgus gāzes tilpumus un katru dienu atbrīvot spiedienu pie optimālas jutības (20) un bez sprādziena riska.
|
Testējamo ķīmisko vielu pievienošana
|
26.
|
Ūdenī šķīstošu testējamo ķīmisko vielu ūdens šķīdumu (18. punkts) iepilda tukšās testēšanas pudelēs (12. punkta b) apakšpunkts). Katram koncentrāciju intervālam izmanto vismaz trīs pudeļu komplektus (20. punkts). Nešķīstošu vai mazšķīstošu testējamo ķīmisko vielu gadījumā tukšās pudelēs ar mikrošļirci injicē šo vielu šķīdumus organiskajos šķīdinātājos, lai iegūtu replikātu komplektus katrai no piecām testējamās vielas koncentrācijām. Šķīdinātāju iztvaicē, pāri šķīdumu virsmai testēšanas pudelēs laižot slāpekļa gāzes strūklu. Alternatīva ir nešķīstošas, cietas ķīmiskās vielas iesvērt un zināmus daudzumus pievienot tieši testēšanas pudelēs.
|
|
27.
|
Ja nešķīstošas un ūdenī vāji šķīstošas šķidras testējamās ķīmiskās vielas nepievieno ar šķīdinātāja starpniecību, tās pēc tam, kad ir pievienots inokulāts un testējamais substrāts (sk. 30. punktu), ar mikrošļirci pievieno tieši testēšanas pudelēs. Tādā pašā veidā var pievienot gaistošas testējamās ķīmiskās vielas.
|
Inokulāta un substrāta pievienošana
|
28.
|
Attiecīgu tilpumu caur sietu izlaistu bionoārdošu dūņu (sk. 16. punktu) samaisa 5 litru pudelē (12. punkta g) apakšpunkts), vienlaikus caur tās brīvo tilpumu laižot slāpekļa gāzes strūklu. Testēšanas pudeles, kas satur ūdens šķīdumus vai testējamo ķīmisko vielu šķīdumus iztvaicētos šķīdinātājos, apmēram divas minūtes skalo ar slāpekļa gāzes strūklu, lai tās atgaisotu. Izmantojot pipeti ar platu galu vai mērcilindru, pa testēšanas pudelēm sadala vienādus daudzumus (piemēram, 100 ml) labi sajauktu dūņu. Ir svarīgi pipeti vienā piegājienā uzpildīt tieši līdz vajadzīgajam dūņu tilpumam, jo dūņu cietvielu daļiņas viegli nogulsnējas. Ja iesūc vairāk, pipeti iztukšo un darbību sāk no jauna.
|
|
29.
|
Tad, kamēr vēl cauri plūst slāpeklis, pietiekamā daudzumā pievieno substrāta šķīdumu (17. punkts), lai barības vielu buljona, rauga ekstrakta un D-glikozes koncentrācija maisījumā katram būtu 2 g/l. Šis ir testēšanas sēriju piemērs.
|
Galīgā testējamo ķīmisko vielu masas koncentrācija testēšanas pudelēs
(mg/l)
|
Testējamo ķīmisko vielu tilpums
(ml)
|
Reaģenti un vide
(ml)
|
|
Izejšķīdums (a)< 10 g/l18. punkts
|
Izejšķīdums (b)< 1 g/l18. punkts
|
Atšķaidīšanas ūdens
14. punkts
|
Inokulāts
16. punkts
|
Substrāts
17. punkts
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Kopējais pudeles tilpums = 160 ml Šķidruma tilpums = 103 ml
Gāzes tilpums = 57 ml jeb 35,6 % kopējā tilpuma
|
|
|
30.
|
Līdzīgi ar slāpekļa gāzi pietiekamā skaitā izskalo tukšas testēšanas pudeles, lai atbrīvotos no jebkādām gaistošām un nešķīstošām šķidrām testējamām ķīmiskajām vielām (sk. 27. punktu).
|
Kontrolparaugi un ķīmiskā standartviela
|
31.
|
Sagatavo vismaz trīs identisku pudeļu komplektus, kuras satur tikai dūņas un substrātu: tie būs kontrolparaugi. Sagatavo papildu replikātu pudeles, kas satur dūņas un substrātu, kā arī pietiekami daudz ķīmiskās standartvielas 3,5-dihlorfenola (21. punkts) izejšķīduma, lai iegūtu galīgo koncentrāciju 150 mg/l. Šī koncentrācija gāzes producēšanos inhibēs par apmēram 50 %. Alternatīvi nosaka ķīmiskās standartvielas koncentrāciju intervālu. Papildu pH mērījumiem sagatavo četras pudeles, kas satur dūņas, atskābekļotu ūdeni un substrātu. Divās pudelēs pievieno testējamo ķīmisko vielu augstākajā testējamajā koncentrācijā un atlikušajās divās pudelēs pievieno atskābekļotu ūdeni.
|
|
32.
|
Nodrošiniet, ka visas pudeles – ar testējamo ķīmisko vielu un ķīmisko standartvielu, kā arī kontrolparaugi – satur vienādu šķidruma tilpumu (VR); ja nepieciešams, pievieno atskābekļotu, dejonizētu ūdeni (14. punkts), lai kompensētu trūkstošo tilpumu. Brīvajam tilpumam jābūt 10 % līdz 40 % pudeles tilpuma, faktisko vērtību izraugās pēc priekštestēšanā iegūtajiem datiem. Pēc visu sastāvdaļu pievienošanas pudelēm noņem adatu, caur kuru pieplūst gāze, un katru pudeli noslēdz ar gumijas aizbāzni un alumīnija uzmavu (12.punkta b) apakšpunkts), aizbāzni samitrinot ar pilienu dejonizēta ūdens, lai atvieglotu tā ievietošanu. Pudeļu saturu sajauc, tās sakratot.
|
Pudeļu inkubēšana
|
33.
|
Pudeles pārvieto uz inkubatoru ar termostatisku regulāciju, vēlams tādu, kas ir aprīkots ar kratīšanas ierīci, un uztur nemainīgu temperatūru 35 °C ± 2 °C. Pudeles inkubē tumsā. Apmēram pēc vienas stundas spiedienu pudelēs izlīdzina ar atmosfēras spiedienu, pēc kārtas caur katras pudeles plombu izdurot manometram pieslēgtu šļirces adatu (12. punkta c) apakšpunkts), atverot vārstu, līdz manometrs rāda nulli, un beidzot vārstu aizverot. Adata jāievieto apmēram 45 °C leņķī, lai novērstu gāzes noplūdi no pudelēm. Ja pudeles inkubē bez kratīšanas ierīces, tās kopējā inkubācijas perioda laikā divas reizes dienā manuāli sakrata, lai sistēmu līdzsvarotu. Pudeles inkubē un apgriež, lai gāze nekādi nezustu caur blīvi. Tomēr inkubēšana nav piemērota gadījumos, kur nešķīstošas testējamās ķīmiskās vielas var pielipt pudeles apakšdaļai.
|
Spiediena mērīšana
|
34.
|
Kad temperatūra pudelēs ir sasniegusi 35 °C ± 2 °C, izmēra un reģistrē sastāva pH divās no četrām šim mērķim sagatavotajām pudelēm un to saturu izlej; atlikušās pudeles turpina tumsā inkubēt. Turpmākajās 48 līdz 72 stundās pH pudelēs mēra un reģistrē divreiz dienā, caur katras pudeles plombu manometrā ievietojot adatu un starp mērījumiem adatu izžāvējot. Laikā, kad notiek mērīšana, kas jāveic iespējami ātri, visas pudeles daļas tur inkubācijas temperatūrā. Spiediena lasījumiem ļauj stabilizēties un tos pieraksta. Tad atver vārstu ventilācijai un, kad spiediena rādījums ir nulle, to aizver. No pirmā spiediena izlīdzināšanās brīža testu parasti turpina 48 stundas, ko apzīmē kā “laiku 0”. Lai samazinātu testējamās ķīmiskās vielas zudumus, attiecībā uz gaistošām ķīmiskajām vielām lasījumu un ventilāciju skaits jāierobežo līdz vienai reizei (inkubācijas beigās) vai divām (10).
|
|
35.
|
Ja spiediena lasījums ir negatīvs, vārstu neatver. Reizēm caurulē un šļirces adatā sakrājas mitrums, par ko liecina nedaudz negatīvs spiediena lasījums. Tādā gadījumā adatu noņem, cauruli sakrata, nosusina ar salveti un pieliek jaunu adatu.
|
pH mērīšana
|
36.
|
Kad izdarīts galīgais spiediena mērījums, mēra un reģistrē katras pudeles satura pH.
|
DATI UN PĀRSKATA SAGATAVOŠANA
Rezultātu izteikšana
|
37.
|
Aprēķina katrā laika intervālā katram replikātu komplektam reģistrēto spiedienu summu un vidējo vērtību, kā arī katrā laika intervālā katram replikātu komplektam aprēķina vidējo kumulatīvo gāzes kopējo spiedienu. Attiecībā uz kontroles, testēšanas un standartvielas pudelēm zīmē līknes, vidējo kumulatīvo gāzes ieguvi (Pa) atliekot pret laiku. Uz līknes lineārās daļas izraugās laiku (parasti 48 stundas) un attiecībā uz katru vienādojuma koncentrāciju [1] aprēķina procentuālo inhibēšanos (I):
|
I = (1 – Pt/PC) × 100
|
[1],
|
kur:
|
I
|
=
|
procentuālā inhibēšanās, %;
|
|
Pt
|
=
|
gāzes spiediens, kas izraudzītajā laikā radies testējamā materiālā, paskālos (Pa);
|
|
Pc
|
=
|
gāzes spiediens, kas tajā pašā laikā radies kontrolparaugā, paskālos (Pa);
|
Ieteicams uzzīmēt abas diagrammas, t. i., 1. diagrammu ar koncentrāciju salīdzinājumu un arī ar šo koncentrāciju logaritmiem, lai varētu izraudzīties to līkni, kas ir vairāk lineāra. Vizuāli vai regresijas analīzes ceļā pēc vairāk lineārās līknes novērtē EC50 (mg/l) vērtību. Salīdzināšanas nolūkos varētu būt noderīgāk ķīmisko vielu koncentrāciju izteikt kā ķīmiskās vielas un kopējās cietvielu daļiņu masas attiecību mg/g. Lai iegūtu šo koncentrāciju, tilpumkoncentrāciju (mg/l) izdala ar sauso dūņu cietvielu daļiņu tilpumkoncentrāciju (g/l) (16. punkts).
|
|
38.
|
Ja ir izpētīts pietiekams skaits koncentrāciju, aprēķina procentuālo inhibēšanos attiecībā uz vienu izmantoto ķīmiskās standartvielas koncentrāciju vai EC50.
|
|
39.
|
Kontrolparaugā radušos vidējo gāzes spiedienu Pc(Pa) tilpumā pārveido, izmantojot manometra kalibrācijas līkni (2. papildinājums), un pēc tā aprēķina gāzes produkciju, kas izteikta kā tilpums, kurš 48 stundās producējas no 100 ml neatšķaidītu dūņu ar cietvielu daļiņu koncentrāciju 2 % (20 g/l) līdz 4 % (40 g/l).
|
Derīguma kritēriji
|
40.
|
ISO starplaboratoriju pētījuma (5) rezultāti parādīja, ka ķīmiskā standartviela (3,5-dihlorfenols) koncentrāciju intervālā no 32 mg/l līdz 510 mg/l (vidēji 153 mg/l) (10. punkts) izraisa gāzes producēšanās inhibēšanos par 50 %. Šis intervāls ir tik plašs, ka stingras inhibēšanās robežas nebija iespējams pārliecinoši noteikt par derīguma kritērijiem; tas būs iespējams tad, kad būs izstrādāti viendabīgāka inokulāta iegūšanas paņēmieni. 48 stundu laikā pudelēs radušās gāzes apjomi bija no 21 ml/g līdz 149 ml/g dūņu sausmasas (vidēji 72 ml/g). Starp radušās gāzes tilpumu un attiecīgo EC50 vērtību nebija skaidra sakara. Galīgā pH vērtība bija no 6,1 līdz 7,5.
|
|
41.
|
Testu uzskata par derīgu, ja standartvielas kontroles paraugā ar 150 mg/l 3,5-dihlorfenola tiek panākta vairāk nekā 20 % inhibēšanās, tukšajā kontrolparaugā rodas vairāk nekā 50 ml gāzes uz g sausmasas un pH vērtība testēšanas beigās ir no 6,2 līdz 7,5.
|
Testēšanas pārskats
|
42.
|
Testēšanas pārskatā jābūt šādai informācijai.
|
|
Testējamā ķīmiskā viela
|
—
|
vispārpieņemtais nosaukums, ķīmiskais nosaukums, CAS numurs, struktūrformula un būtiskās fizikālķīmiskās īpašības;
|
|
—
|
testējamās ķīmiskās vielas tīrība (piemaisījumi).
|
|
|
|
Testēšanas apstākļi:
|
—
|
šķidrā satura tilpums un brīvais tilpums testēšanas traukos;
|
|
—
|
testēšanas trauku un gāzes mērīšanas apraksti (piemēram, manometra veids);
|
|
—
|
testējamās ķīmiskās vielas un ķīmisko standartvielu lietošana testēšanas sistēmā, izmantotās testējamās koncentrācijas un jebkādu šķīdinātāju izmantošana;
|
|
—
|
detalizēta informācija par izmantoto inokulātu: notekūdeņu pārstrādes stacijas nosaukums, apstrādāto notekūdeņu avota apraksts (piemēram, darba temperatūra, dūņu aiztures laiks, pārsvarā sadzīves notekūdeņi vai industriālie notekūdeņi u. c.), cietvielu daļiņu koncentrācija, gāzes producēšanās aktivitāte anaerobiskajos bioreaktoros, iepriekšēja ekspozīcija vai iespējama iepriekšēja adaptācija toksiskām ķīmiskām vielām vai dūņu, sedimentu ievākšanas vieta u. c.;
|
|
—
|
inkubācijas temperatūra un ilgums;
|
|
|
|
Rezultāti
|
—
|
pH vērtības testēšanas beigās;
|
|
—
|
visi mērījumu dati, kas iegūti testēšanas laikā, tukšie un ķīmisko standartvielu kontroltrauki, ja piemērojams, (piemēram, spiediens Pa vai milibāros) tabulas formā;
|
|
—
|
procentuālā inhibēšanās testēšanas pudelēs un standartvielu pudelēs un inhibēšanās–koncentrācijas līknes;
|
|
—
|
EC50 vērtību aprēķins, izsakot to mg/l un mg/g;
|
|
—
|
gāzes produkcija uz g dūņu 48 stundās;
|
|
—
|
jebkādas testa rezultātu nepieņemamības iemesls;
|
|
—
|
secinājumi par rezultātiem, pieminētas jebkādas šīs testēšanas metodes izmantošanā pieļautas novirzes no procedūrām un iztirzātas jebkādas testa rezultātu novirzes no sagaidītā traucējumu vai kļūdu dēļ;
|
|
—
|
minēts arī tas, vai testēšanas nolūks bijis izmērīt toksicitāti mikroorganismiem, kas ir vai nav bijuši eksponēti vielai.
|
|
|
LITERATŪRA
|
(1)
|
Šā pielikuma C.11. nodaļa “Aktīvo dūņu elpošanas inhibēšanās tests”.
|
|
(2)
|
Šā pielikuma C.43. nodaļa “Organisko savienojumu anaerobā noārdīšanās pārstrādes dūņās: gāzes ražošanas mērījumu metode”.
|
|
(3)
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
(4)
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, pp117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
1. papildinājums
PARAUGS: IEKĀRTAS BIOGĀZES PRODUCĒŠANĀS MĒRĪŠANAI PĒC GĀZES SPIEDIENA
Skaidrojums:
|
1
|
–
|
manometrs
|
|
2
|
–
|
trīsvirzienu gāznecaurlaidīgs vārsts
|
|
3
|
–
|
šļirces adata
|
|
4
|
–
|
gāznecaurlaidīga plomba (gofrēta uzmava un blīve)
|
|
5
|
–
|
augšējais slānis
|
|
6
|
–
|
reaģējošu dūņu inokulāts
|
Testēšanas trauki 35 °C ± 2 °C temperatūrā.
2. papildinājums
Manometra rādījumu pārveidošana
Manometra lasījumus var attiecināt uz gāzes tilpumu ar standartlīkņu palīdzību, pēc kurām var aprēķināt radušās gāzes tilpumu uz g sausu dūņu 48 stundās. Šo aktivitātes indeksu izmanto par vienu no kritērijiem testa rezultātu derīguma novērtēšanai. Kalibrācijas līkni iegūst, 35 °C ± 2 °C temperatūrā injicējot zināmus gāzes tilpumus seruma pudelēs, kas satur ūdens tilpumu, kurš vienāds ar reakcijas maisījuma tilpumu VR.
|
—
|
Vienādus daudzumus VR ml ūdens (glabātu 35 °C ± 2 °C) sadala pa piecām seruma pudelēm. Pudeles noslēdz un uz vienu stundu novieto vannā ar 35 °C ± 2 °C siltu ūdeni, lai panāktu izlīdzināšanos.
|
|
—
|
Ieslēdz manometru, ļauj tam stabilizēties un noregulē uz nulli.
|
|
—
|
Vienā no pudelēm caur plombu izdur šļirces adatu, atver vārstu, līdz manometrs rāda nulli, un vārstu aizver.
|
|
—
|
Šo procedūru atkārto atlikušajām pudelēm.
|
|
—
|
Katrā pudelē injicē 1 ml gaisa 35 °C ± 2 °C temperatūrā. Vienai no pudelēm (skaitītāja) adatu izdur cauri plombai un ļauj spiediena rādījumam stabilizēties. Reģistrē spiedienu, atver vārstu, līdz spiediena rādītājs rāda nulli, tad vārstu aizver.
|
|
—
|
Šo procedūru atkārto atlikušajām pudelēm.
|
|
—
|
Atkārto visu procedūru ar 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml un 50 ml gaisa.
|
|
—
|
Novelk pārrēķināšanas līkni, kur spiediens (Pa) atlikts pret injicētās gāzes tilpumu (ml). Instrumenta reakcija ir lineāra 0 līdz 70 000 Pa intervālā un pie radušās gāzes tilpuma no 0 līdz 50 ml.
|
3. papildinājums
Konstatētie faktori, kuru dēļ rezultāti var būt aplami
a) Pudeļu uzmavu kvalitāte
Komerciāli ir pieejamas dažāda veida seruma pudeļu blīves; daudzas no tām, arī butilgumijas blīves, zaudē necaurlaidību, ja tās šā testa apstākļos caurdur ar adatu. Reizēm no brīža, kad blīve caurdurta ar šļirces adatu, spiediens ļoti lēni samazinās. Lai novērstu noplūdes (12. punkta b) apakšpunkts), ir ieteicams izmantot gāznecaurlaidīgas blīves.
b) Mitrums šļirču adatā
Reizēm caurulē un šļirces adatā sakrājas mitrums, par ko liecina nedaudz negatīvs spiediena nolasījums. Lai to labotu, noņem adatu, cauruli sakrata, nosusina ar salveti un pieliek jaunu adatu (12. punkta c) apakšpunkts un 35. punkts).
c) Kontaminācija ar skābekli
Anaerobās metodes ir pakļautas kļūdas riskam, kuras iemesls ir ar skābekli notikusi kontaminēšanās, kuras dēļ var samazināties gāzes producēšanās. Šīs metodes lietošanā šāda iespēja jāsamazina līdz minimumam, stingri ievērojot, lai tiktu izmantotas anaerobās metodes, arī bokss ar cimdiem.
d) Rupjš substrāts dūņās
Anaerobo gāzes producēšanos un dūņu jutīgumu ietekmē substrāti, kas testēšanas pudelēs iekļūst kopā ar inokulātu. Pārstrādātas dūņas no sadzīves anaerobajiem bioreaktoriem nereti joprojām satur atpazīstamu materiālu, piemēram, matus un augu celulozes paliekas, kas apgrūtina reprezentatīvu paraugu ņemšanu. Rupjo nešķīstošo materiālu var aizvākt, dūņas izsijājot, un tad būs varbūtīgāk, ka ņemtie paraugi būs reprezentatīvi (16. punkts).
e) Gaistošas testējamās ķīmiskās vielas
Gaistošas testējamās ķīmiskās vielas nonāks testēšanas pudeļu brīvajā tilpumā. Tādēļ ventilēšanas laikā pēc spiediena mērījumu izdarīšanas no sistēmas var daļēji zust testēšanas materiāls, un EC50 vērtības kļūdaini paaugstinās. Kļūdu var samazināt, ja izvēlas piemērotu brīvā tilpuma un šķidruma tilpumu attiecību un pēc spiediena mērīšanas neventilē (10).
f) Gāzes producēšanās nelinearitāte
Ja vidējās kumulatīvās gāzes producēšanās vērtības un inkubācijas laika salīdzinājuma diagramma 48 stundu periodā nav aptuveni lineāra, testa pareizība var samazināties. Lai to novērstu, ieteicams izmantot bionoārdošas dūņas no dažādiem avotiem un/vai pievienot testējamā substrāta un barības vielu buljonu, rauga ekstraktu un glikozes koncentrāciju paaugstinātā koncentrācijā (29. punkts).
4. papildinājums
Zemas biomasas koncentrācijas vides paraugu lietošana – anaerobās dūņas, sedimenti u. c.
IEVADS
A.1. Dabisku anaerobo dubļu, sedimentu, augšņu u. tml. specifiskā mikrobiālā aktivitāte (saražotās gāzes tilpums uz g sausu cietvielu daļiņu dienā) ir daudz zemāka nekā anaerobām dūņām, kas iegūtas no notekūdeņiem. Tādēļ, kad jāmēra ķīmisko vielu inhibējošā ietekme uz šiem mazāk aktīvajiem paraugiem, daži eksperimentālie apstākļi ir jāmaina. Šo mazāk aktīvo paraugu gadījumā vispār iespējams rīkoties divējādi:
|
a)
|
lai panāktu precīzāku simulāciju (atbilstoši ISO 13 641 1. daļai), izdarīt modificētu priekštestēšanu (25. punkts) ar neatšķaidītu dūņu, augsnes u. tml. paraugu 35 °C ± 2 °C temperatūrā vai tādā pašā temperatūrā kā parauga ievākšanas vietā;
|
|
b)
|
vai arī, lai simulētu zemo aktivitāti, kas sagaidāma vides paraugā, taču uzturot temperatūru 35 °C ± 2 °C (atbilstoši ISO 13 641 2. daļai), veikt testu ar atšķaidītām (1 uz 100) bioreaktora dūņām.
|
A.2. a) variantu var izpildīt, ievērojot šeit aprakstīto metodi (līdzvērtīga ISO 13 641 1. daļai), bet ir būtiski veikt priekštestēšanu (25. punkts), lai pārliecinātos par optimāliem apstākļiem, ja vien tie nav zināmi jau no iepriekšējās testēšanas. Dūņu vai sedimentu paraugs būtu labi jāsakuļ, piemēram, blenderī, un, ja nepieciešams, jāatšķaida ar nelielu daudzumu atskābekļota ūdens šķīduma (14. punkts), lai tas būtu pietiekami plūstošs pārvietošanai ar pipeti ar platu galu vai mērcilindru. Ja uzskata, ka trūkst barības vielu, dūņu paraugi varētu būt jācentrifugē (anaerobos apstākļos) un suspensija atkārtoti jāpagatavo raugu saturošā minerālu vidē (A. 11).
A.3. b) variants. Saprātīgā mērā tiek imitēta vides paraugu zemā aktivitāte, bet trūkst šiem paraugiem raksturīgās cietvielu daļiņu augstās koncentrācijas. Šo cietvielu daļiņu nozīme inhibēšanā nav zināma, bet ir iespējams, ka testējamo ķīmisko vielu toksicitāti varētu mazināt testējamo ķīmisko vielu un dūņu sastāvdaļu reaģēšana, kā arī testējamo ķīmisko vielu adsorbēšanās uz cietvielu daļiņām.
A.4. Vēl viens svarīgs faktors ir temperatūra – lai nodrošinātu precīzu simulāciju, testēšana jāveic temperatūrā, kāda ir parauga ņemšanas vietā, jo dažādas metānu veidojošo baktēriju grupas, kā zināms, darbojas dažādos temperatūras diapazonos, konkrētāk: termofilās ~ 30–35 °C, mezofilās 20–25 °C un psihrofilās < 20 °C; tādēļ inhibēšanās modeļi var atšķirties.
A.5. Ilgums. Vispārīgā testa 1. daļā ar neatšķaidītām dūņām 2–4 dienu laikā producējušās gāzes daudzums vienmēr bija pietiekams, turpretī 2. daļā ar simtkārtīgi atšķaidītām dūņām starplaboratoriju salīdzinošajā testēšanā gāze producējās nepietiekami vai vispār neproducējās. Madsens (Madsen) ar kolēģiem (1996), aprakstot pēdējo minēto testu, apgalvo, ka jāpagaida vismaz septiņas dienas.
Testēšana ar zemu biomasas koncentrāciju (b variants)
Pamattekstā pievieno dažus punktus vai apakšpunktus vai tos aizstāj, to mainot un papildinot šādi:
A.6. 6. punktā “Testēšanas princips” pievieno šādu tekstu:
“Šo tehniku var izmantot simtkārtīgi atšķaidītām anaerobām dūņām, lai daļēji simulētu dūņu un sedimentu zemo aktivitāti. Inkubācijas temperatūra var būt 35 °C vai tāda pati kā parauga ņemšanas vietā. Tā kā baktēriju aktivitāte ir daudz zemāka nekā neatšķaidītās dūņās, inkubācijas periods jāpagarina līdz vismaz 7 dienām.”
A.7. 12. punkta a) apakšpunktā pievieno šādu tekstu:
“inkubatoram jāspēj darboties temperatūrā, kas nepārsniedz 15 °C.”
A.8. Pēc 13. punkta pievieno papildu reaģentu:
“Fosforskābe (H3PO4), masas daļa ūdenī 85 %.”
A.9. 16. punkta beigās pievieno šādu tekstu:
“Testā izmanto galīgo sauso cietvielu daļiņu koncentrāciju 0,20 ± 0,05 g/l.”
A.10. metodes apraksta 17. punkts “Testa substrāts”:
“Šo substrātu nelieto un aizstāj ar rauga ekstraktu (sk. 17. punktu; A.11, A.12, A.13).”
A.11. Anaerobisko dūņu atšķaidīšanai ir nepieciešama minerālvielu barotne, kurā ir arī mikroelementi, un ērti ir barotnei pievienot organisku substrātu, proti, rauga ekstraktu.
Aiz 17. punkta pievieno šādu tekstu:
|
“a)
|
Testēšanas minerālvielu barotne ar rauga ekstraktu.
|
To pagatavo no desmitkārtīgas koncentrācijas testēšanas barotnes (17. punkta b) apakšpunkts; A.12. punkts) ar mikroelementu šķīdumu (17. punkta c) apakšpunkts; A.13. punkts). Izmanto jaunpiegādātu nātrija sulfīda nonahidrātu (17. punkta b) apakšpunkts; A.12. punkts) vai arī to pirms lietošanas skalo un žāvē, lai nodrošinātu pietiekamu reducēšanas spēju. Ja testēšana notiek bez boksa ar cimdiem (12. punkta j) apakšpunkts), nātrija sulfīda koncentrācija izejšķīdumā ir jāpaaugstina līdz 2 g/l (no 1 g/l). Lai iegūtu galīgo koncentrāciju 0,2 g/l, nātrija sulfīdu ar attiecīgu izejšķīdumu var pievienot arī caur slēgtu testēšanas pudeļu blīvēm, jo šāda procedūra samazina oksidēšanās risku. Alternatīvi var izmantot titāna (III) citrātu (17. punkta b) apakšpunkts). To caur slēgtu testēšanas pudeļu blīvēm pievieno līdz koncentrācijai 0,8 mmol/l līdz 1,0 mmol/l. Titāna (III) citrāts ir ļoti efektīvs maztoksisks reduktants, ko pagatavo šādi. 50 ml bezskābekļa ūdens izšķīdina 2,94 g trinātrija citrāta dihidrāta (14. punkts) (iegūstot 200 mmol/l šķīduma) un pievieno 5 ml titāna (III) hlorīda šķīduma (15 g/100 ml atšķaidīšanas ūdens). Ar nātrija karbonātu neitralizē līdz pH 7 ± 0,5 un zem slāpekļa gāzes strūklas ielej attiecīgā seruma pudelē. Titāna (III) citrāta koncentrācija šajā izejšķīdumā ir 164 mmol/l. Testēšanas barotni izmanto uzreiz vai 4 °C temperatūrā glabā ne ilgāk kā vienu dienu.
|
A.12.
|
b)
|
Desmitkārtīga testēšanas barotnes koncentrācija, kas pagatavota ar:
|
bezūdens kālija dihidrogēnfosfātu (KH2PO4)
|
2,7 g
|
|
dinātrija hidrogēnfosfātu (Na2HPO4)
|
4,4 g
|
|
(vai 11,2 g dodekahidrātu)
amonija hlorīdu (NH4Cl)
|
5,3 g
|
|
kalcija hlorīda dihidrātu (CaCl2 · 2H2O)
|
0,75 g
|
|
magnija hlorīda heksahidrātu (MgCl2 · 6H2O)
|
1,0 g
|
|
dzelzs (II) hlorīda tetrahidrātu (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurīnu (redoksa indikators)
|
0,01 g
|
|
nātrija sulfīda nonahidrātu (Na2S · 9H2O)
|
1,0 g
|
|
(vai titāna (III) citrātu) galīgajā koncentrācijā
|
0,8 līdz 1,0 mmol/l
|
|
mikroelementu šķīdumu (sk. 17. punkta c) apakšpunktu; A.13. punktu)
|
10,0 ml
|
|
rauga ekstraktu
|
100 g
|
|
Izšķīdina atšķaidīšanas ūdenī (14. punkts), aizpildot līdz
|
1 000 ml iedaļai.
|
|
|
A.13.
|
c)
|
Mikroelementu šķīdums, kas pagatavots ar:
|
mangāna (II) hlorīda tetrahidrātu (MnCl2 · 4H2O)
|
0,5 g
|
|
ortoborskābi (H3BO3)
|
0,05 g
|
|
cinka hlorīdu (ZnCl2)
|
0,05 g
|
|
vara (II) hlorīdu (CuCl2)
|
0,03 g
|
|
nātrija molibdāta dihidrātu (Na2MoO4 · 2H2O)
|
0,01 g
|
|
kobalta (II) hlorīda heksahidrātu (CoCl2 · 6H2O)
|
1,0 g
|
|
niķeļa (II) hlorīda heksahidrātu (NiCl2 · 6H2O)
|
0,1 g
|
|
dinātrija selenītu (Na2SeO3)
|
0,05 g
|
|
Izšķīdina atšķaidīšanas ūdenī (14. punkts), aizpildot līdz
|
1 000 ml iedaļai.”
|
|
A.14. 25. punkts. Priekštestēšana
Ir būtiski nepieciešams, lai priekštestēšanu veiktu, kā aprakstīts 24. punktā, izņemot to, ka cietvielu daļiņu koncentrācijai dūņās jābūt simtreiz mazākai, nekā norādīts, t. i., 0,1 g/l, 0,2 g/l un 0,4 g/l. Inkubācijai jāilgst vismaz septiņas dienas.
Piezīme. Starplaboratoriju salīdzinošajā testēšanā (5) brīvais tilpums bija pārāk liels – 75 % no kopējā tilpuma; tam jābūt ieteicamajā 10–40 % līmenī. Svarīgs kritērijs ir tāds, ka ar pieņemamu precizitāti (piemēram, ± 5 % līdz ± 10 %) jāspēj izmērīt gāzes tilpumu, kas rodas pie inhibēšanās 80 %.
A.15. 26.–30. punkts. Testējamās ķīmiskās vielas, inokulāta un substrāta pievienošana.
Pievienošana notiek tādā pašā veidā, kā aprakstīts šajos punktos, bet substrāta šķīdumu (17. punkts) aizstāj ar testēšanas barotni, kam pievienots rauga ekstrakta substrāts (A.11. punkts).
Turklāt sauso dūņu cieto daļiņu galīgo koncentrāciju no 2–4 g/l samazina līdz 0,2 ± 0,05 g/l (A.9. punkts). Divi piemēri sastāvdaļu pievienošanai testēšanas maisījumam ir sniegti A.1. tabulā, kas aizstāj 29. punkta tabulu.
A.16. 33. punkts. Pudeļu inkubācija
Tā kā tiek sagaidīts zemāks gāzes producēšanās ātrums, inkubācijas periods ilgst vismaz septiņas dienas.
A.17. 34. punkts. Spiediena mērījumi
Ja nepieciešams zināt gāzveida fāzes daudzumus, pudeļu brīvā tilpuma spiediena mērīšanai izmanto to pašu procedūru, kas aprakstīta 34. punktā. Ja jāmēra CO2 un CH4 kopējais daudzums, šķidrās fāzes pH samazina līdz apmēram 2, katrā attiecīgajā pudelē injicējot H3PO4 un mērot spiedienu pēc 30 minūtēm kratīšanas testēšanas temperatūrā. Tomēr vairāk informācijas par inokulāta kvalitāti var iegūt, ja katrā pudelē spiedienu mēra pirms un pēc paskābināšanas. Piemēram, ja daudz straujāk nekā metāns veidojas CO2, var būt mainīts fermentatīvo baktēriju jutīgums un/vai testējamā ķīmiskā viela pārsvarā ietekmē metānu veidojošās baktērijas.
A.18. 36. punkts. pH mērīšana
Ja paredzēts izmanto H3PO4, īpaši pH mērīšanai sagatavo dažas papildu pudeles, kurām H3PO4, nav pievienota.
ATSAUCE:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
A.1. tabula.
Piemēri: testējamo paraugu sagatavošana testēšanai
|
Reakcijas maisījuma sastāvdaļas
|
1. piemērs
|
2. piemērs
|
Parastā pievienošanas kārtība
|
|
Pagatavotā inokulāta koncentrācija (g/l)
|
0,42
|
2,1
|
—
|
|
Pievienotā inokulāta tilpums (ml)
|
45
|
9
|
4
|
|
Inokulāta koncentrācija testēšanas pudelēs (g/l)
|
0,20
|
0,20
|
—
|
|
Pievienotās testēšanas barotnes tilpums (ml)
|
9
|
9
|
2
|
|
Pievienotā atšķaidīšanas ūdens tilpums (ml)
|
36
|
72
|
3
|
|
Rauga ekstrakta koncentrācija testēšanas pudelēs (g/l)
|
9,7
|
9,7
|
—
|
|
Testējamās ķīmiskās vielas izejšķīduma tilpums (ml)
|
3
|
3
|
1
|
|
Kopējais šķidruma tilpums (ml)
|
93
|
93
|
—
|
5. papildinājums
Definīcijas
Šajā testēšanas metodē ir izmantoti šādi termini.
|
|
Ķīmiskā viela ir viela vai vielu maisījums.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai vielu maisījums, kuru testē, izmantojot šo testēšanas metodi.
|
C.35
LUMBRICULUS TOKSICITĀTES TESTS SEDIMENTU-ŪDENS SISTĒMĀ AR PAPILDINĀTIEM SEDIMENTIEM
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 225 (2007. gads). Endobentiskie dzīvnieki, kas barojas ar sedimentiem, potenciāli lielā apjomā var tikt eksponēti sedimentos saistītām ķīmiskām vielām, tāpēc tiem jāpievērš īpaša vērība, piemēram, (1)(2)(3). No sedimentus uzņemošo dzīvnieku vidus ūdens sistēmu sedimentos svarīga nozīme ir ūdens mazsartārpiem. Palielinot sedimentu bioloģisko duļķainību un kalpojot par medījumu, šie dzīvnieki var spēcīgi ietekmēt minēto vielu biopieejamību citiem organismiem, piemēram, bentosa zivīm. Atšķirībā no epibentiskajiem organismiem endobentiskie ūdens mazsartārpi (piemēram, Lumbriculus variegatus) ierokas sedimentos un barojas ar sedimentu daļiņām, kas atrodas zem to virsmas. Tas nodrošina, ka testējamie dzīvnieki testējamajai ķīmiskajai vielai ir eksponēti pa visiem iespējamajiem uzņemšanas ceļiem (piemēram, tiešā saskarē ar kontaminētām sedimentu daļiņām un to norīšanā, kā arī ar poru ūdens un virsējā ūdens starpniecību).
|
|
2.
|
Šī testēšanas metode ir izstrādāta, lai varētu novērtēt endobentisko mazsartārpu Lumbriculus variegatus (Müller) ilgstošu eksponēšanu sedimentos saistītām ķīmiskām vielām. Tās pamatā ir līdzšinējo sedimentu toksicitātes un bioakumulācijas testu protokoli, piemēram, (3)(4)(5)(6)(7)(8)(9)(10). Metodes apraksts attiecas uz statiskiem testēšanas apstākļiem. Šajā testēšanas metodē izmantotais ekspozīcijas scenārijs paredz sedimentu papildināšanu ar testējamo ķīmisko vielu. Ar šo vielu papildināto sedimentu lietošanas mērķis ir modelēt piesārņotus sedimentus.
|
|
3.
|
Vielas, kas jātestē, lai noskaidrotu to iedarbību uz sedimentos dzīvojošiem organismiem, parasti šajā vides segmentā saglabājas ilgi. Sedimentos dzīvojošie organismi var tikt eksponēti pa dažādiem ceļiem. Katra ekspozīcijas ceļa relatīvā nozīme un laiks, kam jāpaiet, lai kopējā toksiskajā ietekmē izpaustos to līdzietekme, ir atkarīgs no attiecīgās ķīmiskās vielas fizikālķīmiskajām īpašībām un tās galīgā likteņa dzīvnieka organismā. Tādu vielu gadījumā, kam ir spēcīga adsorbēšanās spēja (piemēram, ar log Kow > 5) vai kas ar sedimentiem veido kovalentu saiti, būtisks ekspozīcijas ceļš var būt barošanās ar piesārņotu barību. Lai šādu ķīmisko vielu toksicitāti nenovērtētu par zemu, pirms testējamās ķīmiskās vielas lietošanas sedimentiem pievieno barību, kas nepieciešama, lai nodrošinātu testējamo organismu vairošanos un augšanu (11). Aprakstītā testēšanas metode ir pietiekami detalizēta, lai testēšanu varētu veikt, eksperimenta plānu koriģējot atkarībā no apstākļiem konkrētajās laboratorijās un testējamo ķīmisko vielu atšķirīgajiem raksturlielumiem.
|
|
4.
|
Testēšanas metode ir paredzēta, lai noteiktu testējamās ķīmiskās vielas ietekmi uz testējamo dzīvnieku vairošanos un biomasu. Mērāmie bioloģiskie parametri ir kopējais izdzīvojušo tārpu skaits un biomasa (saussvars) ekspozīcijas beigās. Šos datus analizē, vai nu ar regresijas modeli nosakot koncentrāciju, kas radītu ietekmi x % (piem., EC50, EC25 un EC10), vai statistiskās hipotēzes testēšanā nosakot nenovērotās ietekmes koncentrāciju (NOEC) un zemāko novērojamās ietekmes koncentrāciju (LOEC).
|
|
5.
|
Šā pielikuma C.27. nodaļā “Trīsuļodu toksicitātes tests sedimentu-ūdens sistēmā ar papildinātiem sedimentiem” (6) sniegts daudz būtiskas un noderīgas detalizētas informācijas par attiecīgās sedimentu toksicitātes testēšanas metodes izpildi. Tādēļ, pamatojoties uz šo dokumentu, tika izstrādātas modifikācijas sedimentu toksicitātes testu veikšanai ar Lumbriculus variegatus. Papildu atsauču dokumenti ir, piemēram, ASTM Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates (3), U.S. EPA Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates (7) un ASTM Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates (12). Turklāt šā dokumenta sagatavošanā būtiski nozīmīgi avoti bija šīs testēšanas metodes starplaboratoriju salīdzinošajā testēšanā (13, starplaboratoriju salīdzinošās testēšanas ziņojums) gūtā praktiskā pieredze un literatūras dati.
|
PRIEKŠNOTEIKUMI UN NORĀDĪJUMI
|
6.
|
Pirms pētījuma uzsākšanas jāiegūst informācija par testējamo ķīmisko vielu, piemēram, par drošības pasākumiem, pareizas glabāšanas apstākļiem un analīzes metodēm. Norādījumi par to, kā testēt vielas, kuru fizikālķīmiskās īpašības to testēšanu apgrūtina, sniegti (14).
|
|
7.
|
Pirms testa veikšanas par testējamo ķīmisko vielu jābūt noskaidrotai šādai informācijai:
|
—
|
vispārpieņemtais nosaukums, ķīmiskais nosaukums (vēlams, IUPAC nomenklatūrā), struktūrformula, CAS reģistra numurs, tīrība;
|
|
|
8.
|
Pirms testa uzsākšanas par noderīgu uzskatāma šāda informācija:
|
—
|
oktanola un ūdens sadalīšanās koeficients (Kow);
|
|
—
|
organiskā oglekļa un ūdens sadalīšanās koeficients, izteikts kā Koc;
|
|
—
|
fototransformācija ūdenī;
|
|
|
9.
|
Informācija par izmantošanai paredzēto sedimentu atsevišķiem rādītājiem jāiegūst pirms testa sākšanas (7). Detalizētu informāciju sk. 22. un 25. punktā.
|
TESTĒŠANAS PRINCIPS
|
10.
|
Tārpus vienādā fizioloģiskā stāvoklī (sinhronizētus saskaņā ar 5. papildinājumu) eksponē sedimentu-ūdens sistēmas sedimentu fāzē ievadīta toksikanta koncentrāciju rindai. Par barotni jāizmanto mākslīgie sedimenti un rekonstituēts ūdens. Par kontrolparaugiem izmanto testēšanas traukus bez testējamās ķīmiskās vielas. Lai mazinātu mainību attiecībā uz replikātiem katrā koncentrācijas grupā, sedimentu papildināšanu ar testējamo ķīmisko vielu katram koncentrācijas līmenim izdara no liela tilpuma, un pēc tam testēšanas traukos, kuros sedimentu un ūdens koncentrācija līdzsvarota, ievieto testa organismus (sk. 29. punktu). Testēšanas organismus sedimentu-ūdens sistēmām eksponē 28 dienas. Ņemot vērā zemo barības vielu saturu mākslīgajā augsnē, sedimenti jābagātina ar barības avotu (sk. 22. un 23. punktu un 4. papildinājumu), lai nodrošinātu, ka tārpi kontrolapstākļos aug un vairojas. Tādā veidā nodrošina, ka testa dzīvniekus vielai eksponē gan ar ūdeni un sedimentiem, gan ar barību.
|
|
11.
|
Šā tipa pētījuma vēlamais beigupunkts ir vairošanās un biomasas ECx (piemēram, EC50, EC25, un EC10; ietekmes koncentrācija, kas ietekmē x % testa organismu), respektīvi, salīdzinājumā ar kontrolgrupu. Tomēr jāpiebilst, ka, ņemot vērā, ka zemām ECx (piemēram, EC10, EC25) ir raksturīga liela nenoteiktību ar ārkārtīgi augstu ticamības robežu 95 % (piemēram, (15)) un statistisko jaudu, kas aprēķināta hipotēzes pārbaudes laikā, par visnoturīgāko beigupunktu uzskata EC50. Turklāt, ja ar testēšanas plānu un datiem šādi aprēķini iespējami (sk. 34. un 38. punktu), biomasas un vairošanās rādītājiem var aprēķināt nenovērojamās ietekmes koncentrāciju (NOEC) un zemākās novērojamās ietekmes koncentrāciju (LOEC). Testēšanas plāns ir atkarīgs no tā, vai pētījuma nolūks ir ECx vai NOEC iegūšana.
|
STANDARTTESTI
|
12.
|
Sagaidāms, ka kontrolgrupas organismu izturēšanās pietiekami pierādīs laboratorijas spēju veikt testu un, ja ir pieejami vēsturiski dati, testa atkārtojamību. Turklāt, lai novērtētu testa organismu jutīgumu, ar regulāriem starplaikiem var veikt toksicitātes standarttestus ar standarta toksikantu. Testa dzīvnieku jutīgumu un stāvokli var apmierinoši pierādīt 96 h toksicitātes standarttesti (tikai ūdenī) (4)(7). Informācija par pentahlorfenola (PHF) toksicitāti pabeigtos testos (28 d. eksponēšana papildinātiem sedimentiem) ir iekļauta 6. papildinājumā un pārskatā par testēšanas metodes starplaboratoriju salīdzinošo testēšanu (13). PHF specifiskā akūtā toksicitāte (tikai ūdenī) ir aprakstīta, piemēram, (16). Šo informāciju var izmantot, lai testa organismu jutību standarttestos salīdzinātu ar PHF kā standarta toksikantu. Ieteicami L. variegatus standarta toksikanti ir kālija hlorīds (KCl) vai vara sulfāts (CuSO4) (4)(7). Līdz šim brīdim nav noskaidroti kvalitātes kritēriji, kuru pamatā būtu dati par KCl toksiskumu, jo par L. variegatus trūkst literatūras datu. Informāciju par vara toksiskumu L. variegatus var atrast (17) līdz (21) avotā.
|
TESTA DERĪGUMS
|
13.
|
Lai tests būtu derīgs, ir jāizpilda šādas prasības.
|
—
|
Starplaboratoriju salīdzinošā testēšana (13) pierādījusi, ka attiecībā uz Lumbriculus variegatus ekspozīcijas beigās vidējam dzīvo tārpu skaitam uz kontroles replikātu salīdzinājumā ar tārpu skaitu uz replikātu ekspozīcijas sākumā ir jāpalielinās vismaz 1,8 reizes.
|
|
—
|
Visā testēšanas laikā virsējā ūdens pH jābūt no 6 līdz 9.
|
|
—
|
Testēšanas laikā virsējā ūdens skābekļa koncentrācija nedrīkstētu būt zemāka par 30 % gaisa piesātinājuma vērtības (ASV) testēšanas temperatūrā.
|
|
TESTĒŠANAS METODES APRAKSTS
Testēšanas sistēma
|
14.
|
Ir ieteicamas statiskas sistēmas, kurās virsējo ūdeni neaizstāj. Pie attiecīgas sedimentu un ūdens attiecības (sk. 15. punktu) parasti ar vieglu aerēšanu pietiek, lai uzturētu testa organismiem pieņemamu ūdens kvalitāti (piemēram, palielināt izšķīdušā skābekļa saturu, samazināt vielmaiņas galaproduktu uzkrāšanos). Pusstatiskas sistēmas vai caurplūdes sistēmas, kurās virsējo ūdeni regulāri vai pastāvīgi atjaunina, izmanto tikai izņēmuma gadījumos, jo sagaidāms, ka regulāra virsējā ūdens atjaunināšana ietekmēs ķīmisko līdzsvaru (piemēram, testēšanas sistēmā rodas testējamās ķīmiskās vielas zudumi).
|
Testēšanas trauki un aparatūra
|
15.
|
Eksponēšana jāveic stikla mērglāzēs ar, piemēram, 250 ml tilpumu un 6 cm diametru. Var izmantot arī citus piemērotus stikla traukus, bet tiem jānodrošina attiecīgs virsējā ūdens un sedimentu dziļums. Katrā traukā jābūt apmēram 1,5–3 cm dziļam pagatavoto sedimentu slānim. Sedimentu slāņa dziļuma attiecībai pret virsējā ūdens dziļumu jābūt 1:4. Trauku tilpumam jāatbilst noslogojumam, proti, testa tārpu skaitam uz sedimentu svara vienību (sk. arī 39. punktu).
|
|
16.
|
Testēšanas traukiem un citai aparatūrai, kas nonāk saskarē ar testējamo ķīmisko vielu, jābūt viscaur no stikla vai cita ķīmiski inerta materiāla. Jācenšas nevienā aprīkojuma daļā neizmantot materiālus, kas var izšķīst, absorbēt testējamās vielas vai izskalot citas vielas un nelabvēlīgi ietekmēt testa dzīvniekus. Jebkuram aprīkojumam, kas ir saskarē ar testēšanas vidēm, jābūt no politetrafluoretilēna (PTFE), nerūsošā tērauda un/vai stikla. Tādu organisko ķīmisko vielu gadījumā, par kurām zināms, ka tās adsorbējas pie stikla, var būt nepieciešams silanizēts stikls. Šādās situācijās aprīkojums pēc izmantošanas būs jālikvidē.
|
Testa sugas
|
17.
|
Šā tipa pētījumā izmantotās testa sugas ir saldūdens mazsartārps Lumbriculus variegatus (Müller). Šai sugai pieņemami ir daudz un dažādi sedimentu tipi, un to plaši izmanto sedimentu toksicitātes un bioakumulācijas testēšanā [piemēram, (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Pārskatā jāatspoguļo testa dzīvnieku izcelsme, sugas identitātes apstiprinājums (piemēram, (36)), kā arī kultivēšanas apstākļi. Ja organismi iegūti no laboratorijas kultūras, pirms katras testēšanas identificēt sugu nav vajadzīgs.
|
Testa organismu kultivēšana
|
18.
|
Lai tārpu skaits sedimentu toksicitātes testu veikšanai būtu pietiekams, tos ir lietderīgi turēt pastāvīgā laboratorijas kultūrā. Norādījumi par Lumbriculus variegatus kultivēšanas metodēm laboratorijas apstākļos un sākumkultūru avotiem ir sniegti 5. papildinājumā. Sīkāku informāciju par šo sugu kultivēšanu sk. avotos (3), (7), (27).
|
|
19.
|
Lai nodrošinātu, ka testēšanu veic ar vienas un tās pašas sugas dzīvniekiem, ir stingri ieteicams izveidot viensugas kultūru. Pārliecinieties, ka testēšanā izmantotās kultūras un jo īpaši tārpi ir bez pamanāmām slimībām un anomālijām.
|
Ūdens
|
20.
|
Testēšanā par virsējo ūdeni ieteicams izmantot rekonstituētu ūdeni saskaņā ar šā pielikuma C.1. nodaļu (37); to var izmantot arī tārpu laboratorijas kultūrās (pagatavošanu sk. 2. papildinājumā). Ja nepieciešams, var izmantot dabisko ūdeni. Izraudzītā ūdens kvalitātei jābūt tādai, lai aklimatizācijas laikā un testēšanas periodos testa sugas augtu un vairotos bez izskata vai izturēšanās anomāliju parādīšanās. Ir pierādīts, ka Lumbriculus variegatus šāda veida ūdenī spēj izdzīvot, augt un vairoties (30), un ir nodrošināta maksimāla testa un kultivēšanas nosacījumu standartizācija. Ja izmanto rekonstituētu ūdeni, pārskatā jāatspoguļo tā sastāvs un pirms izmantošanas ūdens jāraksturo vismaz pēc pH, skābekļa satura un cietības (izsaka kā mg CaCO3/l). Lietderīgu informāciju pirms izmantošanas var sniegt ūdens analīze attiecībā uz mikropiesārņotājiem (sk., piemēram, 3. papildinājumu).
|
|
21.
|
Virsējā ūdens pH jābūt robežās no 6,0 līdz 9,0 (sk. 13. punktu). Ja sagaidāma pastiprināta amonjaka producēšanās, uzskata, ka pH ir lietderīgi uzturēt no 6,0 līdz 8,0. Piemēram, vāju organisko skābju testēšanas gadījumā ieteicams pH koriģēt, testēšanas ūdenim pievienojot buferšķīdumus, kā tas aprakstīts, piemēram, 16. avotā. Testēšanas ūdens kopējai cietībai jābūt no 90 līdz 300 mg CaCO3 uz litru dabiskā ūdens. Saskaņā ar ESAO TG 210. (38) pieņemama atšķaidīšanas ūdens papildkritēriji ir apkopoti 3. papildinājumā.
|
Sedimenti
|
22.
|
Tā kā iespējams, ka nepiesārņoti dabiskie sedimenti no konkrēta avota nav visu gadu pieejami un testēšanu var ietekmēt vietējie organismi, kā arī mikropiesārņotāju klātbūtne, vēlams izmantot pagatavotus sedimentus (dēvē arī par rekonstituētajiem, mākslīgajiem vai sintētiskajiem sedimentiem). Pagatavotu sedimentu izmantošana testēšanas apstākļu mainību, kā arī klātesošās faunas ieviešanos samazina līdz minimumam. Turpmāk aprakstīto pagatavoto sedimentu pamatā ir literatūras avotiem (6), (39) un (40) atbilstoši mākslīgie sedimenti. Tos ieteicams izmantot šā tipa testos ((6), (10), (30), (41), (42), (43)):
|
a)
|
4–5 % (saussvars) sfagnu kūdras; ir svarīgi izmantot kūdru pulvera veidā ar “vidēju” sadalīšanās pakāpi, smalki samaltu (daļiņu izmērs ≤ 0,5 mm) un tikai gaisā žāvētu;
|
|
b)
|
20 ± 1 % (saussvars) kaolīna mālu (vēlamais kaolinīta saturs virs 30 %);
|
|
c)
|
75–76 % (saussvars) kvarca smilšu (smalkas, graudiņu izmērs ≤ 2 mm, bet > 50 % daļiņu izmēram jābūt 50–200 μm);
|
|
d)
|
dejonizēts ūdens, 30–50 % sedimentu saussvara papildus sausajām sedimentu sastāvdaļām;
|
|
e)
|
lai koriģētu galīgā sedimentu maisījuma pH, pievieno ķīmiski tīru kalcija karbonātu (CaCO3);
|
|
f)
|
galīgā maisījuma kopējā organiskā oglekļa (TOC) saturam jābūt 2 % (± 0,5) sedimentu saussvara, un tas jākoriģē, izmantojot attiecīgus daudzumus kūdras un smilšu saskaņā ar a) un c) apakšpunktu;
|
|
g)
|
barība, piemēram, samaltas, izžāvētas nātru lapas (Urtica sugas, saskaņā ar farmācijas standartiem, cilvēku lietošanai) vai samaltu, izžāvētu Urtica sugu lapu un alfa-celulozes maisījums (1:1) – 0,4–0,5 % sedimentu saussvara papildus sausajām sedimentu sastāvdaļām; sīkāku informāciju sk. 4. papildinājumā.
|
|
|
23.
|
Jābūt zināmam kūdras, kaolīna mālu, barības materiāla un smilšu avotam. Papildus g) sastāvdaļai šā pielikuma (6) nodaļā C.27. norādīti alternatīvi augu materiāli, ko var izmantot par barības avotu: dehidrētas zīdkoka lapas (Morus alba), baltais āboliņš (Trifolium repens), spināti (Spinacia oleracea) vai labības zāle.
|
|
24.
|
Izraudzītais barības avots jāpievieno, pirms sedimentus papildina ar testējamo ķīmisko vielu, vai papildināšanas laikā. Izraudzītajam barības avotam jānodrošina vismaz pieņemama vairošanās kontrolgrupā. Var būt lietderīgi mākslīgos sedimentus vai to sastāvdaļas pirms izmantošanas analizēt attiecībā uz mikropiesārņotājiem. Mākslīgo sedimentu pagatavošanas piemērs ir aprakstīts 4. papildinājumā. Ir pieņemami samaisīt arī sausas sastāvdaļas, ja pierāda, ka sedimentu sastāvdaļas pēc virsējā ūdens pievienošanas neatdalās (piemēram, pa ūdens virsmu nepeld kūdras daļiņas) un ka kūdra vai sedimenti ir pietiekami labi pagatavoti (sk. 4. papildinājuma 25. punktu). Mākslīgie sedimenti jāraksturo vismaz pēc sastāvdaļu izcelsmes, graudiņu izmēra sadalījuma (procentos smiltis, dūņas un māls), kopējā organiskā oglekļa (TOC) satura, ūdens satura un pH. Redokspotenciāla mērīšana nav obligāta.
|
|
25.
|
Ja, piemēram, specifiskiem testēšanas nolūkiem tas nepieciešams, par testēšanas un/vai kultūras sedimentiem var izmantot arī dabiskos sedimentus no nepiesārņotām vietām (3). Tomēr, ja izmanto dabiskos sedimentus, tie jāraksturo vismaz pēc izcelsmes (ievākšanas vietas), pH un amonjaka satura poru ūdenī, pēc kopējā organiskā oglekļa (TOC) satura un slāpekļa satura, daļiņu sadalījuma pēc lieluma (procentos smiltis, dūņas un māls) un ūdens satura procentos (7), un tiem jābūt bez jebkāda piesārņojuma un citiem organismiem, kas varētu konkurēt ar testa organismiem vai ar tiem baroties. Pēc izvēles var mērīt redokspotenciālu un katjonu apmaiņas kapacitāti. Pirms papildināšanas ar testējamo ķīmisko vielu ir ieteicams dabiskos sedimentus septiņas dienas nogatavināt tādos pašos apstākļos, kādi būs turpmākajā testā. Šā nogatavināšanas perioda beigās virsējais ūdens jānolej un jāizlej.
|
|
26.
|
Izmantošanai paredzēto sedimentu kvalitātei jābūt tādai, lai kontrolgrupu organismi ekspozīcijas periodā spētu izdzīvot un vairoties bez izskata un izturēšanās anomāliju parādīšanās. Kontrolgrupas tārpiem jāierokas sedimentos un jāsāk ar tiem baroties. Vairošanās rādītājiem kontrolgrupu paraugos jāatbilst vismaz 13. punktā aprakstītajiem derīguma kritērijiem. Jāatzīmē, vai sedimentu virskārtā ir vai nav fekāliju granulas, kas liecina, ka tārpi sedimentus ir sagremojuši, un tas var palīdzēt interpretēt testēšanas rezultātus attiecībā uz ekspozīcijas ceļiem. Papildu informācija par barošanos ar sedimentiem ir iegūstama, izmantojot literatūras avotos (24), (25), (44) un (45) aprakstītās metodes, pēc kurām var precizēt barošanos ar sedimentiem vai daļiņu atlasi testa organismos.
|
|
27.
|
Manipulācijas, kas ar dabiskajiem sedimentiem veicamas, pirms tos izmanto laboratorijā, ir aprakstītas avotos (3), (7) un (12). Lumbriculus testam ieteicamo mākslīgo sedimentu pagatavošana un glabāšana ir aprakstīta 4. papildinājumā.
|
Testējamās ķīmiskās vielas lietošana
|
28.
|
Sedimentus papildina ar testējamo ķīmisko vielu. Tā kā sagaidāms, ka lielākajai daļai testējamo ķīmisko vielu būs zema šķīdība ūdenī, tad, lai sagatavotu izejšķīdumu, tās iespējami mazā tilpumā jāizšķīdina piemērotā organiskā šķīdinātājā (piemēram, acetonā, n-heksānā, cikloheksānā). Testēšanas šķīdumus pagatavo, ar to pašu šķīdinātāju atšķaidot izejšķīdumu. Piemērota šķīdinātāja izvēles galvenajam kritērijam jābūt šķīdinātāja toksicitātei un gaistamībai, kā arī testējamās vielas šķīdībai izraudzītajā šķīdinātājā. Visiem koncentrācijas līmeņiem jāizmanto vienāds attiecīgā šķīduma tilpums. Viena koncentrācijas līmeņa sedimenti ar testējamo ķīmisko vielu jāpapildina vienlaikus, lai testējamās ķīmiskās vielas koncentrācijas atšķirības vienas grupas replikātu vidū būtu minimālas. Katru testa šķīdumu tad sajauc ar kvarca smiltīm, kā aprakstīts 22. punktā (piemēram, 10 g kvarca smilšu uz testēšanas trauku). Ir konstatēts, ka kvarca smiltis pilnīgi samirkst 0,20–0,25 ml tilpumā uz g smilšu. Pēc tam šķīdinātājs jāiztvaicē, līdz smiltis ir sausas. Lai līdz minimumam samazinātu testējamās ķīmiskās vielas zudumus līdzizgarošanā (piemēram, atkarībā no ķīmiskās vielas tvaika spiediena), pārklātās smiltis jāizmanto uzreiz pēc izžāvēšanas. Sausās smiltis sajauc ar piemērotu daudzumu pagatavotu attiecīga koncentrācijas līmeņa sedimentu. Sedimentu gatavošanā jāņem vērā smilšu daudzums testējamās ķīmiskās vielas un smilšu maisījumā (t. i., sedimenti tādēļ jāgatavo, izmantojot mazāk smilšu). Šīs procedūras galvenā priekšrocība ir tāda, ka sedimentos šķīdinātājs faktiski nenonāk (7). Alternatīva ir, piemēram, dabisko sedimentu gadījumā testējamo ķīmisko vielu pievienot, tā, kā iepriekš aprakstīts par kvarca smiltīm, papildinot smalki samaltu sedimentu porciju vai arī testējamo ķīmisko vielu iemaisot mitros sedimentos, un pēc tam jebkādam izmantotajam šķīdinātājam ļaujot izgarot. Jācenšas nodrošināt, lai sedimentiem pievienotā testējamā ķīmiskā viela tajos būtu viscaur un vienmērīgi izkliedēta. Ja nepieciešams, var analizēt apakšparaugus, lai apstiprinātu mērķkoncentrācijas sedimentos un noteiktu homogenitātes pakāpi. Lai apstiprinātu mērķkoncentrācijas sedimentos, var būt lietderīgi arī analizēt testa šķīdumu apakšparaugus. Tā kā kvarca smilšu pārklāšanai ar testējamo ķīmisko vielu izmanto šķīdinātāju, jāizmanto arī šķīdinātāja kontrole, ko pagatavo ar tādu pašu šķīdinātāja daudzumu kā testa sedimentus. Pārskatā jāatspoguļo arī papildināšanai izmantotā metode un iemesls, kura dēļ izraudzīta specifiska papildināšanas procedūra, kas nav iepriekš aprakstītā procedūra. Papildināšanas metodi var pielāgot testējamās ķīmiskās vielas fizikālķīmiskajām īpašībām, piemēram, lai viela izgarojot nezustu papildināšanas vai līdzsvarošanās laikā. Papildu norādījumi par papildināšanas procedūrām ir sniegti Environment Canada (1995) materiālā (46).
|
|
29.
|
Kad papildinātie sedimenti ir pagatavoti, sadalīti pa testēšanas trauku replikātiem un pārlieti ar testēšanas ūdeni, ir vēlams pagaidīt, kamēr testējamā ķīmiskā viela sadalīsies sedimentu un ūdens fāzē (piemēram, (3)(7)(9)). To vēlams īstenot tādos pašos temperatūras un aerācijas apstākļos, kādus izmanto testēšanā. Attiecīgais līdzsvarošanās laiks ir atkarīgs no sedimentiem un ķīmiskās vielas un var ilgt no dažām stundām līdz vairākām dienām, retos gadījumos – vairākas nedēļas (4–5) (piemēram, (27)(47)). Šajā testā negaida līdzsvara iestāšanos, bet 48 stundu līdz 7 dienu līdzsvarošanās periods ir ieteicams. Tādējādi testējamās ķīmiskās vielas noārdīšanās tiks samazināta līdz minimumam. Atkarībā no pētījuma mērķa, piemēram, vides apstākļu imitācijas, papildinātos sedimentus līdzsvarot vai nogatavināt var ilgāku periodu.
|
|
30.
|
Šā līdzsvarošanas perioda beigās testējamās ķīmiskās vielas koncentrācijas analīzei jāņem vismaz virsējā ūdens un sedimentu pamatmasas paraugi vismaz augstākajā un zemākajā koncentrācijā. Šajās testējamās ķīmiskās vielas analītiskajās noteikšanās jāvar aprēķināt masas bilanci un rezultātus izteikt uz izmērīto sākumkoncentrāciju pamata. Vispār paraugu ņemšana sedimentu–ūdens sistēmu traucē vai sagrauj. Tāpēc vienus un tos pašus replikātus izmantot gan sedimentu, gan tārpu paraugu ņemšanai parasti nav iespējams. Ir jāsagatavo attiecīga izmēra papildu “analītiskie” trauki, ko apstrādā tādā pašā veidā (tajos ir arī testa organismi), bet neizmanto bioloģiskajiem novērojumiem. Trauku izmēri jāizraugās tā, lai varētu nodrošināt analītiskajai metodei nepieciešamos paraugu apjomus. Sīkāka informācija par paraugu ņemšanu ir aprakstīta 53. punktā.
|
TESTĒŠANAS NORISE
Priekštestēšana
|
31.
|
Ja par testējamās ķīmiskās vielas toksisko ietekmi uz Lumbriculus variegatus nav pieejama nekāda informācija, varētu būt noderīgi veikt priekšeksperimentu, lai noteiktu galīgajā testā testējamo koncentrāciju diapazonu un optimizētu galīgā testa nosacījumus. Šim nolūkam izmanto testējamās ķīmiskās vielas koncentrāciju rindu ar lieliem intervāliem. Tārpus katrai testējamās ķīmiskās vielas koncentrācijai eksponē periodā (piemēram, 28 d. kā galīgajā testā), kas ļauj aplēst attiecīgās testējamās koncentrācijas; kontrolgrupas nav vajadzīgas. Priekštestēšanā jānovēro un jāatzīmē tārpu izturēšanās, piemēram, vairīšanās no sedimentiem, kuru var būt izraisījusi testējamā ķīmiskā viela un/vai paši sedimenti. Priekštestēšanā nav ieteicams testēt koncentrācijas, kas augstākas par 1 000 mg uz kg sedimentu saussvara.
|
Galīgais tests
|
32.
|
Pamatojoties uz diapazonu noteikšanai veiktās priekštestēšanas rezultātiem (31. punkts), galīgajā testā jāizmanto un jāizraugās vismaz piecas koncentrācijas, un jāievēro 35., 36., 37. un 38. punkts.
|
|
33.
|
Papildus testu sērijai izveido kontrolgrupu (par replikāciju sk. 36., 37. un 38. punktu) ar paraugiem, kas satur tās pašas sastāvdaļas, izņemot testējamo ķīmisko vielu. Ja kādu šķīdināšanas līdzekli izmanto testējamās ķīmiskās vielas ievadīšanai, tas nedrīkst būtiski ietekmēt testa organismus, ko pārbauda papildu kontrolgrupā tikai ar šķīdinātāju.
|
Testēšanas plāns
|
34.
|
Testēšanas plāns attiecas uz testa koncentrāciju skaita un intervāla izraudzīšanos, trauku skaitu katrai koncentrācijai un pievienoto tārpu skaitu uz trauku. ECx un NOEC noteikšanas, kā arī robežtesta plāni ir aprakstīti 35., 36., 37. un 38. punktā.
|
|
35.
|
Testa koncentrācijām jāaptver ietekmes koncentrācija (piemēram, EC50, EC25, EC10) un to koncentrāciju diapazons, kurās vēlas noskaidrot ķīmiskās vielas ietekmi. Jāizvairās ekstrapolēt stipri zem zemākās koncentrācijas, kurā vērojama ietekme uz testa organismiem, vai virs augstākās testētās koncentrācijas. Ja izņēmuma gadījumā šādu ekstrapolāciju veic, pārskatā tas pilnīgi jāizskaidro.
|
|
36.
|
Ja jāaprēķina ECx, jātestē vismaz piecas koncentrācijas un attiecībā uz katru koncentrāciju vismaz trīs replikāti; lai labāk aplēstu variabilitāti kontrolgrupā, tajā iesaka izmantot sešus vienādas koncentrācijas paraugus vai, ja izmanto šķīdinātāju, šķīdinātāja kontrolparaugu. Jebkurā gadījumā ieteicams izmantot pietiekamu daudzumu testa koncentrāciju, lai nodrošinātu labu aplēses paraugu. Blakusesošu koncentrāciju dalījums nedrīkst būt lielāks par divi (izņēmumu var pieļaut gadījumos, kur koncentrācijas atbildreakcijas līknei ir lēzens slīpums). Replikātu skaitu katrā apstrādē var samazināt, ja palielina testa koncentrāciju skaitu ar atbildreakcijām intervālā 5–95 %. Replikātu skaita palielināšana vai testa koncentrāciju intervālu samazināšana dod šaurākus testa ticamības intervālus.
|
|
37.
|
Ja jāaplēš LOEC/NOEC vērtības, jāizmanto vismaz piecas testa koncentrācijas ar vismaz četriem paraugiem katrai (lai labāk aplēstu variabilitāti kontrolgrupā, tajā iesaka izmantot sešus vienādas koncentrācijas paraugus vai, ja izmanto šķīdinātāju, šķīdinātāja kontrolparaugu) un blakusesošu koncentrāciju dalījumam nav ieteicams pārsniegt divi. Informācija par statistisko jaudu, kas noskaidrota hipotēzes pārbaudē testa metodes starplaboratoriju salīdzinošajā testēšanā, ir sniegta 6. papildinājumā.
|
|
38.
|
Ja ar koncentrāciju līdz 1 000 mg uz kg sedimentu saussvara nekāda ietekme netiek sagaidīta (piemēram, tas konstatēts priekštestēšanā veiktajā diapazona noteikšanā) vai ja interesējošo NOEC vērtību apstiprināšanai pietiks ar vienas koncentrācijas testēšanu, var veikt robežtestu (ar vienu testa koncentrāciju un kontrolparaugiem). Pēdējā gadījumā testēšanas pārskatā detalizēti jāpamato robežkoncentrāciju izvēle. Robežtesta mērķis ir testu izpildīt ar tik augstu koncentrāciju, lai lēmēji varētu izslēgt ķīmiskās vielas iespējamu toksisku ietekmi, un robežvērtību nosaka tādā koncentrācijā, kādas rašanos neprognozē nekādā gadījumā. Ieteicams 1 000 mg/kg (saussvara). Parasti ir vajadzīgi vismaz seši replikāti gan apstrādei, gan kontrolgrupai. Informācija par testa metodes starplaboratoriju salīdzinošajā testēšanā hipotēzes pārbaudē noskaidroto statistisko jaudu ir sniegta 6. papildinājumā.
|
Ekspozīcijas apstākļi
Testa organismi
|
39.
|
Testēšanu veic ar vismaz 10 tārpiem katrā replikātā, ko izmanto bioloģisko parametru noteikšanā. Šāds tārpu skaits atbilst apmēram 50–100 mg mitrās biomasas. Pieņemot, ka sausais saturs ir 17,1 % (48), iegūtais rezultāts ir apmēram 9–17 mg sausās biomasas uz trauku. ASV Vides aizsardzības aģentūra (2000, (7)) iesaka noslogojumu, kas nepārsniedz sausās biomasas un TOC attiecību 1:50. Attiecībā uz 22. punktā aprakstītajiem pagatavotajiem sedimentiem tas atbilst apmēram 43 g sedimentu (saussvars) uz 10 tārpiem pie TOC 2,0 % sauso sedimentu. Gadījumos, kur uz vienu trauku izmanto vairāk nekā 10 tārpus, attiecīgi jāpielāgo sedimentu un virsējā ūdens daudzums.
|
|
40.
|
Tārpiem, ko izmanto testēšanā, jānāk no viena un tā paša avota un jābūt līdzīgā fizioloģiskajā stāvoklī (sk. 5. papildinājumu). Jāizraugās līdzīga lieluma tārpi (sk. 39. punktu). Pirms testēšanas ieteicams nosvērt tārpu partijas vai kultūras apakšparaugu, lai noteiktu vidējo svaru.
|
|
41.
|
Testēšanas tārpus izņem no kultūras (detalizētu informāciju sk. 5. papildinājumā). Lielus (pieaugušus) dzīvniekus bez nesenas fragmentācijas pazīmēm pārvieto uz stikla šķīvīšiem (piemēram, Petri platēm), kas satur tīru ūdeni. Pēc tam tos sinhronizē, kā aprakstīts 5. papildinājumā. Testēšanā izmanto veselus līdzīga izmēra tārpus pēc 10 līdz 14 d. reģenerācijas, kuri pēc vieglas mehāniskas stimulēšanas aktīvi peld vai rāpo. Ja testēšanas apstākļi (piemēram, pēc temperatūras, gaismas režīma un virsējā ūdens) atšķiras no kultivēšanas apstākļiem, lai tārpi pielāgotos testēšanas apstākļiem, pietiek ar, piem., 24 h aklimatizāciju testa temperatūrā, gaismas režīmā un tādā pašā virsējā ūdenī. Pielāgojušies mazsartārpi jāsadala pa testēšanas traukiem pēc nejaušības principa.
|
Barošana
|
42.
|
Tā kā barību sedimentiem pievieno pirms testējamās ķīmiskās vielas ievadīšanas (vai tās laikā), tārpus testēšanas laikā papildus nebaro.
|
Gaisma un temperatūra
|
43.
|
Kultūras un testa fotoperiods parasti ir 16 stundas (3)(7). Gaismas intensitāte jāuztur zemā līmenī (piemēram, 100–500 lx), lai imitētu dabiskos apstākļus sedimentu virskārtā, un ekspozīcijas periodā vismaz vienreiz jāmēra. Temperatūrai visā testēšanas laikā jābūt 20 ± 2 °C. Vienā konkrētā mērīšanas datumā atšķirībai starp testēšanas traukiem nav ieteicams pārsniegt ± 1 °C. Testēšanas trauki testēšanas inkubatorā vai testēšanas zonā jānovieto pēc nejaušības principa, piemēram, lai attiecībā uz vairošanos līdz minimumam samazinātu sistemātisko novirzi trauku novietojuma dēļ.
|
Aerācija
|
44.
|
Virsējo ūdeni testēšanas traukos viegli aerē (piemēram, 2–4 burbuļi sekundē), izmantojot Pastēra pipeti, kas novietota apmēram 2 cm virs sedimentu virsmas, lai līdz minimumam samazinātu sedimentu uzduļķošanu. Jāraugās, lai izšķīdušā skābekļa koncentrācija nesamazinās zem 30 % gaisa piesātinājuma vērtības (ASV). Gaisa padeve jāpārbauda un, ja nepieciešams, jākoriģē vismaz reizi darba dienā.
|
Ūdens kvalitāte
|
45.
|
Virsējam ūdenim jāmēra šādi ūdens kvalitātes parametri.
|
Temperatūra:
|
vienreiz nedēļā un ekspozīcijas perioda sākumā un beigās vismaz vienā testēšanas traukā katram koncentrācijas līmenim un vienā kontrolgrupas testēšanas traukā; ja iespējams, papildus var reģistrēt apkārtējās vides temperatūru (apkārtējā gaisā vai ūdens peldē), piemēram, ik pēc stundas.
|
|
Izšķīdušā skābekļa saturs:
|
vienreiz nedēļā un ekspozīcijas perioda sākumā un beigās vismaz vienā testēšanas traukā katram koncentrācijas līmenim un vienā kontrolgrupas testēšanas traukā; izsaka mg/l un % ASV (gaisa piesātinājuma vērtība).
|
|
Gaisa piegāde:
|
kontrolē vismaz vienreiz darba dienā un, ja nepieciešams, koriģē.
|
|
pH:
|
vienreiz nedēļā un ekspozīcijas perioda sākumā un beigās vismaz vienā testēšanas traukā katram koncentrācijas līmenim un vienā kontrolgrupas testēšanas traukā.
|
|
Kopējā ūdens cietība:
|
ekspozīcijas perioda sākumā un beigās vismaz vienā kontrolgrupas paraugā un vienā testēšanas traukā ar augstāko koncentrāciju; izsaka mg/l CaCO3.
|
|
Kopējais amonjaka saturs:
|
ekspozīcijas perioda sākumā un turpmāk 3x nedēļā vismaz vienā kontrolgrupas replikātā un vienā testēšanas traukā katram koncentrācijas līmenim; izsaka mg/l NH4
+ vai NH3, vai kā kopējo amonjaka slāpekli.
|
Ja ūdens kvalitātes parametru mērījumiem ūdens paraugi no traukiem jānolej lielā daudzumā, ūdens kvalitātes mērījumiem var būt ieteicams sagatavot atsevišķu trauku, lai nemainītu ūdens un sedimentu tilpuma attiecību.
|
Bioloģiskie novērojumi
|
46.
|
Ekspozīcijas laikā testēšanas trauki jānovēro, lai salīdzinājumā ar kontrolgrupas paraugiem vizuāli novērtētu tārpu izturēšanās izmaiņas (piemēram, vairīšanās no sedimentiem, sedimentu virskārtā redzamas fekāliju granulas). Novērojumi jāpieraksta.
|
|
47.
|
Testēšanas beigās aplūko katru replikātu (var nepārbaudīt papildu traukus, kas paredzēti ķīmiskajām analīzēm). Visi tārpi no testēšanas traukiem jāizņem ar piemērotu paņēmienu. Jāraugās, lai izņemtie tārpi netiktu savainoti. Viena iespējama metode ir tārpu izsijāšana no sedimentiem. Var izmantot nerūsošā tērauda sietu ar atbilstošu acu izmēru. Lielāko daļu virsējā ūdens uzmanīgi nolej un atlikušos sedimentus un ūdeni samaisa, iegūstot biezu suspensiju, ko var laist caur sietu. Izmantojot 500 μm sietu, lielākā daļa sedimentu daļiņu caur sietu izkļūst ļoti ātri; tomēr laišana caur sietu jāveic ātri, lai tārpi neierāptos sietā vai neizkļūtu tam cauri. Ja izmanto 250 μm sietu, tārpi nevarēs ierāpties sietā vai izkļūt tam cauri, tomēr jāraugās, lai sietā paliek iespējami maz sedimentu daļiņu. Katra replikātu trauka izsijāto biezo suspensiju var izlaist caur sietu otru reizi, lai pārliecinātos, ka ir savākti visi tārpi. Alternatīva metode varētu būt sedimentu uzsildīšana, testēšanas traukus novietojot ūdens peldē 50–60 °C temperatūrā; tārpi atstās sedimentus un tos no sedimentu virskārtas varēs savākt, izmantojot rūdīta stikla pipeti ar platu galu. Vēl viena alternatīva metode varētu būt biezas sedimentu suspensijas pagatavošana un izliešana seklā attiecīga izmēra pannā. No biezās suspensijas seklā slāņa tārpus var uzlasīt ar tērauda adatu vai smalku pinceti (izmanto vairāk kā dakšu, nevis kā knaibles, lai tārpus nesavainotu) un pārvietot tīrā ūdenī. Pēc tārpu atdalīšanas no sedimentu suspensijas tos noskalo testēšanas vidē un saskaita.
|
|
48.
|
Neatkarīgi no izmantotās testēšanas metodes laboratorijām jāpierāda, ka to personāls ir spējīgs savākt vidēji vismaz 90 % organismu no visiem sedimentiem. Piemēram, kontrolgrupas sedimentiem vai testa sedimentiem var pievienot noteiktu skaitu testa organismu un pēc vienas stundas noteikt savākšanas rādītāju(7).
|
|
49.
|
Jāreģistrē un jānovērtē kopējais dzīvo un mirušo īpatņu skaits uz replikātu. Par mirušiem uzskata tārpus, kas atbilst šādiem kritērijiem:
|
a)
|
pēc viegla mehāniska stimula nav reakcijas;
|
|
b)
|
ir sadalīšanās pazīmes (kombinācijā ar “a”);
|
Turklāt dzīvos tārpus var iedalīt vienā no trīs grupām:
|
a)
|
lieli, veseli tārpi (pieaugušie) bez reģenerētām ķermeņa daļām;
|
|
b)
|
veseli tārpi ar reģenerētām gaišākas krāsas ķermeņa daļām (piemēram, ar jaunu pakaļdaļu, ar jaunu priekšdaļu vai arī gan jaunu pakaļdaļu, gan priekšdaļu);
|
|
c)
|
neveseli tārpi (t. i., nesen fragmentēti tārpi ar nereģenerētām ķermeņa daļām).
|
Šie papildu novērojumi nav obligāti, bet var tikt izmantoti bioloģisko rezultātu papildu interpretēšanā (piemēram, liels c) grupā iedalīto tārpu skaits var liecināt, ka konkrētā apstrāde kavē vairošanos vai reģenerāciju). Turklāt jāreģistrē arī jebkādas izskata atšķirības (piemēram, ārējā apvalka bojājumi, pietūkušas ķermeņa daļas) starp apstrādes grupas un kontrolgrupas tārpiem, ja tādas tiek novērotas.
|
|
50.
|
Uzreiz pēc saskaitīšanas/novērtēšanas katru dzīvo tārpu no katra replikāta pārvieto sausās, iepriekš nosvērtās un marķētās svēršanas pannās (vienu uz replikātu) un nonāvē ar vienu pilienu etanola uz svēršanas pannu. Svēršanas pannas uz nakti žūšanai novieto žāvēšanas krāsnī 100 ± 5 °C temperatūrā, pēc tam tās atdzesē eksikatorā un nosaka tārpu saussvaru (vēlams, g ar vismaz četriem cipariem aiz komata).
|
|
51.
|
Lai būtu ņemtas vērā neorganiskās sastāvdaļas, kas tārpu gremošanas traktā nokļuvušas no apēstajiem sedimentiem, papildus kopējam saussvaram atbilstoši aprakstam literatūras avotā (49) var noteikt arī bezpelnu saussvaru.
|
|
52.
|
Biomasu nosaka kā kopējo biomasu uz replikātu, ieskaitot pieaugušos un jaunos tārpus. Nosakot biomasu uz replikātu, mirušos tārpus neņem vērā.
|
Testējamo ķīmisko vielu koncentrāciju verificēšana
Paraugu ņemšana
|
53.
|
Paraugi testējamās ķīmiskās vielas ķīmiskajai analīzei jāņem vismaz augstākajā koncentrācijā un kādā zemākā koncentrācijā, vismaz līdzsvarošanās fāzes beigās (pirms testa organismu pievienošanas) un testēšanas beigās. Analīzei ņem paraugus vismaz no sedimentu masas un virsējā ūdens. Katrā paraugu ņemšanas datumā ņem vismaz divus paraugus no kontrolgrupas un no katras apstrādes grupas. Vienu no dublikātparaugiem var glabāt rezervē (lai to analizētu, piemēram, gadījumā, ja sākotnējā analīze neiekļaujas ± 20 % robežās no nominālās koncentrācijas). Specifisku ķīmisko īpašību gadījumā, piemēram, paredzama strauja testējamās ķīmiskās vielas noārdīšanās, analīzes grafiku pēc eksperta uzskatiem var pārplānot (piemēram, biežāka paraugu ņemšana, papildu koncentrācijas līmeņu analīze). Tad paraugus var ņemt paraugu ņemšanas starpdatumos (piemēram, septītajā dienā pēc ekspozīcijas sākšanas).
|
|
54.
|
Virsējā ūdens paraugs jāiegūst, to uzmanīgi nolejot vai nolaižot caur sifonu, lai sedimentu uzduļķošanos samazinātu līdz minimumam. Jāatzīmē paraugu tilpums.
|
|
55.
|
Pēc tam, kad virsējais ūdens ir aizvākts, sedimenti jāhomogenizē un jāpārvieto uz piemērotu konteineru. Mitro sedimentu svaru atzīmē.
|
|
56.
|
Ja papildus nepieciešams testējamo ķīmisko vielu analizēt poru ūdenī, homogenizēto un nosvērto sedimentu paraugi jācentrifugē, lai iegūtu poru ūdeni. Piemēram, 250 ml centrifugēšanas mērglāzēs iepilda apmēram 200 ml mitru sedimentu. Pēc tam paraugus bez filtrēšanas centrifugē, lai izolētu poru ūdeni, piemēram, 10 000 ± 600 × g 30 – 60 min temperatūrā, kas nepārsniedz testēšanā izmantoto temperatūru. Pēc centrifugēšanas virspusē esošo ūdeni nolej vai ar pipeti nosūc, gādājot, lai tajā nenonāk sedimentu daļiņas, un tilpumu atzīmē. Atzīmē atlikušo sedimentu granulu svaru. Sedimentu saussvara noteikšana katrā paraugu ņemšanas datumā var palīdzēt aplēst masas bilanci vai testējamās ķīmiskās vielas atgūstamību ūdens-sedimentu sistēmā. Dažos gadījumos var nebūt iespējams analizēt koncentrācijas poru ūdenī, jo parauga apjoms ir pārāk mazs.
|
|
57.
|
Ja analīzi neveic uzreiz, visi paraugi jāglabā saskaņā ar piemērotu metodi, piemēram, glabāšanas apstākļos, kas ieteicami, lai testējamā ķīmiskā viela noārdītos minimāli (piemēram, vides paraugus parasti glabā tumsā – 18 °C temperatūrā). Pirms pētījuma uzsākšanas iegūst informāciju par konkrētās testējamās ķīmiskās vielas pareizas glabāšanas apstākļiem, piemēram, glabāšanas ilgumu un temperatūru, ekstrakcijas procedūrām u. tml.
|
Analīzes metode
|
58.
|
Tā kā visu procedūru būtībā nosaka testējamajai ķīmiskajai vielai izmantotās analītiskās metodes pareizība, precizitāte un jutība, eksperimentāli pārbauda, vai ar konkrēto metodi apmierinoša ir ķīmiskās analīzes precizitāte un reproducējamība, kā arī testējamās vielas atgūstamība no ūdens un sedimentu paraugiem vismaz zemākajās un augstākajās testa koncentrācijās. Pārbauda arī, vai testējamā ķīmiskā viela kontrolkamerās nav konstatējama koncentrācijās, kas pārsniedz kvantitatīvās noteikšanas robežu. Ja nepieciešams, koriģē nominālās koncentrācijas attiecībā uz vielas atgūstamību ar kvalitātes kontroles paraugiem, kas papildināti ar testējamo vielu (piemēram, ja atgūstamība ir ārpus 80 – 120 % no papildinātā daudzuma). Testēšanas laikā ar visiem paraugiem rīkojas tā, lai līdz minimumam samazinātu piesārņojumu un zudumus (piemēram, tos, kas rodas, testējamai ķīmiskajai vielai adsorbējoties uz paraugu ņemšanas ierīces).
|
|
59.
|
Jāatzīmē un pārskatā jāatspoguļo testējamās ķīmiskās vielas atgūstamība, kvantitatīvās noteikšanas robeža un noteikšanas robeža sedimentos un ūdenī.
|
DATI UN PĀRSKATA SAGATAVOŠANA
Rezultātu apstrāde
|
60.
|
Galvenie, obligātie testa atbildreakcijas mainīgie, kas statistiski jāizvērtē, ir biomasa un kopējais tārpu skaits uz replikātu. Nav obligāti, bet var izvērtēt arī vairošanos (tārpu skaita palielināšanos) un augšanu (sausās biomasas palielināšanos). Tādā gadījumā tārpu saussvara aplēses ekspozīcijas sākumā jāiegūst, piemēram, no sinhronizētu testēšanai paredzēto tārpu partijas reprezentatīva apakšparauga saussvara mērījuma.
|
|
61.
|
Lai gan neizdzīvošana nav šā testa beigupunkts, tā iespējami jāizvērtē. Mirstības skaitliskā novērtēšanā par mirušiem uzskata tārpus, kas nereaģē uz vieglu mehānisku kairinājumu, kam vērojamas sadalīšanās pazīmes, un trūkstošos tārpus. Mirstība vismaz jāatzīmē un jāņem vērā testēšanas rezultātu interpretācijā.
|
|
62.
|
Ietekmes koncentrācijas jāizsaka mg uz kg sedimentu saussvara. Ja testējamās ķīmiskās vielas atgūstamība sedimentos vai sedimentos un virsējā ūdenī ekspozīcijas sākumā ir 80 līdz 120 % no nominālajām koncentrācijām, ietekmes koncentrācijas (ECx, NOEC, LOEC) var izteikt, pamatojoties uz nominālajām koncentrācijām. Ja atgūstamība no nominālajām koncentrācijām atšķiras par vairāk nekā ± 20 %, ietekmes koncentrāciju (ECx,
NOEC, LOEC) pamatā jābūt sākotnēji izmērītajām koncentrācijām ekspozīcijas sākumā, piemēram, ņemot vērā testējamās ķīmiskās vielas masas bilanci testēšanas sistēmā (sk. 30. punktu). Tādos gadījumos, lai apstiprinātu, ka testa sedimenti pagatavoti pareizi, papildu informāciju var iegūt, analizējot izejšķīdumu un/vai lietotos šķīdumus.
|
ECx:
|
63.
|
ECx vērtības 60. punktā aprakstītajiem parametriem aprēķina, izmantojot attiecīgas statistiskas metodes (piemēram, varbūtību analīzi, logistisko vai Veibula funkciju, saīsināto Spīrmena-Kerbera metodi vai vienkāršu interpolāciju). Norādījumi par statistisko izvērtēšanu sniegti literatūras avotos (15) un (50). ECx iegūst, iegūtajā vienādojumā ievietojot vērtību, kas atbilst x % kontroles vidējās vērtības. Lai aprēķinātu EC50 vai jebkādu citu ECx, katras apstrādes vidējai vērtībai (

) jāveic regresijas analīze. |
NOEC/LOEC
|
64.
|
Ja ar statistisku analīzi paredzēts noteikt NOEC/LOEC, ir nepieciešama statistika par katru trauku (atsevišķos traukus uzskata par replikātiem). Jāizmanto attiecīgas statistiskas metodes. Vispār testējamā vienuma nelabvēlīgos efektus salīdzinājumā ar kontrolgrupu pēta, izmantojot vienvirziena (mazāku) hipotēzes pārbaudi pie p ≤ 0,05. Piemēri ir sniegti turpmākajos punktos. Norādījumi par statistikas metožu izraudzīšanos sniegti avotos (15) un (50).
|
|
65.
|
Normālsadalījuma datus var pārbaudīt, piemēram, ar Kolmogorova-Smirnova piemērotības testu (Kolmogorov-Smirnov goodness-of-fit-test), intervāla un standartnovirzes attiecības testu (R/s testu) vai Šapiro-Vilka testu (Shapiro-Wilk test) (divvirzienu, p ≤ 0,05). Kohreina testu (Cochran's test), Levena testu vai Bartleta testu (Bartlett's test) (divvirzienu, p ≤ 0,05) var izmantot, lai pārbaudītu dispersijas homogēniskumu. Ja parametriskās pārbaudes procedūras priekšnosacījumi (normalitāte, dispersijas homogēniskums) ir izpildīti, var veikt vienvirziena dispersijas analīzi (ANOVA) un turpmākus daudzpusējas salīdzināšanas testus. Pāru salīdzinājumus (piemēram, Daneta t-testu) vai descendentās tendences testus (piemēram, Viljamsa testu) var izmantot, lai aprēķinātu, vai ir būtiskas atšķirības (p ≤ 0,05) starp kontrolparaugiem un dažādām testējamo vienumu koncentrācijām. Citos gadījumos NOEC un LOEC aprēķināšanai jāizmanto neparametriskās metodes (piemēram, Bonferoni U-tests pēc Holmsa vai Džonkhīra-Terpstras trenda tests).
|
Robežtests
|
66.
|
Ja ir veikts robežtests (kontrolparauga un tikai viena apstrādes parauga salīdzinājums) un ir izpildīti parametrisko testēšanas procedūru priekšnosacījumi (normalitāte, homogēniskums), metriskās atbildreakcijas (kopējo tārpu skaitu un tārpu sausajā svarā izteiktu biomasu) var izvērtēt pēc Stjūdenta testa (t-testa). Ja šīs prasības neizpildās, var izmantot nevienlīdzīgas dispersijas Velča t-testu (Welch t-test) vai neparametrisku testu, piemēram, Manna-Vitnija U-testu. Informācija par metodes starplaboratoriju salīdzinošajā testēšanā hipotēzes pārbaudē atklāto statistisko jaudu ir sniegta 6. papildinājumā.
|
|
67.
|
Lai noteiktu būtiskas atšķirības starp kontrolgrupām (kontrolgrupu un šķīdinātāja kontrolgrupu), katras kontrolgrupas replikātus var testēt, kā tas aprakstīts robežtestā. Ja šajos testos netiek atklātas būtiskas atšķirības, visus kontrolgrupas un šķīdinātāja kontrolgrupas paraugus var apkopot. Citādi visi apstrādes paraugi jāsalīdzina ar šķīdinātāja kontrolgrupu.
|
Rezultātu interpretācija
|
68.
|
Ja notikusi atkāpšanās no šīs testēšanas metodes un ja mērīto testa koncentrāciju vērtība ir tuvu izmantotās analītiskās metodes noteikšanas robežai, rezultāti jāinterpretē piesardzīgi. Jebkāda atkāpšanās no šīs testēšanas metodes jāatzīmē.
|
Testēšanas pārskats
|
69.
|
Testēšanas pārskatā jāiekļauj vismaz šāda informācija.
|
—
|
Testējamā ķīmiskā viela:
|
—
|
ķīmiskās identifikācijas dati (vispārpieņemtais nosaukums, ķīmiskais nosaukums, struktūrformula, CAS numurs utt.), ietverot tīrību un analītisko metodi, ar ko ir iespējams testējamo ķīmisko vielu noteikt kvantitatīvi; testējamās ķīmiskās vielas avots, jebkādi izmantoto šķīdinātāju identifikācijas dati un koncentrācija;
|
|
—
|
jebkāda informācija, kas pieejama par fizikālajām un fizikālķīmiskajām īpašībām un iegūta pirms testēšanas sākšanas (piemēram, šķīdība ūdenī, tvaika spiediens, sadalīšanās koeficients augsnē (vai sedimentos, ja zināms), log Kow, stabilitāte ūdenī u. c.).
|
|
|
—
|
Testa sugas:
|
—
|
zinātniskais nosaukums, izcelsmes avots, jebkāda iepriekšēja apstrāde, aklimatizācija, kultivēšanas apstākļi u. c.
|
|
|
—
|
Testēšanas apstākļi:
|
—
|
izmantotā testēšanas procedūra (piemēram, statiska, pusstatiska vai ar caurplūdi);
|
|
—
|
testēšanas plāns (piemēram, testēšanas kameru skaits, materiāls un izmērs, ūdens tilpums uz trauku, sedimentu masa un tilpums uz trauku, (caurplūdes vai pusstatiskajām metodēm – ūdens tilpuma nomaiņas ātrums), jebkāda aerēšana pirms testēšanas un tās laikā, paraugu skaits, tārpu skaits uz replikātu ekspozīcijas sākumā, testa koncentrāciju skaits, nogatavināšanas, līdzsvarošanās un ekspozīcijas periodu ilgums, paraugu ņemšanas biežums);
|
|
—
|
sedimentu un virsējā ūdens dziļums;
|
|
—
|
testējamās ķīmiskās vielas priekšapstrādes un papildināšanas/ievadīšanas metode;
|
|
—
|
nominālās testēšanas koncentrācijas, detalizēta informācija par paraugu ņemšanu ķīmiskajai analīzei un analīzes metodes, ar kādām iegūtas testējamo ķīmisko vielu koncentrācijas;
|
|
—
|
sedimentu raksturlielumi atbilstoši 24. – 25. punkta aprakstam un jebkādi citi veikti mērījumi; pagatavoto sedimentu gatavošana;
|
|
—
|
testēšanas ūdens pagatavošana (ja izmanto rekonstituētu ūdeni) un rādītāji (skābekļa koncentrācija, pH, vadītspēja, cietība un jebkādi citi veiktie mērījumi) pirms testēšanas sākuma;
|
|
—
|
detalizēta informācija par barošanu, arī par barības veidu, pagatavošanu, daudzumu un barošanas režīmu;
|
|
—
|
gaismas intensitāte un fotoperiods(-i);
|
|
—
|
visu bioloģisko parametru (piemēram, paraugu ņemšana, izmeklēšana, testa organismu svēršana) un visu abiotisko parametru (piemēram, ūdens un sedimentu kvalitātes parametri) noteikšanā izmantotās metodes;
|
|
—
|
visu ķīmiskās analīzes paraugu tilpums un/vai svars;
|
|
—
|
detalizēta informācija par visu ķīmiskās analīzes paraugu apstrādi, arī par sagatavošanas, glabāšanas un papildināšanas procedūrām, ekstrakciju un analīzes procedūrām (un precizitāti) attiecībā uz testējamo ķīmisko vielu, kā arī testējamās ķīmiskās vielas atgūšanas reizēm.
|
|
|
—
|
Rezultāti:
|
—
|
ūdens kvalitāte testēšanas traukos (pH, temperatūra, izšķīdušā skābekļa koncentrācija, cietība, amonjaka koncentrācijas un jebkādi citi veiktie mērījumi);
|
|
—
|
kopējā organiskā oglekļa (TOC) saturs, saussvara attiecība pret slapjo svaru, sedimentu pH un jebkādi citi veiktie mērījumi;
|
|
—
|
kopējais tārpu skaits un, ja noteikts, veselo un neveselo tārpu skaits katrā testēšanas kamerā testēšanas beigās;
|
|
—
|
tārpu saussvars katrā testēšanas kamerā testēšanas beigās un, ja izmērīts, tārpu apakšparauga saussvars testēšanas sākumā;
|
|
—
|
jebkādas novērotas uzvedības anomālijas salīdzinājumā ar kontrolgrupu (piemēram, vairīšanās no sedimentiem, ir vai nav fekālās granulas);
|
|
—
|
jebkādi novēroti nāves gadījumi;
|
|
—
|
toksisko beigupunktu aplēses (piemēram, ECx, NOEC un/vai LOEC), kā arī to noteikšanai izmantotās statistiskas metodes;
|
|
—
|
nominālās testēšanas koncentrācijas, izmērītās testēšanas koncentrācijas un rezultāti, kas gūti analīzēs, kurās nosaka testējamās ķīmiskās vielas koncentrāciju testēšanas traukā;
|
|
—
|
jebkādas novirzes no derīguma kritērijiem.
|
|
|
—
|
Rezultātu izvērtēšana:
|
—
|
rezultātu atbilstība 13. punktā norādītajiem derīguma kritērijiem;
|
|
—
|
rezultātu iztirzājums, arī jebkāda ietekme uz testēšanas rezultātiem sakarā ar atkāpēm no šīs testēšanas metodes.
|
|
|
LITERATŪRA
|
(1)
|
EC (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Šā pielikuma C.27. nodaļa “Toksicitātes tests ar nosēdumu un ūdens hironomīdiem, izmantojot piesātinātus nosēdumus” .
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Šā pielikuma C.1. nodaļa“Akūtā toksicitāte zivīm”.
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.4.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Additional literature on statistical procedures:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
1. papildinājums
Definīcijas
Šajā testēšanas metodē ir izmantoti šādi termini:
|
|
Ķīmiskā viela ir viela vai vielu maisījums.
|
|
|
Nogatavināšanas periodu izmanto, lai stabilizētu sedimentu mikrobiālo komponenti un atbrīvotos, piemēram, no amonjaka, kas rodas no sedimentu sastāvdaļām; tas notiek pirms sedimentu papildināšanas ar testējamo ķīmisko vielu. Parasti pēc nogatavināšanas virsējo ūdeni nolej.
|
|
|
ECx
ir testējamās ķīmiskās vielas koncentrācija sedimentos, kas rada x % (piemēram, 50 %) ietekmi uz bioloģisko parametru noteiktā ekspozīcijas periodā.
|
|
|
Līdzsvarošanās periodu izmanto, lai testējamai ķīmiskajai vielai ļautu sadalīties starp cieto fāzi, poru ūdeni un virsējo ūdeni; tas notiek pēc sedimentu papildināšanas ar testējamo ķīmisko vielu un pirms testa organismu pievienošanas.
|
|
|
Ekspozīcijas fāze ir laiks, kurā testa organismi ir eksponēti testējamai ķīmiskajai vielai.
|
|
|
Pagatavotie sedimenti jeb rekonstituētie, mākslīgie vai sintētiskie sedimenti ir materiālu maisījums, ar ko atdarina dabisko sedimentu fizikālās sastāvdaļas.
|
|
|
Zemākā novērojamās ietekmes koncentrācija
(LOEC)
ir zemākā testētā testējamās ķīmiskās vielas koncentrācija, pie kuras tai ir konstatēta būtiska toksiska ietekme (pie p < 0,05) salīdzinājumā ar kontrolgrupu. Tomēr visām testa koncentrācijām, kas pārsniedz LOEC, jāuzrāda ietekme, kas ir vienāda ar ietekmi, kura novērojama pie LOEC, vai lielāka par to. Ja šos divus nosacījumus apmierināt nav iespējams, izsmeļoši jāizskaidro, kāpēc izraudzīta šāda LOEC (un attiecīgi NOEC).
|
|
|
Nenovērojamās ietekmes koncentrācija
(NOEC)
ir testējamās ķīmiskās vielas koncentrācija, kura ir tieši zem LOEC vērtības un kurai salīdzinājumā ar kontrolgrupu attiecīgajā ekspozīcijas periodā nav statistiski būtiskas ietekmes (p < 0,05).
|
|
|
Oktanola un ūdens sadalīšanās koeficients (Kow; dažkārt izsaka arī kā Pow) ir ķīmiskās vielas šķīdības n-oktanolā un ūdenī attiecība līdzsvara stāvoklī, un tas atspoguļo ķīmiskās vielas lipofilitāti (šā pielikuma A.24. nodaļa). Kow vai tā logaritmu (log Kow) izmanto par rādītāju ķīmiskās vielas bioakumulācijas potenciālam ūdens organismos.
|
|
|
Organiskā oglekļa un ūdens sadalīšanās koeficients (Koc) ir attiecība starp ķīmiskās vielas koncentrāciju sedimentu organiskā oglekļa frakcijā vai uz tās un šīs vielas koncentrāciju ūdenī līdzsvara stāvoklī.
|
|
|
Virsējais ūdens ir ūdens, ar ko testēšanas traukā nosegti sedimenti.
|
|
|
Poru ūdens jeb starpūdens ir ūdens, kas aizņem telpu starp sedimentu vai augsnes daļiņām.
|
|
|
Papildināti sedimenti ir sedimenti, kam pievienota testējamā ķīmiskā viela.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai vielu maisījums, kuru testē, izmantojot šo testēšanas metodi.
|
2. papildinājums
Ieteicamais rekonstituētā ūdens sastāvs
(aizgūts no šā pielikuma C.1. nodaļas (1))
|
a)
|
Kalcija hlorīda šķīdums
Dejonizētā ūdenī izšķīdina 11,76 g CaCl2 · 2H2O, ar dejonizētu ūdeni papildina līdz 1 l
|
|
b)
|
Magnija sulfāta šķīdums
Dejonizētā ūdenī izšķīdina 4,93 g MgSO4 · 7H2O, ar dejonizētu ūdeni papildina līdz 1 l
|
|
c)
|
Nātrija bikarbonāta šķīdums:
Dejonizētā ūdenī izšķīdina 2,59 g NaHCO3 dejonizētā ūdenī, ar dejonizētu ūdeni papildina līdz 1 l
|
|
d)
|
Kālija hlorīda šķīdums
Dejonizētā ūdenī izšķīdina 0,23 g KCl dejonizētā ūdenī, ar dejonizētu ūdeni papildina līdz 1 l
|
Visām ķīmiskajām vielām jābūt analītiski tīrām.
Destilētā vai dejonizētā ūdens vadītspēja nedrīkst pārsniegt 10 μScm– 1.
Samaisa 25 ml katra a)–d) šķīduma, un kopējo tilpumu līdz 1 l papildina ar dejonizētu ūdeni. Kalcija un magnija jonu summa šajos šķīdumos ir 2,5 mmol/l.
Ca:Mg jonu proporcija ir 4:1, bet Na:K joniem – 10:1. Šā šķīduma skābju neitralizētspēja KS4.3 ir 0,8 mmol/l.
Atšķaidīšanas ūdeni aerē, līdz sasniedz piesātinājumu ar skābekli, tad pirms izmantošanas aptuveni divas dienas glabā bez turpmākas aerācijas.
ATSAUCE
|
(1)
|
Šā pielikuma nodaļa C.1 “Akūtā toksicitāte zivīm”
|
3. papildinājums
Pieņemama atšķaidīšanas ūdens fizikālķīmiskās īpašības
|
Sastāvdaļa
|
Koncentrācijas
|
|
Daļiņas
|
< 20 mg/l
|
|
Kopējais organiskais ogleklis
|
< 2 μg/l
|
|
Nejonizēts amonjaks
|
< 1 μg/l
|
|
Atlikušais hlors
|
< 10 μg/l
|
|
Kopējie fosfororganiskie pesticīdi
|
< 50 ng/l
|
|
Kopējie hlororganiskie pesticīdi un polihlorbifenili
|
< 50 ng/l
|
|
Kopējais organiskais hlors
|
< 25 ng/l
|
|
(aizgūts no ESAO (1992) (1))
|
ATSAUCE
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
4. papildinājums
Ieteicamie mākslīgie sedimenti – pagatavošanas un glabāšanas norādījumi
Sedimentu sastāvdaļas
|
Sastāvdaļa
|
Raksturojums
|
% sedimentu saussvara
|
|
Kūdra
|
Sfagnu sūnu kūdra, sadalīšanās pakāpe: “vidēja”, gaisā žāvēta, bez redzamām augu paliekām, smalki samalta (daļiņu izmērs≤ 0,5 mm)
|
5 ± 0,5
|
|
Kvarca smiltis
|
Graudu izmērs: ≤ 2 mm, bet > 50 % daļiņu jābūt 50–200 μm diapazonā
|
75–76
|
|
Kaolīna māli
|
Kaolinīta saturs ≥ 30 %
|
20 ± 1
|
|
Barības avots
|
piemēram, nātru pulveris (Folia urticae), lielās nātres (Urtica dioica) lapas, smalki samaltas (daļiņu izmērs ≤ 0,5 mm); saskaņā ar farmācijas standartiem, lietošanai pārtikā; papildus sausiem sedimentiem
|
0,4–0,5 %
|
|
Organiskais ogleklis
|
Koriģē, pievienojot kūdru un smiltis
|
2 ± 0,5
|
|
Kalcija karbonāts
|
CaCO3, pulverveida, ķīmiski tīrs, papildus sausajiem sedimentiem
|
0,05–1
|
|
Dejonizēts ūdens
|
Vadītspēja≤ 10 μS/cm, papildus sausajiem sedimentiem
|
30–50
|
Piezīme. Ja paredzama paaugstināta amonjaka koncentrācija, piemēram, ja zināms, ka testējamā ķīmiskā viela aizkavē nitrifikāciju, varētu būt lietderīgi 50 % ar slāpekli bagātā Urtica pulvera aizstāt ar celulozi (piemēram, ar α-celulozes pulveri, kas ir ķīmisku tīrs, daļiņu izmērs ≤ 0,5 mm(1) (2)).
Pagatavošana
Kūdru izžāvē gaisā un samaļ smalkā pulverī. Vajadzīgā daudzuma kūdras pulvera suspensiju dejonizētā ūdenī sagatavo, izmantojot efektīvu homogenizēšanas ierīci. Šīs suspensijas pH ar CaCO3 koriģē līdz vērtībai 5,5 ± 0,5. Suspensiju gatavo vismaz divas dienas, viegli maisot 20 ± 2 °C temperatūrā, lai stabilizētu pH un izveidotu stabilu mikrobiālo komponenti. Vēlreiz mēra pH, kam jābūt 6,0 ± 0,5. Pēc tam kūdras suspensiju samaisa ar citām sastāvdaļām (smiltīm un kaolīna māliem) un dejonizētu ūdeni, lai iegūtu viendabīgus sedimentus ar ūdens saturu diapazonā 30–50 % no sedimentu saussvara. Vēlreiz mēra galīgā maisījuma pH un, ja nepieciešams, to ar CaCO3 koriģē līdz vērtībai 6,5–7,5. Tomēr, ja ir paredzama amonjaka producēšanās, varētu būt lietderīgi gādāt, lai sedimentu pH ir zem 7,0 (piemēram, no 6,0 līdz 6,5). Sedimentu paraugus ņem, lai noteiktu saussvaru un organiskā oglekļa saturu. Ja paredzams, ka veidosies amonjaks, pagatavotos sedimentus, pirms tos papildina ar testējamo ķīmisko vielu, septiņas dienas var nogatavināt tādos pašos apstākļos, kādus rada turpmākajam testam (piemēram, ar sedimentu un ūdens attiecību 1:4 un tādu pašu sedimentu slāņa augstumu kā testēšanas traukos) t. i., tie ir jāpārlej ar ūdeni, kuru iepriekš aerē. Nogatavināšanas perioda beigās virsējo ūdeni nolej un izlej. Pēc tam papildinātās kvarca smiltis katram apstrādes līmenim sajauc ar sedimentiem, sedimentus sadala pa replikātu testēšanas traukiem, pārlejot ar testēšanas ūdeni. Tad šos traukus inkubē tādos pašos apstākļos, kādus rada turpmākajam testam. Tajā brīdī sākas līdzsvarošanas periods. Virsējais ūdens jāaerē.
Izraudzīto barības avotu pievieno pirms sedimentu papildināšanas ar testējamo ķīmisko vielu vai tās laikā. Tos var iepriekš samaisīt ar kūdras suspensiju (sk. iepriekš). Savukārt, iespējami saīsinot periodu starp barības pievienošanu un ekspozīcijas sākumu, var novērst, ka barības avots pārlieku noārdās pirms testa organismu pievienošanas – piemēram, ilga līdzsvarošanas perioda gadījumā. Lai nodrošinātu, ka barība ir papildināta ar testējamo ķīmisko vielu, barības avots ar sedimentiem jāsajauc ne vēlāk kā dienā, kad sedimentus papildina ar testējamo ķīmisko vielu.
Glabāšana
Mākslīgo sedimentu sausās sastāvdaļas var glabāt sausā, vēsā vietā vai istabas temperatūrā. Pagatavotie ar testējamo ķīmisko vielu papildinātie sedimenti testēšanā jāizmanto uzreiz. Papildināto sedimentu paraugus konkrētajai testējamajai ķīmiskajai vielai ieteiktajos apstākļos var glabāt līdz analīzes veikšanai.
ATSAUCES
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
5. papildinājums
Lumbriculus variegatus kultivēšanas metodes
Lumbriculus variegatus (Müller), slieku dzimta (Lumbriculidae), mazsartārpu klase (Oligochaeta) apdzīvo saldūdens sedimentus, un to plaši izmanto ekotoksikoloģiskajā testēšanā. To var viegli kultivēt laboratorijas apstākļos. Turpmāk sniegts kultivēšanas metožu pārskats.
Kultivēšanas metodes
Lumbriculus variegatus kultivēšanas apstākļi ir detalizēti aprakstīti Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Turpmāk sniegts īss kopsavilkums par šiem apstākļiem. L. variegatus būtiska priekšrocība ir šīs sugas ātrā vairošanās, kas rezultējas straujā biomasas pieaugumā laboratorijā kultivētās populācijās (piemēram, (1), (3), (4), (5)).
Tārpus var kultivēt lielos akvārijos (57–80 l) 23 °C temperatūrā ar fotoperiodu 16 h gaisma: 8 h tumsa (100–1 000 lx), izmantojot ik dienas atjauninātu dabisko ūdeni (45–50 l uz vienu akvāriju). Substrātu pagatavo, nebalināta brūnā papīra dvieļus sagriežot strēmelēs, ko pēc tam var dažas sekundes sakult ar kultūras ūdeni, iegūstot nelielu papīra gabaliņu substrātu. Šo substrātu pēc tam var tieši izmantot Lumbriculus kultūras akvārijā, ar to izklājot tvertnes apakšdaļu, vai arī dejonizētā ūdenī sasaldētu glabāt vēlākai lietošanai. Ar jauno substrātu tvertnē pietiek apmēram divus mēnešus.
Katru tārpu kultūru sāk ar 500–1 000 tārpiem un trīs reizes nedēļā, nodrošinot ūdens atjaunināšanu vai caurplūdi, baro ar 10 ml suspensiju, kas satur 6 g foreļu kāpuru barības. Lai nepieļautu baktēriju un sēnīšu augšanu, statiskās vai pusstatiskās kultūrās barību dod retāk.
Šādos apstākļos īpatņu skaits kultūrā aptuveni 10 līdz 14 dienās parasti dubultojas.
Alternatīvi Lumbriculus variegatus var kultivēt arī sistēmā, kas sastāv no kvarca smilšu slāņa, ko izmanto kā mākslīgos sedimentus (1–2 cm dziļumā), un reġenerēta ūdens. Par kultivēšanas traukiem var izmantot 12 līdz 20 cm augstus stikla vai nerūsošā tērauda konteinerus. Ūdens slāni viegli aerē (piemēram, 2 burbulīši sekundē) ar Pastēra pipeti, kas novietota apmēram 2 cm virs sedimentu virskārtas. Lai izvairītos no, piem., amonjaka uzkrāšanās, virsējais ūdens jānomaina, izmantojot caurplūdes sistēmu, vai manuāli vismaz reizi nedēļā. Mazsartārpus var turēt istabas temperatūrā fotoperiodā ar 16 gaišajām stundām (intensitāte – 100–1 000 luksi) un 8 tumšajām stundām. Pusstatiskās kultūrās (ūdens atjaunināšana reizi nedēļā) tārpus divreiz nedēļā baro ar TetraMin (piemēram, 0,6–0,8 mg uz cm2 sedimentu virsmas), ko var ievadīt suspensijas veidā – 50 mg TetraMin uz ml dejonizēta ūdens.
Lumbriculus variegatus no kultūrām izņem, piemēram, uz atsevišķu vārglāzi ar smalku tīkliņu pārvietojot substrātu vai ar rūdīta stikla pipeti ar platu galu (apmēram 5 mm diametrā) – organismus. Ja pārvietošanas laikā vārglāzē nonāk substrāts, tārpus un substrātu saturošo vārglāzi pa nakti atstāj caurplūdē, kura substrātu atdalīs no vārglāzes, tārpiem paliekot trauka apakšdaļā. Pēc tam tārpus var ielaist kultivēšanas tvertnēs, kas sagatavotas no jauna, vai tālāk sagatavot testa vajadzībām, kā tas aprakstīts literatūras avotos (3) un (4) vai turpmāk.
Problēma, kas kritiski jāvērtē, sedimentu testos izmantojot L. variegatus, ir sugas vairošanās veids (piemēram, arhitomija vai morfolakse (6)). Šāda bezdzimumvairošanās rezultējas divos fragmentos, kuri kādu laiku neuzņem barību, kamēr reģenerējas galvas vai astes daļa (piem., (7), (8)). Tas nozīmē, ka L. variegatus nav barošanās ceļā pastāvīgi eksponēti piesārņotiem sedimentiem.
Tāpēc jāveic sinhronizācija, lai līdz minimumam samazinātu nekontrolētu vairošanos un reģenerēšanos un tātad augstu testēšanas rezultātu izkliedi. Šādas atšķirības var rasties tad, ja daži īpatņi, kas sadalījušies fragmentos un tādēļ noteiktu laiku neuzņem barību, testējamās ķīmiskās vielas iedarbībai ir eksponēti mazāk, nekā citi īpatņi, kas testēšanas laikā fragmentos nesadalās (9), (10), (11). 10 līdz 14 dienas pirms ekspozīcijas sākuma tārpi ir jāsadala mākslīgi (sinhronizācija). Sinhronizācijai jāizraugās lieli (pieauguši) tārpi, kam, vēlams, nav nesenas morfolakses pazīmju. Šos tārpus var novietot uz stikla priekšmetstikliņa ar pilienu kultūras ūdens, un ķermeņa vidusdaļā ar skalpeli pārdalīt uz pusēm. Jāraugās, lai pakaļgali būtu vienāda izmēra. Pēc tam pakaļgalus jaunu galvu reģenerēšanai līdz ekspozīcijas sākumam atstāj kultivēšanas traukos, kas satur tādu pašu substrātu, kāds izmantots kultūrā, un rekonstituētu ūdeni. Par jaunu galvu reģenerēšanos liecina sinhronizēto tārpu ierakšanās substrātā (reģenerēto galvu esamību var pārbaudīt, reprezentatīvu apakšparaugu apskatot binokulārā mikroskopā). Pēc tam sagaidāms, ka testa organismi būs vienādā fizioloģiskā stāvoklī. Tas nozīmē, ka, kad testēšanas laikā sinhronizētajiem tārpiem notiek morfolakses izraisītā reģenerācija, sagaidāms, ka praktiski visi dzīvnieki papildinātajiem sedimentiem bijuši eksponēti vienādā mērā. Sinhronizētie tārpi jābaro vienreiz, tiklīdz tārpi sāk ierakties substrātā vai septiņas dienas pēc to sadalīšanas. Barošanas režīmam jābūt salīdzināmam ar parastajām kultūrām, taču sinhronizētos tārpus ieteicams barot no tā paša barības avota, ko paredzēts lietot testēšanā. Tārpi jātur testēšanas temperatūrā, proti, 20 ± 2 °C. Pēc reģenerācijas testēšanā izmanto neskartus un veselus tārpus, kas pēc vieglas mehāniskas stimulēšanas aktīvi peld vai rāpo. Jānovērš tārpu savainošana vai autohtomija, piemēram, darbā ar tārpiem jāizmanto pipetes ar rūdītām malām vai nerūsošā tērauda irbulīši.
Lumbriculus variegatus sākumkultūru avoti (adreses ASV aizgūtas no (4))
|
Eiropa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Vācija
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Vācija
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Somija
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Vācija
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
ASV
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 University Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
ATSAUCES
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
6. papildinājums
Starplaboratoriju salīdzinošās testēšanas rezultātu kopsavilkums
“Sedimentu toksicitātes tests ar Lumbriculus variegatus”
1. tabula.
Atsevišķo starplaboratoriju salīdzinošās testēšanas mēģinājumu rezultāti. Vidējais tārpu skaits kontrolgrupas un šķīdinātāju kontrolgrupas paraugos testēšanas beigās; SD = standartnovirze; CV = variācijas koeficients.
|
|
Vidējais tārpu skaits kontrolgrupas paraugos
|
SD
|
CV (%)
|
n
|
Vidējais tārpu skaits šķīdinātāju kontrolgrupas paraugos
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Starplaboratoriju vidējais
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
N
|
15
|
|
|
|
15
|
|
|
|
|
min.
|
16,3
|
|
|
|
15,0
|
|
|
|
|
maks.
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
2. tabula.
Atsevišķo starplaboratoriju salīdzinošās testēšanas mēģinājumu rezultāti. Vidējais tārpu saussvars uz replikātu kontrolgrupas un šķīdinātāju kontrolgrupas paraugos testēšanas beigās; SD = standartnovirze; CV = variācijas koeficients.
|
|
Kopējais tārpu saussvars uz replikātu (kontrolgrupās)
|
SD
|
CV (%)
|
n
|
Kopējais tārpu saussvars uz replikātu (šķīdinātāju kontrolgrupās)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Starplaboratoriju vidējais
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
N
|
15
|
|
|
|
15
|
|
|
|
|
min.
|
12,9
|
|
|
|
10,5
|
|
|
|
|
maks.
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
3. tabula.
PHF toksicitāte. Kopsavilkums par beigupunktiem starplaboratoriju salīdzinošajā testēšanā; laboratoriju vidējās EC50, NOEC un LOEC vērtības; SD = standartnovirze; CV = variācijas koeficients
|
Bioloģiskais parametrs
|
|
Starplaboratoriju vidējā vērtība (mg/kg)
|
min.
|
maks.
|
Starplaboratoriju koeficients
|
SD
|
CV (%)
|
Ģeometriskais vidējais (mg/kg)
|
|
Kopējais tārpu skaits
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Kopējais tārpu saussvars
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
Mirstība/izdzīvotība
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
Vairošanās (tārpu skaita palielināšanās uz replikātu)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
Augšana (biomasas palielināšanās uz replikātu)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: minimālā nosakāmā atšķirība no kontrolgrupas vērtībām hipotēzes pārbaudē laikā; izmanto par statistiskās jaudas rādītāju
|
ATSAUCE
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the German Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 PLĒSĒJĒRCES (HYPOASPIS (GEOLAELAPS) ACULEIFER) VAIROŠANĀS TESTS AUGSNĒ
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 226 (2008). Šī testēšanas metode ir izveidota, lai izvērtētu augsnē esošu ķīmisko vielu ietekmi uz augsnes ērču sugas Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae) vairošanās rādītāju, ļaujot aplēst specifiskā populācijas augšanas ātruma inhibēšanos (1, 2). Šajā gadījumā vairošanās rādītājs nozīmē jauno īpatņu skaitu testēšanas perioda beigās. H. aculeifer pārstāv vēl vienu trofisko līmeni papildus tām sugām, kam jau ir pieejamas testēšanas metodes. Šai testēšanas metodei par pieņemamu uzskatāms vairošanās tests bez dažādo reproduktīvā cikla stadiju izšķiršanas un kvantifikācijas. Ja eksponētība ķīmiskajām vielām nerodas ar augsnes starpniecību, var būt piemērotas citas pieejas (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer uzskata par reprezentatīvu augsnes faunas un konkrēti plēsējērču pārstāvi. Tā ir izplatīta visā pasaulē (5), un to ir viegli ievākt un izaudzēt laboratorijā. H. aculeifer bioloģiskās informācijas kopsavilkums ir sniegts 7. papildinājumā. Pamatinformācija par ērču sugu ekoloģiju un izmantošanu ekotoksikoloģiskajos pētījumos ir pieejama avotos (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
TESTĒŠANAS PRINCIPS
|
3.
|
Pieaugušas mātītes noteiktā koncentrāciju diapazonā eksponē testējamai ķīmiskajai vielai, ko iejauc augsnē. Testēšanu sāk ar 10 pieaugušām mātītēm uz replikāttrauku. Tēviņus testēšanā neizmanto, jo pieredze liecina, ka mātītes pārojas uzreiz vai neilgi pēc izšķilšanās no deitonimfas stadijas, ja ir pieejami tēviņi. Turklāt tēviņu iekļaušana paildzinātu testēšanas ilgumu tādā mērā, ka kļūtu nepieciešams izšķirt dažādus vecumposmus. Līdz ar to pārošanās testā neietilpst. Mātītes iekļauj testā 28–35 dienas pēc olu dēšanas perioda sākuma sinhronizācijā (sk. 4. papildinājumu), jo tad var uzskatīt, ka mātītes ir jau pārojušās un izgājušas stadiju pirms olu dēšanas. 20 °C temperatūrā testēšana beidzas 14. dienā pēc mātīšu iekļaušanas (0. dienā), kas ļauj pirmajai pēcnācēju kontrolgrupai sasniegt deitonimfu stadiju (sk. 4. papildinājumu). Kā galveno mērīto mainīgo nosaka jauno īpatņu skaitu testēšanas traukos un papildus arī izdzīvojušo mātīšu skaitu. Testējamai ķīmiskajai vielai eksponēto ērču vairošanās rādītāju salīdzina ar to pašu rādītāju kontrolgrupās, lai noteiktu ECx (piemēram, EC10, EC50) vai nenovērojamās ietekmes koncentrāciju (sk. definīcijas 1. papildinājumā) – atkarībā no eksperimenta plāna (sk. 29. punktu). Testēšanas grafika pārskats ir sniegts 8. papildinājumā.
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
4.
|
Vēlams zināt testējamās ķīmiskās vielas šķīdību ūdenī, log Kow, augsnes/ūdens sadalīšanās koeficientu un tvaika spiedienu. Ir vēlama papildu informācija par testējamās ķīmiskās vielas apriti augsnē, piemēram, biotiskās un abiotiskās sadalīšanās ātrumu.
|
|
5.
|
Šo testa metodi var izmantot ūdenī šķīstošām un nešķīstošām ķīmiskajām vielām. Tomēr attiecīgi atšķirsies arī testējamās ķīmiskās vielas ievadīšanas veids. Šī testēšanas metode nav izmantojama nedz gaistošām ķīmiskajām vielām, t. i., ķīmiskajām vielām, kurām Henrija konstante vai gaisa/ūdens sadalījuma koeficients ir lielāks nekā viens, nedz arī ķīmiskajām vielām, kuru tvaika spiediens pārsniedz 0,0133 Pa 25 °C temperatūrā.
|
TESTA DERĪGUMS
|
6.
|
Lai testa rezultāts būtu uzskatāms par derīgu, neapstrādātajās kontrolgrupās ir jābūt izpildītiem šādiem kritērijiem:
|
—
|
testēšanas beigās vidējā pieaugušo mātīšu mirstība nedrīkst pārsniegt 20 %;
|
|
—
|
testēšanas beigās vidējam jauno īpatņu skaitam uz replikātu (ja sākumā iekļautas 10 pieaugušas mātītes) vajadzētu būt vismaz 50;
|
|
—
|
vidējā jauno ērču skaita uz replikātu variācijas koeficients galīgā testa beigās nedrīkst pārsniegt 30 %.
|
|
ĶĪMISKĀ STANDARTVIELA
|
7.
|
Jānosaka ķīmiskās standartvielas NOEC un/vai ECx, lai nodrošinātu to, ka laboratorijas testa apstākļi ir piemēroti, un lai pārliecinātos, ka testējamo organismu reakcija laika gaitā nemainījās. Piemērota ķīmiskā standartviela ar pierādītu ietekmi uz populācijas lielumu (4) ir dimetoāts (CAS Nr. 60-51-5). Par alternatīvu ķīmisko standartvielu var izmantot borskābi (CAS Nr.: 10043-35-3). Ar šo ķīmisko vielu ir mazāka pieredze. Ir iespējami divi plāna varianti.
|
—
|
Ķīmisko standartvielu var testēt paralēli katras testējamās ķīmiskās vielas toksicitātes noteikšanai vienā koncentrācijā, kas, kā iepriekš pierādīts devas–atbildreakcijas pētījumā, ietekmē pēcnācēju skaita samazināšanos par > 50 %. Šajā gadījumā replikātu skaitam vajadzētu būt tādam pašam kā kontrolgrupā (sk. 29. punktu).
|
|
—
|
Alternatīvi ķīmisko standartvielu testē 1 – 2 reizes gadā devas–atbildreakcijas testā. Atkarībā no izraudzītā plāna koncentrāciju un replikātu skaits un kvocients, par kādu pieaug katra nākamā koncentrācija, atšķiras (sk. 29. punktu), taču būtu jāpanāk 10 – 90 % ietekme (kvocients – 1,8). Dimetoāta EC50, pamatojoties uz jauno īpatņu skaitu, vajadzētu būt robežās no 3,0 līdz 7,0 mg/kg augsnes (saussvara). Pamatojoties uz līdz šim iegūtajiem rezultātiem ar borskābi, EC50, kura pamatā ir jauno īpatņu skaits, vajadzētu būt robežās no 100 līdz 500 mg/kg augsnes saussvara.
|
|
TESTA APRAKSTS
Testēšanas trauki un aprīkojums
|
8.
|
Būtu jāizmanto no stikla vai cita ķīmiski inerta materiāla testēšanas trauki 3 – 5 cm diametrā (augsnes līmenis ≥ 1,5 cm), ar ciešu, piegulošu vāku. Priekšroka dodama uzskrūvējamiem vākiem, un tādā gadījumā trauki jāvēdina divas reizes nedēļā. Alternatīvi var izmantot pārklājus, kas dara iespējamu tiešu gāzu apmaiņu starp substrātu un atmosfēru (piemēram, marle). Tā kā testēšanas laikā ir jāuztur pietiekami augsts mitruma līmenis, testēšanas laikā ir būtiski kontrolēt katra eksperimenta trauka svaru un, ja nepieciešams, atjaunināt ūdens saturu. Tas ir īpaši svarīgi, ja nav pieejami uzskrūvējami vāki. Ja izmanto necaurspīdīgu testēšanas trauku, vākam vajadzētu būt izgatavotam no materiāla, kas ļauj iekļūt gaismai (piemēram, perforētam, caurspīdīgam vākam), vienlaikus neļaujot ērcēm izkļūt no trauka. Testēšanas trauku izmērs un tips ir atkarīgs no ekstrakcijas metodes (sīkāku informāciju sk. 5. papildinājumā). Ja testēšanas traukus ekstrakcijai ar karstumu pakļauj tieši, var pievienot apakšas sietu ar piemērotu acu lielumu (noslēgtu līdz ekstrakcijai) un augsnes dziļumam vajadzētu būt pietiekamam, lai nodrošinātu temperatūras un mitruma gradientu.
|
|
9.
|
Nepieciešams laboratorijas standartaprīkojums, jo īpaši:
|
—
|
vēlams – stikla trauki ar uzskrūvējamiem vākiem;
|
|
—
|
pH mērītājs un luksometrs;
|
|
—
|
piemēroti, precīzi svari;
|
|
—
|
piemērota temperatūras kontroles ierīce;
|
|
—
|
piemērota gaisa mitruma kontroles ierīce (nav obligāta, ja ekspozīcijas traukiem ir vāki);
|
|
—
|
inkubators vai neliela telpa ar regulējamu temperatūru;
|
|
—
|
ekstrakcijas aprīkojums (sk. 5. papildinājumu) (13);
|
|
—
|
augšā novietots gaismas panelis ar regulējamu gaismu;
|
|
—
|
burkas ekstrahēto ērču ievākšanai.
|
|
Mākslīgās augsnes sagatavošana
|
10.
|
Šim testam izmanto mākslīgo augsni. Mākslīgā augsne sastāv no šādām sastāvdaļām (visas vērtības norādītas sausmasai):
|
—
|
5 % sfagnu kūdras, gaisžāvētas un smalki samaltas (daļiņu izmērs 2 ± 1 mm ir pieņemams);
|
|
—
|
20 % kaolīna mālu (kaolinīta saturam vēlams būt virs 30 %);
|
|
—
|
apmēram 74 % gaisžāvētu rūpniecisko smilšu (atkarībā no nepieciešamā CaCO3 daudzuma), lielākoties smalku smilšu, kas vairāk nekā par 50 % sastāv no daļiņām ar izmēru 50 līdz 200 mikroni. Faktiskais smilšu daudzums ir atkarīgs no CaCO3 daudzuma (sk. zemāk), kopā tām vajadzētu sastādīt 75 %;
|
|
—
|
< 1,0 % kalcija karbonāta (CaCO3, pulverizēts, analītiskās tīrības pakāpes), lai iegūtu pH 6,0 ± 0,5; pievienojamā kalcija karbonāta daudzums galvenokārt atkarīgs no kūdras kvalitātes/sastāva (sk. 1. piezīmi).
|
1. piezīme. Nepieciešamais CaCO3 daudzums būs atkarīgs no augsnes substrāta sastāvdaļām, un tas būtu jānosaka ar augsnes apakšparaugu pH mērījumiem tieši pirms testēšanas (14).
2. piezīme. Kūdras saturs mākslīgajā augsnē atšķiras no citās augsnes organismu testēšanas metodēs lietotā, kad vairumā gadījumu izmanto 10 % kūdras (piemēram, (15)). Tomēr saskaņā ar EPPO (16) tipiskā lauksaimniecības augsnē nav vairāk kā 5 % organisko vielu, un kūdras satura samazinājums atspoguļo samazināto iespējamību, ka notiks testējamās ķīmiskās vielas sorbcija organiskajā ogleklī dabiskā augsnē.
3. piezīme. Ja nepieciešams, piemēram, specifiskiem testēšanas nolūkiem, par testēšanas un/vai kultūras substrātu var izmantot arī dabiskas augsnes no nepiesārņotām vietām. Tomēr, ja izmanto dabisku augsni, tā būtu jāraksturo vismaz pēc izcelsmes (ievākšanas vietas), pH, tekstūras (daļiņu izmēra sadalījuma) un organisko vielu satura. Ja zināms, būtu jāiekļauj augsnes tips un nosaukums saskaņā ar augšņu klasifikāciju, un augsne nedrīkst būt kontaminēta. Ja testējamā ķīmiskā viela ir metāls vai metālorganisks savienojums, būtu jānosaka arī dabīgās augsnes katjonu apmaiņas kapacitāte (KAK). Īpaša vērība jāpievērš derīguma kritēriju izpildei, jo pamatinformācija par dabiskām augsnēm parasti ir pieejama reti.
|
|
11.
|
Augsnes sausās sastāvdaļas rūpīgi samaisa (piemēram, liela izmēra laboratorijas maisītājā). pH noteikšanā izmanto augsnes un 1 M kālija hlorīda (KCl) vai 0,01 M kalcija hlorīda (CaCl2) šķīduma maisījumu attiecībā 1:5 (sk. (14) un 3. papildinājumu). Ja augsnes skābums pārsniedz vajadzīgo diapazonu (sk. 10. punktu), to var koriģēt, pievienojot atbilstošu daudzumu CaCO3. Ja augsne ir pārāk sārmaina, to var koriģēt, pievienojot vairāk maisījuma, kas satur pirmās trīs 10. punktā minētās sastāvdaļas, bet izlaižot CaCO3.
|
|
12.
|
Mākslīgās augsnes maksimālo ūdensnoturspēju (WHC) nosaka saskaņā ar 2. papildinājumā aprakstītajām procedūrām. Divas līdz septiņas dienas pirms testa sākšanas sauso mākslīgo augsni iepriekš samitrina, pievienojot pietiekami daudz destilēta vai dejonizēta ūdens, lai iegūtu apmēram pusi galīgā ūdens satura, kas ir 40 līdz 60 % maksimālās ūdensnoturspējas. Mitruma saturs tiek pielāgots 40–60 % maksimālās WHC, pievienojot testējamās ķīmiskās vielas šķīdumu un/vai destilētu vai dejonizētu ūdeni (sk. 16.–18. punktu). Augsnes mitruma saturu vajadzētu aptuveni pārbaudīt, maigi saspiežot augsni rokās; ja mitruma saturs ir pareizs, starp pirkstiem jāparādās sīkiem ūdens pilieniem.
|
|
13.
|
Augsnes mitruma saturu nosaka testēšanas sākumā un beigās, to izžāvējot līdz konstantam svaram 105 °C temperatūrā saskaņā ar ISO 11465 (17), bet augsnes pH – saskaņā ar 3. papildinājumu vai ISO 10390 (14). Šie mērījumi jāveic papildu paraugos bez ērcēm – gan kontrolgrupas augsnes paraugā, gan katras testējamās koncentrācijas augsnes paraugā. Augsnes pH nedrīkst pielāgot, ja tiek testētas skābas vai bāziskas ķīmiskās vielas. Mitruma saturs jāmonitorē visu testēšanas laiku, traukus periodiski nosverot (sk. 20. un 24. punktu).
|
Testējamo dzīvnieku izvēle un sagatavošana
|
14.
|
Šajā testā izmanto sugu Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883) Testam ir vajadzīgas pieaugušas mātītes, kas iegūtas no sinhronizētas kohortas. Mātītes ievieto testa traukos apmēram 7–14 dienas pēc tam, kad tās ir sasniegušas pieaugušo stadiju, 28 – 35 dienas pēc tam, kad sākusies olu dēšana sinhronizācijā (sk. 3. punktu un 4. papildinājumu). Jāreģistrē ērču izcelsme vai piegādātājs un laboratorijas kultūras uzturēšana. Ja tiek uzturēta laboratorijas kultūra, vismaz reizi gadā ir ieteicams noteikt piederību pie sugas. Piederības noteikšanas lapa ir iekļauta 6. papildinājumā.
|
Testējamo koncentrāciju sagatavošana
|
15.
|
Testējamo ķīmisko vielu iejauc augsnē. Organiskie šķīdinātāji, ko izmanto, lai veicinātu augsnes apstrādi ar testējamo ķīmisko vielu, būtu jāizvēlas, pamatojoties uz to zemo toksicitāti ērcēm, un testēšanas plānā jāiekļauj attiecīga šķīdinātāja kontrolgrupa (sk. 29. punktu).
|
Ūdenī šķīstoša testējamā ķīmiskā viela
|
16.
|
Pagatavo testējamās ķīmiskās vielas šķīdumu dejonizētā ūdenī daudzumā, kas ir pietiekams visiem vienas testējamās koncentrācijas replikātiem. Ieteicams izmantot atbilstošu ūdens daudzumu, lai panāktu nepieciešamo mitruma saturu, t. i., 40–60 % maksimālās ūdensnoturspējas (sk. 12. punktu). Katru testējamās ķīmiskās vielas šķīdumu pirms iemaisīšanas testēšanas traukā rūpīgi sajauc ar vienu partiju iepriekš samitrinātas augsnes.
|
Ūdenī nešķīstoša testējamā ķīmiskā viela
|
17.
|
Ja ķīmiskā viela nešķīst ūdenī, bet šķīst organiskajos šķīdinātājos, testējamo ķīmisko vielu var izšķīdināt mazākajā iespējamā piemērotas nesējvielas (piemēram, acetona) tilpumā. Būtu jāizmanto tikai gaistoši šķīdinātāji. Kad izmanto tādas nesējvielas, visiem testējamās koncentrācijas un kontrolgrupas paraugiem jāsatur vienāds minimālais nesējvielas daudzums. Nesējvielu iesmidzina vai iejauc nelielā daudzumā (piemēram, 10 g) smalku kvarca smilšu. Substrāta kopējais smilšu saturs jākoriģē atbilstoši šim daudzumam. Nesējvielu iztvaicē, vismaz vienu stundu turot trauku velkmes skapī. Šo kvarca smilšu un testējamās ķīmiskās vielas maisījumu pievieno iepriekš samitrinātai augsnei un rūpīgi samaisa ar atbilstošu daudzumu dejonizēta ūdens, lai iegūtu nepieciešamo mitruma saturu. Galīgo maisījumu ievieto testēšanas traukos. Ņemiet vērā, ka daži šķīdinātāji var būt ērcēm toksiski. Tāpēc ir ieteicams izmantot papildu ūdens kontrolgrupu bez nesējvielas, ja nav zināms, vai šķīdinātājs ir toksisks ērcēm. Ja ir adekvāti pierādīts, ka šķīdinātājam (lietotam paredzētajās koncentrācijās) nav nekādas ietekmes, var izslēgt ūdens kontrolgrupu.
|
Ūdenī un organiskajos šķīdinātājos mazšķīstoša testējamā ķīmiskā viela
|
18.
|
Ja ķīmiskā viela vāji šķīst ūdenī un organiskajos šķīdinātājos, 2,5 g smalki samaltu kvarca smilšu uz katru testēšanas trauku (piemēram, 10 g smalku kvarca smilšu četriem replikātiem) samaisa ar tādu testējamās ķīmiskās vielas daudzumu, lai tiektu iegūta vēlamā testējamā koncentrācija. Substrāta kopējais smilšu saturs būtu jākoriģē atbilstoši šim daudzumam. Šo kvarca smilšu un testējamās ķīmiskās vielas maisījumu pievieno iepriekš samitrinātai augsnei un rūpīgi samaisa ar atbilstošu daudzumu dejonizēta ūdens, lai iegūtu nepieciešamo mitruma saturu. Galīgo maisījumu sadala pa testēšanas traukiem. Procedūru atkārto katrai testējamajai koncentrācijai un sagatavo arī atbilstošus kontroles paraugus.
|
PROCEDŪRA
Testa grupas un kontrolgrupas
|
19.
|
Katrā kontrolgrupas un apstrādes traukā ieteicamas desmit pieaugušas mātītes uz 20 g mākslīgās augsnes sausās masas. Testējamie organismi jāpievieno divu stundu laikā pēc galīgā testa substrāta sagatavošanas (t. i., pēc testējamās vielas ievadīšanas). Specifiskos gadījumos (piemēram, ja nogatavināšanu uzskata par nosakošu faktoru) laiku no galīgā testējamā substrāta sagatavošanas līdz ērču pievienošanai var pagarināt (sīkāku informāciju par šādu nogatavināšanu sk. avotā (18)). Tomēr šādos gadījumos ir jāsniedz zinātnisks pamatojums.
|
|
20.
|
Pēc ērču pievienošanas augsnei ērces apgādā ar barību un mēra katra testējamā trauka sākotnējo svaru, ko izmantos par atsauces svaru augsnes mitruma satura monitorēšanai visā testēšanas laikā, kā aprakstīts 24. punktā. Tad testēšanas traukus aizver, kā aprakstīts 8. punktā, un ievieto testēšanas kamerā.
|
|
21.
|
Katrai testējamās ķīmiskās vielas ievadīšanas metodei, kas aprakstīta 15. līdz 18. punktā, sagatavo piemērotus kontrolparaugus. Sagatavojot kontrolparaugus, ievēro attiecīgās aprakstītās procedūras, izņemot to, ka nepievieno testējamo ķīmisko vielu. Tas nozīmē, ka attiecīgos gadījumos organiskos šķīdinātājus, kvarca smiltis un citas nesējvielas kontrolgrupas paraugiem pievieno tādās pašās koncentrācijās/daudzumos kā apstrādes paraugos. Ja testējamās ķīmiskās vielas pievienošanai izmanto šķīdinātāju vai citu nesējvielu un nav zināms šķīdinātāja toksiskums, jāsagatavo un jānotestē arī papildu kontrolparaugs bez nesējvielas vai testējamās ķīmiskās vielas (sk. 17. punktu).
|
Testēšanas apstākļi
|
22.
|
Testēšanas temperatūrai jābūt 20 ± 2 °C. Temperatūra jāreģistrē vismaz reizi dienā un jākoriģē, ja nepieciešams. Testu veic kontrolētos gaismas un tumsas ciklos (vēlams 16 stundas gaismas un 8 stundas tumsas) pie 400 līdz 800 luksu apgaismojuma testēšanas trauku tuvumā. Salīdzināšanas apsvērumu dēļ šie apstākļi ir tādi paši kā citos augsnes ekotoksikoloģiskajos testos (piemēram, (15)).
|
|
23.
|
Ja izmanto uzskrūvējamus vākus, jānodrošina gāzu apmaiņa, vēdinot testēšanas traukus vismaz divreiz nedēļā. Ja izmanto marles pārklājus, jāpievērš īpaša vērība augsnes mitruma satura uzturēšanai (sk. 8. un 24. punktu).
|
|
24.
|
Augsnes substrāta ūdens saturu testēšanas traukos uztur visā testēšanas laikā, testēšanas traukus regulāri pārsverot un, ja nepieciešams, rehidrējot (piemēram, reizi nedēļā). Zudumus pēc vajadzības kompensē ar dejonizētu ūdeni. Testēšanas laikā mitruma saturam no sākotnējās vērtības nevajadzētu atšķirties par vairāk nekā 10 %.
|
Barošana
|
25.
|
Ir pierādīts, ka piemērots barības avots ir Tyrophagus putrescentiae (Schrank, 1781). Piemērotas var būt arī mazas lēcastes (piemēram, jaunas Folsomia candida, Willem,1902) vai Onychiurus fimatus (19), (20), sīksliekas (piemēram, Enchytraeus crypticus, Westheide & Graefe, 1992) vai nematodes (piemēram, Turbatrix silusiae de Man, 1913) (21). Ir ieteicams barību pirms izmantošanas testā pārbaudīt. Barības tipam un daudzumam būtu jānodrošina pietiekams jauno īpatņu skaits, lai varētu izpildīt derīguma kritērijus (6. punkts). Izvēloties barības avotu, jāņem vērā testējamās vielas iedarbības veids (piemēram, akaricīds var būt toksisks arī pārtikas ērcēm, sk. 26. punktu).
|
|
26.
|
Barība jānodrošina ad libitum (t. i., katru reizi nelielā apmērā (piemēram, lāpstiņas gals)). Šim nolūkam var izmantot arī mazjaudīgu atsūcēju, kā ieteikts lēcastu testā, vai smalku krāsas otu. Barošana testēšanas sākumā un divas līdz trīs reizes nedēļā parasti ir pietiekama. Ja izrādās, ka testējamā ķīmiskā viela ir toksiska barības avotam, būtu jāapsver biežāka barošana un/vai alternatīvs barības avots.
|
Testēšanas koncentrāciju izvēle
|
27.
|
Attiecīgas testēšanas koncentrācijas izvēlē vajadzētu izmantot iepriekšējas zināšanas par testējamās ķīmiskās vielas toksicitāti, piemēram, no diapazona noteikšanas testiem. Ja nepieciešams, veic diapazona noteikšanas testu ar piecām testējamās ķīmiskās vielas koncentrācijām no 0,1 līdz 1 000 mg/kg sausās augsnes – ar vismaz vienu apstrādes replikātu un kontrolreplikātu. Diapazona noteikšanas testa ilgums ir 14 dienas, pēc kā tiek noteikta pieaugušo ērču mirstība un jauno īpatņu skaits. Koncentrāciju diapazonu galīgajā testā vēlams izvēlēties tā, ka tas aptver koncentrācijas, kas ietekmē jauno īpatņu skaitu, bet ne mātīšu paaudzes izdzīvotību. Tas tomēr var nebūt iespējams tādu ķīmisko vielu gadījumā, kas izraisa letālu un subletālu ietekmi gandrīz vienādās koncentrācijās. Testā iekļautajām koncentrācijām būtu jāatver ietekmes koncentrācija (piemēram, EC50, EC25, EC10) un koncentrāciju diapazons, kurā tiek pētīta testējamās ķīmiskās vielas ietekme. Datu ekstrapolēšana ievērojami zem mazākās koncentrācijas, kas ietekmē testējamos organismus, vai virs augstākās testētās koncentrācijas jāveic tikai izņēmuma gadījumos, un pārskatā jāiekļauj pilnīgs paskaidrojums.
|
Eksperimentālais plāns
Devas–atbildreakcijas testi
|
28.
|
Pamatojoties uz vēl vienas starplaboratoriju salīdzinošās testēšanas (sīkslieku vairošanās testa (22)) rekomendācijām, tiek piedāvāti trīs testa plāni. Visu šo plānu vispārējā piemērotību apstiprināja H. aculeifer validācijas iznākums.
|
|
29.
|
Nosakot koncentrāciju diapazonu, būtu jāpatur prātā turpmākais.
|
—
|
ECx (piemēram, EC10, EC50) noteikšanai būtu jātestē divpadsmit koncentrācijas. Katrai testējamajai koncentrācijai ieteicami vismaz divi replikāti, kā arī vēl seši kontrolreplikāti. Kvocients var atšķirties, t. i., tas var būt mazāks vai vienāds ar 1,8 paredzamajā ietekmes diapazonā un lielāks nekā 1,8 augstākām vai zemākām koncentrācijām.
|
|
—
|
NOEC noteikšanai būtu jāizmanto vismaz piecas koncentrācijas ģeometriskā progresijā. Katrai testējamajai koncentrācijai ieteicami četri replikāti, kā arī vēl astoņi kontrolreplikāti. Katrai nākamajai koncentrācijai būtu jābūt ne vairāk kā 2,0 reizes lielākai nekā iepriekšējai.
|
|
—
|
Kombinēta pieeja ļauj noteikt gan NOEC, gan ECx. Būtu jāizmanto astoņas apstrādes koncentrācijas ģeometriskā progresijā. Katrai apstrādei ieteicami četri replikāti, kā arī vēl astoņi kontrolreplikāti. Katrai nākamajai koncentrācijai būtu jābūt ne vairāk kā 1,8 reizes lielākai nekā iepriekšējai.
|
|
Robežtests
|
30.
|
Ja diapazona noteikšanas testā pie augstākās koncentrācijas (t. i., 1 000 mg/kg augsnes sausmasas) nenovēro nekādu ietekmi, galīgo vairošanās testu var veikt kā robežtestu, izmantojot 1 000 mg/kg augsnes sausmasas. Robežtests sniegs iespēju pierādīt, ka vairošanās NOEC vai EC10 ir lielāka nekā robežkoncentrācija, vienlaikus samazinot testā izmantojamo ērču skaitu līdz minimumam. Gan apstrādātajai augsnei, gan kontrolgrupai vajadzīgi astoņi replikāti.
|
Testēšanas ilgums un mērījumi
|
31.
|
Jebkādas novērotās atšķirības ērču uzvedībā un morfoloģijā starp kontrolgrupas un apstrādes traukiem būtu jāreģistrē.
|
|
32.
|
14. dienā izdzīvojušās ērces ekstrahē no augsnes ar karstuma/gaismas ekstrakciju vai citu piemērotu metodi (sk. 5. papildinājumu). Atsevišķi saskaita jaunos īpatņus (t. i., kāpurus, protonimfas un deitonimfas) un pieaugušos īpatņus. Visas pieaugušās ērces, kas šajā laikā netiek atrastas, ir reģistrējamas kā mirušas, jo tiek pieņemts, ka šādas ērces ir mirušas un sadalījušās pirms novērtēšanas. Ekstrakcijas efektivitāte vienreiz vai divreiz gadā jāvalidē kontrolgrupas paraugos ar zināmu pieaugušo un jauno īpatņu skaitu. Efektivitātei vajadzētu būt vidēji virs 90 % visām attīstības stadijām kopā (sk. 5. papildinājumu). Pieaugušo un jauno īpatņu skaitu nekoriģē atbilstoši efektivitātei.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
33.
|
Informācija par statistiskajām metodēm, ko var izmantot testēšanas rezultātu analīzē, ir sniegta 36. līdz 41. punktā. Papildus būtu jāizmanto ESAO 54. dokuments “Pašreizējās pieejas ekotoksicitātes datu statistiskajai analīzei: lietošanas norādījumi” (31).
|
|
34.
|
Testa galvenais beigupunkts ir vairošanās iznākums – šajā gadījumā izšķīlušos jauno īpatņu skaits uz replikāttrauku (ar 10 sākumā ievietotajām mātītēm). Statistiskajai analīzei nepieciešams vairošanās rādītāja aritmētiskais vidējais (X) un dispersija (s2), lai aprēķinātu iznākumu apstrādes un kontrolgrupas paraugos. X un s2 izmanto ANOVA procedūrās, piemēram, Stjūdenta t-testā, Daneta testā vai Viljamsa testā, kā arī 95 % ticamības intervālu noskaidrošanai.
Piezīme. Šis galvenais beigupunkts ir līdzvērtīgs auglībai, ko mēra kā dzīvo jauno īpatņu skaitu, kas izšķīlušies testēšanas laikā, dalītu ar testa sākumā ievietoto mātīšu skaitu.
|
|
35.
|
Izdzīvojušo mātīšu skaits neapstrādātajos kontrolgrupas paraugos ir svarīgs derīguma kritērijs, un tas ir jādokumentē. Tāpat kā diapazona noteikšanas testā, galīgajā pārskatā ir jāiekļauj arī visas citas kaitējuma pazīmes.
|
ECx
|
36.
|
ECx vērtības, tostarp tās, kas saistītas ar zemāko un augstāko 95 % ticamības robežvērtību parametriem, kas aprakstīti 34. punktā, aprēķina, izmantojot atbilstošas statistiskās metodes (piemēram, probita analīzi, logistisko vai Veibula funkciju, saīsināto Spīrmena–Kerbera metodi vai vienkāršu interpolāciju). ECx iegūst, iegūtajā vienādojumā ievietojot vērtību, kas atbilst x % kontrolgrupas vidējās vērtības. Lai aprēķinātu EC50 vai jebkādu citu ECx, pirms apstrādes vidējā vērtība (X) būtu jāpakļauj regresijas analīzei.
|
NOEC/LOEC
|
37.
|
Ja statistiskā analīze ir paredzēta NOEC/LOEC noteikšanai, ir nepieciešama statistika par katru trauku (atsevišķos traukus uzskata par replikātiem). Būtu jāizmanto piemērotas statistiskās metodes (saskaņā ar ESAO 54. dokumentu Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application). Testējamās vielas nelabvēlīgo ietekmi salīdzinājumā ar kontrolgrupu pētī, izmantojot vienpusēju (mazāku) hipotēzes pārbaudi pie p ≤ 0,05. Piemēri ir sniegti turpmākajos punktos.
|
|
38.
|
Datu normālsadalījumu var pārbaudīt, piemēram, ar Kolmogorova–Smirnova atbilstības testu, diapazona un standartnovirzes attiecības testu (R/s testu) vai Šapiro–Vilka testu (divpusēju, p ≤ 0,05). Dispersijas homogenitāti var pārbaudīt Kohreina testu, Levena testu vai Bartleta testu (divpusēju, p ≤ 0,05). Ja parametriskās testēšanas procedūras priekšnosacījumi (normalitāte, dispersijas homogenitāte) ir izpildīti, var veikt vienpusēju dispersijas analīzi (ANOVA) un turpmākus daudzpusējas salīdzināšanas testus. Daudzpusējos salīdzinājumus (piemēram, Daneta testu) vai descendentus trenda testus (piemēram, Viljamsa testu monotonas devas un atbildreakcijas sakarības gadījumā) var izmantot, lai aprēķinātu, vai pastāv būtiskas atšķirības (≤ 0,05) starp kontrolēm un dažādām testējamās vielas koncentrācijām (ieteicamā testa izvēle atbilstoši ESAO 54. dokumentam Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application). Citos gadījumos NOEC un LOEC noteikšanai jāizmanto neparametriskās metodes (piemēram, Bonferoni U-tests pēc Holma vai Džonkhīra–Terpstras trenda tests).
|
Robežtests
|
39.
|
Ja ir veikts robežtests (kontrolgrupas un tikai vienas apstrādes salīdzinājums) un ir izpildīti parametrisko testēšanas procedūru priekšnosacījumi (normalitāte, homogenitāte), metriskās atbildreakcijas var izvērtēt ar Stjūdenta testu (t-testa). Ja šie priekšnosacījumi nav izpildīti, var izmantot nevienlīdzīgas dispersijas t-testu (Velča t-testu) vai neparametrisku testu, piemēram, Manna–Vitnija U-testu.
|
|
40.
|
Lai noteiktu būtiskas atšķirības starp kontrolgrupām (kontrolgrupu un šķīdinātāja kontrolgrupu), katras kontrolgrupas replikātus var testēt, kā aprakstīts attiecībā uz robežtestu. Ja šajos testos netiek atklātas būtiskas atšķirības, visus kontrolgrupas un šķīdinātāja kontrolgrupas replikātus var apkopot. Citādi visas apstrādes grupas jāsalīdzina ar šķīdinātāja kontrolgrupu.
|
Testēšanas pārskats
|
41.
|
Testēšanas pārskatā jāiekļauj šāda informācija.
|
—
|
Testējamā ķīmiskā viela:
|
—
|
testējamās ķīmiskās vielas identitāte, nosaukums, partija, sērija, CAS numurs un tīrība;
|
|
—
|
testējamās ķīmiskās vielas īpašības (piemēram, log Kow, šķīdība ūdenī, tvaika spiediens, Henrija konstante (H) un – vēlams – informācija par tās apriti augsnē).
|
|
|
—
|
Testa organismi:
|
—
|
testa organismu identifikācija un piegādātājs, kultivēšanas apstākļu apraksts;
|
|
—
|
testa organismu vecuma diapazons.
|
|
|
—
|
Testēšanas apstākļi:
|
—
|
eksperimenta plāna un procedūras apraksts;
|
|
—
|
testējamās augsnes sagatavošanas apraksts; sīka specifikācija, ja izmanto dabisku augsni (izcelsme, vēsture, daļiņu izmēra sadalījums, pH, organisko vielu saturs un augsnes klasifikācija, ja zināma);
|
|
—
|
augsnes maksimālā ūdensnoturspēja;
|
|
—
|
testējamās ķīmiskās vielas ievadīšanai augsnē izmantotā paņēmiena apraksts;
|
|
—
|
testējamās ķīmiskās vielas ievadīšanai izmantoto ķīmisko palīgvielu apraksts;
|
|
—
|
testēšanas trauku lielums un testējamās augsnes sausmasa uz trauku;
|
|
—
|
testēšanas apstākļi: gaismas intensitāte, gaismas un tumsas ciklu ilgums, temperatūra;
|
|
—
|
barošanas režīma apraksts; testā izmantotās barības veids un daudzums; barošanas datumi;
|
|
—
|
augsnes pH un ūdens saturs testēšanas sākumā un laikā (kontrolgrupā un katrā apstrādes grupā);
|
|
—
|
sīks ekstrakcijas metodes un ekstrakcijas efektivitātes apraksts.
|
|
|
—
|
Testa rezultāti:
|
—
|
katrā testēšanas traukā noteikto jauno īpatņu skaits testēšanas beigās;
|
|
—
|
pieaugušo mātīšu skaits un pieaugušo mirstība ( %) katrā testēšanas traukā testēšanas beigās;
|
|
—
|
acīmredzamu simptomu vai uzkrītošu uzvedības izmaiņu apraksts;
|
|
—
|
rezultāti, kas iegūti ar ķīmisko standartvielu;
|
|
—
|
statistikas (ECx un/vai NOEC) kopsavilkums, tostarp 95 % ticamības robežas un aprēķina metodes apraksts;
|
|
—
|
koncentrācijas un atbildreakcijas sakarības grafisks attēlojums;
|
|
—
|
atkāpes no procedūrām, kas aprakstītas šajā testēšanas metodē, un jebkādi neraksturīgi notikumi testēšanas laikā.
|
|
|
LITERATŪRA
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: p 241-249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
(8)
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests – Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. Eds. SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(15)
|
Šā pielikuma C.8 nodaļa “Toksicitāte sliekām”.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Šā pielikuma C.32. nodaļa “Sīkslieku vairošanās tests”.
|
|
(23)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
(25)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
(26)
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with “good genes” in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
1. papildinājums
Definīcijas
Šai testēšanas metodei ir piemērojamas šādas definīcijas (visas ietekmes koncentrācijas šajā testā tiek izteiktas kā testējamās ķīmiskās vielas masas un testa augsnes sausmasas attiecība).
|
|
Ķīmiskā viela ir viela vai vielu maisījums.
|
|
|
NOEC
(nenovērojamās ietekmes koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, kādā ietekme nav novērojama. Šajā testā NOEC atbilstošajai koncentrācijai attiecīgajā ekspozīcijas periodā nav statistiski nozīmīgas ietekmes (p < 0,05) salīdzinājumā ar kontrolgrupu.
|
|
|
LOEC
(zemākā novērojamās ietekmes koncentrācija) ir zemākā testējamās ķīmiskās vielas koncentrācija, kādā attiecīgajā ekspozīcijas periodā ir statistiski nozīmīga ietekme (p < 0,05) salīdzinājumā ar kontrolgrupu.
|
|
|
ECx (ietekmes koncentrācija, kas atbilst x % ietekmei) ir koncentrācija, kas attiecīgajā ekspozīcijas periodā testa organismos rada x % ietekmi salīdzinājumā ar kontrolgrupu. Piemēram, EC50 ir aplēstā koncentrācija, kurai eksponētajā populācijā noteiktā ekspozīcijas periodā ir 50 % ietekme uz kādu testa beigupunktu.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai vielu maisījums, kuru testē ar šo testēšanas metodi.
|
2. papildinājums
Augsnes maksimālās ūdensnoturspējas noteikšana
Uzskata, ka augsnes maksimālās ūdensnoturspējas noteikšanai piemērota ir šāda metode. Tā ir aprakstīta ISO DIS 11268-2 (“Augsnes kvalitāte – Piesārņotāju ietekme uz sliekām (Eissenia fetida) 2. daļa: Ietekme uz reprodukciju” C pielikumā. (23)).
Ar piemērotu parauga ņemšanas ierīci (gliemežcauruli u. tml.) ievāciet noteiktu daudzumu (piemēram, 5 g) testēšanas augsnes substrāta. Caurules apakšu pārklājiet ar filtrpapīra gabalu, caurulē iepildiet ūdeni un to novietojiet uz statīva ūdens peldē. Cauruli pakāpeniski iegremdē, līdz ūdens līmenis pārsniedz augsnes virsas līmeni. Ūdenī to atstāj apmēram trīs stundas. Tā kā augsne nevar paturēt visu ūdeni, kas iesūcies kapilāros, augsnes paraugs divas stundas jāpažāvē, cauruli segtā traukā (lai novērstu izkalšanu) novietojot uz ļoti mitru smalku kvarca smilšu pamatnes. Tad paraugs jānosver, 105 °C to izžāvējot līdz konstantai masai. Ūdensnoturspēju (WHC) var aprēķināt šādi:
kur:
S= ūdens piesātinātais substrāts + caurules masa + filtrpapīra masa
T= tara (caurules masa + filtrpapīra masa)
D= substrāta sausmasa
3. papildinājums
Augsnes PH noteikšana
Turpmākā augsnes pH noteikšanas metode balstās uz aprakstu ISO DIS 10390. Augsnes kvalitāte – pH noteikšana (16).
Noteiktu augsnes daudzumu vismaz 12 h žāvē istabas temperatūrā. Tad ar 1 M analītiskās tīrības pakāpes kālija hlorīda (KCl) vai 0,01 M analītiskās tīrības pakāpes kalcija hlorīda (CaCl2) šķīdumu pagatavo augsnes suspensiju (ar vismaz 5 gramiem augsnes), kas vismaz piecas reizes pārsniedz augsnes tilpumu. Suspensiju piecas minūtes labi sakrata un vismaz divas stundas, bet ne ilgāk kā 24 stundas ļauj nosēsties. Tad ar pH mērītāju, kas pirms katra mērījuma kalibrēts, izmantojot attiecīgu buferšķīdumu sēriju (piemēram, pH 4,0 un 7,0), izmēra šķidrās fāzes pH.
4. papildinājums
Pārtikas ērču Hypoaspis (Geolaelaps) aculeifer audzēšana un kultūras sinhronizācija
Hypoaspis (Geolaelaps) aculeifer audzēšana
Kultūras var turēt plastmasas traukos vai stikla burkās, kas pildītas ar ģipša un kokogļu pulvera maisījumu (attiecībā 9:1). Ja nepieciešam, ģipsi var uzturēt mitru, pievienojot dažus pilienus destilēta vai dejonizēta ūdens. Optimālā audzēšanas temperatūra ir 20 ± 2 °C, gaismas/ tumsas režīms šīm sugām nav būtisks. Barības avots var būt Typrophagus putrescentiae vai Caloglyphus sugu ērces (ar pārtikas ērcēm jāstrādā uzmanīgi, jo cilvēkiem tās var radīt alerģijas), bet piemērots barības avots var būt arī nematodes, sīksliekas un lēcastes. To izcelsme jāreģistrē. Populācijas augšana var sākties ar vienu mātīti, jo tēviņi attīstās no neapaugļotām oliņām. Paaudzes plaši pārklājas. Mātīte var nodzīvot vismaz 100 dienas un dzīves laikā var izdēt apmēram 100 oliņas. Maksimālā dēšanas intensitāte tiek sasniegta 10. līdz 40. dienā (pēc pieaugušās stadijas sasniegšanas) un atbilst 2,2 oliņām uz mātīti dienā. 20 °C temperatūrā attīstība no oliņas līdz pieaugušai mātītei notiek apmēram 20 dienas. Būtu iepriekš jāuztur un jāpatur vairāk nekā viena kultūra.
Typrophagus putrescentiae audzēšana
Ērces glabā ar smalku alus rauga pulveri pildītā stikla traukā, ko ievieto plastmasas spainī, kurš piepildīts ar KNO3 šķīdumu, lai neļautu tām izbēgt. Pārtikas ērces novieto uz šā pulvera. Pēc tam tās ar lāpstiņu uzmanīgi iejauc pulverī (kas jānomaina divas reizes nedēļā).
Kultūras sinhronizācija
Īpatņiem, ko izmanto testēšanā, jābūt vienāda vecuma (apmēram 7 dienas pēc pieaugušo stadijas sasniegšanas). Audzēšanas temperatūrā 20 °C to panāk šādi.
Mātītes pārvieto uz tīru audzēšanas trauku un tajā ieliek pietiekami daudz barības.
|
—
|
Ļauj divas līdz trīs dienas notikt dēšanai, pēc tam mātītes izvāc.
|
|
—
|
28. līdz 35. dienā no sākuma testēšanai paņem pieaugušās mātītes, tās ievietojot tīros audzēšanas traukos.
|
Pieaugušās mātītes pēc to lielākā izmēra, uzpūstās formas un brūnā muguras vairoga viegli atšķirt no tēviņiem (tēviņi ir slaidāki un plakani) un citām attīstības stadijām (nenobriedušie īpatņi ir balti līdz krēmkrāsas). Ērču attīstība notiek apmēram pēc turpmāk aprakstītās shēmas temperatūrā, kas zemāka nekā 20 °C (attēls): oliņa – 5 d., kāpurs – 2 d., protonimfa – 5 d., deitonimfa – 7 d., mātītēm pirmsdēšanas periods – 2 d. Pēc tam ērces ir pieaugušas.
Diagramma
Hypoaspis (Geolaelaps) aculeifer attīstība 20 °C temperatūrā (izvākšana = mātītes, ko izmanto testēšanā).
28. līdz 35. dienā pēc tam, kad jauno ērču mātes sākušas dēt (t. i., 7.–14. dienā, kopš jaunās ērces pieaugušas), pieaugušos testa dzīvniekus no sinhronizētās kultūras izvāc un ievieto testēšanas traukos. Tas nodrošina, ka testa dzīvniekiem pirmsdēšanas periods jau bijis un tie ir pārojušies ar kultivēšanas traukā esošajiem tēviņiem. Laboratorijas kultūru novērojumi liecina, ka tēviņu klātbūtnē mātītes pārojas uzreiz pēc pieaugšanas vai neilgi pēc tās (Ruf, Vanninen, personīgie novērojumi). Septiņu dienu periods ir izraudzīts, lai veicinātu integrēšanos laboratorijas režīmā un izlīdzinātu ērču individuālās attīstības atšķirības. Dēšanas sākumā mātīšu skaitam vajadzētu būt vismaz tikpat lielam, kāds beigās būs vajadzīgs testēšanai (ja, piemēram, testēšanai ir vajadzīgas 400 mātītes, vismaz 400 mātītēm jāļauj dēt divas līdz trīs dienas). Sinhronizētās populācijas sākumpunktam vajadzīgas vismaz 1 200 oliņas (dzimumu attiecība apmēram 0,5, mirstība apmēram 0,2). Lai nenotiktu kanibālisms, vienā testēšanas traukā, ja iespējams, turiet ne vairāk kā 20–30 dējošas mātītes.
5. papildinājums
Ekstrakcijas metodes
Mikroposmkājiem piemērota metode īpatņu atdalīšanai no augsnes/substrāta ir karstumekstrakcija (skatīt attēlu zemāk). Metodes pamatā ir organismu aktivitāte, tāpēc atzīmēti var tikt tikai kustīgie īpatņi. Karstumekstrakcijas princips ir organismu apstākļus paraugā pakāpeniski pasliktināt, liekot tiem substrātu pamest un iekrist fiksācijas šķidrumā (piemēram, etanolā). Būtisks ir ekstrakcijas ilgums un organismu apstākļu gradients no labiem līdz mēreniem, līdz sliktiem. Ekotoksikoloģiskajā testēšanā ekstrakcija jāveic iespējami ātri, jo jebkāda populācijas augšana ekstrakcijas laikā sagrozītu rezultātus. No otras puses, temperatūras un mitruma apstākļiem paraugā vienmēr jābūt tādās robežās, ka ērces var pārvietoties. Augsnes parauga karsēšana noved pie substrāta izžūšanas. Ja izžūšana notiek pārāk strauji, dažas ērces arī var izžūt, pirms tās paspēj izbēgt.
Tāpēc ir ieteicama šāda procedūra (24) (25).
|
|
Aprīkojums: Tulgrena piltuve vai ar to salīdzināmas metodes, piemēram, Makfadjena metode (paraugs tiek novietots virs piltuves, karsējot no augšas).
|
|
|
Karsēšanas režīms: 25 °C 12 h, 35 °C 12 h, 45 °C 24 stundas (kopā 48 h). Substrātā jāmēra temperatūra.
|
|
|
Fiksācijas šķīdums: 70 % etanols.
|
|
|
Detalizēta informācija: ņem testēšanā izmantoto stikla trauku. Noņem vāciņu un ap atveri aptin marles vai auduma gabalu. Audumam jābūt ar 1,0 līdz 1,5 mm acīm. Audumu nostiprina ar elastīgu gumiju. Stikla trauku uzmanīgi apgriež otrādi un ievieto ekstrakcijas aparātā. Audums neļauj substrātam iepilēt fiksācijas šķīdumā, taču ļauj ērcēm atstāt paraugu. Kad visi trauki ievietoti, sāk karsēšanas režīmu. Pēc 48 stundām ekstrakciju beidz. Traukus ar fiksācijas šķidrumu noņem un ar stereoskopisko mikroskopu saskaita ērces.
|
Vienreiz vai divreiz gadā jāpierāda izraudzītās metodes ekstrakcijas efektivitāte, izmantojot traukus, kuros ir zināms skaits neapstrādātā testējamā substrātā turētu jauno un pieaugušo ērču. Pa visām attīstības stadijām kopā efektivitātei vajadzētu būt vidēji ≥ 90 %.
Tulgrena tipa ekstrakcijas ierīce
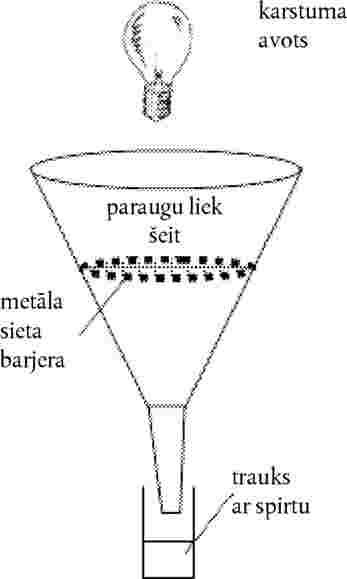
Kā testēšanas trauku pēc testa pabeigšanas sagatavot ekstrakcijai
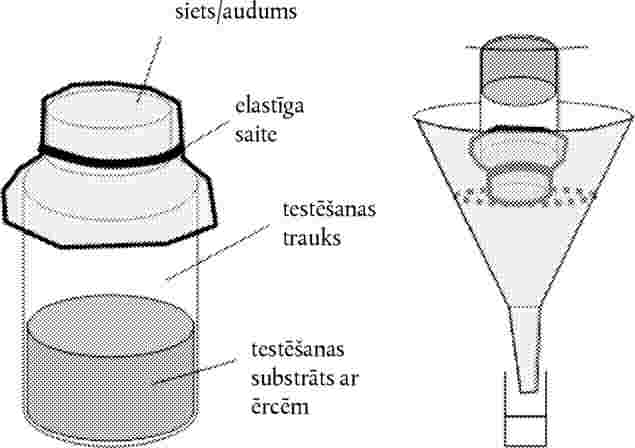
6. papildinājums
Hypoaspis (Geolaelaps) aculeifer piederība
|
Apakšklase/kārta/apakškārta:
|
|
Dzimta:
|
|
Ģints/ apakšģints/sugas:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae.
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autors un datums:
|
F. Faraji, Ph.D. (MITOX), 23 January 2007
|
|
Izmantotā literatūra:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2nd revised edition: 1-523.
Hughes, A.M. (1976).
The mites of stored food and houses.
Ministry of Agriculture, Fisheries and Food 9:400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Raksturīgās pazīmes:
|
tektums (tectum) ar noapaļotu, zobainu malu; hipostomas rievas ar vairāk nekā sešiem zobiņiem; kaudāli dorsāli Z4 sari, ne īpaši gari; akotveidīgi dorsālie sari; ģenitālais vairogs normāls, ne īpaši liels un neaizsniedz anālo vairogu; dorsālā vairoga pakaļējā puse bez nepāra sariem; II un IV kājas ar dažiem bieziem makrosariem; dorsālais Z5 sars divas reizes garāks nekā J5; fiksēts heliceru skaits ar 12–14 zobiem un kustīga helicera ar diviem zobiem; 520–685 μm gara idiosoma.
Hypoaspis miles izmanto arī bioloģiskajā kontrolē, un tās var sajaukt ar H. aculeifer. Galvenā atšķirība:
H. miles pieder Cosmolaelaps apakšģintij un tai ir nažveidīgi dorsālie sari, turpretī H. aculeifer pieder Geolaelaps apakšģintij, un tai ir akotveidīgi dorsālie sari.
|
7. papildinājums
Pamatinformācija par Hypoaspis (GEolaelaps) aculeifer bioloģiju
Hypoaspis aculeifer pieder pie Arthropoda tipa Arachnida klases Acari (ērču) kārtas Laelapidae dzimtas. Tās dzīvo visu veidu augsnēs un pārtiek no citām ērcēm, nematodēm, sīksliekām un lēcastēm (26). Barības trūkuma gadījumā tās pievēršas kanibālismam (27). Plēsējērces ķermenī ir idiosoma un gnatosoma. Idiosoma nav skaidri diferencēta prosomā (galvā) un opistosomā (vēderā). Gnatosomā (galvas vairogā) atrodas barošanās orgāni, piemēram, pedipalpas un heliceras. Heliceras ir trīszarainas un tām ir dažādas formas zobi. Papildus barības norīšanai tēviņi savas heliceras izmanto galvenokārt tam, lai mātītēs nogādātu spermatoforus. Idiosomu gandrīz pilnīgi nosedz dorsāls vairogs. Lielu daļu mātīšu idiosomas aizņem reproduktīvie orgāni, kas kļūst īpaši pamanāmi neilgi pirms oliņu dēšanas. Ventrāli var atrast divus vairogus – sternālo un ģenitālo. Visas kājas ir klātas ar sariņiem un āķīšiem. Sariņus izmanto, lai pieķertos, pārvietojoties augsnē vai pa to. Pirmo kāju pāri pārsvarā izmanto par antenām. Otro kāju pāri izmanto ne tikai, lai pārvietotos, bet arī, lai satvertu laupījumu. Ceturtā kāju pāra āķīšus var izmantot ne vien aizsardzībai, bet arī par “kustīgu motoru” (28). Tēviņi ir 0,55–0,65 mm gari un sver 10–15 μg. Mātītes ir 0,8–0,9 mm garas un sver 50–60 μg (8) (28) (1. att.).
1. att.
Mātīte, tēviņš, protonimfa un H. aculeifer kāpuri.

23 °C temperatūrā ērces dzimumgatavību sasniedz attiecīgi pēc 16 dienām (mātītes) un 18 dienām (tēviņi) (6). Mātītes spermu pārnes ar solenostomu, no kurienes tā nonāk ovārā. Ovārā sperma nobriest un tiek uzglabāta. Tikai pēc spermas nobriešanas ovārā notiek apaugļošanās. Mātītes dēj apaugļotas vai neapaugļotas oliņas pikās vai pa vienai, dodot priekšroku plaisām vai caurumiem. Kopojušās mātītes var izdēt oliņas, no kurām izšķiļas abu dzimumu jaunie īpatņi, turpretī no nekopojušos mātīšu oliņām izšķiļas tikai vīrišķā dzimuma jaunie īpatņi. Līdz brieduma sasniegšanai tiek izietas četras attīstības fāzes (oliņa – kāpurs, kāpurs – protonimfa, protonimfa – deitonimfa, deitonimfa – pieaudzis indivīds).
Oliņa ir pienbalta, stiklaina, eliptiska un apmēram 0,37 mm gara, ar cietu apvalku. Saskaņā ar avotu (8) kāpuri ir 0,42–0,45 mm gari. Tiem ir tikai trīs kāju pāri. Galvas reģionā ir attīstījušies taustekļi un heliceras. Heliceras, kam ir daži sīki zobiņi, izmanto, lai izšķiltos no oliņām. Pēc pirmās ādas mešanas, 1–2 dienas pēc izšķilšanās attīstās protonimfas. Arī tās ir baltas, 0,45–0,62 mm (8) garas un tām ir četri kāju pāri. Zobi uz helicerām ir pilnībā attīstījušies. Sākot ar šo stadiju, ērces sāk meklēt barību. Šim nolūkam tās ar helicerām pārdur laupījuma kutikulu un tajā ievada sekrētu ekstraintestinālai sagremošanai. Izveidojušos barības putru ērce tad var izsūkt. Heliceras var izmantot arī, lai no barības objektiem izrautu lielākas daļiņas (28). Pēc vēl vienas ādas mešanas attīstās deitonimfas. Tās ir 0,60–0,80 mm (8) garas un dzeltenā līdz gaiši brūnā krāsā. Sākot ar šo fāzi, tās var diferencēties mātītēs un tēviņos. Pēc vēl vienas ekdīzes, kuras laikā dzīvnieki ir nekustīgi un tiem attīstās brūns vairogs (apm. pēc 14 dienām), ērces ir pieaugušas (28)(29)(30).To mūžs ir no 48 līdz 100 dienām 25 °C temperatūrā (27).
8. papildinājums
Hypoaspis testa galveno darbību kopsavilkums un grafiks
|
Laiks (dienās)
testa sākums = 0. diena
|
Darbība/uzdevums
|
|
– 35. līdz
– 28. diena
|
Mātītes no izejkultūras pārvieto tīros traukos, lai sāktu sinhronizāciju
Divas dienas vēlāk: mātītes izvāc
Divas vai trīs reizes nedēļā: dod pietiekami daudz barības
|
|
– 5. diena (+/- 2)
|
Pagatavo mākslīgo augsni
|
|
– 4. diena (+/- 2)
|
Nosaka mākslīgās augsnes WHC
Naktī augsni atstāj žūt
Nākamajā dienā: paraugus nosver un aprēķina WHC
|
|
– 4. diena (+/- 2)
|
Mākslīgo augsni iepriekš samitrina, lai panāktu WHC 20–30 %
|
|
0. diena
|
Sāk testēšanu: mākslīgajai augsnei pievieno testējamo ķīmisko vielu
Katrā replikātā ievieto 10 mātītes
Katru replikātu nosver
Sagatavo abiotiskus kontrolparaugus mitruma satura un pH noteikšanai, divi replikāti uz katru apstrādes koncentrāciju
Mitruma kontrolparaugus naktī atstāj žūt
Nākamajā dienā: mitruma kontrolparaugus nosver
Nākamajā dienā: izmēra izžuvušo abiotisko kontrolparaugu pH
|
|
3., 6., 9., 12. diena (apm.)
|
Katrā replikātā nodrošina pietiekamu daudzumu barībā izmantojamu organismu
Katru replikātu nosver un pēc vajadzības pievieno ūdeni iztvaikojušā vietā
|
|
14. diena
|
Testu beidz, ar visiem replikātiem un ekstrakcijas efektivitātes kontrolparaugiem sāk ekstrakciju
Ūdens satura kontrolparaugus naktī atstāj žūt
Nākamajā dienā: ūdens satura kontrolparaugus nosver
Nākamajā dienā: izžāvētajiem kontrolparaugiem izmēra pH
|
|
16. diena
|
Ekstrakciju beidz
|
|
Pēc 16. dienas
|
Reģistrē pieaugušo un jauno īpatņu skaitu ekstrahētajā materiālā
Rezultātus ieraksta tabulu veidlapās
Testēšanas procedūru atspoguļo testa protokola lapās
|
C.37. ZIVJU 21 DIENAS TESTS: ESTROGĒNISKĀS UN ANDROGĒNISKĀS DARBĪBAS UN AROMATĀZES TRAUCĒJUMU ĪSAIS SKRĪNINGS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 230 (2009. gads). Nepieciešamība izstrādāt un validēt zivju testu, ar kuru nosaka endokrīni aktīvas ķīmiskās vielas, izriet no apsvērumiem, ka ķīmisko vielu līmeņi, ķīmiskajām vielām mijiedarbojoties ar cilvēku un savvaļas dzīvnieku endokrīno sistēmu, var šo sistēmu negatīvi ietekmēt. ESAO 1998. gadā uzsāka prioritāru rīcību, lai pārskatītu esošos norādījumus par potenciālu endokrīnās sistēmas traucējumu izraisītāju noteikšanu un testēšanu un izstrādātu jaunus. Viens no rīcības elementiem bija izstrādāt testēšanas norādījumus, kā noteikt ķīmiskas vielas ar aktīvu iedarbību uz zivju sugu endokrīno sistēmu. Zivju 21 dienas endokrīnās sistēmas skrīninga tests tika pārbaudīts visaptverošā validācijas programmā, kurā īstenoja starplaboratoriju salīdzinošos pētījumus ar attiecīgām ķīmiskajām vielām, lai pierādītu, ka tests, kurā detektē estrogēniskās darbības un aromatāzes traucējumus izraisošas ķīmiskās vielas trim pētītajām zivju sugām (melnais platgalvis, Japānas medaka (Japānas rīsa zivs) un zebrzivs) (1, 2, 3, 4, 5), ir atbilstīgs un ticams; androgēnisko aktivitāti ir iespējams detektēt melnajam platgalvim un Japānas medakai, bet ne zebrzivij. Šī testēšanas metode nenodrošina iespēju detektēt antiandrogēniskas iedarbības ķīmiskās vielas. Validācijas darbu ir zinātniski recenzējusi ekspertu grupa, kurus izraudzījušies Testēšanas norādījumu programmas izstrādes nacionālie koordinatori (6). Tests nav izstrādāts tā, lai ar to noteiktu hormonālo traucējumu specifiskos mehānismus, jo testa dzīvniekiem nav skarta hipotalāma-hipofīzes-gonādu (HPG) ass, tāpēc reaģēšana uz ķīmiskajām vielām, kas iedarbojas uz hipotalāma-hipofīzes-gonādu asi, var notikt dažādā līmenī. Zivju vairošanās īsais tests (ESAO TG 229) aptver melnā platgalvja auglību un attiecīgos gadījumos gonādu histopatoloģiju, kā arī šeit aprakstītās testēšanas metodes beigupunktus. ESAO TG 229 nodrošina to ķīmisko vielu skrīningu, kas ietekmē vairošanos ar dažādu mehānismu, arī endokrīnās sistēmas mehānismu starpniecību. Tas jāņem vērā, pirms izraugās piemērotāko metodi.
|
|
2.
|
Šī testēšanas metode apraksta in vivo skrīninga testu, kurā dzimumgatavību sasniegušus zivju tēviņus un nārstojošas mātītes tur kopā un ierobežotā dzīves cikla daļā (21 diena) eksponē kādai ķīmiskai vielai. Pēc 21 dienas ekspozīcijas perioda atkarībā no izmantotās sugas mātītēm un tēviņiem mēra vienu vai divus biomarķieru beigupunktus, kas ir testējamās ķīmiskās vielas estrogēniskās iedarbības, aromatāzi inhibējošās iedarbības vai androgēniskās iedarbības rādītāji; šie beigupunkti ir vitelogenīns un sekundārās dzimumpazīmes. Vitelogenīnu mēra melnajam platgalvim, Japānas medakai un zebrzivij, savukārt sekundārās dzimumpazīmes mēra tikai melnajam platgalvim un Japānas medakai.
|
|
3.
|
Šo biotestu izmanto par in vivo skrīninga testu attiecībā uz noteiktiem endokrīnas iedarbības veidiem, un to skata kopā ar “OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals” (28).
|
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
|
4.
|
Vitelogenīns parasti veidojas oldējēju mugurkaulnieku mātīšu aknās atbildreakcijā uz organismā cirkulējošo endogēno estrogēnu. Tas ir olas dzeltenuma proteīnu prekursors, kas producējas aknās un pa asinsrites sistēmu nonāk olnīcās, kur to uzņem un modificē attīstošās olšūnas. Nenobriedušu zivju mātīšu un tēviņu plazmā vitelogenīns gandrīz nav detektējams, jo organismā pietiekamā daudzumā nav estrogēna, tomēr aknas vitelogenīnu spēj sintezēt un izdalīt, reaģējot uz eksogēnu estrogēnisku stimulāciju.
|
|
5.
|
Vitelogenīna mērījumus izmanto, lai detektētu ķīmiskās vielas ar dažādiem estrogēniskās iedarbības veidiem. Estrogēniskas iedarbības ķīmiskās vielas var detektēt, mērot zivju tēviņu organismā producējušos vitelogenīnu, un tas plaši dokumentēts zinātniski recenzētos izdevumos (piemēram, (7)). Vitelogenīna inducēšanās novērota arī pēc eksponēšanas aromatizējamiem androgēniem (8, 9). Zivju mātīšu organismā cirkulējošā estrogēna līmeņa pazemināšanās, piemēram, inhibējoties aromatāzei, kas endogēno androgēnu pārvērš dabiskā estrogēnā 17β-estradiolā, samazina vitelogenīna līmeni, un pēc tā var noteikt aromatāzi inhibējošas ķīmiskas vielas (10, 11). Bioloģiskā nozīme, kas piemīt vitelogenīna atbildreakcijai uz estrogēnu vai aromatāzes inhibēšanu, ir pierādīta un plaši dokumentēta. Tomēr VTG izstrādāšanos zivju mātīšu organismā var ietekmēt vispārējais vides toksiskums un neendokrīna veida toksiska iedarbība, piemēram, hepatotoksicitāte.
|
|
6.
|
Sekmīgi izstrādātas un standartizētas ir vairākas plaši izmantojamas mērīšanas metodes. Viens no piemēriem ir katrai sugai specifiskas imūnfermentatīvās analīzes (ELISA) metodes, kurās no atsevišķām zivīm ņemtos nelielos asins vai aknu paraugos imūnķīmiskā analīzē kvantitatīvi novērtē vitelogenīna producēšanos (12, 13, 14, 15, 16, 17, 18). VTG mērījumiem izmanto melnā platgalvja asinis, zebrzivs asinis vai galvas/astes homogenātu un Japānas medakas aknas. Japānas medakai konstatēta laba korelācija starp VTG mērījumiem asinīs un aknās (19). 6. papildinājumā sniegta ieteicamā paraugu ņemšanas kārtība vitelogenīna analīzei. Vitelogenīna mērījumu komplekti ir plaši pieejami; šo komplektu pamatā jābūt validētai katrai sugai specifiskai ELISA metodei.
|
|
7.
|
Atsevišķu zivju sugu tēviņu sekundārās dzimumpazīmes ir ārēji redzamas, kvantitatīvi novērtējamas un jutīgas pret organismā cirkulējošo endogēno androgēnu līmeni; tas attiecas uz melno platgalvi un Japānas medaku, taču neattiecas uz zebrzivi, kam kvantitatīvi novērtējamas sekundārās dzimumpazīmes nav novērojamas. Mātītēm, kas eksponētas ūdenī esošām androgēniskām ķīmiskām vielām, var attīstīties tēviņu sekundārās dzimumpazīmes. Zinātniskajā literatūrā ir vairāki pētījumi, kuros šāda reakcija dokumentēta attiecībā uz melno platgalvi (20) un Japānas medaku (21). Interpretējot tēviņu sekundāro dzimumpazīmju izpausmju samazināšanos, sakarā ar zemo statistisko ticamību jāsaglabā piesardzība, un jāņem vērā ekspertu viedoklis un pierādījumu nozīmīgums. Zebrzivs izmantošana šajā testā ir ierobežota sakarā ar to, ka tai nav kvantitatīvi novērtējamu sekundāro dzimumpazīmju, kas reaģētu uz androgēniskas iedarbības ķīmiskām vielām.
|
|
8.
|
Galvenais rādītājs, kas liecina par melnā platgalvja eksponēšanu eksogēnam androgēnam, ir kārpiņu skaits uz zivju mātītes purna. Japānas medakai galvenais rādītājs, kas liecina par eksogēnu eksponēšanu androgēniskām ķīmiskām vielām, ir kārpiņveida izaugumu skaits zivju mātītēm. 5.A papildinājumā un 5.B papildinājumā norādītas ieteicamās procedūras, kā izvērtēt attiecīgi melnā platgalvja un Japānas medakas dzimumpazīmes.
|
|
9.
|
Šajā testēšanas metodē minētās definīcijas ir minētas 1. papildinājumā.
|
TESTĒŠANAS PRINCIPS
|
10.
|
Testēšanas laikā reproduktīvā attīstības posmā esošus zivju tēviņus un mātītes kopā eksponē testēšanas traukos. Tā kā dzīvnieki ir pieauguši un reproduktīvā attīstības posmā, iespējams skaidri atšķirt dzimumus un visus beigupunktus analizēt dzimuma griezumā, un tas arī garantē jutību pret eksogēnām ķīmiskajām vielām. Dzimumu apstiprina testa nobeigumā makroskopiskā dzimumdziedzeru izmeklēšanā, kurā ar šķērēm atver vēdera apvidu. Pārskats par būtiskajiem biotesta nosacījumiem sniegts 2. papildinājumā. Testu parasti veic ar zivīm no nārstojošas populācijas; neizmanto dzīvniekus no novecojošām populācijām. Norādījumi par zivju vecumu un reproduktīvo statusu sniegti sadaļā par zivju izraudzīšans. Testu veic ar trim ķīmiskās ekspozīcijas koncentrācijām, un, ja nepieciešams, nodrošina ūdens un šķīdinātāja kontrolgrupas. Katrā Japānas medakas un zebrzivs apstrādē izmanto divus traukus jeb replikātus (katrā traukā 5 tēviņi un 5 mātītes), savukārt katrā melnā platgalvja apstrādē izmanto četrus traukus jeb replikātus (katrā traukā 2 tēviņi un 4 mātītes). Tas nepieciešams, lai pielāgotos melnā platgalvja tēviņu teritoriālajai uzvedībai, vienlaikus saglabājot pietiekamu testa jaudu. Ekspozīcijas ilgums ir 21 diena, un zivju paraugus ņem ekspozīcijas 21. dienā.
|
|
11.
|
Ņemot paraugus 21. dienā, visus dzīvniekus humāni nonāvē. Melnajam platgalvim un Japānas medakai mēra sekundārās dzimumpazīmes (sk. 5.A papildinājumu un 5.B papildinājumu); ar asins paraugiem nosaka vitelogenīna līmeni zebrzivs un melnā platgalvja organismā, bet vitelogenīna līmeni zebrzivs organismā var noteikt arī ar galvas/astes paraugiem (6. papildinājums); Japānas medakas VTG analīzē izmanto aknu paraugus (6. papildinājums).
|
TESTA PIEŅEMAMĪBAS KRITĒRIJI
|
12.
|
Lai testa rezultāti būtu derīgi, jāizpilda šādi kritēriji:
|
—
|
ekspozīcijas perioda beigās mirstība ūdens (vai šķīdinātāja) kontrolgrupā nepārsniedz 10 %;
|
|
—
|
izšķīdušā skābekļa koncentrācijai visā ekspozīcijas periodā jābūt vismaz 60 % no gaisa piesātinājuma koncentrācijas;
|
|
—
|
ūdens temperatūras atšķirība starp testēšanas tvertnēm jebkurā ekspozīcijas perioda brīdī nepārsniedz ± 1,5 °C, un testa sugām norādītajos temperatūras diapazonos (2. papildinājums) to uztur 2 °C svārstību diapazonā;
|
|
—
|
ir pieejami dati, kas liecina, ka testējamās ķīmiskās vielas koncentrācija šķīdumā ir uzturēta vidējo izmērīto vērtību diapazonā ± 20 %.
|
|
METODES APRAKSTS
Aprīkojums
|
13.
|
Parastais laboratorijas aprīkojums, jo īpaši:
|
a)
|
skābekļa mērīšanas iekārtas un pH metri;
|
|
b)
|
aprīkojums ūdens cietības un sārmainības noteikšanai;
|
|
c)
|
attiecīgs aprīkojums ūdens temperatūras regulēšanai un, vēlams, nepārtrauktai uzraudzībai;
|
|
d)
|
ķīmiski inerta materiāla tvertnes ar piemērotu ietilpību attiecībā uz ieteicamo noslogojumu un apdzīvotības blīvumu (sk. 2. papildinājumu);
|
|
e)
|
melnā platgalvja un zebrzivis nārsta substrāts, nepieciešamā informācija sniegta 4. papildinājumā;
|
|
f)
|
pietiekami precīzi svari (t. i., ar precizitāti ± 0,5 mg).
|
|
Ūdens
|
14.
|
Par testa ūdeni var izmantot jebkādu ūdeni, kurā testa sugas uzrāda pietiekamu ilgtermiņa izdzīvotību un augšanu. Tā kvalitātei testa laikā jābūt nemainīgai. Ūdens pH jābūt diapazonā no 6,5 līdz 8,5, bet konkrētā testā tam jābūt ± 0,5 pH vienību diapazonā. Lai nodrošinātu, ka atšķaidīšanas ūdens pārāk neietekmē testa rezultātu (piemēram, kompleksējoties ar testējamo ķīmisko vielu), paraugus tā analīzei ņem ar noteiktiem starplaikiem. Ja ir zināms, ka atšķaidīšanas ūdens kvalitāte ir relatīvi nemainīga, smago metālu (piemēram, Cu, Pb, Zn, Hg, Cd un Ni), galveno anjonu un katjonu (piemēram, Ca2+, Mg2+, Na+, K+, Cl- un SO4
2–), pesticīdu (piemēram, kopējo fosfororganisko pesticīdu un kopējo hlororganisko pesticīdu), kopējā organiskā oglekļa un suspendēto cieto daļiņu mērījumi jāizdara, piemēram, reizi trijos mēnešos. Ja ir pierādīts, ka vismaz viena gada laikā ūdens kvalitāte ir nemainīga, noteikšanu var veikt retāk un intervāli var būt garāki (piemēram, reizi sešos mēnešos). Daži pieņemama atšķaidīšanas ūdens ķīmiskie parametri ir norādīti 3. papildinājumā.
|
Testēšanas šķīdumi
|
15.
|
Izraudzītās koncentrācijas testēšanas šķīdumus parasti gatavo, atšķaidot izejšķīdumu. Izejšķīdumu vēlams pagatavot, testējamo ķīmisko vielu atšķaidīšanas ūdenī vienkārši iemaisot vai tajā iejaucot ar mehāniskiem līdzekļiem (piemēram, kratīšana vai apstrāde ar ultraskaņu). Piemērotas koncentrācijas izejšķīduma iegūšanai var izmantot piesātināšanas kolonnas (šķīdības kolonnas). Nav ieteicams par nesējvielu izmantot šķīdinātāju. Tomēr, ja šķīdinātājs ir nepieciešams, vienlaikus nodrošina šķīdinātāja kontrolgrupu, kurai šķīdinātāja koncentrācija ir tāda pati kā grupām, ko apstrādā ar ķīmisko vielu. Sarežģīti testējamām ķīmiskajām vielām šķīdinātājs var būt labākais tehniskais risinājums; jāizmanto OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures (22). Šķīdinātāju izraugās atkarībā ķīmiskās vielas ķīmiskajām īpašībām. Jāievēro ESAO Norādījumu dokumentā ieteiktā maksimālā koncentrācija 100 μl/l. Tomēr nesen publicētā pārskatā (23) pausti papildu apsvērumi attiecībā uz šķīdinātāju izmantošanu endokrīnās sistēmas darbības testēšanā. Tāpēc, ja nepieciešams, tehniski pamatotās situācijās šķīdinātāja koncentrāciju samazina līdz minimumam (atkarībā no testējamās ķīmiskās vielas fizikālajām un ķīmiskajām īpašībām).
|
|
16.
|
Testēšanā izmanto caurplūdes sistēmu. Šāda sistēma (piemēram, dozējošais sūknis, proporcionālas atšķaidīšanas ierīce, piesātinātāja sistēma) nepārtraukti piegādā un atšķaida testējamās ķīmiskās vielas izejšķīdumu, lai testēšanas tvertnēs nodrošinātu nemainīgu koncentrāciju. Testa laikā noteiktos intervālos, vēlams, reizi dienā, jāpārbauda izejšķīdumu un atšķaidīšanas ūdens caurplūde, un testa laikā tā nedrīkst mainīties vairāk kā par 10 %. Jāraugās, lai neizmantotu nekvalitatīvas plastmasas caurules vai citus materiālus, kas satur bioloģiski aktīvas ķīmiskās vielas. Izraugoties caurplūdes sistēmas materiālu, jāņem vērā testējamās ķīmiskās vielas iespējama adsorbēšanās uz materiāla.
|
Zivju turēšana
|
17.
|
Testa zivis izvēlas no laboratorijas populācijas, vēlams, no viena bara, kas vismaz divas nedēļas pirms testa ir aklimatizējies testa apstākļiem līdzīgos ūdens kvalitātes un apgaismojuma apstākļos. Svarīgi, lai noslogojums un apdzīvotības blīvums (sk. 1. papildinājumu) būtu izmantotajai testa sugai piemēroti (sk. 2. papildinājumu).
|
|
18.
|
Pēc 48 stundu sākumposma reģistrē mirstību un piemēro šādus kritērijus:
|
—
|
mirstība septiņās dienās ir lielāka par 10 % populācijas: grupu tālākai testēšanai neizmanto;
|
|
—
|
mirstība ir no 5 % līdz 10 % no populācijas: grupu aklimatizē vēl septiņas dienas; ja mirstība otru septiņu dienu laikā pārsniedz 5 %, grupu tālākai testēšanai neizmanto;
|
|
—
|
mirstība septiņās dienās ir mazāka par 5 % no populācijas: grupu izmanto tālākai testēšanai.
|
|
|
19.
|
Aklimatizācijas laikā, pirmsekspozīcijas un ekspozīcijas periodā zivis nedrīkst medikamentozi ārstēt.
|
Pirmsekspozīcijas periods un zivju izraudzīšanās
|
20.
|
Ieteicams vienas nedēļas pirmsekspozīcijas periods, kurā zivis ievieto testēšanas traukiem līdzīgos traukos. Zivis visā turēšanas laikā un ekspozīcijas fāzē baro ad libitum. Ekspozīcijas fāzi sāk ar aktīvi nārstojošām pieaugušām zivīm, kurām ir skaidri izteiktas dzimumatšķirības un kuras izraudzītas no reproduktīvi nobriedušiem laboratorijas dzīvniekiem (piemēram, ja testē melno platgalvi un Japānas medaku – ar skaidri redzamām sekundārajām dzimumpazīmēm,). Tikai vispārīgu norādījumu līmenī (šos norādījumus nedrīkst izvērtēt atrauti no attiecīgās zivju grupas faktiskā reproduktīvā statusa) melnajiem platgalvjiem jābūt aptuveni 20 (± 2) nedēļas veciem, pieņemot, ka tie visā dzīves ciklā audzēti 25 ± 2 °C temperatūrā. Japānas medakām vajadzētu būt aptuveni 16 (± 2) nedēļas vecām, pieņemot, ka tās visā dzīves ciklā audzētas 25 ± 2 °C temperatūrā. Zebrzivīm vajadzētu būt aptuveni 16 (± 2) nedēļas vecām, pieņemot, ka tās visā dzīves ciklā audzētas 26 ± 2 °C temperatūrā.
|
TESTĒŠANAS PLĀNS
|
21.
|
Izmanto trīs testējamās ķīmiskās vielas koncentrācijas, vienu kontrolgrupu (ūdens) un, ja nepieciešams, vienu šķīdinātāja kontrolgrupu. Šos datus var analizēt, lai noteiktu, vai starp apstrādes grupu un kontrolgrupu rezultātiem ir vērojamas statistiski būtiskas atšķirības. Šo analīžu mērķis nav tās izmantot riska novērtēšanā (24), bet gan gūt informāciju par to, vai jāturpina testēt ķīmiskās vielas kaitīgā ietekme (t. i., attiecībā uz izdzīvotību, attīstību, augšanu un vairošanos).
|
|
22.
|
Attiecībā uz Japānas medaku un zebrzivi eksperimenta 21. dienā no katra apstrādes līmeņa un no kontrolgrupas(-ām) paraugam ņem tēviņus un mātītes (5 tēviņus un 5 mātītes no katra no diviem replikātiem), lai mērītu vitelogenīnu un attiecīgā gadījumā sekundārās dzimumpazīmes. Attiecībā uz melno platgalvi ekspozīcijas 21. dienā paraugam ņem tēviņus un mātītes (2 tēviņus un 4 mātītes no katra no četriem replikātiem), arī no kontrolgrupas(-ām), lai mērītu vitelogenīnu un gadījumā sekundārās dzimumpazīmes.
|
Testa koncentrāciju izvēle
|
23.
|
Šā testa vajadzībām augstākā testējamās ķīmiskās vielas koncentrācija ir vai nu diapazona noteikšanā vai no citiem toksicitātes datiem noteiktā maksimāli pieļaujamā koncentrācija (turpmāk “MPK”), vai 10 mg/l, vai maksimālā šķīdība ūdenī – atkarībā no tā, kurš no šiem rādītājiem ir zemākais. MPK definē kā ķīmiskās vielas augstāko testējamo koncentrāciju, kuras izraisītā mirstība ir mazāka nekā 10 %. Šīs pieejas izmantošanai ir nepieciešami jau pieejami empīriski dati par akūto toksicitāti vai citi toksicitātes dati, ar kuriem iespējams noteikt MPK. MPK noteikšana var būt neprecīza, un parasti ir nepieciešams profesionāls viedoklis.
|
|
24.
|
Ir nepieciešamas trīs testa koncentrācijas ar nemainīgu intervāla koeficientu, kas nepārsniedz 10, un atšķaidīšanas ūdens kontrolgrupa (un, ja vajadzīgs, šķīdinātāja kontrolgrupa). Ieteicamie intervāla koeficienti ir no 3,2 līdz 10.
|
PROCEDŪRA
Testa zivju izvēle un svēršana
|
25.
|
Ir svarīgi testa sākumā līdz minimumam samazināt zivju svara atšķirības. Piemērots izmēru diapazons dažādām sugām, ko ieteicams izmantot šajā testā, ir norādīts 2. papildinājumā. Visās testēšanā izmantoto zivju grupās katra atsevišķā zivju tēviņa un mātītes svara diapazons testa sākumā, ja iespējams, nepārsniedz ± 20 % no attiecīgā dzimuma vidējā aritmētiskā svara. Ir ieteicams pirms testēšanas nosvērt apakšparaugu no kopējā zivju parauga, lai novērtētu vidējo svaru.
|
Ekspozīcijas apstākļi
Ilgums
|
26.
|
Testa ilgums ir 21 diena pēc pirmsekspozīcijas perioda. Ieteicamais pirmsekspozīcijas periods ir viena nedēļa.
|
Barošana
|
27.
|
Zivis ad libitum baro ar piemērotu barību (2. papildinājums) pietiekamā daudzumā, lai uzturētu ķermeņa stāvokli. Jāraugās, lai nepieļautu mikrobu augšanu un ūdens duļķainību. Vispārīgs ieteikums ir vienas dienas barības devu sadalīt divās vai trīs vienādās daļās un dienā zivīm izbarot vairākās reizēs ar vismaz triju stundu starplaiku. Ir pieņemama viena lielāka dienas deva, jo īpaši nedēļas nogalēs. 12 stundas pirms paraugu ņemšanas vai autopsijas zivis nebaro.
|
|
28.
|
Izvērtē, vai zivju pārtikā nav piesārņotāju, piemēram, hlororganisko pesticīdu, policiklisko aromātisko ogļūdeņražu (turpmāk “PAO”) un polihlorbifenilu (turpmāk“PHB”). Jāizvairās no barības ar paaugstinātu fitoestrogēnu līmeni, kas testā varētu ietekmēt atbildreakciju uz zināmu estrogēnu agonistu (piemēram, 17-bētaestradiolu).
|
|
29.
|
Neapēstā barība un fekālijas no testēšanas traukiem jāizņem vismaz divas reizes nedēļā, piemēram, katras tvertnes apakšdaļu rūpīgi iztīrot caur sifonu.
|
Gaisma un temperatūra
|
30.
|
Fotoperiods un ūdens temperatūra jāpielāgo testa sugai (sk. 2. papildinājumu).
|
Analītiskās noteikšanas un mērījumu biežums
|
31.
|
Pirms ekspozīcijas perioda sākuma jānodrošina pareiza ķīmiskās vielas piegādes sistēmas darbība. Jābūt apzinātām visām nepieciešamajām analītiskajām metodēm, nepieciešamas arī pietiekamas zināšanas par ķīmisko stabilitāti testa sistēmā. Testa laikā testējamās ķīmiskās vielas koncentrācijas nosaka šādos regulāros intervālos: atšķaidīšanas ūdens un izejšķīduma caurplūdi vēlams pārbaudīt katru dienu, taču ne retāk kā divas reizes nedēļā, un testa laikā tās nedrīkst mainīties vairāk nekā par 10 %. Ir ieteicams katrā tvertnē noteikt faktisko testējamās ķīmiskās vielas koncentrāciju testa sākumā un reizi nedēļā pēc tam.
|
|
32.
|
Rezultātus ieteicams balstīt uz izmērītajām koncentrācijām. Tomēr, ja visā testa laikā šķīdumā ir uzturēta apmierinoša testējamās ķīmiskās vielas koncentrācija ± 20 % no nominālās koncentrācijas, rezultātu var balstīt uz nominālajām vai izmērītajām vērtībām.
|
|
33.
|
Paraugiem var būt vajadzīga filtrēšana (piemēram, ar poru lielumu 0,45 μm) vai centrifugēšana. Vajadzības gadījumā ieteicama centrifugēšana. Tomēr arī filtrēšana var būt pieņemama, ja testēšanas materiāls neadsorbējas uz filtra.
|
|
34.
|
Testa laikā visos traukos vismaz reizi nedēļā nosaka izšķīdušo skābekli, temperatūru un pH. Vismaz reizi nedēļā kontrolgrupā un vienā traukā ar lielāko koncentrāciju nosaka kopējo cietību un sārmainību. Vismaz vienā testēšanas traukā vēlams pastāvīgi uzraudzīt temperatūru.
|
Novērojumi
|
35.
|
Testa laikā vai pēc tā beigām novērtē vairākas vispārīgas atbildreakcijas (piemēram, izdzīvotību) un bioloģiskās atbildreakcijas (piemēram, vitelogenīna līmeņus). Turpmāk aprakstīta šo beigupunktu mērīšana, izvērtēšana un lietderība.
|
Izdzīvotība
|
36.
|
Zivis testēšanas laikā katru dienu jāapskata, jāreģistrē mirstība un nedzīvās zivis iespējami drīz jāizvāc. Nedzīvās zivis neaizstāj ne ar kontrolgrupas zivīm, ne ar zivīm no cita apstrādes trauka. Dzimumdziedzeru makroskopiskā izmeklēšanā nosaka testēšanas laikā mirušo zivju dzimumu.
|
Izturēšanās un izskats
|
37.
|
Jāreģistrē jebkāda anormāla izturēšanās (salīdzinājumā ar kontrolgrupām); tās var būt vispārējas toksicitātes pazīmes, tostarp hiperventilācija, nekoordinēta peldēšana, līdzsvara zudums un netipisks mierīgums vai barošanās. Jāreģistrē arī izskata anomālijas (piemēram, asinsizplūdumi, krāsas zaudēšana). Datu interpretēšanā šādas toksicitātes pazīmes jāvērtē uzmanīgi, jo tās var liecināt par koncentrācijām, kurās nevar paļauties uz endokrīnās sistēmas biomarķieriem. Šādos novērojumos par izturēšanos var iegūt arī noderīgu kvantitatīvu informāciju, pēc kuras noteikt turpmākas iespējamas vajadzības zivju testēšanā. Piemēram, novērots, ka androgēnām vielām eksponēti melnā platgalvja tēviņi vai maskulinizētas mātītes izturas teritoriāli agresīvi, savukārt zebrzivīm estrogēniskas vai antiandrogēniskas ekspozīcijas rezultātā samazinās vai kavējas ierastā pārošanās un nārstošanas aktivitāte pēc rītausmas.
|
|
38.
|
Tā kā izskatu noteiktos aspektos (galvenokārt krāsu) var ātri mainīt manipulācijas, kvalitatīvos novērojumus svarīgi veikt pirms dzīvnieku izņemšanas no testa sistēmas. Līdzšinējā pieredze ar melnajiem platgalvjiem liecina, ka atsevišķas endokrīni aktīvas ķīmiskās vielas sākotnēji var mainīt šādas ķermeņa ārējās pazīmes: krāsu (gaiša vai tumša), krāsojuma struktūru (vertikālu joslu esamība) un ķermeņa formu (galvas un krūšu daļa). Tāpēc zivju izskats jānovēro visā testēšanas laikā un pētījuma noslēgumā.
|
Humāna zivju nonāvēšana
|
39.
|
Testa 21. dienā, t. i., beidzot ekspozīciju, zivis eitanazē ar pietiekamu daudzuma trikaīna (trikaīna metāna sulfonāts, metakaīns, MS-222 (CAS 886-86-2)) daudzumu, 100-500 mg/l gļotādu kairinājuma mazināšanai atšķaidot ar 300 mg/l NaHCO3 (nātrija bikarbonāts, CAS 144-55-8); pēc tam ņem asins vai audu paraugus, lai noteiktu vitelogenīna daudzumu, kā paskaidrots sadaļā par vitelogenīnu.
|
Sekundāro dzimumpazīmju novērtēšana
|
40.
|
Dažas endokrīni aktīvas ķīmiskās vielas var mainīt specifiskas sekundāras dzimumpazīmju izmaiņas (melnā platgalvja tēviņu nārsta kārpiņu skaits, Japānas medakas tēviņu kārpiņveida izaugumi). Zīmīgi, ka ķīmiskās vielas ar noteikta veida iedarbību pretējā dzimuma dzīvniekiem var inducēt anormālas sekundārās dzimumpazīmes, piemēram, androgēna receptoru agonistu, piemēram, trenbolona, metiltestosterona un dihidrotestosterona, ietekmē melnā platgalvja mātītēm var sākt veidoties nārsta kārpiņas, bet Japānas medakas mātītēm – kārpiņveida izaugumi (11, 20, 21). Ir ziņas arī par to, ka estrogēna receptoru agonisti pieaugušiem tēviņiem var samazināt nārsta kārpiņu skaitu un pakauša segmenta lielumu (25, 26). Šādu izteiktu morfoloģisko īpatnību novērojumi var sniegt arī noderīgu kvalitatīvu un kvantitatīvu informāciju, pēc kuras noteikt turpmākas iespējamas vajadzības zivju testēšanā. Melnā platgalvja nārsta kārpiņu skaitu un lielumu un Japānas medakas kārpiņveida izaugumu skaitu kvantitatīvi noteikt var uzreiz vai, praktiskāk, saglabātiem paraugiem. Melnā platgalvja un Japānas medakas sekundāro dzimumpazīmju noteikšanai ieteicamās procedūras norādītas attiecīgi 5.A un 5.B papildinājumā.
|
Vitelogenīns (VTG)
|
41.
|
Ar heparinizētu mikrohematokrīta kapilārcaurulīti vai kardiālās punkcijas šļirci no astes artērijas/vēnas ņem asinis. Atkarībā no zivs lieluma no viena melnā platgalvja parasti ņem 5 līdz 60 μl un no zebrzivs – 5 līdz 15 μl. Plazmu no asinīm atdala centrifugējot, un līdz vitelogenīna analīžu veikšanai, pievienojot proteāzes inhibitorus, glabā – 80 °C temperatūrā. Par audu avotu vitelogenīna noteikšanai var izmantot arī Japānas medakas aknas un zebrzivs galvas vai astes homogenātu (6. papildinājums). VTG mērījuma pamatā jābūt validētai homologai ELISA metodei, kurā izmanto homologu VTG standartvielu un homologas antivielas. Ieteicams izmantot metodi, ar ko ir iespējams konstatēt VTG, kura daudzums ir tikai daži ng/ml plazmā (vai ng/mg audos), kas atbilst fona līmenim testēšanaā neeksponētu zivs tēviņu organismā.
|
|
42.
|
Vitelogenīna analīzes kvalitātes kontrolē izmanto standartvielas, sagataves un vismaz atkārtotas analīzes. Lai noteiktu minimālo parauga atšķaidījuma koeficientu, attiecībā uz katru ELISA metodi jātestē matrices ietekme (paraugatšķaidījuma ietekme). Katrā VTG testos izmantotā ELISA testa platē jābūt šādiem kvalitātes kontroles paraugiem: vismaz 6 kalibrācijas etaloni, kas atbilst paredzamo vitelogenīna koncentrāciju diapazonam, un vismaz viens nespecifisks saistīšanās testa “tukšais paraugs” (analizē dublikātparaugu). Absorbcijai šajos tukšajos paraugos jābūt zemākai par 5 % no absorbcijas, kas vērojama maksimālās kalibrācijas etalonam. No katra parauga atšķaidījuma analizē vismaz divas alikvotas (dublikātiedobes). Dublikātiedobes, kas atšķiras vismaz par 20 %, jāanalizē atkārtoti.
|
|
43.
|
Kalibrācijas līkņu korelācijas koeficientam (R2) jābūt lielākam nekā 0,99. Tomēr ar augstu korelāciju nepietiek, lai garantētu pietiekamu koncentrācijas prognozēšanu visos diapazonos. Papildus tam, ka jābūt pietiekami augstai korelācijai kalibrācijas līknē, katrai standartkoncentrācijai, ko aprēķina pēc kalibrācijas līknes, jābūt 70 līdz 120 % nominālās koncentrācijas. Ja nominālajām koncentrācijām ir tendence attālināties no kalibrācijas regresijas līknes (piemēram, zemākās koncentrācijās), kalibrācijas līkni var būt nepieciešams sadalīt zemajā un augstajā diapazonā vai izmantot nelineāru modeli, lai pietiekami iekļautu absorbcijas datus. Ja līkne tiek sadalīta, abos līknes segmentos jābūt R2 > 0,99.
|
|
44.
|
Detektēšanas robeža (turpmāk“DR”) ir zemākā analītiskā standarta koncentrācija, bet kvantitatīvās noteikšanas robeža (turpmāk “KNR”) ir zemākā analītiskā standarta koncentrācija, kas reizināta ar zemāko atšķaidījuma koeficientu.
|
|
45.
|
Katru dienu, kad veic vitelogenīna testus, analizē stiprinātu paraugu, kas gatavots, izmantojot vairākiem testiem kopīgu references standartvielu (7. papildinājums). Prognozētās koncentrācijas un izmērītās koncentrācijas attiecību testēšanas pārskatā norāda kopā ar katra attiecīgajā dienā veiktā testu kompleksa rezultātiem.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Biomarķieru reakcijas novērtēšana ar dispersijas analīzi (turpmāk “ANOVA”)
|
46.
|
Lai noteiktu ķīmiskās vielas iespējamu endokrīnu iedarbību, dažādās apstrādes grupās un kontrolgrupās iegūtā atbildreakcija jāsalīdzina, izmantojot dispersijas analīzi (ANOVA). Ja izmanto šķīdinātāja kontrolgrupu, attiecīgu statistisku testu, kurā salīdzina atšķaidīšanas ūdens kontrolgrupu un šķīdinātāja kontrolgrupu, veic attiecībā uz katru beigupunktu. Norādījumi par to, kā ar datiem par atšķaidīšanas ūdens kontrolgrupu un šķīdinātāja kontrolgrupu jārīkojas turpmākajā statistiskajā analīzē, atrodami OECD, 2006c (27). Visi bioloģiskās atbildreakcijas dati jāanalizē un testēšanas pārskatā jāiekļauj par katru dzimumu. Ja neizpildās parametriskajām metodēm vajadzīgie pieņēmumi – dati neatbilst normālajam sadalījumam (piemēram, Šapiro-Vilka tests (Shapiro-Wilk's test)) vai ir vērojama heterogēna dispersija (Bartleta tests (Bartlett's test) vai Levena tests (Levene's test)), jāapsver, vai pirms ANOVA veikšanas dati nebūtu jāpārveido, lai dispersijas homogenizētu, vai varbūt jāveic svērta ANOVA. Devas un atbildreakcijas nemonotonas sakarības gadījumā var izmantot Daneta (parametrisko) testu, kurā salīdzina vairākus pārus, vai Manna-Vitnija (Mann-Whitney) testu ar Bonferoni (Bonferroni) (neparametrisku) korekciju. Ja devas un atbildreakcijas sakarība ir aptuveni monotona, var izmantot citus statistiskos testus (piemēram, Džonkhīra-Terpstra testu (Jonckheere-Terpstra test) vai Viljamsa testu (Williams test)). Lai būtu vieglāk lemt, kurš statistiskais tests būtu vispiemērotākais, 8. papildinājumā sniegta statistiska diagramma. Papildu informācija pieejama arī ESAO “Document on Current Approaches to Statistical Analysis of Ecotoxicity Data” (27).
|
Ziņojums par testa rezultātiem
|
47.
|
Pētījuma rezultātos iekļauj šādu informāciju.
|
|
Testēšanas komplekss:
|
—
|
atbildīgie darbinieki un viņu pienākumi pētījumā;
|
|
—
|
katra laboratorija ir pierādījusi kvalifikāciju, izmantojot vairākas reprezentatīvas ķīmiskās vielas.
|
|
|
|
Testējamā ķīmiskā viela:
|
—
|
testējamās ķīmiskās vielas apraksts;
|
|
—
|
fizikālais stāvoklis un attiecīgās fizikālķīmiskās īpašības;
|
|
—
|
testa koncentrāciju pagatavošanas metode un biežums;
|
|
—
|
informācija par stabilitāti un bionoārdāmību.
|
|
|
|
Šķīdinātājs:
|
—
|
šķīdinātāja apraksts (īpašības, izmantotā koncentrācija);
|
|
—
|
šķīdinātāja izraudzīšanās pamatojums (ja šķīdinātājs nav ūdens).
|
|
|
|
Testa dzīvnieki:
|
—
|
piegādātājs un konkrētā piegādātājiestāde;
|
|
—
|
zivju vecums testa sākumā un reproduktīvais/nārstošanas statuss;
|
|
—
|
dati par dzīvnieku aklimatizācijas procedūru;
|
|
—
|
zivju ķermeņa svars ekspozīcijas sākumā (zivju parauga apakšparaugs).
|
|
|
|
Testēšanas apstākļi:
|
—
|
izmantotā testēšanas procedūra (testa tips, noslogojums, apdzīvotības blīvums u. c.);
|
|
—
|
izejšķīdumu pagatavošanas metode un caurplūdes;
|
|
—
|
nominālās testa koncentrācijas, iknedēļas izmērītās testa šķīdumu koncentrācijas un izmantotā analīzes metode, mērījumu vidējās vērtības un standartnovirzes testa traukos un pierādījumi tam, ka mērījumi raksturo testējamās ķīmiskās vielas koncentrācijas īstā šķīdumā;
|
|
—
|
atšķaidīšanas ūdens īpašības (tostarp pH, cietība, sārmainība, temperatūra, izšķīdušā skābekļa koncentrācija, atlikušā hlora līmenis, kopējais organiskais ogleklis, suspendētas cietās daļiņas un citi veiktie mērījumi);
|
|
—
|
ūdens kvalitāte testa traukos: pH, cietība, temperatūra un izšķīdušā skābekļa koncentrācija;
|
|
—
|
detalizēta informācija par barošanu (piemēram, barības(-u) veids(-i), avots, izbarotais daudzums un barošanas biežums, kā arī attiecīgo piesārņotāju (piemēram, PHB, PAO un hlororganisko pesticīdu) analīzes, ja tādas ir veiktas)
|
|
|
|
Rezultāti:
|
—
|
apliecinājums, ka kontrolgrupas atbildušas testa pieņemamības kritērijiem;
|
|
—
|
dati par mirstību ar jebkuru no testa koncentrācijām un kontrolgrupās;
|
|
—
|
izmantotās statistiski analītiskās metodes, datu apstrāde un izmantoto metožu pamatojums;
|
|
—
|
bioloģisko novērojumu dati par morfoloģiskajām pazīmēm, tostarp sekundārajām dzimumpazīmēm un vitelogenīnu;
|
|
—
|
datu analīzes rezultāti, ieteicams – tabulu un grafiku veidā;
|
|
—
|
novērojumi par zivju neraksturīgu izturēšanos un jebkāda redzama testējamās ķīmiskās vielas izraisīta ietekme.
|
|
|
NORĀDĪJUMI PAR REZULTĀTU INTERPRETĀCIJU UN PIEŅEMAMĪBU
|
48.
|
Šajā sadaļā sniegti daži apsvērumi, kas jāņem vērā testa rezultātu interpretēšanā attiecībā uz dažādajiem mērītajiem beigupunktiem. Ja rezultāti liecina, ka testējamā ķīmiskā viela izraisa acīmredzamu toksicitāti vai ietekmē testa dzīvnieka vispārīgo stāvokli, tie jāinterpretē piesardzīgi.
|
|
49.
|
Nosakot testējamās ķīmiskās vielas koncentrāciju diapazonu, jāraugās, lai netiktu pārsniegta maksimālā pieļaujamā koncentrācija, pie kuras iespējama jēgpilna datu interpretācija. Ir svarīgi veikt vismaz vienu apstrādi, kurā testējamās ķīmiskās vielas ietekmes pazīmes nav vērojamas. Slimību un toksiskas ietekmes pazīmes rūpīgi jānovērtē un jāatspoguļo ziņojumā. Piemēram, iespējams, ka VTG producēšanos zivju mātīšu organismā ietekmē arī vispārīgs vides toksiskums vai neendokrīna veida toksiska iedarbība, piemēram, hepatotoksicitāte. Tomēr interpretāciju par ietekmi var nostiprināt, izmantojot citus koncentrācijas līmeņus, kuros sistēmiskas toksicitātes maldinoša ietekme nav vērojama.
|
|
50.
|
Attiecībā uz testa rezultātu pieņemamību jāņem vērā vairāki aspekti. Vispārīgs norādījums ir tāds, ka tēviņu un mātīšu organismā VTG līmeņiem kontrolgrupās attiecībā uz melnajiem platgalvjiem un zebrzivīm jābūt izteiktiem un jāatšķiras aptuveni trīs reizes un attiecībā uz Japānas medakām – aptuveni par vienu lieluma kārtu. Kontrolgrupās un apstrādes grupās novēroto vērtību diapazonu piemēri ir pieejami validācijas pārskatos (1, 2, 3, 4). Augstas VTG vērtības kontrolgrupas tēviņu organismā var ietekmēt testa reaģētspēju un spēju konstatēt vājus estrogēna agonistus. Zemas VTG vērtības kontrolgrupas mātīšu organismā var ietekmēt testa reaģētspēju un spēju konstatēt aromatāzes inhibitorus un estrogēna antagonistus. Norādījumos ir izmantoti validācijas pētījumi.
|
|
51.
|
Ja laboratorija šādu testu iepriekš nav veikusi vai ja ir notikušas būtiskas pārmaiņas (piemēram, mainītas zivju līnijas vai piegādātājs), ir ieteicams veikt tehniskās kvalifikācijas pētījumu. Ieteicams izmantot ķīmiskās vielas ar atšķirīgu iedarbības veidu vai ietekmi uz testa beigupunktiem. Katrai laboratorijai būtu jāapkopo vēsturiski dati par tēviņu un mātīšu kontrolgrupām un jāveic tests ar pozitīvu ķīmisku kontrolvielu, kurai ir zināma estrogēniska iedarbība (piemēram, 17β-estradiols koncentrācijā 100 ng/l koncentrācijā vai zināms vājš agonists) un kura paaugstina VTG līmeni zivju tēviņu organismā, ar pozitīvu ķīmisku kontrolvielu, kura inhibē aromatāzi (piemēram, fadrozols vai prohlorāzs koncentrācijā 300 μg/l) un kura pazemina VTG līmeni zivju mātīšu organismā, un pozitīvu ķīmisku kontrolvielu, kurai ir androgēniska iedarbība (piemēram, 17β-trenbolons koncentrācijā 5 μg/l koncentrācijā) un kura ierosina sekundāro dzimumpazīmju veidošanos melnā platgalvja un Japānas medakas mātītēm. Šos datus var salīdzināt ar pieejamiem validācijas pētījumu datiem (1, 2, 3), lai būtu drošība par laboratorijas kvalifikāciju.
|
|
52.
|
Kopumā vitelogenīna mērījumi jāuzskata par pozitīviem, ja salīdzinājumā ar kontrolgrupu vismaz augstākajā testēto vielu koncentrācijas līmenī ir konstatēts statistiski nozīmīgs VTG palielinājums (p<0,05) tēviņu organismā vai statistiski nozīmīgs VTG samazinājums (p<0,05) mātīšu organismā, un vispārīgas toksicitātes pazīmes nav novērojamas. Pozitīvus rezultātus pamato, pierādot bioloģiski ticamu sakarību starp devu un atbildreakcijas līkni. Kā norādīts iepriekš, ne viss vitelogenīna samazinājums var būt endokrīnas cilmes, tomēr pozitīvs rezultāts kopumā jāinterpretē kā liecība par endokrīnu darbību in vivo, un šādā gadījumā parasti ir jāveic papildu izmeklējumi, lai precizētu rezultātus.
|
LITERATŪRA
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (atvērts 18.09.2008.).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104. lpp.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives; 103 Suppl 7: 173–8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology, 68(3): 277–91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology, 76(3-4): 343–52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences, 67(1): 121–30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology, 70(1): 11–21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology, 123(2): 113–25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C, 129 (3): 217–232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology, 130: 119-131.
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C., 131: 531–539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry, 21: 1699–1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol, 4: 87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science, 50: 301–308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry, 23(3): 774–81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76: 69-92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as “signposts,” not “traffic lights,” in risk assessment. Environmental Health Perspectives; 114 Suppl 1: 106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol., 47: 129–145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem., 27: 478–488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
|
(28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22
|
1. papildinājums
SAīsinājumi un definīcijas
|
|
Ķīmiskā viela ir viela vai to maisījums.
|
|
|
VK ir variācijas koeficients.
|
|
|
ELISA
ir imūnfermentatīvā analīze.
|
|
|
Noslogojums ir kopējais zivju mitro paraugu svars vienā ūdens tilpuma vienībā.
|
|
|
Apdzīvotības blīvums ir zivju skaits vienā ūdens tilpuma vienībā.
|
|
|
VTG
(vitelogenīns) ir olas dzeltenuma fosfolipīdu glikoproteīna prekursors, kas parasti veidojas organismā seksuāli aktīvām mugurkaulnieku mātītēm, kuras dēj olas/nērš ikrus.
|
|
|
HPG
ass ir hipotalāma, hipofīzes un gonādu ass.
|
|
|
MPK: maksimāli pieļaujamā koncentrācija, kas atbilst aptuveni 10 % no letālās koncentrācijas LK50.
|
|
|
Testējamā ķīmiskā viela: ir jebkura viela vai vielu maisījums, kuru testē, izmantojot šo testēšanas metodi.
|
2. papildinājums
Zivju endokrīnās sistēmas skrīninga testa eksperimentālie apstākļi
|
|
Melnais platgalvis
(Pimephales promelas)
|
Japānas medaka
(Oryzias latipes)
|
Zebrzivs
(Danio rerio)
|
|
|
Caurplūde
|
Caurplūde
|
Caurplūde
|
|
|
25 ± 2°C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Apgaismojuma kvalitāte
|
|
Luminiscences spuldzes (plaša spektra)
|
Luminiscences spuldzes (plaša spektra)
|
Luminiscences spuldzes (plaša spektra)
|
|
|
10-20 μE/m2/s, 540-1 000 lux vai 50-100 ft-c (līmenis laboratorijas telpā)
|
10-20 μE/m2/s, 540-1 000 lux vai 50-100 ft-c (līmenis laboratorijas telpā)
|
10-20 μE/m2/s, 540-1 000 lux vai 50-100 ft-c (līmenis laboratorijas telpā)
|
|
6.
|
Fotoperiods (rītausmas/krēslas pārejas ir ieteicamas, taču netiek neuzskatītas par nepieciešamām)
|
|
16 h gaisma, 8 h tumsa
|
12-16 h gaisma, 12-8 h tumsa
|
12-16 h gaisma, 12-8 h tumsa
|
|
|
<5 g uz l
|
<5 g uz l
|
<5 g uz l
|
|
|
10 l (minimālais izmērs)
|
2 l (minimālais izmērs)
|
5 l (minimālais izmērs)
|
|
|
8 l (minimālais izmērs)
|
1,5 l (minimālais izmērs)
|
4 l (minimālais izmērs)
|
|
10.
|
Testa šķīdumu tilpuma apmaiņu skaits
|
|
Vismaz 6 dienā
|
Vismaz 5 dienā
|
Vismaz 5 dienā
|
|
11.
|
Testa organismu vecums
|
|
Sk. 20. punktu.
|
Sk. 20. punktu.
|
Sk. 20. punktu.
|
|
12.
|
Pieaugušu zivju aptuvenais mitrā parauga svars (g)
|
|
Mātītes: 1,5 ± 20 %
Tēviņi: 2,5 ± 20 %
|
Mātītes: 0,35 ± 20 %
Tēviņi: 0,35 ± 20 %
|
Mātītes: 0,65 ± 20 %
Tēviņi: 0,4 ± 20 %
|
|
13.
|
Zivju skaits testa traukā
|
|
6 (2 tēviņi un 4 mātītes)
|
10 (5 tēviņi un 5 mātītes)
|
10 (5 tēviņi un 5 mātītes)
|
|
|
= 3 (plus attiecīgās kontrolgrupas)
|
= 3 (plus attiecīgās kontrolgrupas)
|
= 3 (plus attiecīgās kontrolgrupas)
|
|
15.
|
Trauku skaits katrā apstrādē
|
|
Vismaz 4
|
Vismaz 2
|
Vismaz 2
|
|
16.
|
Zivju skaits uz katru testa koncentrāciju
|
|
16 pieaugušas mātītes un 8 tēviņi (4 mātītes un 2 tēviņi katrā replikāta traukā)
|
10 pieaugušas mātītes un 10 tēviņi (5 mātītes un 5 tēviņi katrā replikāta traukā)
|
10 pieaugušas mātītes un 10 tēviņi (5 mātītes un 5 tēviņi katrā replikāta traukā)
|
|
|
Dzīvas vai saldētas pieaugušas vai nauplija stadijas okeāna garneles divas vai trīs reizes dienā (ad libitum), tirdzniecībā pieejama barība vai abu minēto veidu kombinācija
|
Nauplija stadijas okeāna garneles divas vai trīs reizes dienā (ad libitum), tirdzniecībā pieejama barība vai abu minēto veidu kombinācija
|
Nauplija stadijas okeāna garneles divas vai trīs reizes dienā (ad libitum), tirdzniecībā pieejama barība vai abu minēto veidu kombinācija
|
|
|
Nepiesātina, ja IS koncentrācija nav zemāka par 60 % no piesātinājuma ar gaisu
|
Nepiesātina, ja IS koncentrācija nav zemāka par 60 % no piesātinājuma ar gaisu
|
Nepiesātina, ja IS koncentrācija nav zemāka par 60 % no piesātinājuma ar gaisu
|
|
|
Tīrs virszemes, akas vai rekonstituēts ūdens vai krāna ūdens, no kura attīrīts hlors
|
Tīrs virszemes, akas vai rekonstituēts ūdens vai krāna ūdens, no kura attīrīts hlors
|
Tīrs virszemes, akas vai rekonstituēts ūdens vai krāna ūdens, no kura attīrīts hlors
|
|
20.
|
Pirmsekspozīcijas laiks
|
|
Ieteicams 7 dienas
|
Ieteicams 7 dienas
|
Ieteicams 7 dienas
|
|
21.
|
Ķīmiskās vielas ekspozīcijas ilgums
|
|
21 diena
|
21 diena
|
21 diena
|
|
22.
|
Bioloģiskie beigupunkti
|
|
izdzīvotība
izturēšanās
sekund. dzimumpazīmes
VTG
|
izdzīvotība
izturēšanās
sekund. dzimumpazīmes
VTG
|
izdzīvotība
izturēšanās
VTG
|
|
|
Izšķīdušais skābeklis >60 % piesātinājuma; vidējā temperatūra 25 ± 2 °C; izdzīvotība 90 % no zivīm kontrol grupās; izmērītās testa koncentrācijas 20 % robežās no vidējām izmērītajām vērtībām katrā apstrādes līmenī
|
Izšķīdušais skābeklis >60 % piesātinājuma; vidējā temperatūra 24 ± 2 °C; izdzīvotība 90 % no zivīm kontrolgrupās; izmērītās testa koncentrācijas 20 % robežās no vidējām izmērītajām vērtībām katrā apstrādes līmenī
|
Izšķīdušais skābeklis >60 % piesātinājuma; vidējā temperatūra 26 ± 2 °C; izdzīvotība 90 % no zivīm kontrolgrupās; izmērītās testa koncentrācijas 20 % robežās no vidējiem izmērītajām vērtībām katrā apstrādes līmenī
|
3. papildinājums
Dažas pieņemama atšķaidīšanas ūdens ķīmiskās īpašības
|
Sastāvdaļa
|
Koncentrācijas
|
|
Daļiņas
|
< 20 mg/l
|
|
Kopējais organiskais ogleklis
|
< 2 mg/l
|
|
Nejonizēts amonjaks
|
< 1 μg/l
|
|
Atlikušais hlors
|
< 10μg/l
|
|
Kopējie fosfororganiskie pesticīdi
|
< 50 ng/l
|
|
Kopējie hlororganiskie pesticīdi un polihlorbifenili
|
< 50 ng/l
|
|
Kopējais organiskais hlors
|
< 25 ng/l
|
4.A papildinājums
ZEBRZIVS NĀRSTA SUBSTRĀTS
Nārstošanas paplāte
: stikla instrumentu trauks, piemēram, 22 × 15 × 5.5 cm (g × p × dz), kas pārklāts ar noņemamu nerūsošā tērauda sietiņu (acs platums 2 mm). Sietiņam instrumentu trauka atvere jāpārklāj līdz noteiktam līmenim zem trauka malas.
Uz sietiņa fiksē nārsta substrātu. Jānodrošina iespēja zivīm to izmantot, piemēram, izmantojot mākslīgus akvārija augus, kas izgatavoti no zaļas plastmasas materiāla (NB: jāņem vērā testējamās ķīmiskās vielas iespējamā adsorbēšanās uz plastmasas materiāla). Plastmasas materiāls jāskalo pietiekamā daudzumā silta ūdens, lai nodrošinātu, ka testa ūdenī nenonāk nekādas ķīmiskas vielas. Ja izmanto stikla materiālus, jāgādā, ka zivis enerģisku kustību laikā netiek savainotas vai saspiestas.
Attālumam starp paplāti un tvertnes sienām jābūt vismaz 3 cm, lai nodrošinātu, ka nārstošana nenotiek ārpus paplātes. Uz paplātes iznērstie ikri izkrīt cauri sietiņam, un 45–60 minūtes pēc apgaismošanas sākuma no tiem var ņemt paraugus. Caurspīdīgie ikri ir nelīpoši, un šķērsgaismā tos var viegli saskaitīt. Ja katrā traukā izmanto piecas mātītes, līdz 20 ikriem dienā uzskatāms par zemu, līdz 100 – par vidēju, bet vairāk nekā 100 – par augstu rādītāju. Nārsta paplāte jāizņem, ikri jāsavāc, un nārsta paplāte iespējami vēlu vakarā vai ļoti agri no rīta jāievieto atpakaļ testa traukā. Laiks līdz atpakaļievietošanai nedrīkstētu pārsniegt vienu stundu, citādi nārsta substrāta ievietošana var ierosināt individuālu pārošanos un nārstošanu neraksturīgā laikā. Ja ir kādi apstākļi, kuru dēļ paplāte jāievieto vēlāk, tas jāizdara vismaz 9 stundas pēc apgaismošanas sākuma. Tik vēlu dienā nārstošana vairs netiek ierosināta.
4.B papildinājums
Melnā platgalvja nārsta substrāts
Katrā testa kamerā ievieto divas vai trīs kombinētas plastmasas/keramikas/stikla vai nerūsošā tērauda nārsta flīzes vai paplātes (piemēram, 80 mm garu pelēku pusapļa caurulīti, kas novietota uz 130 mm garas paplātes ar atlokiem) (sk. attēlu). Ir pierādīts, ka nārsta substrātam ir piemērotas attiecīgi sagatavotas PVC vai keramikas flīzes (Thorpe et al, 2007).
Lai uzlabotu saķeri/pielipšanu, flīzes ieteicams padarīt abrazīvas. Paplātei ir vajadzīgs siets, lai zivis nevarētu piekļūt nokritušajiem ikriem, ja vien nav pierādīts, ka ikri efektīvi līp pie izmantotā nārsta substrāta.

Pamatne ir veidota tā, lai saturētu ikrus, kas nepielīp pie flīžu virsmas un nokrīt līdz tvertnes dibenam (vai ikrus, kas iznērsti tieši uz plakanās plastmasas pamatnes). Visus nārsta substrātus pirms izmantošanas vismaz 12 stundas skalo atšķaidīšanas ūdenī.
ATSAUCES
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81: 90-98.
5.A papildinājums
Melnā platgalvja sekundāro dzimumpazīmju novērtēšana noteiktu endokrīni aktīvu ķīmisko vielu detektēšanai
Pārskats
Testējot endokrīnās sistēmas traucējumu izraisītājus, potenciāli svarīgas izskata pazīmes pieaugušiem melnajiem platgalvjiem ir ķermeņa krāsa (t. i., gaiša vai tumša), krāsojuma struktūra (t. i., ir vai nav vertikālas joslas), ķermeņa forma (t. i., galvas un krūšu daļas forma, vēdera apvidus uzpūšanās) un īpašas sekundārās dzimumpazīmes (t. i., nārsta kārpiņu skaits un lielums, pakauša segmenta un dējekļa lielums).
Nārsta kārpiņas reproduktīvi aktīviem melnā platgalvja tēviņiem atrodas uz galvas (uz pakauša segmenta) un parasti ir izkārtotas abpusēji simetriskā struktūrā (Jensen et al. 2001). Kontrolgrupas mātītēm un jauniem tēviņiem un mātītēm kārpiņu attīstīšanās nav novērojama (Jensen et al. 2001). Tēviņiem ap acīm un starp nāsīm var būt līdz astoņām atsevišķām kārpiņām. Vairums lielāko kārpiņu ir izkārtotas divās paralēlās līnijās tieši zem nāsīm un virs mutes. Daudzām zivīm kārpiņu grupas atrodas zem apakšžokļa; mutes tuvumā parasti atrodas viens kārpiņu pāris, tomēr tuvāk vēderam var atrasties līdz četrām kārpiņām. Reti ir vairāk nekā 30 kārpiņu (diapazons, 18–28; Jensen et al. 2001). Galvenās (skaita ziņā) kārpiņas ir atsevišķas, salīdzinoši apaļas struktūras, kuru augstums aptuveni līdzinās to rādiusam. Vairumam reproduktīvi aktīvo tēviņu ir arī vismaz dažas kārpiņas, kas ir tik palielinātas un izteiktas, ka nav atšķiramas kā atsevišķas struktūras.
Dažu endokrīnās sistēmas traucējumus izraisošu ķīmisko vielu ietekmē pretējā dzimuma īpatņiem var parādīties anormālas sekundārās dzimumpazīmes; piemēram, androgēna receptoru agonisti, piemēram, 17β-metiltestosterons vai 17β-trenbolons, var izraisīt nārsta kārpiņu veidošanos melnā platgalvja mātītēm (Smith 1974; Ankley et al. 2001; 2003), bet estrogēna receptoru agonisti var samazināt tēviņu nārsta kārpiņu skaitu un lielumu (Miles-Richardson et al. 1999; Harries et al. 2000).
Turpinājumā sniegts melnā platgalvja nārsta kārpiņu apraksts, pamatojoties uz procedūrām, kuras izmanto ASV Vides aizsardzības aģentūras laboratorija Minesotas štata Dulutā (U.S. Environmental Protection Agency lab in Duluth, MN). Konkrētos izstrādājumus un/vai aprīkojumu var aizstāt ar līdzvērtīgiem pieejamiem materiāliem.
Aplūkošanu vislabāk veikt ar apgaismotu palielināmo stiklu vai apgaismotu mikroskopu ar 3X palielinājumu. Apskatiet zivi no aizmugures un no priekšpuses (ar galvu pret skatītāju).
|
a)
|
Ievietojiet zivi mazā Petri platē (piemēram, ar 100 mm diametru), pavēršot to ar galvu pret skatītāju un ar vēderu uz leju. Fokusējiet skatu meklētāju, lai atrastu kārpiņas. Uzmanīgi un lēni apveliet zivi no viena sāna uz otru, lai noteiktu kārpiņu zonas. Saskaitiet kārpiņas un reģistrējiet to skaitu.
|
|
b)
|
Atkārtojiet apskati uz galvas vēderpuses virsmas, Petri platē pavēršot zivi ar muguru pret skatītāju.
|
|
c)
|
Katra zivs jāapskata 2 minūšu laikā.
|
Kārpiņu skaitīšana un novērtēšana
Melnajiem platgalvjiem ir identificētas sešas konkrētas zonas, kurās novērtē kārpiņu esamību un attīstīšanos. Ir sagatavota veidlapa, kurā var norādīt kārpiņu izvietojumu un daudzumu (sk. šī papildinājuma beigas). Kārpiņu skaitu reģistrē un to lielumu katram organismam kvantitatīvi novērtē atbilstoši šādai skalai: 0 – nav novērojama, 1 – ir novērojama, 2 – palielināta un 3 – izteikta (1. attēls).
0. kategorija – kārpiņas nav novērojamas. 1. kategorija – ir novērojamas; jebkura kārpiņa, kurai ir punkts, kurā tās augstums ir gandrīz vienāds ar rādiusu (diametru). 2 kategorija – palielināta; nosaka pēc audiem, kas izskatā atgādina zvaigznīti; parasti ar starveida pamatni un rievojumu no centrālās daļas. Kārpiņu augstums bieži vien ir nevienmērīgs, bet reizēm tās var būt apaļas. 3. kategorija – izteikta; parasti diezgan liela un noapaļota, ar mazāk izteiktu struktūru. Dažkārt šīs kārpiņas savienojas, izveidojot vienotu masu atsevišķā vai vairākās zonās (turpmāk norādītā B, C un D zona). Krāsojums un struktūra ir līdzīga 2. kategorijai, tomēr reizēm ar diezgan neskaidrām pazīmēm. Izmantojot šo kārpiņu novērtēšanas sistēmu, kopējais punktu skaits normālam kontrolgrupas tēviņam ar 18–20 kārpiņām parasti ir <50 (Jensen et al. 2001).
1. attēls
Dažām zivīm faktiskais kārpiņu skaits var pārsniegt veidnes rūtiņu skaitu (A papildinājums) attiecīgajai novērtējuma zonai. Šādā gadījumā papildu novērtējuma skaitļus var atzīmēt turpat pa labi vai pa kreisi no rūtiņas. Līdz ar to veidlapā nav jāatspoguļo simetrija. Papildu iespēja tādu kārpiņu kartēšanai, kas izvietotas pa pāriem vai vertikāli savienojušās gar mutes horizontālo plakni, ir divas reizes atzīmēt divu kārpiņu novērtējuma punktus vienā rūtiņā.
Kartēšanas zonas.
A– ap aci izvietotas kārpiņas. Kartē muguras-vēdera virzienā ap acs priekšējo gredzenu. Pieaugušiem kontrolgrupas tēviņiem parasti vairākas, kontrolgrupas mātītēm nav, androgēniem eksponētām mātītēm parasti pāris (pa vienai pie katras acs) vai viena.
B– kārpiņas starp nāsīm (sensoro kanālu porām). Vairāk nobriedušiem kontrolgrupas tēviņiem parasti pa pāriem (2 – palielināta vai 3 – izteikta). Kontrolgrupas mātītēm nav novērojamas, bet reizēm novērojamas un attīstās androgēniem eksponētām mātītēm.
C– kārpiņas, kas novietotas tieši nāšu priekšā, paralēli mutei. Nobriedušiem kontrolgrupas tēviņiem parasti palielinātas vai izteiktas. Mazāk attīstītiem tēviņiem vai androgēniem eksponētām mātītēm novērojamas vai palielinātas.
D– gar mutes līniju paralēli novietotas kārpiņas. Kontrolgrupas tēviņiem parasti tās vērtē kā attīstītas. Kontrolgrupas mātītēm to nav, bet androgēniem eksponētām mātītēm ir novērojamas.
E– kārpiņas uz apakšžokļa mutes tuvumā, parasti nelielas un pa pāriem. Mainīgā skaitā kontrolgrupas tēviņiem vai ar testējamo ķīmisko vielu apstrādātiem tēviņiem un ar testējamo ķīmisko vielu apstrādātām mātītēm.
F– kārpiņas izvietotas vēdera virzienā no E zonas. Parasti nelielas un pa pāriem. Novērojamas kontrolgrupas tēviņiem un androgēniem eksponētām mātītēm.
ATSAUCES
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem, 20: 1276– 1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem, 22: 1350–1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol, 34: 3003–3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C, 128: 127–141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol, 59: 515–523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol, 47: 129–145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool, 52: 1031–1038.
|
|
Kārpiņu uzskaites veidlapa
|
Skaitliskais novērtējums
|
|
ID
|
1-ir novērojama
|
|
Datums
|
2 – palielināta
|
|
Kopā punkti
|
3 – izteikta
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
5.B papildinājums
Japānas medakas sekundāro dzimumpazīmju novērtēšana noteiktu endokrīni aktīvu ķīmisko vielu detektēšanai
Turpinājumā sniegts Japānas medakas (Oryzias latipes) sekundāro dzimumpazīmju – kārpiņveida izaugumu (21) – mērījumu apraksts.
|
(1)
|
Pēc aknu izgriešanas (6. papildinājums) ķermeni ievieto koniskā centrifūgas stobriņā, kas satur 10 ml 10 % neitrāla formalīna buferšķīduma (augšpusē: galva, lejpusē: aste). Ja dzimumdziedzeris ir fiksēts šķīdumā, kas nav 10 % neitrāls formalīna buferšķīdums, ar nazi veic šķērsenisku griezienu starp anālās spuras priekšējo daļu un anālo atveri, raugoties, lai nebojātu ģenitālo poru un dzimumdziedzeri (3. attēls). Zivs ķermeņa priekšējo daļu ievieto fiksējošā šķīdumā, lai saglabātu dzimumdziedzeri, bet zivs astes daļu – 10 % neitrālā formalīna buferšķīdumā, kā norādīts iepriekš.
|
|
(2)
|
Kad zivs ķermenis ievietots 10 % neitrālā formalīna buferšķīdumā, ar pinceti satver anālās spuras priekšējo daļu un aptuveni uz 30 sekundēm to saliec, lai anālā spura būtu atvērta. Anālo spuru ar pinceti uzmanīgi satver aiz dažiem priekšējās daļas stariem tā, lai nesaskrambātu kārpiņveida izaugumus.
|
|
(3)
|
Pēc tam, kad anālā spura 30 sekundes ir turēta atplesta, zivs ķermeni līdz kārpiņveida izaugumu mērīšanai (jāmēra pēc vismaz 24 stundu fiksācijas) glabā istabas temperatūras 10 % neitrālā formalīna buferšķīdumā.
|
Mērīšana
|
(1)
|
Pēc tam, kad zivs ķermenis vismaz 24 stundas fiksēts 10 % neitrālā formalīna buferšķīdumā, to no koniskā centrifūgas stobriņa izņem un ar filtrpapīru (vai ar papīra dvieli) nosusina formalīnu.
|
|
(2)
|
Zivi novieto ar vēderu uz augšu. Tad uzmanīgi ar mazām secēšanai paredzētām šķērēm nogriež anālo spuru (anālo spuru ieteicams nogriezt kopā ar nelielu pterigiofora daudzumu).
|
|
(3)
|
Nogrieztās anālās spuras priekšējo daļu satver ar pinceti un noliek uz priekšmetstikliņa, uz kura ir daži pilieni ūdens. Pēc tam anālo spuru pārklāj ar segstikliņu. Anālo spuru ar pinceti satver saudzīgi, lai nesaskrambātu kārpiņveida izaugumus.
|
|
(4)
|
Izmantojot skaitītāju zem bioloģiskā mikroskopa (stateniskā mikroskopa vai invertētā mikroskopa), saskaita spuras staru skrimšļa posmus ar kārpiņveida izaugumiem. Kārpiņveida izaugumus atzīst tad, ja nelieli izaugumi ir redzami uz spuras staru skrimšļa posmu aizmugurējās daļas. Darba lapā ieraksta kārtas skaitli spuras staram ar kārpiņveida izaugumu skaitu uz skrimšļa posmiem (piemēram, pirmajā spuras starā: 0, otrajā spuras starā: 10, trešajā spuras starā: 12 utt.), un kopsummu katrai zivij norāda Excel izklājlapā. Ja nepieciešams, nofotografē anālo spuru un fotogrāfijā saskaita spuru staru skrimšļa posmos esošos kārpiņveida izaugumus.
|
|
(5)
|
Pēc mērīšanas anālo spuru ievieto glabāšanai (1) punktā minētajā konusveida kolbā.
|
1. attēls.
Anālās spuras formas un lieluma atšķirības starp dzimumiem. A – tēviņa anālā spura; B – mātītes anālā spura. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
2. attēls.
A – izaugumi uz anālās spuras staru skrimšļa posmiem; J.P., skrimšļa posmi; A.A. – attālums starp asīm; P. – izaugumi; B – anālās spuras distālais izvirzījums. Aktinotrihija šķiedras (Act.) atrodas spuras galā. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

3. attēls.
Zivs ķermeņa fotogrāfija, kurā redzama griezuma vieta gadījumā, kur dzimumdziedzeris ir fiksējošā šķīdumā, kas nav 10 % neitrāls formalīna buferšķīdums. Šajā gadījumā atlikušo ķermeņa daļu ar nazi nogriež starp anālās spuras priekšējo daļu un anālo atveri (sarkanā līnija), un zivs ķermeņa priekšdaļu ievieto dzimumdziedzerim paredzētajā fiksējošajā šķīdumā, bet zivs astes daļu ievieto 10 % neitrālā formalīna buferšķīdumā.

6. papildinājums
Ieteicamā paraugu ņemšanas kārtība vitelogenīna analīzei
Jāuzmanās, lai tēviņu un mātīšu VTG paraugi savstarpēji nekontaminētos.
1.A procedūra. Melnais platgalvis; asins paraugu ņemšana no astes vēnas/artērijas
Pēc anestezēšanas asti daļēji atdala ar skalpeļa asmeni un ar heparinizētu mikrohematokrīta kapilārstobriņu no astes vēnas/artērijas ievāc asins paraugu. Pēc asins parauga paņemšanas plazmu ātri atdala, centrifugējot 3 minūtes ar paātrinājumu 15 000 g (vai 10 minūtes ar paātrinājumu 15 000 g 4 °C temperatūrā). Ja nepieciešams, pēc centrifugēšanas var noteikt hematokrīta procentuālo daudzumu. Plazmas daļu no mikrohematokrīta caurulītes izņem un glabā centrifūgas stobriņā ar 0,13 vienībām aprotinīna (proteāzes inhibitors) – 80 °C temperatūrā, līdz ir iespējama vitelogenīna noteikšana. Atkarībā no melnā platgalvja lieluma (atkarīgs no dzimuma) ievācamā asins parauga tilpums parasti ir 5 līdz 60 mikrolitri no zivs (Jensen et al. 2001).
1.B procedūra. Melnais platgalvis; sirds asins paraugu ņemšana
Asins paraugus var ņemt arī ar sirds punkcijas metodi, izmantojot heparinizētu šļirci (1 000 heparīna vienības uz ml). Asinis ievieto Ependorfa mēģenēs (uz ledus) un centrifugē (5 minūtes, 7 000 g, istabas temperatūrā). Plazmu ievieto tīrās Ependorfa mēģenēs (ja ar plazmas daudzumu tas iespējams, alikvotās) un līdz analīzes veikšanai nekavējoties sasaldē – 80 °C temperatūrā (Panter et al., 1998).
2.A procedūra. Japānas medaka; aknu izgriešana
Testa zivju izņemšana no testa kameras
|
(1)
|
Testa zivi no testa kameras izņem ar nelielu sietiņkaroti. Jāraugās, lai testa zivis neiekristu citās testa kamerās.
|
|
(2)
|
Testa zivis jāizņem šādā kārtībā: kontrolgrupa, šķīdinātāja kontrolgrupa (attiecīgā gadījumā), zemākās koncentrācijas grupa, vidējās koncentrācijas grupa, augstākās koncentrācijas grupa un pozitīvās kontroles grupa. Turklāt no vienas testa kameras vispirms izņem visus tēviņus, tikai pēc tam izņem mātītes.
|
|
(3)
|
Katras testa zivs dzimumu nosaka pēc ārējām sekundārām dzimumpazīmēm (piemēram, pēc anālās spuras formas).
|
|
(4)
|
Testa zivi ievieto pārvietošanas traukā un pārnes uz darba vietu, kur notiek aknu izgriešana. Pēc marķējuma pārbauda, vai ir pareiza testēšanas kamera un pārvietošanas trauks, un pārliecinās, ka no testēšanas kameras izņemto zivju skaits un testēšanas kamerā palikušo zivju skaits ir attiecīgi.
|
|
(5)
|
Ja dzimumu nav iespējams noteikt pēc zivju izskata, no testēšanas kameras izņem visas zivis. Šādā gadījumā dzimumu nosaka, ar stereoskopisko mikroskopu aplūkojot dzimumdziedzerus vai sekundārās dzimumpazīmes.
|
Aknu izgriešana
|
(1)
|
Testa zivis no pārvietošanas trauka ar nelielu sietiņkaroti ieceļ anestēzijas šķīdumā.
|
|
(2)
|
Pēc testa zivju anestezēšanas tās ar pinceti (patēriņu preču tips) novieto uz filtrpapīra (vai uz papīra dvieļa). Testa zivi ar pinceti satver aiz galvas sāniem, lai nesalauztu asti.
|
|
(3)
|
Ūdeni no testa zivs virsmas nosusina ar filtrpapīru (vai ar papīra dvieli).
|
|
(4)
|
Zivi novieto ar vēderu uz augšu. Pēc tam ar secēšanas šķērēm veic nelielu šķērsenisku iegriezumu pusceļā starp kakla vēderpuses daļu un vēdera vidusdaļu.
|
|
(5)
|
Secēšanas šķēres ievieto nelielajā iegriezumā un pa vēdera viduslīniju uzšķērž vēderu no bronhu apvalka astes puses punkta līdz anālajai atverei galvaskausa pusē. Jāraugās, lai secēšanas šķēres neievietotu pārāk dziļi, bojājot aknas vai dzimumdziedzerus.
|
|
(6)
|
Zem stereoskopiskā mikroskopa veic šādas darbības.
|
|
(7)
|
Testa zivi ar vēderu uz augšu novieto uz papīra dvieļa (uz stikla Petri plates vai priekšmetstikliņa, ja tāds arī ir pieejams).
|
|
(8)
|
Vēdera dobuma sienas papleš ar precīzijas pinceti un izņem iekšējos orgānus. Ja nepieciešams, iekšējos orgānus var izņemt, atdalot vienu no vēdera dobuma sienām.
|
|
(9)
|
Ar vēl vienu precīzijas pincešu pāri vēdera dobumu paver tā, lai būtu redzamas aknu un žultspūšļa savienojuma vieta. Tad satver žultsceļu un nogriež žultspūsli. Jāuzmanās, lai žultspūslis nepārplīstu.
|
|
(10)
|
Satver barības vadu un tādā pašā veidā no aknām atdala kuņģa un zarnu traktu. Jāraugās, lai neizlītu kuņģa un zarnu trakta saturs. Kuņģa un zarnu traktu astes pusē atdala no anālās atveres, un traktu izņem no vēdera dobuma.
|
|
(11)
|
No aknām notīra taukus un citus audus. Jāraugās, lai aknas nesaskrambātu.
|
|
(12)
|
Ar precīzijas pinceti satver aknu portālo zonu, un aknas izņem no vēdera dobuma.
|
|
(13)
|
Aknas novieto uz priekšmetstikliņa. Ja nepieciešams, ar precīzijas pinceti no aknu virsmas noņem palikušos taukus un svešos audus (piemēram, vēderplēvi).
|
|
(14)
|
Aknas ievieto 1,5 ml mikromēģenē, ko izmanto par taru, un ar elektroniskiem analītiskajiem svariem nosaka aknu svaru. Vērtību reģistrē darba lapā (nolasījuma precizitāte: 0,1 mg). Pārbauda identifikācijas informāciju uz mikromēģenes etiķetes.
|
|
(15)
|
Mikromēģenei, kurā ir aknas, uzliek vāciņu. Mikromēģeni glabā dzesēšanas statīvā (vai statīvā ar ledu).
|
|
(16)
|
Pēc vienu aknu izgriešanas secēšanas instrumentus notīra vai aizvieto ar tīriem instrumentiem.
|
|
(17)
|
Pēc šiem norādījumiem aknas izņem visām pārvietošanas traukā esošajām zivīm.
|
|
(18)
|
Kad visām pārvietošanas traukā esošajām zivīm aknas ir izņemtas (t. i., no visiem tēviņiem vai mātītēm no testa kameras), visus aknu paraugus ievieto mēģeņu statīvā ar identifikācijas etiķeti un noglabā saldētavā. Ja aknas drīz pēc izgriešanas nodod priekšapstrādei, paraugus uz nākamo darba vietu nogādā dzesēšanas statīvā (vai statīvā ar ledu).
|
Pēc aknu izgriešanas zivs ķermeni var izmantot sekundāro dzimumpazīmju mērīšanai.
Paraugi
Ja testa zivju aknu paraugus drīz pēc izgriešanas nenodod priekšapstrādei, tos glabā ≤ – 70 °C temperatūrā.
1. att.
Ar šķērēm izdara griezumu tieši pirms krūšuspurām.

2. att.
Ar šķērēm līdz punktam aptuveni 2 mm no anālās atveres galvas virzienā uzšķērž vēdera viduslīniju.
3. att.
Vēdera sienas papleš ar knaiblītēm, lai atsegtu aknas un citus iekšējos orgānus. (Vēdera sienas var ar sekcijas adatām atspraust uz sāniem.)
4. att.
Atdala un ar knaiblītēm izgriež aknas.
5. att.
Ar knaiblītēm saudzīgi atvirza zarnas.
6. att.
Ar knaiblītēm atdala abus zarnu galus un jebkādas apzarņa daļas.

7. att. (mātīte)
Mātītēm veic identisku procedūru.

8. att.
Pabeigta procedūra.
2.B procedūra.Japānas medakas (Oryzias latipes) aknu priekšapstrāde vitelogenīna analīzes veikšanai.
No ELISA komplekta ņem homogenāta buferšķīduma pudelīti un to atdzesē sasmalcināta ledus šķīdumā (šķīduma temperatūra: ≤ 4 °C). Ja izmanto homogenāta buferšķīdumu no EnBio ELISA sistēmas, šķīdumu istabas temperatūrā atkausē, bet pēc tam pudelīti dzesē sadrumstalota ledus šķīdumā.
Homogenāta buferšķīduma daudzumu aknām aprēķina, pamatojoties uz to svaru (uz 1 mg aknu svara pievieno 50 μl homogenāta buferšķīduma). Piemēram, aknām, kas sver 4,5 mg, nepieciešams 225 μl homogenāta buferšķīduma. Sagatavo homogenāta buferšķīduma tilpuma sarakstu visām aknām.
Aknu sagatavošana priekšapstrādei:
|
(1)
|
1,5 ml mikromēģeni ar aknu paraugu no saldētavas izņem tieši pirms priekšapstrādes;
|
|
(2)
|
lai nepieļautu kontaminēšanos ar vitelogenīnu, tēviņu aknām priekšapstrādi veic, pirms apstrādā mātīšu aknas. Turklāt priekšapstrādi testa grupām veic šādā secībā: kontrolgrupa, šķīdinātāja kontrolgrupa (attiecīgos gadījumos), zemākās koncentrācijas grupa, vidējās koncentrācijas grupa, augstākās koncentrācijas grupa un pozitīvā kontrolgrupa;
|
|
(3)
|
no saldētavas noteiktā laikā izņemt drīkst tikai tādu skaitu 1,5 ml mikromēģeņu ar aknu paraugiem, cik šajā laikā var centrifugēt;
|
|
(4)
|
1,5 ml mikromēģenes ar aknu paraugiem pēc paraugu numuriem sakārto statīvā ar ledu (aknas nav jāatkausē).
|
Priekšapstrādes norise
1. Homogenizācijas buferšķīduma pievienošana:
|
(1)
|
sarakstā pārbauda attiecīgajam aknu paraugam izmantojamo homogenāta buferšķīduma daudzumu un mikropipeti (daudzuma diapazons: 100–1 000 μl) pielāgo attiecīgajam daudzumam. Mikropipetei uzliek tīru uzgali;
|
|
(2)
|
1,5 ml mikromēģenē ar aknu paraugu no reaģenta pudelītes pievieno homogenāta buferšķīdumu;
|
|
(3)
|
ievērojot iepriekš norādīto procedūru, homogenāta buferšķīdumu pievieno visās 1,5 ml mikromēģenēm ar aknu paraugiem. Mikropipetes uzgali nav nepieciešams aizstāt ar jaunu. Tomēr, ja uzgalis ir kontaminēts vai varētu tāds būt, tas jānomaina.
|
2. Aknu homogenizācija:
|
(1)
|
mikromēģenes homogenizatoram pievieno jaunu homogenizācijas piestu;
|
|
(2)
|
piestu ievieto 1,5 ml mikromēģenē. Mikromēģenes homogenizatoru tur tā, lai aknas piespiestu starp piestas virsmu un 1,5 ml mikromēģenes iekšējo sieniņu;
|
|
(3)
|
mikromēģenes homogenizatoru darbina 10 līdz 20 sekundes. Procesa laikā 1,5 mikromēģeni dzesē ar sadrumstalotu ledu;
|
|
(4)
|
piestu izceļ no 1,5 ml mikromēģenes un nogaida aptuveni 10 sekundes. Pēc tam suspensiju pārbauda vizuāli;
|
|
(5)
|
ja suspensija ir novērojami aknu gabaliņi, (3) un (4) darbību atkārto, līdz ir sagatavots pieņemams aknu homogenāts;
|
|
(6)
|
aknu homogenāta suspensiju līdz centrifugēšanai dzesē statīvā ar ledu;
|
|
(7)
|
pēc katra homogenāta sagatavošanas piestu aizstāj ar jaunu;
|
|
(8)
|
visas aknas homogenizē ar homogenāta buferšķīdumu, ievērojot iepriekš norādīto procedūru.
|
3. Aknu homogenāta suspensijas centrifugēšana:
|
(1)
|
pārliecinās, ka atdzesētajā centrifūgas kamerā temperatūra ir ≤ 5 °C;
|
|
(2)
|
1,5 ml mikromēģenes ar aknu homogenāta suspensiju ievieto atdzesētā centrifūgā (ja, nepieciešams, noregulē līdzsvaru);
|
|
(3)
|
aknu homogenāta suspensiju 10 min. centrifugē ar 13 000 g ≤ 5 °C temperatūrā. Tomēr, ja centrifugāti ir pietiekami atdalīti, centrifugēšanas spēku un laiku var regulēt pēc vajadzības;
|
|
(4)
|
pēc centrifugēšanas pārliecinās, ka centrifugāti ir pietiekami atdalīti (virsslānis: lipīdi, vidējais slānis: centrifugāta šķīdums, apakšslānis: aknu audi). Ja atdalīšana nav pietiekama, suspensiju centrifugē vēlreiz, ievērojot tos pašus nosacījumus;
|
|
(5)
|
visus paraugus izņem no atdzesētās centrifūgas un paraugu numuru secībā sakārto statīvā ar ledu. Jāraugās, lai atdalītie slāņi pēc centrifugēšanas atkal nesuspendētos.
|
4. Centrifugātu ievākšana:
|
(1)
|
četras centrifugāta glabāšanai paredzētās 0,5 ml mikromēģenes ievieto mēģeņu statīvā;
|
|
(2)
|
ar mikropipeti ievāc 30 μl katra centrifugāta (atdalīts kā atsevišķs slānis) un ievada vienā 0,5 ml mikromēģenē. Jāraugās, lai neievāktu lipīdus no virsslāņa vai aknu audus no apakšslāņa;
|
|
(3)
|
tādā pašā veidā centrifugātu ievāc un ievada citās divās 0,5 ml mikromēģenēs;
|
|
(4)
|
ar mikropipeti ievāc atlikušo centrifugātu (ja iespējams: ≥ 100 μl). Pēc tam centrifugātu ievada ceturtajā 0,5 ml mikromēģenē. Jāraugās, lai neievāktu lipīdus no virsslāņa vai aknu audus no apakšslāņa;
|
|
(5)
|
0,5 ml mikromēģeni aizdara ar vāciņu un uz etiķetes norāda centrifugāta daudzumu. Pēc tam mikromēģenes nekavējoties atdzesē statīvā ar ledu;
|
|
(6)
|
katra centrifugāta ievākšanai mikropipetes uzgali aizstāj ar jaunu. Ja uzgalim pielīp liels daudzums lipīdu, uzgali nekavējoties aizstāj ar jaunu, lai nepieļautu aknu ekstrakta piesārņošanos ar taukiem;
|
|
(7)
|
saskaņā ar iepriekš aprakstīto procedūru visu centrifugēto centrifugātu ievada četrās 0,5 ml mikromēģenēs;
|
|
(8)
|
pēc centrifugāta ievadīšanas 0,5 ml mikromēģenēs tās ievieto mēģeņu statīvā ar identifikācijas etiķeti un nekavējoties sasaldē saldētavā. Ja VTG koncentrācijas mēra tūlīt pēc priekšapstrādes, vienu 0,5 ml mikromēģeni (ar 30 μl centrifugāta) atstāj dzesēties mēģeņu statīvā un nogādā darba vietā, kurā veic ELISA testu. Šādā gadījumā pārējās mikromēģenes ievieto mēģeņu statīvos un sasaldē saldētavā;
|
|
(9)
|
pēc centrifugāta ievākšanas atlikumu atbilstīgi likvidē.
|
Paraugu glabāšana
Aknu homogenāta centrifugātu saturošās 0,5 ml mikromēģenes līdz izmantošanai ELISA glabā ≤ – 70 °C temperatūrā.
3.A procedūra. Zebrzivs; asins paraugu ņemšana no astes vēnas/artērijas
Uzreiz pēc anestezēšanas asti šķērseniski atdala un ar heparinizētu mikrohematokrīta kapilārcaurulīti no astes artērijas/vēnas izvada asinis. Asins daudzums atkarībā no zivs lieluma var būt 5 līdz 15 μl. Mikrokapilāra caurulītē pievieno tādu pašu tilpumu aprotinīna buferšķīduma (6 μgml fosfāta fizioloģiskajā buferšķīdumā (PBS)) un centrifugējot atdala plazmu no asinīm (5 minūtes pie 600 g). Plazmu ievāc testa mēģenēs un līdz vitelogenīna vai citu interesējošo proteīnu analizēšanai glabā – 20 °C temperatūrā.
3.B procedūra. Zebrzivs; asins paraugu ņemšana ar sirds punkciju
Lai nepieļautu asins koagulāciju un proteīnu noārdīšanos, paraugus ievāc fosfāta fizioloģiskajā buferšķīdumā (PBS), kas satur heparīnu (1 000 vienības/ml) un proteāzes inhibitoru aprotinīnu (2 TIU/ml). Ieteicamās buferšķīduma sastāvdaļas ir heparīna amonija sāls un liofilizētais aprotinīns. Asins paraugu ņemšanai ieteicams izmantot šļirci (1 ml) ar fiksētu smalku adatu (piemēram, Braun Omnikan-F). Šļircē iepriekš iepilda buferšķīdumu (aptuveni 100 μl), lai no katras zivs pilnībā eluētu mazus asins daudzumus. Asins paraugus ņem, izmantojot sirds punkciju. Vispirms zivi anestezē ar MS-222 (100 mg/l). Pareizā anestēzijas līmenī iespējams atšķirt zebrzivs sirdsdarbības fāzes. Veicot sirds punkciju, uz šļirces virzuli izdara nelielu spiedienu. Asins parauga lielums var būt 20–40 mikrolitru. Pēc sirds punkcijas asins un buferšķīduma maisījums jāiepilda testa mēģenē. Plazmu no asinīm atdala centrifugējot (20 min; 5 000 g) un līdz nepieciešamo analīžu veikšanai glabā – 80 °C.
3.C procedūra. SOP: zebrzivs; galvas un astes homogenizācija
|
(1)
|
Zivis anestezē un eitanazē atbilstoši testēšanas procedūrai.
|
|
(2)
|
Zivīm atbilstoši 1. attēlam nogriež galvu un asti.
|
Svarīgi. Pirms katras nākamās zivs apstrādes visi sadalīšanas instrumenti un griešanas paliktnis pienācīgi jānoskalo un jānotīra (piemēram, ar 96 % etanolu), lai neeksponētu tēviņu organismus “nepiesārņotu ar vitelogenīnu” no mātītēm vai ķīmiskajai vielai eksponētiem tēviņiem.
1. attēls
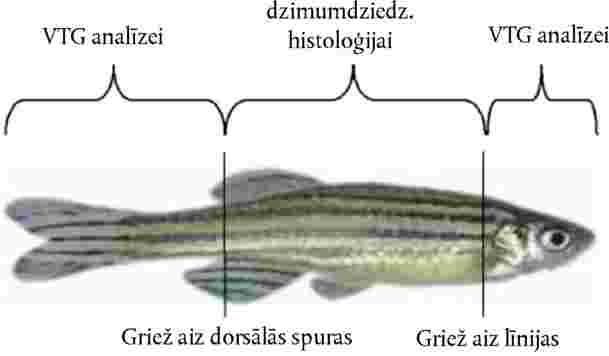
|
(3)
|
Katras zivs galvas un astes svaru nosaka, noapaļojot līdz tuvākajam mg.
|
|
(4)
|
Pēc nosvēršanas zivs daļas ievieto attiecīgās mēģenēs (piemēram, 1,5 mg Ependorfa mēģenēs) un līdz homogenizēšanai sasaldē – 80 °C temperatūrā vai tieši homogenizē uz ledus ar diviem plastmasas irbuļiem. (Ja vien darbības veic uz ledus un tiek iegūta viendabīga masa, var izmantot arī citas metodes.) Svarīga piezīme: mēģenes pienācīgi numurē, lai zivs galva un aste būtu sasaistāma ar attiecīgo ķermeņa daļu, ko izmanto dzimumdziedzeru histoloģijai.
|
|
(5)
|
Pēc viendabīgas masas iegūšanas pievieno ledus temperatūras homogenizācijas buferšķīdumu (22), kura svars 4 reizes pārsniedz audu svaru. Turpina darboties ar irbuļiem, līdz iegūst viendabīgu maisījumu. Svarīga piezīme: katrai zivij izmanto jaunus irbuļus.
|
|
(6)
|
Līdz 30 min centrifugēšanai 4 °C temperatūrā pie 50 000 × g paraugus novieto uz ledus.
|
|
(7)
|
Ar pipeti vismaz divās mēģenēs katrā iepilda 20 μl centrifugāta, pipetes uzgali ievietojot zem virspusē esošā tauku slāņa un rūpīgi iesūcot centrifugātu bez tauku vai plāksnīšu daļiņām.
|
|
(8)
|
Līdz izmantošanai mēģenes glabā – 80 °C temperatūrā.
|
7. papildinājums
Stiprināti vitelogenīna paraugi un vairākiem testiem kopīga references standartviela
Katrā dienā, kad veic vitelogenīna testus, analizē stiprinātu paraugu, kas pagatavots, izmantojot vairākiem testiem kopīgu references standartvielu. Testiem kopīgās references standartvielas pagatavošanai izmantotais vitelogenīns nedrīkst būt no tās partijas, ko izmanto veicamā testa kalibrācijas etalonu sagatavošanā.
Stiprināto paraugu sagatavo, kontrolgrupas tēviņa plazmas paraugam zināmā daudzumā pievienojot testiem kopīgo references standartvielu. Paraugu stiprina, lai vitelogenīna koncentrācija būtu 10 un 100 reizes lielāka nekā paredzamā vitelogenīna koncentrācija kontrolgrupas zivs tēviņa organismā. Kontrolgrupas tēviņa plazmas paraugs, kuru stiprina, var būt no vienas zivs vai no vairākām zivīm.
Vismaz divās dublikātiedobēs analizē apakšparaugu ar nestiprinātu kontrolgrupas tēviņa plazmu. Vismaz divās dublikātiedobēs analizē arī stiprināto paraugu. Lai noteiktu sagaidāmo koncentrāciju, vitelogenīna vidējo daudzumu abos nestiprinātajos kontrolgrupas tēviņa plazmas paraugos pieskaita aprēķinātajam vitelogenīna daudzumam, kas pievienots paraugu stiprināšanai. Šo sagaidāmās koncentrācijas un izmērītās koncentrācijas attiecību kopā ar katra attiecīgajā dienā veiktā testa rezultātiem norāda testēšanas ziņojumā.
8. papildinājums
Lēmumu diagramma statistiskajā analīzē
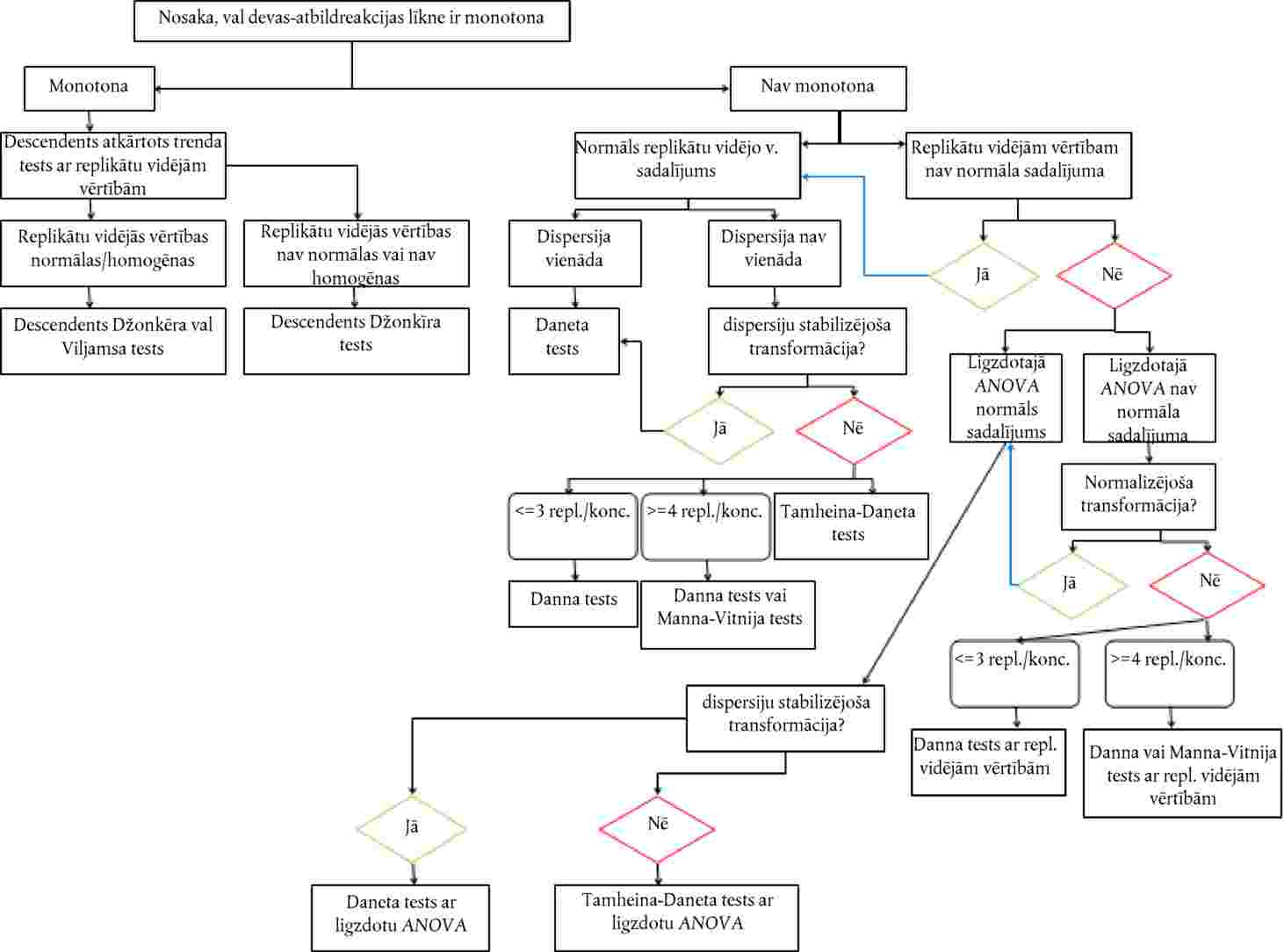
C.38. ABINIEKU METAMORFOZES TESTS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 231 (2009. gads). Tā kā pastāv bažas, ka vidē esošās ķīmiskās vielas var negatīvi ietekmēt cilvēkus un savvaļas sugas, ir nepieciešams izstrādāt un apstiprināt testu vairogdziedzera darbību ietekmējošo ķīmisko vielu noteikšanai mugurkaulnieku sugām. ESAO 1998. gadā uzsāka prioritāru rīcību, lai pārskatītu esošos un izstrādātu jaunus testēšanas norādījumus par potenciālu endokrīnās sistēmas traucējumu izraisītāju noteikšanu un testēšanu. Viens no minētās rīcības elementiem bija izveidot testēšanas norādījumus, kas ļautu noteikt ķīmiskās vielas, kuras ietekmē mugurkaulnieku sugu vairogdziedzera darbību. Tika ierosināts atkārtotas devas 28 dienu orālās toksicitātes pētījuma ar grauzējiem uzlabojums (šā pielikuma B.7. nodaļa) un abinieku metamorfozes tests (AMT). Tika apstiprināta uzlabotā testēšanas metode B.7 un izdota pārskatītā testēšanas metode. Abinieku metamorfozes testam (AMT) veica vērienīgu validācijas programmu, kurā ietilpa pētījumi laboratorijā un starp laboratorijām, kas parādīja testa atbilstību un ticamību (1, 2). Pēc tam neatkarīga ekspertu grupa ar salīdzinošās izvērtēšanas palīdzību veica testa validāciju (3). Šī testēšanas metode izstrādāta, ņemot vērā pieredzi, kas gūta vairogdziedzera darbību ietekmējošo ķīmisko vielu noteikšanas testu validācijas pētījumos un darbā, kas īstenots vairākās ESAO dalībvalstīs.
|
TESTA PRINCIPS
|
2.
|
Abinieku metamorfozes tests (AMT) ir skrīninga tests, kas paredzēts, lai empīriski identificētu ķīmiskās vielas, kuras var traucēt normālu hipotalāma-hipofīzes-vairogdziedzera (HHV) ass sistēmas darbību. AMT atbilst vispārīgam mugurkaulnieku modelim tādā ziņā, ka tas attiecas uz HHV ass sistēmas saglabātajām struktūrām un funkcijām. Tests ir nozīmīgs, jo abinieku metamorfoze nodrošina labi izpētītu, no vairogdziedzera darbības atkarīgu procesu, kas atbild uz HHV ass sistēmā aktīvām ķīmiskajām vielām, un šis ir vienīgais esošais tests, ar ko nosaka vairogdziedzera aktivitāti dzīvniekam morfoloģiskās attīstības laikā.
|
|
3.
|
Standarta eksperimenta plāns paredz veikt testu ar gludās piešvardes (Xenopus laevis) 51. attīstības stadijas kurkuļiem, ko 21 dienu eksponē vismaz trijām dažādām testējamās vielas koncentrācijām, kā arī – kontroles nolūkā – atšķaidīšanas ūdenim. Katrai testa apstrādei ir četri replikāti. Testa sākumā visām apstrādes grupām katrā testēšanas tvertnē atrodas 20 kurkuļi. Novērojamie beigupunkti ir pakaļējās ekstremitātes garums, garums no purna (galvas priekšdaļas) līdz kloākai (SVL – snout to vent lenght), attīstības stadija, mitrais svars, vairogdziedzera histoloģija un mirstības novērojumi katru dienu.
|
METODES APRAKSTS
Testa sugas
|
4.
|
Gludā piešvarde (Xenopus laevis) ir visā pasaulē bieži laboratorijās kultivēta suga, kas viegli iegūstama no komerciālajiem piegādātājiem. Izmantojot cilvēka horiona gonadotropīna (hCG) injekcijas, šai sugai visa gada garumā ir viegli ierosināma vairošanās, un iegūtie kurkuļi ir lielā skaitā viegli izaudzējami līdz izvēlētajām attīstības stadijām, ļaujot izmantot attīstības stadijām specifiskus testēšanas protokolus. Testā vēlams izmantot turpat uz vietas no pieaugušiem īpatņiem iegūtus kurkuļus. Mazāk ieteicama alternatīva ir ikru un embriju nosūtīšana uz testēšanas laboratoriju, kurā tiek veikta aklimatizācija; nav pieļaujama testā izmantojamās stadijas kurkuļu piegāde.
|
Iekārtas un aprīkojums
|
5.
|
Testa veikšanai nepieciešamas šādas iekārtas un aprīkojums:
|
a)
|
ekspozīcijas sistēma (sk. aprakstu turpmāk);
|
|
b)
|
stikla vai nerūsējošā tērauda akvāriji (sk. aprakstu turpmāk);
|
|
d)
|
temperatūras regulēšanas aprīkojums (piem., sildītāji vai dzesētāji (noregulējami uz 22° ± 1 °C));
|
|
f)
|
binokulārais preparēšanas mikroskops;
|
|
g)
|
digitālā kamera ar vismaz 4 megapikseļu izšķirtspēju un makrorežīmu;
|
|
h)
|
attēlu digitalizēšanas programmatūra;
|
|
i)
|
Petri plate (piem., 100 × 15 mm) vai līdzīga izmēra caurspīdīga plastmasas kamera;
|
|
j)
|
analītiskie svari, ar kuriem iespējams veikt mērījumus līdz trīs zīmēm aiz komata (mg);
|
|
k)
|
ūdenī izšķīdušā skābekļa mērītājs;
|
|
m)
|
gaismas intensitātes mērītājs, kas rezultātus uzrāda luksos;
|
|
n)
|
dažādi laboratorijas trauki un piederumi;
|
|
o)
|
regulējamās pipetes (10–5 000 μl) vai atbilstošu lielumu pipešu komplekts;
|
|
p)
|
testējamā ķīmiskā viela testa veikšanai pietiekamā daudzumā, vēlams no vienas partijas;
|
|
q)
|
testējamās ķīmiskās vielas noteikšanai piemērota analītiskā aparatūra vai arī analīžu pakalpojumu sniedzējs, ar ko noslēgts līgums.
|
|
Testēšanas iespējas un ierobežojumi
|
6.
|
Abinieku metamorfozes tests (AMT) balstās uz ekspozīcijas ūdens vidē protokolu, saskaņā ar kuru testējamo ķīmisko vielu ievada testa kamerās ar caurplūdes sistēmas palīdzību. Tomēr caurplūdes metodēm ir ierobežojumi attiecībā uz to, kādas ķīmiskās vielas var tikt testētas atkarībā no to fizikālajām un ķīmiskajām īpašībām. Tādēļ pirms šā protokola izmantošanas jāiegūst pamata informācija par ķīmiskās vielas piemērotību testēšanai, kā arī jāvadās pēc ESAO Norādījumu dokumenta par sarežģītu vielu un maisījumu toksicitātes ūdenī testēšanu (4). Parametri, kas norāda, ka ķīmiskā viela varētu būt grūti testējama ūdens sistēmās, ietver augstu oktanola-ūdens sadalījuma koeficientu (log Kow), lielu gaistamību, uzņēmību pret hidrolīzi un uzņēmību pret fotolīzi parastajos laboratorijas apgaismojuma apstākļos. Testējamību var ietekmēt arī citi faktori, kurus katrā gadījumā jānosaka atsevišķi. Ja ķīmisko vielu nav iespējams veiksmīgi izmantot testā ar caurplūdes sistēmas palīdzību, var izmantot statisku sistēmu ar periodisku ūdens nomaiņu. Ja neviena no šīm sistēmām nav pieskaņojama testējamajai ķīmiskajai vielai, pamatnostādne ir netestēt to ar šo protokolu.
|
Ekspozīcijas sistēma
|
7.
|
Caurplūdes atšķaidīšanas sistēmai, ja iespējams, dodama priekšroka salīdzinājumā ar statisku sistēmu ar periodisku ūdens nomaiņu. Ja kādas testējamās ķīmiskās vielas kāda fizikālā un/vai ķīmiskā īpašība nav piemērota caurplūdes atšķaidīšanas sistēmai, var izmantot alternatīvu ekspozīcijas sistēmu (piem., periodiski atjaunināmu statisko sistēmu). Sistēmā jābūt ūdens saskares komponentiem: stiklam, nerūsējošajam tēraudam un/vai politetrafluoretilēnam. Taču drīkst izmantot arī piemērotus plastmasas materiālus, ja tie nekompromitē pētījumu. Ekspozīcijas tvertnēm jābūt stikla vai nerūsējošā tērauda akvārijiem, kas aprīkoti ar spiediencauruli; aptuvenais tvertnes tilpums ir 4,0–10,0 litri, minimālais ūdens dziļums ir 10–15 cm. Sistēmai jāspēj uzturēt visas ekspozīcijas koncentrācijas un kontrolgrupa, ar četriem replikātiem katrā apstrādē. Plūsmas ātrumam katrā tvertnē jābūt nemainīgam un piemērotam, lai uzturētu gan bioloģiskos apstākļus, gan ķīmisko vielu ekspozīciju (piem., 25 ml/min). Apstrādes tvertnes jāizkārto ekspozīcijas sistēmā tā, lai mazinātu iespējamo novietojuma ietekmi, piem., nelielas temperatūras, gaismas intensitātes u.tml. atšķirības. Lai nodrošinātu 12 stundu gaismas:12 stundu tumsas fotoperiodu, jāizmanto fluorescējošs apgaismojums; apgaismojuma intensitāte ir diapazonā 600–2 000 luksi (lūmeni uz kvadrātmetru) pie ūdens virsmas. Katrā testēšanas tvertnē jāuztur ūdens temperatūra 22° ± 1 °C, pH 6,5–8,5, un izšķīdušā skābekļa koncentrācija > 3,5 mg/l (> 40 % gaisa piesātinājuma). Reizi nedēļā jāmēra vismaz ūdens temperatūra, pH un izšķīdušais skābeklis; temperatūru ieteicams mērīt nepārtraukti vismaz vienā testēšanas traukā. Apstākļi, kādos īsteno testa protokolu, aprakstīti 1. papildinājumā. Papildu informācija par caurplūdes ekspozīcijas sistēmu un/vai statisku sistēmu ar periodisku ūdens nomaiņu izveidi pieejama ASTM Standarta norādījumos par akūtās toksicitātes testu veikšanu ar testa materiāliem ar zivīm, lielajiem bezmugurkaulniekiem un abiniekiem (5), kā arī sk. vispārējos ūdens toksicitātes testus.
|
Ūdens kvalitāte
|
8.
|
Izmantojams jebkurš uz vietas pieejams ūdens (piem., avota ūdens vai ar aktivētās ogles filtru attīrīts krāna ūdens), ja tajā ir iespējama normāla X. laevis kurkuļu augšana un attīstība. Tā kā vietējā ūdens kvalitāte dažādās teritorijās var būtiski atšķirties, ir jāveic ūdens analīzes, jo īpaši, ja nav pieejami vēsturiski dati par ūdens izmantojamību Xenopus audzēšanā. Īpaša uzmanība jāpievērš tam, lai ūdenī nav vara, hlora un hloramīnu, kas ir toksiski vardēm un kurkuļiem. Pēc tam vēlams analizēt arī fluorīda, perhlorāta un hlorāta (dzeramā ūdens dezinfekcijas blakusproduktu) fona līmeni ūdenī, jo visi šie anjoni ir vairogdziedzera joda transportētāja substrāti, un paaugstināts kāda no šiem anjoniem līmenis var ietekmēt pētījuma rezultātu. Analīzes jāveic pirms testa sākuma, un testēšanas ūdenim parasti jābūt brīvam no šiem anjoniem.
|
Joda koncentrācija testēšanas ūdenī
|
9.
|
Lai vairogdziedzeris varētu sintezēt vairogdziedzera hormonu (TH), kurkuļiem jābūt pieejamam pietiekamam joda daudzumam, ko uzņem gan ar ūdeni, gan barību. Pagaidām nav pieejamas empīriski izstrādātas minimālās joda koncentrācijas vadlīnijas. Taču joda pieejamība var ietekmēt endokrīnās sistēmas spēju reaģēt uz vairogdziedzera darbību ietekmējošajām vielām, un ir zināms, ka tā var mainīt vairogdziedzera pamataktivitāti, tādēļ, interpretējot vairogdziedzera histopatoloģijas rezultātus, jāpievērš uzmanība šim aspektam. Tāpēc ziņojumā jāiekļauj izmērītās joda koncentrācijas testēšanas ūdenī. Pamatojoties uz datiem, kas pieejami no validēšanas pētījumiem, šis protokols ir labi īstenojams apstākļos, kad testēšanas ūdens joda (I-) koncentrācijas ir diapazonā 0,5–10 μg/l. Ideālā gadījumā minimālā joda koncentrācija testēšanas ūdenī ir 0,5 μg/l. Ja testēšanas ūdens ir pagatavots no dejonizēta ūdens, tam pievieno jodu minimālajā koncentrācijā 0,5 μg/l. Ja testēšanas ūdenim vēl papildus ir pievienots jods vai citi sāļi, tas noteikti jānorāda ziņojumā.
|
Dzīvnieku turēšana
Pieaugušo dzīvnieku kopšana un audzēšana
|
10.
|
Pieaugušo dzīvnieku kopšana un audzēšana notiek saskaņā ar standarta vadlīnijām, par kurām sīkāku informāciju var iegūt standarta norādījumos varžu embriju teratoģenēzes testa veikšanai (FETAX) (6). Šādas standarta vadlīnijas sniedz pienācīgas turēšanas un audzēšanas metožu piemērus, bet strikta to ievērošana netiek prasīta. Lai ierosinātu vairošanos, pieaugušu tēviņu un mātīšu pāriem (3–5) injicē cilvēka horiona gonadotropīnu (hCG). Mātītēm un tēviņiem injicē attiecīgi aptuveni 800 IU–1 000 IU un 600 IU–800 IU hCG, kas izšķīdināts 0,6–0,9 % sāls šķīdumā. Vaislas pārus tur lielās tvertnēs, kurās ir netraucēti un statiski apstākļi, lai veicinātu nārstu. Vairošanās tvertnēm jābūt ar nerūsējošā tērauda vai plastmasas sieta dubultdibenu, kas iznērstajiem ikriem ļauj uzkrāties tvertnes apakšā. Vardes, kas saņēmušas injekciju vēlā pēcpusdienā, parasti iznērš lielāko daļu ikru nākamās dienas priekšpusdienā. Kad iznērsts un apaugļots pietiekams daudzums ikru, pieaugušos dzīvniekus izņem no vairošanās tvertnēm.
|
Kurkuļu kopšana un atlase
|
11.
|
Pēc tam, kad pieaugušos dzīvniekus izņem no vairošanās tvertnēm, ikrus savāc un novērtē to dzīvotspēju, izmantojot reprezentatīvu embriju apakšgrupu no visām vairošanās tvertnēm. Pamatojoties uz embriju dzīvotspēju un pietiekamu embriju skaitu (vismaz 1 500), jāsaglabā labākais(-ie) individuālais(-ie) nārsts(-i) (ieteicams 2–3, lai izvērtētu iznērsto ikru kvalitāti). Visiem pētījumā izmantotajiem organismiem jānāk no viena un tā paša nārsta (proti, nārstus nedrīkst sajaukt). Embrijus pārnes lielā platē vai šķīvī, un visus acīmredzami nedzīvus vai anomālus ikrus (sk. definīciju (5)) ar pipeti izņem. Veselīgos embrijus no katra no trim nārstiem ievieto trīs atsevišķās izšķilšanās tvertnēs. Pamatojoties uz dzīvotspējas un inkubācijas sekmēm, četras dienas pēc ievietošanas izšķilšanās tvertnēs izvēlas labāko nārstu, un kurkuļus pārvieto uz atbilstoša skaita audzēšanas tvertnēm, kurās uztur 22° ± 1 °C. Turklāt atsevišķās tvertnēs ievieto dažus papildu kurkuļus, kurus izmanto, lai aizstātu audzēšanas tvertnēs pirmajā nedēļā mirušos īpatņus. Šī procedūra uztur nemainīgu organismu blīvumu un tādējādi samazina attīstības atšķirības viena nārsta kohortā. Visas audzēšanas tvertnes katru dienu jātīra ar sifonu. Piesardzības dēļ vinila vai nitrila cimdi ir ieteicamāki nekā lateksa cimdi. Pirmajā nedēļā katru dienu ir jāizņem mirušie īpatņi un jāaizstāj ar rezerves kurkuļiem, lai saglabātu organismu blīvumu. Barošanai jānotiek vismaz divas reizes dienā.
|
|
12.
|
Pirmsekspozīcijas fāzē kurkuļus aklimatizē ekspozīcijas fāzes faktiskajiem apstākļiem, ieskaitot barību, temperatūru, gaismas-tumsas ciklu un kultivēšanas barotni. Tādēļ pirmsekspozīcijas un ekspozīcijas fāzē ir ieteicams lietot vienu un to pašu kultivēšanas/atšķaidīšanas ūdeni. Ja kurkuļu uzturēšanai pirmsekspozīcijas fāzē lieto statisku kultūras sistēmu, kultivēšanas barotne ir pilnībā jānomaina vismaz divas reizes nedēļā. Pirmsekspozīcijas periodā nedrīkst pieļaut pārāk lielu kurkuļu blīvumu, jo tas var būtiski ietekmēt kurkuļu attīstību gaidāmajā testēšanas periodā. Tādēļ īpatņu blīvums audzēšanas traukā nedrīkstētu pārsniegt apmēram četrus kurkuļus uz kultivēšanas barotnes litru (statiskā ekspozīcijas sistēma) vai 10 kurkuļus uz kultivēšanas barotnes litru (izmantojot, piem., 50 ml/min plūsmu pirmsekspozīcijas jeb kultivēšanas sistēmā). Šādos apstākļos kurkuļiem 12 dienu laikā būtu jāattīstās no 45./46. stadijas līdz 51. attīstības stadijai. Reprezentatīviem pamatgrupas kurkuļiem katru dienu pārbauda attīstības stadiju, lai noteiktu, kurā laikā jāsāk ekspozīcija. Kopšana jāveic tā, lai neradītu traumas un stresu kurkuļiem, jo īpaši tos pārvietojot, tīrot akvārijus un veicot manipulācijas ar tiem. Jācenšas izvairīties no tādiem stresu izraisošiem apstākļiem/darbībām kā skaļš un/vai nepārtraukts troksnis, klaudzināšana pa akvārijiem, vibrācijas akvārijos, pārmērīga aktivitāte laboratorijā, straujas vides apstākļu maiņas (gaismas pieejamība, temperatūra, pH, izšķīdušais skābeklis, ūdens plūsmas ātrums u. c.). Ja 17 dienās pēc apaugļošanas kurkuļi nesasniedz 51. attīstības stadiju, par potenciālu iemeslu ir uzskatāms stress.
|
Kurkuļu kultivēšana un barošana
|
13.
|
Pirmsekspozīcijas laikā (pēc Nivkopa un Fābera 45./46. attīstības stadija (8)) un visā 21 dienu ilgajā testa laikā kurkuļus baro, piem., ar komerciālo kurkuļu barību, ko izmantoja validēšanas pētījumos (sk. arī 1. papildinājumu), vai arī ar citu barību, kas ļauj līdzvērtīgi īstenot abinieku metamorfozes testu. Pirmsekspozīcijas laikā barošanas režīms rūpīgi jāpielāgo augošo kurkuļu vajadzībām. Nesen izšķīlušies kurkuļiem barība jādod nelielās porcijās vairākas (vismaz divas) reizes dienā. Jāizvairās no pārāk liela barības daudzuma, lai i) saglabātu ūdens kvalitāti un ii) novērstu žaunu spraugu aizsprostošanos ar barības daļiņām un detrītu. Attiecībā uz validēšanas pētījumos izmantoto kurkuļu barību, ikdienas barības deva ir jāpalielina atbilstoši kurkuļu augšanai, īsi pirms testa sākuma sasniedzot apmēram 30 mg uz dzīvnieku dienā. Validēšanas pētījumos ir pierādīts, ka komerciālā barība nodrošina X. laevis kurkuļu normālu augšanu, un tā sastāv no pietiekami smalkām daļiņām, kas paliek suspendētas ūdens vertikālajā slānī ilgāku laiku un tiek aizskalotas ar plūsmu. Tādēļ kopējā dienas barības deva jāsadala mazākās porcijās, un barošana jāveic vismaz divas reizes dienā. Barošanas režīms attiecībā uz konkrēto barību attēlots 1. tabulā. Barošanas biežumu dokumentē. Barību var izmantot sausā veidā vai kā izejšķīdumu, kas sagatavots ar atšķaidīšanas ūdeni. Svaigu izejšķīdumu jāsagatavo katru otro dienu; ja to neizmanto uzreiz, tas jāuzglabā 4 °C temperatūrā.
1. tabula.
Barošanas režīms AMT ar caurplūdes apstākļiem validēšanas pētījumos, izmantojot komerciālo kurkuļu barību tajā testa posmā, kamēr X.laevis kurkuļi ir dzīvi
|
Pētījuma diena
|
Uzturnorma (mg uz dzīvnieku dienā)
|
|
0–4
|
30
|
|
5–7
|
40
|
|
8–10
|
50
|
|
11–14
|
70
|
|
15–21
|
80
|
|
Analītiskā ķīmija
|
14.
|
Pirms pētījuma veikšanas ir jānovērtē testējamās vielas stabilitāte, izmantojot pieejamo informāciju par tās šķīdību, noārdāmību un gaistamību. Testa sākumā (0. diena) no katras replikātu tvertnes ar katru koncentrāciju jāievāc paraugs analītiskajai ķīmiskajai analīzei, un testa laikā reizi nedēļā jāievāc vismaz četri paraugi. Ieteicams arī katru testa koncentrāciju analizēt sistēmas sagatavošanas laikā, pirms testa sākšanas, lai pārbaudītu sistēmas darbību. Turklāt ieteicams analizēt izejšķīdumus, kad tie tiek nomainīti, jo īpaši gadījumos, kad izejšķīdums nenodrošina ķīmisko vielu tādā daudzumā, kura pietiktu visā paraugu ņemšanas periodā. Ja izmanto ķīmiskās vielas, kuras dažās vai visās testa koncentrācijās nevar detektēt, ir jāveic izejšķīdumu mērījumi un jāreģistrē sistēmas plūsmas ātrums, no kuriem var izrēķināt nominālās koncentrācijas.
|
Ķīmiskās vielas ievadīšana
|
15.
|
Testējamās vielas fizikāli ķīmiskās īpašības nosaka metodi, ar kādu to ievada sistēmā. Ūdenī šķīstošas ķīmiskās vielas var izšķīdināt testēšanas ūdens alikvotā tādā koncentrācijā, kas caurplūdes sistēmā ļauj nodrošināt nepieciešamās testa koncentrācijas. Ķīmiskās vielas, kas istabas temperatūrā ir šķidras un daļēji šķīst ūdenī, var ievadīt izmantojot šķidruma:šķidruma piesātināšanas metodes. Vielas, kas istabas temperatūrā ir cietas un daļēji šķīst ūdenī, var ievadīt, izmantojot piesātināšanas kolonnas no stikla vates (7). Priekšroka dodama sistēmai bez nesējiem, tomēr dažādām testējamajām vielām var būt dažādas fizikāli ķīmiskās īpašības, kas visticamāk prasīs atšķirīgas pieejas ķīmiskās vielas ekspozīcijas ūdens sagatavošanai. Ieteicams izvairīties no šķīdinātājiem vai nesējiem, jo: i) daži šķīdinātāji var būt toksiski paši par sevi un/vai izraisīt nevēlamas vai negaidītas endokrīnas reakcijas, ii) ja testējamās ķīmiskās vielas koncentrācija pārsniedz vielas šķīdību ūdenī (kas bieži var notikt, ja izmanto šķīdinātāju), var tikt nepareizi noteikta ietekmes koncentrācija, iii) šķīdinātāju izmantošana ilgāka termiņa testos var veicināt būtiskas “bioplēves” veidošanos, kas saistīta ar mikrobiālo aktivitāti. Sarežģīti testējamām ķīmiskajām vielām šķīdinātājs jāizmanto kā pēdējā iespēja, un piemērotāko metodi jāizvēlas, izmantojot ESAO Norādījumu dokumentu par sarežģītu vielu un maisījumu toksicitātes ūdenī testēšanu (4). Šķīdinātāja izvēli nosaka ķīmiskās vielas ķīmiskās īpašības. Toksicitātes ūdenī testēšanai efektīvi šķīdinātāji ir acetons, etanols, metanols, dimetilformamīds un trietilēnglikols. Gadījumos, kad izmanto šķīdinātāju-nesēju, šķīdinātāja koncentrācijai jābūt mazākai par hronisku nenovērojamās ietekmes koncentrāciju (NOEC); ESAO Norādījumu dokuments iesaka maksimālo koncetrāciju 100 μl/l; jaunākajā pārskatītajā redakcijā ieteikts izmantot daudz zemāku šķīdinātāja koncentrāciju – 20 μl/l atšķaidīšanas ūdens (12). Ja izmanto šķīdinātājus-nesējus, papildus kontrolgrupām bez šķīdinātāja (tīrs ūdens) jāizvērtē arī atbilstošas kontrolgrupas ar šķīdinātāju. Ja ķīmisko vielu tās fizikāli ķīmisko īpašību dēļ (zema šķīdība) vai ierobežotas ķīmiskās pieejamības dēļ nav iespējams ievadīt caur ūdeni, var apsvērt tās ievadīšanu ar barību. Ir veikts sagatavošanas darbs ekspozīcijai caur barību, taču šis ekspozīcijas ceļš parasti netiek lietots. Metodes izvēle jādokumentē un analītiski jāpierāda.
|
Testa koncentrāciju izvēle
Augstas testa koncentrācijas noteikšana
|
16.
|
Šā testa vajadzībām jānosaka augsta testa koncentrācija, izvēloties zemāko no šiem rādītājiem: testējamās ķīmiskās vielas šķīdības robeža; maksimālā pieļaujamā koncentrācija (MPK) akūti toksiskām ķīmiskām vielām vai 100 mg/l.
|
|
17.
|
MPK definē kā ķīmiskās vielas augstāko testa koncentrāciju, kuras izraisītā mirstība ir mazāka par 10 %. Šīs pieejas izmantošanai nepieciešami empīriski akūtās mirstības dati, no kuriem iespējams aplēst MPK. MPK noteikšana var būt neprecīza, un parasti ir nepieciešams profesionāls vērtējums. Kaut arī tehniski visdrošākā pieeja MPK noteikšanā būtu regresijas modeļu izmantošana, noderīgu MPK aptuveno vērtību var iegūt arī no esošajiem akūtās toksicitātes datiem, izmantojot 1/3 no akūtās LC50
vērtības. Tomēr akūtās toksicitātes dati var nebūt pieejami attiecībā uz testējamo sugu. Ja nav pieejami sugai specifiski akūtās toksicitātes dati, var veikt 96 stundu LC50
testu ar kurkuļiem, kas reprezentē (proti, ir tajā pašā attīstības stadijā) AMT izmantojamos kurkuļus. Alternatīvi, ja ir pieejama informācija par citām ūdenī dzīvojošām sugām (piem., LC50
pētījumi zivīm vai citām abinieku sugām), ar profesionālas izvērtēšanas palīdzību iespējams aplēst MPK, pamatojoties uz starpsugu ekstrapolāciju.
|
|
18.
|
Alternatīvi, ja ķīmiska viela nav akūti toksiska un tās šķīdība ir virs 100 mg/l, tad 100 mg/l jāuzskata par augstāko testa koncentrāciju (HTC), jo šī koncentrācija parasti tiek uzskatīta par “praktiski netoksisku”.
|
|
19.
|
Kaut arī tas ir mazāk ieteicami, gadījumos, kad caurplūdes metodes ir neatbilstošas MPK sasniegšanai, var izmantot statisku sistēmu ar periodisku ūdens nomaiņu. Ja izmanto statiskās sistēmas ar periodisku ūdens nomaiņu, testējamās ķīmiskās vielas koncentrācijas stabilitātei jābūt dokumentētai un tai jāiekļaujas izpildes kritēriju robežās. Ieteicami 24 stundu ūdens nomaiņas periodi. Nav pieņemami nomaiņas periodi, kas pārsniedz 72 stundas. Katra nomaiņas perioda beigās, tieši pirms ūdens nomaiņas, jāmēra ūdens kvalitātes parametri (piem., izšķīdušais skābeklis, temperatūra, pH utt.).
|
Testa koncentrāciju diapazons
|
20.
|
Nepieciešamais minimums ir trīs testa koncentrācijas un tīra ūdens kontrolgrupa (un nesējvielas kontrolgrupa, ja nepieciešams). Mazākā atšķirība starp augstāko un zemāko testa koncentrāciju ir aptuveni viena lieluma kārta. Maksimālā devu atstarpe ir 0,1, minimālā ir 0,33.
|
PROCEDŪRA
Testa sākums un norise
0. diena
|
21.
|
Ekspozīcija jāuzsāk tad, kad pietiekams skaits kurkuļu pirmsekspozīcijas pamatgrupā ir sasnieguši 51. attīstības stadiju saskaņā ar Nivkopu un Fāberu (8), un tā ir sasniegta pēc 17 vai mazāk dienām pēc apaugļošanas. Izvēloties testējamos dzīvniekus, veselus un normāla izskata kurkuļus no pamatgrupas ievieto vienā traukā, kurā ir pietiekams daudzums atšķaidīšanas ūdens. Lai noteiktu attīstības stadiju, kurkuļus pa vienam izņem no kopējās tvertnes, izmantojot nelielu tīklu vai sietu, un ievieto caurspīdīgā mērīšanas kamerā (piem., 100 mm Petri plate) ar atšķaidīšanas ūdeni. Nosakot attīstības stadiju, vēlams neizmantot anestēziju, tomēr drīkst veikt anestēziju individuāliem kurkuļiem, izmantojot trikaīna metānsulfonātu (piem., MS-222), kas pirms lietošanas atbilstoši buferēts ar nātrija bikarbonātu (pH 7,0). Šādā gadījumā no pieredzējušām laboratorijām jāiegūst informācija par metodiku, kā, piem., MS-222, izmanto anestēzijai, un tā jāietver pārskatā par testa rezultātiem. Pārvietošanas laikā ar dzīvniekiem jāstrādā uzmanīgi, lai mazinātu stresu un izvairītos no ievainojumiem.
|
|
22.
|
Dzīvnieku attīstības stadijas nosaka, izmantojot binokulāro preparēšanas mikroskopu. Lai samazinātu galīgās atšķirības attīstības stadijās, ir svarīgi stadijas novērtēt iespējami precīzi. Saskaņā ar Nivkopu un Fāberu (8) 51. stadijas noteikšanas primārais attīstības orientieris ir pakaļējās ekstremitātes morfoloģija. Pakaļējo ekstremitāšu morfoloģiskie parametri ir jāizmeklē mikroskopā. Lai iegūtu precīzu informāciju par kurkuļu stadiju novērtēšanu, jāiepazīstas ar pilnu Nivkopa un Fābera (8) norāžu saturu, tomēr iespējams ticami noteikt metamorfozes stadijas arī izmantojot morfoloģiskās pazīmes. Lai vienkāršotu un standartizētu stadiju novērtēšanu, izmantojot viegli saskatāmās ar dažādām attīstības stadijām saistītas morfoloģiskās pazīmes, izmantojama turpmāk pievienotā tabula, pieņemot, ka attīstība ir normāla.
2. tabula.
Viegli saskatāmas attīstības stadiju morfoloģiskās pazīmes saskaņā ar Nivkopa un Fābera (8) norādēm.
|
Redzamākie morfoloģiskie orientieri
|
Attīstības stadija
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Pakaļējā ekstremitāte
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Priekšējā ekstremitāte
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Galvaskausa struktūras
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Ožas nerva morfoloģija
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Astes garums
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Testa sākumā visiem kurkuļiem jābūt 51. attīstības stadijā. Labākais morfoloģiskais orientieris šīs stadijas konstatēšanai ir pakaļējās ekstremitātes morfoloģija, parādīta 1. attēlā.
1. attēls.
51. attīstības stadijas X. laevis kurkuļa pakaļējās ekstremitātes morfoloģija.
|
|
24.
|
Līdztekus atlasei pēc attīstības stadijas var izmantot arī eksperimenta dzīvnieku atlasi pēc izmēra. Šim nolūkam 0. dienā jāizmēra kopējais ķermeņa garums (nevis purna-kloākas garums) parauga daļai, kurā ir apmēram 20 kurkuļi 51. attīstības stadijā pēc Nivkopa-Fābera. Kad aprēķināts šīs grupas kurkuļu vidējais visa ķermeņa garums, var noteikt eksperimenta dzīvnieku visa ķermeņa garuma minimālās un maksimālās robežas, pieļaujot vidējo vērtību svārstības ± 3 mm (51. stadijas kurkuļiem visa ķermeņa garuma vidējās vērtības ir diapazonā 24,0–28,1 mm ). Tomēr galvenais parametrs, novērtējot katra testējamā dzīvnieka gatavību, ir attīstības stadija. Kurkuļi ar redzamiem iedzimtiem defektiem vai ievainojumiem jāizslēdz no testa.
|
|
25.
|
Kurkuļus, kas atbilst iepriekš aprakstītajiem attīstības stadijas kritērijiem, tur tvertnē ar tīru kultivēšanas ūdeni, līdz sasniegta nepieciešamā attīstības stadija. Kad nepieciešamā attīstības stadija sasniegta, kurkuļus vienmērīgi izvieto ekspozīcijas tvertnēs, līdz katrā tvertnē ir 20 kurkuļi. Katru ekspozīcijas tvertni novēro, lai noteiktu anomāla izskata dzīvniekus (piem., ar ievainojumiem, neparastu peldēšanas uzvedību utt.). Acīmredzami neveselīga izskata kurkuļi jāizņem no ekspozīcijas tvertnēm un jāaizvieto ar kurkuļiem, kas no jauna ņemti no kopējās tvertnes.
|
Novērojumi
|
26.
|
Padziļinātu informāciju par testa pabeigšanas procedūrām un kurkuļu apstrādi var iegūt ESAO Norādījumu dokumentā par abinieku vairogdziedzera histoloģiju (9).
|
Mērījumi septītajā dienā
|
27.
|
Septītajā dienā katram replikātam no katras testa tvertnes paņem piecus nejauši izvēlētus kurkuļus. Nejaušajai atlasei jānodrošina, ka visiem testa dzīvniekiem ir vienāda varbūtība tikt izvēlētiem. Tas sasniedzams ar jebkuru nejaušās izvēles metodi, nepieciešams, lai kurkuļi tiktu ķerti ar tīkliņu. Neatlasītos kurkuļus atlaiž atpakaļ izcelsmes tvertnē, bet atlasītos kurkuļus humāni eitanazē ar 150–200 mg/l, piem., MS-222, kas pH 7,0 sasniegšanai attiecīgi buferēts ar nātrija bikarbonātu. Eitanazētos kurkuļus noskalo ar ūdeni un nosusina sausus, tad nosver ar precizitāti līdz miligramam. Katram kurkulim nosaka pakaļējās ekstremitātes garumu, garumu no purna līdz kloākai un attīstības stadiju (izmantojot binokulāro preparēšanas mikroskopu).
|
Mērījumi 21. dienā (testa pabeigšana)
|
28.
|
Testa beigās (21. dienā) atlikušos kurkuļus izņem no testa tvertnēm un humāni eitanazē ar 150–200 mg/l, piem., MS-222, kas buferēts ar nātrija bikarbonātu, kā norādīts iepriekš. Kurkuļus noskalo ūdenī, nosusina sausus, un to ķermeņa svaru nosaka ar precizitāti līdz miligramam. Katram kurkulim nosaka attīstības stadiju, garumu no purna līdz kloākai un pakaļējās ekstremitātes garumu.
|
|
29.
|
Histoloģiskajai novērtēšanai visus kurkuļus ievieto Davidsona fiksācijas šķīdumā uz 48–72 stundām kā visa ķermeņa paraugus vai arī kā galvas audu paraugus, kuros ietilpst apakšžoklis. Histopatoloģijas analīzēm ievāc piecus kurkuļus no katras replikāta tvertnes. Tā kā folikulārās šūnas augstums ir atkarīgs no attīstības stadijas (10), histoloģijas analīzēm vispiemērotākā atlases pieeja ir vienas attīstības stadijas īpatņu izmantošana, kad vien iespējams. Lai atlasītu vienas attīstības stadijas īpatņus, visu kurkuļu attīstības stadijas jānovērtē jau pirms atlases un turpmākās datu apstrādes, kas nepieciešama datu ievākšanai un saglabāšanai. Tas nepieciešams, jo normālas atšķirības attīstībā izraisa attīstības stadiju sadalījuma atšķirības katrā replikāta tvertnē.
|
|
30.
|
Histopatoloģijai atlasītajiem dzīvniekiem (n = 5 no katra replikāta) pēc iespējas jālīdzinās kontrolgrupas dzīvnieku (apvienotie replikāti) vidējiem parametriem. No replikātu tvertnēm, kurās jābūt vairāk nekā pieciem kurkuļiem vajadzīgajā attīstības stadijā, nejauši atlasa piecus kurkuļus.
|
|
31.
|
Ja replikātu tvertnē ir mazāk nekā pieci kurkuļi vajadzīgajā attīstības stadijā, nejauši atlasa indivīdus no nākamās zemākās vai augstākās attīstības stadijas, lai katrā replikātā parauga lielums būtu pieci kurkuļi. Lēmumu ņemt kurkuļus no nākamās zemākās vai augstākās attīstības stadijas ieteicams pamatot ar stadiju sadalījuma vispārēju novērtējumu kontrolgrupas un ķīmiskās apstrādes tvertnēs. Proti, ja ķīmiskā apstrāde ir saistīta ar attīstības retardāciju, tad papildu kurkuļi jāatlasa no nākamās zemākās stadijas. Savukārt ja ķīmiskā apstrāde ir saistīta ar attīstības paātrināšanos, papildu kurkuļi jāiegūst no nākamās augstākās stadijas.
|
|
32.
|
Ja apstrāde ar testējamo ķīmisko vielu ir izraisa ievērojamas pārmaiņas kurkuļu attīstībā, stadiju izkliede ķīmiskās apstrādes grupā var atšķirties no kontrolgrupā aprēķinātās vidējās attīstības stadijas, un attīstības pakāpes var nepārklāties. Tikai šādos gadījumos atlases procesu var mainīt, iekļaujot attīstības stadijas, kas atšķiras no kontrolgrupas vidējās attīstības pakāpes, lai sasniegtu stadijai atbilstošu kurkuļu ieguvi vairogdziedzera histopatoloģijai. Ja stadijas nav nosakāmas (t. i., asinhronija), histoloģijai nejauši izvēlas piecus kurkuļus no katra replikāta. Ja notiek jebkāda kurkuļu ieguve no stadijām, kas neatbilst kontrolgrupas vidējai attīstībai, šādas ieguves iemesli ir jāatspoguļo pārskatā.
|
Bioloģisko beigupunktu noteikšana
|
33.
|
Ekspozīcijas fāzes, kura ilgst 21 dienu, laikā, 7. un 21. dienā jāveic primāro beigupunktu mērījumi, taču testa dzīvnieku novērojumi jāveic katru dienu. 3. tabula sniedz pārskatu par beigupunktu mērījumiem un par attiecīgajiem laika punktu novērojumiem. Papildu informācija par apikālo beigupunktu mērījumu tehnisko procesu un histoloģiskajiem novērtējumiem sniegta ESAO norādījumu dokumentos (9).
3. tabula.
Abinieku metamorfozes testa (AMT) primāro beigupunktu novērošanas laiki
|
Apikālie beigupunkti
|
Katru dienu
|
7. diena
|
21. diena
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Pakaļējās ekstremitātes garums
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Ķermeņa svars (mitrais parauga svars)
|
|
|
ߦ
|
ߦ
|
|
—
|
Vairogdziedzera histoloģija
|
|
|
|
ߦ
|
|
Apikālie beigupunkti
|
34.
|
Attīstības stadija, pakaļējās ekstremitātes garums, garums no purna līdz kloākai (SVL) un mitrais svars ir abinieku metamorfozes testa apikālie beigupunkti, turpmākajā tekstā ir īsi apskatīts katrs no tiem. Norādījumu dokumentos, uz kuriem dota atsauce, ir pieejama sīkāka tehniska informācija par šo datu ievākšanu, kā arī par ieteicamo analīzi ar datora palīdzību.
|
Attīstības stadija
|
35.
|
X. laevis kurkuļu attīstības stadijas nosaka saskaņā Nivkopa un Fābera (8) izstrādātajiem attīstības stadiju kritērijiem. Informāciju par attīstības stadijām izmanto, lai noteiktu, vai attīstība ir paātrināta, asinhrona, novēlota vai neietekmēta. Paātrināta vai novēlota attīstība ir nosakāma, salīdzinot kontrolgrupu un apstrādes grupu mediāno attīstības stadiju. Attīstība uzskatāma par asinhronu, kad pārbaudītie audi nav ne kroplīgi, ne anomāli, bet morfoģenēzes vai atsevišķu audu relatīvā attīstības norise laikā ir traucēta vienam īpatnim.
|
Pakaļējās ekstremitātes garums
|
36.
|
Pakaļējo ekstremitāšu diferenciācija un augšana notiek vairogdziedzera hormonu ietekmē, un tā ir attīstības stadijas noteikšanas galvenais orientieris. Pakaļējo ekstremitāšu augšanu izmanto kā kvalitatīvu parametru attīstības stadiju novērtēšanā, taču šeit to uzskata par kvantitatīvu beigupunktu. Tādēļ pakaļējās ekstremitātes garumu mēra kā beigupunktu, lai noteiktu ietekmi uz vairogdziedzera asi (2. attēls). Lai nodrošinātu konsekvenci, garumu mēra kreisajai pakaļējai ekstremitātei. Pakaļējās ekstremitātes garumu nosaka testa 7. un 21. dienā. Kā redzams 2. attēlā, 7. dienā pakaļējās ekstremitātes garuma mērīšana ir vienkārša. Sarežģītāka ir mērīšana 21. dienā, jo ekstremitātei ir izliekums. Tādēļ pakaļējās ekstremitātes mērījums 21. dienā jāsāk no ķermeņa virskārtas un tad pa ekstremitātes viduslīniju pāri visiem izliekumiem. Pakaļējās ekstremitātes garums 7. dienā, pat ja tas nav novērojams 21. dienā, joprojām ir uzskatāms par nozīmīgu, vērtējot potenciālo vairogdziedzera darbību. Garuma mērījumi tiek iegūti no digitālajām fotogrāfijām, izmantojot attēlu apstrādes programmatūru, kas aprakstīta ESAO Norādījumu dokumentā par abinieku vairogdziedzera histoloģiju (9).
|
Ķermeņa garums un mitrais svars
|
37.
|
Garuma no purna līdz kloākai (SVL) (2. attēls) un mitrā svara rādījumi ir iekļauti testēšanas protokolā, lai novērtētu testējamo ķīmisko vielu iespējamo ietekmi uz kurkuļu augšanas ātrumu salīdzinājumā ar kontrolgrupu, un šie rādītāji ir lietderīgi, lai novērtētu vispārējo ķīmiskās vielas toksicitāti. Pirms svēršanas liekā ūdens nosusināšana no kurkuļiem var tiem izraisīt stresu un ādas bojājumus, tādēļ šie mērījumi 7. dienā tiek veikti ar daļu ievāktā parauga, un ar visiem pārējiem kurkuļiem testa beigās (21. dienā). Konsekvences labad astes robežas noteikšanai, velciet iedomātu līniju no galvaskausa virspuses uz kloāku.
|
|
38.
|
Purna-kloākas garumu izmanto kurkuļu augšanas novērtēšanā, kā parādīts 2. attēlā.
2. attēls.
X. laevis kurkuļu (A) ķermeņa garuma mērījumu veidi un (B) pakaļējās ekstremitātes garuma mērījumi (1).
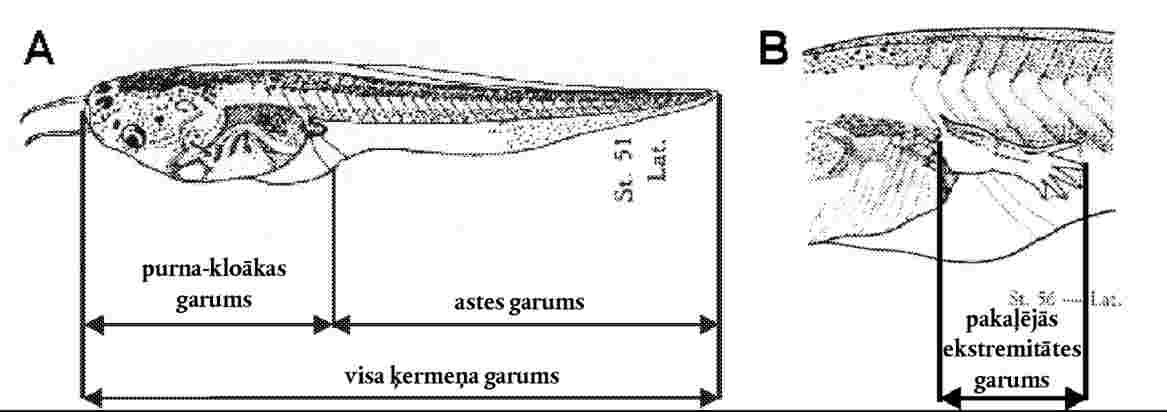
|
Vairogdziedzera histoloģija
|
39.
|
Kaut arī attīstības stadija un pakaļējās ekstremitātes garums ir nozīmīgi beigupunkti, lai novērtētu ekspozīcijas ķīmiskajai vielai izraisītās pārmaiņas metamorfajā attīstībā, attīstības aizturi pašu par sevi nevar uzskatīt par diagnostikas indikatoru vairogdziedzera darbību kavējošai aktivitātei. Dažas pārmaiņas ir konstatējamas tikai veicot rutīnas histopatoloģisko analīzi. Diagnostikas kritēriji ietver vairogdziedzera hipertrofiju/atrofiju, folikulāro šūnu hipertrofiju, folikulāro šūnu hiperplāziju un kā papildu kvalitatīvos kritērijus arī folikulārā lūmena laukumu, koloidāla kvalitāti un folikulāro šūnu augstumu/formu. Pārskatā jāiekļauj smaguma gradācija (4 pakāpes). Informācija par histoloģisko paraugu iegūšanu un apstrādi audu paraugu histoloģiskajai analīzei ir pieejama dokumentā “Abinieku metamorfozes tests: 1. daļa – tehniskie norādījumi attiecībā uz morfoloģisko paraugu ņemšanu un histoloģisko sagatavošanu” un “Abinieku metamorfozes tests: 2. daļa – ieteikumi pētījumu lasīšanai, diagnostikas kritērijiem, izpausmes gradācijai un atlass” (9). Laboratorijām, kas veic testu pirmo(-ās) reizi(-es), pirms histoloģisko analīžu un vairogdziedzera novērtēšanas veikšanas ir mācību nolūkā jākonsultējas ar pieredzējušiem patologiem. Acīmredzamas un būtiskas pārmaiņas apikālos beigupunktos, kas liecina par attīstības paātrinājumu vai asinhroniju, var izslēgt nepieciešamību veikt vairogdziedzera histopatoloģisko analīzi. Tomēr acīmredzamu morfoloģisku pārmaiņu neesība vai attīstības aizture pieprasa histoloģisko analīžu veikšanu.
|
Mirstība
|
40.
|
Katru dienu visās testa tvertnēs pārbauda mirušu kurkuļu klātbūtni, un iegūtos skaitļus katrai tvertnei pieraksta. Katrai novērotajai mirstībai reģistrē datumu, testējamās vielas koncentrāciju un tvertnes numuru. Mirušie dzīvnieki iespējami ātri ir jāizņem no testa tvertnes. Ja mirstība pārsniedz 10 %, tas var liecināt par neatbilstošiem testēšanas apstākļiem vai par testējamās ķīmiskās vielas toksisko iedarbību.
|
Papildu novērojumi
|
41.
|
Ir jāreģistrē anomāla uzvedība, uzkrītoši redzami iedzimti defekti un ievainojumi. Anomāla uzvedības, redzamu iedzimtu defektu un ievainojumu gadījumā reģistrē datumu, testējamās vielas koncentrāciju un tvertnes numuru. Normālai uzvedībai raksturīgs, ka ūdenī esošajiem kurkuļiem aste atrodas augstāk par galvu, ir regulāras astes spuras kustības, tie periodiski uzpeld līdz ūdens virspusei, tiem ir žaunu vāki, atbild uz stimuliem. Par anomālu uzvedību liecina, piem., peldēšana ūdens virspusē, gulēšana tvertnes dibenā, peldēšana ar vēderu uz augšu vai haotiska peldēšana, neuzpeldēšana virspusē, nereaģēšana uz stimuliem. Papildus jāreģistrē arī redzamas atšķirības barības uzņemšanā starp apstrādes replikātiem. Redzami iedzimti defekti un ievainojumi var būt morfoloģiskas anomālijas (piem., ekstremitāšu deformācijas), hemorāģiski bojājumi, baktēriju vai sēnīšu infekcijas u. c. Šie rādītāji ir kvalitatīvi un uzskatāmi par slimības/stresa klīniskajām pazīmēm, tos iegūst salīdzinājumā ar kontrolgrupas dzīvniekiem. Ja šo pazīmju vai to sastopamības biežums eksponētajās tvertnēs ir lielāks nekā kontrolgrupā, pieņem, ka tos izraisījis acīmredzams toksiskums.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Datu vākšana
|
42.
|
Visi dati ir jāapkopo, izmantojot elektroniskas vai manuālas sistēmas saskaņā ar labas laboratorijas prakses (GLP) standartiem. Pētījuma rezultātos ietilpst:
|
|
Testējamā viela:
|
—
|
testējamās ķīmiskās vielas raksturlielumi: fizikālķīmiskās īpašības; informācija par stabilitāti un bionoārdāmību;
|
|
—
|
ķīmiskā informācija un dati: šķīdumu sagatavošanas metode un biežums. Informācijā par testējamo ķīmisko vielu jāiekļauj testējamās vielas faktiskā un nominālā testējamās vielas koncentrācija, atsevišķos gadījumos arī ķīmiskie atvasinājumi. Testējamās ķīmiskās vielas analīzes var būt nepieciešamas gan izejšķīdumiem, gan testējamajiem šķīdumiem;
|
|
—
|
šķīdinātājs (ja tas nav ūdens): šķīdinātāja izvēles pamatojums, šķīdinātāja raksturlielumi (veids, izmantotās koncentrācijas).
|
|
|
|
Testēšanas apstākļi:
|
—
|
darbību apraksti: novērojumi, kas attiecas uz testēšanas sistēmas darbību, atbalstošo vidi un infrastruktūru. Tipiskie darbības apraksti ietver: telpas temperatūru, testa vides temperatūru, fotoperiodu, ekspozīcijas sistēmas kritiskos komponentus (piem., sūkņus, ciklu skaitītājus, spiedienus), plūsmas mērījumus, ūdens līmeņus, bāzes pudeļu nomaiņas, ierakstus par barošanām. Ūdens kvalitātes vispārīgie rādītāji ir: pH, izšķīdušais skābeklis, elektrovadītspēja, kopējais joda daudzums, sārmainība, cietība;
|
|
—
|
novirzes no testēšanas metodes: šeit jāiekļauj jebkāda informācija vai paskaidrojumi par novirzēm no testēšanas metodes.
|
|
|
|
Rezultāti:
|
—
|
bioloģiskie novērojumi un dati ietver: ikdienas mirstības novērojumus, barības uzņemšanu, neparastu peldēšanas uzvedību, letarģiju, līdzsvara zudumus, redzamus iedzimtus defektus, ievainojumus u. c. Iepriekš noteiktos intervālos veiktie novērojumi un ievāktie dati ietver: attīstības stadiju, pakaļējās ekstremitātes garumu, attālumu no purna līdz kloākai, mitro svaru;
|
|
—
|
statistiskās analīzes metodes un izvēlēto metožu pamatojums; statistiskās analīzes rezultāti, kurus vēlams sniegt tabulas formā;
|
|
—
|
histoloģiskie dati ietver: izskaidrojošus aprakstus, kā arī specifisko novērojumu smagumu pa gradācijas pakāpēm un sastopamības biežumu; sīkāk izklāstīts histopatoloģijas norādījumu dokumentā;
|
|
—
|
ad hoc novērojumi ietver: pētījuma laikā iegūtus aprakstus, kas neietilpst nevienā no iepriekš aprakstītajām kategorijām.
|
|
|
Datu pārskats
|
43.
|
Otrajā papildinājumā sniegtas datu vākšanas izklājlapas, ko var izmantot kā paraugu jēldatu ievadei un apkopojošajiem statistiskajiem aprēķiniem. Papildus ir sniegtas tabulas, kas ir ērtas beigupunktu datu apkopošanai. Histoloģisko novērtējumu tabulas ir ievietotas 2. papildinājumā.
|
Veiktspējas kritēriji un testa pieņemamība/ticamība
|
44.
|
Būtiskas novirzes no testēšanas metodes radīs interpretācijai un ziņošanai nepieņemamus datus. Tādēļ 4. tabulā ir izstrādāti norādījumi veiktā testa kvalitātes un kontrolgrupas organismu vispārējā stāvokļa noteikšanai.
4. tabula.
Abinieku metamorfozes testa (AMT) veiktspējas kritēriji
|
Kritērijs
|
Pieņemamās robežas
|
|
Testa koncentrācijas
|
Uztur pie ≤ 20 % CV (izmērītās testa koncentrācijas variācija) visā 21 dienu testa laikā
|
|
Mirstība kontrolgrupā
|
≤ 10 % mirstība jebkurā kontrolgrupas replikātā nedrīkst pārsniegt 2 kurkuļus
|
|
Minimālā vidējā attīstības stadija kontrolgrupās testa beigās
|
57
|
|
Attīstības stadiju izkliede kontrolgrupā
|
Attīstības stadiju sadalījuma 10. un 90. procentīle nedrīkstētu atšķirties par vairāk nekā 4 attīstības stadijām
|
|
Izšķīdušais skābeklis
|
≥ 40 % gaisa piesātinājuma (23)
|
|
pH
|
pH jāuztur robežās no 6,5 līdz 8,5 Atšķirības starp replikātiem un iedarbības veidiem nedrīkstētu pārsniegt 0,5.
|
|
Ūdens temperatūra
|
22° ± 1 °C – atšķirības starp replikātiem un iedarbības veidiem nedrīkstētu pārsniegt 0,5 °C
|
|
Testa koncentrācijas bez acīmredzama toksiskuma
|
≥ 2
|
|
Replikātu vērtējums
|
Tests ir apšaubāms, ja tam ir ≤ 2 replikāti
|
|
Šķīdinātāja izmantošanas īpašie nosacījumi
|
Ja lieto šķīdinātāja nesēju, ir jāizveido kontrolgrupas gan šķīdinātājam, gan tīram ūdenim, un par rezultātiem jāziņo.
|
|
Statistiski būtiskas atšķirības starp šķīdinātāja kontrolgrupas un ūdens kontrolgrupām ir jāapskata atsevišķi. Papildu informāciju sk. turpmāk.
|
|
Īpaši nosacījumi statiskai sistēmai ar periodisku ūdens nomaiņu
|
Jāziņo par reprezentatīvām ķīmiskajām analīzēm pirms un pēc ūdens nomaiņas
|
|
Amonjaka līmenis jāmēra tieši pirms ūdens nomaiņas
|
|
Visi 1. papildinājuma 1. tabulā minētie kvalitātes parametri jāmēra tieši pirms ūdens nomaiņas
|
|
Nomaiņas periods nedrīkst pārsniegt 72 stundas
|
|
Atbilstošs barošanas režīms (komerciālā kurkuļu barība, 50 % dienas normas)
|
|
Testa derīgums
|
45.
|
Lai testu atzītu par pieņemamu/derīgu, tam jāatbilst šādām prasībām:
|
|
derīgs testa eksperiments, kas atzīstams par vairogdziedzera aktivitāti neietekmējošu:
|
(1)
|
jebkurai apstrādei (tostarp kontrolgrupās) mirstība nedrīkst pārsniegt 10 %. Katrā replikātā mirstība nedrīkst pārsniegt trīs īpatņus, citādi replikāts uzskatāms par apšaubāmu;
|
|
(2)
|
analīzei pieejami vismaz divi apstrādes līmeņi, ar visiem četriem replikātiem, kas visi ir neapšaubāmi;
|
|
(3)
|
analīzei pieejami vismaz divi apstrādes līmeņi bez acīmredzama toksiskuma.
|
|
|
|
Derīgs testa eksperiments, kas atzīstams par vairogdziedzera aktivitāti ietekmējošu:
|
(1)
|
kontrolgrupā mirstība nedrīkst būt lielāka kā divi kurkuļi uz replikātu.
|
|
|
Abinieku metamorfozes testa (AMT) lēmumu pieņemšanas loģika
|
46.
|
Abinieku metamorfozes testa lēmumu pieņemšanas loģika ir izstrādāta, lai nodrošinātu loģisku palīdzību biotestēšanas rezultātu ieguvei un interpretācijai (sk. shēmu 3. attēlā). Lēmumu pieņemšanas loģika izvērtē iegūtos beigupunktus: paātrināta attīstība, asinhrona attīstība un vairogdziedzera histopatoloģija tiek uzskatīta par ļoti nozīmīgiem, bet palēnināta attīstība, purna-kloākas garums un mitrais parauga svars ir parametri, ko uzskata par mazāk nozīmīgiem, jo tos var ietekmēt vispārīgais toksiskums.
3. attēls.
Lēmumu pieņemšanas loģika abinieku metamorfozes testa (AMT) veikšanai
|
Paātrināta attīstība (noteikta, izmantojot attīstības stadiju, purna-kloākas garumu (SVL) un pakaļējās ekstremitātes garumu)
|
47.
|
Ir zināms, ka paātrināta attīstība var notikt vienīgi vairogdziedzera hormonu ietekmē. Tās var būt perifēro audu izmaiņas, piem., tiešā mijiedarbībā ar vairogdziedzera hormonu receptoru (piem., T4), vai izmaiņas cirkulējošo vairogdziedzera hormonu līmenī. Jebkurā gadījumā to uzskata par pietiekamu pierādījumu tam, ka ķīmiskā viela ietekmē vairogdziedzera darbību. Paātrinātu attīstību vērtē vienā no diviem veidiem. Pirmkārt, vispārējo attīstības stadiju var novērtēt, izmantojot iepriekš minēto standartizēto pieeju, ko apraksta Nivkops un Fābers (8). Otrkārt, var izmantot specifisko morfoloģisko pazīmju, piem., pakaļējās ekstremitātes garuma mērījumus 7. un 21. dienā, kas ir pozitīvi saistīti ar agonistu iedarbību uz vairogdziedzera hormonu receptoru. Ja konstatē būtisku paātrinājumu pakaļējās ekstremitātes attīstībā, tas liecina, ka ķīmiskā viela ietekmē vairogdziedzera darbību.
|
|
48.
|
Testa dzīvnieku novērtēšana un salīdzināšana ar kontrolgrupas dzīvniekiem paātrinātas attīstības gadījumā balstāma uz statistiskās analīzes rezultātiem, kas veikta ar šādiem četriem beigupunktiem:
|
—
|
pakaļējās ekstremitātes garums (normalizēts ar SVL) pētījuma 7. dienā;
|
|
—
|
pakaļējās ekstremitātes garums (normalizēts ar SVL) pētījuma 21. dienā;
|
|
—
|
attīstības stadija pētījuma 7. dienā;
|
|
—
|
attīstības stadija pētījuma 21. dienā.
|
|
|
49.
|
Pakaļējo ekstremitāšu garuma statistiskās analīzes jāveic, pamatojoties uz kreisās pakaļējās ekstremitātes garuma mērījumiem. Pakaļējo ekstremitāšu garuma dati tiek normalizēti, izmantojot īpatņa pakaļējās ekstremitātes garuma attiecību pret īpatņa garumu no purna līdz kloākai. Turpmāk salīdzina katra apstrādes līmeņa vidējās normalizētās vērtības. Par paātrinātu attīstību liecina pakaļējās ekstremitātes garuma normalizētās vērtības būtisks palielinājums ķīmiskās apstrādes grupā salīdzinājumā ar kontrolgrupu pētījuma 7. dienā un/vai 21. dienā (sk. 3. papildinājumu).
|
|
50.
|
Attīstības stadiju statistiskās analīzes veicamas, pamatojoties uz Nivkopa un Fābera (8) aprakstītajiem attīstības stadiju novērtēšanas morfoloģiskajiem kritērijiem. Par attīstības paātrinājumu liecina multikvantu analīzē konstatēts būtisks palielinājums attīstības stadiju vērtībās ķīmiskās apstrādes grupā salīdzinājumā ar kontrolgrupu pētījuma 7. un/vai 21. dienā.
|
|
51.
|
Abinieku metamorfozes testā būtiska ietekme uz jebkuru no četriem iepriekš minētajiem beigupunktiem tiek uzskatīta par pietiekamu, lai detektētu paātrinātu attīstību. Tas ir, lai apstiprinātu būtisku ietekmi uz pakaļējās ekstremitātes garumu konkrētā laika punktā, nav nepieciešams, lai būtu arī būtiska ietekme uz pakaļējās ekstremitātes garumu citā laika punktā vai arī būtiska ietekme uz attīstības stadiju šajā konkrētajā laika punktā. Savukārt, lai apstiprinātu būtisku ietekmi uz attīstības stadiju konkrētā laika punktā, nav nepieciešams, lai būtu būtiska ietekme uz attīstības stadiju citā laika punktā vai arī būtiska ietekme uz pakaļējās ekstremitātes garumu šajā specifiskajā laika punktā. Tomēr paātrinātās attīstības pierādījumu nozīmīgums noteikti palielināsies, ja būtiska ietekme tiks konstatēta vairāk nekā vienā beigupunktā.
|
Asinhrona attīstība (noteikta, izmantojot attīstības stadiju kritērijus)
|
52.
|
Asinhrona attīstība izpaužas kā morfoģenēzes vai dažādu audu attīstības relatīvās norises laikā traucējumi atsevišķam kurkulim. Ja nav iespējams skaidri noteikt organisma attīstības stadiju pēc katrai attīstības stadijai tipiskajiem morfoloģiskajiem beigupunktiem, tas liecina, ka metamorfozes laikā audi attīstās asinhroni. Asinhrona attīstība ir vairogdziedzera darbības rādītājs. Vienīgais zināmais veids, kā izraisīt asinhronu attīstību, ir ar ķīmisko vielu palīdzību iedarboties uz vairogdziedzera perifēro hormonu darbību un/vai vairogdziedzeru hormonu metabolismu attīstošos audos, piem., tādu, kāda ir novērota ar dejodināzes inhibitoriem.
|
|
53.
|
Testa dzīvnieku novērtēšana asinhronās attīstības gadījumā salīdzinājumā ar kontrolgrupas dzīvniekiem tiek balstīta uz testa dzīvnieku morfoloģisko novērtējumu 7. un 21. testa dienā.
|
|
54.
|
Nivkopa un Fābera (8) sniegtais normālas Xenopus laevis attīstības raksturojums sniedz pamatu, pēc kura var noteikt normālas audu pārveidošanās secīgo kārtību. Termins “asinhrona attīstība” īpaši attiecas uz tām kurkuļa redzamās morfoloģiskās attīstības novirzēm, kas padara par neiespējamu attīstības stadiju galīgo novērtējumu saskaņā ar Nivkopa un Fābera (8) kritērijiem, jo izšķirošās morfoloģiskās pazīmes pārstāv dažādu attīstības stadiju raksturojumus.
|
|
55.
|
Uz asinhrono attīstību attiecas tikai gadījumi, kad novērojamas specifiskas audu pārveidošanās gaitas novirzes salīdzinājumā ar citu specifisku audu pārveidošanās gaitu. Dažiem klasiskajiem fenotipiem raksturīga priekšējās ekstremitātes novēlota parādīšanās vai trūkums, kamēr pakaļējās ekstremitātes un astes audi attīstās normāli vai paātrināti, vai arī pāragra žaunu uzsūkšanās salīdzinājumā ar pakaļējās ekstremitātes attīstību un astes uzsūkšanos. Dzīvnieka attīstība ir vērtējama kā asinhrona gadījumā, ja nevar noteikt attīstības stadiju, jo tā neatbilst lielākajai daļai galveno attīstības kritēriju saskaņā ar Nivkopa-Fābera stadiju (8), vai arī novērojama nozīmīga vienas vai vairāku pamatpazīmju kavēšanās vai paātrinājums (piem., aste uzsūkusies, bet priekšējās ekstremitātes nav parādījušās). Šis novērtējums tiek veikts kvalitatīvi un ir jāpārbauda visas galvenās pazīmes saskaņā ar Nivkopu un Fāberu (8). Taču nav nepieciešams reģistrēt novēroto dzīvnieku dažādo pazīmju attīstības stadijas. Dzīvniekiem, kuru attīstība ir asinhrona, netiek piešķirta kāda no Nivkopa un Fābera norādītajām attīstības stadijām (8).
|
|
56.
|
Līdz ar to galvenais kritērijs anomālas morfoloģiskās attīstības definēšanā par “asinhronu attīstību” ir audu pārveidošanās relatīvā norise laikā un audu morfoģenēzes traucējums, kamēr ietekmēto audu morfoloģija nav acīmredzami anomāla. Piemērs, kas ilustrē redzamo morfoloģisko anomāliju interpretāciju, ir kavēta pakaļējo ekstremitāšu morfoģenēze attiecībā pret citu audu attīstību, kas atbilst “asinhrona attīstības” kritērijam; savukārt gadījumi, kad pakaļējās ekstremitātes nav attīstījušās, novērojami anomāli pirksti (piem., ektrodaktilija vai polidaktilija) vai citi acīmredzami iedzimti ekstremitāšu defekti, netiks uzskatīti par “asinhronu attīstību”.
|
|
57.
|
Šajā kontekstā galvenās morfoloģiskās pazīmes, kuru koordinētā metamorfozes gaita ir jāizvērtē, ir pakaļējās ekstremitātes morfoģenēze, priekšējās ekstremitātes morfoģenēze, priekšējās ekstremitātes parādīšanās, astes uzsūkšanās stadija (jo īpaši – astes spuras uzsūkšanās), un galvas morfoloģija (piem., žaunu izmērs un žaunu uzsūkšanās stadija, apakšžokļa morfoloģija, Mekeļa skrimšļa izvirzījums).
|
|
58.
|
Atkarībā no ķīmiskās vielas darbības veida var novērot dažādus redzamus morfoloģiskos fenotipus. Dažos klasiskajos fenotipos ietilpst priekšējās ekstremitātes novēlota parādīšanās vai trūkums, neskatoties uz normālu vai paātrinātu pakaļējo ekstremitāšu vai astes audu attīstību, un agrīnu žaunu uzsūkšanās salīdzinājumā ar pakaļējās ekstremitātes un astes pārveidošanos.
|
Histopatoloģija
|
59.
|
Ja ķīmiskā viela nav acīmredzami toksiska, nepaātrina attīstību vai neizraisa asinhronu attīstību, ir jānovērtē vairogdziedzera histopatoloģija, izmantojot attiecīgu norādījumu dokumentu (9). Attīstības aizture apstākļos, kuros nav toksiskuma, ir nozīmīgs vairogdziedzera darbību kavējošas aktivitātes rādītājs, un attīstības stadijas analīze ir mazāk jutīga un mazāk diagnostiska nekā vairogdziedzera histopatoloģiskā analīze. Tādēļ šai gadījumā ir nepieciešama vairogdziedzera histopatoloģijas analīze. Ietekme uz vairogdziedzera histoloģiju ir konstatēta arī tad, ja nav ietekmes uz attīstību. Ja konstatētas vairogdziedzera histopatoloģijas pārmaiņas, ķīmiskā viela ir uzskatāma par vairogdziedzeri ietekmējošu. Ja vairogdziedzerī nav novērota attīstības aizture vai histoloģiski bojājumi, ķīmiskā viela ir uzskatāma par vairogdziedzeri neietekmējošu. Šo lēmumu pamato tas, ka vairogdziedzeri ietekmē vairogdziedzeri stimulējošais hormons (TSH), un jebkura ķīmiska viela, kas maina vairogdziedzera hormonu cirkulāciju tik lielā mērā, lai mainītu arī TSH sekrēciju, izraisīs arī histopatoloģiskas pārmaiņas vairogdziedzerī. Cirkulējošo vairogdziedzera hormonu var ietekmēt darbības dažādi režīmi un mehānismi. Kaut arī vairogdziedzera hormonu līmenis liecina par ietekmi, kas saistīta ar vairogdziedzeri, ar to nepietiek, lai noteiktu, kurš darbības režīms vai mehānisms ir saistīts ar atbildes reakciju.
|
|
60.
|
Tā kā šis beigupunkts nav pakļaujams parastajai statistiskajai analīzei, ar ķīmiskās vielas ekspozīciju saistītās ietekmes noteikšana jāveic, izmantojot patologa eksperta vērtējumu.
|
Kavēta attīstība (konstatēta pēc attīstības stadijas, pakaļējās ekstremitātes garuma, ķermeņa svara, purna-kloākas garuma (SVL))
|
61.
|
Kavētu attīstību var izraisīt gan vairogdziedzera darbību kavējoši mehānismi, gan netiešs toksiskums. Viegla attīstības aizture kopā ar acīmredzamām toksiskuma pazīmēm visticamāk liecina par nespecifisku toksisku iedarbību. Ar vairogdziedzeri nesaistīta toksiskuma novērtēšana ir nozīmīga testa daļa, lai samazinātu varbūtību iegūt viltus pozitīvus rezultātus. Liela mirstība acīmredzami liecina par citu toksisku mehānismu norisi. Tāpat arī viegla augšanas samazināšanās, uz ko norāda mitrais svars, un/vai SVL, liecina par ietekmi, kas nav saistīta ar vairogdziedzeri. Acīmredzami palielināti ķermeņa izmēri bieži tiek novēroti kopā ar normālu attīstību ietekmējošām ķīmiskajām vielām. Attiecīgi lielāku dzīvnieku klātbūtne ne vienmēr norāda uz toksiskumu, kas nav saistīts ar vairogdziedzeri. Tomēr, nosakot toksiskumu vairogdziedzerim, nekad nevar paļauties tikai uz augšanu. Vairogdziedzera darbības novērtēšanai labāk ir izmantot augšanu kopā ar attīstības stadiju un vairogdziedzera histopatoloģiju. Acīmredzama toksiskuma novērtēšanā jāņem vērā arī tādi beigupunkti kā tūska, hemorāģiski bojājumi, letarģija, samazināta barības uzņemšana, neparasta/mainīta peldēšanas uzvedība u. c. Ja visas testa koncentrācijas liecina par acīmredzamu toksiskumu, pirms noteikšanas, vai viela ietekmē vai neietekmē vairogdziedzeri, testējamā ķīmiskā viela ir jāizvērtē pie zemākajām testa koncentrācijām.
|
|
62.
|
Statistiski nozīmīga attīstības aizture gadījumā, ja nav citu acīmredzamu toksiskuma pazīmju, norāda, ka viela ietekmē vairogdziedzeri (antagoniski). Ja nav statistiski stingri pierādāmu datu, rezultāts ir pamatojams ar vairogdziedzera histopatoloģijas rezultātiem.
|
Statistiskā analīze
|
63.
|
Statistisko analīžu veikšanā vēlams sekot procedūrām, kas aprakstītas dokumentā “Ekotoksiskuma datu statistiskās analīzes pašreizējās metodes: lietošanas norādījumi” (11). Lai konstatētu būtisku apstrādes ietekmi, visiem nepārtrauktajiem kvantitatīvajiem beigupunktiem (pakaļējās ekstremitātes garums (HLL, purna-kloākas garums, mitrais svars), kuriem vērojama monotona reakcija uz devu, jāizmanto descendents Džonkhīra-Terpstra tests.
|
|
64.
|
Nepārtrauktajiem beigupunktiem, kas neatbilst monotonai reakcijai uz devu, jānovērtē datu normalitāte (vēlams lietot Šapiro-Vilka testu vai Andersona-Dārlinga testu) un dispersijas homogenitāte (priekšroka ir Lēvena testam). Abus testus veic ar ANOVA atlikumu vērtībām. Formālo normalitātes un dispersijas homogenitātes testu vietā var izmantot ekspertu atzinumus, bet formālajiem testiem tiek dota priekšroka. Ja konstatē neatbilstību normālajam sadalījumam un dispersijas heterogenitāti, jāmeklē normalizējoša, dispersiju stabilizējoša transformācija. Ja dati (iespējams, pēc transformācijas) atbilst normālajam sadalījumam ar homogēnu dispersiju, apstrādes ietekmes būtiskumu nosaka ar Daneta testu. Ja dati (iespējams, pēc transformācijas) atbilst normālajam sadalījumam ar heterogēnu dispersiju, apstrādes ietekmes būtiskumu nosaka ar Tamheina-Daneta testu vai T3 testu, vai Manna-Vitneja-Vilkoksona U-testu. Gadījumā, kad nav iespējama normalizējoša transformācija, apstrādes ietekmes būtiskumu nosaka, izmantojot Manna-Vitneja-Vilkoksona U-testu, lietojot Bonferoni-Holma p-vērtību korekciju. Daneta testu izmanto neatkarīgi no ANOVA F-testa, un Manna-Vitneja testu izmanto neatkarīgi no Kruskalla-Vallisa testa.
|
|
65.
|
Būtiska mirstība testā nav sagaidāma, tomēr ar descendentu Kohrana-Armitāža testu jānovērtē, vai dati atbilst devas-reakcijas monotonitātei; ja neatbilst, tad jāizmanto Fišera eksaktais tests ar Bonferoni-Holma korekciju.
|
|
66.
|
Apstrādes ietekmes būtiskums uz attīstības stadijām ir nosakāms ar descendentu Džonkhīra-Terpstra testu, lietojot to uz replikātu mediānām. Ietekmes novērtēšanai var lietot arī multikvantu Džonkhīra testu no 20. līdz 80. procentīlei; šis tests ir ieteicams tādēļ, ka tas ņem vērā pārmaiņas sadalījuma profilā.
|
|
67.
|
Atbilstošā analīzes vienība ir viens replikāts, tādēļ dati sastāv no replikātu mediānām, ja izmantots Džonkhīra-Terpstra vai Manna-Vitneja U-tests, vai no replikātu aritmētiskajiem vidējiem, ja lieto Daneta testu. Devas-reakcijas monotonitāti var novērtēt vizuāli no replikātu un apstrāžu aritmētiskajiem vidējiem vai mediānām, vai ar iepriekš aprakstītajiem formālajiem testiem. Ja ir mazāk nekā pieci apstrādes un kontrolgrupas replikāti, jālieto eksaktās Džonkhīra-Terpstra vai Manna-Vitneja testu permutāciju versijas (ja pieejamas). Visu testu statistiskā nozīme ir novērtējama ar nozīmes līmeni 0,05.
|
|
68.
|
Nepārtrauktu datu statistiskās analīzes shēma sniegta 4. attēlā.
4. attēls.
Statistisko pieeju diagramma nepārtrauktas atbildes reakcijas datiem.
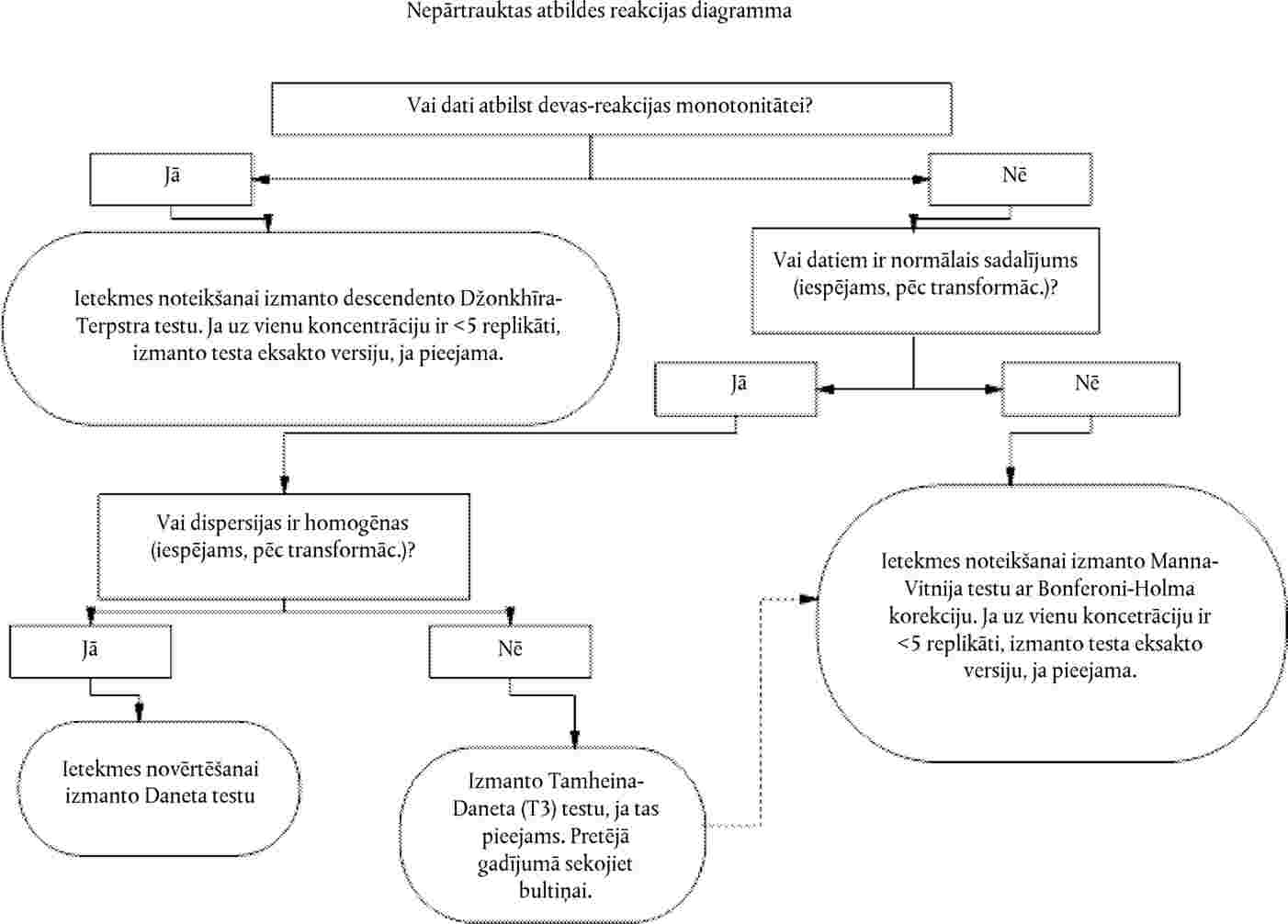
|
Īpaši datu analīzes apsvērumi
Apšaubāmo apstrādes līmeņu lietošana
|
69.
|
Nosakot, vai replikāts vai visa apstrāde liecina par acīmredzamu toksiskumu un būtu jāizslēdz no analīzes, jāņem vērā vairāki faktori. Acīmredzams toksiskums tiek definēts kā >2 mirstības jebkurā no replikātiem, ja tās var būt izskaidrojamas tikai ar toksiskumu, nevis tehnisku kļūdu. Citas acīmredzama toksiskuma pazīmes ir hemorāģijas, anomālas darbības, neparasta peldēšanas uzvedība, anoreksija un jebkuras citas klīniskas saslimšanas pazīmes. Subletālām toksiskuma pazīmēm var būt nepieciešama kvalitatīva novērtēšana, un tā vienmēr jāveic salīdzinājumā ar tīra ūdens kontrolgrupu.
|
Šķīdinātāja kontrolgrupa
|
70.
|
Šķīdinātāja izmantošana ir apsverama tikai kā galējais līdzeklis, kad ir apsvērtas visas citas ķīmiskās ievades iespējas. Ja lieto šķīdinātāju, kopā ar to testē arī kontrolgrupu ar tīru ūdeni. Testu beidzot, jāveic šķīdinātāja potenciālās ietekmes novērtēšana. Tas ir veicams, statistiski salīdzinot šķīdinātāja kontrolgrupu un tīra ūdens kontrolgrupu. Šajā analīzē izmantojamie nozīmīgākie beigupunkti ir attīstības stadija, purna-kloākas garums un mitrais svars, jo tos var ietekmēt ar vairogdziedzeri nesaistīts toksiskums. Ja šajos beigupunktos ir konstatētas statistiski būtiskas atšķirības starp tīra ūdens kontrolgrupu un šķīdinātāja kontrolgrupu, pētījuma beigupunkti atbildei uz testējamo vielu jānosaka, izmantojot tīra ūdens kontrolgrupu. Ja nav statistiski būtisku atšķirību starp tīra ūdens kontrolgrupu un šķīdinātāja kontrolgrupu visiem mērītajiem testa kritērijiem, pētījuma beigupunkti ir nosakāmi, izmantojot apvienotu šķīduma ūdens un šķīdinātāja kontrolgrupu.
|
Ietekmētās grupas, kas sasniegušas 60. un augstāku attīstības stadiju
|
71.
|
Audu resorbcijas un absolūtā ūdens satura samazinājuma dēļ pēc 60. attīstības stadijas samazinās kurkuļu lielums un svars. Tādēļ mitrā svara un SVL mērījumus nevar izmantot augšanas ātrumu atšķirību statistiskajās analīzēs. Attiecīgi mitrā svara un garuma dati organismiem, kas ir vismaz 60. attīstības stadijā, jāizslēdz, un tos nevar izmantot replikātu aritmētisko vidējo un replikātu mediānu analīzēs. Lai analizētu šos ar augšanu saistītos parametrus, var izmantot divas dažādas pieejas.
|
|
72.
|
Viena pieeja ir mitrā svara un/vai SVL statistiskajās analīzēs ņemt vērā tikai tos kurkuļus, kuri ir 60. attīstības stadijā vai mazākā. Ja tikai neliela testa dzīvnieku daļa tiek izslēgta no analīzes (≤ 20 %), uzskata, ka šāda pieeja sniedz pietiekami skaidru informāciju par iespējamās ietekmes uz augšanu nozīmīgumu. Ja 60. attīstības stadiju pārsniegušo kurkuļu skaits ir lielāks (≥ 20 %) vienā vai vairākās nominālajās koncentrācijās, visiem kurkuļiem ir jāveic divfaktoru ANOVA ar hierarhiskās dispersijas struktūru, lai novērtētu ķīmiskās apstrādes ietekmi uz augšanu, ņemot vērā vēlīno stadiju attīstību un augšanu. Norādījumi svara un garuma analīzei ar divfaktoru ANOVA sniegti 3. papildinājumā.
|
LITERATŪRA
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paris
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paris
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelpia, PA
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratotropesis Assay – Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. & Hammermeister,D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551
|
|
(8)
|
Nieuwkoop,P.D. & Faber,J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris
|
|
(10)
|
Dodd,M.H.I. & Dodd,J.M. (1976) Physiology of Amphibia. Lofts,B. (ed.), Academic Press, New York, pp. 467-599
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paris
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
1. papildinājums
1. tabula.
Abinieku metamorfozes 21 dienas testa eksperimenta apstākļi
|
Testa dzīvnieks
|
Xenopus laevis kurkulis
|
|
Kurkuļa sākumstadija
|
51. stadija pēc Nivkopa un Fābera
|
|
Ekspozīcijas laiks
|
21 diena
|
|
Kurkuļu atlases kritēriji
|
Attīstības stadija un kopējais garums (vēlams)
|
|
Testa koncentrācijas
|
Vismaz trīs koncentrācijas, starp kurām ir atšķirība par vismaz vienu lieluma kārtu
|
|
Ekspozīcijas režīms
|
Caurteces (vēlams) un/vai statiska sistēma ar periodisku ūdens nomaiņu
|
|
Testēšanas sistēmas caurteces ātrums
|
25 ml/min (visu tilpumu pilnībā nomaina katrās 2,7 stundās)
|
|
Primārie beigupunkti / noteikšanas dienas
|
Mirstība
|
Katru dienu
|
|
Attīstības stadija
|
7. un 21. diena
|
|
Pakaļējās ekstremitātes garums
|
7. un 21. diena
|
|
Purna-kloākas garums
|
7. un 21. diena
|
|
Ķermeņa svars
|
7. un 21. diena
|
|
Vairogdziedzera histoloģija
|
21. diena
|
|
Atšķaidīšanas ūdens / laboratorijas kontrole
|
Dehlorēts krāna ūdens (filtrēts ar aktīvo ogli) vai līdzvērtīgs laboratorijā sagatavots ūdens
|
|
Kurkuļu blīvums
|
20 kurkuļi uz testēšanas trauku (5 kurkuļi/litru)
|
|
Testēšanas šķīdums / testēšanas trauks
|
4–10 l (10–15 cm ūdens minimums) / stikla vai nerūsējošā tērauda testēšanas trauks (piem., 22,5 cm × 14 cm × 16,5 cm)
|
|
Replikāti
|
4 testa replikāta trauki katrai testa koncentrācijai un kontrolgrupai
|
|
Pieļaujamā mirstība kontrolgrupā
|
≤ 10 % uz vienu testa replikāta trauku
|
|
Vairogdziedzera fiksācija
|
Fiksētais skaits
|
Visi kurkuļi (sākumā tika vērtēti 5 kurkuļi uz replikātu)
|
|
Ķermeņa daļa
|
Galva vai viss ķermenis
|
|
Fiksācijas šķidrums
|
Davidsona fiksācijas šķīdums
|
|
Barošana
|
Barība
|
Komerciāli pieejamā barība, piem., Sera Micron® vai līdzvērtīga
|
|
Daudzums / biežums
|
Barošanas biežumu, izmantojot Sera Micron® sk. 1. tabulā
|
|
Apgaismojums
|
Fotoperiods
|
Gaisma 12 stundas: tumsa 12 stundas
|
|
Intensitāte
|
600–2 000 luksi (mērīts pie ūdens līmeņa)
|
|
Ūdens temperatūra
|
22° ± 1 °C
|
|
pH
|
6,5–8,5
|
|
Izšķīdušā skābekļa (DO) koncentrācija
|
> 3,5 mg/l (> 40 % gaisa piesātinājums)
|
|
Laika plānojums ievācot paraugus ķīmiskajām analīzēm
|
Vienu reizi / reizi nedēļā (4 paraugu ņemšana uz testu)
|
2. papildinājums
Jēldatu un kopsavilkuma datu pārskata tabulas
1. tabula.
Pamatinformācija par testējamo ķīmisko vielu
|
Ķīmiskā informācija
|
|
|
Ievadiet testējamās ķīmiskās vielas nosaukumu, koncentrācijas vienības un veikto iedarbību
|
|
|
Testējamā ķīmiskā viela:
|
|
|
|
|
Koncentrācijas vienības
|
|
|
|
|
1. apstrāde
|
|
|
|
|
2. apstrāde
|
|
|
|
|
3. apstrāde
|
|
|
|
|
4. apstrāde
|
|
|
|
|
|
|
|
|
|
Datums (0. diena)
|
|
Ievadiet datumu (mm/dd/gg)
|
|
|
Datums (7. diena):
|
|
Ievadiet datumu (mm/dd/gg)
|
|
|
Datums (21. diena):
|
|
Ievadiet datumu (mm/dd/gg)
|
2. tabula.
Jēldatu ievākšana 7. un 21. dienā
|
X. DIENA
DATUMS 00/00/00
|
|
|
Koncentrācija
|
Apstrādes numurs
|
Replikāta numurs
|
Individuālais numurs
|
Individuālais identifikators
|
Attīstības stadija
|
Purna-kloākas garums (mm)
|
Pakaļējās ekstremitātes garums (mm)
|
Visa organisma mitrais svars (mg)
|
|
RINDA
|
TRT (apstrāde)
|
TRT#
|
REP (replikāts)
|
IND
|
ID#
|
STADIJA
|
BL (ķermeņa garums)
|
HLL (pakaļējās ekstremitātes garums)
|
SVARS
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
3. tabula.
Aprēķinātie 7. un 21. dienas beigupunktu datu apkopojumi
|
|
|
Attīstības stadija
|
Purna-kloākas garums (SVL, mm)
|
Pakaļējās ekstremitātes garums (mm)
|
Svars (mg)
|
|
TRT (apstrāde)
|
REP (replikāts)
|
MIN
|
MEDIĀNA
|
MAX
|
VIDĒJAIS
|
STANDARTNOVIRZE
|
VIDĒJAIS
|
STANDARTNOVIRZE
|
VIDEĀJIS
|
STANDARTNOVIRZE
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Piezīme: aprēķini šūnās saistīti ar datu ievadi 2. tabulā.
|
4. tabula.
Mirstība pa dienām
|
Testēšanas diena
|
Datums
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0.
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21.
|
#Vērtība!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Replikāta numurs
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Apstrādes numurs
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Piezīme: aprēķini šūnās saistīti ar datu ievadi 1. tabulā.
|
5. tabula.
Ūdens kvalitātes kritēriji
Ekspozīcijas sistēma (caurteces/ ar periodisku ūdens nomaiņu)
Temperatūra:
Gaismas intensitāte
Gaismas-tumsas cikls:
Barība:
Barošanas daudzums
Ūdens pH
Joda koncentrācija testēšanas ūdenī:
6. tabula.
Ķīmija, datu apkopojums
|
Ķīmiskās vielas nosaukums:
|
|
CAS #:
|
|
Testēšanas diena
|
Datums
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0.
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21.
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Piezīme: aprēķini šūnās ir saistīti ar datu ievadi 1. tabulā.
|
7. tabula.
Galvenie histoloģijas parametri, ziņojuma tabula
|
Datums:
|
Ķīmiskā viela:
|
|
|
Patologs:
|
|
|
Vairogdziedzera hipertrofija
|
Vairogdziedzera atrofija
|
Folikulāro šūnu hipertrofija
|
Folikulāro šūnu hiperplāzija
|
|
Vairogdziedzera hipertrofija
|
Vairogdziedzera atrofija
|
Folikulāro šūnu hipertrofija
|
Folikulāro šūnu hiperplāzija
|
|
Kontrolgrupas dzīvnieka ID – replikāts 1
|
|
|
|
|
|
Devas dzīvnieka ID – replikāts 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontroles dzīvnieka ID – replikāts 2
|
|
|
|
|
|
Devas dzīvnieka ID – replikāts 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kopā:
|
|
|
|
|
Kopā:
|
|
|
|
|
|
|
Vairogdziedzera hipertrofija
|
Vairogdziedzera atrofija
|
Folikulāro šūnu hipertrofija
|
Folikulāro šūnu hiperplāzija
|
|
|
Vairogdziedzera hipertrofija
|
Vairogdziedzera atrofija
|
Folikulāro šūnu hipertrofija
|
Folikulāro šūnu hiperplāzija
|
|
Devas dzīvnieka ID – replikāts 1
|
|
|
|
|
|
Devas dzīvnieka ID – replikāts 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – replikāts 2
|
|
|
|
|
|
Devas dzīvnieka ID – replikāts 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kopā:
|
|
|
|
|
Kopā:
|
|
|
|
|
8. tabula.
Papildu histoloģiskie kritēriji
|
Datums:
|
Ķīmiskā viela
|
|
|
Patologs:
|
|
|
|
|
|
|
|
|
Folikulārā lūmena laukuma palielināšanās
|
Folikulārā lūmena laukuma samazināšanās
|
Folikulārārā lūmena laukuma palielināšanās
|
Folikulārā lūmena laukuma samazināšanās
|
|
Kontrolgrupas dzīvnieka ID – 1. replikāts
|
|
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontrolgrupas dzīvnieka ID – 2. replikāts
|
|
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kopā:
|
|
|
Kopā:
|
|
|
|
|
Folikulārā lūmena laukuma palielināšanās
|
Folikulārā lūmena laukuma samazināšanās
|
|
|
Folikulārā lūmena laukuma palielināšanās
|
Folikulārā lūmena laukuma samazināšanās
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 2. replikāts
|
|
|
|
Devas dzīvnieka ID – 2. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kopā:
|
|
|
Kopā:
|
|
|
9. tabula.
Histopatoloģisko novērojumu raksturojumi
|
Datums:
|
|
Ķīmiskā viela:
|
|
Patologs:
|
|
|
Novērojumu raksturojums
|
|
Kontrolgrupas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontrolgrupas dzīvnieka ID – 2. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 2. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 2. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 1. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Devas dzīvnieka ID – 2. replikāts
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10. tabula.
Tabula abinieku metamorfozes testa (AMT) x dienas (7. vai 21. diena) rezultātu apkopojumam
|
|
|
Kontrolgrupa
|
1. deva
|
2. deva
|
3. deva
|
|
Beigupunkts
|
Replikāts
|
Aritmētiskais vidējais
|
SD (standartnovirze)
|
CV
|
N
|
Aritmētiskais vidējais
|
SD
|
CV
|
N
|
p-vērtība
|
Aritmētiskais vidējais
|
SD
|
CV
|
N
|
p-vērtība
|
Aritmētiskais vidējais
|
SD
|
CV
|
N
|
p-vērtība
|
|
Pakaļējās ekstremitātes garums
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aritmētiskais vidējais
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aritmētiskais vidējais
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mitrais svars
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aritmētiskais vidējais
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11. tabula.
Tabula abinieku metamorfozes testa (AMT) x dienas (7. vai 21. diena) attīstības stadijas apkopojumam
|
|
|
Kontrolgrupa
|
1. deva
|
2. deva
|
3. deva
|
|
|
Replikāts
|
Mediāna
|
Min.
|
Maks.
|
N
|
Mediāna
|
Min.
|
Maks.
|
N
|
p-vērtība
|
Mediāna
|
Min.
|
Maks.
|
N
|
p-vērtība
|
Mediāna
|
Min.
|
Maks.
|
Mediāna
|
p-vērtība
|
|
Attīstības stadija
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aritmētiskais vidējais:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. papildinājums
Alternatīvās svara un garuma analīzes gadījumā, ja vēlīnas attīstības stadija dēļ jāizslēdz vairāk nekā 20 % kurkuļu vienā vai vairākās koncentrācijās
Ja 60. attīstības stadiju pārsniegušo kurkuļu skaits ir lielāks (≥ 20 %) vienā vai vairākās nominālajās koncentrācijās, visiem kurkuļiem jāveic divfaktoru ANOVA ar hierarhiskās dispersijas struktūru, lai novērtētu apstrādes ar ķīmisko vielu ietekmi uz augšanu, ņemot vērā vēlīno stadiju attīstību un augšanu.
Ieteikums ir izmantot visus datus, bet ņemt vērā ietekmi uz vēlīnajām attīstības stadijām. Tas ir izdarāms ar divfaktoru ANOVA ar hierarhiskās dispersijas struktūru. Dzīvniekam, kurš sasniedzis 61. attīstības stadiju vai augstāku, definējiet attīstības stadiju kā LateStage=’Yes’. Pretējā gadījumā attīstības stadija tiek definēta kā LateStage=’No’. Pēc tam var veikt divfaktoru ANOVA ar koncentrāciju un LateStage, novērtējot to mijiedarbību, kā nejaušu faktoru izmantojot Rep(Conc) un kā citu nejaušu ietekmi – Tadpole(Rep). Šādi vēl aizvien replikāts (“rep”) tiek analizēts kā analīzes vienība un sniedz būtībā tādus pašus rezultātus kā rep*latestage vidējo vērtību svērtā analīze, izsvērta pēc dzīvnieku skaita uz vidējo. Ja dati neiekļaujas ANOVA nepieciešamajā normalitātē vai dispersijas homogenitātē, šā šķēršļa novēršanai jāveic normalizēta sarindojuma transformācija.
Papildus ANOVA standarta F-testiem Conc, LateStage un to mijiedarbības ietekmes noteikšanai mijiedarbības F-testu var sadalīt divos papildu ANOVA F-testos – viens vidējām atbildes reakcijām uz koncentrācijām attiecībā uz LateStage=’No’ un otrs vidējām atbildes koncentrācijām attiecībā uz LateStage=’Yes’. Turpmāka apstrādes vidējo rezultātu salīdzināšana ar kontrolgrupu tiek veikta katrā LateStage līmenī. Trenda tipa analīzi var veikt, lietojot piemērotus kontrastus vai vienkāršus pāru salīdzinājumus, ja ir aizdomas par LateStage mainīgā līmenī novērotu devas-reakcijas nemonotonitāti. Bonferoni-Holma p-vērtību korekcija jāveic vienīgi tad, ja atbilstošā F-daļa nav būtiska. Tas veicams ar SAS vai, ja iespējams, ar citām datu paketēm. Sarežģījumi var rasties, ja dažās koncentrācijās nav vēlīno attīstības stadiju dzīvnieku, bet šīs situācijas ir vienkārši risināmas.
4. papildinājums
Definīcijas
|
|
Ķīmiska viela ir viela vai maisījums.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai maisījums, ko testē ar šo testēšanas metodi.
|
C.39. KOLEMBOLU VAIROŠANĀS TESTS AUGSNĒ
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 232 (2009. gads). Tā izveidota, lai novērtētu ķīmisko vielu ietekmi uz augsnes kolembolu vairošanās (reproduktīvajām) sekmēm. Tā ir balstīta uz jau esošām procedūrām (1)(2). Partenoģenētiskā Folsomia candida un Folsomia fimetaria, kam raksturīga dzimumvairošanās, ir divas no vispieejamākajām kolembolu sugām, tās ir kultivējamas un komerciāli pieejamas. Gadījumos, kad šīs divas sugas nav izmantojamas specifisku biotopu pētīšanā, metode piemērojama arī citām kolembolu sugām, ja tās var izpildīt testa ticamības kritērijus.
|
|
2.
|
Augsnē dzīvojošās kolembolas ir ekotoksikoloģiskajiem testiem piemērotas sugas. Kolembolas jeb lēcastes ir seškāji ar plānu ārskeletu, kam ir augsta gaisa un ūdens caurlaidība, tās pieder pie posmkājiem, kam salīdzinājumā ar sliekām un sīksliekām ir cits ekspozīcijas ceļš un intensitāte.
|
|
3.
|
Daudzās sauszemes ekosistēmās augsnē un lapu nobirās kolembolu populācijas blīvums sasniedz 105 m– 2 (3)(4). Pieaugušie īpatņi parasti sasniedz 0,5–5 mm garumu, to ieguldījums kopējā augsnes dzīvnieku biomasā un elpošanā ir neliels, no 1 līdz 5 % (5). Tādējādi kolembolu lielākā nozīme varētu būt kā potenciālajiem procesu regulatoriem, jo tās barojas no mikroorganismiem un mikrofaunas. Kolembolas jeb lēcastes ir plēsēji, kas pārtiek no plaša spektra endogeiskajiem un epigeiskajiem bezmugurkaulniekiem – ērcēm, simtkājiem, zirnekļiem, vabolēm un īsspārņiem. Kolembolas piedalās noārdīšanās procesos skābajās augsnēs, kur tās var būt nozīmīgākais augsnes bezmugurkaulnieks kopā ar sīksliekām, jo šeit parasti nav slieku un tūkstoškāju.
|
|
4.
|
F. fimetaria ir izplatīta visā pasaulē un ir bieži sastopama dažādos augšņu tipos – sākot ar smilšainu un smilšmāla līdz mull un mor tipa augsnēm. Tā ir nepigmentēta, bezacu kolembola. Konstatēta lauksaimniecības augsnēs visā Eiropā (6). Visēdāja, tās uzturā ir gan sēņu hifas, gan baktērijas, vienšūņi un trūdvielas. Barojoties tās mijiedarbojas ar augu patogēnajām sēnēm (7) un F. candida gadījumā var ietekmēt mikorizas. Līdzīgi kā vairums kolembolu sugu, tā vairojas dzimumvairošanās ceļā, un olšūnu apaugļošanai ir nepieciešama pastāvīga tēviņu klātbūtne.
|
|
5.
|
F. candida arī ir izplatīta visā pasaulē. Kaut arī tā nav sastopama vairumā dabisko augšņu, tā bieži lielos daudzumos atrodama trūdvielām bagātās augsnēs. Tā ir nepigmentēta, bezacu kolembola. Tai ir labi attīstīta lēcējdakša (orgāns, ko lieto lēkšanai), un tā var aktīvi skriet un lēkt, ja to iztraucē. F. candida ekoloģiskā nozīme ir līdzīga F. Fimetaria ekoloģiskajai nozīmei, bet tās biotopi ir organiskām vielām bagātākas augsnes. Vairojas partenoģenētiski. Tēviņi var būt sastopami retāk kā viens uz tūkstoti.
|
TESTA PRINCIPS
|
6.
|
Sinhronizētas pieaugušās (F. fimetaria) vai juvenilās (F. candida) kolembolas tiek eksponētas testējamās ķīmiskās vielas koncentrāciju diapazonam modificētā mākslīgā augsnē (8) ar 5 % organisko vielu saturu (vai citā augsnē). Testa gaita iedalāma divos posmos:
|
—
|
ja nav pieejama pietiekama informācija par toksiskumu, veic diapazona noteikšanas testu, kurā galvenie beigupunkti ir mirstība un vairošanās; tos nosaka F. fimetaria pēc 2 nedēļām un F. candida pēc 3 nedēļām;
|
|
—
|
galīgajā vairošanās testā tiek noteikts pieaugušo īpatņu radītais kopējais juvenīlo īpatņu skaits un pēcnācējus radījušo īpatņu izdzīvotība. Galīgā testa ilgums ir 3 nedēļas F. fimetaria vai 4 nedēļas F. candida.
|
Testējamās ķīmiskās vielas toksiskā iedarbība uz pieaugušo dzīvnieku mirstību un vairošanos tiek apzīmēta ar LCx un ECx, ar nelineārās regresijas palīdzību pielāgojot datus atbilstošam modelim, lai noteiktu koncentrāciju, kas attiecīgi varētu izraisīt x % mirstību vai reproduktīvā iznākuma samazinājumu, vai alternatīvi to apzīmē kā NOEC/LOEC vērtību (9).
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
7.
|
Vēlams, lai būtu zināmas testējamās ķīmiskās vielas fizikālās īpašības, šķīdība ūdenī, log Kow, augsnes-ūdens sadalījuma koeficients, un tvaika spiediens. Papildus vēlama informācija par testējamās vielas apriti augsnē, piem., fotolīzes, hidrolīzes un biotiskās noārdīšanās pakāpe. Ja iespējams, jādokumentē arī testējamās ķīmiskās vielas identifikācija saskaņā ar IUPAC nomenklatūru, CAS numurs, partija, laidiens, struktūrformula un tīrība.
|
|
8.
|
Testēšanas metodi var izmantot gan ūdenī šķīstošām, gan nešķīstošām ķīmiskajām vielām. Tomēr atkarībā no testējamās vielas atšķirsies tās ievadīšana. Testēšanas metode nav izmantojama gaistošām ķīmiskajām vielām, t.i., vielām, kurām Henrija konstante vai gaisa-ūdens sadalījuma koeficients ir lielāks par vienu, vai vielām, kuru tvaika spiediens pārsniedz 0,0133 Pa pie 25 °C.
|
TESTA DERĪGUMS
|
9.
|
Lai testu varētu uzskatīt par derīgu, tam jāatbilst šādiem kritērijiem:
|
—
|
vidējā pieaugušo īpatņu mirstība testa beigās nedrīkst pārsniegt 20 %;
|
|
—
|
juvenīlo īpatņu skaitam uz trauku testa beigās jābūt vismaz 100;
|
|
—
|
variācijas koeficientam, kas aprēķināts juvenīlo īpatņu skaitam, jābūt mazākam par 30 % galīgā testa beigās.
|
|
ĶĪMISKĀ STANDARTVIELA
|
10.
|
Ķīmiskā standartviela ir jātestē izvēlētajā augsnes tipā tās EC50
koncentrācijā ar regulāriem intervāliem vai arī jāiekļauj katrā testā, lai pārliecinātos, ka testa organismu atbilde testa sistēmā ir normāla līmeņa robežās. Piemērota standartviela ir borskābe, kurai vajadzētu abām sugām samazināt reprodukciju par 50 % (10)(11) apmēram 100 mg/kg augsnes saussvara.
|
TESTA APRAKSTS
Testēšanas trauki un aprīkojums
|
11.
|
Piemēroti testēšanas trauki ir konteineri, kuros var iepildīt 30 g mitras augsnes. Trauka materiālam jābūt no stikla vai no inertas plastmasas (kas nav toksiska). Tomēr jāizvairās no plastmasas konteineru izmantošanas tad, ja ķīmiskās vielas ekspozīcija samazinās sorbcijas dēļ. Testēšanas trauku šķērsgriezuma laukumam jābūt tādam, lai traukā augsnes faktiskais dziļums varētu būt 2–4 cm. Testēšanas traukiem jābūt ar vākiem (piem., stikla vai polietilēna), kuru konstrukcija samazina ūdens iztvaikošanu, vienlaikus pieļaujot gāzu apmaiņu starp augsni un atmosfēru. Konteineram vismaz daļēji jābūt caurspīdīgam, lai tas būtu gaismas caurlaidīgs.
|
|
12.
|
Nepieciešams parastais laboratorijas aprīkojums, kurā noteikti ietilpst:
|
—
|
pH metrs un luksometrs;
|
|
—
|
piemēroti precīzi svari;
|
|
—
|
temperatūras kontrolei piemērots aprīkojums;
|
|
—
|
mitruma kontrolei piemērots aprīkojums (nav obligāts, ja ekspozīcijas trauki aizvērti ar vākiem);
|
|
—
|
inkubators vai neliela istaba ar kontrolētu temperatūru;
|
|
—
|
knaibles vai lēnas iesūkšanas gaisa plūsmas ierīce.
|
|
Testa augsnes sagatavošana
|
13.
|
Izmanto pārveidotu mākslīgo augsni (8) ar organisko vielu saturu 5 %. Var izmantot arī dabisku augsni, ja mākslīgā augsne nelīdzinās dabiskajai augsnei. Ieteicamais mākslīgās augsnes sastāvs (saussvars, žāvēta 105 °C līdz konstantam svaram):
|
—
|
5 % gaissausas un smalki samaltas sfagnu kūdras (pieļaujams daļiņu izmērs līdz 2 ± 1 mm);
|
|
—
|
20 % kaolīna māla (kaolinīta saturs vēlams virs 30 %);
|
|
—
|
apmēram 74 % gaissausas rūpnieciskas smilts (daudzums atkarīgs no nepieciešamā CaCO3 daudzuma), pārsvarā tās sastāvā ir smalka smilts, kurā vairāk nekā 50 % daļiņu ir 50 līdz 200 mikronus lielas. Precīzs smilšu daudzums atkarīgs no CaCO3 satura (sk. turpmāk), kopā jābūt ne vairāk kā 75 %;
|
|
—
|
1,0 % kalcija karbonāta (CaCO3, pulverizēts, analītiskās tīrības pakāpes), lai sasniegtu pH 6,0 ± 0,5; pievienojamā kalcija karbonāta daudzums galvenokārt atkarīgs no kūdras kvalitātes/rakstura (sk. 1. piezīmi).
|
1. piezīme: nepieciešamā CaCO3 daudzums būs atkarīgs no augsnes substrāta sastāvdaļām, un tas jānosaka, mērot pH apakšparaugos tieši pirms testa, mitrā pirmsinkubācijas augsnē.
2. piezīme: ieteicams noteikt pH un neobligāti arī C/N attiecību, katjonu apmaiņas kapacitāti (CEC) un organisko vielu saturu augsnē, lai padarītu iespējamu normalizāciju vēlākajās stadijās un labāku rezultātu interpretēšanu.
3. piezīme: ja nepieciešams, piem., specifiskiem testēšanas nolūkiem, par testa un/vai kontrolgrupas substrātu var izmantot dabiskas augsnes no nepiesārņotām teritorijām. Taču, ja lieto dabisku augsni, tai jābūt brīvai no piesārņojuma, un ir jāraksturo vismaz tās izcelšanās (ņemšanas) vieta, pH, struktūra (daļiņu lieluma sadalījums), CEC un organisko vielu saturs. Dabiskām augsnēm ir ieteicams noskaidrot to piemērotību testam un testa derīguma kritēriju sasniegšanai pirms augsnes izmantošanas galīgā testā.
|
|
14.
|
Augsnes sausās sastāvdaļas rūpīgi sajauc (piem., lielā laboratorijas maisītājā). Mākslīgās augsnes maksimālo ūdensnoturētspēju (WHC) noskaidro saskaņā ar 5. papildinājumā aprakstītajām procedūrām. Testējamās augsnes mitruma saturs ir jāoptimizē, lai iegūtu irdenu porainu augsni, kuras struktūra ļauj kolembolām nokļūt porās. Parasti tas ir 40–60 % no maksimālās ūdensnoturētspējas.
|
|
15.
|
Lai līdzsvarotu/stabilizētu augsnes skābumu, sausā mākslīgā augsne 2–7 dienas pirms testa jāsamitrina, pievienojot dejonizētu ūdeni tik daudz, lai sasniegtu apmēram pusi no testa sākumā nepieciešamā kopējā ūdens daudzuma. pH noteikšanai izmanto augsnes maisījumu un 1 M kālija hlorīda (KCl) vai 0,01 M kalcija hlorīda (CaCl2) šķīduma attiecībā 1:5 (saskaņā ar 6. papildinājumu). Ja augsne ir skābāka par nepieciešamo skābuma diapazonu, to var koriģēt, pievienojot atbilstošu CaCO3 daudzumu. Ja augsne ir pārāk bāziska, to var koriģēt, pievienojot kolembolām nekaitīgu neorganisko skābi.
|
|
16.
|
Iepriekš samitrinātā augsne tiek sadalīta daļās atbilstoši testa koncentrāciju (un ķīmisko standartvielu, ja nepieciešams) un testā izmantoto kontrolgrupu skaitam. Testējamās ķīmiskās vielas pievienošana un ūdens satura regulēšana notiek saskaņā ar 24. punktu.
|
Testējamo dzīvnieku atlase un sagatavošana
|
17.
|
Ieteicamākā suga ir partenoģenētiskā F. candida, jo starplaboratoriju salīdzinošajā testēšanā (11) šī suga biežāk nekā F. fimetaria atbilda ar izdzīvotību saistītajiem derīguma kritērijiem. Ja izmanto citas sugas, tām jāatbilst 9. punktā aprakstītajiem ticamības kritērijiem. Testa sākumā dzīvniekiem jābūt labi pabarotiem; vēlamais vecums ir 23–26 dienas F. fimetaria un 9–12 dienas F. candida. Katrā replikātā jābūt 10 F. fimetaria tēviņiem un 10 mātītēm, un 10 F. candida mātītēm (sk. 2. un 3. papildinājumu). Pēc nejaušības principa no traukiem atlasa sinhronizētus dzīvniekus, un veselību un fizisko stāvokli pārbauda katrai grupai, kas tiek pievienota replikātam. Katra 10/20 īpatņu lielā grupa tiek ielikta nejauši izvēlētā testēšanas konteinerā; ieteicams izvēlēties lielas F. fimetaria mātītes, lai nodrošinātu to atšķiršanu no F. fimetaria tēviņiem.
|
Testa koncentrāciju sagatavošana
|
18.
|
Testējamās ķīmiskās vielas iestrādei augsnē var izmantot četras metodes: 1) testējamās ķīmiskās vielas iejaukšana augsnē ar ūdeni kā nesēju, 2) testējamās ķīmiskās vielas iejaukšana augsnē ar organisko šķīdinātāju kā nesēju, 3) testējamās ķīmiskās vielas iemaisīšana augsnē ar smiltīm kā nesēju, 4) testējamās ķīmiskās vielas izkliedēšana uz augsnes virskārtas. Piemērotākās metodes izvēle atkarīga no ķīmiskās vielas raksturlielumiem un testa mērķa. Pamatā ieteicama testējamās vielas iejaukšana augsnē. Tomēr var būt arī nepieciešamas ķīmiskās vielas ievadīšanas metodes, kas atbilst ķīmiskās vielas praktiskajam izmantojumam (piem., šķidro preparātu izsmidzināšana vai īpašu pesticīdu preparātu, piem. granulu vai sēklu pārklājumu, izmantošana). Augsni apstrādā pirms kolembolu pievienošanas, izņemot gadījumus, kad testējamā ķīmiskā viela tiek izkliedēta augsnes virskārtā, tad kolembolām ļauj vispirms iekļūt augsnē.
|
Ūdenī šķīstoša testējamā ķīmiskā viela
|
19.
|
Testējamās ķīmiskās vielas šķīdumu pagatavo dejonizētā ūdenī tādā daudzumā, kas ir pietiekams vienas testa koncentrācijas visiem replikātiem. Pirms iepildīšanas testēšanas traukā katru testējamās ķīmiskās vielas šķīdumu rūpīgi samaisa ar vienu iepriekš samitrinātas augsnes porciju.
|
Ūdenī nešķīstoša testējamā ķīmiskā viela
|
20.
|
Vielām, kas nešķīst ūdenī, bet šķīst organiskajos šķīdinātājos, testējamo ķīmisko vielu var izšķīdināt mazākajā iespējamajā piemērota organiskā šķīdinātāja (piem., acetona) daudzumā, kas nodrošina ķīmiskās vielas pienācīgu iejaukšanu augsnē un nepieciešamo sajaukšanos ar kvarca smilti. Jālieto tikai gaistoši šķīdinātāji. Ja izmanto organisko šķīdinātāju, visām testa koncentrācijām un šķīduma negatīvajai papildu kontrolgrupai jāsatur vienāds minimālais šķīdinātāja daudzums. Apstrādes konteineri uz zināmu laiku jāatstāj neapsegti, lai ar testējamās ķīmiskās vielas ievadīšanu saistītais šķīdinātājs varētu iztvaikot, vienlaikus nodrošinot, ka nenotiek testējamās ķīmiskās viela disipācija.
|
Testējamās ķīmiskās vielas, kas slikti šķīst ūdenī un organiskajos šķīdinātājos
|
21.
|
Attiecībā uz ķīmiskajām vielām, kas slikti šķīst ūdenī un organiskajos šķīdinātājos, kvarca smiltis, kurām jābūt augsnei pievienoto smilšu sastāvā, sajauc ar tādu testējamās ķīmiskās vielas daudzumu, kas vajadzīgs, lai iegūtu nepieciešamo testa koncentrāciju. Kvarca smilšu un testējamās ķīmiskās vielas maisījumu pievieno iepriekš samitrinātai augsnei un pēc tam, kad ir pievienots atbilstošs daudzums dejonizēta ūdens, iegūstot nepieciešamo mitruma saturu, to rūpīgi izmaisa. Iegūto maisījumu sadala starp testēšanas traukiem. Procedūru atkārto katrai testa koncentrācijai, un sagatavo arī atbilstošu kontrolgrupu.
|
Testējamās ķīmiskās vielas izkliedēšana uz augsnes virskārtas
|
22.
|
Ja testējamā ķīmiskā viela ir pesticīds, var būt lietderīgi to izsmidzināt uz augsnes virskārtas. Augsni apstrādā pēc kolembolu pievienošanas. Testēšanas konteinerus vispirms piepilda ar samitrinātu augsnes substrātu, tad ielaiž dzīvniekus, un pēc tam testēšanas konteinerus nosver. Lai izvairītos no dzīvnieku tiešas eksponētības testējamajai vielai tieša kontakta ceļā, testējamo vielu lieto vismaz pusstundu pēc kolembolu ielaišanas. Testējamā ķīmiskā viela jāizkliedē augsnes virskārtā iespējami vienmērīgi, izmantojot piemērotu laboratorijas mēroga izsmidzināšanas ierīci, kas simulē izsmidzināšanu uz lauka. Apstrāde jāveic temperatūrā, kuras svārstības nepārsiedz ± 2 °C, un ūdens šķīdumu, emulsiju, ūdens dispersiju izkliedēšanas ātrumam jāatbilst riska novērtēšanas ieteikumiem. Ātrums jāpārbauda, izmantojot piemērotu kalibrācijas tehniku. Īpašus preparātus, piem., granulas vai sēklu pārklājumus, var lietot veidā, kas atbilst to lietošanai lauksaimniecībā. Barību pievieno pēc izsmidzināšanas.
|
PROCEDŪRA
Testēšanas apstākļi
|
23.
|
Testa vidējai temperatūrai jābūt 20 ± 1 °C, temperatūras diapazons 20 ± 2 °C. Testu veic kontrolētos gaismas-tumsas ciklu apstākļos (vēlamas 12 stundas gaismas un 12 stundas tumsas) ar 400 līdz 800 luksu apgaismojumu testēšanas trauku tuvumā.
|
|
24.
|
Lai pārbaudītu augsnes mitrumu, traukus nosver testa sākumā, vidū un beigās. Ja svara zudums ir > 2 %, to papildina, pievienojot dejonizētu ūdeni. Jāņem vērā, ka ūdens zudumu var mazināt, uzturot augstu gaisa mitrumu (> 80 %) testa inkubatorā.
|
|
25.
|
pH jāmēra gan diapazona noteikšanas testa, gan galīgā testa sākumā un beigās. Mērījumi jāveic vienā papildu kontrolgrupas paraugā un vienā papildu paraugā no katra apstrādātās augsnes parauga (visām koncentrācijām); papildu paraugus jāsagatavo un jāapstrādā līdzīgi kā testējamās kultūras, bet tiem nepievieno kolembolas.
|
Testa procedūra un mērījumi
|
26.
|
Katrai testa koncentrācijai testēšanas traukā ievieto augsnes daudzumu, kas atbilst 30 g svaigas augsnes. Sagatavo arī ūdens kontrolgrupas bez testējamās ķīmiskās vielas. Ja ķīmiskās vielas ievadīšanai lieto nesējvielu, papildus testa sērijām jāiekārto arī viena testa sērija ar nesējvielu vienu pašu. Šķīdinātāja vai izkliedētāja koncentrācijai jābūt tādai pašai kā testējamo ķīmisko vielu saturošajos testēšanas traukos.
|
|
27.
|
Kolembolas pa vienai uzmanīgi ievieto katrā testēšanas traukā (pēc nejaušības principa) un noliek uz augsnes virskārtas. Dzīvnieku sekmīgai pārnešanai var izmantot gaisa plūsmas ierīces ar zemu iesūkšanas intensitāti. Replikātu skaits katrai testa koncentrācijai un kontrolgrupai ir atkarīgs no izmantotā testēšanas plāna. Testēšanas traukus izvieto testa inkubatorā pēc nejaušības principa, un šo izvietojumu pēc nejaušības principa maina reizi nedēļā.
|
|
28.
|
F. fimetaria testam uz katru testēšanas trauku jālieto divdesmit pieauguši īpatņi (23–26 dienas veci) – 10 mātītes un 10 tēviņi. Testa 21. dienā kolembolas ekstrahē no augsnes un saskaita. Sinhronizētā testa dzīvnieku grupā F. fimetaria dzimumu var noteikt pēc to lieluma. Mātītes ir redzami lielākas nekā tēviņi (sk. 3. papildinājumu).
|
|
29.
|
F. candida testam izmantojami desmit 9–12 dienas veci juvenīlie īpatņi uz vienu testēšanas trauku. Testa 28. dienā kolembolas ekstrahē no augsnes un saskaita.
|
|
30.
|
Testa sākumā un apmēram pēc divām nedēļām kā barības avotu katrā konteinerā pietiekamā daudzumā (t.i. 2–10 mg) ieliek granulētu žāvētu maizes raugu, kas komerciāli pieejams izmantošanai mājsaimniecībās.
|
|
31.
|
Testa beigās novēro mirstību un vairošanos. Pēc trim nedēļām (F. fimetaria) vai četrām nedēļām (F. candida) kolembolas ekstrahē no testa augsnes (sk. 4. papildinājumu) un saskaita (12). Ja kolembola netiek ekstrahēta, to reģistrē kā mirušu. Ekstrakcijas un skaitīšanas metodes ir jāvalidē. Par validētu ekstrakcijas metodi atzīstama tāda, ar kuru var ekstrahēt vairāk nekā 95 % juvenīlo īpatņu, t.i. pievienojot augsnei konkrētu skaitu.
|
|
32.
|
Testa procedūras praktisks kopsavilkums un grafiks aprakstīts 2. papildinājumā.
|
Testa plāns
Diapazona noteikšanas tests
|
33.
|
Ja nepieciešams, diapazona noteikšanas testu veic, piem., ar piecām testējamās ķīmiskās vielas koncentrācijām: 0,1, 1,0, 10, 100 un 1 000 mg/kg saussvara augsnes, kā arī ar katras apstrādes un kontrolgrupas diviem replikātiem. Izvēloties koncentrāciju diapazonu diapazona noteikšanas testam, var izmantot papildu informāciju no testiem ar līdzīgām ķīmiskajām vielām, vai pieejamo literatūru par kolembolu mirstību vai vairošanos.
|
|
34.
|
Diapazona noteikšanas testa ilgums ir divas nedēļas F. fimetaria un trīs nedēļas F. candida, tas atbilst vienas jaunas paaudzes attīstības laikam. Testa beigās novērtē kolembolu mirstību un vairošanos. Ir jāreģistrē pieaugušo īpatņu skaits un juvenīlo īpatņu sastopamība.
|
Galīgais tests
|
35.
|
Lai noteiktu ECx (piem., EC10, EC50
), jātestē 12 koncentrācijas. Ieteicami vismaz divi replikāti apstrādei ar katru testa koncentrāciju un seši kontrolgrupas replikāti. Atstarpes koeficients var variēt atkarībā no devas-reakcijas modeļa.
|
|
36.
|
NOEC/LOEC noteikšanai jātestē vismaz piecas koncentrācijas ģeometriskās sērijās. Katrai testa koncentrācijai ieteicami četri replikāti, kā arī astoņas kontrolgrupas. Atstarpes koeficients starp blakus esošām testa koncentrācijām nedrīkst pārsniegt 1,8.
|
|
37.
|
Kombinēta pieeja ļauj reizē noteikt gan NOEC/LOEC, gan ECx. Šai kombinētajai pieejai izmanto astoņas apstrādes koncentrācijas ģeometriskās sērijās. Ieteicami katras apstrādes četri replikāti un astoņas kontrolgrupas. Atstarpes koeficients starp blakus esošām testa koncentrācijām nedrīkst pārsniegt 1,8.
|
|
38.
|
Ja diapazona noteikšanas testā netiek konstatēta augstākās koncentrācijas (piem., 1 000 mg/kg) ietekme, vairošanās testu var veikt kā pieļaujamā daudzuma testu, izmantojot testa koncentrāciju 1 000 mg/kg un kontrolgrupu. Pieļaujamā daudzuma tests sniegs iespēju pierādīt, ka robežkoncentrācijai nav statistiski būtiskas ietekmes. Gan apstrādātajai augsnei, gan kontrolgrupai izmanto astoņus replikātus.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
39.
|
Vairošanās sekmes ir galvenais testa beigpunkts (piem., radušos juvenīlo īpatņu skaits uz testēšanas trauku). Statistiskās analīzes, piem. ANOVA procedūras, salīdzina apstrādes variantus ar Stjūdenta t-testu, Daneta testu vai Viljamsa testu. 95 % ticamības intervālu aprēķina individuālo apstrāžu vidējiem rādītājiem.
|
|
40.
|
Izdzīvojušo pieaugušo īpatņu skaits neapstrādātajās kontrolgrupās ir galvenais derīguma kritērijs, un tas ir jādokumentē. Līdzīgi kā diapazona noteikšanas testā, visas kaitīgās iedarbības pazīmes jāapraksta arī galīgajā pārskatā.
|
LCx un ECx
|
41.
|
ECx
vērtības, tostarp ar tām saistīto zemāko un augstāko 95 % ticamības robežu parametram, aprēķina, izmantojot piemērotas statistikas metodes (piem., logistisko vai Veibula funkciju, saīsināto Spīrmena-Kārbera metodi vai vienkāršu interpolāciju). ECx iegūst, kontrolgrupas vidējā rādītāja x % atbilstošo vērtību ievietojot atrastajā vienādojumā. Lai aprēķinātu EC50
vai jebkuru citu ECx, visai datu kopai jāveic regresijas analīze. LC50
parasti nosaka ar varbūtības vienības analīzi vai līdzīgu analīzi, kas ņem vērā binomiāli sadalītus mirstības datus.
|
NOEC/LOEC
|
42.
|
Ja statistiskās analīzes nolūks ir noteikt NOEC/LOEC, nepieciešama statistika par katru testēšanas trauku (atsevišķie trauki tiek uzskatīti par replikātiem). Jāizmanto piemērotas statistikas metodes saskaņā ar ESAO 54. dokumentu “Ekotoksiskuma datu statistiskās analīzes pašreizējās metodes: lietošanas norādījumi” (9). Parasti tiek analizēta testējamās ķīmiskas vielas nelabvēlīgā ietekme salīdzinājumā ar kontrolgrupu, izmantojot vienpusējās hipotēzes testu ar p ≤ 0,05.
|
|
43.
|
Normālo sadalījumu un dispersijas homogenitāti var testēt ar piemērotu statistikas testu, piem., attiecīgi Šapiro-Vilka testu un Lēvena testu (p ≤ 0,05). Var izmantot vienvirziena dispersijas analīzi (ANOVA) un turpmākus daudzfaktoru salīdzināšanas testus. Daudzfaktoru salīdzinājumus (piem., Daneta testu) vai descendentus trenda testus (piem., Viljamsa testu) var izmantot, lai aprēķinātu, vai ir statistiski būtiskas atšķirības (p ≤ 0,05) starp kontrolgrupām un dažādajām testējamās ķīmiskās vielas koncentrācijām (ieteicamā testa izvēle saskaņā ar ESAO 54. dokumentu (9)). Vēl NOEC un LOEC noteikšanai izmantojamas neparametriskās metodes (piem., Bonferoni U-tests saskaņā ar Holma vai Džonkhīra-Terpstra trenda testu).
|
Pieļaujamā daudzuma tests
|
44.
|
Ja ir veikts pieļaujamā daudzuma tests (salīdzinājums starp kontrolgrupu un tikai vienu apstrādi) un ir izpildīti parametrisko testu procedūru priekšnoteikumi (normalitāte, homogenitāte), metriskās atbildes analizē, izmantojot Stjūdenta testu (t-testu). Ja šīs prasības nav izpildītas, var izmantot nevienlīdzīgās dispersijas t-testu (Velča t-testu) vai neparametrisku testu (piem., Manna-Vitnija U-testu).
|
|
45.
|
Lai noteiktu būtiskās atšķirības starp kontrolgrupām (kontrolgrupu un šķīdinātāja kontrolgrupu), katras kontrolgrupas replikātus var testēt tāpat, kā aprakstīts attiecībā uz pieļaujamā daudzuma testu. Ja šie testi neparāda būtiskas atšķirības, visus kontrolgrupas un šķīdinātāja kontrolgrupas replikātus var apvienot. Alternatīva ir visus apstrādes replikātus salīdzināt ar šķīdinātāja kontrolgrupu.
|
Testēšanas pārskats
|
46.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā viela:
|
—
|
testējamās ķīmiskās vielas identitāte, partija, sērija un CAS numurs, tīrība;
|
|
—
|
testējamās ķīmiskās vielas fizikāli ķīmiskās īpašības (piem., log Kow, šķīdība ūdenī, tvaika spiediens, Henrija konstante (H), un vēlama informācija par testējamās ķīmiskās vielas apriti augsnē), ja pieejama;
|
|
—
|
ja netiek testēta tīra ķīmiskā viela, jānorāda tās forma un piedevas.
|
|
|
|
Testa organismi:
|
—
|
sugas identifikācija, testa organismu piegādātājs, audzēšanas apstākļu apraksts un testa organismu vecuma diapazons.
|
|
|
|
Testēšanas apstākļi:
|
—
|
eksperimenta plāna un procedūras apraksts;
|
|
—
|
informācija par testa augsnes sagatavošanu; detalizēts apraksts dabiskas augsnes lietošanas gadījumā (izcelsme, vēsture, daļiņu lielums un sadalījums, pH, organisko vielu saturs);
|
|
—
|
augsnes ūdensnoturētspēja;
|
|
—
|
testējamās ķīmiskās vielas pievienošanas augsnei paņēmiena apraksts;
|
|
—
|
testēšanas apstākļi: gaismas intensitāte, gaismas-tumsas ciklu ilgums, temperatūra;
|
|
—
|
barošanas režīma apraksts, testā izmantotās barības veids un daudzums, barošanas datumi;
|
|
—
|
pH un ūdens saturs augsnē testa sākumā un beigās (kontrolgrupa un katra apstrāde);
|
|
—
|
detalizēts ekstrakcijas metodes un ekstrakcijas efektivitātes apraksts.
|
|
|
|
Testa rezultāti:
|
—
|
katrā testēšanas traukā noteikto juvenīlo īpatņu skaits testa beigās;
|
|
—
|
pieaugušo īpatņu skaits un mirstība ( %) katrā testēšanas traukā testa beigās;
|
|
—
|
acīmredzamo fizioloģisku vai patoloģisku simptomu vai izteiktu uzvedības pārmaiņu apraksts;
|
|
—
|
rezultāti, kas iegūti ar testējamo ķīmisko standartvielu;
|
|
—
|
NOEC/LOEC vērtības, mirstības LCx
un vairošanās ECx
(galvenokārt LC50, LC10, EC50
, un EC10
), kopā ar 95 % ticamības intervāliem. Aprēķiniem izmantotā pielāgotā modeļa grafiks, tā funkcijas vienādojums un parametri (sk. (9));
|
|
—
|
visa informācija un novērojumi, kas varētu būt noderīgi rezultātu interpretācijā;
|
|
—
|
faktiskā testa jauda, ja veikts hipotēzes tests (9);
|
|
—
|
atkāpes no šajā testēšanas metodē aprakstītajām procedūrām un neparasti novērojumi testa laikā;
|
|
—
|
attiecībā uz NOEC rādītājam, ja tas noteikts, – minimālā detektējamā atšķirība.
|
|
|
LITERATŪRA
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330pp (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August-2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268
|
|
(8)
|
Šā pielikuma C.36. nodaļa: Plēsējērces (Hypoaspis (Geolaelaps) aculeifer) vairošanās tests augsnē.
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, pp. 412-416
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
1. papildinājums
Definīcijas
Aprakstītajai testēšanas metodei izmantojamas šādas definīcijas (šai testā visas ietekmes koncentrācijas tiek izteiktas kā testējamās ķīmiskās vielas masa uz testa augsnes sauso masu).
|
|
Ķīmiskā viela ir viela vai maisījums.
|
|
|
NOEC
(nenovērojamās ietekmes koncentrācija) ir testējamās ķīmiskās vielas koncentrācija, pie kuras nav novērojama ietekme. Šajā testā koncentrācijai, kas atbilst NOEC, nav statistiski būtiskas ietekmes (p < 0,05) definētā ekspozīcijas laikā salīdzinājumā ar kontrolgrupu.
|
|
|
LOEC
(zemākā novērojamās ietekmes koncentrācija) ir zemākā testējamās ķīmiskās vielas koncentrācija, kurai ir statistiski būtiska ietekme (p < 0,05) definētā ekspozīcijas laikā salīdzinājumā ar kontrolgrupu.
|
|
|
ECx
(x % ietekmes koncentrācija) ir koncentrācija, kas izraisa x % ietekmi uz testa organismiem definētā ekspozīcijas laikā salīdzinājumā ar kontrolgrupu. Piem., EC50
ir koncentrācija, kas testa beigupunktā novērtēta kā ietekmi izraisoša 50 % no eksponētās populācijas definēta ekspozīcijas perioda laikā.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela maisījums, ko testē ar šo testēšanas metodi.
|
2. papildinājums
Kolembolu testa galvenās darbības un laika grafiks
Testa galvenie posmi ir šādi:
|
Laiks (diena)
|
Darbība
|
|
– 23 līdz – 26
|
Sinhronizētas F. fimetaria kultūras sagatavošana
|
|
-14
|
Mākslīgās augsnes sagatavošana (sajaucot sausās sastāvdaļas)
Mākslīgās augsnes pH pārbaude un attiecīgi pielāgojumi
Augsnes maksimālās ūdensnoturētspējas (WHC) mērījumi
|
|
– 9 līdz – 12
|
Sinhronizētas F. candida kultūras sagatavošana
|
|
– 2 līdz – 7
|
Iepriekšēja augsnes mitrināšana
|
|
– 1
|
Juvenīlo īpatņu sadalīšana partijās
Izejšķīdumu sagatavošana un testējamās ķīmiskās vielas pievienošana, ja nepieciešams šķīdinātājs.
|
|
0
|
Izejšķīdumu sagatavošana un testējamo ķīmisko vielu pievienošana, ja plānota cietas vai ūdenī šķīstošas ķīmiskās vielas pievienošana vai izkliedēšana uz virskārtas.
Augsnes pH mērījumi un konteineru svēršana.
Barības ievietošana. Kolembolu ievietošana tvertnēs.
|
|
14
|
F. fimetaria diapazona noteikšanas tests: testa pabeigšana, dzīvnieku ekstrahēšana, pH un ūdens zuduma (pēc svara) mērīšana.
Galīgie testi: mitruma satura noteikšana, papildināšana ar ūdeni un 2–10 mg rauga pievienošana.
|
|
21
|
Galīgais F. fimetaria tests: testa pabeigšana, dzīvnieku ekstrahēšana, augsnes pH un ūdens zuduma (pēc svara) mērīšana.
F. candida diapazona noteikšanas tests: testa pabeigšana, dzīvnieku ekstrahēšana, pH un ūdens zuduma (pēc svara) mērīšana.
|
|
28
|
Galīgais F. candida tests: testa pabeigšana, dzīvnieku ekstrahēšana, pH un ūdens zuduma (pēc svara) mērīšana.
|
3. papildinājums
Norādījumi F. fimetaria un F. candida audzēšanai un sinhronizēšanai
Šajos norādījumos sniegtais laiks un ilgums jāpārbauda katram kolembolu celmam atsevišķi, lai nodrošinātu, ka laika grafiks ļaus pietiekami sinhronizēt juvenīlos īpatņus. Piemērota diena oliņu savākšanai un sinhronu juvenīlo īpatņu savākšanai ir tad, kad pēc pieaugušo īpatņu pārvietošanas uz svaigu substrātu ir notikusi oliņu dēšana un izšķilšanās.
Ieteicams iekārtot permanentu dzīvnieku pamatkultūru, piem., ar 50 konteineriem/Petri platēm. Pamatkultūrai ir jāuztur labi barošanas apstākļi ar barošanu reizi nedēļā, ūdens pievienošanu un vecās barības un mirstīgo atlieku aizvākšanu. Ja uz substrāta būs pārāk maz kolembolu, tas var radīt attīstības kavēšanos palielinātas sēņu augšanas dēļ. Ja pamatkultūru pārāk bieži lieto oliņu ražošanai, kultūra var nolietoties. Kultūras nolietojuma pazīmes ir miruši dzīvnieki un pelējums uz substrāta. Kultūras atjaunošanai var izmantot oliņas, kas palikušas no sinhronizēto dzīvnieku audzēšanas.
Sinhronizētajā F. fimetaria kultūrā mātītes atšķir no tēviņiem vispirms pēc izmēra. Tēviņi ir redzami mazāki nekā mātītes, un tēviņu iešanas ātrums ir lielāks nekā mātītēm. Pareiza dzimuma noteikšana prasa nelielu pieredzi un to var apstiprināt ar ģenitāliju rajona mikroskopisku pārbaudi (13).
1. Turēšana
1.a. Kultivēšanas substrāta sagatavošana
Kultivēšanas substrāts ir ģipsis (kalcija sulfāts) ar aktivēto ogli. Šāds substrāts ir mitrs, un ogle absorbē atkritumu gāzes un izdalījumus (14)(15). Kolembolu novērošanas sekmēšanai var izmantot dažādas ogļu formas. Piem., F. candida un F. fimetaria kultūrās tiek lietota pulverveida ogle (kas veido pelēku/melnu kalcija sulfāta jeb ģipša slāni).
Substrāta sastāvdaļas:
|
—
|
200 ml destilēta ūdens;
|
vai
|
—
|
50 g aktivētās pulverveida ogles;
|
|
—
|
260–300 ml destilēta ūdens;
|
Substrāta maisījumam pirms lietošanas ļauj nostāvēties.
1.b. Vairošanās
Kolembolas tur konteineros, piem., Petri platēs (90 mm × 13 mm), kuru apakša klāta ar 0,5 cm biezu ģipša un ogles substrāta slāni. Tās kultivē 20 ± 1 °C temperatūrā 12–12 stundu gaismas/tumsas ciklā (400–800 luksi). Konteinerus visu laiku tur mitrus, lai nodrošinātu, ka gaisa relatīvais mitrums konteineros ir 100 %. To panāk ar brīva ūdens klātbūtni porainajā ģipsī, taču jāvairās no ūdens plēves rašanās ģipša virskārtā. No ūdens zuduma var izvairīties, nodrošinot mitru gaisu telpā. Visi mirušie īpatņi ir jāizņem no konteineriem, tāpat arī sabojājusies barība. Lai stimulētu oliņu ražošanu, nepieciešams pieaugušos dzīvniekus pārnest uz Petri platēm ar svaigi sagatavotu ģipša/ogles substrātu.
1.c. Barības avots
Granulētu sauso pārtikas raugu lieto kā vienīgo barības avotu gan F. candida, gan F. fimetaria. Lai izvairītos no pelējuma, svaigu barību nodrošina vienreiz vai divreiz nedēļā. To novieto tieši uz ģipša slāņa mazā kaudzītē. Pārtikas rauga daudzumu pielāgo kolembolu populācijas lielumam, bet parasti 2–15 mg ir pietiekams daudzums.
2. Sinhronizācija
Tests jāveic ar sinhronizētiem dzīvniekiem, lai iegūtu homogēnus, vienādas attīstības stadijas un izmēra testa dzīvniekus. Turklāt sinhronizācija, pamatojoties uz seksuālo dimorfismu, t.i. izmēra atšķirībām, ļauj diferencēt F. fimetaria mātītes un tēviņus no trīs nedēļu vecuma un vēlāk. Turpmāk ieteikta procedūra sinhronizētu dzīvnieku iegūšanai (praktiskie soļi ir pēc izvēles).
2.a. Sinhronizācija
|
—
|
Sagatavo konteinerus ar 0,5 cm biezu ģipša/ogles substrāta slāni.
|
|
—
|
Oliņu dēšanai ievāc 150–200 pieaugušus F. fimetaria un 50–100 F. candida īpatņus no labākajiem 15–20 pamatkultūras konteineriem, kuros ir 4–8 nedēļas vecs substrāts; tos pārvieto uz konteineriem un pabaro ar 15 mg pārtikas rauga. Jāizvairās no juvenīlo īpatņu likšanas kopā ar pieaugušajiem, jo to klātbūtne var inhibēt oliņu ražošanu.
|
|
—
|
Kultūrā jāuztur 20 ± 1 °C temperatūra (vidēji jābūt 20 °C) un 12–12 stundu gaismas-tumsas cikls (400–800 luksi). Jānodrošina svaigas pārtikas pieejamība un ar mitrumu piesātināts gaiss. Barības trūkums var izraisīt dzīvnieku defekāciju uz oliņām, kas savukārt izraisīs sēņu augšanu uz oliņām, kā arī F. candida var apēst savas oliņas. Pēc 10 dienām oliņas rūpīgi savāc ar adatu vai lāpstiņu un pārvieto uz “oliņu papīru” (nelieli filtrpapīra gabaliņi iemērkti ģipša vai ģipša/ogles šķidrā maisījumā), kas tiek novietots konteinerā ar svaigu ģipša/ogles substrātu. Uz substrāta tiek nolikti daži rauga graudiņi, lai piesaistītu juvenīlos īpatņus un panāktu, ka viņi pārvietojas uz oliņu papīru. Svarīgi, lai oliņu papīrs un substrāts ir mitri, jo citādi oliņas dehidratēsies. Alternatīva ir pieaugušos dzīvniekus uz divām vai trim dienām aizvākt no sinhronizācijas kultūru kastēm pēc tam, kad tie ir dējuši oliņas.
|
|
—
|
Pēc trim dienām vairums oliņu uz oliņu papīra ir izšķīlušās, un daži juvenīlie īpatņi ir atrodami zem oliņu papīra.
|
|
—
|
Lai iegūtu vienāda vecuma juvenīlos īpatņus, oliņu papīrs ar oliņām, kas nav izšķīlušās, tiek aizvākts no Petri plates ar pincetes palīdzību. Juvenīlie īpatņi, kas tagad ir 0–3 dienas veci, paliek traukā un tiek baroti ar pārtikas raugu. Neizšķīlušās oliņas tiek aizvāktas.
|
|
—
|
Oliņas un izšķīlušos juvenīlos īpatņus kultivē tādos pašos apstākļos kā pieaugušos. Jo īpaši attiecībā uz F. fimetaria jāveic šādi pasākumi: jānodrošina pietiekams svaigas barības daudzums, vecā sabojājusies barība jāaizvāc, pēc vienas nedēļas juvenīlie īpatņi jāpārvieto jaunās Petri platēs, nodrošinot blīvumu virs 200.
|
2.b. Darbības ar kolembolām testa sākumā
|
—
|
9–12 dienas vecas F. candida vai 23–26 dienas vecas F. fimetaria tiek ievāktas, piem., ar iesūkšanu, un izlaistas nelielā konteinerā ar mitru ģipša/ogles substrātu, un to fiziskais stāvoklis tiek novērtēts ar binokulāro mikroskopu (ievainoti un traumēti dzīvnieki tiek aizvākti). Lai izvairītos no sausuma stresa, visas darbības veicamas kolembolām atrodoties mitrā gaisā, piem., samitrinot virsmas.
|
|
—
|
Konteineru apgriež ar apakšu uz augšu un uzsit pa to, lai kolembolas pārvietotu uz augsni. Jāneitralizē statiskās elektrības ietekme, citādi dzīvnieki var aizlidot pa gaisu vai pielipt pie testēšanas konteinera sienām un izžūt. Neitralizēšanai izmantojams jonizētājs vai zem trauciņa palikts mitrs audums.
|
|
—
|
Barība jāizkliedē pa visu augsnes virskārtu un nevis jāatstāj vienā gabalā.
|
|
—
|
Transportēšanas un testēšanas perioda laikā jāuzmanās, lai testa konteineri netiktu dauzīti un citādi fiziski traucēti, jo šādas darbības var palielināt augsnes sablīvēšanos un traucēt kolembolu mijiedarbību.
|
3. Alternatīvās kolembolu sugas
Testēšanai ar šo testēšanas metodi var izmantot arī tādas kolembolu sugas kā Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Pirms citu sugu izmantošanas ir jābūt izpildītiem vairākiem priekšnoteikumiem:
|
—
|
suga ir nepārprotami identificēta;
|
|
—
|
tiek sniegts loģisks pamatojums sugas izvēlei;
|
|
—
|
tiek nodrošināts, ka to reproduktīvā bioloģija iekļaujas testēšanas fāzē, jo tas ir potenciālais mērķis ekspozīcijas laikā;
|
|
—
|
ir zināms to dzīves cikls: nobriešanas laiks, oliņu attīstības ilgums un ekspozīcijai pakļautās attīstības stadijas;
|
|
—
|
ar testa substrātu un barības padevi ir nodrošināti optimāli augšanas un vairošanās apstākļi;
|
|
—
|
lai varētu veikt precīzu toksicitātes novērtējumu, variācijām (starp īpatņiem) jābūt pietiekami zemām.
|
4. papildinājums
Dzīvnieku ekstrakcija un skaitīšana
1. Var izmantot divas ekstrakcijas metodes
|
1.a.
|
Pirmā metode: izmanto kontrolētas temperatūras gradienta ekstrakcijas aparātu, kas darbojas pēc Makfadjena izstrādātajiem principiem (1). Ekstrakcijas kastes augšdaļā atrodas siltuma elements, no kura nāk siltums (ko regulē uz augsnes parauga virskārtas novietots termorezistors). Temperatūru ievākšanas trauku aptverošajā dzesētajā ūdenī regulē uz ievākšanas trauka virsmas novietots termorezistors (novietots zemaugsnes pamata). Termorezistorus savieno ar ieprogrammējamu kontroles vienību, kas paaugstina temperatūru saskaņā ar ieprogrammētu grafiku. Dzīvnieki tiek savākti atdzesētajā ievākšanas traukā (2 °C), kura apakšu klāj ģipša/ogles slānis. Ekstrakcija kopā ilgst 48 stundas, tā sākas 25 °C temperatūrā, un temperatūru katru 12. stundu automātiski paaugstina par 5 °C. Ekstrakcija ir pabeigta pēc 12 stundām 40 °C temperatūrā.
|
|
1.b.
|
Otrā metode: pēc eksperimentāla inkubācijas perioda kolembolu juvenīlo īpatņu skaitu nosaka ar flotāciju. Šim nolūkam testu veic traukos ar apmēram 250 ml tilpumu. Pēc testa beigām tajos tiek pievienoti apmēram 200 ml destilēta ūdens. Augsni maigi samaisa ar smalku otiņu, lai veicinātu kolembolu uzpeldēšanu ūdens virspusē. Ūdenim var pievienot nelielu daudzumu, apm. 0,5 ml, Kentmere fotogrāfiju krāsvielas, palielinot kontrastu starp ūdeni un baltajām kolembolām. Šī krāsviela nav toksiska kolembolām.
|
2. Skaitīšana
Skaitīšanu var veikt pēc redzes vai gaismas mikroskopā, izmantojot režģi, kas novietots virs flotācijas trauka, vai arī nofotografējot katra trauka virsmu un vēlāk saskaitot kolembolas palielinātās izdrukās vai projicētos attēlos. Skaitīšanu var veikt, arī izmantojot digitālās attēlu apstrādes ierīces (12). Visām skaitīšanas metodēm jābūt validētām.
5. papildinājums
Augsnes maksimālās ūdensnoturspējas noteikšana
Turpmāk aprakstītā metode ir atzīta par piemērotu augsnes maksimālās ūdensnoturētspējas (WHC) noteikšanai. Tā ir aprakstīta ISO DIS 11268-2 C pielikumā (Augsnes kvalitāte – piesārņotāju ietekme uz sliekām (Eisenia fetida). 2. daļa: ietekmes uz vairošanos noteikšana).
Ievāciet noteiktu daudzumu (piem., 5 g) testējamās augsnes substrāta ar piemērotu parauga paņemšanas ierīci (skrūves cauruli u. c.) Nosedziet caurules apakšu ar mitra filtrpapīra gabalu un tad novietojiet uz statīva ūdens vannā. Caurule pakāpeniski jāiegremdē, līdz ūdens līmenis pārsniedz augsnes virsmu. Tad tā jāatstāj ūdenī apmēram uz trīs stundām. Tā kā nav iespējams saglabāt visu ūdeni, kas uzsūcies augsnes kapilāros, augsnes paraugam divas stundas jāļauj pažūt, novietojot cauruli uz ļoti smalki samaltu kvarca smilšu dobītes nosegtā traukā (lai novērstu izžūšanu). Tad paraugs jānosver, jāizžāvē līdz konstantai masai 105 °C temperatūrā. Ūdensnoturspēju (WHC) aprēķina šādi:

kur
|
S
|
=
|
ar ūdeni piesātināts substrāts + caurules svars + filtrpapīra svars
|
|
T
|
=
|
tara (caurules svars + filtrpapīra svars)
|
|
D
|
=
|
substrāta saussvars
|
6. papildinājums
Augsnes pH noteikšana
Turpmākā metode augsnes pH noteikšanai balstās uz aprakstu ISO DIS 10390: “Augsnes kvalitāte – pH noteikšana”.
Noteiktu daudzumu augsnes žāvē istabas temperatūrā vismaz 12 h. Tad pagatavo augsnes suspensiju (kura satur vismaz 5 g augsnes) piecreiz lielākā tilpumā no 1 M analītiskās tīrības pakāpes kālija hlorīda (KCl) vai 0,01 M analītiskās tīrības pakāpes kalcija hlorīda (CaCl2) šķīduma. Tad suspensiju kārtīgi sakrata piecas minūtes un ļauj nostādināties vismaz divas stundas, bet ne ilgāk kā 24 stundas. Tad izmēra šķidrās fāzes pH ar pH mērītāju, kas pirms katra mērījuma ticis kalibrēts, izmantojot atbilstošas buferšķīdumu sērijas (piem., pH 4,0 un 7,0).
C.40. TRĪSUĻODU DZĪVES CIKLA SEDIMENTU-ŪDENS TOKSICITĀTES TESTS, IZMANTOJOT AR TESTĒJAMO VIELU PAPILDINĀTU ŪDENI VAI PAPILDINĀTUS SEDIMENTUS
IEVADS
|
1.
|
Šī testēšanas metode ir ekvivalenta ESAO Testēšanas norādījumiem (TG) 233 (2010. gads). Tā ir izstrādāta ietekmes novērtēšanai, kuru izraisa saldūdens divspārņu Chironomus sp. eksponētība ķīmiskām vielām visā to dzīves ciklā; tests pilnībā nosedz Chironomus sp. pirmo paaudzi (P paaudzi) un agrīno otro paaudzi (F1 paaudze). Tā papildina esošās testēšanas metodes C.28 (1) un C.27 (15), kurās izmanto attiecīgi papildināta ūdens ekspozīcijas scenāriju vai papildinātu sedimentu scenāriju. Metode ņem vērā jau esošos Chironomus riparius un Chironomus dilutus (agrākais nosaukums C. tentans (2)) toksicitātes testēšanas protokolus, kas ir izstrādāti Eiropā un Ziemeļamerikā (3)(4)(5)(6)(7)(8)(9) un kam pēc tam veikta starplaboratoriju salīdzinošā testēšana (1)(7)(10)(11)(12). Var izmantot arī citas labi izpētītas trīsuļodu sugas, piem., Chironomus yoshimatsui (13) (14). Kopējais ekspozīcijas ilgums ir apmēram 44 dienas C. riparius un C. yoshimatsui, un aptuveni 100 dienas C. dilutus.
|
|
2.
|
Šajā testēšanas metodē aprakstīti gan ūdens, gan sedimentu ekspozīcijas scenāriji. Atbilstīga ekspozīcijas scenārija izvēle ir atkarīga no paredzētā testēšanas pielietojuma. Ūdens ekspozīcijas scenārijs, kurā ūdens vertikālais slānis tiek papildināts ar testējamo ķīmisko vielu, ir izveidots, lai atdarinātu izsmidzinātu pesticīdu nonesi, un simulē to sākotnējo maksimuma koncentrāciju virszemes ūdeņos. Ūdens papildināšana ar testējamo ķīmisko vielu ir izmantojama arī citiem ekspozīcijas veidiem (ieskaitot ķīmisko vielu noplūdes), bet nav izmantojama, lai analizētu akumulācijas procesus sedimentos par testēšanas periodu ilgākā laikā. Šajā gadījumā, kā arī ja virszemes notece ir galvenais pesticīdu nokļūšanas ceļš ūdenskrātuvēs, piemērotāka būtu papildinātu sedimentu shēmas izmantošana. Ja nepieciešams pielietot citus ekspozīcijas scenārijus, testēšanas plānu var tiem viegli piemērot. Piemēram, ja nav nepieciešams noskaidrot testējamās ķīmiskās vielas sadalījumu starp ūdens fāzi un sedimentu slāni, un ir nepieciešams minimizēt adsorbciju sedimentos, ieteicams apsvērt aizvietojošu mākslīgu sedimentu (piem., kvarca smilšu) lietošanu.
|
|
3.
|
Ķīmiskās vielas, kuru dēļ jātestē sedimentos dzīvojošie organismi, var saglabāties sedimentos ilgstoši. Sedimentos dzīvojošie organismi var tikt eksponēti dažādos veidos. Katra ekspozīcijas ceļa relatīvā nozīme un laiks, kas paiet, lai rastos vispārēja toksiska iedarbība, ir atkarīgs no attiecīgās ķīmiskās vielas fizikālajām un ķīmiskajām īpašībām. Tādu vielu gadījumā, kam ir spēcīga adsorbēšanās spēja vai kas izveido homopolāru saiti ar sedimentiem, būtisks ekspozīcijas ceļš var būt piesārņotas barības uzņemšana. Lai nenovērtētu par zemu augsti lipofīlu ķīmisko vielu toksiskumu, var apsvērt pārtikas pievienošanu sedimentiem pirms testējamās ķīmiskās vielas izmantošanas (sk. 31. punktu). Tādējādi iespējams iekļaut visus ekspozīcijas ceļus un visas attīstības stadijas.
|
|
4.
|
Mērītie beigupunkti ir izšķīlušos pieaugušo īpatņu (gan pirmajā, gan otrajā paaudzē) kopējais skaits, attīstības ātrums (gan pirmajā, gan otrajā paaudzē), pilnīgi izšķīlušos un dzīvo pieaugušo īpatņu dzimumu attiecība (gan pirmajā, gan otrajā paaudzē), oliņu virteņu skaits uz vienu mātīti (tikai pirmajā paaudzē), oliņu virteņu auglība (tikai pirmajā paaudzē).
|
|
5.
|
Ļoti ieteicams izmantot formulēta sastāva sedimentus. Formulētā sastāva sedimentiem ir vairākas priekšrocības salīdzinājumā ar dabiskajiem sedimentiem:
|
—
|
tiek samazināta eksperimentālā mainība, jo šādi sedimenti izveido atkārtojamu “standartizētu matricu” un nav nepieciešams atrast nepiesārņotus un tīrus sedimentus;
|
|
—
|
testēšanu var sākt jebkurā laikā, nesaskaroties ar sezonālu mainību testēšanas sedimentos, un nav nepieciešams sedimentus iepriekš apstrādāt, lai tos attīrītu no vietējās faunas;
|
|
—
|
mazākas izmaksas salīdzinājumā ar sedimentu savākšanu dabā regulārai testēšanai pietiekamos daudzumos;
|
|
—
|
formulēta sastāva sedimentu izmantošana ļauj salīdzināt dažādus toksicitātes pētījumus un attiecīgi klasificēt vielas (3).
|
|
|
6.
|
Izmantotās definīcijas ir dotas 1. papildinājumā.
|
TESTA PRINCIPS
|
7.
|
Pirmās attīstības stadijas trīsuļodu kāpurus eksponē diapazonam testējamās ķīmiskās vielas koncentrāciju sedimentu un ūdens sistēmās. Tests sākas ar pirmās attīstības stadijas kāpuru (pirmā paaudze) ievietošanu testēšanas vārglāzēs, kuros ir formulētā sastāva sedimenti; citā variantā ūdeni papildina ar testējamo ķīmisko vielu pēc kāpuru ievietošanas. Nosaka trīsuļodu izšķilšanos, laiku līdz izšķilšanās brīdim un pilnīgi izšķīlušos un dzīvu odu dzimumu attiecību (attiecība starp tēviņu un mātīšu skaitu). Lai veicinātu izlidošanu, pārošanos un oliņu dēšanu, izšķīlušos pieaugušos īpatņus pārvieto uz vairošanās būriem. Novērtē saražoto oliņu virteņu skaitu un auglību. No šīm oliņu virtenēm tiek iegūti otrās paaudzes pirmās attīstības stadijas kāpuri. Šie kāpuri tiek ievietoti svaigi sagatavotās testēšanas vārglāzēs (procedūra papildināšanai ar testējamo vielu ir tāda pati kā pirmajai paaudzei) otrās paaudzes dzīvotspējas noteikšanai pēc izšķilšanās, laika līdz izšķilšanās brīdim un pilnīgi izšķīlušos un dzīvu odu attiecības starp dzimumiem (dzīves cikla tests shematiski parādīts 5. papildinājumā). Visus datus analizē, izmantojot regresijas modeli, lai noteiktu koncentrāciju, kas izraisītu pētītā beigupunkta X % samazinājumu, vai lietojot hipotēzes testu, lai noteiktu nenovērojamās ietekmes koncentrāciju (NOEC). Otrajā gadījumā nepieciešams ar statistikas testu palīdzību salīdzināt apstrādes rezultātus (atbildes) ar atbilstošās kontrolgrupas rezultātiem. Jānorāda, ka papildinātā ūdens scenārija gadījumā, ja izmanto ķīmiskās vielas, kas ātri sadalās, katras paaudzes pēdējās attīstības stadijas (piem., kūniņas fāze) ir eksponētas ievērojami mazākai koncentrācijai virsējā ūdenī nekā pirmās attīstības stadijas kāpuri. Ja tas rada bažas un ir nepieciešami salīdzināmi ekspozīcijas līmeņi katrai attīstības stadijai, var apsvērt šādus metodes labojumus:
|
—
|
paralēli testi ar testējamās vielas papildināšanu dažādās attīstības stadijās; vai
|
|
—
|
atkārtota papildināšana ar testējamo ķīmisko vielu (vai virsējā ūdens nomaiņa) testēšanas sistēmā abu testa fāžu laikā (pirmā un otrā paaudze), līdz ar ko papildināšanas (ūdens nomaiņas) intervāli ir saskaņoti ar testējamās vielas aprites augsnē īpašībām.
|
Šādi metodes uzlabojumi ir iespējami papildinātā ūdens gadījumā, bet ne papildināto sedimentu gadījumā.
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
8.
|
Ir jābūt zināmai testējamās ķīmiskās vielas šķīdībai ūdenī, tās tvaika spiedienam, log K
ow, izmērītajai vai aprēķinātajai sadalīšanās sedimentos daļai un stabilitātei ūdenī un sedimentos. Jābūt pieejamai uzticamai analītiskajai metodei, ar ko iespējams kvantificēt testējamo ķīmisko vielu virsējā ūdenī, poru ūdenī un sedimentos ar zināmu un apstiprinātu precizitāti un detektēšanas robežu. Lietderīga informācija ietver testējamās ķīmiskās vielas struktūrformulu un tīrību. Tāpat lietderīgi ir zināt testējamās vielas ķīmisko apriti (piem., izkliedēšanās, abiotiskā un biotiskā noārdīšanās utt.). Papildu norādījumi par tādu vielu testēšanu, kuras ir sarežģīti testēt to fizikālo un ķīmisko īpašību dēļ, pieejami atsaucē (16).
|
ĶĪMISKĀS STANDARTVIELAS
|
9.
|
Periodiski var testēt ķīmiskās standartvielas, lai pārliecinātos, ka laboratorijas populācijas jutība nav mainījusies. Līdzīgi kā ar dafnijām, būtu pietiekami veikt akūto 48 stundu testu (kā aprakstīts 17). Taču kamēr nav pieejamas apstiprinātas akūtās vadlīnijas, ieteicams ilglaicīgais tests saskaņā ar šā pielikuma C.28 punktu. Toksisko standartvielu, kas sekmīgi izmantotas salīdzinošajos testos un validēšanas pētījumos, piemēri ietver lindānu, trifluralīnu, pentahlorfenolu, kadmija hlorīdu un kālija hlorīdu (1)(3)(6)(7)(18).
|
TESTA DERĪGUMS
|
10.
|
Lai tests būtu derīgs, piemēro šādus nosacījumus:
|
—
|
vidējam izšķilšanās rezultātam kontrolgrupas apstrādē jābūt vismaz 70 % abu paaudžu ekspozīcijas laika beigās (1) (7);
|
|
—
|
kontrolgrupas apstrādē abām paaudzēm 85 % no visiem C. riparius un C. yoshimatsui jāpārveidojas par pieaugušiem īpatņiem 12–23 dienu laikā pēc pirmās stadijas kāpuru ievietošanas testēšanas traukos; C. dilutus pieļaujams 20–65 dienu ilgs periods;
|
|
—
|
pilnībā izšķīlušos dzīvu pieaugušo īpatņu vidējai attiecībai starp dzimumiem (tēviņu/mātīšu skaita attiecība) abām paaudzēm kontrolgrupā jābūt vismaz 0,4, bet tā nedrīkst pārsniegt 0,6;
|
|
—
|
pirmās paaudzes kontrolgrupā katrā vairošanās būrī oliņu virteņu skaitam jābūt vismaz 0,6 uz katru vairošanās būrī ievietoto mātīti;
|
|
—
|
pirmās paaudzes kontrolgrupā katrā vairošanās būrī auglīgo oliņu virteņu daļai jābūt vismaz 0,6;
|
|
—
|
ekspozīcijas laika beigās abām paaudzēm katrā traukā jānosaka pH un izšķīdušā skābekļa koncentrācija. Skābekļa koncentrācijai jābūt vismaz 60 % no gaisa piesātinājuma vērtības (ASV
(24)), savukārt pH virsējā ūdenī jābūt 6–9 diapazonā visos testēšanas traukos;
|
|
—
|
ūdens temperatūra nedrīkstētu atšķirties vairāk kā par ± 1,0 °C.
|
|
METODES APRAKSTS
Testēšanas trauki un vairošanās būri
|
11.
|
Kāpuru ekspozīcija notiek 600 ml stikla vārglāzēs ar apmēram 8,5 cm diametru (sk. 5. papildinājumu). Der arī citi trauki, bet tiem jānodrošina piemērots virsējā ūdens un sedimentu dziļums. Sedimentu virsmai jābūt pietiekamai, lai nodrošinātu 2–3 cm2 katram kāpuram. Sedimentu slāņa dziļuma attiecībai pret virsējā ūdens dziļumu jābūt apmēram 1:4. Vēlams izmantot vairošanās būrus (vismaz 30 cm visās trijās dimensijās) ar sietu (atvērumi apmēram 1 mm) virspusē un vismaz vienā būra sānā (sk. 5. papildinājumu). Oliņu dēšanai katrā būrī ir ievietots 2 litru kristalizācijas trauks, kurā ir testēšanas ūdens un sedimenti. Arī kristalizācijas traukā dziļuma attiecībai pret virsējā ūdens dziļumu jābūt apmēram 1:4 Pēc tam, kad oliņu virtenes ir savāktas no kristalizācijas trauka, tās tiek ievietotas 12-iedobumu mikrotitrēšanas platē (viena oliņu virtene uz iedobumu, iedobumā vismaz 2,5 ml ūdens no papildinātā kristalizācijas trauka) un pārklātas ar vāku, lai izvairītos no būtiskas iztvaikošanas. Var izmantot arī citus oliņu virteņu ievietošanai piemērotus traukus. Izņemot mikrotitrēšanas plates, testēšanas traukiem un citām iekārtām, kas saskarsies ar testēšanas sistēmu, jābūt pilnībā izgatavotām no stikla vai cita ķīmiski inerta materiāla (piem., politetrafluoretilēna).
|
Sugu izvēle
|
12.
|
Testēšanā vēlams izmantot Chironomus riparius sugas. Var izmantot arī C. yoshimatsui. Arī C. dilutus ir piemēroti, bet grūtāk apstrādājami, un tiem vajadzīgs ilgāks testēšanas periods. Sīkāka informācija par kultivēšanas metodēm attiecībā uz Chironomus riparius ir sniegta 2. papildinājumā. Informācija par kultivēšanas apstākļiem ir pieejama arī attiecībā uz C. dilutus (5) un C. yoshimatsui (14). Sugas identifikācija jāapstiprina pirms testēšanas, bet tā nav nepieciešama katram testam, ja organismi ir audzēti turpat uz vietas.
|
Sedimenti
|
13.
|
Vēlams izmantot formulēta sastāva sedimentus (saukti arī par rekonstituētajiem, mākslīgajiem vai sintētiskajiem sedimentiem). Tomēr, ja izmanto dabiskos sedimentus, tie ir jāraksturo (vismaz pH, organiskā oglekļa sastāvs, ieteicama arī tādu citu parametru noteikšana kā C/N attiecība un granulometrija) un tajos nedrīkstētu būt nekāds piesārņojums un citi organismi, kas varētu konkurēt ar trīsuļodu kāpuriem vai baroties ar tiem. Ieteicams arī pirms izmantošanas sedimentus kondicionēt septiņas dienas tādos pašos apstākļos, kādi pastāvēs testēšanā. Šajā testā (1), ir ieteicams izmantot šādus formulētā sastāva sedimentus (1)(20)(21):
|
a.
|
4-5 % (saussvars) kūdras: pēc iespējas pietuvināta pH 5,5–6,0; ir svarīgi izmantot pulverizētu kūdru, kas smalki samalta (daļiņu izmērs ≤ 1 mm) un kas ir izžāvēta vienīgi ar gaisu;
|
|
b.
|
20 % (saussvars) kaolīna mālu (kaolinīta saturam vēlams būt virs 30 %);
|
|
c.
|
75–76 % (saussvars) kvarca smilšu (pārsvarā tām jāsastāv no smalkām smiltīm, proti, vairāk nekā 50 % daļiņu jābūt 50–200 μm izmērā);
|
|
d.
|
pievieno dejonizētu ūdeni, lai iegūtu galīgā maisījuma mitrumu 30–50 % diapazonā;
|
|
e.
|
pievieno ķīmiski tīras kvalitātes kalcija karbonātu (CaCO3), lai koriģētu galīgā sedimentu maisījuma pH 7,0 ± 0,5 apmērā;
|
|
f.
|
galīgā maisījuma organiskā oglekļa saturam jābūt 2 % (± 0,5), un tas jākoriģē, izmantojot atbilstīgus daudzumus kūdras un smilšu saskaņā ar a) un c) apakšpunktu.
|
|
|
14.
|
Jābūt zināmam kūdras, kaolīna mālu un smilšu avotam. Sedimentu sastāvdaļas ir jāpārbauda, lai pārliecinātos, ka tajās nav ķīmiska piesārņojuma (piem., smago metālu, hlororganisko savienojumu, fosfororganisko savienojumu). Formulēta sastāva sedimentu sagatavošanas piemērs ir aprakstīts 3. papildinājumā. Ir pieņemami samaisīt arī sausas sastāvdaļas, ja tiek pierādīts, ka pēc virsējā ūdens pievienošanas nenotiek sedimentu sastāvdaļu atdalīšanās (piem., kūdras daļiņu peldēšana pa ūdens virsmu) un ka kūdra vai sedimenti ir pietiekami kondicionēti.
|
Ūdens
|
15.
|
Jebkurš ūdens, kas atbilst 2. un 4. papildinājumā noteiktajiem pieņemama atšķaidīšanas ūdens ķīmiskajiem raksturlielumiem, ir piemērots kā testēšanas ūdens. Jebkāds piemērots ūdens, proti, dabīgs ūdens (virszemes vai gruntsūdens), rekonstituēts ūdens (sk. 2. papildinājumu) vai krāna ūdens, no kura attīrīts hlors, ir izmantojams kā kultivēšanas un testēšanas ūdens, ja trīsuļodi tajā bez stresa pazīmēm izdzīvo kultivēšanas un testēšanas laikā. Testēšanas sākumā testēšanas ūdens pH jābūt 6–9 diapazonā, savukārt kopējā cietība nedrīkst pārsniegt 400 mg/l kā CaCO3. Tomēr, ja tiek prognozēta mijiedarbība starp cietības joniem un testējamo vielu, jāizmanto zemākas cietības ūdens (tādēļ šādā situācijā nedrīkst izmantot Elendt barotni M4). Visa pētījuma laikā jāizmanto viena veida ūdens. Ūdens kvalitātes raksturlielumi, kas uzskaitīti 4. papildinājumā, jānosaka vismaz divreiz gadā vai tad, kad ir aizdomas, ka šie raksturlielumi varētu būt būtiski izmainījušies.
|
Izejšķīdumi – ar testējamo vielu papildināts ūdens
|
16.a.
|
Testa koncentrācijas aprēķina, pamatojoties uz koncentrācijām ūdens vertikālajā slānī, t. i., ūdens virsējā slānī virs sedimentiem. Izraudzīto koncentrāciju testēšanas šķīdumus parasti gatavo, atšķaidot izejšķīdumu. Izejšķīdumus vēlams pagatavot, izšķīdinot testējamo vielu testēšanas ūdenī. Lai iegūtu piemērotas koncentrācijas izejšķīdumu, dažos gadījumos var nākties izmantot šķīdinātājus vai dispersantus. Piemērotu šķīdinātāju piemēri ir acetons, etilspirts, metilspirts, etilēnglikola monoetilēteris, etilēnglikola dimetilēteris, dimetilformamīds un trietilēnglikols. Dispersanti, ko var izmantot, ir Cremophor RH40, Tween 80, metilceluloze 0,01 % un HCO-40. Šķīdinātājas vielas koncentrācijai galīgajā testēšanas barotnē jābūt minimālai (t. i., ≤ 0,1 ml/l) un vienādai visās apstrādēs. Ja tiek izmantota šķīdinātāja viela, tai nedrīkst būt ievērojama ietekme uz izdzīvošanu un tā jāapstiprina ar šķīdinātāja kontrolgrupu salīdzinājumā ar negatīvo (ūdens) kontrolgrupu. Jebkurā gadījumā ir jācenšas izvairīties no šādu materiālu izmantošanas.
|
Izejšķīdumi – ar testējamo vielu papildināti sedimenti
|
16.b.
|
Izraudzītās koncentrācijas papildinātos sedimentus parasti sagatavo, testējamās vielas šķīdumu tieši pievienojot sedimentiem. Dejonizētā ūdenī izšķīdinātas testējamās vielas izejšķīdumu samaisa ar formulēta sastāva sedimentiem, izmantojot velmēšanas dzirnavas, barības jaucēju vai manuālu jaukšanu. Ja testējamā viela ir ūdenī mazšķīstoša, to var izšķīdināt pēc iespējas mazākā tilpumā piemērota organiska šķīdinātāja (piem., heksāna, acetona vai hloroforma). Pēc tam šo šķīdumu samaisa ar 10 g smalku kvarca smilšu katram testēšanas traukam. Šķīdinātājam ļauj iztvaikot, un tam ir pilnībā jāpazūd no smiltīm. Pēc tam smiltis samaisa ar piemērotu daudzumu sedimentu. Testējamās vielas šķīdināšanai, disperģēšanai vai emulģēšanai drīkst izmantot tikai tādus preparātus, kas viegli izgaist. Jāpatur prātā, ka testējamās vielas nodrošinātās smiltis un smilšu maisījums ir jāņem vērā, sagatavojot sedimentus (proti, sedimenti ir jāsagatavo, izmantojot mazāk smilšu). Jānodrošina, ka sedimentiem pievienotā testējamā viela ir pienācīgi un vienmērīgi izkliedēta sedimentos. Ja vajadzīgs, var analizēt paraugus, lai noteiktu homogenitātes pakāpi.
|
TESTĒŠANAS PLĀNS
|
17.
|
Testēšanas plāns attiecas uz testa koncentrāciju skaita un intervālu izvēli, trauku skaitu katram koncentrācijas līmenim un kāpuru skaitu traukā, kristalizācijas trauku un vairošanās būru skaitu. Zemāk ir aprakstīti ECx, NOEC testu un pieļaujamā daudzuma testa plāni.
|
Regresijas analīzes plāns
|
18.
|
Testēšanā izmantotajām koncentrācijām ir jāaptver ietekmes koncentrācija (ECx) un koncentrāciju diapazons tā, lai beigupunkts nebūtu jāekstrapolē ārpus ievāktajiem datiem. Jāizvairās no ekstrapolācijas krietni zem zemākās koncentrācijas vai virs augstākās koncentrācijas. Provizorisks diapazona noteikšanas tests, izmantojot testēšanas metodi C.27 vai C.28, palīdzēs izvēlēties piemērotu testa koncentrāciju diapazonu.
|
|
19.
|
Saskaņā ar ECx pieeju, ir nepieciešamas vismaz piecas koncentrācijas un astoņi replikāti katrai koncentrācijai. Katrai koncentrācijai izmanto divus vairošanās būrus (A un B). Astoņus replikātus sadala divās grupās pa četriem replikātiem katrā, un katru grupu ievieto vienā vairošanās būrī. Šī replikātu apvienošana nepieciešama, lai būrī sasniegtu vairošanās novērtēšanai pietiekamu odu skaitu. Tomēr otrajā paaudzē atkal ir nepieciešami astoņi replikāti, kurus izveido no vairošanās būrī esošajām eksponētajām populācijām. Koeficients starp koncentrācijām nedrīkstētu pārsniegt 2 (izņēmums varētu būt gadījumi, kad devu un atbildes reakcijas līknei ir sekls slīpums). Katras apstrādes replikātu skaitu var samazināt līdz sešiem (trīs katrā turēšanas būrī), ja palielina testa koncentrāciju skaitu ar dažādām atbildes reakcijām. Replikātu skaita palielināšana vai testa koncentrāciju intervālu samazināšana parasti noved pie šaurākiem ECx testēšanas ticamības intervāliem.
|
NOEC noteikšanas plāns
|
20.
|
NOEC pieejai nepieciešamas piecas testa koncentrācijas ar vismaz astoņiem replikātiem (4 katrā būrī, A un B), un koeficients starp koncentrācijām nedrīkstētu pārsniegt 2. Replikātu skaitam jābūt pietiekamam, lai nodrošinātu pietiekamu statistisko nozīmību un varētu detektēt 20 % atšķirību no kontrolgrupas pie 5 % nozīmības līmeņa (α = 0,05). Attīstības ātruma, potenciālās auglības un auglības novērtēšanai ir piemērota dispersijas analīze (ANOVA), tai seko Daneta tests vai Viljamsa tests (22–25). Izšķilšanās koeficientu un dzimumu attiecības novērtēšanai ir piemēroti Kohrana-Armitāža tests, Fišera eksaktais tests (ar Bonferoni korekciju) un Mantela-Hencala tests.
|
Pieļaujamā daudzuma tests
|
21.
|
Pieļaujamā daudzuma testu (viena testa koncentrācija un kontroles trauks) var veikt, ja izvēles provizoriskajā diapazona noteikšanas testā netika konstatēta ietekme līdz maksimālajai koncentrācijai. Pieļaujamā daudzuma testa mērķis ir parādīt, ka testējamajai ķīmiskajai vielai ir toksiska iedarbība koncentrācijās, kas ir augstākas par pieļaujamā daudzuma testā analizētajām. Tās būtu 100 mg/l ūdenim un 1 000 mg/kg (saussvars) sedimentiem. Parasti nepieciešami vismaz astoņi replikāti gan apstrādes, gan kontrolgrupas variantiem. Ir jāpanāk pietiekama statistiskā nozīmība, lai varētu detektēt 20 % atšķirību no kontrolgrupas pie 5 % nozīmības līmeņa (α = 0,05). Ar metrisku atbildes reakciju (piem., attīstības ātrums) t-tests parasti ir piemērota statistiskā metode, ja dati atbilst šā testa prasībām (normalitāte, homogēnas dispersijas). Ja rezultāti neatbilst šīm prasībām, var izmantot nevienlīdzīgās dispersijas t-testu vai kādu no neparametriskajiem testiem, piem., Vilkoksona-Manna-Vitneja testu. Fišera eksaktais tests ir piemērots izšķilšanās koeficientu analīzei.
|
PROCEDŪRA
Ekspozīcijas apstākļi
Sedimentu-ūdens sistēmas sagatavošana (ūdens papildināšana ar testējamo vielu)
|
22.a.
|
Formulēta sastāva sedimentus (sk. 13.–14. punktu 3. papildinājumā) ievieto katrā testēšanas traukā un kristalizācijas traukā tā, lai slānis ir vismaz 1,5 cm dziļš (kristalizācijas traukā tas var būt mazliet mazāks) un ne dziļāks par 3 cm. Ūdeni (sk. 15. punktu) pievieno tik daudz, lai attiecība starp sedimentu un ūdens slāņa dziļumu nepārsniegtu 1:4. Pēc ievietošanas testēšanas traukos sedimentu-ūdens sistēma jāatstāj vieglas aerācijas apstākļos apmēram septiņas dienas, pēc kurām tiek pievienoti pirmās attīstības stadijas pirmās vai otrās paaudzes kāpuri (sk. 3. pielikuma 14. punktu). Testa laikā kristalizācijas trauku sedimentu-ūdens sistēma netiek aerēta, jo nav nepieciešamības papildus veicināt kāpuru izdzīvošanu (pirms oliņu virteņu savākšanas). Lai izvairītos no sedimentu sastāvdaļu atdalīšanās un smalku daļiņu atkārtotas suspensijas ūdens vertikālajā slānī testēšanas ūdens pievienošanas laikā, sedimentus var pārklāt ar plastmasas ripu ūdens uzliešanas laikā. Pēc tam ripu nekavējoties noņem. Šim nolūkam der arī citas ierīces.
|
Sedimentu-ūdens sistēmas sagatavošana (testējamā viela pievienota sedimentos)
|
22.b.
|
Ar testējamo ķīmisko vielu papildinātus sedimentus, kas pagatavoti saskaņā ar 16.b. punktu, ievieto testēšanas traukos un kristalizācijas traukos; virsējais ūdens tiek pievienots, panākot sedimentu-ūdens slāņu dziļumu attiecību 1:4. Sedimentu slāņa dziļumam jābūt diapazonā 1,5–3 cm (kristalizācijas traukos tas var būt nedaudz mazāks). Lai izvairītos no sedimentu sastāvdaļu atdalīšanās un smalku daļiņu atkārtotas suspensijas ūdens vertikālajā slānī testēšanas ūdens pievienošanas laikā, sedimentus var pārklāt ar plastmasas ripu ūdens uzliešanas laikā, bet pēc tam ripu nekavējoties noņem. Šim nolūkam der arī citas ierīces. Tiklīdz ir sagatavoti papildinātie sedimenti ar virsējo ūdeni, ir vēlams ļaut testējamai vielai izdalīties no sedimentiem un sajaukties ar ūdens fāzi un (4)(5)(7)(18). To vēlams īstenot tādos pašos temperatūras un aerācijas apstākļos, kādus izmanto testēšanā. Atbilstīgais līdzsvara iestāšanās laiks ir atkarīgs no konkrētajiem sedimentiem un ķīmiskās vielas, tas var būt stundu vai dienu ilgs un retos gadījumos ilgt līdz pat piecām nedēļām. Tā kā šajā laikā varētu noārdīties daudzas ķīmiskās vielas, līdzsvara iestāšanās netiek gaidīta, bet līdzsvarošanai ieteicams paredzēt 48 stundas. Tomēr, ja ir zināms, ka sedimentos ievadītajai ķīmiskajai vielai ir garš pussadalīšanās periods (sk. 8. punktu), līdzsvarošanas laiku var pagarināt. Šā turpmākās līdzsvarošanas perioda beigās ir jānosaka testējamās vielas koncentrācija virsējā ūdenī, poru ūdenī un sedimentos, proti, vismaz augstākā un zemākā koncentrācija (sk. 38. punktu). Šie testējamās vielas analītiskie mērījumi ļauj aprēķināt masas bilanci un noteikt rezultātus, pamatojoties uz izmērītajām koncentrācijām.
|
|
23.
|
Testēšanas trauki ir jāapsedz (piem., ar stikla plāksnēm). Ja vajadzīgs, pētījuma laikā ūdens līmeņus papildina līdz sākotnējam tilpumam, lai kompensētu ūdens iztvaikošanu. Tam jāizmanto destilēts vai dejonizēts ūdens, lai novērstu sāļu uzkrāšanos. Kristalizācijas trauki vairošanās būros netiek apsegti; to ūdens līmeni var regulēt, lai kompensētu testēšanas laika ūdens zudumus, bet tas nav obligāti, jo oliņu virtenes ir kontaktā ar ūdeni tikai vienu dienu un trauki tiek lietoti tikai īsu laiku.
|
Testa organismu pievienošana
|
24.
|
Četras līdz piecas dienas pirms pirmās paaudzes ražošanai paredzēto kāpuru pievienošanas no kultūras jāizņem oliņu masa un jāievieto nelielos traukos ar kultivēšanas barotni. Var izmantot izturētu barotni no pamatkultūras vai svaigi sagatavotu barotni. Jebkurā gadījumā kultivēšanas barotnei jāpievieno neliels daudzums barības, piem., zaļaļģes un/vai daži pilieni filtrāta no smalki samaltas zivju barības pārslu suspensijas (sk. 2. papildinājumu). Jāizmanto tikai svaigi izdētas oliņas. Parasti kāpuri sāk šķilties dažas dienas pēc oliņu izdēšanas (C. riparius pēc 2–3 dienām pie 20 °C, savukārt pēc 1–4 dienām C. dilutus pie 23 °C un C. yoshimatsui pie 25 °C), un kāpuru augšana notiek četrās attīstības stadijās, no kurām katra ilgst 4–8 dienas. Testēšanā jāizmanto pirmās attīstības stadijas kāpuri (vēlākais 48 h pēc izšķilšanās). Kāpuru attīstības stadiju var pārbaudīt, izmantojot galvas kapsulas platumu (7).
|
|
25.
|
Divdesmit pirmās attīstības stadijas kāpurus no pirmās paaudzes ar neasu pipeti vienmērīgi izvieto katrā testēšanas traukā, kurā ir sedimentu-ūdens sistēma. Ūdens aerācija tiek apturēta uz kāpuru ievietošanas laiku un uz nākamajām 24 stundām, kurās turpinās kāpuru ievietošana (sk. 32. punktu). Saskaņā ar pielietoto testēšanas plānu (sk. 19. un 20. punktu), uz katru koncentrāciju izmanto vismaz 120 kāpurus (6 replikāti uz koncentrāciju) ECx noteikšanai, un 160 kāpurus NOEC noteikšanai (8 replikāti uz koncentrāciju). Papildināto sedimentu sistēmā ekspozīcija sākas ar kāpuru ievietošanu.
|
Testējamās vielas pievienošana virsējam ūdenim
|
26.
|
Kad ir pagājušas 24 stundas pēc pirmās paaudzes pirmās attīstības stadijas kāpuru pievienošanas, virsējo ūdeni piesātina ar testējamo ķīmisko vielu un atsāk lēnu aerāciju (testēšanas plāna iespējamās izmaiņas aprakstītas 7. punktā). Nelielus testējamās ķīmiskās vielas izejšķīdumu tilpumus pievieno zem ūdens virsmas, izmantojot pipeti. Pēc tam virsējais ūdens ir uzmanīgi jāsamaisa, neizkustinot sedimentus. Papildinātā ūdens sistēmā ekspozīcija sākas ar testējamās vielas pievienošanu ūdenim (piem., vienu dienu pēc kāpuru pievienošanas).
|
Izšķīlušos pieaugušo īpatņu savākšana
|
27.
|
Pirmās paaudzes izšķīlušies odi tiek savākti vismaz vienu, bet labāk divas reizes dienā (sk. 36. punktu), izmantojot aspiratoru, iesūcēju vai līdzīgu ierīci (sk. 5. papildinājumu). Jācenšas netraumēt pieaugušos īpatņus. No vienas apstrādes četriem testēšanas traukiem savāktie odi tiek ielaisti tiem paredzētajā audzēšanas būrī. Pirmajā (tēviņu) izšķilšanās dienā kristalizācijas trauki tiek papildināti, ar pipeti zem ūdens līmeņa iepilinot nelielu daudzumu testējamās ķīmiskās vielas izejšķīduma (papildinātā ūdens sistēmā). Pēc tam ūdens virsējais slānis ir uzmanīgi jāsamaisa, neizkustinot sedimentus. Testējamās ķīmiskās vielas koncentrācija kristalizācijas traukā nomināli ir tāda pati kā apstrādes traukos, kas paredzēti konkrētajam audzēšanas būrim. Papildināto sedimentu sistēmā kristalizācijas trauki tiek sagatavoti apmēram 11. dienā pēc ekspozīcijas sākuma (pēc pirmās paaudzes kāpuru pievienošanas), lai tie paspētu iziet izlīdzināšanās procesu 48 stundu laikā pirms pirmo oliņu virteņu rašanās.
|
|
28.
|
Oliņu virtenes tiek savāktas no kristalizācijas traukiem, izmantojot pinceti vai neasu pipeti. Katru oliņu virteni ievieto traukā, kurā ir kultivēšanas barotne no tā kristalizācijas trauka, no kura tā tika ievākta (piem., iedobums 12 iedobumu plāksnē kopā ar vismaz 2,5 ml barotnes). Oliņu virteņu trauciņus nosedz ar vāku, lai novērstu būtisku iztvaikošanu. Oliņu virtenes tiek novērotas vismaz sešas dienas pēc to izveidošanas, lai tās varētu novērtēt kā auglīgas vai neauglīgas.
Otrās paaudzes sākumā no katra būra tiek ievāktas vismaz trīs, vēlams sešas oliņu virtenes, un kopā ar nelielu daudzumu barības tiek noliktas šķilties. Vēlams, lai šīs oliņu virtenes ir saražotas oliņu dēšanas maksimuma laikā, kas normāli notiek testa 19. dienā kontrolgrupas variantā. Vislabāk, ja otrās paaudzes visas apstrādes sāk vienā un tai pašā dienā, taču ķīmisko vielu izraisītās ietekmes uz kāpuru attīstību dēļ tas ne vienmēr ir iespējams. Šādā gadījumā augstāko koncentrāciju testēšana var tik uzsākta vēlāk nekā zemāko koncentrāciju, kontrolgrupas un šķīdinātāja kontrolgrupas testēšana.
|
|
29.a.
|
Papildinātā ūdens shēmā sedimentu-ūdens sistēma otrajai paaudzei tiek sagatavota, pievienojot testējamo ķīmisko vielu virsējam ūdenim apmēram vienu stundu pirms pirmās attīstības stadijas kāpuru pievienošanas testēšanas traukos. Nelielus testējamās ķīmiskās vielas izejšķīdumu tilpumus pievieno zem ūdens virsmas, izmantojot pipeti. Pēc tam virsējo ūdeni ir uzmanīgi jāsamaisa, neizkustinot sedimentus. Pēc testējamās vielas pievadīšanas tiek veikta viegla aerācija.
|
|
29.b.
|
Papildināto sedimentu shēmā ekspozīcijas trauki ar otrajai paaudzei izveidoto sedimentu-ūdens sistēmu tiek sagatavoti tādā pašā veidā kā pirmajai paaudzei.
|
|
30.
|
Katrā testēšanas traukā ar papildinātiem sedimentiem un ūdeni pēc nejaušības principa ievieto 20 otrās paaudzes pirmās attīstības stadijas kāpurus (ne vairāk kā 48 stundas pēc izšķilšanās), izmantojot neasu pipeti. Pirmās attīstības stadijas kāpuru ievietošanas laikā testēšanas traukos ir jāpārtrauc ūdens aerācija, un šis pārtraukums jāturpina vēl 24 stundas pēc kāpuru ielaišanas. Saskaņā ar pielietoto testēšanas plānu (sk. 19. un 20. punktu), izmantoto kāpuru skaits uz katru koncentrāciju ir vismaz 120 (6 replikāti uz koncentrāciju) ECx noteikšanai, un 160 kāpuri NOEC noteikšanai (8 replikāti uz koncentrāciju).
|
Barība
|
31.
|
Testēšanas traukos ievietotie kāpuri ir jābaro, vēlams, katru dienu vai vismaz trīs reizes nedēļā. Katram jaunam kāpuram pirmās 10 dienas pietiek ar zivju barību (suspensija ūdenī vai smalki samalta barība, piem., TetraMin vai TetraPhyll, sk. 2. papildinājumu) 0,25–0,5 mg apmērā (0,35–0,5 mg C. yoshimatui). Nedaudz vairāk barības varētu vajadzēt vecākiem kāpuriem, proti, 0,5–1 mg uz kāpuru dienā, ar ko vajadzētu pietikt līdz testēšanas beigām. Ja tiek novērota sēnīšu augšana vai ja kontroles traukos ir novērota mirstība, barības porcija ir jāsamazina visos apstrādes traukos un kontroles traukos. Ja sēnīšu vairošanos neizdodas apturēt, tests ir jāatkārto.
Ekspozīcijas toksikoloģiskais būtiskums, uzņemot ķīmisko vielu ar barību, ir augstāks ķīmiskajām vielām ar augstu afinitāti pret organisko oglekli vai vielām, kas kovalenti saistās ar sedimentiem. Ja testē vielas ar šādām īpašībām, izdzīvošanas un normālas augšanas nodrošināšanai nepieciešamo barības daudzumu var pievienot formulēta sastāva sedimentiem pirms stabilizācijas atkarībā no regulēšanas vajadzībām. Lai novērstu ūdens kvalitātes pasliktināšanos, zivju barība jāaizstāj ar augu materiālu, piem., pievienojot 0,5 % (saussvara) smalki samaltu lielās nātres (Urtica dioica), baltā zīdkoka (Morus alba), baltā āboliņa (Trifolium repens), spinātu (Spinacia oleracea) lapu vai arī citus augu preparātus (Cerophyl vai α-celuloze). Pilnas barības devas pievienošana sedimentiem pirms testējamās ķīmiskās vielas nav mazsvarīga attiecībā uz ūdens kvalitāti un bioloģisko izpildījumu (21), un šī metode nav standartizēta; tomēr jaunākie pētījumi liecina, ka šī metode darbojas (19) (26). Pieaugušajiem īpatņiem būros parasti nav nepieciešama barība, tomēr to potenciālo auglību un auglību var veicināt, ja pieaugušajiem kukaiņiem, kas tikko izšķīlušies, barībai piedāvā piesātinātas saharozes šķīdumā mērcētu vates piciņu (34).
|
Inkubācijas apstākļi
|
32.
|
Abu paaudžu testēšanas traukos 24 stundas pēc pirmās attīstības stadijas kāpuru pievienošanas sāk lēnu virsējā ūdens aerāciju, kas tiek turpināta turpmākā testa laikā (jārūpējas, lai izšķīdušā skābekļa koncentrācija nebūtu zem 60 % gaisa piesātinājuma vērtības). Aerācija tiek nodrošināta ar Pastēra pipeti no stikla, kuras gals fiksēts 2–3 cm virs sedimentu slāņa un kas dod dažus burbuļus sekundē. Ja tiek testētas gaistošas ķīmiskās vielas, jāapsver iespēja neaerēt sedimentu-ūdens sistēmu, taču tajā pašā laikā ir jānodrošina atbilstība testa derīguma kritērijam – 60 % gaisa piesātinājuma (10. punkts). Turpmāki norādījumi sniegti (16).
|
|
33.
|
C. riparius testēšanu veic nemainīgā 20 °C (± 2 °C) temperatūrā. C. dilutus un C. yoshimatsui ieteicamā temperatūra ir attiecīgi 23 °C un 25 °C (± 2 °C). Piemēro 16 stundu fotoperioda ilgumu, un gaismas intensitātei jābūt robežās 500–1 000 luksi. Vairošanās būru režīmam var pievienot stundu garus rīta un vakara krēslas periodus.
|
Ekspozīcijas ilgums
|
34.
|
Papildinātā ūdens shēma: pirmās paaudzes ekspozīcijas laiks sākas brīdī, kad testējamo ķīmisko vielu pievieno virsējam ūdenim testēšanas traukos (vienu dienu pēc kāpuru ievietošanas, ekspozīcijas shēmas iespējamus labojumus sk. 7. punktā). Otrās paaudzes kāpuru ekspozīcija tiek sākta uzreiz, jo tos ievieto sedimentu-ūdens sistēmā, kurai jau pievienota testējamā ķīmiskā viela. Maksimālais ekspozīcijas ilgums C. riparius un C. yoshimatui ir 27 dienas pirmajai paaudzei un 28 dienas otrajai paaudzei (pirmā paaudze vienu dienu pavada testēšanas traukos bez ekspozīcijas). Ņemot vērā pārklāšanos, kopējais testēšanas ilgums ir aptuveni 44 dienas. Maksimālais ekspozīcijas ilgums C. dilutus pirmajai un otrajai paaudzei ir attiecīgi 64 un 65 dienas. Kopējais ilgums ir aptuveni 100 dienas.
Papildināto sedimentu shēma: ekspozīcija sākas ar kāpuru pievienošanu, tā ilgst maksimums 28 dienas C. riparius un C. yoshimatsui abām paaudzēm un maksimums 65 dienas C. dilutus abām paaudzēm.
|
Novērojumi
Izšķilšanās
|
35.
|
Abām paaudzēm tiek noteikts attīstības ilgums un pilnīgi izšķīlušos un dzīvo odu tēviņu un mātīšu skaits. Tēviņus ir viegli identificēt pēc ķemmveidīgajiem taustekļiem un slaidā ķermeņa.
|
|
36.
|
Abu paaudžu testēšanas trauki ir jānovēro vismaz trīs reizes nedēļā, lai vizuāli novērtētu jebkādas anomālijas (piem., sedimentu pamešana, neparasta peldēšana) salīdzinājumā ar kontroles traukiem. Paredzamās izšķilšanās periodā, kas C. riparius un C. yoshimatsui sākas 12 dienas pēc kāpuru ievietošanas (C. dilutus – 20 dienas), izšķīlušies odi katru dienu, vēlams divas reizes dienā (agri no rīta un vēlā pēcpusdienā) jāskaita un jānosaka to dzimums. Pēc identificēšanas pirmās paaudzes odi tiek uzmanīgi pārvietoti no traukiem uz būriem. Otrās paaudzes odi pēc identificēšanas tiek aizvākti un likvidēti. Visas testēšanas traukos atrodamās pirmās paaudzes ražotās olu virtenes ir atsevišķi jāsavāc un kopā ar vismaz 2,5 ml agrākās vides ūdens jāpārliek 12-iedobumu platēs (vai citos piemērotos traukos), kas tiek pārklāti ar vāku, lai novērstu būtisku iztvaikošanu. Jāreģistrē arī mirušo kāpuru un redzamo kūniņu skaits, kuras nav izšķīlušās. Vairošanās būru, testēšanas trauku un iesūcēju piemēri parādīti 5. papildinājumā.
|
Vairošanās
|
37.
|
Par ietekmi uz vairošanos liecina pirmās paaudzes odu saražoto oliņu virteņu skaits un šo oliņu virteņu auglība. Katru dienu no audzēšanas konteinerā ievietotā kristalizācijas trauka tiek savāktas oliņu virtenes. Oliņu virtenes ir jāsavāc un jāpārliek 12-iedobumu plākšņu iedobumos ar vismaz 2,5 ml agrākās vides ūdens (katrā iedobumā viena oliņu virtene), vai citos piemērotos traukos, kas tiek pārklāti ar vāku, lai novērstu būtisku iztvaikošanu. Katrai oliņu virtenei ir jānovērtē šādi parametri: izdēšanas diena; izmērs (normāla, t.i., 1,0 ± 0,3 cm vai maza, parasti ≤ 0,5 cm); struktūra (normāla – banāna forma, ar spirālveida oliņu virknēm vai anomāla, piem., oliņu virknes nav sakārtotas spirālē) un auglība (auglīgas vai neauglīgas). Oliņu virtenes auglība tiek novērtēta sešu dienu laikā pēc tās izdēšanas. Oliņu virtene tiek uzskatīta par auglīgu, ja izšķiļas vismaz viena trešdaļa oliņu. Lai aprēķinātu oliņu virteņu skaitu uz mātīti un auglīgu oliņu virteņu skaitu uz mātīti, izmanto kopējo būrī ielaisto mātīšu skaitu. Ja nepieciešams, oliņu skaitu virtenē var nedestruktīvi noteikt, izmantojot apļu skaitīšanas metodi (detalizēta informācija atsaucē (32) un (33)).
|
Analītiskie mērījumi
Testējamās ķīmiskās vielas koncentrācija
|
38.
|
Jāanalizē vismaz virsējā ūdens, poru ūdens un sedimentu paraugi; tas darāms ekspozīcijas sākumā (ja testējamā viela pievienota ūdenim, tad vēlams vienu stundu pēc pievienošanas) un testa beigās – augstākajā un zemākajā koncentrācijā. Tas attiecas uz abu paaudžu testēšanas traukiem. Būros novietotajos kristalizācijas traukos tiek analizēts tikai virsējais ūdens, jo oliņu virtenes ir kontaktā tikai ar to (papildināto sedimentu shēmā jāapsver arī sedimentu koncentrāciju analītiskā apstiprināšana). Ja uzskata par nepieciešamu, testa laikā var veikt sedimentu, poru ūdens un virsējā ūdens papildu mērījumus. Šie testējamās ķīmiskās vielas koncentrāciju mērījumi ļauj spriest par testējamās vielas uzvedību/izkliedēšanos sedimentu-ūdens sistēmā. Lai varētu ievākt sedimentus un poru ūdeni testa sākumā un laikā (sk. 39. punktu), ir nepieciešami papildu testēšanas trauki analīžu veikšanai. Mērījumi papildinātā ūdens shēmā var nebūt nepieciešami, ja testējamās ķīmiskās vielas izkliedēšanās starp ūdeni un sedimentiem ir skaidri zināma citos sedimentu/ūdens pētījumos, kas veikti salīdzināmos apstākļos (piem., sedimentu/ūdens attiecība, ķīmiskās vielas pievienošanas veids, organiskā oglekļa daudzums sedimentos), vai arī ja ir parādīts, ka virsējā ūdenī izmērītās koncentrācijas saglabājas 80–120 % robežās no nominālajām vai sākotnējām izmērītajām koncentrācijām.
|
|
39.
|
Ja veic starpposma mērījumus (piem., 7. un/vai 14. dienā) un ja analīzei ir vajadzīgi lieli paraugi, ko nevar paņemt no testēšanas traukiem, neietekmējot testēšanas sistēmu, jāveic analītiska noteikšana no paraugiem, kuri ņemti no papildu testēšanas traukiem, kas saņēmuši tādu pašu apstrādi (ietverot testa organismu klātbūtni), bet netiek izmantoti bioloģiskajiem novērojumiem.
|
|
40.
|
Lai izolētu starpūdeni (poru ūdeni), ieteicama centrifugēšana, piem., 10 000 g 4 °C temperatūrā 30 minūtes. Tomēr, ja tiek pierādīts, ka testējamā viela neadsorbējas uz filtriem, var būt pieņemami izmantot arī filtrēšanu. Dažos gadījumos var būt neiespējami analizēt koncentrācijas poru ūdenī, jo parauga izmērs ir pārāk mazs.
|
Fizikālie un ķīmiskie parametri
|
41.
|
Ievērojot atbilstošos nosacījumus (sk. 10. punktu), izmēra pH un izšķīdušo skābekli testēšanas ūdenī, kā arī ūdens temperatūru testēšanas un kristalizācijas traukos. Testēšanas sākumā un beigās jānosaka arī cietība un amonjaks kontroles traukos un vienā testēšanas un kristalizācijas traukā ar augstāko koncentrāciju.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
42.
|
Šā dzīves cikla testa mērķis ir novērtēt testējamās ķīmiskās vielas ietekmi uz vairošanos (divām paaudzēm), attīstības ātrumu un pilnīgi izšķīlušos un dzīvo odu tēviņu un mātīšu skaitu. Lai aprēķinātu izšķilšanās koeficientu, tēviņi un mātītes jāapvieno. Ja nav statistiski būtisku atšķirību starp abiem dzimumiem attīstības ātrumā, statistiskajās analīzēs tēviņu un mātīšu rezultātus var apvienot.
|
|
43.
|
Ietekmes koncentrācijas, kas izteiktas kā koncentrācijas virsējā ūdenī (ja testējamā viela pievienota ūdenim) vai sedimentos (ja testējamā viela pievienota sedimentiem) parasti aprēķina, pamatojoties uz izmērītajām koncentrācijām ekspozīcijas sākumā (sk. 38. punktu). Tādēļ papildinātajam ūdenim katrai ekspozīcijai aprēķina vidējo koncentrāciju, ko parasti mēra ekspozīcijas sākumā virsējā ūdenī abu paaudžu traukos un kristalizācijas traukos. Papildinātajiem sedimentiem katrai apstrādei aprēķina vidējo no koncentrācijām, ko parasti mēra ekspozīcijas sākumā abu paaudžu traukos (un pēc izvēles arī kristalizācijas traukos).
|
|
44.
|
Punktu, piem., ECx, aplēsei īsto replikātu vietā var izmantot statistiku uz katru trauku un katru būri. Aprēķinot ticamības intervālu jebkurai ECx, jāņem vērā mainība starp traukiem vai ir jāpierāda, ka šī mainība ir tik maza, ka to var neņemt vērā. Ja modelim izmanto lineāro regresiju, statistika uz katru trauku ir jākoriģē, lai uzlabotu dispersijas homogenitāti. Tomēr ECx vērtības ir jāaprēķina pēc tam, kad atbildes reakcija ir transformēta atpakaļ uz sākotnējo vērtību (31).
|
|
45.
|
Ja statistiskās analīzes mērķis ir noteikt NOEC ar hipotēzes testu, jāņem vērā mainība starp traukiem, ko garantē ANOVA metožu (piem., Viljamsa un Daneta testu) izmantošana. Viljamsa tests ir piemērots gadījumiem, kad teorētiski ir sagaidāma monotona reakcija uz devu; Daneta tests piemērots gadījumā, ja monotonitātes hipotēze netiek uzturēta. Situācijās, kad nedarbojas parastie ANOVA pieņēmumi (31), var izmantot stabilākus testus (27).
|
Izšķilšanās koeficients
|
46.
|
Izšķilšanās koeficienti ir kvantu dati, ko var analizēt ar descendentu Kohrana-Armitāža testu, ja ir paredzama monotona reakcija uz devu un ja šie dati atbilst šādai prognozei. Ja minētais tests analīzei neder, var izmantot Fišera eksakto testu vai Mantela-Hencala testu ar Bonferoni-Holma koriģētajām p-vērtībām. Ja pastāv liecības par lielāku mainību starp replikātiem ar vienu un to pašu koncentrāciju nekā to norādītu binomināls sadalījums (nereti uz to atsaucas kā uz “papildu binominālu” mainību), tad jāizmanto stabils Kohrana-Armitāža tests vai Fišera eksaktais tests, kā ieteikts atsaucē (27).
Vienā traukā izšķīlušos dzīvo odu (mātītes plus tēviņi) summa ne
, tiek noteikta un izdalīta ar ievietoto kāpuru skaitu, na
:
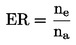
kur:
|
ER
|
=
|
izšķilšanās koeficients;
|
|
ne
|
=
|
izšķīlušos dzīvo odu skaits traukā;
|
|
na
|
=
|
ievietoto kāpuru skaits traukā (parasti 20).
|
Ja ne
ir lielāks nekā na
(t.i., nejauši traukos ir ielikts vairāk kāpuru nekā plānots), na
jāpielīdzina ne
.
|
|
47.
|
Liela apjoma paraugiem ar papildu binominālu dispersiju piemērota alternatīva ir izšķilšanās koeficientu uzskatīt par nepārtrauktu atbildes reakciju un izmantot procedūras, kas atbilst šiem izšķilšanās koeficienta datiem. Šajā kontekstā liels parauga apjoms tiek definēts kā gadījums, kad gan izšķīlušos īpatņu skaits, gan neizšķīlušos īpatņu skaits pārsniedz piecus uz katru replikātu (trauku).
|
|
48.
|
Lai piemērotu ANOVA metodes, izšķilšanās koeficienta vērtības ir vispirms jāpārvērš ar arksinusa kvadrātsaknes vai Takeja-Frīmena transformāciju, lai iegūtu aptuveno normālo sadalījumu un izlīdzinātu dispersijas. Izmantojot absolūto periodiskumu, var piemērot Kohrāna-Armitāža testu, Fišera eksakto testu (Bonferoni) vai Mantela-Hencala testu. Arksinusa kvadrātsaknes transformāciju piemēro, ņemot izšķilšanās koeficienta kvadrātsaknes inverso sinusu (sine– 1).
|
|
49.
|
Izšķilšanās koeficientiem ECx vērtības aprēķina, izmantojot regresijas analīzi (piem., probit, logit vai Veibula modeļus (28)). Ja regresijas analīze ir nesekmīga (piem., tiek iegūtas mazāk nekā divas daļējas atbildes reakcijas), izmanto citas ar parametriem nesaistītas metodes, tādas kā slīdošā vidējā vai vienkāršā interpolācija.
|
Attīstības ātrums
|
50.
|
Vidējais attīstības laiks ir vidējais laikposms starp kāpuru ielaišanu (testa 0. diena) un testējamās kohortas odu izšķilšanos (lai aprēķinātu patieso attīstības laiku, jāapsver kāpuru vecums ielaišanas brīdī). Attīstības ātrums ir attīstības laika apgrieztā vērtība (vienība: 1/diena) un tas reprezentē kāpuru attīstības posmu, kas noris vienas dienas laikā. Šo sedimentu toksicitātes pētījumu novērtēšanai attīstības ātrums ir ieteicamāks, jo tā dispersija ir mazāka un tas ir homogēnāks un tuvāks normālajam sadalījumam salīdzinājumā ar attīstības laiku. Tādējādi efektīvas parametru testēšanas procedūras var izmantot drīzāk ar attīstības ātrumu, nevis ar attīstības laiku. Attiecībā uz attīstības ātrumu kā nepārtrauktu atbildes reakciju ECx vērtības var aplēst, izmantojot regresijas analīzi (piem., (29)(30)). Vidējā attīstības ātruma NOEC var noteikt ar ANOVA metodēm, piem., Viljamsa vai Daneta testu. Tā kā tēviņi izšķiļas agrāk nekā mātītes, tātad tiem ir augstāks attīstības ātrums, ir vērts aprēķināt attīstības ātrumu gan katram dzimumam atsevišķi, gan visiem odiem kopā.
|
|
51.
|
Statistiskajiem testiem pieņem, ka pārbaudes dienā x novēroto odu skaits ir izšķīlies vidējā laika intervālā starp dienu x un dienu x–l (l = pārbaudes intervāla ilgums, parasti 1 diena). Katrā traukā vidējo attīstības ātrumu (
) aprēķina šādi:
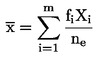
kur:
|
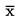
|
:
|
vidējais attīstības ātrums katrā traukā;
|
|
i
|
:
|
pārbaudes intervāla indekss;
|
|
m
|
:
|
pārbaudes intervālu maksimālais skaits;
|
|
f
i
|
:
|
pārbaudes intervālā i izšķīlušos odu skaits;
|
|
ne
|
:
|
kopējais odu skaits, kas izšķīlušies eksperimenta beigās (Σfi
));
|
|
xi
|
:
|
intervālā i izšķīlušos odu attīstības ātrums.
|

kur:
|
dienai
|
:
|
pārbaudes diena (dienas kopš kāpuru ievietošanas);
|
|
li
|
:
|
pārbaudes intervāla i garums (dienas, parasti 1 diena).
|
|
Dzimumu attiecība
|
52.
|
Attiecība starp dzimumiem ir kvantu dati, un tādēļ būtu vērtējami ar Fišera eksakto testu vai citām piemērotām metodēm. C. riparius dabiskā attiecība starp dzimumiem ir viens, jo tēviņi un mātītes ir sastopami vienlīdz bieži. Abām paaudzēm attiecības starp dzimumiem dati ir jāapstrādā vienādi. Tā kā maksimālais odu daudzums uz trauku (piem., 20) ir pārāk mazs pilnvērtīgai statistiskajai analīzei, pilnīgi izšķīlušos un dzīvo odu skaits visos traukos tiek summēts pie katras apstrādes. Šie netransformētie dati tiek testēti salīdzinājumā ar (šķīdinātāja) kontrolgrupu vai apvienoto kontrolgrupu 2 × 2 saistību tabulā.
|
Vairošanās
|
53.
|
Vairošanās, tāpat kā potenciālā auglība, tiek aprēķināta kā oliņu virteņu skaits uz mātīti. Kopējo vienā vairošanās būrī saražoto oliņu virteņu skaitu dala ar dzīvo un neievainoto būrī ielaisto mātīšu kopējo skaitu. Potenciālās auglības NOEC aprēķina ar ANOVA metodēm, piem., Viljamsa vai Daneta testu.
|
|
54.
|
Oliņu virteņu auglību izmanto, lai noteiktu auglīgu oliņu virteņu skaitu uz vienu mātīti. Vienā audzēšanas būrī saražoto auglīgo oliņu virteņu kopējo skaitu dala ar būrī ielaisto dzīvo un neievainoto mātīšu skaitu. Auglības NOEC aprēķina ar ANOVA metodēm, piem., Viljamsa vai Daneta testu.
|
Testēšanas pārskats
|
55.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā viela:
|
—
|
fizikālās un fizikālķīmiskās īpašības (šķīdība ūdenī, tvaika spiediens, log Kow, sadalījuma koeficients augsnē (vai sedimentos, ja pieejams), stabilitāte ūdenī un sedimentos u. c.);
|
|
—
|
ķīmiskās identitātes dati (vispārpieņemtais nosaukums, ķīmiskais nosaukums, struktūrformula, CAS numurs u. c.), iekļaujot tīrību un testējamās ķīmiskās vielas noteikšanas analītisko metodi.
|
|
|
|
Testējamās sugas:
|
—
|
izmantotie testa organismi: suga, zinātniskais nosaukums, organismu izcelsmes vieta un vairošanās apstākļi;
|
|
—
|
informācija par to, kādas darbības veiktas ar oliņām un kāpuriem;
|
|
—
|
informācija par to, kā ar iesūcēju tika strādāts ar pirmās paaudzes izšķīlušamies pieaugušiem īpatņiem (sk. 5. papildinājumu);
|
|
—
|
testējamo pirmās un otrās paaudzes īpatņu vecums ielaišanas brīdī testēšanas traukos.
|
|
|
|
Testēšanas apstākļi:
|
—
|
testā izmantotie sedimenti, t.i., dabiskie vai formulēta sastāva (mākslīgie) sedimenti;
|
|
—
|
dabiskie sedimenti: sedimentu paraugu ieguves atrašanās vieta un tās apraksts, ietverot, ja iespējams, piesārņojuma vēsturi; sedimentu raksturlielumi: pH, organiskā oglekļa saturs, C/N attiecība un granulometrija (ja vajadzīgs).
|
|
—
|
formulētā sastāva sedimenti: sagatavošana, sastāvdaļas un raksturlielumi (organiskā oglekļa saturs, pH, mitrums utt., mērīti testa sākumā);
|
|
—
|
testēšanas ūdens sagatavošana (ja tiek lietots rekonstituēts ūdens) un raksturlielumi (skābekļa koncentrācija, pH, cietība utt., mērīti testa sākumā);
|
|
—
|
sedimentu un virsējā ūdens slāņa dziļums testēšanas traukos un kristalizācijas traukos;
|
|
—
|
virsējā ūdens un poru ūdens tilpums; mitro sedimentu svars ar un bez poru ūdens testēšanas traukos un kristalizācijas traukos);
|
|
—
|
testēšanas trauki (materiāls un izmērs),
|
|
—
|
kristalizācijas trauki (materiāls un izmērs);
|
|
—
|
vairošanās būri (materiāls un izmērs);
|
|
—
|
izejšķīdumu un testa koncentrāciju sagatavošanas metode (testēšanas traukiem un kristalizācijas traukiem);
|
|
—
|
testējamās ķīmiskās vielas ievadīšana testēšanas traukos un kristalizācijas traukos: testa koncentrācijas, replikātu skaits un šķīdinātāji, ja nepieciešami;
|
|
—
|
inkubācijas apstākļi testēšanas traukos: temperatūra, gaismas cikls un intensitāte, aerācija (burbuļi sekundē);
|
|
—
|
inkubācijas apstākļi vairošanās būros un kristalizācijas traukos: temperatūra, gaismas cikls un intensitāte;
|
|
—
|
oliņu virteņu inkubācijas apstākļi mikroplatēs (vai citos traukos): temperatūra, gaismas cikls un intensitāte;
|
|
—
|
detalizēta informācija par barošanu, ietverot barības veidu, sagatavošanu, daudzumu un barošanas režīmu.
|
|
|
|
Rezultāti:
|
—
|
nominālās testa koncentrācijas, izmērītās testa koncentrācijas un visu analīžu rezultāti, lai noteiktu testējamās vielas koncentrāciju testēšanas un kristalizācijas traukos;
|
|
—
|
ūdens kvalitāte testēšanas un kristalizācijas traukos – pH, temperatūra, izšķīdušais skābeklis, cietība un amonjaks;
|
|
—
|
iztvaikojušā testēšanas ūdens aizvietošana testēšanas traukos, ja tā veikta;
|
|
—
|
pirmās un otrās paaudzes izšķīlušos tēviņu un mātīšu odu skaits uz testēšanas trauku dienā;
|
|
—
|
pirmās un otrās paaudzes izšķīlušos odu dzimumu attiecība uz katru apstrādi;
|
|
—
|
par pieaugušiem īpatņiem neizšķīlušos kāpuru skaits uz testēšanas trauku, pirmajā un otrajā paaudzē;
|
|
—
|
pirmās un otrās paaudzes izšķilšanās procentuālā daļa/daļa uz replikātu un testa koncentrāciju (tēviņi un mātītes apvienoti) pirmajai un otrajai paaudzei;
|
|
—
|
pirmās un otrās paaudzes pilnīgi izšķīlušos un dzīvu odu vidējais attīstības ātrums uz replikātu un uz apstrādes rādītāju (tēviņi un mātītes atsevišķi un apvienoti);
|
|
—
|
kristalizācijas traukos sadēto oliņu virteņu skaits katrā vairošanās būrī dienā;
|
|
—
|
katras oliņu virtenes raksturlielumi (izmērs, forma un auglība);
|
|
—
|
potenciālā auglība – oliņu virteņu kopējais skaits uz vairošanās būrī ielaisto mātīšu skaitu;
|
|
—
|
auglība – auglīgu oliņu virteņu kopējais skaits uz vairošanās būrī ielaisto mātīšu skaitu;
|
|
—
|
toksisko beigupunktu aplēses, piem., ECx (un saistītie ticamības intervāli), NOEC un tā noteikšanai izmantotās statistikas metodes;
|
|
—
|
rezultātu iztirzājums, minot arī jebkādas ietekmes uz testēšanas rezultātiem, kas izriet no novirzēm no šīs testēšanas metodes.
|
|
|
LITERATŪRA
|
(1)
|
Šā pielikuma C.28. nodaļa: Trīsuļodu toksicitātes tests sedimentu-ūdens sistēmā, izmantojot papildinātu ūdeni.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
|
|
(15)
|
Šā pielikuma C.27. nodaļa: Trīsuļodu toksicitātes tests sedimentu-ūdens sistēmā, izmantojot papildinātus sedimentus.
|
|
(16)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
|
|
(31)
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidanceto Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
1. papildinājums
Definīcijas
Šajā testēšanas metodē ir izmantoti šādi termini.
|
|
Ķīmiskā viela ir viela vai maisījums.
|
|
|
Formulēta sastāva sedimenti jeb rekonstituēti, mākslīgi vai sintētiski sedimenti ir tādu materiālu maisījums, ko izmanto, lai atveidotu dabisku sedimentu fizikālās sastāvdaļas.
|
|
|
Virsējais ūdens ir ūdens, ar ko nosegti sedimenti testēšanas traukā.
|
|
|
Starpūdens jeb poru ūdens ir ūdens, kas aizņem telpu starp sedimentiem un augsnes daļiņām.
|
|
|
Papildināts ūdens ir testēšanas ūdens, kam pievienota testējamā ķīmiskā viela.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai maisījums, ko testē ar šo testēšanas metodi.
|
2. papildinājums
Ieteikumi attiecībā uz Chironomus riparius kultūru
|
1.
|
Chironomus kāpurus var audzēt kristalizācijas traukos vai lielākos konteineros. Smalkas kvarca smiltis izklāj plānā, aptuveni 5–10 mm biezā slānī konteinera apakšā. Ir pierādīts, ka kā piemērotu substrātu var izmantot Kieselguhr (piem., Merck, 8117. punkts) (pietiek ar plānu slānīti tikai dažu mm augstumā). Pēc tam pievieno piemērotu ūdeni, lai dziļums būtu vairāki cm. Ūdens līmenis ir jāpaaugstina pēc vajadzības, lai atjaunotu iztvaikojušo daudzumu un novērstu izžūšanu. Ūdeni var apmainīt, ja vajadzīgs. Jānodrošina viegla aerācija. Kāpuru audzēšanas trauki jātur piemērotā būrī, kas nepieļaus izšķīlušos pieaugušo īpatņu izbēgšanu. Būrim jābūt pietiekami lielam, lai būtu iespējama izšķīlušos pieaugušo īpatņu spietošana, pretējā gadījumā nenotiks kopulācija (ne mazāks kā apm. 30 × 30 × 30 cm).
|
|
2.
|
Būri jātur istabas temperatūrā vai nemainīgas vides telpā 20° ± 2 °C ar 16 stundu apgaismojuma periodu (intensitāte apm. 1 000 luksi) un 8 stundu tumsas periodu. Ir norādīts, ka gaisa mitrums zem 60 % RH var kavēt vairošanos.
|
Atšķaidīšanas ūdens
|
3.
|
Var izmantot jebkuru piemērotu dabisku vai sintētisku ūdeni. Bieži izmanto akas ūdeni, krāna ūdeni, no kura attīrīts hlors, un mākslīgas barotnes (piem., Elendt M4 vai M7 barotni, sk. turpmāk). Ūdenim pirms izmantošanas jānodrošina aerācija. Ja vajadzīgs, kultivēšanas ūdeni var atjaunot, izmantoto ūdeni no kultivēšanas traukiem uzmanīgi nolejot vai sifonējot, nesadragājot kāpuru kūniņas.
|
Kāpuru barošana
|
4.
|
Chironomus kāpuri ir jābaro ar zivju barības pārslām (TetraMin
®, TetraPhyll
® vai cita līdzīga zīmola patentētu zivju barību), katrā traukā dienā ievietojot aptuveni 250 mg. Barību var dot kā sausu samaltu pulveri vai kā suspensiju ūdenī, proti, 1 g barības pārslu pievieno 20 ml atšķaidīšanas ūdens un samaisa, līdz iegūst homogēnu maisījumu. Šo sagatavi var izbarot aptuveni 5 ml apmērā katrā traukā katru dienu (pirms lietošanas sakratīt). Vecāki kāpuri var saņemt vairāk barības.
|
|
5.
|
Barošanu pielāgo atbilstīgi ūdens kvalitātei. Ja kultivēšanas barotne kļūst duļķaina, barošana ir jāsamazina. Barības papildinājumi ir rūpīgi jāuzrauga. Pārāk maz barības izraisīs kāpuru emigrāciju vertikālā ūdens slāņa virzienā, savukārt pārāk daudz barības izraisīs mikrobiālās aktivitātes pieaugumu un samazinās skābekļa koncentrācijas. Abas situācijas var novest pie mazākiem augšanas ātrumiem.
|
|
6.
|
Izveidojot jaunus kultivēšanas traukus, var pievienot dažas zaļaļģu (piem., Scenedesmus subspicatus, Chlorella vulgaris) šūnas.
|
Izšķīlušos pieaugušo īpatņu barošana
|
7.
|
Dažos testos ir iegūtas liecības, ka kokvilnas vates piciņa, kas piesūcināta ar piesātinātu saharozes šķīdumu, var nodrošināt barību izšķīlušamies pieaugušiem īpatņiem.
|
Izšķilšanās
|
8.
|
Divdesmit grādu ± 2 °C temperatūrā pieaugušie īpatņi sāks šķilties no kāpuru audzēšanas traukiem aptuveni pēc 13–15 dienām. Tēviņus ir viegli atšķirt pēc to spalvainajām antenām un slaidā ķermeņa.
|
Oliņas
|
9.
|
Tiklīdz vairošanās būrī ir pieaugušie īpatņi, visi kāpuru audzēšanas trauki ir jāpārbauda 3 reizes nedēļā, lai konstatētu izdētās želatīnveidīgās oliņas. Ja tās tiek atklātas, oliņas ir uzmanīgi jāizņem. Tās ir jāievieto nelielā šķīvī, kurā ir vairošanās ūdens paraugs. Oliņas izmanto, lai izveidotu jaunus kultivēšanas traukus (piem., 2–4 oliņu kopas katrā traukā), vai tās izmanto toksicitātes testēšanā.
|
|
10.
|
Pirmās attīstības stadijas kāpuriem būtu jāizšķiļas pēc 2 – 3 dienām.
|
Jaunu kultivēšanas trauku iekārtošana
|
11.
|
Pēc tam, kad ir izveidotas kultūras, katru nedēļu vai retāk var izveidot jaunu kāpuru kultivēšanas trauku atkarībā no testēšanas prasībām, un vecos traukus izņem no būriem pēc pieaugušo īpatņu izšķilšanās. Ar šādu sistēmu var nodrošināt regulāru pieaugušo īpatņu piegādi ar minimāliem pārvaldības pasākumiem.
|
Testēšanas šķīdumu M4 and M7 sagatavošana
|
12.
|
Elendt (1990) ir aprakstījis M4 barotni. M7 barotni sagatavo tāpat kā M4 barotni, izņemot 1. tabulā norādītās vielas, kurām koncentrācijas M7 barotnē ir 4 reizes mazākas nekā M4 barotnē. Testēšanas šķīdumu nevajadzētu sagatavot saskaņā ar Elendt and Bias (1990), jo NaSiO3, 5H2O, NaNO3, KH2PO4 un K2HPO4 koncentrācijas, kas norādītas izejšķīdumu sagatavošanai, ir nepiemērotas.
|
M7 barotnes sagatavošana
|
13.
|
Katru izejšķīdumu (I) sagatavo atsevišķi un apvienoto izejšķīdumu (II) pagatavo no šiem izejšķīdumiem (I) (sk. 1. tabulu). 50 ml no katra apvienotā izejšķīduma (II) un 2. tabulā norādītos daudzumus no katra makroelementu izejšķīduma iemaisa 1 litrā dejonizēta ūdens, lai sagatavotu M7 barotni. Vitamīnu izejšķīdumu sagatavo, pievienojot 3 vitamīnus dejonizētam ūdenim, kā norādīts 3. tabulā, un neilgi pirms izmantošanas galīgajai M7 barotnei pievieno 0,1 ml apvienotā vitamīnu izejšķīduma. Vitamīnu izejšķīdumu glabā sasaldētu mazās alikvotās. Barotnei nodrošina aerāciju un to stabilizē.
|
1. tabula
Barotnes M4 un M7 mikroelementu izejšķīdumi
|
Izejšķīdumi (I)
|
Daudzums (mg), ko pievieno 1 litram dejonizēta ūdens
|
Lai sagatavotu apvienoto izejšķīdumu (II), samaisa turpmāk norādītos izejšķīdumu (I) tilpumus (ml) un pievieno 1 litram dejonizēta ūdens
|
Gala koncentrācijas testa šķīdumos (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 × 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
2. tabula
Makroelementu izejšķīdumi barotnei M4 un M7
|
|
Daudzums, ko pievieno 1 litram dejonizēta ūdens
(mg)
|
Makroelementu izejšķīdumu tilpums, ko pievieno, lai sagatavotu barotni M4 un M7
(ml/l)
|
Galīgās koncentrācijas testa šķīdumos M4 un M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
3. tabula
Vitamīnu izejšķīdums barotnei M4 un M7
Visus trīs vitamīnu šķīdumus apvieno, lai sagatavotu vienu vitamīnu izejšķīdumu.
|
|
Daudzums, ko pievieno 1 litram dejonizēta ūdens
(mg)
|
Vitamīnu izejšķīduma tilpums, ko pievieno, lai sagatavotu barotni M4 un M7
(ml/l)
|
Galīgās koncentrācijas testa šķīdumos M4 un M7
(mg/l)
|
|
Tiamīna hidrohlorīds
|
750
|
0,1
|
0,075
|
|
Ciānkobalamīns (B12)
|
10
|
0,1
|
0,0010
|
|
Biotīns
|
7,5
|
0,1
|
0,00075
|
ATSAUCES
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
3. papildinājums
Formulēta sastāva sedimentu sagatavošana
SEDIMENTU SASTĀVS
Formulēta sastāva sedimentu sastāvam jābūt šādam:
|
Sastāvdaļa
|
Raksturlielumi
|
% no sedimentu saussvara
|
|
Kūdra
|
Sfagnu kūdra, kuras pH ir pēc iespējas tuvāks 5,5–6,0 vērtībai, bez redzamām augu atliekām, smalki samalta (daļiņu izmērs: ≤ 1 mm) un izžāvēta ar gaisu
|
4 – 5
|
|
Kvarca smiltis
|
Smilšu graudu izmērs: > 50 % no daļiņām jābūt diapazonā 50–200 μm
|
75 – 76
|
|
Kaolīna māli
|
Kaolīna saturs: ≥ 30 %
|
20
|
|
Organiskais ogleklis
|
Koriģē, pievienojot kūdru un smiltis
|
2 (± 0,5)
|
|
Kalcija karbonāts
|
CaCO3, pulverizēts, ķīmiski tīrs
|
0,05 – 0,1
|
|
Ūdens
|
Vadītspēja: ≤ 10 μS/cm
|
30 – 50
|
SAGATAVOŠANA
Kūdru izžāvē gaisā un samaļ smalkā pulverī. Vajadzīgā daudzuma kūdras pulvera suspensiju dejonizētā ūdenī sagatavo, izmantojot efektīvu homogenizēšanas ierīci. Šīs suspensijas pH koriģē ar CaCO3 līdz 5,5 ± 0,5 vērtībai. Suspensiju kondicionē vismaz 2 dienas, viegli maisot 20 ± 2 °C temperatūrā, lai stabilizētu pH un izveidotu stabilu mikrobiālo sastāvdaļu. Vēlreiz mēra pH, kam jābūt 6 ± 0,5. Pēc tam kūdras suspensiju samaisa ar citām sastāvdaļām (smiltīm un kaolīna māliem) un dejonizētu ūdeni, lai iegūtu homogēnus sedimentus ar ūdens saturu 30–50 % diapazonā no sedimentu sausā svara. Vēlreiz mēra galīgā maisījuma pH un to koriģē 6,5–7,5 vērtībā ar CaCO3, ja vajadzīgs. Ņem sedimentu paraugus, lai noteiktu saussvaru un organiskā oglekļa saturu. Pēc tam, pirms formulēta sastāva sedimentus izmanto trīsuļodu toksicitātes testos, ir ieteicams tos kondicionēt 7 dienas tādos pašos apstākļos, kādi būs testā.
GLABĀŠANA
Mākslīgo sedimentu sausās sastāvdaļas var arī uzglabāt sausā un vēsā vietā istabas temperatūrā. Izstrādātos (mitros) sedimentus nedrīkstētu uzglabāt pirms to izmantošanas testā. Tie ir jāizmanto tūlīt pēc 7 dienu nogatavināšanas perioda, kas pabeidz to sagatavošanu.
ATSAUCES
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
4. papildinājums
Piemērota atšķaidīšas ūdens ķīmiskie raksturlielumi
|
SASTĀVDAĻA
|
KONCENTRĀCIJAS
|
|
Cietās daļiņas
|
< 20 mg/l
|
|
Kopējais organiskais ogleklis
|
< 2 mg/l
|
|
Nejonizēts amonjaks
|
< 1 μg/l
|
|
CaCO3 cietība
|
< 400 mg/l (27)
|
|
Hlora atlikums
|
< 10 μg/l
|
|
Kopējie fosfororganiskie pesticīdi
|
< 50 ng/l
|
|
Hlororganisko pesticīdu un polihlorbifenilu kopējais saturs
|
< 50 ng/l
|
|
Kopējais organiskais hlors
|
< 25 ng/l
|
5. papildinājums
Norādījumi testa veikšanai
Audzēšanas būra piemērs:
|
A
|
:
|
siets būra augšā un vismaz vienā sānā (sieta acu izmērs apmēram 1 mm);
|
|
B
|
:
|
atvērums, pa kuru būrī ielikt izšķīlušos pieaugušos kukaiņus un izņemt izdētās oliņu virtenes no kristalizācijas traukiem (nav parādīts šajā attēlā);
|
|
C
|
:
|
vairošanās būra izmērs: vismaz 30 cm garumā, 30 cm augstumā, 30 cm platumā.
|
Testēšanas trauka piemērs:
|
A
|
:
|
Pastēra pipete gaisa piegādāšanai virsējā ūdenī;
|
|
B
|
:
|
stikla vāks, lai novērstu izšķīlušos odu izbēgšanu;
|
|
C
|
:
|
ūdens līmenis;
|
|
D
|
:
|
testēšanas trauks (vismaz 600 ml tilpuma vārglāze);
|
|
E
|
:
|
sedimentu slānis.
|
Piemērs – iesūcējs pieaugušo īpatņu noķeršanai (bultas norāda gaisa plūsmas virzienu):

|
A
|
:
|
stikla caurule (iekšējais diametrs apmēram 5 mm), savienota ar pašuzsūcošu sūkni;
|
|
B
|
:
|
vulkanizētas gumijas aizbāznis, caurdurts ar stikla cauruli (A). Stikla caurules (A) atvērums iekšpusē ir pārklāts ar kokvilnas audumu un ar sietu (sieta acs izmērs apmēram 1 mm), lai novērstu iesūcējā iesūkto odu savainošanu;
|
|
C
|
:
|
caurspīdīgs konteiners (plastmasa vai stikls, garums apmēram 15 cm) noķertajiem odiem;
|
|
D
|
:
|
vulkanizētas gumijas aizbāznis, caurdurts ar cauruli (E). Lai izlaistu odus vairošanās būrī, aizbāznis D tiek izņemts no konteinera C;
|
|
E
|
:
|
caurule (plastmasas vai stikla, diametrs apmēram 8 mm), lai savāktu pieaugušos īpatņus no trauka.
|
Dzīves cikla shēma:
|
A
|
:
|
Pirmā paaudze – testēšanas trauki ar sedimentu-ūdens sistēmu, 8 replikāti, 20 pirmās attīstības stadijas kāpuri uz trauku;
|
|
B
|
:
|
četri testēšanas trauki katrā vairošanās būrī – A un B;
|
|
C
|
:
|
vairošanās būri (A un B), kuros notiek izlidošana, pārošanās un olu dēšana;
|
|
D
|
:
|
kristalizācijas trauki oliņu virteņu dēšanai;
|
|
E
|
:
|
mikroplates, katrai oliņu virtenei viens iedobums;
|
|
F
|
:
|
otrā paaudze – testēšanas trauki ar sedimentu-ūdens sistēmu, astoņi replikāti, 20 pirmās attīstības stadijas kāpuri uz katru trauku.
|
C.41. ZIVJU DZIMUMATTĪSTĪBAS TESTS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 234 (2011. gads). Tā balstīta uz 1998. gada lēmumu izstrādāt jaunas testēšanas metodes vai atjaunināt esošās potenciālo endokrīnās sistēmas traucējumu izraisītāju noteikšanai un testēšanai. Zivju dzimumattīstības tests (FSDT) ir atzīts par daudzsološu testēšanas metodi, kas aptver tās jutīgās zivju attīstības stadijas, kuras atbild uz estrogēniem un androgēniem līdzīgām ķīmiskajām vielām. No 2006. līdz 2010. gadam testēšanas metodei veikta starplaboratoriju salīdzinošā testēšana, kurā par derīgām atzītas: rīsa zivs jeb Japānas medaka (Oryzias latipes), zebrzivs (Danio rerio) un trīsadatu stagars (Gasterosteus aculeatus), bet biezpaura grundulis (Pimephales promelas) atzīts par daļēji derīgu (41)(42)(43). Šajā protokolā iekļauta Japānas medaka, trīsadatu stagars un zebrzivs. Protokols ir papildinājums ESAO TG 210 Zivju mazuļu toksicitātes testam (1), kur ekspozīcija tiek turpināta līdz zivju dzimumu diferenciācijai, t.i., aptuveni 60 dienas pēc izšķilšanās (dph) Japānas medakai, trīsadatu stagaram un zebrzivij (ekspozīcijas laiks var būt īsāks vai garāks citām sugām, kuru derīgums testam vēl tiks noskaidrots), un testa mērījumu beigupunktos ir iekļauti ar endokrīnās sistēmas jutīgumu saistīti parametri. FSDT novērtē varbūtēji endokrīnajai sistēmai nelabvēlīgu ķīmisku vielu (piem., estrogēnu, androgēnu un steroīdu ģenēzes inhibitoru) potenciāli nelabvēlīgu ietekmi uz agrīnajām attīstības stadijām un dzimumattīstību. Testējamās ķīmiskās vielas darbības veida parādīšanai tiek izmantota divu pamata endokrīno beigupunktu kombinācija – vitellogenīna (VTG) koncentrācija un fenotipiskā dzimumu attiecība. Saistībā ar fenotipiskā dzimuma attiecību maiņu populācijas mērogā, FSDT tests var tikt izmantots bīstamības un riska novērtēšanai. Ja tests tiek izmantots bīstamības vai riska novērtējumam, to nevajadzētu veikt ar stagaru, pagaidām pieejamie validācijas dati liecina, ka šai sugai ļoti reti mainās fenotipiskās dzimuma attiecības testējamās ķīmiskās vielas ietekmē.
|
|
2.
|
Testa procedūra balstīta uz to, ka ūdens vidē zivis pakļauj testējamās ķīmiskās vielas iedarbībai dzimumattīstībai labilā periodā, kurā ir sagaidāms, ka zivis būs visjūtīgākās uz tādām endokrīno sistēmu traucējošām ķīmiskām vielām, kas ietekmē dzimumattīstību. VTG koncentrācijas un dzimumu attiecības (dzimumu pārstāvju proporcijas) ir divi galvenie beigupunkti, kuri tiek mērīti kā indikatori ar endokrīno sistēmu saistītiem traucējumiem, un tos nosaka ar gonādu histoloģijas metodi. Gonādu histopatoloģija (oocītu un spermatoģenēzes šūnu novērtēšana un klasificēšana) ir ieteicama, bet nav obligāta. Ja iespējams, papildus tiek noteikts arī ģenētiskais dzimums (piem., Japānas medakai un trīsadatu stagaram). Ģenētisku dzimummarķieru esība ir nozīmīga priekšrocība, jo tā palielina dzimumu attiecības statistikas ietekmi un padara iespējamu individuālas fenotipiskā dzimuma apvērses detektēšanu. Citi apikālie beigupunkti ir izšķilšanās ātrums, izdzīvotība, ķermeņa garums un svars. Testēšanas metode var tikt pielāgota citām sugām, kuras nav iepriekš minētas, ja: tām tiek veikta validācija līdzīga tai, kas veikta ar Japānas medaku, trīsadatu stagaru un zebrzivi; ja kontrolgrupas zivju dzimums tiek noteikts testa beigās; ja VTG līmenis ir pietiekami augsts, lai varētu konstatēt būtiskas ar ķīmisko vielu saistītas atšķirības; ja testēšanas sistēmas jutība tiek nodrošināta izmantojot endokrīni aktīvas ķīmiskās standartvielas (estrogēnus, antiestrogēnus, androgēnus, antiandrogēnus, aromatāzes inhibitorus u. c.). Jebkādi validācijas ziņojumi, kuros tiek aprakstīti FSDT dati, izmantojot citas sugas, ir jāpārskata ESAO, un jāizvērtē, vai validācijas rezultāti ir uzskatāmi par pietiekamiem.
|
Sākotnējie apsvērumi un ierobežojumi
|
3.
|
VTG parasti tiek ražots oldējēju mugurkaulnieku mātīšu aknās, un tā ir atbildes reakcija uz cirkulējošo endogēno estrogēnu (2). Tas ir olu dzeltenumu proteīnu veidošanās priekšnoteikums; kad tas ir saražots aknās, tas ar asins plūsmu nokļūst olnīcās, kur tiek uzņemts un, ikriem attīstoties, modificēts. Zivju mazuļiem un pieaugušiem zivju tēviņiem VTG sintēze ir ļoti neliela, jo tiem nav pietiekamā daudzumā cirkulējoša estrogēna, taču konstatējama. Tomēr aknas spēj sintezēt un veikt VTG sekrēciju arī eksogēnas estrogēnu stimulācijas gadījumā (3)(4)(5).
|
|
4.
|
VTG mērījumi ļauj detektēt ķīmiskās vielas ar estrogēnu, antiestrogēnu, androgēnu iedarbību, kā arī ķīmiskās vielas, kas traucē steroīdu ģenēzi, piem., aromatāzes inhibitorus. Estrogēno ķīmisko vielu detektēšana ir iespējama, mērot VTG indukciju zivju tēviņiem, un tā ir plaši aprakstīta zinātniskajā recenzētajā literatūrā. Ir pierādīts, ka VTG indukcija notiek arī pēc ekspozīcijas aromatizējamiem androgēniem (6)(7). Cirkulējošo estrogēnu līmeņa samazinājums mātītēm, piem., inhibējot aromatāzes, kas pārvērš endogēno androgēnu par dabisko estrogēnu 17β-estadiolu, izraisa VTG koncentrācijas samazinājumu; tas savukārt tiek izmantots, lai noteiktu ķīmiskās vielas, kurām ir aromatāzes inhibējošas īpašības, jeb vispārinot, kuras ir steroīdu ģenēzes inhibitori (33). VTG atbildes reakcijas bioloģiskais būtiskums pēc estrogēnās/aromatāzes inhibēšanas ir konstatēts un plaši dokumentēts (8)(9). Tomēr iespējams, ka VTG ražošanu mātītēm ietekmē arī vispārīgais toksiskums un neendokrīnas toksiskas darbības veidi.
|
|
5.
|
Ir veiksmīgi izstrādātas un standartizētas vairākas mērījumu metodes rutinētai lietošanai, lai kvantificētu VTG asinīs, aknās, visa ķermeņa vai galvas/astes homogenizētos paraugos, kas ievākti no individuālām zivīm. Tas attiecas uz zebrzivi, trīsadatu stagaru un Japānas medaku, kā arī uz daļēji validēto sugu biezpaura grunduli; tām ir pieejamas sugai specifiskas imūnfermentatīvās analīzes (ELISA) testēšanas metodes, kurās VTG kvantifikācijai izmanto imunoķīmiju (5)(10)(11)(12)(13)(14)(15)(16). Japānas medakai un zebrzivij ir laba korelācija starp VTG mērījumiem asins plazmā, aknās un homogenizētos paraugos, kaut gan homogenizētajos paraugos parasti ir nedaudz zemāki VTG rezultāti nekā asins plazmā (17)(18)(19). 5. papildinājumā aprakstītas VTG analīzēm nepieciešamo paraugu ņemšanas procedūras.
|
|
6.
|
Izmaiņas fenotipiskajā dzimumu attiecībā (dzimumu proporcijā) ir beigupunkts, kas atspoguļo dzimumu apvērsi. Principā estrogēni, antiestrogēni, androgēni, antiandrogēni un steroīdģenēzi inhibējošās ķīmiskās vielas var ietekmēt attīstošos zivju dzimumu attiecību (20). Konstatēts, ka dzimumu apvērse pēc ekspozīcijas estrogēniem līdzīgām ķīmiskām vielām ir daļēji atgriezeniska zebrzivij (21), turpretī dzimumu apvērse pēc ekspozīcijas androgēniem līdzīgām ķīmiskām vielām ir neatgriezeniska (30). Dzimumi tiek definēti kā tēviņš, mātīte, starpdzimums (gonādā gan oocīti, gan spermatoģenēzes šūnas) un nediferencēts dzimums, noteikts individuālai zivij gonādu histoloģiskajā pārbaudē. Norādījumi ir sniegti 7. papildinājumā un ESAO Norādījumu dokumentā Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22).
|
|
7.
|
Ģenētiskais dzimums tiek noteikts, izmantojot ģenētiskos marķierus, ja konkrētajai sugai tādi ir. Japānas medakai mātīšu XX vai tēviņu XY hromosomas var noteikt, izmantojot polimerāzes ķēdes reakciju (PCR), vai arī analizēt ar Y hromosomu saistītā DM domēna gēnu (DMY) (DMY ir vai nav), kā aprakstīts (23)(24). Trīsadatu stagaram ir PCR ekvivalenta metode ģenētiskā dzimuma noteikšanai, un tā aprakstīta 10. papildinājumā. Gadījumos, kad ģenētiskais dzimums var tikt individuāli saistīts ar fenotipisko dzimumu, testa jauda tiek uzlabota, un tādēļ ģenētiskais dzimums jānosaka sugām ar labi aprakstītiem ģenētiskajiem dzimuma marķieriem.
|
|
8.
|
Divi galvenie beigupunkti – VTG un dzimumu attiecība – kombinācijā var parādīt ķīmiskās vielas endokrīno darbības veidu (MOA) (1. tabula). Dzimumu attiecība ir ar populāciju saistāms biomarķieris (25)(26), un dažiem labi definētiem darbības veidiem FSDT rezultātus var izmantot bīstamības un riska novērtēšanai, ja pārraugošā aģentūra tos uzskata par piemērotiem. Pašlaik šie darbības veidi ir estrogēni, androgēni un steroīdģenēzes inhibitori.
1. tabula
Endokrīno beigupunktu reakcija uz ķīmisko vielu dažādiem darbības veidiem:
↑= pieaug, ↓= samazinās, — = nav pētīts.
|
MOA
|
VTG ♂
|
VTG ♀
|
Dzimumu attiecība
|
Atsauces
|
|
Vājš estrogēnu agonists
|
↑
|
↑
|
↑♀ vai ↑nediferencēts
|
(27) (40)
|
|
Spēcīgs estrogēnu agonists
|
↑
|
↑
|
↑♀ vai ↑nediferencēts, nav ♂
|
(28) (40)
|
|
Estrogēnu antagonists
|
—
|
—
|
↓♀, ↑nediferencēts
|
(29)
|
|
Androgēnu agonists
|
↓ vai —
|
↓ vai —
|
↑ ♂, nav ♀
|
(28) (30)
|
|
Androgēnu antagonists
|
—
|
—
|
↑♀,
↑starpdzimumu
|
(31)
|
|
Aromatāzes inhibitors
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
FSDT neietver zivs reproduktīvās dzīves posmu, tādēļ ķīmiskās vielas, kuras zemākās koncentrācijās potenciāli varētu ietekmēt vairošanos un pēc tam dzimumattīstību, jāpārbauda testā, kas ietver vairošanos.
|
|
10.
|
Šajā testēšanas metodē izmantotās definīcijas sniegtas 1. papildinājumā.
|
|
11.
|
In vivo FSDT ir paredzēts, lai noteiktu ķīmiskas vielas ar androgēnām un estrogēnām īpašībām, kā arī antiandrogēnus, antiestrogēnus un steroīdu ģenēzi inhibējošām īpašībām. FSDT validācijas stadijas (1 un 2) neietver estrogēnās, androgēnās un steroīdu ģenēzi inhibējošās ķīmiskās vielas. Estrogēnu antagonistu un androgēnu antagonistu izpausmes FSDT testā ir redzamas 1. tabulā; MOA pagaidām ir mazāk dokumentēti.
|
TESTA PRINCIPS
|
12.
|
Testā zivis eksponē vismaz trijām ūdenī izšķīdinātas testējamās ķīmiskās vielas koncentrācijām, laikposmā no nupat apaugļotiem ikriem līdz dzimuma diferenciācijas beigām. Tests notiek caurplūdes apstākļos, izņemot gadījumus, kad tas nav iespējams testējamās ķīmiskās vielas pieejamības vai īpašību (piem., slikta šķīdība) dēļ. Tests sākas ar nupat apaugļotu ikru (pirms blastulas izveidošanās) ievietošanu testa kamerās. Kameru noslogojums katrai sugai ir aprakstīts 27. punktā. Validētajām zivju sugām – Japānas medakai, trīsadatu stagaram un zebrzivij – testu beidz 60 dienas pēc izšķilšanās. Pēc testa beigām zivis tiek humāni eitanazētas. Bioloģiskie paraugi (asins plazma, aknas vai galvas/astes homogenizēts paraugs) VTG analīzēm tiek ievākti no katras zivs; atlikusī daļa tiek paredzēta gonādu histoloģiskam novērtējumam, lai noteiktu fenotipisko dzimumu; pēc izvēles var tikt veikta histopatoloģija (piem., gonādu attīstības stadijas, starpdzimumu izteiktība). Sugām, kurām raksturīgi attiecīgi marķieri, ģenētiskā dzimuma noteikšanai tiek ievākts bioloģiskais paraugs (anālā vai muguras spura) (9. un 10. papildinājums).
|
|
13.
|
Validētajām sugām – Japānas medakai, trīsadatu stagaram un zebrzivij – piemērotie testēšanas apstākļi aprakstīti 2. papildinājumā.
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
14.
|
Jābūt pieejamiem rezultātiem no akūtās toksicitātes testiem vai citiem īstermiņa toksicitātes testiem [piem., testēšanas metode C.14 (34) un ESAO 210 (1)], kas, vēlams, ir veikti ar testam izvēlēto sugu. Tas nozīmē, ka jābūt zināmai testējamās vielas šķīdībai ūdenī un tvaika spiedienam un jābūt pieejamai uzticamai analītiskajai metodei, ar kuru noteikt ķīmiskās vielas daudzumu testa kamerās, ar zināmu un aprakstītu precizitāti un detektēšanas robežu.
|
|
15.
|
Cita noderīga informācija ir struktūras formula, ķīmiskās vielas tīrība, stabilitāte ūdenī un gaismā, pKa, Pow un tūlītējas bionoārdāmības testa rezultāti (testēšanas metode C.4) (35).
|
Testa pieņemamības kritēriji
|
16.
|
Lai testa rezultāti tiktu atzīti par pieņemamiem, tiem piemēro šādus nosacījumus:
|
—
|
izšķīdušā skābekļa koncentrācijai jābūt vismaz 60 % no gaisa piesātinājuma vērtības (ASV) visa testa laikā;
|
|
—
|
ūdens temperatūra testa kamerās visā ekspozīcijas periodā nedrīkst atšķirties vairāk kā par ± 1,5 °C, un tā jāuztur testējamajai sugai norādītajā temperatūras diapazonā (2. papildinājums);
|
|
—
|
ir jābūt pieejamai validētai testējamās ķīmiskās vielas analīzes metodei ar detektēšanas robežu stipri zem zemākās nominālās koncentrācijas, un ir jāsavāc pierādījumi, ka testējamās ķīmiskās vielas koncentrācijas šķīdumos ir apmierinoši uzturētas vidējo mērīto vērtību ± 20 % robežās;
|
|
—
|
apaugļoto ikru kopējā izdzīvotība kontrolgrupā un, vajadzības gadījumā, šķīdinātāja kontrolgrupā ir lielāka vai vienāda ar 2. papildinājumā definētajiem robežlielumiem;
|
|
—
|
pieņemamības kritēriji, kas testa beigās saistīti ar augšanu un dzimumu attiecību, ir balstīti uz datiem no kontrolgrupām (apvienotas šķīdinātāja un ūdens kontrolgrupas, izņemot gadījumus, kad tās būtiski atšķiras; tad tikai šķīdinātāja kontrolgrupa):
|
|
Japānas medaka
|
Zebrzivs
|
Trīsadatu stagars
|
|
Augšana
|
Zivs mitrais svars pēc nosusināšanas
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Garums (standarta garums)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Dzimumu attiecība (% tēviņi vai mātes)
|
30–70 %
|
30–70 %
|
30–70 %
|
|
|
—
|
Ja izmanto šķīdinātāju, tam nevajadzētu statistiski būtiski ietekmēt izdzīvotību un tas nedrīkstētu izraisīt jebkādus endokrīnās sistēmas traucējumus vai citu šķīdinātāja kontrolē konstatētu nelabvēlīgu ietekmi uz zivju mazuļiem.
|
Ja novēro novirzes no testa pieņemamības kritērijiem, jāapsver saistība ar testa datu uzticamību un šie apsvērumi ir jāiekļauj testēšanas pārskatā.
|
TESTA METODES APRAKSTS
Testa kameras
|
17.
|
Var lietot jebkuru stikla, nerūsējošā tērauda vai citas ķīmiski inertas vielas kameru. Kameras izmēriem jābūt pietiekami lieliem, lai atbilstu tālāk aprakstītajiem noslogojuma rādītājiem. Vēlams, lai testa kameras būtu brīvi izvietotas testēšanas vietā. Pēc nejaušības principa izvietotu katras koncentrācijas grupu izkārtojums ir vēlamāks nekā izkārtojums pilnībā pēc nejaušības principa. Testa kameras jāaizsargā no nevēlamiem traucējumiem.
|
Sugu izvēle
|
18.
|
Ieteicamās zivju sugas ir uzskaitītas 2. papildinājumā. Jaunu sugu iekļaušanas pasākumi ir aprakstīti 2. punktā.
|
Vecākzivju turēšana
|
19.
|
Detalizēti ieteikumi vecākzivju turēšanai atrodami ESAO TG 210 (1). Vecākzivis ir jābaro vienu vai divas reizes dienā ar piemērotu barību.
|
Darbības ar embrijiem un kāpuriem
|
20.
|
Sākumā embrijus un kāpurus var eksponēt galvenajā kamerā, ievietotus mazākās stikla vai nerūsējošā tērauda kamerās, kas sānos vai galos aprīkotas ar sietu, kurš ļauj testējamajai vielai plūst cauri kamerai. Lai nodrošinātu cauri šīm mazajām kamerām plūstošu straumi, kas nav turbulenta, kameras var iekarināt statīvā, kuru kustina uz augšu un leju tā, lai dzīvnieki vienmēr atrastos zem ūdens.
|
|
21.
|
Kad ikru konteineri, režģi un sieti jau ir izmantoti, lai noturētu ikrus galvenajā testa kamerā, pēc kāpuru izšķilšanās šie šķēršļi ir jānoņem, atstājot vienīgi sietus, kas nepieciešami, lai novērstu zivju izbēgšanu. Ja nepieciešams pārvietot kāpurus, tie nedrīkst saskarties ar gaisu, un zivju izņemšanai no ikru konteineriem nevajadzētu lietot tīkliņus. Pārvietošanas laiks ir atkarīgs no sugas, un pārvietošana nav vienmēr nepieciešama.
|
Ūdens
|
22.
|
Par testēšanas ūdeni var izmantot jebkuru ūdeni, kurā kontrolgrupas izdzīvotība ir vismaz tik augsta, kā 3. papildinājumā aprakstītajā ūdenī. Visā testa laikā ūdens kvalitātei jāsaglabājas nemainīgai. Lai nodrošinātu, ka atšķaidīšanas ūdens nevajadzīgi neietekmē testa rezultātus (piem., reaģējot ar testējamo ķīmisko vielu) vai negatīvi neietekmē vaislas zivis, noteiktos intervālos ir jāņem analizējami paraugi. Ja ir zināms, ka atšķaidīšanas ūdens kvalitāte bijusi relatīvi konstanta, kopējais organiskais ogleklis, vadītspēja, pH un suspendētās cietās daļiņas jānosaka, piem., reizi trijos mēnešos. Ja ir šaubas par ūdens kvalitāti, ir jāveic smago metālu (piem., Cu, Pb, Zn, Hg, Cd, Ni), galveno anjonu un katjonu (piem., Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) un pesticīdu analīzes. Sīkāka informācija par ķīmiskajām analīzēm un ūdens ņemšanu sniegta 34. punktā.
|
Testēšanas šķīdumi
|
23.
|
Ja vien tas praktiski iespējams, jāizmanto caurplūdes sistēma. Šādā gadījumā ir vajadzīga sistēma, kas nepārtraukti piegādā un atšķaida testējamās vielas izejšķīdumu (piem., dozējošais sūknis, proporcionālais atšķaidītājs, piesātināšanas sistēma), lai testa kamerām piegādātu nepieciešamo koncentrāciju virkni. Testa laikā noteiktos intervālos ir jāpārbauda izejšķīdumu un atšķaidīšanas ūdens plūsmas ātrumi, testa laikā tie nedrīkst mainīties vairāk nekā par 10 %. Par piemērotu ir atzīts plūsmas ātrums, kas vienāds vismaz ar piecu testa kameru tilpumiem 24 stundās (1). Jācenšas izvairīties no plastmasas caurulēm un citiem materiāliem, kuri var saturēt bioloģiski aktīvas ķīmiskas vielas vai var adsorbēt testējamo ķīmisko vielu.
|
|
24.
|
Izejšķīdumu vēlams sagatavot bez šķīdinātāju izmantošanas, vienkārši maisot vai kratot testējamo vielu atšķaidīšanas ūdenī, izmantojot mehāniskus palīglīdzekļus (piem., maisīšanu vai ultraskaņu). Ja testējamo ķīmisko vielu ir grūti izšķīdināt ūdenī, jāizmanto ESAO Norādījumu dokumentā par sarežģītu vielu un maisījumu toksicitātes ūdens vidē testēšanu (36) aprakstītās procedūras. Ir jāizvairās no šķīdinātāju izmantošanas, tomēr tie var būt nepieciešami atsevišķos gadījumos, lai pagatavotu vajadzīgās koncentrācijas izejšķīdumu. Piemērotu šķīdinātāju piemēri doti atsaucē (36).
|
|
25.
|
Būtu jāizvairās no pusstatiskiem testa apstākļiem, izņemot gadījumus, kad sniegts pārliecinošs pamatojums, kas saistīts ar testējamo ķīmisko vielu (piem., stabilitāte, ierobežota pieejamība, augsta cena vai bīstamība). Pusstatiskajai sistēmai var izmantot divas atšķirīgas ūdens nomaiņas procedūras. Vai nu tīrās kamerās pagatavo jaunus testējamās vielas šķīdumus un izdzīvojušos ikrus un kāpurus uzmanīgi pārceļ uz jaunajām kamerām, vai arī testa dzīvnieki paliek testēšanas kamerās, kamēr katru dienu tiek nomainīta daļa testēšanas ūdens (vismaz divas trešdaļas).
|
PROCEDŪRA
Ekspozīcijas apstākļi
Ikru vākšana un tās ilgums
|
26.
|
Lai izvairītos no neobjektivitātes ģenētisku iemeslu dēļ, ikri tiek vākti no vismaz trim vaislas pāriem vai grupām, tie tiek sajaukti un testam izvēlēti pēc nejaušības principa. Trīsadatu stagara mākslīgās apaugļošanas apraksts atrodams 11. papildinājumā. Tests jāsāk iespējami agri pēc ikru apaugļošanas – embrijus vēlams ielikt testēšanas šķīdumā pirms blastulu dalīšanās sākuma vai pēc iespējas drīzāk pēc šīs stadijas sākuma, bet ne vēlāk kā 12 stundas pēc apaugļošanas. Tests turpinās tik ilgi, kamēr kontrolgrupā ir beigusies dzimumdiferenciācija (60 dienas pēc izšķilšanās Japānas medakai, trīsadatu stagaram un zebrzivij).
|
Noslogojums
|
27.
|
Testa sākumā jābūt vismaz 120 apaugļotiem ikriem uz katru koncentrāciju, tie jāsadala uz vismaz 4 replikātiem (pieļaujama kvadrātsaknes sadale kontrolgrupā). Apstrādēm paredzētie ikri jāsadala pēc nejaušības principa (izmantojot randomizācijas statistikas tabulas). Noslogojumam (definīciju sk. 1. papildinājumā) jābūt pietiekami zemam, lai bez kameru tiešas aerācijas varētu uzturēt izšķīdušā skābekļa koncentrāciju vismaz 60 % ASV līmenī. Caurplūdes apstākļos notiekošiem testiem ieteikts noslogojums, kas nepārsniedz 0,5 g/l 24 stundās, un nepārsniedz 5 g/l jebkurā laikā. Ne vēlāk kā 28 dienas pēc apaugļošanas zivis ir jāsadala starp replikātiem tā, lai visos replikātos ir tik vienāds zivju skaits, cik vien iespējams. Ja ekspozīcijas dēļ vērojama mirstība, replikātu skaits ir jāsamazina tā, lai zivju skaits starp apstrādes līmeņiem tiktu uzturēts iespējami vienāds.
|
Gaisma un temperatūra
|
28.
|
Fotoperioda ilgumam un ūdens temperatūrām jābūt piemērotām testā izmantotajām sugām (FSDT eksperimenta apstākļus sk. 2. papildinājumā).
|
Barošana
|
29.
|
Barība un barošana ir ļoti nozīmīga, un svarīgi, lai katras stadijas dzīvnieki tiek baroti atbilstošos laika intervālos un normālai augšanai nepieciešamajos daudzumos. Barošanai vajadzētu būt ad libitum, vienlaikus izvairoties no pārpalikumiem. Lai panāktu pietiekamu augšanas ātrumu, zivis jābaro vismaz divreiz dienā (pieļaujama barošana vienreiz dienā nedēļas nogalēs), un starp ēdināšanas reizēm jābūt vismaz trīs stundu intervālam. Lai novērstu atkritumu uzkrāšanos, nepieciešamības gadījumā ir jānovāc liekā barība un fekālijas. Balstoties uz pieredzi barība un barošanas režīms ir pastāvīgi jāprecizē, lai uzlabotu izdzīvotību un optimizētu augšanu. Jādara viss iespējamais, lai plānoto režīmu saskaņotu ar atzītiem ekspertiem. Barošana jāpārtrauc 24 stundas pirms testa beigām. Atbilstošu barību piemēri ir uzskaitīti 2. papildinājumā (sk. arī ESAO Zivju testēšanas pamatnostādnes (39)).
|
Testa koncentrācijas
|
30.
|
Intervāli starp testējamās ķīmiskās vielas koncentrācijām ir aprakstīti 4. papildinājumā. Minimums ir trīs testa koncentrācijas ar vismaz četriem replikātiem. Izvēloties testa koncentrāciju diapazonu, jāņem vērā akūtās toksicitātes pētījumos iegūtā līkne, kas attēlo LC50
atkarību no ekspozīcijas laika. Ja rezultātus plānots izmantot riska novērtēšanai, ieteicams izmantot piecas testa koncentrācijas.
|
|
31.
|
Ķīmiskās vielas koncentrācijām, kas augstākas par 10 % no akūtajām pieaugušo dzīvnieku LC50
vai 10 mg/l – mazākais lielums no šiem abiem nav jātestē. Maksimālā testa koncentrācija ir 10 % no LC50
kāpuru/mazuļu periodā.
|
Kontrolgrupas
|
32.
|
Papildus testa koncentrācijām ir jātestē arī atšķaidīšanas ūdens kontrolgrupa (≥ 4 replikāti) un, ja tiek lietots šķīdinātājs, arī šķīdinātāja kontrolgrupa (≥ 4 replikāti). Testā var tikt izmantoti tikai tādi šķīdinātāji, par kuriem ir noskaidrots, ka tiem nav nekādas būtiskas ietekmes uz testa beigupunktiem.
|
|
33.
|
Ja tiek izmantots šķīdinātājs, tā gala koncentrācija nedrīkstētu būt augstāka par 0,1 ml/l (36) un tā koncentrācijai jābūt vienādai visās testa kamerās, izņemot atšķaidīšanas ūdens kontrolgrupu. Tomēr jāpieliek visas pūles, lai izvairītos no šķīdinātāju izmantošanas vai samazinātu šķīdinātāju koncentrācijas līdz minimālajām.
|
Analītiskās noteikšanas un mērījumu biežums
|
34.
|
Testējamās ķīmiskās vielas koncentrācijas ķīmiskā analīze ir jāveic pirms testa sākuma, lai pārbaudītu atbilstību pieņemamības kritērijiem. Visi replikāti jāanalizē individuāli testa sākumā un testa beigās. Uz katru testa koncentrāciju viens replikāts ir jāanalizē vismaz reizi nedēļā testa laikā, sistemātiski mainot analizējamos replikātus (1,2,3,4,1,2…). Ja paraugi tiek saglabāti vēlākai analīzei, paraugu uzglabāšanas metodēm jābūt iepriekš validētām. Paraugus nepieciešams filtrēt (piem., izmantojot poru lielumu 0,45 μm) vai centrifugēt, lai nodrošinātu, ka analīze tiek veikta ar ķīmiski tīru šķīdumu.
|
|
35.
|
Testa laikā visās testa kamerās ir jāmēra izšķīdušais skābeklis, pH, kopējā cietība, sāļums (ja attiecināms) un temperatūra. Minimālajā variantā izšķīdušais skābeklis, sāļums (ja attiecināms) un temperatūra ir jānosaka reizi nedēļā, pH, vadītspēja un cietība jānosaka testa sākumā un beigās. Vēlams, lai vismaz vienā testa kamerā tiktu nepārtraukti novērota temperatūra.
|
|
36.
|
Rezultāti jābalsta uz izmērītajām koncentrācijām. Taču, ja visā testa laikā testējamās koncentrācijas ir apmierinoši uzturētas ± 20 % robežās no nominālās koncentrācijas, tad rezultātus var balstīt vai nu uz nominālajām, vai arī uz izmērītajām vērtībām.
|
Novērojumi un mērījumi
Embrionālās attīstības stadija
|
37.
|
Ekspozīcija jāuzsāk iespējami ātri pēc apaugļošanas un pirms blastulu dalīšanās sākuma, ne vairāk kā 12 stundas pēc apaugļošanas, lai nodrošinātu ekspozīciju agrīnās embrionālās attīstības laikā.
|
Izšķilšanās un izdzīvotība
|
38.
|
Novērojumi par izšķilšanos un izdzīvotību jāizdara vismaz reizi dienā, skaits jāprotokolē. Miruši embriji, kāpuri un zivju mazuļi ir jāaizvāc pēc iespējas ātrāk, jo tie var ātri noārdīties vai tikt sadalīti citu zivju darbību rezultātā. Izvācot mirušos dzīvniekus, ir īpaši jāuzmanās, lai netraumētu vai fiziski nebojātu apkārtējos ikrus vai kāpurus, jo tie ir ārkārtīgi maigi un jutīgi. Nāves kritēriji atšķiras atkarībā no dzīves posma:
|
—
|
ikriem: it īpaši agrīnajās attīstības stadijās vērojams nozīmīgs gaismas caurlaidības zudums un krāsas maiņa, ko izraisa olbaltumvielu koagulācija un/vai izgulsnēšanās, izraisot baltu necaurspīdīgu izskatu;
|
|
—
|
kāpuriem un zivju mazuļiem novēro vienu vai vairākas no šādām pazīmēm: nekustīgums un/vai elpošanas kustību trūkums un/vai sirdspukstu trūkums, un/vai centrālās nervu sistēmas necaurspīdīgi balta krāsa, nav reakcijas uz mehāniskiem kairinājumiem.
|
|
Izskata anomālijas
|
39.
|
Ir jāreģistrē kāpuru vai zivju skaits ar anomālu ķermeņa formu, anomālijas izskats un tās raksturs ir jāapraksta. Jāatzīmē, ka arī dabiski ir sastopami anomāli embriji un kāpuri, dažām sugām tie kontrolgrupā(-s) var būt vairāki procenti. Anomālie dzīvnieki jāizņem no testa kamerām tikai nāves gadījumā. Tomēr saskaņā ar Eiropas Parlamenta un Padomes 2010. gada 22. septembra Direktīvu 2010/63/ES par zinātniskiem mērķiem izmantojamo dzīvnieku aizsardzību, ja anomālijas izraisa sāpes, ciešanas un diskomfortu vai ilgstošu kaitējumu, un ir droši prognozējama nāve, dzīvnieki ir anestezējami un eitanazējami atbilstoši 44. punktā sniegtajam aprakstam, un datu analīzē apstrādājami kā miruši.
|
Uzvedības anomālijas
|
40.
|
Tādas anomālijas kā, piem., hiperventilācija, nekoordinēta peldēšana, netipisks miers un netipiska barošanās uzvedība, ir jānovēro un jāprotokolē.
|
Svars
|
41.
|
Testa beigās visas izdzīvojušās zivis tiek eitanazētas (anestezētas, ja vajadzīgi asins paraugi), un ir jānosaka to individuālais mitrais svars (pēc nosusināšanas).
|
Garums
|
42.
|
Testa beigās izmēra individuālu dzīvnieku garumu (standarta garums).
|
|
43.
|
Šo novērojumu rezultātā tiks iegūti daži vai visi gala ziņojumam nepieciešamie dati:
|
—
|
veselo zivju skaits testa beigās;
|
|
—
|
šķilšanās sākuma un beigu laiks;
|
|
—
|
izdzīvojušo dzīvnieku garums un svars;
|
|
—
|
deformēto kāpuru skaits;
|
|
—
|
zivju skaits ar redzamām darbības anomālijām.
|
|
Zivju ņemšana paraugiem
|
44.
|
Zivju ņemšana paraugiem tiek veikta testa beigās. Ievāktās zivis tiek eitanazētas, piem., ar MS-222 (100-500 mg uz l, buferēts ar 200 mg NaHCO3 uz l) vai FA-100 (4-alili-2-metoksilfenols: eigenols), pēc tam individuāli nomērītas, un tiek noteikts to mitrais svars (pēc nosusināšanas) vai arī anestezētas, ja nepieciešami asins paraugi (sk. 49. punktu).
|
Paraugu ņemšana VTG analīzēm un dzimuma noteikšana ar histoloģisko vērtēšanu
|
45.
|
Visas zivis ir jāņem paraugiem un jāsagatavo dzimuma un VTG analīzei. Dzimuma noteikšanai visas zivis histoloģiski analizē. VTG noteikšanai var ievākt mazākas paraugu apakšgrupas, no katra replikāta ņemot 16 zivis. Tomēr, ja paraugu grupu VTG analīžu rezultāti izrādās neskaidri, ir jāanalizē lielāks zivju skaits.
|
|
46.
|
Paraugu ņemšanas procedūra VTG analīzēm un dzimuma noteikšanai ir atkarīga no VTG analīzes metodes.
|
Galvas/astes homogenizētā materiāla metode VTG analīzēm
|
47.
|
Zivi eitanazē. Katrai zivij no ķermeņa atdala galvu un asti, ar skalpeli izdarot griezienu tieši aiz krūšu spuras un tieši aiz muguras spuras (sk. 1. attēlu). Galvas un astes daļas no katras zivs tiek savāktas, nosvērtas un individuāli sanumurētas, sasaldētas šķidrā slāpeklī un uzglabātas VTG analīzēm -70 °C vai zemākā temperatūrā. Katras zivs ķermeņa paraugi tiek sanumurēti un fiksēti piemērotā fiksējošā vielā histoloģiskajai pārbaudei (22). Ar šīs metodes palīdzību VTG un histopatoloģija tiek veikta katrai zivij atsevišķi, un tādējādi VTG līmeņa iespējamās maiņas var tikt saistītas ar zivs fenotipisko dzimumu un ģenētisko dzimumu (Japānas medakai un trīsadatu stagaram). Sīkāku informāciju skatīt homogenizēšanas norādījumos (5. papildinājums) un VTG kvantitatīvas noteikšanas norādījumos (6. papildinājums).
|
Aknu homogenizētā materiāla metode VTG analīzei
|
48.
|
Zivi eitanazē. Aknas izpreparē un uzglabā -70 °C vai zemākā temperatūrā. Aknu izņemšanai ieteicamās procedūras un priekšapstrāde aplūkotas ESAO TG 229 (37) vai šā pielikuma C.37. nodaļā. Pēc tam aknas individuāli homogenizē saskaņā ar ESAO TG 229 vai šā pielikuma C.37. nodaļu. Iegūto centrifugātu lieto VTG analīzei ar homologo ELISA metodi (sk. 6. papildinājumu zebrzivs materiāla kvantitatīvai noteikšanai vai ESAO TG 229 (37) Japānas medakai). Izmantojot šo pieeju, ir iespējams iegūt datus gan par individuālu zivju VTG, gan gonādu histoloģiju.
|
Asins plazmas metode VTG analīzēm
|
49.
|
Anestezētām zivīm asinis var tikt ņemtas ar šādām metodēm: ar dūrienu sirdī, no astes vēnas vai iegriežot astē; plazmas iegūšanai asinis centrifugē 4 °C temperatūrā. Līdz lietošanai plazmu uzglabā -70 °C vai zemākā temperatūrā. Zivi eitanazē un fiksē histoloģiskajām analīzēm. Gan plazmas paraugi, gan zivis tiek atsevišķi numurētas, lai varētu saistīt VTG vērtības ar zivs dzimumu.
1. attēls
Zivs sagriešana galvas/astes homogenizētā materiāla iegūšanai, kas vajadzīgs VTG mērījumiem un vidusdaļas histoloģiskam novērtējumam

|
Ģenētiskā dzimumu noteikšana
|
50.
|
Sugām, kurām ir attiecīgi marķieri, no individuālām zivīm ņem paraugus ģenētiskā dzimuma noteikšanai. Japānas medakai tiek ņemta anālā vai muguras spura. Detalizēts apraksts ir sniegts 9. papildinājumā, tostarp audu ņemšana paraugiem un dzimuma noteikšana ar PCR metodi. Par trīsadatu stagara audu paraugu ievākšanu un dzimuma noteikšanu ar PCR metodi apraksts sniegts 10. papildinājumā.
|
VTG mērīšana
|
51.
|
VTG mērījumi ir jābalsta uz kvantitatīvi un analītiski validētu metodi. Jābūt pieejamai informācijai par konkrētajā laboratorijā lietotās metodes mainību viena testa robežās un starp vairākiem testiem. Mainības iemesls viena testa robežās un starp vairākiem testiem (visdrīzāk) ir saistāms ar zivju populācijas dažādām attīstības stadijām. Ņemot vērā VTG mērījuma mainību, uz minētā beigupunkta balstītie NOEC novērtējumi ir analizējami ar lielu rūpību. Šajā testā ir apskatītas dažādas pieejamās metodes VTG veidošanās noteikšanai zivju sugās. Mērījumu metode, kas ir gan relatīvi jutīga, gan specifiska, ir olbaltumvielu koncentrāciju noteikšana ar imūnfermentatīvās analīzes (ELISA) palīdzību. Jāizmanto homologās antivielas (izstrādātas pret dažu sugu VTG) un būtiski lietot homologos standartus.
|
Dzimuma noteikšana
|
52.
|
Histoloģiskajai dzimuma noteikšanai (pēc izvēles arī gonādas stadijas noteikšanai) veselas zivis vai katras zivs atlikušo vidusdaļu (atkarībā no VTG paraugu ievākšanas procedūras) novieto iepriekš marķētā kasetē un fiksē ar piemērotu fiksācijas vielu. Fiksācijas un ieguldīšanas norādījumi ir sniegti 7. papildinājumā, kā arī ESAO Norādījumu dokumentā par zivju gonādu endokrīnās histopatoloģijas diagnosticēšanu (22). Pēc apstrādes zivis tiek ieguldītas parafīna blokos. Zivis parafīna blokos liekamas gareniski. No katra īpatņa paņem vismaz sešus frontālas plaknes garengriezumus (3-5 μm biezus), kuros ietilpst gonādu audi. Intervālam starp griezumiem jābūt apmēram 50 μm tēviņiem un 250 μm mātītēm. Tā kā katrā blokā var būt kopā gan mātītes, gan tēviņi (ja katrā blokā ieguldīts vairāk nekā viens indivīds), intervālam starp griezumiem šādos blokos jābūt apmēram 50 μm, kamēr iegūti vismaz seši gonādu griezumi no katra tēviņa. Pēc tam intervālu starp griezumiem mātītēm var palielināt līdz 250 μm. Izgriezumi tiek krāsoti ar hematoksilīnu un eozīnu un aplūkoti gaismas mikroskopā, fokusējoties uz dzimumu (tēviņš, mātīte, starpdzimumu, nediferencēts). Starpdzimumu gadījumu definē kā situāciju, kad uz sešām analizētajām sekcijām ir vairāk nekā viens oocīts sēkliniekā vai spermatoģenēzes šūnas (jā/nē) olnīcās. Histopatoloģija un olnīcu un sēklinieku attīstības stadijas noteikšana nav obligāta, bet, ja tā veikta, tad rezultāti ir statistiski jāapstrādā un jāiekļauj testēšanas pārskatā. Jāatzīmē, ka dažām sugām var dabiski nebūt pilnīgi attīstīta gonādu pāra un var būt tikai viena gonāda (piem., Japānas medakai un dažkārt arī zebrzivij). Visi šādi novērojumi ir jāreģistrē.
|
|
53.
|
Ģenētiskā dzimuma noteikšana Japānas medakai balstās uz to, vai ir konstatējams medaku vīrišķo dzimumu noteicošais gēns GMY, kas atrodas Y hromosomā. Medaku genotipisko dzimumu var noteikt, sekvencējot DMY gēnu no DNS, kas ekstrahēts, piem., no anālās spuras vai muguras spuras gabala. DMY klātbūtne liecina par XY (tēviņu) neatkarīgi no fenotipa, un DMY trūkums liecina par XX (mātīti) neatkarīgi no fenotipa (23). Norādījumi audu sagatavošanā un PCR metodes izmantošanā sniegti 9. papildinājumā. Trīsadatu stagaru indivīdu ģenētiskais dzimums ir nosakāms arī ar PCR metodi, kas aprakstīta 10. papildinājumā.
|
|
54.
|
Starpdzimumu gadījumi (definīciju sk. 1. papildinājumā) jāiekļauj testēšanas pārskatā.
|
Sekundārās dzimumpazīmes
|
55.
|
Sekundārās dzimumpazīmes endokrīnās sistēmas ietekmē veidojas tādām sugām kā Japānas medakai; tādēļ zivju fiziskā izskata novērojumi pēc iespējas veicami ekspozīcijas beigās. Japānas medakai androgēnjutīgs ir papilārs veidojums anālās spuras aizmugurējā daļā. Šā pielikuma C.37. nodaļā (38) atrodamas tēviņu sekundāro dzimumpazīmju raksturojuma un androgenizētu mātīšu fotogrāfijas.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
56.
|
Svarīgi, lai beigupunktu nosaka ar pārliecinošāko derīgo statistisko testu. Eksperimenta vienība ir replikāts, bet atšķirības starp replikātiem ir jāiekļauj statistiskajās analīzēs. Lai palīdzētu izvēlēties piemērotāko statistiskās analīzes metodi atkarībā no testā iegūto datu pazīmēm, 8. papildinājumā ievietota lēmumu pieņemšanas diagramma. Statistiskais nozīmīguma līmenis visiem testā iekļautajiem beigupunktiem ir 0,05.
|
Dzimuma un ģenētiskā dzimuma attiecība
|
57.
|
Ja reakcija uz devu ir monotona, dzimumu attiecību analizē ar Džonkhīra-Terpstra testu (trenda testu), lai noteiktu ekspozīcijas būtisku ietekmi (NOEC/LOEC pieeja). Ja konstatē nemonotonitāti, jāizmanto pāru testēšana. Ja var panākt normalitāti un homogēnu dispersiju, izmanto Daneta testu. Ja konstatē heterogēnu dispersiju, izmanto Tamheina-Daneta testu. Pretējā gadījumā izmantot eksakto Manna-Vitnija testu ar Bonferoni-Holma korekciju. Diagramma, kas parāda dzimumu attiecības analizēšanas statistiskās metodes, ievietota 8. papildinājumā. Dzimumu proporcijas jānorāda tabulās kā koncentrāciju proporcijas ± SD (standartnovirze) tēviņiem, mātītēm, starpdzimumu un nediferencētiem īpatņiem. Jāuzsver statistiskais būtiskums. Piemēri apskatāmi FSDT 2. fāzes validācijas ziņojumā (42). Ģenētisko dzimumu jānorāda kā fenotipiskā dzimuma apvērses procentuālo daļu tēviņiem, mātītēm, starpdzimumu un nediferencētiem indivīdiem.
|
VTG koncentrācijas
|
58.
|
VTG koncentrācijas jāanalizē, lai noteiktu būtisku ekspozīcijas ietekmi (NOEC/LOEC pieeja). Daneta testam ir dodama priekšroka salīdzinājumā ar t-testu ar Bonferoni korekciju. Ja izmanto Bonferoni korekciju, priekšroka dodama Bonferoni-Holma korekcijai. Lai panāktu normalitāti un dispersijas homogenitāti, pieļaujama VTG log-transfomācija. Tomēr gadījumā, ja atbildes reakcija uz koncentrāciju un ir monotona, Džonkhīra-Terpstra tests ir ieteicamāks par visiem iepriekš minētajiem. Ja tiek lietots t-tests vai Daneta tests, nav nepieciešams lietot ANOVA nozīmīguma F-testu. Papildu informācija pieejama 8. papildinājuma diagrammā. Rezultāti jāapkopo tabulās, norādot tēviņu, mātīšu, starpdzimumu vai nediferencēto indivīdu koncentrāciju vidējos rezultātus ± SD. Jāizceļ statistiskais būtiskums fenotipiskajām mātītēm un fenotipiskajiem tēviņiem. Piemēri apskatāmi FSDT 2. fāzes validācijas pārskatā (42).
|
Testējamās ķīmiskās vielas faktiskās koncentrācijas
|
59.
|
Testējamās ķīmiskās vielas faktiskās koncentrācijas testa kamerās jāanalizē ar 34. punktā aprakstīto biežumu. Rezultāti jānorāda tabulās kā vidējās koncentrācijas ± SD no replikātiem, kā arī no koncentrācijām, norādot paraugu skaitu, kā arī norādot gadījumus, kad konstatētas novirzes par vairāk nekā ± 20 % no apstrādes vidējās koncentrācijas. Piemēri apskatāmi FSDT 2. fāzes validācijas ziņojumā (42).
|
Rezultātu interpretācija
|
60.
|
Testa rezultāti jāinterpretē ļoti uzmanīgi gadījumos, kad mērītās testējamās ķīmiskās vielas ir tuvu analītiskās metodes detektēšanas robežai.
|
Testēšanas pārskats
|
61.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā ķīmiskā viela
|
—
|
Attiecīgās fizikālķīmiskās īpašības; ķīmiskās identifikācijas dati, ieskaitot testējamās ķīmiskās vielas tīrību un kvantificēšanas analītisko metodi.
|
|
|
|
Testa apstākļi
|
—
|
Izmantotās testēšanas procedūras (piem., caurplūdes sistēmas/daļēji statiskas/sistēmas ar periodisku ūdens nomaiņu); testēšanas plāns, iekļaujot testa koncentrācijas, izejšķīduma sagatavošanas metodi (pielikumā), ūdens nomaiņas biežumu (ja izmantots, jāmin šķīdinātājs un tā koncentrācijas);
|
|
—
|
nominālās testa koncentrācijas, vidējās izmērītās vērtības un to standartnovirzes testa kamerās, metode, ar kādu noskaidrotas šīs koncentrācijas (izmantotās analītiskās metodes jānorāda pielikumā); apliecinājums, ka mērījumi attiecas uz testējamās vielas koncentrācijām homogēnā šķīdumā;
|
|
—
|
ūdens kvalitāte testa kamerās: pH, cietība, temperatūra un izšķīdušā skābekļa koncentrācija;
|
|
—
|
detalizēta informācija par barošanu (barības veids(-i), avots, barošanas daudzums un biežums), kā arī piesārņojums (piem., PCB, PAH, organiskie pesticīdi), ja attiecināms.
|
|
|
|
Rezultāti
|
—
|
Pierādījumi, ka kontrolgrupas atbilst derīguma kritērijiem: dati par izšķilšanās rādītāju jānorāda tabulās kā procentuālā daļa uz replikātu un uz koncentrāciju. Jāizceļ vērtības ārpus pieņemamības kritēriju robežām (kontrolgrupās). Izdzīvotība ir jānorāda procentuāli uz replikātu un uz koncentrāciju. Jāizceļ vērtības ārpus pieņemamības kritēriju robežām (kontrolgrupās);
|
|
—
|
skaidri jānorāda rezultāti, kas iegūti dažādo beigupunktu novērojumos: embriju izdzīvotība un šķilšanās; ārējās anomālijas; garums un svars; VTG mērījumi (ng/g homogenāta; ng/g plazmas vai ng/g aknu); gonādu histoloģija, dzimumu attiecība, ģenētiskā dzimuma dati; informācija par jebkādu neparastu zivju uzvedību un jebkādas testējamās ķīmiskās vielas izraisītas redzamas izpausmes.
|
|
|
|
62.
|
Rezultāti ir jāattēlo kā vidējās vērtības ± standartnovirze (SD) vai standartkļūda (SE). Statistikas dati jāparāda kā minimālās NOEC un LOEC koncentrācijas un ticamības intervāli. Izmanto statistikas metožu diagrammu (8. papildinājums).
|
LITERATŪRA
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen, and J.P. Sumpter, 1996, “Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals”, Environmental Toxicology and Chemistry 15, pp. 194-202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, “Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment”, Environmental Health Perspectives 103, pp. 173-178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix, and H. Trip (1999), “An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin”, Environmental Toxicology and Chemistry 18, pp. 337-347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen, and P. Bjerregaard (2001a), “Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119-131.
|
|
(6)
|
Andersen, L., P. Bjerregaard, and B. Korsgaard ( 2003), “Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters”, Fish Physiology and Biochemistry 28, pp. 319-321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren, and G.I. Petersen (2003), “Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone”, Aquatic Toxicology 65, pp. 397-411.
|
|
(8)
|
Punkter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla, and C.R. Tyler (2002), “Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances”, Environmental Toxicology and Chemistry 21, pp. 319-326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear, and Z.J. Wang (2007), “Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533-541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc, and C.V.Sullivan (1999), “Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113-125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr, and J.M. Porcher (2002), “Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)”, Environmental Toxicology and Chemistry 21, pp. 1699-1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002), “Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161-169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B.E. Bengtsson (2004), “The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction”, Aquatic Toxicology 70, pp. 311-326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), “Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka”, Journal of Health Science 50, pp. 301-308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Punkter, T. Hutchinson, and A. Goksoyr (2006), “Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology”, 78, pp. 202-206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), “Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)”, Ecotoxicology and Environmental Safety 64, pp. 101-105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b), “Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)”, Nordic Council of Ministers, TemaNord 2001:597, pp. 48-51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher, and A. Goksoyr (2004), “Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening”, Analytical and Bioanalytical Chemistry 378, pp. 621-633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), “Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone”, Archives of Environmental Contamination and Toxicology 51, pp. 237-243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3, pp. 136-151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005), “An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio”, Environmental Toxicology and Chemistry 24, pp. 1088-1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), “Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes”, Developmental Dynamics 231, pp. 518-526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), “Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations”, Zoological Science 21, pp. 613-619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak, and R.W. Flick (2007), “Collapse of a fish population after exposure to a synthetic estrogen”, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron, and K.A. Kidd (2009), “Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake”, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920-1935.
|
|
(27)
|
Punkter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), “Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)”, Aquatic Toxicology 77, pp. 279-290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006), “Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57-66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004), “Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)”, Fish Physiology and Biochemistry 30, pp. 257-266.
|
|
(30)
|
Morthorst, J.E., H. Holbech, and P. Bjerregaard (2010), “Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations”, Aquatic Toxicology 98, pp. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), “Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)”, Aquatic Toxicology 63, pp. 391-403.
|
|
(32)
|
Punkter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley, and C.R. Tyler (2004), “Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development”, Aquatic Toxicology 70, pp. 11-21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen, and P. Bjerregaard (2007), “Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165-170.
|
|
(34)
|
Šā pielikuma C.14. nodaļa. Zivju mazuļu augšanas tests.
|
|
(35)
|
Šā pielikuma C.4. nodaļa. Tūlītēja bionoārdāmība.
|
|
(36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
(37)
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(38)
|
Šā pielikuma C.37. nodaļa: 21 dienas zivju tests: īstermiņa skrīningtests estrogēnās un androgēnās aktivitātes un aromatāzes inhibēšanas noteikšanai.
|
|
(39)
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), “Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio” Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp 768-779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
(42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
|
(44)
|
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. OJ L 276, 20.10.2010, p. 33.
|
1. papildinājums
Saīsinājumi un definīcijas
Apikālais beigupunkts
– rada ietekmi populācijas līmenī
ASV
– gaisa piesātinājuma vērtība
Biomarķieris
– rada ietekmi individuālā līmenī
Ķīmiska viela
– viela vai maisījums
Dph
– dienas pēc izšķilšanās
DMY
– Y specifisks DM domēna gēns, kas nepieciešams Japānas medakas tēviņu attīstībai
ELISA
– imūnfermentatīvā analīze
Zivs svars
– zivs mitrais svars (pēc nosusināšanas)
FSDT
– zivju dzimumattīstības tests
HPG ass
– hipotalāma, hipofīzes un gonādu ass
Starpdzimumu zivs
– zivs ar vairāk nekā vienu olšūnu sēkliniekā sešās analizētajās sekcijās vai spermatoģenēzes šūnu olnīcās (jā/nē)
Noslogojums
– zivju mitrais svars uz ūdens tilpuma vienību
MOA
– iedarbības veids
RT-PCR
– atgriezeniskās transkriptāzes polimerāzes ķēdes reakcija
Testējamā ķīmiskā viela
– jebkura ķīmiska viela vai maisījums, ko testē ar šo testēšanas metodi
Nediferencēta zivs
– zivs ar gonādām, kas neuzrāda pamanāmas dzimumšūnas
VTG
– vitellogenīns
2. papildinājums
Eksperimentālie apstākļi FSDT (saldūdens sugām)
|
|
Japānas medaka (Oryzias latipes)
|
Zebrzivs (Danio rerio)
|
Trīsadatu stagars (Gasterostreus aculeatus)
|
|
|
Caurplūdes vai daļēji statiskos apstākļos
|
Caurplūdes vai daļēji statiskos apstākļos
|
Caurplūdes vai daļēji statiskos apstākļos
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
4.
|
Apgaismojuma kvalitāte
|
|
Luminiscences spuldzes (plašs spektrs)
|
Luminiscences spuldzes (plašs spektrs)
|
Luminiscences spuldzes (plašs spektrs)
|
|
|
10–20 μE/m2/s, 540–1 080 luksi, vai 50–100 ft-c (apkārtējās vides līmeņi laboratorijā)
|
10–20 μE/m2/s, 540–1 080 luksi, vai 50–100 ft-c (apkārtējās vides līmeņi laboratorijā)
|
10–20 μE/m2/s, 540–1 080 luksi, vai 50–100 ft-c (apkārtējās vides līmeņi laboratorijā)
|
|
|
12–16 stundas apgaismojumā un 8–12 stundas tumsā
|
12–16 stundas apgaismojumā un 8–12 stundas tumsā
|
16 stundas apgaismojumā un 8 stundas tumsā
|
|
7.
|
Minimālais kameras izmērs
|
|
Individuālajās kamerās jāietilpst vismaz 7 l ūdens tilpuma
|
Individuālajās kamerās jāietilpst vismaz 7 l ūdens tilpuma
|
Individuālajās kamerās jāietilpst vismaz 7 l ūdens tilpuma
|
|
8.
|
Testēšanas šķīdumu tilpuma nomaiņa
|
|
Vismaz piecas reizes dienā
|
Vismaz piecas reizes dienā
|
Vismaz piecas reizes dienā
|
|
9.
|
Testa organismu vecums ekspozīcijas sākumā
|
|
Tikko apaugļoti ikri (agrīnās blastulas posms)
|
Tikko apaugļoti ikri (agrīnās blastulas posms)
|
Tikko apaugļoti ikri
|
|
10.
|
Ikru skaits vienā apstrādes variantā
|
|
Vismaz 120
|
Vismaz 120
|
Vismaz 120
|
|
11.
|
Apstrādes variantu skaits
|
|
Vismaz 3 (un attiecīgs kontrolgrupu skaits)
|
Vismaz 3 (un attiecīgs kontrolgrupu skaits)
|
Vismaz 3 (un attiecīgs kontrolgrupu skaits)
|
|
12.
|
Replikātu skaits vienam apstrādes variantam
|
|
Vismaz 4 (ja vien kontrolgrupas datu analīzē neizmanto kvadrātsakni)
|
Vismaz 4 (ja vien kontrolgrupas datu analīzē neizmanto kvadrātsakni)
|
Vismaz 4 (ja vien kontrolgrupas datu analīzē neizmanto kvadrātsakni)
|
|
|
Dzīvas Artemia, saldētas pieaugušas sālsūdens garneles, pārslu barība utt. Ieteicams barot divreiz dienā
|
Īpaša zivju mazuļu barība, dzīvas Artemia, saldētas pieaugušas sālsūdens garneles, pārslu barība utt. Ieteicams barot divreiz dienā
|
Dzīvas Artemia, saldētas pieaugušas sālsūdens garneles, pārslu barība utt. Ieteicams barot divreiz dienā
|
|
14.
|
Piesātināšana ar gaisu
|
|
Neveic, ja vien DO koncentrācija nesamazinās zemāk par 60 % piesātinājuma
|
Neveic, ja vien DO koncentrācija nesamazinās zemāk par 60 % piesātinājuma
|
Neveic, ja vien DO koncentrācija nesamazinās zemāk par 70 % piesātinājuma
|
|
|
Tīrs virszemes, avota vai attīrīts ūdens
|
Tīrs virszemes, avota vai attīrīts ūdens
|
Tīrs virszemes, avota vai attīrīts ūdens
|
|
16.
|
Ekspozīcijas testējamajai ķīmiskajai vielai ilgums
|
|
60 dph
|
60 dph
|
60 dph
|
|
17.
|
Bioloģiskie beigupunkti
|
|
Izšķilšanās sekmes, izdzīvotība, vispārējā morfoloģija, VTG, gonādu histoloģija, ģenētiskais dzimums, dzimumu attiecība
|
Izšķilšanās sekmes, izdzīvotība, vispārējā morfoloģija, VTG, gonādu histoloģija, dzimumu attiecība
|
Izšķilšanās sekmes, izdzīvotība, vispārējā morfoloģija, VTG, gonādu histoloģija, dzimumu attiecība
|
|
18.
|
Testa pieņemamības kritēriji izvēlētajām kontrolgrupām
|
|
Izšķilšanās sekmes > 80 %
|
Izšķilšanās sekmes > 80 %
|
Izšķilšanās sekmes > 80 %
|
|
Izdzīvotība pēc izšķilšanās ≥ 70 %
|
Izdzīvotība pēc izšķilšanās ≥ 70 %
|
Izdzīvotība pēc izšķilšanās ≥ 70 %
|
|
Augšana (zivs mitrais svars pēc nosusināšanas) > 150 mg
|
Augšana (zivs mitrais svars pēc nosusināšanas) > 75 mg
|
Augšana (zivs mitrais svars pēc nosusināšanas) > 120 mg
|
|
Garums (standarta garums) > 20 mm
|
Garums (standarta garums) > 14 mm
|
Garums (standarta garums) > 20 mm
|
|
Dzimumu attiecība (% tēviņu vai mātīšu)
30 %–70 %
|
Dzimumu attiecība (% tēviņu vai mātīšu) 30 %–70 %
|
Dzimumu attiecība (% tēviņu vai mātīšu) 30 %–70 %
|
3. papildinājums
Piemērota atšķaidīšanas ūdens ķīmiskie rāksturlielumi
|
SASTĀVDAĻA
|
KONCENTRĀCIJA
|
|
Cietās daļiņas
|
< 20 mg/l
|
|
Kopējais organiskais ogleklis
|
< 2 mg/l
|
|
Nejonizēts amonjaks
|
< 1 μg/l
|
|
Hlora atlikumi
|
< 10 μg/l
|
|
Kopējie fosfororganiskie pesticīdi
|
< 50 ng/l
|
|
Hlororganisko pesticīdu un polihlorbifenīlu kopējais saturs
|
< 50 ng/l
|
|
Kopējais organiskais hlors
|
< 25 ng/l
|
4. papildinājums
No C.14. testēšanas metodes/Norādījumi par testa koncentrācijām
|
Aile (koncentrāciju skaits starp 100 un 10 vai starp 10 un 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
5. papildinājums
Norādījumi zebrzivs, biezpaura grunduļa, trīsadatu stagara un Japānas medakas mazuļu galvu un astu homogenizēšanai
Šīs nodaļas mērķis ir raksturot procedūras, kas jāveic pirms VTG koncentrācijas izteikšanas kvantitatīvos lielumos. Var lietot arī citas procedūras, kas ļauj iegūt salīdzināmus VTG kvantitatīvos lielumus. Pēc izvēles VTG koncentrāciju var noteikt arī asins plazmā vai aknās, ne tikai galvu/astu homogenātā.
Procedūra
|
1.
|
Zivīm veic anestēziju un eitanāziju saskaņā ar testa aprakstu.
|
|
2.
|
Zivīm nogriež galvas un astes saskaņā ar testa aprakstu. Svarīga piezīme: visus sadalīšanas instrumentus un griežamo dēli rūpīgi noskalo un notīra (piem., ar 96 % etanolu) pēc katras atsevišķās zivs apstrādes, lai novērstu kontrolgrupas tēviņu “VTG piesārņojumu” no mātītēm vai apstrādātiem tēviņiem.
|
|
3.
|
Katras zivs galvas un astes kopsvaru mēra ar precizitāti līdz tuvākajam mg.
|
|
4.
|
Pēc nosvēršanas šīs daļas ievieto piemērotās mēģenēs (piem., 1,5 ml Ependorfa mēģenēs) un sasaldē – 80 °C temperatūrā līdz viendabīgas masas iegūšanai vai tiešā veidā homogenizē uz ledus ar divām plastmasas piestulām. (Var lietot arī citas metodes, ja to dara uz ledus un rezultātā iegūst viendabīgu masu.) Svarīga piezīme:
mēģenes pienācīgi numurē tā, lai zivs galvu un asti varētu identificēt ar attiecīgo ķermeņa daļu, ko izmanto gonādu histoloģijai.
|
|
5.
|
Pēc viendabīgas masas iegūšanas pievieno ledusaukstu homogenizācijas buferšķīdumu
(29) apjomā, kas 4–10 reizes pārsniedz audu svaru (atzīmē atšķaidījuma pakāpi). Turpina darbu ar piestulām, kamēr maisījums kļūst viendabīgs. Svarīga piezīme:
katrai zivij izmanto jaunas piestulas.
|
|
6.
|
Paraugus novieto uz ledus, tad 30 minūtes griež centrifūgā 4 °C temperatūrā ar 50 000 g.
|
|
7.
|
Ar pipeti sadala centrifugātu no 20 līdz 50 μl lielās porcijās (atzīmē apjomu) vismaz divās mēģenēs, iemērcot pipetes atvērto galu zem tauku slāņa uz virsmas un rūpīgi izsūcot centrifugātu bez taukiem vai sabiezējumiem.
|
|
8.
|
Pirms lietošanas mēģenes uzglabā – 80 °C temperatūrā.
|
Piezīme. Homogenizācijas buferšķīdumu izlieto tā pagatavošanas dienā. Lietošanas laikā novieto uz ledus.
6. papildinājums
Norādījumi zebrzivs (Danio rerio) galvu un astu homogenāta vitellogenīna kvantificēšanai (grozījumi pēc Holbech et al., 2001). var izmantot citas procedūras, kurās lieto homologas antivielas un standartvielas
|
1.
|
Mikrotitru plates (sertificētā Maxisorp F96, Nunc, Roskilde, Dānija), kas iepriekš pārklātas ar 5 μg/ml anti-zebrzivs lipovitellīnu-IgG, atkausē un mazgā trīs reizes ar mazgāšanas buferšķīdumu (*).
|
|
2.
|
Attīrītu zebrzivs vitellogenīna standartvielu (30) sērijveidā atšķaida līdz 0,2, 0,5, 1, 2, 5, 10 un 20 ng/ml atšķaidīšanas buferšķīdumā (**), un paraugus atšķaida vismaz 200 reizes (lai novērstu matricas efektu) atšķaidīšanas buferšķīdumā un uzklāj uz platēm. Testa kontroli veic divreiz. Katram avotam izmanto 150 μl. Standartvielas izmanto divreiz, un paraugus – trīsreiz. Inkubē kratītājā pa nakti 4 °C temperatūrā.
|
|
3.
|
Plates nomazgā piecas reizes ar mazgāšanas buferšķīdumu (*).
|
|
4.
|
HRP, kas savienots ar dekstrāna ķēdi (piem., AMDEX A/S, Dānija), un saistītās antivielas atšķaida mazgāšanas buferšķīdumā; faktiskā atšķaidīšanas pakāpe katrai partijai un vecumam ir cita. 150 μl izmanto katram avotam, un plates inkubē kratītājā vienu stundu istabas temperatūrā.
|
|
5.
|
Plates mazgā piecas reizes ar mazgāšanas buferšķīdumui (*), bet apakšpuses tām rūpīgi notīra ar etanolu.
|
|
6.
|
Katrā iedobumā lieto 150 μl TMB plus (***). Plates aizsargā pret gaismu ar alvas foliju, un novēro krāsu izmaiņas kratītājā.
|
|
7.
|
Kad standarta līkne ir pilnībā izveidota, enzīmu aktivitāti aptur, katrā avotā pievienojot 150 μl 0,2 M H2SO4.
|
|
8.
|
Absorbciju mēra pie 450 nm (piem., izmantojot Molecular Devices Thermomax plates nolasītāju). Datus analizē ar saistītu programmatūru (piem., Softmax).
|
|
(*)
|
Mazgāšanas buferšķīdums
|
PBS bāze (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Maina pH uz 7,3 un papildina līdz 5 l ar miliporu H2O. Uzglabā 4 °C temperatūrā.
|
|
|
(**)
|
Atšķaidīšanas buferšķīdums
|
PBS bāze (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Maina pH uz 7,3 un papildina līdz 1 l ar miliporu H2O. Uzglabā 4 °C temperatūrā.
|
|
|
(***)
|
TMB plus ir lietošanai gatavs substrāts, ko ražo KemEnTec (Dānija). Tas ir gaismjutīgs. Uzglabā 4 °C temperatūrā.
|
|
(****)
|
PBS izejšķīdums
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 · 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Maina pH uz 6,8 un papildina ar milliporu H2O līdz 2 l. Uzglabā istabas temperatūrā.
|
|
7. papildinājums
Norādījumi audu sekciju sagatavošanai dzimuma noteikšanai un gonādu attīstības stadiju klasificēšanai
Šā papildinājuma mērķis ir raksturot procedūras, kas jāveic pirms histoloģisko sekciju novērtēšanas. Var izmantot citas procedūras, kas līdzīgā veidā ļauj noteikt dzimumu un klasificēt gonādu attīstības stadijas.
Ar nedaudziem izņēmumiem Japānas medakām (JMD) un zebrzivīm (ZZ) šīs procedūras ir līdzīgas.
Eitanāzija, autopsija un audu fiksācija
Mērķi
|
1.
|
Nodrošināt humānu zivs nonāvēšanu.
|
|
2.
|
Iegūt nepieciešamo ķermeņa svaru un mērījumus.
|
|
3.
|
Novērtēt sekundārās dzimumpazīmes.
|
|
4.
|
Iegūt audus VTG analīzei.
|
Procedūras
|
1.
|
Zivs jānonāvē tieši pirms autopsijas. Tādēļ, ja vien nedarbojas vairāki anatomi, vairākas zivis nedrīkst nonāvēt vienlaikus.
|
|
2.
|
Ar smalku tīkliņu zivi izceļ no eksperimentālās kameras un pārnēsājamā traukā nogādā autopsijas zonā.
|
|
3.
|
Zivi ievieto eitanāzijas šķīdumā. Zivi izceļ no šā šķīduma, kad tā pārtrauc elpot un nereaģē uz ārējiem kairinājumiem.
|
|
4.
|
Nosaka zivs parauga kopējo svaru.
|
|
5.
|
Lai sagatavotu audus VTG analīzei, zivi var novietot uz korķa plāksnītes uz anatomiskā mikroskopa platformas.
|
a.
|
Zebrzivij galvu nogriež tieši aiz krūšu spuras un asti nogriež tieši aiz muguras spuras.
|
|
b.
|
Japānas medakai vēderu atver, rūpīgi veicot iegriezumu gar vēdera viduslīniju aiz galvaskausa uz punktu pašā anālās atveres galā. Ar nelielu pinceti un mazām šķērītēm rūpīgi atdala aknas.
|
|
|
6.
|
VTG analīzes paraugus ievieto Ependorfa mēģenēs un nekavējoties sasaldē šķidrā slāpeklī.
|
|
7.
|
Liemeni, tostarp gonādas, novieto iepriekš marķētā audiem paredzētā plastmasas kasetē, ko ievieto Davidsona vai Buina fiksācijas šķīdumā. Fiksācijas šķīduma tilpumam vismaz desmitkārtīgi jāpārsniedz aptuvenais audu tilpums. Fiksācijas šķīduma trauku viegli krata piecas sekundes, lai likvidētu gaisa burbuļus audu kasetē.
|
|
8.
|
|
a.
|
Visus audus pa nakti atstāj Davidsona fiksācijas šķīdumā, bet nākamajā dienā tos pārvieto uz atsevišķiem traukiem ar 10 % neitrāli buferētu formalīnu. Traukus ar audu kastītēm viegli krata piecas sekundes, lai nodrošinātu tajās pietiekamu formalīna iespiešanos.
|
|
b.
|
Audus atstāj Buina fiksācijas šķīdumā uz 24 h, tad ievieto 70 % etanolā.
|
|
Audu apstrāde
Mērķi
|
1.
|
Dehidrēt audus, lai tajos pietiekami iespiestos parafīns.
|
|
2.
|
Impregnēt audus ar parafīnu, lai saglabātu audu integritāti un radītu cietu virsmu mikrotomijai.
|
Procedūras
|
3.
|
Marķētās audu kasetes izņem no formalīna/etanola glabātuves un ievieto apstrādes grozā(-os). Apstrādes grozu ievieto audu procesorā.
|
|
4.
|
Izvēlas apstrādes laika grafiku.
|
|
5.
|
Kad audu procesors ir pabeidzis apstrādes ciklu, grozu(-us) var pārvietot uz ieguldīšanas staciju.
|
Ieguldīšana
Mērķis
Pareizi novietot paraugu sacietējušā parafīnā mikrotomijas nolūkiem.
Procedūras
|
1.
|
Grozu(-s) ar kasetēm izņem no procesora un iemērc ar parafīnu pildītā ieguldīšanas stacijas termiskās konsoles priekškamerā, vai arī šīs kasetes ievieto atsevišķā parafīna sildītājā.
|
|
2.
|
Pirmo ieguldāmo kaseti izņem no termiskās konsoles priekškameras vai parafīna sildītāja. Kasetes vāku noņem un izmet, un kasetes marķējumu salīdzina ar dzīvnieka reģistrācijas ierakstu, lai vēl pirms ieguldīšanas novērstu iespējamās nesakritības.
|
|
3.
|
Izvēlas atbilstoša lieluma ieguldīšanas veidni.
|
|
4.
|
Šo veidni tur zem uzpildes konsoles snīpja un piepilda ar izkausētu parafīnu.
|
|
5.
|
Paraugu izņem no kastītes un ievieto izkausētajā parafīnā veidnē. To atkārto ar 4–8 paraugiem katrā parafīna veidnē. Katras atsevišķās zivs stāvokli atzīmē, novietojot to 180 grādu leņķī pret katru 2–4/8. zivi.
|
|
6.
|
Pievieno vēl parafīnu, lai apsegtu paraugus.
|
|
7.
|
Veidni ar kastīšu pamatni novieto uz krio konsoles dzesēšanas plates.
|
|
8.
|
Pēc parafīna sacietēšanas visu bloku (t. i., sacietējušo parafīnu ar audiem un kasetes pamatni) izņem no veidnes.
|
Mikrotomija
Mērķis
Izgriezt un novietot histoloģiskās sekcijas iekrāsošanai.
Procedūras
|
1.
|
Turpmāk izklāstīts, kā noris mikrotomijas sākumposms, ko dēvē par “pavēršanu”.
|
a.
|
Parafīna bloku nostiprina mikrotoma spīļpatronā.
|
|
b.
|
Spīļpatronu groza, pagriežot mikrotoma ratu, un no parafīna bloka virsmas griež nost plānas plēksnes, kamēr nazis sasniedz ieguldītos audus.
|
|
c.
|
Sekcijas biezumu mikrotomā iestata no 3 līdz 5 mikroniem. Spīļpatronu groza un no bloka nogriež vairākas plēksnes, lai noņemtu jebkurus veidojumus, kas rodas uz audu griezuma virsmas raupjās apgriešanas laikā.
|
|
d.
|
Bloku var izņemt no spīļpatronas un apvērstu novietot uz ledus, lai audi samirktu.
|
|
|
2.
|
Nākamais mikrotomijas posms ir audu slāņu galīgā secēšana un novietošana uz priekšmetstikliņiem. Turpmāk izklāstīta šo procedūru norise.
|
a.
|
Ja bloks ir bijis novietots uz ledus, to noņem no ledus un atkal ievieto mikrotoma spīļpatronā.
|
|
b.
|
Sekcijas biezumu mikrotomā iestata no 3 līdz 5 mikroniem, un tad spīļpatronu groza, pagriežot mikrotoma ratu. No bloka griež nost plēksnes, kamēr iegūst “sloksni” ar vismaz vienu pieņemamu slāni, kas satur gonādas. (Secēšanas laikā, ja nepieciešams, bloku var izņemt no spīļpatronas, novietot uz ledus, lai audi samirktu, un ievietot atpakaļ spīļpatronā.)
|
|
c.
|
Iegūtās sekcijas plakaniski peldina ūdens vanniņā uz ūdens virsmas. Mēģina iegūt vismaz vienu sekciju bez krunkām un bez gaisa burbuļiem apakšpusē.
|
|
d.
|
Mikroskopa priekšmetstikliņu iemērc zem labākās sekcijas, kuru izceļ no ūdens ar priekšmetstikliņu. Minēto procesu dēvē par sekcijas “novietošanu” uz priekšmetstikliņa.
|
|
e.
|
Katras zivs komplektam sagatavo trīs šādas sekcijas. Otro un trešo sekciju griež ar 50 mikronu intervālu no pirmās sekcijas. Ja zivs ar gonādām nav ieguldīta vienā un tajā pašā secēšanas līmenī, sagatavo vairākas sekcijas, lai nodrošinātu, ka no katras zivs tiek iegūtas vismaz sešas sekcijas ar gonādām.
|
|
f.
|
Ar marķēšanas pildspalvu uz katra priekšmetstikliņa uzraksta tā bloka numuru, kuram tika sagatavots attiecīgais priekšmetstikliņš.
|
|
g.
|
Priekšmetstikliņu ievieto iekrāsošanas statīvā.
|
|
h.
|
Bloku izņem no spīļpatronas un apvērstu novieto uzglabāšanai.
|
|
Iekrāsošana, segstikla uzlikšana un priekšmetstikliņa marķēšana
Mērķi
|
—
|
Iekrāsot sekcijas histopatoloģiskai izmeklēšanai.
|
|
—
|
Pastāvīgi noplombēt novietotos un iekrāsotos audus.
|
|
—
|
Pastāvīgi identificēt iekrāsotās sekcijas, lai tās varētu pilnībā izsekot.
|
Procedūras
|
1.
|
Iekrāsošana
|
a.
|
Pirms iekrāsošanas priekšmetstikliņus pa nakti izžāvē gaisā.
|
|
b.
|
Sekcijas iekrāso ar hematoksilīnu-eozīnu.
|
|
|
2.
|
Segstikla uzlikšana
|
a.
|
Segstiklus var uzlikt manuāli vai automātiski.
|
|
b.
|
Priekšmetstikliņu iemērc ksilēnā vai TissueClear, un lieko ksilēnu/TissueClear rūpīgi noņem no priekšmetstikliņa.
|
|
c.
|
Aptuveni 0,1 ml stiprinājuma vielas uzziež netālu no priekšmetstikliņa gala, kas nav matētais gals, vai uz segstikla.
|
|
d.
|
Segstiklu, uzklājot priekšmetstikliņam, novieto ieslīpi, šaurā leņķī.
|
|
|
3.
|
Marķēšana
|
a.
|
Katrā priekšmetstikliņa marķējumā iekļauj turpmāk minēto informāciju.
|
i.
|
Laboratorijas nosaukums
|
|
iii.
|
Parauga Nr./priekšmetstikliņa Nr.
|
|
iv.
|
Ķīmiskā viela/apstrādes grupa
|
|
|
8. papildinājums
Statistikas diagramma vitellogenīna analīzei
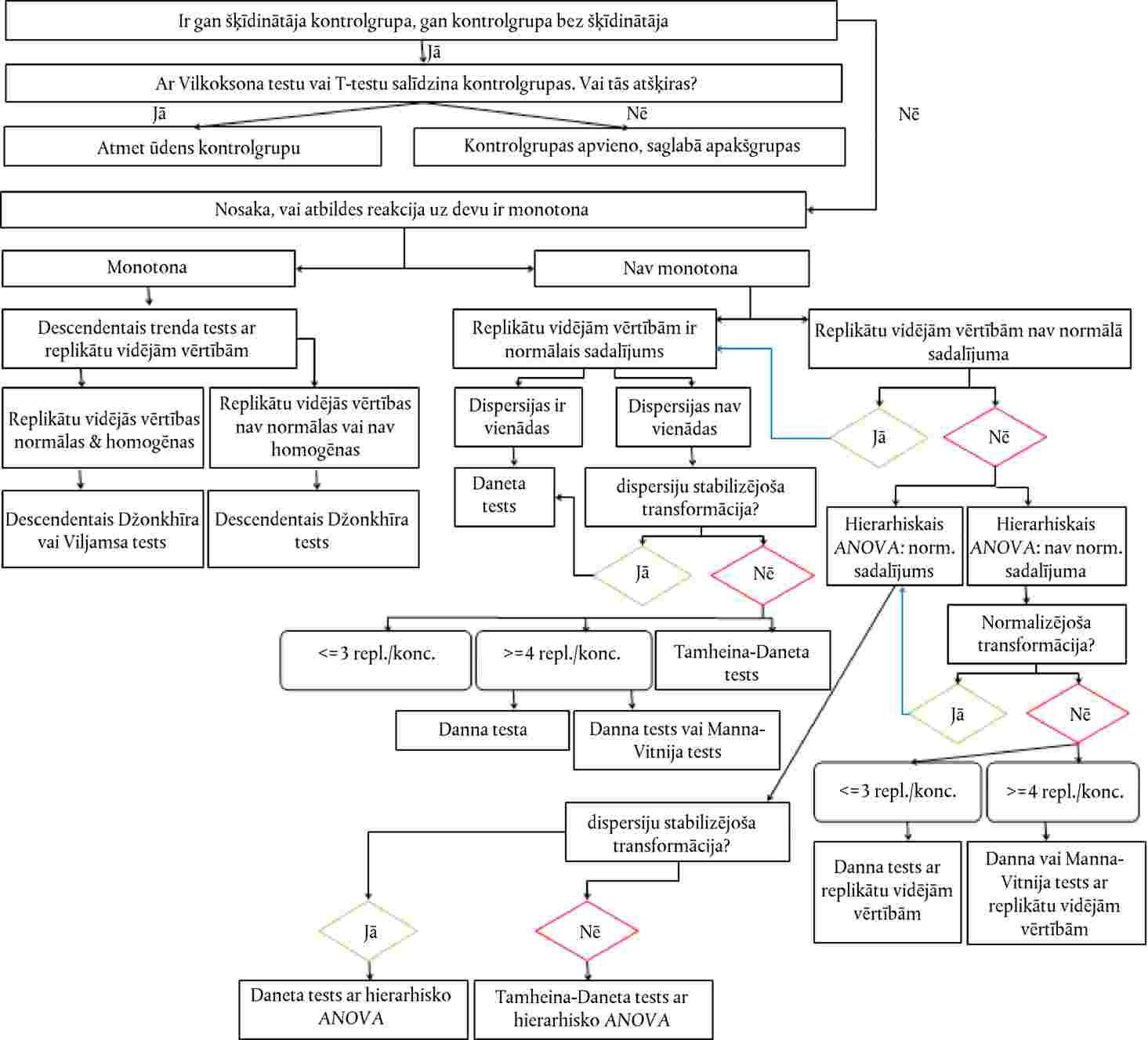
Statistikas diagramma dzimumu attiecības analīzei
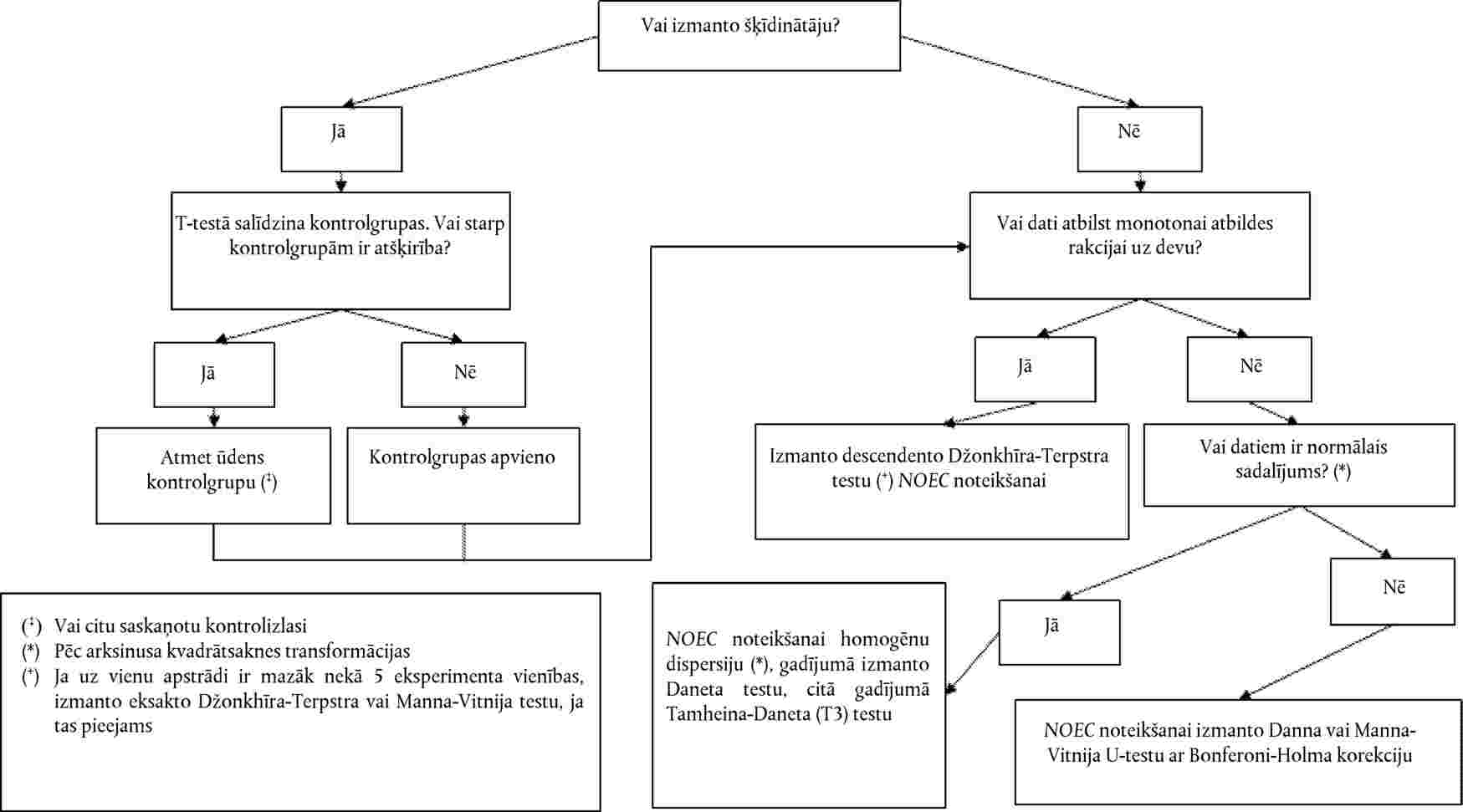
9. papildinājums
Norādījumi audu paraugu ņemšanai, lai noteiktu ģenētisko dzimumu un lai noteiktu ģenētisko dzimumu ar PCR metodi
Japānas medakas audu paraugu ņemšana, sagatavošana un uzglabāšana pirms ģenētiskā dzimuma noteikšanas ar PCR metodi (sagatavojusi Bayer CropScience AG Ūdens organismu laboratorija)
|
1.
|
Ar mazām šķērītēm katrai atsevišķajai zivij nogriež anālo vai muguras spuru un ievieto to mēģenē, kas piepildīta ar 100 μl 1. ekstrakcijas buferšķīduma (turpmāk ir sniegta informācija par šā buferšķīduma sagatavošanu). Šķēres notīra pēc katras zivs, ievietojot tās vārglāzē, kas piepildīta ar destilētu H2O, un nosusina ar papīra salveti.
|
|
2.
|
Pēc tam spuras audus homogenizē ar teflona piestulu mikromēģenē, lai lizētu šūnas. Katrai mēģenei izmanto jaunu piestulu, lai nepieļautu nekādu piesārņošanos. Piestulas pa nakti ievieto 0,5 M NaOH, skalo piecas minūtes destilētā H2O un uzglabā etanolā vai pēc tam sterilizē autoklāvā līdz lietošanai.
|
|
3.
|
Spuru audus var uzglabāt arī bez 1. ekstrakcijas buferšķīduma uz sausā ledus un pēc tam ledusskapī – 80 °C temperatūrā, lai novērstu jebkādu DNS deģenerāciju. Taču ekstrakcija notiek precīzāk, ja vienlaikus ekstrahējat arī DNS (šī darbība ir aprakstīta iepriekš; paraugus atkausē uz ledus pēc uzglabāšanas – 80 °C temperatūrā, pirms buferšķīduma iepildīšanas mēģenēs).
|
|
4.
|
Pēc homogenizācijas visas mēģenes ievieto ūdens vanniņā un vāra 15 minūtes 100 °C temperatūrā.
|
|
5.
|
Pēc tam katrā mēģenē ar pipeti iepilda 100 μl 2. ekstrakcijas buferšķīduma (turpmāk sniegta informācija par šā buferšķīduma pagatavošanu). Paraugus uzglabā istabas temperatūrā 15 minūtes un šajā laikā ik pa brīdim viegli sakrata ar roku.
|
|
6.
|
Pēc tam visas mēģenes vēlreiz ievieto ūdens vanniņā un vāra vēl 15 minūtes 100 °C temperatūrā.
|
|
7.
|
Līdz turpmākajām analīzēm mēģenes sasaldē – 20 °C temperatūrā.
|
Buferšķīduma sagatavošana
PCR 1. buferšķīdums:
|
|
500 mg N-lauroilsarkozīna (piem., Merck KGaA, Darmštate, Vācija);
|
|
|
pievieno 100 ml destilēta H2O;
|
PCR 2. buferšķīdums:
|
|
20 g Chelex (piem., Biorad, Minhene, Vācija);
|
|
|
uzbriedina 100 ml destilēta H2O;
|
Ģenētiskā dzimuma noteikšana (ar PCR metodi) medakām (sagatavojusi Bayer CropScience AG Ūdens organismu laboratorija un Universität Würzburg Biozentrum)
Sagatavotās un sasaldētās mēģenes (iepriekš aprakstītās) atkausē uz ledus. Pēc tam tās griež centrifūgā, lietojot Ependorfa centrifūgu (30 sekundes ar maks. ātrumu, istabas temperatūrā). PCR gadījumā lieto centrifugātu, kas atdalīts no nogulsnēm. Noteikti nedrīkst pieļaut nekādu (nogulsnēs lokalizētu) Chelex palieku pārnesi uz PCR reakciju, jo tās traucēs Taq polimerāzes darbībai. Centrifugātu var lietot tiešā veidā vai uzglabāt turpmākām analīzēm sasaldētā stāvoklī (–20 °C temperatūrā) un atkal atkausēt vairākos ciklos, negatīvi neietekmējot DNS.
1. “Reakcijas maisījuma” pagatavošana (25 μl katram paraugam)
|
|
Tilpums
|
Galīgā koncentrācija
|
|
Veidnes DNS
|
0,5 μl – 2 μl
|
|
|
10 × PCR buferšķīdums ar mgCl2
|
2,5 μl
|
1 ×
|
|
Nukleotīdi (katrs no dATP, dCTP, dGTP un dTTP)
|
4 μl (5 mm)
|
200 μM
|
|
Augšupejošais praimers (10μ M) (sk. turpmāk 3–5)
|
0,5 μl
|
200 nM
|
|
Apgrieztais praimers (10μ M) (sk. turpmāk 3–5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Ūdens (PCR kategorija)
|
līdz 25 μl
|
|
|
Taq e-polimerāze
|
0,3 μl
|
1,5 U
|
|
10 × PCR buferšķīdums ar mgCl2 – 670 mm tris/HCl (pH 8,8 25 °C temperatūrā), 160 mm (NH4)2SO4, 25 mm mgCl2, 0,1 % Tween 20.
|
Katrai PCR (sk. turpmāk 3–5) nepieciešams īpašs praimers kā “reakcijas maisījuma” jauna kombinācija un katram paraugam nepieciešamās veidnes DNS pietiekams daudzums (sk. iepriekš). Attiecīgos tilpumus pārvieto jaunās mēģenēs ar pipetēm. Pēc tam visas mēģenes noslēdz, samaisa (aptuveni 10 sekundes) un centrifugē (10 sekundes istabas temperatūrā). Tad var uzsākt attiecīgās PCR programmas. Turklāt katrā PCR programmā veic pozitīvo kontroli (tipiskam DNS paraugam ar zināmu darbību un nepārprotamiem rezultātiem) un negatīvo kontroli (1 μl destilēta H2O).
2. (1 %) agarozes gela pagatavošana uzsākto PCR programmu ietvaros
|
—
|
Izšķīdina 3 g agarozes 300 ml 1 × TAE buferšķīduma (1 % agarozes gels)
|
|
—
|
Šo šķīdumu vāra, izmantojot mikroviļņus (aptuveni 2–3 minūtes)
|
|
—
|
Karsto šķīdumu ielej īpašā lējuma traukā, kas novietots uz ledus
|
|
—
|
Aptuveni pēc 20 minūtēm agarozes gels ir gatavs lietošanai
|
|
—
|
Agarozes gelu uzglabā 1 × TAE buferšķīdumā līdz PCR programmu pabeigšanai
|
3. Aktīna PCR programma
Šīs PCR reakcijas mērķis ir pierādīt, ka paraugā DNS nav bojāta.
|
—
|
Īpašais praimers
|
—
|
“Mact1 (augšējais/augšupejošais)” → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
“Mact2 (apakšējais/apgrieztais)” → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Programma
|
—
|
5 min. 95 °C temperatūrā
|
|
—
|
Cikls (35 reizes):
|
denaturēšana
|
→ 45 sek. 95 °C temperatūrā;
|
|
rūdīšana
|
→ 45 sek. 56 °C temperatūrā;
|
|
pagarināšana
|
→ 1 min. 68 °C temperatūrā.
|
|
|
—
|
15 min. 68 °C temperatūrā
|
|
4. X un Y gēna PCR programma
Paraugi ar neskartajām DNS šajā PCR programmā tiks izmantoti X un Y gēnu detektēšanai. Vīrišķajām DNS ir jāuzrāda viena dubulta josla, bet sievišķajām DNS – viena atsevišķa josla (pēc iekrāsošanas un gela elektroforēzes). Šīs programmas īstenošanai ir jāparedz viena pozitīva kontrole tēviņiem (XY paraugam) un viena mātītēm (XX paraugam).
|
—
|
Īpašais praimers
|
—
|
“PG 17.5” (augšējais/augšupejošais) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
“PG 17.6” (apakšējais/apgrieztais) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Programma
|
—
|
5 min. 95 °C temperatūrā
|
|
—
|
Cikls (40 reizes):
|
denaturēšana
|
→ 45 sek. 95 °C temperatūrā;
|
|
rūdīšana
|
→ 45 sek. 55 °C temperatūrā;
|
|
pagarināšana
|
→ 1 min. 30. sek. 68 °C temperatūrā.
|
|
|
—
|
15 min. 68 °C temperatūrā
|
|
5. Y gēna PCR programma kā “kontrolgrupa” X un Y gēna PCR programmai
Šī PCR programma pārbauda “X un Y gēna PCR programmas” rezultātus. “Vīrišķajiem paraugiem” jāuzrāda viena josla, bet “sievišķajiem paraugiem” nav jāuzrāda neviena josla (pēc iekrāsošanas un gela elektroforēzes).
|
—
|
Īpašais praimers
|
—
|
“DMTYa (augšējais/augšupejošais)” → GGC CGG GTC CCC GGG TG
|
|
—
|
“DMTYd (apakšējais/apgrieztais)” → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Programma
|
—
|
5 min. 95 °C temperatūrā
|
|
—
|
Cikls (40 reizes):
|
denaturēšana
|
→ 45 sek. 95 °C temperatūrā;
|
|
rūdīšana
|
→ 45 sek. 56 °C temperatūrā;
|
|
pagarināšana
|
→ 1 min. 68 °C temperatūrā.
|
|
|
—
|
15 min. 68 °C temperatūrā
|
|
6. PCR paraugu iekrāsošana
Iekrāsojošais šķīdums:
Ar pipeti iepilina 1 μl iekrāsojošā šķīduma katrā atsevišķajā mēģenē.
7. Gela elektroforēzes sākšana
|
—
|
Sagatavoto 1 % agarozes gelu ievieto gela elektroforēzes kamerā, kas pildīta ar 1 × TAE buferšķīdumu.
|
|
—
|
10–15 μl katra iekrāsotā PCR parauga ar pipeti iepilina agarozes gela atsevišķā joslā.
|
|
—
|
Atsevišķā joslā ar pipeti iepilina arī 5–15 μl 1kb “kāpņu” (invitrogēna).
|
|
—
|
Elektroforēzi sāk ar 200 V.
|
|
—
|
Beidz pēc 30–45 minūtēm.
|
8. Joslu noteikšana
|
—
|
Agarozes gelu tīra destilētā H2O.
|
|
—
|
Pēc tam agarozes gelu pārvieto etīdija bromīdā uz 15–30 minūtēm.
|
|
—
|
Tad ultravioletās gaismas kastē uzņem agarozes gela attēlu.
|
|
—
|
Visbeidzot, paraugus analizē, salīdzinot tos ar pozitīvu kontroles joslu (vai joslām) un kāpnēm.
|
10. papildinājums
Norādījumi audu paraugu ņemšanai, lai ar PCR metodi noteiktu ģenētisko dzimumu trīsadatu stagaram
Audu paraugu ņemšana un DNS ekstrakcija
DNS var ekstrahēt, lietojot dažādus tirdzniecībā pieejamus reaģentus un gan manuālā, gan automātiskā ekstrakcijas sistēmā. Turpmāk raksturots protokols, ko izmanto Cefas Weymouth laboratorija, un attiecīgā gadījumā ir norādītas arī citas metodes.
|
1.
|
Ar mazām šķērītēm katrai atsevišķajai zivij nogriež nelielu audu gabaliņu (10–20 mg) muguras sānu rajonā (pēc galvas un astes nogriešanas VTG analīzei). Šos audus ieliek mēģenē un tieši ievieto šķidrā slāpeklī (uzglabāšanai – 80 °C temperatūrā), vai piepilda ar 70 % etanolu (pārvadāšanai un turpmākai uzglabāšanai 4 °C temperatūrā). Šķēres pēc katras atsevišķās zivs apstrādes notīra 70 % etanolā, tad destilētā ūdenī un nosusina ar papīra salveti.
|
|
2.
|
Etanolu (ja ir) noņem ar atsūkšanas metodi, bet audus pa nakti sašķeļ ar proteināzi K, ievietojot tos 400 μl ATL buferšķīduma (kiagēna). Šķelšanas produkta alikvotu (200 μl) pārvieto uz 96 avotu S bloku (kiagēnu), un DNS ekstrahē 96 avotu formātā, izmantojot Qiagen Universal BioRobot un QIamp Investigator BioRobot komplektu. DNS eluē 50 μl ūdens, kas brīvs no DNāzes un RNāzes. Ja DNS ekstrakcijai izmanto cietos audus (piem., muguras vai krūšu spuras), paraugu var būt nepieciešams homogenizēt līzes buferšķīdumā, lietojot FastPrep® audu līzeri vai citu līdzvērtīgu audu sagraušanas sistēmu.
Citas iespējas
|
a)
|
Audus pa nakti sašķeļ ar proteināzi K, ievietojot tos 400 μl G2 līzes buferšķīduma (kiagēna), un DNS ekstrahē no 200 μl šķelšanas produkta, izmantojot EZ-1 DNS vieglo audu komplektu un EZ-1 biorobotu vai DNS vieglo audu minikomplektu. DNS eluē 50 μl tilpumā.
|
|
b)
|
Audus apstrādā ar DNSzola reaģentu. Īsumā, audu paraugus līzē 1 ml DNSzola 10 minūtes 1,5 ml mikrocentrifūgas mēģenē un tad centrifugē ar 13 000 apgriezienu minūtē piecas minūtes, lai atdalītu jebkuras cietās daļiņas. Līzēto paraugu pēc tam pārvieto jaunā 1,5 ml mikrocentrifūgas mēģenē, kurā atrodas 500 μl 100 % molekulārās kategorijas etanola, un tad centrifugē ar 13 000 apgriezienu minūtē 10 minūtes, lai DNS izkristu nogulsnēs. Etanolu nolej un aizstāj ar 400 μl 70 % molekulārās kategorijas etanola, centrifugē ar 13 000 apgriezienu minūtē piecas minūtes un DNS granulu izšķīdina 50 μl ūdens, kas brīvs no molekulārās DNāzes un RNāzes. Arī šoreiz, ja izmanto cietos audus (krūšu spuru), pirms DNS ekstrakcijas paraugu var būt nepieciešams homogenizēt līzes buferšķīdumā, lietojot FastPrep® audu līzeri vai citu līdzvērtīgu audu sagraušanas sistēmu.
|
|
|
3.
|
DNS uzglabā – 20 °C temperatūrā, kamēr tā ir nepieciešama.
|
Svarīga piezīme: procedūras laikā jāvalkā cimdi.
Polimerāzes ķēdes reakcijas (PCR) analīze
Amplifikāciju veic, izmantojot 2,5 μl DNS ekstrakta 50 μl reakcijas tilpumā, un tad lieto Idh lokusa praimerus (kā izklāstīts izdevumā: Peichel et al., 2004, Current Biology, 1:1416-1424).
|
Augšupejošais praimers
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Apgrieztais praimers
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Piemērotus PCR reaģentus piegādā daudzi piegādātāji. Turpmāk izklāstīto metodi pašlaik izmanto Cefas Weymouth laboratorijā.
1. “Reakcijas maisījuma” pagatavošana (50 μl katram paraugam)
Turpmāk izklāstīts, kā pagatavo pamatmaisījumu. To var pagatavot jau iepriekš un uzglabāt sasaldētu –20 °C temperatūrā, kamēr tas ir nepieciešams. Pagatavo pietiekami daudz pamatmaisījuma, lai varētu veikt negatīvo kontroli (tikai molekulārās bioloģijas kategorijas ūdenī).
|
|
Tilpums (krājuma konc.)/piemērs
|
Galīgā koncentrācija
|
|
5 x GoTaq® reakcijas buferšķīdums
|
10 μl
|
1 x
|
|
MgCl2
|
5 μl (25 mm)
|
2,5 mm
|
|
Nukleotīdi (dATP, dCTP, dGTP un dTTP)
|
0,5 μl (25 mm katrs)
|
250 μM katrs
|
|
Augšupejošais praimers
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Apgrieztais praimers
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Molekulārās bioloģijas kategorijas ūdens
|
30,75 μl
|
|
|
GoTaq polimerāze
|
0,25 μl
|
1,25 U
|
|
—
|
Iepilda 47,5 μl marķētā PCR mēģenē ar 0,5 ml plānu sienu.
|
|
—
|
Pienācīgi marķētā mēģenē pievieno 2,5 μl attīrītas DNS. Atkārto visiem paraugiem un negatīvajai kontrolei.
|
|
—
|
Pārlej ar diviem pilieniem minerāleļļas. Kā alternatīvu izmanto termokameru ar apsildāmu vāku.
|
|
—
|
Paraugus denaturē Peltjē PTC-225 termokamerā 94 ± 2 °C temperatūrā piecas minūtes, tad veic 39 ciklus 94 ± 2 °C temperatūrā pa vienai minūtei, 55 ± 2 °C temperatūrā pa vienai minūtei un 72 ± 2 °C temperatūrā pa vienai minūtei, kā arī galīgo paplašināšanu 72 ± 2 °C temperatūrā 10 minūtes.
|
2. Agarozes gela (2 %) pagatavošana
Parasti PCR produktus izšķīdina 20 % agarozes gelā, kas satur etīdija bromīdu.
Var izmantot arī kapilārās elektroforēzes sistēmas.
|
—
|
Nosver 2 g agarozes 100 ml 1 × TAE buferšķīduma.
|
|
—
|
Silda mikroviļņos (aptuveni 2–3 min.), lai izšķīdinātu agarozi.
|
|
—
|
Pievieno divus pilienus etīdija bromīda ar galīgo koncentrāciju 0,5 μg/ml.
|
|
—
|
Ielej karsto šķīdumu gela liešanas iekārtā.
|
3. Gela elektroforēze
|
—
|
Ielej agarozes gelu elektroforēzes iekārtā un iemērc 1 × TAE buferšķīdumā.
|
|
—
|
Ievieto 20 μl katra parauga atsevišķā joslā, pievienojot molekulārā svara marķieri (100 bp DNS kāpņu Promega) rezerves joslā.
|
|
—
|
Elektroforēzi veic pie 120 V 30–45 minūtes.
|
4. Paplašināšanas produktu vizualizācija
Ja etīdija bromīds ir iekļauts agarozes gelā, kā iepriekš minēts, DNS produktus vizualizē ultravioletās gaismas avotā. Agarozes gelu var arī iekrāsot, pārklājot gelu etīdija bromīda atšķaidītā šķīdumā (0,5 μg/ml ūdenī) 30 minūtes pirms vizualizācijas.
11. papildinājums
Norādījumi trīsadatu stagara mākslīgās apaugļošanas procedūrai
Šīs nodaļas mērķis ir raksturot procedūras, kā iegūt apaugļotus trīsadatu stagara ikrus, lai tās izmantotu FSDT.
Procedūras
Spermas ieguve no tēviņiem
|
1.
|
Eitanazē spilgti iekrāsotu izvēlētās populācijas tēviņu.
|
|
2.
|
Sēkliniekus atdala no abiem zivs sāniem. Sēkliniekiem parasti ir izteikta pigmentācija un stienīšu formas struktūras, kas viegli saskatāmas pie ķermeņa sānu viduslīnijas. Lieto kādu no turpmāk izklāstītajām metodēm.
|
|
3.
|
Ar nelielām šķērītēm, sākot no kloākas, vienā griezienā izveido 1–1,5 cm garu iegriezumu aptuveni 45 grādu leņķī.
|
|
4.
|
Ar skalpeli izveido nelielu iegriezumu zivs sānos uzreiz aiz iegurņa un sānu plātnēs nedaudz uz vēdera pusi.
|
|
5.
|
Sēkliniekus izņem ar mazu pinceti un ievieto Petri platē.
|
|
6.
|
Katru sēklinieku pārlej ar 100 μl svaigi pagatavota Henka gala šķīduma
(31).
|
|
7.
|
Sēkliniekus smalki sagriež gabaliņos ar žileti vai skalpeli. Tādējādi izdalīsies sperma un Henka šķīdums iegūs pienainu izskatu.
|
|
8.
|
Šķidrumu, kas satur spermu, ielej mēģenē, vienlaikus cenšoties neielaist tajā nevienu sēklinieku audu gabaliņu, kad rīkojas ar pipeti.
|
|
9.
|
800 μl Henka gala šķīduma ielej mēģenē un rūpīgi samaisa.
|
|
10.
|
Ja nepieciešams, tēviņu var saglabāt, fiksējot to 100 % etanolā vai citā vēlamā fiksācijas šķīdumā. Tas ir īpaši svarīgi, ja pētījumā nosaka vecākus, no kuriem cēlušies pēcnācēji.
|
Svarīga piezīme:
kaut arī lielākā daļa nepieciešamo izejšķīdumu ir sagatavojami iepriekš,
5. bāze
un līdz ar to arī
gala šķīdums
ir jāpagatavo
svaigs
lietošanas dienā.
|
1. bāze
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Destilēts ūdens (DW)
|
100 ml
|
|
2. bāze
|
|
Na2HPO4 (bezūdens)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Destilēts ūdens
|
100 ml
|
|
3. bāze
|
|
CaCl2
|
0,72 g
|
|
Destilēts ūdens
|
50 ml
|
|
4. bāze
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
Destilēts ūdens
|
50 ml
|
|
5. bāze (svaigi pagatavota)
|
|
NaHCO3
|
0,35 g
|
|
Destilēts ūdens
|
10 ml
|
Piezīme. Ja jums jau ir kādi no iepriekš minētajiem sāļiem, bet ar citu ūdens saturu (t. i., 2H2O, nevis bezūdens), varat tomēr tos lietot, taču pirms tam pielāgojiet svaru, pamatojoties uz molekulāro svaru).
Henka gala šķīdumā kombinēšanas secība ir šāda:
|
1. bāze
|
1,0 ml
|
|
2. bāze
|
0,1 ml
|
|
3. bāze
|
0,1 ml
|
|
Destilēts ūdens
|
8,6 ml
|
|
4. bāze
|
0,1 ml
|
|
5. bāze
|
0,1 ml
|
Pirms lietošanas rūpīgi samaisa.
Apaugļošana
|
1.
|
Vēlamajā populācijā atlasa lielas nobriedušas mātītes; tās ir gatavas ikru izspiešanai tikai tad, kad redzat no kloākas uz āru izvirzītus ikrus. Gatavām mātītēm ir raksturīga “paceltas galvas” poza.
|
|
2.
|
Viegli bīda rādītājpirkstu vai īkšķi lejup gar zivs sānu astes virzienā, lai stimulētu ikru maisa izkrišanu svaigā Petri platē. Atkārto no otra sāna un ievieto zivi atpakaļ traukā.
|
|
3.
|
Ikrus var izkliedēt (izveidojot vienu slāni) ar smalku otiņu. Būtiski ir censties pakļaut spermas iedarbībai iespējami daudzus ikrus, nodrošinot maksimāli plašu ikru virsmu. Svarīga piezīme: nodrošiniet ikriem mitrumu, pārklājot tos ar samitrinātu salveti (ir svarīgi, lai ikri tieši nesaskartos ar ūdeni, kas var priekšlaikus nocietināt horionu, neļaujot apaugļoties). Mātītes var saražot ļoti atšķirīgu ikru skaitu, taču vidēji no vienas nobriedušas mātītes var viegli iegūt aptuveni 150 ikrus.
|
|
4.
|
25 μl spermas Henka maisījumā ar otiņu vienmērīgi izkliedē pāri visu ikru virsmai. Kad apaugļošana sāksies, ikri strauji sacietēs un mainīs krāsu (vienas minūtes laikā). Ja aplēstais ikru skaits pārsniedz 150, atkārtojiet minēto procedūru. Tāpat, ja ikri nesacietē vienas minūtes laikā, pievienojiet nedaudz vairāk spermas. Svarīga piezīme: spermas daudzuma palielināšana ne vienmēr uzlabo apaugļošanas ātrumu.
|
|
5.
|
Ikru un spermas šķīdumu atstāj “mijiedarbībai” vismaz uz 15 minūtēm, un apaugļotos ikrus ievieto ekspozīcijas akvārijā 1,5 stundu laikā pēc apaugļošanas.
|
|
6.
|
Šo procedūru atkārto ar citu mātīti, kamēr ir savākts vēlamais ikru skaits.
|
|
7.
|
Rezervē dažus ikrus no pēdējās partijas, un fiksē tos 10 % etiķskābē.
|
Ikru skaitīšana un izkliedēšana testa akvārijā
|
1.
|
Ikri vienmērīgi jāizkliedē starp visiem apstrādes līmeņiem, lai nepieļautu ģenētiskas novirzes. Visas apaugļoto ikru partijas sadala vienāda lieluma grupās (atbilstoši apstrādes līmeņu skaitam), izmantojot neasu instrumentu (t. i., platasmens entomoloģijas pinceti vai potēšanas cilpu). Ja mērķis katrā apstrādē ir četri replikāti ar 20 ikriem katrā, tad ekspozīcijas akvārijā jāizkliedē 80 ikri. Svarīga piezīme: ieteicams pievienot papildu 20 % (t. i., 96 ikrus katrā apstrādes līmenī), kamēr esat drošs, ka nodrošināsiet 100 % apaugļošanu.
|
|
2.
|
Stagara ikri ārpus tēva apsargātās ligzdas ir ļoti uzņēmīgi pret sēnīšu infekcijām. Tādēļ ir īpaši būtiski pirmās piecas testēšanas dienas apstrādāt visus ikrus ar metilēnzilo. Metilēnzilā izejšķīdumu sagatavo kā 1 mg/ml un ielej ekspozīcijas akvārijā, lai maksimālā gala koncentrācija būtu 2,125 mg/l. Svarīga piezīme: stagarus nedrīkst apstrādāt ar metilēnzilo pēc izšķilšanās, lai pēc sestās dienas sistēma būtu brīva no metilēnzilā.
|
|
3.
|
Ikrus pārbauda katru dienu, un reģistrē visus mirušos vai neapaugļotos ikrus. Svarīga piezīme: pirms izšķilšanās ikri nedrīkst atrasties ārpus ūdens, pat ne uz ļoti īsu brīdi.
|
C.42. BIONOĀRDĀMĪBA JŪRAS ŪDENĪ
VISPĀRĪGS IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 306 (1992. gads). Kad tika izstrādātas oriģinālās testēšanas metodes, nebija zināms, kādā mērā jūras videi var piemērot rezultātus, ko sniedz skrīninga testi attiecībā uz tūlītēju bionoārdāmību, kā inokulātu izmantojot saldūdeni, notekūdeņu efluentu vai aktivētās dūņas. Ir saņemti ziņojumi par atšķirīgiem rezultātiem šajā jomā (piem., (1)).
|
|
2.
|
Daudzi industriālie notekūdeņi, kas satur dažādas ķīmiskās vielas, nonāk jūrā kā tiešas ieplūdes vai ar grīvu un upju starpniecību, kur to atrašanās ilgums ir neliels, salīdzinot ar laikposmu, kas nepieciešams daudzu klātesošo ķīmisko vielu pilnīgai bioloģiskai noārdīšanai. Arvien paaugstinoties izpratnei par nepieciešamību aizsargāt jūras vidi pret augošo ķīmisko vielu slodzi un nepieciešamību novērtēt ķīmisko vielu varbūtējo koncentrāciju jūrā, tika izstrādātas testēšanas metodes attiecībā uz bionoārdāmību jūras ūdenī.
|
|
3.
|
Šeit raksturotās metodes izmanto dabisko jūras ūdeni gan kā ūdens, gan kā mikroorganismu avotu. Cenšoties nodrošināt atbilstību metodēm attiecībā uz tūlītēju bionoārdāmību saldūdenī, tika pētīta īpaši filtrēta un centrifugēta jūras ūdens izmantošana, kā arī jūras sedimentu izmantošana par inokulātu. Šie pētījumi bija nesekmīgi. Tādēļ testēšanas barotne ir dabisks jūras ūdens, kas iepriekš attīrīts, lai aizvāktu rupjās daļiņas.
|
|
4.
|
Lai novērtētu galīgo bionoārdāmību ar “kolbu kratīšanas” metodi, ir jānodrošina salīdzinoši augstas testējamās vielas koncentrācijas, jo izšķīdušā organiskā oglekļa (DOC) analītiskajai metodei ir vāja jutība. Savukārt tādēļ jūras ūdenim ir nepieciešams pievienot minerālvielas (N un P), kuru zemā koncentrācija pretējā gadījumā ierobežotu DOC noārdīšanu. Arī izmantojot “slēgtās pudeles” metodi, pievienotās testējamās vielas koncentrācijas dēļ nepieciešams pievienot uzturvielas.
|
|
5.
|
Tādējādi šīs metodes nav testi tūlītējas bionoārdāmības noteikšanai, jo papildus jūras ūdenī jau esošajiem mikroorganismiem netiek pievienots nekāds inokulāts. Šie testi arī nemodelē jūras vidi, jo tiek pievienotas uzturvielas un testējamās vielas koncentrācija ir daudz augstāka nekā tā būtu jūrā. Šo iemeslu dēļ minētās metodes tiek piedāvātas jaunā apakšnodaļā “Bionoārdāmība jūras ūdenī”.
|
PIEMĒROŠANA
|
6.
|
Pirmo iespaidu par bionoārdāmību jūras ūdenī sniedz tādu testu rezultāti, kurus veic tādēļ, ka attiecīgās vielas lietošanas un likvidēšanas modelis liecina par tās nonākšanu jūrā. Ja rezultāts ir pozitīvs (> 70 % DOC noārdīšana; > 60 % ThOD – teorētiskais skābekļa patēriņš), var secināt, ka jūras vidē ir bioloģiskās noārdīšanās potenciāls. Tomēr arī negatīvs rezultāts neizslēdz šādu potenciālu, bet liecina, ka ir nepieciešama papildu izpēte, piem., izmantojot iespējami zemāku testējamās vielas koncentrāciju.
|
|
7.
|
Jebkurā gadījumā, ja nepieciešama konkrētāka vērtība, kas raksturo bioloģiskās noārdīšanās ātrumu vai pakāpi jūras ūdenī kādā konkrētā vietā, jāizmanto citas, kompleksākas un sarežģītākas un tādēļ arī dārgākas metodes. Piemēram, var veikt modelēšanas testu ar tādu testējamās vielas koncentrāciju, kas ir tuvāka iespējamai koncentrācijai vidē. Tāpat var izmantot arī nebagātinātu un iepriekš neattīrītu jūras ūdeni, kas ņemts no interesējošās vietas, un primāro bionoārdīšanos var pētīt īpašā ķīmiskā analīzē. Galīgo bionoārdāmību var izpētīt, lietojot vielas ar 14C marķējumu, lai varētu izmērīt izšķīdināmā organiskā 14C izzušanas ātrumu un 14CO2 veidošanās ātrumu videi reālistiskās koncentrācijās.
|
METOŽU IZVĒLE
|
8.
|
Piemērojamās metodes izvēle ir atkarīga no vairākiem apstākļiem; izvēli atvieglos turpmāk sniegtā tabula. Vielas, kuru šķīdība ūdenī ir zemāka par aptuveni 5 mg C/l ekvivalentu, nevar testēt ar “kolbu kratīšanas” metodi, bet grūti šķīstošās vielas vismaz principā var testēt ar “slēgtās pudeles” metodi.
Tabula.
“Kolbu kratīšanas” testa un “slēgtās pudeles” testa priekšrocības un trūkumi
|
METODE
|
PRIEKŠROCĪBAS
|
TRŪKUMI
|
|
KOLBU KRATĪŠANA
|
|
—
|
vienkārša aparatūra, izņemot C analizatoru
|
|
—
|
60 dienu ilgums nerada problēmas
|
|
—
|
var pielāgot gaistošām vielām
|
|
|
—
|
nepieciešams C analizators
|
|
—
|
patērē 5–40 mg DOC/1, varētu būt inhibējoša
|
|
—
|
DOC noteikšana jūras ūdenī ir apgrūtināta zemā koncentrācijā (hlorīda efekts)
|
|
—
|
jūras ūdenī dažkārt ir augsta DOC koncentrācija
|
|
|
SLĒGTĀ PUDELE
|
|
—
|
vienkārša galīgā noteikšana
|
|
—
|
izmanto zemu testējamās vielas koncentrāciju (2 mg/l), tādēļ mazāka inhibēšanas iespēja
|
|
—
|
viegli pielāgojama gaistošām vielām
|
|
|
—
|
var būt grūti uzturēt gaisa necaurlaidību pudelēm
|
|
—
|
masveidīgs baktēriju pieaugums var izraisīt kļūdainas vērtības
|
|
—
|
tukšās O2 uzņemšanas vērtības var būt augstas, jo īpaši pēc 28 dienām; to var novērst, ļaujot jūras ūdenim nostāvēties
|
|
—
|
iespējami traucējumi, ko radīs O2 uzņemšana nitrifikācijas rezultātā
|
|
|
“KOLBU KRATĪŠANAS” METODE
IEVADS
|
1.
|
Šī metode ir grozītā ESAO skrīninga testa, kas aprakstīts šā pielikuma C.4B. nodaļā (2), variants jūras ūdenī. Tā tika izstrādāta starplaboratoriju salīdzinošās testēšanas rezultātā, kuru Eiropas Komisijas (EK) uzdevumā organizēja Dānijas Ūdens kvalitātes institūts (3).
|
|
2.
|
Tāpat kā saistītajā “slēgtās pudeles” metodē ar jūras ūdeni šā testa rezultāti nav uzskatāmi par tūlītējas bionoārdāmības rādītājiem, bet ir jāizmanto tikai informācijas iegūšanai par vielu bionoārdāmību jūras vidē.
|
METODES PRINCIPS
|
3.
|
Iepriekš noteiktu testējamās vielas daudzumu izšķīdina testēšanas barotnē, lai iegūtu izšķīdinātā organiskā oglekļa (DOC)/l 5–40 mg koncentrāciju. Ja organiskā oglekļa analīzes jutīguma robežas ir uzlabotas, sekmīgāka var būt zemākas testējamās vielas koncentrācijas izmantošana, jo īpaši attiecībā uz inhibējošām vielām. Testējamās vielas šķīdumu testa barotnē pakļauj inkubācijai, maisot tumsā vai izkliedētā gaismā aerobos apstākļos fiksētā temperatūrā (kontrolējot līdz ± 2 °C), kas parasti būs diapazonā 15–20 °C. Ja pētījuma mērķis ir modelēt vides situācijas, testus var veikt ārpus šā normālā temperatūras diapazona. Ieteicamais maksimālais testēšanas ilgums ir aptuveni 60 dienas. Pēc noārdīšanās veic DOC mērījumus (galīgā noārdīšanās) un dažos gadījumos – īpašu analīzi (primārā noārdīšanās).
|
INFORMĀCIJA PAR TESTĒJAMO VIELU
|
4.
|
Lai uzzinātu, vai konkrētai vielai var veikt attiecīgo testu, jāzina vairākas tās īpašības. Jānosaka organiskā oglekļa saturs vielā, un tās gaistamībai jābūt tādai, lai testa gaitā nerastos būtiski zudumi, bet šķīdībai ūdenī jābūt lielākai par 25–40 mg C/l ekvivalentu. Testējamā viela arī nedrīkst būtiski adsorbēt uz stikla virsmām. Iegūto rezultātu interpretēšanai vajadzīga informācija par testējamās vielas tīrību vai galveno sastāvdaļu salīdzinošajām proporcijām, jo īpaši gadījumos, kad rezultāti ir tuvi “pieņemamam” līmenim.
|
|
5.
|
Piemērotāko testa koncentrāciju izvēlei var noderēt informācija par testējamās vielas toksisko iedarbību uz baktērijām, piem., īstermiņa elpošanas ātruma testa (4) mērījumi, un tā var būt svarīga bionoārdāmības zemo vērtību pareizai interpretēšanai. Tomēr ne vienmēr ar šo informāciju pietiek, lai interpretētu bioloģiskās noārdīšanās testa rezultātus, un 18. punktā izklāstītā procedūra ir piemērotāka.
|
STANDARTVIELAS
|
6.
|
Pārbaudot jūras ūdens parauga mikrobiālo aktivitāti, jāizmanto piemērotas standartvielas. Šim nolūkam var izmantot tādas vielas kā nātrija benzoāts, nātrija acetāts un anilīns. Standartvielām ir jānoārdās pietiekami īsā laikā, pretējā gadījumā ir ieteicams atkārtot testu ar citu jūras ūdens paraugu.
|
|
7.
|
EK starplaboratoriju salīdzinošajā testēšanā, kurai jūras ūdens paraugi tika ņemti dažādās vietās un dažādos gadalaikos (3), adaptācijas (lag) fāze (tL) un laiks, kad jāsasniedz 50 % noārdīšanās (t50), izņemot adaptācijas fāzi, ilga no 1 līdz 4 dienām un nātrija benzoātam – attiecīgi no 1 līdz 7 dienām. Anilīnam tL bija no 0 līdz 10 dienām, bet t50 – no 1 līdz 10 dienām.
|
METODES ATKĀRTOJAMĪBA UN JUTĪBA
|
8.
|
Metodes atkārtojamība tika noteikta starplaboratoriju salīdzinošajā testēšanā (3). Testējamās vielas zemāko koncentrāciju, kurai var izmantot šo metodi ar DOC analīzi, lielākoties nosaka organiskā oglekļa analīzes detektēšanas robeža (pašlaik aptuveni 0,5 mg C/l) un izšķīdinātā organiskā oglekļa koncentrācija izmantotajā jūras ūdenī (parasti aptuveni 3–5 mg/l ūdenim, kas ņemts atklātā jūrā). DOC fona koncentrācija nedrīkst pārsniegt aptuveni 20 % kopējās DOC koncentrācijas pēc testējamās vielas pievienošanas. Ja tas nav iespējams, DOC fona koncentrāciju dažkārt var samazināt, nostādinot jūras ūdeni pirms testēšanas. Ja šo metodi lieto tikai ar īpašo ķīmisko analīzi (ar ko mēra primāro noārdīšanos), pētniekam, sniedzot papildu informāciju, ir jādokumentē, vai ir paredzama galīgā noārdīšanās. Šī papildu informācija var sastāvēt no citu testu rezultātiem attiecībā uz tūlītēju vai raksturīgu bionoārdāmību.
|
METODES APRAKSTS
Aprīkojums
|
9.
|
Parastais laboratorijas aprīkojums un:
|
a.
|
laboratorijas kratītājs, kurā ietilpst 0,5–2 litru Erlenmeijera kolbas ar automātisku temperatūras kontroli vai tāds, ko izmanto konstantas 15–20 °C temperatūras telpā, kontrolējot ± 2 °C robežās;
|
|
b.
|
0,5–2 litru Erlenmeijera kolbas ar šauru kaklu;
|
|
c.
|
membrānfiltrācijas aparāts vai centrifūga;
|
|
d.
|
membrānfiltri, 0,2–0,45 μm;
|
|
f.
|
iekārtas specifiskām analīzēm (pēc izvēles).
|
|
Jūras ūdens
|
10.
|
Paņem jūras ūdens paraugu rūpīgi iztīrītā konteinerā, un nogādā to laboratorijā, vislabāk – vienas vai divu dienu laikā pēc parauga paņemšanas. Pārvadāšanas laikā parauga temperatūrai neļauj būtiski pārsniegt testa gaitā piemēroto temperatūru. Precīzi atzīmē parauga ņemšanas vietu, un raksturo tās piesārņotību un uzturvielu pieejamību. Jo īpaši attiecībā uz piekrastes ūdeņiem šajā raksturojumā iekļauj heterotrofo mikroorganismu koloniju skaitu un izšķīdušo nitrātu, amonjaka un fosfātu noteiktās koncentrācijas.
|
|
11.
|
Par pašu jūras ūdens paraugu sniedz šādu informāciju:
|
—
|
parauga ņemšanas datums;
|
|
—
|
parauga izskats – duļķains utt.;
|
|
—
|
temperatūra parauga ņemšanas laikā;
|
|
—
|
laiks starp parauga paņemšanu un izmantošanu testā.
|
|
|
12.
|
Ja konstatē, ka DOC saturs jūras ūdens paraugā ir augsts (8. punkts), pirms lietošanas jūras ūdeni ieteicams nostādināt aptuveni vienu nedēļu. Nostādina, uzglabājot aerobos apstākļos testēšanas temperatūrā un tumsā vai izkliedētā gaismā. Ja nepieciešams, aerobos apstākļus uztur ar vieglu aerāciju. Nostādināšanas laikā samazinās viegli noārdāmā organiskā materiāla saturs. Starplaboratoriju salīdzinošajā testēšanā (3) netika konstatēta nekāda atšķirība starp nostādināta un svaigi paņemta jūras ūdens parauga noārdīšanās potenciālu. Jūras ūdeni pirms lietošanas iepriekš apstrādā, lai aizvāktu rupjās daļiņas, piem., filtrējot caur neilona filtru vai raupja papīra filtru (nelieto membrānas vai GFC filtrus), vai sedimentējot un dekantējot. Izmantotā procedūra ir jānorāda. Iepriekšēju apstrādi veic pēc nostādināšanas, ja to izmanto.
|
Minerālvielu izejšķīdumi
|
13.
|
No analītiskas tīrības pakāpes reaģentiem pagatavo šādus izejšķīdumus.
|
a)
|
Kālija dihidrogēnortofosfāts, KH2PO4
|
8,50 g
|
|
Dikālija hidrogēnortofosfāts, K2HPO4
|
21,75 g
|
|
Dinātrija hidrogēnortofosfāta dihidrāts, Na2HPO4 · 2H2O
|
33,30 g
|
|
Amonija hlorīds, NH4Cl
|
0,50 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
|
b)
|
Kalcija hlorīds, CaCl2
|
27,50 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
|
c)
|
Magnija sulfāta heptahidrāts, mgSO4 · 7H2O
|
22,50 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
|
d)
|
Dzelzs (III) hlorīda heksahidrāts, FeCl3 . 6H2O
|
0,25 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
Nogulsnēšanos d) šķīdumā var novērst, pievienojot vienu pilienu koncentrēta HCl vai 0,4 g etilēnediaminetetra-etiķskābes (EDTA, dinātrija sāls) uz litru. Ja nogulsnes veidojas izejšķīdumā, to nomaina ar svaigi pagatavotu šķīdumu.
|
Testēšanas barotnes sagatavošana
|
14.
|
Pievieno 1 ml katra iepriekš minētā izejšķīduma uz litru iepriekš apstrādāta jūras ūdens.
|
Inokulāts
|
15.
|
Nepievieno nekādu citu inokulātu papildus tiem mikroorganismiem, kas jau atrodas jūras ūdenī. (Pēc izvēles) nosaka kolonijas veidojošo heterotrofu skaitu jūras ūdens testēšanas barotnē (un vislabāk arī oriģinālajos jūras ūdens paraugos), piem., pēc dzīvotspējīgo mikroorganismu skaita, izmantojot jūras agaru. Tas ir īpaši vēlams paraugiem no piekrastes vai piesārņotām vietām. Pārbauda heterotrofo mikroorganismu aktivitāti jūras ūdenī, veicot testu ar standartvielu.
|
Kolbu sagatavošana
|
16.
|
Nodrošina visu stikla trauku prefektu tīrību, bet ne vienmēr sterilitāti (piem., izmantojot spirta hlorūdeņražskābi), pirms lietošanas tos noskalo un nožāvē, lai nepieļautu piesārņošanos ar iepriekšējo testu atliekām. Kolbas vēlreiz iztīra pirms pirmās lietošanas.
|
|
17.
|
Testējamās vielas vienlaikus novērtē divās kolbās, kā arī standartvielu atsevišķā kolbā. Divreiz veic tukšu testu bez testējamās vielas un bez standartvielas, lai noteiktu analītiskās kontroles. Izšķīdina testējamās vielas testēšanas barotnē, un tās ir ērti pievienot ar koncentrēta izejšķīduma starpniecību, nodrošinot vēlamās sākuma koncentrācijas, kas parasti ir 5–40 mg DOC/l. Parasti standartvielas testē ar sākuma koncentrāciju, kas atbilst 20 mg DOC/l. Ja izmanto testējamo un/vai standartvielu izejšķīdumus, nodrošina, lai jūras ūdens barotnes sāļums būtiski nemainītos.
|
|
18.
|
Ja ir paredzama toksiska iedarbība vai to nav iespējams novērst, testēšanas plānā ieteicams iekļaut arī divreizēju inhibēšanas eksperimentu. Testējamās un standartvielas ielej tajā pašā traukā, parasti paredzot tādu pašu standartvielas koncentrāciju kā kontroltestā (t. i., 20 mg DOC/l), lai varētu salīdzināt.
|
|
19.
|
Izšķīdina pietiekamus testēšanas šķīdumu daudzumus Erlenmeijera kolbās (piemērots apjoms ir aptuveni puse kolbas tilpuma), un pēc tam noslēdz katru kolbu ar vaļīgu vāciņu (piem., no alumīnija folijas), nodrošinot gāzes apmaiņas iespēju starp kolbu un apkārtējo gaisu. (Veicot DOC analīzi, kokvilnas vates aizbāžņi nav piemēroti.) Ievieto traukus kratītājā un vienmērīgi krata ar nelielu ātrumu (piem., 100 apgriezieniem minūtē) visu testa laiku. Kontrolē temperatūru (15–20 °C, nepārsniedzot ± 2 °C), un aizsedz traukus no gaismas, lai nepieļautu aļģu augšanu. Nodrošina, lai gaisā nebūtu toksisku materiālu.
|
Fizikāli ķīmiskās kontroles tests (pēc izvēles)
|
20.
|
Ja ir aizdomas par abiotisku noārdīšanos vai zudumu mehānismiem, piem., hidrolīzi (šī problēma saistās tikai ar īpašo analīzi), izgarošanu vai adsorbciju, ieteicams veikt fizikāli ķīmiskās kontroles eksperimentu. To var izdarīt, pievienojot dzīvsudraba (II) hlorīdu (HgCl2) (32) (50–100 mg/l) traukos ar testējamo vielu, lai apturētu mikrobiālo aktivitāti. Būtisks DOC vai īpašās vielas koncentrācijas samazinājums fizikāli ķīmiskās kontroles testā liecina par abiotiskiem noārdīšanas mehānismiem. (Lietojot dzīvsudraba hlorīdu, īpaša uzmanība jāpievērš traucējumiem vai katalizatora saindēšanai DOC analīzē.)
|
Kolbu skaits
|
21.
|
Parasti testos izmanto šādas kolbas:
|
1. un 2. kolba
|
–
|
satur testējamo vielu (testējamo suspensiju);
|
|
3. un 4. kolba
|
–
|
satur tikai jūras ūdeni (kontroltests);
|
|
5. kolba
|
–
|
satur standartvielu (procedūras kontrolei);
|
|
6. kolba
|
–
|
satur testējamo un standartvielu (toksiskuma kontrolei), pēc izvēles;
|
|
7. kolba
|
–
|
satur testējamo vielu un sterilizācijas līdzekli (abiotiskai sterilitātes kontrolei), pēc izvēles.
|
|
DOC analīze
|
22.
|
Testa gaitā piemērotos laika intervālos izņem paraugus DOC analīzei (1. papildinājums). Paraugus vienmēr izņem testa sākumā (0. dienā) un 60. dienā. Lai raksturotu noārdīšanās secību laikā, kopumā ir nepieciešami vismaz pieci paraugi. Nav iespējams noteikt nemainīgu laika grafiku paraugu ņemšanai, jo bioloģiskās noārdīšanās ātrums ir mainīgs. Katram paraugam DOC noteikšanu veic divreiz.
|
Paraugu ņemšana
|
23.
|
Nepieciešamais paraugu lielums ir atkarīgs no analītiskās metodes (konkrētās analīzes), izmantotā oglekļa analizatora un procedūras (membrānfiltrēšana vai centrifugēšana), kas izvēlēta parauga apstrādei pirms oglekļa noteikšanas (25. un 26. punkts). Pirms parauga ņemšanas pārliecinās, vai testēšanas barotne ir rūpīgi samaisīta un jebkurš materiāls, kas pielipis kolbas sienai, ir izšķīdis vai novākts.
|
|
24.
|
Membrānfiltrēšanu vai centrifugēšanu veic uzreiz pēc parauga paņemšanas. Ja nepieciešams, filtrētos vai centrifugētos paraugus uzglabā 2–4 °C temperatūrā līdz 48 stundām vai zemāk par –18 °C temperatūru – ilgāku laiku (ja ir zināms, ka viela netiks ietekmēta, pirms uzglabāšanas to skābina līdz pH 2).
|
|
25.
|
Membrānfiltri (0,2–0,45 μm) ir derīgi, nodrošinot, ka tie neizdala oglekli un neadsorbē vielu filtrēšanas posmā, piem., polikarbonāta membrānfiltri. Daži membrānfiltri ir piesūcināti ar virsmaktīvām vielām to hidrofilizācijai un var izdalīt ievērojamu daudzumu izšķīdināta oglekļa. Šādus filtrus sagatavo, vārot dejonizētā ūdenī trīs vienu stundu ilgus periodus pēc kārtas. Pēc vārīšanas šos filtrus uzglabā dejonizētajā ūdenī. Pirmos 20 ml filtrāta izlej.
|
|
26.
|
Paraugu centrifugēšanu var izvēlēties kā alternatīvu membrānfiltrēšanai. Centrifugē ar 40 000 m.s– 2 (~ 4 000 g) 15 minūtes, vislabāk – atdzesētā centrifūgā.
Piezīme. Šķiet, ka kopējā organiskā oglekļa (TOC) diferencēšana pa visu DOC (TOC/DOC), centrifugējot ar ļoti zemām koncentrācijām, nelīdzēs, jo visas baktērijas netiks aizvāktas, vai arī ogleklis kā baktēriju plazmas daļa tiks no jauna izšķīdināts. Šķiet arī, ka, paaugstinot testa koncentrācijas (> 10 mg C uz litru), centrifugēšanas kļūda būs salīdzinoši neliela.
|
Paraugu ņemšanas biežums
|
27.
|
Ja analīzes veic uzreiz pēc parauga paņemšanas, nākamreiz ņemot paraugu, ņem vērā arī šo analīžu rezultātu.
|
|
28.
|
Ja paraugus saglabā (24. punkts), lai analizētu vēlāk, paņem vairāk paraugu, nevis tikai nepieciešamo minimālo skaitu, piecus. Vispirms analizē pēdējos paraugus, un veicot piemērotu paraugu pakāpeniski “atpakaļejošu” atlasi analīzei, ir iespējams iegūt pareizu aprakstu par bioloģiskās noārdīšanās līkni ar salīdzinoši nedaudzām analītiskām darbībām. Ja līdz testa beigām vispār nenotiek nekāda noārdīšanās, papildu paraugi nav jāanalizē, un šādā situācijā “atpakaļejošā” stratēģija var ietaupīt būtiskas analīzes izmaksas.
|
|
29.
|
Ja noārdīšanās līknes stacionāro fāzi konstatē pirms 60. dienas, testu beidz. Ja noārdīšanās kā parasti sākas pirms 60. dienas, bet nav sasniegusi stacionāro fāzi, eksperimentu pagarina vēl uz vienu periodu.
|
DATI UN ZIŅOŠANA
Rezultātu apstrāde
|
30.
|
Analīžu rezultātus reģistrē pievienotajā datu lapā (2. papildinājums), un bioloģiskās noārdīšanās vērtības aprēķina gan testējamai vielai, gan standartvielai, izmantojot vienādojumu:
kur:
|
Dt
|
=
|
DOC procentuālā noārdīšanās vai konkrētas vielas noārdīšanās laikā t;
|
|
Co
|
=
|
DOC vai konkrētas vielas sākuma koncentrācija testēšanas barotnē;
|
|
Ct
|
=
|
DOC vai konkrētas vielas koncentrācija testēšanas barotnē laikā t;
|
|
Cbl(0)
|
=
|
DOC vai konkrētas vielas sākuma koncentrācija tukšajā testā;
|
|
Cbl(t)
|
=
|
DOC vai konkrētas vielas koncentrācija tukšajā testā laikā t.
|
|
|
31.
|
Noārdīšanos norāda kā noārdītā DOC procentu (galīgā noārdīšanās) vai noārdījušās konkrētās vielas procentu (primārā noārdīšanās) laikā t. DOC koncentrācijas aprēķina līdz tuvākajam 0,1 mg uz litru, bet Dt vidējās vērtības noapaļo līdz tuvākajam veselajam procentam.
|
|
32.
|
Noārdīšanās gaitu grafiski ilustrē shēmā, kā parādīts attēlā nodaļā “Rezultātu derīgums un interpretācija”. Ja datu pietiek, no līknes aprēķina adaptācijas fāzi (tL) un laiku, kas nepieciešams, lai sasniegtu 50 % noārdīšanos, sākot no adaptācijas fāzes beigām (t50).
|
Testēšanas pārskats
|
33.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā viela:
|
—
|
fizikālās īpašības un attiecīgā gadījumā fizikāli ķīmiskās īpašības;
|
|
|
|
Testēšanas apstākļi:
|
—
|
paraugu ņemšanas vietas novietojums un apraksts; piesārņojuma un uzturvielu situācija (koloniju skaits, nitrāti, amonjaks un fosfāti, ja attiecināms);
|
|
—
|
parauga īpašības (paņemšanas datums, dziļums, izskats, temperatūra, sāļums, DOC (pēc izvēles)), laiks starp parauga paņemšanu un izmantošanu testā;
|
|
—
|
izmantotā metode (ja ir) jūras ūdens nostādināšanai;
|
|
—
|
izmantotā metode jūras ūdens iepriekšējai apstrādei (filtrēšana/sedimentācija);
|
|
—
|
izmantotā metode DOC noteikšanai;
|
|
—
|
izmantotā metode specifiskajai analīzei (pēc izvēles);
|
|
—
|
izmantotā metode heterotrofu skaita noteikšanai jūras ūdenī (dzīvotspējīgo mikroorganismu skaita metode vai cita procedūra) (pēc izvēles);
|
|
—
|
citas metodes (pēc izvēles), ko izmanto jūras ūdens raksturošanai (ATP mērījumi utt.).
|
|
|
|
Rezultāti:
|
—
|
analīzes dati ir paziņoti datu lapā (2. papildinājums);
|
|
—
|
noārdīšanās testa gaita ir grafiski attēlota shēmā, kas parāda adaptācijas fāzi (tL), tendenci un laiku (sākot no adaptācijas fāzes beigām), kas nepieciešams 50 % noārdīšanās sasniegšanai (t50). Afaptācijas fāzi var aplēst grafiski, kā parādīts attēlā nodaļā “Rezultātu derīgums un interpretācija”, vai arī ērti pieņemt kā laiku, kas nepieciešams, lai noārdītos par 10 procentiem;
|
|
—
|
procentuālā noārdīšanās ir izmērīta pēc 60 dienām vai testa beigās.
|
|
|
Rezultātu derīgums un interpretācija
|
34.
|
Rezultātiem, kas iegūti ar standartvielām, piem., nātrija benzoātu, nātrija acetātu vai anilīnu, jābūt salīdzināmiem ar rezultātiem, kas iegūti starplaboratoriju salīdzinošajā testēšanā (3) (sk. nodaļas “Standartvielas” 7. punktu). Ja rezultāti, kas iegūti ar standartvielām, ir netipiski, tests jāatkārto, izmantojot citu jūras ūdens paraugu. Kaut arī inhibēšanas testu rezultāti var ne vienmēr būt viennozīmīgi interpretējami, jo DOC ietekmē arī testējamā viela, pozitīva zīme toksiskās ietekmes jomā ir kopējā DOC noārdīšanās ātruma būtisks samazinājums, salīdzinot ar kontrolgrupas rādītājiem.
|
|
35.
|
Ņemot vērā izmantotās salīdzinoši augstās testa koncentrācijas, salīdzinājumā ar lielāko daļu dabisko sistēmu (un līdz ar to – nelabvēlīgo attiecību starp testējamo vielu un citu oglekļa avotu koncentrācijām), šī metode ir uzskatāma par provizorisku testu, ko var izmantot, lai noskaidrotu, vai vielai piemīt augsta bionoārdāmība. Tādējādi zemais rezultāts ne vienmēr nozīmē, ka testējamajai vielai nepiemīt bionoārdāmība jūras vidē, bet gan apliecina, ka ir nepieciešams papildu darbs, lai varētu to noskaidrot.
Turpmākais attēls parāda teorētiskās noārdīšanās eksperimenta piemēru, kas ilustrē iespējamo veidu, kā aplēst tL vērtības (“adaptācijas fāzes” ilgumu) un t50 (laika intervālu, sākot no tL), kas nepieciešams 50 % noārdīšanās sasniegšanai.
|
SLĒGTĀS PUDELES METODE
IEVADS
|
1.
|
Šī metode ir “slēgtās pudeles” testa (5) variants jūras ūdenim, kas tika izstrādāts starplaboratoriju salīdzinošās testēšanas rezultātā, kuru Eiropas Komisijas (EK) uzdevumā organizēja Dānijas Ūdens kvalitātes institūts (3).
|
|
2.
|
Tāpat kā saistītajā “kolbu kratīšanas” metodē ar jūras ūdeni šā testa rezultāti nav uzskatāmi par tūlītējas bionoārdāmības rādītājiem, bet ir jāizmanto tikai informācijas iegūšanai par vielu bionoārdāmību jūras vidē.
|
METODES PRINCIPS
|
3.
|
Iepriekš noteiktu testējamās vielas daudzumu izšķīdina testēšanas barotnē, parasti koncentrācijā, kas atbilst 2–10 mg testējamās vielas uz litru (var izmantot vienu vai vairākas koncentrācijas). Šķīdumu uzglabā piepildītā noslēgtā pudelē tumsā un ūdens vannā vai telpā ar pastāvīgu temperatūru, ko kontrolē līdz ± 1 °C diapazonā 15–20 °C. Gadījumos, kad pētījuma mērķis ir modelēt vides situācijas, testus var veikt ārpus šā normālā temperatūras diapazona, nodrošinot piemērotus pielāgojumus attiecībā uz temperatūras kontroli. Pēc noārdīšanās tiek veikta skābekļa analīze par visu 28 dienu laikposmu.
|
|
4.
|
Starplaboratoriju salīdzinošā testēšana pierādīja, ka, pagarinot testu pēc šīm 28 dienām, dažādu traucējumu dēļ lielākoties nav iespējams iegūt lietderīgu informāciju. Bioloģiskā skābekļa patēriņa (BOD) kontroltesta vērtības bija pārāk augstas, iespējams, tādēļ, ka nekustīguma dēļ paātrinājās baktēriju augšana un notika nitrifikācija. Tādēļ ieteicamais ilgums ir 28 dienas, bet, ja BOD kontroltesta vērtības saglabājas 30 procentu robežās (15. un 40. punkts), šo testu var pagarināt.
|
INFORMĀCIJA PAR TESTĒJAMO VIELU
|
5.
|
Lai uzzinātu, vai konkrētai vielai var piemērot attiecīgo testu, ir jāzina vairākas tās īpašības. Nepieciešama empīriska formula, lai varētu aprēķināt teorētisko skābekļa patēriņu (ThOD) (sk. 3. papildinājumu); pretējā gadījumā ir jānosaka vielas ķīmiskais skābekļa patēriņš (COD), lai to izmantotu kā standartvērtību. COD lietošana ir mazāk apmierinoša, jo dažas vielas COD testā pilnībā neoksidējas.
|
|
6.
|
Vielas šķīdībai ir jābūt vismaz 2 mg/l, tomēr principā mazāk šķīstošās vielas var testēt (piem., apstrādājot tās ar ultraskaņu), kā arī var testēt gaistošās vielas. Iegūto rezultātu interpretēšanai vajadzīga informācija par testējamās vielas tīrību vai galveno sastāvdaļu salīdzinošajām proporcijām, jo īpaši gadījumos, kad rezultāti ir tuvi “pieņemamam” līmenim.
|
|
7.
|
Piemērotāko testa koncentrāciju izvēlei var ļoti noderēt informācija par vielas toksisko iedarbību uz baktērijām, piem., īstermiņa elpošanas testa (4) mērījumos, un tā var būt svarīga bionoārdāmības zemo vērtību pareizai interpretēšanai. Tomēr ne vienmēr ar šo informāciju pietiek, lai interpretētu bioloģiskās noārdīšanās testa rezultātus, un 27. punktā izklāstītā procedūra ir piemērotāka.
|
STANDARTVIELAS
|
8.
|
Pārbaudot jūras ūdens parauga mikrobiālo aktivitāti, jāizmanto piemērotas standartvielas. Šim nolūkam var izmantot, piem., anilīnu, nātrija acetātu vai nātrija benzoātu. Šīm vielām ir jānoārdās vismaz par 60 procentiem (no to ThOD) pietiekami īsā laikā, pretējā gadījumā ir ieteicams atkārtot testu ar citu jūras ūdens paraugu.
|
|
9.
|
EK starplaboratoriju salīdzinošajā testēšanā, kurai jūras ūdens paraugi tika ņemti dažādās vietās un dažādos gada laikos, adaptācijas fāze (tL) un laiks, kad jāsasniedz 50 % noārdīšanās (t50), izņemot adaptācijas fāzi, ilga no 0 līdz 2 dienām un nātrija benzoātam – attiecīgi no 1 līdz 4 dienām. Anilīnam tL un t50 vērtības bija attiecīgi no 0 līdz 7 un no 2 līdz 12 dienām.
|
ATKĀRTOJAMĪBA
|
10.
|
Metodes atkārtojamība tika noteikta EK starplaboratoriju salīdzinošajā testēšanā (3).
|
METODES APRAKSTS
Aprīkojums
|
11.
|
Parastais laboratorijas aprīkojums un:
|
a)
|
var izmantot 250–300 ml BOD pudeles ar stikla aizbāžņiem vai 250 ml pudeles ar šauru kaklu un stikla aizbāžņiem;
|
|
b)
|
vairākas 2-, 3- un 4-litru pudeles ar litru atzīmēm eksperimenta sagatavošanai un BOD pudeļu piepildīšanai;
|
|
c)
|
ūdens vanna vai istaba ar konstantu temperatūru pudeļu uzturēšanai nemainīgā temperatūrā (± 1 °C), nepieļaujot gaismas iedarbību;
|
|
d)
|
izšķīdinātā skābekļa analīzes iekārtas;
|
|
e)
|
membrānfiltri, 0,2–0,45 μm (pēc izvēles);
|
|
f)
|
iekārtas izvēlētajai analīzei (pēc izvēles).
|
|
Jūras ūdens
|
12.
|
Paņem jūras ūdens paraugu rūpīgi iztīrītā konteinerā, un nogādā to laboratorijā, vislabāk – vienas vai divu dienu laikā pēc parauga paņemšanas. Pārvadāšanas laikā parauga temperatūrai neļauj būtiski pārsniegt testa gaitā piemēroto temperatūru.
|
|
13.
|
Precīzi atzīmē parauga ņemšanas vietu, un raksturo tās piesārņotību un barības vielu daudzumu. Jo īpaši attiecībā uz piekrastes vai piesārņotiem ūdeņiem šajā raksturojumā iekļauj heterotrofo mikroorganismu koloniju skaitu un izšķīdušo nitrātu, amonjaka un fosfātu noteiktās koncentrācijas.
|
|
14.
|
Par pašu jūras ūdens paraugu sniedz šādu informāciju:
|
—
|
parauga ņemšanas datums;
|
|
—
|
parauga izskats – duļķains utt.;
|
|
—
|
temperatūra parauga ņemšanas laikā;
|
|
—
|
izšķīdušais organiskais ogleklis (DOC);
|
|
—
|
laiks starp parauga paņemšanu un izmantošanu testā.
|
|
|
15.
|
Ja parauga DOC saturs tiek atzīts par augstu vai šķiet, ka BOD kontroltests pēc 28 dienām uzrādīs vairāk nekā 30 % standartvielu DOC, ieteicams pirms lietošanas jūras ūdeni nostādināt aptuveni vienu nedēļu.
|
|
16.
|
Paraugu nostādina, uzglabājot aerobos apstākļos testēšanas temperatūrā un tumsā vai izkliedētā gaismā. Ja nepieciešams, aerobos apstākļus uztur ar vieglu aerāciju. Nostādināšanas laikā samazinās viegli noārdāmā organiskā materiāla saturs. Starplaboratoriju salīdzinošajā testēšanā (3) netika konstatēta nekāda atšķirība starp nostādināta un svaigi paņemta jūras ūdens parauga noārdīšanās potenciālu.
|
|
17.
|
Jūras ūdeni pirms lietošanas iepriekš apstrādā, lai aizvāktu rupjās daļiņas, piem., filtrējot caur neilona filtru vai raupja papīra filtru (nelieto membrānas vai GFC filtrus), vai sedimentējot un dekantējot. Par izmantoto procedūru ziņo. Pēc nostādināšanas, ja tā ir veikta, iepriekš apstrādā.
|
Minerālvielu izejšķīdumi
|
18.
|
No analītiskas tīrības pakāpes reaģentiem pagatavo šādus izejšķīdumus.
|
a)
|
Kālija dihidrogēnortofosfāts, KH2PO4
|
8,50 g
|
|
Dikālija hidrogēnortofosfāts, K2HPO4
|
21,75 g
|
|
Dinātrija hidrogēnortofosfāta dihidrāts, Na2HPO4 · 2H2O
|
33,30 g
|
|
Amonija hlorīds, NH4Cl
|
0,50 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
|
b)
|
Kalcija hlorīds, CaCl2
|
27,50 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
|
c)
|
Magnija sulfāta heptahidrāts, MgSO4 · 7H2O
|
22,50 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
|
d)
|
Dzelzs (III) hlorīda heksahidrāts, FeCl3 · 6H2O
|
0,25 g
|
|
Izšķīdina un papildina ar destilētu ūdeni līdz 1 litram
|
|
Nogulsnēšanos d) šķīdumā var novērst, pievienojot vienu pilienu koncentrēta HCl vai 0,4 g etilēnediaminetetra-etiķskābes (EDTA, dinātrija sāls) uz litru. Ja nogulsnes veidojas izejšķīdumā, to nomaina ar svaigi pagatavotu šķīdumu.
|
Testēšanas barotnes sagatavošana
|
19.
|
Uz katru litru iepriekš apstrādāta jūras ūdens pielej 1 ml katra iepriekš minētā izejšķīduma. Testēšanas barotni piesātina ar gaisu testa temperatūrā, aerējot to ar tīru saspiestu gaisu aptuveni 20 minūtes. Kontroles nolūkā nosaka izšķīdinātā skābekļa koncentrāciju. Izšķīdinātā skābekļa piesātināto koncentrāciju kā sāļuma un temperatūras funkciju var nolasīt nomogrammā, kas pievienota šai testēšanas metodei (4. papildinājums).
|
Inokulāts
|
20.
|
Nepievieno nekādu citu inokulātu papildus tiem mikroorganismiem, kas jau atrodas jūras ūdenī. (Pēc izvēles) nosaka kolonijas veidojošo heterotrofu skaitu jūras ūdens testēšanas barotnē (un vislabāk arī oriģinālajos jūras ūdens paraugos), piem., pēc dzīvotspējīgo mikroorganismu skaita, izmantojot jūras agaru. Tas ir īpaši vēlams paraugiem no piekrastes vai piesārņotām vietām. Pārbauda heterotrofo mikroorganismu aktivitāti jūras ūdenī, veicot testu ar standartvielu.
|
Testa pudeļu sagatavošana
|
21.
|
Veic visas nepieciešamās darbības, tostarp jūras ūdens nostādināšanu un iepriekšēju apstrādi izvēlētajā testēšanas temperatūrā no 15 līdz 20 °C, nodrošinot visu stikla trauku tīrību, bet ne sterilitāti.
|
|
22.
|
Vienlaicīgām eksperimentu sērijām sagatavo BOD pudeļu grupas, lai noteiktu testējamās vielas un standartvielas BOD. Katru analīzi veic divās pudelēs (tukšais tests, standartviela un testējamā viela), t. i., katrai noteikšanai sagatavo divas pudeles. Analīzes veic vismaz 0., 5., 15. un 28. dienā (četras noteikšanas). Skābekļa analīzēm, lai veiktu četras noteikšanas, pavisam ir vajadzīgas 3 × 2 × 4 = 24 pudeles (tukšajam testam, standartvielai un testējamai vielai) un līdz ar to aptuveni astoņi litri testēšanas barotnes (vienai testējamās vielas koncentrācijai).
|
|
23.
|
Testējamās vielas un standartvielas šķīdumus atsevišķi sagatavo lielās pudelēs ar pietiekamu tilpumu (11. punkts), šajās daļēji piepildītajās lielajās pudelēs vispirms ielejot testējamās un standartvielas tieši vai arī izmantojot koncentrētu izejšķīdumu. Pievieno papildu testēšanas barotni, lai iegūtu vēlamās galīgās koncentrācijas. Ja izmanto testējamo un/vai standartvielu izejšķīdumus, nodrošina, lai jūras ūdens barotnes sāļums būtiski nemainītos.
|
|
24.
|
Izvēlās testējamo un standartvielu koncentrācijas, ņemot vērā:
|
a)
|
izšķīdinātā skābekļa šķīdību jūras ūdenī testa pamata temperatūrā un sāļuma pamata līmenī (sk. pievienoto nomogrammu 4. papildinājumā);
|
|
b)
|
jūras ūdens BOD kontroltestu un
|
|
c)
|
paredzamo testējamās vielas bionoārdāmību.
|
|
|
25.
|
Izšķīdinātā skābekļa šķīdība 15 °C un 20 °C temperatūrā un ar sāļumu 32 daļas no tūkstoša (okeāna ūdenim) attiecīgi ir aptuveni 8,1 un 7,4 mg/l. Jūras ūdens skābekļa patēriņš (tukšā elpošana) var sasniegt 2 mg O2/l vai vairāk, ja jūras ūdens netiek nostādināts. Tādējādi, lai nodrošinātu būtiskas skābekļa koncentrācijas saglabāšanos pēc testējamās vielas oksidācijas, kā testējamās vielas sākuma koncentrāciju izmanto aptuveni 2–3 mg/l (atkarībā no ThOD) vielām, kurām paredzams, ka testēšanas apstākļos tās pilnībā noārdīsies (piem., standartvielām). Mazāk noārdāmām vielām testu veic ar augstākām koncentrācijām, līdz aptuveni 10 mg/l, ja nerodas toksiska iedarbība. Labākus rezultātus var iegūt, paralēli veicot testus gan ar zemu (aptuveni 2 mg/l), gan augstu (aptuveni 10 mg/l) testējamās vielas koncentrāciju.
|
|
26.
|
Skābekļa tukšais patēriņš jānosaka paralēli, izmantojot pudeles, kurās nav ne testējamās, ne standartvielas.
|
|
27.
|
Ja ir jānosaka inhibēšanas ietekme, atsevišķās lielās pudelēs sagatavo turpmāk minētās šķīdumu sērijas (13. punkts):
|
a)
|
2 mg uz litru viegli noārdāmas vielas, piem., jebkuras minētās standartvielas;
|
|
b)
|
x mg uz testējamās vielas litru (parasti x ir 2);
|
|
c)
|
2 mg uz litru viegli noārdāmas vielas, pieskaitot x mg uz testējamās vielas litru.
|
|
Fizikāli ķīmiskais kontroltests (pēc izvēles)
|
28.
|
Ja izmanto iespēju veikt specifiskas analīzes, var veikt arī fizikāli ķīmisku eksperimentu, lai pārbaudītu, vai abiotiskie mehānismi, piem., hidrolīze vai adsorbcija, ir noārdījuši testējamo vielu. Fizikāli ķīmisko kontroltestu var veikt, pievienojot dzīvsudraba (II) hlorīdu (HgCl2) (33) (50–100 mg/l) divās kolbās ar testējamo vielu, lai apturētu mikrobiālo aktivitāti. Būtisks konkrētās vielas koncentrācijas samazinājums testa gaitā liecina par abiotiskiem noārdīšanās mehānismiem.
|
BOD pudeļu skaits parastā sērijā
|
29.
|
Parastā sērijā izmanto šādas pudeles:
|
—
|
vismaz astoņas ar testējamo vielu;
|
|
—
|
vismaz astoņas, kurās ir tikai ar uzturvielām bagātināts jūras ūdens;
|
|
—
|
vismaz astoņas ar standartvielu un, ja nepieciešams;
|
|
—
|
sešas pudeles ar testējamo un standartvielu (toksicitātes kontrolei).
|
|
PROCEDŪRA
|
30.
|
Pēc pagatavošanas uzreiz iepilda sifonā katru šķīdumu no attiecīgās lielās pudeles apakšējās ceturtdaļas (ne no pašas apakšas), lai piepildītu attiecīgo BOD pudeļu grupu. Nekavējoties analizē nulles kontroles datus (nulles laikā) izšķīdinātajam skābeklim (33. punkts) vai saglabā tos turpmākai ķīmiskai analīzei, veidojot nogulsnes ar MnCl2 (mangāna (II) hlorīdu) un NaOH (nātrija hidroksīdu).
|
|
31.
|
Inkubē pārējās paralēlās BOD pudeles testa temperatūrā (15–20 °C), tur tumsā un izņem no inkubācijas zonas attiecīgos laika intervālos (piem., vismaz pēc 5, 15 un 28 dienām), kā arī analizē attiecībā uz izšķīdināto skābekli (33. punkts).
|
|
32.
|
Specifiskajai analīzei paredzētajiem paraugiem veic membrānfiltrēšanu (0,2–0,45 μm) vai centrifugēšanu 15 minūtes (pēc izvēles). Uzglabā līdz 48 stundām 2–4 °C temperatūrā vai ilgāku laiku –18 °C temperatūrā, ja analīzi neveic nekavējoties (ja ir zināms, ka testējamā viela netiks ietekmēta, pirms uzglabāšanas skābina līdz pH 2).
|
Izšķīdinātā skābekļa noteikšana
|
33.
|
Nosaka izšķīdinātā skābekļa koncentrāciju, izmantojot ķīmisku vai elektroķīmisku metodi, kas atzīta valsts vai starptautiskā līmenī.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
34.
|
Analīzes rezultātus reģistrē pievienotajās datu lapās (5. papildinājums).
|
|
35.
|
BOD aprēķina kā skābekļa satura samazinājuma starpību starp skābekļa tukšo patēriņu un patēriņu testējamās vielas šķīdumu testēšanas apstākļos. Skābekļa satura neto samazinājumu izdala ar vielas koncentrāciju (w/v), lai izteiktu BOD kā mg BOD/mg testējamās vielas. Noārdīšanos definē kā bioķīmiskā skābekļa patēriņa attiecību pret teorētisko skābekļa patēriņu (ThOD) (ieteicamākais variants) vai ķīmisko skābekļa patēriņu (COD), un izsaka to procentos (sk. 36. punktu).
|
|
36.
|
Bioloģiskās noārdīšanās vērtības aprēķina katram paraugu ņemšanas laikam gan testējamai, gan standartvielai, izmantojot vienu no šiem vienādojumiem:
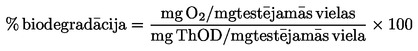
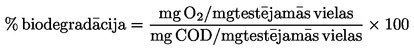
kur:
|
ThOD
|
=
|
teorētiskais skābekļa patēriņš (aprēķini, 3. papildinājums);
|
|
COD
|
=
|
ķīmiskais skābekļa patēriņš, kuru nosaka eksperimentāli.
|
Piezīme. Dažkārt šie abi aprēķināšanas veidi (kā procenti no ThOD vai kā procenti no COD) nesniedz vienādus rezultātus; pareizāk ir lietot ThOD, jo dažas vielas COD testā pilnībā neoksidējas.
|
|
37.
|
Noārdīšanās testa gaitu grafiski ilustrē shēmā (sk. piemēru nodaļā “Rezultātu derīgums un interpretācija”). Ja datu pietiek, no bioloģiskās noārdīšanās līknes aprēķina adaptācijas fāzi (tL) un laiku, kas nepieciešams, lai sasniegtu 50 % noārdīšanos, sākot no adaptācijas fāzes beigām (t50).
|
|
38.
|
Ja izmanto specifiskās analīzes (pēc izvēles), primārās noārdīšanās procentuālo īpatsvaru izsaka kā konkrētās vielas noārdīšanas procentuālo īpatsvaru testa periodā (ar analītisko kontroļu korekciju).
|
Testēšanas pārskats
|
39.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā viela:
|
—
|
fizikālās īpašības un attiecīgā gadījumā fizikāli ķīmiskās īpašības;
|
|
|
|
Testēšanas apstākļi:
|
—
|
paraugu ņemšanas vietas novietojums un apraksts – piesārņojuma un uzturvielu daudzums (koloniju skaits, nitrāti, amonjaks un fosfāti, ja attiecināms);
|
|
—
|
parauga īpašības (paņemšanas datums, dziļums, izskats, temperatūra, sāļums, DOC (pēc izvēles), laiks starp parauga paņemšanu un izmantošanu testā;
|
|
—
|
izmantotā metode (ja ir) jūras ūdens nostādināšanai;
|
|
—
|
izmantotā metode jūras ūdens iepriekšējai apstrādei (filtrēšana/sedimentācija);
|
|
—
|
izmantotā metode COD noteikšanai (ja to veic);
|
|
—
|
izmantotā metode skābekļa mērījumiem;
|
|
—
|
izšķīdināšanas procedūra vielām, kas slikti šķīst testēšanas apstākļos;
|
|
—
|
izmantotā metode heterotrofu skaita noteikšanai jūras ūdenī (dzīvotspējīgo mikroorganismu skaita metode vai cita procedūra);
|
|
—
|
izmantotā metode DOC noteikšanai jūras ūdenī (pēc izvēles);
|
|
—
|
izmantotā metode specifiskajām analīzēm (pēc izvēles);
|
|
—
|
citas izvēles metodes, ko izmanto jūras ūdens raksturošanai (ATP mērījumi utt.).
|
|
|
|
Rezultāti:
|
—
|
analīzes dati ir paziņoti datu lapā (pievienota 5. papildinājumā);
|
|
—
|
noārdīšanās testa gaita ir grafiski attēlota shēmā, kas parāda adaptācijas fāzi (tL), tendenci un laiku (sākot no adaptācijas fāzes beigām), kas nepieciešams testējamās vielas oksidācijas izraisītās skābekļa galīgās uzņemšanas sasniegšanai par 50 procentiem (t50). Adaptācijas fāzi var aplēst grafiski, kā parādīts pievienotajā attēlā, vai arī ērti pieņemt kā laiku, kas nepieciešams, lai noārdītos par 10 procentiem;
|
|
—
|
procentuālā noārdīšanās, kas izmērīta pēc 28 dienām.
|
|
|
Rezultātu derīgums un interpretācija
|
40.
|
Tukšā elpošana nedrīkst pārsniegt 30 procentus skābekļa testa pudelē. Ja šo kritēriju nav iespējams izpildīt ar svaigi paņemtu jūras ūdeni, tas pirms lietošanas ir jānostādina (jāstabilizē).
|
|
41.
|
Jāņem vērā iespēja, ka rezultātus var ietekmēt slāpekli saturošas vielas.
|
|
42.
|
Rezultātiem, kas iegūti ar standartvielām nātrija benzoātu un anilīnu, jābūt salīdzināmiem ar starplaboratoriju salīdzinošajā testēšanā (3) iegūtajiem rezultātiem (9. punkts). Ja rezultāti, kas iegūti ar standartvielām, ir netipiski, tests jāatkārto, izmantojot citu jūras ūdens paraugu.
|
|
43.
|
Testējamo vielu var atzīt par baktēriju darbību kavējošu (izmantotajā koncentrācijā), ja standartvielas un testējamās vielas maisījuma BOD ir mazāks nekā šo abu vielu atsevišķo šķīdumu BOD summa.
|
|
44.
|
Ņemot vērā salīdzinoši augstās testa koncentrācijas salīdzinājumā ar lielāko daļu dabisko sistēmu un līdz ar to – nelabvēlīgo attiecību starp testējamās vielas un citu oglekļa avotu koncentrācijām–, šī metode ir uzskatāma par provizorisku testu, ko var izmantot, lai noskaidrotu, vai vielai piemīt augsta bionoārdāmība. Tādējādi zemais rezultāts ne vienmēr nozīmē, ka testējamā viela nav bionoārdāma jūras vidē, bet gan apliecina, ka ir nepieciešams papildu darbs, lai varētu to noskaidrot.
Turpmākais attēls parāda teorētiskās noārdīšanās eksperimenta piemēru, kas ilustrē iespējamo veidu, kā aplēst tL vērtības (“adaptācijas fāzes” ilgumu) un t50, laika intervālu (sākot no tL), kas nepieciešams testējamās vielas oksidācijas izraisītās skābekļa galīgās uzņemšanas sasniegšanai par 50 procentiem.
|
LITERATŪRA
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Šā pielikuma C.4-B. nodaļa: Tūlītējas bionoārdāmības noteikšana; III daļa: Modificēts ESAO skrīninga tests.
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, March 1987, Commission of the European Communities.
|
|
(4)
|
Šā pielikuma C.11. nodaļa: Bionoārdīšanās: aktivēto dūņu elpošanas inhibēšanas tests.
|
|
(5)
|
Šā pielikuma C.4-E. nodaļa: Tūlītējas bionoārdāmības noteikšana; VI daļa: Slēgtās pudeles tests.
|
1. papildinājums
Organiskā oglekļa noteikšana jūras ūdenī
KOLBU KRATĪŠANAS METODE
Lai noteiktu organisko oglekli ūdens paraugā, šā parauga organiskos savienojumus oksidē par oglekļa dioksīdu, parasti izmantojot vienu no trim šādām metodēm:
|
—
|
mitrā oksidācija ar persulfātu/UV starojumu;
|
|
—
|
mitrā oksidācija ar persulfātu/paaugstinātu temperatūru (116–130 °C);
|
Radušos CO2 izsaka kvantitatīvi, izmantojot infrasarkano spektrometriju vai titrimetriju. Cits paņēmiens ir CO2 reducēšana par metānu, ko izsaka kvantitatīvi ar liesmas jonizācijas detektoru (FID).
Persulfāta/UV metodi plaši izmanto, analizējot “tīru” ūdeni ar zemu cieto daļiņu saturu. Abas pēdējās metodes var izmantot lielākajai daļai ūdens paraugu veidu, un persulfāta/paaugstinātās temperatūras-oksidācijas metode ir piemērotāka zema līmeņa paraugiem, bet dedzināšanas metodi izmanto paraugiem ar negaistošu organiskā oglekļa (NVOC) saturu, kas būtiski pārsniedz 1 mg C/l.
Traucējumi
Visas trīs metodes ir atkarīgas no paraugā esošā neorganiskā oglekļa (IC) izvadīšanas vai kompensēšanas. Skābināta parauga attīrīšana no CO2 ir visbiežāk izmantotā metode IC izvadīšanai, lai gan tā izraisa arī gaistošo organisko savienojumu zudumus (1). Pilnīga IC eliminācija vai kompensēšana ir jānodrošina katrai parauga matricai, bet gaistošais organiskais ogleklis (VOC) ir jānosaka papildus NVOC, atkarībā no parauga veida.
Augstas hlorīda koncentrācijas samazina oksidācijas efektivitāti, izmantojot persulfāta/UV metodi (2). Tomēr šos traucējumus var novērst, izmantojot oksidācijas reaģentu, kas mainīts, pievienojot tam dzīvsudraba (II) nitrātu. Novērtējot katru parauga veidu, kas satur hlorīdu, ieteicams lietot maksimāli pieļaujamo parauga tilpumu. Ja ar dedzināšanas metodi analizētajā paraugā ir augsta sāls koncentrācija, sāls var pārklāt katalizatoru un izraisīt pārmērīgu dedzināšanā izmantotās mēģenes koroziju. Jāveic piesardzības pasākumi, kas paredzēti ražotāja rokasgrāmatā.
Izteikti duļķaini paraugi, kā arī paraugi, kas satur cietas daļiņas, var oksidēties nepilnīgi, izmantojot persulfāta/UV metodi.
Piemērotas metodes piemērs
Negaistošo organisko oglekli nosaka oksidācijā ar persulfātu/UV starojumu, un radušos CO2 pēc tam izsaka kvantitatīvi, izmantojot nedispersīvo infrasarkano spektrometriju.
Oksidācijas reaģentu maina saskaņā ar apsvērumiem, kas minēti (2), kā arī izklāstīti ražotāja rokasgrāmatā.
|
a)
|
8,2 g HgCl2 un 9,6 g Hg(NO3)2 . H2O izšķīdina vairākos simtos mililitru zemas oglekļa koncentrācijas reaģenta ūdens.
|
|
b)
|
20 g K2S2O8 izšķīdina dzīvsudraba sāls šķīdumā.
|
|
c)
|
Maisījumam pievieno 5 ml HNO3 (konc.).
|
|
d)
|
Reaģentu atšķaida līdz 1 000 ml.
|
Hlorīda radītos traucējumus novērš, izmantojot 40 μl parauga tilpuma 10 procentiem hlorīda un 200 μl parauga tilpuma 1,9 procentiem hlorīda. Saskaņā ar šo metodi var analizēt paraugus ar augstām hlorīda koncentrācijām un/vai lielākiem parauga tilpumiem, ja tiek novērsta hlorīda veidošanās oksidācijas traukā. Pēc tam attiecīgajam parauga veidam var veikt gaistošā organiskā oglekļa noteikšanu, ja nepieciešams.
LITERATŪRA
|
(1)
|
ISO, Water quality – determination of total organic carbon. Draft International Standard ISO/DIS 8245, January 16, 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Var noderēt arī (raksturo pašanalīzes sistēmu):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
|
2. papildinājums
Bionoārdīšanās jūras ūdenī
KOLBU KRATĪŠANAS METODE
DATU LAPA
|
3.
|
TESTĒJAMĀ VIELA:
Nosaukums:
|
Izejšķīduma koncentrācija:
|
mg/l kā viela
|
|
Sākotnējā koncentrācija testēšanas barotnē, to:
|
mg/l kā viela
|
|
:
|
mg DOC/l
|
|
|
4.
|
JŪRAS ŪDENS:
Avots:
Parauga ņemšanas datums:
Parauga ņemšanas dziļums:
Izskats parauga ņemšanas laikā (piem., duļķains utt.):
|
Sāļums parauga ņemšanas laikā:
|
‰
|
|
Temperatūra parauga ņemšanas laikā:
|
°C
|
|
DOC“x” stundas pēc parauga paņemšanas:
|
mg/l
|
Iepriekšēja apstrāde pirms testēšanas (piem., filtrēšana, sedimentācija, nostādināšana utt.):
|
Mikroorganismu koloniju skaits
|
|
kolonijas/ml
|
|
|
|
kolonijas/ml
|
|
Citas īpašības:
|
|
|
|
|
5.
|
OGLEKĻA NOTEIKŠANA
Oglekļa analizators:
|
|
Kolba Nr.
|
|
DOC pēc n dienām (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Tests: ar uzturvielām bagātināts jūras ūdens ar testējamo vielu
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
vidēji, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
vidēji, Cb(t)
|
|
|
|
|
|
|
Tukšais tests: ar uzturvielām bagātināts jūras ūdens bez testējamās vielas
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
vidēji, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
vidēji, Cd(t)
|
|
|
|
|
|
| vidēji,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
JĒLDATU NOVĒRTĒJUMS
|
Kolba Nr.
|
Rezultātu aprēķināšana
|
% noārdīšanās pēc n dienām
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|
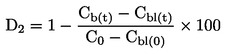
|
0
|
|
|
|
|
|
Vidēji (34)
|
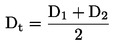
|
0
|
|
|
|
|
|
Piezīme.
|
Līdzīgus formātus var izmantot, ja pēc noārdīšanās veic specifiskas analīzes, ka arī attiecībā uz standartvielu testēšanu un toksicitātes kontroles pasākumiem.
|
|
|
7.
|
ABIOTISKĀ NOĀRDĪŠANĀS (pēc izvēles)
|
|
Laiks (dienas)
|
|
0
|
t
|
|
DOC konc. (mg/1) sterilā kontrolē
|
Cs(o)
|
Cs(t)
|

|
3. papildinājums
Teorētiskā skābekļa patēriņa aprēķināšana
SLĒGTĀS PUDELES METODE
ThOD vielai CcHhClclNnNanaOoPpSs ar molekulāro svaru (MW) aprēķina saskaņā ar:
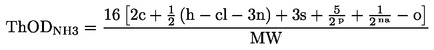
No šā aprēķina izriet, ka C ir mineralizēts par CO2, H – par H2O, P – par P2O5 un Na – par Na2O. Halogēns ir izvadīts kā ūdeņraža halogenīds un slāpeklis kā amonjaks.
Piemērs:
glikoze C6H12O6, MW = 180.
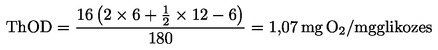
Molekulāro svaru sāļiem, izņemot sārmu metālu sāļus, aprēķina, pieņemot, ka šie sāļi ir hidrolizēti.
Pieņem, ka sērs ir oksidēts līdz + 6 stāvoklim.
Piemērs:
nātrija n-dodekilbenzolsulfonāts C18H29SO3Na, MW = 348.

Vielām, kas satur slāpekli, šo slāpekli var izvadīt kā amonjaku, nitrītu vai nitrātu atbilstoši atšķirīgajiem teorētiskajiem skābekļa patēriņiem.
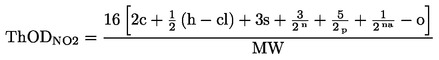
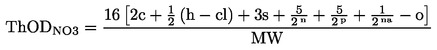
Uzskata, ka pilnīga nitrāta izveidošanās ir novērota, analizējot sekundāro amīnu:
(C12H25)2 NH, MW = 353.
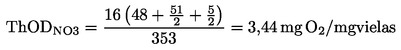
4. papildinājums

5. papildinājums
Bionoārdīšanās jūras ūdenī
SLĒGTĀS PUDELES METODE
DATU LAPA
|
3.
|
TESTĒJAMĀ VIELA:
Nosaukums:
|
Izejšķīduma koncentrācija:
|
mg/l
|
|
Sākotnējā konc. jūras ūdens barotnē:
|
mg/l
|
|
ThOD vai COD:
|
mg O2/mg testējamās vielas
|
|
|
4.
|
JŪRAS ŪDENS:
Avots:
Parauga ņemšanas datums:
Parauga ņemšanas dziļums:
Izskats parauga ņemšanas laikā (piem., duļķains utt.):
|
Sāļums parauga ņemšanas laikā:
|
‰
|
|
Temperatūra parauga ņemšanas laikā:
|
°C
|
|
DOC“x” stundas pēc parauga paņemšanas:
|
mg/l
|
Iepriekšēja apstrāde pirms testēšanas (piem., filtrēšana, sedimentācija, nostādināšana utt.):
|
Mikroorganismu koloniju skaits
|
|
kolonijas/ml
|
|
|
|
kolonijas/ml
|
|
Citas īpašības:
|
|
|
|
|
5.
|
TESTĒŠANAS BAROTNE
|
Temperatūra pēc aerācijas:
|
°C
|
|
O2 koncentrācija pēc aerācijas un stāvoklis pirms testa sākuma:
|
mg O2/l
|
|
|
6.
|
IZŠĶĪDUŠĀ SKĀBEKĻA SATURA (DO) NOTEIKŠANA
Metode – Vinklera/elektroda metode
|
|
Kolba Nr.
|
|
mg O2/l pēc n dienām
|
|
0
|
5
|
15
|
28
|
|
Tests: ar uzturvielām bagātināts jūras ūdens ar testējamo vielu
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Vidēji testā
|
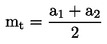
|
|
|
|
|
|
Tukšais tests: ar uzturvielām bagātināts jūras ūdens bez testējamās vielas
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Vidēji tukšais
|
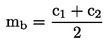
|
|
|
|
|
Piezīme. Līdzīgu formātu var izmantot standartvielas testēšanai un toksicitātes kontroles pasākumiem.
|
|
7.
|
IZŠĶĪDUŠĀ SKĀBEKĻA SATURA SAMAZINĀŠANĀS – PROCENTUĀLĀ NOĀRDĪŠANĀS ( %)
|
|
Izšķīdušā skābekļa satura samazināšanās pēc n dienām
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|
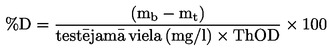
|
|
|
|
|
C.43. ORGANISKO VIELU ANAEROBĀ BIONOĀRDĀMĪBA PĀRSTRĀDĀTĀS DŪŅĀS: SARAŽOTĀS GĀZES MĒRĪŠANA
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 311 (2006. gads). Ir daudzi skrīninga testi organisko vielu aerobās bionoārdāmības novērtēšanai (testēšanas metodes C.4, C.9, C.10 un C.11 (1) un ESAO TG 302C (2)), un to piemērošanas rezultāti tiek sekmīgi izmantoti, prognozējot vielu apriti aerobā vidē, jo īpaši notekūdeņu attīrīšanas aerobajos posmos. Aerobā veidā testē arī ūdenī nešķīstošo vielu dažādas proporcijas, arī tām vielām, kas adsorbē uz notekūdeņos esošajām daļiņām, jo tās ir atrodamas nostādinātos notekūdeņos. Tomēr šo vielu lielākās frakcijas ir piesaistītas primāri nostādinātajām notekūdeņu dūņām, kas tiek atdalītas no nepārstrādātajiem notekūdeņiem nostādināšanas tvertnēs, pirms nostādinātie vai virspusē uzkrātie notekūdeņi tiek attīrīti aerobi. Pēc tam dūņas, kuru intersticiālais šķidrums satur vairākas šķīstošas vielas, tiek novadītas uz apsildāmiem bioreaktoriem anaerobai apstrādei. Tā kā šajās sērijās vēl nav testu anaerobās bionoārdāmības novērtēšanai anaerobajos bioreaktoros, šā testa uzdevums ir aizpildīt minēto trūkumu; tas ne vienmēr ir piemērojams citiem anoksiskās vides nodalījumiem.
|
|
2.
|
Anaerobās bionoārdāmības novērtēšanai sekmīgi ir izmantotas respirometriskās metodes, ar ko mēra saražotās gāzes apjomus, galvenokārt metānam (CH4) un oglekļa dioksīdam (CO2), anaerobos apstākļos. Birch et al. (3) apskatīja šīs procedūras un secināja, ka visaptverošākais ir bijis Šeltona un Tīdjē (4) darbs, pamatojoties uz iepriekšējiem pētījumiem (5)(6)(7). Šī metode (4), ko turpmāk attīstīja citi (8) un kas kļuvusi par ASV standartu (9)(10), neatrisināja problēmas, ko rada CO2 un CH4 atšķirīgā šķīdība testēšanas barotnē un aprēķini par teorētisko gāzes ražošanu no testējamās vielas. ECETOC ziņojums (3) ieteica papildu mērījumus izšķīdinātā neorganiskā oglekļa (DIC) saturam centrifugāta šķidrumā, un tas ļāva šo metodi izmantot plašāk. ECETOC metode tika vērtēta starptautiskā kalibrēšanas pasākumā (jeb starplaboratoriju salīdzinošajā testēšanā) un kļuva par ISO standartu – ISO 11734 (11).
|
|
3.
|
Šī testēšanas metode, kuras pamatā ir ISO 11734 (11), raksturo skrīninga metodi organisko vielu potenciālās anaerobās bionoārdāmības novērtēšanai konkrētos apstākļos (t. i., anaerobā kamerā konkrētā laikposmā un mikroorganismu koncentrāciju diapazonā). Tā kā atšķaidītās dūņas lieto ar salīdzinoši augstu testējamās vielas koncentrāciju un testēšanas ilgums parasti pārsniedz normālo uzglabāšanas laiku anaerobajos bioreaktoros, testēšanas apstākļi ne vienmēr atbilst apstākļiem anaerobajos bioreaktoros un tās neizmanto organisko vielu anaerobās bionoārdāmības novērtēšanai citos vides apstākļos. Dūņas tiek eksponētas testējamajai vielai līdz pat 60 dienām, un tas ir ilgāk par parasto dūņu uzglabāšanas laiku (25–30 dienas) anaerobajos bioreaktoros, taču rūpnieciskajās ražotnēs uzglabāšanas laiks var būt daudz ilgāks. Šā testa rezultātu prognozes nevar būt tik pārliecinošas kā aerobās bioloģiskās noārdīšanās gadījumā, jo pierādījumi, kas uzkrāti par testējamo vielu uzvedību “gatavos” aerobos testos, modelēšanas testos un aerobā vidē, ir pietiekami, lai pārliecinātos par to saistību; par anaerobo vidi nav pieejams daudz līdzīgu pierādījumu. Var pieņemt, ka pilnīga anaerobā bionoārdīšanās ir notikusi, sasniedzot 75–80 % teorētiskā gāzes ražošanas līmeņa. Augstā vielas attiecība pret biomasu, ko izmanto šajos testos, liecina, ka viela, kas tiek izvadīta, visticamāk tiks noārdīta anaerobajā bioreaktorā. Turklāt vielas, kas netiek pārveidotas gāzē testa laikā, ne vienmēr saglabāsies, kad vielas un biomasas attiecības būs vairāk videi atbilstošas. Tāpat, notiek arī citas anaerobas reakcijas, kurās vielas var noārdīties vismaz daļēji, piem., dehlorinācija, bet šis tests nekonstatē minētās reakcijas. Tomēr vielas izzušanu var novērot, izmantojot īpašas analītiskās metodes testējamās vielas noteikšanai (sk. 6., 30., 44. un 53. punktu).
|
TESTA PRINCIPS
|
4.
|
Mazgātas pārstrādātas dūņas (36), kas satur zemu (<10 mg/l) neorganiskā oglekļa (IC) koncentrāciju, atšķaida aptuveni desmit reizes, lai kopējā cietvielu koncentrācija sasniegtu no 1 g/l līdz 3 g/l, un inkubē 35 °C ± 2 °C temperatūrā hermētiskos traukos ar testējamo vielu no 20 līdz 100 mg C/l līdz 60 dienām. Atļauts mērīt dūņu aktivitāti, paralēli veicot kontroltestu ar dūņu inokulātu testēšanas barotnē, bet bez testējamās vielas.
|
|
5.
|
Izmēra augšgala spiediena palielinājumu traukos, ko izraisa oglekļa dioksīda un metāna ražošana. Liela daļa saražotā CO2 testēšanas apstākļos tiks izšķīdināta šķidrajā posmā vai pārveidota par karbonātu vai hidrogēnkarbonātu. Šo neorganisko oglekli mēra testa beigās.
|
|
6.
|
Oglekļa apjomu (neorganisko oglekli un metānu), ko rada testējamās vielas bionoārdīšanās, aprēķina no saražotās gāzes neto apjoma un no neto izveidotā IC šķidrajā posmā, kas pārsniedz tukšās kontrolvērtības. Bioloģiskās noārdīšanās pakāpi aprēķina, pamatojoties uz kopējo saražoto IC un metānu-C, izsakot to kā izmērītā vai aprēķinātā oglekļa, kas pievienots kā testējamā viela, apjoma īpatsvaru procentos. Bioloģiskās noārdīšanās gaitu var uzraudzīt, tikai veicot saražotās gāzes starpposma mērījumus. Turklāt primāro bioloģisko noārdīšanos var noteikt īpašajā analīzē testa sākumā un beigās.
|
INFORMĀCIJA PAR TESTĒJAMO VIELU
|
7.
|
Lai varētu pareizi interpretēt iegūtos rezultātus, ir jāzina testējamās vielas tīrība, šķīdība ūdenī, gaistamības un adsorbcijas īpašības. Organiskā oglekļa saturs ( % w/w) testējamā vielā ir jāuzzina, pamatojoties uz tās ķīmisko struktūru vai mērījumiem. Gaistošām testējamajām vielām lēmuma pieņemšanu par to, vai tests ir atbilstošs, atvieglo izmērītā vai aprēķinātā Henrija likuma konstante. Informācija par testējamās vielas toksicitāti anaerobām baktērijām ir noderīga, izvēloties atbilstošo testa koncentrāciju un interpretējot rezultātus, kas liecina par nepietiekamu bionoārdāmību. Ieteicams paredzēt kavēšanās kontroli, ja vien nav zināms, ka testējamā viela nekavē anaerobo mikroorganismu aktivitāti (sk. 21. punktu un ISO 13641–1 (12)).
|
TESTĒŠANAS METODES IZMANTOJAMĪBA
|
8.
|
Šo testēšanas metodi var piemērot ūdenī šķīstošām vielām; to var piemērot arī nepietiekami šķīstošām un nešķīstošām vielām, ja izmanto precīzas dozēšanas metodi, piem., sk. ISO 10634 (13). Gaistošām vielām parasti ir nepieciešams atsevišķs lēmums katrā gadījumā. Var būt jāveic īpaši pasākumi, piem., lai testa laikā neizdalītos gāze.
|
STANDARTVIELAS
|
9.
|
Lai pārbaudītu procedūru, standartvielu testē, izvēloties atbilstošus traukus, vienlaikus arī kā parastās testa gaitas daļu. Kā piemēri jāmin fenols, nātrija benzoāts un polietilēnglikols 400, un paredzams, ka tie noārdīsies par vairāk nekā 60 % teorētiski saražotās gāzes (t. i., metāna un neorganiskā oglekļa) 60 dienu laikā (3)(14).
|
TESTA REZULTĀTU ATKĀRTOJAMĪBA
|
10.
|
Starptautiskajā starplaboratoriju salīdzinošajā testēšanā (14) gāzes spiediena mērījumi bija pietiekami atkārtojami starp trim vienādiem traukiem. Relatīvā standartnovirze (variācijas koeficients, COV) lielākoties bija zemāka par 20 %, kaut arī šī vērtība bieži palielinājās līdz > 20 % toksisko vielu klātbūtnē vai kad tuvojās 60 dienu inkubācijas perioda beigas. Lielākas novirzes tika konstatētas arī traukos, kuru tilpums bija < 150 ml. Testēšanas barotnes galīgās pH vērtības bija diapazonā 6,5–7,0.
|
|
11.
|
Starplaboratoriju salīdzinošajā testēšanā tika iegūti turpmāk minētie rezultāti.
|
Testējamā viela
|
Kopējie dati
n1
|
Vidējā noārdīšanās
(no kopējiem datiem)
(%)
|
Relatīvā standartnovirze
(no kopējiem datiem)
(%)
|
Derīgie dati
n2
|
Vidējā noārdīšanās
(no derīgajiem datiem)
(%)
|
Relatīvā standartnovirze
(no derīgajiem datiem)
(%)
|
Dati > 60 % Noārdīšanās derīgajos testos
n3
|
|
Palmitīnskābe
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polietilēn Glikols 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Visu ar palmitīnskābi un polietilēnglikolu 400 iegūto vidējo vērtību variācijas koeficienti bija attiecīgi 45 % (n = 36) un 35 % (n = 38). Izlaižot vērtības, kas bija < 40 % un > 100 % (pieņem, ka pirmajiem iemesls bija nepietiekami optimāli apstākļi, bet otrajiem – nezināmi cēloņi), COV samazinājās attiecīgi līdz 26 % un 23 %. “Derīgo” vērtību, kas sasniedza vismaz 60 % noārdīšanās pakāpi, proporcija bija 70 % palmitīnskābei un 83 % polietilēnglikolam 400. Procentuālās bioloģiskās noārdīšanās proporcijas, kas tika atvasinātas no DIC mērījumiem, bija salīdzinoši mazas, taču mainīgas. Palmitīnskābei šis intervāls bija 0–35 %, vidēji 12 %, ar COV 92 %, bet polietilēnglikolam 400 tas bija 0–40 %, vidēji 24 %, ar COV 54 %.
|
TESTĒŠANAS METODES APRAKSTS
Aprīkojums
|
13.
|
Nepieciešamas parastās laboratorijas iekārtas un turpmāk minētais:
|
a.
|
inkubators – aizsargāts pret dzirkstelēm un kontrolēts pie 35 °C ± 2 °C;
|
|
b.
|
spiedienizturīga stikla testēšanas trauki atbilstošā nomināllielumā (38), visi aprīkoti ar gāzes necaurlaidīgu aizbāzni, kas spēj izturēt aptuveni 2 bārus. Augšgala tilpumam jābūt aptuveni 10–30 % no kopējā tilpuma. Ja biogāzi izdala regulāri, piemērots ir aptuveni 10 % augšgala tilpums, bet, ja gāzi izdala tikai testa beigās, piemēroti ir 30 %. Ja spiedienu izlaiž katrā parauga ņemšanas reizē, ieteicamas ir stikla seruma pudeles ar nominālo tilpumu 125 ml, kopējo tilpumu aptuveni 160 ml, noslēgtas ar seruma aizbāžņiem (39) un gofrētiem alumīnija gredzeniem;
|
|
c.
|
spiediena mērierīce (40), kas pielāgota saražotās gāzes mērīšanai un izplūdei, piem., ar roku turams precīza spiediena mērītājs, kas pieslēgts piemērotai šļirces adatai; trīsvirzienu gāzes necaurlaidīgs vārsts atvieglo liekā spiediena atbrīvošanu (1. papildinājums). Nepieciešams saglabāt iespējami mazu iekšējo tilpumu spiediena devēja caurulēm un vārstam, lai kļūdas, ko izraisīs iekārtas tilpuma neievērošana, nebūtu būtiskas;
Piezīme. Spiediena rādījumus tiešā veidā izmanto, aprēķinot augšgalā saražotā oglekļa apjomu (42.–44. punkts). Spiediena rādījumus var arī pārveidot par saražotās gāzes tilpumu (35 °C temperatūrā, ar atmosfēras spiedienu), izmantojot konversijas grafiku. Šis grafiks ir izstrādāts, pamatojoties uz datiem, kas iegūti, ievadot zināmus slāpekļa gāzes tilpumus vairākos testēšanas traukos (piem., seruma pudelēs) 35° +/– 2 °C temperatūrā un reģistrējot iegūtos stabilizētā spiediena rādījumus (sk. 2. papildinājumu). Šie aprēķini ir izklāstīti 44. punkta piezīmē.
Brīdinājums. Centieties izvairīties no adatas dūriena traumām, lietojot mikrošļirces.
|
|
d.
|
oglekļa analizators, kas piemērots neorganiskā oglekļa tiešai noteikšanai diapazonā 1 mg/l–200 mg/l;
|
|
e.
|
šļirces ar augstu precizitātes pakāpi gāzveida un šķidrajiem paraugiem;
|
|
f.
|
magnētiskie maisītāji un dzenmehānismi (pēc izvēles);
|
|
g.
|
cimdu kaste (ieteicama).
|
|
Reaģenti
|
14.
|
Visā testēšanā jāizmanto analītiskas tīrības pakāpes reaģenti.
|
Ūdens
|
15.
|
Destilēts vai dejonizēts ūdens (atbrīvots no skābekļa, apsmidzinot ar slāpekļa gāzi, kas satur mazāk par 5 μl/l skābekļa), kas satur mazāk par 2 mg/l izšķīdināta organiskā oglekļa (DOC).
|
Testēšanas barotne
|
16.
|
Sagatavo izšķīdināšanas barotni, kas satur turpmāk minētās sastāvdaļas norādītajos apjomos.
|
Bezūdens kālija dihidrogēnfosfāts (KH2PO4)
|
0,27 g
|
|
Dinātrija hidrogēnfosfāta dodekahidrāts (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Amonija hlorīds (NH4Cl)
|
0,53 g
|
|
Kalcija hlorīda dihidrāts (CaCl2 · 2H2O)
|
0,075 g
|
|
Magnija hlorīda heksahidrāts (MgCl2 · 6H2O)
|
0,10 g
|
|
Dzelzs (II) hlorīda tetrahidrāts (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurīns (skābekļa rādītājs)
|
0,001 g
|
|
Nātrija sulfīda nonahidrāts (Na2S · 9H2O)
|
0,10 g
|
|
Mikroelementu izejšķīdums (pēc izvēles, 18. punkts)
|
10 ml
|
|
Pievieno no skābekļa atbrīvotu ūdeni (15. punkts)
|
līdz 1 litram
|
Piezīme. Lai nodrošinātu pietiekamu redukcijas spēju, jālieto svaigi piegādāts nātrija sulfīds, vai arī tas pirms lietošanas jāmazgā un jāžāvē. Šo testu var veikt, neizmantojot cimdu kasti (sk. 26. punktu). Šādā gadījumā nātrija sulfīda galīgā koncentrācija barotnē jāpaaugstina līdz 0,20 g Na2S×9H2O uz litru. Nātrija sulfīdu var pievienot arī no piemērota anaerobā izejšķīduma caur noslēgto testēšanas trauku aizbāžņiem, jo šī procedūra mazinās oksidācijas risku. Nātrija sulfīdu var aizstāt ar titāna (III) citrātu, ko pievieno caur noslēgto testēšanas trauku aizbāžņiem, ar galīgo koncentrāciju no 0,8 līdz 1,0 mmol/l. Titāna (III) citrāts ir ļoti efektīvs un maztoksisks reducētājs, kuru pagatavo šādi – izšķīdina 2,94 g trinātrija citrāta dihidrāta 50 ml ūdens, kas atbrīvots no skābekļa (iegūstot 200 mmol/l šķīduma), un pievieno 5 ml 15 % (w/v) titāna (III) hlorīda šķīduma. Neitralizē līdz pH 7 ± 0,2 ar minerālo sārmu un izšķīdina piemērotā traukā zem slāpekļa plūsmas. Titāna (III) citrāta koncentrācija šajā izejšķīdumā ir 164 mmol/l.
|
|
17.
|
Samaisa testēšanas barotnes sastāvdaļas, izņemot reducētāju (nātrija sulfīdu vai titāna citrātu), un apsmidzina šo šķīdumu ar slāpekļa gāzi aptuveni 20 minūtes tieši pirms lietošanas, lai aizvāktu skābekli. Tad pievieno attiecīgu tilpumu svaigi pagatavota reducētāja šķīduma (kas pagatavots no skābekļa atbrīvotā ūdenī) tieši pirms barotnes lietošanas. Ja nepieciešams, pielāgo barotnes pH ar atšķaidītu minerālo skābi vai sārmu līdz 7 ± 0,2.
|
Mikroelementu izejšķīdums (pēc izvēles)
|
18.
|
Ieteicams, lai testēšanas barotne saturētu turpmāk minētos mikroelementus, kas uzlabos anaerobos noārdīšanās procesus, jo īpaši lietojot inokulātu ar zemu koncentrāciju (piem., 1 g/l) (11. literatūras avots).
|
Mangāna hlorīda tetrahidrāts (MnCl2 · 4H2O)
|
50 mg
|
|
Borskābe (H3BO3)
|
5 mg
|
|
Cinka hlorīds (ZnCl2)
|
5 mg
|
|
Vara (II) hlorīds (CuCl2)
|
3 mg
|
|
Dinātrija molibdāta dihidrāts (Na2MoO4 · 2H2O)
|
1 mg
|
|
Kobalta hlorīda heksahidrāts (CoCl2· 6H2O)
|
100 mg
|
|
Niķeļa hlorīda heksahidrāts (NiCl2 · 6H2O)
|
10 mg
|
|
Dinātrija selenīts (Na2SeO3)
|
5 mg
|
|
Pievieno no skābekļa atbrīvotu ūdeni (15. punkts)
|
līdz 1 litram
|
|
Testējamā viela
|
19.
|
Pievieno testējamo vielu kā izejšķīdumu, suspensiju, emulsiju vai tiešā veidā kā cietvielu vai šķidrumu, vai kā absorbciju uz stikla šķiedras filtra, lai nodrošinātu koncentrāciju ar ne vairāk kā 100 mg/l organiskā oglekļa. Ja izmanto izejšķīdumus, sagatavo piemērotu šķīdumu ar ūdeni (15. punkts) (iepriekš to atbrīvo no skābekļa, apsmidzinot ar slāpekļa gāzi) tādā stiprumā, lai pievienotais tilpums būtu mazāks par 5 % kopējā reakcijas maisījuma tilpuma. Pielāgo izejšķīduma pH līdz pH 7 ± 0,2, ja nepieciešams. Attiecībā uz testējamajām vielām, kas pietiekami nešķīst ūdenī, iepazīstieties ar ISO 10634 (13). Ja izmanto šķīdinātāju, sagatavo papildu kontrolgrupu, kuras gaitā šķīdinātāju pievieno tikai inokulētajai barotnei. Jāizvairās no organiskiem šķīdinātājiem, par kuriem zināms, ka tie aizkavē metāna rašanos, piem., no hloroforma un oglekļa tetrahlorīda.
Brīdinājums. Ievērojiet piesardzību, rīkojoties ar toksiskajām testējamajām vielām un vielām, kuru īpašības nav zināmas.
|
Standartvielas
|
20.
|
Standartvielas, piem., nātrija benzoāts, fenols un polietilēnglikols 400, ir sekmīgi lietotas procedūras pārbaudei, un 60 dienu laikā tās bioloģiski noārdījās par vairāk nekā 60 %. Sagatavo izvēlētās standartvielas izejšķīdumu (no skābekļa atbrīvotā ūdenī) tādā pašā veidā, kā testējamajai vielai, un pielāgo līdz pH 7 ± 0,2, ja nepieciešams.
|
Inhibēšanas kontroltests (ar nosacījumiem)
|
21.
|
Lai iegūtu informāciju par testējamās vielas toksicitāti anaerobiem mikroorganismiem, meklējot vispiemērotāko testa koncentrāciju, testējamo vielu un standartvielu pievieno traukā ar testēšanas barotni (sk. 16. punktu), katru tajā pašā koncentrācijā, kā attiecīgi pievienojot (sk. 19. un 20. punktu un arī ISO 13641-1 (12)).
|
Pārstrādātās dūņas
|
22.
|
Savāc pārstrādātās dūņas no bioreaktora notekūdeņu attīrīšanas iekārtām, kurās pārsvarā attīra sadzīves notekūdeņus. Dūņas pilnībā raksturo, un to pamatinformāciju paziņo (sk. 54. punktu). Ja plāno izmantot pielāgotu inokulātu, var paredzēt arī pārstrādātās dūņas no rūpnieciskajām notekūdeņu attīrīšanas iekārtām. Lieto pudeles ar platiem kakliem, kas izgatavotas no īpaši blīva polietilēna vai cita līdzīga materiāla, kas spēj paplašināties, lai savāktu pārstrādātās dūņas. Dūņas iepilda līdz aptuveni 1 cm no pudeļu augšgala un cieši noslēdz, vislabāk ar drošības vārstu. Pēc atvešanas uz laboratoriju savāktās dūņas var izmantot tiešā veidā vai ievietot laboratorijas mēroga bioreaktorā. Izlaiž lieko biogāzi, piesardzīgi atverot dūņu pudeles. Kā inokulāta avotu var izmantot arī laboratorijā audzētas anaerobās dūņas, taču to aktivitātes spektrs var būt nepilnīgs.
Brīdinājums. Pārstrādātas dūņas izdala viegli uzliesmojošas gāzes, kas var aizdegties vai uzsprāgt; tās arī satur potenciāli patogēnus organismus, tādēļ ir jāveic atbilstoši piesardzības pasākumi, rīkojoties ar nogulsnēm. Drošības apsvērumu dēļ dūņu savākšanai nelieto stikla traukus.
|
|
23.
|
Lai samazinātu fona gāzes rašanos un kontrolgrupas ietekmi, var paredzēt dūņu pirmapstrādi. Ja ir nepieciešama pirmapstrāde, dūņām ir jāļauj noārdīties, nepievienojot nekādas uzturvielas vai substrātus 35°C ± 2°C temperatūrā līdz septiņām dienām. Ir konstatēts, ka pirmapstrāde aptuveni piecu dienu garumā parasti optimāli samazina gāzes izdalīšanos kontroltestā, šajā testa posmā neradot nepieņemamus palielinājumus ne adaptācijas fāzes, ne arī inkubācijas periodā, un tā arī neizraisa aktivitātes zudumus nelielajam skaitam testēto vielu.
|
|
24.
|
Attiecībā uz testējamajām vielām, kuras bioloģiski noārdās nepietiekamā mērā vai kurām paredzama šāda nepietiekamība, paredz testējamās vielas pirmsekspozīciju uz dūņām, lai varētu iegūt labāk pielāgotu inokulātu. Šādā gadījumā testējamo vielu pievieno pārstrādātajām dūņām organiskā oglekļa koncentrācijā no 5 mg/l līdz 20 mg/l un inkubē līdz divām nedēļām. Pirms lietošanas ekspozīcijai sagatavotās dūņas rūpīgi nomazgā (sk. 25. punktu), un testēšanas pārskatā norāda šīs pirmsekspozīcijas apstākļus.
|
Inokulāts
|
25.
|
Dūņas mazgā (sk. 22.–24. punktu) tieši pirms lietošanas, lai samazinātu IC koncentrāciju galīgajā testa suspensijā līdz mazāk par 10 mg/l. Dūņas centrifugē hermētiski noslēgtās mēģenēs (piem., 3 000 g piecas minūtes) un izlej centrifugātu. Suspendē iegūto suspensiju barotnē, kas atbrīvota no skābekļa (16. un 17. punkts), vēlreiz centrifugē šo suspensiju un nolej centrifugāta šķidrumu. Ja IC nav pietiekami samazināts, dūņu mazgāšanas procedūru var atkārtot ne vairāk kā divas reizes. Var uzskatīt, ka tas nelabvēlīgi neietekmē mikroorganismus. Visbeidzot, suspendē suspensiju nepieciešamajā testēšanas barotnes tilpumā un nosaka kopējo cietvielu koncentrāciju [piem., ISO 11923 (15)]. Kopējo cietvielu galīgajai koncentrācijai testēšanas traukos ir jābūt diapazonā 1 g/l–3 g/l (jeb aptuveni 10 % cietvielu neatšķaidītās pārstrādātās dūņās). Minētās darbības veic tā, lai dūņu saskare ar skābekli būtu minimāla (piem., izmanto slāpekļa atmosfēru).
|
TESTA PROCEDŪRA
|
26.
|
Turpmāk minētās sākotnējās procedūras veic, lietojot metodes, kas nodrošina praktiski mazāko iespējamo saskari starp pārstrādātajām dūņām un skābekli, piem., var būt nepieciešams strādāt ar cimdu kasti slāpekļa atmosfērā un/vai iztīrīt pudeles ar slāpekli (4).
|
Testa un kontroltestu sagatavošana
|
27.
|
Sagatavo vismaz trīs testēšanas trauku komplektus (sk. 13.b punktu) testējamajai vielai, kontrolgrupai bez testējamās vielas, standartvielai, kavēšanas kontrolgrupai (ar nosacījumiem) un spiediena kontroles kameras (izvēles procedūra) (sk. 7. un 19.–21. punktu). Var sagatavot arī papildu traukus, lai varētu novērtēt primāro bioloģisko noārdīšanos, izmantojot testējamajai vielai specifiskas analīzes. Vienu tīrā ūdens kontrolgrupas komplektu var izmantot vairākām testējamajām vielām tajā pašā testā, kamēr vien augšgala tilpumi ir pietiekami.
|
|
28.
|
Sagatavo atšķaidītu inokulātu, pirms tā pievienošanas traukos, piem., izmantojot pipeti ar platu galu. Pievieno rūpīgi samaisīta inokulāta alikvotas (25. punkts), lai kopējo cietvielu koncentrācija būtu visos traukos vienāda (no 1 g/l līdz 3 g/l). Pielej testējamās vielas un standartvielas izejšķīdumus pēc pielāgošanas līdz pH 7 ± 0,2, ja nepieciešams. Testējamo vielu un standartvielu pievieno, izmantojot vispiemērotāko ievadīšanas ceļu (19. punkts).
|
|
29.
|
Organiskā oglekļa testa koncentrācija parasti ir robežās no 20 līdz 100 mg/l (4. punkts). Ja testējamā viela ir toksiska, testa koncentrācija jāsamazina līdz 20 mg C/l vai pat zemāk, ja ir jāmēra tikai primārā bionoārdīšanās, veicot specifiskas analīzes. Jāpiebilst, ka testa rezultātu mainīgums palielinās, ja testa koncentrācijas ir zemākas.
|
|
30.
|
Kontrolgrupas traukos ielej ekvivalentu izmantotās nesējvielas daudzumu, lai dozētu testējamo vielu, nevis izejšķīdumu, suspensiju vai emulsiju. Ja testējamo vielu pievieno caur stikla šķiedras filtriem vai ar organisko šķīdinātāju starpniecību, kontrolgrupas bez pievienotas ķīmiskās vielas testos izmanto filtru vai līdzvērtīga tilpuma šķīdinātāju, kas ir iztvaicēts. Sagatavo vēl vienu replikātu ar testējamo vielu, lai izmērītu pH vērtību. Pielāgo pH līdz 7 ± 0,2, ja nepieciešams, izmantojot nelielu daudzumu atšķaidītas minerālās skābes vai sārma. Visos testēšanas traukos jāpielej tādi paši apjomi neitralizācijas līdzekļu. Šīs vielas nav jāpielej, ja testējamās vielas un standartvielas izejšķīdumu pH vērtība jau ir pielāgota (sk. 19. un 20. punktu). Ja ir jāmēra primārā bionoārdīšanās, piemērots paraugs jāpaņem no pH kontroles trauka vai no testa papildu trauka, bet testējamās vielas koncentrācija jāmēra, veicot attiecīgās analīzes. Visos traukos var ievietot pārklātus magnētus, ja reakcijas maisījumi ir jāsamaisa (pēc izvēles).
|
|
31.
|
Nodrošina, lai V1 šķidruma kopējais tilpums un augšgala Vh tilpums būtu vienāds visos traukos; V1 un Vh lielumus atzīmē un reģistrē. Visi trauki jānoslēdz ar gāzes necaurlaidīgu aizbāzni un jāpārvieto no cimdu kastes (sk. 26. punktu) uz inkubatoru (sk. 13.a punktu).
|
Nešķīstošās testējamās vielas
|
32.
|
Ūdenī slikti šķīstošo vielu nosvērtus apjomus tiešā veidā ielej sagatavotajos traukos. Ja nepieciešams lietot šķīdinātāju (sk. 19. punktu), testējamās vielas šķīdumu vai suspensiju ielej tukšos traukos. Ja iespējams, iztvaicē šķīdinātāju, laižot slāpekļa gāzi cauri šiem traukiem, un tad pievieno citas sastāvdaļas, proti, atšķaidītās dūņas (25. punkts) un no skābekļa atbrīvotu ūdeni, ja nepieciešams. Jāsagatavo arī papildu šķīdinātāja kontrolgrupa (sk. 19. punktu). Citas metodes nešķīstošo vielu pievienošanai ir apskatāmas ISO 10634 (13). Šķidrās testējamās vielas var dozēt ar šļirci pilnībā sagatavotos noslēgtos traukos, ja paredzams, ka sākotnējais pH nepārsniegs 7 ± 1, pretējā gadījumā dozē tā, kā minēts iepriekš (sk. 19. punktu).
|
Inkubācija un gāzes spiediena mērījumi
|
33.
|
Sagatavotos traukus inkubē 35 °C ± 2 °C temperatūrā aptuveni vienu stundu, lai nodrošinātu uzbriešanu un izlaistu lieko gāzi atmosfērā, piem., kratot visus traukus pēc kārtas, ievietojot spiediena mērītāja adatu (13.c punkts) caur vāciņu un atverot vārstu, kamēr spiediena mērītājs uzrāda nulli. Ja šajā posmā vai starpposma mērījumu laikā augšgala spiediens ir mazāks par atmosfēras spiedienu, jāievada slāpekļa gāze, lai atjaunotu atmosfēras spiedienu. Vārstu noslēdz (sk. 13.c punktu) un turpina inkubāciju tumsā, nodrošinot, lai visas trauku daļas saglabātos pārstrādes temperatūrā. Pēc inkubācijas traukus novēro 24–48 stundas. Trauki nav derīgi, ja to saturs uzrāda izteiktu rozā iekrāsojumu centrifugāta šķidrumā, t. i., ja resazurīns (sk. 16. punktu) ir mainījis krāsu, norādot uz skābekļa klātbūtni (sk. 50. punktu). Kaut arī sistēma var pieļaut nelielu skābekļa apjomu, augstākas tā koncentrācijas var būtiski aizkavēt anaerobās bioloģiskās noārdīšanās gaitu. Viena trauka nejaušs nederīgums no trim trauku komplektiem vēl ir pieņemams, taču, ja rodas vēl citas papildu neprecizitātes, ir jāizmeklē eksperimenta procedūras un jāatkārto tests.
|
|
34.
|
Rūpīgi samaisa katra trauka saturu, maisot vai kratot to vairākas minūtes vismaz divas vai trīs reizes nedēļā un īsi pirms katra spiediena mērījuma. Kratīšana atkal suspendē inokulātu un nodrošina gāzu līdzsvaru. Visi spiediena mērījumi ir jāveic ātri, jo testēšanas traukiem var pazemināties temperatūra, izraisot neprecizitātes rādījumos. Mērot spiedienu, visiem testēšanas traukiem, arī augšgalā, ir jāsaglabājas pārstrādes temperatūrā. Gāzes spiedienu mēra, piem., ievadot caur aizbāzni šļirces adatu (13.c punkts), kas pievienota spiediena uzraudzības mērītājam. Jāparūpējas par to, lai šļirces adatā neiekļūtu ūdens; ja tā notiek, mitrās daļas ir jāizžāvē un jāņem jauna adata. Spiedienu mēra milibāros (sk. 42. punktu). Gāzes spiedienu traukos var mērīt periodiski, piem., reizi nedēļā, un tad pēc izvēles var izlaist atmosfērā lieko gāzi. Cita iespēja ir mērīt spiedienu tikai testa beigās, lai noteiktu saražotās biogāzes apjomu.
|
|
35.
|
Ieteicams nolasīt arī gāzes spiediena starpposma rādījumus, jo spiediena palielināšanās ļauj izprast, kad testu var izbeigt, un uzraudzīt kinētiku (sk. 6. punktu).
|
|
36.
|
Parasti testu beidz pēc 60 dienu inkubācijas perioda, ja vien bioloģiskās noārdīšanās līkne, kas iegūta no spiediena mērījumiem, nesasniedz stacionāro posmu agrāk; tas ir posms, kurā sasniegtā maksimālā noārdīšanās un bioloģiskās noārdīšanās līkne izlīdzinās. Ja stacionārās fāzes vērtība ir mazāka par 60 %, interpretācija ir apgrūtināta, jo tā liecina par to, ka tikai daļa molekulas ir mineralizējusies vai ir pieļauta kāda kļūda. Ja parastā inkubācijas perioda beigās gāze ir saražota, bet stacionārais posms acīmredzami nav sasniegts, jāapsver iespēja pagarināt testu, lai varētu pārbaudīt, vai stacionārā fāze (> 60 %) tiks sasniegta.
|
Neorganiskā oglekļa mērīšana
|
37.
|
Testa beigās pēc pēdējā gāzes spiediena mērījuma, dūņām ļauj nostādināties. Atver visus traukus pēc kārtas un uzreiz paņem paraugus neorganiskā oglekļa (IC) koncentrācijas (mg/l) noteikšanai centrifugāta šķidrumā. Centrifugāta šķidrumam neveic ne centrifugēšanu, ne filtrēšanu, jo var rasties nepieņemami izšķīdinātā oglekļa dioksīda zudumi. Ja šo šķidrumu nevar analizēt parauga ņemšanas brīdī, to uzglabā noslēgtā flakonā bez tukšā augšgala un atdzesē līdz aptuveni 4 °C ne ilgāk kā divas dienas. Pēc IC izmērīšanas mēra un reģistrē pH vērtību.
|
|
38.
|
Cita iespēja ir noteikt IC centrifugātā netieši, izdalot izšķīdināto IC kā oglekļa dioksīdu, ko var izmērīt augšgalā. Pēc gāzes spiediena pēdējā mērījuma pielāgo spiedienu katrā testēšanas traukā, sasniedzot atmosfēras spiedienu. Visos traukos saturu skābina līdz aptuveni pH 1, pievienojot koncentrētu minerālo skābi (piem., H2SO4) caur noslēgto trauku aizbāžņiem. Sakratītos traukus inkubē 35 °C ± 2 °C temperatūrā aptuveni 24 stundas un izmēra gāzes spiedienu, ko rada izveidojies oglekļa dioksīds, izmantojot spiediena mērītāju.
|
|
39.
|
Veic līdzīgus nolasījumus attiecībā uz atbilstošo tukšā testa, standartvielas un, ja ir iekļauti, arī kavēšanās kontrolgrupas traukiem (sk. 21. punktu).
|
|
40.
|
Dažos gadījumos, jo īpaši tad, kad tos pašus kontrolgrupas traukus izmanto vairākām testējamām vielām, ir jāparedz mērījumu veikšana par starpposma IC koncentrācijām testa un kontrolgrupas traukos, ja attiecināms. Šādos gadījumos ir jāsagatavo pietiekams skaits trauku visiem starpposma mērījumiem. Labāk ir veikt šo procedūru, nevis ņemt visus paraugus tikai no viena trauka. No viena trauka paraugus var ņemt tikai tad, kad DIC analīzēm nepieciešamais tilpums nav uzskatāms par pārāk lielu. DIC mērīšana jāveic pēc tam, kad ir izmērīts gāzes spiediens, neizlaižot lieko gāzi, kā izklāstīts turpmāk:
|
—
|
iespējami mazāku centrifugāta parauga tilpumu paņem ar šļirci caur aizbāzni, neatverot traukus, un nosaka IC paraugā;
|
|
—
|
pēc parauga paņemšanas lieko gāzi izlaiž vai neizlaiž;
|
|
—
|
jāņem vērā, ka pat neliels centrifugāta apjoma samazinājums (piem., aptuveni 1 %) var būtiski palielināt gāzes daudzumu augšgalā (Vh);
|
|
—
|
nepieciešamības gadījumā izlabo vienādojumus (sk. 44. punktu), palielinot Vh 3. vienādojumā.
|
|
Specifiskās analīzes
|
41.
|
Ja ir jānosaka primārā anaerobā noārdīšanās (sk. 30. punktu), piemērotu parauga tilpumu attiecīgajai analīzei paņem testa sākumā un beigās no traukiem, kas satur testējamo vielu. Ja tā dara, jāievēro, ka augšgala tilpums (Vh) un šķidruma tilpums (Vl) mainīsies, un tas būs jāņem vērā, aprēķinot gāzes ražošanas rezultātus. Paraugus attiecīgajai analīzei var paņemt arī no papildu maisījumiem, kas iepriekš sagatavoti šim nolūkam (30. punkts).
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
42.
|
Praktisku apsvērumu dēļ gāzes spiedienu mēra milibāros (1 mbar = 1h Pa = 102 Pa; 1 Pa = 1 N/m2), tilpumu litros un temperatūru grādos pēc Celsija.
|
Oglekļa daudzums no šķidruma brīvajā trauka daļā
|
43.
|
Tā kā 1 mols metāna un 1 mols oglekļa dioksīda katrs satur 12 g oglekļa, oglekļa masu dotajā izdalījušās gāzes tilpumā var izteikt šādi.
|
m= 12 × 103×n
|
1. vienādojums
|
kur:
|
m
|
=
|
oglekļa masa (mg) dotajā izdalījušās gāzes tilpumā;
|
|
12
|
=
|
oglekļa relatīvā atommasa;
|
|
n
|
=
|
gāzes molu skaits dotajā tilpumā.
|
Ja ievērojamos apjomos tiek radīta cita gāze, kas nav metāns vai oglekļa dioksīds (piem., N2O), 1. formulu maina, lai paredzētu iespējamās izdalīto gāzu ietekmes.
|
|
44.
|
Saskaņā ar gāzes noteikumiem n var izteikt šādi:
|
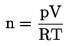
|
2. vienādojums
|
kur:
|
p
|
=
|
gāzes spiediens (paskālos);
|
|
V
|
=
|
gāzes tilpums (m3);
|
|
R
|
=
|
gāzes molārā konstante [8,314 J/(mol K)];
|
|
T
|
=
|
inkubācijas temperatūra (kelvinos).
|
1. un 2. vienādojuma apvienošana un to racionalizēšana, ļauj veikt gāzes ražošanas aprēķinu kontroltestiem:
|

|
3. vienādojums
|
kur:
|
mh
|
=
|
neto oglekļa masa, kas saražota kā gāze augšgalā (mg);
|
|
Dp
|
=
|
vidējā starpība starp sākotnējo un beigu spiedienu testēšanas traukos, atņemot no tās attiecīgo vidējo lielumu kontrolgrupas bez pievienotās ķīmiskās vielas traukos (milibāros);
|
|
Vh
|
=
|
tilpums trauka augšgalā (l);
|
|
0,1
|
=
|
abos gadījumos ņūtonu/m2 konversija milibāros un m3 konversija litros.
|
4. vienādojums jālieto parastai inkubācijas temperatūrai 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
4. vienādojums
|
Piezīme. Alternatīvs tilpuma aprēķins. Spiediena mērītāja rādījumus pārvērš saražotās gāzes ml, izmantojot standarta līkni, kas iegūta, atzīmējot ievadīto tilpumu (ml), salīdzinājumā ar mērītāja rādījumiem (2. papildinājums). Gāzes molu skaitu (n) katra trauka augšgalā aprēķina, izdalot kumulatīvo saražotās gāzes apjomu (ml) ar 25 286 ml/mols, kas ir tilpums, kādu aizņem viens gāzes mols 35 °C temperatūrā un standarta atmosfēras spiediena apstākļos. Tā kā 1 mols CH4 un 1 mols CO2 katrs satur 12 g oglekļa, oglekļa apjoms (mg) augšgalā (mh
) ir parādīts 5. vienādojumā:
|
mh
= 12 × 103×n
|
5. vienādojums
|
Racionalizē, lai varētu veikt gāzes ražošanas kontrolgrupas testu:
|
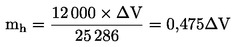
|
6. vienādojums
|
kur:
|
mh
|
=
|
neto oglekļa masa, kas saražota kā gāze augšgalā (mg);
|
|
DV
|
=
|
vidējā starpība starp gāzes tilpumu, kas saražots testēšanas trauku augšgalā un kontrolgrupas bez pievienotas ķīmiskās vielas trauku augšgalā;
|
|
25 286
|
=
|
tilpums, ko aizņem 1 mols gāzes 35 °C temperatūrā 1 atmosfēras spiediena apstākļos.
|
|
|
45.
|
Bioloģiskās noārdīšanās gaitu var izsekot, atzīmējot apvienoto spiediena palielinājumu Dp (milibāros), salīdzinājumā ar laiku, ja attiecināms. No šīs līknes identificē un reģistrē adaptācijas fāzi (dienās). Adaptācijas fāze ir laiks no testa sākuma līdz būtiskas noārdīšanās sākumam (piemēru sk. 3. papildinājumā). Ja tiek paņemti un analizēti centrifugāta starpposma paraugi (sk. 40., 46. un 47. punktu), var atzīmēt kopējā saražotā oglekļa daudzumu (gāzē, kā arī šķidrumā), nevis tikai kumulatīvo spiedienu.
|
Ogleklis šķidrumā
|
46.
|
Metāna apjomu šķidrumā ignorē, jo ir zināms, ka tā šķīdība ūdenī ir ļoti zema. Neorganiskā oglekļa masu testēšanas trauku šķidrumā aprēķina saskaņā ar 7. vienādojumu:
|
ml
=Cnet
×Vl
|
7. vienādojums
|
kur:
|
ml
|
=
|
neorganiskā oglekļa masa šķidrumā (mg);
|
|
Cnet
|
=
|
neorganiskā oglekļa koncentrācija testēšanas traukos, atņemot no tās koncentrāciju kontrolgrupas bez pievienotas ķīmiskās vielas traukos testa beigās (mg/l);
|
|
Vl
|
=
|
šķidruma tilpums traukā (l).
|
|
Kopējais gāzveida ogleklis
|
47.
|
Gāzveida oglekļa kopējo masu traukā aprēķina saskaņā ar 8. vienādojumu:
|
mt
=mh
+ml
|
8. vienādojums
|
kur:
|
|
mt = gāzveida oglekļa kopējā masa (mg);
|
|
|
mh
un ml
ir tādi, kā iepriekš minēts.
|
|
Testējamās vielas ogleklis
|
48.
|
No pievienotās testējamās vielas iegūtā oglekļa masu testēšanas traukos aprēķina saskaņā ar 9. vienādojumu:
|
mv
=Cc
×Vl
|
9. vienādojums
|
kur:
|
mv
|
=
|
testējamās vielas oglekļa masa (mg);
|
|
Cc
|
=
|
testējamās vielas oglekļa koncentrācija testēšanas traukos (mg/l);
|
|
Vl
|
=
|
šķidruma tilpums testēšanas traukā (l).
|
|
Bioloģiskās noārdīšanās pakāpe
|
49.
|
Procentuālo bioloģisko noārdīšanos no virspusē uzkrātās gāzes aprēķina saskaņā ar 10. vienādojumu, bet kopējo procentuālo bioloģisko noārdīšanos – saskaņā ar 11. vienādojumu:
|
Dh
= (mh
/mv
) × 100
|
10. vienādojums
|
|
Dt
= (mt
/mv
) × 100
|
11. vienādojums
|
kur:
|
|
Dh = bionoārdīšanās no virspusē uzkrātās gāzes ( %);
|
|
|
Dt = kopējā bionoārdīšanās ( %);
|
|
|
mh
, mv
un mt
ir tādi, kā iepriekš minēts.
|
Primārās bioloģiskās noārdīšanās pakāpi aprēķina, pamatojoties uz testējamās vielas koncentrācijas (izvēles) mērījumiem inkubācijas sākumā un beigās saskaņā ar 12. vienādojumu:
|
Dp
= (1 –Se
/Si
) × 100
|
12. vienādojums
|
kur:
|
Dp
|
=
|
testējamās vielas primārā noārdīšanās ( %);
|
|
Si
|
=
|
testējamās vielas sākotnējā koncentrācija (mg/l);
|
|
Se
|
=
|
testējamās vielas koncentrācija beigās (mg/l).
|
Ja analīzes metode liecina par testējamās vielas būtiskām koncentrācijām nemainītā anaerobā dūņu inokulātā, izmanto 13. vienādojumu:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
13. vienādojums
|
kur:
|
Dp
1
|
=
|
koriģētā testējamās vielas primārā noārdīšanās ( %);
|
|
Sib
|
=
|
sākotnējā “acīmredzamā” testējamās vielas koncentrācija kontrolgrupu testos (mg/l);
|
|
Seb
|
=
|
“acīmredzamā” testējamās vielas beigu koncentrācija kontrolgrupu testos (mg/l).
|
|
Rezultātu derīgums
|
50.
|
Izmanto spiediena rādījumus tikai no tiem traukiem, kuros nav vērojams rozā iekrāsojums (sk. 33. punktu). Piesārņojumu ar skābekli samazina līdz minimumam, izmantojot atbilstošas anaerobās rīcības metodes.
|
|
51.
|
Jāņem vērā, ka tests ir derīgs, ja standartviela sasniedz stacionāro fāzi, kas pārstāv vairāk nekā 60 % bioloģiskās noārdīšanās (41).
|
|
52.
|
Ja testa beigās pH pārsniedz diapazonu 7 ± 1 un bionoārdīšanās notiek nepietiekami, testu atkārto ar palielinātu barotnes buferšķīduma spēju.
|
Noārdīšanās kavēšana
|
53.
|
Gāzes ražošanai traukos, kas satur testējamo vielu un standartvielu, jābūt vismaz tādā līmenī, kā gāzes ražošanai traukos, kas satur tikai standartvielu; pretējā gadījumā pazīmes liecina par gāzes ražošanas kavēšanu. Dažos gadījumos gāzes ražošana traukos, kas satur testējamo vielu, bet nesatur standartvielu, ir mazāka nekā ražošana kontrolgrupā bez pievienotas ķīmiskās vielas, un tas liecina, ka testējamā viela ir kavējoša.
|
Testēšanas pārskats
|
54.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā viela:
|
—
|
vispārpieņemtais nosaukums, ķīmiskais nosaukums, CAS numurs, struktūrformula un attiecīgās fizikālķīmiskās īpašības;
|
|
—
|
testējamās vielas tīrība (piemaisījumi).
|
|
|
|
Testēšanas apstākļi:
|
—
|
atšķaidītā pārstrādes šķidruma tilpums (Vl
) un augšgala tilpums (Vh
) traukā;
|
|
—
|
testēšanas trauku apraksts, biogāzes mērīšanas galvenās īpašības (piem., spiediena mērītāja tips) un IC analizatora galvenās īpašības;
|
|
—
|
testējamās vielas un standartvielas piemērošana testēšanas sistēmai – izmantotā testa koncentrācija un jebkādu šķīdinātāju lietošana;
|
|
—
|
informācija par izmantoto inokulātu – notekūdeņu attīrīšanas iekārtas nosaukums, attīrīto notekūdeņu avota apraksts (piem., ekspluatācijas temperatūra, dūņu uzglabāšanas laiks, sadzīves notekūdeņu pārsvars utt.), koncentrācija, jebkura informācija, kas nepieciešama minētā pamatošanai, un informācija par jebkuru iepriekšēju inokulāta apstrādi (piem., pirmapstrādi, pirmsekspozīciju);
|
|
—
|
inkubācijas temperatūra;
|
|
|
|
Rezultāti:
|
—
|
pH un IC vērtības testa beigās;
|
|
—
|
testējamās vielas koncentrācija testa sākumā un beigās, ja tiek veikti specifiski mērījumi;
|
|
—
|
visi izmērītie dati, kas savākti attiecīgi testa, kontrolgrupas bez pievienotas ķīmiskās vielas, standartvielas un inhibēšanas kontrolgrupas traukos (piem., spiediens milibāros un neorganiskā oglekļa koncentrācija (mg/l)) un apkopoti tabulas veidā (izmērītie dati par augšgalu un šķidrumu ir jāpaziņo atsevišķi);
|
|
—
|
datu statistiskā apstrāde, testēšanas ilgums un diagramma par testējamās vielas un standartvielas bioloģisko noārdīšanos un inhibēšanas kontroli;
|
|
—
|
testējamās vielas un standartvielas bionoārdīšanās procentos;
|
|
—
|
ikviena testa rezultātu nepieņemšanas iemesli;
|
|
|
LITERATŪRA
|
(1)
|
Šā pielikuma nodaļas:
|
|
C.4. nodaļa. Tūlītējas bionoārdāmības noteikšana;
|
|
|
C.9. nodaļa. Bionoārdīšanās – Zahn-Wellens tests;
|
|
|
C.10. nodaļa. Imitācijas tests – aerobā notekūdeņu attīrīšana:
A. Aktivēto dūņu vienības, B. Bioplēves;
|
|
|
C.11. nodaļa. Bionoārdīšanās: aktivēto dūņu elpošanas inhibēšanas tests.
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (Also published as ECETOC Technical Report No. 28, June 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
International Organization for Standardization (1995) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
(12)
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
(13)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
(15)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
1. papildinājums
Iekārtas piemērs gāzes spiediena apstākļos saražotās biogāzes mērīšanai

Skaidrojums
|
1.
|
Spiediena mērītājs
|
|
2.
|
Gāzes necaurlaidīgs trīsvirzienu vārsts
|
|
3.
|
Šļirces adata
|
|
4.
|
Gāzes necaurlaidīgs blīvējums (gofrēts vāciņš un aizbāznis)
|
|
5.
|
Augšgals (Vh
)
|
|
6.
|
Pārstrādātu dūņu inokulāts (Vl
)
|
Testēšanas trauki 35 °C ± 2 °C temperatūras vidē.
2. papildinājums
Spiediena mērītāja konversija
Spiediena mērītāja rādījumus var saistīt ar gāzes tilpumiem, izmantojot standarta līkni, kas iegūta, ievadot zināmus gaisa tilpumus 35 °C ± 2 °C temperatūrā seruma pudelēs, kurās ūdens tilpums ir vienāds ar reakcijas maisījuma tilpumu, V
R:
|
—
|
sagatavo V
R ml tāda ūdens alikvotu, kas turēts 35 °C ± 2 °C temperatūrā, piecās seruma pudelēs. Noslēdz šīs pudeles un ievieto ūdens vannā 35 °C temperatūrā uz vienu stundu uzbriešanai;
|
|
—
|
ieslēdz spiediena mērītāju, ļauj tam stabilizēties un noregulē uz nulli;
|
|
—
|
iebāž šļirces adatu caur blīvējumu vienā no pudelēm, atver vārstu līdz brīdim, kamēr spiediena mērītājs rāda nulli, un aizver vārstu;
|
|
—
|
atkārto šo procedūru ar pārējām pudelēm;
|
|
—
|
ievada 1 ml gaisa 35 °C ± 2 °C temperatūrā katrā pudelē. Iebāž (mērītāja) adatu caur blīvējumu vienā no pudelēm un ļauj spiediena rādījumiem stabilizēties. Reģistrē spiedienu, atver vārstu līdz brīdim, kamēr spiediens rāda nulli, un tad aizver vārstu;
|
|
—
|
atkārto šo procedūru ar pārējām pudelēm;
|
|
—
|
atkārto visu minēto procedūru, izmantojot 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml un 50 ml gaisa;
|
|
—
|
atzīmē spiediena (Pa) konversijas līkni, salīdzinājumā ar ievadīto gāzes tilpumu Vb (ml). Instrumenta reakcija ir lineāra diapazonā 0 Pa–70 000 Pa un 0 ml–50 ml saražotās gāzes.
|
3. papildinājums
Noārdīšanās līknes piemērs (kumulatīvais neto spiediena palielinājums)
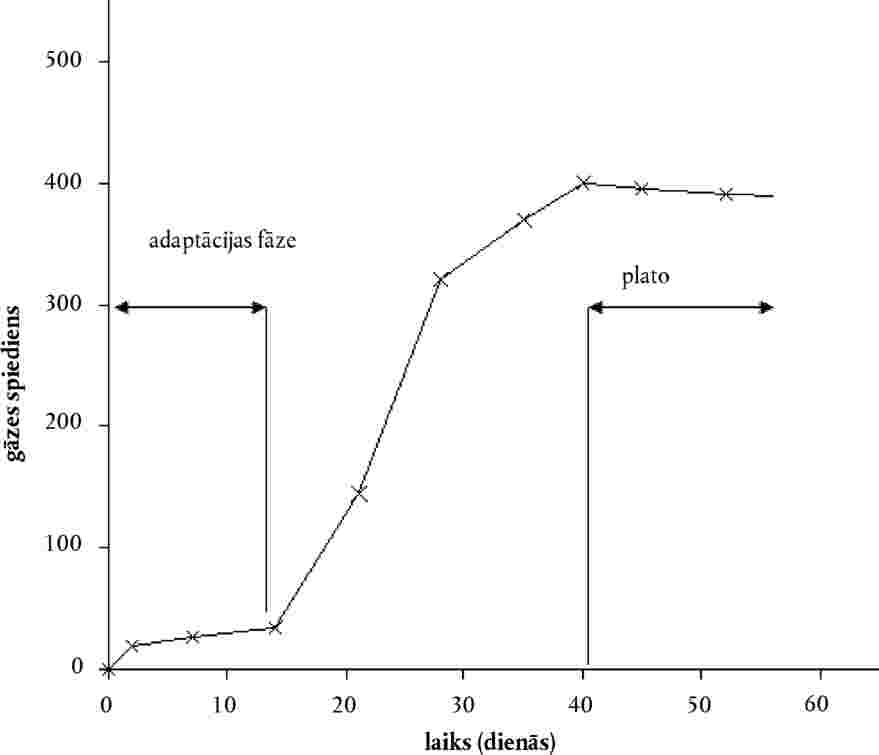
4. papildinājums
Datu lapu piemērs anaerobās bioloģiskās noārdīšanās TESTAM – Datu lapa testējamajai vielai
|
Laboratorija: …
|
Testējamā viela: …
|
Testa Nr.: …
|
|
Testa temperatūra (°C): …
|
Augšgala tilpums (V
h): …(l)
|
Šķidruma tilpums (V
l): …(l)
|
|
Ogleklis testa vielā C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Diena
|
p
1 (tests)
(mbar)
|
p
2 (tests)
(mbar)
|
p
3 (tests)
(mbar)
|
p (tests)
vidēji
(mbar)
|
p
4 (tukšais tests)
(mbar)
|
p
5 (tukšais tests)
(mbar)
|
p
6 (tukšais tests)
(mbar)
|
p (tukšais tests)
vidēji
(mbar)
|
p(neto)
tests – tukšais tests
vidēji (mbar)
|
D
p (neto)
kumulatīvi
(mbar)
|
m
h
augšgala C
(43)
(mg)
|
D
h
bionoārdīšanās (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
tests
(mg)
|
C
IC, 2
tests
(mg)
|
C
IC, 3
tests
(mg)
|
C
IC
tests vidēji
(mg)
|
C
IC, 4
tukšais tests
(mg)
|
C
IC, 5
tukšais tests
(mg)
|
C
IC, 6
Tukšais tests
(mg)
|
C
IC
Tukšais tests vidēji
(mg)
|
C
IC, net
tests – tukšais tests
vidēji
(mg)
|
m
l
šķidrais C
(45)
(mg)
|
m
t
kopējais C
(46)
(mg)
|
D
t
bionoārdīšanās (47)
(%)
|
|
IC (beigās)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (beigās)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorija: …
|
Standartviela: …
|
Testa Nr.: …
|
|
Testa temperatūra (°C): …
|
Augšgala tilpums (V
h): …(l)
|
Šķidruma tilpums (V
l) (litros): …
|
|
Ogleklis standartvielā C
c,v (mg/l): …
|
mv
(48) (mg): …
|
|
|
Diena
|
p
1 (standartviela)
(mbar)
|
p
2 (standartviela)
(mbar)
|
p
3 (standartviela)
(mbar)
|
p (standartviela)
vidēji
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
vidēji
(mbar)
|
p (standartviela)
standartviela – tukšais tests
(mbar)
|
D
p (standartviela)
kumulatīvi
(mbar)
|
m
h
augšgala C
(49)
(mg)
|
D
h
bionoārdīšanās (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
standartviela
(mg)
|
C
IC, 2
standartviela
(mg)
|
C
IC, 3
standartviela
(mg)
|
C
IC
standartviela vidēji
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
inhib. vidēji
(mg)
|
C
IC, net
standartviela – inhib.
(mg)
|
m
l
šķidrais C
(51)
(mg)
|
m
t
kopējais C
(52)
(mg)
|
D
t
bionoārdīšanās (53)
(%)
|
|
IC (beigās)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (beigās)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. IZSKALOŠANĀS AUGSNES KOLONNĀS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 312 (2004. gads). Cilvēku radītas ķīmiskās vielas var nonākt augsnē tiešā veidā, tās apzināti lietojot (piem., lauksaimniecībā izmantojamās ķīmiskās vielas), vai netiešā ceļā (piem., notekūdeņi → notekūdeņu dūņas → augsne vai gaiss → mitrā/sausā nogulsnēšanās). Šo ķīmisko vielu radītā riska novērtēšanai ir svarīgi aplēst to potenciālās ķīmiskās reakcijas augsnē un pārvietošanos (izskalošanos) dziļākos augsnes slāņos un iespējams pat gruntsūdeņos.
|
|
2.
|
Ir pieejamas vairākas metodes, ar ko kontrolētos laboratorijas apstākļos mēra ķīmisko vielu potenciālo izskalošanos augsnē, t. i., augsnes plānslāņa hromatogrāfija, augsnes biezslāņa hromatogrāfija, augsnes kolonnas hromatogrāfija un adsorbcijas–desorbcijas mērījumi (1)(2). Nejonizētām ķīmiskajām vielām n-oktanola-ūdens sadalījuma koeficients (Pow) ļauj laikus aplēst to adsorbcijas un izskalošanās potenciālu (3)(4)(5).
|
|
3.
|
Šeit aprakstītā testēšanas metode balstās uz augsnes kolonnas hromatogrāfiju sajauktā augsnē (definīciju sk. 1. papildinājumā). Ir veikti divu veidu eksperimenti, lai kontrolētos laboratorijas apstākļos noteiktu i) testējamās ķīmiskās vielas izskalošanās potenciālu un ii) reakciju produktu izskalošanās potenciālu (pētījums ar izturētām atliekām) augsnēs (54). Šīs testēšanas metodes pamatā ir esošās metodes (6)(7)(8)(9)(10)(11).
|
|
4.
|
ESAO seminārā par augsnes/sedimentu atlasi, kas 1995. gadā notika Beldžiratē, Itālijā (12), vienojās par šajā testēšanas metodē izmantojamo augšņu skaitu un tipu, kā arī sniedza ieteikumus attiecībā uz augsnes paraugu vākšanu, apstrādi un uzglabāšanu izskalošanās eksperimentu nolūkiem.
|
TESTA METODES PRINCIPS
|
5.
|
Kolonnas, kas veidotas no pietiekami inerta materiāla (piem., stikla, nerūsējošā tērauda, alumīnija, teflona, PVH utt.), piepilda ar augsni un pēc tam piesātina un līdzsvaro ar “mākslīgā lietus” šķīdumu (definīciju sk. 1. papildinājumā) un ļauj tām notecēt. Tad katras augsnes kolonnas virsmu apstrādā ar testējamo ķīmisko vielu un/vai izturētām testējamās ķīmiskās vielas atliekām. Pēc tam augsnes kolonnas aplej ar “mākslīgā lietus” šķīdumu un savāc izskalojumus. Pēc izskalošanas procesa augsni izņem no kolonnām un sadala atbilstošā segmentu skaitā, atkarībā no informācijas, kas jāiegūst pētījumā. Katru augsnes segmentu un izskalojumu pēc tam analizē attiecībā uz testējamo ķīmisko vielu un, ja attiecināms, reakciju produktiem vai citām interesējošām ķīmiskajām vielām.
|
TESTĒŠANAS METODES IZMANTOJAMĪBA
|
6.
|
Testēšanas metodi piemēro testējamajām ķīmiskajām vielām (nemarķētām vai radioaktīvi marķētām, piem., 14C), kurām ir pieejama pietiekami precīza un jutīga analīzes metode. Testēšanas metodi nepiemēro ķīmiskajām vielām, kuras ir gaistošas no augsnes un ūdens un tādēļ šīs testēšanas metodes eksperimentālajos apstākļos nesaglabājas augsnē un/vai izskalojumā.
|
INFORMĀCIJA PAR TESTĒJAMO ĶĪMISKO VIELU
|
7.
|
Nemarķētas vai radioaktīvi marķētas testējamās ķīmiskās vielas var izmantot izskalošanās procesu mērīšanai augsnes kolonnās. Radioaktīvi marķēts materiāls ir nepieciešams reakciju produktu (testējamo ķīmisko vielu izturēto atlieku) izskalošanās izpētei un masas līdzsvara noteikšanai.14C marķējums ir ieteicams, taču var noderēt arī citi izotopi, piem.,13C,15N,3H un32P. Ja iespējams, jāiezīmē molekulas stabilākās daļas. Testējamās ķīmiskās vielas tīrībai jābūt vismaz 95 %.
|
|
8.
|
Lielākā daļa ķīmisko vielu ir jālieto kā atsevišķas vielas. Tomēr attiecībā uz darbīgajām vielām augu aizsardzības līdzekļos var izmantot sintezētus produktus, lai pētītu testējamās pamatvielas izskalošanos, bet to testēšana ir īpaši nepieciešama, ja maisījums var ietekmēt izdalīšanās ātrumu (piem., granulētās vai kontrolēti izdalītās sintezētās vielas). Atkarībā no testējamā maisījuma specifiskajām testēšanas plāna prasībām, pirms testa veikšanas būtu ieteicams konsultēties ar regulatīvajām iestādēm. Izturēto atlieku izskalošanās pētījumos ir jāizmanto tīras testa pamatvielas.
|
|
9.
|
Pirms izskalošanās testu veikšanas augsnes kolonnās ir ieteicams noskaidrot šādu informāciju par testējamo ķīmisko vielu:
|
(1)
|
šķīdība ūdenī [A.6. testēšanas metode] (13);
|
|
(2)
|
šķīdība organiskajos šķīdinātājos;
|
|
(3)
|
tvaika spiediens [A.4. testēšanas metode] (13) un Henrija likuma konstante;
|
|
(4)
|
n-oktanola/ūdens sadalījuma koeficients [A.8. un A.24. testēšanas metode] (13);
|
|
(5)
|
adsorbcijas koeficients (Kd, Kf vai KOC) [C.18. un/vai C.19. testēšanas metode] (13);
|
|
(6)
|
hidrolīze [C.7. testēšanas metode] (13);
|
|
(7)
|
disociācijas konstante (pKa) [ESAO TG 112] (25);
|
|
(8)
|
aerobās un anaerobās reakcijas augsnē [C.23. testēšanas metode] (13).
|
Piezīme. Temperatūru, kurā šie mērījumi veikti, jānorāda attiecīgajos testēšanas pārskatos.
|
|
10.
|
Testējamās ķīmiskās vielas apjomam, ar ko apstrādā augsnes kolonnas, jābūt pietiekamam, lai varētu detektēt vismaz 0,5 % ievietotās devas katrā atsevišķajā segmentā. Attiecībā uz darbīgajām ķīmiskajām vielām augu aizsardzības līdzekļos – izmantotās testējamās ķīmiskās vielas apjoms var atbilst maksimālajam ieteicamajam lietošanas rādītājam (vienā apstrādes reizē).
|
|
11.
|
Testējamās ķīmiskās vielas un, ja attiecināms, tās reakciju produktu augsnē un izskalojumos izteikšanai kvantitatīvā izteiksmē ir jāizmanto atbilstoša analīzes metode ar zināmu pareizību, precizitāti un jutīgumu. Zināmai ir jābūt arī analītiskajai noteikšanas robežai attiecībā uz testējamo ķīmisko vielu un būtiskajiem tās reakciju produktiem (parasti tie ir vismaz visi tie reakciju produkti, kas ≥ 10 % izmantotās devas un novēroti reakciju ķēdes izpētē, taču vislabāk – jebkuri attiecīgie bīstamie reakciju produkti) (sk. 17. punktu).
|
ĶĪMISKĀS STANDARTVIELAS
|
12.
|
Novērtējot testējamās ķīmiskās vielas relatīvo mobilitāti augsnē, jāizmanto standartvielas ar zināmiem izskalošanās parametriem, piem., atrazīns vai monurons, ko var uzskatīt par vielām ar mērenu izskalošanos (1)(8)(11). Lai apliecinātu augsnes kolonnas hidrodinamiskās īpašības, var noderēt arī nesorbējošas un nenoārdāmas polāras standartvielas (piem., tritijs, bromīdi, fluoresceīns un eozīns), kas iezīmē ūdens kustību kolonnā.
|
|
13.
|
Analītiskās standartvielas var noderēt, arī lai varētu raksturot un/vai apzināt reakciju produktus, kas konstatēti augsnes segmentos un izskalojumos, izmantojot hromatogrāfiju, spektroskopiju vai citas attiecīgas metodes.
|
DEFINĪCIJAS UN MĒRVIENĪBAS
|
14.
|
Sk. 1. papildinājumu.
|
KVALITĀTES KRITĒRIJI
Atgūstamība
|
15.
|
Augsnes segmentos un kolonnas izskalojumos pēc izskalošanās konstatētā testējamās ķīmiskās vielas procentuālo daļu summa raksturo atgūstamību, kas panākta izskalošanās eksperimentā. Atgūtajām vielām jābūt diapazonā no 90 līdz 110 % radioaktīvi marķētām ķīmiskajām vielām (11) un no 70 līdz 110 % nemarķētām ķīmiskajām vielām (8).
|
Analītiskās metodes atkārtojamība un jutība
|
16.
|
Analītiskās metodes atkārtojamību, lai varētu kvantitatīvi izteikt testējamo ķīmisko vielu un tās reakciju produktus, var pārbaudīt, veicot divkāršu analīzi vienam un tam pašam augsnes segmenta vai izskalojuma ekstraktam (sk. 11. punktu).
|
|
17.
|
Analītiskās metodes detektēšanas robežai (LOD) attiecībā uz testējamo ķīmisko vielu un tās reakciju produktiem jābūt vismaz 0,01 mg · kg– 1 katrā augsnes segmentā vai izskalojumā (kā testējamajā ķīmiskā viela) vai 0,5 % izmantotās devas jebkurā atsevišķā segmentā, atkarībā no tā, kurš rādītājs zemāks. Ir jānorāda arī kvantitatīvās noteikšanas robeža (LOQ).
|
TESTĒŠANAS METODES APRAKSTS
Testa sistēma
|
18.
|
Testā izmanto izskalošanās kolonnas (sadalāmas vai nesadalāmas sekcijās), kas izgatavotas no pietiekami inerta materiāla (piem., stikla, nerūsējošā tērauda, alumīnija, teflona, PVH utt.), ar iekšējo diametru vismaz 4 cm un minimālo augstumu 35 cm. Kolonnas materiāliem ir jāpārbauda, vai tie nevar reaģēt ar testējamo ķīmisko vielu un/vai tās reakciju produktiem. Piemēri par derīgām kolonnām, kas ir vai nav sadalāmas sekcijās, ir sniegti 2. papildinājumā.
|
|
19.
|
Augsnes kolonnu piepildīšanai un iepakošanai izmanto karoti, virzuli un vibratoru.
|
|
20.
|
Lai augsnes kolonnas aplietu ar mākslīgo lietu, var izmantot virzuļu vai peristaltiskos sūkņus, dušas sadalītājus, Mariotas pudeles vai vienkāršas pilināmās piltuves.
|
Laboratorijas iekārtas un ķīmiskās vielas
|
21.
|
Nepieciešamas standarta laboratorijas iekārtas, konkrēti, turpmāk minētās:
|
(1)
|
analītiskie instrumenti, piem., GLC, HPLC un TLC iekārtas, tostarp atbilstošas detektēšanas sistēmas marķēto vai nemarķēto ķīmisko vielu analizēšanai, vai inversā izotopu atšķaidīšanas metode;
|
|
(2)
|
instrumenti identificēšanai (piem., MS, GC-MS, HPLC-MS, NMR utt.);
|
|
(3)
|
šķidro scintilāciju skaitītājs radioaktīvi marķētai testējamajai ķīmiskajai vielai;
|
|
(4)
|
oksidētājs marķētā materiāla sadedzināšanai;
|
|
(5)
|
ekstrakcijas aparāts (piem., centrifūgas mēģenes aukstajai ekstrakcijai un Soksleta aparāts nepārtrauktai ekstrakcijai atteces apstākļos);
|
|
(6)
|
instrumentārijs koncentrētiem šķīdumiem un ekstraktiem (piem., rotējošs iztvaicētājs).
|
|
|
22.
|
Izmanto tādas ķīmiskās vielas kā analītiskās tīrības pakāpes organiskie šķīdinātāji, piem., acetons, metanols utt., scintilācijas šķidrumu, 0,01 M CaCl2 šķīdumu destilētā vai dejonizētā ūdenī (= “mākslīgo lietu”).
|
Testējamā ķīmiskā viela
|
23.
|
Lai augsnes kolonnu varētu apstrādāt ar testējamo ķīmisko vielu, tā jāizšķīdina (dejonizētā vai destilētā) ūdenī. Ja testējamā ķīmiskā viela nepietiekami šķīst ūdenī, to var izmantot kā sintezētu produktu (ja nepieciešams, pēc suspendēšanas vai emulģēšanas ūdenī) vai jebkura organiskā šķīdinātāja sastāvā. Ja izmanto organisku šķīdinātāju, tas jālieto minimāli un jāiztvaicē no augsnes kolonnas virsmas pirms izskalošanas procedūras uzsākšanas. Cietie sintezētie produkti, piem., granulas, jāizmanto cietā veidā, bez ūdens, lai tie vienmērīgāk izklātos pa augsnes kolonnas virsmu, sintezētos produktus pirms lietošanas var samaisīt ar nelielu daudzumu kvarca smilšu (piem., 1 g).
|
|
24.
|
Testējamās ķīmiskās vielas apjomam, ar ko apstrādā augsnes kolonnas, jābūt pietiekamam, lai varētu detektēt vismaz 0,5 % ievietotās devas katrā atsevišķajā segmentā. Aktīvām ķīmiskajām vielām augu aizsardzības līdzekļos var piemērot maksimālo ieteicamo lietošanas devu (vienreizējās lietošanas devu), un gan pamata izskalojumiem, gan nostādinātiem izskalojumiem testējamās ķīmiskās vielas apjoms ir jāsaista ar izmantoto augsnes kolonnas virsmas platību (55).
|
Ķīmiskās standartvielas
|
25.
|
Izskalošanās eksperimentos izmanto standartvielas (sk. 12. punktu). Ar tām apstrādā augsnes kolonnas virsmu līdzīgi kā ar testējamajām ķīmiskajām vielām un atbilstošā daudzumā, lai varētu nodrošināt pietiekamu detektēšanu, pamatojoties uz iekšēju standartu un kopā ar testējamo ķīmisko vielu tajā pašā augsnes kolonnā, vai arī vienu pašu atsevišķā augsnes kolonnā. Vislabāk ir izmantot abas ķīmiskās vielas vienā un tajā pašā kolonnā, ja vien tās nav līdzīgi marķētas.
|
Augsnes
Augsnes izvēle
|
26.
|
Izskalošanās pētījumiem, izmantojot testējamās ķīmiskās vielas, izvēlas no trīs līdz četrām augsnēm ar atšķirīgu pH, organiskā oglekļa saturu un konsistenci (12). Norādījumi par augsnes izvēli izskalošanās eksperimentiem ir iekļauti turpmākajā 1. tabulā. Jonizējamām testējamajām ķīmiskajām vielām jāizvēlas augsnes ar plašu pH diapazonu, lai varētu novērtēt ķīmiskās vielas mobilitāti jonizētā un nejonizētā formā; vismaz trim augsnēm ir nepieciešams pH līmenis, kurā testējamā ķīmiskā viela mobilā formā.
1. tabula.
Norādījumi augsnes izvēlei izskalošanās pētījumos
|
Augsnes Nr.
|
pH vērtība
|
Organiskais ogleklis
%
|
Māla saturs
%
|
Konsistence (56)
|
|
1
|
> 7,5
|
3,5–5,0
|
20–40
|
viegls māls
|
|
2
|
5,5–7,0
|
1,5–3,0
|
15–25
|
viegls smilšmāls
|
|
3
|
4,0–5,5
|
3,0–4,0
|
15–30
|
smilšmāls
|
|
4
|
< 4,0–6,0 (57)
|
< 0,5–1,5 (57)
(58)
|
< 10–15 (57)
|
mālsmilts
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
mālsmilts/smilts
|
|
|
27.
|
Dažkārt var būt nepieciešami citi augsnes tipi, lai pārstāvētu vēsākus, mērenās joslas un tropu reģionus. Tādēļ, izvēloties citus augsnes tipus, tie jāraksturo ar tiem pašiem parametriem, un tiem ir nepieciešamas līdzīgas raksturlielumu variācijas, kā augsnes tipiem, kas minēti norādījumos par augsnes izvēli izskalošanās pētījumiem (sk. iepriekš 1. tabulu), pat ja tie precīzi neatbilst kritērijiem.
|
|
28.
|
Izskalošanās pētījumos ar “izturētām atliekām” izmanto vienu augsni (12). Tai nepieciešams smilts saturs, kas > 70 %, un organiskā oglekļa saturs 0,5–1,5 % (piem., 4. augsne 1. tabulā). Var izmantot arī citus augsnes tipus, ja svarīgi ir dati par reakciju produktiem.
|
|
29.
|
Visas augsnes ir jāraksturo vismaz attiecībā uz konsistenci [ % smilts, % nogulumu, % māla saskaņā ar PLO un ASV Lauksaimniecības departamenta klasifikācijas sistēmām (14)], pH, katjonu apmaiņas spēju, organiskā oglekļa saturu, tilpuma blīvumu (sajauktām augsnēm) un ūdens noturēšanas spēju. Mikroorganismu biomasas mērījumi ir nepieciešami tikai augsnei, ko izmanto nostādināšanas/inkubācijas periodā pirms nostādināto izskalojumu eksperimenta. Informācija par augsnes papildu īpašībām (piem., augsnes klasifikāciju, māla mineraloģiju un īpašo virsmas platību) var noderēt, interpretējot šā pētījuma rezultātus. Augsnes īpašību noteikšanai var izmantot metodes, kas ieteiktas atsaucēs (15)(16)(17)(18)(19).
|
Augsnes savākšana un uzglabāšana
|
30.
|
Augšņu paraugi jāpaņem no augšējā slāņa (A horizonta) ne dziļāk par 20 cm. Veģetācijas paliekas, makrofauna un akmeņi ir jānovāc. Augsnes paraugiem (izņemot tos, ko izmanto testējamās ķīmiskās vielas nostādināšanai) ļauj izžūt istabas temperatūrā (vislabāk 20–25 °C). Irdināšana jāizdara ar minimālu spēku, lai augsnes sākotnējā struktūra mainītos iespējami mazāk. Augsnes paraugus izsijā caur ≤ 2 mm sietu. Ir ieteicams augsni rūpīgi homogenizēt, jo tas uzlabo rezultātu atkārtojamību. Pirms lietošanas augsnes paraugus var uzglabāt apkārtējās vides temperatūrā un turēt sausus (12). Uzglabāšanas laikam netiek noteikti nekādi ierobežojumi, taču, ja augsni uzglabā ilgāk par trim gadiem, tā pirms lietošanas atkārtoti jāanalizē attiecībā uz organiskā oglekļa saturu un pH.
|
|
31.
|
Jānodrošina sīka vēsturiskā informācija par vietām, kurās testa augšņu paraugi paņemti. Šī informācija ietver precīzu atrašanās vietu [kas precīzi definēta ar UTM (Universālo transversālo Merkatora projekciju/Eiropas horizontālo atskaites sistēmu) vai ģeogrāfiskajām koordinātēm], veģetācijas segu, apstrādi ar ķīmiskajiem kultūraugu aizsardzības līdzekļiem, apstrādi ar organisko un neorganisko mēslojumu, bioloģisko materiālu vai nejauša piesārņojuma piedevas (12). Ja iepriekšējo četru gadu laikā augsne ir apstrādāta ar testējamo ķīmisko vielu vai tās strukturālajiem analogiem, šādu augsni nedrīkst izmantot izskalošanās pētījumos.
|
Testēšanas apstākļi
|
32.
|
Testēšanas perioda laikā augsnes izskalošanās kolonnas jātur tumsā apkārtējās vides temperatūrā, kamēr vien šī temperatūra tiek uzturēta diapazonā ± 2 °C. Ieteicamā temperatūra ir no 18 līdz 25 °C.
|
|
33.
|
Augsnes kolonnu virsmu nepārtraukti laista ar “mākslīgo lietu” (0,01 M CaCl2), kura daudzums ir 200 mm 48 stundu laikā (60); šis rādītājs ir līdzvērtīgs 251 ml, ar ko apstrādā kolonnu, kuras iekšējais diametrs ir 4 cm. Ja testa nolūkiem nepieciešams, papildus var izmantot citu “mākslīgā lietus” daudzumu un ilgāku periodu.
|
Testa norise
Izskalošanās ar izcelsmes testējamo ķīmisko vielu
|
34.
|
Sagatavo vismaz divas vienādas izskalošanās kolonnas ar neapstrādātu, izžuvušu un izsijātu augsni (< 2 mm), un to augstums ir aptuveni 30 cm. Lai pildījums būtu vienveidīgs, augsni kolonnās iepilda pa nelielām porcijām ar karoti un piespiež ar virzuli, vienlaikus viegli vibrējot kolonnu, līdz brīdim, kamēr augsnes kolonnas augšgals vairs neiegrimst. Vienveidīga iepildīšana ir nepieciešama, lai no izskalošanās kolonnām iegūtu atkārtojamus rezultātus. Informācija par kolonnu sagatavošanas paņēmieniem ir atrodama atsaucēs (20)(21)(22). Lai varētu kontrolēt iepildīšanas procedūras atkārtojamību, nosaka kolonnās iepildītās augsnes kopējo svaru (61); dubulto kolonnu svaram ir jābūt līdzīgam.
|
|
35.
|
Pēc iepildīšanas augsnes kolonnas sākotnēji samitrina ar “mākslīgo lietu” (0,01 M CaCl2) no apakšas uz augšu, lai ar ūdeni izspiestu gaisu no augsnes porām. Pēc tam augsnes kolonnām ļauj uzbriest, un lieko ūdeni notecina smaguma spēks. Kolonnas piesātināšanas metodes ir apskatītas atsaucē (23).
|
|
36.
|
Tad augsnes kolonnas apstrādā ar testējamo ķīmisko vielu un/vai standartvielu (sk. arī 23.–25. punktu). Lai nodrošinātu homogēnu izkliedi, testējamās ķīmiskās vielas un/vai standartvielas šķīdumus, suspensijas vai emulsijas vienmērīgi uzklāj uz augsnes kolonnu virsmas. Ja testējamās ķīmiskās vielas piemērošanai ir ieteicama iestrādāšana augsnē, tā jāsamaisa ar nelielu daudzumu (piem., 20 g) augsnes un jāuzklāj uz augsnes kolonnas virsmas.
|
|
37.
|
Tad augsnes kolonnu virsmas pārklāj ar stikla plāvas disku, stikla pērlēm, stikla šķiedras filtriem vai apaļu filtrpapīru, lai vienmērīgi izkliedētu “mākslīgo lietu” pa visu virsmu un novērstu augsnes virskārtas bojājumus, ko izraisa lietus lāses. Jo lielāks kolonnas diametrs, jo lielāka rūpība nepieciešama augsnes kolonnu apstrādē ar “mākslīgo lietu”, lai nodrošinātu “mākslīgā lietus” vienmērīgu izkliedēšanu pa augsnes virskārtu. Pēc tam augsnes kolonnas pilienu veidā apstrādā ar “mākslīgo lietu”, izmantojot virzuli vai peristaltisko sūkni, vai pilināmo piltuvi. Izskalojumus vislabāk savākt pa frakcijām un reģistrēt to attiecīgos tilpumus (62).
|
|
38.
|
Pēc izskalošanās un kolonnu notecināšanas augsnes kolonnas sadala segmentos, kuru skaits atkarīgs no pētījumā iegūstamās informācijas apjoma, tad segmentus ekstrahē ar piemērotiem šķīdinātājiem vai šķīdinātāju maisījumiem un analizē datus par testējamo ķīmisko vielu un, ja nepieciešams, reakciju produktiem, kopējo radioaktivitāti un standartvielu. Izskalojumu vai izskalojumu frakciju analīzi veic tieši vai pēc ekstrakcijas par tām pašām vielām. Izmantojot radioaktīvi marķētas testējamās ķīmiskās vielas, jāidentificē visas frakcijas, kas satur ≥ 10 % piemērotās radioaktivitātes.
|
Izskalošanās ar izturētām atliekām
|
39.
|
Svaigu augsni (iepriekš nežāvētu) apstrādā ar radioaktīvi marķētu testējamo ķīmisko vielu ar ātrumu, kas atbilst augsnes kolonnu virsmas platībai (sk. 24. punktu), un inkubē aerobos apstākļos saskaņā ar C.23. testēšanas metodi (13). Inkubācijas (izturēšanas) periodam jābūt pietiekami ilgam, lai radītu būtiskus reakciju produktu apjomus; ieteicams izturēšanas periods, kas atbilst testējamās ķīmiskās vielas vienam pussabrukšanas periodam (63), bet tas nedrīkst pārsniegt 120 dienas. Pirms izskalošanās izturētajā augsnē analizē testējamās ķīmiskās vielas un tās reakciju produktu klātbūtni.
|
|
40.
|
Izskalošanās kolonnas piepilda 28 cm augstumā ar to pašu augsni (bet izžuvušu), kas tika izmantota 34. punktā aprakstītajā izturēšanas eksperimentā, un nosaka arī piepildīto augsnes kolonnu kopējo svaru. Tad augsnes kolonnas sākotnēji samitrina, kā minēts 35. punktā.
|
|
41.
|
Pēc tam ar testējamo ķīmisko vielu un tās reakciju produktiem apstrādā augsnes kolonnu virsmu, ko veido izturētas augsnes atliekas (sk. 39. punktu) 2 cm biezā augsnes segmentā. Augsnes kolonnu kopējam augstumam (neapstrādātā augsne + nostādinātā augsne) nebūtu jāpārsniedz 30 cm (sk. 34. punktu).
|
|
42.
|
Izskalošanu veic tā, kā aprakstīts 37. punktā.
|
|
43.
|
Pēc izskalošanās augsnes segmentus un izskalojumus saskaņā ar 38. punktu analizē attiecībā uz testējamo ķīmisko vielu, tās reakciju produktu klātbūtni un neekstrahēto radioaktivitāti. Lai noteiktu, cik daudz izturēto atlieku ir palicis augšējā 2 cm slānī pēc izskalošanās, šo segmentu analizē atsevišķi.
|
DATI UN PĀRSKATU SAGATAVOŠANA
Rezultātu apstrāde
|
44.
|
Testējamās ķīmiskās vielas, tās reakciju produktu, neekstrahējamo vielu un, ja iekļauta, arī standartvielas apjomus norāda procentos no izmantotās sākotnējās devas katram augsnes segmentam un izskalojumu frakcijai. Par katru kolonnu ir jāiesniedz grafisks attēls, atzīmējot konstatētos procentus, atkarībā no augsnes dziļuma.
|
|
45.
|
Ja šajos kolonnas izskalošanās pētījumos ir iekļauta standartviela, minētās ķīmiskās vielas izskalošanos var novērtēt salīdzinošā griezumā, izmantojot relatīvās mobilitātes koeficientus (RMF; definīciju sk. 3. papildinājumā) (1)(11), kas ļauj salīdzināt dažādu ķīmisko vielu izskalošanās datus, kas iegūti no dažādiem augsnes tipiem. Piemēri par RMF vērtībām daudziem ķīmiskajiem kultūraugu aizsardzības līdzekļiem ir iekļauti 3. papildinājumā.
|
|
46.
|
Aplēses par Koc (organiskā oglekļa normalizēto adsorbcijas koeficientu) un Kom (organisko vielu normalizēto izkliedes koeficientu) var iegūt arī no kolonnas izskalošanās rezultātiem, pamatojoties uz vidējo izskalošanās attālumu vai noteiktajām sakarībām starp RMF un attiecīgi Kom vai Koc (4) vai piemērojot vienkāršās hromatogrāfijas teoriju (24). Tomēr otrā metode ir jāizmanto piesardzīgi, jo īpaši ņemot vērā, ka izskalošanās process attiecas ne tikai uz piesātinātas plūsmas apstākļiem, bet drīzāk uz nepiesātinātām sistēmām.
|
Rezultātu interpretēšana
|
47.
|
Šajā metodē raksturotie kolonnas izskalošanās pētījumi ļauj noteikt testējamās ķīmiskās vielas (galvenajā izskalošanās pētījumā) un/vai tās reakciju produktu (izturēto atlieku izskalošanās pētījumā) izskalošanās jeb mobilitātes potenciālu augsnē. Šie testi nesniedz kvantitatīvas prognozes par izskalošanās gaitu lauka apstākļos, taču tos var izmantot, lai salīdzinātu vienas ķīmiskās vielas “izskalojamību” ar citām ķīmiskajām vielām, kuru izskalošanās parametri var būt zināmi (24). Tāpat, tie kvantitatīvi nemēra izmantotās ķīmiskās vielas procentuālo īpatsvaru, kas var sasniegt gruntsūdeņus (11). Tomēr kolonnas izskalošanās pētījumu rezultāti var palīdzēt pieņemt lēmumu par to, vai ir jāveic papildu testēšana puslauka vai lauka apstākļos ķīmiskajām vielām ar augstu mobilitātes potenciālu laboratorijas testos.
|
Testēšanas pārskats
|
48.
|
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
|
|
Testējamā ķīmiskā viela un standartviela (ja tiek lietota):
|
—
|
vispārpieņemtais nosaukums, ķīmiskais nosaukums (IUPAC un CAS nomenklatūrā), CAS numurs, ķīmiskā struktūra (norādot marķējuma pozīciju, ja izmanto radioaktīvi marķētu materiālu) un attiecīgās fizikālķīmiskās īpašības;
|
|
—
|
testējamās ķīmiskās vielas tīrība (piemaisījumi);
|
|
—
|
marķētās ķīmiskās vielas radioķīmiskā tīrība un īpatnējā aktivitāte (attiecīgā gadījumā).
|
|
|
|
Testa augsnes:
|
—
|
informācija par savākšanas vietu;
|
|
—
|
augšņu īpašības, piem., pH, organiskā oglekļa un māla saturs, konsistence un tilpuma blīvums (sajauktām augsnēm);
|
|
—
|
augsnes mikrobiālā aktivitāte (tikai augsnei, ko izmanto testējamās ķīmiskās vielas nostādināšanai);
|
|
—
|
augsnes uzglabāšanas ilgums un uzglabāšanas apstākļi.
|
|
|
|
Testēšanas apstākļi:
|
—
|
pētījumu norises datumi;
|
|
—
|
izskalošanās kolonnu garums un diametrs;
|
|
—
|
kopējais augsnes svars augsnes kolonnās;
|
|
—
|
testējamās ķīmiskās vielas un, ja attiecināms, standartvielas izmantotais apjoms;
|
|
—
|
piemērotā “mākslīgā lietus” apjoms, biežums un ilgums;
|
|
—
|
eksperimentālā veidojuma temperatūra;
|
|
—
|
replikātu skaits (vismaz divi);
|
|
—
|
testējamās ķīmiskās vielas, tās reakciju produktu un, ja attiecināms, standartvielas analīzes metodes dažādos augsnes segmentos un izskalojumos;
|
|
—
|
reakciju produktu raksturošanas un identificēšanas metodes augsnes segmentos un izskalojumos.
|
|
|
|
Testa rezultāti:
|
—
|
tabulas ar rezultātiem, kas izteikti kā koncentrācijas un piemērotās devas procentuālie īpatsvari augsnes segmentos un izskalojumos;
|
|
—
|
masas bilance, ja attiecināma;
|
|
—
|
izskalošanās attālumi un, ja attiecināms, relatīvie mobilitātes koeficienti;
|
|
—
|
augsnes segmentos konstatēto procentu grafisks attēlojums, salīdzinājumā ar augsnes segmentu dziļumu;
|
|
—
|
rezultātu novērtējums un interpretācija.
|
|
|
LITERATŪRA
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Annex I to Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market, OJ L 172, 22.7.1995, p.8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
|
|
(13)
|
Šā pielikuma nodaļas:
|
|
A.4. nodaļa: Tvaika spiediens;
|
|
|
A.6. nodaļa: Šķīdība ūdenī;
|
|
|
A.8. nodaļa: Sadalījuma koeficients, kolbu kratīšanas metode;
|
|
|
A.24. nodaļa: Sadalījuma koeficients, HPLC metode;
|
|
|
C.7. nodaļa: Noārdīšanās –abiotiska noārdīšanās hidrolīze atkarībā no pH
|
|
|
C.18. nodaļa: Adsorbcija/desorbcija ar partijas līdzsvara metodi.
|
|
|
C.23. nodaļa: Aerobā un anaerobā pārvēršanās augsnē.
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49-53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177-217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115-133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
|
1. papildinājums
Definīcijas un mērvienības
Izturētas augsnes atliekas
– testējamā ķīmiskā viela un tās reakciju produkti, kas atrodas augsnē pēc to piemērošanas un pēc pietiekami ilga laikposma, lai varētu nodrošināt transporta, adsorbcijas, metabolisma un izkliedes procesus, pārveidojot sadalījuma un dažu izmantoto ķīmisko vielu ķīmisko raksturu (1).
Mākslīgais lietus
– 0,01 M CaCl2 šķīdums destilētā vai dejonizētā ūdenī.
Vidējais izskalošanās attālums
– augsnes sekcijas apakšdaļa, kurā kumulatīvā atgūtā ķīmiskā viela = 50 % kopējās atgūtās testējamās ķīmiskās vielas apjoma [parastā izskalošanās eksperimentā], vai (augsnes sekcijas apakšdaļa, kurā kumulatīvā atgūtā ķīmiskā viela = 50 % kopējās atgūtās testējamās ķīmiskās vielas apjoma) – ((izturēto atlieku slāņa biezums)/2) [izturēto atlieku izskalošanās pētījumā].
Ķīmiskā viela
– viela vai maisījums.
Izskalojums
– ūdens fāze, kas izkāsta caur augsnes profilu vai augsnes kolonnu (1).
Izskalošanās
– process, kurā ķīmiskā viela pārvietojas virzienā uz leju caur augsnes profilu vai augsnes kolonnu (1).
Izskalošanās attālums
– dziļākais augsnes segments, kurā pēc izskalošanās procesa konstatē ≥ 0,5 % izmantotās testējamās ķīmiskās vielas vai izturēto atlieku (līdzvērtīgs iespiešanās dziļumam).
Detektēšanas robeža
(LOD)
un kvantitatīvās noteikšanas robeža
(LOQ)
– detektēšanas robeža (LOD) ir ķīmiskās vielas koncentrācija, zem kuras vielas identitāte nav atšķirama no analītiskiem artefaktiem. Kvantitatīvās noteikšanas robeža (LOQ) ir ķīmiskās vielas koncentrācija, zem kuras tā nav nosakāma ar pieņemamu precizitāti.
RMF relatīvās mobilitātes koeficients
– (testējamās ķīmiskās vielas izskalošanās attālums (cm))/(standartvielas izskalošanās attālums (cm)).
Testējamā ķīmiskā viela
– jebkura viela vai maisījums, ko testē ar šo testēšanas metodi.
Reakcijas produkts
– jebkura ķīmiska viela, kas iegūta testējamās vielas biotiskās vai abiotiskās ķīmiskajās reakcijās, tostarp CO2 un produkti, kas ir saistīti atliekās.
Augsne
– minerālo un organisko ķīmisko sastāvdaļu maisījums, ar augstu oglekļa un slāpekļa saturu un lielu molekulsvaru, kuru apdzīvo nelieli organismi (galvenokārt mikroorganismi). Augsni var iedalīt divās grupās:
|
—
|
neskarta augsne, kāda tā laika gaitā ir izveidojusies raksturīgos dažādu augšņu tipu slāņos;
|
|
—
|
sajaukta augsne, kāda tā parasti ir atrodama aramlaukos vai kāda izveidojas, ja rokot vāc paraugus un izmanto šajā testēšanas metodē (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167-1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
2. papildinājums
1. attēls.
Piemērs: no stikla izgatavotas un sekcijās nesadalāmas izskalošanās kolonnas,
kuru garums 35 cm un iekšējais diametrs 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Köln.
|
2. attēls.
Sekcijās sadalāmu metāla kolonnu ar 4 cm iekšējo diametru (1) piemērs

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
3. papildinājums
Relatīvās mobilitātes koeficientu
(64)
(RMF) piemēri dažādiem ķīmiskajiem kultūraugu aizsardzības līdzekļiem (1)(2) un atbilstošās mobilitātes klases
(66)
|
RMF diapazons
|
Ķīmiskā viela (RMF)
|
Mobilitātes klase
|
|
≤ 0,15
|
Parations (< 0,15), flurodifēns (0,15)
|
I
nemobila
|
|
0,15 – 0,8
|
Profenofoss (0,18), propikonazols (0,23), diazinons (0,28), diurons (0,38), terbutilazīns (0,52), metidations (0,56), prometrīns (0,59), propazīns (0,64), alahlors (0,66), metolahlors (0,68)
|
II
viegli mobila
|
|
0,8 – 1,3
|
Monurons (65) (1,00), atrazīns (1,03), simazīns (1,04), fluometurons (1,18)
|
III
mēreni mobila
|
|
1,3 – 2,5
|
Prometons (1,67), cianazīns (1,85), bromacils (1,91), karbutilāts (1,98)
|
IV
diezgan mobila
|
|
2,5 – 5,0
|
Karbofurāns (3,00), dioksakarbs (4,33)
|
V
mobila
|
|
> 5,0
|
Monokrotofoss (> 5,0), dikrotofoss (> 5,0)
|
VI
ļoti mobila
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium “Physicochemical Properties and their Role in Environmental Hazard Assessment.” Canterbury, UK, 1-3 July 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165-174.
|
C.45. APLĒSE PAR EMISIJĀM VIDĒ NO KOKSNES, KAS APSTRĀDĀTA AR KONSERVANTIEM: LABORATORIJAS METODE SASKARĒ AR SALDŪDENI VAI JŪRAS ŪDENI ESOŠIEM KOKA IZSTRĀDĀJUMIEM BEZ PĀRKLĀJUMA
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 313 (2007. gads). Lai attiecībā uz koksni, kas apstrādāta ar konservantiem, varētu izdarīt vides riska novērtējumu, ir kvantitatīvi jānosaka emisijas, kas no apstrādātās koksnes nonāk vidē. Šī testēšanas metode ir laboratorijas metode, ar kuru emisijas no koksnes, kas apstrādāta ar konservantu, novērtē divās situācijās, kurās emisijas var nokļūt vidē:
|
—
|
emisijas no apstrādātas koksnes, kas atrodas saskarē ar saldūdeni. Emisijas no apstrādātās koksnes virsmas var iekļūt ūdenī;
|
|
—
|
emisijas no apstrādātas koksnes, kas atrodas saskarē ar jūras ūdeni. Emisijas no apstrādātās koksnes virsmas var iekļūt jūras ūdenī.
|
|
|
2.
|
Šīs testēšanas metodes mērķis ir testēt emisijas no koksnes un koka izstrādājumiem, kam nav pārklājuma un kas atrodas saskarē ar saldūdeni vai jūras ūdeni. Starptautiski izmanto lietojuma klases, kas kategorizē bioloģisko apdraudējumu, kurš var rasties apstrādātajai precei. Lietojuma klašu klasifikācijā arī definēts, kādās situācijās apstrādāto preci lieto, un noteikts, kādus vides segmentus (gaiss, ūdens, augsne) ar konservantu apstrādātā koksne potenciāli apdraud.
|
|
3.
|
Šī testēšanas metode ir laboratorijas procedūra paraugu (emisāta) iegūšanai no ūdens, kuru lieto apstrādātās koksnes iemērkšanai arvien ilgākos starplaikos pēc ekspozīcijas. Emisijas daudzums emisātā ir atkarīgs no koksnes virsmas platības un ekspozīcijas ilguma, to aplēš kā plūsmu mg/m2/dienā. Tā var aplēst plūsmu (izskalošanās ātrumu) pēc arvien ilgākiem ekspozīcijas periodiem.
|
|
4.
|
Emisijas daudzumu var izmantot apstrādātās koksnes vides riska novērtēšanā.
|
SĀKOTNĒJIE APSVĒRUMI
|
5.
|
Pieņem, ka mehānisms, kā notiek izskalošanās no koksnes virsmas, pēc rakstura un smaguma saldūdenim nav vienāds ar jūras ūdeni. Tādēļ attiecībā uz tādiem koksnes konservēšanas līdzekļiem vai maisījumiem, ko lieto jūras ūdens vidē izmantotas koksnes apstrādei, nepieciešams koksnes izskalošanās pētījums attiecībā uz jūras ūdeni.
|
|
6.
|
Koksnei, proti, ar koksnes konservantu apstrādātai koksnei jābūt reprezentatīvai attiecībā uz tirdzniecībā pieejamo koksni. Tā jāapstrādā saskaņā ar konservanta ražotāja norādījumiem un atbilstoši attiecīgajiem standartiem un specifikācijām. Jānorāda koksnes pēcapstrādes nogatavināšanas parametri pirms testa uzsākšanas.
|
|
7.
|
Izmantotajiem koksnes paraugiem jābūt reprezentatīviem attiecībā uz lietotajām precēm (piemēram, koku sugām, koksnes blīvumam un citām īpašībām).
|
|
8.
|
Koksnei šo testu var izmantot, ja lieto iespiešanās tehnoloģiju vai uzklāšanu uz virsmas, un to var izmantot arī apstrādātai koksnei, kurai virsma obligāti jāapstrādā papildus (piemēram, komerciālā lietošanā ir prasība, lai virsma būtu krāsota).
|
|
9.
|
Koksnes emisiju kvantitātes, satura un rakstura noteikšanā svarīgs ir ūdens sastāvs, daudzums, pH un fizikālais veids.
|
TESTĒŠANAS METODES PRINCIPS
|
10.
|
Testējot ar konservantu apstrādātu koksni, paraugus mērcē ūdenī. Ūdeni (emisātu) ekspozīcijas periodā vairākas reizes ievāc un ķīmiski analizē tik ilgā ekspozīcijas periodā, ar kuru pietiek statistiskajiem aprēķiniem. No analīžu rezultātiem aprēķina emisijas ātrumus mg/m2 dienā. Paraugu ņemšanas periodi jāatzīmē. Ja pirmajos trijos datu punktos fonu nekonstatē, testus ar neapstrādātiem paraugiem var beigt.
|
|
11.
|
Iekļaujot neapstrādātas koksnes paraugus, var noteikt tādu koksnes emisātu fona līmeņus, kas nav lietotais konservants.
|
KVALITĀTES KRITĒRIJI
Pareizība
|
12.
|
Emisijas novērtēšanas testēšanas metodes pareizība ir atkarīga no tā, vai testējamie paraugi reprezentē komerciāli apstrādātu koksni, no tā, cik ūdens reprezentē reālo ūdeni un cik ekspozīcijas režīms reprezentē dabiskos apstākļus.
|
|
13.
|
Analīzes metodes pareizība, precizitāte un atkārtojamība jānosaka pirms testa veikšanas.
|
Reproducējamība
|
14.
|
Ievāc un analizē trīs ūdens paraugus, un to vidējo vērtību atzīst par emisijas vērtību. Rezultātu reproducējamība vienā laboratorijā un starp dažādām laboratorijām ir atkarīga no mērcēšanas režīma un no testējamiem paraugiem izmantotās koksnes.
|
Pieņemamais rezultātu diapazons
|
15.
|
Šajā testā pieņemams ir rezultātu diapazons, kurā augstākās un zemākās vērtības atšķiras par mazāk nekā vienu lieluma kārtu.
|
TESTĒŠANAS APSTĀKĻI
Ūdens
|
16.
|
Saldūdens izskalošanās scenāriji – ja jānovērtē saldūdenim eksponēta koksne, izskalošanās testā ieteicams lietodejonizētu ūdeni (piemēram, ASTM D 1193, II tips). Ūdens temperatūrai jābūt 20 °C +/– 2 °C, un izmērīto pH un ūdens temperatūru atspoguļo testēšanas pārskatā. Analizējot izmantotā ūdens paraugus, kas ņemti pirms apstrādāto paraugu iemērkšanas, var aplēst analizēto ķīmisko vielu daudzumu ūdenī. Šis ir kontroles pasākums, kurā nosaka fona līmeņus ķīmiskajām vielām, kuras pēc tam ķīmiski analizē.
|
|
17.
|
Jūras ūdens izskalošanās scenāriji – ja jānovērtē jūras ūdenim eksponēta koksne, izskalošanās testā ieteicams lietot sintētisku jūras ūdeni (piemēram, ASTM D 1141, okeāna ūdens aizstājējs bez smagajiem metāliem). Ūdens temperatūrai jābūt 20 °C +/– 2 °C, un izmērīto pH un ūdens temperatūru atspoguļo testēšanas pārskatā. Analizējot izmantotā ūdens paraugus, kas ņemti pirms apstrādāto paraugu iemērkšanas, var aplēst analizējamo ķīmisko vielu saturu ūdenī. Šis ir kontroles pasākums, kurā analizē interesējošo ķīmisko vielu fona līmeņus.
|
Koksnes testā izmantojamie paraugi
|
18.
|
Koku sugām jābūt tām koku sugām, kuras parasti lieto koksnes konservantu iedarbīguma testēšanai. Ieteicamas ir Pinus sylvestris L. (parastā priede), Pinus resinosa Ait. (sarkanā priede) vai Pinus spp (dienvidu priede). Papildu testiem var izmantot arī citas sugas.
|
|
19.
|
Jālieto taisnšķiedras koksne bez māzeriem. Jāizvairās lietot materiālus ar sveķainu izskatu. Koksnei ir jābūt tādai, kāda parasti ir pieejama tirdzniecībā. Atspoguļo koksnes avotu, blīvumu un gadskārtu gredzenu skaitu uz 10 mm.
|
|
20.
|
Testā ieteicams izmantot koka paraugus, kuri sastāv no blokiem, kas ir komplektā pa pieci, pēc izmēra atbilst EN 113 (25 mm x 50 mm x 15 mm) un kam gareniskās skaldnes ir paralēlas koksnes šķiedrai, lai gan var izmantot arī citus izmērus, piemēram, 50 mm × 150 mm × 10 mm. Testēšanas paraugs pilnībā jāiemērc ūdenī. Testēšanas paraugiem jāsastāv no 100 % aplievas. Katru paraugu unikāli marķē, lai to varētu identificēt visā testa gaitā.
|
|
21.
|
Visiem testēšanas paraugiem jābūt ēvelētiem vai gareniski sazāģētiem, un to virsmas nedrīkst būt slīpētas.
|
|
22.
|
Koksnes testā izmanto vismaz piecus paraugu komplektus: trīs paraugu komplektus apstrādā ar konservantu, vienu atstāj neapstrādātu un vēl viens ir paredzēts, lai aplēstu, kāds ir neapstrādātu testēšanas paraugu mitrumsaturs pēc žāvēšanas krāsnī. Sagatavo pietiekami daudzus testēšanas paraugus, lai varētu atlasīt trīs komplektus ar paraugiem, kam konservanta aizture ir 5 % robežās no visu testēšanas paraugu konservanta aiztures vidējās vērtības.
|
|
23.
|
Visiem testēšanas paraugiem galus hermetizē ar ķīmisko vielu, kas novērš konservanta iespiešanos paraugu gala šķiedrās vai nepieļauj izskalošanos no paraugiem pa gala šķiedrām. Paraugiem, kuriem veic uzklāšanu uz virsmas, gala hermētiķi jālieto citādāk nekā paraugiem, kam izmanto iespiešanās tehnoloģiju. Gala hermētiķi pirms apstrādes jāizmanto tikai gadījumā, ja veic uzklāšanu uz virsmas.
|
|
24.
|
Apstrādē ar iespiešanās tehnoloģiju gala šķiedrām jābūt atklātām. Tādēļ paraugu gali jāhermetizē nogatavināšanas perioda beigās. Emisiju aplēš tikai gareniskajam virsmas laukumam. Hermētiķi jāpārbauda un, ja nepieciešams, pirms izskalošanās ierosināšanas jālieto atkārtoti, un pēc izskalošanās ierosināšanas tos atkārtoti lietot nedrīkst.
|
Mērcēšanas tvertne
|
25.
|
Šo tvertni izgatavo no inerta materiāla, un tā ir pietiekami liela, lai tajā 500 ml ūdens varētu ievietot piecus EN113 koksnes paraugus, nodrošinot virsmas platības attiecību pret ūdens tilpumu 0,4 cm2/ml.
|
Testēšanas paraugu balstīšanas konstrukcija
|
26.
|
Testēšanas paraugus balsta konstrukcijā, kas nodrošina, ka visas eksponētās parauga virsmas ir saskarē ar ūdeni.
|
PROCEDŪRA APSTRĀDEI AR KONSERVANTU
Apstrādāto testēšanas paraugu sagatavošana
|
27.
|
Testēšanai paredzēto koksnes paraugu, ko testā apstrādās ar konservantu, apstrādā, izmantojot šim konservantam norādīto metodi, un tā var būt apstrāde ar iespiešanās tehnoloģiju vai virsmuzklāšanas tehnoloģija, kurā var izmantot iemērkšanu, aerosolu vai otu.
|
Konservanti, ar kuriem veic apstrādi ar iespiešanās tehnoloģiju
|
28.
|
Sagatavo tādu konservanta šķīdumu, kas apstrādē ar iespiešanās tehnoloģiju panāks nepieciešamo uzņemšanu vai aizturi. Testēšanai paredzēto koksnes paraugu nosver un noteic tā izmērus. Apstrāde ar iespiešanās tehnoloģiju jāveic tā, kā paredzēts attiecībā uz 4. vai 5. lietojuma klases koksnes konservantu. Pēc apstrādes paraugu vēlreiz nosver, un konservanta aizturi (kg/m3) aprēķina pēc šāda vienādojuma:

|
|
29.
|
Jāņem vērā, ka šajā testā var izmantot rūpnieciskā apstrādes iekārtā (piemēram, ar vakuumspiediena piesūcināšanu) apstrādātus kokmateriālus. Atzīmē izmantotās procedūras, un analizē un atzīmē šādi apstrādātā materiāla aizturi.
|
Konservanti, ar kuriem veic apstrādi ar uzklāšanu uz virsmas
|
30.
|
Uzklāšana uz virsmas notiek, testēšanai paredzētos koksnes paraugus iemērcot, apsmidzinot vai apstrādājot ar otu. Konservanta uzklāšanā uz virsmas jāievēro paredzētā procedūra un patēriņš (piemēram, litri/m2).
|
|
31.
|
Šādā gadījumā jāņem arī vērā, ka testā var izmantot rūpnieciskā apstrādes iekārtā apstrādātus kokmateriālus. Atzīmē lietotās procedūras, un analizē un atzīmē šādi apstrādātā materiāla aizturi.
|
Testēšanas paraugu nogatavināšana pēc apstrādes
|
32.
|
Apstrādātie testēšanas paraugi ir jānogatavina saskaņā ar ieteikumiem, ko atbilstoši konservanta marķēšanas prasībām vai komerciālajai apstrādes praksei, vai standartam EN 252 standartam sniedzis testējamā konservanta piegādātājs.
|
Testēšanas paraugu sagatavošana un atlase
|
33.
|
Kad ir pabeigta pēcapstrādes nogatavināšana, aprēķina testēšanas paraugu grupas vidējo aizturi un izskalošanās mērījumu vajadzībām pēc nejaušības principa atlasa trīs reprezentatīvus paraugu komplektus, kuru aizture ir 5 % robežās no grupas vidējā rādītāja.
|
KONSERVANTA EMISIJU MĒRĪŠANAS PROCEDŪRA
Iemērkšanas metode
|
34.
|
Testēšanas paraugus nosver un pēc tam pilnīgi iemērc ūdenī, pierakstot datumu un laiku. Tvertni pārsedz, lai samazinātu iztvaikošanu.
|
|
35.
|
Ūdeni nomaina ar šādiem starplaikiem: 6 stundas, 1 diena, 2 dienas, 4 dienas, 8 dienas, 15 dienas, 22 dienas, 29 dienas (piezīme – norādīts ir kopējais laiks, nevis starplaiki). Reģistrē ūdens nomaiņas laiku un datumu un no tvertnes atgūtā ūdens masu.
|
|
36.
|
Pēc katras ūdens nomaiņas turpmākai ķīmiskai analīzei ņem paraugu no ūdens, kurā testēšanas paraugu komplekti bija iemērkti.
|
|
37.
|
Paraugu ņemšanas procedūra dod iespēju aprēķināt emisiju daudzuma profilu laika griezumā. Paraugus glabā analīta konservēšanai piemērotos apstākļos, piemēram, ledusskapī un tumsā, lai pirms analīzes paraugā nesavairotos mikroorganismi.
|
EMISIJAS MĒRĪŠANA
Apstrādātie paraugi
|
38.
|
Ievākto ūdeni ķīmiski analizē attiecībā uz aktīvo vielu un/vai attiecīgajiem tās noārdīšanās/pārstrādāšanās produktiem, ja nepieciešams.
|
Neapstrādātie paraugi
|
39.
|
Ūdens (emisāta) ievākšana šajā sistēmā un turpmāka to ķīmisko vielu analīze, kas izskalojušās no neapstrādātajiem koksnes paraugiem, dod iespēju aplēst neapstrādātai koksnei iespējamo konservanta emisijas ātrumu. Emisātu ievācot un analizējot pēc pakāpeniski pieaugošiem ekspozīcijas periodiem, var aplēst, kā emisijas ātrums mainās laikā. Šī analīze ir kontroles procedūra, kurā nosaka testējamās ķīmiskās vielas fona līmeņus neapstrādātā koksnē, lai apstiprinātu, ka paraugiem izmantotā koksne ar konservantu iepriekš nav apstrādāta.
|
DATI UN PĀRSKATA SAGATAVOŠANA
Ķīmiskās analīzes
|
40.
|
Ievākto ūdeni ķīmiski analizē, un ūdens analīžu rezultātus izsaka piemērotās mērvienībās, piemēram, μg/l.
|
Datu ziņošana
|
41.
|
Visus rezultātus atzīmē. Papildinājumā ir dots piemērs ar iespējamu atzīmēšanas veidlapu vienam apstrādātu testa paraugu komplektam, kā arī kopsavilkuma tabula vidējo emisijas vērtību aprēķināšanai katrā paraugu ņemšanas intervālā.
|
|
42.
|
Vienas dienas emisijas plūsmu mg/m2/dienā aprēķina, izmantojot triju mērījumu vidējo rādītāju trijos replikātos un izdalot to ar mērcēšanas dienu skaitu.
|
Testēšanas pārskats
|
43.
|
Testēšanas pārskatā jāsniedz vismaz šāda informācija:
|
—
|
testējamā konservanta piegādātāja nosaukums;
|
|
—
|
testējamā konservanta specifiskais un unikālais nosaukums vai kods;
|
|
—
|
aktīvās(-o) sastāvdaļas(-u) tirdzniecības nosaukums vai vispārpieņemtais nosaukums ar vispārīgu aprakstu par papildvielām (piemēram, papildu šķīdinātājs, sveķi) un sastāvs, kas izteikts kā sastāvdaļu % m/m;
|
|
—
|
attiecīgā aizture vai slodze (attiecīgi kg/m3 vai l/m2), kas norādīta saskarē ar ūdeni lietotai koksnei;
|
|
—
|
izmantotās koku sugas, norādot blīvumu un pieauguma ātrumu gadskārtu gredzenos uz 10 mm;
|
|
—
|
testējamā konservanta slodze vai aizture un formula, ar kuru aizturi aprēķina, izsakot l/m2 vai kg/m3;
|
|
—
|
konservanta lietošanas paņēmiens, iespiešanās tehnoloģijas gadījumā norādot apstrādes laika grafiku un virsmas apstrādes tehnoloģijas gadījumā – uzklāšanas metodi;
|
|
—
|
konservanta lietošanas datums un aplēse par testēšanas paraugu mitrumsaturu, kas izteikts procentos;
|
|
—
|
izmantotās nogatavināšanas procedūras, norādot veidu, apstākļus un ilgumu;
|
|
—
|
norāde par izmantoto koksnes galu hermētiķi un cikreiz tas izmantots;
|
|
—
|
norāde par jebkuru turpmāko koksnes apstrādi, piemēram, norāde par krāsvielu piegādātāju, krāsas veidu, īpašībām un krāsas slodzi;
|
|
—
|
katra mērcējuma laiks un datums, ūdens daudzums, ko katrā mērcējumā izmanto testēšanas paraugu mērcēšanai un ūdens daudzums, ko koksne uzsūc mērcēšanas laikā;
|
|
—
|
jebkāda atkāpe no aprakstītās metodes, un jebkādi apstākļi, kas varējuši ietekmēt rezultātus.
|
|
LITERATŪRA
|
(1)
|
European Standard, EN 84 – 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
(2)
|
European Standard, EN 113/A1 – 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
(3)
|
European Standard, EN 252 – 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
(4)
|
European Standard, EN 335 – Part 1: 2006. Durability of wood and wood-based products – Definition of use classes – Part1: General.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
1. papildinājums
Testēšanas metodes atzīmēšanas veidlapa
Aplēse par emisijām vidē no koksnes, kas apstrādāta ar konservantiem: laboratorijas metode saskarē ar saldūdeni vai jūras ūdeni esošiem koka izstrādājumiem bez pārklājuma
|
Testēšanas vieta
|
|
|
Koksnes konservants
|
|
Konservanta piegādātājs
|
|
|
Konservanta specifiskais un unikālais nosaukums vai kods
|
|
|
Konservanta tirdzniecības nosaukums vai vispārpieņemtais nosaukums
|
|
|
Papildvielas
|
|
|
Saskarē ar ūdeni lietotās koksnes attiecīgā aizture
|
|
|
Lietošana
|
|
Lietošanas metode
|
|
|
Lietošanas datums
|
|
|
Aiztures aprēķināšanai izmantotā formula
|
|
|
Nogatavināšanas procedūra
|
|
|
Nogatavināšanas ilgums
|
|
|
Galu hermētiķis/ cik reizes lietots
|
|
|
Pēcapstrāde
|
attiecīgā gadījumā
|
|
Testēšanas paraugi
|
|
Koku sugas
|
|
|
Koksnes blīvums
|
(minimālais … vidējā vērtība … maksimālais)
|
|
Pieauguma ātrums (gadskārtu gredzeni uz 10 mm)
|
(minimālais … vidējā vērtība … maksimālais)
|
|
Mitrumsaturs
|
|
|
Testa kompleksi
(67)
|
Aizture (piemēram, kg/m3)
|
|
Apstrādāts “x”
|
Vidējā vērtība un standartnovirze vai diapazons pieciem paraugiem
|
|
Apstrādāts “y”
|
Vidējā vērtība un standartnovirze vai diapazons pieciem paraugiem
|
|
Apstrādāts “z”
|
Vidējā vērtība un standartnovirze vai diapazons pieciem paraugiem
|
|
Neapstrādāts
|
|
|
Testēšanas metodes parametru mainība
|
piemēram, ūdens kvalitāte, testēšanas paraugu izmēri utt.
|
|
Laiks
|
Ūdens nomaiņa
|
Parauga masa
|
Uzņemtais ūdens
|
Ūdens paraugs
|
|
Apstrādāts (vidēji)
|
Neapstrādāts
|
Apstrādāts (vidēji)
|
Neapstrādāts
|
|
Testēšanas ūdens
|
x
|
y
|
z
|
|
|
Datums
|
g
|
g
|
g
|
g
|
Nr.
|
pH
|
pH
|
pH
|
pH
|
|
Sākums
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 stundas
|
|
|
|
|
|
1.
|
|
|
|
|
|
24 stundas
|
|
|
|
|
|
2.
|
|
|
|
|
|
2 dienas
|
|
|
|
|
|
3.
|
|
|
|
|
|
4 dienas
|
|
|
|
|
|
4.
|
|
|
|
|
|
8 dienas
|
|
|
|
|
|
5.
|
|
|
|
|
|
15 dienas
|
|
|
|
|
|
6.
|
|
|
|
|
|
22 dienas
|
|
|
|
|
|
7.
|
|
|
|
|
|
29 dienas
|
|
|
|
|
|
8.
|
|
|
|
|
|
|
|
Par katru aktīvo sastāvdaļu sagatavo atsevišķu tabulu
|
Laiks
|
Ūdens nomaiņa
|
Analīzes rezultāti
|
|
Neapstrādātie paraugi
|
Apstrādātie paraugi
|
|
Aktīvās sastāvdaļas koncentrācija ūdenī
mg/l
|
Emitētais daudzums
mg/m2
|
Emisijas ātrums
mg/m2/d
|
Aktīvās sastāvdaļas koncentrācija ūdenī
|
Emitētais daudzums
|
Emisijas ātrums
|
|
x
|
y
|
z
|
Vidēji
|
x
|
y
|
z
|
Vidēji
|
x
|
y
|
z
|
Vidēji
|
|
|
Datums
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6 stundas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 stundas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 dienas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 dienas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 dienas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 dienas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 dienas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 dienas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Piezīme. Tā kā neapstrādātā parauga rezultātus var izmantot, lai koriģētu apstrādāto paraugu emisijas ātrumu, neapstrādāto paraugu rezultātus norāda pirmos, un visas vērtības, kas attiecas uz apstrādātajiem paraugiem, būs “koriģētās vērtības”. Koriģēt var arī sākotnējo ūdens analīzi.
2. papildinājums
Definīcijas
|
|
Ķīmiskā viela ir viela vai to maisījums.
|
|
|
Testējamā ķīmiskā viela ir jebkura viela vai to maisījums, kuru testē, izmantojot šo testēšanas metodi
|
C.46. BIOAKUMULĀCIJA SEDIMENTOS DZĪVOJOŠOS BENTISKOS MAZSARTĀRPOS
IEVADS
|
1.
|
Šī testēšanas metode ir līdzvērtīga ESAO Testēšanas norādījumiem (TG) 315 (2008. gads). Endobentiskie dzīvnieki, kas barojas ar sedimentiem, var tikt eksponēti sedimentos saistītām vielām (1). No sedimentus uzņemošo dzīvnieku vidus ūdens sistēmu pamatā liela nozīme ir ūdens mazsartārpiem. Tie mājo sedimentos un bieži vien ir visplašāk izplatītās sugas biotopos, kur vides apstākļi nav citiem dzīvniekiem labvēlīgi. Palielinot sedimentu bioloģisko duļķainību un kalpojot par medījumu, šie dzīvnieki var spēcīgi ietekmēt minēto vielu biopieejamību citiem organismiem, piemēram, bentosa zivīm. Atšķirībā no epibentiskajiem organismiem endobentiskie ūdens mazsartārpi ierokas sedimentos un barojas ar sedimentu daļiņām, kas atrodas zem to virsmas. Minētā iemesla dēļ šie organismi vielai tiek eksponēti pa daudziem uzņemšanas ceļiem, tostarp nonākot tiešā saskarē, barojoties ar piesārņotām sedimentu daļiņām, caur poru ūdeni un virsējo ūdeni. Dažas ekotoksikoloģiskajā testēšanā pašlaik izmantotas bentisko mazsartārpu sugas ir aprakstītas 6. papildinājumā.
|
|
2.
|
Parametri, kas raksturo vielas bioakumulāciju, pirmām kārtām ir bioakumulācijas koeficients (BAF), no sedimentiem notiekošās uzņemšanas ātruma konstante (ks) un eliminācijas ātruma konstante (ke). Detalizētas šo parametru definīcijas sniegtas 1. papildinājumā.
|
|
3.
|
Lai vispārīgi novērtētu vielu bioakumulācijas potenciālu un izpētītu to vielu bioakumulāciju, kurām ir tendence sedimentos sadalīties vai tajos nogulsnēties, nepieciešama vides segmentam specifiska testēšanas metode (1)(2)(3)(4).
|
|
4.
|
Šī testēšanas metode ir izstrādāta, lai varētu novērtēt ar sedimentiem saistīto vielu bioakumulāciju endobentiskajos mazsartārpos. Sedimentus papildina ar testējamo vielu. Ar šo vielu papildināto sedimentu lietošanas mērķis ir modelēt piesārņotus sedimentus.
|
|
5.
|
Šīs metodes pamatā ir līdzšinējās sedimentu toksicitātes un bioakumulācijas testēšanas metodes (1)(4)(5)(6)(7)(8)(9). Var noderēt arī citi dokumenti, piemēram, starptautiskā seminārā notikušas diskusijas un tā rezultāti (11) un starptautiskas starplaboratoriju salīdzinošās testēšanas rezultāti (12).
|
|
6.
|
Šo testu veic ar stabilām, neitrālām organiskām vielām, kurām ir tendence saistīties ar sedimentiem. Ar šo metodi var mērīt arī bioakumulāciju ar sedimentiem saistītos stabilos metālorganiskos savienojumos (12). Metāliem un citiem mikroelementiem (11) to izmanto, tikai mainot testēšanas plānu attiecībā uz substrāta un ūdens tilpumiem un, iespējams, – arī audu parauga lielumu.
|
PRIEKŠNOTEIKUMI UN INFORMĀCIJA PAR TESTĒJAMO VIELU
|
7.
|
Attiecībā uz bioakumulācijas procesiem pašlaik pieejami ir tikai daži labi izstrādāti struktūras un aktivitātes kvanitatīvās sakarības modeļi (QSAR) (14). Visplašāk izmantotā sakarība ir stabilu organisko vielu bioakumulācijas un biokoncentrēšanās korelācija ar to lipofilitāti (izteikta kā oktanola-ūdens sadalīšanās koeficienta logaritms (log Kow); definīciju sk. 1. papildinājumā), kas izstrādāta, lai aprakstītu vielas sadalīšanos starp ūdeni un zivīm. Izmantojot šo sakarības modeli, korelācijas tika noteiktas arī atsevišķi sedimentiem (15)(16)(17)(18). Korelācija log Kow–log BCF kā svarīgs QSAR var noderēt pirmajai provizoriskajai aplēsei par sedimentos saistīto vielu bioakumulācijas potenciālu. Tomēr BAF var ietekmēt lipīdu saturs testa organismā un organiskā oglekļa saturs sedimentos. Tādējādi par svarīgu sedimentos saistītu organisko vielu bioakumulācijas rādītāju var izmantot arī organiskā oglekļa un ūdens sadalīšanās koeficientu (Koc).
|
|
8.
|
Šo testu var izmantot:
|
—
|
stabilām organiskām vielām, kuru log Kow vērtības ir robežās no 3,0 līdz 6,0 (5)(19), un superlipofīlām vielām, kuru log Kow pārsniedz 6,0 (5);
|
|
—
|
vielām, kuras pieder pie to organisko vielu klases, kas pazīstamas ar savu potenciālu bioakumulēties dzīvajos organismos, piemēram, virsmaktīvām vielām vai ļoti adsorptīvām vielām (piemēram, ar augstu Koc).
|
|
|
9.
|
Pirms pētījuma uzsākšanas jāiegūst informācija par testējamo vielu, piemēram, par drošības pasākumiem, pareizas glabāšanas apstākļiem un stabilitāti, kā arī analīzes metodēm. Norādījumi par to, kā testēt vielas, kuru fizikālķīmiskās īpašības apgrūtina to testēšanu, sniegti (20) un (21). Pirms veikt bioakumulācijas testu ar ūdens mazsartārpiem, par testējamo vielu ir jābūt noskaidrotai šādai informācijai:
|
—
|
vispārpieņemtais nosaukums, ķīmiskais nosaukums (vēlams, IUPAC nomenklatūrā), struktūrformula, CAS reģistra numurs un tīrība;
|
|
—
|
šķīdība ūdenī [testēšanas metode A.6. (22)];
|
|
—
|
oktanola-ūdens sadalīšanās koeficients Kow [testēšanas metodes A.8. un A.24. (22)];
|
|
—
|
sedimentu-ūdens sadalīšanās koeficients, kas izteikts kā Kd vai Koc [testēšanas metode C.19. (22)];
|
|
—
|
hidrolīze [testēšanas metode C.7. (22)];
|
|
—
|
fototransformācija ūdenī (23);
|
|
—
|
tvaika spiediens [testēšanas metode A.4. (22)];
|
|
—
|
tūlītēja bionoārdāmība [testēšanas metodes C.4. un C.29. (22)];
|
|
—
|
virsmas spraigums [testēšanas metode A.5. (22)];
|
|
—
|
kritiskā micellu koncentrācija (24).
|
Turklāt svarīga ir arī šāda informācija, ja ir pieejama:
|
—
|
bionoārdāmība ūdens vidē [testēšanas metodes C.24. un C.25. (22)];
|
|
—
|
Henrija likuma konstante.
|
|
|
10.
|
Radioaktīvi iezīmētas testējamās vielas var atvieglot ūdens, sedimentu un bioloģisko paraugu analīzi, un tās var izmantot, lai noteiktu, vai noārdīšanās produkti jāidentificē un jāizsaka kvantitatīvi. Šeit aprakstītā metode ir validēta starptautiskajā starplaboratoriju salīdzinošajā testēšanā (12) attiecībā uz vielām, kas iezīmētas ar 14C. Mērot kopējās radioaktīvās atliekas, bioakumulācijas koeficienta (BAF) pamatā ir pamatviela, kurā ietilpst arī jebkādi saglabājušies noārdīšanās produkti. Metabolisma pētījumu ir iespējams arī apvienot ar bioakumulācijas pētījumu, analizējot un kvantitatīvi izsakot pamatvielas un tās noārdīšanās produktu procentuālo īpatsvaru paraugos, kas ņemti uzņemšanas fāzes beigās vai bioakumulēšanās kulminācijas līmenī. Jebkurā gadījumā BAF aprēķina pamatā ir ieteicams likt pamatvielas koncentrāciju organismos, nevis tikai radioaktīvo atlieku kopdaudzumu.
|
|
11.
|
Papildus testējamās vielas īpašībām ir nepieciešama arī cita informācija, proti, toksicitāte testā izmantojamām mazsartārpu sugām, piemēram, 50 % letālā koncentrācija (LC50) laikā, kas nepieciešams uzņemšanas fāzē, lai nodrošinātu, ka izraudzītās ekspozīcijas koncentrācijas ir daudz zemākas par toksiskajiem līmeņiem. Priekšroka ir toksicitātes vērtībām, kas iegūtas ilgtermiņa pētījumos par subletālajiem beigupunktiem (EC50), ja tie ir pieejami. Ja šādu datu nav, derīgu informāciju var sniegt akūtās toksicitātes tests apstākļos, kas identiski bioakumulācijas testēšanas apstākļiem, vai toksicitātes dati par citām surogātsugām.
|
|
12.
|
Attiecībā uz vielas kvantitatīvo noteikšanu testēšanas šķīdumos, sedimentos un bioloģiskajā materiālā, ir nepieciešama attiecīga analīzes metode ar zināmu pareizību, precizitāti un jutību, kā arī informācija par parauga sagatavošanu un glabāšanu un materiāla drošības datu lapas. Jāzina arī testējamās vielas analītiskās noteikšanas robežas ūdenī, sedimentos un tārpu audos. Ja izmanto radioaktīvi iezīmētu testējamo vielu, jāzina arī specifiskā radioaktivitāte (t. i., Bq mol– 1), radioaktīvi iezīmētā atoma vieta un ar piemaisījumiem saistītās radioaktivitātes procents. Testējamās vielas specifiskajai radioaktivitātei jābūt iespējami augstai, lai konstatētu iespējami zemas testa koncentrācijas (11).
|
|
13.
|
Jābūt pieejamai informācijai par izmantojamo sedimentu īpašībām (piemēram, par sedimentu vai to sastāvdaļu izcelsmi, pH un amonjaka koncentrāciju poru ūdenī (lauka apstākļos iegūtos sedimentos), organiskā oglekļa saturu (TOC), daļiņu sadalījumu pēc lieluma (smilšu, dūņu un māla procents) un sausnas procents) (6).
|
TESTĒŠANAS PRINCIPS
|
14.
|
Testam ir divas fāzes – uzņemšanas (ekspozīcijas) fāze un eliminācijas (pēcekspozīcijas) fāze. Uzņemšanas fāzē tārpi ir eksponēti sedimentiem, kas papildināti ar testējamo vielu, pārlieti ar rekonstituētu ūdeni un attiecīgi līdzsvaroti (11). Kontrolgrupu tārpus tur tādos pašos apstākļos bez testējamās vielas.
|
|
15.
|
Eliminācijas fāzē tārpus pārvieto uz sedimentu-ūdens sistēmu bez testējamās vielas. Eliminācijas fāze ir nepieciešama, lai varētu iegūt informāciju par to, cik intensīvi testa organismi izvada testējamo vielu (19)(25). Eliminācijas fāze ir nepieciešama vienmēr, izņemot gadījumus, kur testējamās vielas uzņemšana ekspozīcijas fāzē bijusi maznozīmīga (piemēram, ja nav statistiskas atšķirības starp testējamās vielas koncentrāciju testa grupas un kontrolgrupas tārpos). Ja uzņemšanas fāzē netiek sasniegts stacionārs stāvoklis, kinētisko lielumu – BAF
k, uzņemšanas un eliminācijas ātrumu konstanšu – noteikšanā var izmantot eliminācijas fāzes rezultātus. To, kā mainās testējamās vielas koncentrācija tārpos un uz tiem, novēro abās testa fāzēs.
|
|
16.
|
Uzņemšanas fāzē mērījumus veic līdz brīdim, kad BAF sasniedz plato jeb stacionāru stāvokli. Pēc noklusējuma uzņemšanas fāze ilgst 28 dienas. Praktiskā pieredze liecina, ka ar 12–14 dienas ilgu uzņemšanas fāzi attiecībā uz vairākām stabilām, neitrālām organiskajām vielām pietiek, lai iestātos stacionārs stāvoklis (6)(8)(9).
|
|
17.
|
Tomēr, ja 28 dienās stacionārs stāvoklis neiestājas, uzsāk eliminācijas fāzi, eksponētos mazsartārpus pārvietojot uz traukiem ar tādu pašu vidi, bet bez testējamās vielas. Eliminācijas fāzi izbeidz vai nu tad, kad koncentrācijas līmenis sasniedzis 10 % no koncentrācijas, kas tārpos konstatēta uzņemšanas fāzes 28. dienā, vai pēc maksimālā perioda 10 dienas. Atlieku līmeni tārpos eliminācijas fāzes beigās pārskatā ieraksta kā papildu beigupunktu, piemēram, kā neeliminētās atliekas (NER). Bioakumulācijas koeficientu (BAF
ss) vislabāk rēķināt gan kā attiecību starp koncentrāciju tārpos (Ca) un sedimentā (Cs) acīmredzami stacionārā stāvoklī, gan kā kinētisko bioakumulācijas koeficientu BAF
K, kas ir attiecība starp no sedimentiem notiekošās uzņemšanas ātruma konstanti (ks) un eliminācijas ātruma konstanti (ke), pieņemot pirmās kārtas kinētiku. Ja 28 dienās netiek sasniegts stacionārs stāvoklis, BAF
K aprēķina no uzņemšanas ātruma un eliminācijas ātruma konstantēm. Aprēķinus sk. 2. papildinājumā. Ja neizmanto pirmās kārtas kinētiku, jālieto sarežģītāki modeļi (2. papildinājums un literatūras avots (25)).
|
|
18.
|
Ja 28 dienās stacionāru stāvokli nesasniedz, uzņemšanas fāzi pēc izvēles var arī paildzināt, eksponēto tārpu grupām, ja tādas ir pieejamas, veicot papildu mērījumus līdz pat stacionāra stāvokļa sasniegšanai; tomēr līdztekus uzņemšanas fāzes 28. dienā ir jāuzsāk eliminācijas fāze.
|
|
19.
|
Uzņemšanas ātruma konstanti, eliminācijas ātruma konstanti (vai konstantes, ja tiek izmantoti sarežģītāki modeļi), kinētisko bioakumulācijas koeficientu (BAF
K) un, ja iespējams, arī katra šā parametra ticamības robežas aprēķina, izmantojot datorizētus paraugvienādojumus (paraugus sk .2. papildinājumā). Jebkura parauga piemērotību var noteikt, pamatojoties uz korelācijas koeficientu jeb noteikšanas koeficientu (ja šis koeficients ir tuvs 1, piemērotība ir pietiekama).
|
|
20.
|
Lai mazinātu testa rezultātu mainību organiskām vielām ar augstu lipofilitāti, bioakumulācijas koeficienti papildus jāizsaka arī attiecībā pret lipīdu saturu testa organismos un organiskā oglekļa saturu (TOC) sedimentos (biotas-sedimentu akumulācijas koeficients jeb BSAF uz kilogramu sedimentu TOC un kg–1 lipīdu satura tārpos). Šādas pieejas pamatā ir pieredze un teorētiskās korelācijas attiecībā uz vides ūdens segmentu, kur – attiecībā uz dažām ķīmisko vielu klasēm – starp vielas bioakumulācijas potenciālu un tās lipofilitāti pastāv skaidra sakarība, kas ir pietiekami konstatēta zivīm kā modeļa organismiem (14)(25)(27). Sakarība pastāv arī starp lipīdu saturu testa zivīs un šādu vielu novēroto bioakumulāciju. Līdzīgas korelācijas ir konstatētas attiecībā uz bentiskajiem organismiem (15)(16)(17)(18). Ja tārpu audi ir pieejami pietiekamā daudzumā, lipīdu saturu testa dzīvnieku organismā var noteikt ar to pašu bioloģisko materiālu, kas lietots testējamās vielas koncentrācijas noteikšanai. Tomēr, lai izmērītu lipīdu saturu, ko pēc tam var izmantot BAF vērtību standartizēšanai, praksē ir izdevīgāk lietot aklimatizētus kontrolgrupas dzīvniekus vismaz uzņemšanas fāzes sākumā vai – vislabāk – beigās.
|
TESTA DERĪGUMS
|
21.
|
Lai tests būtu derīgs, jāievēro šādi nosacījumi.
|
—
|
Tārpu kumulatīvā mirstība (kontrolgrupā un apstrādes grupās) līdz testēšanas beigām nedrīkst pārsniegt 20 % sākotnējā skaita.
|
|
—
|
Turklāt, lai ekspozīcija tiktu atzīta par maksimālu, ir jāpierāda, ka tārpi ierokas sedimentos. Papildu informāciju sk. 28. punktā.
|
|
METODES APRAKSTS
Testa sugas
|
22.
|
Testam var izmantot vairākas ūdens mazsartārpu sugas. Visbiežāk izmantotās sugas ir minētas 6. papildinājumā.
|
|
23.
|
Lai pierādītu testa dzīvnieku veselības stāvokli, regulāri (piemēram, reizi mēnesī) ar standarta toksikantu, piemēram, kālija hlorīdu (KCl) vai vara sulfātu (CuSO4) (1), jāveic toksicitātes testi (96 stundas, tikai ūdenī) (1)(6). Ja regulāri neveic toksicitātes standarttestus, organismu daļa, kas izmantojama sedimentu bioakumulācijas testā, jāpārbauda ar standarta toksikantu. Noderīgu informāciju par dzīvnieku stāvokli var gūt arī no lipīdu satura mērījumiem.
|
Testa organismu kultivēšana
|
24.
|
Lai bioakumulācijas testu veikšanai pietiktu tārpu, iespējams, tie jātur pastāvīgā vienas sugas laboratoriskā kultūrā. Izraudzīto testa sugu laboratoriskās kultivēšanas metodes ir apkopotas 6. papildinājumā. Papildu informācija ir atrodama literatūras avotos (8)(9)(10)(18)(28)(29)(30)(31)(32).
|
Aprīkojums
|
25.
|
Jācenšas nevienā aprīkojuma daļā nelietot materiālus, kas var izšķīst, absorbēt testējamās vielas vai izskalot citas vielas un nelabvēlīgi ietekmēt testa dzīvniekus. Var izmantot no ķīmiski inerta materiāla izgatavotas taisnstūrainas vai cilindriskas standartkameras, kurām ir pietiekama, noslogojumam, t. i., testējamo tārpu skaitam, atbilstoša ietilpība. Ūdens vai gaisa ievadīšanai jāizvairās lietot mīkstas plastmasas caurules. Jebkuram aprīkojumam, kas ir saskarē ar testēšanas vidēm, jābūt no politetrafluoretilēna, nerūsošā tērauda un/vai stikla. Vielām ar augstu adsorbcijas koeficientu, piemēram, sintētiskajiem piretroīdiem, var būt nepieciešams silanizēts stikls. Šādās situācijās aprīkojums pēc izmantošanas būs jālikvidē (5). Attiecībā uz radioaktīvi iezīmētām testējamām vielām un gaistošām vielām jācenšas izvairīties no testējamās vielas atsegšanas un atsegtās testējamās vielas noplūdes. Jāizmanto lamatas (piemēram, gāzes mazgāšanai paredzētas stikla pudeles), kas satur piemērotus absorbentus, kuros saglabājas jebkuras atliekas, kas iztvaiko no testēšanas kamerām (11).
|
Ūdens
|
26.
|
Virsējā ūdens kvalitātei jābūt tādai, lai testa sugas dzīvnieki aklimatizācijas laiku un testēšanas periodus izturētu bez izskata vai izturēšanās anomāliju parādīšanās. Par virsējo ūdeni testos, kā arī laboratoriskajās tārpu kultūrās ir ieteicams lietot rekonstituēto ūdeni saskaņā ar testēšanas metodi C.1. (25). Ir pierādīts, ka vairākas testa sugas šajā ūdenī spēj izdzīvot, augt un vairoties (8), un ir nodrošināta maksimāla testa un kultivēšanas apstākļu standartizācija. Ūdens ir jāraksturo vismaz pēc pH, elektrovadītspējas un cietības. Lietderīgu informāciju pirms lietošanas var sniegt ūdens analīze attiecībā uz mikropiesārņotājiem (4. papildinājums).
|
|
27.
|
Ūdens kvalitātei testa laikā jābūt nemainīgai. Virsējā ūdens pH jābūt robežās no 6 līdz 9. Kopējai cietībai testa sākumā ir jābūt no 90 līdz 400 mg CaCO3 uz vienu litru (7). Minētā rekonstituētā ūdens pH un cietības diapazoni ir norādīti testēšanas metodē C.1. (25). Ja rodas aizdomas par cietības jonu un testējamās vielas mijiedarbību, izmanto ūdeni ar mazāku cietību. Saskaņā ar ESAO TG 210 (34) pieņemama atšķaidīšanas ūdens papildkritēriji ir apkopoti 4. papildinājumā.
|
Sedimenti
|
28.
|
Sedimentu kvalitātei jābūt tādai, lai testa organismi aklimatizācijas laiku un testēšanas periodus spētu izdzīvot un, vēlams, arī vairoties bez izskata vai izturēšanās anomāliju parādīšanās. Tārpiem ir jāierokas sedimentos. Ar ierakšanos saistītā izturēšanās var ietekmēt ekspozīciju un pēc tam arī BAF. Tādēļ ir jāatzīmē testa organismu vairīšanās no sedimentiem vai ar ierakšanos saistītā izturēšanās, ja vien virsējā ūdens duļķainuma pakāpe pieļauj šādu novērošanu. Tārpiem (gan no kontrolgrupas, gan no apstrādes grupas) jāierokas sedimentos 24 stundu laikā pēc ievietošanas testēšanas traukos. Ja konstatē, ka ierakšanās vispār nenotiek vai ka tārpi no sedimentiem izvairās (piemēram, vairāk nekā 20 % ilgāk nekā pusi no uzņemšanas fāzes), tas liecina, ka testēšanas apstākļi nav piemēroti vai testa organismi nav veseli, vai arī šādu izturēšanos izraisa testējamās vielas koncentrācija. Šādā gadījumā tests jāaptur un jāatkārto uzlabotos apstākļos. Papildu informācija par barošanos ar sedimentiem ir iegūstama, izmantojot literatūras avotos (35)(36) aprakstītās metodes, pēc kurām var precizēt barošanos ar sedimentiem vai daļiņu atlasi testa organismos. Novērojamības robežās jāatzīmē vismaz tas, vai uz sedimentu virsmas ir vai nav fekāliju granulas, kas apliecina, ka tārpi barojas ar sedimentiem, un tas ir jāņem vērā, interpretējot testa rezultātus attiecībā uz ekspozīcijas mehānismu.
|
|
29.
|
Gan testos, gan laboratorijas tārpu kultūrās (5. papildinājums) ieteicams lietot mākslīgos sedimentus, kuru pamatā testēšanas metodē C.8. (40) aprakstītā mākslīgā augsne, jo iespējams, ka attiecīgas kvalitātes dabiskie sedimenti nav visu gadu pieejami. Turklāt testu var ietekmēt vietējie organismi, kā arī iespējamā mikropiesārņotāju klātbūtne dabiskajos sedimentos. Mākslīgajos sedimentos spēj izdzīvot, augt un vairoties vairākas testa sugas (8).
|
|
30.
|
Mākslīgie sedimenti ir jāraksturo vismaz pēc sastāvdaļu izcelsmes, daļiņu sadalījuma pēc lieluma (smilšu, dūņu un māla procents), organiskā oglekļa satura (TOC), ūdens satura un pH. Pēc izvēles var mērīt arī redokspotenciālu. Tomēr par testa un/vai kultūras sedimentiem var izmantot arī dabiskos sedimentus no nepiesārņotām vietām (1). Dabiskie sedimenti ir jāraksturo vismaz pēc izcelsmes (ievākšanas vietas), pH un amonjaka satura poru ūdenī, pēc organiskā oglekļa satura (TOC), daļiņu sadalījuma pēc lieluma (smilšu, dūņu un māla procents) un ūdens satura procentos (6). Ja paredzams, ka veidosies amonjaks, pirms dabisko sedimentu papildināšanas ar testējamo vielu ieteicams tos septiņas dienas nogatavināt tādos pašos apstākļos, kādi būs turpmākajā testā. Šā nogatavināšanas perioda beigās virsējais ūdens jānolej un jāizlej. Lietderīgu informāciju pirms lietošanas var sniegt sedimentu vai to sastāvdaļu analīze attiecībā uz mikropiesārņotājiem.
|
Sagatavošana
|
31.
|
Darbības ar dabiskajiem sedimentiem pirms to lietošanas laboratorijā ir aprakstītas literatūras avotos (1)(6)(44). Mākslīgo sedimentu gatavošana ir aprakstīta 5. papildinājumā.
|
Glabāšana
|
32.
|
Dabisko sedimentu glabāšanai laboratorijā ir jābūt iespējami īsai. ASV Vides aizsardzības aģentūra (6) par maksimālo glabāšanas termiņu iesaka noteikt 8 nedēļas 4 ± 2°C temperatūrā tumsā. Glabāšanas tvertnēs virs sedimentiem nedrīkst atstāt tukšu telpu. Mākslīgu sedimentu glabāšana ieteikumi ir sniegti 5. papildinājumā.
|
Testējamās vielas lietošana
|
33.
|
Sedimentus papildina ar testējamo vielu. Papildināšanas procedūrā ar testējamo vielu pārklāj vienu vai vairākas sedimentu sastāvdaļas. Piemēram, piemērotā šķīdinātājā kopā ar testējamās vielas šķīdumu var iemērkt kvarca smiltis vai to porciju (piemēram, 10 g kvarca smilšu uz vienu testēšanas trauku), šķīdinātāju pēc tam lēni iztvaicējot līdz izžūšanai. Pārklāto frakciju pēc tam var iemaisīt mitrajos sedimentos. Smilšu daudzums testējamās vielas un smilšu maisījumā jāņem vērā sedimentu gatavošanā, t. i., sedimenti tādēļ jāgatavo, izmantojot mazāk smilšu (6).
|
|
34.
|
Dabiskajiem sedimentiem testējamo vielu var pievienot, ar to papildinot izžāvētu sedimentu porciju, kā iepriekš aprakstīts attiecībā uz mākslīgiem sedimentiem, vai testējamo vielu iemaisot mitros sedimentos un pēc tam jebkuram izmantotajam šķīdinātājam ļaujot izgarot. Mitru sedimentu papildināšanai piemēroti šķīdinātāji ir etanols, metanols, etilēnglikola monometilēteris, etilēnglikola dimetilēteris, dimetilformamīds un trietolēnglikols (5)(34). Piemērota šķīdinātāja atlases galvenajam kritērijam jābūt šķīdinātāja toksicitātei un gaistamībai, kā arī testējamās vielas šķīdībai izraudzītajā šķīdinātājā. Papildu norādījumi par papildināšanas procedūrām ir sniegti izdevumā Environment Canada (1995) (41). Jācenšas nodrošināt, lai sedimentiem pievienotā testējamā viela sedimentos būtu viscaur un vienmērīgi izkliedēta. Analizē papildināto sedimentu apakšparaugu replikātus, lai pārbaudītu testējamās vielas koncentrāciju sedimentos un noteiktu testējamās vielas viendabīguma pakāpi.
|
|
35.
|
Kad papildinātie sedimenti ar virsējo ūdeni ir sagatavoti, vēlams nodrošināt testējamās vielas sadalīšanos starp sedimentiem un ūdens fāzi. To vēlams īstenot tādos pašos temperatūras un aerācijas apstākļos, kādus izmanto testēšanā. Attiecīgais līdzsvarošanās laiks ir atkarīgs no sedimentiem un vielas un var ilgt no dažām stundām līdz vairākām dienām, retos gadījumos – vairākas nedēļas (4–5) (28)(42). Šajā testā negaida līdzsvara iestāšanos, bet 48 stundu līdz 7 dienu līdzsvarošanās periods ir ieteicams. Atkarībā no pētījuma mērķa, piemēram, vides apstākļu imitācijas, papildinātos sedimentus līdzsvarot vai nostādināt var ilgāku laiku (11).
|
TESTĒŠANAS NORISE
Priekštestēšana
|
36.
|
Lai testēšanas apstākļus optimizētu galīgajam testam, piemēram, izraudzītos testējamās vielas koncentrāciju (koncentrācijas) un noteiktu uzņemšanas fāzes un eliminācijas fāzes ilgumu, var noderēt priekšeksperiments. Priekštestēšanā jānovēro un jāatzīmē tārpu izturēšanās, piemēram, vairīšanās no sedimentiem, jeb to bēgšana no sedimentiem, kuru var būtu izraisījusi testējamā viela un/vai paši sedimenti. Vairīšanos no sedimentiem priekštestēšanā var izmantot arī kā subletālu parametru, ar kura palīdzību aplēš bioakumulācijas testā lietojamo testējamās vielas koncentrāciju.
|
Ekspozīcijas nosacījumi
Uzņemšanas fāzes ilgums
|
37.
|
Testa organismus uzņemšanas fāzē eksponē testējamai vielai. Pirmais paraugs ir jāņem no 4 līdz 24 stundu laikā pēc uzņemšanas fāzes sākuma. Uzņemšanas fāze būtu jāturpina 28 dienas (1)(6)(11), ja vien nevar pierādīt, ka līdzsvars ir sasniegts agrāk. Stacionārs stāvoklis iestājas, kad: i) bioakumulācijas koeficientu attēls katrā paraugu ņemšanas periodā attiecībā pret laiku ir laika asij paralēls; ii) trīs BAF analīzes pēc kārtas, kas ņemtajiem paraugiem veiktas ar vismaz divu dienu starplaiku, viena no otras atšķiras ne vairāk kā par ± 20 %; un iii) starp šiem trim paraugu ņemšanas periodiem nav būtisku atšķirību (pamatojoties uz statistiskiem salīdzinājumiem, piemēram, dispersijas analīzi un regresijas analīzi). Ja 28 dienu laikā stacionārs stāvoklis netiek sasniegts, uzņemšanas fāzi var beigt, uzsākot eliminācijas fāzi, un BAF
K var aprēķināt pēc uzņemšanas un eliminācijas ātruma konstantēm (skatīt arī 16.–18. punktu).
|
Eliminācijas fāzes ilgums
|
38.
|
Pirmais paraugs jāņem no 4 līdz 24 stundu laikā pēc eliminācijas fāzes uzsākšanas, jo sākotnējā periodā var notikt straujas izmaiņas audu atliekās. Eliminācijas fāzi ieteicams beigt vai nu tad, kad testējamās vielas koncentrācija ir mazāka par 10 % stacionārā stāvokļa koncentrācijas, vai arī pēc maksimālā 10 dienu ilguma. Atlieku līmeni tārpos eliminācijas fāzes beigās atspoguļo kā sekundāru beigupunktu. Šo periodu tomēr nosaka periods, kurā testējamās vielas koncentrācija tārpos paliek virs analītiskās noteikšanas robežas.
|
Testa organismi
Testa tārpu skaits
|
39.
|
Tārpu skaitam katrā paraugā ir jānodrošina tāda tārpu audu masa, lai testējamās vielas masa katrā paraugā attiecīgi uzņemšanas fāzes sākumā un eliminācijas fāzes beigās būtu ievērojami lielāka par testējamās vielas noteikšanas robežu bioloģiskā materiālā. Minētajās uzņemšanas fāzes un eliminācijas fāzes pakāpēs koncentrācija testa dzīvniekos parasti ir samērā zema (6)(8)(18). Tā kā individuālais svars daudzām ūdens mazsartārpu sugām ir ļoti mazs (Lumbriculus variegatus un Tubifex tubifex individuālais mitrais svars 5–10 mg), svēršanai un testējamās ķīmiskās vielas analīzei konkrētā replikāta testēšanas kamerā var izmantot tārpu kopējo masu. Testa sugām ar lielāku individuālo svaru (piemēram, Branchiura sowerbyi) var izmantot replikātus ar vienu īpatni, taču šādā gadījumā replikātu skaits katrā paraugu ņemšanas punktā jāpalielina līdz pieci (11). Tomēr jāpiebilst, ka starplaboratoriju salīdzinošajā testēšanā B. sowerbyi nebija iekļauti (12), tādēļ šī suga nav ieteicama kā minētajai metodei piemērotākā.
|
|
40.
|
Jāizmanto līdzīga lieluma tārpi (par L. variegatus skatīt 6. papildinājumu). Tie iegūstami no viena avota, un tiem jābūt vienas vecuma kategorijas pieaugušiem vai lieliem dzīvniekiem (sk. 6. papildinājumu). Dzīvnieka svars un vecums var būtiski ietekmēt BAF vērtības (jo piemēram, atšķiras lipīdu satura un/vai organismos ir olas); šie parametri ir rūpīgi jāreģistrē. Lai izmērītu vidējo mitro svaru un saussvaru, pirms testa uzsākšanas nosver tārpu apakšparaugu.
|
|
41.
|
Izmantojot Tubifex tubifex un Lumbriculus variegatus, testēšanas periodā sagaida vairošanos. Ja bioakumulācijas testā nenotiek vairošanās, tas jāatspoguļo un jāņem vērā, interpretējot testa rezultātus.
|
Noslogojums
|
42.
|
Lai uzņemšanas fāzē testa vielas koncentrācija sedimentos samazinātos lēnāk un lai nesamazinātos izšķīdušā skābekļa koncentrācija, jāizmanto augsta sedimentu-tārpu un ūdens-tārpu attiecība. Izraudzītajam noslogojumam jāatbilst arī izraudzīto sugu dabiski sastopamajam populācijas blīvumam (43). Piemēram, attiecībā uz Tubifex tubifex ir ieteicams noslogojums 1–4 mg tārpu audu (mitrais svars) uz vienu gramu mitru sedimentu (8)(11). Attiecībā uz L. Variegatus iesaka noslogojumu, kas ir ≤ 1 g tārpu audu saussvara uz 50 g sedimentu organiskā oglekļa (1)(6).
|
|
43.
|
Testā izmantojamos tārpus izņem no kultūras, izsijājot tās sedimentus. Dzīvniekus (pieaugušus vai lielus tārpus bez nesenas fragmentācijas pazīmēm) pārvieto uz stikla šķīvjiem (piemēram, Petri platēm) ar tīru ūdeni. Ja testēšanas apstākļi atšķiras no kultivēšanas apstākļiem, pietiek ar 24 stundu aklimatizāciju. Pirms nosvēršanas tārpus atbrīvo no liekā ūdens. To var izdarīt, tārpus saudzīgi novietojot uz iepriekš samitrinātas salvetes. Tārpu nosusināšanai nav ieteicams izmantot absorbējošu papīru, jo tas tārpiem var izraisīt stresu vai tos savainot. Brunson et al. (1998) iesaka izmantot nenosusinātus tārpus, kuru biomasa aptuveni 1,33 reizes pārsniedz vēlamo biomasu. Šie papildu 33 % atbilst starpībai starp nosusinātiem un nenosusinātiem tārpiem (28).
|
|
44.
|
Uzņemšanas fāzes sākumā (testa 0. dienā) testa organismus izņem no aklimatizācijas kameras un pēc nejaušības principa sadala pa traukiem (piemēram, pa Petri platēm), kas satur rekonstituētu ūdeni, un katrā traukā pievieno tārpus grupās pa divi, līdz katrā traukā ir desmit tārpi. Pēc tam katru no šīm tārpu grupām ar mīkstu tērauda pinceti vai kā citādi pēc nejaušības principa ievieto atsevišķos testēšanas traukos. Tad testēšanas traukus atbilstoši testēšanas nosacījumiem inkubē.
|
Barošana
|
45.
|
Ņemot vērā zemo barības vielu saturu mākslīgajos sedimentos, tajos ir jānodrošina barības vielu avots. Lai pārāk zemu nenovērtētu testējamo organismu eksponētību, kas notiek, piemēram, selektīvi izbarojot nepiesārņotu barību, barību, kas nepieciešama, lai testa organismi vairotos un augtu, sedimentiem pievieno vienreiz – pirms testējamās vielas pievienošanas vai tās laikā (sk. 5. papildinājumu).
|
Sedimentu un ūdens attiecība
|
46.
|
Ieteicamā sedimentu un ūdens attiecība ir 1:4 (45). Uzskatāms, ka šī attiecība ir piemērota, lai būtu nodrošināts pietiekams skābekļa koncentrācijas līmenis un novērsta amonjaka uzkrāšanos virsējā ūdenī. Skābekļa saturs virsējā ūdenī jāuztur ar ≥ 40 % piesātinājumu. Virsējo ūdeni testēšanas traukos viegli aerē (piemēram, 2–4 burbuļi sekundē), izmantojot Pastēra pipeti, kas novietota aptuveni 2 cm virs sedimentu virsmas, lai mazinātu sedimentu uzduļķošanu.
|
Gaisma un temperatūra
|
47.
|
Fotoperiods kultūrā un testā ir 16 stundas (1)(6). Gaismas intensitāte testa zonā jānodrošina aptuveni 500–1 000 luksu līmenī. Temperatūrai visā testēšanas laikā jābūt 20 ± 2 °C.
|
Testēšanas koncentrācijas
|
48.
|
Uzņemšanas kinētikas noteikšanai izmanto vienu testēšanas koncentrāciju (iespējami zemu), bet var izmantot arī otru (augstāku) (piemēram, (46)). Tādā gadījumā paraugus ņem un analizē stacionārā stāvoklī vai pēc 28 dienām, lai apstiprinātu BAF, kas izmērīts ar zemāko koncentrāciju (11). Augstāko koncentrāciju izraugās tādu, lai nebūtu iespējama nelabvēlīga ietekme (piemēram, izraugoties aptuveni 1 % no zemākās zināmās hroniskās ietekmes koncentrācijas ECx, kas izsecināta no attiecīgiem hroniskās toksicitātes pētījumiem). Zemākajai testēšanas koncentrācijai jābūt krietni augstākai par izmantotās analīzes metodes noteikšanas robežu sedimentos un bioloģiskajos paraugos. Ja ietekmi izraisošā testējamās vielas koncentrācija ir tuva analītiskās noteikšanas robežai, ieteicams izmantot radioaktīvi iezīmētu testa vielu ar augstu īpatnējo radioaktivitāti.
|
Apstrādes grupas un kontrolgrupas replikāti
|
49.
|
Kinētikas mērījumu vajadzībām visā uzņemšanas fāzē un visā eliminācijas fāzē katrā paraugu ņemšanas punktā no apstrādes grupas jābūt ņemtiem vismaz trim replikātiem (11). Papildu replikātus izmanto tad, ja vēl kādos datumos ņem neobligātus paraugus. Eliminācijas fāzei attiecīgā skaitā sagatavo replikātus ar nepapildinātiem sedimentiem un virsējo ūdeni, lai apstrādātos tārpus uzņemšanas fāzes beigās no īpašajiem apstrādes traukiem varētu pārvietot uz neapstrādātiem traukiem. Ar kopējo no apstrādes grupas ņemto replikātu skaitu jāpietiek gan uzņemšanas fāzei, gan eliminācijas fāzei.
|
|
50.
|
Cita iespēja ir tāda, ka eliminācijas fāzes paraugu ņemšanai paredzētos tārpus var eksponēt vienā lielā tvertnē, kas satur ar ķīmisko vielu papildinātus sedimentus no tās pašas partijas, ko izmanto uzņemšanas kinētikas noteikšanai. Ir jāpierāda, ka testēšanas apstākļi (piemēram, sedimentu dziļums, sedimentu un ūdens attiecība, noslogojums, temperatūra, ūdens kvalitāte) ir salīdzināmi ar apstākļiem uzņemšanas fāzei paredzētajos replikātos. Uzņemšanas fāzes beigās no šīs tvertnes analīzēm jāņem ūdens, sedimentu un tārpu paraugi, un no tās uzmanīgi jāizņem un eliminācijas fāzei paredzētajos replikātos pietiekamā skaitā jāievieto lieli tārpi bez nesenas fragmentācijas pazīmēm (piemēram, katrā replikāta traukā desmit organismi).
|
|
51.
|
Ja vienīgais izmantotais šķīdinātājs ir ūdens, bioloģiskajām un fona analīzēm nodrošina vismaz deviņus negatīvās kontroles replikātus (vismaz trīs paraugus, kas ņemti sākumā, trīs – uzņemšanas fāzes beigās un vēl trīs – eliminācijas fāzes beigās). Ja testējamās vielas lietošanā izmanto kādu šķīdinātāju, jāveic šķīdinātāja kontrole (vismaz trīs replicēti paraugi jāņem sākumā, trīs – uzņemšanas fāzes beigās un vēl trīs – eliminācijas fāzes beigās). Šādā gadījumā paraugu ņemšanas vajadzībām uzņemšanas fāzes beigās jānodrošina vismaz četri negatīvās kontroles replikāti (bez šķīdinātāja). Lai iegūtu informāciju par šķīdinātāja iespējamo ietekmi uz testa organismiem, šos replikātus var bioloģiski salīdzināt ar šķīdinātāja kontroles trauku. Papildu informācija ir sniegta 3. papildinājumā.
|
Ūdens kvalitātes mērīšanas biežums
|
52.
|
Uzņemšanas fāzē un eliminācijas fāzē virsējam ūdenim ir jāmēra vismaz šādi ūdens kvalitātes parametri.
|
Temperatūra
|
katrā paraugu ņemšanas datumā vienā traukā katram apstrādes līmenim un vienreiz nedēļā, kā arī uzņemšanas fāzes un eliminācijas fāzes sākumā un beigās vienā kontroles traukā; var arī piemēram, nepārtraukti vai ar stundu ilgiem starplaikiem reģistrēt temperatūru apkārtējā vidē (apkārtējā gaisā vai ūdens peldē) vai vienā reprezentatīvā testēšanas traukā;
|
|
Izšķīdušā skābekļa saturs
|
katrā paraugu ņemšanas datumā vienā traukā katram apstrādes līmenim un vienā kontroles traukā; izsaka mg/L un % ASV (gaisa piesātinājuma vērtība);
|
|
Gaisa padeve
|
kontrolē vismaz vienreiz dienā (darba dienās) un noregulē pēc vajadzības;
|
|
pH
|
katrā paraugu ņemšanas datumā vienā apstrādes traukā katram apstrādes līmenim un vienreiz nedēļā, kā arī uzņemšanas fāzes un eliminācijas fāzes sākumā un beigās vienā kontroles traukā;
|
|
Kopējā ūdens cietība
|
vismaz vienā apstrādes traukā un vienā kontroles testa traukā uzņemšanas fāzes un eliminācijas fāzes sākumā un beigās, izsaka mg/l CaCO3;
|
|
Kopējais amonjaka saturs
|
vismaz vienā apstrādes traukā un vienā kontroles testa traukā uzņemšanas fāzes un eliminācijas fāzes sākumā un beigās, izsaka mg/l NH4
+ vai NH3, vai kā kopējo amonjaka slāpekli.
|
|
Tārpu, sedimentu un ūdens paraugu ņemšana un analīze
Paraugu ņemšanas grafiks
|
53.
|
Paraugu ņemšanas grafiku piemēri 28 dienu uzņemšanas fāzei un 10 dienu eliminācijas fāzei ir sniegti 3. papildinājumā.
|
|
54.
|
Ūdens un sedimentu paraugus no testēšanas kamerām ņem, lai noteiktu testējamās vielas koncentrāciju pirms tārpu ielaišanas, kā arī uzņemšanas fāzes un eliminācijas fāzes laikā. Testa laikā nosaka testējamās vielas koncentrācijas tārpos, sedimentos un ūdenī, lai novērotu testējamās vielas izkliedēšanos dažādos testēšanas sistēmas segmentos.
|
|
55.
|
Tārpu, sedimentu un ūdens paraugus uzņemšanas fāzē, kā arī eliminācijas fāzē ņem vismaz sešas reizes.
|
|
56.
|
Paraugu ņemšanu turpina, līdz iestājies plato (stacionārs stāvoklis) (skatīt 1. papildinājumu), vai 28 dienas. Ja 28 dienu laikā plato neiestājas, sāk eliminācijas fāzi. Uzsākot eliminācijas fāzi, izraudzītos tārpus pārvieto uz replikātu kamerām, kurās ir neapstrādāti sedimenti un ūdens (skatīt arī 17. un 18. punktu).
|
Paraugu ņemšana un paraugu sagatavošana
|
57.
|
Iegūst ūdens paraugus, izlejot, iztecinot vai ar pipeti ņemot tilpumu, ar ko pietiek testējamās vielas daudzuma izmērīšanai paraugā.
|
|
58.
|
Testēšanas kamerās atlikušo virsējo ūdeni uzmanīgi izlej vai iztecina. Sedimentu paraugi jāņem uzmanīgi, lai tārpus iespējami maz traucētu.
|
|
59.
|
Paraugu ņemšanas laikā no testa replikāta izņem visus tārpus, piemēram, sedimentus suspendējot virsējā ūdenī un katra replikāta saturu izkliedējot uz seklas paplātes, bet tārpus ņemot ar mīksta tērauda pinceti. Tos seklā stikla vai tērauda paplātē ātri noskalo ar ūdeni. Lieko ūdeni notecina. Tārpus uzmanīgi pārvieto iepriekš nosvērtā traukā un tos nosver. Tārpus nonāvē sasaldējot (piemēram, ≤ – 18 °C temperatūrā). Reģistrē kokonu un/vai jauno īpatņu esamību un skaitu.
|
|
60.
|
Uzreiz pēc paraugu ņemšanas tārpi ir bez zarnu attīrīšanās posma jānosver un jānonāvē, lai iegūtu piesardzīgi aplēstu BAF, kurā ierēķināts piesārņoto zarnu saturs, un lai kādā periodā, kad notiek zarnu attīrīšanās tikai ūdenī (8), nezustu ķermenī esošas atliekas. Paredzams, ka jebkurā periodā, kurā notiek zarnu attīrīšanās tikai ūdenī, netiks būtiski eliminētas vielas, kam log Kow pārsniedz pieci, bet vielas, kam log Kow zemāks par četri, var zust diezgan būtiski (47).
|
|
61.
|
Eliminācijas fāzē tārpiem attīrās zarnas tīros sedimentos. Tas nozīmē, ka mērījumi, kas veikti tieši pirms eliminācijas fāzes, aptver piesārņotos zarnu sedimentus, bet pieņem, ka pēc pirmajām 4–24 eliminācijas fāzes stundām lielāko daļu piesārņotā zarnu satura ir nomainījuši tīri sedimenti (11)(47). Tad var uzskatīt, ka šajā tārpu paraugā vielas koncentrācija ir tāda pati kā koncentrācija audos pēc zarnu attīrīšanās. Lai eliminācijas fāzē ņemtu vērā testējamās vielas koncentrācijas atšķaidīšanos ar nepiesārņotiem sedimentiem, var aplēst zarnu satura svaru pēc tārpu mitrā svara/tārpu pelnu svara vai tārpu saussvara/tārpu pelnu svara attiecības.
|
|
62.
|
Ja konkrētā pētījuma mērķis ir izmērīt biopieejamību un patiesās audos esošās atliekas testa organismos, tad vismaz apstrādāto dzīvnieku apakšparaugs (piemēram, no trim papildu replikātu traukiem) jānosver, ieteicams, paraugus ņemot tad, kad iestājies stacionārs stāvoklis, tīrā ūdenī sešas stundas (47) attīrot un vēlreiz nosverot pirms analīzes. Pēc tam datus par tārpu svaru un koncentrāciju ķermenī šajā apakšparaugā var salīdzināt ar vērtībām, kas iegūtas no neattīrītiem tārpiem. Lai dzīvniekiem iespējami neradītu papildu stresu, eliminācijas mērījumiem paredzētie tārpi nebūtu jāattīra, pirms tie nav pārvietoti tīros sedimentos.
|
|
63.
|
Lai novērstu noārdīšanos vai citus zudumus un lai turpmākajā testa gaitā varētu aprēķināt aptuveno uzņemšanas ātrumu un eliminācijas ātrumu, ūdens, sedimentu un tārpu paraugus vislabāk analizēt uzreiz pēc izņemšanas (t. i., 1–2 dienu laikā). Tūlītēja analīze arī palīdz bez kavēšanās noteikt līknes plato sasniegšanu.
|
|
64.
|
Ja analīzi neveic uzreiz, paraugi jāglabā piemērotos apstākļos. Informāciju par konkrētās testējamās vielas stabilitāti un pareizajiem glabāšanas apstākļiem (piemēram, par glabāšanas ilgumu un temperatūru, ekstrakcijas procedūrām utt.) iegūst pirms pētījuma uzsākšanas. Ja šāda informācija nav pieejama un to uzskata par nepieciešamu, glabāšanas stabilitātes noteikšanai paralēli var izmantot ar testa vielu papildinātus kontroles audus.
|
Analīzes metodes kvalitāte
|
65.
|
Tā kā visu procedūru būtībā nosaka testējamajai vielai izmantotās analīzes metodes pareizība, precizitāte un jutība, eksperimentāli pārbauda, vai ar konkrēto metodi apmierinoša ir ķīmiskās analīzes precizitāte un reproducējamība, kā arī testējamās vielas atgūstamība ūdens, sedimentu un tārpu paraugos. Pārbauda arī, vai kontrolkamerās testējamā viela nav konstatējama koncentrācijās, kas pārsniedz fonu. Ja nepieciešams, koriģē Cw, Cs un Ca vērtības attiecībā uz atgūstamību un attiecībā uz fona vērtībām, kas iegūtas ar kontrolgrupu. Testa laikā ar visiem paraugiem rīkojas tā, lai līdz minimumam samazinātu piesārņojumu un zudumus (piemēram, tos, kas rodas, testējamajai vielai adsorbējoties uz paraugu ņemšanas ierīces).
|
|
66.
|
Testējamās vielas kopējo atgūstamību un atgūstamību tārpos, sedimentos, ūdenī un, ja tādas izmanto, arī lamatās, kas satur absorbentus, kuri aiztur iztvaikojošo testējamo vielu, reģistrē un atspoguļo pārskatā.
|
|
67.
|
Tā kā ieteicams izmantot radioaktīvi iezīmētas vielas, ir iespējams analizēt kopējo radioaktivitāti (t. i., pamatvielai un noārdīšanās produktiem). Tomēr, ja analītiski ir iespējama pamatvielas un noārdīšanās produktu kvantitatīva izteikšana stacionārā stāvoklī vai uzņemšanas fāzes beigās, tā var sniegt nozīmīgu informāciju. Ja tiek plānots veikt šādus mērījumus, ar paraugiem veic attiecīgas ekstrakcijas procedūras, lai pamatvielu varētu kvantitatīvi izteikt atsevišķi. Ja kādam no konstatētajiem noārdīšanās produktiem ir būtisks īpatsvars (piemēram, > 10 %) radioaktivitātē, kas testa organismiem izmērīta stacionārā stāvoklī vai uzņemšanas fāzes beigās, šos noārdīšanās produktus ir vēlams norādīt (5).
|
|
68.
|
Tā kā individuālā biomasa ir maza, testējamās vielas koncentrāciju katrā atsevišķajā tārpā bieži vien nav iespējams noteikt, ja vien par testa sugu neizmanto Branchiura sowerbyi (40–50 mg mitrā svara vienam tārpam) (11). Tādēļ no viena testēšanas trauka ņemtus īpatņus drīkst apstrādāt kopā, taču tas ierobežo statistiskās procedūras, ko var piemērot datiem. Ja ir būtiski izmantot konkrētu statistisku procedūru un svarīga ir statistiskā jauda, testā iekļauj tik daudz testa dzīvnieku un/vai replikāta testēšanas kameru, lai vēlamajai apkopošanai, procedūrai un statistiskajai jaudai ar to pietiktu.
|
|
69.
|
Ieteicams BAF izteikt gan kā funkciju no kopējā mitrā svara, gan no kopējā saussvara un, ja nepieciešams (piemēram, izteikti lipofīlām vielām), kā funkciju no sedimentu lipīdu satura un TOC. Lipīdu satura noteikšanai jāizmanto piemērotas metodes (48)(49). Par standartmetodi (48) var ieteikt hloroforma/metanola ekstrakcijas metodi (50). Tomēr, lai izvairītos no hloru saturošu šķīdinātāju lietošanas, var izmantot starplaboratoriju salīdzinošajā testēšanā pārbaudītu Bligh&Dyer metodes modifikāciju (50), kā aprakstīts (51). Tā kā ar dažādajām metodēm nav iegūstamas identiskas vērtības (48), svarīgi ir detalizēti aprakstīt izmantoto metodi. Kad iespējams, t. i., ja ir pieejams pietiekami daudz tārpu audu, lipīdu saturu mēra tam pašam paraugam vai ekstraktam, ko izmanto testējamās vielas analīzei, jo pirms parauga hromatogrāfiskas analīzes (5) tas nereti jāattīra no lipīdiem. Tomēr, lai izmērītu lipīdu saturu, piemēram, trijos paraugos, praksē ir izdevīgāk vismaz uzņemšanas fāzes sākumā vai – vislabāk – beigās izmantot aklimatizētus kontrolgrupas dzīvniekus.
|
DATI UN PĀRSKATA SAGATAVOŠANA
Rezultātu apstrāde
|
70.
|
Testējamās vielas uzņemšanas līkni iegūst, aritmētiskā skalā testējamās vielas koncentrāciju tārpos vai uz tiem uzņemšanas fāzē atliekot pret laiku. Ja līkne ir sasniegusi plato, aprēķina stacionārā stāvokļa BAF
ss:

|
|
71.
|
Nosaka kinētisko bioakumulācijas koeficientu (BAFK) kā attiecību ks/ke. Eliminācijas konstanti (ke) parasti nosaka pēc eliminācijas līknes (t. i., grafiski parādot testējamās vielas koncentrācijas tārpos eliminācijas fāzes laikā). Pēc tam, pamatojoties uz uzņemšanas līknes kinētiku, aprēķina uzņemšanas ātruma konstanti ks. Labākā metode BAFK un ks un ke ātrumu konstanšu iegūšanai ir ar datoru, izmantojot nelineārās parametriskās aplēšanas metodes (skatīt 2. papildinājumu). Ja eliminācija acīmredzami nav pirmās kārtas process, jāizmanto sarežģītāki modeļi (25)(27)(52).
|
|
72.
|
Biotas-sedimentu akumulācijas koeficientu (BSAF) nosaka, normalizējot BAFK attiecībā uz lipīdu saturu tārpos un sedimentu kopējo organiskā oglekļa saturu.
|
Rezultātu interpretācija
|
73.
|
Ja izmērītās testējamās vielas koncentrācijas ir tuvas izmantotajai analīzes metodei piemītošajai noteikšanas robežai, rezultāti jāinterpretē piesardzīgi.
|
|
74.
|
Skaidri definētas uzņemšanas un eliminācijas līknes liecina par kvalitatīviem bioakumulācijas datiem. Kopumā BAF vērtību ticamības robežām labi izplānotos pētījumos nevajadzētu pārsniegt 25 % (5).
|
Testēšanas pārskats
|
75.
|
Testēšanas pārskatā jābūt šādai informācijai.
|
|
Testējamā viela:
|
—
|
fizikālais raksturs un fizikālķīmiskās īpašības, piemēram, log Kow, šķīdība ūdenī;
|
|
—
|
ķīmiskās identifikācijas dati; testējamās vielas avots, jebkura izmantotā šķīdinātāja identitāte un koncentrācija;
|
|
—
|
ja vielu radioaktīvi iezīmē, precīza iezīmēto atomu vieta, īpatnējā radioaktivitāte un ar piemaisījumiem saistītā radioaktivitātes procentuālā daļa.
|
|
|
|
Testa sugas:
|
—
|
zinātniskais nosaukums, līnija, avots, jebkāda priekšapstrāde, aklimatizācija, vecums, izmēru diapazons utt.
|
|
|
|
Testēšanas nosacījumi:
|
—
|
izmantotā testēšanas procedūra (piemēram, statiska, pusstatiska vai ar caurplūdi);
|
|
—
|
izmantotā apgaismojuma veids un rādītāji, kā arī fotoperiods(-i);
|
|
—
|
testēšanas plāns (piemēram, testēšanas kameru skaits, materiāls un izmērs, ūdens tilpums, sedimentu masa un tilpums, ūdens tilpuma nomaiņas ātrums (caurplūdē vai pusstatiskās procedūrās), jebkāda aerēšana pirms testa un tā laikā, replikātu skaits, tārpu skaits katrā replikātā, testēšanas koncentrāciju skaits, uzņemšanas fāzes un eliminācijas fāzes ilgums, paraugu ņemšanas biežums);
|
|
—
|
testējamās vielas sagatavošanas un pievienošanas metode, kā arī konkrētās metodes izraudzīšanās pamatojums;
|
|
—
|
nominālās testēšanas koncentrācijas;
|
|
—
|
mākslīgā ūdens un sedimentu sastāvdaļu avots vai – ja izmanto dabisku vidi – ūdens un sedimentu izcelsme, jebkādas priekšapstrādes apraksts, jebkādi pierādījumi par testa dzīvnieku spēju dzīvot un/vai vairoties izmantotajā vidē, sedimentu īpašības (poru ūdens pH un amonjaka saturs (dabiskajos sedimentos), organiskā oglekļa saturs (TOC), daļiņu sadalījums pēc lieluma (smilšu, dūņu un mālu procents), procentuālais ūdens saturs un jebkuri citi veiktie mērījumi) un ūdens īpašības (pH, cietība, vadītspēja, temperatūra, izšķīdušā skābekļa koncentrācija, atlikušā hlora līmeņi (ja ir mērīti) un jebkuri citi veiktie mērījumi);
|
|
—
|
nominālais un izmērītais mākslīgo sedimentu saussvars procentos no mitrā svara (vai saussvara attiecība pret mitro svaru); attiecībā uz dabā iegūtiem sedimentiem izmērītais sedimentu saussvars procentos no mitrā svara (vai saussvara attiecība pret mitro svaru);
|
|
—
|
ūdens kvalitāte testēšanas kamerās, kuru raksturo temperatūra, pH, amonjaka saturs, kopējā cietība un izšķīdušā skābekļa koncentrācija;
|
|
—
|
detalizēta informācija par ūdens, sedimentu un tārpu paraugu apstrādi, arī par pagatavošanas, glabāšanas un papildināšanas procedūrām, ekstrakciju un analīzes procedūrām (un precizitāti) attiecībā uz testējamo vielu un lipīdu saturu, kā arī testējamās vielas atgūstamību.
|
|
|
|
Rezultāti:
|
—
|
kontrolgrupas tārpu mirstība un tārpu mirstība katrā testēšanas kamerā un jebkāda novērota subletāla ietekme, arī anomāla izturēšanās (piemēram, vairīšanās no sedimentiem, ir vai nav fekālās granulas un nevairošanās);
|
|
—
|
izmērītais sedimentu un testa organismu saussvars procentos no mitrā svara (vai saussvara attiecība pret mitro svaru) (noder normalizācijai);
|
|
—
|
līknes, kas attēlo testējamās vielas uzņemšanas un eliminācijas kinētiku tārpos un laiku, kurš vajadzīgs, lai iestātos stacionārs stāvoklis;
|
|
—
|
Ca, Cs un Cw (attiecīgā gadījumā ar standartnovirzi un diapazonu) visiem paraugu ņemšanas laikiem (Ca izteikts g kg– 1 visa ķermeņa mitrā svara un saussvara, Cs izteikts g kg– 1 sedimentu mitrā svara un saussvara un Cw izteikts mg l– 1). Ja nepieciešams biotas-sedimentu akumulācijas koeficients (BSAF; skatīt definīciju 1. papildinājumā) (piemēram, lai salīdzinātu rezultātus, kas iegūti divos vai vairākos testos ar dzīvniekiem, kuriem lipīdu saturs atšķiras), Ca ir papildus jāizsaka kā organisma lipīdu saturs g kg– 1 un Cs jāizsaka kā sedimentu organiskais ogleklis (OC) g kg– 1;
|
|
—
|
BAF (izteikts kā kg mitro sedimentu kg– 1 mitru tārpu), no sedimentiem notiekošās uzņemšanas ātruma konstante ks (izteikta g mitro sedimentu kg– 1 mitru tārpu d– 1) un eliminācijas ātruma konstante ke (izteikta kā d– 1); atsevišķi var norādīt BSAF (izteikts kā kg sedimentu OC kg– 1 lipīdu satura tārpos);
|
|
—
|
neeliminētās atliekas (NER) eliminācijas fāzes beigās;
|
|
—
|
ja tiek mērīti – testa dzīvnieku organismos konstatētais pamatvielas, noārdīšanās produktu un saistīto atlieku procentuālais īpatsvars (t. i., tās testējamās vielas procents, ko nevar ekstrahēt ar parastajām ekstrakcijas metodēm);
|
|
—
|
datu statistiskajā analīzē izmantotās metodes.
|
|
|
|
Rezultātu izvērtējums:
|
—
|
rezultātu atbilstība 21. punktā norādītajiem derīguma kritērijiem;
|
|
—
|
negaidīti vai netipiski rezultāti, piemēram, nepilnīga testējamās vielas eliminācija no testa dzīvnieku organisma; šādos gadījumos noderīgu informāciju var sniegt jebkura priekšpētījuma rezultāti.
|
|
|
1. papildinājums
Definīcijas un mērvienības
|
|
Mākslīgie sedimenti jeb pagatavotie, rekonstituētie vai sintētiskie sedimenti ir materiālu maisījums, kurā ir atdarinātas dabisko sedimentu fizikālās sastāvdaļas.
|
|
|
Bioakumulācija ir testējamās vielas koncentrācijas pieaugums organismā vai uz tā salīdzinājumā ar testējamās vielas koncentrāciju apkārtējā vidē. Bioakumulācija rodas gan biokoncentrēšanās, gan biopalielināšanās procesā (skatīt turpmāk).
|
|
|
Bioakumulācijas koeficients (BAF) šā bioakumulācijas testa uzņemšanas fāzes jebkurā brīdī ir testējamās vielas koncentrācija testa organismā vai uz tā (C
a, izteikts g kg– 1 mitrā svara vai saussvara), kas dalīta ar vielas koncentrāciju apkārtējā vidē (C
s, izteikts g kg– 1 sedimentu mitrā svara vai saussvara). Lai varētu izmantot C
a un C
s mērvienības, BAF mērvienības ir kg sedimentu kg– 1 tārpu (15).
|
|
|
Bioakumulācijas koeficientus, kuri tieši aprēķināti no attiecības, ko iegūst, no sedimentiem notiekošās uzņemšanas ātruma konstanti dalot ar eliminācijas ātruma konstantēm (attiecīgi ks un ke – skatīt turpmāk), dēvē par kinētisko bioakumulācijas koeficientu (BAF
K).
|
|
|
Biokoncentrēšanās ir tikai caur ķermeņa virsmu notiekošas uzņemšanas radīts testējamās vielas koncentrācijas pieaugums organismā vai uz tā salīdzinājumā ar testējamās vielas koncentrāciju apkārtējā vidē.
|
|
|
Biopalielināšanās ir galvenokārt ar piesārņotas barības vai medījuma starpniecību notiekošas uzņemšanas radīts testējamās vielas koncentrācijas pieaugums organismā vai uz tā salīdzinājumā ar testējamās vielas koncentrāciju barībā vai medījumā. Biopalielināšanās var izraisīt testējamās vielas pārnesi pa barošanās tīklu vai akumulāciju tajā.
|
|
|
Biotas-sedimentu akumulācijas koeficients
(BSAF) ir attiecībā uz lipīdiem normalizēta testējamās vielas stacionārā stāvokļa koncentrācija testa organismā vai uz tā, kas dalīta ar attiecībā uz organisko oglekli normalizētu testējamās vielas stacionārā stāvokļa koncentrāciju sedimentos. Tātad Ca izsaka ar g kg– 1 organisma lipīdu satura un Cs – ar g kg– 1 sedimentu organiskā satura.
|
|
|
Nogatavināšanas periodu izmanto, lai stabilizētu sedimentu mikrobiālo komponenti un atbrīvotos, piemēram, no amonjaka, kas rodas no sedimentu sastāvdaļām; tas notiek pirms sedimentu papildināšanas ar testējamo vielu. Parasti pēc nogatavināšanas virsējo ūdeni nolej.
|
|
|
Testējamās vielas eliminācija ir tāda šīs vielas izzušana no testa organisma audiem ar aktīvu vai pasīvu procesu starpniecību, kas notiek neatkarīgi no tā, vai apkārtējā vidē testējamā viela ir vai nav.
|
|
|
Eliminācijas fāze ir tas laiks pēc testa organismu pārvietošanas no piesārņotas vides uz vidi bez testējamās vielas, kurā pēta šīs vielas elimināciju (jeb neto zudumu) no testa organismiem.
|
|
|
Eliminācijas ātruma konstante (ke) ir skaitliska vērtība, kas raksturo, cik strauji pēc tam, kad testa organismi no testējamo vielu saturošas vides pārvietoti uz vidi bez ķīmiskiem piemaisījumiem, samazinās šīs vielas koncentrācija testa organismā vai uz tā; ke izsaka ar d– 1.
|
|
|
Līdzsvarošanās periodu izmanto, lai testējamajai vielai ļautu sadalīties starp cieto fāzi, poru ūdeni un virsējo ūdeni; tas notiek pēc sedimentu papildināšanas ar testējamo vielu un pirms testa organismu pievienošanas.
|
|
|
Oktanola un ūdens sadalīšanās koeficients (Kow) ir vielas šķīdības n-oktanolā un ūdenī attiecība līdzsvara stāvoklī, ko dažreiz izsaka arī kā Pow . Kow logaritmu (log Kow) izmanto par rādītāju vielas bioakumulācijas potenciālam ūdens organismos.
|
|
|
Organiskā oglekļa un ūdens sadalīšanās koeficients (Koc) ir attiecība starp vielas koncentrāciju sedimentu organiskā oglekļa frakcijā vai uz tās un šīs vielas koncentrāciju ūdenī līdzsvara stāvoklī.
|
|
|
Virsējais ūdens ir ūdens, ar ko testēšanas traukā nosegti sedimenti.
|
|
|
Plato jeb stacionārs stāvoklis ir līdzsvars starp uzņemšanas procesu un eliminācijas procesu, kuri vienlaicīgi notiek ekspozīcijas fāzē. BAF grafiskajā attēlojumā katrā paraugu ņemšanas periodā stacionārs stāvoklis pret laiku ir sasniegts tad, kad līkne kļūst paralēla laika asij un trim pēc kārtas veiktām BAF analīzēm ar paraugiem, kas ņemti ar vismaz divu dienu starplaikiem, savstarpējā sakritība ir 20 % robežās, kā arī starp trim paraugu ņemšanas periodiem nav statistiski būtisku atšķirību. Testējamām vielām, ko uzņem lēni, piemērotāki būtu septiņu dienu starplaiki (5).
|
|
|
Poru ūdens jeb starpūdens ir ūdens, kas aizņem telpu starp sedimentu vai augsnes daļiņām.
|
|
|
No sedimentiem notiekošās uzņemšanas ātruma konstante (ks) ir skaitliska vērtība, kas raksturo, cik strauji pieaug testējamās vielas koncentrācija testa organismā vai uz tā, notiekot uzņemšanai no sedimentu fāzes. ks izsaka ar g sedimentu kg– 1 no tārpu d– 1.
|
|
|
Papildināti sedimenti ir sedimenti, kam pievienota testējamā viela.
|
|
|
Stacionāra stāvokļa bioakumulācijas koeficients (BAFss) ir BAF stacionārā stāvoklī un ilgākā laikā būtiski nemainās, šajā laikā nemainoties arī testējamās vielas koncentrācijai apkārtējā vidē (Cs kā g kg– 1 sedimentu mitrā svara vai saussvara).
|
|
|
Uzņemšanas fāze jeb ekspozīcijas fāze ir laiks, kurā testa organismi ir eksponēti testējamai vielai.
|
2. papildinājums
Uzņemšanas un eliminācijas parametru aprēķināšana
Bioakumulācijas testa galvenais beigupunkts ir bioakumulācijas koeficients BAF. Izmērīto BAF var aprēķināt, stacionārā stāvokļa testējamās vielas koncentrāciju testa organismā Ca dalot ar attiecīgo testējamās vielas koncentrāciju sedimentos Cs. Ja uzņemšanas fāzē stacionārais stāvoklis nav sasniegts, BAF tādā pašā veidā aprēķina attiecībā uz 28. dienu. Tomēr ir jānorāda, vai BAF pamatā ir vai nav koncentrācijas stacionārā stāvoklī.
Piemērotākais veids, kā iegūt kinētisko bioakumulācijas koeficientu (BAFK
), sedimentu uzņemšanas ātruma konstanti (ks) un eliminācijas ātruma konstanti (ke), ir ar datoru, izmantojot nelineārās parametriskās aplēšanas metodes. Ņemot vērā pēc tārpu un sedimentu mitrā svara rēķināto vidējo akumulācijas koeficientu dinamisko rindu (Ca, katra paraugu ņemšanas datuma vidējās vērtības/Cs katra paraugu ņemšanas datuma vidējās vērtības = AF) uzņemšanas fāzē un paraugvienādojumu
|
AF(t) = BAF × (1 – eke × t)
|
[1. vienādojums]
|
kur AF(t) ir testējamās vielas koncentrācijas tārpos attiecība pret tās koncentrāciju sedimentos jebkurā konkrētā uzņemšanas fāzes laika punktā (t), šīs datorprogrammas aprēķina vērtības BAFK, ks un ke.
Ja uzņemšanas fāzē tiek sasniegts stacionārs stāvoklis (t. i., t = ∞), 1. vienādojumu var reducēt uz:
|
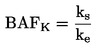
|
[2. vienādojums]
|
kur
|
ks
|
=
|
uzņemšanas ātruma konstante audos [g sedimentu kg– 1 tārpu d–1];
|
|
ke
|
=
|
eliminācijas ātruma konstante [d– 1].
|
Tādā gadījumā ks/ke × Cs ir metode, kā noteikt testējamās vielas koncentrāciju tārpu audos stacionārā stāvoklī (Ca,ss).
Biotas-sedimentu akumulācijas koeficientu (BSAF) aprēķina šādi:
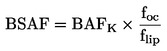
kur foc ir sedimentu organiskā oglekļa frakcija un flip ir lipīdu frakcija tārpos, abi vai nu uz saussvara, vai mitrā svara bāzes.
Pamatojoties uz koncentrācijas vērtību dinamisko rindu, var modelēt eliminācijas kinētiku, izmantojot turpmāk minētos paraugvienādojumus un datora aprēķinus ar nelineāro parametru aplēšanas metodi.
Par noklusējuma sākumpunktu ieteicams izmantot uzņemšanas fāzes beigās izmērītās vidējās atliekas ķermenī. Ja, piemēram, izmērītā vērtība būtiski atšķiras no ķermenim modelētās atlieku vērtības, jālieto tikai no uzņemšanas fāzes modelētās/aplēstās vērtības. Skatīt arī 50. punktu attiecībā uz eliminācijai paredzēto tārpu pirmsekspozīcijas alternatīvu; šajā pieejā tiek uzskatīts, ka no paraugiem ar minētajiem provizoriski eksponētajiem tārpiem eliminācijas fāzes 0. dienā iegūstamas reālistiskas ķermenī konstatējamo atlieku vērtības, ar kurām var uzsākt eliminācijas kinētikas aprēķinus.
Ja attiecībā pret laiku grafikā atliktie datu punkti liecina, ka testējamās vielas koncentrācija dzīvnieku organismā nepārtraukti eksponenciāli samazinās, eliminācijas norisi laikā var aprakstīt, izmantojot viena segmenta modeli (4. vienādojums).
|
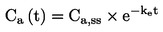
|
[3. vienādojums]
|
Izrādās, ka eliminācijas procesi dažkārt ir divfāzu procesi, kur sākumposmos novēro Ca strauju samazināšanos, kas mainās uz testējamās vielas lēnāku zudumu eliminācijas vēlākās fāzēs (8)(19)(25). Abas fāzes var interpretēt ar pieņēmumu, ka organismā ir divi atšķirīgi segmenti, no kuriem testējamā viela izzūd atšķirīgā ātrumā. Šādos gadījumos ir jāpētī nozares literatūra (15)(16)(17)(25).
Divsegmentu elimināciju apraksta, piemēram, šāds vienādojums (25):
|
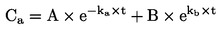
|
[4. vienādojums]
|
A un B raksturo šo segmentu lielumu (procentos no kopējām atliekām audos), kur A ir segments ar straujiem vielas zudumiem, bet B ir segments, no kura testējamā viela izzūd lēni. A un B summa ir vienāda ar 100 % visa dzīvnieka segmentu tilpuma stacionārā stāvoklī. ka un kb ir attiecīgās eliminācijas konstantes [d– 1]. Pielāgojot divsegmentu modeli attīrīšanās datiem, uzņemšanas ātruma konstanti ks var noteikt šādi (53)(54):
|

|
[5. vienādojums]
|
Tomēr šie paraugvienādojumi ir jāizmanto piesardzīgi, jo īpaši gadījumos, kur testa laikā mainās testējamās vielas biopieejamība (42).
Kā alternatīvu iepriekš minētajiem paraugvienādojumiem kinētikas parametrus (ks un ke) var aprēķināt arī kopā, piemērojot pirmās kārtas kinētikas modeli kopā visiem datiem gan no uzņemšanas fāzes, gan eliminācijas fāzes. Attiecībā uz metodi, ar kuru būtu iespējams šādi kombinēti aprēķināt uzņemšanas ātruma un eliminācijas ātruma konstantes, var iepazīties ar literatūras avotiem (55)(56)(57).
Neeliminētās atliekas (NER) aprēķina kā sekundāru parametru, reizinot ar 100 attiecību starp vidējo vielas koncentrāciju tārpos (Ca) eliminācijas fāzes 10. dienā un vidējo koncentrāciju tārpos (Ca) stacionārā stāvoklī (uzņemšanas fāzes 28. dienā):

3. papildinājums
Paraugu ņemšanas grafika paraugs 28 dienu bioakumulācijas testam
a) Uzņemšanas fāze (arī četras dienas ilgs līdzsvarošanās posms)
|
Diena
|
Darbība
|
|
-6
|
Kūdras suspensijas pagatavošana sedimentiem; šīs suspensijas nogatavināšana 48 stundas.
|
|
-4
|
Sedimentu vai sedimentu frakcijas papildināšana ar testējamo vielu; visu sedimentu sastāvdaļu samaisīšana; apstrādāto sedimentu paraugu un šķīdinātāja kontrolgrupas sedimentu paraugu izņemšana testējamo vielu koncentrācijas noteikšanai; virsējā ūdens pievienošana; inkubācija testēšanas apstākļos (līdzsvarošanās posms).
|
|
-3/-2
|
Testa organismu atdalīšana no kultūras aklimatizācijas nolūkā.
|
|
0
|
Ūdens kvalitātes mērīšana (sk. 52. punktu); replikātu izņemšana nolūkā ņemt ūdens un sedimentu paraugus testējamās vielas koncentrācijas noteikšanai; tārpu sadalīšana pa testēšanas kamerām pēc nejaušības principa; pietiekamu tārpu apakšparaugu saglabāšana analītisko fona vērtību noteikšanai; gaisa padeves kontrolēšana slēgta tipa testēšanas sistēmu lietošanas gadījumā.
|
|
1
|
Replikātu izņemšana paraugu ņemšanai; gaisa padeves, tārpu izturēšanās un ūdens kvalitātes kontrolēšana (sk. 56. punktu); ūdens, sedimentu un tārpu paraugu ņemšana testējamās vielas koncentrācijas noteikšanai.
|
|
2
|
Gaisa padeves, tārpu izturēšanās un temperatūras kontrole.
|
|
3
|
Tāpat kā 1. dienā.
|
|
4 – 6
|
Tāpat kā 2. dienā.
|
|
7
|
Tāpat kā 1. dienā; ūdens papildināšana iztvaikojušā vietā, ja nepieciešams.
|
|
8 – 13
|
Tāpat kā 2. dienā.
|
|
14
|
Tāpat kā 1. dienā; ūdens papildināšana iztvaikojušā vietā, ja nepieciešams.
|
|
15 – 20
|
Tāpat kā 2. dienā.
|
|
21
|
Tāpat kā 1. dienā; ūdens papildināšana iztvaikojušā vietā, ja nepieciešams.
|
|
22 – 27
|
Tāpat kā 2. dienā.
|
|
28
|
Tāpat kā 1. dienā; ūdens kvalitātes mērīšana (skatīt 52. punktu); uzņemšanas fāzes beigas; pietiekami lielu tārpu paraugu daļu saglabāšana analītisko fona vērtību noteikšanai; mitrais svars un saussvars un lipīdu saturs; tārpu pārvietošana no atlikušajiem eksponētajiem replikātiem uz tīrus sedimentus saturošiem traukiem eliminācijas fāzes vajadzībām (bez zarnu attīrīšanas); ūdens, sedimentu un tārpu paraugu ņemšana no šķīdinātāja kontroles traukiem; šķīduma paraugu ņemšana no lamatām, ja tādas ir uzstādītas.
|
|
|
Pirmsekspozīcijas darbības (līdzsvarošanās posms) jāplāno, ņemot vērā testējamās vielas īpašības. Ja nepieciešams, pagatavoto sedimentu nogatavināšana zem virsējā ūdens 20 ± 2 °C temperatūrā septiņas dienas; šādā gadījumā sediments jāsagatavo laikus!
|
|
|
Otrajā dienā paredzētās darbības ir jāveic katru dienu (vismaz darbdienās).
|
b) Eliminācijas fāze
|
Diena
|
Darbība
|
|
-6
|
Kūdras suspensijas pagatavošana sedimentiem; šīs suspensijas nogatavināšana 48 stundas.
|
|
-4
|
Visu sedimentu sastāvdaļu samaisīšana; apstrādāto sedimentu paraugu un šķīdinātāja kontrolgrupas sedimentu paraugu izņemšana testējamo vielu koncentrācijas noteikšanai; virsējā ūdens pievienošana; inkubācija testēšanas apstākļos.
|
|
0 (uzņemšanas fāzes 28. diena)
|
Ūdens kvalitātes mērīšana (sk. 52. punktu); tārpu pārvietošana no atlikušajiem eksponētajiem replikātiem uz traukiem, kas satur tīrus sedimentus; pēc 4 – 6 stundām replikātu izņemšana nolūkā ņemt ūdens, sedimentu un tārpu paraugus testējamās vielas koncentrācijas noteikšanai; tārpu sadalīšana pa testēšanas kamerām pēc nejaušības principa.
|
|
1
|
Replikātu izņemšana paraugu ņemšanai; gaisa padeves, tārpu izturēšanās un ūdens kvalitātes kontrole (sk. 52. punktu); ūdens, sedimentu un tārpu paraugu ņemšana testa vielas koncentrācijas noteikšanai.
|
|
2
|
Gaisa padeves, tārpu izturēšanās un temperatūras kontrolēšana.
|
|
3
|
Tāpat kā 1. dienā.
|
|
4
|
Tāpat kā 2. dienā.
|
|
5
|
Tāpat kā 1. dienā.
|
|
6
|
Tāpat kā 2. dienā.
|
|
7
|
Tāpat kā 1. dienā; ūdens papildināšana iztvaikojušā vietā, ja nepieciešams.
|
|
8 – 9
|
Tāpat kā 2. dienā.
|
|
10
|
Tāpat kā 1. dienā; eliminācijas fāzes beigas; ūdens kvalitātes mērīšana (sk. 52. punktu); ūdens, sedimentu un tārpu paraugu ņemšana no šķīdinātāja kontroles traukiem; šķīdumu paraugu ņemšana no lamatām, ja tādas ir uzstādītas.
|
|
|
Sedimentu pagatavošana pirms eliminācijas fāzes sākuma jāveic tāpat kā pirms uzņemšanas fāzes.
|
|
|
Otrajā dienā paredzētās darbības ir jāveic katru dienu (vismaz darbdienās).
|
4. papildinājums
Dažas pieņemama atšķaidīšanas ūdens fizikālķīmiskās īpašības
|
SASTĀVDAĻA
|
KONCENTRĀCIJAS
|
|
Cietās daļiņas
|
< 20 mg/l
|
|
Kopējais organiskais ogleklis
|
< 2μg/l
|
|
Nejonizēts amonjaks
|
< 1 μg/l
|
|
Atlikušais hlors
|
< 10 μg/l
|
|
Kopējie fosfororganiskie pesticīdi
|
< 50 ng/l
|
|
Kopējie hlororganiskie pesticīdi un polihlorbifenili
|
< 50 ng/l
|
|
Kopējais organiskais hlors
|
< 25 ng/l
|
IETEICAMAIS REKONSTITUĒTĀ ŪDENS SASTĀVS
|
a)
|
Kalcija hlorīda šķīdums
Dejonizētā ūdenī izšķīdina 11,76 g CaCl2 2 H2O; ar dejonizētu ūdeni papildina līdz 1 l.
|
|
b)
|
Magnija sulfāta šķīdums
Dejonizētā ūdenī izšķīdina 4,93 g MgSO4 7 H2O; ar dejonizētu ūdeni papildina līdz 1 l.
|
|
c)
|
Nātrija bikarbonāta šķīdums
Dejonizētā ūdenī izšķīdina 2,59 g NaHCO3; ar dejonizētu ūdeni papildina līdz 1 l.
|
|
d)
|
Kālija hlorīda šķīdums
Dejonizētā ūdenī izšķīdina 0,23 g KCl; ar dejonizētu ūdeni papildina līdz 1 l.
|
Visām ķīmiskajām vielām jābūt analītiski tīrām.
Destilētā vai dejonizētā ūdens vadītspēja nedrīkst pārsniegt 10 μScm– 1.
Samaisa 25 ml katra a) – d) šķīduma, un kopējo tilpumu papildina ar dejonizētu ūdeni līdz 1 l. Kalcija un magnija jonu summa šajā šķīdumā ir 2,5 mmol/l.
Ca:Mg jonu proporcija ir 4:1, bet Na:K joniem – 10:1. Šā šķīduma skābju neitralizētspēja KS4.3 ir 0,8 mmol/l.
Atšķaidīšanas ūdeni aerē, līdz sasniegts piesātinājums ar skābekli, tad pirms lietošanas aptuveni divas dienas glabā bez turpmākas aerācijas.
Pieņemama atšķaidīšanas ūdens pH jābūt diapazonā no 6 līdz 9.
5. papildinājums
Mākslīgie sedimenti – pagatavošanas un glabāšanas ieteikumi
Pretēji prasībām, ko piemēro testēšanas metodei C.8. (40), mākslīgajiem sedimentiem ieteicamais kūdras saturs ir 2 %, nevis 10 % saussvara, lai tas atbilstu zemam līdz vidējam organiskajam saturam dabiskajos sedimentos (58).
Mākslīgo sedimentu sauso sastāvdaļu procentuālais īpatsvars
|
Sastāvdaļa
|
Īpašības
|
Sausie sedimenti (%)
|
|
Kūdra
|
Sfagnu sūnu kūdra, sadalīšanās pakāpe – “vidēja”, kaltēta, bez redzamām augu paliekām, smalki sasmalcināta (daļiņu izmērs≤ 0,5 mm)
|
2 ± 0,5
|
|
Kvarca smiltis
|
Graudu izmērs ≤ 2 mm, bet > 50 % daļiņu jābūt 50–200 μm diapazonā
|
76
|
|
Kaolinīta māls
|
Kaolinīta saturs ≥ 30 %
|
22 ± 1
|
|
Barības avots
|
papildus sausajiem sedimentiem Folia urticae, pulverī saberztas Urtica sp. (nātru) lapas, smalki samaltas (daļiņu izmērs≤ 0,5 mm), vai pulverī saberztas Urtica sp. lapas maisījumā ar alfa-celulozi (1:1); saskaņā ar farmācijas standartiem, lietošanai pārtikā;
|
0,4–0,5 %
|
|
Kalcija karbonāts
|
CaCO3, pulverveida, ķīmiski tīrs, papildus sausajiem sedimentiem
|
0,05–1
|
|
Dejonizēts ūdens
|
Vadītspēja ≤ 10 μS/cm, papildus sausajiem sedimentiem
|
30–50
|
Ja paredzamas paaugstinātas amonjaka koncentrācijas, piemēram, ja zināms, ka testējamā viela aizkavē nitrifikāciju, var būt lietderīgi 50 % ar slāpekli bagātā Urtica pulvera aizstāt ar celulozi (piemēram, ar α-celulozes pulveri, kas ir ķīmiski tīrs, daļiņu izmērs ≤ 0,5 mm).
Pagatavošana
Kūdru izžāvē gaisā un saberž smalkā pulverī (graudu lielums ≤ 0,5 mm, bez redzamām augu paliekām). Ar augsti iedarbīgu homogenizācijas ierīci pagatavo suspensiju ar nepieciešamo kūdras pulvera daudzumu, izmantojot dejonizēta ūdens porciju, kuru pievieno sausajiem sedimentiem (tiek atzīts, ka samaisāmas kūdras putriņas iegūšanai piemērotais ūdens tilpums ir 11,5 × kūdras saussvara(8)).
Šīs suspensijas pH ar CaCO3 koriģē līdz vērtībai 5,5 ± 0,5. Suspensiju nogatavina vismaz divas dienas, viegli maisot 20 ± 2 °C temperatūrā, lai stabilizētu pH un izveidotu stabilu mikrobiālo komponenti. Vēlreiz izmēra pH un, ja nepieciešams, to ar CaCO3 koriģē līdz 6,0 ± 0,5. Tad visu šo suspensiju samaisa ar citām sausajām sastāvdaļām, ņemot vērā jebkādu daudzumu, kas izmantots papildināšanai ar ķīmisko vielu. Pievieno atlikušo dejonizēto ūdeni, iegūstot viendabīgus sedimentus. Vēlreiz izmēra pH un, ja nepieciešams, to ar CaCO3 koriģē līdz 6,5–7,5. Tomēr, ja ir paredzama amonjaka veidošanās, sedimentu pH var būt lietderīgi saglabāt zem 7,0 (piemēram, no 6,0 līdz 6,5). Ņem sedimentu paraugus, lai noteiktu saussvaru un organiskā oglekļa saturu. Ja ir paredzams, ka veidosies amonjaks, mākslīgos sedimentus septiņas dienas var nogatavināt tādos pašos apstākļos, kādus rada turpmākajam testam (piemēram, ar sedimentu un ūdens attiecību 1:4 un tādu pašu sedimentu slāņa augstumu kā testēšanas traukos), pirms tos papildina ar testējamo vielu, t. i., tie ir jāpārlej ar ūdeni, kuru iepriekš aerē. Nogatavināšanas perioda beigās virsējo ūdeni nolej un izlej. Ņem sedimentu paraugus, lai noteiktu saussvaru un kopējo organiskā oglekļa saturu (piemēram, trīs paraugus).
Pēc tam papildinātās kvarca smiltis katram apstrādes līmenim sajauc ar sedimentiem un sedimentus sadala pa replikātu testēšanas traukiem, pārlejot ar testēšanas ūdeni (piemēram, sedimentu un ūdens attiecībā 1:4 un tādu pašu sedimentu slāņa augstumu kā testēšanas traukos). Tad šos traukus inkubē tādos pašos apstākļos, kādus rada turpmākajam testam. Tajā brīdī sākas līdzsvarošanas periods. Virsējais ūdens jāaerē.
Izraudzīto barības avotu pievieno pirms sedimentu papildināšanas ar testējamo vielu vai tās laikā. To var iepriekš samaisīt ar kūdras suspensiju (skatīt iepriekš). Savukārt, iespējami saīsinot periodu starp barības pievienošanu un ekspozīcijas sākumu, var novērst, ka barības avots pārmērīgi noārdās pirms testa organismu pievienošanas – piemēram, ilga līdzsvarošanās perioda gadījumā. Lai nodrošinātu, ka barība pietiekami saskaras ar testējamo vielu, tās avots ar sedimentiem jāsamaisa ne vēlāk kā dienā, kad sedimentus papildina ar testējamo vielu. Izņēmumus var pieļaut tad, ja ilgstošais līdzsvarošanas periods izraisa pārmērīgu mikroorganismu noārdīšanos barībā pirms testa organismu pievienošanas. Ņem sedimentu paraugus, lai noteiktu saussvaru un kopējo organiskā oglekļa saturu (piemēram, trīs paraugus ar papildinātiem vai kontrolgrupas sedimentiem).
Sastāvdaļu (kūdras, smilšu un kaolīna) saussvars jānorāda gramos un procentos no kopējā saussvara.
Ūdens tilpums, kas jāpievieno sausajām sastāvdaļām sedimentu pagatavošanas laikā, arī jāizsaka procentos no kopējā saussvara (piem., 100 % saussvara + 46 % ūdens nozīmē, ka 1 000 g saussvara uzņem kopumā 460 ml ūdens, izveidojoties 1 460 g mitru sedimentu).
Glabāšana
Mākslīgo sedimentu sausās sastāvdaļas var glabāt sausā un vēsā vietā istabas temperatūrā. Pagatavotos mitros sedimentus (tikai turpmākai lietošanai kultūrā) 4 ± 2 °C temperatūrā un tumsā var glabāt 2 līdz 4 nedēļas, skaitot no pagatavošanas dienas (8).
Ar testējamo vielu papildināti sedimenti jāizmanto nekavējoties, ja vien nav pieejama informācija, kas liecina, ka konkrētos sedimentus var glabāt, neietekmējot testējamās vielas toksicitāti un biopieejamību. Papildināto sedimentu paraugus tādos apstākļos, kas ieteikti konkrētajai testējamajai vielai, var glabāt līdz analīzes veikšanai.
6. papildinājums
Bioakumulācijas testēšanai ieteicamās mazsartārpu sugas
Tubifex tubifex (MÜLLER), stobriņtārpu dzimta (Tubificidae), mazsartārpu klase (Oligochaeta)
Stobriņu mazsartārpi (stobriņtārpu dzimta (Tubificidae), mazsartārpu klase (Oligochaeta)) Tubifex tubifex (Müller) dzīvo saldūdens sedimentos stobriņos, kas izklāti ar gļotām. Šajos stobriņos tārpi mīt ar galvu uz leju un barojas ar sedimentu daļiņām, proti, ar saistītajiem mikroorganismiem un organiskajām atliekām. Elpošanu nodrošina organisma pakaļējā daļa, kas parasti viļņojas virs sedimentiem esošā ūdens slānī. Kaut arī šī suga apdzīvo visdažādāko veidu sedimentus visā ziemeļu puslodē, Tubifex tubifex dod priekšroku samērā smalkiem sedimentiem (59). Minētās sugas piemērotība ekotoksikoloģijas testiem ir raksturota, piemēram, (8)(29)(31)(39)(60)(62)(63).
Kultivēšanas metodes
Lai pietiktu Tubifex tubifex tārpu bioakumulācijas testu veikšanai, tie jātur pastāvīgā laboratoriskā kultūrā. T. tubifex kultūrai ir ieteicama sistēma, kas sastāv no mākslīgiem sedimentiem, kuru bāze ir mākslīgā augsne saskaņā ar testēšanas metodi C.8. (40) un rekonstituētais ūdens saskaņā ar testēšanas metodi C.1. (8).
Par kultivēšanas traukiem var izmantot stikla vai nerūsošā tērauda tvertnes ar augstumu no 12 līdz 20 cm. Visas kultivēšanas tvertnes piepilda ar mitru mākslīgo sedimentu slāni, kas pagatavots saskaņā ar 5. papildinājumu. Sedimentu slāņa dziļumam jānodrošina tārpu dabiskā izturēšanās – ierakšanās – (tārpiem T. tubifex minimālais dziļums 2 cm). Sistēmai pielej rekonstituētu ūdeni. Jāparūpējas, lai līdz minimumam samazinātu sedimentu sajaukšanos. Ūdens masu viegli aerē (piemēram, divi burbuļi sekundē ar 0,45 μm filtrēta gaisa), izmantojot Pastēra pipeti, kas novietota 2 cm virs sedimentu virsmas. Ieteicamā kultūras temperatūra ir 20 ±2 °C.
Tārpus pievieno kultūras sistēmai tā, lai noslogojums nepārsniegtu 20 000 īpatņu uz 1 m2 sedimentu virsmas. Lielāks noslogojums var mazināt augšanas un vairošanās tempu (43).
Mākslīgo sedimentu kultūrās tārpi ir jābaro. Par papildu barības vielu var izmantot smalki saberztu zivju barību, piemēram, TetraMin® (8); Klerks 1994, personal communication. Barošanas intensitātei jānodrošina pietiekama augšana un vairošanās, un amonjaka veidošanās un sēnīšu augšana kultūrā jāierobežo līdz minimumam. Barošanu var veikt divreiz nedēļā (piemēram, 0,6–0,8 mg uz 1 cm2 sedimentu virsmas). Praktiskā pieredze liecina, ka dejonizētā ūdenī suspendētas un homogenizētas barības izmantošana var atvieglot vienmērīgu barības izkliedi kultūras tvertnēs pa sedimentu virsmu.
Lai virsējā ūdenī neuzkrātos amonjaks, ūdens jāmaina, izmantojot caurplūdes sistēmu vai – vismaz vienreiz nedēļā – to izdarot manuāli. Izejkultūrās sedimenti jāmaina ik pēc trim mēnešiem.
Ja nepieciešami tikai pieauguši tārpi, tos no kultūras paraugiem var ņemt, kultūras sedimentus izlaižot caur 1 mm sietu. Kokonu ievākšanai piemēroti būs sieti ar 0,5 mm acīm, bet jauno indivīdu ievākšanai – ar 0,25 mm. Pēc tam, kad caur sietiem izlaisti sedimenti, sietus var ievietot rekonstituētā ūdenī. Tārpi no sieta atlīp, un tad tos var izņemt no ūdens ar mīksta tērauda pinceti vai pipeti ar rūdīta stikla malām.
Testa vai jaunu kultūru sākšanai izmanto tikai veselus un skaidri identificētus Tubifex tubifex īpatņus (piemēram, (64)). Slimi vai ievainoti tārpi, kā arī ar sēnīšu hifu inficēti kokoni būs jālikvidē.
Sinhronizētā kultivēšanā var piemērotos starplaikos pēc vēlēšanās iegūt konkrēta vecuma tārpus. Jaunus kultivēšanas traukus uzstāda izraudzītos starplaikos (piemēram, ik pēc divām nedēļām), sākot ar noteikta vecuma dzīvniekiem (piemēram, kokoniem). Šeit minētajos kultivēšanas apstākļos tārpi ir pieauguši pēc 8–10 nedēļām. Kultūras var ievākt, kad tārpi ir radījuši jaunus kokonus, piemēram, pēc desmit nedēļām. Paraugam ņemtos pieaugušos tārpus var izmantot testēšanai, un ar kokoniem var uzsākt jaunas kultūras veidošanu.
Lumbriculus variegatus (MÜLLER), ūdensslieku dzimta (Lumbriculidae), mazsartārpu klase (Oligochaeta)
Lumbriculus variegatus (ūdensslieku dzimta (Lumbriculidae), mazsartārpu klase (Oligochaeta)) arī mīt saldūdens sedimentos visā pasaulē, un tos plaši izmanto ekotoksikoloģiskajos testos. Informācija par šīs sugas bioloģiju, kultivēšanas apstākļiem un jutīgumu atrodama (1)(6)(9)(36). Lumbriculus variegatus ar noteiktiem ierobežojumiem var kultivēt arī mākslīgajos sedimentos, kas ieteicami T. tubifex (8). Tā kā dabā L. variegatus dod priekšroku rupjākiem sedimentiem nekā T. tubifex (59), laboratorijas kultūras ar mākslīgajiem sedimentiem, ko izmanto T. tubifex, 4–6 mēnešu laikā var izbeigties. Praktiskā pieredze liecina, ka L. variegatus smilšainā substrātā (piem., kvarca smiltīs, smalkā grantī) ar caurplūdes sistēmu, barojot ar zivju barību, bez substrāta atjaunošanas var turēt vairākus gadus. Salīdzinot ar citām ūdens mazsartārpu sugām, galvenā L. variegatus priekšrocība ir straujā vairošanās, kas dod iespēju ātri palielināt biomasu laboratorijā kultivētām populācijām (1)(6)(9)(10).
Kultivēšanas metodes
Lumbriculus variegatus kultivēšanas apstākļi ir detalizēti aprakstīti Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1) un U.S. EPA (2000) (6). Turpmāk sniegts īss kopsavilkums par šiem apstākļiem.
Tārpus var kultivēt lielos akvārijos (57–80 l) 23 °C temperatūrā ar fotoperiodu 16 h gaismas:8 h tumsas (100–1 000 luksi), izmantojot katru dienu atjauninātu dabisko ūdeni (45–50 l uz vienu akvāriju). Substrātu pagatavo, nebalināta brūna papīra dvieļus sagriežot strēmelēs, ko pēc tam var dažas sekundes sakult ar kultūras ūdeni, iegūstot nelielu papīra gabaliņu substrātu. Šo substrātu pēc tam var tieši izmantot Lumbriculus kultūras akvārijā, ar to izklājot tvertnes apakšdaļu, vai dejonizētā ūdenī sasaldētu glabāt vēlākai lietošanai. Ar jauno substrātu tvertnē parasti pietiek aptuveni divus mēnešus.
Katru tārpu kultūru sāk ar 500–1 000 tārpiem un trīs reizes nedēļā, nodrošinot ūdens atjaunināšanu vai caurplūdi, baro ar 10 ml suspensiju, kas satur 6 g foreļu kāpuru barības. Lai nepieļautu baktēriju un sēnīšu augšanu, statiskās vai pusstatiskas kultūrās barību dod retāk. Barību un papīra substrātu analizē attiecībā uz bioakumulācijas testos izmantojamu vielu klātbūtni.
Šādos apstākļos īpatņu skaits kultūrā aptuveni 10–14 dienās parasti dubultojas.
Lumbriculus variegatus no kultūrām izņem, piemēram, uz atsevišķu vārglāzi ar smalku tīkliņu pārvietojot substrātu vai ar rūdīta stikla pipeti ar platu atvērumu (aptuveni 5 mm diametrā) – organismus. Ja uz šo vārglāzi pārvieto arī substrātu, tārpus un substrātu saturošo vārglāzi pa nakti atstāj caurplūdē, kura substrātu atdalīs no vārglāzes, tārpiem paliekot trauka apakšā. Pēc tam tārpus var ielaist kultūras tvertēs, kas sagatavotas no jauna, vai tālāk sagatavot testa vajadzībām(1)(6). Nedrīkst pieļaut tārpu savainošanu vai to autotomiju, piemēram, darbā ar tārpiem jāizmanto pipetes ar rūdīta stikla malām vai nerūsošā tērauda irbuļi.
Problēma, kas kritiski jāvērtē, sedimentu bioakumulācijas testos izmantojot L. variegatus, ir šīs sugas vairošanās veids (arhitomija, kam seko morfalakse). Šāda bezdzimumvairošanās rezultējas divos fragmentos, kuri kādu laiku neuzņem barību, kamēr reģenerējas galvas vai astes daļa (36)(37). Tas nozīmē, ka sugas L. variegatus tārpi sedimentus un piesārņotājus ar barības starpniecību neuzņem pastāvīgi kā stobriņtārpi, kuri nevairojas fragmentējoties.
Tādēļ ir jāveic sinhronizācija, lai nekontrolētu vairošanos un reģenerēšanos un attiecīgi – būtiskas atšķirības testa rezultātos – samazinātu līdz minimumam. Šādas atšķirības var rasties tad, ja daži īpatņi, kas sadalījušies fragmentos un tādēļ noteiktu laiku neuzņem barību, testējamajai vielai ir eksponēti mazāk nekā citi īpatņi, kas testa laikā fragmentos nesadalās (38). 10–14 dienas pirms ekspozīcijas sākuma tārpi ir jāsadala mākslīgi (sinhronizācija) (65). Jāizmanto lieli tārpi, vislabāk tādi, kuriem nav nesenas fragmentācijas pazīmju. Šos tārpus var novietot uz stikla priekšmetstikliņa kultūras ūdens pilienā un ķermeņa vidusdaļā ar skalpeli pārdalīt uz pusēm. Jāraugās, lai pakaļgali būtu līdzīga izmēra. Pēc tam pakaļgalus jaunu galvu reģenerēšanai līdz ekspozīcijas sākumam atstāj kultivēšanas traukos, kas satur tādu pašu substrātu, kāds izmantots kultūrā, un rekonstituētu ūdeni. Par jaunu galvu reģenerēšanos liecina sinhronizēto tārpu ierakšanās substrātā (reģenerēto galvu esamību var pārbaudīt, reprezentatīvu apakšparaugu apskatot binokulārā mikroskopā). Pēc tam sagaidāms, ka testa organismi būs vienādā fizioloģiskā stāvoklī. Tas nozīmē, ka tad, kad testa laikā sinhronizētajiem tārpiem notiek morfalakses izraisītā reģenerācija, sagaidāms, ka praktiski visi dzīvnieki ar ķīmisko vielu papildinātajiem sedimentiem bijuši eksponēti vienādā mērā. Sinhronizētie tārpi jābaro, tiklīdz tie sāk ierakties substrātā, vai septiņas dienas pēc to sadalīšanas. Barošanas režīmam jābūt salīdzināmam ar parastajām kultūrām, taču sinhronizētos tārpus ieteicams barot no tā paša barības avota, ko paredzēts lietot testēšanā. Tārpi jātur testēšanas temperatūrā, proti, 20 ± 2 °C. Pēc reģenerācijas testēšanā izmanto neskartus un veselus līdzīga izmēra tārpus, kas aktīvi peld vai lien, reaģējot uz vieglu mehānisku kairinājumu. Nedrīkst pieļaut tārpu savainošanu vai to autotomiju, piemēram, darbā ar tārpiem jāizmanto pipetes ar rūdīta stikla malām vai nerūsošā tērauda irbuļi.
Ja testam izmanto Lumbriculus variegatus, ņemot vērā šīs sugas īpašo vairošanās veidu, piemērotos apstākļos testa laikā tārpu skaitam jāpieaug (6. literatūras avots). Bioakumulācijas testā ar L. variegatus nevairošanās fakts jāatspoguļo pārskatā un jāņem vērā, interpretējot testa rezultātus.
Branchiura sowerbyi (BEDDARD), stobriņtārpu dzimta (Tubificidae), mazsartārpu klase (Oligochaeta) (starplaboratoriju salīdzinošajā testēšanā nav apstiprināti)
Suga Branchiura sowerbyi cēlusies tropiskos apgabalos un apdzīvo dažāda veida sedimentus ūdenstilpēs, ezeros, dīķos un upēs. Tā ir sastopama arī ziemeļu puslodes siltajās ūdenstilpēs. Tomēr daudz bagātīgāk tā ir pārstāvēta dūņu un māla sedimentos ar augstu organisko vielu saturu. Turklāt tārpi dzīvo sedimentu slānī. Sedimentos parasti ieracies ir arī pakaļgals. Šo sugu viegli atpazīt pēc žaunu pavedieniem mugurpusē. Pieauguši tārpi var sasniegt 9–11 cm garumu un mitro svaru 40–50 mg. Tārpi strauji vairojas, un, temperatūrai un barošanai atbilstot turpmāk minētajiem nosacījumiem, to populācija mazāk nekā divās nedēļās dubultojas (Aston et al. 1982, (65)). B. sowerbyi izmanto gan toksicitātes, gan bioakumulācijas pētījumos (attiecīgi Marchese & Brinkhurst 1996 (31) un Roghair et al. 1996, (67)).
Kultivēšanas metodes
Turpmāk ir sniegts kopsavilkums par Branchiura sowerbyi kultivēšanas apstākļiem (sagatavojuši Mercedes R. Marchese, INALI, Argentīna, un Carla J. Roghair, RIVM, Nīderlande).
Testa organismu kultivēšanai nav nepieciešama viena noteikta metodika. Šos organismus var kultivēt, izmantojot nepiesārņotus dabiskos sedimentus (31). Praktiskā pieredze liecina, ka vidē, kas sastāv no dabiskiem sedimentiem un smiltīm, tārpu stāvoklis ir labāks nekā tikai dabiskos sedimentos (32)(67). Kultivēšanai var izmantot trīs L vārglāzes, kas satur 1 500 ml sedimentu/ūdens vides, kuras sastāvā ir 375 ml dabisku nepiesārņotu sedimentu (kopējais organiskais ogleklis aptuveni 10 %; aptuveni 17 % daļiņu ≤ 63 μm), 375 ml tīru smilšu (M32) un 750 ml rekonstituēta vai no hlora attīrīta krāna ūdens (31)(32)(67). Par kultivēšanas substrātu var izmantot arī papīra dvieļus, taču populācijas pieaugums būs lēnāks nekā dabiskajos sedimentos. Pusstatiskās sistēmās ūdens slāni vārglāzē lēni aerē, un virsējais ūdens ir jāatjaunina katru nedēļu.
Katrā vārglāzē kultūras aizsākšanai ievieto 25 jaunus tārpus. Pēc diviem mēnešiem lielos tārpus ar pinceti izņem no sedimentiem un ievieto jaunā vārglāzē ar svaigi pagatavotu sedimentu/ūdens vidi. Vecajā vārglāzē atrodas arī kokoni un jaunie indivīdi. Šādi no katras vārglāzes var iegūt līdz 400 tārpu mazuļiem. Pieaugušos tārpus reprodukcijai izmantot var vismaz vienu gadu.
Kultūras uztur 21–25 °C temperatūrā. Temperatūras svārstības saglabā ± 2 °C robežās. Laiks, kas nepieciešams embriju attīstībai no oliņas izdēšanas līdz brīdim, kad jaunie tārpi pamet kokonu, ir aptuveni trīs nedēļas 25 °C temperatūrā. Ir konstatēts, ka oliņu daudzums, ko iegūst no katra izdzīvojušā B. sowerbyi tārpa, svārstās no 6,36 (31) līdz 11,2 (30) dūņās 25 °C temperatūrā. Oliņu skaits uz vienu kokonu svārstās no 1,8 līdz 2,8 (66)(69) vai līdz 8 (68).
Katru izšķīdušo skābekli, ūdens cietību, temperatūru un pH mēra katru nedēļu. Zivju barību (piemēram, TetraMin®) var divas vai trīs reizes nedēļā pievienot kā suspensiju ad libitum. Tārpus var ad libitum barot arī ar atkausētām salātlapām.
Šīs sugas galvenā priekšrocība ir liela individuālā biomasa (viena īpatņa mitrais svars līdz 40–50 mg). Tādēļ šo sugu var izmantot bioakumulācijas testēšanai attiecībā uz testējamajām vielām, kas nav radioaktīvi iezīmētas. To var eksponēt sistēmās, ko izmanto ar T. tubifex vai L. variegatus, katrā replikātā izmantojot vienu īpatni (11). Tomēr tādā gadījumā ir jāpalielina replikātu skaits, ja vien neizmanto lielākas testēšanas kameras (11). Šai sugai jākoriģē arī derīguma kritērijs, kas saistīts ar ierakšanos.
LITERATŪRA
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
European Commission (EC) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the European Communities, Luxembourg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(5)
|
Šā pielikuma C.13. nodaļa “Biokoncentrācija – zivju analīze caurplūdes apstākļos”
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Šā pielikuma C.27. nodaļa “Toksicitātes tests ar nosēdumu un ūdens hironomīdiem, izmantojot piesātinātus nosēdumus”.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R + D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
(20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Šā pielikuma nodaļas
|
|
A.4. nodaļa “Tvaika spiediens”
|
|
|
A.4. nodaļa “Virsmas spraigums”
|
|
|
A.6. nodaļa “Šķīdība ūdenī”
|
|
|
A.8. nodaļa “Sadalīšanās koeficients, kolbu kratīšanas metode”
|
|
|
A.24. nodaļa “Sadalīšanās koeficients, HPLC metode”
|
|
|
C.7. nodaļa “Noārdīšanās – abiotiska noārdīšanās: hidrolīze atkarībā no pH”
|
|
|
C.4. nodaļa ““Vieglas” bioloģiskās noārdīšanās spējas noteikšana, A–F”
|
|
|
C.19. nodaļa “Adsorbcijas koeficienta (KOC) noteikšana uz augsnes un uz kanalizācijas nosēdumiem ar augstas izšķiršanas šķidruma hromatogrāfiju (HPLC)”
|
|
|
C.29. nodaļa “Vieglas bionoārdīšanās spēja – CO2 hermētiski noslēgtos traukos (brīvā tilpuma tests)”.
|
|
|
(23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Šā pielikuma C.1. nodaļa “Akūtā toksicitāte zivīm”.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(40)
|
Šā pielikuma C.8. nodaļa “Toksicitātes noteikšana sliekām”.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274
|
” |