ISSN 1977-0715
Eiropas Savienības
Oficiālais Vēstnesis
L 331

Izdevums latviešu valodā
Tiesību akti
57. sējums
2014. gada 18. novembris
|
ISSN 1977-0715 |
||
|
Eiropas Savienības Oficiālais Vēstnesis |
L 331 |
|

|
||
|
Izdevums latviešu valodā |
Tiesību akti |
57. sējums |
|
|
|
Labojumi |
|
|
|
* |
|
|
|
|
|
(1) Dokuments attiecas uz EEZ |
|
LV |
Tiesību akti, kuru virsraksti ir gaišajā drukā, attiecas uz kārtējiem jautājumiem lauksaimniecības jomā un parasti ir spēkā tikai ierobežotu laika posmu. Visu citu tiesību aktu virsraksti ir tumšajā drukā, un pirms tiem ir zvaigznīte. |
II Neleģislatīvi akti
REGULAS
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/1 |
PADOMES ĪSTENOŠANAS REGULA (ES) Nr. 1225/2014
(2014. gada 17. novembris),
ar kuru īsteno Regulu (ES) Nr. 269/2014 par ierobežojošiem pasākumiem attiecībā uz darbībām, ar ko tiek grauta vai apdraudēta Ukrainas teritoriālā integritāte, suverenitāte un neatkarība
EIROPAS SAVIENĪBAS PADOME,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Padomes Regulu (ES) Nr. 269/2014 (2014. gada 17. marts) par ierobežojošiem pasākumiem attiecībā uz darbībām, ar ko tiek grauta vai apdraudēta Ukrainas teritoriālā integritāte, suverenitāte un neatkarība (1), un jo īpaši tās 14. panta 1. punktu,
tā kā:
|
(1) |
Padome 2014. gada 17. martā pieņēma Regulu (ES) Nr. 269/2014. |
|
(2) |
Būtu jāgroza informācija par vienu personu, kas saskaņā ar Regulu (ES) Nr. 269/2014 ir iekļauta sarakstā. |
|
(3) |
Tādēļ attiecīgi būtu jāgroza Regulas (ES) Nr. 269/2014 I pielikums, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Ar šo Regulas (ES) Nr. 269/2014 I pielikumu groza tā, kā norādīts šīs regulas pielikumā.
2. pants
Šī regula stājas spēkā nākamajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Padomes vārdā –
priekšsēdētāja
F. MOGHERINI
(1) OV L 78, 17.3.2014., 6. lpp.
PIELIKUMS
Ierakstu attiecībā uz šo Regulas (ES) Nr. 269/2014 I pielikumā minēto personu aizstāj ar šādu:
|
|
Vārds |
Identifikācijas informācija |
Pamatojums |
Sarakstā iekļaušanas datums |
|
|
“Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Dzimis 25.4.1946.Almaty (iepriekš zināma arī kā Alma-Ata) Kazahstānā. |
Valsts Domes Padomes loceklis; Krievijas Liberāldemokrātiskās partijas vadītājs. Aktīvi atbalstīja Krievijas bruņoto spēku izmantošanu Ukrainā un Krimas aneksiju. Aktīvi aicinājis sadalīt Ukrainu. Viņa vadītās Krievijas Liberāldemokrātiskās partijas vārdā parakstījis nolīgumu ar t. s. “Doņeckas Tautas Republiku”. |
12.9.2014.” |
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/3 |
KOMISIJAS REGULA (ES) Nr. 1226/2014
(2014. gada 17. novembris)
par atļaujas piešķiršanu veselīguma norādēm uz pārtikas produktiem, kuras attiecas uz slimības riska samazināšanu
(Dokuments attiecas uz EEZ)
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Eiropas Parlamenta un Padomes 2006. gada 20. decembra Regulu (EK) Nr. 1924/2006 par uzturvērtības un veselīguma norādēm uz pārtikas produktiem (1) un jo īpaši tās 17. panta 3. punktu,
tā kā:
|
(1) |
Saskaņā ar Regulu (EK) Nr. 1924/2006 veselīguma norādes uz pārtikas produktiem ir aizliegtas, ja vien Komisija tās nav atļāvusi saskaņā ar minēto regulu un tās nav iekļautas atļauto norāžu sarakstā. |
|
(2) |
Regulā (EK) Nr. 1924/2006 paredzēts arī, ka uzņēmēji, kas iesaistīti pārtikas apritē, veselīguma norāžu atļaujas pieteikumus var iesniegt dalībvalsts kompetentajai iestādei. Dalībvalsts kompetentā iestāde nosūta derīgus pieteikumus Eiropas Pārtikas nekaitīguma iestādei (EFSA, turpmāk “iestāde”). |
|
(3) |
Pēc pieteikuma saņemšanas iestāde par to nekavējoties informē pārējās dalībvalstis un Komisiju, kā arī sniedz atzinumu par attiecīgo veselīguma norādi. |
|
(4) |
Komisija, ņemot vērā iestādes sniegto atzinumu, lemj par veselīguma norāžu atļaujas piešķiršanu. |
|
(5) |
Pēc pieteikuma saņemšanas no Lactalis B&C, kas iesniegts saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei tika lūgts sniegt atzinumu par veselīguma norādi saistībā ar “Smērējamiem taukiem ar zemu tauku saturu un zemu transtaukskābju saturu, bagātīgu nepiesātināto taukskābju un omega-3 taukskābju saturu” un ZBL holesterīna koncentrācijas samazināšanu. (Jautājums Nr. EFSA-Q-2009-00458) (2). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Tauku ar augstu piesātināto taukskābju un transtaukskābju saturu aizstāšana ar taukiem, kuros ir daudz nepiesātināto taukskābju, palīdz samazināt ZBL holesterīna līmeni asinīs. ZBL holesterīna līmenis ir riska faktors”. |
|
(6) |
Komisija un dalībvalstis 2011. gada 25. maijā saņēma iestādes atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka ir noteikta cēloņsakarība starp piesātinātajām taukskābēm pārtikā un ZBL holesterīna koncentrācijas paaugstināšanos asinīs, un ka piesātināto taukskābju maisījuma aizvietošana, par pamatu ņemot masas attiecību g/g, ar cis-mononepiesātinātajām taukskābēm un/vai cis-polinepiesātinātajām taukskābēm pārtikas produktos vai uzturā samazina ZBL holesterīna koncentrāciju. Līdz ar to veselīguma norāde, kas ir saskaņā ar šo secinājumu, būtu jāuzskata par atbilstošu Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, un tā būtu jāiekļauj Savienības atļauto norāžu sarakstā. Klīnisko intervences pētījumu, kuru pieprasījuma iesniedzējs bija norādījis kā patentētu, iestāde neuzskatīja par vajadzīgu secinājuma izdarīšanai. Tādēļ tiek uzskatīts, ka Regulas (EK) Nr. 1924/2006 21. panta 1. punkta c) apakšpunktā minētā prasība nav izpildīta un līdz ar to īpašumtiesību datu aizsardzība nebūtu jānodrošina. |
|
(7) |
Minētajā atzinumā iestāde secina, ka, lai izmantotu šo norādi, ievērojams piesātināto taukskābju daudzums būtu jāaizstāj ar mononepiesātinātajām un/vai polinepiesātinātajām taukskābēm pārtikas produktos vai uzturā, par pamatu ņemot masas attiecību g/g. Tādēļ, lai nodrošinātu, ka pārtikas produkts sniedz ievērojamu mononepiesātināto un/vai polinepiesātināto taukskābju apjomu, ir lietderīgi ierobežot norāžu izmantošanu attiecībā uz taukiem un eļļām, un noteikt izmantošanas nosacījumus, kā minēts uzturvērtības norādē “AUGSTS NEPIESĀTINĀTO TAUKU LĪMENIS”, saskaņā ar Regulas (EK) Nr. 1924/2006 pielikumu. |
|
(8) |
Regulas (EK) Nr. 1924/2006 16. panta 4. punktā ir noteikts – ja atzinums ir labvēlīgs attiecībā uz atļaujas piešķiršanu veselīguma norādei, tajā būtu jāiekļauj konkrētas ziņas. Attiecīgi šai informācijai vajadzētu būt minētai šīs regulas pielikumā attiecībā uz atļauto veselīguma norādi, un vajadzības gadījumā tajā iekļauj pārskatītais norādes formulējums, īpašie norādes lietošanas nosacījumi un attiecīgā gadījumā pārtikas produkta lietošanas nosacījumi vai ierobežojumi un/vai papildu paziņojums vai brīdinājums saskaņā ar Regulas (EK) Nr. 1924/2006 noteikumiem un atbilstoši iestādes atzinumiem. |
|
(9) |
Viens no Regulas (EK) Nr. 1924/2006 mērķiem ir nodrošināt, lai veselīguma norādes ir patiesas, skaidras, uzticamas un lietderīgas patērētājam un saistībā ar iepriekš minēto tiek ņemts vērā veselīguma norāžu formulējums un noformējums. Tāpēc gadījumos, kad norāžu formulējums patērētājiem nozīmē to pašu, ko veselīguma norāde, par kuru jau ir izsniegta atļauja, jo tās liecina, ka pastāv tāda pati saikne, kāda ir starp pārtikas produktu kategoriju, pārtikas produktu vai kādu tā sastāvdaļu un veselību, uz norādēm būtu jāattiecina tādi paši lietošanas nosacījumi, kā minēts šīs regulas pielikumā. |
|
(10) |
Nosakot šajā regulā paredzētos pasākumus, Komisija ņēma vērā atsauksmes, ko tā saskaņā ar Regulas (EK) Nr. 1924/2006 16. panta 6. punktu saņēmusi no pieteikuma iesniedzējiem un sabiedrības pārstāvjiem. |
|
(11) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pārtikas aprites un dzīvnieku veselības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
1. Šīs regulas pielikumā minēto veselīguma norādi ir atļauts lietot uz pārtikas produktiem Savienības tirgū saskaņā ar minētajā pielikumā paredzētajiem nosacījumiem.
2. Šā panta 1. punktā minēto veselīguma norādi iekļauj Regulas (EK) Nr. 1924/2006 14. panta 1. punktā paredzētajā Savienības atļauto norāžu sarakstā.
2. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Komisijas vārdā –
priekšsēdētājs
Jean-Claude JUNCKER
(1) OV L 404, 30.12.2006., 9. lpp.
(2) EFSA Journal, 2011; 9(5):2168.
PIELIKUMS
Atļautā veselīguma norāde
|
Pieteikums – Regulas (EK) Nr. 1924/2006 attiecīgie noteikumi |
Pieteikuma iesniedzējs, adrese |
Uzturviela, viela, pārtika vai pārtikas kategorija |
Norāde |
Norādes izmantošanas nosacījumi |
Pārtikas lietošanas nosacījumi un/vai ierobežojumi un/vai papildu paziņojums vai brīdinājums |
Atsauce uz EFSA atzinumu |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Lactalis B&C, ZA Les Placis, 35230 Bourgbarré, France |
Mononepiesātinātās un/vai polinepiesātinātās taukskābes |
Ir pierādīts, ka uzturā piesātināto tauku aizstāšana ar nepiesātinātajiem taukiem pazemina/samazina holesterīna līmeni asinīs. Augsts holesterīna līmenis ir riska faktors saslimšanai ar koronāro sirds slimību. |
Norādi var izmantot tikai pārtikas produktiem, kuriem ir liels nepiesātināto taukskābju saturs, kā minēts norādē “AUGSTS NEPIESĀTINĀTO TAUKU LĪMENIS” Regulas (EK) Nr. 1924/2006 pielikumā. |
Norādi var izmantot tikai attiecībā uz taukiem un eļļām. |
Q-2009-00458 |
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/6 |
KOMISIJAS ĪSTENOŠANAS REGULA (ES) Nr. 1227/2014
(2014. gada 17. novembris),
ar ko nosaka Padomes Regulā (EK) Nr. 73/2009 paredzēto tiešo maksājumu korekcijas likmi attiecībā uz 2014. kalendāro gadu un atceļ Komisijas Īstenošanas regulu (ES) Nr. 879/2014
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Eiropas Parlamenta un Padomes 2013. gada 17. decembra Regulu (ES) Nr. 1306/2013 par kopējās lauksaimniecības politikas finansēšanu, pārvaldību un uzraudzību un Padomes Regulu (EEK) Nr. 352/78, (EK) Nr. 165/94, (EK) Nr. 2799/98, (EK) Nr. 814/2000, (EK) Nr. 1290/2005 un (EK) Nr. 485/2008 atcelšanu (1) un jo īpaši tās 26. panta 4. punktu,
apspriedusies ar Lauksaimniecības fondu komiteju,
tā kā:
|
(1) |
Komisija 2014. gada 21. martā pieņēma priekšlikumu Eiropas Parlamenta un Padomes regulai par Regulā (EK) Nr. 73/2009 paredzētās tiešo maksājumu korekcijas likmes noteikšanu attiecībā uz 2014. kalendāro gadu (2). Tomēr līdz 2014. gada 30. jūnijam Eiropas Parlaments un Padome šo korekcijas likmi vēl nebija noteikuši. Tāpēc saskaņā ar Padomes Regulas (ES) Nr. 1306/2013 26. panta 3. punktu Komisija ir noteikusi korekcijas likmi Komisijas Īstenošanas regulā (ES) Nr. 879/2014 (3). |
|
(2) |
Prognozes attiecībā uz tiešajiem maksājumiem un ar tirgu saistītajiem izdevumiem Komisijas 2015. gada budžeta projekta grozījumu vēstulē Nr. 1 liecina, ka nepieciešams pielāgot finanšu disciplīnas korekcijas likmi, kas tika ņemta vērā 2015. gada budžeta projektā. Minētā grozījumu vēstule ir sagatavota, ņemot vērā finanšu disciplīnas summu 433 miljonu euro apmērā attiecībā uz rezervi krīzes situācijām lauksaimniecības nozarē, kas minēta Regulas (ES) Nr. 1306/2013 25. pantā. Lai ņemtu vērā šo jauno informāciju, Komisijai būtu jāpielāgo Īstenošanas regulā (ES) Nr. 879/2014 noteiktā korekcijas likme. |
|
(3) |
Parasti lauksaimnieki, kuri iesniedz atbalsta pieteikumu tiešajiem maksājumiem vienam kalendārajam gadam (N), maksājumu saņem noteikta maksājumu perioda laikā finanšu gadā (N + 1). Tomēr dalībvalstīm ir iespēja noteiktās robežās veikt novēlotus maksājumus lauksaimniekiem neierobežotu laiku pēc šā maksājumu perioda. Šādi novēloti maksājumi var notikt vēlākā finanšu gadā. Piemērojot finanšu disciplīnu konkrētam kalendārajam gadam, korekcijas likmi nevajadzētu piemērot maksājumiem, attiecībā uz kuriem atbalsta pieteikumi ir iesniegti nevis tajā kalendārajā gadā, kuram piemēro finanšu disciplīnu, bet citos kalendārajos gados. Tāpēc, lai nodrošinātu vienlīdzīgu attieksmi pret lauksaimniekiem, ir piemēroti noteikt, ka korekcijas likme būtu piemērojama maksājumiem, attiecībā uz kuriem atbalsta pieteikumi ir iesniegti tajā kalendārajā gadā, kuram piemēro finanšu disciplīnu, neatkarīgi no tā, kad atbalstu izmaksā lauksaimniekiem. |
|
(4) |
Eiropas Parlamenta un Padomes Regulas (ES) Nr. 1307/2013 (4) 8. panta 1. punkts paredz, ka tiešajiem maksājumiem piemēroto korekcijas likmi, kas noteikta saskaņā ar Regulas (ES) Nr. 1306/2013 26. pantu, piemēro tikai tiešajiem maksājumiem, kas pārsniedz EUR 2 000 un kas piešķirami lauksaimniekiem attiecīgajā kalendārajā gadā. Turklāt Regulas (ES) Nr. 1307/2013 8. panta 2. punkts paredz, ka pakāpeniskas tiešo maksājumu ieviešanas rezultātā korekcijas likmi Bulgārijai un Rumānijai piemēro tikai no 2016. gada 1. janvāra, bet Horvātijai – no 2022. gada 1. janvāra. Korekcijas likme, kas jānosaka ar šo regulu, tāpēc nebūtu jāpiemēro maksājumiem, ko lauksaimniekiem veic minētajās dalībvalstīs. |
|
(5) |
Lai nodrošinātu, ka pielāgotā korekcijas likme ir piemērojama no dienas, kad maksājumi lauksaimniekiem ir sākti saskaņā ar Regulu (ES) Nr. 1306/2013, šī regula būtu jāpiemēro no 2014. gada 1. decembra. |
|
(6) |
Pielāgotā korekcijas likme būtu jāņem vērā, aprēķinot visus maksājumus, kas piešķirami lauksaimniekam, pamatojoties uz atbalsta pieteikumu, kurš iesniegts par 2014. kalendāro gadu. Tāpēc skaidrības labad Īstenošanas regula (ES) Nr. 879/2014 būtu jāatceļ, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
1. Lai piemērotu korekciju, kas paredzēta Regulas (ES) Nr. 1306/2013 25. un 26. pantā, un saskaņā ar Regulas (ES) Nr. 1307/2013 8. panta 1. punktu to maksājumu summas Padomes Regulas (EK) Nr. 73/2009 (5) 2. panta d) punkta nozīmē, kas jāpiešķir lauksaimniekam un kas pārsniedz EUR 2 000 saistībā ar atbalsta pieteikumu, kurš iesniegts attiecībā uz 2014. kalendāro gadu, samazina par 1,302214 %.
2. Šā panta 1. punktā minētais samazinājums neattiecas uz Bulgāriju, Horvātiju un Rumāniju.
2. pants
Īstenošanas regulu (ES) Nr. 879/2014 atceļ.
3. pants
Šī regula stājas spēkā septītajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
To piemēro no 2014. gada 1. decembra.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Komisijas vārdā –
priekšsēdētājs
Jean-Claude JUNCKER
(1) OV L 347, 20.12.2013., 549. lpp.
(2) COM(2014) 175.
(3) Komisijas 2014. gada 12. augusta Īstenošanas regula (ES) Nr. 879/2014, ar ko nosaka Padomes Regulā (EK) Nr. 73/2009 paredzēto tiešo maksājumu korekcijas likmes attiecībā uz 2014. kalendāro gadu (OV L 240, 13.8.2014., 20. lpp.).
(4) Eiropas Parlamenta un Padomes 2013. gada 17. decembra Regula (ES) Nr. 1307/2013, ar ko izveido noteikumus par lauksaimniekiem paredzētiem tiešajiem maksājumiem, kurus veic saskaņā ar kopējās lauksaimniecības politikas atbalsta shēmām, un ar ko atceļ Padomes Regulu (EK) Nr. 637/2008 un Padomes Regulu (EK) Nr. 73/2009 (OV L 347, 20.12.2013., 608. lpp.).
(5) Padomes 2009. gada 19. janvāra Regula (EK) Nr. 73/2009, ar ko paredz kopējus noteikumus tiešā atbalsta shēmām saskaņā ar kopējo lauksaimniecības politiku un izveido dažas atbalsta shēmas lauksaimniekiem, kā arī groza Regulas (EK) Nr. 1290/2005, (EK) Nr. 247/2006, (EK) Nr. 378/2007 un atceļ Regulu (EK) Nr. 1782/2003 (OV L 30, 31.1.2009., 16. lpp.).
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/8 |
KOMISIJAS REGULA (ES) Nr. 1228/2014
(2014. gada 17. novembris),
ar ko piešķir un noraida atļaujas konkrētām veselīguma norādēm uz pārtikas produktiem, kuras attiecas uz slimības riska samazināšanu
(Dokuments attiecas uz EEZ)
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Eiropas Parlamenta un Padomes 2006. gada 20. decembra Regulu (EK) Nr. 1924/2006 par uzturvērtības un veselīguma norādēm uz pārtikas produktiem (1) un jo īpaši tās 17. panta 3. punktu,
tā kā:
|
(1) |
Saskaņā ar Regulu (EK) Nr. 1924/2006 veselīguma norādes uz pārtikas produktiem ir aizliegtas, ja vien Komisija tās nav atļāvusi saskaņā ar minēto regulu un tās nav iekļautas atļauto norāžu sarakstā. |
|
(2) |
Regulā (EK) Nr. 1924/2006 paredzēts arī, ka pārtikas apritē iesaistītie uzņēmēji veselīguma norāžu atļaujas pieteikumus var iesniegt dalībvalsts kompetentajai iestādei. Valsts kompetentajai iestādei ir jānosūta derīgie pieteikumi Eiropas Pārtikas nekaitīguma iestādei (EFSA) (turpmāk – “iestāde”). |
|
(3) |
Pēc pieteikuma saņemšanas iestāde par to nekavējoties informē pārējās dalībvalstis un Komisiju, kā arī sniedz atzinumu par attiecīgo veselīguma norādi. |
|
(4) |
Komisija, ņemot vērā iestādes sniegto atzinumu, lemj par atļaujas piešķiršanu veselīguma norādēm. |
|
(5) |
Pēc tam, kad uzņēmums Wrigley GmbH iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar to, kāda ietekme uz kaulu masas samazināšanos ir košļājamām tabletēm ar kalciju un D3 vitamīnu (jautājums Nr. EFSA-Q-2008-721) (2). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Košļājamās tabletes ar kalciju un D vitamīnu uzlabo kaulu blīvumu sievietēm no 50 gadu vecuma. Košļājamās tabletes var samazināt osteoporozes izraisītu kaulu lūzumu risku.” |
|
(6) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2009. gada 7. augustā, secināja, ka ir noteikta cēloņsakarība starp kalcija uzņemšanu, atsevišķi vai kopā ar D vitamīnu, un samazinātu kaulu minerālā blīvuma (KMB) zudumu sievietēm pēcmenopauzes periodā. Samazinot KMB zudumu, iespējams samazināt kaulu lūzumu risku. Līdz ar to divas veselīguma norādes, kas ir saskaņā ar šo secinājumu, būtu jāuzskata par atbilstošām Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, un tās būtu jāiekļauj Savienības atļauto norāžu sarakstā. Tomēr iestāde secināja, ka sniegtā informācija ir nepietiekama, lai norādēm noteiktu lietošanas nosacījumus. Pēc tam Komisija atkārtoti vērsās pie iestādes pēc ieteikuma, lai riska pārvaldītāji attiecīgajām veselīguma norādēm varētu noteikt piemērotus lietošanas nosacījumus. Atzinumā, kuru Komisija un dalībvalstis saņēma 2010. gada 17. maijā (jautājums Nr. EFSA-Q-2009-00940) (3), iestāde secināja, ka, lai iegūtu norādīto ietekmi, dienā nepieciešams uzņemt vismaz 1 200 mg kalcija no visiem avotiem vai vismaz 1 200 mg kalcija un 800 I.U. (20 μg) D vitamīna no visiem avotiem. |
|
(7) |
Ja veselīguma norāde attiecas tikai uz kalciju, ir lietderīgi noteikt lietošanas nosacījumus, kuri ļauj norādi lietot tikai uz produktiem, kas satur vismaz 400 mg kalcija noteiktā porcijā, tādējādi nodrošinot, ka pārtikas produkts sniedz ievērojamu kalcija daudzumu. |
|
(8) |
Ņemot vērā lielo D vitamīna devu (20 μg), kas jāuzņem, lai sasniegtu norādīto ietekmi, gadījumos, kad veselīguma norāde attiecas uz kalcija un D vitamīna kombināciju, ir lietderīgi atļaut norādes izmantošanu tikai uz uztura bagātinātājiem. Lai nodrošinātu, ka uztura bagātinātājs sniedz ievērojamu kalcija un D vitamīna daudzumu, saistībā ar šo norādi ir lietderīgi noteikt lietošanas nosacījumus, kas ļauj norādi lietot tikai uz uztura bagātinātājiem, kuri dienas devā nodrošina vismaz 400 mg kalcija un 15 μg D vitamīna. |
|
(9) |
Pēc tam, kad uzņēmums DSM Nutritional Products Europe AG iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā D vitamīnu un nokrišanas risku vīriešiem un sievietēm no 60 gadu vecuma (jautājums Nr. EFSA-Q-2010-01233) (4). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “D vitamīns samazina risku nokrist. Krišana ir riska faktors lūzumiem.” |
|
(10) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2011. gada 30. septembrī, secināja, ka ir noteikta cēloņsakarība starp D vitamīna uzņemšanu un nokrišanas riska samazināšanu, jo D vitamīns labvēlīgi ietekmē nestabilu stāju un muskuļu vājumu. Samazināt nokrišanas risku vīriešiem un sievietēm no 60 gadu vecuma ir labvēlīgi veselībai, jo samazinās risks gūt kaulu lūzumus. Līdz ar to veselīguma norāde, kas ir saskaņā ar šo secinājumu, būtu jāuzskata par atbilstošu Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, un tā būtu jāiekļauj Savienības atļauto norāžu sarakstā. |
|
(11) |
Iestāde savā atzinumā secināja arī, ka, lai iegūtu norādīto ietekmi, no visiem avotiem dienā nepieciešams uzņemt 800 I.U. (20 μg) D vitamīna. Ņemot vēra lielo D vitamīna devu (20 μg), kas jāuzņem, lai sasniegtu norādīto ietekmi, ir lietderīgi atļaut norādes izmantošanu tikai uz uztura bagātinātājiem. Lai nodrošinātu, ka uztura bagātinātājs sniedz ievērojamu D vitamīna daudzumu, saistībā ar šo norādi ir lietderīgi noteikt lietošanas nosacījumus, kas ļauj norādi lietot tikai uz uztura bagātinātājiem, kuri dienas devā nodrošina vismaz 15 μg D vitamīna. |
|
(12) |
Regulas (EK) Nr. 1924/2006 16. panta 4. punktā ir noteikts – ja atzinums ir labvēlīgs attiecībā uz atļaujas piešķiršanu veselīguma norādei, tajā būtu jāiekļauj konkrētas ziņas. Līdz ar to šīs ziņas par atļautajām veselīguma norādēm būtu jāiekļauj šīs regulas I pielikumā, un vajadzības gadījumā tajās jāiekļauj pārskatītais norādes formulējums, īpašie norādes lietošanas nosacījumi un attiecīgā gadījumā – pārtikas produkta lietošanas nosacījumi vai ierobežojumi un/vai papildu paziņojums vai brīdinājums saskaņā ar Regulas (EK) Nr. 1924/2006 noteikumiem un atbilstoši iestādes atzinumiem. |
|
(13) |
Viens no Regulas (EK) Nr. 1924/2006 mērķiem ir nodrošināt, lai veselīguma norādes ir patiesas, skaidras, uzticamas un lietderīgas patērētājam, un saistībā ar iepriekš minēto tiek ņemts vērā veselīguma norāžu formulējums un noformējums. Tāpēc gadījumos, kad norāžu formulējums patērētājiem nozīmē to pašu, ko veselīguma norāde, par kuru jau ir izsniegta atļauja, jo tas liecina, ka pastāv tāda pati saikne, kāda ir starp pārtikas produktu kategoriju, pārtikas produktu vai kādu tā sastāvdaļu un veselību, uz to būtu jāattiecina tādi paši lietošanas nosacījumi, kā minēts šīs regulas I pielikumā. |
|
(14) |
Pēc tam, kad uzņēmums GP International Holding B.V. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar glikozamīna hidrohlorīdu un palēninātu skrimšļu deģenerāciju (jautājums Nr. EFSA-Q-2009-00412) (5). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Palēnina/samazina muskuloskeletālās sistēmas skrimšļu sairšanas procesu, kā rezultātā samazinās osteoartrīta risks.” |
|
(15) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2009. gada 29. oktobrī, secināja, ka nav noteikta cēloņsakarība starp glikozamīna hidrohlorīda lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(16) |
Pēc tam, kad Eiropas Dabisko sojas produktu ražotāju asociācija (ENSA), Eiropas Augu proteīnu asociācija (EUVEPRO) un Sojas proteīnu asociācija (SPA) iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar izolētu sojas proteīnu ietekmi uz ZBL holesterīna koncentrācijas pazemināšanu asinīs (jautājums Nr. EFSA-Q-2011-00784) (6). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Ir pierādīts, ka proteīnbagātās sojas pupiņu sastāvdaļas pazemina/samazina holesterīna līmeni asinīs. Holesterīna līmeņa pazemināšana asinīs var samazināt risku saslimt ar sirds asinsvadu slimību.” |
|
(17) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2012. gada 2. februārī, secināja, ka nav noteikta cēloņsakarība starp izolēta sojas proteīna lietošanu pārtikā, kā to definējis pieteikuma iesniedzējs, un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(18) |
Pēc tam, kad uzņēmums Health Concern B.V. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar augu sterīnu un Cholesternorm®mix kombināciju un ZBL holesterīna koncentrācijas samazināšanu asinīs (jautājums Nr. EFSA-Q-2009-00237, EFSA-Q-2011-01114) (7). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Efektīvi samazina holesterīna līmeni asinīs.” |
|
(19) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2012. gada 17. jūlijā, secināja, ka nav noteikta cēloņsakarība starp augu sterīnu un Cholesternorm®mix kombinācijas lietošanu pārtikā atbilstīgi ierosinātajiem lietošanas nosacījumiem un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(20) |
Pēc tam, kad uzņēmums Minami Nutrition Health BVBA iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar eikozānpentaēnskābes (EPA) ietekmi uz arahidonskābes (AA)/EPA attiecības samazināšanu asinīs bērniem ar uzmanības deficīta un hiperaktivitātes sindromu (ADHD) (jautājums Nr. EFSA-Q-2012-00573) (8). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Ir pierādīts, ka EPA samazina AA/EPA attiecību asinīs. Augsts AA/EPA līmenis ir riska faktors uzmanības deficīta attīstībai bērniem, kuriem ir ADHD līdzīgi simptomi. Šiem bērniem ir arī raksturīgs zemāks hiperaktivitātes līmenis un/vai opozicionāla uzvedība.” |
|
(21) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2013. gada 8. aprīlī, secināja, ka norādes mērķgrupa ir slimi bērni (t. i., bērni ar ADHD) un norādītā ietekme attiecināma uz slimības ārstēšanu. |
|
(22) |
Regula (EK) Nr. 1924/2006 papildina Eiropas Parlamenta un Padomes 2000. gada 20. marta Direktīvas 2000/13/EK par dalībvalstu tiesību aktu tuvināšanu attiecībā uz pārtikas produktu marķēšanu, noformēšanu un reklāmu (9) vispārējos principus. Direktīvas 2000/13/EK 2. panta 1. punkta b) apakšpunktā ir noteikts, ka marķējumā sniegtā informācija nedrīkst piedēvēt pārtikas produktam spējas novērst, ārstēt vai izārstēt kādu cilvēka slimību vai atsaukties uz šādām spējām. Tā kā ārstniecisku īpašību piedēvēšana pārtikas produktiem ir aizliegta, ar eikozānpentaēnskābes (EPA) ietekmi uz AA/EPA attiecības samazināšanu asinīs bērniem ar ADHS saistītajai norādei nebūtu jāpiešķir atļauja. |
|
(23) |
Pēc tam, kad uzņēmums McNeil Nutritionals and Raisio Nutrition Ltd iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 14. panta 1. punkta a) apakšpunktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar to, ka, uzņemot 2 g augu stanola (augu stanola esteru) dienā kā diētas ar zemu piesātināto tauku saturu sastāvdaļu, ZBL holesterīna koncentrācija asinīs samazinās divas reizes vairāk, nekā tikai ievērojot diētu ar zemu piesātināto tauku saturu (jautājums Nr. EFSA-Q-2012-00915) (10). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Uzņemot 2 g augu stanolu (augu stanola esteru) dienā kā diētas ar zemu piesātināto tauku saturu sastavdalu, ZBL holesterīna koncentrācija samazinās divas reizes vairāk, nekā tikai ievērojot diētu ar zemu piesātināto tauku saturu. Augsts holesterīna līmenis ir riska faktors saslimšanai ar sirds un asinsvadu slimību.” |
|
(24) |
Pamatojoties uz iesniegtajiem datiem, iestāde atzinumā, kuru Komisija un dalībvalstis saņēma 2013. gada 8. aprīlī, secināja, ka pieteikuma iesniedzēja sniegtie pierādījumi nepierāda, ka uzņemot 2 g augu stanolu (augu stanola esteru) dienā kā diētas ar zemu piesātināto tauku saturu sastāvdaļu, ZBL holesterīna koncentrācija samazinās divas reizes vairāk, nekā tikai ievērojot diētu ar zemu piesātināto tauku saturu. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajām prasībām, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(25) |
Nosakot šajā regulā paredzētos pasākumus, Komisija ņēma vērā atsauksmes, ko tā saņēmusi no pieteikuma iesniedzējiem un sabiedrības pārstāvjiem saskaņā ar Regulas (EK) Nr. 1924/2006 16. panta 6. punktu. |
|
(26) |
Vielu pievienošanu pārtikas produktiem vai vielu izmantošanu pārtikas produktos, kā arī produktu klasificēšanu par pārtikas produktiem vai par zālēm reglamentē īpaši Savienības un valstu tiesību akti. Lēmumi par veselīguma norādēm saskaņā ar Regulu (EK) Nr. 1924/2006, piemēram, lēmums par iekļaušanu 14. panta 1. punktā minētajā atļauto norāžu sarakstā, nenozīmē ne tirdzniecības atļauju vielai, par kuru ir norāde, ne arī lēmumu par to, vai vielu var izmantot pārtikas produktos, ne konkrēta produkta klasifikāciju par pārtikas produktu. |
|
(27) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pārtikas aprites un dzīvnieku veselības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
1. Šīs regulas I pielikumā minētās veselīguma norādes ir atļauts lietot uz pārtikas produktiem Savienības tirgū saskaņā ar minētajā pielikumā paredzētajiem nosacījumiem.
2. Šā panta 1. punktā minētās veselīguma norādes iekļauj Regulas (EK) Nr. 1924/2006 14. panta 1. punktā paredzētajā Savienības atļauto norāžu sarakstā.
2. pants
Šīs regulas II pielikumā minētās veselīguma norādes neiekļauj Regulas (EK) Nr. 1924/2006 14. panta 1. punktā paredzētajā Savienības atļauto norāžu sarakstā.
3. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Komisijas vārdā –
priekšsēdētājs
Jean-Claude JUNCKER
(1) OV L 404, 30.12.2006., 9. lpp.
(2) EFSA Journal (2009); 1180, 1.–13. lpp.
(3) EFSA Journal (2010); 8(5):1609.
(4) EFSA Journal (2011); 9(9):2382.
(5) EFSA Journal 2009; 7(10):1358.
(6) EFSA Journal 2012; 10(2):2555.
(7) EFSA Journal 2012; 10(7):2810.
(8) EFSA Journal 2013; 11(4):3161.
(9) OV L 109, 6.5.2000., 29. lpp.
(10) EFSA Journal 2013; 11(4):3160.
I PIELIKUMS
Atļautās veselīguma norādes
|
Pieteikums – Regulas (EK) Nr. 1924/2006 attiecīgie noteikumi |
Pieteikuma iesniedzējs, adrese |
Uzturviela, viela, pārtikas produkts vai pārtikas produktu kategorija |
Norāde |
Norādes izmantošanas nosacījumi |
Pārtikas produkta lietošanas nosacījumi un/vai ierobežojumi un/vai papildu paziņojums vai brīdinājums |
Atsauce uz EFSA atzinumu |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Vācija |
Kalcijs |
Kalcijs palīdz samazināt kaulu minerālvielu zudumu sievietēm pēc menopauzes. Zems kaulu minerālais blīvums ir riska faktors osteoporotiskiem kaulu lūzumiem. |
Norādi var izmantot tikai pārtikas produktiem, kas noteiktā porcijā satur vismaz 400 mg kalcija. Patērētājam sniedz informāciju par to, ka norāde attiecināta tieši uz sievietēm no 50 gadu vecuma un ka labvēlīgo ietekmi panāk, dienā uzņemot vismaz 1 200 mg kalcija no visiem avotiem. |
Attiecībā uz pārtikas produktiem ar pievienotu papildu kalciju norādi var izmantot tikai tiem, kuru mērķgrupa ir sievietes no 50 gadu vecuma. |
Q-2008-721 Q- 2009-00940 |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Vācija |
Kalcijs un D vitamīns |
Kalcijs un D vitamīns palīdz samazināt kaulu minerālvielu zudumu sievietēm pēc menopauzes. Zems kaulu minerālais blīvums ir riska faktors osteoporotiskiem kaulu lūzumiem. |
Norādi var izmantot tikai uztura bagātinātājiem, kas dienas devā satur vismaz 400 mg kalcija un 15 μg D vitamīna. Patērētājam sniedz informāciju par to, ka norāde attiecināta tieši uz sievietēm no 50 gadu vecuma un ka labvēlīgo ietekmi panāk, dienā uzņemot vismaz 1 200 mg kalcija un 15 μg D vitamīna no visiem avotiem. |
Attiecībā uz uztura bagātinātājiem ar pievienotu papildu kalciju un D vitamīnu norādi var izmantot tiem, kuru mērķgrupa ir sievietes no 50 gadu vecuma. |
Q-2008-721 Q- 2009-00940 |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
DSM Nutritional Products Europe AG, P.O. Box 2676, 4002 Bāzele, Šveice |
D vitamīns |
D vitamīns samazina risku nokrist, jo tas ietekmē nestabilu stāju un muskuļu vājumu. Vīriešiem un sievietēm no 60 gadu vecuma nokrišana ir riska faktors kaulu lūzumiem. |
Norādi var izmantot tikai uztura bagātinātājiem, kas dienas devā satur vismaz 15 μg D vitamīna. Patērētājam sniedz informāciju par to, ka labvēlīgo ietekmi panāk, dienā uzņemot 20 μg D vitamīna no visiem avotiem. |
Attiecībā uz uztura bagātinātājiem ar pievienotu papildu D vitamīnu norādi var izmantot tikai tiem, kuru mērķgrupa ir vīrieši un sievietes no 60 gadu vecuma |
Q-2010-01233 |
II PIELIKUMS
Noraidītās veselīguma norādes
|
Pieteikums – Regulas (EK) Nr. 1924/2006 attiecīgie noteikumi |
Uzturviela, viela, pārtikas produkts vai pārtikas produktu kategorija |
Norāde |
Atsauce uz EFSA atzinumu |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Glikozamīna hidrohlorīds |
Palēnina/samazina muskuloskeletārās sistēmas skrimšļu sairšanas procesu, kā rezultātā samazina osteoartrīta risku. |
Q-2009-00412 |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Izolēts sojas proteīns |
Ir pierādīts, ka proteīnbagātas sojas pupiņu sastāvdaļas pazemina/samazina holesterīna līmeni asinīs; holesterīna līmeņa pazemināšana asinīs var samazināt risku saslimt ar sirds asinsvadu slimību. |
Q-2011-00784 |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Augu sterīnu un Cholesternorm®mix kombinācija |
Efektīvi samazina holesterīna līmeni. |
Q-2009-00237 Q-2011-01114 |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Eikozānpentaēnskābe (EPA) |
Ir pierādīts, ka EPA samazina AA/EPA attiecību asinīs. Augsts AA/EPA līmenis ir riska faktors uzmanības deficīta attīstībai bērniem, kuriem ir ADHD līdzīgi simptomi. Šiem bērniem ir arī raksturīgs zemāks hiperaktivitātes līmenis un/vai opozicionāra uzvedība. |
Q-2012-00573 |
|
14. panta 1. punkta a) apakšpunktā minētā veselīguma norāde, kas attiecas uz slimības riska samazināšanu |
Augu stanoli (augu stanola esteri) |
Uzņemot 2 g augu stanolu (augu stanola esteru) dienā kā diētas ar zemu piesātināto tauku saturu sastāvdaļu, ZBL holesterīna koncentrācija samazinās divas reizes vairāk, nekā tikai ievērojot diētu ar zemu piesātināto tauku saturu. Augsts holesterīna līmenis ir riska faktors saslimšanai ar sirds asinsvadu slimību. |
Q-2012-00915 |
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/14 |
KOMISIJAS REGULA (ES) Nr. 1229/2014
(2014. gada 17. novembris)
par atteikumu piešķirt atļauju konkrētām veselīguma norādēm uz pārtikas produktiem, kuras neattiecas uz slimības riska samazināšanu un uz bērnu attīstību un veselību
(Dokuments attiecas uz EEZ)
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Eiropas Parlamenta un Padomes 2006. gada 20. decembra Regulu (EK) Nr. 1924/2006 par uzturvērtības un veselīguma norādēm uz pārtikas produktiem (1) un jo īpaši tās 18. panta 5. punktu,
tā kā:
|
(1) |
Saskaņā ar Regulu (EK) Nr. 1924/2006 veselīguma norādes uz pārtikas produktiem ir aizliegtas, ja vien Komisija tās nav atļāvusi saskaņā ar minēto regulu un tās nav iekļautas atļauto norāžu sarakstā. |
|
(2) |
Regulā (EK) Nr. 1924/2006 arī paredzēts, ka pārtikas apritē iesaistītie uzņēmēji veselīguma norāžu atļaujas pieteikumus var iesniegt dalībvalsts kompetentajai iestādei. Valsts kompetentajai iestādei ir jānosūta derīgie pieteikumi Eiropas Pārtikas nekaitīguma iestādei (EFSA) (turpmāk – “iestāde”) zinātniskā novērtējuma veikšanai, kā arī Komisijai un dalībvalstīm informācijai. |
|
(3) |
Iestāde sniedz atzinumu par attiecīgo veselīguma norādi. |
|
(4) |
Komisija, ņemot vērā iestādes sniegto atzinumu, lemj par atļaujas piešķiršanu veselīguma norādēm. |
|
(5) |
Pēc tam, kad uzņēmums Italsur s.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar Toskānas melno lapu kāpostu, trīskrāsu Šveices mangoldu, divkrāsu spinātu un Savojas zilo kāpostu kombinācijas ietekmi uz asins lipīdu aizsardzību pret oksidācijas izraisītiem bojājumiem (jautājums Nr. EFSA-Q-2013-00574) (2). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Palīdz aizsargāt asins lipīdus pret oksidācijas izraisītiem bojājumiem”. |
|
(6) |
Komisija un dalībvalstis 2013. gada 30. oktobrī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp Toskānas melno lapu kāpostu, trīskrāsu Šveices mangoldu, divkrāsu spinātu un Savojas zilo kāpostu kombinācijas lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(7) |
Pēc tam, kad uzņēmums Italsur s.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar sarkano spinātu, zaļo spinātu, sarkano cigoriņu, zaļo cigoriņu, zaļlapu mangoldu, sarkanlapu mangoldu, sarkano Šveices mangoldu, dzelteno Šveices mangoldu un balto Šveices mangoldu kombinācijas ietekmi uz asins lipīdu aizsardzību pret oksidācijas izraisītiem bojājumiem (jautājums Nr. EFSA-Q-2013-00575) (3). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Palīdz aizsargāt asins lipīdus pret oksidācijas izraisītiem bojājumiem”. |
|
(8) |
Komisija un dalībvalstis 2013. gada 30. oktobrī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp sarkano spinātu, zaļo spinātu, sarkano cigoriņu, zaļo cigoriņu, zaļlapu mangoldu, sarkanlapu mangoldu, sarkano Šveices mangoldu, dzelteno Šveices mangoldu un balto Šveices mangoldu kombinācijas lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(9) |
Pēc tam, kad uzņēmums Italsur s.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar Toskānas melno lapu kāpostu, “trīskrāsu” Šveices mangoldu, “divkrāsu” spinātu un Savojas zilo kāpostu kombinācijas ietekmi uz normālas ZBL holesterīna koncentrācijas saglabāšanu asinīs (jautājums Nr. EFSA-Q-2013-00576) (4). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Saglabā normālu holesterīna koncentrāciju asinīs”. |
|
(10) |
Komisija un dalībvalstis 2013. gada 30. oktobrī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp Toskānas melno lapu kāpostu, “trīskrāsu” Šveices mangoldu, “divkrāsu” spinātu un Savojas zilo kāpostu kombinācijas lietošanu pārtikā un norādīto ietekmi. Līdz ar to minētā veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(11) |
Pēc tam, kad uzņēmums Italsur s.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar sarkano spinātu, zaļo spinātu, sarkano cigoriņu, zaļo cigoriņu, zaļlapu mangoldu, sarkanlapu mangoldu, sarkano Šveices mangoldu, dzelteno Šveices mangoldu un balto Šveices mangoldu kombinācijas ietekmi uz normālas ZBL holesterīna koncentrācijas saglabāšanu asinīs (jautājums Nr. EFSA-Q-2013-00579) (5). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Saglabā normālu holesterīna koncentrāciju asinīs”. |
|
(12) |
Komisija un dalībvalstis 2013. gada 30. oktobrī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp sarkano spinātu, zaļo spinātu, sarkano cigoriņu, zaļo cigoriņu, zaļlapu mangoldu, sarkanlapu mangoldu, sarkano Šveices mangoldu, dzelteno Šveices mangoldu un balto Šveices mangoldu kombinācijas lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(13) |
Pēc tam, kad uzņēmums Omikron Italia S.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar diosmīna, trokserutīna un hesperidīna kombinācijas ietekmi uz normālas venozo kapilāru caurlaidības uzturēšanu (jautājums Nr. EFSA-Q-2013-00353) (6). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Flavonoīdu maisījums, kas satur 300 mg diosmīna, 300 mg trokserutīna un 100 mg hesperidīna, ir lietderīga palīgviela, lai uzturētu venozo kapilāru fizioloģisku caurlaidību”. |
|
(14) |
Komisija un dalībvalstis 2014. gada 13. janvārī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp diosmīna, trokserutīna un hesperidīna kombinācijas lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(15) |
Pēc tam, kad uzņēmums Omikron Italia S.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar diosmīna, trokserutīna un hesperidīna kombinācijas ietekmi uz normāla venozā tonusa uzturēšanu (jautājums Nr. EFSA-Q-2013-00354) (7). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Flavonoīdu maisījums, kas satur 300 mg diosmīna, 300 mg trokserutīna un 100 mg hesperidīna, ir lietderīga palīgviela, lai uzturētu fizioloģisku venozo tonusu”. |
|
(16) |
Komisija un dalībvalstis 2014. gada 13. janvārī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp diosmīna, trokserutīna un hesperidīna kombinācijas lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(17) |
Pēc tam, kad uzņēmums Italsur s.r.l. iesniedza pieteikumu saskaņā ar Regulas (EK) Nr. 1924/2006 13. panta 5. punktu, iestādei lūdza sniegt atzinumu par veselīguma norādi saistībā ar miežu zupas Orzotto ietekmi uz asins lipīdu aizsardzību pret oksidācijas izraisītiem bojājumiem (jautājums Nr. EFSA-Q-2013-00578) (8). Pieteikuma iesniedzējs ierosināja šādu norādes formulējumu: “Palīdz aizsargāt asins lipīdus pret oksidācijas izraisītiem bojājumiem”. |
|
(18) |
Komisija un dalībvalstis 2014. gada 10. janvārī saņēma iestādes zinātnisko atzinumu, kurā tā, pamatojoties uz iesniegtajiem datiem, secināja, ka nav noteikta cēloņsakarība starp miežu zupas Orzotto lietošanu pārtikā un norādīto ietekmi. Līdz ar to veselīguma norāde neatbilst Regulā (EK) Nr. 1924/2006 noteiktajiem kritērijiem, tādēļ tai nebūtu jāpiešķir atļauja. |
|
(19) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pārtikas aprites un dzīvnieku veselības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Šīs regulas pielikumā minētās veselīguma norādes neiekļauj Regulas (EK) Nr. 1924/2006 13. panta 3. punktā paredzētajā Savienības atļauto norāžu sarakstā.
2. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Komisijas vārdā –
priekšsēdētājs
Jean-Claude JUNCKER
(1) OV L 404, 30.12.2006., 9. lpp.
(2) The EFSA Journal 2013;11(10):3413.
(3) The EFSA Journal 2013;11(10):3414.
(4) The EFSA Journal 2013;11(10):3415.
(5) The EFSA Journal 2013;11(10):3416.
(6) The EFSA Journal 2014;12(1):3511.
(7) The EFSA Journal 2014;12(1):3512.
(8) The EFSA Journal 2014;12(1):3519.
PIELIKUMS
Noraidītās veselīguma norādes
|
Pieteikums – Regulas (EK) Nr. 1924/2006 attiecīgie noteikumi |
Uzturviela, viela, pārtikas produkts vai pārtikas produktu kategorija |
Norāde |
Atsauce uz EFSA atzinumu |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Toskānas melno lapu kāpostu, “trīskrāsu” Šveices mangoldu, “divkrāsu” spinātu un Savojas zilo kāpostu kombinācija |
Palīdz aizsargāt asins lipīdus pret oksidācijas izraisītiem bojājumiem |
Q-2013-00574 |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Sarkano spinātu, zaļo spinātu, sarkano cigoriņu, zaļo cigoriņu, zaļlapu mangoldu, sarkanlapu mangoldu, sarkano Šveices mangoldu, dzelteno Šveices mangoldu un balto Šveices mangoldu kombinācija |
Palīdz aizsargāt asins lipīdus pret oksidācijas izraisītiem bojājumiem |
Q-2013-00575 |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Toskānas melno lapu kāpostu, “trīskrāsu” Šveices mangoldu, “divkrāsu” spinātu un Savojas zilo kāpostu kombinācija |
Saglabā normālu holesterīna koncentrāciju asinīs |
Q-2013-00576 |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Sarkano spinātu, zaļo spinātu, sarkano cigoriņu, zaļo cigoriņu, zaļlapu mangoldu, sarkanlapu mangoldu, sarkano Šveices mangoldu, dzelteno Šveices mangoldu un balto Šveices mangoldu kombinācija |
Saglabā normālu holesterīna koncentrāciju asinīs |
Q-2013-00579 |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Diosmīna, trokserutīna un hesperidīna kombinācija |
Flavonoīdu maisījums, kas satur 300 mg diosmīna, 300 mg trokserutīna un 100 mg hesperidīna, ir lietderīga palīgviela, lai uzturētu venozo kapilāru fizioloģisku caurlaidību |
Q-2013-00353 |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Diosmīna, trokserutīna un hesperidīna kombinācija |
Flavonoīdu maisījums, kas satur 300 mg diosmīna, 300 mg trokserutīna un 100 mg hesperidīna, ir lietderīga palīgviela, lai uzturētu fizioloģisku venozo tonusu |
Q-2013-00354 |
|
Veselīguma norāde saskaņā ar 13. panta 5. punktu, kas pamatota ar jaunākajām zinātniskām atziņām un/vai ietver prasību pēc īpašumtiesību datu aizsardzības |
Miežu zupa Orzotto |
Palīdz aizsargāt asins lipīdus pret oksidācijas izraisītiem bojājumiem |
Q-2013-00578 |
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/18 |
KOMISIJAS ĪSTENOŠANAS REGULA (ES) Nr. 1230/2014
(2014. gada 17. novembris)
par atļauju izmantot vara bilizinātu kā barības piedevu visu sugu dzīvniekiem
(Dokuments attiecas uz EEZ)
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Eiropas Parlamenta un Padomes 2003. gada 22. septembra Regulu (EK) Nr. 1831/2003 par dzīvnieku ēdināšanā lietotām piedevām (1) un jo īpaši tās 9. panta 2. punktu,
tā kā:
|
(1) |
Regulā (EK) Nr. 1831/2003 ir noteikts, ka dzīvnieku ēdināšanā lietotām piedevām vajadzīga atļauja, un paredzēts šādas atļaujas piešķiršanas pamatojums un kārtība. |
|
(2) |
Saskaņā ar Regulas (EK) Nr. 1831/2003 7. pantu tika iesniegts pieteikums, lai saņemtu atļauju vara bilizināta lietošanai. Minētajam pieteikumam bija pievienotas Regulas (EK) Nr. 1831/2003 7. panta 3. punktā prasītās ziņas un dokumenti. |
|
(3) |
Pieteikums attiecas uz atļauju vara bilizinātam, lai to lietotu kā barības piedevu visām dzīvnieku sugām un klasificētu piedevu kategorijā “uzturfizioloģiskās piedevas”. |
|
(4) |
Eiropas Pārtikas nekaitīguma iestāde (turpmāk “Iestāde”) 2014. gada 3. jūlija atzinumā (2) secināja, ka ieteiktajos lietošanas apstākļos vara bilizināts kaitīgi neietekmē dzīvnieku veselību, cilvēku veselību vai vidi un ka to var uzskatīt par vērtīgu vara avotu visām dzīvnieku sugām. Iestāde uzskata, ka nav vajadzības noteikt īpašas prasības uzraudzībai pēc piedevas laišanas tirgū. Iestāde pārbaudīja arī ziņojumu par barībā esošās barības piedevas analīzes metodi, ko iesniegusi ar Regulu (EK) Nr. 1831/2003 izveidotā references laboratorija. |
|
(5) |
Vara bilizināta novērtējums liecina, ka Regulas (EK) Nr. 1831/2003 5. pantā paredzētie atļaujas piešķiršanas nosacījumi ir izpildīti. Tādēļ šo vielu būtu jāļauj lietot atbilstīgi šīs regulas pielikumam. |
|
(6) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Augu, dzīvnieku, pārtikas aprites un dzīvnieku barības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Pielikumā minēto vielu, kas ietilpst barības piedevu kategorijā “uzturfizioloģiskās piedevas” un funkcionālajā grupā “mikroelementu maisījumi”, ir atļauts izmantot kā barības piedevu atbilstīgi pielikumā izklāstītajiem nosacījumiem.
2. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Komisijas vārdā –
priekšsēdētājs
Jean-Claude JUNCKER
(1) OV L 268, 18.10.2003., 29. lpp.
(2) EFSA Journal 2014; 12(7):3796.
PIELIKUMS
|
Piedevas identifikācijas numurs |
Atļaujas turētāja nosaukums |
Piedeva |
Sastāvs, ķīmiskā formula, apraksts, analītiskā metode |
Dzīvnieku suga vai kategorija |
Maksimālais vecums |
Minimālais saturs |
Maksimālais saturs |
Citi noteikumi |
Atļaujas derīguma termiņš |
||||||||||||||||||||||||||||
|
Elementa (Cu) saturs mg/kg kompleksās barības ar 12 % mitruma saturu |
|||||||||||||||||||||||||||||||||||||
|
Uzturfizioloģisko piedevu kategorija. Funkcionālā grupa: mikroelementu maisījumi |
|||||||||||||||||||||||||||||||||||||
|
3b411 |
— |
Vara bilizināts |
Piedevas raksturojums Pulveris vai granulas, kas satur ≥ 14,5 % vara un ≥ 84,0 % lizīna. Darbīgās vielas raksturojums L-lizināta-HCL vara helāts Ķīmiskā formula: Cu(C6H13N2O2)2 × 2HCl CAS numurs: 53383-24-7 Analītiskās metodes (1) Lizīna satura kvantitatīvai noteikšanai piedevā:
Kopējā vara daudzuma kvantitatīvai noteikšanai piedevā un premiksos:
Kopējā vara daudzuma kvantitatīvai noteikšanai barības sastāvdaļās un kombinētajā barībā:
|
Visas dzīvnieku sugas |
— |
— |
Liellopi:
Aitas: 15 (kopā). Sivēni līdz 12 nedēļām: 170 (kopā). Vēžveidīgie: 50 (kopā). Citi dzīvnieki: 25 (kopā). |
|
2024. gada 8. decembris |
||||||||||||||||||||||||||||
(1) Sīkāka informācija par analītiskajām metodēm atrodama references laboratorijas tīmekļa vietnē: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports.
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/22 |
KOMISIJAS ĪSTENOŠANAS REGULA (ES) Nr. 1231/2014
(2014. gada 17. novembris),
ar kuru nosaka standarta importa vērtības atsevišķu veidu augļu un dārzeņu ievešanas cenas noteikšanai
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Eiropas Parlamenta un Padomes 2013. gada 17. decembra Regulu (ES) Nr. 1308/2013, ar ko izveido lauksaimniecības produktu tirgu kopīgu organizāciju un atceļ Padomes Regulas (EEK) Nr. 922/72, (EEK) Nr. 234/79, (EK) Nr. 1037/2001 un (EK) Nr. 1234/2007 (1),
ņemot vērā Komisijas 2011. gada 7. jūnija Īstenošanas regulu (ES) Nr. 543/2011, ar ko nosaka sīki izstrādātus noteikumus Padomes Regulas (EK) Nr. 1234/2007 piemērošanai attiecībā uz augļu un dārzeņu un pārstrādātu augļu un dārzeņu nozari (2), un jo īpaši tās 136. panta 1. punktu,
tā kā:
|
(1) |
Īstenošanas regulā (ES) Nr. 543/2011, piemērojot Urugvajas kārtas daudzpusējo tirdzniecības sarunu iznākumu, paredzēti kritēriji, pēc kuriem Komisija nosaka standarta importa vērtības minētās regulas XVI pielikuma A daļā norādītajiem produktiem no trešām valstīm un laika periodiem. |
|
(2) |
Standarta importa vērtību aprēķina katru darbdienu saskaņā ar Īstenošanas regulas (ES) Nr. 543/2011 136. panta 1. punktu, ņemot vērā mainīgos dienas datus. Tāpēc šai regulai būtu jāstājas spēkā dienā, kad to publicē Eiropas Savienības Oficiālajā Vēstnesī, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Standarta importa vērtības, kas paredzētas Īstenošanas regulas (ES) Nr. 543/2011 136. pantā, ir tādas, kā norādīts šīs regulas pielikumā.
2. pants
Šī regula stājas spēkā dienā, kad to publicē Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2014. gada 17. novembrī
Komisijas
un tās priekšsēdētāja vārdā –
lauksaimniecības un lauku attīstības ģenerāldirektors
Jerzy PLEWA
(1) OV L 347, 20.12.2013., 671. lpp.
(2) OV L 157, 15.6.2011., 1. lpp.
PIELIKUMS
Standarta importa vērtības atsevišķu veidu augļu un dārzeņu ievešanas cenas noteikšanai
|
(EUR/100 kg) |
||
|
KN kods |
Trešās valsts kods (1) |
Standarta importa vērtība |
|
0702 00 00 |
AL |
94,9 |
|
MA |
77,1 |
|
|
MK |
78,8 |
|
|
ZZ |
83,6 |
|
|
0707 00 05 |
AL |
67,4 |
|
JO |
194,1 |
|
|
TR |
128,5 |
|
|
ZZ |
130,0 |
|
|
0709 93 10 |
AL |
65,0 |
|
MA |
52,3 |
|
|
TR |
125,4 |
|
|
ZZ |
80,9 |
|
|
0805 20 10 |
MA |
130,6 |
|
ZZ |
130,6 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
TR |
74,4 |
|
ZZ |
74,4 |
|
|
0805 50 10 |
TR |
78,7 |
|
ZZ |
78,7 |
|
|
0806 10 10 |
BR |
293,5 |
|
LB |
337,2 |
|
|
PE |
282,9 |
|
|
TR |
149,1 |
|
|
US |
303,0 |
|
|
ZZ |
273,1 |
|
|
0808 10 80 |
BR |
54,0 |
|
CA |
135,3 |
|
|
CL |
80,6 |
|
|
MD |
29,7 |
|
|
NZ |
144,2 |
|
|
US |
102,4 |
|
|
ZA |
108,6 |
|
|
ZZ |
93,5 |
|
|
0808 30 90 |
CN |
75,6 |
|
ZZ |
75,6 |
|
(1) Valstu nomenklatūra, kas paredzēta Komisijas 2012. gada 27. novembra Regulā (ES) Nr. 1106/2012, ar ko attiecībā uz valstu un teritoriju nomenklatūras atjaunināšanu īsteno Eiropas Parlamenta un Padomes Regulu (EK) Nr. 471/2009 par Kopienas statistiku attiecībā uz ārējo tirdzniecību ar ārpuskopienas valstīm (OV L 328, 28.11.2012., 7. lpp.). Kods “ZZ” nozīmē “cita izcelsme”.
LĒMUMI
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/24 |
PADOMES LĒMUMS 2014/800/KĀDP
(2014. gada 17. novembris)
par Eiropas Savienības padomdevējas misijas civilās drošības sektora reformai Ukrainā (EUAM Ukraine) sākšanu un Lēmuma 2014/486/KĀDP grozīšanu
EIROPAS SAVIENĪBAS PADOME,
ņemot vērā Līgumu par Eiropas Savienību un jo īpaši tā 28. pantu, 42. panta 4. punktu un 43. panta 2. punktu,
ņemot vērā Padomes Lēmumu 2014/486/KĀDP (2014. gada 22. jūlijs) par Eiropas Savienības padomdevēju misiju civilās drošības sektora reformai Ukrainā (EUAM Ukraine) (1) un jo īpaši tā 4. pantu,
ņemot vērā Savienības Augstās pārstāves ārlietās un drošības politikas jautājumos priekšlikumu,
tā kā:
|
(1) |
Padome 2014. gada 22. jūlijā pieņēma Lēmumu 2014/486/KĀDP. |
|
(2) |
Padome 2014. gada 20. oktobrī apstiprināja EUAM Ukraine operācijas plānu. |
|
(3) |
Pēc civilā operāciju komandiera ieteikuma un pēc tam, kad EUAM Ukraine ir sasniegusi operatīvās spējas, EUAM Ukraine būtu jāsāk 2014. gada 1. decembrī. |
|
(4) |
Lēmumā 2014/486/KĀDP laikposmam līdz 2014. gada 30. novembrim bija paredzēta finanšu atsauces summa EUR 2 680 000 apmērā. Būtu jāparedz jauna finanšu atsauces summa 12 mēnešu laikposmam, sākot ar 2014. gada 1. decembri. Tāpēc būtu jāgroza Lēmums 2014/486/KĀDP. |
|
(5) |
EUAM Ukraine tiks īstenota situācijā, kas var pasliktināties un varētu kavēt Līguma 21. pantā izklāstīto Savienības ārējās darbības mērķu sasniegšanu, |
IR PIEŅĒMUSI ŠO LĒMUMU.
1. pants
Eiropas Savienības padomdevēja misija civilās drošības sektora reformai Ukrainā (EUAM Ukraine) tiks sākta 2014. gada 1. decembrī.
2. pants
Ar šo EUAM Ukraine civilais operāciju komandieris nekavējoties tiek pilnvarots sākt operācijas īstenošanu.
3. pants
Lēmuma 2014/486/KĀDP 14. panta 1. punktu aizstāj ar šādu:
“1. Finanšu atsauces summa, kas paredzēta, lai ar EUAM Ukraine saistītus izdevumus segtu līdz 2014. gada 30. novembrim, ir EUR 2 680 000. Finanšu atsauces summa, kas paredzēta, lai ar EUAM Ukraine saistītus izdevumus segtu laikposmā no 2014. gada 1. decembra līdz 2015. gada 30. novembrim, ir EUR 13 100 000. Par finanšu atsauces summu turpmākajiem laikposmiem lēmumu pieņem Padome.”
4. pants
Šis lēmums stājas spēkā tā pieņemšanas dienā.
Briselē, 2014. gada 17. novembrī
Padomes vārdā –
Priekšsēdētāja
F. MOGHERINI
(1) OV L 217, 23.7.2014., 42. lpp.
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/26 |
PADOMES LĒMUMS 2014/801/KĀDP
(2014. gada 17. novembris),
ar kuru groza Lēmumu 2014/145/KĀDP par ierobežojošiem pasākumiem attiecībā uz darbībām, ar ko tiek grauta vai apdraudēta Ukrainas teritoriālā integritāte, suverenitāte un neatkarība
EIROPAS SAVIENĪBAS PADOME,
ņemot vērā Līgumu par Eiropas Savienību un jo īpaši tā 29. pantu,
tā kā:
|
(1) |
Padome 2014. gada 17. martā pieņēma Lēmumu 2014/145/KĀDP (1). |
|
(2) |
Būtu jāgroza informācija par vienu personu, kas saskaņā ar Lēmumu 2014/145/KĀDP ir iekļauta sarakstā. |
|
(3) |
Tādēļ attiecīgi būtu jāgroza Lēmuma 2014/145/KĀDP pielikums, |
IR PIEŅĒMUSI ŠO LĒMUMU.
1. pants
Ar šo Lēmuma 2014/145/KĀDP pielikumu groza tā, kā izklāstīts šā lēmuma pielikumā.
2. pants
Šis lēmums stājas spēkā nākamajā dienā pēc tā publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Briselē, 2014. gada 17. novembrī
Padomes vārdā –
Priekšsēdētāja
F. MOGHERINI
(1) Padomes Lēmums 2014/145/KĀDP (2014. gada 17. marts) par ierobežojošiem pasākumiem attiecībā uz darbībām, ar ko tiek grauta vai apdraudēta Ukrainas teritoriālā integritāte, suverenitāte un neatkarība (OV L 78, 17.3.2014., 16. lpp.).
PIELIKUMS
Ierakstu attiecībā uz šo Lēmuma 2014/145/KĀDP pielikumā minēto personu aizstāj ar šādu:
|
|
Vārds |
Identifikācijas informācija |
Pamatojums |
Sarakstā iekļaušanas datums |
|
|
“Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Dzimis 25.4.1946.Almaty (iepriekš arī zināma kā Alma-Ata) Kazahstānā. |
Valsts Domes Padomes loceklis; Krievijas Liberāldemokrātiskās partijas vadītājs. Aktīvi atbalstīja Krievijas bruņoto spēku izmantošanu Ukrainā un Krimas aneksiju. Aktīvi aicinājis sadalīt Ukrainu. Viņa vadītās Krievijas Liberāldemokrātiskās partijas vārdā parakstījis nolīgumu ar t. s. “Doņeckas Tautas Republiku”. |
12.9.2014.” |
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/28 |
KOMISIJAS ĪSTENOŠANAS LĒMUMS
(2014. gada 14. novembris),
ar kuru groza Lēmumu 2010/470/ES un 2010/472/ES attiecībā uz tām dzīvnieku veselības prasībām saistībā ar skrepi slimību, kas noteiktas attiecībā uz aitu un kazu embriju tirdzniecību un importu Savienībā
(izziņots ar dokumenta numuru C(2014) 8339)
(Dokuments attiecas uz EEZ)
(2014/802/ES)
EIROPAS KOMISIJA,
ņemot vērā Līgumu par Eiropas Savienības darbību,
ņemot vērā Padomes 1992. gada 13. jūlija Direktīvu 92/65/EEK, ar ko paredz dzīvnieku veselības prasības attiecībā uz tādu dzīvnieku, spermas, olšūnu un embriju tirdzniecību un importu Kopienā, uz kuriem neattiecas dzīvnieku veselības prasības, kas paredzētas īpašos Kopienas noteikumos, kuri minēti Direktīvas 90/425/EEK (1) A(I) pielikumā, un jo īpaši tās 11. panta 3. punkta trešo ievilkumu, 17. panta 2. punkta b) apakšpunktu, 18. panta 1. punkta pirmo ievilkumu un 19. panta ievadteikumu un b) apakšpunktu,
tā kā:
|
(1) |
Komisijas Lēmuma 2010/470/ES (2) IV pielikuma A daļā iekļauts veselības sertifikāta paraugs Savienības iekšējai tirdzniecībai ar aitu un kazu tādu olšūnu un embriju sūtījumiem, kuri iegūti vai sagatavoti pēc 2010. gada 31. augusta. |
|
(2) |
Komisijas Lēmuma 2010/472/ES (3) IV pielikuma 2. daļā iekļauts veselības sertifikāta paraugs aitu un kazu olšūnu un embriju sūtījumu importam Savienībā. |
|
(3) |
Eiropas Parlamenta un Padomes Regulā (EK) Nr. 999/2001 (4) ir paredzēti noteikumi transmisīvo sūkļveida encefalopātiju (TSE) profilaksei, kontrolei un apkarošanai liellopiem, aitām un kazām. Minētās regulas VIII pielikuma A nodaļā paredzēti nosacījumi attiecībā uz Savienības iekšējo tirdzniecību ar dzīviem dzīvniekiem, spermu un embrijiem. Turklāt minētās regulas IX pielikumā paredzēti nosacījumi dzīvu dzīvnieku, embriju, olšūnu un dzīvnieku izcelsmes produktu importēšanai Savienībā no trešām valstīm. |
|
(4) |
Ņemot vērā jaunākos zinātniskos pierādījumus, Regula (EK) Nr. 999/2001 tika grozīta ar Komisijas Regulu (ES) Nr. 630/2013 (5). Minētie grozījumi attiecībā uz skrepi slimību tika ņemti vērā Komisijas Īstenošanas lēmuma 2013/470/ES (6) veselības sertifikāta paraugā Savienības iekšējai tirdzniecībai ar aitu un kazu olšūnu un embriju sūtījumiem, kas iekļauts Lēmuma 2010/470/ES IV pielikuma A daļā, un veselības sertifikāta paraugā aitu un kazu olšūnu un embriju sūtījumu importam Savienībā, kas iekļauts Lēmuma 2010/472/ES IV pielikuma 2. daļā, piemērojot pārejas periodu līdz 2014. gada 31. decembrim. |
|
(5) |
Eiropas Pārtikas nekaitīguma iestāde (EFSA) 2013. gada 24. janvārī pieņēma atzinumu par klasiskā skrepi pārnešanas risku, transplantējot in vivo iegūtus embrijus aitām, kurā tā secināja, ka klasiskā skrepi pārnešanas risks, transplantējot aitu homozigotiskos vai heterozogotiskos ARR embrijus, ir uzskatāms par nenozīmīgu, ja tiek ievēroti OIE ieteikumi un procedūras saistībā ar embriju transplantāciju; ņemot vērā šo atzinumu, attiecīgie Regulas (EK) Nr. 999/2001 noteikumi tika grozīti ar Komisijas Regulu (ES) Nr. 1148/2014 (7). |
|
(6) |
Tādēļ, lai atspoguļotu prasības, kas noteiktas Regulā (EK) Nr. 999/2001, kura grozīta ar Regulu (ES) Nr. 1148/2014, būtu jāgroza veselības sertifikāta paraugs Lēmuma 2010/470/ES IV pielikuma A daļā, kas paredzēts Savienības iekšējai tirdzniecībai ar aitu un kazu olšūnām un embrijiem, un veselības sertifikāta paraugs Lēmuma 2010/472/ES IV pielikuma 2. daļā, kas paredzēts aitu un kazu olšūnu un embriju sūtījumu importēšanai Savienībā. |
|
(7) |
Turklāt, lai novērstu jebkādu divdomību, Lēmuma 2010/470/ES IV pielikuma A daļā iekļautajā veselības sertifikāta paraugā Savienības iekšējai tirdzniecībai ar aitu un kazu olšūnu un embriju sūtījumiem ir jāgroza dažas atsauces uz Regulu (EK) Nr. 999/2001. |
|
(8) |
Papildus iepriekšminētajam, ir vajadzīgs precīzāks formulējums Lēmuma 2010/472/ES IV pielikuma 2. daļā iekļautajā veselības sertifikāta paraugā aitu un kazu olšūnu un embriju sūtījumu importam Savienībā, lai tādējādi nodrošinātu skaidru izpratni par to, ka testēšanas režīmi, kas attiecas uz epizootisko hemorāģisko slimību (EHD), ir attiecināmi uz donoraitām un donorkazām. |
|
(9) |
Tādēļ būtu attiecīgi jāgroza Lēmums 2010/470/ES un 2010/472/ES. |
|
(10) |
Šajā lēmumā paredzētie pasākumi ir saskaņā ar Pārtikas aprites un dzīvnieku veselības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO LĒMUMU.
1. pants
Lēmuma 2010/470/ES IV pielikumu groza saskaņā ar šā lēmuma I pielikumu.
2. pants
Lēmuma 2010/472/ES IV pielikumu groza saskaņā ar šā lēmuma II pielikumu.
3. pants
Šis lēmums stājas spēkā 2015. gada 1. janvārī.
4. pants
Šis lēmums ir adresēts dalībvalstīm.
Briselē, 2014. gada 14. novembrī
Komisijas vārdā –
Komisijas loceklis
Vytenis ANDRIUKAITIS
(1) OV L 268, 14.9.1992., 54. lpp.
(2) Komisijas 2010. gada 26. augusta Lēmums 2010/470/ES, ar ko nosaka veselības sertifikātu paraugus zirgu dzimtas dzīvnieku, aitu un kazu spermas, olšūnu un embriju un cūku dzimtas dzīvnieku olšūnu un embriju tirdzniecībai Eiropas Savienībā (OV L 228, 31.8.2010., 15. lpp.).
(3) Komisijas 2010. gada 26. augusta Lēmums 2010/472/ES par aitu un kazu spermas, olšūnu un embriju importu Eiropas Savienībā (OV L 228, 31.8.2010., 74. lpp.).
(4) Eiropas Parlamenta un Padomes 2001. gada 22. maija Regula (EK) Nr. 999/2001, ar ko paredz noteikumus dažu transmisīvo sūkļveida encefalopātiju profilaksei, kontrolei un apkarošanai (OV L 147, 31.5.2001., 1. lpp.).
(5) Komisijas 2013. gada 28. jūnija Regula (ES) Nr. 630/2013, ar kuru groza pielikumus Eiropas Parlamenta un Padomes Regulai (EK) Nr. 999/2001, ar ko paredz noteikumus dažu transmisīvo sūkļveida encefalopātiju profilaksei, kontrolei un apkarošanai (OV L 179, 29.6.2013., 60. lpp.).
(6) Komisijas 2013. gada 20. septembra Īstenošanas lēmums 2013/470/ES, ar kuru groza Lēmumu 2010/470/ES un 2010/472/ES attiecībā uz tām dzīvnieku veselības prasībām saistībā ar skrepi slimību, kas noteiktas attiecībā uz aitu un kazu spermas, olšūnu un embriju tirdzniecību un importu Savienībā (OV L 252, 24.9.2013., 32. lpp.).
(7) Komisijas 2014. gada 28. oktobra Regula (ES) Nr. 1148/2014, ar kuru groza II, VII, VIII, IX un X pielikumu Eiropas Parlamenta un Padomes Regulai (EK) Nr. 999/2001, ar ko paredz noteikumus dažu transmisīvo sūkļveida encefalopātiju profilaksei, kontrolei un apkarošanai (OV L 308, 29.10.2014., 66. lpp.).
I PIELIKUMS
Lēmuma 2010/470/ES IV pielikuma A daļu aizstāj ar šādu:
“A DAĻA
Veselības sertifikāta IVA paraugs Savienības iekšējai tirdzniecībai ar aitu un kazu tādu olšūnu un embriju sūtījumiem, kuri iegūti vai sagatavoti saskaņā ar Padomes Direktīvu 92/65/EEK pēc 2010. gada 31. augusta un nosūtīti no apstiprinātas embriju ieguves brigādes vai sagatavošanas grupas, kas ir olšūnu vai embriju izcelsmes vieta
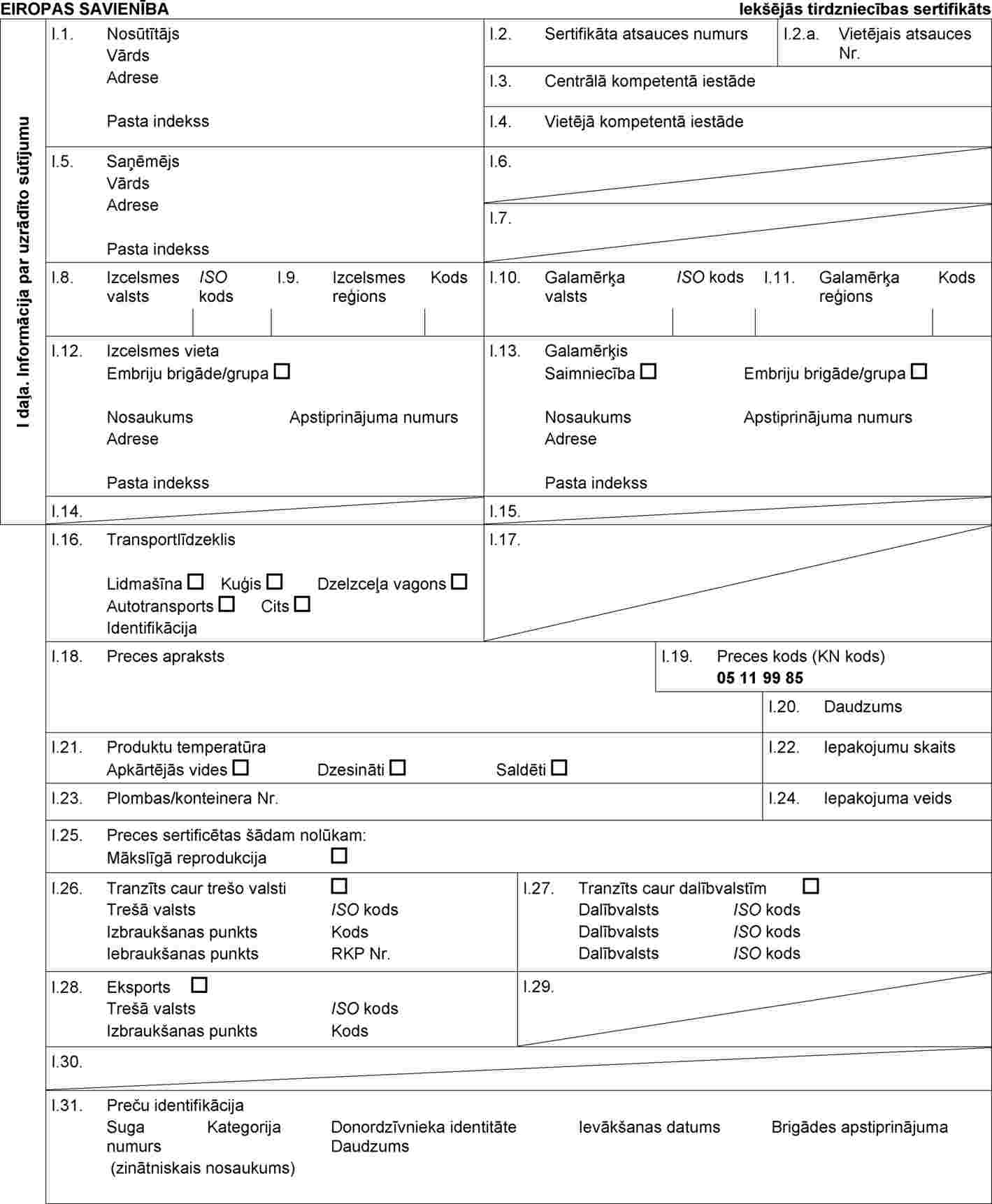

 ”
”
II PIELIKUMS
Lēmuma 2010/472/ES IV pielikuma 2. daļu aizstāj ar šādu:
“2. DAĻA
Veselības sertifikāta paraugs aitu un kazu olšūnu un embriju sūtījumu importam
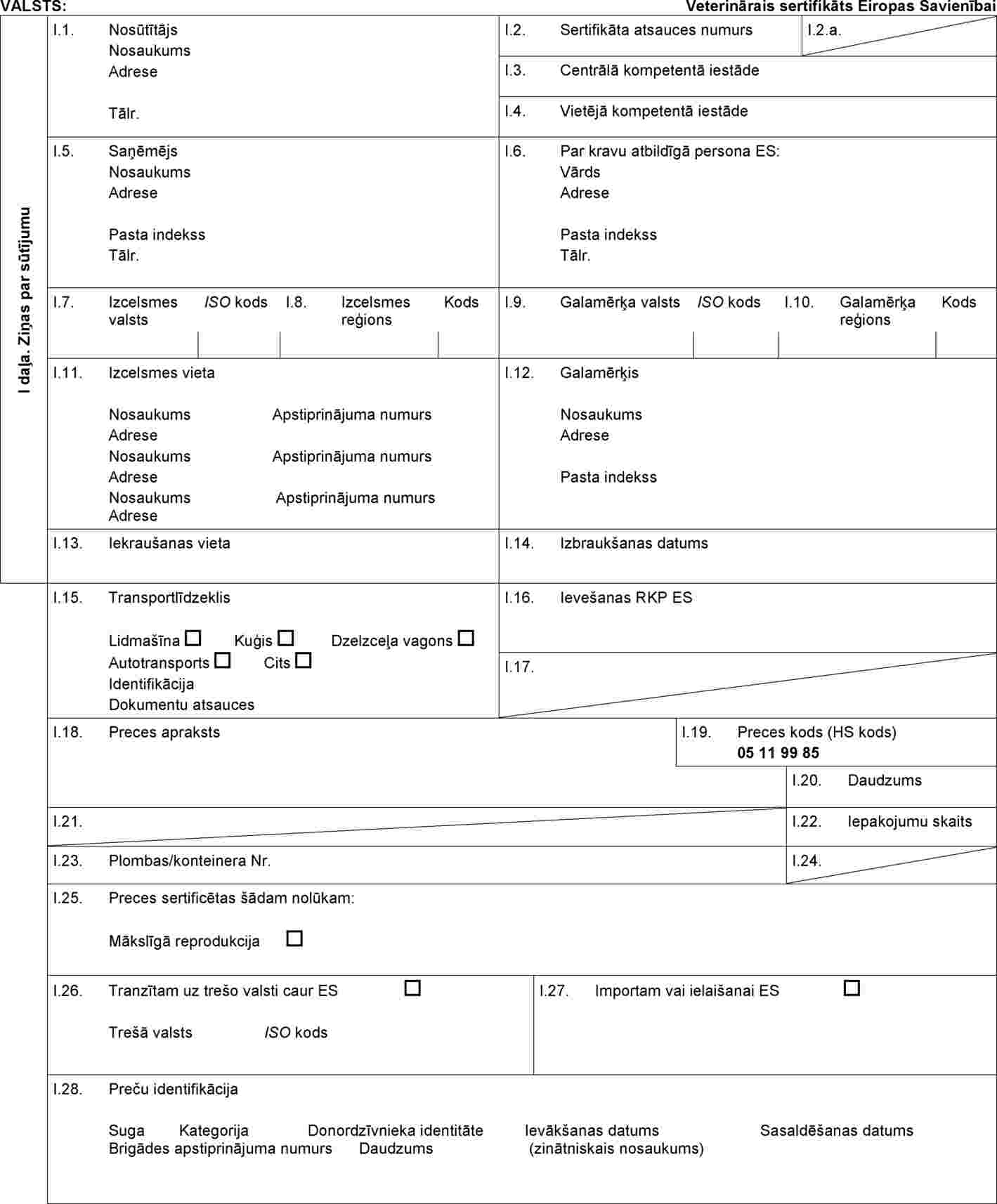



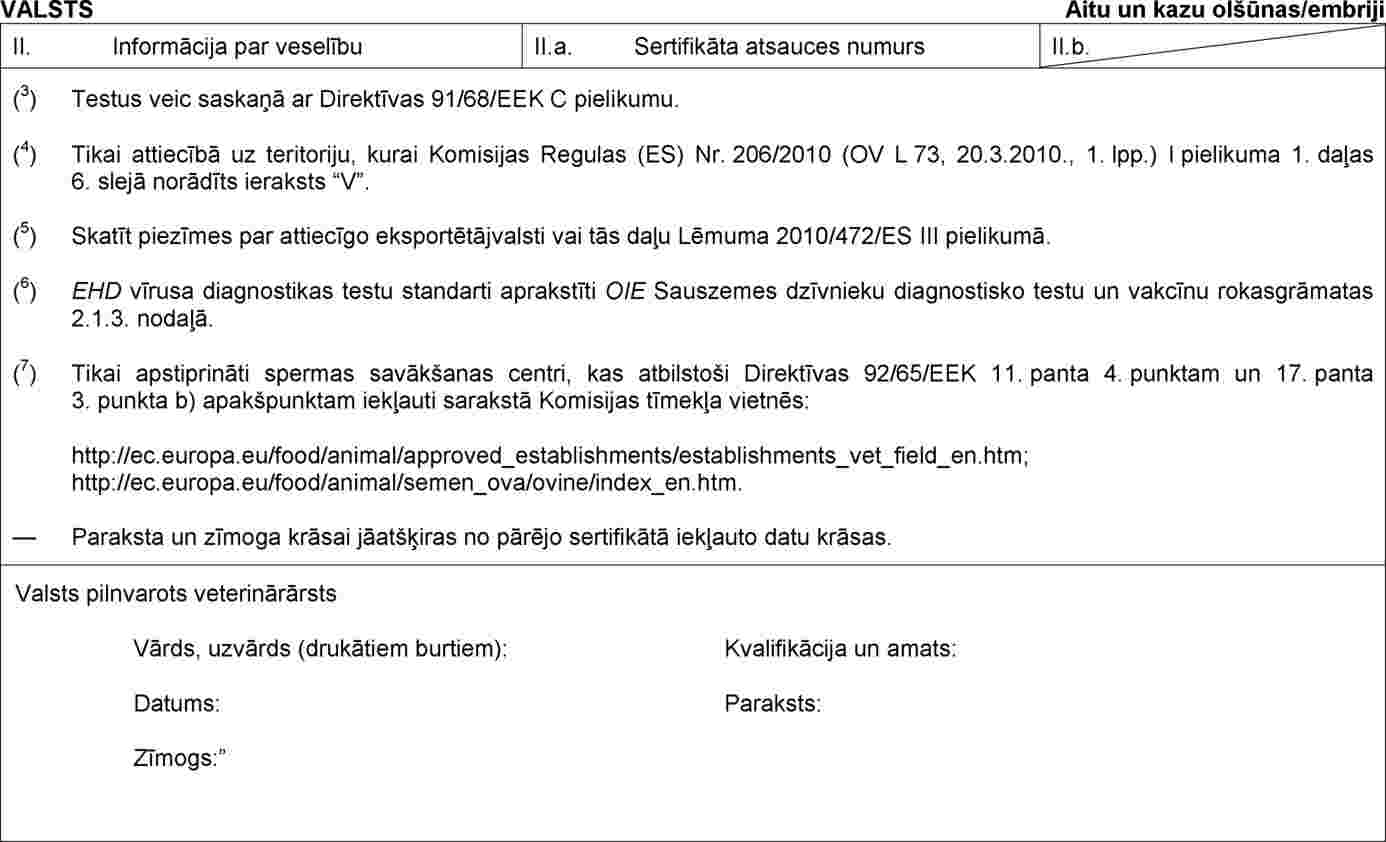 ”
”
TIESĪBU AKTI, KO PIEŅEM STRUKTŪRAS, KURAS IZVEIDOTAS AR STARPTAUTISKIEM NOLĪGUMIEM
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/38 |
ES UN ŠVEICES APVIENOTĀS KOMITEJAS LĒMUMS Nr. 1/2014
(2014. gada 10. oktobris),
ar ko nosaka gadījumus, kuros neveic datu nodošanu, kas paredzēta I pielikuma 3. panta 3. punkta pirmajā daļā 2009. gada 25. jūnija Nolīgumā starp Eiropas Kopienu un Šveices Konfederāciju par pārbaužu un formalitāšu vienkāršošanu attiecībā uz preču pārvadājumiem un muitas drošības pasākumiem
(2014/803/ES)
APVIENOTĀ KOMITEJA,
ņemot vērā 2009. gada 25. jūnija Nolīgumu starp Eiropas Kopienu un Šveices Konfederāciju par pārbaužu un formalitāšu vienkāršošanu attiecībā uz preču pārvadājumiem un muitas drošības pasākumiem (“nolīgums”) un jo īpaši tā 21. panta 3. punktu saistībā ar I pielikuma 3. panta 3. punkta otro daļu,
tā kā:
|
(1) |
Nolīguma mērķis ir sekmēt pārbaužu un formalitāšu vienkāršošanu, precēm šķērsojot robežu, kā arī netraucētu tirdzniecību starp abām līgumslēdzējām pusēm, vienlaikus nodrošinot augstu drošības līmeni piegādes ķēdē. |
|
(2) |
Līgumslēdzējas puses ir apņēmušās katra savā teritorijā nodrošināt līdzvērtīgu drošības līmeni, veicot pasākumus saskaņā ar Eiropas Savienībā spēkā esošajiem tiesību aktiem. |
|
(3) |
Ja preces no vienas līgumslēdzējas puses muitas teritorijas uz trešo valsti izved, šķērsojot otras līgumslēdzējas puses muitas teritoriju, pirmās līgumslēdzējas puses kompetentā iestāde nodod otras līgumslēdzējas puses kompetentajai iestādei datus attiecībā uz drošību, kas minēti izvešanas kopsavilkuma deklarācijā, kura iesniegta pirmās līgumslēdzējas puses kompetentajā iestādē. |
|
(4) |
Apvienotā komiteja var noteikt gadījumus, kuros šī informācijas nodošana nav nepieciešama, ja vien tā neietekmē nolīgumā paredzēto drošības līmeni. |
|
(5) |
Eiropas Savienības dalībvalstis un Šveices Konfederācija ir Čikāgas Konvencijas par starptautisko civilo aviāciju līgumslēdzējas puses. Saskaņā ar šīs konvencijas 17. pielikumu gaisa pārvadātāji visiem kravu pārvadājumiem pirms iekraušanas gaisa kuģī veic drošības kontroli, lai aizsargātu starptautisko civilo aviāciju pret nelikumīgu iejaukšanos. |
|
(6) |
Eiropas Kopienu un Šveices Konfederāciju saista 1999. gada 21. jūnijā noslēgtais nolīgums par gaisa transportu, kas regulē jo īpaši aviācijas drošumu un drošību, |
IR PIEŅĒMUSI ŠO LĒMUMU.
1. pants
Nolīguma I pielikuma 3. panta 3. punkta pirmajā daļā minētās preču izvešanas gadījumos datu nodošana nav nepieciešama, ja:
|
a) |
preces pārvadā aviosabiedrība, kura nodrošina pārvadājumus ārpus Līgumslēdzēju pušu muitas teritorijas; |
|
b) |
preču izvešana caur otras Līgumslēdzējas puses muitas iestādi tiek veikta, izmantojot aviotransportu; |
|
c) |
izvešanas kopsavilkuma deklarācija vai eksporta muitas deklarācija, kas atbilst nosacījumiem, kas paredzēti attiecīgajai kopsavilkuma deklarācijai, ir iesniegta kompetentajai muitas iestādei vietā, no kuras preces tiek eksportētas; |
|
d) |
tad, kad preces nonāk muitas iestādē vietā, kur notiek izvešana no otras līgumslēdzējas puses muitas teritorijas, pārvadātājs šīs muitas iestādes rīcībā pēc tās pieprasījuma nodod kopiju no eksportētajām precēm pievienotā Savienības eksporta pavaddokumenta vai jebkāda līdzīga dokumenta, ko izdevušas Šveices muitas iestādes un kurā ietverti dati par eksportēto preču drošību. |
2. pants
Šis lēmums stājas spēkā nākamajā dienā pēc tā pieņemšanas.
Vacallo, 2014. gada 10. oktobrī
ES un Šveices Apvienotās komitejas vārdā –
priekšsēdētāja
Michaela SCHÄRER-RICKENBACHER
Labojumi
|
18.11.2014 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 331/40 |
Labojums Padomes Lēmumā 2014/252/ES (2014. gada 14. aprīlis) par to, lai noslēgtu Nolīgumu starp Eiropas Savienību un Turcijas Republiku par tādu personu atpakaļuzņemšanu, kuras uzturas neatļauti
( “Eiropas Savienības Oficiālais Vēstnesis” L 134, 2014. gada 7. maijs )
1. lappusē 3. apsvērumā:
tekstu:
|
“(3) |
Saskaņā ar 1. un 2. pantu Protokolā (Nr. 21) par Apvienotās Karalistes un Īrijas nostāju saistībā ar brīvības, drošības un tiesiskuma telpu, kas pievienots Līgumam par Eiropas Savienību un Līgumam par Eiropas Savienības darbību, un neskarot minētā protokola 4. pantu, Apvienotā Karaliste nepiedalās šā lēmuma pieņemšanā, un šis lēmums tai nav saistošs un nav jāpiemēro.” |
lasīt šādi:
|
“(3) |
Saskaņā ar 3. pantu Protokolā (Nr. 21) par Apvienotās Karalistes un Īrijas nostāju saistībā ar brīvības, drošības un tiesiskuma telpu, kas pievienots Līgumam par Eiropas Savienību un Līgumam par Eiropas Savienības darbību, Apvienotā Karaliste 2012. gada 21. septembra vēstulē ir paziņojusi, ka vēlas piedalīties šā lēmuma pieņemšanā un piemērošanā.” |