ISSN 1725-5112
doi:10.3000/17255112.L_2009.220.lav
Eiropas Savienības
Oficiālais Vēstnesis
L 220

Izdevums latviešu valodā
Tiesību akti
52. sējums
2009. gada 24. augusts
|
ISSN 1725-5112 doi:10.3000/17255112.L_2009.220.lav |
||
|
Eiropas Savienības Oficiālais Vēstnesis |
L 220 |
|

|
||
|
Izdevums latviešu valodā |
Tiesību akti |
52. sējums |
|
Saturs |
|
I Tiesību akti, kuri pieņemti, piemērojot EK/Euratom līgumus, un kuru publicēšana ir obligāta |
Lappuse |
|
|
|
REGULAS |
|
|
|
* |
Komisijas Regula (EK) Nr. 761/2009 (2009. gada 23. jūlijs), ar kuru, pielāgojot tehnikas attīstībai, groza Regulu (EK) Nr. 440/2008 par testēšanas metožu noteikšanu saskaņā ar Eiropas Parlamenta un Padomes Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH) ( 1 ) |
|
|
|
|
|
(1) Dokuments attiecas uz EEZ |
|
LV |
Tiesību akti, kuru virsraksti ir gaišajā drukā, attiecas uz kārtējiem jautājumiem lauksaimniecības jomā un parasti ir spēkā tikai ierobežotu laika posmu. Visu citu tiesību aktu virsraksti ir tumšajā drukā, un pirms tiem ir zvaigznīte. |
I Tiesību akti, kuri pieņemti, piemērojot EK/Euratom līgumus, un kuru publicēšana ir obligāta
REGULAS
|
24.8.2009 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 220/1 |
KOMISIJAS REGULA (EK) Nr. 761/2009
(2009. gada 23. jūlijs),
ar kuru, pielāgojot tehnikas attīstībai, groza Regulu (EK) Nr. 440/2008 par testēšanas metožu noteikšanu saskaņā ar Eiropas Parlamenta un Padomes Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH)
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Eiropas Parlamenta un Padomes 2006. gada 18. decembra Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH), un ar kuru izveido Eiropas Ķimikāliju aģentūru, groza Direktīvu 1999/45/EK un atceļ Padomes Regulu (EEK) Nr. 793/93 un Komisijas Regulu (EK) Nr. 1488/94, kā arī Padomes Direktīvu 76/769/EEK un Komisijas Direktīvu 91/155/EEK, Direktīvu 93/67/EEK, Direktīvu 93/105/EK un Direktīvu 2000/21/EK (1), un jo īpaši tās 13. panta 3. punktu,
tā kā:
|
(1) |
Komisijas Regulā (EK) Nr. 440/2008 (2) ir noteiktas Regulas (EK) Nr. 1907/2006 piemērošanai izmantojamās testēšanas metodes vielu fizikāli ķīmisko īpašību, toksicitātes un ekotoksicitātes noteikšanai. |
|
(2) |
Regula (EK) Nr. 440/2008 jāatjaunina, lai iekļautu tajā konkrētu testēšanas metožu izmaiņas un vairākas jaunas ESAO pieņemtas testēšanas metodes. Par šo priekšlikumu ir notikusi apspriešanās ar ieinteresētajām personām. Minētie grozījumi pielāgo attiecīgās metodes zinātnes un tehnikas attīstībai. |
|
(3) |
Ir jāpārskata noteikumi par tvaika spiedienu, lai tajos iekļautu jauno efūzijas metodi. |
|
(4) |
Ir jāpievieno jauna metode šķiedru vidējā svērtā ģeometriskā diametra mērīšanai. |
|
(5) |
Ir lietderīgi papildināt Regulu (EK) Nr. 440/2008, iekļaujot tajā kā prioritāti jaunu in-vitro testēšanas metodi ādas kairinājuma noteikšanai, lai samazinātu izmēģinājumos izmantojamo dzīvnieku skaitu atbilstīgi Padomes 1986. gada 24. novembra Direktīvai 86/609/EEK par dalībvalstu normatīvo un administratīvo aktu tuvināšanu attiecībā uz to dzīvnieku aizsardzību, kurus izmanto izmēģinājumos un citiem zinātniskiem mērķiem (3). Lai gan in-vitro testēšanas metode ādas kairinājuma noteikšanai joprojām tiek apspriesta ESAO, ir lietderīgi šajā izņēmuma gadījumā B.46. metodi iekļaut šajā regulā. B.46. metode ir jāatjaunina iespējami drīz, tiklīdz panākta vienošanās ESAO vai kļūst pieejama turpmāka informācija, kas pamato šādu pārskatīšanu. |
|
(6) |
Noteikumi par aļģu augšanas kavēšanas testu ir jāpārskata, lai iekļautu tajos vēl citas sugas un panāktu atbilstību prasībām par bīstamības noteikšanu un ķīmisko vielu klasifikāciju. |
|
(7) |
Ir jāpievieno jauna metode virszemes ūdeņu aerobās mineralizācijas noteikšanai ar biodegradācijas imitācijas testu un jauna metode Lemna ģints toksicitātes noteikšanai ar augšanas kavēšanas testu. |
|
(8) |
Tāpēc attiecīgi jāgroza Regula (EK) Nr. 440/2008. |
|
(9) |
Šajā regulā noteiktie pasākumi ir saskaņā ar atzinumu, ko sniegusi atbilstīgi Regulas (EK) Nr. 1907/2006 133. pantam izveidotā komiteja, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Regulas (EK) Nr. 440/2008 pielikumu groza šādi.
|
1. |
Pielikuma A daļu groza šādi:
|
|
2. |
Pielikuma B daļu groza šādi: iekļauj šīs regulas III pielikumā izklāstīto B.46. nodaļu. |
|
3. |
Pielikuma C daļu groza šādi:
|
2. pants
Šī regula stājas spēkā trešajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2009. gada 23. jūlijā
Komisijas vārdā –
Komisijas loceklis
Stavros DIMAS
(1) OV L 396, 30.12.2006., 1. lpp.
(2) OV L 142, 31.5.2008., 1. lpp.
(3) OV L 358, 18.12.1986., 1. lpp.
I PIELIKUMS
|
A.4. |
TVAIKA SPIEDIENS |
1. METODE
Šī metode ir ekvivalenta OECD TG 104 (2004).
1.1. IEVADS
Šajā A.4. metodes (1) pārstrādātajā versijā papildus ir iekļauta efūzijas metode – izotermiskā termogravimetrija, kas paredzēta tvaika spiediena noteikšanai vielām, kurām tas ir ļoti zems (līdz pat 10–10 Pa). Ņemot vērā vajadzību pēc noteikšanas metodēm, īpaši, lai noteiktu tvaika spiedienu vielām, kurām tas ir zems, tiek atkārtoti izvērtēti citi šie metodes paņēmieni izmantošanai citos spiediena intervālos.
Termodinamiskā līdzsvara apstākļos tīras vielas tvaika spiediens ir atkarīgs tikai no temperatūras. Pamatprincipu aprakstu sk. (2)(3).
Nevienu mērīšanas paņēmienu nevar izmantot visā tvaika spiedienu intervālā no mazāk kā 10–10 līdz 105 Pa. Šajā metodikā ir iekļautas astoņas tvaika spiediena mērīšanas metodes, kuras var izmantot dažādos tvaika spiediena intervālos. Metožu salīdzinājums, ņemot vērā to pielietojumu un mērījumu intervālu, dots 1. tabulā. Šīs metodes var izmantot tikai testēšanas apstākļos stabilu vielu tvaika spiediena noteikšanai. Ja šīs eksperimentālās metodes tehnisku iemeslu dēļ izmantot nevar, tvaika spiedienu var noteikt pēc aprēķina metodes, un ieteicamā aprēķinu metode ir aprakstīta pielikumā.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Vielas tvaika spiediens tiek definēts kā piesātināta tvaika spiediens virs cietas vai šķidras vielas.
Jāizmanto SI sistēmas spiediena mērvienība, t. i., paskāls (Pa). Citas agrāk izmantotas mērvienības un sakarības starp tām ir šādas:
|
1 tors |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atm |
= |
1,013 × 105 Pa |
|
|
|
1 bar |
= |
105 Pa |
|
|
SI sistēmas temperatūras mērvienība ir kelvins (K). Temperatūru no Celsija skalas grādiem kelvinos pārrēķina pēc šādas formulas:
T = t + 273,15
kur T ir temperatūra kelvinos jeb termodinamiskā temperatūra un t ir temperatūra pēc Celsija.
1. tabula
|
Mērīšanas metode |
Vielas |
Novērtētā atkārtojamība |
Novērtētā reproducējamība |
Ieteicamais intervāls |
|
|
Cietas vielas |
Šķidras vielas |
||||
|
Dinamiskā metode |
ar zemu kušanas temp. |
Jā |
līdz 25 % no 1 līdz 5 % |
līdz 25 % no 1 līdz 5 % |
103 Pa līdz 2 × 103 Pa 2 × 103 Pa līdz 105 Pa |
|
Statiskā metode |
Jā |
Jā |
no 5 līdz 10 % |
no 5 līdz 10 % |
no 10 Pa līdz 105 Pa no 10–2 Pa līdz 105 Pa (1) |
|
Izoteniskopa metode |
Jā |
Jā |
no 5 līdz 10 % |
no 5 līdz 10 % |
no 102 Pa līdz 105 Pa |
|
Efūzijas metode: tvaika spiediena svari |
Jā |
Jā |
no 5 līdz 20 % |
līdz 50 % |
no 10–3 līdz 1 Pa |
|
Efūzijas metode: Knudsena šūna |
Jā |
Jā |
no 10 līdz 30 % |
— |
no 10–10 līdz 1 Pa |
|
Efūzijas metode: izotermiskā termogravimetrija |
Jā |
Jā |
no 5 līdz 30 % |
līdz 50 % |
no 10–10 līdz 1 Pa |
|
Gāzes piesātināšanas metode |
Jā |
Jā |
no 10 līdz 30 % |
līdz 50 % |
no 10–10 līdz 103 Pa |
|
Rotējošā rotora metode |
Jā |
Jā |
no 10 līdz 20 % |
— |
no 10–4 līdz 0,5 Pa |
1.3. METODES PRINCIPS
Kopumā tvaika spiedienu nosaka dažādās temperatūrās. Ierobežotā temperatūru intervālā tīras vielas tvaika spiediena logaritms ir apgriezti proporcionāls termodinamiskajai temperatūrai saskaņā ar vienkāršotu Klapeirona-Klauziusa vienādojumu.

kur:
|
p |
= |
tvaika spiediens (Pa) |
|
ΔHv |
= |
iztvaikošanas siltums J mol–1 |
|
R |
= |
gāzu universālā konstante 8,314 J mol–1 K–1 |
|
T |
= |
temperatūra K |
1.4. STANDARTVIELAS
Standartvielas nav nepieciešamas. Tās galvenokārt izmanto metodes veiktspējas periodiskām pārbaudēm un pēc dažādām metodēm iegūtu rezultātu salīdzināšanai.
1.5. METODES APRAKSTS
1.5.1. Dinamiskā metode (Kotrela metode)
1.5.1.1. Princips
Tvaika spiedienu nosaka, mērot vielas vārīšanās temperatūru pie dažādiem spiedieniem aptuveni no 103 līdz 105 Pa. Šo metodi ir ieteicams izmantot arī viršanas temperatūras noteikšanai. Šajā nolūkā metodi ieteicams izmantot līdz 600 K. Hidrostatiskā spiediena dēļ šķidrumu viršanas temperatūra 3 līdz 4 cm dziļumā ir par aptuveni 0,1 °C augstāka nekā uz virsmas. Kotrela metodē (4) termometru novieto tvaikos virs šķidruma virsmas, un virstošais šķidrums nepārtraukti apskalo termometra rezervuāru. Rezervuāru pārklāj plāns šķidruma slānis, kas ir līdzsvarā ar tvaiku pie atmosfēras spiediena. Tādējādi termometrs uzrāda faktisko viršanas temperatūru bez kļūdām, ko rada šķidruma pārkaršana vai hidrostatiskais spiediens. Sūknis, kuru pirmo reizi izmantojis Kotrels, ir parādīts 1. att. Mēģenē A atrodas virstošais šķidrums. Pamatnē iekausētā platīna stieple B veicina vienmērīgu viršanu. Sānu caurulīte C ir savienota ar dzesinātāju, un apvalks D aukstajam kondensātam neļauj nokļūt pie termometra E. Šķidrumam A virstot, piltuves uztvertie burbuļi un šķidrums pa diviem sūkņa F zariem apskalo termometra rezervuāru.
|
1. attēls
|
2. attēls
|
Kotrela sūknis (4)
|
A: |
Termopāris |
|
B: |
Vakuuma bufertvertne |
|
C: |
Manometrs |
|
D: |
Vakuums |
|
E: |
Mērīšanas punkts |
|
F: |
Sildelements, apm. 150 W |
1.5.1.2. Aparatūra
Ļoti precīzs aparāts, kas darbojas pēc Kotrela principa, parādīts 2. att. Tas sastāv no caurules ar viršanas sekciju apakšējā daļā, dzesinātāju vidusdaļā, kā arī izeju un uzmalu augšējā daļā. Kotrela sūkni ievieto viršanas sekcijā, ko silda ar elektrisko sildelementu. Temperatūru mēra, izmantojot termopāri apvalkā vai pretestības termometru, ko ievieto cauri uzmalai no augšas. Izeja savienota ar sistēmu spiediena regulēšanai. Tā sastāv no vakuumsūkņa, bufertvertnes, manostata spiediena regulēšanai, ievadot slāpekli, un manometra.
1.5.1.3. Procedūra
Vielu ievieto viršanas sekcijā. Problēmas var radīt cietas vielas, kas nav pulvera veidā, taču tās dažkārt var atrisināt ar dzesēšanas apvalka sildīšanu. Aparātu noslēdz pie uzmalas, un vielu atgāzo. Putojošām vielām šo metodi izmantot nevar.
Tad iestata zemāko nepieciešamo spiedienu un ieslēdz sildītāju. Tajā pašā laikā reģistrējošajai ierīcei pievieno temperatūras sensoru.
Līdzsvars tiek sasniegts, kad pastāvīgā spiedienā tiek reģistrēta nemainīga viršanas temperatūra. Īpaša uzmanība jāpievērš tam, lai novērstu pārkaršanu viršanas laikā. Bez tam dzesinātājā ir jāpanāk tvaiku pilnīga kondensācija. Nosakot tvaika spiedienu cietām vielām ar zemu kušanas temperatūru, jāraugās, lai tās nenosprostotu dzesinātāju.
Pēc līdzsvara punkta reģistrēšanas iestata augstāku spiedienu. Procesu šādi turpina, līdz tiek sasniegti 105 Pa (kopumā apmēram 5 līdz 10 mērījumu punkti). Pārbaudei līdzsvara punkti jāsasniedz, spiedienu pazeminot.
1.5.2. Statiskā metode
1.5.2.1. Princips
Statiskajā metodē (5) tvaika spiedienu termodinamiskā līdzsvara stāvoklī nosaka noteiktā temperatūrā. Šī metode piemērota tvaika spiediena noteikšanai vielām un daudzkomponentu maisījumiem, kas ir šķidras vai cietas vielas, intervālā no 10 līdz 105 Pa, un arī intervālā no 1 līdz 10 Pa ar nosacījumu, ka tiek veikti nepieciešamie pasākumi.
1.5.2.2. Aparatūra
Iekārta sastāv no vannas, kurā uztur pastāvīgu temperatūru (ar precizitāti ±0,2 K), parauga konteinera, kas pievienots vakuuma līnijai, manometra un sistēmas spiediena regulēšanai. Parauga kamera (3a. attēls) ir pievienota vakuuma līnijai ar vārstu un diferenciālo manometru (U-veida caurulīti ar piemērotu manometra šķidrumu), ko izmanto par nulles indikatoru. Diferenciālajā manometrā atkarībā no spiedienu intervāla un testējamās vielas ķīmiskajām īpašībām var izmantot dzīvsudrabu, silikonus un ftalātus. Tomēr, rūpējoties par vidi, no dzīvsudraba izmantošanas būtu pēc iespējas jāizvairās. Testējamā viela nedrīkst ievērojami šķīst, kas ir U-veida caurulītē, vai ar to reaģēt. U-veida caurulītes vietā var izmantot manometru (3.b attēls). Manometrā dzīvsudrabu var izmantot intervālā no parastā atmosfēras spiediena līdz 102 Pa, bet silikona šķidrumi un ftalāti ir piemēroti spiedieniem, kas ir zemāki par 102 Pa līdz 10 Pa. Ir citi manometri, ko var izmantot, ja spiediens ir zemāks par 102 Pa, un sildāmās membrānas kapacitātes manometrus var izmantot pat tad, ja spiediens ir zemāks par 10–1 Pa. Temperatūru mēra uz trauka ārējās sienas, kurā atrodas paraugs, vai pašā traukā.
1.5.2.3. Procedūra
Izmantojot 3a. att. parādīto aparātu, uzpilda U-veida caurulīti ar izvēlēto šķidrumu, kas pirms mērījumiem paaugstinātā temperatūrā ir jāatbrīvo no gāzēm. Testējamo vielu ievieto aparātā un pazeminātā temperatūrā atbrīvo no gāzēm. Izmantojot daudzkomponentu paraugus, temperatūrai jābūt pietiekami zemai, lai nenotiktu materiāla sastāva izmaiņas. Līdzsvara iestāšanos paātrina ar maisīšanu. Paraugu var atdzesēt ar šķidro slāpekli vai sauso ledu, raugoties lai nenotiktu gaisa mitruma vai sūkņa šķidruma kondensācija. Virs parauga trauka atver vakuuma krānu un paraugu vairākas minūtes atgaiso ar vakuumu. Ja nepieciešams, atgaisošanu atkārto vairākas reizes.
|
3.a attēls
|
3.b attēls
|
Sildot paraugu, kad krāns ir aizvērts, pieaug tvaika spiediens. Tādēļ izmainās šķidruma līdzsvars U-veida caurulītē. Lai to kompensētu, aparātā ievada slāpekli vai gaisu, līdz diferenciālais spiediena indikators atkal atrodas nulles stāvoklī. Tam nepieciešamo spiedienu nolasa ar manometru vai precīzāku instrumentu. Šis spiediens atbilst vielas tvaika spiedienam mērījuma temperatūrā. Izmantojot 3.b att. parādīto aparātu, tvaika spiedienu nosaka ar tiešiem mērījumiem.
Tvaika spiedienu līdz nepieciešamajai maksimālajai temperatūrai nosaka piemērotos nelielos temperatūras intervālos (kopumā apmēram 5 līdz 10 mērījumu punkti).
Pārbaudei jāatkārto nolasījumi zemās temperatūrās. Ja atkārtotos mērījumos noteiktās temperatūras neatbilst līknei, kas iegūta, temperatūru pakāpeniski paaugstinot, tam var būt šādi iemesli:
|
i) |
paraugā vēl ir gaiss (piemēram, izteikti viskozu materiālu gadījumā) vai arī vielas ar zemu viršanas temperatūru, kas izdalās sildīšanas laikā; |
|
ii) |
izmantotajā temperatūras intervālā vielā ar vielu notiek ķīmiska reakcija (piemēram, sadalīšanās, polimerizācija). |
1.5.3. Izoteniskopa metode
1.5.3.1. Princips
Izoteniskopā (6) izmanto statiskās metodes principu. Pēc šīs metodes vielas paraugu pārnes rezervuārā, kuram uztur nemainīgu temperatūru un ir savienots ar manometru un vakuumsūkni. Piemaisījumi, kuru gaistamība ir lielāka nekā testējamajai vielai, tiek atdalīti ar degazāciju pazeminātā spiedienā. Parauga tvaika spiediens izvēlētajā temperatūrā tiek līdzsvarots ar inertas gāzes zināmu spiedienu. Izoteniskops tika izstrādāts, lai noteiktu atsevišķu šķidro ogļūdeņražu tvaika spiedienu, tas ir piemērots arī cietu vielu analīzei. Metode parasti nav piemērota daudzkomponentu sistēmām. Ja paraugs satur negaistošus piemaisījumus, rezultātu kļūda ir neliela. Ieteicamais noteikšanas intervāls ir no 102 līdz 105 Pa.
1.5.3.2. Aparatūra
Mērinstrumenta paraugs parādīts 4. att. Pilnīgāks metodes apraksts ir atrodams ASTM D 2879–86 (6).
1.5.3.3. Procedūra
Analizējot šķidrumu, pati viela kļūst par diferenciālā manometra šķidrumu. Izoteniskopā pārnes tik daudz šķidruma, lai piepildītu rezervuāru un manometra īso atzaru. Izoteniskopu pieslēdz vakuumam un atgaiso, tad piepilda ar slāpekli. Atbrīvošanu no gāzēm un attīrīšanu atkārto divas reizes, lai izdalītu atlikušo skābekli. Uzpildīto izoteniskopu novieto horizontāli tā, lai paraugs plānā slānī izklātu parauga rezervuāru un manometru. Sistēmā spiedienu samazina līdz 133 Pa, un paraugu uzmanīgi silda, līdz tas sāk vārīties (atbrīvošanai no izšķīdušajām gāzēm). Tad izoteniskopu novieto tā, lai paraugs ieplūstu atpakaļ rezervuārā un piepildītu manometra īso zaru. Uztur 133 Pa spiedienu. Parauga rezervuāra pagarināto galu ar nelielu liesmu silda, līdz sāk izdalīties un pietiekami izplešas testējamās vielas tvaiks, izspiežot daļu parauga no rezervuāra augšējās daļas manometra zarā, un izveidojas ar tvaiku pildīta telpa, kurā nav slāpekļa. Tad izoteniskopu novieto vannā, kurā uztur pastāvīgu temperatūru, un regulē slāpekļa spiedienu, līdz tas ir līdzsvarā ar testējamās vielas parauga tvaika spiedienu. Līdzsvara stāvoklī slāpekļa spiediens atbilst vielas tvaika spiedienam.
4. attēls

Cietām vielām atkarībā no spiediena un temperatūras intervāliem izmanto tādus manometra šķidrumus kā silikonus vai ftalātus. Degazēto manometra šķidrumu iepilda izcilnī uz izoteniskopa garā zara. Tad testējamo cieto vielu ievieto parauga rezervuārā un paaugstinātā temperatūrā degazē. Pēc tam izoteniskopu noliec tā, lai manometra šķidrums ieplūstu U-veida caurulītē.
1.5.4. Efūzijas metode: tvaika spiediena svari (7)
1.5.4.1. Princips
Testējamās vielas paraugu karsē nelielā krāsnī, kas novietota zem kupola, no kura atsūknēts gaiss. Krāsnij ir vāks ar sīkiem noteikta diametra urbumiem. Vielas tvaiki, izplūstot pa vienu no urbumiem, tiek novirzīti uz ļoti jutīgu svaru kausu, kas arī atrodas zem kupola, no kura evakuēts gaiss. Dažās konstrukcijās svaru kausam, uz kura kondensējas izplūstošais tvaiks, ir dzesēšanas kamera, nodrošinot siltuma aizvadīšanu termiskās kondukcijas ceļā, un to atdzesē starojums. Tvaika strūklas enerģija darbojas kā spēks uz svariem. Tvaika spiedienu var aprēķināt divos veidos: tieši, ņemot vērā spēku, kas darbojas uz svaru kausu, un iztvaikošanas ātrumu, izmantojot Herca-Knudsena vienādojumu (2):

kur:
|
G |
= |
iztvaikošanas ātrums (kg s–1 m–2) |
|
M |
= |
molmasa (g mol–1) |
|
T |
= |
temperatūra (K) |
|
R |
= |
gāzu universālā konstante (J mol–1 K–1) |
|
p |
= |
tvaika spiediens (Pa) |
Ieteicamais noteikšanas intervāls ir no 10–3 līdz 1 Pa.
1.5.4.2. Aparatūra
Aparāta principiālo shēmu sk. 5. att.
5. attēls

|
A: |
Pamata plāksne |
F: |
Dzesēšanas kamera un dzesēšanas stienis |
|
B: |
Mērinstruments ar kustīgu tinumu |
G: |
Iztvaicēšanas krāsns |
|
C: |
Kupols |
H: |
Djuāra trauks ar šķidro slāpekli |
|
D: |
Svari ar svaru kausu |
I: |
Parauga temperatūras mērīšana |
|
E: |
Vakuuma mērīšanas ierīce |
J: |
Testējamā viela |
1.5.5. Efūzijas metode: Knudsena šūna
1.5.5.1. Princips
Metodes pamatā ir testējamās vielas masas noteikšana, kas ultravakuuma apstākļos laika vienībā tvaika veidā pa mikroatveri izplūst no Knudsena šūnas (8). Izplūdušā tvaika masu var noteikt pēc šūnas masas zuduma, vai vielas tvaikus zemā temperatūrā kondensējot un ar hromatogrāfiju nosakot iztvaicētās vielas daudzumu. Tvaika spiedienu aprēķina pēc Herca-Knudsena vienādojuma (sk. 1.5.4.1.) un izmantojot no aparāta parametriem atkarīgus korekcijas koeficientus (9). Ieteicamais noteikšanas intervāls ir no 10–10 līdz 1 Pa (10)(11)(12)(13)(14).
1.5.5.2. Aparatūra
Aparāta principiālo shēmu sk. 6. att.
6. attēls

|
1: |
Savienojums ar vakuumu |
7: |
Vāks ar vītni |
|
2: |
Platīna pretestības termometra vai temperatūras regulēšanas ierīces ligzdas |
8: |
Spārnuzgrieznis |
|
3: |
Vakuumkameras vāks |
9: |
Skrūves |
|
4: |
Blīve |
10: |
Nerūsējošā tērauda efūzijas šūnas |
|
5: |
Alumīnija vakuumkamera |
11: |
Sildelements |
|
6: |
Mehānisms efūzijas šūnu ievietošanai un izņemšanai |
|
|
1.5.6. Efūzijas metode: izotermiskā termogravimetrija
1.5.6.1. Princips
Šīs metodes pamatā ir testējamās vielas palielināta iztvaikošanas ātruma noteikšana paaugstinātās temperatūrās pie atmosfēras spiediena, izmantojot termogravimetriju (10)(15)(16)(17)(18)(19)(20). Iztvaikošanas ātrumi vT tiek iegūti, uz testējamo vielu iedarbojoties ar lēnu inertas gāzes plūsmu un atbilstošos laika periodos nosakot masas zudumus izotermiskos apstākļos pie definētajām temperatūrām T (kelvinos). Tvaika spiedienus pT aprēķina no vT vērtībām, izmantojot lineāru sakarību starp tvaika spiediena logaritmu un iztvaikošanas ātruma logaritmu. Ja nepieciešams, izmantojot log pT regresiju atkarībā no 1/T, var veikt ekstrapolāciju 20 un 25 °C. Šī metode ir piemērota vielām, kuru tvaika spiediens ir pat 10–10 Pa (10–12 mbar) un tīrības pakāpe ir iespējami tuvu 100 %, lai izvairītos no kļūdām noteikto masas zudumu interpretācijā.
1.5.6.2. Aparatūra
Eksperimentālās iekārtas principiālā shēma 7. att.
7. attēls
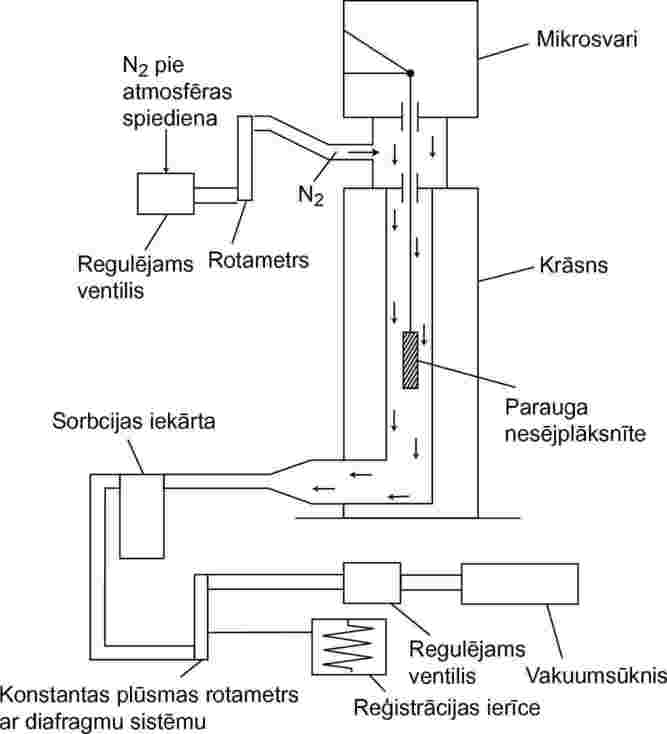
Parauga nesējplāksnīti, kas piekārta mikrosvariem kamerā ar kontrolējamu temperatūru, izkustina sausa gāzveida slāpekļa plūsma, kas nes iztvaicētās testējamās vielas molekulas. Izplūstot no kameras, vielu sorbcijas iekārtā uztver no gāzes plūsmas.
1.5.6.3. Procedūra
Testējamo vielu homogēnā slānī uzklāj uz stikla plāksnītes ar nelīdzenu virsmu. Analizējot cietas vielas, plāksni vienmērīgi samitrina ar vielas šķīdumu piemērotā šķīdinātājā un žāvē inertā atmosfērā. Lai veiktu mērījumus, pārklāto plāksni piekar termogravimetriskajā analizatorā, un pēc tam masas zudumus mēra nepārtraukti kā laika funkciju.
Iztvaikošanas ātrumu vT noteiktā temperatūrā aprēķina, izmantojot parauga plāksnes masas zudumu Δm

kur F ir ar testējamo vielu pārklātās plāksnītes virsmas laukums, parasti parauga plāksnītes virsmas laukums, un t – laiks, kurā novēro masas zudumu Δm.
Tvaika spiedienu pT aprēķina kā funkciju no iztvaikošanas ātruma vT:
log pT = C + D log vT
kur C un D ir ar izmantoto eksperimentālo iekārtu saistītas konstantes, kas atkarīgas no mērījumu kameras diametra un gāzes plūsmas ātruma. Šīs konstantes jānosaka vienreiz, analizējot vairākus savienojumus ar zināmu tvaika spiedienu un aprēķinot log pT regresiju atkarībā no log vT (11)(21)(22).
Tvaika spiedienu pT atkarībā no temperatūras T (kelvinos) apraksta ar sakarību
log pT = A + B 1/T
kur A un B ir konstantes, ko nosaka, aprēķinot log pT regresiju pēc 1/T. Izmantojot šo vienādojumu, ar ekstrapolāciju var aprēķināt tvaika spiedienu jebkurā citā temperatūrā.
1.5.7. Gāzes piesātināšanas metode (23)
1.5.7.1. Princips
Pār testējamo vielu istabas temperatūrā laiž inertas gāzes plūsmu ar noteiktu ātrumu, kas ir pietiekami mazs, lai nodrošinātu gāzes piesātināšanos. Gāzes fāzes piesātinājumam ir būtiska nozīme. Pārnesto vielu uztver, parasti izmantojot sorbentu, un nosaka tās daudzumu. Kā alternatīvu tvaika sorbcijai un tai sekojošai vielas daudzuma noteikšanai var izmantot analītiskās metodes, kurās notiek vielas pārnese, piemēram, gāzu hromatogrāfiju, lai kvantitatīvi noteiktu pārnestās vielas daudzumu. Tvaika spiedienu aprēķina pieņemot, ka ir spēkā ideālas gāzes likums, un tāpēc gāzu maisījuma kopējais spiediens ir vienāds ar tās atsevišķo komponentu spiedienu summu. Testējamās vielas parciālo spiedienu, t. i., tvaika spiedienu, aprēķina, zinot gāzes kopējo tilpumu un tās pārnestās vielas masu.
Gāzes piesātināšanas metode ir izmantojama vielām šķidru un cietu vielu veidā. To var izmantot pat tik zema tvaika spiediena noteikšanai kā 10–10 Pa (10)(11)(12)(13)(14). Šī metode ir drošākā tvaika spiedieniem, kas ir zemāki par 103 Pa. Virs 103 Pa noteiktās tvaika spiediena vērtības parasti ir paaugstinātas, iespējams, aerosolu veidošanās dēļ. Tā kā tvaika spiedienu mēra istabas temperatūrā, nav nepieciešams ekstrapolēt paaugstinātās temperatūrās iegūtus datus, kas bieži rada nopietnas kļūdas.
1.5.7.2. Aparatūra
Jāizmanto kamera, kurā uztur pastāvīgu temperatūru. Shēmā 8. att. parādīta kamera ar trijiem cietu vielu un trijiem šķidru vielu paraugu turētājiem, kas dod iespējas veikt cietas vai šķidras vielas parauga analīzi trijos atkārtojumos. Temperatūru uztur ar precizitāti vismaz ±0,5 °C vai ar augstāku precizitāti.
8. attēls

Parasti par inertu nesējgāzi izmanto slāpekli, taču atsevišķos gadījumos var būt nepieciešama cita gāze (24). Nesējgāzei jābūt sausai. Gāzes plūsmu, ko regulē ar adatvārstiem (apm. 0,79 mm atvere), sadala 6 daļās un pa vara caurulīti ar iekšējo diametru 3,8 mm ievada kamerā. Pēc temperatūras līdzsvarošanas gāze plūst cauri paraugam, uztvērējam ar sorbentu un izplūst ārā no kameras.
Cietās vielas paraugu ievieto stikla caurulītē ar iekšējo diametru 5 mm, un tās abus galus noslēdz ar stikla vates aizbāžņiem (sk. 9. att.). Šķidru vielu paraugu turētājs un sorbcijas sistēma parādīta 10. att. Labāk reproducējamus šķidrumu tvaika spiediena mērījumu rezultātus iegūst, ja turētāju piepilda ar stikla lodītēm vai inertu sorbentu, piemēram, silīcija dioksīdu, uz kuru virsmas uznesta šķidra viela. Otra iespēja ir nesējgāzi laist cauri rupjam fritam un barbotēt caur testējamo vielu, kas ir šķidruma veidā.
|
9. attēls
|
10. attēls
|
Sorbcijas sistēmā ir plūsmai pretējā un aizmugurējā sorbenta daļa. Pie ļoti zema tvaika spiediena sorbents vielu aiztur tikai nelielā daudzumā, un par nopietnu problēmu var kļūt adsorbcija uz stikla vates un stikla caurulītes sieniņām posmā starp paraugu un sorbentu.
Cits efektīvs iztvaicētās vielas uztveršanas paņēmiens ar izmantot uztvērēju, ko dzesē ar cietu CO2. Tas nerada pretspiedienu uz piesātināšanas kolonnas, un uztvertā viela ir kvantitatīvi vienkārši pārnesama.
1.5.7.3. Procedūra
Nesējgāzes plūsmas ātrumu mēra istabas temperatūrā. Plūsmas ātrumu eksperimenta laikā kontrolē pietiekami bieži, lai nodrošinātu, ka nesējgāzes tilpums tiek noteikts precīzi. Ieteicams veikt nepārtrauktus masas plūsmas mērījumus. Gāzes fāzes piesātināšanai var būt vajadzīgs visai ilgs kontakta laiks, un tāpēc pavisam neliels gāzes plūsmas ātrums (25).
Eksperimenta beigās priekšējo un aizmugurējo sorbenta daļu analizē atsevišķi. Vielu no katras sorbenta daļas atsevišķi desorbē ar šķīdinātāju. Iegūtajos šķīdumos kvantitatīvi nosaka no abām sorbenta daļām desorbētās vielas masu. Analītiskās metodes izvēle (arī sorbenta un desorbcijas šķīdinātāja izvēle) ir atkarīga no testējamās vielas īpašībām. Desorbcijas efektivitāti novērtē, noteikta lieluma paraugu pārnesot uz sorbenta, desorbējot un nosakot atgūstamību. Desorbcijas efektivitāte jāpārbauda, izmantojot parauga koncentrāciju testēšanas apstākļos, vai tai iespējami līdzīgu koncentrāciju.
Lai pārliecinātos par nesējgāzes piesātināšanos ar testējamo vielu, noteikšanu veic pie trijiem atšķirīgiem gāzes plūsmas ātrumiem. Ja aprēķinātais tvaika spiediens nav atkarīgs no plūsmas ātruma, gāzi uzskata par piesātinātu.
Tvaika spiedienu aprēķina pēc šāda vienādojuma:

kur:
|
p |
= |
tvaika spiediens (Pa) |
|
W |
= |
iztvaikojušās testējamās vielas masa (g) |
|
V |
= |
piesātinātas gāzes tilpums (m3) |
|
R |
= |
gāzu universālā konstante 8,314 (J mol–1 K–1) |
|
T |
= |
temperatūra (K) |
|
M |
= |
testējamās vielas molmasa (g mol–1) |
Jāveic izmērītā tilpuma korekcija, ņemot vērā spiediena un temperatūras atšķirības plūsmas mērīšanas ierīcē un piesātināšanas kamerā.
1.5.8. Rotējošā rotora metode
1.5.8.1. Princips
Šajā metodē izmanto rotējošā rotora viskozimetru, kurā mērelements ir magnētiskajā laukā piekārta neliela izmēra tērauda lodīte, kas griežas rotējošā laukā (26)(27)(28). Uztveršanas spoles ļauj noteikt rotācijas ātrumu. Kad lodīte ir sasniegusi noteikto rotācijas ātrumu, parasti apmēram 400 apgr./s, aktivāciju pārtrauc, un ātrums sāk palēnināties gāzes radītās berzes dēļ. Rotācijas ātruma samazināšanos mēra kā laika funkciju. Tvaika spiedienu nosaka pēc tērauda lodītes palēninājuma, kas atkarīgs no spiediena. Ieteicamais noteikšanas intervāls ir no 10–4 līdz 0,5 Pa.
1.5.8.2. Aparatūra
Eksperimentālās iekārtas shematisks zīmējums parādīts 11. att. Mērelements ir apvalkā ar pastāvīgu temperatūru, ko regulē ar 0,1 °C precizitāti. Parauga konteineru ievieto atsevišķā apvalkā, kurā arī regulē temperatūru ar 0,1 °C precizitāti. Visās pārējās iekārtas daļās tiek uzturēta augstāka temperatūra, lai novērstu kondensāciju. Visa aparatūra ir pievienota sistēmai, kas tajā rada dziļu vakuumu.
11. attēls

2. REZULTĀTI UN PĀRSKATS
2.1. REZULTĀTI
Tvaika spiediens, izmantojot jebkuru no minētajām metodēm, jānosaka vismaz divās temperatūrās. Ieteicams izmantot trīs vai vairāk temperatūras intervālā no 0 līdz 50 °C, lai pārbaudītu tvaika spiediena līknes linearitāti. Izmantojot efūzijas metodi (Knudsena šūnu, izotermisko termogravimetriju) un gāzes piesātināšanas metodi, ieteicamais noteikšanas temperatūru intervāls ir nevis 0 līdz 50 °C, bet gan 120 līdz 150 °C.
2.2. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj šāda informācija:
|
— |
izmantotā metode, |
|
— |
vielas precīzs apraksts (identitāte un piemaisījumi) un attīrīšanas paņēmieni, ja to veic, |
|
— |
vismaz divas tvaika spiediena un temperatūras vērtības – un ieteicams trīs vai vairāk – intervālā no 0 līdz 50 °C (vai 120 līdz 150 °C), |
|
— |
vismaz vienai temperatūrai ir jābūt 25 °C vai par to zemākai, ja tas ir iespējams saskaņā ar izvēlēto metodi, |
|
— |
visi izejas dati, |
|
— |
log p pret 1/T līkne, |
|
— |
aprēķinātais tvaika spiediens 20 vai 25 °C temperatūrā. |
Ja novērojamas testējamās vielas pārvērtības (agregātstāvokļa maiņa, sadalīšanās), jānorāda šāda informācija:
|
— |
pārvērtības veids; |
|
— |
temperatūra, kurā pārvērtība notiek pie atmosfēras spiediena; |
|
— |
tvaika spiediens 10 un 20 °C zem izmaiņu temperatūras un 10 un 20 °C virs šīs temperatūras (izņemot, ja ir pāreja no cieta agregātstāvokļa gāzveida stāvoklī). |
Jānorāda visa rezultātu interpretācijai nepieciešamā informācija, īpaši ziņas par piemaisījumiem un vielas fizikālo stāvokli.
3. LITERATŪRA
|
(1) |
Eiropas Kopienu Oficiālais Vēstnesis L 383 A, 26–47 (1992). |
|
(2) |
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., and Vodar, B., Eds., Butterworths, London. |
|
(3) |
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York. |
|
(4) |
Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York. |
|
(5) |
NF T 20–048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method. |
|
(6) |
ASTM D 2879–86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
(7) |
NF T 20–047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method. |
|
(8) |
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593. |
|
(9) |
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173. |
|
(10) |
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521–532. |
|
(11) |
Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000) |
|
(12) |
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22–28 |
|
(13) |
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269–278. |
|
(14) |
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117–122. |
|
(15) |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137–147. |
|
(16) |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393–400. |
|
(17) |
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161–168. |
|
(18) |
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27–31. |
|
(19) |
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300–310. |
|
(20) |
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512–20. |
|
(21) |
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range – 25 °C to 150 °C. |
|
(22) |
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002) |
|
(23) |
40 CFR, 796. (1993). pp 148–153, Office of the Federal Register, Washington DC |
|
(24) |
Rordorf B.F. (1985). Thermochimica Acta 85, 435. |
|
(25) |
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375. |
|
(26) |
Messer G., Röhl, P., Grosse G., and Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440. |
|
(27) |
Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642. |
|
(28) |
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715. |
(1) Izmantojot kapacitātes manometru
Papildinājums
Aprēķina metode
IEVADS
Pēc aprēķina metodes noteiktās tvaika spiediena vērtības var izmantot:
|
— |
lai izvēlētos piemērotākās eksperimentālās metodes; |
|
— |
aptuvenas vērtības vai robežvērtības noteikšanai gadījumos, kad eksperimentālā metode nav izmantojama tehnisku iemeslu dēļ. |
APRĒĶINA METODE
Šķidru un cietu vielu tvaika spiedienu var aprēķināt, izmantojot modificētu Vatsona korelāciju (a). Eksperimentāli jānosaka tikai viršanas punkts normālos apstākļos. Šī metode ir piemērota tvaika spiediena aprēķināšanai, kas ir intervālā no 105 Pa līdz 10–5 Pa.
Detalizēta informācija par metodi ir sniegta “Handbook of Chemical Property Estimation Methods” (b). Sk. arī OECD Environmental Monograph No 67 (c).
APRĒĶINĀŠANA
Tvaika spiedienu aprēķina pēc formulas:

kur:
|
T |
= |
temperatūra, kurai aprēķina tvaiku spiedienu |
|
Tb |
= |
viršanas punkts normālos apstākļos |
|
Pvp |
= |
tvaika spiediens temperatūrā T |
|
ΔHvb |
= |
iztvaikošanas siltums |
|
ΔZb |
= |
saspiežamības faktors (novērtēts kā 0,97) |
|
m |
= |
empīrisks koeficients, kas atkarīgs no vielas fizikālā stāvokļa attiecīgajā temperatūrā |
Turklāt

kur KF ir empīrisks koeficients, kas ir atkarīgs no vielas polaritātes. Vairākiem savienojumu tipiem KF koeficienti norādīti literatūras avotā (b).
Bieži ir pieejami dati par viršanas punktu pazeminātā spiedienā. Šajā gadījumā tvaika spiedienu aprēķina:
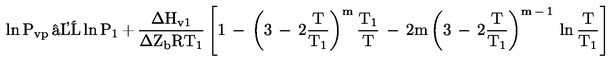
kur T1 ir viršanas punkts pazeminātā spiedienā P1.
PĀRSKATS
Izmantojot aprēķina metodi, pārskatā pilnībā jādokumentē viss aprēķins.
LITERATŪRA
|
(a) |
Watson, K. M. (1943). Ind. Eng. Chem, 35, 398. |
|
(b) |
Lyman, W.J., Reehl, W.F., Rosenblatt, D. H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill. |
|
(c) |
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993). |
II PIELIKUMS
|
A.22. |
GARUMU SVĒRTAIS ĢEOMETRISKAIS VIDĒJAIS ŠĶIEDRU DIAMETRS |
1. METODE
1.1. IEVADS
Šī metode apraksta Garumu svērtā ģeometriskā vidējā šķiedru diametra (GSĢVD) mērīšanas procedūru mākslīgām minerālajām šķiedrām (MMŠ). Sakarā ar to, ka kopumam noteiktais GSĢVD ar 95 % varbūtību atrodas 95 % ticamības līmeņu starpā (GSĢVD ± divas standartkļūdas), tad ziņojumā norādītā vērtība (testa vērtība) būs zemākais parauga 95 % ticamības līmenis (t. i., GSĢVD – 2 standartkļūdas). Šī metode pamatojas uz HSE nozares procedūras projekta redakciju (1994.gada jūnijs), kas apstiprināta ECFIA un HSE sanāksmē Česterā 26.9.1993. un izstrādāta otrajam starplaboratoriju izmēģinājumam un pamatojoties uz to (1,2). Šī mērījumu metode var tikt izmantota, lai raksturotu šķiedru diametru nesakārtotā stāvoklī esošām vielām vai produktiem, kas satur MMŠ, ieskaitot ugunsizturīgas keramikas šķiedras (UKŠ), mākslīgas stikla šķiedras (MSŠ), kristāliskās un polikristāliskās šķiedras.
Svēršana pēc garumiem ir līdzeklis kā kompensēt paraugu ņemšanas vai materiāla apstrādes nodarītā garu šķiedru pārrāvuma ietekmi uz diametra sadalījumu. Ģeometriskos statistiskos datus (ģeometriskos vidējos) izmanto, lai novērtētu MMŠ diametru izmēru sadalījumu, jo šiem diametriem parasti ir izmēru sadalījums, kas aproksimējamas uz logaritmisko normālo.
Gan garuma, gan diametra mērīšana ir nogurdinošs un darbietilpīgs darbs, bet ja mēra tikai tās šķiedras, kas pieskaras bezgalīgai tievai līnijai SEM redzes laukā, tad dotās šķiedras izvēles varbūtība ir proporcionāla tās garumam. Tā kā minētais ņem vērā garumu garuma svēršanas aprēķinos, tad vienīgais mērījums, kas ir nepieciešams, ir diametrs, bet GSĢVD-2SE var aprēķināt kā aprakstīts turpmāk.
1.2. DEFINĪCIJAS
Daļiņa: objekts ar garuma pret platumu attiecību mazāku par 3:1.
Šķiedra: objekts ar garuma pret platumu attiecību (aspekta attiecība) vismaz 3:1.
1.3. PIELIETOJUMI UN IEROBEŽOJUMI
Šī metode ir izstrādāta, lai apskatītu diametru sadalījumu, kurās vidēji diametri sastāda no 0,5 μm līdz 6 μm. Lielākus diametrus var izmērīt, izmantojot mazākus SEM palielinājumus, bet metodes pielietojamība smalkākām šķiedru sadalījumam pakāpeniski samazinās, tāpēc ieteicams pielietot TEM (transmisijas elektronisko mikroskopu), ja vidējais diametrs ir mazāks par 0,5 μm.
1.4. TESTĒŠANAS METODES PRINCIPS
No šķiedru paklāja vai vaļīgām šķiedrām ņem kādu reprezentatīvu serdes paraugu skaitu. Vaļīgām šķiedrām samazina garumu, pielietojot sasmalcināšanas procedūru un attiecīgi sagatavoto reprezentatīvo paraugu disperģē ūdenī. Alikvotas ekstrahē un filtrē caur polikarbonāta filtru ar 0,2 μm lielām porām un sagatavo pētīšanai ar skenēšanas elektroniskās mikroskopijas (SEM) metodi. Šķiedru diametrus mēra pie attēla palielinājuma ×10 000 vai vairāk (1), izmantojot līnijas šķērsojuma metodi, iegūstot nesagrozītu vidējā diametra novērtējumu. Zemāko 95 % ticamības intervālu (pamatojoties uz vienas puses testu) aprēķina, lai novērtētu mazāko materiāla šķiedras ģeometriskā vidējā diametra vērtību.
1.5. TESTEŠANAS METODES APRAKSTS
1.5.1. Drošība/piesardzības pasākumi
Jāsamazina personu ekspozīcija gaisā lidojošām šķiedrām un jāizmanto velkmes skapis vai kamera ar cimdiem, strādājot ar sausām šķiedrām. Periodiski jāpārbauda personu ekspozīcija, lai novērtētu aizsardzības metožu efektivitāti. Strādājot ar MMŠ, jāvalkā vienreizējas lietošanas cimdi, lai samazinātu ādas kairinājumu un novērstu abpusēju piesārņošanu.
1.5.2. Aparatūra/iekārta
|
— |
Prese un presforma, kas spēj nodrošināt 10 MPa. |
|
— |
Polikarbonāta filtri ar kapilārporām 0,2 μm (filtra diametrs 25 mm). |
|
— |
Celulozes estera membrānas filtrs ar 5 μm porām, kas izmantojams kā palīgfiltrs. |
|
— |
Stikla ierīce filtrēšanai (vai vienreizējas lietošanas filtrēšanas sistēmas), kas paredzēta 25 mm diametra filtram (piem., Millipore stikla komplekts mikroanalīzei, tips XX10 025 00). |
|
— |
Svaigs destilēts ūdens, kas nofiltrēts caur filtru ar 0,2 μm lielām porām, lai atdalītu mikroorganismus. |
|
— |
Pārklājums uzsmidzinātājs ar zelta vai zelta/pallādija anodu. |
|
— |
Skenējošais elektronu mikroskops ar izšķirtspēju līdz 10 nm un palielinājumu x10 000. |
|
— |
Dažādi piederumi: lāpstiņas, 24. tipa skalpelis, pincete, SEM lampas, oglekļa līme vai oglekļa līmlente, sudraba putekļi. |
|
— |
Ultraskaņas zonde vai galda ultraskaņas vanna. |
|
— |
Rīks serdes paraugu ņemšanai vai parauga ņemšanas urbis serdes paraugu ņemšanai no MMŠ paklāja. |
1.5.3. Testa procedūra
1.5.3.1. Paraugu ņemšana
Paklāju un segu gadījumā šķērsgriezuma paraugu ņemšanai jāizmanto 25 mm rīks serdes paraugu ņemšanai vai parauga ņemšanas urbis. Paraugus ņem vienādās atstarpēs maza paklāja gabala platumā vai ņem pēc nejaušības principa izvēlētās vietās, ja rīcībā ir garāki paklāja gabali. Tos pašus piederumus var izmantot, ņemot paraugus pēc nejaušības principa no vaļīgām šķiedrām. Ja iespējams, jāņem seši paraugi, lai atspoguļotu nesakārtotā materiāla telpisko neviendabīgumu.
Seši serdes paraugi jāsasmalcina 50 mm diametra presformā pie 10 MPa. Materiālu samaisa ar lāpstiņu un atkārtoti saspiež pie 10 MPa. Pēc tam materiālu izņem no presformas un glabā noslēgtā stikla traukā.
1.5.3.2. Paraugu sagatavošana
Ja nepieciešams, no organiskajām saistvielām var atbrīvoties, ievietojot šķiedru krāsnī pie 450 °C aptuveni uz vienu stundu.
Paraugs jānoskalda un jāsadala četrās daļas (tas jādara putekļu aizsargkamerā).
Mazu parauga daudzumu (< 0,5 g) pievieno ar lāpstiņu 100 ml svaiga destilēta ūdens, kas nofiltrēts caur 0,2 μm membrānas filtru (var izmantot alternatīvus augstākās tīrības ūdens avotus, ja šo avotu atbilstība ir pierādīta). Rūpīgi disperģē, pielietojot ultraskaņas zondi ar jaudu 100 W, zondi noregulējot tā, ka notiek kavitācija. (Ja zondes nav pieejama, jāpielieto šāda metode: nepārtraukti sakrata un apgroza 30 sekunžu laikā; apstrādā ar ultraskaņu galda ultraskaņas vannā 5 minūšu laikā; pēc tam atkal sakrata un apgroza turpmāko 30 sekunžu laikā).
Tūlīt pēc šķiedras dispērģēšanas jāņem vairākas alikvotas (piem., trīs alikvotas pa 3, 6 un 10 ml) ar platmutes pipeti.
Katrai alikvotai veic vakuuma filtrēšanu caur 0,2 μm polikarbonāta filtru ar 5 µm lielu poru MEC palīgfiltru, izmantojot 25 mm stikla filtra piltuvi ar cilindrisku trauku. Aptuveni 5 ml nofiltrētā destilēta ūdens jāielej piltuvē un alikvotu lēnām pilina ūdenī ar pipetes palīdzību, turot pipetes galu zem meniska. Pēc pilināšanas pipete un trauks rūpīgi jānoskalo, jo tievām šķiedrām ir tendence novietoties uz virsmas.
Piesardzīgi noņem filtru un atdala no palīgfiltra, pēc tam ievieto traukā žāvēšanai.
Nogriež ceturtdaļu vai pusi no nofiltrētās nogulsnes filtra, izmantojot 24.tipa skalpeli ar šūpojošo kustību. Nogriezto daļu piesardzīgi piestiprina pie SEM galviņas ar oglekļa līmlenti vai oglekļa līmi. Sudraba putekļus jāuzklāj vismaz trīs vietās, lai uzlabotu elektrisko kontaktu filtra un galviņas malās. Kad līme/sudraba putekļi ir izžuvuši, jāuzsmidzina aptuveni 50 nm bieza zelta vai zelta/pallādija kārta uz nogulsnes virsmas.
1.5.3.3. SEM kalibrēšana un darbība
1.5.3.3.1. Kalibrēšana
SEM kalibrēšana jāpārbauda vismaz vienu reizi nedēļā (ideāli būtu reizi dienā) ar sertificētā kalibrēšanas režģa palīdzību. Kalibrēšana jāārbauda pēc sertificētā etalona un ja izmērītā vērtība (SEM) neatbilst ±2 % no sertificētās vērtības, tad SEM kalibrēšana jāregulē un jāpārbauda atkārtoti.
SEM jābūt spējīgam izšķirt vismaz minimālo saskatāmu diametru 0,2 µm, izmantojot reālo parauga matricu pie palielinājuma × 2 000.
1.5.3.3.2. Darbība
SEM jāpielieto pie palielinājuma 10 000 (2) apstākļos, kas nodrošina labu izšķiršanu ar pieņemamu attēlu pie lēniem skenēšanas ātrumiem, piemēram, 5 sekundes uz kadru. Kaut gan ekspluatācijas prasības dažādiem SEM var būt dažādas, parasti labākas redzamības un izšķiršanas nodrošināšanai relatīvi mazu atomsvaru materiālu gadījumā jāpielieto paātrinājuma spriegumi 5–10 keV ar mazu punktu izmēru uzstādīšanu un īsu darba attālumu. Veicot lineāro pārskatīšanu, jāizmanto 0o slīpums, lai minimizētu atkārtotu nostādīšanu fokusā, vai, ja SEM ir centrētā režīmā, jāizmanto pret centru mērāmais darba attālums. Mazāku palielinājumu var izmantot, ja materiāls nesatur mazas (pēc diametra) šķiedras un šķiedru diametri ir lieli (> 5 μm)
1.5.3.4. Izmēru noteikšana
1.5.3.4.1. Pētījums pie maza palielinājuma, novērtējot paraugu
Paraugs jāpēta vispirms pie maza palielinājuma, meklējot lielu šķiedru sablīvēšanās pierādījumus un novērtējot šķiedras blīvumu. Pārmērīgas sablīvēšanās gadījumā ieteicams sagatavot jaunu paraugu.
Lai nodrošinātu statistisko precizitāti, jāmēra minimāls šķiedru daudzums, turklāt ir ieteicams liels šķiedru blīvums, jo tukšu lauku pētīšana ir laikietilpīga un neveicina analīzi. Tomēr ja filtrs ir pārblīvēts, tad grūti izmērīt visas mērāmās šķiedras, jo lielākās šķiedras var aizsegt mazākās un tās var tikt nepamanītas.
GSĢVD pārvērtēšanas tendence iespējama gadījumā, ja šķiedru blīvums pārsniedz 150 šķiedras uz milimetru lineārās pārskatīšanas. Savukārt, maza šķiedru koncentrācija palielina analīzes laiku un bieži izdevīgāk būtu sagatavot paraugu ar šķiedru blīvumu, kas tuvāks optimālam, nekā turpināt skaitīt uz filtra ar mazu šķiedru koncentrāciju. Optimālam šķiedru blīvumam jādod vidēji viena vai divas saskaitāmās šķiedras uz redzeslauku pie 5 000 palielinājuma. Tomēr optimālais blīvums ir atkarīgs no šķiedru izmēra (diametra), tāpēc nepieciešams, lai operators pamatotos uz profesionālu pieredzi, lai noteiktu, vai šķiedru blīvums ir vai nav tuvs optimālam.
1.5.3.4.2. Šķiedru diametra svēršana attiecībā pret garumiem
Jāskaita tikai tās šķiedras, kas pieskaras (vai šķērso) bezgalīgo tievo līniju SEM ekrānā. Šim nolūkam jānovelk horizontāla (vai vertikāla) līnija caur ekrāna centru.
Alternatīva varētu būt viena punkta izmantošana ekrāna centrā un nepārtrauktas skenēšanas uzsākšana vienā virzienā filtrā. Jāmēra un jāreģistrē diametrs katrai šķiedrai ar garuma pret platumu attiecību, kas ir lielāka par 3:1, un kas pieskaras vai šķērso šo punktu.
1.5.3.4.3. Šķiedru izmēru noteikšana
Ieteicams izmērīt vismaz 300 šķiedras. Katru šķiedru mēra tikai vienu reizi krustošanās punktā ar punktu vai līniju, kas novilkta attēlā (vai krustošanās punkta tuvumā, ja šķiedras malas ir neskaidras). Ja gadās šķiedras ar neregulāriem šķērsgriezumiem, tad jāveic mērījums, kas atspoguļotu vidējo šķiedru diametru. Jāievēro piesardzība, nosakot malas un mērot īsāko atstarpi starp šķiedru malām. Izmēru noteikšanu var veikt līnijās vai ārlīnijās, izmantojot saglabātus attēlus vai fotogrāfijas. Ieteicams pielietot pusautomātiskas attēla mērīšanas sistēmas, kas datus lejupielādē tieši izklājlapā, jo šīs sistēmas ļauj ietaupīt laiku, novērš kopēšanas kļūdas un var automatizēt aprēķinus.
Garu šķiedru gali jāapskata pie maza palielinājuma, lai pārliecinātos, ka tie nav ielocījušies atpakaļ mērāmajā redzes laukā un tiek izmērīti tikai vienu reizi.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Parasti šķiedru diametriem nav normālā sadalījuma. Tomēr, veicot logaritmisko pārveidošanu, var iegūt sadalījumu, kas aproksimējama uz normālo.
Aprēķina n šķiedru diametru (D) naturālā logaritma (lnD) aritmētisko vidējo (vidējais lnD) un standartnovirzi (SDlnD).
|
|
(1) |
|
|
(2) |
Standartnovirzi dala ar mērījumu skaita (n) kvadrātsakni, iegūstot standartkļūdu (SElnD).
|
|
(3) |
Divkāršoto standartkļūdu atskaita no vidējā un aprēķina šo vērtību eksponenciāli (vidējo atskaitot divkāršoto standartkļūdu), iegūstot ģeometrisko vidējo (formulā apzīmēts kā LWGMD) mīnuss divas ģeometriskās standartkļūdas.
|
|
(4) |
3. ZIŅOJUMS
TESTA PĀRSKATS
Testa pārskatā jāiekļauj vismaz šāda informācija:
|
— |
GSĢVD-2SE vērtība. |
|
— |
Attiecīgs pamatojums jebkādām atkāpēm, it īpaši tādām, kas varētu ietekmēt rezultātu precizitāti un pareizību. |
4. IZMANTOTĀ LITERATŪRA
|
1. |
B. Tylee SOP MF 240. Health and Safety Executive. February 1999. |
|
2. |
G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994. |
(1) Šī palielinājuma vērtība norādīta 3 µm šķiedrām, 6 µm šķiedrām būtu piemērotāks × 5 000 palielinājums.
(2) Attiecībā uz 3 μm šķiedrām, skatīt iepriekšējo piezīmi.
III PIELIKUMS
|
B.46. |
ĀDAS KAIRINĀJUMA NOTEIKŠANA AR CILVĒKA EPIDERMAS REKONSTRUKCIJAS MODEĻA IN VITRO TESTU |
1. METODE
1.1. IEVADS
Ādas kairinājums ir atgriezeniska audu bojājuma veidošanās ādā ne ilgāk kā 4 stundas pēc testējamās vielas aplicēšanas [saskaņā ar Apvienoto Nāciju Organizācijas (ANO) vielu klasificēšanas un marķēšanas globāli harmonizēto sistēmu (GHS)] (1). Šajā testēšanas metodē aprakstīta noteikšanas procedūra in vitro, pēc kuras, atkarībā no vajadzīgās informācijas, var noteikt vielu izraisīto ādas kairinājumu kā pakāpeniskas loģiski secīgas testēšanas stratēģijas (2) atsevišķu testu.
Ādas kairinājuma novērtēšanai parasti veic laboratorijas izmēģinājumus ar dzīvniekiem (sk. B.4. metodi) (3). Lai dzīvniekiem neradītu sāpes un ciešanas, ņemot vērā ar dzīvnieku labturību saistītus apsvērumus, ar B.4. metodi nosaka ādas kairinājumu/kodīgu jeb korozīvu iedarbību uz ādu pēc pakāpeniskas loģiski secīgas testēšanas stratēģijas, izmantojot validētas in vitro un ex vivo metodes. Kodīgo īpašību noteikšanai saskaņā ar B.4. metodē paredzēto secīgas testēšanas stratēģiju var izmantot pavisam trīs validētas in vitro testēšanas metodes un testēšanas norādījumus, attiecīgi B.40., B.40.bis un TG 435 (4, 5, 6).
Šajā testēšanas metodē izmanto cilvēka epidermas rekonstrukcijas modeļus (kuriem par šūnu avotu izmanto cilvēka epidermas keratinocītus, ādai reprezentatīvu audu un citoloģisko arhitektūru), kuriem kopumā ir ļoti līdzīgas bioķīmiskās un fizioloģiskās īpašības ar cilvēka ādas virsējo daļu, t. i., epidermu. Pēc šīs testēšanas metodes identificē ANO GHS 2. kat. klasificētās kairinošās vielas. Šajā testēšanas metodē noteikti arī veiktspējas raksturlielumi tādu līdzīgu vai modificētu testēšanas metožu novērtēšanai, kurās izmanto cilvēka epidermas rekonstrukcijas modeļus (7).
Divām in vitro testēšanas metodēm EpiSkin™ un EpiDerm™, kurās izmanto cilvēka epidermas rekonstrukcijas modeļus un kas ir pieejamas tirgū, veikti pirmsvalidācijas, optimizācijas un validācijas pētījumi (8, 9, 10, 11, 12, 13, 14, 15, 16, 17). Šie standarti balstās uz R 38. Noteikto aspektu pārrēķināšana GHS mērķiem ir adresēta standartā 25. Metodes ar veikšanu ekvivalentas EpiSkin™ (validētā 1. standartmetode) ir ieteikta par aizstājēju in vivo testam ar izmēģinājumu trušiem, kuru izmanto GHS 2. kat. kairinošo vielu klasifikācijai. Metodes ar veikšanu ekvivalentas EpiDerm™ (validētā 2. standartmetode) ir ieteikta izmantošanai tikai par skrīninga testu vai kā pakāpeniskas loģiski secīgas testēšanas stratēģijas daļu GHS 2. kat. kairinošo vielu klasifikācijai. Lai cilvēka epidermas rekonstrukcijas modeļa in vitro testēšanas metodes ādas kairinājuma noteikšanai varētu izmantot reglamentācijas nolūkiem, jānosaka to ticamība, piemērotība (precizitāte) un izmantošanas ierobežojumi, lai atbilstoši šajā testēšanas metodē (papildinājumā) noteiktajiem veiktspējas standartiem nodrošinātu to salīdzināmību ar validēto 1. standartmetodi.
Atbilstoši šajā testēšanas metodē noteiktajām prasībām validētas vēl divas citas cilvēka epidermas rekonstrukcijas modeļa in vitro testēšanas metodes, un pēc tām iegūtie rezultāti ir līdzīgi rezultātiem, kas iegūti, izmantojot validēto 1. standartmetodi (18). Šīs metodes ir modificētā EpiDerm™ testēšanas metode (modificēta 2. standartmetode) un SkinEthic RHE™ testēšanas metode (līdzīga 1. standartmetodei).
1.2. DEFINĪCIJAS
Šajā testēšanas metodes aprakstā izmanto šādas definīcijas.
Precizitāte. Pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar attiecīgajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto ar nozīmi “sakritība” vai atbilstība, ar to domājot pareizu rezultātu daļu, ko iegūst pēc testēšanas metodes.
Partijas kontrolviela. Standartviela, kas izraisa audu dzīvotspējas vidēja stipruma reakciju.
Šūnu dzīvotspēja. Parametrs, kas raksturo šūnu populācijas kopējo aktivitāti, piemēram, šūnu mitohondriju dehidrogenāžu spēju reducēt vitālo krāsvielu MTT (3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolija bromīds, tiazolilzilais), kas, atkarībā no nosakāmā testēšanas beigu punkta un izmantotā testēšanas plāna testa, korelē ar dzīvo šūnu kopējo skaitu un/vai dzīvotspēju.
ET50 . Ekspozīcijas laiks, kas pēc noteiktas koncentrācijas ķīmiskā marķiera aplicēšanas nepieciešams šūnu dzīvotspējas samazināšanai par 50 %, sk. arī IC50.
Šķietami negatīvi rezultāti. Visu to vielu daļa, kurām ir attiecīgā veida iedarbība, bet kuras ar konkrēto testēšanas metodi tiek kļūdaini identificētas par vielām bez attiecīgā veida iedarbības. Tas ir viens no metodes veiktspējas raksturlielumiem.
Šķietami pozitīvi rezultāti. Visu to (neaktīvo) vielu daļa, kurām nav attiecīgā veida iedarbības, bet kuras ar konkrēto testēšanas metodi tiek kļūdaini identificētas par vielām ar šādu iedarbību. Tas ir viens no metodes veiktspējas raksturlielumiem.
Nefiksēta deva. Uz ādas aplicētais testējamās vielas daudzums, kas ir lielāks par ādas virsmas pilnīgai un vienmērīgai pārklāšanai nepieciešamo daudzumu.
GHS (Ķīmisko vielu klasificēšanas un marķēšanas Globāli harmonizētā sistēma): Sistēma, saskaņā ar kuru vielas un maisījumus klasificē pēc kaitīgās iedarbības veidiem un to intensitātes uz cilvēka veselību un vidi, kā arī paredz atbilstošu saziņas elementu izmantošanu, piemēram, piktogrammas, signālvārdus, bīstamības apzīmējumus, drošības apzīmējumus un drošības datu lapas, kuru mērķis ir sniegt informāciju, kas nepieciešama cilvēku (tostarp darba devēju, strādājošo, transporta darbinieku, patērētāju un avārijas dienestu darbinieku) un vides aizsardzībai pret to kaitīgo iedarbību (1) un ieviesta ES ar Regulu (EK) Nr. 1272/2008.
IC50 . Ķīmiskā marķiera koncentrācija, pie kuras audu dzīvotspēja pēc noteikta ekspozīcijas laika samazinās par 50 % (IC50), sk. arī ET50.
Veiktspējas standarti. Pamatojoties uz validētu standartmetodi noteikti standarti, pēc kuriem novērtē pēc noteikšanas mehānisma vai funkcionalitātes ziņā līdzīgu testēšanas metožu salīdzināmību. Tajos ietilpst I) testēšanas metodes būtiskie komponenti; II) obligāti izmantojamās standartvielas, kas izraudzītas no tām vielām, kuras izmantotas attiecīgās validētās testēšanas metodes veiktspējas pieņemamības uzskatāmai parādīšanai; kā arī III) salīdzināmi pareizības un ticamības līmeņi, kuru pamatā ir attiecīgajai validētajai testēšanas metodei noteiktie konkrētie līmeņi un kuru nodrošināšanu ar novērtējamo testēšanas metodi var uzskatāmi parādīt ar obligāti izmantojamajām standartvielām.
Ticamība. Raksturo pēc testēšanas metodes iegūto rezultātu reproducējamību, metodi dažādos laikos pēc viena protokola atkārtoti izmantojot vienā un vairākās laboratorijās. To novērtē, aprēķinot reproducējamību vienā laboratorijā un vairākās laboratorijās.
Jutība. Ar konkrēto testēšanas metodi pareizi klasificēto pozitīvo jeb aktīvo vielu daļa, kurām ir attiecīgā veida iedarbība. Jutība raksturo testēšanas metodes precizitāti, ar kādu iegūst nepārprotami skaidrus rezultātus, un tā ir svarīgs faktors, kas jāņem vērā, novērtējot testēšanas metodes piemērotību.
Specifiskums. Ar konkrēto testēšanas metodi pareizi klasificēto negatīvo jeb neaktīvo vielu daļa, kurām nav attiecīgā veida iedarbības. Specifiskums raksturo testēšanas metodes precizitāti, ar kādu iegūst nepārprotami skaidrus rezultātus, un tas ir svarīgs faktors, kas jāņem vērā, novērtējot testēšanas metodes piemērotību.
Ādas kairinājums. Atgriezeniska audu bojājuma veidošanās ādā ne ilgāk kā 4 stundas pēc testējamās vielas aplicēšanas. Ādas kairinājums ir vietēja ar imūnsistēmu nesaistīta reakcija, kas parādās neilgi pēc kairinātāja iedarbības (24). Tās svarīgākā iezīme ir procesu atgriezeniskums, kas saistīti ar iekaisuma reakcijām un ar iekaisuma procesu saistītā kairinājuma raksturīgo klīnisko pazīmju (ādas apsarkums, pietūkums, niezēšana un sāpes) lielāko daļu.
1.3. PIELIETOJUMI UN IEROBEŽOJUMI
Cilvēka epidermas rekonstrukcijas modeļa testus, kas aprakstīti šajā testēšanas metodē, var izmantot tikai vielu kā ādas kairinātāju klasifikācijai ANO GHS 2. kat. klasē. Ar tiem nav iespējams konstatēt vielas, kuras var klasificēt ANO GHS 3 kat. klasē, tāpēc visas pārējās vielas ar tiem nevar klasificēt (noteikt to kategorijas klasi). Atkarībā no reglamentācijas vajadzībām, esošo testu uzlabojumiem un jaunu vai līdzīgu testu izstrādāšanas, kā arī iespējamu jaunu beigu punktu iekļaušanu, šī testēšanas metode var būt regulāri jāpārskata.
Pēc šīs testēšanas metodes iespējams identificēt kairinošas vielas gan atsevišķi, gan daudzkomponentu maisījumos (19), taču tā nedod pareizu priekšstatu par vielas kodīgumu jeb korozīvo iedarbību uz ādu. To nevar izmantot gāzu un aerosolu testēšanai, jo šādu maisījumu un preparātu testēšanas rezultāti vēl nav novērtēti validācijas pētījumā.
1.4. METODES PRINCIPS
Testējamo vielu topikāli aplicē uz cilvēka epidermas rekonstrukcijas trīsdimensiju modeļa, kuru veido normāli cilvēka epidermas keratinocīti, kultivēti tā, lai veidotos labi diferencētas daudzslāņu cilvēka epidermas modelis. Tam ir bazālais, spinālais un granulārais slānis, daudzslāņu stratum corneum ar lamelāriem lipīdu starpšūnu slāņiem, kuru uzbūve ir līdzīga kā in vivo.
Cilvēka epidermas rekonstrukcijas modeļa testa princips pamatojas uz premisu, ka difūzijas rezultātā kairinošas vielas var nokļūt stratum corneum un šīm vielām ir citotoksiska iedarbība uz šūnām slāņos zem tā. Šūnu dzīvotspēju novērtē pēc vitālās krāsvielas MTT [3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolija bromīds, tiazolilzilais; EINECS Nr. 206–069–5, CAS Nr. 298–93–1)] konversijas ar dehidrogenāzi par zilas krāsas formazāna sāli, kura daudzumu audu ekstraktā nosaka kvantitatīvi (20). Kairinošas vielas tiek klasificētas pēc šūnu dzīvotspējas samazināšanās zemāk par kādu noteiktu iepriekš pieņemtu robežvērtību (kas ANO GHS 2. kat. klases kairinošajām vielām ir ≤ 50 %). Vielas, kuru iedarbībā šūnu dzīvotspēja nesamazinās zem šīs robežvērtības, netiek klasificētas (t. i., ja > 50 % bez kat. klases).
Cilvēka epidermas rekonstrukcijas modeļu sistēmas var izmantot cietu vielu, šķidrumu, puscietu materiālu un vasku testēšanai. Šķidrumi var būt ūdens vai neūdens šķīdumu veidā, cietas vielas var būt gan ūdenī šķīstošas, gan nešķīstošas. Ja iespējams, cietas vielas jātestē smalka pulvera veidā. Tā kā cilvēka epidermas rekonstrukcijas modeļu testu sistēmu validācijai izmantotas 58 vielas, kas izraudzītas no dažādām vielu klasēm, sagaidāms, ka šīs metodes izmantojamas gandrīz visām klasēm piederīgo vielu testēšanai (16). Validācija iekļauj 13 GHS 2. kat. kairinātājus. Tam vajadzētu būt pieminētam, ka skābes, bāzes, sāļi un citas neorganiskas vielas, kas nav kodīgas netika iekļautas validācijā un dažas zināmas organisko kairinātāju klases tādas kā hidroperoksīdi, fenoli un virsmaktīvās vielas netika iekļautas vai iekļautas tikai ierobežotā apjomā.
1.5. PRASMES DEMONSTRĒŠANA
Pirms sākt plaši izmantot kādu ar šo testēšanas metodi saistītu validētu testu, tehniskās prasmes uzskatāmai parādīšanai laboratorijas var izmantot desmit vielas, kas norādītas 1. tab. Pēc šīs testēšanas metodes atsevišķi neklasificē vielas, ko var klasificēt ANO GHS 3. kat. Līdzīgām jaunām metodēm, kas izstrādātas saskaņā ar šo testēšanas metodi un kuras ir strukturāli un funkcionāli līdzīgas validētām standartmetodēm, kā arī validēto metožu modifikācijām jāatbilst šīs testēšanas metodes papildinājumā aprakstītajiem veiktspējas standartiem, kuri jāizmanto attiecīgās jaunās testēšanas metodes ticamības un precizitātes uzskatāmai parādīšanai pirms tās izmantošanas testēšanai, kas saistīta ar reglamentāciju.
1. tabula.
Papildinājumā minēto standartvielu izlases kopa
|
Viela |
CAS Nr. |
In vivo reakcija |
Fizikālais stāvoklis |
GHS kategorija |
|
Naftalīnetiķskābe |
86–87–3 |
0 |
Cietv. |
Neklas. |
|
Izopropanols |
67–63–0 |
0,3 |
Šķidr. |
Neklas. |
|
Metilstearāts |
112–61–8 |
1 |
Cietv. |
Neklas. |
|
Heptilbutirāts |
5870–93–9 |
1,7 |
Šķidr. |
Iesp. 3. kat. |
|
Heksilsalicilāts |
6259–76–3 |
2 |
Šķidr. |
Iesp. 3. kat. |
|
Ciklamenaldehīds |
103–95–7 |
2,3 |
Šķidr. |
2. kat. |
|
1-bromheksāns |
111–25–1 |
2,7 |
Šķidr. |
2. kat. |
|
Butilmetakrilāts |
97–88–1 |
3 |
Šķidr. |
2. kat. |
|
1-metil-3-fenil-1-piperazīns |
5271–27–2 |
3,3 |
Cietv. |
2. kat. |
|
Heptanāls |
111–71–7 |
4 |
Šķidr. |
2. kat. |
1.6. METODES APRAKSTS
Turpmāk aprakstīti ādas kairinājuma noteikšanai izmantojamo cilvēka epidermas rekonstrukcijas modeļu testu komponenti un procedūras. Cilvēka epidermas rekonstrukcijas modeļus var izveidot, sagatavot vai tie ir nopērkami gatavi (piemēram, EpiSkin™, EpiDerm™ un SkinEthic RHE™). EpiSkin™, EpiDerm™ un SkinEthic RHE™ testēšanas metožu standartprotokoli ir atrodami [http://ecvam.jrc.ec.europa.eu](21, 22, 23). Testēšana jāveic, ievērojot turpmāk aprakstītos noteikumus.
1.6.1. Cilvēka epidermas rekonstrukcijas modeļu komponenti
1.6.1.1. Vispārīgas prasības par modeli
Epitēlija izveidošanai jāizmanto normāli cilvēka keratinocīti. Zem funkcionāla stratum corneum jābūt vairākiem dzīvotspējīgu epitēlija šūnu slāņiem (bazālajam slānim, stratum spinosum, stratum granulosum). Stratum corneum jābūt daudzslāņu, ar raksturīgo lipīdu profilu, kas izveido funkcionālo barjeru, kura novērš citotoksisko marķieru, piemēram, nātrija dodecilsulfāta (SDS) vai Triton X-100, ātru penetrāciju. Barjeras funkciju novērtē, nosakot koncentrāciju, pie kuras ķīmiskais marķieris pēc noteikta ekspozīcijas laika samazina audu dzīvotspēju par 50 % (IC50), vai nosakot ekspozīcijas laiku, pēc kura noteiktas fiksētas koncentrācijas ķīmiskā marķiera iedarbībā audu dzīvotspēja samazinās par 50 % (ET50). Modeļa aizturēšanas īpašībām jānovērš ap stratum corneum esošā materiāla pāreja dzīvotspējīgos audos, kuras dēļ var tikt nepareizi modelēta faktiskā iedarbība uz ādu. Ādas modelis nedrīkst būt kontaminēts ar baktērijām, vīrusiem, mikoplazmu un sēnītēm.
1.6.1.2. Prasības par modeļa funkcionalitāti
1.6.1.2.1. Dzīvotspēja
Ieteicamākā metode dzīvotspējas noteikšanai ir MTT (20). Ar negatīvo kontroli (NC) apstrādāto audu krāsvielas ekstrakta (šķīduma) optiskajam blīvumam (OD) jābūt vismaz 20 reizes lielākam par ekstrakcijas šķīduma optisko blīvumu. Jādokumentē ar NC apstrādāto audu stabilitāte kultūrā (jābūt ar salīdzināmiem dzīvotspējas rādītājiem) visas testa ekspozīcijas laikā.
1.6.1.2.2. Barjeras funkcija
Stratum corneum un tā lipīdu sastāvam jābūt tādiem, lai aizturētu citotoksisku ķīmisko marķieru, piemēram, nātrija dodecilsulfāta (SDS) vai Triton X-100), ātru penetrāciju, ko nosaka pēc IC50 vai ET50.
1.6.1.2.3. Morfoloģija
Atbilstoši kvalificētam personālam jāveic ādas/epidermas rekonstrukcijas modeļa histoloģiski izmeklējumi, lai demonstrētu modeļa līdzību cilvēka ādas/epidermas struktūrai (ieskaitot daudzslāņu stratum corneum).
1.6.1.2.4. Reproducējamība
Ar konkrētu modeli iegūtajiem rezultātiem uzskatāmi jāparāda to reproducējamība laikā, šim nolūkam vēlams kontrolei izmantot piemērotu vielu partijas kontrolei (standartvielu) (sk. papildinājumu).
1.6.1.2.5. Modeļa kvalitātes kontrole (KK)
Visām lietojamām epidermas modeļu partijām jāatbilst noteiktiem ražojuma kvalitātes kritērijiem, no kuriem svarīgākie ir dzīvotspēja (1.6.1.2.1. punkts) un barjeras funkcija (1.6.1.2.2. punkts). Ādas modeļa piegādātājiem (vai pašiem testētājiem gadījumos, kad izmanto pašizgatavotus modeļus) jānosaka IC50 vai ET50 vērtību pieņemamības intervāls (augšējā un apakšējā robeža). Pēc audu saņemšanas laboratorijā jāpārbauda to barjeras funkcija. Kairinošās iedarbības prognozēšanai ir derīgi tikai ar prasībām atbilstošiem audu modeļiem noteiktie rezultāti. Kā piemērs turpmāk norādīti validētajām standartmetodēm noteiktie pieņemamības intervāli.
2. tabula.
Partiju kvalitātes kontroles pieņemamības intervāli
|
|
Apakšējā pieņemamības robežvērtība |
Pieņemamības intervāla vidējā vērtība |
Augšējā pieņemamības robežvērtība |
|
Validētā 1. standartmetode (18 h iedarbība ar nātrija dodecilsulfātu SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Validētā 2. standartmetode (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
1.6.1.3. Testējamās vielas un kontrolvielas aplicēšana
Testējamo paraugu un kontrolparaugu sērijām jābūt pietiekamam atkārtojumu skaitam (katrā sērijā vismaz trīs atkārtojumi). Testējamās vielas, kas ir šķidras vai cietas vielas, uz ādas virsmas vienmērīgā slānī jāaplicē pietiekamā daudzumā, raugoties, lai netiktu testēta nefiksēta deva (sk. definīciju 1.2. punktā), t. i., minimāli 25 μl/cm2 vai 25 mg/cm2. Testējot cietas vielas, lai nodrošinātu pietiekami labu kontaktu ar ādu, pirms to aplicēšanas epidermas virsma jāsamitrina ar dejonizētu vai destilētu ūdeni. Ja iespējams, cietas vielas jātestē smalka pulvera veidā. Ekspozīcijas perioda beigās testējamais materiāls no ādas virsmas rūpīgi jānoskalo ar piemērotu buferšķīdumu vai 0,9 % NaCl. Atkarībā no lietotā cilvēka ādas epidermas rekonstrukcijas modeļa ekspozīcijas laiks var būt no 15 līdz 60 min, bet inkubēšanas temperatūra no 20 līdz 37 °C. Sīkāk par šo triju metožu standartoperāciju procedūrām (SOP) sk. (21, 22, 23).
Jāizmanto paralēlas negatīvās kontroles (NC) un pozitīvās kontroles (PC), lai uzskatāmi parādītu, ka katrā noteikšanā šūnu dzīvotspēja (NC), barjeras funkcija un audu jutība (PC) ir iepriekš noteiktajā vērtību pieņemamības intervālā. Par pozitīvo kontrolvielu var izmantot nātrija dodecilsulfāta 5 % šķīdumu ūdenī. Par negatīvo kontrolvielu var izmantot ūdeni vai fizioloģisko šķīdumu ar fosfātbuferi (PBS).
1.6.1.4. Šūnu dzīvotspējas noteikšana
Testēšanas procedūras svarīgākais elements ir ievērot, ka dzīvotspējas mērījumus nedrīkst veikt tūlīt pēc testējamo vielu ekspozīcijas un ka noskalotajiem audiem jaunā barotnē ir vajadzīgs pietiekami ilgs pēcekspozīcijas inkubēšanas laiks. Šajā laikā izzūd vāja kairinājuma pazīmes un parādās nepārprotamas citotoksiskas iedarbības izpausmes. Testēšanas optimizācijas posmā noskaidrots (9, 10, 11, 12, 13), ka optimālais pēcekspozīcijas inkubēšanas laiks ir 42 h, un tas tāpēc izmantots testēšanas standartmetožu validācijā.
Šūnu dzīvotspējas mērīšanai izmantojamā validētā kvantitatīvā metode ir MTT konversijas noteikšana. Tā ir audu trīsdimensiju modelim piemērota metode. Ādas paraugu uz 3 stundām pārnes atbilstošas koncentrācijas (piemēram, 0,3–1 mg/ml) MTT šķīdumā. Pēc tam veic nogulsnētā zilas krāsas formazāna produkta ekstrakciju ar šķīdinātāju (piemēram, izopropanolu vai paskābinātu izopropanolu) un nosaka formazāna koncentrāciju, mērot optisko blīvumu pie viļņa garuma 570 nm ± 30 nm.
Testējamās vielas optiskās īpašības vai ķīmiskās reakcijas ar MTT var traucēt noteikšanu, un tāpēc dzīvotspēja var būt noteikta nepareizi (jo testējamā viela var gan kavēt, gan veicināt krāsas veidošanos vai atkrāsošanos). Tas var notikt gadījumos, kad testējamo vielu pilnībā nenoskalo no ādas vai tad, ja tā penetrē epidermā. Ja testējamais materiāls tieši iedarbojas uz vitālo krāsvielu MTT, tam ir krāsa vai krāsa izveidojas ekspozīcijas laikā, testējamo vielu radīto dzīvotspējas mērījumu traucējumu noteikšanai un korekcijām jāizmanto papildu kontroles. Precīzu aprakstu par to, kā noteikt MTT tiešu reducēšanu, sk. validēto standartmetožu testēšanas protokolu (21, 22, 23). Nespecifisks krāsojums (NSC), kura cēlonis ir traucējumi, nedrīkst būt lielāks par 30 % no NC (korekcijām). Ja NSC > 30 %, testējamā viela nav piemērota testēšanai pēc šīs testēšanas metodes.
1.6.1.5. Noteikšanas rezultātu pieņemamības kritēriji
No testēšanai derīgu audu modeļu partijām (sk. 1.6.1.2.5. punktu) ar negatīvās kontroles vielu apstrādātajiem audiem noteiktajām optiskā blīvuma vērtībām jāraksturo to kvalitāte visos nosūtīšanas un saņemšanas cikla posmos un visos ādas kairinājuma noteikšanas protokola procesos. Negatīvajā kontrolē noteiktās optiskā blīvuma vērtības nedrīkst būt zemākas par vēsturisko datu noteiktu zemāko vērtību. Arī datiem par audiem, kas apstrādāti ar pozitīvās kontroles vielu, t. i., nātrija dodecilsulfāta (SDS) 5 % šķīdumu ūdenī, katras atsevišķas noteikšanas apstākļos jāraksturo audiem saglabājusies jutība un to spēja reaģēt uz ķīmisko kairinājumu (piemēram, šūnu dzīvotspēja ≤ 40 % validētajai 1. standartmetodei un ≤ 20 % validētajai 2. standartmetodei). Jānosaka attiecīgi kritēriji par atkārtojumos noteikto rezultātu pieļaujamo mainību (piemēram, ja par šādu kritēriju izmanto standartnovirzi, tai jābūt ≤ 18 %).
2. DATI
2.1. DATI
Par katru noteikšanu, arī par atkārtotiem eksperimentiem, ja tos veic, tabulas veidā apkopo visus datus par testējamā parauga visiem atkārtojumiem (piemēram, optiskā blīvuma vērtības, datus par testējamās vielas ietekmi uz šūnu dzīvotspēju un tās klasifikācijas datus). Par katru izmēģinājumu variantu jānorāda rezultāta vidējā vērtība ± standartnovirze. Par katru testējamo vielu un testējamo vielu, kurai ir krāsa, jādokumentē novērotā iedarbība ar MTT reaģentu.
2.2. REZULTĀTU INTERPRETĀCIJA
Katram testējamajam paraugam iegūtās optiskā blīvuma vērtības var izmantot dzīvotspējīgo šūnu daļas aprēķināšanai salīdzinājumā ar negatīvo kontroli (NC), kuru pieņem par 100 %. Precīzi jānosaka un jādokumentē šūnu dzīvotspējas robežvērtība, pēc kuras identificē un atšķir testējamās kairinošās vielas no šādi neklasificētajām vielām, kā arī testēšanas rezultātu izvērtēšanai izmantotās statistiskās procedūras, un uzskatāmi jāparāda to piemērotība. Veicot testēšanu pēc validētajām standartmetodēm, kairinošas iedarbības prognozēšanai izmanto šādas robežvērtības.
Uzskatāms, ka testējamā viela izraisa tādu ādas kairinājumu, ka tā jāklasificē ANO GHS 2. kat.:
|
i) |
ja audu šūnu dzīvotspēja pēc ekspozīcijas un pēcapstrādes inkubēšanas laika ir mazāka vai vienāda ar (≤) 50 %. |
Testējamo vielu neklasificē kā ādas kairinājumu izraisošu:
|
ii) |
ja audu šūnu dzīvotspēja pēc ekspozīcijas un pēcapstrādes inkubēšanas laika ir lielāka par (>) 50 %. |
3. ZIŅOŠANA
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj šāda informācija.
Testējamās un kontrolvielas:
|
— |
ķīmiskais nosaukums, piemēram, IUPAC vai CAS nosaukums un CAS numurs, ja zināms, |
|
— |
vielas tīrība un sastāvs (masas procentos), |
|
— |
fizikāli ķīmiskās īpašības, kas attiecas uz testēšanu (piemēram, fizikālais stāvoklis, stabilitāte un iztvaikošanas spēja, pH, šķīdība ūdenī, ja tās ir zināmas), |
|
— |
testējamās/kontrolvielas sagatavošana pirms testēšanas, ja veikta (piemēram, sildīšana, sasmalcināšana), |
|
— |
glabāšanas apstākļi. |
Ādas modeļa un testēšanas protokola izmantošanas pamatojums.
Testēšanas apstākļi:
|
— |
izmantotā šūnu sistēma; |
|
— |
šūnu dzīvotspējas mērīšanai izmantotās mērierīces (piemēram, spektrofotometra) kalibrēšanas dati un viļņa garums, pie kura veikti dzīvotspējas mērījumi; |
|
— |
pilnīga informācija par izmantoto ādas modeli un tā veiktspējas raksturlielumiem. Tajā jānorāda vismaz:
|
|
— |
informācija par izmantoto testēšanas procedūru; |
|
— |
testēšanai lietotās devas, ekspozīcijas laiks un pēcekspozīcijas inkubēšanas laiks; |
|
— |
ja ir, testēšanas procedūras modifikāciju apraksts; |
|
— |
vēsturiskie dati par modeli. No tiem jānorāda vismaz:
|
|
— |
izmantotie novērtēšanas kritēriji un iedarbības prognozes modelim izraudzīto robežvērtību pamatojums. |
Rezultāti:
|
— |
tabulas veidā apkopoti dati par atsevišķiem testa paraugiem; |
|
— |
citu novēroto efektu apraksts. |
Rezultātu novērtējums.
Secinājumi.
4. LITERATŪRA
|
1. |
United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Available at: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html. |
|
2. |
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Available at:http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649. |
|
3. |
Test Method B.4. ACUTE TOXICITY; DERMAL IRRITATION/CORROSION. |
|
4. |
Test Method B.40. IN VITRO SKIN CORROSION: TRANSCUTANEOUS ELECTRICAL RESISTANCE TEST TER. |
|
5. |
Test Method B.40 BIS. IN VITRO SKIN CORROSION: HUMAN SKIN MODEL TEST. |
|
6. |
OECD (2006). Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Adopted July 19, 2006. Available at: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html. |
|
7. |
ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu. |
|
8. |
Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in Vitro 15, 57–93. |
|
9. |
Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765–770. |
|
10. |
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107–114. |
|
11. |
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test. ATLA 33, 351–367. |
|
12. |
Cotovio, J., Grandidier, M.–H., Portes, P., Roguet, R. & G. Rubinsteen. (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329–249. |
|
13. |
Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30,109–129. |
|
14. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601. |
|
15. |
Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 pp. + annexes. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu. |
|
16. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603–619. |
|
17. |
J. Cotovio, M.–H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy -Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351–358. |
|
18. |
ESAC statement on updated EpiDerm and similar SkinEthic assays. 5 November 2008. |
|
19. |
EC (2006). Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. Official Journal of the European Union L396/1 of 30.12.2006. OPOCE, Luxembourg. |
|
20. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55–63. |
|
21. |
EpiSkin™ SOP, Version 1.6 (January 2005). Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu. |
|
22. |
EpiDerm™ SOP, Version 5.0 (October 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu. |
|
23. |
SkinEthic RHE™ SOP. Will be available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu. |
|
24. |
Harvell, J.D., Lamminstausta, K, Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, pp 7–18 |
|
25. |
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008. |
Papildinājums
Veiktspējas raksturlielumu noteikšana ādas kairinājuma in vitro testēšanas metodēm, kurās izmanto cilvēka epidermas rekonstrukcijas modeļus
IEVADS
Izmantojot vielas, kas aptver visu ādas reakcijas klasifikācijas Dreiza (Draize) skalu, jānosaka ticamība un precizitāte visām procedūrām, kuras izmanto saskaņā ar šo testēšanas metodi. Novērtēšanai izmantojot 20 ieteicamās standartvielas (2. tab.), testēšanas metodēm jābūt tādām ticamības un precizitātes raksturlielumu vērtībām, kas ir salīdzināmas ar validētajai 1. standartmetodei noteiktajām vērtībām (3. tab.) (1). Prasības attiecībā uz ticamību un precizitāti noteiktas turpmāk II un III iedaļā. Iekļautas neklasificētas un (ANO GHS 2. kat.) klasificētas vielas no attiecīgajām vielu klasēm tā, tā lai novērtējamās testēšanas metodes ticamība un ar izmantošanu prognozēšanai saistīto raksturlielumu vērtības (jutība, specifiskums, šķietami negatīvo un šķietami pozitīvo rezultātu daļa, precizitāte) varētu salīdzināt ar attiecīgajām validētajai 1. standartmetodei noteiktajām vērtībām. Pirms jaunu vielu testēšanas jānosaka izmantojamās testēšanas metodes ticamība un iespējas ar tās palīdzību pareizi identificēt ANO GHS 2. kat. klasificētās kairinošās vielas.
VEIKTSPĒJAS STANDARTI
Veiktspējas standartiem ir trīs šādi elementi: I) testēšanas metodes būtiskie komponenti, II) standartvielas un III) rezultātu precizitātes un ticamības raksturlielumu vērtības (2). Šie veiktspējas standarti noteikti pēc ECVAM veiktā ādas kairinājuma noteikšanas validācijas pētījuma rezultātiem (3).
I) Testēšanas metodes būtiskie komponenti
Vispārīgas prasības par modeli
Epitēlija izveidošanai jāizmanto normāli cilvēka keratinocīti. Zem funkcionāla stratum corneum jābūt vairākiem dzīvotspējīgu epitēlija šūnu slāņiem (bazālajam slānim, stratum spinosum, stratum granulosum). Stratum corneum jābūt daudzslāņu, ar raksturīgo lipīdu profilu, kas izveido funkcionālo barjeru, kura novērš citotoksisko ķīmisko marķieru, piemēram, SDS vai Triton X-100, ātru penetrāciju. Barjeras funkciju novērtē, nosakot koncentrāciju, pie kuras ķīmiskais marķieris pēc noteikta ekspozīcijas laika samazina audu dzīvotspēju par 50 % (IC50), vai nosakot ekspozīcijas laiku, pēc kura noteiktas fiksētas koncentrācijas ķīmiskā marķiera iedarbībā audu dzīvotspēja samazinās par 50 % (ET50). Modeļa aizturēšanas īpašībām jānovērš ap stratum corneum esošā materiāla pāreja dzīvotspējīgos audos, kuras dēļ var tikt nepareizi modelēta faktiskā iedarbība uz ādu. Ādas modelis nedrīkst būt kontaminēts ar baktērijām, vīrusiem, mikoplazmu un sēnītēm.
Prasības par modeļa funkcionalitāti
Dzīvotspēja
Ieteicamākā metode dzīvotspējas noteikšanai ir MTT (4). Ar NC apstrādāto audu krāsvielas ekstrakta (šķīduma) optiskajam blīvumam jābūt vismaz 20 reizes lielākam par ekstrakcijas šķīduma optisko blīvumu. Jādokumentē ar NC apstrādāto audu stabilitāte kultūrā (jābūt ar salīdzināmiem dzīvotspējas rādītājiem) visas testa ekspozīcijas laikā.
Barjeras funkcija
Stratum corneum un tā lipīdu sastāvam jābūt tādiem, lai aizturētu citotoksisku ķīmisko marķieru, piemēram, SDS vai Triton X-100), ātru penetrāciju, ko nosaka pēc IC50 vai ET50.
Morfoloģija
Atbilstoši kvalificētam personālam jāveic ādas/epidermas rekonstrukcijas modeļa histoloģiski izmeklējumi, lai demonstrētu modeļa līdzību cilvēka ādas/epidermas struktūrai (ieskaitot daudzslāņu stratum corneum).
Reproducējamība
Ar konkrētu modeli iegūtajiem rezultātiem uzskatāmi jāparāda to reproducējamība laikā, šim nolūkam vēlams kontrolei izmantot piemērotu vielu partijas kontrolei (standartvielu) (sk. definīcijas 1.2. iedaļā).
Modeļa kvalitātes kontrole (KK)
Visām lietojamām epidermas modeļu partijām jāatbilst noteiktiem ražojuma kvalitātes kritērijiem, no kuriem svarīgākie ir dzīvotspēja (4. punkts) un barjeras funkcija (5. punkts). Ādas modeļa piegādātājiem (vai pašiem testētājiem gadījumos, kad izmanto pašizgatavotus modeļus) jānosaka IC50 vai ET50 vērtību pieņemamības intervāls (augšējā un apakšējā robeža). Pēc audu saņemšanas laboratorijā jāpārbauda to barjeras funkcija. Kairinošās iedarbības prognozēšanai ir derīgi tikai ar prasībām atbilstošiem audu modeļiem noteiktie rezultāti. Kā piemērs turpmāk norādīti validētajām standartmetodēm noteiktie pieņemamības intervāli.
1. tabula.
Partiju kvalitātes kontroles kritēriju piemēri
|
|
Apakšējā pieņemamības robežvērtība |
Pieņemamības intervāla vidējā vērtība |
Augšējā pieņemamības robežvērtība |
|
Validētā 1. standartmetode (18 h iedarbība ar SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Validētā 2. standartmetode (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
II) Standartvielas
Validētām standartmetodēm strukturāli un funkcionāli pietiekami līdzīgu tādu jaunu testēšanas metožu vai nedaudz modificētu standartmetožu ticamības un precizitātes noteikšanai, kurās izmanto cilvēka epidermas rekonstrukcijas modeļus in vitro, lieto standartvielas, ar kurām iegūst pēc attiecīgās validētās 1. standartmetodes veiktspējas ziņā salīdzināmus rezultātus (1). 2. tab. norādītās 20 standartvielas ir dažādām vielu klasēm piederošas kairinošas vielas, tostarp arī ANO GHS 2. kat. vielas. No tām 10 ir ANO GHS 2. kat. vielas, 3 ir vielas, ko var klasificēt ANO GHS 3. kat., un 7 ir par kairinošām neklasificējamas vielas. Pēc šīs testēšanas metodes atsevišķi neklasificē vielas, ko var klasificēt ANO GHS 3. kat. Šīs standartvielas ir standartvielu minimālais kopums, kas jālieto ādas kairinājuma testēšanas metodes precizitātes un ticamības noteikšanai, izmantojot cilvēka epidermas rekonstrukcijas modeli. Gadījumos, kad kāda no norādītajām vielām nav pieejama, var izmantot citas vielas, par kurām ir piejami atbilstoši dati in vivo izmēģinājumos. Ja nepieciešams, testēšanas metodes precizitātes un ticamības noteikšanas uzlabošanai standartvielu minimālajam kopumam papildus var izmantot citām vielu klasēm piederošas vielas, par kurām ir pieejami atbilstoši dati, kas iegūti in vivo izmēģinājumos.
2. tabula.
Standartvielas cilvēka epidermas rekonstrukcijas modeļu precizitātes un ticamības noteikšanai
|
Viela (1) |
CAS Nr. |
EINECS Nr. |
Fizikālais stāvoklis |
In vivo reakcija |
GHS in vitro kat. |
GHS in vivo kat. |
|
1-brom-4-hlorbutāns |
6940–78–9 |
230–089–3 |
Šķidr. |
0 |
2. kat. |
Neklas. |
|
Dietilftalāts |
84–66–2 |
201–550–6 |
Šķidr. |
0 |
Neklas. |
Neklas. |
|
Naftalīnetiķskābe |
86–87–3 |
201–705–8 |
Cietv. |
0 |
Neklas. |
Neklas. |
|
Alilfenoksiacetāts |
7493–74–5 |
231–335–2 |
Šķidr. |
0,3 |
Neklas. |
Neklas. |
|
Izopropanols |
67–63–0 |
200–661–7 |
Šķidr. |
0,3 |
Neklas. |
Neklas. |
|
4-metil-tio-benzaldehīds |
3446–89–7 |
222–365–7 |
Šķidr. |
1 |
2. kat. |
Neklas. |
|
Metilstearāts |
112–61–8 |
203–990–4 |
Cietv. |
1 |
Neklas. |
Neklas. |
|
Heptilbutirāts |
5870–93–9 |
227–526–5 |
Šķidr. |
1,7 |
Neklas. |
Iesp. 3. kat. |
|
Heksilsalicilāts |
6259–76–3 |
228–408–6 |
Šķidr. |
2 |
Neklas. |
Iesp. 3. kat. |
|
Triizobutilfosfāts |
126–71–6 |
204–798–3 |
Šķidr. |
2 |
2. kat. |
Iesp. 3. kat. |
|
1-dekanols |
112–30–1 |
203–956–9 |
Šķidr. |
2,3 |
2. kat. |
2. kat. |
|
Ciklamenaldehīds |
103–95–7 |
203–161–7 |
Šķidr. |
2,3 |
2. kat. |
2. kat. |
|
1-bromheksāns |
111–25–1 |
203–850–2 |
Šķidr. |
2,7 |
2. kat. |
2. kat. |
|
2-hlormetil-3,5-dimetil-4-metoksipiridīna hidrohlorīds |
86604–75–3 |
434–680–9 |
Cietv. |
2,7 |
2. kat. |
2. kat. |
|
a-terpineols |
98–55–5 |
202–680–6 |
Šķidr. |
2,7 |
2. kat. |
2. kat. |
|
di-n-propildisulfīds |
629–19–6 |
211–079–8 |
Šķidr. |
3 |
Neklas. |
2. kat. |
|
butilmetakrilāts |
97–88–1 |
202–615–1 |
Šķidr. |
3 |
2. kat. |
2. kat. |
|
5–(1,1-dimetiletil)-2-metilbenzotiols |
7340–90–1 |
438–520–9 |
Šķidr. |
3,3 |
2. kat. |
2. kat. |
|
1-metil-3-fenil-1-piperazīns |
5271–27–2 |
431–180–2 |
Cietv. |
3,3 |
2. kat. |
2. kat. |
|
Heptanāls |
111–71–7 |
203–898–4 |
Šķidr. |
4 |
2. kat. |
2. kat. |
Vielas, kas norādītas 2. tab., ir reprezentatīva daļa no 58 vielām, kas izmantotas ECVAM starptautiskajā ādas kairinājuma testēšanas validācijas pētījumā (1). To izvēles pamatā ir šādi kritēriji:
|
— |
vielas ir komerciāli piejamas, |
|
— |
tās ir visam Dreiza (Draize) ādas kairinājuma reakcijas intervālam reprezentatīvas (no nekairinošām līdz stipri kairinošām), |
|
— |
tās ir ar precīzi noteiktu ķīmisko struktūru, |
|
— |
tās ir reprezentatīvas validētās metodes reproducējamībai un izmantojamībai prognozēšanai, kas noteikta ECVAM veiktajā validācijas pētījumā, |
|
— |
vielas ir reprezentatīvas validācijas procesā izmantotajām ķīmiskajām funkcijām, |
|
— |
tās nav ekstrēmi toksiskas (piemēram, kancerogēnas vai reproduktīvajai sistēmai toksiskas), un to lietošana nav saistīta ar pārlieku augstām atkritumu apsaimniekošanas izmaksām. |
III) Rezultātu precizitātes un ticamības raksturlielumu vērtības
Testēšanas metodes veiktspējas rakstulielumiem, kas saistīti ar rezultātu izmantojamību prognozēšanai (jutība, specifiskums, šķietami negatīvie un šķietami pozitīvie rezultāti, precizitāte), jābūt ar validētajai 1. standartmetodei noteiktajiem (3. tab.) salīdzināmiem, t. i., jutībai jābūt vienādai vai lielākai (≥) par 80 %, specifiskumam jābūt vienādam vai lielākam (≥) par 70 %, un precizitātei jābūt vienādai vai lielākai (≥) par 75 %. Ar izmantojamību prognozēšanai saistīto raksturlielumu vērtības jāaprēķina, izmantojot visas klasifikācijas, kas norādītajām 20 standartvielām noteiktas dažādās laboratorijās, kas piedalījās validācijā. Katras vielas klasifikāciju attiecīgajā laboratorijā nosaka pēc šūnu dzīvotspējas vidējās vērtības, kas noteikta vairākām testējamo paraugu sērijām (vismaz trīs derīgas sērijas).
3. tabula.
Validētās 1. standartmetodes veiktspēja (2)
|
Testēšanas metode |
Vielu skaits |
Jutība |
Specifiskums |
Šķietami negatīvi rezultāti |
Šķietami pozitīvi rezultāti |
Precizitāte |
|
Validētā 1. standartmetode (3) |
58 |
87,2 % (4) |
71,1 % (5) |
12,8 % |
29,9 % |
74,7 % |
|
Validētā 1. standartmetode (3) |
20 |
90 % |
73,3 % |
10 % |
26,7 % |
81,7 % |
Novērtējamās testēšanas metodes ticamībai jābūt salīdzināmai ar validēto standartmetožu ticamību.
Reproducējamība vienā laboratorijā
Reproducējamībai vienā laboratorijā jābūt tādai, ka pēc vienā laboratorijā dažādās neatkarīgās 20 standartvielu testēšanas sērijās iegūtajiem rezultātiem noteiktās vielu klasifikācijas (2. kat./ neklasificējamas) sakritība ir vienāda vai lielāka (≥) par 90 %.
Starplaboratoriju reproducējamība
Starplaboratoriju reproducējamībai nav būtiskas nozīmes gadījumos, kad attiecīgo testēšanas metodi paredzēts izmantot tikai vienā laboratorijā. Metodēm, kuras paredzēts izmantot vairākās laboratorijās, starplaboratoriju reproducējamībai ir jābūt tādai, ka pēc vismaz trijās laboratorijās dažādās neatkarīgās 20 standartvielu testēšanas sērijās iegūtajiem rezultātiem noteiktās vielu klasifikācijas (2. kat./ neklasificējamas) sakritība ir vienāda vai lielāka (≥) par 80 %.
LITERATŪRA
|
1. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601. |
|
2. |
OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris. |
|
3. |
ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Available under Download Study Documents, at http://ecvam.jrc.ec.europa.eu. Accessed on 27.10.2008. |
|
4. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55–63. |
|
5. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603–619. |
(1) Šīs 20 standartvielas ir to 58 vielu reprezentatīva paraugkopa, kuras sākotnēji tika izmantotas 1. standartmetodes (EpiSkin™) validācijai. Testēto vielu pilnīgu uzskaitījumu un to izraudzīšanās kritērijus sk. (5).
(2) 3. tabulā norādītas 1. standartmetodes raksturlielumu veiktspēja, jo pēc tās iespējams pareizi identificēt kairinošas vielas (ANO GHS 2. kat.) un šādi neklasificētas vielas (neklasificējamas vielas un vielas, kuras var klasificēt ANO GHS 3. kat.), šīs vērtības noteiktas, izmantojot attiecīgi 58 un 20 (2. tab.) standartvielas.
(3) EpiSkin™
(4) Balstoties uz 13 GHS kat. 2 kairinātājiem.
(5) Balstoties uz 45 GHS kat. 3 kairinātājiem vai GHS ne kategorijas ķīmiskajām vielām.
IV PIELIKUMS
|
C.3. |
SALDŪDENS AĻĢU UN CIĀNBAKTĒRIJU (ZILAĻĢU) AUGŠANAS INHIBĒŠANAS TESTS |
1. METODE
Šī metode ir ekvivalenta OECD TG 201 (2006).
1.1. IEVADS
Testēšanas metodes periodiski pārskata un pilnveido, ņemot vērā zinātnes attīstību. C.3. testēšanas metode bija jāpārstrādā, iekļaujot papildu sugas un izpildot noteiktās prasības par bīstamības novērtējumu un vielu klasifikāciju. Metode pārstrādāta, ņemot vērā plašo praktisko pieredzi, jaunākās zinātniskās atziņas pētījumos par toksisko iedarbību uz aļģēm un izmantošanas pieredzi reglamentēšanas jomā, kas iegūta kopš sākotnējās pieņemšanas.
1.2. DEFINĪCIJAS
Šajā testēšanas metodē ir izmantotas šādas definīcijas un saīsinājumi:
Biomasa: ir populācijas dzīvās vielas sausais svars (sausna), kas izteikts noteiktā tilpuma vienībā; piemēram, mg aļģu sausnas/litrā testa šķīduma. Parasti “biomasa” tiek definēta kā masa, taču šajā testēšanas metodes aprakstā šis vārds tiek lietots, lai apzīmētu masu tilpuma vienībā. Bez tam šajā testā parasti mēra biomasas aizstājējparametrus, tādus kā šūnu skaitu, fluorescenci utt., un lietotais termins “biomasa” līdz ar to attiecas arī uz šiem aizstājējparametru mērījumiem.
Variācijas koeficients: ir parametra mainības bezdimensijas mērs, ko nosaka kā standartnovirzes attiecību pret vidējo vērtību. Šo koeficientu var izteikt arī procentos. Kontroles kultūru atkārtojumu vidējā īpatnējā augšanas ātruma vidējo variācijas koeficientu aprēķina šādi:
|
1. |
Izmantojot konkrētā atkārtojuma ikdienas / katras sekcijas augšanas ātrumus, aprēķina vidējā īpatnējā augšanas ātruma variācijas koeficientu procentos. |
|
2. |
Lai iegūtu kontroles kultūru atkārtojumu ikdienas / katras sekcijas īpatnējā augšanas ātruma vidējo variācijas koeficientu, aprēķina visu 1. punktā noteikto vērtību vidējo lielumu. |
ECx : ir testa barotnē izšķīdinātās testējamās vielas koncentrācija, kas noteiktajā iedarbības periodā izraisa testa organisma x % (piemēram, 50 %) augšanas inhibēšanu (periodu norāda, ja tas atšķiras no pilna vai normālā testēšanas laika). Lai nepārprotami norādītu efektīvās koncentrācijas EC vērtību, kas iegūta no augšanas ātruma vai arī iznākuma, izmanto attiecīgi simbolus “ErC” un “EyC”.
Audzēšanas barotne: ir pilnvērtīga sintētiska barotne, kurā aug testa aļģes, kad tās pakļauj testējamās vielas iedarbībai. Testējamā viela parasti tiek izšķīdināta barotnē.
Augšanas ātrums (vidējais īpatnējais augšanas ātrums): ir biomasas pieauguma logaritms iedarbības laikā.
Zemākā novērojamās ietekmes koncentrācija (LOEC): ir zemākā pārbaudītā koncentrācija, kādā testējamā viela noteiktajā iedarbības laikā statistiski nozīmīgā līmenī, salīdzinot ar kontroli, samazina augšanu (pie p < 0,05). Tomēr visām koncentrācijām, kas pārsniedz LOEC, ir jārada tikpat kaitīga vai kaitīgāka iedarbība, kā LOEC. Ja abus nosacījumus izpildīt nav iespējams, ir rūpīgi jāizskaidro, kā tika izvēlēta LOEC (un līdz ar to arī NOEC).
Nenovērojamās ietekmes koncentrācija (NOEC): ir testējamā koncentrācija tieši zem LOEC.
Atbildes reakcijas mainīgais lielums: toksiskuma rādītājs, ko ar dažādu aprēķina metožu palīdzību iegūst no jebkura mērītā parametra, kas apraksta biomasu. Šajā metodē atbildes reakcijas mainīgie ir augšanas ātrums un iznākums, ko iegūst tieši, mērot biomasu vai izmantojot kādu no minētajiem aizstājējparametri.
Īpatnējais augšanas ātrums: ir atbildes reakcijas mainīgais, ko definē kā novērojamā parametra (šajā testēšanas metodē – biomasas) naturālo logaritmu starpību attiecīgā laika periodā.
Iznākums: ir mērāmā mainīgā vērtība iedarbības perioda beigās, no kuras ir atņemta mērāmā mainīgā vērtība iedarbības perioda sākumā, t. i., biomasas pieaugums testēšanas laikā.
1.3. TESTA PIELIETOJUMS
Šī testēšanas metode ir vieglāk izmantojama ūdenī šķīstošām vielām, kas testa apstākļos, visticamāk, paliks ūdens šķīdumā. Testējot gaistošas, izteikti adsorbējošas, krāsainas vielas, kā arī tādas vielas, kas slikti šķīst ūdenī, vai arī vielas, kas var ietekmēt barības vielu vai minerālvielu pieejamību barotnē, var būt nepieciešamas aprakstītā procesa modifikācijas (piemēram, noslēgta sistēma, testa trauku kondicionēšana). Norādījumi par dažām izmantojamajām modifikācijām ir sniegti (2)(3) un (4).
1.4. METODES PRINCIPS
Šī testa mērķis ir noteikt, kā viela ietekmē saldūdens mikroaļģu un/vai ciānbaktēriju augšanu. Eksponenciāli augošus testa organismus periodiski audzētās kultūrās pakļauj testējamās vielas iedarbībai laika posmā, kas parasti ilgst 72 stundas. Lai gan tests ir diezgan īslaicīgs, tas ļauj izvērtēt iedarbību uz vairākām paaudzēm.
Sistēmas atbildes reakcija ir dažādu testējamās vielas koncentrāciju iedarbībai pakļauto aļģu kultūru sēriju (testa vienības) augšanas samazināšanās. Atbildes reakciju vērtē kā iedarbības koncentrāciju funkciju, salīdzinot ar atkārtojumu, iedarbībai nepakļauto kontroles kultūru, vidējo augšanu. Lai pilnībā izpaustos sistēmas reakcija uz toksisko iedarbību (optimālā jutība), kultūrām ļauj neierobežoti eksponenciāli augt, nodrošinot pietiekami daudz barības vielu un nepārtrauktu gaismu pietiekami ilgu laiku, lai varētu izmērīt īpatnējā augšanas ātruma samazināšanos.
Augšanu un augšanas inhibēšanu skaitliski nosaka, izmērot aļģu biomasu kā laika funkciju. Aļģu biomasu definē kā sausnas masu tilpuma vienībā, tas ir, mg aļģu litrā testa šķīduma. Tomēr sausnas masa ir grūti mērāma, tāpēc tiek izmantoti aizstājējparametri. Visbiežāk izmantotais no šiem aizstājējiem parametriem ir šūnu skaits. Citi aizstājējparametri ir šūnu tilpums, fluorescence, optiskais blīvums, u. c. Jānosaka pārrēķināšanas koeficients attiecīgā aizstājējparametra pārvēršanai biomasā.
Testa mērķis ir augšanas inhibēšana, ko izsaka kā biomasas logaritmisko pieaugumu (vidējais īpatnējais augšanas ātrums) iedarbības perioda laikā. Izmantojot testējamajos šķīdumos noteiktos vidējos īpatnējos augšanas ātrumus, aprēķina koncentrāciju, kas izraisa augšanas ātruma konkrēto x % inhibēšanu (piemēram, 50 %), un izsaka kā ErCx (piemēram, ErC50).
Šīs metodes veikšanai ES noteiktajos ietvaros rezultātu aprēķināšana vajadzētu būt balstītai uz vidējo specifisko augšanas ātrumu apstākļiem, kas aprakstīti zemāk 2.2. sadaļā. Šajā testēšanas metodē izmantotais atbildes reakcijas papildu mainīgais ir iznākums, kas var būt nepieciešams, lai izpildītu dažu valstu specifiskas reglamentējošas prasības. To definē kā biomasu iedarbības perioda beigās, no kura atņem biomasu iedarbības perioda sākumā. Izmantojot testējamo šķīdumu sērijās noteikto iznākumu, aprēķina koncentrāciju, kas izraisa iznākuma konkrēto x % inhibēšanu (piemēram, 50 %) un izsaka kā EyCx (piem., EyC50).
Turklāt zemāko novērojamās ietekmes koncentrāciju (LOEC) un koncentrāciju, pie kuras ietekme nav novērojama (NOEC), var noteikt statistiski.
1.5. INFORMĀCIJA PAR TESTĒJAMO VIELU
Testēšanas apstākļu noteikšanai var būt noderīga informācija par testējamās vielas struktūrformulu, tīrības pakāpi, stabilitāti gaismā, stabilitāti testēšanas apstākļos, gaismu absorbējošajām īpašībām, pKa, kā arī transformācijas pētījumu rezultātiem, ieskaitot bioloģiskās noārdīšanas spēju ūdenī.
Jāzina pārbaudāmās vielas šķīdība ūdenī, sadalījuma koeficients sistēmā oktanols/ūdens (Pow) un tvaika spiediens, un jābūt pieejamai validētai metodei vielas daudzuma noteikšanai pārbaudāmajā šķīdumā ar zināmu atgūstamību un kvalitatīvās noteikšanas robežu.
1.6. STANDARTVIELA
Standartvielas, piemēram, 3,5-dihidrofenolu, ko izmanto starptautiskajās starplaboratoriju salīdzinošās testēšanas programmās (4), var lietot testēšanas procedūras pārbaudei. Zaļaļģēm par standartvielu var izmantot kālija dihromātu. Testēšanu ar standartvielām vēlams veikt vismaz divas reizes gadā.
1.7. TESTA DERĪGUMS
Lai tests būtu derīgs, ir jāizpilda šādi veiktspējas kritēriji:
|
— |
Kontroles kultūru biomasai 72 stundu laikā ir jāpieaug eksponenciāli, vismaz 16-kārtīgi. Tas atbilst īpatnējam augšanas ātrumam 0,92 dienā–1. Biežāk izmantotajām sugām augšanas ātrums ir būtiski lielāks (skatīt I pielikumu). Šo kritēriju var neizpildīt, ja izmanto sugas, kas aug lēnāk par I pielikumā norādītajām. Tādā gadījumā testēšanas laiks jāpagarina, lai iegūtu vismaz 16-kārtīgu kontroles kultūru pieaugumu, visu testa laiku saglabājot eksponenciālu augšanu. Testa laiku var saīsināt līdz vismaz 48 stundām, lai testa laikā saglabātu neierobežotu eksponenciālu augšanu, kamēr ir sasniegts minimālais pieauguma koeficients 16. |
|
— |
Katras sekcijas īpatnējo augšanas ātrumu vidējais variācijas koeficients (0.–1. diena, 1.–2. diena un 2.–3. diena 72 stundu testam) kontroles kultūrās (sk. “Variācijas koeficients” sadaļu 1.2) nedrīkst pārsniegt 35 %. Par katras sekcijas īpatnējā augšanas ātruma aprēķināšanu sk. 2.2.1 otrajā daļā. Šis kritērijs attiecas uz kontroles kultūru atkārtojumu variācijas koeficientu vidējo vērtību. |
|
— |
Testa laikā kontroles kultūru atkārtojumu vidējo īpatnējo augšanas ātrumu variācijas koeficients testos ar Pseudokirchneriella subcapitata un Desmodesmus subspicatus nedrīkst pārsniegt 7 %. Mazāk analizētām sugām šai vērtībai nevajadzētu pārsniegt 10 %. |
1.8. METODES APRAKSTS
1.8.1. Aparatūra
Traukiem un citai aparatūrai, kas saskaras ar testa šķīdumiem, jābūt no stikla vai cita ķīmiski inerta materiāla. Priekšmeti ir rūpīgi jāmazgā, lai novērstu iespējamo organisko vai neorganisko piesārņotāju ietekmi uz aļģu augšanu vai testēajmo šķīdumu sastāvu.
Testēšanai izmantojamie trauki parasti ir stikla kolbas, kurām jābūt pietiekami lielām, lai nodrošinātu kultūras tilpumu, kas nepieciešams mērījumiem testa laikā, kā arī atbilstošai CO2 masas pārnesei no atmosfēras (sk. 1.8.9. otro daļu). Jāņem vērā, ka šķidruma tilpumam jābūt analītiskajām noteikšanām pietiekami lielam (sk. 1.8.11 piekto daļu).
Turklāt nepieciešama kāda no šīm iekārtām vai tās visas:
|
— |
iekārta kultūras audzēšanai: ir ieteicams izmantot skapi vai kameru, kurā vajadzīgo inkubācijas temperatūru var uzturēt ar precizitāti ±2 °C, |
|
— |
instrumenti apgaismojuma mērīšanai: jāuzsver, ka mērījuma rezultātu ietekmē gaismas intensitātes mērīšanas metode un īpaši uztvērēja (kolektora) tips. Mērījumus ieteicams veikt, izmantojot sfērisku (4π) uztvērēju, kas reaģē uz tiešo un atstaroto gaismu visos leņķos virs mērījuma plaknes un zem tās, vai 2 π uztvērēju, kas reaģē uz visu gaismu virs mērījumu plaknes, |
|
— |
iekārtas aļģu biomasas noteikšanai. Šūnu skaitu, kas ir biežāk izmantotais aļģu biomasas aizstājējparametrs, var noteikt, izmantojot daļiņu elektronisko skaitītāju, mikroskopu ar skaitīšanas kameru vai arī plūsmas citometru. Citus biomasas aizstājējparametrus var mērīt, izmantojot plūsmas citometru, fluorimetru, spektrofotometru vai kolorimetru. Aprēķinos ieteicams izmantot pārrēķināšanas koeficientu šūnu skaita pārvēršanai sausnas masā. Lai ar spektrofotometru iegūtu derīgus mērījumus pie zemas biomasas koncentrācijas, var būt nepieciešams izmantot kivetes ar optisko ceļu vismaz 4 cm. |
1.8.2. Testa organismi
Var izmantot vairākas brīvi dzīvojošu mikroaļģu un zilaļģu sugas. 1. pielikumā uzskaitītie celmi ir pierādījuši savu piemērotību izmantošanai šajā testēšanas metodē izklāstītajai procedūrai.
Izmantojot citas sugas, jānorāda celms un/vai izcelsme. Ir jāapstiprina, ka izvēlēto testa aļģu eksponenciālo augšanu, saglabājot noteiktos apstākļus, ir iespējams nodrošināt visu testa laiku.
1.8.3. Audzēšanas barotne
Ieteicams izmantot divas alternatīvas barotnes: OECD un AAP barotnes. Šo barotņu sastāvs norādīts 2. pielikumā. Jāievēro, ka sākotnējais pH un buferietilpība (spēja uzturēt nemainīgu pH) abām barotnēm ir atšķirīga. Tāpēc testēšanas rezultāti atkarībā no izmantotās barotnes var būt dažādi, īpaši analizējot vielas, kas jonizējas.
Barotnes var būt nepieciešams modificēt noteiktiem mērķiem, piemēram, analizējot metālus vai helātus veidojošas vielas, vai arī veicot testēšanu pie dažādām pH vērtībām. Modificētas barotnes izmantošana ir sīki jāapraksta un jāpamato (2)(3).
1.8.4. Biomasas sākotnējā koncentrācija
Testa kultūru sākotnējai biomasai ir jābūt vienādai visās testa kultūrās un pietiekami mazai, lai kultūra visu inkubācijas periodu varētu augt eksponenciāli, neiztērējot barības vielas. Sākotnējā biomasa nedrīkst pārsniegt 0,5 mg/l sausnas masas. Šīs ir ieteiktās sākotnējās šūnu koncentrācijas:
|
Pseudokirchneriella subcapitata: |
5 × 103-104 |
šūnas/ml |
|
Desmodesmus subspicatus |
2–5 × 103 |
šūnas/ml |
|
Navicula pelliculosa |
104 |
šūnas/ml |
|
Anabaena flos-aquae |
104 |
šūnas/ml |
|
Synechococcus leopoliensis |
5 × 104-105 |
šūnas/ml |
1.8.5. Testējamās vielas koncentrācija
Koncentrāciju intervālu, kurā iespējama iedarbība, var noteikt, ņemot vērā intervāla noteikšanas testu rezultātus. Galīgajam definitīvajam testam ir jāizvēlas vismaz piecas koncentrācijas, kas veido ģeometrisko progresiju ar kāpinātāju, kas nepārsniedz 3,2. Testējamajām vielām ar lēzenu koncentrācijas atbildes reakcijas līkni, iespējams, ir jāizmanto lielākas kāpinātāja vērtības. Koncentrāciju sērijām būtu jānodrošina 5–75 % aļģu augšanas ātruma inhibēšana.
1.8.6. Atkārtojumi un kontroles
Testēšanas plānā jāparedz trīs atkārtojumi katram testējamās koncentrācijas variantam. Ja NOEC noteikt nav nepieciešams, testēšanas plānu var mainīt, palielinot koncentrāciju skaitu un samazinot katras koncentrācijas atkārtojumu skaitu. Kontrolei nepieciešami vismaz trīs atkārtojumi, bet ideāli to skaitam ir jābūt divas reizes lielākam par katra testējamās koncentrācijas varianta atkārtojumu skaitu.
Testējamās vielas koncentrācijas analītiskai noteikšanai var sagatavot atsevišķus testējamos šķīdumus (sk. 1.8.11. ceturto un sesto daļu).
Ja testējamās vielas šķīdināšanai izmanto šķīdinātāju, testēšanas plānā jāiekļauj papildu kontroles, kas satur šķīdinātāju tādā pašā koncentrācijā, kādā tas izmantots testa kultūrām.
1.8.7. Inokulācijas kultūras sagatavošana
Lai pielāgotu testa aļģes testēšanas apstākļiem un nodrošinātu, ka testējamo šķīdumu inokulācijai izmantotās aļģes atrodas eksponenciālās augšanas fāzē, 2–4 dienas pirms testa sākuma sagatavo inokulācijas kultūru. Aļģu biomasa ir jākoriģē, lai līdz testa sākumam inokulācijas kultūrā dominētu eksponenciālā augšana. Inokulācijas kultūru inkubē tādos pašos apstākļos kā testa kultūras. Lai pārliecinātos, ka testa celms kultivēšanas apstākļos aug normāli, nosaka inokulācijas kultūras biomasas pieaugumu. Aļģu kultūru audzēšanas piemērs izklāstīts 3. pielikumā. Lai novērstu šūnu sinhronu dalīšanos testa laikā, inokulācijas kultūra, iespējams, būs jāpārsēj atkārtoti.
1.8.8. Testa šķīdumu sagatavošana
Visos testējamajos šķīdumos jābūt vienādai barotnes koncentrācijai un testa aļģu sākotnējai biomasai. Izvēlētās koncentrācijas testa šķīdumus parasti sagatavo, samaisot testējamās vielas izejas šķīdumu ar barotni un inokulācijas kultūru. Izejas šķīdumu parasti sagatavo, izšķīdinot vielu testa vidē.
Lai testa videi pievienotu vielas ar zemu šķīdību ūdenī, kā nesējus var izmantot šķīdinātājus, piemēram, acetonu, t-butilspirtu un dimetilformamīdu (1)(2). Šķīdinātāja koncentrācija nedrīkst pārsniegt 100 µl/l, un visām testa sērijas kultūrām (ieskaitot kontroles) šķīdinātājs jāpievieno vienādā koncentrācijā.
1.8.9. Inkubācija
Testa traukus noslēdz ar gaisu caurlaidīgiem aizbāžņiem. Traukus sakrata un ievieto kultivēšanas aparātā. Testa laikā aļģes nepieciešams turēt suspensijas stāvoklī un veicināt CO2 pārnesi. Šim nolūkam izmanto pastāvīgu kratīšanu vai maisīšanu. Kultūras ir audzē temperatūrā no 21 līdz 24 °C, ko uztur ar ±2 °C precizitāti. Sugām, kas nav minētās 1. pielikumā, piemēram, tropiskajām sugām, var būt piemērotas augstākas temperatūras ar nosacījumu, ka iespējams izpildīt derīguma kritērijus. Kolbas ir ieteicams izvietot nejaušā secībā un katru dienu mainīt to stāvokli inkubatorā.
Kontroles barotnes pH testa laikā nedrīkst palielināties vairāk par 1,5 vienībām. Lai iegūtu reproducējamus un precīzi definētus rezultātus metāliem un savienojumiem, kas testa pH atbilstošā ūdeņraža jonu koncentrācijā daļēji jonizējas, var būt jāierobežo pH izmaiņas. Tehniski iespējams panākt par 0,5 pH vienībām mazākas izmaiņas, kas sasniedzams, nodrošinot adekvātu CO2 masas pārnesi no apkārtējā gaisa testa šķīdumā, piemēram, palielinot kratīšanas ātrumu. Tāpat, samazinot sākotnējo biomasu vai arī testa ilgumu, var samazināt kultūras CO2 vajadzību.
Virsmai, uz kuras tiek inkubētas kultūras, jāsaņem pastāvīgs, viendabīgi fluorescējošs, piemēram, “vēsi baltās” vai “dienasgaismas” tipa apgaismojums. Aļģu un ciānbaktēriju gaismas prasības ir atšķirīgas. Gaismas intensitāte ir jāizvēlas atbilstoši izmantotajam testa organismam. Ieteicamajām zaļaļģu sugām gaismas intensitāte šķīdumu līmenī ir jāizvēlas intervālā 60–120 µE·m–2·s–1, ar atbilstošu uztvērēju mērot pie fotosintētiski efektīvo viļņu garuma, t. i., 400–700 nm. Dažas sugas, īpaši Anabaena flos-aquae, labi aug zemākas intensitātes gaismā un var tikt bojātas, ja gaismas intensitāte ir augsta. Šādām sugām vidējā gaismas intensitāte ir jāizvēlas intervālā 40–60 µE·m–2·s–1. (Apgaismojuma mērīšanas instrumentiem, kas ir kalibrēti luksos, ekvivalents 4 440–8 880 lx aukstās baltās gaismas intervāls aptuveni atbilst ieteiktajai gaismas intensitātei 60–120 µE·m–2·s–1). Gaismas intensitāte no vidējās gaismas intensitātes virs inkubācijas virsmas nedrīkst atšķirties vairāk par ±15 %.
1.8.10. Testa ilgums
Tests parasti ilgst 72 stundas. Tomēr var izmantot īslaicīgākus vai ilglaicīgākus testus ar nosacījumu, ka tiek ievēroti 1.7. sadaļā minētie derīguma kritēriji.
1.8.11. Mērījumi un noteikšanas analīzes
Aļģu biomasa katrā kolbā testēšanas laikā jānosaka vismaz vienu reizi dienā. Ja mērījumus veic, izmantojot ar pipeti no testa šķīduma ņemtus nelielus tilpumus, tos nedrīkst aizstāt.
Biomasu mēra, skaitot šūnas ar mikroskopu vai izmantojot daļiņu elektronisko skaitītāju (pēc šūnu skaita un/vai bioloģiskā tilpuma). Citas metodes, piemēram, plūsmas citometriju, in vitro vai in vivo hlorofila fluorescences (6)(7) vai optiskā blīvuma mērījumi ir izmantojami ar nosacījumu, ka var demonstrēt testēšanas apstākļos iegūstamās biomasas pietiekami ciešu korelāciju ar šādu alternatīvu parametru.
Testa sākumā un beigās jānosaka šķīdumu pH.
Ja izmantoto koncentrāciju diapazonā pieejama analītiska procedūra testējamās vielas noteikšanai, testa šķīdumi jāanalizē, lai apstiprinātu sākotnējās koncentrācijas un iedarbības koncentrāciju saglabāšanos visā testēšanas laikā.
Ja sagaidās, ka iedarbības koncentrāciju nominālās vērtības testēšanas laikā mainīsies ne vairāk par 20 %, iespējams, ka pietiks noteikt testējamās vielas koncentrāciju zemas un augstas koncentrācijas variantos testa sākumā un beigās, kā arī koncentrāciju, kas aptuveni atbilst EC50. Ja koncentrācijas, visticamāk, nesaglabāsies 80–120 % robežās no nominālās koncentrācijas, ieteicams analizēt visas pārbaudāmās koncentrācijas testa sākumā un beigās. Lai precīzāk noteiktu gaistošu, nestabilu vai izteikti adsorbējošu testējamo vielu zudumus, iedarbības laikā ar 24 stundu intervālu laikā ieteicams ņemt analīzēm papildu testējamās vielas paraugus. Šīm vielām būs nepieciešami papildu atkārtojumi. Visos gadījumos testējamās vielas koncentrācijas ir jānosaka tikai no viena katras pārbaudāmās koncentrācijas atkārtojuma (vai arī vairākos vienā atkārtojumā apvienotos traukos).
Iedarbības koncentrāciju analīzei testa laikā īpaši sagatavotās barotnes jāapstrādā identiski testā izmantotajām, t. i., tās jāinokulē ar aļģēm un jāinkubē identiskos apstākļos. Ja jānosaka izšķīdušās testējamās vielas koncentrācija, iespējams, ka aļģes jāatdala no barotnes. Atdalīšanu ieteicams veikt centrifūgā pie relatīvi neliela centrbēdzes spēka, kas ir pietiekams aļģu izgulsnēšanai.
Konstatējot, ka testējamās vielas koncentrācija visa testa laikā ir saglabājusies ±20 % no nominālās vai noteiktās sākotnējās koncentrācijas, rezultātu analīzei var izmantot nominālās vai noteiktās sākotnējās vērtības. Ja novirze no nominālās vai arī noteiktās sākotnējās koncentrācijas pārsniedz ±20 %, rezultātu analīzei jāizmanto vidējā ģeometriskā koncentrācija iedarbības laikā, vai arī modeļi, kas apraksta pārbaudāmās vielas koncentrācijas samazināšanos (3)(8).
Aļģu augšanas inhibēšanas tests ir dinamiskāka testa sistēma nekā lielākā daļa citu īslaicīgo testu, ko izmanto toksiskuma noteikšanai ūdens vidē. Līdz ar to faktiskās koncentrācijas var būt grūti nosakāmas, īpaši adsorbējošām vielām zemās koncentrācijās. Šādos gadījumos vielas izzušana no šķīduma, adsorbējoties uz pieaugošās aļģu biomasas nenozīmē, ka tās testa sistēmā vairs nav. Analizējot testēšanas rezultātus jāpārbauda, vai līdz ar testējamās vielas koncentrācijas samazināšanos testa laikā samazinās arī augšanas inhibēšana. Ja tā notiek, var apsvērt iespējas izmantot piemērotu modeli testējamās vielas koncentrācijas samazināšanās (8) aprakstīšanai. Ja nē, rezultātu analīzei var izmantot sākotnējās (nominālās vai izmērītās) koncentrācijas.
1.8.12. Citi novērojumi
Lai pārliecinātos par inokulējamās kultūras normālu un veselīgu izskatu, kā arī konstatētu visas aļģu anomālijas (ko var izraisīt testējamās vielas iedarbība), testa beigās jāveic mikroskopiski izmeklējumi.
1.8.13. Robežvērtību tests
Dažos gadījumos, piemēram, ja iepriekšējais tests norāda, ka testējamās vielas koncentrācijām līdz 100 mg·l–1 vai arī līdz šķīdības robežai testa vidē (atkarībā no tā, kura no vērtībām ir mazāka) nav toksiskas iedarbības, var veikt robežvērtību testu, kurā salīdzina reakciju kontroles grupā un vienā apstrādes varianta grupā (100 mg·l–1 vai koncentrācijā, kas atbilst šķīdības robežai). To ieteicams papildināt ar iedarbības koncentrācijas analīzi. Uz robežvērtības testu attiecas visi iepriekš aprakstītie testa nosacījumi un derīguma kritēriji, izņemot to, ka nepieciešami vismaz seši katra apstrādes varianta atkārtojumi. Reakcijas mainīgos kontroles grupā un apstrādes grupā var analizēt, izmantojot statistisku testu vidējo vērtību salīdzināšanai, piemēram, Stjūdenta t-testu. Ja abu grupu dispersija nav vienāda, jāveic nevienādām dispersijām pielāgots t-tests.
1.8.14. Modifikācijas stripri krāsainām vielām
Iradiācijai (vieglas intensitātes) vajadzētu būt augstākai diapazona beigās, kā aprakstīts šajā testēšanas metodē: 120µE m-2 s-1 vai augstāk.
Gaismas ceļam vajadzētu būt īsākam pie testa šķīduma tilpuma samazināšanas (diapazonā 5–25 ml).
Pietiekamu sakratīšanu (piemēram, mērenu sakratīšanu) vajadzētu veikt, lai iegūtu augstas iedarbības biežumu uz aļģēm un augstu irridāciju uz kultūras virsmu.
2. DATI
2.1. AUGŠANAS GRAFIKI
Biomasu testa traukos var izteikt mērījumam izmantotā aizstājējparametra vienībās (piemēram, šūnu skaits, fluorescence).
Lai konstruētu augšanas grafikus, tabulas veidā apkopo datus par biomasas koncentrācijām testa kultūrās un kontrolēs un testējamās vielas koncentrācijām un mērījumu termiņiem, ko reģistrē ar precizitāti vismaz līdz veselām stundām. Šajā pirmajā posmā var izmantot gan logaritmisko, gan lineāro mērogu, taču logaritmisko skalu izmantot ir obligāti, un tā kopumā labāk attēlo augšanas izmaiņas testēšanas laikā. Jāņem vērā, ka eksponenciālo augšanu logaritmisko koordinātu sistēmā attēlo ar taisnu līniju, un līnijas virziena koeficients (slīpums) raksturo īpatnējo augšanas ātrumu.
Izmantojot grafikus, pārbauda, vai kontroles kultūras testa laikā aug eksponenciāli un paredzamajā ātrumā. Kritiski izvērtē visus datu punktus un grafiku veidu, kā arī pārbauda izejas datus un procedūras, vai tajos nav kļūdu. Īpašu uzmanību pievērš visiem datiem, kas, kā šķiet, atšķiras par sistemātisku kļūdu. Ja dati norāda uz kļūdām procedūrā un tās ir/vai var tikt uzskatītas par ļoti ticamām, attiecīgo datu punktu atzīmē kā izkrītošu un neiekļauj turpmākajā statistiskajā analīzē. (Ja aļģu koncentrācija vienā no diviem vai trim varianta atkārtojumu traukiem atbilst nullei, tas, iespējams, norāda, ka trauki nav pareizi inokulēti vai pietiekami tīri). Iemesli, kāpēc datu punkts tika atzīts par izkrītošu, ir skaidri jānorāda testēšanas pārskatā. Pieņemamie iemesli ir tikai (reti) kļūdas procedūrā un nevis vienkārši zema precizitāte. Statistiskās procedūras izkritušo vērtību identificēšanai šī tipa problēmām ir izmantojamas ierobežoti, un tās nevar aizstāt eksperta vērtējumu. Izkritušās vērtības (atbilstoši identificētas) ieteicams atstāt starp grafikos vai tabulās attēlotajiem datu punktiem.
2.2. ATBILDES REAKCIJAS MAINĪGIE
Šī testa mērķis ir noteikt, kā testējamā viela ietekmē aļģu augšanu. Šajā testēšanas metodē aprakstīti divi atbildes reakcijas mainīgie, jo dalībvalstīm ir atšķirīga to izvēle un dažādas ar reglamentāciju saistītās vajadzības. Lai testa rezultāti tiktu atzīti visās dalībvalstīs, efekti ir jāizvērtē, izmantojot abus reakcijas mainīgos (a) un (b), kas aprakstīti turpmāk.
|
(a) |
Vidējais īpatnējais augšanas ātrums: šo reakcijas mainīgo aprēķina, pēc testa laikā konstatētā biomasas logaritmiskā pieauguma, ko izsaka vieni dienai. |
|
(b) |
Iznākums: šis reakcijas mainīgais ir biomasa testa beigās, no kuras atņem biomasu testa sākumā. |
Šīs metodes veikšanai ES noteiktajos ietvaros, rezultātu aprēķināšanai vajadzētu būt balstītai uz vidējo specifisko augšanas ātrumu apstākļiem, kas aprakstīti zemāk. Jāatzīmē, ka toksiskās iedarbības aprēķinu rezultāts ir atkarīgs no izmantotā atbildes reakcijas mainīgā, kas nav salīdzināmi, un šīs atšķirības jāņem vērā, izmantojot testa rezultātus. Ņemot vērā katras pieejas matemātisko bāzi un stingri ievērojot šajā metodē noteiktos testēšanas apstākļus, uz vidējo īpatnējo augšanas ātrumu (ErCx) balstītās ECx vērtības kopumā būs augstākas par rezultātiem, kas aprēķināti pēc iznākuma (EyCx). To nevar interpretēt kā abu atbildes reakcijas mainīgo jutības atšķirības, jo šīs vērtības ir matemātiski dažādas. Vidējā īpatnējā augšanas ātruma koncepcija ir balstīta uz aļģu vispārējā eksponenciālās augšanas modeļa neierobežotās kultūrās, kurās toksisko iedarbību vērtē, ņemot vērā ietekmi uz augšanas ātrumu, neatkarīgi no kontroles kultūras absolūtā īpatnējā augšanas ātruma, koncentrācijas un atbildes reakcijas grafika slīpuma vai testēšanas ilguma. Pretēji tam uz iznākumu balstītie rezultāti ir atkarīgi no visiem šiem mainīgajiem. EyCx ir atkarīgs no katrā testā izmantoto aļģu sugu īpatnējā augšanas ātruma un maksimālā īpatnējā augšanas ātruma, kas dažādām sugām un pat atšķirīgiem aļģu celmiem var būt dažāds. Šo reakcijas mainīgo nevar izmantot, lai salīdzinātu dažādu aļģu sugu vai pat atšķirīgu celmu jutību pret toksiskajām vielām. Lai gan vidējā īpatnējā augšanas ātruma izmantošanai toksiskās iedarbības novērtēšanā no zinātniskā viedokļa būtu dodama priekšroka, dažās valstīs spēkā esošo reglamentējošo prasību izpildei šajā testa metodē ir iekļauts arī uz iznākumu balstīts toksiskās iedarbības novērtējums.
2.2.1. Vidējais augšanas ātrums
Katram kontroles un apstrādes varianta traukam vidējo īpatnējo augšanas ātrumu noteiktam periodam aprēķina kā biomasas logaritmisko pieaugumu saskaņā ar vienādojumu:
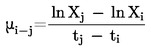 (diena–1)
(diena–1)
kur:
|
µ i–j - |
ir vidējais īpatnējais augšanas ātrums no laika i līdz j; |
|
X i - |
ir biomasa laikā i; |
|
X j - |
ir biomasa laikā j. |
Katrā apstrādes varianta grupā un kontroles grupā aprēķina vidējo augšanas ātrumu un tā dispersiju.
Aprēķina vidējo īpatnējo augšanas ātrumu visā testa laikā (parasti 0–3 dienās), par sākuma vērtību izmantojot nomināli inokulēto biomasu, nevis noteikto sākuma vērtību, jo šādā veidā parasti var sasniegt lielāku precizitāti. Ja biomasas mērīšanā izmantotās iekārtas ļauj pietiekami precīzi noteikt zemu inokulētās kultūras biomasu (piemēram, plūsmas citometrs), tad var izmantot noteikto sākotnējo biomasas koncentrāciju. Tāpat izvērtē katras sekcijas augšanas ātrums, ko aprēķina kā katras testa dienas (0.–1. diena, 1.–2. diena un 2.–3. diena) īpatnējo augšanas ātrumu un pārbauda, vai kontroles augšanas laiks ir pastāvīgs (sk. derīguma kritērijus 1.7. sadaļā). Par vidējo kopējo īpatnējo augšanas ātrumu būtiski zemāks īpatnējais augšanas ātrums pirmajā dienā var liecināt par kultūras atrašanos kavēšanās fāzē, kurā tā attīstās lēni. Lai gan kavēšanās fāzi kontroles kultūrās var līdz minimumam samazināt un praktiski novērst, atbilstoši pavairojot pirmskultūru, kavēšanās fāze apstrādes variantu kultūrās var liecināt par kultūras atveseļošanos pēc sākotnējā toksiskā stresa, vai par sākotnēji samazinātu iedarbību testējamās vielas zudumu dēļ (ieskaitot sorbciju aļģu biomasā). Līdz ar to, lai izvērtētu testa vielas ietekmi visas iedarbības laikā, var noteikt katras sekcijas augšanas ātrumu. Būtiska atšķirība starp katras sekcijas augšanas ātrumu un vidējo augšanas ātrumu norāda uz novirzi no pastāvīgas eksponenciālas augšanas un liecina par nepieciešamību sīkāk izpētīt augšanas līknes.
Augšanas ātruma inhibēšanu procentos katram apstrādes atkārtojumam aprēķina šādi:
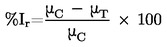
kur:
|
%Ir: |
vidējā īpatnējā augšanas ātruma inhibēšana procentos; |
|
µC: |
kontroles grupas vidējais īpatnējais augšanas ātrums (µ); |
|
µT: |
apstrādes varianta atkārtojumu vidējais īpatnējais augšanas ātrums. |
Ja testējamo šķīdumu gatavošanai lieto šķīdinātājus, inhibēšanas procentu aprēķināšanā jāizmanto nevis kontroles bez šķīdinātājiem, bet gan kontroles ar šķīdinātājiem.
2.2.2. Iznākums
Iznākumu aprēķina no katra kontroles trauka un apstrādes varianta trauka biomasas testa beigās, atņemot biomasu testa sākumā. Katrai testējamajai koncentrācijai un kontrolei aprēķina vidējo iznākumu un tā dispersiju. Iznākuma inhibēšanu procentos (%Iy) katram atkārtojumam var aprēķināt:

kur:
|
% Iy: |
iznākuma inhibēšana procentos |
|
YC: |
iznākuma vidējā vērtība kontroles grupā |
|
YT: |
apstrādes varianta atkārtojumu iznākuma vērtība |
2.3. KONCENTRĀCIJAS-ATBILDES REAKCIJAS GRAFIKS
Inhibēšanas vērtības procentos atkarībā no testējamās vielas koncentrācijas logaritma atliek uz grafika, neņemot vērā punktus, kas atzīti par izkritušiem testēšanas pirmajā posmā. Ar roku vai izmantojot datorizētu interpolāciju, starp datu punktiem izvelk gludu līniju, lai iegūtu pirmo iespaidu par koncentrācijas-atbildes reakcijas sakarību, tad turpina, lietojot precīzāku metodi, ieteicams, datorizētu statistisku metodi. Atkarībā no plānotā datu izmantošanas veida, to kvalitātes (precizitātes) un apjoma, kā arī datu analīzes instrumentu pieejamības, var pieņemt lēmumu (un dažreiz tas ir pamatoti) pārtraukt datu analīzi šajā posmā, un no grafika vienkārši nolasīt galvenos parametrus EC50 un EC10 (un/vai EC20) (sk. arī sadaļu par veicinošu iedarbību turpinājumā). Iemesli, kas attaisno statistiskās metodes neizmantošanu:
|
— |
Dati nav piemēroti datorizētām metodēm, lai iegūtu drošākus rezultātus par tiem, ko var iegūt ar eksperta vērtējumu – šajās situācijās ar dažām datorprogrammām, iespējams, pat nevarēs iegūt risinājumu (iterācijas var nekonverģēt, u. c.). |
|
— |
Lietojot pieejamās datora programmas, nav iespējams adekvāti izmantot datus par augšanas stimulāciju (sk. turpmāk). |
2.4. STATISTISKĀS PROCEDŪRAS
Mērķis – izmantojot regresijas analīzi, iegūt kvantitatīvu koncentrācijas-atbildes reakcijas sakarību. Lai gan pēc atbildes reakcijas datu lineāras transformēšanas iespējams izmantot svērto lineāro regresiju, piemēram, probit vai logit, vai Weibull vienībās (9), tomēr ieteicams izmantot nelineārās regresijas metodes, kas labāk apraksta neizbēgamās datu kļūdas un novirzes no nesimetriskajiem sadalījumiem. Tuvojoties nullei vai pilnīgai inhibēšanai, šādas novirzes var palielināt analīzi apgrūtinošā transformācija (9). Jāņem vērā, ka analīžu standartmetodes, kas izmanto probit, logit vai Weibull pārveidojumus, ir paredzētas tādu datu analīzei, kas ir galīgi lielumi (piemēram, mirstības vai izdzīvošanas datiem), un tās jāmodificē, piemērojot augšanas vai biomasas datiem, kas ir nepārtraukti gadījuma lielumi. Īpašas procedūras ECx vērtību noteikšanai, izmantojot datus, kas ir nepārtraukti lielumi, ir aprakstītas (10),(11) un (12). Nelineārās regresijas analīze sīkāk aprakstīta 4. pielikumā.
Lai izskaitļotu punktu ECx vērtības, katram analizējamajam reakcijas mainīgajam izmanto koncentrācijas-atbildes reakcijas sakarību. Ja iespējams, katrai vērtībai jānosaka 95 % ticamības līmeņi. Atbildes reakcijas datu atbilstība regresijas modelim jāizvērtē vai nu grafiski, vai statistiski. Regresijas analīze jāveic, izmantojot nevis apstrādes variantu grupu vidējos rādītājus, bet atsevišķu atkārtojumu atbildes reakcijas. Ja tomēr nelineāra grafika izmantošana ir grūti īstenojama datu lielās izkliedes dēļ, problēmu var apiet, veicot regresiju grupas vidējām vērtībām, jo tā ir praktiska iespēja, kā samazināt iespējamo izkritušo vērtību ietekmi. Ja atsevišķie atkārtojumi nedod labu rezultātu, par šīs iespējas izmantošanu kā par novirzi no parastās procedūrasa jānorāda testēšanas pārskatā.
Ja pieejamie regresijas modeļi/metodes datiem nav piemēroti, EC50 vērtības un ticamības līmeņus var iegūt arī, izmantojot lineāro interpolāciju ar bootstrapping – statistisku metodi datu kopas pārbaudei, izveidojot to pseidoatkārtojumus pēc gadījuma izvēles principa (13).
Lai izvērtētu LOEC un līdz ar to arī NOEC, kā arī testējamās vielas ietekmi uz augšanas ātrumu, izmantojot dispersijas analīzes metodes, jāsalīdzina ar to apstrādes variantu grupu vidējās vērtības. Katras koncentrācijas vidējā vērtība pēc tam, izmantojot atbilstošu daudzkārtīgu salīdzinājumu vai trenda testa metodes, ir jāsalīdzina ar kontroles vidējo vērtību. Iespējams, būs noderīgs Dunnett vai Williams tests (14)(15)(16)(17)(18). Jānovērtē, vai ir spēkā pieņēmums par dispersijas homogenitāti. Šo izvērtējumu var veikt grafiski vai arī izmantojot formālu testu (18). Piemēroti ir Levene vai Bartlett testi. Dispersijas nehomogenitāti dažreiz var koriģēt ar datu logaritmisko transformāciju. Tomēr, ja dispersijas heterogenitāte ir ļoti liela un to nav iespējams novērst ar transformāciju, būtu jālemj par tādu metožu kā Jonkheere trenda testa izmantošanu. Sīkāki norādījumi par NOEC noteikšanu aprakstīti (12).
Zinātnes jaunākās atziņas ir pamatā ieteikumam atteikties no NOEC jēdziena, tās vietā izmantojot ECx vērtības, ko nosaka ar regresijas analīzi. Šim aļģu testam nav noteikta piemērota x vērtība. Piemērotākais acīmredzot ir 10 līdz 20 % intervāls, (atkarībā no izvēlētā reakcijas mainīgā), un testēšanas pārskatā vēlams norādīt EC10 un EC20 vērtības.
2.5. AUGŠANAS VEICINĀŠANA
Dažkārt zemās koncentrācijās novēro augšanas veicināšanu (negatīvo inhibēšanu). Tā iemesls ir vai nu hormēzes parādība (“toksiskā stimulācija”), vai arī augšanu veicinošu faktoru pievienošana izmantotajai minimālajai barotnei ar testējamo vielu. Jāņem vērā, ka neorganisko barības vielu pievienošanai nedrīkstētu būt tiešas ietekmes uz attīstību, jo testa vidē visā tā laikā ir jābūt barības vielu pārākumam. Aprēķinot EC50, zemu devu stimulācijas efektu parasti var neņemt vērā, ja vien tā nav ekstrēmi liela. Tomēr, ja tā ir ekstrēmi liela vai arī ECx vērtība jāaprēķina pie maziem x, var būt nepieciešamas īpašas procedūras. Ja iespējams, no datu analīzes nevajadzētu izslēgt veicinošas reakcijas, un, ja ar izmantojamo grafiku veidošanas programmatūru nav iespējams akceptēt nelielu stimulāciju, var izmantot lineāro interpolāciju ar bootstrapping, lai izdarītu secinājumus par pārējiem datiem. Ekstrēmas stimulācijas gadījumā, iespējams, ka var būt jāizmanto hormēzes modelis (19).
2.6. NETOKSISKA AUGŠANAS INHIBĒŠANA
Gaismu absorbējošas testējamās vielas var samazināt augšanas ātrumu, jo noēnojums samazina pieejamās gaismas daudzumu. Šāda fiziskā iedarbība, modificējot testa apstākļus, ir jānodala no toksiskās iedarbības, un fiziskā iedarbība ir jānorāda atsevišķi. Norādes ir pieejamas (2) un (3).
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj šāda informācija:
Testējamā viela:
|
— |
fizikālais stāvoklis un būtiskās fizikāli ķīmiskās īpašības, ieskaitot šķīdību ūdeni, |
|
— |
ķīmiskās identifikācijas dati, ieskaitot tīrību. |
Testa sugas:
|
— |
celms, piegādātājs vai izcelsmes avots un izmantotie kultivēšanas apstākļi. |
Testēšanas apstākļi:
|
— |
testēšanas sākuma datums un ilgums, |
|
— |
testēšanas plāna apraksts: testa trauki, kultūras tilpumi, biomasas blīvums testa sākumā, |
|
— |
barotnes sastāvs, |
|
— |
testējamās koncentrācijas un atkārtojumi (piemēram, atkārtojumu skaits, testējamo koncentrāciju variantu skaits un izmantotā ģeometriskā progresija), |
|
— |
testa šķīdumu sagatavošanas apraksts, ieskaitot šķīdinātāju izmantošanu, u. c., |
|
— |
kultivēšanai izmantotā aparatūra, |
|
— |
gaismas intensitāte un kvalitāte (avots, homogenitāte), |
|
— |
temperatūra, |
|
— |
testējamās koncentrācijas: nominālās testējamās koncentrācijas un visi rezultāti, kas iegūti analīzēs ar mērķi noteikt testējamās vielas koncentrāciju testa traukos. Pārskatā jānorāda testējamās vielas atgūstamība un kvantitatīvās noteikšanas robeža testa matricā, |
|
— |
visas novirzes no šīs testēšanas metodes, |
|
— |
biomasas noteikšanas metode un noteiktā parametra korelācijas pierādījumi ar sausnas masu. |
Rezultāti:
|
— |
pH vērtības testa sākumā un beigās visos izmēģinājuma variantos, |
|
— |
katras kolbas biomasa visos mērījumu punktos un biomasas mērīšanas metode, |
|
— |
augšanas grafiki (biomasas izmaiņas laikā), |
|
— |
katra varianta atkārtojumam aprēķinātie atbildes reakcijas mainīgie ar vidējām vērtībām un variācijas koeficientiem atkārtojumos, |
|
— |
koncentrācijas/iedarbības sakarības grafiskais attēlojums, |
|
— |
atbildes reakcijas mainīgo toksiskās iedarbības rādītāju piemēram, EC50, EC10, EC20 aprēķinātās vērtības un to ticamības intervāli. Ja aprēķina, arī LOEC un NOEC vērtības, jānorāda to noteikšanai izmantotās statistiskās metodes, |
|
— |
ja izmanto dispersijas analīzi, nosakāmās iedarbības apjoms (piemēram, mazākā būtiskā starpība), |
|
— |
jebkāda augšanas veicināšana, kas konstatēta kādā no variantiem, |
|
— |
citi novērojumi, piemēram, aļģu morfoloģiskās izmaiņas, |
|
— |
rezultātu izvērtējums, norādot arī atkāpes no šīs testēšanas metodes, kurām varētu būt ietekme uz testēšanas rezultātiem. |
4. LITERATŪRA
|
(1) |
OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test |
|
(2) |
ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442 |
|
(3) |
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23. |
|
(4) |
ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667–16. |
|
(5) |
ISO 1993: Water quality – Algal growth inhibition test. ISO 8692 |
|
(6) |
Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525–2531. |
|
(7) |
Slovacey, R.E. and Hanna, P. J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp.919–925 |
|
(8) |
Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G. E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073–2079. |
|
(9) |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718. |
|
(10) |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E. R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167. |
|
(11) |
Bruce, R.D., and Versteeg, D. J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485–1494. |
|
(12) |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
(13) |
Norberg-King T. J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN. |
|
(14) |
Dunnett, C. W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096–1121 |
|
(15) |
Dunnett, C. W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482–491. |
|
(16) |
Williams, D. A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117. |
|
(17) |
Williams, D. A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531. |
|
(18) |
Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York. |
|
(19) |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Water Research, 29, 93–96. |
1. papildinājums
Metodei piemērotie celmi
Zaļaļģes
|
— |
Pseudokirchneriella subcapitata, (agrāk pazīstama kā Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG |
|
— |
Desmodesmus subspicatus (agrāk pazīstama kā Scenedesmus subspicatus) 86.81 SAG |
Diatomejas
|
— |
Navicula pelliculosa, UTEX 664 |
Zilaļģes
|
— |
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A |
|
— |
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1 |
Celmu avoti
Ieteiktie celmi ir pieejami kā aļģu tīrkultūras no šādām kolekcijām (alfabētiskā secībā):
|
|
|
|
|
|
|
|
|
|
|
|
Ieteikto sugu izskats un īpašības
|
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
Anabaena flos-aquae |
S. leopoliensis |
|
Izskats |
Izliektas, savītas atsevišķas šūnas |
Ovālas, parasti atsevišķas šūnas |
Nūjiņas |
Ovālu šūnu ķēdes |
Nūjiņas |
|
Izmērs (L × W) µm |
8–14 × 2–3 |
7–15 × 3–12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Šūnu tilpums (µm3/šūna) |
40–60 (1) |
60–80 (1) |
40–50 (1) |
30–40 (1) |
2,5 (2) |
|
Šūnas sausnas masa (mg/šūna) |
2–3 × 10–8 |
3–4 × 10–8 |
3–4 × 10–8 |
1–2 × 10–8 |
2–3 × 10–9 |
|
Augšanas ātrums (3) (diena–1) |
1,5–1,7 |
1,2–1,5 |
1,4 |
1,1–1,4 |
2,0–2,4 |
Norādījumi par ieteicamo testa sugu kultivēšanu un uzturēšanu
Pseudokirchneriella subcapitata un Desmodesmus subspicatus
Šīs zaļaļģes kopumā ir viegli audzējamas dažādās barotnēs. Informācija par piemērotām barotnēm ir pieejama kultūras kolekcijās. Šūnas parasti attīstās atsevišķi, un šūnu blīvumu var viegli izmērīt ar daļiņu elektronisko skaitītāju vai mikroskopu.
Anabaena flos-aquae
Rezerves kultūras uzturēšanai var izmantot dažādas barotnes. Īpaši svarīgi ir neļaut periodiski audzētajai kultūrai atjaunojoties pāriet no augšanas kavēšanās fāzes nākamajā augšanas fāzē, jo tas apgrūtina kultūras ataudzēšanu.
Anabaena flos-aquae veido cieši saistītu šūnu ķēdes. Šo agregātu izmēri atkarībā no kultivēšanas apstākļiem var atšķirties. Lai biomasas noteikšanā izmantotu mikroskopu vai daļiņu elektronisko skaitītāju, šie agregāti, iespējams, būs jāsadala.
Lai samazinātu skaitīšanas rezultātu mainību, ķēdes var izjaukt, apstrādājot ar ultraskaņu. Ultraskaņas iedarbība, kuras ilgums pārsniedz ķēžu izjaukšanai nepieciešamo, var iznīcināt šūnas. Visi varianti ir jāapstrādā ar ultraskaņu vienādi ilgi.
Lai kompensētu mainīgumu, ir jāizskaita pietiekami daudz lauciņu uz hemocitometra (vismaz 400 šūnas). Tas uzlabo mikroskopiskās noteikšanas ticamību.
Lai noteiktu kopējo Anabaena šūnu tilpumu, pēc šūnu atdalīšanas ar saudzīgu sonifikāciju var izmantot daļiņu elektronisko skaitītāju. Sonifikācijas enerģijai ir jābūt tādai, lai nesagrautu šūnas.
Lai testa trauku inokulācijā izmantotā aļģu suspensija būtu labi sajaukta un homogēna, maisīšanai izmanto vorteksu.
Testa trauki ir jānovieto uz kratītāja platformas, kas izdara orbitālas vai turp/atpakaļ svārstības apm. 150 reizes minūtē. Lai samazinātu Anabaena tieksmi veidot pikas, var veikt maisīšanu ar pārtraukumiem. Ja ir izveidojušās pikas, jāpievērš uzmanība reprezentatīvu paraugu iegūšanai biomasas mērījumiem. Lai izjauktu aļģu pikas, pirms paraugu ņemšanas var būt nepieciešama enerģiska kratīšana.
Synechococcus leopoliensis
Pamatkultūras uzturēšanai var izmantot dažādas barotnes. Informācija par piemērotām barotnēm ir pieejama kultūras kolekcijās.
Synechococcus leopoliensis attīstās kā atsevišķas nūjiņveida šūnas. Šūnas ir ļoti sīkas, kas apgrūtina biomasas mērījumus, skaitīšanai izmantojot mikroskopu. Ieteicams izmantot elektroniskos daļiņu skaitītājus, kas ir aprīkoti, lai skaitītu pat apmēram 1 µm lielas daļiņas. Var izmantot arī in vitro fluorometriskos mērījumus.
Navicula pelliculosa
Pamatkultūras uzturēšanai var izmantot dažādas barotnes. Informācija par piemērotām barotnēm ir pieejama kultūras kolekcijās. Jāievēro, ka barotnei jāpievieno silikāts.
Navicula pelliculosa noteiktos augšanas apstākļos var veidot agregātus. Izdaloties lipīdiem, aļģu šūnas dažkārt var veidot plēvi uz virsmas. Šajos apstākļos ir jāveic īpaši pasākumi, lai iegūtu reprezentatīvu paraugu, ņemot paraugus biomasas noteikšanai. Iespējams, būs nepieciešama intensīva kratīšana, piemēram, izmantojot vorteksu.
(1) Noteikts, izmantojot daļiņu elektronisko skaitītāju
(2) Aprēķināts, ņemot vērā izmēru
(3) Parasti novērojamie augšanas ātrumi OECD barotnē, pie gaismas intensitātes aptuveni 70 µE·m–2·s–1 un 21 °C temperatūrā.
2. papildinājums
Barotnes
Var izmantot kādu no šīm divām barotnēm:
OECD barotne: Sākotnējā OECD TG 201 barotne, arī saskaņā ar ISO 8692
ASV. EPA barotne AAP, arī saskaņā ar ASTM.
Sagatavojot šīs barotnes, jāizmanto reaģenta vai analītiskās tīrības pakāpes vielas un dejonizēts ūdens.
AAP barotnes (ASV EPA) un OECD TG 201 barotnes sastāvs
|
Sastāvdaļa |
EPA |
OECD |
||
|
|
mg/l |
mM |
mg/l |
mM |
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
|
|
|
NH4Cl |
|
|
15,0 |
0,280 |
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
|
|
|
KH2PO4 |
|
|
1,60 |
0,00919 |
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
Testā ar diatomejām Navicula pelliculosa abas barotnes jāpapildina ar Na2SiO3·9H20, lai iegūtu 1,4 mg Si/l.
Barotnes pH iegūst, karbonātu sistēmai vidē līdzsvarojoties ar CO2 parciālo spiedienu atmosfēras gaisā. Aptuvena attiecība starp pH 25 °C temperatūrā un bikarbonāta molāro koncentrāciju ir:
pHeq = 11,30 + log [HCO3]
Ar 15 mg/l NaHCO3, pHeq = 7,5 (ASV EPA barotne), un ar 50 mg/l NaHCO3, pHeq = 8,1 (OECD barotne).
Testa barotnes elementu sastāvs
|
Elements |
EPA |
OECD |
|
|
mg/l |
mg/l |
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
OECD barotnes sagatavošana
|
Barības viela |
Koncentrācija izejas šķīdumā |
|
Izejas šķīdums Nr. 1: makroelementi |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
Izejas šķīdums Nr. 2: dzelzs |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
Izejas šķīdums Nr. 3: mikroelementi |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
Izejas šķīdums Nr. 4: bikarbonāts |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H20 |
|
Izejas šķīdumus sterilizē, izmantojot membrānu filtrāciju (vidējais poru diametrs 0,2 µm) vai arī autoklāvā (120 °C, 15 min). Šķīdumus glabā tumsā 4 °C temperatūrā.
Izejas šķīdumus Nr. 2 un Nr. 4 neapstrādā autoklāvā, bet sterilizē, izmantojot membrānu filtrāciju.
Barotni sagatavo, ūdenim pievienojot atbilstošu 1.–4. izejas šķīduma tilpumu:
Apm. 500 ml sterila ūdens pievieno:
|
— |
10 ml izejas šķīduma Nr. 1 |
|
— |
1 ml izejas šķīduma Nr. 2 |
|
— |
1 ml izejas šķīduma Nr. 3 |
|
— |
1 ml izejas šķīduma Nr. 4 |
Ar sterilu ūdeni uzpilda līdz 1 000 ml tilpumam
Atvēl pietiekami daudz laika, lai barotne varētu līdzsvaroties ar atmosfēras CO2, ja nepieciešams, dažas stundas barbotējot sterilu filtrētu gaisu.
AAP barotnes sagatavošana
|
A1.1. |
Pa 1 ml no katra A1.2.1-A1.2.7 minētā izejas šķīduma pievieno apm. 900 ml dejonizēta vai destilēta ūdens un tad atšķaida līdz 1 litram. |
|
A1.2. |
Makroelementu izejas šķīdumus gatavo, 500 ml dejonizēta vai destilēta ūdens izšķīdinot turpmāk minētās vielas. Reaģentus A1.2.1, A1.2.2, A1.2.3, un A1.2.4 var apvienot vienā izejas šķīdumā. |
|
A1.2.1. |
NaNO3 – 12,750 g |
|
A1.2.2. |
MgCl2·6H2O – 6,082 g |
|
A1.2.3. |
CaCl2·2H2O – 2,205 g |
|
A1.2.4. |
Mikroelementu izejas šķīdums (sk. A1.3.) |
|
A1.2.5. |
MgSO4·7H2O – 7,350 g |
|
A1.2.6. |
K2HPO4 – 0,522 g |
|
A1.2.7. |
NaHCO3 – 7,500 g |
|
A1.2.8. |
Na2SiO3·9H2O (sk. A1.1 piezīmi) A1.1 piezīme. Izmantot tikai diatomeju sugām: var pievienot tieši (204,4 mg) vai arī izmantojot izejas šķīdumu, lai Si galīgā koncentrācija barotnē būtu 20 mg/l. |
|
A1.3. |
Mikroelementu izejas šķīdumu sagatavo, 500 ml dejonizētā vai destilētā ūdenī izšķīdinot: |
|
A1.3.1. |
H3BO3 – 92,760 mg |
|
A1.3.2. |
MnCl2·4H2O – 207,690 mg |
|
A1.3.3. |
ZnCl2 – 1,635 mg |
|
A1.3.4. |
FeCl3·6H2O – 79,880 mg |
|
A1.3.5. |
CoCl2·6H2O – 0,714 mg |
|
A1.3.6. |
Na2MoO4·2H2O – 3,630 mg |
|
A1.3.7. |
CuCl2·2H2O – 0,006 mg |
|
A1.3.8. |
Na2EDTA·2H2O – 150,000 mg [etilēndiamīntetraetiķskābes dinātrija sāls] |
|
A1.3.9. |
Na2SeO4·5H2O – 0,005 mg (sk. A1.2 piezīmi) A1.2 piezīme. Izmantot tikai diatomeju rezerves kultūrām paredzētām barotnēm. |
|
A1.4. |
izmantojot 0,1 N vai 1,0 N NaOH vai HCl, koriģē pH līdz 7,5 ± 0,1. |
|
A1.5. |
Barotni filtrē sterilā traukā caur 0,22-μm membrānas filtru, ja izmanto daļiņu skaitītāju, vai 0,45-μm filtru, ja daļiņu skaitītāju neizmanto. |
|
A1.6. |
Līdz lietošanai barotni glabā tumsā apmēram 4 °C temperatūrā. |
(1) EDTA molārā attiecība pret dzelzi nedaudz pārsniedz stehiometrisko. Tādējādi novērš dzelzs izgulsnēšanos, vienlaikus līdz minimumam samazinot smago metālu jonu helātu veidošanos.
3. papildinājums
Aļģu kultivēšanas piemērs
Vispārīgas piezīmes
Kultivēšanas mērķis šajā gadījumā ir iegūt aļģu kultūras toksiskās iedarbības noteikšanai.
Jāizmanto piemērotas metodes, kas nodrošina, ka aļģu kultūras nav inficētas ar baktērijām. Iespējams, būs vēlamas no citiem organismiem brīvas kultūras, taču ir nepieciešams izveidot un izmantot aļģu tīrkultūras.
Visas darbības ir jāveic sterilos apstākļos, lai izvairītos no piesārņošanas ar baktērijām vai citām aļģēm.
Iekārtas un materiāli
Skatīt “Testa metode”: Aparatūra.
Aļģu kultūru iegūšanas procedūras
Barības vielu šķīdumu (barotņu) sagatavošana:
Visi barotnē esošo barības vielu sāļi tiek sagatavoti koncentrētu izejas šķīdumu veidā, ko glabā tumšā un vēsā vietā. Šos šķīdumus sterilizē filtrējot vai autoklavējot.
Barotni sagatavo, atbilstošu izejas šķīduma tilpumu pievienojot sterilam destilētam ūdenim tā, lai novērstu inficēšanos. Lai iegūtu cieto barotni, pievieno 0,8 procentus agara.
Pamatkultūra:
Pamatkultūras ir nelielas aļģu kultūras, ko regulāri pārnes svaigā barotnē izmantošanai par testa sākotnējo materiālu. Ja kultūras neizmanto regulāri, tās sēj mēģenēs uz slīpagara. Pārsēj svaigā barotnē vismaz reizi divos mēnešos.
Pamatkultūras audzē koniskās kolbās, kas satur atbilstošo barotni (tilpums apmēram 100 ml). Aļģes inkubējot 20 °C temperatūrā pastāvīgā apgaismojumā, tās ir jāpārsēj katru nedēļu.
Pārsēšanas laikā daļu “vecās” kultūras ar sterilām pipetēm pārnes kolbā ar svaigu barotni tā, lai strauji augošām sugām sākotnējā koncentrācija būtu apmēram 100 reižu mazāka nekā vecajā kultūrā.
Sugas augšanas ātrumu var noteikt, izmantojot augšanas grafiku. Ja tas ir zināms, var noteikt blīvumu, pie kura kultūra ir jāpārnes uz jaunu barotni. Tas jādara, pirms kultūra sasniegusi bojāejas fāzi.
Pirmskultūra:
Pirmskultūrā jāiegūst testa kultūru inokulācijai piemērots aļģu daudzums. Pirmskultūru inkubē testa apstākļos un izmanto tās eksponenciālās augšanas fāzē, parasti pēc 2–4 dienu ilgas inkubācijas. Ja aļģu kultūras satur deformētas vai nenormālas šūnas, tās neizmanto.
4. papildinājums
Datu analīze, izmantojot nelineāro regresiju
Vispārīgi apsvērumi
Atbildes reakcija aļģu un citu mikroorganismu augšanas testos – dabiskā biomasas augšana, to raksturojot ar procesa ātrumu, ir nepārtraukts vai metriskais mainīgais lielums, un tā integrālis laikā, ja izmanto biomasu. Tie abi ir saistīti ar atbilstošo vidējo atbildes reakciju, kas kontroles atkārtojumos uzrāda maksimālo vērtību, reaģējot testēšanas apstākļiem, no kuriem aļģu testā noteicošie faktori ir gaisma un temperatūra. Sistēmai ir normālais sadalījums vai tā ir homogēna, un biomasu var uzskatīt par nepārtrauktu lielumu, neņemot vērā atsevišķās šūnas. Šādas sistēmas reakcijas mainība ir atkarīga tikai no eksperimentāliem faktoriem (ko parasti apraksta log-normālais vai normālais kļūdas sadalījums). Tas atšķiras no tipiskām bioloģiskā testa reakcijām, ko raksturo dati, kas ir diskrēti lielumi, kuriem bieži par galveno mainīgo komponentu uzskata atsevišķu organismu toleranci (kam parasti ir binominālais sadalījums). Kontroles atbildes reakcijas šajā gadījumā atbilst nullei vai fona līmenim.
Parasti normalizēta vai relatīva reakcija r monotoni samazinās no 1 (nulles inhibēšana) līdz 0 (100-procentīga inhibēšana). Ņemot vērā, ka visām reakcijām piemīt ar tām saistītās kļūdas, aprēķinātā šķietami negatīvā inhibēšana izskaidrojama tikai ar gadījuma kļūdu.
Regresijas analīze
Modeļi
Regresijas analīzes mērķis ir kvantitatīvi aprakstīt reakciju atkarībā no koncentrācijas, izmantojot matemātisku regresijas funkciju Y = f (C) vai arī biežāk F (Z), kur Z = log C. Izmantojot apgriezto funkciju C = f–1 (Y), var aprēķināt ECx, ieskaitot EC50, EC10 un EC20, kā arī to 95 % ticamības līmeņus. Vairākas vienkāršas matemātiskas funkcijas labi apraksta aļģu augšanas inhibēšanas testos iegūto koncentrācijas-reakcijas sakarību. Šādas funkcijas ir, piemēram, loģistiskais vienādojums, nesimetriskais Weibull vienādojums un log-normālā sadalījuma funkcija, kas visas ir sigmoīdas līknes, kuras asimptotiski tiecas uz vērtību viens, ja C → 0, un uz nulli, ja C → ∞ (bezgalību).
Nepārtrauktu sliekšņa funkciju modeļu izmantošana (piemēram, Koimana [Koyman] modelis “populācijas augšanas inhibēšanai”, Kooijman et al. 1996.) ir nesen ieteikts vai alternatīvs asimptotiskajiem modeļiem. Šajā modelī pieņem, ka nav nekādas iedarbības pie koncentrācijām, kas mazākas par noteiktu slieksni EC0+, ko nosaka, ekstrapolējot reakcijas un koncentrācijas sakarību, un nosakot tās krustošanās punktu ar koncentrāciju asi, izmantojot vienkāršu nepārtrauktu funkciju, kas koordinātu sākuma punktā nav diferencējama.
Jāņem vērā, ka analīze var būt vienkārša atlikuma kvadrātu summas samazināšana (pieņemot pastāvīgu dispersiju) vai arī svērto kvadrātu summa, ja dispersijas heterogenitāte ir kompensēta.
Procedūra
Procedūra kopumā ir šāda: izvēlas atbilstošu funkciju Y = f (C), ko, izmantojot nelineāru regresiju, piemēro datiem. Lai no datiem iegūtu iespējami vairāk informācijas, ieteicams izmantot katra atsevišķa atkārtojuma mērījumus, nevis atkārtojumu vidējās vērtības. No otras puses, ja datu izliede ir liela, praktiskā pieredze liecina, ka atkārtojumu vidējās vērtības var nodrošināt daudz robustāku matemātisko novērtējumu, jo, lai gan satur sistemātisko kļūdu, tās mazāk ietekmē gadījuma kļūdas, nekā tas notiktu, saglabājot katru individuālo datu punktu.
Izveido atbilstošu grafiku, atliek izmērītos datus un pārbauda grafika atbilstību. Šajā nolūkā īpaši noderīga var būt atlikuma dispersijas analīze. Ja koncentrācijas un reakcijas sakarības izteikšanai izraudzītā funkcionālā sakarība pietiekami labi neapraksta visu līkni vai tās būtisku daļu, piemēram, atbildes reakciju zemās koncentrācijās, simetriska grafika vietā izvēlas citu iespēju, piemēram, nesimetrisku grafiku, tādu kā Weibull funkcija. Inhibēšanas negatīvas vērtības var būt problemātiskas, piemēram, izmantojot log-normālā sadalījuma funkciju, un attiecīgi arī nosakot vajadzību izmantot citu regresijas funkciju. Šādām negatīvām atbildes reakcijām nav ieteicams piešķirt nulles vai nelielu pozitīvu vērtību, jo tādējādi rodas kļūdas sadalījuma kropļojumi. Iespējams, lai novērtētu EClow x, dažas grafika daļas, piemēram, zemas inhibēšanas daļu, būs nepieciešamas atsevišķas līknes. Izmantojot attiecīgo vienādojumu (“apgriezto funkciju”), aprēķina C = f–1 (Y), raksturīgo punktu vērtības ECx, un testēšanas pārskatā norāda vismaz EC50 un vienu vai divas EClow x vērtības. Veiktajos testos iegūtā pieredze liek secināt, ka aļģu testa precizitāte parasti ļauj pietiekami adekvāti novērtēt 10 % inhibēšanu, ja datu punktu skaits ir pietiekams, ja vien zemas koncentrācijas neveicina augšanu, līdz ar to apgrūtinot vērtēšanu. Tā kā EC20 parasti atrodas uz koncentrācijas-atbildes reakcijas līknes centrālās daļas, kas ir aptuveni lineāra, tās noteikšanas precizitāte bieži ir daudz augstāka par EC10, noteikšanas precizitāti. Dažreiz EC10 var būt grūti interpretēt augšanas stimulācijas dēļ. Tāpēc, lai arī parasti EC10 vērtību var noteikt pietiekami precīzi, pārskatā vienmēr ieteicams norādīt arī EC20.
Iesvara koeficienti
Eksperimenta dispersija parasti nav konstanta, un tajā ietilpst proporcionālitātes komponents, līdz ar to parasti izdevīgāk veikt svērto regresiju. Šajā analīzē iesvara koeficientus parasti uzskata par apgriezti proporcionāliem dispersijai:
Wi = 1/Var(ri)
Daudzas regresijas programmas ļauj veikt svērto regresijas analīzi ar tabulā norādītajiem iesvara koeficientiem. Ērtības labad iesvara koeficientus normalizē, tos reizinot ar n/Σ w (n ir datu punktu skaits), tā, lai to summa būtu viens.
Normalizētās atbildes reakcijas
Normalizēšana, izmantojot vidējo kontroles reakciju, rada dažas principiālas problēmas un diezgan komplicētu dispersijas struktūru. Dalot atbildes reakcijas ar vidējo kontroles reakciju inhibēšanas procenta iegūšanai, ievieš papildu neprecizitāti, ko rada kontroles vidējās vērtības kļūda. Ja vien kļūda nav nenozīmīgi maza, regresijas un ticamības līmeņu iesvara koeficienti jākoriģē, ņemot vērā kovariāciju ar kontroli (17). Jāievēro, ka kontroles vidējās reakcijas augsta precizitāte ir svarīga, lai samazinātu relatīvās atbildes reakcijas kopējo dispersiju. Šī dispersija ir šāda:
apakšējais indekss i attiecas uz koncentrācijas līmeni i un apakšējais indekss 0 attiecas uz kontrolēm)
Yi = relatīvā atbildes reakcija = ri/r0 = 1 – I = f (Ci)
ar dispersiju:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
un tā kā
(∂Yi/ ∂ ri) = 1/r0 un (∂ Yi / ∂ r0) = ri/r0 2
datiem ar normālu sadalījumu, kā arī mi un m0 atkārtojumiem:
Var(ri) = σ2/mi
līdz ar to relatīvās atbildes reakcijas kopējā dispersija Yi ir:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Kontroles vidējās vērtības kļūda ir apgriezti proporcionāla kontroles atkārtojumu vidējā skaita kvadrātsaknei, un dažreiz ir vēlams iekļaut vēsturiskos datus, tādējādi būtiski samazinot kļūdu. Alternatīva procedūra ir datu normalizāciju neveikt un izmantot atbildes reakcijas un arī kontroles reakcijas datu absolūtās vērtības, taču ieviešot kontroles reakcijas vērtības kā papildu parametru, kura vērtības nosaka ar nelineāru regresiju. Izmantojot parasto divu parametru regresijas vienādojumu, pēc šīs metodes jāizmanto trīs parametri, līdz ar to vajadzīgs arī vairāk datu punktu, nekā veicot nelineāro regresiju datiem, ko normalizē, izmantojot iepriekš noteiktu kontroles atbildes reakciju.
Ticamības intervālu apgrieztās vērtības
Nelineāras regresijas ticamības intervālu izskaitļošana, izmantojot apgrieztās vērtības, ir diezgan sarežģīta un nav pieejama parastajās datorprogrammu paketēs, ko izmanto statistisko aprēķinu veikšanai. Aptuvenus ticamības līmeņus var iegūt, izmantojot standarta nelineāras regresijas programmas ar atkārtotu parametrizāciju (Bruce and Versteeg, 1992), kas paredz pārveidot matemātisko vienādojumu, izmantojot nepieciešamo punktu vērtības, piemēram, EC10 un EC50 kā nosakāmos parametrus. (Šī funkcija ir I = f (α, β koncentrācija), un nepieciešams izmantot definīcijas sakarības f (α, β, EC10) = 0,1 un f (α, β, EC50) = 0,5, lai f ((α, β koncentrācija) aizstātu ar ekvivalentu funkciju g (EC10, EC50, koncentrācija).
Tiešāks aprēķins (Andersen et al, 1998.) ir izmantot sākotnējo vienādojumu kopā ar Teilora ekspansiju ap vidējām ri un r0 vērtībām.
Nesen popularitāti ir ieguvušas bootstrap metodes. Šajās metodēs dispersijas empīriskā sadalījuma noteikšanai izmanto eksperimentālos datus, no kuriem izveido pseidoatkārtojumus pēc gadījuma izvēles principa, izmantojot nejaušo skaitļu ģeneratoru.
Literatūra
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625–1632.
Bruce, R.D. and Versteeg, D. J. (1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485–1494
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405–420.
V PIELIKUMS
|
C.25. |
AEROBĀ MINERALIZĀCIJA VIRSZEMES ŪDENĪ – BIOLOĢISKĀS NOĀRDĪŠANĀS IMITĀCIJAS TESTS |
1. METODE
Šī metode ir līdzvērtīga metodei OECD TG 309 (2004) (1)
1.1. IEVADS
Pēc šīs metodes nosaka testējamās vielas bioloģiskās noārdīšanās gaitu mazās koncentrācijās aerobos apstākļos dabīgā ūdenī, un novērojumus kvantitatīvi izsaka ar kinētisko ātrumu. Šis imitācijas tests ir laboratorijas metode, izmantojot paraugu sēriju kratīšanu kolbās, lai noteiktu organisko vielu aerobās bioloģiskās noārdīšanās ātrumu dabīgā virszemes ūdens (saldūdens, sāļūdens vai jūras ūdens) paraugos. Tās pamatā ir ISO/DIS 14592–1 (2), iekļaujot arī C.23. un C.24. testēšanas metodes (3)(4) elementus. Lai novērstu testa mikrovides bojāšanos ilgstošas testēšanas laikā, darbības ar paraugu sērijām var aizstāt ar pusnepārtraukto paņēmienu. Imitācijas testa galvenais mērķis ir noteikt testējamās vielas mineralizāciju virszemes ūdenī, un noārdīšanās kinētiku izsaka pēc mineralizācijas. Otrs sekundārais mērķis ir iegūt informāciju par primāro noārdīšanos un galveno pārveidošanās produktu veidošanos. Pārveidošanās produktu identificēšana un, ja iespējams, to koncentrāciju kvantitatīva noteikšana ir īpaši svarīga vielām, kas mineralizējas ļoti lēni (piemēram, vielām, kuru kopējā atlikuma 14C sadalīšanās pusperiods pārsniedz 60 dienas). Galveno pārveidošanās produktu identificēšanai analītisko ierobežojumu dēļ parasti ir jāizmanto lielākas testējamās vielas koncentrācijas (piemēram, > 100 μg/l).
Zema koncentrācija šajā metodē nozīmē koncentrāciju (piemēram, mazāku par 1 μg/l līdz 100 μg/l), kas ir pietiekami maza, lai nodrošinātu, ka testēšanas apstākļos noteiktā bioloģiskās noārdīšanās kinētika raksturo dabas vidē sagaidāmo. Salīdzinājumā ar bioloģiski noārdāmu oglekli saturošo vielu kopējo masu, ko satur testā izmantojamais dabīgais ūdens, testējamā viela mazā koncentrācijā kalpo kā sekundārais substrāts. Tas nozīmē, ka sagaidāmās bioloģiskās noārdīšanās reakciju kinētika ir pirmās kārtas (“neaugoša” kinētika) un ka testējamā viela var noārdīties “kometabolisma” procesā. Pirmās kārtas noārdīšanās reakcijās noārdīšanās ātrums (mg/l/dienā) ir proporcionāls substrāta koncentrācijai, kura samazinās laikā. Īstas pirmās kārtas kinētikas gadījumā īpatnējā noārdīšanās ātruma konstante k nav atkarīga no laika un koncentrācijas. Tas ir, k ievērojami nemainās eksperimenta laikā un nemainās, palielinot koncentrāciju citā eksperimentā. Pēc definīcijas īpatnējā noārdīšanās ātruma konstante ir vienāda ar koncentrācijas relatīvajām izmaiņām laikā: k = (1/C) · (dC/dt). Kaut arī šeit norādītajos apstākļos parasti ir sagaidāma pirmās kārtas kinētika, var būt gadījumi, kad procesu labāk apraksta citi kinētisko reakciju mehānismi. Novirzes no pirmās kārtas kinētikas var būt novērojamas, piemēram, ja bioloģiskās pārveidošanās ātrumu ierobežo nevis pašu bioloģisko reakciju ātrums, bet ar masas pārneses procesiem saistītās parādības, piemēram, difūzijas ātrums. Tomēr datus gandrīz vienmēr var aprakstīt ar pseidopirmās kārtas kinētiku, izmantojot no koncentrācijas atkarīgu reakcijas ātruma konstanti.
Lai atvieglotu eksperimenta plānošanu un rezultātu interpretāciju, pirms testa jābūt pieejamai informācijai par testējamās vielas bioloģisko noārdīšanos lielākās koncentrācijās (piemērm, no standarta skrīninga testiem), kā arī informācijai par abiotisko noārdīšanos, pārveidošanās produktiem un attiecīgajām fizikāli ķīmiskajām īpašībām. Ar 14C iezīmētu testējamo vielu izmantošana un 14C fāzu sadalījuma noteikšana testēšanas beigās dod iespējas noteikt galīgo bioloģisko noārdīšanos. Ja izmanto ar izotopiem neiezīmētu testējamo vielu, galīgo bioloģisko noārdīšanos var noteikt, tikai testējot to augstākās koncentrācijās, un ja ir zināmi visi tās svarīgākie pārveidošanās produkti.
1.2. DEFINĪCIJAS
Primārā bioloģiskā noārdīšanās: vielas struktūras izmaiņas (pārveidošanās) mikroorganismu iedarbībā, kuru dēļ zūd tās ķīmiskā identitāte.
Funkcionālā bioloģiskā noārdīšanās: vielas struktūras izmaiņas (pārveidošanās) mikroorganismu iedarbībā, kuru dēļ zūd kāda tās specifiska īpašība.
Galīgā aerobā bioloģiskā noārdīšanās: vielas noārdīšanās skābekļa klātbūtnē līdz oglekļa dioksīdam, ūdenim un citu klātesošo elementu minerālsāļiem (mineralizācija) mikroorganismu iedarbībā, veidojoties jaunai biomasai un jaunām organiskām vielām, kas ir mikrobu biosintēzes produkti.
Mineralizācija: vielas noārdīšanās skābekļa klātbūtnē līdz oglekļa dioksīdam, ūdenim un citu klātesošo elementu minerālsāļiem mikroorganismu iedarbībā.
Kavēšanās fāze: laiks no testēšanas sākuma līdz noārdošo mikroorganismu adaptācijai, kurā vielas vai organiskā materiāla bioloģiskās noārdīšanās pakāpe ir sasniegusi nosakāmu līmeni (piemēram, 10 % no maksimālās teorētiskās vai mazāk, atkarībā no noteikšanas metodes precizitātes).
Bioloģiskās noārdīšanās maksimālais līmenis: vielas vai organiskā materiāla procentos izteikta bioloģiskās noārdīšanās pakāpe testa apstākļos, virs kuras testēšanas laikā turpmāka bioloģiskā noārdīšanās nenotiek.
Primārais substrāts: dabīgā oglekļa un enerģijas avotu kopums, kas nodrošina mikrobu biomasas augšanu un uzturēšanu.
Sekundārais substrāts: komponents, kas substrātā ir tik zemā koncentrācijā, ka tam noārdoties, aktīvajiem mikroorganismiem tiek piegādāti tikai nenozīmīgi oglekļa un enerģijas daudzumi, salīdzinot ar galveno substrāta komponentu (primāro substrātu) noārdīšanā piegādāto oglekli un enerģiju.
Noārdīšanās ātruma konstante: pirmās kārtas vai pseidopirmās kārtas kinētiskās reakcijas ātruma konstante k (d–1), kas raksturo noārdīšanās procesu ātrumu. Eksperimentāli k nosaka no noārdīšanās līknes sākuma daļas, ko iegūst pēc kavēšanās fāzes beigām.
Pussadalīšanās periods, t1/2 (d): termins, ko izmanto, lai raksturotu pirmās kārtas reakcijas ātrumu. Tas ir laika intervāls, kurā koncentrācija samazinās 2 reizes. Pussadalīšanās perioda un noārdīšanās ātruma konstantes savstarpējo sakarību izsaka ar vienādojumu t1/2 = ln2/k.
Pusnoārdīšanās laiks, DT50 (d): termins, ko izmanto, lai kvantitatīvi izteiktu bioloģiskās noārdīšanās testēšanas rezultātus. Tas ir laika intervāls, iekļaujot kavēšanās fāzi, kas vajadzīgs, lai bioloģiskās noārdīšanās pakāpe sasniegtu 50 %.
Noteikšanas robeža (LOD) un kvantitatīvās noteikšanas robeža (LOQ): kvalitatīvās noteikšanas robeža ( LOD ) ir vielas koncentrācija, zem kuras vielas identitāte nav atšķirama no analītiskiem artefaktiem. Kvantitatīvās noteikšanas robeža (LOQ) ir vielas koncentrācija, zem kuras tā nav nosakāma ar pieņemamu precizitāti.
Izšķīdušais organiskais ogleklis (DOC): ūdens paraugā esošā tā organiskā oglekļa daļa, ko nevar atdalīt ar norādīto fāzu atdalīšanu, piemēram, ar centrifugēšanu pie 40 000 ms–2 15 min vai ar membrānas filtrāciju, izmantojot membrānas ar porām 0,2 μm–0,45 μm diametrā.
Kopējā organiskā 14C aktivitāte (TOA): kopējā 14C aktivitāte, kas saistīta ar organisko oglekli.
Izšķīdušā organiskā 14C aktivitāte (DOA): kopējā 14C aktivitāte, kas saistīta ar izšķīdušo organisko oglekli.
Daļiņu organiskā 14C aktivitāte (POA): kopējā 14C aktivitāte, kas saistīta ar daļiņu organisko oglekli.
1.3. TESTA PIELIETOJAMĪBA
Šis imitācijas tests ir pielietojams negaistošām vai maz gaistošām organiskām vielām, ko testē mazās koncentrācijās. Lietojot kolbas, kurās var piekļūt atmosfēras gaiss (piemēram, ar vates aizbāžņiem), vielas, kuru ar Henrija konstante ir mazāka par aptuveni 1 Pa·m3/mol (apm. 10–5 atm·m3/mol), var uzskatīt par praktiski negaistošām. Lietojot noslēgtas kolbas ar augšpusē tukšu telpu, ir iespējams bez zudumiem no testēšanas sistēmas testēt maz gaistošas vielas (Henrija konstante < 100 Pa·m3/mol jeb < 10 3 atm·m3/mol). Var notikt ar 14C iezīmēto vielu zudums, ja neveic pasākumus ar CO2 izdalīšanos saistīto zudumu novēršanai. Tādā situācija var būt nepieciešams uztvert CO2 iekšējā absorberā ar sārmu vai izmantot ārējo CO2 absorbcijas sistēmu (tieša 14CO2 noteikšana, sk. 3. pielikumu). Bioloģiskās noārdīšanās kinētikas noteikšanai testējamās vielas koncentrācijām jābūt mazākām par tās šķīdību ūdenī. Tomēr jāatzīmē, ka šķīdība ūdenī pēc literatūras datiem var būt ievērojami augstāka par testējamās vielas šķīdību dabīgajos ūdeņos. Īpaši slikti šķīstošu testējamo vielu šķīdību var noteikt, izmantojot testam lietojamos dabīgos ūdeņus.
Metodi var izmantot bioloģiskās noārdīšanās imitācijai virszemes ūdenī, kurā nav rupju daļiņu (pelaģiskais tests) vai duļķainā virszemes ūdenī, piemēram, ūdenī tuvu ūdens/nosēdumu robežvirsmai (suspendēto nosēdumu tests).
1.4. TESTA PRINCIPS
Testu veic sēriju veidā, inkubējot testējamo vielu tikai ar virszemes ūdeni (pelaģiskais tests) vai ar virszemes ūdeni, kam pievienotas suspendētas cietās daļiņas/sedimenti 0,01 līdz 1 g/l sausnas masas (suspendēto sedimentu tests), lai imitētu ūdeni ar suspendētām cietām daļiņām vai atkārtoti suspendētiem sedimentiem. Suspendēto cieto daļiņu/sedimentu koncentrācija minētā intervāla zemākajā daļā ir tipiska lielākajai daļai virszemes ūdeņu. Testa kolbas inkubē tumsā apkārtējās vides temperatūrā aerobos apstākļos kratot. Lai noteiktu noārdīšanās kinētiku, ir jāizmanto vismaz divas dažādas testējamās vielas koncentrācijas. Koncentrācijām savā starpā ir jāatšķiras 5 līdz 10 reizes, un jāatbilst vides apstākļos sagaidāmajam koncentrāciju diapazonam. Testējamās vielas maksimālā koncentrācija nedrīkst pārsniegt 100 µg/l, bet vēlama ir maksimālā testējamās vielas koncentrācija 10 µg/l vai mazāka, lai nodrošinātu, ka bioloģiskā noārdīšanās notiek atbilstoši pirmās kārtas kinētikai. Mazākā koncentrācija nedrīkst pārsniegt 10 µg/l, bet vēlamā mazākās testējamās vielas koncentrācijas ir 1–2 μg/l, vai mazākas par 1 μg/l. Parasti šādas mazas koncentrācijas var pareizi noteikt, izmantojot komerciāli pieejamas ar 14C izotopu iezīmētas vielas. Analītisko ierobežojumu dēļ bieži nav iespējams izmērīt testa vielas koncentrāciju ar vajadzīgo precizitāti, ja testējamās vielas koncentrācija ≤ 100 µg/l (sk. 1.7.2. iedaļas otro rindkopu). Lielākas testējamās vielas koncentrācijas (> 100 µg/l un dažreiz > 1 mg/l) var izmantot galveno pārveidošanās produktu identificēšanai un kvantitatīvai noteikšanai vai gadījumā, ja nav pieejama specifiska analīzes metode ar pietiekami zemu noteikšanas robežu. Ja testējamās vielas koncentrācija ir augsta, iegūtie rezultāti var nebūt izmantojami pirmās kārtas noārdīšanās reakcijas konstantes un pussadalīšanās perioda noteikšanai, jo noārdīšanās, iespējams, var neatbilst pirmās kārtas kinētikai.
Noārdīšanās procesu kontrolē piemērotos laika intervālos, mērot atlikušā 14C izotopa vai testējamās vielas atlikušo koncentrāciju, ja izmanto specifisku ķīmisko analīzi. Molekulas stabilākās daļas iezīmēšana ar 14C nodrošina kopējās mineralizācijas noteikšanu, bet mazāk stabilās molekulas daļas iezīmēšana ar 14C, kā arī specifiskas analīzes izmantošana dod iespēju novērtēt tikai primāro bioloģisko noārdīšanos. Tomēr stabilākā daļa ne vienmēr iekļauj molekulas attiecīgo funkcionālo grupu (kura var būt saistīta ar specifisku īpašību, tādu kā toksiskums, bioakumulācija, u. c.). Tādā gadījumā, lai izsekotu specifiskas īpašības zušanu, var būt lietderīgi izmantot funkcionālajā daļā ar 14C izotopu iezīmētu testējamo vielu.
1.5. INFORMĀCIJA PAR TESTĒJAMO VIELU
Šajā testā var izmantot gan ar radioaktīvajiem izotopiem iezīmētas, gan neiezīmētas vielas. Ieteicams izmantot iezīmēšanas metodi ar 14C, un marķierim parasti jābūt molekulas stabilākajā(-ās) daļā(-ās) (sk. arī 1.4. iedaļu). Vielām, kas satur vairākus aromātiskos gredzenus, vēlams ar 14C iezīmēt vismaz vienu oglekļa atomu katrā gredzenā. Turklāt ir vēlams ar 14C iezīmēt vienu vai vairākus oglekļa atomus abās pusēs no viegli noārdāmām saitēm. Testējamās vielas ķīmiskajai un/vai radioķīmiskajai tīrībai jābūt > 95 %. Ar radioaktīvajiem izotopiem iezīmētām vielām vēlamā īpatnējā aktivitāte ir aptuveni 50 μCi/mg (1,85 MBq) vai augstāka, lai atvieglotu 14C mērījumus testos, ko izdara ar mazām sākotnējām koncentrācijām. Par testējamo vielu jābūt pieejamai šādai informācijai:
|
— |
šķīdība ūdenī [A.6. metode], |
|
— |
šķīdība organiskos šķīdinātājos (vielām, kuras pielieto ar šķīdinātāju vai kuras slikti šķīst ūdenī), |
|
— |
disociācijas konstante (pKa), ja vielai ir tieksme pievienot vai zaudēt protonus [OECD TG 112] (5), |
|
— |
tvaika spiediens [A.4. metode] un Henrija konstante, |
|
— |
ķīmiskā stabilitāte ūdenī un tumsā (hidrolīze) [C.7. metode]. |
Ja ūdenī slikti šķīstošas vielas testē jūras ūdenī, var būt noderīgi arī zināt izsālīšanās konstanti (jeb Sečenova konstanti) Ks, ko aprēķina pēc vienādojuma: log (S/S') = Ks Cm, kur S un S' attiecīgi ir vielas šķīdība saldūdenī un jūras ūdenī un Cm ir sāls molārā koncentrācija.
Ja testēšanu veic “suspendēto sedimentu testa” veidā, jābūt pieejamai arī šādai informācijai:
|
— |
sadalījuma koeficients sistēmā n-oktanols/ūdens [A.8. metode], |
|
— |
adsorbcijas koeficients [C.18. metode]. |
Cita noderīga informācija var būt:
|
— |
koncentrācija vidē, ja tā ir noteikta vai aprēķināta, |
|
— |
testējamās vielas toksiskums mikroorganismiem [C.11. metode], |
|
— |
bioloģiskās noārdīšanās spēja un/vai potenciālā bioloģiskā noārdāmība [metodes C.4 A–F, C.12, C.9, OECD TG 302 (5)], |
|
— |
bioloģiskās noārdīšanās spēja augsnē aerobos vai anaerobos apstākļos un sedimentu/ūdens transformācijas pētījumi [C.23., C.24. metode]. |
1.6. STANDARTVIELAS
Par standartvielu jāizmanto viela, kas parasti viegli noārdās aerobos apstākļos (piemēram, anilīns vai nātrija benzoāts). Sagaidāmais anilīna un nātrija benzoāta noārdīšanās laika intervāls parasti ir mazāks par 2 nedēļām. Standartvielu izmantošanas nolūks ir nodrošināt, ka testa ūdens mikrobu aktivitāte ir zināmās robežās, t. i., ka ūdens satur aktīvu mikrobu populāciju.
1.7. KVALITĀTES KRITĒRIJI
1.7.1. Atgūstamība
Tūlīt pēc testējamās vielas pievienošanas katra sākotnējā testējamā koncentrācija ir jāpārbauda, mērot 14C aktivitāti, vai veicot neiezīmētu vielu ķīmisko analīzi vismaz dublikātu paraugiem. Tas sniedz informāciju par analītiskās metodes pielietojamību, par tās atkārtojamību un par testējamās vielas sadalījuma viendabīgumu. Parasti izmērīto sākotnējo 14C aktivitāti vai testējamās vielas faktisko koncentrāciju – un nevis nominālo koncentrāciju – izmanto turpmākajai datu analīzei, jo ar to kompensē sorbcijas radītos zudumus un dozēšanas kļūdas. Ar 14C iezīmētas testējamās vielas atgūstamību eksperimenta beigās nosaka pēc masas bilances (sk. 1.8.9.4. iedaļas pēdējo rindkopu). Ideālā gadījumā ar radioaktīvo izotopu iezīmētas vielas masas bilancei jābūt diapazonā no 90 % līdz 110 %, ievērojot, ka neiezīmētu testa vielu analītiskajai precizitātei jānodrošina sākotnējā atgūstamība 70 % līdz 110 %. Norādītie diapazoni uzskatāmi par mērķa vērtībām, un tie nav jāizmanto kā testēšanas rezultātu pieņemamības kritēriji. Analītisko precizitāti testējamai vielai var noteikt pie zemākas koncentrācijas nekā sākotnējā koncentrācija, vai arī to noteikt svarīgākajiem pārveidošanās produktiem.
1.7.2. Analītiskās metodes atkārtojamība un jutība
Analītiskās metodes atkārtojamība (arī sākotnējās ekstrakcijas efektivitāte) testējamās vielas vai attiecīgos gadījumos svarīgāko pārveidošanās produktu kvantitatīvai noteikšanai jāpārbauda ar virszemes ūdens piecu atsevišķu ekstraktu atkārtotām analīzēm.
Testējamās vielas un pārveidošanās produktu analītiskās metodes kvalitatīvās noteikšanas robežai (LOD), ja iespējams, jābūt vismaz 1 % no testēšanas sistēmā pievienotā sākotnējā daudzuma. Kvantitatīvās noteikšanas robežai (LOQ) jābūt vienādai vai mazākai par 10 % no izmantotās koncentrācijas. Daudzu organisko vielu un to pārveidošanās produktu ķīmiskajai analīzei bieži nepieciešams, lai testējamās vielas koncentrācija būtu relatīvi augsta, t. i., > 100 μg/l.
1.8. TESTĒŠANAS METODES APRAKSTS
1.8.1. Aparatūra
Testu var veikt piemērota tilpuma (piemēram 0,5 vai 1,0 l) koniskajās vai cilindriskajās kolbās, kas noslēgtas ar silikona vai gumijas aizbāžņiem, vai seruma kolbās ar CO2 necaurlaidīgiem vāciņiem (piemēram, ar butilkaučuka blīvēm). Testu var veikt arī ar vairākām kolbām vienam variantam, un analīzei ņem visas kolbas saturu, katrā paraugu intervālā vismaz divos atkārtojumos (sk. 1.8.9.1. iedaļas pēdējo rindkopu). Negaistošām testējamajām vielām, kas nav iezīmētas ar radioaktīvajiem izotopiem, gāzi necaurlaidīgi aizbāžņi vai vāciņi nav vajadzīgi, un ir piemēroti vaļīgi vates aizbāžņi, kas novērš piesārņošanos no gaisa (sk. 1.8.9.1. iedaļas otro rindkopu). Maz gaistošas vielas jātestē biometra tipa sistēmā, uzmanīgi maisot ūdens virsmu. Lai būtu droši, ka nenotiek bakteriālā piesārņošanās, traukus pirms lietošanas var sterilizēt karsējot vai apstrādājot autoklāvā. Turklāt tiek izmantots šāds standarta laboratorijas aprīkojums:
|
— |
kratītājs vai magnētiskie maisītāji testa kolbu nepārtrauktai maisīšanai, |
|
— |
centrifūga, |
|
— |
pH metrs, |
|
— |
turbidimetrs nefelometriskiem duļķainības mērījumiem, |
|
— |
žāvējamais skapis vai mikroviļņu krāsns sausnas masas noteikšanai, |
|
— |
membrānfiltrācijas aparāts, |
|
— |
autoklāvs vai skapis stikla trauku termiskai sterilizēšanai, |
|
— |
ierīces darbam ar 14C iezīmētām vielām, |
|
— |
aprīkojums 14C aktivitātes kvantitatīvai noteikšanai CO2 absorbcijas šķīdumu paraugos un vajadzības gadījumā sedimentu paraugos, |
|
— |
analītiskais aprīkojums testējamās vielas (un standartvielas) noteikšanai, ja izmanto specifisku ķīmisko analīzi (piemēram, gāzu hromatogrāfu, augstspiediena šķidruma hromatogrāfu). |
1.8.2. Testējamās vielas izejas standartšķīdums
Testējamās vielas un standartvielas izejas standartšķīdumu gatavošanai izmanto dejonizētu ūdeni (sk. 1.8.7. iedaļas pirmo rindkopu). Dejonizētajā ūdenī nedrīkst būt mikroorganismiem toksisku vielu, un izšķīdušajam organiskajam ogleklim (DOC) jābūt ne vairāk par 1 mg/l (6).
1.8.3. Virszemes ūdens paraugu ņemšana un transportēšana
Paraugu ņemšanas vieta virszemes ūdens savākšanai katrā konkrētajā situācijā jāizraugās atbilstoši testēšanas nolūkam. Izraugoties paraugu ņemšanas vietas, jāņem vērā iespējamo lauksaimniecības, rūpniecības vai mājsaimniecības vielu ievadīšanas vēsture. Ja zināms, ka ūdens vide iepriekšējo četru gadu laikā ir piesārņota ar testējamo vielu vai tās struktūras analogiem, testējamā ūdens paraugus no tās neņem, izņemot gadījumus, kad izpētes mērķis ir noskaidrot noārdīšanās ātrumu tās iedarbībai pakļautajās vietās. Parauga ņemšanas laikā jāizmēra ūdens pH un temperatūra. Turklāt ir jāatzīmē paraugu ņemšanas dziļums un ūdens paraugu izskats (piemēram, krāsa un duļķainība) (sk. 3. iedaļu). Lai parādītu, ka apstākļi ir aerobi – ja vien tas nav acīmredzami, spriežot pēc ārējām pazīmēm un vietas vēstures, jāmēra skābekļa koncentrācija un/vai redokspotenciāls ūdenī un nosēdumu virsmas slānī. Virszemes ūdens jātransportē pilnīgi tīrā konteinerā. Parauga temperatūra transportēšanas laikā nedrīkst ievērojami pārsniegt temperatūru testēšanas laikā. Ja transportēšanas laiks ir ilgāks par 2 līdz 3 stundām, ūdens paraugu ieteicams atdzesēt līdz 4 oC temperatūrai. Ūdens paraugu nedrīkst sasaldēt.
1.8.4. Virszemes ūdensparaugu glabāšana un sagatavošana testēšanai
Testēšanu vēlams sākt vienas dienas laikā pēc paraugu ņemšanas. Ja paraugi jāglabā, glabāšanas laikam jābūt iespējami īsam, un tas nedrīkst pārsniegt 4 nedēļas. Līdz lietošanai ūdens paraugs jāglabā 4 °C temperatūrā aerējot. Pirms izmantošanas jāatdala rupjās daļiņas, piemēram, filtrējot caur neilona filtru ar aptuveni 100 μm acu izmēru vai caur rupju papīra filtru, vai nostādinot.
1.8.5. Ar sedimentiem papildināta ūdens sagatavošana (neobligāti)
Suspendēto sedimentu testam kolbās, kas satur dabīgo ūdeni (filtrētu, lai atdalītu rupjās daļiņas, kā aprakstīts 1.8.4. iedaļā), pievieno sedimenta virskārtu suspensijas iegūšanai; suspendēto cieto vielu koncentrācijai jābūt no 0,01 līdz 1 g/l. Sedimenta virskārtu ņem no tās pašas vietas, kur ņemts ūdens paraugs. Atkarībā no konkrētās ūdens vides sedimentiem var būt raksturīgs liels organiskā oglekļa saturs (2,5–7,5 %) un smalka tekstūra vai mazs organiskā oglekļa saturs (0,5–2,5 %) un rupja tekstūra (3). Sedimenta virskārtas paraugu var sagatavot šādi: lietojot caurspīdīgu plastmasa cauruli, izņem vairākus sedimenta griezumus, nekavējoties atdala augšējos aerobos slāņus (no virsmas līdz maksimāli 5 mm dziļumam) un tos apvieno. Tādā veidā izveidotais apvienotais sedimentu paraugs jātransportē konteinerā ar plašu gaisa telpu, lai sedimentus uzglabātu aerobos apstākļos (atdzesēt līdz 4 °C, ja transportēšanas ilgums pārsniedz 2–3 stundas). Sedimentu paraugs jāsuspendē testa ūdenī attiecībā 1:10 un līdz lietošanai jāglabā 4 °C temperatūrā aerējot. Ja sedimenti jāglabā, glabāšanas laikam jābūt iespējami īsam, un tas nedrīkst pārsniegt 4 nedēļas.
1.8.6. Pusnepārtrauktā procedūra (neobligāti)
Ilgstoša inkubēšana (vairākus mēnešus) var būt nepieciešama, ja, pirms var izmērīt testējamās vielas ievērojamu noārdīšanos, ir ilgs kavēšanās laiks. Ja tas ir zināms no vielas līdzšinējās testēšanas pieredzes, testu var sākt, izmantojot pusnepārtraukto procedūru, kas ļauj periodiski atjaunot daļu testējamā ūdens prauga vai suspensijas (sk. 2. pielikumu). Parasto sēriju testu var pārveidot par pusnepārtraukto testu, ja, izmantojot sēriju procedūru, aptuveni 60 dienu laikā nav novērojama vielas bioloģiskā noārdīšanās (sk. 1.8.8.3. iedaļas otro rindkopu).
1.8.7. Testējamās vielas (vai standartvielas) pievienošana
Vielām, kas labi šķīst ūdenī (> 1 mg/l) un ir maz gaistošas (Henrija konstantes < 1 Pa·m3/mol jeb < 10–5 atm·m3/mol), izejas standartšķīdumu var sagatavot dejonizētā ūdenī (sk 1.8.2. iedaļu); lai sasniegtu vajadzīgo koncentrāciju, atbilstošu izejas standartšķīduma tilpumu pievieno testa traukos. Pievienotais izejas standartšķīduma tilpums nedrīkst pārsniegt praktisko minimumu (ja iespējams, < 10 % no galīgā šķidruma tilpuma). Par organisko šķīdinātāju lietošanas alternatīvu var uzskatīt arī testējamās vielas šķīdināšanu lielākā testa ūdens tilpumā.
Negaistošu vielu ar mazu šķīdību ūdenī izejas standartšķīdumi jāgatavo, izmantojot organisku šķīdinātāju, ja no tā nevar izvairīties, bet testējamai sistēmai pievienotā šķīdinātāja daudzums nedrīkst pārsniegt 1 % tilp., un tas nedrīkst nevēlami ietekmēt mikrobu aktivitāti. Šķīdinātājs nedrīkst ietekmēt testējamās vielas stabilitāti ūdenī. Šķīdinātājs jālieto niecīgā daudzumā, tā, lai tas ievērojami nepalielinātu testa ūdens vai suspensijas izšķīdušā organiskā oglekļa (DOC) koncentrāciju. Tas jāpārbauda ar vielai specifisku analīzi vai, ja iespējams, DOC analīzi (6). Jāraugās, lai pārnestā šķīdinātāja daudzums nepārsniegtu absolūti nepieciešamo, un testējamās vielas daudzums izšķīstu testa ūdens galīgajā tilpumā. Var izmantot citas metodes testējamās vielas ievadīšanai testa traukos, kā aprakstīts (7) un (8). Ja testējamās vielas pievienošanai izmanto organisko šķīdinātāju, tad līdzīgi kā ar aktīvā testa traukiem, kuros pievienota testa viela ar šķīdinātāju kā nesēju, ir jārīkojas ar kontroles traukiem, kas satur testa ūdeni (bez pievienotām vielu piedevām) un testa ūdeni ar pievienotu standartvielu. Šķīdinātāja kontrole vajadzīga, lai konstatētu iespējamo šķidinātāja nevēlamo iedarbību uz mikrobu populāciju, par ko liecina standartvielas noārdīšanās.
1.8.8. Testēšanas apstākļi
1.8.8.1. Testēšanas temperatūra
Inkubācijai jānotiek tumsā (vēlams) vai izkliedētā apgaismojumā temperatūrā, ko uztur ar precizitāti ± 2 °C, un var būt apkārtējā temperatūra vai standarta temperatūra 20–25 °C. Apkārtējā temperatūra var būt parauga faktiskā temperatūra parauga ņemšanas laikā vai vidējā temperatūra parauga ņemšanas vietā.
1.8.8.2. Maisīšana
Maisīšana ar nepārtrauktu kratīšanu vai maisīšanu jāveic, lai daļiņas un mikroorganismi visu laiku būtu suspensijā. Maisīšana arī atvieglo skābekļa pārnesi no virsējās tukšās telpas šķidrumā tā, lai varētu uzturēt aerobus apstākļus. Kolbas novieto kratītājā (aptuveni 100 apgr./min kratīšana) vai izmanto magnētisko maisītāju. Maisīšanai jābūt nepārtrauktai. Kratīšanai vai maisīšanai jābūt iespējami saudzīgai, kas tomēr saglabā homogēnu suspensiju.
1.8.8.3. Testēšanas ilgums
Testēšanas laiks parasti nedrīkst pārsniegt 60 dienas, ja neizmanto pusnepārtraukto procedūru ar testa suspensijas periodisku atjaunošanu (sk. 1.8.6. iedaļu un 2. pielikumu). Tomēr testēšanas ilgumu sēriju testā var paildzināt maksimāli līdz 90 dienām, ja testējamās vielas noārdīšanās ir sākusies pirmo 60 dienu laikā. Noārdīšanos piemērotos laika intervālos kontrolē, nosakot atlikušā 14C aktivitāti vai izdalījušos 14CO2 (sk. 1.8.9.4. iedaļu) un/vai ar ķīmisko analīzi (1.8.9.5. iedaļa). Lai novērtētu noārdīšanās procesu, inkubācijas laikam jābūt pietiekami ilgam. Vēlams, lai noārdīšanās pakāpe būtu lielāka par 50 %; vielām, kas noārdās lēni, noārdīšanās pakāpei jābūt pietiekami lielai (parasti lielākai par 20 %), lai varētu noteikt noārdīšanās kinētiskā ātruma konstanti.
Jāveic regulāri pH un skābekļa koncentrācijas mērījumi, izņemot gadījumus, kad pieredze ar tajā pašā vietā ņemtiem ūdens un nosēdumu paraugiem liecina, ka šādi mērījumi nav vajadzīgi. Dažkārt primāro substrātu metabolisms daudz lielākās koncentrācijās ar ūdeni un nosēdumiem var izraisīt pietiekamu CO2 veidošanos un skābekļa patēriņu, kas ievērojami atšķiras no eksperimenta apstākļiem testēšanas laikā.
1.8.9. Procedūra
1.8.9.1. Kolbu sagatavošana pelaģiskajam testam
Piemērotu testa ūdens tilpumu pārnes testa kolbās apmēram līdz vienai trešdaļai no kolbas tilpuma, bet ne mazāk par 100 ml. Ja izmanto vairākas kolbas (lai varētu izmantot visas kolbas saturu katrā parauga ņemšanas laikā), piemērotākais testa ūdens tilpums arī ir ap 100 ml, jo mazi paraugu tilpumi var ietekmēt kavēšanās fāzes ilgumu. Testējamo vielu pievieno no izejas standartšķīduma, kā aprakstīts 1.8.2. un 1.8.7. iedaļā. Lai noteiktu noārdīšanās kinētiku un aprēķinātu noārdīšanās kinētisko ātruma konstanti, jāizmanto vismaz divas testējamās vielas koncentrācijas, kas atšķiras 5 līdz 10 reizes. Abām izraudzītajām koncentrācijām jābūt mazākām par 100 µg/l un vēlams diapazonā < 1–10 µg/l.
Kolbas noslēdz ar gaisu un CO2 necaurlaidīgiem aizbāžņiem vai vāciņiem. Ar 14C neiezīmētām negaistošām testa vielām ieteicams izmantot vaļīgus vates aizbāžņus, kas novērš piesārņošanos no gaisa (sk. 1.8.1. iedaļu), ja galvenie noārdīšanās produkti ir negaistoši un CO2 nosaka netieši (sk. 3. pielikumu).
Kolbas inkubē izraudzītajā temperatūrā (sk. 1.8.8.1. iedaļu). Paraugus ķīmiskajai analīzei vai 14C mērījumiem ņem testēšanas sākumā (t. i., pirms sākusies bioloģiskā noārdīšanās, sk. 1.7.1. iedaļu) un pēc tam piemērotos laika intervālos testēšanas laikā. Paraugus var ņemt, ņemot apakšparaugus (piemēram, 5 ml alikvotas) no katra atkārtojuma, vai izmantojot visas kolbas saturu katrā parauga ņemšanas reizē. Testa vielas mineralizāciju var noteikt tieši vai netieši (sk. 3. pielikumu). Parasti noārdīšanās fāzes laikā (t. i., pēc kavēšanās fāzes) ir vajadzīgi vismaz pieci paraugu ņemšanas punkti, lai ticami noteiktu ātruma konstanti, ja vien nav ietiekama pamatojuma uzskatīt, ka trīs paraugu ņemšanas punkti ir pietiekami vielām, kuras ātri noārdās. Vielām, kas nenoārdās ātri, noārdīšanās fāzē viegli var izdarīt vairākus mērījumus, un tāpēc konstantes noteikšanai jāizmanto vairāk datu punktu. Paraugu ņemšanai fiksētu grafiku nevar noteikt, jo bioloģiskās noārdīšanās ātrums ir katrai vielai atšķirīgs, tomēr ieteicams ņemt paraugus reizi nedēļā, ja noārdīšanās notiek lēni. Ja testējamā viela noārdās ātri, paraugi jāņem trīs dienas pēc kārtas vienreiz dienā, un pēc tam katru otro vai trešo dienu. Dažos gadījumos, piemēram, ar vielām, kas ļoti ātri hidrolizējas, paraugi var būt jāņem ar dažu stundu intervālu. Pirms testēšanas ieteicams veikt orientējošu pētījumu, lai noteiktu piemērotākos paraugu ņemšanas intervālus. Ja paraugi nepieciešami turpmākām analīzēm, ieteicams ņemt vairāk paraugu un pēc tam izvēlēties tos, kas analizējami eksperimenta beigās saskaņā ar atpakaļgaitas stratēģiju, t. i., pēdējos paraugus analizē vispirms (sk. norādījumus par paraugu stabilitāti glabāšanas laikā 1.8.9.5. iedaļas otrajā rindkopā).
1.8.9.2. Kolbu un paraugu skaits
Nokomplektē pietiekamu testa kolbu skaitu, lai būtu:
|
— |
testa kolbas, katrai testējamās vielas koncentrācijai vismaz divos atkārtojumos (vēlams vismaz 3), vai vairāk, ja katrā paraugu ņemšanas reizē izmanto visu kolbas saturu (apzīmē ar FT), |
|
— |
testa kolbas masas bilances aprēķināšanai katrai testa vielas koncentrācijai vismaz divas kolbas (apzīmē ar FM), |
|
— |
tukšais mēģinājums bez testējamās vielas, vismaz viena testa kolba, kura satur tikai testa ūdeni (apzīmē ar FB), |
|
— |
standartvielas kontroles mēģinājums; divas kolbas ar standartvielu (piemēram, anilīnu vai nātrija benzoātu 10 µg/l) (apzīmē ar FC). Standartvielas kontroles nolūks ir apstiprināt mikrobu aktivitātes minimumu. Ja iespējams, var izmantot ar radioaktīvo izotopu iezīmētu standartvielu arī tad, ja testējamās vielas noārdīšanos kontrolē ar ķīmiskajām analīzēm, |
|
— |
sterilā kontrole; viena vai divas kolbas, kas satur sterilizētu testa ūdeni, lai konstatētu iespējamu abiotisku noārdīšanos vai citādu ar bioloģiskiem procesiem nesaistītu testējamās vielas izmantošanu (apzīmē ar FS). Bioloģisko aktivitāti var apturēt, testa ūdeni sterilizējot autoklāvā (121 °C; 20 min) vai pievienojot toksisku vielu (piemēram, nātrija azīdu (NaN3) 10–20 g/l, dzīvsudraba hlorīdu (HgCl2) 100 mg/l vai formalīnu 100 mg/l), vai apstarojot ar gamma stariem. Ja izmanto HgCl2, tas testa ūdens jālikvidē kā toksiskie atkritumi. Ūdenim ar lielu pievienoto sedimenta daudzumu sterilitāti panākt nav viegli, tādā gadījumā ieteicama atkārtota apstrāde autoklāvā (piemēram, trīs reizes). Jāņem vērā, ka sterilizācija autoklāvā var mainīt sedimentu sorbcijas īpašības, |
|
— |
šķīdinātāja kontrole; satur testa ūdeni un testa ūdeni ar standartvielu; divas kolbas, ar to pašu šķīdinātāja daudzumu un izmantojot to pašu procedūru kā testējamajai vielai. Nolūks ir konstatēt iespējamo nevēlamo šķīdinātāja ietekmi, nosakot standartvielas noārdīšanos. |
Testēšanas plānā jāņem vērā, vai svarīgāk palielināt atkārtojumu skaitu, vai arī ņemšanas laiku skaitu. Precīzs vajadzīgo kolbu skaits ir atkarīgs no noārdīšanās mērījumiem izmantojamās metodes (sk. 1.8.9.1. iedaļas trešo rindkopu, 1.8.9.4. iedaļu un 3. pielikumu).
No katras kolbas katrā paraugu ņemšanas laikā jāņem divi apakšparaugi (piemēram, 5 ml alikvotas). Ja vienam variantam izmanto vairākas kolbas, lai varētu izmantot visu kolbas saturu, katram paraugu ņemšanas laikam jāizmanto vismaz divas kolbas (sk. 1.8.9.1. iedaļas pirmo rindkopu).
1.8.9.3. Kolbu sagatavošana suspendēto nosēdumu testam [neobligāti]
Iepilda vajadzīgos testa ūdens un, ja vajadzīgs, sedimentu tilpumus testa traukos (sk. 1.8.5. iedaļu). Kolbu sagatavošana suspendēto sedimentu testam ir tāda pati kā pelaģiskajam testam (sk. 1.8.9.1. un 1.8.9.2. iedaļu). Izmanto, vēlams, seruma pudeles vai līdzīgas formas kolbas. Noslēgtas kolbas horizontāli novieto uz kratītāja platformas. Acīmredzot, atvērtas kolbas ar 14C neiezīmētām negaistošām vielām ir jānovieto vertikāli, tādā gadījumā ieteicams izmantot magnētisko maisītāju un magnētiskos stienīšus ar stikla pārklājumu. Aerobus apstākļu nodrošināšanai veic pudeļu satura aerāciju.
1.8.9.4. Radioķīmiskās noteikšanas metodes
Izdalījušos 14CO2 daudzumu nosaka tiešos vai netiešos mērījumos (sk. 3. pielikumu). Netieši 14CO2 nosaka pēc starpības starp sākotnējo 14C aktivitāti testa ūdenī vai suspensijā un kopējo atlikuma aktivitāti parauga ņemšanas laikā, mērot pēc parauga paskābināšanas līdz pH 2–3 un CO2 izdalīšanas. Tādā veidā tiek aizvadīts neorganiskais ogleklis, un izmērītā atlikuma aktivitāte attiecināma uz organisko vielu. Netiešu 14CO2 noteikšanu neizmanto, ja testējamās vielas noārdīšanās laikā radušies svarīgākie pārveidošanās produkti ir gaistoši (sk. 3. pielikumu). Ja iespējams, 14CO2 izdalīšanās jāmēra tieši (sk. 3. pielikumu) katrā paraugu ņemšanas laikā vismaz vienā testa kolbā; šī procedūra rada iespējas kontrolēt gan masas bilanci, gan bioloģiskās noārdīšanās procesu, taču metodi var izmantot tikai testiem, ko veic ar noslēgtām kolbām.
Ja radušos 14CO2 mēra tieši testa laikā, šajā nolūkā testa sākumā jāsagatavo vairāk kolbu. Tiešu 14CO2 noteikšanu veikt ir ieteicams, ja testējamās vielas pārveidošanās laikā radušies svarīgākie pārveidošanās produkti ir gaistoši. Katrā mērījumu punktā testa papildu kolbas paskābina līdz pH 2–3 un 14CO2 uztver iekšējā vai ārējā absorberā (sk. 3. pielikumu).
Pēc izvēles ar 14C izotopu iezīmētu testējamo vielu un to galveno pārveidošanās produktu koncentrāciju var noteikt ar radiohromatogrāfiju (piemēram, plānslāņa hromatogrāfiju, RAD-TLC) vai HPLC ar radioķīmisko detektēšanu.
Pēc izvēles var noteikt atlikuma radioaktivitātes fāzu sadalījumu (sk. 1. pielikumu), un testējamās vielas nesadalījušos atlikumu vai tās pārveidošanās produktus.
Testēšanas beigās tiešos 14CO2 mērījumos nosaka masas bilanci, izmantojot atsevišķas testa kolbas, no kurām testēšanas laikā netika ņemti paraugi (sk. 3. pielikumu).
1.8.9.5. Ķīmisko analīžu metodes
Ja ir iespējams izmantot jutīgu analīzes metodi, primāro bioloģisko noārdīšanos var novērtēt, izmērot testējamās vielas atlikuma kopējo koncentrāciju bez iezīmēšanas a radioaktīvo izotopu. Ja izmanto ar radioaktīvu izotopu iezīmētu testējamo vielu (lai noteiktu kopējo mineralizāciju), paralēli var izdarīt specifisku ķīmisko analīzi, lai sniegtu noderīgu papildu informāciju un kontrolētu procedūru. Specifiskas ķīmiskās analīzes var izmantot arī, lai mērītu pārveidošanās produktus, kas veidojas testa vielas noārdīšanās laikā, un tas ir ieteicams vielām, kuru mineralizēšanās pusperiods ir lielāks par 60 dienām. Katram parauga ņemšanas laikam jāmēra un jāreģistrē testējamās vielas un pārveidošanās produktu koncentrācija (koncentrācijas veidā un kā procentuālais daudzums no lietotās). Vispār ir jāidentificē pārveidošanās produkti, kas ir detektēti pie ≥ 10 % no lietotās koncentrācijas katrā parauga ņemšanas reizē, ja nav pienācīgi pamatots citādi. Jāapsver arī tādu pārveidošanās produktu identifikācijas nepieciešamība, kuru koncentrācija pastāvīgi palielinās, pat ja to koncentrācija nepārsniedz iepriekš norādīto robežu, jo tas var norādīt uz noturīgumu. Jāapsver pārveidošanās produktu analizēšanas nepieciešamība sterilajā kontrolē ja uzskata, ka iespējama testējamās vielas ātra abiotiska pārveidošanās (piemēram, hidrolīze). Vajadzība identificēt un kvantitatīvi noteikt pārveidošanās produktus jāapsver, katru gadījumu izskatot atsevišķi, un tās pamatojumu sniedzot testēšanas pārskatā. Ekstrakcijas metodes ar organisku šķīdinātāju jāizmanto saskaņā ar attiecīgās analītiskās procedūras aprakstā sniegtajiem norādījumiem.
Visi paraugi jāglabā 2–4 °C temperatūrā un bez gaisa piekļuves, ja analīzi veic 24 stundu laikā (vēlams). Ilgākai glabāšanai paraugi ir jāsasaldē zem –18 °C vai ķīmiski jākonservē. Paraugu konservēšanai paskābināšana nav ieteicama, jo paskābināti paraugi var būt nestabili. Ja paraugus neanalizē 24 stundu laikā un tie tiek glabāti ilgāk, ir jāveic pētījums par stabilitāti glabājot, lai parādītu, ka nosakāmā viela, glabājot –18 °C temperatūrā vai konservēšanas apstākļos ir stabila. Ja analītiskajā metodē ietilpst ekstrakcija ar šķīdinātāju vai cietās fāzes ekstrakciju (CFE), ekstrakcija jāveic tūlīt pēc paraugu ņemšanas vai pēc glabāšanas vēsumā ne ilgāk par 24 stundām.
Atkarībā no analītiskās metodes jutības var būt vajadzīgi lielāki parauga tilpumi nekā norādīts 1.8.1. iedaļā. Testēšana ērti izdarāma ar viena litra paraugiem 2–3 litru tilpuma kolbās, kas dod iespējas analīzēm ņemt apmēram 100 ml tilpuma paraugus.
2. DATI UN TESTĒŠANAS PĀRSKATS
2.1. REZULTĀTU APSTRĀDE
2.1.1. Datu atlikšana
Paraugu ņemšanas laiku noapaļo līdz veselām stundām (ja vien viela ievērojami nenoārdās minūšu līdz dažu stundu laikā), bet nevis līdz veselam skaitam dienu. Testējamās vielas atlikuma aktivitāti (ar 14C iezīmētām vielām) vai atlikuma koncentrāciju (neiezīmētām vielām) atkarībā no laika atliek uz grafika lineārās un puslogaritmiskās koordinātēs (sk. 1.a, 1.b attēlu). Ja ir notikusi noārdīšanās, salīdzina rezultātus no kolbām FT ar rezultātiem no kolbām FS. Ja rezultātu vidējie lielumi no kolbām ar testējamo vielu (FT) un no sterilajām kolbām (FS) atšķiras mazāk par 10 %, var pieņemt, ka novērotā noārdīšanās galvenokārt ir abiotiska. Ja noārdīšanās kolbās FS ir mazāka, skaitļus var izmantot, lai koriģētu tos, kas iegūti ar kolbām FT (atņemot) novērtētu bioloģiskās noārdīšanās pakāpi. Ja veic svarīgāko pārveidošanās produktu analīzes, to veidošanās un samazināšanās grafiki ir jāsniedz papildus testējamās vielas daudzuma samazināšanās grafikam.
Pēc noārdīšanās līknes (puslogaritmiskais grafiks) nosaka kavēšanās fāzes ilgumu tL, ekstrapolējot tās lineāro daļu uz nulles noārdīšanos vai nosakot laiku, kurā noārdījušies aptuveni 10 % vielas (sk. 1.a un 1.b att.). No puslogaritmiskā grafika novērtē pirmās kārtas ātruma konstanti k un tās standartkļūdu pēc naturālā logaritma ln lineārās regresijas (14C atlikuma aktivitātei vai testa vielas atlikuma koncentrācijai) atkarībā no laika. Jo īpaši ar 14C mērījumiem izmanto tikai datus, kas piederīgi līknes sākotnējai lineārajai daļai pēc kavēšanās fāzes beigām, un dod priekšroku dažu reprezentatīvu datu izvēlei, nevis lielāka skaita mazāk drošu datu izvēlei. Nenoteiktība šajā gadījumā iekļauj kļūdas, kas piemīt ieteicamajai izmērīto 14C atlikuma aktivitāšu izmantošanai (sk. turpmāk). Dažkārt var būt jāaprēķina divas dažādas ātruma konstantes, ja noārdīšanās notiek divās fāzēs. Šajā nolūkā definē divas atšķirīgas noārdīšanās līknes fāzes. Ātruma konstanti k un pussadalīšanās periodu t½ = ln2/k aprēķina katram atkārtojumam, ja apakšparaugus ņem no vienas kolbas, vai izmantojot vidējās vērtības, ja katrā parauga ņemšanas laikā izmanto visu vienas kolbas saturu (sk. 1.8.9.2. iedaļas pēdējo rindkopu). Pirmajā gadījumā ātruma konstante un pussadalīšanās periods jānorāda katram atkārtojumam atsevišķi, to vidējā vērtība ar standartkļūdu. Ja ir izmantotas lielas testējamās vielas koncentrācijas, noārdīšanās līkne var ievērojami atšķirties no taisnes (puslogaritmiskais grafiks), un pirmās kārtas kinētika var nebūt spēkā. Tāpēc nav nozīmes noteikt pussadalīšanās periodu. Tomēr ierobežotā datu diapazonā var izmantot pseidopirmās kārtas kinētiku un noteikt pusnoārdīšanās laiku DT50 (laiku, kurā sasniedz 50 % noārdīšanos). Tomēr jāievēro, ka noārdīšanās gaitu ārpus izraudzītajam datu diapazonam pēc DT50 nevar prognozēt, un ka apraksta tikai konkrēto datu kopumu. Pieejamas datu analīzes metodes statistikas aprēķinu veikšanai un līknes aproksimācijai, un šim nolūkam ieteicams izmantot minētā veida programmatūru.
Ja veic specifiskas ķīmiskās analīzes, primārās noārdīšanās ātruma konstantes un pussadalīšanās periodus nosaka kopējai mineralizācijai, kā norādīts iepriekš. Ja limitējošais process ir primārā noārdīšanās, var izmantot datu punktus no visas noārdīšanās gaitas. Tā tas ir tāpēc, ka mērījumi ir tieši, pretstatā 14C aktivitātes mērījumiem.
Ja izmanto ar 14C izotopu iezīmētas vielas, masas bilanci izsaka procentos no lietotās sākotnējās koncentrācijas vismaz testa beigās.
2.1.2. Atlikuma aktivitāte
Ja noārdās ar 14C iezīmētā organiskās vielas daļa, lielākā 14C daļa pārvēršas par 14CO2, bet otra daļa tiek izmantota biomasas pieaugumam un/vai ārpusšūnu metabolītu sintēzei. Tāpēc pilnīgā “galīgā” vielas bioloģiskā noārdīšanās nenotiek tās oglekļa 100 % pārvēršanās par 14CO2. Biosintēzes produktos saistītais 14C turpmāk lēni izdalās 14CO2 veidā “sekundārās mineralizācijas” dēļ. Šo iemeslu dēļ organiskā 14C atlikuma aktivitātes (mērītas pēc CO2 izdalīšanās) vai 14CO2 atlikuma aktivitāte atkarībā no laika, uzrāda “astes” pēc noārdīšanās beigām. Tas apgrūtina kinētikas interpretāciju, un tāpēc noārdīšanās ātruma konstantes noteikšanai parasti izmanto tikai līknes sākuma daļu (pēc kavēšanās fāzes beigām un pirms ir sasniegta apm. 50 % noārdīšanās). Noārdīšanās procesa laikā kopējā atlikuma organiskā 14C aktivitāte vienmēr ir lielāka par 14C aktivitāti, kas saistīta ar vēl nenoārdījušos testējamo vielu. Ja testējamās vielas noārdīšanās notiek pēc pirmās kārtas reakcijas mehānisma un konstanta daļa α mineralizējas par CO2, 14C noārdīšanās līknes sākotnējais virziena koeficients – slīpums (kopējā organiskā 14C attiecība pret laiku) ir α reizinājums ar atbilstošās testējamās vielas (vai precīzāk ar 14C iezīmētās testējamās vielas daļas) koncentrācijas līknes virziena koeficientu. Ja izmanto nekoriģētus kopējās organiskā 14C aktivitātes mērījumus, aprēķinātā sadalīšanās ātruma konstante tāpēc būs konservatīvs lielums. Literatūrā aprakstītas procedūras testējamās vielas koncentrācijas aprēķināšanai pēc izmērītām radioķīmiskām aktivitātēm, pamatojoties uz dažādiem vienkāršojošiem pieņēmumiem (2)(9)(10)(11). Tādas procedūras vienkāršāk izmantojamas vielām, kas ātri noārdās.
2.2. REZULTĀTU INTERPRETĀCIJA
Ja tiek konstatēts, ka k nav atkarīga no pievienotās koncentrācijas (t. i., ja aprēķinātā k vērtība ir aptuveni vienāda pie dažādām testējamās vielas koncentrācijām), var pieņemt, ka izmantotajiem testēšanas apstākļiem, t. i., testējamajai vielai, ūdens paraugam un testa temperatūrai, reprezentatīva ir pirmās kārtas reakcijas ātruma konstante. Ciktāl rezultātus var vispārināt vai ekstrapolēt uz citām sistēmām, ir jānovērtē eksperta slēdzienā. Ja izmanto lielu testējamās vielas koncentrāciju un tāpēc noārdīšanās nenotiek atbilstoši pirmās kārtas kinētikai, datus nevar izmantot pirmās kārtas reakcijas ātruma konstantes vai atbilstošā pussadalīšanās perioda tiešai aprēķināšanai. Tomēr datus, kas iegūti testā ar augstu testējamās vielas koncentrāciju, var izmantot, lai novērtētu kopējo mineralizācijas pakāpi un/vai identificētu un kvantitatīvi noteiktu pārveidošanās produktus.
Ja ir zināmi citu noārdīšanās procesu ātrumi, kas nav bioloģiskā noārdīšanās, (piemēram, hidrolīzes vai iztvaikošanas) ātrumi, aptuvenai bioloģiskās noārdīšanās ātruma aprēķināšanai tos var atņemt no testa laikā novērotā kopējā noārdīšanās ātruma. Hidrolīzes datus var, piemēram, iegūt no sterilās kontroles vai no paralēla testa, kurā izmanto lielāku testējamās vielas koncentrāciju.
Netiešo un tiešo 14CO2 noteikšanu (1.8.9.4. iedaļa un 3. pielikums) var izmantot tikai, lai izmērītu testa vielas mineralizāciju līdz CO2. Radiohromatogrāfiju (RAD-TLC) vai HPLC var izmantot, lai analizētu ar 14C iezīmētas testa vielas koncentrāciju un galveno pārveidošanās produktu veidošanos (1.8.9.4. iedaļas trešā rindkopa). Lai varētu tieši novērtēt pussadalīšanās periodu, ir nepieciešams, lai klāt nebūtu svarīgākie pārveidošanās produkti (definēti kā ≥ 10 % no pievienotās testējamās vielas daudzuma). Ja tā definētie galvenie pārveidošanās produkti ir klāt, nepieciešams sīks datu novērtējums. Šim nolūkam var veikt atkārtotu testēšanu un/vai pārveidošanās produktu identificēšanu (sk. 1.8.9.5. iedaļas pirmo rindkopu), ja vien pārveidošanās produktu rezultātu nevar pamatoti novērtēt no pieredzes (piemēram, no informācijas par noārdīšanās ceļiem). Tā kā testējamās vielas oglekļa daļa, kas pārvēršas par CO2, mainās (galvenokārt atkarībā no testējamās vielas koncentrācijas un citiem pieejamiem substrātiem, testēšanas apstākļiem un mikroorganismu kopuma), šis tests neļauj tieši novērtēt galīgo bioloģisko noārdīšanos, kā tas ir DOC izzušanas testā, bet rezultāts ir līdzīgs respirometrijas testā iegūtajam rezultātam. Mineralizācijas pakāpe tāpēc ir mazāka vai vienāda ar galīgās bioloģiskās noārdīšanās minimālo līmeni. Lai iegūtu pilnīgāku ainu par galīgo bioloģisko noārdīšanos (mineralizāciju un izmantošanu biomasas veidošanai), testa beigās jāveic 14C fāzu sadalījuma analīze (sk. 1. pielikumu). Cieto daļiņu masā esošais 14C daudzums sastāv no baktēriju biomasā ietvertā 14C, un no 14C, ko ir sorbējušas organiskās daļiņas.
2.3. TESTĒŠANAS METODES VALIDĀCIJA
Ja standartviela sagaidāmajā laika intervālā nenoārdās (anilīns un nātrija benzoāts parasti noārdās mazāk nekā divās nedēļās), iegūtie testēšanas rezultāti ir apšaubāmi, un tie ir jāverificē vai testēšana jāatkārto ar jaunu ūdens paraugu. Pēc ISO metodes veiktā starplaboratoriju salīdzinošajā testēšanā, kurā piedalījās septiņas Eiropas laboratorijas, noteiktās koriģētās anilīna noārdīšanās ātruma konstantes bija diapazonā no 0,3 līdz 1,7 dienas–1 ar vidējo vērtību 0,8 d–1 20 oC temperatūrā un ar standartkļūdu ±0,4 d–1 (t½ = 0,9 dienas). Parastie kavēšanās laiki bija 1 līdz 7 dienas. Analizētajos ūdens paraugos baktēriju biomasas daudzums atbilda 103-104 kolonijas veidojošām vienībām (KVV) vienā mililitrā. Noārdīšanās ātrumi ar barības vielām bagātos Eiropas vidienes ūdeņos bija lielāki nekā Ziemeļu oligotrofajos ūdeņos, kas varētu būt izskaidrojams ar trofiskā režīma atšķirībām vai ar vielu iepriekšēju iedarbību.
Kopējai atgūstamībai (masas bilancei) testa beigās jābūt no 90 % līdz 110 % ar radioaktīvo izotopu iezīmētām vielām, bet neiezīmēto vielu sākotnējai atgūstamībai eksperimenta sākumā jābūt no 70 % līdz 110 %. Tomēr norādītie diapazoni jāinterpretē tikai kā mērķa vērtības, un tie nav jāizmanto par testēšanas rezultātu pieņemamības kritērijiem.
3. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā skaidri jānorāda testēšanas paņēmiens, t. i., pelaģiskais vai suspendētu sedimentu tests, un testēšanas pārskatā jābūt arī vismaz šādai informācijai.
Testējamās vielas un standartvielas:
|
— |
vispārējie nosaukumi, ķīmiskie nosaukumi (ieteicams izmantot IUPAC un/vai CAS nosaukumu), CAS numuri, struktūrformulas (norādot 14C vietu, ja izmanto ar radioaktīvo izotopu iezīmētu vielu), un testējamās vielas un standartvielas attiecīgās fizikāli ķīmiskās īpašības (sk. 1.5. un 1.6. iedaļu), |
|
— |
ķīmiskie nosaukumi, CAS numuri, struktūrformulas (norādot 14C vietu, ja izmanto radioaktīvi iezīmētu vielu) un attiecīgās fizikāli ķīmiskās īpašības vielām, ko izmanto par standartiem pārveidošanās produktu identificēšanai un kvantitatīvai noteikšanai, |
|
— |
testējamās vielas un standartvielu tīrība (piemaisījumi), |
|
— |
iezīmētās vielas radioķīmiskā tīrība un īpatnējā aktivitāte (attiecīgā gadījumā). |
Virszemes ūdens:
Par ņemto ūdens paraugu jāsniedz vismaz šāda informācija:
|
— |
parauga ņemšanas vietas atrašanās un apraksts, iekļaujot, ja iespējams, piesārņojuma vēsturi, |
|
— |
parauga ņemšanas datums un laiks, |
|
— |
barības vielas (kopējais N, amonijs, nitrīti, nitrāti, kopējais P, šķīstošie ortofosfāti), |
|
— |
ņemšanas dziļums, |
|
— |
parauga izskats (piemēram, krāsa un duļķainība), |
|
— |
DOC un TOC, |
|
— |
bioloģiskais skābekļa patēriņš (BSP), |
|
— |
temperatūra un pH ņemšanas vietā un laikā, |
|
— |
skābekļa saturs, vai redokspotenciāls (obligāti tikai, ja apstākļi nav acīmredzami aerobi), |
|
— |
sāļu saturs vai elektrovadītspēja (jūras ūdens un sāļūdens gadījumā), |
|
— |
suspendēto vielu saturs (ja paraugs ir duļķains), |
|
— |
iespējama cita veida informācija par parauga ņemšanas vietu parauga ņemšanas laikā (piemēram, pašreizējie vai vēsturiskie dati par upju vai jūras straumju plūsmas ātrumu, tuvējām lielām izplūdēm un izplūžu veidu, laika apstākļiem pirms parauga ņemšanas laika). |
Un neobligāti:
|
— |
mikrobu biomasa (piemēram, kolonijas veidojošo vienību skaits vai tiešā šūnu skaitīšana mikroskopā, izmantojot akridīnoranžo), |
|
— |
neorganiskā oglekļa saturs, |
|
— |
Hlorofila-a koncentrācija kā aļģu biomasas specifisks rādītājs. |
Ja veic suspendēto sedimentu testu, papildus jāsniedz šāda informācija par sedimentiem:
|
— |
sedimentu ņemšanas dziļums, |
|
— |
sedimentu izskats (piemēram, krāsaini, dūņaini, mālaini vai smilšaini), |
|
— |
tekstūra (piemēram, rupju smilšu, smalku smilšu, sanesu un mālu %), |
|
— |
suspendēto cieto vielu sausnas masa g/l, TOC koncentrācija vai masas zudums izkvēlinot kā organisko vielu satura mērs, |
|
— |
pH, |
|
— |
skābekļa saturs vai redokspotenciāls (obligāti tikai tad, ja apstākļi nav acīmredzami aerobi). |
Testēšanas apstākļi:
|
— |
paraugu glabāšanas ilgums no paraugu ņemšanas laika līdz testēšanai laboratorijā, parauga glabāšana un tā sagatavošana, testēšanas datumi, |
|
— |
pielietotais testējamās vielas daudzums, testējamā koncentrācija un izmantotā standartviela, |
|
— |
testējamās vielas lietošanas metode, iekļaujot šķīdinātāju izmantošanu, |
|
— |
lietotā virszemes ūdens un nosēdumu (ja tos lieto) tilpums un katrā paraugu ņemšanas laikā analīzei ņemtā parauga tilpums, |
|
— |
izmantotās testēšanas sistēmas apraksts. |
Ja testēšana nav jāveic tumsā, informācija par “izkliedētā apgaismojuma” apstākļiem:
|
— |
informācija par metodi(-ēm), kas lietota(-as) sterilai kontrolei (piemēram, autoklavēšanas temperatūra, ilgums un skaits), |
|
— |
inkubācijas temperatūra, |
|
— |
informācija par analītiskajām metodēm un par metodēm, kas izmantotas radioķīmiskajos mērījumos, masas bilances noteikšanai, un fāzu sadalījuma mērījumos (ja tie veikti), |
|
— |
atkārtojumu skaits. |
Rezultāti:
|
— |
atgūstamība procentos (sk. 1.7.1. iedaļu); |
|
— |
izmantoto analītisko metožu atkārtojamība un jutība, iekļaujot noteikšanas robežu (LOD) un kvantitatīvās noteikšanas robežu (LOQ) (sk. 1.7.2. iedaļu); |
|
— |
visi mērījumu dati (iekļaujot paraugu ņemšanas laikus) un aprēķinātās vērtības tabulas veidā, un noārdīšanās līknes; katrai testa koncentrācijai un katra atkārtojuma kolbai pārskatā norāda logaritmiskā grafika slīpuma virziena lineārās korelācijas koeficientu, aprēķināto kavēšanās fāzes ilgumu un pirmās kārtas vai pseidopirmās kārtas ātruma konstanti (ja iespējams) un atbilstošo pusnoārdīšanās periodu (vai pusperiodu t50); |
|
— |
attiecīgās vērtības norāda kā atsevišķos atkārtojumos novēroto rezultātu – piemēram, kavēšanās fāzes ilguma, noārdīšanās ātruma konstantes un pusnoārdīšanās perioda (vai t50) – vidējās vērtības; |
|
— |
sistēmas klasifikāciju kā neadaptētu vai adaptētu, spriežot no noārdīšanās līknes rakstura un testējamās koncentrācijas iespējamās ietekmes; |
|
— |
galīgās masas bilances pārbaudes rezultāti un fāzu sadalījuma mērījumu rezultāti (ja tādi ir); |
|
— |
mineralizētā 14C daļa un, ja ir izmantotas specifiskas analīzes, primārās noārdīšanās galīgais līmenis; |
|
— |
lietotās vielas un attiecīgā gadījumā svarīgāko pārvēršanās produktu identifikācija, molārā koncentrācija un procenti (sk. 1.8.9.5. iedaļas pirmo rindkopu); |
|
— |
ja vajadzīgs, iespējamais pārveidošanās mehānisms; |
|
— |
rezultātu izvērtējums. |
4. LITERATŪRA
|
1. |
OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test |
|
2. |
ISO/DIS 14592–1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions. |
|
3. |
Testing Method C.23. Aerobic and anaerobic transformation in soil. |
|
4. |
Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments. |
|
5. |
OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris. |
|
6. |
ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC). |
|
7. |
ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium. |
|
8. |
OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 |
|
9. |
Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394–401. |
|
10. |
Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274–283. |
|
11. |
ISO/CD 14592–1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions. |
1. papildinājums
14 C fāzu sadalījums
Lai pārbaudītu procedūru, atlikuma kopējo organiskā 14C aktivitāti (TOA) parastajiem mērījumiem papildus jāveic masas bilances mērījumi, kurā ietilpst izdalītā 14CO2 tieša noteikšana pēc uztveršanas absorberā (sk. 3. pielikumu). Pati par sevi pozitīva 14CO2 veidošanās bilance ir tiešs pierādījums par bioloģisko noārdīšanos pretstatā abiotiskās noārdīšanās vai citiem zudumu mehānismiem, piemēram, iztvaikošanai vai sorbcijai. Noderīgu papildu informāciju, kas raksturo bioloģisko noārdīšano, var iegūt no TOA sadalījuma mērījumiem starp izšķīdušo stāvokli (izšķīdušā organiskā 14C aktivitāte, DOA) un stāvokli cieto daļiņu veidā (daļiņu organiskā 14C aktivitāte, POA) pēc daļiņu atdalīšanas ar membrānfiltrāciju vai centrifugēšanu. POA sastāv no testa vielas, kas sorbēta uz mikrobu biomasas un uz citām daļiņām, papildus testa vielas ogleklim, kas ir izmantots jauna šūnu materiāla sintēzei un tādējādi iekļauts daļiņu biomasas frakcijā. Izšķīdušā 14C organiskā materiāla veidošanos var novērtēt kā DOA bioloģiskās noārdīšanās beigās (līknes plato daļa noārdīšanās izmaiņu laika grafikā).
Atlikuma 14C fāzu sadalījumu paraugos novērtē, tos filtrējot caur 0,22 μm vai 0,45 μm membrānas filtru no materiāla, kas neadsorbē ievērojamus testējamās vielas daudzumus (piemēroti var būt polikarbonāta filtri). Ja testa vielas sorbcija uz filtra ir pārāk liela, lai to varētu neņemt vērā (jāpārbauda pirms eksperimenta), filtrēšanas vietā var izmantot ultracentrifugēšanu (2 000 g; 10 min).
Ar filtrātu vai centrifugātu rīkojas, kā 3. pielikumā aprakstīts par nefiltrētiem paraugiem. Membrānas filtrus izšķīdina piemērotā scintilāciju šķidrumā un skata, kā parasts, parasti izmantojot tikai ārējā standarta koeficienta metodi, lai koriģētu vājinājumu, vai lieto parauga oksidētāju. Ja ir izmantota centrifugēšana, no daļiņu frakcijas izveidojušos granulu atkārtoti suspendē 1–2 ml destilēta ūdens, un mazgāšanas ūdeni pārnes scintilāciju stobriņā. Pēc tam divas reizes skalo ar 1 ml destilēta ūdens un mazgāšanas ūdeni pārnes stobriņā. Vajadzības gadījumā suspensiju var iekļaut gelā šķidruma scintilāciju skaitīšanai.
2. papildinājums
Pusnepārtrauktā procedūra
Lai panāktu grūti noārdāmu vielu pietiekamu noārdīšanos, inkubācija var būt jāveic vairākus mēnešus. Testēšanas ilgums parasti nedrīkst pārsniegt 60 dienas, ja vien sākotnējā ūdens parauga īpašības netiek saglabātas, atjaunojot testa suspensiju. Ja suspensiju neatjaunojot testējamās vielas noārdīšanās ir sākusies pirmo 60 dienu laikā, testēšanas laiku var paildzināt ne vairāk kā līdz 90 dienām.
Ilgstošas inkubācijas laikā dažādu zudumu veidošanās mehānismu dēļ un ūdens paraugā samazinoties galveno barības vielu saturam un izsīkstot primārajiem oglekļa substrātiem, var samazināties mikroorganismu daudzveidība. Tāpēc, lai pareizi noteiktu lēni noārdošos vielu noārdīšanās ātrumu, ir ieteicams izmantot pusnepārtraukto testu. Tests jāuzsāk, izmantojot pusnepārtraukto procedūru, ja, pamatojoties uz iepriekšējo pieredzi, ir sagaidāms, ka 20 % vielas noārdīšanās sasniegšanai būs trīs mēnešu ilgs inkubācijas periods. Var arī parasto sēriju testu var nomainīt ar pusnepārtraukto testu, ja sēriju procedūrā aptuveni 60 dienās testējamās vielas noārdīšanās nav novērota. Pusnepārtraukto procedūru var izbeigt un testēšanu turpināt kā sēriju testu gadījumos, kad tiek novērota nozīmīga noārdīšanās (piemēram, > 20 %).
Pusnepārtrauktajā testā ik pēc divām nedēļām aptuveni vienu trešdaļu no testējamās suspensijas tilpuma aizstāj ar svaigi ņemtu ūdeni, kam sākotnējā koncentrācijā pievienota testējamā viela. Ja veic suspendēto sedimenta testu, kas nav neobligāti, aizstāšanas ūdenim tāpat pievieno arī sedimentus sākotnējā koncentrācijā (no 0,01 līdz 1 g/l). Veicot testu ar suspendētām sedimentu cietām vielām, ir svarīgi, lai testējamā sistēma tiktu uzturēta pilnīgi suspendētā stāvoklī arī ūdens atjaunošanas laikā, un lai uzturēšanās laiks sistēmā cietajām vielām un ūdenim būtu identisks, citādi var zust paredzētā līdzība ar homogēnu ūdens sistēmu bez fiksētām fāzēm. Šo iemeslu dēļ, ja izmanto pusnepārtraukto procedūru, vēlama ir suspendēto sedimentu koncentrācija norādītā intervāla mazākajā daļā.
Testējamās vielas pievienošana nozīmē, ka testējamās vielas sākotnējā koncentrācija ar testa suspensijas daļējo atjaunošanu netiek pārsniegta un tādējādi tiek novērsta adaptācija, kas bieži novērojama pie lielām testējamo vielu koncentrācijām. Tā kā procedūrā ietilpst atkārtota inokulācija un noplicināto barības vielu un primāro substrātu kompensācija, mikroorganismu sākotnējā daudzveidība tiek atjaunota, un testēšanas ilgumu principā var pagarināt bezgalīgi. Ja izmanto pusnepārtraukto procedūru, ir svarīgi atzīmēt, ka testējamās vielas atlikuma koncentrācija ir jākoriģē, ņemot vērā testējamās vielas daudzumus, ko katrā atjaunošanas procedūrā pievieno un aizvada. Savienojumiem, kas sorbējas maz, savstarpēji aizstājamas koncentrācijas ir testējamās vielas kopējā un izšķīdušās daļas koncentrācija. Sorbcija ir nenozīmīga (< 5 %) norādītajos apstākļos (0,1 1 g cietas vielas/l) vielām, kurām log Kow < 3 (spēkā neitrāliem lipofīliem savienojumiem). To raksturo šāds aprēķina piemērs. 0,1 g/l cietu vielu aptuveni atbilst 10 mg oglekļa litrā (oglekļa daļa fC = 0,01). Pieņemot, ka
log Kow (testējamai vielai) = 3
Koc = 0,42 × Kow
sadalījuma koeficients Kd = fC × Koc
tādā gadījumā izšķīdusī daļa no kopējās koncentrācijas (C-ūdens (Cw)/C-kopējā (Ct) ir:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 x 10–3) = 0,999
3. papildinājums
14CO2 noteikšana
14CO2 netieša noteikšana
Rutīnas mērījumiem netiešā metode parasti ir mazāk laikietilpīga un ir pati precīzākā, ja testējamā viela ir negaistoša un tās pārveidošanās produkti nav gaistoši. Nefiltrētus paraugus, piemēram, 5 ml tilpuma paraugus, pārnes scintilāciju stobriņos. Piemērota paraugu sākotnējā aktivitāte ir 5 000 dpm-10 000 dpm (80–170 Bq), bet minimālā sākotnējā aktivitāte ir aptuveni 1 000 dpm. Pēc paskābināšanas līdz pH 2–3 ar 1–2 pilieniem koncentrētas H3PO4 vai HCl ir jāizdala CO2. CO2 var aizvadīt, barbotējot cauri gaisu aptuveni ½–1 stundu. Otra iespēja ir 1–2 stundas stobriņus intensīvi kratīt (piemēram, uz mikroplašu kratītāja), vai maisot ne tik intensīvi, atstāt līdz nākamajai dienai. CO2 izdalīšanas efektivitāte ir jāpārbauda (paildzinot aerēšanas vai kratīšanas laiku). Pēc tam jāpievieno scintilāciju šķidrums, kas piemērots skaitīšanai ūdens paraugos, paraugs jāhomogenizē vorteksā, un ar šķidruma scintilāciju skaitīšanu jānosaka radioaktivitāte, atņemot fona aktivitāti, kas noteikta tukšajiem paraugiem (FB). Ja testa ūdens nav ļoti krāsains vai nesatur cietās daļiņas lielā koncentrācijā, paraugi parasti uzrāda vienādu dzēšanu, un ir pietiekami izdarīt dzēšanas koriģēšanu, izmantojot ārējo standartu. Ja testa ūdens ir stipri krāsains, var būt nepieciešama dzēšanas korekcija, izmantojot iekšējo standartu. Ja daļiņu koncentrācija ir ļoti liela, var nebūt iespējams iegūt homogēnu šķīdumu vai gelu, vai arī dzišanas atšķirības starp paraugiem var būt lielas. Tādā gadījumā testa maisījumam var izmantot turpinājumā aprakstīto skaitīšanas metodi. Ja testu izdara kā suspendētu sedimentu testu, 14CO2 mērījumus var izdarīt netieši – ņemt homogēnu 10 ml testa ūdens/suspensijas paraugu un atdalīt fāzes, centrifugējot ar piemērotu ātrumu (piemēram, 40 000 m/s2 15 min). Pēc tam ar ūdens fāzi rīkojas, kā aprakstīts iepriekš. Cieto daļiņu fāzē (POA) 14C aktivitāte jānosaka, sedimentus atkārtoti suspendējot nelielā daudzumā destilēta ūdens, pārnesot scintilāciju stobriņos un pievienojot scintilāciju šķidrumu, lai veidotos gels (šim nolūkam ir pieejami īpaši scintilāciju šķidrumi). Atkarībā no daļiņu īpašībām (piemēram, organiskās vielas satura) var būt lietderīgi paraugu līdz nākamajai dienai atstāt iedarboties ar audus šķīdinošu vielu, un tad pirms scintilāciju šķidruma pievienošanas homogenizēt ar vorteksu. Cita POA noteikšanas metode ir sadedzināšana skābekļa pārākumā, izmantojot parauga oksidētāju. Skaitīšanai noteikti jāizmanto iekšējie standarti, un var būt javeic dzēšanas korekcijas, pievienojot iekšējo standartu katram atsevišķajam paraugam.
14CO2 tiešā noteikšana
Ja 14CO2 izdalīšanos mēra tieši, tas ir jādara, sakomplektējot testa sākumā vairāk kolbu, un katrā mērīšanas punktā izlietojot visu testa kolbu saturu, ko paskābina līdz pH 2–3 un uztverot 14CO2 iekšējā (kas testa sākumā ievietots katrā testa kolbā) vai ārējā absorbentā. Par absorbējošo vidi var izmantot sārmu (piemēram, 1 N NaOH šķīdumu vai NaOH granulas), etanolamīnu vai tirdzniecībā pieejamus absorbentus uz etanolamīna bāzes. Lai tieši noteiktu 14CO2, kolbas jānoslēdz, piemēram, ar butilkaučuka membrānām.
1a. attēls
Datu aritmētiskas atlikšanas piemērs (atlikuma aktivitāte atkarībā no laika)

1b. attēls
Puslogaritmiskās datu atlikšanas piemērs (atlikuma aktivitātes ln atkarībā no laika)

VI PIELIKUMS
|
C.26. |
LEMNA SP. AUGŠANAS INHIBĒŠANAS TESTS |
1. METODE
Šī metode ir līdzvērtīga OECD TG 221 (2006) (1). Panākta plaša vienošanās starp ES iestādēm, ka Lemna tests ir piemērota alternatīva alģu testam stipri krāsainām vielām (2)(3).
1.1. IEVADS
Šī testēšanas metode paredzēta vielu toksiskās iedarbības novērtēšanai uz Lemna jeb ūdensziedu ģints saldūdens augiem. Tās pamatā ir esošās metodes (4, 5, 6, 7, 8, 9), taču šeit aprakstītās metodes modificētas saskaņā ar jaunākajiem pētījumiem un konsultācijām par vairākiem būtiskiem jautājumiem. Piedāvātā metode validēta starptautiskā starplaboratoriju salīdzinošā testēšanā (10).
Šajā testēšanas metodē aprakstīta toksiskuma noteikšana, izmantojot Lemna gibba un Lemna minor; abas sugas ir plaši pētītas un izmantotas par objektu iepriekš minētajos standartos. Lemna ģints taksonomija ir sarežģīta, jo sastopami daudzveidīgi fenotipi. Toksisko vielu ietekmē var parādīties Lemna ģenētiskā dažādība. Attiecībā uz ģenētisko dažādību pašlaik nav pietiekami daudz datu, lai ieteiktu konkrētu klonu izmantošanai šajā testēšanas metodē. Jāatzīmē, ka testu neveic aksēniskā jeb sterilā kultūrā, taču testa norises laikā zināmos posmos veic pasākumus, lai kontaminācija ar citiem organismiem būtu minimāla.
Sniegta informācija par testēšanas norisi gan ar šķīduma atjaunošanu (pusstatiskā metode un caurplūdes metode), gan arī bez šķīduma atjaunošanas (statiskā metode). Atkarībā no testēšanas mērķiem un reglamentējošām prasībām ieteicams apsvērt pusstatiskās metodes un caurplūdes metodes lietošanu, piemēram, vielām, kas ātri izdalās no šķīduma iztvaikošanas, fotoķīmiskās sadalīšanās, izgulsnēšanās vai bioloģiskās noārdīšanās rezultātā. Papildu norādījumi sniegti literatūrā (11).
1.2. DEFINĪCIJAS
Šajā testēšanas metodē lietotas turpmāk dotās definīcijas un saīsinājumi.
Biomasa. Populācijas dzīvās vielas sausnas masa. Šajā testā parasti biomasu aizvieto ar tādu parametru mērījumiem kā ūdensziedu plātnīšu skaits vai plātnīšu zonas platība; termins “biomasa” attiecas arī uz šiem aizstājējparametriem.
Hloroze. Ūdensziedu plātnīšu audu dzeltēšana.
Klons. Organisms vai šūna, kas cēlusies no atsevišķa indivīda (īpatņa, eksemplāra) veģetatīvās vairošanās ceļā. Viena un tā paša klona indivīdi tāpēc ir ģenētiski vienādi.
Kolonija. Agregāts, kas veidojas no savstarpēji sasaistītām ūdensziedu mātes un meitas plātnītēm (parasti 2–4). To dažkārt sauc par augu.
ECx Testa vidē izšķīdinātās testējamās vielas koncentrācija, kuras iedarbībā par x % (piemēram, par 50 %) samazinās Lemna augšana noteiktā laika posmā (skaidri norādot, ja ir novirzes no pilna vai normāla testēšanas ilguma). Lai nepārprotami norādītu, ka minētā EC vērtība iegūta no augšanas ātruma vai biomasas iznākuma, saistībā ar augšanas ātrumu jālieto simbols “ErC” un saistībā ar biomasas iznākumu jālieto “EyC”, t. i., vadoties pēc mērāmā mainīgā parametra, piemēram, ErC (plātnīšu skaits).
Caurplūde. Tests, kurā notiek testa šķīdumu nepārtraukta apmaiņa.
Plātnīte. Ūdenszieda atsevišķa struktūrvienība, pēc ārējā izskata lapveidīga. Tā ir ūdenszieda mazākā vienība, kas spējīga vairoties.
Kumpainība. Ūdenszieda plātnītes, kas izskatās kumpainas vai uzpūtušās.
Augšana. Mainīgā lieluma mērāmās vērtības palielināšanās, piemēram, ūdensziedu plātnīšu skaita, sausnas, dabīgi mitrās masas vai plātnīšu zonas palielināšanās testa periodā.
Augšanas ātrums (vidējais īpatnējais augšanas ātrums). Logaritmiskais biomasas pieaugums iedarbības periodā.
Zemākā novērojamās ietekmes koncentrācija (LOEC). Mazākā pārbaudītā koncentrācija, pie kuras novērota statistiski nozīmīga vielas kavējošā ietekme uz augšanu (pie p < 0,05) salīdzinājumā ar kontroli noteiktā iedarbības laikā. Tomēr visām testa koncentrācijām, kas pārsniedz LOEC, jāuzrāda kaitīga iedarbība, kura ir vienāda vai lielāka par to, kas novērojama pie LOEC. Ja ir neiespējami nodrošināt šos abus nosacījumus, jāsniedz izsmeļošs izskaidrojums, kāpēc šāds LOEC (un tādējādi NOEC) izvēlēts.
Mērāmie parametri jeb mainīgie lielumi. Parametri, kas tiek mērīti, lai izteiktu testēšanas beigu rezultātu ar vienu vai vairākiem citiem atšķirīgiem parametriem. Šajā metodē mērāmie parametri ir ūdensziedu plātnīšu skaits, plātnīšu zonas platība, dabīgi mitrā masa un sausna.
Monokultūra. Vienas sugas augu kultūra.
Nekroze. Nedzīvi (t. i., balti vai ūdenī izmirkuši) plātnīšu audi.
Nenovērojamas ietekmes koncentrācija (NOEC). Testa koncentrācija, kuras skaitliskā vērtība ir nākamā zemākā tieši zem LOEC.
Fenotips. Organisma morfoloģisko un fizioloģisko pazīmju kopums, ko nosaka tā gēnu un vides savstarpējā mijiedarbība.
Iegūtie parametri jeb mainīgie lielumi. Toksiskuma noteikšanas parametri, kas atvasināti no mērāmiem parametriem un raksturo biomasu ar dažādu aprēķina metožu izmantojumu. Šajā metodē iegūtie parametri ir augšanas ātrums un biomasas iznākums, kas atvasināti no tādiem mērāmiem parametriem kā ūdensziedu plātnīšu skaits, plātnīšu zonas platība, dabīgi mitrā masa un sausna.
Pusstatiskais tests. Tests, kurā testa šķīdumu periodiski maina ar noteiktu regularitāti testa gaitā.
Statiskais tests. Testa metode, kurā šķīdumu testa gaitā nemaina.
Testa beigu rezultāts. Galvenais faktors, kas mainās testējamās vielas ietekmē salīdzinājumā ar kontroli un ir testēšanas mērķis. Šajā metodē testa beigu rezultāts ir augšanas kavēšana, ko var izteikt ar dažādiem iegūtiem raksturlielumiem, kas pamatoti ar vienu vai vairākiem mērāmiem parametriem.
Testa barotne. Pilnvērtīga sintētiskā barotne testa augu kultivēšanai, kurai pievienota testējamā viela. Testējamā viela parasti ir izšķīdināta testa barotnē.
Iznākums. Mērāmā parametra vērtība, kas raksturo biomasas daudzumu iedarbības perioda beigās, no kura atņemts attiecīgā parametra vērtība iedarbības perioda sākumā.
1.3. METODES PRINCIPS
Eksponenciāli augošām Lemna ģints monokultūrām pievieno testējamo vielu dažādās koncentrācijās un kultivē septiņas dienas. Šī testa mērķis ir kvantitatīvi noteikt testējamās vielas ietekmi uz augu veģetatīvo augšanu konkrētā periodā, izvērtējot izvēlētos mērāmos parametrus. Ūdensziedu plātnīšu skaits ir primārais mērāmais parametrs. Jāmēra vēl vismaz viens cits parametrs (kopējā plātnīšu zonas platība, dabīgi mitrā masa vai sausna), tāpēc ka dažas vielas citus mērāmos parametrus var ietekmēt vairāk nekā plātnīšu skaitu. Lai kvantitatīvi noteiktu testējamās vielas ietekmi, augšanu testa šķīdumos salīdzina ar augšanu kontrolšķīdumos un atrod koncentrāciju, kas izraisa noteiktu x % augšanas kavēšanu (piemēram, 50 %), ko izsaka kā ECx (piemēram, EC50).
Testa beigu rezultāts ir augšanas kavēšana, kas izteikta kā mērāmā parametra (vidējā īpatnējā augšanas ātruma) logaritmiskais pieaugums testējamās vielas iedarbības jeb iedarbības periodā. No vidējā īpatnējā augšanas ātruma skaitliskajām vērtībām, ko iegūst testa šķīdumu rindā, atrod koncentrāciju, kas izraisa noteiktu x % augšanas kavēšanu (piemēram, 50 %), ko izsaka kā ErCx (piemēram, ErC50).
Papildu parametrs, ko izmanto šajā testa metodē, ir biomasas iznākums, kas nepieciešams dažās valstīs atbilstoši īpašām normatīvām prasībām. Tas definēts kā mērāmais parametrs iedarbības perioda beigās, no kura atņemts attiecīgs iedarbības perioda sākumā izmērīts parametrs. No biomasas iznākuma skaitliskajām vērtībām, ko iegūst testa šķīdumu rindā, atrod koncentrāciju, kas izraisa noteiktu x % biomasas iznākuma samazināšanos (piemēram, 50 %), ko izsaka kā EyCx (piemēram, EyC50).
Turklāt statistiski jānosaka mazākā novērojamās iedarbības koncentrācija (LOEC) un nenovērojamas iedarbības koncentrācija (NOEC).
1.4. INFORMĀCIJA PAR TESTĒJAMO VIELU
Jābūt pieejamai pietiekami jutīgai analīzes metodei vielas kvantitatīvai noteikšanai testa barotnē.
Nosakot testēšanas apstākļus, var noderēt informācija par testējamo vielu – struktūrformula, tīrības pakāpe, stabilitāte ūdenī un gaismā, pKa, Kow, tvaika spiediens un bioloģiskās noārdīšanās spēja. Šķīdību ūdenī un tvaika spiedienu var izmantot, lai aprēķinātu Henrija konstanti un novērtētu, vai testa periodā iespējami būtiski testējamās vielas zudumi. Tā iespējams gūt norādījumus, vai jāveic īpaši pasākumi šādu zudumu kontrolei. Ja informācija par testējamās vielas šķīdību un stabilitāti ir neprecīza, ieteicams to novērtēt testa apstākļos, t. i., ar barotni, temperatūru, apgaismojuma režīmu, ko izmantos testa laikā.
Ja īpaši svarīga ir testa vides pH kontrole, piemēram, ja testējamie metāli vai vielas ir hidrolītiski nestabilas, barotnei ieteicams pievienot buferšķīdumu (sk. 1.7.4. iedaļas pirmo rindkopu). Papildu norādījumi par testiem ar tādām vielām, kas grūti testējamas to fizikāli ķīmisko īpašību dēļ, atrodami (11).
1.5. STANDARTVIELA
Standartvielu(-as), piemēram, 3,5-dihlorfenolu, ko lieto starptautiskā starplaboratoriju salīdzinošā testēšanā (10), var izmantot par testēšanas procedūras pārbaudes līdzekli. Ieteicams testēt standartvielu vismaz divas reizes gadā vai arī, ja testēšana notiek retāk, veikt to paralēli ar testējamās vielas toksiskuma noteikšanu.
1.6. TESTĒŠANAS REZULTĀTU VALIDĀCIJA
Lai testēšanas rezultātus atzītu par derīgiem, plātnīšu skaita divkāršošanās laikam kontrolē jābūt mazākam par 2,5 dienām (60 h), kas atbilst aptuveni septiņkārtīgam pieaugumam septiņās dienās un vidējam īpatnējam augšanas ātrumam 0,275 d–1. Izmantojot šajā testēšanas metodē aprakstītās barotnes un pārbaudes apstākļus, šo kritēriju var sasniegt statiskā testa režīmā (8). Tāpat sagaidāms, ka šo kritēriju var sasniegt, izmantojot testā pusstatisko metodi un caurplūdes metodi. Divkāršošanās laika aprēķināšana norādīta 2.1. iedaļā.
1.7. METODES APRAKSTS
1.7.1. Aparatūra
Visām iekārtām, kas ir saskarē ar testa vidi, jābūt izgatavotām no stikla vai cita ķīmiski inerta materiāla. Stikla traukiem, kas paredzēti kultivēšanai un testēšanai, jāattīra no ķīmiska piesārņojuma, kas varētu iekļūt testa vidē, un tiem jābūt steriliem. Testa traukiem jābūt pietiekami lieliem, lai kolonijas kontroles traukos varētu brīvi augt, testa beigās nepārklājoties cita citai. Nav būtiski, ja saknītes pieskaras testa trauka dibenam, tomēr visiem testa traukiem ieteicamais minimālais dziļums ir 20 mm un minimālais tilpums 100 ml. Testa trauku izvēlei nav citas būtiskas nozīmes, ja vien tiek izpildītas minētās prasības. Par piemērotām atzītas arī atbilstoša izmēra stikla vārglāzes, kristalizatori vai Petri trauki no stikla. Testa traukiem jābūt apsegtiem, lai līdz minimumam samazinātu iztvaikošanu un nejauša piesārņojuma iespēju, vienlaikus nodrošinot nepieciešamo gaisa apmaiņu. Piemēroti ir tādi testa trauki un it īpaši to pārsegums, kas nenoēno augus vai nerada gaismas spektra izmaiņas.
Kultūras un testa traukus nedrīkst izvietot vienkopu. Šī prasība labāk izpildāma, izmantojot atsevišķas audzēšanas kameras, inkubatorus vai skapjus. Apgaismojums un temperatūra jākontrolē un jāuztur nemainīgā līmenī (sk. 1.7.8. iedaļu).
1.7.2. Testa organismi
Šajā testā izmantojamie organismi ir Lemna gibba vai Lemna minor. Toksiskuma noteikšanai izmantojamo ūdensziedu sugu īss apraksts dots 1. pielikumā. Augu materiāls jāsaņem no kultūru kolekcijas, no citas laboratorijas vai jāievāc lauka apstākļos. Lauka apstākļos ievākti augi vismaz 8 nedēļas pirms izmantošanas jāuztur kultūrā tieši tādā barotnē, kādu izmanto testēšanai. Vietām uz lauka, kur ievāc sākotnējo kultūras sējmateriālu, jābūt bez redzamiem piesārņojuma avotiem. Ja augu materiāls saņemts no citas laboratorijas vai no kultūru kolekcijas, tas jāuztur līdzīgi vismaz 3 nedēļas. Visos gadījumos jānorāda testā izmantojamā augu materiāla izcelsmes avots, suga un klons (ja zināms).
Jāizmanto monokultūras, kas redzami nav piesārņotas ar aļģēm un vienšūņiem. Veselīgi L. minor augi sastāv no kolonijām, ko veido 2–5 plātnītes, bet veselīgā L. gibba kolonijā var būt pat 7 plātnītes.
Testā izmantojamo augu kvalitāte un viendabīgums būtiski ietekmē testa rezultātus, tāpēc tie jāizraugās rūpīgi. Jāizmanto jauni, ātri augoši augi bez redzamiem bojājumiem vai krāsas izmaiņām (hlorozes). Labas kvalitātes kultūras pazīme ir daudz koloniju, kas sastāv no vismaz 2 plātnītēm. Liels atsevišķu plātnīšu skaits liecina par vides stresu, piemēram, barības vielu nepietiekamību, un testēšanai sējmateriālu no šādām augu kultūrām izmantot nedrīkst.
1.7.3. Audzēšana
Lai manipulācijas kultūras uzturēšanai varētu veikt retāk (piemētam, ja Lemna testi tuvākajā laikā nav plānoti), kultūras glabā samazināta apgaismojuma apstākļos pazeminātā temperatūrā (4–10 °C). Sīkāka informācija par kultūru uzturēšanu dota 2. pielikumā. Ja novērojamas aļģu vai citu organismu kontaminācijas pazīmes, jāņem Lemna plātnīšu izlases paraugs, jāveic tā virsmas sterilizācija un pēc tam jāpārnes svaigā barotnē (sk. 2. pielikumu). Šādā gadījumā atlikusī kontaminētā kultūra jālikvidē.
Vismaz 7 dienas pirms testēšanas sākuma pietiekamu daudzumu koloniju aseptiski pārvieto svaigā barotnē un 7–10 dienas kultivē testa apstākļos.
1.7.4. Testa barotne
Turpmāk minētas vairākas barotnes, kas ieteicamas Lemna minor un Lemna gibba kultivēšanai. Rūpīgi jāapsver pH buferšķīduma pievienošana barotnēm (4-morfolīnpropānsulfonskābe; CAS Nr.1132–61–2; EINECS Nr.214–478–5 Lemna gibba barotnei un NaHCO3 Lemna minor barotnei), ja iespējams, ka tas varētu reaģēt ar testējamo vielu un ietekmēt tās toksiskumu. Var izmantot arī Steinberga barotni (12), ja tā atbilst ticamības kritērijiem.
Arī modificēta Zviedrijas standartos (SIS) minētā Lemna barotne ieteicama kultivēšanai un testēšanai ar L. minor. Šīs barotnes sastāvs dots 3. pielikumā.
Barotne 20X – AAP, kas aprakstīta 3. pielikumā, ieteicama kultivēšanai un pārbaudēm ar L. gibba.
Steinberga barotne, kas aprakstīta 3. pielikumā, arī ir piemērota L. minor, un ja tā atbilst derīguma kritērijiem, izmantojama arī L. gibba kultivēšanai.
1.7.5. Testa šķīdumi
Testa šķīdumus parasti gatavo, atšķaidot pamatšķīdumu. Testējamās vielas pamatšķīdumu parasti gatavo, izšķīdinot vielu barotnē.
Lielākā testējamā koncentrācija parasti nav augstāka par vielas šķīdību ūdenī testa apstākļos. Jānorāda, ka Lemna ūdensziedi peld barotnes virspusē un uz tiem var iedarboties vielas, kas uzkrājas ūdens un gaisa saskares zonā (piemēram, ūdenī slikti šķīstošas vai hidrofobas vielas, vai virsmaktīvās vielas). Tādos apstākļos iedarbību var radīt viela, kura atrodas ārpus šķīduma, un atkarībā no testējamās vielas īpašībām testa koncentrācijas var pārsniegt tās šķīdību ūdenī. No slikti šķīstošām testējamajām vielām var būt jāgatavo koncentrēti pamatšķīdumi vai dispersijas, izmantojot organiskos šķīdinātājus vai disperģētājvielas, lai atvieglotu vielas disperģēšanu un šķīdināšanu, dodot iespējas paaugstināt testējamās vielas dozēšanas precizitāti testa barotnē. Tomēr jādara viss iespējamais, lai izvairītos no šādu materiālu lietošanas. Šīs palīgvielas – šķīdinātāji vai disperģētājvielas – nedrīkst būt fitotoksiskas. Piemēram, parasti izmantojamie šķīdinātāji, kas nav fitotoksiski koncentrācijā virs 100 µl/l, ir acetons un dimetilformamīds. Ja lieto šķīdinātājus vai disperģētājvielas, jānorāda šo vielu gala koncentrācija un tā jāuztur minimālā līmenī (≤ 100 µl/l), un visos variantos – testējamās vielas un kontroles traukos – šķīdinātājam vai disperģētājvielai jābūt vienādā koncentrācijā. Papildu norādījumi par disperģētājvielu lietošanu atrodami literatūrā (11).
1.7.6. Testa un kontroles grupas
Piemērotu testējamo koncentrāciju izvēlei ieteicams iegūt priekšzināšanas par testējamās vielas toksiskumu Lemna ūdensziediem, piemēram, veicot orientējošu izmēģinājumu vielas koncentrāciju diapazona noteikšanai. Galīgajā toksiskuma testā parasti jābūt vismaz piecām testējamo koncentrāciju variantiem sērijā, kas palielinās ģeometriskā progresijā. Vēlams, lai sadalījuma koeficients starp testa koncentrācijām nepārsniegtu 3,2; lielāku vērtību var izmantot tad, ja koncentrācijas–iedarbības līkne ir lēzena. Ja testē mazāk nekā piecas koncentrācijas, tas ir jāpamato. Katram testējamās koncentrācijas variantam jābūt vismaz trijos atkārtojumos.
Nosakot testējamo koncentrāciju diapazonu (orientējošam izmēģinājumam un/vai galīgajam toksiskuma testam), jāņem vērā šādi apsvērumi.
|
— |
ECx, noteikšanā testa koncentrācijām jāietver ECx, vērtība, lai nodrošinātu atbilstošu ticamību. Piemēram, nosakot EC50, augstākajai testētajai koncentrācijai jābūt lielākai par EC50 vērtību. Ja EC50 vērtība atrodas ārpus testa koncentrāciju diapazona, attiecīgie ticamības intervāli ir lieli, un nebūs iespējama modeļa statistiskā derīguma korekta novērtēšana. |
|
— |
Ja mērķis ir noteikt LOEC/NOEC, zemākajai testa koncentrācijai jābūt pietiekami mazai, tā, lai augšana nebūtu ievērojami lēnāka kā kontrolē. Pie tam augstākajai testa koncentrācijai jābūt pietiekami lielai, tā, lai augšana būtu ievērojami lēnāka nekā kontrolē. Ja tā nav, testēšana jāatkārto, izmantojot citādu koncentrāciju diapazonu (ja vien lielākā koncentrācija nav tuvu šķīdības robežai vai maksimāli pieļaujamajai robežkoncentrācijai, piemēram, 100 mg/l). |
Katram testam jāiekļauj kontrole, kurā ir tā pati barotne, vienāds plātnīšu un koloniju skaits, vides apstākļi, manipulācijas kā testa traukos, bet bez testējamās vielas. Ja lieto palīgšķīdinātāju vai disperģētājvielu, kontrolei papildus jāpievieno tas pats šķīdinātājs/disperģētājviela tieši tādā koncentrācijā kā testa traukos. Atkārtojumu skaitam kontroles traukiem (arī traukiem ar šķīdinātāju, ja to lieto) jābūt vismaz tādam pašam kā trauku skaitam katrai testējamās koncentrācijas variantam, ideālā gadījumā divreiz lielākam par to.
Ja nav nepieciešams noteikt NOEC, eksperimenta plānu var mainīt, palielinot testējamo koncentrāciju skaitu un samazinot katras koncentrācijas atkārtojumu skaitu. Taču kontrolei jābūt vismaz 3 atkārtojumiem.
1.7.7. Iedarbība
Kolonijas, kas sastāv no 2–4 saredzamām plātnītēm, no inokulāta kultūras aseptiskos apstākļos pārsēj testa traukos, sadalot pēc gadījuma principa. Katrā testa traukā jāatrodas pavisam 9–12 plātnītēm. Plātnīšu un koloniju skaitam visos testa traukos jābūt vienādam. Šīs metodes izmantošanas pieredze un starplaboratoriju salīdzinošās testēšanas dati liecina, ka trīs atkārtojumi katram testa traukam, kur sākumā iesētas 9–12 plātnītes, ir pietiekami, lai starp testa traukiem konstatētu augšanas atšķirības pie aptuveni 4–7 % inhibēšanas, kas aprēķināta pēc augšanas ātruma (10–15 %, ja aprēķināta pēc biomasas iznākuma) (10).
Testa trauki inkubatorā jāizvieto pēc gadījuma principa, lai iespējami samazinātu telpiskās atšķirības gaismas intensitātes vai temperatūras ziņā. Nepieciešams arī bloka plānojums vai trauku pārvietošana pēc gadījuma izvēles principa pēc tam, kad izdarīti novērojumi (vai arī trauku pārvietošana jāveic biežāk).
Ja orientējošā izmēģinājumā konstatē, ka testa periodā (7 dienas) testējamās vielas koncentrāciju nav iespējams uzturēt (t. i., izmērītā koncentrācija ir mazāka par 80 % no sākotnējās koncentrācijas), ieteicams izmantot pusstatisko metodi. Šādā gadījumā kolonijas jāiesēj svaigi sagatavotā testēšanas barotnē un kontrolšķīdumos vismaz divas reizes testa laikā (t. i., 3. un 5. dienā). Pārsēšanas biežums svaigā barotnē atkarīgs no testējamās vielas stabilitātes; parasti tā var būt vajadzīga, lai ļoti nestabilām un gaistošām vielām uzturētu iespējami nemainīgu koncentrāciju. Dažkārt var būt jāizmanto caurplūdes metode (11, 13).
Iedarbības modeļi, testējamo vielu izsmidzinot uz auga lapām, šajā testēšanas metodē nav aprakstīti, bet ir atrodami literatūrā (14).
1.7.8. Inkubācijas apstākļi
Pastāvīgas silti vai vēsi baltas dienasgaismas avots, kas nodrošina apgaismojuma intensitāti diapazonā 85–135 μE·m–2·s–1, mērot fotosintēzes aktivitātei atbilstošā spektra daļā (400–700 nm) tādā pašā attālumā no gaismas avota, kādā atrodas Lemna plātnītes (ekvivalents 6 500–10 000 lux). Jebkuras novirzes no izraudzītās apgaismojuma intensitātes testa zonā nedrīkst pārsniegt ± 15 %. Apgaismojuma noteikšanas un mērīšanas metodes, it īpaši sensora veids, var ietekmēt izmērītās vērtības. Par labākiem atzīstami sfēriskie sensori (reaģē uz gaismu visos leņķos virs mērījumu plaknes un zem tās) un “kosinusa” sensori (reaģē uz gaismu visos leņķos virs mērījumu plaknes) salīdzinājumā ar vienvirziena sensoriem, un var iegūt augstākus nolasījumus no šeit aprakstītā veida daudzpunktu gaismas avota.
Temperatūrai testa traukos jābūt 24±2 °C. Kontroles barotnē testēšanas laikā pH nedrīkst mainīties vairāk kā par 1,5 vienībām. Tomēr noviržu dēļ, kas pārsniedz 1,5 vienības, testēšanas rezultāti nav uzskatāmi par nederīgiem, ja tas atbilst derīguma kritērijiem. Papildu uzraudzība pH novirzēm vajadzīga īpašos gadījumos – ja jātestē nestabilas vielas vai metāli. Sīkākus norādījumus sk. literatūrā (11).
1.7.9. Ilgums
Testu beidz 7 dienas pēc augu iesēšanas testa traukos.
1.7.10. Mērījumi un analītiskā noteikšana
Testēšanas sākumā jānosaka un jāreģistrē plātnīšu skaits testa traukos, pārliecinoties, ka tiek uzskaitītas uz āru izvirzītas, skaidri saskatāmas plātnītes. Plātnīšu skaits jānosaka testa sākumā, tad vismaz vienu reizi 3 dienās iedarbības periodā (t. i., vismaz 2 reizes 7 dienu periodā) un testa beigās, uzskaitot gan normālās, gan anomālās plātnītes. Jāievēro augu attīstības izmaiņas, t. i., plātnīšu lielums, ārējais izskats, nekrozes pazīmes, hloroze, kumpainība, koloniju sadalīšanās, peldspējas zudums, kā arī saknīšu garums un izskats. Jānovēro arī barotnes izmaiņu pazīmes (t. i., neizšķīdušas vielas, aļģu augšana testa traukā).
Papildus plātnīšu skaita noteikšanai testēšanas laikā jānovērtē arī testējamās vielas ietekme uz vienu (vai vairākiem) šādiem mērāmajiem parametriem:
|
i) |
kopējā plātnīšu zonas platība; |
|
ii) |
sausna; |
|
iii) |
dabīgi mitrā masa. |
Kopējās plātnīšu zonas platības noteikšanai ir tāda priekšrocība, ka to var noteikt katram testējamā varianta un kontroles traukam testa sākumā, norises gaitā un testa beigās. Sausna vai dabīgi mitrā masa jānosaka reprezentatīvā paraugā testa sākumā no inokulāta kultūras, kuru lietos par sējmateriālu testa sākšanai, kā arī testa beigās augu materiālā no katra testējamā varianta un kontroles trauka. Ja plātnīšu zonas platība netiek mērīta, vēlams noteikt sausnu, nevis dabīgi mitro masu.
Kopējo plātnīšu zonas platību, sausnu un dabīgi mitro masu var noteikt šādi:
|
i) |
Kopējā plātnīšu zonas platība. Kopējo visu koloniju zonas platību var noteikt ar attēlu analīzi. Testa trauka un augu siluetus var fiksēt ar videokameru (t. i., novietojot trauku uz gaismas kameras), un iegūto attēlu digitalizēt. Ja kalibrēšanu veic ar plakanas formas modeļiem, var noteikt kopējo plātnīšu zonas platību testa traukā. Jāraugās, lai nebūtu traucējumu, ko rada testa trauka malas. Alternatīva, bet darbietilpīgāka metode ir fotografēt testa traukus un augus, izgriezt iegūto koloniju siluetu un izmērīt to laukumu, izmantojot lapu virsmas platības analizatoru vai milimetrpapīru. Piemērotas ir arī citas metodes (piemēram, izmantojot papīru, var noteikt papīra masas attiecību starp koloniju silueta laukumu un laukuma vienību). |
|
ii) |
Sausna. No katra testa trauka ievāc visas kolonijas un skalo ar destilētu vai dejonizētu ūdeni. Nosusina, lai atbrīvotos no liekā ūdens un 60 °C temperatūrā žāvē līdz nemainīgai masai. Jāņem arī saknīšu fragmenti. Sausna jānosaka vismaz ar 0,1 mg precizitāti. |
|
iii) |
Dabīgi mitrā masa. Visas kolonijas pārvieto iepriekš nosvērtās polistirola (vai cita inerta materiāla) mēģenēs ar noapaļotu apakšdaļu un sīkām (1 mm) atverēm. Mēģenes 10 minūtes istabas temperatūrā centrifugē ar ātrumu 3 000 apgr./min. Mēģenes ar nosusinātajām kolonijām atkal nosver un aprēķina dabīgi mitro masu, atņemot tukšas mēģenes masu. |
1.7.10.1. Mērījumu un analītiskās noteikšanas biežums
Izmantojot statisko metodi, pH jāmēra katrā testēšanas traukā testa sākumā un beigās. Pusstatiskās metodes gadījumā pH jāmēra katrā “svaigā” testa šķīduma porcijā pirms šķīduma nomaiņas, kā arī attiecīgajās “izlietoto” šķīdumu porcijās.
Apgaismojuma intensitāte jāmēra audzēšanas kamerā, inkubatorā vai skapī tādā pašā attālumā no gaismas avota, kādā atrodas Lemna plātnītes. Mērījumi jāveic vismaz vienreiz testēšanas laikā. Barotnes temperatūras mērīšanu veic aizvietotājtraukā, kas novietots identiskos apstākļos audzēšanas kamerā, inkubatorā vai skapī, un tā jāmēra vismaz vienreiz dienā.
Testa laikā testējamās vielas koncentrāciju nosaka atbilstošos intervālos. Statiskajos testos minimālā prasība ir noteikt koncentrāciju testēšanas sākumā un beigās.
Pusstatiskajos testos, kad sagaidāms, ka testējamās vielas koncentrācija saglabāsies ± 20 % robežās no nominālās koncentrācijas, jāanalizē visi no jauna pagatavotie testa šķīdumi, kā arī tie paši šķīdumi pirms katras ievadīšanas testa traukos (sk. 1.7.7. iedaļas trešo punktu). Tomēr tādos testos, kur testējamās vielas izmērītā sākotnējā koncentrācija nav ± 20 % no nominālās koncentrācijas, bet pietiekami pierādījumi liecina, ka sākotnējā koncentrācija ir atkārtojama un stabila (t. i., 80–120 % no sākotnējās koncentrācijas), ķīmiskās analīzes var veikt tikai pie pašām lielākajām un mazākajām testējamajām koncentrācijām. Visos gadījumos testējamās vielas koncentrācija jānosaka pirms svaiga šķīduma pievienošanas – tikai no viena atkārtojuma (trauka) katrai koncentrācijai (var apvienot paraugus no visiem atkārtojumiem).
Ja izmanto caurplūdes metodi, paraugus ņem līdzīgā režīmā, kā aprakstīts pusstatiskās metodes gadījumā, tajā skaitā ņem analīzes testēšanas sākumā, vidusposmā un beigās; veikt mērījumus “izlietotajos” šķīdumos nav lietderīgi. Šajā testā šķīdinātāja un testējamās vielas vai testējamās vielas pamatšķīduma plūsmas ātrums jāpārbauda katru dienu.
Ja ir liecības, ka testējamās vielas koncentrācija testa gaitā ir pietiekami nemainīga ± 20 % robežās no nominālās vai izmērītās sākotnējās koncentrācijas, rezultātu analīzi var veikt, pamatojoties uz sākotnējām nominālām vai izmērītām vērtībām. Ja novirzes no nominālās vai izmērītās sākotnējās koncentrācijas ir lielākas par ± 20 %, rezultātu analīzei jāpamatojas uz vidējo ģeometrisko koncentrāciju iedarbības periodā vai arī uz modeļiem, kas apraksta testējamās vielas koncentrācijas samazināšanos (11).
1.7.11. Robežkoncentrācijas tests
Atsevišķos gadījumos, piemēram, ja orientējošā izmēģinājumā redzams, ka testējamā viela nav toksiska koncentrācijā līdz 100 mg/l vai līdz tās šķīdības robežai testa barotnē (atkarībā no tā, kura ir mazāka), var veikt robežkoncentrācijas testu, kurā salīdzina kontroles grupas un apstrādes grupas reakciju (100 mg/l vai koncentrācijā, kas vienāda ar šķīdību). Noteikti ieteicams to apstiprināt, analizējot koncentrācijas, ar kādām apstrādā paraugus. Iepriekš aprakstītie testa apstākļi un derīguma kritēriji attiecas uz robežkoncentrācijas testu, izņemot to, ka katras koncentrācijas atkārtojumu skaits jādubulto. Augšanu kontroles grupā un apstrādes grupā var analizēt, izmantojot statistikas metodes, piemēram, Stjūdenta kritēriju.
2. DATI UN TESTĒŠANAS PĀRSKATS
2.1. DIVKĀRŠOŠANĀS LAIKS
Lai noteiktu ūdensziedu plātnīšu skaita divkāršošanās laiku (Td) un pētījuma atbilstību šim derīguma kritērijam (1.6. iedaļa), aprēķiniem ar kontroles traukos iegūtiem datiem izmanto šādu formulu:
Td = ln 2/μ
kur µ ir vidējais īpatnējais augšanas ātrums, ko nosaka, kā aprakstīts 2.2.1. iedaļas pirmajā un otrajā rindkopā.
2.2. ATBILDES REAKCIJAS MAINĪGIE RAKSTURLIELUMI
Testēšanas mērķis ir noteikt testējamās vielas ietekmi uz Lemna veģetatīvo augšanu. Šajā testēšanas metodē aprakstīti divi raksturlielumi, jo dalībvalstīm ir dažādas preferences un reglamentējošās prasības. Lai testa rezultāti būtu pieņemami visās dalībvalstīs, vielu iedarbību var vērtēt pēc abiem turpmāk a) un b) apakšpunktā minētajiem parametriem.
|
a) |
Vidējais īpatnējais augšanas ātrums. Šis atbildes reakcijas rādītājs aprēķināts, pamatojoties uz plātnīšu skaita logaritma izmaiņām un pamatojoties uz vēl cita mērāmā parametra (kopējās plātnīšu zonas platības, dabīgi mitrās masas vai sausnas) logaritma izmaiņām laikā (izteikts dienās) kontrolē un katrā testējamās koncentrācijas variantā. To dažreiz apzīmē par relatīvo augšanas ātrumu (15). |
|
b) |
Biomasas iznākums. Šis atbildes reakcijas rādītājs aprēķināts, pamatojoties uz plātnīšu skaita izmaiņām un uz vēl kāda cita mērāma parametra (kopējās plātnīšu zonas platības, dabīgi mitrās masas vai sausnas) izmaiņām kontrolēs un katrā apstrādes varianta grupā periodā līdz testēšanas beigām. |
Jāatzīmē, ka toksiskuma rādītāji, kas aprēķināti, izmantojot šos abus atbildes reakcijas rādītājus, nav savstarpēji salīdzināmi, un šī atšķirība jāapzinās, izmantojot testa rezultātus. Ja šīs testa metodes noteikumi ir ievēroti, matemātiskās pieejas atšķirību dēļ ECx vērtība, kas noteikta pēc vidējā īpatnējā augšanas ātruma (ErCx), parasti ir augstāka salīdzinājumā ar rezultātiem, kas iegūti, pamatojoties uz biomasas iznākumu (EyCx). To nedrīkst interpretēt kā šo abu iegūto parametru jutības atšķirību, gluži vienkārši, šie lielumi matemātiski ir dažādi. Vidējā īpatnējā augšanas ātruma koncepcijas pamatā ir ūdensziedu kultūras neierobežota eksponenciāla augšana, toksiskumu nosakot pēc ietekmes uz augšanas ātrumu neatkarīgi no kontroles īpatnējā augšanas ātruma absolūtā lieluma, koncentrācijas-iedarbības līknes slīpuma vai no testa ilguma. Pretstatā tam rezultāti, kas balstās uz biomasas iznākumu kā iegūto mainīgo atbildes reakcijas rādītāju, ir atkarīgi no visiem citiem minētajiem parametriem. ErCx ir atkarīgs no konkrētās testā izmantojamās ūdensziedu sugas īpatnējā augšanas ātruma un no maksimālā īpatnējā augšanas ātruma, kas dažādām sugām un pat dažādiem kloniem var būt aršķirīgs. Pēc šā rādītāja nevar savstarpēji salīdzināt ūdensziedu sugu un pat dažādu klonu jutību pret toksiskām vielām. Kaut gan no zinātniskā viedokļa labāk ir toksiskuma noteikšanai izmantot vidējo īpatnējo augšanas ātrumu, šajā testēšanas metodē iekļauta arī toksiskuma noteikšana, kas pamatojas uz biomasas iznākumu, ievērojot pašlaik vairākās valstīs spēkā esošās normatīvās prasības.
Toksiskuma noteikšanai jāpamatojas uz plātnīšu skaitu un vēl vismaz vienu citu mērāmo parametru (plātnīšu zonas kopējā platība, sausna vai dabīgi mitrā masa), tā kā dažas vielas var ietekmēt citus mērāmos lielumus vairāk nekā plātnīšu skaitu. Šo iedarbību nevar noteikt, aprēķinot tikai plātnīšu skaitu.
Plātnīšu skaits, kā arī jebkurš cits iegūtais mērāmais parametrs, t. i., plātnīšu zonas kopējā platība, sausna vai dabīgi mitrā masa, jāapkopo tabulā kopā ar testējamās vielas koncentrāciju katrā mērījumu termiņā. Turpmāko datu analīzei, piemēram, lai noteiktu LOEC, NOEC vai ECx, jāpamatojas uz katrā atsevišķā atkārtojumā iegūtām vērtībām, nevis katram nosakāmajam variantam aprēķināto vidējo vērtību.
2.2.1. Vidējais īpatnējais augšanas ātrums
Vidējo īpatnējo augšanas ātrumu noteiktā laika posmā aprēķina kā plātnīšu skaita un vēl cita mērāmā lieluma (kopējās plātnīšu zonas platības, dabīgi mitrās masas vai sausnas) logaritmisko pieaugumu katram atkārtojumam kontroles un apstrādes variantu grupās, izmantojot formulu:

kur:
|
— |
μi–j: |
vidējais īpatnējais augšanas ātrums laika posmā no i līdz j |
|
— |
Ni: |
mērāmais lielums testa vai kontroltraukā laika punktā i |
|
— |
Nj: |
mērāmais lielums testējamās koncentrācijas vai kontroles traukā laika punktā j |
|
— |
t: |
laika posms no i līdz j |
Katra apstrādes varianta atkārtojumu grupai un kontroles grupai aprēķina augšanas ātruma vidējo vērtību un dispersiju.
Vidējais īpatnējais augšanas ātrums jāaprēķina visam testa periodam (laika punkts “i” ir testa sākums, un laika punkts “j” ir testa beigas). Katrai apstrādes varianta atkārtojumu grupai un kontroles grupai aprēķina vidējā īpatnējā augšanas ātruma vidējo vērtību un dispersiju. Bez tam jānosaka augšanas ātrums pa posmiem, lai novērtētu testējamās vielas iedarbības parādīšanos apstrādes periodā (piemēram, pārbaudot logaritmiskās augšanas līknes). Augšanas līknes ir noteikti jāanalizē, jo vidējā augšanas ātruma būtiskas atšķirības no augšanas ātruma starpposmos liecina par novirzi no konstantas eksponenciālas augšanas. Šajā gadījumā konservatīva pieeja būtu salīdzināt apstrādāto kultūru īpatnējo augšanas ātrumu maksimālās kavēšanas periodā ar kontroles kultūrām tajā pašā laika periodā.
Procentuālo augšanas ātruma kavēšanu (Lr) katrai testējamajai koncentrācijai (apstrādes grupai) aprēķina pēc šādas formulas:

kur:
|
— |
% Ir: |
vidējā īpatnējā augšanas ātruma procentuālās kavēšanas vērtība |
|
— |
μC: |
μ vidējā vērtība kontrolē |
|
— |
μT: |
μ vidējā vērtība apstrādes grupā. |
2.2.2. Biomasas iznākums
Ietekmi uz biomasas iznākumu nosaka, pamatojoties uz diviem mērāmajiem parametriem, – plātnīšu skaitu un vēl kādu citu mērāmo lielumu (kopējo plātnīšu zonas platību, dabīgi mitro masu vai sausnu) katrā testa traukā testēšanas sākumā un beigās. Sākotnējās biomasas sausnu vai dabīgi mitro masu nosaka, ņemot plātnīšu paraugus no tās pašas partijas, ko izmanto sēšanai testa traukos (sk. 1.7.3. iedaļas otro rindkopu). Katrai apstrādes grupai un kontroles grupai aprēķina vidējā īpatnējā augšanas ātruma vidējo vērtību un dispersiju. Vidējo biomasas iznākuma kavēšanas procentuālo vērtību (% Iy) katrai apstrādes grupai aprēķina šādi:

kur:
|
— |
% Iy: |
biomasas iznākuma samazināšanās procentuālā vērtība |
|
— |
bC: |
kontroles grupas biomasa testa beigās, no kuras atņemta biomasa testa sākumā |
|
— |
bT: |
apstrādes grupas biomasa testa beigās, no kuras atņemta biomasa testa sākumā |
2.2.3. Koncentrācijas-iedarbības līkņu konstruēšana
Koncentrācijas-iedarbības līknes konstruē, saistot atbildes reakcijas rādītāju vidējo inhibēšanu procentos (Ir un Iy aprēķina, kā noteikts 2.2.1. iedaļas pēdējā rindkopā vai 2.2.2. iedaļā) atkarībā no testējamās vielas koncentrācijas logaritma.
2.2.4. ECx noteikšana
ECx (piemēram, EC50) aprēķina pēc vidējā īpatnējā augšanas ātruma (ErCx) un biomasas iznākuma (EyCx), kurus savukārt nosaka pēc plātnīšu skaita un izmantojot vēl kādu citu mērāmo lielumu (kopējo plātnīšu zonas platību, dabīgi mitro masu vai sausnu). Tas ir tāpēc, ka ir testējamās vielas, kas atšķirīgi ietekmē plātnīšu skaitu un citus mērāmos parametrus. Vēlamie toksiskuma rādītāji tāpēc ir četras dažādas ECx vērtības katram inhibēšanas līmenim x: ErCx (plātnīšu skaits); ErCx (kopējā plātnīšu zonas platība, dabīgi mitrā masa vai sausna); EyCx (plātnīšu skaits); un EyCx (kopējā plātnīšu zonas platība, dabīgi mitrā masa vai sausna).
2.3. STATISTIKAS PROCEDŪRAS
Datu statistiskās analīzes mērķis ir ar regresijas analīzes palīdzību iegūt koncentrācijas-iedarbības kvantitatīvās attiecības. Var izmantot svērto lineāro regresiju pēc tam, kad veikta iegūto datu lineārā transformācija, piemēram, probit vai logit, vai arī Weibull vienībās (16), taču vēlams izmantot augstākas kārtas regresiju, kas ir piemērotāka gadījumos ar nenovēršamām datu kļūdām un novirzēm no varbūtību vienmērīga sadalījuma. Tuvojoties nulles inhibēšanai vai pilnīgai inhibēšanai, transformācija šādas novirzes var palielināt, traucējot analīzi (16). Jānorāda, ka analīzes standarta metodes, kurās izmanto probit, logit, vai Weibull pārveidojumus, paredzētas datiem, ko izsaka ar galīgu skaitli (piemēram, mirstība vai izdzīvotība) un tās jāmodificē, lai pielāgotu augšanas ātruma vai biomasas iznākuma datiem. Īpašas procedūras ECx vērtību noteikšanai datiem, kas ir nepārtraukti gadījuma lielumi, aprakstītas literatūrā (17, 18, 19).
ECx vērtību aprēķiniem konkrētos punktos katram analizējamajam atbildes reakcijas rādītājam izmanto koncentrācijas-iedarbības sakarības kvantitatīvās attiecības. Ja iespējams, jānosaka katra aprēķinātā lieluma 95 % ticamības robežas. Iegūto datu atbilstība regresijas modelim jāpārbauda grafiski vai statistiski. Regresijas analīze jāveic, izmantojot katrā atsevišķā atkārtojumā iegūtās vērtības, nevis apstrādes variantu grupu vidējās vērtības.
Gadījumos, kad pieejamie regresijas modeļi/metodes nav piemēroti iegūtajiem datiem, EC50 vērtības var aprēķināt un ticamības robežas noteikt arī, izmantojot lineāro interpolāciju ar bootstrapping (20) – statistisku metodi datu kopas pārbaudei, izveidojot to pseidoatkārtojumus pēc gadījuma izvēles principa.
Lai noteiktu LOEC un līdz ar to NOEC, jāsalīdzina apstrādes variantu vidējās vērtības, izmantojot dispersijas analīzi. Katras koncentrācijas vidējais lielums jāsalīdzina ar kontroles vidējo lielumu, izmantojot atbilstošu multiplās salīdzināšanas vai trenda testa metodi. Noderīgi var būt Daneta (Dunnett) vai Viljamsa (Williams) testi (21, 22, 23, 24). Jāpārbauda, vai ir spēkā pieņēmums par dispersijas homogenitāti, kas ir dispersijas analīzes pamatā. Šo pārbaudi var veikt grafiski vai formālā testā (25). Piemēroti testi ir Levena (Levene) vai Bārtleta (Bartlett) testi. Ja nav izpildīts pieņēmums attiecībā uz dispersijas homogenitāti, to dažreiz var labot, veicot datu logaritmisku transformāciju. Ja dispersijas heterogenitāte ir pārlieku liela un to nevar koriģēt ar transformāciju, jāveic analīze ar tādām metodēm kā pamazinošā soļa Jonkēra (Jonkheere) trenda tests. Papildu norādījumi par NOEC noteikšanu sniegti literatūrā (19).
Ar jaunākajām zinātnes atziņām pamatots ieteikums atteikties no NOEC koncepcijas, tās vietā izmantojot ECx, ko aprēķina pēc attiecīgajiiem regresijas vienādojumiem. Ieteicamākā x vērtība šim Lemna testam nav konstatēta. Taču noskaidrots, ka ir piemērots 10–20 % diapazons (atkarībā no izmantojamā atbildes reakcijas rādītāja), un vēlams norādīt gan EC10, gan EC20.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jābūt šādai informācijai:
Testējamā viela:
|
— |
fizikālās īpašības un fizikāli ķīmiskās īpašības, t.sk. šķīdība ūdenī, |
|
— |
ķīmiskās identifikācijas dati (piemēram, CAS numurs), tostarp tīrības pakāpe. |
Testa sugas:
|
— |
zinātniskais nosaukums, klons (ja zināms) un izcelsmes avots. |
Testa apstākļi:
|
— |
izvēlētā testēšanas procedūra (statiskā, pusstatiskā vai caurplūdes metode), |
|
— |
testa sākuma un beigu datums un tā ilgums, |
|
— |
barotne, |
|
— |
eksperimentālā plāna apraksts: testa trauki un pārsegums, šķīdumu tilpums, plātnīšu un koloniju skaits katrā testa traukā testa sākumā, |
|
— |
izraudzītās testējamās koncentrācijas (nominālās un izmērītās, pēc vajadzības) un katra koncentrācijas varianta atkārtojumu skaits, |
|
— |
pamatšķīdumu un testa šķīdumu pagatavošanas metodes, tostarp šķīdinātāju vai disperģētājvielu izmantošana, |
|
— |
temperatūra testēšanas laikā, |
|
— |
gaismas avots, gaismas intensitāte un homogenitāte, |
|
— |
pH vērtības testējamiem un kontroles šķīdumiem, |
|
— |
testējamās vielas koncentrācija un analīzes metode ar attiecīgiem kvalitātes novērtēšanas datiem (analīžu validācijas pētījumi, standartnovirzes vai ticamības robežas), |
|
— |
metodes plātnīšu skaita un citu mērāmo parametru, piemēram, sausnas, dabīgi mitrās masas vai plātnīšu zonas kopējās platības noteikšanai, |
|
— |
visas atkāpes no šīs testēšanas metodes. |
Rezultāti:
|
— |
izejas dati: plātnīšu skaits un citi mērāmie parametri – no katra testējamā un kontroles trauka visos novērojumu vai analīžu termiņos, |
|
— |
katra mērāmā lieluma vidējās vērtības un standartnovirzes, |
|
— |
augšanas līknes katrai koncentrācijai (ieteicams ar logaritmiski pārveidotu mērāmo parametru, sk. 2.2.1. iedaļas otro rindkopu), |
|
— |
divkāršošanās laiks/augšanas ātrums kontrolē, kas aprēķināts pēc plātnīšu skaita, |
|
— |
aprēķinātie atbildes reakcijas rādītāji visiem testē'jamo variantu atkārtojumiem, to vidējās vērtības un atkārtojumu variācijas koeficienti, |
|
— |
koncentrācijas un tās ietekmes savstarpējās sakarības grafisks attēlojums, |
|
— |
iegūto parametru toksiskumu raksturojošo beigu punktu aprēķini, piemēram, EC50, EC10, EC20 un saistītie ticamības intervāli; LOEC un/vai NOEC; ja tās ir aprēķinātas, un to noteikšanai izmantotās statistikas metodes, |
|
— |
ja izmanto dispersijas analīzi, iedarbības apmērs, ko iespējams konstatēt (piemēram, mazākā būtiskā starpība), |
|
— |
apstrādes variantos konstatētā augšanas stimulēšana, |
|
— |
fitotoksiskuma vizuālas pazīmes, kā arī testējamo šķīdumu novērojumi, |
|
— |
rezultātu novērtējums un ziņas par atkāpēm no šīs testēšanas metodes, kuras ietekmējušas noteikšanas rezultātus. |
4. LITERATŪRA
|
(1) |
OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test |
|
(2) |
The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals |
|
(3) |
Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, available at http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A |
|
(4) |
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA. |
|
(5) |
USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., “Public draft”. EPA 712-C-96–156. 8pp. |
|
(6) |
AFNOR – Association Française de Normalisation. (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp. |
|
(7) |
SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish). |
|
(8) |
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37–120 pp |
|
(9) |
Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145. |
|
(10) |
Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency. |
|
(11) |
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23. |
|
(12) |
ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test. |
|
(13) |
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3–77 108. September 1977. |
|
(14) |
Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353–359. |
|
(15) |
Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481–483. |
|
(16) |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718. |
|
(17) |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167. |
|
(18) |
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485–1494. |
|
(19) |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
(20) |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN. |
|
(21) |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096–1121. |
|
(22) |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482–491. |
|
(23) |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117. |
|
(24) |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531. |
|
(25) |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96. |
1. papildinājums
Lemna spp. apraksts
Ūdensaugs Lemna, kuru parasti sauc par ūdensziediem, pieder Lemnaceae dzimtai, kas ietver četras Lemna ģintis ar daudzām pasaulē plaši izplatītām sugām. Šo augu ārējais izskats un taksonomija ir izsmeļoši aprakstīta (1, 2). Lemna gibba un L. minor ir raksturīgas mērenā klimata joslu sugas, un tās parasti izmanto toksiskuma pārbaudēs. Abām sugām raksturīgas ūdenī brīvi peldošas vai iegrimušas diskveida plātnītes ar sīku pavedienveida saknīti katras plātnītes apakšpuses vidusdaļā. Lemna sugām ziedi veidojas reti; šie augi vairojas veģetatīvi, attīstoties jaunām plātnītēm (3). Salīdzinājumā ar vecākiem eksemplāriem jaunie augi ir bālāki, ar īsākām saknēm, un tie veidoti no divām vai trim dažāda lieluma plātnītēm. Lemna ģints augiem raksturīgs mazs izmērs, vienkārša uzbūve, veģetatīva vairošanās un īss ģenerāciju (paaudžu maiņas) laiks, tāpēc šīs ģints augi ir ļoti piemēroti laboratorijas testiem (4, 5).
Tā kā iespējama jutības starpsugu mainība, ticams ir vienīgi jutības salīdzinājums vienas sugas robežās.
Testēšanai izmantoto Lemna sugu piemēri. Sugu norādes
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935–941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., “Public draft”. EPA 712-C-96–156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., “Public draft”. EPA 712-C-96–156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959–1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87–96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481–483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102–2111.
Lemna sugu kolekcijas
|
University of Toronto Culture Collection of Algae and Cyanobacteria |
|
Department of Botany, University of Toronto |
|
Toronto, Ontario, Kanāda, M5S 3 B2 |
|
Tel: +1–416–978–3641 |
|
Fakss:+1–416–978–5878 |
|
e-pasts: jacreman@botany.utoronto.ca |
|
http://www.botany.utoronto.ca/utcc |
|
North Carolina State University |
|
Forestry Dept |
|
Duckweed Culture Collection |
|
Campus Box 8002 |
|
Raleigh, NC 27695–8002 |
|
Amerikas Savienotās Valstis |
|
Tel: 001 (919) 515–7572 |
|
astomp@unity.ncsu.edu |
|
Institute of Applied Environmental Research (ITM) Stockholm University |
|
SE-106 91 STOCKHOLM |
|
ZVIEDRIJA |
|
Tel: +46 8 674 7240 |
|
Fakss: +46 8 674 7636 |
|
Federal Environmental Agency (UBA) |
|
FG III 3.4 |
|
Schichauweg 58 |
|
12307 Berlin |
|
Vācija |
|
e-pasts: Lemna@uba.de |
|
http://www.umweltbundesamt.de/contact.htm |
Literatūra
|
1) |
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221–287. |
|
2) |
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland. |
|
3) |
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82–991150–0–0. The Agricultural Research Council of Norway, University of Oslo. |
|
4) |
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1–14. |
|
5) |
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7–22. |
2. papildinājums
Pamatkultūras uzturēšana
Pamatkultūras pazeminātā temperatūrā (4–10 °C) var uzturēt, ilgāku laiku neatjaunojot. Lemna kultivēšanai var izmantot to pašu barotni, ko lieto testēšanai, bet pamatkultūrai var lietot citu ar barības vielām bagātu barotni.
Periodiski vairākus jaunus, gaiši zaļas krāsas augus aseptiski pārnes kultivēšanas traukos ar svaigu barotni. Uzglabājot kultūru šeit ieteiktajā temperatūras režīmā, pārsēšanas intervāls var būt līdz trim nedēļām.
Jālieto ķīmiski tīri (mazgāti ar skābi) un sterili stikla kultivēšanas trauki, un manipulācijas jāveic aseptiski. Pamatkultūras kontaminācijas gadījumā, piemēram, ar aļģēm vai sēnēm, jāveic pasākumi kontaminējošo organismu likvidēšanā. Aļģes un vairākus citus kontaminējošos organismus iespējams likvidēt, sterilizējot virsmu. Ņem kontaminētā augu materiāla paraugu un nogriež saknītes. Materiālu enerģiski krata tīrā ūdenī, pēc tam iegremdē 0,5 % (tilp. %) nātrija hipohlorīta šķīdumā uz laiku no 30 sekundēm līdz 5 minūtēm. Augu materiālu pēc tam skalo ar sterilu ūdeni un vairākās porcijās pārvieto kultivēšanas traukos ar svaigu barotni. Daudzas plātnītes šīs apstrādes rezultātā iet bojā, it īpaši, ja iedarbības periods ir ilgāks; izdzīvojušie eksemplāri parasti ir attīrīti no kontaminācijas. Tos var izmantot pārsēšanai jaunā kultūrā.
3. papildinājums
Barotnes
L. minor un L. gibba kultivēšanai ieteicamas dažādas barotnes. L. minor kultivēšanai ieteicama modificēta Zviedrijas standartos (SIS) minētā barotne, bet L. gibba ieteicama 20X AAP barotne. Abu barotņu sastāvs norādīts turpmāk. Gatavojot šīs barotnes, jālieto ķīmiski tīras vai analītiski tīras vielas un dejonizēts ūdens.
Zviedrijas standarta (Swedish Standard, SIS) Lemna barotne
|
— |
Pamatšķīdumus I–V sterilizē autoklāvā (120 °C, 15 min) vai ar mebrānfiltrāciju (poru izmērs aptuveni 0,2 µm). |
|
— |
Pamatšķīdumu VI (vai VII) sterilizē tikai ar mebrānfiltrāciju; tos nedrīkst sterilizēt autoklāvā. |
|
— |
Sterilie pamatšķīdumi jāuzglabā vēsā un tumšā vietā. Pamatšķīdumi I–V derīgi sešus mēnešus, bet pamatšķīdumam VI (vai VII) derīguma termiņš ir viens mēnesis.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
— |
Lai pagatavotu vienu litru SIS barotnes, 900 ml dejonizēta ūdens pievieno pamatšķīdumus:
Piezīme: papildu pamatšķīdums VII (MOPS buferšķīdums) var būt vajadzīgs dažām testa vielām (sk. 1.4. iedaļas pēdējo rindkopu). |
|
— |
Noregulē pH 6,5 ± 0,2 ar 0,1 M vai 1 M HCl vai NaOH šķīdumu, tilpumu uzpilda līdz vienam litram ar dejonizētu ūdeni. |
20X AAP barotne
Pamatšķīdumus gatavo sterilā destilētā vai dejonizētā ūdenī.
Sterilie pamatšķīdumi jāglabā tumšā vēsā vietā. Šādos apstākļos glabājot, pamatšķīdumu derīguma termiņš ir vismaz 6–8 nedēļas.
20X – AAP barotnei gatavo piecus barības vielu pamatšķīdumus (A1, A2, A3, B un C), izmantojot ķīmiski tīras vielas. Barotni pagatavo aptuveni 850 ml dejonizēta ūdens pievienojot 20 ml katra barības vielu pamatšķīduma. Noregulē pH 7,5 ± 0,1 ar 0,1 M vai 1 M HCl vai NaOH šķīdumu, un tilpumu uzpilda līdz vienam litram ar dejonizētu ūdeni. Barotni filtrē caur 0,2 µm (aptuveni) membrānfiltru sterilā traukā.
Lai stabilizētos testēšanai izmantojamās barotnes pH, to pagatavo 1–2 dienas pirms lietošanas. Barotnes pH pirms lietošanas jāpārbauda un, ja nepieciešams, noregulē ar 0,1 M vai 1 M HCl vai NaOH šķīdumu, kā minēts iepriekš.
|
Pamatšķīdums Nr. |
Viela |
Koncentrācija pamatšķīdumā (g/l) (1) |
Koncentrācija gatavā barotnē (mg/l) (1) |
Gatavā barotne |
|
|
Elements |
Koncentrācija (mg/l) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4; 3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
Piezīme. Teorētiski atbilstošā bikarbonātu galīgā koncentrācija (kad iespējams iztikt bez vērā ņemamas pH līmeņa regulēšanas) ir 15 mg/l, nevis 300 mg/l. Tomēr vēsturiski, tajā skaitā starplaboratoriju salīdzinošajā testēšanā, 20X – AAP barotnē lietotā koncentrācija ir 300 mg/l (I. Sims, P. Whitehouse and R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency).
Steinberga barotne (ISO 20079)
Koncentrācijas un pamatšķīdumi
|
— |
Modificēto Steinberga barotni saskaņā ar ISO 20079 izmanto tikai Lemna minor kultivēšanai (tā kā pēc šīs metodes atļauta vienīgi Lemna minor), taču testos gūtā pieredze liecina, ka labi rezultāti sasniedzami arī ar Lemna gibba. |
|
— |
Gatavojot šo barotni, jālieto ķīmiski tīras vai analītiski tīras vielas un dejonizēts ūdens. |
|
— |
Barotni gatavo no pamatšķīdumiem vai no desmitkārtīgas koncentrācijas barotnes; tā ir barotnes maksimālā koncentrācija, kas iespējama bez vielu izgulsnēšanās. |
1. tabula
Steinberga barotne ar stabilizētu pH (modificēta pēc Altenburgera)
|
Viela |
Barotne |
||
|
Makroelementi |
Molekulmasa |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Mikroelementi |
Molekulmasa |
µg/l |
µmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4·7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4·2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2·4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3·6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA-dinātrija dihidrāts |
372,24 |
1 500,00 |
4,03 |
2. tabula
Pamatšķīdumi (makroelementi)
|
g/l |
||
|
1. pamatšķīdums: |
|||
|
KNO3 |
17,50 |
||
|
KH2PO4 |
4,5 |
||
|
K2HPO4 |
0,63 |
||
|
2. pamatšķīdums: |
|||
|
MgSO4 · 7H2O |
5,00 |
||
|
3. pamatšķīdums: |
|||
|
Ca(NO3)2·4H2O |
14,75 |
||
3. tabula
Pamatšķīdumi (mikroelementi)
|
mg/l |
||
|
4. pamatšķīdums: |
|||
|
H3BO3 |
120,0 |
||
|
5. pamatšķīdums: |
|||
|
ZnSO4·7H2O |
180,0 |
||
|
6. pamatšķīdums: |
|||
|
Na2MoO4·2H2O |
44,0 |
||
|
7. pamatšķīdums: |
|||
|
MnCl2·4H2O |
180,0 |
||
|
8. pamatšķīdums: |
|||
|
FeCl3·6H2O |
760,00 |
||
|
EDTA dinātrija dihidrāts |
1 500,00 |
||
|
— |
Vienā šķīdumā var apvienot 2. un 3. pamatšķīdumu, un atsevišķi 4. līdz 7. (ņemot vērā nepieciešamās koncentrācijas). |
|
— |
Ilgākai glabāšanai pamatšķīdumus sterilizē autoklāvā pie 121 °C, 20 min, vai kā alternatīvu izmanto sterilo filtrēšanu (0,2 µm). Stingri jāievēro, ka 8. pamatšķīdumu sterilizē ar filtrēšanu (0,2 µm). |
Modificētās Steinberga barotnes pagatavošana galīgajā koncentrācijā
|
— |
Aptuveni 900 ml dejonizēta ūdens pievieno pa 20 ml 1., 2. un 3.pamatšķīduma (sk. 2. tab.), lai nenotiktu izgulsnēšanās. |
|
— |
Pievieno pa 1,0 ml 4., 5., 6. 7. un 8. pamatšķīduma (sk. 3. tab.). |
|
— |
pH jābūt 5,5 ± 0,2 (noregulē, pievienojot pēc iespējas mazāku tilpumu NaOH šķīduma vai HCl). |
|
— |
Uzpilda ar ūdeni līdz 1 000 ml. |
|
— |
Ja pamatšķīdumus sterilizē un tiek lietots piemērots ūdens, gatavā barotne nav jāsterilizē. Ja barotni sterilizē tās galīgajā koncentrācijā, 8. pamatšķīdums jāpievieno pēc autoklavēšanas (121 °C, 20 min). |
Koncentrētas (×10) modificētās Steinberga barotnes pagatavošana pagaidu uzglabāšanai
|
— |
Lai nenotiktu izgulsnēšanās, pie aptuveni 30 ml dejonizēta ūdens pievieno pa 20 ml 1., 2. un 3.pamatšķīduma (sk.2. tab.). |
|
— |
Pievieno 1,0 ml 4., 5., 6. 7. un 8. pamatšķīduma (sk. 3.tab.). Uzpilda ar ūdeni līdz 100 ml. |
|
— |
Ja pamatšķīdumus sterilizē un tiek lietots piemērots ūdens, gatavā barotne nav jāsterilizē. Ja barotni sterilizē tās galīgajā koncentrācijā, 8. pamatšķīdums jāpievieno pēc autoklavēšanas (121 °C, 20 min). |
|
— |
Barotnes pH (galīgajā koncentrācijā) jābūt 5,5 ± 0,2. |
(1) Ja nav norādīts citādi.