ISSN 1725-5112
Eiropas Savienības
Oficiālais Vēstnesis
L 73

Izdevums latviešu valodā
Tiesību akti
50. sējums
2007. gada 13. marts
|
ISSN 1725-5112 |
||
|
Eiropas Savienības Oficiālais Vēstnesis |
L 73 |
|

|
||
|
Izdevums latviešu valodā |
Tiesību akti |
50. sējums |
|
|
|
|
|
(1) Dokuments attiecas uz EEZ |
|
LV |
Tiesību akti, kuru virsraksti ir gaišajā drukā, attiecas uz kārtējiem jautājumiem lauksaimniecības jomā un parasti ir spēkā tikai ierobežotu laika posmu. Visu citu tiesību aktu virsraksti ir tumšajā drukā, un pirms tiem ir zvaigznīte. |
I Tiesību akti, kas pieņemti, piemērojot EK/Euratom līgumus, un kuru publicēšana ir obligāta
REGULAS
|
13.3.2007 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 73/1 |
KOMISIJAS REGULA (EK) Nr. 242/2007
(2007. gada 6. marts)
par atļauju izmantot endo-1,4-beta ksilanāzi EC 3.2.1.8 (Belfeed B1100MP un Belfeed B1100ML) kā barības piedevu
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Eiropas Parlamenta un Padomes 2003. gada 22. septembra Regulu (EK) Nr. 1831/2003 par dzīvnieku ēdināšanā lietotām piedevām (1), un jo īpaši tās 9. panta 2. punktu,
tā kā:
|
(1) |
Ar Regulu (EK) Nr. 1831/2003 reglamentē atļauju dzīvnieku barības piedevu izmantošanai, kā arī pamatojumu un kārtību šādas atļaujas piešķiršanai. |
|
(2) |
Saskaņā ar Regulas (EK) Nr. 1831/2003 7. pantu tika iesniegts pieteikums, lai saņemtu atļauju preparātam, kas minēts pielikumā. Attiecīgajā pieteikumā bija pievienotas vajadzīgās ziņas un dokumenti atbilstīgi minētās regulas 7. panta 3. punktam. |
|
(3) |
Pieteikums attiecas uz atļauju preparāta endo-1,4-beta ksilanāzes EC 3.2.1.8, ko iegūst no Bacillus subtilis (LMG S-15136), kā barības piedevas jaunam lietojumam pīlēm, kas klasificējams kā piedeva kategorijā “zootehniskās piedevas”. |
|
(4) |
Analīzes metode, kas saskaņā ar Regulas (EK) Nr. 1831/2003 7. panta 3. punkta c) apakšpunktu ir iekļauta pieteikumā atļaujas saņemšanai, skar barībā izmantotās pārtikas piedevas aktīvās vielas noteikšanu. Tāpēc šīs regulas pielikumā minētā analīzes metode nav uzskatāma par Kopienas analīzes metodi tajā nozīmē, kas noteikta ar 11. pantu Eiropas Parlamenta un Padomes 2004. gada 29. aprīļa Regulā (EK) Nr. 882/2004 par oficiālo kontroli, ko veic, lai nodrošinātu atbilstības pārbaudi saistībā ar dzīvnieku barības un pārtikas aprites tiesību aktiem un dzīvnieku veselības un dzīvnieku labturības noteikumiem (2). |
|
(5) |
Ar Komisijas Regulu (EK) Nr. 1206/2005 (3) (atšķirto) sivēnu barībā un ar Komisijas Regulu (EK) Nr. 1259/2004 (4) gaļas cāļu barībā bez termiņa ierobežojuma bija atļauts izmantot no Bacillus subtilis (LMG S-15136) iegūtu endo-1,4-beta ksilanāzi EC 3.2.1.8. Tika iesniegti jauni dati, atbalstot pieteikumu to izmantot pīlēm. Eiropas Pārtikas nekaitīguma iestāde (turpmāk tekstā – iestāde) 2006. gada 15. jūnija atzinumā (5) secināja, ka jau ir atzīts šīs piedevas nekaitīgums patērētājam, lietotājam un videi un, to izmantojot ierosinātajā jaunajā veidā, tas nemainīsies. Turklāt tā secināja, ka šā preparāta izmantošanai nav kaitīgas iedarbības uz šo dzīvnieku papildu kategoriju un ka, izmantojot minēto preparātu, var uzlabot zootehniskos pīļu parametrus. Bet iestāde neuzskata, ka ir vajadzība ieviest īpašas pēcpārdošanas uzraudzības prasības. Minētajā atzinumā ir arī apstiprināts ziņojums par barībā izmantotās piedevas analīzes metodi, ko iesniegusi Kopienas references laboratorija, kas izveidota ar Regulu (EK) Nr. 1831/2003. |
|
(6) |
Minētā preparāta novērtējumā ir norādīts, ka ir izpildīti Regulas (EK) Nr. 1831/2003 5. pantā paredzētie nosacījumi atļaujas saņemšanai. Attiecīgi minēto preparātu jāļauj izmantot atbilstoši šīs regulas pielikumā noteiktajam. |
|
(7) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pastāvīgās pārtikas aprites un dzīvnieku veselības komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Pielikumā minēto preparātu, kas iekļauts barības piedevu kategorijā “zootehniskās piedevas” un funkcionālajā grupā “zarnu floras stabilizētāji”, ir atļauts izmantot kā dzīvnieku barības piedevu, uz ko attiecina pielikumā izklāstītos nosacījumus.
2. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2007. gada 6. martā
Komisijas vārdā –
Komisijas loceklis
Markos KYPRIANOU
(1) OV L 268, 18.10.2003., 29. lpp. Regulā grozījumi izdarīti ar Komisijas Regulu (EK) Nr. 378/2005 (OV L 59, 5.3.2005., 8. lpp.).
(2) OV L 165, 30.4.2004., 1. lpp. Regulā jaunākie grozījumi izdarīti ar Padomes Regulu (EK) Nr. 1791/2006 (OV L 363, 20.12.2006., 1. lpp.).
(3) OV L 197, 28.7.2005., 12. lpp.
(4) OV L 239, 9.7.2004., 8. lpp.
(5) Zinātnes ekspertu grupas atzinums par piedevām un produktiem vai vielām, ko izmanto dzīvnieku barībā, par fermentu preparāta Belfeed B1100MP un Belfeed B1100ML (endo-1-4-beta ksilanāzes) drošumu un efektivitāti, kas kā barības piedeva atļauti saskaņā ar Padomes Direktīvu 70/524/EEK. Pieņemts 2006. gada 15. jūnijā. EFSA Vēstnesis (2006) 368, 1–7.
PIELIKUMS
|
Piedevas identifikā-cijas numurs |
Atļaujas turētāja nosaukums |
Piedeva (tirdzniecības nosaukums) |
Sastāvs, ķīmiskā formula, apraksts, analītiskā metode |
Dzīvnieka suga vai kategorija |
Maksimā-lais vecums |
Minimālais saturs |
Maksimālais saturs |
Citi noteikumi |
Atļaujas termiņš |
||||||||
|
Aktivitātes vienības/kg no kompleksās barības ar mitruma saturu 12 % |
|||||||||||||||||
|
Zootehnisko piedevu kategorija. Funkcionālā grupa: gremošanas veicinātāji. |
|||||||||||||||||
|
4a1606 |
Beldem SA |
Endo-1,4-beta-ksilanāze EC 3.2.1.8 (Belfeed B1100MP Belfeed B1100ML) |
Piedevas sastāvs endo-1,4-beta-ksilanāze EC 3.2.1.8, kuras minimālā aktivitāte cietā un šķidrā veidā ir 100 IU (1) /g or ml Darbīgās vielas raksturojums endo-1,4-beta-ksilanāze EC 3.2.1.8, ko iegūst no Bacillus subtilis (LMG S-15136) Analītiskā metode (2) Kolorimetriskā metode, ar ko nosaka ūdenī šķīstošas krāsvielas daudzumu, ko no ar azurīnu saistīta kviešu arabinoksilāna substrāta izdala enzīms |
Pīles |
— |
10 IU |
— |
|
2.4.2017. |
||||||||
(1) IU ir fermenta daudzums, kas vienā minūtē no bērza koksnes ksilāna atbrīvo 1 mikromolu reducējošo cukuru (ksilozes ekvivalentu), ja pH līmenis ir 4,5 un temperatūra – 30 oC.
(2) Sīka informācija par analīzes metodēm atrodama šādā Kopienas references laboratorijas tīmekļa vietnē: www.irmm.jrc.be/html/crlfaa/
|
13.3.2007 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 73/4 |
KOMISIJAS REGULA (EK) Nr. 243/2007
(2007. gada 6. marts)
par atļauju izmantot 3-fitāzi (Natuphos) kā dzīvnieku barības piedevu
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Eiropas Parlamenta un Padomes 2003. gada 22. septembra Regulu (EK) Nr. 1831/2003 par dzīvnieku ēdināšanā lietotām piedevām (1), un jo īpaši tās 9. panta 2. punktu,
tā kā:
|
(1) |
Ar Regulu (EK) Nr. 1831/2003 atļauts izmantot piedevas dzīvnieku barībā un noteikts šādas atļaujas piešķiršanas pamatojums un kārtība. |
|
(2) |
Saskaņā ar Regulas (EK) Nr. 1831/2003 7. pantu iesniegts pieteikums, lai saņemtu atļauju pielikumā minētajam preparātam. Pieteikumam bija pievienoti sīkāki dati un dokumenti, kas vajadzīgi saskaņā ar minētās regulas 7. panta 3. punktu. |
|
(3) |
Pieteikums attiecas uz atļauju Aspergillus niger (CBS 101.672) ražotajam enzīmu preparātam 3-fitāze, kas paredzēts atšķirtiem sivēniem, gaļas cūkām, gaļas cāļiem un ko klasificēs katgorijā “zootehniskās piedevas”. |
|
(4) |
Eiropas Pārtikas nekaitīguma iestāde (turpmāk “iestāde”) 2006. gada 15. jūnija lēmumā un 2006. gada 17. maija lēmumā secināja, ka Aspergillus niger (CBS 101.672) ražotajai 3-fitāzei nav kaitīgas ietekmes uz dzīvnieku un cilvēku veselību vai vidi (2). Turklāt tā secināja, ka Aspergillus niger (CBS 101.672) ražotais enzīmu preparāts 3-fitāze nerada arī nekādus citus apdraudējumus, kuru dēļ saskaņā ar Regulas (EK) Nr. 1831/2003 5. panta 2. punktu atļauju nevarētu piešķirt. Iestādes atzinumā ieteikti piemēroti pasākumi lietotāju drošībai. Tā neuzskata, ka ir vajadzīgas īpašas uzraudzības prasības pēc pārdošanas. Šajā atzinumā arī apstiprināts ar Regulu (EK) Nr. 1831/2003 izveidotās Kopienas references laboratorijas iesniegtais ziņojums par dzīvnieku barības piedevas analītisko metodi. Minētā preparāta novērtējumā konstatēts, ka Regulas (EK) Nr. 1831/2003 5. pantā paredzētie nosacījumi ir ievēroti. Attiecīgi ir jāatļauj šā preparāta izmantošana, kā minēts šīs regulas pielikumā. |
|
(5) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pārtikas aprites un dzīvnieku veselības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Saskaņā ar pielikumā minētajiem nosacījumiem kā dzīvnieku barības piedevu atļauj izmantot pielikumā aprakstīto preparātu, kas ietilpst “zootehnisko piedevu” kategorijā un “gremošanas veicinātāju” funkcionālajā grupā.
2. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2007. gada 6. martā
Komisijas vārdā –
Komisijas loceklis
Markos KYPRIANOU
(1) OV L 268, 18.10.2003., 29. lpp. Regulā grozījumi izdarīti ar Komisijas Regulu (EK) Nr. 378/2005 (OV L 59, 5.3.2005., 8. lpp.).
(2) Zinātnes ekspertu grupas piedevu un produktu vai dzīvnieku barībā izmantoto vielu jomā (FEEDAP) un zinātnes ekspertu grupas ģenētiski modificētu organismu jomā (GMO) atzinums par Aspergillus niger ražotā enzīmu preparāta Natuphos® (3-fitāze) drošumu un iedarbīgumu. Pieņemts 2006. gada 15. jūnijā (FEEDAP ekspertu grupa) un 2006. gada 17. maijā (GMO ekspertu grupa). EPNI Vēstnesis (2006) 369, 1.-19. lpp.
PIELIKUMS
|
Piedevas identifikācijas numurs |
Atļaujas turētāja nosaukums |
Piedeva (tirdzniecības nosaukums) |
Sastāvs, ķīmiskā formula, apraksts, analītiskā metode |
Dzīvnieku suga vai kategorija |
Maksimālais vecums |
Minimālais saturs |
Maksimālais saturs |
Citi noteikumi |
Atļaujas termiņš |
||||||||
|
Aktīvās vienības/kg kompleksās dzīvnieku barības ar mitruma saturu 12 % |
|||||||||||||||||
|
Zootehnisko piedevu kategorija. Funkcionālā grupa: gremošanas veicinātāji. |
|||||||||||||||||
|
4a 1600 |
BASF Aktiengesellschaft |
3-fitāze EK 3.1.3.8 (Natuphos5 000 G Natuphos5 000 L Natuphos10 000 G Natuphos10 000 L) |
Piedevas sastāvs: Aspergillus niger (CBS 101.672) ražota 3-fitāze ar šādu minimālo aktivitāti: cietā veidā: 5 000 FTU/g šķidrā veidā: 5 000 FTU/ml Aktīvās vielas raksturojums: Aspergillus niger (CBS 101.672) ražota 3-fitāze Analītiskā metode (1) Kolometriska metode, ar ko mēra neorganisko fosfātu, ko enzīms izdala no fitāta substrāta. |
Sivēni (atšķirti) |
— |
500 FTU |
|
|
2.4.2017. |
||||||||
|
Gaļas cūkas |
|
280 FTU |
|
|
|||||||||||||
|
Gaļas cāļi |
— |
375 FTU |
|
|
|||||||||||||
(1) Sīki dati par analītisko metodi ir pieejami Kopienas references laboratorijas interneta lapā: www.irmm.jrc.be/html/crlfaa/
|
13.3.2007 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 73/6 |
KOMISIJAS REGULA (EK) Nr. 244/2007
(2007. gada 7. marts)
par L-histidīna monohidrohlorīda monohidrāta kā dzīvnieku barības piedevas lietošanas atļauju
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Eiropas Parlamenta un Padomes 2003. gada 22. septembra Regulu (EK) Nr. 1831/2003 par dzīvnieku ēdināšanā lietotām piedevām (1), un jo īpaši tās 9. panta 2. punktu,
tā kā:
|
(1) |
Ar Regulu (EK) Nr. 1831/2003 reglamentē atļaujas dzīvnieku barības piedevu izmantošanai un šādu atļauju piešķiršanas pamatojumu un kārtību. |
|
(2) |
Tika iesniegts L-histidīna monohidrohlorīda monohidrāta kā aminoskābes lietošanas atļaujas pieteikums. |
|
(3) |
Tā kā atļaujas pieteikums tika iesniegts pirms Regulā (EK) Nr. 1831/2003 norādītā datuma, to iesniedza saskaņā ar 1982. gada 30. jūnija Padomes Direktīvu 82/471/EEK par dažiem produktiem, ko izmanto dzīvnieku barībā (2). No 2004. gada 18. oktobra aminoskābes, to sāļi un analogi ir iekļauti Regulā (EK) Nr. 1831/2003. Tāpēc šo pieteikumu uzskata par Regulas (EK) Nr. 1831/2003 7. pantā minēto pieteikumu. |
|
(4) |
Lai izpildītu Regulas (EK) Nr. 1831/2003 7. pantā izklāstītās prasības, pamatojot pieteikumu, tika iesniegta papildu informācija un precīzas ziņas. |
|
(5) |
Pieteikums attiecas uz atļauju L-histidīna monohidrohlorīda monohidrātu lietot kā dzīvnieku barības piedevu lašu dzimtas zivīm, un šo piedevu klasificē dzīvnieku barības piedevu kategorijā “uzturfizioloģiskās piedevas”, un tā ir ietverta funkcionālajā grupā “aminoskābes, to sāļi un analogi”. |
|
(6) |
Eiropas Pārtikas nekaitīguma iestāde (turpmāk tekstā – “iestāde”) 2005. gada 2. marta (3) un 2006. gada 18. oktobra (4) atzinumos secināja, ka L-histidīna monohidrohlorīda monohidrātam nav kaitīgas iedarbības uz dzīvnieku veselību, cilvēku veselību vai vidi. Atzinumā arī norādīts, ka L-histidīna monohidrohlorīda monohidrāts nerada citu risku, kas atbilstīgi Regulas (EK) Nr. 1831/2003 5. panta 2. punktam būtu par pamatu minētās piedevas aizliegšanai. Saskaņā ar minēto atzinumu arī zivīm tā ir svarīga aminoskābe, un ir pierādīts, ka, ievērojot lašu dzimtas zivju audzēšanas nosacījumus un lietojot minēto preparātu, tiek novērsta katarakta. Iestādes atzinumā ir ieteikti attiecīgi pasākumi lietotāju drošībai. Taču iestāde uzskata, ka īpašas prasības attiecībā uz pēcpārdošanas uzraudzību nav vajadzīgas. Kopienas references laboratorija, kas izveidota ar Regulu (EK) Nr. 1831/2003, ir iesniegusi pārskatu par barībā lietotās dzīvnieku barības piedevas analīzes metodi. Minētā preparāta novērtējums liecina, ka Regulas (EK) Nr. 1831/2003 5. pantā paredzētie atļaujas piešķiršanas nosacījumi ir izpildīti. Attiecīgi jāatļauj minētā preparāta lietošana, kā noteikts šīs regulas pielikumā. |
|
(7) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pastāvīgās pārtikas aprites un dzīvnieku veselības komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Pielikumā minēto preparātu, kas iekļauts barības piedevu kategorijā “uzturfizioloģiskās piedevas” un funkcionālajā grupā “aminoskābes, to sāļi un analogi”, ir atļauts lietot kā dzīvnieku barības piedevu atbilstīgi šīs regulas pielikumā izklāstītajiem nosacījumiem.
2. pants
Šī regula stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2007. gada 7. martā
Komisijas vārdā –
Komisijas loceklis
Markos KYPRIANOU
(1) OV L 268, 18.10.2003., 29. lpp. Regulā grozījumi izdarīti ar Komisijas Regulu (EK) Nr. 378/2005 (OV L 59, 5.3.2005., 8. lpp.).
(2) OV L 213, 21.7.1982., 8. lpp. Direktīvā jaunākie grozījumi izdarīti ar Komisijas Direktīvu 2004/116/EK (OV L 379, 24.12.2004., 81. lpp.).
(3) Dzīvnieku barībā izmantojamo piedevu un produktu ekspertu grupas atzinums par L-histidīna monohidrohlorīda monohidrāta drošumu un biopieejamību lašu dzimtas zivīm. Pieņemts 2005. gada 2. martā. EPNI Vēstnesis (2005) 195, 1.–10. lpp.
(4) Atbilstīgi Regulai (EK) 1831/2003 Dzīvnieku barībā izmantojamo piedevu un produktu ekspertu grupas atzinums par L-histidīna monohidrohlorīda monohidrātu kā barības piedevu lašu dzimtas zivīm. Pieņemts 2006. gada 18. oktobrī. EPNI Vēstnesis (2006) 407, 1.–5. lpp.
PIELIKUMS
|
Piedevas reģistrācijas numurs |
Atļaujas turētāja nosaukums |
Piedeva |
Sastāvs, ķīmiskā formula, apraksts, analīzes metode |
Dzīvnieka suga vai kategorija |
Maksimālais vecums |
Minimālais saturs |
Maksimālais saturs |
Citi noteikumi |
Atļaujas perioda beigu termiņš |
|
Maksimālais saturs mg/kgkompleksajā barībā |
|||||||||
|
Uzturfizioloģisko piedevu kategorija. Funkcionālā grupa: aminoskābes, to sāļi un analogi |
|||||||||
|
3c3.5.1 |
— |
L-histidīna monohidrohlorīda monohidrāts |
Piedevas raksturojums: L-histidīna monohidrohlorīda monohidrāts 98 % Ražotājs – Escherichia (ATCC 9637) C3H3N2-CH2-CH(NH2)-COOH· HCl· H2O Analīzes metode Kopienas metode aminoskābju noteikšanai (Komisijas Direktīva 98/64/EK par Kopienas analīžu metodēm aminoskābju, kopeļļu, koptauku un olahindoksa noteikšanai dzīvnieku barībā, un par Direktīvas 71/393/EEK grozījumiem (1). |
Lašu dzimtas zivis |
— |
— |
— |
— |
2.4.2017. |
|
13.3.2007 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 73/9 |
KOMISIJAS REGULA (EK) Nr. 245/2007
(2007. gada 8. marts),
ar ko groza un pielāgo Eiropas Parlamenta un Padomes Regulas (EK) Nr. 998/2003 II pielikumu attiecībā uz Bulgāriju, Rumāniju un Malaiziju
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Bulgārijas un Rumānijas Pievienošanās līgumu, un jo īpaši tā 4. panta 3. punktu,
ņemot vērā Bulgārijas un Rumānijas Pievienošanās aktu, un jo īpaši tā 56. pantu,
ņemot vērā Eiropas Parlamenta un Padomes 2003. gada 26. maija Regulu (EK) Nr. 998/2003 par dzīvnieku veselības prasībām, kas piemērojamas lolojumdzīvnieku nekomerciālai pārvietošanai, un ar kuru groza Padomes Direktīvu Nr. 92/65/EEK (1), un jo īpaši tās 10. un 19. pantu,
tā kā:
|
(1) |
Regulā (EK) Nr. 998/2003 ir noteiktas dzīvnieku veselības prasības, kas piemērojamas lolojumdzīvnieku nekomerciālai pārvietošanai un noteikumi, kas attiecas uz šādas pārvietošanas pārbaudēm. |
|
(2) |
Regulā (EK) Nr. 998/2003 noteikts, ka šīs regulas II pielikuma C daļā jāiekļauj to trešo valstu saraksts, no kurām, ievērojot zināmas prasības, var tikt atļauta lolojumdzīvnieku pārvietošana uz Kopienu. |
|
(3) |
Regulas (EK) Nr. 998/2003 II pielikuma C daļā esošajā sarakstā iekļautas trešas valstis un teritorijas, kurās nav trakumsērgas, un trešās valstis un teritorijas, attiecībā uz kurām konstatēts, ka risks trakumsērgas ievazāšanai Kopienā, pārvietojot lolojumdzīvniekus no šīm trešām valstīm un teritorijām, nav augstāks par risku, kas saistīts ar to pārvietošanu starp dalībvalstīm. |
|
(4) |
Ņemot vērā Malaizijas kompetento iestāžu sniegto informāciju, rodas pārliecība, ka risks trakumsērgas ievazāšanai Kopienā, pārvietojot lolojumdzīvniekus no šīs valsts, nevarētu būt augstāks par risku, kas saistīts ar lolojumdzīvnieku pārvietošanu starp dalībvalstīm vai no Regulā (EK) Nr. 998/2003 jau uzskaitītajām trešām valstīm. Tādēļ Malaizija būtu jāiekļauj Regulas (EK) Nr. 998/2003 II pielikuma C daļā. |
|
(5) |
Tā kā Bulgārija un Rumānija kopš 2007. gada 1. janvāra ir dalībvalstis, Kopienas tiesību aktu skaidrības labad no Regulas Nr. 998/2003 II pielikuma C daļas jāizņem atsauces uz šīm valstīm, skaitot no pievienošanās dienas. |
|
(6) |
Tādēļ attiecīgi jāgroza Regula (EK) Nr. 998/2003. |
|
(7) |
Šajā regulā paredzētie pasākumi ir saskaņā ar Pārtikas aprites un dzīvnieku veselības pastāvīgās komitejas atzinumu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Regulas (EK) Nr. 998/2003 II pielikuma C daļu groza šādi.
|
1) |
Šādus ierakstus svītro: “BG – Bulgārija RO – Rumānija”. |
|
2) |
Iekļauj šādu ierakstu: “MY – Malaizija”. |
2. pants
Šī regula stājas spēkā trešajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
Regulas 1. panta 1. punktu piemēro no 2007. gada 1. janvāra.
Šī regula uzliek saistības kopumā un ir tieši piemērojama visās dalībvalstīs.
Briselē, 2007. gada 8. martā
Komisijas vārdā –
Komisijas loceklis
Markos KYPRIANOU
(1) OV L 146, 13.6.2003., 1. lpp. Regulā jaunākie grozījumi izdarīti ar Komisijas Regulu (EK) Nr. 1467/2006 (OV L 274, 5.10.2006., 3. lpp.).
DIREKTĪVAS
|
13.3.2007 |
LV |
Eiropas Savienības Oficiālais Vēstnesis |
L 73/10 |
KOMISIJAS DIREKTĪVA 2007/13/EK
(2007. gada 7. marts),
ar ko groza II pielikumu Padomes Direktīvā 71/316/EEK par dalībvalstu tiesību aktu tuvināšanu attiecībā uz kopīgiem noteikumiem, ko piemēro metroloģiskās kontroles mērinstrumentiem un metodēm
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Padomes 1971. gada 26. jūlija Direktīvu 71/316/EEK par dalībvalstu tiesību aktu tuvināšanu attiecībā uz kopīgiem noteikumiem, ko piemēro metroloģiskās kontroles mērinstrumentiem un metodēm (1), un jo īpaši tās 16. panta pirmo teikumu,
tā kā:
|
(1) |
Direktīvas 71/316/EEK II pielikuma 3.1.1.1. punkta a) apakšpunktā ir paredzēti noteikumi attiecībā uz lielajiem burtiem valstu identifikācijai, ko izmanto EEK sākotnējās verifikācijas zīmēm, kas piestiprinātas mērinstrumentam un norāda šā instrumenta atbilstību EEK prasībām. |
|
(2) |
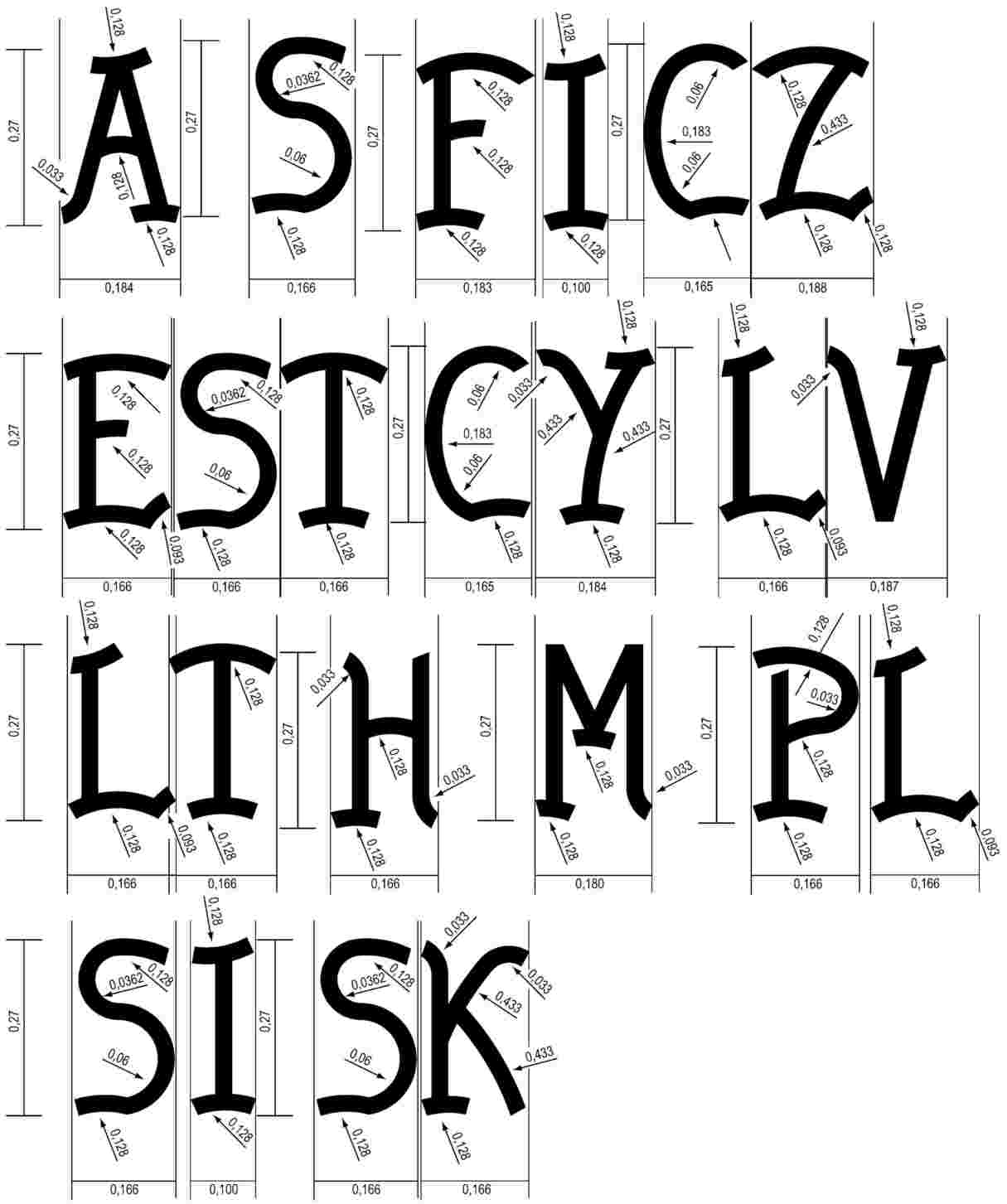
Direktīvas 71/316/EEK II pielikuma 3.2.1. punktā ir paredzēti noteikumi attiecībā uz zīmējumiem, kuros norādītas burtu formas, izmēri un kontūras minētā pielikuma 3.1. punktā noteiktajām EEK sākotnējās verifikācijas zīmēm. |
|
(3) |
Identifikācijas burtu zīmējumi netika noteikti Austrijas, Somijas un Zviedrijas Pievienošanās aktā un 2003. gada Pievienošanās aktā. Saskaņā ar II pielikuma 1. nodaļas D1. punkta b) apakšpunktu Austrijas, Somijas un Zviedrijas Pievienošanās aktā un saskaņā ar 2003. gada Pievienošanās aktu zīmējumi, uz kuriem sniegta atsauce Direktīvas 71/316/EEK II pielikuma 3.2.1. punktā, ir papildināti ar attiecīgajiem burtiem. |
|
(4) |
Attiecīgi ir jāgroza Direktīvas 71/316/EEK II pielikuma 3.2.1. punkts, lai iekļautu identifikācijas burtu zīmējumus. |
|
(5) |
Šajā direktīvā paredzētie pasākumi ir saskaņā ar atzinumu, ko sniegusi Tehniskā progresa ieviešanas komiteja, kas izveidota saskaņā ar Direktīvas 71/316/EEK 17. pantu, |
IR PIEŅĒMUSI ŠO DIREKTĪVU.
1. pants
Direktīvas 71/316/EEK II pielikumu groza saskaņā ar šīs direktīvas pielikumu.
2. pants
1. Dalībvalstīs stājas spēkā normatīvie un administratīvie akti, kas vajadzīgi, lai izpildītu šīs direktīvas prasības vēlākais līdz 2008. gada 10. martam. Dalībvalstis nekavējoties iepazīstina Komisiju ar šo aktu tekstu.
Kad dalībvalstis pieņem minētos noteikumus, tajos ietver atsauci uz šo direktīvu vai arī šādu atsauci pievieno to oficiālajai publikācijai. Dalībvalstis nosaka, kā izdarāma šāda atsauce.
2. Dalībvalstis nosūta Komisijai galveno valsts tiesību aktu tekstus, ko tās pieņem jomās, uz kurām attiecas šī direktīva.
3. pants
Šī direktīva stājas spēkā divdesmitajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
4. pants
Šī direktīva ir adresēta dalībvalstīm.
Briselē, 2007. gada 7. martā
Komisijas vārdā –
priekšsēdētāja vietnieks
Günter VERHEUGEN
(1) OV L 202, 6.9.1971., 1. lpp. Direktīvā jaunākie grozījumi izdarīti ar 2003. gada Pievienošanās aktu.
PIELIKUMS
Direktīvas 71/316/EEK II pielikumam pievienotajā pirmajā zīmējumā burtus “A, S, FI, CZ, EST, CY, LV, LT, H, M, PL, SI, SK” papildina ar šādiem zīmējumiem.