ISSN 1725-5120
doi:10.3000/17255120.L_2009.220.lit
Europos Sąjungos
oficialusis leidinys
L 220

Leidimas lietuvių kalba
Teisės aktai
52 tomas
2009m. rugpjūčio 24d.
|
ISSN 1725-5120 doi:10.3000/17255120.L_2009.220.lit |
||
|
Europos Sąjungos oficialusis leidinys |
L 220 |
|

|
||
|
Leidimas lietuvių kalba |
Teisės aktai |
52 tomas |
|
Turinys |
|
I Aktai, priimti remiantis EB ir (arba) Euratomo steigimo sutartimis, kuriuos skelbti privaloma |
Puslapis |
|
|
|
REGLAMENTAI |
|
|
|
* |
2009 m. liepos 23 d. Komisijos Reglamentas (EB) Nr. 761/2009 iš dalies keičiantis Reglamentą (EB) Nr. 440/2008, nustatantį bandymų metodus pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), siekiant jį suderinti su technikos pažanga ( 1 ) |
|
|
|
|
|
(1) Tekstas svarbus EEE |
|
LT |
Aktai, kurių pavadinimai spausdinami paprastu šriftu, yra susiję su kasdieniu žemės ūkio reikalų valdymu ir paprastai galioja ribotą laikotarpį. Visų kitų aktų pavadinimai spausdinami ryškesniu šriftu ir prieš juos dedama žvaigždutė. |
I Aktai, priimti remiantis EB ir (arba) Euratomo steigimo sutartimis, kuriuos skelbti privaloma
REGLAMENTAI
|
24.8.2009 |
LT |
Europos Sąjungos oficialusis leidinys |
L 220/1 |
KOMISIJOS REGLAMENTAS (EB) Nr. 761/2009
2009 m. liepos 23 d.
iš dalies keičiantis Reglamentą (EB) Nr. 440/2008, nustatantį bandymų metodus pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), siekiant jį suderinti su technikos pažanga
(Tekstas svarbus EEE)
EUROPOS BENDRIJŲ KOMISIJA,
atsižvelgdama į Europos bendrijos steigimo sutartį,
atsižvelgdama į 2006 m. gruodžio 18 d. Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), įsteigiantį Europos cheminių medžiagų agentūrą, iš dalies keičiantį Direktyvą 1999/45/EB bei panaikinantį Tarybos reglamentą (EEB) Nr. 793/93, Komisijos reglamentą (EB) Nr. 1488/94, Tarybos direktyvą 76/769/EEB ir Komisijos direktyvas 91/155/EEB, 93/67/EEB, 93/105/EB bei 2000/21/EB (1), ypač į jo 13 straipsnio 3 dalį,
kadangi:
|
(1) |
Komisijos reglamente (EB) Nr. 440/2008 (2) pateikti bandymo metodai, taikomi nustatant pagal Reglamentą (EB) Nr. 1907/2006 naudojamų medžiagų fizikines ir chemines savybes, toksiškumą ir ekotoksiškumą. |
|
(2) |
Būtina atnaujinti Reglamentą (EB) Nr. 440/2008 siekiant įtraukti tam tikrų bandymų metodų pakeitimus bei kelis OECD priimtus naujus bandymų metodus. Dėl šio pasiūlymo buvo konsultuojamasi su suinteresuotosiomis šalimis. Tais pakeitimais nagrinėjami metodai derinami su mokslo ir technikos pažanga. |
|
(3) |
Reikėtų persvarstyti nuostatas dėl garų slėgio, kad būtų įtrauktas naujas efuzijos metodas. |
|
(4) |
Būtina įtraukti naują metodą plaušelių skersmens ilgio svertiniam vidurkiui matuoti. |
|
(5) |
Reikia atnaujinti Reglamentą (EB) Nr. 440/2008 siekiant prioritetine tvarka įtraukti naują in vitro odos dirginimo bandymų metodą, kad būtų sumažintas bandymų tikslams naudojamų gyvūnų skaičius, atsižvelgiant į 1986 m. lapkričio 24 d. Tarybos direktyvą 86/609/EEB dėl valstybių narių įstatymų ir kitų teisės aktų, susijusių su eksperimentiniais ir kitais mokslo tikslais naudojamų gyvūnų apsauga, suderinimo (3). Nors in vitro odos dirginimo bandymų metodo projektas vis dar svarstomas OECD, šiuo išskirtiniu atveju B.46 metodą reikėtų įtraukti į šį reglamentą. B.46 metodą reikėtų kuo greičiau atnaujinti, kai dėl jo susitars OECD šalys arba kai bus gauta daugiau informacijos, dėl kurios jį reikėtų atnaujinti. |
|
(6) |
Reikia persvarstyti dumblių inhibavimo bandymo nuostatas, siekiant įtraukti papildomas rūšis ir užtikrinti atitiktį cheminių medžiagų pavojaus vertinimo bei klasifikavimo reikalavimams. |
|
(7) |
Būtina įtraukti naują metodą aerobiniam mineralizavimui paviršiniame vandenyje matuoti taikant modeliuojamo biologinio skaidymo bandymą ir naują metodą toksiniam poveikiui plūdenos (Lemna) genčiai nustatyti taikant augimo inhibavimo bandymą. |
|
(8) |
Todėl Reglamentą (EB) Nr. 440/2008 reikėtų atitinkamai iš dalies pakeisti. |
|
(9) |
Šiame reglamente numatytos priemonės atitinka pagal Reglamento (EB) Nr. 1907/2006 133 straipsnį įsteigto komiteto nuomonę, |
PRIĖMĖ ŠĮ REGLAMENTĄ:
1 straipsnis
Reglamento (EB) Nr. 440/2008 priedas iš dalies keičiamas taip:
|
1) |
A dalis iš dalies keičiama taip:
|
|
2) |
B dalis iš dalies keičiama taip: įtraukiamas B.46 skyrius, pateiktas šio reglamento III priede. |
|
3) |
C dalis iš dalies keičiama taip:
|
2 straipsnis
Šis reglamentas įsigalioja trečią dieną nuo jo paskelbimo Europos Sąjungos oficialiajame leidinyje.
Šis reglamentas yra privalomas visas ir tiesiogiai taikomas visose valstybėse narėse.
Priimta Briuselyje 2009 m. liepos 23 d.
Komisijos vardu
Stavros DIMAS
Komisijos narys
(1) OL L 396, 2006 12 30, p. 1.
(2) OL L 142, 2008 5 31, p. 1.
(3) OL L 358, 1986 12 18, p. 1.
I PRIEDAS
|
A.4. |
GARŲ SLĖGIS |
1. METODAS
Šis metodas atitinka OECD TG 104 (2004).
1.1. ĮVADAS
Į pataisytąją A.4 metodo (1) versiją įtrauktas vienas papildomas metodas, t.y., efuzijos metodas: izoterminė termogravimetrija, skirtas cheminėms medžiagoms, kurių garų slėgis yra labai mažas (iki 10–10 Pa). Atsižvelgiant į metodikų poreikį, ypač tokių, kurios tiktų žemo garų slėgio medžiagoms, kitos šio metodo metodikos yra pakartotinai įvertintos dėl jų tinkamumo kitiems slėgio intervalams.
Termodinaminės pusiausvyros sąlygomis grynosios medžiagos garų slėgis yra tik temperatūros funkcija. Pagrindiniai metodo principai aprašyti kitur (2)(3).
Jokia viena matavimo metodika netinka garų slėgiui matuoti intervale nuo mažiau kaip 10–10 iki 105 Pa. Šį metodą sudaro aštuoni garų slėgio matavimo metodai, kurie gali būti taikomi skirtingiems garų slėgio intervalams. Įvairių metodų taikymo atvejai ir matavimo intervalai pateikti 1 lentelėje. Metodai gali būti taikomi tik bandymo sąlygomis patvariems junginiams. Jei bandymo metodai negali būti taikomi dėl techninių priežasčių, garų slėgį irgi galima įvertinti, o rekomenduojamas įvertinimo metodas aprašytas priedėlyje.
1.2. APIBRĖŽTYS IR VIENETAI
Medžiagos garų slėgis apibrėžiamas kaip sočiųjų garų slėgis virš kietosios arba skystosios medžiagos.
Reikėtų naudoti SI slėgio vienetą – Paskalį (Pa). Čia pateikiami istoriškai naudoti vienetai ir faktoriai jiems perskaičiuoti:
|
1 toras |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atmosfera |
= |
1,013 × 105 Pa |
|
|
|
1 baras |
= |
105 Pa |
|
|
SI temperatūros vienetas – kelvinas (K). Temperatūrai Celsijaus laipsniais perskaičiuoti į Kelvino laipsnius taikoma formulė:
T = t + 273,15
čia, T – Kelvino arba termodinaminė temperatūra ir t – Celsijaus temperatūra.
1 lentelė
|
Matavimo metodas |
Medžiagos |
Pakartojamumo įvertis |
Atkuriamumo įvertis |
Rekomenduojamas intervalas |
|
|
kietosios |
skystosios |
||||
|
Dinaminis metodas |
Žema lyd. temp. |
Taip |
iki 25 % 1–5 % |
iki 25 % 1–5 % |
103 Pa – 2 × 103 Pa 2 × 103 Pa – 105 Pa |
|
Statinis metodas |
Taip |
Taip |
5–10 % |
5–10 % |
10 Pa – 105 Pa 10–2 Pa – 105 Pa (1) |
|
Izoteniskopo metodas |
Taip |
Taip |
5–10 % |
5–10 % |
102 Pa – 105 Pa |
|
Efuzijos metodas: garų slėgio pusiausvyra |
Taip |
Taip |
5–20 % |
iki 50 % |
10–3 – 1 Pa |
|
Efuzijos metodas: Knudseno kamera |
Taip |
Taip |
10–30 % |
— |
10–10 – 1 P |
|
Efuzijos metodas: izoterminė termogravimetrija |
Taip |
Taip |
5–30 % |
iki 50 % |
10–10 – 1 Pa |
|
Dujų soties metodas |
Taip |
Taip |
10–30 % |
iki 50 % |
10–10 – 103 Pa |
|
Sukamojo rotoriaus metodas |
Taip |
Taip |
10–20 % |
— |
10–4-0,5 Pa |
1.3. BANDYMO ESMĖ
Apskritai, garų slėgis nustatomas įvairioje temperatūroje. Ribotame temperatūros intervale grynos medžiagos garų slėgio logaritmas yra tiesinė atvirkštinės termodinaminės temperatūros funkcija pagal supaprastintą Klapeirono-Klauzijaus lygtį:
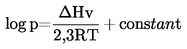
čia:
|
p |
= |
garų slėgis Paskaliais |
|
ΔHv |
= |
garavimo šiluma J mol–1 |
|
R |
= |
universalioji dujų konstanta, 8,314 J mol–1 K–1 |
|
T |
= |
temperatūra K. |
1.4. ETALONINĖS MEDŽIAGOS
Etaloninių medžiagų naudoti nebūtina. Visų pirma, jos skirtos kartkarčiais patikrinti metodo taikomąsias savybes ir lyginti skirtingais metodais gautus rezultatus.
1.5. METODŲ APRAŠYMAS
1.5.1. Dinaminis metodas (Cottrell‘o metodas)
1.5.1.1. Metodo esmė
Garų slėgis nustatomas matuojant medžiagos virimo temperatūrą esant įvairiems apibrėžtiems slėgiams nuo maždaug 103 iki 105 Pa. Be to, šis metodas rekomenduojamas virimo temperatūrai nustatyti. Šiuo atveju jis tinka iki 600 K. Dėl skysčių stulpelio hidrostatinio slėgio jų virimo temperatūra 3–4 cm gylyje yra maždaug 0,1 °C aukštesnė nei paviršiuje. Taikant Cottrell‘o metodą (4), termometras laikomas garuose virš skysčio paviršiaus, o verdantis skystis visą laiką siurbiamas virš termometro burbuliuko. Burbuliuką dengia skysčio, esančio pusiausvyroje su garais atmosferos slėgyje, sluoksnis. Taigi termometras rodo tikrąją virimo temperatūrą, kai nėra paklaidos dėl perkaitinimo arba hidrostatinio slėgio. Siurblys, kurį pirmą kartą panaudojo Cottrell‘as, pavaizduotas 1 paveiksle. Verdantis skystis yra A mėgintuvėlyje. Į jo dugną įlydyta platinos viela B užtikrina tolygų virimą. Šoninis vamzdelis C sujungtas su kondensatoriumi, o apvalkalas D apsaugo termometrą E nuo šalto kondensato. Kai skystis A mėgintuvėlyje verda, piltuvu sugauti burbuliukai ir skystis pilami nuo dviejų siurblio F atšakų ant termometro burbuliuko.
|
1 paveikslas
|
2 paveikslas
|
Cottrell‘o siurblys (4)
|
A: |
Termopora |
|
B: |
Vakuumo buferinis tūris |
|
C: |
Slėgmatis |
|
D: |
Vakuumas |
|
E: |
Matavimo taškas |
|
F: |
Kaitinimo elementas c.a. 150 W |
1.5.1.2. Aparatūra
Labai tikslus aparatas, taikantis Cottrell‘o principą, pavaizduotas 2 paveiksle. Jį sudaro vamzdis su virintuvo skyriumi apatinėje dalyje, aušintuvu vidurinėje dalyje ir išleidžiamąja anga bei junge viršutinėje dalyje. Cottrell‘o siurblys įstatomas į virintuvo dalį, kaitinamą elektriniu kaitintuvu. Temperatūra matuojama dengtąja termopora arba varžiniu termometru, įstatomu per jungę viršuje. Išleidžiamoji anga jungiama su slėgio reguliavimo sistema. Pastarąją sudaro vakuuminis siurblys, buferinis tūris, slėgio stabilizatorius azotui, kuriuo reguliuojamas slėgis, įleisti ir slėgmatis.
1.5.1.3. Darbo eiga
Medžiaga dedama į virintuvo skyrių. Gali kilti problemų, jei kietosios medžiagos ne milteliai, bet jas kartais galima išspręsti šildant aušinimo gaubtą. Jungės vietoje aparatūra sandariai uždaroma ir medžiaga nudujinama. Taikant šį metodą, negalima matuoti putojančių medžiagų garų slėgio.
Nustatomas mažiausias reikiamas slėgis ir įjungiamas kaitinimas. Tuo pat metu prie savirašio prijungiamas temperatūros jutiklis.
Pusiausvyra pasiekiama, kai pastoviame slėgyje užrašoma pastovi virimo temperatūra. Ypač reikia stengtis išvengti verdančio skysčio šuolių. Be to, ant aušintuvo turi įvykti visiška kondensacija. Nustatant žemos lydymosi temperatūros kietųjų medžiagų garų slėgį, reikėtų žiūrėti, kad neužsikimštų kondensatorius.
Užrašius šią pusiausvyrinę temperatūrą, nustatomas didesnis slėgis. Procesas tęsiamas tuo pačiu būdu tol, kol pasiekiamas 105 Pa slėgis (viso maždaug nuo 5 iki 10 matavimo taškų). Siekiant patikrinti, pusiausvyrinės temperatūros vertės turi būti nustatytos mažinant slėgį.
1.5.2. Statinis metodas
1.5.2.1. Metodo esmė
Taikant statinį metodą (5), tam tikroje temperatūroje nustatomas termodinaminę pusiausvyrą atitinkantis garų slėgis. Šis metodas tinka medžiagoms ir daugiakomponenčiams skysčiams bei kietosioms medžiagoms intervale nuo 10–1 iki 105 Pa, be to, jei būtų imtasi atsargumo priemonių, intervale nuo 1 iki 10 Pa.
1.5.2.2. Aparatūra
Įrangą sudaro pastovios temperatūros vonia (preciziškumas ±0,2 K), indas medžiagai, prijungtas prie vakuumo, slėgmatis ir sistema slėgiui reguliuoti. Ėminio kamera (3a paveikslas) prijungiama prie vakuumo per vožtuvą ir diferencinį slėgmatį (U vamzdelį, pripildytą atitinkamo slėgmačio skysčio), kuris naudojamas kaip nulio rodytuvas. Diferenciniam slėgmačiui pildyti tinka gyvsidabris, polisiloksanai ir ftalatai, atsižvelgiant į slėgio intervalą ir bandomosios medžiagos chemines savybes. Tačiau, jei įmanoma, dėl aplinkos problemų reikėtų vengti naudoti gyvsidabrį. Bandomoji medžiaga neturi pastebimai tirpti U vamzdelio skystyje arba su juo reaguoti. Vietoj U vamzdelio galima naudoti slėgmatį (3b paveikslas). Slėgmačiui pildyti tinka gyvsidabris slėgio intervale nuo normalaus iki 102 Pa slėgio, o polisiloksaniniai skysčiai ir ftalatai – nuo mažesnio kaip 102 Pa iki 10 Pa slėgio. Yra kiti slėgmačiai mažesniam kaip 102 Pa slėgiui matuoti ir kaitinamos membranos talpiniai manometrai tinka matuoti net mažesnį kaip 10–1 Pa slėgį. Matuojama indo su ėminiu išorinės sienelės temperatūra arba temperatūra pačiame inde.
1.5.2.3. Darbo eiga
Naudodami 3a paveiksle pavaizduotą aparatą, pripildykite U vamzdelį pasirinktu skysčiu, kuris turi būti nudujintas aukštesnėje temperatūroje prieš užrašant rodmenis. Bandomoji medžiaga dedama į aparatą ir nudujinama žemesnėje temperatūroje. Jei ėminys daugiakomponentis, temperatūra turėtų būti pakankamai žema, kad negalėtų pakisti medžiagos sudėtis. Pusiausvyra greičiau pasiekiama maišant. Ėminį galima atšaldyti skystu azotu arba sausu ledu, tačiau reikėtų imtis priemonių išvengti oro drėgmės arba siurblio skysčio kondensacijos. Atidarius ėminio indo vožtuvą, kelias minutes siurbiama orui pašalinti. Prireikus nudujinimas kartojamas kelis kartus.
|
3a paveikslas
|
3b paveikslas
|
Kai uždarius vožtuvą ėminys kaitinamas, garų slėgis didėja. Tai keičia skysčio U vamzdelyje pusiausvyrą. Jai atstatyti į aparatą leidžiamas azotas arba oras tol, kol slėgio skirtumo rodytuvas vėl rodo nulį. Pusiausvyrai pasiekti būtinas slėgis gali būti matuojamas slėgmačiu arba didesnio preciziškumo prietaisu. Šis slėgis atitinka medžiagos garų slėgį matuojamoje temperatūroje. Naudojant 3 b paveiksle pavaizduotą aparatą, garų slėgis rodomas tiesiogiai.
Garų slėgis nustatomas atitinkamai mažiems temperatūros intervalams (viso maždaug nuo 5 iki 10 matavimo taškų) iki reikiamos aukščiausios temperatūros.
Kaip tikrinimo priemonė, turi būti pakartotinai gauti rodmenys mažinant temperatūrą. Jei kartotinių matavimų rodmenys neatitinka didėjančios temperatūros kreivei gautų rodmenų, to priežastimi gali būti šios aplinkybės:
|
i) |
ėminyje vis dar yra oro (pvz., labai klampių medžiagų atveju) arba žemos virimo temperatūros medžiagų, kuri arba kurios išsiskiria kaitinant; |
|
ii) |
vyksta medžiagos cheminė reakcija tiriamame temperatūros intervale (pvz., skilimas, polimerizacija). |
1.5.3. Izoteniskopo metodas
1.5.3.1. Metodo esmė
Izoteniskopas (6) pagrįstas statinio metodo principu. Taikant metodą, ėminys dedamas į pastovios temperatūros kolbutę, jungiamą su slėgmačiu ir vakuuminiu siurbliu. Lakesnės nei medžiaga priemaišos šalinamos nudujinant sumažintame slėgyje. Ėminio garų slėgis pasirinktoje temperatūroje pusiausvirinamas matuojamu inertiniu dujų slėgiu. Izoteniskopas buvo sukurtas tam tikrų skystųjų angliavandenilių garų slėgiui matuoti, bet jis tinka ir kietosioms medžiagoms tirti. Metodas paprastai netinka daugiakomponentėms sistemoms. Rezultatų paklaidos yra mažos tik tokiu atveju, jei ėminiai turi nelakių priemaišų. Rekomenduojamas intervalas nuo 102 iki 105 Pa.
1.5.3.2. Aparatūra
Matavimo įtaiso pavyzdys pavaizduotas 4 paveiksle. Visą aprašymą galima rasti ASTM D 2879–86 (6).
1.5.3.3. Darbo eiga
Skysčių atveju pati medžiaga naudojama kaip diferencinio slėgmačio skystis. Į izoteniskopą įpilama skysčio, kurio kiekio pakanka kolbutei ir trumpajai slėgmačio atšakai pripildyti. Izoteniskopas jungiamas prie vakuumavimo sistemos ir išsiurbus orą pripildomas azoto. Sistemos išsiurbimas ir prapūtimas kartojamas du kartus deguonies likučiui pašalinti. Pripildytas izoteniskopas dedamas į horizontalią padėtį, taigi ėminys plonu sluoksniu pasklinda ėminio kolbutėje ir slėgmatyje. Sistemos slėgis sumažinamas iki 133 Pa ir ėminys iš lėto kaitinamas tol, kol pradeda virti (šalinamos ištirpusios dujos). Izoteniskopas statomas taip, kad ėminys vėl subėgtų į kolbutę ir užpildytų trumpąją slėgmačio atšaką. 133 Pa slėgis nekeičiamas. Ištemptas kolbutės smaigalys kaitinamas silpna liepsna tol, kol susidarę ėminio garai išsiplečia tiek, kad dalis ėminio išstumiama iš viršutinės kolbutės dalies ir slėgmačio atšakos į slėgmatį, sudarydami garais užpildytą ir azoto neturinčią erdvę. Izoteniskopas dedamas į pastovios temperatūros vonią ir azoto slėgis sulyginamas su ėminio slėgiu. Esant pusiausvyrai, azoto slėgis atitinka medžiagos garų slėgį.
4 paveikslas
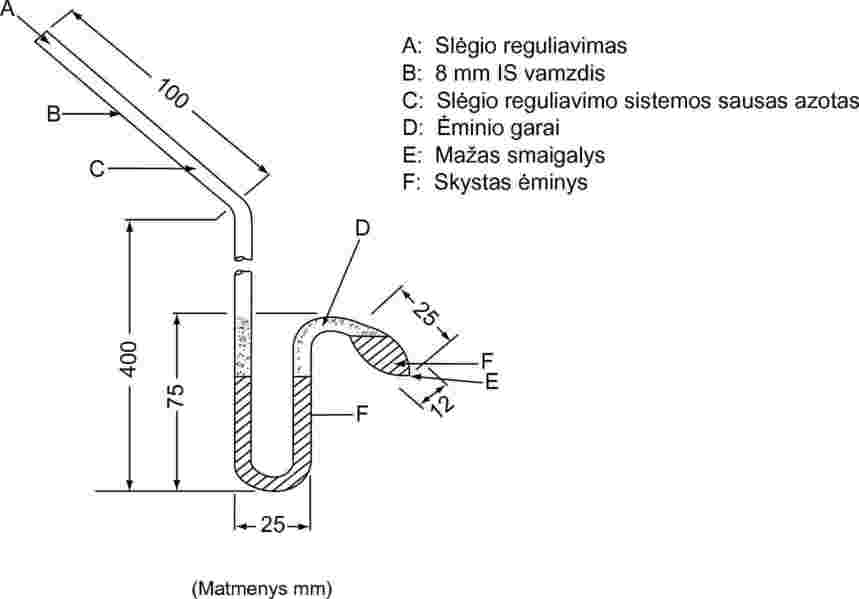
Kietųjų medžiagų atveju naudojami slėgmačio skysčiai, pvz., polisiloksaniniai skysčiai arba ftalatai, atsižvelgiant į taikomus slėgio ir temperatūros intervalus. Nudujintas slėgmačio skystis supilamas į izoteniskopo ilgosios atšakos pastorintą vietą. Tiriama kietoji medžiaga dedama į ėminio kolbutę ir nudujinama padidintoje temperatūroje. Izoteniskopas palenkiamas, kad slėgmačio skystis galėtų tekėti į U vamzdelį.
1.5.4. Efuzijos metodas: garų slėgio pusiausvyra (7)
1.5.4.1. Metodo esmė
Bandomosios medžiagos ėminys kaitinamas mažoje krosnyje ir dedamas po gaubtu, iš kurio išsiurbiamas oras. Krosnis uždengiama dangčiu, kuriame yra mažos žinomo skersmens skylutės. Per vieną iš skylučių išeinantys medžiagos garai nukreipiami į svarstyklių, kurios irgi yra po išsiurbtu gaubtu, lėkštę. Pagal kai kurias schemas svarstyklių lėkštė yra apgaubta šaldymo kamera, kuri sklaido šilumą į išorę tik šiluminio laidumo dėka, ir aušinama tik spinduliavimu, taigi išeinantys garai kondensuojasi ant lėkštės. Garų srauto kinetinė energija veikia lėkštę kaip jėga. Garų slėgis gali būti gautas dviem būdais: tiesiogiai pagal svarstyklių lėkštę veikiančią jėgą ir dar pagal garavimo spartą, taikant Hertzo-Knudseno lygtį (2):
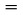
čia:
|
G |
= |
garavimo sparta (kg s–1 m–2) |
|
M |
= |
molinė masė (g mol–1) |
|
T |
= |
temperatūra (K) |
|
R |
= |
universalioji dujų konstanta (J mol–1 K–1) |
|
P |
= |
garų slėgis (Pa) |
Rekomenduojamas intervalas yra nuo 10–3 iki 1 Pa.
1.5.4.2. Aparatūra
Bendroji aparatūros schema pavaizduota 5 paveiksle.
5 paveikslas
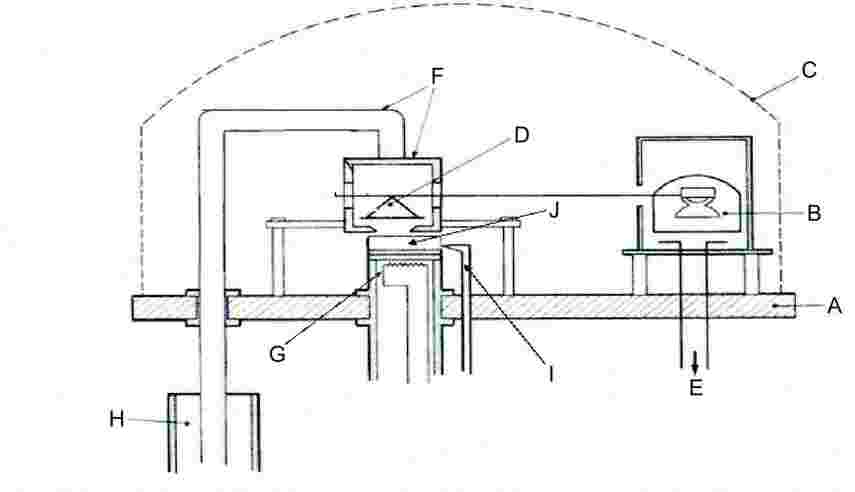
|
A: |
Pagrindo plokštė |
F: |
Šaldymo kamera ir šaldymo strypas |
|
B: |
Judamosios ritės prietaisas |
G: |
Garinimo krosnis |
|
C: |
Gaubtas |
H: |
Diuaro indas su skystu azotu |
|
D: |
Svarstyklės ir jų lėkštė |
I: |
Ėminio temperatūros matuoklis |
|
E: |
Vakuumetras |
J: |
Bandomoji medžiaga |
1.5.5. Efuzijos metodas: Knudseno kamera
1.5.5.1. Metodo esmė
Taikant metodą, įvertinama bandomosios medžiagos masė, per laiko vienetą ištekanti garų pavidalu iš Knudseno kameros (8) per mažą angą ypač didelio vakuumo sąlygomis. Ištekančių garų masę galima nustatyti pagal kameros masės mažėjimą arba kondensuojant garus žemoje temperatūroje ir išgaravusios medžiagos kiekį nustatant chromatografijos metodu. Garų slėgis apskaičiuojamas, taikant Hertz-Knudsen lygtį (žr. 1.5.4.1 skirsnį) ir pataisos faktorius, susietus su aparatūros parametrais (9). Rekomenduojamas intervalas yra nuo 10–10 iki 1 Pa (10)(11)(12)(13)(14).
1.5.5.2. Aparatūra
Bendroji aparatūros schema pavaizduota 6 paveiksle.
6 paveikslas

|
1: |
Vakuumo jungtis |
7: |
Užsukamas dangtelis |
|
2: |
Lizdai platinos varžiniam termometrui arba temperatūrai matuoti ir reguliuoti |
8: |
Sparnuotosios veržlės |
|
3: |
Vakuuminio indo dangtis |
9: |
Varžtai |
|
4: |
Žiedinis tarpiklis |
10: |
Efuzijos kameros iš nerūdijančiojo plieno |
|
5: |
Vakuuminis indas iš aliuminio |
11: |
Kaitinimo elementas |
|
6: |
Įtaisas efuzijos kameroms įdėti ir išimti |
|
|
1.5.6. Efuzijos metodas: izoterminė termogravimetrija
1.5.6.1. Metodo esmė
Metodas pagrįstas bandomosios medžiagos pagreitinto garavimo aukštesnėje temperatūroje ir aplinkos slėgyje spartos nustatymu, taikant termogravimetriją (10)(15)(16)(17)(18)(19)(20). Garavimo spartos vertės vT gaunamos pasirinktą junginį veikiant iš lėto tekančių inertinių dujų atmosfera ir nustatant masės mažėjimą per atitinkamą laikotarpį, esant apibrėžtai pastoviai absoliučiajai temperatūrai T. Garų slėgio vertės pT apskaičiuojamos pagal vT vertes, taikant tiesinę garų slėgio logaritmo ir garavimo spartos logaritmo funkciją. Prireikus galima ekstrapoliuoti 20 ir 25 °C temperatūros vertėms, atliekant regresinę log pT kaip 1/T funkcijos analizę. Šis metodas tinka medžiagoms, kurių garų slėgio vertės yra 10–10 Pa (10–12 mbar) ir grynumas kiek įmanoma arčiau 100 %, kad būtų išvengta išmatuoto masės sumažėjimo neteisingo aiškinimo.
1.5.6.2. Aparatūra
Bandymo įrangos bendroji schema pavaizduota 7 paveiksle.
7 paveikslas

Ėminio laikiklio plokštė, pakabinta ant mikrosvarstyklių reguliuojamos temperatūros kameroje, nupučiama sauso azoto srove, kuri išneša bandomąją medžiagą. Iš kameros išėjęs dujų srautas valomas sorbcijos bloke.
1.5.6.3. Darbo eiga
Šiurkštinto paviršiaus stiklo plokštė padengiama vienalyčiu bandomosios medžiagos sluoksniu. Jei tiriamos kietosios medžiagos, plokštė tolygiai suvilgoma medžiagos tirpalu atitinkamame tirpiklyje ir džiovinama inertinių dujų atmosferoje. Matavimui atlikti dengtoji plokštė kabinama į termogravimetrinį analizatorių ir nepertraukiamai matuojamas jos masės mažėjimas kaip laiko funkcija.
Garavimo sparta vT tam tikroje temperatūroje apskaičiuojama pagal ėminio masės sumažėjimą Δm taikant lygtį:
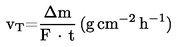
čia F – plotas, padengtas bandomąja medžiaga, paprastai ėminio plokštės paviršiaus plotas, ir t – laikas, per kurį masė sumažėja Δm.
Garų slėgis pT apskaičiuojamas kaip garavimo spartos vT funkcija:
log pT = C + D log vT
čia C ir D yra konstantos, būdingos naudojamai bandymo įrangai, susijusios su matavimo kameros skersmeniu ir dujų srautu. Šios konstantos turi būti nustatytos vieną kartą matuojant žinomo garų slėgio junginių rinkinį ir atliekant log pT kaip log vT funkcijos regresiją (11)(21)(22).
Santykis tarp garų slėgio pT ir absoliučiosios temperatūros T aprašomas lygtimi:
log pT = A + B 1/T
čia A ir B yra konstantos, gautos atliekant log pT pagal 1/T regresiją. Pagal šią lygtį garų slėgis gali būti apskaičiuotas ekstrapoliavimo būdu bet kuriai kitai temperatūrai.
1.5.7. Dujų soties metodas (23)
1.5.7.1. Metodo esmė
Žinomo tūrio kambario temperatūros inertinių dujų srautas teka per bandomosios medžiagos ėminį arba virš jo tokiu greičiu, kuris užtikrintų dujų prisotinimą. Labai svarbu pasiekti dujų fazės sotį. Pernešta medžiaga sulaikoma, dažniausiai sorbentu, ir nustatomas jos kiekis. Vietoj garų sulaikymo ir vėlesnės analizės kiekybiniam perneštos medžiagos kiekio nustatymui galima taikyti nuosekliai atliekamos analizės metodus, pvz., dujų chromatografiją. Garų slėgis apskaičiuojamas darant prielaidą, kad dujoms tinka idealiųjų dujų dėsnis ir visas dujų mišinio slėgis yra lygus mišinį sudarančių komponentų slėgių sumai. Bandomosios medžiagos dalinis slėgis, t. y. garų slėgis, apskaičiuojamas pagal išmatuotą visą dujų tūrį ir perneštos medžiagos masę.
Dujų soties metodas tinka kietosioms arba skystosioms cheminėms medžiagoms. Jis gali būti taikomas garų slėgiui iki 10–10 Pa (10)(11)(12)(13)(14). Metodo patikimumas didžiausias, kai garų slėgis yra mažesnis kaip 103 Pa. Kai jis yra didesnis kaip 103 Pa, paprastai gaunamos padidintos garų slėgio vertės, galbūt dėl aerozolių susidarymo. Kadangi garų slėgio matavimai atliekami kambario temperatūroje, nėra būtina ekstrapoliuoti aukštesnės temperatūros vertėms gautus duomenis, taigi išvengiama aukštai temperatūrai gautų duomenų ekstrapoliacijos, kuri dažnai gali būti didelių paklaidų priežastimi.
1.5.7.2. Aparatūra
Taikant šį metodą būtina naudoti pastovios temperatūros kamerą. 8 paveiksle pateiktame kameros eskize pavaizduota kamera, turinti po tris kietųjų ir skystųjų ėminių talpyklas, todėl įmanoma kietojo arba skystojo ėminio analizę kartoti tris kartus. Temperatūra reguliuojama ±0,5 °C arba geresniu tikslumu.
8 paveikslas
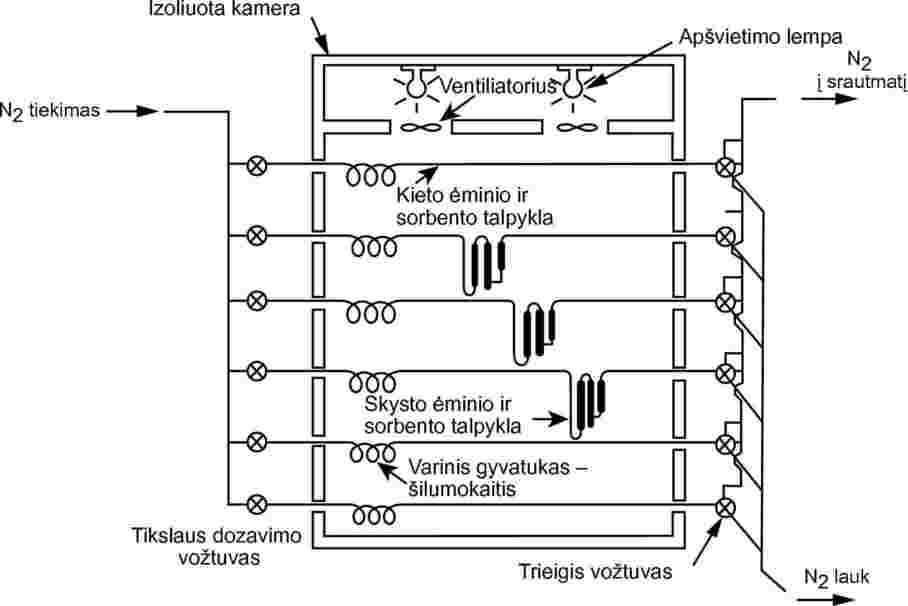
Dažniausiai kaip inertinis nešiklis naudojamos azoto dujos, bet kartais gali tekti naudoti kitas dujas (24). Nešiklio dujos turi būti sausos. Dujų srautas dalijamas į 6 srautus, reguliuojamus adatiniais vožtuvais (anga maždaug 0,79 mm), ir teka į kamerą per 3,8 mm v. s. varinius vamzdžius. Pasiekus temperatūros pusiausvyrą, dujos teka per ėminį, gaudyklę su sorbentu ir išleidžiamos iš kameros.
Kietėji ėminiai dedami į 5 mm v. s. stiklo vamzdžius tarp stiklo vatos kamščių (žr. 9 paveikslą). 10 paveiksle pavaizduota skystojo ėminio talpykla ir sorbento sistema. Geriausi atkuriamumo rezultatai gaunami taikant skysčių garų slėgio matavimo metodą, kai stiklo arba inertinio sorbento, pvz., kvarco, karoliukai padengiami skysčiu ir šiais karoliukais pripildoma talpyklą. Pagal kitą būdą nešiklio dujos gali būti leidžiamos per didelio akytumo sukepintą stiklą ir barbotuojamos per skystos bandomosios medžiagos kolonėlę.
|
9 paveikslas
|
10 paveikslas
|
Sorbento sistemą sudaro priekinis ir atsarginis sorbento skyriai. Kai garų slėgis yra labai mažas, sorbentu sulaikomas tik labai mažas kiekis ir rimta problema gali būti adsorbcija ant stiklo vatos bei stiklinių vamzdžių.
Kietu CO2 aušinamos gaudyklės yra kitas efektyvus būdas medžiagos garams surinkti. Jos nesudaro jokio priešslėgio prisotinimo kolonėlėje, be to, labai lengva pašalinti sulaikytą medžiagą.
1.5.7.3. Darbo eiga
Ištekančių nešiklio dujų srautas matuojamas kambario temperatūroje. Bandymo metu srautas dažnai tikrinamas, siekiant užtikrinti tikslų visą nešiklio dujų tūrį. Geriau būtų visą laiką jį matuoti masės srautmačiu. Dujų fazei prisotinti gali būti reikalinga gana didelė sąlyčio trukmė, taigi visiškai mažos dujų srauto vertės (25).
Po bandymo priekinis ir atsarginis sorbento skyriai analizuojami atskirai. Kiekviename skyriuje esantis junginys desorbuojamas tirpikliu. Atliekama gautų tirpalų kiekybinė analizė iš kiekvieno skyriaus desorbuotai masei nustatyti. Analizės metodo (ir sorbento bei desorbcijai naudojamo tirpiklio) pasirinkimą lemia bandomosios medžiagos prigimtis. Desorbcijos efektyvumui nustatyti žinomas ėminio kiekis švirkščiamas ant sorbento, desorbuojamas ir atgautas kiekis analizuojamas. Svarbu patikrinti desorbcijos efektyvumą esant koncentracijai, kuri būtų lygi arba beveik lygi ėminio koncentracijai bandymo sąlygomis.
Norint įsitikinti, ar nešiklio dujos yra prisotintos bandomąja medžiaga, naudojami trys skirtingi dujų srautai. Jei apskaičiuota garų slėgio vertė nesikeičia dėl srauto pokyčio, daroma prielaida, kad dujos yra prisotintos.
Garų slėgis apskaičiuojamas pagal lygtį:
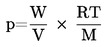
čia:
|
p |
= |
garų slėgis (Pa) |
|
W |
= |
išgaravusios bandomosios medžiagos masė (g) |
|
V |
= |
sočiųjų garų tūris (m3) |
|
R |
= |
universalioji dujų konstanta 8,314 (J mol–1 K–1) |
|
T |
= |
temperatūra (K) |
|
M |
= |
bandomosios medžiagos molinė masė (g mol–1) |
Turi būti daroma matuojamų tūrių pataisa dėl srautmačio ir prisotinimo kolonėlės slėgio ir temperatūros skirtumo.
1.5.8. Sukamasis rotorius
1.5.8.1. Metodo esmė
Taikant šį metodą, naudojamas sukamojo rotoriaus klampos matuoklis, kurio matavimo elementas yra magnetiniame lauke pakabintas mažas plieninis rutuliukas, sukamųjų laukų verčiamas suktis (26)(27)(28). Apsisukimų dažnis gali būti išmatuotas matavimo ritėmis. Kai rutuliukas pasiekia nustatytą apsisukimų dažnį, paprastai apie 400 apsisukimų per sekundę, žadinimas nutraukiamas ir dažnis pradeda mažėti dėl dujų trinties. Apsisukimo dažnio mažėjimas matuojamas kaip laiko funkcija. Garų slėgis nustatomas pagal plieninio rutuliuko lėtėjimą, kuris yra slėgio funkcija. Rekomenduojamas intervalas yra nuo 10–4 iki 0,5 Pa.
1.5.8.2. Aparatūra
Bandymo įrenginio schema pavaizduota 11 paveiksle. Matavimo galvutė įdedama į gaubtą, kurio pastovi temperatūra reguliuojama 0,1 °C tikslumu. Ėminio indas dedamas į atskirą gaubtą, kurio temperatūra irgi reguliuojama 0,1 °C tikslumu. Visų kitos įrenginio dalių temperatūra yra aukštesnė, siekiant išvengti kondensacijos. Visas aparatas yra prijungtas prie vakuumo sistemos.
11 paveikslas

2. DUOMENYS IR ATASKAITOS RENGIMAS
2.1. DUOMENYS
Garų slėgis, gautas taikant bet kurį iš pirmiau pateiktų metodų, turėtų būti nustatytas bent dviem temperatūros vertėms. Siekiant patikrinti garų slėgio kreivės tiesiškumą, pageidautina slėgį nustatyti trims arba daugiau verčių intervale nuo 0 iki 50 °C. Vietoje temperatūros intervalo nuo 0 iki 50 °C efuzijos metodo (Knudseno kamera ir izoterminė termogravimetrija) ir dujų soties metodo atveju rekomenduojamas matavimo temperatūros intervalas nuo 120 iki 150 °C.
2.2. BANDYMŲ ATASKAITA
Bandymų ataskaitą turi sudaryti ši informacija:
|
— |
taikytas metodas, |
|
— |
tiksli medžiagos specifikacija (identifikavimo duomenys ir priemaišos) ir pradinio gryninimo pakopa, jei taikoma, |
|
— |
bent dvi būtinos garų slėgio ir temperatūros vertės, geriau trys arba daugiau, intervale nuo 0 iki 50 °C (arba nuo 120 iki 150 °C), |
|
— |
bent viena iš temperatūros verčių turėtų būti lygi 25 °C arba žemesnė, jei techniškai įmanoma pagal pasirinktą metodą, |
|
— |
visi pradiniai duomenys, |
|
— |
log p kaip 1/T funkcijos kreivė, |
|
— |
garų slėgio 20 arba 25 °C įvertis. |
Jei stebimas virsmas (būsenos pokytis, skilimas), turėtų nūti pažymėta ši informacija:
|
— |
virsmo pobūdis, |
|
— |
virsmo temperatūra atmosferos slėgyje, |
|
— |
garų slėgis 10 ir 20 °C žemiau virsmo temperatūros bei 10 ir 20 °C aukščiau šios temperatūros (išskyrus virsmą iš kietosios į dujinę būseną). |
Ataskaitoje turi būti pateikta visa rezultatams interpretuoti būtina informacija ir pastabos, ypač apie priemaišas ir medžiagos fizikinę būseną.
3. LITERATŪRA
|
(1) |
Official Journal of the European Communities L 383 A, 26–47 (1992). |
|
(2) |
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., and Vodar, B., Eds., Butterworths, London. |
|
(3) |
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York. |
|
(4) |
Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York. |
|
(5) |
NF T 20–048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method. |
|
(6) |
ASTM D 2879–86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
(7) |
NF T 20–047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method. |
|
(8) |
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593. |
|
(9) |
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173. |
|
(10) |
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521–532. |
|
(11) |
Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000) |
|
(12) |
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22–28 |
|
(13) |
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269–278. |
|
(14) |
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117–122. |
|
(15) |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137–147. |
|
(16) |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393–400. |
|
(17) |
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161–168. |
|
(18) |
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27–31. |
|
(19) |
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300–310. |
|
(20) |
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512–20. |
|
(21) |
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range -25 °C to 150 °C. |
|
(22) |
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002) |
|
(23) |
40 CFR, 796. (1993). pp 148–153, Office of the Federal Register, Washington DC |
|
(24) |
Rordorf B.F. (1985). Thermochimica Acta 85, 435. |
|
(25) |
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375. |
|
(26) |
Messer G., Röhl, P., Grosse G., and Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440. |
|
(27) |
Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642. |
|
(28) |
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715. |
(1) Naudojant talpinį slėgmatį.
Priedėlis
Apytikrio įvertinimo metodas
ĮVADAS
Apytikriai apskaičiuotos vertės gali būti taikomos:
|
— |
nuspręsti, kuris iš bandymo metodų tinka; |
|
— |
gauti įverčiui arba ribinei vertei tais atvejais, kai bandymo metodas negali būti taikomas dėl techninių priežasčių. |
APYTIKRIO ĮVERTINIMO METODAS
Skysčių ir kietųjų medžiagų garų slėgis gali būti apytikriai įvertintas, taikant modifikuotą Watson koreliaciją (a). Vieninteliai reikalingi bandymų duomenys – virimo temperatūra normaliajame slėgyje. Metodas tinka slėgio intervalui nuo 105 Pa iki 10–5 Pa.
Detali informacija apie metodą yra pateikta „Handbook of Chemical Property Estimation Methods“ (b). Be to, žr. OECD Environmental Monograph No.67 (c).
APSKAIČIAVIMO METODIKA
Garų slėgis apskaičiuojamas taip:

čia:
|
T |
= |
matavimo temperatūra, |
|
Tb |
= |
virimo temperatūra normaliajame slėgyje, |
|
PVP |
= |
garų slėgis temperatūroje T, |
|
ΔHVb |
= |
garavimo šiluma, |
|
ΔZb |
= |
spūdumo faktorius (įvertintas 0,97), |
|
m |
= |
empirinis faktorius, susietas su fizikine būsena matavimo temperatūroje. |
Toliau,

čia, KF – empirinis faktorius, skirtas atsižvelgti į medžiagos poliškumą. Kelių tipų junginių KF faktoriai yra pateikti (b) nuorodoje.
Duomenys labai dažnai pateikiami, nurodant virimo temperatūra sumažintame slėgyje. Tokiu atveju garų slėgis apskaičiuojamas taip:
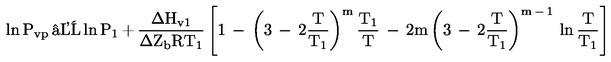
čia, T1 – virimo temperatūra sumažintame slėgyje P1.
ATASKAITA
Taikant įvertinimo metodą, į ataskaitą turi būti įtraukti išsamūs apskaičiavimo dokumentai.
LITERATŪRA
|
(a) |
Watson, K.M. (1943). Ind. Eng. Chem, 35, 398. |
|
(b) |
Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill. |
|
(c) |
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993). |
II PRIEDAS
|
A.22. |
PLAUŠELIŲ SKERSMENS ILGIO SVORINIS GEOMETRINIS VIDURKIS |
1. METODAS
1.1. ĮVADAS
Šiame metode aprašyta biriųjų dirbtinių mineralinių plaušelių (MMMF) skersmens ilgio svorinio geometrinio vidurkio (Length Weighted Geometric Mean Diameter – LWGMD) matavimo metodika. Kadangi LWGMD generalinės aibės vertės turės 95 % tikimybę būti tarp imties 95 % pasikliovimo lygmenų (LWGMD ± dviguba standartinės paklaidos vertė), ataskaitoje pateikta vertė (bandymo vertė) bus imties apatinio 95 % pasikliovimo rėžio vertė (t.y. LWGMD – dviguba standartinės paklaidos vertė). Metodas pagrįstas atnaujintu (1994 m. birželis) Saugos ir sveikatos agentūros (HSE) pramonei skirtos metodikos projektu, kuris buvo suderintas ECFIA ir HSE pasitarime Chesteryje 1993 m. rugsėjo 26 d. ir kuris buvo parengtas pagal antrąjį tarplaboratorinį tyrimą bei jam yra skirtas (1, 2). Šis matavimo metodas gali būti taikomas MMMF turinčių biriųjų medžiagų arba produktų plaušelių skersmeniui apibūdinti, įskaitant ugniai atsparios keramikos pluoštus (RCF), dirbtinius stiklo pluoštus (MMVF), kristalinius ir polikristalinius pluoštus.
Ilgio svorinis skaičiavimas yra būdas kompensuoti skersmens pasiskirstymą dėl ilgų plaušelių trūkinėjimo, imant medžiagos ėminius arba ją tvarkant. MMMF skersmens verčių pasiskirstymui matuoti naudojama geometrinė statistika (geometrinis vidurkis), kadangi šių skersmens verčių pasiskirstymui aproksimuoti naudojamas lognormalusis skirstinys.
Ilgio ir skersmens matavimas yra varginantis ir daug laiko užimantis procesas, tačiau jei būtų matuojami tik tie plaušeliai, kurie liečia be galo ploną liniją rastrinio elektroninio mikroskopo (SEM) regos lauke, tikimybė pasirinkti tam tikrą plaušelį proporcinga jo ilgiui. Kadangi taip atsižvelgiama į ilgį darant ilgio svorinius apskaičiavimus, vienintelis reikalingas matmuo yra skersmuo ir LWGMD – 2SE galima apskaičiuoti aprašytu būdu.
1.2. APIBRĖŽTYS
Dalelė: objektas, kurio ilgio ir pločio santykis yra mažesnis kaip 3:1.
Plaušelis: objektas, kurio ilgio ir pločio santykis (matmenų santykis) yra ne mažesnis kaip 3:1.
1.3. TAIKYMO SRITIS IR APRIBOJIMAI
Metodas skirtas tirti skersmens verčių pasiskirstymą, kai vidutinis medianinis skersmuo yra nuo 0,5 μm iki 6 μm. Galima matuoti didesnes skersmens vertes, jeigu būtų naudojamas mažesnis SEM didinimas, tačiau mažesnio skersmens plaušelių skirstiniams vis labiau pasireikštų metodo apribojimai, todėl rekomenduojama naudoti matavimus TEM (elektroniniu peršvietimo mikroskopu), jei skersmens medianinė vertė yra mažesnė kaip 0,5 μm.
1.4. BANDYMO METODO ESMĖ
Imamas tam tikras kiekis tipinių pluoštinių audinių arba supiltų biriųjų plaušelių kerno ėminių. Biriųjų plaušelių ilgis mažinamas juos sutrupinant būdu, ir gautas tipinis antrinis ėminys disperguojamas vandenyje. Alikvotinės dalys ekstrahuojamos ir filtruojamos per 0,2 μm akutes turintį polikarbonatinį filtrą ir ruošiamos tirti rastrinio elektroninio mikroskopo (SEM) metodais. Plaušelių skersmuo matuojamas esant ×10 000 arba didesniam ekrano didinimui (1), taikant linijų susikirtimo metodą nepaslinktajai skersmens medianinei vertei gauti. Apskaičiuojamas apatinis 95 % pasikliovimo intervalas (pagal vienpusį kriterijų) medžiagos plaušelių skersmens geometrinio vidurkio mažiausiai vertei gauti.
1.5. BANDYMO METODO APRAŠYMAS
1.5.1. Saugos įspėjimai
Turi būti kiek įmanoma sumažintas ore esančių plaušelių poveikis žmonėms, o su sausais plaušeliais turi būti dirbama tik traukos spintoje arba apsauginėje kameroje su pirštinėmis. Turi būti vykdomas periodinis personalo veikimo monitoringas kontrolės metodų efektyvumui tikrinti. Dirbant su MMMF būtina mūvėti vienkartines pirštines, kad mažiau būtų dirginama oda ir būtų išvengta kryžminio užteršimo..
1.5.2. Aparatūra/įranga
|
— |
Presai ir presformos (kuriose galima gauti 10 MPa); |
|
— |
0,2 μm akučių kapiliarinių akučių filtrai iš polikarbonato (25 mm skersmens); |
|
— |
5 μm akučių membraninis filtras iš celiuliozės esterių, naudojamas kaip atraminis filtras; |
|
— |
stiklinis filtravimo aparatas (arba vienkartinės filtravimo sistemos), pritaikytas 25 mm skersmens filtrams (pvz., Millipore stiklinis mikroanalizės rinkinys, tipas Nr. XX10 025 00); |
|
— |
šviežiai distiliuotas vanduo, filtruotas per 0,2 μm akučių filtrą mikroorganizmams pašalinti; |
|
— |
dulkinamojo dengimo įrenginys su aukso arba aukso/paladžio taikiniu; |
|
— |
rastrinis elektroninis mikroskopas, kurio skyra būtų iki 10 nm ir turėtų ×10 000 didinimą; |
|
— |
įvairios priemonės: mentelės, 24 tipo skalpelis, pincetas, SEM mėgintuvėliai, grafitiniai klijai arba grafitinė lipnioji juosta, sidabriniai klijai; |
|
— |
ultragarsinis zondas arba stalinė ultragarsinė vonia; |
|
— |
kerno ėmiklis arba kamščių grąžtas, kerno mėginiams iš MMMF audinių lakštų imti. |
1.5.3. Bandymo eiga
1.5.3.1. Ėminių ėmimas
Audiniams ir šiluminės izoliacijos lakštams naudojamas 25 mm kerno ėmiklis arba kamščių grąžtas skerspjūvio ėminiams paimti. Ėminių ėmimo vietos turi būti vienodai išdėstytos skersai nedidelio ilgio lakštų arba ėminiai imami iš atsitiktinių vietų, jei yra didelio ilgio lakštų atraižos. Tokia pačia įranga galima imti atsitiktinius biriųjų plaušelių ėminius.. Jei įmanoma, turi būti imami šeši ėminiai, siekiant įvertinti erdvinius biriosios medžiagos nukrypimus.
Šeši kerno ėminiai trupinami 50 mm skersmens presformoje esant 10 MPa. Medžiaga sumaišoma mentele ir iš naujo suspaudžiama esant 10 MPa. Medžiaga išimama iš presformos ir laikoma uždarytame stikliniame butelyje.
1.5.3.2. Ėminių ruošimas
Prireikus organinį rišiklį galima pašalinti, jei plaušeliai maždaug vieną valandą kaitinami 450 °C temperatūros krosnyje.
Ėminys supilamas į kūgį ir taikomas ketvirčiavimo metodas jam toliau padalyti (šis veiksmas turi būti daromas traukos spintoje).
Nedidelis ėminio kiekis (< 0,5 g) mentele įdedamas į 100 ml šviežiai distiliuoto vandens, filtruoto per 0,2 μm membraninį filtrą (galima naudoti kitus ypač švaraus vandens šaltinius, jei būtų įrodytas jų tinkamumas). Ėminys kruopščiai disperguojamas ultragarsiniu zondu, dirbančiu 100 W galia ir reguliuojamu kavitacijai gauti. (Jei zondo nėra, taikomas šis metodas: kelis kartus indas purtomas ir apverčiamas 30 s; penkias minutes veikiamas ultragarsu stalinėje ultragarsinėje vonioje; vėliau indas kelis kartus purtomas ir apverčiamas dar 30 s).
Iškart po plaušelių dispergavimo paimamos kelios alikvotinės dalys (pvz., trys 3, 6 ir 10 ml alikvotinės dalys) plačios angos pipete (2–5 ml tūrio).
Kiekviena alikvotinė dalis siurbiama vakuumu per 0,2 μm polikarbonatinį filtrą, uždėtą ant 5 µm akučių MEC atraminio filtro, naudojant cilindro formos 25 mm stiklinio filtro piltuvą. Į piltuvą įpilama maždaug 5 ml filtruoto distiliuoto vandens ir alikvotinė ėminio dalis lėtai lašinama iš pipetės į vandenį, pipetės galiuką laikant žemiau menisko. Supylus ėminį, pipetė ir filtro indas turi būti kruopščiai plaunami, nes ploni plaušeliai paprastai lieka ant paviršiaus.
Filtras atsargiai išimamas ir, prieš dedant į džiovinimo indą, atskiriamas nuo atsarginio filtro.
Ketvirtadalis arba pusė filtro su filtruotomis nuosėdomis pjaunama 24 tipo skalpeliu, naudojant supimo veiksmą. Išpjauta dalis kruopščiai tvirtinama prie SEM stovo lipnios grafitinės juostos gabaliuku arba grafitiniais klijais. Elektriniam kontaktui pagerinti bent trijose stovo ir filtro kraštų vietose užtepama sidabrinių klijų. Išdžiūvus klijams/sidabro klijams, ant nuosėdų paviršiaus užpurškiamas maždaug 50 nm aukso arba aukso/paladžio sluoksnis.
1.5.3.3. SEM kalibravimas ir darbas
1.5.3.3.1. Kalibravimas
SEM kalibravimas turi būti tikrinamas bent kartą per savaitę (geriau būtų kartą per dieną) sertifikuotu kalibravimo tinkleliu. Kalibravimas turi būti tikrinamas pagal sertifikuotą etaloną ir jei išmatuota vertė (SEM) neatitinka sertifikuotosios vertės ±2 % tikslumu, SEM reikia kalibruoti ir dar kartą tikrinti.
SEM turi būti įmanoma skirti bent 0,2 µm mažiausią matomą skersmenį, naudojant tikrąją ėminio matricą esant × 2 000 didinimui.
1.5.3.3.2. Darbas
SEM turi dirbti naudojant 10 000 didinimą (2), esant sąlygoms, užtikrinančioms gerą skyrą ir priimtiną vaizdą, kai mažas skleidimo greitis, pvz., 5 s kadrui. Nors skirtingų SEM veikimo reikalavimai gali skirtis, paprastai geriausiam matomumui ir skyrai gauti, kai tiriamos palyginti mažos molekulinės masės medžiagos, greitinimo įtampa turi būti 5–10 keV, nustatant mažą dėmės dydį ir trumpą darbinį atstumą. Kadangi daromi linijų kirtimo matavimai, turi būti naudojamas 0o polinkis perfokusavimui sumažinti arba, jei SEM turi eucentrinį staliuką, turi būti naudojamas eucentrinis darbinis atstumas. Galima naudoti mažesnį didinimą, jei medžiaga neturi mažų (mažo skersmens) plaušelių ir jei plaušelių skersmens vertės yra didelės (> 5 μm).
1.5.3.4. Dydžio nustatymas
1.5.3.4.1. Tyrimas ėminiui įvertinti, esant mažam didinimui
Ėminys iš pradžių turi būti tiriamas esant mažam didinimui, kad būtų galima rasti duomenų apie didelių plaušelių susikaupimą ir įvertinti plaušelių tankį. Jei susikaupimas yra per didelis, rekomenduojama ruošti naują ėminį.
Siekiant statistinio tikslumo, būtina matuoti tam tikrą mažiausią plaušelių skaičių, todėl didelis plaušelių tankis lyg ir būtų pageidautinas, kadangi tuštiems laukams tirti reikia daug laiko ir toks tyrimas nepadidina analizės duomenų. Tačiau jei filtras yra perkrautas, tampa sunku išmatuoti visus matuotinus plaušelius, ir maži plaušeliai gali likti nepastebėti, kadangi būtų paslėpti po dideliais plaušeliais.
Gali būti poslinkis į per didelių LWGMD įverčių pusę, jei plaušelių tankis būtų didesnis kaip 150 plaušelių kertamos linijos milimetrui. Iš kitos pusės, dėl mažos plaušelių koncentracijos pailgėja analizės laikas ir dažnai labiau apsimoka paruošti ėminį, kurio plaušelių tankis būtų netoli optimalaus, nei tęsti plaušelių skaičiavimą ant filtrų su maža koncentracija. Esant optimaliam plaušelių tankiui, skaičiuotinų plaušelių vidurkis turėtų būti vienas arba du plaušeliai laukuose su 5 000 didinimu. Vis dėlto optimalus tankis priklausys nuo plaušelių dydžio (skersmens), todėl būtina, kad operatorius naudotų ekspertų įvertinimą, siekiant nuspręsti, ar plaušelių tankis yra arti optimalaus ar ne.
1.5.3.4.2. Ilgio svorinis plaušelių skersmens verčių įvertinimas
Skaičiuojami tik tie plaušeliai, kurie liečia (arba kerta) (be galo) ploną liniją SEM ekrane. Šiam tikslui per ekrano vidurį brėžiama horizontali (arba vertikali) linija.
Kitaip galima pažymėti vieną tašką ekrano centre ir pradėti nepertraukiamai judėti viena kryptimi skersai filtro. Matuojamas ir užrašomas skersmuo visų plaušelių, turinčių didesnį kaip 3:1 matmenų santykį ir liečiančių arba kertančių šį tašką.
1.5.3.4.3. Plaušelių dydžio nustatymas
Rekomenduojama matuoti ne mažiau kaip 300 plaušelių. Kiekvienas plaušelis matuojamas tik kartą susikirtimo su linija taške arba ekrane nupieštame taške (arba arti susikirtimo taško, jei plaušelio kraštų nesimato). Jei pasitaiko nevienodo skerspjūvio plaušeliai, turi būti naudojamas matmuo, atitinkantis plaušelio vidutinį skersmenį. Reikia kruopščiai nustatyti plaušelių kraštą ir matuoti trumpiausią atstumą tarp plaušelio kraštų. Dydį galima matuoti žiūrint, arba ant saugomų vaizdų arba fotografijų. Rekomenduojama naudoti pusiau automatines vaizdo matavimo sistemas, kurios tiesiogiai siunčia duomenis į elektroninę lentelę, nes taip taupomas laikas, šalinamos užrašymo klaidos ir galima automatizuoti apskaičiavimus.
Esant mažam didinimui, tikrinami ilgų plaušelių galai, siekiant įsitikinti, ar jie nesusisuka ir dar kartą neatsiduria matavimo regos lauke ir yra matuojami tik vieną kartą.
2. DUOMENYS
2.1. REZULTATŲ APDOROJIMAS
Plaušelių skersmens vertės paprastai neatitinka normaliojo skirstinio. Tačiau padarius logaritminę transformaciją galima gauti skirstinį, kuris aproksimuotų normalųjį.
Apskaičiuojamas n plaušelių skersmens (D) natūraliojo logaritmo verčių (lnD) aritmetinis vidurkis (vidutinis lnD) ir standartinis nuokrypis (SDlnD).
|
|
(1) |
|
|
(2) |
Standartinės paklaidos vertei (SElnD) gauti standartinis nuokrypis dalijamas iš matavimų skaičiaus (n) kvadratinės šaknies.
|
|
(3) |
Geometrinio vidurkio bei dvigubos geometrinės standartinės paklaidos skirtumui gauti iš aritmetinio vidurkio vertės atimama dviguba standartinė paklaida ir apskaičiuojama šios vertės (vidurkio ir dvigubos standartinės paklaidos skirtumo) eksponentė.
|
|
(4) |
3. ATASKAITOS RENGIMAS
BANDYMO ATASKAITA
Bandymų ataskaitą turi sudaryti bent ši informacija:
|
— |
LWGMD – 2SE vertė; |
|
— |
visi nukrypimai, ypač galintys daryti įtaką rezultatų preciziškumui ir tikslumui, ir atitinkami duomenys jiems pagrįsti. |
4. NUORODOS
|
1. |
B. Tylee SOP MF 240. Health and Safety Executive. February 1999. |
|
2. |
G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994. |
(1) Šis didinimas nurodomas 3 µm plaušeliams, 6 µm plaušeliams labiau gali tikti × 5 000 didinimas.
(2) Apie 3 μm plaušelius žr. pirmiau pateiktą pastabą.
III PRIEDAS
|
B.46. |
IN VITRO ODOS DIRGINIMAS. REKONSTRUOTO ŽMOGAUS EPIDERMIO MODELIO BANDYMAS |
1. METODAS
1.1. ĮVADAS
Odos dirginimu vadinama grįžtamoji odos pažaida po bandomosios medžiagos uždėjimo ne ilgiau kaip 4 valandoms [kaip apibrėžta Jungtinių Tautų (JT) visuotinai suderintoje cheminių medžiagų klasifikavimo ir ženklinimo sistemoje (GHS)](1). Šis bandymo metodas apima in vitro procedūrą, pagal kurią, atsižvelgiant į informacijos reikalavimus, galima nustatyti cheminių medžiagų gebą dirginti odą atliekant atskirą pakaitinį bandymą kaip bandymų strategijos dalį, taikant įrodomosios vertės nustatymo metodą (2).
Odos dirginimas paprastai buvo vertinamas naudojant laboratorinius gyvūnus (žr. B.4 metodą)(3). Rūpinantis gyvūnų gerove, B.4 metodu galima nustatyti ėsdinamąjį ar dirginamąjį poveikį odai pagal nuosekliųjų bandymų strategiją, taikant patvirtinto tinkamumo in vitro ir ex vivo metodus ir taip apsaugant gyvūnus nuo skausmo ir kančių. Nuosekliosios bandymų strategijos B.4 ėsdinimo bandymams tinka trys patvirtinto tinkamumo in vitro bandymų metodai ar bandymų rekomendacijos: B.40, B.40bis ir TG 435 (4, 5, 6).
Šis bandymo metodas yra pagrįstas rekonstruoto žmogaus epidermio modeliais, kurių bendroji schema (kaip ląstelių šaltinis naudojami žmogaus epidermio keratinocitai, reprezentatyvusis audinys ir citoarchitektonika) labai artima žmogaus odos viršutinių dalių, t.y., epidermio biocheminėms ir fiziologinėms savybėms. Taikant šiame bandymo metode aprašytą procedūrą galima identifikuoti JT GHS 2 kategorijos dirginančių medžiagų pavojų. Be to, į šį bandymo metodą įtrauktas naudojimo charakteristikų standartų rinkinys, skirtas įvertinti panašius ir modifikuotus bandymo metodus, pagrįstus rekonstruoto žmogaus epidermio tyrimu (7).
Buvo atlikti dviejų in vitro bandymo metodų (8, 9, 10, 11, 12, 13, 14, 15, 16, 17), kuriuos galima pirkti kaip EpiSkin™ ir EpiDerm™, pradinio tinkamumo patvirtinimo, optimizavimo ir tinkamumo patvirtinimo tyrimai, naudojant rekonstruoto žmogaus epidermio modelius. Šios nuorodos pateiktos remiantis R.38. Tam tikri perskaičiavimo aspektai, taikytini pagal GHS, aptariami 25 nuorodoje. Metodus, kurių naudojimo charakteristikos atitinka EpiSkin™ (patvirtinto tinkamumo 1-ojo pamatinio metodo) naudojimo charakteristikas, rekomenduojama naudoti kaip atskirus pakaitinius triušių in vivo bandymo metodus GHS 2 kategorijos dirginančioms cheminėms medžiagoms klasifikuoti. Metodus, kurių naudojimo charakteristikos atitinka EpiDerm™ (patvirtinto tinkamumo 2-ojo pamatinio metodo) naudojimo charakteristikas, rekomenduojama naudoti tik kaip atrankos bandymo metodus arba kaip nuosekliosios bandymų strategijos dalis taikant įrodomosios vertės nustatymo metodą GHS 2 kategorijos dirginančioms cheminėms medžiagoms klasifikuoti. Prieš taikant siūlomą in vitro rekonstruoto žmogaus epidermio modelio bandymą reglamentavimo tikslais, reikėtų nustatyti jo patikimumą, tinkamumą (tikslumą) ir siūlomo naudojimo apribojimus, siekiant užtikrinti jo panašumą į patvirtinto tinkamumo 1-ąjį pamatinį metodą pagal šiame bandymo metode nustatytus naudojimo charakteristikų standartus (priedėlis).
Dviejų kitų in vitro rekonstruoto žmogaus epidermio bandymo metodų tinkamumas buvo patvirtintas pagal šio bandymo metodo reikalavimus, o gauti rezultatai buvo panašūs į patvirtinto tinkamumo 1-ojo pamatinio metodo rezultatus (18). Tai yra modifikuotas EpiDerm™ bandymo metodas (modifikuotas 2-asis pamatinis metodas) ir SkinEthic RHE™ bandymo metodas (1-asis me-too metodas).
1.2. APIBRĖŽTYS
Šiame bandymo metode taikomos šios apibrėžtys:
Tikslumas – bandymo metodo rezultatų ir patvirtintų pamatinių verčių sutapimo artumas. Tikslumas yra bandymo metodo naudojimo charakteristikų matas ir vienas iš tinkamumo aspektų. Terminas dažnai vartojamas kaip lygiavertis terminui „sutapimas“ tinkamų bandymo metodo rezultatų daliai išreikšti.
Partijos kontrolinė medžiaga – palyginamoji medžiaga, kurią naudojant gaunamas audinio ląstelių gyvybingumo atsako intervalo vidurkis.
Ląstelių gyvybingumas – parametras suminiam ląstelių populiacijos aktyvumui matuoti, pvz., ląstelių mitochondrinių dehidrogenazių geba redukuoti vitalinį dažiklį MTT ([3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolinio bromidą, tiazolilo mėlynąjį), kuris, atsižvelgiant į galutinį matuojamą dydį ir taikomą bandymo schemą, yra susijęs su suminių ląstelių kiekiu ir (arba) jų gyvybingumu.
ET50 – veikimo trukmė, per kurią ląstelių gyvybingumas sumažėja 50 % jas veikiant tam tikros pastovios koncentracijos cheminiu žymekliu, žr. taip pat IC50.
Klaidingai neigiamų rezultatų dalis – visų teigiamų medžiagų, kurios taikant bandymo metodą yra klaidingai identifikuotos kaip neigiamos, dalis. Tai yra vienas iš bandymo metodo naudojimo charakteristikų rodiklių.
Klaidingai teigiamų rezultatų dalis – visų neigiamų (neveikliųjų) medžiagų, kurios yra klaidingai identifikuotos kaip teigiamos, dalis. Tai yra vienas iš bandymo metodo naudojimo charakteristikų rodiklių.
Neribota dozė – ant odos dedamas bandomosios medžiagos kiekis, didesnis už kiekį, kurio reikia visiškai ir tolygiai uždengti odos paviršių.
GHS (Visuotinai suderinta cheminių medžiagų klasifikavimo ir ženklinimo sistema) – sistema, kurioje pateikiama cheminių medžiagų (medžiagų ir mišinių) klasifikacija pagal standartizuotus fizikinių pavojų, pavojų sveikatai bei aplinkai tipus ir nagrinėjami atitinkami informaciniai elementai, pvz., piktogramos, signaliniai žodžiai, pavojaus pareiškimai, įspėjamieji pareiškimai ir saugos duomenų lapai, kad būtų galima informuoti apie medžiagų neigiamą poveikį, siekiant apsaugoti žmones (įskaitant darbuotojus, darbininkus, vežėjus, vartotojus ir avarijų likvidatorius) ir aplinką (1), ES įgyvendinama Reglamentu (EB) Nr. 1272/2008.
IC50 – cheminio žymeklio koncentracija, kuriai esant ląstelių gyvybingumas sumažėja 50 % (IC50) praėjus nustatytai veikimo trukmei, žr. taip pat ET50.
Naudojimo charakteristikų standartai – standartai, pagrįsti patvirtinto tinkamumo pamatiniu metodu, kuriuo grindžiamas siūlomo struktūriniu ir funkciniu požiūriu panašaus bandymo metodo palyginamumas. Įtraukti: I) esminiai bandymo metodo komponentai; II) trumpiausias sąrašas pamatinių cheminių medžiagų, atrinktų iš cheminių medžiagų, naudojamų įrodant patvirtinto tinkamumo pamatinio metodo priimtinas naudojimo charakteristikas; III) palyginamieji tikslumo ir patikimumo lygiai, pagrįsti gautais patvirtinto tinkamumo pamatiniam metodo duomenimis, kuriuos siūlomas bandymo metodas turėtų atitikti, kai yra vertinamas naudojant trumpiausią pamatinių cheminių medžiagų sąrašą.
Patikimumas – bandymo metodo, tam tikrą laiką taikomo laboratorijose ir tarp laboratorijų pagal tą patį protokolą atkuriamumo laipsnio matai. Patikimumas įvertinamas apskaičiuojant atkuriamumą laboratorijoje ir tarp laboratorijų.
Jautrumas – visų teigiamų (veikliųjų) medžiagų, kurios yra tinkamai klasifikuotos atliekant bandymą, dalis. Jis yra bandymo metodo, kuriuo gaunami vienareikšmiai rezultatai, tikslumo matas ir yra svarbus bandymo metodo tinkamumo vertinimo veiksnys.
Specifiškumas – visų neigiamų (neveikliųjų) medžiagų, kurios yra tinkamai klasifikuotos atliekant bandymą, dalis. Jis yra bandymo metodo, kuriuo gaunami vienareikšmiai rezultatai, tikslumo matas ir yra svarbus bandymo metodo tinkamumo vertinimo veiksnys.
Odos dirginimas – grįžtamosios odos pažaidos gavimas po bandomosios medžiagos uždėjimo ne ilgiau kaip 4 valandoms. Odos dirginimas yra vietinis neimunogeninis atsakas, kuris atsiranda netrukus po veikimo medžiaga (24). Jo pagrindinė savybė – grįžtamasis procesas vykstant uždegiminiams atsakams ir esant su uždegiminiu procesu susijusiems būdingiems klinikiniams dirginimo požymiams (eritemai, edemai, niežėjimui ir skausmui).
1.3. TAIKYMO SRITIS IR APRIBOJIMAI
Rekonstruoto žmogaus epidermio bandymų, kuriems taikomas šis bandymo metodas, apribojimas yra tai, kad pagal juos tik JT GHS 2-osios kategorijos cheminės medžiagos klasifikuojamos kaip odos dirgikliai. Kadangi pagal šiuos bandymus medžiagų negalima priskirti papildomai 3-iajai kategorijai, kuri apibrėžta JT GHS, visos likusios medžiagos nebus klasifikuojamos (nėra kategorijos). Atsižvelgiant į kontrolės institucijų reikalavimus ir galimą naujų galutinių matuojamųjų dydžių įtraukimą, naujų me-too bandymų tobulinimą arba sukūrimą, šį bandymo metodą gali tekti persvarstyti.
Šiuo bandymo metodu galima identifikuoti vieno komponento dirginančių medžiagų pavojų (19), bet juo negalima gauti tinkamos informacijos apie odos ėsdinimą. Dujų ir aerozolių bandyti negalima, o mišiniai dar nėra įvertinti atliekant tinkamumo patvirtinimo tyrimą.
1.4. BANDYMO METODO PRINCIPAS
Bandomoji cheminė medžiaga uždedama ant trijų matmenų rekonstruoto žmogaus epidermio modelio, sudaryto iš normalių žmogaus odos keratinocitų, kurie buvo auginami, kad galėtų būti gautas daugiasluoksnis labai gerai diferencijuotas žmogaus epidermio modelis. Jį sudaro suformuoti pamatinis, dygliuotasis ir grūdėtasis sluoksniai ir daugiasluoksnis stratum corneum, turintis tarpląstelinių žvynelių pavidalo lipidų sluoksnių, kurių struktūra yra analogiška in vivo nustatytai struktūrai.
Rekonstruoto žmogaus epidermio modelio bandymas pagrįstas prielaida, kad dirginančios cheminės medžiagos gali prasiskverbti per stratum corneum difuzijos būdu ir kad jos yra citotoksinės po juo esančių sluoksnių ląstelėms. Ląstelių gyvybingumas matuojamas dehidrogenazėmis redukuojant vitalinį dažiklį MTT [3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolinio bromidą, tiazolilo mėlynąjį; EINECS numeris 206–069–5, CAS numeris 298–93–1)] į mėlyną formazano druską, kuri kiekybiškai nustatoma ją ekstrahavus iš audinių (20). Dirginančios medžiagos identifikuojamos pagal jų gebą sumažinti ląstelių gyvybingumą iki mažesnio nei nustatytas ribinio lygio (t. y. ≤ 50 % JT GHS 2-osios kategorijos dirginančioms medžiagoms). Medžiagos, kurių atveju gaunamas didesnis nei nustatyto ribinio lygio ląstelių gyvybingumas, nebus klasifikuotos (t. y. > 50 %, nėra kategorijos).
Rekonstruoto žmogaus epidermio modelio sistemos gali būti naudojamos kietosioms medžiagoms, skysčiams, pusiau kietoms medžiagoms ir vaškams bandyti. Skysčiai gali būti vandeniniai arba nevandeniniai; kietosios medžiagos gali būti tirpios arba netirpios vandenyje. Jei įmanoma, kietąsias medžiagas reikėtų bandyti smulkių miltelių pavidalu. Kadangi į rekonstruoto žmogaus epidermio modelio sistemų tinkamumo patvirtinimo tyrimą buvo įtrauktos 58 kruopščiai parinktos cheminės medžiagos, reprezentuojančios įvairias cheminių junginių klases, manoma, kad aptariami metodai iš esmės tinka visoms cheminių junginių klasėms (16). Į tinkamumo patvirtinimo tyrimą įtraukta 13 GHS 2-osios kategorijos medžiagų. Reikėtų pabrėžti, kad antikorozinės rūgštys, bazės, druskos ir kitos neorganinės medžiagos nebuvo įtrauktos į tinkamumo patvirtinimo tyrimą. Kai kurios žinomos organinių medžiagų klasės, tokios kaip hidroperoksidai, fenoliai ir aktyviosios paviršiaus medžiagos, taip pat nebuvo įtrauktos į tyrimą arba įtrauktos tik iš dalies.
1.5. BANDYMŲ KOKYBĖS ĮRODYMAS
Prieš pradėdamos įprastu būdu taikyti patvirtinto tinkamumo metodą, kuris susietas su šiuo bandymo metodu, laboratorijos gali pareikšti norą įrodyti techninę kvalifikaciją, naudodamos dešimt cheminių medžiagų, rekomenduotų 1 lentelėje. Pagal šį bandymo metodą JT GHS papildomos 3-iosios kategorijos medžiagos priskiriamos prie kategorijos neturinčių medžiagų. Pagal šį bandymo metodą sukurtiems naujiems panašiems (me-too) bandymo metodams, kurie struktūros ir funkcijų požiūriu yra panašūs į patvirtinto tinkamumo pamatinius metodus, arba patvirtinto tinkamumo metodų pakeitimams reikėtų naudoti šio bandymo metodo priedėlyje aprašytus naudojimo charakteristikų standartus, kad būtų galima įrodyti naujų bandymo metodų palyginamąjį patikimumą ir tikslumą prieš pradedant juos taikyti bandymams reglamentavimo tikslais.
1 lentelė
Bandymų kokybei įrodyti naudojamos cheminės medžiagos, kurios yra priedėlyje išvardytų pamatinių cheminių medžiagų pogrupis
|
Cheminė medžiaga |
CAS numeris |
In vivo balas |
Fizikinė būsena |
GHS kategorija |
|
naftalenacto rūgštis |
86–87–3 |
0 |
K |
nėra kat. |
|
izopropanolis |
67–63–0 |
0,3 |
S |
nėra kat. |
|
metilstearatas |
112–61–8 |
1 |
K |
nėra kat. |
|
heptilbutiratas |
5870–93–9 |
1,7 |
S |
Papildoma 3-ioji kat. |
|
heksilsalicilatas |
6259–76–3 |
2 |
S |
Papildoma 3-ioji kat. |
|
ciklamenaldehidas |
103–95–7 |
2,3 |
S |
2-oji kat. |
|
1-bromheksanas |
111–25–1 |
2,7 |
S |
2-oji kat. |
|
butilmetakrilatas |
97–88–1 |
3 |
S |
2-oji kat. |
|
1-metil-3-fenil-1-piperazinas |
5271–27–2 |
3,3 |
K |
2-oji kat. |
|
Heptanalis |
111–71–7 |
4 |
S |
2-oji kat. |
1.6. METODO APIBŪDINIMAS
Toliau aprašomi odos dirginimui įvertinti naudojamo rekonstruoto žmogaus epidermio modelio bandymų komponentai ir procedūros. Rekonstruoto žmogaus epidermio modelis gali būti sukurtas, paruoštas arba nupirktas (pvz., EpiSkin™, EpiDerm™ ir SkinEthic RHE™). EpiSkin™, EpiDerm™ ir SkinEthic RHE™ standartinius bandymo metodų protokolus galima gauti adresu [http://ecvam.jrc.ec.europa.eu](21, 22, 23). Bandymai turi būti atliekami kaip nurodyta toliau.
1.6.1. Rekonstruoto žmogaus epidermio modelio komponentai
1.6.1.1. Bendrosios modelio sąlygos
Epiteliui gauti turėtų būti naudojami normalūs žmogaus odos keratinocitai. Po funkciniu stratum corneum turi būti keli gyvybingų epitelio ląstelių sluoksniai (pamatinis sluoksnis, dygliuotasis (stratum spinosum), grūdėtasis (stratum granulosum)). Stratum corneum turėtų būti daugiasluoksnis ir turėti pagrindinius lipidų sluoksnius, kad būtų gautas patvarus funkcinis barjeras, kuris būtų atsparus cheminių citotoksinių žymeklių, pvz., natrio dodecilsulfato (SDS) arba Triton X-100, greitam prasiskverbimui. Barjero funkcija gali būti įvertinta nustatant koncentraciją, kuriai esant cheminis žymeklis sumažina audinių gyvybingumą 50 % (IC50), praėjus nustatytai veikimo trukmei, arba nustatant tam tikros pastovios koncentracijos cheminio žymeklio veikimo trukmę, per kurią ląstelių gyvybingumas sumažėja 50 % (ET50). Modelis turėtų turėti sulaikymo savybes, kurios apsaugotų nuo medžiagos patekimo į gyvąjį audinį apeinant stratum corneum, dėl ko būtų blogai modeliuojamas odos veikimas medžiaga. Ant odos modelio neturėtų būti bakterijų, virusų, mikoplazmų arba grybelių užkrato.
1.6.1.2. Funkcinės modelio sąlygos
1.6.1.2.1. Gyvybingumas
Gyvybingumo dydžiui nustatyti dažniausiai taikomas MTT bandymas (20). Dažiklio, ekstrahuoto (ištirpinto) iš neigiama kontroline medžiaga apdoroto audinio, optinis tankis turėtų būti bent 20 kartų didesnis už ekstrahavimui naudoto tirpiklio optinį tankį. Reikėtų patvirtinti dokumentais, kad neigiama kontroline medžiaga apdorotas audinys yra stabilus kultūroje (gaunami panašūs gyvybingumo matavimai) visą veikimo medžiaga laikotarpio trukmę.
1.6.1.2.2. Barjero funkcija
Stratum corneum ir jo lipidų sudėtis turėtų būti pakankama, kad jie būtų atsparūs greitam cheminių citotoksinių žymeklių, pvz., SDS arba Triton X-100, prasiskverbimui, įvertintam matuojant IC50 arba ET50.
1.6.1.2.3. Morfologija
Rekonstruotos odos (epidermio) histologinį tyrimą, siekiant įrodyti, kad ji turi į žmogaus odą (epidermį) panašią struktūrą (įskaitant daugiasluoksnį stratum corneum), turėtų atlikti tinkamą kvalifikaciją turintys darbuotojai.
1.6.1.2.4. Atkuriamumas
Reikėtų įrodyti metodo rezultatų, gautų taikant tam tikrą modelį, atkuriamumą bėgant laikui; tam pageidautina naudoti partijos kontrolinę (palyginamąją) medžiagą (žr. priedėlį).
1.6.1.2.5. Kontrolinės medžiagos modelio kokybei nustatyti
Kiekviena naudojamo epidermio modelio partija turėtų atitikti apibrėžtus produkcijos išleidimo kriterijus, iš kurių svarbiausi būtų gyvybingumo (1.6.1.2.1 punktas) ir barjero funkcijos (1.6.1.2.2 punktas) kriterijai. IC50 arba ET50 priimtinumo intervalą (viršutinę ir apatinę ribą) turėtų nustatyti odos modelio tiekėjas (arba tyrėjas, kai naudojamas vidinis modelis). Gavusi audinius, laboratorija turėtų patikrinti jų apsaugines savybes. Tik su kokybiškais audiniais gauti rezultatai gali būti laikomi patikimais prognozuojant dirginimo reiškinius. Kaip pavyzdys, toliau pateikti patvirtinto tinkamumo metodų priimtinumo intervalai.
2 lentelė
Partijos gamybos kokybės kontrolės kriterijų pavyzdžiai
|
|
Apatinė priimtinumo riba |
Priimtinumo intervalo vidurkis |
Viršutinė priimtinumo riba |
|
Patvirtinto tinkamumo 1-asis pamatinis metodas (18 h apdorojimas SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Patvirtinto tinkamumo 2-asis pamatinis metodas (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
1.6.1.3. Bandomosios ir kontrolinės medžiagų uždėjimas
Turėtų būti naudojamas pakankamas kartotinių audinio bandinių skaičius kiekvienam apdorojimo ir kontroliniam bandymui (bent trys kartotiniai bandiniai vienam bandymui). Tiriant skystąsias ir kietąsias medžiagas, naudojamos bandomosios medžiagos kiekis turi būti pakankamas, kad odos paviršius būtų tolygiai padengtas medžiaga, bet vengiama neribotos dozės (žr. 1.2 Apibrėžtys), t. y. reikėtų naudoti ne mažiau kaip 25 μl/cm2 arba 25 mg/cm2. Jei bandomos kietosios medžiagos, prieš jų uždėjimą epidermio paviršių reikėtų suvilgyti dejonizuotu arba distiliuotu vandeniu, kad būtų užtikrintas geras sąlytis su oda. Jei įmanoma, kietąsias medžiagas reikėtų bandyti smulkių miltelių pavidalu. Pasibaigus veikimo medžiaga laikotarpiui, bandomoji medžiaga turi būti kruopščiai nuplauta nuo odos paviršiaus vandeniniu buferiniu tirpalu arba 0,9 % NaCl. Atsižvelgiant į naudotą rekonstruoto žmogaus epidermio modelį, veikimo medžiaga trukmė gali būti nuo 15 iki 60 min, o inkubavimo temperatūra – nuo 20 iki 37 °C. Išsami informacija pateikta trijų metodų standartinėse taikymo procedūrose (21, 22, 23).
Kiekviename tyrime lygiagrečiai turėtų būti naudojamos neigiamos (NC) ir teigiamos (PC) kontrolinės medžiagos siekiant įrodyti, kad audinių gyvybingumas (NC), barjero funkcija ir gautas audinių jautrumas (PC) atitinka anksčiau sukauptų duomenų priimtinumo intervalą. Siūloma PC medžiaga būtų 5 % vandeninis SDS. Siūlomos NC medžiagos yra vanduo arba fiziologinis tirpalas fosfatiniame buferyje (PBS).
1.6.1.4. Ląstelių gyvybingumo matavimai
Svarbiausias bandymo procedūros elementas yra tai, kad gyvybingumas matuojamas ne iš karto, kai baigiama veikti bandomąja chemine medžiaga, bet praėjus pakankamai ilgam inkubaciniam laikotarpiui po veikimo ir audinių plovimo šviežia terpe. Per šį laikotarpį sudaromos sąlygos atsigauti po silpno dirginimo poveikio ir atsirasti aiškiam citotoksiniam poveikiui. Bandymo optimizavimo tarpsniu (9, 10, 11, 12, 13) buvo nustatyta, kad optimali inkubacinio laikotarpio po apdorojimo trukmė lygi 42 h, todėl ji buvo naudojama patvirtinant pamatinių bandymo metodų tinkamumą.
MTT virsmo bandymas yra patvirtinto tinkamumo kiekybinis metodas, kuris turėtų būti taikomas ląstelių gyvybingumui matuoti. Jis yra suderinamas su trijų matmenų audinio modeliu. Odos ėminys 3 h laikomas reikiamos koncentracijos MTT tirpale (pvz., 0,3–1 mg/ml). Mėlynos spalvos formazano junginio nuosėdos ekstrahuojamos iš audinio tirpikliu (pvz., izopropanoliu, parūgštintu izopropanoliu), o formazano koncentracija matuojama nustatant optinį tankį esant 570 nm bangos ilgiui ir ne didesniam kaip ±30 nm praleidimo juostos pločiui.
Bandomosios medžiagos optinės savybės arba jos cheminis poveikis MTT gali trukdyti atliekant bandymą ir taip gali būti gautas klaidingas gyvybingumo įvertis (nes bandomoji medžiaga gali trukdyti atsirasti spalvai, leisti jai išnykti arba sukelti spalvos atsiradimą). Tai gali įvykti, kai tam tikra bandomoji medžiaga nevisiškai pašalinama iš odos skalaujant arba kai ji prasiskverbia į epidermį. Jei bandomoji medžiaga tiesiogiai veikia MTT, yra iš prigimties spalvota arba nusidažo apdorojant audinį, reikėtų naudoti papildomas kontrolines medžiagas, kad būtų galima aptikti bandomosios medžiagos trikdžius taikomam gyvybingumo matavimo metodui ir padaryti pataisą. Išsamų tiesioginio MTT redukavimo aprašymą galima rasti patvirtinto tinkamumo pamatinių metodų protokole (21, 22, 23). Dėl šių trikdžių atsiradusios nespecifinės spalvos (NSC) dalis neturėtų būti didesnė kaip 30 % NC (pataisoms daryti). Jei NSC > 30 %, bandomoji medžiaga laikoma netinkama bandymui atlikti.
1.6.1.5. Bandymo priimtinumo kriterijai
Per kiekvieną bandymą, kurį atliekant naudojamos patvirtinto tinkamumo partijos (žr. 1.6.1.2.5 punktą), turėtų būti gautos tokios neigiama kontroline medžiaga apdorotų audinių optinio tankio vertės, kurios rodytų visus vežimo bei priėmimo etapus ir visą dirginimo bandymo protokolo procesą praėjusių audinių kokybę. Gautos kontrolinių medžiagų optinio tankio vertės neturėtų būti mažesnės nei pagal ankstesnius duomenis nustatytos apatinės ribinės vertės. Panašiai, teigiama kontroline medžiaga, t. y. 5 % vandeniniu SDS, apdoroti audiniai turėtų rodyti audinių išsaugotą jautrumą ir jų gebą atsakyti į dirginančios cheminės medžiagos veikimą kiekvieno atskiro bandymo sąlygomis (pvz., gyvybingumas ≤ 40 % taikant patvirtinto tinkamumo 1-ąjį pamatinį metodą ir ≤ 20 % taikant patvirtinto tinkamumo 2-ąjį pamatinį metodą). Reikėtų nustatyti susijusius ir tinkamus kartotinių bandinių kintamumo matus (pvz., jei taikomi standartiniai nuokrypiai, jie turėtų būti ≤ 18 %).
2. DUOMENYS
2.1. DUOMENYS
Lentelėse turėtų būti pateikti kiekvieno atskiro apdoroto audinio kartotinio bandinio duomenys (pvz., optinio tankio vertės ir apskaičiuotų ląstelių gyvybingumo procentinių verčių duomenys kiekvienai bandomajai cheminei medžiagai, įskaitant klasifikavimą), įskaitant pakartotų bandymų, jei reikia, duomenis. Be to, ataskaitoje reikėtų pateikti kiekvieno bandymo vidutinės vertės ± standartinio nuokrypio duomenis. Ataskaitoje reikėtų nurodyti pastebėtas spalvotų bandomųjų medžiagų sąveikas su MTT reagentu.
2.2. REZULTATŲ INTERPRETAVIMAS
Gautos kiekvieno bandinio optinio tankio vertės gali būti naudojamos nustatant gyvybingumo procentinę dalį, palyginti su neigiamais kontroliniais bandiniais, kurių gyvybingumas prilyginamas 100 %. Ribinė ląstelių gyvybingumo procentinės dalies vertė, skirianti dirginančias bandomąsias medžiagas nuo neklasifikuojamųjų, ir statistinė (-ės) procedūra (-os), taikyta (-os) rezultatams įvertinti ir dirginančioms medžiagoms identifikuoti, turi būti aiškiai apibrėžtos ir patvirtintos dokumentais, taip pat turi būti įrodytas jų tinkamumas. Toliau pateikiamos dirginimui prognozuoti naudojamos ribinės vertės, atitinkančios patvirtinto tinkamumo pamatinius metodus:
Laikoma, kad bandomoji medžiaga yra dirginanti odą pagal JT GHS 2-ąją kategoriją:
|
i) |
jei audinio gyvybingumas po veikimo medžiaga ir paskesnio inkubavimo yra mažesnis arba lygus (≤) 50 %. |
Laikoma, kad bandomoji medžiaga nepriskiriama jokiai kategorijai:
|
ii) |
jei audinio gyvybingumas po veikimo medžiaga ir paskesnio inkubavimo yra didesnis (>) kaip 50 %. |
3. ATASKAITOS PATEIKIMAS
3.1. BANDYMO ATASKAITA
Bandymo ataskaitoje turėtų būti pateikta ši informacija:
Bandomosios ir kontrolinės medžiagos:
|
— |
cheminis (-iai) pavadinimas (-ai), pvz., IUPAC arba CAS pavadinimas, ir CAS numeris, jei žinomas, |
|
— |
medžiagos grynumas ir sudėtis (masės procentine (-ėmis) dalimi (-is)), |
|
— |
fizikocheminės savybės (pvz., fizikinė būsena, stabilumas ir lakumas, pH, tirpumas vandenyje, jei žinomas), svarbios atliekamam tyrimui, |
|
— |
bandomųjų ir (arba) kontrolinių medžiagų apdorojimas prieš bandymą, jei taikomas (pvz., šildymas, malimas), |
|
— |
laikymo sąlygos. |
Odos modelio ir naudoto protokolo pagrindimas.
Bandymo sąlygos:
|
— |
naudota ląstelių sistema, |
|
— |
informacija apie ląstelių gyvybingumui matuoti naudoto matavimo prietaiso (pvz., spektrofotometro) kalibravimą ir praleidimo juostą, |
|
— |
visa su konkrečiu odos modeliu susijusi informacija, įskaitant jo naudojimo charakteristikas. Ją turėtų sudaryti šie ir kiti duomenys:
|
|
— |
išsami informacija apie taikytą bandymo procedūrą, |
|
— |
naudotos bandomosios dozės, veikimo medžiaga trukmė ir inkubacinis laikotarpis po veikimo, |
|
— |
visų bandymo procedūros pakeitimų aprašymas, |
|
— |
nuoroda į anksčiau sukauptus modelio duomenis. Turėtų būti pateikti šie ir kiti duomenys:
|
|
— |
taikytų vertinimo kriterijų, įskaitant prognozės modelio ribinio (-ių) taško (-ų) pagrindimo kriterijus, aprašymas. |
Rezultatai:
|
— |
atskirų tiriamųjų bandinių duomenų lentelės, |
|
— |
kitų pastebėtų reiškinių aprašymas. |
Rezultatų aptarimas.
Išvados.
4. NUORODOS
|
1. |
United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Galima rasti adresu http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html. |
|
2. |
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Galima rasti adresu http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649. |
|
3. |
Test Method B.4. ACUTE TOXICITY; DERMAL IRRITATION/CORROSION. |
|
4. |
Test Method B.40. IN VITRO SKIN CORROSION: TRANSCUTANEOUS ELECTRICAL RESISTANCE TEST TER. |
|
5. |
Test Method B.40 BIS. IN VITRO SKIN CORROSION: HUMAN SKIN MODEL TEST. |
|
6. |
OECD (2006). Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Adopted July 19, 2006. Galima rasti adresu http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html. |
|
7. |
ECVAM (2009) Performance Standards for applying human skin models to in vitro skin irritation. Galima rasti adresu http://ecvam.jrc.ec.europa.eu, spustelėjus Download Study Documents. |
|
8. |
Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in Vitro 15, 57–93. |
|
9. |
Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765–770. |
|
10. |
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107–114. |
|
11. |
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test. ATLA 33, 351–367. |
|
12. |
Cotovio, J., Grandidier, M.–H., Portes, P., Roguet, R. & G. Rubinsteen. (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329–249. |
|
13. |
Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30,109–129. |
|
14. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601. |
|
15. |
Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 pp. + annexes. Galima rasti adresu http://ecvam.jrc.ec.europa.eu, spustelėjus Download Study Documents. |
|
16. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603–619. |
|
17. |
J. Cotovio, M.–H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy -Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351–358. |
|
18. |
ESAC statement on updated EpiDerm and similar SkinEthic assays. 5 November 2008. |
|
19. |
EB (2006). 2006 m. gruodžio 18 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), įsteigiantis Europos cheminių medžiagų agentūrą, iš dalies keičiantis Direktyvą 1999/45/EB bei panaikinantis Tarybos reglamentą (EEB) Nr. 793/93, Komisijos reglamentą (EB) Nr. 1488/94, Tarybos direktyvą 76/769/EEB ir Komisijos direktyvas 91/155/EEB, 93/67/EEB, 93/105/EB bei 2000/21/EB. Europos Sąjungos oficialusis leidinys L396/1, 2006 12 30. OPOCE, Liuksemburgas. |
|
20. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55–63. |
|
21. |
EpiSkin™ SOP, Version 1.6 (January 2005). Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Galima rasti adresu http://ecvam.jrc.ec.europa.eu, spustelėjus Download Study Documents. |
|
22. |
EpiDerm™ SOP, Version 5.0 (October 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Galima rasti adresu http://ecvam.jrc.ec.europa.eu, spustelėjus Download Study Documents. |
|
23. |
SkinEthic RHE™ SOP. Bus galima rasti adresu http://ecvam.jrc.ec.europa.eu, spustelėjus Download Study Documents. |
|
24. |
Harvell, J.D., Lammintausta, K. Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, pp 7–18. |
|
25. |
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008 |
Priedėlis
Odos dirginimui nustatyti pasiūlytų in vitro rekonstruoto žmogaus epidermio modelių naudojimo charakteristikų įvertinimas
ĮVADAS
Reikėtų įvertinti procedūras, siūlomas naudoti pagal šį bandymo metodą, kad būtų galima nustatyti jų patikimumą ir tikslumą naudojant medžiagas, kurios atitinka visą Draize dirginimo balų intervalą. Kai įvertinama naudojant 20 rekomenduojamų pamatinių cheminių medžiagų (2 lentelė), pasiūlytų procedūrų patikimumo ir tikslumo vertės turėtų būti panašios į vertes, gautas patvirtinto tinkamumo 1-uoju pamatiniu metodu (3 lentelė) (1). Tikslumo ir patikimumo standartai, kuriuos reikėtų pasiekti, pateikti II ir III dalyse. Įtrauktos atitinkamas cheminių medžiagų klases reprezentuojančios neklasifikuojamos ir klasifikuojamos (JT GHS 2-osios kategorijos) medžiagos, kad pasiūlyto bandymo metodo patikimumą ir naudojimo charakteristikas (jautrumą, specifiškumą, klaidingai neigiamų bei klaidingai teigiamų rezultatų dalis ir tikslumą) būtų galima palyginti su patvirtinto tinkamumo 1-ojo pamatinio metodo naudojimo charakteristikomis. Bandymo metodo patikimumas ir jo geba tinkamai identifikuoti JT GHS 2-osios kategorijos dirginančias medžiagas turėtų būti nustatyti prieš pradedant jį taikyti naujų medžiagų bandymams.
NAUDOJIMO CHARAKTERISTIKŲ STANDARTAI
Naudojimo charakteristikų standartus sudaro šie trys elementai: I) esminiai bandymo metodo komponentai, II) pamatinės cheminės medžiagos ir III) apibrėžtos tikslumo ir patikimumo vertės (2). Šie naudojimo charakteristikų standartai buvo apibrėžti baigus ECVAM (Europos alternatyvių metodų patvirtinimo centro) odos dirginimo bandymų tinkamumo patvirtinimo tyrimą (3).
I) Esminiai bandymo metodo komponentai
Bendrosios modelio sąlygos
Epiteliui gauti turėtų būti naudojami normalūs žmogaus odos keratinocitai. Po funkciniu stratum corneum turi būti keli gyvybingų epitelio ląstelių sluoksniai (pamatinis sluoksnis, dygliuotasis (stratum spinosum), grūdėtasis (stratum granulosum)). Stratum corneum turėtų būti daugiasluoksnis ir turėti pagrindinius lipidų sluoksnius, kad būtų gautas patvarus funkcinis barjeras, kuris būtų atsparus cheminių citotoksinių žymeklių, pvz., natrio dodecilsulfato (SDS) arba Triton X-100, greitam prasiskverbimui. Barjero funkcija gali būti įvertinta nustatant koncentraciją, kuriai esant cheminis žymeklis sumažina audinių gyvybingumą 50 % (IC50), praėjus nustatytai veikimo trukmei, arba nustatant tam tikros pastovios koncentracijos cheminio žymeklio veikimo trukmę, per kurią ląstelių gyvybingumas sumažėja 50 % (ET50). Modelis turėtų turėti sulaikymo savybes, kurios apsaugotų nuo medžiagos patekimo į gyvąjį audinį apeinant stratum corneum, dėl ko būtų blogai modeliuojamas odos veikimas medžiaga. Ant odos modelio neturėtų būti bakterijų, virusų, mikoplazmų arba grybelių užkrato.
Funkcinės modelio sąlygos
Gyvybingumas
Gyvybingumo dydžiui nustatyti dažniausiai taikomas MTT bandymas (20). Dažiklio, ekstrahuoto (ištirpinto) iš neigiama kontroline medžiaga apdoroto audinio, optinis tankis turėtų būti bent 20 kartų didesnis už ekstrahavimui naudoto tirpiklio optinį tankį. Reikėtų patvirtinti dokumentais, kad neigiama kontroline medžiaga apdorotas audinys yra stabilus kultūroje (gaunami panašūs gyvybingumo matavimai) visą veikimo laikotarpio trukmę. Gyvybingumo dydžiui nustatyti dažniausiai taikomas MTT bandymas (20). Dažiklio, ekstrahuoto (ištirpinto) iš neigiama kontroline medžiaga apdoroto audinio, optinis tankis turėtų būti bent 20 kartų didesnis už ekstrahavimui naudoto tirpiklio optinį tankį. Reikėtų patvirtinti dokumentais, kad neigiama kontroline medžiaga apdorotas audinys yra stabilus kultūroje (gaunami panašūs gyvybingumo matavimai) visą veikimo medžiaga laikotarpio trukmę.
Barjero funkcija
Stratum corneum ir jo lipidų sudėtis turėtų būti pakankama, kad jie būtų atsparūs greitam cheminių citotoksinių žymeklių, pvz., SDS arba Triton X-100, prasiskverbimui, įvertintam matuojant IC50 arba ET50.
Morfologija
Rekonstruotos odos (epidermio) histologinį tyrimą, siekiant įrodyti, kad ji turi į žmogaus odą (epidermį) panašią struktūrą (įskaitant daugiasluoksnį stratum corneum), turėtų atlikti tinkamą kvalifikaciją turintys darbuotojai.
Atkuriamumas
Reikėtų įrodyti metodo rezultatų, gautų taikant tam tikrą modelį, atkuriamumą bėgant laikui; tam pageidautina naudoti partijos kontrolinę (palyginamąją) medžiagą (žr. 1.2 skirsnio apibrėžtis).
Kontrolinės medžiagos modelio kokybei nustatyti
Kiekviena naudojamo epidermio modelio partija turėtų atitikti apibrėžtus produkcijos išleidimo kriterijus, iš kurių svarbiausi būtų gyvybingumo ir barjero funkcijos kriterijai. IC50 arba ET50 priimtinumo intervalą (viršutinę ir apatinę ribą) turėtų nustatyti odos modelio tiekėjas (arba tyrėjas, kai naudojamas vidinis modelis). Gavusi audinius, laboratorija turėtų patikrinti jų apsaugines savybes. Tik su kokybiškais audiniais gauti rezultatai gali būti laikomi patikimais prognozuojant dirginimo reiškinius. Kaip pavyzdys, toliau pateikti patvirtinto tinkamumo metodų priimtinumo intervalai.
1 lentelė
Partijos gamybos kokybės kontrolės kriterijų pavyzdžiai
|
|
Apatinė priimtinumo riba |
Priimtinumo intervalo vidurkis |
Viršutinė priimtinumo riba |
|
Patvirtinto tinkamumo 1-asis pamatinis metodas (18 h apdorojimas SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Patvirtinto tinkamumo 2-asis pamatinis metodas (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
II) Pamatinės cheminės medžiagos
Pamatinės cheminės medžiagos naudojamos norint nustatyti, ar pasiūlyto naujo in vitro rekonstruoto žmogaus epidermio bandymo metodo, kuris, kaip įrodyta, struktūriniu ir funkciniu požiūriu gana panašus į patvirtinto tinkamumo pamatinius metodus arba turi tik nedidelių patvirtinto tinkamumo pamatinio metodo pakeitimų, ir patvirtinto tinkamumo 1-ojo pamatinio metodo naudojimo charakteristikos yra panašios (1). 2 lentelėje išvardyta 20 pamatinių cheminių medžiagų, kurios reprezentuoja skirtingas tiriamas cheminių medžiagų klases ir JT GHS 2-osios kategorijos chemines medžiagas. Šio sąrašo medžiagas sudaro 10 JT GHS 2-osios kategorijos cheminių medžiagų, 3 JT GHS papildomos 3-iosios kategorijos cheminės medžiagos ir 7 kategorijos neturinčios medžiagos. Pagal šį bandymo metodą JT GHS papildomos 3-iosios kategorijos medžiagos priskiriamos prie kategorijos neturinčių medžiagų. Šis pamatinių cheminių medžiagų skaičius atitinka mažiausią cheminių medžiagų skaičių, kurį reikėtų naudoti įvertinant odos dirginimui nustatyti pasiūlyto rekonstruoto žmogaus epidermio bandymo metodo tikslumą ir patikimumą. Jei negalima gauti sąraše nurodytos cheminės medžiagos, galima naudoti kitas chemines medžiagas, apie kurias turima reikiamų in vivo informacinių duomenų. Norint nuodugniau įvertinti pasiūlyto bandymo metodo tikslumą, į trumpiausią pamatinių cheminių medžiagų sąrašą galima įtraukti papildomas chemines medžiagas, kurios reprezentuotų kitas cheminių medžiagų klases ir apie kurias būtų turima reikiamų in vivo informacinių duomenų.
2 lentelė
Pamatinės cheminės medžiagos rekonstruoto žmogaus epidermio modelių tikslumui ir patikimumui nustatyti tiriant odos dirginimą
|
Cheminė medžiaga (1) |
CAS Nr. |
EINECS Nr. |
Fizikinė būsena |
In vivo balas |
GHS in vitro kat. |
GHS in vivo kat. |
|
1-brom-4-chlorbutanas |
6940–78–9 |
230–089–3 |
S |
0 |
2-oji kat. |
nėra kat. |
|
dietilftalatas |
84–66–2 |
201–550–6 |
S |
0 |
nėra kat. |
nėra kat. |
|
naftalenacto rūgštis |
86–87–3 |
201–705–8 |
K |
0 |
nėra kat. |
nėra kat. |
|
alilfenoksiacetatas |
7493–74–5 |
231–335–2 |
S |
0,3 |
nėra kat. |
nėra kat. |
|
Izopropanolis |
67–63–0 |
200–661–7 |
S |
0,3 |
nėra kat. |
nėra kat. |
|
4-metiltiobenz aldehidas |
3446–89–7 |
222–365–7 |
S |
1 |
2-oji kat. |
nėra kat. |
|
metilstearatas |
112–61–8 |
203–990–4 |
K |
1 |
nėra kat. |
nėra kat. |
|
heptilbutiratas |
5870–93–9 |
227–526–5 |
S |
1,7 |
nėra kat. |
Papildoma 3 kat. |
|
heksilsalicilatas |
6259–76–3 |
228–408–6 |
S |
2 |
nėra kat. |
Papildoma 3-ioji kat. |
|
triizobutilfosfatas |
126–71–6 |
204–798–3 |
S |
2 |
2-oji kat. |
Papildoma 3-ioji kat. |
|
1-dekanolis |
112–30–1 |
203–956–9 |
S |
2,3 |
2-oji kat. |
2-oji kat. |
|
ciklamenaldehidas |
103–95–7 |
203–161–7 |
S |
2,3 |
2-oji kat. |
2-oji kat. |
|
1-bromheksanas |
111–25–1 |
203–850–2 |
S |
2,7 |
2-oji kat. |
2-oji kat. |
|
2-chlormetil-3,5-dimetil-4-metoksipiridino hidrochloridas |
86604–75–3 |
434–680–9 |
K |
2,7 |
2-oji kat. |
2-oji kat. |
|
α-terpineolis |
98–55–5 |
202–680–6 |
S |
2,7 |
2-oji kat. |
2-oji kat. |
|
di-n-propil disulfidas |
629–19–6 |
211–079–8 |
S |
3 |
nėra kat. |
2-oji kat. |
|
butilmetakrilatas |
97–88–1 |
202–615–1 |
S |
3 |
2-oji kat. |
2-oji kat. |
|
5–(1,1-dimetiletil)-2-metil benzentiolis |
7340–90–1 |
438–520–9 |
S |
3,3 |
2-oji kat. |
2-oji kat. |
|
1-metil-3-fenil-1-piperazinas |
5271–27–2 |
431–180–2 |
K |
3,3 |
2-oji kat. |
2-oji kat. |
|
Heptanalis |
111–71–7 |
203–898–4 |
S |
4 |
2-oji kat. |
2-oji kat. |
2 lentelėje išvardytos cheminės medžiagos yra 58 cheminių medžiagų, naudotų atliekant ECVAM tarptautinį odos dirginimo bandymų tinkamumo patvirtinimo tyrimą (1), reprezentatyvusis skirstinys. Jų atranka pagrįsta šiais kriterijais:
|
— |
chemines medžiagas galima nusipirkti, |
|
— |
jos atitinka visą Draize dirginimo balų intervalą (nuo nedirginančios iki stipriai dirginančios), |
|
— |
jos turi gerai apibrėžtą cheminę struktūrą, |
|
— |
jos atitinka patvirtinto tinkamumo metodo atkuriamumą ir prognozavimo gebą, kaip nustatyta atliekant ECVAM tinkamumo patvirtinimo tyrimą, |
|
— |
jos atitinka tinkamumo patvirtinimo procese naudotą cheminį funkcionalumą, |
|
— |
jos nesusijusios su ypač didelio toksiškumo parametrais (pvz., kancerogeniškumu arba toksiškumu reprodukcijos sistemai) ir su labai didelėmis šalinimo išlaidomis. |
III) Apibrėžtos tikslumo ir patikimumo vertės
Pasiūlyto bandymo metodo naudojimo charakteristikos (jautrumas, specifiškumas, klaidingai neigiamų bei klaidingai teigiamų rezultatų dalys ir tikslumas) turėtų būti panašios į patvirtinto tinkamumo 1-ojo pamatinio metodo naudojimo charakteristikas (3 lentelė), t. y. jautrumas turėtų būti lygus arba didesnis (≥) kaip 80 %, specifiškumas – lygus arba didesnis (≥) kaip 70 %, tikslumas – lygus arba didesnis (≥) kaip 75 %. Naudojimo charakteristikos turėtų būti nustatomos naudojant visas skirtingose laboratorijose nustatytas 20 cheminių medžiagų klases. Kiekvienos cheminės medžiagos klasė kiekvienoje laboratorijoje turėtų būti nustatyta naudojant vidutinę gyvybingumo vertę, gautą atliekant skirtingus bandymus (ne mažiau kaip tris patvirtintus bandymus).
3 lentelė
Patvirtinto tinkamumo 1 pamatinio metodo naudojimo charakteristikos (2)
|
Bandymo metodas |
Cheminių medžiagų skaičius |
Jautrumas |
Specifiškumas |
Klaidingai neigiamų rezultatų dalis |
Klaidingai teigiamų rezultatų dalis |
Tikslumas |
|
Patvirtinto tinkamumo 1 pamatinis metodas (3) |
58 |
87,2 % (4) |
71,1 % (5) |
12,8 % |
29,9 % |
74,7 % |
|
Patvirtinto tinkamumo 1 pamatinis metodas (3) |
20 |
90 % |
73,3 % |
10 % |
26,7 % |
81,7 % |
Pasiūlyto bandymo metodo patikimumas turėtų būti panašus į patvirtinto tinkamumo pamatinių metodų patikimumą.
Atkuriamumas laboratorijoje
Vertinant kintamumą laboratorijoje, klasifikavimo (2-oji kategorija arba nėra kategorijos) sutapimas, nustatytas vienoje atskiroje laboratorijoje atliekant skirtingus ir nepriklausomus 20 pamatinių cheminių medžiagų bandymus, turėtų būti lygus arba didesnis (≥) kaip 90 %.
Tarplaboratorinis atkuriamumas
Vertinti tarplaboratorinį atkuriamumą nebūtina, jei pasiūlytas bandymo metodas taikomas tik vienoje laboratorijoje. Jei metodai būtų perduodami tarp laboratorijų, klasifikavimo (2-oji kategorija arba nėra kategorijos) sutapimas, nustatytas ne mažiau kaip trijose laboratorijose atliekant skirtingus ir nepriklausomus 20 pamatinių cheminių medžiagų bandymus, turėtų būti lygus arba didesnis (≥) kaip 80 %.
NUORODOS
|
1. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601. |
|
2. |
OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris. |
|
3. |
ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Galima rasti adresu http://ecvam.jrc.ec.europa.eu, spustelėjus Download Study Documents. Prieinama nuo 2008 m. spalio 27 d. |
|
4. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55–63. |
|
5. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603–619. |
(1) 20 pamatinių cheminių medžiagų yra 58 cheminių medžiagų, kurios iš pradžių buvo naudotos 1-ojo pamatinio metodo (EpiSkin™) tinkamumui patvirtinti, reprezentatyvioji imtis. Visas bandomųjų cheminių medžiagų sąrašas ir jų atrankos kriterijai yra pateikti (5).
(2) 3 lentelėje pateiktas patvirtinto tinkamumo 1-ojo pamatinio metodo naudojimo charakteristikos atsižvelgiant į gebą tinkamai identifikuoti dirginančias chemines medžiagas (JT GHS 2-osios kategorijos) ir neklasifikuojamas chemines medžiagas (neturinčias kategorijos, įskaitant 3 papildomą kategoriją), naudojant atitinkamai 58 ir 20 pamatinių cheminių medžiagų (2 lentelė).
(3) EpiSkin™
(4) Išbandyta 13 GHS 2-osios kategorijos dirginančių cheminių medžiagų.
(5) Išbandytos 45 GHS 3-osios kategorijos dirginančios cheminės medžiagos arba kategorijos neturinčios cheminės medžiagos.
IV PRIEDAS
|
C.3. |
GĖLO VANDENS DUMBLIAI IR CIANOBAKTERIJOS. AUGIMO INHIBAVIMO BANDYMAS |
1. METODAS
Šis metodas atitinka OECD TG 201 (2006) (1).
1.1. ĮVADAS
Bandymo metodai yra periodiškai peržiūrimi ir atnaujinami, atsižvelgiant į mokslo pažangą. C.2 bandymo metodą reikėjo pataisyti, siekiant įtraukti papildomas rūšis ir atitikti cheminių medžiagų pavojaus įvertinimo reikalavimus bei klasifikavimą. Pataisymas atliktas atsižvelgiant į didelį praktinį patyrimą, mokslo pažangą toksiškumo dumbliams tyrimo srityje ir platų naudojimą norminiuose teisės aktuose, kurie atsirado po pradinio priėmimo.
1.2. APIBRĖŽTYS
Šiame bandymo metode vartojamos šios apibrėžtys ir santrumpos:
Biomasė: populiaciją sudarančios gyvos medžiagos masė, išreikšta tam tikrame tūrio vienete esančios sausos medžiagos mase; pvz., mg dumblių/litre bandymo tirpalo. Paprastai „biomasė“ yra apibrėžiama kaip masė, bet šiame bandyme šis žodis yra vartojamas masei tūrio vienete apibrėžti. Be to, šiame bandyme vietoj biomasės paprastai matuojami pakaitiniai parametrai, pvz., ląstelių skaičius, fluorescencija ir t. t., todėl terminas „biomasė“ taikomas ir šiems pakaitiniams matams.
Variacijos koeficientas: dimensijos neturintis parametro kintamumo matas, apibrėžiamas kaip standartinio nuokrypio ir vidurkio santykis. Jį galima išreikšti procentais. Kartotinių kontrolinių ėminių kultūrų vidutinio savitojo augimo greičio vidutinis variacijos koeficientas turėtų būti apskaičiuojamas taip:
|
1. |
Apskaičiuojamas atitinkamo kartotinio ėminio vidutinio savitojo augimo greičio % CV pagal kasdienius (atskirų laikotarpių) augimo greičius. |
|
2. |
Apskaičiuojama visų pagal 1 punktą apskaičiuotų verčių vidutinė vertė kasdienių (atskirų laikotarpių) kartotinių kontrolinių ėminių kultūrų vidutinio savitojo augimo greičio vidutiniam variacijos koeficientui gauti. |
EC x: bandymo terpėje ištirpusios bandomosios medžiagos koncentracija, kuriai esant bandymo organizmo augimo greitis per nustatytą veikimo laikotarpį (tiksliai nurodomą, jei nukrypsta nuo visos arba normalios bandymo trukmės) sumažėja x % (pvz., 50 %). EC vertei, gautai pagal augimo greitį arba pagal išeigą, vienareikšmiškai žymėti vartojami simboliai „ErC“ ir „EyC“.
Auginimo terpė: visiškai paruošta sintetinė kultūros terpė, kurioje auga bandomosios medžiagos veikiami bandymo dumbliai. Bandomoji medžiaga paprastai tirpinama bandymo terpėje.
Augimo greitis (vidutinis specifinis augimo greitis): logaritminis biomasės didėjimas veikimo laikotarpiu.
Mažiausia stebimo poveikio koncentracija (LOEC): mažiausia bandymo terpėje ištirpusios bandomosios medžiagos koncentracija, kuriai esant medžiagos poveikis augimo mažėjimui per nustatytą veikimo laikotarpį yra statistiškai reikšmingas palyginti su kontroliniais ėminiais (kai p < 0,05). Tačiau esant visoms didesnėms kaip LOEC bandymo koncentracijos vertėms, kenksmingas poveikis turi būti lygus arba didesnis nei poveikis, kuris būtų esant LOEC. Kai negalima įvykdyti šių dviejų sąlygų, turi būti pateiktas išsamus paaiškinimas, kaip buvo pasirinkta LOEC (taigi ir NOEC) vertė.
Nestebimo poveikio koncentracija (NOEC): vos mažesnė nei LOEC bandymo koncentracija.
Atsako kintamasis: toksiškumui įvertinti naudojamas kintamasis, gautas pagal bet kurį nors iš matuojamų parametrų, skirtingais apskaičiavimo metodais aprašančių biomasę. Šiame metode atsako kintamieji yra augimo greičiai ir išeiga, gauti tiesiogiai matuojant biomasę arba kurį nors iš išvardytų pakaitinių parametrų.
Savitasis augimo greitis: atsako kintamasis, apibrėžiamas kaip stebimo parametro (šiame bandymo metode – biomasės) natūraliųjų logaritmų skirtumo ir atitinkamo laikotarpio dalmuo.
Išeiga: matuojamo kintamojo verčių veikimo laikotarpio pabaigoje ir pradžioje skirtumas biomasės padidėjimui bandymo metu išreikšti.
1.3. BANDYMO TAIKOMUMAS
Šį bandymo metodą lengviausia taikyti vandenyje tirpioms medžiagoms, kurios bandymo sąlygomis tikriausiai lieka vandenyje. Norint bandyti lakias, stipriai absorbuojamas, spalvotas, mažai tirpias medžiagas arba medžiagas, galinčias veikti bandymo terpės mitybinių arba mineralinių medžiagų įsisavinimą, gali tekti atlikti tam tikrus procedūros pakeitimus (pvz., naudoti uždarą sistemą, kondicionuoti bandymo indus). Rekomendacijos dėl tam tikrų tinkamų pakeitimų pateiktos (2), (3) ir (4) nuorodose.
1.4. BANDYMO ESMĖ
Šio bandymo tikslas – nustatyti medžiagos poveikį gėlo vandens mikrodumblių ir (arba) cianobakterijų augimui. Pagal eksponentės dėsnį augantys bandymo organizmai paprastai 72 h laikotarpiu veikiami bandomąja medžiaga periodinio kultūrų auginimo sąlygomis. Nežiūrint į palyginti trumpą bandymo trukmę, galima įvertinti poveikį kelioms kartoms.
Sistemos atsakas yra dumblių kultūrų, veikiamų įvairios koncentracijos bandomąja medžiaga, serijos (bandymo vienetų) augimo mažėjimas. Atsakas įvertinamas kaip bandomosios medžiagos koncentracijos funkcija palyginti su kartotinių kontrolinių ėminių kultūrų, neveikiamų bandomąja medžiaga, augimu. Siekiant visiškai išreikšti sistemos atsaką į toksinius poveikius (optimalųjį jautrį), kultūroms leidžiama pakankamai ilgą laiką neribotai augti pagal eksponentę pakankamos mitybos ir nuolatinio apšvietimo sąlygomis, kad būtų galima išmatuoti savitojo augimo greičio mažėjimą.
Augimas ir augimo inhibavimas yra kiekybiškai įvertinami matuojant dumblių biomasę kaip laiko funkciją. Dumblių biomasė yra išreiškiama sausos medžiagos mase tūrio vienetui, pvz., mg dumblių/litre bandymo tirpalo. Tačiau sausos medžiagos masę yra sunku išmatuoti, todėl taikomi pakaitiniai parametrai. Iš šių pakaitinių parametrų dažniausiai taikomas ląstelių skaičius. Kitus pakaitinius parametrus sudaro ląstelių tūris, fluorescencija, optinis tankis ir t. t. Turėtų būti žinomas išmatuoto pakaitinio parametro perskaičiavimo į biomasę faktorius.
Bandymo rezultatas – augimo inhibavimas, išreiškiamas kaip biomasės didėjimo veikimo laikotarpiu logaritmas (vidutinis savitasis augimo greitis). Pagal bandymo tirpalų serijai gautus vidutinius savituosius augimo greičius apskaičiuojama apibrėžtą augimo greičio mažėjimą x % (pvz., 50 %) sukelianti koncentracija, kuri išreiškiama ErCx (pvz., ErC50).
Taikant šį metodą pagal ES teisės aktus, rezultatai turėtų būti skaičiuojami remiantis vidutiniu savituoju augimo greičiu dėl 2.2 skirsnyje nurodytų priežasčių. Šiame metode taikomas papildomas atsako kintamasis – išeiga, kuris gali būti reikalingas kai kurių valstybių nustatytiems specifiniams norminiams reikalavimams įvykdyti. Jis yra apibrėžiamas kaip biomasės veikimo laikotarpio pabaigoje ir pradžioje skirtumas. Pagal bandymo tirpalų serijai gautą išeigą nustatoma apibrėžtą išeigos mažėjimą x % (pvz., 50 %) sukelianti koncentracija, kuri išreiškiama EyCx (pvz., EyC50).
Be to, galima statistiškai nustatyti mažiausią stebimo poveikio koncentraciją (LOEC) ir nestebimo poveikio koncentraciją (NOEC).
1.5. INFORMACIJA APIE BANDOMĄJĄ MEDŽIAGĄ
Informaciją apie bandomąją medžiagą, kuri gali būti naudinga bandymo sąlygoms nustatyti, sudaro struktūrinė formulė, grynumas, patvarumas veikiant šviesai, patvarumas bandymo sąlygomis, šviesos absorbcijos savybės, pKa ir virsmo tyrimų rezultatai, įskaitant biologinio skaidumo vandenyje rezultatus.
Reikėtų žinoti bandomosios medžiagos tirpumą vandenyje, pasiskirstymo oktanolio ir vandens mišinyje koeficientą (Pow) ir garų slėgį, be to, reikėtų turėti patvirtinto tinkamumo kiekybinio nustatymo bandymo tirpaluose metodą, kurio atgavimo efektyvumas ir aptikimo riba būtų paskelbti.
1.6. ETALONINĖ MEDŽIAGA
Kaip priemonė bandymo procedūrai patikrinti gali būti bandoma (-os) etaloninė (-ės) medžiaga (-os), pvz., 3,5-dichlorfenolis, naudotas tarptautiniame tarplaboratoriniame bandyme (4). Dar kaip etaloninę medžiagą žaliesiems dumbliams galima naudoti kalio dichromatą. Pageidautina etaloninę medžiagą bandyti bent du kartus per metus.
1.7. BANDYMO TINKAMUMAS
Turėtų būti vykdomi šie bandymo charakteristikų kriterijai jo tinkamumui patvirtinti:
|
— |
Per 72 h bandymo laikotarpį kontrolinių ėminių kultūrų biomasė turėtų eksponentiškai padidėti bent 16 kartų. Šis skaičius atitinka savitąjį augimo greitį 0,92 para–1. Dažniausiai naudojamų rūšių augimo greitis paprastai yra gerokai didesnis (žr. 1 priedėlį). Šis kriterijus gali būti neįvykdytas, jei naudojamos rūšys, kurios auga lėčiau nei išvardytos 1 priedėlyje. Toki atveju bandymas turėtų būti pratęstas kontrolinės kultūros kiekiui padidinti bent 16 kartų, ir augimas visą bandymo laiką turi vykti pagal eksponentės dėsnį. Jei tik pasiekiamas mažiausias nustatytas dauginimosi faktorius 16, bandymo laikotarpis gali būti sutrumpintas ne mažiau kaip iki 48 h neribotam eksponentiniam augimui bandymo laikotarpiu užtikrinti. |
|
— |
Atskirų laikotarpių (0–1, 1–2 ir 2–3 parų, 72 h bandymų) kontrolinių kultūrų savitųjų augimo greičių vidutinis variacijos koeficientas (žr. 1.2 skirsnio punktą „variacijos koeficientas“) neturi viršyti 35 %. Atskirų laikotarpių savitojo augimo greičio skaičiavimas pateiktas 2.2.1 skirsnio antroje pastraipoje. Šis kriterijus taikomas vidutinei variacijos koeficiento vertei, apskaičiuotai kartotinių kontrolinių ėminių kultūroms. |
|
— |
Pseudokirchneriella subcapitata ir Desmodesmus subspicatus kontrolinių kultūrų vidutinių savitųjų augimo greičių variacijos koeficientas visą bandymo laikotarpį neturi viršyti 7 %. Kitų rečiau naudojamų rūšių atveju ši vertė neturėtų viršyti 10 %. |
1.8. METODO APRAŠYMAS
1.8.1. Aparatūra
Bandymo indai ir kita aparatūrą, kuri liečiasi su bandymo tirpalais, turėtų būti pagaminta vien tik iš stiklo arba kitos chemiškai inertinės medžiagos. Indai turėtų būti gerai išplauti, siekiant užtikrinti, kad jokie organiniai arba neorganiniai teršalai negalėtų veikti dumblių augimo arba bandymo tirpalų sudėties.
Paprastai kaip bandymo indai naudojamos stiklinės kolbos, kurių matmenų pakaktų talpinti kultūros kiekį, reikalingą bandymo metu atliekamiems matavimams, ir užtikrinti pakankamą CO2 masės pernešimą iš atmosferos (žr. 1.8.9 skirsnio antrąją pastraipą). Atkreipiamas dėmesys į tai, kad skysčio tūrio turi pakakti analiziniams nustatymams (žr. 1.8.11 skirsnio penktąją pastraipą).
Be to, bus reikalinga visa arba tik kai kuri ši įranga:
|
— |
Kultūros auginimo aparatūra: rekomenduojama naudoti spintą arba kamerą, kurioje temperatūrą būtų galima išlaikyti ±2 °C tikslumu. |
|
— |
Apšvietimo matavimo prietaisai: svarbu pažymėti, kad išmatuotą vertę veiks šviesos intensyvumo matavimo metodas ir ypač jutiklio (kolektoriaus) tipas. Pageidautina matavimus atlikti naudojant sferinį (4 π) jutiklį (kuris reaguoja į tiesioginę ir atspindėtą šviesą, krintančią visais kampais virš ir žemiau matavimo plokštumos) arba 2 π jutiklį (kuris reaguoja į šviesą, krintančia visais kampais virš matavimo plokštumos). |
|
— |
Aparatūra dumblių biomasei nustatyti. Ląstelių skaičius, kuris yra dažniausiai taikomas dumblių biomasės pakaitinis parametras, gali būti nustatytas naudojant elektroninį dalelių skaitiklį, mikroskopą su skaičiavimo kamera arba tekėjimo citometrą. Kiti biomasės pakaitiniai parametrai gali būti matuojami naudojant tekėjimo citometrą, fluorimetrą, spektrofotometrą arba kolorimetrą. Naudinga apskaičiuoti perskaičiavimo faktorių, kuris susietų sausos medžiagos masę ir dalelių skaičių. Siekiant užtikrinti tinkamus matavimus spektrofotometru, esant mažoms biomasės koncentracijos vertėms, gali tekti naudoti kiuvetes, kurių šviesos kelio ilgis būtų bent 4 cm. |
1.8.2. Bandymo organizmai
Galima naudoti kelias nepritvirtintų mikrodumblių ir cianobakterijų rūšis. Buvo patikrinta, kad šiame bandymo metode nurodytai bandymo procedūrai tinka 1 priedėlyje išvardyti štamai.
Jei naudojamos kitos rūšys, ataskaitoje turėtų būti nurodytas štamas ir (arba) kilmė. Turi būti patvirtinta, kad pasirinktų bandymo dumblių eksponentinis augimas gali būti užtikrintas visą bandymo laikotarpį vyraujančiomis bandymo sąlygomis.
1.8.3. Auginimo terpė
Rekomenduojamos dvi alternatyvios auginimo terpės: OECD ir AAP terpės. Šių terpių sudėtis pateikta 2 priedėlyje. Atkreipiamas dėmesys, kad skiriasi abiejų terpių pradinė pH vertė ir buferinė talpa (pH didėjimui reguliuoti). Todėl bandymų rezultatai gali skirtis dėl naudojamos bandymo terpės, ypač kai bandomos joninės medžiagos.
Auginimo terpes gali tekti tam tikrais atvejais modifikuoti, pvz., kai bandomi metalai ir chelantai arba bandymai atliekami, esant skirtingoms pH vertėms. Modifikuotų terpių naudojimas turi būti detaliai aprašytas ir pagrįstas (3)(4).
1.8.4. Pradinė biomasės koncentracija
Visų bandymo kultūrų pradinė biomasė turi būti vienoda ir gana maža, kad būtų įmanomas eksponentinis augimas visą inkubavimo laikotarpį ir nebūtų mitybinių medžiagų išeikvojimo rizikos. Pradinė biomasė neturėtų viršyti 0,5 mg/l sausos medžiagos masės. Rekomenduojamos šios pradinės ląstelių koncentracijos vertės:
|
Pseudokirchneriella subcapitata: |
5 × 103 – 104 |
ląstelių/ml |
|
Desmodesmus subspicatus |
2–5 × 103 |
ląstelių/ml |
|
Navicula pelliculosa |
104 |
ląstelių/ml |
|
Anabaena flos-aquae |
104 |
ląstelių/ml |
|
Synechococcus leopoliensis |
5 × 104 – 105 |
ląstelių/ml |
1.8.5. Bandomosios medžiagos koncentracijos vertės
Tikėtinus poveikius atitinkantis koncentracijos intervalas gali būti nustatytas atliekant intervalo nustatymo bandymus. Galutiniam nustatomajam bandymui turėtų būti pasirinktos bent penkios koncentracijos vertės, išdėstytos pagal geometrinę progresiją, kurios vardiklis būtų ne didesnis kaip 3,2. Jei bandomosios medžiagos koncentracijos atsako kreivė yra gulsčia, galima pagrįsti didesnį vardiklį. Koncentracijos verčių eilutė turi sudaryti intervalą, atitinkantį 5–75 % dumblių augimo greičio mažėjimą.
1.8.6. Kartotiniai ir kontroliniai ėminiai
Pagal bandymo planą turėtų būti trys kartotiniai kiekvienos bandymo koncentracijos ėminiai. Jei nereikia nustatyti NOEC, bandymo schema gali būti pakeista padidinant koncentracijos verčių skaičių ir sumažinant kiekvienos bandymo koncentracijos kartotinių ėminių skaičių. Kartotinių kontrolinių ėminių skaičius turi būti ne mažesnis kaip trys ir geriausiu atveju turėtų būti du kartus didesnis nei kiekvienos bandymo koncentracijos kartotinių ėminių skaičius.
Galima paruošti atskirą bandymo tirpalų rinkinį bandomosios medžiagos koncentracijos vertėms nustatyti analizės metodais (žr. 1.8.11 skirsnio ketvirtąją ir šeštąją pastraipas).
Kai bandomajai medžiagai soliubilizuoti naudojamas tirpiklis, turi būti įtraukti papildomi kontroliniai ėminiai, turintys tirpiklio, kurio koncentracija atitiktų naudojamą bandymo kultūroms.
1.8.7. Sėjimo kultūros ruošimas
Norint bandymo dumblius pritaikyti prie bandymo sąlygų ir užtikrinti, kad į bandymo tirpalus sėjamų dumblių augimo tarpsnis būtų eksponentinis, 2–4 dienos prieš bandymo pradžią sėjimo kultūra ruošiama bandymo terpėje. Dumblių biomasė turėtų būti reguliuojama taip, kad iki pat bandymo pradžios sėjimo kultūros augimas būtų iš esmės eksponentinis. Sėjimo kultūra turėtų būti inkubuojama bandymo kultūrų sąlygomis. Matuojamas sėjimo kultūros biomasės didėjimas, kad būtų galima užtikrinti bandymo štamo normalų augimo intervalą auginimo sąlygomis. Dumblių auginimo procedūros pavyzdys aprašytas 3 priedėlyje. Siekiant išvengti vienalaikio ląstelių dalijimosi bandymo eigoje, gali būti reikalinga antra sėjimo kultūros dauginimosi pakopa.
1.8.8. Bandymo tirpalų ruošimas
Turi būti vienoda visų bandymo tirpalų auginimo terpės koncentracija ir pradinė bandymo dumblių biomasė. Pasirinktos koncentracijos bandymo tirpalai paprastai ruošiami maišant bandomosios medžiagos pradinį tirpalą ir auginimo terpę bei sėjimo kultūrą. Pradiniai tirpalai paprastai ruošiami tirpinant medžiagą bandymo terpėje.
Tirpikliai, pvz., acetonas, tret-butilo alkoholis ir dimetilformamidas, gali būti naudojami kaip nešikliai vandenyje mažai tirpioms medžiagoms įdėti į bandymo terpę (2)(3). Tirpiklio koncentracija neturėtų viršyti 100 µl/l ir visų bandymo serijos kultūrų (įskaitant kontrolines) tirpiklio koncentracija turėtų būti vienoda.
1.8.9. Inkubavimas
Bandymo indai užkemšami orui nelaidžiais kamščiais. Indai kratomi ir statomi į kultūros auginimo aparatą. Būtina, kad bandymo metu dumbliai būtų suspenduoti CO2 pernešimui palengvinti. Šiuo tikslu reikėtų nuolat maišyti arba purtyti. Kultūrų temperatūra turėtų būti 21–24 °C intervale ir reguliuojama ±2 °C tikslumu. Jei naudojamos kitos nei 1 priedėlyje nurodytos rūšys, pvz., tropinės rūšys, galbūt labiau tiktų aukštesnė temperatūra, jei būtų įmanoma užtikrinti tinkamumo kriterijus. Rekomenduojama kolbas statyti atsitiktinai ir kasdien keisti jų vietą inkubatoriuje.
Bandymo metu kontrolinių ėminių terpės pH neturėtų padidėti daugiau kaip 1,5 vieneto. Jei bandomi ir junginiai, kurie iš dalies jonizuojasi pH vertėms esant arti bandymo terpės pH, gali tekti riboti pH kitimą atkuriamiems ir tiksliai apibrėžtiems rezultatams gauti. Techniškai įmanoma pakeisti pH vertę < 0,5 pH vieneto, ir tai galima pasiekti esant atitinkamam CO2 masės pernešimo iš aplinkos į bandymo tirpalą greičiui, pvz., didinant maišymo greitį. Kita galimybė – mažinti CO2 suvartojimą, mažinant pradinę biomasę arba bandymo trukmę.
Paviršius, ant kurio yra inkubuotos kultūros, turėtų būti nuolat ir vienodai apšviestas liuminescencinių lempų šviesa, pvz., šaltai balta arba dienos šviesos tipo šviesa. Dumblių ir cianobakterijų štamų reikalavimai šviesai skiriasi. Šviesos intensyvumas turėtų būti pasirinktas taip, kad atitiktų naudojamą bandymo organizmą. Rekomenduotoms žaliųjų dumblių rūšims pasirinktas šviesos intensyvumas bandymo tirpalų lygyje turėtų atitikti 60–120 µE·m–2·s–1 intervalą, kai jis matuojamas esant fotosintezei optimaliam bangų ilgių intervalui 400–700 nm ir naudojant atitinkamą jutiklį. Kai kurios rūšys, ypač Anabaena flos-aquae, gerai auga esant mažesniam šviesos intensyvumui ir gali būti pažeistos esant dideliam intensyvumui. Tokioms rūšims turėtų būti pasirinktas vidutinis šviesos intensyvumas 40–60 µE·m–2·s–1. (Jei apšvietos matavimo prietaisai kalibruoti liuksais, šaltai baltos šviesos 4 440–8 880 liuksų apšvieta maždaug atitinka 60–120 µE·m–2·s–1 šviesos intensyvumą). Šviesos intensyvumas virš inkubavimo vietos neturi kisti daugiau kaip ±15 % vidutinio šviesos intensyvumo.
1.8.10. Bandymo trukmė
Bandymo trukmė paprastai yra 72 h. Tačiau ji gali būti trumpesnė arba ilgesnė, jei vykdomi visi 1.7 skirsnio tinkamumo kriterijai.
1.8.11. Matavimai ir analiziniai nustatymai
Dumblių biomasė kiekvienoje kolboje nustatoma bent kasdien visą bandymo laikotarpį. Jei matavimai atliekami naudojant mažus tūrius, paimamus pipete iš bandymo tirpalo, papildyti šiuos tūrius nereikia.
Biomasės matavimai atliekami skaičiuojant ląsteles mikroskopu rankiniu būdu arba elektroniniu dalelių skaitikliu (ląstelių skaičių ir (arba) biologinį tūrį). Galima taikyti kitus metodus, pvz., pratekamąją citometriją, in vitro arba in vivo chlorofilo fluorescenciją (6)(7) arba optinio tankio matavimą, jei galima įrodyti patenkinamą koreliaciją su biomase, atitinkančia bandymo biomasės intervalą.
Tirpalų pH turi būti išmatuotas bandymo pradžioje ir pabaigoje.
Jei yra analizės procedūra naudojamo intervalo bandomosios medžiagos koncentracijai nustatyti, bandymo tirpalai turėtų būti analizuojami pradinei koncentracijai patikrinti ir veikimo koncentracijos vertėms bandymo eigoje užtikrinti.
Gali pakakti nustatyti mažą ir didelę bandomosios medžiagos koncentraciją bandymo pradžioje ir pabaigoje ir koncentraciją, kuri maždaug atitiktų laukiamą EC50 vertę, jei tikėtina, kad bandymo laikotarpiu veikimo koncentracijos vertės keisis mažiau kaip 20 % vardinės vertės. Rekomenduojama nustatyti visas bandymo koncentracijos vertes bandymo pradžioje ir pabaigoje, jei manoma, kad koncentracija vargu ar išliks 80–120 % vardinės vertės. Rekomenduojama veikimo laikotarpiu kas 24 h papildomai imti analizei lakių, nepatvarių arba stipriai adsorbuojamų medžiagų mėginius, kad galima būtų geriau apibrėžti bandomosios medžiagos nuostolį. Bus reikalingi papildomi šių medžiagų kartotiniai ėminiai. Visais atvejais bandomosios medžiagos koncentraciją reikia nustatyti tik viename kiekvienos bandymo koncentracijos kartotinio ėminio inde (arba analizuoti sujungtų kartotinių ėminių turinį).
Bandymo terpės, kurios specialiai ruošiamos veikimo koncentracijai nustatyti bandymo eigoje, turėtų būti apdorojamos kaip ir bandymo terpės, t. y. į jas turėtų būti sėjami dumbliai ir indai inkubuojami vienodomis sąlygomis. Jei reikia nustatyti ištirpusios bandomosios medžiagos koncentraciją, gali tekti dumblius atskirti nuo terpės. Pageidautina atskirti centrifugavimu, esant mažai perkrovos jėgos vertei, kurios pakaktų dumbliams nusodinti.
Jei yra duomenų, kad visą bandymą bandomosios medžiagos koncentracijos kitimas buvo patenkinamas ir ne didesnis kaip ±20 % vardinės arba išmatuotos pradinės koncentracijos vertės, rezultatų analizę galima atlikti pagal vardinę arba išmatuotą pradinę vertę. Jei nuokrypis nuo vardinės arba išmatuotos pradinės koncentracijos yra didesnis kaip ±20 %, rezultatų analizė turėtų būti atliekama pagal veikimo laikotarpio geometrinio vidurkio koncentraciją arba taikant modelius, aprašančius bandomosios medžiagos koncentracijos mažėjimą (3)(8).
Dumblių augimo inhibavimo bandymas yra dinamiškesnė bandymo sistema palyginti su daugeliu kitų trumpalaikių toksiškumo vandens organizmams bandymų. Dėl tos priežasties gali būti sunku apibrėžti faktines veikimo koncentracijos vertes, ypač adsorbuojamų medžiagų, bandomų esant mažoms koncentracijos vertėms. Tokiais atvejais medžiagos išnykimas iš tirpalo dėl adsorbcijos ant dumblių, kurių biomasė didėja, nereiškia, kad ji pasišalino iš bandymo sistemos. Analizuojant bandymo rezultatą, reikėtų patikrinti, ar dėl bandomosios medžiagos koncentracijos mažėjimo bandymo eigoje mažėja augimo inhibavimas. Jei taip, galima nagrinėti, kaip taikyti tinkamą modelį, aprašantį bandomosios medžiagos koncentracijos mažėjimą (8). Jei ne, rezultatų analizę galbūt tiktų pagrįsti pradinėmis (vardinėmis arba išmatuotomis) koncentracijos vertėmis.
1.8.12. Kiti stebėjimai
Bandymo pabaigoje sėjimo kultūra turėtų būti apžiūrėta per mikroskopą jos normaliai ir sveikai išvaizdai patikrinti ir visiems dumblių išvaizdos nukrypimams (kuriuos gali sukelti veikimas bandomąja medžiaga) stebėti.
1.8.13. Ribinis bandymas
Kai kuriomis aplinkybėmis, pvz., kai pradinis bandymas rodo, kad bandomosios medžiagos toksinis poveikis nepasireiškia esant mažesnei kai 100 mg·l–1 arba tirpumą bandymo terpėje atitinkančiai koncentracijai (kuri būtų mažesnė), galima atlikti ribinį bandymą, kuriame būtų lyginami kontrolinės grupės ir vienos apdorotų ėminių grupės (100 mg·l–1 arba tirpumo vertei lygi koncentracija) atsakai. Labai rekomenduojama, kad jis būtų patvirtintas analizuojant veikiančios medžiagos koncentraciją. Ribiniam bandymui taikomos visos anksčiau aprašytos bandymo sąlygos ir tinkamumo kriterijai, išskyrus tai, kad būtų ne mažiau kaip šeši kartotiniai apdoroti ėminiai. Vidurkiams palyginti kontrolinių ir apdorotų ėminių grupių atsako kintamieji gali būti analizuojami taikant statistinį kriterijų, pvz., Stjudento t kriterijų. Jei dviejų grupių dispersijos yra nelygios, analizė turėtų būti atliekama taikant t kriterijų, pritaikytą nelygioms dispersijoms.
1.8.14. Metodo modifikacija, jei bandomos ryškių spalvų medžiagos
Apšvietimas (šviesos intensyvumas) turėtų būti didžiausias, koks gali būti šiame bandymo metode nustatytame diapazone: 120µE m-2 s-1 arba didesnis.
Šviesos kelias turėtų būti sutrumpinamas sumažinant bandymo tirpalų tūrį (5–25 ml).
Dumblius reikėtų pakankamai suaktyvinti (pavyzdžiui, lengvai pakratant kolbą), kad jie būtų dažnai apšviečiami stipriu šviesos šaltiniu kultūros paviršiuje.
2. DUOMENYS
2.1. AUGIMO KREIVIŲ GAVIMAS
Biomasę bandymo induose galima išreikšti matuojamų pakaitinių parametrų vienetais (pvz., ląstelių skaičiumi, fluorescencija).
Augimo kreivių grafikams gauti į lenteles surašomos įvertintos bandymo ir kontrolinių kultūrų biomasės koncentracijos vertės, bandomosios medžiagos koncentracijos vertės ir matavimo laikas, skaičiuojamas bent sveikos valandos tikslumu. Šioje stadijoje gali būti naudingos logaritminių ir linijinių parametrų skalė, bet logaritminės skalės yra privalomos ir paprastai jos geriau rodo augimo vaizdo kitimus bandymo laikotarpiu. Atkreipiamas dėmesys į tai, kad logaritminėse koordinatėse gauta eksponentinio augimo kreivę yra tiesė, kurios palinkimas (krypties koeficientas) žymi savitąjį augimo greitį.
Pagal grafikus tiriama, ar visa bandymą kontrolinės kultūros auga laukiamu greičiu pagal eksponentės dėsnį. Kritiškai tiriami visi duomenų taškai ir grafiko išvaizda, neapdoroti duomenys ir procedūros tikrinamos, norint rasti galimas klaidas. Ypač tikrinami visi duomenų taškai, kurie atrodytų, kad nukrypo dėl sistemingosios paklaidos. Jei akivaizdų, kad galima identifikuoti ir (arba) laikyti labai tikėtinomis procedūros klaidas, konkretus duomenų taškas žymimas kaip riktas ir neįtraukiamas į vėliau atliekama statistinę analizę. (Nulinė dumblių koncentracija viename iš dviejų arba trijų kartotinių ėminių indų gali rodyti, kad į indą nebuvo tinkamai pasėta arba jis buvo blogai išplautas). Duomenų taškų atmetimo kaip riktų priežastys turi būti aiškiai nurodytos bandymų ataskaitoje. Priimamos priežastys yra tik (retos) procedūros klaidos ir ne vien tik blogas preciziškumas. Statistinės riktų identifikavimo procedūros šio tipo problemai taikomos ribotai ir negali pakeisti ekspertų įvertinimo. Riktus (pažymėtus, kad jie yra tokie) geriau būtų palikti tarp duomenų taškų, kurie vėliau kokiu nors būdu pateikiami kaip grafiniai arba lentelių duomenys.
2.2. ATSAKO KINTAMIEJI
Bandymo tikslas – nustatyti bandomosios medžiagos poveikį dumblių augimui. Šiame bandymo metode aprašyti du atsako kintamieji, nes valstybės narės juos skirtingai vertina ir skiriasi norminiai reikalavimai. Siekiant užtikrinti rezultatų priimtinumą visose valstybėse narėse, poveikis turėtų būti įvertintas taikant abu toliau aprašytus atsako kintamuosius a ir b.
|
a) |
Vidutinis savitasis augimo greitis: šis atsako kintamasis yra apskaičiuojamas pagal biomasės logaritminį padidėjimą bandymo laikotarpiu, išreiškiamą parai. |
|
b) |
Išeiga: šis atsako kintamasis yra biomasės bandymo pabaigoje ir pradžioje skirtumas. |
Taikant šį metodą pagal ES teisės aktus, rezultatai turėtų būti skaičiuojami remiantis vidutiniu savituoju augimo greičiu dėl toliau nurodytų priežasčių. Reikėtų pažymėti, kad nėra lygintinos toksiškumo vertės, apskaičiuotos taikant šiuos du kintamuosius, ir šis skirtumas turi būti suvoktas naudojant bandymo rezultatus. Dėl atitinkamų metodų matematinio pagrindo, savitojo augimo greičio vidurkiu pagrįstos ECx vertės (ErCx), paprastai bus didesnės nei išeiga pagrįsti rezultatai (EyCx), jei laikomasi šio bandymo metodo sąlygų. Tai neturėtų būti interpretuojama kaip dviejų atsako kintamųjų jautrio skirtumas, tiesiog vertės skiriasi matematiškai. Vidutinio savitojo augimo greičio sąvoka pagrįsta bendrąja dumblių eksponentinio augimo neribojamose kultūrose schema, kurią taikant toksiškumas įvertinamas pagal poveikį augimo greičiui, kuris nepriklauso nuo kontroliniams ėminiams gauto absoliutaus savitojo augimo greičio lygio, koncentracijos ir atsako kreivės krypties koeficiento arba nuo bandymo trukmės. Priešingai, rezultatai, pagrįsti išeiga kaip atsako kintamuoju, priklauso nuo visų šių kitų kintamųjų. EyCx priklauso nuo kiekviename bandyme naudojamų dumblių rūšių savitojo augimo greičio ir nuo didžiausio savitojo augimo greičio, kuris gali būti skirtingas dumblių rūšims ir netgi štamams. Šis atsako kintamasis neturėtų būti taikomas lyginant dumblių rūšių arba net skirtingų štamų jautrį toksinėms medžiagoms. Nors toksiškumui įvertinti moksliniu požiūriu būtų geriau taikyti vidutinį savitąjį augimo greitį, išeiga pagrįsti toksiškumo įverčiai irgi yra įtraukti į šį bandymo metodą, siekiant atitikti kai kurių šalių galiojančių norminių teisės aktų reikalavimus.
2.2.1. Vidutinis augimo greitis
Vidutinis savitasis augimo greitis per tam tikrą laikotarpį yra apskaičiuojamas kaip kiekvieno atskiro kontrolinių ir apdorotų ėminių indo biomasės logaritminis padidėjimas pagal lygtį:
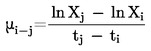 (para–1)
(para–1)
čia:
|
µ i–j : |
– vidutinis savitasis augimo greitis per laiką i – j; |
|
X i : |
–biomasė laiku i; |
|
X j : |
–biomasė laiku j. |
Kiekvienai apdorotų ir kontrolinių ėminių grupei apskaičiuojama augimo greičio vidutinė vertė ir dispersijos įverčiai.
Apskaičiuojamas visą bandymo trukmę atitinkantis vidutinis savitasis augimo greitis (paprastai 0–3 paros), kaip pradinę vertę naudojant pasėtos biomasės pradinę vardinę vertę, bet ne matuojamą pradinę vertę, nes šiuo būdu paprastai gaunamas didesnis preciziškumas. Jei biomasei matuoti naudojama įranga galima gana tiksliai nustatyti mažą sėjinio biomasę (pvz., tekėjimo citometras), galima naudoti išmatuotą pradinę biomasės koncentraciją. Be to, įvertinamas augimo greitis atskirais laikotarpiais, apskaičiuojamas kaip kiekvienos bandymo dienos savitieji augimo greičiai (0–1, 1–2 ir 2–3 paros) ir tiriama, ar kontrolinių ėminių augimo greitis lieka pastovus (žr. tinkamumo kriterijus, 1.7 skirsnis). Gerokai mažesnis savitasis augimo greitis pirmąją parą palyginti su bendruoju vidutiniu savituoju augimo greičiu gali rodyti vėlavimo tarpsnio buvimą. Tuo tarpu kai kontrolinių kultūrų vėlavimo tarpsnį galima labai sumažinti ir praktiškai pašalinti tinkamai paskleidžiant iš anksto paruoštą kultūrą, veikiamų kultūrų vėlavimo tarpsnis gali rodyti atsigavimą po pradinio toksinio streso arba sumažėjusį palyginti su pradiniu veikimą dėl bandomosios medžiagos nuostolių (įskaitant sorbciją ant dumblių biomasės). Taigi galima įvertinti atskirų laikotarpių augimo greitį, kad būtų galima įvertinti bandomosios medžiagos poveikius veikimo laikotarpiu. Dideli atskiriems laikotarpiams gautų augimo greičių ir vidutinio augimo greičio skirtumai rodo, kad yra nuokrypis nuo pastovaus eksponentinio augimo ir kad reikia atlikti nuodugnų augimo kreivių tyrimą.
Kiekvieno apdoroto kartotinio ėminio augimo greičio mažėjimas procentais apskaičiuojamas pagal lygtį:

čia:
|
% Ir |
vidutinio savitojo augimo greičio mažėjimas procentais; |
|
µC |
kontrolinės grupės vidutinio savitojo augimo greičio (µ) vidutinė vertė; |
|
µT |
apdoroto kartotinio ėminio vidutinis savitasis augimo greitis. |
Kai bandymo tirpalams ruošti naudojami tirpikliai, inhibavimo procentinei daliai apskaičiuoti geriau būtų naudoti tirpiklio kontrolinius ėminius, o ne kontrolinius ėminius be tirpiklių.
2.2.2. Išeiga
Išeiga apskaičiuojama kaip biomasės bandymo pabaigoje ir pradinės biomasės skirtumas kiekvienam atskiram kontrolinių ir apdorotų ėminių indui. Kiekvienai bandymo koncentracijai ir kontroliniam ėminiui apskaičiuojama išeigos vidutinė vertė ir dispersijos įverčiai. Kiekvieno apdoroto kartotinio ėminio išeigos mažėjimą procentais (% Iy) galima apskaičiuoti taip:

čia:
|
% Iy: |
išeigos mažėjimas procentais; |
|
YC: |
vidutinė kontrolinės grupės išeigos vertė; |
|
YT: |
apdoroto kartotinio ėminio išeigos vertė. |
2.3. KONCENTRACIJOS IR ATSAKO SANTYKIO KREIVĖS BRĖŽIMAS
Braižomas ir nuodugniai tiriamas inhibavimo procentinės vertės ir bandomosios medžiagos koncentracijos logaritmo grafikas, atmetant visus duomenų taškus, kurie buvo pažymėti kaip riktas per pirmąjį tarpsnį. Iš akies arba taikant kompiuterinį interpoliavimą per duomenų taškus brėžiama tolydi linija pradiniam koncentracijos ir atsako santykio vaizdui gauti, vėliau taikomas detalesnis metodas, pageidautina taikyti kompiuterinį statistinį metodą. Atsižvelgiant į numatytą duomenų paskirtį, kokybę (preciziškumą), duomenų kiekį ir jų analizės priemonių buvimą, gali būti nuspręsta (ir kartais tinkamai pagrįsta) stabdyti duomenų analizę šioje stadijoje ir tiesiog iš akies nubrėžtoje kreivėje rasti pagrindinius skaičius EC50 ir EC10 (ir (arba) EC20) (dar žr. skirsnį apie skatinamuosius poveikius). Pagrįstomis priežastimis netaikyti statistinio metodo gali būti:
|
— |
Duomenys netinka kompiuteriniais metodais gauti rezultatus, kurie būtų patikimesni nei eskspertų įvertinimu gauti rezultatai; tokiomis aplinkybėmis kai kuriomis kompiuterinėmis programomis netgi nepasiseka gauti patikimo sprendinio (iteracijos gali nekonverguoti ir t. t.). |
|
— |
Negalima tinkamai apdoroti skatinamo augimo atsakų, taikant turimas kompiuterines programas (žr. toliau). |
2.4. STATISTINĖS PROCEDŪROS
Tikslas – gauti kiekybinį koncentracijos ir atsako santykį, taikant regresinę analizę. Galima taikyti svertinę tiesinę regresiją, atlikus atsako duomenų tiesinamąjį transformavimą, pvz., į probito, logito arba Weibullo vienetus (9), bet geresnės yra netiesinės regresijos metodų procedūros, kurias taikant geriau apdorojami neišvengiami duomenų netolygumai ir nukrypimai nuo glodžiųjų skirstinių. Artėjant į nulinį arba visišką inhibavimą, tokie netolygumai dėl transformavimo gali padidėti ir trukdyti analizei (9). Reikėtų pažymėti, kad tipiniai analizės metodai, taikant probito, logito arba Weibullo transformuotus dydžius, yra skirti dichotominiams (pvz., mirtingumas arba išlikimas) duomenims ir turi būti modifikuojami, norint juos pritaikyti augimo arba biomasės duomenims. Specifinės ECx verčių nustatymo pagal tolydžiuosius duomenis procedūros yra pateiktos (10)(11) ir (12). Netiesinės regresijos taikymas detaliau aprašytas 4 priedėlyje.
Kiekvienam analizuojamam atsako kintamajam naudojamas koncentracijos ir atsako santykis ECx verčių taškiniams įverčiams apskaičiuoti. Kai įmanoma, turėtų būti nustatyti kiekvieno įverčio 95 % pasikliautinieji rėžiai. Atsako duomenų atitiktis regresijos modeliui turėtų būti įvertinta grafiškai arba statistiškai. Regresinė analizė turėtų būti atliekama naudojant atskirus kartotinių ėminių atsakus, bet ne apdorotų ėminių grupių vidurkius. Tačiau jei netiesinę kreivę yra sunku arba nepavyksta pritaikyti dėl per didelės duomenų sklaidos, problemą galima apeiti, atliekant grupės vidutinių verčių regresiją, kuri yra praktinis būdas sumažinti įtariamųjų riktų įtaką. Šio varianto taikymas turėtų būti nurodytas bandymų ataskaitoje kaip nukrypimas nuo normalios procedūros, nes pritaikant kreivę pagal atskirus kartotinius ėminius nebuvo gautas tinkamas rezultatas.
Be to, jei turimi regresijos modeliai (metodai) netinka duomenims, EC50 įverčiai ir pasikliautinieji rėžiai gali būti gauti taikant tiesinį interpoliavimą ir savaiminio gerinimo metodus (anglų k. bootstrapping) (13).
Norint įvertinti LOEC, taigi ir NOEC, ir bandomosios medžiagos poveikį augimo greičiui, yra būtina palyginti apdorotų ėminių vidutines vertes, taikant dispersinės analizės (ANOVA) metodus. Tuomet kiekvienai koncentracijai gautas vidurkis turi būti lyginamas su kontrolinio ėminio vidurkiu, taikant atitinkamą kartotinių palyginimų arba trendo kriterijaus metodą. Gali būti naudingas Dunnetto arba Williamso kriterijus (14)(15)(16)(17)(18). Yra būtina įvertinti, ar galioja ANOVA dispersijos vienalytiškumo prielaida. Šį įvertinimą galima atlikti grafiškai arba taikant formalųjį kriterijų (18). Tinkami kriterijai yra Levene arba Bartletto kriterijai. Neatitiktį prielaidai dėl dispersijų vienalytiškumo kartais galima pataisyti atliekant duomenų logaritminį transformavimą. Jei dispersijos nevienalytiškumas yra labai didelis ir jo neįmanoma pataisyti transformavimo keliu, reikėtų nagrinėti galimybę taikyti kitus analizės metodus, pvz., žingsnio mažinimo Jonkheere trendo kriterijus. Papildomus nurodymus dėl NOEC nustatymo galima rasti (12).
Atsižvelgiant į naujus mokslo pasiekimus rekomenduojama atsisakyti NOEC sąvokos ir ją pakeisti regresija pagrįstais ECx taškiniais įverčiais. Atitinkama šio dumblių bandymo x vertė nėra nustatyta. Atrodo, kad tiktų į 10–20 % intervalą patenkanti vertė (pagal pasirinktą atsako kintamąjį), ir pageidautina ataskaitoje pateikti abi EC10 ir EC20 vertės.
2.5. AUGIMO SKATINIMAS
Mažoms koncentracijos vertėms kartais yra stebimas augimo skatinimas (neigiamas inhibavimas). Šio reiškinio priežastis gali būti hormezė („toksinis skatinimas“) arba augimą skatinančių priemonių pridėjimas su bandomąja medžiaga į mažiausią naudojamos terpės tūrį. Atkreipiamas dėmesys į tai, kad neorganinių mitybinių medžiagų pridėjimas neturėtų daryti kokį nors tiesioginį poveikį, kadangi bandymo terpėje visą bandymą turėtų būti užtikrintas mitybinių medžiagų perteklius. Į skatinimą mažomis dozėmis paprastai galima nekreipti dėmesio apskaičiuojant EC50, jei jis nėra labai didelis. Tačiau jei jis yra labai didelis arba reikia apskaičiuoti mažą x atitinkančią ECx vertę, gali tekti taikyti specialias procedūras. Jei įmanoma, reikėtų vengti skatinamųjų atsakų pašalinimo iš duomenų analizės, ir jei turima kreivių pritaikymo programinė įranga negali leisti mažo skatinimo, galima taikyti tiesinę interpoliaciją ir savaiminio gerinimo metodą. Jei skatinimas labai didelis, galima nagrinėti hormezės taikymo klausimą (19).
2.6. NETOKSINIS AUGIMO INHIBAVIMAS
Šviesą sugeriančios bandomosios medžiagos gali būti augimo greičio mažėjimo priežastimi dėl to, kad tamsinimas mažina gaunamos šviesos kiekį. Tokie fizikinio tipo reiškiniai turėtų būti atskirti nuo toksinių poveikių, keičiant bandymo sąlygas, ir ataskaitoje apie juos reikėtų paskelbti atskirai. Rekomendacijas galima rasti (2) ir (3)..
3. ATASKAITOS RENGIMAS
3.1. BANDYMŲ ATASKAITA
Bandymų ataskaitą turi sudaryti ši informacija:
Bandomoji medžiaga:
|
— |
fizikinė būsena ir atitinkamos fizikocheminės savybės, įskaitant ribinę tirpumo vandenyje koncentraciją, |
|
— |
cheminio identifikavimo duomenys, įskaitant grynumą. |
Bandymo rūšys:
|
— |
štamas, tiekėjas arba šaltinis ir naudotos auginimo sąlygos. |
Bandymo sąlygos:
|
— |
bandymo pradžios data ir jo trukmė, |
|
— |
bandymo schemos aprašymas: bandymo indai, kultūros tūriai, biomasės tankis bandymo pradžioje, |
|
— |
terpės sudėtis, |
|
— |
bandymo koncentracijos vertės ir kartotiniai ėminiai (pvz., kartotinių ėminių skaičius, bandymo koncentracijos verčių skaičius ir taikyta geometrinė progresija), |
|
— |
bandymo tirpalų ruošimo aprašymas, įskaitant tirpiklių naudojimą ir t. t., |
|
— |
kultūros auginimo aparatūra, |
|
— |
šviesos intensyvumas ir kokybė (šaltinis, vienalytiškumas), |
|
— |
temperatūra, |
|
— |
bandytos koncentracijos vertės: vardinės bandymo koncentracijos vertės ir visi bandomosios medžiagos nustatymo bandymo induose rezultatai. Ataskaitoje turėtų būti nurodytas metodo atgavimo laipsnis ir kiekybinio nustatymo riba esant bandymo matricai, |
|
— |
visi nukrypimai nuo šio bandymo metodo, |
|
— |
biomasės nustatymo metodas ir duomenys apie matuojamo parametro ir sausos medžiagos masės koreliaciją. |
Rezultatai:
|
— |
visų apdorotų indų tirpalų pH vertės bandymo pradžioje ir pabaigoje, |
|
— |
kiekvienos kolbos biomasė kiekviename matavimo taške ir biomasės matavimo metodas, |
|
— |
augimo kreivės (biomasės kaip laiko funkcijos grafikas), |
|
— |
apskaičiuoti kiekvieno apdoroto kartotinio ėminio atsako kintamieji, jų vidutinės vertės ir kartotinių ėminių variacijos koeficientas, |
|
— |
grafinis koncentracijos ir poveikio santykio pateikimas, |
|
— |
toksiškumo įverčiai pagal atsako kintamuosius, pvz., EC50, EC10, EC20 ir atitinkami pasikliautinieji intervalai. Jei buvo apskaičiuotos, LOEC ir NOEC vertės ir jų nustatymo statistiniai metodai, |
|
— |
jei buvo taikytas dispersinės analizės metodas ANOVA, poveikio, kurį galima aptikti, dydis (pvz., mažiausiais reikšminis skirtumas), |
|
— |
bet koks augimo skatinimas, nustatytas kuriam nors apdorojimo atvejui, |
|
— |
visi kiti stebėti reiškiniai, pvz., dumblių morfologiniai pokyčiai, |
|
— |
rezultatų aptarimas, įskaitant nukrypimų nuo šio bandymo metodo įtaką bandymo rezultatams. |
4. LITERATŪRA
|
(1) |
OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test |
|
(2) |
ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442 |
|
(3) |
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23. |
|
(4) |
ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667–16. |
|
(5) |
ISO 1993: Water quality – Algal growth inhibition test. ISO 8692 |
|
(6) |
Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525–2531. |
|
(7) |
Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp.919–925 |
|
(8) |
Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073–2079. |
|
(9) |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718. |
|
(10) |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167. |
|
(11) |
Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485–1494. |
|
(12) |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
(13) |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN. |
|
(14) |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096–1121 |
|
(15) |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482–491. |
|
(16) |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117. |
|
(17) |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531. |
|
(18) |
Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York. |
|
(19) |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96. |
1 Priedėlis
Patvirtinti bandymams tinkami štamai
Žalieji dumbliai
|
— |
Pseudokirchneriella subcapitata, (anksčiau vadinti Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG |
|
— |
Desmodesmus subspicatus (anksčiau vadinti Scenedesmus subspicatus) 86.81 SAG |
Diatomėjos
|
— |
Navicula pelliculosa, UTEX 664 |
Cianobakterijos
|
— |
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A |
|
— |
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1 |
Štamų šaltiniai
Rekomenduojamus štamus galima gauti kaip vienos rūšies dumblių kultūrą iš šių rinkinių (abėcėlės tvarka):
|
|
|
|
|
|
|
|
|
|
|
|
Rekomenduojamų rūšių išvaizda ir charakteristikos
|
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
A. flos-aquae |
S. leopoliensis |
|
Išvaizda |
Lenktos, susuktos atskiros ląstelės |
Ovalo formos, daugiausia atskiros ląstelės |
Strypeliai |
Ovalo formos ląstelių grandinės |
Strypeliai |
|
Dydis (L × W) µm |
8–14 × 2–3 |
7–15 × 3–12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Ląstelės tūris (µm3/ląstelė) |
40–60 (1) |
60–80 (1) |
40–50 (1) |
30–40 (1) |
2,5 (2) |
|
Sausų ląstelių masė (mg/ląstelė) |
2–3 × 10–8 |
3–4 × 10–8 |
3–4 × 10–8 |
1–2 × 10–8 |
2–3 × 10–9 |
|
Augimo greitis (3) (para–1) |
1,5–1,7 |
1,2–1,5 |
1,4 |
1,1–1,4 |
2,0–2,4 |
Konkrečios rekomendacijos dėl siūlomų naudoti bandymo rūšių auginimo ir tvarkymo
Pseudokirchneriella subcapitata ir Desmodesmus subspicatus
Šiuos žaliuosius dumblius paprastai lengva prižiūrėti įvairiose kultūros terpėse. Informaciją apie tinkamas terpes galima gauti iš kultūros rinkinių tiekėjų. Ląstelės paprastai yra pavienės ir jų tanki lengva matuoti elektroniniu dalelių skaitikliu arba mikroskopu.
Anabaena flos-aquae
Pradinei kultūrai laikyti tinka įvairios auginimo terpės. Ypač svarbu neleisti pasibaigti atnaujinamos atskiro ėminio kultūros eksponentinio augimo tarpsniui, nes atgaivinti pasibaigus šiam tarpsniui būtų sunku.
Anabaena flos-aquae sudaro lizdo formos ląstelių grandinių agregatus. Šių agregatų dydis gali keistis atsižvelgiant į auginimo sąlygas. Šiuos agregatus gali tekti suardyti, kai biomasei nustatyti skaičiuojama mikroskopu arba elektroniniu dalelių skaitikliu.
Grandinėms suardyti ir dumblių skaičiaus kintamumui sumažinti dalinius ėminius galima apdoroti ultragarsu. Ląstelės gali būti sunaikintos, jei jos apdorojamos ultragarsu ilgiau nei reikia grandinėms sutrumpinti. Kiekvieno apdorojimo ultragarsu intensyvumas ir trukmė turi būti vienodi.
Skaičiuojamas pakankamas skaičius hemocitometro laukų (bent 400 ląstelių) kintamumui sumažinti. Dėl to pagerėtų tankio mikroskopinio nustatymo patikimumas.
Suminiam Anabaena ląstelių tūriui nustatyti galima naudoti elektroninį dalelių skaitiklį, ląstelių grandines sutrumpinus atsargiai apdorojant ultragarsu. Ląstelių irimui išvengti apdorojimo ultragarsu energija turi būti reguliuojama.
Siekiant užtikrinti, kad bandymo indams apsėti naudojama dumblių suspensija būtų gerai sumaišyta ir vienalytė, naudojamas sūkurinis maišytuvas arba panašus tinkamas būdas.
Bandymo indai statomi ant sukamojo arba slankiojamojo tipo purtyklės stalo ir maišomi 150 apsisukimų per minutę greičiu. Dar galima naudoti periodiškai nutraukiamą maišymą, kuris sumažintų Anabaena polinkį sudaryti gniužulus. Jei gniužulai susidaro, būtina imtis priemonių gauti tipinius biomasei matuoti skirtus ėminius. Gali tekti stipriai maišyti prieš ėminių ėmimą, norint suardyti dumblių gniužulus.
Synechococcus leopoliensis
Pradinei kultūrai laikyti tinka įvairios auginimo terpės. Informaciją apie tinkamas terpes galima gauti iš kultūros rinkinių tiekėjų.
Synechococcus leopoliensis auga kaip pavienės strypelio formos ląstelės. Ląstelės yra labai mažos, todėl biomasės matavimams yra sunkiau naudoti skaičiavimą mikroskopu. Tinka elektroniniai dalelių skaitikliai su įranga mažesnėms kaip maždaug 1 µm dydžio dalelėms skaičiuoti. Be to, tinka in vitro fluorimetriniai matavimai.
Navicula pelliculosa
Pradinei kultūrai laikyti tinka įvairios auginimo terpės. Informaciją apie tinkamas terpes galima gauti iš kultūros rinkinių tiekėjų. Atkreipiamas dėmesys į tai, kad terpėje turi būti silikato.
Tam tikromis auginimo sąlygomis Navicula pelliculosa gali sudaryti agregatus. Dėl lipidų susidarymo dumblių ląstelės kartais gali kauptis paviršiaus plėvelėje. Norint tokiomis aplinkybėmis gauti tipinius ėminius, būtina imtis specialių priemonių, kai daliniai ėminiai imami biomasei nustatyti. Gali būti reikalingas stiprus maišymas, pvz., sūkuriniu maišytuvu.
(1) Išmatuotas elektroniniu dalelių skaitikliu.
(2) Apskaičiuotas pagal dydį.
(3) Dažniausiai buvo stebimas augimo OECD terpėje greitis, esant šviesos intensyvumui maždaug 70 µE·m–2·s–1 ir 21 °C.
2 priedėlis
Auginimo terpės
Galima naudoti vieną iš šių dviejų auginimo terpių:
OECD terpė: originali OECD TG 201 terpė, be to, naudojama pagal ISO 8692
JAV AAA AAP terpė, be to, naudojama pagal ASTM.
Šioms terpėms ruošti turi būti naudojamos analiziškai grynos cheminės medžiagos ir dejonizuotas vanduo.
AAP terpės (JAV AAA) ir OECD TG 201 terpė
|
Komponentas |
EPA |
OECD |
||
|
|
mg/l |
mmol |
mg/l |
mmol |
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
|
|
|
NH4Cl |
|
|
15,0 |
0,280 |
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
|
|
|
KH2PO4 |
|
|
1,60 |
0,00919 |
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
Atliekant bandymą su diatomėjomis Navicula pelliculosa, į abi terpes turi būti papildomai įdėta Na2SiO3·9H2O 1,4 mg Si/l koncentracijai gauti.
Terpės pH vertė gaunama, nusistovėjus pusiausvyrai tarp karbonatinės sistemos ir atmosferos oro CO2 dalinio slėgio. pH ir molinės hidrokarbonato koncentracijos santykį, esant 25 °C, apytikriai galima išreikšti taip:
pHeq = 11,30 + log [HCO3]
Esant 15 mg NaHCO3/l, pHeq = 7,5 (JAV AAA terpė) ir esant 50 mg NaHCO3/l, pHeq = 8,1 (OECD terpė).
Bandymo terpės elementinė sudėtis
|
Elementas |
EPA |
OECD |
|
|
mg/l |
mg/l |
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
OECD terpės ruošimas
|
Mitybinė medžiaga |
Pradinio tirpalo koncentracija |
|
1 pradinis tirpalas: mitybiniai makroelementai |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
2 pradinis tirpalas: geležies |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
3 pradinis tirpalas: mikroelementai |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
4 pradinis tirpalas: hidrokarbonatas |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H2O |
|
Pradiniai tirpalai sterilizuojami filtravimu per membraną (vidutinis akučių skersmuo 0,2 µm) arba apdorojami autoklave (120 °C, 15 min). Tirpalai laikomi tamsoje, esant 4 °C.
Negalima apdoroti autoklave 2 ir 4 pradinių tirpalų, jie sterilizuojami filtravimu per membraną.
Auginimo terpė ruošiama į vandenį įpilant atitinkamą 1–4 pradinių tirpalų tūrį:
Į 500 ml sterilizuoto vandens įpilama:
|
— |
10 ml 1 pradinio tirpalo |
|
— |
1 ml 2 pradinio tirpalo |
|
— |
1 ml 3 pradinio tirpalo |
|
— |
1 ml 4 pradinio tirpalo |
Sterilizuotu vandeniu skiedžiama iki 1 000 ml.
Tirpalai paliekami pakankamą laiką stovėti, kad nusistovėtų terpės ir atmosferos CO2 pusiausvyra, prireikus kelias valandas barbotuojant sterilų filtruotą orą.
AAP terpės ruošimas
|
A1.1. |
1 ml kiekvieno A1.2.1–A1.2.7 pradinio tirpalo įpilama į maždaug 900 ml dejonizuoto arba distiliuoto vandens ir skiedžiama iki 1 litro. |
|
A1.2. |
Mitybinių makroelementų pradiniai tirpalai ruošiami tirpinant šiuos medžiagų kiekius 500 ml dejonizuoto arba distiliuoto vandens. A1.2.1, A1.2.2, A1.2.3 ir A1.2.4 reagentai gali būti sujungti į vieną pradinį tirpaląruošiami tirpinant šiuos medžiagų kiekius 500 ml dejonizuoto arba distiliuoto vandens. A1.2.1, A1.2.2, A1.2.3 ir A1.2.4 reagentai gali būti sujungti į vieną pradinį tirpalą. |
|
A1.2.1. |
NaNO3 –12,750 g. |
|
A1.2.2. |
MgCL2 ·6H2O –6,082 g. |
|
A1.2.3. |
CaCl2 ·2H2O –2,205 g. |
|
A1.2.4. |
Mitybinių makroelementų pradiniai tirpalai – (žr. A1.3). |
|
A1.2.5. |
MgSO4·7H2O –7,350 g. |
|
A1.2.6. |
K2HPO4 –0,522 g. |
|
A1.2.7. |
NaHCO3 –7,500 g. |
|
A1.2.8. |
Na2SiO3·9H2O – žr. A1.1 pastabą. A1.1 pastaba – Naudojamas tik tokiu atveju, kai bandymo rūšis yra diatomėjos. Gali būti įdėtas tiesiogiai (202,4 mg) arba kaip pradinis tirpalas, kad galutinė terpės koncentracija būtų 20 mg/l Si. |
|
A1.3. |
Mitybinių mikroelementų pradinis tirpalas ruošiamas 500 ml dejonizuoto arba distiliuoto vandens tirpinant: |
|
A1.3.1. |
H3BO3 –92,760 mg. |
|
A1.3.2. |
MnCl2·4H2O –207,690 mg. |
|
A1.3.3. |
ZnCl2 –1,635 mg. |
|
A1.3.4. |
FeCl3·6H2O –79,880 mg. |
|
A1.3.5. |
CoCl2·6H2O –0,714 mg. |
|
A1.3.6. |
Na2MoO4·2H2O –3,630 mg. |
|
A1.3.7. |
CuCl2·2H2O –0,006 mg. |
|
A1.3.8. |
Na2EDTA·2H2O –150,000 mg. [dinatrio(etilendinitrilo)tetraacetatas]. |
|
A1.3.9. |
Na2SeO4·5H2O –0,005 mg žr A1.2. pastabą. A1.2 pastaba – Naudojamas tik diatomėjų rūšių pradinių kultūrų terpei. |
|
A1.4. |
pH vertė 7,5 ± 0,1 nustatoma 0,1 N arba 1,0 N NaOH arba HCl. |
|
A1.5. |
Terpės filtruojamos į sterilų indą per 0,22 μm membraninį filtrą, jei būtų naudojamas dalelių skaitiklis, arba 0,45 μm filtrą, jei dalelių skaitiklis nebūtų naudojamas. |
|
A1.6. |
Nenaudojama terpė laikoma tamsoje, maždaug 4 °C temperatūroje. |
(1) EDTA ir geležies molinis santykis vos viršija vienetą. Tai apsaugo nuo geležies jonų nusodinimo, bet tuo pačiu kiek įmanoma sumažinamas sunkiųjų metalų chelatinimas.
3 priedėlis
Dumblių auginimo procedūros pavyzdys
Bendrosios pastabos
Kultūros auginimo pagal šią procedūrą tikslas – gauti dumblių kultūras toksiškumo bandymams.
Siekiant užtikrinti dumblių kultūrų apsaugą nuo užkrėtimo bakterijomis, turi būti taikomi tinkami metodai. Pageidautina naudoti akseniškas kultūras, tačiau turi būti gautos ir naudojamos vienaląsčių dumblių kultūros.
Visi veiksmai turi būti atliekami steriliomis sąlygomis, kad būtų išvengta užkrėtimo bakterijomis ir kitais dumbliais.
Įranga ir medžiagos
Žr. bandymo metodo skyriaus aparatūros aprašymą.
Dumblių kultūrų gavimo procedūros
Mitybinių medžiagų tirpalų (terpių) ruošimas:
Visos terpės mitybinių medžiagų druskos ruošiamos kaip koncentruoti pradiniai tirpalai, kurie laikomi tamsoje ir šaltai. Šie tirpalai sterilizuojami filtravimu arba apdorojant autoklave.
Terpė ruošiama į sterilų distiliuotą vandenį įpilant tikslų pradinio tirpalo kiekį, imantis priemonių apsaugoti ją nuo užkrėtimo. Ruošiant kietąją terpę įdedama 0,8 procento agaro.
Pradinė kultūra:
Pradinės kultūros yra mažos dumblių kultūros, kurios reguliariai pernešamos į šviežią terpę kaip pradinė bandymų medžiaga. Jei kultūros reguliariai nenaudojamos, jos sėjamos ant gulsčiojo agaro mėgintuvėliuose. Šios kultūros pernešamos į šviežią terpę bent kartą per du mėnesius.
Pradinės kultūros auginamos kūginėse kolbose su atitinkama terpe (tūris apie 100 ml). Kai dumbliai inkubuojami 20 °C temperatūroje nuolatinio apšvietimo sąlygomis, pernešti reikia kas savaitę.
Į kolba su šviežia terpe sterilia pipete pernešamas toks „senos“ kultūros kiekis, kad pradinė greitai augančių rūšių koncentracija būtų maždaug 100 kartų mažesnė nei senos kultūros.
Rūšies augimo greitis gali būti nustatytas iš augimo kreivės. Jei greitis žinomas, galima įvertinti, koks turi būti į naują terpę pernešamos kultūros tankis. Tai turi būti daroma anksčiau kaip kultūra pasiekia žūties tarpsnį.
Iš anksto paruošta kultūra
Iš anksto paruošta kultūra skirta gauti dumblių kiekį, reikalingą bandymo kultūroms sėti. Iš anksto paruošta kultūra inkubuojama bandymo sąlygomis ir naudojama tuomet, kai dar auga eksponentiškai, paprastai maždaug po 2–4 inkubavimo parų. Kai dumblių kultūroje yra deformuotų arba nenormalių ląstelių, jos turi būti pašalintos.
4 Priedėlis
Duomenų analizė taikant netiesinę regresiją
Bendrieji klausimai
Dumblių ir kitų mikrobų augimo bandymų atsakas – biomasės augimas yra iš prigimties tolydusis arba metrinis kintamasis: proceso greitis, jei naudojamas augimo greitis, ir jo integralas pagal laiką, kintamuoju pasirinkus biomasę. Abu dydžiai lyginami su atitinkamu neveikiamų kartotinių kontrolinių ėminių vidutiniu atsaku, kuris yra didžiausias atsakas taikomomis sąlygomis, kai dumblių bandymo pagrindiniai lemiami veiksniai yra šviesa ir temperatūra. Sistema yra paskirstytoji arba vienalytė ir į biomasę galima žiūrėti kaip į ištisinį parametrą, neatsižvelgiant į atskiras ląsteles. Tokios sistemos šio tipo atsako dispersijos pasiskirstymas (paprastai aprašomas lognormaliuoju arba normaliuoju paklaidų skirstiniu) susijęs vien tik su bandymo veiksniais. Jis yra priešingas tipiniams dichotominių duomenų biologinio bandymo atsakams, kuriems dažnai daroma prielaida, kad vyraujantis dispersijos komponentas yra atskirų organizmų atsparumas (paprastai binominio skirstinio). Šiuo atveju kontrolinių ėminių atsakai yra nulis arba fono lygis.
Esant paprastai situacijai, normalizuotas arba santykinis atsakas r monotoniškai mažėja nuo 1 (nulinis inhibavimas) iki 0 (visiškas (100 %) inhibavimas). Atkreipiamas dėmesys į tai, kad visi atsakai turi asocijuotąją paklaidą ir kad gali būti apskaičiuotas tariamas neigiamas inhibavimas, kaip vien tik atsitiktinės paklaidos rezultatas.
Regresinė analizė
Modeliai
Regresinės analizės tikslas – koncentracijos ir atsako santykio kreivę kiekybiškai aprašyti kaip matematinę regresijos funkciją Y = f (C) arba dažniau F (Z), kai Z = log C. Naudojant atvirkštinę funkciją C = f–1 (Y), galima apskaičiuoti ECx vertes, įskaitant EC50, EC10 ir EC20, bei jų 95 % pasikliautinuosius rėžius. Pasirodė, kad kelios paprastos matematinių funkcijų formos tinka sėkmingai aprašyti koncentracijos ir atsako santykius, gaunamus atliekant dumblių augimo inhibavimo bandymus. Tokios funkcijos būtų, pvz., logistinė lygtis, nesimetrinė Weibulo lygtis ir lognormaliojo skirstinio funkcija, kurios visos yra sigmoidės, asimptotiškai artėjančios prie vieneto, kai C → 0, ir prie nulio, kai C → begalybę.
Neseniai buvo pasiūlyta vietoj asimptotinių modelių taikyti tolydžiosios ribinės funkcijos modelius (pvz., Koymano„populiacijos augimo inhibavimo“ modelį, Kooijman et al. 1996). Pagal šį modelį daroma prielaida, kad poveikio nėra, kai koncentracija yra mažesnė nei tam tikra ribinė vertė EC0+, kuri įvertinama ekstrapoliuojant atsako ir koncentracijos santykį iki susikirtimo su koncentracijos verčių ašimi, kai santykiui išreikšti naudojama paprasta tolydžioji funkcija, nediferencijuojama pradžios taške.
Atkreipiamas dėmesys į tai, kad jei kompensuojamas dispersijos nevienalytiškumas, analizė gali būti tiesiog liekamųjų kvadratų (darant prielaidą apie pastovią dispersiją) arba svertinių mažiausių kvadratų sumos minimizavimas.
Procedūra
Procedūrą galima bendrais bruožais apibūdinti taip: pasirenkama atitinkama funkcinė lygtis Y = f (C) ir pritaikoma duomenims, taikant netiesinę regresiją. Pageidautina naudoti kiekvienos atskiros kolbos matavimų duomenis, bet ne vidutines kartotinių ėminių vertes, iš duomenų siekiant gauti kiek įmanoma daugiau informacijos. Tačiau, kita vertus, jei dispersija yra didelė, praktinis patyrimas rodo, kad kartotinių ėminių vidutinės vertės gali užtikrinti tvirtesnį matematinį įvertinimą, mažiau paveiktą duomenų sistemingųjų paklaidų, palyginti su tuo atveju, kai imamas kiekvienas paliktas atskiras duomenų taškas.
Pažymimi duomenų taškai, brėžiama pritaikyta kreivė ir tiriama, ar parinkta kreivė tinka. Šiam tikslui gali būti ypač naudinga liekanų analizė. Jei pasirinktoji koncentracijos ir atsako pritaikymo funkcija tinka ne visai kreivei arba kuriai nors jos esminei daliai aprašyti, pvz., atsako duobei esant mažoms koncentracijos vertėms, vietoj simetrinės pasirenkama kita pritaikoma kreivė, pvz., nesimetrinė Weibulo funkcijos kreivė. Neigiamas inhibavimas gali kelti problemų, pvz., naudojant lognormaliąją pasiskirstymo funkciją, kai irgi reikės taikyti kitą regresijos funkciją. Tokių neigiamų verčių nerekomenduojama prilyginti nuliui arba priskirti joms kitą mažą teigiamą vertę, nes taip būtų iškreiptas paklaidų pasiskirstymas. Galbūt tiktų pritaikyti kreivę atskirai kreivių dalims, pvz., mažo inhibavimo daliai, norint įvertinti EClow x skaičius. Pagal pritaikytą lygtį apskaičiuojami (taikant „atvirkštinį įvertinimą“ C = f–1 (Y) būdingųjų taškų įverčiai ECx, ir ataskaitoje pateikiamas bent EC50 įvertis ir vienas iš dviejų EClow x įverčių. Praktinių bandymų patyrimas parodė, kad dumblių bandymo preciziškumas paprastai leidžia gana tiksliai įvertinti 10 % atitinkantį inhibavimo lygį, jei yra pakankamas duomenų taškų skaičius, išskyrus kai esant mažoms koncentracijos vertėms trukdantis veiksnys yra augimo skatinimas. EC20 įverčio preciziškumas dažnai yra gerokai geresnis palyginti su EC10, nes EC20 paprastai yra apytikriai tiesiojoje vidurinės koncentracijos atsako kreivės dalyje. Kartais EC10 yra sunku interpretuoti dėl augimo skatinimo. Taigi, nors EC10 paprastai galima gauti pakankamu tikslumu, ataskaitoje visuomet rekomenduojama pateikti EC20.
Svertiniai koeficientai
Bandymų dispersija apskritai yra nepastovi ir jos dalį paprastai sudaro proporcingasis komponentas, taigi kaip įprasta sėkmingai atliekama svertinė regresija. Tokiai analizei naudojami svertiniai koeficientai paprastai laikomi atvirkščiai proporcingais dispersijai:
Wi = 1/Var(ri)
Daug regresijos programų leidžia pasirinkti svertinės regresijos analizę, svertinius koeficientus pateikiant lentelėje. Būtų patogu svertinius koeficientus normalizuoti, dauginant juos iš n/Σ wi (n yra duomenų taškų skaičius), taigi jų suma yra lygi vienetui.
Atsakų normalizavimas
Normalizavimas pagal vidutinį kontrolinio ėminio atsaką sukelia kai kurių metodinių problemų ir gaunama gana sudėtingos struktūros dispersiją. Dalinant atsakus iš vidutinio kontrolinio ėminio atsako inhibavimo procentinei vertei gauti, atsiranda papildoma vidutinio kontrolinio ėminio atsako paklaida. Išskyrus kai ši paklaida yra labai maža, turi būti daroma regresijos svertinių koeficientų ir pasikliautinųjų rėžių kontrolinio ėminio kovariacijos pataisa (17). Atkreipiamas dėmesys į tai, kad yra labai svarbus vidutinio kontrolinio ėminio atsako įverčio preciziškumas, kad būtų kiek įmanoma sumažinta santykinio atsako suminė dispersija. Ši dispersija atrodo taip:
apatinis indeksas i rodo koncentraciją i, indeksas 0 atitinka kontrolinius ėminius
Yi = santykinis atsakas = ri/r0 = 1 – I = f (Ci),
kurio dispersija:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
ir kadangi
(∂ Yi/ ∂ ri) = 1/r0 ir (∂ Yi / ∂ r0) = ri/r0 2,
esant normaliam duomenų skirstiniui ir mi bei m0 yra kartotiniai ėminiai:
Var(ri) = σ2/mi,
taigi suminė santykinio atsako dispersija Yi tampa:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Kontrolinio ėminio vidurkio paklaida yra atvirkščiai proporcinga suvidurkintai kvadratinei šakniai iš kontrolinių kartotinių ėminių skaičiaus, ir kartais pasiteisina įtraukti sukauptus duomenis ir šiuo būdu labai sumažinti paklaidą. Pagal kitą procedūrą nereikia normalizuoti duomenų ir pritaikyti absoliučius atsakus, įskaitant kontrolinių ėminių atsakų duomenis, bet imti kontrolinių ėminių atsako vertę kaip papildomą parametrą, kurį reikia pritaikyti netiesinės regresijos metodu. Jei paprastai taikoma 2 parametrų regresijos lygtis, taikant šį metodą reikia pritaikyti pagal 3 parametrus, todėl reikia daugiau duomenų taškų, nei taikant netiesinę regresiją duomenims, kurie yra normalizuojami naudojant iš anksto nustatytą kontrolinių ėminių atsaką.
Atvirkštiniai pasikliautinieji intervalai
Netiesinės regresijos pasikliautinųjų intervalų apskaičiavimas taikant atvirkštinį įvertinimą yra gana sudėtingas ir paprastuose statistinių kompiuterinių programų rinkiniuose jo nėra kaip tipinės pasirinkties. Apytikrius pasikliautinuosius intervalus galima gauti, taikant tipines netiesinės regresijos programas ir parametrų pakeitimą (Bruce ir Versteeg, 1992), kurį sudaro matematinės lygties perrašymas pagal reikiamus taškų įverčius, pvz., EC10 ir EC50 kaip parametrus, kuriuos reikia įvertinti. (Tegul bus funkciją I = f (α, β, koncentracija) ir naudojami apibrėžiamieji santykiai f (α, β, EC10) = 0,1 bei f (α, β, EC50) = 0,5 funkcijai f (α, β, koncentracija) pakeisti lygiaverte funkcija g (EC10, EC50, koncentracija).
Labiau tiesioginis apskaičiavimas (Andersen et al, 1998) atliekamas nekeičiant pradinės lygties ir taikant Tayloro eilutės skleidinį apie ri ir r0 vidurkius.
Neseniai populiariais tapo savaiminio gerinimo (boot strap) metodai. Empiriniam dispersijos skirstiniui įvertinti taikant tokius metodus, naudojami išmatuoti duomenys ir atsitiktinių skaičių generatoriaus valdomas dažnas kartotinis ėminių ėmimas.
Literatūra
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625–1632.
Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485–1494
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405–420.
V PRIEDAS
|
C.25. |
AEROBINĖ MINERALIZACIJA PAVIRŠINIAME VANDENYJE. BIOLOGINIO SKAIDYMO BANDYMO MODELIAVIMAS |
1. METODAS
Šis metodas atitinka OECD TG 309 (2004) (1).
1.1. ĮVADAS
Šio bandymo tikslas – išmatuoti mažos koncentracijos bandomosios medžiagos biologinio skaidymo eigą aerobiniame gamtiniame vandenyje ir kiekybiškai įvertinti stebėjimus greičio kinetinių lygčių pavidalu. Šis modeliavimo bandymas yra laboratorinis atskirų ėminių kratomos kolbos bandymas organinių medžiagų aerobinio biologinio skaidymo gamtinio paviršinio vandens (gėlo, sūroko arba jūros) ėminiuose greičiui nustatyti. Jis yra pagrįstas ISO/DIS 14592–1 (2), be to, į jį yra įtraukti C.23 ir C.24 bandymo metodų (3)(4) elementai. Siekiant išvengti bandymo mikrokosmo savybių blogėjimo, kai bandymų trukmė yra didelė, atskirų ėminių bandymą galima pakeisti pusiau nepertraukiamu procesu. Pagrindinis modeliavimo bandymo tikslas – nustatyti bandomosios medžiagos mineralizaciją paviršiniame vandenyje, ir mineralizacija sudaro skaidymo kinetikos išraiškos pagrindą. Tačiau papildomas antrinis bandymo tikslas – gauti duomenų apie pirminį skaidymą ir pagrindinių virsmo produktų susidarymą. Virsmo produktų identifikavimas ir, jei įmanoma, jų koncentracijos kiekybinis įvertinimas yra ypač svarbus labai lėtai mineralizuojamoms medžiagoms (pvz., kurių visos liekamosios 14C pusėjimo trukmė viršija 60 parų). Dėl analizinių apribojimų pagrindiniams virsmo produktams identifikuoti ir kiekybiškai įvertinti paprastai turėtų būti naudojama didesnė bandomosios medžiagos koncentracija (pvz., > 100 μg/l).
Šio bandymo sąlygomis maža koncentracija yra tokia gana maža koncentracija (pvz., mažesnė kaip 1 μg/l – 100 μg/l), kuri galėtų užtikrinti, kad gauta biologinio skaidymo kinetika atitinka aplinkoje laukiamą kinetiką. Mažos koncentracijos bandomoji medžiaga bus kaip antrinis substratas palyginti su visa biologiškai skaidomos anglies substratų, esančių bandymo gamtiniame vandenyje, mase. Taigi tikėtina, kad biologinio skaidymo kinetika yra pirmojo laipsnio („ne augimo“ kinetika) ir kad bandomoji medžiaga gali būti skaidoma „kometabolizmo“ būdu. Pirmojo laipsnio kinetika reiškia, kad skaidymo greitis (mg/l/parą) yra proporcingas per laiką mažėjančiai substrato koncentracijai. Esant tikrajai pirmo laipsnio kinetikai, savitoji skaidymo greičio konstanta, k, nėra laiko ir koncentracijos funkcija. T. y. k mažai kinta bandymo laikotarpiu ir nekinta dėl koncentracijos padidinimo tarp bandymų. Pagal apibrėžtį, savitoji skaidymo greičio konstanta yra lygi santykiniam koncentracijos pokyčiui per laiką: k = (1/C) · (dC/dt). Nors nustatytomis sąlygomis paprastai laukiama pirmojo laipsnio kinetikos, gali būti tam tikrų aplinkybių, kai labiau tiktų kito tipo kinetika. Nukrypimus nuo pirmojo laipsnio kinetikos galima stebėti, kai biologinio virsmo greitį riboja ne reakcijos greitis, bet masės pernešimo reiškiniai, pvz., difuzijos greitis. Tačiau duomenis beveik visuomet galima aprašyti pseudopirmojo laipsnio kinetika, darant prielaidą apie greičio konstantos priklausomybę nuo koncentracijos.
Informacija apie bandomosios medžiagos biologinį skaidumą esant didesnei koncentracijai (pvz., tipinių atrankos bandymų) ir informacija apie abiotinį skaidumą, virsmo produktus ir atitinkamas fizikochemines savybes turėtų būti gauta prieš bandymą, kad ji galėtų padėti parengti bandymo planą ir interpretuoti rezultatus. 14C žymėtų bandomųjų medžiagų naudojimas ir 14C fazinio pasiskirstymo bandymo pabaigoje nustatymas sudaro sąlygas visiškam biologiniam skaidumui nustatyti. Kai naudojama nežymėta bandomoji medžiaga, visišką biologinį skaidymą galima tik įvertinti, jei bandomos didesnės koncentracijos vertės ir yra žinomi visi pagrindiniai virsmo produktai.
1.2. APIBRĖŽTYS
Pirminis biologinis skaidymas. Mikroorganizmais veikiamos cheminės medžiagos struktūros pokytis (virsmas), jai netenkant cheminės tapatybės.
Funkcinis biologinis skaidymas. Mikroorganizmais veikiamos cheminės medžiagos struktūros pokytis (virsmas), jai netenkant būdingos savybės.
Visiškas aerobinis biologinis skaidymas. Mikroorganizmais veikiamos cheminės medžiagos skaidymas esant deguoniui į anglies dioksidą, vandenį ir į visų kitų ją sudarančių elementų neorganines druskas (mineralizacija) ir naujos biomasės bei organinės mikrobinės biosintezės produktų gamyba.
Mineralizacija. Mikroorganizmais veikiamos cheminės medžiagos arba organinės medžiagos skaidymas esant deguoniui į anglies dioksidą, vandenį ir į visų kitų ją sudarančių elementų neorganines druskas.
Vėlavimo tarpsnis. Laikas nuo bandymo pradžios iki skaidomųjų mikroorganizmų adaptacijos momento ir cheminės medžiagos arba organinės medžiagos biologinio skaidymo laipsnio padidėjimo iki nustatomo lygio (pvz., 10 % didžiausio teorinio biologinio skaidymo arba mažiau, atsižvelgiant į matavimo metodo tikslumą).
Didžiausias biologinio skaidymo laipsnis. Cheminės medžiagos arba organinės medžiagos biologinio skaidymo laipsnis procentais, kurį pasiekus biologinis skaidymas toliau bandant nebevyksta.
Pirminis substratas. Gamtinių anglies ir energijos šaltinių rinkinys, kuris užtikrina mikrobinės biomasės augimą ir gyvavimą.
Antrinis substratas. Tokios mažos koncentracijos substrato komponentas, dėl kurio skaidymo tik nežymiai padidėja veikliųjų mikroorganizmų anglies ir energijos ištekliai, palyginti su anglies ir energijos ištekliais, kuriuos tiekia pagrindiniai substrato komponentai (pirminiai substratai).
Skaidymo greičio konstanta. Pirmojo arba pseudopirmojo laipsnio kinetikos greičio konstanta, k (d–1), kuri rodo skaidymo procesų greitį. Atliekant siuntos bandymą, k apskaičiuojama pagal pradinę skaidymo kreivės, gautos pasibaigus vėlavimo tarpsniui, dalį.
Pusėjimo trukmė, t1/2 (d). Terminas, vartojamas pirmojo laipsnio reakcijos greičiui apibūdinti. Tai laikas, per kurį koncentracija sumažėja 2 kartus. Pusėjimo trukmė ir skaidymo greičio konstanta yra susietos lygtimi t1/2 = ln2/k.
Skaidymo pusėjimo trukmė. DT50 (d). Terminas, vartojamas kiekybiškai įvertinti biologinio skaidymo bandymą. Tai laikas, įskaitant vėlavimo tarpsnį, per kurį pasiekiamas 50 % biologinis skaidymas.
Aptikimo riba (LOD) ir kiekybinio nustatymo riba (LOQ). Aptikimo riba (LOD) – medžiagos koncentracija, kai jai esant mažesnei negalima atskirti medžiagos tapatybės požymių ir analizinių trukdžių. Kiekybinio nustatymo riba (LOQ) – medžiagos koncentracija, kai koncentracijai esant mažesnei ji negali būti nustatyta priimtinu tikslumu.
Ištirpusi organinė anglis (DOC). Ta vandens ėminio organinės anglies dalis, kuri negali būti pašalinta fazių atskyrimu, pvz., 15 min trukmės centrifugavimu esant 40 000 ms–2 pagreičiui arba membraniniu filtravimu, naudojant membranas, kurių poros yra 0,2 μm – 0,45 μm skersmens.
Suminis organinės 14C aktyvumas (TOA). Suminis 14C aktyvumas, atitinkantis organinę anglį.
Ištirpusios organinės 14C aktyvumas (DOA). Suminis 14C aktyvumas, atitinkantis ištirpusią organinę anglį.
Kietųjų dalelių organinės 14C aktyvumas (POA). Suminis 14C aktyvumas, atitinkantis kietųjų dalelių organinę anglį.
1.3. BANDYMO TAIKOMUMAS
Šis modeliavimo bandymas skirtas nelakioms arba mažai lakioms organinėms medžiagoms, bandomoms esant mažai koncentracijai. Jei naudoti atmosferai atviras kolbas (pvz., užkimštas vata), medžiagos, kurių Henrio dėsnio konstanta yra mažesnė nei maždaug 1 Pa·m3/mol (apie 10–5 atm·m3/mol), praktiškai gali būti priskirtos nelakioms. Naudojant uždarytas kolbas su laisvąja erdve, galima bandyti mažai lakias medžiagas (kurių Henrio dėsnio konstantos < 100 Pa·m3/mol arba < 10–3 atm·m3/mol), nepatiriant bandymo sistemos nuostolių. Gali būti 14C žymėtų medžiagų nuostoliai, jei nebūtų imamasi tinkamų atsargumo priemonių šalinant CO2. Tokiais atvejais gali tekti gaudyti CO2 naudojant vidinį šarminį absorbentą arba naudoti išorinę CO2 absorbento sistemą (tiesioginis 14CO2 nustatymas; žr. 3 priedą). Biologinio skaidymo kinetikai nustatyti bandomosios medžiagos koncentracijos vertės turi būti mažesnės nei tirpumo vandenyje vertės. Tačiau reikėtų pažymėti, literatūroje pateikiamos tirpumo vandenyje vertės gali būti gerokai didesnės nei bandomosios medžiagos tirpumas gamtiniuose vandenyse. Ypač mažai vandenyje tirpių bandomųjų medžiagų tirpumas gali būti nustatytas naudojant bandomus gamtinius vandenis.
Metodas gali būti taikomas norint modeliuoti biologinį skaidymą stambių dalelių neturinčiame paviršiniame vandenyje (pelaginis bandymas) arba drumstame paviršiniame vandenyje, pvz., kuris gali būti arti vandens ir nuosėdų sąlyčio paviršiaus (suspenduotų nuosėdų bandymas).
1.4. BANDYMO METODO ESMĖ
Atliekamas atskirų ėminių bandymas, inkubuojant bandomąją medžiagą tik su paviršiniu vandeniu (pelaginis bandymas) arba su paviršiniu vandeniu, į kurį pridėta 0,01–1 g/l sausos masės suspenduotų kietųjų dalelių (nuosėdų) (suspenduotų nuosėdų bandymas) vandens telkiniui su suspenduotomis kietosiomis dalelėmis arba su suspenduotomis nuosėdomis modeliuoti. Apatinę šio intervalo dalį atitinkanti suspenduotų kietų dalelių (nuosėdų) koncentracija yra tipinė didesnės dalies paviršinių vandenų koncentracija. Bandymo kolbos inkubuojamos tamsoje esant aplinkos temperatūrai, aerobinėmis ir maišymo sąlygomis. Skaidymo kinetikai nustatyti turėtų būti naudojamos bent dvi skirtingos bandomosios medžiagos koncentracijos vertės. Koncentracijos vertės turi skirtis 5–10 kartų ir turi atitikti tikėtina koncentracijos aplinkoje intervalą. Didžiausia bandomosios medžiagos koncentracija turėtų būti ne didesnė kaip 100 µg/l, bet siekiant užtikrinti, kad biologinis skaidymas atitiktų pirmojo laipsnio kinetiką, pageidautina didžiausia bandymo koncentracija yra 10 µg/l arba mažesnė. Mažiausia koncentracija neturėtų būti didesnė kaip 10 µg/l, bet pageidautina 1–2 μg/l arba mažesnė kaip 1 μg/l bandymo koncentracija. Pakankamai tiksli analizė esant tokioms mažoms koncentracijos vertėms dažniausiai gali būti pasiekta naudojant komercines 14C žymėtas medžiagas. Dėl analizinių apribojimų dažnai neįmanoma išmatuoti bandomosios medžiagos koncentraciją reikiamu tikslumu, jei pridedamos bandomosios medžiagos koncentracija ≤ 100 µg/l (žr. 1.7.2 skirsnio antrąją pastraipą). Pagrindiniams virsmo produktams identifikuoti galima naudoti didesnes bandomosios medžiagos koncentracijos vertes (> 100 µg/l ir kartais > 1 mg/l), jei nėra specifinio mažą aptikimo ribą turinčio analizės metodo. Jei bandant naudojama didesnė bandomosios medžiagos koncentracija, rezultatų gali būti neįmanoma panaudoti pirmojo laipsnio skaidymo konstantai ir pusėjimo trukmei įvertinti, kadangi skaidymas gali neatitikti pirmojo laipsnio kinetikos.
Skaidymas stebimas atitinkamais laiko intervalais, matuojant liekamąją 14C arba liekamąją bandomosios medžiagos koncentraciją, kai taikoma specifinė analizė. Patvariausios molekulės dalies žymėjimas 14C užtikrina visiškos mineralizacijos nustatymą, žymint 14C mažiau patvarią molekulės dalį arba taikant specifinę analizę, galima įvertinti tik pirminį biologinį skaidymą. Tačiau patvariausioje dalyje nebūtinai turi būti molekulei būdinga funkcinė grupė (kuri galėtų būti susieta su specifine savybe, pvz., toksiškumu, biologiniu kaupimusi ir t. t.). Tokiu atveju galbūt būtų tikslinga naudoti bandomąją medžiagą, kurios funkcinė grupė būtų žymėta 14C specifinės savybės išnykimui stebėti.
1.5. INFORMACIJA APIE BANDOMĄJĄ MEDŽIAGĄ
Šiame bandyme galima naudoti žymėtąsias ir nežymėtas bandomąsias medžiagas. Rekomenduojama taikyti 14C žymėjimo metodą ir paprastai turėtų būti žymėta patvariausia (-ios) molekulės dalis (-ys) (žr. dar 1.4 skirsnį). Jei medžiagos turi daugiau kaip vieną aromatinį žiedą, geriau būtų 14C žymėti vieną arba daugiau anglies atomų kiekviename žiede. Be to, geriau būtų žymėti 14C vieną arba daugiau anglies atomų abiejose lengvai skaidomų jungčių pusėse. Bandomosios medžiagos cheminis ir (arba) radiocheminis grynumas turėtų būti > 95 %. Siekiant palengvinti 14C matavimus, kai atliekami mažos koncentracijos medžiagų bandymai, žymėtųjų medžiagų savitasis aktyvumas turėtų būti maždaug 50 μCi/mg (1,85 MBq) arba didesnis. Turi būti ši informacija apie bandomąją medžiagą:
|
— |
tirpumas vandenyje [A.6 metodas], |
|
— |
tirpumas organiniame (-iuose) tirpiklyje (-iuose) (tirpiklyje ištirpintų arba mažo tirpumo vandenyje medžiagų), |
|
— |
disociacijos konstanta (pKa), jei medžiaga gali prisijungti arba atiduoti protonus [OECD TG 112] (5), |
|
— |
garų slėgis [A.4 metodas] ir Henrio dėsnio konstanta, |
|
— |
cheminis stabilumas vandenyje ir tamsoje (hidrolizė) [C.7 metodas]. |
Kai vandenyje mažai tirpios medžiagos yra bandomos jūros vandenyje, gali būti naudinga žinoti išsūdymo konstantą (arba „Sečenovo konstantą“) Ks, apibrėžiamą lygtimi: log (S/S’) = Ks Cm, kurioje S ir S’ yra medžiagos tirpumas gėlame ir jūros vandenyje, Cm – molinė druskos koncentracija.
Jei bandymas atliekamas kaip „suspenduotų nuosėdų bandymas“, reikėtų turėti šią informaciją:
|
— |
pasiskirstymo koeficientas n-oktanolis/vanduo [A.8 metodas], |
|
— |
adsorbcijos koeficientas [C.18 metodas]. |
Kita naudinga informacija gali būti:
|
— |
koncentracija aplinkoje, jei žinoma arba įvertinta, |
|
— |
bandomosios medžiagos toksiškumas mikroorganizmams [C.11 metodas], |
|
— |
lengvas ir (arba) būdingasis biologinis skaidumas [C.4 A–F, C.12, C.9 metodai, OECD TG 302 (5)], |
|
— |
aerobinio arba anaerobinio biologinio skaidumo dirvožemyje ir nuosėdų (vandens) virsmo tyrimai [C.23, C.24 metodai]. |
1.6. ETALONINĖ MEDŽIAGA
Etalonine medžiaga turėtų būti naudojama medžiaga, kuri paprastai lengvai skaidoma aerobinėmis sąlygomis (pvz., anilinas arba natrio benzoatas). Tikėtina anilino ir natrio benzoato skaidymo trukmė paprastai yra mažesnė kaip 2 savaitės. Etaloninių medžiagų naudojimo tikslas – užtikrinti, kad bandymo vandens mikrobinis aktyvumas atitiktų tam tikras ribas; t. y. kad mikrobų populiacija vandenyje būtų aktyvi.
1.7. KOKYBĖS KRITERIJAI
1.7.1. Atgavimas
Iškart po bandomosios medžiagos pridėjimo kiekviena pradinė bandymo koncentracija turėtų tikrinama matuojant bent dviejų kartotinių ėminių 14C aktyvumą arba atliekant cheminę analizę nežymėtų medžiagų atveju. Taip gaunama informacija apie analizės metodo tinkamumą ir pakartojamumą ir apie bandomosios medžiagos pasiskirstymo vienodumą. Atliekant vėlesnę duomenų analizę, paprastai naudojamas išmatuotas pradinis 14C aktyvumas arba bandomosios medžiagos koncentracija, bet ne vardinė koncentracija, kadangi tokiu būdu kompensuojami nuostoliai dėl sorbcijos ir dozavimo paklaidos. 14C žymėtos bandomosios medžiagos atgavimo laipsnis bandymo pabaigoje nurodomas kaip masių balansas (žr. 1.8.9.4 skirsnio paskutinę pastraipą). Geriausiu atveju žymėtųjų cheminių medžiagų masių balansas turėtų būti intervale nuo 90 % iki 110 %, analizės tikslumas turėtų užtikrinti 70 % – 110 % nežymėtų bandomųjų medžiagų atgavimo laipsnį. Šiuos intervalus reikėtų interpretuoti kaip kontrolinius skaičius ir jie neturėtų būti naudojami kaip bandymo priimtinumo kriterijai. Galėtų būti nustatomas bandomosios medžiagos, kai jos koncentracija yra mažesnė nei pradinė koncentracija, ir pagrindinių virsmo produktų analizės tikslumas.
1.7.2. Analizės metodo pakartojamumas ir jautris
Bandomosios medžiagos ir prireikus virsmo produktų kiekybinės analizės metodo pakartojamumas (įskaitant pradinio ekstrahavimo efektyvumą) gali būti patikrintas penkis kartus atliekant paviršinio vandens atskirų ekstraktų analizę.
Jei įmanoma, bandomosios medžiagos ir virsmo produktų analizės metodo aptikimo riba (LOD) turėtų būti bent 1 % į sistemą pridėto pradinio kiekio. Kiekybinio nustatymo riba (LOQ) turėtų būti lygi 10 % naudotos koncentracijos arba mažesnė. Didelio skaičiaus organinių medžiagų ir jų virsmo produktų cheminei analizei dažnai reikia, kad būtų pridedama palyginti didelės koncentracijos bandomoji medžiaga, t. y. > 100 μg/l.
1.8. BANDYMO METODO APRAŠYMAS
1.8.1. Įranga
Bandymą galima atlikti atitinkamos talpos (pvz., 0,5 arba 1,0 litro) kūginėse arba cilindrinėse kolbose, užkimštose polisiloksaniniais arba guminiais kamščiais, arba serumo kolbose su CO2 nelaidžiais dangčiais (pvz., su butilkaučiuko membrana). Kitaip bandymą galima atlikti naudojant daug kolbų, ir imti visą kolbos turinį, bent dviejų kolbų, kiekvienam mėginio ėmimo intervalui (žr. 1.8.9.1 skirsnio paskutinę pastraipą). Nelakių bandomųjų medžiagų, kurios nėra žymėtos, nebūtina sandariai užkimšti kamščiaus arba dangčiais; tinka nesandarūs vatos kamščiai, kurie apsaugotų nuo oro teršalų (žr. 1.8.9.1 skirsnio antrąją pastraipą). Mažai lakios medžiagos turėtų būti bandomos biometro tipo sistemoje, nestipriai maišant vandens paviršių. Siekiant apsisaugoti nuo užkrėtimo bakterijomis, prieš naudojimą indus galima sterilizuoti kaitinant krosnyje arba apdorojant autoklave. Be to, naudojama ši tipinė laboratorinė įranga:
|
— |
purtyklė arba magnetinės maišyklės bandymo kolbų turiniui nuolat maišyti; |
|
— |
centrifuga, |
|
— |
pH-metras, |
|
— |
nefelometras drumstumui matuoti nefelometriniais metodais, |
|
— |
krosnis arba mikrobangė krosnis sausos medžiagos masei nustatyti, |
|
— |
membraninio filtravimo aparatas, |
|
— |
autoklavas arba krosnis stikliniams indams sterilizuoti karščiu, |
|
— |
priemonės dirbti su 14C žymėtomis medžiagomis, |
|
— |
įranga CO2 sugavimo tirpalų ir, jei reikia, nuosėdų mėginių 14C aktyvumui kiekybiškai įvertinti, |
|
— |
analizės įranga bandomajai (ir etaloninei) medžiagai nustatyti, jei taikoma specifinė cheminė analizė (pvz., dujų chromatografas, didelio slėgio skysčių chromatografas). |
1.8.2. Bandomosios medžiagos pradiniai tirpalai
Bandomosios ir etaloninės medžiagos pradiniams tirpalams ruošti naudojamas dejonizuotas vanduo (žr. 1.8.7 skirsnio pirmąją pastraipą). Dejonizuotame vandenyje neturėtų būti medžiagų, kurios galėtų būti toksiškos mikroorganizmams, ir ištirpusios organinės anglies (DOC) turėtų būti ne daugiau kaip 1 mg/l (6).
1.8.3. Paviršinio vandens ėminių rinkimas ir gabenimas
Paviršinio vandens ėminių ėmimo vieta turėtų būti pasirinkta atsižvelgiant į bandymo tikslą tam tikromis aplinkybėmis. Pasirenkant ėminių ėmimo vietas, turi būti atsižvelgta į galimų žemės ūkio, pramonės arba buitinių šaltinių istoriją. Jei žinoma, kad vandens aplinka ketverius ankstesniu metus buvo teršiama bandomąja medžiaga arba jos struktūriniais analogais, bandymo vanduo neturėtų būti imamas, išskyrus kai tyrėjas specialiai tiria skaidymo greitį anksčiau užterštose vietose. Vandens pH ir temperatūra turėtų būti matuojama ėminių rinkimo vietoje. Be to, reikėtų nurodyti ėminio ėmimo gylį ir vandens ėminio išvaizdą (pvz., spalvą ir drumstumą) (žr. 3 skyrių). Turėtų būti išmatuota deguonies koncentracija ir (arba) oksidacijos redukcijos potencialas vandenyje ir nuosėdų paviršiniame sluoksnyje, kad galima būtų įrodyti aerobinių sąlygų buvimą, išskyrus kai jos yra akivaizdžios, sprendžiant pagal išvaizdą ir vietos istorinius duomenis. Paviršinis vanduo turėtų būti gabenamas labai gerai išplautuose induose. Gabenamo vandens temperatūra neturėtų labai viršyti bandymo temperatūrą. Rekomenduojama atšaldyti iki 4 °C, jei vanduo gabenamas ilgiau kaip 2–3 h. Vandens ėminys neturi būti užšalęs.
1.8.4. Paviršinio vandens laikymas ir ruošimas
Pageidautina bandymą pradėti per parą nuo ėminio paėmimo. Jei vandenį tenka laikyti, jo laikymo trukmė turėtų būti kiek įmanoma trumpesnė ir jokiu atveju neturi viršyti 4 savaičių. Iki naudojimo vandens ėminys turėtų būti laikomas 4 °C temperatūroje ir aeruojamas. Prieš naudojimą turėtų būti pašalintos stambios dalelės, pvz., filtravimu per nailono filtrą, kurio akučių dydis apie 100 μm, arba per akytą popieriaus filtrą, arba sedimentacijos būdu.
1.8.5. Vandens su nuosėdų priedu ruošimas (neprivaloma)
Atliekant suspenduotų nuosėdų bandymą, paviršinės nuosėdos dedamos į kolbą su gamtiniu vandeniu (filtruojamu stambioms dalelėms pašalinti, kaip aprašyta 1.8.4 skirsnyje) suspensijai gauti; suspenduotų kietųjų dalelių koncentracija turėtų būti nuo 0,01 iki 1 g/l. Paviršinės nuosėdos turėtų būti iš tos pačios vietos, iš kurios buvo paimtas vandens ėminys. Atsižvelgiant į konkrečią vandens aplinką, paviršinės nuosėdos gali būti apibūdinamos dideliu organinės anglies kiekiu (2,5–7,5 %) ir smulkiagrūde tekstūra arba mažu organinės anglies kiekiu (0,5–2,5 %) ir stambiagrūde tekstūra (3). Paviršines nuosėdas galima ruošti taip: išimami keli nuosėdų kernai, naudojant skaidraus plastiko vamzdį, iškart po ėminio paėmimo nupjaunami viršutiniai aerobiniai sluoksniai (nuo paviršiaus iki ne didesnio kaip 5 mm gylio) ir supilami kartu. Gautas nuosėdų ėminys turėtų būti gabenamas inde su didele laisvąja erdve orui, kad nuosėdas būtų galima laikyti aerobinėmis sąlygomis (atšaldoma iki 4 °C, jei jos gabenamos ilgiau kaip 2–3 h). Nuosėdų ėminys turėtų būti suspenduotas bandymo vandenyje santykiu 1:10 ir iki naudojimo laikomas 4 °C temperatūroje ir aeruojamas. Jei nuosėdas tenka laikyti, jų laikymo trukmė turėtų būti kiek įmanoma trumpesnė ir jokiu atveju neturi viršyti 4 savaičių.
1.8.6. Pusiau nepertraukiama procedūra (neprivaloma)
Gali tekti inkubuoti ilgiau (kelis mėnesius), jei yra ilgas vėlavimo tarpsnis prieš prasidedant didesniam bandomosios medžiagos skaidymui, kurį būtų galima išmatuoti. Jei tai žinoma iš ankstesnių medžiagos bandymų, bandymą galima pradėti, taikant pusiau nepertraukiamą procedūrą, kuri sudarytų sąlygas periodiškai atnaujinti bandymo vandens arba suspensijos dalį (žr. 2 priedą). Kitu būdu įprastas atskirų ėminių bandymas gali būti pakeistas pusiau nepertraukiamu bandymu, jei bandomosios medžiagos skaidymas neprasideda per maždaug 60 bandymo parų, taikant atskirų ėminių procedūrą (žr. 1.8.8.3 skirsnio antrąją pastraipą).
1.8.7. Bandomosios (arba etaloninės) medžiagos pridėjimas
Jei medžiagos gerai tirpsta vandenyje (> 1 mg/l) ir jų lakumas yra mažas (Henrio dėsnio konstantos < 1 Pa·m3/mol arba < 10–5 atm·m3/mol), pradinį tirpalą galima ruošti naudojant dejonizuotą vandenį (žr. 1.8.2 skirsnį); atitinkamas pradinio tirpalo tūris įpilamas į bandymo indus reikiamai koncentracijai pasiekti. Visų įpilamų pradinių tirpalų tūris turėtų būti kiek įmanoma mažesnis (< 10 % skysčio galutinio tūrio, jei įmanoma). Pagal kitą procedūrą, į kurią galima žiūrėti kaip į organinių tirpiklių naudojimo alternatyvą, bandomoji medžiaga ištirpinama didesniame bandymo vandens tūryje.
Jei neišvengiama, vandenyje mažai tirpių nelakiųjų medžiagų tirpalai turėtų būti ruošiami naudojant lakųjį organinį tirpiklį, tačiau į bandymo sistemą pridėto tirpiklio kiekis neturėtų būti didesnis kaip 1 % V/V ir neturėtų neigiamai veikti mikrobų aktyvumo. Tirpiklis neturėtų veikti bandomosios medžiagos stabilumo vandenyje. Tirpiklis turėtų būti pašalintas iki visiškai mažo kiekio, kad labai nepadidintų DOC koncentracijos bandymo vandenyje arba suspensijoje. Tai turėtų būti tikrinama atliekant medžiagai specifinę analizę arba DOC analizę, jei įmanoma (6). Reikėtų imtis priemonių apriboti pernešto tirpiklio kiekį tik būtinuoju kiekiu ir užtikrinti, kad bandomosios medžiagos kiekis galėtų ištirpti galutiniame bandymo vandens tūryje. Galima taikyti kitus metodus bandomajai medžiagai pridėti į bandymo indus, kaip aprašyta (7) ir (8). Kai bandomajai medžiagai pridėti naudojamas organinis tirpiklis, tirpiklio ir bandymo vandens (be jokių priedų) kontroliniai ėminiai ir bandymo vandens su pridėta etalonine medžiaga ėminiai turėtų būti apdorojami panašiai kaip aktyvieji bandymo indai, į kuriuos pridėta nešiklyje ištirpinta bandomoji medžiaga. Tirpiklio kontrolinių ėminių tikslas – ištirti galimą neigiamą tirpiklio poveikį mikrobų populiacijai pagal etaloninės medžiagos skaidymą.
1.8.8. Bandymo sąlygos
1.8.8.1. Bandymo temperatūra
Inkubuoti reikėtų tamsoje (pageidautina) arba išsklaidytoje šviesoje, esant reguliuojamai (± 2 °C) tikslumu temperatūrai, kuri gali būti lauko temperatūra arba tipinė 20–25 °C temperatūra. Lauko temperatūra gali būti faktinė ėminio temperatūra jo ėmimo momentu arba vidutinė ėminio ėmimo vietos lauko temperatūra.
1.8.8.2. Maišymas
Turi būti užtikrintas nuolatinis purtymas arba maišymas, kad dalelės ir mikroorganizmai būtų suspenduoti. Be to, maišymas lengvina deguonies pernešimą iš laisvosios erdvės į skystį, taigi gali būti užtikrintos reikiamos aerobinės sąlygos. Kolbos statomos ant purtyklės (maišymas maždaug 100 min–1 dažniu) arba naudojama magnetinė maišyklė. Maišymas turi būti nuolatinis. Tačiau purtymas arba maišymas turėtų būti kiek įmanoma švelnesnis, bet visgi turi užtikrinti vienalytę suspensiją.
1.8.8.3. Bandymo trukmė
Bandymo trukmė paprastai neturėtų būti ilgesnė kaip 60 parų, išskyrus kai taikoma pusiau nepertraukiama procedūra ir periodinis bandymo suspensijos atnaujinimas (žr. 1.8.6 skirsnį ir 2 priedą). Tačiau atskirų ėminių bandymo trukmė gali būti padidinta iki ne ilgiau kaip 90 parų, jei bandomosios medžiagos skaidymas prasideda per pirmąsias 60 parų. Skaidymas stebimas atitinkamais laiko tarpais nustatant liekamosios 14C aktyvumą arba išsiskyrusio 14CO2 kiekį (žr. 1.8.9.4 skirsnį) ir (arba) atliekant cheminę analizę (1.8.9.5 skirsnis). Inkubavimo trukmė turi būti pakankamai ilga skaidymo procesui įvertinti. Pageidautina, kad skaidymo laipsnis būtų didesnis kaip 50 %; lėtai skaidomų medžiagų skaidymo laipsnis turi būti pakankamas (paprastai didesnis kaip 20 % skaidymas) kinetinės skaidymo greičio konstantos įverčiui gauti.
Periodiškai turi būti matuojama pH vertė ir deguonies koncentracija bandymo sistemoje, išskyrus kai tokie matavimai nebūtini, turint ankstesnius panašių bandymų duomenis, gautus toje pačioje vietoje paimtiems vandens ir nuosėdų ėminiams. Kai kuriomis aplinkybėmis, esant gerokai didesnei koncentracijai vandenyje arba nuosėdose, dėl pirminių substratų metabolizmo išsiskyrusio CO2 kiekio ir deguonies kiekio sumažėjimo gali pakakti labai pakeisti vykstančio bandymo sąlygas.
1.8.9. Darbo eiga
1.8.9.1. Kolbų ruošimas pelaginiam bandymui
Į bandymo kolbas įpilamas reikiamas bandymo vandens kiekis, kuris sudarytų apie trečdalį kolbos tūrio, bet ne mažiau kaip apie 100 ml. Jei naudojama daug kolbų (kad mėginį sudarytų visas kolbos turinys), reikiamas bandymo vandens tūris irgi yra apie 100 ml, nes maži ėminių tūriai gali turėti įtakos vėlavimo tarpsnio trukmei. Bandomoji medžiaga pridedama naudojant pradinį tirpalą, kaip aprašyta 1.8.2 ir 1.8.7 skirsniuose. Turėtų būti naudojamos bent dvi skirtingos bandomosios medžiagos koncentracijos vertės, kurios skirtųsi 5–10 kartų, kad būtų galima nustatyti skaidymo kinetikos laipsnį ir apskaičiuoti kinetinę skaidymo greičio konstantą. Abi pasirinktos koncentracijos vertės turėtų būti mažesnės kaip 100 µg/l ir pageidautina intervale < 1–10 µg/l.
Užkimškite kolbas kamščiais arba uždenkite orui ir CO2 nelaidžiais dangčiais. Jei naudojamos 14C nežymėtos ir nelakios bandomosios medžiagos, tinka nesandarūs vatos kamščiai, kurie apsaugotų nuo oro teršalų (žr. 1.8.1 skirsnį), jei žinoma, kad visi pagrindiniai skaidymo produktai yra nelakūs ir jei taikomas netiesioginis CO2 nustatymo metodas (žr. 3 priedą).
Inkubuokite kolbas pasirinktoje temperatūroje (žr. 1.8.8.1 skirsnį). Paimkite mėginius cheminei analizei arba 14C matavimams bandymo pradžioje (t. y. prieš biologinio skaidymo pradžią; žr. 1.7.1 skirsnį) ir vėliau atitinkamais laiko intervalais bandymo eigoje. Mėginius galima imti kaip dalinius mėginius (pvz., 5 ml alikvotines dalis) iš kiekvieno kartotinio ėminio arba kiekvienu mėginio ėmimo momentu imti visą kolbos turinį. Bandomosios medžiagos mineralizacija gali būti nustatyta netiesiogiai arba tiesiogiai (žr. 3 priedą). Norint gauti patikimą greičio konstantos įvertį, skaidymo tarpsniu (t. y. pasibaigus vėlavimo tarpsniui) paprastai turi būti paimti bent penki mėginiai, išskyrus kai galima pagrįsti, kad greitai skaidomoms medžiagoms pakanka trijų mėginių. Jei medžiagos skaidomos lėtai, skaidymo tarpsniu nesunku atlikti daugiau matavimų, taigi turėtų būti naudojama daugiau taškų k vertei gauti. Negalima nurodyti tam tikro mėginių ėmimo grafiko, kadangi biologinio skaidymo greitis yra nevienodas; tačiau lėto skaidymo atveju rekomenduojamas vienas mėginys per savaitę. Jei bandomoji medžiaga skaidoma greit, mėginius reikėtų imti kartą per parą pirmąsias tris paras ir vėliau kas antrą arba trečią parą. Tam tikromis aplinkybėmis, pvz., jei medžiagos greitai hidrolizuojasi, mėginius gali tekti imti kas valandą. Prieš bandymus rekomenduojama atlikti parengiamąjį tyrimą reikiamiems mėginių ėmimo intervalams nustatyti. Jei mėginius reikia turėti kitai specifinei analizei, patariama paimti daugiau mėginių ir tuomet atrinkti tuos, kurie turi būti analizuojami pasibaigus bandymui taikant atbulinės krypties strategiją, t. y. paskutiniai mėginiai analizuojami pirmi (žr. 1.8.9.5 skirsnio antrąją pastraipą dėl nurodymų laikomų ėminių stabilumui užtikrinti).
1.8.9.2. Kolbų ir ėminių skaičius
Paruošiamas pakankamas skaičius bandymo kolbų, kad būtų:
|
— |
bandymo kolbos; bent dvi kolbos kiekvienai bandomosios medžiagos koncentracijai (geriau ne mažiau kaip 3) arba daug bandymo kolbų kiekvienai koncentracijai, jei kiekvieną imamą mėginį sudaro visas kolbos turinys (žymimos FT), |
|
— |
bandymo kolbos masių balansui apskaičiuoti; bent dvi kolbos kiekvienai bandymo koncentracijai (žymimos FM), |
|
— |
tuščiojo kontrolinio ėminio kolba, be bandomosios medžiagos; bent viena tuščiojo ėminio bandymo kolba, kurioje būtų tik bandymo vanduo (žymima FB), |
|
— |
etaloninio kontrolinio ėminio kolbos; dvi kolbos su etalonine medžiaga (pvz., anilinu arba natrio benzoatu, 10 µg/l) (žymimos FC). Etaloninio kontrolinio ėminio paskirtis – patvirtinti mažiausią mikrobų aktyvumą. Jei tinka, galima naudoti žymėtąją etaloninę medžiagą, ir kai bandomosios medžiagos skaidymas stebimas atliekant cheminę analizę, |
|
— |
sterilumo kontrolės kolbos; viena arba dvi kolbos, kuriose būtų sterilizuotas bandymo vanduo galimam abiotiniam skaidymui arba kitokio tipo ne biologiniam bandomosios medžiagos šalinimui tirti (žymimos FS). Biologinį aktyvumą galima stabdyti bandymo vandenį apdorojant autoklave (121 °C; 20 min) arba pridedant toksinės medžiagos (pvz., natrio azido (NaN3) 10–20 g/l, gyvsidabrio (II) chlorido (HgCl2) 100 mg/l arba formalino at 100 mg/l) arba švitinant gama spinduliuote. Jei naudojamas HgCl2, jis turėtų būti šalinamas kaip toksiškos atliekos. Jei naudojamas vanduo su dideli nuosėdų kiekiu, gauti sterilias sąlygas nelengva; šiuo atveju rekomenduojamas pakartotinis apdorojimas autoklave (pvz., tris kartus). Reikėtų atsižvelgti į tai, kad apdorojant autoklave gali pakisti nuosėdų sorbcinės charakteristikos, |
|
— |
tirpiklio kontrolinės kolbos, kuriose būtų bandymo vanduo ir bandymo vanduo su etalonine medžiaga; po dvi kolbas, apdorotas tuo pačiu tirpiklio kiekiu, kurioms taikoma ta pati procedūra, kaip ir bandomosioms medžiagoms. Tirpiklio kontrolinių ėminių tikslas – ištirti galimą neigiamą tirpiklio poveikį mikrobų populiacijai, nustatant etaloninės medžiagos skaidymą. |
Rengdamas bandymo planą, tyrėjas turėtų išnagrinėti santykinį bandinio kartotinių ėminių ir didesnio mėginių skaičiaus santykio reikšmingumą. Tikslus reikiamų kolbų skaičius priklausys nuo taikomo skaidymo matavimo metodo (žr. 1.8.9.1 skirsnio trečiąją pastraipą; 1.8.9.4 skirsnį ir 3 priedą).
Kiekvienu mėginio ėmimo momentu iš kiekvienos bandymo kolbos turėtų būti imami du daliniai mėginiai (pvz., 5 ml alikvotinės dalys). Jei naudojama daug kolbų, kai mėginį sudaro visas kolbos turinys, kiekvieną kart imant mėginį turėtų būti paimtos bent dvi kolbos (žr. 1.8.9.1 skirsnio pirmąją pastraipą).
1.8.9.3. Kolbų ruošimas suspenduotų nuosėdų bandymui [neprivaloma]
Į bandymo indus įpilami reikiami tūriai bandymo vandens ir nuosėdų, jei reikia (žr. 1.8.5 skirsnį). Kolbų ruošimas suspenduotų nuosėdų bandymui atitinką kolbų ruošimą pelaginiam bandymui (žr. 1.8.9.1 ir 1.8.9.2 skirsnius). Geriausia naudoti serumo butelius arba panašios formos kolbas. Užkimštos kolbos dedamos horizontaliai ant purtyklės. Aišku, kad atviros kolbos su 14C nežymėtomis, nelakiomis medžiagomis yra statomos; šiuo atveju rekomenduojama maišyti magnetine maišykle ir naudoti stiklu dengtus magnetinius strypelius. Prireikus buteliai aeruojami tinkamoms aerobinėms sąlygoms užtikrinti.
1.8.9.4. Radiocheminiai nustatymai
Išsiskyręs 14CO2 yra matuojamas netiesiogiai ir tiesiogiai (žr. 3 priedą). 14CO2 nustatomas netiesiogiai kaip skirtumas tarp pradinio 14C aktyvumo bandymo vandenyje arba suspensijoje ir paimto mėginio suminio liekamojo aktyvumo, išmatuoto po mėginio rūgštinimo iki pH 2–3 ir CO2 pašalinimo. Taip pašalinama neorganinė anglis ir išmatuotas liekamasis aktyvumas yra organinės medžiagos aktyvumas. Netiesioginis 14CO2 nustatymas neturėtų būti taikomas, jei kaip pagrindiniai bandomosios medžiagos virsmo produktai susidaro lakieji junginiai (žr. 3 priedą). Jei įmanoma, išsiskyrusio 14CO2 kiekis turėtų būti matuojamas tiesiogiai (žr. 3 priedą) kiekvieną kartą imant mėginį bent iš vienos bandymo kolbos; taikant šią procedūrą, galima patikrinti masių balansą ir biologinio skaidymo procesą, bet ji tinka tik bandymams, atliekamiems su uždarytomis kolbomis.
Jei atliekant bandymą išsiskyrusio 14CO2 kiekis matuojamas tiesiogiai, šiam tikslui bandymo pradžioje turėtų būti paruošta daugiau kolbų. Rekomenduojamas tiesioginis 14CO2 nustatymas, jei kaip pagrindiniai bandomosios medžiagos virsmo produktai susidaro lakieji junginiai. Kiekvieną kartą matuojant, papildomų bandymo kolbų turinys yra rūgštinamas iki pH 2–3 ir 14CO2 surenkamas vidiniu arba išoriniu absorbentu (žr. 3 priedą).
14C žymėtos bandomosios medžiagos ir pagrindinių virsmo produktų koncentracijos vertės gali būti nustatytos, taikant radiocheminę chromatografiją (pvz., plonasluoksnę chromatografiją, RAD-TLC) arba HPLC ir radiocheminį aptikimo metodą.
Papildomai galima nustatyti liekamojo radioaktyvumo fazinį pasiskirstymą (žr. 1 priedą), bandomosios medžiagos likutį ir virsmo produktus.
Baigus bandymą, turėtų būti nustatytas masių balansas, tiesiogiai matuojant 14CO2 atskirose bandymo kolbose, iš kurių atliekant bandymą mėginiai nebuvo imami (žr. 3 priedą).
1.8.9.5. Specifinė cheminė analizė
Jei yra jautrus specifinis analizės metodas, jį galima taikyti vietoj radiocheminių metodu pirminiam biologiniam skaidymui įvertinti, matuojant suminę bandomosios medžiagos liekamąją koncentraciją. Jei naudojama žymėtoji bandomoji medžiaga (visiškai mineralizacijai matuoti), specifinė cheminė analizė gali būti atliekama lygiagrečiai papildomai informacijai gauti ir procedūrai patikrinti. Be to, specifinė cheminė analizė gali būti taikoma nustatyti virsmo produktus, susidariusiems skaidant bandomąją medžiagą, ir ši analizė rekomenduojama medžiagoms, kurių mineralizacijos pusėjimo trukmė ilgesnė kaip 60 parų. Kiekvieną kart imant mėginį turėtų būti išmatuota ir pateikta ataskaitoje bandomosios medžiagos ir virsmo produktų koncentracija (kaip koncentracija ir kaip įdėto kiekio procentinė dalis). Apskritai, jei bet kuriuo mėginio ėmimo momentu aptikti virsmo produktai sudaro ≥ 10 % įdėtos medžiagos koncentracijos, jie turėtų būti identifikuoti, išskyrus kai jie gana patikimai patvirtinami kitu būdu. Virsmo produktų, kurių koncentracija visą tyrimą didėja, irgi turėtų būti identifikuojami, net jei jų koncentracija neviršija pirmiau nurodytos ribinės vertės, nes tai galėtų rodyti patvarumą. Reikėtų spręsti virsmo produktų analizės sterilumo kontrolės ėminiuose klausimą, jei manoma, kad galėtų vykti greitas abiotinis bandomosios medžiagos virsmas (pvz., hidrolizė). Virsmo produktų kiekybinio nustatymo ir identifikavimo būtinybė turėtų būti nagrinėjama kiekvienu konkrečiu atveju, pagrindimą pateikiant ataskaitoje. Ekstrahavimas organiniais tirpikliais turėtų būti taikomas pagal atitinkamos analizės metodikos rekomendacijas.
Visi mėginiai turėtų būti laikomi 2–4 °C temperatūroje ir nesiliesti su oru, jei analizė atliekama per 24 h (pageidautina). Laikant ilgiau, mėginiai turėtų būti užšaldomi žemiau –18 °C arba konservuojami cheminiu būdu. Konservuojamų mėginių rūgštinti nerekomenduojama, kadangi rūgštinti mėginiai gali būti nestabilūs. Jei analizei skirti mėginiai laikomi ilgiau kaip 24 h, turėtų būti atliktas stabilumo laikymo sąlygomis tyrimas, kuris įrodytų nagrinėjamų cheminių medžiagų stabilumą, kai laikoma –18 °C temperatūroje arba konservavimo sąlygomis. Jei analizės metodą sudaro ekstrahavimas tirpikliu arba kietosios fazės ekstrahavimas (anglų k. SPE), ekstrahuoti reikėtų iškart paėmus mėginį arba ne vėliau kaip per 24 h, jei mėginys atšaldomas.
Atsižvelgiant į analizės metodo jautrį, gali tekti imti didesnio tūrio ėminius nei nurodyta 16 skirsnyje. Bandymą būtų lengva atlikti, jei būtų naudojami vieno litro bandymo tūriai 2–3 litrų talpos kolbose, iš kurių būtų galima imti maždaug 100 ml mėginius.
2. DUOMENYS IR ATASKAITOS RENGIMAS
2.1. REZULTATŲ APDOROJIMAS
2.1.1. Duomenų grafikas
Mėginių ėmimo laikas suapvalinamas iki sveiko valandų skaičiaus (išskyrus kai medžiaga skyla dideliu laipsniu per minutes arba valandas), bet ne iki sveiko parų skaičiaus. Braižomi bandomosios medžiagos liekamojo aktyvumo (14C žymėtų medžiagų) arba liekamosios koncentracijos (nežymėtų medžiagų) įverčių kaip laiko funkcijos grafikai, naudojant linijinius ir pusiau logaritminius parametrus (žr. 1a, 1b paveikslus). Jei skaidymas vyko, lyginami FT ir FS kolbų rezultatai. Jei kolbų su bandomąja medžiaga (FT) ir sterilių kolbų (FS) rezultatų vidurkiai skiriasi mažiau kaip 10 %, galima daryti prielaidą, kad stebimas skaidymas iš esmės yra abiotinis. Jei skaidymas FS kolbose vyksta mažesniu laipsniu, skaičiai gali būti naudojami FT kolboms gautų rezultatų pataisai daryti (atimant), kad ūbtų galima įvertinti biologinio skaidymo laipsnį. Kai atliekama neprivaloma pagrindinių virsmo produktų analizė, be bandomosios medžiagos išnykimo grafiko turėtų būti pateikti virsmo produktų susidarymo ir išnykimo grafikai.
Pagal skaidymo kreivę nustatoma vėlavimo tarpsnio trukmė tL (pusiau logaritminis grafikas) tiesiąją kreivės dalį ekstrapoliuojant į nulinį skaidymo laiką arba nustatant maždaug 10 % skaidymo trukmę (žr. 1a ir 1b paveikslus). Pagal pusiau logaritminį grafiką įvertinama pirmojo laipsnio greičio konstanta k ir jos standartinė paklaida, atliekant ln (liekamojo 14C aktyvumo arba bandomosios medžiagos koncentracijos) kaip lakiko funkcijos tiesinę regresiją. Konkrečiai, kai atliekami 14C matavimai, reikia naudoti tik pradinės tiesinės kreivės dalies, pasibaigus vėlavimo tarpsniui, duomenis, ir geriau atrinkti nedidelį skaičių tipinių duomenų, bet ne didesnį skaičių mažiau apibrėžtų duomenų. Šiuo atveju neapibrėžtį sudaro paklaidos, būdingos taikant rekomenduojamą tiesioginio liekamojo 14C aktyvumo (žr. toliau) matavimo metodą. Kartais galbūt reikėtų apskaičiuoti dvi skirtingas greičio konstantas, jei skaidymas atitinka dviejų tarpsnių schemą. Šiuo tikslu nustatomi du skirtingi skaidymo kreivės tarpsniai. Greičio konstantos k ir pusėjimo trukmė t½ = ln2/k turėtų būti apskaičiuojamos atskirai kiekvienai kartotinių ėminių kolbai, kai daliniai mėginiai imami iš tos pačios kolbos, arba naudojant vidutines vertes, kai kiekvieną kartą kaip mėginys imamas visas kolbos turinys (žr. 1.8.9.2 skirsnio paskutinę pastraipą). Kai taikoma pirmoji nurodyta procedūra, ataskaitoje turėtų būti pateikta greičio konstanta ir pusėjimo trukmė, gauta atskirai kiekvienai kolbai, jų vidutinė vertė ir jos standartinė paklaida. Jei buvo naudojamos didelės bandomosios medžiagos koncentracijos vertės, skaidymo kreivė gali gerokai nukrypti nuo tiesės (pusiau logaritminio grafiko) ir pirmojo laipsnio kinetika gali negalioti. Taigi neįmanoma apibrėžti pusėjimo trukmės. Tačiau ribotam duomenų intervalui galima taikyti pseudopirmojo laipsnio kinetiką ir įvertinti skaidymo pusėjimo trukmę DT50 (laikas 50 % skaidymo laipsniui pasiekti). Tačiau reikia atminti, kad skaidymo eigos, išskyrus pasirinktą duomenų intervalą, negalima prognozuoti taikant DT50, kuri aprašo tik nurodytą duomenų rinkinį. Nesunku gauti statistiniams apskaičiavimams ir kreivės pritaikymui palengvinti skirtas analizines priemones ir rekomenduojama naudoti šio tipo programinę įrangą.
Jei atliekama specifinė cheminė analizė, įvertinamos pirminio skaidymo greičio konstantos ir pusėjimo trukmės vertės, kaip tai buvo atliekama visiškai mineralizacijai. Jei pirminis skaidymas yra greitį ribojantis procesas, kartais galima naudoti visos skaidymo eigos duomenų taškus. Taip yra todėl, kad priešingai 14C aktyvumo matavimui, šie matavimai yra tiesioginiai.
Jei naudojamos 14C žymėtos medžiagos, masių balansas bent bandymo pabaigoje turėtų būti išreikštas kaip naudotos pradinės koncentracijos procentinė dalis.
2.1.2. Liekamasis aktyvumas
Kai biologiškai skaidoma 14C žymėta organinės medžiagos dalis, didžiausia 14C dalis virsta 14CO2, kita jo dalis naudojama biomasei didinti ir (arba) neląstelinių metabolitų sintezei. Taigi vykstant „visiškam“ biologiniam medžiagos skaidymui, ne visa jos anglis virsta 14CO2. 14C, patekęs į biosintezės būdu gautus produktus, vėliau lėtai išsiskiria kaip 14CO2 dėl „antrinės mineralizacijos“. Dėl šių priežasčių liekamojo organinio 14C aktyvumo (išmatuoto pašalinus CO2) arba gauto 14CO2 kiekio kaip laiko funkcijos kreivėse atsiranda „uodega“, kai skaidymas jau yra baigtas. Tai apsunkina duomenų kinetinį interpretavimą ir tik pradinė kreivės dalis (pasibaigus vėlavimo tarpsniui ir anksčiau nei pasiekiamas maždaug 50 % skaidymas) paprastai turėtų būti naudojama skaidymo greičio konstantai įvertinti. Jei bandomoji medžiaga yra skaidoma, suminis liekamasis organinės 14C aktyvumas yra visuomet didesnis nei 14C aktyvumas, atitinkantis likusią nesuskaidytą bandomąją medžiagą. Jei bandomoji medžiaga skaidoma pagal pirmojo laipsnio reakciją ir pastovi dalis α mineralizuojama į CO2, pradinis 14C išnykimo (suminės organinės 14C kaip laiko funkcijos) kreivės krypties koeficientas bus lygus α, padaugintai iš bandomosios medžiagos (arba, jei kalbėti tiksliai, bandomosios medžiagos 14C žymėtosios dalies) atitinkamos koncentracijos kreivės krypties koeficiento. Taigi naudojant nepataisyto suminio organinės 14C aktyvumo matavimus, apskaičiuota skaidymo greičio konstanta bus sumažinta. Bandomosios medžiagos koncentracijos verčių apskaičiavimo pagal išmatuotą radiocheminį aktyvumą metodikos, pagrįstos įvairiomis supaprastinančiomis prielaidomis, yra aprašytos literatūroje (2)(9)(10)(11). Tokias metodikas lengviausia taikyti greitai skaidomoms medžiagoms.
2.2. REZULTATŲ INTERPRETAVIMAS
Jei nustatoma, kad didinant koncentraciją k nesikeičia (t. y., jei apskaičiuotoji k vertė yra maždaug tokia pati, esant skirtingoms bandomosios medžiagos koncentracijos vertėms), galima daryti prielaidą, kad esamas bandymo sąlygas, t. y. bandomąją medžiagą, vandens ėminį ir bandymo temperatūrą, atitinka pirmojo laipsnio greičio konstanta. Ekspertų sprendimu turi būti įvertinta, kokiu laipsniu rezultatus galima apibendrinti ir ekstrapoliuoti kitoms sistemoms. Jei naudojama didelė bandomosios medžiagos koncentracija, ir dėl tos priežasties skaidymas neatitinka pirmojo laipsnio kinetikos, duomenys negali būti naudojami tiesiogiai įvertinti pirmojo laipsnio greičio konstantą arba atitinkamą pusėjimo trukmę. Tačiau duomenys, gauti atliekant bandymus, kuriuose naudojama didelė bandomosios medžiagos koncentracija, vis dar gali būti naudingi visiškos mineralizacijos laipsniui įvertinti ir (arba) virsmo produktams aptikti ir kiekybiškai nustatyti.
Jei yra žinomi kitų nei biologinis skaidymas išnykimo procesų (pvz., hidrolizės arba garavimo) greičiai, juos galima atimti iš bandymo metu stebimo suminio išnykimo greičio apytikriam biologinio skaidymo įverčiui gauti. Hidrolizės duomenis galima, pvz., gauti pagal sterilumo kontrolės ėminio duomenis arba atlikti lygiagretų bandymą, naudojant didesnę bandomosios medžiagos koncentraciją.
Netiesioginis ir tiesioginis 14CO2 nustatymas (1.8.9.4 skirsnis ir 3 priedas) gali būti taikomas tik bandomosios medžiagos mineralizacijos į CO2 laipsniui matuoti. Radiocheminė chromatografija (RAD-TLC) arba HPLC gali būti naudojama 14C žymėtos bandomosios medžiagos koncentracijos vertėms nustatyti ir pagrindinių virsmo produktų susidarymui analizuoti (1.8.9.4 skirsnio trečioji pastraipa). Norint tiesiogiai įvertinti pusėjimo trukmę, būtina, kad nebūtų pagrindinių virsmo produktų (pagal apibrėžtį sudarančių ≥ 10 % pridėto bandomosios medžiagos kiekio). Jei esama pagrindinių virsmo produktų, kaip jie yra apibrėžti pagal šį bandymą, reikia atlikti detalų duomenų įvertinimą. Jį gali sudaryti pakartotinis bandymas ir (arba) virsmo produktų identifikavimas (žr. 1.8.9.5 skirsnio pirmąją pastraipą), išskyrus kai virsmo produktų likimas gali būti pakankamai pagrįstai įvertintas naudojant turimus duomenis (pvz., informaciją apie skaidymo kelią). Kadangi CO2 virtusios bandomosios medžiagos anglies dalis kinta (labiausiai dėl bandomosios medžiagos ir kitų esančių substratų koncentracijos, bandymų sąlygų ir mikrobų populiacijos), šiuo bandymu neįmanoma tiesiogiai įvertinti visišką biologinį skaidymą, kaip DOC išnykimo metodu; bet rezultatas yra panašus į respirometriniu bandymu gaunamą rezultatą. Todėl mineralizacijos laipsnis bus lygus arba mažesnis kaip mažiausias visiško biologinio skaidymo lygis. Išsamesniam visiško biologinio skaidymo (mineralizacijos ir įjungimo į biomasę) vaizdui gauti, bandymo pabaigoje reikėtų atlikti 14C fazinio pasiskirstymo analizę (žr. 1 priedą). Telkinyje su kietosiomis dalelėmis 14C sudarys į biomasę įjungtas 14C ir organinėmis dalelėmis sorbuotas 14C.
2.3. BANDYMO TINKAMUMAS
Jei etaloninė medžiaga nesuskaidoma per numatomą laiko intervalą (anilino ir natrio benzoato – paprastai trumpesnė kaip dvi savaitės), turėtų būti suabejota bandymo tinkamumu ir turi būti papildomai patikrintas arba turėtų būti pakartotas naujo vandens ėminio bandymas. ISO atliktame tarplaboratoriniame metodo tyrime, kuriame dalyvavo septynios po Europą išdėstytos laboratorijos, buvo priimta, kad anilino skaidymo greičio konstantų intervalas yra 0,3–1,7 para–1, jo vidurkis 0,8 d–1 ir standartinė paklaida ±0,4 d–1 (t½ = 0,9 paros). Tipinės vėlavimo trukmės vertės buvo 1–7 paros. Nurodoma, kad tirtų vandens ėminių bakterijų biomasė atitiko 103 – 104 kolonijas sudarančių vienetų (anglų k. CFU) viename ml. Skaidymo greitis daug mitybinių medžiagų turinčiuose vidurio Europos vandenyse buvo didesnis nei šiauriniuose oligotrofiniuose vandenyse, galbūt dėl skirtingos trofinės būsenos arba dėl ankstesnio cheminių medžiagų veikimo.
Suminis žymėtųjų medžiagų atgavimas (masių balansas) bandymo pabaigoje turėtų būti nuo 90 % iki 110 %, tuo tarpu nežymėtų medžiagų pradinis atgavimas bandymo pradžioje turėtų būti nuo 70 % iki 110 %. Tačiau nurodyti intervalai turėtų būti suprantami tik kaip kontroliniai skaičiai ir netaikomi kaip bandymo priėmimo kriterijai.
3. BANDYMŲ ATASKAITA
Tyrimo tipas, t. y. pelaginis arba suspenduotų nuosėdų bandymas, turėtų būti aiškiai nurodytas bandymų ataskaitoje, kurioje dar turi būti bent ši informacija:
Bandomoji medžiaga ir etaloninė (-ės) medžiaga (-os):
|
— |
įprasti pavadinimai, cheminiai pavadinimai (rekomenduojama vartoti IUPAC ir (arba) CAS pavadinimus), CAS numeriai, struktūrinės formulės (rodančios 14C padėtį, jei naudojama žymėtoji medžiaga) ir atitinkamos fizikocheminės savybės (žr. 1.5 ir 1.6 skirsnius), |
|
— |
medžiagų, naudojamų kaip virsmo produktų identifikavimo ir kiekybinio nustatymo etalonai, cheminiai pavadinimai, CAS numeriai, struktūrinės formulės (rodančios 14C padėtį, jei naudojama žymėtoji medžiaga) ir atitinkamos fizikocheminės savybės, |
|
— |
bandomosios ir etaloninės medžiagų grynumas (priemaišos), |
|
— |
radiocheminis žymėtosios cheminės medžiagos grynumas ir savitasis aktyvumas (jei tinka). |
Paviršinis vanduo:
Turi būti pateikta bent ši informacija apie paimta vandens ėminį:
|
— |
ėminio ėmimo vieta ir jos aprašymas, įskaitant, jei įmanoma, užteršimo istoriją, |
|
— |
ėminio ėmimo data ir laikas, |
|
— |
mitybinės medžiagos (suminis N, amonis, nitritas, nitratas, suminis P, ištirpęs ortofosfatas), |
|
— |
ėmimo gylis, |
|
— |
ėminio išvaizda (pvz., spalva ir drumstumas), |
|
— |
DOC ir TOC, |
|
— |
BOD, |
|
— |
temperatūra ir pH ėminio ėmimo vietoje ir ėmimo laiku, |
|
— |
deguonies koncentracija arba oksidacijos redukcijos potencialas (privaloma, jei nėra aiškaus aerobinių sąlygų įrodymo), |
|
— |
druskingumas arba laidis (jūros ir sūroko vandens atveju), |
|
— |
suspenduotos kietosios dalelės (drumsto ėminio atveju), |
|
— |
visa kita galima informacija apie ėminio vietą ėmimo momentu (pvz., faktiniai arba anksčiau sukaupti duomenys apie upių arba jūros srovių srautą, šalia esančius pagrindinius ištakius ir ištakių tipą, oro sąlygas prieš ėminio ėmimą), |
ir neprivalomai:
|
— |
mikrobų biomasė (pvz., tiesioginis skaičius, naudojant akridino oranžinį, arba kolonijas sudarančių vienetų skaičius), |
|
— |
neorganinė anglis, |
|
— |
chlorofilo a koncentracija kaip specifinis dumblių biomasės įvertis. |
Be to, turėtų būti pateikta ši papildoma informacija apie nuosėdas, jei atliekamas suspenduotų nuosėdų bandymas:
|
— |
nuosėdų ėmimo gylis, |
|
— |
nuosėdų išvaizda (pvz., spalvotos, purvinos, dumblinos arba smėlėtos), |
|
— |
tekstūra (pvz., % stambaus smėlio, smulkaus smėlio, dumblo ir molio), |
|
— |
sausų suspenduotų kietųjų dalelių masė g/l, TOC koncentracija arba masės nuostolis iškaitinus, kaip organinės medžiagos kiekio matas, |
|
— |
pH, |
|
— |
deguonies koncentracija arba oksidacijos redukcijos potencialas (privaloma, jei nėra aiškaus aerobinių sąlygų įrodymo). |
Bandymų sąlygos:
|
— |
laiko tarpas nuo ėminio paėmimo iki jo panaudojimo laboratoriniame bandyme, ėminio laikymas ir pradinis apdorojimas, tyrimų atlikimo data, |
|
— |
įdėtos bandomosios medžiagos kiekis, bandomosios ir etaloninės medžiagos koncentracija, |
|
— |
bandomosios medžiagos įdėjimo būdas, įskaitant tirpiklių naudojimą, |
|
— |
naudoto paviršinio vandens ir nuosėdų (jei naudotos) tūris ir analizei imamo kiekvieno mėginio tūris, |
|
— |
naudotos bandymo sistemos aprašymas, |
jei neturi būti užtikrinamos tamsos sąlygos, informacija apie „išsklaidyto šviesos“ sąlygas,
|
— |
informacija apie metodą (-us), taikytą (-us) sterilumo kontrolės ėminiams gauti (pvz., temperatūra, apdorojimų autoklave trukmė ir skaičius), |
|
— |
inkubavimo temperatūra, |
|
— |
informacija apie analizės metodus, radiocheminių matavimų, masės balanso tikrinimo ir fazinio pasiskirstymo matavimo (jei atliekamas) metodą (-us), |
|
— |
kartotinių ėminių skaičius. |
Rezultatai:
|
— |
atgavimo procentinės dalies vertės (žr. 1.7.1 skirsnį), |
|
— |
taikytų analizės metodų pakartojamumas ir jautrumas, įskaitant aptikimo ribą (LOD) ir kiekybinio nustatymo ribą (LOQ) (žr. 1.7.2 skirsnį), |
|
— |
visų matavimų duomenys (įskaitant mėginių ėmimo laiko taškus) ir apskaičiuotos vertės lentelių ir skaidymo kreivių pavidalu; kiekvienai bandymo koncentracijai ir kiekvienai kartotinio ėminio kolbai nurodomas logaritminio grafiko tiesinės koreliacijos krypties koeficientas, vėlavimo tarpsnio ir pirmojo laipsnio arba pseudopirmojo laipsnio greičio konstantos (jei įmanoma) įvertis, atitinkama skaidymo pusėjimo trukmė (arba pusėjimo periodas, t50), |
|
— |
ataskaitoje atitinkamos vertės pateikiamos kaip atskirų kartotinių ėminių rezultatų vidurkis, pvz., vėlavimo tarpsnio trukmės, skaidymo greičio konstantos ir skaidymo pusėjimo trukmės (arba t50), |
|
— |
sistema priskiriama prie neprisitaikiusios arba prisitaikiusios pagal skaidymo kreivės išvaizdą ir galimą bandymo koncentracijos įtaką, |
|
— |
galutinio masės balanso tikrinimo ir fazinio pasiskirstymo matavimų (jei buvo atliekami) rezultatai, |
|
— |
mineralizuotos 14C dalis ir galutinis pirminio skaidymo lygis, jei taikoma specifinė analizė, |
|
— |
įdėtų ir pagrindinių virsmo produktų identifikavimas, molinė koncentracija ir procentinė dalis (žr. 1.8.9.5 skirsnio pirmąją pastraipą), jei tinka, |
|
— |
siūlomas virsmo kelias, jei tinka, |
|
— |
rezultatų aptarimas. |
4. LITERATŪRA
|
1. |
OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test |
|
2. |
ISO/DIS 14592–1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions. |
|
3. |
Testing Method C.23. Aerobic and anaerobic transformation in soil. |
|
4. |
Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments. |
|
5. |
OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris. |
|
6. |
ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC). |
|
7. |
ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium. |
|
8. |
OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 (to be published summer 2000). |
|
9. |
Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394–401. |
|
10. |
Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274–283. |
|
11. |
ISO/CD 14592–1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions. |
1 Priedas
14C Fazinis pasiskirstymas
Norint patikrinti procedūrą, įprasti liekamojo suminio organinės 14C aktyvumo (TOA) matavimai turėtų būti papildyti masių balanso matavimais, įskaitant tiesioginį išsiskyrusio ir absorbentu sugauto 14CO2 nustatymą (žr. 3 priedą). Patvirtintas 14CO2 susidarymas jau pats savaime yra tiesioginis biologinio skaidymo, bet ne abiotinio skaidymo arba kitų mažėjimo mechanizmų, pvz., garavimo ir sorbcijos, įrodymas. Papildoma naudinga informacija, apibūdinanti biologinio skaidumo charakteristikas, gali būti gauta matuojant TOA pasiskirstymą tarp skystosios fazės (ištirpusios organinės 14C aktyvumą DOA) ir kietųjų dalelių fazės (kietųjų dalelių organinės 14C aktyvumą POA), kietąsias daleles atskyrus membraniniu filtravimu arba centrifugavimu. Be bandomosios medžiagos anglies, kuri buvo panaudota naujų ląstelių medžiagai sintetinti ir taip pateko į kietąją biomasę, POA sudaro bandomoji medžiaga, sorbuota ant mikrobų biomasės ir ant kitų kietųjų dalelių. Ištirpusios organinės medžiagos 14C susidarymas gali būti įvertintas kaip DOA biologinio skaidymo pabaigoje (skaidymo kaip laiko funkcijos kreivės gulsčioji dalis).
Liekamosios 14C faziniam pasiskirstymui pasirinktuose ėminiuose įvertinti, ėminiai filtruojami per 0,22 μm arba 0,45 μm membraninį filtrą, pagamintą iš medžiagos, kuri neadsorbuoja didelių bandomosios medžiagos kiekių (gali tikti polikarbonatiniai filtrai). Jei bandomosios medžiagos sorbcija ant filtro per didelė, kad į ją būtų galima neatsižvelgti (turi būti tikrinama prieš bandymą), vietoj filtravimo galima naudoti didelio greičio centrifugavimą (2 000 g; 10 min).
Filtratas arba centrifugatas apdorojamas taip, kaip 3 priede aprašyta nefiltruotiems ėminiams. Membraniniai filtrai ištirpinami atitinkamame scintiliacijos skystyje ir skaičiuojama kaip visuomet, paprastai taikant tik išorinio etalono santykio metodą gesinimo pataisai įvertinti, arba naudojamas ėminio oksidatorius. Jei buvo naudojamas centrifugavimas, susidariusi kietųjų dalelių tabletė suspenduojama 1–2 ml distiliuoto vandens ir skystis supilamas į scintiliacijos buteliuką. Centrifugavimo mėgintuvėlis du kartus plaunamas 1 ml distiliuoto vandens ir plovimo vanduo supilamas į buteliuką. Prireikus suspensija gali būti įlieta į gelį scintiliacijai skystyje skaičiuoti.
2 Priedas
Pusiau nepertraukiamo skaidymo procedūra
Gali tekti inkubuoti keliems mėnesiams pakankamam patvarių medžiagų skaidymo laipsniui pasiekti. Bandymo trukmė paprastai neturėtų būti ilgesnė kaip 60 parų, išskyrus kai pradinio vandens ėminio charakteristikos išlaikomos atnaujinant bandymo suspensija. Tačiau bandymo laikotarpis gali būti pratęstas iki ne daugiau kaip 90 parų neatnaujinant bandymo suspensijos, jei bandomosios medžiagos skaidymas prasidėjo per pirmąsias 60 parų.
Inkubuojant ilgą laiką gali sumažėti mikrobų populiacijos įvairovė dėl įvairių išnykimo mechanizmų ir dėl galimo vandens ėminio pagrindinių mitybinių medžiagų ir pirminių anglies substratų išeikvojimo. Todėl lėtai skaidomų medžiagų skaidymo greičiui nustatyti rekomenduojama taikyti pusiau nepertraukiamą bandymą. Bandymas turėtų būti pradėtas taikant pusiau nepertraukiamą procedūrą, jei ankstesnis patyrimas rodo, kad reikės trijų mėnesių inkubavimo laikotarpio 20 % medžiagos skaidymo laipsniui pasiekti. Kitu būdu įprastas atskirų ėminių bandymas gali būti pakeistas pusiau nepertraukiamu bandymu, jei maždaug per 60 bandymo parų, taikant atskirų ėminių procedūrą, bandomosios medžiagos skaidymas neprasidėjo. Pusiau nepertraukiama procedūra gali būti sustabdyta ir bandymas tęsiamas kaip atskirų ėminių bandymas, kai yra pasiekiamas didelis skaidymo laipsnis (pvz., > 20 %).
Atliekant pusiau nepertraukiamą bandymą, maždaug trečdalis bandymo suspensijos tūrio kas dvi savaites keičiamas iš naujo paimtu vandeniu su bandomąją medžiaga, kurios koncentracija atitinka pradinę koncentraciją. Tokiu pat būdu į pakaitinį vandenį įdedama nuosėdų, kurių koncentracija atitinka pradinę koncentraciją (nuo 0,01 iki 1 g/l), jei atliekamas neprivalomas suspenduotų nuosėdų bandymas. Atliekant suspenduotų nuosėdų bandymą svarbu, kad keičiant vandenį būtų išlaikoma visiškai suspenduotų dalelių sistema ir kad būtų vienoda kietųjų dalelių ir vandens buvimo trukmė, nes priešingu atveju galima netekti laukiamo panašumo su vienalyte vandenine sistema be nejudančiųjų fazių. Dėl šių priežasčių būtų geriau, jei taikant pusiau nepertraukiamą procedūrą suspenduotų nuosėdų pradinė koncentracija atitiktų nurodyto intervalo apatines vertes.
Daroma prielaida, kad dėl nustatytų bandomosios medžiagos kiekių įdėjimo iš dalies atnaujinant bandymo suspensiją, pradinė bandomosios medžiagos koncentracija nėra viršijama, taigi išvengiama adaptacijos, kuri dažnai stebima esant didelei bandomosios medžiagos koncentracijai. Kadangi procedūrą sudaro pakartotinis sėjimas ir suvartotų mitybinių medžiagų bei pirminių substratų kompensavimas, atstatoma pradinė mikrobų įvairovė ir bandymo trukmė iš esmės gali būti begalinė. Reikia atkreipti dėmesį, kad taikant pusiau nepertraukiamą procedūrą turi būti daroma liekamosios bandomosios medžiagos koncentracijos pataisa dėl bandomosios medžiagos kiekio, pridėto ir pašalinto per kiekvieną atnaujinimo procedūrą. Jei junginių sorbcija maža, vietoj suminės bandomosios medžiagos koncentracijos galima naudoti ištirpusios bandomosios medžiagos koncentraciją ir atvirkščiai. Nurodytomis sąlygomis (0,1–1 g kietųjų dalelių/l) mažai sorbuojamos (< 5 %) medžiagos, kurių log Kow < 3 (tinka neutraliems, lipofiliniams junginiams). Tai galima įrodyti šiuo apskaičiavimo pavyzdžiu. 0,1 g/l kietųjų dalelių atitinka maždaug 10 mg anglies viename litre (anglies dalis fC = 0,01). Darant prielaidą, kad:
log Kow (bandomosios medžiagos) = 3,
Koc = 0,42 × Kow,
pasiskirstymo koeficientas, Kd = fC × Koc,
ištirpusiai medžiagai tenkanti suminės koncentracijos dalis (C vandenyje (Cw)/C suminė (Ct) yra:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999.
3 Priedas
14CO2 Nustatymas
Netiesioginis 14CO2 nustatymas
Atliekant įprastus matavimus, netiesioginis metodas paprastai reikalauja mažiausiai laiko ir yra tiksliausias, jei bandomoji medžiaga yra nelaki ir nevirsta lakiais virsmo produktais. Nefiltruoti mėginiai pvz., 5 ml tūrio, tiesiog supilami į scintiliacijos buteliukus. Tinkamas mėginių pradinis aktyvumas yra 5 000 dpm-10 000 dpm (80–170 Bq) ir mažiausias pradinis aktyvumas yra apie 1 000 dpm. CO2 turėtų būti pašalintas, parūgštinus iki pH 2–3 1–2 lašais koncentruotos H3PO4 arba HCl. CO2 galima pašalinti, barbotuojant orą maždaug ½-1 h. Kitaip buteliukus galima stipriai purtyti 1–2 h (pvz., ant mikroplokštelių purtyklės) arba per naktį purtant švelniau. CO2 šalinimo procedūros efektyvumas turi būti tikrinamas (pratęsiant aeravimo arba purtymo trukmę). Įpilama scintiliacijos skysčio, tinkamo vandeninių mėginių scintiliacijai skaičiuoti, mėginys maišomas sūkuriniu maišytuvu ir radioaktyvumas nustatomas skaičiuojant scintiliaciją skystyje ir atimant fono aktyvumą, nustatytą bandymo tuščiajam ėminiui (FB). Jei bandymo vanduo nėra labai spalvotas arba kietųjų dalelių koncentracija nėra didelė, mėginių gesinimas bus tolygus ir pataisoms dėl gesinimo daryti pakaktų išorinio etalono. Jei bandymo vanduo yra labai spalvotas, pataisą dėl gesinimo gali tekti daryti naudojant vidinį etaloną. Jei kietųjų dalelių koncentracija yra didelė, gali būti neįmanoma gauti vienalyčio tirpalo arba gelio arba gali labai skirtis mėginių gesinimas. Tokiu atveju galima taikyti toliau aprašytą skaičiavimo metodą, taikomą bandymo suspensijoms. Jei bandymas atliekamas kaip suspenduotų nuosėdų bandymas, 14CO2 galima matuoti netiesiogiai, imant vienalytį 10 ml bandymo vandens ir suspensijos mėginį ir atskiriant fazes centrifugavimu, esant tinkamam pagreičiui (pvz., 40 000 m/s2, 15 min). Vėliau vandeninė fazė apdorojama kaip pirmiau aprašyta. Kietųjų dalelių fazės 14C aktyvumui (POA) nustatyti nuosėdas vėl suspenduojamos mažame tūryje distiliuoto vandens, suspensija supilama į scintiliacijos buteliukus ir įpilama scintiliacijos skysčio geliui gauti (šiam tikslui yra specialūs scintiliacijos skysčiai). Atsižvelgiant į kietųjų dalelių tipą (pvz., organinių medžiagų kiekį jose), gal būtų tikslinga mėginį per naktį skaidyti audinių soliubilizavimo priemone ir prieš įpilant scintiliacijos skysčio homogenizuoti sūkuriniu maišytuvu. Kitaip POA gali būti nustatytas mėginį sudeginant oksidacijos įrenginyje, esant deguonies pertekliui. Skaičiuojant visuomet reikėtų įtraukti vidinius etalonus, ir gali tekti daryti pataisas dėl gesinimo, kiekvienam atskiram mėginiui naudojant vidinį etaloną.
Tiesioginis 14CO2 nustatymas
Jei išsiskyręs 14CO2 yra matuojamas tiesiogiai, tai turėtų būti daroma ruošiant daugiau kolbų bandymo pradžioje, kiekvienam matavimui imti visą bandymo kolbos turinį, jį rūgštinti iki pH 2–3 ir surinkti 14CO2 vidiniu (bandymo pradžioje įdėtu į kiekvieną bandymo kolbą) arba išoriniu absorbentu. Absorbentu gali būti šarmas (pvz., 1 N NaOH tirpalas arba NaOH granulės), etanolaminas, absorbentai etanolamino pagrindu ir prekyboje esantys absorbentai. Atliekant tiesioginį 14CO2 matavimą, kolbos turėtų būti uždarytos, pvz., butilkaučiuko membrana.
1a paveikslas.
Aritmetinio duomenų grafiko pavyzdys (liekamasis aktyvumas kaip laiko funkcija)

1b paveikslas.
Pusiau logaritminio duomenų grafiko pavyzdys (ln liekamojo aktyvumo kaip laiko funkcija)

IV PRIEDAS
|
C.26. |
LEMNA SPP. AUGIMO INHIBAVIMO BANDYMAS |
1. METODAS
Šis metodas atitinka OECD TG 221 (2006) (1). Daug ES institucijų sutaria, kad tiriant ryškių spalvų medžiagas Lemna bandymas yra tinkama dumblių bandymo alternatyva (2)(3).
1.1. ĮVADAS
Šis bandymo metodas yra skirtas medžiagų toksiškumui genties Lemna (plūdena) gėlavandeniams augalams įvertinti. Jis yra pagrįstas esamomis rekomendacijomis (4)(5)(6)(7)(8)(9), bet į jį įtraukti šių metodų pakeitimai, siekiant atsižvelgti į naujus tyrimus ir konsultacijas dėl daugelio pagrindinių problemų. Pasiūlyto metodo tinkamumas buvo patvirtintas atliekant tarptautinį tarplaboratorinį bandymą (10).
Šiame bandymo metode aprašomas toksiškumo bandymas naudojant Lemna gibba ir Lemna minor rūšis, kurios abi buvo plačiai tiriamos ir yra pirmiau nurodytų standartų tiriamasis objektas. Lemna spp. klasifikavimas yra sudėtingas, nes jį apsunkina didelio kiekio fenotipų buvimas. Nors Lemna atsakas į toksines medžiagas gali būti genetinis kintamumas, šiuo metu nepakanka duomenų apie šio kintamumo šaltinį, kad šiam bandymui būtų galima rekomenduoti specifinį kloną. Reikėtų pažymėti, kad bandymas nėra atliekamas steriliai, bet atliekant atskiras bandymo pakopas imamasi žingsnių kiek įmanoma sumažinti užkrėtimą kitais organizmais.
Aprašytos bandymo su bandymo tirpalo atnaujinimu (pusiau stacionariojo ir pratekamojo srauto) ir be atnaujinimo (stacionariojo) detalės. Atsižvelgiant į bandymo tikslus ir norminius reikalavimus, rekomenduojama išnagrinėti galimybę taikyti pusiau stacionarųjį ir pratekamojo srauto metodus, pvz., jei medžiagos greit išnyksta iš tirpalo dėl garavimo, fotocheminio skaidymo, nusėdimo arba biologinio skaidymo. Papildomi nurodymai pateikti (11).
1.2. APIBRĖŽTYS
Šiame bandymo metode vartojamos šios apibrėžtys ir santrumpos:
Biomasė: populiaciją sudarančios sausos gyvos medžiagos masė. Šiame bandyme vietoj biomasės paprastai matuojami pakaitiniai parametrai, pvz., gniužulų skaičius arba gniužulų plotas, taigi terminas „biomasė“ taikomas ir šiems pakaitiniams matams.
Chlorozė: gniužulų audinio pageltimas.
Klonas: organizmas arba ląstelė, gauta iš vieno individo nelytinio dauginimosi būdu. Taigi to paties klono individai yra genetiškai tapatūs.
Kolonija: sujungtų moterinių ir dukterinių gniužulų (paprastai nuo 2 iki 4) sankaupa. Kartais vadinama augalu.
ECx : bandymo terpėje ištirpusios bandomosios medžiagos koncentracija, kuriai esant Lemna augimo greitis per nustatytą veikimo laikotarpį (tiksliai nurodomą, jei nukrypsta nuo visos arba normalios bandymo trukmės) sumažėja x % (pvz., 50 %). EC vertei, gautai pagal augimo greitį arba pagal išeigą, vienareikšmiškai žymėti vartojami simboliai „ErC“ augimo greičiui ir „EyC“išeigai, toliau nurodant naudotą matuojamą kintamąjį, pvz., ErC (gniužulų skaičius).
Pratekamojo srauto: bandymas, kurį atliekant bandymo tirpalai keičiami nepertraukiamai.
Gniužulas: atskira (pavienė) plūdenos augalo „lapo formos“ struktūra. Tai yra mažiausiais galintis daugintis vienetas, t. y. individas.
Gumbuotumas: žymi gumbuotų arba išsipūtusių gniužulų išvaizdą.
Augimas: matuojamo kintamojo, pvz., gniužulų skaičiaus, sausos medžiagos masės, šviežios medžiagos masės arba gniužulų ploto, didėjimas bandymo laikotarpiu.
Augimo greitis (vidutinis savitasis augimo greitis): logaritminis biomasės didėjimas veikimo laikotarpiu.
Mažiausia stebimo poveikio koncentracija (LOEC): mažiausia bandomosios medžiagos koncentracija, kuriai esant medžiagos poveikis augimo mažėjimui per nustatytą veikimo laikotarpį yra statistiškai reikšmingas palyginti su kontroliniais ėminiais (kai p < 0,05). Tačiau esant visoms didesnėms kaip LOEC bandymo koncentracijos vertėms, kenksmingas poveikis turi būti lygus arba didesnis nei poveikis, kuris būtų esant LOEC. Kai negalima įvykdyti šių dviejų sąlygų, turi būti pateiktas išsamus paaiškinimas, kaip buvo pasirinkta LOEC (taigi ir NOEC) vertė.
Matuojami kintamieji: visų tipų kintamieji, kurie yra matuojami bandymo rezultatui išreikšti, naudojant vieną arba daugiau skirtingų atsako kintamųjų. Šiame metode matuojami kintamieji yra gniužulų skaičius, gniužulų plotas, šviežios medžiagos masė ir sausos medžiagos masė.
Monokultūra: vienos rūšies augalų kultūra.
Nekrozė: žuvęs (t. y. baltas arba vandens persisunkęs) gniužulų audinys.
Nestebimo poveikio koncentracija (NOEC): vos mažesnė nei LOEC bandymo koncentracija.
Fenotipas: stebimos organizmo charakteristikos, nustatomos pagal jo genų sąveiką su aplinka.
Atsako kintamieji: toksiškumui įvertinti naudojami kintamieji, gauti pagal bet kurį nors iš matuojamų kintamųjų, skirtingais apskaičiavimo metodais apibūdinančių biomasę. Šiame metode iš matuojamų kintamųjų gauti atsako kintamieji yra gniužulų skaičius, gniužulų plotas, šviežios medžiagos masė arba sausos medžiagos masė.
Pusiau stacionarusis (atnaujinimo) bandymas: bandymas, kurį atliekant bandymo tirpalas periodiškai keičiamas po tam tikro laiko tarpo.
Stacionarusis bandymas: bandymas, kurį atliekant bandymo tirpalas neatnaujinamas.
Bandymo rezultatas: aprašo bendrąjį veiksnį, kurį siekiama pakeisti palyginti su kontroliniu ėminiu, veikiant bandomąja chemine medžiaga. Šiame bandymo metode bandymo rezultatas yra augimo inhibavimas, kuris gali būti išreikštas skirtingais atsako kintamaisiais, pagrįstais vienu arba daugiau matuojamųjų kintamųjų.
Bandymo terpė: visiškai paruošta sintetinė kultūros terpė, kurioje auga bandomosios medžiagos veikiami bandymo augalai. Bandomoji medžiaga paprastai tirpinama bandymo terpėje.
Išeiga: matuojamo kintamojo vertė biomasės skirtumui veikimo laikotarpio pabaigoje ir pradžioje išreikšti.
1.3. BANDYMO ESMĖ
Pagal eksponentės dėsnį augančios Lemna genties augalų kultūros septynių parų laikotarpiu auginamos kaip monokultūra esant skirtingoms bandomosios medžiagos tirpalo koncentracijos vertėms. Bandymo tikslas – su medžiaga susijusių poveikių vegetatyviniam augimui šiuo laikotarpiu kiekybinis įvertinimas, pagrįstas pasirinktų matuojamų kintamųjų įvertinimu. Gniužulų skaičius yra pagrindinis matuojamas kintamasis. Be to, nustatomas dar bent vienas kitas matuojamas kintamasis (suminis gniužulų plotas, sausos medžiagos masė arba šviežios medžiagos masė), kadangi kitus matuojamus kintamuosius kai kurios medžiagos gali veikti labiau nei gniužulų skaičių. Norint kiekybiškai įvertinti su medžiaga susijusius poveikius, augimas bandymo tirpaluose yra lyginamas su augimu kontroliniuose ėminiuose ir nustatoma apibrėžtą augimo greičio mažėjimą x % (pvz., 50 %) sukelianti koncentracija, kuri išreiškiama ECx (pvz., EC50).
Bandymo rezultatas yra augimo inhibavimas, išreiškiamas kaip logaritminis matuojamo kintamojo padidėjimas (vidutinis savitasis augimo greitis) veikimo laikotarpiu. Pagal bandymo tirpalų serijoje gautus vidutinius savituosius augimo greičius nustatoma apibrėžtą augimo greičio mažėjimą x % (pvz., 50 %) sukelianti koncentracija, kuri išreiškiama ErCx (pvz., ErC50).
Šiame metode taikomas papildomas atsako kintamasis – išeiga, kuris gali būti reikalingas kai kurių valstybių nustatytiems specifiniams norminiams reikalavimams įvykdyti. Jis yra apibrėžiamas kaip biomasės veikimo laikotarpio pabaigoje ir pradžioje skirtumas. Pagal bandymo tirpalų serijoje gautą išeigą apskaičiuojama apibrėžtą išeigos mažėjimą x % (pvz., 50 %) sukelianti koncentracija, kuri išreiškiama EyCx (pvz., EyC50).
Be to, galima statistiškai nustatyti mažiausią stebimo poveikio koncentraciją (LOEC) ir nestebimo poveikio koncentraciją (NOEC).
1.4. INFORMACIJA APIE BANDOMĄJĄ MEDŽIAGĄ
Turėtų būti atitinkamo jautrio analizės metodas medžiagos kiekiui bandymo terpėje kiekybiškai nustatyti.
Informaciją apie bandomąją medžiagą, kuri gali būti naudinga bandymo sąlygoms nustatyti, sudaro struktūrinė formulė, grynumas, tirpumas vandenyje, patvarumas veikiant vandeniui ir šviesai, pKa, Kow, garų slėgis ir biologinis skaidumas. Tirpumas vandenyje ir garų slėgis gali būti naudojamas Henrio dėsnio konstantai apskaičiuoti, kuri rodytų, ar atliekant bandymą yra tikimybė prarasti didelį bandomosios medžiagos kiekį. Tai padėtų nustatyti, ar reikėtų imtis konkrečių priemonių tokiems nuostoliams kontroliuoti. Jei duomenys apie bandomosios medžiagos tirpumą ir patvarumą yra abejotini, šias savybes rekomenduojama įvertinti bandymo sąlygomis, t. y. bandymui naudotos auginimo terpės, temperatūros, apšvietimo režimo sąlygomis.
Jei yra ypač svarbu kontroliuoti bandymo terpės pH vertę, pvz., kai bandomi metalai arba vandenyje nepatvarios medžiagos, į auginimo terpę rekomenduojama įpilti buferinio tirpalo (žr. 1.7.4 skirsnio pirmąją pastraipą). Papildomi nurodymai, kaip bandyti medžiagas, kurių fizikinės cheminės savybės apsunkina jų bandymus, yra pateikti (11) nuorodoje.
1.5. ETALONINĖ MEDŽIAGA
Kaip priemonė bandymo procedūrai patikrinti gali būti bandoma (-os) etaloninė (-ės) medžiaga (-os), pvz., 3,5-dichlorfenolis, naudotas tarptautiniame tarplaboratoriniame bandyme (10). Patartina etaloninę medžiagą bandyti bent du kartus per metus arba lygiagrečiai bandomosios medžiagos toksiškumo nustatymui, jei bandymai atliekami rečiau.
1.6. BANDYMO TINKAMUMAS
Kad bandymas būtų tinkamas, gniužulų skaičiaus kontroliniuose ėminiuose dvigubėjimo trukmė turi būti trumpesnė kaip 2,5 paros (60 h), atitinkanti padidėjimą maždaug septynis kartus per septynias paras ir vidutinį savitąjį augimo greitį 0,275 d–1. Šiame bandymo metode aprašytomis terpių ir bandymo sąlygomis šį kriterijų galima pasiekti atliekant stacionarųjį bandymą (8). Be to, tikimasi, kad šį kriterijų bus galima pasiekti pusiau stacionariojo ir pratekamojo srauto bandymo sąlygomis. Dvigubėjimo trukmės apskaičiavimas pateiktas 2.1 skirsnyje.
1.7. METODO APRAŠYMAS
1.7.1. Aparatūra
Visa įranga, kuri liečiasi su bandymo terpe, turėtų būti pagaminta vien tik iš stiklo arba kitos chemiškai inertinės medžiagos. Stikliniai indai, skirti kultūroms auginti ir bandymams atlikti, turėtų būti išvalyti nuo cheminių medžiagų priemaišų, kurios galėtų būti išplautos į bandymo terpę, ir jie turėtų būti sterilūs. Bandymo indai turėtų būti pakankamai platūs, kad skirtingų kolonijų gniužulai kontrolinių ėminių induose galėtų augti nesant sanklotos bandymo pabaigoje. Neturi reikšmės, jei šaknys liečia bandymo indų dugną, bet patartina naudoti ne mažesnio kaip 20 mm gylio ir 100 ml tūrio indus. Nesvarbu kokio tipo bandymo indai pasirenkami, jei jie atitinka šiuos reikalavimus. Tinka atitinkamų matmenų cheminės stiklinės, kristalizatoriai arba stiklinės Petri lėkštelės. Bandymo indai turi būti uždengti garavimui ir atsitiktiniam užteršimui sumažinti, bet tuo pat metu turi užtikrinti būtinus oro mainus. Tinkami bandymo indai ir ypač dangčiai neturi mesti šešėlių arba pakeisti šviesos spektrines charakteristikas.
Kultūros ir bandymo indai neturėtų būti laikomi kartu. Geriausia tai būtų pasiekti naudojant atskiras klimatines auginimo kameras, inkubatorius arba patalpas. Turi būti įmanoma kontroliuoti ir užtikrinti pastovaus lygio apšvietimą ir temperatūrą (žr. 1.7.8 skirsnį).
1.7.2. Bandymo organizmas
Šiam bandymui naudojamas organizmas yra Lemna gibba arba Lemna minor. Toksiškumo bandymui naudojamų plūdenų rūšių trumpas aprašymas pateiktas 1 priedėlyje. Augalinė medžiaga gali būti gauta iš kultūros rinkinio, kitos laboratorijos arba iš lauko. Jei kultūra renkama lauke, kultūrai auginami augalai bent aštuonias savaites prieš bandymą turėtų būti laikomi toje pačioje terpėje, kuri naudojama bandymams. Pradinėms kultūroms rinkti naudojamose lauko vietose neturi būti akivaizdžių užkrėtimo šaltinių. Jei kultūros gaunamos iš kitos laboratorijos arba iš kultūros rinkinio, jos turėtų būti panašiai laikomos bent tris savaites. Ataskaitoje turėtų būti visuomet nurodytas bandymui naudojamos augalinės medžiagos šaltinis, rūšis ir klonas (jei žinomas).
Turėtų būti naudojamos monokultūros, kurios neturėtų aiškiai matomų užkrėtimo kitais organizmais, pvz., dumbliais ir pirmuonimis, požymių. Sveikus L. minor augalus sudaro kolonijos, turinčios nuo dviejų iki penkių gniužulų, tuo tarpu sveikas L. gibba kolonijas gali sudaryti iki septynių gniužulų.
Bandymui naudojamų augalų kokybė ir vienodumas darys didelę įtaką bandymo rezultatui, todėl jie turėtų būti kruopščiai atrenkami. Turėtų būti naudojami jauni, greitai augantys augalai, neturintys matomų pažeidimų arba spalvos pokyčio (chlorozės). Geros kokybės kultūros požymis – didelis skaičius kolonijų, kurias sudarytų bent du gniužulai. Didelis vieno gniužulo kolonijų skaičius rodo aplinkos sukeltą stresą, pvz., dėl riboto mitybinių medžiagų kiekio, ir tokių kultūrų augalinė medžiaga bandymams neturėtų būti naudojama.
1.7.3. Auginimas
Norint sumažinti kultūros priežiūros dažnumą (pvz., kai tam tikrą laikotarpį nesiruošiama atlikti bandymų su Lemna), kultūras galima laikyti sumažinto apšvietimo ir temperatūros (4–10 °C) sąlygomis. Kultūros auginimo detalės pateiktos 2 priedėlyje. Esant akivaizdiems užkrėtimo dumbliais arba kitais organizmais požymiams, turėtų būti atliekamas Lemna gniužulų dalinių ėminių paviršinis sterilizavimas, juos vėliau pernešant į naujai paruoštą terpę (žr. 2 priedėlį). Jei taip atsitinka, likusi užkrėsta kultūra turėtų būti pašalinta.
Bent septynios paros prieš bandymą pakankamas skaičius kolonijų steriliu būdu pernešamas į naują sterilią terpę, kurioje kultūra 7–10 parų auginama bandymo sąlygomis.
1.7.4. Bandymo terpė
Lemna minor ir Lemna gibba rekomenduojamos skirtingos terpės, kaip aprašyta toliau. Reikėtų labai kruopščiai išnagrinėti pH reguliuoti skirto buferinio tirpalo (MOPS (4-morfolinpropansulfonrūgšties, CAS Nr. 1132–61–2; EINECS Nr. 214–478–5) L. minor terpėje ir NaHCO3 L. gibba terpėje) naudojimą bandymo terpėje, jei kyla įtarimų, kad jis gali reaguoti su bandomąja medžiaga ir gali veikti jos toksiškumo pasireiškimą. Be to, priimtina Steinbergo terpė (12), jei ji atitinka bandymo tinkamumo kriterijus.
L. minor auginti ir bandyti rekomenduojama modifikuota Švedijos standarto (SIS) Lemna auginimo terpė. Šios terpės sudėtis pateikta 3 priedėlyje.
L. gibba auginti ir bandyti rekomenduojama auginimo terpė 20X – AAP, aprašyta 3 priedėlyje.
Be to, L. minor tinka Steinbergo terpė, aprašyta 3 priedėlyje, bet ji gali būti naudojama ir L. gibba auginti, jei atitinka bandymo tinkamumo kriterijus.
1.7.5. Bandymo tirpalai
Bandymo tirpalai paprastai ruošiami skiedžiant pradinį tirpalą. Bandomosios medžiagos pradiniai tirpalai dažniausiai ruošiami tirpinant medžiagą auginimo terpėje.
Didžiausia bandyta bandomosios medžiagos koncentracija paprastai neturėtų būti didesnė nei medžiagos tirpumą bandymo sąlygomis atitinkanti koncentracija. Tačiau reikėtų pažymėti, kad Lemna spp. plaukia paviršiumi ir gali būti veikiama medžiagų, kurios kaupiasi vandens ir oro sąlyčio paviršiuje (pvz., mažai vandenyje tirpių, hidrofobinių arba paviršinio aktyvumo medžiagų). Tokiomis aplinkybėmis veikia kitos nei tirpale esančios medžiagos ir bandymo koncentracijos vertės, atsižvelgiant į bandomosios medžiagos charakteristikas, gali būti didesnės nei tirpumo vandenyje vertė. Jei bandomosios medžiagos mažai tirpsta vandenyje, koncentruotą pradinį tirpalą arba medžiagos dispersiją gali tekti ruošti naudojant organinį tirpiklį arba dispergentą, kad būtų lengviau įdėti tikslius bandomosios medžiagos kiekius į bandymo terpę ir palengvinti jos dispergavimą ir tirpinimą. Reikia kiek įmanoma vengti naudoti tokias medžiagas. Neturi būti fitotoksiškumo dėl tokių pagalbinių tirpiklių arba dispergentų naudojimo. Pvz., įprastų tirpiklių, kurie nesukelia fitotoksiškumo, kai jų koncentracija ne didesnė nei 100 μl·l–1, sąraše yra acetonas ir dimetilformamidas. Jei naudojamas tirpiklis arba dispergentas, jo galutinė koncentracija turėtų būti nurodyta ataskaitoje ir būti kiek įmanoma mažesnė (≤ 100 μl·l–1), be to, visuose apdorotuose ir kontroliniuose ėminiuose turėtų būti vienoda tirpiklio arba dispergento koncentracija. Papildomi nurodymai dėl dispergentų naudojimo pateikti (11).
1.7.6. Bandymo ir kontrolinių ėminių grupės
Išankstiniai bandomosios medžiagos toksiškumo Lemna duomenys, pvz., intervalo nustatymo bandymo, padėtų pasirinkti tinkamas bandymo koncentracijos vertes. Atliekant galutinį toksiškumo nustatymo bandymą, turėtų būti pasirinktos bent penkios koncentracijos vertės, išdėstytos pagal geometrinę progresiją. Pageidautina, kad gretimų bandymo koncentracijos verčių santykis būtų ne didesnis kaip 3,2, bet ši vertė gali būti didesnė, jei koncentracijos ir atsako santykio kreivė yra gulsčia. Reikėtų pagrįsti mažesnio nei penkių koncentracijos verčių skaičiaus naudojimą. Kiekvienai koncentracijai turėtų būti naudojami bent trys kartotiniai ėminiai.
Nustatant bandymo koncentracijos verčių intervalą (intervalo nustatymo ir (arba) galutinio toksiškumo bandymo), reikėtų atsižvelgti į šias aplinkybes:
|
— |
Norint nustatyti ECx vertę, ji turėtų būti tarp bandymo koncentracijos verčių reikiamam pasikliautinumo lygmeniui užtikrinti. Pvz., jei įvertinama EC50, didžiausia bandymo koncentracija turėtų būti didesnė nei EC50 vertė. Jei EC50 vertė yra už bandymo koncentracijos verčių intervalo ribų, atitinkami pasikliautinieji intervalai bus dideli ir gali būti neįmanomas tinkamas statistinio modelio atitikimo įvertinimas. |
|
— |
Jei reikia įvertinti LOEC/NOEC, mažiausia bandymo koncentracija turėtų būti pakankamai maža, kad augimas nebūtų gerokai mažesnis nei kontroliniuose ėminiuose. Be to, didžiausia bandymo koncentracija turėtų būti gana didelė, augimas būtų gerokai mažesnis nei kontroliniuose ėminiuose. Jei taip nėra, bandymą reikės pakartoti taikant kitą koncentracijos verčių intervalą (išskyrus kai didžiausia koncentracija atitinka ribinę tirpumo vandenyje koncentraciją arba didžiausią reikiamą ribinę koncentraciją, pvz., 100 mg·l–1). |
Atliekant kiekvieną bandymą turėtų būti kontroliniai ėminiai, kuriuos sudarytų ta pati kaip ir bandymo induose mitybinė terpė, tas pats gniužulų ir kolonijų skaičius, tos pačios aplinkos sąlygos ir procedūros, tik nebūtų bandomosios medžiagos. Jei naudojamas pagalbinis tirpiklis arba dispergentas, turėtų būti įtrauktas papildomas kontrolinis ėminys, turintis tirpiklio (dispergento), kurio koncentracija atitiktų naudojamą induose su bandomąja medžiaga. Būtų gerai, jei kartotinių kontrolinių ėminių indų skaičius (ir tirpiklio indų, jei naudojamas) būtų bent du kartus didesnis nei kiekvienai bandymo koncentracijai naudojamų indų skaičius.
Jei nereikia nustatyti NOEC, bandymo schema gali būti pakeista padidinant koncentracijos verčių skaičių ir sumažinant kiekvienos bandymo koncentracijos kartotinių ėminių skaičių. Tačiau kartotinių kontrolinių ėminių skaičius turi būti ne mažesnis kaip trys.
1.7.7. Veikimas
Kolonijos, sudarytos iš 2–4 matomų gniužulų paimamos iš sėjimo kultūros indo ir steriliomis sąlygomis atsitiktinai paskirstomos tarp bandymo indų. Kiekviename inde turėtų būti iš viso 9–12 gniužulų. Kiekviename bandymo inde turėtų būti vienodas gniužulų ir kolonijų skaičius. Patyrimas, sukauptas taikant šį metodą, ir tarplaboratorinio tyrimo duomenys parodė, kad naudojant tris kartotinius vienos koncentracijos ėminius, kurių kiekviename iš pradžių būtų 9–12 gniužulų, pakanka aptikti skirtumus tarp apdorotų ėminių augimo, esant 4–7 % inhibavimui, apskaičiuotam pagal augimo greitį (10–15 %, apskaičiuotam pagal išeigą) (10).
Reikia taikyti atsitiktinio bandymo indų išdėstymo inkubatoriuje schemą, siekiant kiek įmanoma sumažinti padėties erdvėje, šviesos intensyvumo arba temperatūros skirtumų įtaką. Be to, atliekant stebėjimus reikia taikyti blokinę schemą arba atsitiktinį indų padėties keitimą (arba dažniau keisti padėtį).
Jei išankstinis patvarumo bandymas rodo, kad neįmanoma užtikrinti bandomosios medžiagos koncentracijos (t. y. išmatuotoji koncentracija sumažėja iki mažiau kaip 80 % išmatuotos pradinės koncentracijos) visą bandymo trukmę (7 paras), rekomenduojamas pusiau stacionarusis bandymo režimas. Šiuo atveju kolonijoms veikti naudojami bandymo ir kontrolinių ėminių tirpalai turėtų būti keičiami naujais bent du kartus per bandymą (pvz., 3 ir 5 parą). Dažnis, kuriuo terpė keičiama į naują, priklausys nuo bandomosios medžiagos patvarumo; dažniau gali tekti keisti labai nepatvarių arba lakių medžiagų tirpalus, siekiant užtikrinti beveik pastovias koncentracijos vertes. Kai kuriomis aplinkybėmis gali tekti taikyti pratekamojo srauto procedūrą (11)(13).
Veikimo per lapus (purškiant) scenarijus pagal šį bandymo metodą netaikomas, vietoj to žr. (14).
1.7.8. Inkubavimo sąlygos
Siekiant užtikrinti šviesos intensyvumą, pasirenkamą 85–135 μE·m–2·s–1 (atitinka 6 500–10 000 liuksų) intervale, kai optimalų fotosintezės diapazoną atitinkanti spinduliuotė (400–700 nm) matuojama tokiu pat atstumu nuo šviesos šaltinio, kaip ir Lemna gniužulai, turėtų būti naudojama nuolatinė šiltai arba šaltai balta liuminescencinių lempų šviesa. Šviesos intensyvumas virš bandymo vietos neturi kisti daugiau kaip ± 15 % pasirinkto šviesos intensyvumo. Išmatuotą vertę veiks šviesos aptikimo ir matavimo metodas, ypač jutiklio tipas. Sferiniai jutikliai (kurie reaguoja į šviesą, krintančią visais kampais virš ir žemiau matavimo plokštumos) ir „kosinusiniai“ jutikliai (kurie reaguoja į šviesą, krintančią visais kampais virš matavimo plokštumos) yra geresni nei vienos krypties jutikliai, ir šiame bandyme aprašytam daugiataškio šviesos šaltinio tipui bus gaunami didesni rodmenys.
Temperatūra bandymo induose turėtų būti 24 ± 2 °C. Bandymo metu kontrolinių ėminių terpės pH neturėtų padidėti daugiau kaip 1,5 vieneto. Tačiau didesnis nei 1,5 vieneto nuokrypis nepaneigtų bandymo tinkamumo, jei būtų galima įrodyti, kai tinkamumo kriterijai yra vykdomi. Reikia imtis papildomų atsargumo priemonių dėl pH kitimo specialiais atvejais, pvz., bandant nepatvarias medžiagas arba metalus. Papildomi nurodymai pateikti (11).
1.7.9. Trukmė
Bandymas baigiamas praėjus 7 paroms nuo augalų pernešimo į bandymo indus.
1.7.10. Matavimai ir analiziniai nustatymai
Bandymo pradžioje suskaičiuojamas ir užrašomas gniužulų skaičius bandymo induose, imantis priemonių užtikrinti, kad būtų įskaityti atsikišę, aiškiai matomi gniužulai. Gniužulų skaičius, ar jis būtų normalus arba nenormalus, turi būti nustatytas bandymo pradžioje, bent kartą kas 3 paras veikimo laikotarpiu (t. y. bent 2 kartus 7 parų laikotarpiu) ir bandymo pabaigoje. Turėtų būti pažymėti augalų vystymosi pokyčiai, pvz., gniužulų dydžio, išvaizdos, nekrozės požymiai, chlorozė arba gumbuotumas, kolonijų smulkėjimas arba plūdrumo netekimas, šaknų ilgis ir išvaizda. Be to, reikėtų pažymėti reikšmingas bandymo terpės savybes (pvz., neištirpusios medžiagos buvimą, dumblių augimą bandymo inde).
Be gniužulų skaičiaus nustatymo bandymo eigoje, dar įvertinamas bandomosios medžiagos poveikis vienam (arba daugiau) iš šių matuojamų kintamųjų:
|
(i) |
suminiam gniužulų plotui; |
|
(ii) |
sausos medžiagos masei; |
|
(iii) |
šviežios medžiagos masei. |
Suminio gniužulų ploto pranašumas – jį galima nustatyti kiekviename bandymo ir kontrolinio ėminio inde bandymo pradžioje, jo eigoje ir pabaigoje. Sausos arba šviežios medžiagos masė turėtų būti nustatyta bandymo pradžioje, imant sėjimo kultūros ėminį, atitinkantį bandymo pradžioje naudojamą kultūrą, ir bandymo pabaigoje, imant augalinę medžiagą iš kiekvieno bandymo ir kontrolinio ėminio indo. Jei gniužulų plotas nematuojamas, geriau matuoti sausos medžiagos masę, bet ne šviežios medžiagos masę.
Suminis gniužulų plotas, sausos medžiagos masė ir šviežios medžiagos masė gali būti nustatyta taip:
|
i) |
Suminis gniužulų plotas: Visų kolonijų suminis gniužulų plotas gali būti nustatytas atliekant vaizdų analizę. Bandymo indo ir augalų siluetas gali būti fiksuojamas vaizdo kamera (t. y. pastačius indą ant šviesos dėžės) ir gautas vaizdas apdorojamas skaitmeniniu būdu. Vėliau kalibruojant pagal plokščius žinomo ploto vaizdus, gali būti nustatytas suminis gniužulų plotas. Reikėtų imtis priemonių indo krašto sukeltiems trukdžiams pašalinti. Taikant kitą daugiau darbo reikalaujantį metodą, daroma bandymo indų ir augalų fotokopija, išpjaunamas gautas kolonijų siluetas ir jų plotas nustatomas lapų ploto analizatoriumi arba naudojant milimetrinį popierių. Be to, gali tikti kiti metodai (pvz., kolonijų silueto ploto ir vienetinio ploto popieriaus masės santykis). |
|
(ii) |
Sausos medžiagos masė: Visų bandymo indų visos kolonijos surenkamos ir plaunamos distiliuotu arba dejonizuotu vandeniu. Sausinamos sugeriamuoju popieriumi vandens pertekliui pašalinti ir džiovinamos 60 °C temperatūroje iki pastovios masės. Turėtų būti įskaityti visi šaknų likučiai. Sausos medžiagos masė turėtų būti išreikšta bent 0,1 mg tikslumu. |
|
(iii) |
Šviežios medžiagos masė: Visos kolonijos surenkamos į iš anksto pasvertus polistireno (arba kitos inertinės medžiagos) mėgintuvėlius su mažomis (1 mm) skylutėmis užapvalintuose dugnuose. Mėgintuvėliai 10 min centrifuguojami 3 000 min–1 apsisukimų dažniu, esant kambario temperatūrai. Mėgintuvėliai su sausomis kolonijomis sveriami iš naujo ir šviežios medžiagos masė apskaičiuojama atimant tuščio mėgintuvėlio masę. |
1.7.10.1. Matavimų ir analizinių nustatymų dažnis
Jei taikoma stacionariojo bandymo schema, kiekvieno apdoroto ėminio pH vertė turėtų būti matuojama bandymo pradžioje ir pabaigoje. Jei taikoma pusiau stacionariojo bandymo schema, turėtų būti matuojama kiekvienos naujos bandymo tirpalo dalies pH vertė prieš kiekvieną atnaujinimą ir dar atitinkamo panaudoto tirpalo pH vertė.
Šviesos intensyvumas turėtų būti matuojamas tose auginimo kameros, inkubatoriaus arba patalpos vietose, kurios nuo šviesos šaltinio nutolusios tokiu pat atstumu kaip ir Lemna gniužulai. Matuojama bent vieną kartą bandymo laikotarpiu. Terpės temperatūra pakaitiniame inde, kuris laikomas tokioms pačiomis auginimo kameros, inkubatoriaus arba patalpos sąlygomis, turėtų būti užrašoma bent kartą per dieną.
Bandomosios medžiagos koncentracijos vertės yra nustatomos bandymo eigoje atitinkamais laiko tarpais. Mažiausias reikalavimas atliekant stacionariuosius bandymus yra koncentracijos matavimas bandymo pradžioje ir pabaigoje.
Atliekant pusiau stacionariuosius bandymus, kai nelaukiama, kad bandomosios medžiagos koncentracija nesikeis daugiau kaip ± 20 % palyginti su vardine koncentracija, būtina analizuoti visus naujai paruoštus bandymo tirpalus ir pačius atnaujintus tirpalus kiekvieno atnaujinimo momentu (žr. 1.7.7 skirsnio trečiąją pastraipą). Tačiau atliekant tuos bandymus, kurių išmatuota pradinė bandomosios medžiagos koncentracija neatitinka vardinės ± 20 % tikslumu, bet apie kuriuos galima pateikti pakankamai įrodančių duomenų, kad pradinės koncentracijos vertės yra atkartojamos ir pastovios (t. y. atitinka 80–120 % pradinės koncentracijos intervalą), galima atlikti tik didžiausios ir mažiausios bandymo koncentracijos tirpalų cheminę analizę. Visais atvejais bandomosios medžiagos koncentraciją reikia nustatyti tik viename kiekvienos bandymo koncentracijos kartotinio ėminio inde (arba analizuoti sujungtų kartotinių ėminių turinį).
Jei atliekamas pratekamojo srauto bandymas, tinka ėminių ėmimo režimas, taikomas aprašytiems pusiau stacionariesiems bandymams, įskaitant analizę bandymo pradžioje, pusiaukelėje ir bandymo pabaigoje, bet šiuo atveju nereikia matuoti panaudotų tirpalų koncentracijos. Atliekant šio tipo bandymus, skiediklio ir bandomosios medžiagos tirpalo arba bandomosios medžiagos pradinio tirpalo srautas turėtų būti tikrinamas kasdien.
Jei yra duomenų, kad visą bandymą bandomosios medžiagos koncentracijos kitimas buvo patenkinamas ir ne didesnis kaip ± 20 % vardinės arba išmatuotos pradinės koncentracijos vertės, rezultatų analizę galima atlikti pagal vardinę arba išmatuotą pradinę vertę. Jei nuokrypis nuo vardinės arba išmatuotos pradinės koncentracijos yra didesnis kaip ± 20 %, rezultatų analizė turėtų būti atliekama pagal veikimo laikotarpio geometrinio vidurkio koncentraciją arba taikant modelius, aprašančius bandomosios medžiagos koncentracijos mažėjimą (11).
1.7.11. Ribinis bandymas
Kai kuriomis aplinkybėmis, pvz., kai pradinis bandymas rodo, kad bandomosios medžiagos toksinis poveikis nepasireiškia esant mažesnei kai 100 mg·l–1 arba tirpumą bandymo terpėje atitinkančiai koncentracijai (kuri būtų mažesnė), galima atlikti ribinį bandymą, kuriame būtų lyginami kontrolinės grupės ir vienos apdorotų ėminių grupės (100 mg·l–1 arba tirpumo vertei lygi koncentracija) atsakai. Labai rekomenduojama, kad jis būtų patvirtintas atliekant veikimo koncentracijos analizę. Labai rekomenduojama, kad jis būtų patvirtintas analizuojant veikiančios medžiagos koncentraciją. Ribiniam bandymui taikomos visos anksčiau aprašytos bandymo sąlygos ir tinkamumo kriterijai, išskyrus tai, kad kartotinių apdorotų ėminių turėtų būti du kartus daugiau. Vidurkiams palyginti augimas kontrolinių ir apdorotų ėminių grupėse gali būti analizuojamas taikant statistinį kriterijų, pvz., Stjudento t kriterijų.
2. DUOMENYS IR ATASKAITOS RENGIMAS
2.1. DVIGUBĖJIMO TRUKMĖ
Norint nustatyti gniužulų skaičiaus dvigubėjimo trukmę (Td) ir tyrimo atitiktį šiam tinkamumo kriterijui (1.6 skirsnis), gautiems kontrolinių ėminių duomenims taikoma ši formulė:
Td = ln 2/μ
kurioje μ yra vidutinis savitasis augimo greitis, nustatytas kaip aprašyta 2.2.1 skirsnio pirmojoje ir antrojoje pastraipoje.
2.2. ATSAKO KINTAMIEJI
Bandymo tikslas – nustatyti bandomosios medžiagos poveikį Lemna vegetatyviniam augimui. Šiame bandymo metode aprašyti du atsako kintamieji, nes valstybės narės juos skirtingai vertina ir skiriasi norminiai reikalavimai. Siekiant užtikrinti rezultatų priimtinumą visose valstybėse narėse, poveikis turėtų būti įvertintas taikant abu toliau aprašytus atsako kintamuosius a ir b.
|
a) |
Vidutinis savitasis augimo greitis: šis atsako kintamasis yra apskaičiuojamas pagal kontrolinių ėminių ir kiekvienos apdorotų ėminių grupės gniužulų skaičiaus logaritmo ir papildomai kitų matuojamų parametrų (suminio gniužulų ploto, sausos medžiagos masės arba šviežios medžiagos masės) logaritmo pokytį per laiką (išreiškiamą para). Jis kartais vadinamas santykiniu augimo greičiu (15). |
|
b) |
Išeiga: šis atsako kintamasis yra apskaičiuojamas pagal kontrolinių ėminių ir kiekvienos apdorotų ėminių grupės gniužulų skaičiaus ir papildomai kitų matuojamų parametrų (suminio gniužulų ploto, sausos arba šviežios medžiagos masės) pokytį bandymo laikotarpiu. |
Reikėtų pažymėti, kad nėra lygintinos toksiškumo vertės, apskaičiuotos taikant šiuos du kintamuosius, ir šis skirtumas turi būti suvoktas naudojant bandymo rezultatus. Dėl atitinkamų metodų matematinio pagrindo, savitojo augimo greičio vidurkiu pagrįstos ECx vertės (ErCx), paprastai bus didesnės nei išeiga pagrįsti rezultatai (EyCx), jei laikomasi šio bandymo metodo sąlygų. Tai neturėtų būti interpretuojama kaip dviejų atsako kintamųjų jautrio skirtumas, tiesiog vertės skiriasi matematiškai. Vidutinio savitojo augimo greičio sąvoka pagrįsta bendrąja plūdenų eksponentinio augimo neribojamose kultūrose schema, kurią taikant toksiškumas įvertinamas pagal poveikį augimo greičiui, kuris nepriklauso nuo kontroliniams ėminiams gauto absoliutaus savitojo augimo greičio lygio, koncentracijos ir atsako kreivės krypties koeficiento arba nuo bandymo trukmės. Priešingai, rezultatai, pagrįsti išeiga kaip atsako kintamuoju, priklauso nuo visų šių kitų kintamųjų. EyCx priklauso nuo kiekviename bandyme naudojamų plūdenų rūšių savitojo augimo greičio ir nuo didžiausio savitojo augimo greičio, kuris gali būti skirtingas plūdenų rūšims ir netgi klonams. Šis atsako kintamasis neturėtų būti taikomas lyginant plūdenų rūšių arba net skirtingų klonų jautrį toksinėms medžiagoms. Nors toksiškumui įvertinti moksliniu požiūriu būtų geriau taikyti vidutinį savitąjį augimo greitį, išeiga pagrįsti toksiškumo įverčiai irgi yra įtraukti į šį bandymo metodą, siekiant atitikti kai kurių šalių galiojančių norminių teisės aktų reikalavimus.
Toksiškumo įverčiai turėtų būti pagrįsti gniužulų skaičiumi ir vienu papildomu matuojamu kintamuoju (suminiu gniužulų plotu, sausos medžiagos mase arba šviežios medžiagos mase), nes kai kurios medžiagos gali veikti kitą matuojamą kintamąjį gerokai stipriau nei gniužulų skaičių. Šis poveikis nebūtų nustatytas apskaičiuojant vien tik gniužulų skaičių.
Gniužulų skaičius ir visi kiti užrašyti matuojami kintamieji, t. y. suminis gniužulų plotas, sausos medžiagos masė arba šviežios medžiagos masė, surašomi į lenteles kartu su kiekvieną matavimą atitinkančiomis bandomosios medžiagos koncentracijos vertėmis. Vėlesnė duomenų analizė, pvz., LOEC, NOEC arba ECx įvertinti, turėtų būti pagrįsta atskirų kartotinių ėminių vertėmis, bet ne apskaičiuota kiekvienos apdorotų ėminių grupės vidurkiu.
2.2.1. Vidutinis savitasis augimo greitis
Vidutinis savitasis augimo greitis tam tikru laikotarpiu apskaičiuojamas kiekvienam kontroliniam ir apdorotam kartotiniam ėminiui kaip augimo kintamųjų: gniužulų skaičiaus ir vieno kito matuojamo kintamojo (suminio gniužulų ploto, sausos arba šviežios medžiagos masės), logaritminis padidėjimas, taikant šią formulę:

čia:
|
— |
μi–j: |
vidutinis savitasis augimo greitis per laiką i – j |
|
— |
Ni: |
bandymo arba kontrolinio indo matuojamas kintamasis laiku i |
|
— |
Nj: |
bandymo arba kontrolinio indo matuojamas kintamasis laiku j |
|
— |
t: |
laikotarpis nuo i iki j |
Kiekvienai apdorotų ir kontrolinių ėminių grupei apskaičiuojama augimo greičio vidutinė vertė ir dispersijos įverčiai.
Turėtų būti apskaičiuotas viso bandymo laikotarpio (pirmiau pateiktoje formulėje i yra bandymo pradžios laikas, j – bandymo pabaigos laikas) vidutinis savitasis augimo greitis. Kiekvienai bandymo koncentracijai ir kontroliniam ėminiui apskaičiuojama vidutinio savitojo augimo greičio vidutinė vertė ir dispersijos įverčiai. Be to, turėtų būti įvertintas augimo greitis atskirais laikotarpiais, kad būtų galima įvertinti bandomosios medžiagos poveikius veikimo laikotarpiu (pvz., nagrinėjant logaritmines augimo kreives). Dideli atskiriems laikotarpiams gautų augimo greičių ir vidutinio augimo greičio skirtumai rodo, kad yra nuokrypis nuo pastovaus eksponentinio augimo ir kad reikia atlikti nuodugnų augimo kreivių tyrimą. Šiuo atveju apskaičiavimas su atsarga būtų apdorotų kultūrų savitojo augimo greičio didžiausiu inhibavimo laikotarpiu ir kontrolinių ėminių augimo greičio tuo pačiu laikotarpiu lyginimas.
Kiekvieno apdoroto kartotinio ėminio augimo greičio mažėjimas procentais (Ir) gali būti apskaičiuotas kiekvienai koncentracijai (apdorotų ėminių grupei) pagal šią lygtį:
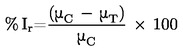
čia:
|
— |
% Ir: |
vidutinio savitojo augimo greičio mažėjimas procentais; |
|
— |
μC: |
kontrolinių ėminių µ vidutinė vertė; |
|
— |
μT: |
apdorotų ėminių grupės µ vidutinė vertė. |
2.2.2. Išeiga
Poveikis išeigai nustatomas kiekvienam bandymo indui pagal du bandymo pradžioje ir pabaigoje matuojamus kintamuosius: gniužulų skaičių ir vieną kitą matuojamą kintamąjį (suminį gniužulų plotą, sausos medžiagos masę arba šviežios medžiagos masę). Sausos arba šviežios medžiagos pradinė biomasė nustatoma pagal gniužulų ėminį, imamą iš tos pačios kultūros, kuri sėjama į bandymo indus (žr. 1.7.3 skirsnio antrąją pastraipą). Kiekvienai bandymo koncentracijai ir kontroliniam ėminiui apskaičiuojama išeigos vidutinė vertė ir dispersijos įverčiai. Kiekvienos apdorotų ėminių grupės vidutinį išeigos mažėjimą procentais (% Iy) galima apskaičiuoti taip:

čia:
|
— |
% Iy: |
išeigos mažėjimas procentais |
|
— |
bC: |
kontrolinių ėminių grupės galutinės ir pradinės masių skirtumas |
|
— |
bT: |
apdorotų ėminių grupės galutinės ir pradinės masių skirtumas |
2.2.3. Koncentracijos ir atsako santykio kreivių brėžimas
Turėtų būti braižomos koncentracijos ir atsako santykio kreivės, kurios susieja atsako kintamojo (Ir arba Iy, apskaičiuoto kaip parodyta 2.2.1 skirsnio paskutinėje pastraipoje arba 2.2.2 skirsnyje) vidutinį mažėjimo laipsnį procentais ir bandomosios medžiagos koncentracijos logaritmą.
2.2.4. ECx įvertinimas
ECx įverčiai (pvz., EC50) turėtų būti pagrįsti vidutiniu savituoju augimo greičiu (ErCx) ir išeiga (EyCx), kurių kiekvienas savo ruožtu turėtų būti pagrįstas gniužulų skaičiumi ir vienu papildomu matuojamu kintamuoju (suminiu gniužulų plotu, sausos medžiagos mase arba šviežios medžiagos mase). Tai daroma dėl tos priežasties, kad yra bandomųjų medžiagų, kurios skirtingai veikia gniužulų skaičių ir kitus matuojamus kintamuosius. Taigi reikiami toksiškumo parametrai yra kiekvienam inhibavimo laipsniui x apskaičiuotos keturios ECx vertės: ErCx (gniužulų skaičius); ErCx (suminis gniužulų plotas, sausos medžiagos masė arba šviežios medžiagos masė); EyCx (gniužulų skaičius) ir EyCx (suminis gniužulų plotas, sausos medžiagos masė arba šviežios medžiagos masė).
2.3. STATISTINĖS PROCEDŪROS
Tikslas – gauti kiekybinį koncentracijos ir atsako santykį, taikant regresinę analizę. Galima taikyti svertinę tiesinę regresiją, atlikus atsako duomenų tiesinamąjį transformavimą, pvz., į probito, logito arba Weibullo vienetus (16), bet geresnės yra netiesinės regresijos metodų procedūros, kurias taikant geriau apdorojami neišvengiami duomenų netolygumai ir nukrypimai nuo glodžiųjų skirstinių. Artėjant į nulinį arba visišką inhibavimą, tokie netolygumai dėl transformavimo gali padidėti ir trukdyti analizei (16). Reikėtų pažymėti, kad tipiniai analizės metodai, taikant probito, logito arba Weibullo transformuotus dydžius, yra skirti dichotominiams (pvz., mirtingumas arba išlikimas) duomenims ir turi būti modifikuojami, norint juos pritaikyti augimo arba biomasės duomenims. Specifinės ECx verčių nustatymo pagal tolydžiuosius duomenis procedūros yra pateiktos (17), (18) ir (19).
Kiekvienam analizuojamam atsako kintamajam naudojamas koncentracijos ir atsako santykis ECx verčių taškiniams įverčiams apskaičiuoti. Kai įmanoma, turėtų būti nustatyti kiekvieno įverčio 95 % pasikliautinieji rėžiai. Atsako duomenų atitiktis regresijos modeliui turėtų būti įvertinta grafiškai arba statistiškai. Regresinė analizė turėtų būti atliekama naudojant atskirus kartotinių ėminių atsakus, bet ne apdorotų ėminių grupių vidurkius.
Be to, jei turimi regresijos modeliai (metodai) netinka duomenims, EC50 įverčiai ir pasikliautinieji rėžiai gali būti gauti taikant tiesinį interpoliavimą ir savaiminio gerinimo metodus (anglų k. bootstrapping) (20).
Norint įvertinti LOEC, taigi ir NOEC, yra būtina palyginti apdorotų ėminių vidutines vertes, taikant dispersinės analizės (ANOVA) metodus. Tuomet kiekvienai koncentracijai gautas vidurkis turi būti lyginamas su kontrolinio ėminio vidurkiu, taikant atitinkamą kartotinių palyginimų arba trendo kriterijaus metodą. Gali būti naudingas Dunnetto arba Williamso kriterijus (21)(22)(23)(24).. Yra būtina įvertinti, ar galioja ANOVA dispersijos vienalytiškumo prielaida. Šį įvertinimą galima atlikti grafiškai arba taikant formalųjį kriterijų (25). Tinkami kriterijai yra Levene arba Bartletto kriterijai. Neatitiktį prielaidai dėl dispersijų vienalytiškumo kartais galima pataisyti atliekant duomenų logaritminį transformavimą. Jei dispersijos nevienalytiškumas yra labai didelis ir jo neįmanoma pataisyti transformavimo keliu, reikėtų nagrinėti galimybę taikyti kitus analizės metodus, pvz., žingsnio mažinimo Jonkheere trendo kriterijus. Papildomus nurodymus dėl NOEC nustatymo galima rasti (19).
Atsižvelgiant į naujus mokslo pasiekimus rekomenduojama atsisakyti NOEC sąvokos ir ją pakeisti regresija pagrįstais ECx taškiniais įverčiais. Atitinkama šio Lemna bandymo x vertė nėra nustatyta. Tačiau atrodo, kad tiktų į 10–20 % intervalą patenkanti vertė (pagal pasirinktą atsako kintamąjį), ir pageidautina ataskaitoje pateikti abi EC10 ir EC20 vertės.
3. ATASKAITOS RENGIMAS
3.1. BANDYMŲ ATASKAITA
Bandymų ataskaitą turi sudaryti ši informacija:
Bandomoji medžiaga:
|
— |
fizikinė būsena ir atitinkamos fizikocheminės savybės, įskaitant ribinę tirpumo vandenyje koncentraciją, |
|
— |
cheminio identifikavimo duomenys (pvz., CAS numeris), įskaitant grynumą. |
Bandymo rūšys:
|
— |
mokslinis pavadinimas, klonas (jei žinomas) ir šaltinis. |
Bandymo sąlygos:
|
— |
taikyta bandymo procedūra (stacionarusis, pusiau stacionarusis arba pratekamojo srauto bandymas), |
|
— |
bandymo pradžios data ir jo trukmė, |
|
— |
bandymo terpė, |
|
— |
bandymo schemos aprašymas: bandymo indai ir dangčiai, tirpalų tūriai, kolonijų ir gniužulų skaičius bandymo inde bandymo pradžioje, |
|
— |
bandymo koncentracijos vertės (vardinės ir išmatuotos, jei tinka) vienos koncentracijos kartotinių ėminių skaičius, |
|
— |
pradinių ir bandymo tirpalų ruošimo metodai, įskaitant tirpiklių arba dispergentų naudojimą, |
|
— |
bandymo temperatūra, |
|
— |
šviesos šaltinis, šviesos intensyvumas ir vienalytiškumas, |
|
— |
apdorotų ir kontrolinių ėminių terpės pH vertės, |
|
— |
bandomosios medžiagos koncentracijos vertės, analizės metodas ir atitinkami kokybės įvertinimo duomenys (tinkamumo patvirtinimo tyrimai, analizės rezultatų standartiniai nuokrypiai arba pasikliautinieji rėžiai), |
|
— |
gniužulų skaičiaus ir kitų matuojamų kintamųjų, pvz., sausos medžiagos masės, šviežios medžiagos masės arba gniužulų ploto, nustatymas, |
|
— |
visi nukrypimai nuo šio bandymo metodo. |
Rezultatai:
|
— |
neapdoroti duomenys: gniužulų skaičius kiekviename bandymo ir kontroliniame inde ir kiti matuojami kintamieji kiekvienu stebėjimo ir analizės atveju, |
|
— |
kiekvieno matuojamo kintamojo vidurkis ir standartinis nuokrypis, |
|
— |
kiekvieną koncentraciją atitinkančios augimo kreivės (rekomenduojama matuojamą kintamąjį logaritmuoti, žr. 2.2.1 skirsnio antrąją pastraipą), |
|
— |
kontrolinio ėminio dvigubėjimo trukmė (augimo greitis) pagal gniužulų skaičių, |
|
— |
apskaičiuoti kiekvieno apdoroto kartotinio ėminio atsako kintamieji, jų vidutinės vertės ir kartotinių ėminių variacijos koeficientas, |
|
— |
grafinis koncentracijos ir poveikio santykio pateikimas, |
|
— |
toksiškumo įverčiai pagal atsako kintamuosius, pvz., EC50, EC10, EC20, ir atitinkami pasikliautinieji intervalai. Jei buvo apskaičiuotos, LOEC ir NOEC vertės ir jų nustatymo statistiniai metodai, |
|
— |
jei buvo taikytas dispersinės analizės metodas ANOVA, poveikio, kurį galima aptikti, dydis (pvz., mažiausiais reikšminis skirtumas), |
|
— |
bet koks augimo skatinimas, nustatytas kuriam nors apdorojimo atvejui, |
|
— |
visi stebimi fitotoksiškumo požymiai ir bandymo tirpalų stebėjimai, |
|
— |
rezultatų aptarimas, įskaitant nukrypimų nuo šio bandymo metodo įtaką bandymo rezultatams. |
4. LITERATŪRA
|
(1) |
OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test |
|
(2) |
The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals |
|
(3) |
Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, pateikiama adresu http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A |
|
(4) |
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA. |
|
(5) |
USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp. |
|
(6) |
AFNOR – Association Française de Normalisation. (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp. |
|
(7) |
SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish). |
|
(8) |
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37–120 pp |
|
(9) |
Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145. |
|
(10) |
Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency. |
|
(11) |
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23. |
|
(12) |
ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test. |
|
(13) |
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3–77 108. September 1977. |
|
(14) |
Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353–359. |
|
(15) |
Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481–483. |
|
(16) |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718. |
|
(17) |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167. |
|
(18) |
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485–1494. |
|
(19) |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
(20) |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN. |
|
(21) |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096–1121. |
|
(22) |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482–491. |
|
(23) |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117. |
|
(24) |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531. |
|
(25) |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96. |
1 Priedėlis
Lemna SPP Aprašymas.
Vandens augalas, kurio įprastas pavadinimas plūdena, Lemna spp., priklauso Lemnaceae šeimai, kurią sudaro kelios pasaulyje paplitusios keturių genčių rūšys. Jų skirtinga išvaizda ir klasifikavimas yra išsamiai aprašytas (1)(2). Lemna gibba ir L. minor rūšis atitinka vidutinio klimato zonų rūšis ir paprastai naudojamos toksiškumo bandymams atlikti. Abi rūšis turi plaukiojantį arba panardintą disko formos kamieną (gniužulą) ir iš apatinio kiekvieno gniužulo vidurio skleidžiasi labai plona šaknis. Lemna spp. retai žydi ir augalai dauginasi vegetatyviniu būdu susidarant naujiems gniužulams (3). Palyginti su senais augalais jaunesni augalai yra šviesesni, turi trumpesnes šaknis ir yra sudaryti iš dviejų arba trijų skirtingo dydžio gniužulų. Mažo dydžio Lemna yra paprastos struktūros augalai, kurie dauginasi nelytiniu būdu, ir dėl trumpos vienos kartos trukmės šios genties augalai labai tinka laboratoriniams bandymams (4)(5).
Kadangi gali skirtis rūšių jautris, tinka tik vienos rūšies jautrio tarpusavio lyginimas.
Bandymams atlikti naudotų Lemna rūšių pavyzdžiai. Rūšių naudojimo nuorodos:
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935–941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959–1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87–96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481–483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102–2111.
Lemna rūšių šaltiniai
|
University of Toronto Culture Collection of Algae and Cyanobacteria |
|
Department of Botany, University of Toronto |
|
Toronto, Ontario, Canada, M5S 3 B2 |
|
Tel: +1–416–978–3641 |
|
Fax:+1–416–978–5878 |
|
e-mail: jacreman@botany.utoronto.ca |
|
http://www.botany.utoronto.ca/utcc |
|
North Carolina State University |
|
Forestry Dept |
|
Duckweed Culture Collection |
|
Campus Box 8002 |
|
Raleigh, NC 27695–8002 |
|
United States |
|
phone 001 (919) 515–7572 |
|
astomp@unity.ncsu.edu |
|
Institute of Applied Environmental Research (ITM) Stockholm University |
|
SE-106 91 STOCKHOLM |
|
SWEDEN |
|
Tel: +46 8 674 7240 |
|
Fax +46 8 674 7636 |
|
Federal Environmental Agency (UBA) |
|
FG III 3.4 |
|
Schichauweg 58 |
|
12307 Berlin |
|
Germany |
|
e-mail: lemna@uba.de |
|
http://www.umweltbundesamt.de/contact.htm |
Literatūra
|
(1) |
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221–287. |
|
(2) |
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland. |
|
(3) |
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82–991150–0–0. The Agricultural Research Council of Norway, University of Oslo. |
|
(4) |
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1–14. |
|
(5) |
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7–22. |
2 priedėlis
Pradinės kultūros priežiūra
Pradines kultūras galima laikyti ilgesnį laiką žemesnėje temperatūroje (4–10 °C) ir nereikia rekultivuoti. Lemna auginimo terpė gali būti tokia pat, kaip ir bandymo terpė, bet pradinėms kultūroms galima naudoti kitų mitybinių medžiagų turinčias terpes.
Periodiškai tam tikras skaičius jaunų, šviesiai žalių augalų steriliai pernešami į naujos kultūros indus su nauja terpe. Esant šiame metode siūlomoms vėsesnėms sąlygoms, persėti galima ne rečiau kaip kas tris mėnesius.
Kultūroms auginti turėtų būti naudojami chemiškai švarūs (rūgštimi išplauti) ir sterilūs stikliniai indai ir taikomi sterilaus apdorojimo metodai. Jei pradinė kultūra užkrečiama, pvz., dumbliais arba grybeliais, reikia imtis būtinų žingsnių užkrato organizmams pašalinti. Dumblių ir daugumos kitų užkrečiančių organizmų atveju tai galima pasiekti, atliekant paviršinį sterilizavimą. Imamas užkrėstos augalinės medžiagos ėminys ir nupjaunamos šaknys. Medžiaga iš pradžių stipriai purtoma švariame vandenyje ir nuo 30 s iki 5 minučių įmerkiama į 0,5 % (V/V) natrio hipochlorito tirpalą. Vėliau augalinė medžiaga skalaujama steriliu vandeniu ir pernešama kelių atskirų ėminių pavidalu į kultūros auginimo indus su nauja auginimo terpe. Po tokio apdorojimo daug gniužulų žūsta, ypač ilgiau apdorojant, bet tam tikra likusių augalų dalis paprastai nebeturi užkrato. Jie gali būti naudojami naujoms kultūroms sėti.
3 Priedėlis
Terpės
L. minor ir L. gibba auginti rekomenduojamos skirtingos terpės. L. minor rekomenduojama Švedijos standarto (SIS) terpė, o L. gibba rekomenduojama 20X AAP terpė. Toliau pateikta abiejų terpių sudėtis. Šioms terpėms ruošti turėtų būti naudojamos analiziškai grynos cheminės medžiagos ir dejonizuotas vanduo.
Švedijos standarto (SIS) Lemna auginimo terpė
|
— |
Pradiniai tirpalai I–V sterilizuojami autoklave (120 °C, 15 min) arba filtravimu per membraną (vidutinis akučių skersmuo 0,2 µm). |
|
— |
VI (ir papildomai VII) pradiniai tirpalai sterilizuojami tik filtravimu per membraną; jų negalima apdoroti autoklave. |
|
— |
Sterilūs pradiniai tirpalai turėtų būti laikomi šaltai ir tamsoje. I–V pradiniai tirpalai turėtų būti pašalinti po šešių mėnesių, o VI (ir papildomo VII) tirpalų laikymo trukmė vienas mėnuo.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
— |
1 litrui SIS terpės paruošti į 900 ml dejonizuoto vandens įpilama:
Pastaba.: Papildomo VII pradinio tirpalo (MOPS buferio) gali prireikti tam tikroms bandomosioms medžiagoms (žr. 1.4 skirsnio paskutinę pastraipą). |
|
— |
0,1 mol/l arba 1 mol/l HCl arba NaOH nustatoma pH vertė 6,5 ± 0,2 ir dejonizuotu vandeniu skiedžiama iki vieno litro tūrio. |
20X AAP auginimo terpė
Pradiniam tirpalams ruošti naudojamas sterilus distiliuotas arba dejonizuotas vanduo.
Sterilūs pradiniai tirpalai turėtų būti laikomi šaltai ir tamsoje. Pradinių tirpalų laikymo trukmė tokiomis sąlygomis yra bent 6–8 savaitės.
20X – AAP terpei ruošiami penki pradiniai mitybinių medžiagų tirpalai (A1, A2, A3, B ir C), naudojant analiziškai grynas medžiagas. Auginimo terpei gauti 20 ml kiekvieno pradinio mitybinių medžiagų tirpalo įpilama į maždaug 850 ml dejonizuoto vandens. 0,1 mol/l arba 1 mol/l HCl arba NaOH nustatoma pH vertė 7,5 ± 0,1 ir dejonizuotu vandeniu skiedžiama iki vieno litro tūrio. Terpė filtruojama į sterilų indą per 0,2 μm (maždaug) membraninį filtrą.
Bandymams skirtą auginimo terpę reikėtų ruošti 1–2 paros prieš naudojimą, kad galėtų nusistovėti pH vertė. Auginimo terpės pH vertė turėtų būti patikrinta prieš naudojimą ir prireikus reguliuojama, įpilant 0,1 mol/l arba 1 mol/l NaOH arba HCl, kaip aprašyta pirmiau.
|
Pradinis tirpalas Nr. |
Medžiaga |
Pradinio tirpalo koncentracija (g·l–1) (1) |
Paruoštos terpės koncentracija (mg·l–1) (1) |
Paruošta terpė |
|
|
Elementas |
Koncentracija (mg·l–1) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4; 3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
Išnaša: Teoriškai tinkama galutinė hidrokarbonato koncentracija (kuri leistų išvengti didesnio pH reguliavimo) yra lygi 15 mg/l, bet ne 300 mg/l. Tačiau anksčiau 20X-AAP terpei ruošti, įskaitant tarplaboratorinį šio metodo tyrimą, buvo naudojama 300 mg/l. (I. Sims, P. Whitehouse and R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency).
STEINBERGO terpė (pagal ISO 20079)
Koncentracijos vertės ir pradiniai tirpalai
|
— |
Modifikuota Steinbergo terpė naudojama standarte ISO 20079 tik Lemna minor (nes pagal jį leidžiama naudoti tik Lemna minor), bet bandymai parodė, kad gerų rezultatų galima gauti ir su Lemna gibba. |
|
— |
Terpei ruošti turėtų būti naudojamos analiziškai grynos cheminės medžiagos ir dejonizuotas vanduo. |
|
— |
Mitybinė terpė ruošiama iš pradinių tirpalų arba iš 10 kartų didesnės koncentracijos terpės, kuri yra didžiausia terpės koncentracija, kai dar nesusidaro nuosėdos. |
1 lentelė.
Pastovios pH vertės STEINBERGO terpė (modifikuota pagal Altenburgerį)
|
Medžiaga |
Mitybinė terpė |
||
|
Makroelementai |
molinė masė |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Mikroelementai |
molinė masė |
µg/l |
µmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4 · 7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4 · 2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2 · 4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3 · 6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA dinatrio dihidratas |
372,24 |
1 500,00 |
4,03 |
2 lentelė.
Pradiniai tirpalai (makroelementų)
|
g/l |
||
|
1 pradinis tirpalas: |
|||
|
KNO3 |
17,50 |
||
|
KH2PO4 |
4,5 |
||
|
K2HPO4 |
0,63 |
||
|
2 pradinis tirpalas: |
|||
|
MgSO4 · 7H2O |
5,00 |
||
|
3 pradinis tirpalas: |
|||
|
Ca(NO3)2 · 4H2O |
14,75 |
||
3 lentelė.
Pradiniai tirpalai (mikroelementų)
|
mg/l |
||
|
4 pradinis tirpalas: |
|||
|
H3BO3 |
120,0 |
||
|
5 pradinis tirpalas: |
|||
|
ZnSO4 · 7H2O |
180,0 |
||
|
6 pradinis tirpalas: |
|||
|
Na2MoO4 · 2H2O |
44,0 |
||
|
7 pradinis tirpalas: |
|||
|
MnCl2 · 4H2O |
180,0 |
||
|
8 pradinis tirpalas: |
|||
|
FeCl3 · 6H2O |
760,00 |
||
|
EDTA dinatrio dihidratas |
1 500,00 |
||
|
— |
2 ir 3 pradiniai tirpalai ir atskirai 4–7 pradiniai tirpalai gali būti supilti kartu (atsižvelgiant į reikiamą koncentraciją). |
|
— |
Siekiant užtikrinti ilgesnę laikymo trukmę, pradiniai tirpalai 20 min apdorojami autoklave, esant 121 °C, arba atliekamas jų sterilus filtravimas (0,2 µm). Labai rekomenduojama steriliai filtruoti (0,2 µm) 8 pradinį tirpalą. |
Galutinės koncentracijos STEINBERGO terpės (modifikuotos) ruošimas
|
— |
20 ml 1, 2 ir 3 pradinių tirpalų (žr. 2 lentelę) įpilama į maždaug 900 ml dejonizuoto vandens, kad būtų išvengta nuosėdų susidarymo. |
|
— |
Įpilama po 1,0 ml 4, 5, 6, 7 ir 8 pradinių tirpalų (žr. 3 lentelę). |
|
— |
pH vertė turėtų būti 5,5 ± 0,2 (reguliuojama įpilant kiek įmanoma mažesnį NaOH arba HCl tirpalo tūrį). |
|
— |
Skiedžiama vandeniu iki 1 000 ml. |
|
— |
Jei pradiniai tirpalai yra sterilizuoti ir naudojamas tinkamas vanduo, papildomai sterilizuoti nebūtina. Jei sterilizuojama galutinė terpė, 8 pradinis tirpalas turėtų būti įpilamas po terpės apdorojimo autoklave (20 min, esant 121 °C). |
10 kartų didesnės koncentracijos tarpinės STEINBERGO terpės (modifikuotos) ruošimas
|
— |
20 ml 1, 2 ir 3 pradinių tirpalų (žr. 2 lentelę) įpilama į maždaug 30 ml vandens, kad būtų išvengta nuosėdų susidarymo. |
|
— |
Įpilama po 1,0 ml 4, 5, 6, 7 ir 8 pradinių tirpalų (žr. 3 lentelę). Skiedžiama vandeniu iki 100 ml. |
|
— |
Jei pradiniai tirpalai yra sterilizuoti ir naudojamas tinkamas vanduo, papildomai sterilizuoti nebūtina. Jei sterilizuojama galutinė terpė, 8 pradinis tirpalas turėtų būti įpilamas po terpės apdorojimo autoklave (20 min, esant 121 °C). |
|
— |
Terpės pH vertė (galutinės koncentracijos) turėtų būti 5,5 ± 0,2. |
(1) Jei nenurodyta kitaip.