PRIEDAS
„VI PRIEDAS
ANALIZĖS METODAI GYVŪNINĖMS SUDEDAMOSIOMS DALIMS NUSTATYTI ATLIEKANT OFICIALIĄJĄ PAŠARŲ KONTROLĘ
1. TIKSLAS IR TAIKYMO SRITIS
Gyvūninės sudedamosios dalys pašaruose nustatomos taikant šviesos mikroskopiją arba PGR vadovaujantis šio priedo nuostatomis.
Šie du metodai leidžia aptikti gyvūnines sudedamąsias dalis pašarinėse žaliavose ir kombinuotajame pašare. Tačiau juos taikant tokių sudedamųjų medžiagų kiekio pašarinėse žaliavose ir kombinuotajame pašare neįmanoma apskaičiuoti. Abiejų metodų aptikimo riba žemesnė nei 0,1 % (m/m).
PGR būdas leidžia nustatyti gyvūninių sudedamųjų dalių pašarinėse žaliavose ir kombinuotajame pašare taksonominę grupę.
Šie metodai taikomi atliekant Reglamento (EB) Nr. 999/2001 7 straipsnio 1 dalyje bei IV priede ir Reglamento (EB) Nr. 1069/2009 11 straipsnio 1 dalyje nustatytų draudimų taikymo kontrolę.
Atsižvelgiant į tiriamą pašarą, šie metodai gali būti naudojami atskirai arba kartu viename bendrame tyrimo protokole, vadovaujantis standartinėmis tyrimo procedūromis, nustatytomis už gyvūninių baltymų pašaruose tyrimus atsakingos ES etaloninės laboratorijos (toliau – EURL-AP laboratorija) ir paskelbtomis jos svetainėje (1).
2. METODAI
2.1. Šviesos mikroskopija
2.1.1. Principas
Gyvūninės sudedamosios dalys, kurių gali būti ištirti atsiųstose pašarinėse žaliavose ir kombinuotajame pašare, identifikuojamos pagal tipines mikroskopu nustatomas savybes, kaip antai raumenų skaidulos ir kitos mėsos dalys, kremzlės, kaulai, ragai, plaukai, šeriai, kraujas, plunksnos, kiaušinių lukštai, žuvų kaulai ir žvynai).
2.1.2. Reagentai ir įranga
2.1.2.1. Reagentai
2.1.2.1.1. Koncentravimo medžiaga
2.1.2.1.1.1. Tetrachloretilenas (lyginamasis svoris – 1,62).
2.1.2.1.2. Dažymo reagentas
2.1.2.1.2.1. Alizarino raudonojo tirpalas (2,5 ml 1 mol/l vandenilio chlorido rūgšties skiedžiama 100 ml vandens ir į šį tirpalą pridedama 200 mg alizarino raudonojo tirpalo).
2.1.2.1.3. Padengimo terpė
2.1.2.1.3.1. Šarmas (NaOH 2,5 % m/V arba KOH 2,5 % m/V).
2.1.2.1.3.2. Glicerolis (nepraskiestas, klampumas – 1 490 cP).
2.1.2.1.3.3. „Norland ® Optical Adhesive 65“ (klampumas – 1 200 cP) arba lygiaverčių savybių turinti derva, skirta paruošti daugkartinio naudojimo objektiniam stikleliui.
2.1.2.1.4. Padengimo terpė su dažymo savybėmis
2.1.2.1.4.1. Liugolio tirpalas (2 g kalio jodido ištirpinama 100 ml vandens ir staigiai kratant pridedama 1 g jodo).
2.1.2.1.4.2. Cistino reagentas (2 g švino acetato, 10 g NaOH/100 ml vandens).
2.1.2.1.4.3. Felingo reagentas (ruošiamas prieš naudojimą iš dviejų pradinių tirpalų (A ir B) vienodų dalių (1/1). A tirpalas: 6,9 g vario sulfato pentahidrato ištirpinama 100 ml vandens. B tirpalas: 34,6 g kalio natrio tartratas tetrahidratas ir 12 g NaOH ištirpinama 100 ml vandens).
2.1.2.1.4.4. Tetrametilbenzidinas/vandenilio peroksidas (1 g 3,3’,5,5’ tetrametilbenzidino (toliau – TMB) ištirpinama 100 ml ledinės acto rūgšties ir 150 ml vandens. Prieš naudojimą 4 šio TMB tirpalo dalys sumaišomos su viena dalimi 3 % vandenilio peroksido).
2.1.2.1.5. Plovikliai
2.1.2.1.5.1. Etanolis ≥ 96 % (techninis grynumas).
2.1.2.1.5.2. Acetonas (techninis grynumas).
2.1.2.1.6. Balinimo reagentas
2.1.2.1.6.1. Komercinis natrio hipochlorito tirpalas (9–14 % aktyviojo chloro).
2.1.2.2. Įranga
2.1.2.2.1. Analizės svarstyklės, kurių tikslumas – 0,001 g.
2.1.2.2.2. Smulkinimo įranga: malūnas arba grūstuvė.
2.1.2.2.3. Sieteliai, kurių kvadratinių akučių dydis – 0,25 mm, o plotis – 1 mm.
2.1.2.2.4. Kūgio formos 250 ml talpos stiklinis dalijamasis piltuvas su čiaupu iš teflono arba nepoliruoto stiklo kūgio apačioje. Čiaupo skersmuo turi būti ne mažesnis kaip 4 mm. Galima naudoti ir nusodinimo menzūrą kūginiu dugnu su sąlyga, kad laboratorija įrodo, jog aptikimo ribos yra lygiavertės gaunamoms kūgio formos stikliniu dalijamuoju piltuvu.
Dalijamasis piltuvas
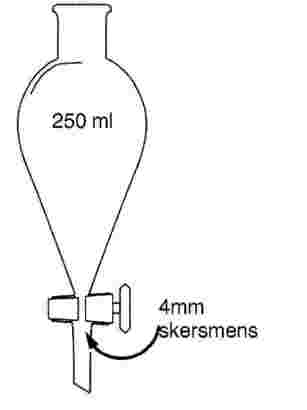
2.1.2.2.5. Stereomikroskopas, kurio galutinis didinimo intervalas yra ne mažesnis kaip 6,5–40 kartų.
2.1.2.2.6. Sudėtinis mikroskopas, kurio galutinis didinimo intervalas su šviesos lauko praeinamąja šviesa yra mažiausiai 100–400 kartų. Papildomai galima naudoti poliarizuotąją šviesą ir diferencinį interferencinį kontrastą.
2.1.2.2.7. Tipiniai laboratoriniai stikliniai indai
2.1.2.2.8. Objektinio stiklelio paruošimo įranga: tradiciniai mikroskopo stikleliai, tušti stikleliai, dengiamieji stikleliai (20 × 20 mm), pincetai, smulki mentelė.
2.1.3. Mėginių ėmimas ir mėginių ruošimas
2.1.3.1. Mėginių ėmimas
Naudojamas reprezentatyvusis mėginys, paimtas pagal I priedo nuostatas.
2.1.3.2. Būtinos atsargumo priemonės
Siekiant išvengti kryžminės laboratorinės taršos, visa daugkartinio naudojimo įranga prieš naudojimą rūpestingai nuvaloma. Prieš valymą išrenkamos dalijamojo piltuvo dalys. Dalijamojo piltuvo dalys ir stikliniai indai pirmiausia išplaunami rankomis, po to – plautuvėje. Sieteliai nuvalomi kietų šerių šepečiu. Jeigu prieš tai buvo sijojama riebi medžiaga, kaip antai žuvų miltai, pabaigoje sietelius rekomenduojama išvalyti acetonu ir suspaustu oru.
2.1.3.3. Mėginių, jei tai ne riebalai ar aliejus, paruošimas
2.1.3.3.1. Mėginių džiovinimas: prieš naudojimą mėginiai, kurių drėgnis didesnis kaip 14 %, išdžiovinami.
2.1.3.3.2. Paruošiamasis mėginių sijojimas: granuliuotą pašarą ir branduolius rekomenduojama iš anksto prasijoti pro 1 mm dydžio akutes, o dvi gautas frakcijas vėliau paruošti ir išanalizuoti kaip atskirus mėginius.
2.1.3.3.3. Mėginio dalijimas ir smulkinimas: analizės tikslais padalijama ir vėliau susmulkinama bent 50 g mėginio.
2.1.3.3.4. Nuosėdų ekstrahavimas ir paruošimas: 10 g susmulkinto pomėginio dalis (0,01 g. tikslumu) perkeliama į dalijamąjį piltuvą arba nusodinimo menzūrą kūginiu dugnu ir įpilama 50 ml tetrachloretileno. Į piltuvą perkelta dalis negali viršyti 3 g, jeigu tai yra žuvų miltai arba kiti gryni gyvūniniai produktai, mineralinės sudedamosios dalys arba premiksai, iš kurių susidaro daugiau kaip 10 % nuosėdų. Mišinys stipriai kratomas bent 30 s, tada įpilama dar bent 50 ml tetrachloretileno, kad bet kokios prie piltuvo vidaus prilipusios dalelės būtų švariai nuplautos į indo vidų. Gautas mišinys pastatomas bent 5 minutėms, tada atidaromas čiaupas ir nuosėdos atskiriamos.
Jeigu naudojama nusodinimo menzūra kūginiu dugnu, mišinys energingai maišomas bent 15 s, tada įpilama dar bent 10 ml švaraus tetrachloretileno, kad bet kokios prie menzūros sienelės prilipusios dalelės būtų švariai nuplautos į indo vidų. Mišinys pastatomas bent 3 minutėms, vėl pamaišomas 15 s, tada įpilama dar bent 10 ml švaraus tetrachloretileno, kad bet kokios prie menzūros sienelės prilipusios dalelės būtų švariai nuplautos į indo vidų Gautas mišinys pastatomas bent 5 minutėms, tada, atlikus dekantavimą, pašalinama skystoji frakcija, stengiantis neprarasti nė trupučio nuosėdų.
Nuosėdos išdžiovinamos ir vėliau sveriamos (0,001 g tikslumu). Jeigu daugiau nei 5 % nuosėdų sudaryta iš didesnių nei 0,50 mm dalelių, jos prasijojamos pro 0,25 mm akutes, o abi gautos frakcijos ištiriamos.
2.1.3.3.5. Plūdrių ekstrahavimas ir paruošimas: po to, kai taikant nurodytąjį metodą gaunamos nuosėdos, dalijamajame piltuve turėtų likti dvi fazės: skystoji, sudaryta iš tetrachloretileno, ir kietoji, sudaryta iš plūdriųjų medžiagų. Ši kietoji fazė – tai plūdriai, kurie gaunami atidarius čiaupą ir išpylus iš piltuvo visą tetrachloretileną. Apvertus dalijamąjį piltuvą, plūdriai perkeliami į didelę Petri lėkštelę ir išdžiovinama oro traukos gaubte. Jeigu daugiau nei 5 % plūdrių sudaryta iš didesnių nei 0,50 mm dalelių, jie prasijojama pro 0,25 mm akutes, o abi gautos frakcijos ištiriamos.
2.1.3.3.6. Žaliavos paruošimas: paruošiama bent 5 g masės susmulkinto pomėginio dalis. Jeigu daugiau nei 5 % medžiagos sudaryta iš didesnių nei 0,50 mm dalelių, ji prasijojama pro 0,25 mm akutes, o abi gautos frakcijos ištiriamos.
2.1.3.4. Mėginių, kurių sudėtyje yra riebalų ar aliejaus, paruošimas
Ruošiant mėginius, kurių sudėtyje yra riebalų ar aliejaus, vadovaujamasi šiuo protokolu:
|
— |
jeigu riebalai yra kieti, jie šildomi krosnyje tol, kol suskystėja, |
|
— |
pipete iš mėginio dugno į centrifugavimo mėgintuvėlį perkeliama 40 ml riebalų ar aliejaus, |
|
— |
centrifuguojama 10 min. 4 000 apsukų per minutę greičiu, |
|
— |
jeigu po centrifugavimo riebalai yra kieti, jie šildomi krosnyje tol, kol suskystėja, |
|
— |
centrifuguojama dar kartą 5 min. 4 000 apsukų per minutę greičiu, |
|
— |
analizės tikslais pusė dekantuotų priemaišų mažu šaukšteliu arba mentele perkeliama ant mikroskopo objektinių stiklelių; kaip terpę rekomenduojama naudoti glicerolį, |
|
— |
likusios priemaišos naudojamos ruošiant nuosėdas, kaip aprašyta 2.1.3.3 punkte. |
2.1.3.5. Dažymo reagentų naudojimas
Kai subjektas ruošia mėginius, siekdamas supaprastinti tinkamą gyvūninių sudedamųjų dalių identifikavimą, jis gali naudoti dažymo reagentus pagal EURL-AP laboratorijos išleistas ir jos svetainėje paskelbtas gaires.
Jeigu nuosėdoms nuspalvinti naudojamas alizarino raudonojo tirpalas, vadovaujamasi šiuo protokolu:
|
— |
išdžiovintos nuosėdos perkeliamos į stiklinį mėgintuvėlį ir dukart praskalaujamos maždaug 5 ml etanolio (kiekvieną sykį 30 s naudojamas sūkurinis maišytuvas, po to leidžiama tirpalui 1 min. 30 s nusistovėti ir jis išpilamas), |
|
— |
nuosėdos nubalinamos pridedant ne mažiau kaip 1 ml natrio hipochlorito tirpalo. Reakcija turėtų trukti 10 min. Mėgintuvėlis pripildomas vandens, nuosėdoms leidžiama 2–3 min. nusistovėti, po to vanduo ir suspenduotosios dalelės atsargiai išpilami, |
|
— |
nuosėdos darkart kelis kartus praskalaujamos 10 ml vandens (30 s naudojamas sūkurinis maišytuvas, po to leidžiama joms nusistovėti ir kaskart išpilamas vanduo), |
|
— |
pridedama 2–10 lašų alizarino raudonojo tirpalo, tada mišinys išmaišomas sūkuriniu maišytuvu. Reakcija turėtų trukti 30 s, tada nusispalvinusios nuosėdos dukart praskalaujamos maždaug 5 ml etanolio ir vieną kartą acetonu (kaskart 30 s naudojamas sūkurinis maišytuvas, po to leidžiama tirpikliui apie 1 min. nusistovėti ir jis išpilamas), |
|
— |
nuspalvintos nuosėdos išdžiovinamos. |
2.1.4. Mikroskopinis tyrimas
2.1.4.1. Objektinio stiklelio paruošimas
Mikroskopo objektiniai stikleliai ruošiami naudojant nuosėdas ir, atsižvelgiant į subjekto pasirinkimą, plūdrius arba žaliavą. Jeigu ruošiant mėginius buvo naudotas sietas, paruošiamos abi gautos frakcijos –smulkioji ir rupioji. Frakcijų dalys ant objektinių stiklelių turi būti būdingos visai frakcijai.
Siekiant įvykdyti visus 2.1.4.2 punkte nustatytus tyrimo protokolo reikalavimus, paruošiama užtektinai objektinių stiklelių.
Mikroskopo objektiniai stikleliai naudojami kartu su tinkama terpe, vadovaujantis EURL-AP laboratorijos nustatytomis ir jos svetainėje paskelbtomis standartinėmis tyrimo procedūromis. Objektiniai stikleliai uždengiami dengiamaisiais stikleliais.
2.1.4.2. Stebėjimo protokolai, leidžiantys aptikti gyvūnines sudedamąsias dalis kombinuotajame pašare ir pašarinėse žaliavose
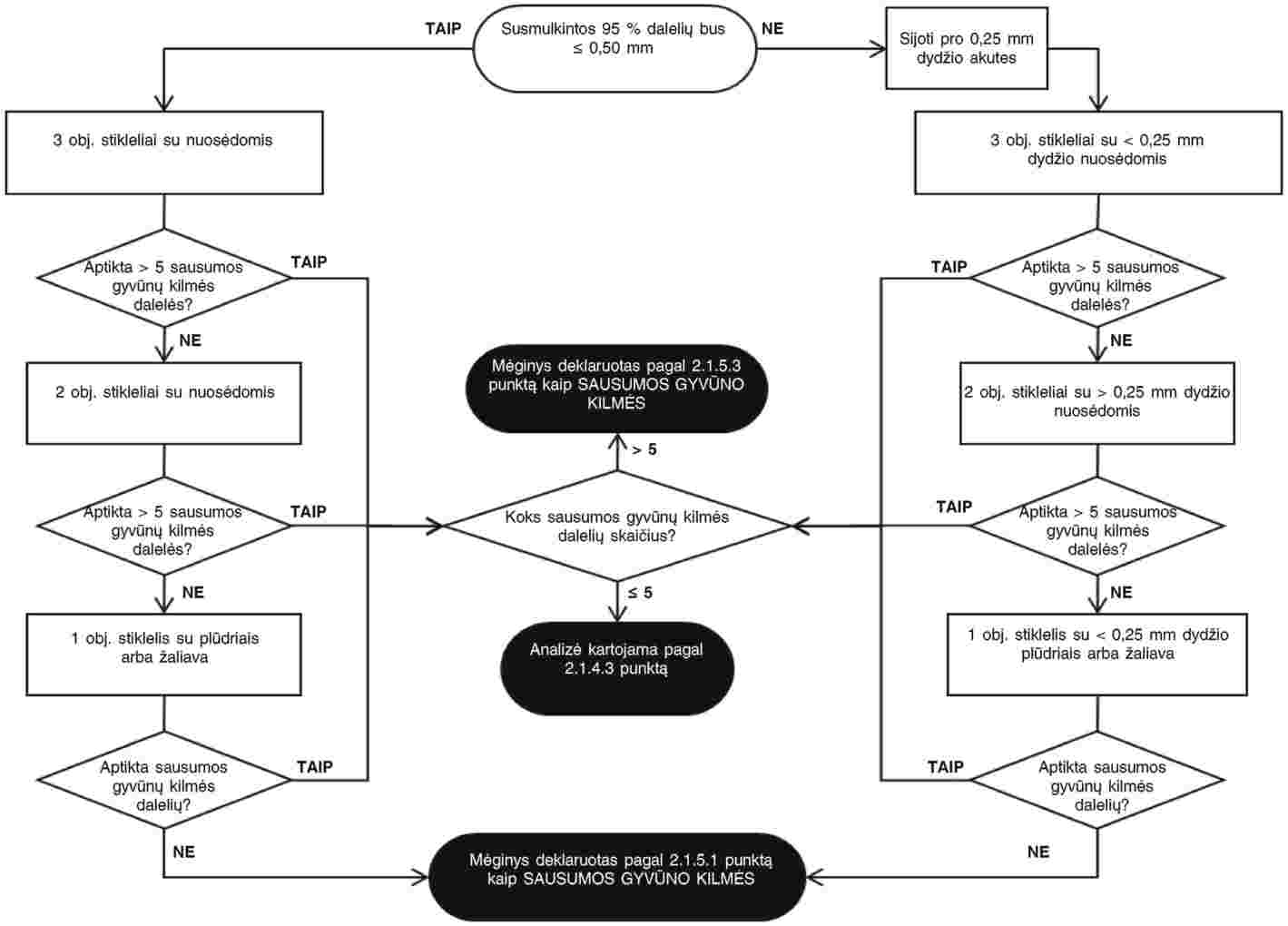
Paruošti mikroskopo objektiniai stikleliai stebimi vadovaujantis stebėjimo protokolais, nurodytais 1 schemoje (kombinuotasis pašaras ir pašarinės žaliavos, išskyrus grynus žuvų miltus) arba 2 schemoje (gryni miltai).
Stebima pro sudėtinį mikroskopą naudojant nuosėdas ir, atsižvelgiant į subjekto pasirinkimą, plūdrius arba žaliavas. Rupiosios frakcijos gali būti tiriamos stereomikroskopu, ne tik sudėtiniu mikroskopu. Kiekvienas objektinis stiklelis iš pagrindų peržiūrimas nustatant įvairius didinimo lygius.
Turi būti griežtai paisoma, kiek mažiausiai objektinių stiklelių turi būti patikrinta kiekvienu stebėjimo protokole numatytu etapu, nebent visos frakcijų medžiagos nepakanka, kad būtų galima laikytis nustatyto objektinių stiklelių skaičiaus. Kaskart analizuojant stebimi ne daugiau kaip 6 objektiniai stikleliai.
Kad būtų lengviau nustatyti dalelių pobūdį ir kilmę, subjektas gali naudoti tokias paramos priemones, kaip sprendimų patvirtinimo sistemos, vaizdo rinkiniai ir etaloniniai mėginiai.
1 schema
Stebėjimo protokolas, leidžiantis aptikti gyvūnines sudedamąsias dalis kombinuotajame pašare ir pašarinėse žaliavose, išskyrus žuvų miltus

2 schema
Stebėjimo protokolas, leidžiantis aptikti gyvūnines daleles žuvų miltuose
2.1.4.3. Analizių skaičius
Jeigu, atlikus pirmąją analizę atitinkamai pagal 1 schemoje arba 2 schemoje nurodytą stebėjimo protokolą, neaptinkama jokių nurodyto pobūdžio gyvūninių dalelių (t. y. sausumos gyvūno arba žuvies), papildomos analizės atlikti nebereikia, o apie pirmosios analizės rezultatus pranešama pagal 2.1.5.1 punkto nuostatas.
Jeigu, atlikus pirmąją analizę atitinkamai pagal 1 schemoje arba 2 schemoje nurodytus stebėjimo protokolus, bendras aptiktų nurodytos kilmės (t. y. sausumos gyvūno arba žuvies) gyvūninių dalelių kiekis yra nuo 1 iki 5, paimamas naujas 50 g masės pomėginys ir atliekama antroji analizė. Jeigu, atlikus antrąją analizę, aptiktų nurodyto pobūdžio gyvūninių dalelių kiekis yra nuo 0 iki 5, apie analizės rezultatus pranešama pagal 2.1.5.2 punkto nuostatas; priešingu atveju paimamas naujas 50 g masės pomėginys ir atliekama trečioji analizė. Nepaisant to, jeigu, atlikus pirmąją ir antrąją analizes, per jas aptiktų nurodyto pobūdžio dalelių suma yra didesnė nei 15, papildomos analizės atlikti nebereikia, o apie analizės rezultatus pranešama tiesiogiai pagal 2.1.5.3 punkto nuostatas. Jeigu, atlikus trečiąją analizę, per tris analizes aptiktų nurodyto pobūdžio dalelių suma yra didesnė nei 15, apie analizės rezultatus pranešama pagal 2.1.5.3 punkto nuostatas. Priešingu atveju analizės rezultatai pranešami pagal 2.1.5.2 punkto nuostatas.
Jeigu, atlikus pirmąją analizę atitinkamai pagal 1 schemoje arba 2 schemoje nurodytus stebėjimo protokolus, aptinkama daugiau kaip 5 nurodyto pobūdžio gyvūninės dalelės (t. y. sausumos gyvūno arba žuvies), apie analizės rezultatus pranešama pagal 2.1.5.3 punkto nuostatas.
2.1.5. Rezultatų užrašymas
Pateikdamas rezultatus laboratorija nurodo, su kokios rūšies medžiaga (nuosėdomis, plūdriai ar žaliava) buvo atliekama analizė ir kiek kartų buvo analizuojama.
Laboratorijos ataskaitoje pateikiama informacija bent apie sudedamąsias dalis, gautas iš sausumos gyvūnų ir žuvies.
Įvairi informacija gali būti pranešta toliau nurodytais būdais.
2.1.5.1. Neaptikta jokių nurodyto pobūdžio gyvūninių dalelių:
|
— |
kiek buvo įmanoma įžiūrėti šviesos mikroskopu, pateiktame mėginyje nebuvo aptikta jokių sausumos gyvūnų kilmės dalelių, |
|
— |
kiek buvo įmanoma įžiūrėti šviesos mikroskopu, pateiktame mėginyje nebuvo aptikta jokių žuvų kilmės dalelių, |
2.1.5.2. Vidutiniškai aptikta nuo 1 iki 5 nurodyto pobūdžio gyvūninių dalelių:
|
— |
kiek buvo įmanoma įžiūrėti šviesos mikroskopu, pateiktame mėginyje per kiekvieną analizę vidutiniškai aptikta ne daugiau kaip po penkias sausumos gyvūnų kilmės daleles. Dalelės identifikuotos kaip ... [kaulas, kremzlės, raumuo, plaukai, ragas ir kt.]. Toks nedidelis kiekis, nesiekiantis aptikimo mikroskopu ribos, reiškia, kad negalima atmesti klaidingai teigiamo rezultato prielaidos. |
Arba atitinkamai:
|
— |
kiek buvo įmanoma įžiūrėti šviesos mikroskopu, pateiktame mėginyje per kiekvieną analizę vidutiniškai aptikta ne daugiau kaip po penkias žuvų kilmės daleles. Dalelės identifikuotos kaip ... [žuvies kaulas, žuvies žvynai, kremzlės, raumuo, kaulinė vidinės ausies dalis, žiauna ir kt.]. Toks nedidelis kiekis, nesiekiantis aptikimo mikroskopu ribos, reiškia, kad negalima atmesti klaidingai teigiamo rezultato prielaidos. |
Kai atliekamas paruošiamasis mėginių sijojimas, laboratorijos ataskaitoje nurodoma, kurioje frakcijoje (prasijotoje, granuliuotoje ar branduolių) buvo aptikta gyvūninių dalelių, kadangi jų aptikimas tik prasijotoje frakcijoje gali būti aplinkos užteršimo požymis.
2.1.5.3. Vidutiniškai aptiktos daugiau kaip penkios nurodyto pobūdžio gyvūninės dalelės
|
— |
kiek buvo įmanoma įžiūrėti šviesos mikroskopu, pateiktame mėginyje per kiekvieną analizę vidutiniškai aptikta daugiau kaip po penkias sausumos gyvūnų kilmės daleles. Dalelės identifikuotos kaip ... [kaulas, kremzlė, raumuo, plaukai, ragas ir kt.]. |
Arba atitinkamai:
|
— |
kiek buvo įmanoma įžiūrėti šviesos mikroskopu, pateiktame mėginyje per kiekvieną analizę vidutiniškai aptikta daugiau kaip po penkias žuvų kilmės daleles. Dalelės identifikuotos kaip ... [žuvies kaulas, žuvies žvynai, kremzlės, raumuo, kaulinė vidinės ausies dalis, žiauna ir kt.]. |
Kai atliekamas paruošiamasis mėginių sijojimas, laboratorijos ataskaitoje nurodoma, kurioje frakcijoje (prasijotoje, granuliuotoje ar branduolių) buvo aptikta gyvūninių dalelių, kadangi jų aptikimas tik prasijotoje frakcijoje gali būti aplinkos užteršimo požymis.
2.2. PGR
2.2.1. Principas
Gyvūninės deoksiribonukleorūgšties (toliau – DNR) fragmentai, kurių gali būti pašarinėse žaliavose ir kombinuotame pašare, aptinkami PGR būdu, taikant genų amplifikacijos metodą gyvūno rūšiai būdingiems DNR fragmentams.
Taikant PGR metodą, pirmiausia būtina atlikti DNR išskyrimą. Tokiu būdu gautam DNR ekstraktui vėliau taikoma amplifikacija, siekiant aptikti tikslines gyvūnų rūšis.
2.2.2. Reagentai ir įranga
2.2.2.1. Reagentai
2.2.2.1.1. DNR išskyrimo etapu naudojami reagentai.
Naudojami tik EURL-AP laboratorijos patvirtinti ir jos svetainėje paskelbti reagentai.
2.2.2.1.2. Atliekant genų amplifikaciją naudojami reagentai
2.2.2.1.2.1. Pradmenys ir zondai
Naudojami tik EURL-AP laboratorijos patvirtintų sekų oligonukleotidų pradmenys ir zondai (2).
2.2.2.1.2.2. Reakcijų mišiniai
Naudojami tik tie reakcijų mišinių tirpalai, kuriuose nėra reagentų, kurie sudarytų galimybes gauti klaidingus rezultatus, dėl juose pačiuose esančios gyvūnų DNR (3).
2.2.2.1.2.3. Dezinfekavimo reagentai
2.2.2.1.2.3.1. Druskos rūgšties tirpalas (0,1 N).
2.2.2.1.2.3.2. Chlorkalkės (natrio hipochlorito tirpalas, kuriame yra 0,15 % aktyviojo chloro).
2.2.2.1.2.3.3. Korozijos neskatinantys reagentai, kuriais dezinfekuojami brangūs prietaisai, kaip antai analizės svarstyklės (pvz., „MP Biomedicals“ siūlomas „DNA EraseTM“).
2.2.2.2. Įranga
2.2.2.2.1. Analizės svarstyklės, kurių tikslumas – 0,001 g.
2.2.2.2.2. Smulkinimo įranga.
2.2.2.2.3. Termocikleris, kuriuo galima atlikti PGR realiuoju laiku.
2.2.2.2.4. Mikrocentrifuga, skirta mikrocentrifuginiams mėgintuvėliams.
2.2.2.2.5. Mikropipečių, kuriomis galima įtraukti nuo 1 μl iki 1 000 μl, rinkinys.
2.2.2.2.6. Standartiniai plastikiniai indai, skirti molekulinei biologijai: mikrocentrifuginiai mėgintuvėliai, plastikiniai mikropipečių antgaliai su filtrais, termociklerio plokštelės.
2.2.2.2.7. Šaldikliai, kuriuose saugomi mėginiai ir reagentai.
2.2.3. Mėginių ėmimas ir mėginių ruošimas
2.2.3.1. Mėginių ėmimas
Naudojamas reprezentatyvusis mėginys, paimtas pagal I priedo nuostatas.
2.2.3.2. Mėginių ruošimas
Laboratorinių mėginių paruošimas iki pat DNR išskyrimo turi atitikti II priede nustatytus reikalavimus. Analizės tikslais iš mėginio turi būti paimta bent 50 g pomėginio, kuris vėliau susmulkinamas.
Mėginys ruošiamas patalpoje, kuri nėra skirta DNR išskyrimui ir genų amplifikacijos reakcijoms, kaip aprašyta standarte ISO 24276.
Paruošiamos dvi ne mažesnės kaip 100 mg masės mėginio dalys.
2.2.4. DNR išskyrimas
Vadovaujantis EURL-AP laboratorijos nustatytomis ir jos svetainėje paskelbtomis standartinėmis tyrimo procedūromis atliekamas kiekvienos paruošto mėginio dalies DNR išskyrimas.
Kaip aprašyta standarte ISO 24276, paruošiami du kiekvienos mėginių imties DNR išskyrimo kontroliniai mėginiai:
|
— |
neigiamas DNR išskyrimo kontrolinis mėginys, |
|
— |
teigiamas DNR išskyrimo kontrolinis mėginys. |
2.2.5. Genų amplifikacija
Genų amplifikacija atliekama taikant kiekvienai identifikuotinai rūšiai patvirtintus metodus. Šie metodai pateikti EURL-AP laboratorijos nustatytose ir jos svetainėje paskelbtose standartinėse tyrimo procedūrose. Kiekvienas DNR ekstraktas analizuojamas tą patį DNR ekstraktą praskiedžiant bent dviem skirtingais būdais, siekiant įvertinti inhibiciją.
Paruošiami du kiekvienos tikslinės rūšies amplifikacijos kontroliniai mėginiai, kaip aprašyta standarte ISO 24276:
|
— |
kiekvienai plokštelei arba PGR tyrimų sekai naudojamas teigiamas DNR tikslinis kontrolinis mėginys; |
|
— |
kiekvienai plokštelei arba PGR bandymų sekai naudojamas amplifikacijos reagentų kontrolinis mėginys (vadinamasis neigiamas kontrolinis mėginys, angl. no template control). |
2.2.6. Rezultatų aiškinimas ir dėstymas
Kai pranešami rezultatai, laboratorija nurodo bent naudotų mėginių dalių svorį, taikytą išskyrimo būdą, atliktų analizių skaičių ir metodo aptikimo ribą.
Rezultatai nebus interpretuojami ir pranešami, jeigu, analizuojant tikslinius mėginius, teigiamas DNR išskyrimo kontrolinis mėginys ir teigiamas DNR tikslinis kontrolinis mėginys neduoda teigiamų rezultatų, nors amplifikacijos reagentų kontrolės rezultatas yra neigiamas.
Jeigu, naudojant dvi mėginio dalis, gaunami nenuoseklūs rezultatai, pakartojamas bent genų amplifikacijos etapas. Jeigu laboratorija įtaria, kad nenuoseklumo priežastimi gali būti DNR ekstraktai, prieš aiškinant rezultatus atliekamas naujas DNR išskyrimas, o vėliau – genų amplifikacija.
Galiausiai rezultatas išdėstomas atsižvelgiant į dviejų vieno mėginio dalių tyrimų rezultatus, apibendrintus ir paaiškintus vadovaujantis EURL-AP laboratorijos nustatytomis ir jos svetainėje paskelbtomis standartinėmis tyrimo procedūromis.
2.2.6.1. Neigiamas rezultatas
Neigiamas rezultatas pranešamas taip:
Pateiktame mėginyje neaptikta jokios X DNR (X – analizuojama tikslinė gyvūnų rūšis arba gyvūnų rūšių grupė).
2.2.6.2. Teigiamas rezultatas
Teigiamas rezultatas pranešamas taip:
Pateiktame mėginyje aptikta X DNR (X – analizuojama tikslinė gyvūnų rūšis arba gyvūnų rūšių grupė).“
(1) http://eurl.craw.eu/
(2) Šių pradmenų ir zondų, skirtų kiekvienai analizuojamai gyvūnų rūšiai, sąrašas yra pateiktas EURL-AP laboratorijos svetainėje.
(3) Tinkami „Master Mix“ tirpalų pavyzdžiai pateikti EURL-AP laboratorijos svetainėje.