ISSN 1977-0707
Gazzetta ufficiale
dell'Unione europea
L 204

Edizione in lingua italiana
Legislazione
62° anno
2 agosto 2019
|
ISSN 1977-0707 |
||
|
Gazzetta ufficiale dell'Unione europea |
L 204 |
|

|
||
|
Edizione in lingua italiana |
Legislazione |
62° anno |
|
|
|
|
|
(1) Testo rilevante ai fini del SEE. |
|
IT |
Gli atti i cui titoli sono stampati in caratteri chiari appartengono alla gestione corrente. Essi sono adottati nel quadro della politica agricola ed hanno generalmente una durata di validità limitata. I titoli degli altri atti sono stampati in grassetto e preceduti da un asterisco. |
II Atti non legislativi
REGOLAMENTI
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/1 |
REGOLAMENTO DI ESECUZIONE (UE) 2019/1292 DEL CONSIGLIO
del 31 luglio 2019
che attua l'articolo 21, paragrafo 2, del regolamento (UE) 2016/44 concernente misure restrittive in considerazione della situazione in Libia
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) 2016/44 del Consiglio, del 18 gennaio 2016, concernente misure restrittive in considerazione della situazione in Libia e che abroga il regolamento (UE) n. 204/2011 (1), in particolare l'articolo 21, paragrafo 2,
vista la proposta dell'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza,
considerando quanto segue:
|
(1) |
Il 18 gennaio 2016 il Consiglio ha adottato il regolamento (UE) 2016/44. |
|
(2) |
A norma dell'articolo 21, paragrafo 6, del regolamento (UE) 2016/44, il Consiglio ha riesaminato l'elenco delle persone ed entità designate di cui all'allegato III di tale regolamento. |
|
(3) |
Le voci relative a due persone dovrebbero essere rimosse dall'elenco delle persone ed entità di cui all'allegato III del regolamento (UE) 2016/44. |
|
(4) |
È opportuno pertanto modificare di conseguenza l'allegato III del regolamento (UE) 2016/44, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
L'allegato III del regolamento (UE) 2016/44 è modificato conformemente all'allegato del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 31 luglio 2019
Per il Consiglio
La presidente
T. TUPPURAINEN
ALLEGATO
Nell'allegato III (Elenco delle persone fisiche e giuridiche, delle entità o degli organismi di cui all'articolo 6, paragrafo 2) del regolamento (UE) 2016/44, le voci 1 (relativa a ABDUSSALAM, Abdussalam Mohammed) e 14 (relativa a AL-BAGHDADI, Dr Abdulqader Mohammed) sono soppresse dall'elenco di cui alla sezione A (Persone) e le voci rimanenti sono rinumerate di conseguenza.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/3 |
REGOLAMENTO DI ESECUZIONE (UE) 2019/1293 DELLA COMMISSIONE
del 29 luglio 2019
che modifica il regolamento di esecuzione (UE) n. 577/2013 per quanto riguarda l'elenco dei territori e dei paesi terzi di cui all'allegato II e il modello di certificato sanitario per cani, gatti e furetti di cui all'allegato IV
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) n. 576/2013 del Parlamento europeo e del Consiglio, del 12 giugno 2013, sui movimenti a carattere non commerciale di animali da compagnia e che abroga il regolamento (CE) n. 998/2003 (1), in particolare l'articolo 13, paragrafo 2, e l'articolo 25, paragrafo 2,
considerando quanto segue:
|
(1) |
Il regolamento di esecuzione (UE) n. 577/2013 della Commissione (2) definisce, tra l'altro, gli elenchi dei territori e dei paesi terzi di cui all'articolo 13 del regolamento (UE) n. 576/2013 e il certificato sanitario richiesto per i movimenti a carattere non commerciale verso uno Stato membro di cani, gatti e furetti da territori e paesi terzi. |
|
(2) |
Il regolamento di esecuzione (UE) n. 577/2013 è stato integrato nell'accordo sullo Spazio economico europeo (SEE) con decisione del Comitato misto SEE n. 66/2016 (3) e si applica pienamente alla Norvegia allo stesso modo che agli Stati membri dell'UE. |
|
(3) |
La Norvegia figura nell'elenco dell'allegato II, parte 1, del regolamento di esecuzione (UE) n. 577/2013. La decisione del Comitato misto SEE n. 66/2016 disciplina i movimenti a carattere non commerciale di cani, gatti e furetti provenienti dalla Norvegia. È pertanto necessario cancellare la Norvegia dall'elenco dei territori e dei paesi terzi di cui all'allegato II, parte 1, del regolamento di esecuzione (UE) n. 577/2013. |
|
(4) |
È inoltre necessario che l'ex Repubblica iugoslava di Macedonia» figuri con la nuova denominazione nell'elenco dei territori e dei paesi terzi di cui all'allegato II, parte 2, del regolamento di esecuzione (UE) n. 577/2013. |
|
(5) |
Il regolamento (UE) n. 576/2013 stabilisce, tra l'altro, che i cani, i gatti e i furetti oggetto di movimenti a carattere non commerciale verso uno Stato membro da un territorio o un paese terzo devono rispettare le misure sanitarie preventive per malattie o infezioni diverse dalla rabbia adottate ai sensi dell'articolo 19, paragrafo 1, dello stesso regolamento ed essere accompagnati da un documento di identificazione nel formato di un certificato sanitario. L'allegato IV, parte 1, del regolamento di esecuzione (UE) n. 577/2013 della Commissione stabilisce il modello di certificato sanitario. |
|
(6) |
A seguito del riesame obbligatorio del regolamento delegato (UE) n. 1152/2011 della Commissione (4), la Commissione ha inoltre adottato il regolamento delegato (UE) 2018/772 (5) che stabilisce tra l'altro le norme per la classificazione degli Stati membri, o di parti del loro territorio, in vista del diritto degli stessi di applicare misure sanitarie preventive necessarie alla lotta contro l'infezione da Echinococcus multilocularis nei cani. Il regolamento delegato (UE) 2018/772 ha abrogato il regolamento delegato (UE) n. 1152/2011 con efficacia a decorrere dal 1o luglio 2018. |
|
(7) |
L'elenco degli Stati membri che rispettano le norme di classificazione di cui al regolamento delegato (UE) 2018/772 nella totalità o in parti del loro territorio figura nell'allegato del regolamento di esecuzione (UE) 2018/878 della Commissione (6). |
|
(8) |
Nel modello di certificato sanitario dell'allegato IV del regolamento di esecuzione (UE) n. 577/2013 i riferimenti al regolamento delegato (UE) n. 1152/2011 dovrebbero pertanto essere sostituiti con riferimenti al regolamento delegato (UE) 2018/772 e al regolamento di esecuzione (UE) 2018/878. |
|
(9) |
È pertanto opportuno modificare di conseguenza gli allegati II e IV del regolamento di esecuzione (UE) n. 577/2013. |
|
(10) |
Al fine di evitare perturbazioni negli spostamenti di cani, gatti e furetti, l'uso dei certificati sanitari rilasciati in conformità all'allegato IV, parte 1, del regolamento di esecuzione (UE) n. 577/2013, come modificato dal regolamento di esecuzione (UE) 2016/561 (7) della Commissione, dovrebbe essere autorizzato fino al 28 febbraio 2020. |
|
(11) |
Le misure di cui al presente regolamento sono conformi al parere del comitato permanente per le piante, gli animali, gli alimenti e i mangimi, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Il regolamento di esecuzione (UE) n. 577/2013 è così modificato:
|
1) |
nell'allegato II, la parte 1 è sostituita dal testo riportato nell'allegato I del presente regolamento; |
|
2) |
nell'allegato II, la parte 2 è sostituita dal testo riportato nell'allegato II del presente regolamento; |
|
3) |
nell'allegato IV, la parte 1 è sostituita dal testo riportato nell'allegato III del presente regolamento. |
Articolo 2
Per un periodo transitorio che termina il 28 febbraio 2020 gli Stati membri autorizzano l'entrata di cani, gatti e furetti oggetto di movimenti a carattere non commerciale verso uno Stato membro da un territorio o un paese terzo accompagnati da un certificato sanitario rilasciato entro il 31 ottobre 2019 conformemente al modello figurante nell'allegato IV, parte 1, del regolamento di esecuzione (UE) n. 577/2013 come modificato dal regolamento di esecuzione (UE) 2016/561.
Articolo 3
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a decorrere dal 1o novembre 2019.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 29 luglio 2019
Per la Commissione
Il presidente
Jean-Claude JUNCKER
(1) GU L 178 del 28.6.2013, pag. 1.
(2) Regolamento di esecuzione (UE) n. 577/2013 della Commissione, del 28 giugno 2013, relativo ai modelli dei documenti di identificazione per i movimenti a carattere non commerciale di cani, gatti e furetti, alla definizione di elenchi di territori e paesi terzi, e ai requisiti relativi al formato, all'aspetto e alle lingue delle dichiarazioni attestanti il rispetto di determinate condizioni di cui al regolamento (UE) n. 576/2013 del Parlamento europeo e del Consiglio (GU L 178 del 28.6.2013, pag. 109).
(3) Decisione del Comitato misto SEE n. 66/2016, del 29 aprile 2016, che modifica l'allegato I (Questioni veterinarie e fitosanitarie) dell'accordo SEE [2017/2017] (GU L 300 del 16.11.2017, pag. 1).
(4) Regolamento delegato (UE) n. 1152/2011 della Commissione, del 14 luglio 2011, che completa il regolamento (CE) n. 998/2003 del Parlamento europeo e del Consiglio per quanto riguarda le misure sanitarie preventive necessarie alla lotta contro l'infezione dei cani da Echinococcus multilocularis (GU L 296 del 15.11.2011, pag. 6).
(5) Regolamento delegato (UE) 2018/772 della Commissione, del 21 novembre 2017, che integra il regolamento (UE) n. 576/2013 del Parlamento europeo e del Consiglio per quanto riguarda le misure sanitarie preventive necessarie alla lotta contro l'infezione da Echinococcus multilocularis nei cani e che abroga il regolamento delegato (UE) n. 1152/2011 (GU L 130 del 28.5.2018, pag. 1).
(6) Regolamento di esecuzione (UE) 2018/878 della Commissione, del 18 giugno 2018, che adotta un elenco degli Stati membri, o delle parti del loro territorio, che rispettano le norme di classificazione di cui all'articolo 2, paragrafi 2 e 3, del regolamento delegato (UE) 2018/772 relativo all'applicazione di misure sanitarie preventive per la lotta contro l'infezione da Echinococcus multilocularis nei cani (GU L 155 del 19.6.2018, pag. 1).
(7) Regolamento di esecuzione (UE) 2016/561 della Commissione, dell'11 aprile 2016, che modifica l'allegato IV del regolamento di esecuzione (UE) n. 577/2013 per quanto riguarda il modello di certificato sanitario per cani, gatti e furetti oggetto di movimenti a carattere non commerciale verso uno Stato membro da un territorio o un paese terzo (GU L 96 del 12.4.2016, pag. 26).
ALLEGATO I
«PARTE 1
Elenco dei territori e dei paesi terzi di cui all'articolo 13, paragrafo 1, del regolamento (UE) n. 576/2013
|
Codice ISO |
Territorio o paese terzo |
|
AD |
Andorra |
|
CH |
Svizzera |
|
FO |
Isole Fær Øer |
|
GI |
Gibilterra |
|
GL |
Groenlandia |
|
IS |
Islanda |
|
LI |
Liechtenstein |
|
MC |
Monaco |
|
SM |
San Marino |
|
VA |
Stato della Città del Vaticano» |
ALLEGATO II
«PARTE 2
Elenco dei territori e dei paesi terzi di cui all'articolo 13, paragrafo 2, del regolamento (UE) n. 576/2013
|
Codice ISO |
Territorio o paese terzo |
Territori compresi |
|
AC |
Isola dell'Ascensione |
|
|
AE |
Emirati arabi uniti |
|
|
AG |
Antigua e Barbuda |
|
|
AR |
Argentina |
|
|
AU |
Australia |
|
|
AW |
Aruba |
|
|
BA |
Bosnia-Erzegovina |
|
|
BB |
Barbados |
|
|
BH |
Bahrein |
|
|
BM |
Bermuda |
|
|
BQ |
Bonaire, Sint Eustatius e Saba (Isole BES) |
|
|
BY |
Bielorussia |
|
|
CA |
Canada |
|
|
CL |
Cile |
|
|
CW |
Curaçao |
|
|
FJ |
Figi |
|
|
FK |
Isole Falkland |
|
|
HK |
Hong Kong |
|
|
JM |
Giamaica |
|
|
JP |
Giappone |
|
|
KN |
Saint Kitts e Nevis |
|
|
KY |
Isole Cayman |
|
|
LC |
Santa Lucia |
|
|
MS |
Monserrat |
|
|
MK |
Macedonia del Nord |
|
|
MU |
Maurizio |
|
|
MX |
Messico |
|
|
MY |
Malaysia |
|
|
NC |
Nuova Caledonia |
|
|
NZ |
Nuova Zelanda |
|
|
PF |
Polinesia francese |
|
|
PM |
Saint Pierre e Miquelon |
|
|
RU |
Russia |
|
|
SG |
Singapore |
|
|
SH |
Sant'Elena |
|
|
SX |
Sint Maarten |
|
|
TT |
Trinidad e Tobago |
|
|
TW |
Taiwan |
|
|
US |
Stati Uniti d'America |
AS — Samoa americane GU — Guam MP — Isole Marianne settentrionali PR — Portorico VI — Isole Vergini americane» |
|
VC |
Saint Vincent e Grenadine |
|
|
VG |
Isole Vergini britanniche |
|
|
VU |
Vanuatu |
|
|
WF |
Wallis e Futuna |
|
Allegato III
«PARTE 1
Modello di certificato sanitario per i movimenti a carattere non commerciale di cani, gatti o furetti verso uno Stato membro da un territorio o un paese terzo conformemente all'articolo 5, paragrafi 1 e 2, del regolamento (UE) n. 576/2013
 Testo di immagine
Testo di immagine
 Testo di immagine
Testo di immagine
 Testo di immagine
Testo di immagine
 Testo di immagine
Testo di immagine
 Testo di immagine
Testo di immagine
 Testo di immagine
Testo di immagine
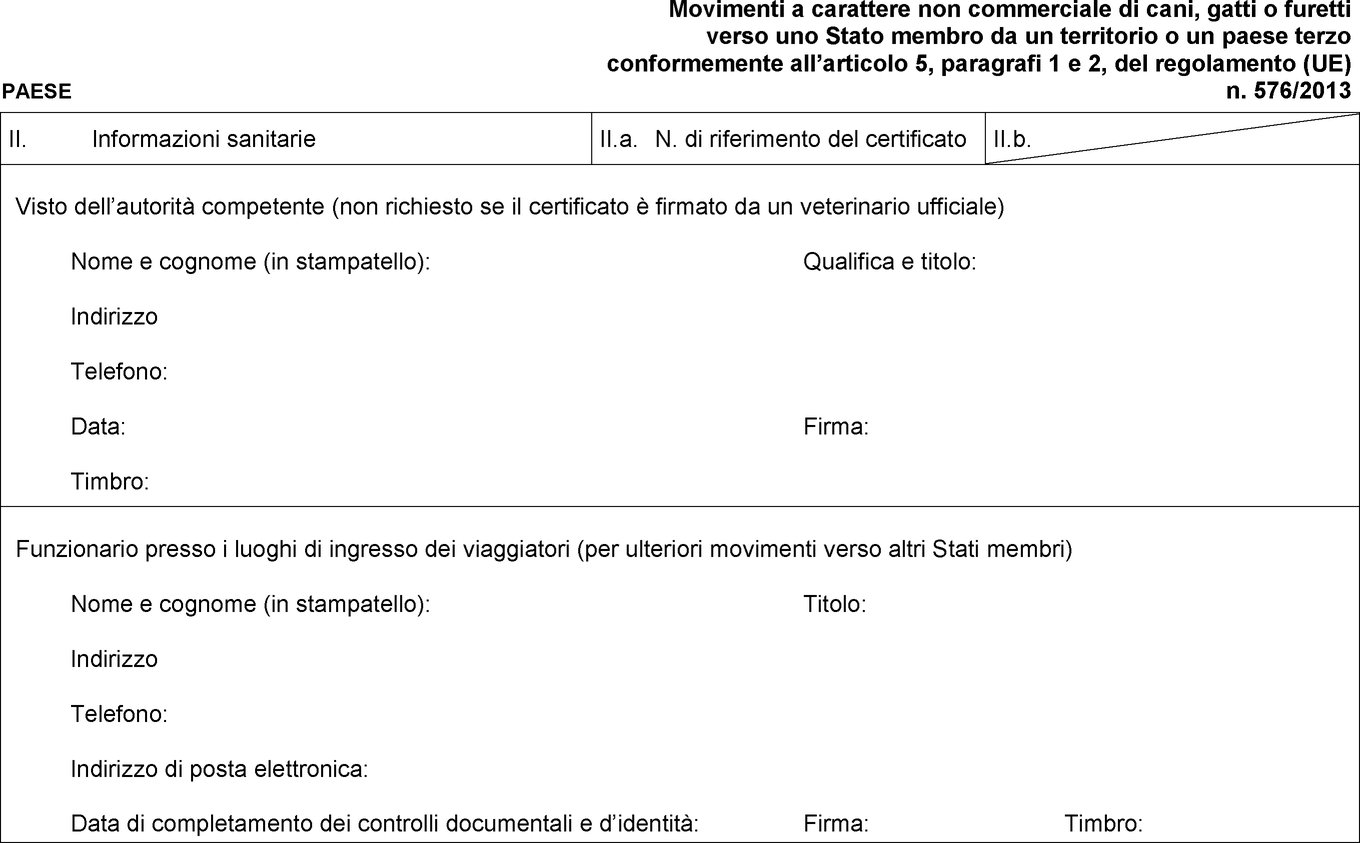 Testo di immagine
»
Testo di immagine
»|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/16 |
REGOLAMENTO DI ESECUZIONE (UE) 2019/1294 DELLA COMMISSIONE
del 1o agosto 2019
che autorizza l'immissione sul mercato della betaina quale nuovo alimento a norma del regolamento (UE) 2015/2283 del Parlamento europeo e del Consiglio e che modifica il regolamento di esecuzione (UE) 2017/2470 della Commissione
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) 2015/2283 del Parlamento europeo e del Consiglio, del 25 novembre 2015, relativo ai nuovi alimenti e che modifica il regolamento (UE) n. 1169/2011 del Parlamento europeo e del Consiglio e abroga il regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio e il regolamento (CE) n. 1852/2001 della Commissione (1), in particolare l'articolo 12,
considerando quanto segue:
|
(1) |
Il regolamento (UE) 2015/2283 dispone che solo i nuovi alimenti autorizzati e inseriti nell'elenco dell'Unione possano essere immessi sul mercato dell'Unione. |
|
(2) |
A norma dell'articolo 8 del regolamento (UE) 2015/2283 è stato adottato il regolamento di esecuzione (UE) 2017/2470 della Commissione (2), che istituisce l'elenco dell'Unione dei nuovi alimenti autorizzati. |
|
(3) |
A norma dell'articolo 12 del regolamento (UE) 2015/2283, la Commissione è tenuta a decidere in merito all'autorizzazione e all'immissione sul mercato dell'Unione di un nuovo alimento e all'aggiornamento dell'elenco dell'Unione. |
|
(4) |
Il 12 giugno 2015 la società DuPont Nutrition Biosciences ApS («il richiedente») ha presentato all'autorità competente della Finlandia una domanda di immissione sul mercato dell'Unione della betaina quale nuovo ingrediente alimentare ai sensi dell'articolo 1, paragrafo 2, lettera e), del regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio (3). La domanda riguarda l'uso della betaina in barrette proteiche e ai cereali, polveri per bevande e bevande isotoniche pronte per l'uso destinate a persone di età superiore a 10 anni che praticano attività sportive nonché in barrette proteiche e ai cereali e alimenti a fini medici speciali e/o nei sostituti dell'intera razione alimentare giornaliera quali definiti nel regolamento (UE) n. 609/2013 (4) del Parlamento europeo e del Consiglio, esclusi gli alimenti destinati ai lattanti e ai bambini nella prima infanzia. |
|
(5) |
A norma dell'articolo 35, paragrafo 1, del regolamento (UE) 2015/2283, qualsiasi domanda di immissione sul mercato dell'Unione di un nuovo alimento, presentata a uno Stato membro a norma dell'articolo 4 del regolamento (CE) n. 258/97 e per la quale non è stata presa alcuna decisione definitiva entro il 1o gennaio 2018, è considerata una domanda a norma del regolamento (UE) 2015/2283. |
|
(6) |
La domanda di immissione sul mercato dell'Unione della betaina quale nuovo alimento è stata presentata a uno Stato membro in conformità all'articolo 4 del regolamento (CE) n. 258/97, ma soddisfa anche i requisiti del regolamento (UE) 2015/2283. |
|
(7) |
Il 21 ottobre 2015 l'autorità competente della Finlandia ha presentato una relazione di valutazione iniziale. In tale relazione essa è giunta alla conclusione che la betaina soddisfa i criteri relativi ai nuovi ingredienti alimentari di cui all'articolo 3, paragrafo 1, del regolamento (CE) n. 258/97. |
|
(8) |
Il 23 ottobre 2015 la Commissione ha trasmesso la relazione di valutazione iniziale agli altri Stati membri. Gli altri Stati membri, entro il termine di 60 giorni di cui all'articolo 6, paragrafo 4, primo comma, del regolamento (CE) n. 258/97, hanno formulato obiezioni motivate in merito agli effetti nocivi osservati al cosiddetto «livello al quale non si osservano effetti nocivi» (NOAEL) proposto dal richiedente per lo studio di tossicità orale cronica e cancerogenicità, allo stretto margine di esposizione tra le dosi di betaina nel quale sono stati osservati gli effetti negli studi tossicologici e alla dose giornaliera di betaina proposta. |
|
(9) |
Alla luce di tali obiezioni motivate, il 4 aprile 2016 la Commissione ha consultato l'Autorità europea per la sicurezza alimentare («l'Autorità»), chiedendole di effettuare una valutazione complementare della betaina quale nuovo ingrediente alimentare in conformità al regolamento (CE) n. 258/97. |
|
(10) |
Il 25 ottobre 2017 l'Autorità ha adottato un parere scientifico sulla sicurezza della betaina quale nuovo prodotto alimentare a norma del regolamento (CE) n. 258/97 (5). Tale parere, sebbene elaborato e adottato dall'Autorità a norma del regolamento (CE) n. 258/97, è in linea con i requisiti di cui all'articolo 11 del regolamento (UE) 2015/2283. |
|
(11) |
Nel suo parere scientifico, l'Autorità, ricorrendo all'approccio basato sulla dose di riferimento (BMD) (6), ha concluso che, per i gruppi di popolazione cui è destinata, la betaina è sicura se aggiunta agli alimenti a una dose massima giornaliera di 400 mg/giorno (6 mg/kg di peso corporeo al giorno). In tale parere l'Autorità ha concluso che la sicurezza della betaina non è stata stabilita per gli usi e i livelli d'uso proposti dal richiedente, che si tradurrebbero in assunzioni di betaina pari a 2 500 mg al giorno. |
|
(12) |
Il 25 gennaio 2018 il richiedente ha presentato alla Commissione una richiesta di tutela dei dati di proprietà industriale per nove studi forniti a sostegno della domanda, nello specifico le relazioni riguardanti uno studio di tossicità orale acuta (7), due studi di tossicità orale subacuta (14 (8) e 28 (9) giorni) e uno di tossicità orale subcronica (10) (42 giorni), tre studi di mutagenicità e genotossicità (11), uno studio di tossicità orale cronica e cancerogenicità (12) e uno studio sull'esposizione alimentare cronica (sei mesi) dell'uomo (13). |
|
(13) |
Il 18 febbraio 2018 l'Autorità ha osservato (14) che, nell'elaborazione del parere sulla betaina quale nuovo alimento, si è avvalsa dei dati dello studio di tossicità orale cronica e cancerogenicità per l'analisi della BMD e per determinare i livelli sicuri di assunzione della betaina per la popolazione destinataria, mentre i dati dello studio sull'esposizione alimentare cronica dell'uomo hanno costituito la base per determinare l'assunzione sicura della betaina per la popolazione destinataria e i dati dei tre studi di genotossicità sono stati utilizzati per attenuare le preoccupazioni relative alla potenziale genotossicità della betaina. L'Autorità ritiene pertanto che le conclusioni sulla sicurezza della betaina non avrebbero potuto essere raggiunte senza i dati della relazione non pubblicata riguardante tali studi. |
|
(14) |
Dopo aver ricevuto le osservazioni dell'Autorità, la Commissione ha chiesto al richiedente di chiarire ulteriormente la motivazione fornita riguardo al diritto di proprietà industriale concernente lo studio di tossicità orale cronica e cancerogenicità, lo studio sull'esposizione alimentare cronica dell'uomo e i tre studi di mutagenicità e genotossicità, e di motivare la rivendicazione di un diritto esclusivo di riferimento a tali studi conformemente all'articolo 26, paragrafo 2, lettera b), del regolamento (UE) 2015/2283. |
|
(15) |
Il richiedente ha dichiarato che al momento della presentazione della domanda deteneva diritti esclusivi di proprietà industriale relativi a tali studi in forza del diritto nazionale e che pertanto i soggetti terzi non potevano accedere legalmente a detti studi né utilizzarli. |
|
(16) |
La Commissione ha valutato tutte le informazioni fornite dal richiedente e ritenuto che quest'ultimo abbia sufficientemente dimostrato la conformità ai requisiti di cui all'articolo 26, paragrafo 2, del regolamento (UE) 2015/2283. Di conseguenza, lo studio di tossicità orale cronica e cancerogenicità, lo studio sull'esposizione alimentare cronica dell'uomo e i tre studi di genotossicità contenuti nel fascicolo del richiedente non dovrebbero essere utilizzati dall'Autorità a vantaggio di un richiedente successivo nei cinque anni a decorrere dalla data di entrata in vigore del presente regolamento. È pertanto opportuno limitare al richiedente, per il suddetto periodo, l'immissione sul mercato dell'Unione della betaina autorizzata dal presente regolamento. |
|
(17) |
Il fatto di limitare l'autorizzazione della betaina e del riferimento agli studi contenuti nel fascicolo del richiedente all'uso esclusivo di quest'ultimo non impedisce tuttavia ad altri richiedenti di presentare una domanda di autorizzazione all'immissione sul mercato dello stesso nuovo alimento, purché la domanda si fondi su informazioni ottenute legalmente a sostegno dell'autorizzazione a norma del presente regolamento. |
|
(18) |
Il 2 novembre 2018 il richiedente ha presentato alla Commissione, ai sensi dell'articolo 10, paragrafo 1, del regolamento (UE) 2015/2283, una domanda di modifica delle condizioni d'uso della betaina, che figuravano nella domanda presentata il 12 giugno 2015 dal richiedente all'autorità competente della Finlandia per l'immissione della betaina sul mercato dell'Unione quale nuovo ingrediente alimentare. Le modifiche richieste riguardano gli usi e i livelli d'uso previsti per la betaina in polveri per bevande, bevande isotoniche, barrette proteiche e ai cereali e alimenti sostitutivi di un pasto destinati a sportivi, nonché l'uso della betaina nei sostituti dell'intera razione alimentare giornaliera per il controllo del peso e negli alimenti a fini medici speciali, quali definiti nel regolamento (UE) n. 609/2013 del Parlamento europeo e del Consiglio, esclusi gli alimenti destinati ai lattanti e ai bambini nella prima infanzia. Tali modifiche richieste garantirebbero che l'assunzione di betaina da parte della popolazione in generale non superi la soglia di 400 mg/giorno (6 mg/kg di peso corporeo al giorno), ritenuta sicura dall'Autorità nel parere del 2017. |
|
(19) |
Il 12 dicembre 2018 la Commissione ha consultato l'Autorità chiedendole di effettuare una valutazione complementare delle modifiche relative agli usi e ai livelli d'uso previsti per la betaina quale nuovo alimento a norma dell'articolo 10, paragrafo 3, del regolamento (UE) 2015/2283. |
|
(20) |
Il 14 marzo 2019 l'Autorità ha adottato un parere scientifico sulla sicurezza della betaina quale nuovo alimento a norma del regolamento (UE) 2015/2283 (15). Tale parere è conforme ai requisiti di cui all'articolo 11 del regolamento (UE) 2015/2283. |
|
(21) |
In tale parere l'Autorità ha concluso che, alle nuove condizioni d'uso proposte, la betaina è sicura. Il parere scientifico fornisce pertanto motivi sufficienti per stabilire che, per gli usi e i livelli d'uso proposti, la betaina è conforme all'articolo 12, paragrafo 1, del regolamento (UE) 2015/2283, se utilizzata come ingrediente in polveri per bevande, bevande isotoniche, barrette proteiche e ai cereali e alimenti sostitutivi di un pasto destinati a sportivi, nonché nei sostituti dell'intera razione alimentare giornaliera per il controllo del peso e negli alimenti a fini medici speciali, quali definiti nel regolamento (UE) n. 609/2013 del Parlamento europeo e del Consiglio, esclusi gli alimenti destinati ai lattanti e ai bambini nella prima infanzia. |
|
(22) |
Il livello sicuro di assunzione della betaina potrebbe essere superato se gli alimenti contenenti betaina sono consumati in combinazione con integratori alimentari che la contengono. È pertanto necessario informare, con un'etichetta appropriata, i consumatori del fatto che gli alimenti contenenti betaina non devono essere utilizzati se nello stesso giorno sono consumati anche gli integratori alimentari contenenti betaina. |
|
(23) |
L'uso della betaina dovrebbe essere autorizzato fatte salve le disposizioni del regolamento (UE) n. 609/2013 che stabilisce i requisiti relativi agli alimenti destinati ai lattanti e ai bambini nella prima infanzia, agli alimenti a fini medici speciali e ai sostituti dell'intera razione alimentare giornaliera per il controllo del peso. |
|
(24) |
Le misure di cui al presente regolamento sono conformi al parere del comitato permanente per le piante, gli animali, gli alimenti e i mangimi, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
1. La betaina, come specificato nell'allegato del presente regolamento, è inserita nell'elenco dell'Unione dei nuovi alimenti autorizzati istituito dal regolamento di esecuzione (UE) 2017/2470.
2. Per un periodo di cinque anni a decorrere dalla data di entrata in vigore del presente regolamento, solo il richiedente iniziale:
|
|
società: DuPont Nutrition Biosciences ApS, |
|
|
indirizzo: Langebrogade 1 DK-1411 Copenhagen K, Danimarca, |
è autorizzato a immettere sul mercato dell'Unione il nuovo alimento di cui al paragrafo 1, salvo nel caso in cui un richiedente successivo ottenga l'autorizzazione per il nuovo alimento senza riferimento ai dati protetti conformemente all'articolo 2 del presente regolamento o con il consenso di DuPont Nutrition Biosciences ApS.
3. La voce figurante nell'elenco dell'Unione di cui al paragrafo 1 comprende le condizioni d'uso e i requisiti in materia di etichettatura indicati nell'allegato del presente regolamento.
4. L'autorizzazione di cui al presente articolo lascia impregiudicate le disposizioni del regolamento (UE) n. 609/2013.
Articolo 2
Gli studi contenuti nel fascicolo della domanda, in base ai quali l'Autorità ha valutato il nuovo alimento di cui all'articolo 1, che secondo quanto sostenuto dal richiedente sono protetti da proprietà industriale e senza i quali il nuovo alimento non avrebbe potuto essere autorizzato, non sono utilizzati a vantaggio di un richiedente successivo nei cinque anni a decorrere dalla data di entrata in vigore del presente regolamento senza il consenso di DuPont Nutrition Biosciences ApS.
Articolo 3
L'allegato del regolamento di esecuzione (UE) 2017/2470 è modificato conformemente all'allegato del presente regolamento.
Articolo 4
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 1o agosto 2019
Per la Commissione
Il presidente
Jean-Claude JUNCKER
(1) GU L 327 dell'11.12.2015, pag. 1.
(2) Regolamento di esecuzione (UE) 2017/2470 della Commissione, del 20 dicembre 2017, che istituisce l'elenco dell'Unione dei nuovi alimenti a norma del regolamento (UE) 2015/2283 del Parlamento europeo e del Consiglio relativo ai nuovi alimenti (GU L 351 del 30.12.2017, pag. 72).
(3) Regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio, del 27 gennaio 1997, sui nuovi prodotti e i nuovi ingredienti alimentari (GU L 43 del 14.2.1997, pag. 1).
(4) Regolamento (UE) n. 609/2013 del Parlamento europeo e del Consiglio, del 12 giugno 2013, relativo agli alimenti destinati ai lattanti e ai bambini nella prima infanzia, agli alimenti a fini medici speciali e ai sostituti dell'intera razione alimentare giornaliera per il controllo del peso e che abroga la direttiva 92/52/CEE del Consiglio, le direttive 96/8/CE, 1999/21/CE, 2006/125/CE e 2006/141/CE della Commissione, la direttiva 2009/39/CE del Parlamento europeo e del Consiglio e i regolamenti (CE) n. 41/2009 e (CE) n. 953/2009 della Commissione (GU L 181 del 29.6.2013, pag. 35).
(5) EFSA Journal 2017; 15 (11): 5057.
(6) EFSA Journal 2017; 15 (1): 4658.
(7) LIFE Science Research Limited, 1990, non pubblicato.
(8) TNO BIBRA, 2001, non pubblicato.
(9) TNO BIBRA, 2001, non pubblicato.
(10) Imasde Aglomentaria, 2012, non pubblicato.
(11) Asquith 1989 a, b, c; non pubblicato.
(12) Hatano Research Institute, 2002, studi non pubblicati.
(13) Relazione non pubblicata, senza data.
(14) Gruppo di esperti scientifici dell'EFSA sui prodotti dietetici, l'alimentazione e le allergie, verbale della 83a sessione plenaria svoltasi il 7-8 febbraio 2018, approvato il 18 febbraio 2018. (https://www.efsa.europa.eu/sites/default/files/event/180207-1-m.pdf)
(15) EFSA Journal 2019; 17 (4): 5658.
ALLEGATO
L'allegato del regolamento di esecuzione (UE) 2017/2470 è così modificato:
|
(1) |
nella tabella 1 (Nuovi alimenti autorizzati), è inserita, in ordine alfabetico, la seguente voce:
|
||||||||||||||||||||||
|
(2) |
nella tabella 2 (Specifiche) è inserita, in ordine alfabetico, la seguente voce:
|
||||||
(*1) Livelli massini d'uso nel prodotto finale pronto per il consumo, commercializzato come tale o ricostituito secondo le istruzioni del produttore»
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/22 |
REGOLAMENTO DI ESECUZIONE (UE) 2019/1295 DELLA COMMISSIONE
del 1o agosto 2019
recante modifica del regolamento di esecuzione (UE) 2018/1469 che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Russia e dell'Ucraina, in seguito a un riesame intermedio parziale a norma dell'articolo 11, paragrafo 3, del regolamento (UE) 2016/1036
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) 2016/1036 del Parlamento europeo e del Consiglio, dell'8 giugno 2016, relativo alla difesa contro le importazioni oggetto di dumping da parte di paesi non membri dell'Unione europea (1) («regolamento di base»), in particolare l'articolo 11, paragrafo 3,
considerando quanto segue:
1. PROCEDURA
1.1. Misure in vigore
|
(1) |
Con il regolamento (CE) n. 954/2006 (2) il Consiglio, in seguito a un'inchiesta («l'inchiesta iniziale»), ha istituito un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Croazia, della Russia e dell'Ucraina. Le misure consistevano in un dazio antidumping ad valorem, compreso tra il 12,3 % e il 25,7 %, istituito nei confronti delle importazioni provenienti da determinati produttori esportatori ucraini, con un'aliquota di dazio residuo del 25,7 % applicata alle importazioni provenienti da tutte le altre società in Ucraina. Il dazio antidumping definitivo istituito nei confronti dell'esportatore produttore oggetto dell'inchiesta di riesame attuale, CJSC Nikopolsky Seamless Tubes Plant Niko Tube e OJSC Nizhnedneprovsky Tube Rolling Plant, la cui denominazione attuale è LLC Interpipe Niko Tube e OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant («il richiedente» o «Interpipe»), era del 25,1 %. |
|
(2) |
A seguito della presentazione, da parte di Interpipe, di una domanda di annullamento del regolamento (CE) n. 954/2006 del Consiglio, il Tribunale dell'Unione europea ha annullato l'articolo 1 del suddetto regolamento, nella parte in cui il dazio antidumping fissato per Interpipe eccedeva quello che sarebbe stato applicabile se non si fosse proceduto ad un adeguamento del prezzo all'esportazione effettuato al titolo di una commissione, laddove invece le vendite avevano avuto luogo con l'intermediazione dell'operatore commerciale collegato Sepco SA (3). Il 16 febbraio 2012 la Corte di giustizia dell'Unione europea ha confermato la sentenza del Tribunale dell'Unione europea (4). |
|
(3) |
In seguito a tali sentenze, il Consiglio ha modificato il regolamento (CE) n. 954/2006 del Consiglio con il regolamento di esecuzione (UE) n. 540/2012 (5), al fine di correggere il dazio antidumping istituito nei confronti di Interpipe che era stato fissato erroneamente. Il dazio applicabile a Interpipe è stato pertanto modificato al 17,7 %. |
|
(4) |
Con il regolamento di esecuzione (UE) n. 585/2012 (6) il Consiglio, a seguito di un riesame in previsione della scadenza, ha mantenuto le misure istituite dal regolamento (CE) n. 954/2006 del Consiglio sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Russia e dell'Ucraina. |
|
(5) |
A seguito di una domanda di Interpipe a norma dell'articolo 11, paragrafo 3, del regolamento di base, il Consiglio, con il regolamento di esecuzione (UE) n. 795/2012 (7), ha modificato le misure definitive istituite dal regolamento di esecuzione (UE) n. 585/2012 per quanto riguarda Interpipe («l'ultimo riesame intermedio»). Il dazio applicabile a Interpipe è stato pertanto modificato al 13,8 %. |
|
(6) |
Con il regolamento di esecuzione (UE) 2018/1469 (8) la Commissione, a seguito di un riesame in previsione della scadenza, ha mantenuto le misure istituite dal regolamento di esecuzione (CE) n. 585/2012 del Consiglio, modificato da ultimo dal regolamento di esecuzione (UE) n. 795/2012 e dal regolamento di esecuzione (UE) n. 1269/2012 del Consiglio (9) sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Russia e dell'Ucraina («l'inchiesta di riesame in previsione della scadenza»). |
|
(7) |
I dazi antidumping attualmente in vigore vanno dal 35,8 % al 24,1 % per le importazioni originarie della Russia e dal 25,7 % al 12,3 % per le importazioni originarie dell'Ucraina. |
1.2. Domanda di riesame intermedio parziale
|
(8) |
Il 7 maggio 2018 la Commissione ha annunciato, con un avviso pubblicato nella Gazzetta ufficiale dell'Unione europea, l'apertura di un riesame intermedio parziale («avviso di apertura») (10) delle misure antidumping applicabili alle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari dell'Ucraina, a norma dell'articolo 11, paragrafo 3, del regolamento di base. |
|
(9) |
Il riesame, la cui portata è limitata all'analisi del dumping del produttore esportatore Interpipe, è stato aperto a seguito di una domanda documentata presentata dalla società. Nella domanda Interpipe ha fornito elementi di prova sufficienti a dimostrare che le circostanze che hanno portato all'istituzione delle misure in vigore sono cambiate e che tale mutamento ha un carattere duraturo. |
1.3. Inchiesta
|
(10) |
L'inchiesta sul livello di dumping ha riguardato il periodo compreso tra il 1o aprile 2017 e il 31 marzo 2018 («il periodo dell'inchiesta di riesame»). |
|
(11) |
La Commissione ha ufficialmente informato dell'apertura del riesame intermedio parziale il richiedente, le autorità del paese esportatore e l'industria dell'Unione. Alle parti interessate è stata offerta la possibilità di comunicare le proprie osservazioni per iscritto e di chiedere un'audizione entro il termine previsto nell'avviso di apertura. |
|
(12) |
Al fine di ottenere le informazioni necessarie per la sua inchiesta, la Commissione ha inviato un questionario al richiedente, che ha risposto entro il termine stabilito. |
|
(13) |
La Commissione ha raccolto e verificato tutte le informazioni ritenute necessarie per determinare il livello del dumping. Sono state effettuate visite di verifica presso le sedi del richiedente e presso le società commerciali collegate LLC Interpipe Ukraine, Interpipe Europe SA e Interpipe Central Trade GmbH. |
2. PRODOTTO OGGETTO DEL RIESAME E PRODOTTO SIMILE
2.1. Prodotto oggetto del riesame
|
(14) |
Il prodotto oggetto del riesame è lo stesso definito nel regolamento di esecuzione (UE) 2018/1469 che ha istituito le misure attualmente in vigore, vale a dire i tubi senza saldature, di ferro o di acciaio, a sezione circolare, con diametro esterno inferiore o uguale a 406,4 mm e un valore equivalente di carbonio (Carbon Equivalent Value, CEV) non superiore a 0,86 secondo la formula e l'analisi chimica dell'Istituto internazionale della saldatura (International Institute of Welding, IIW) (11), originari tra l'altro dell'Ucraina, attualmente classificati con i codici NC ex 7304 11 00, ex 7304 19 10, ex 7304 19 30, ex 7304 22 00, ex 7304 23 00, ex 7304 24 00, ex 7304 29 10, ex 7304 29 30, ex 7304 31 80, ex 7304 39 58, ex 7304 39 92, ex 7304 39 93, ex 7304 51 89, ex 7304 59 92 ed ex 7304 59 93 («il prodotto oggetto del riesame»). |
2.2. Prodotto simile
|
(15) |
Come stabilito dall'inchiesta iniziale e dai successivi riesami, l'inchiesta attuale ha confermato che il prodotto fabbricato in Ucraina ed esportato nell'UE, il prodotto fabbricato e venduto sul mercato interno ucraino e il prodotto fabbricato e venduto nell'UE dai produttori dell'Unione presentano le stesse caratteristiche fisiche e tecniche di base e sono destinati agli stessi usi finali. Questi prodotti sono pertanto considerati prodotti simili ai sensi dell'articolo 1, paragrafo 4, del regolamento di base. |
3. CARATTERE DURATURO DEL MUTAMENTO DI CIRCOSTANZE
|
(16) |
A norma dell'articolo 11, paragrafo 3, del regolamento di base è stato esaminato se il mutamento delle circostanze relative al dumping potesse essere considerato di carattere duraturo. |
|
(17) |
Durante l'inchiesta antidumping iniziale del 2006 e nel riesame intermedio più recente relativo a Interpipe del 2012, riguardante il periodo dell'inchiesta di riesame dal 1o ottobre 2010 al 30 settembre 2011, la principale materia prima per la fabbricazione del prodotto oggetto del riesame, ossia billette a sezione tonda in acciaio, è stata acquistata da Interpipe da fornitori indipendenti. |
|
(18) |
Nella sua domanda di riesame intermedio parziale, il richiedente ha affermato che l'integrazione verticale della LLC Metallurgical Plant «Dneprosteel» nel 2013 ha portato alla produzione interna della principale materia prima (billette in acciaio), il che ha comportato una significativa riduzione dei costi e un cambiamento del portafoglio dei prodotti. Il richiedente ha inoltre affermato che, rispetto ai tipi di prodotto fabbricati ed esportati nel periodo dell'inchiesta di riesame dell'ultimo riesame intermedio, ossia acciaio «standard», ha ora aggiunto prodotti nuovi e più sofisticati (acciai «di qualità», acciai per «tubi per condotta e meccanici») al suo portafoglio di prodotti, che hanno rappresentato una quota importante delle esportazioni totali nell'UE durante l'attuale periodo dell'inchiesta di riesame dal 1o aprile 2017 al 31 marzo 2018. |
|
(19) |
L'inchiesta ha confermato che la principale materia prima è stata prodotta internamente dal richiedente e che tale cambiamento ha comportato una variazione significativa dei costi e del portafoglio prodotti. L'inchiesta ha confermato che i tipi di prodotto esportati nell'UE da Interpipe erano in larga misura diversi da quelli esportati durante il periodo dell'inchiesta di riesame dell'ultimo riesame intermedio. Alla luce di quanto sopra e data la natura strutturale di tali cambiamenti, si è concluso che le modifiche descritte al considerando 17 erano di carattere duraturo e che probabilmente non cambieranno nel prossimo futuro. Di conseguenza, si è ritenuto opportuno riesaminare l'applicazione delle misure in vigore al loro livello attuale. |
|
(20) |
Un ulteriore cambiamento cui il richiedente ha fatto riferimento dopo l'apertura del presente riesame, ossia l'esistenza/costituzione di una joint venture tra Interpipe e Vallourec Tubes, non è stato preso in considerazione poiché è avvenuto successivamente all'apertura del presente riesame intermedio. |
4. DUMPING
4.1.1. Assetto societario e metodologia utilizzata per calcolare il dumping
|
(21) |
Durante il periodo dell'inchiesta di riesame, Interpipe controllava due produttori esportatori interamente di proprietà («le entità produttive»), LLC Interpipe Niko Tube («NIKO») e OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant («NTRP»). |
|
(22) |
Nell'inchiesta iniziale, poiché il sistema contabile del richiedente non permetteva di identificare la società di produzione competente in relazione alle vendite, è stato calcolato un margine di dumping comune aggregando tutti i dati relativi alla produzione, alla redditività e alle vendite nell'UE delle due entità produttive. |
|
(23) |
Al momento dell'ultimo riesame intermedio, a seguito di un sensibile cambiamento dell'assetto societario del gruppo che consente di identificare la società di produzione competente in relazione alle vendite e alla produzione e conformemente all'articolo 2, paragrafi 11 e 12, del regolamento di base, la Commissione non ha più aggregato i dati delle società di produzione, ma ha utilizzato la metodologia standard. Tale metodologia consisteva nel calcolare un margine di dumping comune per i due produttori esportatori, calcolando dapprima l'importo del dumping per ciascun singolo produttore esportatore per determinare successivamente un unico margine di dumping medio ponderato per entrambe le società. |
|
(24) |
Nella presente inchiesta è stato inoltre possibile individuare la società di produzione competente in relazione alle vendite. Pertanto, conformemente all'articolo 2, paragrafi 11 e 12, del regolamento di base e in linea con la prassi consolidata delle istituzioni dell'Unione, è stata applicata la stessa metodologia dell'ultimo riesame intermedio. |
4.1.2. Valore normale
|
(25) |
Conformemente all'articolo 2, paragrafo 2, del regolamento di base la Commissione ha dapprima esaminato se per ciascun produttore esportatore il volume totale delle vendite del prodotto simile ad acquirenti indipendenti sul mercato interno fosse rappresentativo rispetto al volume complessivo delle sue vendite all'esportazione nell'UE, vale a dire se il volume totale di tali vendite corrispondesse ad almeno il 5 % del volume totale delle esportazioni nell'UE del prodotto oggetto di riesame. L'esame ha stabilito che le vendite sul mercato interno erano rappresentative per entrambi i produttori esportatori. |
|
(26) |
La Commissione ha successivamente verificato se le vendite sul mercato interno di Interpipe per il tipo di prodotto identico o comparabile al tipo di prodotto esportato nell'Unione fossero rappresentative conformemente all'articolo 2, paragrafo 2, del regolamento di base. Le vendite sul mercato interno di un tipo di prodotto sono rappresentative se il volume totale delle vendite sul mercato interno di questo tipo di prodotto ad acquirenti indipendenti rappresenta, durante il periodo dell'inchiesta, almeno il 5 % del volume totale delle vendite all'esportazione nell'Unione del tipo di prodotto identico o comparabile. La Commissione ha stabilito che le vendite sul mercato interno del tipo di prodotto, identico o comparabile al tipo di prodotto esportato nell'Unione, sono risultate in larga misura rappresentative durante il periodo dell'inchiesta, dal momento che tra il 60 e l'80 % (12) dei modelli esportati è risultato essere venduto in quantità rappresentative sul mercato interno. |
|
(27) |
Si è poi esaminato se le vendite sul mercato interno di ciascun tipo di prodotto, effettuate in quantità rappresentative, potessero essere considerate come realizzate nel corso di normali operazioni commerciali, conformemente all'articolo 2, paragrafo 4, del regolamento di base. A tale scopo si è determinata, per ciascun tipo di prodotto oggetto del riesame esportato durante il periodo dell'inchiesta di riesame, la percentuale delle vendite effettuate con un margine di profitto ad acquirenti indipendenti sul mercato interno. |
|
(28) |
Per i tipi di prodotto per i quali oltre l'80 % (in volume) delle vendite sul mercato interno era effettuato a un prezzo superiore al costo di produzione e la media ponderata dei prezzi di vendita era pari o superiore al costo unitario di produzione, il valore normale per tipo di prodotto è stato calcolato come media ponderata dei prezzi effettivi di tutte le vendite, remunerative o meno, del tipo di prodotto in questione sul mercato interno. |
|
(29) |
Quando il volume delle vendite remunerative di un tipo di prodotto rappresentava l'80 % o meno del volume totale delle vendite di quel tipo di prodotto o quando la media ponderata dei prezzi di quel tipo di prodotto era inferiore al costo di produzione unitario, il valore normale è stato determinato in base al prezzo effettivamente applicato sul mercato interno, calcolato come media ponderata dei prezzi delle sole vendite remunerative di quel tipo di prodotto effettuate sul mercato interno nel periodo dell'inchiesta di riesame. |
|
(30) |
Dall'analisi delle vendite sul mercato interno è emerso che dal 35 al 55 % (13) di tutte le vendite sul mercato interno del tipo di prodotto che erano identiche o comparabili al tipo di prodotto esportato nell'Unione erano remunerative e che la media ponderata dei prezzi di vendita era superiore al costo di produzione. Il valore normale è quindi stato calcolato come media ponderata delle sole vendite remunerative. |
|
(31) |
Il valore normale per i tipi di prodotto non rappresentativi (ossia quelli per i quali le vendite sul mercato interno hanno rappresentato meno del 5 % delle vendite all'esportazione nell'UE o che non sono stati venduti sul mercato interno) è stato calcolato sulla base del costo di fabbricazione per tipo di prodotto maggiorato di un importo per le spese generali, amministrative e di vendita e per i profitti. In caso di vendite sul mercato interno sono stati utilizzati i profitti relativi alle transazioni effettuate sul mercato interno nel corso di normali operazioni commerciali per tipo di prodotto per i tipi di prodotto in esame. In caso di assenza di vendite sul mercato interno sono stati utilizzati i profitti medi (14). |
|
(32) |
Dopo la divulgazione finale delle informazioni, il gruppo Interpipe ha contestato alcuni degli elementi utilizzati dalla Commissione nel calcolo del valore normale. Le contestazioni riguardavano i seguenti aspetti: i) il calcolo delle SGAV; ii) l'asserita esclusione di altri costi di esercizio; iii) l'utilizzo dei costi finanziari; iv) il doppio conteggio in merito agli adeguamenti dei costi delle SGAV. |
|
(33) |
Dopo aver esaminato gli elementi del fascicolo, la Commissione ha deciso di accettare le argomentazioni addotte in merito ai punti ii) e iv) di cui sopra e di respingere quelle per i punti i) e iii). In considerazione della riservatezza delle informazioni contenute nelle contestazioni formulate dal gruppo Interpipe e nell'analisi da parte della Commissione delle argomentazioni addotte, la Commissione ha proceduto alla data di adozione del presente regolamento a una divulgazione aggiuntiva delle informazioni al gruppo Interpipe, fornendo una motivazione dettagliata. |
|
(34) |
Avendo accettato le argomentazioni addotte per i punti ii) e iv), la Commissione ha proceduto a una revisione del margine di dumping di Interpipe. L'impatto sul margine di dumping è stato delineato in una divulgazione aggiuntiva delle informazioni alla società, la quale è stata invitata a presentare osservazioni. La Commissione ha inoltre informato l'industria dell'Unione delle variazioni del margine di dumping della società. |
|
(35) |
Successivamente alla divulgazione aggiuntiva delle informazioni, Interpipe ha ribadito le argomentazioni respinte dalla Commissione, senza aggiungere nuovi elementi che potessero modificare le conclusioni della Commissione comunicate alla società. |
4.1.3. Prezzo all'esportazione
|
(36) |
Le vendite all'esportazione del prodotto oggetto del riesame nell'UE hanno interessato diverse entità all'interno del gruppo Interpipe: gli stabilimenti, una società di coordinamento con sede in Ucraina («Interpipe Ukraine» o «IPU»), un importatore collegato con sede in Germania («Interpipe Central Trade GmbH» o «IPCT») e un operatore commerciale collegato con sede in Svizzera («Interpipe Europe SA» o «IPE»). |
|
(37) |
Il prezzo all'esportazione è stato stabilito conformemente all'articolo 2, paragrafo 8, del regolamento di base, fatta eccezione per le operazioni effettuate tramite la società collegata operante come importatore (IPCT). In questo caso, il prezzo all'esportazione è stato stabilito in base al prezzo al quale il prodotto importato è stato rivenduto per la prima volta ad acquirenti indipendenti nell'UE, conformemente all'articolo 2, paragrafo 9, del regolamento di base. Sono stati quindi applicati adeguamenti al prezzo per tener conto di tutti i costi sostenuti tra l'importazione e la rivendita nonché di un profitto ragionevole. Tali adeguamenti sono stati calcolati sulla base delle spese generali, amministrative e di vendita dell'IPE e di un profitto teorico ottenuto da un importatore indipendente (2,5 % del fatturato). |
4.1.4. Confronto
|
(38) |
Il valore normale e il prezzo all'esportazione dei due produttori esportatori sono stati confrontati a livello franco fabbrica. Allo scopo di garantire un confronto equo tra il valore normale e il prezzo all'esportazione, si è tenuto debitamente conto, in forma di adeguamenti, delle differenze incidenti sui prezzi e sulla loro comparabilità, conformemente all'articolo 2, paragrafo 10, del regolamento di base. Sono state quindi apportate rettifiche per quanto riguarda costi di trasporto, assicurazione, movimentazione, carico e costi accessori, oneri all'importazione, dazi doganali, commissioni e costo del credito. |
|
(39) |
Durante il periodo dell'inchiesta di riesame, Interpipe ha esportato il prodotto oggetto del riesame nell'UE attraverso due diversi canali di vendita: tramite lo stesso operatore commerciale collegato con sede in Svizzera (IPE) come nell'ultimo riesame intermedio, e tramite una società collegata operante come importatore con sede nell'UE (IPCT), istituita nel 2014. Quest'ultimo canale di distribuzione non esisteva nell'ultimo riesame intermedio. In considerazione della riservatezza delle informazioni contenute nell'analisi della Commissione, quest'ultima ha proceduto alla data di adozione del presente regolamento a una divulgazione aggiuntiva delle informazioni al gruppo Interpipe, fornendo una motivazione dettagliata. |
|
(40) |
Di conseguenza, la Commissione ha ritenuto giustificato un adeguamento a norma dell'articolo 2, paragrafo 10, lettera i), del regolamento di base. Tale adeguamento è stato calcolato deducendo dal prezzo di vendita al primo acquirente indipendente le spese generali, amministrative e di vendita dell'operatore commerciale collegato, che non erano state prese in considerazione ai fini degli adeguamenti, e un profitto teorico ottenuto da un operatore commerciale indipendente (2,5 % del fatturato). |
|
(41) |
Successivamente alla divulgazione finale delle informazioni, il gruppo Interpipe ha contestato la conclusione della Commissione di non trattare IPE come parte di un'unica entità economica insieme alle altre entità NIKO, NTRP e IPU. Dopo aver riesaminato gli elementi del fascicolo, la Commissione ha deciso di respingere tale contestazione. Come indicato al considerando 34, l'impatto sul margine di dumping è stato delineato in una divulgazione aggiuntiva delle informazioni alla società, la quale è stata invitata a presentare osservazioni. Nella sua risposta Interpipe ha ribadito le affermazioni respinte dalla Commissione. Non sono pervenute ulteriori osservazioni a questo proposito. |
|
(42) |
In considerazione della riservatezza delle informazioni contenute nella contestazione formulata dal gruppo Interpipe e nell'analisi da parte della Commissione delle argomentazioni addotte, la Commissione ha proceduto alla data di adozione del presente regolamento a una divulgazione aggiuntiva delle informazioni al gruppo Interpipe, fornendo una motivazione dettagliata. |
4.1.5. Margine di dumping
|
(43) |
A norma dell'articolo 2, paragrafi 11 e 12, del regolamento di base, la media ponderata del valore normale è stata confrontata con la media ponderata del prezzo all'esportazione per tipo di prodotto a livello franco fabbrica separatamente per ciascuno dei due produttori esportatori. Un margine di dumping comune è stato poi stabilito per Interpipe calcolando un unico margine di dumping medio ponderato per entrambi i produttori esportatori appartenenti a Interpipe. |
|
(44) |
Sulla base di quanto sopra, il margine di dumping, espresso come percentuale del prezzo cif franco frontiera dell'Unione, dazio non corrisposto, è pari all'8,1 %. |
|
(45) |
Successivamente alla divulgazione aggiuntiva delle informazioni, ESTA ha sostenuto che la riduzione del margine di dumping di Interpipe è suscettibile di arrecare un ulteriore pregiudizio all'industria dei tubi di acciaio senza saldatura dell'UE. La Commissione osserva che, a norma dell'articolo 9, paragrafo 4, del regolamento di base, l'importo del dazio antidumping non può superare il margine di dumping, che in questo caso è stato fissato all'8,1 %. |
|
(46) |
Il comitato istituito dall'articolo 15, paragrafo 1, del regolamento di base non ha espresso alcun parere, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Nella tabella dell'articolo 1, paragrafo 2, del regolamento di esecuzione (UE) n. 585/2012, la voce relativa a LLC Interpipe Niko Tube e OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) è sostituita dalla seguente:
|
«LLC Interpipe Niko Tube e OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) |
8,1 % |
A743» |
Articolo 2
Il presente regolamento entra in vigore il giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 1o agosto 2019
Per la Commissione
Il presidente
Jean-Claude JUNCKER
(1) GU L 176 del 30.6.2016, pag. 21.
(2) Regolamento (CE) n. 954/2006 del Consiglio, del 27 giugno 2006, che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, della Croazia, della Romania, della Russia e dell'Ucraina, abroga i regolamenti (CE) n. 2320/97 e (CE) n. 348/2000 del Consiglio, chiude il riesame intermedio delle misure antidumping applicabili alle importazioni di taluni tubi di ferro o di acciai non legati, originari, tra l'altro, della Russia e della Romania e chiude il riesame intermedio delle misure antidumping applicabili alle importazioni di taluni tubi senza saldature, di ferro o di acciai non legati, originari della Croazia e dell'Ucraina (GU L 175 del 29.6.2006, pag. 4).
(3) Sentenza del Tribunale di primo grado del 10 marzo 2009, Interpipe Niko Tube e Interpipe NTRP/Consiglio, T-249/06, ECLI:EU:T:2009:62.
(4) Sentenza della Corte di giustizia del 16 febbraio 2012, Consiglio e Commissione/Interpipe Niko Tube e Interpipe NTRP, cause riunite C-191/09 P e C-200/09 P, ECLI:EU:C:2012:78.
(5) Regolamento di esecuzione (UE) n. 540/2012 del Consiglio, del 21 giugno 2012, che modifica il regolamento (CE) n. 954/2006 che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Croazia, della Romania, della Russia e dell'Ucraina (GU L 165 del 26.6.2012, pag. 1).
(6) Regolamento di esecuzione (UE) n. 585/2012 del Consiglio, del 26 giugno 2012, che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Russia e dell'Ucraina in seguito al riesame in previsione della scadenza a norma dell'articolo 11, paragrafo 2, del regolamento (CE) n. 1225/2009 e che chiude il procedimento di riesame in previsione della scadenza riguardante le importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Croazia (GU L 174 del 4.7.2012, pag. 5).
(7) Regolamento di esecuzione (UE) n. 795/2012 del Consiglio, del 28 agosto 2012, recante modifica del regolamento di esecuzione (UE) n. 585/2012 che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Russia e dell'Ucraina, in seguito a un riesame intermedio parziale a norma dell'articolo 11, paragrafo 3, del regolamento (CE) n. 1225/2009 (GU L 238 del 4.9.2012, pag. 1).
(8) Regolamento di esecuzione (UE) 2018/1469 della Commissione, del 1o ottobre 2018, che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari della Russia e dell'Ucraina in seguito al riesame in previsione della scadenza a norma dell'articolo 11, paragrafo 2, del regolamento (UE) n. 2016/1036 del Parlamento europeo e del Consiglio (GU L 246 del 2.10.2018, pag. 20).
(9) Regolamento di esecuzione (UE) n. 1269/2012 del Consiglio, del 21 dicembre 2012, recante modifica del regolamento di esecuzione (UE) n. 585/2012 che istituisce un dazio antidumping definitivo sulle importazioni di alcuni tubi senza saldature, di ferro o di acciaio, originari, tra l'altro, della Russia in seguito a un riesame intermedio parziale a norma dell'articolo 11, paragrafo 3, del regolamento (CE) n. 1225/2009 (GU L 357 del 28.12.2012, pag. 1).
(10) GU C 159 del 7.5.2018, pag. 18.
(11) Il CEV va determinato conformemente al Technical Report, 1967, doc. IX-555-67, pubblicato dall'Istituto internazionale della saldatura (International Institute of Welding, IIW).
(12) La cifra esatta non è fornita poiché si tratta dei dati specifici della società.
(13) La cifra esatta non è fornita poiché si tratta dei dati specifici della società.
(14) Questa modifica della metodologia è dovuta al fatto che dopo l'inchiesta iniziale un gruppo speciale OMC ha presentato la relazione Comunità europee — Misure antidumping applicabili alle importazioni di salmone d'allevamento dalla Norvegia, adottata dall'organo di conciliazione dell'OMC, in cui si stabilisce che non si può trascurare il margine di profitto effettivo stabilito per le transazioni effettuate nel corso di normali operazioni commerciali riguardanti tipi di prodotto pertinenti per cui occorre determinare il valore normale. Cfr. WT/DS337/R del 16 novembre 2007: relazione adottata dall'organo di conciliazione in data 15 gennaio 2008, punti da 7.289 a 7.319.
DECISIONI
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/29 |
DECISIONE (PESC) 2019/1296 DEL CONSIGLIO
del 31 luglio 2019
a sostegno del rafforzamento della sicurezza e protezione biologica in Ucraina in linea con l'attuazione della risoluzione 1540 (2004) del Consiglio di sicurezza delle Nazioni Unite sulla non proliferazione delle armi di distruzione di massa e dei relativi vettori
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sull'Unione europea, in particolare l'articolo 28, paragrafo 1, e l'articolo 31, paragrafo 1,
vista la proposta dell'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza,
considerando quanto segue:
|
(1) |
Il 12 dicembre 2003 il Consiglio europeo ha adottato la strategia dell'UE contro la proliferazione delle armi di distruzione di massa, il cui capitolo II contiene un elenco di misure atte a combattere tale proliferazione. Tali misure devono essere adottate sia nell'Unione sia nei paesi terzi. |
|
(2) |
L'Unione sta attivamente attuando tale strategia e le misure elencate nel relativo capitolo III, in particolare liberando risorse finanziarie a sostegno di specifici progetti condotti da istituzioni multilaterali, fornendo assistenza tecnica e conoscenze specialistiche agli Stati relativamente a un'ampia gamma di misure di non proliferazione e promuovendo il ruolo del Consiglio di sicurezza delle Nazioni Unite (United Nations Security Council – UNSC). |
|
(3) |
Il 28 aprile 2004 l'UNSC ha adottato la risoluzione 1540 (2004) («UNSCR 1540 (2004)»), il primo strumento internazionale che tratta in modo integrato e globale delle armi di distruzione di massa, dei relativi vettori e dei materiali connessi. L'UNSCR 1540 (2004) ha stabilito obblighi vincolanti per tutti gli Stati, il cui scopo era impedire e dissuadere gli attori non statali dall'ottenere l'accesso a tali armi e materiali connessi. L'UNSC ha inoltre stabilito che tutti gli Stati devono adottare e applicare misure efficaci per istituire controlli interni volti a prevenire la proliferazione di armi nucleari, chimiche o biologiche e dei loro vettori, anche introducendo controlli adeguati sui materiali connessi. |
|
(4) |
L'11 maggio 2017 il Consiglio ha adottato la decisione (PESC) 2017/809 (1) a sostegno dell'attuazione dell'UNSCR 1540 (2004). L'esecuzione tecnica delle attività previste dalla decisione (PESC) 2017/809 è affidata all'Ufficio delle Nazioni Unite per gli affari del disarmo (UN Office for Disarmament Affairs – UNODA) in collaborazione con le pertinenti organizzazioni regionali internazionali, in particolare l'Organizzazione per la sicurezza e la cooperazione in Europa (Organisation for Security and Cooperation in Europe – OSCE). |
|
(5) |
L'11 luglio 2017 il Consiglio ha adottato la decisione (PESC) 2017/1252 (2) a sostegno del rafforzamento della sicurezza e protezione chimica in Ucraina in linea con l'attuazione dell'UNSCR 1540 (2004). L'esecuzione tecnica delle attività previste dalla decisione (PESC) 2017/1252 è affidata al segretariato OSCE. |
|
(6) |
L'adesione universale alla Convenzione sulle armi biologiche e tossiche (Biological and Toxin Weapons Convention – BTWC) e all'UNSCR 1540 (2004) e la loro piena attuazione sono tra le priorità principali dell'Ucraina nel campo della non proliferazione delle armi di distruzione di massa. |
|
(7) |
Il 21 marzo e il 27 giugno 2014 l'Unione e l'Ucraina hanno firmato un accordo di associazione (3) che prevede, tra l'altro, una rapida armonizzazione della legislazione nazionale ucraina con la pertinente legislazione dell'Unione, compresa l'eliminazione di eventuali ostacoli all'attuazione integrale in Ucraina dell'UNSCR 1540 (2004). Alcune parti dell'accordo di associazione UE-Ucraina sono applicate in via provvisoria dal 1o novembre 2014. L'accordo di associazione UE-Ucraina è entrato in vigore il 1o settembre 2017. |
|
(8) |
Secondo il piano d'azione del governo ucraino per l'attuazione dell'accordo di associazione UE-Ucraina per gli anni 2018-2020, l'Ucraina si è impegnata a sviluppare e migliorare la regolamentazione e i meccanismi nel settore della sicurezza e protezione biologica in linea con gli obblighi ad essa derivanti dalla BTWC e dall'UNSCR 1540 (2004) nonché con le norme e gli standard internazionali, in particolare la pertinente legislazione dell'UE. |
|
(9) |
In tale contesto, il segretariato OSCE, in stretta cooperazione con le autorità competenti ucraine, ha elaborato tre proposte di progetto nella prospettiva di rafforzare la sicurezza e protezione biologica generale in Ucraina. |
|
(10) |
Il segretariato OSCE dovrebbe essere incaricato dell'esecuzione tecnica dei progetti da realizzare a norma della presente decisione. |
|
(11) |
I progetti dovrebbero essere eseguiti in linea con le disposizioni corrispondenti del piano d'azione del governo ucraino per l'attuazione dell'accordo di associazione UE-Ucraina. Le attività dovrebbero tenere conto delle pertinenti buone pratiche e degli insegnamenti tratti dall'attuazione della decisione (PESC) 2017/1252. |
|
(12) |
Il segretariato OSCE dovrebbe garantire una cooperazione efficace con le organizzazioni e gli organismi internazionali pertinenti, quali l'Unità di supporto all'attuazione della BTWC, il comitato del Consiglio di sicurezza delle Nazioni Unite istituito a norma dell'UNSCR 1540 (2004), l'Ufficio internazionale delle epizoozie (OIE) e il partenariato globale contro la diffusione di armi e materiali di distruzione di massa. Esso dovrebbe inoltre garantire complementarità e sinergia di progetti intrapresi in seguito alla presente decisione con pertinenti progetti e attività passati e in corso in Ucraina sostenuti da singoli Stati membri dell'UE e da altri programmi finanziati dall'Unione in questo settore, compresi lo strumento inteso a contribuire alla stabilità e alla pace e i centri di eccellenza dell'UE in materia di attenuazione del rischio chimico, biologico, radiologico e nucleare, |
HA ADOTTATO LA PRESENTE DECISIONE
Articolo 1
1. Al fine di promuovere la pace e la sicurezza, nonché un multilateralismo efficace a livello globale e regionale, l'Unione persegue i seguenti obiettivi:
|
— |
rafforzare la sicurezza e protezione biologica in Ucraina migliorando la base legislativa e regolamentare di tale paese e il suo sistema sanitario umano e veterinario e sensibilizzando gli scienziati della vita; |
|
— |
favorire un multilateralismo efficace a livello regionale sostenendo l'azione dell'OSCE volta a rafforzare le capacità delle autorità competenti ucraine nel campo della sicurezza e protezione biologica in linea con gli obblighi derivanti dall'UNSCR 1540 (2004) e dalla BTWC. |
2. Per conseguire gli obiettivi di cui al paragrafo 1, l'Unione intraprende i seguenti progetti:
|
— |
armonizzazione della regolamentazione vigente in Ucraina in materia di biosicurezza e bioprotezione con gli standard internazionali; |
|
— |
creazione di un sistema sostenibile di sorveglianza veterinaria in Ucraina per le malattie legate a patogeni particolarmente pericolosi; |
|
— |
sensibilizzazione, istruzione e formazione degli scienziati della vita in materia di biosicurezza e bioprotezione. |
Una descrizione particolareggiata dei progetti di cui sopra figura nell'allegato.
Articolo 2
1. L'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza («alto rappresentante») è responsabile dell'attuazione della presente decisione.
2. L'esecuzione tecnica dei progetti di cui all'articolo 1, paragrafo 2, è assicurata dal segretariato OSCE, che svolge tale compito sotto il controllo dell'alto rappresentante. A tal fine, l'alto rappresentante conclude gli accordi necessari con il segretariato OSCE.
Articolo 3
1. L'importo di riferimento finanziario per l'esecuzione dei progetti di cui all'articolo 1, paragrafo 2, è pari a 1 913 900 EUR.
2. Le spese finanziate con l'importo di cui al paragrafo 1 sono gestite in conformità delle procedure e delle norme applicabili al bilancio generale dell'Unione.
3. La Commissione vigila sulla corretta gestione delle spese di cui al paragrafo 1. A tal fine conclude un accordo di finanziamento con il segretariato OSCE. Tale accordo prevede che il segretariato OSCE assicuri la visibilità del contributo dell'Unione corrispondente all'entità di tale contributo.
4. La Commissione si adopera per concludere l'accordo di finanziamento di cui al paragrafo 3 non appena possibile dopo l'entrata in vigore della presente decisione. La Commissione informa il Consiglio di ogni difficoltà in tale procedimento e della data di conclusione dell'accordo di finanziamento.
Articolo 4
L'alto rappresentante riferisce al Consiglio in merito all'attuazione della presente decisione, fondandosi sulle relazioni periodiche stilate dal segretariato OSCE. Su tali relazioni si basa la valutazione del Consiglio. La Commissione fornisce informazioni sugli aspetti finanziari dei progetti di cui all'articolo 1, paragrafo 2.
Articolo 5
1. La presente decisione entra in vigore il giorno dell'adozione.
2. La presente decisione cessa di produrre effetti 36 mesi dopo la conclusione dell'accordo di finanziamento di cui all'articolo 3, paragrafo 3, o sei mesi dopo la data di adozione se l'accordo di finanziamento non è stato concluso entro tale termine.
Fatto a Bruxelles, il 31 luglio 2019
Per il Consiglio
La presidente
T. TUPPURAINEN
(1) Decisione (PESC) 2017/809 del Consiglio, dell'11 maggio 2017, a sostegno dell'attuazione della risoluzione 1540 (2004) del Consiglio di sicurezza delle Nazioni Unite sulla non proliferazione delle armi di distruzione di massa e dei relativi vettori (GU L 121 del 12.5.2017, pag. 39).
(2) Decisione (PESC) 2017/1252 del Consiglio, dell'11 luglio 2017, a sostegno del rafforzamento della sicurezza e protezione chimica in Ucraina in linea con l'attuazione della risoluzione 1540 (2004) del Consiglio di sicurezza delle Nazioni Unite sulla non proliferazione delle armi di distruzione di massa e dei relativi vettori (GU L 179 del 12.7.2017, pag. 8).
(3) Accordo di associazione tra l'Unione europea e la Comunità europea dell'energia atomica e i loro Stati membri, da una parte, e l'Ucraina, dall'altra (GU L 161 del 29.5.2014, pag. 3).
ALLEGATO
Rafforzare la sicurezza e protezione biologica in Ucraina in linea con la UNSCR 1540 (2004)
1. Contesto
La legislazione ucraina che vieta le armi biologiche è dettagliata e completa. Tuttavia, buona parte di tale legislazione e regolamentazione è obsoleta e non è conforme alle norme e agli standard internazionali e pertanto richiede con urgenza una revisione e un aggiornamento allo scopo di armonizzarla maggiormente con i pertinenti standard mondiali.
L'Ucraina non ha una normativa quadro in materia di biosicurezza e bioprotezione che consenta di predisporre un sistema di biosicurezza e bioprotezione e di assicurarne il buon funzionamento (per esempio, stabilendo per legge l'organismo esecutivo centrale responsabile della biosicurezza e bioprotezione e incaricato di svolgere funzioni specialistiche e di monitoraggio). Inoltre, non esiste attualmente una cooperazione generale tra tutti i ministeri, le agenzie e le organizzazioni interessati per prevenire e dare una risposta alle situazioni di emergenza collegate a minacce biologiche.
Mancano anche meccanismi che consentano allo Stato di controllare il rispetto delle prescrizioni in materia di bioprotezione per le attività con uso di agenti biologici. Non esiste un registro dei soggetti, economici e non, che trattano agenti biologici pericolosi nel territorio ucraino e tali soggetti non sono inoltre tenuti per legge ad essere in possesso di apposita autorizzazione. Di fatto, l'abolizione del sistema di autorizzazione ha portato a una situazione in cui non è prevista né la comunicazione né il controllo del rispetto delle prescrizioni in materia di biosicurezza e bioprotezione applicabili nei laboratori di microbiologia, il cui numero effettivo è sconosciuto. Un documento normativo che disciplinava la contabilizzazione, il trasporto, la conservazione e il trasferimento di materiali biologici pericolosi è stato annullato. I documenti applicabili prestano scarsa attenzione ad altri aspetti della bioprotezione, come la verifica dell'affidabilità del personale e tutela delle informazioni riservate.
Per via del ritmo di crescita della produzione agricola, della bioproduzione, dei trasporti e delle relazioni commerciali esterne nel mondo moderno, la medicina umana e veterinaria è confrontata a molti problemi specificamente correlati al rischio di proliferazione di materiali biologici, in particolare malattie infettive e parassitarie frequenti nelle persone e negli animali.
Le principali minacce per la sicurezza biologica e alimentare in Ucraina sono oggi associate alla peste suina africana, all'influenza aviaria, all'afta epizootica e ai batteri patogeni multiresistenti. Esistono rischi naturali localizzati di focolai di carbonchio, rabbia, peste suina classica e tularemia. Assicurare la sicurezza alimentare e biologica è una questione sensibile che non può essere risolta senza ricorrere a mezzi affidabili di monitoraggio, previsione e diagnosi precoce di infezioni animali emergenti ed economicamente significative, tra cui le infezioni zoonotiche. La sicurezza biologica e alimentare in Ucraina può provenire solo dall'integrazione della ricerca di base nel campo della genetica e della biotecnologia molecolare nella medicina e diagnostica umana e veterinaria.
Anche se il personale della maggioranza dei laboratori ucraini di scienze della vita è esperto nella manipolazione di materiali biologici pericolosi, è molto raro che nei laboratori si applichino i principi e approcci moderni in materia di biosicurezza e bioprotezione, le tecniche e pratiche moderne e codici di condotta legati alle pratiche moderne. Un buon numero di laboratori di scienze della vita possiede una certa quantità, seppur limitata, di attrezzature moderne; ma, per mancanza di formazione operativa il personale di laboratorio non le usa o le usa in modo inappropriato. Oltre a ciò, l'attuale sistema di formazione avanzata per alcune categorie di scienziati della vita non copre tutti i pertinenti aspetti di biosicurezza e bioprotezione. Tutti questi fattori possono far calare il livello di biosicurezza e bioprotezione dei laboratori in cui sono manipolati materiali biologici pericolosi.
In seguito all'analisi sopra riportata, l'OSCE ha predisposto tre progetti con l'obiettivo di rafforzare la sicurezza e protezione biologica generale in Ucraina. Tali progetti sono stati sviluppati in cooperazione con le pertinenti autorità ucraine. Tutti i progetti saranno eseguiti in linea con le disposizioni corrispondenti del piano d'azione del governo ucraino per l'attuazione dell'accordo di associazione UE-Ucraina.
I progetti sarebbero eseguiti anche tenendo conto delle pertinenti buone pratiche e degli insegnamenti tratti dall'attuazione in corso della decisione (PESC) 2017/1252 a sostegno del rafforzamento della sicurezza e protezione chimica in Ucraina.
2. Obiettivo
L'obiettivo generale della presente decisione è sostenere i progetti dell'OSCE volti a rafforzare la sicurezza e protezione biologica in Ucraina in linea con gli obblighi derivanti a quest'ultima dalla BTWC e dall'UNSCR 1540 (2004), nonché nel rispetto dell'accordo di associazione UE-Ucraina.
3. Descrizione dei progetti
3.1. Armonizzazione della regolamentazione vigente in Ucraina in materia di biosicurezza e bioprotezione con gli standard internazionali.
3.1.1. Obiettivo del progetto
|
— |
Migliorar la base legislativa e regolamentare dell'Ucraina in materia di sicurezza e protezione biologica, in linea con gli obblighi derivanti dall'UNSCR 1540 (2004), vale a dire adottare e applicare leggi adeguate ed efficaci che vietino a qualsiasi soggetto non statale di fabbricare, acquisire, possedere, sviluppare, trasportare, trasferire o utilizzare armi biologiche e relativi vettori, in particolare per scopi terroristici. |
3.1.2. Descrizione del progetto
|
— |
Le misure specifiche connesse ai miglioramenti legislativi e regolamentari nel settore della biosicurezza e bioprotezione che devono essere attuate in via prioritaria e che saranno direttamente sostenute dal presente progetto comprendono quanto segue:
|
3.1.3 Risultati attesi del progetto
|
— |
Miglioramento del sistema ucraino di biosicurezza e bioprotezione attraverso un rafforzamento del quadro legislativo e regolamentare nazionale in questo campo; |
|
— |
promozione della collaborazione tra le varie agenzie responsabili della biosicurezzza e bioprotezione; |
|
— |
conseguimento di un sistema di biosicurezza e bioprotezione sostenibile in Ucraina. |
3.1.4 Beneficiari del progetto
|
— |
Ministero della sanità. |
3.2 Creazione di un sistema sostenibile di sorveglianza veterinaria in Ucraina per le malattie legate a patogeni particolarmente pericolosi
3.2.1. Obiettivo del progetto
|
— |
Migliorare la biosicurezza e la bioprotezione rafforzando il sistema sanitario umano e veterinario in Ucraina, in linea con gli obblighi derivanti dall'UNSCR 1540 (2004), in particolare attraverso l'applicazione di misure efficaci per istituire controlli interni volti a prevenire la proliferazione di armi biologiche e dei loro vettori, anche introducendo controlli adeguati sui materiali connessi. |
3.2.2. Descrizione del progetto
|
— |
Esecuzione di un monitoraggio efficace delle malattie umane e animali attraverso la creazione di un centro condiviso per il sequenziamento e la caratterizzazione genetica di determinati agenti e la dotazione agli istituti partecipanti di apparecchi per la retrotrascrizione-reazione a catena della polimerasi (RT-PCR); |
|
— |
definizione di misure di reazione rapida in situazioni di emergenza e introduzione di una diagnosi rapida delle malattie animali particolarmente pericolose attraverso lo sviluppo di strumenti diagnostici basati sulla RT-PCR per l'individuazione tramite PCR di determinati agenti (agenti responsabili di: influenza aviaria, malattia di Newcastle, tubercolosi multiresistente, dermatite nodulare contagiosa, tularemia, peste suina africana, peste suina classica, afta epizootica, brucellosi, salmonelle multiresistenti e carbonchio) partendo da protocolli interni elaborati in Ucraina; |
|
— |
conservazione in condizioni di sicurezza dei patogeni, inclusi i patogeni zoonotici, i virali e quelli batterici, nei laboratori e nei depositi attraverso lo sviluppo di fascicoli di registrazione per i kit basati sulla RT-PCR; |
|
— |
definizione di un approccio tecnico unificato nel campo della valutazione di conformità per i laboratori di prova, ottenimento della fiducia a livello nazionale e internazionale, definizione di condizioni in materia di reciproco riconoscimento delle prestazioni e trasparenza, sensibilizzazione e competenza nel settore della protezione biologica; |
|
— |
sviluppo delle capacità nella diagnostica molecolare delle malattie legate a patogeni particolarmente pericolosi. |
3.2.3. Risultati attesi del progetto
|
— |
Rafforzamento della capacità nazionale di sorveglianza e previsione nella medicina veterinaria; |
|
— |
sviluppo di strumenti nazionali efficaci di diagnostica e sorveglianza, sulla base di apparecchiature per l'RT-PCR e la PCR isotermica (R&S, validazione e implementazione nei laboratori); |
|
— |
esecuzione di un monitoraggio efficace delle malattie animali (incluse le malattie zoonotiche); |
|
— |
creazione di capacità umane nel settore della diagnostica molecolare di malattie legate a patogeni particolarmente pericolosi (formazioni in tecniche di PCR in laboratorio). |
3.2.4. Beneficiari del progetto
|
— |
Servizio pubblico ucraino per la sicurezza alimentare e la protezione dei consumatori; |
|
— |
destinatario dell'assistenza: Centro scientifico nazionale «Istituto di medicina veterinaria sperimentale e clinica» (Kharkiv, Ucraina). |
3.3 Sensibilizzazione, istruzione e formazione per gli scienziati della vita in materia di biosicurezza e bioprotezione
3.3.1. Obiettivo del progetto
|
— |
Migliorare la sicurezza e la protezione biologica e la bioetica in Ucraina sensibilizzando gli scienziati della vita nel campo della biosicurezza e bioprotezione, in linea con gli obblighi derivanti dall'UNSCR 1540 (2004), ivi compresa l'attuazione di misure nazionali efficaci per prevenire la proliferazione delle armi biologiche e dei relativi vettori. |
3.3.2. Descrizione del progetto
|
— |
Creazione di un gruppo di formatori provenienti dai diversi istituti ucraini di scienze della vita che saranno in grado di divulgare le conoscenze moderne in materia di biosicurezza, bioprotezione e principi bioetici, le migliori pratiche di laboratorio e le tecniche e i metodi per la gestione dei rischi biologici nei laboratori; |
|
— |
miglioramento delle risorse attuali per l'ulteriore divulgazione delle conoscenze e la sensibilizzazione in materia di biosicurezza, bioprotezione e bioetica tra docenti, studenti e ricercatori in scienze della vita e altri soggetti interessati, tenendo pienamente conto del progetto P633 del centro di scienza e tecnologia in Ucraina «Istruzione e sensibilizzazione in Ucraina»; |
|
— |
mantenimento delle capacità di formazione dopo il completamento del progetto. |
3.3.3. Risultati attesi del progetto
|
— |
Maggiore consapevolezza da parte dei soggetti interessati nazionali e locali nel settore della sicurezza e protezione biologica; |
|
— |
maggiore capacità degli scienziati della vita di manipolare materiali biologici pericolosi in condizioni di sicurezza; |
|
— |
maggiore capacità degli scienziati della vita ucraini di ridurre i rischi di possibile uso improprio di materiali e attrezzature impiegati per la loro ricerca nonché delle loro conoscenze e dei loro risultati; |
|
— |
costituzione di un gruppo di formatori ferrato in materia di biosicurezza e bioprotezione per gli scienziati della vita; |
|
— |
risorse migliori e durature per la divulgazione a distanza delle conoscenze in materia di biosicurezza, bioprotezione e bioetica. |
3.4. Beneficiari del progetto
|
— |
Ministero della sanità. |
4. Sostegno amministrativo per l'esecuzione dei progetti
Personale dedicato presso il segretariato OSCE e l'ufficio del coordinatore dei progetti OSCE in Ucraina coordinerà e gestirà l'esecuzione delle attività di progetto di cui al punto 3 al fine di sviluppare ulteriormente il quadro di collaborazione tra i partner ucraini, anche mediante lo sviluppo di nuove proposte di progetti e misure nazionali pertinenti.
Il personale di sostegno svolgerà i seguenti compiti:
|
— |
gestire i progetti in tutte le fasi del ciclo del progetto; |
|
— |
effettuare la vigilanza finanziaria ordinaria dei progetti; |
|
— |
prestare consulenze tecniche e giuridiche, sostenere le grandi gare d'appalto, coinvolgere altre organizzazioni internazionali, effettuare garanzia della qualità e controllo della qualità dei risultati tangibili dei progetti approvati, e riferire all'Unione europea. |
5. Durata
La durata totale stimata dei progetti è di 36 mesi.
6. Ente incaricato dell'attuazione tecnica
L'attuazione tecnica della presente decisione sarà affidata al Centro per la prevenzione dei conflitti del segretariato OSCE e al coordinatore dei progetti OSCE in Ucraina. L'OSCE eseguirà le attività ai sensi della presente decisione in cooperazione con altre agenzie e organizzazioni internazionali, in particolare al fine di garantire efficaci sinergie ed evitare duplicazioni.
7. Relazioni
Il segretariato OSCE elaborerà relazioni periodiche, nonché relazioni dopo il completamento di ciascuna delle attività descritte. Le relazioni finali dovrebbero essere presentate all'Unione europea non oltre sei settimane dopo il completamento delle attività cui si riferiscono.
8. Comitato direttivo
Il comitato direttivo per i progetti sarà composto di un rappresentante dell'alto rappresentante e di un rappresentante dell'ente incaricato dell'attuazione di cui al punto 6 del presente allegato. Il comitato direttivo esaminerà l'attuazione della presente decisione periodicamente, e almeno ogni sei mesi, anche facendo uso di mezzi di comunicazione elettronici.
9. Stima del costo totale dei progetti e contributo finanziario dell'Unione europea
Il costo totale dei progetti è pari a 1 913 900 EUR.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/36 |
DECISIONE (PESC) 2019/1297 DEL CONSIGLIO
del 31 luglio 2019
che modifica la decisione (PESC) 2016/2382, che istituisce l'Accademia europea per la sicurezza e la difesa (AESD)
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sull'Unione europea, in particolare l'articolo 28, paragrafo 1, l'articolo 42, paragrafo 4, e l'articolo 43, paragrafo 2,
vista la proposta dell'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza,
considerando quanto segue:
|
(1) |
Il 21 dicembre 2016 il Consiglio ha adottato la decisione (PESC) 2016/2382 (1), che ha istituito l'Accademia europea per la sicurezza e la difesa (AESD). |
|
(2) |
Il 14 maggio 2018 il Consiglio ha adottato la decisione (PESC) 2018/712 (2), che ha affidato all'AESD la creazione di una piattaforma informatica in materia di istruzione, formazione, valutazione ed esercitazioni, sottolineando nel contempo la necessità di assicurare la complementarità con altri impegni e iniziative dell'Unione. |
|
(3) |
Il 6 novembre 2018 il Consiglio ha adottato la decisione (PESC) 2018/1655 (3), che ha modificato la decisione (PESC) 2016/2382 e ha stabilito un importo finanziario di riferimento per il periodo dal 1o gennaio 2019 al 31 dicembre 2019. |
|
(4) |
Il 20 settembre 2018 il comitato politico e di sicurezza ha adottato il mandato del gruppo di formazione civile dell'UE in quanto configurazione speciale del comitato per gli aspetti civili della gestione delle crisi. |
|
(5) |
Il 15 marzo 2019, durante la riunione del gruppo di formazione civile dell'UE, gli Stati membri hanno segnalato l'esigenza di un sostegno finanziario dell'Unione per i coordinatori civili della formazione. |
|
(6) |
Il 3 giugno 2019 il comitato direttivo dell'AESD ha deciso che l'AESD debba amministrare e gestire i costi connessi alle spese di viaggio e soggiorno dei coordinatori civili della formazione. |
|
(7) |
È pertanto opportuno modificare di conseguenza la decisione (PESC) 2016/2382, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
All'articolo 4, paragrafo 3, della decisione (PESC) 2016/2382 è aggiunto il punto seguente:
|
«j) |
sostiene il comitato per gli aspetti civili della gestione delle crisi e il gruppo di formazione civile dell'UE amministrando e gestendo le spese di viaggio e soggiorno relative alle attività dei coordinatori civili della formazione.». |
Articolo 2
La presente decisione entra in vigore il giorno dell'adozione.
Fatto a Bruxelles, il 31 luglio 2019
Per il Consiglio
La presidente
T. TUPPURAINEN
(1) Decisione (PESC) 2016/2382 del Consiglio, del 21 dicembre 2016, che istituisce l'Accademia europea per la sicurezza e la difesa (AESD) e abroga la decisione 2013/189/PESC (GU L 352 del 23.12.2016, pag. 60).
(2) Decisione (PESC) 2018/712 del Consiglio, del 14 maggio 2018, che modifica la decisione (PESC) 2016/2382 che istituisce l'Accademia europea per la sicurezza e la difesa (AESD) (GU L 119 del 15.5.2018, pag. 37).
(3) Decisione (PESC) 2018/1655 del Consiglio, del 6 novembre 2018, che modifica la decisione (PESC) 2016/2382 che istituisce l'Accademia europea per la sicurezza e la difesa (AESD) (GU L 276 del 7.11.2018, pag. 9).
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/37 |
DECISIONE (PESC) 2019/1298 DEL CONSIGLIO
del 31 luglio 2019
volta a sostenere il dialogo e la cooperazione tra Africa, Cina e Europa per prevenire la diversione di armi e munizioni in Africa
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sull'Unione europea, in particolare l'articolo 28, paragrafo 1, e l'articolo 31, paragrafo1,
vista la proposta dell'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza,
considerando quanto segue:
|
(1) |
Il trattato sul commercio delle armi (Arms Trade Treaty – ATT) è entrato in vigore il 24 dicembre 2014 e vi aderiscono tutti gli Stati membri. L'ATT mira a stabilire norme internazionali comuni quanto più possibile elevate per disciplinare il commercio legale di armi convenzionali e per prevenire e sradicare il commercio illegale di armi convenzionali e impedirne la diversione. |
|
(2) |
Il 19 novembre 2018 il Consiglio ha adottato la strategia dell'Unione europea contro le armi da fuoco, armi leggere e di piccolo calibro illegali e relative munizioni «Mettere in sicurezza le armi, proteggere i cittadini» («strategia»). Obiettivo cardine della strategia è la piena ed efficace attuazione del programma d'azione delle Nazioni Unite del 2001 per prevenire, combattere e sradicare il commercio illegale di armi leggere e di piccolo calibro in tutti i suoi aspetti. La strategia prevede che l'UE continui a promuovere controlli responsabili ed efficaci delle esportazioni di armi e a sostenere l'universalizzazione e l'attuazione dell'ATT. Prevede inoltre che l'UE continui a sostenere gli sforzi profusi dall'Unione africana e dalle pertinenti comunità economiche regionali per contrastare il commercio illegale di armi leggere e di piccolo calibro e relative munizioni. |
|
(3) |
Nel gennaio 2017, la 28a sessione ordinaria dell'Assemblea dell'Unione africana ha adottato la «African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020» (tabella di marcia generale dell'Unione africana contenente misure pratiche per mettere a tacere le armi in Africa entro il 2020), in virtù della quale gli Stati membri dell'Unione africana si impegnano a: ridurre l'afflusso e la circolazione illeciti di armi illegali; impedire che i ribelli/gli insorti abbiano accesso alle armi; interrompere i legami con i fornitori e i destinatari di armi illegali, anche tramite l'imposizione di divieti, in linea con l'ATT. |
|
(4) |
Nelle sue conclusioni del 18 luglio 2016 relative alla strategia dell'UE sulla Cina, il Consiglio ha sostenuto l'instaurazione di un dialogo regolare e approfondito dell'UE con la Cina per individuare, congiuntamente agli Stati membri, ulteriori punti di convergenza in materia di disarmo, non proliferazione, antiterrorismo, migrazione e sicurezza informatica. |
|
(5) |
Il 30 giugno 2018, la terza conferenza delle Nazioni Unite di revisione dei progressi compiuti nell'attuazione del programma d'azione dell'ONU contro le armi leggere e di piccolo calibro illegali ha adottato un documento finale in cui gli Stati rinnovano il loro impegno a prevenire e a combattere la diversione delle armi leggere e di piccolo calibro. Gli Stati ribadiscono la loro volontà di perseguire la cooperazione internazionale e di rafforzare quella regionale migliorando il coordinamento, le consultazioni, lo scambio di informazioni e la cooperazione operativa, coinvolgendo le pertinenti organizzazioni regionali e subregionali, come pure le autorità di contrasto, le autorità incaricate dei controlli di frontiera nonché le autorità preposte al rilascio delle licenze di esportazione e importazione. Gli Stati si impegnano inoltre a scambiare e, conformemente ai rispettivi quadri giuridici e obblighi di sicurezza a livello nazionale, mettere in pratica le esperienze, gli insegnamenti appresi e le migliori prassi per quanto riguarda il controllo delle esportazioni, delle importazioni e del transito delle armi leggere e di piccolo calibro, compresi i processi di certificazione e i certificati di destinazione finale. |
|
(6) |
Nell'Agenda 2030 per lo sviluppo sostenibile si afferma che la lotta al commercio illegale di armi leggere e di piccolo calibro è necessaria per il raggiungimento di molti obiettivi di sviluppo sostenibile, inclusi quelli relativi a pace, giustizia e istituzioni forti, riduzione della povertà, crescita economica, salute, parità di genere e città sicure. Pertanto, con l'obiettivo di sviluppo sostenibile 16.4, tutti gli Stati si sono impegnati a ridurre in maniera significativa i flussi finanziari illeciti e i flussi illegali di armi. |
|
(7) |
Il 27 febbraio 2012 il Consiglio ha adottato la decisione 2012/121/PESC (1), a sostegno delle attività intese a promuovere il dialogo e la cooperazione UE-Cina-Africa sul controllo delle armi convenzionali. Questo progetto è stato efficacemente messo in atto da Saferworld, ma sono necessari ulteriori sforzi in tale campo per conseguire gli obiettivi prefissati nella decisione. |
|
(8) |
Dal 2008 il Consiglio ha adottato undici decisioni a sostegno di attività di sensibilizzazione per un controllo responsabile delle esportazioni di armi, conformemente all'ATT e alla posizione comune 2008/944/PESC del Consiglio (2), ma il confronto con la Cina su questo tema è stato limitato, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
1. Scopo della presente decisione è contribuire a prevenire e a combattere la diversione di armi e munizioni in Africa.
2. Conformemente al paragrafo 1, l'Unione appoggia i seguenti obiettivi:
|
a) |
accrescere la consapevolezza dei portatori di interessi in Africa, in Cina e nell'Unione sui modi in cui il flusso illegale di armi, in particolare delle armi leggere e di piccolo calibro (small arms and light weapons – SALW) e relative munizioni, verso attori non autorizzati contribuisce in maniera significativa a esacerbare l'insicurezza e la violenza in varie parti dell'Africa, minando in tal modo la coesione sociale, la pubblica sicurezza, lo sviluppo socioeconomico e l'efficace funzionamento delle istituzioni statali; |
|
b) |
promuovere la rendicontabilità e la responsabilità riguardo al commercio legale di armi, dimostrando ai portatori di interessi in Africa, in Cina e nell'Unione quanto un controllo efficace delle esportazioni di armi possa contribuire ad attenuare il rischio di diversione delle stesse nel mercato illecito. |
3. Per conseguire tali obiettivi, la presente decisione sostiene l'istituzione e lo sviluppo di un gruppo congiunto Africa-Cina-Europa di esperti non governativi sul controllo delle armi convenzionali («gruppo di esperti») i cui compiti principali saranno, da un lato, accrescere la consapevolezza e il coinvolgimento delle comunità strategiche in Africa, in Cina e nell'Unione e far sì che prendano provvedimenti, e dall'altro rafforzare la cooperazione regionale e internazionale per prevenire la diversione di armi e munizioni in Africa.
4. I risultati che ci si attende dalla presente decisione sono i seguenti:
|
a) |
una migliore comprensione dell'impatto della diversione e dell'uso improprio delle armi in Africa grazie alla ricerca comune e all'analisi orientata all'azione condotte da ricercatori e accademici africani, cinesi e dell'Unione, con raccomandazioni riguardanti progetti specifici sostenuti dalla Cina; |
|
b) |
una maggiore consapevolezza da parte dei portatori di interessi in Africa, in Cina e nell'Unione circa il ruolo di un efficace controllo delle esportazioni di armi nell'attenuare il rischio di diversione e l'impatto negativo di armi e munizioni illegali in Africa; |
|
c) |
un maggior contributo della Cina alle pertinenti iniziative internazionali e regionali, compresa l'iniziativa dell'Unione africana volta a fare tacere le armi in Africa entro il 2020 e l'attuazione dell'ATT; |
|
d) |
l'inserimento del controllo delle armi di piccolo calibro nell'ordine del giorno del dialogo condotto nel quadro del Forum per la cooperazione Cina-Africa (FOCAC); |
|
e) |
la creazione di nuovi consessi che riuniscano esperti dei governi, della società civile, delle imprese e del mondo accademico provenienti dall'Africa, dalla Cina e dall'Unione e che contribuiscano ad informare il dialogo strategico ad alto livello UE-Cina. |
5. I beneficiari diretti dei progetti saranno, secondo le stime, 500 attori delle comunità strategiche in Africa, in Cina e nell'Unione, tra cui organizzazioni non governative, think tank, rappresentanti dell'industria, funzionari pubblici competenti in materia di controllo delle armi convenzionali e parlamentari. I beneficiari indiretti saranno la popolazione, le comunità, i gruppi e gli individui in Africa che subiscono le conseguenze della proliferazione di armi e munizioni illegali nel continente.
6. Una descrizione particolareggiata del progetto figura nell'allegato.
Articolo 2
1. L'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza («AR») è responsabile dell'attuazione della presente decisione.
2. L'organizzazione non governativa Saferworld è incaricata dell'esecuzione tecnica del progetto di cui all'articolo 1.
3. Saferworld svolge i suoi compiti sotto la responsabilità dell'AR. A tal fine, l'AR stabilisce le necessarie modalità con Saferworld.
Articolo 3
1. L'importo di riferimento finanziario per l'esecuzione del progetto finanziato dall'Unione di cui all'articolo 1 è pari a 994 007 EUR.
2. Le spese finanziate con l'importo di riferimento di cui al paragrafo 1 sono gestite secondo le procedure e le norme applicabili al bilancio dell'Unione.
3. La Commissione vigila sulla corretta gestione delle spese di cui al paragrafo 1. A tal fine, conclude il necessario accordo di finanziamento con Saferworld. L'accordo di finanziamento stabilisce che Saferworld deve assicurare la visibilità del contributo dell'Unione in funzione della sua entità.
4. La Commissione si adopera per concludere l'accordo di finanziamento di cui al paragrafo 3 non appena possibile dopo l'entrata in vigore della presente decisione. Essa informa il Consiglio di ogni difficoltà incontrata in tale contesto e della data di conclusione dell'accordo di finanziamento.
Articolo 4
1. L'AR riferisce al Consiglio in merito all'attuazione della presente decisione sulla base di relazioni periodiche trimestrali preparate da Saferworld. Su tali relazioni si basa la valutazione del Consiglio.
2. La Commissione riferisce sugli aspetti finanziari del progetto di cui all'articolo 1.
Articolo 5
1. La presente decisione entra in vigore il giorno dell'adozione.
2. La presente decisione cessa di produrre effetti 36 mesi dopo la data di conclusione dell'accordo di finanziamento di cui all'articolo 3, paragrafo 3. Tuttavia, essa cessa di produrre effetti sei mesi dopo la data della sua entrata in vigore se non è stato concluso alcun accordo entro tale termine.
Fatto a Bruxelles, il 31 luglio 2019
Per il Consiglio
La presidente
T. TUPPURAINEN
(1) Decisione 2012/121/PESC del Consiglio, del 27 febbraio 2012, a sostegno delle attività intese a promuovere il dialogo e la cooperazione UE-Cina-Africa sul controllo delle armi convenzionali (GU L 54 del 28.2.2012, pag. 8).
(2) Posizione comune 2008/944/PESC del Consiglio, dell'8 dicembre 2008, che definisce norme comuni per il controllo delle esportazioni di tecnologia e attrezzature militari (GU L 335 del 13.12.2008, pag. 99).
ALLEGATO
DIALOGO E COOPERAZIONE TRA AFRICA, CINA E EUROPA PER PREVENIRE LA DIVERSIONE DI ARMI E MUNIZIONI IN AFRICA
1. Descrizione del progetto e delle attività
Il progetto si articolerà in due fasi principali, riassunte qui di seguito nella sezione 1.1 relativa all'istituzione di un gruppo di esperti e nella sezione 1.2 relativa alla sensibilizzazione dei portatori di interessi in Africa, in Cina e nell'Unione per promuovere le azioni da intraprendere per prevenire la diversione di armi e munizioni in Africa.
1.1. Fase 1: istituzione e sviluppo di un gruppo congiunto Africa-Cina-Europa di esperti non governativi sulla prevenzione della diversione di armi e munizioni in Africa
1.1.1. Obiettivi
Istituire un gruppo congiunto Africa-Cina-Europa di esperti non governativi («gruppo di esperti») che riunisca esperti non governativi africani, cinesi e dell'Unione per svolgere attività di sensibilizzazione dei portatori di interesse in Africa, in Cina e nell'Unione e sostenere il dialogo e la cooperazione trilaterali sulla prevenzione della diversione di armi e munizioni in Africa al fine di:
|
a) |
illustrare i costi socioeconomici, umanitari e in termini di sicurezza della diversione di armi, soprattutto delle armi leggere e di piccolo calibro e relative munizioni, in Africa ed esporre le modalità con cui un migliore controllo dei trasferimenti di armi, anche sul versante dell'offerta, può contribuire a ridurre il rischio di diversione di armi nelle mani di attori non autorizzati; |
|
b) |
contribuire a informare il dialogo strategico ad alto livello UE-Cina, soprattutto per quanto riguarda la cooperazione in materia di sicurezza e controllo delle armi in Africa; |
|
c) |
condividere informazioni, idee, competenze e ricerche tra i suoi membri e valutare l'efficacia delle politiche e iniziative in atto; |
|
d) |
contattare attivamente i portatori di interesse governativi e rivolgere loro raccomandazioni. I funzionari africani, cinesi, dell'Unione e degli Stati membri saranno invitati in qualità di osservatori e contributori ai lavori del gruppo di esperti. |
1.1.2. Attività
Tra le attività da sostenere nell'ambito dell'attuazione dei compiti di cui alla fase 1 figureranno:
|
a) |
la mappatura e lo sviluppo, da parte di Saferworld, di un approccio fondato sul dialogo nei confronti dei partner e dei portatori di interesse principali nelle amministrazioni, nel settore imprenditoriale, nelle organizzazioni della società civile, nelle istituzioni accademiche e nelle agenzie multilaterali, nonché nei confronti degli attori a livello regionale e comunitario, che saranno essenziali per il successo e la sostenibilità del progetto; |
|
b) |
sulla base dei risultati del progetto dell'Unione sostenuto a titolo della decisione 2012/121/PESC: i) l'organizzazione di un massimo di 20 riunioni preparatorie e di follow-up in Africa, in Cina e in Europa per migliorare la conoscenza del progetto, compresi la struttura e il calendario, e garantire il sostegno delle autorità competenti, ii) l'individuazione, in Africa, in Cina e nell'Unione, di esperti chiave che saranno coinvolti nel gruppo di esperti, iii) l'elaborazione di piani di lavoro dettagliati per l'istituzione e la messa in attività del gruppo di esperti, iv) l'istituzione di una squadra di coordinamento del progetto, v) la definizione e l'assegnazione delle responsabilità all'interno della squadra e vi) il monitoraggio e la valutazione dei progressi compiuti nell'esecuzione delle attività; |
|
c) |
la creazione di un gruppo di esperti che sostenga il dialogo e la cooperazione trilaterali. Il gruppo di esperti dovrebbe comprendere nove esperti in materia di controllo delle armi di piccolo calibro provenienti da Africa, Cina ed Europa e appartenenti a think tank, centri di ricerca e istituzioni accademiche, che saranno scelti in base a interessi, competenze e capacità di partecipazione al progetto; |
|
d) |
la creazione di un sito web del gruppo di esperti, che fungerà da piattaforma online per l'interfaccia pubblica del gruppo; |
|
e) |
tre riunioni del gruppo di esperti (una in Africa, una in Cina e una in Europa) per consentire l'interazione e l'apprendimento condiviso tra i membri del gruppo e i funzionari africani, cinesi, dell'Unione e degli Stati membri, nonché per fornire orientamenti in merito all'attuazione delle attività di sensibilizzazione e di ricerca. |
1.1.3. Risultati
Svolgendo un ruolo fondamentale nel riunire esperti in materia di controllo delle armi di piccolo calibro provenienti da Africa, Cina ed Europa, contribuendo a colmare il divario tra le comunità strategiche e della ricerca e assicurando l'effettiva trasmissione dei risultati del progetto ai governi di Africa, Cina ed Europa e alle istituzioni dell'Unione, il gruppo di esperti diventa il caposaldo del processo di dialogo promosso dalla presente decisione.
1.2. Fase 2: sensibilizzazione dei portatori di interessi governativi in Africa, in Cina e nell'Unione per quanto concerne la prevenzione della diversione e la lotta al possesso, al trasferimento e all'uso illeciti di armi e munizioni in Africa
1.2.1 Obiettivi
|
a) |
conseguire una riduzione della diversione di armi e munizioni nel continente africano, riducendo in tal modo le minacce alla sicurezza umana, contribuire a un ambiente di pace e di sicurezza per i cittadini africani e promuovere lo sviluppo; |
|
b) |
sostenere gli Stati africani nell'attuazione della «African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020» (tabella di marcia generale dell'Unione africana contenente misure pratiche per mettere a tacere le armi in Africa entro il 2020) e delle pertinenti strategie delle comunità economiche regionali; |
|
c) |
promuovere sinergie con l'attuazione di altre iniziative internazionali e regionali pertinenti, tra cui l'ATT, il programma d'azione delle Nazioni Unite sulle SALW e il protocollo delle Nazioni Unite sulle armi da fuoco; |
|
d) |
coordinare e creare sinergie con le pertinenti iniziative sostenute dall'Unione in Africa, compresi i progetti dell'UE in materia di controllo delle esportazioni di armi e di sensibilizzazione sull'ATT sostenuti dalle decisioni (PESC) 2018/299 (1) e (PESC) 2018/101 (2) del Consiglio e il progetto iTrace di Conflict Armament Research Ltd. (CAR) sostenuto dalla decisione (PESC) 2017/2283 del Consiglio (3); |
|
e) |
impegnarsi nel processo di riesame giuridico pluriennale attualmente in corso in Cina, che sfocerà nell'adozione di una nuova legge sul controllo delle esportazioni; |
|
f) |
sostenere il lavoro sul controllo delle armi di piccolo calibro a livello di comunità coinvolgendo i comuni cittadini e offrendo loro la possibilità di esprimersi e proporre soluzioni per ridurre il costo umano delle armi e delle munizioni illegali; |
|
g) |
sostenere la ricerca comune e l'analisi orientata all'azione condotte da esperti africani, cinesi e dell'Unione sui problemi connessi alla diversione e all'uso improprio di armi e munizioni in Africa, formulando raccomandazioni per azioni specifiche che contribuiscano ad affrontare e ridurre le minacce associate alle armi e munizioni illegali. Tali azioni possono includere, tra l'altro, il controllo delle esportazioni; il deposito sicuro e protetto di armi e munizioni; la distruzione delle armi e delle munizioni in eccedenza; la marcatura, la registrazione e il rintracciamento delle armi, compresa la cooperazione con le missioni delle Nazioni Unite incaricate di individuare e rintracciare le armi illegali; il monitoraggio e l'applicazione degli embarghi sulle armi; lo scambio di informazioni operative per smantellare le reti del traffico di armi. |
1.2.2 Attività
Tra le attività da sostenere nell'ambito dell'attuazione dei compiti di cui alla fase 2 figureranno:
|
a) |
due seminari (uno in Africa e uno in Cina) sul tema «Promuovere la rendicontabilità e la responsabilità riguardo al commercio di armi e prevenire la diversione di armi e munizioni verso attori non autorizzati e destabilizzanti in Africa» da tenersi sotto l'egida del gruppo di esperti, i cui membri assisteranno Saferworld e parteciperanno inoltre agli eventi; |
|
b) |
elaborazione e diffusione di un documento di riflessione dal titolo «Lotta alla proliferazione di armi e munizioni illegali in Africa: raccomandazioni al FOCAC», in vista del vertice FOCAC del 2021; |
|
c) |
elaborazione e diffusione di un documento di riflessione in lingua inglese e cinese sul tema «Proliferazione di armi e munizioni illegali in Africa: cosa possono fare gli Stati fornitori per attenuare il rischio di diversione?»; |
|
d) |
tre visite di ricerca sul campo del gruppo di esperti, ciascuna della durata di dieci giorni, in tre paesi africani selezionati per affrontare questioni relative alla proliferazione e alla circolazione incontrollata di armi e munizioni illegali (tra cui la complessità dei processi di diversione derivanti da partecipazioni o trasferimenti autorizzati e fenomeni transfrontalieri problematici quali il furto di bestiame, che sono alimentati dalla proliferazione di armi e munizioni illegali); |
|
e) |
elaborazione di tre documenti di ricerca (in cinese, inglese e francese) da parte del gruppo di esperti sulla ricerca sul campo, con raccomandazioni sulle azioni concrete necessarie per contrastare le armi e munizioni illegali, in particolare in relazione al ruolo dei fornitori di armi in Africa, in Cina e nell'Unione per ridurre il rischio di diversione; |
|
f) |
circa 20 riunioni bilaterali con funzionari africani, cinesi e degli Stati membri per condividere e comunicare in modo efficace le raccomandazioni del gruppo di esperti, fare opera di sensibilizzazione e garantire una maggiore presa politica dei progetti di cooperazione a livello ufficiale; |
|
g) |
elaborazione e diffusione di una relazione di ricerca (in cinese, inglese e francese) sulle armi e munizioni illegali in Africa, nella quale si valuterà l'efficacia delle azioni in corso e si formuleranno raccomandazioni per progetti attuabili che contribuiscano a contrastare meglio le armi e munizioni illegali, riducendone così l'impatto negativo e contribuendo alla pace e alla sicurezza a livello nazionale, regionale e internazionale. La relazione s'incentrerà in particolare sul ruolo dei fornitori di armi in Africa, in Cina e nell'Unione per ridurre il rischio della diversione di armi in Africa; |
|
h) |
organizzazione di un seminario conclusivo in Cina per comunicare le raccomandazioni scaturite dal processo di ricerca e dialogo e dimostrare i vantaggi della cooperazione tra l'Africa, la Cina, l'Unione e gli Stati membri e della partecipazione ad attività congiunte, e istituzione di processi volti a sostenere il dialogo in futuro. |
1.2.3 Risultati
|
— |
Aumento della consapevolezza, della conoscenza e della comprensione - da parte di 500 attori delle comunità strategiche in Africa, in Cina e nell'Unione, compresi i funzionari competenti in materia di controlli all'esportazione di armi convenzionali, studiosi, parlamentari, organizzazioni non governative, rappresentanti dell'industria e giornalisti - dei fattori che contribuiscono all'ampia disponibilità di armi e munizioni illegali in Africa, delle questioni e ripercussioni principali sul campo e del ruolo e della responsabilità degli Stati fornitori di armi nell'attenuare il rischio di diversione al momento di trasferire le armi; |
|
— |
miglioramento del dialogo, dell'interazione e della cooperazione per quanto concerne la prevenzione e la lotta alla diversione di armi e munizioni tra 60 funzionari africani, cinesi, dell'Unione e degli Stati membri e attori della società civile, anche mediante l'individuazione di settori di cooperazione pratica tra l'Africa, la Cina e l'Unione, che aiuterà a ridurre la diversione di armi e munizioni in Africa; |
|
— |
riduzione del numero di episodi e casi di diversione di armi e munizioni verso attori non autorizzati e destabilizzanti in Africa, |
|
— |
sostegno dell'attuazione della «African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020» (tabella di marcia generale dell'Unione africana contenente misure pratiche per mettere a tacere le armi in Africa entro il 2020) e del programma d'azione dell'ONU sulle SALW illegali; |
|
— |
maggiore allineamento delle norme e dei regolamenti nazionali in Africa e in Cina alle norme internazionali in materia di controllo delle esportazioni di armi, quali l'ATT, al fine di attenuare il rischio di diversione nel commercio di armi; |
|
— |
reinserimento del controllo delle armi nell'ordine del giorno del FOCAC in quanto punto di accesso fondamentale per rafforzare il dialogo e la cooperazione tra l'Africa e la Cina in materia di prevenzione della diversione delle armi verso attori non autorizzati e destabilizzanti in Africa; |
|
— |
produzione di un insieme di analisi basate su dati concreti del problema delle armi e munizioni illegali in Africa, sulla base di attività di ricerca comune sul campo condotte da esperti africani, cinesi e dell'Unione che contribuiscano a una migliore comprensione complessiva della diversione e del ritrasferimento di armi verso attori non autorizzati e destabilizzanti in Africa e offrano un terreno comune più solido affinché l'Africa, la Cina e l'Unione possano collaborare in modo più efficace per affrontare il problema, |
|
— |
individuazione di strumenti pratici per affrontare le minacce connesse alla proliferazione di armi e munizioni illegali e la necessità di risposte internazionali collettive e cooperative, in linea con i principali impegni e iniziative politiche a livello internazionale e regionale, tra cui il programma d'azione dell'ONU sulle SALW illegali, lo strumento internazionale per il rintracciamento, l'Agenda 2030 per lo sviluppo sostenibile, il trattato sul commercio delle armi, la strategia dell'Unione africana sul controllo della proliferazione, della circolazione e del traffico illecito di armi leggere e di piccolo calibro, l'agenda strategica 2020 UE-Cina per la cooperazione, la strategia dell'UE sulla Cina e la strategia dell'UE contro le armi da fuoco, le armi leggere e le armi di piccolo calibro illegali e le relative munizioni, nonché le pertinenti strategie e piani d'azione delle comunità economiche regionali; |
|
— |
maggiore capacità da parte delle autorità nazionali africane e delle organizzazioni regionali di individuare le esigenze specifiche in materia di assistenza tecnica e individuazione delle piattaforme adeguate nel quadro del loro dialogo con la Cina e l'UE per convogliare le risorse verso il soddisfacimento di tali esigenze. |
2. Partecipanti e sedi dei seminari/laboratori ed eventi di apertura e chiusura
Salvo diversamente specificato nel testo del presente allegato, Saferworld proporrà partecipanti e sedi potenziali per i seminari e gli altri eventi previsti dal progetto, che saranno quindi approvati dall'AR, in consultazione con i competenti organi del Consiglio.
3. Genere
Saferworld integrerà la dimensione di genere nelle strategie e attività connesse all'attuazione del progetto affinché sia le donne che gli uomini possano orientare il progetto, parteciparvi e trarne vantaggio in modo equo. Nella misura del possibile, Saferworld incoraggerà i partner di progetto a presentare delegazioni miste per quanto riguarda il genere per partecipare alle attività di progetto e a garantire che l'impatto di genere delle armi e munizioni illegali figuri in tutti i seminari e le visite di studio.
4. Partner
Si prevede che i principali partner di progetto siano l'Associazione cinese per il controllo delle armi e il disarmo e il Centro di ricerca e informazione in materia di sicurezza (Kenya).
5. Comitato direttivo
Il comitato direttivo per tale progetto sarà composto da un rappresentante dell'AR, della Commissione e di Saferworld. Il comitato direttivo esaminerà l'attuazione della presente decisione ogni sei mesi, anche facendo uso dei mezzi di comunicazione elettronici.
6. Relazioni
Saferworld elaborerà semestralmente relazioni descrittive per esaminare i progressi compiuti verso il raggiungimento dei risultati del progetto. Saferworld presenterà rapporti annuali descrittivi e finanziari, oltre a un rapporto finale entro sei mesi dal termine del periodo di attuazione.
7. Visibilità dell'Unione e disponibilità del materiale per l'assistenza
Il materiale prodotto nell'ambito del progetto e il sito web dedicato garantiranno la visibilità dell'Unione, in particolare grazie al logo e alla grafica del manuale di comunicazione e visibilità per le azioni esterne dell'Unione europea. Le delegazioni dell'Unione dovrebbero essere coinvolte negli eventi realizzati nei paesi terzi per migliorare il seguito politico e la visibilità.
(1) Decisione (PESC) 2018/299 del Consiglio, del 26 febbraio 2018, che promuove la rete europea di gruppi di riflessione indipendenti sulla non proliferazione e il disarmo a sostegno dell'attuazione della strategia dell'UE contro la proliferazione delle armi di distruzione di massa (GU L 56 del 28.2.2018, pag. 46).
(2) Decisione (PESC) 2018/101 del Consiglio, del 22 gennaio 2018, relativa alla promozione dell'efficacia dei controlli sulle esportazioni di armi (GU L 17 del 23.1.2018, pag. 40).
(3) Decisione (PESC) 2017/2283 del Consiglio, dell'11 dicembre 2017, a sostegno di un meccanismo mondiale di segnalazione sulle armi leggere e di piccolo calibro e su altre armi e munizioni convenzionali illegali volto a ridurre il rischio del loro commercio illegale («iTrace III») (GU L 328 del 12.12.2017, pag. 20).
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/44 |
DECISIONE DI ESECUZIONE (PESC) 2019/1299 DEL CONSIGLIO
del 31 luglio 2019
che attua la decisione (PESC) 2015/1333 concernente misure restrittive in considerazione della situazione in Libia
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sull'Unione europea, in particolare l'articolo 31, paragrafo 2,
vista la decisione (PESC) 2015/1333 del Consiglio, del 31 luglio 2015, concernente misure restrittive in considerazione della situazione in Libia e che abroga la decisione 2011/137/PESC (1), in particolare l'articolo 12, paragrafo 2,
vista la proposta dell'alto rappresentante dell'Unione per gli affari esteri e la politica di sicurezza,
considerando quanto segue:
|
(1) |
Il 31 luglio 2015 il Consiglio ha adottato la decisione (PESC) 2015/1333. |
|
(2) |
A norma dell'articolo 17, paragrafo 2, della decisione (PESC) 2015/1333, il Consiglio ha riesaminato gli elenchi delle persone ed entità designate di cui agli allegati II e IV di tale decisione. |
|
(3) |
Dovrebbero essere rimosse la voce di una persona dall'allegato II della decisione (PESC) 2015/1333, e le voci di due persone dall'allegato IV della stessa decisione. |
|
(4) |
È opportuno modificare di conseguenza la decisione (PESC) 2015/1333, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Gli allegati II e IV della decisione (PESC) 2015/1333 sono modificati conformemente all'allegato della presente decisione.
Articolo 2
La presente decisione entra in vigore il giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Fatto a Bruxelles, il 31 luglio 2019
Per il Consiglio
La presidente
T. TUPPURAINEN
ALLEGATO
La decisione (PESC) 2015/1333 è modificata come segue:
|
1) |
nell'allegato II, (Elenco delle persone e delle entità di cui all'articolo 8, paragrafo 2), la voce 1 (relativa a ABDUSSALAM, Abdussalam Mohammed) è soppressa dall'elenco di cui alla sezione A (Persone); |
|
2) |
nell'allegato IV, (Elenco delle persone e delle entità di cui all'articolo 9, paragrafo 2), le voci 1 (relativa a ABDUSSALAM, Abdussalam Mohammed) e 14 (relativa a AL-BAGHDADI, Dr Abdulqader Mohammed) sono soppresse dall'elenco di cui alla sezione A (Persone). |
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/46 |
DECISIONE DI ESECUZIONE (UE) 2019/1300 DELLA COMMISSIONE
del 26 luglio 2019
relativa all'immissione in commercio di un garofano geneticamente modificato (Dianthus caryophyllus L., line FLO-40685-2)
[notificata con il numero C(2019) 5496]
(Il testo in lingua neerlandese è il solo facente fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
vista la direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (1), in particolare l'articolo 18, paragrafo 1, primo comma,
previa consultazione dell'Autorità europea per la sicurezza alimentare,
considerando quanto segue:
|
(1) |
A norma della direttiva 2001/18/CE l'immissione in commercio di un prodotto contenente o costituito da un organismo geneticamente modificato o una combinazione di organismi geneticamente modificati è subordinata al rilascio di un'autorizzazione scritta da parte dell'autorità competente dello Stato membro che ha ricevuto la notifica di immissione in commercio di tale prodotto. |
|
(2) |
Nell'ottobre 2013 la società Suntory Holdings Limited di Osaka (Giappone) ha presentato all'autorità competente dei Paesi Bassi una notifica relativa all'immissione in commercio di un garofano geneticamente modificato (Dianthus caryophyllus L., linea FLO-40685-2). |
|
(3) |
La notifica riguarda l'importazione, la distribuzione e la vendita al dettaglio di fiori recisi di garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2. |
|
(4) |
In conformità all'articolo 14 della direttiva 2001/18/CE l'autorità competente dei Paesi Bassi ha redatto una relazione di valutazione, secondo cui non sussistono motivi che giustifichino un rifiuto dell'autorizzazione all'immissione in commercio di fiori recisi di garofano geneticamente modificato (Dianthus caryophyllus L., linea FLO-40685-2) per uso ornamentale, purché siano rispettate specifiche condizioni. |
|
(5) |
La relazione di valutazione è stata presentata alla Commissione e alle autorità competenti degli altri Stati membri, alcune delle quali hanno sollevato obiezioni riguardo all'immissione in commercio del prodotto. Uno Stato membro ha mantenuto le proprie obiezioni. |
|
(6) |
Nel parere del 10 marzo 2016 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha concluso che non sussiste alcun motivo scientifico per ritenere che l'importazione, la distribuzione e la vendita al dettaglio nell'Unione di fiori recisi di garofano FLO-40685-2 per uso ornamentale abbiano un'incidenza negativa sulla salute umana o sull'ambiente (2). L'Autorità ha inoltre ritenuto accettabile il piano di monitoraggio presentato dal titolare dell'autorizzazione alla luce degli utilizzi cui è destinato il garofano FLO-40685-2. |
|
(7) |
In base all'esame del parere dell'Autorità, che ha preso in considerazione l'intera notifica, la relazione di valutazione redatta dall'autorità competente dei Paesi Bassi, le obiezioni degli Stati membri e le informazioni supplementari fornite dal notificante in risposta alle obiezioni degli Stati membri, non sussiste alcun motivo per ritenere che l'immissione in commercio di fiori recisi di garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2 abbia un'incidenza negativa sulla salute umana o sull'ambiente nel contesto dell'uso ornamentale proposto. |
|
(8) |
Ai fini del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (3) e del regolamento (CE) n. 65/2004 della Commissione (4), al garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2 dovrebbe essere assegnato un identificatore unico. |
|
(9) |
Visto il parere dell'Autorità non è necessario stabilire condizioni specifiche per l'uso previsto riguardanti la manipolazione o l'imballaggio del prodotto e la protezione di particolari ecosistemi, ambienti o aree geografiche. |
|
(10) |
L'etichettatura del prodotto dovrebbe contenere l'informazione che i fiori recisi di garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2 non possono essere usati per il consumo umano o animale né per la coltivazione. |
|
(11) |
Come prescritto nell'allegato III B.D.12 della direttiva 2001/18/CE, nel dicembre 2016 è stato verificato e provato un metodo di rilevazione per il garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2. |
|
(12) |
Il comitato istituito a norma dell'articolo 30, paragrafo 1, della direttiva 2001/18/CE non ha formulato un parere entro il termine fissato dal suo presidente. Dato che è stato ritenuto necessario un atto di esecuzione, il presidente ha sottoposto il progetto di tale atto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso un parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Autorizzazione
1. L'autorità competente dei Paesi Bassi rilascia un'autorizzazione scritta all'immissione in commercio del garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2, notificato dalla società Suntory Holdings Limited di Osaka (Giappone) (riferimento C/NL/13/02) e definito all'articolo 2.
2. L'autorizzazione è rilasciata per iscritto e indica specificatamente i requisiti di cui agli articoli 3 e 4 e l'identificatore unico di cui all'articolo 2, paragrafo 3.
3. L'autorizzazione è limitata all'immissione in commercio di fiori recisi di garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2 in quanto prodotto.
4. L'autorizzazione riguarda la progenie derivata attraverso riproduzione vegetativa del garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2.
5. L'autorizzazione ha una validità di 10 anni a decorrere dalla data del suo rilascio.
Articolo 2
Prodotto
1. L'organismo geneticamente modificato da immettere in commercio è un garofano (Dianthus caryophyllus L.) con colore del fiore modificato, ottenuto da una coltura cellulare di Dianthus caryophyllus L. e trasformato con il ceppo AGL0 di Agrobacterium tumefaciens utilizzando il vettore pCGP1991 per dare origine alla linea FLO-40685-2.
Il garofano geneticamente modificato contiene il seguente DNA in tre cassette.
|
a) |
Cassetta 1 Il gene dfr di petunia codificante per la diidroflavonolo 4-reduttasi (DFR), un enzima chiave nella via biosintetica delle antocianine, compreso il suo promotore e terminatore. |
|
b) |
Cassetta 2 La sequenza promotrice del gene per la calcone sintasi di bocca di leone, la flavonoide 3′5′-idrossilasi (f3′5′h) del cDNA di Viola hortensis codificante per F3'5'H, un enzima chiave nella via biosintetica delle antocianine, e il terminatore del gene di petunia D8 codificante per una proteina putativa di trasferimento dei fosfolipidi. Queste due cassette sono state inserite nel genoma della pianta per ottenere il colore del fiore desiderato. |
|
c) |
Cassetta 3 Il promotore 35S del virus del mosaico del cavolfiore, la regione 5′ non tradotta del gene di petunia codificante per la proteina legante di clorofilla a/b, il gene SuRB (als) codificante per una proteina mutante di acetolattato sintasi (ALS) derivata da Nicotiana tabacum, che conferisce tolleranza alla sulfonilurea, compreso il suo terminatore. Questa caratteristica è stata utilizzata come marcatore per la selezione dei trasformanti. |
2. Il garofano geneticamente modificato contiene l'inserto, o una sua parte, in quattro loci:
|
— |
locus 1: una copia del T-DNA, contenente le tre cassette e una copia incompleta del T-DNA contenente solo la cassetta f3′5′h con il bordo destro del T-DNA. Le due copie del T-DNA sono separate da una regione genomica del DNA del garofano; |
|
— |
locus 2: un inserto contenente il terminatore D8 e il bordo destro del T-DNA; |
|
— |
locus 3: una copia completa e una copia incompleta della cassetta f3′5′h, contenenti entrambe le sequenze terminali D8 e i bordi destri del T-DNA orientati in direzione opposta; |
|
— |
locus 4: una copia incompleta della cassetta als e il bordo sinistro del T-DNA. |
3. L'identificatore unico del garofano geneticamente modificato è FLO-4Ø685-2.
Articolo 3
Condizioni per l'immissione in commercio
L'immissione in commercio del garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2 è soggetta alle seguenti condizioni:
|
a) |
il garofano geneticamente modificato può essere usato soltanto per scopi ornamentali; |
|
b) |
la coltivazione del garofano geneticamente modificato non è autorizzata; |
|
c) |
fatti salvi i requisiti di riservatezza di cui all'articolo 25 della direttiva 2001/18/CE, la metodologia di rilevazione e identificazione del garofano geneticamente modificato, compresi i dati sperimentali che dimostrano la specificità della metodologia, quale convalidata dal laboratorio di riferimento dell'Unione europea, è disponibile al pubblico all'indirizzo http://gmo-crl.jrc.ec.europa.eu/valid-2001-18.htm; |
|
d) |
fatti salvi i requisiti di riservatezza di cui all'articolo 25 della direttiva 2001/18/CE, il titolare dell'autorizzazione mette a disposizione campioni di controllo positivi e negativi del prodotto, o del suo materiale genetico o dei materiali di riferimento, su richiesta delle autorità competenti, dei servizi di ispezione degli Stati membri e dei laboratori di controllo dell'Unione; |
|
e) |
l'etichetta o, in caso di prodotti non preconfezionati, il documento di accompagnamento dei garofani geneticamente modificati reca la dicitura «Questo prodotto è un organismo geneticamente modificato» o «Questo prodotto è un garofano geneticamente modificato» e la dicitura «Non destinato al consumo umano o animale né alla coltivazione». |
Articolo 4
Monitoraggio
1. Durante il periodo di validità dell'autorizzazione il titolare della stessa provvede affinché sia messo in atto e attuato il piano di monitoraggio contenuto nella notifica e costituito da un piano di sorveglianza generale per controllare gli eventuali effetti negativi sulla salute umana o sull'ambiente derivanti dalla manipolazione o dall'uso del garofano geneticamente modificato Dianthus caryophyllus L., linea FLO-40685-2.
Il piano di monitoraggio è disponibile all'indirizzo [link: piano pubblicato su Internet].
2. Il titolare dell'autorizzazione comunica direttamente agli operatori e agli utilizzatori le caratteristiche generali e di sicurezza del garofano geneticamente modificato e le condizioni del monitoraggio, comprese le opportune misure di gestione da adottare in caso di propagazione accidentale.
3. Il titolare dell'autorizzazione presenta alla Commissione e alle autorità competenti degli Stati membri relazioni annuali sui risultati delle attività di monitoraggio.
4. Il titolare dell'autorizzazione è in grado di dimostrare alla Commissione e alle autorità competenti degli Stati membri che:
|
a) |
le reti di monitoraggio esistenti, compresi le reti di osservazione botanica e i servizi fitosanitari nazionali, quali specificati nel piano di monitoraggio contenuto nella notifica, raccolgono le informazioni necessarie per il monitoraggio del garofano geneticamente modificato; e |
|
b) |
le reti di monitoraggio esistenti di cui alla lettera a) hanno accettato di mettere tali informazioni a disposizione del titolare dell'autorizzazione prima della data di presentazione delle relazioni sul monitoraggio alla Commissione e alle autorità competenti degli Stati membri in conformità al paragrafo 3. |
Articolo 5
Destinatario
Il Regno dei Paesi Bassi è destinatario della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 106 del 17.4.2001, pag. 1.
(2) EFSA, Gruppo di esperti scientifici sugli organismi geneticamente modificati (gruppo scientifico GMO), 2016. Scientific opinion on a Part C notification (reference C/NL/13/02) from Suntory Holdings Limited for the import, distribution and retailing of carnation FLO-40685-2 cut flowers with modified petal colour for ornamental use (Parere scientifico su una notifica, parte C (riferimento C/NL/13/02) della Suntory Holdings Limited per l'importazione, la distribuzione e la vendita al dettaglio di fiori recisi di garofano FLO-40685-2 con colore dei petali modificato, per uso ornamentale). EFSA Journal 2016;14(4):4431, 18 pp. doi: 10.2903/j.efsa.2016.4431.
(3) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE EC (GU L 268 del 18.10.2003, pag. 24).
(4) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/50 |
DECISIONE DI ESECUZIONE (UE) 2019/1301 DELLA COMMISSIONE
del 26 luglio 2019
che modifica la decisione di esecuzione 2013/327/UE per quanto riguarda il rinnovo dell'autorizzazione all'immissione in commercio di mangimi contenenti o costituiti da colza geneticamente modificata Ms8, Rf3 e Ms8 × Rf3, a norma del regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5499]
(Il testo in lingua tedesca è il solo facente fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 11, paragrafo 3, e l'articolo 23, paragrafo 3,
considerando quanto segue:
|
(1) |
La decisione di esecuzione 2013/327/UE della Commissione (2), ha autorizzato l'immissione in commercio di alimenti contenenti o costituiti da colza geneticamente modificata Ms8, Rf3 e Ms8 × Rf3 e di alimenti e mangimi prodotti a partire da tale colza geneticamente modificata. |
|
(2) |
In precedenza, la decisione 2007/232/CE della Commissione (3) ha autorizzato l'immissione in commercio di mangimi contenenti o costituiti da colza geneticamente modificata Ms8, Rf3 e Ms8 × Rf3. Nel campo di applicazione di tale autorizzazione rientravano anche prodotti contenenti o costituiti da colza Ms8, Rf3 e Ms8 × Rf3, per usi diversi dall'alimentazione umana o animale, ad eccezione della coltivazione. |
|
(3) |
Il 20 maggio 2016 la società Bayer CropScience AG ha presentato alla Commissione, in conformità all'articolo 11 e all'articolo 23 del regolamento (CE) n. 1829/2003, una domanda di rinnovo dell'autorizzazione all'immissione in commercio dei prodotti oggetto della decisione 2007/232/CE. |
|
(4) |
Il 28 novembre 2017 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole (4) in conformità agli articoli 6 e 18 del regolamento (CE) n. 1829/2003. Essa ha concluso che la domanda di rinnovo non conteneva elementi di prova di nuovi pericoli, modifiche dell'esposizione o incertezze scientifiche che potessero cambiare le conclusioni della valutazione dei rischi iniziale relativa alla colza Ms8, Rf3 e Ms8 × Rf3, adottata dall'EFSA nel 2005 (5). |
|
(5) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande specifiche e le preoccupazioni espresse dagli Stati membri nel contesto della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(6) |
L'Autorità ha inoltre concluso che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, costituito da un piano generale di sorveglianza, è conforme agli usi previsti dei prodotti. |
|
(7) |
Alla luce di tali considerazioni, è opportuno rinnovare l'autorizzazione all'immissione in commercio dei prodotti oggetto della decisione 2007/232/CE. |
|
(8) |
Il 30 novembre 2017 il richiedente Bayer CropScience ha chiesto alla Commissione di riunire in un'unica autorizzazione gli usi della colza Ms8, Rf3 e Ms8 × Rf3 oggetto della domanda di rinnovo e gli usi della colza oggetto della decisione di esecuzione 2013/327/UE. La Commissione ha comunicato al richiedente, con lettera del 5 dicembre 2017, che la fusione avrebbe avuto luogo mediante l'estensione del campo di applicazione della decisione di esecuzione 2013/327/UE ai prodotti oggetto dalla domanda di rinnovo del 20 maggio 2016. Il richiedente è stato quindi informato che, in seguito alla fusione, i prodotti oggetto della domanda di rinnovo sarebbero stati soggetti alle condizioni di autorizzazione stabilite nella decisione di esecuzione 2013/327/CE. |
|
(9) |
La Commissione ritiene che la richiesta sia giustificata a fini di semplificazione. È pertanto opportuno modificare la decisione di esecuzione 2013/327/UE inserendo nel suo campo di applicazione i prodotti attualmente oggetto della decisione 2007/232/CE. |
|
(10) |
La Bayer CropScience AG ha chiesto alla Commissione, con lettera del 1o agosto 2018, il trasferimento dei propri diritti e obblighi per tutte le autorizzazioni alla società BASF Agricultural Solutions Seed US LLC. Con lettera del 6 agosto 2018, la BASF SE ha confermato l'accettazione di tale trasferimento a nome della BASF Agricultural Solutions Seed US LLC. Tale trasferimento concerne la decisione 2007/232/CE e la decisione di esecuzione 2013/327/UE. |
|
(11) |
Alla colza Ms8, Rf3 e Ms8 × Rf3 è stato assegnato un identificatore unico in conformità al regolamento (CE) n. 65/2004 della Commissione (6). Tale identificatore unico dovrebbe continuare a essere utilizzato. |
|
(12) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli previsti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (7). Tuttavia, al fine di garantire che l'uso di tali prodotti rimanga nei limiti dell'autorizzazione rilasciata con la presente decisione, l'etichettatura dei prodotti contenenti o costituiti da colza Ms8, Rf3 e Ms8 × Rf3, ad eccezione dei prodotti alimentari, dovrebbe contenere una dicitura indicante chiaramente che i prodotti in questione non sono destinati alla coltivazione. |
|
(13) |
Non è necessario modificare il piano di monitoraggio degli effetti ambientali previsto nella decisione di esecuzione 2013/327/UE, poiché è sostanzialmente identico a quello valutato dall'Autorità nell'ambito della domanda di rinnovo. |
|
(14) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel Registro comunitario degli alimenti e dei mangimi geneticamente modificati, di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(15) |
È opportuno abrogare la decisione 2007/232/CE. |
|
(16) |
La presente decisione deve essere notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità all'articolo 9, paragrafo 1, e all'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (8). |
|
(17) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Modifiche
1. La decisione di esecuzione 2013/327/UE è così modificata:
|
1) |
il titolo è sostituito dal seguente: «Decisione di esecuzione 2013/327/UE della Commissione, del 25 giugno 2013, che autorizza l'immissione in commercio di alimenti e mangimi contenenti, costituiti o prodotti a partire da colza geneticamente modificata Ms8, Rf3 e Ms8 × Rf3 a norma del regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio»; |
|
2) |
l'articolo 2 è sostituito dal seguente: «Articolo 2 Autorizzazione I prodotti seguenti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità alle condizioni stabilite nella presente decisione:
|
|
3) |
all'articolo 3 è inserito un nuovo secondo comma: «Sull'etichetta e nei documenti di accompagnamento dei prodotti contenenti o costituiti dalla colza geneticamente modificata di cui all'articolo 2, ad eccezione degli alimenti e degli ingredienti alimentari, figura la dicitura “non destinato alla coltivazione”.»; |
|
4) |
è aggiunto un nuovo articolo 3 bis: «Articolo 3 bis Metodo di rilevazione Per la rilevazione della colza ACS-BNØØ5-8, ACS-BNØØ3-6 e ACS-BNØØ5-8 × ACS-BNØØ3-6 si applica il metodo indicato nell'allegato, lettera d).»; |
|
5) |
l'articolo 6 è sostituito dal seguente: «Articolo 6 Titolare dell'autorizzazione Il titolare dell'autorizzazione è la società BASF Agricultural Solutions Seed US LLC, Stati Uniti, rappresentata dalla BASF SE, Germania.»; |
|
6) |
l'articolo 8 è sostituito dal seguente: «Articolo 8 Destinatario La società BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Germania, è destinataria della presente decisione.». |
2. L'allegato della decisione di esecuzione 2013/327/UE è così modificato:
|
1) |
la lettera a) è sostituita dalla seguente: «a) Richiedente e titolare dell'autorizzazione
Rappresentata dalla BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Germania.»; |
|
2) |
la lettera b) è sostituita dalla seguente: «b) Designazione e specifiche dei prodotti
|
|
3) |
alla lettera c) è aggiunto un nuovo secondo comma: «Sull'etichetta e nei documenti di accompagnamento dei prodotti contenenti o costituiti dalla colza geneticamente modificata di cui alla lettera b), ad eccezione degli alimenti e degli ingredienti alimentari, figura la dicitura «non destinato alla coltivazione.». |
Articolo 2
Abrogazione
La decisione 2007/232/CE è abrogata.
Articolo 3
Destinatario
La società BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Germania, è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Decisione di esecuzione 2013/327/UE della Commissione, del 25 giugno 2013, che autorizza la commercializzazione di alimenti contenenti o costituiti da colza geneticamente modificata Ms8, Rf3 e Ms8 × Rf3, o alimenti e mangimi prodotti a partire da organismi geneticamente modificati di cui al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio (GU L 175 del 27.6.2013, pag. 57).
(3) Decisione 2007/232/CE della Commissione, del 26 marzo 2007, relativa all'immissione in commercio, a norma della direttiva 2001/18/CE del Parlamento europeo e del Consiglio, di prodotti geneticamente modificati della colza (Brassica napus L., linee Ms8, Rf3 e Ms8 × Rf3) tolleranti all'erbicida glufosinato (GU L 100 del 17.4.2007, pag. 20).
(4) Gruppo di esperti scientifici sugli OGM dell'EFSA, 2017, Scientific opinion on the assessment of genetically modified oilseed rape MS8, RF3 and MS8 x RF3 for renewal of authorisation under Regulation (EC) No 1829/2003 (application EFSA-GMO-RX-004) [Parere scientifico sulla valutazione della colza geneticamente modificata Ms8, Rf3 e Ms8 × Rf3 ai fini del rinnovo dell'autorizzazione a norma del regolamento (CE) n. 1829/2003 (domanda EFSA-GMO-RX-004)], EFSA Journal 2017;15(11):5067.
(5) EFSA, 2005, Opinion of the Scientific Panel on Genetically Modified Organisms on a request from the Commission related to the application (Reference C/BE/96/01) for the placing on the market of glufosinate-tolerant hybrid oilseed rape Ms8 × Rf3, derived from genetically modified parental lines (Ms8, Rf3), for import and processing for feed and industrial uses, under Part C of Directive 2001/18/EC from Bayer CropScience [Parere del gruppo scientifico sugli organismi geneticamente modificati relativo a una richiesta della Commissione legata alla domanda della Bayer CropScience (rif. C/BE/96/01) per l'immissione in commercio della colza ibrida Ms8 × Rf3 resistente al glufosinato, derivata da linee parentali geneticamente modificate (Ms8, Rf3), ai fini dell'importazione e della trasformazione per l'alimentazione animale e per usi industriali, a norma della direttiva 2001/18/CE, parte C], EFSA Journal 2005; 3(10):281, pag. 23.
(6) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(7) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(8) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/54 |
DECISIONE DI ESECUZIONE (UE) 2019/1302 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati dal cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985 in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5501]
(Il testo in lingua tedesca è il solo facente fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
L'11 febbraio 2011 Bayer CropScience AG («il richiedente») ha presentato all'autorità nazionale competente dei Paesi Bassi, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003, una domanda relativa all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati da cotone GHB614 × LLCotton25 × MON 15985 e dalla sottocombinazione LLCotton25 × MON 15985 («la domanda»). La domanda riguardava altresì l'immissione in commercio del cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985 e della sottocombinazione LLCotton25 × MON 15985 in prodotti contenenti o costituiti da tale cotone per usi diversi dagli alimenti e dai mangimi, ad eccezione della coltivazione. |
|
(2) |
Con lettera del 20 aprile 2011, il richiedente è stato informato del fatto che, a causa delle caratteristiche riproduttive del cotone GHB614 × LLCotton25 × MON 15985, era opportuno eliminare la sottocombinazione LLCotton25 × MON 15985 dalla domanda al fine di valutarla separatamente. Con lettera del 15 giugno 2015, il richiedente ha presentato una versione aggiornata della domanda all'Autorità europea per la sicurezza alimentare («l'Autorità»), restringendo l'ambito di applicazione all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati da cotone GHB614 × LLCotton25 × MON 15985. |
|
(3) |
In conformità dell'articolo 5, paragrafo 5, e dell'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003, la domanda comprendeva le informazioni e le conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2) nonché le informazioni richieste negli allegati III e IV di tale direttiva. La domanda conteneva inoltre un piano di monitoraggio degli effetti ambientali di cui all'allegato VII della direttiva 2001/18/CE. |
|
(4) |
Il 20 aprile 2018 l'Autorità ha espresso un parere favorevole conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (3). L'Autorità ha concluso che il cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985, nel contesto del campo di applicazione della domanda, è sicuro quanto il comparatore non geneticamente modificato e si presume avere lo stesso impatto nutrizionale. |
|
(5) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande specifiche e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(6) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, è conforme agli usi a cui i prodotti sono destinati. |
|
(7) |
Tenendo conto di tali considerazioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati dal cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985. |
|
(8) |
Con lettera del 1o agosto 2018, Bayer CropScience AG ha richiesto alla Commissione di trasferire i diritti e gli obblighi in capo a Bayer CropScience AG relativi a tutte le autorizzazioni e a tutte le domande pendenti di prodotti geneticamente modificati a BASF Agricultural Solutions Seed US LLC. Con lettera del 6 agosto 2018, BASF SE ha confermato il proprio consenso a tale trasferimento per conto di BASF Agricultural Solutions Seed US LLC. |
|
(9) |
In conformità del regolamento (CE) n. 65/2004 della Commissione (4), è opportuno assegnare un identificatore unico al cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985. |
|
(10) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (5). Tuttavia, al fine di garantire che l'uso di tali prodotti rimanga entro i limiti dell'autorizzazione rilasciata con la presente decisione, sull'etichettatura dei prodotti contenenti o costituiti dal cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985, ad eccezione dei prodotti alimentari, dovrebbe figurare una dicitura che indichi chiaramente che essi non sono destinati alla coltivazione. |
|
(11) |
Il titolare dell'autorizzazione dovrebbe presentare relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio degli effetti ambientali. Tali risultati dovrebbero essere presentati conformemente alle prescrizioni relative ai formulari standard per la comunicazione dei risultati stabilite dalla decisione 2009/770/CE della Commissione (6). |
|
(12) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio e/o all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(13) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(14) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità dell'articolo 9, paragrafo 1, e dell'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (7). |
|
(15) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Al cotone (Gossypium hirsutum) geneticamente modificato GHB614 × LLCotton25 × MON 15985, di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7 conformemente al regolamento (CE) n. 65/2004.
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità delle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da cotone GHB614 × LLCotton25 × MON 15985; |
|
b) |
mangimi contenenti, costituiti o derivati da cotone GHB614 × LLCotton25 × MON 15985; |
|
c) |
prodotti contenenti o costituiti da cotone GHB614 × LLCotton25 × MON 15985, per usi diversi da quelli indicati alle lettere a) e b) del presente articolo, ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «cotone».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti dal cotone geneticamente modificato di cui all'articolo 1, ad eccezione degli alimenti e degli ingredienti alimentari, e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del cotone geneticamente modificato di cui all'articolo 1 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Piano di monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, in conformità della decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Il titolare dell'autorizzazione è BASF Agricultural Solutions Seed US LLC (Stati Uniti), rappresentata da BASF SE (Germania).
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Germania, è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Scientific opinion on the assessment of genetically modified cotton GHB614 x LLCotton25 x MON 15985 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2011-94) [Parere scientifico sulla valutazione del cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985 destinato all'uso come alimento o come mangime, a norma del regolamento (CE) n. 1829/2003 (domanda EFSA-GMO-NL-2011-94).]. EFSA Journal 2018;16(4):5213, 27 pagg. doi: 10.2903/j.efsa.2018.5213.
(4) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(5) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(6) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(7) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
BASF Agricultural Solutions Seed US LLC |
|
Indirizzo |
: |
100 Park Avenue, Florham Park, New Jersey 07932, Stati Uniti d'America |
Rappresentata da BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Germania.
b) Designazione e specifica dei prodotti
|
1) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da cotone GHB614 × LLCotton25 × MON 15985; |
|
2) |
mangimi contenenti, costituiti o derivati da cotone GHB614 × LLCotton25 × MON 15985; |
|
3) |
prodotti contenenti o costituiti da cotone GHB614 × LLCotton25 × MON 15985, per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il cotone geneticamente modificato GHB614 × LLCotton25 × MON 15985, come descritto nella domanda, esprime la proteina 2mEPSPS che conferisce tolleranza agli erbicidi a base di glifosato, la proteina PAT che conferisce tolleranza agli erbicidi a base di glufosinato-ammonio, e le proteine Cry1Ac e Cry1Ab2 che conferiscono protezione da determinate specie di lepidotteri nocivi. Come marcatori selettivi nel processo di modificazione genetica sono inoltre stati utilizzati un gene uidA che codifica per la proteina GUS, un gene nptII che conferisce resistenza alla kanamicina e alla neomicina, e un gene aadA che conferisce resistenza alla spectinomicina e alla streptomicina.
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «cotone»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da cotone GHB614 × LLCotton25 × MON 15985 specificati alla lettera e), ad eccezione degli alimenti e degli ingredienti alimentari, e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
I metodi di rilevamento quantitativi evento-specifici PCR per il cotone GHB614 × LLCotton25 × MON 15985 sono quelli convalidati per gli eventi del cotone geneticamente modificato BCS-GHØØ2-5, ACS-GHØØ1-3 e MON-15985-7. I metodi di rilevamento sono stati convalidati sul DNA genomico estratto dalle foglie di cotone BCS-GHØØ2-5, ACS-GHØØ1-3 e MON-15985-7; |
|
2) |
convalidati dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicati all'indirizzo http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
materiale di riferimento: AOCS 1108-A5 (per BCS-GHØØ2-5), AOCS 0306-E2 (per ACS-GHØØ1-3) e AOCS 0804-D (MON-15985-7) accessibile tramite la American Oil Chemists' Society (AOCS) all'indirizzo https://www.aocs.org/crm. |
e) Identificatore unico
BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7.
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato all'atto della notifica nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/60 |
DECISIONE DI ESECUZIONE (UE) 2019/1303 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati dal granturco geneticamente modificato 5307 (SYN-Ø53Ø7-1) in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio relativo agli alimenti e ai mangimi geneticamente modificati
[notificata con il numero C(2019) 5493]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
Il 7 aprile 2011 Syngenta Crop Protection AG, per mezzo della sua società affiliata Syngenta Crop Protection NV/SA, ha presentato all'autorità nazionale competente della Germania, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003, una domanda relativa all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati dal granturco geneticamente modificato 5307 («la domanda»). La domanda riguardava anche l'immissione in commercio di prodotti contenenti o costituiti dal granturco geneticamente modificato 5307 per usi diversi dagli alimenti e dai mangimi, ad eccezione della coltivazione. |
|
(2) |
In conformità dell'articolo 5, paragrafo 5, e dell'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003, la domanda comprendeva le informazioni e le conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2) nonché le informazioni richieste negli allegati III e IV di tale direttiva. La domanda conteneva inoltre un piano di monitoraggio degli effetti ambientali di cui all'allegato VII della direttiva 2001/18/CE. |
|
(3) |
Il 5 maggio 2015 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (3). L'Autorità non è stata in grado di giungere ad una conclusione generale sul granturco 5307 a causa delle carenze di uno studio di tossicità a 28 giorni per la proteina eCry3.1Ab. |
|
(4) |
L'8 dicembre 2016 il richiedente ha fornito un nuovo studio di tossicità a 28 giorni sulla proteina eCry3.1Ab. |
|
(5) |
L'11 aprile 2018, tenendo conto dello studio di tossicità supplementare, l'Autorità ha pubblicato una dichiarazione che integrava il proprio parere scientifico (4). L'Autorità ha concluso che, sulla base della valutazione di cui al parere iniziale e dello studio di tossicità supplementare, il granturco 5307, nel campo di applicazione della domanda, è sicuro e nutriente quanto la sua versione tradizionale. |
|
(6) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti prevista dall'articolo 6, paragrafo 4, e dall'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(7) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, è conforme agli usi a cui i prodotti sono destinati. |
|
(8) |
Alla luce di tali conclusioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati dal granturco geneticamente modificato 5307 per gli usi elencati nella domanda. |
|
(9) |
In conformità del regolamento (CE) n. 65/2004 della Commissione (5), è opportuno assegnare un identificatore unico al granturco geneticamente modificato 5307. |
|
(10) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (6). Tuttavia, al fine di garantire che l'uso di tali prodotti rimanga entro i limiti dell'autorizzazione rilasciata con la presente decisione, sull'etichettatura dei prodotti contenenti o costituiti dal granturco geneticamente modificato 5307, ad eccezione dei prodotti alimentari, dovrebbe figurare una dicitura che indichi chiaramente che i prodotti in questione non sono destinati alla coltivazione. |
|
(11) |
Al fine di rendere conto dell'attuazione e dei risultati delle attività previste dal piano di monitoraggio degli effetti ambientali, il titolare dell'autorizzazione dovrebbe presentare relazioni annuali in conformità delle prescrizioni sui formulari standard di cui alla decisione 2009/770/CE della Commissione (7). |
|
(12) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(13) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(14) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità dell'articolo 9, paragrafo 1, e dell'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (8). |
|
(15) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Al granturco (Zea mays L.) geneticamente modificato 5307, di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico SYN-Ø53Ø7-1 conformemente al regolamento (CE) n. 65/2004.
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità delle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco SYN-Ø53Ø7-1; |
|
b) |
mangimi contenenti, costituiti o derivati da granturco SYN-Ø53Ø7-1; |
|
c) |
prodotti contenenti o costituiti da granturco SYN-Ø53Ø7-1, per usi diversi da quelli indicati alle lettere a) e b) del presente articolo, ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco SYN-Ø53Ø7-1, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del granturco SYN-Ø53Ø7-1 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, in conformità della decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Il titolare dell'autorizzazione è Syngenta Crop Protection AG, Svizzera, rappresentata da Syngenta Crop Protection NV/SA, Belgio.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
Syngenta Crop Protection NV/SA, Avenue Louise 489, 1050 Bruxelles, Belgio è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2015. Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG. [Parere scientifico sulla domanda (EFSA-GMO-DE-2011-95) relativa all'immissione in commercio del granturco geneticamente modificato 5307 a fini di alimentazione umana ed animale, importazione e lavorazione, presentata da Syngenta Crop Protection AG a norma del regolamento (CE) n. 1829/2003]. EFSA Journal 2015;13(5):4083, 29 pagg. https://doi.org/10.2903/j.efsa.2015.4083.
(4) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Statement complementing the EFSA Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG taking into consideration an additional toxicological study.[Dichiarazione che, alla luce dello studio di tossicità supplementare, integra il parere scientifico dell'EFSA sulla domanda (EFSA-GMO-DE-2011-95) relativa all'immissione in commercio del granturco geneticamente modificato 5307 a fini di alimentazione umana ed animale, importazione e lavorazione, presentata da Syngenta Crop Protection AG a norma del regolamento (CE) n. 1829/2003]. EFSA Journal 2018;16(4):5233, 9 pagg. https://doi.org/10.2903/j.efsa.2018.5233.
(5) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(6) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(7) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(8) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
Syngenta Crop Protection AG |
|
Indirizzo |
: |
Schwarzwaldallee 215, CH-4058 Basilea, Svizzera |
Rappresentata da Syngenta Crop Protection NV/SA, Avenue Louise 489, 1050 Bruxelles, Belgio.
b) Designazione e specifica dei prodotti
|
1) |
alimenti contenenti, costituiti o derivati da granturco SYN-Ø53Ø7-1; |
|
2) |
mangimi contenenti, costituiti o derivati da granturco SYN-Ø53Ø7-1; |
|
3) |
prodotti contenenti o costituiti da granturco SYN-Ø53Ø7-1, per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il granturco geneticamente modificato SYN-Ø53Ø7-1, come descritto nella domanda, esprime la proteina eCry3.1Ab che conferisce resistenza a determinate specie di coleotteri nocivi, e la proteina PMI che è stata utilizzata come marcatore selettivo.
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco SYN-Ø53Ø7-1, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
Metodo quantitativo evento-specifico, basato sulla PCR in tempo reale, per il rilevamento del granturco geneticamente modificato SYN-Ø53Ø7-1; |
|
2) |
convalidato dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicato all'indirizzo http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx; |
|
3) |
materiale di riferimento: AOCS 0411-C e AOCS 0411-D accessibile tramite la American Oil Chemists Society (AOCS) all'indirizzo https://www.aocs.org/crm. |
e) Identificatore unico
SYN-Ø53Ø7-1.
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato all'atto della notifica nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/65 |
DECISIONE DI ESECUZIONE (UE) 2019/1304 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato 4114 (DP-ØØ4114-3) in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5491]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
Il 27 novembre 2014 Pioneer Overseas Corporation, per conto di Pioneer Hi-Bred International Inc., Stati Uniti, ha presentato una domanda all'autorità nazionale competente dei Paesi Bassi, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003 («la domanda»). La domanda riguardava l'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati da granturco geneticamente modificato 4114. La domanda riguardava altresì l'immissione in commercio di prodotti contenenti o costituiti da granturco geneticamente modificato 4114 per usi diversi dagli alimenti e dai mangimi, ad eccezione della coltivazione. |
|
(2) |
In conformità all'articolo 5, paragrafo 5, e all'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003, la domanda comprendeva le informazioni e le conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2). Essa comprendeva altresì le informazioni richieste negli allegati III e IV di tale direttiva nonché un piano di monitoraggio degli effetti ambientali di cui all'allegato VII della stessa direttiva. |
|
(3) |
Il 24 maggio 2018 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (3). L'Autorità ha concluso che il granturco geneticamente modificato 4114, come descritto nella domanda, è sicuro quanto i comparatori non geneticamente modificati e quanto le varietà di riferimento di granturco non geneticamente modificate sottoposte a test per quanto riguarda i potenziali effetti sulla salute umana e animale e sull'ambiente. |
|
(4) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(5) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, è conforme agli usi cui sono destinati i prodotti. |
|
(6) |
Tenendo conto di tali considerazioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato 4114 per gli usi elencati nella domanda. |
|
(7) |
Al granturco geneticamente modificato 4114 dovrebbe essere assegnato un identificatore unico conformemente al regolamento (CE) n. 65/2004 della Commissione (4). |
|
(8) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (5). Tuttavia, al fine di garantire che l'uso di tali prodotti rimanga nel rispetto dei limiti fissati dall'autorizzazione rilasciata con la presente decisione, l'etichettatura dei prodotti contenenti o costituiti da granturco geneticamente modificato 4114, ad eccezione degli alimenti e degli ingredienti alimentari, dovrebbe riportare una dicitura che indichi chiaramente che essi non sono destinati alla coltivazione. |
|
(9) |
Al fine di rendere conto dell'attuazione e dei risultati delle attività previste dal piano di monitoraggio degli effetti ambientali, il titolare dell'autorizzazione dovrebbe presentare relazioni annuali conformemente alle prescrizioni relative ai formulari standard per la comunicazione dei dati stabilite dalla decisione 2009/770/CE della Commissione (6). |
|
(10) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(11) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(12) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità all'articolo 9, paragrafo 1, e all'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (7). |
|
(13) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Al granturco geneticamente modificato (Zea mays L.) 4114 di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico DP-ØØ4114-3 conformemente al regolamento (CE) n. 65/2004.
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità alle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco geneticamente modificato 4114; |
|
b) |
mangimi contenenti, costituiti o derivati da granturco geneticamente modificato 4114; |
|
c) |
prodotti contenenti o costituiti da granturco geneticamente modificato 4114 per usi diversi da quelli indicati alle lettere a) e b), ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco geneticamente modificato 4114, ad eccezione degli alimenti e degli ingredienti alimentari, e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del granturco geneticamente modificato 4114 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, in conformità alla decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Il titolare dell'autorizzazione è Pioneer Hi-Bred International, Inc., Stati Uniti, rappresentata da Pioneer Overseas Corporation, Belgio.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
Pioneer Overseas Corporation, Avenue des Arts 44, B-1040 Bruxelles, Belgio è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Scientific Opinion on the assessment of genetically modified maize 4114 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014-123). [Parere scientifico sulla valutazione del granturco geneticamente modificato 4114 destinato all'uso come alimento o come mangime a norma del regolamento (CE) n. 1829/2003 (domanda EFSA-GMO-NL-2014-123)]. EFSA Journal 2018; 16(5):5280, 25 pagg., https://doi.org/10.2903/j.efsa.2018.5280.
(4) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(5) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(6) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(7) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
Pioneer Hi-Bred International, Inc. |
|
Indirizzo |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, USA |
Rappresentata da: Pioneer Overseas Corporation, Avenue des Arts 44, 1040 Bruxelles, Belgio
b) Designazione e specifica dei prodotti
|
1) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco geneticamente modificato 4114; |
|
2) |
mangimi contenenti, costituiti o derivati da granturco geneticamente modificato 4114; |
|
3) |
prodotti contenenti o costituiti da granturco geneticamente modificato 4114 per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il granturco geneticamente modificato 4114 esprime le proteine Cry1F (versione troncata), Cry34Ab1 e Cry35Ab1 che conferiscono protezione da specifici parassiti dell'ordine dei lepidotteri e dei coleotteri, nonché la proteina PAT che conferisce tolleranza agli erbicidi a base di glufosinato ammonio.
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco geneticamente modificato 4114, ad eccezione dei prodotti di cui alla lettera b), punto 1) del presente allegato, e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
Metodo evento-specifico basato su PCR quantitativa in tempo reale per il granturco geneticamente modificato DP-ØØ4114-3; |
|
2) |
convalidato dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003 pubblicato all'indirizzo http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx; |
|
3) |
materiale di riferimento: ERM®-BF439, accessibile tramite il Centro comune di ricerca (JRC) della Commissione europea all'indirizzo https://ec.europa.eu/jrc/en/reference-materials/catalogue/. |
e) Identificatore unico
DP-ØØ4114-3
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato alla notifica nel registro degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/69 |
DECISIONE DI ESECUZIONE (UE) 2019/1305 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato Bt11 × MIR162 × 1507 × GA21 e dalle sottocombinazioni Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 e MIR162 × 1507 in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5502]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
Il 10 agosto 2010 Syngenta Crop Protection AG, per mezzo della sua società affiliata Syngenta Crop Protection NV/SA, ha presentato all'autorità nazionale competente della Germania, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003, una domanda relativa all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati da granturco geneticamente modificato Bt11 × MIR162 × 1507 × GA21 («la domanda»). La domanda riguardava altresì l'immissione in commercio di prodotti contenenti o costituiti da granturco geneticamente modificato Bt11 × MIR162 × 1507 × GA21 per usi diversi dagli alimenti e dai mangimi, ad eccezione della coltivazione. |
|
(2) |
In conformità all'articolo 5, paragrafo 5, e all'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003, la domanda comprendeva le informazioni e le conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2) nonché le informazioni richieste negli allegati III e IV di tale direttiva. La domanda conteneva inoltre un piano di monitoraggio degli effetti ambientali di cui all'allegato VII della direttiva 2001/18/CE. |
|
(3) |
Il 30 luglio 2013 Syngenta ha esteso il campo di applicazione della domanda a tutte le dieci sottocombinazioni dei singoli eventi di trasformazione che costituiscono il granturco Bt11 × MIR162 × 1507 × GA21. |
|
(4) |
Il 31 marzo 2016 Syngenta ha aggiornato il campo di applicazione della domanda escludendo le sottocombinazioni che rientravano nell'ambito di altre domande: Bt11 × MIR162 × GA21, Bt11 × MIR162, Bt11 × GA21 e MIR162 × GA21, autorizzate dalla decisione di esecuzione (UE) 2016/1685 della Commissione (3) e le sottocombinazioni Bt11 × 1507 × GA21, Bt11 × 1507 e 1507 × GA21, autorizzate dalla decisione di esecuzione (UE) 2017/1209 della Commissione (4). Il campo di applicazione della domanda comprende quindi le sottocombinazioni Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 e MIR162 × 1507. |
|
(5) |
L'11 luglio 2018 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (5). L'Autorità ha concluso che, nel contesto del campo di applicazione della domanda, il granturco geneticamente modificato Bt11 × MIR162 × 1507 × GA21, quale descritto nella domanda, è sicuro quanto il comparatore non geneticamente modificato e ad esso equivalente sotto il profilo nutrizionale. Per quanto riguarda le tre sottocombinazioni che rientrano nel campo di applicazione della domanda, l'Autorità ha concluso che ci si può attendere che siano sicure quanto i singoli eventi Bt11, MIR162, 1507 e GA21, quanto le sottocombinazioni precedentemente valutate e quanto il granturco contenente quattro eventi combinati Bt11 × MIR162 × 1507 × GA21. |
|
(6) |
Nel suo parere l'Autorità ha preso in considerazione le domande e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(7) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, è conforme agli usi cui sono destinati i prodotti. |
|
(8) |
Tenendo conto di tali conclusioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato Bt11 × MIR162 × 1507 × GA21 e delle tre sottocombinazioni di granturco Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 e MIR162 × 1507 per gli usi elencati nella domanda. |
|
(9) |
A ciascun organismo geneticamente modificato oggetto della presente decisione dovrebbe essere assegnato un identificatore unico conformemente al regolamento (CE) n. 65/2004 della Commissione (6). |
|
(10) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (7). Tuttavia, al fine di garantire che l'uso di tali prodotti avvenga nel rispetto dei limiti fissati dall'autorizzazione rilasciata con la presente decisione, l'etichettatura di tali prodotti, ad eccezione dei prodotti alimentari, dovrebbe riportare una dicitura che indichi chiaramente che non sono destinati alla coltivazione. |
|
(11) |
Al fine di rendere conto dell'attuazione e dei risultati delle attività previste dal piano di monitoraggio degli effetti ambientali, il titolare dell'autorizzazione dovrebbe presentare relazioni annuali conformemente alle prescrizioni relative ai formulari standard per la comunicazione dei dati stabilite dalla decisione 2009/770/CE della Commissione (8). |
|
(12) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(13) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(14) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità all'articolo 9, paragrafo 1, e all'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (9). |
|
(15) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismi geneticamente modificati e identificatori unici
Al granturco geneticamente modificato di cui all'allegato, lettera b), della presente decisione, sono assegnati i seguenti identificatori unici conformemente al regolamento (CE) n. 65/2004:
|
a) |
l'identificatore unico SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9 per il granturco geneticamente modificato (Zea mays L.) Bt11 × MIR162 × 1507 × GA21; |
|
b) |
l'identificatore unico SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 per il granturco geneticamente modificato (Zea mays L.) Bt11 × MIR162 × 1507; |
|
c) |
l'identificatore unico SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9 per il granturco geneticamente modificato (Zea mays L.) MIR162 × 1507 × GA21; |
|
d) |
l'identificatore unico SYN-IR162-4 × DAS-Ø15Ø7-1 per il granturco geneticamente modificato (Zea mays L.) MIR162 × 1507. |
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità alle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati dal granturco geneticamente modificato di cui all'articolo 1; |
|
b) |
mangimi contenenti, costituiti o derivati dal granturco geneticamente modificato di cui all'articolo 1; |
|
c) |
prodotti contenenti o costituiti dal granturco geneticamente modificato di cui all'articolo 1 per usi diversi da quelli indicati alle lettere a) e b), ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti dal granturco geneticamente modificato di cui all'articolo 1, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del granturco geneticamente modificato di cui all'articolo 1 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, in conformità alla decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Il titolare dell'autorizzazione è Syngenta Crop Protection AG, Svizzera, rappresentata da Syngenta Crop Protection NV/SA, Belgio.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
Syngenta Crop Protection NV/SA, Avenue Louise 489, 1050 Bruxelles, Belgio è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Decisione di esecuzione (UE) 2016/1685 della Commissione, del 16 settembre 2016, che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato Bt11 × MIR162 × MIR604 × GA21, e da varietà di granturco geneticamente modificato che combinano due o tre degli eventi Bt11, MIR162, MIR604 e GA21, e che abroga le decisioni 2010/426/UE, 2011/892/UE, 2011/893/UE e 2011/894/UE (GU L 254 del 20.9.2016, pag. 22).
(4) Decisione di esecuzione (UE) 2017/1209 della Commissione, del 4 luglio 2017, che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato Bt11 × 59122 × MIR604 × 1507 × GA21 e da granturco geneticamente modificato che combina due, tre o quattro degli eventi Bt11, 59122, MIR604, 1507 e GA21 ai sensi del regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio relativo agli alimenti e ai mangimi geneticamente modificati (GU L 173 del 6.7.2017, pag. 28).
(5) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Scientific Opinion on the assessment of genetically modified maize Bt11 x MIR162 x 1507 x GA21 and three subcombinations independently of their origin, for food and feed uses under Regulation (EC) No 1829/2003 (application EFSA-GMO-DE-2010-86). [Parere scientifico sulla valutazione del granturco geneticamente modificato Bt11 x MIR162 x 1507 x GA21 e delle tre sue sottocombinazioni, a prescindere dalla loro origine, destinati all'uso come alimento o come mangime a norma del regolamento (CE) n. 1829/2003 (domanda EFSA-GMO-DE-2010-86)]. EFSA Journal 2018;16(7):5309.
(6) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(7) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(8) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(9) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
Syngenta Crop Protection AG |
|
Indirizzo |
: |
Schwarzwaldallee 215, CH-4058 Basilea, Svizzera |
Rappresentata da Syngenta Crop Protection NV/SA, Avenue Louise 489, 1050 Bruxelles, Belgio.
b) Designazione e specifica dei prodotti
|
1) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati dal granturco geneticamente modificato (Zea mays L.) di cui alla lettera e); |
|
2) |
mangimi contenenti, costituiti o derivati dal granturco geneticamente modificato (Zea mays L.) di cui alla lettera e); |
|
3) |
prodotti contenenti o costituiti dal granturco geneticamente modificato di cui alla lettera e) per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il granturco geneticamente modificato SYN-BTØ11-1 esprime la proteina Cry1Ab, che conferisce protezione da determinate specie di lepidotteri nocivi, e la proteina PAT, che conferisce tolleranza agli erbicidi a base di glufosinato-ammonio.
Il granturco geneticamente modificato SYN-IR162-4 esprime la proteina Vip3Aa20, che conferisce protezione da determinate specie di lepidotteri nocivi, e la proteina PMI, che è stata usata come marcatore selezionabile.
Il granturco geneticamente modificato DAS-Ø15Ø7-1 esprime la proteina Cry1F, che conferisce protezione da determinate specie di lepidotteri nocivi, e la proteina PAT, che conferisce tolleranza agli erbicidi a base di glufosinato-ammonio.
Il granturco geneticamente modificato MON-ØØØ21-9 esprime la proteina mEPSPS, che conferisce tolleranza agli erbicidi a base di glifosato.
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti dal granturco di cui alla lettera e), ad eccezione dei prodotti di cui alla lettera b), punto 1, del presente allegato, e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
I metodi di rilevamento evento-specifici basati su PCR quantitativa per il granturco Bt11 × MIR162 × 1507 × GA21 sono quelli convalidati per gli eventi del granturco geneticamente modificato SYN-BTØ11-1, SYN-IR162-4, DAS-Ø15Ø7-1 e MON-ØØØ21-9; |
|
2) |
convalidati dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicati all'indirizzo: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
materiale di riferimento: ERM®-BF412 (per SYN-BTØ11-1) e ERM®-BF418 (per DAS-Ø15Ø7-1) accessibili tramite il Centro comune di ricerca (JRC) della Commissione europea all'indirizzo https://ec.europa.eu/jrc/en/reference-materials/catalogue/, nonché AOCS 1208-A e AOCS 0407-A (per SYN-IR162-4), AOCS 0407-A e AOCS 0407-B (per MON-ØØØ21-9) accessibili tramite la American Oil Chemists Society all'indirizzo https://www.aocs.org/crm#maize. |
e) Identificatori unici
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9;
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1;
SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9;
SYN-IR162-4 × DAS-Ø15Ø7-1.
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato all'atto della notifica nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Le modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/75 |
DECISIONE DI ESECUZIONE (UE) 2019/1306 DELLA COMMISSIONE
del 26 luglio 2019
che rinnova l'autorizzazione all'immissione in commercio di prodotti contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato 1507 × NK603 (DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6) in conformità del regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5503]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 11, paragrafo 3, e l'articolo 23, paragrafo 3,
considerando quanto segue:
|
(1) |
La decisione 2007/703/CE della Commissione (2) ha autorizzato l'immissione in commercio di alimenti e mangimi contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato della linea 1507 × NK603 (di seguito «granturco 1507 × NK603»). Il campo di applicazione di tale autorizzazione riguarda anche l'immissione in commercio di prodotti, diversi da alimenti e mangimi, contenenti o costituiti da granturco 1507 × NK603 per gli stessi usi di tutti gli altri tipi di granturco ad eccezione della coltivazione. |
|
(2) |
Il 20 ottobre 2016 Pioneer Overseas Corporation, per conto di Pioneer Hi-Bred International, Inc., e Dow AgroSciences Europe, per conto di Dow AgroSciences LLC, hanno presentato congiuntamente alla Commissione una domanda di rinnovo di tale autorizzazione conformemente agli articoli 11 e 23 del regolamento (CE) n. 1829/2003. |
|
(3) |
Il 25 luglio 2018 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole (3) conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003. Essa ha concluso che la domanda di rinnovo non conteneva prove di nuovi pericoli, modifiche dell'esposizione o incertezze scientifiche tali da modificare le conclusioni della valutazione iniziale del rischio relativa al granturco 1507 × NK603 adottata dall'Autorità nel 2006 (4). |
|
(4) |
Nel suo parere del 25 luglio 2018 l'Autorità ha preso in considerazione tutte le domande e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(5) |
L'Autorità ha inoltre concluso che il piano di monitoraggio degli effetti ambientali presentato dai richiedenti, costituito da un piano generale di sorveglianza, è conforme agli usi previsti dei prodotti. |
|
(6) |
Tenendo conto di tali conclusioni, è opportuno rinnovare l'autorizzazione all'immissione in commercio di alimenti e mangimi contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato 1507 × NK603 e di prodotti contenenti o costituiti da tale granturco per usi diversi dagli alimenti o dai mangimi, ad eccezione della coltivazione. |
|
(7) |
Con lettera del 13 settembre 2018, Dow AgroSciences Europe ha chiesto alla Commissione, nel contesto del recesso del Regno Unito dall'Unione europea, che il rappresentante nell'Unione di Dow AgroSciences LLC, Stati Uniti, sia Dow AgroSciences Distribution S.A.S., con sede in Francia. Con lettera del 7 settembre 2018, Dow AgroSciences Distribution S.A.S ha confermato il proprio accordo. |
|
(8) |
Con lettera del 12 ottobre 2018, Dow AgroSciences LLC ha anch'essa confermato il proprio accordo ad essere rappresentata da Dow AgroSciences Distribution S.A.S. e ha chiarito che Mycogen Seeds è una controllata di Dow AgroSciences LLC. |
|
(9) |
Al granturco geneticamente modificato 1507 × NK603 è stato assegnato un identificatore unico conformemente al regolamento (CE) n. 65/2004 della Commissione (5) nel contesto dell'autorizzazione iniziale. È opportuno continuare a utilizzare tale identificatore unico. |
|
(10) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (6). Tuttavia, al fine di garantire che l'utilizzo dei prodotti contenenti o costituiti da granturco 1507 × NK603 resti nei limiti fissati dall'autorizzazione rilasciata con la presente decisione, l'etichettatura di tali prodotti, ad eccezione dei prodotti alimentari, dovrebbe riportare una dicitura che indichi chiaramente che essi non sono destinati alla coltivazione. |
|
(11) |
I titolari dell'autorizzazione dovrebbero presentare relazioni annuali congiunte sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio. Tali risultati dovrebbero essere presentati conformemente ai requisiti stabiliti dalla decisione 2009/770/CE della Commissione (7). |
|
(12) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(13) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(14) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità dell'articolo 9, paragrafo 1, e dell'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (8). |
|
(15) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Al granturco geneticamente modificato (Zea mays L.) 1507 × NK603, di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6 conformemente al regolamento (CE) n. 65/2004.
Articolo 2
Rinnovo dell'autorizzazione
L'autorizzazione all'immissione in commercio dei seguenti prodotti è rinnovata conformemente alle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato 1507 × NK603; |
|
b) |
mangimi contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato 1507 × NK603; |
|
c) |
prodotti contenenti o costituiti da granturco geneticamente modificato 1507 × NK603, per usi diversi da quelli indicati alle lettere a) e b) del presente articolo, ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco geneticamente modificato 1507 × NK603, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del granturco geneticamente modificato 1507 × NK603 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Piano di monitoraggio degli effetti ambientali
1. I titolari dell'autorizzazione provvedono affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. I titolari dell'autorizzazione presentano alla Commissione relazioni annuali congiunte sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, conformemente al formulario di cui alla decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolari dell'autorizzazione
1. I titolari dell'autorizzazione sono:
|
a) |
Pioneer Hi-Bred International, Inc., Stati Uniti, rappresentata da Pioneer Overseas Corporation, Belgio, e |
|
b) |
Dow AgroSciences LLC, Stati Uniti, rappresentata da Dow AgroSciences Distribution S.A.S., Francia. |
2. Entrambi i titolari dell'autorizzazione sono responsabili dell'adempimento degli obblighi imposti ai titolari dell'autorizzazione dalla presente decisione e dal regolamento (CE) n. 1829/2003.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatari
I destinatari della presente decisione sono:
|
a) |
Pioneer Overseas Corporation, Avenue des Arts 44, B-1040 Bruxelles, Belgio; e |
|
b) |
Dow AgroSciences Distribution S.A.S., 6, rue Jean Pierre Timbaud, 78180 Montigny le Bretonneux, Francia. |
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Decisione 2007/703/CE della Commissione, del 24 ottobre 2007, che autorizza l'immissione in commercio di prodotti contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato della linea 1507 × NK603 (DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6) a norma del regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio (GU L 285 del 31.10.2007, pag. 47).
(3) Gruppo di esperti scientifici sugli OGM dell'EFSA, 2018. Scientific Opinion on the assessment of genetically modified maize 1507 × NK603 for renewal of authorisation under Regulation (EC) No 1829/2003 [Parere scientifico sulla valutazione del granturco geneticamente modificato 1507 × NK603 ai fini del rinnovo dell'autorizzazione a norma del regolamento (CE) n. 1829/2003] (domanda EFSA-GMO-RX-008). EFSA Journal 2018;16(7): 5347.
(4) Opinion of the Scientific Panel on Genetically Modified Organisms on an application (Reference EFSA-GMO-UK-2004-05) for the placing on the market of insect-protected and glufosinate and glyphosate-tolerant genetically modified maize 1507 × NK603, for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Pioneer Hi-Bred and Mycogen Seeds [Parere del gruppo di esperti scientifici sugli organismi geneticamente modificati relativo a una domanda (riferimento EFSA-GMO-UK-2004-05) per l'immissione sul mercato di granturco geneticamente modificato 1507 × NK603 protetto dagli insetti e tollerante al glufosinato e al glifosato, destinato all'alimentazione umana e animale, all'importazione e alla lavorazione presentata a norma del regolamento (CE) n. 1829/2003 da Pioneer Hi-Bred e Mycogen Seeds]. EFSA Journal 2006;4(5): 355.
(5) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(6) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(7) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(8) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedenti e titolari dell'autorizzazione
|
Nome |
: |
Pioneer Hi-Bred International, Inc. |
|
Indirizzo |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, Stati Uniti |
Rappresentata da: Pioneer Overseas Corporation, Avenue des Arts 44, 1040 Bruxelles, Belgio
e
|
Nome |
: |
Dow AgroSciences LLC |
|
Indirizzo |
: |
9330 Zionsville Road, Indianapolis, IN 46268-1054, Stati Uniti |
Rappresentata da: Dow AgroSciences Distribution S.A.S., 6, rue Jean Pierre Timbaud, 78180 Montigny le Bretonneux, Francia
b) Designazione e specifica dei prodotti
|
1) |
alimenti e ingredienti alimentari contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato 1507 × NK603; |
|
2) |
mangimi contenenti, costituiti da o prodotti a partire da granturco geneticamente modificato 1507 × NK603; |
|
3) |
prodotti contenenti o costituiti da granturco geneticamente modificato 1507 × NK603 per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il granturco geneticamente modificato 1507 × NK603 esprime il gene cry1F che conferisce protezione da determinate specie di lepidotteri nocivi, il gene pat che conferisce tolleranza agli erbicidi a base di glufosinato-ammonio e il gene cp4 epsps che conferisce tolleranza agli erbicidi a base di glifosato.
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco geneticamente modificato 1507 × NK603, ad eccezione dei prodotti di cui alla lettera b), punto 1), del presente allegato, e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
Metodi evento-specifici basati su PCR quantitativa in tempo reale per il granturco geneticamente modificato DAS-Ø15Ø7-1 e il granturco MON-ØØ6Ø3-6 convalidati sul granturco DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6; |
|
2) |
convalidato dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicato all'indirizzo http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx; |
|
3) |
materiale di riferimento: ERM®-BF418 (per DAS-Ø15Ø7-1) e ERM®-BF415 (per MON-ØØ6Ø3-6) accessibili tramite il Centro comune di ricerca (JRC) della Commissione europea, all'indirizzo https://ec.europa.eu/jrc/en/reference-materials/catalogue/. |
e) Identificatore unico
DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato alla notifica nel registro degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (1).
[Link: piano pubblicato nel registro degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
(1) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/81 |
DECISIONE DI ESECUZIONE (UE) 2019/1307 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati dal granturco geneticamente modificato MON 87403 (MON-874Ø3-1) in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5481]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
Il 26 giugno 2015 Monsanto Europe SA/N.V. ha presentato per conto di Monsanto Company, Stati Uniti d'America, all'autorità nazionale competente del Belgio, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003, una domanda relativa all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati dal granturco geneticamente modificato MON 87403 («la domanda»). La domanda riguardava altresì l'immissione in commercio di prodotti contenenti o costituiti dal granturco geneticamente modificato MON 87403 per usi diversi dagli alimenti e dai mangimi, ad eccezione della coltivazione. |
|
(2) |
In conformità dell'articolo 5, paragrafo 5, e dell'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003, la domanda comprendeva le informazioni e le conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2) nonché le informazioni richieste negli allegati III e IV di tale direttiva. La domanda conteneva inoltre un piano di monitoraggio degli effetti ambientali di cui all'allegato VII della direttiva 2001/18/CE. |
|
(3) |
Il 26 aprile 2018 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (3). L'Autorità ha concluso che il granturco geneticamente modificato MON 87403, come descritto nella domanda, è sicuro quanto la sua versione tradizionale e le varietà di riferimento non geneticamente modificate sottoposte a test per quanto riguarda i potenziali effetti sulla salute umana e animale e sull'ambiente. |
|
(4) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande specifiche e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(5) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, era conforme agli usi a cui i prodotti sono destinati. |
|
(6) |
Tenendo conto di tali conclusioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati dal granturco geneticamente modificato MON 87403 per gli usi elencati nella domanda. |
|
(7) |
Con lettera del 27 agosto 2018, Monsanto Europe N.V. ha informato la Commissione del fatto che Monsanto Europe N.V. aveva modificato la propria forma giuridica e il proprio nome in Bayer Agriculture BVBA, Belgio. |
|
(8) |
In conformità del regolamento (CE) n. 65/2004 della Commissione (4), è opportuno assegnare un identificatore unico al granturco geneticamente modificato MON 87403. |
|
(9) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (5). Tuttavia, al fine di garantire che l'uso di tali prodotti rimanga entro i limiti dell'autorizzazione rilasciata con la presente decisione, sull'etichettatura dei prodotti contenenti o costituiti dal granturco geneticamente modificato MON 87403, ad eccezione dei prodotti alimentari, dovrebbe figurare una dicitura che indichi chiaramente che essi non sono destinati alla coltivazione. |
|
(10) |
Al fine di rendere conto dell'attuazione e dei risultati delle attività previste dal piano di monitoraggio degli effetti ambientali, il titolare dell'autorizzazione dovrebbe presentare relazioni annuali conformemente alle prescrizioni relative ai formulari standard per la comunicazione dei risultati stabilite dalla decisione 2009/770/CE della Commissione (6). |
|
(11) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(12) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(13) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della convenzione sulla diversità biologica, in conformità dell'articolo 9, paragrafo 1, e dell'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (7). |
|
(14) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Al granturco geneticamente modificato (Zea mays L.) MON 87403, di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico MON-874Ø3-1 conformemente al regolamento (CE) n. 65/2004.
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità delle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco MON-874Ø3-1; |
|
b) |
mangimi contenenti, costituiti o derivati da granturco MON-874Ø3-1; |
|
c) |
prodotti contenenti o costituiti da granturco MON-874Ø3-1, per usi diversi da quelli indicati alle lettere a) e b) del presente articolo, ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco MON-874Ø3-1, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del granturco MON-874Ø3-1 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, in conformità della decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Il titolare dell'autorizzazione è Monsanto Company, Stati Uniti d'Americas, rappresentata da Bayer Agriculture BVBA, Belgio.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
Bayer Agriculture BVBA, Scheldelaan 460, 2040 Anversa, Belgio, è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Scientific Opinion on the assessment of genetically modified maize MON 87403 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-BE-2015-125). [Parere scientifico sulla valutazione del granturco geneticamente modificato MON 87403 destinato all'uso come alimento o come mangime, all'importazione e alla lavorazione a norma del regolamento (CE) n. 1829/2003 (domanda EFSA-GMO-BE-2015-125).]. EFSA Journal 2018;16(3):5225, 28 pagg. https://doi.org/10.2903/j.efsa.2018.5225.
(4) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(5) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(6) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(7) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
Monsanto Company |
|
Indirizzo |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Stati Uniti d'America |
Rappresentata da Bayer Agriculture BVBA, Scheldelaan 460, 2040 Anversa, Belgio.
b) Designazione e specifica dei prodotti
|
1) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco MON-874Ø3-1; |
|
2) |
mangimi contenenti, costituiti o derivati da granturco MON-874Ø3-1; |
|
3) |
prodotti contenenti o costituiti da granturco MON-874Ø3-1, per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il granturco geneticamente modificato MON-874Ø3-1 è stato sviluppato al fine di aumentare la biomassa della spiga all'inizio della fase riproduttiva attraverso l'espressione della proteina AtHB17Δ113 (codificata da un gene di Arabidopsis thaliana).
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco MON-874Ø3-1, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
Metodo quantitativo evento-specifico, basato sulla PCR in tempo reale, per il rilevamento del granturco geneticamente modificato MON-874Ø3-1; |
|
2) |
convalidato dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicato all'indirizzo http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx; |
|
3) |
materiale di riferimento: AOCS 0216-A accessibile tramite la American Oil Chemists Society (AOCS) all'indirizzo https://www.aocs.org/crm. |
e) Identificatore unico
MON-874Ø3-1.
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato all'atto della notifica nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/85 |
DECISIONE DI ESECUZIONE (UE) 2019/1308 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato MON 87411 (MON-87411-9) in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5487]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
Il 5 febbraio 2015 Monsanto Europe N.V. ha presentato, per conto di Monsanto Company, Stati Uniti, all'autorità nazionale competente dei Paesi Bassi, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003, una domanda relativa all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati da granturco MON 87411 («la domanda»). La domanda riguardava altresì l'immissione in commercio di prodotti costituiti da granturco geneticamente modificato MON 87411, diversi dagli alimenti e dai mangimi e destinati agli stessi usi di tutti gli altri tipi di granturco, ad eccezione della coltivazione. |
|
(2) |
In conformità all'articolo 5, paragrafo 5, e all'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003, la domanda comprendeva le informazioni e conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2) nonché le informazioni richieste negli allegati III e IV di tale direttiva. La domanda conteneva inoltre un piano di monitoraggio degli effetti ambientali indicato nell'allegato VII della direttiva 2001/18/CE. |
|
(3) |
Il 2 luglio 2018 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (3). L'Autorità ha concluso che il granturco geneticamente modificato MON 87411, come descritto nella domanda, è sicuro ed equivalente dal punto di vista nutrizionale rispetto alla sua versione tradizionale e alle varietà di riferimento non geneticamente modificate sottoposte a test per quanto riguarda i potenziali effetti sulla salute umana e animale e sull'ambiente. |
|
(4) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande e le preoccupazioni degli Stati membri espresse nel contesto della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(5) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, è conforme agli usi cui i prodotti sono destinati. |
|
(6) |
Tenendo conto di tali conclusioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati da granturco geneticamente modificato MON 87411 per gli usi elencati nella domanda. |
|
(7) |
Con lettera del 27 agosto 2018, Monsanto Europe N.V. ha informato la Commissione del fatto che Monsanto Europe N.V. aveva modificato la propria forma giuridica e il proprio nome in Bayer Agriculture BVBA, Belgio. |
|
(8) |
In conformità al regolamento (CE) n. 65/2004 della Commissione (4) è opportuno assegnare un identificatore unico al granturco geneticamente modificato MON 87411. |
|
(9) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (5). Tuttavia, al fine di garantire che l'utilizzo di tali prodotti resti nei limiti fissati dall'autorizzazione rilasciata con la presente decisione, l'etichettatura dei prodotti contenenti o costituiti dal granturco geneticamente modificato MON 87411, ad eccezione dei prodotti alimentari, dovrebbe riportare una dicitura indicante chiaramente che essi non sono destinati alla coltivazione. |
|
(10) |
Al fine di rendere conto dell'attuazione e dei risultati delle attività previste nel piano di monitoraggio degli effetti ambientali, il titolare dell'autorizzazione dovrebbe presentare relazioni annuali conformemente alle prescrizioni relative ai formulari standard per la comunicazione dei risultati stabilite dalla decisione 2009/770/CE della Commissione (6). |
|
(11) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(12) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel Registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(13) |
La presente decisione va notificata attraverso il Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica, in conformità all'articolo 9, paragrafo 1, e all'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (7). |
|
(14) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Al granturco geneticamente modificato (Zea mays L.) MON 87411, di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico MON-87411-9, come previsto dal regolamento (CE) n. 65/2004.
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, in conformità alle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco MON-87411-9; |
|
b) |
mangimi contenenti, costituiti o derivati da granturco MON-87411-9; |
|
c) |
prodotti contenenti o costituiti da granturco MON-87411-9, per usi diversi da quelli indicati alle lettere a) e b) del presente articolo, ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco MON-87411-9, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento del granturco MON-87411-9 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, in conformità alla decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato della presente decisione sono inserite nel Registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Titolare dell'autorizzazione è Monsanto Company, Stati Uniti, rappresentata da Bayer Agriculture BVBA, Belgio.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
Bayer Agriculture BVBA, Scheldelaan 460, 2040 Anversa, Belgio, è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Scientific Opinion on the assessment of genetically modified maize MON 87411 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2015-124) [parere scientifico sulla valutazione del granturco geneticamente modificato MON 87411 a fini di alimentazione umana e animale, importazione e trasformazione, a norma del regolamento (CE) n. 1829/2003 (domanda EFSA-GMO-NL-2015-124)], EFSA Journal 2018; 16(6):5310, 29 pp. doi: 10.2903/j.efsa.2018.5310.
(4) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(5) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(6) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(7) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
Monsanto Company |
|
Indirizzo |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Stati Uniti d'America |
Rappresentata da Bayer Agriculture BVBA, Scheldelaan 460, 2040 Anversa, Belgio.
b) Designazione e specifica dei prodotti
|
1) |
Alimenti e ingredienti alimentari contenenti, costituiti o derivati da granturco MON-87411-9; |
|
2) |
mangimi contenenti, costituiti o derivati da granturco MON-87411-9; |
|
3) |
prodotti contenenti o costituiti da granturco MON-87411-9, per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
Il granturco geneticamente modificato MON-87411-9 esprime la proteina CP4 EPSPS, che conferisce tolleranza agli erbicidi a base di glifosato, la proteina Cry3Bb1 e il dsRNA DvSnf7, che conferisce resistenza alla diabrotica del mais (Diabrotica spp.).
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «granturco»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da granturco MON-87411-9, ad eccezione dei prodotti di cui alla lettera b), punto 1), del presente allegato e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
Metodo quantitativo evento-specifico, basato sulla PCR in tempo reale, per il rilevamento del granturco geneticamente modificato MON 87411; |
|
2) |
convalidato dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicato all' indirizzo http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
materiale di riferimento: AOCS 0215-B accessibile tramite la American Oil Chemists' Society (AOCS) all'indirizzo https://www.aocs.org/crm. |
e) Identificatore unico
MON-87411-9
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato alla notifica nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/90 |
DECISIONE DI ESECUZIONE (UE) 2019/1309 DELLA COMMISSIONE
del 26 luglio 2019
che autorizza l'immissione in commercio di prodotti contenenti, costituiti o derivati da soia geneticamente modificata MON 87751 (MON-87751-7) in conformità al regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio
[notificata con il numero C(2019) 5489]
(I testi in lingua francese e neerlandese sono i soli facenti fede)
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1829/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, relativo agli alimenti e ai mangimi geneticamente modificati (1), in particolare l'articolo 7, paragrafo 3, e l'articolo 19, paragrafo 3,
considerando quanto segue:
|
(1) |
Il 26 settembre 2014 Monsanto Europe SA/N.V. ha presentato per conto di Monsanto Company, Stati Uniti, all'autorità nazionale competente dei Paesi Bassi, conformemente agli articoli 5 e 17 del regolamento (CE) n. 1829/2003, una domanda relativa all'immissione in commercio di alimenti, ingredienti alimentari e mangimi contenenti, costituiti o derivati da soia geneticamente modificata MON 87751 («la domanda»). La domanda riguardava altresì l'immissione in commercio di prodotti contenenti o costituiti da soia geneticamente modificata MON 87751 per usi diversi dagli alimenti e dai mangimi, ad eccezione della coltivazione. |
|
(2) |
Conformemente all'articolo 5, paragrafo 5, e all'articolo 17, paragrafo 5, del regolamento (CE) n. 1829/2003 la domanda comprendeva le informazioni e conclusioni sulla valutazione del rischio effettuata conformemente ai principi di cui all'allegato II della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (2) nonché le informazioni richieste negli allegati III e IV di tale direttiva. Essa conteneva anche un piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE. |
|
(3) |
Il 2 agosto 2018 l'Autorità europea per la sicurezza alimentare («l'Autorità») ha espresso un parere favorevole conformemente agli articoli 6 e 18 del regolamento (CE) n. 1829/2003 (3). L'Autorità ha concluso che la soia geneticamente modificata MON 87751, come descritta nella domanda, è sicura quanto la sua versione tradizionale e le varietà di riferimento non geneticamente modificate sottoposte a test per quanto riguarda i potenziali effetti sulla salute umana e animale ed è ad esse equivalente sotto il profilo nutrizionale. |
|
(4) |
Nel suo parere l'Autorità ha preso in considerazione tutte le domande e le preoccupazioni sollevate dagli Stati membri nell'ambito della consultazione delle autorità nazionali competenti, come previsto all'articolo 6, paragrafo 4, e all'articolo 18, paragrafo 4, del regolamento (CE) n. 1829/2003. |
|
(5) |
L'Autorità è inoltre pervenuta alla conclusione che il piano di monitoraggio degli effetti ambientali presentato dal richiedente, consistente in un piano generale di sorveglianza, era conforme agli usi cui i prodotti sono destinati. |
|
(6) |
Tenendo conto di tali conclusioni, è opportuno autorizzare l'immissione in commercio di prodotti contenenti, costituiti o derivati da soia geneticamente modificata MON 87751 per gli usi elencati nella domanda. |
|
(7) |
Con lettera del 27 agosto 2018, Monsanto Europe N.V. ha informato la Commissione del fatto che Monsanto Europe N.V. aveva modificato la propria forma giuridica e cambiato il proprio nome in Bayer Agriculture BVBA, Belgio. |
|
(8) |
È opportuno assegnare un identificatore unico alla soia geneticamente modificata MON 87751 conformemente al regolamento (CE) n. 65/2004 della Commissione (4). |
|
(9) |
In base al parere dell'Autorità, per i prodotti oggetto della presente decisione non risultano necessari requisiti specifici in materia di etichettatura diversi da quelli di cui all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003 e all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio (5). Tuttavia, al fine di garantire che l'uso di tali prodotti rimanga entro i limiti dell'autorizzazione rilasciata con la presente decisione, sull'etichettatura dei prodotti contenenti o costituiti da soia geneticamente modificata MON 87751, ad eccezione dei prodotti alimentari, dovrebbe figurare una dicitura che indichi chiaramente che essi non sono destinati alla coltivazione. |
|
(10) |
Al fine di rendere conto dell'attuazione e dei risultati delle attività previste dal piano di monitoraggio degli effetti ambientali, il titolare dell'autorizzazione dovrebbe presentare relazioni annuali conformemente alle prescrizioni sui formulari standard di cui alla decisione 2009/770/CE della Commissione (6). |
|
(11) |
Il parere dell'Autorità non giustifica l'imposizione di condizioni specifiche o di restrizioni all'immissione in commercio, all'uso e alla manipolazione, compresi i requisiti relativi al monitoraggio successivo all'immissione in commercio per quanto riguarda il consumo degli alimenti e dei mangimi o per la tutela di particolari ecosistemi/ambienti o aree geografiche, secondo quanto disposto dall'articolo 6, paragrafo 5, lettera e), e dall'articolo 18, paragrafo 5, lettera e), del regolamento (CE) n. 1829/2003. |
|
(12) |
Tutte le informazioni pertinenti relative all'autorizzazione dei prodotti dovrebbero essere iscritte nel Registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003. |
|
(13) |
La presente decisione va notificata attraverso il centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House) alle parti del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica, in conformità all'articolo 9, paragrafo 1, e all'articolo 15, paragrafo 2, lettera c), del regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio (7). |
|
(14) |
Il comitato permanente per le piante, gli animali, gli alimenti e i mangimi non ha espresso alcun parere entro il termine fissato dal suo presidente. Il presente atto di esecuzione è stato ritenuto necessario e il presidente lo ha sottoposto al comitato di appello per una nuova delibera. Il comitato di appello non ha espresso alcun parere, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Organismo geneticamente modificato e identificatore unico
Alla soia geneticamente modificata [Glycine max (L.) Merr.] MON 87751, di cui all'allegato, lettera b), della presente decisione, è assegnato l'identificatore unico MON-87751-7 conformemente al regolamento (CE) n. 65/2004.
Articolo 2
Autorizzazione
I seguenti prodotti sono autorizzati ai fini dell'articolo 4, paragrafo 2, e dell'articolo 16, paragrafo 2, del regolamento (CE) n. 1829/2003, conformemente alle condizioni stabilite nella presente decisione:
|
a) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da soia geneticamente modificata MON-87751-7; |
|
b) |
mangimi contenenti, costituiti o derivati da soia geneticamente modificata MON-87751-7; |
|
c) |
prodotti contenenti o costituiti da soia geneticamente modificata MON-87751-7 per usi diversi da quelli indicati alle lettere a) e b), ad eccezione della coltivazione. |
Articolo 3
Etichettatura
1. Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «soia».
2. La dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da soia geneticamente modificata MON-87751-7, ad eccezione dei prodotti di cui all'articolo 2, lettera a), e nei documenti che li accompagnano.
Articolo 4
Metodo di rilevamento
Per il rilevamento della soia geneticamente modificata MON-87751-7 si applica il metodo indicato alla lettera d) dell'allegato.
Articolo 5
Monitoraggio degli effetti ambientali
1. Il titolare dell'autorizzazione provvede affinché sia avviato e attuato il piano di monitoraggio degli effetti ambientali di cui alla lettera h) dell'allegato.
2. Il titolare dell'autorizzazione presenta alla Commissione relazioni annuali sull'attuazione e sui risultati delle attività previste dal piano di monitoraggio, conformemente alla decisione 2009/770/CE.
Articolo 6
Registro comunitario
Le informazioni indicate nell'allegato sono inserite nel Registro comunitario degli alimenti e dei mangimi geneticamente modificati di cui all'articolo 28, paragrafo 1, del regolamento (CE) n. 1829/2003.
Articolo 7
Titolare dell'autorizzazione
Il titolare dell'autorizzazione è Monsanto Company, Stati Uniti, rappresentata da Bayer Agriculture BVBA, Belgio.
Articolo 8
Validità
La presente decisione si applica per un periodo di dieci anni a decorrere dalla data di notifica.
Articolo 9
Destinatario
Bayer Agriculture BVBA, Scheldelaan 460, 2040 Anversa, Belgio, è destinataria della presente decisione.
Fatto a Bruxelles, il 26 luglio 2019
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 268 del 18.10.2003, pag. 1.
(2) Direttiva 2001/18/CE del Parlamento europeo e del Consiglio, del 12 marzo 2001, sull'emissione deliberata nell'ambiente di organismi geneticamente modificati e che abroga la direttiva 90/220/CEE del Consiglio (GU L 106 del 17.4.2001, pag. 1).
(3) Gruppo di esperti scientifici dell'EFSA sugli organismi geneticamente modificati (OGM), 2018. Scientific opinion on the assessment of genetically modified soybean MON 87751 for food and feed uses under Regulation (EC) No 1829/2003. [Parere scientifico sulla valutazione della soia geneticamente modificata MON 87751 destinata all'uso come alimento o come mangime a norma del regolamento (CE) n. 1829/2003] (domanda EFSA-GMO-NL-2014-121). EFSA Journal 2018; 16(8):5346, 32 pagg. doi: 10.2903/j.efsa.2018.5346.
(4) Regolamento (CE) n. 65/2004 della Commissione, del 14 gennaio 2004, che stabilisce un sistema per la determinazione e l'assegnazione di identificatori unici per gli organismi geneticamente modificati (GU L 10 del 16.1.2004, pag. 5).
(5) Regolamento (CE) n. 1830/2003 del Parlamento europeo e del Consiglio, del 22 settembre 2003, concernente la tracciabilità e l'etichettatura di organismi geneticamente modificati e la tracciabilità di alimenti e mangimi ottenuti da organismi geneticamente modificati, nonché recante modifica della direttiva 2001/18/CE (GU L 268 del 18.10.2003, pag. 24).
(6) Decisione 2009/770/CE della Commissione, del 13 ottobre 2009, che istituisce formulari standard per la comunicazione dei risultati del monitoraggio dell'emissione deliberata nell'ambiente di organismi geneticamente modificati, come prodotti o all'interno di prodotti, ai fini della loro immissione sul mercato, ai sensi della direttiva 2001/18/CE del Parlamento europeo e del Consiglio (GU L 275 del 21.10.2009, pag. 9).
(7) Regolamento (CE) n. 1946/2003 del Parlamento europeo e del Consiglio, del 15 luglio 2003, sui movimenti transfrontalieri degli organismi geneticamente modificati (GU L 287 del 5.11.2003, pag. 1).
ALLEGATO
a) Richiedente e titolare dell'autorizzazione
|
Nome |
: |
Monsanto Company |
|
Indirizzo |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Stati Uniti |
Rappresentata da Bayer Agriculture BVBA, Scheldelaan 460, 2040 Anversa, Belgio.
b) Designazione e specifica dei prodotti
|
1) |
alimenti e ingredienti alimentari contenenti, costituiti o derivati da soia geneticamente modificata MON-87751-7; |
|
2) |
mangimi contenenti, costituiti o derivati da soia geneticamente modificata MON-87751-7; |
|
3) |
prodotti contenenti o costituiti da soia geneticamente modificata MON-87751-7 per usi diversi da quelli indicati ai punti 1) e 2), ad eccezione della coltivazione. |
La soia geneticamente modificata MON-87751-7 è stata sviluppata per conferire protezione da determinati parassiti dell'ordine dei lepidotteri attraverso l'espressione dei geni cry1 A.105 e cry2Ab2.
c) Etichettatura
|
1) |
Ai fini dei requisiti in materia di etichettatura stabiliti all'articolo 13, paragrafo 1, e all'articolo 25, paragrafo 2, del regolamento (CE) n. 1829/2003, nonché all'articolo 4, paragrafo 6, del regolamento (CE) n. 1830/2003, il «nome dell'organismo» è «soia»; |
|
2) |
la dicitura «non destinato alla coltivazione» figura sull'etichetta dei prodotti contenenti o costituiti da soia geneticamente modificata MON-87751-7, ad eccezione dei prodotti di cui alla lettera b), punto 1) del presente allegato, e nei documenti che li accompagnano. |
d) Metodo di rilevamento
|
1) |
Metodi evento-specifici basati su PCR quantitativa in tempo reale per la soia geneticamente modificata MON-87751-7; |
|
2) |
convalidati dal laboratorio di riferimento dell'UE istituito con regolamento (CE) n. 1829/2003, pubblicati all'indirizzo: http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
materiale di riferimento: AOCS 0215-A accessibile tramite la American Oil Chemists' Society (AOCS) all'indirizzo https://www.aocs.org/crm. |
e) Identificatore unico
MON-87751-7.
f) Informazioni richieste a norma dell'allegato II del protocollo di Cartagena sulla biosicurezza della Convenzione sulla diversità biologica
[Centro di scambio di informazioni sulla biosicurezza (Biosafety Clearing House), numero di registro: pubblicato alla notifica nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
g) Condizioni o restrizioni per l'immissione in commercio, l'utilizzo o la manipolazione dei prodotti
Non applicabile.
h) Piano di monitoraggio degli effetti ambientali
Piano di monitoraggio degli effetti ambientali conformemente all'allegato VII della direttiva 2001/18/CE.
[Link: piano pubblicato nel registro comunitario degli alimenti e dei mangimi geneticamente modificati].
i) Requisiti relativi al monitoraggio successivo all'immissione in commercio dell'utilizzo degli alimenti destinati al consumo umano
Non applicabile.
Nota: in futuro potrà essere necessario modificare i link ai documenti pertinenti. Tali modifiche saranno rese pubbliche mediante aggiornamento del registro comunitario degli alimenti e dei mangimi geneticamente modificati.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/94 |
DECISIONE DI ESECUZIONE (UE) 2019/1310 DELLA COMMISSIONE
del 31 luglio 2019
recante modalità di impiego del pool europeo di protezione civile e di rescEU
[notificata con il numero C(2019) 5614]
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
vista la decisione n. 1313/2013/UE del Parlamento europeo e del Consiglio (1) del 17 dicembre 2013, su un meccanismo unionale di protezione civile, in particolare l'articolo 32, paragrafo 1, lettera g),
considerando quanto segue:
|
(1) |
Nel rispetto della responsabilità primaria degli Stati membri per la prevenzione, la preparazione e la risposta alle catastrofi naturali e provocate dall'uomo, il meccanismo unionale promuove la solidarietà e la cooperazione tra gli Stati membri in conformità, rispettivamente, all'articolo 3, paragrafo 3, del trattato sull'Unione europea (TUE) e all'articolo 196 del trattato sul funzionamento dell'Unione europea (TFUE). |
|
(2) |
Con l'adozione della decisione (UE) 2019/420 del Parlamento europeo e del Consiglio (2), il meccanismo unionale è stato rafforzato aumentando il sostegno finanziario dell'Unione per il pool europeo di protezione civile e istituendo rescEU. |
|
(3) |
A norma dell'articolo 21, paragrafo 2, lettera c), della decisione n. 1313/2013/UE, i mezzi di risposta che beneficiano del sostegno finanziario dell'Unione per i costi di adattamento devono essere messi a disposizione nell'ambito del pool europeo di protezione civile per un periodo minimo connesso al finanziamento ricevuto e compreso tra 3 e 10 anni a decorrere dalla data di disponibilità effettiva. È opportuno precisare i periodi di impegno esatti al fine di garantire la certezza del diritto. |
|
(4) |
rescEU dovrebbe fornire assistenza in situazioni particolarmente pressanti in cui l'insieme delle risorse esistenti a livello nazionale nonché le risorse impegnate dagli Stati membri nel pool europeo di protezione civile non sono sufficienti per rispondere efficacemente alle catastrofi. È opportuno adottare norme per l'istituzione, la gestione e il mantenimento delle risorse di rescEU al fine di garantirne l'efficace attuazione. |
|
(5) |
I mezzi di risposta sono messi a disposizione delle operazioni di risposta nell'ambito del meccanismo unionale. A seguito di una richiesta di assistenza tramite il centro di coordinamento della risposta alle emergenze (ERCC), la Commissione, in stretto coordinamento con lo Stato membro richiedente e con lo Stato membro che detiene, affitta o noleggia la risorsa di rescEU, deve decidere in merito alla mobilitazione di tale risorsa. È opportuno stabilire i criteri per le decisioni sulla mobilitazione e le procedure operative pertinenti al fine di garantire un processo decisionale efficace e trasparente. È inoltre opportuno fissare criteri per l'adozione di decisioni sulla mobilitazione in caso di contrasto delle richieste di utilizzo delle risorse di rescEU. |
|
(6) |
Le risorse di rescEU possono essere utilizzate a fini nazionali quando non sono utilizzate o necessarie per le operazioni di risposta nell'ambito del meccanismo unionale. Al fine di garantire che le risorse di rescEU siano a disposizione e pronte per la mobilitazione nell'ambito del meccanismo unionale nei tempi previsti dai pertinenti requisiti di qualità di ciascun tipo di risorsa di rescEU, è opportuno stabilire norme adeguate per il loro uso a livello nazionale. |
|
(7) |
Gli Stati membri dovrebbero notificare alla Commissione quando le risorse di rescEU sono utilizzate a fini nazionali. Il sistema di notifica in caso di utilizzo a livello nazionale delle risorse di rescEU dovrebbe essere semplice ed efficace. |
|
(8) |
Al fine di garantire l'efficienza operativa, dovrebbero essere stabilite norme chiare per la smobilitazione e il disimpegno delle risorse di rescEU. |
|
(9) |
A norma dell'articolo 12, paragrafo 10, della decisione n. 1313/2013/UE, in casi specifici gli Stati membri possono rifiutare di mobilitare il proprio personale addetto delle risorse di rescEU al di fuori dell'Unione. È opportuno stabilire norme che disciplinino tali casi specifici. |
|
(10) |
Con l'adozione della decisione di esecuzione (UE) 2019/570 della Commissione (3), i mezzi aerei per combattere gli incendi boschivi sono stati definiti risorse di rescEU. Al fine di fornire l'assistenza finanziaria dell'Unione per lo sviluppo di tali risorse a norma dell'articolo 21, paragrafo 3, della decisione n. 1313/2013/UE, occorre definire i costi totali stimati. I costi totali stimati dovrebbero essere calcolati tenendo conto delle categorie di costi ammissibili di cui all'allegato I BIS della decisione n. 1313/2013/UE. |
|
(11) |
Al fine di ridurre la durata della mobilitazione e migliorare la certezza del diritto, è opportuno chiarire i termini e le condizioni relativi allo stazionamento e all'impiego delle risorse di rescEU. Tali condizioni dovrebbero costituire la base di contratti operativi tra la Commissione e gli Stati membri. |
|
(12) |
Al fine di dare risalto all'Unione e alla mobilitazione delle risorse di rescEU e di garantire condizioni uniformi per l'attuazione dell'articolo 20 bis della decisione n. 1313/2013/UE, è opportuno che la presente decisione stabilisca norme appropriate in materia di visibilità. |
|
(13) |
Le risorse di rescEU dovrebbero essere registrate, certificate e sottoposte a manutenzione adeguata dagli Stati membri in conformità delle vigenti regolamentazioni nazionali e internazionali. È inoltre opportuno completare il processo di certificazione del meccanismo unionale. |
|
(14) |
Con l'entrata in vigore, il 21 marzo 2019, della decisione (UE) 2019/420, l'Unione può ora fornire assistenza finanziaria per i costi operativi. È pertanto necessario stabilire norme e procedure che consentano agli Stati membri di chiedere tale assistenza. |
|
(15) |
Le misure previste dalla presente decisione sono conformi al parere del comitato di cui all'articolo 33, paragrafo 1, della decisione n. 1313/2013/UE, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Oggetto
La presente decisione stabilisce le modalità d'esecuzione della decisione n. 1313/2013/UE per quanto riguarda:
|
a) |
l'impegno nell'ambito del pool europeo di protezione civile di risorse che ricevono finanziamenti per i costi di adattamento; |
|
b) |
i criteri per le decisioni sulla mobilitazione delle risorse di rescEU, anche in caso di richieste contrastanti; |
|
c) |
i criteri per le decisioni di smobilitazione e disimpegno; |
|
d) |
l'utilizzo nazionale delle risorse di rescEU; |
|
e) |
il rifiuto di mobilitare personale al di fuori dell'Unione; |
|
f) |
il contenuto generale dei contratti operativi; |
|
g) |
i requisiti in materia di visibilità per l'utilizzo delle risorse di rescEU; |
|
h) |
la certificazione e la registrazione delle risorse di rescEU; |
|
i) |
i costi totali stimati per i mezzi aerei per combattere gli incendi boschivi di rescEU; e |
|
j) |
le disposizioni per richiedere l'assistenza finanziaria per i costi operativi. |
Articolo 2
Impegno nell'ambito del pool europeo di protezione civile di risorse che ricevono finanziamenti per i costi di adattamento
1. Gli Stati membri che beneficiano di un sostegno finanziario dell'Unione per i costi di adattamento delle risorse in conformità all'articolo 21, paragrafo 2, lettera c), della decisione n. 1313/2013/UE stanziano dette risorse a favore del pool europeo di protezione civile per periodi minimi diversi in base all'importo totale del finanziamento ricevuto.
I periodi minimi sono determinati come segue:
|
a) |
un periodo minimo di 3 anni per le risorse che ricevono un sostegno finanziario dell'Unione fino a 300 000 EUR; |
|
b) |
un periodo minimo di 5 anni per le risorse che ricevono un sostegno finanziario dell'Unione da 300 001 EUR fino a 1 000 000 EUR; |
|
c) |
un periodo minimo di 7 anni per le risorse che ricevono un sostegno finanziario dell'Unione da 1 000 001 EUR fino a 2 000 000 EUR; |
|
d) |
un periodo minimo di 10 anni per le risorse che ricevono un sostegno finanziario dell'Unione superiore a 2 000 000 EUR. |
2. Qualora la durata della vita economica di una risorsa sia inferiore al periodo minimo di cui al paragrafo 1, il periodo minimo è determinato in base alla durata della vita economica.
3. La Commissione, tramite il centro di coordinamento della risposta alle emergenze (ERCC), può decidere di porre fine al periodo minimo di cui al paragrafo 1 relativamente a una risorsa specifica, se ciò è debitamente giustificato da uno Stato membro.
Articolo 3
Criteri per le decisioni sulla mobilitazione delle risorse di rescEU
1. Quando riceve una richiesta di assistenza, l'ERCC valuta se le risorse esistenti messe a disposizione dagli Stati membri attraverso il meccanismo unionale e quelle preimpegnate nell'ambito del pool europeo di protezione civile siano sufficienti a garantire una risposta efficace alla richiesta. Qualora non sia possibile garantire una risposta efficace, la Commissione, tramite l'ERCC, decide in merito alla mobilitazione delle risorse di rescEU conformemente alla procedura di cui all'articolo 12, paragrafo 6, della decisione n. 1313/2013/UE.
2. La decisione di mobilitare le risorse di rescEU tiene conto dei seguenti criteri specifici:
|
a) |
la situazione operativa tra gli Stati membri e i rischi potenziali di catastrofi; |
|
b) |
l'idoneità e l'adeguatezza delle risorse di rescEU per rispondere alla catastrofe; |
|
c) |
l'ubicazione geografica delle risorse di rescEU, compresi i tempi di trasporto stimati verso la zona interessata; |
|
d) |
altri criteri pertinenti, compresi i termini e le condizioni delle risorse di rescEU previsti nei contratti operativi. |
3. In caso di richieste di assistenza contrastanti, si tiene conto dei seguenti criteri supplementari al momento di decidere dove mobilitare le risorse di rescEU:
|
a) |
i rischi previsti per le vite umane; |
|
b) |
i rischi previsti per le infrastrutture critiche di cui all'articolo 2, lettera a), della direttiva 2008/114/CE del Consiglio (4), indipendentemente dal fatto che queste si trovino all'interno o all'esterno dell'Unione; |
|
c) |
l'impatto previsto delle catastrofi, compreso l'impatto ambientale; |
|
d) |
le esigenze individuate dall'ERCC e i piani di mobilitazione esistenti; |
|
e) |
il rischio potenziale di diffusione delle catastrofi; |
|
f) |
ripercussioni socioeconomiche; |
|
g) |
il ricorso alla clausola di solidarietà di cui all'articolo 222 del trattato sul funzionamento dell'Unione europea; |
|
h) |
altri fattori operativi pertinenti. |
Articolo 4
Criteri per le decisioni di smobilitazione e disimpegno
1. Le risorse di rescEU sono smobilitate nei seguenti casi:
|
a) |
dopo aver ricevuto una notifica di pre-chiusura nel sistema comune di comunicazione e informazione per le emergenze (CECIS); o |
|
b) |
quando è adottata una decisione di disimpegno conformemente al paragrafo 2. |
2. La Commissione adotta, mediante l'ERCC, la decisione di disimpegnare una risorsa di rescEU quando vi è una maggiore necessità operativa della risorsa altrove o quando la necessità sul terreno non ne giustifica più l'uso. La decisione è adottata in stretto coordinamento con lo Stato membro che ospita la risorsa di rescEU e lo Stato membro o gli Stati membri che chiedono assistenza nonché con eventuali paesi terzi o organizzazioni internazionali.
3. Ai fini dell'adozione della decisione di cui al paragrafo 2, la Commissione considera, tra l'altro, i criteri elencati all'articolo 3, paragrafi 2 e 3.
Articolo 5
Utilizzo nazionale delle risorse di rescEU
1. Gli Stati membri che utilizzano le risorse di rescEU a fini nazionali garantiscono:
|
a) |
la disponibilità e lo stato di prontezza alle operazioni nell'ambito del meccanismo unionale entro i termini previsti dai pertinenti requisiti di qualità, salvo diversamente concordato con la Commissione; |
|
b) |
la parità di trattamento delle risorse di rescEU e di altre risorse nazionali per quanto riguarda l'adeguatezza del mantenimento, dello stoccaggio, dell'assicurazione, del personale e delle altre attività pertinenti di gestione e mantenimento; |
|
c) |
la riparazione rapida in caso di danni. |
2. Gli Stati membri notificano alla Commissione, tramite l'ERCC, l'uso nazionale delle risorse di rescEU e presentano una relazione in seguito al loro utilizzo.
3. Qualora l'utilizzo delle risorse di rescEU a livello nazionale pregiudichi la disponibilità di cui al paragrafo 1, lettera a), prima della mobilitazione gli Stati membri sono tenuti a chiedere, tramite l'ERCC, il consenso alla Commissione.
Qualora le risorse di rescEU siano necessarie per operazioni di risposta nell'ambito del meccanismo unionale, gli Stati membri ne assicurano la disponibilità nel più breve tempo possibile.
Articolo 6
Rifiuto di mobilitare personale al di fuori dell'Unione
1. Qualora sia stata adottata una decisione di mobilitazione delle risorse di rescEU al di fuori dell'Unione conformemente all'articolo 12, paragrafo 10, della decisione n. 1313/2013/UE, gli Stati membri possono rifiutare di mobilitare il proprio personale nei casi seguenti:
|
a) |
quando le relazioni diplomatiche tra lo Stato membro e il paese terzo richiedente sono state interrotte; |
|
b) |
quando un conflitto armato, il rischio di un conflitto armato, o altri motivi altrettanto gravi metterebbero a repentaglio la sicurezza del personale e impedirebbero allo Stato membro interessato di adempiere il proprio obbligo di diligenza. |
2. Lo Stato membro che rifiuta la mobilitazione del proprio personale ne informa immediatamente la Commissione fornendo una giustificazione motivata.
Articolo 7
Contenuto generale dei contratti operativi
I contratti operativi di cui all'articolo 12, paragrafo 5, della decisione n. 1313/2013/UE, tra l'altro:
|
a) |
specificano la natura dell'entità che ospita le risorse di rescEU; |
|
b) |
specificano le ubicazioni delle risorse ospitate di rescEU; |
|
c) |
forniscono informazioni sui servizi logistici e assicurativi pertinenti; |
|
d) |
descrivono a grandi linee il processo decisionale nazionale per garantire la disponibilità e lo stato di prontezza delle risorse di rescEU per le operazioni nell'ambito del meccanismo unionale nei tempi previsti dai pertinenti requisiti di qualità; |
|
e) |
contengono informazioni aggiornate sul personale, compresi i termini e le condizioni del loro contratto di lavoro, i contratti di assicurazione, la formazione e una descrizione delle misure adottate per garantire la loro mobilitazione a livello internazionale; |
|
f) |
comprendono un piano di mantenimento; |
|
g) |
prevedono obblighi specifici in materia di comunicazione; |
|
h) |
stabiliscono i requisiti in materia di visibilità per l'Unione di cui all'articolo 20 bis della decisione n. 1313/2013/UE. |
Articolo 8
Norme in materia di visibilità per l'utilizzo delle risorse di rescEU
Quando le risorse di rescEU sono impiegate per operazioni di risposta nell'ambito del meccanismo unionale, lo Stato membro che ospita la risorsa di rescEU e lo Stato membro che richiede assistenza assicurano un'adeguata visibilità all'Unione in conformità all'articolo 20 bis della decisione n. 1313/2013/UE.
Articolo 9
Responsabilità e risarcimento danni
Gli Stati membri rinunciano ad avviare eventuali azioni giudiziarie contro la Commissione per i danni subiti in conseguenza di un intervento di assistenza fornito nel quadro del meccanismo unionale o per le conseguenze derivanti dalla mancata mobilitazione, dalla smobilitazione o dal disimpegno delle risorse di rescEU fornite nell'ambito del meccanismo unionale e della presente decisione, fatti salvi i casi debitamente provati di dolo o colpa grave.
Articolo 10
Norme di certificazione e registrazione
1. Gli Stati membri garantiscono la certificazione e la registrazione delle risorse di rescEU conformemente alle norme e ai regolamenti nazionali e internazionali applicabili.
2. Qualora le risorse di rescEU siano multifunzionali, la certificazione e la registrazione sono completate di conseguenza.
3. Gli Stati membri certificano quanto prima le risorse di rescEU nell'ambito del processo di certificazione del meccanismo unionale e conformemente all'articolo 11, paragrafo 4, della decisione n. 1313/2013/UE e al capitolo 5 della decisione di esecuzione 2014/762/UE della Commissione (5). Le risorse di rescEU che sono in procinto di completare il processo di certificazione dell'Unione possono essere mobilitate conformemente all'articolo 3.
Articolo 11
Costi totali stimati per i mezzi aerei per combattere gli incendi boschivi di rescEU
1. Nel calcolo del costo totale stimato dei mezzi aerei per combattere gli incendi boschivi di rescEU si tiene conto delle categorie di costi di cui ai punti da 1 a 6 e al punto 8 dell'allegato I BIS della decisione n. 1313/2013/UE.
2. I costi per la categoria «costi delle attrezzature» di cui al punto 1 dell'allegato I BIS della decisione n. 1313/2013/UE per gli aerei per combattere gli incendi boschivi sono calcolati sulla base dei prezzi di mercato applicabili quando sono acquistati, affittati o noleggiati a norma dell'articolo 12, paragrafo 3, della decisione n. 1313/2013/UE. Quando gli Stati membri acquistano, affittano o noleggiano le risorse di rescEU, forniscono alla Commissione una prova documentata dei prezzi di mercato effettivamente applicabili.
I costi per la categoria «costi delle attrezzature» di cui al punto 1 dell'allegato I BIS della decisione n. 1313/2013/UE per gli elicotteri per combattere gli incendi boschivi sono calcolati sulla base dei prezzi di mercato applicabili quando sono acquistati, affittati o noleggiati a norma dell'articolo 12, paragrafo 3, della decisione n. 1313/2013/UE. Quando gli Stati membri acquistano, affittano o noleggiano le risorse di rescEU, forniscono alla Commissione una prova documentata dei prezzi di mercato effettivamente applicabili.
3. Il costo per le categorie di costi di cui ai punti da 2 a 6 e al punto 8 dell'allegato I BIS della decisione n. 1313/2013/UE per gli aerei per combattere gli incendi boschivi è calcolato almeno una volta nel periodo di ciascun quadro finanziario pluriennale a partire dal periodo 2014-2020, tenendo conto delle informazioni a disposizione della Commissione, tra cui l'inflazione e i calcoli dei costi effettuati ai fini del finanziamento delle risorse nazionali a norma dell'articolo 35 della decisione n. 1313/2013/UE. Tale costo è utilizzato dalla Commissione per fornire un'assistenza finanziaria annua.
Il costo per le categorie di costi di cui ai punti da 2 a 6 e al punto 8 dell'allegato I BIS della decisione n. 1313/2013/UE per gli elicotteri per combattere gli incendi boschivi è calcolato almeno una volta nel periodo di ciascun quadro finanziario pluriennale a partire dal periodo 2014-2020, tenendo conto delle informazioni a disposizione della Commissione, tra cui l'inflazione e i calcoli dei costi effettuati ai fini del finanziamento delle risorse nazionali a norma dell'articolo 35 della decisione n. 1313/2013/UE. Tale costo è utilizzato dalla Commissione per fornire un'assistenza finanziaria annua.
Articolo 12
Costi operativi ammissibili
1. I costi operativi di cui all' articolo 23, paragrafi 2, 4 ter e 4 quater, della decisione n. 1313/2013/UE comprendono tutti i costi di esercizio di una risorsa durante un'operazione che sono necessari per assicurarne l'efficacia operativa. Tali costi possono comprendere, se del caso, costi relativi al personale, ai trasporti internazionali e locali, alla logistica, ai beni di consumo e alle forniture, al mantenimento e altri costi necessari per garantire l'uso efficace di tali risorse.
2. I costi di cui al paragrafo 1 non sono ammissibili al finanziamento se coperti da un sostegno della nazione ospitante ai sensi dell'articolo 39 della decisione di esecuzione 2014/762/UE o dell'articolo 3, paragrafo 2, della decisione di esecuzione (UE) 2019/570, o se sono finanziati attraverso altri strumenti finanziari dell'Unione.
3. Le procedure per la richiesta del sostegno al trasporto di cui all'articolo 48, all'articolo 49, paragrafi 1 e 3, all'articolo 51, all'articolo 53 e all'allegato VIII della decisione di esecuzione 2014/762/UE si applicano mutatis mutandis alle richieste di assistenza finanziaria per i costi operativi fino alla loro sostituzione, se del caso.
Articolo 13
Destinatari
Gli Stati membri sono destinatari della presente decisione.
Fatto a Bruxelles, il 31 luglio 2019
Per la Commissione
Christos STYLIANIDES
Membro della Commissione
(1) GU L 347 del 20.12.2013, pag. 924.
(2) Decisione (UE) 2019/420 del Parlamento europeo e del Consiglio, del 13 marzo 2019, che modifica la decisione n. 1313/2013/UE su un meccanismo unionale di protezione civile (GU L 77I del 20.3.2019, pag. 1).
(3) Decisione di esecuzione (UE) 2019/570 della Commissione, dell'8 aprile 2019, recante modalità d'esecuzione della decisione n. 1313/2013/UE del Parlamento europeo e del Consiglio per quanto riguarda i mezzi di rescEU e che modifica la decisione di esecuzione 2014/762/UE della Commissione (GU L 99 del 10.4.2019, pag. 41).
(4) Direttiva 2008/114/CE del Consiglio, dell'8 dicembre 2008, relativa all'individuazione e alla designazione delle infrastrutture critiche europee e alla valutazione della necessità di migliorarne la protezione (GU L 345 del 23.12.2008, pag. 75).
(5) Decisione di esecuzione della Commissione, del 16 ottobre 2014, recante modalità d'esecuzione della decisione n. 1313/2013/UE del Parlamento europeo e del Consiglio su un meccanismo unionale di protezione civile e che abroga le decisioni 2004/277/CE, Euratom e 2007/606/CE, Euratom (GU L 320 del 6.11.2014, pag. 1).
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/100 |
DECISIONE (UE) 2019/1311 DELLA BANCA CENTRALE EUROPEA
del 22 luglio 2019
su una terza serie di operazioni mirate di rifinanziamento a più lungo termine (BCE/2019/21)
IL CONSIGLIO DIRETTIVO DELLA BANCA CENTRALE EUROPEA,
Visto il trattato sul funzionamento dell'Unione europea, in particolare il primo trattino dell'articolo 127, paragrafo 2,
visto lo Statuto del Sistema europeo di banche centrali e della Banca centrale europea, in particolare il primo trattino dell'articolo 3.1, nonché l'articolo 12.1, il secondo trattino dell'articolo 18.1 e il secondo trattino dell'articolo 34.1,
considerando quanto segue:
|
(1) |
La decisione BCE/2014/34 (1) prevede una serie di operazioni mirate di rifinanziamento a più lungo termine (OMRLT) da effettuarsi nell'arco di due anni dal 2014 al 2016 (OMRLT-I) e la decisione (UE) 2016/810 della Banca centrale europea (BCE/2016/10) (2) prevede la conduzione di una seconda serie di OMRLT da effettuarsi nell'arco di due anni da giugno 2016 a marzo 2017 (OMRLT-II). |
|
(2) |
In data 7 marzo 2019, nel perseguimento del proprio mandato di mantenimento della stabilità dei prezzi, il Consiglio direttivo ha deciso di lanciare una nuova serie di sette operazioni mirate di rifinanziamento a più lungo termine (OMRLT-III), da effettuarsi da settembre 2019 a marzo 2021, ognuna con scadenza a due anni. Le OMRLT-III mirano a contribuire a preservare condizioni favorevoli di erogazione del credito bancario e a sostenere l'orientamento accomodante della politica monetaria negli Stati membri la cui moneta è l'euro. Dai prestiti idonei al settore privato non finanziario nel contesto della presente misura sono esclusi i prestiti alle famiglie per l'acquisto di abitazioni. Le OMRLT-III, in combinazione con altre misure non convenzionali in atto, mirano a contribuire a riportare i tassi di inflazione a livelli inferiori, ma prossimi al 2 per cento nel medio termine. |
|
(3) |
Come per la prima e la seconda serie di OMRLT, al fine di agevolare la partecipazione di enti che, per motivi organizzativi, ricorrono ai finanziamenti dell'Eurosistema attraverso una struttura di gruppo, la partecipazione alle OMRLT-III dovrebbe essere possibile a livello di gruppo solo in presenza di determinate condizioni. La partecipazione a livello di gruppo dovrebbe avvenire attraverso uno specifico componente del gruppo, ove risultino soddisfatte le condizioni prescritte. Inoltre, al fine di fronteggiare le problematiche connesse alla distribuzione della liquidità all'interno del gruppo, in caso di gruppi costituiti sulla base di stretti legami tra i suoi membri, tutti i componenti del gruppo dovranno dare formale conferma scritta della loro partecipazione al gruppo. Un gruppo OMRLT riconosciuto ai fini delle OMRLT-II ai sensi della decisione (UE) 2016/810 (BCE/2016/10) dovrebbe poter partecipare alle OMRLT-III come gruppo OMRLT-III fatte salve specifiche procedure relative alla notifica e al riconoscimento. |
|
(4) |
L'importo complessivo che può essere preso in prestito nel quadro delle OMRLT-III dovrebbe essere stabilito sulla base dell'ammontare in essere dei prestiti idonei erogati dal partecipante al settore privato non finanziario alla data del 28 febbraio 2019, e tenendo conto degli importi precedentemente presi in prestito dal partecipante a OMRLT-III nell'ambito delle OMRLT-II ai sensi della decisione (UE) 2016/810 (BCE/2016/10) e ancora in essere. Inoltre, anche i prestiti idonei erogati al settore privato non finanziario che siano stati autocartolarizzati (ossia in cui i titoli garantiti da attività risultanti dalla cartolarizzazione siano integralmenete trattenuti), fatte salve determinate condizioni, possono essere tenuti in considerazione ai fini del calcolo del limite di finanziamento del partecipante. Ciò migliorerà il rapporto tra il limite del finanziamento e l'erogazione di prestiti all'economia. |
|
(5) |
Dovrebbe applicarsi un limite massimo di offerta a ciascuna OMRLT-III. Limitare le dimensioni delle offerte mira a evitare un'eccessiva concentrazione di offerte in poche operazioni. |
|
(6) |
Il tasso di interesse applicabile a ciascuna OMRLT-III dovrebbe essere stabilito sulla base dei prestiti erogati dal partecipante nel periodo compreso tra il 1o aprile 2019 e il 31 marzo 2019 in conformità ai principi dettati dalla presente decisione. |
|
(7) |
Ciascuna OMRLT-III avrà scadenza a due anni. Alla luce di tale scadenza più breve rispetto alle prime OMRLT e alle OMRLT-II, ai partecipanti non viene accordata l'opzione di ripagare volontariamente alcuna somma aggiudicata nell'ambito della OMRLT-III prima della loro scadenza. |
|
(8) |
Gli enti che intendono partecipare alle OMRLT-III dovrebbero essere assoggettati a taluni obblighi di segnalazione. I dati segnalati saranno utilizzati: a) per determinare il limite di finanziamento; b) per calcolare il valore di riferimento applicabile; c) per valutare la performance dei partecipanti rispetto ai rispettivi valori di riferimento e d) ad altri scopi analitici secondo quanto richiesto per l'assolvimento dei compiti dell'Eurosistema. Si prevede altresì che le banche centrali nazionali degli Stati membri la cui moneta è l'euro (di seguito le «BCN») che ricevono i dati segnalati possano scambiarli nell'ambito dell'Eurosistema nella misura e al livello necessario per la corretta attuazione del regime delle OMRLT-III, nonché per l'analisi della sua efficacia e per altri scopi analitici dell'Eurosistema. I dati segnalati possono essere condivisi nell'ambito dell'Eurosistema al fine di convalidare i dati forniti. |
|
(9) |
Al fine di concedere agli enti creditizi tempo sufficiente per prepararsi organizzativamente alla prima OMRLT-III, la presente decisione dovrebbe entrare in vigore senza indebito ritardo. |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Definizioni
Ai fini della presente decisione si applicano le seguenti definizioni:
|
1) |
per «livello di riferimento dei prestiti netti» s'intende l'importo dei prestiti netti idonei che un partecipante deve superare nel periodo compreso tra il 1o aprile 2019 e il 31 marzo 2021 per ottenere un tasso d'interesse sul finanziamento erogato al partecipante a titolo di OMRLT-III inferiore a quello applicato inizialmente, calcolato in conformità ai principi e alle disposizioni di dettaglio di cui all'articolo 4 e all'allegato I; |
|
2) |
per «livello di riferimento delle consistenze in essere» s'intende la somma delle consistenze in essere dei prestiti idonei di un partecipante alla data del 31 marzo 2019 e del livello di riferimento dei prestiti netti calcolato in conformità ai principi e alle disposizioni di dettaglio di cui all'articolo 4 e all'allegato I; |
|
3) |
per «limite di offerta» si intende l'importo massimo che può essere preso in prestito da un partecipante in ogni OMRLT-III calcolato in conformità ai principi e alle disposizioni di dettaglio di cui all'articolo 4 e all'allegato I; |
|
4) |
per «limite di finanziamento» si intende l'importo complessivo che può essere preso in prestito da un partecipante in tutte le OMRLT-III calcolato in conformità ai principi e alle disposizioni di dettaglio di cui all'articolo 4 e all'allegato I; |
|
5) |
per «ente creditizio» si intende un ente creditizio come definito nell'articolo 2, punto 14), dell'indirizzo (UE) 2015/510 della Banca centrale europea (BCE/2014/60) (3); |
|
6) |
per «deviazione dal livello di riferimento delle consistenze in essere» si intende l'aumento o la diminuzione in punti percentuali dei prestiti idonei di un partecipante erogati nel periodo dal 1o aprile 2019 al 31 marzo 2021 rispetto al suo livello di riferimento delle consistenze in essere, calcolato in conformità alle disposizioni dettagliate di cui all'articolo 4 e all'allegato I; |
|
7) |
per «prestiti idonei» s'intendono i prestiti a società non finanziarie e famiglie (incluse le istituzioni senza scopo di lucro al servizio delle famiglie) residenti in Stati membri la cui moneta è l'euro, ad eccezione dei prestiti a famiglie per l'acquisto di abitazioni secondo quanto specificato nell'allegato II;, a tali fini, il termine «residente» va inteso nell'accezione di cui all'articolo 1, punto 4), del regolamento (CE) n. 2533/98 del Consiglio (4); |
|
8) |
per «prestiti netti idonei» si intendono i prestiti lordi sotto forma di prestiti idonei al netto dei rimborsi delle consistenze in essere dei prestiti idonei nel corso di un periodo determinato, come specificato nell'allegato II; |
|
9) |
per «società veicolo finanziaria» (SVF) si intende una società veicolo finanziaria come definita all'articolo 1, paragrafo 1, del regolamento (UE) n. 1075/2013 della Banca centrale europea (BCE/2013/40) (5); |
|
10) |
per «primo periodo di riferimento» si intende il periodo compreso tra il 1o aprile 2018 e il 31 marzo 2019; |
|
11) |
per «codice SVF» si intende un codice identificativo unico per una SVF che si trova nell'elenco di SVF redatto e pubblicato dalla Banca centrale europea (BCE) a fini statistici ai sensi dell'articolo 3 del regolamento (UE) n. 1071/2013 (BCE/2013/40); |
|
12) |
per «aggiustamento incentivante del tasso di interesse» (interest rate incentive adjustment) si intende l'eventuale riduzione del tasso di interesse applicato agli importi presi in prestito nell'ambito della OMRLT-III espressa in una frazione della differenza tra il tasso di interesse massimo possibile e il tasso di interesse minimo possibile calcolato in conformità alle disposizioni dettagliate di cui all'allegato I. |
|
13) |
per «identificativo dell'entità giuridica» (Legal Entity Identifier, LEI) si intende un codice alfanumerico di riferimento conforme allo standard ISO 17442 assegnato a una entità giuridica; |
|
14) |
per «istituzione finanziaria monetaria» (IFM) s'intende un istituzione finanziaria monetaria come definita nell'articolo 1, lettera a), del regolamento (UE) n. 1071/2013 della Banca centrale europea (BCE/2013/33) (6); |
|
15) |
per «codice IFM» si intende un codice identificativo unico per una IFM che si trova nell'elenco di IFM redatto e pubblicato dalla Banca centrale europea (BCE) a fini statistici ai sensi dell'articolo 4 del regolamento (UE) n. 1071/2013 (BCE/2013/33); |
|
16) |
per «consistenze in essere dei prestiti idonei» si intendono le consistenze in essere dei prestiti idonei iscritti a bilancio, ad esclusione dei prestiti idonei cartolarizzati o altrimenti trasferiti senza cancellazione dal bilancio, come ulteriormente specificato nell'allegato II. |
|
17) |
per «partecipante» s'intende una controparte idonea a operazioni di mercato aperto di politica monetaria dell'Eurosistema in conformità all'indirizzo (UE) 2015/510 (BCE/2014/60), che presenta offerte nell'ambito di procedure d'asta relative a OMRLT-III individualmente o a livello di gruppo come capofila e che è soggetta a diritti e obblighi associati alla sua partecipazione alle procedure d'asta relative a OMRLT-III. |
|
18) |
per «consistenze in essere di riferimento» si intende la somma delle consistenze in essere dei prestiti idonei e, una volta esercitata l'opzione di cui all'articolo 6, paragrafo 3, le consistenze in essere dei prestiti idonei autocartolarizzati alla data del 28 febbraio 2019; |
|
19) |
per «BCN competente» s'intende, rispetto a un particolare partecipante, la BCN dello Stato membro in cui il partecipante ha sede; |
|
20) |
per «secondo periodo di riferimento» si intende il periodo compreso tra il 1o aprile 2019 e il 31 marzo 2021; |
|
21) |
per «cartolarizzazione» si intende: a) una cartolarizzazione tradizionale come definita all'articolo 2, punto 9, del regolamento (UE) 2017/2402 del Parlamento europeo e del Consiglio (7), e/o b) una cartolarizzazione come definita all'articolo 1, paragrafo 2 del regolamento (UE) n. 1075/2013 (BCE/2013/40) e che implica il trasferimento a una SVF dei prestiti cartolarizzati; |
|
22) |
per «prestiti idonei autocartolarizzati» si intendono prestiti idonei ceduti e cartolarizzati da un partecipante o da un componente di un gruppo OMRLT-III in cui i titoli garantiti da attività risultanti dalla cartolarizzazione sono trattenuti al 100 per cento da tale partecipante o componente del gruppo OMRLT-III. |
Articolo 2
La terza serie di operazioni mirate di rifinanziamento a più lungo termine
1. L'Eurosistema conduce sette OMRLT-III secondo il calendario indicativo per le OMRLT-III pubblicato sul sito Internet della BCE.
2. Ciascuna OMRLT-III viene a scadenza, senza che vi sia alcuna opzione di rimborso anticipato volontario, due anni dopo la rispettiva data di regolamento, in data coincidente con la data di regolamento di un'operazione di rifinanziamento principale dell'Eurosistema, in conformità al calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE;
3. Le OMRLT-III sono:
|
a) |
operazioni temporanee di finanziamento; |
|
b) |
effettuate a livello decentrato dalle singole BCN; |
|
c) |
effettuate mediante aste standard; e |
|
d) |
effettuate mediante procedure d'asta a tasso fisso. |
4. Alle OMRLT-III si applicano le condizioni standard alle quali le BCN sono disponibili a effettuare operazioni di finanziamento, se non diversamente specificato nella presente decisione. Tali condizioni includono le procedure per l'esecuzione di operazioni di mercato aperto, i criteri di idoneità delle controparti e delle garanzie ai fini delle operazioni di finanziamento dell'Eurosistema e le sanzioni in caso di inosservanza degli obblighi di controparte. Ciascuna di queste condizioni è prevista dal quadro normativo generale e da quello temporaneo applicabile alle operazioni di rifinanziamento, come attuato mediante disposizioni contrattuali e/o regolamentari adottate dalle BCN a livello nazionale.
5. In caso di discrepanze tra la presente decisione e l'indirizzo BCE/2015/510 (BCE/2014/60) o gli altri atti giuridici della BCE che dettano la disciplina giuridica applicabile alle operazioni di rifinanziamento a più lungo termine e/o misure attuative e a livello nazionale, la presente decisione prevale.
Articolo 3
Partecipazione
1. Gli enti possono partecipare alle OMRLT-III individualmente, se sono controparti idonee per le operazioni di politica monetaria di mercato aperto dell'Eurosistema.
2. Gli enti possono partecipare alle OMRLT-III a livello di gruppo costituendo un gruppo OMRLT-III. La partecipazione a livello di gruppo è rilevante ai fini del calcolo dei limiti di finanziamento e dei livelli di riferimento applicabili di cui all'articolo 4 e dei connessi obblighi di segnalazione di cui all'articolo 6. La partecipazione come gruppo è soggetta alle seguenti limitazioni:
|
a) |
un'ente non può far parte di più di un gruppo OMRLT-III; |
|
b) |
un ente partecipante a OMRLT-III a livello di gruppo non può parteciparvi individualmente; |
|
c) |
l'ente designato come capofila è il solo componente del gruppo OMRLT-III ammesso a partecipare alle procedure d'asta relative a OMRLT-III; e |
|
d) |
la composizione e l'ente capofila di un gruppo OMRLT-III rimangono invariate per tutte le OMRLT-III, salvo quanto disposto ai paragrafi 5 e 6 del presente articolo. |
3. Al fine di partecipare a OMRLT-III mediante un gruppo OMRLT-III, devono essere soddisfatte le seguenti condizioni.
|
a) |
Con effetto dall'ultimo giorno del mese precedente la domanda di cui al punto d) del presente paragrafo, ciascun componente del gruppo:
|
|
b) |
Il gruppo nomina un proprio componente capofila del gruppo. L'ente capofila è una controparte ammessa alle operazioni di politica monetaria dell'Eurosistema di mercato aperto. |
|
c) |
Ciascun componente del gruppo OMRLT-III è un ente creditizio con sede in uno Stato membro la cui moneta è l'euro, e soddisfa i criteri di cui ai punti a), b) e c) dell'articolo 55 dell'indirizzo (UE) 2015/510 (BCE/2014/60). |
|
d) |
Salvo quanto disposto al punto e), l'ente capofila presenta domanda di partecipazione a livello di gruppo alla propria BCN secondo il calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE. La domanda indica:
|
|
e) |
Un gruppo OMRLT-II riconosciuto ai fini delle OMRLT-II ai sensi della decisione BCE/2016/10 può partecipare a OMRLT-III come gruppo OMRLT-III a condizione che l'ente capofila ne dia comunicazione scritta alla BCN competente in conformità al calendario indicativo per le OMRLT-III pubblicato sul sito Internet della BCE. La notifica include:
|
|
f) |
L'ente capofila riceve conferma dalla propria BCN del riconoscimento del gruppo OMRLT-III. Prima di darne conferma, la BCN competente può richiedere all'ente capofila di fornire tutte le informazioni supplementari rilevanti per la valutazione del potenziale gruppo OMRLT-III. Nella valutazione di una domanda di gruppo, la BCN competente tiene conto altresì delle valutazioni effettuate dalle BCN dei componenti del gruppo che possano risultare necessarie, ad esempio la verifica della documentazione fornita ai sensi delle lettere d) o e), secondo il caso. |
Ai fini della presente decisione, anche gli enti creditizi soggetti a vigilanza su base consolidata, incluse le filiali dello stesso ente creditizio, sono considerati richiedenti idonei ai fini del riconoscimento del gruppo OMRLT-III e sono tenuti a rispettare, mutatis mutandis, le condizioni previste nel presente articolo. Ciò agevola la formazione di gruppi OMRLT-III tra tali enti, ove questi facciano parte della stessa entità giuridica. Ai fini della conferma della costituzione di un gruppo OMRLT-III o di cambiamenti nella sua composizione, si applicano, rispettivamente, il paragrafo 3, lettera d), punto v), e il paragrafo 6, lettera b), punto ii), numero 5).
4. Se uno o più enti indicati nella domanda per il riconoscimento del gruppo OMRLT-II non soddisfano le condizioni di cui al paragrafo 3, la BCN competente può respingere parzialmente la domanda del gruppo proposto. In tal caso, gli enti che presentano la domanda possono decidere di operare come gruppo OMRLT-III con partecipazione limitata ai componenti che soddisfano le condizioni necessarie o ritirare la domanda di riconoscimento del gruppo OMRLT-III.
5. In casi eccezionali, ove ricorrano ragioni oggettive, il Consiglio direttivo può decidere di derogare alle condizioni di cui ai paragrafi 2 e 3.
6. Salvo il paragrafo 5, la composizione di un gruppo riconosciuto in conformità al paragrafo 3 può mutare in presenza delle seguenti circostanze:
|
a) |
un componente è escluso dal gruppo OMRLT-III se non soddisfa più i requisiti di cui al paragrafo 3, lettere a) o c). La BCN del componente del gruppo interessato informa l'ente capofila della mancata integrazione dei requisiti necessari da parte del componente del gruppo. In tali casi, l'ente capofila interessato notifica alla BCN competente il cambiamento di status di componente del gruppo. |
|
b) |
se, in relazione al gruppo OMRLT-III, dopo l'ultimo giorno del mese precedente la domanda di cui al paragrafo 3, lettera d), sono instaurati ulteriori stretti legami o rapporti per la detenzione indiretta di riserve obbligatorie minime presso l'Eurosistema, la composizione del gruppo OMRLT-III può mutare per rispecchiare l'ingresso di un nuovo componente a condizione che:
|
|
c) |
Se, in relazione al gruppo OMRLT-III, una fusione, un'acquisizione o uno scorporo che interessa i componenti del gruppo OMRLT-III si verifica dopo l'ultimo giorno del mese precedente la domanda di cui al paragrafo 3, lettera d), e tale operazione non comporta alcuna variazione nella serie di prestiti idonei, la composizione del gruppo OMRLT-III può cambiare per rispecchiare, secondo il caso, la fusione, l'acquisizione o lo scorporo purché siano soddisfatte le condizioni elencate alla lettera b). |
7. Ove i cambiamenti nella composizione di un gruppo OMRLT-II siano stati accettati dal Consiglio direttivo in conformità al paragrafo 5 o i cambiamenti nella composizione di gruppi OMRLT-II siano avvenuti in conformità al paragrafo 6, salva diversa decisione del Consiglio direttivo, si applicano le seguenti disposizioni:
|
a) |
in relazione ai cambiamenti cui si applicano il paragrafo 5, il paragrafo 6, lettera b) o il paragrafo 6, lettera c), l'ente capofila può partecipare a una OMRLT-III con il gruppo OMRLT-III di nuova composizione per la prima volta sei settimane dopo che l'ente capofila abbia presentato con esito favorevole alla sua BCN la domanda per il riconoscimento della nuova composizione del gruppo; e |
|
b) |
un ente che non faccia più parte di un gruppo OMRLT-II non può partecipare ad alcuna ulteriore OMRLT-III, né individualmente né come componente di un altro gruppo OMRLT-III, a meno che non presenti una nuova domanda di partecipazione in conformità a paragrafi 1, 3 o 6. |
8. Ove venga meno l'idoneità di un ente capofila come controparte per operazioni di politica monetaria di mercato aperto dell'Eurosistema, il suo gruppo OMRLT-III non è più riconosciuto e l'ente capofila è tenuto a rimborsare gli importi presi in prestito nell'ambito delle OMRLT-III.
Articolo 4
Limite di finanziamento, limite di offerta e livelli di riferimento
1. Il limite di finanziamento applicabile a un partecipante individuale è calcolato sulla base dei dati relativi ai prestiti in relazione alle consistenze in essere di riferimento del partecipante individuale. Il limite di finanziamento applicabile a un partecipante ente capofila di un gruppo OMRLT-III è calcolato sulla base dei dati aggregati relativi ai prestiti in relazione alle consistenze in essere di riferimento per tutti i componenti del gruppo OMRLT-III.
2. Il limite di finanziamento di ciascun partecipante è pari al 30 per cento del totale delle consistenze in essere di riferimento, detratti gli importi precedentemente presi in prestito dal partecipante alle OMRLT-III nell'ambito della OMRLT-II ai sensi della decisione (UE) 2016/810 (BCE/2016/10) e ancora in essere alla data di regolamento di una OMRLT-III, tenuto conto di ogni notifica giuridicamente vincolante per il rimborso anticipato effettuata dal partecipante in conformità all'articolo 6 della decisione (UE) 2016/810 (BCE/2016/10). Le relative modalità tecniche di calcolo sono descritte nell'allegato I.
3. Se un membro di un gruppo OMRLT riconosciuto ai fini di OMRLT-II ai sensi della decisione (UE) 2016/810 (BCE/2016/10) non intende aderire al rispettivo gruppo OMRLT-III, ai fini del calcolo del limite di finanziamento per OMRLT-III per tale ente creditizio come partecipante a titolo individuale, si considera che esso abbia preso in prestito, nell'ambito della OMRLT-II, un importo pari a quello preso in prestito dall'ente capofila del gruppo OMRLT-II nella OMRLT-II e ancora in essere alla data di regolamento di una OMRLT-III, moltiplicato per la quota di prestiti idonei del componente di quel gruppo OMRLT-II al 31 gennaio 2016. Quest'ultimo importo sarà detratto da quello che si considera preso in prestito dal rispettivo gruppo OMRLT-III nell'ambito della OMRLT-II ai fini del calcolo del limite di finanziamento per l'OMRLT-III dell'ente capofila.
4. Il limite di offerta per ciascun partecipante in ciascuna OMRLT-III è pari: (i) al rispettivo limite di finanziamento detratti gli importi presi in prestito nell'ambito di precedenti OMRLT-III; ovvero (ii) a un decimo del totale delle consistenze in essere di riferimento, se inferiore. Tale importo è considerato il limite massimo di offerta per ciascun partecipante e trovano applicazione le norme relative alle offerte che superano il limite massimo di offerta, di cui all'articolo 36 dell'indirizzo (UE) 2015/510 (BCE/2014/60). Le relative modalità tecniche di calcolo sono descritte nell'allegato I.
5. Il livello di riferimento dei prestiti netti di un partecipante è determinato sulla base dei prestiti netti idonei nel primo periodo di riferimento come segue:
|
a) |
per i partecipanti che segnalano prestiti netti idonei di segno positivo o pari a zero nel primo periodo di riferimento, il livello di riferimento dei prestiti netti è pari a zero; |
|
b) |
per i partecipanti che segnalano prestiti idonei di segno negativo nel primo periodo di riferimento, il livello di riferimento dei prestiti netti di riferimento è pari ai prestiti netti idonei per il primo periodo di riferimento. |
I relativi calcoli tecnici sono descritti nell'allegato I. Il livello di riferimento dei prestiti netti per i partecipanti cui sia stata concessa una licenza bancaria dopo il 28 febbraio 2019 è pari a zero, salvo che il Consiglio direttivo, in presenza di giustificazioni obiettive, abbia deciso altrimenti.
6. Il livello di riferimento delle consistenze in essere di un partecipante corrisponde alla somma delle consistenze in essere dei prestiti idonei alla data del 31 marzo 2019 e del livello di riferimento dei prestiti netti. Le relative modalità tecniche di calcolo sono descritte nell'allegato I.
Articolo 5
Interessi
1. Fatto salvo il paragrafo 2, il tasso di interesse applicabile all'importo preso in prestito nell'ambito di ciascuna OMRLT-III è fissato a 10 punti base al di sopra del tasso medio sull'operazione di rifinanziamento principale per tutta la durata della relativa OMRLT-III.
2. Il tasso di interesse applicabile agli importi presi in prestito dai partecipanti i cui prestiti netti idonei nel secondo periodo di riferimento superano il livello di riferimento dei prestiti netti, è inferiore al tasso indicato al paragrafo 1 e può essere inferiore fino a un livello pari al tasso medio di interesse sui depositi presso la banca centrale per tutta la durata della relativa OMRLT-III con l'aggiunta di 10 punti base, a seconda della deviazione dal livello di riferimento delle consistenze in essere. Le disposizioni dettagliate e i calcoli sono descritti nell'allegato I.
3. La deviazione dal livello di riferimento delle consistenze in essere, l'eventuale aggiustamento incentivante del tasso di interesse che ne risulta e i tassi di interesse definitivi sono comunicati ai partecipanti in conformità al calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE.
4. L'interesse è regolato posticipatamente alla scadenza di ciascuna OMRLT-III.
5. Se, in conseguenza dell'esercizio dei rimedi esperibili dalla BCN in forza delle proprie disposizioni contrattuali o regolamentari, un partecipante è tenuto a rimborsare le consistenze in essere di OMRLT-III prima che l'eventuale deviazione dal livello di riferimento delle consistenze in essere e l'eventuale aggiustamento incentivante del tasso di interesse che ne risulta gli siano comunicati, il tasso di interesse applicabile agli importi presi in prestito dal partecipante nell'ambito di ciascuna OMRLT-III è fissato a un livello superiore di 10 punti base rispetto al tasso medio sull'operazione di rifinanziamento principale per tutta la durata della relativa OMRLT-III fino alla data in cui il rimborso è stato richiesto dalla BCN. Se tale rimborso è richiesto dopo che l'eventuale deviazione dal livello di riferimento delle consistenze in essere e l'eventuale aggiustamento incentivante del tasso di interesse che ne risulta, gli sono stati comunicati, il tasso di interesse applicabile agli importi presi in prestito dal partecipante nell'ambito di ciascuna OMRLT-III è fissato tenendo conto della deviazione dal livello di riferimento delle consistenze in essere.
Articolo 6
Obblighi di segnalazione
1. Ciascun partecipante a OMRLT-III fornisce alla BCN competente i dati indicati nei modelli di segnalazione di cui all'allegato II, con le modalità di seguito indicate:
|
a) |
le consistenze in essere di riferimento, al fine di stabilire il limite di finanziamento del partecipante, i limiti di offerta e i dati relativi al primo periodo di riferimento al fine di stabilire i livelli di riferimento del partecipante (di seguito, la «prima relazione»). |
|
b) |
i dati relativi al secondo periodo di riferimento al fine di stabilire i tassi di interesse applicabili (di seguito, la «seconda relazione»). |
2. I dati sono forniti in conformità a:
|
a) |
il calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE; |
|
b) |
le indicazioni di cui allegato II; e |
|
c) |
i requisiti minimi richiesti per l'accuratezza e la conformità concettuale di cui all'allegato IV del regolamento (UE) n. 1071/2013 (BCE/2013/33). |
3. I partecipanti che intendono includere prestiti idonei autocartolarizzati ai fini del calcolo del limite di finanziamento esercitano tale opzione trasmettendo le voci supplementari relative a tutti i prestiti idonei autocartolarizzati, di cui all'allegato II, unitamente alla valutazione del revisore di tali voci supplementari in conformità alle seguenti regole:
|
a) |
i partecipanti che prendono parte alla prima o alla seconda operazione OMRLT-III possono partecipare sulla base di una prima relazione che non contiene voci supplementari. Tuttavia, affinché i prestiti idonei autocartolarizzati siano inclusi nei calcoli del loro limite di finanziamento e limiti di offerta per la seconda o la terza operazione, le voci supplementari e la relativa valutazione del revisore delle voci supplementari sono rese disponibili alla BCN competente prima della scadenza del termine per la prima relazione per una qualsiasi di tali operazioni specificato nel calendario indicativo per le OMRLT-III pubblicato nel sito internet della BCE; |
|
b) |
i partecipanti che prendono parte per la prima volta alla terza operazione OMRLT-III o a una successiva, entro il relativo termine specificato nel calendario indicativo per le OMRLT-III pubblicato nel sito internet della BCE rendono disponibile per la BCN competente sia la prima relazione comprensiva delle voci supplementari, sia la rispettiva valutazione del revisore delle voci supplementari. |
4. I termini utilizzati nella relazione presentata dai partecipanti sono interpretati in conformità alle corrispondenti definizioni di essi di cui al regolamento (UE) n. 1071/2013 (BCE/2013/33).
5. Gli enti capofila di gruppi OMRLT-III presentano relazioni che rispecchiamo i dati aggregati relativi a tutti i componenti del gruppo OMRLT-III. Inoltre, la BCN dell'ente capofila o la BCN di un membro di un gruppo OMRLT-III può, in coordinamento con la BCN dell'ente capofila, richiedere che l'ente capofila presenti dati disaggregati per ogni singolo componente del gruppo.
6. Ciascun partecipante si assicura che la qualità dei dati forniti ai sensi dei paragrafi da 1 a 3 sia valutata da un revisore esterno in conformità alle seguenti regole:
|
a) |
la valutazione del revisore in merito alla prima relazione è messa a disposizione della BCN competente entro il relativo termine indicato nel calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE; |
|
b) |
i risultati della valutazione del revisore in merito alla seconda relazione sono messi a disposizione della BCN competente entro il relativo termine indicato nel calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE; |
|
c) |
le valutazioni del revisore sono incentrate sui requisiti di cui ai paragrafi 2 e 4. In particolare, il revisore:
In caso di partecipazione a livello di gruppo, l'esito delle verifiche del revisore è condiviso con le BCN degli altri componenti del gruppo OMRLT-III. Gli esiti dettagliati delle verifiche eseguite ai sensi di questo paragrafo sono forniti alla BCN del partecipante che ne faccia richiesta e, in caso di partecipazione di gruppo, successivamente condivisi con le BCN dei componenti del gruppo. |
|
d) |
le valutazioni del revisore contengono come minimo i seguenti elementi:
|
L'Eurosistema può fornire ulteriori indicazioni sulle modalità con le quali la valutazione del revisore deve essere condotta, nel qual caso i partecipanti si assicurano che i revisori effettuino la valutazione nel rispetto di tali indicazioni.
7. Fatto salvo il paragrafo 8, a seguito di un cambiamento nella composizione del gruppo OMRLT-III o di una rioganizzazione societaria come una fusione, un'acquisizione o uno scorporo (compresa quella che risulta dalla risoluzione o liquidazione di un partecipante), che incida sui prestiti idonei del partecipante, è presentata una prima relazione riveduta in conformità alle istruzioni ricevute dalla BCN del partecipante. La BCN competente valuta l'impatto della revisione e adotta misure appropriate. Tali misure possono includere l'obbligo di rimborso delle somme prese in prestito che, tenuto conto delle modifiche nella composizione del gruppo OMRLT-III o della riorganizzazione societaria, eccedono il relativo limite di finanziamento. Il partecipante interessato, che può consistere in un ente di nuova costituzione a seguito la riorganizzazione societaria, fornisce le informazioni supplementari richieste dalla BCN competente funzionali alla valutazione dell'impatto della revisione.
8. In deroga al paragrafo 7, non è necessario un riesame della prima relazione ma si può invece tenere traccia del relativo impatto sui prestiti idonei sotto forma di aggiustamento nella seconda relazione, nei casi in cui:
|
a) |
la riorganizzazione societaria coinvolga enti che prima della riorganizzazione societaria erano soggetti a misure di vigilanza o di risoluzione e tali misure, come confermato dalle relative BCN, di fatto abbiano ostacolato la loro capacità di erogare prestiti per almeno la metà del secondo periodo di riferimento; |
|
b) |
la riorganizzazione societaria coinvolga un'acquisizione da parte di un partecipante che sia stata completata negli ultimi sei mesi del secondo periodo di riferimento; ovvero |
|
c) |
la BCN competente valuti che l'impatto del cambiamento nella composizione del gruppo o della riorganizzazione societaria del gruppo non necessita di una relazione riveduta. |
Per i casi di cui ai punti b) e c), i partecipanti possono ancora scegliere di rivedere la prima relazione per tenere conto delle riorganizzazioni societarie.
9. I dati forniti dai partecipanti ai sensi del presente articolo possono essere utilizzati dall'Eurosistema per l'attuazione del regime delle OMRLT-III nonché per l'analisi della relativa efficacia e ad altri fini di analisi. A tali fini, le BCN che ricevono i dati segnalati in conformità al presente articolo possono scambiarli nell'ambito dell'Eurosistema. I dati segnalati in conformità al presente articolo possono anche essere condivisi nell'ambito dell'Eurosistema al fine di convalidare i dati forniti.
Articolo 7
Inosservanza degli obblighi di segnalazione
1. Ove un partecipante ometta di presentare una relazione o di rispettare gli obblighi di revisione, ovvero siano riscontrati errori nei dati segnalati, si applicano le seguenti norme:
|
a) |
se un partecipante omette di mettere a disposizione della BCN competente la prima relazione entro il relativo termine, il suo limite di finanziamento è ridotto a zero. |
|
b) |
se un partecipante omette di mettere a disposizione della BCN competente i risultati della valutazione del revisore della prima relazione entro il relativo termine indicato nel calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE, il partecipante è tenuto a rimborsare tutte le consistenze in essere di OMRLT-lII il giorno di regolamento della prossima operazione di rifinanziamento principale al tasso di interesse pari al tasso medio sull'operazione di rifinanziamento principale per tutta la durata della relativa OMRLT-III con l'aggiunta di 10 punti. |
|
c) |
Se un partecipante omette di mettere a disposizione della BCN competente la seconda relazione entro il relativo termine, il tasso di interesse pari al tasso medio sull'operazione di rifinanziamento principale per la durata di ogni rispettiva OMRLT-III con l'aggiunta di 10 punti si applica agli importi presi in prestito dal partecipante nell'ambito delle OMRLT-III unitamente a una penalità giornaliera aggiuntiva di EUR 500 fino alla presentazione della seconda relazione, ma fino a un massimo di EUR 15 000. La penalità è cumulata e addebitata dalla BCN competente al momento della ricezione della seconda relazione o quando è stato raggiunto il massimo della penalità qualora fino a quel momento la seconda relazione non sia ancora stata ricevuta. |
|
d) |
Se un partecipante omette di presentare i risultati della valutazione del revisore della seconda relazione entro il relativo termine, il tasso di interesse pari al tasso medio sull'operazione di rifinanziamento principale per tutta la durata di ogni rispettiva OMRLT-III con l'aggiunta di 10 punti si applica agli importi presi in prestito dal partecipante nell'ambito delle OMRLT-III. |
|
e) |
Se un partecipante non ottempera altrimenti agli obblighi di cui all'articolo 6, paragrafo 6, o all'articolo 6, paragrafo 7, il tasso di interesse pari al tasso medio sull'operazione di rifinanziamento principale per tutta la durata di ogni rispettiva OMRLT-III con l'aggiunta di 10 punti si applica agli importi presi in prestito dal partecipante nell'ambito delle OMRLT-III. |
|
f) |
Se un partecipante, in connessione con la revisione di cui all'articolo 6, paragrafo 6 o altrimenti, riscontra errori nei dati presentati nelle relazioni, incluse imprecisioni e lacune, esso ne dà notifica alla BCN competente quanto prima. Ove la BCN competente riceva una notifica in merito a tali errori, imprecisioni o omissioni, o ne venga altrimenti a conoscenza: (i) il partecipante fornisce quanto prima le informazioni supplementari richieste dalla BCE competente funzionali alla valutazione dell'impatto degli errori, imprecisioni o omissioni, in questione, e (ii) la BCN competente può adottare misure adeguate, che possono includere un ricalcolo dei relativi valori che a sua volta può incidere sul tasso di interesse applicato agli importi presi in prestito dal partecipante nell'ambito di OMRLT-III e l'obbligo di rimborsare gli importi presi in prestito che, in conseguenza dell'errore, dell'imprecisione o dell'omissione, eccedono il limite di finanziamento del partecipante. |
2. Il paragrafo 1 si applica fatte salve eventuali sanzioni che possono essere irrogate a norma della decisione BCE/2010/10 (9) in relazione agli obblighi di segnalazione di cui al regolamento (UE) n. 1071/2013 (BCE/2013/33).
Articolo 8
Entrata in vigore
La presente decisione entra in vigore il 3 agosto 2019.
Fatto a Francoforte sul Meno, il 22 luglio 2019
Il presidente della BCE
Mario DRAGHI
(1) Decisione BCE/2014/34, del 29 luglio 2014, relativa a misure sulle operazioni mirate di rifinanziamento a più lungo termine (GU L 258 del 29.8.2014, pag. 11).
(2) Decisione (UE) 2016/810 della Banca centrale europea, del 28 aprile 2016, su una seconda serie di operazioni mirate di rifinanziamento a più lungo termine (BCE/2016/10) (GU L 132 del 21.5.2016, pag. 107).
(3) Indirizzo (UE) 2015/510 della Banca centrale europea, del 19 dicembre 2014, sull'attuazione del quadro di riferimento della politica monetaria dell'Eurosistema (BCE/2014/60) (GU L 91 del 2.4.2015, pag. 3).
(4) Regolamento (CE) n. 2533/98 del Consiglio, del 23 novembre 1998, sulla raccolta di informazioni statistiche da parte della Banca centrale europea (GU L 318 del 27.11.1998, pag. 8).
(5) Regolamento (UE) n. 1075/2013 della Banca centrale europea, del 18 ottobre 2013, riguardante le statistiche sulle attività e passività delle società veicolo finanziarie coinvolte in operazioni di cartolarizzazione (BCE/2013/40) (GU L 297 del 7.11.2013, pag. 107).
(6) Regolamento (UE) n. 1071/2013 della Banca centrale europea, del 24 settembre 2013, relativo al bilancio del settore delle istituzioni finanziarie monetarie (BCE/2013/33) (GU L 297 del 7.11.2013, pag. 1).
(7) Regolamento (UE) 2017/2402 del Parlamento europeo e del Consiglio, del 12 dicembre 2017, che stabilisce un quadro generale per la cartolarizzazione, instaura un quadro specifico per cartolarizzazioni semplici, trasparenti e standardizzate e modifica le direttive 2009/65/CE, 2009/138/CE e 2011/61/UE e i regolamenti (CE) n. 1060/2009 e (UE) n. 648/2012 (GU L 347 del 28.12.2017, pag. 35).
(8) Regolamento (CE) n. 1745/2003 della Banca centrale europea, del 12 settembre 2003, sull'applicazione di riserve obbligatorie minime (BCE/2003/9) (GU L 250 del 2.10.2003, pag. 10).
(9) Decisione BCE/2010/10 del 19 agosto 2010 relativa all'inosservanza degli obblighi di segnalazione statistica (GU L 226 del 28.8.2010, pag. 48).
ALLEGATO I
ESECUZIONE DELLA TERZA SERIE DI OPERAZIONI MIRATE DI RIFINANZIAMENTO A PIÙ LUNGO TERMINE
1. Calcolo del limite di finanziamento e del limite di offerta
Ai partecipanti in una delle operazioni mirate di rifinanziamento a più lungo termine (OMRLT-III) della terza serie, individualmente o come ente capofila di un gruppo OMRLT-III, si applica un limite di finanziamento. Detto limite, una volta calcolato, sarà arrotondato per eccesso al multiplo successivo di 10 000 EUR.
Il limite di finanziamento applicabile a un partecipante individuale a OMRLT-III è calcolato sulla base delle consistenze in essere di riferimento comprendente le consistenze in essere di prestiti idonei e, al momento dell'esercizio dell'opzione di cui all'articolo 6, paragrafo 3, prestiti idonei autocartolarizzati al 28 febbraio 2019. Il limite di finanziamento applicabile all'ente capofila di un gruppo OMRLT-III è calcolato sulla base delle consistenze in essere di riferimento di tutti i componenti del gruppo OMRLT-III.
Il limite di finanziamento è pari al 30 per cento delle consistenze in essere di riferimento del partecipante (1) detratti gli importi presi in prestito dal partecipante nelle OMRLT condotte ai sensi della decisione (UE) 2016/810 (BCE/2016/10) (OMRLT-II) e ancora in essere alla data di regolamento della rispettiva OMRLT-III, o pari a zero se tale consistenza è negativa, ossia:
BAk = max(0,3 × ORFeb 2019 – OBk , 0) per k = 1,…,7.
Dove BAk è il limite di finanziamento nell'OMRLT-III k (con k = 1,…,7), ORFeb 2019 rappresenta le consistenze in essere di riferimento alla data del 28 febbraio 2019 e OBk è l'importo preso in prestito dal partecipante a OMRLT-II e ancora in essere alla data di regolamento della OMRLT-III k.
Il limite di offerta applicabile a ciascun partecipante in ciascuna OMRLT-III è: a) il suo limite di finanziamento BAk detratti gli importi presi in prestito nell'ambito delle precedenti OMRLT-III; o b) un decimo delle consistenze in essere di riferimento totali, se inferiore. Sia Ck ≥ 0 l'importo preso in prestito da un partecipante nell'ambito di una OMRLT-III k, quindi Ck ≤ BLk dove BLk è il limite di offerta per tale partecipante nell'operazione k, definito come segue:
BL 1 = min(BA 1, 0,1 × ORFeb 2019)
e

per k = 2,…,7.
2. Calcolo dei livelli di riferimento
Sia NLm l'ammontare dei prestiti netti idonei di un partecipante nel mese di calendario m, calcolato come il flusso lordo di nuovi prestiti idonei in quel mese, detratti i rimborsi dei prestiti idonei, come definiti nell'allegato II.
Si indica come NLB il livello di riferimento dei prestiti netti per tale partecipante. Questo è così definito:
NLB = min (NLApr 2018 + NLMay 2018 + … + NLMar 2019, 0)
Ciò implica che, se il valore dei prestiti netti idonei erogati dal partecipante è positivo o pari a zero nel primo periodo di riferimento, allora NLB = 0. Tuttavia, se il valore dei prestiti netti idonei erogati dal partecipante è negativo nel primo periodo di riferimento, allora NLB = NLApr 2018 + NLMay 2018 + … + NLMar 2019.
Si indica come OAB il livello di riferimento delle consistenze in essere di un partecipante. Questo è definito come segue:
OAB = max (OLMar 2019 + NLB,0)
dove OLMar 2019 rappresenta le consistenze in essere di prestiti idonei a fine marzo 2019.
3. Calcolo del tasso di interesse
Sia NSMar 2021 l'importo risultante dalla somma dei prestiti netti idonei nel periodo compreso tra il 1o aprile 2019 e il 31 marzo 2021 e delle consistenze in essere dei prestiti idonei al 31 marzo 2019; questo è calcolato come NSMar 2021 = OLMar 2019 + NLApr 2019 + … + NLMar 2021.
Si indica ora con EX la deviazione percentuale NSMar 2021 dal livello di riferimento delle consistenze in essere, ossia:

EX sarà espresso come percentuale, arrotondato a 15 cifre decimali. Se OAB è uguale a zero, EX si considera uguale a 2,5.
Sia  il tasso medio per le operazioni di rifinanziamento principali (ORP) applicabile per tutta la durata della OMRLT-III k ed espresso come tasso percentuale annuo e sia
il tasso medio per le operazioni di rifinanziamento principali (ORP) applicabile per tutta la durata della OMRLT-III k ed espresso come tasso percentuale annuo e sia  il tasso medio di interesse sui depositi presso la banca centrale applicabile per tutta la durata della OMRLT-III k ed espresso come tasso percentuale annuo, ossia:
il tasso medio di interesse sui depositi presso la banca centrale applicabile per tutta la durata della OMRLT-III k ed espresso come tasso percentuale annuo, ossia:


Nelle precedenti equazioni nk (per k=1,..7) indica il numero di giorni della OMRLT-III k, MROk,t indica il tasso applicato alla ORP nel t-esimo giorno della OMRLT-III k, se tale ORP viene eseguita in base a un regime di aggiudicazione piena a tasso fisso, oppure MROk,t indica il tasso minimo di offerta applicato alla OPR nel t-esimo giorno della OMRLT-III k, se tale ORP viene eseguita secondo una procedura d'asta a tasso variabile, ed espresso come tasso percentuale annuo. Nelle precedenti equazioni DFk,t indica il tasso applicato ai depositi presso la banca centrale nel t-esimo giorno della OMRLT-III k, ed espresso come tasso percentuale annuo.
L'aggiustamento incentivante del tasso di interesse, calcolato come frazione del corridoio medio tra il tasso di interesse massimo possibile ( ) e il tasso di interesse minimo possibile (
) e il tasso di interesse minimo possibile ( ), sia indicato come iri; il tasso di interesse applicabile per la OMRLT-III k, espresso come tasso percentuale annuo, sia indicato come rk
; iri e rk
sono determinati come segue:
), sia indicato come iri; il tasso di interesse applicabile per la OMRLT-III k, espresso come tasso percentuale annuo, sia indicato come rk
; iri e rk
sono determinati come segue:
|
a) |
Se un partecipante non supera il livello di riferimento delle consistenze in essere dei prestiti idonei al 31 marzo 2021, il tasso di interesse applicato a tutti gli importi presi in prestito dal partecipante nell'ambito delle OMRLT-III è fissato a 10 punti base al di sopra del tasso medio per le ORP per tutta la durata della rispettiva OMRLT-III, ossia: se EX ≤ 0, allora iri = 0 % e |
|
b) |
Se un partecipante supera di almeno il 2,5 % il proprio livello di riferimento delle consistenze in essere dei prestiti idonei al 31 marzo 2021, il tasso di interesse applicato a tutti gli importi presi in prestito dal partecipante nell'ambito delle OMRLT-III è pari al tasso medio di interesse sui depositi presso la banca centrale per tutta la durata della rispettiva OMRLT-III con l'aggiunta di 10 punti base, ossia: se EX ≥ 2,5, allora iri = 100 % e |
|
c) |
Se un partecipante supera il livello di riferimento delle consistenze in essere dei prestiti idonei in misura inferiore al 2,5 % al 31 marzo 2021, il tasso di interesse applicato a tutti gli importi presi in prestito dal partecipante nell'ambito delle OMRLT-III è in proporzione lineare all'eccedenza percentuale rispetto al livello di riferimento delle consistenze in essere dei prestiti idonei, ossia: se 0 < EX < 2,5, allora |
L'aggiustamento incentivante del tasso di interesse (iri) sarà espresso arrotondando a 15 cifre decimali.
Il tasso di interesse (rk ) sarà espresso come tasso percentuale annuo, arrotondato per difetto alla quarta cifra decimale.
(1) I riferimenti ad un «partecipante» si intendono fatti a partecipanti individuali o a gruppi OMRLT-III
ALLEGATO II
LA TERZA SERIE DI OPERAZIONI MIRATE DI RIFINANZIAMENTO A PIÚ LUNGO TERMINE - LINEE GUIDA PER LA COMPILAZIONE DEI DATI RICHIESTI DAI MODELLI DI SEGNALAZIONE
1. Introduzione (1)
Le presenti linee guida dettano istruzioni per la compilazione delle relazioni sui dati che i partecipanti alle OMRLT-III sono tenuti a presentare in conformità all'articolo 6. Gli obblighi di segnalazione sono esposti nei modelli di segnalazione alla fine del presente allegato. Le presenti linee guida specificano anche gli obblighi di segnalazione degli enti capofila dei gruppi OMRLT-III che partecipano alle operazioni.
Le sezioni 2 e 3 forniscono informazioni generali relative alla compilazione e alla trasmissione dei dati e la sezione 4 fornisce spiegazioni sugli indicatori oggetto di segnalazione.
2. Informazioni di carattere generale
Le misure da utilizzare nel calcolo dei limite di finanziamento si riferiscono a prestiti di istituzioni finanziarie monetarie (IFM) a società non finanziarie dell'area dell'euro e a prestiti di IFM alle famiglie nell'area dell'euro (2), esclusi i prestiti per l'acquisto di abitazioni, in tutte le valute. In conformità all'articolo 6, devono essere presentate due relazioni sui dati: la prima relazione riguarda i dati sulle consistenze in essere di riferimento nonché i dati relativi al primo periodo di riferimento, e la seconda relazione riguarda i dati relativi al secondo periodo di riferimento. Le consistenze devono essere segnalate separatamente per le società non finanziarie e per le famiglie. Le consistenze in essere dei prestiti idonei sono soggette ad aggiustamento per i prestiti cartolarizzati o altrimenti trasferiti e non cancellati dal bilancio, tuttavia i partecipanti possono esercitare l'opzione di cui all'articolo 6, paragrafo 3, per aggiungere prestiti idonei autocartolarzzati ai fini del calcolo del limite di finanziamento, indipendentemente dalla loro rilevazione nel bilancio. Devono essere fornite anche informazioni dettagliate sulle relative sottocomponenti di tali voci, nonché sugli effetti che si traducono in variazioni nelle consistenze in essere dei prestiti idonei ma che non sono in correlazione con i prestiti netti idonei (di seguito, gli «aggiustamenti alle consistenze in essere»), incluse cessioni e acquisti di prestiti e altri trasferimenti di prestiti.
Per quanto riguarda l'utilizzo delle informazioni raccolte, i dati sulle consistenze in essere di riferimento saranno utilizzati per determinare il limite di finanziamento. Inoltre, i dati sui prestiti netti idonei nel corso del primo periodo di riferimento saranno utilizzati per il calcolo del livello di riferimento dei prestiti netti e del livello di riferimento delle consistenze in essere. Nel frattempo i dati sui prestiti netti idonei nel corso del secondo periodo di riferimento saranno utilizzati per verificare l'evoluzione dei prestiti e, di conseguenza, i tassi di interesse applicabili. Tutti gli altri indicatori sono necessari per verificare la coerenza interna delle informazioni e la loro coerenza con i dati statistici raccolti nell'ambito dell'Eurosistema, nonché per il monitoraggio approfondito dell'impatto del programma OMRLT-III.
Il quadro generale alla base delle relazioni sui dati è costituito dagli obblighi di segnalazione delle IFM dell'area euro nel contesto delle statistiche sulle voci di bilancio (Balance Sheet Items, BSI) delle IFM, come specificato nel regolamento (UE) n. 1071/2013 (BCE/2013/33). In particolare, per quanto riguarda i prestiti, l'articolo 8, paragrafo 2, del regolamento (UE) n. 1071/2013 (BCE/2013/33) richiede che essi siano «segnalati al valore del capitale in essere alla fine del mese. Le perdite parziali e totali, come definite dalle pratiche contabili pertinenti, sono escluse da questo importo. […] crediti non si compensano con qualunque altra attività o passività». Tuttavia, in deroga alle norme di cui all'articolo 8, paragrafo 2, che implicano altresì la segnalazione dei prestiti al lordo degli accantonamenti, l'articolo 8, paragrafo 4, stabilisce che «[l]e BCN possono consentire la segnalazione di crediti accantonati al netto degli accantonamenti e la segnalazione di crediti acquistati al prezzo concordato al momento dell'acquisto [cioè, il loro valore di transazione], sempre che tali pratiche di segnalazione siano seguite da tutti i soggetti dichiaranti residenti». I prestiti idonei autocartolarizzati non possono essere segnalati al netto degli accantonamenti se sono cancellati dal bilancio. Le implicazioni di questa deviazione dalle linee guida generali sulle BSI sulla compilazione delle relazioni sui dati sono esaminate in dettaglio più avanti.
Il regolamento (UE) n. 1071/2013 (BCE/2013/33) dovrebbe inoltre essere utilizzato come documento di riferimento per quanto riguarda le definizioni da applicare nella compilazione delle relazioni sui dati. Si vedano, in particolare, l'articolo 1 per le definizioni generali, e l'allegato II, parti 2 e 3, per la definizione, rispettivamente, delle categorie degli strumenti da includere nel concetto di «prestiti» e dei settori dei partecipanti. In particolare, nell'ambito della disciplina sulle BSI gli interessi maturati sui prestiti sono, di regola, soggetti a iscrizione in bilancio nel momento in cui maturano (vale a dire per competenza, piuttosto che per cassa), ma dovrebbero essere esclusi dai dati sulle consistenze in essere dei prestiti. Tuttavia, gli interessi capitalizzati dovrebbero essere registrati come parte delle consistenze in essere.
Mentre gran parte dei dati da segnalare è già compilata dalle IFM in conformità alle disposizioni del regolamento (UE) n. 1071/2013 (BCE/2013/33), alcune informazioni supplementari devono essere compilate dai partecipanti che presentano offerte nelle OMRLT-III. Il quadro metodologico per le statistiche sulle BSI, come previsto nel Manuale sulle statistiche di bilancio delle IFM (3) fornisce tutte le informazioni di base necessarie per la compilazione dei dati supplementari; ulteriori dettagli sono forniti al punto 4 concernente le definizioni dei singoli indicatori.
3. Istruzioni generali di segnalazione
a) Struttura dei modelli di segnalazione
I modelli includono l'indicazione dei dati di riferimento cui si riferiscono i dati e raggruppano gli indicatori in due blocchi: i prestiti delle IFM alle società non finanziarie dell'area euro e i prestiti delle IFM alle famiglie dell'area euro, esclusi i prestiti per l'acquisto di abitazioni. I dati in tutte le celle evidenziate in giallo vengono calcolati in base ai dati inseriti nelle altre celle, mediante le formule previste. I modelli incorporano anche regole di convalida che verificano la coerenza interna dei dati.
Nella OMRLT-III sono previste due relazioni:
|
— |
la prima relazione richiede il modello A per la segnalazione dei dati completo, relativo alle consistenze in essere di riferimento ai fini del calcolo del limite di finanziamento e dei limiti dell'offerta. I partecipanti che esercitano l'opzione di cui all'articolo 6, paragrafo 3, devono trasmettere le voci supplementari riguardanti i prestiti idonei autocartolarizzati, e la valutazione di tali voci da parte del revisore, conformemente all'articolo 6, paragrafo 6, lettera c), punto v). La prima relazione richiede inoltre il modello B completo per il «primo periodo di riferimento», ossia dal 1o aprile 2018 al 31 marzo 2019 ai fini del calcolo dei prestiti netti idonei e dei livelli di riferimento. |
|
— |
la seconda relazione richiede il modello B per la segnalazione dei dati completo per il «secondo periodo di riferimento», ossia dal 1o aprile 2019 al 31 marzo 2021, ai fini del calcolo dei prestiti netti idonei e del raffronto con i livelli di riferimento sui quali sono basati i tassi di interesse applicabili. |
Nel modello B, gli indicatori relativi alle consistenze in essere devono essere segnalati alla fine del mese precedente l'inizio del periodo di segnalazione e alla fine del periodo di segnalazione; pertanto, le consistenze in essere devono essere segnalate, per il primo periodo di riferimento, al 31 marzo 2018 e al 31 marzo 2019, e, per il secondo periodo di riferimento, al 31 marzo 2019 e al 31 marzo 2021. A loro volta, i dati sulle transazioni e gli aggiustamenti devono riguardare tutti gli effetti rilevanti che si producono durante il periodo di segnalazione.
b) Segnalazione con riguardo a gruppi OMRLT-III
In relazione alla partecipazione di gruppo alle OMRLT-III, i dati dovrebbero essere segnalati, di norma, su base aggregata. Tuttavia, le banche centrali nazionali degli Stati membri la cui moneta è l'euro (BCN), se del caso, hanno la possibilità di raccogliere le informazioni a livello del singolo ente.
c) Trasmissione delle relazioni sui dati
Le relazioni sui dati complete dovrebbero essere trasmesse alla BCN competente come specificato nell'articolo 6 e in conformità al calendario indicativo per le OMRLT-III pubblicato sul sito internet della BCE, che stabilisce anche i periodi di riferimento coperti in ciascuna trasmissione e le raccolte di dati da utilizzare per la compilazione.
d) Unità dei dati
I dati devono essere segnalati in migliaia di euro.
4. Definizioni
La presente sezione fornisce le definizioni delle voci da segnalare; e la numerazione utilizzata nei modelli di segnalazione è indicata tra parentesi.
a) Consistenze in essere di prestiti idonei (1 e 4)
I dati in queste celle vengono calcolati sulla base delle cifre segnalate in relazione alle seguenti voci di bilancio: «Consistenze in essere a bilancio» (1.1 e 4.1), meno «Consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti ma non cancellati dal bilancio» (1.2 e 4.2), più «Accantonamenti in essere» (1.3 e 4.3). Quest'ultima sottovoce è rilevante nei soli casi in cui, contrariamente alla prassi generale in materia di BSI, i prestiti siano segnalati al netto degli accantonamenti.
Le voci sottostanti delle consistenze in essere dei prestiti idonei sono le seguenti:
|
i) |
Consistenze in essere a bilancio (1.1 e 4.1) Questa voce comprende le consistenze in essere di prestiti concessi a società non finanziarie e famiglie dell'area euro, esclusi i prestiti per l'acquisto di abitazioni. Gli interessi maturati, al contrario degli interessi capitalizzati, sono esclusi dagli indicatori. Queste celle sono direttamente correlate ai requisiti di cui all'allegato I, parte 2, del regolamento (UE) n. 1071/2013 (BCE/2013/33) (blocco 2 della tabella 1 sulle consistenze in essere mensili). Per una definizione più dettagliata delle voci da includere nelle relazioni sui dati, si rimanda all'allegato II, parte 2, del regolamento (UE) n. 1071/2013 (BCE/2013/33) e alla sezione 4.3 del Manuale sulle statistiche di bilancio delle IFM. |
|
ii) |
Consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti ma non cancellati dal bilancio (1.2 e 4.2) Questa voce comprende le consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti, ma non cancellati dal bilancio. Tutte le attività di cartolarizzazione devono essere segnalate, indipendentemente dalla sede delle società veicolo. Da questa voce sono esclusi i prestiti presentati come garanzie all'Eurosistema per le operazioni di finanziamento di politica monetaria in forma di crediti che si traducono in un trasferimento senza cancellazione dal bilancio. L'allegato I, parte 5, del regolamento (UE) n. 1071/2013 (BCE/2013/33) (blocco 5.1 della tabella 5a sui dati mensili) riguarda le informazioni richieste sui prestiti cartolarizzati a società non finanziarie e famiglie, che non sono stati cancellati dai bilanci, ma non richiede che questi ultimi siano disaggregati in base allo scopo. Inoltre, le consistenze in essere dei prestiti altrimenti trasferiti (cioè non attraverso un'operazione di cartolarizzazione), ma non cancellati dai bilanci, non sono disciplinati dal regolamento (UE) n. 1071/2013 (BCE/2013/33). Ai fini della compilazione delle relazioni sui dati, si richiede l'estrapolazione dei dati dalle banche dati interne delle IFM. Per dettagli aggiuntivi delle voci da includere nelle relazioni sui dati, si veda l'allegato I, parte 5, del regolamento (UE) n. 1071/2013 (BCE/2013/33) e la sezione 4.3.11 del Manuale sulle statistiche di bilancio delle IFM. |
|
iii) |
Accantonamenti in essere (1.3 e 4.3) Questi dati sono rilevanti solo per quegli enti che, contrariamente alla prassi generale in materia di BSI, segnalano i prestiti al netto degli accantonamenti. Nel caso di enti che presentano offerte come gruppo OMRLT-III, questo requisito si applica solo agli enti del gruppo che registrano i prestiti al netto degli accantonamenti. Questa voce comprende accantonamenti specifici e generici per rettifiche di valore per deterioramento di crediti e perdite su prestiti (prima che abbiano luogo perdite totali e parziali). I dati devono riferirsi a «Consistenze in essere di prestiti a bilancio» (1.1 e 4.1), escludendo le «Consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti ma non cancellati dal bilancio» (1.2 e 4.2). Come indicato in precedenza nel punto 2, terzo comma, nelle statistiche sulle BSI i prestiti dovrebbero essere segnalati, di regola, al valore del capitale in essere, con i corrispondenti accantonamenti imputati a «Capitale e riserve». In tali casi, non si richiede una segnalazione separata degli accantonamenti. Allo stesso tempo, nei casi in cui i prestiti siano segnalati al netto degli accantonamenti, queste informazioni supplementari devono essere segnalate al fine di raccogliere dati relativi a IFM pienamente comparabili tra loro. Laddove la prassi sia quella di segnalare le consistenze in essere dei prestiti al netto degli accantonamenti, le BCN hanno la possibilità di rendere non obbligatoria la segnalazione di queste informazioni. Tuttavia, in tali casi, i calcoli previsti dalla disciplina delle OMRLT-III saranno basati sull'ammontare in essere dei prestiti iscritti a bilancio al netto degli accantonamenti (4). Per ulteriori dettagli, si veda il riferimento agli accantonamenti nella definizione di «Capitale e riserve» di cui alla parte 2 dell'allegato II al regolamento (UE) n. 1071/2013 (BCE/2013/33). |
b) Prestiti netti idonei (2)
Queste celle registrano i prestiti netti (operazioni) erogati nel periodo di segnalazione. I dati sono calcolati sulla base dei dati segnalati nelle sottovoci, ossia «Prestiti lordi» (2.1) meno «Rimborsi» (2.2).
I prestiti rinegoziati nel corso del periodo di segnalazione dovrebbero essere segnalati sia come «Rimborsi» che come «Prestiti lordi» al momento della rinegoziazione. I dati relativi agli aggiustamenti devono includere gli effetti relativi alla rinegoziazione del prestito.
Le operazioni stornate nel corso del periodo, ossia i prestiti concessi e rimborsati nel corso del periodo, dovrebbero in linea di principio essere segnalate sia come «Prestiti lordi» che come «Rimborsi». Tuttavia, le IFM partecipanti possono escludere tali operazioni al momento di compilare le relazioni sui dati, nella misura in cui ciò possa alleviare gli oneri di segnalazione. In questo caso, esse dovrebbero informarne la BCN competente e i dati relativi agli aggiustamenti alle consistenze in essere devono escludere gli effetti relativi alle operazioni stornate. Tale deroga non si applica ai prestiti erogati nel corso del periodo che risultano cartolarizzati o altrimenti trasferiti.
Dovrebbe altresì tenersi conto dei debiti da carta di credito, dei prestiti rotativi e degli scoperti di conto. Per questi strumenti, variazioni nei saldi a causa di importi utilizzati o ritirati durante i periodi di segnalazione dovrebbero essere utilizzati come indicatori per determinare l'importo dei prestiti netti. Importi di segno positivo dovrebbero essere segnalati come «Prestiti lordi» (2.1), mentre importi di segno negativo dovrebbero essere segnalati (con il segno positivo) come «Rimborsi» (2.2).
|
i) |
Prestiti lordi (2.1) Questa voce comprende il flusso di nuovi prestiti lordi nel periodo di segnalazione, escluse eventuali acquisizioni di prestiti. Il credito erogato riferito a debiti da carta di credito, prestiti rotativi e scoperti di conto dovrebbe altresì essere segnalato, come spiegato sopra. Dovrebbero essere inclusi anche gli importi aggiunti nel corso del periodo ai saldi dei clienti dovuti, per esempio, agli interessi capitalizzati (al contrario di quelli maturati) e alle commissioni. |
|
ii) |
Rimborsi (2.2) Questa voce comprende il flusso dei rimborsi in conto capitale durante il periodo di segnalazione, esclusi quelli relativi ai prestiti cartolarizzati o altrimenti trasferiti, che non risultano cancellati dal bilancio. Anche i rimborsi relativi a debiti da carta di credito, prestiti rotativi e scoperti di conto dovrebbero essere segnalati, come spiegato sopra. I pagamenti di interessi relativi agli interessi maturati e non ancora capitalizzati, le cessioni di prestiti e altri aggiustamenti delle consistenze in essere (comprese le perdite parziali e quelle totali) non dovrebbero essere segnalati. Il regolamento (UE) n. 1071/2013 (BCE/2013/33) richiede che le conversioni da titoli di debito ad azioni e altre partecipazioni siano trattate come operazioni. Tuttavia, ai fini della compilazione delle relazioni sui dati OMRLT-III, le conversioni da titoli di debito ad azioni e altre partecipazioni, mediante le quali i prestiti concessi da un partecipante a società non finanziarie sono sostituiti da partecipazioni detenute da tale partecipante in dette società non finanziarie, possono essere segnalate come riclassificazione più che come rimborso dei prestiti, purché l'importo del finanziamento fornito dal partecipante all'economia reale non sia in tal modo ridotto, come stabilito dalla BCN competente. Il partecipante fornirà tutte le informazioni necessarie alla BCN affinché quest'ultima decida come debba essere trattata la conversione. |
c) Aggiustamenti alle consistenze in essere (3)
Queste celle servono a segnalare variazioni nelle consistenze in essere dei prestiti idonei [riduzioni (–) e aumenti (+)] che si verificano durante il periodo di segnalazione e che non sono collegate a prestiti netti idonei. Tali variazioni derivano da operazioni quali cartolarizzazioni dei prestiti e altri trasferimenti di prestiti nel periodo di segnalazione, e da altri aggiustamenti relativi a rivalutazioni dovute a variazioni dei tassi di cambio, perdite parziali e totali dei prestiti e riclassificazioni.
Le voci relative agli aggiustamenti alle consistenze in essere vengono calcolate sulla base dei dati segnalati nelle sottovoci, vale a dire «Cessioni e acquisti di prestiti e altri trasferimenti di prestiti durante il periodo di segnalazione» (3.1), più «Altri aggiustamenti» (3.2).
|
i) |
Cessioni e acquisti di prestiti e altri trasferimenti di prestiti durante il periodo di segnalazione (3.1)
|
|
ii) |
Altri aggiustamenti (3.2) Le seguenti voci relative ad altri aggiustamenti devono essere segnalate per i prestiti in essere iscritti a bilancio, esclusi i prestiti cartolarizzati o altrimenti trasferiti che non sono stati cancellati.
|
d) Consistenze supplementari relative a prestiti idonei autocartolarizzati (S.1)
I partecipanti che esercitano l'opzione di cui all'articolo 6, paragrafo 3, devono anche trasmettere le seguenti voci supplementari relative alle consistenze in essere di prestiti idonei autocartolarizzati nel modello A:
|
i) |
«Consistenze in essere di prestiti idonei autocartolarizzati non cancellati dal bilancio» (S.1.1) Questi dati si riferiscono a prestiti autocartolarizzati e inclusi nelle consistenze segnalate nell'ambito della voce 1.2. |
|
ii) |
«Consistenze in essere di prestiti idonei autocartolarizzati cancellati dal bilancio» (S.1.2) Questi dati si riferiscono a prestiti autocartolarizzati e non più iscritti a bilancio in quanto cancellati. Nella misura in cui continuino ad essere gestiti dal partecipante, i prestiti resteranno soggetti a segnalazione secondo quanto disposto nella parte 5 dell'allegato I al regolamento (UE) n. 1071/2013 (BCE/2013/33) (blocco 3.1 delle tabelle 5a e 5b). |
|
iii) |
«Consistenze in essere di accantonamenti a fronte di prestiti idonei autocartolarizzati non cancellati dal bilancio» (S.1.3) Questi dati si riferiscono a prestiti non cancellati dal bilancio, ossia segnalati alla voce S.1.1. Queste voci devono essere segnalate solo nei casi in cui, contrariamente alla prassi generale in materia di BSI, i prestiti siano segnalati al netto degli accantonamenti. Tuttavia, ove ciò avvenga, i partecipanti possono decidere di non fornire questa informazione, nel qual caso i relativi importi non saranno inclusi nel calcolo delle consistenze in essere di prestiti idonei. |
Segnalazione per OMRLT-III
Modello di segnalazione A per OMRLT-III
|
Periodo di segnalazione:28 febbraio 2019 |
|||||||||
|
|
|||||||||
|
Prestiti a società non finanziarie e a famiglie, esclusi i prestiti a famiglie per l'acquisto di abitazioni (migliaia di EUR) |
|||||||||
|
|
|||||||||
|
|
Dati aggregati principali per la consistenza in essere di riferimento |
|
Prestiti a società non finanziarie |
Prestiti a famiglie (comprese le istituzioni senza scopo di lucro al servizio delle famiglie), esclusi i prestiti per l'acquisto di abitazioni |
|
|
|
||
|
|
|
|
|
|
|
|
voce |
formula |
convalida |
|
|
1 |
Consistenze in essere di prestiti idonei … |
|
0 |
0 |
1 |
1 = 1.1 - 1.2 (1.3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1 |
Consistenze supplementari riguardanti i prestiti idonei autocartolarizzati … |
|
0 |
0 |
S.1 |
S.1 = S.1.1 + S.1.2 (+ S.1.3) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Voci sottostanti |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Consistenze in essere di prestiti idonei a bilancio |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1 |
Consistenze in essere a bilancio … |
|
|
|
1.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2 |
Consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti ma non cancellati dal bilancio … |
|
|
|
1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3 |
Accantonamenti in essere a fronte dei prestiti segnalati alla voce 1.1, esclusa la voce 1.2 (*1)… |
|
|
|
1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Voci supplementari relative ai prestiti idonei autocartolarizzati |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.1 |
Consistenze in essere di prestiti idonei autocartolarizzati non cancellati dal bilancio… |
|
|
|
S.1.1 |
|
S.1.1 <= 1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.2 |
Consistenze in essere di prestiti idonei autocartolarizzati cancellati dal bilancio … |
|
|
|
S.1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.3 |
Consistenze in essere di accantonamenti a fronte dei prestiti idonei autocartolarizzati non cancellati dal bilancio (*1)… |
|
|
|
S.1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Modello di segnalazione B per OMRLT-III
|
Periodo di segnalazione: dal 1o aprile 2018 al 31 marzo 2019 (primo periodo di riferimento) / dal 1o aprile 2019 al 31 marzo 2021 (secondo periodo di riferimento) |
|||||||||
|
|
|||||||||
|
Prestiti a società non finanziarie e a famiglie, esclusi i prestiti a famiglie per l'acquisto di abitazioni (migliaia di EUR) |
|||||||||
|
|
|||||||||
|
|
Dati aggregati principali |
|
Prestiti a società non finanziarie |
Prestiti a famiglie (comprese le istituzioni senza scopo di lucro al servizio delle famiglie), esclusi i prestiti per l'acquisto di abitazioni |
|
|
|
||
|
|
|
|
|
|
|
|
voce |
formula |
convalida |
|
|
1 |
Consistenze in essere di prestiti idonei alla fine del mese precedente l'inizio del periodo di segnalazione … |
|
0 |
0 |
1 |
1 = 1.1 - 1.2 (+1.3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Prestiti netti idonei durante il periodo di segnalazione … |
|
0 |
0 |
2 |
2 = 2.1 - 2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Aggiustamenti alle consistenze in essere: riduzioni (-) e aumenti (+) … |
|
0 |
0 |
3 |
3 = 3.1 + 3.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
Consistenze in essere di prestiti idonei alla fine del periodo di segnalazione … |
|
0 |
0 |
4 |
4 = 4.1 - 4.2 (+4.3) |
4 = 1 + 2 + 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Voci sottostanti |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Consistenze in essere di prestiti idonei alla fine del mese precedente l'inizio del periodo di segnalazione |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1 |
Consistenze in essere a bilancio … |
|
|
|
1.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2 |
Consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti ma non cancellati dal bilancio … |
|
|
|
1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3 |
Accantonamenti in essere a fronte dei prestiti segnalati alla voce 1.1, esclusa la voce 1.2 (*2)… |
|
|
|
1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Prestiti netti idonei durante il periodo di segnalazione |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.1 |
Prestiti lordi … |
|
|
|
2.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2 |
Rimborsi … |
|
|
|
2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aggiustamenti alle consistenze in essere: riduzioni (-) e aumenti (+) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1 |
Cessioni e acquisti di prestiti e altri trasferimenti di prestiti durante il periodo di segnalazione … |
|
0 |
0 |
3.1 |
3.1 = 3.1A + 3.1B + 3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1A |
Flussi netti di prestiti cartolarizzati con impatto sulle consistenze dei prestiti … |
|
|
|
3.1A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1B |
Flussi netti di prestiti altrimenti trasferiti con impatto sulle consistenze dei prestiti … |
|
|
|
3.1B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1C |
Flussi netti di prestiti cartolarizzati o altrimenti trasferiti senza impatto sulle consistenze dei prestiti … |
|
|
|
3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2 |
Altri aggiustamenti … |
|
0 |
0 |
3.2 |
3.2 = 3.2A + 3.2B + 3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2A |
Rivalutazioni dovute a variazioni dei tassi di cambio … |
|
|
|
3.2A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2B |
Perdite totali/perdite parziali … |
|
|
|
3.2B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2C |
Riclassificazioni … |
|
|
|
3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Consistenze in essere di prestiti idonei alla fine del periodo di segnalazione |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.1 |
Consistenze in essere a bilancio … |
|
|
|
4.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.2 |
Consistenze in essere di prestiti cartolarizzati o altrimenti trasferiti ma non cancellati dal bilancio … |
|
|
|
4.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.3 |
Accantonamenti in essere a fronte dei prestiti segnalati alla voce 4.1, esclusa la voce 4.2 (*2)… |
|
|
|
4.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) Il quadro concettuale sottostante agli obblighi di segnalazione rimane invariato rispetto a quello specificato nelle decisioni BCE/2014/34 e (UE) 2016/810 (BCE/2016/10), fatta eccezione per le modifiche relative all'inclusione dei prestiti idonei autocartolarizzati ai fini del calcolo del limite di finanziamento.
(2) Ai fini delle relazioni sui dati, il termine «famiglie» comprende le istituzioni senza scopo di lucro al servizio delle famiglie.
(3) Si veda il Manuale sulle statistiche di bilancio delle IFM, BCE, gennaio 2019, disponibile all'indirizzo http://www.ecb.europa.eu. In particolare, la sezione 4.3, alla pag. 40, si occupa della segnalazione statistica dei prestiti.
(4) Questa eccezione ha anche implicazioni per la segnalazione dei dati sulle perdite parziali e totali, come chiarito di seguito.
(5) La presente convenzione in merito al segno, che è l'opposto rispetto a quanto previsto dalle disposizioni del regolamento (UE) n. 1071/2013 (BCE/2013/33), è coerente con l'obbligo generale relativo ai dati di aggiustamento, come sopra specificato — vale a dire gli effetti che portano a un aumento (diminuzione) delle consistenze in essere devono essere segnalati rispettivamente con segno positivo o negativo.
(6) Il regolamento (UE) n. 1071/2013 (BCE/2013/33) permette alle IFM di segnalare i prestiti acquistati al valore dell'operazione a patto che si tratti di una pratica nazionale applicata da tutte le IFM residenti nel paese. In tali casi, le componenti di rivalutazione che possono sorgere devono essere segnalate alla voce 3.2B.
(7) Dovrebbero essere utilizzati i tassi di cambio di riferimento della BCE. Si veda il comunicato stampa dell'8 luglio 1998, che istituisce standard nel mercato comune, disponibile sul sito Internet della BCE (http://www.ecb.europa.eu).
(8) Tale obbligo differisce dagli obblighi di segnalazione ai sensi del Regolamento (UE) n. 1071/2013 (BCE/2013/33).
(9) Questo obbligo è lo stesso che riguarda le informazioni da segnalare ai sensi del Regolamento (UE) n. 1071/2013 (BCE/2013/33) da parte delle IFM che registrano i prestiti al netto degli accantonamenti.
(*1) Applicabile solo nei casi in cui i prestiti siano segnalati al netto degli accantonamenti; si vedano le istruzioni di segnalazione per ulteriori dettagli.
(*2) Applicabile solo nei casi in cui i prestiti siano segnalati al netto degli accantonamenti; si vedano le istruzioni di segnalazione per ulteriori dettagli.
|
2.8.2019 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 204/123 |
DECISIONE (UE) 2019/1312 DELLA BANCA CENTRALE EUROPEA
del 22 luglio 2019
che modifica la decisione (UE) 2016/810 (BCE/2016/10) su una seconda serie di operazioni mirate di rifinanziamento a più lungo termine (BCE/2019/22)
IL CONSIGLIO DIRETTIVO DELLA BANCA CENTRALE EUROPEA,
Visto il trattato sul funzionamento dell'Unione europea, in particolare il primo trattino dell'articolo 127, paragrafo 2,
visto lo Statuto del Sistema europeo di banche centrali e della Banca centrale europea, in particolare il primo trattino dell'articolo 3.1, nonché l'articolo 12.1, il secondo trattino dell'articolo 18.1 e il secondo trattino dell'articolo 34.1,
visto l'Indirizzo (EU) 2015/510 della Banca centrale europea, del 19 dicembre 2014, sull'attuazione del quadro di riferimento della politica monetaria dell'Eurosistema (BCE/2014/60) (1),
considerando quanto segue:
|
(1) |
Ai sensi dell'articolo 1, paragrafo 4, dell'indirizzo (UE) 2015/510 (BCE/2014/60), il Consiglio direttivo può, in ogni momento, modificare lo strumentario, i singoli strumenti, i requisiti, i criteri e le procedure per l'attuazione delle operazioni di politica monetaria dell'Eurosistema. |
|
(2) |
In data 28 aprile 2016, nel perseguimento del proprio mandato di mantenimento della stabilità dei prezzi e per rafforzare la trasmissione della politica monetaria incentivando ulteriormente l'erogazione di prestiti bancari a favore del settore privato non finanziario, il Consiglio direttivo ha adottato la decisione (UE) 2016/810 della Banca centrale europea (BCE/2016/10) (2). Tale decisione prevedeva una seconda serie di operazioni mirate di rifinanziamento a più lungo termine (OMRLT-II) da effettuarsi nel periodo compreso tra giugno 2016 e marzo 2017. |
|
(3) |
In data 7 marzo 2019, per contribuire a preservare condizioni favorevoli di erogazione del credito bancario e sostenere l'orientamento accomodante della politica monetaria negli Stati membri la cui moneta è l'euro, il Consiglio direttivo ha deciso di effettuare una nuova serie di sette operazioni mirate di rifinanziamento a più lungo termine (OMRLT-III). Le disposizioni che disciplinano le OMRLT-III saranno stabilite in una decisione separata. |
|
(4) |
Al fine di rendere più agevole il calcolo dei limiti di offerta per le OMRLT-III e tenuto conto di eventuali rimborsi anticipati volontari degli importi presi in prestito nell'ambito delle OMRLT-II, è necessario modificare il periodo di notifica per tali rimborsi anticipati. |
|
(5) |
Al fine di concedere agli enti creditizi tempo sufficiente per prepararsi organizzativamente alla prima OMRLT-III, la presente decisione dovrebbe entrare in vigore senza indebito ritardo. |
|
(6) |
Pertanto, è opportuno modificare di conseguenza la decisione (UE) 2016/810 (BCE/2016/10), |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Modifiche
All'articolo 6 della decisione (UE) 2016/810 (BCE/2016/10), i paragrafi 3 e 4 sono sostituiti dai seguenti:
«3. Al fine di potersi avvalere della procedura di rimborso anticipato, un partecipante notifica alla BCN competente che intende effettuare un rimborso avvalendosi della procedura di rimborso anticipato alla data di rimborso anticipato, almeno due settimane prima di tale data.
4. La notifica di cui al paragrafo 3 diviene vincolante per il partecipante interessato due settimane prima della data di rimborso anticipato cui fa riferimento. Il mancato regolamento, integrale o parziale, da parte del partecipante, dell'importo dovuto nell'ambito della procedura di rimborso anticipato alla data del rimborso può comportare l'irrogazione di una sanzione pecuniaria. La sanzione pecuniaria applicabile è calcolata in conformità all'allegato VII all'indirizzo (UE) 2015/510 (BCE/2014/60) e corrisponde alla sanzione pecuniaria applicata in caso di inadempimento dell'obbligo di garantire adeguatamente e regolare l'importo assegnato alla controparte in relazione a operazioni temporanee a fini di politica monetaria. L'irrogazione di una sanzione pecuniaria non pregiudica il diritto della BCN di adottare le misure previste in caso di inadempimento di cui all'articolo 166 dell'Indirizzo (UE) 2015/510 (BCE/2014/60).».
Articolo 2
Entrata in vigore
La presente decisione entra in vigore il 3 agosto 2019.
Fatto a Francoforte sul Meno, il 22 luglio 2019.
Per il Consiglio direttivo della BCE
Il presidente della BCE
Mario DRAGHI
(1) Indirizzo (UE) 2015/510 della Banca centrale europea, del 19 dicembre 2014, sull'attuazione del quadro di riferimento della politica monetaria dell'Eurosistema (BCE/2014/60) (Indirizzo sulle caratteristiche generali) (GU L 91 del 2.4.2015, pag. 3).
(2) Decisione (UE) 2016/810 della Banca centrale europea, del 28 aprile 2016, su una seconda serie di operazioni mirate di rifinanziamento a più lungo termine (BCE/2016/10) (GU L 132 del 21.5.2016, pag. 107).