ISSN 1977-0707
doi:10.3000/19770707.L_2012.219.ita
Gazzetta ufficiale
dell'Unione europea
L 219

Edizione in lingua italiana
Legislazione
55o anno
17 agosto 2012
|
ISSN 1977-0707 doi:10.3000/19770707.L_2012.219.ita |
||
|
Gazzetta ufficiale dell'Unione europea |
L 219 |
|

|
||
|
Edizione in lingua italiana |
Legislazione |
55o anno |
|
|
|
|
|
(1) Testo rilevante ai fini del SEE |
|
IT |
Gli atti i cui titoli sono stampati in caratteri chiari appartengono alla gestione corrente. Essi sono adottati nel quadro della politica agricola ed hanno generalmente una durata di validità limitata. I titoli degli altri atti sono stampati in grassetto e preceduti da un asterisco. |
II Atti non legislativi
REGOLAMENTI
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/1 |
REGOLAMENTO DI ESECUZIONE (UE) N. 742/2012 DEL CONSIGLIO
del 16 agosto 2012
che attua l’articolo 32, paragrafo 1, del regolamento (UE) n. 36/2012, concernente misure restrittive in considerazione della situazione in Siria
IL CONSIGLIO DELL’UNIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (UE) n. 36/2012 (1), in particolare l’articolo 32, paragrafo 1,
considerando quanto segue:
|
(1) |
Il 18 gennaio 2012 il Consiglio ha adottato il regolamento (UE) n. 36/2012. |
|
(2) |
Conformemente alla decisione di esecuzione 2012/478/PESC del Consiglio, del 16 agosto 2012, che attua la decisione 2011/782/PESC relativa a misure restrittive nei confronti della Siria (2), un’altra entità dovrebbe essere inserita nell’elenco delle persone fisiche e giuridiche, delle entità o degli organismi soggetti a misure restrittive riportato nell’allegato II del regolamento (UE) n. 36/2012, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
L’entità elencata nell’allegato del presente regolamento è aggiunta all’elenco riportato nell’allegato II del regolamento (UE) n. 36/2012.
Articolo 2
Il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 16 agosto 2012
Per il Consiglio
Il presidente
A. D. MAVROYIANNIS
(1) GU L 16 del 19.1.2012, pag. 1.
(2) Cfr. pag. 21 della presente Gazzetta ufficiale.
ALLEGATO
ENTITÀ DI CUI ALL'ARTICOLO 1
Entità
|
|
Nome |
Informazioni identificative |
Motivi |
Data di inserimento nell'elenco |
|
1. |
Drex Technologies Holding S.A. |
Registrata in Lussemburgo con il numero B77616; in precedenza aveva sede al seguente indirizzo: 17, rue Beaumont L-1219 Luxembourg. |
Il proprietario effettivo della Drex Technologies Holding S.A. é Rami Makhlouf, persona oggetto di sanzioni dell'UE perché finanziatore del regime siriano. |
16.8.2012 |
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/3 |
REGOLAMENTO DI ESECUZIONE (UE) N. 743/2012 DELLA COMMISSIONE
del 9 agosto 2012
recante iscrizione di una denominazione nel registro delle denominazioni di origine protette e delle indicazioni geografiche protette![]() (YANCHENG LONG XIA) (IGP)
(YANCHENG LONG XIA) (IGP)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (CE) n. 510/2006 del Consiglio, del 20 marzo 2006, relativo alla protezione delle indicazioni geografiche e delle denominazioni d’origine dei prodotti agricoli e alimentari (1), in particolare l’articolo 7, paragrafo 4, primo comma,
considerando quanto segue:
|
(1) |
A norma dell’articolo 6, paragrafo 2, primo comma, del regolamento (CE) n. 510/2006, la domanda di registrazione della denominazione «
|
|
(2) |
Poiché alla Commissione non è stata notificata alcuna dichiarazione di opposizione ai sensi dell’articolo 7 del regolamento (CE) n. 510/2006, detta denominazione deve essere registrata, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
La denominazione che figura nell’allegato del presente regolamento è registrata.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 9 agosto 2012
Per la Commissione, a nome del presidente
Andris PIEBALGS
Membro della Commissione
(1) GU L 93 del 31.3.2006, pag. 12.
(2) GU C 359 del 9.12.2011, pag. 17.
ALLEGATO
Prodotti agricoli destinati al consumo umano elencati nell’allegato I del trattato:
Classe 1.7. Pesce, molluschi, crostacei freschi e prodotti derivati
CINA
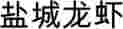 (Yancheng Long Xia) (IGP)
(Yancheng Long Xia) (IGP)
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/5 |
REGOLAMENTO (UE) N. 744/2012 DELLA COMMISSIONE
del 16 agosto 2012
che modifica gli allegati I e II della direttiva 2002/32/CE del Parlamento europeo e del Consiglio per quanto riguarda i livelli massimi di arsenico, fluoro, piombo, mercurio, endosulfan, diossine, Ambrosia spp., diclazuril e lasalocid A sodico e le soglie d’intervento per le diossine
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
vista la direttiva 2002/32/CE del Parlamento europeo e del Consiglio, del 7 maggio 2002, relativa alle sostanze indesiderabili nell’alimentazione degli animali (1), in particolare l’articolo 8, paragrafo 1,
considerando quanto segue:
|
(1) |
La direttiva 2002/32/CE proibisce l’uso di prodotti destinati all’alimentazione degli animali che presentano un contenuto di sostanze indesiderabili superiore ai livelli massimi fissati nell’allegato I della medesima. L’allegato II stabilisce soglie d’intervento che richiedono indagini nei casi di aumento dei livelli di tali sostanze. |
|
(2) |
Sono stati fissati livelli massimi superiori di arsenico, fluoro, piombo e mercurio nella materia prima per mangimi carbonato di calcio e livelli massimi superiori di arsenico e fluoro nella materia prima per mangimi ossido di magnesio, ma non nella materia prima per mangimi carbonato di calcio e di magnesio, miscuglio naturale di carbonato di calcio e di magnesio. Per motivi di coerenza, è opportuno allineare i limiti massimi superiori di arsenico, fluoro, piombo e mercurio nella materia prima per mangimi carbonato di calcio e di magnesio all’attuale limite massimo superiore nel carbonato di calcio. |
|
(3) |
Nel suo parere scientifico sulla sicurezza e sull’efficacia del dicloruro di rame triidrossido (cloruro di rame tribasico, TBCC) impiegato come additivo per mangimi (2), l’Autorità europea per la sicurezza alimentare (EFSA) ha concluso che sarebbe appropriato fissare per questo additivo lo stesso limite massimo di arsenico previsto per il solfato di rame pentaidrato e il carbonato di rame. È opportuno modificare il limite massimo di arsenico nel dicloruro di rame triidrossido. |
|
(4) |
Taluni alimenti composti per animali da compagnia contengono una percentuale significativa di materie prime per mangimi a base di pesce, altri animali acquatici e loro prodotti e/o farina di alghe marine. Tali materie prime contengono un elevato tenore totale di arsenico. Tuttavia, l’arsenico presente in tali materie prime per mangimi è soprattutto arsenico organico, che rappresenta la forma meno tossica. È pertanto opportuno modificare il limite massimo di arsenico applicabile ai mangimi complementari e completi per gli animali da compagnia contenenti pesce, altri animali acquatici e loro prodotti e/o farina di alghe marine. |
|
(5) |
Le due zeoliti natrolite e clinoptilolite sono i costituenti attivi della natrolite-fonolite (E566) e della clinoptilolite di origine vulcanica (E567). È quindi opportuno applicare lo stesso limite massimo di piombo nella natrolite-fonolite (E566) e nella clinoptilolite di origine vulcanica (E567). |
|
(6) |
Al fine di aumentare la sostenibilità della piscicoltura dei salmonidi, l’uso degli oli di pesce è gradualmente sostituito da quello di oli vegetali. Tuttavia, tale sostituzione, che inciderebbe in maniera molto favorevole sulla sostenibilità dell’ambiente marino, in alcuni casi non è possibile a causa del limite massimo estremamente dell’endosulfan nei mangimi completi per pesci. Su richiesta della Commissione l’Autorità europea per la sicurezza alimentare (EFSA) ha emesso un parere scientifico. Nella sua dichiarazione sulla tossicità orale dell’endosulfan nel pesce (3), l’EFSA ha dichiarato che non si sono osservati effetti negativi significativi nel pesce (salmone dell’Atlantico) in gabbie in mare aperto esposto fino a 0,1 mg/kg di endosulfan nei mangimi, mentre si sono osservati effetti negativi di piccola entità per i salmoni in vasche esposti a livelli superiori rispetto all’attuale limite massimo nei mangimi. Uno studio di portata limitata indica che l’esposizione della tilapia del Nilo all’endosulfan attraverso il mangime in vasche ha causato effetti negativi. È quindi opportuno proporre un limite massimo superiore di endosulfan nei mangimi completi per i salmonidi, per favorire l’evoluzione verso una maggiore sostenibilità della piscicoltura, senza che ciò comporti effetti nocivi per la salute dei pesci e per quella umana. |
|
(7) |
Dati recenti indicano che i livelli di diossina nella farina di crostacei, un sottoprodotto della produzione alimentare utilizzata principalmente nei mangimi per pesci ornamentali in percentuale da 1 a 3 %, sono superiori all’attuale livello massimo. Per consentire l’uso di questa farina nei mangimi e per ridurre la quantità dei rifiuti alimentari senza mettere a repentaglio la salute animale e quella pubblica, è opportuno aumentare leggermente il limite massimo delle diossine nella farina di crostacei. |
|
(8) |
La direttiva 2002/32/CE si propone di evitare la diffusione di germi vitali di Ambrosia spp. nell’ambiente. Poiché la macinazione o la frantumazione distrugge la germinabilità delle sementi, non è necessario pulire i grani e semi contenenti livelli non conformi di semi di Ambrosia spp. prima della macinazione o della frantumazione, a condizione che vengano adottate misure preventive per evitare la diffusione dei semi di Ambrosia spp. nell’ambiente durante il trasporto, la conservazione o la trasformazione. |
|
(9) |
Per quanto concerne i coccidiostatici diclazuril e lasalocid A sodico, è necessario apportare modifiche per tener conto delle autorizzazioni recentemente rilasciate per tali sostanze dal regolamento (UE) n. 169/2011 della Commissione, del 23 febbraio 2011, relativo all’autorizzazione del diclazuril come additivo per mangimi destinati alle faraone (titolare dell’autorizzazione Janssen Pharmaceutica N.V.) (4), dal regolamento di esecuzione (UE) n. 888/2011 della Commissione, del 5 settembre 2011, relativo all’autorizzazione del diclazuril come additivo per mangimi destinati a tacchini da ingrasso (titolare dell’autorizzazione Janssen Pharmaceutica N.V.) e che modifica il regolamento (CE) n. 2430/1999 (5) e dal regolamento di esecuzione (UE) n. 900/2011 della Commissione, del 7 settembre 2011, relativo all’autorizzazione del lasalocid A sodico come additivo per mangimi destinati a fagiani, faraone, quaglie e pernici, diversi dalle specie ovaiole [titolare dell’autorizzazione Alpharma (Belgio) BVBA] (6). |
|
(10) |
Dal momento che si propone un aumento del livello massimo di diossine nella farina di crostacei, è opportuno che anche la soglia d’intervento applicabile alla farina di crostacei di cui all’allegato II della direttiva 2002/32/CE sia aumentata in misura corrispondente. |
|
(11) |
Le misure di cui al presente regolamento sono conformi al parere del comitato permanente per la catena alimentare e la salute degli animali e ad esse non si sono opposti né il Parlamento europeo né il Consiglio, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Gli allegati I e II della direttiva 2002/32/CE sono modificati conformemente all’allegato del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 16 agosto 2012
Per la Commissione
Il presidente
José Manuel BARROSO
(1) GU L 140 del 30.5.2002, pag. 10.
(2) Gruppo di esperti scientifici dell’EFSA sugli additivi, prodotti o sostanze usati nei mangimi (FEEDAP); Scientific Opinion on safety and efficacy of di copper chloride tri hydroxide (tribasic copper chloride, TBCC) as feed additive for all species [Parere scientifico sulla sicurezza e l’efficacia del dicloruro di rame triidrossido (cloruro di rame tribasico, TBCC) come additivo per mangimi per tutte le specie]. EFSA Journal 2011; 9(9):2355. [18 pagg.]. doi:10.2903/j.efsa.2011.2355. Disponibile online sul sito www.efsa.europa.eu/efsajournal
(3) EFSA Journal 2011; 9(4):2131. Disponibile on line all’indirizzo: www.efsa.europa.eu/efsajournal
(4) GU L 49 del 24.2.2011, pag. 6.
(5) GU L 229 del 6.9.2011, pag. 9.
(6) GU L 231 dell’8.9.2011, pag. 15.
ALLEGATO
|
1. |
L’allegato I della direttiva 2002/32/CE è così modificato:
|
|
2. |
La riga 1, diossine [somma di policlorodibenzo-para-diossine (PCDD) e policlorodibenzofurani (PCDF), espressi in equivalenti di tossicità dell’Organizzazione mondiale della sanità (OMS), utilizzando gli OMS-TEF (fattori di tossicità equivalente, 2005)] della sezione: Diossine e PBC, dell’allegato II della direttiva 2002/32/CE, è sostituita dal testo seguente:
|
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/13 |
REGOLAMENTO DI ESECUZIONE (UE) N. 745/2012 DELLA COMMISSIONE
del 16 agosto 2012
recante fissazione dei coefficienti applicabili ai cereali esportati sotto forma di Scotch whisky per il periodo 2012/13
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (CE) n. 1234/2007 del Consiglio, del 22 ottobre 2007, recante organizzazione comune dei mercati agricoli e disposizioni specifiche per taluni prodotti agricoli (regolamento unico OCM) (1),
visto il regolamento (CE) n. 1670/2006 della Commissione, del 10 novembre 2006, recante modalità di applicazione del regolamento (CE) n. 1784/2003 del Consiglio riguardo alla determinazione e alla concessione di restituzioni adattate per i cereali esportati sotto forma di talune bevande alcoliche (2), in particolare l’articolo 5,
considerando quanto segue:
|
(1) |
A norma dell’articolo 4, paragrafo 1, del regolamento (CE) n. 1670/2006, i quantitativi per i quali è concessa la restituzione sono i quantitativi di cereali sottoposti a controllo e distillati, moltiplicati per un coefficiente fissato annualmente per ogni Stato membro interessato. Tale coefficiente esprime il rapporto esistente tra i quantitativi totali esportati e i quantitativi totali commercializzati della bevanda alcolica in questione, sulla base della tendenza registrata nell’andamento di tali quantitativi durante il numero di anni corrispondente al periodo medio d’invecchiamento di detta bevanda alcolica. |
|
(2) |
In base alle informazioni fornite dal Regno Unito relativamente al periodo compreso tra il 1o gennaio e il 31 dicembre 2011, per lo Scotch whisky il periodo medio di invecchiamento nel 2011 era di otto anni. |
|
(3) |
Il regolamento di esecuzione (UE) n. 1094/2011 della Commissione, del 28 ottobre 2011, recante fissazione dei coefficienti applicabili ai cereali esportati sotto forma di Scotch whisky per il periodo 2011/2012 (3) ha cessato di avere effetto dato che riguarda i coefficienti applicabili per il periodo 2011/12. Occorre pertanto fissare i coefficienti per il periodo dal 1o ottobre 2012 al 30 settembre 2013. |
|
(4) |
L’articolo 10 del protocollo n. 3 dell’accordo sullo Spazio economico europeo esclude la concessione di restituzioni per le esportazioni nel Liechtenstein, in Islanda e in Norvegia. L’Unione ha inoltre concluso accordi con alcuni paesi terzi che comportano la soppressione delle restituzioni all’esportazione. Di conseguenza, in applicazione dell’articolo 7, paragrafo 2, del regolamento (CE) n. 1670/2006, occorre tenere conto di questi elementi nel calcolo del coefficiente per il periodo 2012/13, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Per il periodo dal 1o ottobre 2012 al 30 settembre 2013 i coefficienti di cui all’articolo 4 del regolamento (CE) n. 1670/2006, applicabili ai cereali utilizzati nel Regno Unito per la fabbricazione dello Scotch whisky, sono fissati nell’allegato del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica dal 1o ottobre 2012 al 30 settembre 2013.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 16 agosto 2012
Per la Commissione
Il presidente
José Manuel BARROSO
(1) GU L 299 del 16.11.2007, pag. 1.
(2) GU L 312 dell’11.11.2006, pag. 33.
(3) GU L 283 del 29.10.2011, pag. 30.
ALLEGATO
|
Coefficienti applicabili nel Regno Unito |
||
|
Periodo di applicazione |
Coefficiente applicabile |
|
|
all’orzo trasformato in malto utilizzato nella fabbricazione di whisky di malto («malt whisky») |
ai cereali utilizzati nella fabbricazione di whisky di cereali («grain whisky») |
|
|
Dal 1o ottobre 2012 al 30 settembre 2013 |
0,229 |
0,152 |
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/15 |
REGOLAMENTO DI ESECUZIONE (UE) N. 746/2012 DELLA COMMISSIONE
del 16 agosto 2012
che approva la sostanza attiva Adoxophyes orana granulovirus, in conformità al regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio relativo all’immissione sul mercato dei prodotti fitosanitari e che modifica l’allegato del regolamento di esecuzione (UE) n. 540/2011 della Commissione
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio, del 21 ottobre 2009, relativo all’immissione sul mercato dei prodotti fitosanitari e che abroga le direttive del Consiglio 79/117/CEE e 91/414/CEE (1), in particolare l’articolo 13, paragrafo 2, e l’articolo 78, paragrafo 2,
considerando quanto segue:
|
(1) |
A norma dell’articolo 80, paragrafo 1, lettera a) del regolamento (CE) n. 1107/2009, per quanto riguarda la procedura e le condizioni di applicazione, la direttiva 91/414/CEE del Consiglio (2) si applica alle sostanze attive con riferimento alle quali è stata adottata una decisione conformemente all’articolo 6, paragrafo 3, di tale direttiva prima del 14 giugno 2011. Per la sostanza Adoxophyes orana granulovirus le condizioni dell’articolo 80, paragrafo 1, lettera a) del regolamento (CE) n. 1107/2009 sono rispettate dalla decisione 2007/669/CE della Commissione (3). |
|
(2) |
Conformemente all’articolo 6, paragrafo 2, della direttiva 91/414/CEE, il 29 novembre 2004 la Germania ha ricevuto da Andermatt Biocontrol GmbH la richiesta di iscrizione della sostanza attiva Adoxophyes orana granulovirus nell’allegato I della direttiva 91/414/CEE. Con decisione 2007/669/CE della Commissione è stata riconosciuta la completezza del fascicolo, nel senso che poteva essere considerato conforme, in linea di massima, ai requisiti concernenti i dati e le informazioni di cui agli allegati II e III della direttiva 91/414/CEE. |
|
(3) |
Gli effetti di tale sostanza attiva sulla salute umana e animale e sull’ambiente sono stati valutati in conformità alle disposizioni dell’articolo 6, paragrafi 2 e 4 della direttiva 91/414/CEE relativamente agli impieghi proposti dal richiedente. Lo Stato membro relatore designato ha presentato un progetto di rapporto di valutazione il 13 agosto 2008. |
|
(4) |
Il progetto di rapporto di valutazione è stato oggetto di un esame inter pares degli Stati membri e dell’Autorità per la sicurezza alimentare (di seguito «l’Autorità»). In data 4 aprile 2012 l’Autorità ha presentato alla Commissione le sue conclusioni sull’esame inter pares di valutazione dei rischi della sostanza attiva Adoxophyes orana granulovirus (4). Tale progetto di rapporto è stato riesaminato dagli Stati membri e dalla Commissione nell’ambito del Comitato permanente per la catena alimentare e la salute degli animali e ultimato il 13 luglio 2012 sotto forma di rapporto di riesame della Commissione sulla sostanza Adoxophyes orana granulovirus. |
|
(5) |
Dai vari esami effettuati è risultato che si può prevedere che i prodotti fitosanitari contenenti Adoxophyes orana granulovirus soddisfino in generale le esigenze di cui all’articolo 5, paragrafo 1, lettere a) e b), e all’articolo 5, paragrafo 3, della direttiva 91/414/CEE, in particolare per quanto riguarda gli impieghi esaminati e specificati nel rapporto di riesame della Commissione. È pertanto opportuno autorizzare la sostanza Adoxophyes orana granulovirus. |
|
(6) |
Fatti salvi gli obblighi conseguenti all’approvazione di cui al regolamento (CE) n. 1107/2009 e tenendo conto della specifica situazione dovuta alla transizione dalla direttiva 91/414/CEE al regolamento (CE) n. 1107/2009, vanno tuttavia applicate le disposizioni riportate di seguito. Agli Stati membri va concesso un periodo di 6 mesi dopo l’approvazione per riesaminare le autorizzazioni rilasciate ai prodotti fitosanitari contenenti Adoxophyes orana granulovirus. Gli Stati membri dovranno eventualmente modificare, sostituire o revocare le autorizzazioni in vigore. In deroga al termine suddetto, è opportuno concedere un periodo più lungo per presentare e valutare il fascicolo completo di cui all’allegato III della direttiva 91/414/CEE relativo a ogni prodotto fitosanitario e a ogni suo impiego previsto, in conformità ai principi uniformi. |
|
(7) |
L’esperienza acquisita con le iscrizioni nell’allegato I della direttiva 91/414/CEE di sostanze attive valutate nel quadro del regolamento (CEE) n. 3600/92 della Commissione, dell’11 dicembre 1992, recante disposizioni d’attuazione della prima fase del programma di lavoro di cui all’articolo 8, paragrafo 2, della direttiva 91/414/CEE del Consiglio relativa all’immissione in commercio dei prodotti fitosanitari (5), ha dimostrato che possono presentarsi difficoltà di interpretazione per quanto riguarda gli obblighi dei titolari delle autorizzazioni vigenti in relazione all’accesso ai dati. Per evitare ulteriori difficoltà è perciò necessario chiarire gli obblighi degli Stati membri, in particolare quello di verificare che il titolare di un’autorizzazione dimostri di avere accesso a un fascicolo conforme alle prescrizioni dell’allegato II di detta direttiva. Tale chiarimento non impone tuttavia alcun nuovo obbligo agli Stati membri o ai titolari di autorizzazioni oltre a quelli già previsti dalle direttive finora adottate che modificano l’allegato I di detta direttiva o dai regolamenti che approvano le sostanze attive. |
|
(8) |
In conformità all’articolo 13, paragrafo 4, del regolamento (CE) n. 1107/2009 è opportuno modificare di conseguenza l’allegato del regolamento di esecuzione (UE) n. 540/2011 della Commissione del 25 maggio 2011, recante disposizioni di attuazione del regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio per quanto riguarda l’elenco delle sostanze attive approvate (6). |
|
(9) |
Le misure di cui al presente regolamento sono conformi al parere del Comitato permanente per la catena alimentare e la salute degli animali, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Approvazione della sostanza attiva
La sostanza attiva Adoxophyes orana granulovirus, di cui all’allegato I, è autorizzata alle condizioni indicate in tale allegato.
Articolo 2
Riesame dei prodotti fitosanitari
1. In applicazione del regolamento (CE) n. 1107/2009 gli Stati membri, se necessario, modificano o revocano entro il 31 luglio 2013 le autorizzazioni esistenti per i prodotti fitosanitari contenenti Adoxophyes orana granulovirus come sostanza attiva.
Entro tale data essi verificano, in particolare, che siano rispettate le condizioni di cui all’allegato I del presente regolamento, escluse quelle della colonna relativa alle disposizioni specifiche di tale allegato, e che il titolare dell’autorizzazione sia in possesso di o abbia accesso a un fascicolo conforme alle prescrizioni dell’allegato II della direttiva 91/414/CEE, conformemente alle condizioni specificate all’articolo 13, paragrafi da 1 a 4, di tale direttiva e all’articolo 62, del regolamento (CE) n. 1107/2009.
2. In deroga al paragrafo 1, ogni prodotto fitosanitario autorizzato che contenga Adoxophyes orana granulovirus come unica sostanza attiva o come una tra più sostanze attive, tutte iscritte non oltre il 31 gennaio 2013 nell’elenco di cui all’allegato del regolamento di esecuzione (UE) n. 540/2011, va riesaminato dagli Stati membri in conformità ai principi uniformi di cui all’articolo 29, paragrafo 6, del regolamento (CE) n. 1107/2009, in base a un fascicolo che rispetti le prescrizioni dell’allegato III della direttiva 91/414/CEE e tenga conto della colonna sulle disposizioni specifiche dell’allegato I del presente regolamento. In base a tale valutazione, essi stabiliscono se il prodotto è conforme alle condizioni di cui all’articolo 29, paragrafo 1, del regolamento (CE) n. 1107/2009.
Sulla base di quanto stabilito, gli Stati membri:
|
a) |
nel caso di un prodotto contenente Adoxophyes orana granulovirus come unica sostanza attiva, modificano o revocano, se necessario, l’autorizzazione entro il 31 luglio 2014; oppure |
|
b) |
nel caso di prodotti contenenti Adoxophyes orana granulovirus come sostanza attiva in combinazione con altre, ove necessario, modificano o revocano l’autorizzazione entro il 31 luglio 2014 ovvero entro il termine, qualora più esteso, fissato per la modifica o la revoca rispettivamente dall’atto o dagli atti che hanno inserito la sostanza o le sostanze nell’allegato I della direttiva 91/414/CEE. |
Articolo 3
Modifiche del regolamento di esecuzione (UE) n. 540/2011
L’allegato del regolamento di esecuzione (UE) n. 540/2011 è modificato conformemente all’allegato II del presente regolamento.
Articolo 4
Entrata in vigore e data di applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 1o febbraio 2013.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 16 agosto 2012
Per la Commissione
Il presidente
José Manuel BARROSO
(1) GU L 309 del 24.11.2009, pag. 1.
(2) GU L 230 del 19.8.1991, pag. 1.
(3) GU L 274 del 18.10.2007, pag. 15.
(4) The EFSA Journal 2012; 10(4):2654. Disponibile on line all’indirizzo: www.efsa.europa.eu
(5) GU L 366 del 15.12.1992, pag. 10.
(6) GU L 153 dell’11.6.2011, pag. 1.
ALLEGATO I
|
Nome comune, numeri d’identificazione |
Denominazione IUPAC |
Purezza (1) |
Data di approvazione |
Scadenza dell’approvazione |
Disposizioni specifiche |
|
Adoxophyes orana granulovirus Raccolta delle colture n. DSM BV-0001 N. CIPAC 782 |
Non applicabile |
Impurezze non rilevanti |
1o febbraio 2013 |
31 gennaio 2023 |
Per l’applicazione dei principi uniformi di cui all’articolo 29, paragrafo 6, del regolamento (CE) n. 1107/2009, si deve tener conto delle conclusioni del rapporto di riesame sulla sostanza Adoxophyes orana granulovirus, in particolare delle relative appendici I e II, nella versione definitiva elaborata dal Comitato permanente per la catena alimentare e la salute degli animali il 13 luglio 2012. |
(1) Ulteriori dettagli sull’identità e sulle specifiche della sostanza attiva sono contenuti nel rapporto di riesame.
ALLEGATO II
Alla parte B dell’allegato del regolamento di esecuzione (UE) n. 540/2011 è aggiunta la seguente voce:
|
Numero |
Nome comune, numeri d’identificazione |
Denominazione IUPAC |
Purezza (1) |
Data di approvazione |
Scadenza dell’approvazione |
Disposizioni specifiche |
|
«26 |
Adoxophyes orana granulovirus Raccolta delle colture n. DSM BV-0001 N. CIPAC 782 |
Non applicabile |
Impurezze non rilevanti |
1o febbraio 2013 |
31 gennaio 2023 |
Per l’applicazione dei principi uniformi di cui all’articolo 29, paragrafo 6, del regolamento (CE) n. 1107/2009, si deve tener conto delle conclusioni del rapporto di riesame sulla sostanza Adoxophyes orana granulovirus, in particolare delle relative appendici I e II, nella versione definitiva elaborata dal Comitato permanente per la catena alimentare e la salute degli animali il 13 luglio 2012.» |
(1) Ulteriori dettagli sull’identità e sulle specifiche della sostanza attiva sono contenuti nel rapporto di riesame.
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/19 |
REGOLAMENTO DI ESECUZIONE (UE) N. 747/2012 DELLA COMMISSIONE
del 16 agosto 2012
recante fissazione dei valori forfettari all'importazione ai fini della determinazione del prezzo di entrata di taluni ortofrutticoli
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1234/2007 del Consiglio, del 22 ottobre 2007, recante organizzazione comune dei mercati agricoli e disposizioni specifiche per taluni prodotti agricoli (regolamento unico OCM) (1),
visto il regolamento di esecuzione (UE) n. 543/2011 della Commissione, del 7 giugno 2011, recante modalità di applicazione del regolamento (CE) n. 1234/2007 del Consiglio nei settori degli ortofrutticoli freschi e degli ortofrutticoli trasformati (2), in particolare l'articolo 136, paragrafo 1,
considerando quanto segue:
|
(1) |
Il regolamento di esecuzione (UE) n. 543/2011 prevede, in applicazione dei risultati dei negoziati commerciali multilaterali dell'Uruguay round, i criteri per la fissazione da parte della Commissione dei valori forfettari all'importazione dai paesi terzi, per i prodotti e i periodi indicati nell'allegato XVI, parte A, del medesimo regolamento. |
|
(2) |
Il valore forfettario all'importazione è calcolato ciascun giorno feriale, in conformità dell’articolo 136, paragrafo 1, del regolamento di esecuzione (UE) n. 543/2011, tenendo conto di dati giornalieri variabili. Pertanto il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell'Unione europea, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
I valori forfettari all'importazione di cui all'articolo 136 del regolamento di esecuzione (UE) n. 543/2011 sono quelli fissati nell'allegato del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 16 agosto 2012
Per la Commissione, a nome del presidente
José Manuel SILVA RODRÍGUEZ
Direttore generale dell'Agricoltura e dello sviluppo rurale
(1) GU L 299 del 16.11.2007, pag. 1.
(2) GU L 157 del 15.6.2011, pag. 1.
ALLEGATO
Valori forfettari all'importazione ai fini della determinazione del prezzo di entrata di taluni ortofrutticoli
|
(EUR/100 kg) |
||
|
Codice NC |
Codice dei paesi terzi (1) |
Valore forfettario all'importazione |
|
0702 00 00 |
MK |
57,4 |
|
ZZ |
57,4 |
|
|
0707 00 05 |
MK |
66,1 |
|
TR |
106,1 |
|
|
ZZ |
86,1 |
|
|
0709 93 10 |
TR |
102,9 |
|
ZZ |
102,9 |
|
|
0805 50 10 |
AR |
87,7 |
|
CL |
88,4 |
|
|
TR |
95,0 |
|
|
UY |
82,8 |
|
|
ZA |
96,2 |
|
|
ZZ |
90,0 |
|
|
0806 10 10 |
BA |
56,7 |
|
EG |
207,4 |
|
|
MK |
50,2 |
|
|
TR |
169,4 |
|
|
ZZ |
120,9 |
|
|
0808 10 80 |
AR |
168,7 |
|
BR |
103,6 |
|
|
CL |
119,7 |
|
|
NZ |
114,1 |
|
|
US |
194,6 |
|
|
ZA |
91,4 |
|
|
ZZ |
132,0 |
|
|
0808 30 90 |
AR |
111,1 |
|
CL |
165,2 |
|
|
CN |
80,2 |
|
|
TR |
145,2 |
|
|
ZA |
101,4 |
|
|
ZZ |
120,6 |
|
|
0809 30 |
TR |
170,0 |
|
ZZ |
170,0 |
|
|
0809 40 05 |
BA |
66,1 |
|
IL |
80,1 |
|
|
ZZ |
73,1 |
|
(1) Nomenclatura dei paesi stabilita dal regolamento (CE) n. 1833/2006 della Commissione (GU L 354 del 14.12.2006, pag. 19). Il codice «ZZ» corrisponde a «altre origini».
DECISIONI
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/21 |
DECISIONE DI ESECUZIONE 2012/478/PESC DEL CONSIGLIO
del 16 agosto 2012
che attua la decisione 2011/782/PESC relativa a misure restrittive nei confronti della Siria
IL CONSIGLIO DELL’UNIONE EUROPEA,
visto il trattato sull’Unione europea,
vista la decisione 2011/782/PESC (1), in particolare l’articolo 21, paragrafo 1,
considerando quanto segue:
|
(1) |
Il 1o dicembre 2011 il Consiglio ha adottato la decisione 2011/782/PESC. |
|
(2) |
Un’altra entità dovrebbe essere inserita nell’elenco delle persone e delle entità soggette a misure restrittive riportato nell’allegato I della decisione 2011/782/PESC, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
L’entità elencata nell’allegato della presente decisione è aggiunta all’elenco riportato nell’allegato I della decisione 2011/782/PESC.
Articolo 2
La presente decisione entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Fatto a Bruxelles, il 16 agosto 2012
Per il Consiglio
Il presidente
A. D. MAVROYIANNIS
(1) GU L 319 del 2.12.2011, pag. 56.
ALLEGATO
ENTITÀ DI CUI ALL'ARTICOLO 1
Entità
|
|
Nome |
Informazioni identificative |
Motivi |
Data di inserimento nell'elenco |
|
1. |
Drex Technologies Holding S.A. |
Registrata in Lussemburgo con il numero B77616; in precedenza aveva sede al seguente indirizzo: 17, rue Beaumont L-1219 Luxembourg. |
Il proprietario effettivo della Drex Technologies Holding S.A è Rami Makhlouf, persona oggetto di sanzioni dell'UE perché finanziatore del regime siriano. |
16.8.2012 |
|
17.8.2012 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 219/23 |
DECISIONE DI ESECUZIONE DELLA COMMISSIONE
del 14 agosto 2012
che modifica la decisione 2007/777/CE per quanto concerne le voci riguardanti Israele negli elenchi di paesi terzi da cui taluni prodotti a base di carne possono essere introdotti nell’Unione
[notificata con il numero C(2012) 5703]
(Testo rilevante ai fini del SEE)
(2012/479/UE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
vista la direttiva 2002/99/CE del Consiglio, del 16 dicembre 2002, che stabilisce norme di polizia sanitaria per la produzione, la trasformazione, la distribuzione e l’introduzione di prodotti di origine animale destinati al consumo umano (1), in particolare l’articolo 8, frase introduttiva, l’articolo 8, punto 1, primo comma, e l’articolo 8, punto 4,
considerando quanto segue:
|
(1) |
La decisione 2007/777/CE della Commissione, del 29 novembre 2007, che definisce le condizioni sanitarie e di polizia sanitaria nonché i modelli dei certificati per le importazioni da paesi terzi di prodotti a base di carne e stomaci, vesciche e intestini trattati destinati al consumo umano e abroga la decisione 2005/432/CE (2), fissa le norme applicabili alle importazioni, al transito e al deposito nell’Unione di partite di prodotti a base di carne e di partite di stomaci, vesciche e intestini trattati quali definiti nel regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, che stabilisce norme specifiche in materia di igiene per gli alimenti di origine animale (3). |
|
(2) |
L’allegato II, parte 2, della decisione 2007/777/CE, istituisce un elenco di paesi terzi o parti di paesi terzi da cui sono autorizzate le importazioni di prodotti a base di carne e di stomaci, vesciche e intestini trattati, purché tali prodotti siano conformi al trattamento indicato in tale elenco. Qualora i paesi terzi siano regionalizzati ai fini dell’iscrizione nel suddetto elenco, i relativi territori regionalizzati sono stabiliti nella parte 1 di tale allegato. |
|
(3) |
L’allegato II, parte 4, della decisione 2007/777/CE, stabilisce i trattamenti di cui alla parte 2 di tale allegato, assegnando un codice a ciascuno di essi. Tale parte stabilisce un trattamento generico «A» e i trattamenti specifici da «B» a «F» enumerati in ordine decrescente di rigorosità. |
|
(4) |
A seguito della comparsa di focolai di influenza aviaria ad alta patogenicità in talune zone di Israele, la decisione 2007/777/CE, modificata dal regolamento di esecuzione (UE) n. 532/2012 della Commissione (4), dispone che le importazioni nell’Unione di prodotti a base di carne e stomaci, vesciche e intestini trattati di pollame, selvaggina da penna di allevamento, ratiti di allevamento e volatili selvatici sono autorizzate dalle zone di questo paese terzo interessate dal focolaio soltanto qualora siano state sottoposte al trattamento specifico «D», a norma dell’allegato II, parte 4, della decisione 2007/777/CE. La zona di Israele interessata dal focolaio a cui si applica la regionalizzazione per motivi di polizia sanitaria è elencata nella tabella di cui alla parte 1 dell’allegato II della decisione. |
|
(5) |
Israele ha eradicato i focolai di influenza aviaria ad alta patogenicità in base alle informazioni presentate sulla situazione sanitaria favorevole per quanto riguarda tale malattia. Inoltre, la vigilanza esercitata dall’autorità competente in Israele nel periodo trascorso dalla soppressione del pollame nelle aziende avicole infette e dalla pulizia e disinfezione dei relativi locali non ha rivelato nessuna ulteriore diffusione della malattia. |
|
(6) |
È pertanto opportuno modificare le voci riguardanti Israele nell’allegato II, parti 1 e 2, della decisione 2007/777/CE, per autorizzare le importazioni nell’Unione provenienti dall’intero territorio di Israele di prodotti a base di carne e stomaci, vesciche e intestini trattati di pollame, selvaggina da penna di allevamento, ratiti di allevamento e volatili selvatici sottoposti a un trattamento generico «A», a norma dell’allegato II, parte 4, della decisione 2007/777/CE. |
|
(7) |
Occorre pertanto modificare di conseguenza la decisione 2007/777/CE. |
|
(8) |
Le misure di cui alla presente decisione sono conformi al parere del comitato permanente per la catena alimentare e la salute degli animali, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
L’allegato II della decisione 2007/777/CE è modificato conformemente all’allegato della presente decisione.
Articolo 2
Gli Stati membri sono destinatari della presente decisione.
Fatto a Bruxelles, il 14 agosto 2012
Per la Commissione
John DALLI
Membro della Commissione
(1) GU L 18 del 23.1.2003, pag. 11.
(2) GU L 312 del 30.11.2007, pag. 49.
(3) GU L 139 del 30.4.2004, pag. 55.
(4) GU L 163 del 22.6.2012, pag. 1.
ALLEGATO
L’allegato II della decisione 2007/777/CE è così modificato:
|
1) |
nella parte 1, l’intera voce «Israele» è soppressa; |
|
2) |
nella parte 2, la voce «Israele» è sostituita da quanto segue:
|